ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет по предварительной заяке U.S. 13/840233, поданной 15 марта 2013 г., раскрытие которой явно включено в настоящее изобретение в качестве ссылки.
Уровень техники
Появление нежелательной растительности, например, сорняков, является для фермеров постоянным затруднением, проявляющимся в сельскохозяйственных культурах, на пастбищах и других участках. Сорняки конкурируют с сельскохозяйственными культурами и неблагоприятно влияют на урожайность сельскохозяйственной культуры. Применение химических гербицидов является важным средством борьбы с нежелательной растительностью.
Сохраняется необходимость в новых химических гербицидах, которые обеспечивают борьбу с более широким спектром сорняков, селективность, минимальное повреждение сельскохозяйственной культуры, стабильность при хранении, легкость использования, более значительную активность по отношению к сорнякам и/или средства борьбы с устойчивостью по отношению к использующимся в настоящее время гербицидам.
Краткое изложение сущности изобретения
Настоящее изобретение относится к соединениям формулы (I):
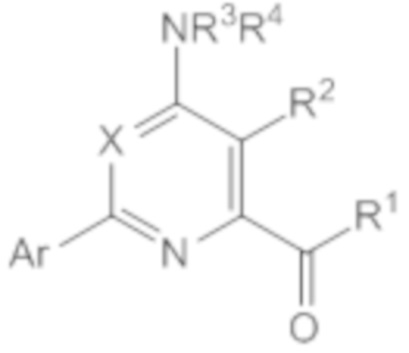
(I),
в которой X означает N или CY, где Y означает водород, галоген, C1-C3-алкил, C1-C3-галогеналкил, C1-C3-алкоксигруппу, C1-C3-галогеналкоксигруппу, C1-C3-алкилтиогруппу или C1-C3-галогеналкилтиогруппу;
R1 означает OR1′, где R1′ означает H, C1-C8-алкил или C7-C10-арилалкил;
R2 означает галоген, C1-C4-алкил, C1-C4-галогеналкил, C2-C4-алкенил, C2-C4-галогеналкенил, C2-C4-алкинил, C2-C4-галогеналкинил, C1-C4-алкоксигруппу, C1-C4-галогеналкоксигруппу, C1-C4-алкилтиогруппу, C1-C4-галогеналкилтиогруппу, аминогруппу, C1-C4-алкиламиногруппу, C2-C4-галогеналкиламиногруппу, формил, (C1-C3-алкил)карбонил, (C1-C3-галогеналкил)карбонил, цианогруппу или группу формулы -CR17=CR18-SiR19R20R21, в которой R17 означает водород, F или Cl; R18 означает водород, F, Cl, C1-C4-алкил или C1-C4-галогеналкил; и R19, R20 и R21 все независимо означают C1-C10-алкил, C3-C6-циклоалкил, C1-C10-галогеналкил, C3-C6-галогенциклоалкил, фенил, замещенный фенил, C1-C10-алкоксигруппу или OH;
R3 и R4 все независимо означают водород, C1-C6-алкил, C1-C6-галогеналкил, C3-C6-алкенил, C3-C6-галогеналкенил, C3-C6-алкинил, гидроксигруппу, C1-C6-алкоксигруппу, C1-C6-галогеналкоксигруппу, формил, (C1-C3-алкил)карбонил, (C1-C3-галогеналкил)карбонил, (C1-C6-алкокси)карбонил, (C1-C6-алкил)карбамил, C1-C6-алкилсульфонил, три(C1-C6-алкил)силил, ди(C1-C6-алкил)фосфонил, или R3 и R4 вместе с атомом азота, к которому они присоединены, образуют 5- или 6-членное насыщенное кольцо, или R3 и R4, взятые вместе, означают =CR3′R4′, где R3′ и R4′ все независимо означают водород, C1-C6-алкил, C3-C6-алкенил, C3-C6-алкинил, C1-C6-алкоксигруппу или C1-C6-алкиламиногруппу или R3′ и R4′ вместе с атомом углерода, к которому они присоединены, образуют 5- или 6-членное насыщенное кольцо;
Ar означает Ar1, Ar2, Ar3, Ar4, Ar5 или Ar6:
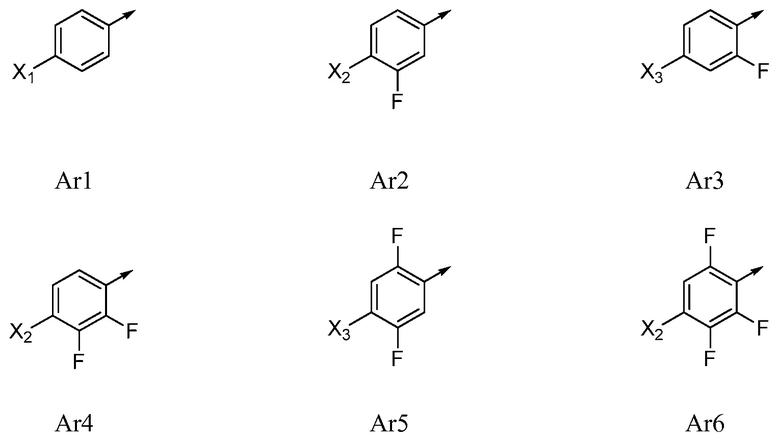 ,
,
где X1 означает H, F, Br, I, этинил, галогенэтинил, CF2H, OCF2H, OCF3, CN, CONH2, CO2H, CO2CH3 или NO2;
X2 означает H, F, Cl, Br, I, этинил, галогенэтинил, CH3, CFH2, CF2H, CF3, OCF2H, OCF3, CN, CONH2, CO2H или NO2;
X3 означает H, F, Br, I, этинил, галогенэтинил, CH3, CFH2, CF2H, CF3, OCF2H, OCF3, CN, CONH2, CO2H или NO2;
где, если Ar означает  ,
,
то X означает N, CH, CF, CCl или CCH3;
при условиях, что:
R2 не означает Cl или винил, если X означает N;
X1 не означает H, F, OCF3 или CN, если R2 означает Cl и X означает CH;
X1 не означает F, I, CN или этинил, если R2 означает OCH3 и X означает CF;
X1 не означает H, если X означает CCl; и
если Ar означает  ,
,
то X означает N, CH, CF, CCl или CCH3;
при условиях, что:
R2 не означает Cl, если X означает N;
X2 не означает Cl, если R2 означает OCH3 или винил и X означает N;
X2 не означает Cl, если R2 означает Cl и X означает CH;
X2 не означает Cl, Br, I или CF3, если R2 означает OCH3 и X означает CF; и
если Ar означает 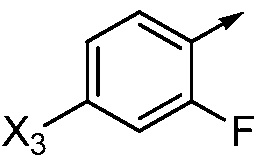 ,
,
то X означает N, CH или CF;
при условиях, что:
R2 не означает Cl, если X означает N;
X3 не означает CH3, если R2 означает OCH3 и X означает N;
X3 не означает H, F или CH3, если R2 означает Cl и X означает CH;
X3 не означает Br или I, если R2 означает OCH3 и X означает CF; и
если Ar означает 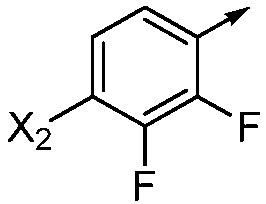 ,
,
то X означает N, CH или CF;
при условиях, что:
R2 не означает Cl, если X означает N;
X2 не означает Cl, если R2 означает OCH3 или винил и X означает N;
X2 не означает F, если R2 означает Cl и X означает CH;
X2 не означает Cl, Br, I или CF3, если R2 означает OCH3 и X означает CF;
если Ar означает 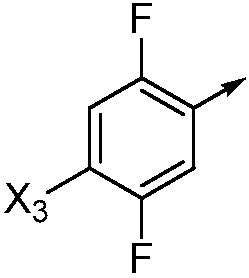 ,
,
то X означает N, CH или CF;
при условии, что:
X3 не означает CH3, если R2 означает Cl и X означает N;
X3 не означает Br или I, если X означает CF и R2 означает OCH3; и
если Ar означает 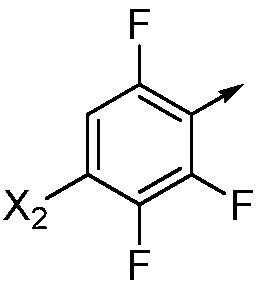 ,
,
то X означает N, CH или CF;
или к их N-оксиду или сельскохозяйственно-приемлемой соли.
Настоящее изобретение также относится к способам борьбы с нежелательной растительностью, включающим (a) взаимодействие нежелательной растительности или участка, находящегося рядом с нежелательной растительностью, или (b) довсходовое взаимодействие почвы или воды с гербицидно-эффективным количеством по меньшей мере одного соединения формулы (I) или его сельскохозяйственно-приемлемого производного (например, сельскохозяйственно-приемлемые соли, сольваты, гидраты, сложные эфиры, амиды, N-оксиды или другие производные).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
При использовании в настоящем изобретении гербицид и гербицидно-активный ингредиент означает соединение, которое при нанесении в надлежащем количестве обеспечивает борьбу с нежелательной растительностью.
При использовании в настоящем изобретении борьба с нежелательной растительностью означает уничтожение или предупреждение появления растительности или оказание какого-то другого неблагоприятного изменяющего воздействия на растительность, например, приводящего к отклонению от естественного роста или развития, регулирование, обезвоживание, замедление и т.п.
При использовании в настоящем изобретении гербицидно-эффективное или обеспечивающее борьбу с растительностью количество представляет собой количество гербицидно-активного ингредиента, нанесение которого обеспечивает борьбу с соответствующей нежелательной растительностью.
При использовании в настоящем изобретении нанесение гербицида или гербицидной композиции означает ее доставку непосредственно к целевой растительности или на участок ее произрастания, или на участок, на котором желательна борьба с нежелательной растительностью. Методики нанесения включают, но не ограничиваются только ими, довсходовое взаимодействие с почвой или водой или послевсходовое взаимодействие с нежелательной растительностью или участком, находящимся рядом с нежелательной растительностью.
При использовании в настоящем изобретении растения и растительность включают, но не ограничиваются только ими, семена в состоянии покоя прорастающие семена, всходящие растения, растения, всходящие из вегетативных побегов, незрелую растительность и укоренившуюся растительность.
При использовании в настоящем изобретении сельскохозяйственно-приемлемые соли и сложные эфиры означают соли и сложные эфиры, которые обладают гербицидной активностью или которые превращаются или которые можно превратить в растениях, в воде или почве в указанный гербицид. Типичными сельскохозяйственно-приемлемыми сложными эфирами являются такие, которые путем гидролиза, окисления, метаболизма или иным образом превращаются или которые можно превратить, например, в растениях, в воде или почве, в соответствующую карбоновую кислоту, которая в зависимости от pH может находиться в диссоциированной или недиссоциированной форме.
Подходящие соли включают образованные со щелочными или щелочноземельными металлами и образованные с аммиаком и аминами. Предпочтительные катионы включают катионы натрия, калия, магния и аминия формулы:
R13R14R15R16N+,
в которой R1, R2, R3 и R4 все независимо означают водород или C1-C12-алкил, C3-C12-алкенил или C3-C12-алкинил, каждый из которых необязательно замещен одной или большим количеством заместителей, таких как гидроксигруппа, C1-C4-алкоксигруппа, C1-C4-алкилтиогруппа или фенильная группа, при условии, что R13, R14, R15 и R16 являются стерически совместимыми. Кроме того, любые два R13, R14, R15 и R16 вместе могут означать алифатический бифункциональный фрагмент, содержащий от 1 до 12 атомов углерода и до двух атомов кислорода или серы. Соли соединений формулы (I) можно получить путем обработки соединений формулы (I) гидроксидом металла, таким как гидроксид натрия, амином, таким как аммиак, триметиламин, диэтаноламин, 2-метилтиопропиламин, бисаллиламин, 2-бутоксиэтиламин, морфолин, циклододециламин или бензиламин, или тетраалкиламмонийгидроксидом, таким как тетраметиламмонийгидроксид или гидроксид холина. Соли аминов - соединений формулы (I) являются полезными формами или производными соединений формулы (I), поскольку они растворимы в воде сами, позволяют получить желательные гербицидные композиции на водной основе.
Другие формы или производные соединений формулы (I) включают N-оксиды соединений формулы (I). Пиридин N-оксиды можно получить окислением соответствующих пиридинов. Подходящие методики окисления описаны, например, в публикации Houben-Weyl, Methoden der organischen Chemie [Methods in organic chemistry], expanded and subsequent volumes to the 4th edition, volume E 7b, p. 565 f.
При использовании в настоящем изобретении "ацил" включает формил, (C1-C3-алкил)карбонил и (C1-C3-галогеналкил)карбонил.
При использовании в настоящем изобретении "алкил" означает насыщенные, обладающие линейной или разветвленной цепью углеводородные фрагменты. Если не указано иное, предполагаются C1-C10-алкильные группы. Примеры включают, но не ограничиваются только ими, метил, этил, пропил, 1-метилэтил, бутил, 1-метилпропил, 2-метилпропил, 1,1-диметилэтил, пентил, 1-метилбутил, 2-метилбутил, 3-метилбутил, 2,2-диметилпропил, 1-этилпропил, гексил, 1,1-диметилпропил, 1,2-диметилпропил, 1-метилпентил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 1,1-диметилбутил, 1,2-диметилбутил, 1,3-диметилбутил, 2,2-диметилбутил, 2,3-диметилбутил, 3,3-диметилбутил, 1-этилбутил, 2-этилбутил, 1,1,2-триметилпропил, 1,2,2-триметилпропил, 1-этил-1-метилпропил и 1-этил-2-метилпропил.
При использовании в настоящем изобретении "галогеналкил" означает обладающие линейной или разветвленной цепью алкильные группы, где в этих группах атомы водорода могут быть частично или полностью замещены одним или большим количеством атомов галогенов. Если не указано иное, предполагаются C1-C8-группы. Примеры включают, но не ограничиваются только ими, хлорметил, бромметил, дихлорметил, трихлорметил, фторметил, дифторметил, трифторметил, хлорфторметил, дихлорфторметил, хлордифторметил, 1-хлорэтил, 1-бромэтил, 1-фторэтил, 2-фторэтил, 2,2-дифторэтил, 2,2,2-трифторэтил, 2-хлор-2-фторэтил, 2-хлор-2-дифторэтил, 2,2-дихлор-2-фторэтил, 2,2,2-трихлорэтил, пентафторэтил и 1,1,1-трифторпроп-2-ил.
При использовании в настоящем изобретении "алкенил" означает ненасыщенные, обладающие линейной или разветвленной цепью углеводородные фрагменты, содержащие одну или большее количество двойных связей. Если не указано иное, предполагаются C2-C8-алкенилы. Алкенильные группы могут содержать более одной кратной связи. Примеры включают, но не ограничиваются только ими, этенил, 1-пропенил, 2-пропенил, 1-метилэтенил, 1-бутенил, 2-бутенил, 3-бутенил, 1-метил-1-пропенил, 2-метил-1-пропенил, 1-метил-2-пропенил, 2-метил-2-пропенил, 1-пентенил, 2-пентенил, 3-пентенил, 4-пентенил, 1-метил-1-бутенил, 2-метил-1-бутенил, 3-метил-1-бутенил, 1-метил-2-бутенил, 2-метил-2-бутенил, 3-метил-2-бутенил, 1-метил-3-бутенил, 2-метил-3-бутенил, 3-метил-3-бутенил, 1,1-диметил-2-пропенил, 1,2-диметил-1-пропенил, 1,2-диметил-2-пропенил, 1-этил-1-пропенил, 1-этил-2-пропенил, 1-гексенил, 2-гексенил, 3-гексенил, 4-гексенил, 5-гексенил, 1-метил-1-пентенил, 2-метил-1-пентенил, 3-метил-1-пентенил, 4-метил-1-пентенил, 1-метил-2-пентенил, 2-метил-2-пентенил, 3-метил-2-пентенил, 4-метил-2-пентенил, 1-метил-3-пентенил, 2-метил-3-пентенил, 3-метил-3-пентенил, 4-метил-3-пентенил, 1-метил-4-пентенил, 2-метил-4-пентенил, 3-метил-4-пентенил, 4-метил-4-пентенил, 1,1-диметил-2-бутенил, 1,1-диметил-3-бутенил, 1,2-диметил-1-бутенил, 1,2-диметил-2-бутенил, 1,2-диметил-3-бутенил, 1,3-диметил-1-бутенил, 1,3-диметил-2-бутенил, 1,3-диметил-3-бутенил, 2,2-диметил-3-бутенил, 2,3-диметил-1-бутенил, 2,3-диметил-2-бутенил, 2,3-диметил-3-бутенил, 3,3-диметил-1-бутенил, 3,3-диметил-2-бутенил, 1-этил-1-бутенил, 1-этил-2-бутенил, 1-этил-3-бутенил, 2-этил-1-бутенил, 2-этил-2-бутенил, 2-этил-3-бутенил, 1,1,2-триметил-2-пропенил, 1-этил-1-метил-2-пропенил, 1-этил-2-метил-1-пропенил и 1-этил-2-метил-2-пропенил.
При использовании в настоящем изобретении "алкинил" означает обладающие линейной или разветвленной цепью углеводородные фрагменты, содержащие одну или большее количество тройных связей. Если не указано иное, предполагаются C2-C8-алкинильные группы. Алкинильные группы могут содержать более одной кратной связи. Примеры включают, но не ограничиваются только ими, C2-C6-алкинил, такой как этинил, 1-пропинил, 2-пропинил (или пропаргил), 1-бутинил, 2-бутинил, 3-бутинил, 1-метил-2-пропинил, 1-пентинил, 2-пентинил, 3-пентинил, 4-пентинил, 3-метил-1-бутинил, 1-метил-2-бутинил, 1-метил-3-бутинил, 2-метил-3-бутинил, 1,1-диметил-2-пропинил, 1-этил-2-пропинил, 1-гексинил, 2-гексинил, 3-гексинил, 4-гексинил, 5-гексинил, 3-метил-1-пентинил, 4-метил-1-пентинил, 1-метил-2-пентинил, 4-метил-2-пентинил, 1-метил-3-пентинил, 2-метил-3-пентинил, 1-метил-4-пентинил, 2-метил-4-пентинил, 3-метил-4-пентинил, 1,1-диметил-2-бутинил, 1,1-диметил-3-бутинил, 1,2-диметил-3-бутинил, 2,2-диметил-3-бутинил, 3,3-диметил-1-бутинил, 1-этил-2-бутинил, 1-этил-3-бутинил, 2-этил-3-бутинил и 1-этил-1-метил-2-пропинил.
При использовании в настоящем изобретении "алкоксигруппа" означает группу формулы R-O-, в которой R означает алкил, определенный выше. Если не указано иное, предполагаются алкоксигруппы, в которых R означает C1-C8-алкильную группу. Примеры включают, но не ограничиваются только ими, метоксигруппу, этоксигруппу, пропоксигруппу, 1-метилэтоксигруппу, бутоксигруппу, 1-метилпропоксигруппу, 2-метилпропоксигруппу, 1,1-диметилэтоксигруппу, пентоксигруппу, 1-метилбутилоксигруппу, 2-метилбутоксигруппу, 3-метилбутоксигруппу, 2,2-диметилпропоксигруппу, 1-этилпропоксигруппу, гексоксигруппу, 1,1-диметилпропоксигруппу, 1,2-диметилпропоксигруппу, 1-метилпентоксигруппу, 2-метилпентоксигруппу, 3-метилпентоксигруппу, 4-метил-penoxy, 1,1-диметилбутоксигруппу, 1,2-диметилбутоксигруппу, 1,3-диметилбутоксигруппу, 2,2-диметилбутоксигруппу, 2,3-диметилбутоксигруппу, 3,3-диметилбутоксигруппу, 1-этилбутоксигруппу, 2-этилбутоксигруппу, 1,1,2-триметилпропоксигруппу, 1,2,2-триметилпропоксигруппу, 1-этил-1-метилпропоксигруппу и 1-этил-2-метилпропоксигруппу.
При использовании в настоящем изобретении "галогеналкоксигруппа" означает группу формулы R-O-, в которой R означает галогеналкил, определенный выше. Если не указано иное, предполагаются галогеналкоксигруппы, в которых R означает C1-C8-алкильную группу. Примеры включают, но не ограничиваются только ими, хлорметоксигруппу, бромметоксигруппу, дихлорметоксигруппу, трихлорметоксигруппу, фторметоксигруппу, дифторметоксигруппу, трифторметоксигруппу, хлорфторметоксигруппу, дихлорфторметоксигруппу, хлордифторметоксигруппу, 1-хлорэтоксигруппу, 1-бромэтоксигруппу, 1-фторэтоксигруппу, 2-фторэтоксигруппу, 2,2-дифторэтоксигруппу, 2,2,2-трифторэтоксигруппу, 2-хлор-2-фторэтоксигруппу, 2-хлор,2-дифторэтоксигруппу, 2,2-дихлор-2-фторэтоксигруппу, 2,2,2-трихлорэтоксигруппу, пентафторэтоксигруппу и 1,1,1-трифторпроп-2-оксигруппу.
При использовании в настоящем изобретении "алкилтиогруппа" означает группу формулы R-S-, в которой R означает алкил, определенный выше. Если не указано иное, предполагаются алкилтиогруппы, в которых R означает C1-C8-алкильную группу. Примеры включают, но не ограничиваются только ими, метилтиогруппу, этилтиогруппу, пропилтиогруппу, 1-метилэтилтиогруппу, бутилтиогруппу, 1-метилпропилтиогруппу, 2-метилпропилтиогруппу, 1,1-диметилэтилтиогруппу, пентилтиогруппу, 1-метилбутилтиогруппу, 2-метилбутилтиогруппу, 3-метилбутилтиогруппу, 2,2-диметилпропилтиогруппу, 1-этилпропилтиогруппу, гексилтиогруппу, 1,1-диметилпропилтиогруппу, 1,2-диметилпропилтиогруппу, 1-метилпентилтиогруппу, 2-метилпентилтиогруппу, 3-метилпентилтиогруппу, 4-метилпентилтиогруппу, 1,1-диметилбутилтиогруппу, 1,2-диметилбутилтиогруппу, 1,3-диметилбутилтиогруппу, 2,2-диметилбутилтиогруппу, 2,3-диметилбутилтиогруппу, 3,3-диметилбутилтиогруппу, 1-этилбутилтиогруппу, 2-этилбутилтиогруппу, 1,1,2-триметилпропилтиогруппу, 1,2,2-триметилпропилтиогруппу, 1-этил-1-метилпропилтиогруппу и 1-этил-2-метилпропилтиогруппу.
При использовании в настоящем изобретении "галогеналкилтиогруппа" означает алкилтиогруппу, определенную выше, в которой атомы углерода частично или полностью замещены одним или большим количеством атомов галогенов. Если не указано иное, предполагаются галогеналкилтиогруппы, в которых R означает C1-C8-алкильную группу. Примеры включают, но не ограничиваются только ими, хлорметилтиогруппу, бромметилтиогруппу, дихлорметилтиогруппу, трихлорметилтиогруппу, фторметилтиогруппу, дифторметилтиогруппу, трифторметилтиогруппу, хлорфторметилтиогруппу, дихлорфторметилтиогруппу, хлордифторметилтиогруппу, 1-хлорэтилтиогруппу, 1-бромэтилтиогруппу, 1-фторэтилтиогруппу, 2-фторэтилтиогруппу, 2,2-дифторэтилтиогруппу, 2,2,2-трифторэтилтиогруппу, 2-хлор-2-фторэтилтиогруппу, 2-хлор-2-дифторэтилтиогруппу, 2,2-дихлор-2-фторэтилтиогруппу, 2,2,2-трихлорэтилтиогруппу, пентафторэтилтиогруппу и 1,1,1-трифторпроп-2-илтиогруппу.
При использовании в настоящем изобретении "арил", а также производные термины, такие как "арилоксигруппа", означает фенильную, инданильную или нафтильную группу. В некоторых вариантах осуществления фенил является предпочтительным. Термин "гетероарил", а также производные термины, такие как "гетероарилоксигруппа", означает 5- или 6-членное ароматическое кольцо, содержащее один или большее количество гетероатомов, например, N, O или S; эти гетероароматические кольца могут быть сконденсированы с другими ароматическими системами. Арильные или гетероарильные заместители могут быть незамещенными или содержать один или большее количество заместителей, выбранных из группы, включающей, например, галоген, гидроксигруппу, нитрогруппу, цианогруппу, формил, C1-C6-алкил, C2-C6-алкенил, C2-C6-алкинил, C1-C6-алкоксигруппу, C1-C6-галогеналкил, C1-C6-галогеналкоксигруппу, C1-C6-ацил, C1-C6-алкилтиогруппу, C1-C6-алкилсульфинил, C1-C6-алкилсульфонил, (C1-C6-алкокси)карбонил, C1-C6-карбамоил, гидроксикарбонил, (C1-C6-алкил)карбонил, аминокарбонил, (C1-C6-алкиламино)карбонил, (ди(C1-C6-алкил)амино)карбонил, при условии, что заместители стерически совместимы и соблюдаются требования правил образования химических связей и энергии напряжения. В некоторых вариантах осуществления предпочтительные заместители включают, например, галоген, C1-C2-алкил и C1-C2-галогеналкил.
При использовании в настоящем изобретении "алкоксикарбонил" означает группу формулы 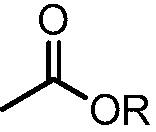 , в которой R означает алкил.
, в которой R означает алкил.
При использовании в настоящем изобретении "алкиламиногруппа" или "диалкиламиногруппа" означает аминогруппу, замещенную одной или двумя алкильными группами, которые могут быть одинаковыми или разными.
При использовании в настоящем изобретении "алкилкарбамил" означает карбамильную группу, замещенную по атому азота алкильной группой.
При использовании в настоящем изобретении "алкилсульфонил" означает -SO2R, где R означает алкил (например, C1-C10-алкил).
При использовании в настоящем изобретении "карбамил" (также называющийся, как карбамоил или аминокарбонил) означает группу формулы 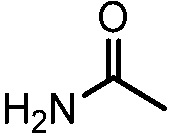 .
.
При использовании в настоящем изобретении "галогеналкиламиногруппа" означает алкиламиногруппу, в которой атомы углерода алкила частично или полностью замещены одним или большим количеством атомов галогенов.
При использовании в настоящем изобретении "Me" означает метильную группу.
При использовании в настоящем изобретении термин "галоген", включая производные термины, такие как "галогенид", означает фтор, хлор, бром или йод (или фторид, хлорид, бромид или йодид).
При использовании в настоящем изобретении растения и растительность включают, но не ограничиваются только ими, прорастающие семена, всходящие растения, растения, всходящие из вегетативных побегов, и укоренившуюся растительность.
СОЕДИНЕНИЯ
Настоящее изобретение относится к соединениям формулы (I), определенным в настоящем изобретении (например, выше в Кратком изложении сущности изобретения), и их N-оксидам или сельскохозяйственно-приемлемым солям.
В некоторых вариантах осуществления соединением является карбоновая кислота или ее сельскохозяйственно-приемлемый сложный эфир или соль. В некоторых вариантах осуществления соединением является карбоновая кислота или ее метиловый эфир.
В некоторых вариантах осуществления:
Ar выбран из группы, включающей Ar1, Ar2, Ar3, Ar4, Ar5 и Ar6;
R1 означает OR1’, где R1’ означает H или C1-C8-алкил;
R2 означает галоген, C2-C4-алкенил, C2-C4-галогеналкенил, C1-C4-алкоксигруппу, C1-C4-галогеналкоксигруппу, C1-C4-алкилтиогруппу или C1-C4-галогеналкилтиогруппу;
R3 и R4 все независимо означают водород, C1-C6-алкил, C1-C6-галогеналкил, C3-C6-алкенил, C3-C6-галогеналкенил, C3-C6-алкинил, формил, (C1-C3-алкил)карбонил, (C1-C3-галогеналкил)карбонил, (C1-C6-алкокси)карбонил, (C1-C6-алкил)карбамил, три(C1-C6-алкил)силил, или R3 и R4, взятые вместе, означают =CR3′R4′, где R3′ и R4′ все независимо означают водород, C1-C6-алкил, C3-C6-алкенил, C3-C6-алкинил, C1-C6-алкоксигруппу или C1-C6-алкиламиногруппу; и
X означает N или CY, где Y означает водород, галоген, C1-C3-алкил, C1-C3-галогеналкил, C1-C3-алкоксигруппу, C1-C3-галогеналкоксигруппу, C1-C3-алкоксигруппу, C1-C3-алкилтиогруппу или C1-C3-галогеналкилтиогруппу.
В одном варианте осуществления X означает N. В одном варианте осуществления X означает CY.
В одном варианте осуществления Y означает водород. В одном варианте осуществления Y означает галоген (например, F, Cl, Br, I). В одном варианте осуществления Y означает C1-C3-алкил (например, метил, этил, н-пропил, изопропил). В одном варианте осуществления Y означает C1-C3-галогеналкил (например, CFH2, CF2H, CF3, CF2CF3). В одном варианте осуществления Y означает C1-C3-алкоксигруппу (например, OCH3, OCH2CH3). В одном варианте осуществления Y означает C1-C3-галогеналкоксигруппу (например, OCFH2, OCF2H, OCF3, OCF2CF3). В одном варианте осуществления Y означает C1-C3-алкилтиогруппу (например, SCH3, SCH2CH3). В одном варианте осуществления Y означает C1-C3-галогеналкилтиогруппу (например, SCFH2, SCF2H, SCF3, SCF2CF3).
В некоторых вариантах осуществления X означает N или CY, где Y означает водород, галоген, C1-C3-алкил, C1-C3-галогеналкил, C1-C3-алкоксигруппу, C1-C3-галогеналкоксигруппу, C1-C3-алкоксигруппу, C1-C3-алкилтиогруппу или C1-C3-галогеналкилтиогруппу.
В некоторых вариантах осуществления X означает N или CY, где Y означает H, галоген, или C1-C3-алкил. В некоторых вариантах осуществления X означает N или CY, где Y означает H или галоген. В некоторых вариантах осуществления X означает N или CY, где Y означает H, F, Cl, или Br. В некоторых вариантах осуществления X означает N или CY, где Y означает H, F или Cl. В некоторых вариантах осуществления X означает N или CY, где Y означает H или C1-C3-алкил. В некоторых вариантах осуществления X означает N или CY, где Y означает H или CH3. В некоторых вариантах осуществления X означает N или CY, где Y означает H. В некоторых вариантах осуществления X означает N или CY, где Y означает H, F, Cl, Br, или CH3. В некоторых вариантах осуществления X означает N или CY, где Y означает H, F, Cl, или CH3. В некоторых вариантах осуществления X означает N или CY, где Y означает H или F. В некоторых вариантах осуществления X означает N или CY, где Y означает Br. В некоторых вариантах осуществления X означает N или CY, где Y означает H. В некоторых вариантах осуществления Y означает H. В некоторых вариантах осуществления Y означает F. В некоторых вариантах осуществления Y означает Cl. В некоторых вариантах осуществления Y означает Br. В некоторых вариантах осуществления Y означает CH3. В некоторых вариантах осуществления Y означает H, галоген, или C1-C3-алкил. В некоторых вариантах осуществления Y означает H или галоген. В некоторых вариантах осуществления Y означает H, F, Cl, или Br. В некоторых вариантах осуществления Y означает H, F или Cl. В некоторых вариантах осуществления Y означает H или C1-C3-алкил. В некоторых вариантах осуществления Y означает H или CH3. В некоторых вариантах осуществления Y означает H, F, Cl, Br, или CH3. В некоторых вариантах осуществления Y означает H, F, Cl, или CH3. В некоторых вариантах осуществления Y означает H или F. В некоторых вариантах осуществления Y означает галоген.
В одном варианте осуществления R1 означает OR1′.
В одном варианте осуществления R1′ означает H. В одном варианте осуществления R1′ означает C1-C8-алкил (например, метил, этил, н-пропил, изопропил). В одном варианте осуществления R1′ означает C7-C10-арилалкил (например, бензил).
В некоторых вариантах осуществления R1 означает OR1′, где R1′ означает H или C1-C8-алкил. В некоторых вариантах осуществления R1 означает OR1′, где R1′ означает H или C7-C10-арилалкил.
В некоторых вариантах осуществления R1 означает OR1′, где R1′ означает H, метил, этил, или бензил. В некоторых вариантах осуществления R1 означает OR1′, где R1′ означает H, метил, или этил. В некоторых вариантах осуществления R1 означает OR1′, где R1′ означает H или метил. В некоторых вариантах осуществления R1 означает OR1′, где R1′ означает H или бензил.
В одном варианте осуществления R2 означает галоген (например, F, Cl, Br, I). В одном варианте осуществления R2 означает C1-C4-алкил (например, метил, этил, пропил, бутил). В одном варианте осуществления R2 означает C1-C4-галогеналкил (например, CFH2, CF2H, CF3, CF2CF3). В одном варианте осуществления R2 означает C2-C4-алкенил (например, винил или этенил, пропенил, бутенил). В одном варианте осуществления R2 означает C2-C4-галогеналкенил. В одном варианте осуществления R2 означает C2-C4-алкинил. В одном варианте осуществления R2 означает C2-C4-галогеналкинил. В одном варианте осуществления R2 означает C1-C4-алкоксигруппу (например, OCH3, OCH2CH3). В одном варианте осуществления R2 означает C1-C4-галогеналкоксигруппу (например, OCFH2, OCF2H, OCF3, OCF2CF3). В одном варианте осуществления R2 означает C1-C4-алкилтиогруппу (например, SCH3, SCH2CH3). В одном варианте осуществления R2 означает C1-C4-галогеналкилтиогруппу (например, SCFH2, SCF2H, SCF3, SCF2CF3). В одном варианте осуществления R2 означает аминогруппу. В одном варианте осуществления R2 означает C1-C4-алкиламиногруппу. В одном варианте осуществления R2 означает C2-C4-галогеналкиламиногруппу. В одном варианте осуществления R2 означает формил. В одном варианте осуществления R2 означает (C1-C3-алкил)карбонил. В одном варианте осуществления R2 означает (C1-C3-галогеналкил)карбонил. В одном варианте осуществления R2 означает цианогруппу.
В одном варианте осуществления R2 означает -CR17=CR18-SiR19R20R21.
В одном варианте осуществления R17 означает водород. В одном варианте осуществления R17 означает F. В одном варианте осуществления R17 означает Cl.
В одном варианте осуществления R18 означает водород. В одном варианте осуществления R18 означает F. В одном варианте осуществления R18 означает Cl. В одном варианте осуществления R18 означает C1-C4-алкил. В одном варианте осуществления R18 означает C1-C4-галогеналкил.
В одном варианте осуществления R19 означает C1-C10-алкил. В одном варианте осуществления R19 означает C3-C6-циклоалкил. В одном варианте осуществления R19 означает C1-C10-галогеналкил. В одном варианте осуществления R19 означает C3-C6-галогенциклоалкил. В одном варианте осуществления R19 означает фенил. В одном варианте осуществления R19 означает замещенный фенил. В одном варианте осуществления R19 означает C1-C10-алкоксигруппу. В одном варианте осуществления R19 означает OH.
В одном варианте осуществления R20 означает C1-C10-алкил. В одном варианте осуществления R20 означает C3-C6-циклоалкил. В одном варианте осуществления R20 означает C1-C10-галогеналкил. В одном варианте осуществления R20 означает C3-C6-галогенциклоалкил. В одном варианте осуществления R20 означает фенил. В одном варианте осуществления R20 означает замещенный фенил. В одном варианте осуществления R20 означает C1-C10-алкоксигруппу. В одном варианте осуществления R20 означает OH.
В одном варианте осуществления R21 означает C1-C10-алкил. В одном варианте осуществления R21 означает C3-C6-циклоалкил. В одном варианте осуществления R21 означает C1-C10-галогеналкил. В одном варианте осуществления R21 означает C3-C6-галогенциклоалкил. В одном варианте осуществления R21 означает фенил. В одном варианте осуществления R21 означает замещенный фенил. В одном варианте осуществления R21 означает C1-C10-алкоксигруппу. В одном варианте осуществления R21 означает OH.
В некоторых вариантах осуществления R2 означает галоген, C2-C4-алкенил, C2-C4-галогеналкенил, C1-C4-алкоксигруппу, C1-C4-галогеналкоксигруппу, C1-C4-алкилтиогруппу или C1-C4-галогеналкилтиогруппу. В некоторых вариантах осуществления R2 означает галоген, C2-C4-алкенил, C2-C4-галогеналкенил, или C1-C4-алкоксигруппу.
В некоторых вариантах осуществления R2 означает галоген, C2-C4-алкенил, или C1-C4-алкоксигруппу. В некоторых вариантах осуществления R2 означает Cl, винил, или OCH3. В некоторых вариантах осуществления R2 означает Cl. В некоторых вариантах осуществления R2 означает винил. В некоторых вариантах осуществления R2 означает OCH3.
В одном варианте осуществления R3 означает водород. В одном варианте осуществления R3 означает C1-C6-алкил. В одном варианте осуществления R3 означает C1-C6-галогеналкил. В одном варианте осуществления R3 означает C3-C6-алкенил. В одном варианте осуществления R3 означает C3-C6-галогеналкенил. В одном варианте осуществления R3 означает C3-C6-алкинил. В одном варианте осуществления R3 означает гидроксигруппу. В одном варианте осуществления R3 означает C1-C6-алкоксигруппу. В одном варианте осуществления R3 означает C1-C6-галогеналкоксигруппу. В одном варианте осуществления R3 означает формил. В одном варианте осуществления R3 означает (C1-C3-алкил)карбонил. В одном варианте осуществления R3 означает (C1-C3-галогеналкил)карбонил. В одном варианте осуществления R3 означает (C1-C6-алкокси)карбонил. В одном варианте осуществления R3 означает (C1-C6-алкил)карбамил. В одном варианте осуществления R3 означает C1-C6-алкилсульфонил. В одном варианте осуществления R3 означает три(C1-C6-алкил)силил. В одном варианте осуществления R3 означает ди(C1-C6-алкил)фосфонил.
В одном варианте осуществления R4 означает водород. В одном варианте осуществления R4 означает C1-C6-алкил. В одном варианте осуществления R4 означает C1-C6-галогеналкил. В одном варианте осуществления R4 означает C3-C6-алкенил. В одном варианте осуществления R4 означает C3-C6-галогеналкенил. В одном варианте осуществления R4 означает C3-C6-алкинил. В одном варианте осуществления R4 означает гидроксигруппу. В одном варианте осуществления R4 означает C1-C6-алкоксигруппу. В одном варианте осуществления R4 означает C1-C6-галогеналкоксигруппу. В одном варианте осуществления R4 означает формил. В одном варианте осуществления R4 означает (C1-C3-алкил)карбонил. В одном варианте осуществления R4 означает (C1-C3-галогеналкил)карбонил. В одном варианте осуществления R4 означает (C1-C6-алкокси)карбонил. В одном варианте осуществления R4 означает (C1-C6-алкил)карбамил. В одном варианте осуществления R4 означает C1-C6-алкилсульфонил. В одном варианте осуществления R4 означает три(C1-C6-алкил)силил. В одном варианте осуществления R4 означает ди(C1-C6-алкил)фосфонил.
В одном варианте осуществления R3 и R4 вместе с атомом азота, к которому они присоединены, образуют 5-членное насыщенное кольцо. В одном варианте осуществления R3 и R4 вместе с атомом азота, к которому они присоединены, образуют 6-членное насыщенное кольцо.
В одном варианте осуществления R3 и R4, взятые вместе, означают =CR3′R4′.
В одном варианте осуществления R3′ означает водород. В одном варианте осуществления R3′ означает C1-C6-алкил. В одном варианте осуществления R3′ означает C3-C6-алкенил. В одном варианте осуществления R3′ означает C3-C6-алкинил. В одном варианте осуществления R3′ означает C1-C6-алкоксигруппу. В одном варианте осуществления R3′ означает C1-C6-алкиламиногруппу.
В одном варианте осуществления R4′ означает водород. В одном варианте осуществления R4′ означает C1-C6-алкил. В одном варианте осуществления R4′ означает C3-C6-алкенил. В одном варианте осуществления R4′ означает C3-C6-алкинил. В одном варианте осуществления R4′ означает C1-C6-алкоксигруппу. В одном варианте осуществления R4′ означает C1-C6-алкиламиногруппу.
В одном варианте осуществления R3′ и R4′ вместе с атомом углерода, к которому они присоединены, образуют 5-членное насыщенное кольцо. В одном варианте осуществления R3′ и R4′ вместе с атомом углерода, к которому они присоединены, образуют 6-членное насыщенное кольцо.
В некоторых вариантах осуществления R3 и R4 все независимо означают водород, C1-C6-алкил, C1-C6-галогеналкил, C3-C6-алкенил, C3-C6-галогеналкенил, C3-C6-алкинил, формил, (C1-C3-алкил)карбонил, (C1-C3-галогеналкил)карбонил, (C1-C6-алкокси)карбонил, (C1-C6-алкил)карбамил, три(C1-C6-алкил)силил. В некоторых вариантах осуществления R3 и R4, взятые вместе, означают =CR3′R4′, где R3′ и R4′ все независимо означают водород, C1-C6-алкил, C3-C6-алкенил, C3-C6-алкинил, C1-C6-алкоксигруппу или C1-C6-алкиламиногруппу.
В некоторых вариантах осуществления R3 означает H.
В некоторых вариантах осуществления R4 означает H.
В одном варианте осуществления Ar означает Ar1.
В одном варианте осуществления настоящее изобретение относится к соединению формулы (I-1) или к его N-оксиду или сельскохозяйственно-приемлемой соли:
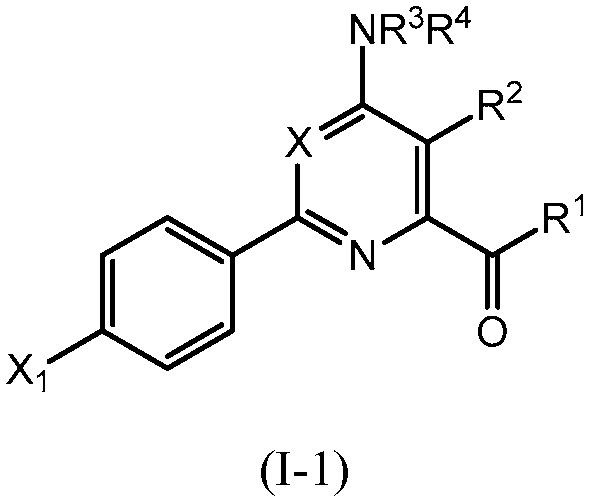 ,
,
в которой X, R1, R2, R3, R4 и X1 определены в настоящем изобретении.
В одном варианте осуществления в соединении формулы (I-1) R1 означает OH и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-1) R1 означает OH и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-1) R1 означает OH и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-1) R1 означает OH и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-1) R1 означает OH и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-1) R1 означает OH и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-1) R1 означает OH и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-1) R1 означает -O-(C1-C4-алкил) и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-1) R1 означает -O-(C1-C4-алкил) и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-1) R1 означает -O-(C1-C4-алкил) и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-1) R1 означает -O-(C1-C4-алкил) и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-1) R1 означает -O-(C1-C4-алкил) и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-1) R1 означает -O-(C1-C4-алкил) и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-1) R1 означает -O-(C1-C4-алкил) и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-1) R1 означает OCH3 и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-1) R1 означает OCH3 и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-1) R1 означает OCH3 и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-1) R1 означает OCH3 и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-1) R1 означает OCH3 и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-1) R1 означает OCH3 и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-1) R1 означает OCH3 и R2 означает 1-пропенил.
В одном варианте осуществления настоящее изобретение относится к соединению формулы (I-1a), (I-1b), (I-1c), (I-1d) или (I-1e) или к его N-оксиду или сельскохозяйственно-приемлемой соли:
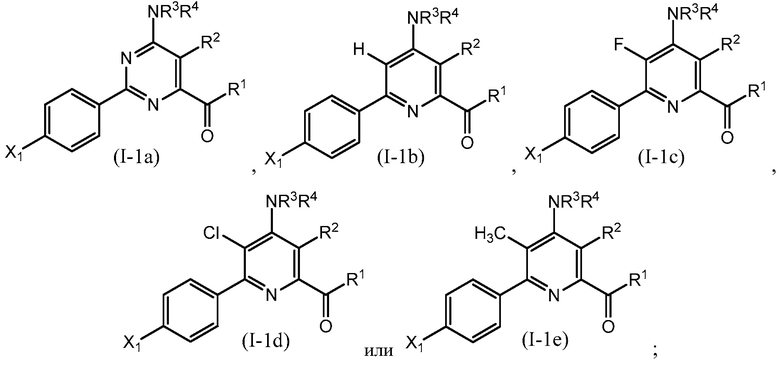
в которой R1, R2, R3, R4 и X1 определены в настоящем изобретении.
В одном варианте осуществления в соединении формулы (I-1a) R1 означает OH и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-1a) R1 означает OH и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-1a) R1 означает OH и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-1a) R1 означает OH и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-1a) R1 означает OH и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-1a) R1 означает OH и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-1a) R1 означает OH и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-1a) R1 означает -O-(C1-C4-алкил) и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-1a) R1 означает -O-(C1-C4-алкил) и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-1a) R1 означает -O-(C1-C4-алкил) и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-1a) R1 означает -O-(C1-C4-алкил) и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-1a) R1 означает -O-(C1-C4-алкил) и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-1a) R1 означает -O-(C1-C4-алкил) и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-1a) R1 означает -O-(C1-C4-алкил) и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-1a) R1 означает OCH3 и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-1a) R1 означает OCH3 и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-1a) R1 означает OCH3 и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-1a) R1 означает OCH3 и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-1a) R1 означает OCH3 и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-1a) R1 означает OCH3 и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-1a) R1 означает OCH3 и R2 означает 1-пропенил.
В одном варианте осуществления в соединении формулы (I-1b) R1 означает OH и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-1b) R1 означает OH и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-1b) R1 означает OH и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-1b) R1 означает OH и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-1b) R1 означает OH и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-1b) R1 означает OH и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-1b) R1 означает OH и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-1b) R1 означает -O-(C1-C4-алкил) и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-1b) R1 означает -O-(C1-C4-алкил) и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-1b) R1 означает -O-(C1-C4-алкил) и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-1b) R1 означает -O-(C1-C4-алкил) и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-1b) R1 означает -O-(C1-C4-алкил) и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-1b) R1 означает -O-(C1-C4-алкил) и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-1b) R1 означает -O-(C1-C4-алкил) и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-1b) R1 означает OCH3 и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-1b) R1 означает OCH3 и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-1b) R1 означает OCH3 и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-1b) R1 означает OCH3 и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-1b) R1 означает OCH3 и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-1b) R1 означает OCH3 и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-1b) R1 означает OCH3 и R2 означает 1-пропенил.
В одном варианте осуществления в соединении формулы (I-1c) R1 означает OH и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-1c) R1 означает OH и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-1c) R1 означает OH и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-1c) R1 означает OH и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-1c) R1 означает OH и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-1c) R1 означает OH и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-1c) R1 означает OH и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-1c) R1 означает -O-(C1-C4-алкил) и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-1c) R1 означает -O-(C1-C4-алкил) и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-1c) R1 означает -O-(C1-C4-алкил) и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-1c) R1 означает -O-(C1-C4-алкил) и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-1c) R1 означает -O-(C1-C4-алкил) и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-1c) R1 означает -O-(C1-C4-алкил) и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-1c) R1 означает -O-(C1-C4-алкил) и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-1c) R1 означает OCH3 и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-1c) R1 означает OCH3 и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-1c) R1 означает OCH3 и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-1c) R1 означает OCH3 и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-1c) R1 означает OCH3 и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-1c) R1 означает OCH3 и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-1c) R1 означает OCH3 и R2 означает 1-пропенил.
В одном варианте осуществления в соединении формулы (I-1d) R1 означает OH и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-1d) R1 означает OH и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-1d) R1 означает OH и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-1d) R1 означает OH и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-1d) R1 означает OH и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-1d) R1 означает OH и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-1d) R1 означает OH и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-1d) R1 означает -O-(C1-C4-алкил) и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-1d) R1 означает -O-(C1-C4-алкил) и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-1d) R1 означает -O-(C1-C4-алкил) и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-1d) R1 означает -O-(C1-C4-алкил) и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-1d) R1 означает -O-(C1-C4-алкил) и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-1d) R1 означает -O-(C1-C4-алкил) и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-1d) R1 означает -O-(C1-C4-алкил) и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-1d) R1 означает OCH3 и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-1d) R1 означает OCH3 и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-1d) R1 означает OCH3 и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-1d) R1 означает OCH3 и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-1d) R1 означает OCH3 и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-1d) R1 означает OCH3 и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-1d) R1 означает OCH3 и R2 означает 1-пропенил.
В одном варианте осуществления в соединении формулы (I-1e) R1 означает OH и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-1e) R1 означает OH и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-1e) R1 означает OH и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-1e) R1 означает OH и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-1e) R1 означает OH и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-1e) R1 означает OH и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-1e) R1 означает OH и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-1e) R1 означает -O-(C1-C4-алкил) и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-1e) R1 означает -O-(C1-C4-алкил) и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-1e) R1 означает -O-(C1-C4-алкил) и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-1e) R1 означает -O-(C1-C4-алкил) и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-1e) R1 означает -O-(C1-C4-алкил) и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-1e) R1 означает -O-(C1-C4-алкил) и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-1e) R1 означает -O-(C1-C4-алкил) и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-1e) R1 означает OCH3 и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-1e) R1 означает OCH3 и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-1e) R1 означает OCH3 и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-1e) R1 означает OCH3 и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-1e) R1 означает OCH3 и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-1e) R1 означает OCH3 и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-1e) R1 означает OCH3 и R2 означает 1-пропенил.
В одном варианте осуществления Ar означает Ar2.
В одном варианте осуществления настоящее изобретение относится к соединению формулы (I-2) или к его N-оксиду или сельскохозяйственно-приемлемой соли:
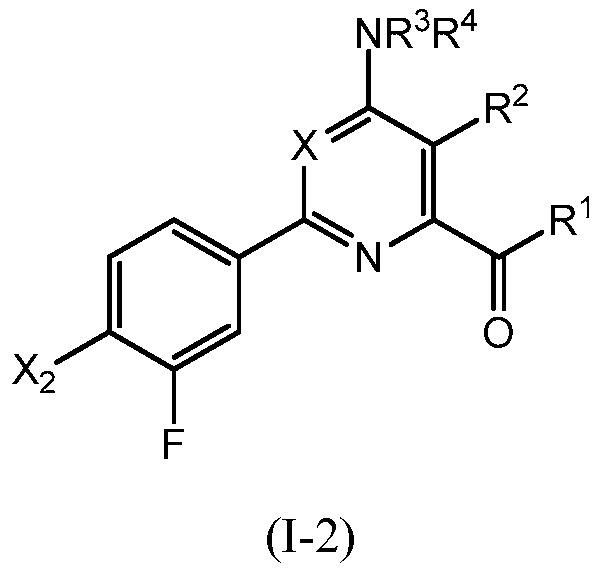 ,
,
в которой X, R1, R2, R3, R4 и X2 определены в настоящем изобретении.
В одном варианте осуществления в соединении формулы (I-2) R1 означает OH и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-2) R1 означает OH и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-2) R1 означает OH и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-2) R1 означает OH и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-2) R1 означает OH и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-2) R1 означает OH и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-2) R1 означает OH и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-2) R1 означает -O-(C1-C4-алкил) и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-2) R1 означает -O-(C1-C4-алкил) и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-2) R1 означает -O-(C1-C4-алкил) и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-2) R1 означает -O-(C1-C4-алкил) и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-2) R1 означает -O-(C1-C4-алкил) и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-2) R1 означает -O-(C1-C4-алкил) и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-2) R1 означает -O-(C1-C4-алкил) и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-2) R1 означает OCH3 и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-2) R1 означает OCH3 и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-2) R1 означает OCH3 и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-2) R1 означает OCH3 и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-2) R1 означает OCH3 и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-2) R1 означает OCH3 и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-2) R1 означает OCH3 и R2 означает 1-пропенил.
В одном варианте осуществления настоящее изобретение относится к соединению формулы (I-2a), (I-2b), (I-2c), (I-2d) или (I-2e) или к его N-оксиду или сельскохозяйственно-приемлемой соли:
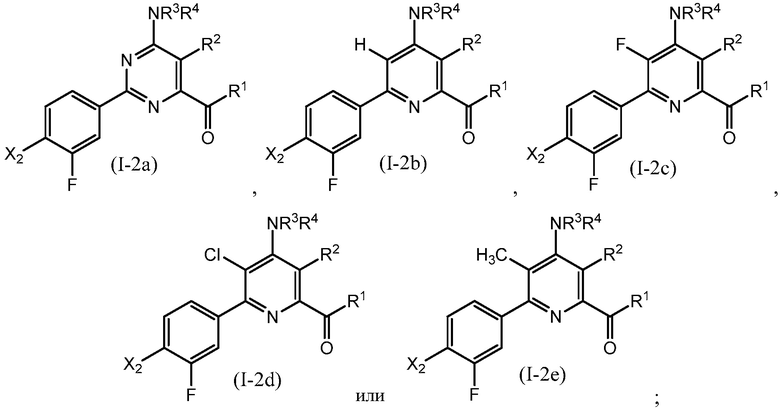
в которой R1, R2, R3, R4 и X2 определены в настоящем изобретении.
В одном варианте осуществления в соединении формулы (I-2a) R1 означает OH и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-2a) R1 означает OH и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-2a) R1 означает OH и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-2a) R1 означает OH и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-2a) R1 означает OH и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-2a) R1 означает OH и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-2a) R1 означает OH и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-2a) R1 означает -O-(C1-C4-алкил) и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-2a) R1 означает -O-(C1-C4-алкил) и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-2a) R1 означает -O-(C1-C4-алкил) и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-2a) R1 означает -O-(C1-C4-алкил) и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-2a) R1 означает -O-(C1-C4-алкил) и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-2a) R1 означает -O-(C1-C4-алкил) и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-2a) R1 означает -O-(C1-C4-алкил) и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-2a) R1 означает OCH3 и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-2a) R1 означает OCH3 и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-2a) R1 означает OCH3 и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-2a) R1 означает OCH3 и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-2a) R1 означает OCH3 и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-2a) R1 означает OCH3 и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-2a) R1 означает OCH3 и R2 означает 1-пропенил.
В одном варианте осуществления в соединении формулы (I-2b) R1 означает OH и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-2b) R1 означает OH и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-2b) R1 означает OH и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-2b) R1 означает OH и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-2b) R1 означает OH и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-2b) R1 означает OH и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-2b) R1 означает OH и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-2b) R1 означает -O-(C1-C4-алкил) и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-2b) R1 означает -O-(C1-C4-алкил) и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-2b) R1 означает -O-(C1-C4-алкил) и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-2b) R1 означает -O-(C1-C4-алкил) и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-2b) R1 означает -O-(C1-C4-алкил) и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-2b) R1 означает -O-(C1-C4-алкил) и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-2b) R1 означает -O-(C1-C4-алкил) и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-2b) R1 означает OCH3 и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-2b) R1 означает OCH3 и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-2b) R1 означает OCH3 и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-2b) R1 означает OCH3 и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-2b) R1 означает OCH3 и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-2b) R1 означает OCH3 и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-2b) R1 означает OCH3 и R2 означает 1-пропенил.
В одном варианте осуществления в соединении формулы (I-2c) R1 означает OH и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-2c) R1 означает OH и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-2c) R1 означает OH и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-2c) R1 означает OH и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-2c) R1 означает OH и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-2c) R1 означает OH и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-2c) R1 означает OH и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-2c) R1 означает -O-(C1-C4-алкил) и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-2c) R1 означает -O-(C1-C4-алкил) и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-2c) R1 означает -O-(C1-C4-алкил) и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-2c) R1 означает -O-(C1-C4-алкил) и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-2c) R1 означает -O-(C1-C4-алкил) и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-2c) R1 означает -O-(C1-C4-алкил) и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-2c) R1 означает -O-(C1-C4-алкил) и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-2c) R1 означает OCH3 и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-2c) R1 означает OCH3 и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-2c) R1 означает OCH3 и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-2c) R1 означает OCH3 и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-2c) R1 означает OCH3 и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-2c) R1 означает OCH3 и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-2c) R1 означает OCH3 и R2 означает 1-пропенил.
В одном варианте осуществления в соединении формулы (I-2d) R1 означает OH и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-2d) R1 означает OH и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-2d) R1 означает OH и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-2d) R1 означает OH и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-2d) R1 означает OH и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-2d) R1 означает OH и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-2d) R1 означает OH и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-2d) R1 означает -O-(C1-C4-алкил) и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-2d) R1 означает -O-(C1-C4-алкил) и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-2d) R1 означает -O-(C1-C4-алкил) и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-2d) R1 означает -O-(C1-C4-алкил) и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-2d) R1 означает -O-(C1-C4-алкил) и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-2d) R1 означает -O-(C1-C4-алкил) и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-2d) R1 означает -O-(C1-C4-алкил) и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-2d) R1 означает OCH3 и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-2d) R1 означает OCH3 и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-2d) R1 означает OCH3 и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-2d) R1 означает OCH3 и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-2d) R1 означает OCH3 и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-2d) R1 означает OCH3 и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-2d) R1 означает OCH3 и R2 означает 1-пропенил.
В одном варианте осуществления в соединении формулы (I-2e) R1 означает OH и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-2e) R1 означает OH и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-2e) R1 означает OH и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-2e) R1 означает OH и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-2e) R1 означает OH и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-2e) R1 означает OH и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-2e) R1 означает OH и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-2e) R1 означает -O-(C1-C4-алкил) и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-2e) R1 означает -O-(C1-C4-алкил) и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-2e) R1 означает -O-(C1-C4-алкил) и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-2e) R1 означает -O-(C1-C4-алкил) и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-2e) R1 означает -O-(C1-C4-алкил) и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-2e) R1 означает -O-(C1-C4-алкил) и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-2e) R1 означает -O-(C1-C4-алкил) и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-2e) R1 означает OCH3 и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-2e) R1 означает OCH3 и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-2e) R1 означает OCH3 и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-2e) R1 означает OCH3 и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-2e) R1 означает OCH3 и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-2e) R1 означает OCH3 и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-2e) R1 означает OCH3 и R2 означает 1-пропенил.
В одном варианте осуществления Ar означает Ar3.
В одном варианте осуществления настоящее изобретение относится к соединению формулы (I-3) или к его N-оксиду или сельскохозяйственно-приемлемой соли:
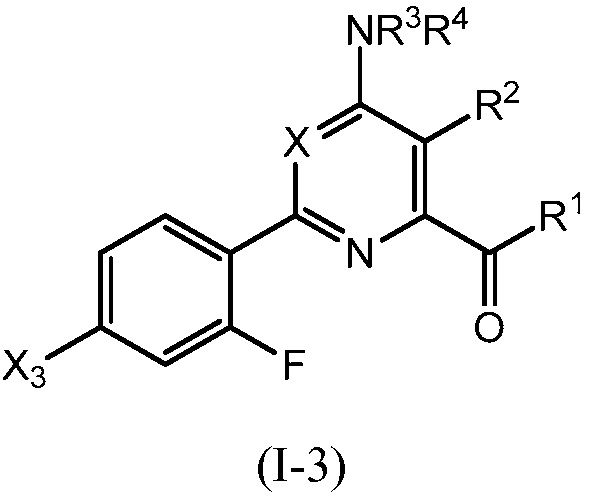 ,
,
в которой X, R1, R2, R3, R4 и X3 определены в настоящем изобретении.
В одном варианте осуществления в соединении формулы (I-3) R1 означает OH и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-3) R1 означает OH и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-3) R1 означает OH и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-3) R1 означает OH и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-3) R1 означает OH и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-3) R1 означает OH и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-3) R1 означает OH и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-3) R1 означает -O-(C1-C4-алкил) и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-3) R1 означает -O-(C1-C4-алкил) и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-3) R1 означает -O-(C1-C4-алкил) и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-3) R1 означает -O-(C1-C4-алкил) и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-3) R1 означает -O-(C1-C4-алкил) и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-3) R1 означает -O-(C1-C4-алкил) и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-3) R1 означает -O-(C1-C4-алкил) и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-3) R1 означает OCH3 и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-3) R1 означает OCH3 и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-3) R1 означает OCH3 и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-3) R1 означает OCH3 и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-3) R1 означает OCH3 и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-3) R1 означает OCH3 и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-3) R1 означает OCH3 и R2 означает 1-пропенил.
В одном варианте осуществления настоящее изобретение относится к соединению формулы (I-3a), (I-3b) или (I-3c) или к его N-оксиду или сельскохозяйственно-приемлемой соли:

в которой R1, R2, R3, R4 и X3 определены в настоящем изобретении.
В одном варианте осуществления в соединении формулы (I-3a) R1 означает OH и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-3a) R1 означает OH и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-3a) R1 означает OH и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-3a) R1 означает OH и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-3a) R1 означает OH и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-3a) R1 означает OH и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-3a) R1 означает OH и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-3a) R1 означает -O-(C1-C4-алкил) и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-3a) R1 означает -O-(C1-C4-алкил) и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-3a) R1 означает -O-(C1-C4-алкил) и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-3a) R1 означает -O-(C1-C4-алкил) и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-3a) R1 означает -O-(C1-C4-алкил) и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-3a) R1 означает -O-(C1-C4-алкил) и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-3a) R1 означает -O-(C1-C4-алкил) и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-3a) R1 означает OCH3 и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-3a) R1 означает OCH3 и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-3a) R1 означает OCH3 и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-3a) R1 означает OCH3 и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-3a) R1 означает OCH3 и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-3a) R1 означает OCH3 и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-3a) R1 означает OCH3 и R2 означает 1-пропенил.
В одном варианте осуществления в соединении формулы (I-3b) R1 означает OH и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-3b) R1 означает OH и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-3b) R1 означает OH и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-3b) R1 означает OH и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-3b) R1 означает OH и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-3b) R1 означает OH и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-3b) R1 означает OH и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-3b) R1 означает -O-(C1-C4-алкил) и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-3b) R1 означает -O-(C1-C4-алкил) и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-3b) R1 означает -O-(C1-C4-алкил) и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-3b) R1 означает -O-(C1-C4-алкил) и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-3b) R1 означает -O-(C1-C4-алкил) и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-3b) R1 означает -O-(C1-C4-алкил) и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-3b) R1 означает -O-(C1-C4-алкил) и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-3b) R1 означает OCH3 и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-3b) R1 означает OCH3 и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-3b) R1 означает OCH3 и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-3b) R1 означает OCH3 и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-3b) R1 означает OCH3 и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-3b) R1 означает OCH3 и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-3b) R1 означает OCH3 и R2 означает 1-пропенил.
В одном варианте осуществления в соединении формулы (I-3c) R1 означает OH и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-3c) R1 означает OH и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-3c) R1 означает OH и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-3c) R1 означает OH и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-3c) R1 означает OH и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-3c) R1 означает OH и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-3c) R1 означает OH и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-3c) R1 означает -O-(C1-C4-алкил) и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-3c) R1 означает -O-(C1-C4-алкил) и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-3c) R1 означает -O-(C1-C4-алкил) и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-3c) R1 означает -O-(C1-C4-алкил) и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-3c) R1 означает -O-(C1-C4-алкил) и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-3c) R1 означает -O-(C1-C4-алкил) и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-3c) R1 означает -O-(C1-C4-алкил) и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-3c) R1 означает OCH3 и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-3c) R1 означает OCH3 и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-3c) R1 означает OCH3 и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-3c) R1 означает OCH3 и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-3c) R1 означает OCH3 и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-3c) R1 означает OCH3 и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-3c) R1 означает OCH3 и R2 означает 1-пропенил.
В одном варианте осуществления Ar означает Ar4.
В одном варианте осуществления настоящее изобретение относится к соединению формулы (I-4) или к его N-оксиду или сельскохозяйственно-приемлемой соли:
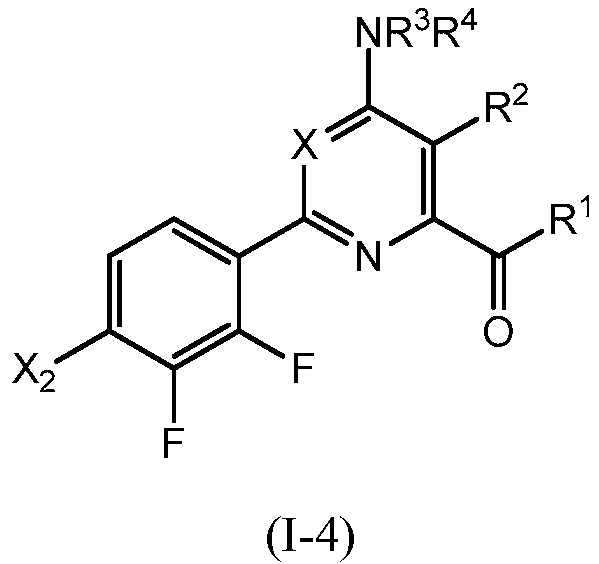 ,
,
в которой X, R1, R2, R3, R4 и X2 определены в настоящем изобретении.
В одном варианте осуществления в соединении формулы (I-4) R1 означает OH и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-4) R1 означает OH и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-4) R1 означает OH и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-4) R1 означает OH и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-4) R1 означает OH и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-4) R1 означает OH и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-4) R1 означает OH и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-4) R1 означает -O-(C1-C4-алкил) и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-4) R1 означает -O-(C1-C4-алкил) и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-4) R1 означает -O-(C1-C4-алкил) и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-4) R1 означает -O-(C1-C4-алкил) и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-4) R1 означает -O-(C1-C4-алкил) и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-4) R1 означает -O-(C1-C4-алкил) и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-4) R1 означает -O-(C1-C4-алкил) и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-4) R1 означает OCH3 и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-4) R1 означает OCH3 и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-4) R1 означает OCH3 и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-4) R1 означает OCH3 и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-4) R1 означает OCH3 и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-4) R1 означает OCH3 и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-4) R1 означает OCH3 и R2 означает 1-пропенил.
В одном варианте осуществления настоящее изобретение относится к соединению формулы (I-4a), (I-4b) или (I-4c) или к его N-оксиду или сельскохозяйственно-приемлемой соли:
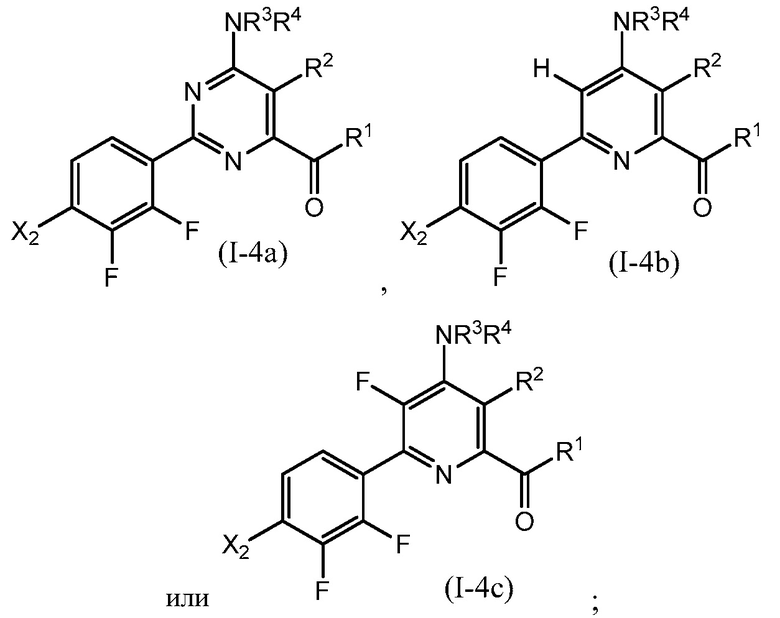
в которой R1, R2, R3, R4 и X2 определены в настоящем изобретении.
В одном варианте осуществления в соединении формулы (I-4a) R1 означает OH и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-4a) R1 означает OH и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-4a) R1 означает OH и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-4a) R1 означает OH и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-4a) R1 означает OH и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-4a) R1 означает OH и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-4a) R1 означает OH и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-4a) R1 означает -O-(C1-C4-алкил) и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-4a) R1 означает -O-(C1-C4-алкил) и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-4a) R1 означает -O-(C1-C4-алкил) и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-4a) R1 означает -O-(C1-C4-алкил) и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-4a) R1 означает -O-(C1-C4-алкил) и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-4a) R1 означает -O-(C1-C4-алкил) и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-4a) R1 означает -O-(C1-C4-алкил) и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-4a) R1 означает OCH3 и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-4a) R1 означает OCH3 и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-4a) R1 означает OCH3 и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-4a) R1 означает OCH3 и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-4a) R1 означает OCH3 и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-4a) R1 означает OCH3 и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-4a) R1 означает OCH3 и R2 означает 1-пропенил.
В одном варианте осуществления в соединении формулы (I-4b) R1 означает OH и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-4b) R1 означает OH и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-4b) R1 означает OH и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-4b) R1 означает OH и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-4b) R1 означает OH и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-4b) R1 означает OH и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-4b) R1 означает OH и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-4b) R1 означает -O-(C1-C4-алкил) и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-4b) R1 означает -O-(C1-C4-алкил) и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-4b) R1 означает -O-(C1-C4-алкил) и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-4b) R1 означает -O-(C1-C4-алкил) и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-4b) R1 означает -O-(C1-C4-алкил) и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-4b) R1 означает -O-(C1-C4-алкил) и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-4b) R1 означает -O-(C1-C4-алкил) и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-4b) R1 означает OCH3 и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-4b) R1 означает OCH3 и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-4b) R1 означает OCH3 и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-4b) R1 означает OCH3 и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-4b) R1 означает OCH3 и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-4b) R1 означает OCH3 и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-4b) R1 означает OCH3 и R2 означает 1-пропенил.
В одном варианте осуществления в соединении формулы (I-4c) R1 означает OH и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-4c) R1 означает OH и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-4c) R1 означает OH и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-4c) R1 означает OH и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-4c) R1 означает OH и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-4c) R1 означает OH и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-4c) R1 означает OH и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-4c) R1 означает -O-(C1-C4-алкил) и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-4c) R1 означает -O-(C1-C4-алкил) и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-4c) R1 означает -O-(C1-C4-алкил) и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-4c) R1 означает -O-(C1-C4-алкил) и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-4c) R1 означает -O-(C1-C4-алкил) и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-4c) R1 означает -O-(C1-C4-алкил) и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-4c) R1 означает -O-(C1-C4-алкил) и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-4c) R1 означает OCH3 и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-4c) R1 означает OCH3 и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-4c) R1 означает OCH3 и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-4c) R1 означает OCH3 и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-4c) R1 означает OCH3 и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-4c) R1 означает OCH3 и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-4c) R1 означает OCH3 и R2 означает 1-пропенил.
В одном варианте осуществления Ar означает Ar5.
В одном варианте осуществления настоящее изобретение относится к соединению формулы (I-5) или к его N-оксиду или сельскохозяйственно-приемлемой соли:
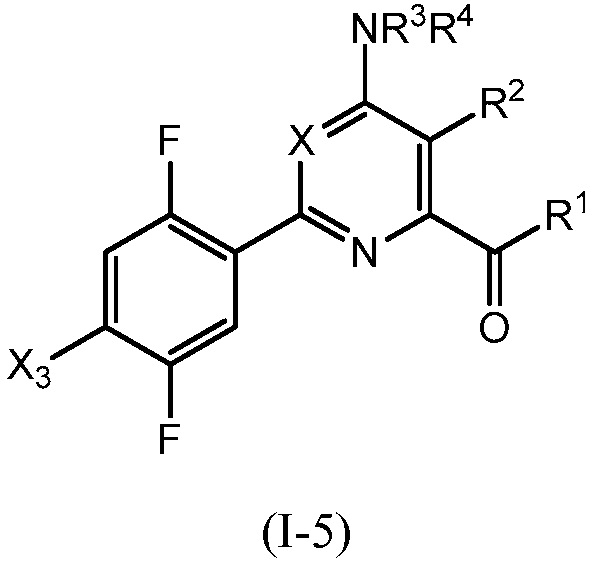 ,
,
в которой X, R1, R2, R3, R4 и X3 определены в настоящем изобретении.
В одном варианте осуществления в соединении формулы (I-5) R1 означает OH и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-5) R1 означает OH и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-5) R1 означает OH и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-5) R1 означает OH и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-5) R1 означает OH и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-5) R1 означает OH и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-5) R1 означает OH и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-5) R1 означает -O-(C1-C4-алкил) и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-5) R1 означает -O-(C1-C4-алкил) и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-5) R1 означает -O-(C1-C4-алкил) и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-5) R1 означает -O-(C1-C4-алкил) и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-5) R1 означает -O-(C1-C4-алкил) и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-5) R1 означает -O-(C1-C4-алкил) и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-5) R1 означает -O-(C1-C4-алкил) и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-5) R1 означает OCH3 и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-5) R1 означает OCH3 и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-5) R1 означает OCH3 и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-5) R1 означает OCH3 и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-5) R1 означает OCH3 и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-5) R1 означает OCH3 и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-5) R1 означает OCH3 и R2 означает 1-пропенил.
В одном варианте осуществления настоящее изобретение относится к соединению формулы (I-5a), (I-5b) или (I-5c) или к его N-оксиду или сельскохозяйственно-приемлемой соли:
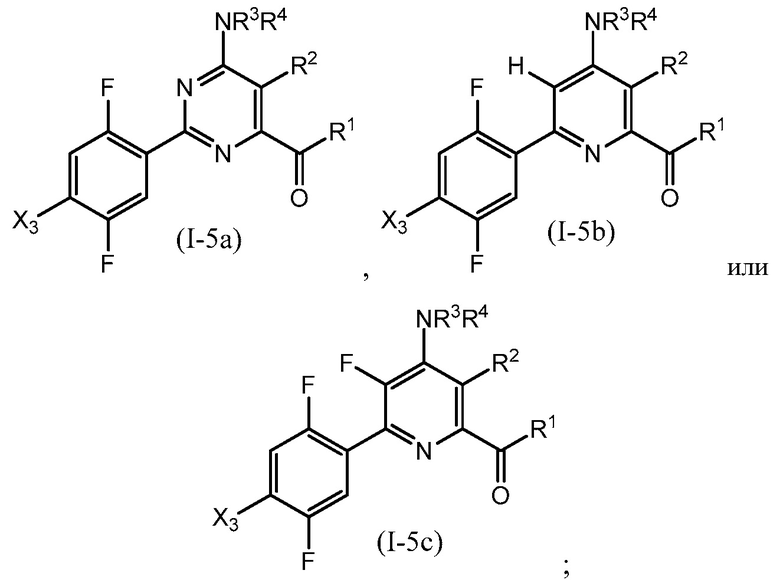
в которой R1, R2, R3, R4 и X3 определены в настоящем изобретении.
В одном варианте осуществления в соединении формулы (I-5a) R1 означает OH и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-5a) R1 означает OH и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-5a) R1 означает OH и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-5a) R1 означает OH и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-5a) R1 означает OH и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-5a) R1 означает OH и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-5a) R1 означает OH и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-5a) R1 означает -O-(C1-C4-алкил) и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-5a) R1 означает -O-(C1-C4-алкил) и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-5a) R1 означает -O-(C1-C4-алкил) и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-5a) R1 означает -O-(C1-C4-алкил) и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-5a) R1 означает -O-(C1-C4-алкил) и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-5a) R1 означает -O-(C1-C4-алкил) и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-5a) R1 означает -O-(C1-C4-алкил) и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-5a) R1 означает OCH3 и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-5a) R1 означает OCH3 и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-5a) R1 означает OCH3 и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-5a) R1 означает OCH3 и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-5a) R1 означает OCH3 и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-5a) R1 означает OCH3 и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-5a) R1 означает OCH3 и R2 означает 1-пропенил.
В одном варианте осуществления в соединении формулы (I-5b) R1 означает OH и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-5b) R1 означает OH и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-5b) R1 означает OH и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-5b) R1 означает OH и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-5b) R1 означает OH и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-5b) R1 означает OH и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-5b) R1 означает OH и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-5b) R1 означает -O-(C1-C4-алкил) и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-5b) R1 означает -O-(C1-C4-алкил) и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-5b) R1 означает -O-(C1-C4-алкил) и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-5b) R1 означает -O-(C1-C4-алкил) и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-5b) R1 означает -O-(C1-C4-алкил) и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-5b) R1 означает -O-(C1-C4-алкил) и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-5b) R1 означает -O-(C1-C4-алкил) и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-5b) R1 означает OCH3 и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-5b) R1 означает OCH3 и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-5b) R1 означает OCH3 и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-5b) R1 означает OCH3 и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-5b) R1 означает OCH3 и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-5b) R1 означает OCH3 и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-5b) R1 означает OCH3 и R2 означает 1-пропенил.
В одном варианте осуществления в соединении формулы (I-5c) R1 означает OH и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-5c) R1 означает OH и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-5c) R1 означает OH и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-5c) R1 означает OH и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-5c) R1 означает OH и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-5c) R1 означает OH и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-5c) R1 означает OH и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-5c) R1 означает -O-(C1-C4-алкил) и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-5c) R1 означает -O-(C1-C4-алкил) и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-5c) R1 означает -O-(C1-C4-алкил) и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-5c) R1 означает -O-(C1-C4-алкил) и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-5c) R1 означает -O-(C1-C4-алкил) и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-5c) R1 означает -O-(C1-C4-алкил) и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-5c) R1 означает -O-(C1-C4-алкил) и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-5c) R1 означает OCH3 и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-5c) R1 означает OCH3 и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-5c) R1 означает OCH3 и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-5c) R1 означает OCH3 и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-5c) R1 означает OCH3 и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-5c) R1 означает OCH3 и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-5c) R1 означает OCH3 и R2 означает 1-пропенил.
В одном варианте осуществления Ar означает Ar6.
В одном варианте осуществления настоящее изобретение относится к соединению формулы (I-6) или к его N-оксиду или сельскохозяйственно-приемлемой соли:
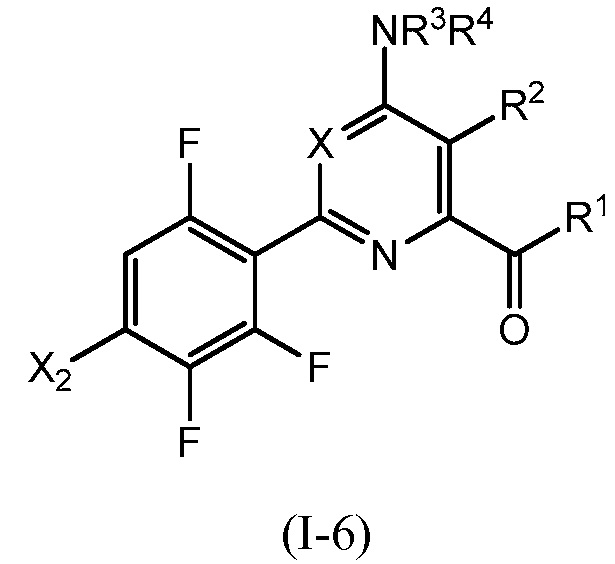 ,
,
в которой X, R1, R2, R3, R4 и X2 определены в настоящем изобретении.
В одном варианте осуществления в соединении формулы (I-6) R1 означает OH и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-6) R1 означает OH и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-6) R1 означает OH и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-6) R1 означает OH и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-6) R1 означает OH и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-6) R1 означает OH и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-6) R1 означает OH и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-6) R1 означает -O-(C1-C4-алкил) и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-6) R1 означает -O-(C1-C4-алкил) и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-6) R1 означает -O-(C1-C4-алкил) и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-6) R1 означает -O-(C1-C4-алкил) и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-6) R1 означает -O-(C1-C4-алкил) и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-6) R1 означает -O-(C1-C4-алкил) и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-6) R1 означает -O-(C1-C4-алкил) и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-6) R1 означает OCH3 и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-6) R1 означает OCH3 и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-6) R1 означает OCH3 и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-6) R1 означает OCH3 и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-6) R1 означает OCH3 и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-6) R1 означает OCH3 и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-6) R1 означает OCH3 и R2 означает 1-пропенил.
В одном варианте осуществления настоящее изобретение относится к соединению формулы (I-6a), (I-6b) или (I-6c) или к его N-оксиду или сельскохозяйственно-приемлемой соли:
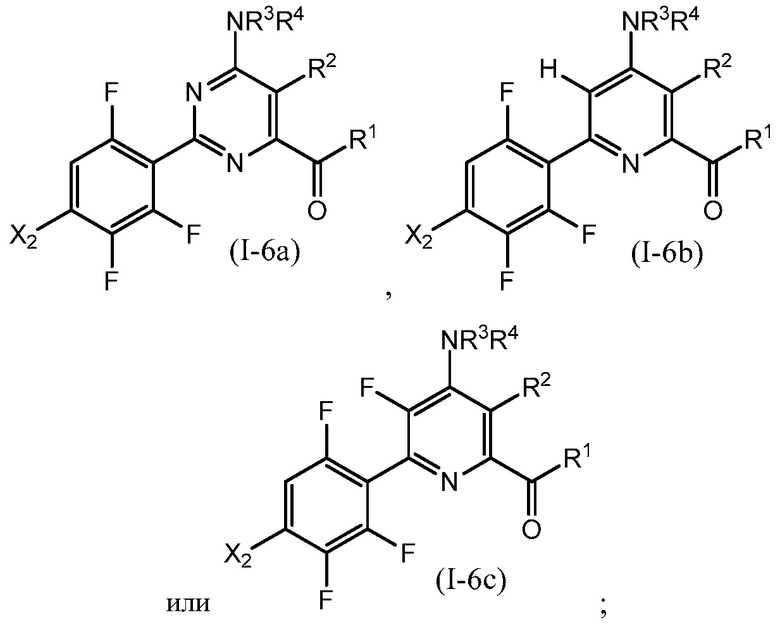
в которой R1, R2, R3, R4 и X2 определены в настоящем изобретении.
В одном варианте осуществления в соединении формулы (I-6a) R1 означает OH и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-6a) R1 означает OH и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-6a) R1 означает OH и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-6a) R1 означает OH и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-6a) R1 означает OH и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-6a) R1 означает OH и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-6a) R1 означает OH и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-6a) R1 означает -O-(C1-C4-алкил) и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-6a) R1 означает -O-(C1-C4-алкил) и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-6a) R1 означает -O-(C1-C4-алкил) и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-6a) R1 означает -O-(C1-C4-алкил) и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-6a) R1 означает -O-(C1-C4-алкил) и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-6a) R1 означает -O-(C1-C4-алкил) и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-6a) R1 означает -O-(C1-C4-алкил) и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-6a) R1 означает OCH3 и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-6a) R1 означает OCH3 и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-6a) R1 означает OCH3 и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-6a) R1 означает OCH3 и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-6a) R1 означает OCH3 и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-6a) R1 означает OCH3 и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-6a) R1 означает OCH3 и R2 означает 1-пропенил.
В одном варианте осуществления в соединении формулы (I-6b) R1 означает OH и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-6b) R1 означает OH и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-6b) R1 означает OH и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-6b) R1 означает OH и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-6b) R1 означает OH и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-6b) R1 означает OH и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-6b) R1 означает OH и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-6b) R1 означает -O-(C1-C4-алкил) и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-6b) R1 означает -O-(C1-C4-алкил) и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-6b) R1 означает -O-(C1-C4-алкил) и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-6b) R1 означает -O-(C1-C4-алкил) и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-6b) R1 означает -O-(C1-C4-алкил) и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-6b) R1 означает -O-(C1-C4-алкил) и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-6b) R1 означает -O-(C1-C4-алкил) и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-6b) R1 означает OCH3 и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-6b) R1 означает OCH3 и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-6b) R1 означает OCH3 и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-6b) R1 означает OCH3 и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-6b) R1 означает OCH3 и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-6b) R1 означает OCH3 и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-6b) R1 означает OCH3 и R2 означает 1-пропенил.
В одном варианте осуществления в соединении формулы (I-6c) R1 означает OH и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-6c) R1 означает OH и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-6c) R1 означает OH и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-6c) R1 означает OH и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-6c) R1 означает OH и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-6c) R1 означает OH и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-6c) R1 означает OH и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-6c) R1 означает -O-(C1-C4-алкил) и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-6c) R1 означает -O-(C1-C4-алкил) и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-6c) R1 означает -O-(C1-C4-алкил) и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-6c) R1 означает -O-(C1-C4-алкил) и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-6c) R1 означает -O-(C1-C4-алкил) и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-6c) R1 означает -O-(C1-C4-алкил) и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-6c) R1 означает -O-(C1-C4-алкил) и R2 означает 1-пропенил. В одном варианте осуществления в соединении формулы (I-6c) R1 означает OCH3 и R2 означает галоген. В одном варианте осуществления в соединении формулы (I-6c) R1 означает OCH3 и R2 означает C2-C4-алкенил. В одном варианте осуществления в соединении формулы (I-6c) R1 означает OCH3 и R2 означает C1-C4-алкоксигруппу. В одном варианте осуществления в соединении формулы (I-6c) R1 означает OCH3 и R2 означает Cl. В одном варианте осуществления в соединении формулы (I-6c) R1 означает OCH3 и R2 означает OCH3. В одном варианте осуществления в соединении формулы (I-6c) R1 означает OCH3 и R2 означает винил (или этенил). В одном варианте осуществления в соединении формулы (I-6c) R1 означает OCH3 и R2 означает 1-пропенил.
В одном варианте осуществления X1 означает H. В одном варианте осуществления X1 означает F. В одном варианте осуществления X1 означает Br. В одном варианте осуществления X1 означает I. В одном варианте осуществления X1 означает этинил. В одном варианте осуществления X1 означает CF2H. В одном варианте осуществления X1 означает OCF2H. В одном варианте осуществления X1 означает OCF3. В одном варианте осуществления X1 означает CN. В одном варианте осуществления X1 означает CONH2. В одном варианте осуществления X1 означает CO2H. В одном варианте осуществления X1 означает CO2CH3. В одном варианте осуществления X1 означает NO2.
В некоторых вариантах осуществления X1 означает H, F, Br, I, этинил, CF2H, OCF2H, OCF3, CN, CONH2, CO2CH3 или NO2.
В некоторых вариантах осуществления X1 означает F. В некоторых вариантах осуществления X1 означает Br или I.
В одном варианте осуществления X2 означает H. В одном варианте осуществления X2 означает F. В одном варианте осуществления X2 означает Cl. В одном варианте осуществления X2 означает Br. В одном варианте осуществления X2 означает I. В одном варианте осуществления X2 означает этинил. В одном варианте осуществления X2 означает CH3. В одном варианте осуществления X2 означает CFH2. В одном варианте осуществления X2 означает CF2H. В одном варианте осуществления X2 означает CF3. В одном варианте осуществления X2 означает OCF2H. В одном варианте осуществления X2 означает OCF3. В одном варианте осуществления X2 означает CN. В одном варианте осуществления X2 означает CONH2. В одном варианте осуществления X2 означает CO2H. В одном варианте осуществления X2 означает NO2.
В некоторых вариантах осуществления X2 означает H, Cl, Br, I, этинил, CH3, CF2H, CF3, OCF2H или CN.
В некоторых вариантах осуществления X2 означает H, F, Br, I, этинил, CH3, CF3, OCF2H или CN.
В некоторых вариантах осуществления X2 означает F или Cl. В некоторых вариантах осуществления X2 означает Br или I.
В одном варианте осуществления X3 означает H. В одном варианте осуществления X3 означает F. В одном варианте осуществления X3 означает Br. В одном варианте осуществления X3 означает I. В одном варианте осуществления X3 означает этинил. В одном варианте осуществления X3 означает CH3. В одном варианте осуществления X3 означает CFH2. В одном варианте осуществления X3 означает CF2H. В одном варианте осуществления X3 означает CF3. В одном варианте осуществления X3 означает OCF2H. В одном варианте осуществления X3 означает OCF3. В одном варианте осуществления X3 означает CN. В одном варианте осуществления X3 означает CONH2. В одном варианте осуществления X3 означает CO2H. В одном варианте осуществления X3 означает NO2.
В некоторых вариантах осуществления X3 означает H, Br, I, этинил, OCF2H, CN или NO2.
В некоторых вариантах осуществления X3 означает H, F, Br, I, CH3, CF2H, CF3, OCF2H или CN.
В некоторых вариантах осуществления X3 означает F или Cl. В некоторых вариантах осуществления X3 означает Br или I.
В одном варианте осуществления, если Ar означает 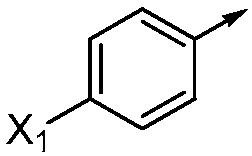 , то X означает N, CH, CF, CCl или CCH3, при условиях, что:
, то X означает N, CH, CF, CCl или CCH3, при условиях, что:
R2 не означает Cl или винил, если X означает N;
X1 не означает H, F, OCF3 или CN, если R2 означает Cl и X означает CH;
X1 не означает F, I, CN или этинил, если R2 означает OCH3 и X означает CF; и
X1 не означает H, если X означает CCl.
В одном варианте осуществления, если Ar означает 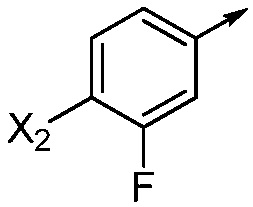 , то X означает N, CH, CF, CCl или CCH3, при условиях, что:
, то X означает N, CH, CF, CCl или CCH3, при условиях, что:
R2 не означает Cl, если X означает N;
X2 не означает Cl, если R2 означает OCH3 или винил и X означает N;
X2 не означает Cl, если R2 означает Cl и X означает CH; и
X2 не означает Cl, Br, I или CF3, если R2 означает OCH3 и X означает CF.
В одном варианте осуществления, если Ar означает 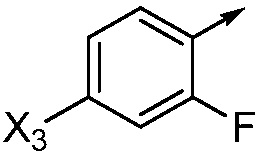 , то X означает N, CH или CF, при условиях, что:
, то X означает N, CH или CF, при условиях, что:
R2 не означает Cl, если X означает N;
X3 не означает CH3, если R2 означает OCH3 и X означает N;
X3 не означает H, F или CH3, если R2 означает Cl и X означает CH; и
X3 не означает Br или I, если R2 означает OCH3 и X означает CF.
В одном варианте осуществления, если Ar означает 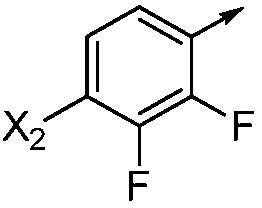 , то X означает N, CH или CF, при условиях, что:
, то X означает N, CH или CF, при условиях, что:
R2 не означает Cl, если X означает N;
X2 не означает Cl, если R2 означает OCH3 или винил и X означает N;
X2 не означает F, если R2 означает Cl и X означает CH; и
X2 не означает Cl, Br, I или CF3, если R2 означает OCH3 и X означает CF.
В одном варианте осуществления, если Ar означает 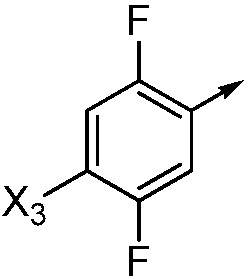 , то X означает N, CH или CF, при условии, что:
, то X означает N, CH или CF, при условии, что:
X3 не означает CH3, если R2 означает Cl и X означает N; и
X3 не означает Br или I, если X означает CF и R2 означает OCH3.
В одном варианте осуществления, если Ar означает 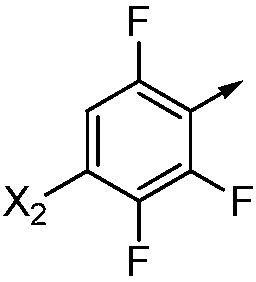 , то X означает N, CH или CF.
, то X означает N, CH или CF.
Любая из комбинаций Ar, X, Y, R1, R2, R3, R4, R1′, R1″, R2″, R17, R18, R19, R20, R21, R3′, R4′, Ar1, Ar2, Ar3, Ar4, Ar5, Ar6, X1, X2 и/или X3, и/или других заместителей, описанных в настоящем изобретении, входит в объем настоящего изобретения и специально включена в настоящее изобретение.
СПОСОБЫ ПОЛУЧЕНИЯ СОЕДИНЕНИЙ
Ниже приведены типичные процедуры синтеза соединений формулы (I).
3,5-Дизамещенные-4-амино-6-(необязательно замещенный фенил)пиколиновые кислоты формулы (I) можно получить разными путями. Как показано на схеме I, 4-амино-6-хлорпиколинаты формулы (II) можно превратить в 4-амино-6-замещенные пиколинаты формулы (III), в которой Ar является таким, как определено в настоящем изобретении, с помощью сочетания по Судзуки с бороновой кислотой или ее эфиром в присутствии основания, такого как фторид калия, и катализатора, такого как бис(трифенилфосфин)-палладий(II) дихлорид, в смеси полярного и протонного растворителя, такой как ацетонитрил-вода, при температуре, такой как равная 110°C, например, в микроволновом реакторе (реакция a1). 4-Амино-6-замещенные пиколинаты формулы (III) можно превратить в 5-йод-4-амино-6-замещенные пиколинаты формулы (IV) по реакции с йодирующими реагентами, такими как йодная кислота и йод, в полярном протонном растворителе, таком как метиловый спирт (реакция b1). Сочетание по Стилле 5-йод-4-амино-6-замещенных пиколинатов формулы (IV) со станнаном, таким как тетраметилолово, в присутствии катализатора, такого как бис(трифенилфосфин)-палладий(II) дихлорид, в нереакционноспособном растворителе, таком как 1,2-дихлорэтан, при температуре, такой как равная 120-130°C, например, в микроволновом реакторе, дает 5-(замещенные)-4-амино-6-замещенные пиколинаты формулы (I-A), в которой Z1 означает алкил, алкенил, алкинил, галогеналкенил и алкилтиогруппу (реакция c1).
Альтернативно, 4-амино-6-хлорпиколинаты формулы (II) можно превратить в 5-йод-4-амино-6-хлорпиколинаты формулы (V) по реакции с йодирующими реагентами, такими как йодная кислота и йод, в полярном протонном растворителе, таком как метиловый спирт (реакция b2). Сочетание по Стилле 5-йод-4-амино-6-хлорпиколинатов формулы (V) со станнаном, таким как тетраметилолово, в присутствии катализатора, такого как бис(трифенилфосфин)-палладий(II) дихлорид, в нереакционноспособном растворителе, таком как 1,2-дихлорэтан, при температуре, такой как равная 120-130°C, например, в микроволновом реакторе, дает 5-(замещенные)-4-амино-6-хлорпиколинаты формулы (VI), в которой Z1 означает алкил, алкенил, алкинил, галогеналкенил и алкилтиогруппу (реакция c2). 5-Замещенные-4-амино-6-хлорпиколинаты формулы (VI) можно превратить в 5-замещенные-4-амино-6-замещенные пиколинаты формулы (I-A), в которой Ar является таким, как определено в настоящем изобретении, с помощью сочетания по Судзуки с бороновой кислотой или ее эфиром в присутствии основания, такого как фторид калия, и катализатора, такого как бис(трифенилфосфин)-палладий(II) дихлорид, в смеси полярного и протонного растворителя, такой как ацетонитрил-вода, при температуре, такой как равная 110°C, например, в микроволновом реакторе (реакция a2).
Схема I
 .
.
Как показано на схеме II, 4,5,6-трихлорпиколинат формулы (VII) можно превратить в соответствующий изопропиловый эфир формулы (VIII) по реакции с изопропиловым спиртом и концентрированной серной кислотой, например, при кипячении с обратным холодильником при условиях Дина-Штарка (реакция d). Изопропиловый эфир формулы (VIII) можно ввести в реакцию с источником фторид-иона, таким как фторид цезия, в полярном апротонном растворителе, таком как диметилсульфоксид (ДМСО), при температуре, такой как равная 80°C, при условиях Дина-Штарка, и получить изопропил-4,5,6-трифторпиколинат формулы (IX) (реакция e). Изопропил-4,5,6-трифторпиколинат формулы (IX) можно аминировать с помощью источника азота, такого как аммиак, в полярном апротонном растворителе, таком как ДМСО, и получить 4-амино-5,6-дифторпиколинат формулы (X) (реакция f). Фторидный заместитель в положении 6 4-амино-5,6-дифторпиколината формулы (X) можно заменить на хлоридный заместитель путем обработки с помощью источника хлорида, такого как хлорид водорода, например, в диоксане, в реакторе Парра, при температуре, такой как равная 100°C, и получить 4-амино-5-фтор-6-хлорпиколинат формулы (XI) (реакция g). 4-Амино-5-фтор-6-хлорпиколинат формулы (XI) можно переэтерифицировать и получить соответствующий метиловый эфир формулы (XII) по реакции с изопропоксидом титана(IV) в метиловом спирте при кипячении с обратным холодильником (реакция h).
Схема II
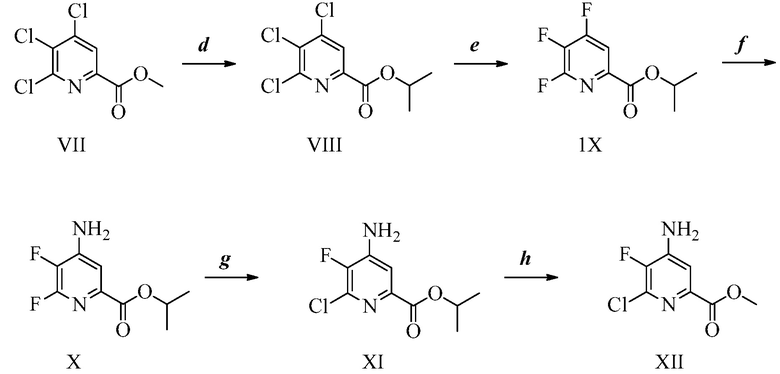 .
.
Как показано на схеме III, 4-амино-5-фтор-6-хлорпиколинат формулы (XII) можно превратить в 3-йод-4-амино-5-фтор-6-хлорпиколинат формулы (XIII) по реакции с йодирующими реагентами, такими как йодная кислота и йод, в полярном протонном растворителе, таком как метиловый спирт (реакция b3). Сочетание по Стилле 3-йод-4-амино-5-фтор-6-хлорпиколинатов формулы (XIII) со станнаном, таким как трибутил(винил)станнан, в присутствии катализатора, такого как бис(трифенилфосфин)-палладий(II) дихлорид, в нереакционноспособном растворителе, таком как 1,2-дихлорэтан, при температуре, такой как равная 120-130°C, например, в микроволновом реакторе, дает 3-(замещенные)-4-амино-5-фтор-6-хлорпиколинаты формулы (XIV), где R2 означает алкил, алкенил, алкинил, галогеналкенил и алкилтиогруппу (реакция c3). Альтернативно, 3-йод-4-амино-5-фтор-6-хлорпиколинаты формулы (XIII) можно обработать карбонатом цезия и каталитическими количествами йодида меди(I) и 1,10-фенантролина в присутствии полярного протонного растворителя, такого как метиловый спирт, при температуре, такой как равная 65°C, и получить 3-(замещенные)-4-амино-5-фтор-6-хлорпиколиновые кислоты формулы (XIV), в которой R2 означает алкоксигруппу или галогеналкоксигруппу (реакция i1), которые можно этерифицировать и получить метиловые эфиры, например, путем обработки хлоридом водорода (газообразным) и метиловым спиртом при температуре, равной 50°C (реакция j1). 3-(Замещенные)-4-амино-5-фтор-6-хлорпиколинаты формулы (XIV) можно превратить в 4-амино-6-замещенные пиколинаты формулы (I-B), в которой Ar является таким, как определено в настоящем изобретении, с помощью сочетания по Судзуки с бороновой кислотой или ее эфиром в присутствии основания, такого как фторид калия, и катализатора, такого как бис(трифенилфосфин)-палладий(II) дихлорид, в смеси полярного и протонного растворителя, такой как ацетонитрил-вода, при температуре, такой как равная 110°C, например, в микроволновом реакторе (реакция a3).
Альтернативно, 4-амино-5-фтор-6-хлорпиколинаты формулы (XII) можно превратить в 4-амино-5-фтор-6-замещенные пиколинаты формулы (XV), в которой Ar является таким, как определено в настоящем изобретении, с помощью сочетания по Судзуки с бороновой кислотой или ее эфиром в присутствии основания, такого как фторид калия, и катализатора, такого как бис(трифенилфосфин)-палладий(II) дихлорид, в смеси полярного и протонного растворителя, такой как ацетонитрил-вода, при температуре, такой как равная 110°C, например, в микроволновом реакторе (реакция a4). 4-Амино-5-фтор-6-замещенные пиколинаты формулы (XV) можно превратить в 3-йод-4-амино-5-фтор-6-замещенные пиколинаты формулы (XVI) по реакции с йодирующими реагентами, такими как йодная кислота и йод, в полярном протонном растворителе, таком как метиловый спирт (реакция b4). Сочетание по Стилле 3-йод-4-амино-5-фтор-6-замещенных пиколинатов формулы (XVI) со станнаном, таким как трибутил(винил)станнан, в присутствии катализатора, такого как бис(трифенилфосфин)-палладий(II) дихлорид, в нереакционноспособном растворителе, таком как 1,2-дихлорэтан, при температуре, такой как равная 120-130°C, например, в микроволновом реакторе, дает 3-(замещенные)-4-амино-5-фтор-6-замещенные пиколинаты формулы (I-B), где R2 означает алкил, алкенил, алкинил, галогеналкенил и алкилтиогруппу (реакция c4). Альтернативно, 3-йод-4-амино-5-фтор-6-замещенные пиколинаты формулы (XVI) можно обработать карбонатом цезия и каталитическими количествами йодида меди(I) и 1,10-фенантролина в присутствии полярного протонного растворителя, такого как метиловый спирт, при температуре, такой как равная 65°C, и получить 3-(замещенные)-4-амино-5-фтор-6-замещенные пиколиновые кислоты формулы (I-B), где R2 означает алкоксигруппу или галогеналкоксигруппу (реакция i2), которые можно этерифицировать и получить метиловые эфиры, например, путем обработки хлоридом водорода (газообразным) и метиловым спиртом при температуре, такой как равная 50°C (реакция j2).
Схема III
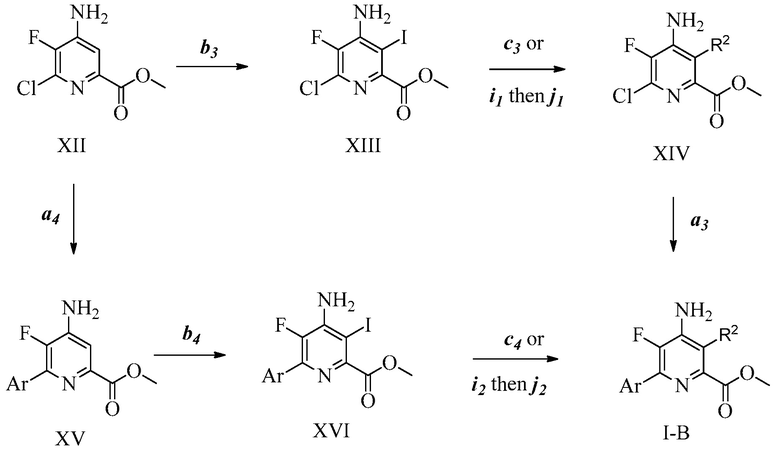 .
.
Как показано на схеме IV, 4-ацетамидо-6-(триметилстаннил)пиколинаты формулы (XVII) можно превратить в 4-ацетамидо-6-замещенные пиколинаты формулы (XVIII), в которой Ar является таким, как определено в настоящем изобретении, с помощью сочетания по Стилле с арилбромидом или арилйодидом в присутствии катализатора, такого как бис(трифенилфосфин)-палладий(II) дихлорид, в растворителе, таком как 1,2-дихлорэтан, например, при кипячении с обратным холодильником (реакция k). 4-Амино-6-замещенные пиколинаты формулы (I-C), в которой Ar является таким, как определено в настоящем изобретении, можно синтезировать из 4-ацетамидо-6-замещенные пиколинаты формулы (XVIII) по стандартным методикам удаления защитных групп, таким как проводимые с использованием газообразной хлористоводородной кислоты в метаноле (реакция l).
Схема IV
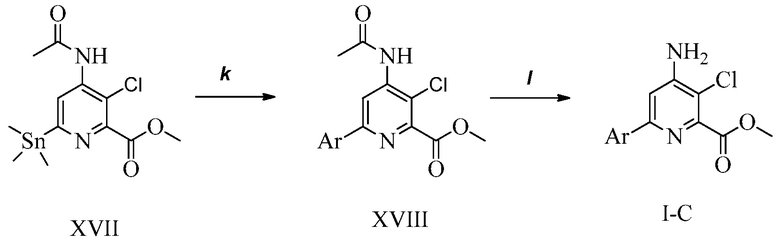 .
.
Как показано на схеме V, 2,4-дихлор-5-метоксипиримидин (XIX) можно превратить в 2,4-дихлор-5-метокси-6-винилпиримидин (XX) по реакции с винилмагнийбромидом в полярном апротонном растворителе, таком как тетрагидрофуран (реакция m). 2,4-Дихлор-5-метокси-6-винилпиримидин (XX) можно превратить в 2,6-дихлор-5-метоксипиримидин-4-карбоксальдегид (XXI) путем обработки озоном, например, в смеси растворителей дихлорметан:метанол (реакция n). 2,6-Дихлор-5-метоксипиримидин-4-карбоксальдегид (XXI) можно превратить в метил-2,6-дихлор-5-метоксипиримидин-4-карбоксилат (XXII) путем обработки бромом, например, в смеси растворителей метанол:вода (реакция o). Метил-2,6-дихлор-5-метоксипиримидин-4-карбоксилат (XXII) можно превратить в метил-6-амино-2-хлор-5-метоксипиримидин-4-карбоксилат (XXIII) путем обработки аммиаком (например, 2 экв.) в растворителе, таком как ДМСО (реакция p). В заключение, 6-амино-2-замещенные-5-метоксипиримидин-4-карбоксилаты формулы (I-D), в которой Ar является таким, как определено в настоящем изобретении, можно получить с помощью сочетания по Судзуки бороновой кислоты или ее эфира с 6-амино-2-хлор-5-метоксипиримидин-4-карбоксилатом (XXIII) в присутствии основания, такого как фторид калия, и катализатора, такого как бис(трифенилфосфин)-палладий(II) дихлорид, в смеси полярного и протонного растворителя, такой как ацетонитрил-вода, при температуре, такой как равная 110°C, например, в микроволновом реакторе (реакция a5).
Схема V
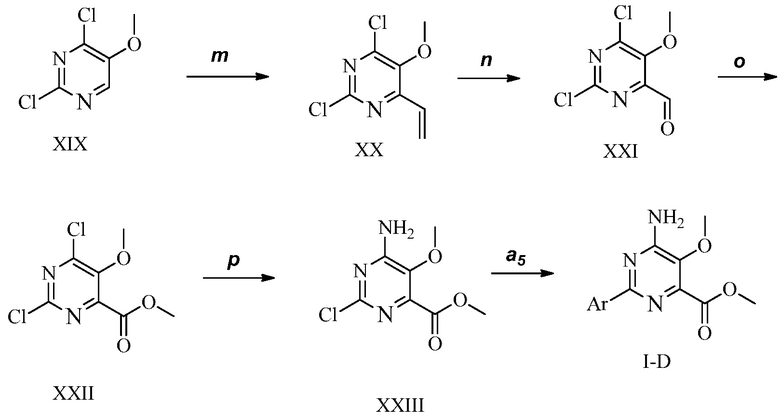 .
.
Соединения формул I-A, I-B, I-C и I-D, полученные по любой из этих методик, можно выделить по обычным методикам и очистить по стандартным методикам, например, с помощью перекристаллизации или хроматографии. Соединения формулы (I) можно получить из соединений формул I-A, I-B, I-C и I-D по стандартным методикам, хорошо известным в данной области техники.
КОМПОЗИЦИИ И СПОСОБЫ
В некоторых вариантах осуществления соединения, предлагаемые в настоящем изобретении, используют в смесях, содержащих гербицидно-эффективное количество соединения вместе по меньшей мере с одним сельскохозяйственно-приемлемым вспомогательным веществом или носителем. Типичные вспомогательные вещества или носители включают такие, которые не являются фитотоксичными или не являются значительно фитотоксичными по отношению к ценным сельскохозяйственным культурам, например, в концентрациях, использующихся при нанесении композиций для селективной борьбы с сорняками в присутствии сельскохозяйственных культур, и/или химически не взаимодействуют или значительно не взаимодействуют с соединениями, предлагаемыми в настоящем изобретении, или другими ингредиентами композиции. Такие смеси можно разработать для нанесения непосредственно на сорняки или место их произрастания или они могут представлять собой концентраты или составы, которые перед нанесением разбавляют дополнительными носителями и вспомогательными веществами. Они могут быть твердыми веществами, такими как, например, дусты, гранулы, диспергирующиеся в воде гранулы или смачивающиеся порошки, или жидкостями, такими как, например, эмульгирующиеся концентраты, растворы, эмульсии или суспензии. Кроме того, они могут поставляться в виде премикса или представлять собой баковую смесь.
Подходящие сельскохозяйственные вспомогательные вещества и носители, которые используют для приготовления гербицидных смесей, , предлагаемых в настоящем изобретении, хорошо известны специалистам в данной области техники. Некоторые из этих вспомогательных веществ включают, но не ограничиваются только ими, концентрат растительного масла (минеральное масло (85%) + эмульгаторы (15%)); нонилфенолэтоксилат; четвертичную бензилкокоалкилдиметиламмониевую соль; смесь углеводородов нефти, алкиловых сложных эфиров, органической кислоты и анионогенного поверхностно-активного вещества; C9-C11-алкилполигликозид; фосфатированный этоксилат спирта; этоксилат природного первичного спирта (C12-C16); привитый ди-втор-бутилфенолом блок-сополимер ЭО-ПО (этиленоксид-пропиленоксид); полисилоксанметиловый кэп; нонилфенолэтоксилат + мочевина + нитрат аммония; эмульгированное метилированное растительное масло; этоксилат тридецилового спирта (синтетический) (8 звеньев ЭО); таллоуаминэтоксилат (15 звеньев ЭО); PEG(400) диолеат-99.
Жидкие носители, которые можно использовать, включают воду и органические растворители. Обычно использующиеся органические растворители включают, но не ограничиваются только ими, фракции нефти или углеводороды, такие как минеральное масло, ароматические растворители, парафиновые масла и т.п.; растительные масла, такие как соевое масло, рапсовое масло, оливковое масло, касторовое масло, подсолнечное масло, кокосовое масло, кукурузное масло, хлопковое масло, льняное масло, пальмовое масло, арахисовое масло, сафлоровое масло, кунжутное масло, тунговое масло и т.п.; сложные эфиры указанных выше растительных масел; сложные эфиры одноатомных или двухатомных, трехатомных или других низших многоатомных спиртов (содержащих 4-6 гидроксигрупп), такие как 2-этилгексилстеарат, н-бутилолеат, изопропилмиристат, пропиленгликольдиолеат, диоктилсукцинат, дибутиладипат, диоктилфталат и т.п.; эфиры одно-, двух- и многоосновных карбоновых кислот и т.п. Конкретные органические растворители включают толуол, ксилол, петролейный эфир, растительное масло, ацетон, метилэтилкетон, циклогексанон, трихлорэтилен, перхлорэтилен, этилацетат, амилацетат, бутилацетат, монометиловый эфир пропиленгликоля и монометиловый эфир диэтиленгликоля, метиловый спирт, этиловый спирт, изопропиловый спирт, амиловый спирт, этиленгликоль, пропиленгликоль, глицерин, N-метил-2-пирролидинон, N,N-диметилалкиламиды, диметилсульфоксид, жидкие удобрения и т.п. В некоторых вариантах осуществления в качестве носителя для разбавления концентратов используют воду.
Подходящие твердые носители включают тальк, пирофиллитовую глину, диоксид кремния, аттапульгитовую глину, каолиновую глину, кизельгур, мел, диатомовую землю, известь, карбонат кальция, бентонитовую глину, фуллерову землю, шелуху семян хлопчатника, пшеничную муку, соевую муку, пемзу, древесную муку, муку орехового дерева, лигнин и т.п.
В некоторых вариантах осуществления в композициях, предлагаемых в настоящем изобретении, используют одно или большее количество поверхностно-активных веществ. Такие поверхностно-активные вещества в некоторых вариантах осуществления используют и в твердых, и в жидких композициях, например, в предназначенных для разбавления носителем перед нанесением. Поверхностно-активные вещества по характеру могут быть анионогенными, катионогенными или неионогенными и их можно использовать в качестве эмульгирующих агентов, смачивающих агентов, суспендирующих агентов или для других целей. Поверхностно-активные вещества, которые обычно используют для приготовления составов и которые также можно использовать в составах, предлагаемых в настоящем изобретении, описаны, в частности, в публикациях McCutcheon’s Detergents and Emulsifiers Annual, MC Publishing Corp., Ridgewood, New Jersey, 1998, и Encyclopedia of Surfactants, Vol. I-III, Chemical Publishing Co., New York, 1980-81. Типичные поверхностно-активные вещества включают алкилсульфаты, такие как диэтаноламонийлаурилсульфат; алкиларилсульфонаты, такие как додецилбензолсульфонат кальция; продукты присоединения алкилфенол-алкиленоксид, такие как нонилфенол-C18-этоксилат; продукты присоединения спирт-алкиленоксид, такие как тридециловый спирт-C16-этоксилат; мыла, такие как стеарат натрия; алкилнафталинсульфонаты, такие как дибутилнафталинсульфонат натрия; диалкиловые эфиры сульфосукцинатов, такие как ди(2-этилгексил)сульфосукцинат натрия; сложные эфиры сорбита, такие как сорбитолеат; четвертичные амины, такие как лаурилтриметиламмонийхлорид; полиэтиленгликолевые эфиры жирных кислот, такие как стеарат полиэтиленгликоля; блок-сополимеры этиленоксида и пропиленоксида; соли моно- и диалкилфосфатов; растительные масла или масла из семян растений, такие как соевое масло, рапсовое масло/масло канолы, оливковое масло, касторовое масло, подсолнечное масло, кокосовое масло, кукурузное масло, хлопковое масло, льняное масло, пальмовое масло, арахисовое масло, сафлоровое масло, кунжутное масло, тунговое масло и т.п.; и сложные эфиры указанных выше растительных масел, например, метиловые эфиры.
Часто некоторые из этих веществ, такие как растительные масла или масла из семян растений и их сложные эфиры, можно использовать взаимозаменяемым образом в качестве сельскохозяйственного вспомогательного вещества, в качестве жидкого носителя или в качестве поверхностно-активного вещества.
Другие вспомогательные вещества, обычно использующиеся в сельскохозяйственных композициях, включают агенты, обеспечивающие совместимость, противовспенивающие агенты, связывающие агенты, нейтрализующие агенты и буферы, ингибиторы коррозии, красители, отдушки, агенты, усиливающие растекание, средства, способствующие проницаемости, агенты, придающие липкость, диспергирующие агенты, загущающие агенты, агенты, снижающие температуру замерзания, противомикробные агенты и т.п. Композиции также могут содержать другие совместимые компоненты, например, другие гербициды, регуляторы роста растений, фунгициды, инсектициды и т.п., и могут готовиться вместе с жидкими удобрениями или твердыми, измельченными удобрениями-носителями, такими как нитрат аммония, мочевина и т.п.
Концентрация активных ингредиентов в композициях, предлагаемых в настоящем изобретении, обычно равна от примерно 0,001 до примерно 98 масс.%. Часто используют концентрации, равные от примерно 0,01 до примерно 90 масс.%. В композициях, предназначенных для использования в виде концентратов, активные ингредиенты обычно содержатся в концентрации, равной от примерно 5 до примерно 98 масс.%, предпочтительно от примерно 10 до примерно 90 масс.%. Такие композиции перед использованием обычно разбавляют инертным носителем, таким как вода. Разбавленные композиции, которые обычно наносят на сорняки или место произрастания сорняков, обычно содержат от примерно 00001 до примерно 1 масс.% активного ингредиента и предпочтительно содержат примерно от 0,001 до примерно 0,05 масс.%.
Композиции, предлагаемые в настоящем изобретении, можно наносить на сорняки или место их произрастания с помощью обычных наземных или авиационных опыливателей, разбрызгивателей и устройств для внесения гранул, путем добавления в воду для орошения или в затопляемое рисовое поле и с помощью других обычных средств, известных специалистам в данной области техники.
В некоторых вариантах осуществления соединения и композиции, описанные в настоящем изобретении, наносят путем послевсходового нанесения, довсходового нанесения, внесения в воду на затопляемое рисовое поле или в водоемы (например, пруды, озера и водотоки), или нанесения до полного уничтожения.
В некоторых вариантах осуществления соединения и композиции, предлагаемые в настоящем изобретении, используют для борьбы с сорняками в сельскохозяйственных культурах, включая, но не ограничиваясь только ими, цитрусовые, яблони, каучуконосы, масличные, пальмы, леса, посеянные семенами, посеянные в затопленное поле и пересаженный рис, пшеницу, ячмень, овес, рожь, сорго, кукурузу/маис, выгоны, сенокосные угодья, пастбища, землю под паром, дерн, деревья и виноград, водные растения, или пропашные культуры, а также для борьбы растительностью на незасеянных участках, например, на промышленных территориях (IVM) и полосах отчуждения. В некоторых вариантах осуществления соединения и композиции используют для борьбы с древесными растениями, широколиственными и травянистыми сорняками или осоковыми.
В некоторых вариантах осуществления композиции и способы, предлагаемые в настоящем изобретении, используют для борьбы с нежелательной растительностью в рисе. В некоторых вариантах осуществления нежелательной растительностью является Brachiaria platyphylla (Groseb.) Nash (ветвянка широколистная, BRAPP), Digitaria sanguinalis (L.) Scop. (росичка кровяная, DIGSA), Echinochloa crus-galli (L.) P. Beauv. (просо куриное, ECHCG), Echinochloa colonum (L.) LINK (ежовник крестьянский, ECHCO), Echinochloa oryzoides (Ard.) Fritsch (ежовник рисовидный, ECHOR), Echinochloa oryzicola (Vasinger) Vasinger (ежовник бородчатый, ECHPH), Ischaemum rugosum Salisb. (исхемум, ISCRU), Leptochloa chinensis (L.) Nees (лептохлоя китайская, LEFCH), Leptochloa fascicularis (Lam.) Gray (лептохлоя, LEFFA), Leptochloa panicoides (Presl.) Hitchc. (вид лептохлои, LEFPA), Panicum dichotomiflorum (L.) Michx. (просо раздвоенноцветковое, PANDI), Paspalum dilatatum Poir. (паспалум расширенный, PASDI), Cyperus difformis L. (сыть разнородная, CYPDI), Cyperus esculentus L. (сыть съедобная, CYPES), Cyperus iria L. (сыть ирия, CYPIR), Cyperus rotundus L. (сыть круглая, CYPRO), виды Eleocharis (ELOSS), Fimbristylis miliacea (L.) Vahl (фимбристилис, FIMMI), Schoenoplectus juncoides Roxb. (камыш ситниковидный, SCPJU), Schoenoplectus maritimus L. (схеноплектус морской, SCPMA), Schoenoplectus mucronatus L. (схеноплектус остроконечный, SCPMU), виды Aeschynomene (копеечник виргинский, AESSS), Alternanthera philoxeroides (Mart.) Griseb. (очереднопыльник филоксеровый, ALRPH), Alisma plantago-aquatica L. (частуха подорожниковая, ALSPA), виды Amaranthus, (маревые и амарантовые, AMASS), Ammannia coccinea Rottb. (аммания, AMMCO), Eclipta alba (L.) Hassk. (эклипта белая, ECLAL), Heteranthera limosa (SW.) Willd./Vahl (гетерантера илистая, HETLI), Heteranthera reniformis R. & P. (гетерантера почковидная, HETRE), Ipomoea hederacea (L.) Jacq. (ипомея плющевидная, IPOHE), Lindernia dubia (L.) Pennell (линдерния, LIDDU), Monochoria korsakowii Regel & Maack (монохория, MOOKA), Monochoria vaginalis (Burm. F.) C. Presl ex Kuhth, (монохория, MOOVA), Murdannia nudiflora (L.) Brenan (мурданния узлоцветковая, MUDNU), Polygonum pensylvanicum L. (горец пенсильванский, POLPY), Polygonum persicaria L. (горец почечуйный, POLPE), Polygonum hydropiperoides Michx. (водяной перец, POLHP), Rotala indica (Willd.) Koehne (ротала индийская, ROTIN), виды Sagittaria (стрелолист, SAGSS), Sesbania exaltata (Raf.) Cory/Rydb. Ex Hill (сесбания рослая, SEBEX) или Sphenoclea zeylanica Gaertn. (сфеноклея цейлонская, SPDZE).
В некоторых вариантах осуществления композиции и способы, предлагаемые в настоящем изобретении, используют для борьбы с нежелательной растительностью в злаковых культурах. В некоторых вариантах осуществления нежелательной растительностью является Alopecurus myosuroides Huds. (лисохвост мышехвостниковидный, ALOMY), Apera spica-venti (L.) Beauv. (метлица обыкновенная, APESV), Avena fatua L. (овсюг, AVEFA), Bromus tectorum L. (костер кровельный, BROTE), Lolium multiflorum Lam. (райграс итальянский, LOLMU), Phalaris minor Retz. (канареечник малый, PHAMI), Poa annua L. (мятлик однолетний, POAAN), Setaria pumila (Poir.) Roemer & J.A. Schultes (желтый щетинник, SETLU), Setaria viridis (L.) Beauv. (зеленый щетинник, SETVI), Cirsium arvense (L.) Scop. (бодяк полевой, CIRAR), Galium aparine L. (подмаренник цепкий, GALAP), Kochia scoparia (L.) Schrad. (кохия, KCHSC), Lamium purpureum L. (яснотка пурпурная, LAMPU), Matricaria recutita L. (ромашка аптечная, MATCH), Matricaria matricarioides (Less.) Porter (ромашка пахучая, MATMT), Papaver rhoeas L. (мак самосейка, PAPRH), Polygonum convolvulus L. (горец вьющийся, POLCO), Salsola tragus L. (солянка сорная, SASKR), Stellaria media (L.) Vill. (звездчатка средняя, STEME), Veronica persica Poir. (вероника персидская, VERPE), Viola arvensis Murr. (фиалка полевая, VIOAR) или Viola tricolor L. (фиалка трехцветная, VIOTR).
В некоторых вариантах осуществления соединения и композиции, предлагаемые в настоящем изобретении, используют для борьбы с нежелательной растительностью на выгонах и пастбищах. В некоторых вариантах осуществления нежелательной растительностью является Ambrosia artemisiifolia L. (амброзия полынолистная, AMBEL), Cassia obtusifolia (кассия туполистная, CASOB), Centaurea maculosa auct. non Lam. (василек пятнистый, CENMA), Cirsium arvense (L.) Scop. (бодяк полевой, CIRAR), Convolvulus arvensis L. (вьюнок полевой, CONAR), Euphorbia esula L. (молочай острый, EPHES), Lactuca serriola L./Torn. (латук компасный, LACSE), Plantago lanceolata L. (подорожник ланцетолистный, PLALA), Rumex obtusifolius L. (щавель туполистный, RUMOB), Sida spinosa L. (сида колючая, SIDSP), Sinapis arvensis L. (горчица полевая, SINAR), Sonchus arvensis L. (осот полевой, SONAR), виды Solidago (золотарник, SOOSS), Taraxacum officinale G.H. Weber ex Wiggers (одуванчик аптечный, TAROF), Trifolium repens L. (клевер белый, TRFRE) или Urtica dioica L. (крапива двудомная, URTDI).
В некоторых вариантах осуществления соединения и композиции, предлагаемые в настоящем изобретении, используют для борьбы с нежелательной растительностью, обнаруживаемой в пропашных культурах. В некоторых вариантах осуществления нежелательной растительностью является Alopecurus myosuroides Huds. (лисохвост мышехвостниковидный, ALOMY), Avena fatua L. (овсюг, AVEFA), Brachiaria platyphylla (Groseb.) Nash (ветвянка широколистная, BRAPP), Digitaria sanguinalis (L.) Scop. (росичка кровяная, DIGSA), Echinochloa crus-galli (L.) P. Beauv. (просо куриное, ECHCG), Echinochloa colonum (L.) Link (ежовник крестьянский, ECHCO), Lolium multiflorum Lam. (райграс итальянский, LOLMU), Panicum dichotomiflorum Michx. (просо раздвоенноцветковое, PANDI), Panicum miliaceum L. (просо обыкновенное, PANMI), Setaria faberi Herrm. (щетинник Фабера, SETFA), Setaria viridis (L.) Beauv. (зеленый щетинник, SETVI), Sorghum halepense (L.) Pers. (джонсонова трава, SORHA), Sorghum bicolor (L.) Moench ssp. Arundinaceum (сорго травянистое, SORVU), Cyperus esculentus L. (сыть съедобная, CYPES), Cyperus rotundus L. (сыть круглая, CYPRO), Abutilon theophrasti Medik. (абутилон Теофраста, ABUTH), виды Amaranthus (маревые и амарантовые, AMASS), Ambrosia artemisiifolia L. (амброзия полынолистная, AMBEL), Ambrosia psilostachya DC. (амброзия голометельчатая, AMBPS), Ambrosia trifida L. (амброзия трехраздельная, AMBTR), Asclepias syriaca L. (ваточник сирийский, ASCSY), Chenopodium album L. (марь белая, CHEAL), Cirsium arvense (L.) Scop. (бодяк полевой, CIRAR), Commelina benghalensis L. (коммелина бенгальская, COMBE), Datura stramonium L. (дурман обыкновенный, DATST), Daucus carota L. (морковь дикая, DAUCA), Euphorbia heterophylla L. (молочай разнолистный, EPHHL), Erigeron bonariensis L. (мелколепестничек буэносайресский, ERIBO), Erigeron canadensis L. (мелколепестничек канадский, ERICA), Helianthus annuus L. (подсолнечник обыкновенный, HELAN), Jacquemontia tamnifolia (L.) Griseb. (джакемонтия тамнифолия, IAQTA), Ipomoea hederacea (L.) Jacq. (ипомея плющевидная, IPOHE), Ipomoea lacunosa L. (ипомея ямчатая, IPOLA), Lactuca serriola L./Torn. (латук компасный, LACSE), Portulaca oleracea L. (портулак огородный, POROL), Sida spinosa L. (сида колючая, SIDSP), Sinapis arvensis L. (горчица полевая, SINAR), Solanum ptychanthum Dunal (паслен черный восточный, SOLPT) или Xanthium strumarium L. (дурнишник обыкновенный, XANST).
В некоторых вариантах осуществления нормы расхода, равные от примерно 1 до примерно 4000 граммов/гектар (г/га), используют для послевсходовых операций. В некоторых вариантах осуществления нормы расхода, равные от примерно 1 до примерно 4000 г/га, используют для довсходовых операций.
В некоторых вариантах осуществления соединения, композиции и способы, предлагаемые в настоящем изобретении, используют вместе с одним или большим количеством других гербицидов для борьбы с более широким спектром нежелательной растительности. При использовании вместе с другими гербицидами соединения, предлагаемые в настоящем изобретении, можно приготовить в виде состава вместе с другим гербицидом или гербицидами, в виде баковой смеси с другим гербицидом или гербицидами или нанести последовательно вместе с другим гербицидом или гербицидами. Некоторые из гербицидов, которые можно использовать вместе с соединениями, предлагаемыми в настоящем изобретении, включают: 4-CPA, 4-CPB, 4-CPP, 2,4-D, соль 2,4-D холина, сложные эфиры и амины 2,4-D, 2,4-DB, 3,4-DA, 3,4-DB, 2,4-DEB, 2,4-DEP, 3,4-DP, 2,3,6-TBA, 2,4,5-T, 2,4,5-TB, ацетохлор, ацифлюорфен, аклонифен, акролеин, алахлор, аллидохлор, аллоксидим, аллиловый спирт, алорак, аметридион, аметрин, амбузин, амикарбазон, амидосульфурон, аминоциклопирахлор, аминопиралид, амипрофос-метил, амитрол, сульфамат аммония, анилофос, анисурон, асулам, атратон, атразин, азафенидин, азимсульфурон, азипротрин, барбан, BCPC, бефлубутамид, беназолин, бенкарбазон, бенфлуралин, бенфуресат, бенсульфурон-метил, бенсулид, бентиокарб, бентазон-натрий, бензадокс, бензфендизон, бензипрам, бензобициклон, бензофенап, бензофтор, бензоилпроп, бензтиазурон, бициклопирон, бифенокс, биланафос, биспирибак-натрий, буру, бромацил, бромбонил, бромобутид, бромфеноксим, бромоксинил, бромпиразон, бутахлор, бутафенацил, бутамифос, бутенахлор, бутидазол, бутиурон, бутралин, бутроксидим, бутурон, бутилат, какодиловую кислоту, кафенстрол, хлорат кальция, цианамид кальция, камбендихлор, карбасулам, карбетамид, карбоксазол, хлорпрокарб, карфентразон-этил, CDEA, CEPC, хлометоксифен, хлорамбен, хлоранокрил, хлоразифоп, хлоразин, хлорбромурон, хлорбуфам, хлорэтурон, хлорфенак, хлорфенпроп, хлорфлуразол, хлорфлуренол, хлоридазон, хлоримурон, хлорнитрофен, хлоропон, хлортолурон, хлороксурон, хлороксинил, хлорпрофам, хлорсульфурон, хлортал, хлортиамид, цинидон-этил, цинметилин, циносульфурон, цисанилид, клетодим, клиодинат, клодинафоп-пропаргил, клофоп, кломазон, кломепроп, клопроп, клопроксидим, клопиралид, клорансулам-метил, CMA, сульфат меди, CPMF, CPPC, кредазин, крезол, кумилурон, цианатрин, цианазин, циклоат, циклосульфамурон, циклоксидим, циклурон, цигалофоп-бутил, циперкват, ципразин, ципразол, ципромид, даимурон, далапон, дазомет, делахлор, десмедифам, десметрин, диаллат, дикамба, дихлобенил, дихлоральмочевина, дихлормат, дихлорпроп, дихлорпроп-P, диклофоп, диклосулам, диэтамкват, диэтатил, дифенопентен, дифеноксурон, дифензокват, дифлуфеникан, дифлубензопир, димефурон, димепиперат, диметахлор, диметаметрин, диметенамид, диметенамид-P, димексано, димидазон, динитрамин, динофенат, динопроп, диносам, диносеб, динотерб, дифенамид, дипропетрин, дикват, дисул, дитиопир, диурон, DMPA, DNOC, DSMA, EBEP, эглиназин, эндотал, эпроназ, EPTC, эрбон, эспрокарб, эталфлуралин, этбензамид, этаметсульфурон, этидимурон, этиолат, этобензамид, этобензамид, этофумезат, этоксифен, этоксисульфурон, этинофен, этнипромид, этобензанид, EXD, фенасулам, фенопроп, феноксапроп, феноксапроп-P-этил, феноксапроп-P-этил + изоксадифен-этил, феноксасульфон, фентеракол, фентиапроп, фентразамид, фенурон, сульфат железа(II), флампроп, флампроп-M, флазасульфурон, флорасулам, флуазифоп, флуазифоп-P-бутил, флуазолат, флукарбазон, флуцетосульфурон, флухлоралин, флуфенацет, флуфеникан, флуфенпир-этил, флуметсулам, флумезин, флумиклорак-пентил, флумиоксазин, флумипропин, флуометурон, фтордифен, фторгликофен, фтормидин, фторнитрофен, флуотиурон, флупоксам, флупропацил, флупропанат, флупирсульфурон, флуридон, флурохлоридон, флуроксипир, флуртамон, флутиацет, фомесафен, форамсульфурон, фосамин, фурилоксифен, глуфосинат, глуфосинат-аммоний, глифосат, галосафен, галосульфурон-метил, галоксидин, галоксифоп-метил, галоксифоп-P-метил, галауксифен-метил, гексахлорацетон, гексафлурат, гексазинон, имазаметабенз, имазамокс, имазапик, имазапир, имазахин, имазетапир, имазосульфурон, инданофан, индазифлам, йодобонил, йодметан, йодосульфурон, иофенсульфурон, иоксинил, ипазин, ипфенкарбазон, ипримидам, изокарбамид, изоцил, изометиозин, изонорурон, изополинат, изопропалин, изопротурон, изоурон, изоксабен, изоксахлортол, изоксафлутол, изоксапирифоп, карбутилат, кетоспирадокс, лактофен, ленацил, линурон, MAA, MAMA, сложные эфиры и амины MCPA, MCPA-тиоэтил, MCPB, мекопроп, мекопроп-P, мединотерб, мефенацет, мефлуидид, мезопразин, мезосульфурон, мезотрион, метам, метамифоп, метамитрон, метазахлор, метазосульфурон, метфлуразон, метабензтиазурон, металпропалин, метазол, метиобенкарб, метиозолин, метиурон, метометон, метопротрин, метилбромид, метилизотиоцианат, метилдимрон, метобензурон, метобромурон, метолахлор, метосулам, метоксурон, метрибузин, метсульфурон, молинат, моналид, монисоурон, монохлоруксусную кислоту, монолинурон, монурон, морфамкват, MSMA, напроанилид, напропамид, напропамид-M, напталам, небурон, никосульфурон, нипираклофен, нитралин, нитрофен, нитрофторфен, норфлуразон, норурон, OCH, орбенкарб, орто-дихлорбензол, ортосульфамурон, оризалин, оксадиаргил, оксадиазон, оксапиразон, оксасульфурон, оксазикломефон, оксифлуорфен, парафлуфен-этил, парафлурон, паракват, пебулат, пеларгоновую кислоту, пендиметалин, фенокссулам, пентахлорфенол, пентанохлор, пентоксазон, перфлуидон, пентоксамид, фенизофам, фенмедифам, фенмедифам-этил, фенобензурон, фенилмеркурацетат, пиклорам, пиколинафен, пиноксаден, пиперофос, арсенит калия, азид калия, цианат калия, претилахлор, примисульфурон-метил, проциазин, продиамин, профлуазол, профлуралин, профоксидим, проглиназин, прогександион-кальций, прометон, прометрин, пропахлор, пропанил, пропахизафоп, пропазин, профам, пропизохлор, пропоксикарбазон, пропирисульфурон, пропизамид, просульфалин, просульфокарб, просульфурон, проксан, принахлор, пиданон, пираклонил, пирафлуфен, пирасульфотол, пиразогил, пиразолинат, пиразосульфурон-этил, пиразоксифен, пирибензоксим, пирибутикарб, пириклор, пиридафол, пиридат, пирифталид, пириминобак, пиримисульфан, пиритиобак-метил, пироксасульфон, пироксулам, хинклорак, хинмерак, хинокламин, хинонамид, хизалофоп, хизалофоп-P-этил, родетанил, римсульфурон, сафлуфенацил, S-метолахлор, себутилазин, секбуметон, сетоксидим, сидурон, симазин, симетон, симетрин, SMA, арсенит натрия, азид натрия, хлорат натрия, сулкотрион, сульфаллат, сульфентразон, сульфометурон, сульфосат, сульфосульфурон, серную кислоту, сулгликапин, свеп, TCA, тебутам, тебутиурон, тефурилтрион, темботрион, тепралоксидим, тербацил, тербукарб, тербухлор, тербуметон, тербутилазин, тербутрин, тетрафлурон, тенилхлор, тиазафлурон, тиазопир, тидиазимин, тидиазурон, тиенкарбазон-метил, тифенсульфурон, тиобенкарб, тиокарбазил, тиоклорим, топрамезон, тралкоксидим, триафамон, три-аллат, триасульфурон, триазифлам, трибенурон, трикамба, сложные эфиры и амины триклопира, тридифан, триэтазин, трифлоксисульфурон, трифлуралин, трифлусульфурон, трифоп, трифопсим, тригидрокситриазин, триметурон, трипропиндан, тритак, тритосульфурон, вернолат и ксилахлор.
Соединения и композиции, предлагаемые в настоящем изобретении, для повышения их селективности обычно можно использовать в комбинации с известными антидотами гербицидов, такими как беноксакор, бентиокарб, брассинолид, клохинтоцет (например, мексил), циометринил, даимурон, дихлормид, дициклонон, димепиперат, дисульфотон, фенхлоразол-этил, фенклорим, флуразол, флуксофеним, фурилазол, белки гарпины, изоксадифен-этил, мефенпир-диэтил, MG 191, MON 4660, нафтойный ангидрид (NA), оксабетринил, R29148 и амиды N-фенилсульфонилбезойной кислоты.
Соединения, композиции и способы, описанные в настоящем изобретении, используют для борьбы с нежелательной растительностью в устойчивых по отношению к глифосату, устойчивых по отношению к глуфосинату, устойчивых по отношению к дикамба, устойчивых по отношению к феноксиауксину, устойчивых по отношению к пиридилоксиауксину, устойчивых по отношению к арилоксифеноксипропионату, устойчивых по отношению к ингибитору ацетил-CoA-карбоксилазы (ACCase), устойчивых по отношению к имидазолинону, устойчивых по отношению к ингибитору ацетолактатсинтазы (ALS), устойчивых по отношению к ингибитору 4-гидроксифенилпируватдиоксигеназы (HPPD), устойчивых по отношению к ингибитору протопорфириногеноксидазы (PPO), устойчивых по отношению к триазину и устойчивых по отношению к бромоксинилу сельскохозяйственных культурах (такие как, но не ограничиваясь только ими, соя, хлопчатник, канола/масличный рапс, рис, злаки, кукуруза, дерн и т.п.), например, вместе с глифосатом, глуфосинатом, дикамба, феноксиауксинами, пиридилоксиауксинами, арилоксифеноксипропионатами, ингибиторами ACCase, имидазолинонами, ингибиторами ALS, ингибиторами HPPD, ингибиторами PPO, триазинами и бромоксинилом. Композиции и способы можно использовать для борьбы с нежелательной растительностью в сельскохозяйственных культурах, обладающих многими или совмещенными признаками, придающими устойчивость по отношению к различным химикатам и/или ингибиторам, обладающим несколькими путями воздействия. Соединения и композиции, предлагаемые в настоящем изобретении, также можно использовать для борьбы с устойчивыми или стойкими по отношению к гербициду сорняками. Типичные устойчивые или стойкие сорняки включают, но не ограничиваются только ими, обладающие биотипом, характеризующимся устойчивостью или стойкостью по отношению к ингибиторам ацетолактатсинтазы (ALS), ингибиторам фотосистемы II, ингибиторам ацетил-CoA-карбоксилазы (ACCase), синтетическим ауксинам, ингибиторам фотосистемы I, ингибиторам 5-енолпирувилшикимат-3-фосфатсинтазы (EPSP), ингибиторам сборки микротрубочек, ингибиторам синтеза липидов, ингибиторам протопорфириногеноксидазы (PPO), ингибиторам биосинтеза каротиноидов, ингибиторам обладающих очень длинной цепью жирных кислот (VLCFA), ингибиторам фитоендесатуразы (PDS), ингибиторам глутаминсинтетазы, ингибиторам 4-гидроксифенилпируватдиоксигеназы (HPPD), ингибиторам митоза, ингибиторам биосинтеза целлюлозы, гербицидам, обладающим множеством типов воздействия, таким как хинклорак, и неклассифицированным гербицидам, таким как ариламинопропионовые кислоты, дифензокват, эндоталл и мышьякорганические соединения. Типичные устойчивые или стойкие сорняки включают, но не ограничиваются только ими, обладающие биотипами, характеризующимся устойчивостью или стойкостью по отношению ко многим гербицидам, многим классам химикатов и гербицидам, обладающим несколькими путями воздействия.
Описанные варианты осуществления и приведенные ниже примеры приведены только в иллюстративных целях и не предназначены для ограничения объема формулы изобретения. Для специалиста с общей подготовкой в данной области техники должны быть очевидны другие модификации, применения или комбинации композиций, описанных в настоящем изобретении, которые не отклоняются от сущности и объема заявленного объекта.
Примеры
СИНТЕЗ ПРЕДШЕСТВЕННИКОВ
Общие вопросы: Спектры фтора снимали при 376 МГц на спектрометре Bruker DRX400. Спектры получали с использованием трихлорфторметана (CFCl3) в качестве внутреннего стандарта и обычно с развязкой протонов.
Пример 1: Получение метил-4-амино-3,6-дихлорпиколинатаа (соединение A)
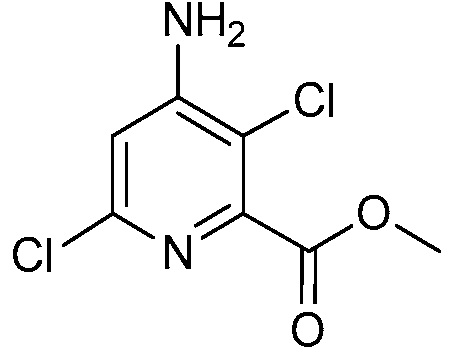 .
.
Получали, как описано в публикации Fields et al., WO 2001051468 A1.
Пример 2: Получение метил-4-амино-3,6-дихлор-5-фторпиколината (соединение B)
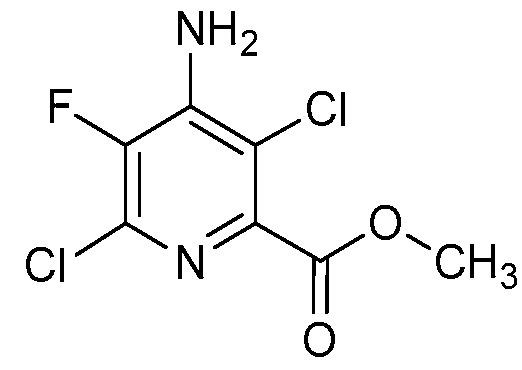 .
.
Получали, как описано в публикации Fields et al., Tetrahedron Letters 2010, 51, 79-81.
Пример 3: Получение 2,6-дихлор-5-метокси-4-винилпиримидина
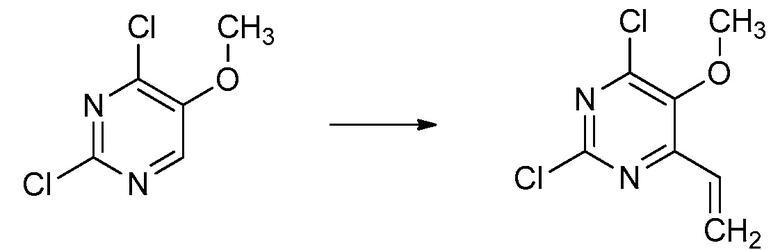 .
.
К раствору имеющегося в продаже 2,6-дихлор-5-метоксипиримидина (100 граммов (г), 0,55 моля в сухом тетрагидрофуране) в течение 1 часа (ч) при комнатной температуре по каплям добавляли 1-молярный (м) раствор винилмагнийбромида в тетрагидрофуране (124 г, 0,94 моля). Затем смесь перемешивали в течение 4 ч при комнатной температуре. Избыток реагента Гриньяра нейтрализовывали путем добавления ацетона (200 миллилитров (мл)) и температуру смеси поддерживали равной ниже 20°C. Затем одной порцией добавляли 2,3-дихлор-5,6-дициано-п-бензохинон (DDQ; 151 г, 0,67 моля) и перемешивали в течение ночи. Осаждалось желтое твердое вещество. Твердое вещество отфильтровывали и промывали этилацетатом (500 мл). Фильтрат концентрировали при пониженном давлении и полученное неочищенное вещество разбавляли этилацетатом (2 литра (л)). Полученное нерастворенное темное полужидкое вещество отделяли фильтрованием с использованием этилацетата. Его дополнительно концентрировали при пониженном давлении и получали неочищенное соединение, которое очищали с помощью колоночной хроматографии. Соединение элюировали с помощью от 5% до 10% смеси этилацетата с гексанами и получали искомое соединение (70 г, 60%): Температура плавления 60-61°C; 1H ЯМР (CDCl3) δ 3,99 (с, 3H), 5,85 (д, 1H), 6,75 (д, 1H), 6,95 (дд, 1H).
Пример 4: Получение 2,6-дихлор-5-метоксипиримидин-4-карбальдегида
 .
.
Раствор 2,6-дихлор-5-метокси-4-винилпиримидин (50 г, 0,24 моля) в смеси дихлорметан:метанол (4:1, 2 и) охлаждали до -78°C. В течение 5 ч через него пропускали озон. Реакцию останавливали диметилсульфидом (50 мл). Смесь медленно нагревали до комнатной температуры и концентрировали при пониженном давлении при 40°C и получали искомое соединение (50,5 г, 100%).
Пример 5: Получение метил-2,6-дихлор-5-метоксипиримидин-4-карбоксилата
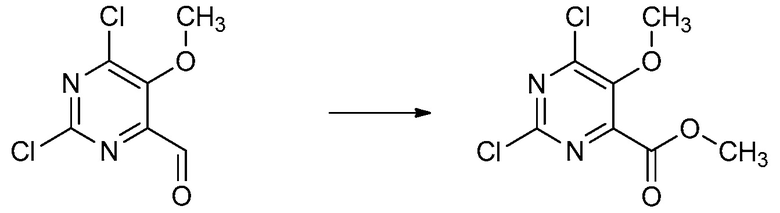 .
.
Готовили раствор 2,6-дихлор-5-метоксипиримидин-4-карбальдегида (50 г, 0,24 моля) в метаноле (1 л) и воде (60 мл). К раствору добавляли бикарбонат натрия (400 г). К раствору пиримидина в течение 45 мин (мин) при 0°C при перемешивании смеси по каплям добавляли 2 M раствор брома (192 г, 1,2 моля) в смеси метанол/вода (600 мл, 9:1 об./об.). Перемешивание продолжали при такой же температуре в течение 1 ч. Затем смесь перемешивали при комнатной температуре в течение 4 ч. Затем при перемешивании реакционную смесь выливали в смесь измельченного льда (2 л), бисульфита натрия (50 г) и хлорида натрия (NaCl; 200 г). Продукт экстрагировали этилацетатом (1 л×2) и объединенный органический слой сушили над сульфатом натрия (Na2SO4) и фильтровали. Выпаривание растворителя при пониженном давлении давало густое вещество, которое при длительном выдерживании затвердевало, и получали искомое соединение (50,8 г, 87%): ИЭРМС m/z 238 ([M+H]+).
Пример 6: Получение метил-6-амино-2-хлор-5-метоксипиримидин-4-карбоксилата (соединение C)
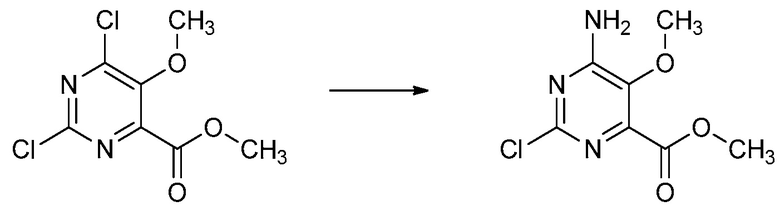 .
.
Готовили раствор метил-2,6-дихлор-5-метоксипиримидин-4-карбоксилата (25 г, 0,1 моля) и диметилсульфоксида (ДМСО). К этому раствору при 0-5°C добавляли раствор аммиака (2 эквивалента (экв.)) в ДМСО. Эту смесь перемешивали при такой же равной 0-5°C температуре в течение от 10 до 15 мин. Затем смесь разбавляли этилацетатом и полученное твердое вещество отфильтровывали. Этилацетатный фильтрат промывали рассолом и сушили над Na2SO4. После концентрирования получали неочищенный продукт. Неочищенный продукт перемешивали в минимальном количестве этилацетата и фильтровали и получали чистое соединение. Дополнительное количество чистого соединения получали из фильтрата, которое после концентрирования очищали с помощью флэш-хроматографии. Это давало искомое соединение (11 г, 50%): Температура плавления 158°C; 1H ЯМР (ДМСО-d6) δ 3,71 (с, 3H), 3,86 (с, 3H), 7,65 (ушир.с, 1H), 8,01 (ушир.с, 1H).
Пример 7: Получение метил-4-амино-3,6-дихлор-5-йодпиколината
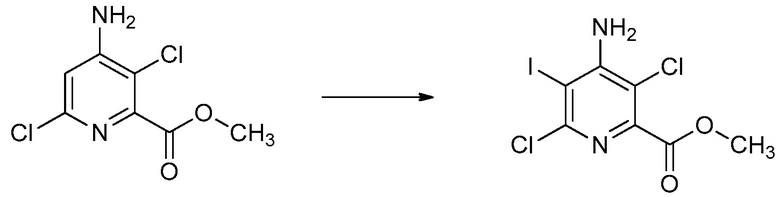 .
.
Метил-4-амино-3,6-дихлорпиколинат (10,0 г, 45,2 ммоля), йодную кислоту (3,93 г, 17,2 миллимолей (ммоля)) и йод (11,44 г, 45,1 ммоля) растворяли в метаноле (30 мл) и перемешивали при кипячении с обратным холодильником при 60°C в течение 27 ч. Реакционную смесь концентрировали, разбавляли диэтиловым эфиром и дважды промывали насыщенным водным раствором бисульфита натрия. Водные слои один раз экстрагировали диэтиловым эфиром и объединенные органические слои сушили над безводным Na2SO4. Продукт концентрировали и очищали с помощью флэш-хроматографии (силикагель; 0-50% этилацетат/гексаны) и получали искомое соединение в виде бледно-желтого твердого вещества (12,44 г, 79%): Температура плавления 130,0-131,5°C; 1H ЯМР (400 МГц, CDCl3) δ 5,56 (с, 2H), 3,97 (с, 3H); 13C ЯМР (101 МГц, CDCl3) δ 163,80, 153,00, 152,75, 145,63, 112,12, 83,91, 53,21; ИЭРМС m/z 346.
Пример 8: Получение метил-4-амино-3,6-дихлор-5-метилпиколината (соединение D)
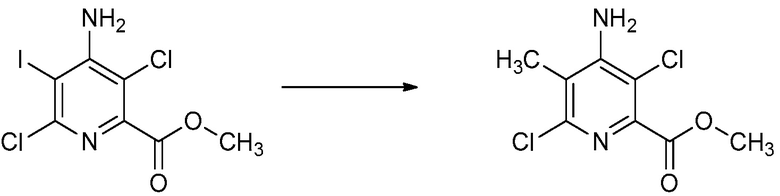 .
.
Смесь метил-4-амино-3,6-дихлор-5-йодпиколината (8,1 г, 23,4 ммоля), тетраметилстаннана (8,35 г, 46,7 ммоля) и бис(трифенилфосфин)хлорида палладия(II) (2,5 г, 3,5 ммоля) в 1,2-дихлорэтане (40 мл) облучали в микроволновом реакторе Biotage InitiatorTM при 120°C в течение 30 мин и за температурой следили с помощью установленного сбоку наружного инфракрасного (ИК) датчика температуры. Реакционную смесь загружали прямо в картридж с силикагелем и очищали с помощью флэш-хроматографии (силикагель; 0-50% этилацетат/гексаны) и получали искомое соединение в виде оранжевого твердого вещества (4,53 г, 83%): Температура плавления 133-136°C; 1H ЯМР (400 МГц, CDCl3) δ 4,92 (с, 2H), 3,96 (с, 3H), 2,29 (с, 3H); 13C ЯМР (101 МГц, CDCl3) δ 164,34, 150,24, 148,69, 143,94, 117,01, 114,60, 53,02, 14,40; ИЭРМС m/z 236 ([M+H]+), 234 ([M-H]-).
Пример 9: Получение метил-6-амино-2,5-дихлорпиримидин-4-карбоксилата (соединение E)
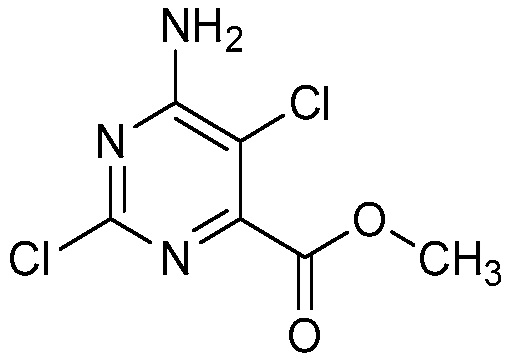 .
.
Получали, как описано в публикации Epp et al., WO 2007082076 A1.
Пример 10: Получение метил-4-амино-6-хлор-5-фтор-3-метоксипиколината (соединение F)
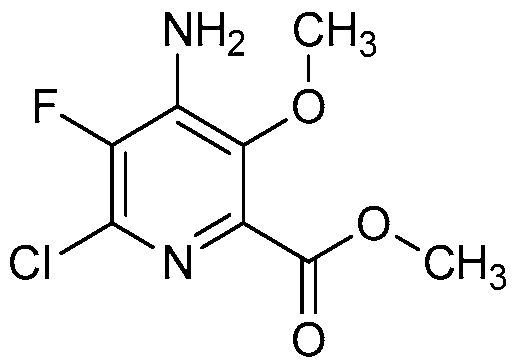 .
.
Получали, как описано в публикации Epp et al., WO 2013003740 A1.
Пример 11: Получение метил-4-амино-6-хлор-5-фтор-3-винилпиколината (соединение G)
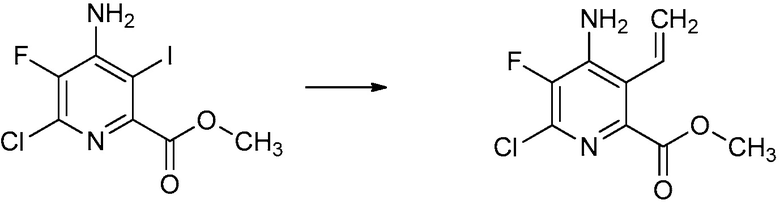 .
.
Метил-4-амино-6-хлор-5-фтор-3-йодпиколинат (7,05 г, 21,33 ммоля, полученный, как описано в публикации Epp et al., WO 2013003740 A1) и винилтри-н-бутилолово (7,52 мл, 25,6 ммоля) суспендировали в дихлорэтане (71,1 мл) и смесь дегазировали аргоном в течение 10 мин. Затем добавляли бис(трифенилфосфин)хлорид палладия(II) (1,497 г, 2,133 ммоля) и реакционную смесь перемешивали при 70°C в течение ночи (прозрачный оранжевый раствор). За протеканием реакции следили с помощью газовой хроматографии-масс-спектрометрии (ГХ-МС). Через 20 ч реакционную смесь концентрировали, адсорбировали на целите и очищали с помощью колоночной хроматографии (силикагель (SiO2); градиентный режим гексаны/этилацетат) и получали искомое соединение в виде светло-коричневого твердого вещества (3,23 г, 65,7%): Температура плавления 99-100°C; 1H ЯМР (400 МГц, CDCl3) δ 6,87 (дд, J=18,1, 11,6 Гц, 1H), 5,72 (дд, J=11,5, 1,3 Гц, 1H), 5,52 (дд, J=18,2, 1,3 Гц, 1H), 4,79 (с, 2H), 3,91 (с, 3H); 19F ЯМР (376 МГц, CDCl3) δ -138,79 (с); ИЭРМС m/z 230.
Пример 12: Получение метил-4-амино-3,5,6-трихлорпиколината (соединение H)
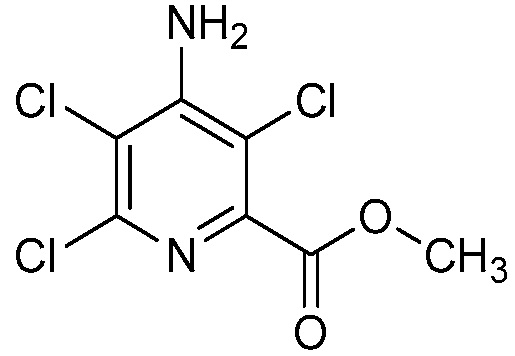 .
.
Получали, как описано в публикации Finkelstein et al., WO 2006062979 A1.
Пример 13: Получение метил-4-амино-6-бром-3-хлор-5-фторпиколината (соединение I)
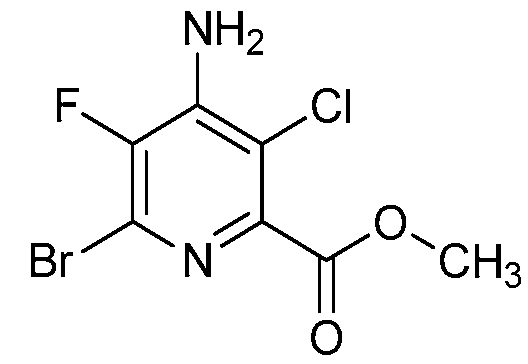 .
.
Получали, как описано в публикации Arndt et al., US 20120190857 A1.
Пример 14: Получение метил-4-амино-3-хлор-5-фтор-6-(триметилстаннил)пиколината (соединение J)
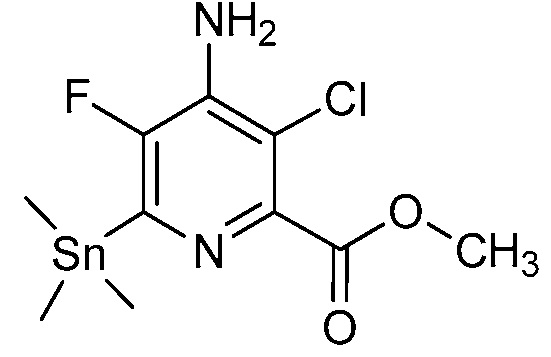 .
.
Метил-4-амино-6-бром-3-хлор-5-фторпиколинат (500 миллиграммов (мг), 1,8 ммоля), 1,1,1,2,2,2-гексаметилдистаннан (580 мг, 1,8 ммоля) и бис(трифенилфосфин)-хлорид палладия(II) (120 мг, 0,18 ммоля) объединяли в сухом диоксане (6 мл), продували потоком азота в течение 10 мин и затем нагревали при 80°C в течение 2 ч. Охлажденную смесь перемешивали с этилацетатом (25 мл) и насыщенным раствором NaCl (25 мл) в течение 15 мин. Органическую фазу отделяли, фильтровали через диатомовую землю, сушили (Na2SO4) и выпаривали. Остаток переносили в этилацетат (4 мл), перемешивали и порциями обрабатывали гексанами (15 мл). Мутный белый раствор сливали с полученных твердых веществ, фильтровали через стеклянную вату и выпаривали и получали искомое соединение в виде почти белого твердого вещества (660 мг, 100%): 1H ЯМР (400 МГц, CDCl3) δ 4,63 (д, J=29,1 Гц, 2H), 3,97 (с, 3H), 0,39 (с, 9H); 19F ЯМР (376 МГц, CDCl3) δ -130,28; ИЭРМС m/z 366.
Пример 15: Получение метил-4-ацетамидо-3-хлор-6-(триметилстаннил)-пиколината (соединение K)
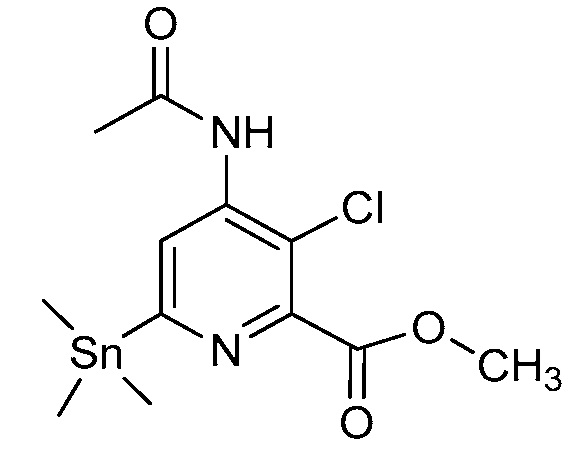 .
.
Получали, как описано в публикации Balko et al., WO 2003011853 A1.
Пример 16: Получение метил-4-ацетамидо-3,6-дихлорпиколината (соединение л)
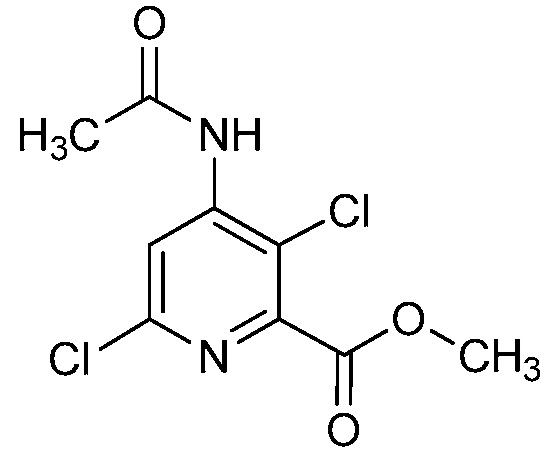 .
.
Получали, как описано в публикации Fields et al., WO 2001051468 A1.
Пример 17: Получение метил-4-амино-3-хлор-6-йодпиколината (соединение M)
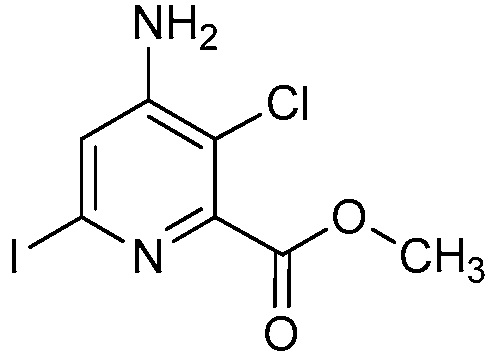 .
.
Получали, как описано в публикации Balko et al., WO 2007082098 A2.
Пример 18: Получение метил-4-ацетамидо-3-хлор-6-йодпиколината (соединение N)
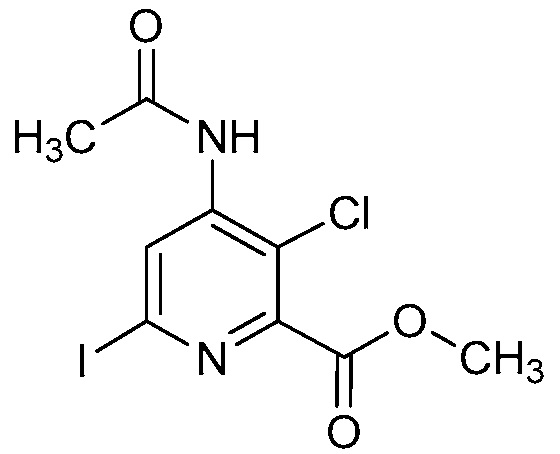 .
.
Получали, как описано в публикации Balko et al., WO 2007082098 A2.
Пример 19: Получение метил-4-амино-6-бром-3,5-дифторпиколината (соединение O)
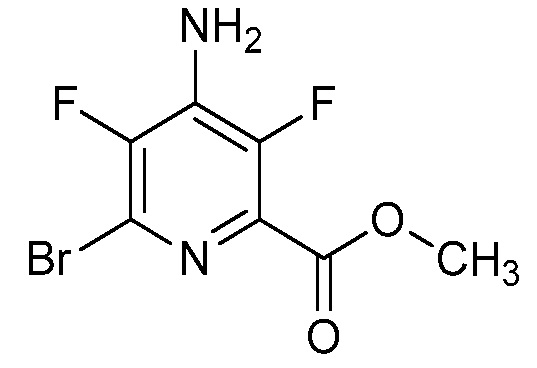 .
.
Получали, как описано в публикации Fields et al., WO 2001051468 A1.
Пример 20: Получение метил-6-амино-2-хлор-5-винилпиримидин-4-карбоксилата (соединение P)
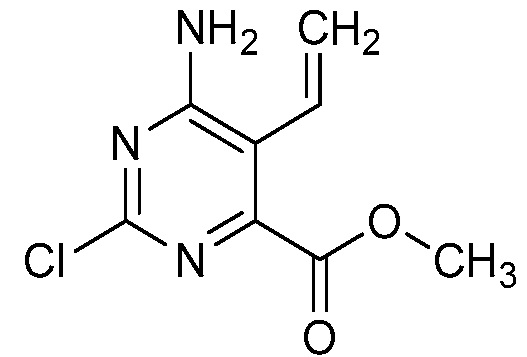 .
.
Получали, как описано в публикации Epp et al., US 20090088322.
Пример 22: Получение 4-бром-2-фторфенил)триметилсилана
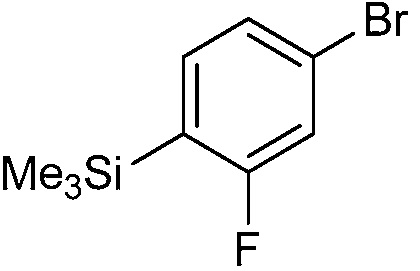 .
.
2,5 M Раствор н-бутиллития в гексанах (n-BuLi; 900 микролитров (мкл), 2,2 ммоля, 1,1 экв.) при перемешивании добавляли к раствору 1,4-дибром-2-фторбензола (500 мг, 2,0 ммоля, 1,0 экв.) в диэтиловом эфире (10 мл) при -78°C. Полученный бледно-желтый раствор перемешивали при -78°C в течение 2 ч. Добавляли хлортриметилсилан (300 мкл, 2,4 ммоля, 1,2 экв.) и полученный бледно-желтому раствору давали медленно нагреваться до 23°C, давая растаять бане твердый диоксид углерода/ацетон, и перемешивали в течение 72 ч. Реакционную смесь разбавляли водой (50 мл) и экстрагировали дихлорметаном (3×50 мл). Объединенные органические слои сушили (сульфат магния (MgSO4)), фильтровали самотеком и концентрировали путем выпаривания в роторном испарителе и получали искомое соединение в виде бледно-желтого масла (350 мг, 71%): ИК (тонкая пленка) 3068 (w), 2955 (м), 2927 (м), 2855 (w), 1598 (w), 1567 (w) см-1; 1H ЯМР (400 МГц, ДМСО-d6) δ 7,38-7,49 (м, 3H), 0,30 (с, 9H).
Пример 23: Получение (2-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)триметилсилана
 .
.
2,5 M Раствор n-BuLi (8,5 мл, 21 ммоля, 1,1 экв.) при перемешивании добавляли к раствору (4-бром-2-фторфенил)триметилсилана (4,8 г, 19 ммоля, 1,0 экв.) в тетрагидрофуране (80 мл) при -78°C. Полученный оранжевый раствор перемешивали при -78°C в течение 15 мин. Добавляли 2-изопропокси-4,4,5,5-тетраметил-1,3,2-диоксаборолан (4,4 мл, 21 ммоля, 1,1 экв.) и мутному оранжевому раствору давали медленно нагреваться до 23°C, давая растаять бане твердый диоксид углерода/ацетон, и перемешивали в течение 20 ч. Реакционную смесь разбавляли водой (200 мл), значение pH устанавливали равным примерно 4 с помощью 1 M хлористоводородной кислоты (HCl) и экстрагировали дихлорметаном (3×100 мл). Объединенные органические слои сушили (MgSO4), фильтровали самотеком и концентрировали путем выпаривания в роторном испарителе и получали искомое соединение в виде бледно-желтого полужидкого твердого вещества (6,0 г, 99%): 1H ЯМР (400 МГц, CDCl3) δ 7,55 (дт, J=7,5, 1 Гц, 1H), 7,38-7,42 (м, 2H), 1,34 (с, 12H), 0,29 (д, J=1 Гц, 9H).
Следующие соединения получали по методикам, раскрытым в примере 23:
2-(4-(Дифторметил)фенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан
 .
.
1H ЯМР (400 МГц, CDCl3) δ 7,89 (ушир д, J=8 Гц, 2H), 7,50 (ушир д, J=8 Гц, 2H), 6,65 (т, J=56 Гц, 1H), 1,35 (с, 12H).
2-(4-(Дифторметил)-3-фторфенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан
 .
.
1H ЯМР (400 МГц, CDCl3) δ 7,51-7,68 (м, 3H), 6,90 (т, J=55 Гц, 1H), 1,35 (с, 12H).
Пример 24: Получение (2,3-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)триметилсилана
 .
.
2,5 M Раствор n-BuLi (9,5 мл, 24 ммоля, 1,1 экв.) при перемешивании добавляли к раствору (2,3-дифторфенил)триметилсилана (4,0 г, 21 ммоля, 1,0 экв.) в тетрагидрофуране (86 мл) при -78°C. Полученный очень бледно-желтый раствор перемешивали при -78°C в течение 1 ч. Добавляли 2-изопропокси-4,4,5,5-тетраметил-1,3,2-диоксаборолан (4,8 мл, 24 ммоля, 1,1 экв.) и бледно-желтому раствору давали медленно нагреваться до 23°C, давая растаять бане твердый диоксид углерода/ацетон, и перемешивали в течение 20 ч. Реакционную смесь разбавляли водой (200 мл), значение pH устанавливали равным примерно 4 с помощью 1M HCl и экстрагировали дихлорметаном (3×100 мл). Объединенные органические слои сушили (MgSO4), фильтровали самотеком и концентрировали путем выпаривания в роторном испарителе и получали искомое соединение в виде белого порошкообразного вещества (6,4 г, 96%): 1H ЯМР (400 МГц, CDCl3) δ 7,42 (ддд, J=7,5, 4,5, 0,5 Гц, 1H), 7,09 (ддд, J=7,5, 4, 1 Гц, 1H), 1,34 (с, 12H), 0,29 (д, J=1 Гц, 9H).
Пример 25: Получение (3-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)триметилсилана
 .
.
2,5 M Раствор n-BuLi (3,5 мл, 8,5 ммоля, 1,1 экв.) при перемешивании добавляли к раствору 1,4-дибром-2-фторбензола (2,0 г, 7,9 ммоля, 1,0 экв.) в тетрагидрофуране (ТГФ; 26 мл) при -78°C. Полученный ярко-желтый раствор перемешивали при -78°C в течение 15 мин. Добавляли 2-изопропокси-4,4,5,5-тетраметил-1,3,2-диоксаборолан (1,8 мл, 8,7 ммоля, 1,1 экв.) и полученный бледно-желтый раствор перемешивали при -78°C в течение 30 мин. Добавляли 2,5 M раствор n-BuLi (3,5 мл, 8,5 ммоля, 1,1 экв.) и полученный желто-коричневый раствор перемешивали при -78°C в течение 15 мин. Добавляли хлортриметилсилан (2,2 мл, 17 ммоля, 2,2 экв.) и полученный бледно-желтому раствору давали медленно нагреваться до 23°C, давая растаять бане твердый диоксид углерода/ацетон, и перемешивали в течение 18 ч. Реакционную смесь разбавляли водой (150 мл) и экстрагировали дихлорметаном (2×100 мл). Объединенные органические слои сушили (MgSO4), фильтровали самотеком и концентрировали путем выпаривания в роторном испарителе и получали искомое соединение в виде бледно-желтого порошкообразного вещества (2,3 г, 99%): ИК (тонкая пленка) 3058 (w), 2981 (с), 2932 (м), 1615 (м) см-1; 1H ЯМР (400 МГц, CDCl3) δ 7,72 (дд, J=7,5, 6 Гц, 1H), 7,26 (м, 1H), 7,16 (д, J=7,5 Гц, 1H), 1,34 (с, 12H), 0,23 (с, 9H).
Пример 26: Получение 2,3,5-трифтор-4-йоданилина
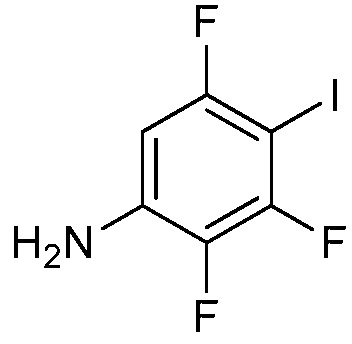 .
.
При перемешивании к раствору 2,3,5-трифторанилина (2,0 г, 13,605 ммоля, 1,0 экв.) в сухом ТГФ (40 мл) при -78°C в течение 30 мин добавляли втор-бутиллитий (10,88 мл, 13,6 ммоля, 1,0 экв.). Перемешивание продолжали при -78°C в течение 2 ч. По каплям добавляли раствор йода (4,14 г, 16,32 ммоля, 1,2 экв.) и реакционную смесь медленно нагревали до 20°C в течение 1 ч. Реакцию останавливали 10% водным раствором тиосульфата натрия (Na2S2O3) и экстрагировали метил-трет-бутиловым эфиром (МТБЭ; 3×50 мл). Объединенные органические экстракты промывали насыщенным рассолом, сушили над безводным Na2SO4, фильтровали и выпаривали досуха при пониженном давлении. Неочищенный продукт очищали на колонке с диоксидом кремния с использованием 0-10% этилацетата (EtOAc) с гексанами в качестве элюента и получали 2,3,5-трифтор-4-йоданилин (1,3 г, 35%) в виде розового твердого вещества: 1H ЯМР (400 МГц, CDCl3) δ 6,43-6,39 (м, 1H), 3,99 (ушир.с, 2H); ИЭРМС m/z 274 ([M+H]+).
Пример 27: Получение 4-бром-1-(дифторметокси)-2-фторбензола
 .
.
В колбу объемом 100 мл, в которой находился N,N-диметилформамид (ДМФ; 23 мл), добавляли 2-хлор-2,2-дифторацетат натрия (4,79 г, 31,4 ммоля), карбонат калия (2,60 г, 18,85 ммоля), 4-бром-2-фторфенол (3 г, 15,71 ммоля). Добавляли воду (5,75 мл) и реакционную смесь нагревали при 100°C в течение 3 ч. При охлаждении до комнатной температуры реакционную смесь разбавляли диэтиловым эфиром (Et2O; 100 мл) и 2-нормальным (н.) раствором гидроксида натрия (NaOH) (100 мл). Органический слой удаляли и сушили над безводным Na2SO4. После фильтрования органический раствор концентрировали в роторном испарителе на водяной бане при 4°C и получали искомое соединение в виде прозрачного масла (1 г, 13%): 1H ЯМР (400 МГц, CDCl3) δ 7,35 (дд, J=9,7, 2,3 Гц, 1H), 7,27 (ддд, J=8,7, 2,3, 1,5 Гц, 1H), 7,19-7,04 (м, 1H), 6,53 (т, J=73,0 Гц, 1H); ИЭРМС m/z 242([M+H]+).
Следующие соединения получали по методикам, раскрытым в примере 27.
1-Бром-4-(дифторметокси)-2-фторбензол
 .
.
1H ЯМР (400 МГц, CDCl3) δ 7,53 (дд, J=8,8, 7,7 Гц, 1H), 6,95 (дд, J=9,1, 2,7 Гц, 1H), 6,90-6,79 (м, 1H), 6,50 (т, J=72,8 Гц, 1H); ИК (тонкая пленка) 781,76, 811,23, 856,78, 945,20, 1043,80, 977,35, 1141,65, 1113,50, 1174,18, 1260,90, 1285,55, 1382,78, 1423,39, 1487,03, 1593,17, 2847,53, 2927,91, 2992,21, 3112,78 см-1; ИЭРМС m/z 242([M+H]+).
1-Бром-4-(дифторметокси)-2,3-дифторбензол
 .
.
1H ЯМР (400 МГц, CDCl3) δ 7,31 (ддд, J=9,2, 6,9, 2,5 Гц, 1H), 7,02-6,93 (м, 1H), 6,56 (т, J=72,4 Гц, 1H); ИК (тонкая пленка) 776,30, 811,66, 884,39, 986,70, 1100,95, 1144,65, 1211,05, 1241,96, 1266,36, 1297,59, 1383,98, 1494,35, 1474,47, 1600,40, 1679,63, 3038,31, 3103,90 см-1; ИЭРМС m/z 260 ([M+H]+).
Пример 28: Получение 2-(4-(дифторметокси)-3-фторфенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана
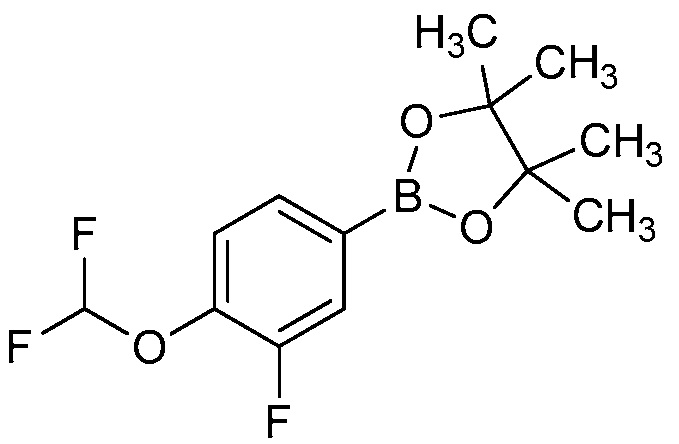 .
.
К ДМСО (10 мл) добавляли 4,4,4',4',5,5,5',5'-октаметил-2,2'-би(1,3,2-диоксаборолан) (1,264 г, 4,98 ммоля), PdCl2(dppf) (0,304 г, 0,415 ммоля), ацетат калия (1,222 г, 12,45 ммоля) и 4-бром-1-(дифторметокси)-2-фторбензол (1 г, 4,15 ммоля). Реакционную смесь нагревали при наружной температуре, равной 80°C, в течение 18 ч. После охлаждения реакционную смесь выливали на лед с водой (50 мл). Смесь со льдом с водой переносили в делительную воронку и дважды экстрагировали с помощью EtOAc (50 мл). Органические слои объединяли, сушили над Na2SO4 и фильтровали. Раствор концентрировали на целите (5 г) с использованием EtOAc в качестве растворителя. Пропитанный целит очищали с помощью хроматографии на силикагеле с использованием смеси 0-30% EtOAc:гексаны и получали искомое соединение в виде желтого масла (773 мг, 64%): 1H ЯМР (400 МГц, CDCl3) δ 7,61-7,53 (м, 2H), 7,25-7,16 (м, 1H), 6,58 (т, J=73,5 Гц, 1H), 1,34 (с, 12H); ИЭРМС m/z 289 ([M+H]+).
Следующие соединения получали по методикам, раскрытым в примере 28:
2-(4-(Дифторметокси)-2-фторфенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан
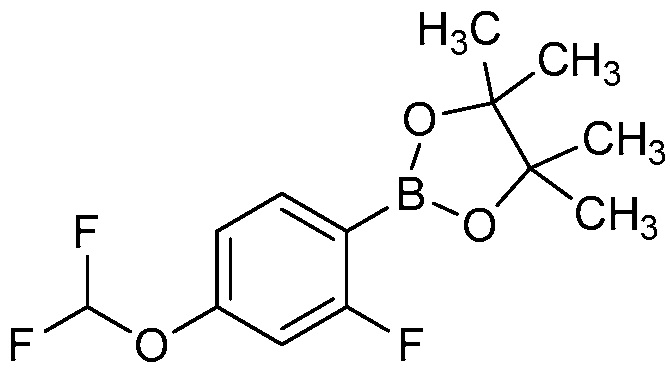 .
.
1H ЯМР (400 МГц, CDCl3) δ 7,74 (дд, J=8,3, 6,8 Гц, 1H), 6,89 (дд, J=8,3, 2,2 Гц, 1H), 6,81 (дд, J=9,9, 2,2 Гц, 1H), 6,54 (т, J=73,2 Гц, 1H), 1,26 (с, 12H); ИК (тонкая пленка) 848,53, 961,04, 1066,43, 1125,19, 1172,02, 1238,3, 1212,77, 1330,51, 1281,58, 1357,05, 1372,85, 1380,73, 1425,32, 1469,05, 1579,31, 1621,00, 2933,42, 2982,31 см-1; ИЭРМС m/z 289 ([M+H]+).
2-(4-(Дифторметокси)-2,3-дифторфенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан
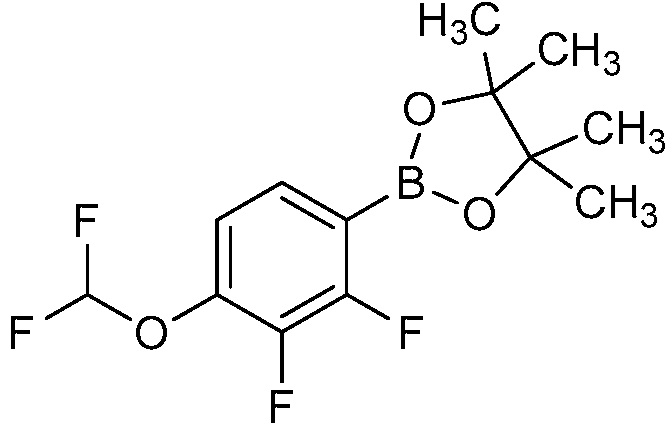 .
.
1H ЯМР (400 МГц, CDCl3) δ 7,46 (ддд, J=8,3, 5,8, 2,3 Гц, 1H), 7,05-6,95 (м, 1H), 6,59 (т, J=72,8 Гц, 1H), 1,35 (с, 12H); ИК (тонкая пленка) 673,35, 851,08, 916,78, 965,07, 1123,87, 1142,58, 1210,42, 1331,14, 1280,13, 1362,56, 1392,44, 1467,32, 1507,77, 1589,62, 1629,61, 2935,00, 2982,70 см-1; ИЭРМС m/z 307 ([M+H]+).
Пример 29: Получение 1,4-дифтор-2-йод-5-(трифторметил)бензола
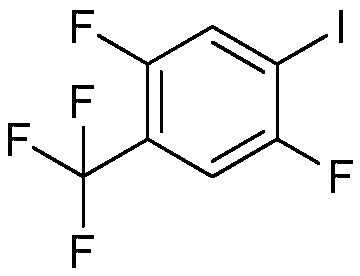 .
.
N-(2,5-Дифтор-4-(трифторметил)фенил)ацетамид (950 мг, 4,0 ммоля; полученный в соответствии с публикацией Y. Tanabe et al, J. Org. Chem. 1988, 53, 4585-4587), перемешивали в метаноле (25 мл), обрабатывали ацетилхлоридом (3 мл) и кипятили с обратным холодильником в течение 2 ч. Летучие вещества удаляли путем выпаривания, и твердый остаток растворяли в 6 н. HCl (50 мл), охлаждали до 5°C и обрабатывали порциями раствора нитрита натрия (410 мг, 6,0 ммоля) в воде (5 мл). Через 30 мин эту смесь выливали в раствор йодида натрия (2,4 г, 16 ммоля) в воде (50 мл) и быстро перемешивали с дихлорметаном (50 мл). Через 30 мин добавляли твердый бисульфит натрия для удаления окраски йодом и отделенную органическую фазу промывали насыщенным раствором NaCl, сушили (Na2SO4) и выпаривали. Вещество очищали с помощью флэш-хроматографии (SiO2; при элюировании гексанами) и получали искомое соединение в виде летучей прозрачной жидкости (250 мг, 20%): 1H ЯМР (400 МГц, CDCl3) δ 7,64 (ддд, J=8,8, 4,8, 0,4 Гц, 1H), 7,28 (дд, J=11,1, 4,7 Гц, 1H); 19F ЯМР (376 МГц, CDCl3) δ -61,92, -97,64, -97,68, -118,59, -118,63, -118,64, -118,67; ИЭРМС m/z 308.
Пример 30: Получение 2-(2,5-дифтор-4-(трифторметил)фенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана
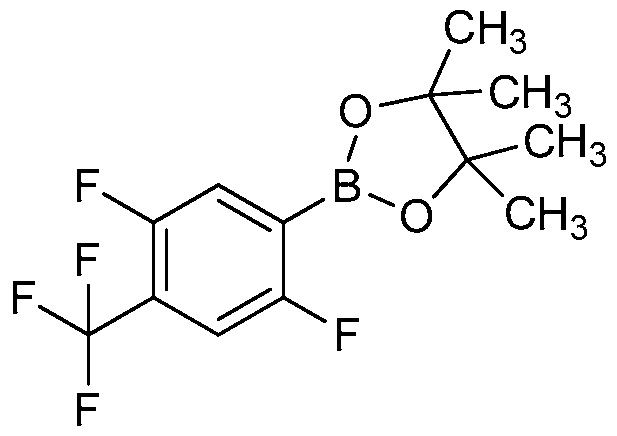
1,4-Дифтор-2-йод-5-(трифторметил)бензол (500 мг, 1,6 ммоля) растворяли в сухом ТГФ (7 мл), охлаждали до 0°C и обрабатывали порциями комплекса изопропилхлорид магния - хлорид лития (1,3 M; 1,4 мл, 1,8 ммоля) и перемешивали в течение 40 мин при 5°C. Добавляли 2-изопропокси-4,4,5,5-тетраметил-1,3,2-диоксаборолан (360 мкл, 330 мг, 1,8 ммоля) и перемешивание продолжали в течение 1 ч. После обработки насыщенным раствором хлорида аммония (NH4Cl) смесь встряхивали с этилацетатом. Органическую фазу промывали насыщенным раствором NaCl, сушили (Na2SO4) и выпаривали и получали искомое соединение в виде светло-коричневого масла (500 мг, 100%). Вещество использовали без дополнительной очистки: 1H ЯМР (400 МГц, CDCl3) δ 7,54 (дд, J=9,9, 4,3 Гц, 1H), 7,27 (дд, J=8,0, 5,2 Гц, 2H), 1,37 (с, 12H); 19F ЯМР (376 МГц, CDCl3) δ -62,10, -62,13, -106,85, -106,90, -121,81, -121,87, -121,90.
Пример 31: Получение 4-бром-2,5-дифторбензальдегида
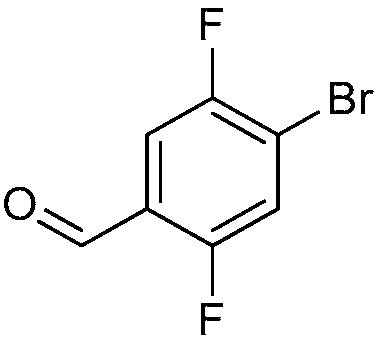 .
.
К раствору 2,5-дибром-1,4-дифторбензола (10,0 г, 36,77 ммоля) в диэтиловом эфире (150 мл) при -78°C в атмосфере азота по каплям добавляли н-бутиллитий (2,5 M в гексанах, 14,86 мл, 37,15 ммоля). Реакционную смесь перемешивали при -78°C в течение 30 мин По каплям добавляли сухой ДМФ (3,13 мл, 40,46 ммоля) в диэтиловом эфире (10 мл) и реакционную смесь медленно нагревали до комнатной температуры в течение 2 ч. Реакцию останавливали насыщенным водным раствором NH4Cl (25 мл) и экстрагировали диэтиловым эфиром. Органическую фазу промывали насыщенным рассолом, сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении (Примечание: Продукт является высоколетучим). Неочищенный продукт очищали с помощью флэш-хроматографии (SiO2, при элюировании с помощью 2-20% этилацетата в гексанах) и получали искомое соединение в виде бледно-желтого твердого вещества (7,0 г, 86%): 1H ЯМР (400 МГц, CDCl3) δ 7,50 (дд, J=5,08, 8,92 Гц, 1H), 7,62 (дд, J=5,80, 7,68 Гц, 1H), 10,30 (д, J=2,76 Гц, 1H).
Пример 32: Получение оксима (E)-4-бром-2,5-дифторбензальдегида
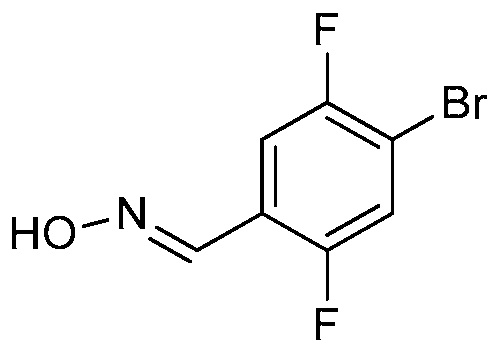 .
.
Раствор 4-бром-2,5-дифторбензальдегида (7,0 г, 31,67 ммоля), гидроксиламингидрохлорида (2,42 г, 34,84 ммоля) в пиридине (35 мл) и этанола (35 мл) перемешивали при комнатной температуре в течение 30 мин. Реакционную смесь разбавляли насыщенным раствором NH4Cl и экстрагировали этилацетатом. Органическую фазу промывали насыщенным рассолом, сушили (Na2SO4), фильтровали и концентрировали при пониженном давлении. Неочищенный продукт очищали с помощью флэш-хроматографии (SiO2; при элюировании с помощью 5-100% этилацетата в гексанах) и получали искомое соединение в виде желтого твердого вещества (4,0 г, 53%): ИЭРМС m/z 238 ([M+2H]+).
Пример 33: Получение 4-бром-2,5-дифторбензонитрила
 .
.
Раствор хлорангидрида циануровой кислоты (3,12 г, 16,94 ммоля) и сухого ДМФ (8,5 мл) перемешивали в течение 30 мин или до образования белого твердого вещества. Израсходование хлорангидрида циануровой кислоты подтверждали с помощью тонкослойной хроматографии (ТСХ). К суспензии по каплям добавляли оксим (E)-4-бром-2,5-дифторбензальдегида (4,0 г, 16,94 ммоля) в ДМФ (26 мл) и перемешивали в течение 1 ч. Реакционную смесь разбавляли водой и экстрагировали гексанами. Органический экстракт промывали водой, промывали насыщенным рассолом, сушили (Na2SO4), фильтровали и выпаривали досуха при пониженном давлении. Неочищенный продукт очищали с помощью флэш-хроматографии (SiO2; при элюировании с помощью 2-20% этилацетата в гексанах) и получали искомое соединение в виде белого твердого вещества (2,5 г, 68%): 1H ЯМР (400 МГц, CDCl3) δ 7,40 (дд, J=5,36, 7,10 Гц, 1H), 7,52 (дд, J=5,40, 7,66 Гц, 1H); ИЭРМС m/z 218.
Пример 34: Получение 1-бром-4-(дифторметил)-2,5-дифторбензола
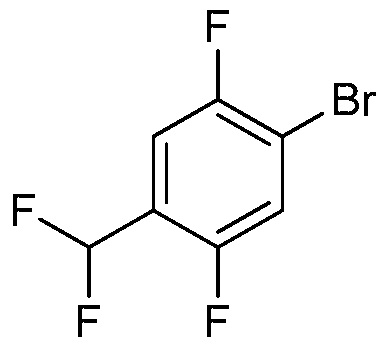 .
.
К раствору 4-бром-2,5-дифторбензальдегида (11,0 г, 49,77 ммоля) в дихлорметане (55 мл) по каплям при 0°C добавляли (диэтиламино)трифторид серы (ДАТС; 24,06 г, 0,15 моля). После завершения добавления охлаждающую баню удаляли и перемешивание продолжали в течение 2 ч при комнатной температуре (КТ). Реакционную смесь разбавляли дихлорметаном, промывали водой, промывали насыщенным рассолом, сушили (Na2SO4) и выпаривали при пониженном давлении. Неочищенный продукт очищали с помощью флэш-хроматографии (SiO2; при элюировании с помощью 0-10% этилацетата в гексанах) и получали искомое соединение в виде бледно-коричневой жидкости (8,39 г, 69%): 1H ЯМР(400 МГц, CDCl3) δ 6,58 (т, J=72,32 Гц, 1H), 7,12 (т, J=7,92 Гц, 1H), 7,44 (дд, J=6,32, 9,18 Гц, 1H); ИЭРМС m/z 244.
Пример 35: Получение 1-бром-4-(дифторметокси)-2,5-дифторбензола
 .
.
В герметизированной пробирке раствор 4-бром-2,5-дифторфенола (5,0 г, 23,9 ммоля) и гидроксида калия (26,8 г, 479 ммоля) в 1:1 смеси ацетонитрила и воды (110 мл) при -78°C обрабатывали одной порцией бромдифторметилдиэтилфосфоната (12,8 г, 47,9 ммоля). Содержимое герметизированной пробирки перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли диэтиловым эфиром и органическую фазу отделяли. Водную фазу дважды экстрагировали диэтиловым эфиром. Объединенные органические экстракты промывали насыщенным рассолом, сушили (Na2SO4), фильтровали и выпаривали досуха при пониженном давлении. Неочищенный продукт очищали с помощью флэш-хроматографии (SiO2; при элюировании с помощью 0-10% этилацетата в гексанах) и получали искомое соединение в виде прозрачной жидкости (4,2 г, 67,8%): 1H ЯМР(300 МГц, CDCl3) δ 6,56 (т, J=72,36 Гц, 1H), 7,11 (т, J=7,32 Гц, 1H), 7,40-7,45 (м, 1H); ИЭРМС m/z 259.
Пример 36: Общая методика синтеза бороновых кислот
 .
.
В герметизированной пробирке через раствор бромфенилового субстрата (1,0 экв.), ацетата калия (3,0 экв.), и бис-(пинаколято)дибора (1,1 экв.) в ДМСО (объем, достаточный для получения 0,1-0,2 M в субстрате) в течение 15 мин пропускали аргон. Добавляли Pd(dppf)Cl2 (0,1 экв.) и герметизированную пробирку закрывали. Реакционную смесь нагревали при 80°C в течение 18 ч. Охлажденную реакционную смесь разбавляли водой и экстрагировали метил-трет-бутиловым эфиром. Органический экстракт промывали водой, промывали насыщенным рассолом, сушили (Na2SO4), фильтровали и выпаривали досуха при пониженном давлении. Неочищенный боронат (1,0 экв.) растворяли в диэтиловом эфире (10 объемов) и добавляли диэтаноламин (1,1 экв.). Реакционную смесь перемешивали при комнатной температуре в течение 30-45 мин. Белое твердое вещество осаждалось через 45 мин. Перемешивание прекращали и растворитель декантировали. К твердому веществу добавляли свежий эфир и затем избыток 1,5 н. HCl . Полученный двухфазный раствор перемешивали в течение 30 мин. Органическую фазу промывали насыщенным рассолом, сушили (Na2SO4), фильтровали и выпаривали досуха при пониженном давлении. Полученные таким образом бороновые кислоты использовали на следующей стадии без очистки.
Следующие соединения получали по методикам, раскрытым в примере 36:
(4-(Дифторметокси)-2,5-дифторфенил)бороновая кислота
 .
.
1H ЯМР(300 МГц, CDCl3) δ 6,59 (т, J=72,78 Гц, 1H), 6,97 (дд, J=2,70, 9,14 Гц, 1H), 7,52 (дд, J=5,19, 10,29 Гц, 1H).
(4-(Дифторметил)-2,5-дифторфенил)бороновая кислота
 .
.
1H ЯМР(400 МГц, CDCl3) δ 6,87 (дт, J=8,48, 54,64 Гц, 1H), 7,25-7,32 (м, 1H), 7,49 (дд, J=4,08, 9,48 Гц, 1H), 7,59-7,60 (м, 1H).
Пример 37: Общая методика синтеза бороновых кислот (методика A)
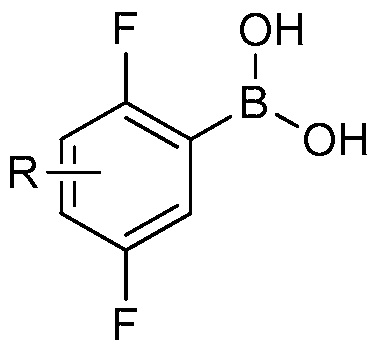 .
.
К раствору соответствующего бромфенилового субстрата (1,0 экв.) в сухом ТГФ (10 объемов) при -78°C по каплям добавляли n-BuLi (2,5 M в гексанах; 1,2 экв.). После завершения добавления перемешивание продолжали в течение 30 мин. Одной порцией добавляли триметилборат (1,5 экв.) и перемешивание продолжали в течение 1 ч при -78°C. Реакционную смесь медленно нагревали до комнатной температуры, реакцию останавливали с помощью 1,5 н. HCl и экстрагировали этилацетатом. Органический экстракт промывали водой, промывали насыщенным рассолом, сушили (Na2SO4), фильтровали и выпаривали досуха при пониженном давлении. Полученные таким образом бороновые кислоты использовали на следующей стадии без очистки.
Следующее соединение получали по методикам, раскрытым в примере 37:
(2,5-Дифтор-4-метилфенил)бороновая кислота
 .
.
1H ЯМР(300 МГц, CDCl3) δ 2,30 (с, 3H), 5,03 (ушир.с, 2H), 6,89 (дд, J=5,67, 10,25 Гц, 1H), 7,42 (дд, J=5,40, 9,19 Гц, 1H).
Пример 38: Общая методика синтеза бороновых кислот (методика B)
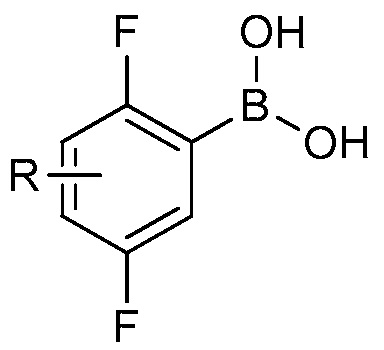 .
.
К раствору соответствующего бромфенилового субстрата (1,0 экв.) в сухом ТГФ (10 объемов) при -40°C по каплям добавляли раствор комплекса изопропилхлорид магния - хлорид лития (1,3 M раствор в ТГФ; 1,05 экв.). После завершения добавления реакционную смесь перемешивали при -40°C в течение 45 мин, затем медленно нагревали до 0°C. По каплям добавляли пинаколиновый эфир изопропоксибороновой кислотой (1,07 экв.) и перемешивание продолжали при 0°C в течение 2 ч. Реакционную смесь нагревали до комнатной температуры, реакцию останавливали насыщенным водным раствором NH4Cl и экстрагировали этилацетатом. Органический экстракт промывали насыщенным рассолом, сушили (Na2SO4), фильтровали и выпаривали при пониженном давлении. Полученные таким образом бороновые кислоты использовали на следующей стадии без очистки.
Следующее соединение получали по методикам, раскрытым в примере 38:
(4-Циано-2,5-дифторфенил)бороновая кислота
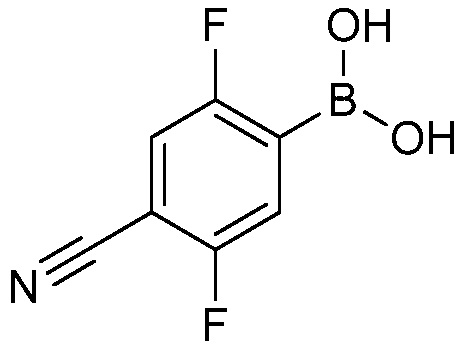 .
.
1H ЯМР(300 МГц, CDCl3) δ 5,15 (ушир.с, 2H), 7,29-7,36 (м, 1H), 7,69 (дд, J=4,80, 8,28 Гц, 1H).
Пример 39: Получение метил-4-амино-3-хлор-6-(3-фтор-4-(триметилсилил)фенил)пиколината
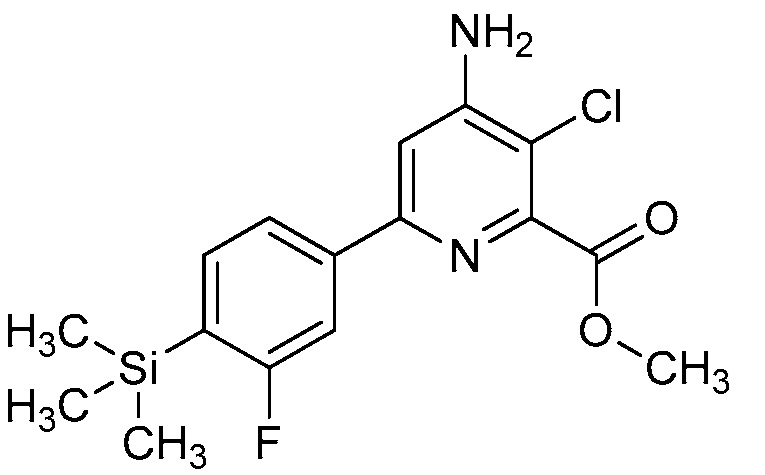 .
.
В сосуд для микроволновой печи объемом 20 мл, снабженный стержнем для перемешивания, помещали соединение A (500 мг, 2,262 ммоля), (2-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)триметилсилан (997 мг, 3,39 ммоля), бис(трифенилфосфин)палладий(II) дихлорид (203 мг, 3,39 ммоля), и фторид цезия (741 мг, 4,88 ммоля). Сосуд помещали в атмосферу азота (N2) и добавляли ацетонитрил (4,0 мл) и H2O (1,0 мл). Сосуд помещали в микроволновый реактор Biotage InitiatorTM на 30 мин при 120°C и за температурой следили с помощью установленного сбоку от сосуда ИК датчика температуры. Реакционную смесь выливали в рассол и экстрагировали этилацетатом (3×75 мл). Объединенные органические слои сушили над безводным MgSO4, фильтровали и концентрировали. Полученный остаток очищали с помощью флэш-хроматографии (силикагель; 0-30% EtOAc в гексанах) и получали искомое соединение в виде желтого твердого вещества (0,328 г, 41%): 1H ЯМР (400 МГц, ДМСО-d6) δ 7,68 (дд, J=7,5, 1,4 Гц, 1H), 7,61-7,47 (м, 2H), 7,30 (с, 1H), 6,78 (с, 2H), 3,88 (с, 3H), 0,30 (д, J=0,8 Гц, 9H); 19F ЯМР (376 МГц, ДМСО-d6) δ -101,12; ИЭРМС m/z 353 ([M+H]+).
Следующие соединения получали по методикам, раскрытым в примере 39:
Метил-4-амино-3,5-дихлор-6-(3-фтор-4-(триметилсилил)фенил)пиколинат
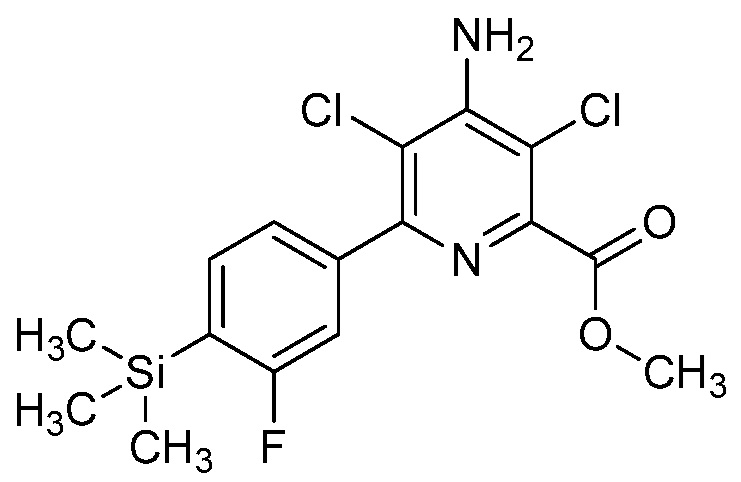 .
.
Искомое соединение получали, как описано в примере 39, с использованием соединения H (500 мг, 1,96 ммоля) и выделяли в виде белого твердого вещества (0,381 г, 50%): 1H ЯМР (400 МГц, ДМСО-d6) δ 7,52 (дд, J=7,6, 5,9 Гц, 1H), 7,41 (дд, J=7,5, 1,3 Гц, 1H), 7,30 (дд, J=9,6, 1,4 Гц, 1H), 7,11 (с, 2H), 3,87 (с, 3H), 0,33 (д, J=0,9 Гц, 9H); 19F ЯМР (376 МГц, ДМСО-d6) δ -101,38; ИЭРМС m/z 387 ([M+H]+).
Метил-6-амино-2-(3-фтор-4-(триметилсилил)фенил)-5-метоксипиримидин-4-карбоксилат
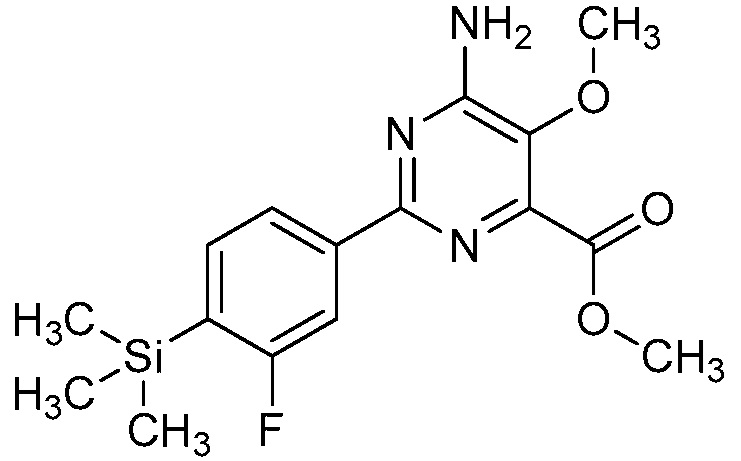 .
.
Искомое соединение получали, как описано в примере 39, с использованием соединения C (0,510 г, 2,34 ммоля) и выделяли в виде желтого твердого вещества (0,307 г, 38%): 1H ЯМР (400 МГц, ДМСО-d6) δ 8,08-7,99 (м, 1H), 7,82 (дд, J=10,3, 1,4 Гц, 1H), 7,60-7,27 (м, 3H), 3,91 (с, 3H), 3,74 (с, 3H), 0,32 (д, J=0,9 Гц, 9H); 19F ЯМР (376 МГц, ДМСО-d6) δ -101,73; ИЭРМС m/z 350 ([M+H]+).
Метил-4-ацетамидо-3-хлор-6-(3-фтор-4-(триметилсилил)фенил)пиколинат
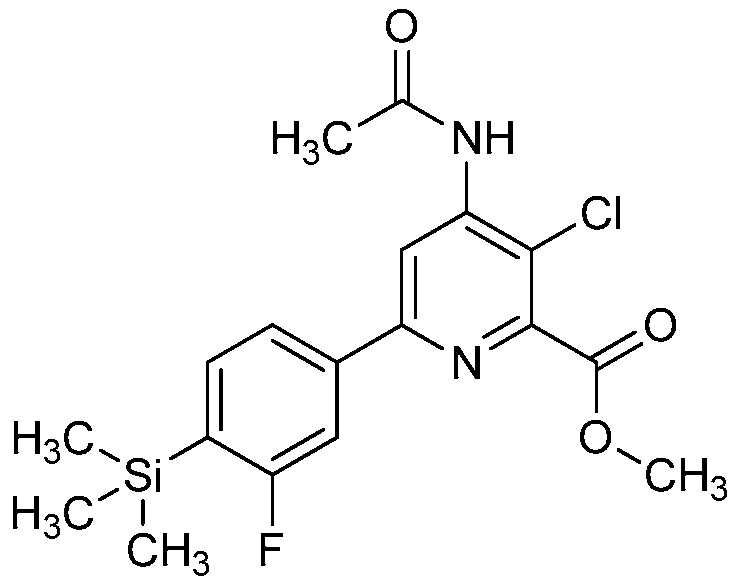 .
.
Искомое соединение получали, как описано в примере 39, с использованием соединения L (0,500 г, 1,90 ммоля) в диоксане (7,0 мл) и H2O (2,0 мл) и выделяли в виде желтого твердого вещества (0,433 г, 58%): 1H ЯМР (400 МГц, ДМСО-d6) δ 9,99 (с, 1H), 8,71 (с, 1H), 7,75 (дд, J=7,6, 1,5 Гц, 1H), 7,63 (дд, J=10,1, 1,5 Гц, 1H), 7,56 (дд, J=7,7, 5,9 Гц, 1H), 3,94 (с, 3H), 2,24 (с, 3H), 0,30 (д, J=0,8 Гц, 9H); 19F ЯМР (376 МГц, ДМСО-d6) δ -100,78; ИЭРМС m/z 396 ([M+H]+).
Метил-4-амино-3-хлор-6-(4-циано-2-фторфенил)-5-фторпиколинат (соединение 44)
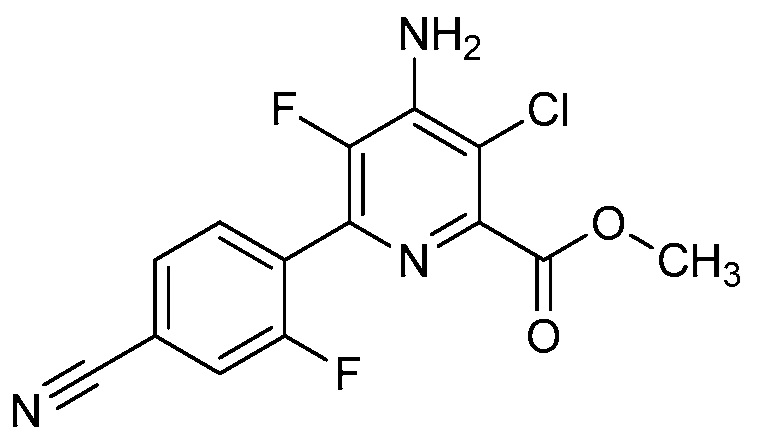 .
.
Искомое соединение получали, как описано в примере 39, с использованием соединения B (400 мг, 1,673 ммоля) и (4-циано-2-фторфенил)бороновой кислоты (400 мг, 2,425 ммоля) в диоксане (4,5 мл) и H2O (1,2 мл) и выделяли в виде почти белого твердого вещества (0,451 г, 83%).
Метил-6-амино-2-(3-фтор-4-(трифторметил)фенил)-5-винилпиримидин-4-карбоксилат (соединение 137)
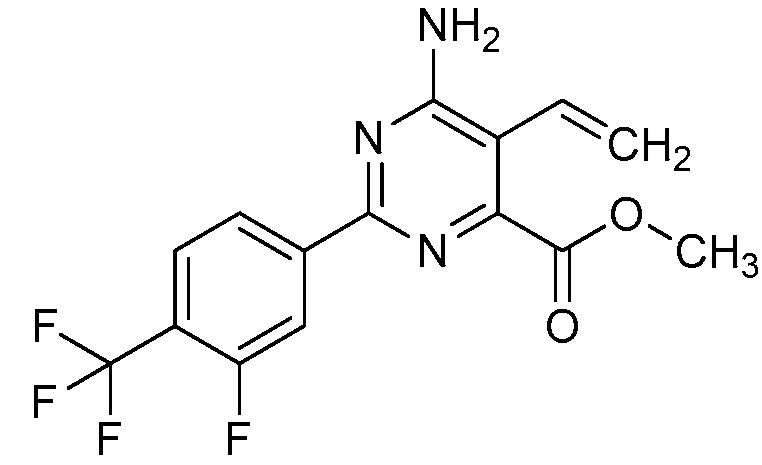 .
.
Искомое соединение получали, как описано в примере 39, с использованием соединения P (350 мг, 1,64 ммоля) и (3-фтор-4-(трифторметил)фенил)бороновой кислоты (445 мг, 2,14 ммоля) в диоксане (5,0 мл) и H2O (1,0 мл) и выделяли в виде светло-желтовато-коричневого твердого вещества (0,291 г, 52%).
Метил-6-амино-2-(4-циано-2-фторфенил)-5-винилпиримидин-4-карбоксилат (соединение 98)
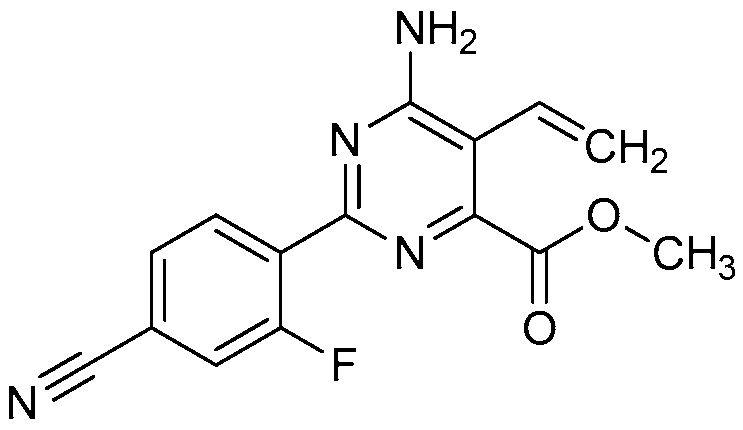 .
.
Искомое соединение получали, как описано в примере 39, с использованием соединения P (350 мг, 1,638 ммоля) и (4-циано-2-фторфенил)бороновой кислоты (375 мг, 2,27 ммоля) в диоксане (4,5 мл) и H2O (1,2 мл) и выделяли в виде желтого твердого вещества (0,291 г, 60%).
Метил-6-амино-2-(4-аминофенил)-5-винилпиримидин-4-карбоксилат
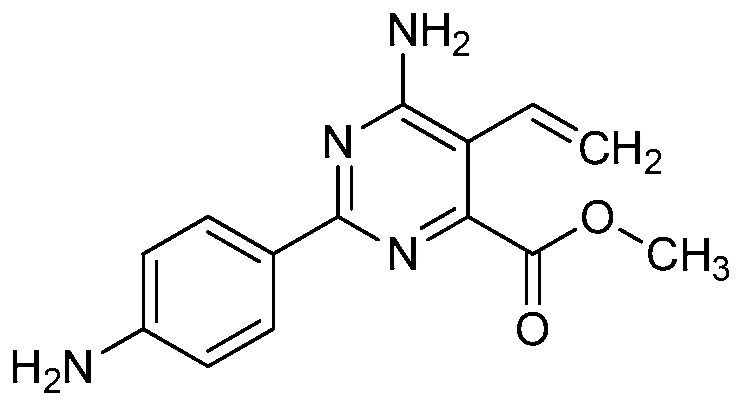 .
.
Искомое соединение получали, как описано в примере 39, с использованием соединения P (0,800 г, 3,74 ммоля) и 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилина (0,985 г, 4,49 ммоля) в диоксане (15,6 мл) и H2O (3,12 мл) и выделяли в виде желтого твердого вещества (0,400 г, 40%): 1H ЯМР (400 МГц, ДМСО-d6) δ 8,08-7,86 (м, 2H), 6,99 (с, 2H), 6,76-6,51 (м, 3H), 5,61 (с, 2H), 5,49-5,30 (м, 2H), 3,81 (с, 3H); ИЭРМС m/z 271 ([M+H]+).
Метил-6-амино-2-(2,3,4-трифторфенил)-5-винилпиримидин-4-карбоксилат (соединение 197)
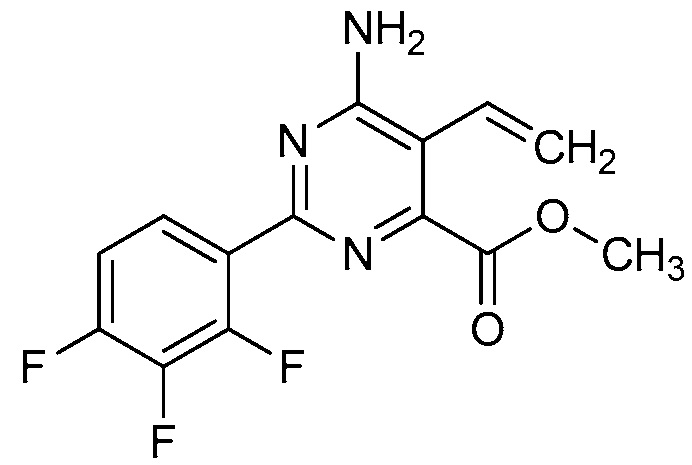 .
.
Искомое соединение получали, как описано в примере 39, с использованием соединения P (0,350 г, 1,64 ммоля) и (2,3,4-трифторфенил)бороновой кислоты (0,346 г, 1,97 ммоля) в диоксане (5,0 мл) и H2O (1,0 мл) и выделяли в виде желтого твердого вещества (0,414 г, 82%).
Пример 40. Получение метил-4-амино-3-хлор-6-(3-фтор-4-(трифторметил)фенил)пиколината (соединение 29)
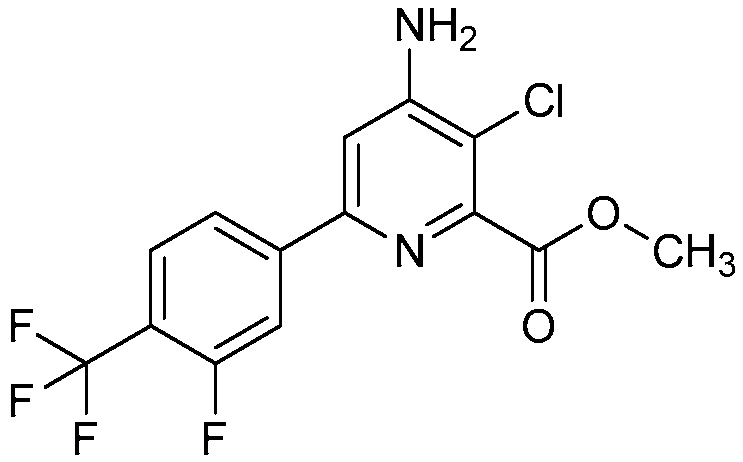 .
.
Метил-4-амино-3,6-дихлорпиколинат (630 мг, 2,85 ммоля), 2-(3-фтор-4-(трифторметил)фенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан (1,06 г, 3,65 ммоля, 1,3 экв.), бис(трифенилфосфин)хлорид палладия(II) (209 мг, 0,30 ммоля, 0,1 экв.) и фторид калия (510 мг, 8,8 ммоля, 3 экв.) в смеси ацетонитрил/вода (8 мл, 3:1) закрывали в сосуде объемом 25 мл и помещали в микроволновый реактор Biotage InitiatorTM на 20 мин при 115°C и за температурой следили с помощью установленного сбоку от сосуда ИК датчика температуры. Реакционную смесь разбавляли этилацетатом и промывали водой. Водный слой экстрагировали этилацетатом и объединенные органические слои сушили над безводным Na2SO4, фильтровали и концентрировали. Неочищенное соединение загружали в картридж с целитом и сушили в вакуумном сушильном шкафу. Очистка с помощью флэш-хроматографии с обращенной фазой (0-60, 60, 60-100% ацетонитрил/вода) давала искомое соединение в виде белого твердого вещества (0,57 г, 57%).
Следующие соединения получали по методикам, раскрытым в примере 40:
Метил-4-амино-3-хлор-6-(4-цианофенил)-5-метилпиколинат (соединение 83)
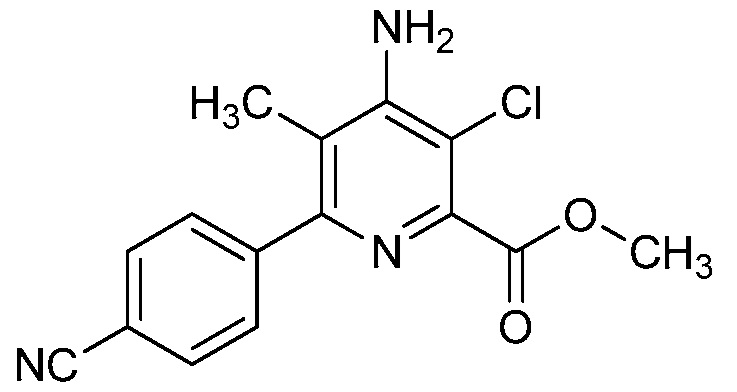 .
.
Искомое соединение получали, как в примере 40, с использованием соединения D и выделяли в виде оранжевого твердого вещества (180 мг, 55%).
Метил-4-амино-3-хлор-6-(4-(дифторметокси)фенил)-5-метилпиколинат (соединение 111)
 .
.
Искомое соединение получали, как в примере 40 и выделяли в виде воскообразного желтого твердого вещества (120 мг, 32%).
Метил-4-амино-3-хлор-5-метил-6-(4-(триметилсилил)фенил)пиколинат
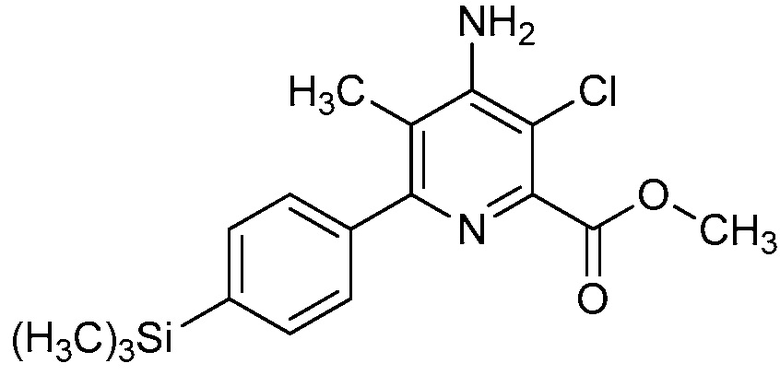 .
.
Искомое соединение получали, как в примере 40, с использованием соединения D и выделяли в виде желтого твердого вещества (1,11 г, 45%): Температура плавления 160-163°C; 1H ЯМР (400 МГц, CDCl3) δ 7,57 (д, J=8,2 Гц, 2H), 7,42 (д, J=8,2 Гц, 2H), 4,80 (с, 2H), 3,94 (с, 3H), 2,18 (с, 3H), 0,28 (с, 9H); 13C ЯМР (101 МГц, CDCl3) δ 167,01, 157,65, 150,16, 146,19, 141,69, 141,24, 134,39, 129,61, 117,96, 114,49, 53,95, 15,86, 1,16; ИЭРМС m/z 348 ([M]-).
Метил-4-амино-3-хлор-6-(3-фтор-4-(триметилсилил)фенил)-5-метилпиколинат
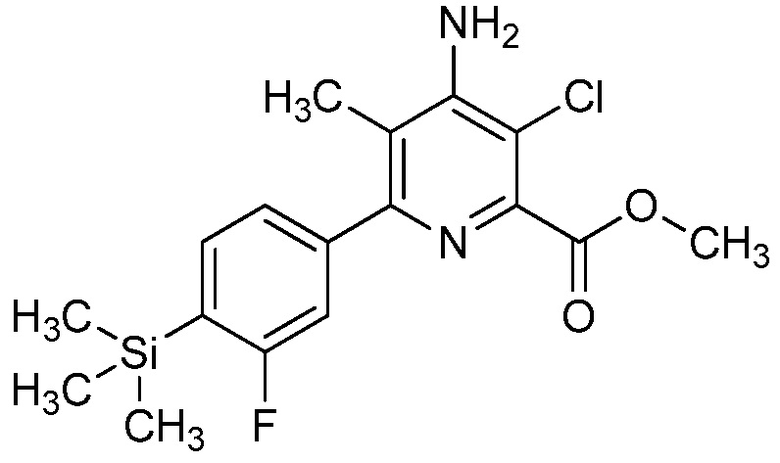 .
.
Искомое соединение получали, как в примере 40, с использованием соединения D и выделяли в виде желтого твердого вещества (346 мг, 27%): Температура плавления 167°C (с разложением); 1H ЯМР (400 МГц, CDCl3) δ 7,43 (дд, J=7,4, 5,8 Гц, 1H), 7,20 (дд, J=7,4, 0,9 Гц, 1H), 7,10 (дд, J=9,2, 1,3 Гц, 1H), 4,83 (с, 2H), 3,95 (с, 3H), 2,18 (с, 3H), 0,33 (д, J=0,8 Гц, 9H); 19F ЯМР (376 МГц, CDCl3) δ -100,73; ИЭРМС m/z 367 ([M+H]+).
Метил-4-амино-3-хлор-6-(4-циано-3-фторфенил)-5-метилпиколинат (соединение 155)
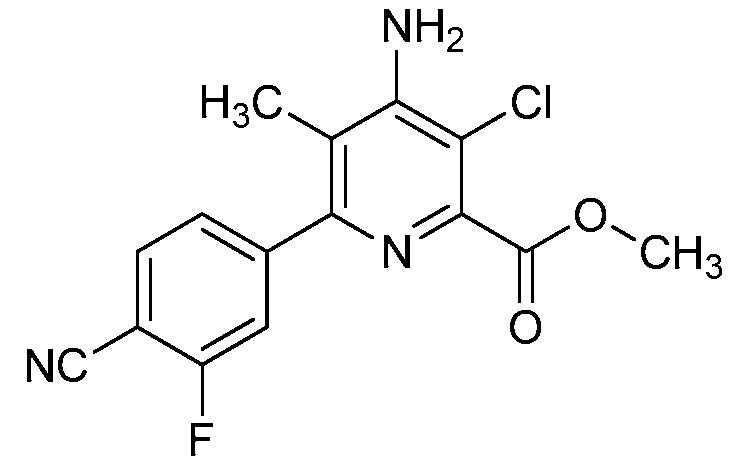
Искомое соединение получали, как в примере 40, с использованием соединения D и выделяли в виде белого хлопьевидного твердого вещества (200 мг, 49%).
Метил-4-амино-3-хлор-6-(3-фтор-4-формилфенил)-5-метилпиколинат
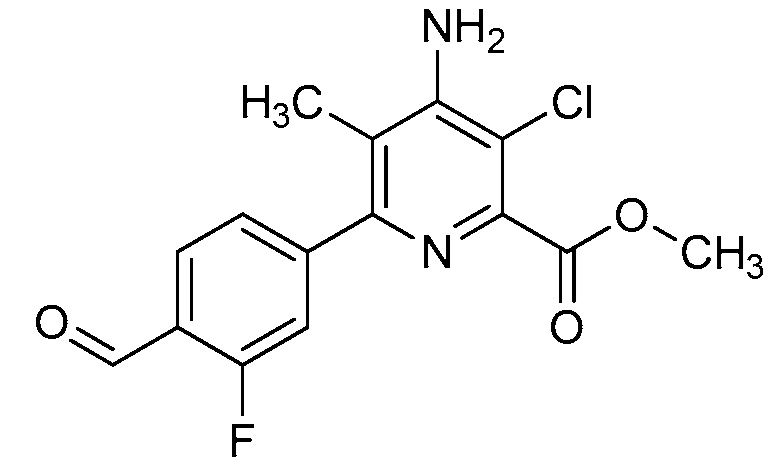 .
.
Искомое соединение получали, как в примере 40, с использованием соединения D и выделяли в виде оранжевого твердого вещества (747 мг, 65%): Температура плавления 114-120°C; 1H ЯМР (400 МГц, CDCl3) δ 10,40 (с, 1H), 7,92 (т, J=7,5 Гц, 1H), 7,38-7,29 (м, 2H), 4,97 (с, 2H), 3,97 (с, 3H), 2,18 (с, 3H); 19F ЯМР (376 МГц, CDCl3) δ -121,53; ИЭРМС m/z 323 ([M+H]+).
Метил-4-амино-3-хлор-5-фтор-6-(2,4,5-трифторфенил)пиколинат (соединение 200)
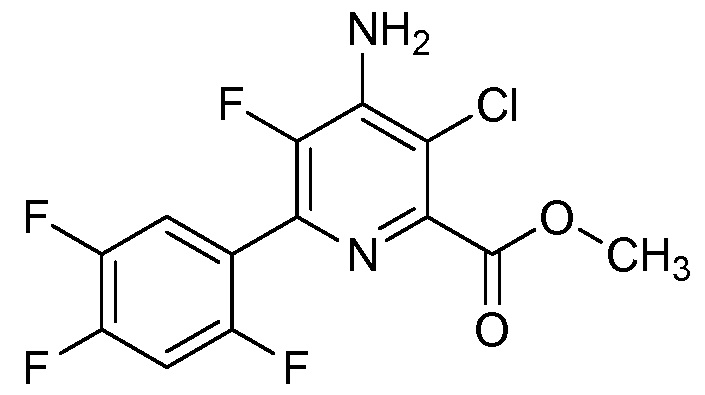
Искомое соединение получали, как в примере 40, с использованием соединения B и выделяли в виде белого порошкообразного вещества (370 мг, 73%).
Пример 41: Получение метил-4-амино-3-хлор-5-фтор-6-(4-нитрофенил)пиколината (соединение 95)
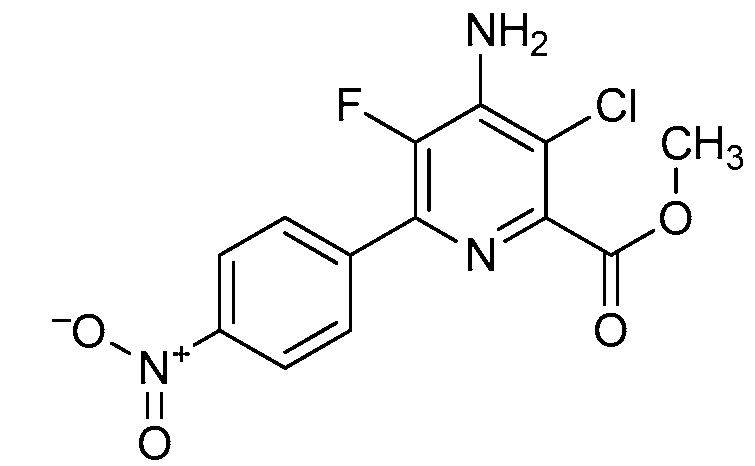 .
.
К суспензии соединения B (250 мг, 1,05 ммоля), (4-нитрофенил)бороновой кислоты (192 мг, 1,15 ммоля), фторида цезия (CsF; 315 мг, 2,09 ммоля) и гидрата натриевой соли трис(3-сульфонатофенил)фосфина (TPPTS, 60 мг, 0,11 ммоля) в смеси вода/ацетонитрил (2,8/0,7 мл) добавляли ацетат палладия (12 мг, 0,05 ммоля). В настольном микроволновом реакторе BiotageTM смесь нагревали при 150°C в течение 5 мин. Затем реакционную смесь фильтровали через целит, разбавляли с помощью EtOAc, промывали водой и рассолом. Затем органические вещества сушили (Na2SO4), фильтровали, концентрировали в вакууме и затем очищали с помощью хроматографии на силикагеле при элюировании с помощью 0-100% EtOAc в гексанах и получали светло-желтое твердое вещество (150 мг, 44%).
Следующее соединение получали по методикам, раскрытым в примере 41:
Метил-4-ацетамидо-3-хлор-6-(2,3-дифтор-4-(трифторметил)фенил)пиколинат
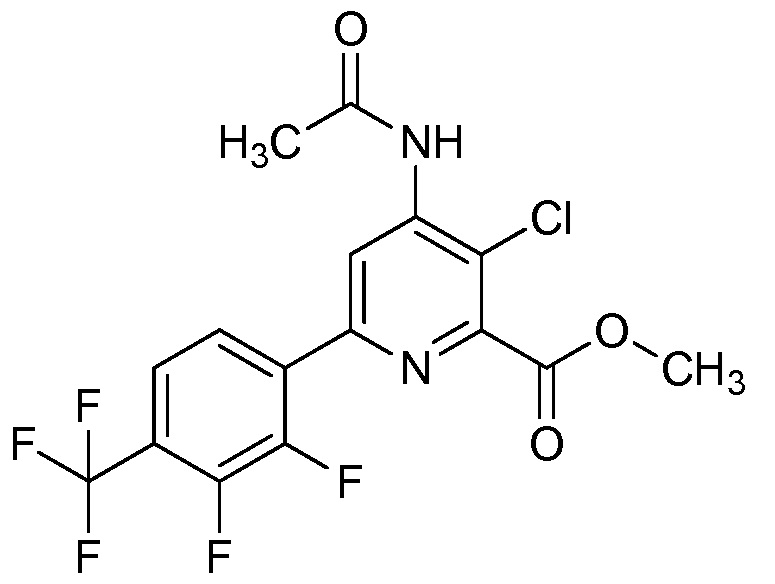
1H ЯМР (400 МГц, ДМСО-d6) δ 10,03 (с, 1H), 8,79 (д, J=1,0 Гц, 1H), 7,93-7,84 (м, 1H), 7,75 (дд, J=8,3, 6,3 Гц, 1H), 3,96 (с, 3H), 2,26 (с, 3H); ИЭРМС m/z 409 ([M+H]+).
Пример 42: Получение метил-4-амино-3-хлор-6-(4-циано-3-фторфенил)-5-фторпиколината (соединение 135)
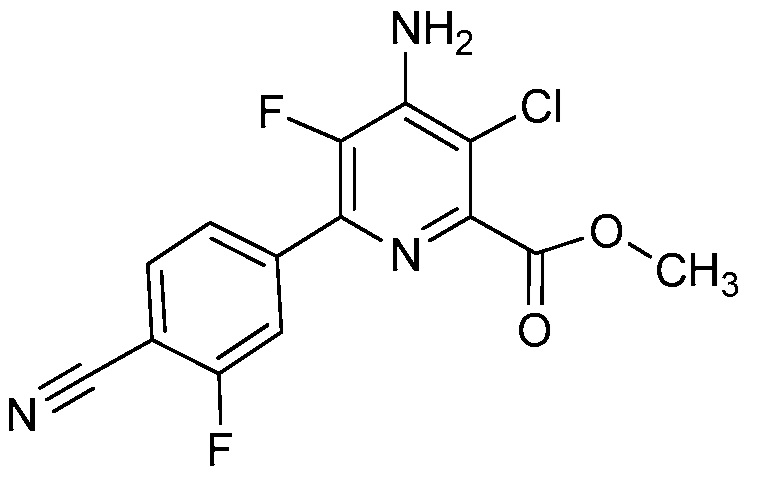 .
.
Соединение B (0,300 г, 1,255 ммоля), 4-циано-3-фторфенилбороновую кислоту (0,248 г, 1,506 ммоля), бис(трифенилфосфин)хлорид палладия(II) (0,088 г, 0,126 ммоля) и фторид цезия (0,381 г, 2,51 ммоля) объединяли в 1,2-диметоксиэтане (2 мл) и воде (2 мл) и нагревали в микроволновом реакторе при 110°C в течение 20 мин. Охлажденную реакционную смесь подвергали распределению между этилацетатом и водой. Органическую фазу сушили и концентрировали. Продукт очищали с помощью флэш-хроматографии (SiO2; при элюировании с помощью 5-60% этилацетата в гексанах) и получали искомое соединение в виде белого твердого вещества (0,189 г, 46,5%).
Пример 43: Получение метил-4-амино-3-хлор-5-фтор-6-(4-(метоксикарбонил)фенил)пиколината (соединение 190)
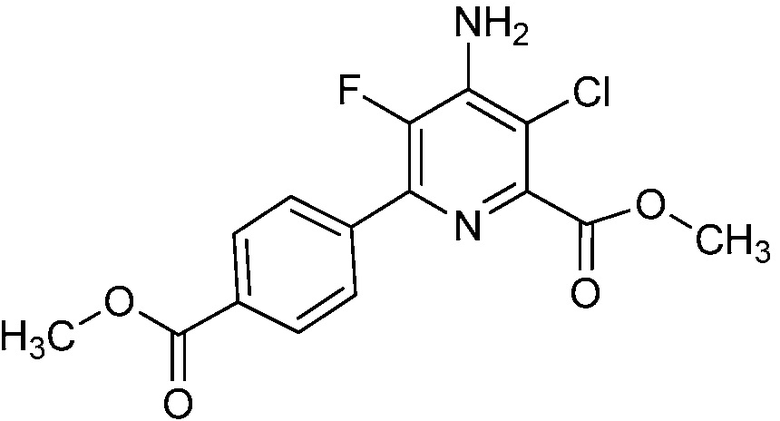 .
.
Соединение B (0,4 г, 1,673 ммоля), 4-(метоксикарбонил)фенилбороновую кислоту (0,392 г, 2,175 ммоля), фторид калия (0,253 г, 4,35 ммоля) и бис(трифенилфосфин)хлорид палладия(II) (0,059 г, 0,084 ммоля) объединяли в ацетонитриле (3 мл) и воде (1 мл). Затем реакционную смесь облучали в микроволновой печи при 110°C в герметизированном сосуде в течение 20 мин. Охлажденную реакционную смесь подвергали распределению между этилацетатом и водой. Органическую фазу сушили и концентрировали на силикагеле. Эту смесь вводили сверху в колонку с силикагелем и продукт элюировали в градиентном режиме с использованием системы растворителей 5-60% этилацетата в гексанах. Эта процедура давала искомое соединение в виде белого твердого вещества (0,230 г, 40,6%).
Пример 44: Получение метил-4-амино-6-(4-бром-2,3-дифторфенил)-3-хлорпиколината (соединение 114)
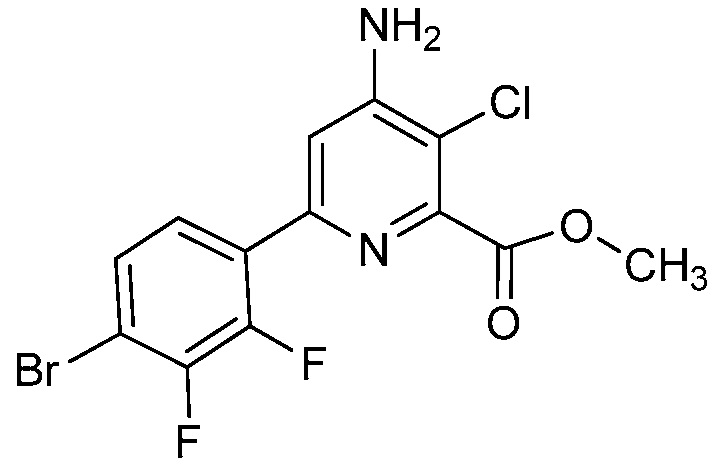 .
.
Стадия 1: Соединение N (0,600 г, 1,692 ммоля), 4-бром-2,3-дифторфенилбороновую кислоту (0,481 г, 2,031 ммоля), фторид цезия (0,617 г, 4,06 ммоля) и бис(трифенилфосфин)хлорид палладия(II) (0,119 г, 0,169 ммоля) объединяли в 1,2-диметоксиэтане (4 мл) и воде (4 мл) и нагревали в микроволновом реакторе в течение 20 мин при 110°C. Охлажденную реакционную смесь подвергали распределению между этилацетатом и водой. Органическую фазу отделяли и концентрировали на силикагеле. Продукт элюировали в градиентном режиме с использованием смеси этилацетат/гексаны и получали метил-4-ацетамидо-6-(4-бром-2,3-дифторфенил)-3-хлорпиколинат (0,515 г, 72,5%) в виде белого твердого вещества.
Стадия 2: Метил-4-ацетамидо-6-(4-бром-2,3-дифторфенил)-3-хлорпиколинат (0,515 г, 1,227 ммоля) суспендировали в метаноле (20 мл) и по каплям добавляли ацетилхлорид (1,559 мл, 21,93 ммоля). Реакционную смесь перемешивали в течение ночи при комнатной температуре и концентрировали в вакууме. Остаток подвергали распределению между этилацетатом и 5% водным раствором бикарбоната натрия. Органическую фазу концентрировали на силикагеле и очищали с помощью флэш-хроматографии (SiO2; при элюировании с помощью 5-60% этилацетата в гексанах) и получали искомое соединение в виде белого твердого вещества (0,231 г, 55,8%).
Пример 45: Получение метил-4-амино-3-хлор-6-(2,3-дифтор-4-(триметилсилил)фенил)-5-фторпиколината
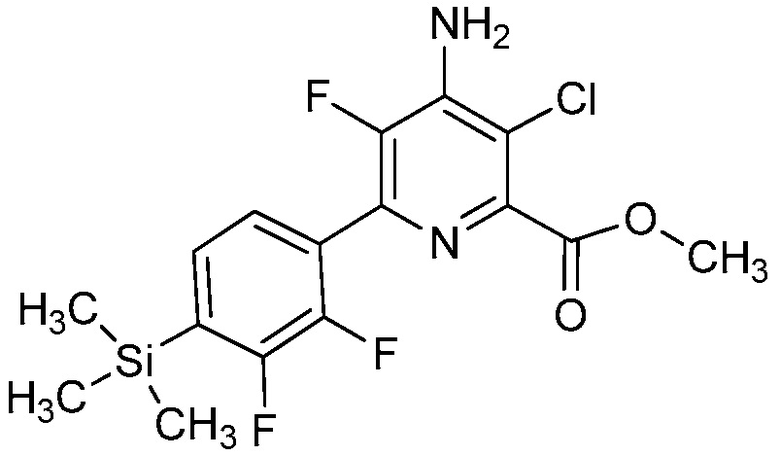 .
.
Соединение B (2,0 г, 8,37 ммоля), (2,3-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)триметилсилан (3,40 г, 10,88 ммоля), карбонат натрия (0,887 г, 8,37 ммоля) и бис(трифенилфосфин)хлорид палладия(II) (0,587 г, 0,837 ммоля) объединяли в ацетонитриле (25 мл) и воде (8 мл). Затем реакционную смесь кипятили с обратным холодильником в течение 4 ч. Охлажденную реакционную смесь подвергали распределению между этилацетатом и водой. Органическую фазу дважды дополнительно промывали водой затем концентрировали на силикагеле. Эту смесь очищали с помощью хроматографии на силикагеле и продукт элюировали с помощью системы растворителей 7-60% этилацетата в гексанах. Эта процедура давала искомое соединение в виде белого твердого вещества (2,7 г, 83%): Температура плавления 160-162°C; 1H ЯМР (300 МГц, CDCl3) δ 7,37-7,28 (м, 1H), 7,21 (ддд, J=7,7, 4,4, 1,3 Гц, 1H), 4,96 (ушир.с, 2H), 3,97 (с, 3H), 0,35 (с, 9H).
Пример 46: Получение метил-6-амино-2-(3-фтор-4-(трифторметил)фенил)-5-метоксипиримидин-4-карбоксилата (соединение 26)
 .
.
В сосуд для микроволновой печи добавляли соединение C (184 мг, 0,846 ммоля), 2-(3-фтор-4-(трифторметил)фенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан (270 мг, 0,930 ммоля), фторид калия (128 мг, 2,198 ммоля) и бис(трифенилфосфин)хлорид палладия(II) (59,3 мг, 0,085 ммоля). Затем добавляли ацетонитрил (2,789 мл) и воду (2,79 мл). Затем реакционный сосуд закрывали и помещали в микроволновый реактор BiotageTM Initiator на 20 мин при 115°C и за температурой следили с помощью установленного сбоку от сосуда ИК датчика температуры. Реакционную смесь охлаждали до комнатной температуры, разбавляли с помощью EtOAc и промывали с помощью H2O. Органические вещества сушили над Na2SO4, фильтровали и концентрировали в вакууме. Неочищенный продукт очищали с помощью флэш-хроматографии (диоксид кремния; гексаны/EtOAc). Эта процедура давала искомое соединение (172 мг, 58,9%) в виде белого твердого вещества.
Пример 47: Получение метил-4-амино-3-хлор-5-фтор-6-(4-(триметилсилил)фенил)пиколината
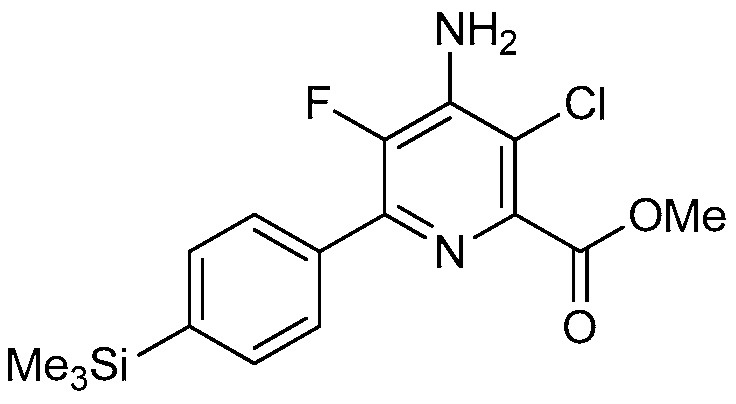 .
.
Соединение B (600 мг, 2,5 ммоля, 1,0 экв.) и (4-(триметилсилил)фенил)бороновую кислоту (540 мг, 2,8 ммоля, 1,1 экв.) объединяли в сосуде объемом 20 мл и затем добавляли фторид цезия (420 мг, 2,8 ммоля, 1,1 экв.), ацетат палладия (28 мг, 0,13 ммоля, 0,05 экв.) и 3,3',3''-фосфинтриилтрибензолсульфонат натрия (140 мг, 0,25 ммоля, 0,10 экв.). Добавляли 3:1 смесь вода:ацетонитрил (7,2 мл) и полученную коричневую смесь закрывали и помещали в микроволновый реактор Biotage InitiatorTM на 5 мин при 150°C и за температурой следили с помощью установленного сбоку от сосуда ИК датчика температуры. Охлажденную реакционную смесь разбавляли водой (150 мл) и экстрагировали дихлорметаном (5×60 мл). Объединенные органические слои сушили (MgSO4), фильтровали самотеком и концентрировали путем выпаривания в роторном испарителе. Остаток очищали с помощью колоночной хроматографии на силикагеле (33% этилацетата в гексанах) и получали искомое соединение в виде бледно-желтого порошкообразного вещества (700 мг, 79%): Температура плавления 148-150°C; 1H ЯМР (300 МГц, CDCl3) δ 7,86 (м, 2H), 7,62 (м, 2H), 4,88 (ушир.с, 2H), 3,98 (с, 3H), 0,29 (с, 9H); ИЭРМС m/z 353 ([M+H]+).
Следующие соединения получали по методикам, раскрытым в примере 47:
Метил-4-амино-3-хлор-5-фтор-6-(2-фтор-4-формилфенил)пиколинат
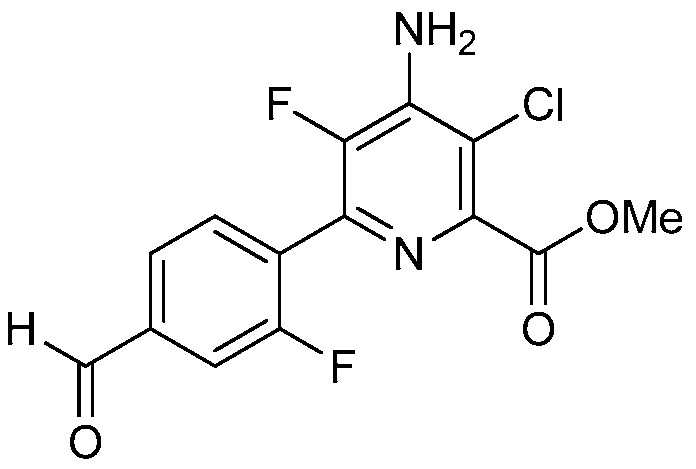 .
.
Температура плавления 151-154°C; 1H ЯМР (400 МГц, CDCl3) δ 10,06 (д, J=2 Гц, 1H), 7,79-7,84 (м, 2H), 7,67 (дд, J=10, 1 Гц, 1H), 5,00 (ушир.с, 2H), 3,99 (с, 3H); ИЭРМС m/z 327 ([M+H]+).
Метил-6-амино-2-(2-фтор-4-формилфенил)-5-метоксипиримидин-4-карбоксилат
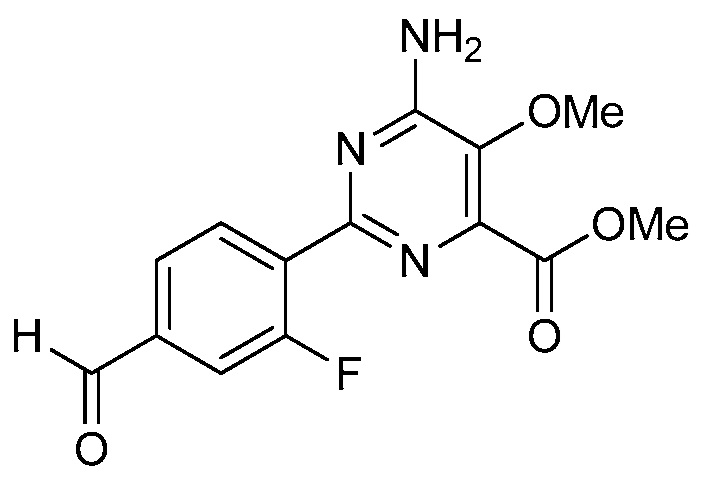 .
.
Температура плавления 176-178°C; 1H ЯМР (400 МГц, CDCl3) δ 10,03 (д, J=2 Гц, 1H), 8,10 (т, J=8 Гц, 1H), 7,73 (дд, J=8, 1,5 Гц, 1H), 7,65 (дд, J=8, 1,5 Гц, 1H), 5,45 (ушир.с, 2H), 4,00 (с, 3H), 3,96 (с, 3H); ИЭРМС m/z 306 ([M+H]+).
Метил-4-амино-3-хлор-6-(2,3-дифтор-4-формилфенил)-5-фторпиколинат
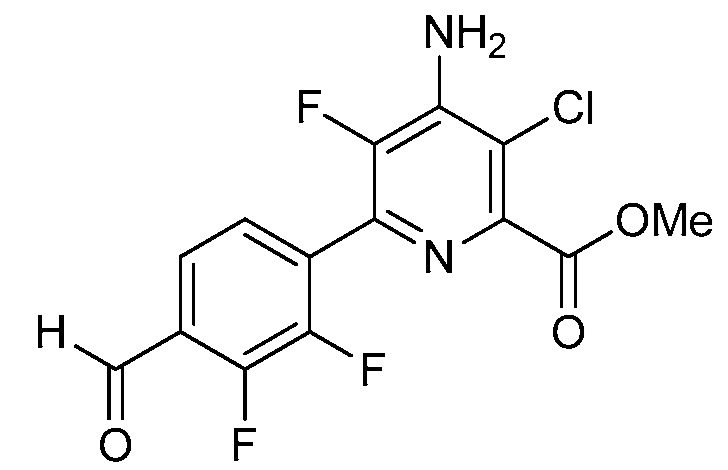 .
.
1H ЯМР (400 МГц, CDCl3) δ 10,40 (д, J=1 Гц, 1H), 7,74 (м, 1H), 7,52 (м, 1H), 5,01 (ушир.с, 2H), 3,97 (с, 3H).
Метил-6-амино-2-(2,3-дифтор-4-формилфенил)-5-метоксипиримидин-4-карбоксилат
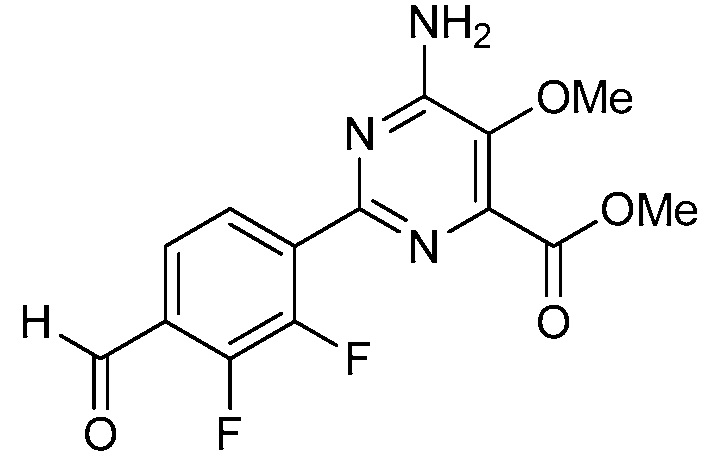 .
.
Температура плавления 184-186°C; 1H ЯМР (400 МГц, CDCl3) δ 10,38 (д, J=0,5 Гц, 1H), 7,84 (м, 1H), 7,67 (ддд, J=8, 6, 2 Гц, 1H), 5,47 (ушир.с, 2H), 4,01 (с, 3H), 3,96 (с, 3H); ИЭРМС m/z 324 ([M+H]+).
Метил-6-амино-2-(4-формилфенил)-5-метоксипиримидин-4-карбоксилат
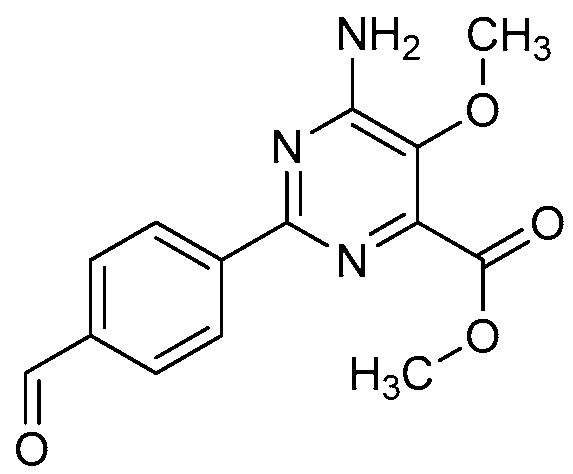 .
.
Температура плавления 155-156°C; 1H ЯМР (400 МГц, CDCl3) δ 10,1 (с, 1H), 8,54 (д, 2H), 7,99 (д, 2H), 5,56 (с, 2H), 4,08(с, 3H), 3,99(с, 3H); ИЭРМС m/z 288 ([M+H]+).
Метил-4-амино-3,5-дихлор-6-(4-формилфенил)пиколинат
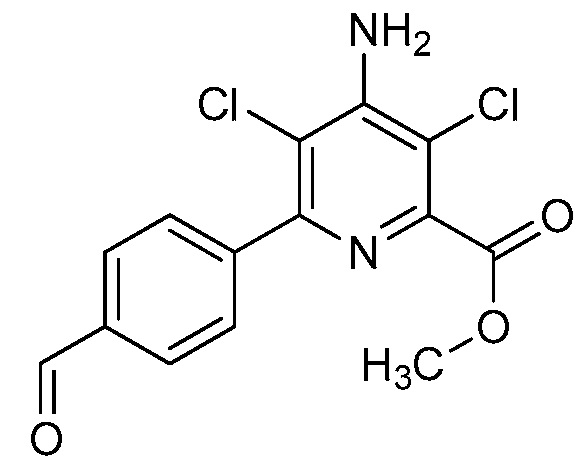 .
.
Температура плавления 131-133°C; 1H ЯМР (400 МГц, CDCl3) δ 10,08 (с, 1H), 7,96 (д, 2H), 7,83 (д, 2H), 5,36 (с, 2H), 3,98 (с, 3H); ИЭРМС m/z 325 ([M+H]+).
Пример 48: Получение метил-4-амино-3-хлор-5-фтор-6-(3-фтор-4-(триметилсилил)фенил)пиколината
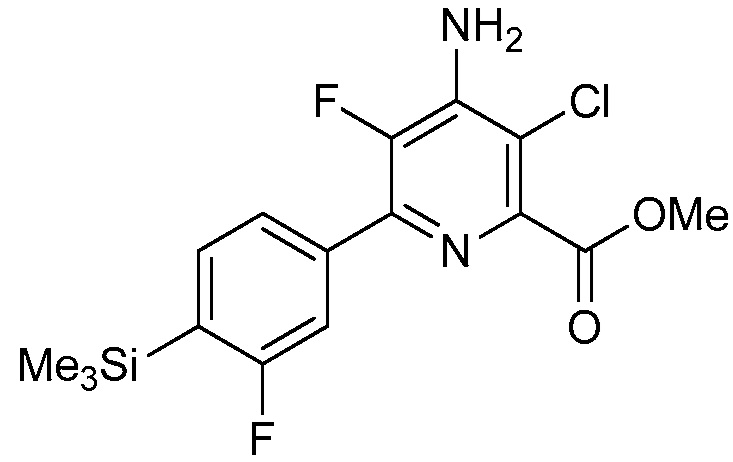 .
.
Дихлор[бис(трифенилфосфино)]-палладий(II) (150 мг, 0,21 ммоля, 0,10 экв.) и карбонат натрия (270 мг, 2,5 ммоля, 1,2 экв.) при перемешивании последовательно добавляли к смеси неочищенного (2-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)триметилсилана (990 мг, 2,5 ммоля, 1,2 экв.) и соединение B (500 мг, 2,1 ммоля, 1,0 экв.) в 1:1 смеси вода:ацетонитрил (7,0 мл) при 23°C. Полученную темно-оранжевую смесь нагревали при 85°C и перемешивали в течение 4 ч. Охлажденную реакционную смесь разбавляли водой (150 мл) и экстрагировали дихлорметаном (3×80 мл). Объединенные органические слои сушили (MgSO4), фильтровали самотеком и концентрировали путем выпаривания в роторном испарителе. Остаток очищали с помощью колоночной хроматографии на силикагеле (25% этилацетата в гексанах) и получали искомое соединение в виде бледно-желтого порошкообразного вещества (500 мг, 65%): Температура плавления 125-127°C; ИК (тонкая пленка) 3481 (м), 3350 (с), 2952 (w), 1728 (м), 1610 (м) см-1; 1H ЯМР (400 МГц, CDCl3) δ 7,71 (дт, J=6,5, 1 Гц, 1H), 7,59 (дт, J=10, 1 Гц, 1H), 7,50 (дд, J=8, 6,5 Гц, 1H), 4,91 (ушир.с, 2H), 3,99 (с, 3H), 0,33 (д, 9H); ИЭРМС m/z 371 ([M+H]+).
Следующие соединения получали по методикам, раскрытым в примере 48:
Метил-4-амино-3-хлор-6-(2,3-дифтор-4-(триметилсилил)фенил)-5-фторпиколинат
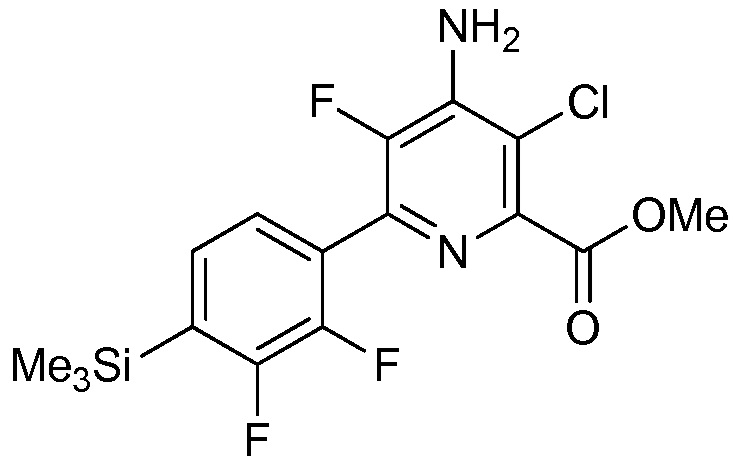 .
.
1H ЯМР (400 МГц, CDCl3) δ 7,33 (ддд, J=8, 4,5, 1 Гц, 1H), 7,21 (ддд, J=8, 5, 1,5 Гц, 1H), 4,94 (ушир.с, 2H), 3,96 (с, 3H), 0,33 (д, J=1 Гц, 9H); ИЭРМС m/z 389 ([M+H]+).
Метил-4-амино-3-хлор-5-фтор-6-(2-фтор-4-(триметилсилил)фенил)пиколинат
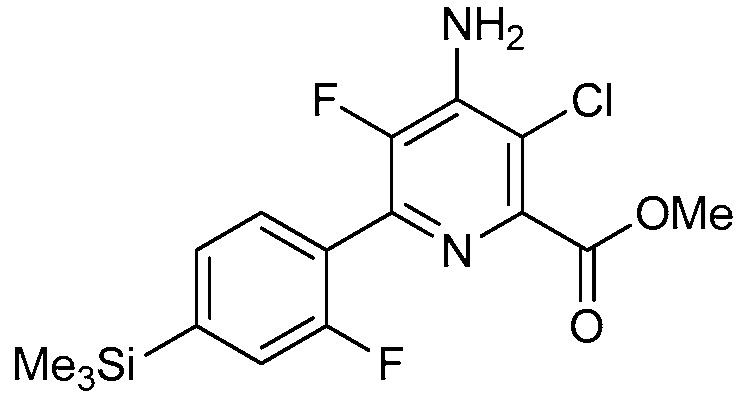 .
.
Температура плавления 175-177°C; 1H ЯМР (400 МГц, CDCl3) δ 7,58 (т, J=8 Гц, 1H), 7,39 (дд, J=8, 1 Гц, 1H), 7,27 (м, 1H), 4,91 (ушир.с, 2H), 3,96 (с, 3H), 0,26 (с, 9H); ИЭРМС m/z 371 ([M+H]+).
Метил-6-амино-2-(2-фтор-4-(триметилсилил)фенил)-5-метоксипиримидин-4-карбоксилат
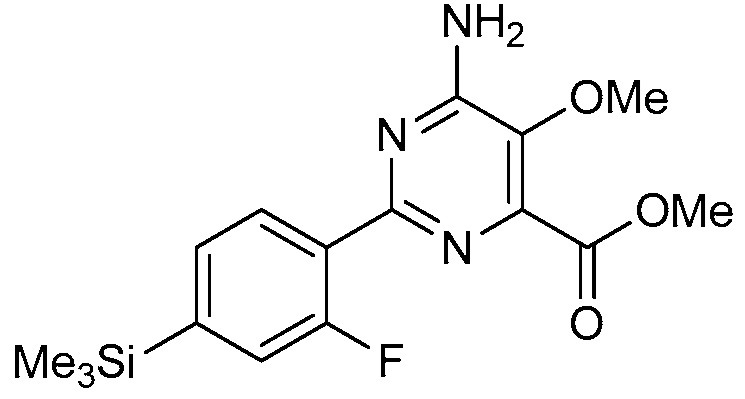 .
.
Температура плавления 140-142°C; 1H ЯМР (400 МГц, CDCl3) δ 7,85 (т, J=8 Гц, 1H), 7,32 (дд, J=8, 1 Гц, 1H), 7,26 (м, 1H), 5,38 (ушир.с, 2H), 3,99 (с, 3H), 3,94 (с, 3H), 0,26 (с, 9H); ИЭРМС m/z 348 ([M-H]-).
Метил-4-ацетамидо-3-хлор-6-(2,3-дифтор-4-(триметилсилил)фенил)пиколинат
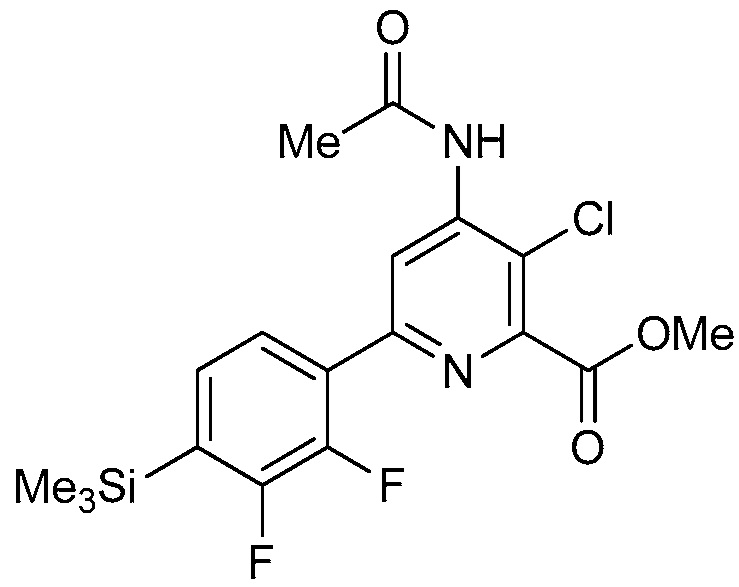 .
.
1H ЯМР (400 МГц, CDCl3) δ 9,04 (д, J=1 Гц, 1H), 7,99 (ушир.с, 1H), 7,65 (м, 1H), 7,18 (м, 1H), 4,00 (с, 3H), 2,31 (с, 3H), 0,33 (д, J=1 Гц, 9H); ИЭРМС m/z 413 ([M-H]-).
Метил-6-амино-5-метокси-2-(4-(триметилсилил)фенил)пиримидин-4-карбоксилат
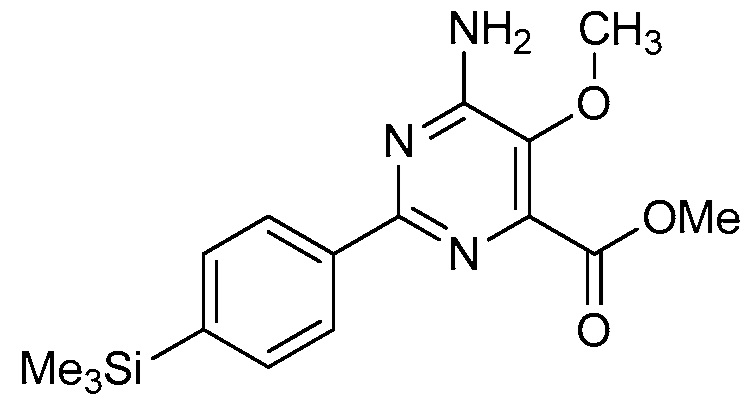 .
.
1H ЯМР (400 МГц, CDCl3) δ 8,25 (м, 2H), 7,58 m, 2H), 5,35 (ушир.с, 2H), 4,01 (с, 3H), 3,91 (с, 3H). 0,30 (с, 9H); ИЭРМС m/z 330 ([M-H]-).
Метил-4-ацетамидо-3-хлор-6-(4-(триметилсилил)фенил)пиколинат
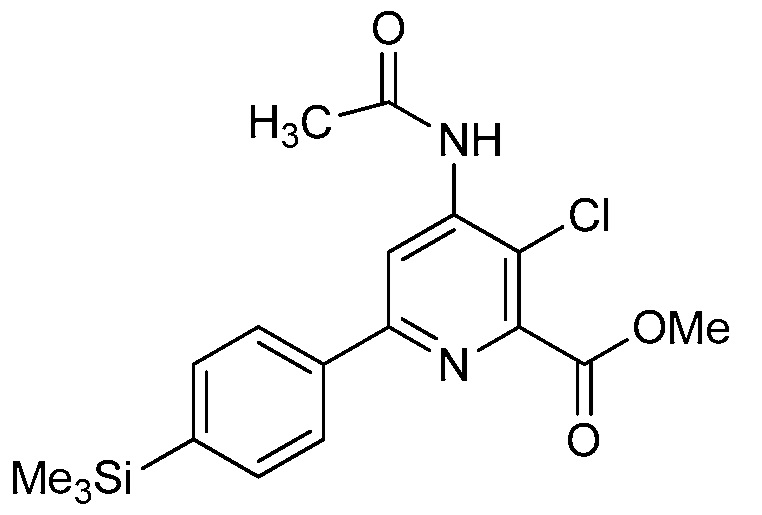 .
.
1H ЯМР (400 МГц, CDCl3) δ 9,00 (с, 1H), 7,98 (м, 2H), 7,61 (м, 2H), 7,25 (с, 1H), 4,01 (с, 3H), 2,32 (с, 3H), 0,29 (с, 9H); ИЭРМС m/z 375 ([M-H]-).
Пример 49: Получение метил-4-ацетамидо-6-(4-амино-2,3,6-трифторфенил)-3-хлорпиколината
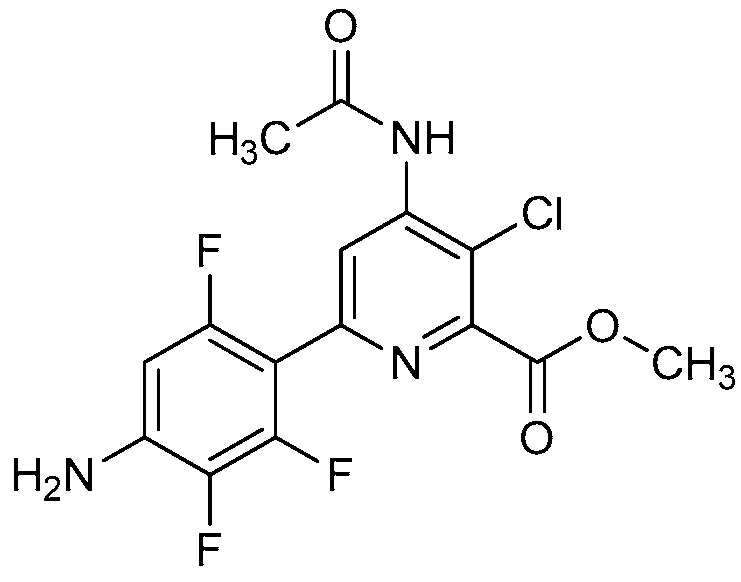 .
.
Суспензию метил-4-ацетамидо-3-хлор-6-(триметилстаннил)пиколината (соединение K; 0,502 г, 1,409 ммоля, 1,0 экв.), 2,3,5-трифтор-4-йоданилина (0,5 г, 1,831 ммоля, 1,3 экв.), бис(трифенилфосфин)хлорида палладия(II) (0,098 г, 0,1401 ммоля, 0,1 экв.) и CuI (26 мг, 0,1401 ммоля, 0,1 экв.) в сухом ДМФ (3 мл) облучали микроволновым излучением при 120°C в течение 1 ч. Реакционную смесь охлаждали до 20°C и перемешивали с водным раствором фторида калия (KF) (20 мл) в течение 15 мин и затем экстрагировали этилацетатом (3×100 мл). Объединенные органические слои сушили над безводным Na2SO4, фильтровали и выпаривали досуха при пониженном давлении. Неочищенный продукт очищали на силикагеле (60-120 меш) в градиентном режиме с использованием 0-30% EtOAc в гексанах и получали искомое соединение в виде коричневого твердого вещества (280 мг, 44,8%): 1H ЯМР (400 МГц, ДМСО-d6) δ 9,96 (с, 1H), 8,32 (с, 1H), 6,51-6,46 (м, 1H), 6,22 (ушир.с, 2H), 3,92 (с, 3H), 2,23 (с, 3H); ИЭРМС m/z 376 ([M+3H]+).
Пример 50: Получение метил-4-амино-3-хлор-6-(2,5-дифтор-4-(триметилсилил)фенил)-5-фторпиколината
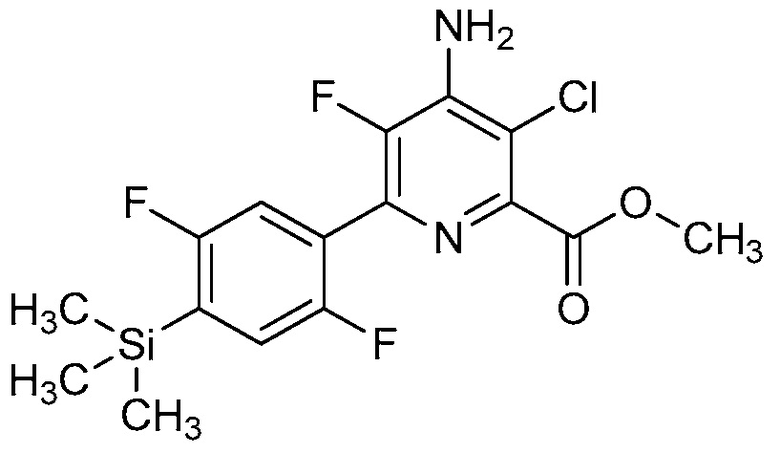 .
.
В сосуде для микроволновой печи суспензию (2,5-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)триметилсилана (см., например, WO 2013003740 A1; 0,6 г, 1,922 ммоля), метил-4-амино-3,6-дихлор-5-фторпиколината (соединение B; 0,383 г, 1,601 ммоля), бис(трифенилфосфин)хлорида палладия(II) (0,112 г, 0,160 ммоля) и карбоната натрия (0,204 г, 1,922 ммоля) в 3:1 смеси ацетонитрила (4,00 мл) и воды (1,334 мл) перемешивали при нагревании микроволновым излучением (120°C, 20 мин). Реакционную смесь выливали в разбавленный вдвое насыщенный рассол и экстрагировали с помощью EtOAc (3×). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали с помощью препаративной ВЭЖХ с обращенной фазой (градиентный режим вода/ацетонитрил) и получали искомое соединение в виде белого твердого вещества (0,271 г, 43,5%): 1H ЯМР (400 МГц, CDCl3) δ 7,23 (дд, J=7,8, 5,1 Гц, 1H), 7,13 (дд, J=9,3, 4,0 Гц, 1H), 4,95 (с, 2H), 3,98 (с, 3H), 0,33 (д, J=0,8 Гц, 9H); 19F ЯМР (376 МГц, CDCl3) δ -106,81, -106,87, -121,20, -121,25, -121,29, -121,35, -137,32, -137,41; ИЭРМС m/z 389 ([M+H]+).
Пример 51: Получение метил-4-амино-3-хлор-6-(2,5-дифтор-4-(триметилсилил)фенил)пиколината
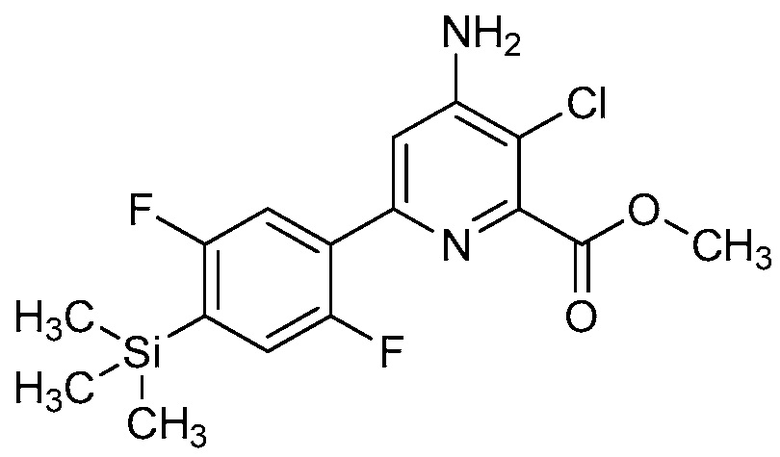 .
.
В сосуде для микроволновой печи суспензию (2,5-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)триметилсилана (см., например, WO 2013003740 A1) (0,6 г, 1,922 ммоля), метил-4-амино-3,6-дихлорпиколината (соединение A) (0,354 г, 1,601 ммоля), бис(трифенилфосфин)хлорида палладия(II) (0,112 г, 0,160 ммоля) и карбоната натрия (0,204 г, 1,922 ммоля) в 3:1 смеси ацетонитрила (4,00 мл) и воды (1,334 мл) перемешивали при нагревании микроволновым излучением (120°C, 20 мин). Реакционную смесь выливали в разбавленный вдвое насыщенный рассол и экстрагировали с помощью EtOAc (3×). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали с помощью препаративной ВЭЖХ с обращенной фазой (градиентный режим вода/ацетонитрил) и получали искомое соединение в виде белого твердого вещества (0,234 г, 0,631 ммоля, 39,4%): 1H ЯМР (400 МГц, CDCl3) δ 7,66 (дд, J=8,7, 5,8 Гц, 1H), 7,25 (д, J=1,2 Гц, 1H), 7,09 (дд, J=10,8, 4,1 Гц, 1H), 4,84 (с, 2H), 4,00 (с, 3H), 0,32 (д, J=0,7 Гц, 9H); 19F ЯМР (376 МГц, CDCl3) δ -106,56, -106,61, -124,00, -124,06; ИЭРМС m/z 371 ([M+H]+).
Пример 52: Получение метил-4-ацетамидо-3-хлор-6-(2,5-дифтор-4-(триметилсилил)фенил)пиколината
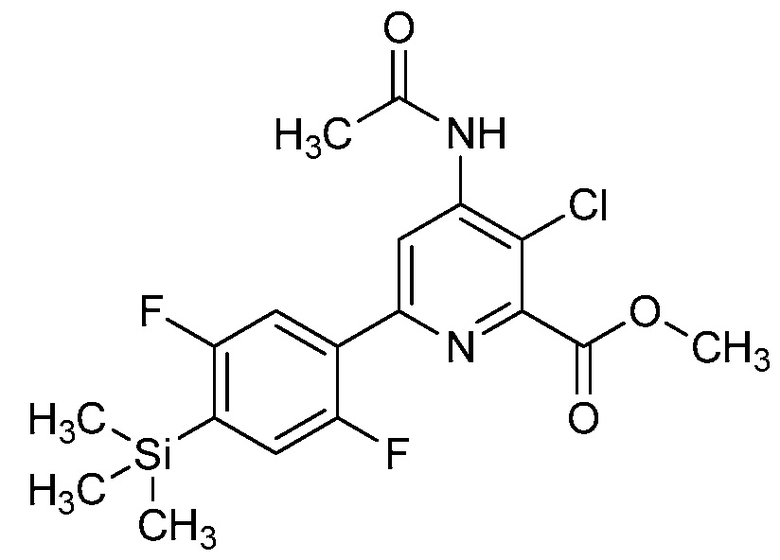 .
.
В сосуде для микроволновой печи суспензию (2,5-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)триметилсилана (см., например, WO 2013003740 A1; 1 г, 2,56 ммоля), метил-4-ацетамидо-3,6-дихлорпиколината (соединение L; 0,562 г, 2,135 ммоля), бис(трифенилфосфин)хлорида палладия(II) (0,150 г, 0,214 ммоля) и карбоната натрия (0,272 г, 2,56 ммоля) в 3:1 смеси ацетонитрила (5,34 мл) и воды (1,779 мл) перемешивали при нагревании микроволновым излучением (120°C, 20 мин). Реакционную смесь выливали в разбавленный вдвое насыщенный рассол и экстрагировали с помощью EtOAc (3×). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали с помощью препаративной ВЭЖХ с обращенной фазой (градиентный режим вода/ацетонитрил) и получали искомое соединение в виде белого твердого вещества (0,481 г, 54,6%): Температура плавления 135-137°C; 1H ЯМР (400 МГц, CDCl3) δ 9,07 (д, J=0,8 Гц, 1H), 7,96 (с, 1H), 7,62 (дд, J=8,5, 5,7 Гц, 1H), 7,13 (дд, J=10,5, 4,1 Гц, 1H), 4,02 (с, 3H), 2,33 (с, 3H), 0,33 (д, J=0,8 Гц, 9H); 19F ЯМР (376 МГц, CDCl3) δ -106,66, -106,72, -123,42, -123,48; ИЭРМС m/z 411 ([M-H]-).
Пример 53: Получение метил-6-амино-2-(2,5-дифтор-4-(триметилсилил)фенил)-5-метоксипиримидин-4-карбоксилата
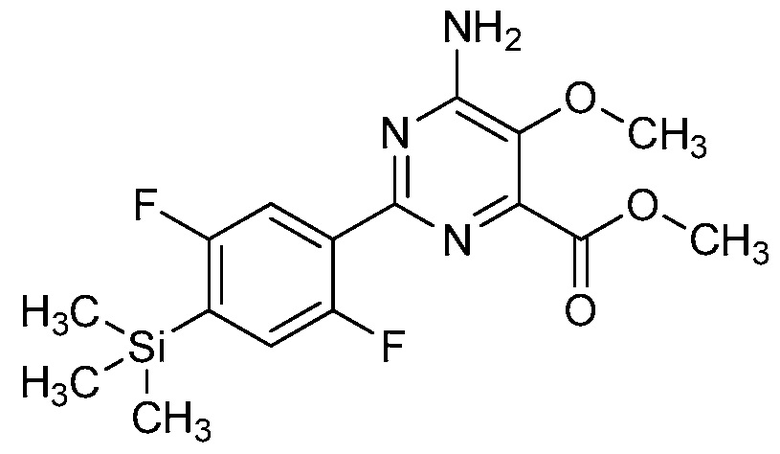 .
.
В сосуде для микроволновой печи суспензию (2,5-дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)триметилсилана (см., например, WO 2013003740 A1; 1,925 г, 5,05 ммоля), метил-6-амино-2-хлор-5-метоксипиримидин-4-карбоксилата (соединение C; 1 г, 4,60 ммоля), бис(трифенилфосфин)хлорида палладия(II) (0,323 г, 0,460 ммоля) и карбоната натрия (0,584 г, 5,51 ммоля) в 3:1 смеси ацетонитрила (8,62 мл) и воды (2,87 мл) перемешивали при нагревании микроволновым излучением (120°C, 20 мин). Реакционную смесь выливали в разбавленный вдвое насыщенный рассол и экстрагировали с помощью EtOAc (3×). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали с помощью препаративной ВЭЖХ с обращенной фазой (градиентный режим вода/ацетонитрил) и получали искомое соединение в виде белого твердого вещества (0,994 г, 58,9%): Температура плавления 130-131°C; 1H ЯМР (400 МГц, CDCl3) δ 7,53 (дд, J=8,4, 5,6 Гц, 1H), 7,10 (дд, J=10,2, 4,1 Гц, 1H), 5,44 (с, 2H), 4,00 (с, 3H), 3,94 (с, 3H), 0,32 (д, J=0,9 Гц, 9H); 19F ЯМР (376 МГц, CDCl3) δ -107,45, -107,51, -122,32, -122,37; ИЭРМС m/z 367 ([M]+).
Пример 54: Получение метил-4-амино-6-(2,3-дифтор-4-(трифторметил)фенил)-5-фтор-3-винилпиколината (соединение 53)
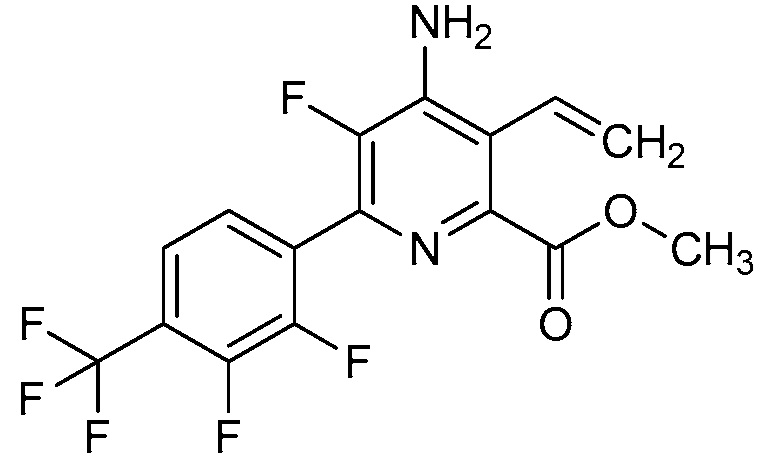 .
.
В сосуде для микроволновой печи суспензию 2-(2,3-дифтор-4-(трифторметил)фенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана (имеется в продаже; 0,641 г, 2,081 ммоля), метил-4-амино-6-хлор-5-фтор-3-винилпиколината (соединение G; 0,4 г, 1,734 ммоля), бис(трифенилфосфин)хлорида палладия(II) (0,122 г, 0,173 ммоля) и карбоната натрия (0,368 г, 3,47 ммоля) в 3:1 смеси ацетонитрила (3,25 мл) и воды (1,084 мл) перемешивали при нагревании микроволновым излучением (120°C, 20 мин). Реакционную смесь выливали в разбавленный вдвое насыщенный рассол и экстрагировали с помощью EtOAc (3×). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали с помощью препаративной ВЭЖХ с обращенной фазой (градиентный режим вода/ацетонитрил) и получали искомое соединение в виде коричневого твердого вещества (0,163 г, 24,98%).
Пример 55: Получение метил-4-амино-6-(4-аминофенил)-5-фтор-3-винилпиколината
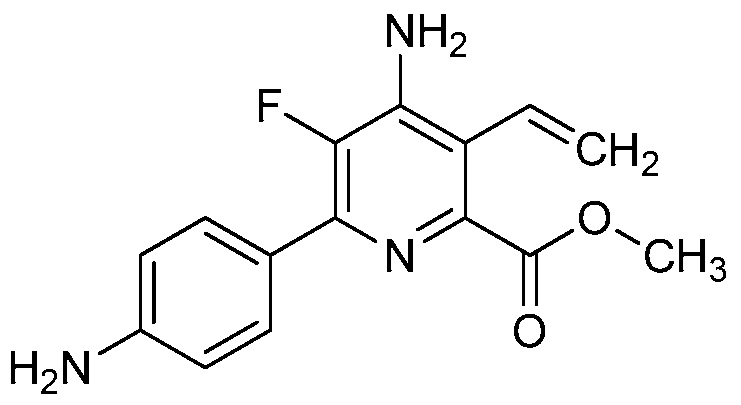 .
.
В сосуде для микроволновой печи суспензию 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)анилина (имеется в продаже; 0,617 г, 2,82 ммоля), метил-4-амино-6-хлор-5-фтор-3-винилпиколината (соединение G; 0,5 г, 2,168 ммоля), бис(трифенилфосфин)хлорида палладия(II) (0,152 г, 0,217 ммоля) и фторида калия (0,327 г, 5,64 ммоля) в 1:1 смеси ацетонитрила (3,61 мл) и воды (3,61 мл) перемешивали при нагревании микроволновым излучением (120°C, 20 мин). Реакционную смесь выливали в разбавленный вдвое насыщенный рассол и экстрагировали с помощью EtOAc (3×). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали с помощью колоночной флэш-хроматографии (SiO2, 24 г; градиентный режим гексаны/EtOAc) и получали искомое соединение в виде желтого твердого вещества (0,552 г, 89%): 1H ЯМР (400 МГц, ДМСО-d6) δ 7,60-7,58 (м, 2H), 6,72 (дд, J=17,7, 11,5 Гц, 1H), 6,65-6,58 (м, 2H), 6,24 (с, 2H), 5,47 (с, 2H), 5,45 (дд, J=11,5, 1,2 Гц, 1H), 5,38 (дд, J=17,7, 1,2 Гц, 1H), 3,77 (с, 3H); 19F ЯМР (376 МГц, ДМСО-d6) δ -146,62; ИЭРМС m/z 286 ([M-H]-).
Пример 56: Получение метил-6-амино-2-(4-(дифторметокси)фенил)-5-метоксипиримидин-4-карбоксилата (соединение 106)
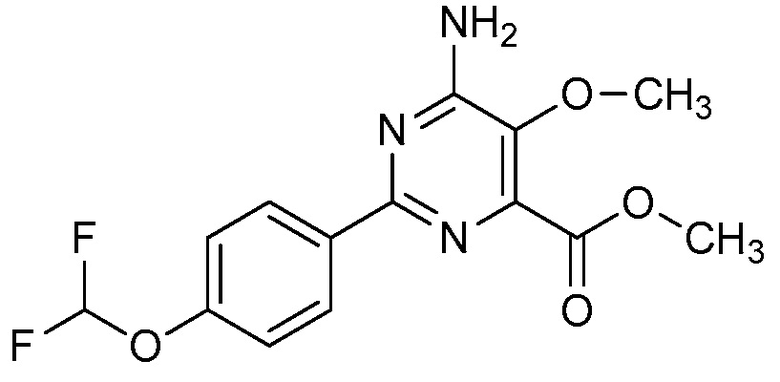 .
.
В безопасный сосуд для микроволновой печи объемом 5 мл добавляли фторид калия (0,151 г, 2,59 ммоля), ацетат палладия(II) (0,012 г, 0,052 ммоля), 2-(4-(дифторметокси)фенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан (0,28 г, 1,037 ммоля), метил-6-амино-2-хлор-5-метоксипиримидин-4-карбоксилат (0,226 г, 1,037 ммоля), и 3,3',3''-фосфинтриилтрибензолсульфонат натрия (0,052 г, 0,104 ммоля). Добавляли смесь воды (1 мл) и ацетонитрила (2 мл) и реакционный сосуд закрывали и помещали в микроволновый реактор Biotage InitiatorTM на 6 мин при 160°C и за температурой следили с помощью установленного сбоку от сосуда ИК датчика температуры. После охлаждения до комнатной температуры реакционную смесь разбавляли с помощью EtOAc (50 мл) и воды (50 мл). Дополнительно экстрагировали с помощью CH2Cl2 (50 мл) и экстракты объединяли с EtOAc и сушили над Na2SO4 (50 г) затем содержащий CH2Cl2 слой фильтровали через слой ваты. Объединенные органические вещества концентрировали в роторном испарителе и остаток очищали с помощью системы очистки Teledyne ISCO в градиентном режиме с использованием системы элюентов CH2Cl2 и EtOAc и получали искомое соединение в виде белого твердого вещества (134,4 мг, 39,8%).
Пример 57: Получение метил-4-амино-6-(4-цианофенил)-5-фтор-3-винилпиколината (соединение 107)
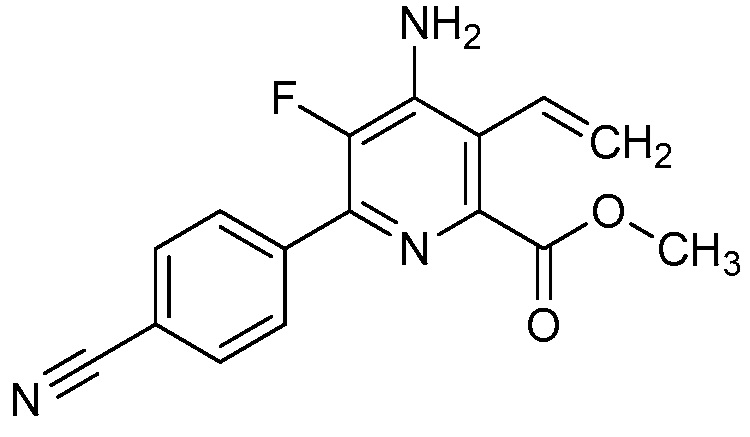 .
.
В безопасный сосуд для микроволновой печи объемом 5 мл добавляли фторид калия (0,227 г, 3,90 ммоля), метил-4-амино-6-хлор-5-фтор-3-винилпиколинат (0,3 г, 1,301 ммоля), бис-(трифенилфосфин)палладий (II) хлорид (0,091 г, 0,130 ммоля) и 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензонитрил (0,313 г, 1,366 ммоля. Добавляли смесь воды (1 мл) и ацетонитрила (2 мл) и реакционный сосуд закрывали и помещали в микроволновый реактор Biotage InitiatorTM на 20 мин при 115°C и за температурой следили с помощью установленного сбоку от сосуда ИК датчика температуры. После охлаждения до комнатной температуры реакционную смесь разбавляли с помощью CH2Cl2 (25 мл) и воды (25 мл), и органический слой фильтровали через слой ваты. Дополнительно экстрагировали с помощью EtOAc (25 мл) и экстракты объединяли с CH2Cl2 и сушили над Na2SO4 (50 г). После фильтрования объединенных органических веществ через слой ваты и концентрирования в роторном испарителе остаток очищали с помощью системы очистки Teledyne ISCO в градиентном режиме с использованием системы элюентов CH2Cl2 и EtOAc и получали искомое соединение в виде желтовато-коричневого твердого вещества (297 мг, 76%).
Пример 58: Получение метил-4-амино-5-фтор-6-(4-формилфенил)-3-винилпиколината
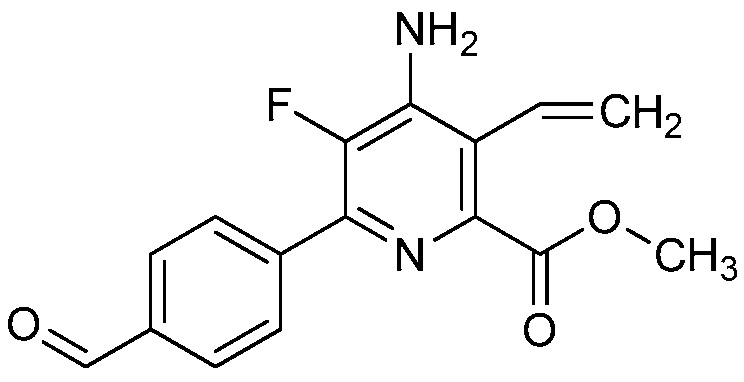 .
.
В безопасный сосуд для микроволновой печи объемом 5 мл добавляли фторид калия (0,378 г, 6,50 ммоля), метил-4-амино-6-хлор-5-фтор-3-винилпиколинат (0,5 г, 2,168 ммоля), бис(трифенилфосфин)хлорид палладия(II) (0,152 г, 0,217 ммоля) и 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензальдегид (0,528 г, 2,276 ммоля). Добавляли смесь воды (1 мл) и ацетонитрила (2 мл) и реакционный сосуд закрывали и помещали в микроволновый реактор Biotage InitiatorTM на 20 мин при 115°C и за температурой следили с помощью установленного сбоку от сосуда ИК датчика температуры. После охлаждения до комнатной температуры реакционную смесь разбавляли с помощью CH2Cl2 (25 мл) и воды (25 мл) и органический слой фильтровали через слой ваты. Дополнительно экстрагировали с помощью EtOAc (25 мл) и экстракты объединяли с CH2Cl2 и сушили над Na2SO4 (50 г). После фильтрования объединенных органических веществ через слой ваты и концентрирования в роторном испарителе остаток очищали с помощью системы очистки Teledyne ISCO в градиентном режиме с использованием системы элюентов CH2Cl2 и EtOAc и получали искомое соединение в виде белого твердого вещества (635 мг, 98%): 1H ЯМР (400 МГц, CDCl3) δ 10,08 (с, 1H), 8,13 (дд, J=8,3, 1,6 Гц, 2H), 8,03-7,93 (м, 2H), 6,91 (ддд, J=18,1, 11,6, 0,5 Гц, 1H), 5,73 (дд, J=11,5, 1,4 Гц, 1H), 5,60 (дд, J=18,1, 1,4 Гц, 1H), 4,77 (с, 2H), 3,94 (с, 3H); 19F ЯМР (376 МГц, CDCl3) δ -143,49; ИЭРМС m/z 301 ([M+H]+).
Пример 59: Получение метил-4-амино-3-хлор-6-(2,5-дифтор-4-(трифторметил)фенил)пиколината (соединение 70)
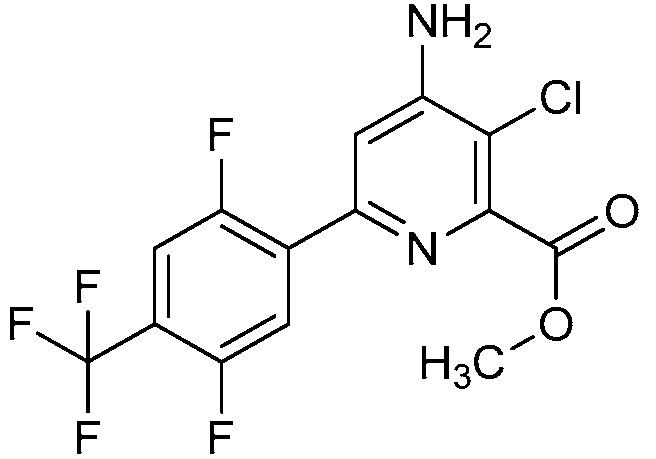 .
.
1,4-Дифтор-2-йод-5-(трифторметил)бензол (250 мг, 0,81 ммоля), соединение K (318 мг, 0,81 ммоля), йодид меди(I) (0,08 ммоля) и бис(трифенилфосфин)хлорид палладия(II) (57 мг, 0,08 ммоля) объединяли в сухом ДМФ (5 мл), деаэрировали потоком азота в течение 10 мин и нагревали при 75°C. Через 2 ч смесь охлаждали и подвергали распределению между этилацетатом и водой. Органическую фазу промывали насыщенным раствором NaCl, сушили (Na2SO4) и выпаривали. Неочищенный продукт очищали с помощью флэш-хроматографии (SiO2; при элюировании с помощью 0-30% этилацетата в гексанах) и получали 100 мг промежуточного ацетамида. Это вещество переносили в метанол (20 мл), обрабатывали ацетилхлоридом (3 мл) и перемешивали в течение 3 дней при 20°C. После удаления летучих веществ в вакууме смесь перемешивали с насыщенным раствором NaHCO3 и этилацетатом. Органическую фазу промывали насыщенным раствором NaCl, сушили (Na2SO4) и выпаривали и получали искомое соединение в виде белого твердого вещества (77 мг, 24%).
Пример 60: Получение метил-6-амино-2-(2,5-дифтор-4-(трифторметил)фенил)-5-метоксипиримидин-4-карбоксилата (соединение 148)
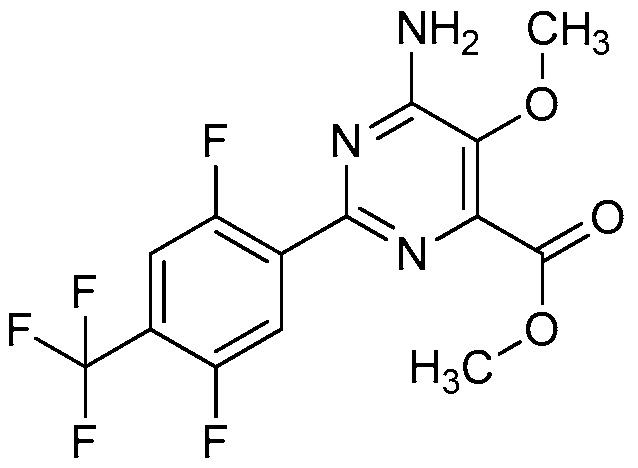 .
.
2-(2,5-Дифтор-4-(трифторметил)фенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан (400 мг, 1,2 ммоля), соединение C (250 мг 1,2 ммоля), фторид цезия (360 мг, 2,3 ммоля) и бис(трифенилфосфин)хлорид палладия(II) (82 мг, 0,12 ммоля) объединяли в смеси ацетонитрил-вода (4 мл) в соотношении 1:1 объем к объему (об./об.) и нагревали при 115°C в течение 30 мин в микроволновом реакторе. Смесь подвергали распределению между водой и этилацетатом. Органическую фазу промывали насыщенным раствором NaCl, сушили (Na2SO4) и выпаривали. Вещество очищали с помощью флэш-хроматографии (SiO2; при элюировании с помощью 0-30% этилацетата в гексанах) и получали коричневое масло, которое растирали со смесью гексаны-дихлорметан, и получали искомое соединение в виде белого твердого вещества (40 мг, 8,8%).
Пример 61: Получение метил-6-амино-2-(2,3-дифтор-4-(триметилсилил)фенил)-5-метоксипиримидин-4-карбоксилата
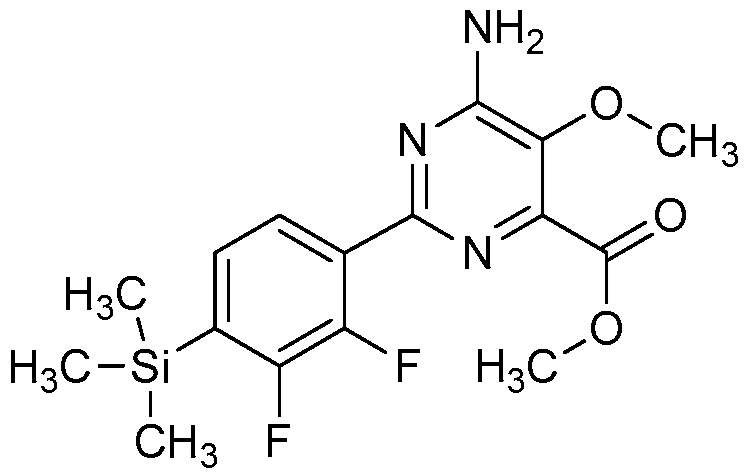 .
.
(2,3-Дифтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)триметилсилан(1,3 г, 4,2 ммоля) (см., например, WO 2013003740 A1), соединение C (750 мг, 3,5 ммоля) и бис(трифенилфосфин)хлорид палладия(II) (240 мг, 0,34 ммоля) объединяли в смеси 1:1 об./об. ацетонитрил-вода (10 мл) и нагревали микроволновым излучением при 115°C в течение 30 мин. Охлажденную смесь подвергали распределению между насыщенным раствором NaCl и этилацетатом. Органическую фазу промывали насыщенным раствором NaCl, сушили (Na2SO4) и выпаривали. Вещество очищали с помощью флэш-хроматографии (SiO2; при элюировании с помощью 0-20% этилацетата в гексанах) и получали искомое соединение в виде белого твердого вещества (330 мг, 26%): Температура плавления 157-159°C; 1H ЯМР (400 МГц, CDCl3) δ 7,60 (ддд, J=7,5, 6,0, 1,2 Гц, 1H), 7,14 (ддд, J=7,7, 4,5, 1,5 Гц, 1H), 5,48 (с, 2H), 4,00 (с, 3H), 3,95 (с, 3H), 0,34 (д, J=0,7 Гц, 9H); 19F ЯМР (376 МГц, CDCl3) δ от -127,10 до -127,25 (м), -142,40 (дд, J=22,6, 3,6 Гц); ИЭРМС m/z 368 ([M+H]+).
Следующее соединение получали по методикам, раскрытым в примере 61, из имеющегося в продаже (4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)триметилсилана:
Метил-4-амино-3,5-дихлор-6-(4-(триметилсилил)фенил)пиколинат (получали с использованием соединения H)
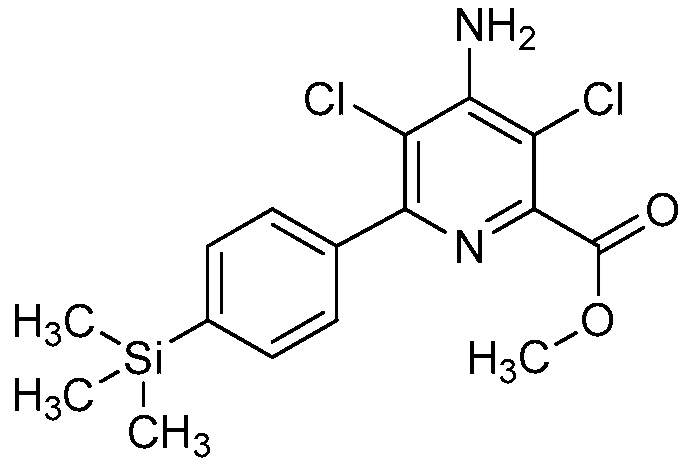 .
.
Температура плавления 171-174°C; 1H ЯМР (400 МГц, CDCl3) δ 6,36(м, 4H), 5,33(2, 2H), 3,99(с, 3H), 0,307 (с, 9H); ИЭРМС m/z 369 ([M+H]+).
Следующие соединения получали по методикам, раскрытым в примере 61, из имеющегося в продаже 2-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)триметилсилана (получали в соответствии с WO 2013003740 A1):
Метил-4-амино-3-хлор-6-(2-фтор-4-(триметилсилил)фенил)пиколинат (получали с использованием соединения A)
 .
.
Температура плавления 154-156°C; 1H ЯМР (400 МГц, CDCl3) δ 7,97 (м, 1H), 7,30 (м, 3H), 4,84 (с, 2H), 4,01 (с, 3H), 0,293 (с, 9H); ИЭРМС m/z 353 ([M+H]+).
Метил-4-амино-3,5-дихлор-6-(2-фтор-4-(триметилсилил)фенил)пиколинат (получали с использованием соединения H)
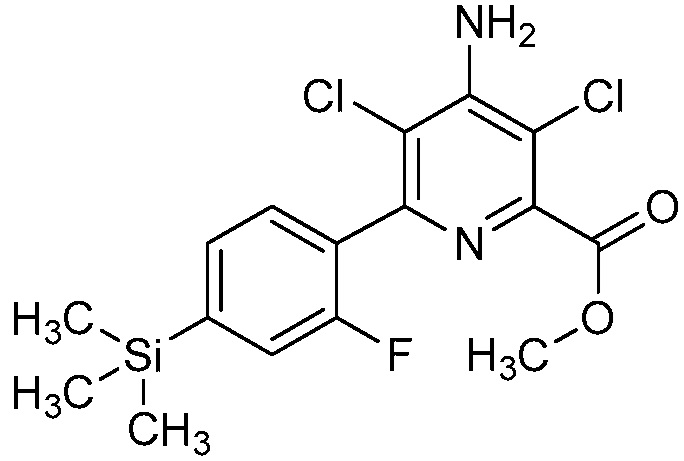 .
.
Температура плавления 184-185°C; 1H ЯМР (400 МГц, CDCl3) δ 7,35 (м, 3H), 5,33 (с, 2H), 3,96 (с, 3H), 0,290 (с, 9H); ИЭРМС m/z 387 ([M+H])+).
Пример 62: Общая методика сочетания по Судзуки (методика A)
Аргон в течение 15 мин в герметизированной пробирке пропускали через раствор соединения A, соединения B или соединения C (1,0 экв.), бороновой кислоты (1,0 экв.), Na2CO3 (2,0 экв.) и Pd(PPh3)4 (0,1 экв.) в смеси 1:1 толуол: этанол (20 объемов). Затем реакционную смесь нагревали в герметизированной пробирке при 110°C в течение 18 ч. Охлажденную реакционную смесь разбавляли водой и экстрагировали этилацетатом. (Примечание: Водный слой содержал образовавшиеся карбоновые кислоты, которые выделяли, как описано ниже). Органические экстракты промывали водой, промывали насыщенным рассолом, сушили (Na2SO4), фильтровали и выпаривали досуха при пониженном давлении. Неочищенный продукт очищали с помощью препаративной ТСХ и получали чистые сложные эфиры. Водный слой подкисляли до pH 2 с помощью 1,5 н. HCl и экстрагировали этилацетатом. Органический экстракт промывали насыщенным рассолом, сушили (Na2SO4), фильтровали и выпаривали досуха при пониженном давлении. Неочищенный продукт очищали с помощью препаративной ТСХ и получали чистые производные карбоновых кислот.
Пример 63: Общая методика сочетания по Судзуки (методика B)
Аргон в течение 15 мин в герметизированной пробирке пропускали через раствор соединения A, соединения B или соединения C (0,8 экв.), бороновой кислоты (1,0 экв.), NaHCO3 (2 M раствор, 1,0 экв.) и Pd(PPh3)4 (0,1 экв.) в сухом диоксан (20 объемов). Содержимое герметизированной пробирки нагревали при 80°C в течение 18 ч. Охлажденную реакционную смесь разбавляли водой и экстрагировали этилацетатом. Органический экстракт промывали водой, промывали насыщенным рассолом, сушили (Na2SO4), фильтровали и выпаривали досуха при пониженном давлении. Неочищенный продукт очищали с помощью флэш-хроматографии (SiO2; при элюировании с помощью 5-40% этилацетата в гексанах) и получали чистое соединение.
Пример 64: Получение метил-4-амино-3-хлор-6-(3-фтор-4-йодфенил)пиколината (соединение 66)
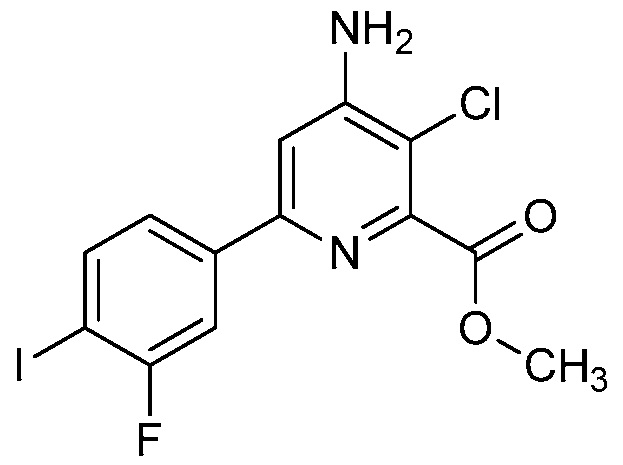 .
.
В круглодонную колбу объемом 250 мл, снабженную стержнем для перемешивания, добавляли метил-4-амино-3-хлор-6-(3-фтор-4-(триметилсилил)фенил)пиколинат (0,328 г, 0,930 ммоля) и дихлорметан (5,0 мл). К этому раствору добавляли монохлорид йода (0,141 мл, 2,79 ммоля). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Добавляли еще порцию монохлорида йода (0,141 мл, 2,79 ммоля) и реакционную смесь перемешивали при комнатной температуре в течение еще 4,5 ч. Реакционную смесь выливали в 1 M Na2SO3 и слои подвергали распределению. Водную фазу дополнительно экстрагировали этилацетатом (2×100 мл). Объединенные органические слои сушили над безводным MgSO4, фильтровали и концентрировали и получали искомое соединение в виде коричневого твердого вещества (0,375 г, 99%).
Следующие соединения получали по методикам, раскрытым в примере 64:
Метил-4-амино-3,5-дихлор-6-(3-фтор-4-йодфенил)пиколинат (соединение 13)
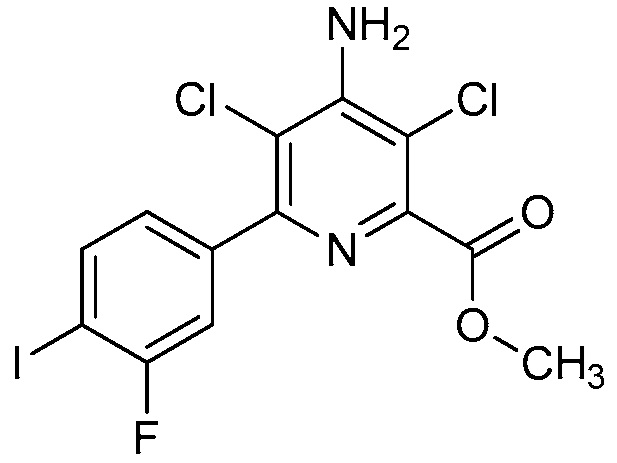 .
.
Искомое соединение получали, как описано в примере 64, с использованием метил-4-амино-3,5-дихлор-6-(3-фтор-4-(триметилсилил)фенил)пиколината (0,381 г, 0,984 ммоля) и выделяли в виде желтого твердого вещества (0,360 г, 83%).
Метил-6-амино-2-(3-фтор-4-йодфенил)-5-метоксипиримидин-4-карбоксилат (соединение 27)
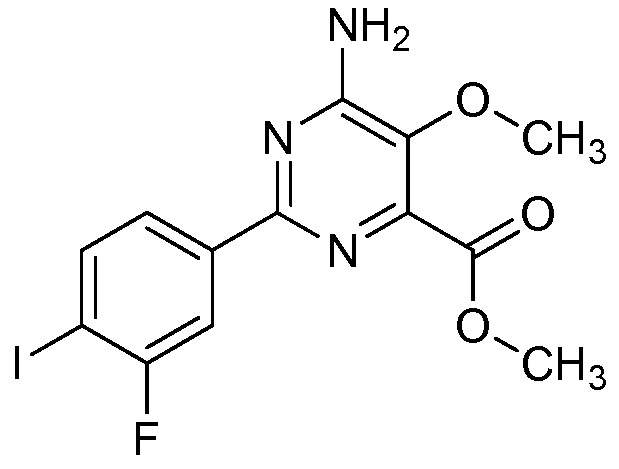 .
.
Искомое соединение получали, как описано в примере 64, с использованием метил-6-амино-2-(3-фтор-4-(триметилсилил)фенил)-5-метоксипиримидин-4-карбоксилата (0,307 г, 0,879 ммоля) и выделяли в виде желтого твердого вещества (0,368 г).
Пример 65: Получение метил-4-амино-3-хлор-6-(4-йодфенил)-5-метилпиколината (соединение 136)
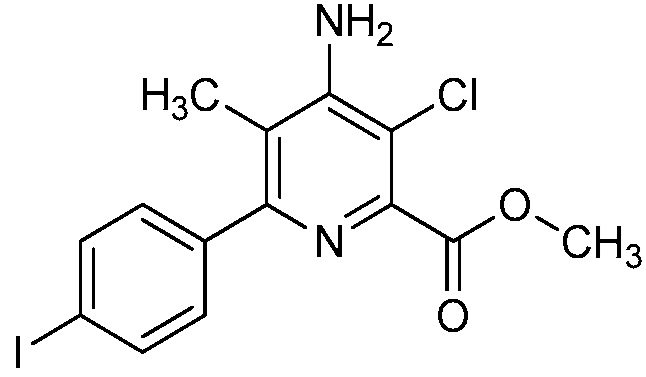 .
.
К метил-4-амино-3-хлор-5-метил-6-(4-(триметилсилил)фенил)пиколинату (0,95 г, 2,72 ммоля) в дихлорметане (9 мл) по каплям добавляли монохлорид йода (920 мг, 5,67 ммоля) в дихлорметане (4,5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 4 ч, затем реакцию останавливали насыщенным водным раствором тиосульфата натрия, разбавляли водой и экстрагировали дихлорметаном (3×). Органические слои сушили над безводным Na2SO4, фильтровали и концентрировали. Очистка с помощью флэш-хроматографии (0-30% этилацетат/гексаны) давала искомое соединение в виде красно-оранжевого твердого вещества (618 мг, 56%).
Следующее соединение получали по методикам, раскрытым в примере 65:
Метил-4-амино-3-хлор-6-(3-фтор-4-йодфенил)-5-метилпиколинат (соединение 79)
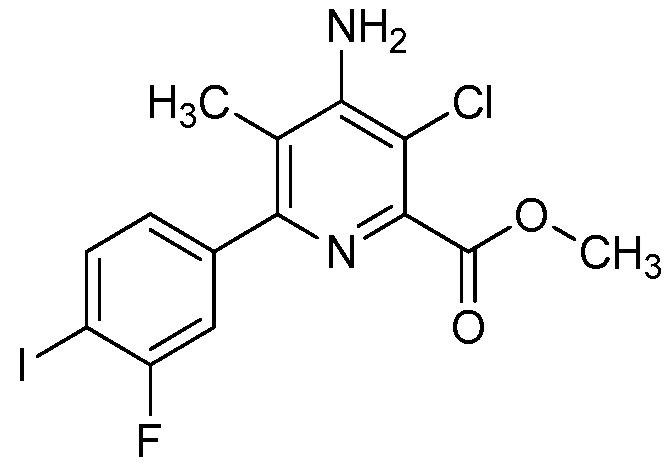 .
.
Искомое соединение получали, как в примере 65, и выделяли в виде почти белого твердого вещества (54 мг, 59%).
Пример 66: Получение метил-4-амино-6-(4-йодфенил)-3-хлор-5-фторпиколината (соединение 118)
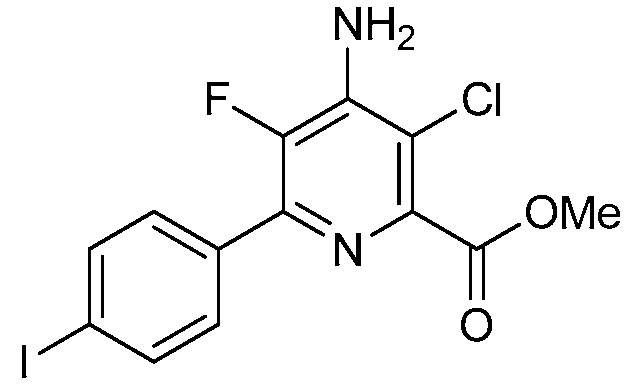 .
.
Монохлорид йода (280 мг, 1,7 ммоля, 2,0 экв.) при перемешивании добавляли к раствору метил-4-амино-3-хлор-5-фтор-6-(4-(триметилсилил)фенил)пиколината (300 мг, 0,85 ммоля, 1,0 экв.) в 1,2-дихлорэтане (5,7 мл) при 23°C. Полученный коричневый раствор перемешивали при 23°C в течение 17 ч. Реакционную смесь разбавляли насыщенным раствором тиосульфата натрия (100 мл) и экстрагировали дихлорметаном (4×40 мл). Объединенные органические слои сушили (MgSO4), фильтровали самотеком и концентрировали путем выпаривания в роторном испарителе. Остаток очищали с помощью колоночной хроматографии на силикагеле (33% этилацетата в гексанах) и получали искомое соединение в виде бледно-пурпурного порошкообразного вещества (250 мг, 71%).
Следующие соединения получали по методикам, раскрытым в примере 66:
Метил-4-ацетамидо-3-хлор-6-(2,3-дифтор-4-йодфенил)пиколинат
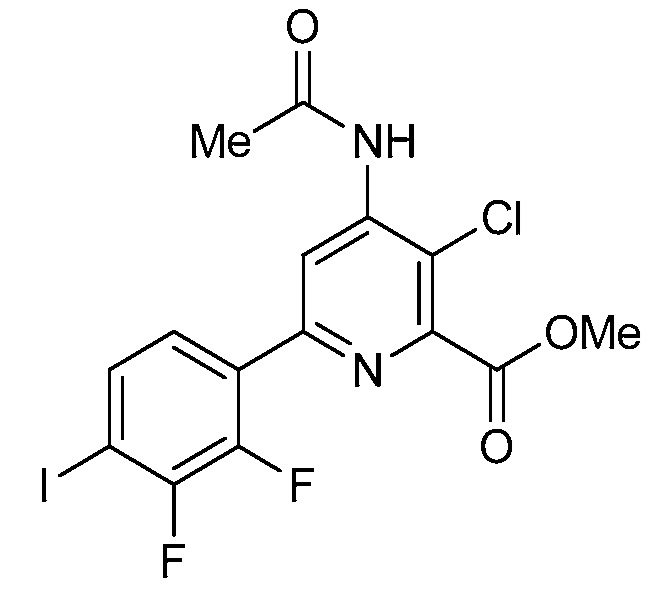 .
.
1H ЯМР (400 МГц, CDCl3) δ 9,06 (д, J=1,5 Гц, 1H), 7,98 (ушир.с, 1H), 7,60 (ддд, J=9, 5, 2 Гц, 1H), 7,53 (ддд, J=9, 7, 2 Гц, 1H), 4,03 (с, 3H), 2,34 (с, 3H); ИЭРМС m/z 467 ([M+H]+).
Метил-4-ацетамидо-3-хлор-6-(4-йодфенил)пиколинат
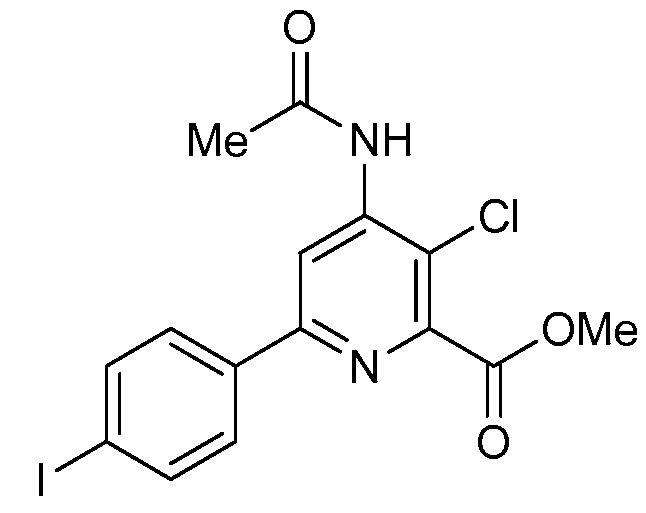 .
.
1H ЯМР (400 МГц, CDCl3) δ 9,00 (с, 1H), 7,77 (м, 4H), 7,25 (с, 1H), 4,03 (с, 3H), 2,33 (с, 3H); ИЭРМС m/z 431 ([M+H]+).
Пример 67: Получение метил-4-амино-3-хлор-6-(2,5-дифтор-4-йодфенил)-5-фторпиколината (соединение 55)
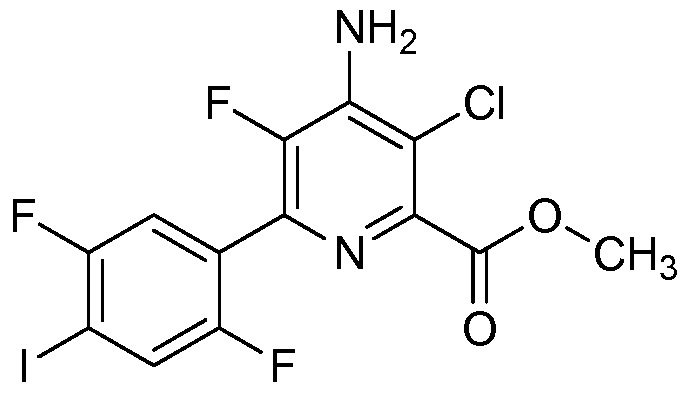 .
.
К раствору метил-4-амино-3-хлор-6-(2,5-дифтор-4-(триметилсилил)фенил)-5-фторпиколината (0,280 г, 0,720 ммоля) в CH2Cl2 (2,88 мл) при 20°C добавляли монохлорид йода (0,144 мл, 2,880 ммоля). Реакционную смесь перемешивали при 20°C в течение ночи. Затем смесь выливали в 10% водный раствор Na2SO3, экстрагировали с помощью EtOAc (3×), сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали с помощью колоночной флэш-хроматографии (SiO2; градиентный режим гексаны/EtOAc) и получали искомое соединение в виде белого твердого вещества (0,237 г, 74,4%).
Следующее соединение получали по методикам, раскрытым в примере 67:
Метил-4-ацетамидо-3-хлор-6-(2,5-дифтор-4-йодфенил)пиколинат
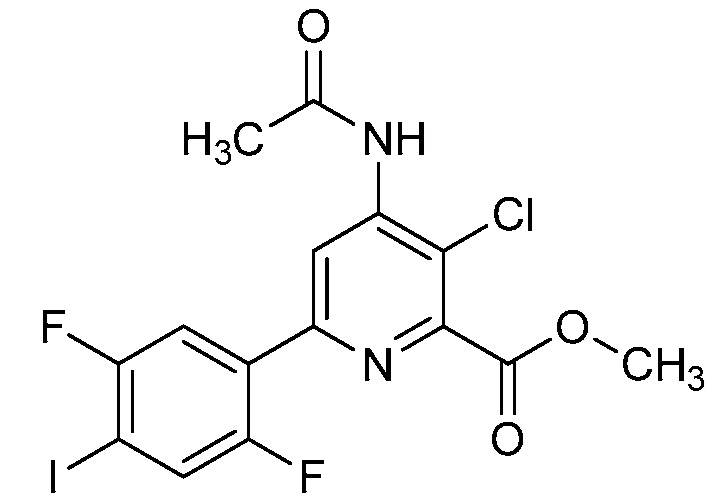 .
.
1H ЯМР (400 МГц, CDCl3) δ 9,10 (д, J=0,7 Гц, 1H), 7,96 (с, 1H), 7,76 (дд, J=8,4, 6,4 Гц, 1H), 7,57 (дд, J=9,8, 5,0 Гц, 1H), 4,03 (с, 3H), 2,33 (с, 3H); 19F ЯМР (376 МГц, CDCl3) δ -99,95, -100,00, -119,90, -119,95; ИЭРМС m/z 465 ([M-H]-).
Пример 68: Получение метил-6-амино-2-(2,3-дифтор-4-йодфенил)-5-метоксипиримидин-4-карбоксилата (соединение 24)
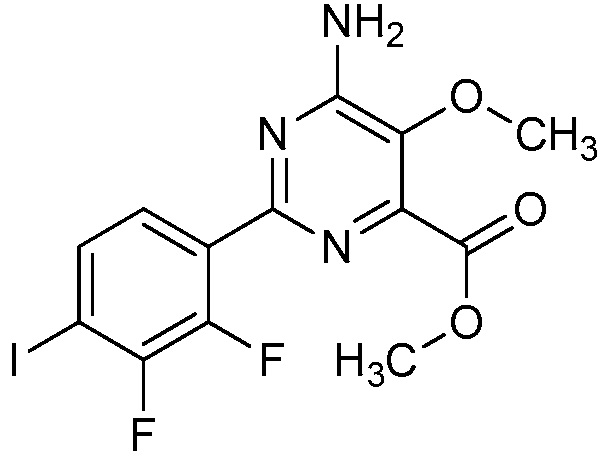 .
.
Метил-6-амино-2-(2,3-дифтор-4-(триметилсилил)фенил)-5-метоксипиримидин-4-карбоксилат (330 мг, 0,90 ммоля) перемешивали в 1,2-дихлорэтане (5 мл), обрабатывали монохлоридом йода (1,0 г, 6,9 ммоля) и нагревали при 70° C в течение 21 ч. После охлаждения смесь разбавляли этилацетатом, промывали с помощью 15% бисульфита натрия, промывали насыщенным раствором NaCl, сушили (Na2SO4) и выпаривали. Вещество очищали с помощью ВЭЖХ с обращенной фазой с использованием 70% ацетонитрила и получали искомое соединение в виде белого твердого вещества (250 мг, 66%).
Пример 69: Получение метил-4-ацетамидо-6-(4-бром-3-фторфенил)-3-хлорпиколината
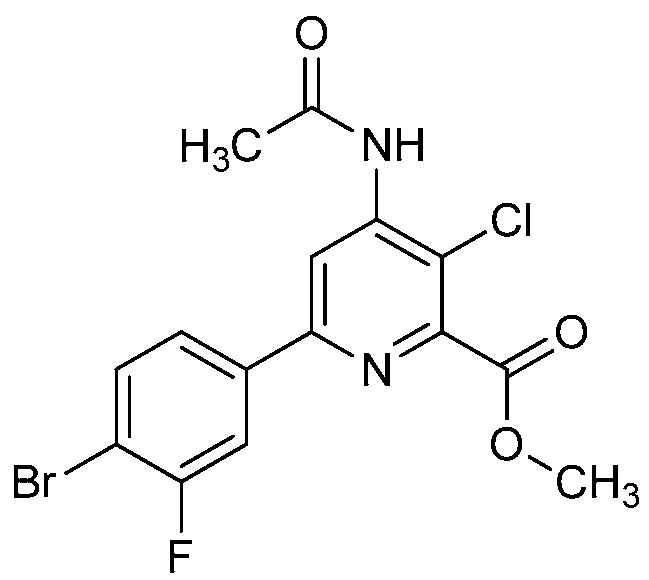 .
.
В круглодонную колбу объемом 100 мл, снабженную стержнем для перемешивания, добавляли метил-4-ацетамидо-3-хлор-6-(3-фтор-4-(триметилсилил)фенил)пиколинат (433 мг, 1,11 ммоля), дихлорметан (10 мл) и бром (0,225 мл, 4,39 ммоля). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Затем реакционную смесь выливали в 1 н. раствор Na2SO3 и экстрагировали этилацетатом (3×50 мл). Объединенные органические слои сушили над безводным MgSO4, фильтровали и концентрировали. Полученный остаток очищали с помощью флэш-хроматографии (0-50% EtOAc в гексанах) и получали искомое соединение в виде светло-желтовато-коричневого твердого вещества (0,440 г, 100%): 1H ЯМР (400 МГц, ДМСО-d6) δ 10,02 (с, 1H), 8,71 (с, 1H), 7,98-7,81 (м, 2H), 7,74 (дд, J=8,4, 2,1 Гц, 1H), 3,94 (с, 3H), 2,23 (с, 3H); 19F ЯМР (376 МГц, ДМСО-d6) δ -107,44; ИЭРМС m/z 402 ([M+H])+).
Следующие соединения получали по методикам, раскрытым в примере 69:
Метил-4-амино-6-(4-бром-3-фторфенил)-3,5-дихлорпиколинат (соединение 73)
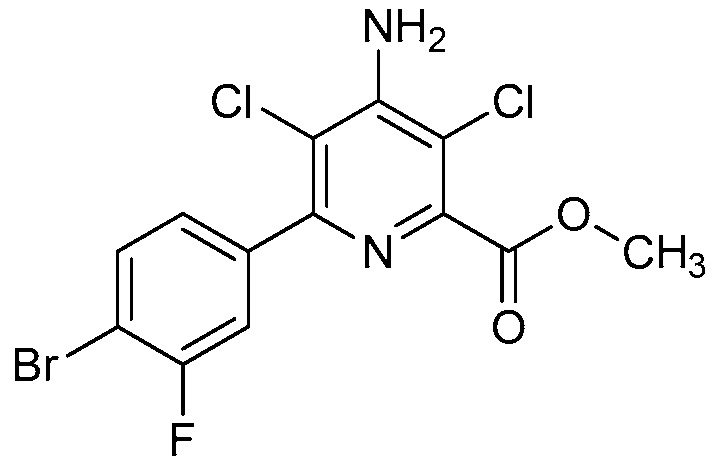 .
.
Искомое соединение получали, как описано в примере 69, с использованием метил-4-амино-3,5-дихлор-6-(3-фтор-4-(триметилсилил)фенил)пиколината (0,290 г, 0,749 ммоля) и выделяли в виде белого твердого вещества (0,250 г, 85%).
Метил-6-амино-2-(4-бром-3-фторфенил)-5-метоксипиримидин-4-карбоксилат (соединение 171)
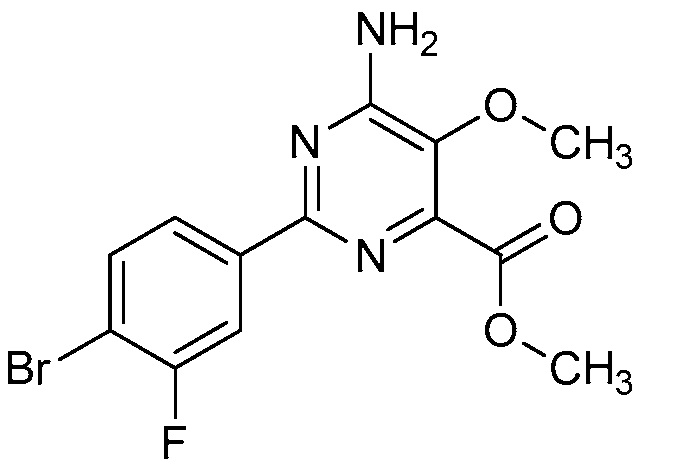 .
.
Искомое соединение получали, как описано в примере 69, с использованием метил-6-амино-2-(3-фтор-4-(триметилсилил)фенил)-5-метоксипиримидин-4-карбоксилата (0,250 г, 0,715 ммоля) и выделяли в виде белого твердого вещества (0,200 г, 78%).
Пример 70: Получение метил-4-амино-6-(4-бромфенил)-3-хлор-5-метилпиколината (соединение 81)
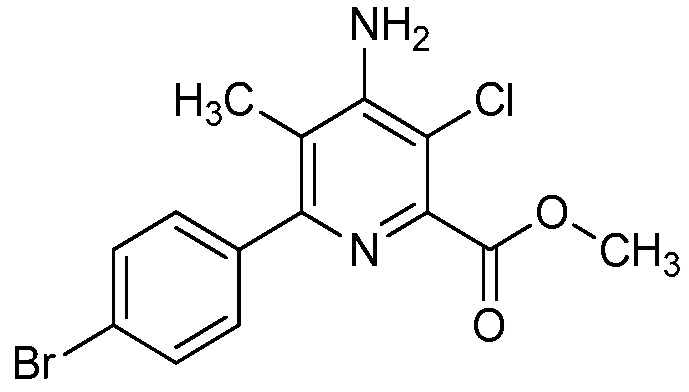 .
.
К метил-4-амино-3-хлор-5-метил-6-(4-(триметилсилил)фенил)пиколинату (150 мг, 0,43 ммоля) и карбонату калия (215 мг, 1,56 ммоля) в 1,2-дихлорэтане (ДХЭ, 2,9 мл) добавляли бром (0,03 мл, 0,58 ммоля) и перемешивали при комнатной температуре в течение 18 ч. ДХЭ удаляли в вакууме и неочищенное вещество подвергали распределению между этилацетатом и водным раствором карбоната калия. Водный слой экстрагировали этилацетатом (3×), промывали водой, сушили над безводным MgSO4, фильтровали и адсорбировали на силикагеле. Очистка с помощью флэш-хроматографии (0-40% этилацетат/гексаны) давала искомое соединение в виде бледно-оранжевого порошкообразного вещества (68 мг, 45%).
Следующее соединение получали по методикам, раскрытым в примере 70:
Метил-4-амино-6-(4-бром-3-фторфенил)-3-хлор-5-метилпиколинат (соединение 112)
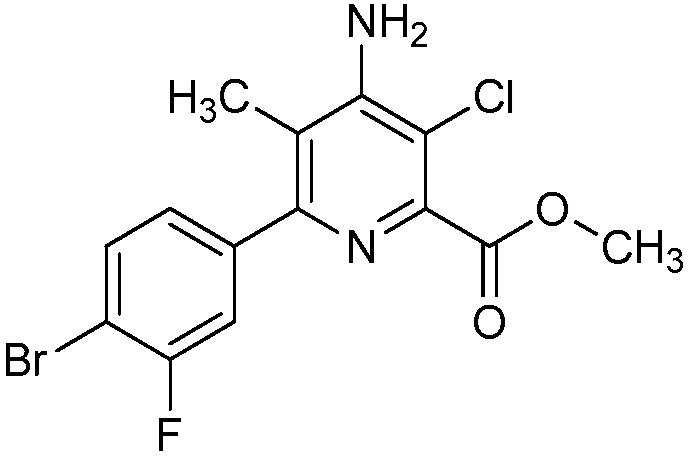 .
.
Искомое соединение получали, как в примере 70, и выделяли в виде почти белого твердого вещества (96 мг, 52%).
Пример 71: Получение метил-4-амино-6-(4-бром-2,3-дифторфенил)-3-хлор-5-фторпиколината (соединение 109)
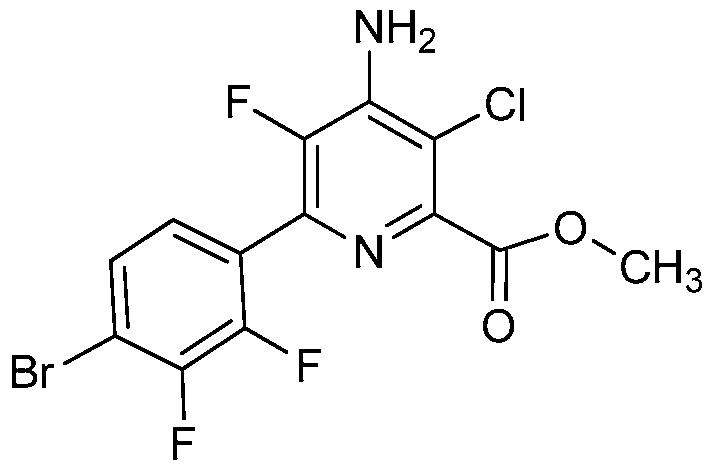 .
.
Метил-4-амино-3-хлор-6-(2,3-дифтор-4-(триметилсилил)фенил)-5-фторпиколинат (2,5 г, 6,43 ммоля) растворяли в ацетонитриле (32 мл) и добавляли бром (3,31 мл, 64,3 ммоля). Реакционную смесь перемешивали при комнатной температуре в течение 4 ч и затем жидкостная хроматография-масс-спектрометрия (ЖХ-МС) показывала, что реакция в основном завершилась. Реакционную смесь подвергали распределению между дихлорметаном и водой и добавляли тиосульфат натрия (10,17 г, 64,3 ммоля). Водную фазу экстрагировали дихлорметаном и органические экстракты объединяли и концентрировали в вакууме. Продукт очищали с помощью флэш-хроматографии (SiO2; при элюировании с помощью 5-40% этилацетата в гексанах) и получали искомое соединение в виде светло-желтого твердого вещества (1,62 г, 63,7%).
Пример 72: Получение метил-4-амино-6-(4-бромфенил)-3-хлор-5-фторпиколината (соединение 138)
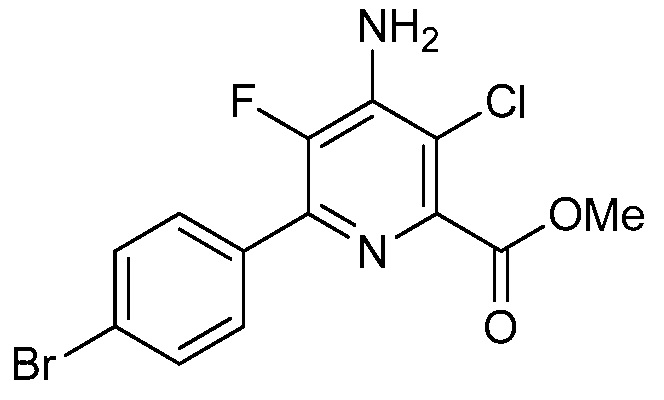 .
.
Бром (47 мкл, 0,92 ммоля, 1,2 экв.) при перемешивании при 23°C добавляли к раствору метил-4-амино-3-хлор-5-фтор-6-(4-(триметилсилил)фенил)пиколината (270 мг, 0,77 ммоля, 1,0 экв.) в 1,2-дихлорэтане (5,1 мл). Полученный темно-оранжевый раствор перемешивали при 23°C в течение 24 ч. Реакцию останавливали насыщенным раствором тиосульфата натрия (5 мл) и затем значение pH устанавливали равным 10 с помощью 2 M гидроксид натрия. Реакционную смесь разбавляли водой (50 мл) и экстрагировали дихлорметаном (3×30 мл). Объединенные органические слои сушили (MgSO4), фильтровали самотеком и концентрировали путем выпаривания в роторном испарителе. Остаток очищали с помощью колоночной хроматографии с обращенной фазой (градиентный режим от 5% ацетонитрила до 100% ацетонитрила) и получали искомое соединение в виде желтовато-коричневого порошкообразного вещества (160 мг, 57%).
Следующее соединение получали по методикам, раскрытым в примере 72.
Метил-4-ацетамидо-6-(4-бромфенил)-3-хлорпиколинат
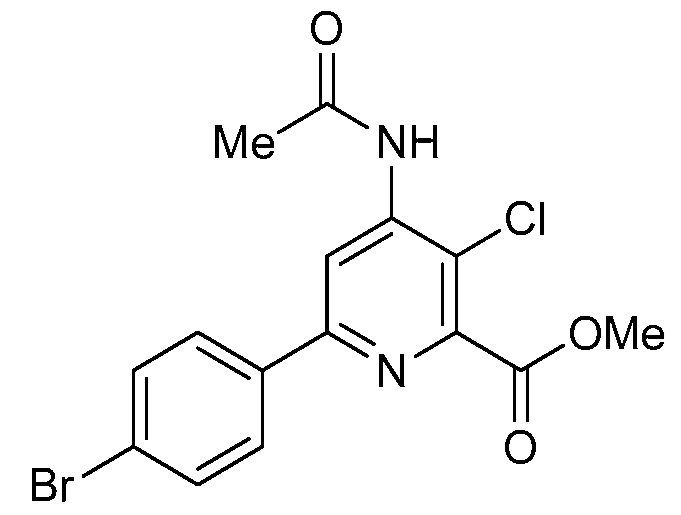 .
.
1H ЯМР (400 МГц, CDCl3) δ 9,01(с, 1H), 7,90 (м, 2H), 7,49 (м, 2H), 7,25 (с, 1H), 4,03 (с, 3H), 2,34 (с, 3H); ИЭРМС m/z 385 ([M+H]+).
Пример 73: Получение метил-4-амино-6-(4-бром-2,5-дифторфенил)-3-хлор-5-фторпиколината (соединение 51)
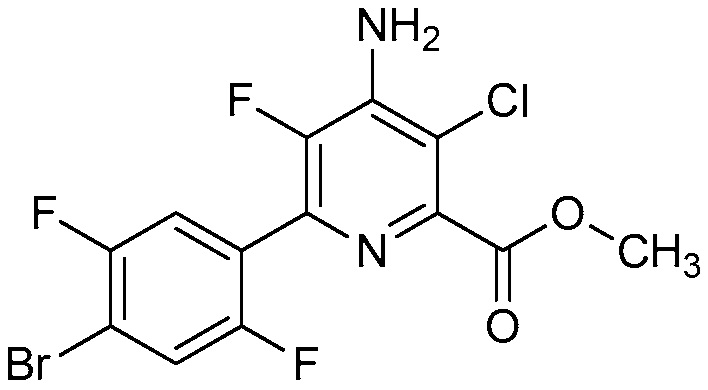 .
.
К раствору метил-4-амино-3-хлор-6-(2,5-дифтор-4-(триметилсилил)фенил)-5-фторпиколината (0,240 г, 0,617 ммоля) в CH2Cl2 (2,469 мл) при 20°C добавляли бром (0,127 мл, 2,469 ммоля). Через 24 ч реакционную смесь выливали в насыщенный водный раствор Na2S2O3 и экстрагировали с помощью EtOAc (3×). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали с помощью колоночной флэш-хроматографии (SiO2; градиентный режим гексаны/EtOAc) и получали искомое соединение в виде белого твердого вещества (0,187 г, 77%).
Следующее соединение получали по методикам, раскрытым в примере 73:
Метил-4-ацетамидо-6-(4-бром-2,5-дифторфенил)-3-хлорпиколинат
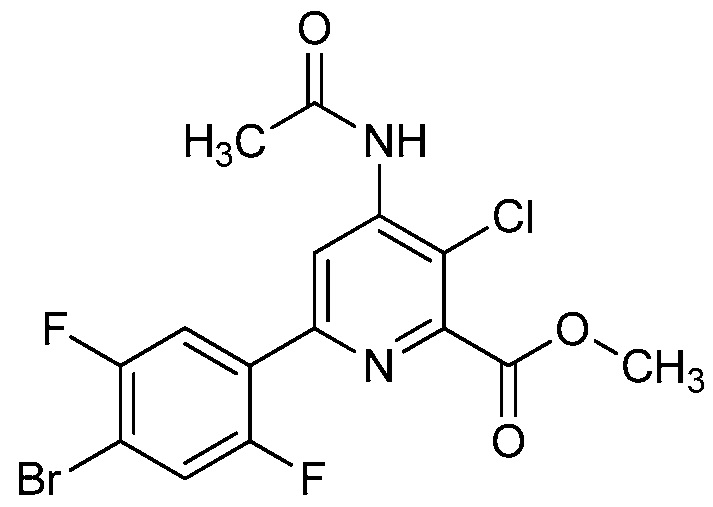 .
.
Температура плавления 177-179°C; 1H ЯМР (400 МГц, CDCl3) δ 9,10 (д, J=0,7 Гц, 1H), 7,97 (с, 1H), 7,85 (дд, J=9,1, 6,6 Гц, 1H), 7,40 (дд, J=9,9, 5,5 Гц, 1H), 4,03 (с, 3H), 2,33 (с, 3H); 19F ЯМР (376 МГц, CDCl3) δ -112,76, -112,80, -119,21, -119,26; ИЭРМС m/z 418 ([M-H]-).
Пример 74: Получение метил-6-амино-2-(4-бром-2,3-дифторфенил)-5-метоксипиримидин-4-карбоксилата (соединение 122)
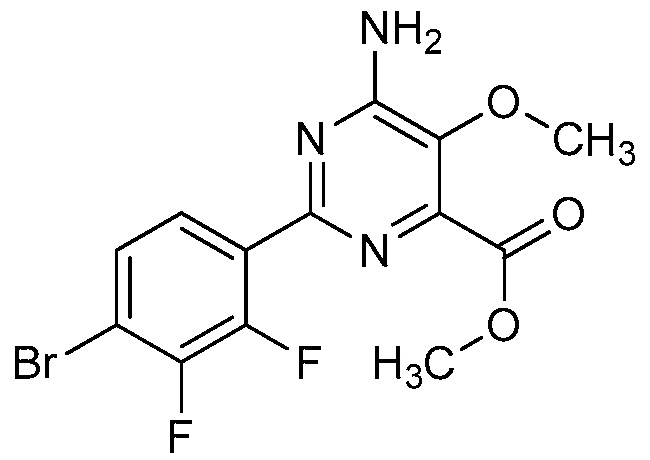 .
.
Метил-6-амино-2-(2,3-дифтор-4-(триметилсилил)фенил)-5-метоксипиримидин-4-карбоксилат (350 мг, 0,95 ммоля) перемешивали в 1,2-дихлорэтане (4 мл), обрабатывали бромом (1,0 г, 6,3 ммоля) и нагревали при 60°C в течение 6 ч. После охлаждения смесь перемешивали с 15% раствором бисульфита натрия до отрицательной реакции с помощью бумаги со смесью крахмал-йод. Смесь разбавляли этилацетатом, промывали насыщенным раствором NaCl, сушили (Na2SO4) и выпаривали. Очистка с помощью флэш-хроматографии (SiO2; при элюировании с помощью 0-30% этилацетата в гексанах) давала искомое соединение в виде белого твердого вещества (75 мг, 23%).
Пример 75: Получение метил-4-амино-6-(4-бром-3-фторфенил)-3-хлорпиколината (соединение 115)
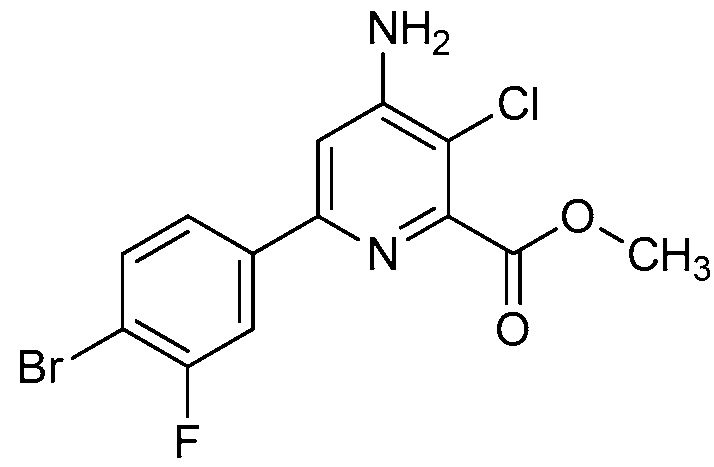 .
.
В круглодонную колбу объемом 100 мл, снабженную стержнем для перемешивания, добавляли метил-4-ацетамидо-6-(4-бром-3-фторфенил)-3-хлорпиколинат (0,411 г, 1,023 ммоля), метанол (5,12 мл) и ацетилхлорид (1,45 мл, 20,5 ммоля). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Растворитель удаляли с помощью роторного испарителя. Полученное твердое вещество растворяли в 1 н. NaHCO3 и экстрагировали этилацетатом (3×75 мл). Объединенные органические слои сушили над безводным MgSO4, фильтровали и концентрировали и получали искомое соединение в виде белого твердого вещества (0,324 г, 88%).
Пример 76: Получение метил-4-амино-3-хлор-6-(2,3-дифтор-4-йодфенил)пиколината (соединение 129)
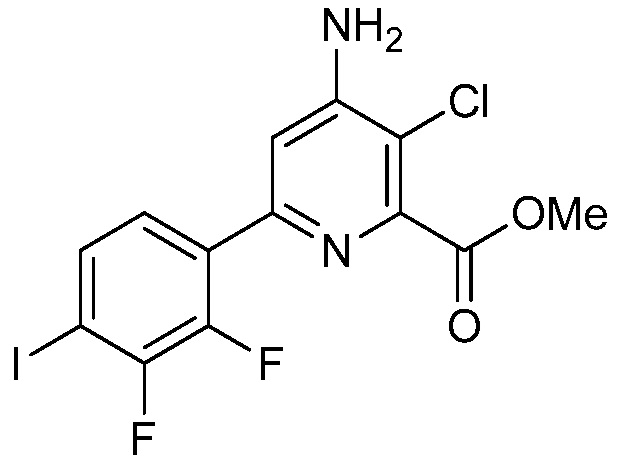 .
.
Ацетилхлорид (1,3 мл, 18 ммоля, 10 экв.) медленно добавляли к метанолу (12 мл) и перемешивали при 23°C в течение 30 мин. Добавляли метил-4-ацетамидо-3-хлор-6-(2,3-дифтор-4-йодфенил)пиколинат (830 мг, 1,8 ммоля, 1,0 экв.) и гетерогенную белую смесь перемешивали при 23°C в течение 18 ч. Реакционную смесь концентрировали путем выпаривания в роторном испарителе. Остаток разбавляли насыщенным раствором бикарбоната натрия (200 мл) и экстрагировали дихлорметаном (3×75 мл). Органический слой сушили (MgSO4), фильтровали самотеком и концентрировали путем выпаривания в роторном испарителе и получали искомое соединение в виде белого порошкообразного вещества (720 мг, 95%).
Пример 77: Получение метил-4-амино-6-(4-бром-2,5-дифторфенил)-3-хлорпиколината (соединение 127)
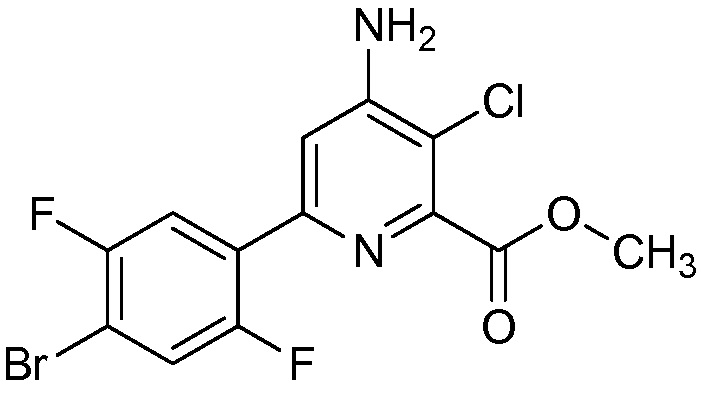 .
.
К раствору метил-4-ацетамидо-6-(4-бром-2,5-дифторфенил)-3-хлорпиколината (0,300 г, 0,715 ммоля) в смеси метанола (3,57 мл) и ТГФ (3,57 мл) медленно добавляли ацетилхлорид (1,017 мл, 14,30 ммоля). Реакционную смесь перемешивали при 20°C в течение 2 ч. Затем смесь выливали в насыщенный водный раствор NaHCO3 и экстрагировали с помощью EtOAc (3x). Объединенные органические слои сушили над Na2SO4, фильтровали, концентрировали и сушили в вакууме и получали метил-4-амино-6-(4-бром-2,5-дифторфенил)-3-хлорпиколинат (0,257 г, 95%) в виде белого твердого вещества.
Пример 78: Получение метил-4-(N-ацетилацетамидо)-3-хлор-6-(2,5-дифтор-4-(триметилсилил)фенил)пиколината
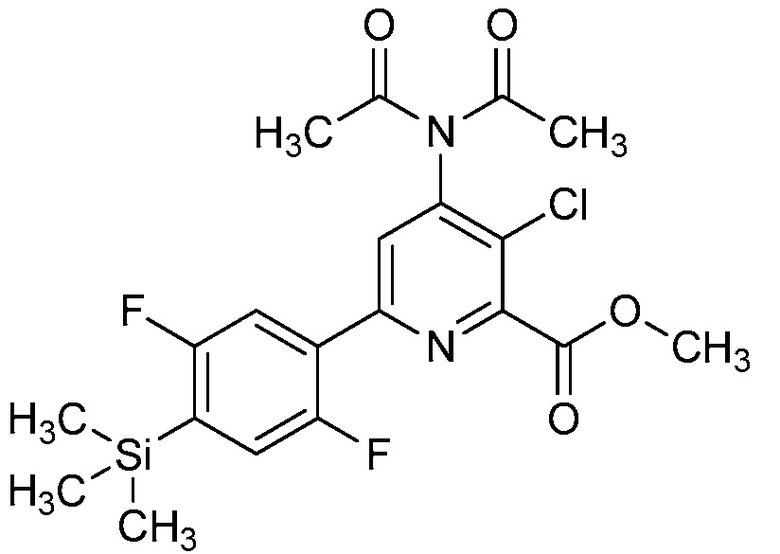 .
.
К раствору метил-4-амино-3-хлор-6-(2,5-дифтор-4-(триметилсилил)фенил)пиколината (0,280 г, 0,755 ммоля) в дихлорэтане (3,02 мл) добавляли N,N-диизопропилэтиламин (0,396 мл, 2,265 ммоля) и ацетилхлорид (0,107 мл, 1,510 ммоля). Реакционную смесь перемешивали при 20°C в течение 4 ч и затем при 60°C в течение 2 ч. Смесь выливали в насыщенный водный раствор NH4Cl и экстрагировали с помощью EtOAc (3×). Объединенные органические слои промывали рассолом, сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали с помощью колоночной флэш-хроматографии (SiO2; градиентный режим гексаны/EtOAc) и получали искомое соединение в виде светло-желтого твердого вещества (104 мг, 30,3%): Температура плавления 121-123°C; 1H ЯМР (400 МГц, CDCl3) δ 7,88 (д, J=0,7 Гц, 1H), 7,79 (дд, J=8,5, 5,8 Гц, 1H), 7,15 (дд, J=10,9, 4,1 Гц, 1H), 4,05 (с, 3H), 2,35 (с, 6H), 0,35 (д, J=0,8 Гц, 9H); ИЭРМС m/z 455 ([M+H]+).
Пример 79: Получение метил-4-амино-6-(4-бромфенил)-5-фтор-3-винилпиколината (соединение 57)
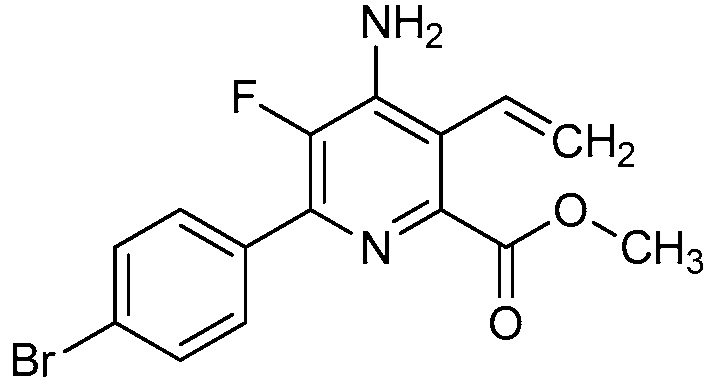 .
.
При 0°C к суспензии нитрозилтетрафторбората (0,122 г, 1,044 ммоля) в CH2Cl2 (2 мл) добавляли раствор метил-4-амино-6-(4-аминофенил)-5-фтор-3-винилпиколината (0,3 г, 1,044 ммоля) в 1:1 смеси CH2Cl2 и CH3CN (10 мл). Реакционную смесь перемешивали при 0°C в течение 30 мин, затем к суспензии по каплям добавляли бромид калия (0,497 г, 4,18 ммоля), 18-краун-6 (0,028 г, 0,104 ммоля), бромид меди(II) (0,023 г, 0,104 ммоля), бромид меди(I) (0,015 г, 0,104 ммоля) и 1,10-фенантролин (0,019 г, 0,104 ммоля). Смесь перемешивали при 20°C в течение 1 ч. Дополнительно добавляли бромид меди(I) (0,749 г, 5 экв.) и реакционную смесь перемешивали при 20°C в течение еще 1 ч. Реакционную смесь разбавляли с помощью Et2O и фильтровали через тонкий слой целита. Надосадочную жидкость концентрировали и очищали с помощью колоночной флэш-хроматографии (SiO2; градиентный режим гексаны/EtOAc), затем с помощью препаративной ВЭЖХ с обращенной фазой (градиентный режим вода/ацетонитрил) и получали искомое соединение в виде светло-коричневого твердого вещества (130 мг, 35,5%).
Следующее соединение получали по методикам, раскрытым в примере 79:
Метил-4-ацетамидо-6-(4-бром-2,3,6-трифторфенил)-3-хлорпиколинат
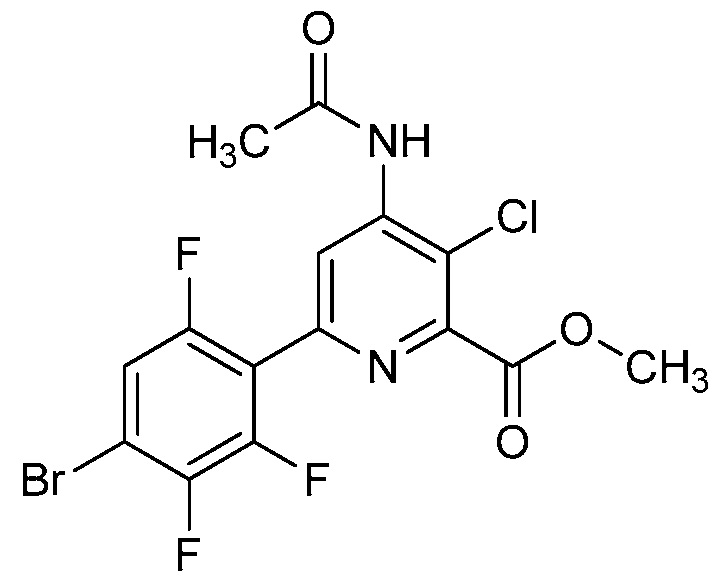 .
.
1H ЯМР (400 МГц, ДМСО-d6) δ 10,08 (с, 1H), 8,48 (с, 1H), 7,87-7,84 (м, 1H), 3,93 (с, 3H), 2,25 (с, 3H); ИЭРМС m/z 437 ([M+2H]+).
Пример 80: Получение метил-6-амино-2-(4-йодфенил)-5-винилпиримидин-4-карбоксилата (соединение 164)
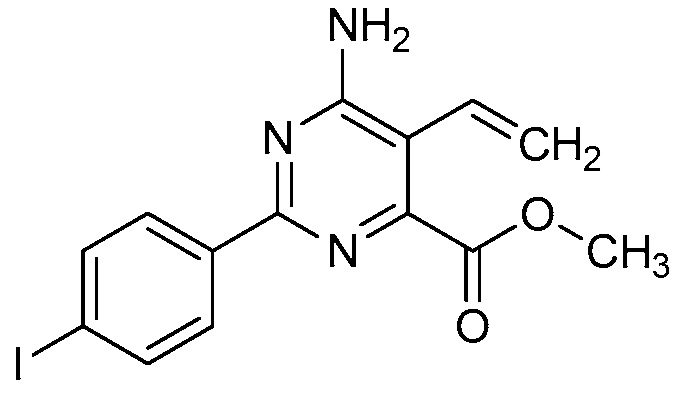 .
.
В круглодонную колбу объемом 50 мл, снабженную стержнем для перемешивания, добавляли нитрозилтетрафторборат (78 мг, 0,67 ммоля) и дихлорметан (2,0 мл). Колбу охлаждали в бане из воды со льдом и помещали в атмосферу N2. Затем по каплям добавляли метил-6-амино-2-(4-аминофенил)-5-винилпиримидин-4-карбоксилат (180 мг, 0,666 ммоля) в дихлорметане (2,5 мл). Реакционную смесь перемешивали в течение 60 мин. Затем добавляли йодид натрия (499 мг, 3,33 ммоля) в минимальном количестве H2O, затем диоксан (1,0 мл). Реакционную смесь перемешивали в течение 18 ч при комнатной температуре. Реакционную смесь выливали в насыщенный раствор Na2SO3 и экстрагировали этилацетатом (3×50 мл). Объединенные органические слои сушили над безводным MgSO4, фильтровали и концентрировали. Полученный остаток очищали с помощью флэш-хроматографии (силикагель; 0-30% EtOAc в гексанах) и хроматографии с обращенной фазой и получали искомое соединение в виде светло-желтого твердого вещества (0,068 г, 27%).
Пример 81: Получение метил-4-амино-5-фтор-6-(4-йодфенил)-3-винилпиколината (соединение 139)
 .
.
При 0°C к суспензии нитрозилтетрафторбората (0,041 г, 0,348 ммоля) в CH2Cl2 (1 мл) добавляли раствор метил-4-амино-6-(4-аминофенил)-5-фтор-3-винилпиколината (0,1 г, 0,348 ммоля) в 1:1 смеси CH2Cl2 и CH3CN (4 мл). Реакционную смесь перемешивали при 0°C в течение 30 мин, затем добавляли раствор йодида натрия (0,261 г, 1,740 ммоля) в минимальном количестве воды и реакционную смесь перемешивали при 20°C в течение 30 мин. Затем смесь выливали в 10% водный раствор сульфита натрия и экстрагировали с помощью EtOAc (3×). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали с помощью колоночной флэш-хроматографии (SiO2; градиентный режим гексаны/EtOAc), затем с помощью препаративной ВЭЖХ с обращенной фазой (градиентный режим вода/ацетонитрил) и получали искомое соединение в виде белого твердого вещества (32 мг, 23,09%).
Следующее соединение получали по методикам, раскрытым в примере 81:
Метил-4-ацетамидо-3-хлор-6-(2,3,6-трифтор-4-йодфенил)пиколинат
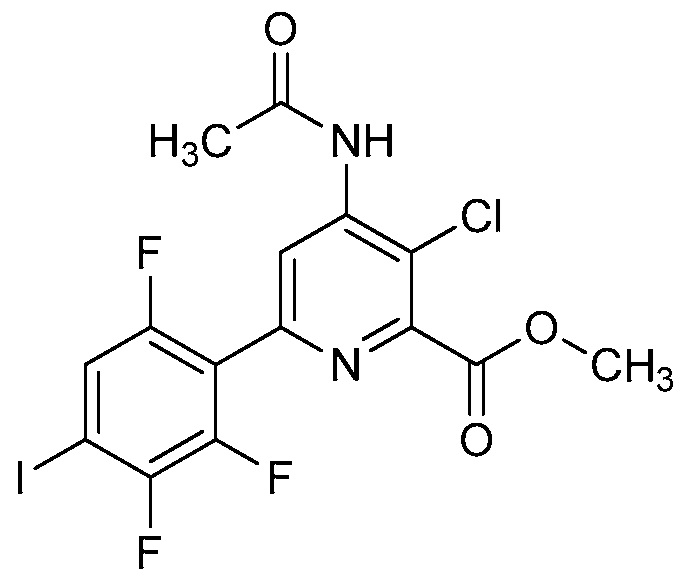 .
.
1H ЯМР (400 МГц, ДМСО-d6) δ 10,07 (с, 1H), 8,46 (с, 1H), 7,89-7,85 (м, 1H), 3,93 (с, 3H), 2,25 (с, 3H); ИЭРМС m/z 487 ([M+3H]+).
Пример 82. Получение метил-4-амино-3-хлор-5-метил-6-(4-((триметилсилил)этинил)фенил)пиколината
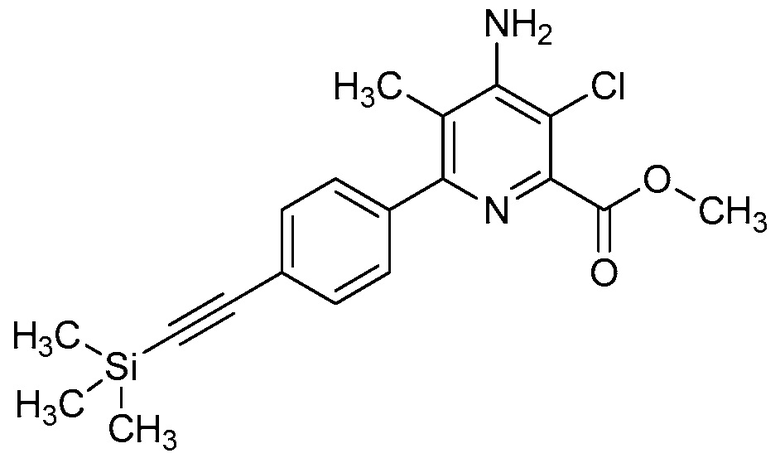 .
.
Смесь метил-4-амино-3-хлор-6-(4-йодфенил)-5-метилпиколината (264 мг, 0,66 ммоля), триметил((трибутилстаннил)этинил)силана (280 мг, 0,72 ммоля), тетракис(трифенилфосфин)палладия(0) (75 мг, 0,065 ммоля) в безводном ДМФ (1,3 мл) нагревали при 90°C в течение 16 ч. Реакционную смесь охлаждали, разбавляли водой и экстрагировали этилацетатом (2×). Органические слои сушили над безводным MgSO4, фильтровали и адсорбировали на силикагеле. Очистка с помощью флэш-хроматографии (0-100% этилацетат/гексаны) давала искомое соединение в виде коричневого твердого вещества (52 мг, 21%): Температура плавления 158-164°C; 1H ЯМР (400 МГц, CDCl3) δ 7,52 (д, J=8,5 Гц, 2H), 7,40 (д, J=8,5 Гц, 2H), 4,83 (с, 2H), 3,96 (с, 3H), 2,14 (с, 3H), 0,26 (с, 9H); ИК (тонкая пленка) 3325, 3227, 2955, 2157, 1729, 1629, 1246 см-1; ИЭРМС m/z 372 ([M]+).
Пример 83: Получение метил-4-амино-3-хлор-6-(4-этинилфенил)-5-метилпиколината (соединение 40)
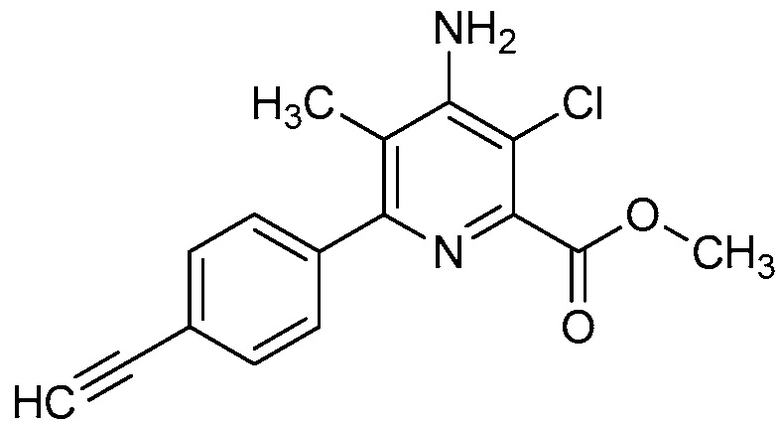 .
.
К метил-4-амино-3-хлор-5-метил-6-(4-((триметилсилил)этинил)фенил)-пиколинату (50 мг, 0,13 ммоля) в метаноле (0,7 мл) добавляли карбонат калия (24 мг, 0,17 ммоля). Реакционную смесь перемешивали при комнатной температуре в течение 40 мин, затем разбавляли водой и экстрагировали дихлорметаном (4×). Органические слои сушили над безводным MgSO4, фильтровали и концентрировали и получали искомое соединение в виде коричневого масла (34 мг, 84%).
Пример 84: Получение метил-4-амино-3-хлор-5-фтор-6-(4-((триметилсилил)этинил)фенил)пиколината
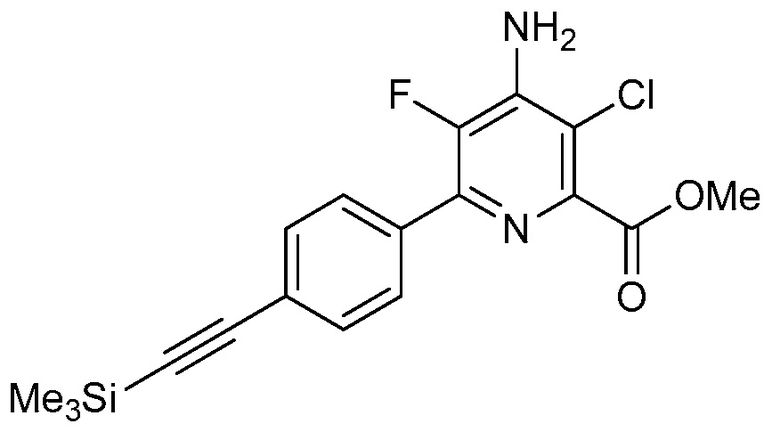 .
.
Триметил((трибутилстаннил)этинил)силан (510 мг, 1,3 ммоля, 1,1 экв.) при 23°C при перемешивании добавляли к смеси метил-4-амино-3-хлор-5-фтор-6-(4-йодфенил)пиколината (490 мг, 1,2 ммоля, 1,0 экв.) и тетракис(трифенилфосфин)палладия(0) (140 мг, 0,12 ммоля, 0,10 экв.) в ДМФ (2,4 мл). Реакционную смесь нагревали при 90°C и получали гомогенный желтый раствор, и перемешивали в течение 20 ч. Охлажденную реакционную смесь разбавляли водой (200 мл) и экстрагировали диэтиловым эфиром (4×100 мл). К объединенным органическим слоям добавляли гексаны (100 мл) и мутный раствор промывали водой (200 мл). Органический слой сушили (MgSO4), фильтровали самотеком и концентрировали путем выпаривания в роторном испарителе. Остаток очищали с помощью колоночной хроматографии на силикагеле (25% этилацетата в гексанах) и получали искомое соединение в виде желтовато-коричневого порошкообразного вещества (330 мг, 73%): Температура плавления 83-86°C; ИК (тонкая пленка) 3487 (м), 3375 (с), 2958 (с), 2159 (м), 1739 (с), 1618 (с) см-1; 1H ЯМР (300 МГц, CDCl3) δ 7,89 (м, 2H), 7,55 (м, 2H), 4,89 (ушир.с, 2H), 3,99 (с, 3H), 0,26 (с, 9H); ИЭРМС m/z 377 ([M+H]+).
Пример 85: Получение метил-4-амино-3-хлор-6-(4-этинилфенил)-5-фторпиколината (соединение 7)
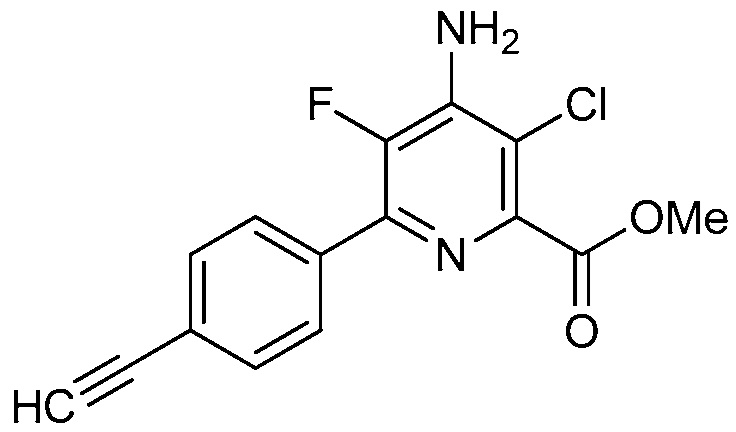 .
.
Карбонат калия (100 мг, 0,74 ммоля, 1,0 экв.) при перемешивании добавляли к смеси метил-4-амино-3-хлор-5-фтор-6-(4-((триметилсилил)этинил)фенил)пиколината (280 мг, 0,74 ммоля, 0,10 экв.) в метаноле (3,7 мл) при 23°C. Гетерогенную бледно-желтую смесь перемешивали при 23°C в течение 30 мин. Реакционную смесь разбавляли водой (200 мл) и экстрагировали дихлорметаном (5×50 мл). Органические слои сушили (MgSO4), фильтровали самотеком и концентрировали путем выпаривания в роторном испарителе и получали искомое соединение в виде желтовато-коричневого порошкообразного вещества (220 мг, 96%).
Пример 86: Получение метил-4-амино-3-хлор-6-(4-этинил-3-фторфенил)-5-фторпиколината (соединение 133)
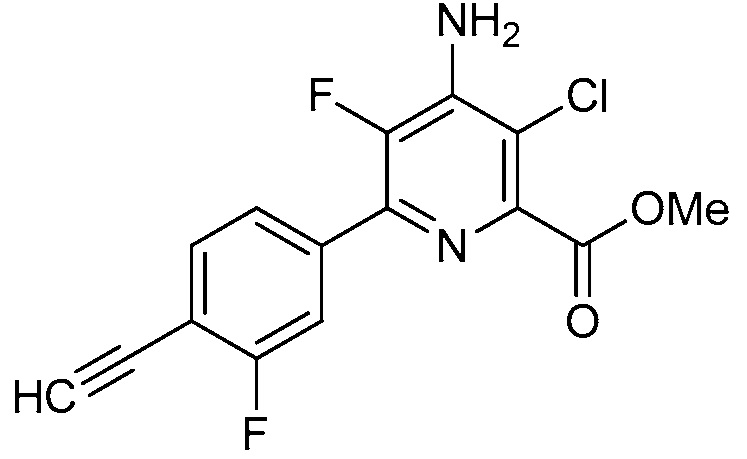 .
.
Диметил-1-диазо-2-оксопропилфосфонат (290 мг, 1,5 ммоля, 1,2 экв.) при 23°C при перемешивании добавляли к смеси метил-4-амино-3-хлор-5-фтор-6-(3-фтор-4-формилфенил)пиколината (410 мг, 1,3 ммоля, 1,0 экв.) и твердого карбоната калия (350 мг, 2,5 ммоля, 2,0 экв.) в метаноле (12 мл). Полученную мутную бледно-желтую смесь перемешивали при 23°C в течение 2 ч. Реакционную смесь разбавляли водой (150 мл) и экстрагировали дихлорметаном (4×60 мл). Органические слои сушили (MgSO4), фильтровали самотеком и концентрировали путем выпаривания в роторном испарителе. Остаток очищали с помощью колоночной хроматографии на силикагеле (33% этилацетата в гексанах) и получали искомое соединение в виде белого порошкообразного вещества (150 мг, 38%).
Пример 87. Получение метил-4-амино-3-хлор-6-(4-этинил-3-фторфенил)-5-метилпиколината (соединение 151)
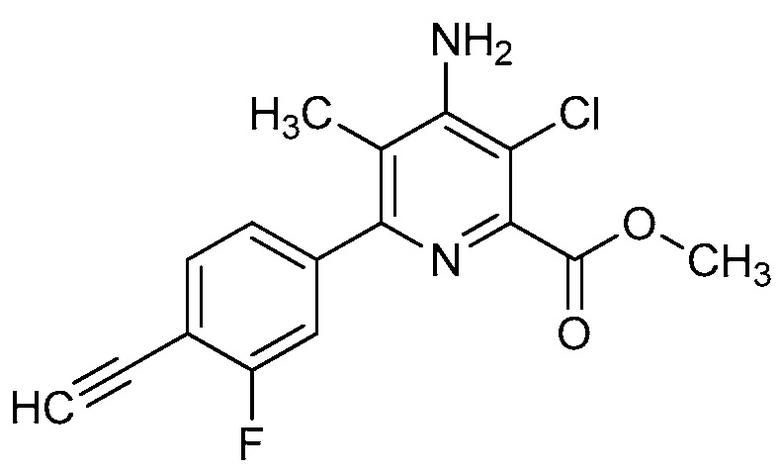 .
.
К раствору метил-4-амино-3-хлор-6-(3-фтор-4-формилфенил)-5-метилпиколината (358 мг, 1,1 ммоля) и карбоната калия (537 мг, 3,9 ммоля) в метаноле (11 мл) при комнатной температуре добавляли диметил (1-диазо-2-оксопропил)фосфонат (реагент Bestmann-Ohira, неочищенный реагент; 1 мл) и смесь перемешивали в течение 3 ч. Реакцию останавливали насыщенным водным раствором бикарбоната натрия и экстрагировали этилацетатом (3×). Объединенные органические слои сушили над безводным Na2SO4, фильтровали и адсорбировали на силикагеле. Очистка с помощью флэш-хроматографии (0-50% этилацетат/гексаны) давала искомое соединение в виде желтого твердого вещества (245 мг, 69%).
Пример 88: Получение метил-4-амино-6-(4-этинилфенил)-5-фтор-3-винилпиколината (соединение 60)
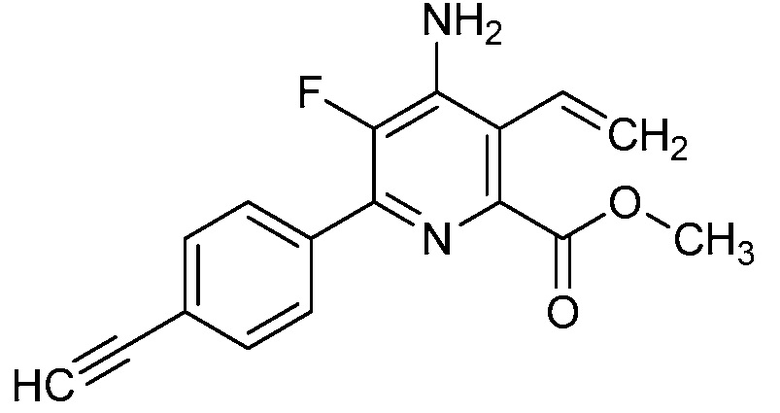 .
.
В реакционный сосуд объемом 20 мл добавляли метил-4-амино-5-фтор-6-(4-формилфенил)-3-винилпиколинат (0,41 г, 1,365 ммоля), карбонат калия (0,377 г, 2,73 ммоля) и метанол (10 мл). Одной порцией добавляли диметил-(1-диазо-2-оксопропил)фосфонат (0,315 г, 1,638 ммоля). После перемешивания в течение 4 ч реакционную смесь разбавляли с помощью Et2O (50 мл) и промывали 5% раствором NaHCO3 (25 мл). Органический слой сушили над MgSO4 (5 г), фильтровали и концентрировали в роторном испарителе. Полученный остаток очищали с помощью системы очистки Teledyne ISCO в градиентном режиме с использованием системы элюентов CH2Cl2 и EtOAc и получали искомое соединение в виде белого твердого вещества (250 мг, 61%).
Пример 89: Получение метил-4-((трет-бутоксикарбонил)амино)-3-хлор-6-(4-хлор-3-фторфенил)-5-фторпиколината
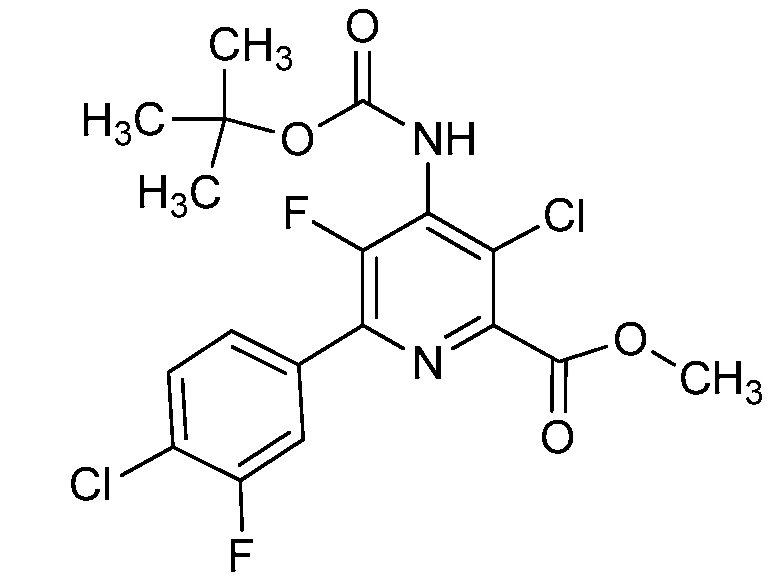 .
.
Стадия 1: Метил-4-амино-3-хлор-6-(4-хлор-3-фторфенил)-5-фторпиколинат (1,43 г, 4,29 ммоля) объединяли с ди-трет-бутилдикарбонатом (2,99 мл, 12,88 ммоля) и N,N-диметилпиридин-4-амином (0,079 г, 0,644 ммоля) в дихлорметане (30 мл). Реакционную смесь перемешивали в течение ночи при КТ. Реакционную смесь концентрировали в потоке азота и прямо вводили в колонку с силикагелем. Соединение элюировали в градиентном режиме с использованием системы растворителей 2-20% этилацетат/гексаны и получали метил-4-(бис(трет-бутоксикарбонил)амино)-3-хлор-6-(4-хлор-3-фторфенил)-5-фторпиколинат (2,1 г, 92%) в виде белого твердого вещества.
Стадия 2: Метил-4-(бис(трет-бутоксикарбонил)амино)-3-хлор-6-(4-хлор-3-фторфенил)-5-фторпиколинат (2,1 г, 3,94 ммоля) при КТ растворяли в дихлорэтане (20 мл) и добавляли трифторуксусную кислоту (0,598 мл, 7,76 ммоля). Реакционную смесь перемешивали в течение ночи при КТ затем концентрировали в вакууме. Продукт очищали с помощью флэш-хроматографии (SiO2; при элюировании с помощью 2-20% этилацетата в дихлорметане) и получали искомое соединение в виде белого твердого вещества (1,64 г, 98%): 1H ЯМР (300 МГц, CDCl3) δ 7,80 (дд, J=22,0, 8,5 Гц, 2H), 7,50 (дд, J=8,3, 7,6 Гц, 1H), 6,51 (с, 1H), 4,02 (с, 3H), 1,56 (с, 9H); ИЭРМС m/z 431 ([M-H]-).
Пример 90: Получение метил-4-амино-6-(4-хлор-3-фторфенил)-5-фтор-3-винилпиколината (соединение 215)
 .
.
Стадия 1: Метил-4-(трет-бутоксикарбониламино)-3-хлор-6-(4-хлор-3-фторфенил)-5-фторпиколинат (1,5 г, 3,46 ммоля), трибутил(винил)станнан (2,196 г, 6,92 ммоля) и бис(трифенилфосфин)хлорид палладия(II) (0,365 г, 0,519 ммоля) объединяли в 1,2-дихлорэтане (4,62 мл) и облучали в микроволновой печи при 130°C в герметизированном сосуде в течение 30 мин. Охлажденную реакционную смесь прямо вводили в колонку с силикагелем и элюировали в градиентном режиме с использованием смеси 5-40% этилацетат/гексаны и получали метил-4-(трет-бутоксикарбониламино)-6-(4-хлор-3-фторфенил)-5-фтор-3-винилпиколинат (0,966 г, 65,7%) в виде белого твердого вещества.
Стадия 2: Метил-4-(трет-бутоксикарбониламино)-6-(4-хлор-3-фторфенил)-5-фтор-3-винилпиколинат (0,966 г, 2,274 ммоля) растворяли в дихлорэтане (11 мл) и добавляли трифторуксусную кислоту (3,50 мл, 45,5 ммоля). После выдерживания в течение 4 ч при КТ реакционную смесь концентрировали в вакууме, затем еще два раза выпаривали вместе с дополнительным количеством дихлорэтана. Остаток очищали с помощью флэш-хроматографии (SiO2; при элюировании с помощью 7-60% этилацетата в гексанах) и получали искомое соединение в виде белого твердого вещества (0,705 г, 95%).
Пример 91: Получение метил-4-амино-5-бром-3-хлор-6-(2,5-дифтор-4-(триметилсилил)фенил)пиколината
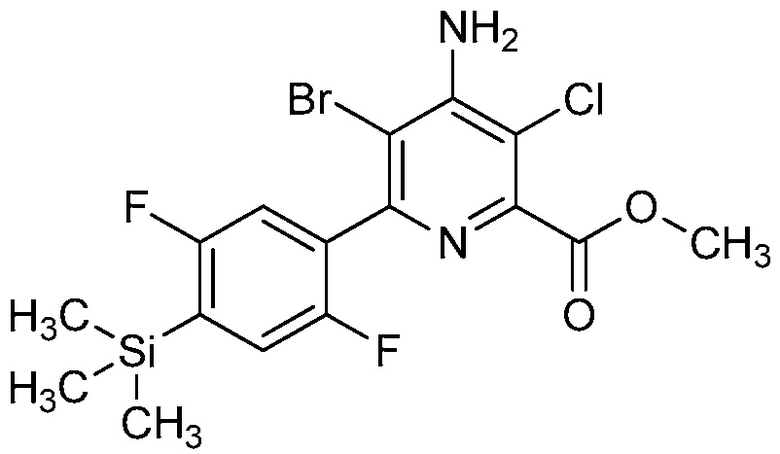 .
.
К раствору метил-4-амино-3-хлор-6-(2,5-дифтор-4-(триметилсилил)фенил)пиколината (0,210 г, 0,566 ммоля) в CH2Cl2 (2,265 мл) при 20°C добавляли бром (0,117 мл, 2,265 ммоля). Реакционную смесь перемешивали при 20°C в течение ночи. Затем смесь выливали в насыщенный водный раствор Na2S2O3 и экстрагировали с помощью EtOAc (3×). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали с помощью колоночной флэш-хроматографии (SiO2; градиентный режим гексаны/EtOAc) и получали искомое соединение в виде белого твердого вещества (0,125 г, 49,1%): Температура плавления 165-166°C; 1H ЯМР (400 МГц, CDCl3) δ 7,10 (дд, J=8,9, 4,0 Гц, 1H), 7,03 (дд, J=7,6, 5,1 Гц, 1H), 5,43 (с, 2H), 3,96 (с, 3H), 0,33 (д, J=0,7 Гц, 9H); ИЭРМС m/z 450 ([M+H]+).
Пример 92: Получение 4-амино-3-хлор-6-(3-фтор-4-йодфенил)пиколиновой кислоты (соединение 77)
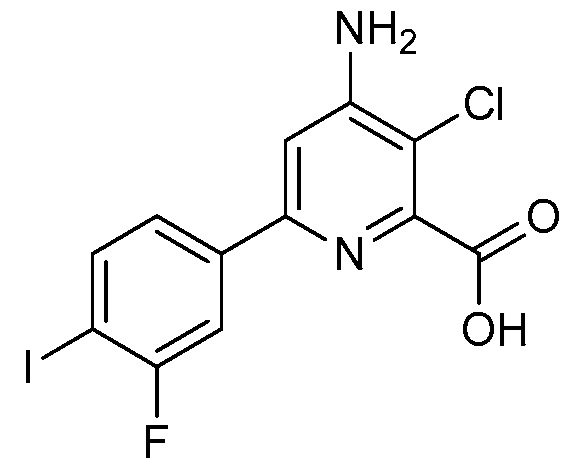 .
.
В круглодонную колбу объемом 100 мл, снабженную стержнем для перемешивания, добавляли метил-4-амино-3-хлор-6-(3-фтор-4-йодфенил)пиколинат (0,284 г, 0,699 ммоля), 1,0 н. раствор гидроксида натрия (2,79 мл, 2,79 ммоля) и метанол (5,0 мл). Реакционную смесь перемешивали в течение 18 ч при КТ. Затем растворитель удаляли с помощью роторного испарителя. Полученное твердое вещество разбавляли с помощью H2O и значение pH устанавливали равным ~3,0 с помощью 1 н. HCl и экстрагировали этилацетатом (3×50 мл). Объединенные органические слои сушили над безводным MgSO4, фильтровали и концентрировали и получали искомое соединение в виде белого твердого вещества (0,056 г, 21%).
Следующие соединения получали по методикам, раскрытым в примере 92:
4-Амино-3,5-дихлор-6-(3-фтор-4-йодфенил)пиколиновая кислота (соединение 145)
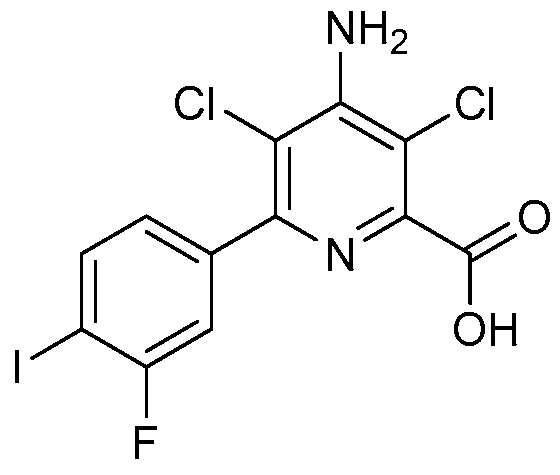 .
.
Искомое соединение получали, как описано в примере 92, с использованием метил-4-амино-3,5-дихлор-6-(3-фтор-4-йодфенил)пиколината (0,197 г, 0,447 ммоля) и выделяли в виде белого твердого вещества (0,133 г, 70%).
6-Амино-2-(3-фтор-4-йодфенил)-5-метоксипиримидин-4-карбоновая кислота (соединение 37)
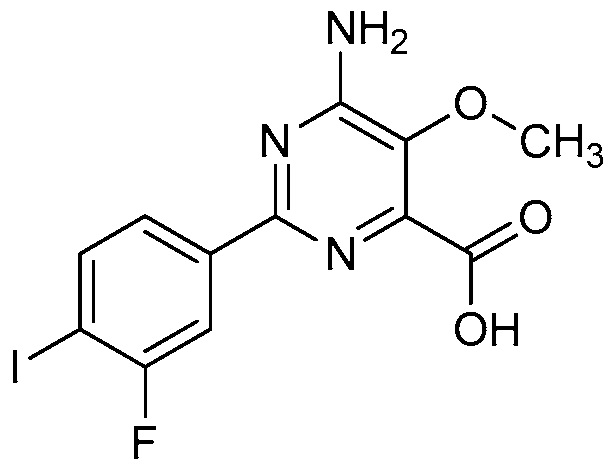 .
.
Искомое соединение получали, как описано в примере 92, с использованием метил-6-амино-2-(3-фтор-4-йодфенил)-5-метоксипиримидин-4-карбоксилата (0,309 г, 0,766 ммоля) и выделяли в виде белого твердого вещества (0,065 г, 22%).
4-Амино-6-(4-бром-3-фторфенил)-3-хлорпиколиновая кислота (соединение 110)
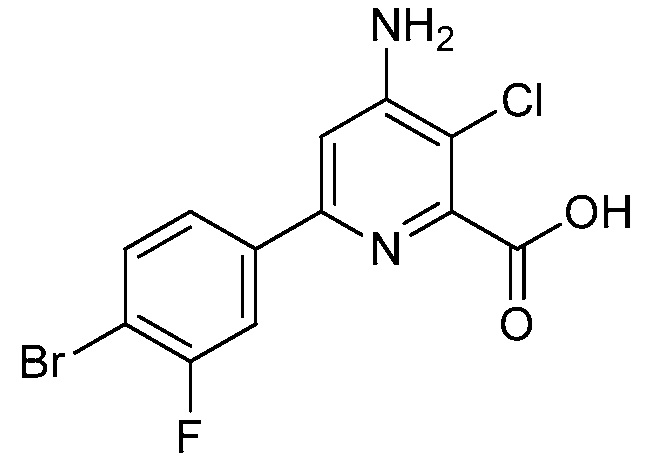 .
.
Искомое соединение получали, как описано в примере 92, с использованием метил-4-амино-6-(4-бром-3-фторфенил)-3-хлорпиколината (291 мг, 0,809 ммоля) и выделяли в виде почти белого твердого вещества (0,247 г, 88%).
4-Амино-6-(4-бром-3-фторфенил)-3,5-дихлорпиколиновая кислота (соединение 43)
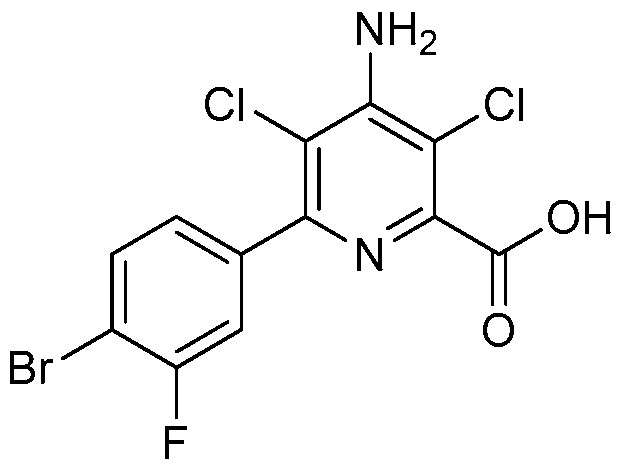 .
.
Искомое соединение получали, как описано в примере 92, с использованием метил-4-амино-6-(4-бром-3-фторфенил)-3,5-дихлорпиколината (225 мг, 0,571 ммоля) и выделяли в виде белого твердого вещества (0,219 г, 100%).
6-Амино-2-(4-бром-3-фторфенил)-5-метоксипиримидин-4-карбоновая кислота (соединение 113)
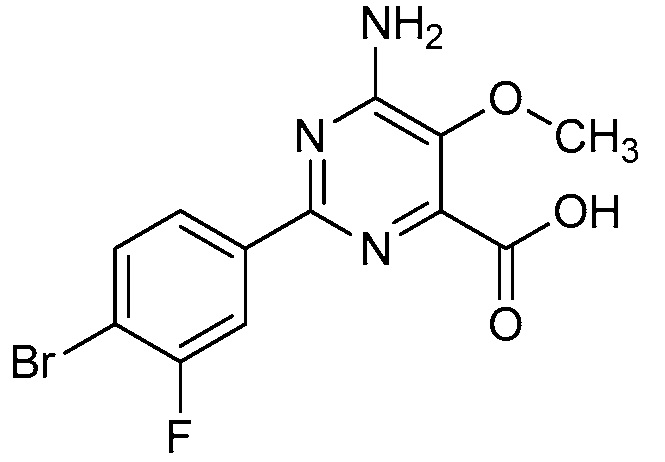 .
.
Искомое соединение получали, как описано в примере 92, с использованием метил-6-амино-2-(4-бром-3-фторфенил)-5-метоксипиримидин-4-карбоксилата (166 мг, 0,466 ммоля) и выделяли в виде белого твердого вещества (0,056 г, 35%).
6-Амино-2-(4-циано-2-фторфенил)-5-винилпиримидин-4-карбоновая кислота (соединение 5)
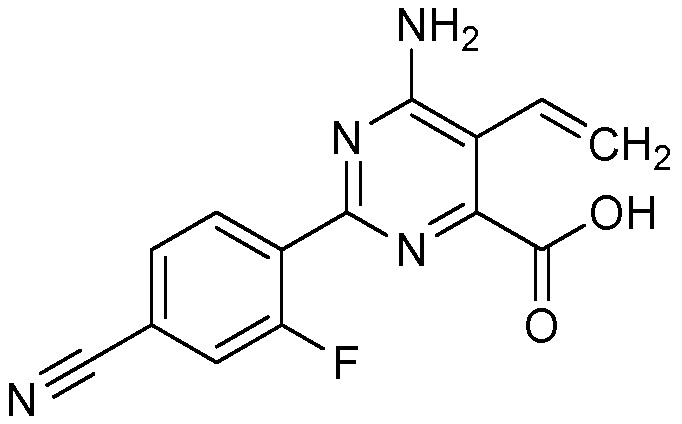 .
.
Искомое соединение получали, как описано в примере 92, с использованием метил-6-амино-2-(4-циано-2-фторфенил)-5-винилпиримидин-4-карбоксилата (294 мг, 0,986 ммоля) и выделяли в виде оранжевого твердого вещества (0,202 г, 72%).
6-Амино-2-(3-фтор-4-(трифторметил)фенил)-5-винилпиримидин-4-карбоновая кислота (соединение 32)
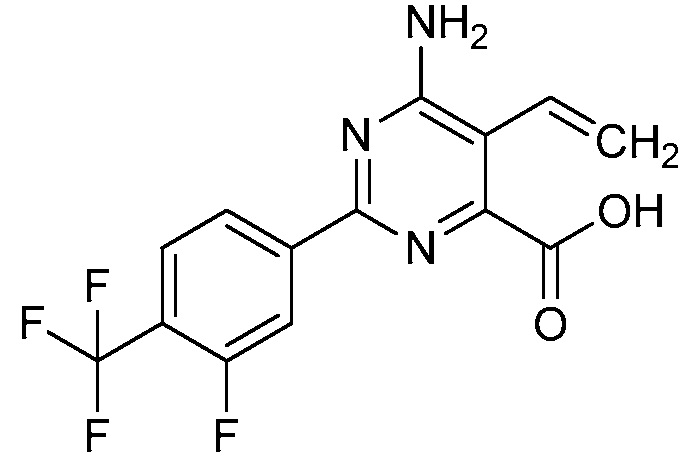 .
.
Искомое соединение получали, как описано в примере 92, с использованием метил-6-амино-2-(3-фтор-4-(трифторметил)фенил)-5-винилпиримидин-4-карбоксилата (265 мг, 0,777 ммоля) и выделяли в виде светло-желтого твердого вещества (0,234 г, 92%).
6-Амино-2-(2,3,4-трифторфенил)-5-винилпиримидин-4-карбоновая кислота (соединение 191)
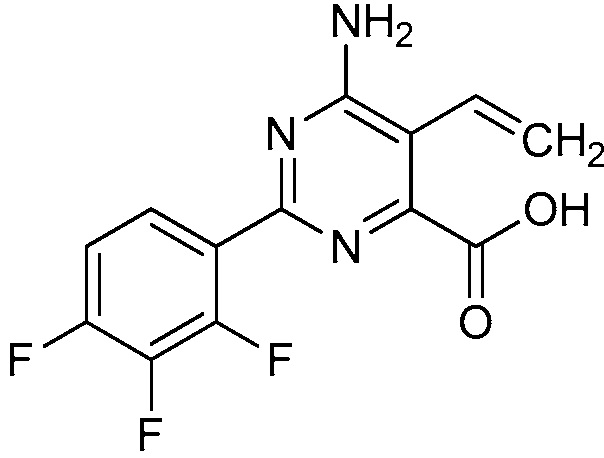 .
.
Искомое соединение получали, как описано в примере 92, с использованием метил-6-амино-2-(2,3,4-трифторфенил)-5-винилпиримидин-4-карбоксилата (335 мг, 1,08 ммоля) и выделяли в виде желтого твердого вещества (0,275 г, 86%).
Пример 93: Получение 4-амино-3-хлор-6-(4-циано-2-фторфенил)-5-фторпиколиновой кислоты (соединение 65)
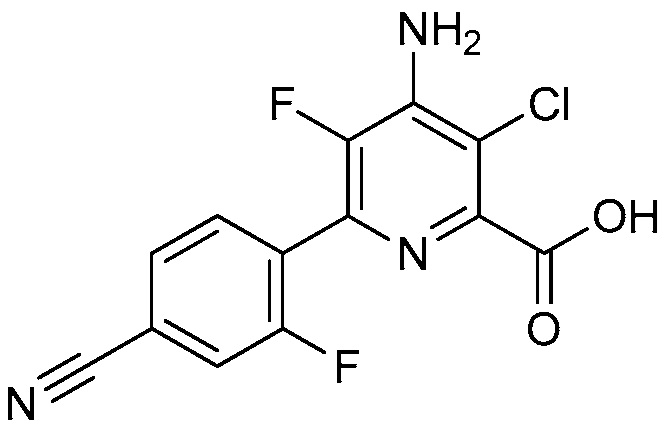 .
.
В круглодонной колбе объемом 50 мл, снабженной стержнем для перемешивания, метил-4-амино-3-хлор-6-(4-циано-2-фторфенил)-5-фторпиколинат (351 мг, 1,084 ммоля) и гидрат гидроксида лития (100 мг, 2,383 ммоля) растворяли в тетрагидрофуране (2,0 мл), метаноле (2,0 мл) и H2O (1,0 мл). Реакционную смесь перемешивали при КТ в течение 2 ч. Затем растворитель удаляли с помощью роторного испарителя. Полученное твердое вещество обрабатывали с помощью H2O и затем значение pH устанавливали равным ~3,0 с помощью 1 н. HCl и экстрагировали этилацетатом (3×50 мл). Объединенные органические слои сушили над безводным MgSO4, фильтровали и концентрировали. Полученный остаток при необходимости очищали с помощью хроматографии с обращенной фазой (150 г C18, 0-100% ацетонитрила в H2O) и получали искомое соединение в виде коричневого твердого вещества (0,058 г, 20%).
Следующее соединение получали по методикам, раскрытым в примере 93:
6-Амино-2-(4-йодфенил)-5-винилпиримидин-4-карбоновая кислота (соединение 123)
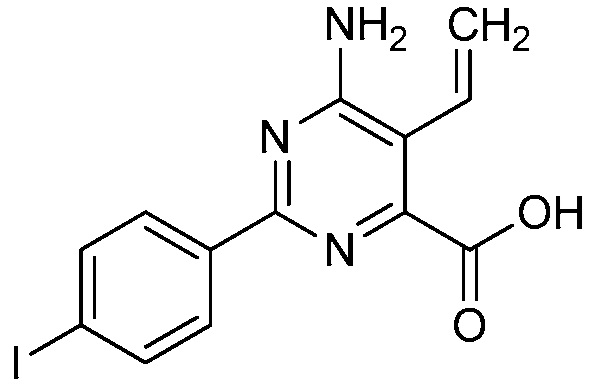 .
.
Искомое соединение получали, как описано в примере 93, с использованием метил-6-амино-2-(4-йодфенил)-5-винилпиримидин-4-карбоксилата (65 мг, 0,177 ммоля) и выделяли в виде почти белого твердого вещества (60 мг, 92%).
Пример 94. Получение 4-амино-3-хлор-6-(3-фтор-4-(трифторметил)фенил)-5-метилпиколиновой кислоты (соединение 161)
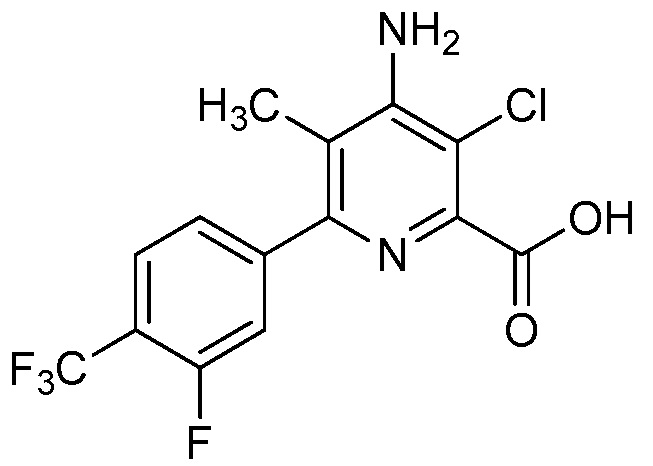 .
.
К метил-4-амино-3-хлор-6-(3-фтор-4-(трифторметил)фенил)-5-метилпиколинату (0,35 г, 0,96 ммоля) в метаноле (6,4 мл) добавляли 2 н. NaOH (1,93 мл, 3,9 ммоля) и реакционную смесь перемешивали при КТ в течение 18 ч. Раствор подкисляли с помощью 2 н. HCl и осадок фильтровали в вакууме и получали искомое соединение в виде белого порошкообразного вещества (199 мг, 59%).
Следующие соединения получали по методикам, раскрытым в примере 94:
4-Амино-3-хлор-6-(4-(дифторметокси)фенил)-5-метилпиколиновая кислота (соединение 94)
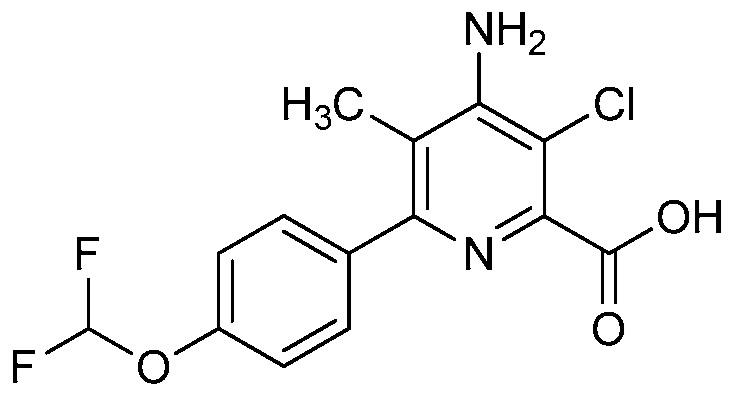 .
.
Искомое соединение получали, как в примере 94, и выделяли в виде желтого твердого вещества (36 мг, 68%).
4-Амино-6-(4-бромфенил)-3-хлор-5-метилпиколиновая кислота (соединение 78)
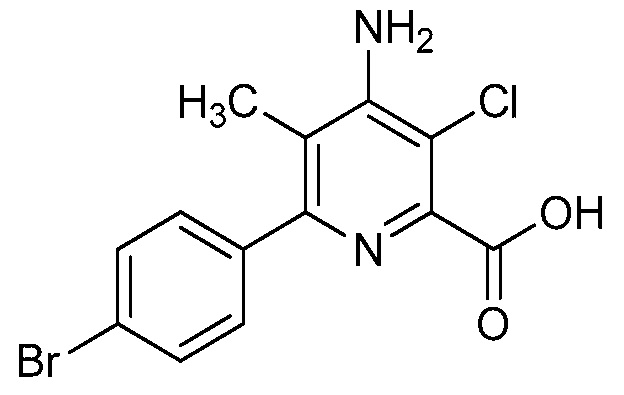 .
.
Искомое соединение получали, как в примере 94, и выделяли в виде белого твердого вещества (24 мг, 71%).
4-Амино-3-хлор-6-(4-йодфенил)-5-метилпиколиновая кислота (соединение 116)
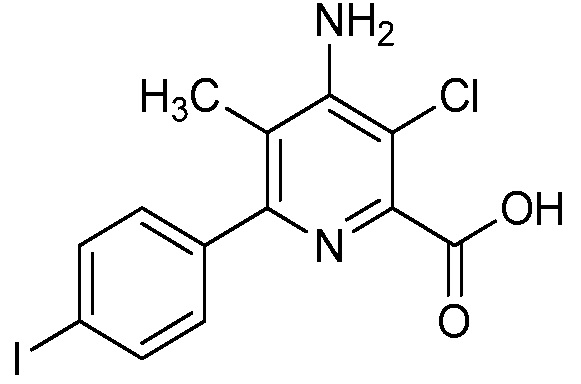 .
.
Искомое соединение получали, как в примере 94, и выделяли в виде оранжевого порошкообразного вещества (86 мг, 83%).
4-Амино-3-хлор-6-(3-фтор-4-йодфенил)-5-метилпиколиновая кислота (соединение 87)
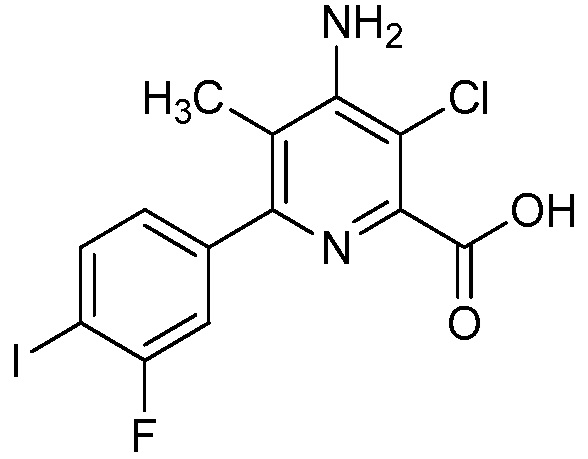 .
.
Искомое соединение получали, как в примере 94, и выделяли в виде белого порошкообразного вещества (120,5 мг, 88%).
4-Амино-3-хлор-6-(4-этинил-3-фторфенил)-5-метилпиколиновая кислота (соединение 6)
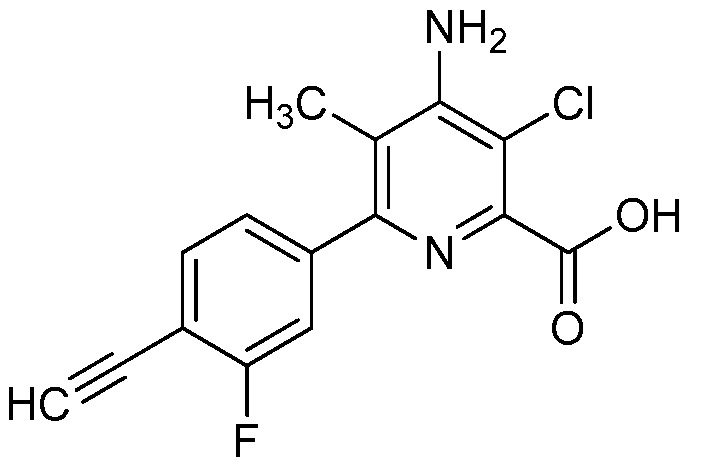 .
.
Искомое соединение получали, как в примере 94, и выделяли в виде желтого порошкообразного вещества (147 мг, 82%).
Пример 95: Получение 4-амино-3-хлор-5-фтор-6-(4-нитрофенил)пиколиновой кислоты (соединение 31)
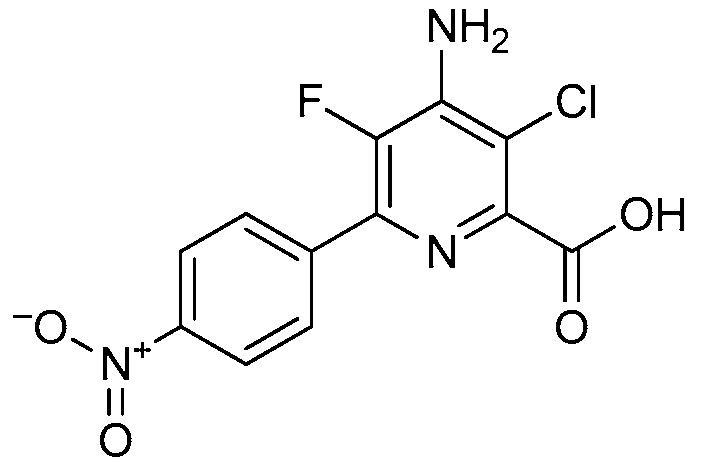 .
.
К раствору метил-4-амино-3-хлор-5-фтор-6-(4-нитрофенил)пиколината (88 мг, 0,27 ммоля) в метаноле (MeOH; 3 мл) добавляли 1-нормальный (н.) водный раствор гидроксида натрия (NaOH; 3 мл, 3 ммоля). Реакционную смесь перемешивали в течение 24 ч при температуре окружающей среды. Затем раствор концентрировали и подкисляли 2 н. водным раствором HCl. Искомый продукт, осадившийся из раствора, собирали с помощью воронки Бюхнера и ему давали высыхать в течение ночи и получали желтовато-коричневое твердое вещество (84 мг, 100%).
Пример 96: Получение 4-амино-3-хлор-6-(2,3-дифтор-4-(трифторметил)фенил)пиколиновой кислоты (соединение 172)
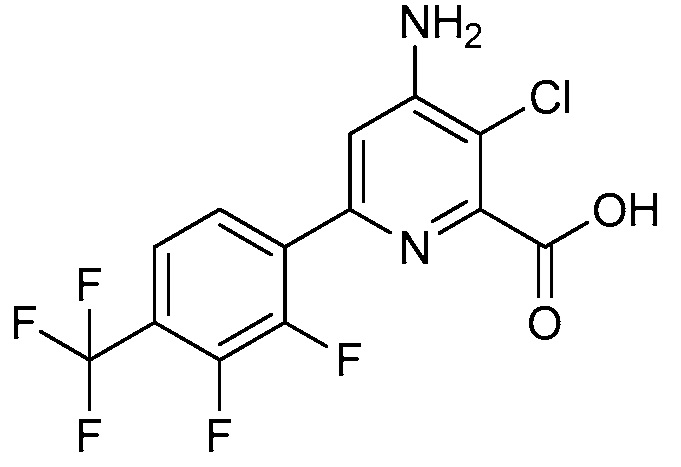 .
.
К смеси метил-4-ацетамидо-3-хлор-6-(2,3-дифтор-4-(трифторметил)фенил)пиколината (115 мг, 0,28 ммоля) в метаноле (1 мл) добавляли 2-нормальный (н.) водный раствор гидроксида натрия (NaOH; 1,4 мл, 2,81 ммоля). Раствор реакционной смеси перемешивали при температуре окружающей среды в течение 15 ч. Затем раствор концентрировали, и подкисляли 2 н. водным раствором HCl. Искомый продукт осаждался из раствора. Эту смесь экстрагировали (3×) дихлорметаном, органические вещества объединяли, сушили (Na2SO4), фильтровали и концентрировали в вакууме и получали белое твердое вещество (94 мг, 90%).
Пример 97: Получение 4-амино-3-хлор-5-фтор-6-(4-йодфенил)пиколиновой кислоты (соединение 45)
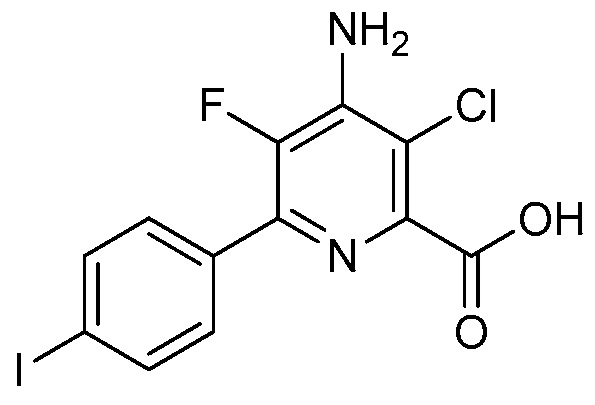 .
.
2 M Раствор гидроксида натрия (740 мкл, 1,5 ммоля, 4,0 экв.) при 23°C при перемешивании добавляли к раствору метил-4-амино-6-(4-йодфенил)-3-хлор-5-фторпиколината (150 мг, 0,37 ммоля, 1,0 экв.) в метаноле (3,7 мл). Полученный розовый раствор перемешивали при 23°C в течение 3 ч. Значение pH реакционной смеси устанавливали равным 3 с помощью концентрированной HCl и концентрировали путем выпаривания в роторном испарителе. Остаток диспергировали в воде и фильтровали в вакууме и получали искомое соединение в виде бледно-розового порошкообразного вещества (110 мг, 79%).
Пример 98: Получение 4-амино-3-хлор-6-(2,3-дифтор-4-йодфенил)-5-фторпиколиновой кислоты (соединение 141)
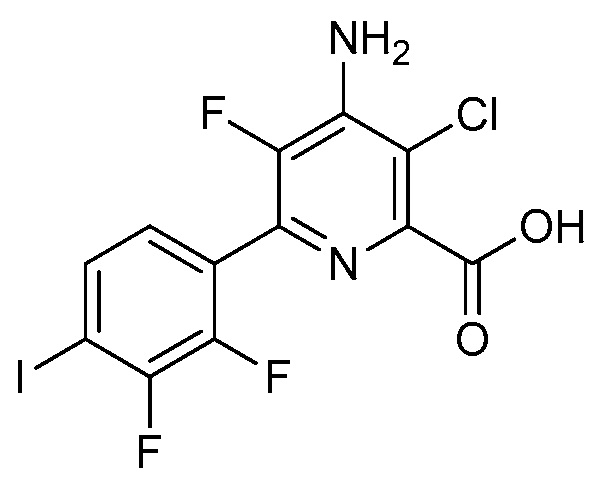 .
.
2 M Водный раствор гидроксида натрия (270 мкл, 0,54 ммоля, 2,0 экв.) при 23°C при перемешивании добавляли к суспензии метил-4-амино-3-хлор-6-(2,3-дифтор-4-йодфенил)-5-фторпиколината (120 мг, 0,27 ммоля, 1,0 экв.) в метаноле (2,7 мл). Гетерогенную белую смесь перемешивали при 23°C в течение 18 ч. Значение pH реакционной смеси устанавливали равным примерно 4 с помощью проводимого по каплям добавления концентрированной HCl и концентрировали с помощью роторного испарителя. Остаток растворяли в дихлорметане (250 мл), пропускали через устройство для разделения фаз с гидрофобной мембраной, сушили (MgSO4), фильтровали самотеком и концентрировали путем выпаривания в роторном испарителе и получали искомое соединение в виде белого порошкообразного вещества (110 мг, 92%).
Пример 99: Получение 4-амино-6-(4-бром-2,3,6-трифторфенил)-3-хлорпиколиновой кислоты (соединение 162)
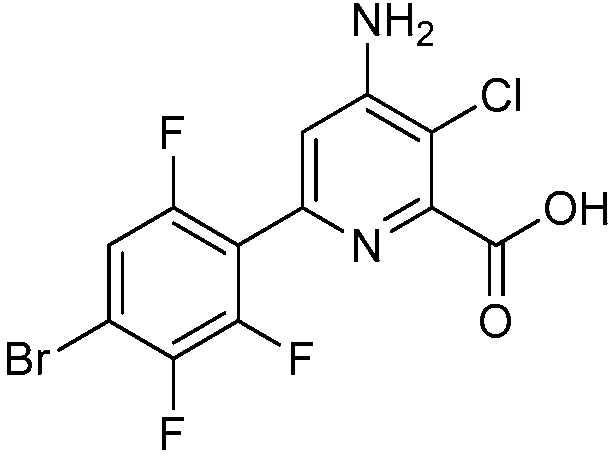 .
.
Раствор метил-4-ацетамидо-6-(4-бром-2,3,6-трифторфенил)-3-хлорпиколината (50 мг, 0,122 ммоля, 1,0 экв.) и гидроксида натрия (14 мг, 0,366 ммоля, 3,0 экв.) в смеси ТГФ:MeOH:H2O (1:1:0,5; 2,5 мл) перемешивали при 20°C в течение 2 ч. Реакционную смесь подкисляли до pH 4-5 с помощью 1,5 н. HCl и экстрагировали с помощью EtOAc (2×). Объединенный органический экстракт сушили над безводным Na2SO4 и выпаривали досуха при пониженном давлении и получали искомое соединение в виде коричневого твердого вещества (30 мг, 65%).
Пример 100: Получение 4-амино-6-(4-бром-2,5-дифторфенил)-3-хлор-5-фторпиколиновой кислоты (соединение 42)
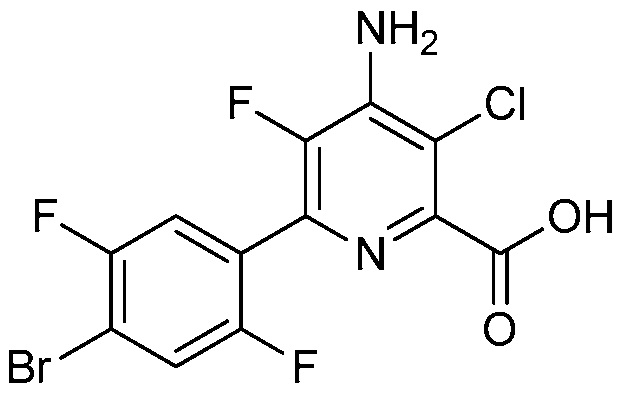 .
.
К раствору метил-4-амино-6-(4-бром-2,5-дифторфенил)-3-хлор-5-фторпиколината (0,160 г, 0,404 ммоля) в 1:1 смеси MeOH (0,674 мл) и ацетона (0,674 мл) добавляли 2 н. водный раствор гидроксида натрия (0,607 мл, 1,213 ммоля). Реакционную смесь перемешивали при 20°C в течение ночи. Реакционную смесь концентрировали, выливали в 2 н. водный раствор HCl и экстрагировали с помощью EtOAc (3×). Объединенные органические слои сушили над Na2SO4, фильтровали, концентрировали и сушили в вакууме и получали искомое соединение в виде светло-коричневого твердого вещества (126 мг, 82%).
Пример 101: Получение 4-амино-3-хлор-6-(4-(дифторметокси)-3-фторфенил)-5-фторпиколиновой кислоты (соединение 92)
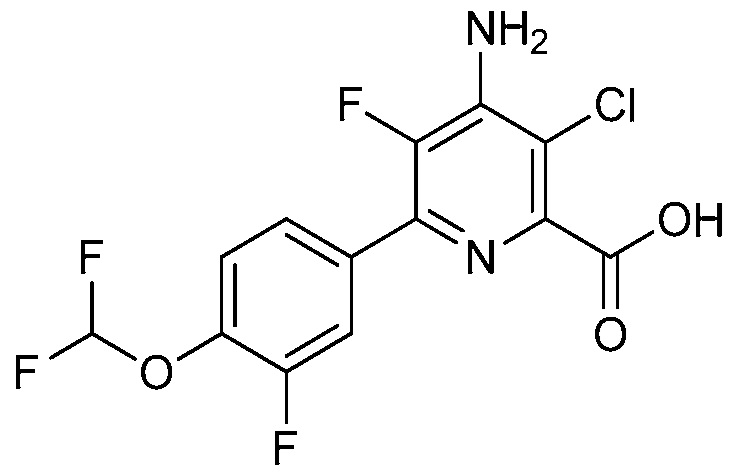 .
.
В колбу, содержащую MeOH (2 мл), добавляли метил-4-амино-3-хлор-6-(4-(дифторметокси)-3-фторфенил)-5-фторпиколинат (190 мг, 0,52 ммоля) и 2 M раствор гидроксида натрия (1 мл, 1 ммоля). После механического перемешивания в течение 12 ч реакционную смесь концентрировали с помощью роторного испарителя при температуре бани с водой, равной 40°C. К полученному маслу добавляли воду и раствор медленно подкисляли путем добавления концентрированной HCl до образования желтовато-коричневого осадка. Фильтрование с помощью фильтровальной бумаги и воронки Бюхнера давало искомое соединение в виде желтовато-коричневого твердого вещества (108 мг, 59%).
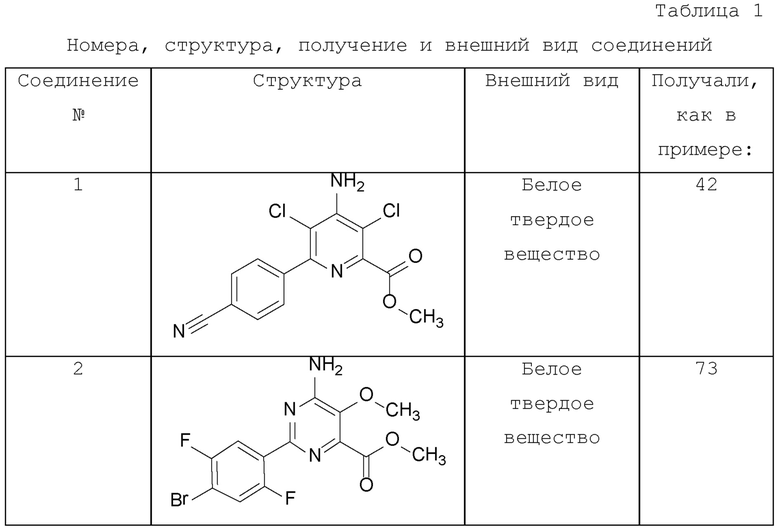
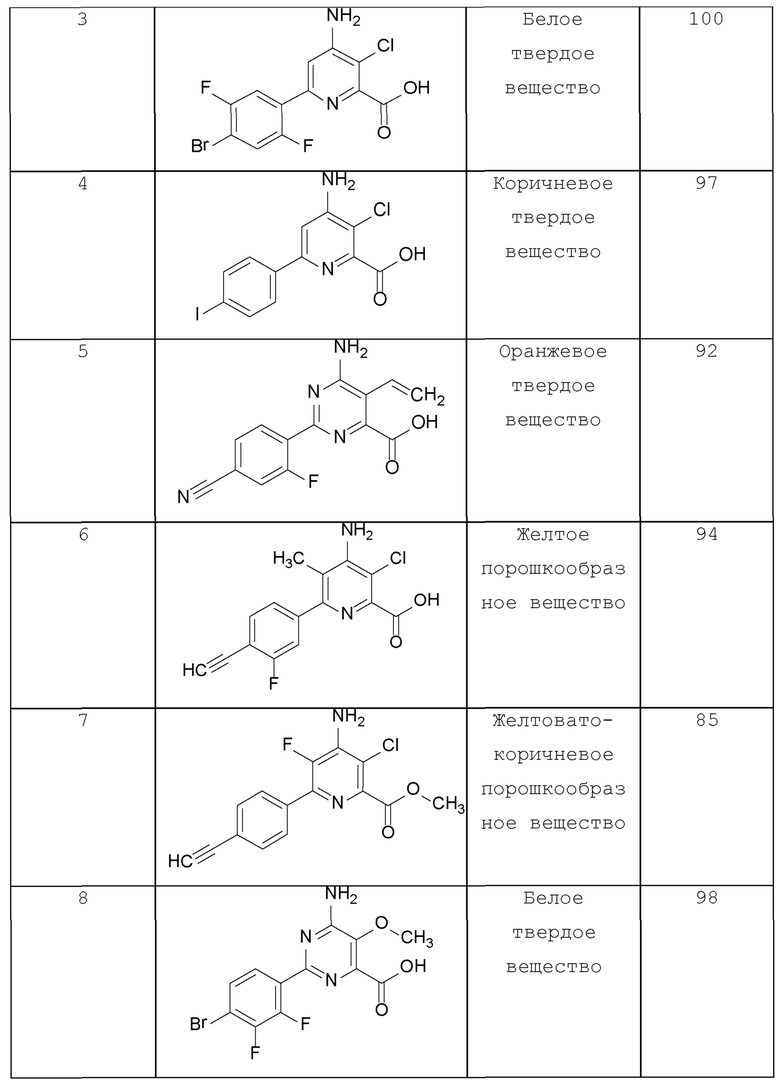
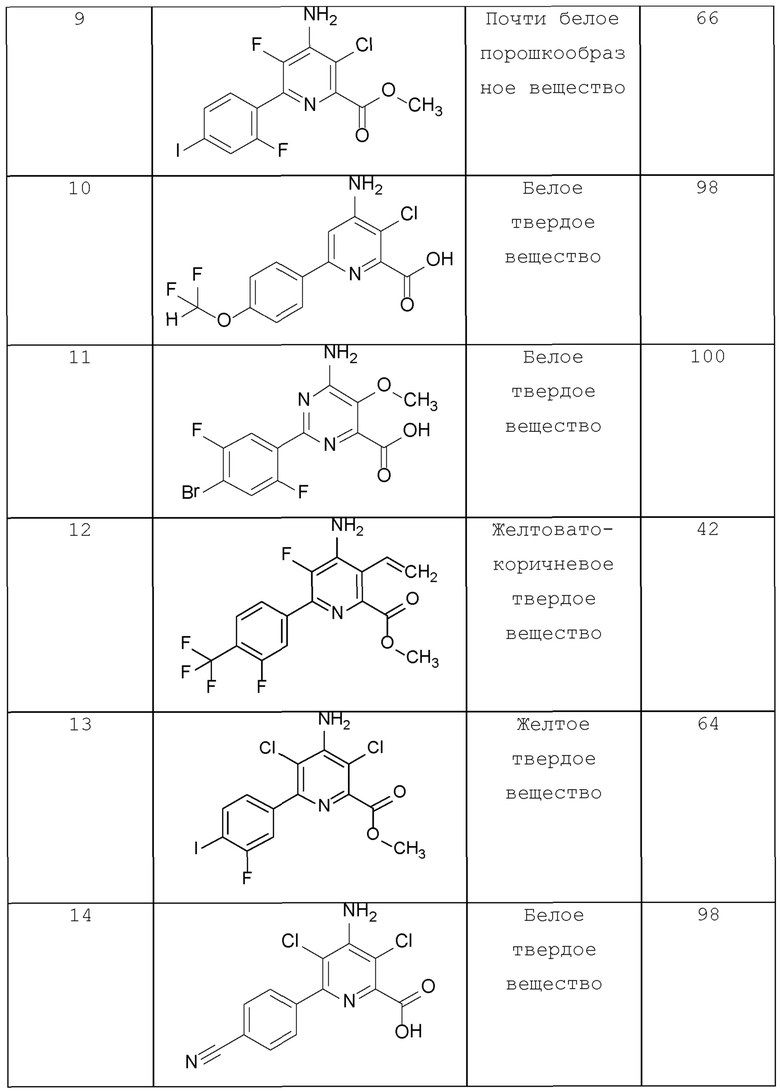
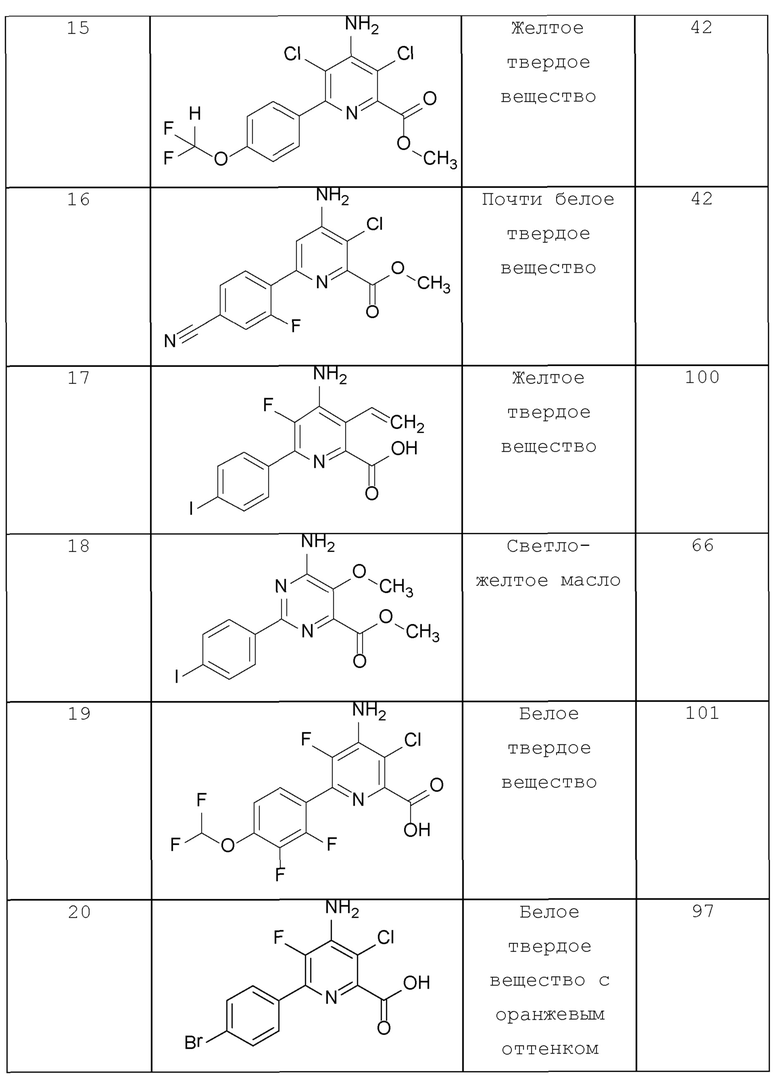
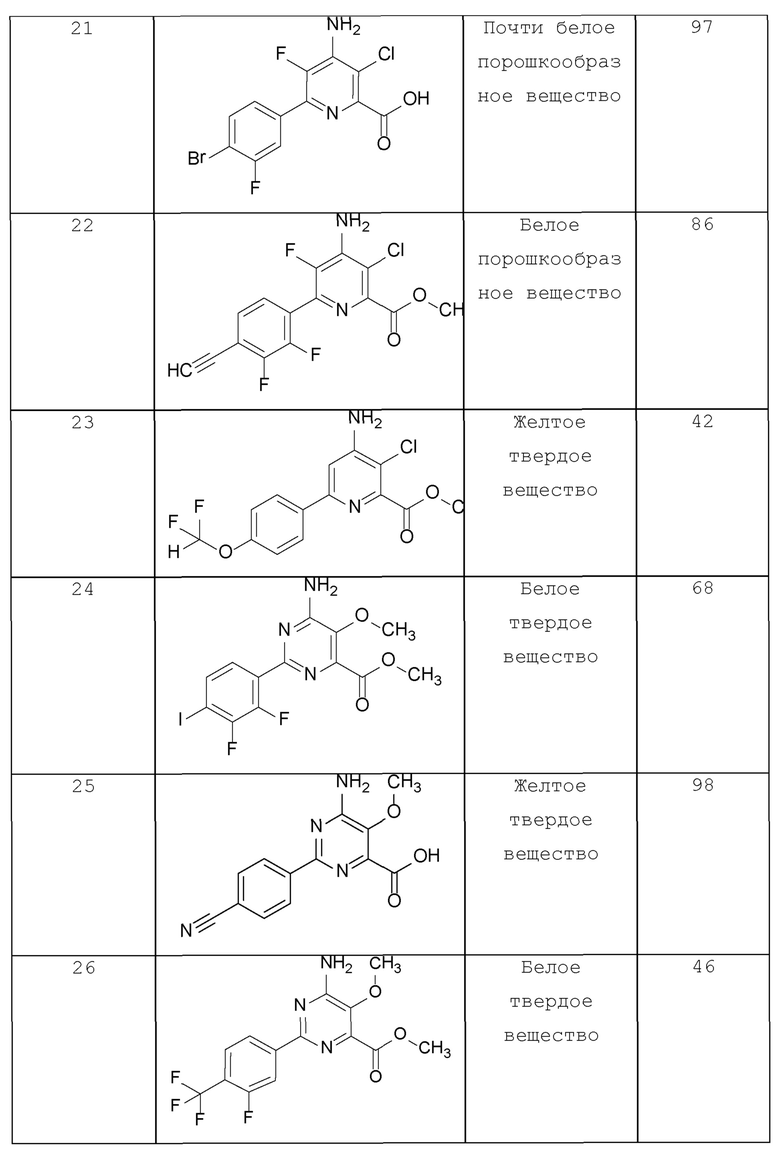
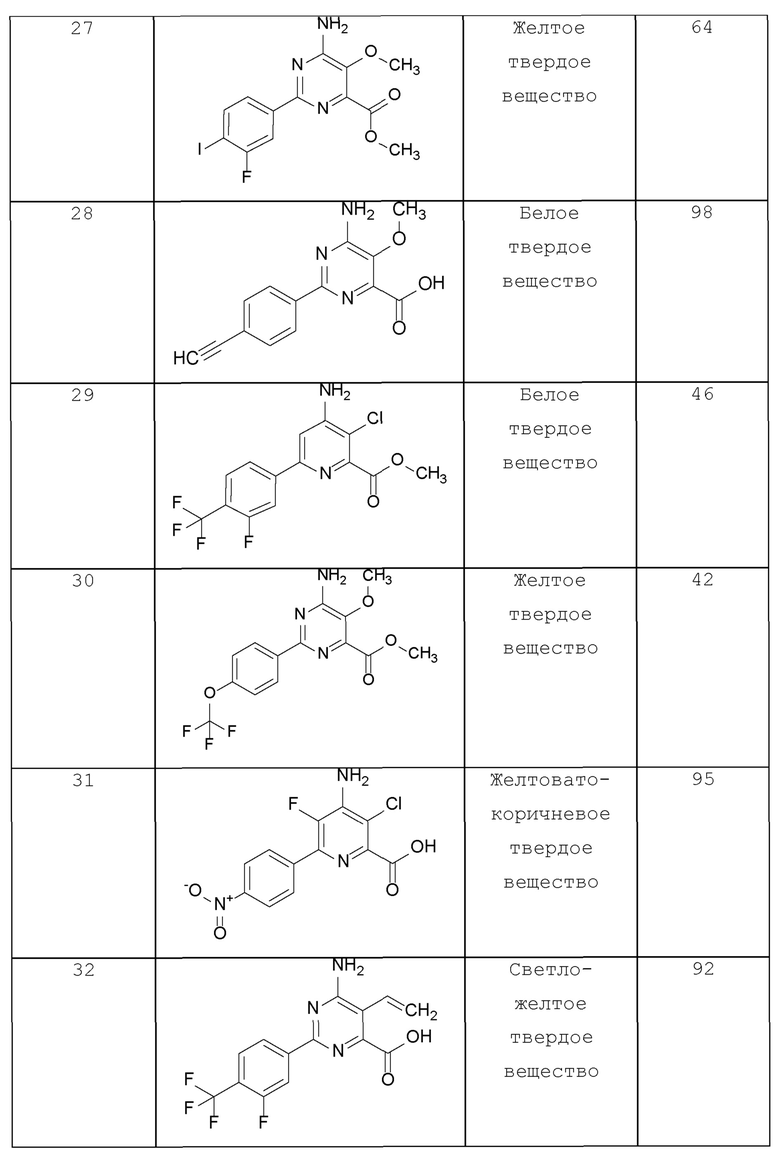
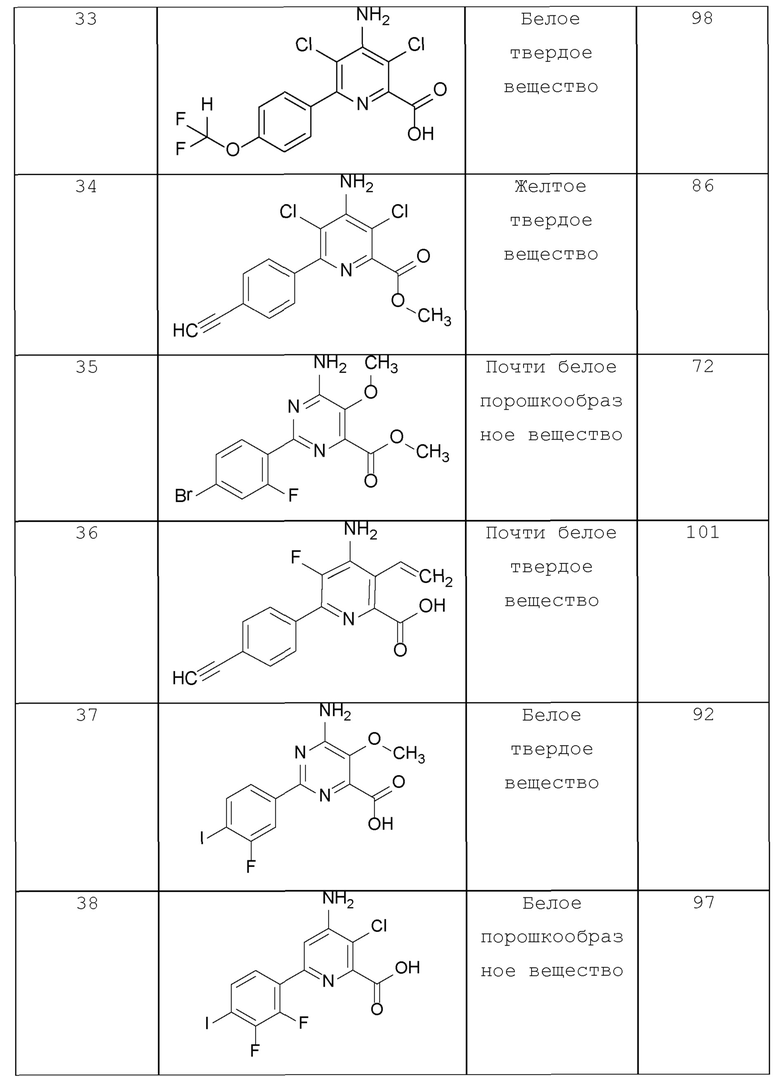
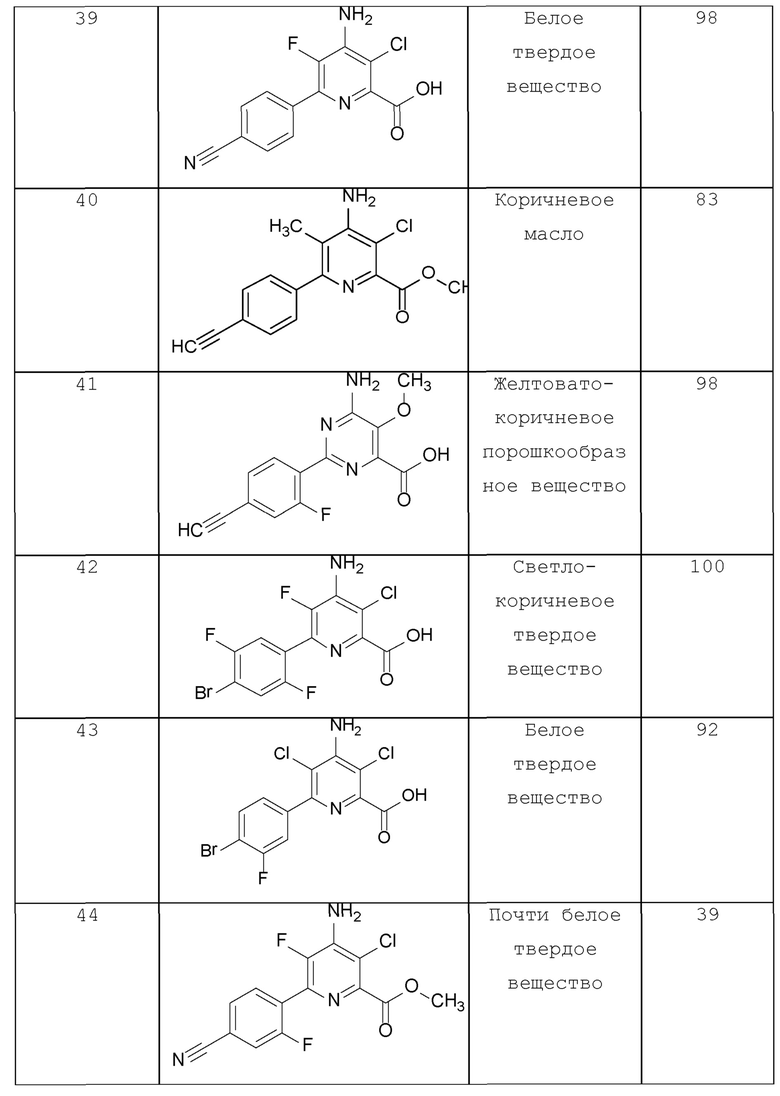
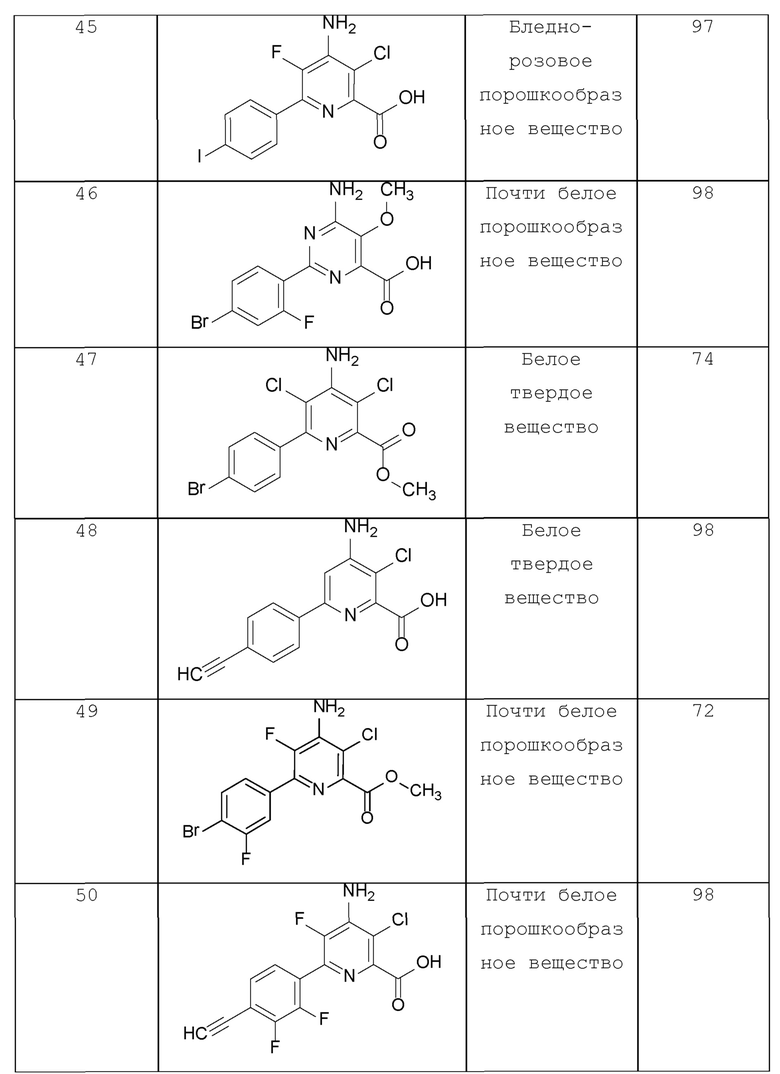

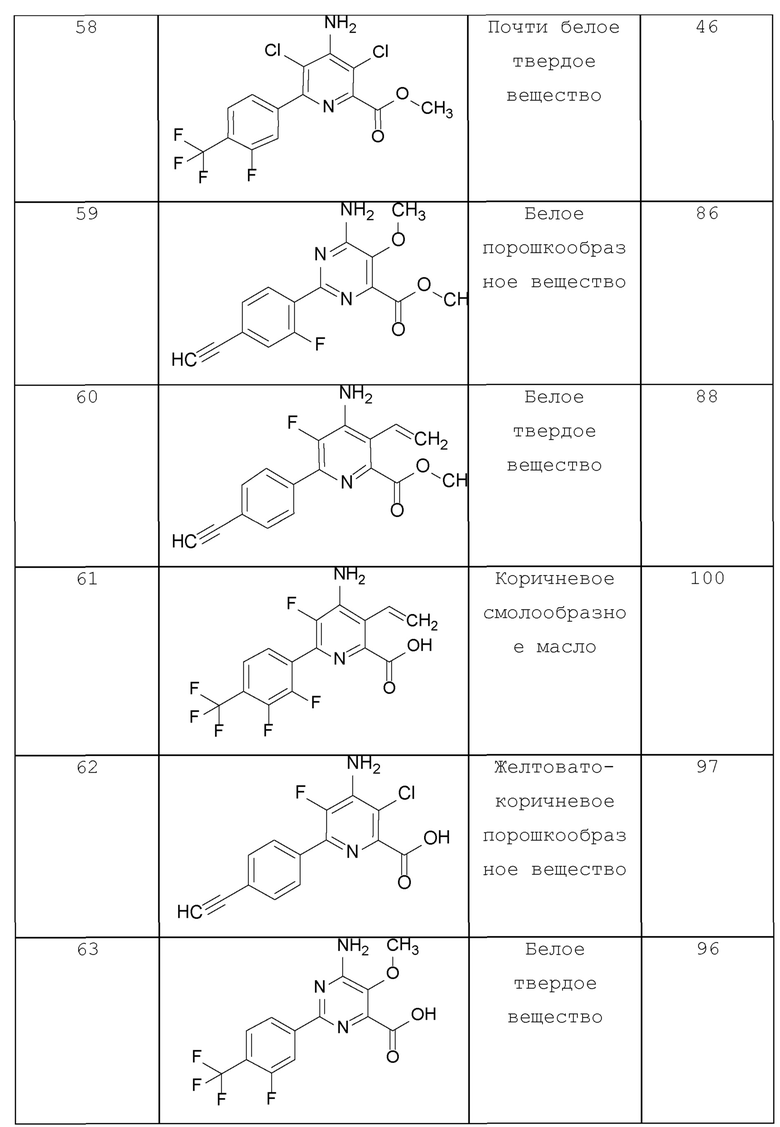
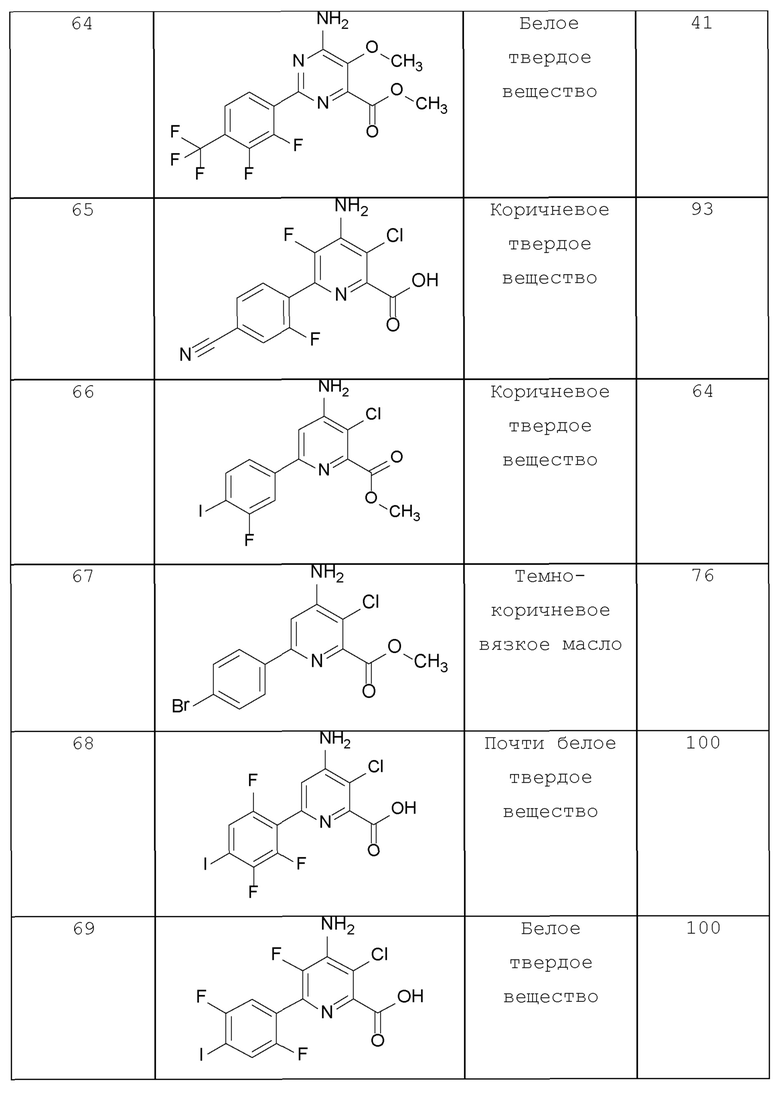
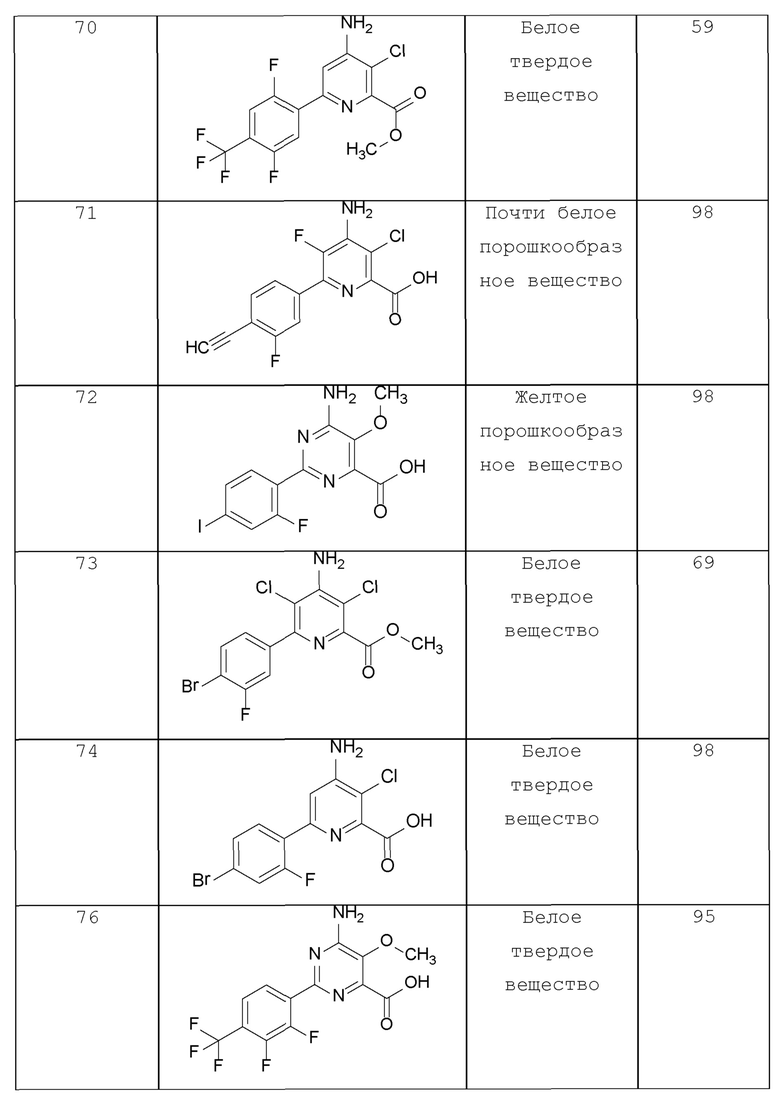
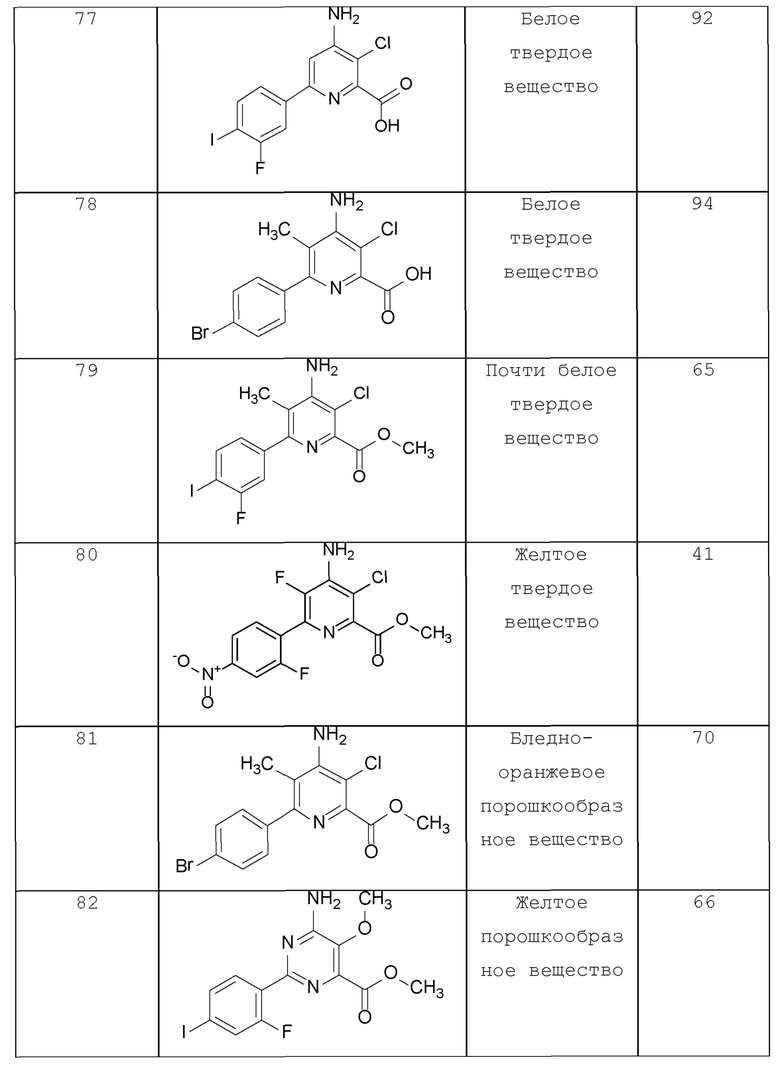
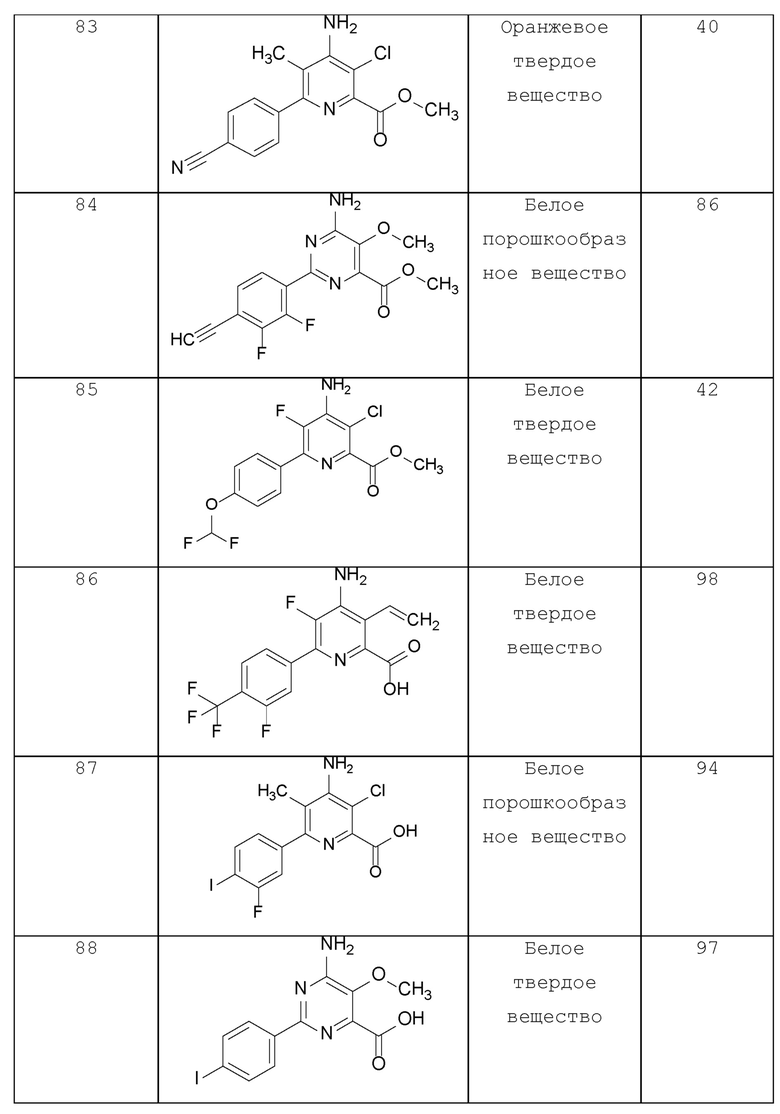
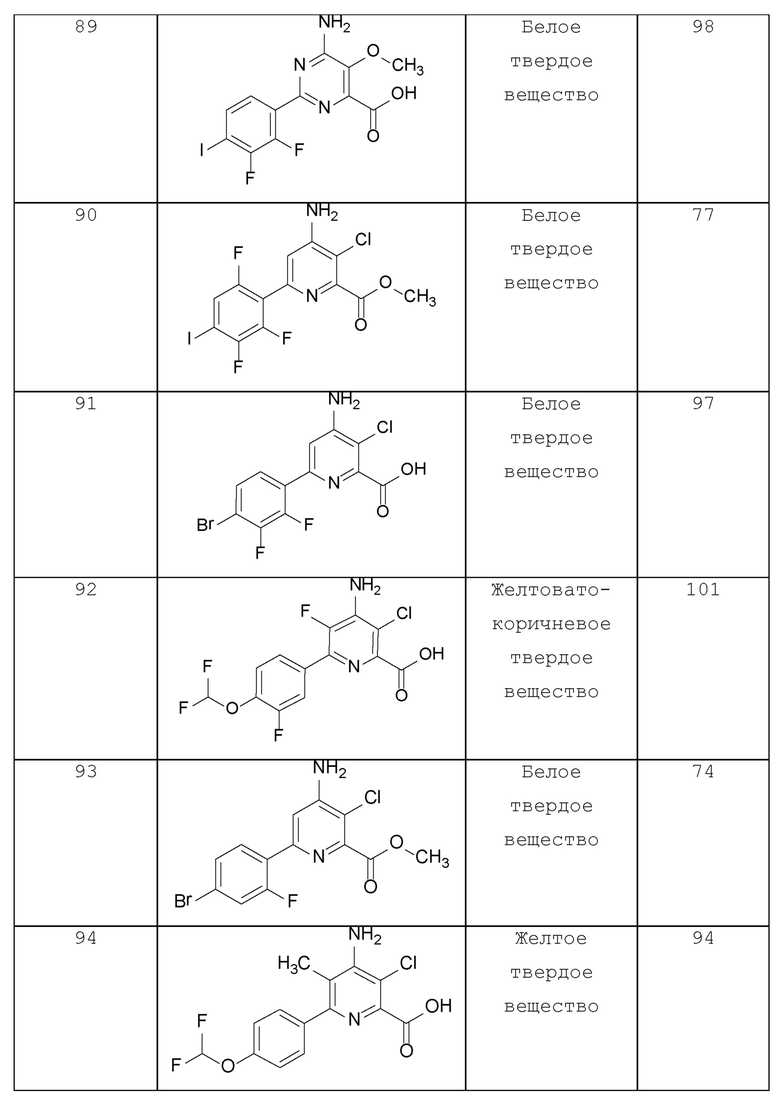
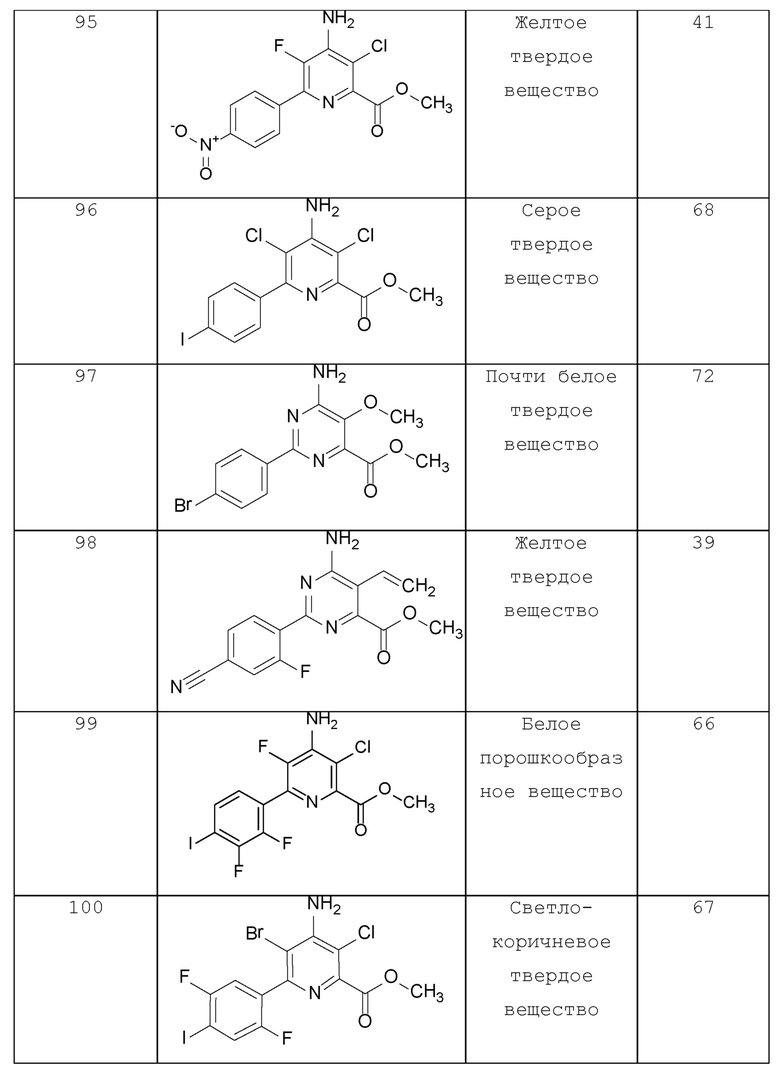
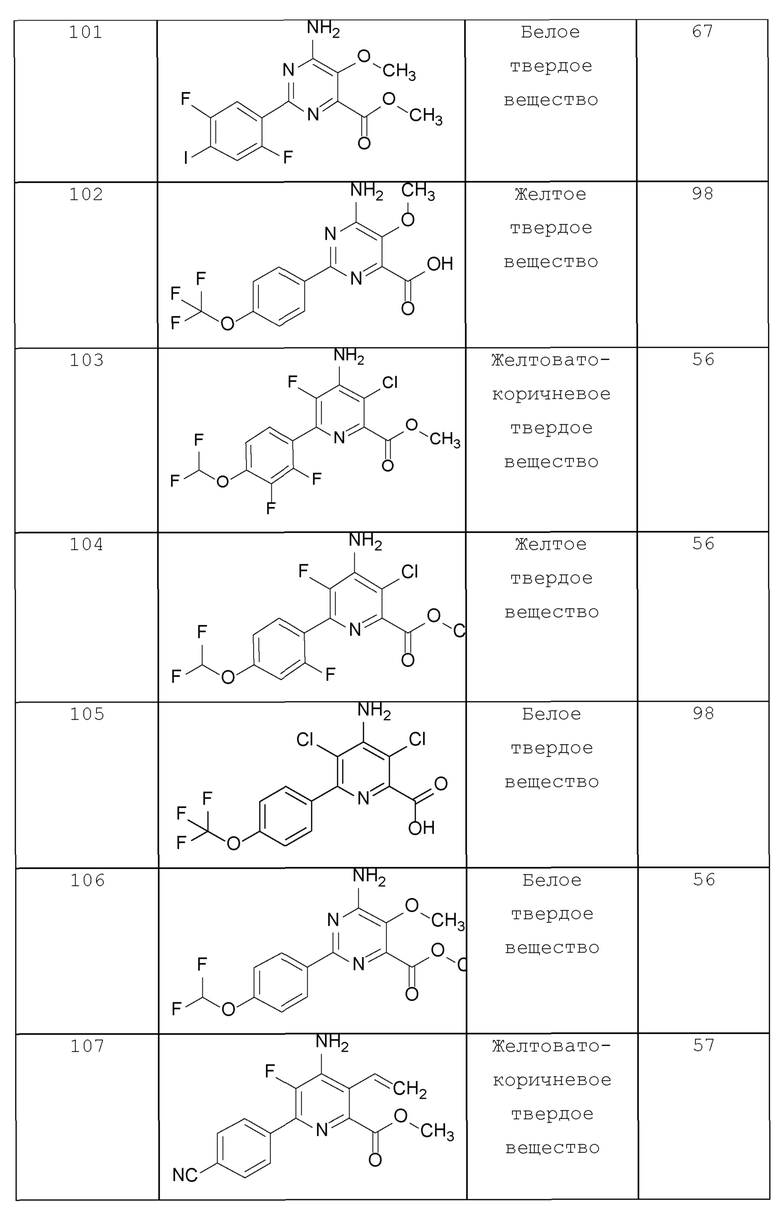
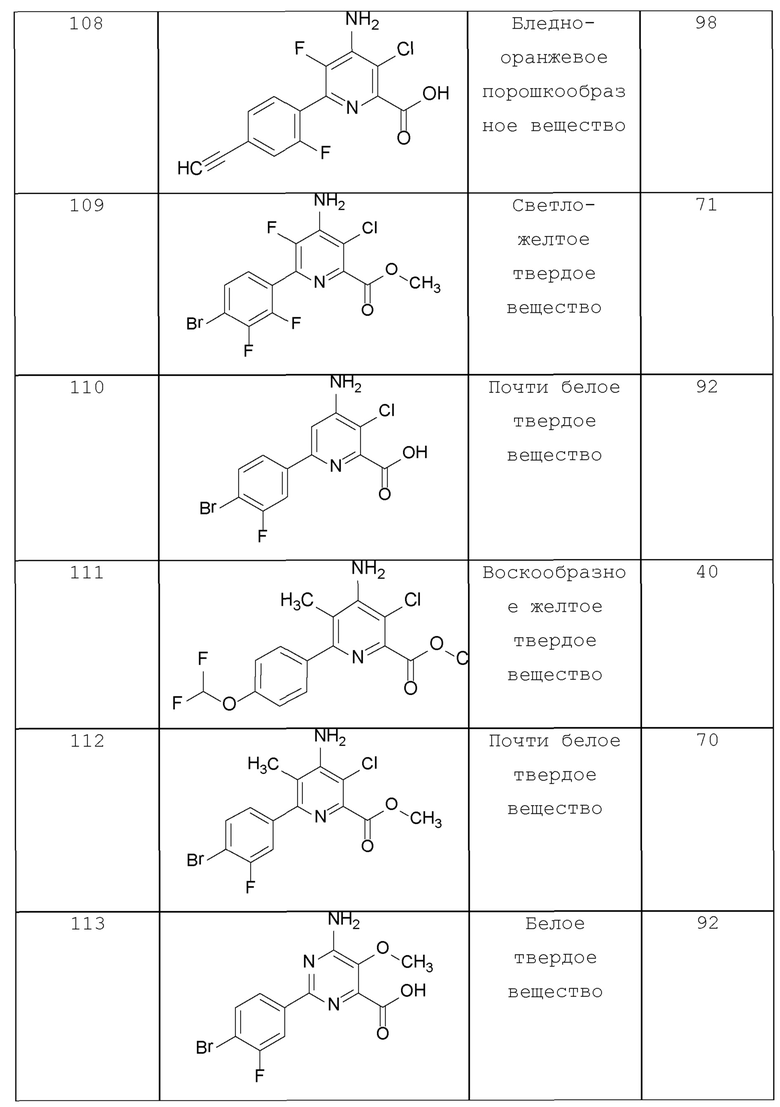
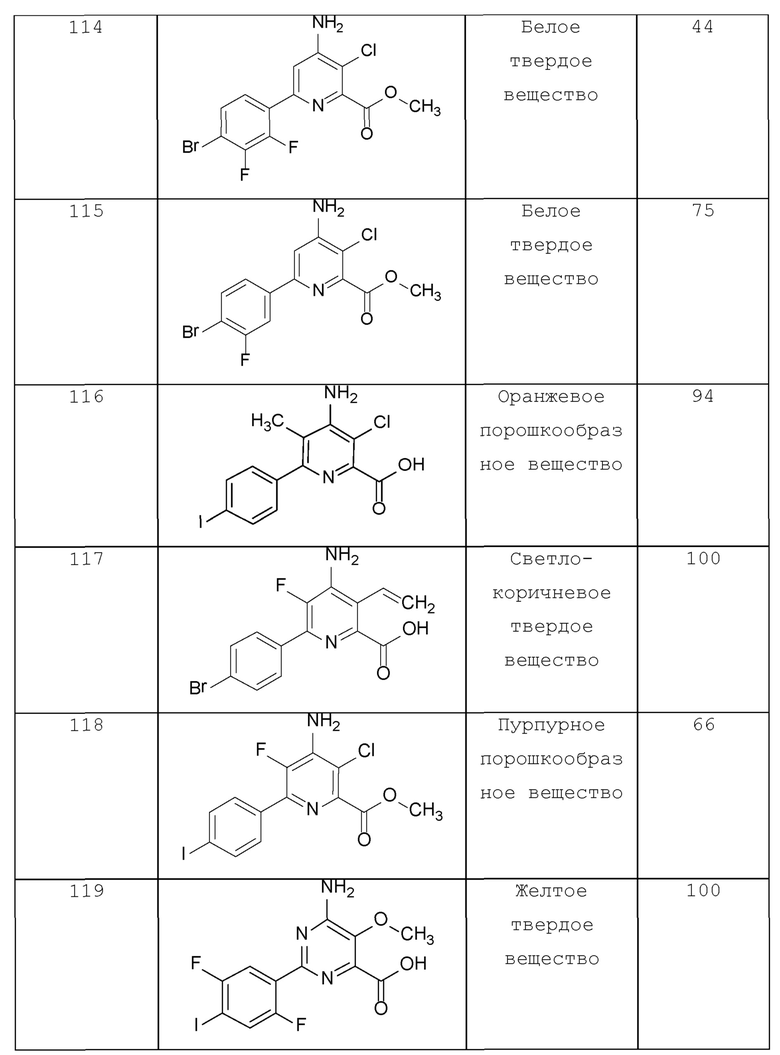
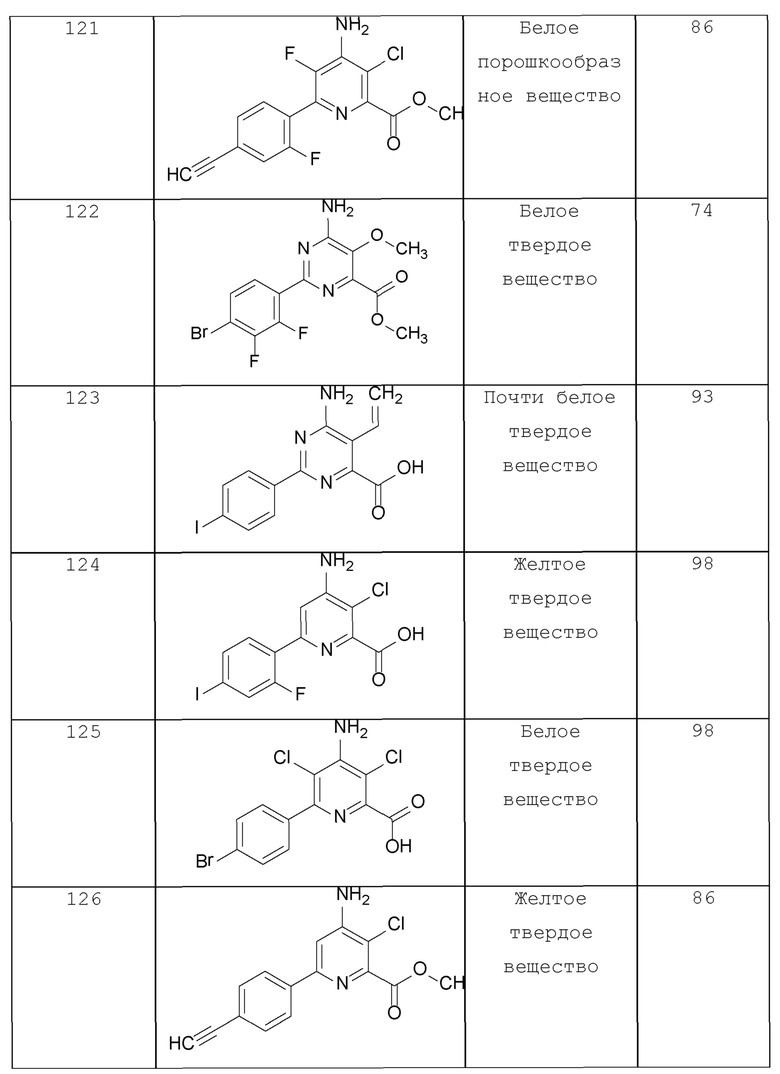
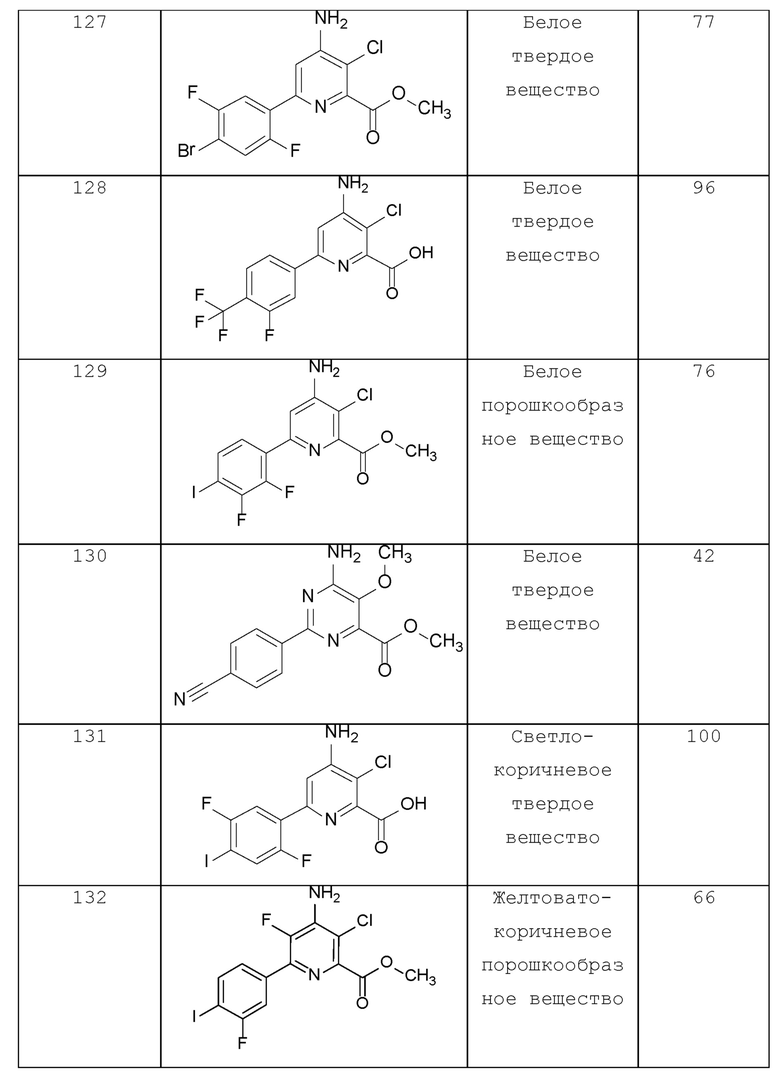
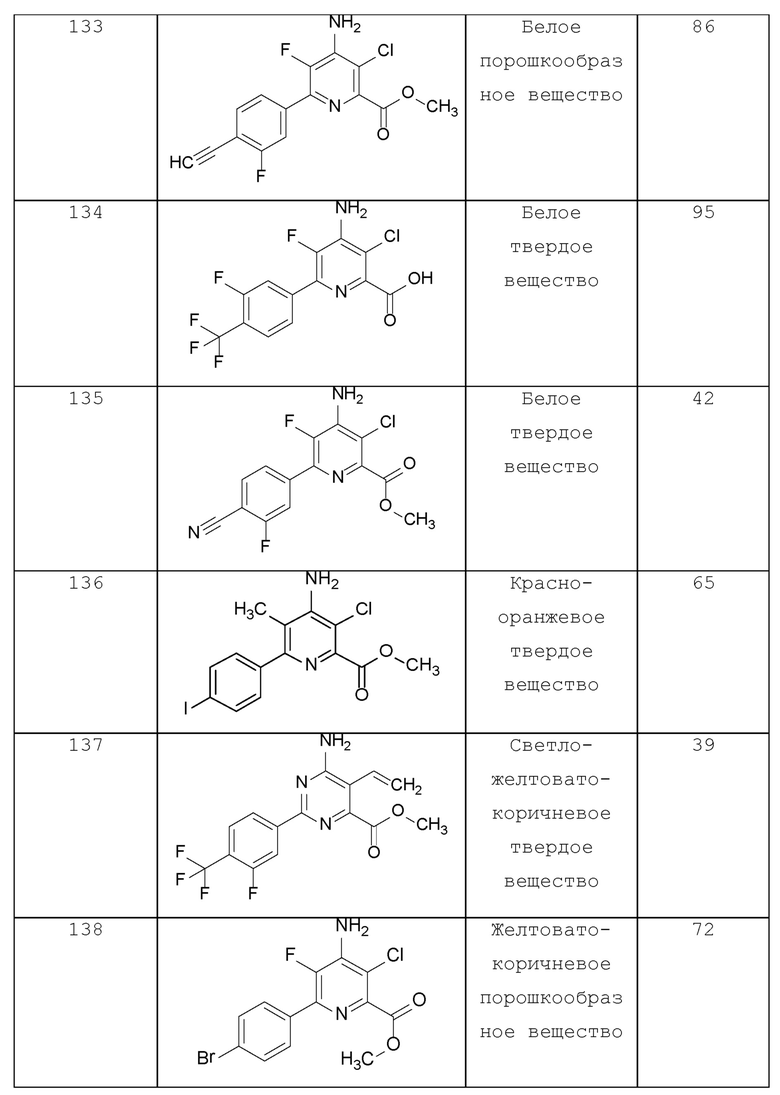
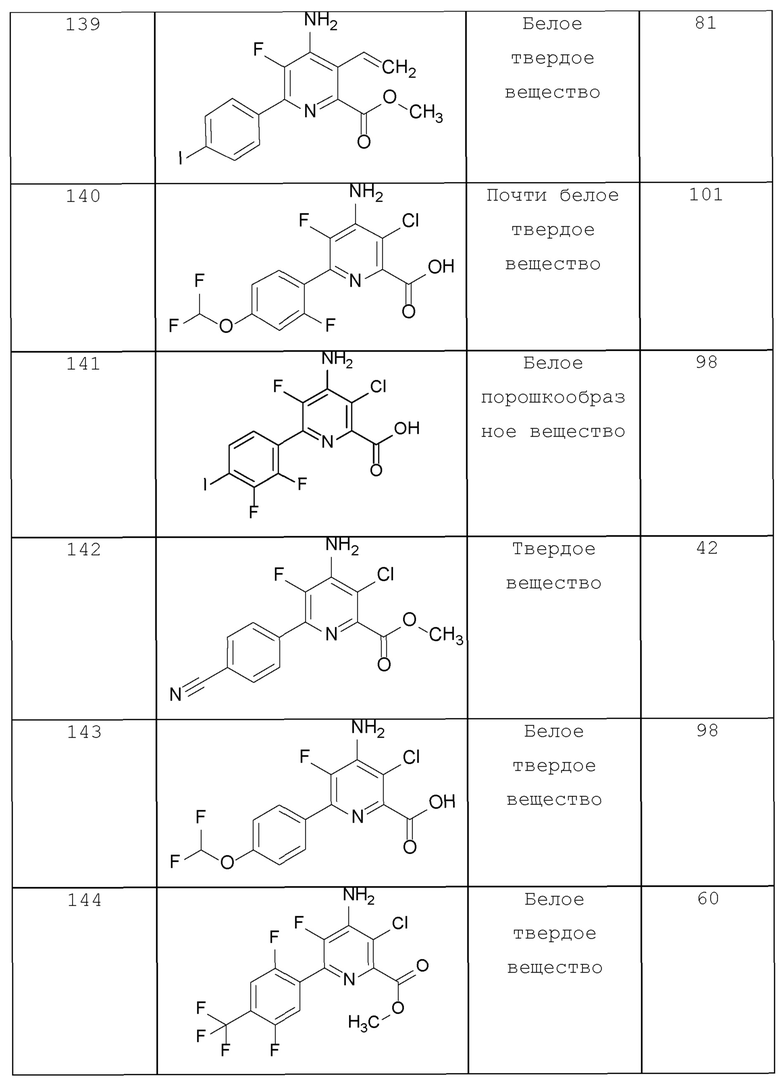
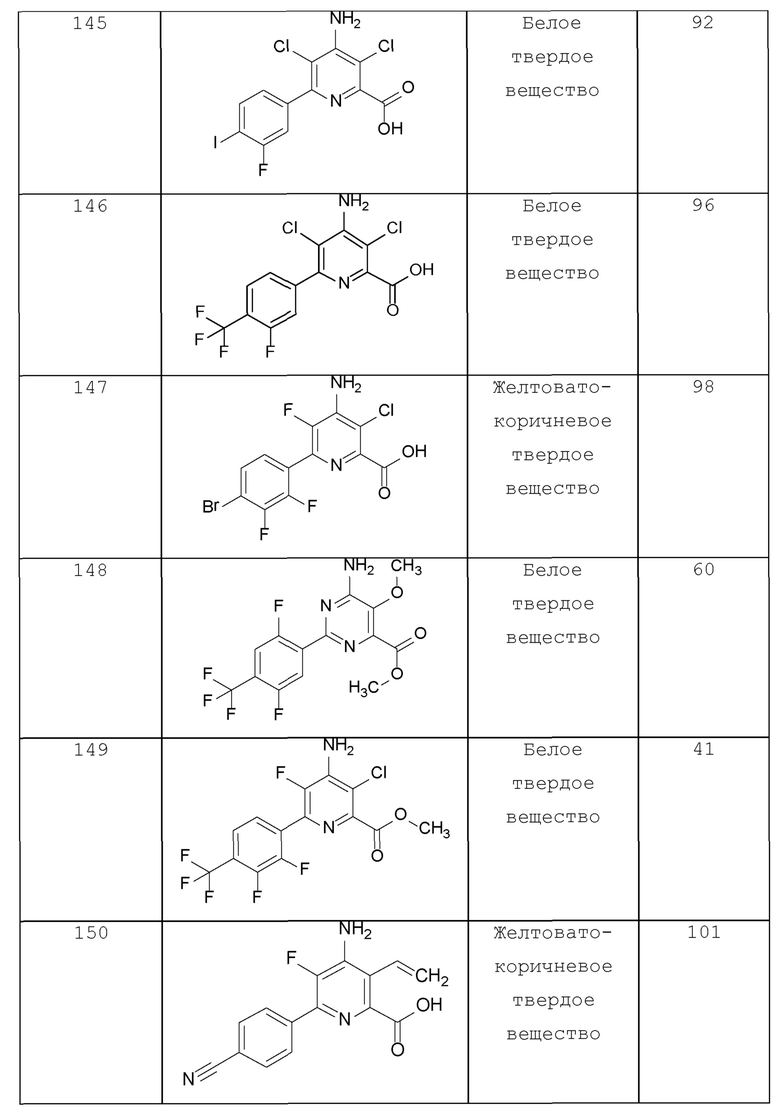
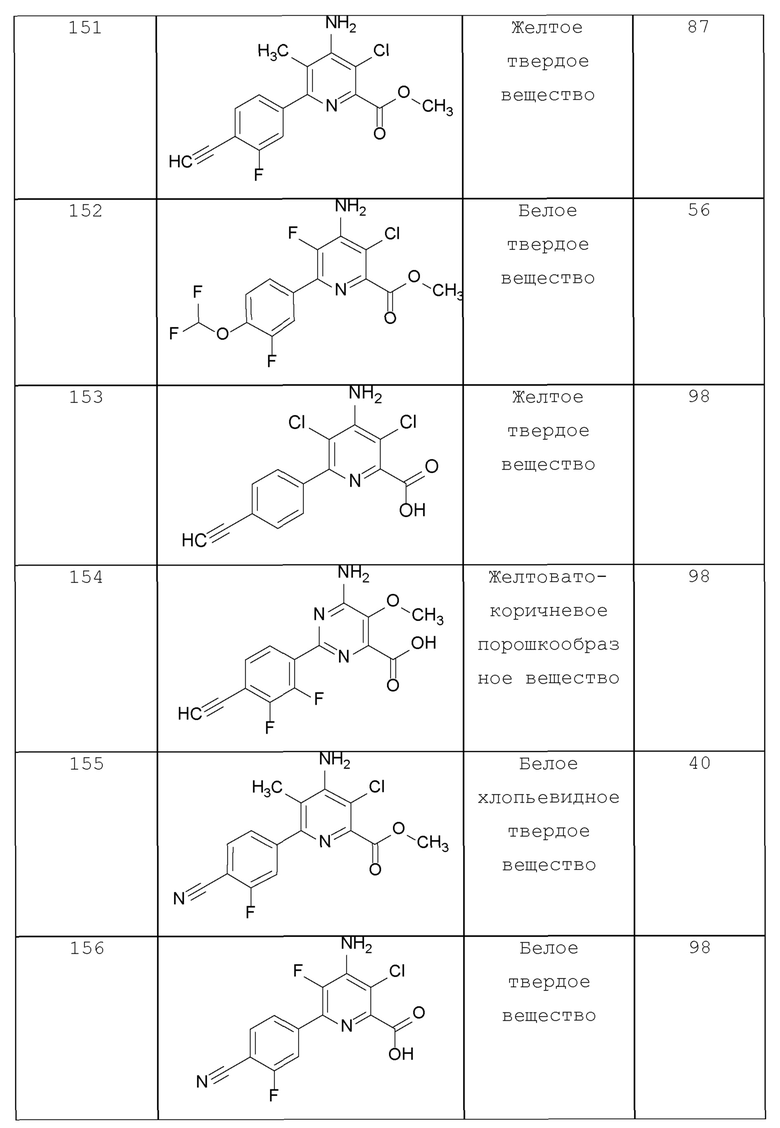

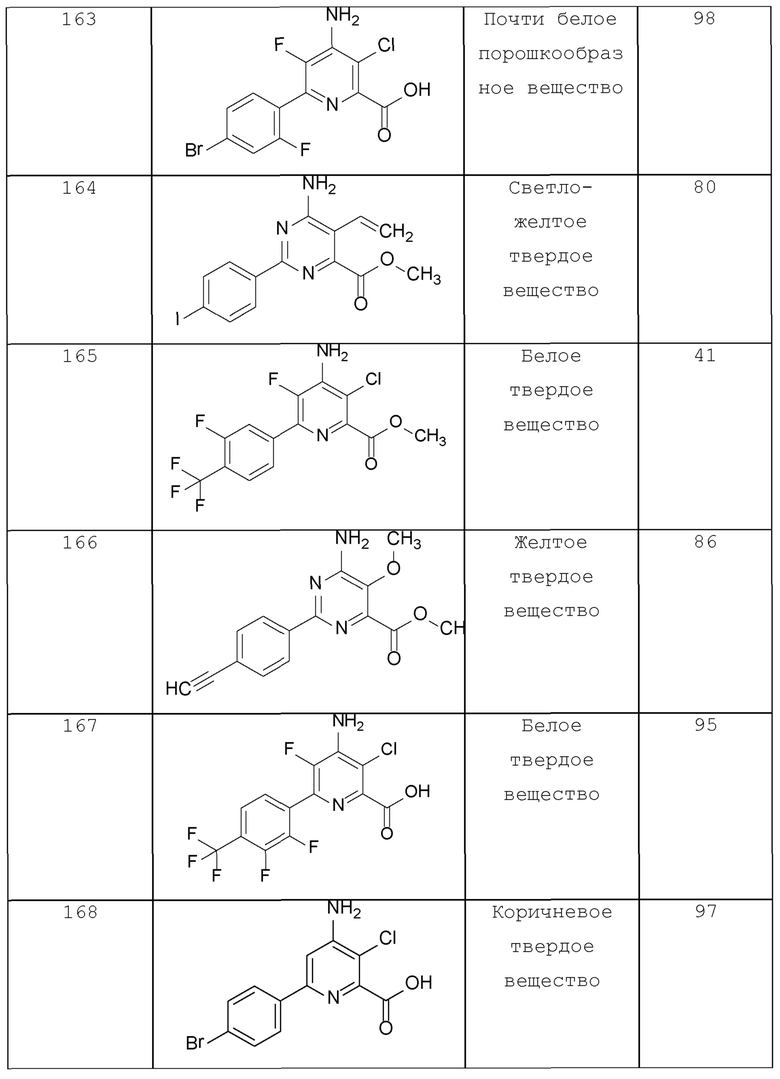
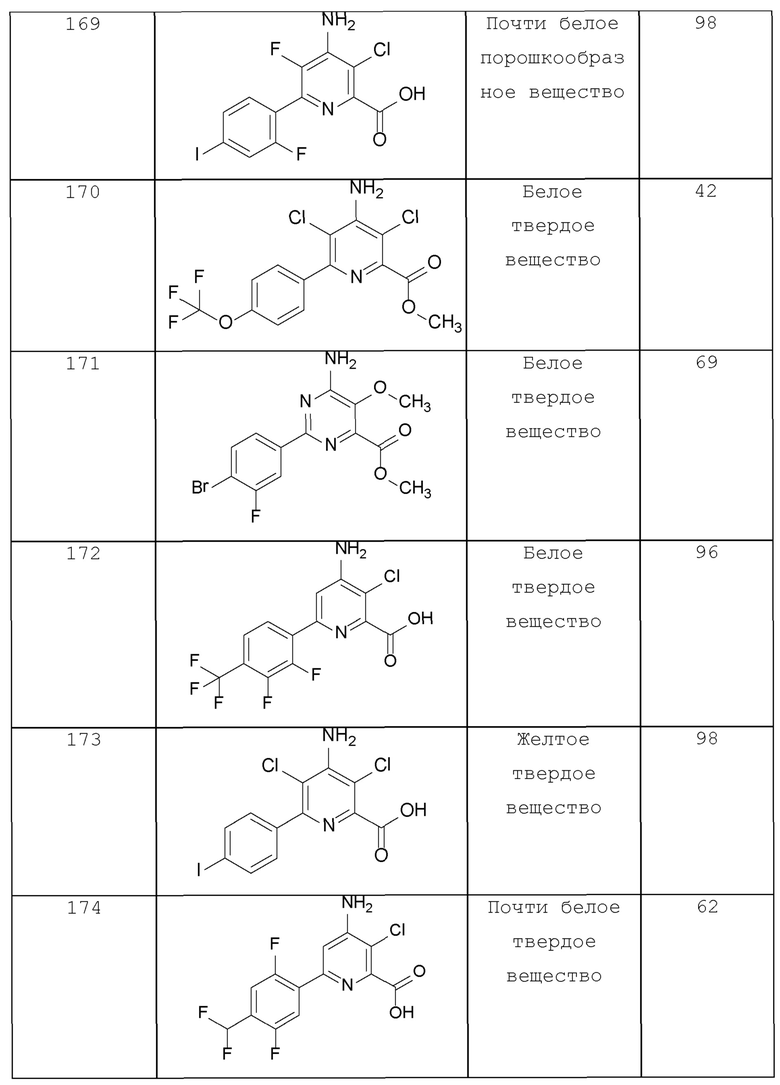
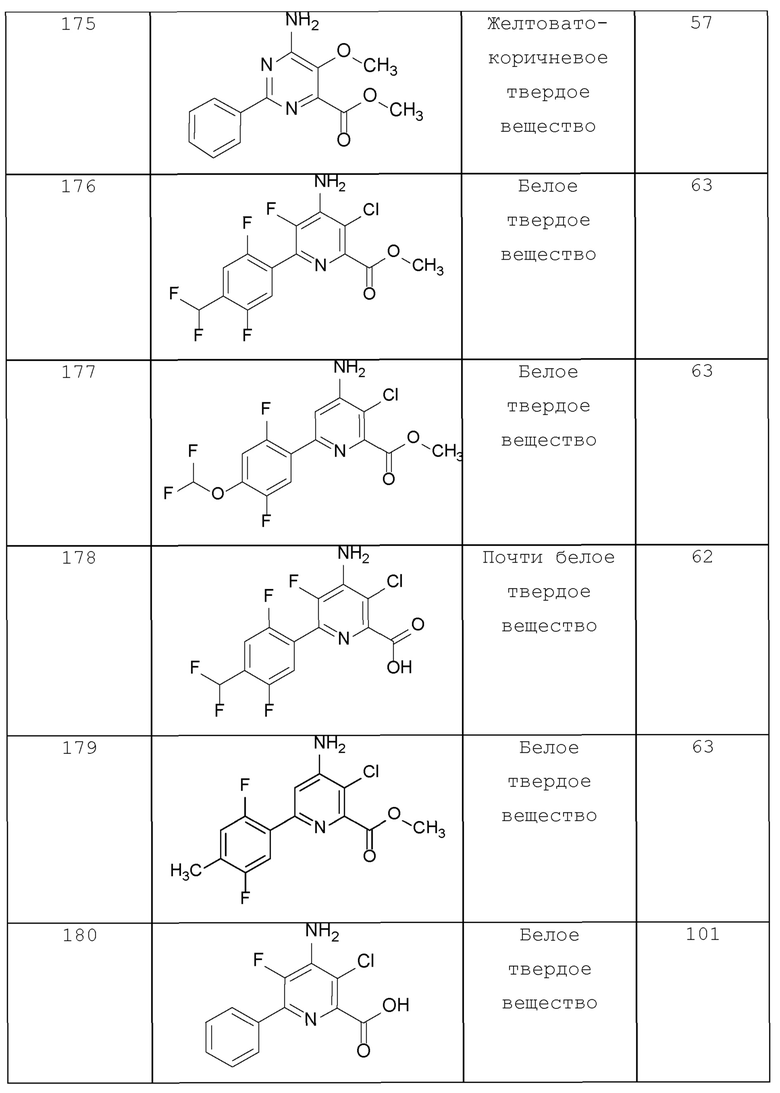
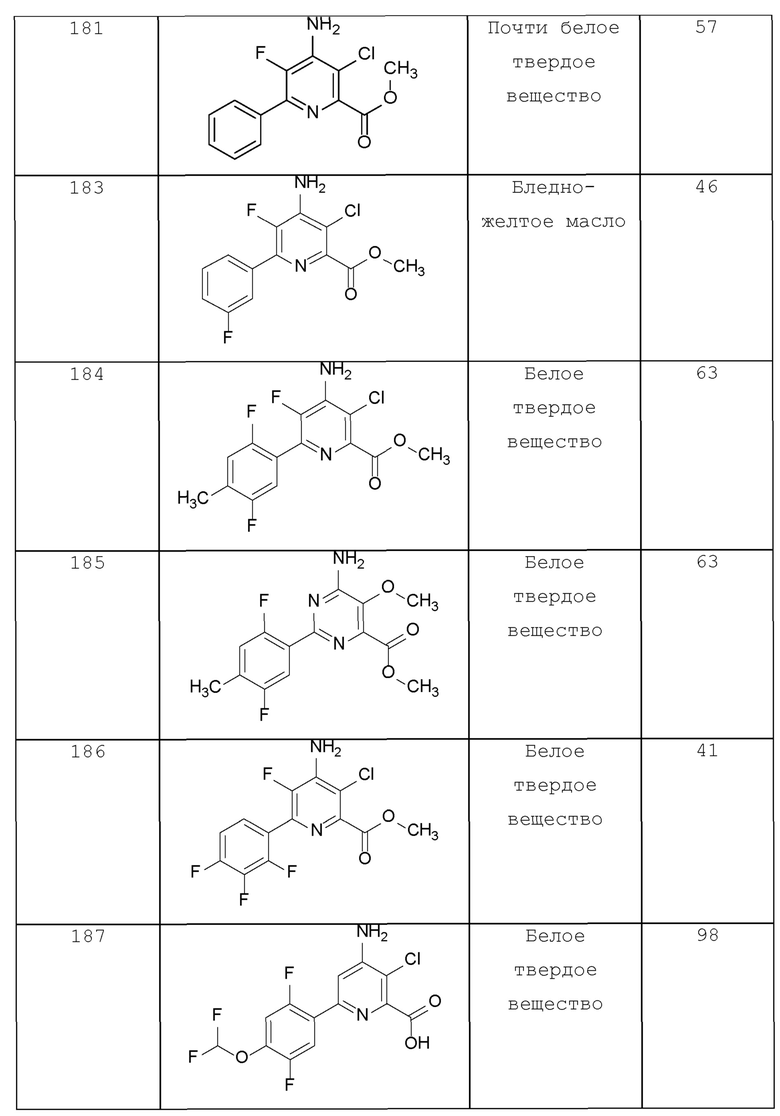
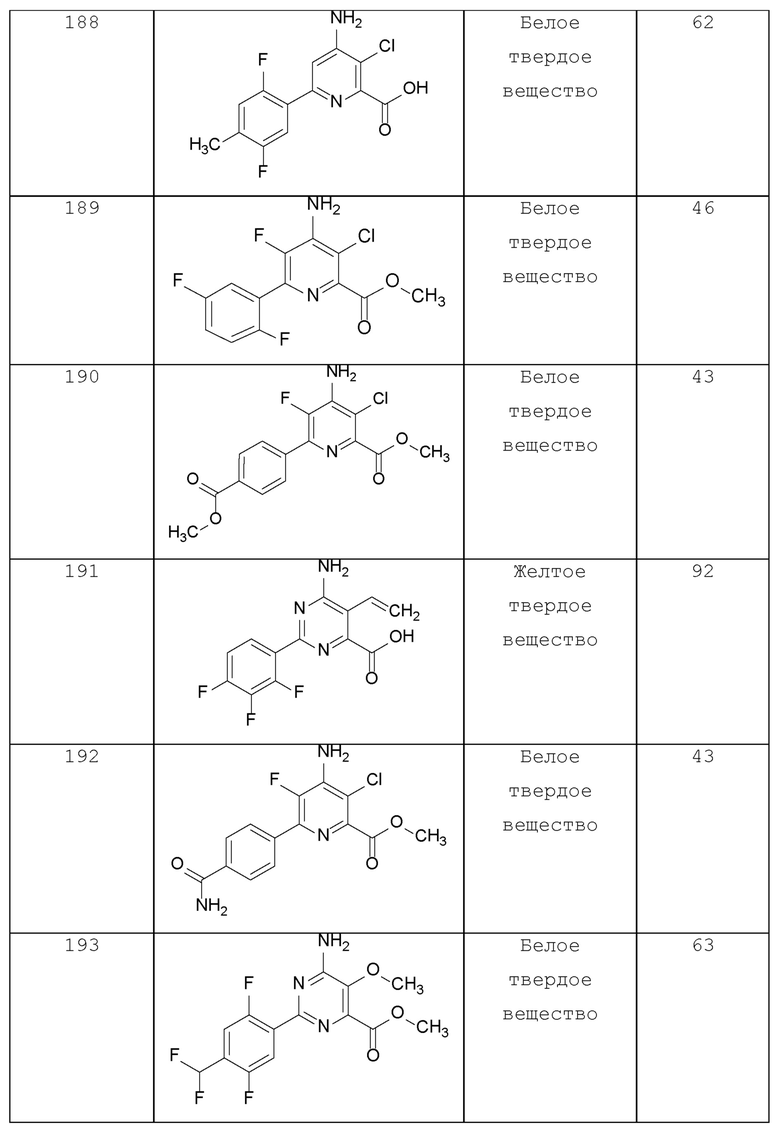
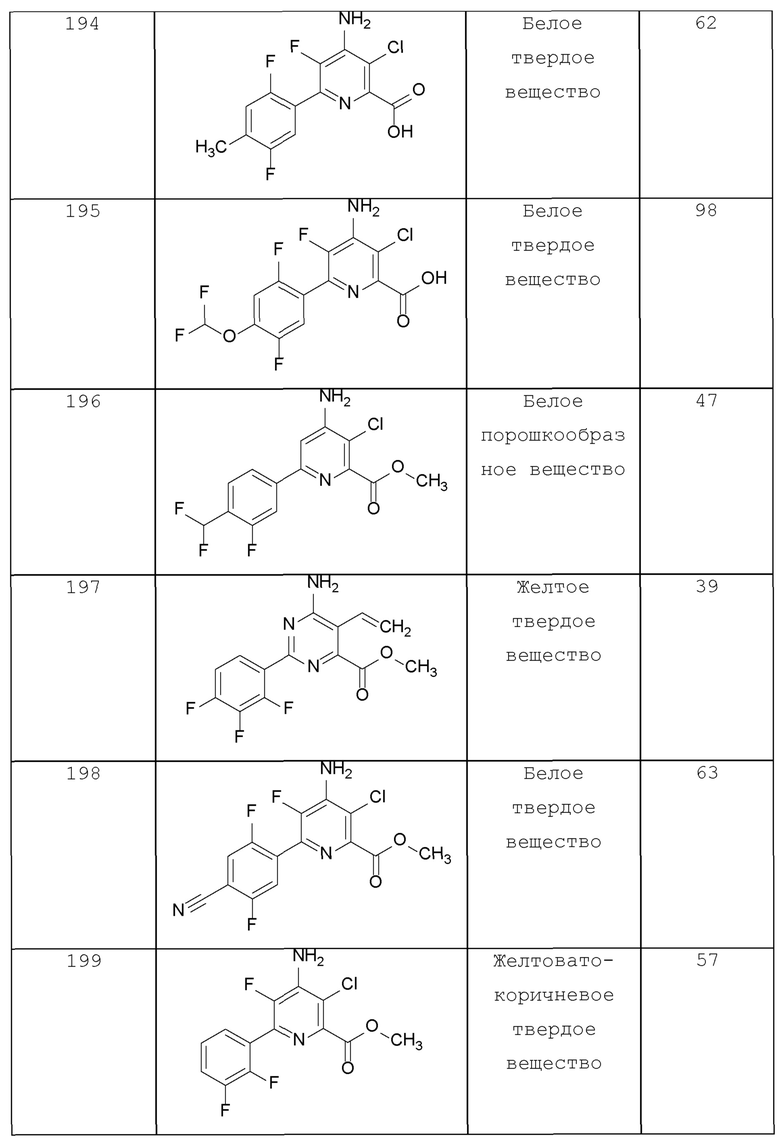
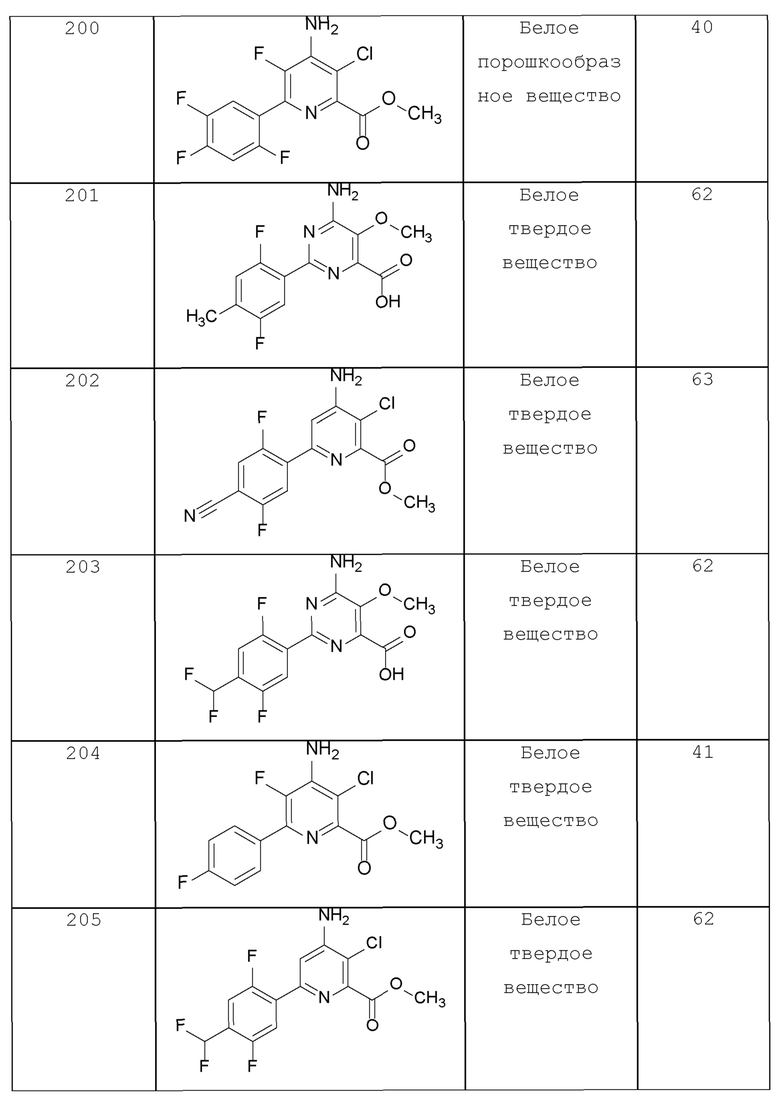
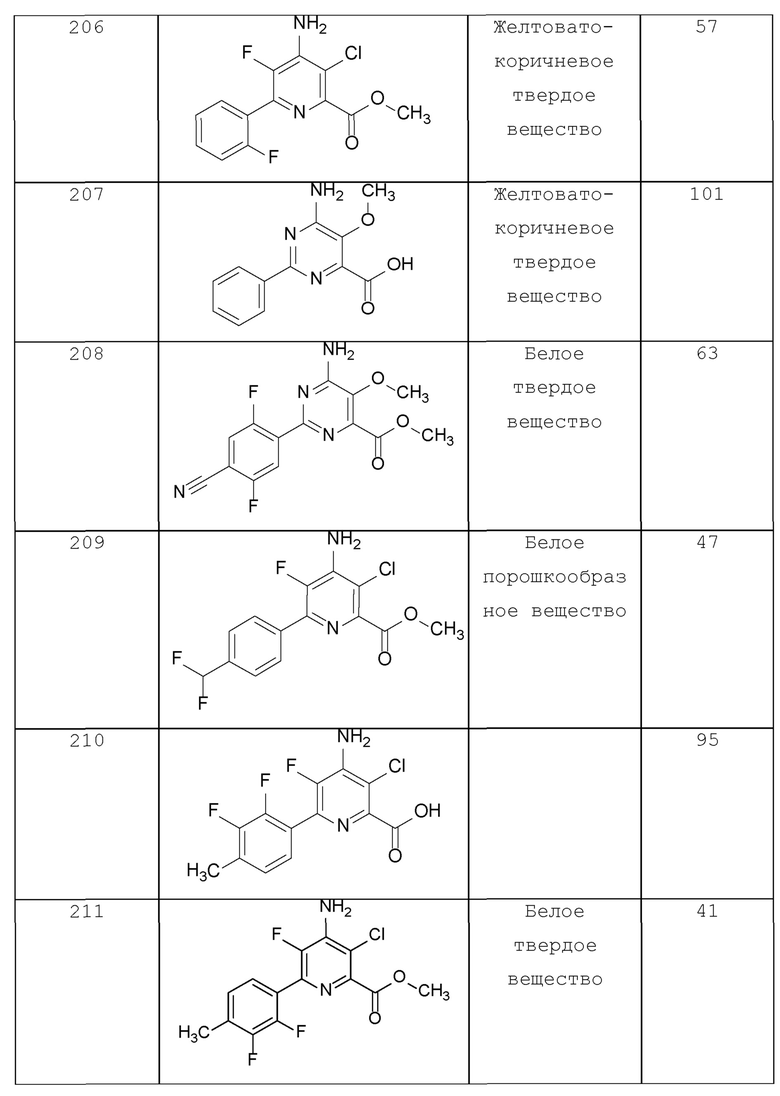
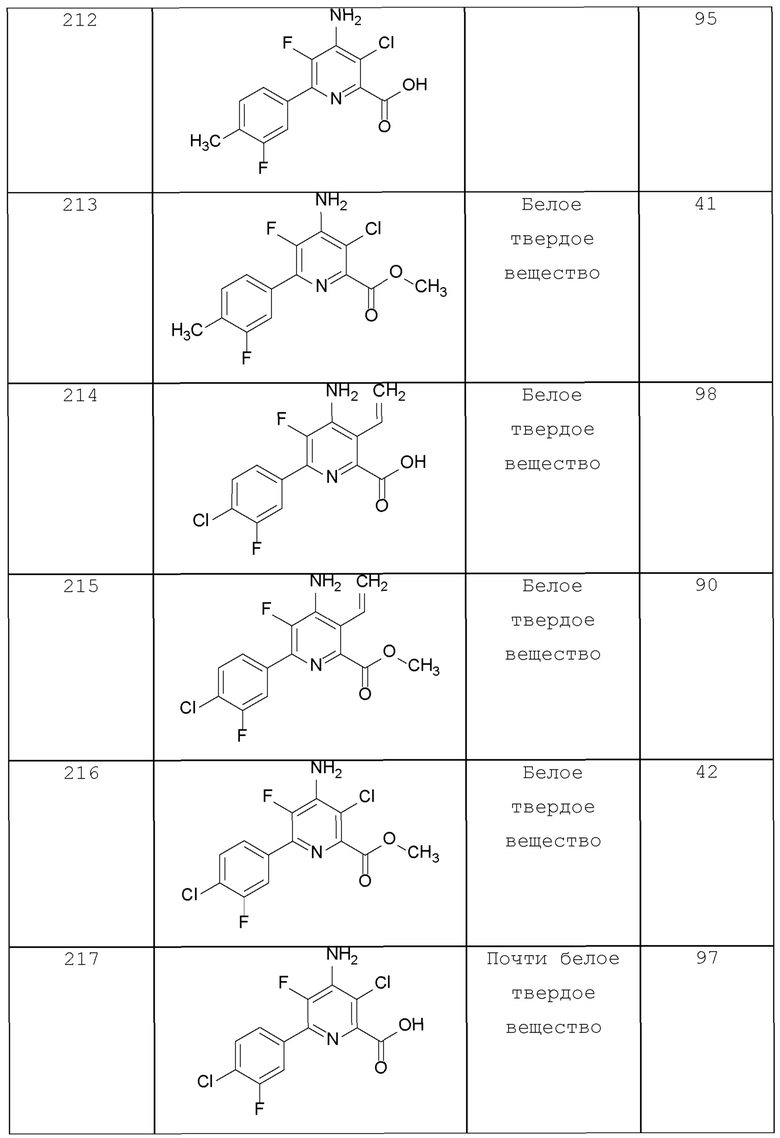
-59,9, -115,7,
-116,0
-61,3, -113,9
-141,43
см-1
-112,74, -112,78, -116,99, -117,03, -117,09, -117,13, -137,28, -137,38
-61,16, -61,20,
-135,77, -135,83, -135,86, -135,92, -138,61, -138,65, -138,67, -138,68, -138,70, -138,72, -138,74, -138,77, -140,73, -140,82.
-99,87, -99,91,
-117,70, -117,74, -117,80, -117,84, -137,25, -137,35.
-144,04
-59,9, -115,6,
-116,3
([M+H]+1)
-143,86
-61,22, -61,25,
-135,48, -135,54, -135,57, -135,62, -137,62, -137,66, -137,68, -137,69, -137,71, -137,73, -137,75, -137,78, -137,87, -137,95
-116,7
([M-H]+)
-99,15, -99,20,
-117,70, -117,74, -117,79, -117,83, -134,64, -134,71
-61,69, -61,73,
-119,19, -119,22, -119,24, -119,27, -120,01, -120,06
-93,62
([M-H]-)
-61,37, -61,41,
-114,17, -114,20, -114,24, -114,27, -143,61
([M-H]-)
([M-H]-)
-99,80, -99,84,
-116,84, -116,89
-100,82, -100,86, -118,25, -118,29
-143,64
([M-H]-)
([M-H]-)
-80,81
-107,04
([M-H]-)
-129,82 (с), -129,88 (с), -135,73 (с), -135,79 (с)
([M-H]-)
-112,80, -112,84, -119,98, -120,02
-60,0, -114,7,
-116,5
-143,98
см-1
-61,82, -61,85,
-116,72, -116,76, -116,81, -116,86, -119,30, -119,33, -119,35, -119,38, -137,15, -137,24
-116,6
([M-H]-)
-61,73, -61,76,
-117,59, -117,64, -120,18, -120,21, -120,23, -120,26
-140,74
-110,01
([M-H]-)
см-1
([M-H]+)
-61,4, -113,3
([M-H]-)
-161,04 (т, J=21,3 Гц)
-161,04 (т, J=21,3 Гц)
-111,33, -111,38, -115,73, -115,77, -115,83, -115,89, -136,82, -136,92
-114,6, -131,0,
-137,5, -142,0
-111,15, -119,08
b Все данные 1H ЯМР получали в CDCl3 при 400 МГц, если не указано иное.
Примеры гербицидной активности
Оценки гербицидной активности проводили визуально по шкале от 0 до 100 где 0 соответствовал отсутствию активности и 100 соответствовали полной гибели растения. Данные представлены так, как указано в таблице A.
Пример A. Исследование послевсходовой гербицидной активности
Послевсходовое исследование I: Семена исследуемых видов приобретали у частных поставщиков и высевали в круглый горшок диаметром 13 сантиметров (см), содержащий не включающую почву смешанные среды (Metro-Mix 360®, Sun Gro Horticulture). Семена для послевсходового исследования высевали за 8-12 дней до нанесения средства для обработки и выращивали в теплице, снабженной дополнительными источниками освещения, создающими световой день продолжительностью 16 часов (ч) при 24-29°C. Для всех горшков проводили поверхностное орошение.
Отвешенное количество, определяющееся наибольшей исследуемой нормой расхода, каждого соединения растворяли в 1,3 мл смеси ацетон-диметилсульфоксид (ДМСО; 97:3 (об./об.)) и разбавляли с помощью 4,1 мл концентрата вода-изопропанол-растительное масло (78:20:2, об./об./об.), содержащего 0,02% Triton X-155, и получали концентрированные исходные растворы. Растворы для других норм расхода получали серийным разведением раствора для наибольшей нормы расхода раствором, содержащим необходимый объем 97:3 об./об. смеси ацетона и ДМСО и соответствующего объема смеси воды, изопропилового спирта, концентрата растительного масла (78:20:2, об./об./об.), содержащей 0,02% Triton X-155.
Приготовленные соединения наносили с помощью опрыскивателя DeVilbiss®, работающего на сжатом воздухе под давлением 2-4 фунта на квадратный дюйм (фунт/дюйм2). После обработки горшки возвращали в теплицу на время проведения эксперимента. Во всех горшках проводили подпочвенное орошение, требующееся для обеспечения оптимальных условий роста. Во все горшки с помощью подпочвенного орошения один раз в неделю вносили удобрение Peters Peat-Lite Special® (20-10-20).
Оценки фитотоксичности проводили через 10 дней после послевсходовой обработки. Все оценки проводили визуально по шкале от 0 до 100 где 0 соответствовал отсутствию активности и 100 соответствовали полной гибели растения и данные представлены так, как указано в таблице A.
Описание некоторых исследованных соединений, использованные нормы расхода, виды исследованных растений и результаты приведены в таблице 3.
га)
AVEFA: овсюг (Avena fatua)
ECHCG: просо куриное (Echinochloa crus-galli)
HELAN: подсолнечник (Helianthus annuus)
IPOHE: ипомея плющевидная (Ipomoea hederecea)
SETFA: щетинник Фабера (Setaria faberi)
кг АИ/га: килограммов активного ингредиента на гектар
НИ: не исследовали
Пример B. Исследование довсходовой гербицидной активности
Довсходовое исследование I: Семена исследуемых видов высевали в круглые пластмассовые горшки (диаметром 5 дюймов), содержащие супесчаную почву. После высевания во всех горшках проводили подпочвенное орошение за 16 ч до нанесения соединения.
Соединения растворяли в 97:3 об./об. смеси ацетона и ДМСО и разбавляли до соответствующей конечной концентрации раствором, содержащим воду, ацетон, изопропанол, ДМСО и Agri-dex (концентрат растительного масла) в соотношении 59:23:15:1,0:1,5 об./об. и содержащим 0,02% масс./об. (масса/объем) Triton X-155 и получали раствор для опрыскивания для наибольшей нормы расхода. Растворы для других норм расхода получали серийным разведением раствора для наибольшей нормы расхода указанным выше раствором для нанесения.
Приготовленные соединения (2,7 мл) пипеткой равномерно наносили на почву и затем вводили в почву водой (15 мл). После обработки горшки возвращали в теплицу на время проведения эксперимента. Теплица была запрограммирована на световой день продолжительностью примерно 15 ч и температуру поддерживали равной примерно 23-29°C днем и 22-28°C ночью. Удобрения и воду регулярно добавляли с помощью поверхностного орошения и при необходимости обеспечивали дополнительное верхнее освещение металлгалогенидными лампами мощностью 1000 Вт.
Оценки гербицидного воздействия проводили через 14 дней после обработки. Все оценки проводили при сопоставлении с соответствующими контролями по шкале от 0 до 100 где 0 означает отсутствие гербицидного воздействия и 100 означает гибель растения или отсутствие всходов из почвы и данные представлены так, как указано в таблице A. Описание некоторых исследованных соединений, использованные нормы расхода, виды исследованных растений и результаты приведены в таблице 4.
AVEFA: овсюг (Avena fatua)
ECHCG: просо куриное (Echinochloa crus-galli)
HELAN: подсолнечник (Helianthus annuus)
IPOHE: ипомея плющевидная (Ipomoea hederecea)
SETFA: щетинник Фабера (Setaria faberi)
кг АИ/га: килограммов активного ингредиента на гектар
НИ: не исследовали
Пример C. Исследование послевсходовой гербицидной активности
Послевсходовое исследование II: Семена или орешки исследуемых видов растений высевали в смесь для выращивания Sun Gro Metro-Mix® 360, которая обычно обладала значением pH, равным от 6,0 до 6,8, и содержанием органических веществ, равным примерно 30%, в пластмассовые горшки, обладающие площадью поверхности, равной 64 квадратных сантиметров. При необходимости для обеспечения хорошего прорастания и образования здоровых растений проводили обработку фунгицидом и/или другую химическую или физическую обработку. Растения выращивали в течение 7-21 дня в теплице при продолжительности светового дня, равной примерно 15 ч, и температуру поддерживали равной примерно 23-29°C днем и 22-28°C ночью. Регулярно добавляли удобрения и воду и при необходимости обеспечивали дополнительное верхнее освещение металлгалогенидными лампами мощностью 1000 Вт. Растения использовали для исследования, когда они достигали стадии первого или второго настоящего листа.
Отвешенное количество, определяющееся наибольшей исследуемой нормой расхода, каждого исследуемого соединения помещали в стеклянный сосуд объемом 25 мл и растворяли в 4 мл смеси 97:3 об./об. ацетона и ДМСО и получали концентрированные исходные растворы. Если исследуемое соединение плохо растворялось, то смесь нагревали и/или обрабатывали ультразвуком. Полученные концентрированные исходные растворы разбавляли с помощью 20 мл водной смеси, содержащей ацетон, воду, изопропиловый спирт, ДМСО, концентрат растительного масла Atplus 411F и поверхностно-активное вещество Triton® X-155 в соотношении 48,5:39:10:1,5:1,0:0,02 об./об., и получали растворы для опрыскивания для наибольших норм расхода. Растворы для других норм расхода получали серийным разведением 12 мл раствора для наибольшей нормы расхода раствором, содержащим 2 мл смеси 97:3 об./об. ацетона и ДМСО и 10 мл водной смеси, содержащей ацетон, воду, изопропиловый спирт, ДМСО, концентрат растительного масла Atplus 411F и поверхностно-активное вещество Triton X-155 в соотношении 48,5:39:10:1,5:1,0:0,02 об./об. и получали 1/2×, 1/4×, 1/8× и 1/16× разведения раствора для наибольшей нормы расхода. Количества соединений определяли для наносимого объема, равного 12 мл, при норме расхода, равной 187 литров на гектар (л/га). Готовые соединения наносили на растительный материал с помощью самоходного опрыскивателя с нисходящей струей Mandel, снабженного соплами 8002E, калиброванными для выдачи 187 л/га на площади, равной 0,503 квадратного метра (м2) при высоте опрыскивания, равной 18 дюймов (43 см) над средней высотой растительного покрова. Контрольные растения таким же образом опрыскивали чистым растворителем.
Обработанные растения и контрольные растения помещали в теплицу, как описано выше, и поливали с помощью подпочвенного орошения для предупреждения вымывания исследуемых соединений. Через 14 дней состояние исследуемых растений визуально сопоставляли с состояниями необработанных растений и проводили оценку по шкале от 0 до 100%, где 0 соответствует отсутствию повреждения и 100 соответствует полному уничтожению, и данные представлены так, как указано в таблице A. Описание некоторых исследованных соединений, использованные нормы расхода, виды исследованных растений и результаты приведены в таблице 5.
га)
AMARE: амарант метельчатый (Amaranthus retroflexus)
BRSNN: масличный рапс, канола (Brassica napus)
CHEAL: марь белая (Chenopodium album)
EPHHL: молочай разнолистный (Euphorbia heterophylla)
HELAN: подсолнечник (Helianthus annuus)
VIOTR: фиалка трехцветная (Viola tricolor)
г АИ/га: граммов активного ингредиента на гектар
НИ: не исследовали
га)
CYPES: сыть съедобная (Cyperus esculentus)
DIGSA: росичка (Digitaria sanguinalis)
ORYSA: рис (Oryza sativa)
SETFA: щетинник Фабера (Setaria faberi)
SORVU: джонсонова трава (Sorghum vulgare)
TRZAS: пшеница яровая (Triticum aestivum)
ZEAMX: маис, кукуруза (Zea mays)
г АИ/га: граммов активного ингредиента на гектар
НИ: не исследовали
Пример D. Исследование послевсходовой гербицидной активности в пшенице и ячмене
Послевсходовое исследование III. Семена необходимых исследуемых видов растений высевали в смесь для выращивания Sun Gro MetroMix® 306, которая обычно обладала значением pH, равным от 6,0 до 6,8, и содержанием органических веществ, равным примерно 30%, в пластмассовые горшки, обладающие площадью поверхности, равной 103,2 квадратных сантиметров (см2). При необходимости для обеспечения хорошего прорастания и образования здоровых растений проводили обработку фунгицидом и/или другую химическую или физическую обработку. Растения выращивали в течение 7-36 дней в теплице при продолжительности светового дня, равной примерно 14 ч, и температуру поддерживали равной примерно 18°C днем и 17°C ночью. Регулярно добавляли удобрения и воду и при необходимости обеспечивали дополнительное верхнее освещение металлгалогенидными лампами мощностью 1000 Вт. Растения использовали для исследования, когда они достигали стадии второго или третьего настоящего листа.
Отвешенное количество, определяющееся наибольшей исследуемой нормой расхода, каждого исследуемого соединения помещали в стеклянный сосуд объемом 25 мл и растворяли в 4 мл смеси 97:3 об./об. ацетона и ДМСО и получали концентрированные исходные растворы. Если исследуемое соединение плохо растворялось, то смесь нагревали и/или обрабатывали ультразвуком. Полученные концентрированные исходные растворы разбавляли с помощью 20 мл водной смеси, содержащей ацетон, воду, изопропиловый спирт, ДМСО, концентрат растительного масла Agri-Dex и поверхностно-активное вещество X-77 в соотношении 48:39:10:1,5:1,5:0,02 об./об., и получали растворы для опрыскивания для наибольших норм расхода. Растворы для других норм расхода получали серийным разведением 12 мл раствора для наибольшей нормы расхода раствором, содержащим 2 мл смеси 97:3 об./об. ацетона и ДМСО и 10 мл водной смеси, содержащей ацетон, воду, изопропиловый спирт, ДМСО, концентрат растительного масла Agri-Dex и поверхностно-активное вещество X-77 в соотношении 48:39:10:1,5:1,5:0,02 об./об. и получали 1/2×, 1/4×, 1/8× и 1/16× разведения раствора для наибольшей нормы расхода. Количества соединений определяли для наносимого объема, равного 12 мл, при норме расхода, равной 187 литров на гектар (л/га). Готовые соединения наносили на растительный материал с помощью самоходного опрыскивателя с нисходящей струей Mandel, снабженного соплами 8002E, калиброванными для выдачи 187 л/га на площади, равной 0,503 квадратного метра (м2) при высоте опрыскивания, равной 18 дюймов (43 см) над средней высотой растительного покрова. Контрольные растения таким же образом опрыскивали чистым растворителем.
Обработанные растения и контрольные растения помещали в теплицу, как описано выше, и поливали с помощью подпочвенного орошения для предупреждения вымывания исследуемых соединений. Через 21 день состояние исследуемых растений визуально сопоставляли с состояниями необработанных растений и проводили оценку по шкале от 0 до 100%, где 0 соответствует отсутствию повреждения и 100 соответствует полному уничтожению, и данные представлены так, как указано в таблице A.
С помощью популярного пробит-анализа, описанного в публикациях J. Berkson in Journal of the American Statistical Society, 48, 565 (1953) и D. Finney in "Probit Analysis" Cambridge University Press (1952), вызванное гербицидом повреждение для конкретного соединения при разных нормах расхода можно использовать для расчета значений GR20, GR50, GR80 и GR90, которые определены, как коэффициенты уменьшения роста, которые соответствуют эффективной норме расхода необходимого гербицида для обеспечения уменьшения роста растения (GR), составляющего 20%, 50%, 80% и 90% соответственно. Пробит-анализ применяли для данных, полученных при использовании разных доз отдельных соединений, по методикам, описанным в приведенных ниже примерах. Данные для некоторых из норм расхода и анализ для всех норм расхода представлены в приведенных ниже таблицах.
Описание некоторых исследованных соединений, использованные нормы расхода, виды исследованных растений и результаты приведены в таблицах 7-11.
га)
га)
нение №
APESV: метлица обыкновенная (Apera spica-venti)
BROTE: костер кровельный (Bromus tectorum)
HORSS: ячмень, включая яровой и озимый (Hordeum vulgare)
TRZSS: пшеница, включая яровую и озимую (Triticum aestivum)
LOLSS: плевел, включая райграсс итальянский (Lolium multiflorum), плевел жесткий (Lolium rigidum), райграс однолетний (Lolium multiflorum subsp. Gaudini)
PHAMI: канареечник малый (Phalaris minor)
SETVI: зеленый щетинник (Setaria viridis)
KCHSC: кохия (Kochia scoparia)
LAMSS: включая яснотку пурпурную (Lamium purpureum) и яснотку стеблеобъемлющую (Lamium amplexicaule)
GALAP: подмаренник цепкий (Galium aparine)
VERPE: вероника персидская (veronica persica)
PAPRH: мак самосейка (Papaver rhoeas)
SASKR: солянка сорная (Salsola iberica)
CIRAR: бодяк полевой (Cirsium arvense)
VIOSS: фиалка трехцветная (Viola tricolor), фиалка полевая (Viola arvensis)
MATSS: ромашка аптечная (Matricaria chamomilla), ромашка пахучая (Matricaria matricarioides)
STEME: звездчатка средняя (Stellaria media).
г АИ/га: граммов активного ингредиента на гектар
НИ: не исследовали
GR20: Уменьшение роста растения на 20%
GR50: Уменьшение роста растения на 50%
GR80: Уменьшение роста растения на 80%
GR90: Уменьшение роста растения на 90%
Пример E. Исследование довсходовой гербицидной активности
Довсходовое исследование III. Семена исследуемых видов высевали в квадратные пластмассовые горшки (шириной 10 см), содержащие супесчаную почву. После высевания во всех горшках проводили подпочвенное орошение за 16 ч до нанесения соединения.
Отвешенное количество, определяющееся наибольшей исследуемой нормой расхода, каждого исследуемого соединения помещали в стеклянный сосуд объемом 25 мл и растворяли в 4 мл смеси 97:3 об./об. ацетона и ДМСО и получали концентрированные исходные растворы. Если исследуемое соединение плохо растворялось, то смесь нагревали и/или обрабатывали ультразвуком. Полученные концентрированные исходные растворы разбавляли с помощью 20 мл водной смеси, содержащей воду и 0,02% масс./об. (масса/объем) Triton X-155, и получали растворы для опрыскивания для наибольших норм расхода. Растворы для других норм расхода получали серийным разведением 12 мл раствора для наибольшей нормы расхода раствором, содержащим 2 мл смеси 97:3 об./об. ацетона и ДМСО и 10 мл водной смеси, содержащей воду и 0,02% масс./об. (масса/объем) Triton X-155, и получали 1/2×, 1/4×, 1/8× и 1/16× разведения раствора для наибольшей нормы расхода. Количества соединений определяли для наносимого объема, равного 12 мл, при норме расхода, равной 187 литров на гектар (л/га). Готовые соединения наносили на поверхность почвы с помощью самоходного опрыскивателя с нисходящей струей Mandel, снабженного соплами 8002E, калиброванными для выдачи 187 л/га на площади, равной 0,503 квадратного метра. Контрольные горшки таким же образом опрыскивали чистым растворителем.
Обработанные горшки и контрольные горшки помещали в теплицу, как описано выше, и поливали с помощью поверхностного орошения. Через 21 день состояние растений в исследуемых горшках визуально сопоставляли с состояниями растений в необработанных горшках и проводили оценку по шкале от 0 до 100%, где 0 означает отсутствие гербицидного воздействия и 100 означает гибель растения или отсутствие всходов из почвы, и данные представлены так, как указано в таблице A.
С помощью популярного пробит-анализа, описанного в публикациях J. Berkson in Journal of the American Statistical Society, 48, 565 (1953) и D. Finney in "Probit Analysis" Cambridge University Press (1952), вызванное гербицидом повреждение для конкретного соединения при разных нормах расхода можно использовать для расчета значений GR20, GR50, GR80 и GR90, которые определены, как коэффициенты уменьшения роста, которые соответствуют эффективной норме расхода необходимого гербицида для обеспечения уменьшения роста растения (GR), составляющего 20%, 50%, 80% и 90% соответственно. Пробит-анализ применяли для данных, полученных при использовании разных доз отдельных соединений, по методикам, описанным в приведенных ниже примерах. Данные для некоторых из норм расхода и анализ для всех норм расхода представлены в приведенных ниже таблицах.
Описание некоторых исследованных соединений, использованные нормы расхода, виды исследованных растений и результаты приведены в таблице 12.
LAMPU: яснотка пурпурная (Lamium purpureum)
LOLSS: плевел, включая райграсс итальянский (Lolium multiflorum), плевел жесткий (Lolium rigidum), райграс однолетний (Lolium multiflorum subsp. Gaudini)
SETVI: зеленый щетинник (Setaria viridis)
HORSS: ячмень, включая яровой и озимый (Hordeum vulgare)
TRZSS: пшеница, включая яровую и озимую (Triticum aestivum)
г АИ/га: граммов активного ингредиента на гектар
НИ: не исследовали
GR20: Уменьшение роста растения на 20%
GR50: Уменьшение роста растения на 50%
GR80: Уменьшение роста растения на 80%
GR90: Уменьшение роста растения на 90%
Пример F. Исследование послевсходовой гербицидной активности в посеянном семенами рисе
Семена или орешки исследуемых видов растений высевали в почвенную основу, полученную смешиванием суглинистой почвы (43% ила, 19% глины и 38% песка, обладающую значением pH, равным примерно 8,1, и содержанием органических веществ, равным примерно 1,5%) и речного песка в отношении 80:20. Почвенную основу помещали в пластмассовые горшки, обладающие площадью поверхности, равной 139,7 см2. При необходимости для обеспечения хорошего прорастания и образования здоровых растений проводили обработку фунгицидом и/или другую химическую или физическую обработку. Растения выращивали в течение 10-17 дней в теплице при продолжительности светового дня, равной примерно 14 ч, и температуру поддерживали равной примерно 29°C днем и 26°C ночью. Регулярно добавляли удобрения и воду и при необходимости обеспечивали дополнительное верхнее освещение металлгалогенидными лампами мощностью 1000 Вт. Растения использовали для исследования, когда они достигали стадии второго или третьего настоящего листа.
Отвешенное количество, определяющееся наибольшей исследуемой нормой расхода, каждого исследуемого соединения помещали в стеклянный сосуд объемом 25 мл и растворяли в объеме смеси 97:3 об./об. ацетон-ДМСО и получали 12× исходные растворы. Если исследуемое соединение плохо растворялось, то смесь нагревали и/или обрабатывали ультразвуком. Концентрированные исходные растворы добавляли к растворам для опрыскивания, так чтобы конечные концентрации ацетона и ДМСО равнялись 16,2% и 0,5% соответственно. Растворы для опрыскивания разбавляли до соответствующих конечных концентраций путем добавления 10 мл водной смеси, содержащей 1,5% (об./об.) концентрата растительного масла Agri-dex. Конечные растворы для опрыскивания содержали 1,25% (об./об.) концентрата растительного масла Agri-dex. Количества соединений определяли для наносимого объема, равного 12 мл, при норме расхода, равной 187 л/га. Готовые соединения наносили на растительный материал с помощью самоходного опрыскивателя с нисходящей струей Mandel, снабженного соплами 8002E, калиброванными для выдачи 187 л/га на площади, равной 0,503 квадратного метра (м2) при высоте опрыскивания, равной 18 дюймов (43 см) над средней высотой растительного покрова. Контрольные растения таким же образом опрыскивали чистым растворителем.
Обработанные растения и контрольные растения помещали в теплицу, как описано выше, и поливали с помощью подпочвенного орошения для предупреждения вымывания исследуемых соединений. Через 20-22 дня состояние исследуемых растений визуально сопоставляли с состояниями необработанных растений и проводили оценку по шкале от 0 до 100%, где 0 соответствует отсутствию повреждения и 100 соответствует полному уничтожению, и данные представлены так, как указано в таблице A.
С помощью популярного пробит-анализа, описанного в публикациях J. Berkson in Journal of the American Statistical Society, 48, 565 (1953) и D. Finney in "Probit Analysis" Cambridge University Press (1952), вызванное гербицидом повреждение для конкретного соединения при разных нормах расхода можно использовать для расчета значений GR20, GR50, GR80 и GR90, которые определены, как коэффициенты уменьшения роста, которые соответствуют эффективной норме расхода необходимого гербицида для обеспечения уменьшения роста растения (GR), составляющего 20%, 50%, 80% и 90% соответственно. Пробит-анализ применяли для данных, полученных при использовании разных доз отдельных соединений, по методикам, описанным в приведенных ниже примерах. Данные для некоторых из норм расхода и анализ для всех норм расхода представлены в приведенных ниже таблицах.
Некоторые использованные нормы расхода и соотношения, виды исследованных растений и результаты приведены в таблице 13.
CYPSS: осока, включая сыть разнородную (Cyperus difformis), сыть съедобную (Cyperus esculentus), сыть ирию (Cyperus iria)
ECHSS: включая просо куриное, (Echinochloa crus-galli), ежовник крестьянский, (Echinochloa colonum)
LEFSS: лептохлоя, включая лептохлою китайскую (Leptochloa chinensis), вид лептохлои (Leptochloa dubia)
SCPJU: камыш ситниковидный, Schoenoplectus juncoides
SEBEX : сесбания рослая (Sesbania exaltata)
ORYSS : рис (Oryza sativa)
НИ: не исследовали
г АИ/га : граммов активного ингредиента на гектар
| название | год | авторы | номер документа |
|---|---|---|---|
| 4-АМИНО-6-(4-ЗАМЕЩЕННЫЕ-ФЕНИЛ)-ПИКОЛИНАТЫ И 6-АМИНО-2-(4-ЗАМЕЩЕННЫЕ-ФЕНИЛ)-ПИРИМИДИН-4-КАРБОКСИЛАТЫ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ГЕРБИЦИДОВ | 2014 |
|
RU2652132C2 |
| 4-АМИНО-6-(ГЕТЕРОЦИКЛИЛ)ПИКОЛИНАТЫ И 6-АМИНО-2-(ГЕТЕРОЦИКЛИЛ)ПИРИМИДИН-4-КАРБОКСИЛАТЫ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ГЕРБИЦИДОВ | 2014 |
|
RU2782064C2 |
| 4-АМИНО-6-(ГЕТЕРОЦИКЛИЛ)ПИКОЛИНАТЫ И 6-АМИНО-2-(ГЕТЕРОЦИКЛИЛ)ПИРИМИДИН-4-КАРБОКСИЛАТЫ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ГЕРБИЦИДОВ | 2014 |
|
RU2672584C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ 4-АМИНО-3-ГАЛОГЕН-6(ЗАМЕЩЕННЫХ)ПИКОЛИНАТОВ И 4-АМИНО-5-ФТОР-3-ГАЛОГЕН-6-(ЗАМЕЩЕННЫХ)ПИКОЛИНАТОВ | 2013 |
|
RU2658825C2 |
| 4-АМИНО-6-(ГЕТЕРОЦИКЛИЧЕСКИЕ)ПИКОЛИНАТЫ И 6-АМИНО-2-(ГЕТЕРОЦИКЛИЧЕСКИЕ)ПИРИМИДИН-4-КАРБОКСИЛАТЫ И ИХ ИСПОЛЬЗОВАНИЕ В КАЧЕСТВЕ ГЕРБИЦИДОВ | 2014 |
|
RU2672587C2 |
| СЛОЖНЫЕ АРИЛАЛКИЛОВЫЕ ЭФИРЫ 4-АМИНО-6-(ЗАМЕЩЕННЫЙ ФЕНИЛ)ПИКОЛИНАТОВ И 6-АМИНО-2-(ЗАМЕЩЕННЫЙ ФЕНИЛ)-4-ПИРИМИДИНКАРБОКСИЛАТОВ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ГЕРБИЦИДОВ | 2012 |
|
RU2566760C2 |
| ПЕСТИЦИДНЫЕ КОМПОЗИЦИИ И СВЯЗАННЫЕ С НИМИ СПОСОБЫ | 2015 |
|
RU2690375C2 |
| СПОСОБ ПОЛУЧЕНИЯ 4-АМИНО-5-ФТОР-3-ГАЛОГЕН-6-(ЗАМЕЩЕННЫХ)ПИКОЛИНАТОВ | 2012 |
|
RU2545074C1 |
| СПОСОБ ПОЛУЧЕНИЯ 4-АМИНО-5-ФТОР-3-ГАЛОГЕН-6-(ЗАМЕЩЕННЫХ)ПИКОЛИНАТОВ | 2013 |
|
RU2632203C2 |
| 4'-ЗАМЕЩЕННЫЕ НУКЛЕОЗИДНЫЕ ИНГИБИТОРЫ ОБРАТНОЙ ТРАНСКРИПТАЗЫ И ИХ ПОЛУЧЕНИЕ | 2016 |
|
RU2720811C2 |
Изобретение относится к сельскому хозяйству, в частности к средствам для борьбы с нежелательной растительностью. Гетероциклическое азотсодержащее соединение формулы (I):
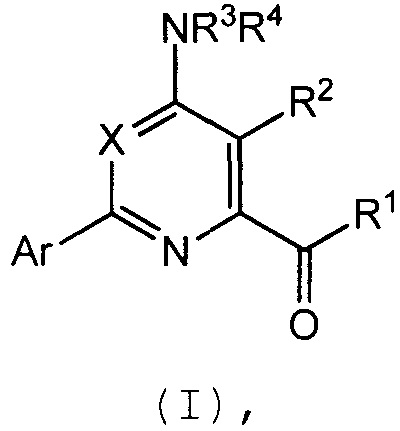
в которой X означает N, CH, CF, CCl или CCH3; R1 означает OR1′, в которой R1′ означает H, C1-C8-алкил или C7-C10-арилалкил; R2 означает C1-C4-алкоксигруппу, когда X означает N, или R2 означает Cl, когда X означает CH, CF, CCl или CCH3; R3 и R4 все независимо означают водород, C1-C6-алкил или C1-C6-алкоксигруппу; Ar означает:
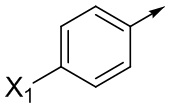 ,
,
где X1 означает Br, I, этинил, CF2H, OCF2H, CN или NO2; при условии, что X1 не представляет собой CN, когда X представляет собой N, CCl или CCH3; или его N-оксид, или сельскохозяйственно-приемлемая соль, обладает гербицидной активностью. Предлагаемое гетероциклическое азотсодержащее соединение формулы (I) обеспечивает борьбу с широким спектром сорняков, селективность, минимальное повреждение сельскохозяйственной культуры, стабильность при хранении, легкость использования, значительную активность по отношению к сорнякам. 11 з.п. ф-лы, 14 табл., 113 пр.
1. Гетероциклическое азотсодержащее соединение формулы (I):
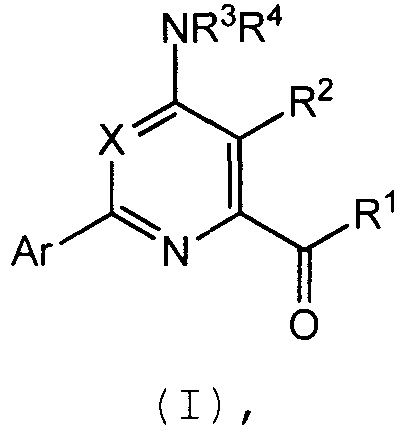
в которой X означает N, CH, CF, CCl или CCH3;
R1 означает OR1′, в которой R1′ означает H, C1-C8-алкил или C7-C10-арилалкил;
R2 означает C1-C4-алкоксигруппу, когда X означает N, или R2 означает Cl, когда X означает CH, CF, CCl или CCH3;
R3 и R4 - все независимо означают водород, C1-C6-алкил или C1-C6-алкоксигруппу;
Ar означает:
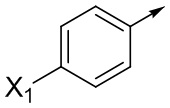 ,
,
где
X1 означает Br, I, этинил, CF2H, OCF2H, CN или NO2;
при условии, что X1 не представляет собой CN, когда X представляет собой N, CCl или CCH3;
или его N-оксид, или сельскохозяйственно-приемлемая соль.
2. Соединение по п.1, в котором X означает N, и R2 означает OСН3.
3. Соединение по любому из пп.1, 2, в котором X означает CF.
4. Соединение по любому из пп.1, 2, в котором X означает N.
5. Соединение по любому из пп.1-4, в котором X1 означает I, этинил или CN.
6. Соединение по любому из пп.1-4, в котором X1 означает I.
7. Соединение по любому из пп.1-4, в котором X1 означает этинил.
8. Соединение по любому из пп.1-4, в котором X1 означает CN.
9. Соединение по любому из пп.1-8, в котором R3 и R4 - каждый означает водород.
10. Соединение по п.1, в котором X означает CF, R1 означает OН, R2 означает Cl, R3 и R4 - каждый означает водород, и X1 означает I.
11. Соединение по п.1, в котором X означает CF, R1 означает OСН3, R2 означает Cl, R3 и R4 - каждый означает водород, и X1 означает CN.
12. Соединение по п.1, в котором X означает CF, R1 означает OН, R2 означает Cl, R3 и R4 - каждый означает водород, и X1 означает этинил.
| WO 2013003740 A1, 03.01.2013 | |||
| WO 2010092339 A1, 19.08.2010 | |||
| WO 2010125332 A1, 04.11.2010 | |||
| WO 2009046090 A1, 09.04.2009 | |||
| ПРОИЗВОДНЫЕ 2-АМИНО-N-[[[4-(АМИНОКАРБОНИЛ)-ПИРИМИДИН-2-ИЛ]-АМИНО]АЛКИЛ]ПИРИМИДИН-4-КАРБОКСАМИДА ИЛИ ИХ КИСЛОТНО-АДДИТИВНЫЕ СОЛИ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1993 |
|
RU2111963C1 |
Авторы
Даты
2022-04-29—Публикация
2014-03-12—Подача