Настоящая заявка испрашивает приоритет по предварительной заявке на патент Соединенных Штатов №62/433113, поданной 12 декабря 2016 г., содержание которой включено посредством ссылки, как если бы оно было написано в данном документе во всей своей полноте.
В данном документе раскрыты новые гетероциклические соединения и композиции и их применение в качестве фармацевтических препаратов для лечения заболевания. Также предусмотрены способы подавления активности МСТ4 у субъекта-человека или субъекта-животного для лечения заболеваний, таких как рак.
Выведение молочной кислоты из гликолитических клеток, как правило, опосредовано монокарбоксилат-транспортером МСТ4. МСТ4 проявляет слабую аффинность в отношении лактата (Km=28 мМ), связанную с высокой скоростью обмена, обеспечивая быстрое выведение больших количеств молочной кислоты. Экспрессия МСТ4 обычно ограничена высокогликолитическими тканями, такими как белые мышечные волокна, лимфоциты, астроциты и клетки Сертоли. Несмотря на то, что МСТ4 отсутствует в большинстве нормальных тканей, экспрессия МСТ4 в высокой степени повышена и коррелирует с низкой выживаемостью при множестве показаний рака, в том числе колоректальном раке, глиоме, раке головы и шеи, трижды негативном раке молочной железы, раке предстательной железы, KRAS-мутантном раке легкого, раке печени и раке почки.
Корреляция экспрессии МСТ4 и плохого исхода при раке, по-видимому, является значительным функциональным следствием во множестве моделей рака. Стабильная экспрессия МСТ4 является в высокой степени онкогенной в ксенотрансплантатной модели Ras-трансформированных фибробластов с нарушенным дыханием. Напротив, сайленсинг МСТ4 обеспечивает замедление или устранение роста опухоли в ксенотрансплантатных моделях рака молочной железы, колоректального рака и глиомы. Экспрессия МСТ4 необходима для опосредованного воспалительным цитокином IL-8 ангиогенеза в ксенотрансплантатных моделях рака молочной железы и толстой кишки. Также показано, что МСТ4 играет важные роли в миграции раковых клеток, инвазии и разных аспектах эффекта Варбурга (например, пролиферация на глюкозе, внеклеточное окисление и секреция лактата).
Подавление опосредованного МСТ4 выведения молочной кислоты может представлять собой эффективную стратегию нарушения эффекта Варбурга при раке. К сожалению, эффективных и селективных ингибиторов МСТ4 описано не было. Известны от умеренных до слабых ингибиторы МСТ4 (например, флоретин и α-CN-4-ОН-циннамат); однако такие соединения случайным образом подавляют ряд других транспортеров, в том числе МСТ1.
Таким образом, существует необходимость в эффективных и селективных ингибиторах МСТ4 для применения в лечении или предупреждении рака.
ПОДРОБНОЕ ОПИСАНИЕ
Были открыты новые соединения и фармацевтические композиции, некоторые из которых, как было обнаружено, подавляют МСТ4, вместе со способами синтеза и с применением соединений, включая способы лечения заболеваний, опосредованных МСТ4, у пациента посредством введения соединений.
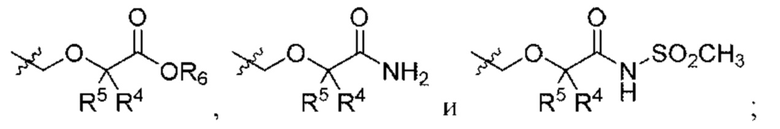
Предусмотрено соединение структурной формулы I
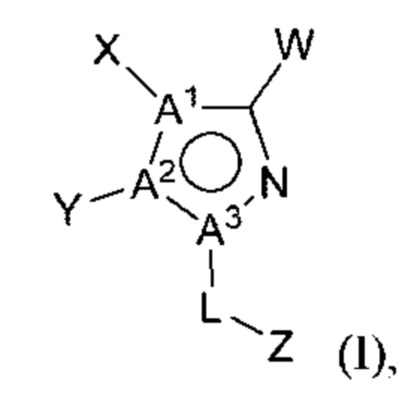
или его соль, где
А1, А2 и А3 независимо выбраны из N и С, где по меньшей мере один из А1, А2 и А3 представляет собой N;
L выбран из связи, метилена и этилена;
W выбран из 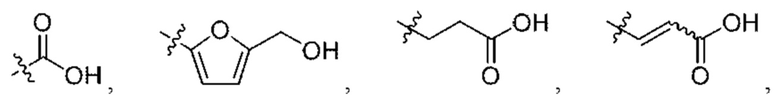
X представляет собой Н или отсутствует, или выбран из алкениламино, алкила, аминоалкенила и аминоалкила, любой из которых необязательно замещен одной - тремя группами R1;
Y выбран из алкенила, алкениламино, алкила, аминоалкенила, аминоалкила, арила, арилметила, ариламино, арилокси, циклоалкила, гетероциклоалкила и гетероарила, любой из которых необязательно замещен одной - тремя группами R2, или
X и Y вместе с атомами, к которым они присоединены, могут образовывать арил, циклоалкил, гетероарил или гетероциклоалкильное кольцо, любой из которых необязательно замещен одной - тремя группами R7; и
Z выбран из алкила, циклоалкила, гетероциклоалкила, арила и гетероарила, любой из которых необязательно замещен одной - тремя группами R3;
каждая R1 независимо выбрана из алкила, алкенила, алкокси, галогеналкила, галогеналкокси, амино, карбоксамидо, сульфонамидо, галогена, циано, гидрокси, циклоалкила, арила, гетероарила;
каждая R2 независимо выбрана из алкила, алкенила, алкокси, алкоксиалкила, алкилтио, галогеналкила, галогеналкокси, циклоалкокси, циклоалкилметокси, гетероциклоалкилметокси, амино, аминоалкила, карбоксамидо, сульфонамидо, галогена, циано, гидрокси, циклоалкила, гетероциклоалкила, арила и гетероарила, или
две R2 вместе с промежуточными атомами образуют 5-7-членное циклоалкильное или гетероциклоалкильное кольцо;
каждая R3 независимо выбрана из алкила, алкенила, алкокси, галогеналкила, галогеналкокси, циклоалкокси, амино, аминоалкила, карбоксамидо, сульфонамидо, галогена, циано, гидрокси, циклоалкила, гетероциклоалкила, арила и гетероарила и необязательно замещена одной - тремя группами R8, или
две R3 вместе с промежуточными атомами образуют 5-7-членное циклоалкильное или гетероциклоалкильное кольцо;
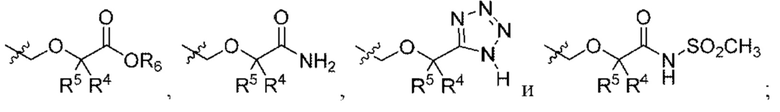
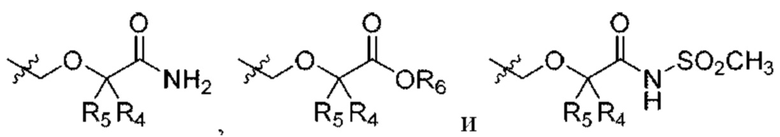
R4 и R5 независимо выбраны из Н и C1-С6алкила, где R4 и R5 вместе содержат не более 6 атомов углерода, или
R4 и R5 вместе с атомами, к которым они присоединены, образуют 3-7-членное циклоалкильное или гетероциклоалкильное кольцо;
R6 выбран из Н и С1-С4алкила;
каждая R7 независимо выбрана из алкила, алкенила, алкокси, галогеналкила, галогеналкокси, амино, карбоксамидо, сульфонамидо, галогена, циано, гидрокси, циклоалкила, арила и гетероарила; и
каждая R8 независимо выбрана из циано, галогена, гидрокси и оксо.
Некоторые соединения, раскрытые в данном документе, могут обладать полезной активностью подавления МСТ4 и могут применяться в лечении или профилактике заболевания или состояния, в которых МСТ4 играет активную роль. Таким образом, в широком аспекте определенные варианты осуществления также предусматривают фармацевтические композиции, содержащие одно или несколько соединений, раскрытых в данном документе, вместе с фармацевтически приемлемым носителем, а также способы получения и применения соединений и композиций. Определенные варианты осуществления предусматривают способы подавления МСТ4. Другие варианты осуществления предусматривают способы лечения нарушения, опосредованного МСТ4, у пациента, нуждающегося в таком лечении, предусматривающие введение указанному пациенту терапевтически эффективного количества соединения или композиции по настоящему изобретению. Также предусмотрено применение определенных соединений, раскрытых в данном документе, для применения в изготовлении лекарственного препарата, предназначенного для лечения заболевания или состояния, которые облегчаются посредством подавления МСТ4.
В некоторых вариантах осуществления X выбран из алкениламино, алкила, аминоалкенила, аминоалкила и Н; и Y выбран из алкенила, алкениламино, алкила, аминоалкенила, аминоалкила, арила, циклоалкила и гетероарила.
В некоторых вариантах осуществления X и Y вместе с атомами, к которым они присоединены, могут образовывать арил, циклоалкил, гетероарил или гетероциклоалкильное кольцо.
В некоторых вариантах осуществления точно два из А1, А2 и А3 представляют собой N.
В некоторых вариантах осуществления точно один из А1, А2 и А3 представляет собой N.
В некоторых вариантах осуществления А1 и А2 представляют собой С; и А3 представляет собой N.
В некоторых вариантах осуществления X представляет собой водород.
В некоторых вариантах осуществления W выбран из 
 .
.
В некоторых вариантах осуществления W выбран из 
В некоторых вариантах осуществления W представляет собой 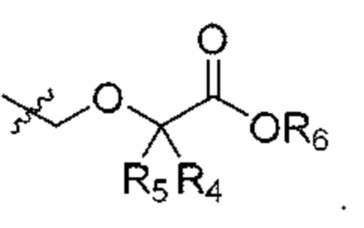
В некоторых вариантах осуществления Y выбран из арила и гетероарила, любой из которых необязательно замещен одной - тремя группами R2.
В некоторых вариантах осуществления Y выбран из фенила, тиенила, тиазолила, хинолинила, изохинолинила, циннолинила, индазолила и индолила.
В некоторых вариантах осуществления Y выбран из хинолинила, изохинолинила, циннолинила, индазолила и индолила.
В некоторых вариантах осуществления Y выбран из фенила, тиенила и тиазолила.
В некоторых вариантах осуществления Z выбран из фенила, пиридинила, хинолинила, изохинолинила, циннолинила, индазолила и индолила.
В некоторых вариантах осуществления Z выбран из фенила и пиридинила.
В некоторых вариантах осуществления каждая R2 независимо выбрана из алкенила, алкокси, алкоксиалкила, циклоалкокси, циклоалкилметокси, галогеналкокси, алкила, арила, галогена, гетероарила и галогеналкила.
В некоторых вариантах осуществления каждая R2 независимо выбрана из алкокси, алкоксиалкила, циклоалкокси, циклоалкилметокси, галогеналкокси, алкила, галогена и галогеналкила.
В некоторых вариантах осуществления две R2 вместе с промежуточными атомами образуют 5-7-членное циклоалкильное или гетероциклоалкильное кольцо.
В некоторых вариантах осуществления каждая R3 независимо выбрана из алкенила, алкокси, алкила, арила, галогена, гетероарила и галогеналкила.
В некоторых вариантах осуществления каждая R3 независимо выбрана из алкокси, алкила, арила и гетероарила.
В некоторых вариантах осуществления две R3 вместе с промежуточными атомами образуют 5-7-членное циклоалкильное или гетероциклоалкильное кольцо.
В некоторых вариантах осуществления каждая R3 представляет собой алкокси.
В некоторых вариантах осуществления каждая R3 представляет собой метокси.
В некоторых вариантах осуществления каждая R3 представляет собой галоген.
В некоторых вариантах осуществления каждая R3 независимо выбрана из F, Br и I.
В некоторых вариантах осуществления каждая R3 представляет собой F.
В некоторых вариантах осуществления R4 и R5 независимо выбраны из Н и C1-С2алкила.
В некоторых вариантах осуществления R4 и R5 независимо выбраны из Н и метила.
В некоторых вариантах осуществления R4 и R5 вместе с атомами, к которым они присоединены, образуют 3-7-членное циклоалкильное или гетероциклоалкильное кольцо.
В некоторых вариантах осуществления R6 выбран из Н и C1-С2алкила.
В некоторых вариантах осуществления R6 выбран из Н и метила.
В некоторых вариантах осуществления каждая R7 независимо выбрана из алкила, алкокси, галогеналкила, галогеналкокси, амино, карбоксамидо, галогена, циано, гидрокси, циклоалкила, арила и гетероарила.
В некоторых вариантах осуществления каждая R7 независимо выбрана из алкила и алкокси.
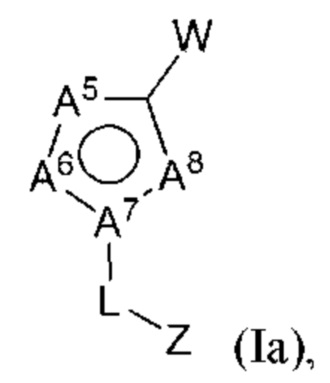
В некоторых вариантах осуществления соединения характеризуются структурной формулой Ia:
или соответствующими ей солью или таутомером, где
А5 выбран из С-Х и N;
А6 выбран из C-Y и N;
и А7 и А8 выбраны из следующих комбинаций:
А7 представляет собой С, и А8 представляет собой NH; или
А7 представляет собой N, и А8 представляет собой N;
где по меньшей мере один из А5, А6 и А7 представляет собой N;
L выбран из связи и метилена;
W выбран из 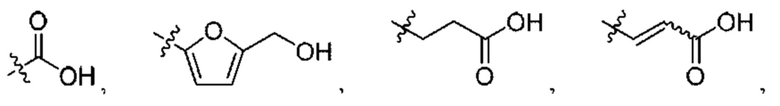
X представляет собой Н или выбран из алкениламино, алкила, аминоалкенила и аминоалкила, любой из которых необязательно замещен одной - тремя группами R1;
Y выбран из алкенила, алкениламино, алкила, аминоалкенила, аминоалкила, арила, циклоалкила и гетероарила, любой из которых необязательно замещен одной -тремя группами R2, или
X и Y вместе с атомами, к которым они присоединены, могут образовывать арил, циклоалкил, гетероарил или гетероциклоалкильное кольцо, любой из которых необязательно замещен одной - тремя группами R7; и
Z выбран из алкила, циклоалкила, гетероциклоалкила, арила и гетероарила, любой из которых необязательно замещен одной - тремя группами R3;
каждая R1 независимо выбрана из алкила, алкенила, алкокси, галогеналкила, галогеналкокси, амино, карбоксамидо, сульфонамидо, галогена, циано, гидрокси, циклоалкила, арила, гетероарила;
каждая R2 независимо выбрана из алкила, алкенила, алкокси, алкоксиалкила, галогеналкила, галогеналкокси, циклоалкокси, циклоалкилметокси, амино, карбоксамидо, сульфонамидо, галогена, циано, гидрокси, циклоалкила, арила и гетероарила;
каждая R3 независимо выбрана из алкила, алкенила, алкокси, галогеналкила, галогеналкокси, амино, карбоксамидо, сульфонамидо, галогена, циано, гидрокси, циклоалкила, арила и гетероарила;
R4 и R5 независимо выбраны из Н и C1-С6алкила, где R4 и R5 вместе содержат не более 6 атомов углерода;
R6 выбран из Н и С1-С4алкила; и
каждая R7 независимо выбрана из алкила, алкенила, алкокси, галогеналкила, галогеналкокси, амино, карбоксамидо, сульфонамидо, галогена, циано, гидрокси, циклоалкила, арила и гетероарила.
В некоторых вариантах осуществления соединения характеризуются структурной формулой II:
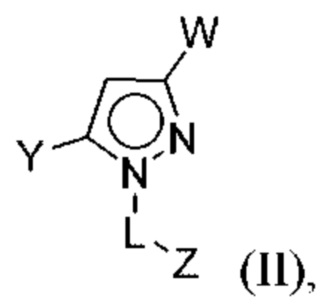
или соответствующей ей солью, где
L выбран из связи и метилена;
W выбран из 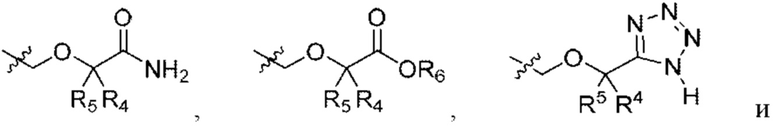
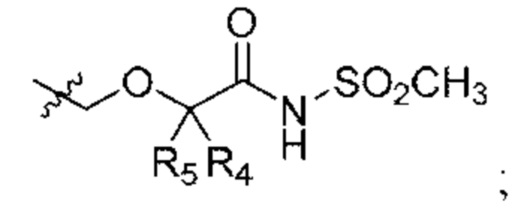
Y выбран из арила, арилметила, ариламино, арилокси, циклоалкила, гетероциклоалкила и гетероарила, любой из которых необязательно замещен одной - тремя группами R2;
Z выбран из арила и гетероарила, любой из которых необязательно замещен одной - тремя группами R3;
каждая R2 независимо выбрана из алкила, алкокси, алкоксиалкила, алкилтио, галогеналкила, галогеналкокси, циклоалкокси, циклоалкилметокси, гетероциклоалкилметокси, амино, аминоалкила, карбоксамидо, сульфонамидо, галогена, циано, гидрокси, циклоалкила, гетероциклоалкила, арила и гетероарила, или
две R2 вместе с промежуточными атомами образуют 5-7-членное циклоалкильное или гетероциклоалкильное кольцо;
каждая R3 независимо выбрана из алкила, алкокси, галогеналкила, галогеналкокси, циклоалкокси, амино, аминоалкила, карбоксамидо, сульфонамидо, галогена, циано, гидрокси, циклоалкила, гетероциклоалкила, арила и гетероарила и необязательно замещена одной - тремя группами R8, или
две R3 вместе с промежуточными атомами образуют 5-7-членное циклоалкильное или гетероциклоалкильное кольцо;
R4 и R5 независимо выбраны из Н и C1-С6алкила, где R4 и R5 вместе содержат не более 6 атомов углерода, и где по меньшей мере один из R4 и R5 представляет собой C1-С6алкил, или
R4 и R5 вместе с атомами, к которым они присоединены, образуют 3-7-членное циклоалкильное или гетероциклоалкильное кольцо;
R6 выбран из Н и С1-С4алкила; и
каждая R8 независимо выбрана из циано, галогена, гидрокси и оксо.
В некоторых вариантах осуществления структурной формулы II
L представляет собой связь; и
каждая R2 выбрана из алкенила, С2-С6алкокси, циклоалкокси, циклоалкилметокси, галогеналкокси, алкила, арила, галогена, гетероарила и галогеналкила.
В некоторых вариантах осуществления структурной формулы II
Z выбран из арила и гетероарила, любой из которых замещен одной - тремя группами R3;
каждая R2 выбрана из алкенила, С2-С6алкокси, циклоалкокси, циклоалкилметокси, галогеналкокси, алкила, арила, гетероарила и галогеналкила; и
каждая R3 независимо выбрана из алкила, алкенила, алкокси, галогеналкила, галогеналкокси, амино, карбоксамидо, сульфонамидо, циклоалкила, арила и гетероарила.
В некоторых вариантах осуществления структурной формулы II
Y представляет собой гетероарил и замещен одной - тремя группами R2; и
каждая R2 выбрана из алкенила, С2-С6алкокси, циклоалкокси, циклоалкилметокси, галогеналкокси, алкила, арила, галогена, гетероарила и галогеналкила.
В некоторых вариантах осуществления структурной формулы II
Y выбран из группы, состоящей из фурила, тиенила, пирролила, имидазолила и оксазолила, любой из который замещен одной - тремя группами R2; и
каждая R2 выбрана из алкенила, С2-С6алкокси, циклоалкокси, циклоалкилметокси, галогеналкокси, алкила, арила, галогена, гетероарила и галогеналкила.
В некоторых вариантах осуществления структурной формулы II по меньшей мере один из R4 и R5 представляет собой Н.
В некоторых вариантах осуществления структурной формулы II точно один из R4 и R5 представляет собой Н.
В некоторых вариантах осуществления соединения характеризуются структурной формулой III:
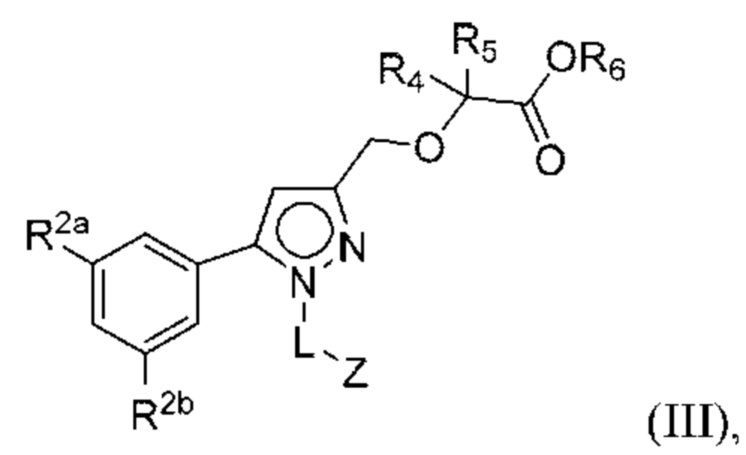
или соответствующей ей солью, где
L выбран из связи и метилена;
Z выбран из арила и гетероарила, любой из которых необязательно замещен одной или двумя группами R3;
R2a и R2b независимо выбраны из H, алкила, алкокси, галогеналкила, галогеналкокси, циклоалкокси, циклоалкилметокси, галогена, циклоалкила и гетероциклоалкила;
каждая R3 независимо выбрана из алкила, алкокси, галогеналкила, галогеналкокси, амино, аминоалкила, карбоксамидо, галогена, циано, гидрокси и циклоалкила и необязательно замещена одной или двумя группами R8;
R4 и R5 независимо выбраны из Н и C1-С6алкила, где R4 и R5 вместе содержат не более 6 атомов углерода, и где по меньшей мере один из R4 и R5 представляет собой C1-С6алкил, или
R4 и R5 вместе с атомами, к которым они присоединены, образуют 3-7-членное циклоалкильное или гетероциклоалкильное кольцо;
R6 выбран из Н и метила; и
каждая R8 независимо выбрана из циано, галогена, гидрокси и оксо.
В некоторых вариантах осуществления структурной формулы III
Z выбран из хинолинила, изохинолинила, циннолинила, индазолила и индолила, любой из которых необязательно замещен одной - тремя группами R3; и
каждая R3 независимо выбрана из алкила, алкенила, алкокси, галогеналкила, галогеналкокси, амино, карбоксамидо, сульфонамидо, галогена, циано, гидрокси, циклоалкила, арила и гетероарила.
В некоторых вариантах осуществления структурной формулы III Z выбран из алкила, циклоалкила и гетероциклоалкила, любой из которых необязательно замещен одной - тремя группами R3.
В некоторых вариантах осуществления структурной формулы III R2 выбран из алкенила, С2-С6алкокси, циклоалкокси, циклоалкилметокси, галогеналкокси, алкила, арила, галогена, гетероарила и галогеналкила.
В некоторых вариантах осуществления структурной формулы III R2 выбран из алкокси, алкила, галогена, галогеналкила и галогеналкокси.
В некоторых вариантах осуществления структурной формулы III каждая R3 независимо выбрана из алкенила, алкокси, алкила, амино, арила, галогена, гетероарила и галогеналкила; и
В некоторых вариантах осуществления структурной формулы III Z выбран из алкила, циклоалкила и гетероциклоалкила, любой из которых необязательно замещен одной - тремя группами R3.
В некоторых вариантах осуществления структурной формулы III
L представляет собой связь;
Z выбран из арила и гетероарила, любой из которых замещен одной - тремя группами R3; и
каждая R3 независимо выбрана из алкенила, алкокси, алкила, амино, фтора, брома и йода.
В некоторых вариантах осуществления структурной формулы III
L представляет собой метилен;
Z выбран из арила и гетероарила, любой из которых замещен одной - тремя группами R3; и
каждая R3 независимо выбрана из алкенила, С2-С6алкокси, С4-С8алкила, арила и йода.
В некоторых вариантах осуществления структурной формулы III
L представляет собой связь; и
Z выбран из пиридин-3-ила и пиридин-4-ила и необязательно замещен одной - тремя группами R3.
В некоторых вариантах осуществления структурной формулы III
L представляет собой метилен; и
Z представляет собой пиридил и необязательно замещен одной - тремя группами R3.
В некоторых вариантах осуществления структурной формулы III
L представляет собой метилен; и
Z представляет собой пиридил и необязательно замещен двумя или тремя группами R3.
В некоторых вариантах осуществления соединения характеризуются структурной формулой IV:
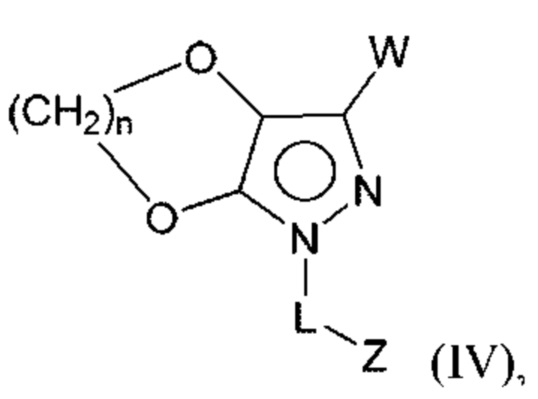
или соответствующей ей солью, где
L выбран из связи и метилена;
W выбран из 
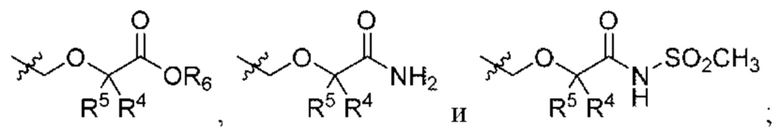
Z выбран из алкила, циклоалкила, гетероциклоалкила, арила и гетероарила, любой из которых необязательно замещен одной - тремя группами R3;
каждая R3 независимо выбрана из алкила, алкенила, алкокси, галогеналкила, галогеналкокси, амино, карбоксамидо, сульфонамидо, галогена, циано, гидрокси, циклоалкила, арила и гетероарила;
R4 и R5 независимо выбраны из Н и C1-С6алкила, где R4 и R5 вместе содержат не более 6 атомов углерода;
R6 выбран из Н и С1-С4алкила; и
n выбран из 1, 2 и 3.
В некоторых вариантах осуществления соединения характеризуются структурной формулой V:
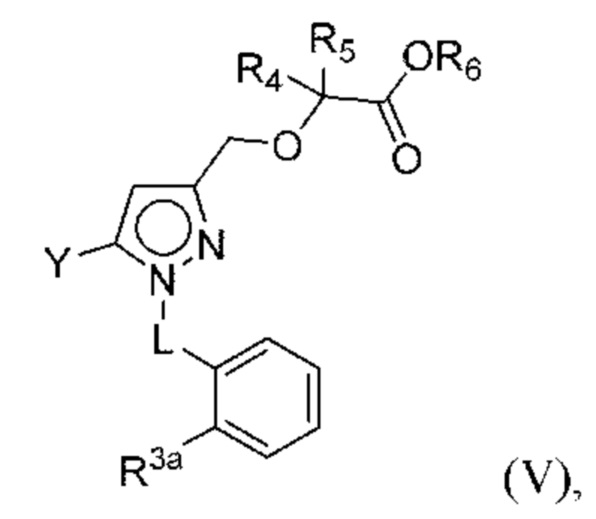
или соответствующей ей солью, где
L выбран из связи и метилена;
Y выбран из фенила, тиенила, фурила, тиазолила и оксазолила, любой из которых необязательно замещен одной или двумя группами R2, или
каждая R2 независимо выбрана из алкокси, алкилтио, галогеналкокси, циклоалкокси, циклоалкилметокси, гетероциклоалкилметокси и галогена;
R3a выбран из Н, алкокси, галогеналкокси, циклоалкокси, амино и галогена;
R4 и R5 независимо выбраны из C1-С3алкила, или
R4 и R5 вместе с атомами, к которым они присоединены, образуют 3-7-членное циклоалкильное или гетероциклоалкильное кольцо; и
R6 выбран из Н и С1-С4алкила.
В некоторых вариантах осуществления соединения характеризуются структурной формулой VI:
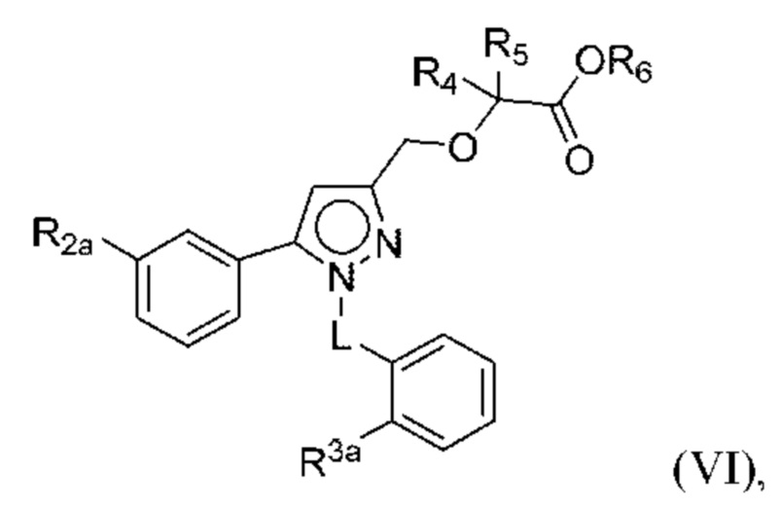
или соответствующей ей солью, где
L выбран из связи и метилена;
R2a выбран из алкокси, алкилтио, галогеналкокси, циклоалкокси, циклоалкилметокси, гетероциклоалкилметокси и галогена;
R3a выбран из Н, алкокси, галогеналкокси, циклоалкокси, амино и галогена;
R4 и R5 независимо выбраны из C1-С3алкила, или
R4 и R5 вместе с атомами, к которым они присоединены, образуют 3-7-членное циклоалкильное или гетероциклоалкильное кольцо; и
R6 выбран из Н и С1-С4алкила.
В некоторых вариантах осуществления соединения характеризуются структурной формулой VII:
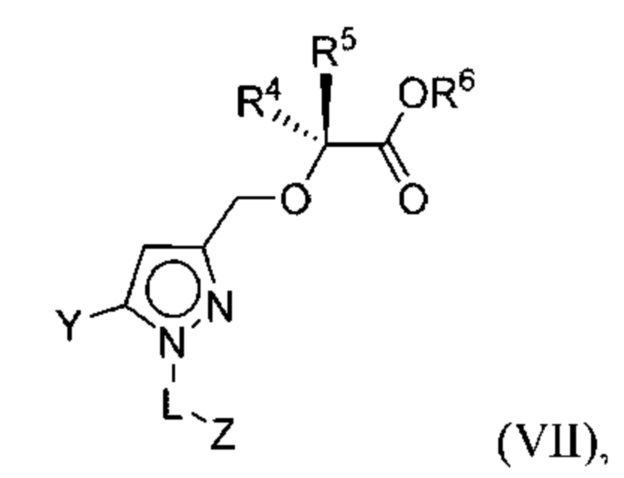
или соответствующей ей солью, где
Y выбран из арила, арилметила, ариламино, арилокси, циклоалкила, гетероциклоалкила и гетероарила, любой из которых необязательно замещен одной -тремя группами R2, или
Z выбран из арила и гетероарила, любой из которых необязательно замещен одной - тремя группами R3;
каждая R2 независимо выбрана из алкила, алкенила, алкокси, алкоксиалкила, алкилтио, галогеналкила, галогеналкокси, циклоалкокси, циклоалкилметокси, гетероциклоалкилметокси, амино, аминоалкила, карбоксамидо, сульфонамидо, галогена, циано, гидрокси, циклоалкила, гетероциклоалкила, арила и гетероарила, или
две R2 вместе с промежуточными атомами образуют 5-7-членное циклоалкильное или гетероциклоалкильное кольцо;
каждая R3 независимо выбрана из алкила, алкенила, алкокси, галогеналкила, галогеналкокси, циклоалкокси, амино, аминоалкила, карбоксамидо, сульфонамидо, галогена, циано, гидрокси, циклоалкила, гетероциклоалкила, арила и гетероарила и необязательно замещена одной - тремя группами R8, или
две R3 вместе с промежуточными атомами образуют 5-7-членное циклоалкильное или гетероциклоалкильное кольцо;
R4 и R5 независимо выбраны из C1-С6алкила, где точно один из R4 и R5 представляет собой метил;
R6 выбран из Н и С1-С4алкила; и
каждая R8 независимо выбрана из циано, галогена, гидрокси и оксо.
В некоторых вариантах осуществления соединения характеризуются структурной формулой VII:
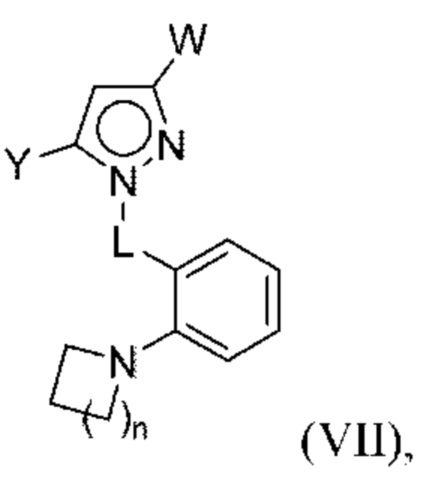
или соответствующей ей солью, где
L выбран из связи и метилена;
W выбран из 
Y выбран из алкенила, алкениламино, алкила, аминоалкенила, аминоалкила, арила, арилметила, ариламино, арилокси, циклоалкила, гетероциклоалкила и гетероарила, любой из которых необязательно замещен одной - тремя группами R2;
каждая R2 независимо выбрана из алкила, алкенила, алкокси, алкоксиалкила, алкилтио, галогеналкила, галогеналкокси, циклоалкокси, циклоалкилметокси, гетероциклоалкилметокси, амино, аминоалкила, карбоксамидо, сульфонамидо, галогена, циано, гидрокси, циклоалкила, гетероциклоалкила, арила и гетероарила;
n равняется 1 или 2 (с образованием азетидин-1-ила или пирролидин-1-ила);
R4 и R5 независимо выбраны из C1-С3алкила; и
R6 выбран из Н и С1-С4алкила.
В некоторых вариантах осуществления структурной формулы VII Y выбран из арила и гетероарила, любой из которых необязательно замещен одной - тремя группами R2.
В некоторых вариантах осуществления структурной формулы VII каждая R2 независимо выбрана из алкокси, циклоалкокси, галогеналкокси, алкила, галогена и галогеналкила.
В некоторых вариантах осуществления структурной формулы VII W представляет собой 
В некоторых вариантах осуществления структурной формулы VII n равняется 1 с образованием азетидин-1-ила.
В некоторых вариантах осуществления структурной формулы VII L представляет собой связь.
В некоторых вариантах осуществления соединения характеризуются структурной формулой VIII:
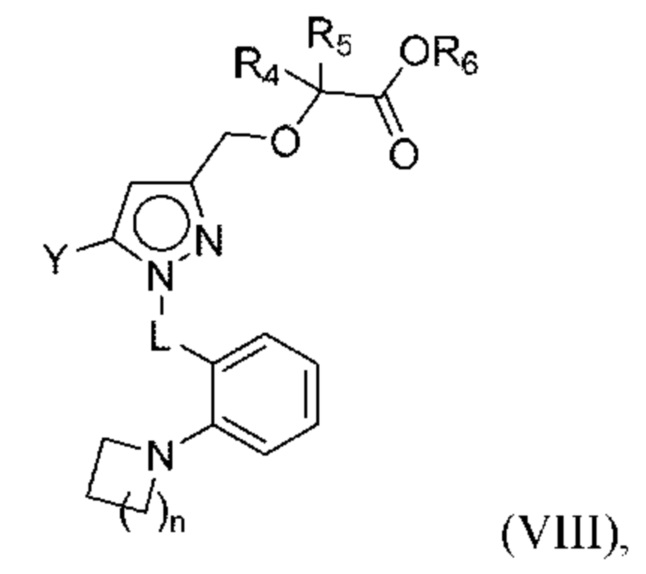
или соответствующей ей солью, где
L выбран из связи и метилена;
Y выбран из фенила, индазолила, тиенила, индазолила и индолила, любой из которых необязательно замещен одной или двумя группами R2;
n равняется 1 или 2 (с образованием азетидин-1-ила или пирролидин-1-ила);
каждая R2 независимо выбрана из алкила, алкокси, алкилтио, галогеналкокси, циклоалкокси, циклоалкилметокси, гетероциклоалкилметокси и галогена;
R4 и R5 независимо выбраны из C1-С3алкила; и
R6 выбран из Н и С1-С4алкила.
В некоторых вариантах осуществления структурной формулы VIII Y выбран из фенила и индазолила, любой из которых необязательно замещен одной или двумя группами R2.
В некоторых вариантах осуществления структурной формулы VIII каждая R2 независимо выбрана из алкокси, циклоалкокси, галогеналкокси, алкила, галогена и галогеналкила.
В некоторых вариантах осуществления структурной формулы VIII n равняется 1 с образованием азетидин-1-ила.
В некоторых вариантах осуществления структурной формулы VIII L представляет собой связь.
В некоторых вариантах осуществления структурной формулы VIII Y представляет собой фенил, замещенный одной или двумя группами R2, независимо выбранными из алкокси, циклоалкокси, галогеналкокси, алкила, галогена и галогеналкила.
В некоторых вариантах осуществления структурной формулы VIII каждая R2 независимо выбрана из С1-С4алкокси, циклопропокси, циклобутокси и C1-С3алкила.
В некоторых вариантах осуществления структурной формулы VIII Y представляет собой индазолил, замещенный группами R2, выбранными из метила, этила и пропила.
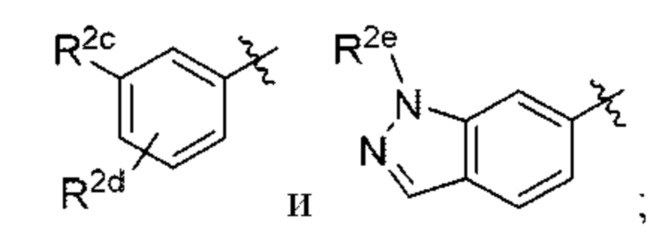
В некоторых вариантах осуществления структурной формулы VIII Y выбран из
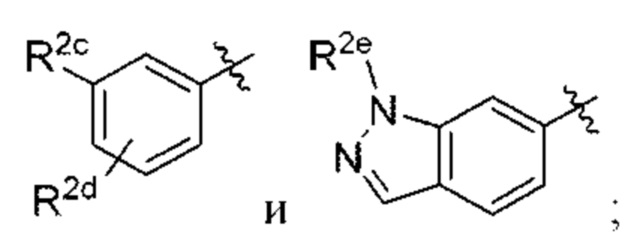
R2c выбран из С1-С4алкокси и С1-С4циклоалкокси;
R2d отсутствует или выбран из С1-С4алкокси; и
R2e представляет собой С1-С4алкил.
В некоторых вариантах осуществления соединения характеризуются структурной формулой IX:
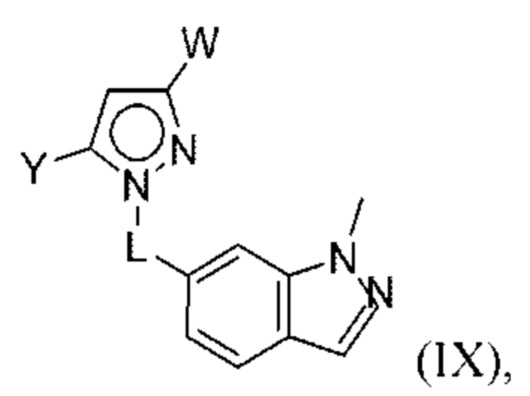
или соответствующей ей солью, где
L выбран из связи и метилена;
W выбран из 
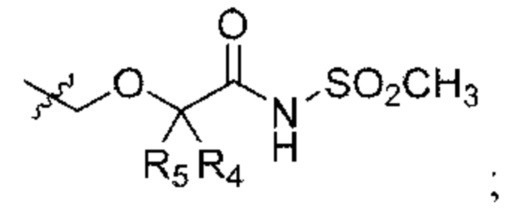
Y выбран из арила, арилметила, ариламино, арилокси, циклоалкила, гетероциклоалкила и гетероарила, любой из которых необязательно замещен одной -тремя группами R2;
Z выбран из арила и гетероарила, любой из которых необязательно замещен одной - тремя группами R3;
каждая R2 независимо выбрана из алкила, алкокси, алкоксиалкила, алкилтио, галогеналкила, галогеналкокси, циклоалкокси, циклоалкилметокси, гетероциклоалкилметокси, амино, аминоалкила, карбоксамидо, сульфонамидо, галогена, циано, гидрокси, циклоалкила, гетероциклоалкила, арила и гетероарила;
R4 и R5 независимо выбраны из C1-С3алкила; и
R6 выбран из Н и С1-С4алкила.
В некоторых вариантах осуществления структурной формулы IX Y выбран из арила и гетероарила, любой из которых необязательно замещен одной - тремя группами R2.
В некоторых вариантах осуществления структурной формулы IX каждая R2 независимо выбрана из алкокси, циклоалкокси, галогеналкокси, алкила, галогена и галогеналкила.
В некоторых вариантах осуществления структурной формулы IX W представляет собой 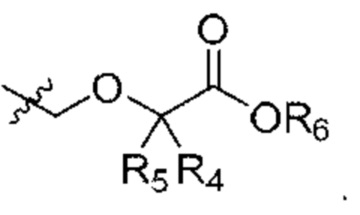
В некоторых вариантах осуществления структурной формулы IX L представляет собой связь.
В некоторых вариантах осуществления структурной формулы IX Y представляет собой фенил, замещенный одной или двумя группами R2, независимо выбранными из алкокси, циклоалкокси, галогеналкокси, алкила, галогена и галогеналкила.
В некоторых вариантах осуществления структурной формулы IX каждая R2 независимо выбрана из С1-С4алкокси, циклопропокси, циклобутокси и C1-С3алкила.
В некоторых вариантах осуществления соединения характеризуются структурной формулой X:
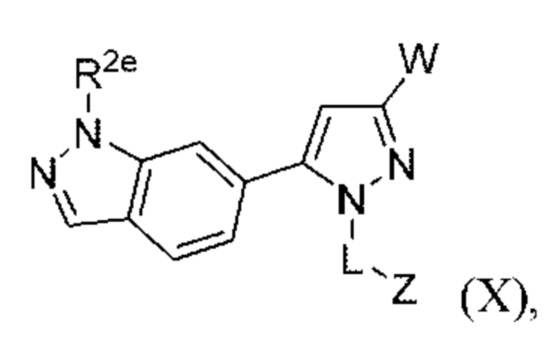
или соответствующей ей солью, где
W выбран из 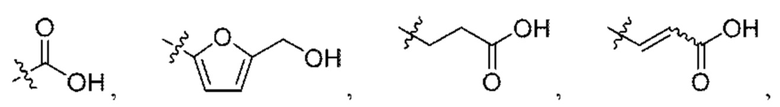

R2e представляет собой С1-С4алкил;
L выбран из связи и метилена;
Z выбран из арила и гетероарила, любой из которых необязательно замещен одной - тремя группами R3;
каждая R3 независимо выбрана из алкила, алкокси, галогеналкила, галогеналкокси, циклоалкокси, амино, аминоалкила, карбоксамидо, сульфонамидо, галогена, циано, гидрокси, циклоалкила, гетероциклоалкила, арила и гетероарила и необязательно замещена одной - тремя группами R8, или
две R3 вместе с промежуточными атомами образуют 5-7-членное циклоалкильное или гетероциклоалкильное кольцо;
R4 и R5 независимо выбраны из C1-С3алкила;
R6 выбран из Н и С1-С4алкила; и
каждая R8 независимо выбрана из циано, галогена, гидрокси и оксо.
В некоторых вариантах осуществления структурной формулы X W представляет собой 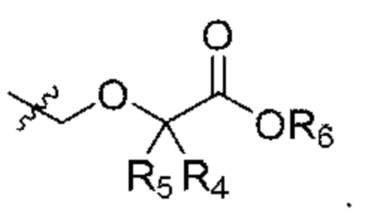
В некоторых вариантах осуществления структурной формулы X L представляет собой связь.
В некоторых вариантах осуществления структурной формулы X Z выбран из фенила и индазолила, любой из которых необязательно замещен одной - тремя группами R3.
В некоторых вариантах осуществления структурной формулы X Z выбран из
n равняется 1 или 2 (с образованием азетидин-1-ила или пирролидин-1-ила);
R4 и R5 независимо выбраны из C1-С3алкила;
R6 выбран из Н и С1-С4алкила; и
R9 выбран из галогена, амино и С1-С4алкокси.
В некоторых вариантах осуществления структурной формулы X R9 выбран из хлора, диметиламино и этокси.
В некоторых вариантах осуществления структурной формулы X R9 выбран из хлора и этокси.
В некоторых вариантах осуществления структурной формулы X n равняется 1 с образованием азетидин-1-ила.
В некоторых вариантах осуществления соединения характеризуются структурной формулой XI:
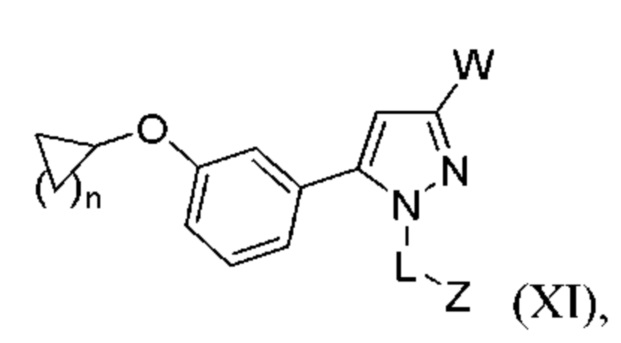
или соответствующей ей солью, где
W выбран из 

n равняется 1, 2 или 3 (с образованием циклопропила, циклобутила или циклопентила);
L выбран из связи и метилена;
Z выбран из арила и гетероарила, любой из которых необязательно замещен одной - тремя группами R3;
каждая R3 независимо выбрана из алкила, алкокси, галогеналкила, галогеналкокси, циклоалкокси, амино, аминоалкила, карбоксамидо, сульфонамидо, галогена, циано, гидрокси, циклоалкила, гетероциклоалкила, арила и гетероарила и необязательно замещена одной - тремя группами R8, или
две R3 вместе с промежуточными атомами образуют 5-7-членное циклоалкильное или гетероциклоалкильное кольцо;
R4 и R5 независимо выбраны из C1-С3алкила;
R6 выбран из Н и С1-С4алкила; и
каждая R8 независимо выбрана из циано, галогена, гидрокси и оксо.
В некоторых вариантах осуществления структурной формулы XI W представляет собой 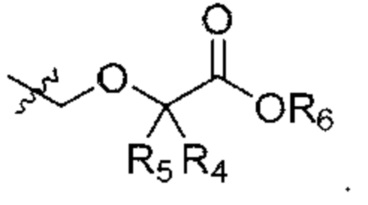
В некоторых вариантах осуществления структурной формулы XI L представляет собой связь.
В некоторых вариантах осуществления структурной формулы XI Z выбран из фенила и индазолила, любой из которых необязательно замещен одной - тремя группами R3.
В некоторых вариантах осуществления структурной формулы XI Z выбран из 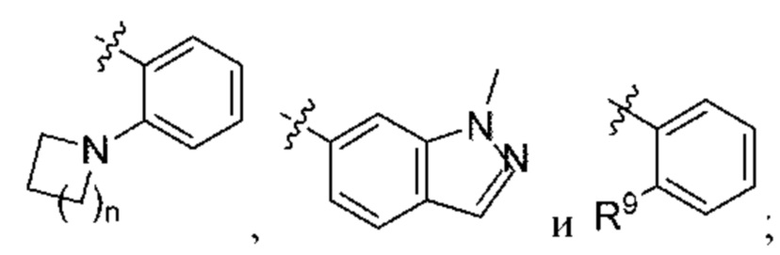
n равняется 1 или 2 (с образованием азетидин-1-ила или пирролидин-1-ила);
R4 и R5 независимо выбраны из C1-С3алкила;
R6 выбран из Н и С1-С4алкила; и
R9 выбран из галогена, амино и С1-С4алкокси.
В некоторых вариантах осуществления структурной формулы XI R9 выбран из хлора, диметиламино и этокси.
В некоторых вариантах осуществления структурной формулы XI R9 выбран из хлора и этокси.
В некоторых вариантах осуществления структурной формулы XI n равняется 1 с образованием азетидин-1-ила.
В некоторых вариантах осуществления соединения характеризуются структурной формулой II:

или соответствующей ей солью, где
L выбран из связи и метилена;
W выбран из 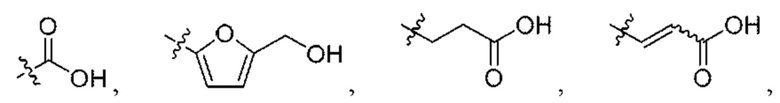
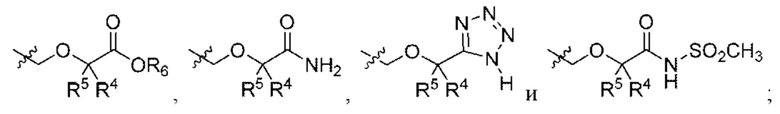
Y выбран из
R2e представляет собой С1-С4алкил;
Z выбран из
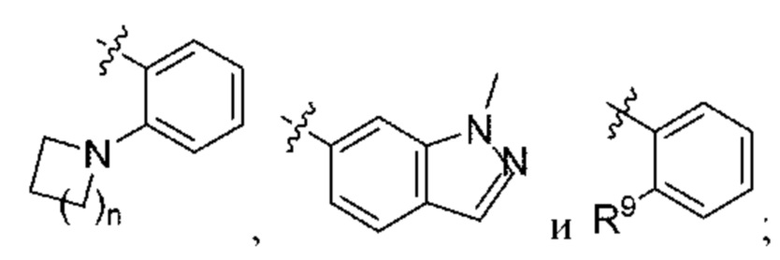
n равняется 1 или 2 (с образованием азетидин-1-ила или пирролидин-1-ила);
R4 и R5 независимо выбраны из C1-С3алкила;
R6 выбран из Н и С1-С4алкила; и
R9 выбран из галогена и С1-С4алкокси.
В некоторых вариантах осуществления структурной формулы II W представляет собой 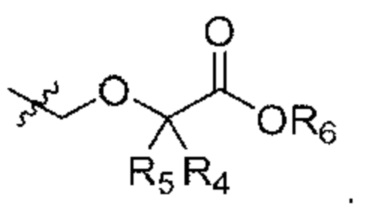
В некоторых вариантах осуществления структурной формулы II R9 выбран из хлора и этокси.
В некоторых вариантах осуществления структурной формулы II L представляет собой связь.
В некоторых вариантах осуществления структурной формулы II
Y представляет собой 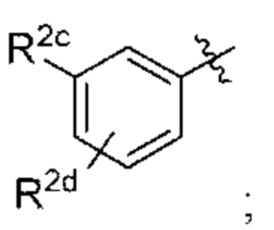
R2c выбран из С1-С4алкокси и С1-С4циклоалкокси; и
R2d отсутствует или выбран из С1-С4алкокси.
В некоторых вариантах осуществления структурной формулы II
R2c выбран из метокси, метилпропокси, циклопропокси и циклобутокси; и
R2d отсутствует или выбран из метокси.
В некоторых вариантах осуществления структурной формулы II
Y представляет собой 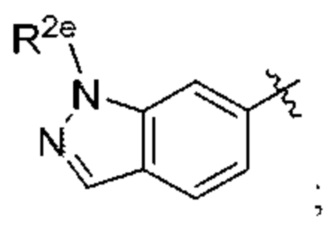 и
и
R2e представляет собой С1-С4алкил.
В некоторых вариантах осуществления структурной формулы II R2e выбран из этила и пропила.
В некоторых вариантах осуществления структурной формулы II Z представляет собой 
В некоторых вариантах осуществления структурной формулы II n равняется 1 с образованием азетидин-1-ила.
В некоторых вариантах осуществления структурной формулы II Z представляет собой 
В некоторых вариантах осуществления структурной формулы II Z представляет собой 
В некоторых вариантах осуществления структурной формулы II R9 выбран из хлора и этокси.
Также предусмотрены варианты осуществления, где любой вариант осуществления, представленный выше, может быть объединен с любым одним или несколькими из таких вариантов осуществления, при условии, что комбинация не является взаимоисключающей.
Как применяется в данном документе, два варианта осуществления являются "взаимоисключающими", когда один определен как являющийся отличным от другого. Например, вариант осуществления, где две группы объединяют с образованием циклоалкила, является взаимоисключающим с вариантом осуществления, в котором одна группа представляет собой этил, а другая группа представляет собой водород. Аналогично, вариант осуществления, где одна группа представляет собой СН2, является взаимоисключающим с вариантом осуществления, где та же группа представляет собой NH.
Также предусмотрено соединение, выбранное из примеров, раскрытых в данном документе.
Настоящее изобретение также относится к способу подавления по меньшей мере одной функции МСТ4, включающему стадию приведения МСТ4 в контакт с соединением, описанным в данном документе. Можно осуществлять контроль фенотипа клетки, пролиферации клетки, активности МСТ4, изменения биохимического выхода, получаемого с помощью активной МСТ4, экспрессии МСТ4 или связывания МСТ4 с естественным партнером по связыванию. Такие способы могут представлять собой способы лечения заболевания, биологические анализы, клеточные анализы, биохимические анализы или т.п.
Также в данном документе предусмотрен способ лечения заболевания, опосредованного МСТ4, включающий введение терапевтически эффективного количества соединения, раскрытого в данном документе, или его соли, пациенту, нуждающемуся в этом.
В некоторых вариантах осуществления заболевание выбрано из пролиферативных воспалительных заболеваний.
В некоторых вариантах осуществления заболевание представляет собой метаболическое заболевание.
В некоторых вариантах осуществления указанное метаболическое заболевание выбрано из метаболического синдрома, диабета, дислипидемии, жировой болезни печени, неалкогольного стеатогепатита, ожирения и резистентности к инсулину.
В некоторых вариантах осуществления указанный диабет представляет собой диабет II типа.
В некоторых вариантах осуществления, указанная дислипидемия представляет собой гиперлипидемию.
Кроме того, предусмотрен способ достижения эффекта у пациента, включающий введение терапевтически эффективного количества соединения, раскрытого выше, пациенту, где эффект выбран из группы, состоящей из снижения уровня триглицеридов, снижения уровня холестерина и снижения уровня гемоглобина А1с.
Дополнительно предусмотрен способ, раскрытый выше, где указанный холестерин выбран из холестерина LDL и VLDL.
Кроме того, предусмотрен способ, раскрытый выше, где указанные триглицериды выбраны из триглицеридов плазмы крови и триглицеридов печени.
Также в данном документе предусмотрено соединение, раскрытое в данном документе, для применения в качестве лекарственного препарата.
Также в данном документе предусмотрено соединение, раскрытое в данном документе, для применения в качестве лекарственного препарата для лечения заболевания, опосредованного МСТ4.
Также предусмотрено применение соединения, раскрытого в данном документе, в качестве лекарственного препарата.
Также предусмотрено применение соединения, раскрытого в данном документе, в качестве лекарственного препарата для лечения заболевания, опосредованного МСТ4.
Также предусмотрено соединение, раскрытое в данном документе, для применения в изготовлении лекарственного препарата для лечения заболевания, опосредованного МСТ4.
Также предусмотрено применение соединения, раскрытого в данном документе, для лечения заболевания, опосредованного МСТ4.
Также в данном документе предусмотрен способ подавления МСТ4, предусматривающий приведение МСТ4 в контакт с соединением, раскрытым в данном документе, или его солью.
Также в данном документе предусмотрен способ достижения эффекта у пациента, предусматривающий введение терапевтически эффективного количества соединения, раскрытого в данном документе, или его соли, пациенту, где эффект выбран из усиления когнитивных функций.
В некоторых вариантах осуществления заболевание, опосредованное МСТ4, выбрано из пролиферативных воспалительных заболеваний.
Также предусмотрен способ модуляции функции, опосредованной МСТ4, у субъекта, предусматривающий введение терапевтически эффективного количества соединения, раскрытого в данном документе.
Также предусмотрена фармацевтическая композиция, содержащая соединение, раскрытое в данном документе, вместе с фармацевтически приемлемым носителем.
В определенных вариантах осуществления фармацевтическая композиция составлена для перорального введения.
В определенных вариантах осуществления фармацевтическая композиция для перорального применения выбрана из таблетки и капсулы.
Сокращения и определения
С целью облегчения понимания настоящего изобретения ряд терминов и сокращений, применяемых в данном документе, определен ниже следующим образом.
Подразумевается, что при введении элементов согласно настоящему изобретению или его предпочтительному(-ым) варианту(-ам) осуществления формы существительного единственного числа и "указанный" обозначают один или несколько элементов. Термины "содержащий", "включающий" и "имеющий" подразумеваются как включительные и означают то, что могут быть дополнительные элементы, отличные от перечисленных элементов.
Термин "и/или" при применении в перечне из двух или более пунктов означает, что любой один из перечисленных пунктов может применяться сам по себе или в комбинации с любым одним или несколькими из перечисленных пунктов. Например, подразумевается, что экспрессия "А и/или В" означает любое из или оба из А и В, т.е. А отдельно, В отдельно или А и В в комбинации. Подразумевается, что экспрессия "А, В и/или С" означает А отдельно, В отдельно, С отдельно, А и В в комбинации, А и С в комбинации, В и С в комбинации или А, В и С в комбинации.
При раскрытии диапазонов значений и применении обозначения "n1-n2" или "от n1 … до n2", где n1 и n2 представляют собой числа, если не указано иное, то данное обозначение предназначено для включения самих чисел и диапазона между ними. Данный диапазон может состоять из целых чисел или непрерывного ряда значений и включать конечные значения. В качестве примера диапазон "от 2 до 6 атомов углерода" предназначен для включения двух, трех, четырех, пяти и шести атомов углерода, поскольку атомы углерода существуют в виде целых единиц. При сравнении, в качестве примера, диапазон "от 1 до 3 мкМ (микромолярный)", который предназначен для включения 1 мкМ, 3 мкМ и всех значений между любыми числами значащих цифр (например, 1,255 мкМ, 2,1 мкМ, 2,9999 мкМ и т.д.).
Термин "приблизительно", используемый в данном документе, предназначен для количественного определения численных значений, которые он модифицирует, обозначая такое значение как переменную в пределах ошибки. Если не указаны конкретные пределы ошибки, такие как стандартное отклонение от среднего значения, приведенные на графике или в таблице данных, то следует понимать, что термин "приблизительно" обозначает диапазон, который бы охватывал указанное значение и диапазон, который был бы включен при округлении до данной цифры, учитывая значащие цифры.
Термин "ацил", используемый в данном документе отдельно или в комбинации, относится к карбонилу, присоединенному к алкенилу, алкилу, арилу, циклоалкилу, гетероарилу, гетероциклу или любому другому фрагменту, в котором атом, присоединенный к карбонилу, представляет собой углерод. "Ацетильная" группа относится к группе -С(O)СН3. "Алкилкарбонильная" или "алканоильная" группы относятся к алкильной группе, присоединенной к исходному молекулярному фрагменту посредством карбонильной группы. Примеры таких групп включают метилкарбонил и этилкарбонил. Примеры ацильных групп включают формил, алканоил и ароил.
Термин "алкенил", используемый в данном документе отдельно или в комбинации, относится к прямоцепочечному или разветвленному углеводородному радикалу, имеющему одну или несколько двойных связей и содержащему от 2 до 20 атомов углерода. В определенных вариантах осуществления указанный алкенил будет содержать от 2 до 6 атомов углерода. Термин "алкенилен" относится к системе углерод-углеродной двойной связи, присоединенной в двух или более положениях, такой как этенилен [(-СН=СН-), (-С::С-)]. Примеры подходящих алкенильных радикалов включают этенил, пропенил, 2-метилпропенил, 1,4-бутадиенил и т.п. Если не указано иное, термин "алкенил" может включать "алкениленовые" группы.
Термин "алкокси", используемый в данном документе отдельно или в комбинации, относится к алкилэфирному радикалу, где термин алкил является таким, как определено ниже. Примеры подходящих алкилэфирных радикалов включают метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, втор-бутокси, трет-бутокси и т.п.
Термин "алкил", используемый в данном документе отдельно или в комбинации, относится к прямоцепочечному или разветвленному алкильному радикалу, содержащему от 1 до 20 атомов углерода. В определенных вариантах осуществления указанный алкил будет содержать от 1 до 10 атомов углерода. В дополнительных вариантах осуществления указанный алкил будет содержать от 1 до 8 атомов углерода. Алкильные группы могут быть необязательно замещенными, как определено в данном документе. Примеры алкильных радикалов включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, изоамил, гексил, октил, нонил и т.п. Термин "алкилен", используемый в данном документе отдельно или в комбинации, относится к насыщенной алифатической группе, полученной из насыщенного углеводорода с прямой или разветвленной цепью, присоединенного в двух или более положениях, такого как метилен
(-СН2-) и этилен (-СН2СН2-). Если не указано иное, термин "алкил" может включать "алкиленовые" группы.
Термин "алкиламино", используемый в данном документе отдельно или в комбинации, относится к алкильной группе, присоединенной к исходному молекулярному фрагменту посредством аминогруппы. Подходящие алкиламиногруппы могут быть моно- или диалкилированными, образуя такие группы как, например, N-метиламино, N-этиламино, N,N-диметиламино, N,N-этилметиламино и т.п.
Термин "алкилиден", используемый в данном документе отдельно или в комбинации, относится к алкенильной группе, в которой один атом углерода углерод-углеродной двойной связи принадлежит фрагменту, к которому присоединена алкенильная группа.
Термин "алкилтио", используемый в данном документе отдельно или в комбинации, относится к алкилтиоэфирному (R-S-) радикалу, где термин алкил является таким, как определено выше, и где сера может быть однократно или двукратно окислена. Примеры подходящих алкилтиоэфирных радикалов включают метилтио, этилтио, н-пропилтио, изопропилтио, н-бутилтио, изобутилтио, втор-бутилтио, трет-бутилтио, метансульфонил, этансульфинил и т.п.
Термин "алкинил", используемый в данном документе отдельно или в комбинации, относится к прямоцепочечному или разветвленному углеводородному радикалу, имеющему одну или несколько тройных связей и содержащему от 2 до 20 атомов углерода. В определенных вариантах осуществления указанный алкинил содержит от 2 до 6 атомов углерода. В дополнительных вариантах осуществления указанный алкинил содержит от 2 до 4 атомов углерода. Термин "алкинилен" относится к углерод-углеродной тройной связи, присоединенной в двух положениях, такой как этинилен (-С:::С-,
-С≡С-). Примеры алкинильных радикалов включают этинил, пропинил, гидроксипропинил, бутин-1-ил, бутин-2-ил, пентин-1-ил, 3-метилбутин-1-ил, гексин-2-ил и т.п. Если не указано иное, термин "алкинил" может включать "алкиниленовые" группы.
Термины "амидо", "карбоксамидо" и "карбамоил", используемые в данном документе отдельно или в комбинации, относятся к аминогруппе, описанной ниже, присоединенной к исходному молекулярному фрагменту посредством карбонильной группы или наоборот. Термин "С-амидо", используемый в данном документе отдельно или в комбинации, относится к группе -C(O)N(RR') с R и R', определенными в данном документе, или как определено с помощью конкретно пронумерованных групп, обозначенных "R". Термин "N-амидо", используемый в данном документе отдельно или в комбинации, относится к группе RC(O)N(R')- с R и R', определенными в данном документе, или как определено с помощью конкретно пронумерованных групп, обозначенных "R". Термин "ациламино", используемый в данном документе отдельно или в комбинации, охватывает ацильную группу, присоединенную к исходному фрагменту посредством аминогруппы. Пример "ациламино-" группы представляет собой ацетиламино (CH3C(O)NH-).
Термин "амино", используемый в данном документе отдельно или в комбинации, относится к -NRR', где R и R' независимо выбраны из водорода, алкила, ацила, гетероалкила, арила, циклоалкила, гетероарила и гетероциклоалкила, любой из которых может быть необязательно замещен. Кроме того, R и R' могут объединяться с образованием гетероциклоалкила, любой из которых может быть необязательно замещенным.
Термин "арил", используемый в данном документе отдельно или в комбинации, означает карбоциклическую ароматическую систему, содержащую одно, два или три кольца, где такие полициклические кольцевые системы конденсированы вместе. Термин "арил" охватывает ароматические группы, такие как фенил, нафтил, антраценил и фенантрил.
Термины "арилалкенил" или "аралкенил", используемые в данном документе отдельно или в комбинации, относятся к арильной группе, присоединенной к исходному молекулярному фрагменту посредством алкенильной группы.
Термины "арилалкокси" или "аралкокси", используемые в данном документе отдельно или в комбинации, относятся к арильной группе, присоединенной к исходному молекулярному фрагменту посредством алкоксигруппы.
Термины "арилалкил" или "аралкил", используемые в данном документе отдельно или в комбинации, относятся к арильной группе, присоединенной к исходному молекулярному фрагменту посредством алкильной группы.
Термины "арилалкинил" или "аралкинил", используемые в данном документе отдельно или в комбинации, относятся к арильной группе, присоединенной к исходному молекулярному фрагменту посредством алкинильной группы.
Термины "арилалканоил", или "аралканоил", или "ароил", используемые в данном документе отдельно или в комбинации, относятся к ацильному радикалу, полученному из арилзамещенной алканкарбоновой кислоты, такому как бензоил, нафтоил, фенилацетил, 3-фенилпропионил (гидроциннамоил), 4-фенилбутирил, (2-нафтил)ацетил, 4-хлоргидроциннамоил и т.п.
Термин арилокси, используемый в данном документе отдельно или в комбинации, относится к арильной группе, присоединенной к исходному молекулярному фрагменту посредством окси.
Термины "бензо" и "бенз", используемые в данном документе отдельно или в комбинации, относятся к двухвалентному радикалу С6Н4=, полученному из бензола. Примеры включают бензотиофен и бензимидазол.
Термин "карбамат", используемый в данном документе отдельно или в комбинации, относится к сложному эфиру карбаминовой кислоты (-NHCOO-), который может быть присоединен к исходному молекулярному фрагменту либо с азотного конца, либо с кислотного конца, и который необязательно может быть замещенным, как определено в данном документе.
Термин "О-карбамил", используемый в данном документе отдельно или в комбинации, относится к группе -OC(O)NRR' с R и R', определенными в данном документе.
Термин "N-карбамил", используемый в данном документе отдельно или в комбинации, относится к группе ROC(O)NR'- с R и R', определенными в данном документе.
Термин "карбонил", используемый в данном документе, при использовании отдельно включает формил [-С(O)Н], а в комбинации представляет собой группу -С(О)-.
Термины "карбоксил" или "карбокси", используемые в данном документе, относятся к -С(O)ОН или соответствующему "карбоксилатному" аниону, такому как анион в составе соли карбоновой кислоты. Группа "О-карбокси" относится к группе RC(O)O-, где R является таким, как определено в данном документе. Группа "С-карбокси" относится к группе -C(O)OR, где R является таким, как определено в данном документе.
Термин "циано", используемый в данном документе отдельно или в комбинации, относится к -CN.
Термины "циклоалкил" или, в качестве альтернативы, "карбоцикл", используемые в данном документе отдельно или в комбинации, относятся к насыщенной или частично насыщенной моноциклической, бициклической или трициклической алкильной группе, где каждый циклический фрагмент содержит от 3 до 12 атомов углерода в качестве членов кольца и которая может необязательно представлять собой бензоконденсированную кольцевую систему, которая необязательно замещена, как определено в данном документе. В определенных вариантах осуществления указанный циклоалкил будет содержать от 5 до 7 атомов углерода. Примеры таких циклоалкильных групп включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, тетрагидронафтил, инданил, октагидронафтил, 2,3-дигидро-1H-инденил, адамантил и т.п. Подразумевается, что "бициклический" и "трициклический", применяемые в данном документе, включают обе конденсированные кольцевые системы, такие как декагидронафталин, октагидронафталин, а также полициклический (многоцентровый) насыщенный или частично ненасыщенный тип. В целом, примерами последнего типа изомера являются бицикло[1,1,1]пентан, камфора, адамантан и бицикло[3,2,1]октан.
Термин "сложный эфир", используемый в данном документе отдельно или в комбинации, относится к карбоксильной группе, соединяющей два фрагмента, связанных по атомам углерода.
Термин "эфир", используемый в данном документе отдельно или в комбинации, относится к оксигруппе, соединяющей два фрагмента, связанных по атомам углерода.
Термины "галогено" или "галоген", используемые в данном документе отдельно или в комбинации, относятся к фтору, хлору, брому или йоду.
Термин "галогеналкокси", используемый в данном документе отдельно или в комбинации, относится к галогеналкильной группе, присоединенной к исходному молекулярному фрагменту посредством атома кислорода.
Термин "галогеналкил", используемый в данном документе отдельно или в комбинации, относится к алкильному радикалу, имеющему значение, определенное выше, где один или несколько атомов водорода заменены галогеном. Конкретно охватываются моногалогеналкильные, дигалогеналкильные и полигалогеналкильные радикалы. Моногалогеналкильный радикал, в качестве одного примера, может содержать атом йода, брома, хлора или фтора в радикале. Дигалогеновые и полигалогеналкильные радикалы могут содержать два или более таких же атомов галогена или комбинацию различных галогеновых радикалов. Примеры галогеналкильных радикалов включают фторметил, дифторметил, трифторметил, хлорметил, дихлорметил, трихлорметил, пентафторэтил, гептафторпропил, дифторхлорметил, дихлорфторметил, дифторэтил, дифторпропил, дихлорэтил и дихлорпропил. "Галогеналкилен" относится к галогеналкильной группе, присоединенной в двух или более положениях. Примеры включают фторметилен (-CFH-), дифторметилен (-CF2-), хлорметилен (-CHCl-) и т.п.
Термин "гетероалкил", используемый в данном документе отдельно или в комбинации, относится к устойчивой прямой или разветвленной цепи или их комбинациям, полностью насыщенной или содержащей от 1 до 3 степеней ненасыщенности, состоящей из указанного числа атомов углерода и от одного до трех гетероатомов, выбранных из N, О и S, и где атомы N и S могут быть необязательно окислены и гетероатом N может быть необязательно кватернизован. Гетероатом(гетероатомы) может(могут) быть размещен(размещены) в любом внутреннем положении гетероалкильной группы. Не более двух гетероатомов могут быть последовательными, такие как, например, -CH2-NH-OCH3.
Термин "гетероарил", используемый в данном документе отдельно или в комбинации, относится к 3-15-членному ненасыщенному гетеромоноциклическому кольцу или конденсированной моноциклической, бициклической или трициклической кольцевой системе, в которой по меньшей мере одно из конденсированных колец является ароматическим, которая содержит по меньшей мере один атом, выбранный из N, О и S. В определенных вариантах осуществления указанный гетероарил будет содержать от 1 до 4 гетероатомов в качестве членов кольца. В дополнительных вариантах осуществления указанный гетероарил будет содержать от 1 до 2 гетероатомов в качестве членов кольца. В определенных вариантах осуществления указанный гетероарил будет содержать от 5 до 7 атомов. Термин также охватывает конденсированные полициклические группы, где гетероциклические кольца конденсированы с арильными кольцами, где гетероарильные кольца конденсированы с другими гетероарильными кольцами, где гетероарильные кольца конденсированы с гетероциклоалкильными кольцами или где гетероарильные кольца конденсированы с циклоалкильными кольцами. Примеры гетероарильных групп включают пирролил, пирролинил, имидазолил, пиразолил, пиридил, пиримидинил, пиразинил, пиридазинил, триазолил, пиранил, фурил, тиенил, оксазолил, изоксазолил, оксадиазолил, тиазолил, тиадиазолил, изотиазолил, индолил, изоиндолил, индолизинил, бензимидазолил, хинолил, изохинолил, хиноксалинил, хиназолинил, индазолил, бензотриазолил, бензодиоксолил, бензопиранил, бензоксазолил, бензоксадиазолил, бензотиазолил, бензотиадиазолил, бензофурил, бензотиенил, хромонил, кумаринил, бензопиранил, тетрагидрохинолинил, тетразолопиридазинил, тетрагидроизохинолинил, тиенопиридинил, фуропиридинил, пирролопиридинил и т.п. Иллюстративные трициклические гетероциклические группы включают карбазолил, бензидолил, фенантролинил, дибензофуранил, акридинил, фенантридинил, ксантенил и т.п.
Каждый из терминов "гетероциклоалкил" и "гетероцикл", взаимозаменяемо используемых в данном документе отдельно или в комбинации, относится к насыщенной, частично ненасыщенной или полностью ненасыщенной (но неароматической) моноциклической, бициклической или трициклической гетероциклической группе, содержащей по меньшей мере один гетероатом в качестве члена кольца, где каждый указанный гетероатом может быть независимо выбран из азота, кислорода и серы. В определенных вариантах осуществления указанный гетероциклоалкил будет содержать от 1 до 4 гетероатомов в качестве членов кольца. В дополнительных вариантах осуществления указанный гетероциклоалкил будет содержать от 1 до 2 гетероатомов в качестве членов кольца. В определенных вариантах осуществления указанный гетероциклоалкил будет содержать от 3 до 8 членов кольца в каждом кольце. В дополнительных вариантах осуществления указанный гетероциклоалкил будет содержать от 3 до 7 членов кольца в каждом кольце. В еще дополнительных вариантах осуществления указанный гетероциклоалкил будет содержать от 5 до 6 членов кольца в каждом кольце. "Гетероциклоалкил" и "гетероцикл" предназначены для включения сульфонов, сульфоксидов, N-оксидов с третичными атомами азота в кольце и карбоциклических конденсированных и бензо-конденсированных кольцевых систем; кроме того, оба термина также включают системы, где гетероциклическое кольцо конденсировано с арильной группой, определенной в данном документе, или с дополнительной гетероциклической группой. Примеры гетероциклических групп включают азиридинил, азетидинил, 1,3-бензодиоксолил, дигидроизоиндолил, дигидроизохинолинил, дигидроциннолинил, дигидробензодиоксинил, дигидро[1,3]оксазоло[4,5-b]пиридинил, бензотиазолил, дигидроиндолил, дигидропиридинил, 1,3-диоксанил, 1,4-диоксанил, 1,3-диоксоланил, изоиндолинил, морфолинил, пиперазинил, пирролидинил, тетрагидропиридинил, пиперидинил, тиоморфолинил и т.п. Гетероциклические группы могут быть необязательно замещены, если это конкретно не запрещено.
Термин "гидразинил", используемый в данном документе отдельно или в комбинации, относится к двум аминогруппам, соединенным посредством одинарной связи, т.е. -N-N-.
Термин "гидрокси", используемый в данном документе отдельно или в комбинации, относится к -ОН.
Термин "гидроксиалкил", используемый в данном документе отдельно или в комбинации, относится к гидроксигруппе, присоединенной к исходному молекулярному фрагменту посредством алкильной группы.
Термин "имино", используемый в данном документе отдельно или в комбинации, относится к =N-.
Термин "иминогидрокси", используемый в данном документе отдельно или в комбинации, относится к =N(OH) и =N-O-.
Фраза "в основной цепи" относится к наиболее длинной непрерывной или смежной цепи атомов углерода, начинающейся в точке присоединения группы к соединениям любой из формул, раскрытых в данном документе.
Термин "изоцианато" относится к группе -NCO.
Термин "изотиоцианато" относится к группе -NCS.
Фраза "линейная цепь атомов" относится к наиболее длинной прямой цепи атомов, независимо выбранных из углерода, азота, кислорода и серы.
Термин "низший", используемый в данном документе отдельно или в комбинации, где конкретно не определено иное, означает содержащий от 1 до и включительно 6 атомов углерода (т.е. С1-С6алкил).
Термин "низший арил", используемый в данном документе отдельно или в комбинации, означает фенил или нафтил, любой из которых может быть необязательно замещенным, как предусмотрено.
Термин "низший гетероарил", используемый в данном документе отдельно или в комбинации, означает либо 1) моноциклический гетероарил, содержащий пять или шесть членов кольца, в котором от одного до четырех указанных членов могут являться гетероатомами, выбранными из N, О и S, или 2) бициклический гетероарил, где каждое из конденсированных колец содержит пять или шесть членов кольца, содержащих между ними от одного до четырех гетероатомов, выбранных из N, О и S.
Термин "низший циклоалкил", используемый в данном документе отдельно или в комбинации, означает моноциклический циклоалкил, содержащий от трех до шести членов кольца (т.е. С3-С6циклоалкил). Низшие циклоалкилы могут быть ненасыщенными. Примеры низшего циклоалкила включают циклопропил, циклобутил, циклопентил и циклогексил.
Термин "низший гетероциклоалкил", используемый в данном документе отдельно или в комбинации, означает моноциклический гетероциклоалкил, содержащий от трех до шести членов кольца, в котором от одного до четырех членов могут являться гетероатомами, выбранными из N, О и S (т.е. С3-С6гетероциклоалкил). Примеры низших гетероциклоалкилов включают пирролидинил, имидазолидинил, пиразолидинил, пиперидинил, пиперазинил и морфолинил. Низшие гетероциклоалкилы могут быть ненасыщенными.
Термин "низший амино", используемый в данном документе отдельно или в комбинации, относится к
-NRR', где R и R' независимо выбраны из водорода и низшего алкила, любой из которых может быть необязательно замещенным.
Термин "меркаптил", используемый в данном документе отдельно или в комбинации, относится к группе RS-, где R является таким, как определено в данном документе.
Термин "нитро", используемый в данном документе отдельно или в комбинации, относится к -NO2.
Термины "окси" или "окса", используемые в данном документе отдельно или в комбинации, относятся к -О-.
Термин "оксо", используемый в данном документе отдельно или в комбинации, относится к =O.
Термин "пергалогеналкокси" относится к алкоксигруппе, где все атомы водорода заменены атомами галогена.
Термин "пергалогеналкил", используемый в данном документе отдельно или в комбинации, относится к алкильной группе, где все атомы водорода заменены атомами галогена.
Термины "сульфонат", "сульфоновая кислота" и "сульфоновый", используемые в данном документе отдельно или в комбинации, относятся к группе -SO3H и ее аниону, поскольку сульфоновую кислоту применяют в солеобразовании.
Термин "сульфанил", используемый в данном документе отдельно или в комбинации, относится к -S-.
Термин "сульфинил", используемый в данном документе отдельно или в комбинации, относится к -S(O)-.
Термин "сульфонил", используемый в данном документе отдельно или в комбинации, относится к -S(O)2-
Термин "N-сульфонамидо" относится к группе RS(=O)2NR'- с R и R', определенными в данном документе.
Термин "S-сульфонамидо" относится к группе -S(O)2NRR' с R и R', определенными в данном документе.
Термин "сульфонамидо" охватывает обе группы N-сульфонамидо и S-сульфонамидо.
Термины "тиа" и "тио", используемые в данном документе отдельно или в комбинации, относятся к группе -S- или эфиру, где кислород заменен серой. Окисленные производные тиогруппы, а именно сульфинил и сульфонил, включены в определение тиа и тио.
Термин "тиол", используемый в данном документе отдельно или в комбинации, относится к группе -SH.
Термин "тиокарбонил", используемый в данном документе, при использовании отдельно включает тиоформил -C(S)H, а в комбинации представляет собой группу -C(S)-.
Термин "N-тиокарбамил" относится к группе ROC(S)NR- с R и R', определенными в данном документе.
Термин "О-тиокарбамил" относится к группе -OC(S)NRR' с R и R, определенными в данном документе.
Термин "тиоцианато" относится к группе -CNS.
Термин "тригалогенметансульфонамидо" относится к группе X3CS(O)2NR-, где X представляет собой галоген, и R является таким, как определено в данном документе.
Термин "тригалогенметансульфонил" относится к группе X3CS(O)2-, где X представляет собой галоген.
Термин "тригалогенметокси" относится к группе Х3СО-, где X представляет собой галоген.
Термин "тризамещенный силил", используемый в данном документе отдельно или в комбинации, относится к силиконовой группе, замещенной по ее трем свободным валентностям группами, перечисленными в данном документе, как определено для замещенного амино. Примеры включают триметилсилил, трет-бутилдиметилсилил, трифенилсилил и т.п.
Любое определение в данном документе можно использовать в комбинации с любым другим определением для описания сложной структурной группы. По определению замыкающий элемент любого такого определения представляет собой элемент, который присоединяется к исходному фрагменту. Например, сложная группа алкиламидо будет представлять собой алкильную группу, присоединенную к исходной молекуле посредством амидогруппы, и термин алкоксиалкил будет представлять собой алкоксигруппу, присоединенную к исходной молекуле посредством алкильной группы.
Когда группа определена как "нулевая", это означает, что указанная группа отсутствует.
Термин "необязательно замещенный" означает, что предшествующая группа может быть замещенной или незамещенной. Будучи замещенными заместители "необязательно замещенной" группы могут включать без ограничения один или несколько заместителей, независимо выбранных из следующих групп или конкретно обозначенных наборов групп отдельно или в комбинации: низший алкил, низший алкенил, низший алкинил, низший алканоил, низший гетероалкил, низший гетероциклоалкил, низший галогеналкил, низший галогеналкенил, низший галогеналкинил, низший пергалогеналкил, низший пергалогеналкокси, низший циклоалкил, фенил, арил, арилокси, низший алкокси, низший галогеналкокси, оксо, низший ацилокси, карбонил, карбоксил, низший алкилкарбонил, низший карбоксиловый сложный эфир, низший карбоксамидо, циано, водород, галоген, гидрокси, амино, низший алкиламино, ариламино, амидо, нитро, тиол, низший алкилтио, низший галогеналкилтио, низший пергалогеналкилтио, арилтио, сульфонат, сульфоновая кислота, тризамещенный силил, N3, SH, SCH3, C(O)CH3, CO2CH3, CO2H, пиридинил, тиофен, фуранил, низший карбамат и низшая мочевина. Там, где это является структурно возможным, два заместителя могут быть соединены вместе с образованием конденсированного пяти-, шести- или семичленного карбоциклического или гетероциклического кольца, состоящего из нуля - трех гетероатомов, например, образуя метилендиокси или этилендиокси. Необязательно замещенная группа может быть незамещенной (например, -СН2СНЗ), полностью замещенной (например, -CF2CF3), монозамещенной (например, -CH2CH2F) или замещенной на уровне где-либо между полностью замещенной и монозамещенной (например, -CH2CF3). В тех случаях, когда заместители указываются без уточнения в отношении замещения, охватываются как замещенные, так и незамещенные формы. В тех случаях, когда заместитель определен как "замещенный", конкретно подразумевается замещенная форма. Кроме того, в случае необходимости могут быть определены различные наборы необязательных заместителей для конкретного фрагмента; в таких случаях необязательное замещение будет таким, как определено, часто непосредственно следующее за фразой "необязательно замещен".
Термин R или термин R', встречающиеся сами по себе и без числового обозначения, если не указано иное, относятся к фрагменту, выбранному из водорода, алкила, циклоалкила, гетероалкила, арила, гетероарила и гетероциклоалкила, любой из которых может быть необязательно замещенным. Такие группы R и R' следует понимать как необязательно замещенные, как определено в данном документе. Независимо от того, имеет ли группа R числовое обозначение или нет, каждую группу R, включая R, R' и Rn, где n=(1, 2, 3, … n), каждый заместитель и каждый элемент следует понимать, как независимые от любых других в отношении выбора из группы. Если какая-либо переменная, заместитель или элемент (например, арил, гетероцикл, R и т.д.) встречаются в формуле или общей структуре более одного раза, их определение в каждом случае является независимым от определения в каждом другом случае. Специалистам в данной области техники также будет понятно, что некоторые группы могут быть присоединены к исходной молекуле или могут занимать положение в цепи элементов с любого конца, как написано. Например, асимметрическая группа, такая как -C(O)N(R)-, может быть присоединена к исходному фрагменту либо посредством углерода, либо посредством азота.
В раскрытых в данном документе соединениях присутствуют центры асимметрии. Такие центры обозначены с помощью символов "R" или "S" в зависимости от конфигурации заместителей вокруг хирального атома углерода. Следует понимать, что настоящее изобретение охватывает все стереохимические изомерные формы, в том числе диастереомерные, энантиомерные и эпимерные формы, а также d-изомеры и 1-изомеры и их смеси. Отдельные стереоизомеры соединений могут быть получены синтетически из коммерчески доступных исходных веществ, которые содержат хиральные центры, или посредством получения смесей энантиомерных продуктов с последующим разделением, таким как превращение в смесь диастереомеров с последующим разделением или перекристаллизацией, с помощью хроматографической методики, прямого разделения энантиомеров на хиральных хроматографических колонках или любого другого подходящего способа, известного из уровня техники. Исходные соединения с конкретной стереохимией являются либо коммерчески доступными, либо могут быть получены и выделены с помощью методик, известных из уровня техники. Кроме того, раскрытые в данном документе соединения могут существовать в виде геометрических изомеров. Настоящее изобретение включает все цис-, транс-, син-, анти-, entgegen- (Е) и zusammen- (Z) изомеры, а также их соответствующие смеси. Кроме того, соединения могут существовать в виде таутомеров; все таутомерные изомеры предусмотрены в настоящем изобретении. Кроме того, раскрытые в данном документе соединения могут существовать в несольватированной, а также сольватированной формах с фармацевтически приемлемыми растворителями, такими как вода, этанол и т.п. В целом, сольватированные формы считаются эквивалентными несольватированным формам.
Термин "связь" относится к ковалентной связи между двумя атомами или двумя фрагментами, где атомы, соединенные посредством связи, считаются частью большей субструктуры. Связь может быть одинарной, двойной или тройной, если не указано иное. Пунктирная линия между двумя атомами на рисунке молекулы указывает на то, что дополнительная связь может присутствовать или отсутствовать в этом положении.
Подразумевается, что термин "заболевание", используемый в данном документе, является в целом синонимичным и используется взаимозаменяемо с терминами "нарушение", "синдром" и "состояние" (т.е. медицинское состояние) в том, что все они отражают аномальное состояние организма человека или животного или одной из его частей, что ухудшает его нормальное функционирование, при этом оно обычно проявляется посредством отличительных признаков и симптомов и приводит к сокращению продолжительности или ухудшению качества жизни у человека или животного.
Термин "комбинированная терапия" означает введение двух или более терапевтических средств для лечения терапевтического состояния или нарушения, описанных в настоящем изобретении. Такое введение охватывает совместное введение таких терапевтических средство фактически одновременно, как, например, в одной капсуле, содержащей фиксированное соотношение активных ингредиентов, или в нескольких отдельных капсулах для каждого активного ингредиента. Кроме того, такое введение также охватывает применение каждого типа терапевтического средства последовательным образом. В обоих случаях схема лечения обеспечит благоприятные эффекты комбинации лекарственных средств в лечении состояний или нарушений, описанных в данном документе.
Термин "ингибитор МСТ4" применяется в данном документе для обозначения соединения, которое проявляет IC50 по отношению к активности МСТ4, составляющую не более приблизительно 100 мкМ и, более часто, не более приблизительно 50 мкМ, как измерено с помощью ферментного анализа МСТ4, описанного в общих чертах в данном документе ниже. IC50 представляет собой такую концентрацию ингибитора, которая обеспечивает снижение активности фермента (например, МСТ4) до полумаксимального уровня. Было обнаружено, что некоторые соединения, раскрытые в данном документе, характеризуются подавлением в отношении МСТ4. В некоторых вариантах осуществления соединения будут характеризоваться IC50 по отношению к МСТ4, составляющей не более приблизительно 10 мкМ; в дополнительных вариантах осуществления соединения будут характеризоваться IC50 по отношению к МСТ4, составляющей не более приблизительно 5 мкМ; в еще дополнительных вариантах осуществления соединения будут характеризоваться IC50 по отношению к МСТ4, составляющей не более приблизительно 1 мкМ; в еще дополнительных вариантах осуществления соединения будут характеризоваться IC50 по отношению к МСТ4, составляющей не более приблизительно 200 нМ, как измерено в анализе связывания МСТ4, описанном в данном документе.
Фраза "терапевтически эффективный" предназначена для количественного определения количества активных ингредиентов, применяемых в лечении заболевания или нарушения или при влиянии на клинический конечный результат.
Термин "терапевтически приемлемый" относится к таким соединениям (или солям, пролекарствам, таутомерам, цвиттер-ионным формам и т.д.), которые являются подходящими для применения в контакте с тканями пациентов без нежелательных токсичности, раздражения и аллергического ответа, являются соизмеримыми с обоснованным соотношением благоприятный эффект/риск и являются эффективными в отношении их предполагаемого применения.
Как применяется в данном документе, ссылка на "лечение" пациента предназначена для включения профилактики. Лечение также может быть упреждающим по природе, т.е. оно может включать предупреждение заболевания. Предупреждение заболевания может включать полную защиту от заболевания, например, как в случае предупреждения инфекции патогеном, или может включать предупреждение прогрессирования заболевания. Например, предупреждение заболевания может не означать полное окончание действия какого-либо эффекта, относящегося к заболеваниям на любом уровне, но вместо этого может означать предупреждение симптомов заболевания до клинически значимого или выявляемого уровня. Предупреждение заболеваний также может означать предупреждение прогрессирования заболевания до следующей стадии заболевания.
Термин "пациент" в целом является синонимичным термину "субъект" и включает всех млекопитающих, в том числе людей. Примеры пациентов включают людей, домашний скот, такой как коровы, козы, овцы, свиньи и кролики, и домашних животных, таких как собаки, кошки, кролики и лошади. Предпочтительно пациент представляет собой человека.
Термин "пролекарство" относится к соединению, которое становится более активным in vivo. Некоторые соединения, раскрытые в данном документе, также могут существовать в виде пролекарств, как описано в Hydrolysis in Drug and Prodrug Metabolism: Chemistry, Biochemistry, and Enzymology (Testa, Bernard and Mayer, Joachim M. Wiley-VHCA, Zurich, Switzerland 2003). Пролекарства на основе соединений, описанных в данном документе, представляют собой структурно модифицированные формы соединения, которые быстро претерпевают химические изменения в физиологических условиях с обеспечением соединения. Кроме того, пролекарства можно превращать в соединение посредством химических или биохимических способов в среде ex vivo. Например, пролекарства могут быть медленно превращены в соединение при помещении в резервуар трансдермального пластыря с помощью подходящего фермента или химического реагента. Пролекарства часто являются пригодными, поскольку в некоторых ситуациях их можно вводить легче, чем соединение или исходное лекарственное средство. Они могут, например, являться биодоступными при пероральном введении, при этом исходное лекарственное средство нет. Пролекарства также могут обладать улучшенной растворимостью в фармацевтических композициях по сравнению с исходным лекарственным средством. Широкое разнообразие производных пролекарств известно из уровня техники, например, пролекарства, которые зависят от гидролитического расщепления или окислительной активации пролекарства. Примером пролекарства без ограничения будет соединение, которое вводят в виде сложного эфира ("пролекарство"), но затем оно метаболически гидролизуется до карбоновой кислоты, активного вещества. Дополнительные примеры включают пептидильные производные соединения.
Соединения, раскрытые в данном документе, могут существовать в виде терапевтически приемлемых солей. Настоящее изобретение включает соединения, перечисленные выше, в форме солей, включая соли присоединения кислоты. Подходящие соли включают соли, образованные как с органическими, так и с неорганическими кислотами. Такие соли присоединения кислоты обычно будут являться фармацевтически приемлемыми. Однако соли, не являющиеся фармацевтически приемлемыми солями, могут применяться при получении и очистке рассматриваемого соединения. Соли присоединения основания также могут образовываться, и они могут являться фармацевтически приемлемыми. Для более полного обсуждения получения и выбора солей, см. Pharmaceutical Salts: Properties, Selection, and Use (Stahl, P. Heinrich. Wiley-VCHA, Zurich, Switzerland, 2002).
Термин "терапевтически приемлемая соль", используемый в данном документе, представляет собой соли или цвиттер-ионные формы соединений, раскрытых в данном документе, которые способны к растворению или диспергированию в воде или масле и являются терапевтически приемлемыми, как определено в данном документе. Соли могут быть получены в ходе конечного выделения и очистки соединений или отдельно посредством осуществления реакции соответствующего соединения в форме свободного основания с подходящей кислотой. Иллюстративные соли присоединения кислоты включают ацетат, адипат, альгинат, L-аскорбат, аспартат, бензоат, бензолсульфонат (безилат), бисульфат, бутират, камфорат, камфорсульфонат, цитрат, диглюконат, формиат, фумарат, гентизат, глутарат, глицерофосфат, гликолят, гемисульфат, гептаноат, гексаноат, гиппурат, гидрохлорид, гидробромид, гидройодид, 2-гидроксиэтансульфонат (изетионат), лактат, малеат, малонат, DL-манделат, мезитиленсульфонат, метансульфонат, нафталинсульфонат, никотинат, 2-нафталинсульфонат, оксалат, памоат, пектинат, персульфат, 3-фенилпопионат, фосфонат, пикрат, пивалат, пропионат, пироглутамат, сукцинат, сульфонат, тартрат, L-тартрат, трихлорацетат, трифторацетат, фосфат, глутамат, бикарбонат, пара-толуолсульфонат (п-тозилат) и ундеканоат. Также основные группы в соединениях, раскрытых в данном документе могут быть кватернизированными с метил-, этил-, пропил- и бутилхлоридами, бромидами и йодидами; диметил-, диэтил-, дибутил- и диамилсульфатами; децил-, лаурил-, миристил- и стерилхлоридами, бромидами и йодидами; и бензил- и фенэтилбромидами. Примеры кислот, которые могут быть использованы для образования терапевтически приемлемых солей присоединения, включают неорганические кислоты, такие как хлористоводородная, бромистоводородная, серная и фосфорная, и органические кислоты, такие как щавелевая, малеиновая, янтарная и лимонная. Соли также могут образовываться посредством образования координационной связи соединений с ионом щелочного металла или щелочноземельного металла. Следовательно, в настоящем изобретении рассматриваются соли натрия, калия, магния и кальция с соединениями, раскрытыми в данном документе, и т.п.
Соли присоединения основания могут быть получены во время конечного выделения и очистки соединений посредством осуществления реакции карбоксильной группы с подходящим основанием, таким как гидроксид, карбонат или бикарбонат катиона металла, или с аммиаком или органическим первичным, вторичным или третичный амином. Катионы терапевтически приемлемых солей включают литий, натрий, калий, кальций, магний и алюминий, а также нетоксичные катионы четвертичных аминов, такие как аммоний, тетраметиламмоний, тетраэтиламмоний, метиламин, диметиламин, триметиламин, триэтиламин, диэтиламин, этиламин, трибутиламин, пиридин, N,N-диметиланилин, N-метилпиперидин, N-метилморфолин, дициклогексиламин, прокаин, дибензиламин, N,N-дибензилфенэтиламин, 1-эфенамин N,N'-дибензилэтилендиамин. Другие иллюстративные органические амины, пригодные для образования солей присоединения основания, включают этилендиамин, этаноламин, диэтаноламин, пиперидин и пиперазин.
Хотя можно вводить соединения по настоящему изобретению в виде исходного химического вещества, также можно предоставить их в виде фармацевтического состава. Соответственно, в данном документе предусмотрены фармацевтические составы, которые содержат одно или несколько определенных соединений, раскрытых в данном документе, или одну или несколько их фармацевтически приемлемых солей, сложных эфиров, пролекарств, амидов или сольватов вместе с одним или несколькими их фармацевтически приемлемыми носителями и необязательно одним или несколькими другими терапевтическими ингредиентами. Носитель(носители) должен(должны) быть "приемлемым(приемлемыми)", в смысле должен(должны) являться совместимым(совместимыми) с другими ингредиентами состава и не являться вредным(вредными) для его получателя. Надлежащий состав зависит от выбранного пути введения. Можно применять любые хорошо известные методики, носители и наполнители как подходящие и известные из уровня техники. Фармацевтические композиции, раскрытые в данном документе, могут быть изготовленными любым образом, известным из уровня техники, например, с помощью способов традиционного смешивания, растворения, гранулирования, получения драже, растирания в порошок, эмульгирования, инкапсулирования, заключения или прессования.
Составы включают составы, подходящие для перорального, парентерального (в том числе подкожного, внутрикожного, внутримышечного, внутривенного, внутрисуставного и внутримозгового), внутрибрюшинного, трансмукозального, трансдермального, ректального и местного (в том числе дермального, буккального, сублингвального и внутриглазного) введения, хотя наиболее подходящий путь может зависеть, например, от состояния и нарушения получателя. Составы могут быть удобным образом представлены в единичной лекарственной форме и могут быть получены с помощью любого из способов, хорошо известных в области фармацевтики. Как правило, такие способы включают стадию объединения соединения по настоящему изобретению или его фармацевтически приемлемой соли, сложного эфира, амида, пролекарства или сольвата ("активного ингредиента") с носителем, который состоит из одного или нескольких дополнительных ингредиентов. В целом, составы получают посредством равномерного и тщательного объединения активного ингредиента с жидкими носителями или тонкоизмельченными твердыми носителями или ими обоими, и затем, при необходимости, придания продукту формы необходимого состава.
Составы соединений, раскрытых в данном документе, подходящие для перорального введения, могут быть представлены в виде дискретных единиц, таких как капсулы, саше или таблетки, каждая из которых содержит предварительно определенное количество активного ингредиента; в виде порошка или гранул; в виде раствора или суспензии в водном растворе или неводном растворе; или в виде жидкой эмульсии типа масло в воде или в виде жидкой эмульсии типа вода в масле. Активный ингредиент также может быть представлен в виде болюса, электуария или пасты.
Фармацевтические препараты, который могут использоваться перорально, включают таблетки, твердые капсулы, изготовленные из желатина, а также мягкие, запаянные капсулы, изготовленные из желатина, и пластификатор, такой как глицерин или сорбит. Таблетки могут быть получены посредством прессования или формования, необязательно с одним или несколькими дополнительным ингредиентами. Прессованные таблетки могут быть получены посредством прессования в подходящей установке активного ингредиента в сыпучей форме, такой как порошок или гранулы, необязательно посредством смешивания со связующими веществами, инертными разбавителями или смазывающими, поверхностно-активными или диспергирующими веществами. Формованные таблетки могут быть получены посредством формования в подходящей установке смеси порошкообразного соединения, увлажненного инертным жидким разбавителем. Таблетки могут быть необязательно покрыты или иметь линию разлома и могут быть составлены так, чтобы обеспечивать медленное или контролируемое высвобождение из них активного ингредиента. Все составы для перорального введения должны быть в дозировках, подходящих для такого введения. Твердая капсула может содержать активные ингредиенты в смеси с наполнителем, таким как лактоза, связующие вещества, такие как виды крахмала, и/или смазочные средства, такие как тальк или стеарат магния, и необязательно стабилизаторы. В мягких капсулах активные соединения могут быть растворены или суспендированы в подходящих жидкостях, таких как жирные масла, жидкий парафин или жидкие полиэтиленгликоли. Кроме того, могут быть добавлены стабилизаторы. Ядра драже обеспечены подходящими покрытиями. Для этой цели могут применяться концентрированные растворы сахара, которые могут необязательно содержать аравийскую камедь, тальк, поливинилпирролидон, карбополовый гель, полиэтиленгликоль и/или диоксид титана, растворы лака и подходящие органические растворители или смеси растворителей. Красители или пигменты можно добавлять к покрытиям таблеток или драже для идентификации или определения характеристик различных комбинаций доз активного соединения.
Соединения могут быть составлены для парентерального введения посредством инъекции, например, посредством болюсной инъекции или непрерывной инфузии. Составы для инъекции могут быть представлены в единичной лекарственной форме, например, в ампулах или в многодозных контейнерах, с добавленным консервантом. Композиции могут принимать такие формы как суспензии, растворы или эмульсии в масляных или водных средах-носителях и могут содержать вспомогательные вещества, такие как суспендирующие, стабилизирующие и/или диспергирующие средства. Составы могут быть представлены в однодозных или многодозных контейнерах, например, запаянных ампулах и флаконах, и могут храниться в форме порошка или в сублимированном (лиофилизированном) состоянии, требующем только добавления стерильного жидкого носителя, например, солевого раствора или стерильной апирогенной воды непосредственно перед применением. Экстемпоральные инъекционные растворы и суспензии могут быть получены из стерильных порошков, гранул и таблеток ранее описанного типа.
Составы для парентерального введения включают водные и неводные (масляные) стерильные растворы активных соединений для инъекций, которые могут содержать антиоксиданты, буферы, бактериостатические вещества и растворенные компоненты, которые делают состав изотоничным с кровью предполагаемого получателя; и водные и неводные стерильные суспензии, которые могут включать суспендирующие средства и загустители. Подходящие липофильные растворители или носители включают жирные масла, такие как кунжутное масло, или синтетические сложные эфиры жирных кислот, такие как этилолеат или триглицериды, или липосомы. Водные инъекционные суспензии могут содержать вещества, которые увеличивают вязкость суспензии, такие как карбоксиметилцеллюлоза натрия, сорбит или декстран. Необязательно суспензия также может содержать подходящие стабилизаторы или средства, которые повышают растворимость соединений, что позволяет получать высококонцентрированные растворы.
В дополнение к составам, описанным ранее, соединения также могут быть составлены в виде депо-препаратов. Данные долгодействующие составы можно вводить посредством имплантации (например, подкожно или внутримышечно) или посредством внутримышечной инъекции. Таким образом, например, соединения могут быть составлены с подходящими полимерными или гидрофобными материалами (например, в виде эмульсии в приемлемом масле) или ионообменными смолами, или в виде умеренно растворимых производных, например, в виде умеренно растворимой соли.
Для буккального или сублингвального введения композиции могут находиться в форме таблеток, таблеток для рассасывания, пастилок или гелей, составленных традиционным образом. Такие композиции могут содержать активный ингредиент в ароматизированной основе, такой как сахароза и аравийская камедь или трагакант.
Соединения также могут быть составлены в композиции для ректального применения, такие как суппозитории или удерживающие клизмы, например, содержащие традиционные основы для суппозиториев, такие как масло какао, полиэтиленгликоль или другие глицериды.
Некоторые соединения, раскрытые в данном документе, можно вводить местно, то есть посредством несистемного введения. Это включает применение соединения, раскрытого в данном документе, внешне в отношении эпидермиса или полости рта, и инсталляцию такого соединения в ухо, глаз и нос, так, чтобы соединение не попадало в значительной степени в кровоток. Напротив, системное введение относится к пероральному, внутривенному, внутрибрюшинному и внутримышечному введению.
Составы, подходящие для местного введения, включают жидкие или полужидкие препараты, подходящие для проникновения через кожу к очагу воспаления, такие как гели, жидкие мази, лосьоны, кремы, мази или пасты, и капли, подходящие для введения в глаз, ухо или нос. Активный ингредиент для местного введения может составлять, например, от 0,001% до 10% вес/вес (по весу) состава. В определенных вариантах осуществления активный ингредиент может составлять не более 10% вес/вес. В других вариантах осуществления он может составлять менее 5% вес/вес. В определенных вариантах осуществления активный ингредиент может составлять от 2% вес/вес до 5% вес/вес. В других вариантах осуществления он может составлять от 0,1% до 1% вес/вес состава.
Для введения посредством ингаляции соединения можно удобно доставлять из инсуффлятора, аэрозольных баллонов, находящихся под давлением, или других удобных средств доставки аэрозоля. Аэрозольные баллоны могут содержать подходящий газ-вытеснитель, такой как дихлордифторметан, трихлорфторметан, дихлортетрафторэтан, диоксид углерода или другой подходящий газ. В случае находящегося под давлением аэрозоля единицу дозирования можно определить посредством обеспечения клапана для доставки дозированного количества. В качестве альтернативы, для введения посредством ингаляции или инсуффляции соединения в соответствии с настоящим изобретением могут принимать форму сухой порошкообразной композиции, например, порошкообразной смеси соединения и подходящей порошкообразной основы, такой как лактоза или крахмал. Порошкообразная композиция может быть представлена в единичной лекарственной форме, например, в капсулах, картриджах, желатиновых или блистерных упаковках, из которых порошок можно вводить с помощью ингалятора или инсуффлятора.
Предпочтительные единичные дозированные составы представляют собой составы, содержащие эффективную дозу, указанную в данном документе ниже, или ее соответствующую часть активного ингредиента.
Следует понимать, что в дополнение к ингредиентам, конкретно указанным выше, составы, описанные выше, могут включать другие средства, общепринятые в данной области техники, с учетом типа рассматриваемого состава, например, те, которые подходят для перорального введения, могут включать ароматизирующие средства.
Соединения можно вводить перорально или с помощью инъекции в дозе от 0,1 до 500 мг/кг в день. Диапазон доз для взрослых людей в целом составляет от 5 мг до 2 г/день. Таблетки или другие формы выпуска, предусмотренные в дискретных единицах, для удобства могут содержать количество одного или нескольких соединений, которые являются эффективными в такой дозе или кратной ей, например, единицы, содержащие от 5 мг до 500 мг, обычно от около 10 мг до 200 мг.
Количество активного ингредиента, которое можно объединить с материалами-носителями для получения одной лекарственной формы, будет изменяться в зависимости от пациента, лечение которого осуществляют, и конкретного способа введения.
Соединения можно вводить с помощью различных способов, например, перорально, местно или с помощью инъекции. Точное количество соединения, вводимого пациенту, будет находиться в пределах ответственности лечащего врача. Конкретный уровень дозы для какого-либо конкретного пациента будет зависеть от ряда факторов, в том числе активности конкретного используемого соединения, возраста, веса тела, общего состояния здоровья, пола, рационов, времени введения, пути введения, скорости выведения, комбинации лекарственных средств, конкретного нарушения, лечение которого осуществляют, и тяжести показания или состояния, лечение которых осуществляют. Кроме того, путь введения может изменяться в зависимости от состояния и его тяжести.
В некоторых случаях может быть целесообразно вводить по меньшей мере одно из соединений, описанных в данном документе (или их фармацевтически приемлемую соль, сложный эфир или пролекарство) в комбинации с другим терапевтическим средством. Только в качестве примера, если одним из побочных эффектов, испытываемых пациентом при получении одного из соединений, описанных в данном документе, является гипертензия, может быть целесообразно вводить антигипертензивное средство в комбинации с исходным терапевтическим средством. Или только в качестве примера, терапевтическая эффективность одного из соединений, описанных в данном документе, может быть увеличена посредством введения вспомогательного средства (т.е. само по себе вспомогательное средство может иметь только минимальный терапевтический благоприятный эффект, но в комбинации с другим терапевтическим средством общий терапевтический благоприятный эффект в отношении пациента является увеличенным). Или только в качестве примера, благоприятный эффект, испытываемый пациентом, может быть увеличен посредством введения одного из соединений, описанных в данном документе, с другим терапевтическим средством (что также включает терапевтическую схему), которое также обладает терапевтическим благоприятным эффектом. Только в качестве примера, в лечении диабета, предусматривающем введение одного из соединений, описанных в данном документе, увеличение терапевтического благоприятного эффекта может также происходить в результате обеспечения пациента другим терапевтическим средством для лечения диабета. В любом случае, независимо от заболевания, нарушения или состояния, подлежащих лечению, общий благоприятный эффект, испытываемый пациентом, может являться просто аддитивным для двух терапевтических средств или пациент может испытывать синергетический благоприятный эффект.
Таким образом, в другом аспекте некоторые варианты осуществления предусматривают способы лечения нарушений, опосредованных МСТ4, у субъекта-человека или субъекта-животного, нуждающихся в таком лечении, предусматривающие введение указанному субъекту количества соединения, раскрытого в данном документе, эффективного для уменьшения тяжести или предупреждения указанного нарушения у субъекта, в комбинации с по меньшей мере одним дополнительным средством для лечения указанного нарушения, которое известно из уровня техники. В связанном аспекте некоторые варианты осуществления предусматривают терапевтические композиции, содержащие по меньшей мере одно соединение, раскрытое в данном документе, в комбинации с одним или несколькими дополнительными средствами для лечения нарушений, опосредованных МСТ4.
Также в данном документе предусмотрен способ лечения нарушения, опосредованного монокарбоксилат-транспортером МСТ4, у субъекта, нуждающегося в этом, включающий последовательное или совместное введение соединения, раскрытого в данном документе, или его фармацевтически приемлемой соли и другого терапевтического средства.
В некоторых вариантах осуществления терапевтическое средство представляет собой ингибитор протеинкиназы.
В некоторых вариантах осуществления ингибитор протеинкиназы выбран из ингибиторов Aurora В, EGFR, PLK-1, CDK.
В некоторых вариантах осуществления терапевтическое средство выбрано из антиметаболита, ингибитора bcr-abl, средства, повреждающего ДНК, ингибитора EGFR, ингибитора, стабилизирующего микротрубочки, ингибитора блокировки митоза, ингибитора S-фазы и таксана.
В некоторых вариантах осуществления терапевтическое средство представляет собой средство, разрушающее ДНК, выбранное из алкилирующего средства, антрациклина, антиметаболитного средства, сшивающего средства, ингибитора репликации ДНК, интеркалятора, средства, разрушающего микротрубочки, ингибитора PARP, радиомиметического средства, радиосенсибилизирующего средства, средства, разрывающего нити, и ингибитора топоизомеразы II.
В некоторых вариантах осуществления терапевтическое средство выбрано из аминоглутетимида, амсакрина, анастрозола, аспарагиназы, барасертиба, bcg, бикалутамида, блеомицина, бусерелина, бусульфана, камптотецина, капецитабина, карбоплатина, кармустина, хлорамбуцила, хлорохина, цисплатина, кладрибина, клодроната, колхицина, циклофосфамида, ципротерона, цитарабина, дакарбазина, дактиномицина, даунорубицина, деметоксивиридина, дихлорацетата, диенестрола, диэтилстильбэстрола, доцетаксела, доксорубицина, эпирубицина, эстрадиола, эстрамустина, этопозида, эверолимуса, эксеместана, филграстима, флударабина, флудрокортизона, фторурацила, флуоксиместерона, флутамида, гемцитабина, генистеина, гозерелина, гидроксимочевины, идарубицина, ифосфамида, иматиниба, интерферона, иринотекана, иронотекана, летрозола, лейковорина, лейпролида, левамизола, ломустина, лонидамина, мехлорэтамина, медроксипрогестерона, мегестрола, мелфалана, меркаптопурина, месны, метформина, метотрексата, митомицина, митотана, митоксантрона, нилутамида, нокодазола, олапариба, октреотида, оксалиплатина, паклитаксела, памидроната, пентостатина, перифозина, пликамицина, порфимера, прокарбазина, ралтитрексида, ритуксимаба, сорафениба, стрептозоцина, сунитиниба, сурамина, тамоксифена, темозоломида, темсиролимуса, тенипозида, тестостерона, тиогуанина, тиотепы, титаноцена дихлорида, топотекана, трастузумаба, третиноина, винбластина, винкристина, виндезина и винорелбина.
Для применения при раке и неопластических заболеваниях ингибитор МСТ4 оптимально можно применять вместе с одним или несколькими из следующих неограничивающих примеров противораковых средств: (1) алкилирующие средства, включая без ограничения цисплатин (PLATIN), карбоплатин (PARAPLATIN), оксалиплатин (ELOXATIN), стрептозоцин (ZANOSAR), бусульфан (MYLERAN) и циклофосфамид (ENDOXAN); (2) антиметаболиты, включая без ограничения меркаптопурин (PIIRINETHOL), тиогуанин, пентостатин (NIPENT), цитозина арабинозид (ARA-C), гемцитабин (GEMZAR), фторурацил (CARAC), лейковорин (FUSILEV) и метотрексат (RHEUMATREX); (3) растительные алкалоиды и терпеноиды, включая без ограничения винкристин (ONCOVIN), винбластин и паклитаксел (TAXOL); (4) ингибиторы топоизомеразы, включая без ограничения иринотекан (CAMPTOSAR), топотекан (HYCAMTIN) и этопозид (EPOSIN); (5) цитотоксические антибиотики, включая без ограничения актиномицин D (COSMEGEN), доксорубицин (ADRIAMYCIN), блеомицин (BLENOXANE) и митомицин (MITOSOL); (6) ингибиторы ангиогенеза, включая без ограничения сунитиниб (SUTENT) и бевацизумаб (AVASTEST); и (7) ингибиторы тирозинкиназы, включая без ограничения иматиниб (GLEEVEC), эрлотиниб (TARCEVA), лапатиниб (TYKERB) и акситиниб (JNLYTA).
Если субъект страдает воспалительным состоянием или имеет риск его развития, соединение, представляющее собой ингибитор МСТ4, описанное в данном документе, необязательно применяют вместе с одним или несколькими средствами или способами для лечения воспалительного состояния в любой комбинации. Терапевтические средства/средства лечения для лечения аутоиммунного и/или воспалительного состояния включают без ограничения любой из следующих примеров: (1) кортикостероиды, включая без ограничения кортизон, дексаметазон и метилпреднизолон; (2) нестероидные противовоспалительные лекарственные средства (NSAID), включая без ограничения ибупрофен, напроксен, ацетаминофен, аспирин, фенопрофен (NALFON), флурбипрофен (ANSAID), кетопрофен, оксапрозин (DAYPRO), диклофенак натрия (VOLTAREN), диклофенак калия (CATAFLAM), этодолак (LODINE), индометацин (INDOCIN), кеторолак (TORADOL), сулиндак (CLINORIL), толметин (TOLECTIN), меклофенамат (MECLOMEN), мефенаминовую кислоту (PONSTEL), набуметон (RELAFEN) и пироксикам (FELDENE); (3) иммуносупрессанты, включая без ограничения метотрексат (RHEUMATREX), лефлуномид (ARAVA), азатиоприн (IMURAN), циклоспорин (NEORAL, SANDIMMUNE), такролимус и циклофосфамид (CYTOXAN); (4) блокаторы CD20, включая без ограничения ритуксимаб (RITUXAN); (5) блокаторы фактора некроза опухоли (TNF), включая без ограничения этанерцепт (ENBREL), инфликсимаб (REMICADE) и адалимумаб (HUMIRA); (6) антагонисты рецепторов интерлейкина-1, включая без ограничения анакинру (KINERET); (7) ингибиторы интерлейкина-6, включая без ограничения тоцилизумаб (ACTEMRA); (8) ингибиторы интерлейкина-17, включая без ограничения AIN457; (9) ингибиторы Янус-киназы, включая без ограничения тазоцитиниб; и (10) ингибиторы syk, включая без ограничения фостаматиниб.
В некоторых вариантах осуществления способ дополнительно включает осуществление способов лечения рака, не относящихся к химиотерапевтическим.
В некоторых вариантах осуществления способ дополнительно включает осуществление лучевой терапии.
В некоторых вариантах осуществления способ дополнительно включает осуществление хирургического вмешательства, термоабляции, терапии фокусированным ультразвуком, криотерапии или любой их комбинации.
В любом случае, несколько терапевтических средств (по меньшей мере одно из которых представляет собой соединение, раскрытое в данном документе) можно вводить в любом порядке или даже одновременно. При одновременном введении несколько терапевтических средств могут быть представлены в одной единой форме, или в нескольких формах (только в качестве примера, либо в виде одной пилюли, либо в виде двух отдельных пилюль). Одно из терапевтических средств может быть предоставлено в нескольких дозах, или оба средства могут быть предоставлены в нескольких дозах. При не одновременном введении период времени между введением нескольких доз может быть любой продолжительности, находящейся в диапазоне от нескольких минут до четырех недель.
Таким образом, в другом аспекте некоторые варианты осуществления предусматривают способы лечения нарушений, опосредованных МСТ4, у субъекта-человека или субъекта-животного, нуждающихся в таком лечении, предусматривающие введение указанному субъекту количества соединения, раскрытого в данном документе, эффективного для уменьшения тяжести или предупреждения указанного нарушения у субъекта, в комбинации с по меньшей мере одним дополнительным средством для лечения указанного нарушения, которое известно из уровня техники. В связанном аспекте некоторые варианты осуществления предусматривают терапевтические композиции, содержащие по меньшей мере одно соединение, раскрытое в данном документе, в комбинации с одним или несколькими дополнительными средствами для лечения нарушений, опосредованных МСТ4.
Настоящее изобретение предусматривает соединения и фармацевтические композиции, которые подавляют глутаминазную активность, в частности, активность МСТ4, и, таким образом, пригодны в лечении или предупреждении нарушений, связанных с МСТ4. Соединения и фармацевтические композиции по настоящему изобретению селективно модулируют МСТ4 и, таким образом, пригодны в лечении или предупреждении ряда нарушений, связанных с МСТ4, и включают без ограничения пролиферативные и воспалительные заболевания.
Соответственно, в данном документе предусмотрен способ подавления активности монокарбоксилат-транспортера МСТ4 или его мутанта в биологическом образце, включающий стадию приведения указанного биологического образца в контакт с соединением, раскрытым в данном документе, или его солью.
Также в данном документе предусмотрен способ подавления активности монокарбоксилат-транспортера МСТ4 или его мутанта у пациента, включающий стадию введения пациенту соединения, раскрытого в данном документе, или его соли.
Также в данном документе предусмотрен способ избирательного подавления активности монокарбоксилат-транспортера МСТ4 или его мутанта относительно монокарбоксилат-транспортера МСТ1 или его мутанта у пациента, включающий стадию введения пациенту соединения, раскрытого в данном документе, или его соли.
В некоторых вариантах осуществления подавление является избирательным по меньшей мере в 100 раз в отношении МСТ4 по сравнению с МСТ1.
В некоторых вариантах осуществления соединения и фармацевтические композиции по настоящему изобретению могут быть пригодны в лечении или предупреждении рака.
В некоторых вариантах осуществления соединения по настоящему изобретению могут применяться для предупреждения или лечения рака, где рак представляет собой одно из или вариант острого лимфобластного лейкоза (ALL), острого миелоидного лейкоза (AML), адренокортикальной карциномы, СПИД-ассоциированных видов рака (саркома Капоши и лимфома), рака анального канала, рака аппендикса, атипичной тератоидной/рабдоидной опухоли, базальноклеточной карциномы, рака желчного протока (включая внепеченочный), рака мочевого пузыря, рака кости (включая остеосаркому и злокачественную фиброзную гистиоцитому), опухоли головного мозга (такой как астроцитомы, опухоли головного мозга и спинного мозга, глиома ствола головного мозга, атипичная тератоидная/рабдоидная опухоль центральной нервной системы, эмбриональные опухоли центральной нервной системы, краниофарингиома, эпендимобластома, эпендимома, медуллобластома, медуллоэпителиома, опухоли паренхимы шишковидной железы промежуточной дифференцировки, супратенториальные примитивные нейроэктодермальные опухоли и пинеобластома), рака молочной железы, бронхиальных опухолей, лимфомы Беркитта, карциноидной опухоли, карциномы с неизвестной первичной локализацией, центральной нервной системы (такого как атипичная тератоидная/рабдоидная опухоль, эмбриональные опухоли и лимфома), рака шейки матки, видов детского рака, хордомы, хронического лимфоцитарного лейкоза (CLL), хронического миелогенного лейкоза (CML), хронических миелопролиферативных нарушений, рака толстой кишки, колоректального рака, краниофарингиомы, Т-клеточной лимфомы кожи (грибовидная гранулема и синдром Сезари), желчного протока (внепеченочный), протоковой карциномы in situ (DCIS), эмбриональных опухолей (центральной нервной системы), рака эндометрия, эпендимобластомы, эпендимомы, рака пищевода, эстезионейробластомы, опухолей семейства саркомы Юинга, экстракраниальной герминогенной опухоли, внегонадной герминогенной опухоли, рака внепеченочного желчного протока, рака глаза (такого интраокулярная меланома, ретинобластома), фиброзной гистиоцитомы кости (включая злокачествленную и остеосаркому), рака желчного пузыря, рака желудка (желудочный), желудочно-кишечной карциноидной опухоли, желудочно-кишечных стромальных опухолей (GIST), герминогенной опухоли (экстракраниальной, внегонадной, яичников), гестационной трофобластической опухоли, глиомы, лейкоза ворсистых клеток, рака головы и шеи, рака сердца, гепатоцеллюлярного рака (печени), гистиоцитоза, клеток Лангерганса, лимфомы Ходжкина, гипофарингеального рака, интраокулярной меланомы, опухолей островковых клеток (эндокринная, поджелудочной железы), саркомы Капоши, почки (включая почечно-клеточный), гистиоцитоза клеток Лангерганса, рака гортани, лейкоза (включая острый лимфобластный (ALL), острый миелоидный (AML), хронический лимфоцитарный (CLL), хронический миелогенный (CML), волосистых клеток), рака губ и ротовой полости, рака печени (первичного), лобулярной карциномы in situ (LCIS), рака легкого (немелкоклеточного и мелкоклеточного), лимфомы (СПИД-ассоциированной, Беркитта, кожной Т-клеточной (грибовидная гранулема и синдром Сезари), Ходжкина, неходжкинской, первичного центральной нервной системы (CNS), макроглобулинемии, Вальденстрема, рака молочной железы у мужчин, злокачественной фиброзной гистиостомы кости и остеосаркомы, медуллобластомы, медуллоэпителиомы, меланомы (включая интраокулярную (глаза)), карциномы клеток Меркеля, мезотелиомы (злокачественной), метастатического плоскоклеточного рака шеи со скрытым первичным источником, карциномы срединного тракта, в которой участвует ген NUT, рака рта, синдромов множественной эндокринной неоплазии, множественной миеломы/плазмоклеточного новообразования, грибовидного микоза, миелодиспластических синдромов, миелодиспластических/миелопролиферативных новообразований, миелогенного лейкоза, хронического (CML), миелоидного лейкоза, острого (AML), миеломы и множественной миеломы, миелопролиферативных нарушений (хронических), рака носовой полости и околоносовых пазух, назофарингеального рака, нейробластомы, неходжкинской лимфомы, немелкоклеточногог рак легкого, рака полости рта, рака ротовой полости, губ и, орофарингеального рака, остеосаркомы и злокачественной фиброзной гистиоцитомы кости, рака яичника (такого как эпителиальный, герминогенная опухоль и опухоль с низким злокачественным потенциалом), рака поджелудочной железы (включая опухоли островковых клеток), папилломатоза, параганглиомы, рака околоносовых пазух и носовой полости, рака паращитовидной железы, рака полового члена, фарингеального рака, феохромоцитомы, опухолей паренхимы шишковидной железы промежуточной дифференцировки, пинеобластомы и супратенториальных примитивных нейроэктодермальных опухолей, опухоли гипофиза, плазмоклеточных новообразований/множественной миеломы, плевролегочной бластомы, рака молочной железы во время беременности, первичной лимфомы центральной нервной системы (CNS), рака предстательной железы, рака прямой кишки, почечно-клеточного рака (почки), почечной лоханки и мочеточника, переходноклеточного рака, ретинобластомы, рабдомиосаркомы, рака слюнной железы, саркомы (такой как опухоли семейства саркомы Юинга, Капоши, мягких тканей, матки), синдрома Сезари, рака кожи (такого как меланома, карцинома из клеток Меркеля, немеланома), мелкоклеточного рака легкого, рака тонкой кишки, саркомы мягких тканей, плоскоклеточной карциномы, плоскоклеточного рака шеи со скрытым первичным источником, метастатического, рака желудка (желудочного), супратенториальных примитивных нейроэктодермальных опухолей, Т-клеточной лимфомы (кожной, грибовидного микоза и синдрома Сезари), рака яичка, рака горла, тимомы и карциномы вилочковой железы, рака щитовидной железы, переходноклеточного рака почечной лоханки и мочеточника, трофобластической опухоли (гестационной), с неизвестным первичным источником, атипичных видов рака у детей, мочеточника и почечной лоханки, переходноклеточного рака, рака уретры, рака матки, эндометрия, саркомы матки, макроглобулинемии Вальденстрема или опухоли Вильмса.
В некоторых вариантах осуществления рак, подлежащий лечению, представляет собой рак, специфический по отношению к Т-клеткам, такой как Т-клеточная лимфома и лимфобластный Т-клеточный лейкоз.
В некоторых вариантах осуществления применяют способы, описанные в данном документе, для лечения патологического состояния, включающие введение субъекту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы I или его фармацевтически приемлемой соли, где состояние представляет собой рак, при котором развилась устойчивость к химиотерапевтическим лекарственным средствам и/или ионизирующему излучению.
В некоторых вариантах осуществления соединения и фармацевтические композиции по настоящему изобретению могут быть пригодны в лечении или предупреждении воспалительного заболевания.
В некоторых вариантах осуществления соединения по настоящему изобретению могут применяться для предупреждения или лечения воспалительного заболевания, где воспалительное заболевание представляет собой одно из или вариант вызванного кислотой повреждения легких, акне (PAPA), синдрома острой дыхательной недостаточности, болезни Аддисона, гиперплазии надпочечников, недостаточности коры надпочечников, старения, СПИД, алкогольного гепатита, алкогольного заболевания печени, аллерген-индуцированной астмы, аллергического бронхолегочного аспергиллеза, аллергического конъюнктивита, облысения, болезни Альцгеймера, амилоидоза, бокового амиотрофического склероза, стенокардии, ангионевротического отека, ангидротической эктодермальной дисплазии (например, с иммуннодефицитом), анкилозирующего спондилита, воспаления переднего сегмента, антифосфолипидного синдрома, афтозного стоматита, аппендицита, астмы, атеросклероза, атопического дерматита, аутоиммунных заболеваний, аутоиммунного гепатита, индуцированного укусом пчелы воспаления, болезни Бехчета, паралича Белла, бериллиоза, синдрома Блау, боли в костях, бронхиолита, ожогов, бурсита, гипертрофии сердца, синдрома канала запястья, катаболических нарушений, видов катаракты, аневризмы сосудов головного мозга, индуцированного химическим раздражителем воспаления, хориоретинита, хронической сердечной недостаточности, хронического заболевания легких при незрелости, хронического обструктивного заболевания легких, колита, комплексного регионарногог болевого синдрома, заболевания соединительных тканей, язвы роговицы, болезни Крона, криопирин-ассоциированных периодических синдромов, криптококкоза, кистозного фиброза, дефицита антагониста рецептора интерлейкина-1, дерматита, дерматита с эндотоксемией, дерматомиозита, эндометриоза, эндотоксемии, эпикондилита, эритробластопении, семейной амилоидотической полинейропатии, семейной холодовой крапивницы, семейной средиземноморской лихорадки, задержки развития плода, глаукомы, гломерулярной болезни, гломерулонефрита, подагры, подагрического артрита, реакции трансплантата против хозяина, заболеваний кишечника, повреждения головы, головной боли, потери слуха, заболевания сердца, гемолитической анемии, болезни Шенлейна-Геноха, гепатита, наследственного синдрома перемежающейся лихорадки, опоясывающего и простого герпеса, HIV-1, болезни Гентингтона, синдрома гиалиновых мембран, гипераммониемии, гиперкальцемии, гиперхолестеринемии, гипериммуноглобулинемии D с возвратной лихорадкой, гипопластической и других видов анемии, идиопатического легочного фиброза, идиопатической тромбоцитопенической пурпуры, недержания пигмента, инфекционного мононуклеоза, воспалительного заболевания кишечника, воспалительного заболевания легких, воспалительной нейропатии, воспалительной боли, вызванного укусом насекомого воспаления, ирита, ишемии/реперфузии, ювенильного ревматоидного артрита, кератита, заболевания почек, повреждения почек, обусловленного паразитарными инфекциями, профилактики отторжения трансплантированной почки, лептоспироза, эндокардита Леффлера, повреждения легких, волчанки, волчаночного нефрита, менингита, мезотелиомы, смешанного заболевания соединительных тканей, синдрома Макла-Уэлса (крапивница-глухота-амилоидоз), рассеянного склероза, мышечной атрофии, мышечной дистрофии, злокачественной миастении, миокардита, грибовидного микоза, миелодиспластического синдрома, миозита, назального синусита, некротического энтероколита, мультисистемного воспалительного заболевания неонатального возраста (NOMID), нефротического синдрома, неврита, нейропатологических заболеваний, индуцированной отличными от аллергии факторами астмы, ожирения, аллергических заболеваний глаз, неврита зрительного нерва, трансплантации органов, остеоартрита, отита среднего уха, болезни Паджета, боли, панкреатита, болезни Паркинсона, пузырчатки, перикардита, перемежающейся лихорадки, периодонтита, коклюша, промежностного или перитонеального эндометриоза, фарингита и аденита (синдром PFAPA), индуцированного растительным раздражителем воспаления, плазмоклеточной инфекции, пневмонии, пневмонита, индуцированного сумахом/урушиоловым маслом воспаления, нодозного полиартериита, полихондрита, поликистозного заболевания почек, полимиозита, псориаза, заболевания, вызванного психологическим стрессом, заболевания легких, фиброза легких, легочной гипертензии, гангренозной приодермии, пиогенного стерильного артрита, заболевания почек, заболевания сетчатки глаза, ревматоидного заболевания, ревматоидного артрита, ревматического кардита, саркоидоза, себореи, сепсиса, сильной боли, серповидного эритроцита, серповидноклеточной анемии, индуцированных диоксидом кремния заболеваний, синдрома Шегрена, заболеваний кожи, апноэ во сне, повреждения спинного мозга, синдрома Стивенса-Джонсона, инсульта, субарахноидального кровоизлияния, солнечного ожога, системного склероза (склеродермии), темпорального артериита, теносиновита, тромбоцитопении, тиреоидита, трансплантации тканей, ассоциированного с рецептором TNF периодического синдрома (TRAPS), токсоплазмоза, трансплантации, травматического повреждения головного мозга, туберкулеза, диабета 1 типа, диабета 2 типа, язвенного колита, крапивницы, увеита, гранулематоза Вегенера и потери веса.
Таким образом, в другом аспекте в некоторых вариантах осуществления предусмотрены способы лечения опосредованного монокарбоксилат-транспортером МСТ4 нарушения у субъекта, нуждающегося в этом, включающие стадию введения указанному пациенту соединения, раскрытого в данном документе, или его фармацевтически приемлемой соли.
В некоторых вариантах осуществления субъект представляет собой человека.
В некоторых вариантах осуществления опосредованное монокарбоксилат-транспортером МСТ4 нарушение выбрано из воспалительного нарушения и пролиферативного нарушения.
В некоторых вариантах осуществления опосредованное монокарбоксилат-транспортером МСТ4 нарушение представляет собой пролиферативное нарушение.
В некоторых вариантах осуществления пролиферативное нарушение представляет собой рак.
В некоторых вариантах осуществления рак выбран из аденокарциномы, Т-клеточного лейкоза/лимфомы у взрослого, рака мочевого пузыря, бластомы, рака кости, рака молочной железы, рака головного мозга, карциномы, миелоидной саркомы, рака шейки матки, колоректального рака, рака пищевода, рака желудочно-кишечного тракта, мультиформной глиобластомы, глиомы, рака желчного пузыря, рака желудка, рака головы и шеи, лимфомы Ходжкина, неходжкинской лимфомы, рака кишечника, рака почки, рака гортани, лейкоза, рака легкого, лимфомы, рака печени, мелкоклеточного рака легкого, немелкоклеточного рака легкого, мезотелиомы, множественной миеломы, рака глаза, опухоли зрительного нерва, рака полости рта, рака яичника, опухоли гипофиза, первичной лимфомы центральной нервной системы, рака предстательной железы, рака поджелудочной железы, фарингеального рака, почечноклеточной карциномы, рака прямой кишки, саркомы, рака кожи, опухоли спинного мозга, рака тонкой кишки, рака желудка, Т-клеточной лимфомы, рака яичка, рака щитовидной железы, рака горла, рака органов мочеполовой системы, уротелиальной карциномы, рака матки, рака влагалища и опухоли Вильмса.
В некоторых вариантах осуществления опосредованное монокарбоксилат-транспортером МСТ4 нарушение представляет собой воспалительное нарушение.
В некоторых вариантах осуществления воспалительное нарушение выбрано из болезни Крона, язвенного колита, идиопатического легочного фиброза, мышечной дистрофии, ревматоидного артрита и системного склероза (склеродермии).
Также в данном документе предусмотрено соединение, раскрытое в данном документе, или его фармацевтически приемлемая соль для применения в терапии человека.
Также в данном документе предусмотрено соединение, раскрытое в данном документе, или его фармацевтически приемлемая соль для применения в лечении опосредованного монокарбоксилат-транспортером МСТ4 нарушения, например, как раскрыто в любом из вышеуказанных вариантов осуществления и абзацев, которые относятся к способам лечения.
Также в данном документе предусмотрено применение соединения, раскрытого в данном документе, или его фармацевтически приемлемой соли для изготовления лекарственного препарата, предназначенного для лечения опосредованного монокарбоксилат-транспортером МСТ4 нарушения, например, как раскрыто в любом из вышеуказанных вариантов осуществления и абзацев, которые относятся к способам лечения.
Метаболический синдром (также известный как метаболический синдром X) характеризуется наличием по меньшей мере трех из следующих симптомов: резистентность к инсулину; абдоминальный жир - у мужчин он определяется как обхват талии 40 дюймов или больше, у женщин - 35 дюймов или больше; высокие уровни сахара в крови - по меньшей мере 110 миллиграмм на децилитр (мг/дл) после голодания; высокий уровень триглицеридов - по меньшей мере 150 мг/дл в кровотоке; низкий уровень HDL - менее 40 мг/дл; протромботическое состояние (например, высокий уровень фибриногена или ингибитора активатора плазминогена в крови); или кровяное давление, составляющее 130/85 мм рт.ст. или выше. Была обнаружена взаимосвязь между метаболическим синдромом и другими состояниями, такими как ожирение, высокое кровяное давление и высокие уровни холестерина LDL, все из которых представляют собой факторы риска сердечно-сосудистых заболеваний. Например, была показана повышенная связь между метаболическим синдромом и атеросклерозом. Люди с метаболическим синдром также имеют большую склонность к развитию диабета 2 типа, а также PCOS (синдром поликистоза яичников) у женщин и рака предстательной железы у мужчин.
Как описано выше, резистентность к инсулину может проявляться несколькими путями, включая диабет 2 типа. Диабет 2 типа является состоянием, наиболее явно связанным с резистентностью к инсулину. Компенсаторная гиперинсулинемия помогает поддерживать нормальные уровни глюкозы, часто в течение десятилетий, до того, как разовьется явный диабет. В конце концов, бета-клетки поджелудочной железы становятся не способны преодолеть резистентность к инсулину посредством гиперсекреции. Уровни глюкозы повышаются, и можно поставить диагноз диабета. У пациентов с диабетом 2 типа сохраняется гиперинсулинемия, пока у них не развивается поздняя стадия заболевания. Как описано выше, резистентность к инсулину также может коррелировать с гипертензией. Одна половина пациентов с существенной гипертензией характеризуется резистентностью к инсулину и гиперинсулинемией, и это является фактом того, что кровяное давление связано со степенью резистентности к инсулину. Гиперлипидемия также ассоциирована с резистентностью к инсулину. Липидный профиль пациентов с диабетом 2 типа включает повышенные уровни холестерина липопротеинов очень низкой плотности и триглицеридов в сыворотке крови и иногда повышенный уровень холестерина липопротеинов низкой плотности. Резистентность к инсулину была обнаружена у людей с очень низкими уровнями липопротеина высокой плотности. Уровни инсулина также были связаны с синтезом липопротеина очень низкой плотности и уровнями триглицеридов в плазме крови.
Соответственно, также раскрыты способы лечения резистентности к инсулину у субъекта, включающие выбор субъекта, нуждающегося в лечении в отношении резистентности к инсулину; и введение субъекту эффективного количества соединения, которое обеспечивает подавление МСТ4.
Конкретные заболевания, подлежащие лечению с помощью соединений, композиций и способов, раскрытых в данном документе, представляют собой заболевания, опосредованные по меньшей мере частично МСТ4. Соответственно, в данном документе раскрыты способы уменьшения накопления гликогена у субъекта; повышения уровней HDL или HDLc, понижения уровней LDL или LDLc, сдвига размера частиц LDL от низкой плотности к нормальным LDL, понижения уровней VLDL, понижения уровней триглицеридов или подавления всасывания холестерина у субъекта; уменьшения резистентности к инсулину, улучшения в отношении усвоения глюкозы или снижения кровяного давления у субъекта; уменьшения висцерального жира у субъекта; снижения уровней трансаминаз в сыворотке крови у субъекта; или лечения заболевания; при этом все включают введение терапевтического количества соединения, описанного в данном документе, пациенту, нуждающемуся в этом. В дополнительных вариантах осуществления заболевание, подлежащее лечению, может представлять собой метаболическое заболевание. В дополнительном варианте осуществления метаболическое заболевание может быть выбрано из группы, состоящей из ожирения, сахарного диабета, в частности, диабета 2 типа, гиперинсулинемии, нарушения толерантности к глюкозе, метаболического синдрома X, дислипидемии, гипертриглицеридемии, гиперхолестеринемии и стеатоза печени. В других вариантах осуществления заболевание, подлежащее лечению, может быть выбрано из группы, состоящей из сердечно-сосудистых заболеваний, в том числе сосудистого заболевания, атеросклероза, коронарной болезни сердца, цереброваскулярного заболевания, сердечной недостаточности и заболевания периферических сосудов. В предпочтительных вариантах осуществления вышеупомянутые способы не приводят в результате к индукции или поддержанию гипогликемического состояния.
Кроме того, что они являются пригодными для лечения человека, некоторые соединения и составы, раскрытые в данном документе, также могут быть пригодны для ветеринарного лечения домашних животных, экзотических животных и сельскохозяйственных животных, включая млекопитающих, грызунов и т.п. Более предпочтительные животные включают лошадей, собак и кошек. Список сокращений
Ас2О = уксусный ангидрид; AcCl = ацетилхлорид; АсОН = уксусная кислота; AIBN = азобисизобутиронитрил; водн. = водный; Ar = ароматическая группа; BAST = трифторид бис(2-метоксиэтил)аминосеры; BCECF = 2',7'-бис(карбоксиэтил)-5(6)-карбоксифлюоресцеин; Bu = бутил; Bu3SnH = гидрид трибутилолова; CD3OD = дейтерированный метанол; CDCl3 = дейтерированный хлороформ; CDI = 1,1'-карбонилдиимидазол; DAST = трифторид (диэтиламино)серы; dba = дибензилиденацетон; DBU = 1,8-диазабицикло[5.4.0]ундец-7-ен; DCM = дихлорметан; DEAD = диэтилазодикарбоксилат; DIAD = диизопропилазодикарбоксилат; DIBAL-H = гидрид диизобутилалюминия; DIEA = DIPEA = N,N-диизопропилэтиламин; DMAP = 4-диметиламинопиридин; DMF = N,N-диметилформамид; DMSO-d6 = дейтерированный диметилсульфоксид; DMSO = диметилсульфоксид; DPPA = дифенилфосфорилазид; dppf = 1,1'-бис(дифенилфосфино)ферроцен; EDC⋅HCl = EDCI⋅HCl = гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида; Et = этил; Et2O = диэтиловый эфир; EtOAc = этилацетат; EtOH = этанол; ч. = час; HATU = 2-(1Н-7-азабензотриазол-1-ил)-1,1,3,3-тетраметилурония гексафторфосфат метанаминия; HMDS = гексаметилдисилазан; НОВТ = 1-гидроксибензотриазол; i-Pr = изопропил = 2-пропил; i-PrOH = изопропанол; LAH = алюмогидрид лития; LDA = диизопропиламид лития; LiHMDS = бис(триметилсилил)амид лития; MeCN = ацетонитрил; MeI = йодистый метил; МеОН = МеОН; MP-карбонатная смола = макропористая карбонатная смола на основе триэтиламмония-метилполистирола; MsCl = мезилхлорид; МТВЕ = метил-трет-бутиловый эфир; n-BuLi = н-бутиллитий; NaHMDS = бис(триметилсилил)амид натрия; NaOEt = этоксид натрия; NaOMe = метоксид натрия; NaOtBu = трет-бутоксид натрия; NBS = N-бромсукцинимид; NCS = N-хлорсукцинимид; NIS = N-йодсукцинимид; NMP = N-метил-2-пирролидон; Pd(PPh3)4 = тетракис(трифенилфосфин)палладий(0); Pd2(dba)3 = трис(дибензилиденацетон)дипалладий(0); PdCl2(PPh3)2 = дихлорид бис(трифенилфосфин)палладия(II); PG = защитная группа; Ph = фенил; prep-HPLC = препаративная высокоэффективная жидкостная хроматография; РМВ = пара-метоксибензил; PMBCl = пара-метоксибензилхлорид; РМВОН = пара-метоксибензиловый спирт; PyBop = гексафторфосфат (бензотриазол-1-илокси)трипирролидинофосфония; Pyr = пиридин; к.т. = комнатная температура; RuPhos = 2-дициклогексилфосфино-2',6'-диизопропоксибифенил; насыщ. = насыщенный; ss = насыщенный раствор; tBu = t-Bu = трет-бутил = 1,1-диметилэтил; TBAF = фторид тетрабутиламмония; TBDPS = трет-бутилдифенилсилил; t-BuOH = трет-бутанол; Т3Р = пропилфосфоновый ангидрид; TEA = Et3N = триэтиламин; TFA = трифторуксусная кислота; TFAA = трифторуксусный ангидрид; THF = тетрагидрофуран; TIPS = триизопропилсилил; Tol = толуол; TsCl = тозилхлорид; Trt = тритил = (трифенил)метил; Xantphos = 4,5-бис(дифенилфосфино)-9,9-диметилксантен; XPhos = 2-дициклогексилфосфино-2',4',6'-триизопропилбифенил.
Общие синтетические способы получения соединений
Следующие схемы можно применять для осуществления на практике настоящего изобретения.
Схема I
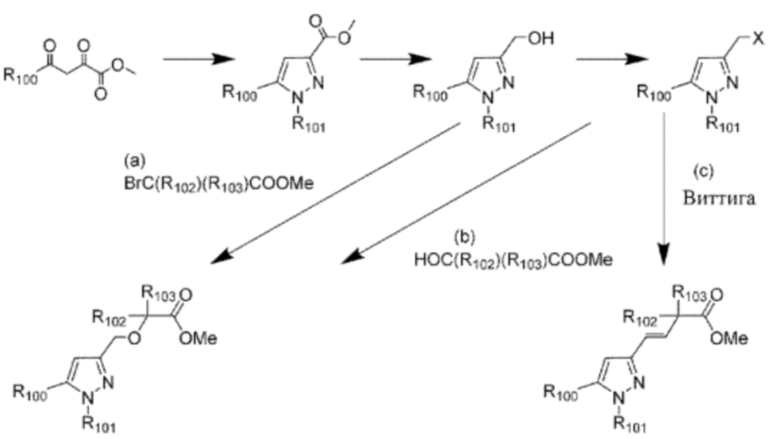
В целом, не будучи предназначенной для ограничения, схема синтеза для примеров в данном изобретении изображена на схеме I. Осуществляют реакцию подходящим образом замещенного сложного эфира 2,4-дикетобутановой кислоты с замещенным гидразином с образованием пиразольного ядра. Восстановление сложного эфира приводит к получению гидроксиметильного соединения. Боковая цепь может быть завершена с помощью прямого алкилирования с помощью сложного эфира, содержащего галоген в 2-положении, как показано в пути (а). В качестве альтернативы гидроксиметильную функциональную группу превращают в галогенметильную группу, которая может претерпевать замещение с помощью сложного 2-гидроксиэфира, как показано в пути (b), или трансформироваться посредством химической реакции Виттига, как показано в пути (с), с получением алкена.
Схема II
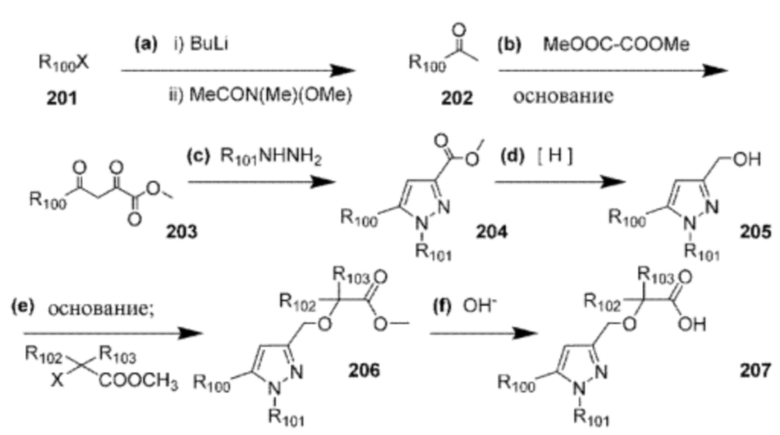
Схема II, изображенная выше, может применяться для получения некоторых примеров, раскрытых в данном документе. На стадии (а) органогалогенид 201 превращают в органолитий с последующей конденсацией с помощью замещенного ацетамида с получением ацетильного функционализированного соединения 202. Осуществляют реакцию этого соединения на стадии (b) при условиях реакции Клайзена со сложным эфиром щавелевой кислоты с получением сложного 2,4-дикетоэфира 203, который затем вводят в реакцию с замещенным гидразином на стадии (с) с конструированием пиразольного ядра 204. Функциональную группу сложного эфира восстанавливают на стадии (d), а на стадии (е) полученный спирт 205 алкилируют с подходящим сложным эфиром галогенуксусной кислоты с получением эфира 206. Наконец, сложный эфир гидролизуют на стадии (f) при основных условиях с получением карбоновой кислоты 207. На изображенной схеме R100-R103, как будет понятно специалисту в данной области техники, представляют собой любую подходящую группу. Например, в некоторых вариантах осуществления R100 и R101 могут быть независимо выбраны из арила, циклоалкила, гетероциклоалкила и гетероарила, любой из которых необязательно замещен. Подобным образом, в некоторых вариантах осуществления R102 и R103 могут быть независимо выбраны из водорода, алкила и галогена. R100-R103 также могут соответствовать группам, определенным в формулах I, II, или любой другой формуле, раскрытой в данном документе. Наконец, данную схему можно присоединять в любой точке путем использования подходящего промежуточного соединения, показанного в данном документе, которое доступно либо из коммерческих источников, либо посредством замещающих способов синтеза.
Схема III
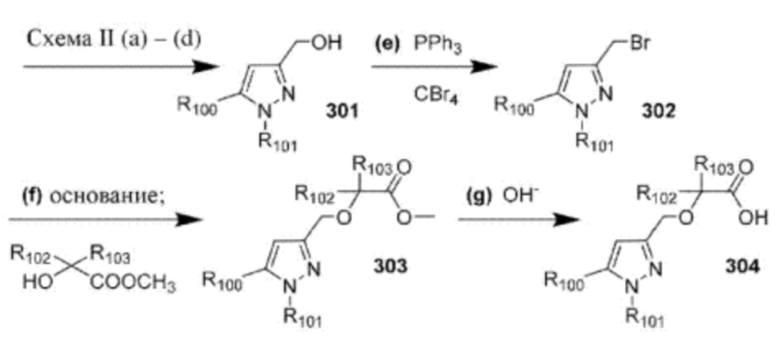
Схема III, изображенная выше, может применяться для получения некоторых иллюстративных соединений, раскрытых в данном документе. Стадии (а)-(d) из схемы I применяют для получения пиразолметанола 301, который затем превращают в бромметильное соединение 302 на стадии (е) с применением одной из различных методик, доступных для данного преобразования. Затем осуществляют реакцию алкилгалогенида 302 при условиях реакции синтеза простых эфиров Вильямсона со сложным гидроксиэфиром на стадии (f) с получением 303. Синтез затем завершают на стадии (g) гидролизом сложного эфира с получением 304.
Схема IV
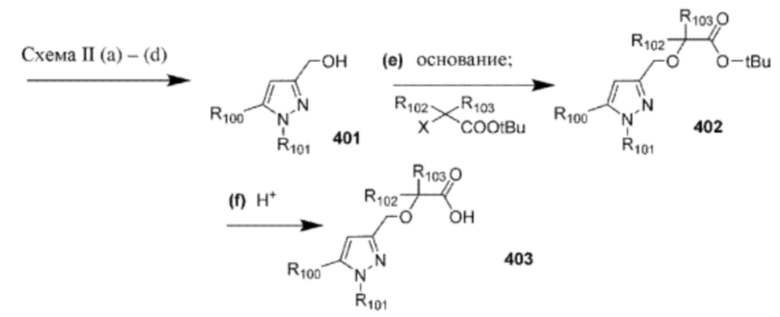
Схема IV, изображенная выше, может применяться для получения некоторый иллюстративных соединений, раскрытых в данном документе. Стадии (а)-(d) из схемы I применяют с получением пиразолметанола 401, который алкилируют с получением сложного tBu-эфира 402. Расщепление сложного эфира осуществляют при кислотных условиях с получением кислоты 403.
Схема V
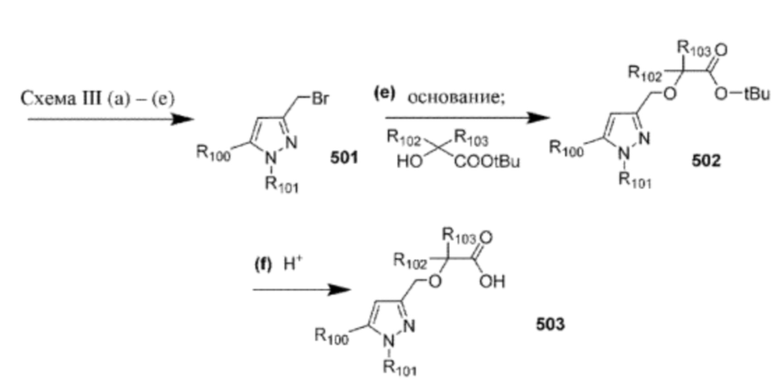
Схема V, изображенная выше, может применяться для получения некоторый иллюстративных соединений, раскрытых в данном документе. Стадии (а)-(е) из схемы III применяют с получением (бромметил)пиразола 501. Реакция со сложным гидроксиэфиром при основных условиях приводит к получению сложного tBu-эфира 502. Расщепление сложного эфира осуществляют при кислотных условиях с получением кислоты 503.
Схема VI

Схема VI, изображенная выше, может применяться для получения некоторых иллюстративных соединений, раскрытых в данном документе. Фенилацетон конденсируют со сложным эфиром щавелевой кислоты с получением сложного эфира 5-фенилпентановой кислоты 601. Конденсация с помощью замещенного гидразина обеспечивает образование пиразольного ядра 602. Восстановление сложного эфира, алкилирование спирта и гидролиз сложного эфира продолжаются, как указано ранее. Синтез кислоты 603 завершают с применением либо стадий (d)-(f) из схемы II, либо стадий (d)-(g) из схемы III.
Схема VII
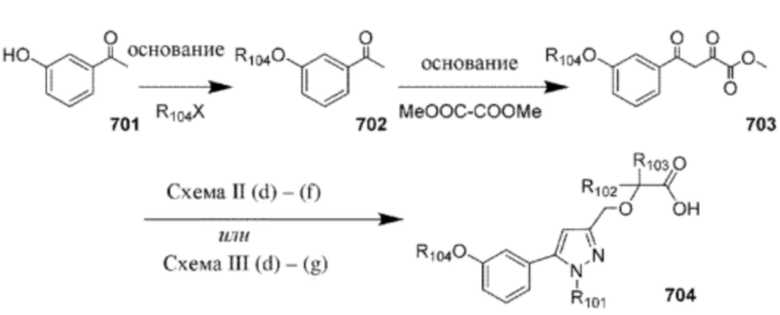
Схема VII, изображенная выше, может применяться для получения некоторых иллюстративных соединений, раскрытых в данном документе. Ацетилированное гидроксиарильное соединение 701 вступает в реакцию при условиях реакции синтеза простых эфиров Вильямсона с алкилгалогенидом или сходным соединением с получением алкоксиарильного соединения 702. Конденсация со сложным эфиром щавелевой кислоты приводит к получению сложного 2,4-дикетоэфира 703, как на схеме II. Синтез завершают с применением либо стадий (d)-(f) из схемы II, либо стадий (d)-g) из схемы III.
Схема VIII
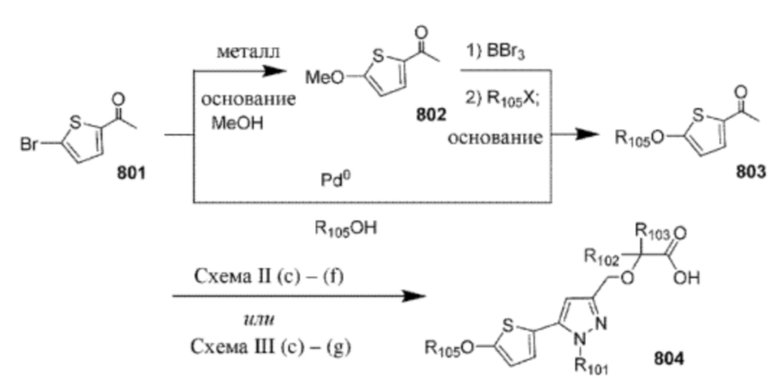
Схема VIII, изображенная выше, может применяться для синтеза некоторых иллюстративных соединений, раскрытых в данном документе. Бромарильное соединение 801 превращают в метоксиарильное соединение 802 в присутствии подходящего металлического катализатора в присутствии основания. Метиловый эфир расщепляют с помощью кислоты Льюиса. Полученное гидроксильное соединение вводят в реакцию при условиях реакции синтеза простых эфиров Вильямсона с получением алкоксиарильного соединения 803. В качестве альтернативы, осуществляют непосредственную реакцию бромарильного соединения со спиртом, представляющим интерес, с получением необходимого эфира 803 напрямую. На изображенной схеме R100-R106, как будет понятно специалисту в данной области техники, представляют собой любую подходящую группу. Синтез 804 завершают с применением либо стадий (с)-(f) из схемы II, либо стадий (с)-(g) из схемы III.
Схема IX
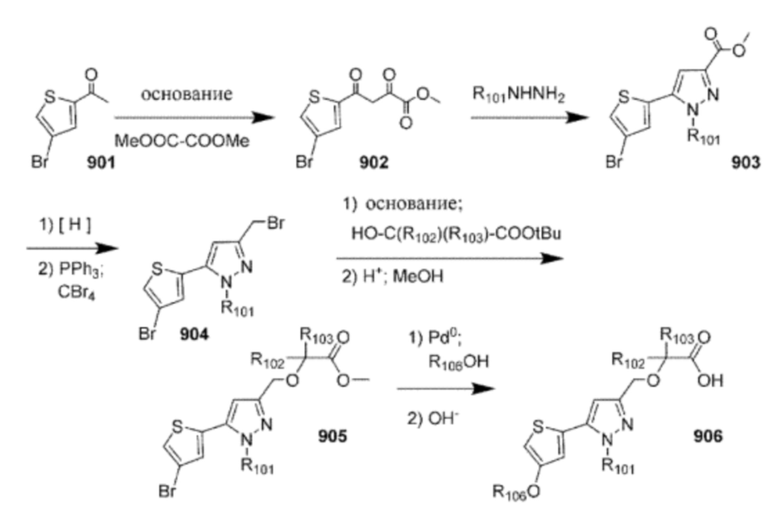
Схема IX, изображенная выше, может применяться для синтеза некоторых иллюстративных соединений, раскрытых в данном документе. Бромарильное соединение 901 превращают в (бромметил)пиразол 904. Осуществляют реакцию соединения при условиях реакции синтеза простых эфиров Вильямсона с подходящим сложным гликолевым эфиром с получением эфира 905. После переэтерификации со сложным метиловым эфиром 905 следует замещение арилбромида с применением подходящего катализатора Pd0. Синтез завершают с помощью щелочного гидролиза сложного метилового эфира с получением кислоты 906.
Схема X
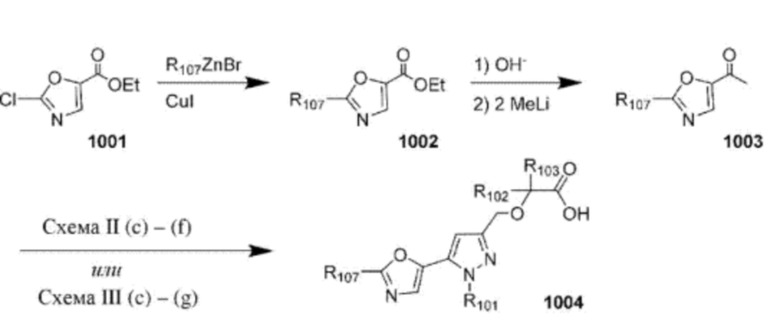
Схема X, изображенная выше, может применяться для синтеза некоторых иллюстративных соединений, раскрытых в данном документе. Сложный эфир хлорарилкарбоновой кислоты 1001 сочетают с органоцинковым реагентом в присутствии йодида меди(1) с получением 1002. Функциональную группу сложного эфира превращают в метилкетон 1003. Конденсация с диэтилоксалатом обеспечивает получение соединения, представляющего собой β-дикетон. Синтез 1004 завершают с применением либо стадий (с)-(f) из схемы II, либо стадий (с)-(g) из схемы III.
Схема XI
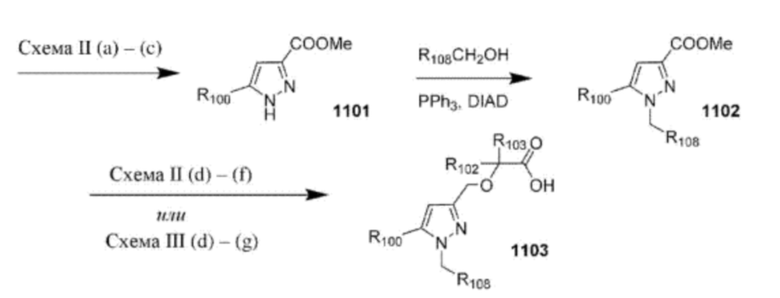
Схема XI, изображенная выше, может применяться для синтеза некоторых иллюстративных соединений, раскрытых в данном документе. Сложный пиразольный эфир 1101 получают посредством стадий (а)-(с) схемы II. Соединение при условиях реакции Мицунобу сочетают с подходящим спиртом с получением алкилированного продукта 1102. Синтез кислоты 1103 завершают с применением либо стадий (d) - (f) из схемы II, либо стадий (d) - (g) из схемы III.
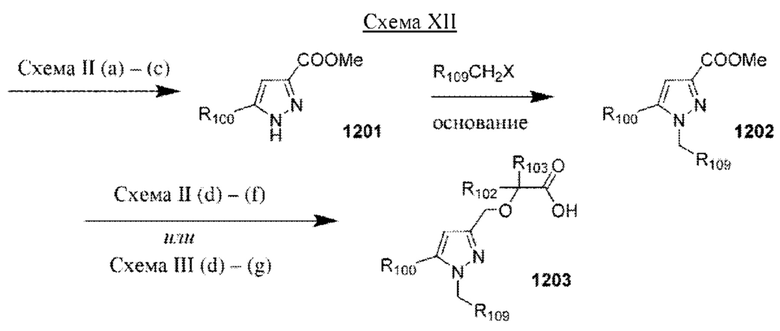
Схема XII, изображенная выше, может применяться для синтеза некоторых иллюстративных соединений, раскрытых в данном документе. Сложный пиразольный эфир 1201 получают посредством стадий (а) - (с) схемы II. Соединение сочетают с алкилгалогенидом в присутствии основания с получением 1202. Синтез кислоты 1203 завершают с применением либо стадий (d) - (f) из схемы II, либо стадий (d) - (g) из схемы III.
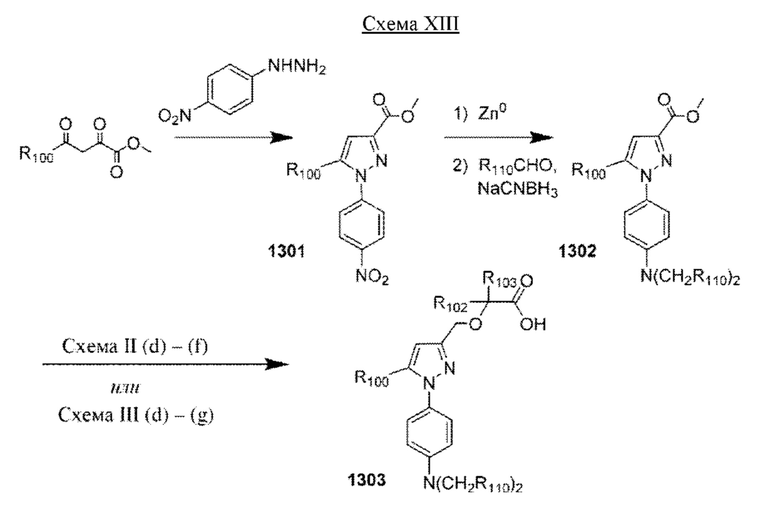
Схема XIII, изображенная выше, может применяться для получения определенных иллюстративных соединений, раскрытых в данном документе. Сложный 2,4-дикетоэфир конденсируют с нитроароматическим соединением, таким как 4-нитроанилин, с получением пиразольного фрагмента 1301. После восстановления нитрогруппы следует восстановительное аминирование с получением (диалкил)аминосоединения 1302. Синтез кислоты 1303 завершают с применением либо стадий (d) - (f) из схемы II, либо стадий (d) - (g) из схемы III.
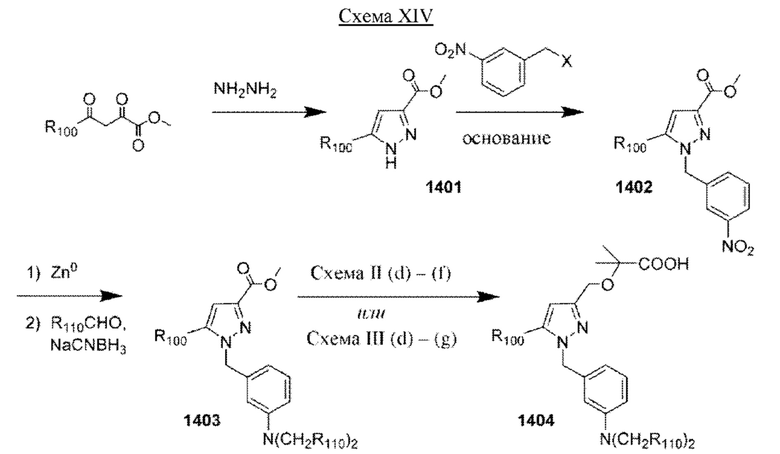
Схема XIV, изображенная выше, может применяться для синтеза некоторых иллюстративных соединений, раскрытых в данном документе. Сложный 2,4-дикетоэфир конденсируют с гидразином с образованием пиразола 1401, который затем алкилируют с помощью замещенного бензилбромида с получением 1402. После восстановления до амина следует восстановительное алкилирование с получением замещенного амина 1403. Синтез кислоты 1404 завершают с применением либо стадий (d) - (f) из схемы II, либо стадий (d) - (g) из схемы III.
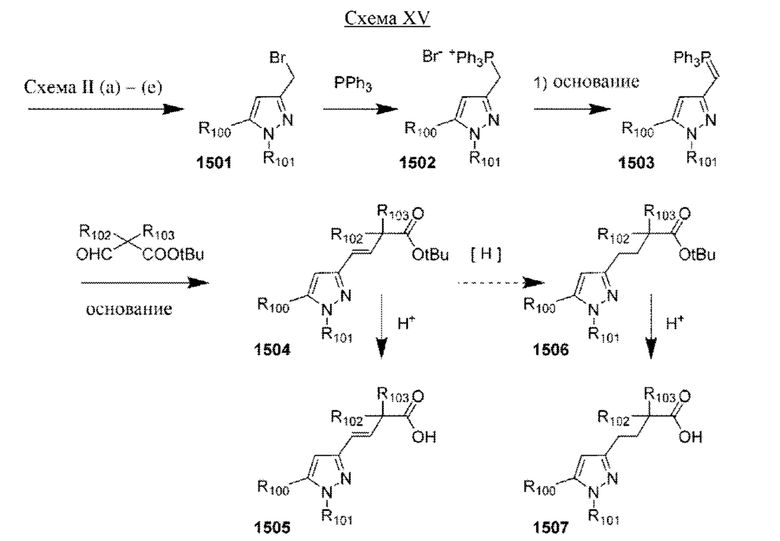
Схема XV, изображенная выше, может применяться для синтеза некоторых иллюстративных соединений, раскрытых в данном документе. (Бромметил)пиразол 1501, полученный посредством стадий (а) - (е) схемы II, превращают в соль фосфония 1502. Обработка с помощью основания обеспечивает образование фосфоранилида 1503; реакция Виттига с подходящим альдегидом обеспечивает получение алкена 1504. Алкен может быть необязательно гидрогенизирован с получением алкана 1506. Синтез завершают гидролизом сложного эфира с получением алкена 1505 или алкана 1507, соответственно.
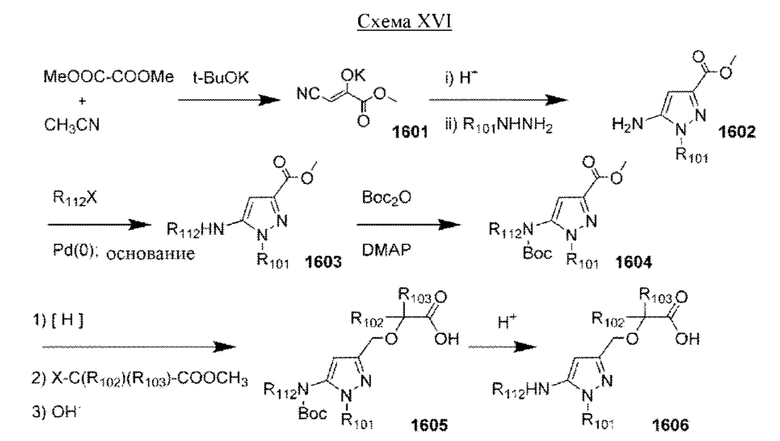
Схема XVI, изображенная выше, может применяться для получения некоторых иллюстративных соединений, раскрытых в данном документе. Ацетонитрил конденсируют со сложным эфиром щавелевой кислоты с получением продукта, представляющего собой сложный кетоэфир, который может быть выделен в виде его соли 1601. После нейтрализации соли следует конденсация с замещенным гидразином с получением 5-аминопиразольного соединения 1602. Затем функциональную аминогруппу замещают посредством реакции с органогалогенидом в опосредованной палладием (0) реакции с получением 1603, а затем вводят защитную группу в виде его Вос-карбамата 1604. Восстановление сложного эфира, алкилирование спирта и гидролиз сложного эфира продолжаются, как указано ранее, с получением кислоты 1605. Защитную Вос-группу удаляют в кислотных условиях с получением 1606.
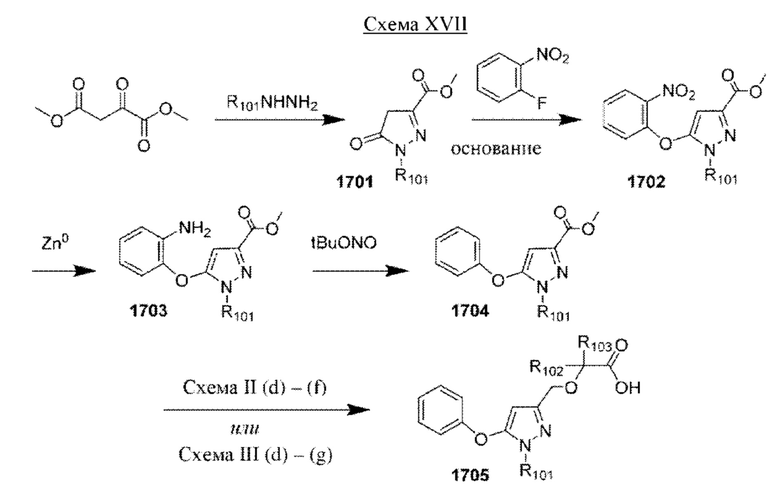
Схема XVII, изображенная выше, может применяться для получения некоторых иллюстративных соединений, раскрытых в данном документе. Сложный эфир 2-кетоянтарной кислоты конденсируют с замещенным гидразином с получением 5-гидроксипиразольного соединения 1701, показанного в данном документе в виде его кетотаутомера. Гидроксигруппу алкилируют с помощью электрофильного арена, такого как 2-фторнитробензол, с получением эфира 1702. Функциональную нитрогруппу удаляют путем поэтапного восстановления с цинком(0) до амина 1703 с последующим дезаминированием с помощью алкилнитрита с получением 1704. Синтез кислоты 1705 завершают с применением либо стадий (d) - (f) из схемы II, либо стадий (d) - (g) из схемы III.

Схема XVIII, изображенная выше, может применяться для получения некоторых иллюстративных соединений, раскрытых в данном документе. Осуществляют реакцию нитроацетофенона 1801 при условиях реакции Клайзена со сложным эфиром щавелевой кислоты с получением сложного 2,4-дикетоэфира 1802, который затем вводят в реакцию с замещенным гидразином на стадии (с) с конструированием пиразольного ядра 1803, которое алкилируют с получением 1804. Функциональную группу сложного эфира восстанавливают до спирта (не показано) и алкилируют с получением сложного эфира 1805. В данной точке нитрогруппу восстанавливают с помощью цинка с получением амина 1806 и ацилируют с применением стандартных реагентов для реакции сочетания с получением амида 1807. Синтез завершают основным гидролизом сложного эфира с получением карбоновой кислоты 1808.
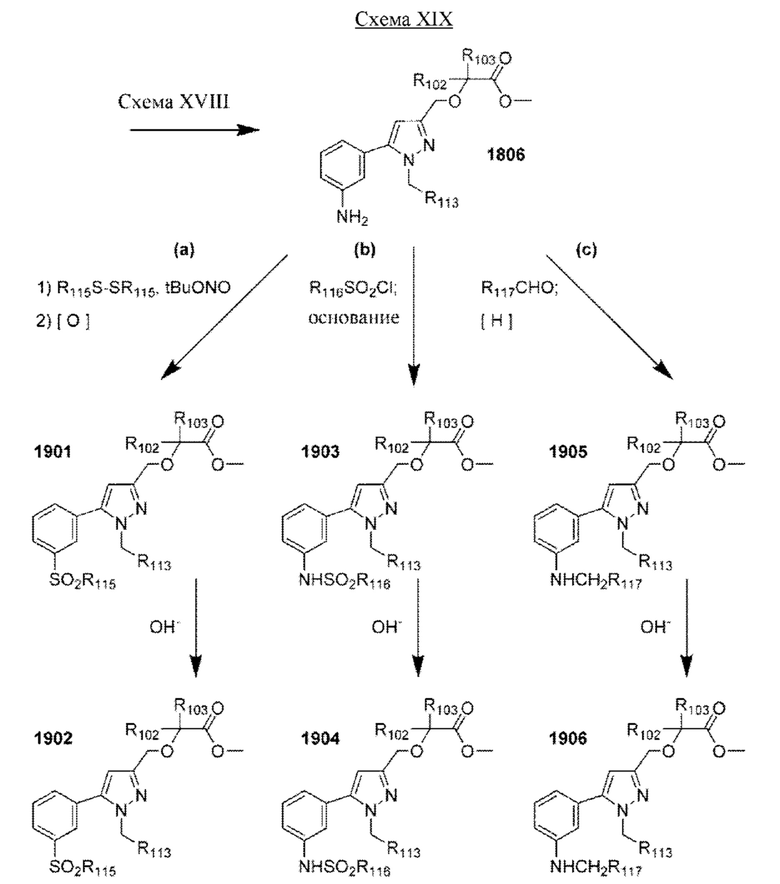
Схема XIX, изображенная выше, может применяться для получения некоторых иллюстративных соединений, раскрытых в данном документе. В пути (а) амин 1806, полученный с применением способа схемы XVIII, обрабатывают органонитритом в присутствии дисульфида с получением тиоэфира, который окисляют до сульфона 1901. В пути (b) амин 1806 вводят в реакцию с сульфонилхлоридом с получением сульфонамида 1903. В пути (с) амин 1806 обрабатывают альдегидом при условиях восстановительного аминирования с получением амина 1905. В путях (а), (b) и (с) синтез завершают основным гидролизом сложного эфира с получением карбоновой кислоты 1902, 1904 и 1906 соответственно.
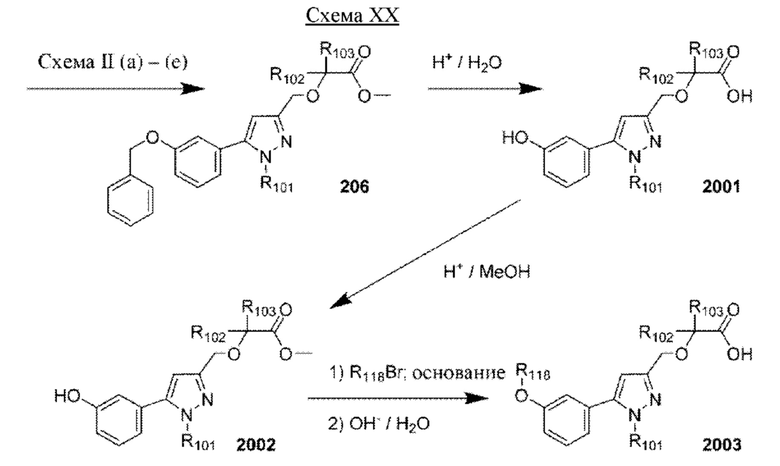
Схема XX, изображенная выше, может применяться для получения некоторых иллюстративных соединений, раскрытых в данном документе. Бензиловый эфир 206 получают с применением стадий (а) - (е) схемы II. Обработка кислотой обеспечивает расщепление как эфирной группы, так и сложного метилового эфира с получением кислоты 2001. При необходимости, синтез может быть продолжен с помощью реакции этерификации Фишера до 2002, алкилированием фенола при основных условиях и гидролизом сложного метилового эфира с получением кислоты 2003.
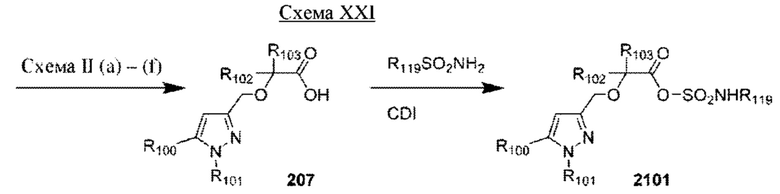
Схема XXI, изображенная выше, может применяться для получения некоторых иллюстративных соединений, раскрытых в данном документе. Карбоновую кислоту 207 получают с применением стадий (а) - (f) схемы II. Обработка кислоты алкилсульфонамидом обеспечивает получение сложного эфира 2101.
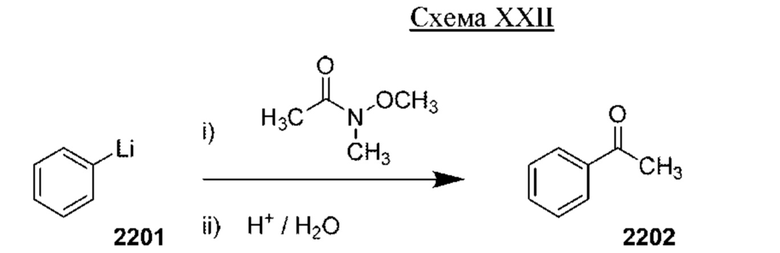
Схема XXII, изображенная выше, может применяться для получения определенных иллюстративных соединений, раскрытых в данном документе. Ариллитий 2201, полученный литированием, обменом галоген-металл или другими способами, которые доступны в области техники, вводят в реакцию с N-метил-N-метоксиацетамидом, что обеспечивает получение ацетильного соединения 2202, которое может быть превращено в необходимый продукт посредством любой из предыдущих схем.
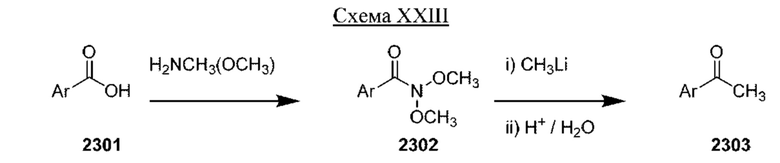
Схема XXIII, изображенная выше, может применяться для получения определенных иллюстративных соединений, раскрытых в данном документе. Карбоновую кислоту 2301 превращают в соответствующий алкоксиамид 2302 с применением стандартных процедур образования амидов. Алкоксиамид затем вводят в реакцию с подходящим органолитиевым реагентом, что обеспечивает получение кетонного соединения 2303, которое может быть превращено в необходимый продукт посредством любой из предыдущих схем.
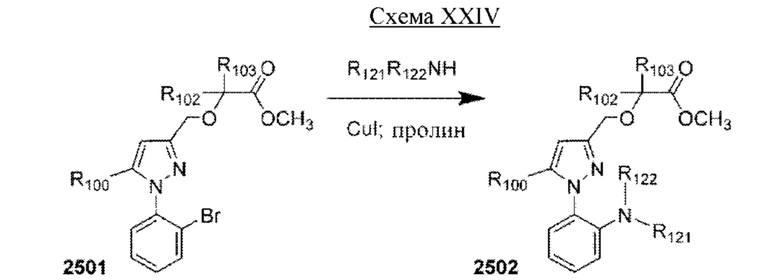
Схема XXIV, изображенная выше, может применяться для получения определенных иллюстративных соединений, раскрытых в данном документе. Арилгалогенид 2401, полученный с применением любого из способов, раскрытых в данном документе, превращают в соответствующий ариламин 2402. Данное преобразование можно осуществить с помощью катализатора на основе меди или других методик, известных из уровня техники. Синтез затем может быть завершен с применением способов, раскрытых в данном документе.
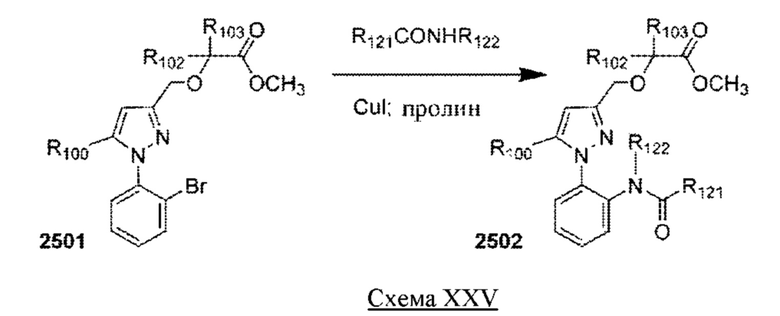
Схема XXV, изображенная выше, может применяться для получения определенных иллюстративных соединений, раскрытых в данном документе. Арилгалогенид 2501, полученный с применением любого из способов, раскрытых в данном документе, превращают в соответствующий ариламид 2502. Данное преобразование можно осуществить с помощью катализатора на основе меди или других методик, известных из уровня техники. Синтез затем может быть завершен с применением способов, раскрытых в данном документе.
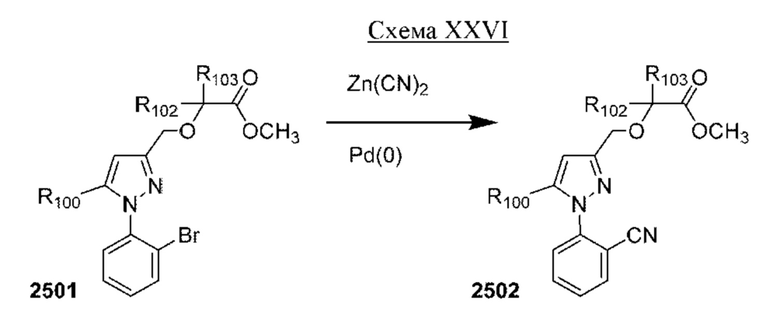
Схема XXVI, изображенная выше, может применяться для получения определенных иллюстративных соединений, раскрытых в данном документе. Арилгалогенид 2601, полученный с применением любого из способов, раскрытых в данном документе, превращают в соответствующий арилнитрил 2602. Данное преобразование можно осуществить с помощью катализатора на основе Pd или других методик, известных из уровня техники. Синтез затем может быть завершен с применением способов, раскрытых в данном документе.
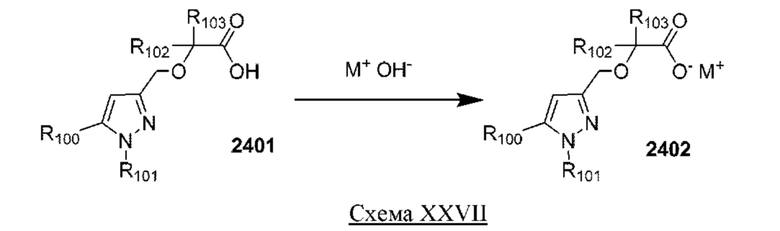
Схема XXVII, изображенная выше, может применяться для получения определенных иллюстративных соединений, раскрытых в данном документе. Карбоновую кислоту 2701, полученную с применением любого из способов, раскрытых в данном документе, превращают в соответствующий карбоксилатную соль 2702. Данное преобразование можно осуществлять с помощью гидроксида металла или оксида металла. Металл может быть выбран из щелочных металлов, щелочноземельных металлов или других металлов.

Схема XXVIII, изображенная выше, может применяться для получения определенных иллюстративных соединений, раскрытых в данном документе. Ар ильный или гетероарильный галогенид 2801 превращают в соответствующий гидразин 2802. Синтез пиразольного ядра проводят посредством конденсации с подходящим карбонильным соединением, как раскрыто в данном документе. Функциональная аминогруппа в арильном или гетероарильном фрагменте 2801 может быть защищена с помощью присоединения подходящей защитной группы, такой как защитная SEM-группа. Защитную группа можно удалить в удобной точке синтеза с применением способов, известных из уровня техники.
Промежуточные соединения
Следующие промежуточные соединения синтезировали для применения в получении соединений по настоящему изобретению.
Промежуточное соединение А-1: 1-(1-метил-1Н-индол-6-ил)этан-1-он
6-Бром-1-метил-1H-индол. Смесь 6-бром-1H-индола (5 г, 25,50 ммоль, 1,00 эквив.), K2CO3 (7 г, 50,65 ммоль, 2,00 эквив.) и CH3I (7,3 г, 51,43 ммоль, 2,00 эквив.) в ацетоне (100 мл) перемешивали в течение 16 ч. при 55°С, затем охлаждали до к. т., разбавляли с помощью 100 мл Н2О и экстрагировали с помощью 2×200 мл EtOAc. Объединенные органические слои промывали с помощью 100 мл солевого раствора, высушивали над Na2SO4, концентрировали под вакуумом и очищали с помощью хроматографии на силикагеле с применением EtOAc/петролейного эфира (1:10) с получением 3,4 г (63%) указанного в заголовке соединения в виде желтого масла. LC-MS: (ES, масса/заряд): 208. 1Н ЯМР (300 МГц, DMSO-d6) δ 7,69 (dt, J=1,6, 0,7 Гц, 1H), 7,49 (dd, J=8,4, 0,6 Гц, 1H), 7,34 (d, J=3,1 Гц, 1H), 7,13 (dd, J=8,4, 1,8 Гц, 1H), 6,43 (dd, J=3,1, 0,9 Гц, 1H), 3,77 (s, 3Н).
1-(1-Метил-1H-индол-6-ил)этан-1-он. К раствору 6-бром-1-метил-1H-индола (3,4 г, 16,19 ммоль, 1,00эквив.) в THF (100 мл) добавляли BuLi (12 мл, 2,00 эквив., 2,5 М) по каплям с перемешиванием при -78°С. Раствор перемешивали в течение 1 ч., затем добавляли по каплям N-метокси-N-метилацетамид (4,1 г, 39,76 ммоль, 2,50 эквив.) с перемешиванием при -78°С. Раствор перемешивали в течение 30 мин., затем нагревали до к. т. и перемешивали дополнительно 2 ч. Реакционную смесь охлаждали до 0°С, затем реакцию останавливали посредством добавления 1 М HCl и экстрагировали с помощью 2×200 мл EtOAc. Объединенные органические слои промывали с помощью 100 мл солевого раствора, высушивали над Na2SO4, концентрировали под вакуумом и очищали с помощью хроматографии на силикагеле с применением EtOAc/петролеиного эфира (1:5) с получением 1,9 г (68%) указанного в заголовке соединения в виде желтого твердого вещества. LC-MS: (ES, масса/заряд): 173. 1Н ЯМР: (300 МГц, DMSO-d6) δ 8,12 (dt, J=1,5, 0,8 Гц, 1H), 7,70-7,59 (m, 2Н), 7,57 (d, J=3,0 Гц, 1H), 6,51 (dd, J=3,0, 0,9 Гц, 1H), 3,88 (s, 3Н), 2,63 (s, 3Н).
Промежуточное соединение А-2: 1-(1-метил-1Н-индазол-6-ил)этан-1-он
1-(1-Метил-1H-индазол-6-ил)этан-1-он. К раствору 6-бром-1-метил-1H-индазола (2,5 г, 11,85 ммоль, 1,00 эквив.) в THF (50 мл) в атмосфере N2 при -78°С добавляли по каплям n-BuLi (10 мл, 2,00 эквив.) с перемешиванием. Раствор перемешивали в течение 60 мин. при данной температуре, затем добавляли N-метокси-N-метилацетамид (3 г, 29,09 ммоль, 2,50 эквив.) и раствор перемешивали в течение дополнительных 60 мин. при данной температуре. Полученный раствор перемешивали в течение 1 ч. при к. т., охлаждали до 0°С, реакцию останавливали посредством добавления HCl (1 М) и экстрагировали с помощью 2×100 мл EtOAc. Объединенные органические слои промывали с помощью 50 мл солевого раствора, высушивали над Na2SO4, концентрировали под вакуумом и очищали с помощью хроматографии на силикагеле с применением EtOAc/петролеиного эфира (1:10) с получением 1,5 г (73%) указанного в заголовке соединения в виде желтого масла. LC-MS: (ES, масса/заряд): 174. 1H ЯМР: (400 МГц, DMSO-d6) δ 8,36 (q, J=1,1 Гц, 1H), 8,16 (d, J=1,0 Гц, 1H), 7,86 (dd, J=8,5, 0,8 Гц, 1H), 7,69 (dd, J=8,5, 1,4 Гц, 1H), 4,16 (s, 3Н), 2,70 (s, 3Н).
Следующие ацетиларены получали посредством сходных способов.
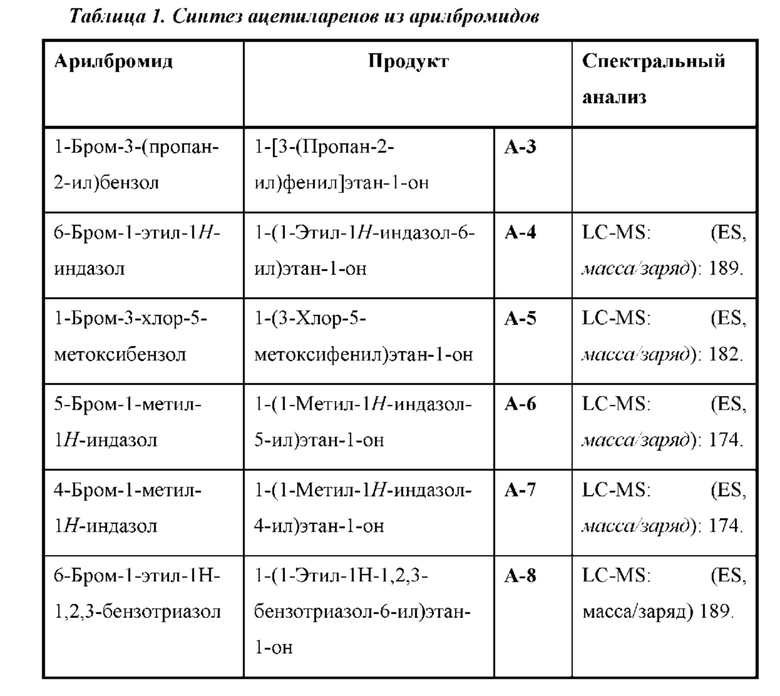
Следующие промежуточные соединения, представляющие собой ацетиларены, получали посредством схемы XXII.
Промежуточное соединение А-9: 1-(3-циклобутоксифенил)этан-1-он
К смеси 1-(3-гидроксифенил)этан-1-она (4,5 г, 33,05 ммоль, 1,00эквив.) и Cs2CO3 (10,78 г, 33,09 ммоль, 1,00эквив.) в DMA (50 мл) добавляли по каплям бромциклобутан (9,0 г, 66,67 ммоль, 2,00 эквив.) с перемешиванием при к.т. Полученную смесь перемешивали в течение 16 ч. при 130°С, затем охлаждали и разбавляли с помощью 200 мл EtOAc. Объединенные органические слои промывали с помощью 2×200 мл Н2О и 2×200 мл солевого раствора, затем высушивали над Na2SO4, концентрировали под вакуумом и очищали с помощью хроматографии на силикагеле с применением EtOAc/петролейного эфира (1:10) с получением 5,0 г (80%) указанного в заголовке соединения в виде бесцветного масла. 1Н ЯМР: (300 МГц, DMSO-d6) δ 7,53 (ddd, J=7,6, 1,7, 1,1 Гц, 1Н), 7,41 (t, J=7,9 Гц, 1Н), 7,32 (dd, J=2,6, 1,6 Гц, 1Н), 7,10 (ddd, J=8,1, 2,7, 1,0 Гц, 1H), 4,83-4,67 (m, 1H), 2,55 (s, 3Н), 2,47-2,31 (m, 2Н), 2,14-1,94 (m, 2Н), 1,88-1,72 (m, 1H), 1,72-1,56 (m, 1H).
Промежуточное соединение А-10: 1-[3-(оксетан-3-илметокси)фенил]этан-1-он
В колбе в атмосфере N2 объединяли раствор оксетан-3-илметанола (3,24 г, 36,77 ммоль, 1,00 эквив.) в THF (100 мл), 1-(3-гидроксифенил)этан-1-он (5 г, 36,72 ммоль, 1,00 эквив.) и PPh3 (14,5 г, 1,50 эквив.) с последующим добавлением по каплям DEAD (8,3 г, 47,66 ммоль, 1,30 эквив.) с перемешиванием при 0°С. Полученный раствор перемешивали в течение 12 ч. при к. т., затем экстрагировали с помощью EtOAc. Объединенные органические слои высушивали над Na2SO4, концентрировали под вакуумом и очищали посредством хроматографии на силикагеле с применением EtOAc/петролейного эфира (0-20%) с получением 4,4 г (58%) указанного в заголовке соединения в виде светло-желтого масла. LC-MS: (ES, масса/заряд): 206,90. Н-ЯМР: δH (300 МГц, DMSO-d6) 7,56 (1Н, ddd, J=7,6, 1,6, 1,0 Гц), 7,45 (2Н, m), 7,23 (1Н, ddd, J=8,2, 2,7, 1,1 Гц), 4,71 (2Н, dd, J=7,9, 6,0 Гц), 4,44 (2Н, t, J=6,0, 6,0 Гц), 4,26 (2Н, d, J=6,7 Гц), 3,39 (1Н, m), 2,57 (3Н, s).
Следующие алкилированные соединения получали в результате реакции синтеза 3-гидроксиацетофенона по Вильямсону.
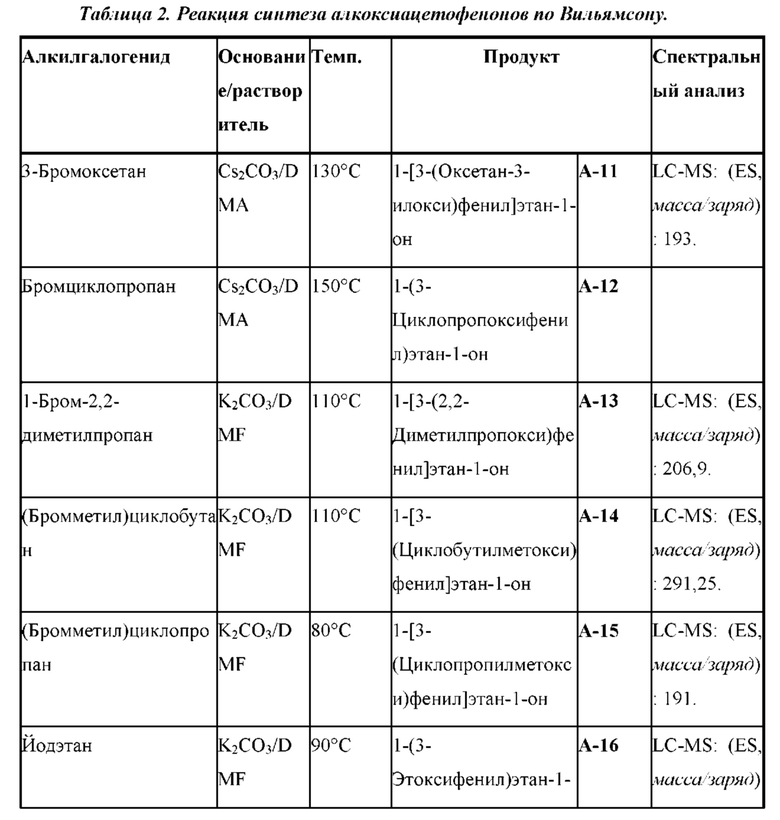

Промежуточное соединение А-19: 1-(3,5-диметоксифенил)этан-1-он
В колбе объединяли 1-(3,5-дигидроксифенил)этан-1-он (2 г, 13,15 ммоль, 1,00 эквив.), йодметан (6,5 г, 45,79 ммоль, 4,00 эквив.), K2CO3 (3,6 г, 25,86 ммоль, 2,00 эквив.) и ацетон (40 мл). Полученную смесь перемешивали в течение 16 ч. при 56°С, затем охлаждали до к. т., разбавляли с помощью 100 мл воды и экстрагировали с помощью 2×50 мл EtOAc. Объединенные органические слои промывали с помощью 20 мл солевого раствора, высушивали над Na2SO4, концентрировали под вакуумом и очищали с помощью хроматографии на силикагеле с применением EtOAc/петролейного эфира (1:10) с получением 2 г (84%) указанного в заголовке продукта в виде бесцветного масла. LC-MS: (ES, масса/заряд): 181. 1H ЯМР: (300 МГц, DMSO-d6) δ 7,07 (d, J=2,3 Гц, 2Н), 6,77 (t, J=2,3 Гц, 1H), 3,89-3,71 (m, 6Н), 2,56 (s, 3Н).
Промежуточное соединение А-20: 1-(3,5-диэтоксифенил)этан-1-он
В колбе объединяли 1-(3,5-дигидроксифенил)этан-1-он (5 г, 32,86 ммоль, 1,00 эквив.), йодэтан (20 г, 128,23 ммоль, 4,00 эквив.), K2CO3 (18 г, 130,43 ммоль, 4,00 эквив.) и ацетон (100 мл). Полученную смесь нагревали до температуры возврата флегмы в течение ночи, затем охлаждали до к. т.и экстрагировали с помощью 3×100 мл EtOAc. Объединенные органические слои высушивали над Na2SO4 и концентрировали под вакуумом с получением 6 г (88%) указанного в заголовке соединения в виде коричневого твердого вещества. LC-MS: (ES, масса/заряд): 208,95.
Промежуточное соединение А-21: 1-(3-этокси-5-метоксифенил)этан-1-он
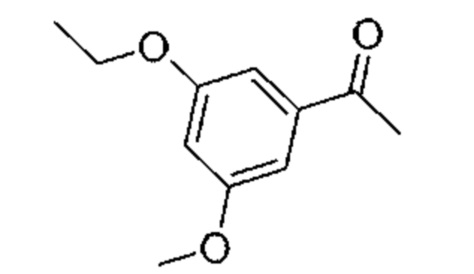
1-(3-Гидрокси-5-метоксифенил)этан-1-он. К смеси 1-(3,5-дигидроксифенил)этан-1-она (5,0 г, 32,86 ммоль, 1,00 эквив.), K2CO3 (6,85 г, 49,56 ммоль, 1,50 эквив.) и ацетона (100 мл) добавляли по каплям MeI (4.67 г, 32,89 ммоль, 1,00 эквив.) с перемешиванием при к. т. Полученный раствор нагревали до температуры возврата флегмы в течение 2 ч., концентрировали под вакуумом и очищали посредством хроматографии на силикагеле с применением EtOAc/петролейного эфира (1:3) с получением 2 г (37%) указанного в заголовке соединения в виде белого твердого вещества. LC-MS: (ES, масса/заряд): 167.
1-(3-Этокси-5-метоксифенил)этан-1-он. К смеси 1-(3-гидрокси-5-метоксифенил)этан-1-она (2 г, 12,04 ммоль, 1,00 эквив.), K2CO3 (2,5 г, 18,09 ммоль, 1,50 эквив.) и DMF (50 мл) добавляли по каплям EtI (2,8 г, 17,95 ммоль, 1,00 эквив.) с перемешиванием при к. т. Полученный раствор перемешивали в течение 16 ч. при 90°С, разбавляли с помощью 100 мл EtOAc, промывали с помощью 1×100 мл воды и 1×100 мл солевого раствора, высушивали над Na2SO4, концентрировали под вакуумом и очищали с помощью хроматографии на силикагеле с применением EtOAc/петролейного эфира (1:5) с получением 950 мг (41%) указанного в заголовке соединения в виде бесцветного масла. LC-MS: (ES, масса/заряд): 195. 1H-ЯМР: (DMSO, ppm): δ: 7,06 (dq, J=2,9, 1,4 Гц, 2Н), 6,75 (t, J=2,3 Гц, 1H), 4,07 (q, J=7,0 Гц, 2Н), 2,56 (s, 3Н), 1,34 (t, J=6,9 Гц, 3Н).
Промежуточное соединение А-22: 1-[2-(пропан-2-илокси)-1,3-оксазол-5-ил]этан-1-он
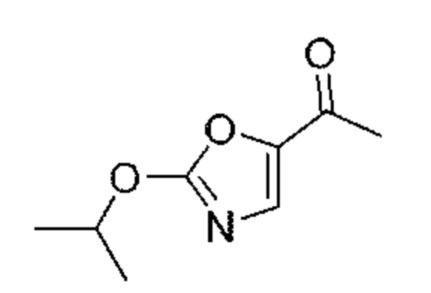
2-Гидрокси-1,3-оксазол-5-карбоновая кислота. Раствор этил-2-хлор-1,3-оксазол-5-карбоксилата (3 г, 17,09 ммоль, 1,00 эквив.) и LiOH (1,7 г, 70,98 ммоль, 4,00 эквив.) в THF/H2O (60/15 мл) перемешивали в течение 16 ч. при 30°С. Затем уровень рН доводили до 4 с помощью 1 М HCl и полученный раствор экстрагировали с помощью 4×50 мл EtOAc. Объединенные органические слои высушивали над безводным Na2SO4 и концентрировали под вакуумом с получением 2 г (91%) указанного в заголовке соединения в виде желтого твердого вещества. LC-MS: (ES, масса/заряд): 129.
2-Гидрокси-N-метокси-N-метил-1,3-оксазол-5-карбоксамид. Раствор N-метокси-N-метиламина гидрохлорида (1,8 г, 18,45 ммоль, 1,20 эквив.), HATU (7,6 г, 20,54 ммоль, 1,30 эквив.), DIEA (6 г, 46,43 ммоль, 3,00 эквив.) и 2-гидрокси-1,3-оксазол-5-карбоновой кислоты (2 г, 15,50 ммоль, 1,00 эквив.) в DMF (60 мл) перемешивали в течение 5 ч. при комнатной температуре. Полученную смесь концентрировали под вакуумом и очищали с помощью хроматографии на силикагеле с применением CH2Cl2/МеОН (50:1) с получением 1,3 г (49%) указанного в заголовке соединения в виде желтого твердого вещества. LC-MS: (ES, масса/заряд): 173.
N-метокси-N-метил-2-(пропан-2-илокси)-1,3-оксазол-5-карбоксамид. Смесь 2-гидрокси-N-метокси-N-метил-1,3-оксазол-5-карбоксамида (1,8 г, 10,46 ммоль, 1,00 эквив.), 2-йодпропана (3,6 г, 2,00 эквив.), K2CO3 (2,9 г, 2,00 эквив.) и DMF (15 мл) в 20-мл герметизированной пробирке перемешивали в течение 16 ч. при 90°С. Реакционную смесь охлаждали до к. т., разбавляли с помощью 20 мл Н2О и экстрагировали с помощью 4×20 мл EtOAc. Объединенные органические слои высушивали над Na2SO4, концентрировали под вакуумом и очищали с помощью хроматографии на силикагеле с применением CH2Cl2/МеОН (100:1) с получением 1,5 г (67%) указанного в заголовке соединения в виде желтого твердого вещества. LC-MS: (ES, масса/заряд): 214.
1-[2-(Пропан-2-илокси)-1,3-оксазол-5-ил]этан-1-он. К раствору N-метокси-N-метил-2-(пропан-2-илокси)-1,3-оксазол-5-карбоксамида (1,5 г, 7,00 ммоль, 1,00 эквив.) в THF (40 мл) в атмосфере N2 при -78°С добавляли частями MeMgBr (21 мл, 3,00 эквив.). Полученный раствор перемешивали в течение 2 ч. при к. т., охлаждали до 0°С, реакцию останавливали посредством добавления HCl (1 М) и экстрагировали с помощью 2x50 мл EtOAc. Объединенные органические слои промывали с помощью 30 мл солевого раствора, высушивали над Na2SO4, концентрировали под вакуумом и очищали посредством хроматографии на силикагеле с применением EtOAc/петролейного эфира (1:10) с получением 670 мг (57%) указанного в заголовке соединения в виде желтого твердого вещества. LC-MS: (ES, масса/заряд): 169.
Промежуточное соединение А-23: 1-[1,3-диметил-1Н-тиено[2,3-с]пиразол-5-ил]этан-1-он
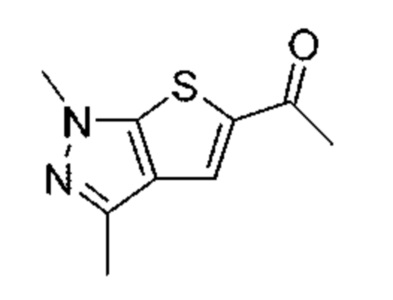
N-метокси-N,1,3-триметил-1H-тиено[2,3-c]пиразол-5-карбоксамид. Раствор 1,3-диметил-1Н-тиено[2,3-с]пиразол-5-карбоновой кислоты (2 г, 10,19 ммоль, 1,00 эквив.) метокси(метил)амина гидрохлорида (1,06 г, 10,87 ммоль, 1,10 эквив.), DIEA (4 г, 30,95 ммоль, 3,00 эквив.) и HATU (5,8 г, 15,26 ммоль, 1,50 эквив.) в DMF (30 мл) перемешивали в течение 2 ч. при к. т., разбавляли с помощью 100 мл воды и экстрагировали с помощью 2×100 мл EtOAc. Объединенные органические слои промывали с помощью 100 мл солевого раствора, высушивали над Na2SO4, концентрировали под вакуумом и очищали с помощью хроматографии на силикагеле с применением EtOAc/петролейного эфира (1:3) с получением 2,2 г (90%) указанного в заголовке соединения в виде желтого твердого вещества. LC-MS: (ES, масса/заряд): 240.
1-[1,3-Диметил-1Н-тиено[2,3-с]пиразол-5-ил]этан-1-он. К раствору продукта из предыдущей стадии (2,2 г, 9,19 ммоль, 1,00 эквив.) в THF (50 мл) при -78°С в атмосфере N2 добавляли по каплям бромид метилмагния (1,0 М в THF, 29 мл, 3,00 эквив.) с перемешиванием. Полученный раствор перемешивали в течение 2 ч. при комнатной температуре, затем охлаждали до 0°С и затем реакцию останавливали с помощью добавления водн. HCl. Полученный раствор разбавляли с помощью 100 мл Н2О и экстрагировали с помощью 2×200 мл EtOAc. Объединенные органические слои промывали с помощью 50 мл солевого раствора, высушивали над Na2SO4, концентрировали под вакуумом и очищали с помощью хроматографии на колонке с силикагелем с применением EtOAc/петролейного эфира (1:3) с получением 1,4 г (78%) указанного в заголовке соединения в виде белого твердого вещества.
LC-MS: (ES, масса/заряд): 195. 1Н ЯМР (300 МГц, DMSO-d6) δ 8,04 (s, 1H), 3,86 (s, 3Н), 2,52 (s, 4Н), 2,39 (s, 3Н).
Промежуточное соединение А-24: 1-(5-метокситиен-2-ил)этан-1-он
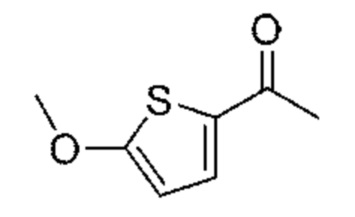
Смесь 1-(5-хлортиен-2-ил)-1-этанона (11 г, 96,35 ммоль, 1,00 эквив.), Cs2CO3 (22 г, 1,20 эквив.) и Brettphos Pd G3 (550 мг) в МеОН (60 мл) нагревали в герметизированной пробирке в течение 1 ч. при 100°С с помощью микроволнового излучения. Полученную смесь концентрировали под вакуумом, затем экстрагировали с помощью 3×100 мл EtOAc. Объединенные органические слои высушивали над безводным MgSO4, концентрировали под вакуумом и очищали с помощью хроматографии на силикагеле с применением EtOAc/петролейного эфира (1/50) с получением 5 г (33%) указанного в заголовке продукта в виде желтого твердого вещества.
Промежуточное соединение А-25: 1-[2-(2-метилпропокси)-1,3-тиазол-5-ил]этан-1-он
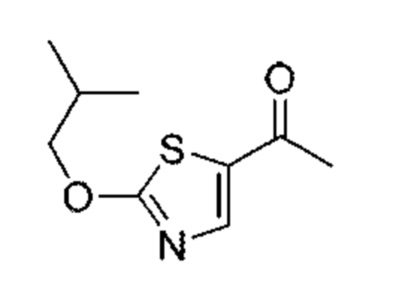
К раствору 1-(2-бром-1,3-тиазол-5-ил)этан-1-она (2 г, 9,71 ммоль, 1,00 эквив.) в 2-метилпропан-1-оле (15 мл) в герметизированной пробирке объемом 40 мл в атмосфере N2 добавляли последовательно Cs2CO3 (6,4 г, 19,64 ммоль, 2,00 эквив.) и Brettphos Pd G3 (440 мг, 0,49 ммоль, 0,05 эквив.). Полученный раствор перемешивали в течение 1 ч. при 90°С. Раствор охлаждали, разбавляли с помощью 50 мл Н2О и экстрагировали с помощью 2×100 мл EtOAc. Объединенные органические слои промывали с помощью 50 мл водн. раствора NaCl, высушивали над безводным Na2SO4, концентрировали под вакуумом и очищали с помощью колонки с силикагелем с применением EtOAc/петролейного эфира (1:10) с получением 550 мг (28%) указанного в заголовке соединения в виде желтого масла.
Промежуточное соединение А-26: 1-[5-(2-метилпропокси)тиен-2-ил]этан-1-он
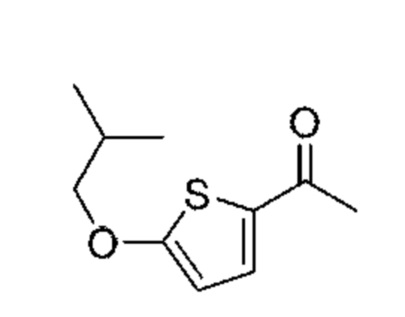
1-(5-Гидрокситиен-2-ил)этан-1-он. К раствору 1-(5-метокси-тиен-2-ил)этан-1-она добавляли по каплям BBr3 (180 мл) с перемешиванием при к. т. Полученный раствор перемешивали в течение 2 дней при 35°С. Реакционную смесь охлаждали с помощью бани с водой/льдом. Затем в реакционной смеси реакцию останавливали посредством добавления 500 мл воды/льда. Полученный раствор разбавляли с помощью 500 мл CH2Cl2. Значение рН раствора доводили до 7-8 с помощью (насыщ.) NaHCO3 (водн.) (500 моль/л). Смесь высушивали над безводным Na2SO4 и концентрировали под вакуумом. Остаток пропускали через колонку с силикагелем с применением EtOAc/петролейного эфира (1:10). В результате этого получали указанное в заголовке соединение в виде красного масла (5,0 г, 61%).
1-[5-(2-Метилпропокси)тиен-2-ил]этан-1-он. К раствору продукта из предыдущей стадии (800 мг, 5,63 ммоль, 1,00 эквив.) в DMF (20 мл) добавляли Cs2CO3 (3,67 г, 11,26 ммоль, 2,00 эквив.) с последующим добавлением по каплям 1-йод-2-метилпропана (2,07 г, 11,25 ммоль, 2,00 эквив.) с перемешиванием при к. т. Полученный раствор перемешивали в течение 16 ч. при 90°С. Полученный раствор разбавляли с помощью 100 мл EtOAc, затем промывали с помощью 2×100 мл воды и 2×100 мл солевого раствора. Смесь высушивали над безводным Na2SO4 и концентрировали под вакуумом. Остаток пропускали через колонку с силикагелем с применением EtOAc/петролейного эфира (1:10). В результате этого получали указанное в заголовке соединение в виде желтого масла (600 мг, 54%).
Промежуточное соединение А-27: 1-(4-метокситиен-2-ил)этан-1-он
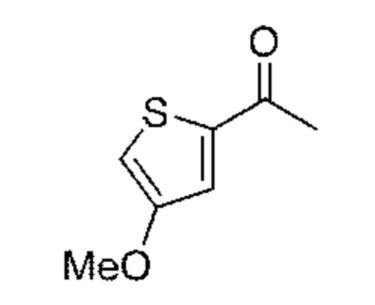
К раствору 1-(4-бромтиен-2-ил)этан-1-она (3,0 г, 14,63 ммоль, 1,00 эквив.) в МеОН (25 мл) добавляли NaOMe (5,4 мл, 2,00 эквив., 5,4 М) при комнатной температуре, а затем добавляли CuBr (627 мг, 4,38 ммоль, 0,30 эквив.) при комнатной температуре. Полученный раствор перемешивали в течение 16 ч. при 100°С, затем разбавляли с помощью 100 мл EtOAc, промывали с помощью 2×100 мл солевого раствора, высушивали над безводным Na2SO4 и концентрировали под вакуумом. Остаток очищали с помощью хроматографии на силикагеле с применением EtOAc/петролейного эфира (1:20) с получением 700 мг (31%) указанного в заголовке продукта в виде желтого масла.
Промежуточное соединение А-28: 1-[2-(2-метилпропил)-1,3-оксазол-5-ил]этан-1-он
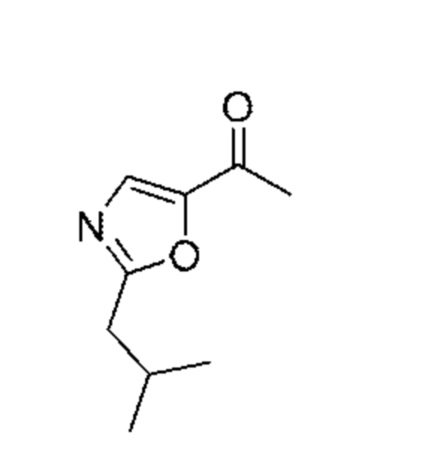
Этил-2-(2-метилпропил)-1,3-оксазол-5-карбоксилат. К раствору этил-2-хлор-1,3-оксазол-5-карбоксилата (3 г, 17,09 ммоль, 1,00 эквив.) в THF (45 мл) в атмосфере N2 добавляли йодид меди(I) (1,5 г, 7,88 ммоль, 0,50 эквив.). За этим следовало добавление бром(2-метилпропил)цинка (15 мл, 2,00 эквив.) при -5°С. Полученный раствор перемешивали в течение 3 ч. при комнатной температуре. Затем в реакционной смеси реакцию останавливали посредством добавления водн. 1 М HCl. Полученный раствор экстрагировали с помощью 2×100 мл EtOAc и органические слои объединяли и высушивали над безводным Na2SO4 и концентрировали под вакуумом. Остаток пропускали через колонку с силикагелем с применением EtOAc/петролейного эфира (1:5). В результате этого получали указанное в заголовке соединение в виде красного масла (1,3 г, 39%).
2-(2-Метилпропил)-1,3-оксазол-5-карбоновая кислота. К раствору продукта из предыдущей стадии (1,3 г, 6,59 ммоль, 1,00 эквив.) в THF/H2O (20/5 мл) добавляли LiOH (600 мг, 25,05 ммоль, 4,00 эквив.). Полученный раствор перемешивали в течение 3 ч. при комнатной температуре. Реакционную смесь охлаждали с помощью бани с водой/льдом. Значение рН раствора доводили до 1 с помощью водн. 1 М HCl. Полученный раствор экстрагировали с помощью 2×50 мл EtOAc и органические слои объединяли и высушивали над безводным Na2SO4 и концентрировали под вакуумом. В результате этого получали указанное в заголовке соединение в виде красного твердого вещества (1 г, 90%).
1-[2-(2-Метилпропил)-1,3-оксазол-5-ил]этан-1-он. К раствору продукта из предыдущей стадии (1 г, 5,91 ммоль, 1,00 эквив.) в Et2O (30 мл) в атмосфере N2 добавляли MeLi (7,4 мл, 2,00 эквив.). Полученный раствор перемешивали в течение 3 ч. при 0°С в бане с водой/льдом. Затем в реакционной смеси реакцию останавливали посредством добавления водн. HCl (1 М). Полученный раствор экстрагировали с помощью 2×50 мл EtOAc и органические слои объединяли и высушивали над безводным Na2SO4 и концентрировали под вакуумом. Остаток пропускали через колонку с силикагелем с применением EtOAc/петролейного эфира (1:5). В результате этого получали указанное в заголовке соединение в виде красного масла (800 мг, 81%).
Промежуточное соединение А-29: 1-(1-метил-1Н-1,3-бензодиазол-6-ил)этан-1-он
N-метокси-N,1-диметил-1H-1,3-бензодиазол-6-карбоксамид. К раствору 1-метил-1Н-1,3-бензодиазол-6-карбоновой кислоты (5,0 г, 28,38 ммоль, 1,00 эквив.) в CH2Cl2 (100 мл) добавляли метокси(метил)амина гидрохлорид (2,78 г, 28,50 ммоль, 1,00 эквив.), EDC (6,54 г, 42,13 ммоль, 1,20 эквив.) с последующим добавлением DMAP (3,46 г, 28,32 ммоль, 1,00 эквив.) частями при к. т. Полученный раствор перемешивали в течение 16 ч., концентрировали под вакуумом и очищали с помощью хроматографии на силикагеле с применением CH2Cl2/МеОН (100:1) с получением 4,0 г (64%) указанного в заголовке соединения в виде желтого твердого вещества. LC-MS: (ES, масса/заряд): [М+1] = 220.
1-(1-Метил-1Н-1,3-бензодиазол-6-ил)этан-1-он. К раствору продукта из предыдущей стадии (2,0 г, 9,12 ммоль, 1,00 эквив.) в THF (60 мл) в атмосфере N2 добавляли по каплям MeMgBr (9,1 мл, 3,00 эквив.) с перемешиванием при -60°С. Полученную смесь перемешивали при данной температуре в течение 30 мин., обеспечивали нагревание до к. т., затем перемешивали в течение 2 ч. при к. т. Затем в реакционной смеси реакцию останавливали посредством добавления воды/льда. Полученный раствор экстрагировали с помощью 100 мл EtOAc, высушивали над Na2SO4, концентрировали под вакуумом и очищали с помощью хроматографии на силикагеле с применением CH2Cl2/МеОН (50:1) с получением 1,3 г (82%) указанного в заголовке соединения в виде желтого твердого вещества.
Промежуточное соединение А-30: 3-ацетил-N-(пропан-2-ил)бензамид
К суспензии 3-ацетилбензойной кислоты (10 г, 60,92 ммоль), HATU (20 г, 52,60 ммоль,) и пропан-2-амина (4 г, 67,67 ммоль) в DMF (180 мл) при -5°С добавляли по каплям DIEA. Полученную смесь перемешивали при комнатной температуре в течение 2 ч. в атмосфере N2, затем выливали в 100 мл Н2О и экстрагировали с помощью EtOAc (3×100 мл). Объединенные органические слои промывали с помощью 300 мл солевого раствора, высушивали над безводным Na2SO4, фильтровали и концентрировали под вакуумом. Это приводило к получению 11 г (88%) указанного в заголовке продукта в виде желтого твердого вещества.
Следующие 2,4-диоксобутаноатные сложные эфиры синтезировали для применения в получении соединений по настоящему изобретению, включая без ограничения применение в схеме I.
Промежуточное соединение В-1: метил-4-(2-метоксифенил)-2,4-диоксобутаноат

К раствору 1-(2-метоксифенил)этан-1-она (1 г, 6,66 ммоль, 1,00 эквив.) в МеОН (20 мл) добавляли последовательно диметилоксалат (2,36 г, 19,99 ммоль, 3,00 эквив.), затем добавляли MeONa (3,7 мл, 3,00 эквив., 5,4 М). Полученный раствор перемешивали в течение ночи при 30°С, затем реакцию останавливали с помощью добавления воды/льда. Значение рН раствора доводили до 5 с помощью водн. 1 М HCl. Полученный раствор экстрагировали с помощью 3×50 мл EtOAc и органические слои объединяли и высушивали над безводным Na2SO4 и концентрировали под вакуумом. Остаток пропускали через колонку с силикагелем с применением EtOAc/гексана (1/4). В результате этого получали указанное в заголовке соединение в виде желтого твердого вещества (1,2 г, 76%).
Промежуточное соединение B-2: метил-4-(3-метоксифенил)-2,4-диоксобутаноат
К раствору 1-(3-метоксифенил)этан-1-она (10 г, 66,59 ммоль, 1,00 эквив.) в МеОН (200 мл) добавляли последовательно NaOMe (30 мл) и диметилоксалат (10,2 г, 86,38 ммоль, 1,3 эквив.). Полученный раствор перемешивали в течение 8 ч. при комнатной температуре. Реакционную смесь охлаждали до 0°С с помощью бани с водой/льдом. Полученный раствор разбавляли с помощью 200 мл EtOAc. Значение рН раствора доводили до 3 с помощью водн. HCl (3 моль/л). Полученный раствор экстрагировали с помощью 2×300 мл EtOAc и органические слои объединяли и высушивали над безводным Na2SO4 и концентрировали под вакуумом. В результате этого получали указанное в заголовке соединение в виде желтого твердого вещества (11 г, 70%).
Промежуточное соединение В-3: метил-4-[3-(оксетан-3-илметокси)фенил]-2,4-диоксобутаноат
В 100-мл колбе объединяли раствор 1-[3-(оксетан-3-илметокси)фенил]этан-1-она (пром. соед. А-10, 3 г, 14,55 ммоль, 1,00 эквив.) в МеОН (40 мл), диметилоксалат (3,42 г, 28,96 ммоль, 2,00 эквив.) и раствор MeONa (2,36 г, 43,70 ммоль, 3,00 эквив.) в МеОН (8 мл). Полученный раствор перемешивали в течение 12 ч. при к. т., затем выливали в лед/воду. Уровень рН доводили до 3 с помощью HCl. Твердые вещества, которые образовывались, собирали посредством фильтрации с получением 3,2 г (75%) указанного в заголовке соединения в виде светло-желтого твердого вещества. LC-MS:(ES, масса/заряд): 293,0. 1H-ЯМР: δH (300 МГц, DMSO-d6) 7,68 (1Н, d, J=7,7 Гц), 7,53 (2Н, m), 7,30 (1Н, m), 7,14 (1Н, s), 4,72 (2Н, dd, J=7,9, 6,0 Гц), 4,45 (2Н, t, J 6,0, 6,0 Гц), 4,30 (2Н, d, J=6,7 Гц), 3,86 (3Н, s), 3,40 (1H, tt, J=8,0, 8,0, 6,3, 6,3 Гц).
Следующие замещенные 4-арил-2,4-диоксобутаноатные сложные эфиры получали в результате реакции конденсации Клайзена 1-арилэтанона со сложным эфиром щавелевой кислоты.


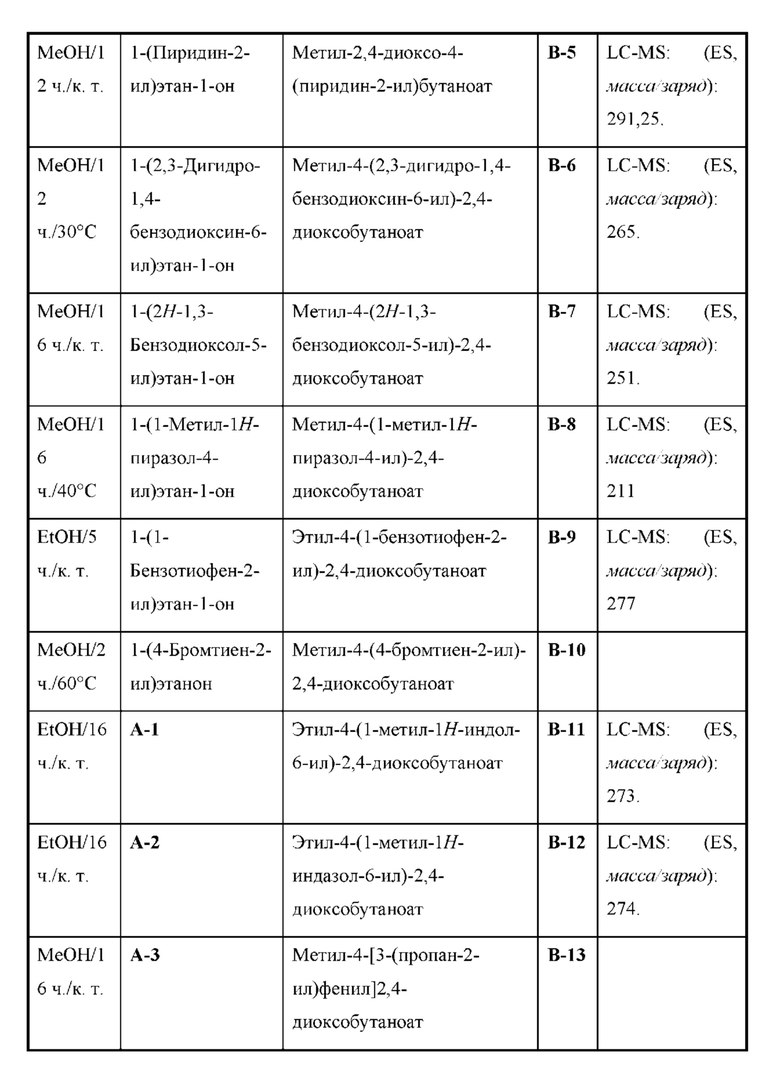
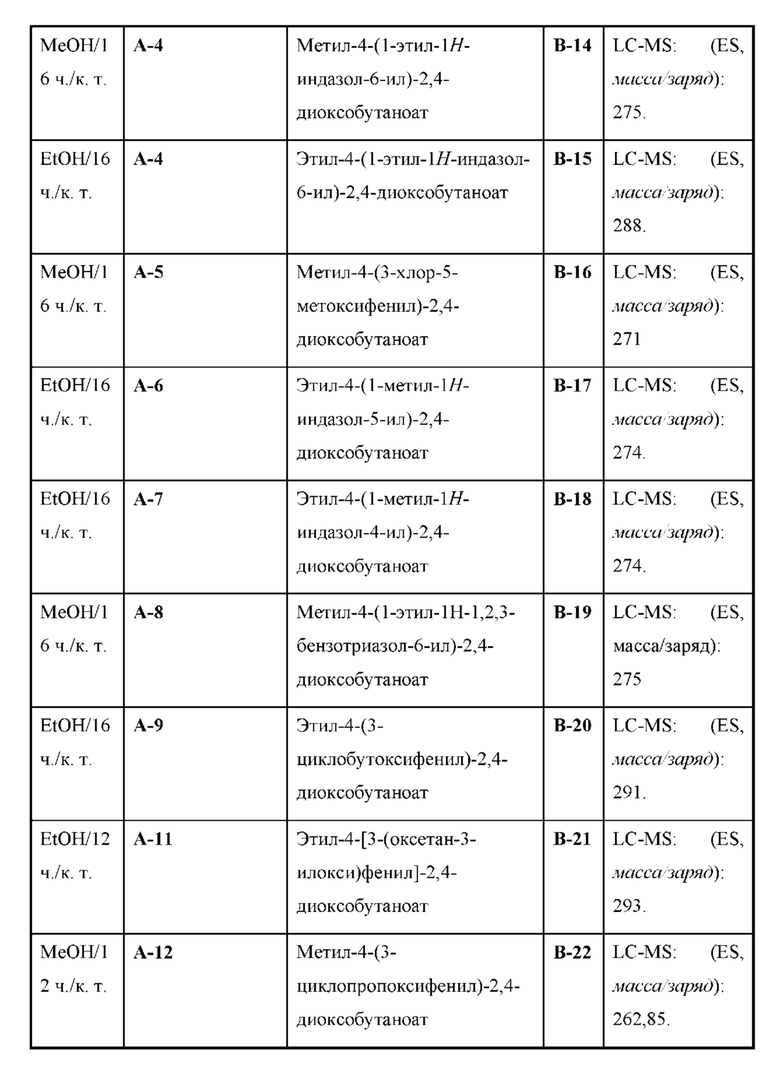
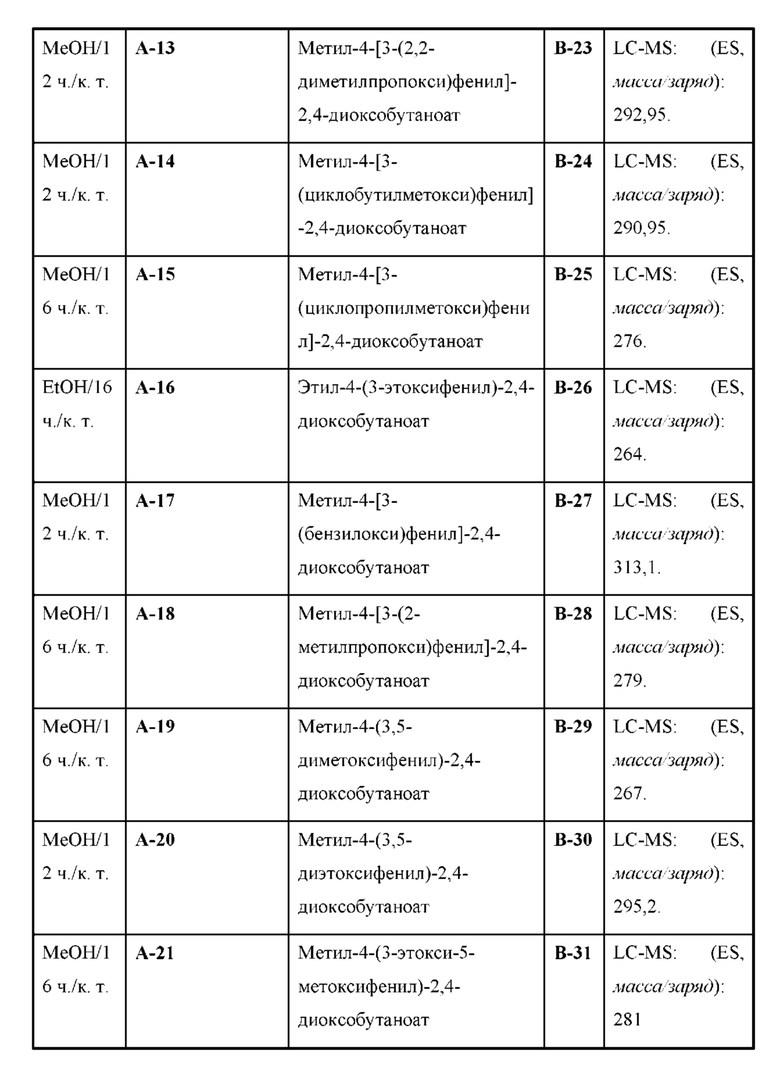
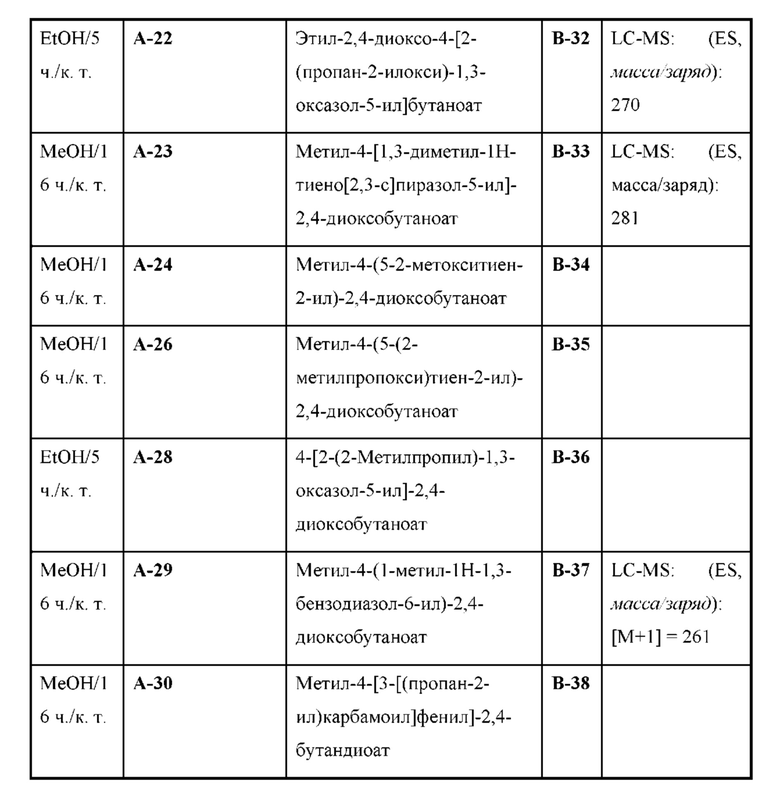
Промежуточное соединение B-39: этил-4-[2-(2-метилпропокси)-1,3-тиазол-5-ил]-2,4-диоксобутаноат
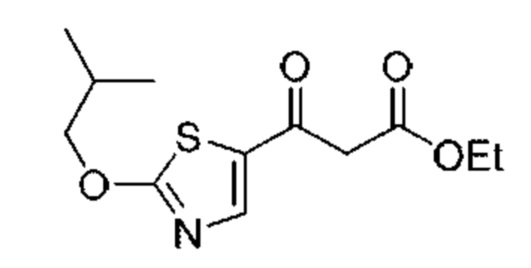
К раствору пром. соед. А-25 (500 мг, 2,51 ммоль, 1,00 эквив.) в THF (10 мл) добавляли последовательно диэтилоксалат (1100 мг, 7,53 ммоль, 2,00 эквив.) и t-BuOK (850 мг, 7,58 ммоль, 3,00 эквив.). Полученный раствор перемешивали в течение 4 ч. при комнатной температуре с последующим разбавлением с помощью 20 мл Н2О, экстракцией с помощью 2×30 мл EtOAc, а органические слои объединяли и высушивали над безводным Na2SO4 и концентрировали под вакуумом. Остаток пропускали через колонку с силикагелем с применением EtOAc/петролейного эфира (1:4). В результате этого получали указанное в заголовке соединение в виде желтого твердого вещества (400 мг, 53%).
Промежуточное соединение B-40: этил-2,4-диоксо-5-фенилпентаноат
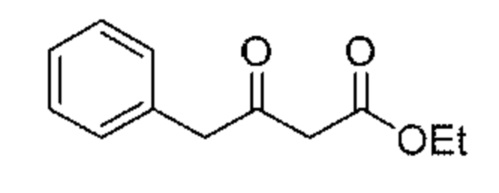
К раствору 1-фенил-2-пропанона (1 г, 8,32 ммоль, 1,00 эквив.) в THF (25 мл) добавляли частями NaH (269 мг, 11,21 ммоль, 1,50 эквив.) при 0°С в течение 30 мин. с последующим добавлением диэтилоксалата (1,64 г, 11,22 ммоль, 1,50 эквив.). Полученный раствор перемешивали в течение 1 ч. при комнатной температуре, затем охлаждали до 0°С. Затем в реакционной смеси реакцию останавливали посредством добавления 20 мл воды. Полученный раствор экстрагировали с помощью 3×50 мл EtOAc и объединенные органические слои высушивали над безводным Na2SO4, концентрировали под вакуумом и очищали с помощью хроматографии на силикагеле с применением EtOAc/петролейного эфира (1:40) с получением 700 мг (36%) указанного в заголовке продукта в виде желтой жидкости.
Следующие замещенные сложные кетоэфиры также применяли в синтезе пиразолов.
Промежуточное соединение В-41: метил-2,4-диоксо-4-(1-пропил-1Н-индазол-6-ил)бутаноат
Промежуточное соединение В-42: метил-4-(3-циклобутоксифенил)-2,4-диоксобутаноат
Следующие промежуточные соединения, представляющие собой арилгидразин, синтезировали для применения в получении соединений по настоящему изобретению, включая без ограничения применение в схеме I.
Промежуточное соединение С-1: 2-(дифторметокси)фенил]гидразина трифторацетат
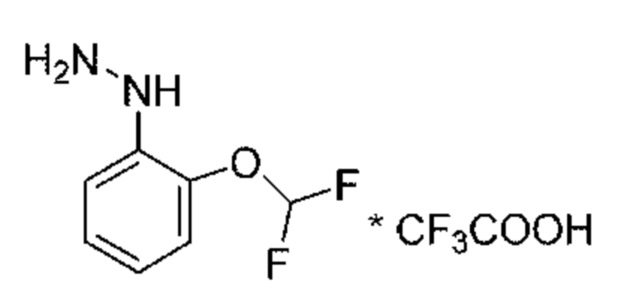
Вос-защищенный 2-(дифторметокси)фенил]гидразин. К раствору 1-бром-2-(дифторметокси)бензола (8,0 г, 35,87 ммоль, 1,00 эквив.), (трет-бутокси)карбогидразида (5,68 г, 42,98 ммоль, 1,20 эквив.) и BrettPhos Pd G3 (1,74 г, 1,92 ммоль, 0,05 эквив.) в диоксане (60 мл) в атмосфере N2 добавляли частями Cs2CO3 (11,70 г, 35,91 ммоль, 1,00 эквив.) при комнатной температуре. Полученный раствор перемешивали в течение 16 ч. при 100°С, затем разбавляли с помощью 200 мл EtOAc, промывали с помощью 200 мл солевого раствора, высушивали над безводным Na2SO4 и концентрировали под вакуумом. Неочищенный продукт очищали посредством хроматографии на силикагеле с применением EtOAc/петролейного эфира (1:5) с получением 8,0 г (81%) указанного в заголовке соединения в виде оранжевого твердого вещества. LC-MS: (ES, масса/заряд): 275. 1Н ЯМР (400 МГц, DMSO-d6) δ 8,83 (s, 1H), 7,29-7,22 (m, 1H), 7,07 (q, J=7,7 Гц, 2Н), 6,80-6,68 (m, 2Н), 1,42 (s, 9Н).
2-(Дифторметокси)фенил] гидразина трифторацетат. Раствор продукта из предыдущей стадии (2,0 г, 7,29 ммоль, 1,00 эквив.) и TFA (10 мл) в CH2Cl2 (20 мл) перемешивали в течение 2 ч. при комнатной температуре, затем концентрировали под вакуумом с получением 1,0 г (48%) указанного в заголовке соединения в виде коричневого масла. LC-MS: (ES, масса/заряд): 175.
Следующие арилгидразины синтезировали из соответствующих арилгалогенидов с применением сходных процедур.

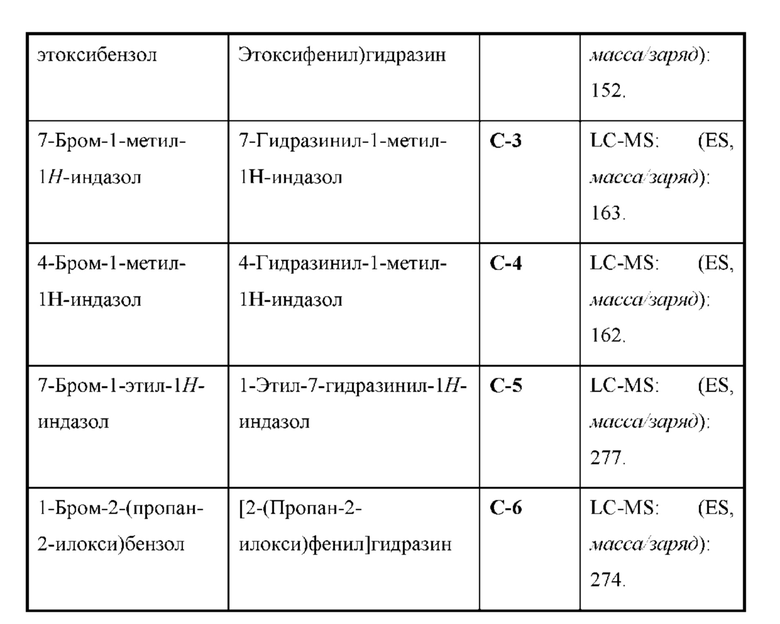
Сначала обеспечивали защиту свободных аминогрупп следующих реагирующих веществ с помощью SEM-групп (NaH; SEM-Cl). Обработка присоединяющегося продукта с помощью TFA для удаления Вос-групп также обеспечивала удаление защитных SEM-групп.
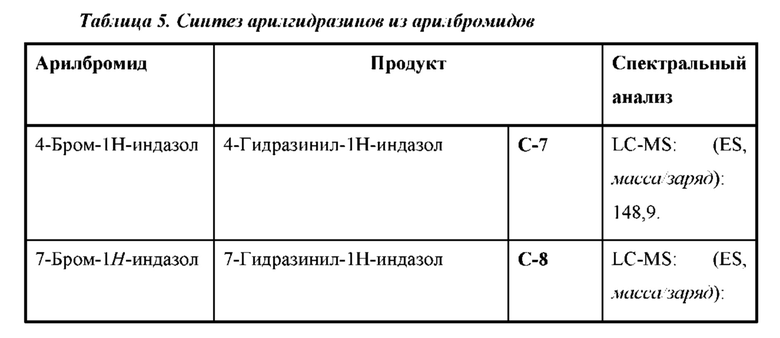
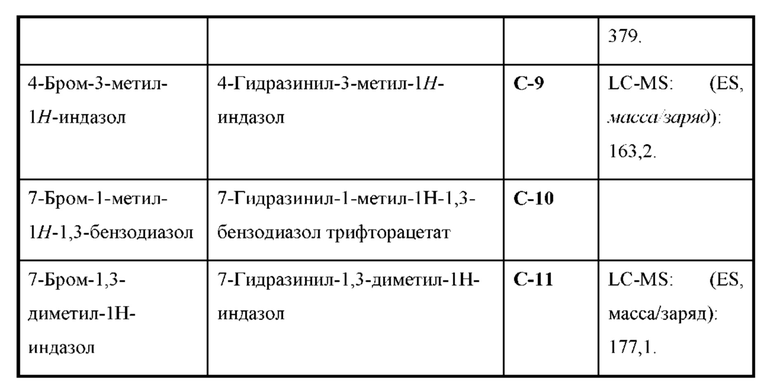
Промежуточное соединение С-12: 7-гидразинил-1-метил-1Н-1,2,3-бензотриазола трифторацетат

2-Бром-N-метил-6-нитроанилин. Смесь 1-бром-2-фтор-3-нитробензола (7 г, 31,82 ммоль, 1,00 эквив.), K2CO3 (8,8 г, 63,21 ммоль, 2,00 эквив.) и CH3NH2 (10 мл, 33%) в CH2Cl2 (50 мл) перемешивали 16 ч. при к. т., затем разбавляли с помощью 100 мл воды. Полученный раствор экстрагировали с помощью 2×200 мл CH2Cl2. Объединенные органические слои промывали с помощью 50 мл солевого раствора, высушивали над Na2SO4 и концентрировали под вакуумом с получением 7 г (95%) указанного в заголовке соединения в виде красного масла. LC-MS: (ES, масса/заряд): 230. 1Н ЯМР (400 МГц, DMSO-d6) δ 7,77 (ddd, J=9,8, 8,0, 1,6 Гц, 2Н), 6,70 (t, J=8,0 Гц, 1H), 6,43-6,19 (m, 1H), 2,71 (d, J=5,3 Гц, 3Н).
6-Бром-1-N-метилбензол-1,2-диамин. Смесь продукта из предыдущей стадии (8 г, 34,62 ммоль, 1,00 эквив.) и Zn (4 г, 62,50 ммоль, 2,00 эквив.) в АсОН (120 мл) перемешивали в течение 16 ч. при к. т. Твердые вещества удаляли фильтрацией и фильтрат концентрировали под вакуумом. Остаток растворяли в 300 мл CH2Cl2, промывали с помощью 100 мл NaHCO3, высушивали над Na2SO4 и концентрировали под вакуумом с получением 4 г (57%) указанного в заголовке соединения в виде черного масла. LC-MS: (ES, масса/заряд): 201.
7-Бром-1-метил-1Н-1,2,3-бензотриазол. К раствору продукта из предыдущей стадии (4 г, 19,89 ммоль, 1,00 эквив.) в HBr/Н2О (60 мл) при 5°С добавляли по каплям раствор NaNO2 (2,07 г, 1,50 эквив.) в H2O (10 мл) с перемешиванием. Раствор перемешивали в течение 4 ч. при 15-20°С. Уровень рН доводили до 8 с помощью NaHCO3 (3 моль/л). Полученный раствор экстрагировали с помощью 2×200 мл EtOAc. Объединенные органические слои промывали с помощью 100 мл солевого раствора, высушивали над безводным Na2SO4, концентрировали под вакуумом и очищали с помощью хроматографии на силикагеле с применением EtOAc/петролейного эфира (1:5) с получением 4 г (95%) указанного в заголовке соединения в виде черного твердого вещества. LC-MS: (ES, масса/заряд): 212. 1Н ЯМР (400 МГц, DMSO-d6) δ 8,06 (dd, J=8,3, 0,8 Гц, 1H), 7,84-7,73 (m, 1H), 7,31 (dd, J=8,4, 7,5 Гц, 1H), 4,51 (s, 3Н).
7-Гидразинил-1-метил-1Н-1,2,3-бензотриазола трифторацетат получали из предыдущего соединения с применением процедуры С-1. LC-MS: (ES, масса/заряд): 163.
Промежуточное соединение С-13: [(2-хлорфенил)метил]гидразина дигидрохлорид
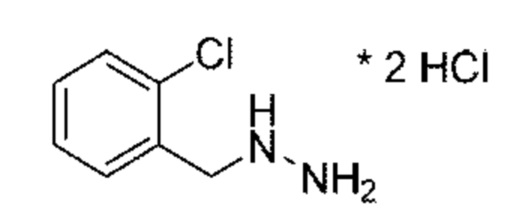
К раствору гидрата гидразина (85%) (31 г, 8,50 эквив.) в EtOH (100 мл) добавляли по каплям раствор 1-хлор-2-(хлорметил)бензола (10 г, 62,10 ммоль, 1,00 эквив.) в EtOH (50 мл) на протяжении 1 ч. при 70°С. Полученный раствор перемешивали в течение 1 ч. при 70°С, концентрировали под вакуумом, разбавляли водой и экстрагировали с помощью EtOAc три раза. Объединенные органические слои охлаждали до 0°С, затем добавляли 4 н. раствор HCl в диоксане. Твердые вещества, которые образовывались, собирали посредством фильтрации с получением 6,1 г (63%) указанного в заголовке продукта в виде белого твердого вещества.
Промежуточное соединение D-1: этил-5-[[(трет-бутокси)карбонил](фенил)амино]-1-[(2-хлорфенил)метил]-1Н-пиразол-3-карбоксилат
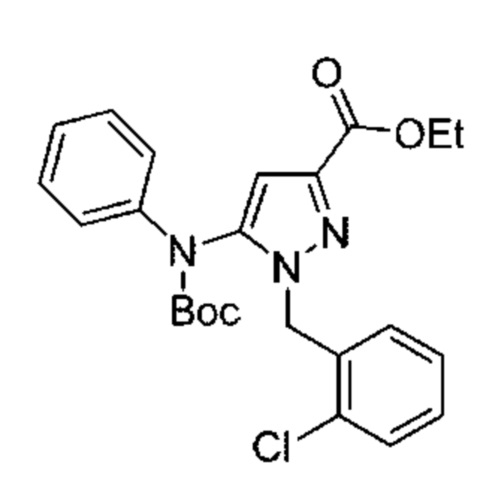
Этил-3-циано-2-(калийокси)проп-2-еноат. К раствору диэтилоксалата (5,06 г, 34,62 ммоль, 1,00 эквив.) в CH3CN (20 мл) добавляли t-BuOK (3,90 г, 34,76 ммоль, 1,12 эквив.) частями при к. т. Полученный раствор перемешивали в течение 1,5 ч. при к. т. Твердые вещества, которые образовывались, собирали посредством фильтрации. Это приводило к получению 5,09 г (82%) указанного в заголовке продукта в виде желтого твердого вещества.
Этил-5-амино-1-[(2-хлорфенил)метил]-1Н-пиразол-3-карбоксилат. К раствору продукта из предыдущей стадии (2,0 г, 11,16 ммоль, 1,00 эквив.) в 1,4-диоксане (20 мл) добавляли по каплям TFA (2 мл) с перемешиванием при к. т. Полученную смесь перемешивали при к. т. в течение 30 мин. К ней добавляли частями пром. соед. С-13 (2,0 г, 12,77 ммоль, 1,15 эквив.) при к. т. Полученный раствор перемешивали в течение ночи при к. т., затем разбавляли с помощью 200 мл EtOAc, промывали с помощью 2×200 мл солевого раствора, высушивали над безводным Na2SO4, концентрировали под вакуумом и очищали посредством хроматографии на силикагеле с применением EtOAc/петролейного эфира (1:3) с получением 1,8 г (58%) указанного в заголовке соединения в виде желтого масла.
Этил-1-[(2-хлорфенил)метил]-5-(фениламино)-1Н-пиразол-3-карбоксилат.
Обеспечивали раствор продукта из предыдущей стадии (1,0 г, 3,57 ммоль, 1,00 эквив.), йодбензола (768 мг, 3,76 ммоль, 1,05 эквив.), предкатализатора Brettphos Pd G3 (326 мг, 0,36 ммоль, 0,10 эквив.) и Cs2CO3 (1,4 г, 4,30 ммоль, 1,20 эквив.) в 1,4-диоксане (20 мл). Полученный раствор перемешивали в герметизированной пробирке в атмосфере N2 при 90°С в течение 3 ч. Полученный раствор разбавляли с помощью 200 мл EtOAc, промывали с помощью 2×200 мл солевого раствора, высушивали над Na2SO4, концентрировали под вакуумом и очищали с помощью хроматографии на силикагеле с применением петролейного эфира: EtOAc:DCM (3:1:0,1) с получением 1,3 г (102%) указанного в заголовке продукта в виде желтого твердого вещества.
Этил-5-[[(трет-бутокси)карбонил](фенил)амино]-1-[(2-хлорфенил)метил]-1Н-пиразол-3-карбоксилат. К раствору продукта из предыдущей стадии (800 мг, 2,25 ммоль, 1,00 эквив.) и DMAP (548 мг, 4,49 ммоль, 2,00 эквив.) в толуоле (20 мл) добавляли частями ди-трет-бутилдикарбонат (980 мг, 4,49 ммоль, 2,00 эквив.) при к. т. Полученный раствор нагревали с обратным холодильником в течение ночи. Полученный раствор разбавляли с помощью 200 мл EtOAc, промывали с помощью 2×100 мл солевого раствора, высушивали над безводным Na2SO4, концентрировали под вакуумом и очищали с помощью хроматографии на силикагеле с применением EtOAc/петролейного эфира (1:3) с получением 1,0 г (101%) указанного в заголовке продукта в виде бесцветного масла.
Промежуточное соединение D-2: метил-5-(3-циклопропоксифенил)-1Н-пиразол-3-карбоксилат
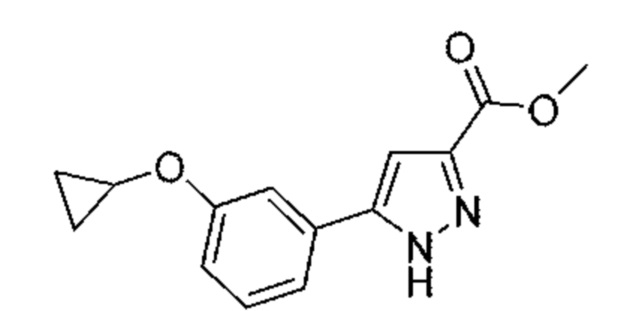
Раствор пром. соед. В-22 (2 г, 7,63 ммоль, 1,00 эквив.) и гидрата гидразина (540 мг, 10,00 ммоль, 1,30 эквив.) в АсОН (20 мл) перемешивали в течение 2 ч. при 100°С, затем охлаждали. Значение рН доводили до 7 с помощью насыщ. NaHCO3 и полученный раствор экстрагировали посредством 3×100 мл EtOAc. Объединенные органические слои высушивали над Na2SO4, концентрировали под вакуумом и очищали с помощью хроматографии на силикагеле с применением EtOAc/гексана (1/1) с получением 1,5 г (76%) указанного в заголовке соединения в виде светло-желтого твердого вещества. LC-MS: (ES, масса/заряд): 259. 1Н ЯМР (300 МГц, MeOD) δ 7,35 (m, 3Н), 7,13 (d, J=21,3 Гц, 2Н), 3,92 (s, 3Н), 3,84 (dp, J=6,4, 3,0, 3,0, 2,9, 2,9 Гц, 1H), 0,82 (m, 2Н), 0,72 (m, 2Н).
Следующие замещенные сложные эфиры 3-пиразолкарбоновой кислоты получали в результате конденсации метил-4-(арил)-2,4-диоксобутаноата с гидразином.
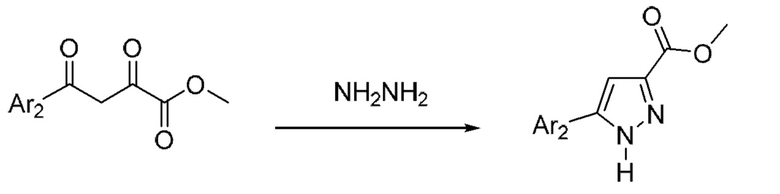
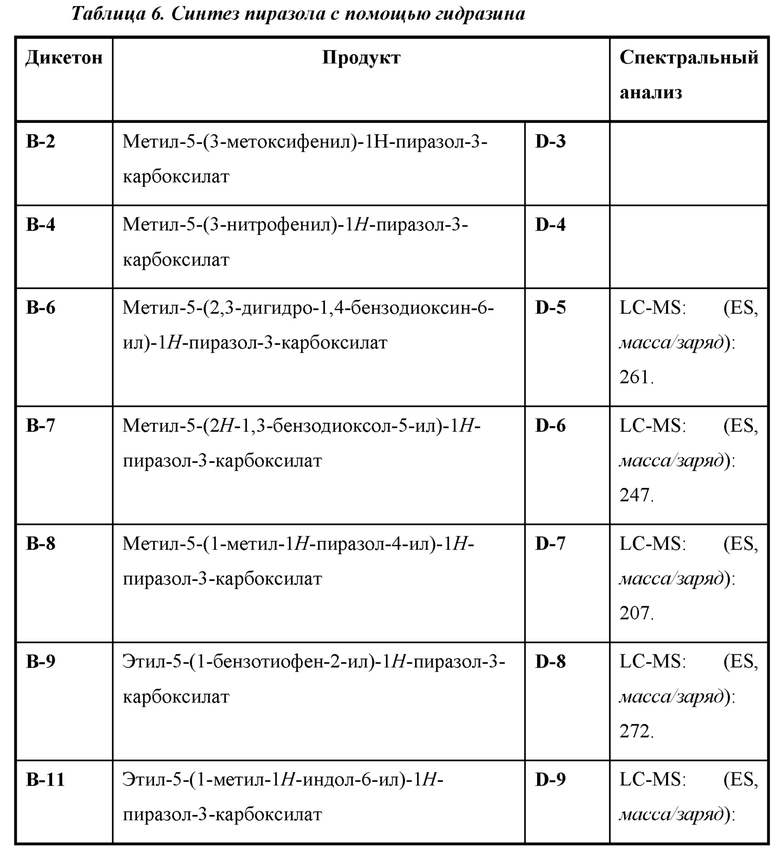
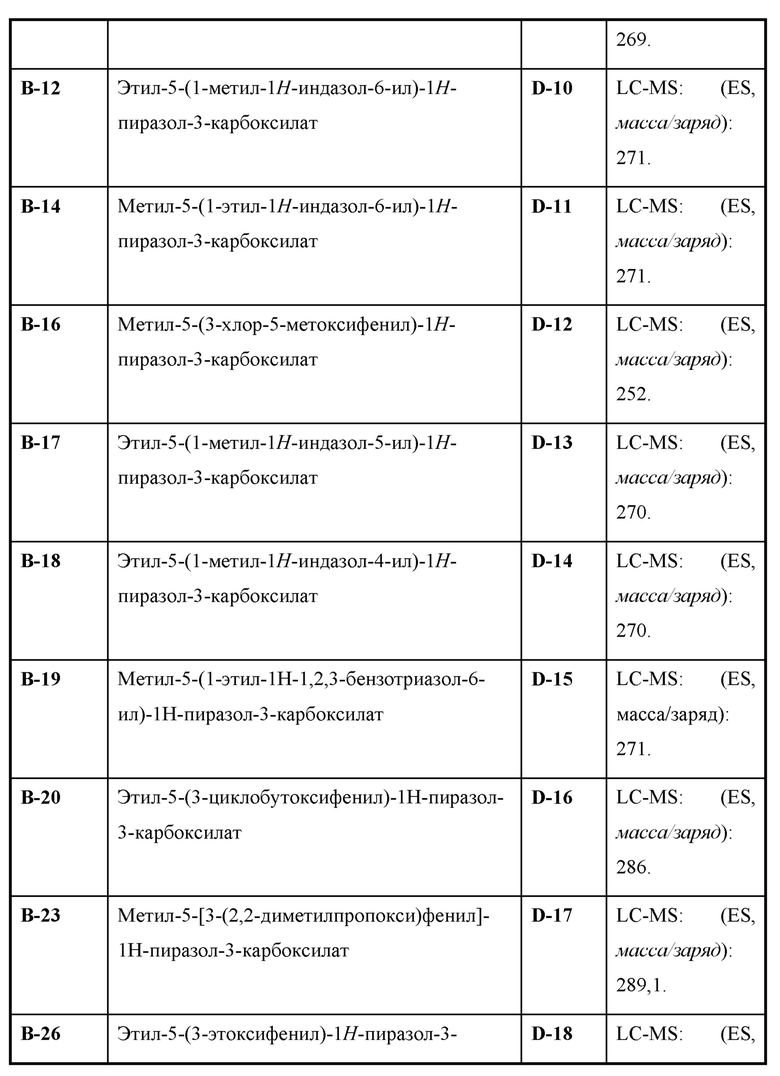
Промежуточное соединение D-27: метил-1-[(2-хлорфенил)метил]-5-(3-(пропан-2-ил)фенил)-1Н-пиразол-3-карбоксилат
Раствор пром. соед. В-13 (1,0 г, 4,03 ммоль, 1,00 эквив.) и пром. соед. С-13 (1,38 г, 6,01 ммоль, 1,50 эквив.) в АсОН (20 мл) перемешивали в течение 2 ч. при 100°С, затем концентрировали под вакуумом, разбавляли с помощью 200 мл EtOAc, промывали с помощью 2×100 мл насыщ. NaHCO3, высушивали над безводным Na2SO4 и концентрировали под вакуумом. Неочищенный продукт очищали с помощью хроматографии на силикагеле с применением EtOAc/петролейного эфира (1:5) с получением 1,05 г (71%) указанного в заголовке продукта в виде желтого твердого вещества.
Промежуточное соединение D-28: метил-1-[(2-хлорфенил)метил]-5-(3-метоксифенил)-1Н-пиразол-3-карбоксилат
К раствору пром. соед. В-2 (3,8 г, 16,09 ммоль, 1,00 эквив.) в МеОН (80 мл) добавляли пром. соед. С-13 (4,8 г, 20,91 ммоль, 1,30 эквив.). Полученный раствор перемешивали в течение 3 ч. при 65°С, затем концентрировали под вакуумом и очищали с помощью хроматографии на силикагеле с применением EtOAc/петролейного эфира (1:2) с получением указанного в заголовке соединения в виде белого твердого вещества (5,5 г, 96%).
Следующие замещенные сложные эфиры 3-пиразолкарбоновой кислоты получали в результате конденсации метил-4-(арил)-2,4-диоксобутаноата с различными замещенными гидразинами.
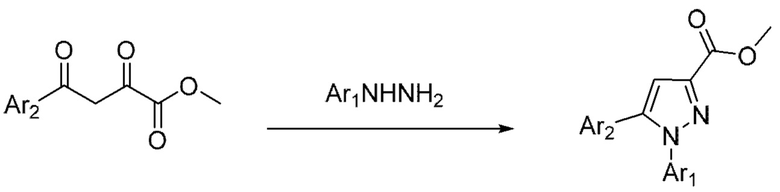
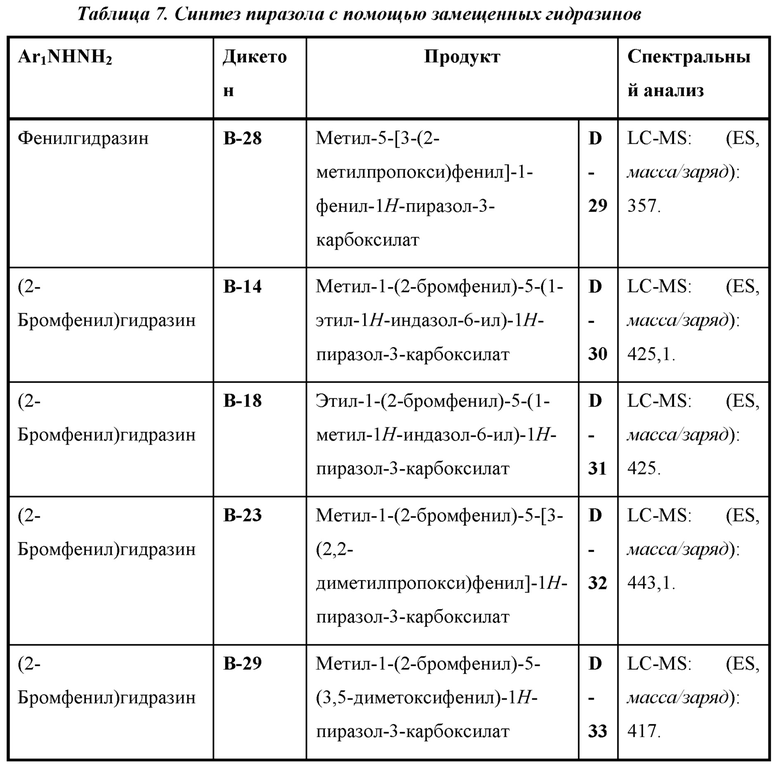
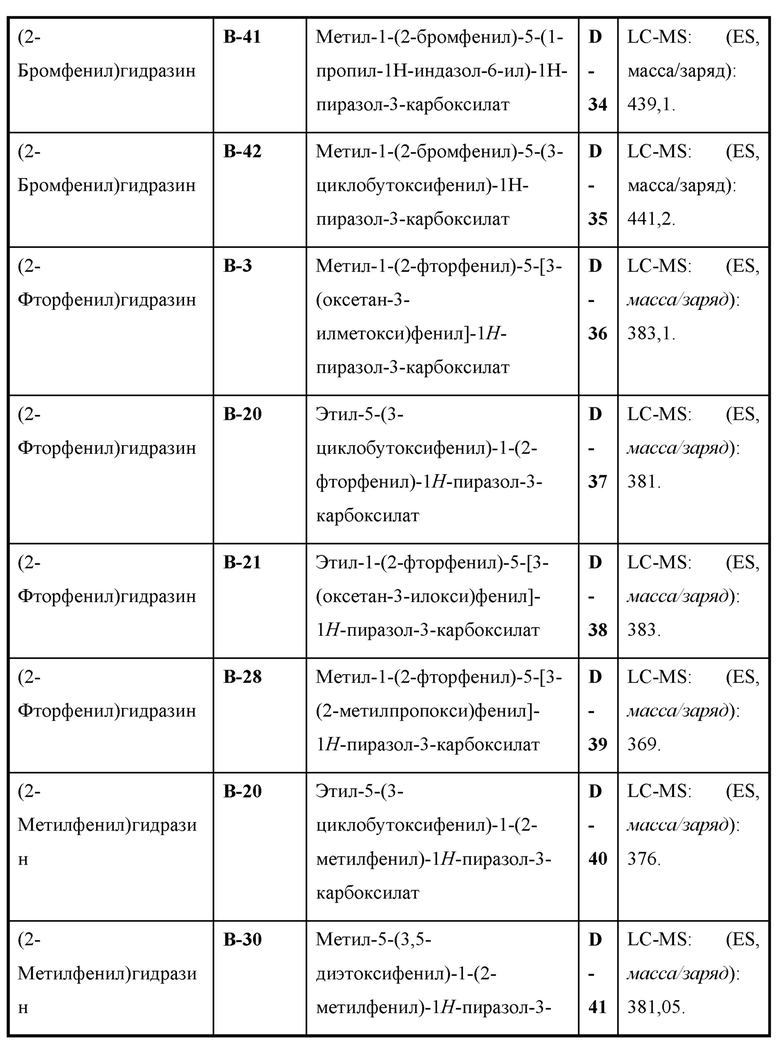
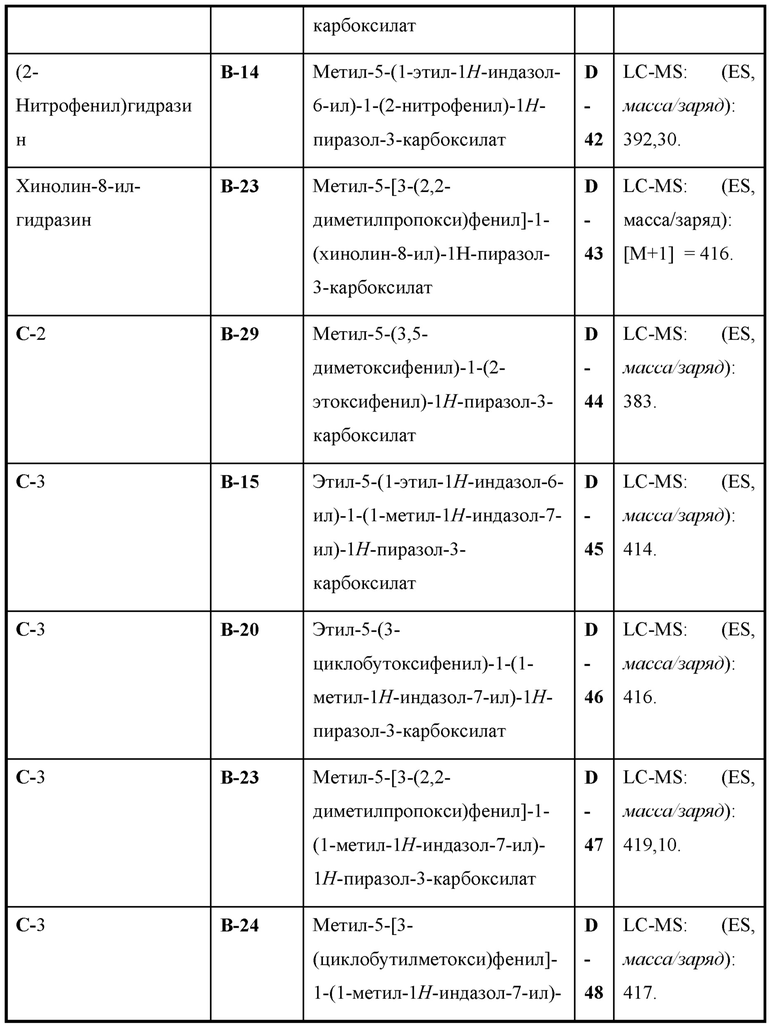
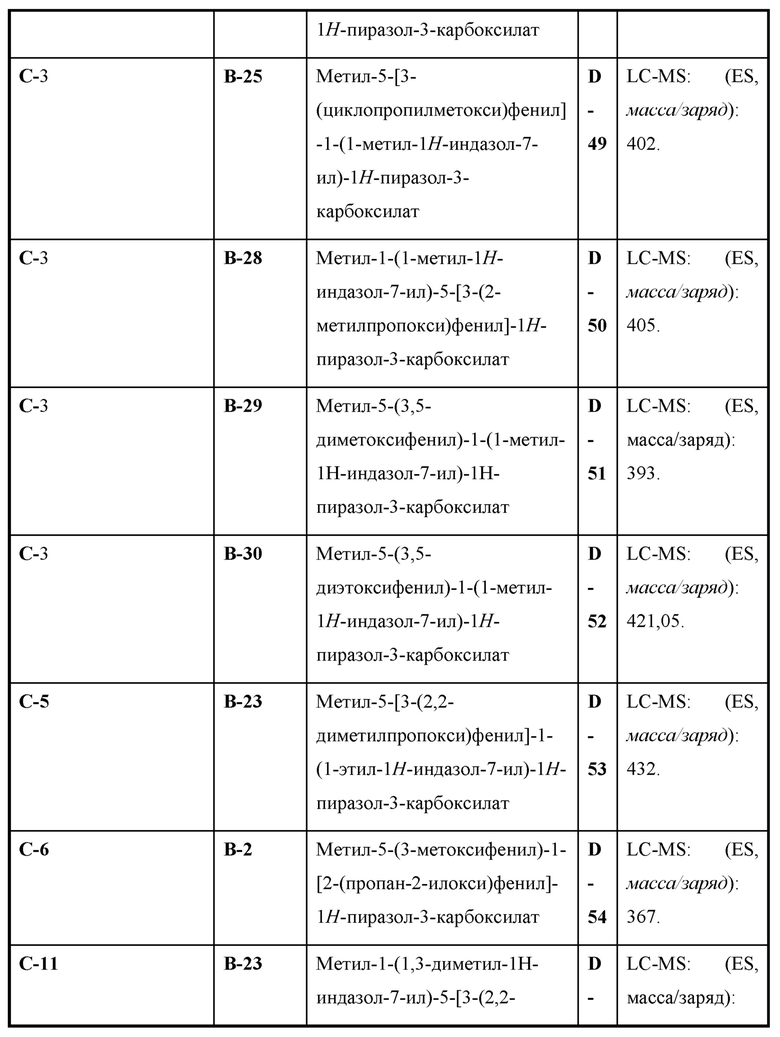
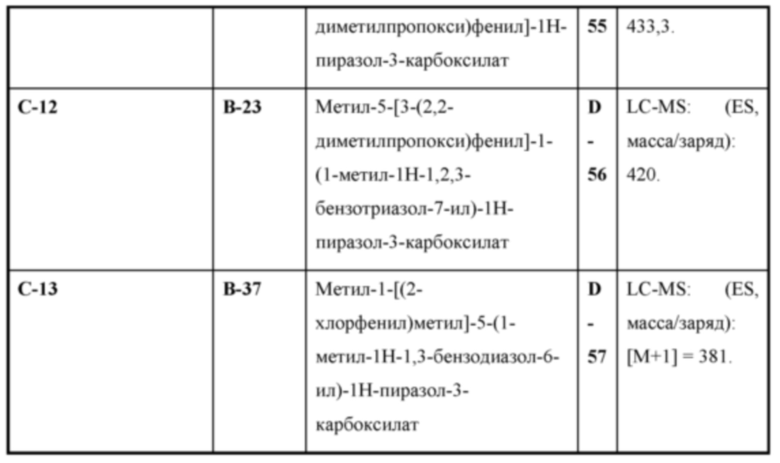
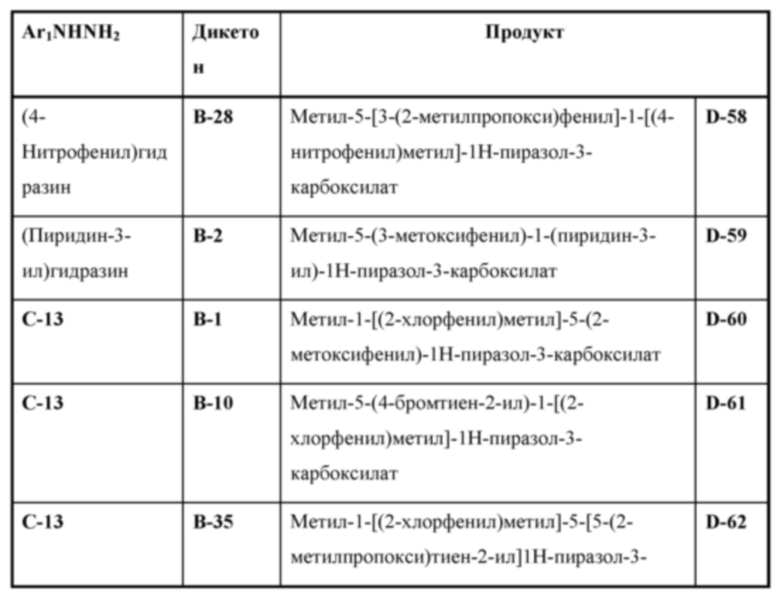
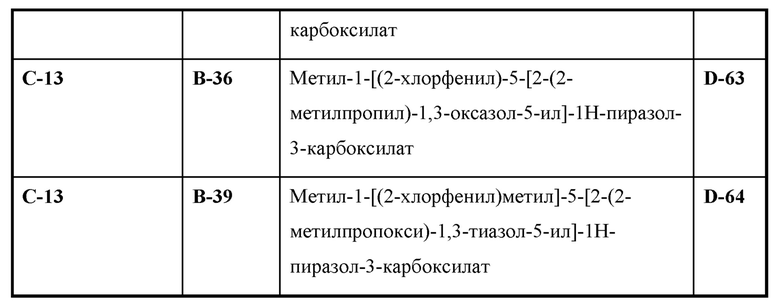
Следующие замещенные сложные эфиры 3-пиразолкарбоновой кислоты получали в результате конденсации различных метил-4-арил-2,4-диоксобутаноатов с (2-хлорфенил)гидразином.
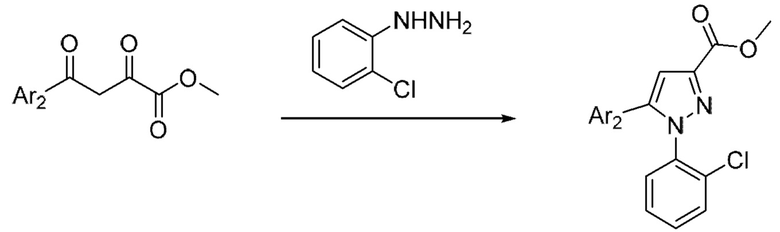


Следующие замещенные сложные эфиры 3-пиразолкарбоновой кислоты получали в результате конденсации пром. соед. В-22 с различными замещенными гидразинами.
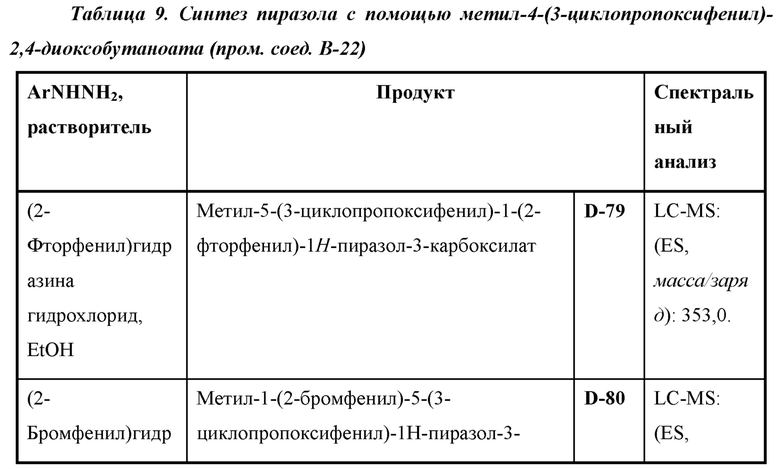
Промежуточное соединение Е-1: 1-(бромметил)-2-этоксибензол
К раствору (2-этоксифенил)метанола (15,2 г, 99,87 ммоль, 1,00 эквив.) и CBr4 (50,1 г, 150,00 ммоль, 1,50 эквив.) в CH2Cl (200 мл) добавляли частями PPh3 (39,45 г, 150,41 ммоль, 1,50 эквив.) при 0°С. Полученный раствор перемешивали в течение 16 ч. при к.т., концентрировали под вакуумом и очищали с помощью хроматографии на силикагеле с применением EtOAc/петролейного эфира (1:10) с получением 14 г (65%) указанного в заголовке соединения в виде бесцветного масла. 1H-ЯМР: (CDCl3, ppm): δ: 7,51-7,25 (m, 1H), 7,06-6,86 (m, 1H), 4,65 (s, 1H), 4,16 (q, J=7,0 Гц, 1Н), 1,53 (t, J=7,0 Гц, 1Н).
Промежуточное соединение Е-2: 1-(бромметил)-2-циклопропоксибензол
Метил-2-циклопропоксибензоат. К смеси метил-2-гидроксибензоата (5,0 г, 32,86 ммоль, 1,00эквив.), Cs2CO3 (32 г, 98,21 ммоль, 3,00 эквив.) в DMA (100 мл) добавляли по каплям бромциклопропан (39,8 г, 328,99 ммоль, 10,00 эквив.) с перемешиванием при к.т. Полученный раствор перемешивали в течение 16 ч. при 130°С, охлаждали, разбавляли с помощью 200 мл EtOAc, промывали с помощью 2×200 мл воды и 2×200 мл солевого раствора, высушивали над Na2SO4 и концентрировали под вакуумом. Остаток очищали с помощью хроматографии на силикагеле с применением EtOAc/петролейного эфира (1:6) с получением 1,6 г (25%) указанного в заголовке соединения в виде желтого масла. LC-MS: (ES, масса/заряд): 193. 1Н ЯМР (400 МГц, CDCl3) δ 7,80 (dd, J=7,8, 1,8 Гц, 1Н), 7,49 (ddd, J=8,9, 7,3, 1,8 Гц, 1Н), 7,38 (dd, J=8,4, 1,1 Гц, 1Н), 7,01 (td, J=7,5, 7,5, 1,2 Гц, 1Н), 3,89 (s, 3H), 3,83 (tt, J=5,9, 5,9, 3,2, 3,2 Гц, 1Н), 0,86 (m, 4H).
(2-Циклопропоксифенил)метанол. К раствору метил-2-циклопропоксибензоата (1,5 г, 7,80 ммоль, 1,00 эквив.) в THF (100 мл) добавляли частями LiAlH4 (594 мг, 15,65 ммоль, 2,00 эквив.) при 0°С. Полученную смесь перемешивали в течение 2 ч. при 0°С на бане со льдом/солью, затем реакцию останавливали посредством добавления Na2SO4/10 Н2О. Твердые вещества удаляли посредством фильтрации. Полученный раствор концентрировали под вакуумом и очищали посредством хроматографии на силикагеле с применением EtOAc/петролейного эфира (1:5) с получением 750 мг (59%) указанного в заголовке соединения в виде желтого масла. LC-MS: (ES, масса/заряд): 187. 1H ЯМР: (400 МГц, CDCl3) δ 7,30 (m, 3H), 6,98 (tdd, J=7,5, 7,5, 3,7, 1,5 Гц, 1Н), 4,65 (s, 2H), 3,80 (m, 1Н), 0,82 (m, 4H).
1-(Бромметил)-2-циклопропоксибензол. К раствору (2-циклопропоксифенил)метанола (750 мг, 4,57 ммоль, 1,00 эквив.) и CBr4 (3,06 г, 9,16 ммоль, 2,00 эквив.) в CH2Cl (30 мл) добавляли частями PPh3 (2,40 г, 9,15 ммоль, 2,00 эквив.) при 0°С. Полученный раствор перемешивали в течение 2 ч. при комнатной температуре, концентрировали под вакуумом и очищали с помощью хроматографии на силикагеле с применением EtOAc/петролейного эфира (1:5) с получением 1,0 г (96%) указанного в заголовке соединения в виде бесцветного масла. 1H ЯМР (300 МГц, CDCl3) δ 7,30 (m, 3Н), 6,96 (dt, J=7,6, 1,8, 1,8 Гц, 1Н), 4,52 (s, 2H), 3,84 (m, 1H), 0,83 (m, 4H).
Промежуточное соединение Е-3: 2-(бромметил)-1-этокси-3-фторбензол
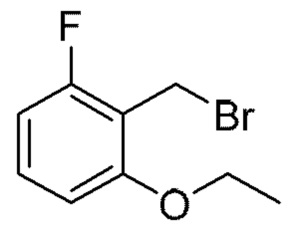
Метил-2-этокси-6-фторбензоат. Смесь метил-2-фтор-6-гидроксибензоата (500 мг, 2,94 ммоль, 1,00 эквив.), K2CO3 (811 мг, 5,87 ммоль, 2,00 эквив.), EtI (911 мг, 5,84 ммоль, 2,00 эквив.) в DMF (15 мл) перемешивали в течение ночи при 80°С, охлаждали до к.т. и экстрагировали с помощью 3×20 мл EtOAc. Объединенные органические слои высушивали над Na2SO4 и концентрировали под вакуумом с получением 500 мг (86%) указанного в заголовке соединения в виде светло-желтого масла.
LC-MS: (ES, масса/заряд): 199,3. 1H ЯМР (300 МГц, CDCl3) δ 7,29 (m, 1H), 6,70 (m, 2H), 4,08 (q, J=7,0, 7,0, 7,0 Гц, 2H), 3,92 (s, 3Н), 1,40 (t, J=7,0, 7,0 Гц, 3Н).
2-Этокси-6-фторбензойная кислота. Раствор продукта из предыдущей стадии (2,6 г, 13,12 ммоль, 1,00 эквив.) и NaOH (2 г, 50,00 ммоль, 4,00 эквив.) в МеОН/H2O (20/10 мл) перемешивали в течение ночи при 40°С. Значение рН раствора доводили до 5 с помощью 1 M HCl. Полученный раствор экстрагировали с помощью 3×50 мл EtOAc. Объединенные органические слои высушивали над Na2SO4 и концентрировали под вакуумом с получением 1,9 г (79%) указанного в заголовке соединения в виде бесцветного масла.
LC-MS: (ES, масса/заряд): 185,3.
(2-Этокси-6-фторфенил)метанол. К раствору продукта из предыдущей стадии (1,9 г, 10,32 ммоль, 1,00 эквив.) и изобутилхлорформиата (2,1 г, 15,38 ммоль, 1,50 эквив.) в THF (50 мл) при 0°С добавляли TEA (4,5 мл, 3,00 эквив.). Реакционную смесь перемешивали в течение 2 ч. при 0°С, затем фильтровали. К фильтрату добавляли NaBH4 (780 мг, 20,62 ммоль, 2,00 эквив.) при 0°С. Полученный раствор перемешивали в течение 3 ч. при комнатной температуре. Затем в реакционной смеси реакцию останавливали с помощью добавления 10 мл воды/льда. Полученный раствор экстрагировали с помощью 3×50 мл EtOAc. Объединенные органические слои высушивали над Na2SO4, концентрировали под вакуумом и очищали с помощью хроматографии на силикагеле с применением EtOAc/петролейного эфира (2/1) с получением 0,7 г (40%) указанного в заголовке соединения в виде светло-желтого масла.
1H ЯМР (300 МГц, DMSO) δ 7,27 (td, J=8,3, 8,3, 7,0 Гц, 1Н), 6,77 (m, 2H), 4,75 (t, J=5,5, 5,5 Гц, 1Н), 4,48 (dd, J=5,5, 1,9 Гц, 2H), 4,06 (q, J=7,0, 7,0, 7,0 Гц, 2H), 1,35 (t, J=6,9, 6,9 Гц, 3Н).
2-(Бромметил)-1-этокси-3-фторбензол. Раствор продукта из предыдущей стадии (700 мг, 4,11 ммоль, 1,00 эквив.), PPh3 (2,16 г, 8,24 ммоль, 2,00 эквив.) и CBr4 (2,7 г, 2,00 эквив.) в CH2Cl2 (30 мл) перемешивали в течение 2 ч. при к.т. Полученный раствор экстрагировали с помощью 3×30 мл EtOAc. Объединенные органические слои высушивали над Na2SO4, концентрировали под вакуумом и очищали посредством хроматографии на силикагеле с применением EtOAc/петролейного эфира (5/1) с получением 0,4 г (42%) указанного в заголовке соединения в виде светло-желтого масла.
1H ЯМР (300 МГц, CDCl3) δ 7,24 (m, 1Н), 6,69 (m, 2H), 4,67 (dd, J=32,8, 1,5 Гц, 2H), 4,13 (qd, J=7,0, 7,0, 7,0, 2,5 Гц, 2H), 1,48 (td, J=7,0, 6,9, 3,2 Гц, 3Н).
Промежуточное соединение Е-4: 1-(бромметил)-2-(пропан-2-илокси)бензол
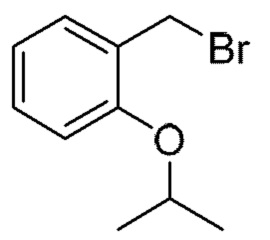
[2-(Пропан-2-илокси)фенил] метанол. К раствору 2-(гидроксиметил)фенола (2 г, 16,11 ммоль, 1,00 эквив.) в DMF (10 мл) добавляли последовательно 2-йодпропан (5,48 г, 32,24 ммоль, 2,00 эквив.) затем Cs2CO3 (10,5 г, 32,23 ммоль, 2,00 эквив.). Полученный раствор перемешивали в течение ночи при 85°С. Реакционную смесь охлаждали до комнатной температуры. Полученный раствор экстрагировали с помощью 3×50 мл EtOAc и органические слои объединяли, высушивали над безводным Na2SO4 и концентрировали под вакуумом. Остаток пропускали через колонку с силикагелем с применением EtOAc/гексана (1/4). В результате этого получали указанное в заголовке соединение в виде светло-желтого масла (2,1 г, 78%).
1-(Бромметил)-2-(пропан-2-илокси)бензол. К раствору продукта из предыдущей стадии (3 г, 18,05 ммоль, 1,00 эквив.) в CH2Cl2 (50 мл) добавляли последовательно CBr4 (12,84 г, 36,17 ммоль, 2,00 эквив.) и PPh3 (9,48 г, 36,14 ммоль, 2,00 эквив.) на ледяной бане. Полученный раствор перемешивали в течение 5 ч. при комнатной температуре. Полученный раствор экстрагировали с помощью 3×100 мл CH2Cl2 и органические слои объединяли, высушивали над безводным Na2SO4 и концентрировали под вакуумом. Остаток пропускали через колонку с силикагелем с применением EtOAc/гексана (1/4). В результате этого получали указанное в заголовке соединение в виде светло-желтого масла (1,6 г, 39%).
Следующие алкилирующие средства вводили в реакцию с пиразолами, как раскрыто ниже.
Промежуточное соединение Е-5 1-(хлорметил)-2-нитробензол
Промежуточное соединение Е-6 1-бром-2-(бромметил)-бензол
Промежуточное соединение Е-7 1-(бромметил)-2-хлорбензол
Промежуточное соединение Е-8 2-(бромметил)-1-фтор-3-нитробензол
Промежуточное соединение Е-9 (2-бромэтил)бензол
Промежуточное соединение Е-10 1-(хлорметил)-2-хлорбензол
Промежуточное соединение Е-11 2-(бромметил)пиридин
Промежуточное соединение Е-12 7-(бромметил)-1-метил-lH-индазол
Промежуточное соединение Е-13 1-бром-2-метилпропан
Промежуточное соединение Е-14 4-(бромметил)тетрагидропиран
Промежуточное соединение D-98: метил-1-[(3-хлорфенил)метил]-5-фенил-1H-пиразол-3-карбоксилат
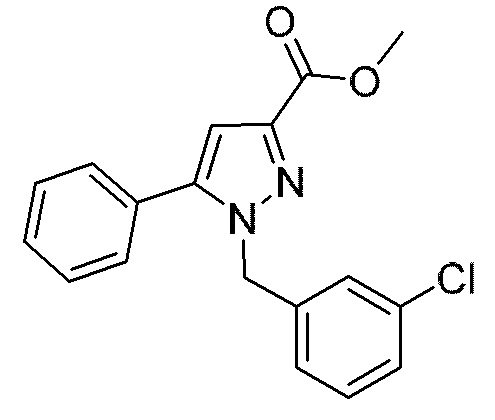
К суспензии метил-5-фенил-lH-пиразол-3-карбоксилата (1) (1,0 г, 4,94 ммоль) в толуоле добавляли порциями NaH (60%) (0,394 г, 9,88 ммоль) в атмосфере N2 при комнатной температуре и продолжали перемешивание в течение 30 мин. К вышеуказанной смеси добавляли по каплям раствор 3-хлорбензилбромида (0,96 мл, 7,42 ммоль) в толуоле (3 мл) при 60°С. Реакционную смесь перемешивали при 110°С в течение 16 ч. Смесь охлаждали до комнатной температуры и реакцию останавливали с помощью водн. раствора NH4Cl. Смесь разделяли с помощью EtOAc (100 мл) и отделяли органический слой. Слой EtOAc промывали с помощью солевого раствора (2×25 мл) и высушивали над Na2SO4 и растворитель выпаривали. Остаток подвергали хроматографии над SiO2 (ISCO CombiFlash® Rƒ 200) с применением 0-50% градиента EtOAc в гексане с получением указанного в заголовке соединения (1,2 г, 75%). 1Н ЯМР (CDCl3, 400 МГц) δ 3,95 (s, 3Н), 5,36 (s, 2H), 6,85-6,92 (m, 2H), 6,95-6,99 (m, 1H), 7,17-7,29 (m, 4H). 7,35-7,48 (m, 3Н).
Промежуточное соединение D-99: метил-1-[(2-циклопропоксифенил)метил]-5-(3-метоксифенил)-1Н-пиразол-3-карбоксилат
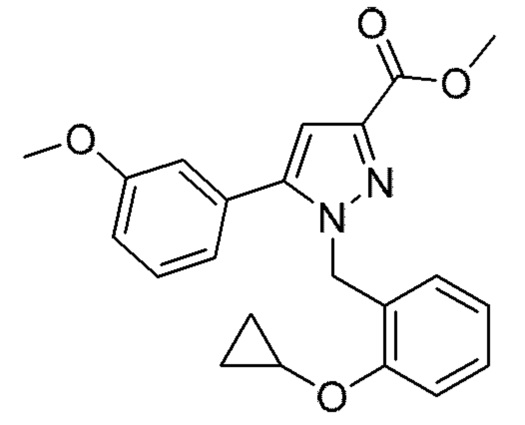
К раствору пром. соед. D-3 (793 мг, 3,41 ммоль, 1,00 эквив.) в толуоле (10 мл) добавляли NaH (164 мг, 6,83 ммоль, 2,00 эквив.). Полученный раствор перемешивали при к.т. в течение 30 мин., затем нагревали до 60°С. К нему добавляли раствор пром. соед. Е-2 (1 г, 4,40 ммоль, 1,30 эквив.) в толуоле (10 мл). Полученный раствор перемешивали при 60°С в течение 1 ч., затем раствор нагревали до 110°С и перемешивали в течение 6 ч. при данной температуре. Реакционную смесь затем охлаждали до к.т., реакцию останавливали с помощью добавления 10 мл воды/льда и экстрагировали с помощью 3×100 мл EtOAc. Объединенные органические слои высушивали над Na2SO4, и концентрировали под вакуумом, и очищали с помощью колонки с силикагелем с применением EtOAc/гексана (1/3) с получением 1 г (77%) указанного в заголовке соединения в виде желтого масла. LC-MS: (ES, масса/заряд): 379.
Промежуточное соединение D-100: метил-1-[(2-хлорфенил)метил]-5-(3,5-диметоксифенил)-1Н-пиразол-3-карбоксилат
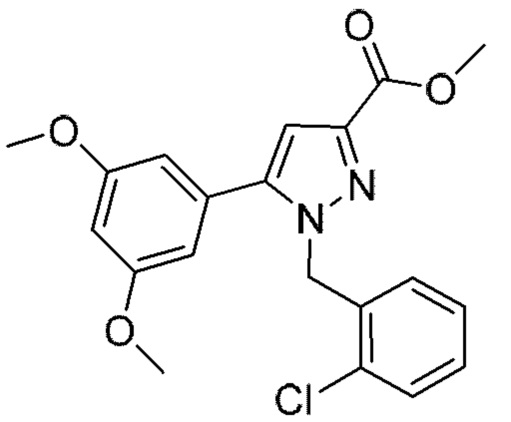
К раствору метильного пром. соед. D-21 (1,0 г, 3,81 ммоль, 1,00 эквив.) в толуоле (50 мл) добавляли частями NaH (304 мг, 7,60 ммоль, 2,00 эквив.) при к. т. Смесь перемешивали при к.т. в течение 30 мин., затем добавляли по каплям пром. соед. Е-7 (1,56 г, 7,59 ммоль, 2,00 эквив.) с перемешиванием при 60°С. Полученный раствор перемешивали в течение 1 ч. при 60°С, затем нагревали до 110°С и перемешивали в течение дополнительных 3 ч. В реакционной смеси затем реакцию останавливали посредством добавления воды/льда. Полученный раствор экстрагировали с помощью 200 мл EtOAc и объединенные органические слои промывали с помощью 2×100 мл солевого раствора, высушивали над Na2SO4, концентрировали под вакуумом и очищали посредством хроматографии на силикагеле с применением EtOAc/петролейного эфира (1:3) с получением 800 мг (54%) указанного в заголовке соединения в виде бесцветного масла. LC-MS: (ES, масса/заряд): 387. 1H-ЯМР: (CDCl3, ppm): δ: 7,42-7,29 (m, 1H), 7,29-7,13 (m, 2H), 6,97 (s, 1H), 6,77-6,67 (m, 1H), 6,42 (dd, J=30,5, 2,3 Гц, 3Н), 5,55 (s, 2H), 3,97 (d, J=1,0 Гц, 3Н), 3,69-3,60 (m, 6H).
Следующие замещенные пиразолы получали в результате алкилирования с использованием алкилгалогенида.

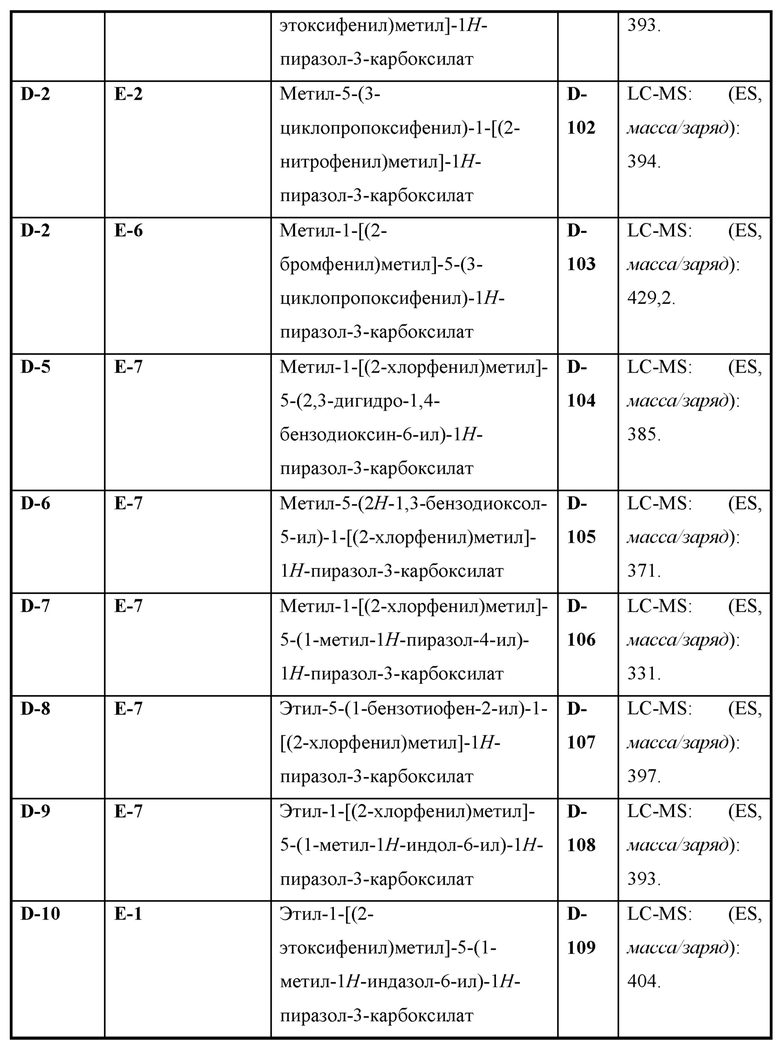
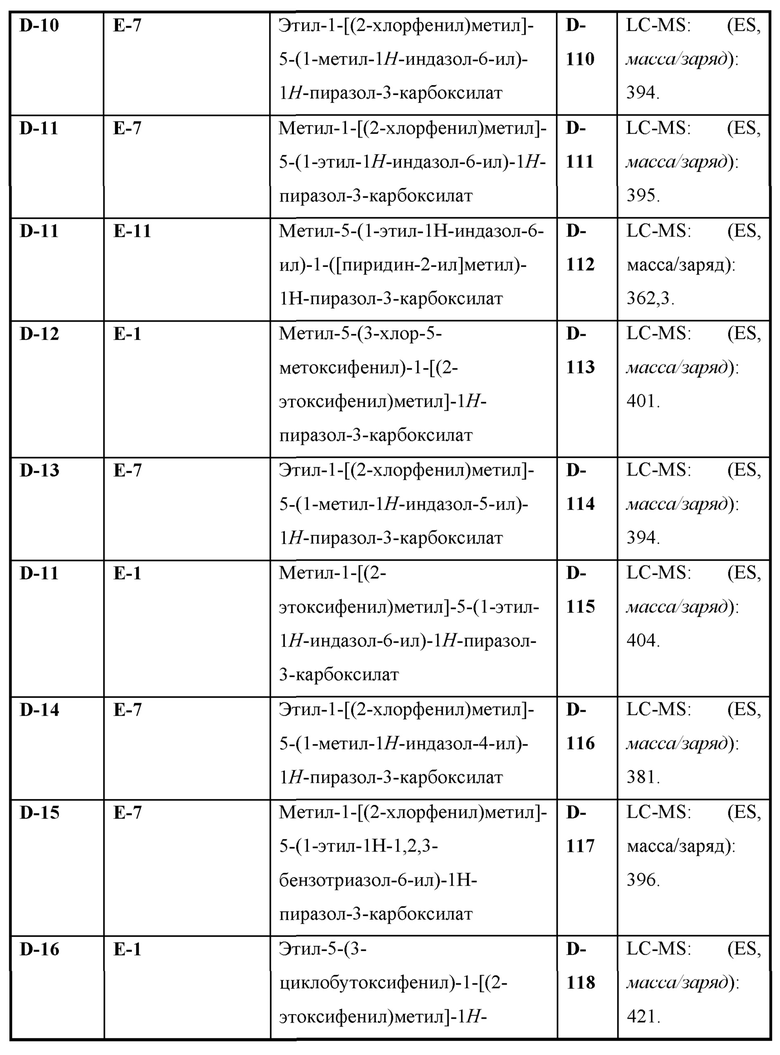

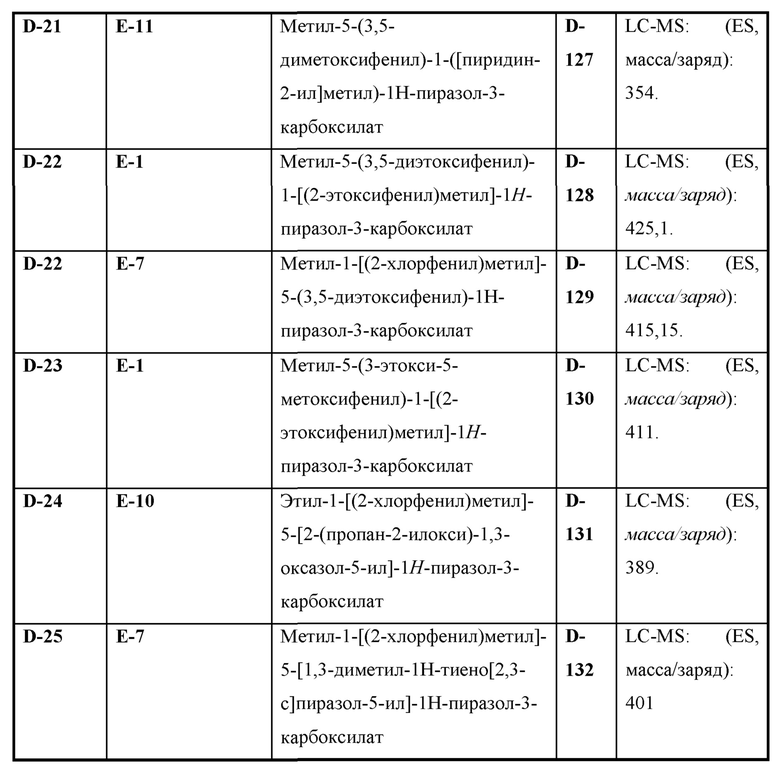


Промежуточное соединение D-139: метил-1-[(2,6-диметоксифенил)метил]-5-[3-(2-метилпропокси)фенил]-1Н-пиразол-3-карбоксилат
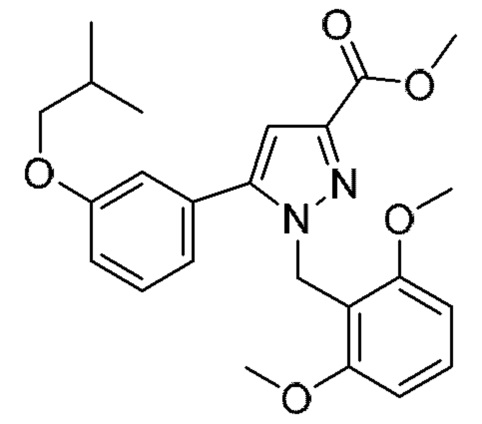
К раствору пром. соед. D-20 (1,37 г, 4,99 ммоль, 1,00 эквив.) в THF (50 мл) в атмосфере N2 при 0°С добавляли (2,6-диметоксифенил)метанол (1,26 г, 7,49 ммоль, 1,50 эквив.), а затем добавляли PPh3 (1,81 г, 6,90 ммоль, 1,30 эквив.). Затем добавляли по каплям DIAD (1,75 г, 8,65 ммоль, 1,50 эквив.) и полученный раствор перемешивали в течение 16 ч. при 25°С. Остаток пропускали через колонку с силикагелем с использованием EtOAc/петролейного эфира (1:19). В результате этого получали указанное в заголовке соединение в виде желтого твердого вещества (890 мг, 42%).
Промежуточное соединение D-140: метил-1-[(3-хлорпиридин-2-ил)метил]-5-(3-метоксифенил)-1Н-пиразол-3-карбоксилат
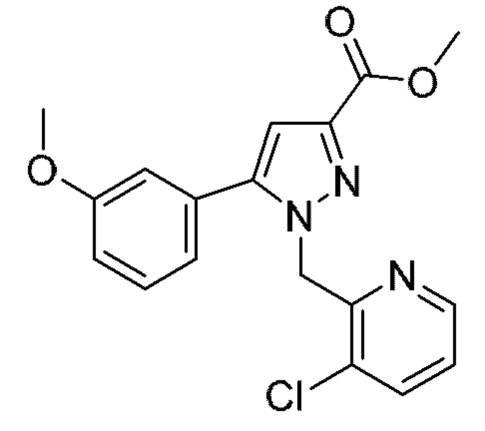
(3-Хлорпиридин-2-ил)метанол. К раствору 3-хлорпиридин-2-карбоновой кислоты (2,1 г, 13,33 ммоль, 1,00 эквив.) в THF (40 мл) добавляли Et3N (2,7 г, 26,68 ммоль, 2,00 эквив.) с последующим добавлением по каплям хлор(пропан-2-илокси)метанона (2,45 г, 19,99 ммоль, 1,50 эквив.) с перемешиванием при 0°С. Раствор перемешивали в течение 1 ч. при комнатной температуре. Твердое вещество удаляли с помощью фильтрации. К фильтрату добавляли NaBH4 (1,53 г, 40,44 ммоль, 3,00 эквив.). Полученный раствор перемешивали в течение 2 ч. при к.т., затем разбавляли с помощью 50 мл Н2О и экстрагировали с помощью 2×100 мл EtOAc. Объединенные органические слои промывали с помощью 50 мл насыщенного NaCl, высушивали над Na2SO4, концентрировали под вакуумом и очищали с помощью хроматографии на силикагеле с применением EtOAc/петролейного эфира (1:6) с получением 0,9 г (47%) указанного в заголовке соединения в виде бесцветного масла.
Метил-1-[(3-хлорпиридин-2-ил)метил]-5-(3-метоксифенил)-1Н-пиразол-3-карбоксилат. К раствору продукта из предыдущей стадии (850 мг, 5,92 ммоль, 1,00 эквив.) в THF (8,5 мл), в атмосфере N2 добавляли пром. соед. D-3 (1,4 г, 6,03 ммоль, 1,00 эквив.) и Ph3P (3,1 г, 11,82 ммоль, 2,00 эквив.) с последующим добавлением по каплям DIAD (1,8 г, 8,91 ммоль, 1,50 эквив.) с перемешиванием при 0°С. Полученный раствор перемешивали в течение 5 ч. при к.т., разбавляли с помощью 30 мл Н2О и экстрагировали с помощью 2×50 мл EtOAc. Объединенные органические слои промывали с помощью 20 мл насыщенного NaCl, высушивали над Na2SO4, концентрировали под вакуумом и очищали посредством хроматографии на силикагеле с применением EtOAc/петролейного эфира (1:10) с получением 1,7 г (80%) указанного в заголовке соединения в виде белого твердого вещества. 1H-ЯМР (400 МГц, DMSO-d6) δ 8,90 (s, 1H), 8,35 (dd, J=4,7, 1,5 Гц, 1H), 7,99 (dd, J=8,1, 1,5 Гц, 1Н), 7,51 (s, 1H), 7,45 (dt, J=7,7, 1,2 Гц, 1H), 7,41 (dd, J=2,6, 1,5 Гц, 1H), 7,36-7,30 (m, 1H), 6,91 (ddd, J=8,2, 2,7, 1,0 Гц, 1H), 5,99 (s, 2H), 3,80 (s, 3H), 3,77 (s, 3H).
Промежуточное соединение D-141: метил-1-[[4-(диметиламино)фенил]метил]-5-[3-(2-метилпропокси)фенил]-1Н-пиразол-3-карбоксилат
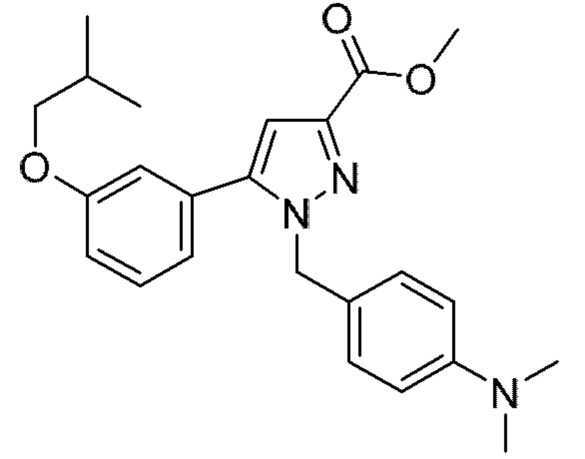
Метил-1-[(4-аминофенил)метил]-5-[3-(2-метилпропокси)фенил]-1Н-пиразол-3-карбоксилат. К раствору пром. соед. D-58 (2 г, 4,88 ммоль, 1,00 эквив.) в АсОН/Н2О (100/40 мл) добавляли Zn (1 г, 15,29 ммоль, 3,00 эквив.) и полученный раствор перемешивали в течение 5 ч. при 25°С. Твердые вещества собирали посредством фильтрации. Значение рН раствора доводили до 7 с помощью (насыщ.) NaHCO3 (водн.) и полученный раствор экстрагировали с помощью 200 мл EtOAc. Объединенные органические слои концентрировали под вакуумом с получением 1,5 г (81%) указанного в заголовке соединения в виде желтого масла.
Метил-1-[[4-(диметиламино)фенил]метил]-5-[3-(2-метилпропокси)фенил]-1H-пиразол-3-карбоксилат. К раствору продукта из предыдущей стадии (1,35 г, 3,56 ммоль, 1,00 эквив.) в МеОН (50 мл) добавляли формальдегид (5 мл, 1,50 эквив.) в течение 30 мин. К нему добавляли NaCNBH3 (800 мг, 12,73 ммоль, 3,00 эквив.) и полученный раствор перемешивали в течение 5 мин. при 25°С. Полученный раствор экстрагировали с помощью 200 мл EtOAc и объединенные органические слои очищали посредством хроматографии на силикагеле с применением EtOAc/петролейного эфира (1:7) с получением 810 мг (56%) указанного в заголовке соединения в виде желтой жидкости.
Промежуточное соединение D-142: метил-1-[[2-(диметиламино)-6-фторфенил]метил]-5-(3-метоксифенил)-1Н-пиразол-3-карбоксилат
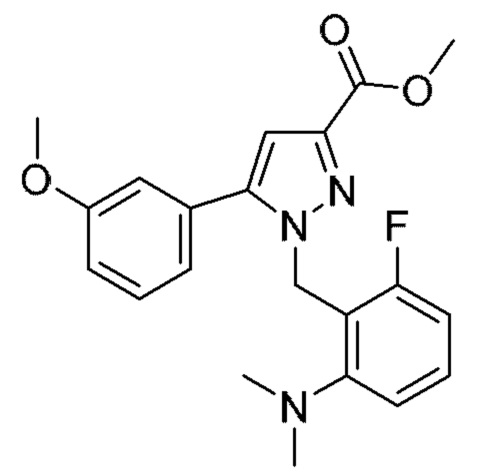
Промежуточное соединение D-142 получали из пром. соед. D-133 посредством выполнения последовательности восстановления с помощью цинка/восстановительного аминирования, сходной с таковой, применяемой для получения пром. соед. D-141.
Промежуточное соединение D-143: метил-1-[(2-хлорфенил)метил]-5-[3-(оксетан-3-илметокси)фенил]-1Н-пиразол-3-карбоксилат
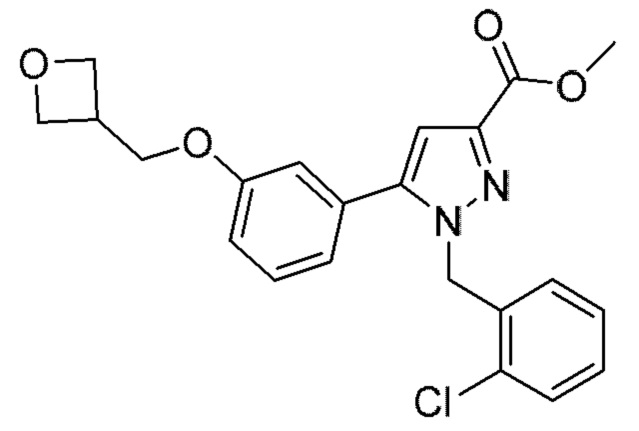
1-[(2-Хлорфенил)метил]-5-(3-гидроксифенил)-1Н-пиразол-3-карбоновая кислота. Раствор пром. соед. D-122 (3,2 г, 7,39 ммоль, 1,00 эквив.) в АсОН/HCl (15/5 мл) перемешивали в течение 2 ч. при 90°С, затем охлаждали, концентрировали под вакуумом и очищали с помощью хроматографии на силикагеле с применением EtOAc/петролейного эфира (2/1) с получением 2 г (82%) указанного в заголовке соединения в виде светло-желтого масла. LC-MS: (ES, масса/заряд): 329,0. 1Н ЯМР: (300 МГц, DMSO) δ 12,83 (s, 1Н), 9,72 (s, 1H), 7,46 (m, 1H), 7,29 (m, 3H), 6,81 (m, 5H), 5,48 (s, 2H).
Метил-1-[(2-хлорфенил)метил]-5-(3-гидроксифенил)-1H-пиразол-3-карбоксилат. Раствор продукта из предыдущей стадии (2 г, 6,08 ммоль, 1,00 эквив.) и H2SO4 (1 мл) в МеОН (20 мл) перемешивали в течение 2 ч. при 65°С. Значение рН доводили до 7 с помощью насыщенного NaHCO3. Полученный раствор экстрагировали с помощью 3×30 мл EtOAc и объединенные органические слои высушивали над Na2SO4, концентрировали под вакуумом и очищали посредством хроматографии на силикагеле с применением EtOAc/петролейного эфира (2/1) с получением 1,7 г (82%) указанного в заголовке соединения в виде белого твердого вещества. LC-MS: (ES, масса/заряд): 343,1. 1Н ЯМР: (400 МГц, DMSO) δ 9,74 (s, 1Н), 7,46 (m, 1H), 7,31 (m, 3H), 6,93 (s, 1Н), 6,83 (m, 4H), 5,50 (s, 2H), 3,82 (s, 3H).
Метил-1-[(2-хлорфенил)метил]-5-[3-(оксетан-3-илметокси)фенил]-1H-пиразол-3-карбоксилат. К раствору продукта из предыдущей стадии (1,7 г, 4,96 ммоль, 1,00 эквив.), PPh3 (2,62 г, 9,99 ммоль, 2,00 эквив.) и (оксетан-3-ил)метанола (870 мг, 9,87 ммоль, 2,00 эквив.) в THF (30 мл) при -10°С в атмосфере N2 добавляли DTAD (1,82 г, 9,01 ммоль, 1,80 эквив.). Полученный раствор перемешивали в течение ночи при к.т. и экстрагировали с помощью 3×30 мл EtOAc. Объединенные органические слои высушивали над Na2SO4, концентрировали под вакуумом и очищали посредством хроматографии на силикагеле с применением EtOAc/петролейного эфира (1/3) с получением 1,1 г (54%) указанного в заголовке соединения в виде белого твердого вещества. LC-MS: (ES, масса/заряд): 413,1.
Промежуточное соединение D-144: метил-5-(3-циклопропоксифенил)-1-(1-[[2-(триметилсилил)этокси]метил]-1Н-индазол-7-ил)-1Н-пиразол-3-карбоксилат
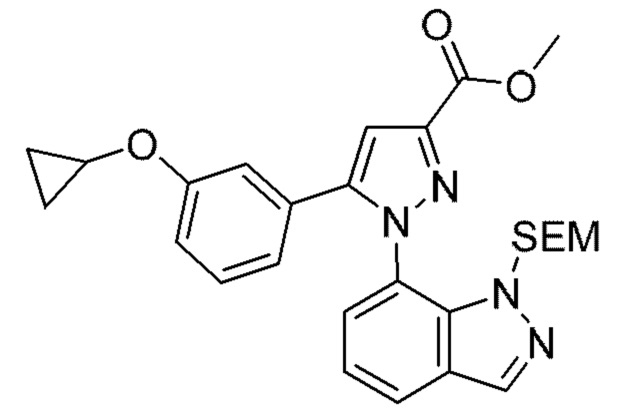
К раствору пром. соед. D-95 (600 мг, 1,60 ммоль, 1,00 эквив.) в CH2Cl2 (15 мл) добавляли NaH (128 мг, 5,33 ммоль, 2,00 эквив.). Раствор перемешивали в течение 10 мин., затем добавляли SEMCl (664 мг, 2,50 эквив.). Полученный раствор перемешивали в течение 16 ч. при к.т., затем реакцию останавливали посредством добавления воды и экстрагировали с помощью 2×100 мл EtOAc. Объединенные органические слои промывали с помощью 100 мл солевого раствора, высушивали над Na2SO4, концентрировали под вакуумом и очищали с помощью колонки с силикагелем с применением EtOAc/петролейного эфира (1:2) с получением 300 мг (37%) указанного в заголовке соединения в виде желтого масла. LC-MS: (ES, масса/заряд): 504.
Промежуточное соединение D-145: метил-5-(3-циклопропоксифенил)-1-(1-[[2-(триметилсилил)этокси]метил]-1Н-индазол-4-ил)-1Н-пиразол-3-карбоксилат
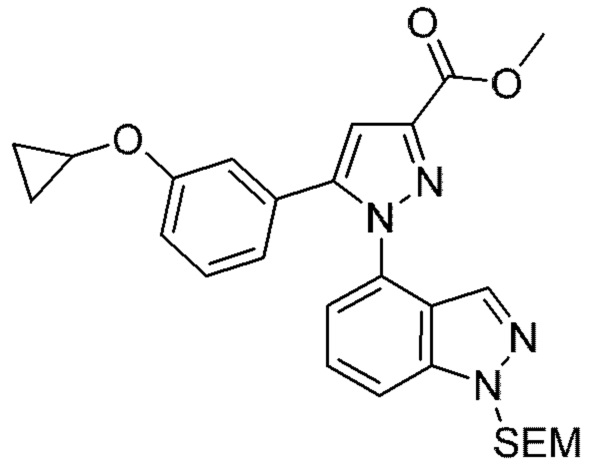
К раствору пром. соед. D-94 (460 мг, 1,23 ммоль, 1,00 эквив.) в CH2Cl2 (10 мл) добавляли NaH (57,5 мг, 2,40 ммоль, 2,00 эквив.) при 0°С. Полученный раствор перемешивали в течение 30 мин., затем добавляли SEMC1 (253 мг, 0,69 ммоль, 1,30 эквив.). Полученный раствор перемешивали в течение 5 ч. при к.т., затем реакцию останавливали с помощью Н2О и экстрагировали с помощью 3×20 мл EtOAc. Объединенные органические слои высушивали над Na2SO4, концентрировали под вакуумом и очищали посредством хроматографии на силикагеле с применением EtOAc/петролейного эфира (1/3) с получением 300 мг (48%) указанного в заголовке соединения в виде бесцветного масла. LC-MS: (ES, масса/заряд): 505,1.
Промежуточное соединение D-146: метил-5-(3-циклопропоксифенил)-1-(3-метил-1-[[2-(триметилсилил)этокси]метил]-1Н-индазол-4-ил)-1Н-пиразол-3-карбоксилат
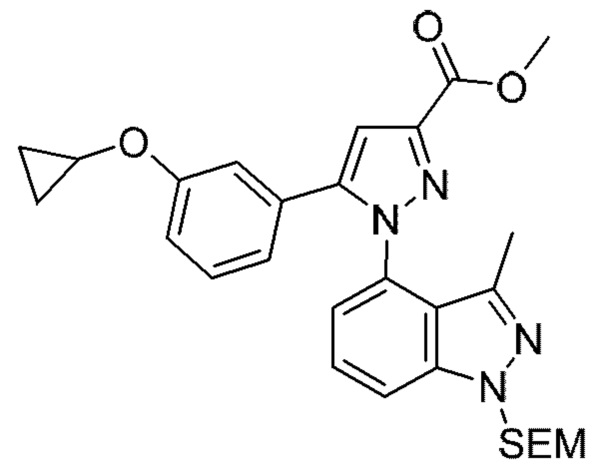
К раствору пром. соед. D-96 (500 мг, 1,29 ммоль, 1,00 эквив.) в CH2Cl2 (10 мл) добавляли NaH (62 мг, 2,58 ммоль, 2,00 эквив.). Полученный раствор перемешивали в течение 30 мин. при 0°С, затем добавляли [2-(хлорметокси)этил]триметилсилан (278 мг, 1,67 ммоль, 1,30 эквив.). Полученный раствор перемешивали в течение 5 ч. при к.т., затем реакцию останавливали с помощью Н2О и экстрагировали с помощью 3×20 мл CH2Cl2. Объединенные органические слои высушивали над Na2SO4, концентрировали под вакуумом и очищали посредством Prep-TLC с применением EtOAc/петролейного эфира (1/3) с получением 250 мг (36%) указанного в заголовке соединения в виде бесцветного масла. LC-MS: (ES, масса/заряд): 519,40.
Промежуточное соединение D-147: этил-1-[(2-хлорфенил)метил]-5-фенокси-1H-пиразол-3-карбоксилат

Этил-1-[(2-хлорфенил)метил]-5-оксо-4,5-дигидро-1Н-пиразол-3-карбоксилат. Раствор пром. соед. С-13 (4 г, 17,54 ммоль, 1,00 эквив.) и 1,4-диэтил-2-оксобутандиоата (0 мг, 1,30 эквив.) в EtOH (120 мл) нагревали до температуры возврата флегмы в течение ночи, затем концентрировали под вакуумом. Неочищенный продукт очищали посредством хроматографии на силикагеле с применением EtOAc/петролейного эфира (1:20~1:5) с получением 2,8 г (57%) указанного в заголовке продукта в виде желтого сиропа.
Этил-1-[(2-хлорфенил)метил]-5-(2-нитрофенокси)-1Н-пиразол-3-карбоксилат. Раствор продукта из предыдущей стадии (2,8 г, 9,97 ммоль, 1,00 эквив.), 1-фтор-2-нитробензола (2,8 г, 19,84 ммоль, 2,00 эквив.) и K2CO3 (2,7 г, 19,57 ммоль, 2,00 эквив.) в DMF (20 мл) перемешивали в течение ночи при 90°С. Полученный раствор разбавляли с помощью EtOAc, промывали с помощью воды и солевого раствора, высушивали над безводным Na2SO4 и концентрировали под вакуумом. Неочищенный продукт очищали посредством хроматографии на силикагеле с применением EtOAc/петролейного эфира (1:50-1:10) с получением 0,8 г (20%) указанного в заголовке продукта в виде желтого масла.
Этил-5-(2-аминофенокси)-1-[(2-хлорфенил)метил]-1Н-пиразол-3-карбоксилат. Раствор продукта из предыдущей стадии (800 мг, 1,99 ммоль, 1,00 эквив.) в АсОН/Н2О (3:1) (8 мл) перемешивали над Zn (600 мг, 9,38 ммоль, 5,00 эквив.) в течение 3 ч. при 60°С. Твердые вещества удаляли посредством фильтрации и фильтрат концентрировали под вакуумом. Неочищенный продукт очищали посредством хроматографии на силикагеле с применением EtOAc/петролейного эфира (1:30~1:5) с получением 540 мг (73%) указанного в заголовке продукта в виде желтого твердого вещества.
Этил-1-[(2-хлорфенил)метил]-5-фенокси-1Н-пиразол-3-карбоксилат. К раствору продукта из предыдущей стадии (540 мг, 1,45 ммоль, 1,00 эквив.) в THF (15 мл) добавляли трет-бутиловыи нитрит (450 мг, 4,36 ммоль, 3,00 эквив.). Полученный раствор перемешивали в течение 30 мин. при 60°С, затем концентрировали под вакуумом. Остаток очищали посредством Prep-TLC (EtOAc:PE=1:3) с получением 220 мг (42%) указанного в заголовке продукта в виде твердого вещества.
Промежуточное соединение F-1: [1-[(3-хлорфенил)метил]-5-фенил-1Н-пиразол-3-ил]метанол
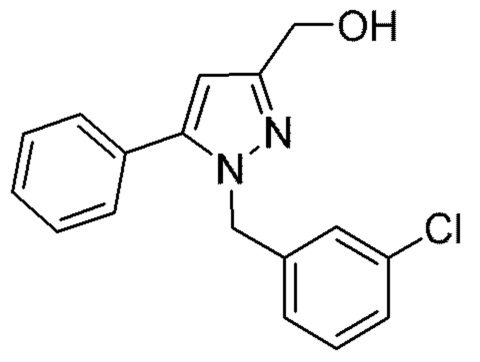
Раствор пром. соед. D-98 (0,80 г, 2,45 ммоль) в безводном THF охлаждали до 0°С. К вышеуказанной смеси добавляли порциями LiAlH4 (0,14 г, 3,67 ммоль) и продолжали перемешивание при 0°С в течение 1,30 ч. В смеси реакцию останавливали с помощью воды (0,15 мл) и 30% води. раствора NaOH (0,3 мл) при 0°С и продолжали перемешивание в течение 30 мин. Реакционную смесь фильтровали, осадок на фильтре промывали с помощью THF (2х 10 мл) и фильтраты объединяли и выпаривали до сухого состояния. Остаток подвергали хроматографии над SiO2 (ISCO CombiFlash® Rƒ 200) с применением 0-40% градиента EtOAc в DCM с получением указанного в заголовке продукта (0,58 г, 79%). 1H ЯМР (CDCl3, 400 МГц) δ 4,64-4,81 (d, 2H), 5,31 (s, 2H), 6,35 (s, 1H), 6,86-6,94 (m, 1H), 6,98-7,05 (m, 1H), 7,19-7,23 (m, 2H), 7,26-7,35 (m, 2H), 7,39-7,46 (m 3H).
Следующие замещенные 3-(гидроксиметил)пиразолы получали в результате восстановления LiAlH4 соответствующих сложных метиловых эфиров.
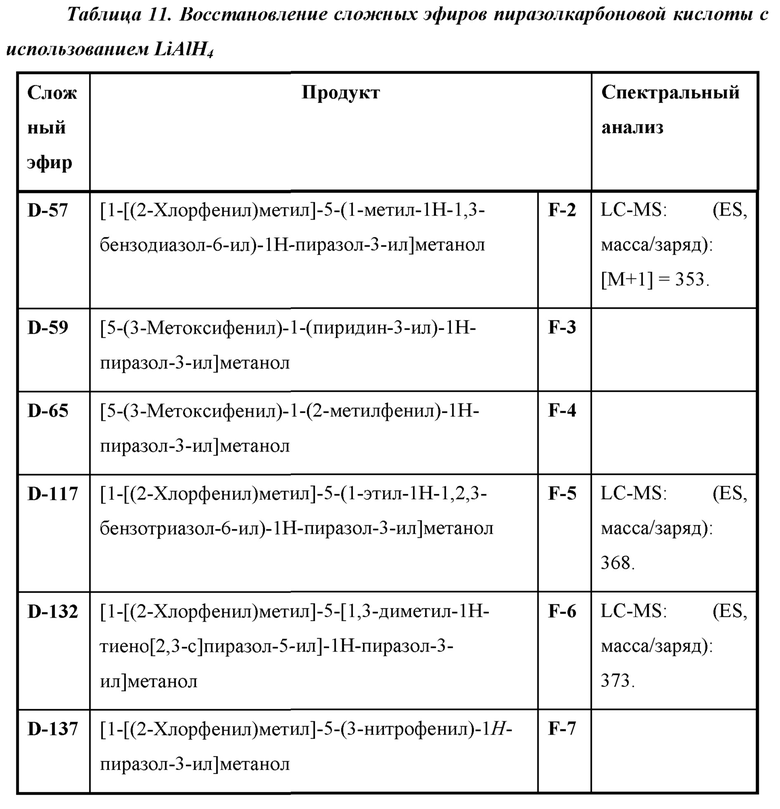
Промежуточное соединение F-8: [1-[(2-хлорфенил)метил]-5-(3-метоксифенил)-1Н-пиразол-3-ил]метанол
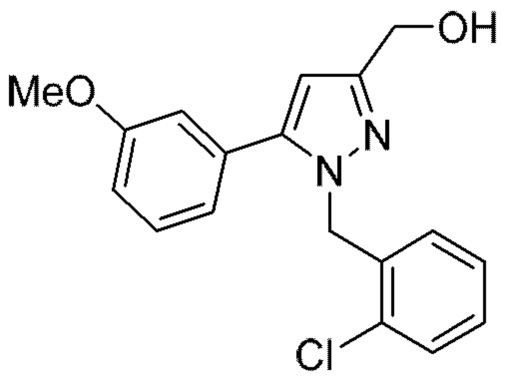
(iii) К раствору пром. соед. D-28 (5,5 г, 15,41 ммоль, 1,00 эквив.) в THF (100 мл) добавляли по каплям LiBH4 (20 мл) с перемешиванием при 0°С в течение 5 мин. Полученный раствор перемешивали в течение 16 ч. при комнатной температуре. В реакционной смеси затем реакцию останавливали посредством добавления 5 мл воды, разбавляли с помощью 200 мл Н2О, экстрагировали с помощью 2×200 мл EtOAc и органические слои объединяли. Полученную смесь промывали с помощью 1×100 мл солевого раствора, затем высушивали над безводным Na2SO4 и концентрировали под вакуумом. Остаток пропускали через колонку с силикагелем с применением EtOAc/петролейного эфира (1:8). В результате этого получали указанное в заголовке соединение в виде белого твердого вещества (4,3 г, 85%).
Следующие замещенные 3-(гидроксиметил)пиразолы получали в результате восстановления соответствующих сложных метиловых эфиров с использованием LiBH4.

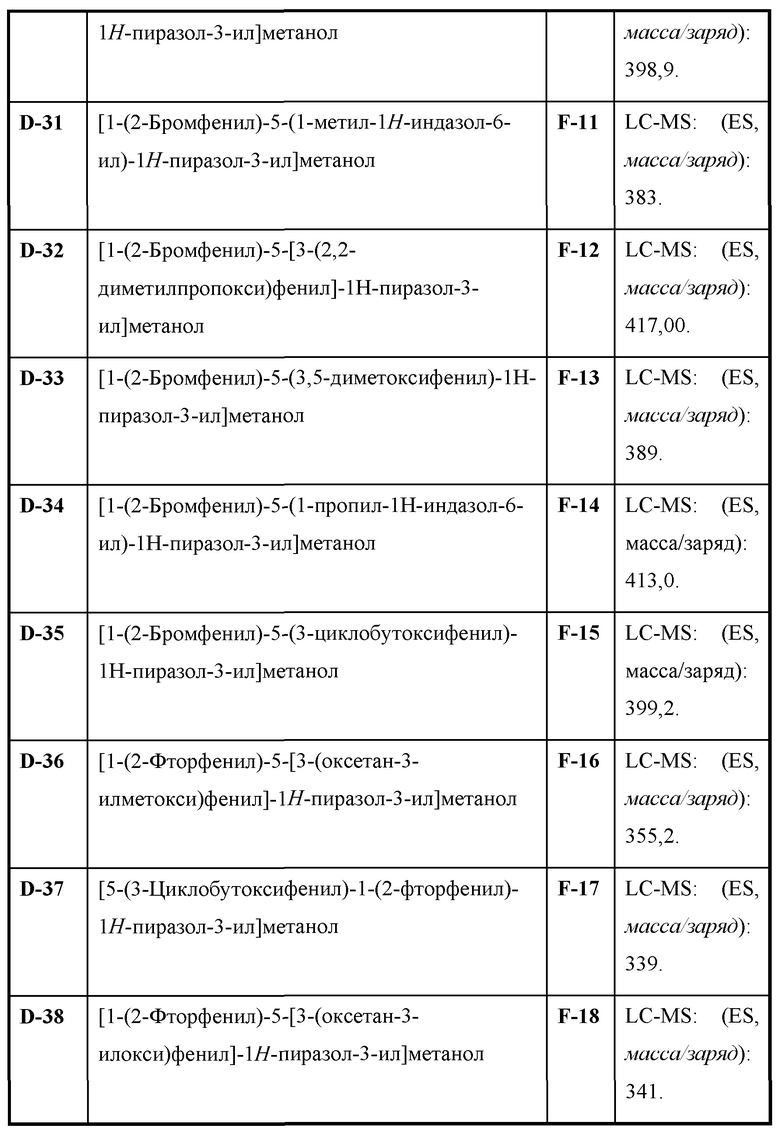
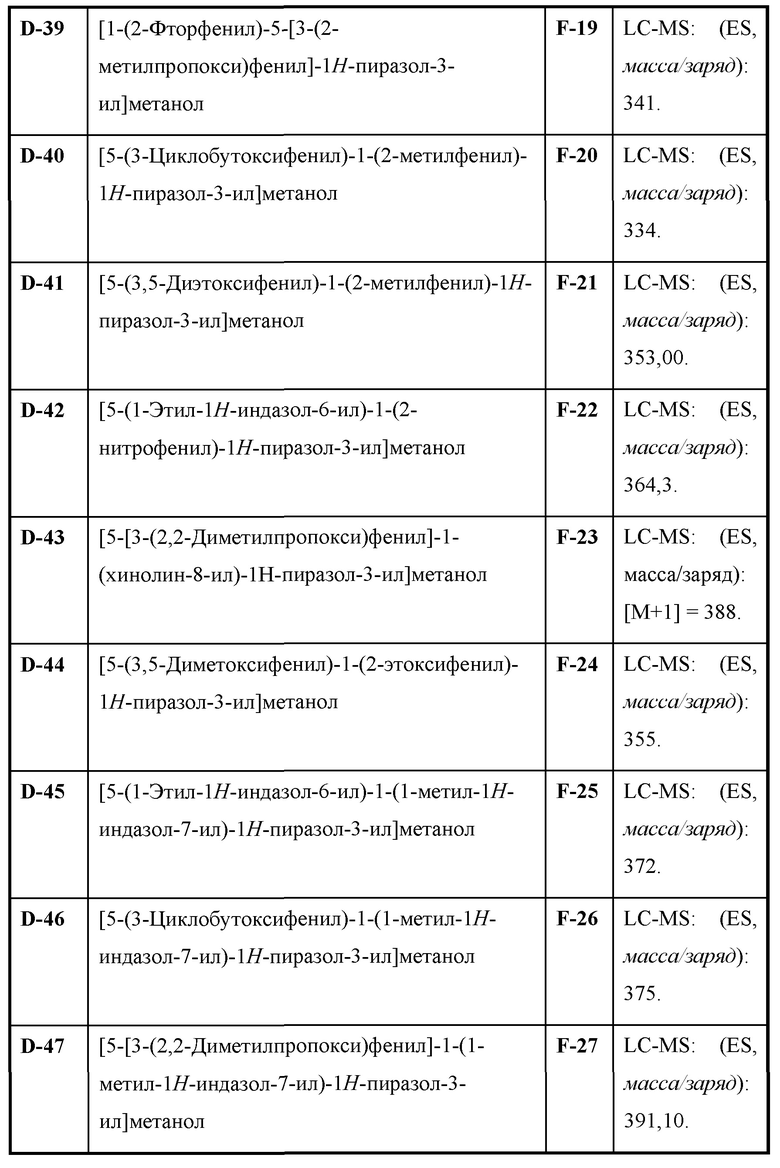
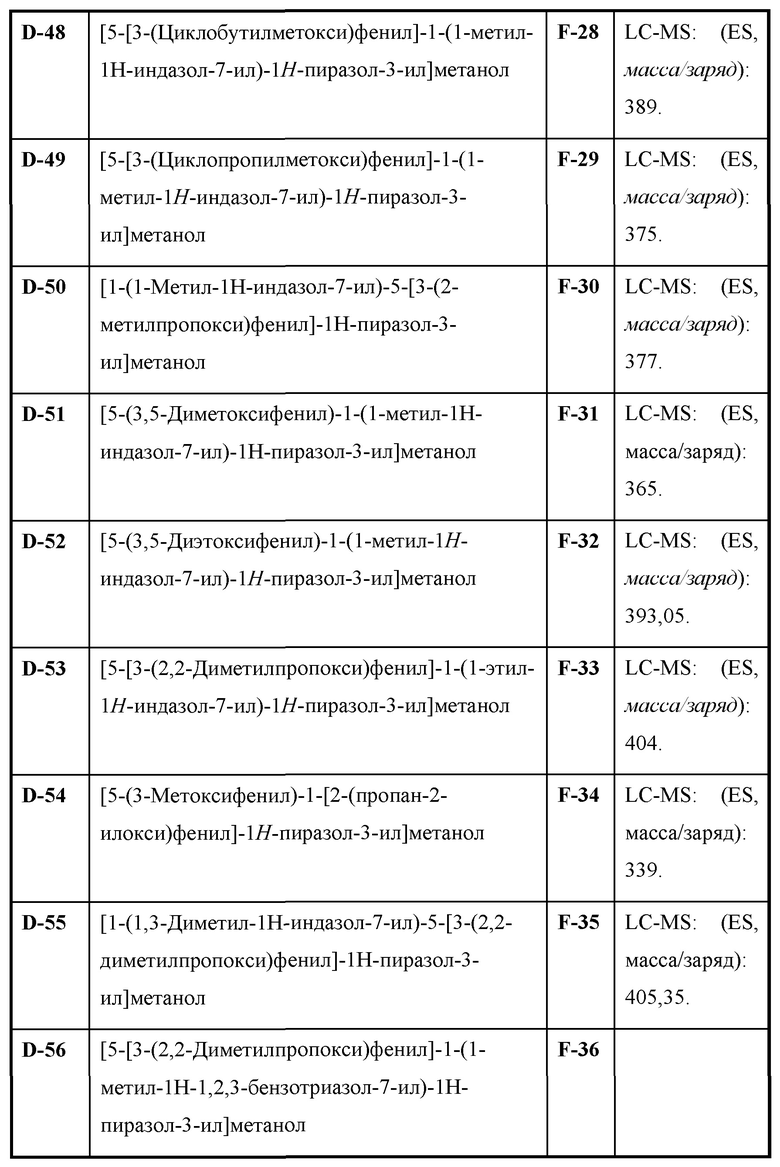
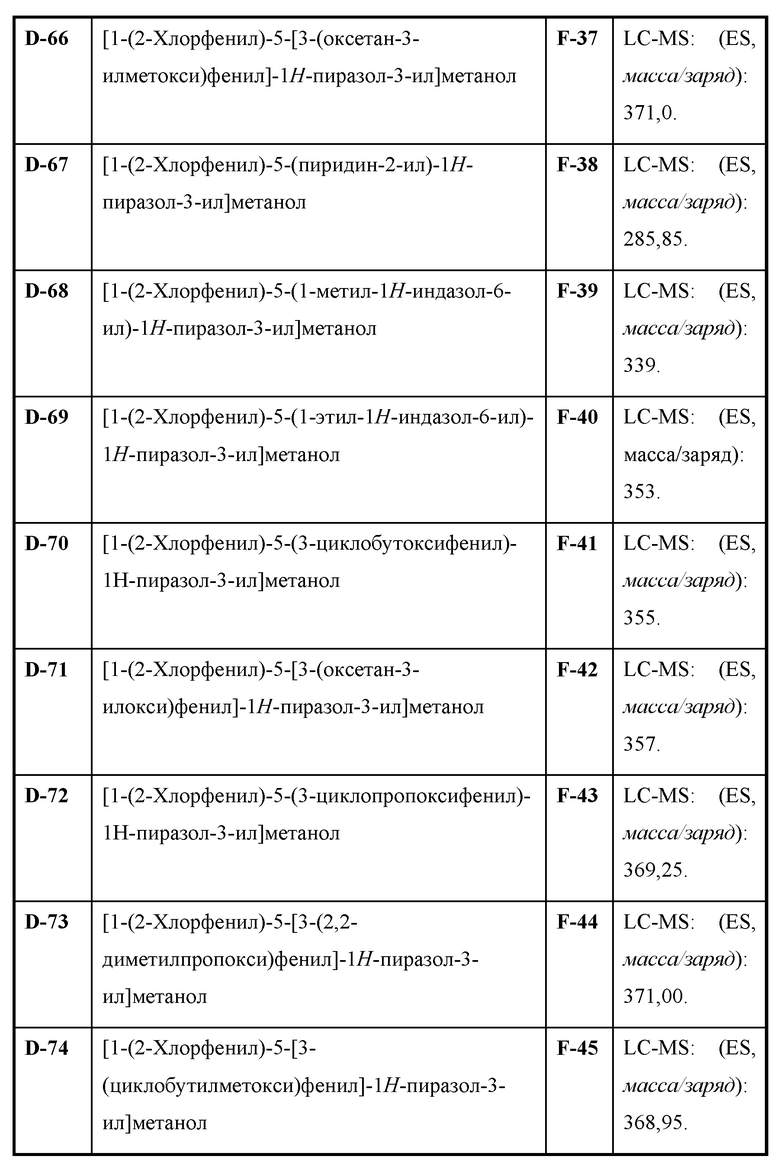
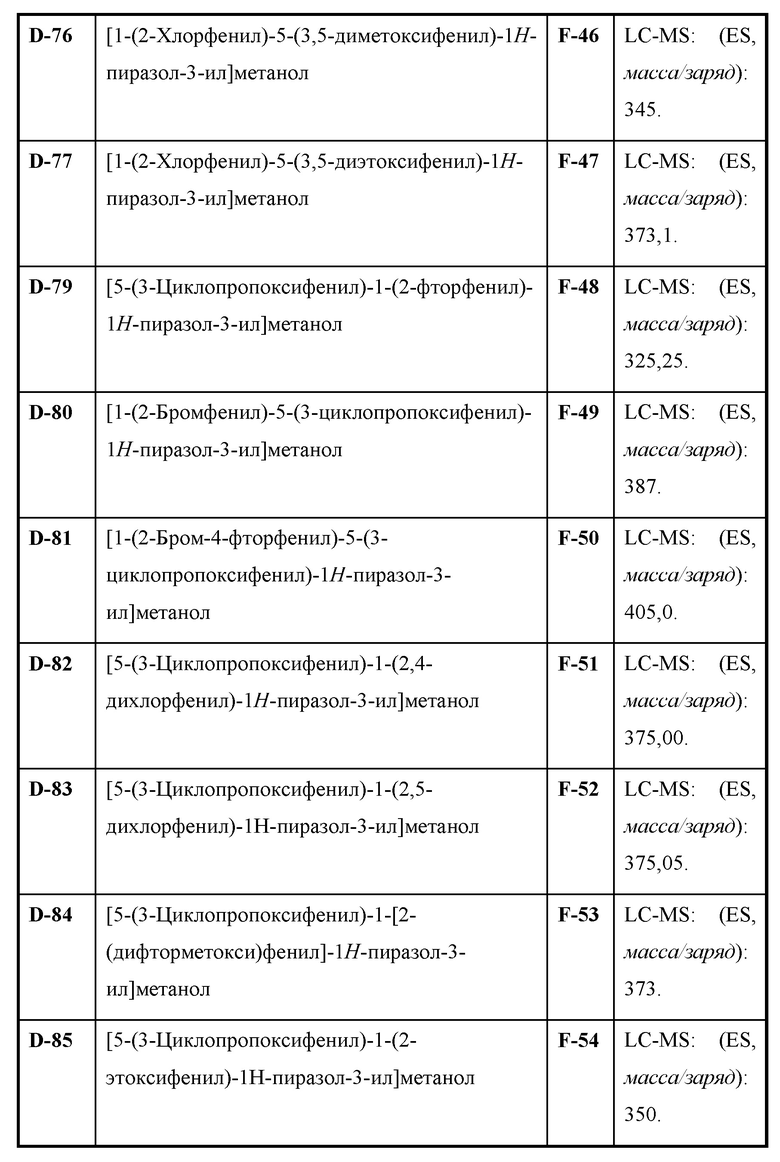
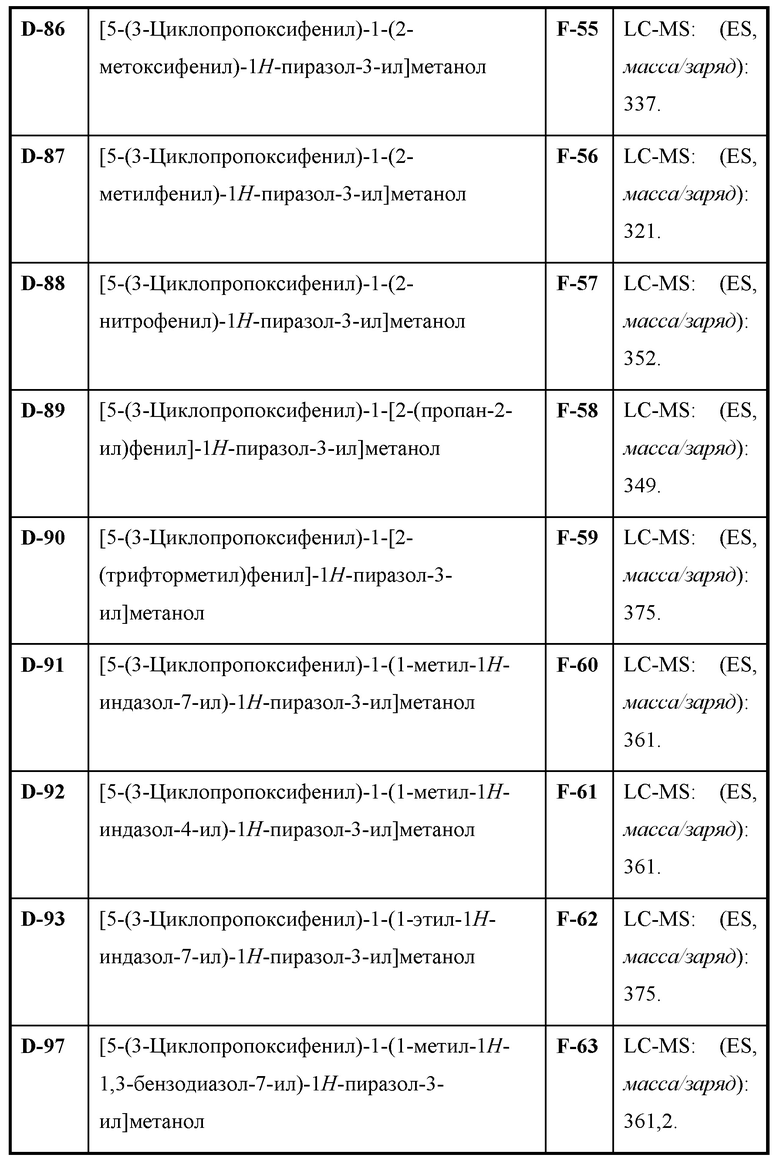
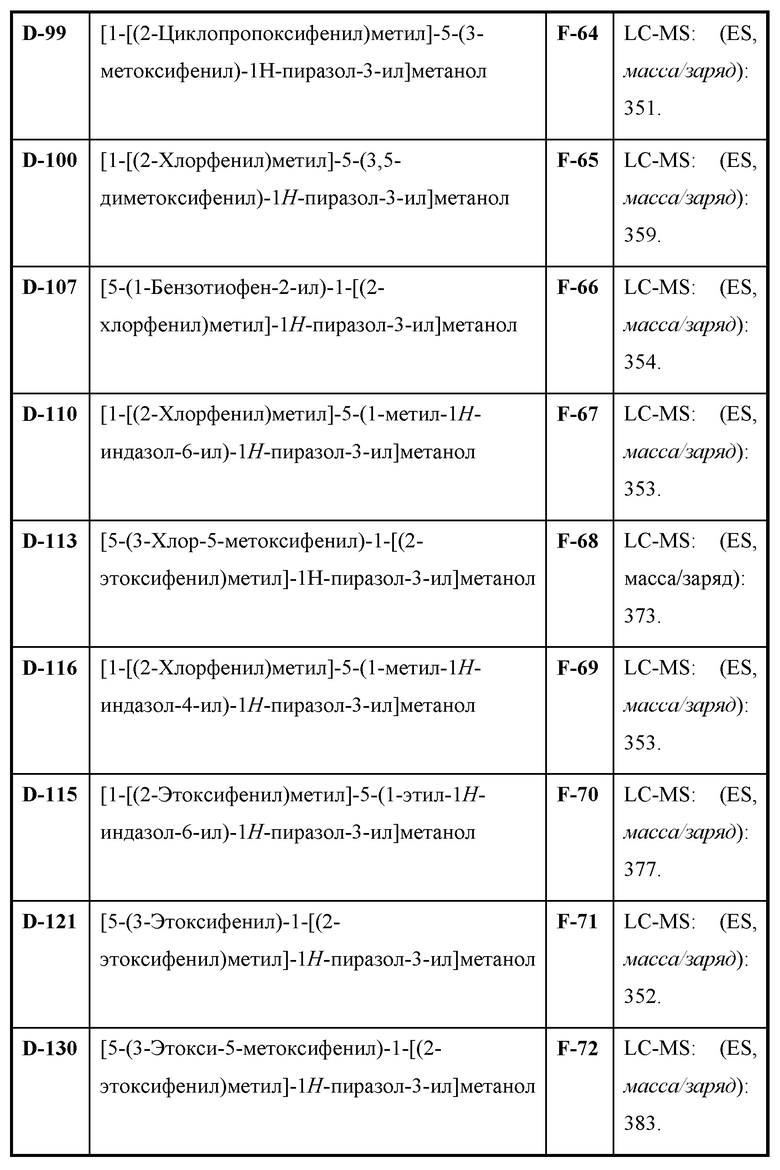

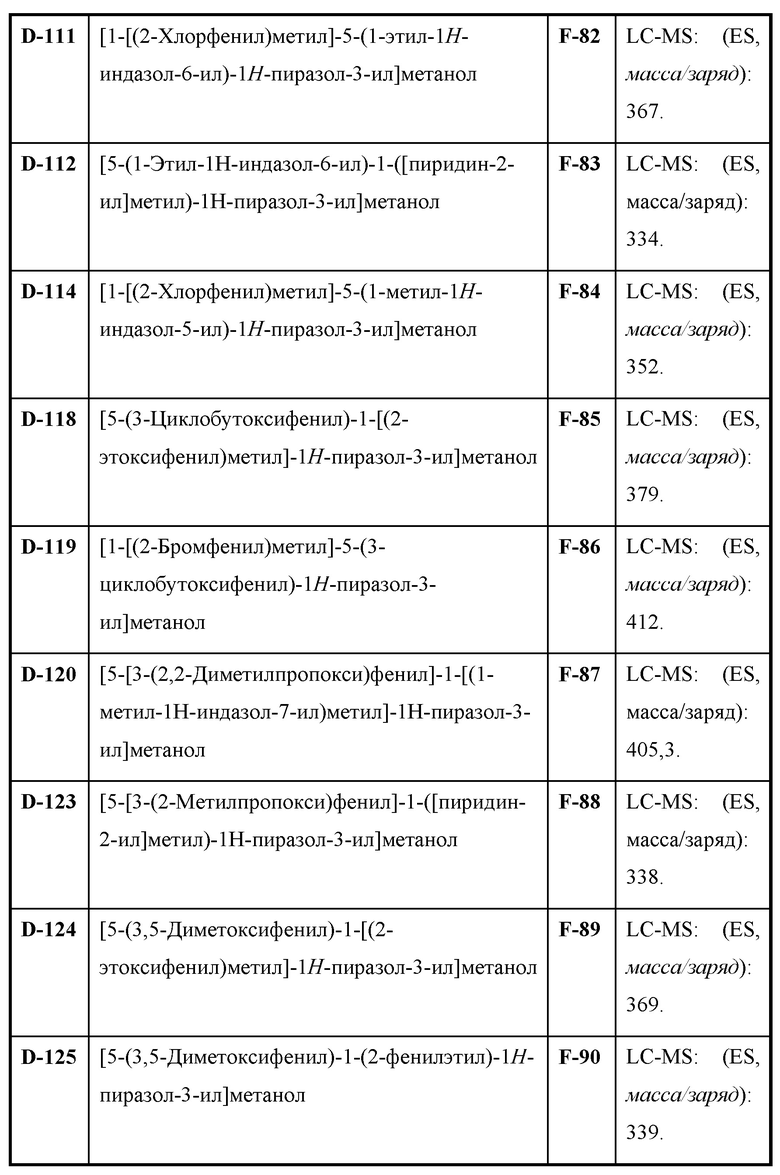
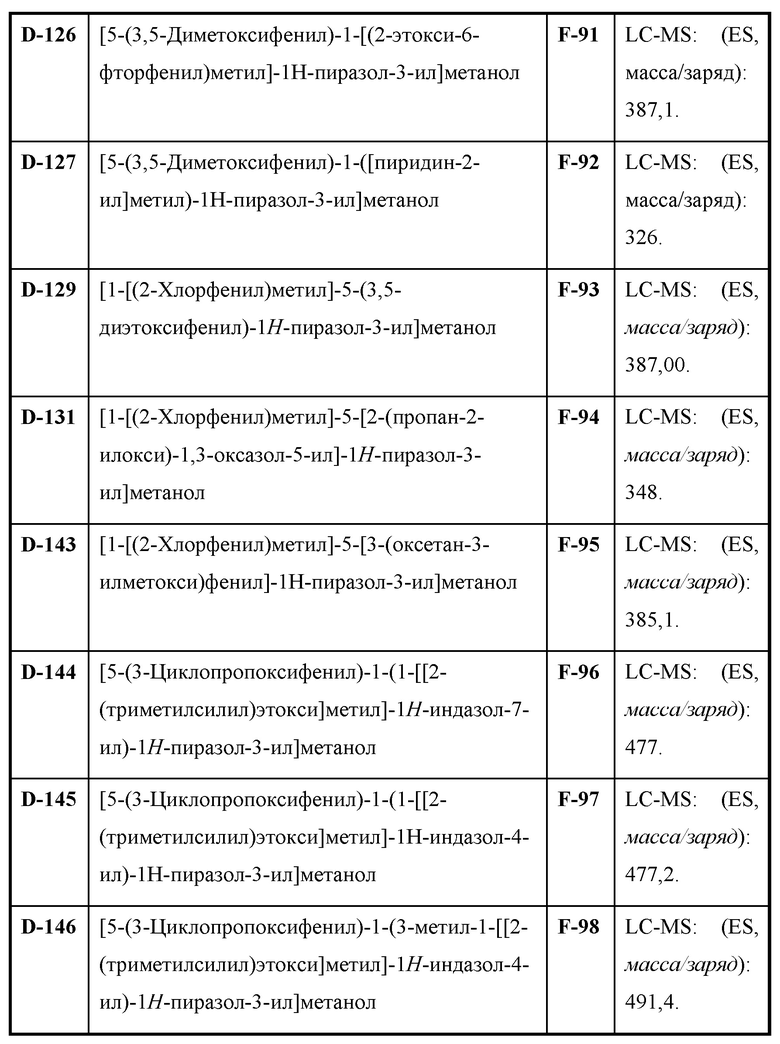



Промежуточное соединение F-116: [5-(3-циклопропоксифенил)-1-[[2-(диметиламино)фенил]метил]-1Н-пиразол-3-ил]метанол

[1-[(2-Аминофенил)метил]-5-(3-циклопропоксифенил)-1H-пиразол-3-ил]метанол. В 25-мл колбе объединяли пром. соед. F-74 [5-(3-циклопропоксифенил)-1-[(2-нитрофенил)метил]-1H-пиразол-3-ил]метанол (350 мг, 0,96 ммоль, 1,00 эквив.), АсОН (7,5 мл), Н2О (2,5 мл) и Zn (350 мг, 5,38 ммоль, 5,60 эквив.). Полученную смесь перемешивали в течение 3 ч. при к.т. Твердые вещества удаляли. Полученный раствор экстрагировали с помощью 3×30 мл EtOAc. Объединенные органические слои высушивали над Na2SO4 и концентрировали под вакуумом с получением 300 мг (93%) указанного в заголовке соединения в виде желтого масла. LC-MS (ES, масса/заряд): 336.
[5-(3-Циклопропоксифенил)-1-[[2-(диметиламино)фенил]метил]-1Н-пиразол-3-ил]метанол. В 15-мл колбе объединяли продукт из предыдущей стадии (300 мг, 0,89 ммоль, 1,00 эквив.) МеОН (5 мл), АсОН (0,25 мл), НСНО (358 мг, 11,92 ммоль, 4,00 эквив.) и NaCNBH3 (225 мг, 3,57 ммоль, 4,00 эквив.). Полученный раствор перемешивали в течение 2 ч. при 40°С, реакцию останавливали с помощью добавления 5 мл воды/льда и экстрагировали с помощью 3×30 мл EtOAc. Объединенные органические слои высушивали над Na2SO4, концентрировали под вакуумом и очищали посредством Prep-TLC с применением EtOAc/гексана (1/1) с получением 300 мг (92%) указанного в заголовке соединения в виде желтого масла. LC-MS: (ES, масса/заряд): 365. 1H ЯМР: (300 МГц, DMSO) δ 7,30 (dd, J=8,8, 7,6 Гц, 1H), 7,22 (td, J=7,6, 7,2, 1,6 Гц, 1H), 7,14 (dd, J=8,1, 1,4 Гц, 1H), 7,00 (m, 2Н), 6,88 (dd, J=6,9, 1,5 Гц, 2Н), 6,73 (dd, J=7,7, 1,5 Гц, 1H), 6,42 (s, 1H), 5,35 (s, 2Н), 4,46 (s, 2Н), 3,67 (dt, J=5,9, 3,1, 3,1 Гц, 1H), 2,55 (s, 6Н), 0,62 (ddd, J=5,9, 3,5, 1,3 Гц, 2Н), 0,57 (m, 2Н).
Следующие соединения получали посредством выполнения сходной последовательности восстановления с помощью цинка/алкилирования.
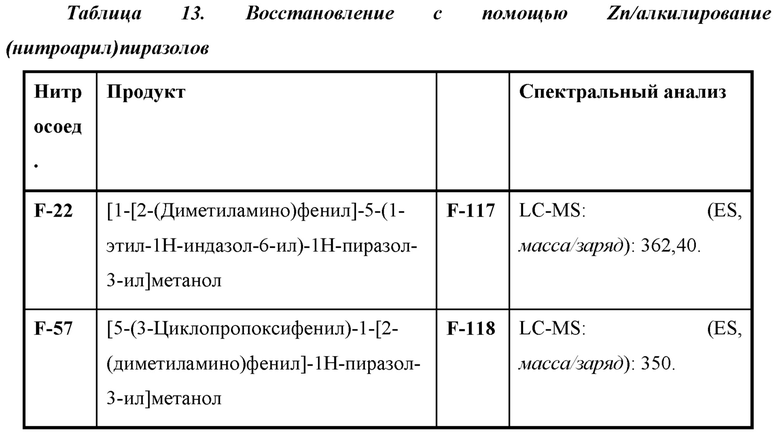
Промежуточное соединение G-1: 3-(бромметил)-1-[(2-хлорфенил)метил]-5-(3-метоксифенил)-1H-пиразол
К раствору пром. соед. F-8 (4,3 г, 13,08 ммоль, 1,00 эквив.) в CH2Cl2 (100 мл) добавляли CBr4 (6,5 г, 1,50 эквив.). За этим следовало добавление по каплям раствора PPh3 (7 г, 26,69 ммоль, 2,00 эквив.) в CH2Cl2 (10 мл) с перемешиванием при 0°С в течение 5 мин. Полученный раствор перемешивали в течение 4 ч. при к.т. Полученную смесь концентрировали под вакуумом. Остаток пропускали через колонку с силикагелем с применением EtOAc/петролейного эфира (1:5). В результате этого получали указанное в заголовке соединение в виде желтого масла (3,5 г, 68%).
Следующие замещенные 3-(бромметил)пиразолы получали в результате реакции соответствующего (гидроксиметил)пиразола с PPh3/CBr4.
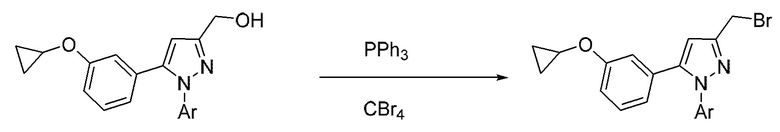
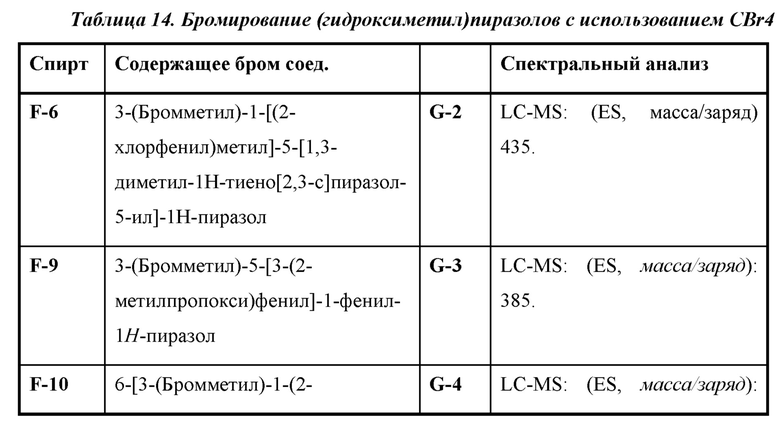
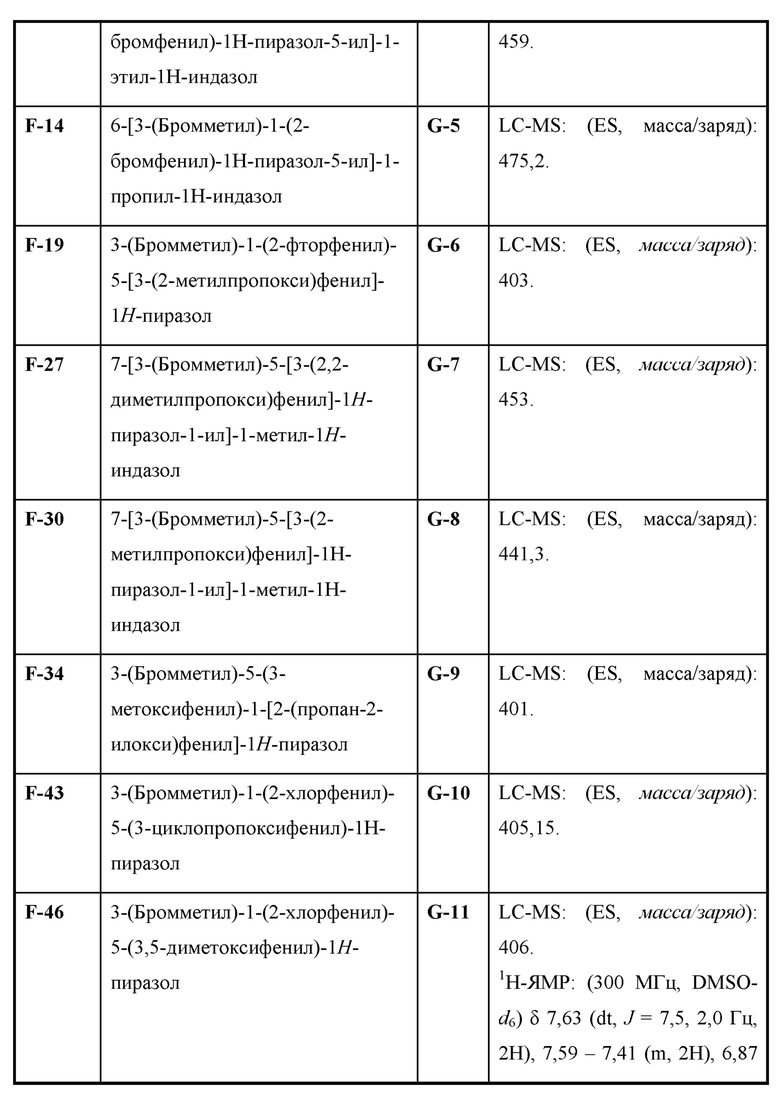
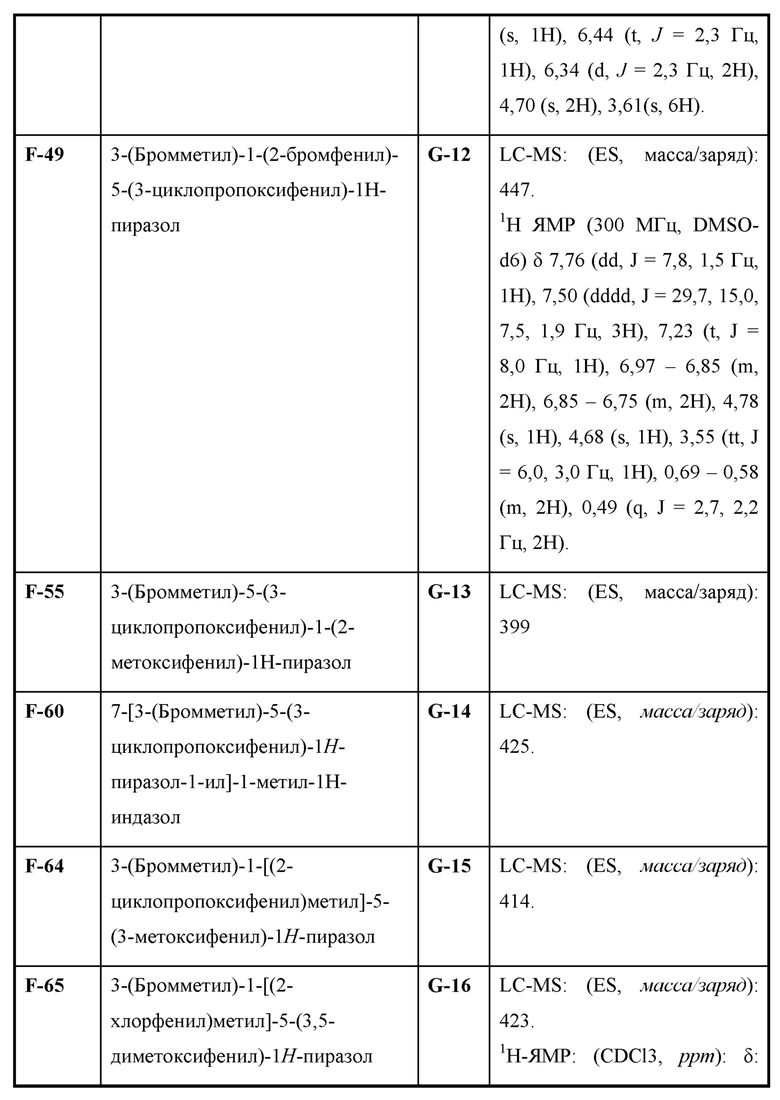
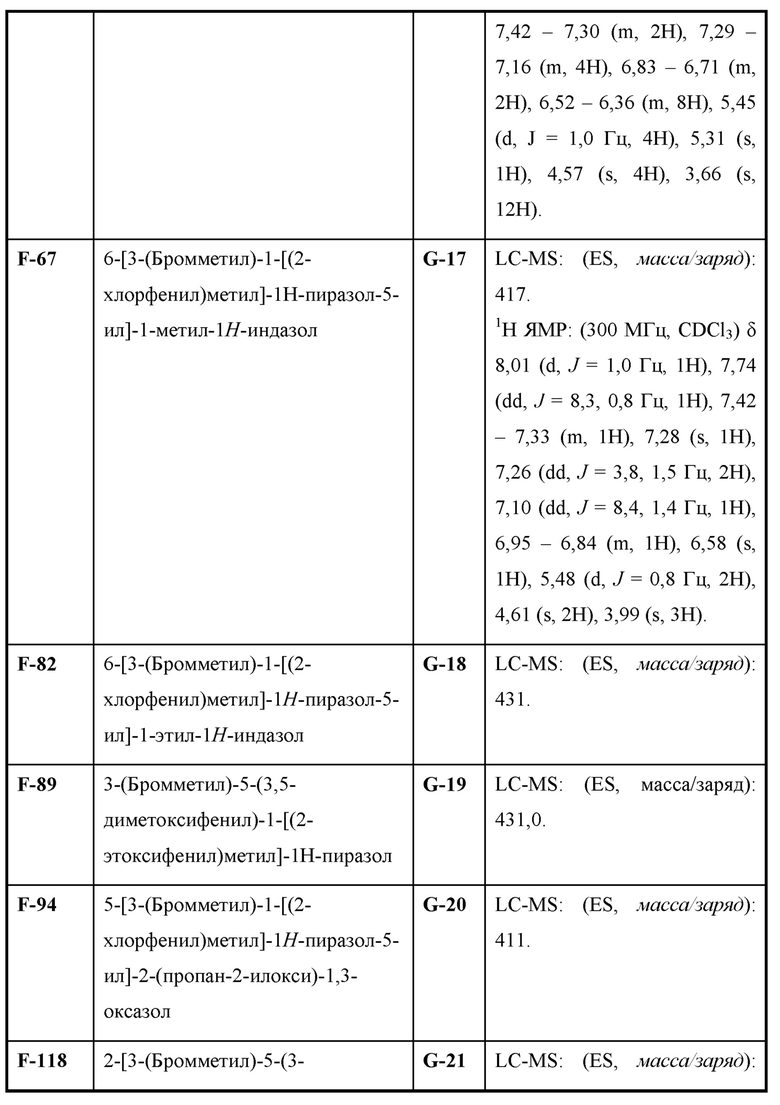
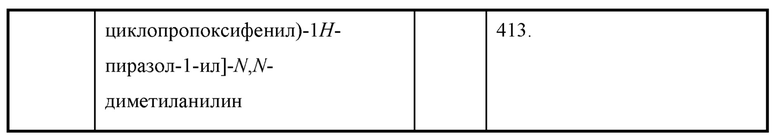
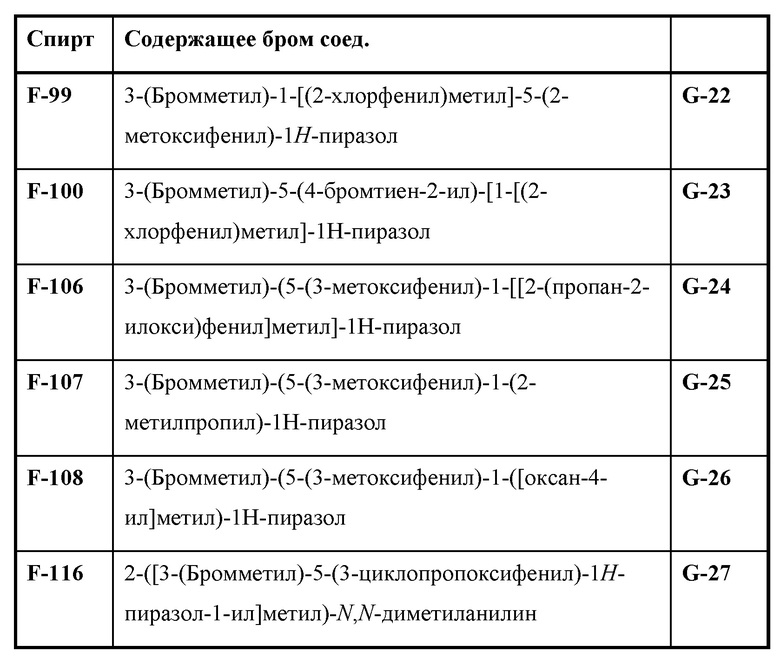
Промежуточное соединение Н-1: метил-2-([1-[(3-хлорфенил)метил]-5-фенил-1Н-пиразол-3-ил/метокси)-2-метилпропаноат
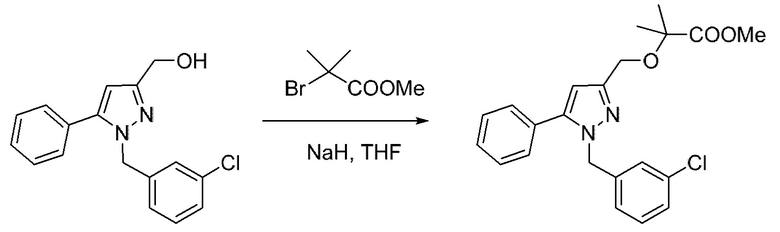
К раствору пром. соед. F-1 (0,288 г, 0,964 ммоль) в DMF добавляли порциями NaH (60%) (0,077 г, 1,93 ммоль) в атмосфере N2 при комнатной температуре и продолжали перемешивание в течение 30 мин. Смесь охлаждали до 0°С и добавляли по каплям метил-2-бром-2-метилпропаноат (0,16 мл, 1,25 ммоль), а затем добавляли NaI (0,143 г, 0,964 ммоль). Реакционную смесь постепенно нагревали до комнатной температуры и перемешивали в течение ночи. В конце данного периода добавляли водн. раствор NH4Cl и смесь разделяли с помощью EtOAc (40 мл). Водный слой экстрагировали с помощью EtOAc (2×20 мл). Объединенные EtOAc-слои промывали с помощью солевого раствора и высушивали над Na2SO4 и растворитель выпаривали. Остаток подвергали хроматографии над SiO2 (ISCO CombiFlash® Rƒ 200) с применением 0-50% градиента EtOAc в гексанах с получением указанного в заголовке продукта в виде масла (0,068 г, 38%). 1H ЯМР (CDCl3, 400 МГц): δ 1,56 (s, 6Н). 3,68 (s, 3Н), 4,58 (s, 2Н), 5,25 (s, 2Н), 6,45 (s, 1H), 6,87-6,93 (m, 1H), 7,00 (s, 1H), 7,16-7,22 (m, 2Н), 7,26-7,34 (m, 2Н), 7,34-7,42 (m, 3Н).
Следующие замещенные сложные эфиры пиразолкарбоновой кислоты получали в результате синтеза соответствующего (гидроксиметил)пиразола посредством реакции синтеза простых эфиров по Вильямсону с использованием BrC(СН3)2СООМе.
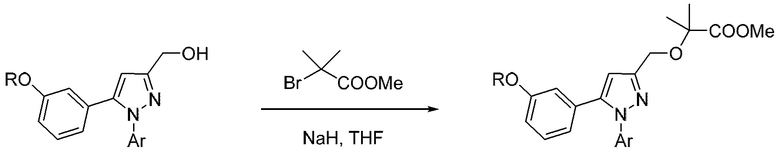

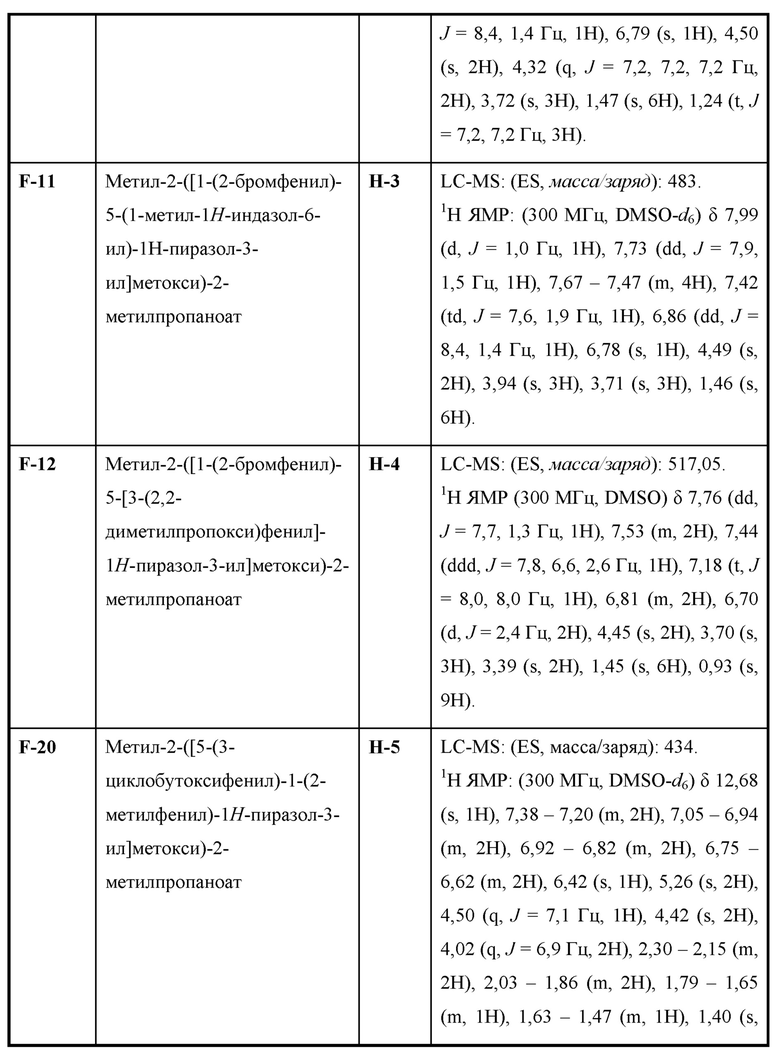
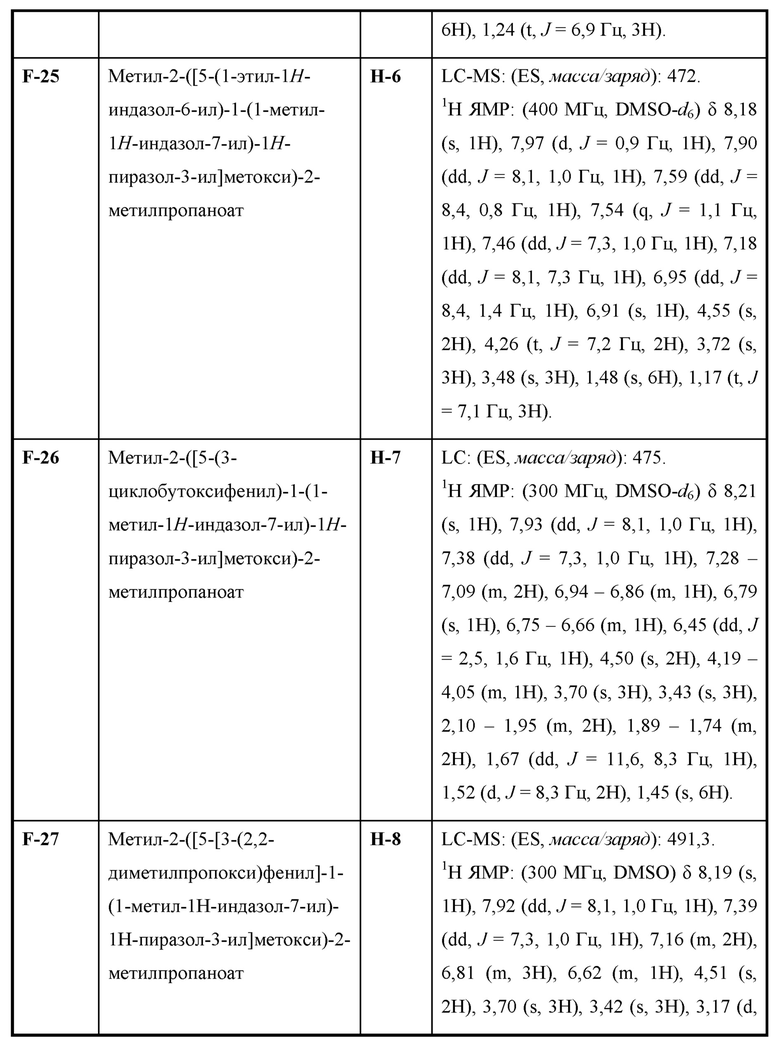
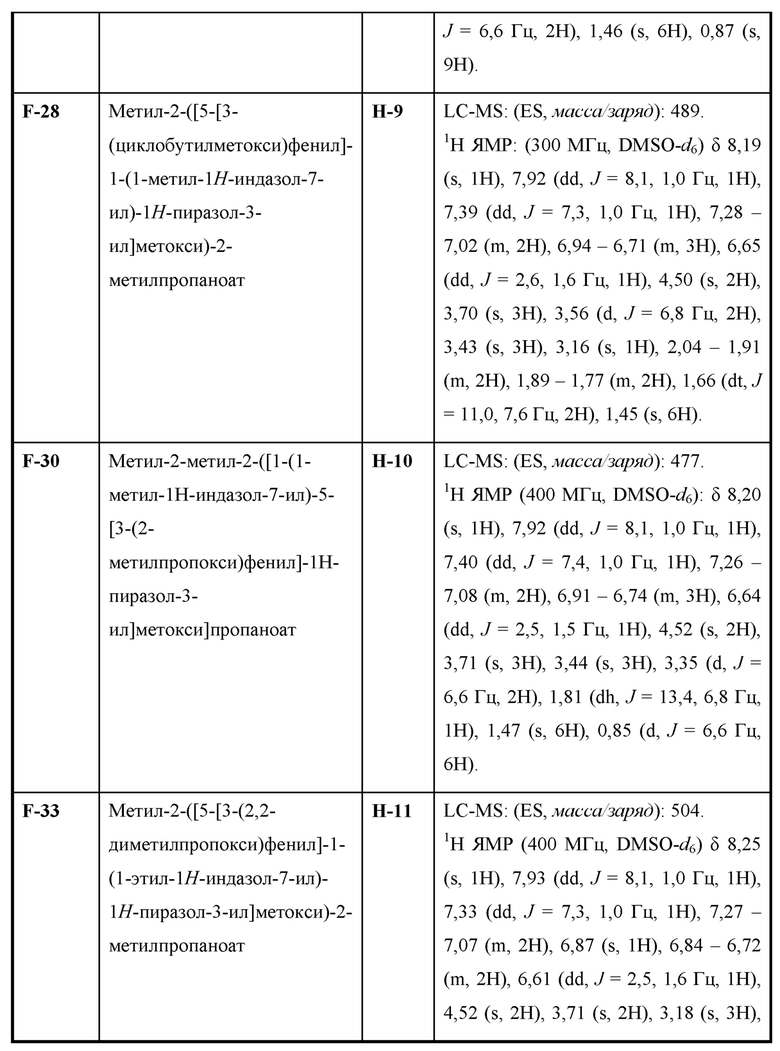
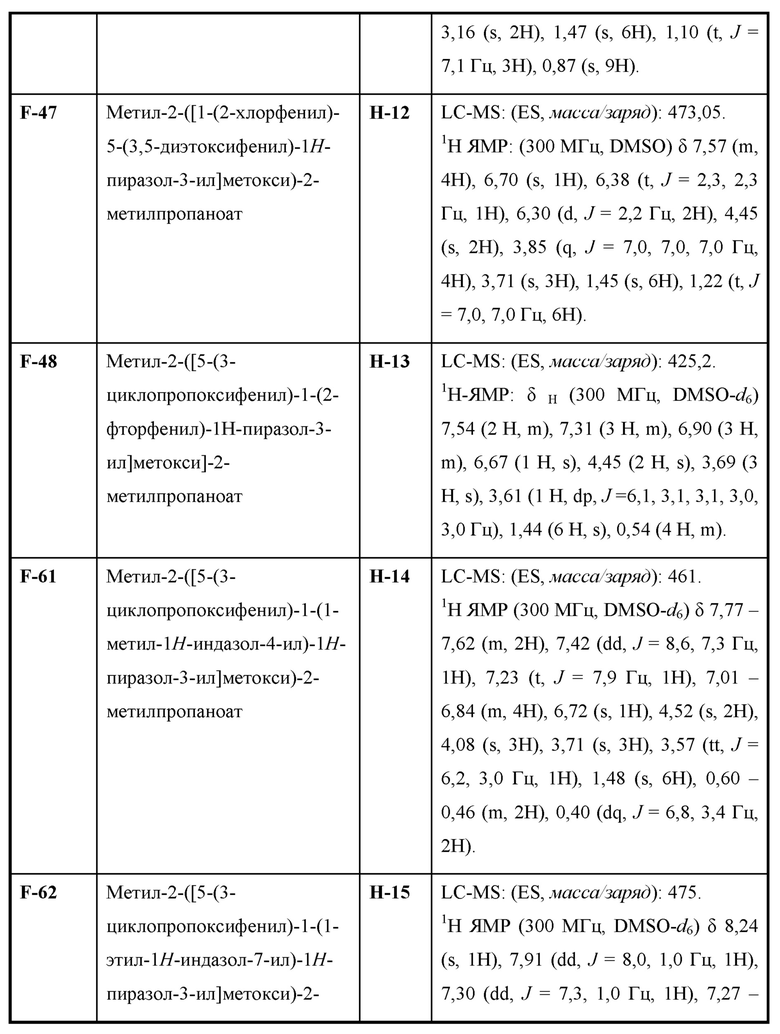
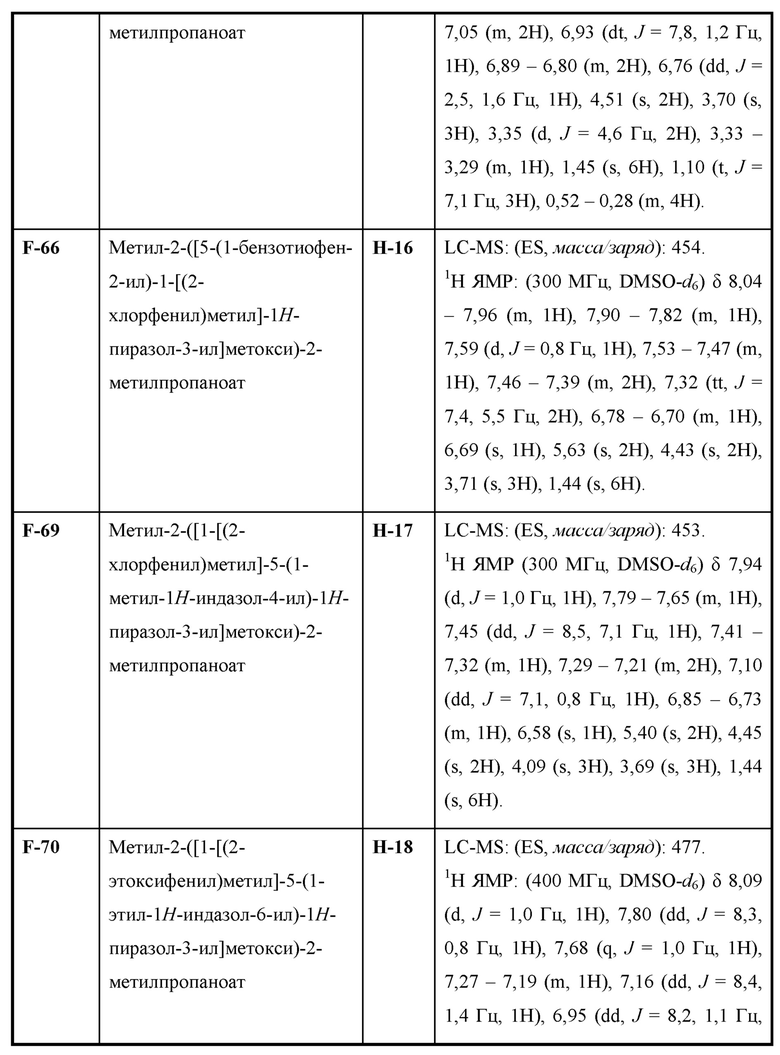
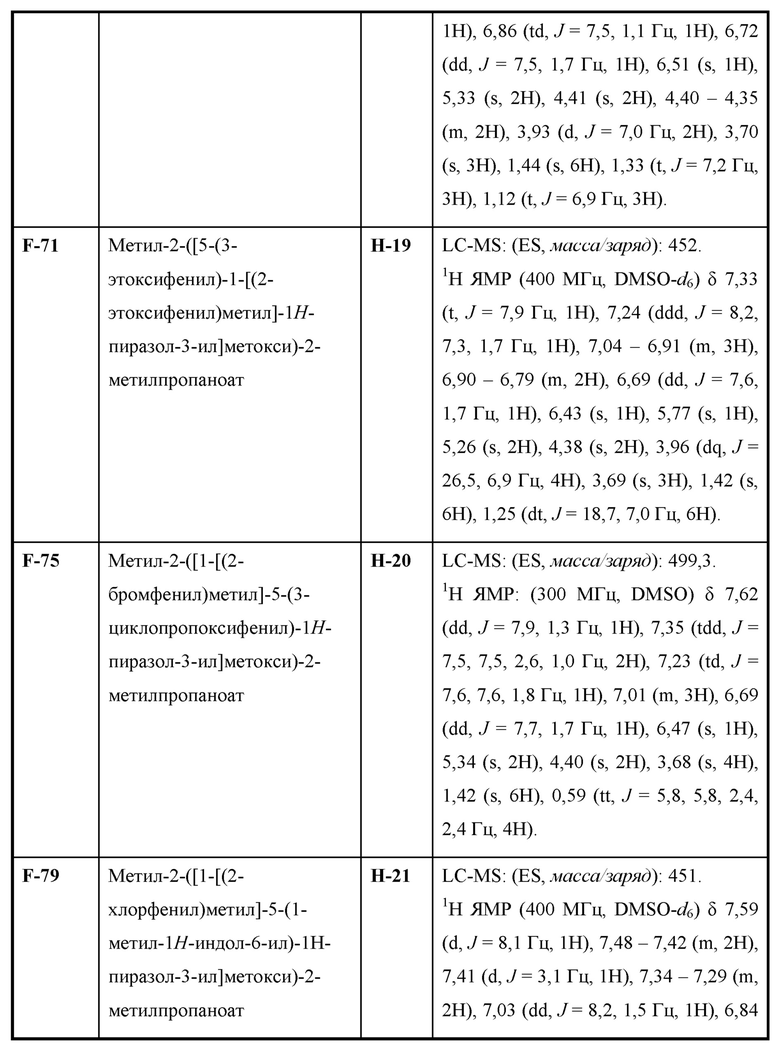
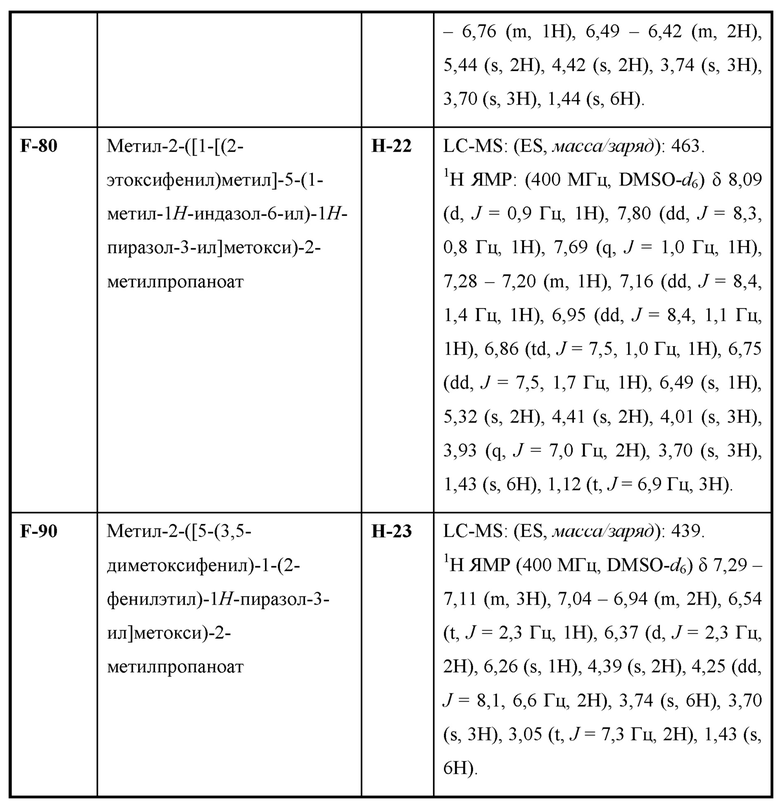

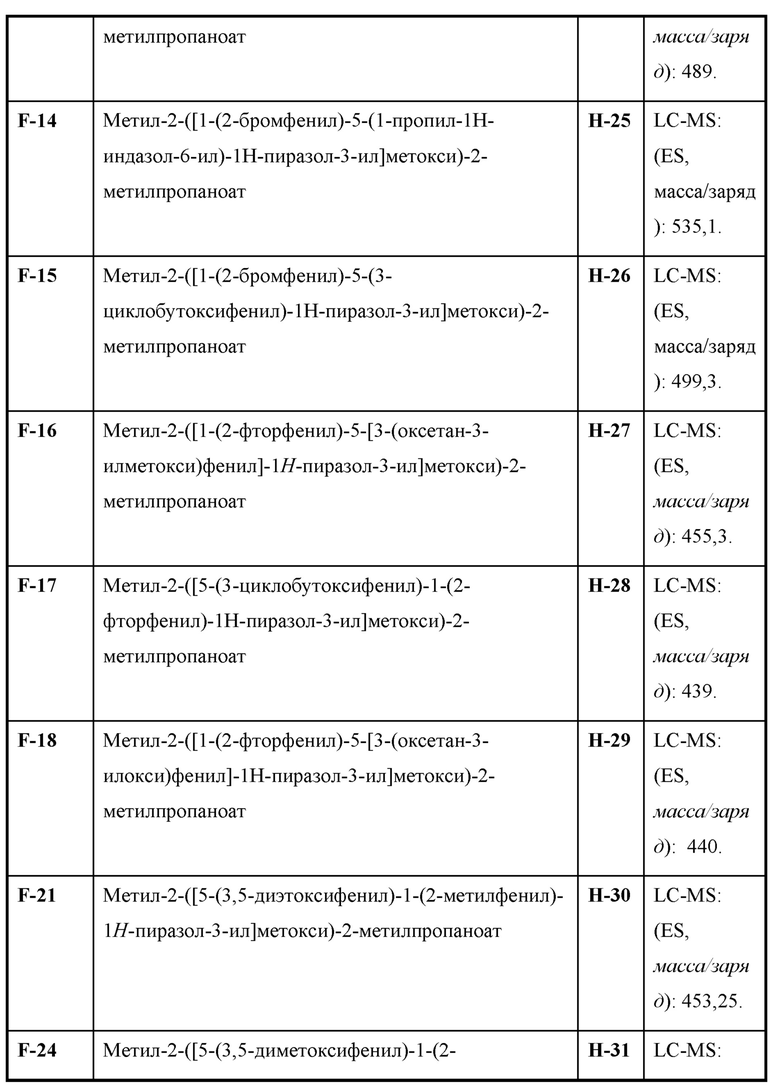
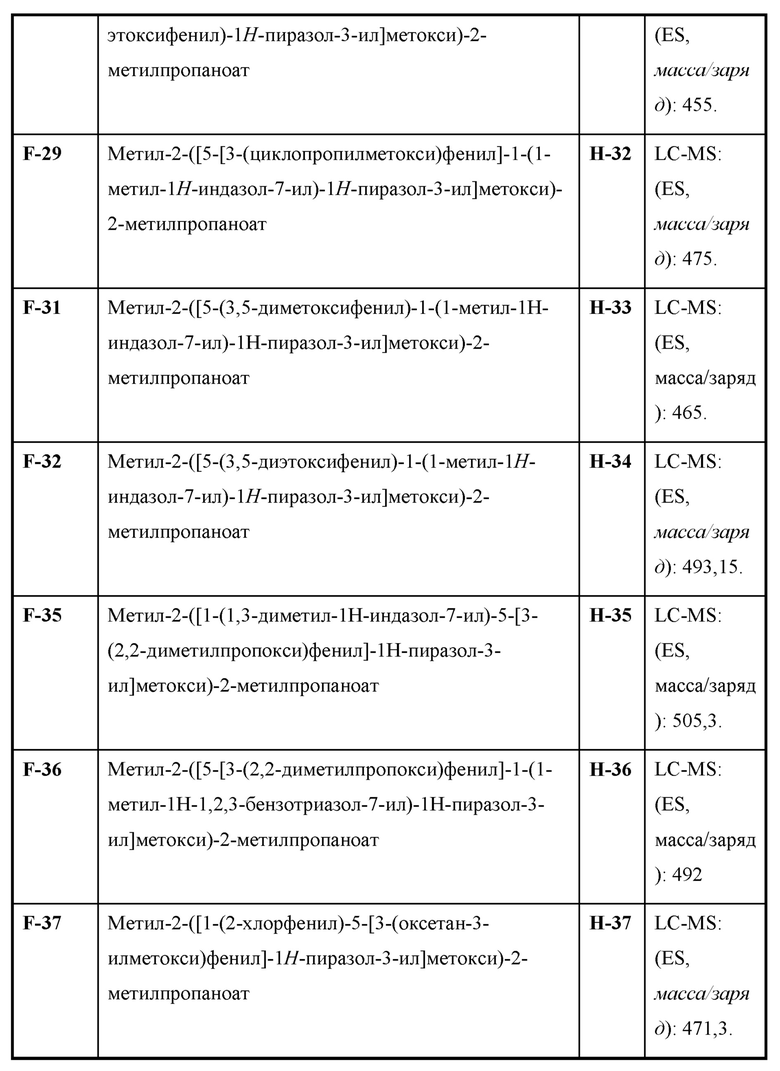

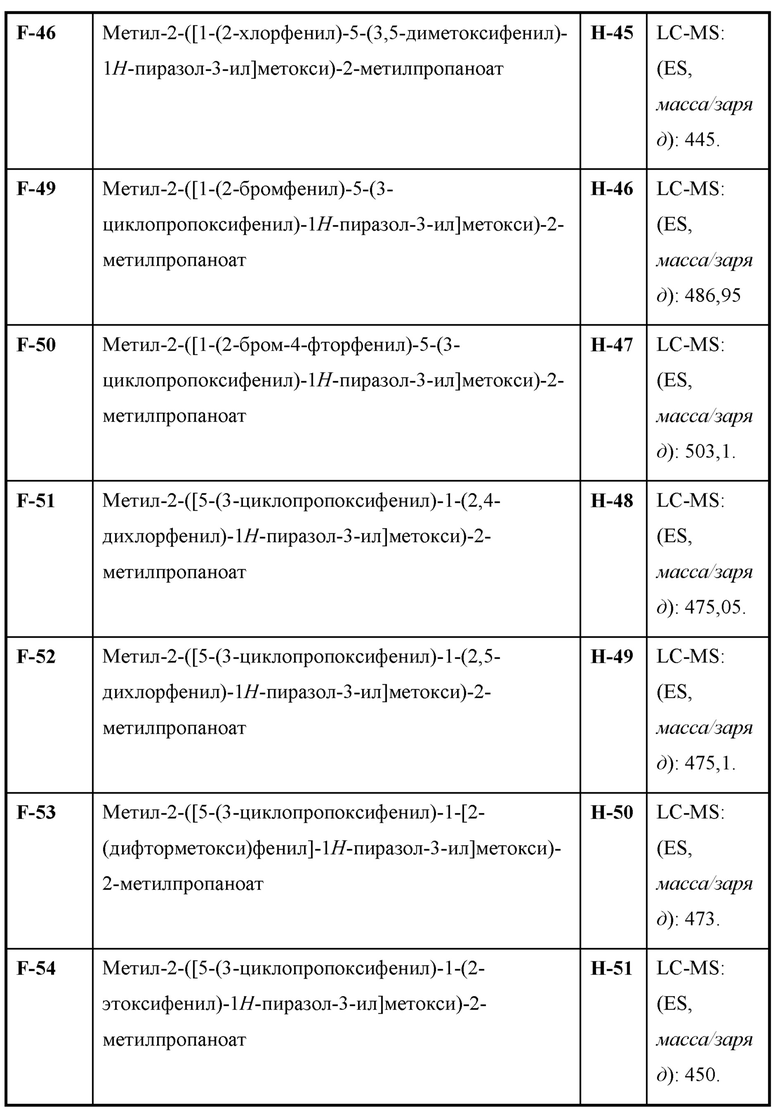
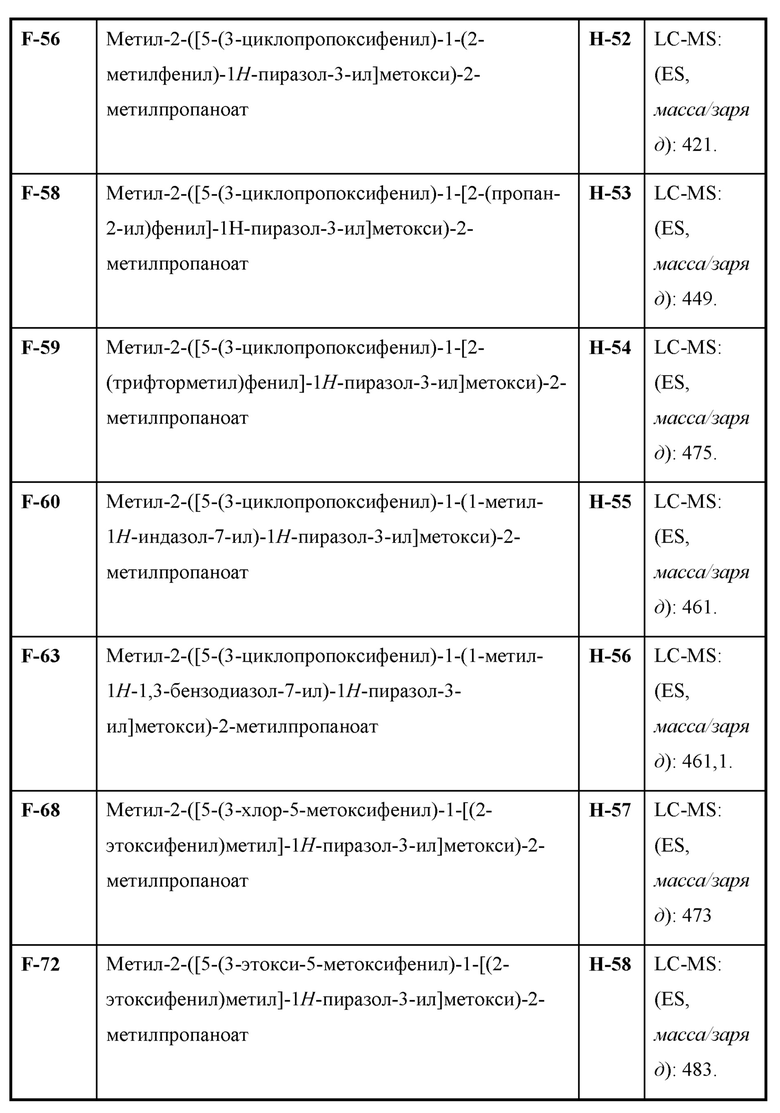
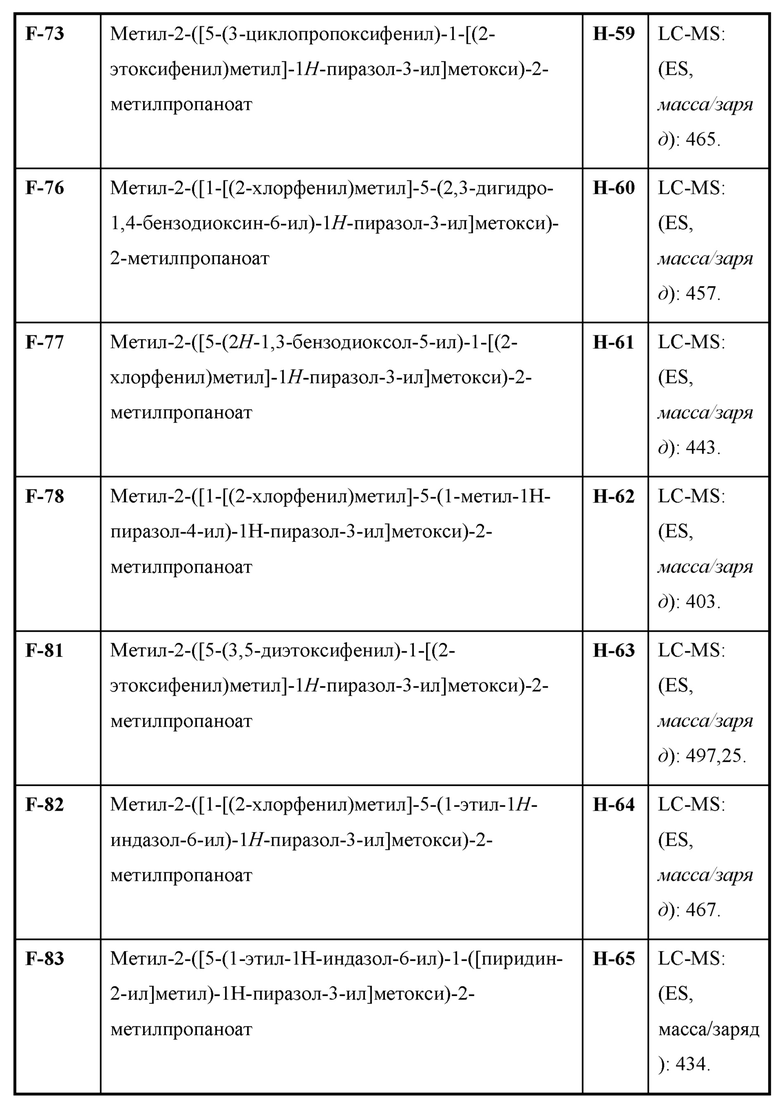
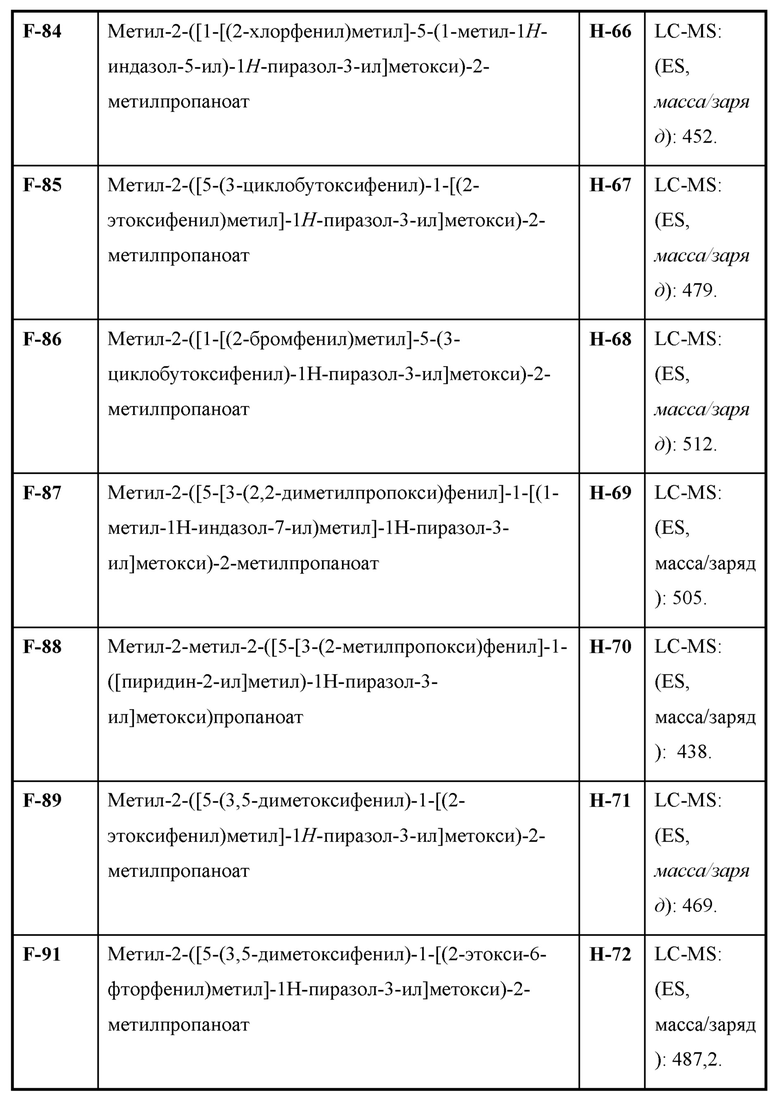
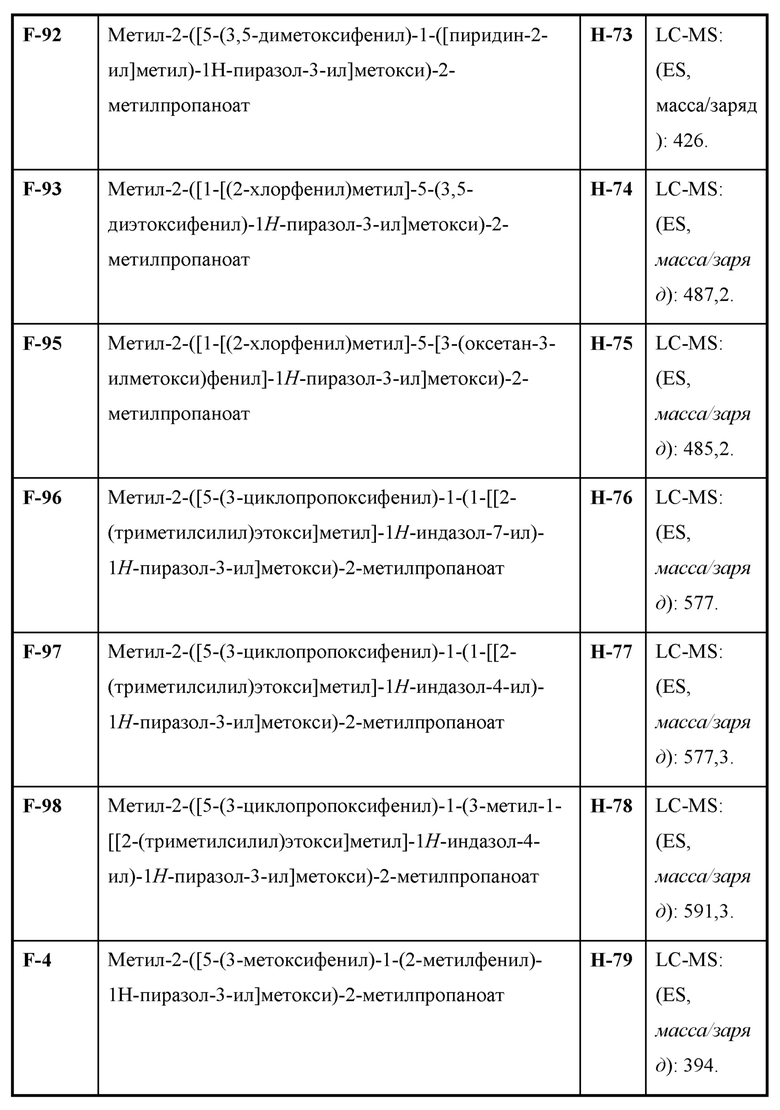

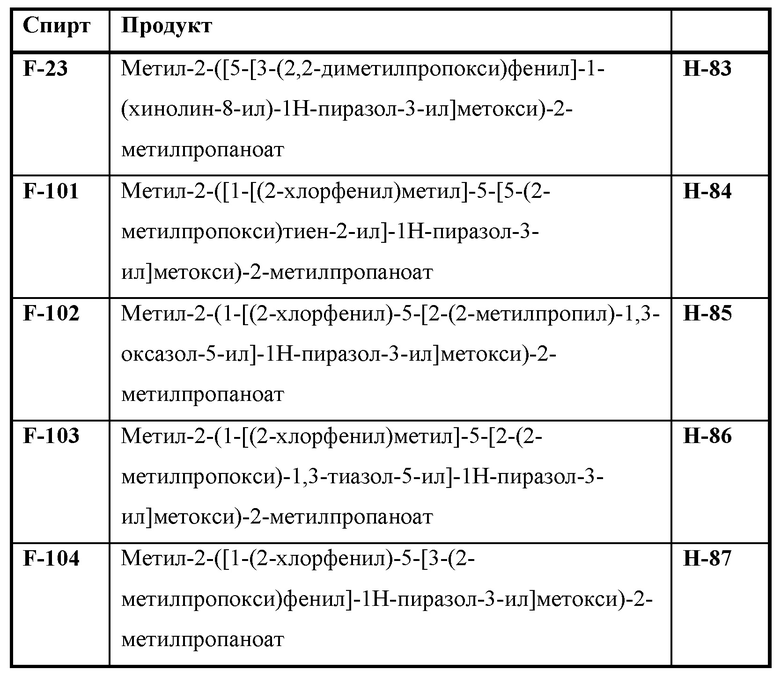

Получали следующие сложные эфиры 2-гидрокси-2-метилбутановой кислоты.
Метил-2-гидрокси-2-метилбутаноат. К раствору 2-гидрокси-2-метилбутановой кислоты (3,0 г, 25,40 ммоль, 1,00 эквив.) в МеОН (100 мл) добавляли по каплям H2SO4 (3 мл) с перемешиванием при 0°С. Полученный раствор нагревали до температуры возврата флегмы в течение 16 ч., охлаждали, концентрировали под вакуумом, разбавляли с помощью 200 мл EtOAc, промывали с помощью 1×100 мл (насыщ.) NaHCO3 (водн.), высушивали над Na2SO4 и концентрировали под вакуумом с получением 780 мг (23%) указанного в заголовке соединения в виде бесцветного масла.
Метил-(2R)-2-гидрокси-2-метилбутаноат. К раствору (2R)-2-гидрокси-2-метилбутановой кислоты (1,0 г, 8,47 ммоль, 1,00 эквив.) в МеОН (50 мл) добавляли по каплям SOCl2 (2,0 г, 2,00 эквив.) с перемешиванием при 0°С. Полученный раствор нагревали до температуры возврата флегмы в течение 16 ч., затем концентрировали под вакуумом, разбавляли с помощью 100 мл CH2Cl2. Смесь высушивали над Na2SO4 и концентрировали под вакуумом с получением 700 мг (63%) указанного в заголовке соединения в виде бесцветного масла. 1H-ЯМР: (300 МГц, CDCl3) δ: 3,79 (s, 3Н), 3,04 (s, 1H), 1,89-1,61 (m, 2Н), 1,41 (s, 3Н), 0,88 (t, J=7,4 Гц, 3Н).
Метил-(2S)-2-гидрокси-2-метилбутаноат. К раствору (2S)-2-гидрокси-2-метилбутановой кислоты (500 мг, 4,23 ммоль, 1,00 эквив.) в МеОН (30 мл) добавляли по каплям SOCl2 (1,03 мг, 0,01 ммоль, 2,00 эквив.) с перемешиванием при 0°С. Полученный раствор перемешивали в течение 16 ч. при 60°С, затем концентрировали под вакуумом, разбавляли с помощью 200 мл CH2Cl2, промывали с помощью 1×100 мл (насыщ.) NaHCO3 (водн.) и выпаривали при пониженном давлении. Твердое вещество, которое образовывалось, высушивали в печи при пониженном давлении с получением 400 мг (72%) указанного в заголовке соединения в виде бесцветного масла. LC-MS: (ES, масса/заряд): 132. 1Н ЯМР (DMSO) δ: 5,10 (s, 1H), 3,62 (s, 3Н), 1,73-1,44 (m, 2Н), 1,24 (s, 3Н), 0,78 (t, J=7,4 Гц, 3Н).
Следующие замещенные сложные эфиры пиразолкарбоновой кислоты получали в результате синтеза соответствующего (бромметил)пиразола посредством реакции синтеза простых эфиров по Вильямсону с использованием НО-С(СН3)2СООМе:
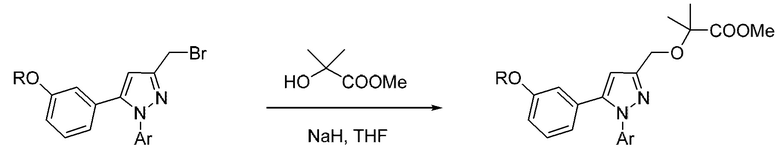

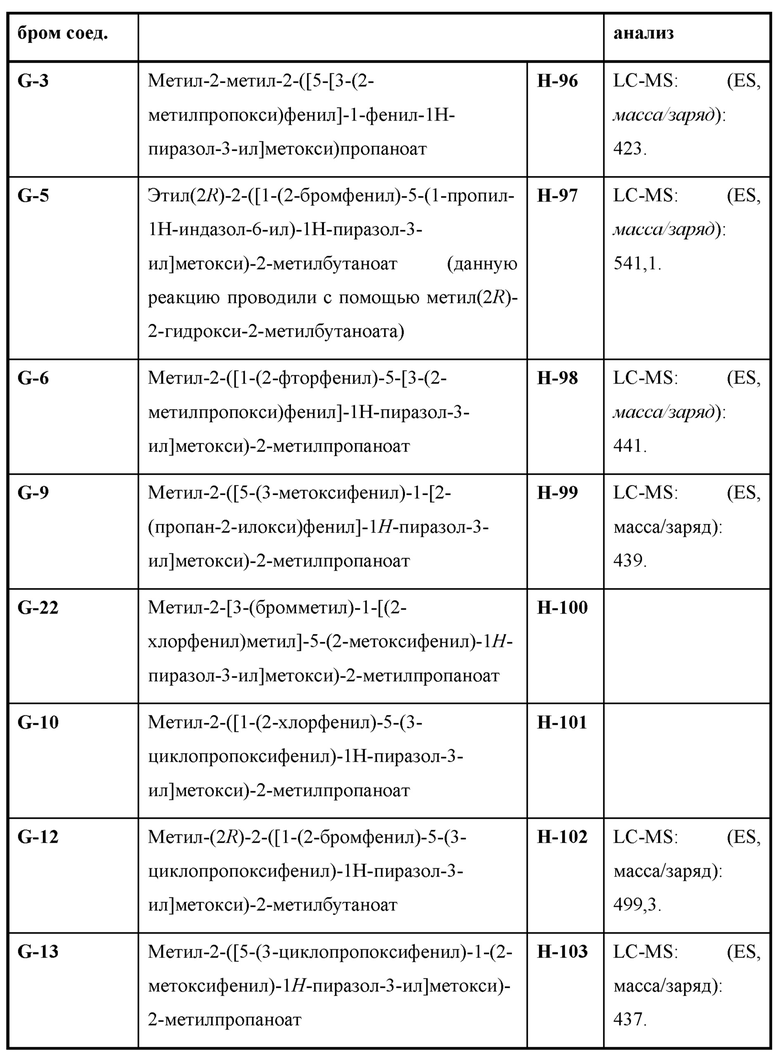


Промежуточное соединение Н-114: метил-2-([1-[(2-хлорфенил)метил]-5-(4-циклопропокситиен-2-ил)-1Н-пиразол-3-ил]метокси)-2-метилпропаноат
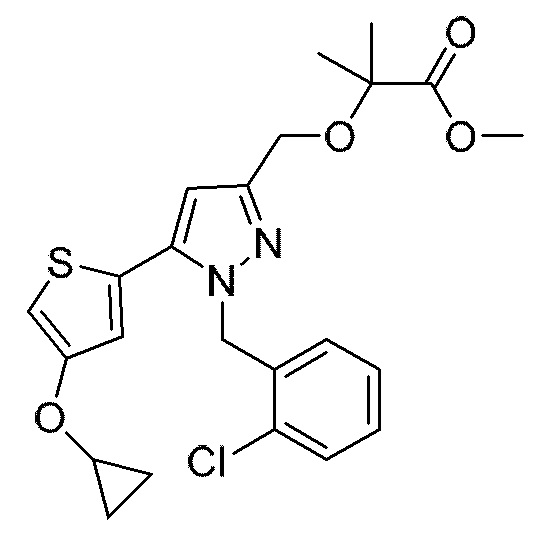
Трет-бутил-2-([1-[(2-хлорфенил)метил]-5-(4-бромтиен-2-ил)-1Н-пиразол-3-ил]метокси)-2-метилпропаноат. К раствору трет-бутил-2-гидрокси-2-метилпропаноата (2,14 г, 13,36 ммоль, 3,00 эквив.) в THF (50 мл) добавляли частями NaH (535 мг, 13,38 ммоль, 3,00 эквив.) при 0°С. Смесь перемешивали при 0°С в течение 20 мин. К ней добавляли пром. соед. G-23 (2 г, 4,48 ммоль, 1,00 эквив.) при 0°С и Bu4NI (1,0 г, 2,72 ммоль, 0,50 эквив.). Полученный раствор перемешивали в течение 16 ч. при к.т., затем реакцию останавливали посредством добавления воды/льда. Полученный раствор экстрагировали с помощью 500 мл EtOAc и органические слои объединяли и высушивали над безводным Na2SO4 и концентрировали под вакуумом. Остаток пропускали через колонку с силикагелем с применением EtOAc/петролейного эфира (1:2). В результате этого получали указанное в заголовке соединение в виде желтого масла (400 мг, 17%).
Метил-2-([5-(4-бромтиен-2-ил)-1-[(2-хлорфенил)метил]-1Н-пиразол-3-ил]метокси)-2-метилпропаноат. К раствору продукта из предыдущей стадии (400 мг, 0,76 ммоль, 1,00 эквив.) в МеОН (20 мл) добавляли по каплям водн. HCl (1 мл) с перемешиванием при к.т. Полученный раствор перемешивали в течение 3 ч. при 65°С, концентрировали под вакуумом и разбавляли с помощью 100 мл EtOAc. Значение рН раствора доводили до 7-8 с помощью (насыщ.) NaHCO3 (водн.). Смесь высушивали над безводным Na2SO4 и концентрировали под вакуумом. В результате этого получали указанное в заголовке соединение в виде желтого масла (350 мг, 95%).
Метил-2-([1-[(2-хлорфенил)метил]-5-(4-циклопропокситиен-2-ил)-1Н-пиразол-3-ил]метокси)-2-метилпропаноат. К раствору продукта из предыдущей стадии (350 мг, 0,72 ммоль, 1,00 эквив.) в диоксане (10 мл) постепенно добавляли Cs2CO3 (473 мг, 1,45 ммоль, 2,00 эквив.), предкатализатор XantPhos 2-го поколения (322 мг, 0,36 ммоль, 0,50 эквив.) и циклопропанол (168 мг, 2,89 ммоль, 4,00 эквив.). Конечную реакционную смесь облучали с помощью микроволнового излучения в течение 1 ч. при 85°С. Полученный раствор разбавляли 100 мл EtOAc. Полученную смесь промывали с помощью 2×100 мл солевого раствора. Смесь высушивали над безводным Na2SO4 и концентрировали под вакуумом. Остаток пропускали через колонку с силикагелем с применением EtOAc/петролейного эфира (1:2). В результате этого получали указанное в заголовке соединение в виде желтого масла (150 мг, 45%).
Промежуточное соединение Н-115: метил-2-([5-(3-аминофенил)-1-[(2-хлорфенил)метил]-1Н-пиразол-3-ил]метокси)-2-метилпропаноат

К раствору пром. соед. Н-95 (400 мг, 0,90 ммоль, 1,00 эквив.) в АсОН/Н2О (10/1 мл) добавляли частями Zn (400 мг, 6,15 ммоль) при комнатной температуре. Полученную смесь перемешивали в течение 2 ч. при комнатной температуре. Твердые вещества удаляли посредством фильтрации. Значение рН раствора доводили до 7-8 с помощью насыщ. NHCO3. Полученный раствор экстрагировали с помощью 100 мл EtOAc и органические слои объединяли, промывали с помощью 2×200 мл солевого раствора, высушивали над безводным Na2SO4 и концентрировали под вакуумом.
Остаток очищали с помощью Prep-TLC с применением DCM/MeOH (30:1) с получением 230 мг (62%) указанного в заголовке продукта в виде желтого масла.
Промежуточное соединение Н-116: метил-2-([1-[(2-хлорфенил)метил]-5-[3-(2-метилпропанамидо)фенил]-1Н-пиразол-3-ил]метокси)-2-метилпропаноат
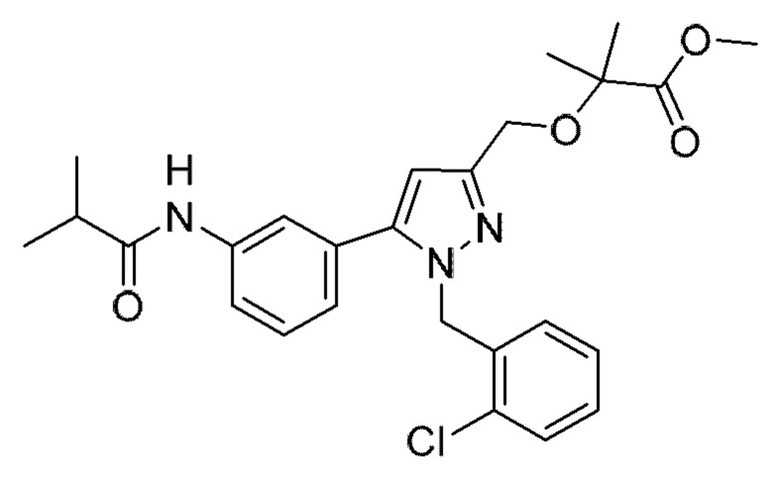
Раствор пром. соед. Н-115 (200 мг, 0,48 ммоль, 1,00 эквив.), HATU (276 мг, 0,73 ммоль, 1,50 эквив.), 2-метилпропановой кислоты (130 мг, 1,48 ммоль, 3,00 эквив.) и DIEA (187 мг, 1,45 ммоль, 3,00 эквив.) в DMF (20 мл) перемешивали в течение ночи при к.т. , затем разбавляли с помощью 200 мл EtOAc, промывали с помощью 2×100 мл солевого раствора, высушивали над безводным Na2SO4 и концентрировали под вакуумом. Остаток очищали посредством Prep-TLC с применением DCM/MeOH (30:1) с получением 155 мг (66%) указанного в заголовке продукта в виде желтого твердого вещества.
Промежуточное соединение Н-117: метил-2-([1-[(2-хлорфенил)метил]-5-[3-(метилсульфанил)фенил]-1Н-пиразол-3-ил]метокси)-2-метилпропаноат
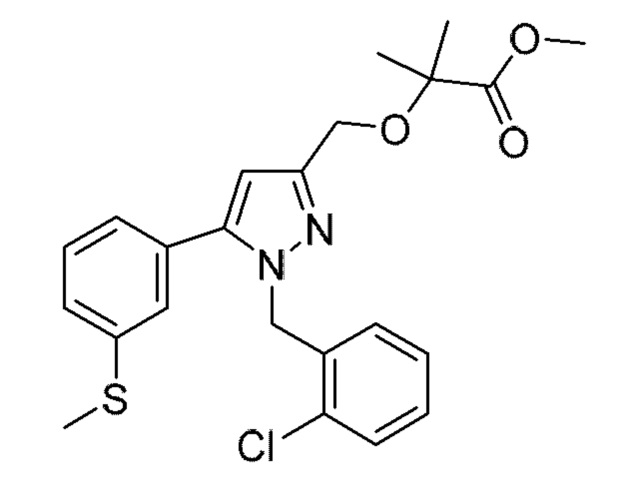
К раствору пром. соед. Н-115 (700 мг, 1,69 ммоль, 1,00 эквив.) в MeCN (10 мл), добавляли диметилдисульфид (319 мг, 3,39 ммоль, 2,00 эквив.). Полученную смесь нагревали при 60°С в течение 1 ч., затем охлаждали до к.т. Затем добавляли по каплям трет-бутилнитрит (350 мг, 3,40 ммоль, 2,00 эквив.) с перемешиванием и полученный раствор перемешивали в течение 3 ч. при 60°С, затем разбавляли с помощью 200 мл EtOAc, промывали с помощью 2×100 мл солевого раствора, высушивали над безводным Na2SO4 и концентрировали под вакуумом. Остаток подвергали Prep-TLC с применением EtOAc/петролейного эфира (1:2). Это приводило к получению 300 мг (40%) указанного в заголовке продукта в виде желтого масла.
Промежуточное соединение Н-118: метил-2-([1-[(2-хлорфенил)метил]-5-(3-метансульфонилфенил)-1Н-пиразол-3-ил]метокси)-2-метилпропаноат
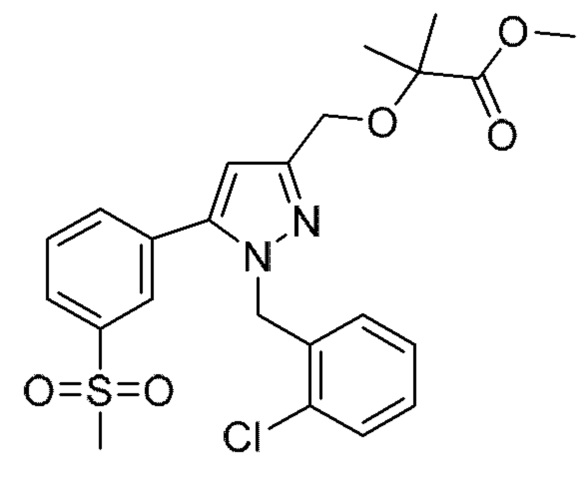
К раствору пром. соед. Н-117 (300 мг, 0,67 ммоль, 1,00 эквив.) в МеОН/Н2О (10/5 мл) добавляли частями K2S2O8 (233 мг, 1,53 ммоль, 1,00 эквив.) при к.т. Полученный раствор перемешивали в течение 2 ч., затем разбавляли с помощью 200 мл EtOAc, промывали с помощью 2×100 мл солевого раствора, высушивали над безводным Na2SO4 и концентрировали под вакуумом. Остаток подвергали Prep-TLC с применением EtOAc/петролейного эфира (1:3). Это приводило к получению 180 мг (58%) указанного в заголовке продукта в виде желтого твердого вещества.
Промежуточное соединение Н-119: метил-2-([1-[(2-хлорфенил)метил]-5-(3-метансульфонамидофенил)-1Н-пиразол-3-ил]метокси)-2-метилпропаноат
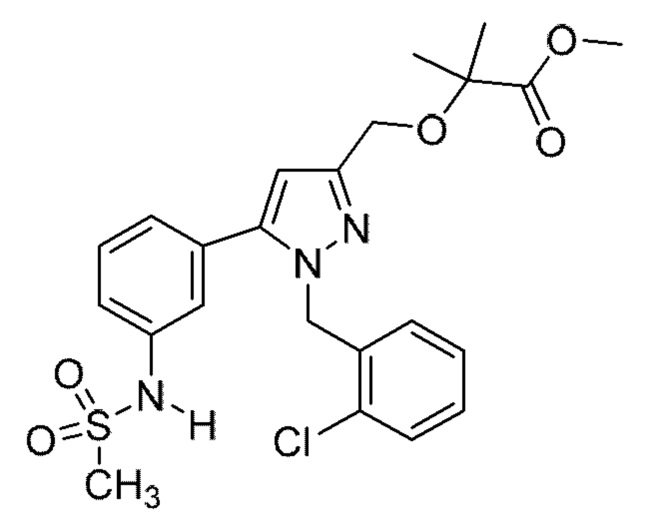
К раствору пром. соед. Н-115 (200 мг, 0,48 ммоль, 1,00 эквив.), пиридина (75 мг, 0,95 ммоль, 2,00 эквив.) и DMAP (6 мг, 0,05 ммоль, 0,10 эквив.) в DCM (10 мл) добавляли по каплям метансульфонилхлорид (83 мг, 0,72 ммоль, 1,50 эквив.) с перемешиванием при 0°С. Полученный раствор перемешивали в течение ночи при к.т., затем разбавляли с помощью 100 мл DCM, промывали с помощью 2×100 мл солевого раствора, высушивали над безводным Na2SO4 и концентрировали под вакуумом. Остаток подвергали Prep-TLC с применением EtOAc/петролейного эфира (1:4). Это приводило к получению 100 мг (42%) указанного в заголовке продукта в виде желтого масла.
Промежуточное соединение Н-120: метил-2-([1-[(2-хлорфенил)метил]-5-[3-(метиламино)фенил]-1Н-пиразол-3-ил]метокси)-2-метилпропаноат
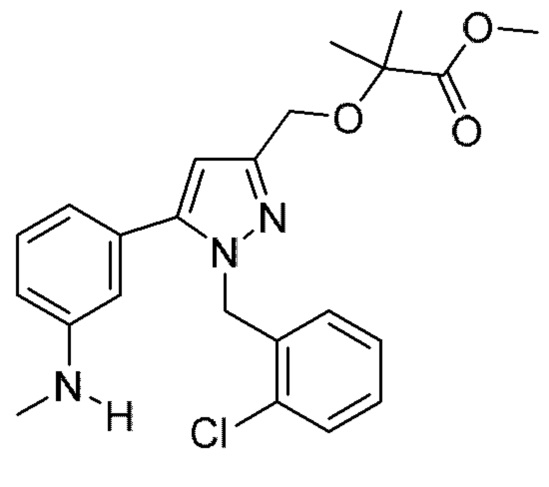
К раствору пром. соед. Н-115 (200 мг, 0,48 ммоль, 1,00 эквив.) в МеОН (10 мл) добавляли параформальдегид (107 мг, 2,43 ммоль, 5,00 эквив.) с последующим добавлением по каплям MeONa (0,45 мл, 5,00 эквив., 5,4 М) с перемешиванием при комнатной температуре. Полученный раствор перемешивали в течение 2 ч. при 60°С, затем охлаждали до 0°С. Добавляли NaBH4 (92 мг, 2,43 ммоль, 5,00 эквив.) и раствор перемешивали в течение 1 ч. при 60°С, затем охлаждали, разбавляли с помощью 100 мл EtOAc, промывали с помощью 2×50 мл солевого раствора, высушивали над безводным Na2SO4 и концентрировали под вакуумом. Остаток подвергали Prep-TLC с применением EtOAc/петролейного эфира (1:4). Это приводило к получению 100 мг (48%) указанного в заголовке продукта в виде желтого масла.
Промежуточное соединение Н-121: метил-2-([1-[(2-хлорфенил)метил]-5-(3-метоксифенил)-1Н-пиразол-3-ил]метокси)-2-этилбутаноат
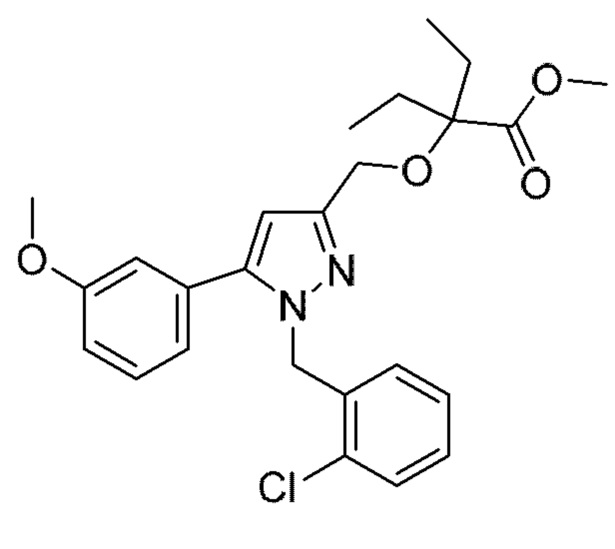
Метил-2-этил-2-гидроксибутаноат. К раствору 2-этил-2-гидроксибутановой кислоты (2,0 г, 15,13 ммоль, 1,00 эквив.) в МеОН (100 мл) добавляли по каплям H2SO4 (3 мл) с перемешиванием при к.т. Полученный раствор нагревали до температуры возврата флегмы в течение 16 ч., затем концентрировали под вакуумом, разбавляли с помощью 200 мл EtOAc, промывали с помощью 2×100 мл насыщ. NaHCO3, высушивали над безводным Na2SO4 и концентрировали под вакуумом с получением 800 мг (36%) указанного в заголовке продукта в виде бесцветного масла.
Метил-2-([1-[(2-хлорфенил)метил]-5-(3-метоксифенил)-1Н-пиразол-3-ил]метокси)-2-этилбутаноат. К раствору метил-2-этил-2-гидроксибутаноата (371 мг, 2,54 ммоль, 2,00 эквив.) в DMF/THF (7/7 мл) добавляли NaH (100 мг, 4,17 ммоль, 2,00 эквив.) при 0°С в течение 30 мин. К нему добавляли NaI (140 мг) и пром. соед. G-1 (500 мг, 1,28 ммоль, 1,00 эквив.). Полученный раствор перемешивали в течение 16 ч. при к.т. Остаток подвергали Prep-TLC с применением EtOAc/петролейного эфира (1:10). Собранные фракции объединяли и концентрировали под вакуумом. Это приводило к получению 210 мг (38%) указанного в заголовке продукта в виде белой жидкости.
Промежуточное соединение Н-122: метил-(2R)-2-([5-(3-циклопропоксифенил)-1-(1-метил-1Н-индазол-7-ил)-1Н-пиразол-3-ил]метокси)-2-метилбутаноат
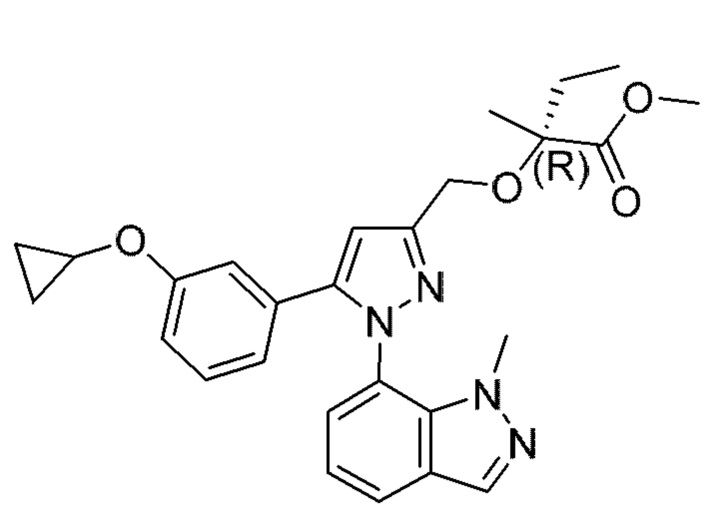
Метил-(2R)-2-([5-(3-циклопропоксифенил)-1-(1-метил-1Н-индазол-7-ил)-1Н-пиразол-3-ил]метокси)-2-метилбутаноат. К раствору метил-(2R)-2-гидрокси-2-метилбутаноата (250 мг, 1,89 ммоль, 2,00 эквив.) в THF (20 мл) добавляли частями NaH (76 мг, 1,90 ммоль, 2,00 эквив.) при 0°С. Смесь перемешивали при 0°С в течение 20 мин., затем добавляли пром. соед. F-10 (400 мг, 0,94 ммоль, 1,00 эквив.) при 0°С, Bu4NI (200 мг, 0,54 ммоль, 0,50 эквив.). Полученный раствор перемешивали в течение 16 ч. при к.т., затем реакцию останавливали посредством добавления воды/льда. Полученный раствор экстрагировали с помощью 100 мл этилацетата и объединенные органические слои высушивали над Na2SO4, концентрировали под вакуумом и очищали с помощью Prep-TLC с применением EtOAc/петролейного эфира (1:1) с получением 160 мг (36%) указанного в заголовке соединения в виде желтого твердого вещества. LC-MS: (ES, масса/заряд): 475.
Следующие замещенные сложные эфиры пиразолкарбоновой кислоты получали в результате синтеза соответствующего (бромметил)пиразола посредством реакции синтеза простых эфиров по Вильямсону с использованием НО-С(СН3)(Et)СООМе.
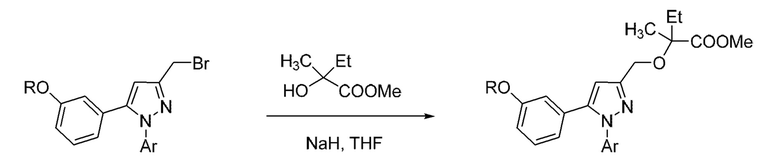
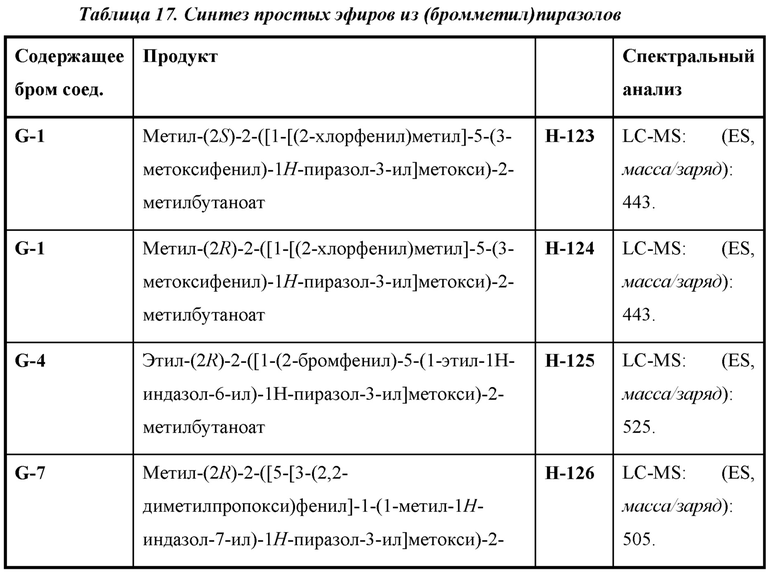
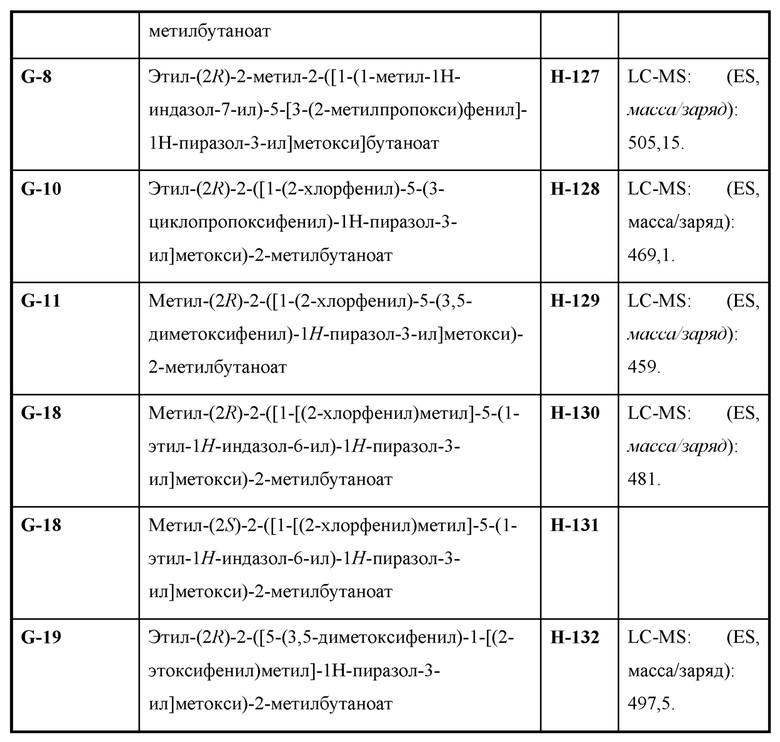
Промежуточное соединение Н-133: метил-2-([1-[2-(азетидин-1-ил)фенил]-5-(1-этил-1Н-индазол-6-ил)-1Н-пиразол-3-ил]метокси)-2-метилпропаноат
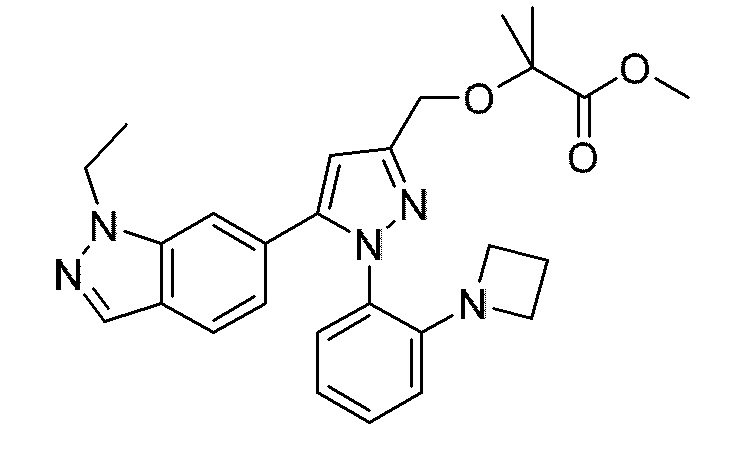
В 20-мл герметизированной пробирке объединяли метил-2-([1-(2-бромфенил)-5-(1-этил-1Н-индазол-6-ил)-1Н-пиразол-3-ил]метокси)-2-метилпропаноат (200 мг, 0,40 ммоль, 1,00 эквив.) L-пролин (46 мг, 0,40 ммоль, 1,00 эквив.), CuI (38 мг, 0,20 ммоль, 0,50 эквив.), K2CO3 (166 мг, 1,20 ммоль, 3,00 эквив.), азетидин (69 мг, 1,21 ммоль, 3,00 эквив.) и DMSO (10 мл). Полученный раствор перемешивали в течение ночи при 70°С. Реакционную смесь охлаждали до комнатной температуры. Полученный раствор экстрагировали с помощью 3×20 мл EtOAc и органические слои объединяли и высушивали над Na2SO4 и концентрировали под вакуумом. Остаток очищали посредством Prep-TLC с применением EtOAc/петролейного эфира (1/3). Это приводило к получению 50 мг (26%) указанного в заголовке соединения в виде светло-желтого масла. LC-MS: (ES, масса/заряд): 474. 1Н ЯМР: (300 МГц, CDCl3) δ 7,90 (s, 1H), 7,62 (d, J=8,4 Гц, 1H), 7,34 (s, 1H), 7,24 (m, 2Н), 7,07 (dd, J=7,8, 1,5 Гц, 1H), 6,76 (s, 1H), 6,69 (td, J=7,6, 7,5, 1,3 Гц, 1H), 6,45 (dd, J=8,2, 1,3 Гц, 1H), 4,63 (s, 2Н), 4,25 (q, J=7,3, 7,3, 7,3 Гц, 2Н), 3,79 (s, 3Н), 3,58 (dq, J=24,9, 7,4, 7,3, 7,3 Гц, 4Н), 2,10 (р, J=7,3, 7,3, 7,3, 7,3 Гц, 2Н), 1,56 (s, 6Н), 1,34 (q, J=8,2, 8,2, 7,2 Гц, 3Н).
Промежуточное соединение Н-134: метил-2-([1-[2-(азетидин-1-ил)фенил]-5-[3-(2,2-диметилпропокси)фенил]-1Н-пиразол-3-ил]метокси)-2-метилпропаноат

В 30-мл герметизированной пробирке объединяли пром. соед. Н-4 (200 мг, 0,39 ммоль, 1,00 эквив.), L-пролин (44 мг, 0,38 ммоль, 1,00 эквив.), CuI (40 мг, 0,21 ммоль, 0,50 эквив.), K2CO3 (160 мг, 1,16 ммоль, 3,00 эквив.), азетидин (66 мг, 1,16 ммоль, 3,00 эквив.) и DMSO (10 мл). Полученный раствор перемешивали в течение ночи при 70°С, охлаждали и экстрагировали с помощью 3×15 мл EtOAc. Объединенные органические слои высушивали над Na2SO4, концентрировали под вакуумом и очищали с помощью prep-TLC с применением EtOAc/петролейного эфира (1/3) с получением 70 мг (37%) указанного в заголовке соединения в виде светло-желтого масла. LC-MS: (ES, масса/заряд): 492,30. 1H ЯМР: (300 МГц, DMSO) δ 7,28 (ddd, J=8,5, 7,4, 1,6 Гц, 1H), 7,20 (t, J=7,9, 7,9 Гц, 1H), 6,98 (ddd, J=9,9, 7,2, 1,5 Гц, 2H), 6,84 (m, 2Н), 6,69 (m, 2Н), 6,51 (dd, J=8,3, 1,3 Гц, 1H), 4,44 (s, 2Н), 3,71 (s, 3Н), 3,50 (m, 2Н), 3,42 (m, 2Н), 2,07 (m, 2Н), 1,45 (s, 6Н), 0,94 (s, 9Н).
Следующие аминозамещенные арильные соединения получали посредством применения сходных процедур сочетания, опосредованного медью (I).
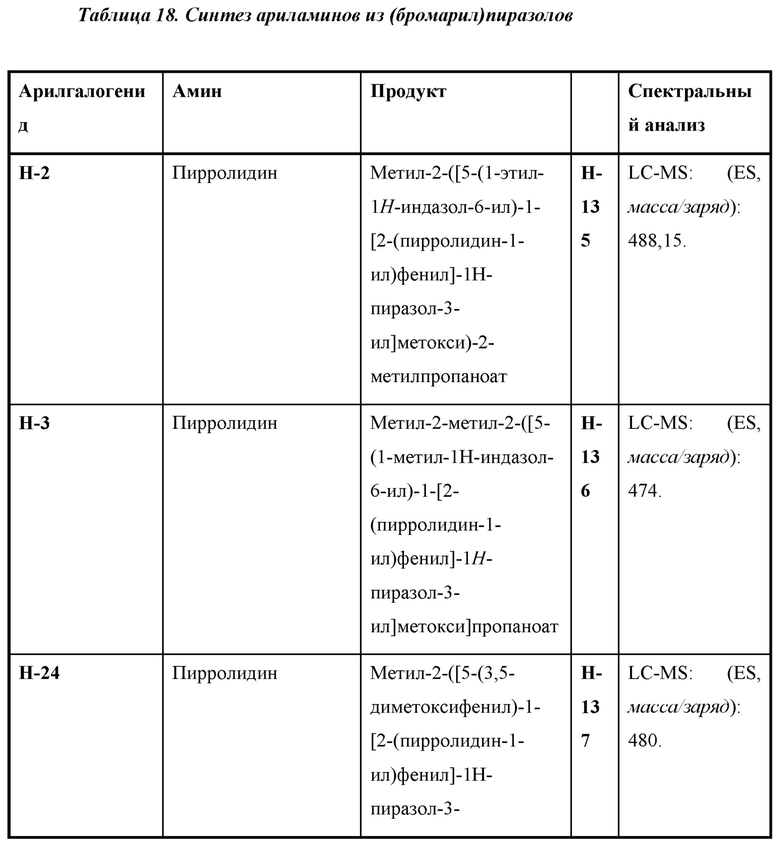
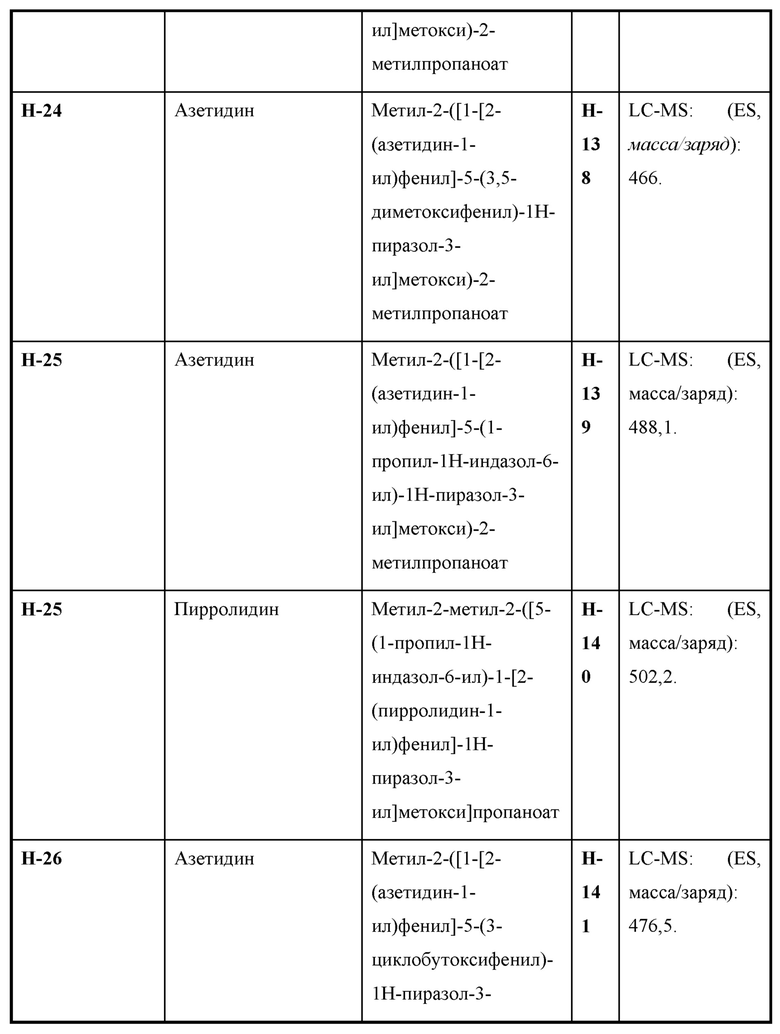
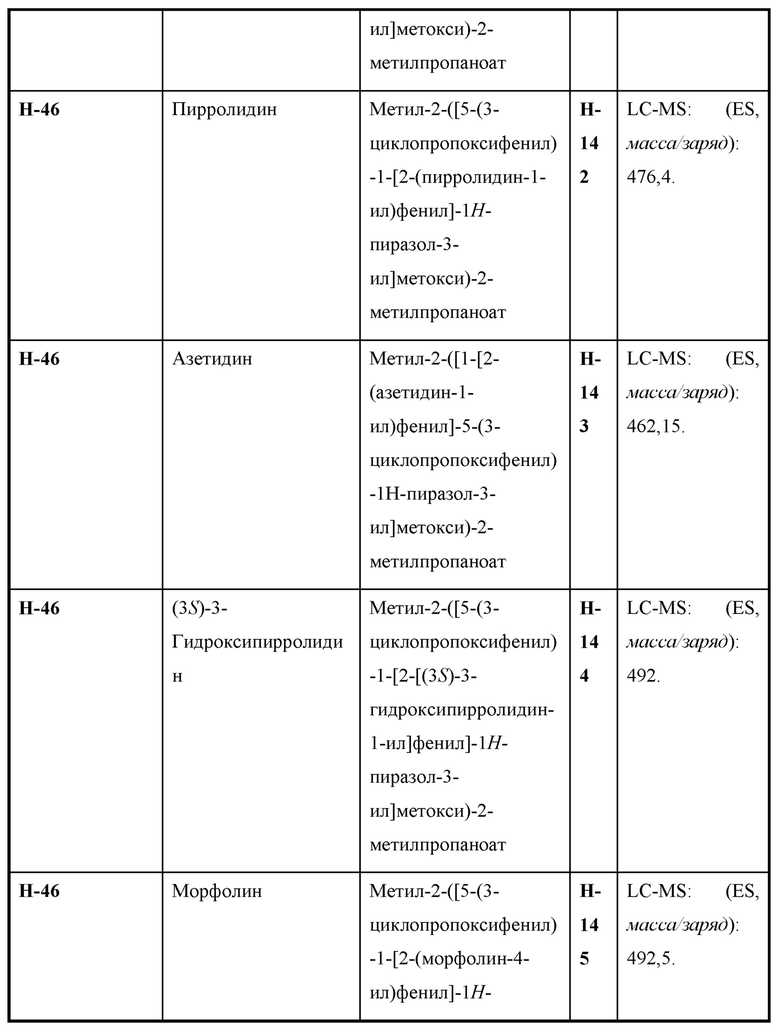
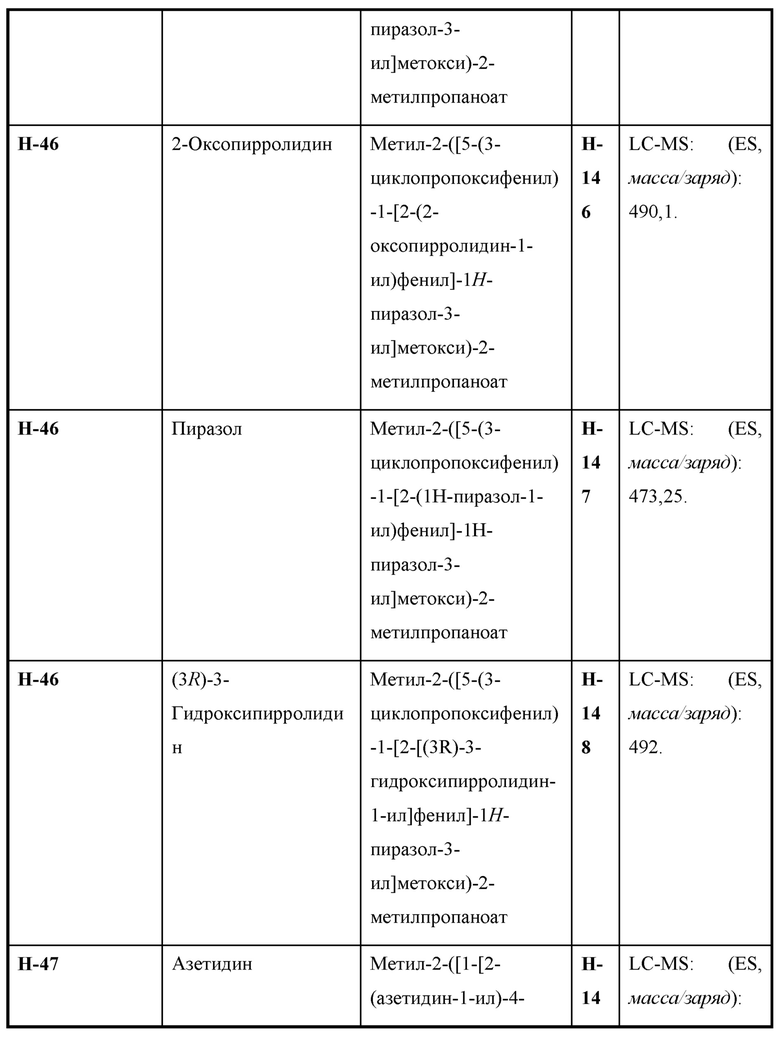
Промежуточное соединение Н-156: метил-2-([1-(2-цианофенил)-5-(3-циклопропоксифенил)-1Н-пиразол-3-ил/метокси)-2-метилпропаноат
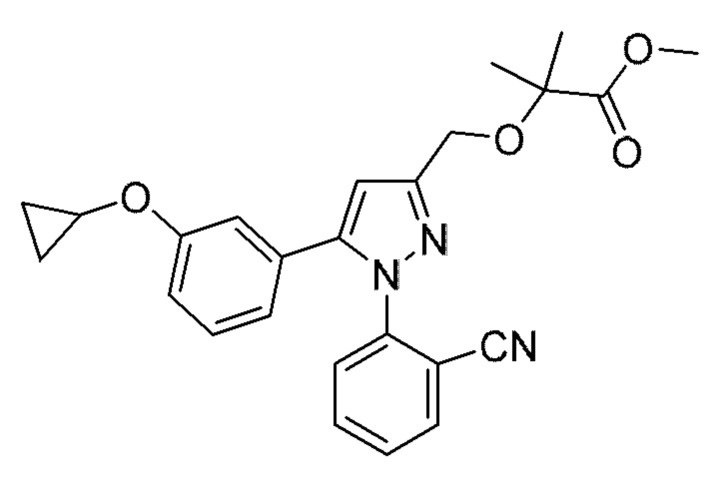
К раствору пром. соед. Н-46 (150 г, 309,04 ммоль, 1,00 эквив.) и Zn(CN)2 (72 мг, 0,62 ммоль, 2,00 эквив.) в DMF (15 мл) добавляли частями Pd(PPh3)4 (36 мг, 0,03 ммоль, 0,10 эквив.) при к.т. Полученный раствор перемешивали в течение 16 ч. при 100°С, разбавляли с помощью 100 мл EtOAc, промывали с помощью 2×50 мл (насыщ.) FeSO4 (водн.), высушивали над Na2SO4 и концентрировали под вакуумом. Остаток подвергали Prep-TLC с применением EtOAc/петролейного эфира (1:2). Это приводило к получению 100 мг указанного в заголовке соединения в виде бесцветного масла. LC-MS: (ES, масса/заряд): 432.
Хроматографические процедуры
Все хроматографические процедуры проводили на приборе 2#-AnalyseHPLC-SHIMADZU(HPLC-10) с детекцией при 254/220 нм. Колонки, применяемые для очистки, включают следующее.
"Xselect": колонка XSelect CSH Prep C18 OBD, 19*250 мм, 5 мкм.
"XBridge": колонка XBridge Prep C18 OBD, 19*150 мм, 5 мкм.
Примеры
Настоящее изобретение дополнительно проиллюстрированно с помощью следующих примеров.
Пример 1: 2-([1-[(3-хлорфенил)метил]-5-фенил-1Н-пиразол-3-ил]метокси)-2-метилпропановая кислота.
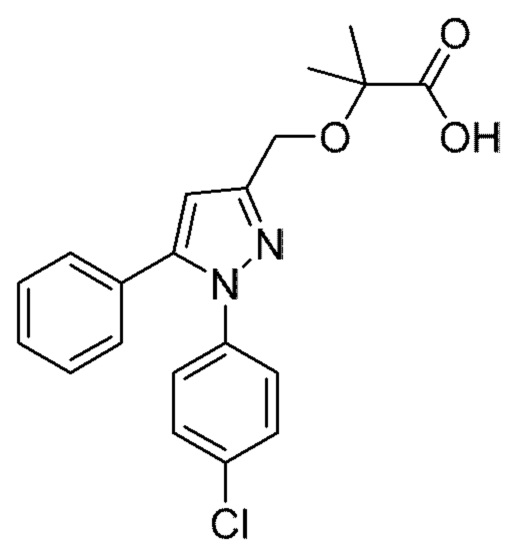
К раствору пром. соед. Н-1 (0,068 г, 0,170 ммоль) в THF: МеОН: H2O (2:1:1) (8 мл) добавляли LiOH*Н2О (0,035 г, 0,85 ммоль) при к.т. и продолжали перемешивание в течение дополнительных 3 ч. Затем растворитель выпаривали и к остатку добавляли воду (2 мл) и подкисляли с помощью 1 М лимонной кислоты. Смесь экстрагировали с помощью EtOAc (25 мл) и промывали с помощью воды (10 мл), а затем солевого раствора (10 мл). Слой EtOAc высушивали над Na2SO4 и растворитель удаляли с помощью выпаривания. Неочищенный продукт подвергали хроматографии над SiO2 (ISCO CombiFlash® Rƒ 200) с применением 0-30% градиента MeOH в DCM с получением указанного в заголовке продукта в виде белого твердого вещества (0,032 г). 1НЯМР(CDCl3): δ 1,56(s, 6Н), 4,61 (s, 2Н), 5,34 (s, 2Н), 6,38(s, 1H), 6,87-6,97(m, 1H), 7,04(s, 1H), 7,18-7,24(m, 2Н), 7,26-7,35(m, 2Н), 7,35-7,45(m, 3Н).
Примеры 2-50 получали аналогично, как описано в примере 1.
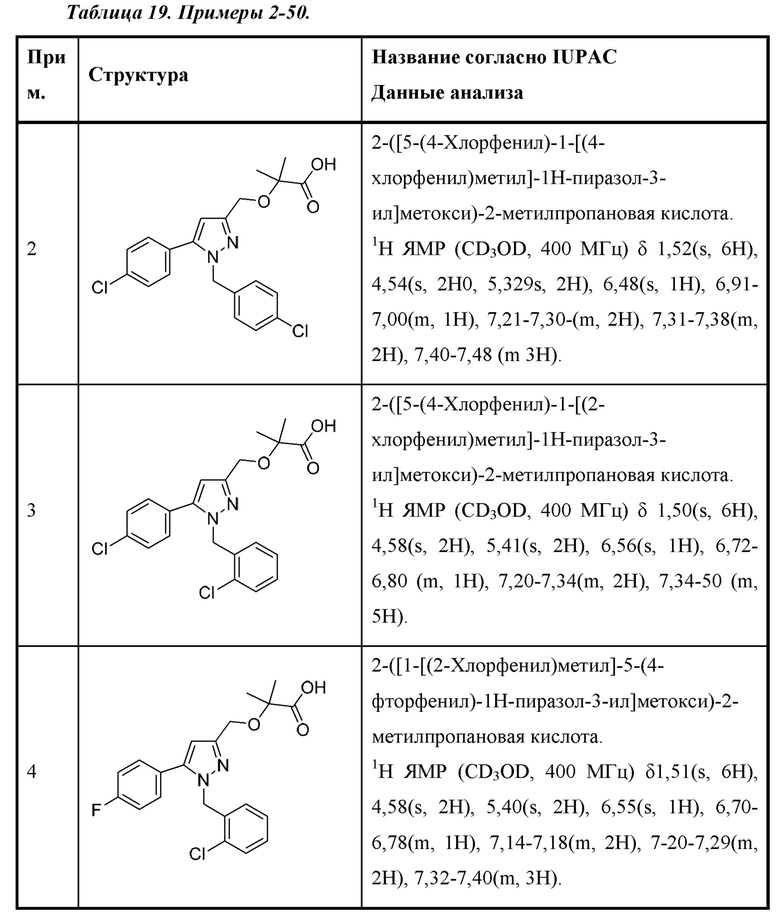
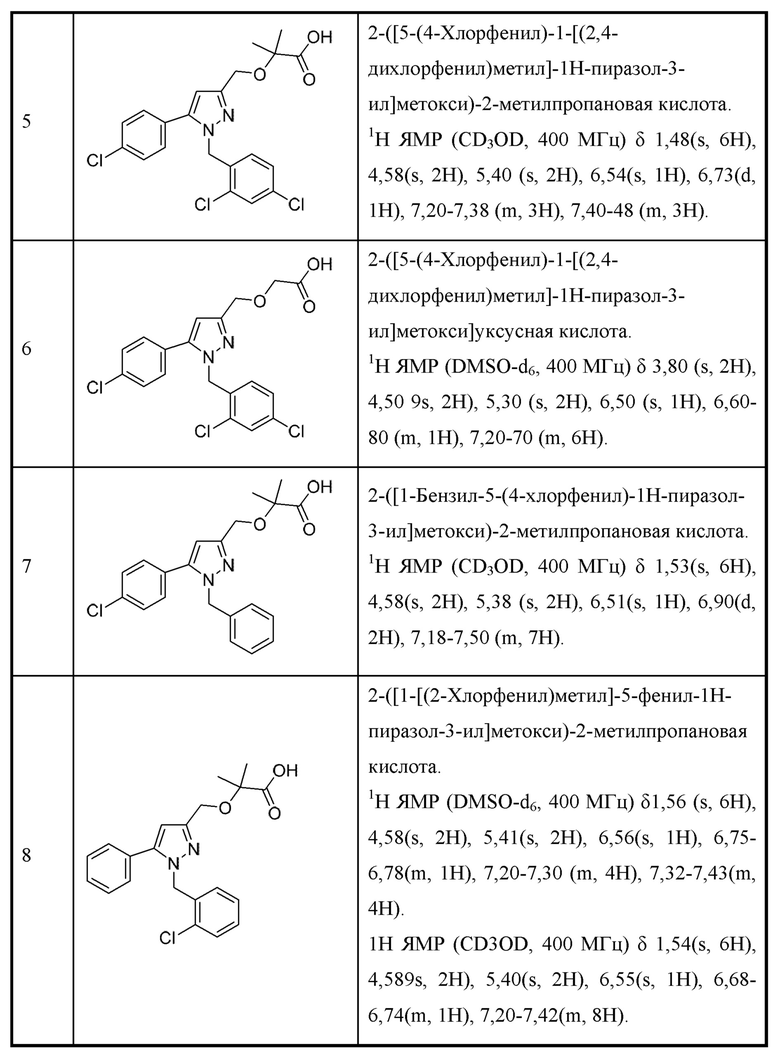
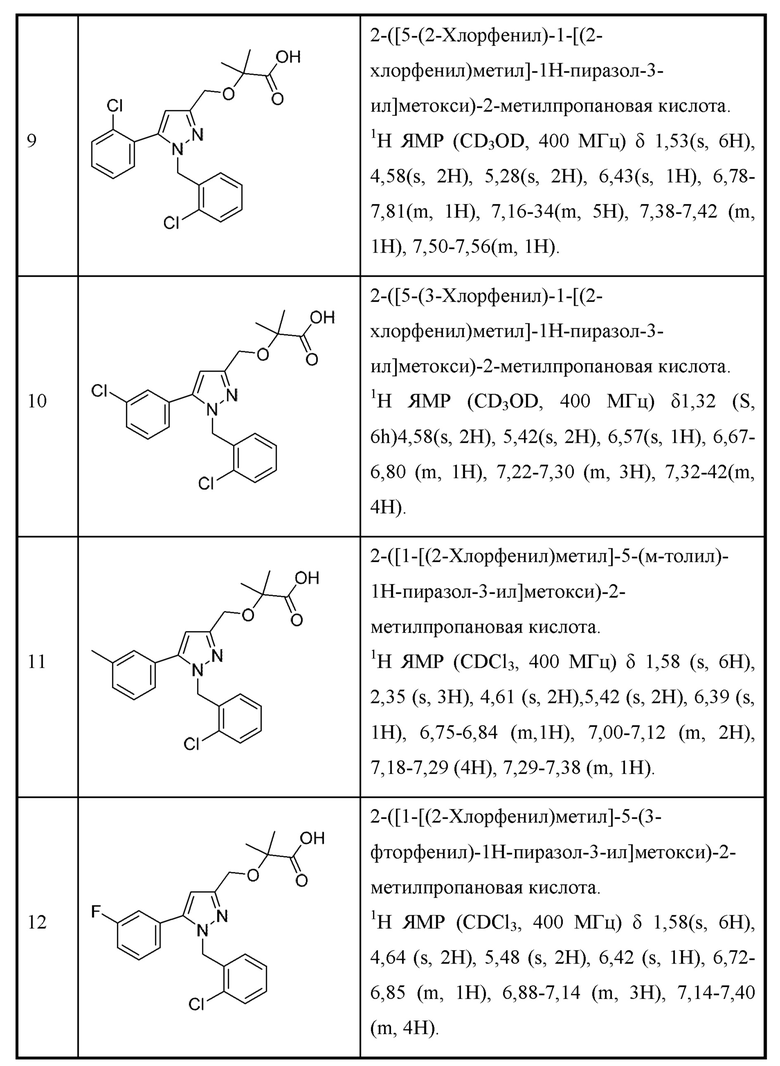
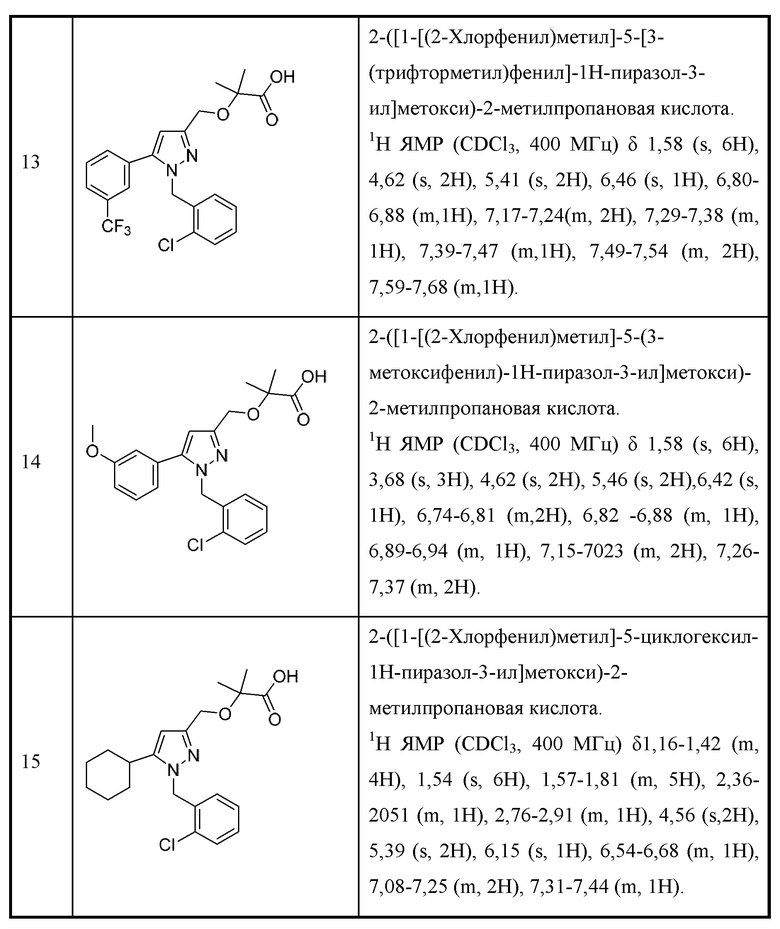
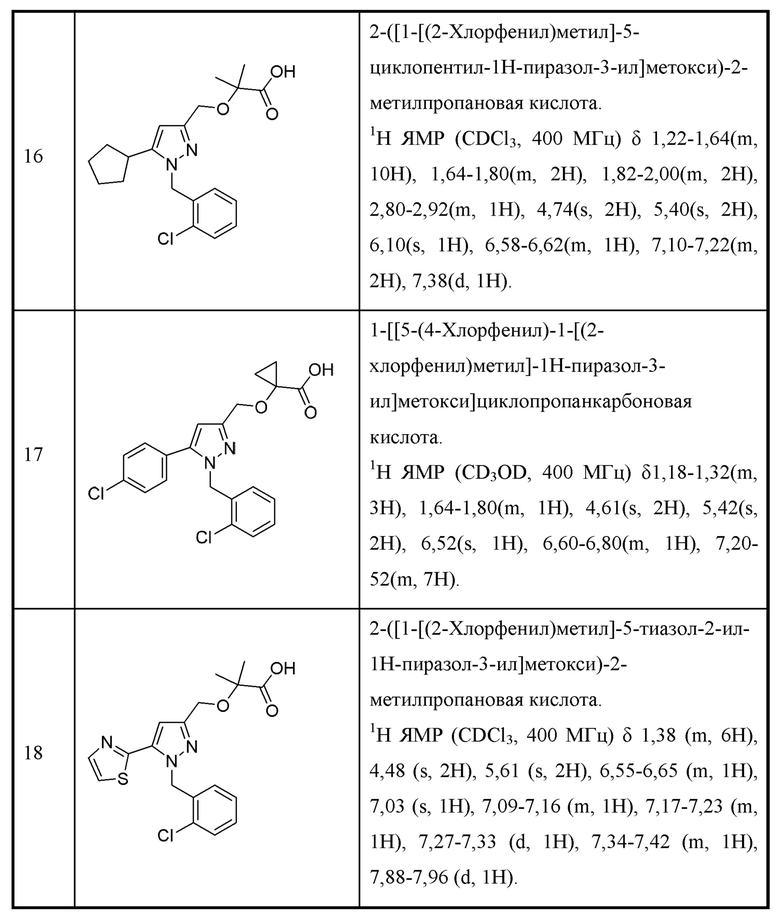
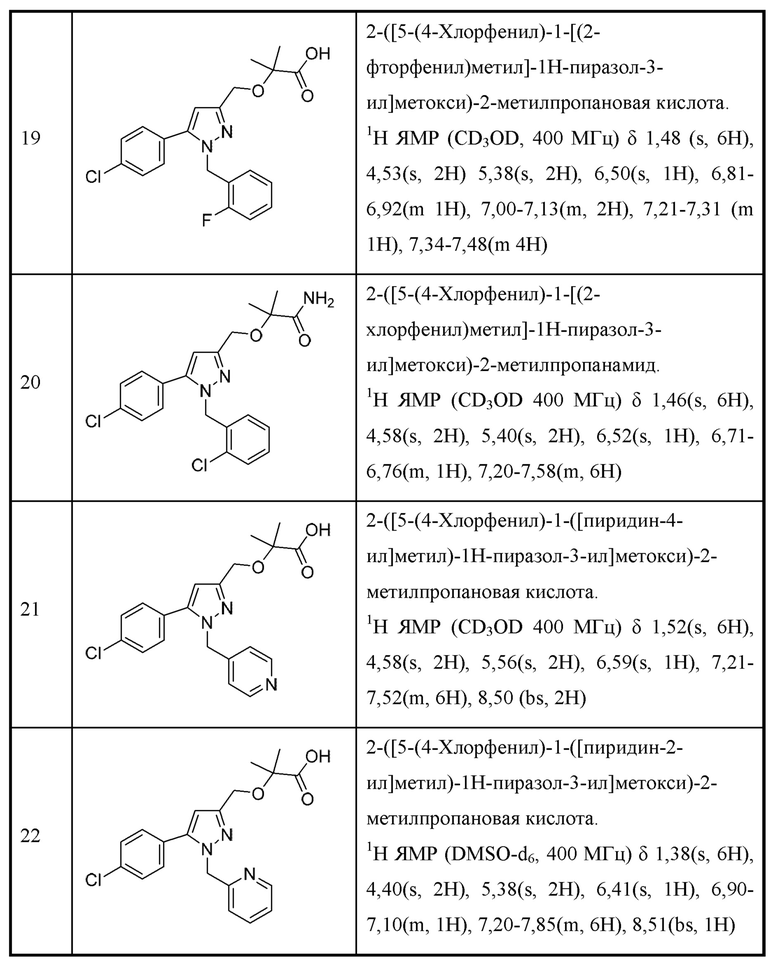

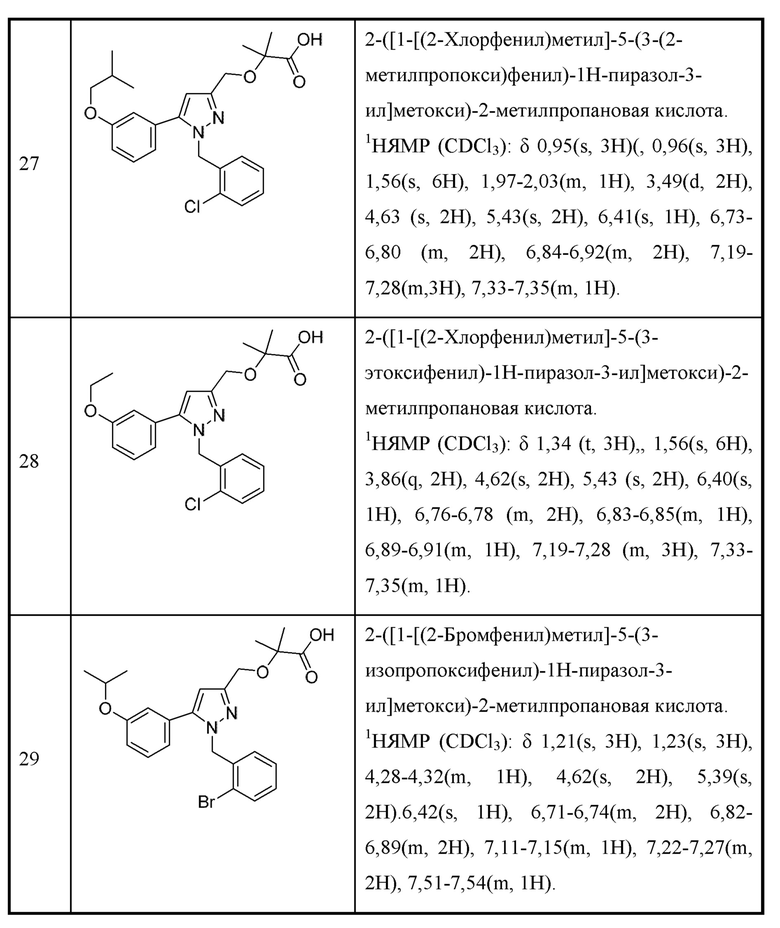
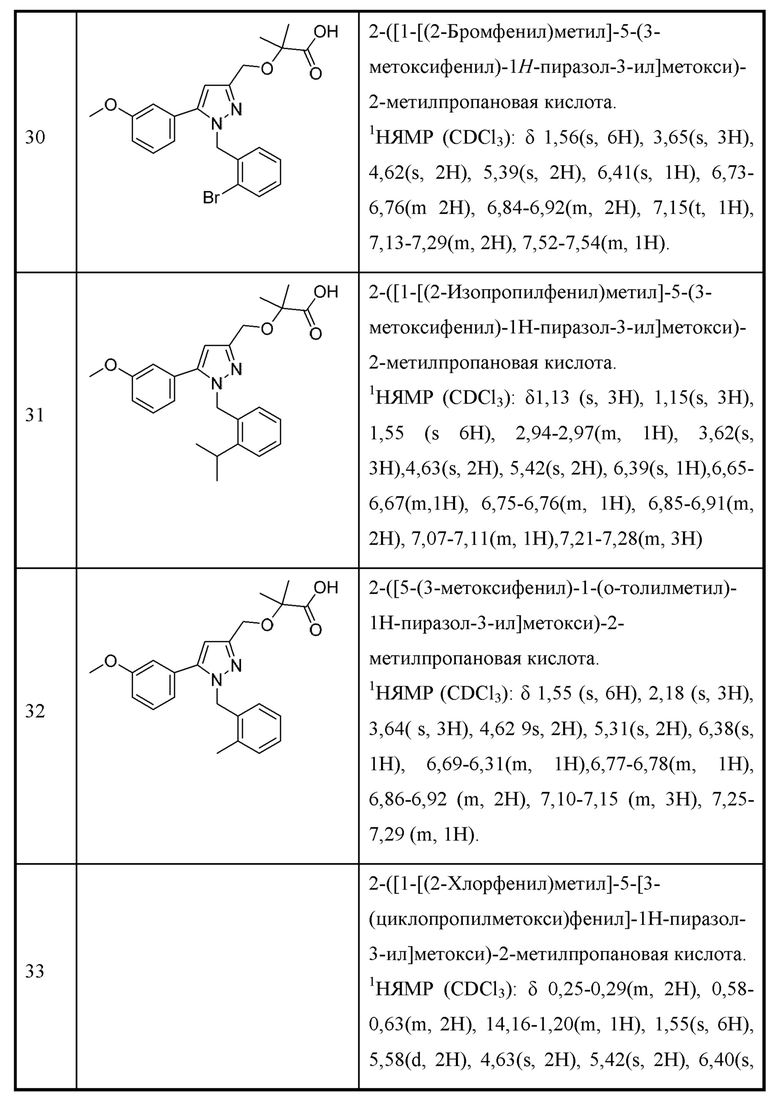
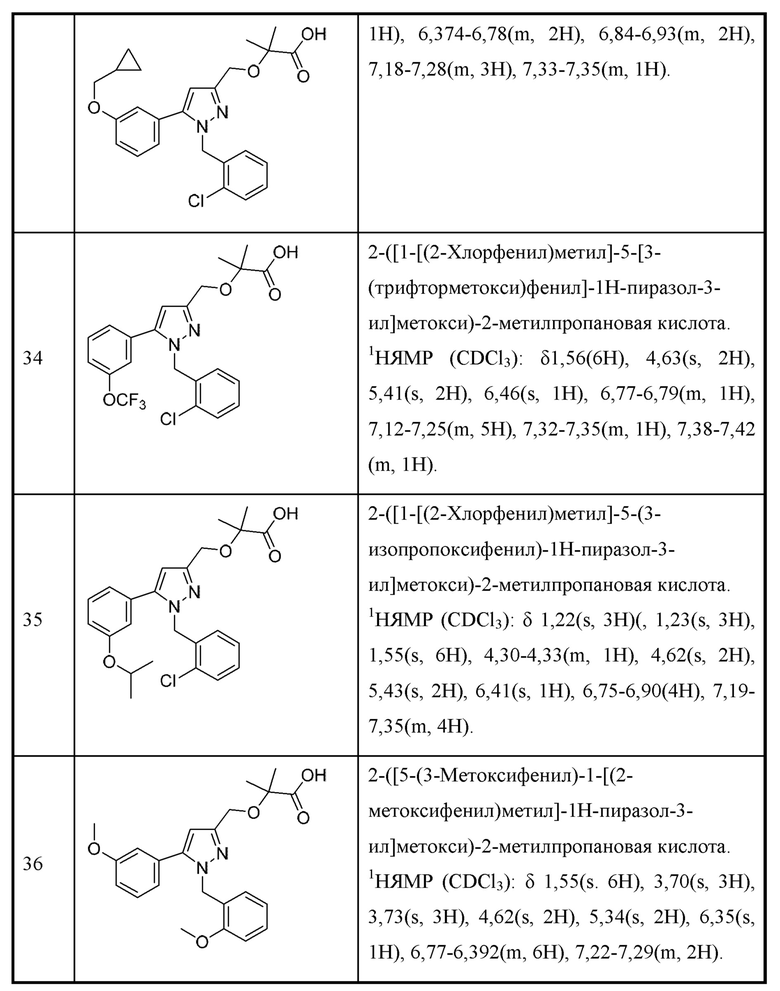
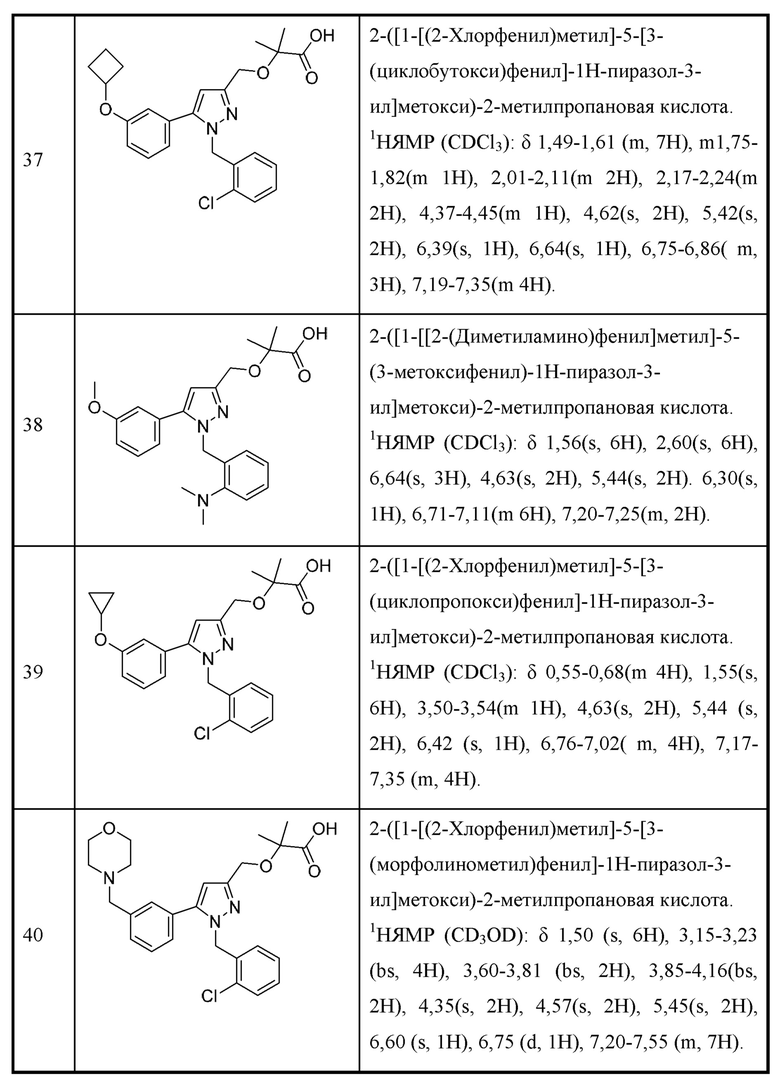
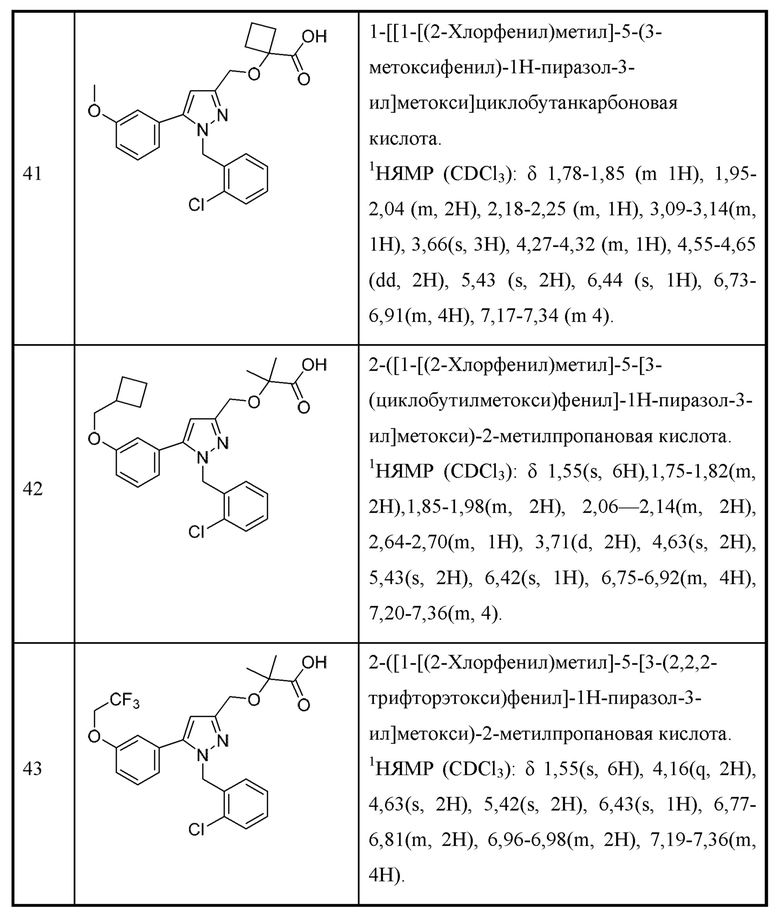
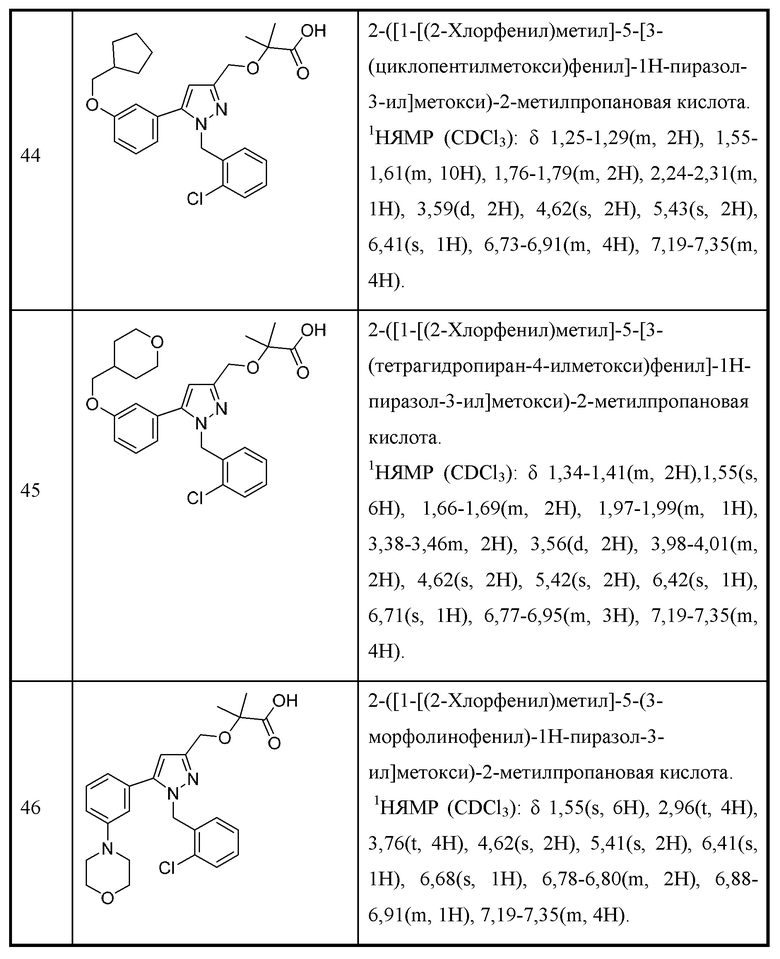
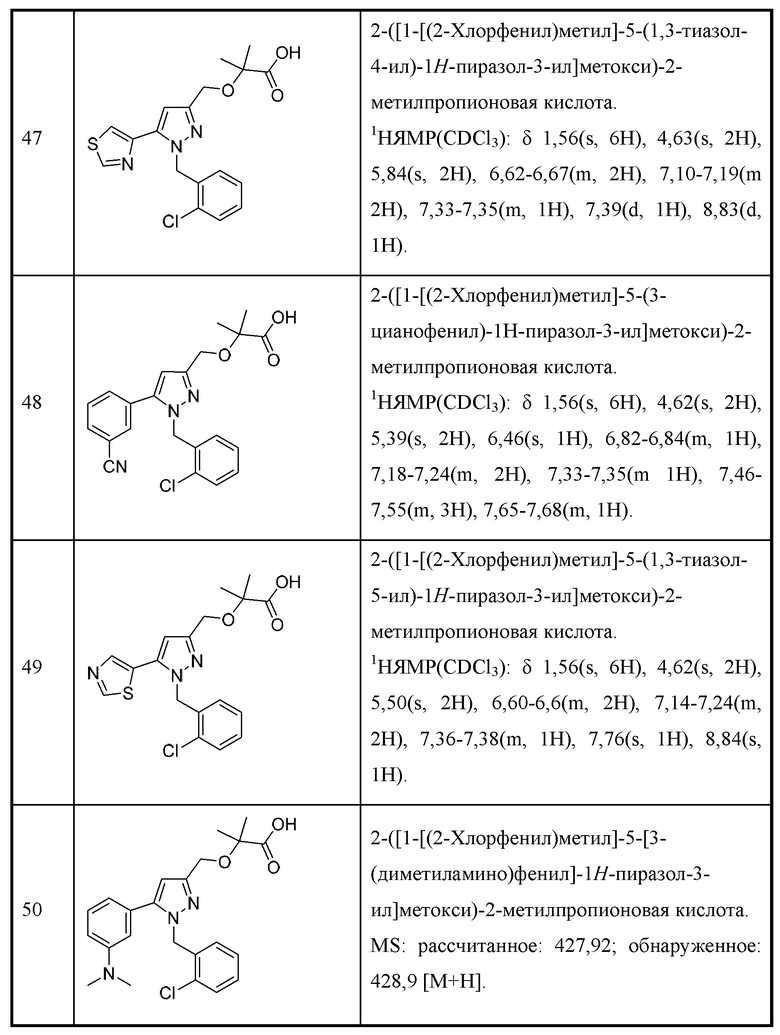
Примеры 51-74 получали с применением способов, раскрытых на указанных схемах.
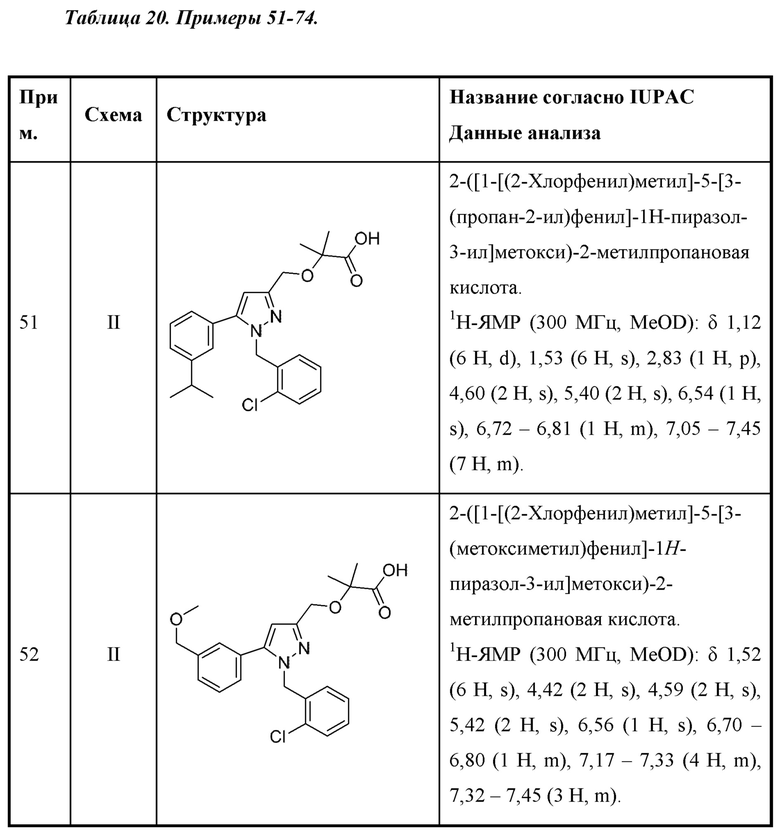

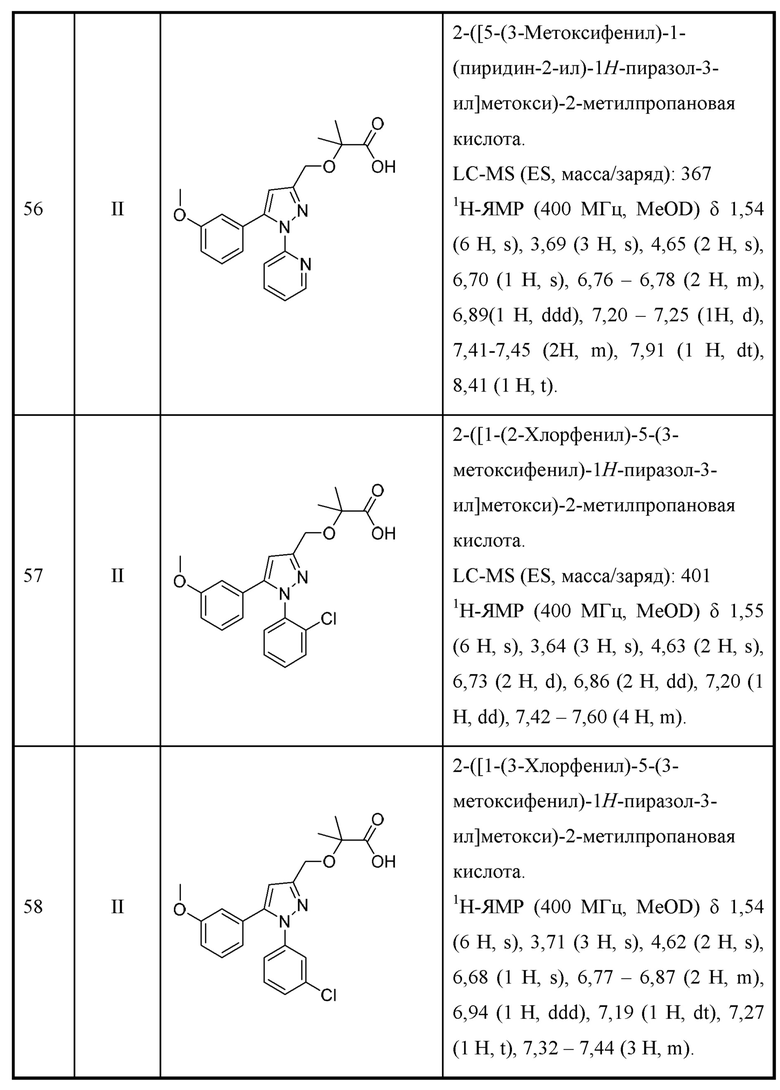
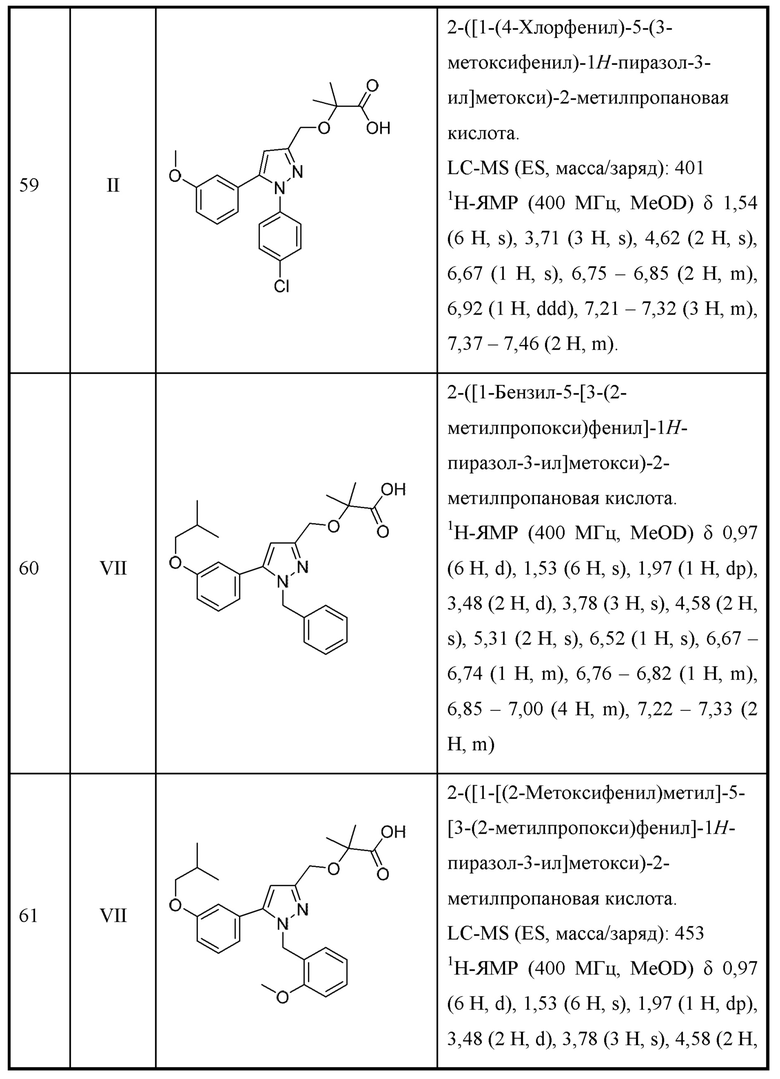

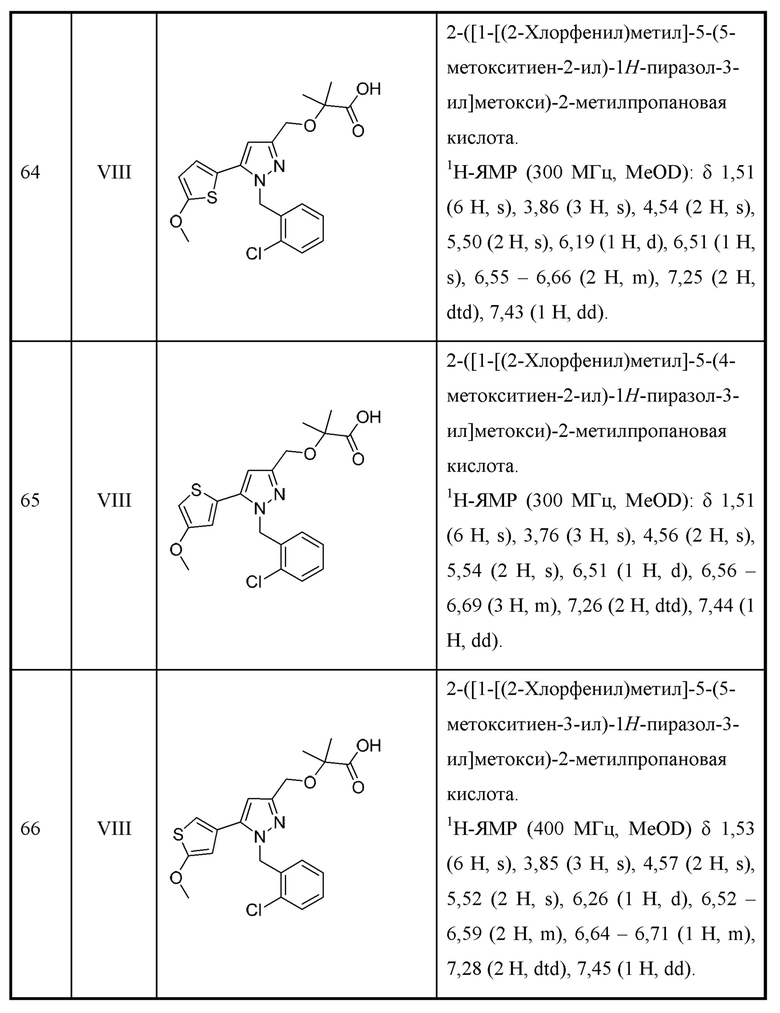
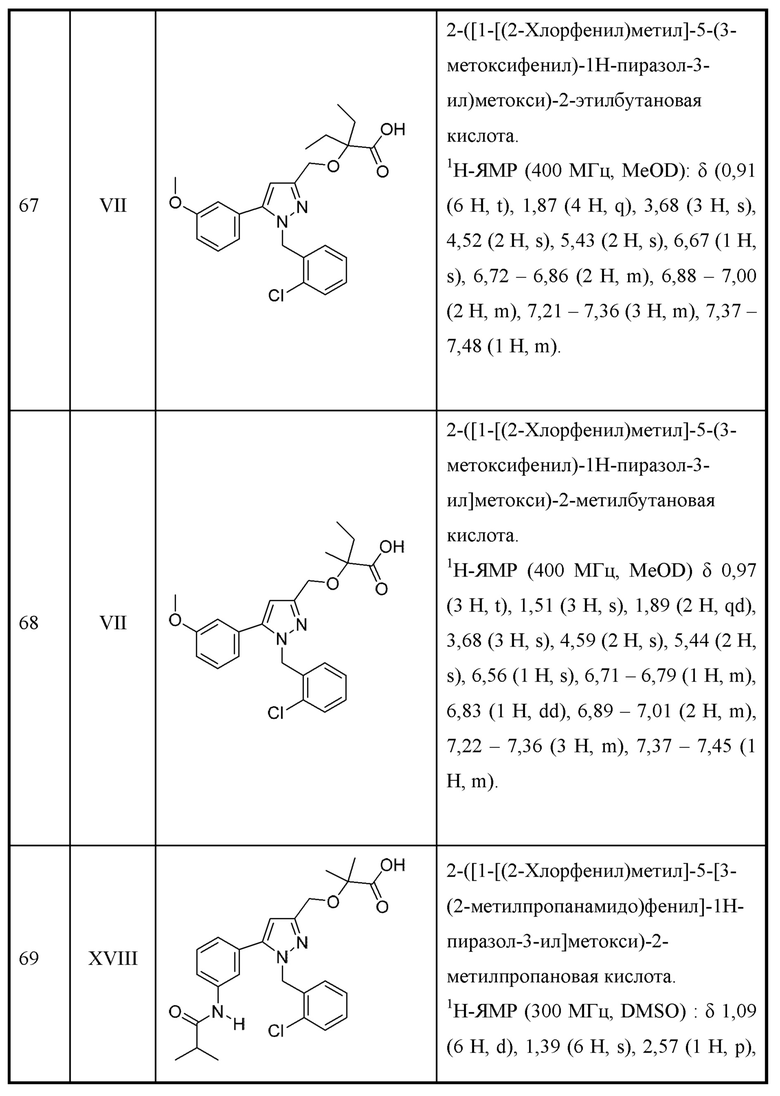

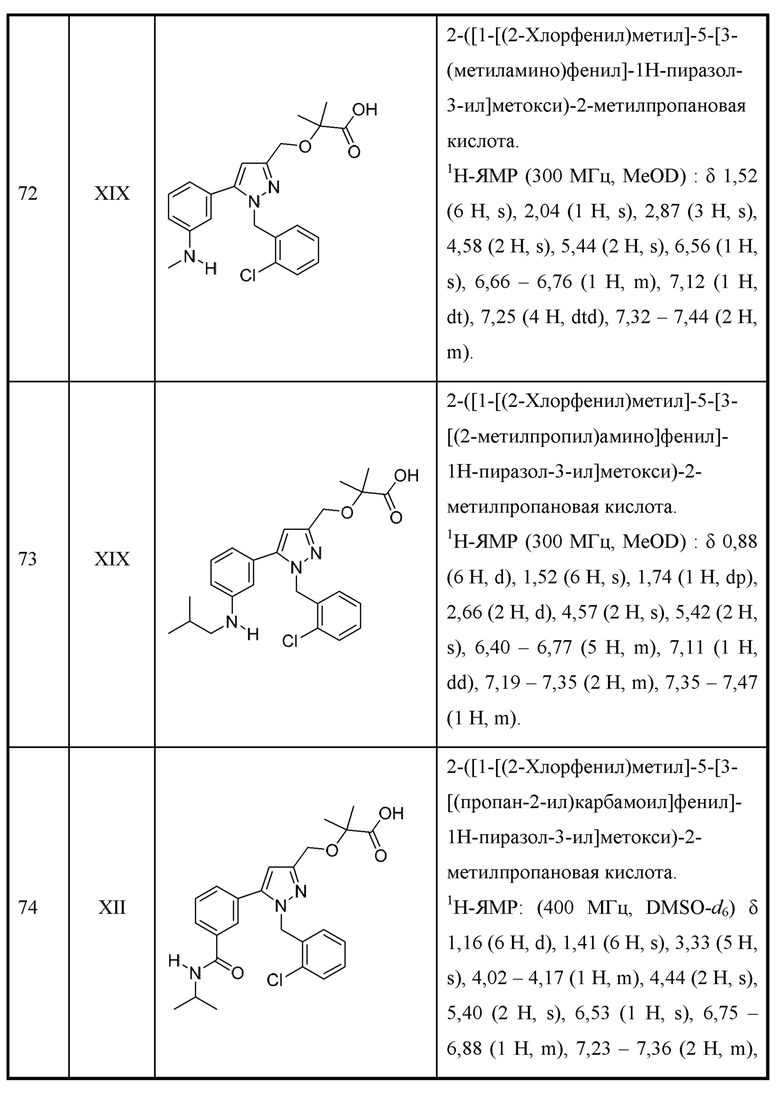

Пример 75: 2-([1-[(2-хлорфенил)метил]-5-(фениламино)-1Н-пиразол-3-ил]метокси)-2-метилпропановая кислота.
2-[(5-[[(трет-Бутокси)карбонил](фенил)амино]-1-[(2-хлорфенил)метил]-1Н-пиразол-3-ил)метокси)-2-метилпропановую кислоту получали из пром. соед. Н-93 с применением процедуры из примера 1. В результате этого получали 200 мг в виде желтого масла.
2-([1-[(2-Хлорфенил)метил]-5-(фениламино)-1Н-пиразол-3-ил]метокси)-2-метилпропановая кислота. К раствору продукта из предыдущей стадии (200 г, 400,01 ммоль, 1,00 эквив.) в DCM (10 мл) добавляли по каплям TFA (5 мл) с перемешиванием при к.т. Полученный раствор перемешивали в течение 1 ч., затем концентрировали под вакуумом. Неочищенный продукт (150 мг) очищали с помощью Prep-HPLC с применением следующих условий (2#-AnalyseHPLC-SHFMADZU(HPLC-10)): колонка, колонка SunFire С18 OBD Prep, 0,1 нМ, 5 мкМ, 19 мм × 150 мм, подвижная фаза, Waters (0,1% TFA) и ACN (61,0% ACN до 74,0% в течение 6 мин.); детектор, УФ 254 нм), с получением 19,2 мг указанного в заголовке продукта в виде белого твердого вещества.
1Н-ЯМР (300 МГц, MeOD) δ 1,50 (6Н, s), 4,48 (2Н, s), 5,34 (2Н, d), 6,18 (1Н, s), 6,68-6,95 (4Н, m), 7,11-7,30 (4Н, m), 7,33-7,43 (1Н, m).
Следующие примеры получали с применением указанных схем.
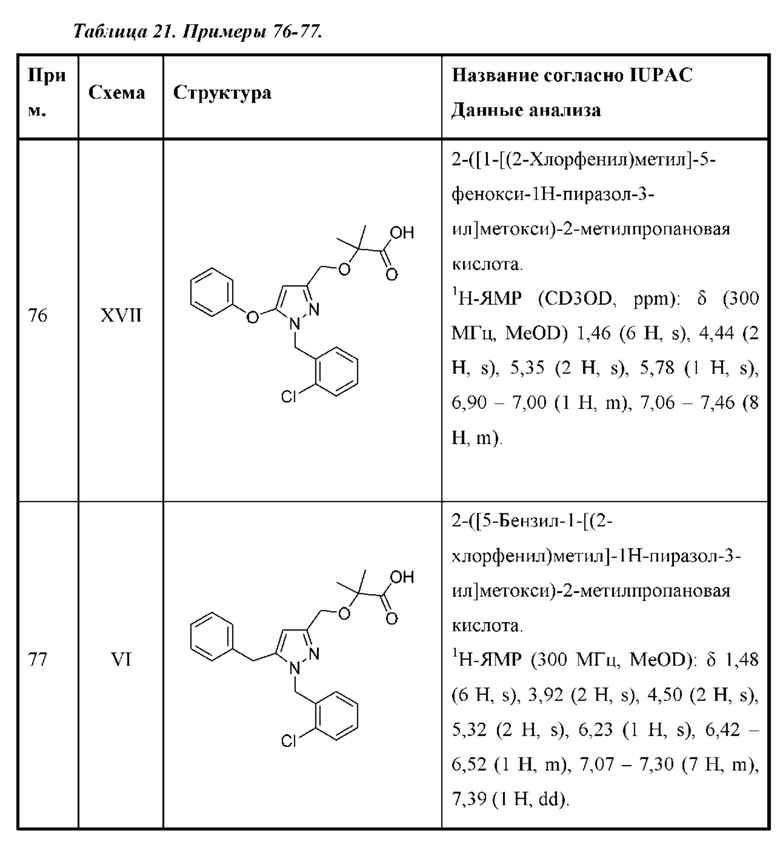
Пример 78 намеренно не применялся.
Пример 79: 2-([1-[(2-хлорфенил)метил]-5-(3-гидроксифенил)-1Н-пиразол-3-ил]метокси)-2-метилпропановая кислота.
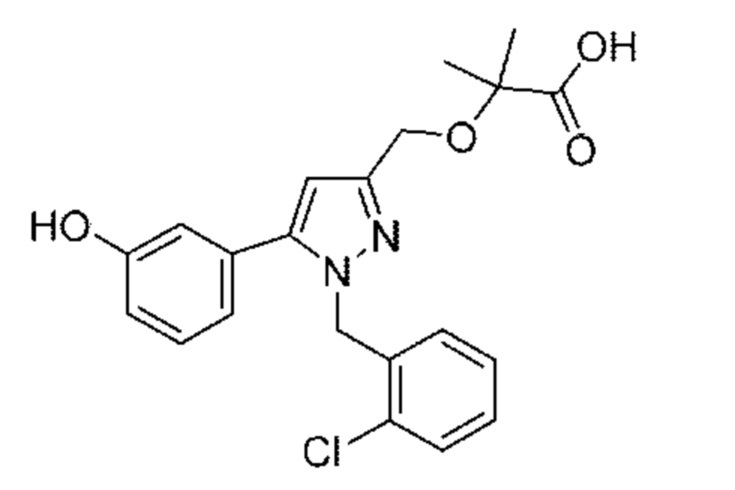
(i) 2-([1-[(2-Хлорфенил)метил]-5-(3-гидроксифенил)-1Н-пиразол-3-ил]метокси)-2-метилпропановая кислота. Раствор метил-2-([5-(3-бензилоксифенил)-1-[(2-хлорфенил)метил]-1H-пиразол-3-ил]метокси)-2-метилпропаноата в смеси уксусной кислоты и конц. HCl (8 мл) (3:1, об./об.) нагревали при 90°С в течение 6 ч. В конце этого периода реакционную смесь выпаривали до сухого состояния и остаток подвергали хроматографии над SiO2 с применением 0-20% градиента МеОН в DCM с получением указанного в заголовке продукта. 1НЯМР (CDCl3): δ 1,55 (s, 6Н), 4,61 (s, 2Н), 5,40(s, 2Н), 6,38 (s, 1H), 6,74-6,83(m, 4Н), 7,18-7,35(m, 4Н).
Пример 80: 2-([1-[(2-хлорфенил)метил]-5-[3-(оксетан-3-илметокси)фенил]-1Н-пиразол-3-ил]метокси)-2-метилпропановая кислота.
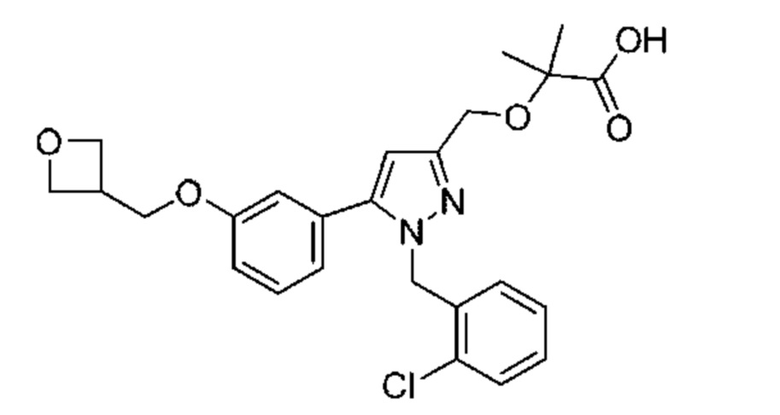
(i) Метил-2-([1-[(2-хлорфенил)метил]-5-(3-гидроксифенил)-1Н-пиразол-3-ил]метокси)-2-метилпропаноат. К раствору 2-([1-[(2-хлорфенил)метил]-5-(3-гидроксифенил)-1H-пиразол-3-ил]метокси)-2-метилпропановой кислоты (пример 79) в МеОН добавляли 4 капли конц. H2SO4 и раствор нагревали при температуре образования флегмы в течение 16 ч. Продукт выпаривали до сухого состояния и остаток подвергали хроматографии над SiO2 с применением 0-25% градиента МеОН в DCM с получением указанного в заголовке продукта.
(ii) Метил-2-([1-[(2-хлорфенил)метил]-5-[3-(оксетан-3-илметокси)фенил]-1Н-пиразол-3-ил]метокси)-2-метилпропаноат. К раствору метил-2-([1-[(2-хлорфенил)метил]-5-(3-гидроксифенил)-1H-пиразол-3-ил]метокси)-2-метилпропаноата (0,170 г, 0,410 ммоль) в DMF добавляли [оксетан-3-ил]метил-4-метилбензолсульфонат (0,149 г, 0,615 ммоль) и K2CO3 (0,113 г, 0,820 ммоль) при комнатной температуре.
Смесь нагревали при 60°С в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры, добавляли воду и смесь экстрагировали с помощью EtOAc (20 мл × 2). Объединенные органические слои промывали с помощью воды (20 мл) и солевого раствора (20 мл), высушивали над Na2SO4 и концентрировали при пониженном давлении. Остаток подвергали хроматографии над SiO2 с применением 0-100% градиента EtOAc в гексане с получением указанного в заголовке продукта. 1НЯМР (CDCl3): δ 1,54 (s, 6Н), 3,33-3,36 (m, 1H), 3,77 (s, 3Н), 3,97 (d, 2Н), 4,30 (t, 2Н), 4,56 (s, 2Н), 4,84 (t, 2Н), 5,40 (s, 2Н), 6,53 (s, 1H), 6,77-6,90 (m, 4Н), 7,19-7,37 (m, 4Н).
(iii) 2-([1-[(2-Хлорфенил)метил]-5-[3-(оксетан-3-илметокси)фенил]-1Н-пиразол-3-ил]метокси)-2-метилпропановую кислоту получали аналогично, как описано на стадии iv примера 1, с получением указанного в заголовке продукта (20 мг). 1НЯМР (CDCl3): δ 1,55 (s, 6Н), 3,34-3,74 (m, 1H), 3,98 (d, 2Н), 4,49 (t, 2Н), 4,63 (s, 2Н), 4,83 (t, 2Н), 5,43 (s, 2Н), 6,44 (s, 1H), 6,76-6,93 (m, 4Н), 7,20-7,37 (m, 4Н).
Пример 81: 2-([1-[(2-хлорфенил)метил]-5-(3-метоксифенил)-1Н-пиразол-3-ил]метокси)-2-метил-N-метилсульфонилпропанамид.
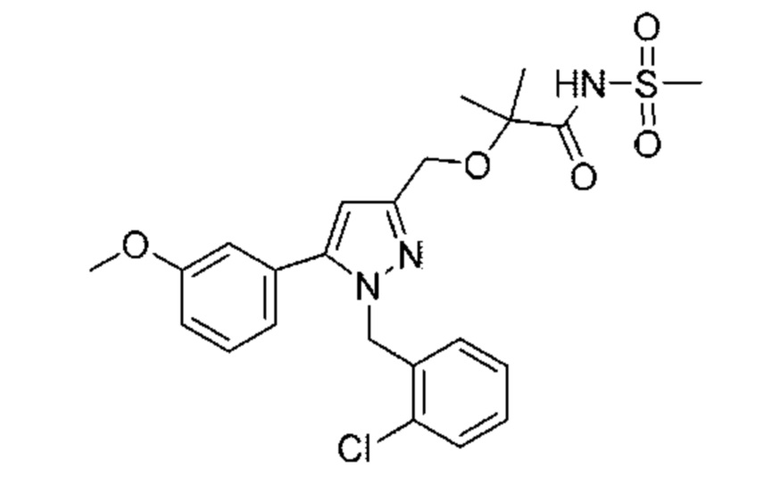
К раствору примера 14 (2-([1-[(2-хлорфенил)метил]-5-(3-метоксифенил)-1Н-пиразол-3-ил]метокси)-2-метилпропановой кислоты) (0,08 г, 0,192 ммоль) в CH3CN добавляли CDI (0,047 г, 0,288 ммоль) и метансульфонамид (0,022 г, 0,23 ммоль) при к.т. Смесь перемешивали при к.т. в течение 16 ч. Растворитель выпаривали и остаток подвергали хроматографии над SiO2 с применением 0-20% градиента МеОН в DCM с получением указанного в заголовке продукта. 1НЯМР (CDCl3): δ 1,55 (s, 6Н), 3,21 (s, 3Н), 3,67 (s, 3Н), 4,58 (s, 2Н), 5,48 (s, 2Н), 6,36 (s, 1H), 6,75-6,92 (m, 4Н), 7,18-7,35 (m, 4Н).
Пример 82: метил-2-([1-[(2-хлорфенил)метил]-5-(3-метоксифенил)-1Н-пиразол-3-ил]метокси)-2-метилпропаноат.
Пример 82 получали аналогично, как описано в примере 1, с исключением стадии iv. 1НЯМР (CDCl3): δ 1,54 (s, 6Н), 3,65 (s, 3Н), 3,77 (s, 3Н), 4,56 (s, 2Н), 5,37 (s, 2Н), 6,53 (s, 1H), 6,71-6,78 (m, 2Н), 6,85-6,90 (m 2Н), 7,10-7,13 (m, 1H), 7,21-7,27 (m, 2Н), 7,51-7,53 (m 1H).
Примеры 83-100 намеренно не применялись.
Следующие примеры получали с применением указанных схем.

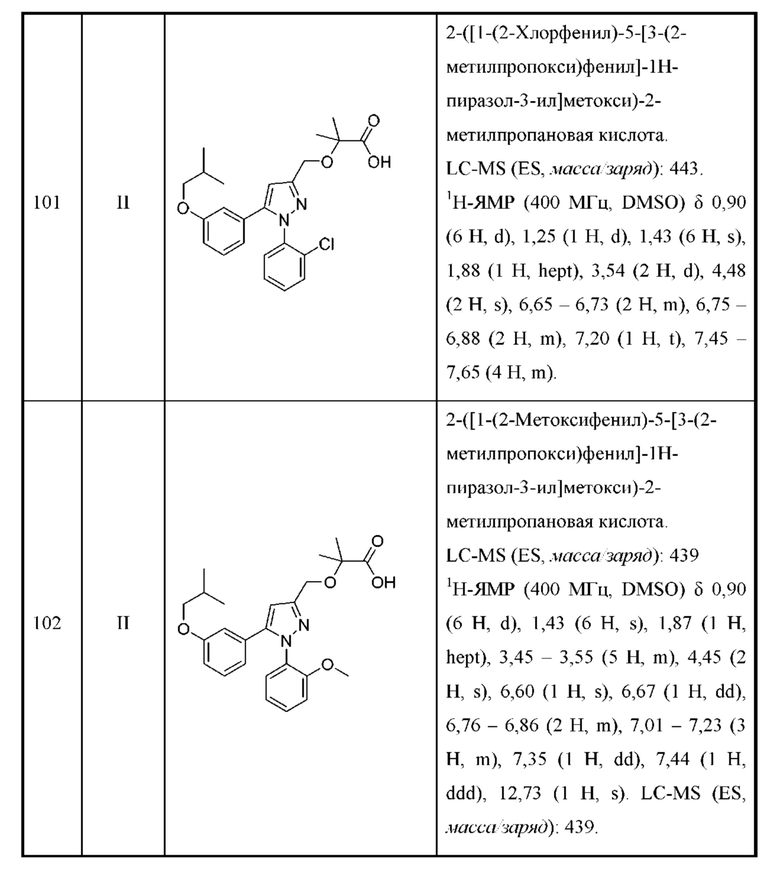
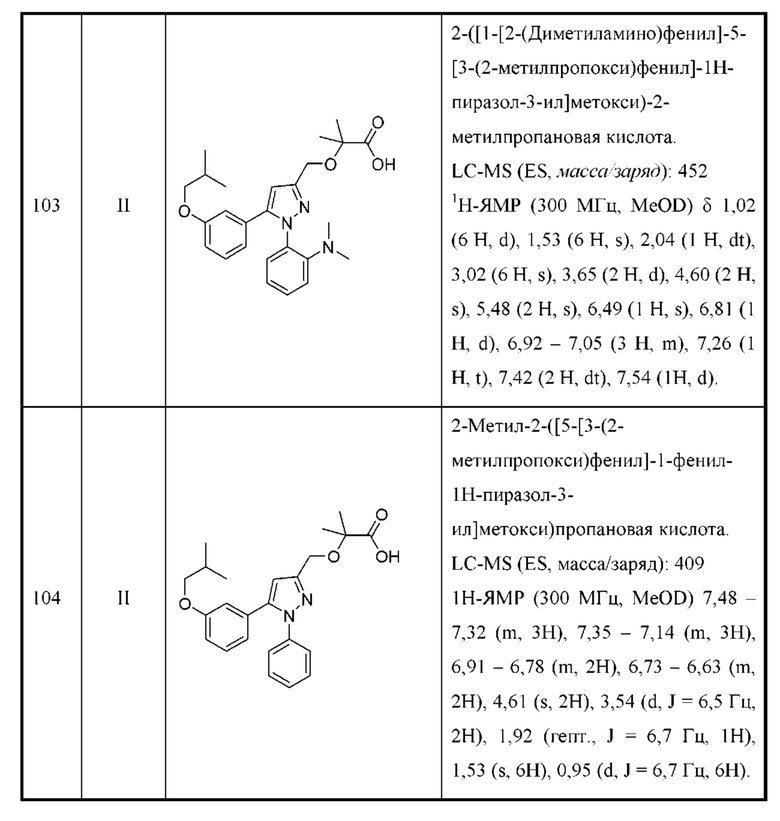
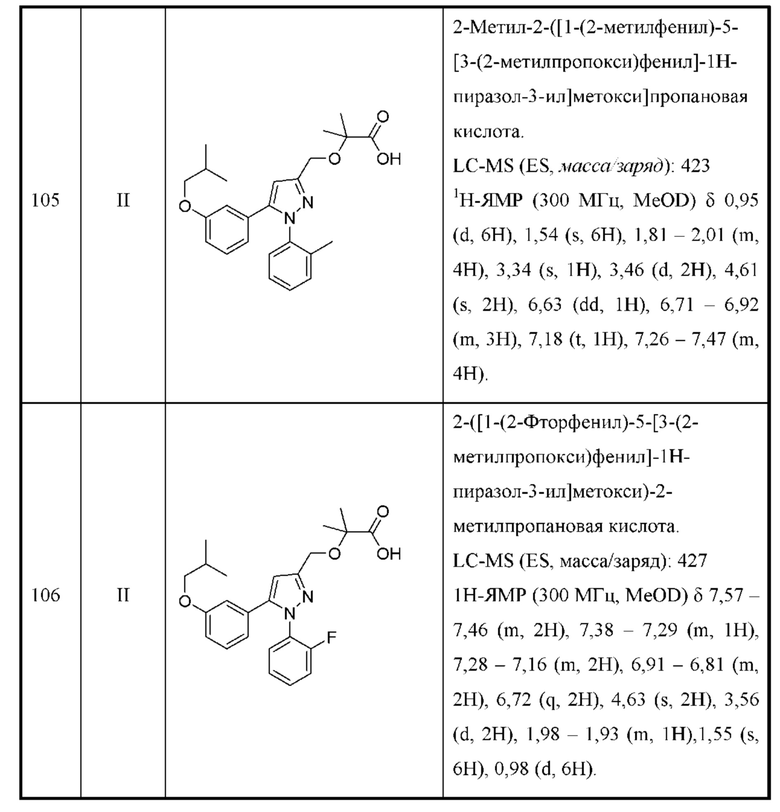
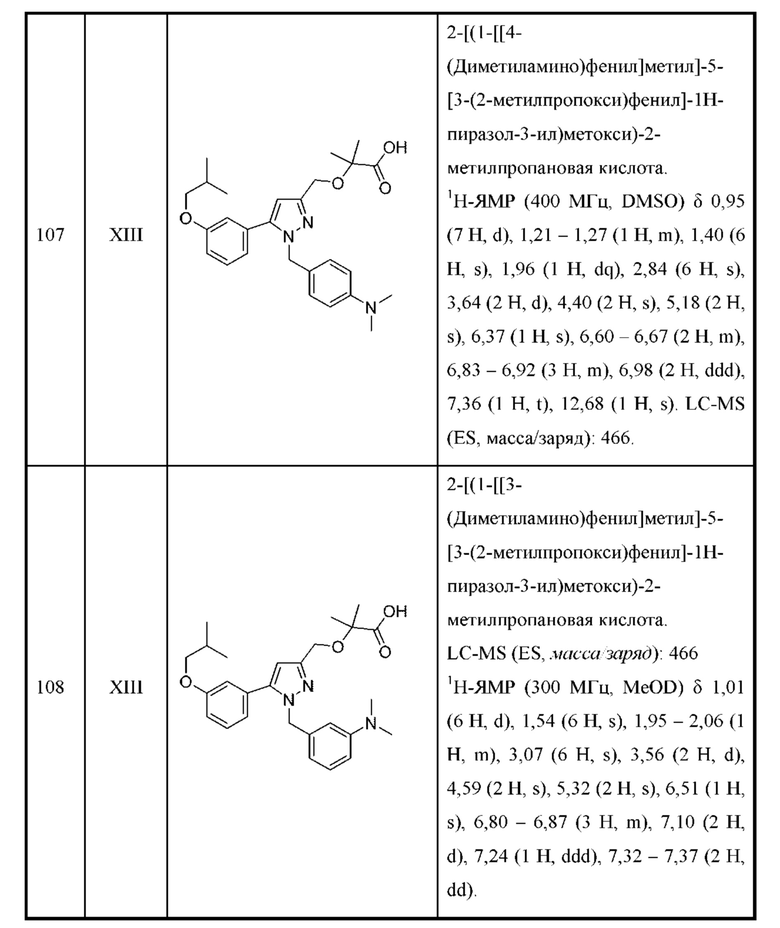

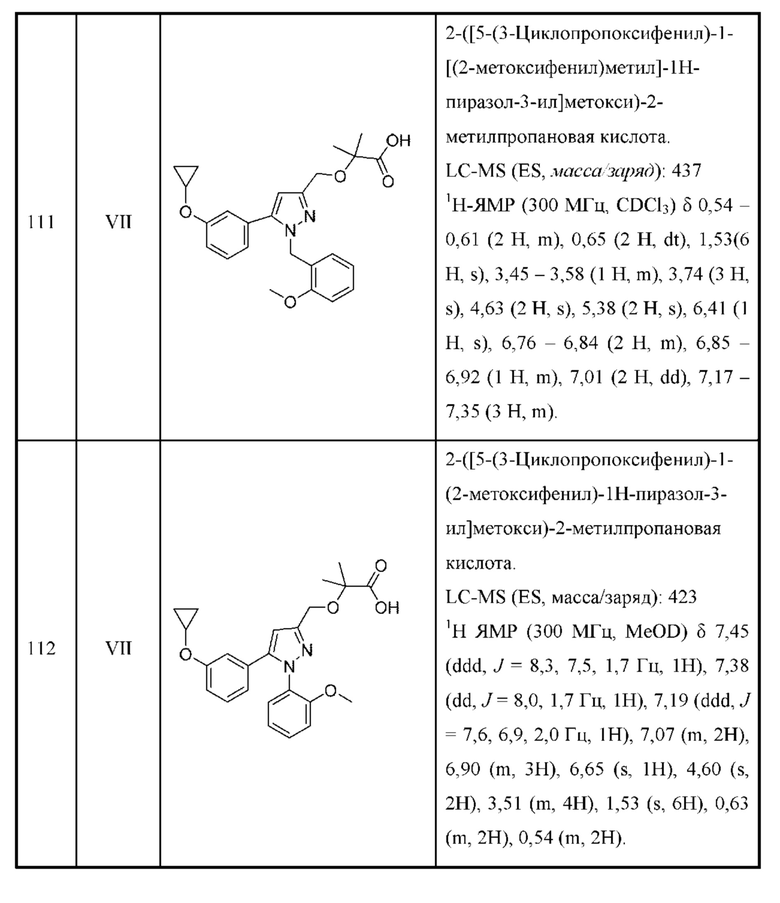
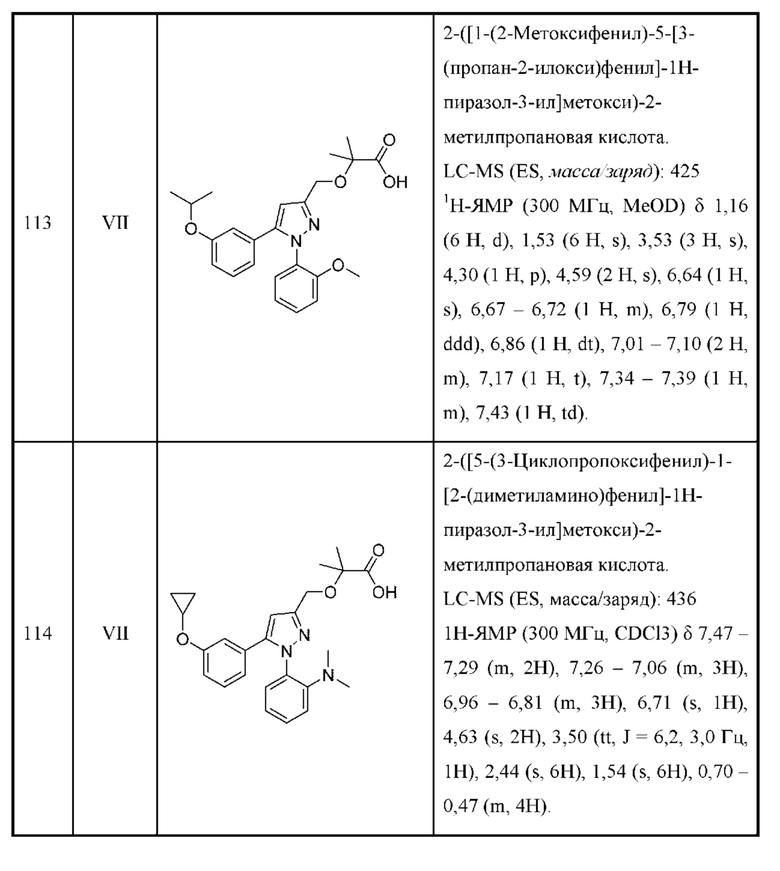
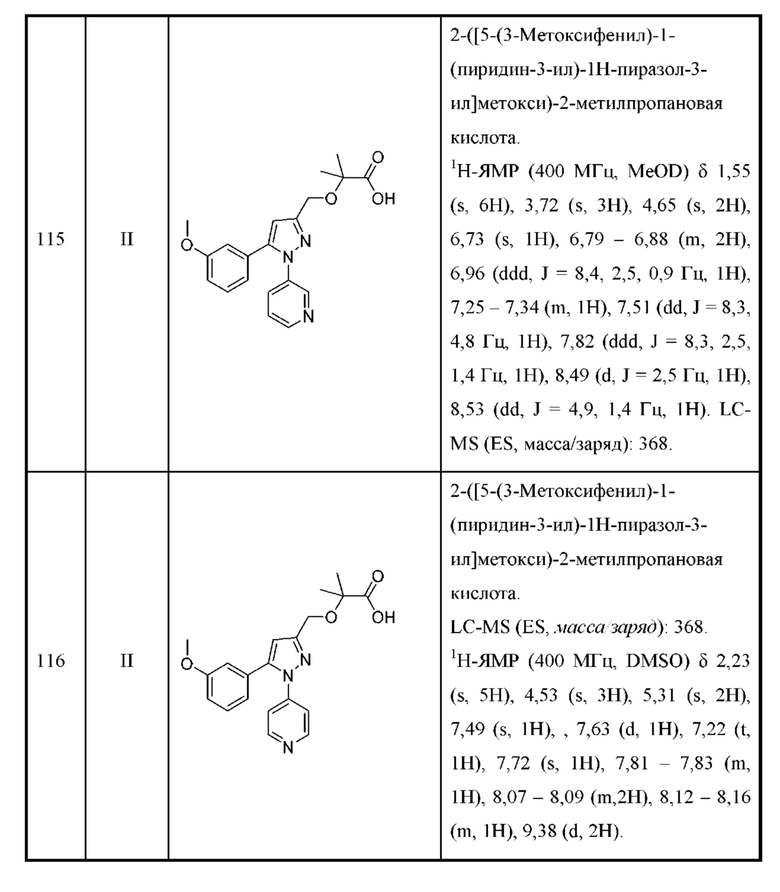
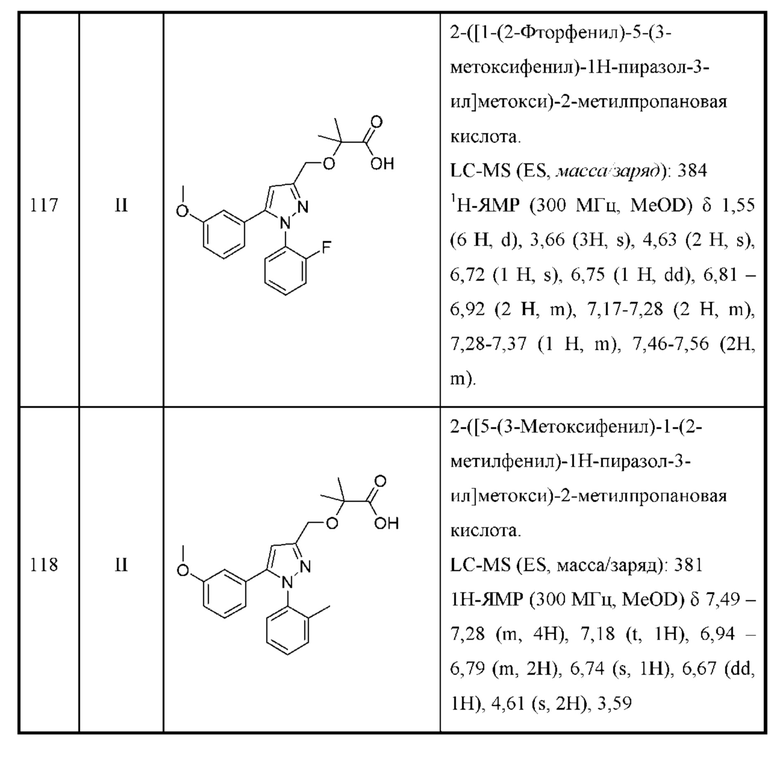
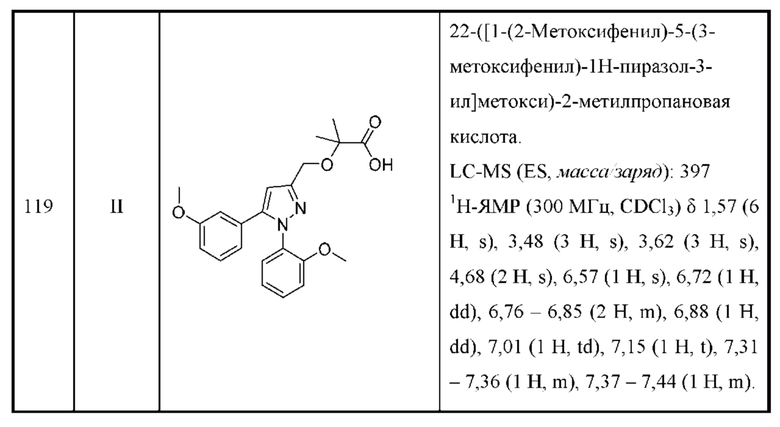
Примеры 120/121: (2S)-2-([1-[(2-хлорфенил)метил]-5-(3-метоксифенил)-1Н-пиразол-3-ил]метокси)-2-метилбутановая кислота и (2R)-2-([1-[(2-хлорфенил)метил]-5-(3-метоксифенил)-1Н-пиразол-3-ил]метокси)-2-метилбутановая кислота.
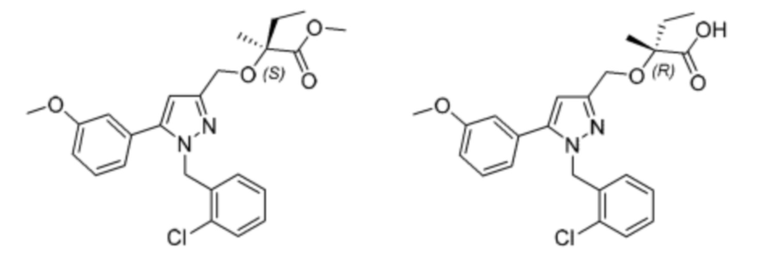
Этил-2-([1-[(2-хлорфенил)метил]-5-(3-метоксифенил)-1Н-пиразол-3-ил]метокси)-2-метилбутаноат. К раствору пром. соед. G-1 (700 мг, 1,79 ммоль, 1,00эквив.) в THF (10 мл) в атмосфере N2, добавляли NaH (200 мг, 8,33 ммоль, 3,00эквив.). Раствор перемешивали в течение 10 мин. при 0°С. К нему добавляли метил-2-гидрокси-2-метилбутаноат (700 мг, 5,30 ммоль, 3,00 эквив.), Bu4NI (330 мг, 0,50 эквив.). Полученный раствор перемешивали в течение 4 ч. при комнатной температуре. Реакцию останавливали с помощью добавления 1 мл воды. Полученный раствор разбавляли 20 мл Н2О, экстрагировали с помощью 2×30 мл EtOAc и органические слои объединяли. Полученную смесь промывали с помощью 20 мл насыщенного NaCl, затем высушивали над безводным Na2SO4 и концентрировали под вакуумом. Остаток пропускали через колонку с силикагелем с применением EtOAc/петролейного эфира (1:5). В результате этого получали указанное в заголовке соединение в виде желтого масла (300 мг, 38%).
(vi) Хиральный разделение этил-2-([1-[(2-хлорфенил)метил]-5-(3-метоксифенил)-1Н-пиразол-3-ил]метокси)-2-метилбутаноата. Неочищенный продукт стадии v очищали с помощью хиральной Prep-HPLC с применением следующих условий (Prep-HPLC-004): колонка, Chiralpak IC, 2*25 см, 5 мкм; подвижная фаза, гекс- и этанол- (удерживание 2,0% этанол - в течение 23 мин.); детектор, УФ 254/220 нм. Получали 100 мг продукта с Alpha (25°С, 0,05 моль/л, МеОН). В результате этого получали этил-(2,5)-2-([1-[(2-хлорфенил)метил]-5-(3-метоксифенил)-1H-пиразол-3-ил]метокси)-2-метилбутаноат в виде бесцветного масла (100 мг, 36%) и этил-(2S)-2-([1-[(2-хлорфенил)метил]-5-(3 -метоксифенил)-1Н-пиразол-3-ил] метокси)-2-метилбутаноат в виде бесцветного масла (100 мг, 36%).
(vii) (2S)-2-([1-[(2-Хлорфенил)метил]-5-(3-метоксифенил)-1H-пиразол-3-ил]метокси)-2-метилбутановую кислоту получали из этил-(2S)-2-([1-[(2-хлорфенил)метил]-5-(3-метоксифенил)-1Н-пиразол-3-ил]метокси)-2-метилбутаноата аналогично, как описано на стадии iv примера 1. 1H-ЯМР (400 МГц, MeOD) δ 7,45 -7,38 (m, 1H), 7,34 (d, J=7,9 Гц, 1H), 7,31-7,29 (m, 1H), 7,29-7,24 (m, 1H), 6,83 (dd, J=2,5, 1,6 Гц, 1H), 6,80-6,72 (m, 1H), 6,56 (s, 1H), 5,44 (s, 2Н), 4,59 (s, 2Н), 3,69 (s, 3Н), 1,89 (qd, J=7,2, 5,0 Гц, 2Н), 1,51 (s, 3Н), 0,98 (t, J=7,5 Гц, 3H). LC-MS (ES, масса/заряд): 429.
(viii) (2R)-2-([1-[(2-Хлорфенил)метил]-5-(3-метоксифенил)-1Н-пиразол-3-ил]метокси)-2-метилбутановую кислоту получали из этил-(2R)-2-([1-[(2-хлорфенил)метил]-5-(3-метоксифенил)-1Н-пиразол-3-ил]метокси)-2-метилбутаноата аналогично, как описано на стадии iv примера 1. 1H-ЯМР (400 МГц, MeOD) δ 7,45-7,38 (m, 1H), 7,37-7,31 (m, 1H), 7,31-7,29 (m, 1H), 7,29-7,24 (m, 1H), 6,97 (ddd, J=8,4, 2,6, 0,9 Гц, 1H), 6,93 (dt, J=7,6, 1,2 Гц, 1H), 6,83 (dd, J=2,6, 1,6 Гц, 1H), 6,81-6,72 (m, 1H), 6,56 (s, 1H), 5,44 (s, 2Н), 4,59 (s, 2Н), 3,69 (s, 3Н), 1,89 (qd, J=7,2, 4,9 Гц, 2Н), 1,51 (s, 3Н), 0,98 (t, J=7,5 Гц, 3Н). LC-MS (ES, масса/заряд): 429.
Альтернативный синтез примеров 120/121: (2S)-2-([1-[(2-хлорфенил)метил]-5-(3-метоксифенил)-1Н-пиразол-3-ил]метокси)-2-метилбутановая кислота и (2R)-2-([1-[(2-хлорфенил)метил]-5-(3-метоксифенил)-1Н-пиразол-3-ил]метокси)-2-метилбутановая кислота.

Метил-2-([1-[(2-хлорфенил)метил]-5-(3-метоксифенил)-1H-пиразол-3-ил]метокси)-2-метилбутаноат. К раствору метил-2-гидрокси-2-метилбутаноата (780 мг, 5,90 ммоль, 1,00 эквив.) в THF (50 мл) в атмосфере N2 добавляли частями NaH (236 мг, 5,90 ммоль, 1,00 эквив.) при 0°С. Смесь перемешивали при 0°С в течение 30 мин., затем добавляли пром. соед. G-1 (1,16 г, 2,96 ммоль, 0,50 эквив.) и Bu4NI (600 мг, 1,63 ммоль, 0,50 эквив.) при 0°С. Полученный раствор перемешивали в течение 16 ч. при к. т., затем реакцию останавливали с помощью добавления воды/льда. Полученный раствор разбавляли с помощью 200 мл EtOAc, промывали с помощью 2×100 мл солевого раствора, высушивали над Na2SO4, концентрировали под вакуумом и очищали с помощью Prep-HPLC с применением следующих условий (2#-AnalyseHPLC-SHIMADZU(HPLC-10)): колонка, колонка XBridge Prep OBD С18, 30×150 мм, 5 мкм; подвижная фаза, вода (0,1% FA) и ACN (55,0% ACN до 79,0% в течение 7 мин.); детектор, УФ 254/220 нм, с получением 200 мг (8%) указанного в заголовке соединения в виде бесцветного масла. LC-MS: (ES, масса/заряд): 443.
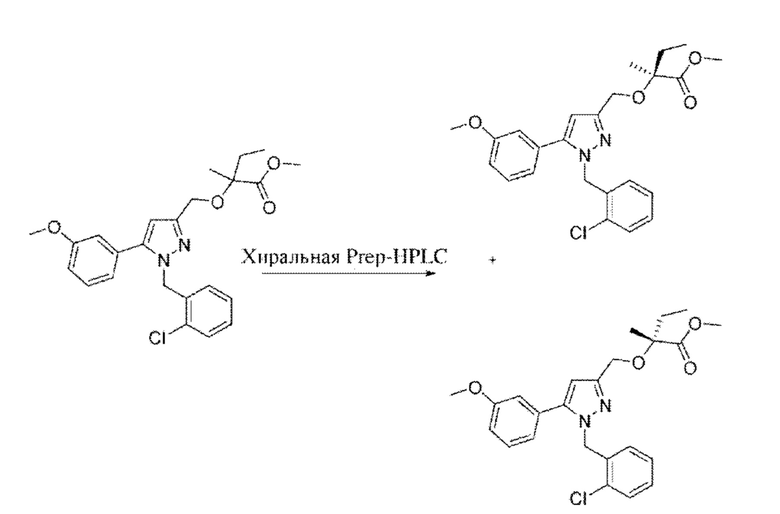
Хиральный разделение (2R)- и (2S)-метил-2-([1-[(2-хлорфенил)метил]-5-(3-метоксифенил)-1Н-пиразол-3-ил]метокси)-2-метилбутаноата. Рацемический сложный метиловый эфир (200 мг, 0,45 ммоль, 1,00 эквив.) разделяли на энантиомеры с помощью хиральной Prep-HPLC с применением следующих условий: колонка: Chiralpak IC, 2*25 см, 5 мкм; подвижная фаза А:Нех--HPLC, подвижная фаза В: EtOH--HPLC; скорость потока: 20 мл/мин.; градиент: 2 В до 2 В в течение 24 мин.; 220/254 нм; RT1:18,171; RT2:20,742, с получением 80 мг (40%) метил-(2S)-2-([1-[(2-хлорфенил)метил]-5-(3-метоксифенил)-1Н-пиразол-3-ил]метокси)-2-метилбутаноата и 70 мг (35%) метил-(2R)-2-([1-[(2-хлорфенил)метил]-5-(3-метоксифенил)-1H-пиразол-3-ил]метокси)-2-метилбутаноата, оба в виде бесцветных масел.
Альтернативный синтез метил-(2S)-2-([1-[(2-хлорфенил)метил]-5-(3-метоксифенил)-1Н-пиразол-3-ил]метокси)-2-метилбутаноата
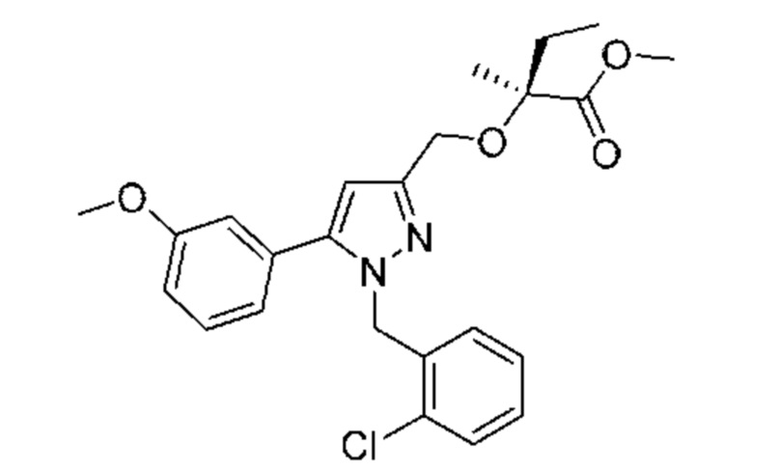
Метил-(2S)-2-([1-[(2-хлорфенил)метил]-5-(3-метоксифенил)-1H-пиразол-3-ил]метокси)-2-метилбутаноат. К раствору метил-(2S)-2-гидрокси-2-метилбутаноата (400 мг, 3,03 ммоль, 1,00 эквив.) в THF (20 мл) добавляли частями NaH (122 мг, 3,05 ммоль, 1,00 эквив.) при 0°С. Смесь перемешивали при 0°С в течение 10 мин., затем добавляли пром. соед. G-1 (400 мг, 1,02 ммоль, 0,34 эквив.) и Bu4NI (200 мг, 0,54 ммоль, 0,50 эквив.) при 0°С. Полученный раствор перемешивали в течение 16 ч. при к. т., реакцию останавливали с помощью добавления воды/льда и экстрагировали с помощью 100 мл EtOAc. Объединенные органические слои промывали с помощью 1×100 мл солевого раствора, высушивали над Na2SO4, концентрировали под вакуумом и очищали с помощью Prep-TLC с применением EtOAc/петролейного эфира (1:3) с получением 150 мг (11%) указанного в заголовке соединения в виде бесцветного масла. LC-MS: (ES, масса/заряд): 443.
Пример 120: (2S)-2-([1-[(2-хлорфенил)метил]-5-(3-метоксифенил)-1H-пиразол-3-ил]метокси)-2-метилбутановая кислота.
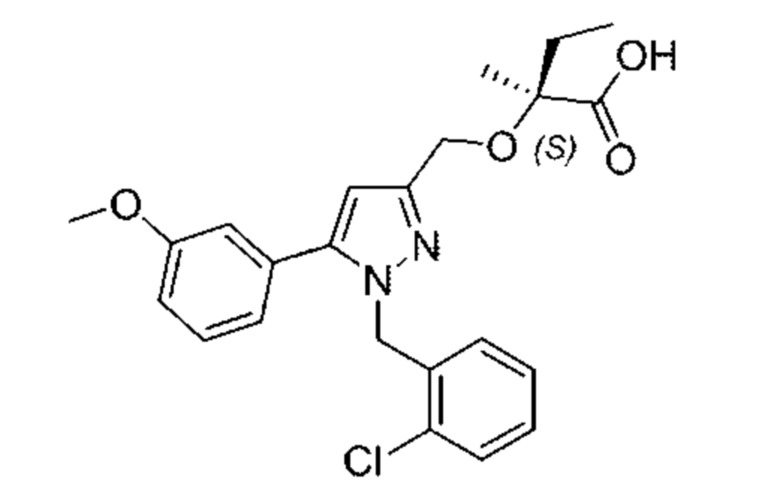
К раствору метил-(2S)-2-([1-[(2-хлорфенил)метил]-5-(3-метоксифенил)-1Н-пиразол-3-ил]метокси)-2-метилбутаноата (70 мг, 0,16 ммоль, 1,00 эквив.) в THF/Н2О/МеОН (4/2/2 мл) добавляли частями LiOH (23 мг, 0,96 ммоль, 6,00 эквив.) при к.т. Полученный раствор перемешивали в течение 2 ч. при комнатной температуре. Уровень рН доводили до 3-4 с помощью конц. HCl. Полученный раствор экстрагировали с помощью 100 мл EtOAc. Объединенные органические слои высушивали над Na2SO4, концентрировали под вакуумом и очищали с помощью Prep-HPLC с применением следующих условий (2#-AnalyseHPLC-SHIMADZU(HPLC-10)): колонка, колонка XBridge Prep OBD С18, 30×150 мм, 5 мкм; подвижная фаза, вода (0,1% FA) и ACN (40,0% ACN до 75,0% в течение 7 мин.); детектор, УФ 254/220 нм, с получением 40 мг (59%) указанного в заголовке соединения в виде бесцветного масла. LC-MS: (ES, масса/заряд): 429. 1Н ЯМР: (400 МГц, DMSO-d6) δ 12,60 (s, 1H), 7,50-7,22 (m, 4Н), 7,02-6,84 (m, 3Н), 6,78-6,69 (m, 1H), 6,45 (s, 1H), 5,38 (s, 2Н), 4,41 (d, J=2,2 Гц, 2Н), 3,69 (s, 3Н), 1,87-1,61 (m, J=7,1 Гц, 2Н), 1,36 (s, 3Н), 0,85 (t, J=7,4 Гц, 3Н).
Пример 121: (2R)-2-([1-[(2-хлорфенил)метил]-5-(3-метоксифенил)-1Н-пиразол-3-ил]метокси)-2-метилбутановая кислота.
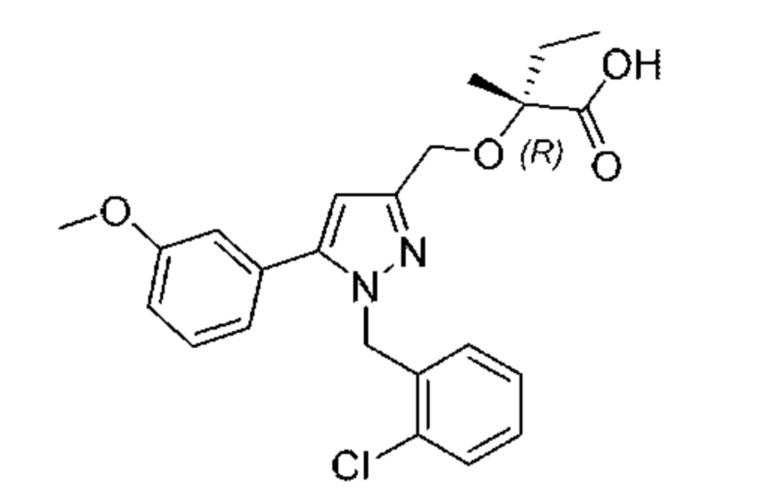
К раствору метил-(2R)-2-([1-[(2-хлорфенил)метил]-5-(3-метоксифенил)-1H-пиразол-3-ил]метокси)-2-метилбутаноата (80 мг, 0,18 ммоль, 1,00эквив.) в THF/Н2О/МеОН (4/2/2 мл) добавляли частями LiOH (26 мг, 1,09 ммоль, 6,00 эквив.) при к. т.Полученный раствор перемешивали в течение 2 ч. при к. т.Уровень рН доводили до 3-4 с помощью конц. HCl. Полученный раствор экстрагировали с помощью 100 мл EtOAc и органические слои объединяли, высушивали над Na2SO4, концентрировали под вакуумом и очищали с помощью Prep-HPLC с применением следующих условий (2#-AnalyseHPLC-SHIMADZU(HPLC-10)): колонка, колонка XBridge Prep OBD С18, 30×150 мм, 5 мкм; подвижная фаза, вода (0,1% FA) и ACN (40,0% ACN до 75,0% в течение 7 мин.); детектор, УФ 254/220 нм, с получением 46,3 мг (60%) указанного в заголовке соединения в виде бесцветного масла. LC-MS: (ES, масса/заряд): 429. 1Н ЯМР: (400 МГц, DMSO-d6) δ 12,61 (s, 1H), 7,49-7,22 (m, 4Н), 7,02-6,84 (m, 3Н), 6,78-6,69 (m, 1H), 6,46 (s, 1H), 5,38 (s, 2H), 4,41 (d, J=2,2 Гц, 2H), 3,69 (s, 3Н), 1,84-1,61 (m, J=7,6 Гц, 2H), 1,36 (s, 3Н), 0,85 (t, J=7,4 Гц, 3Н).
Следующие примеры получали с применением схемы III.
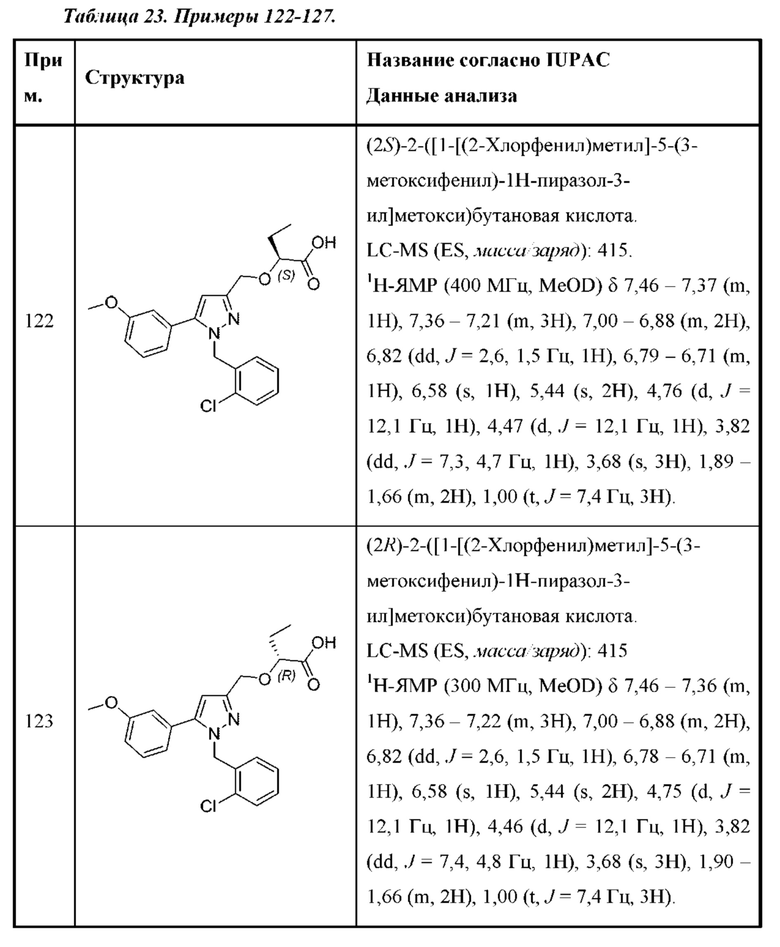
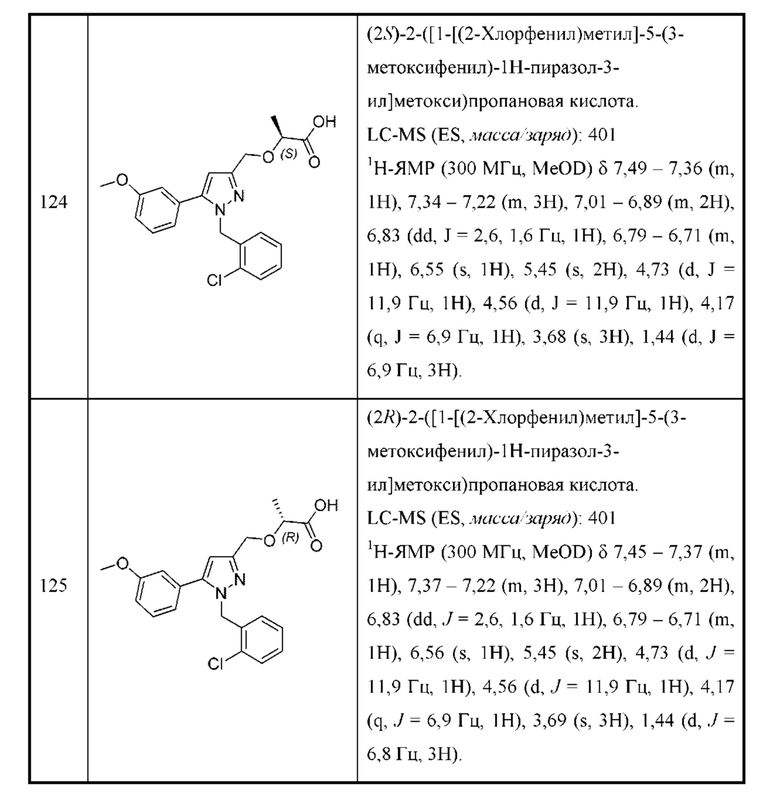
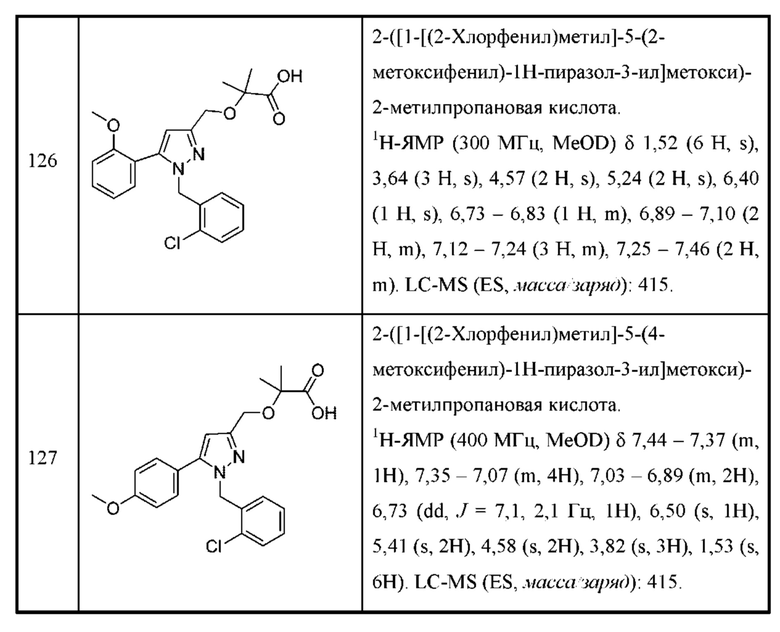
Следующие примеры получали с применением указанных схем.
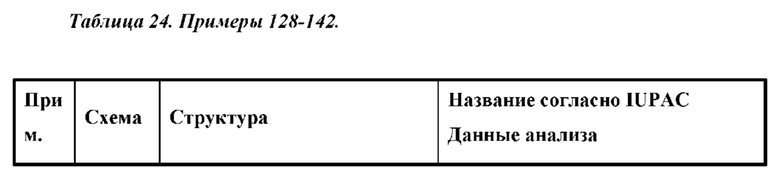
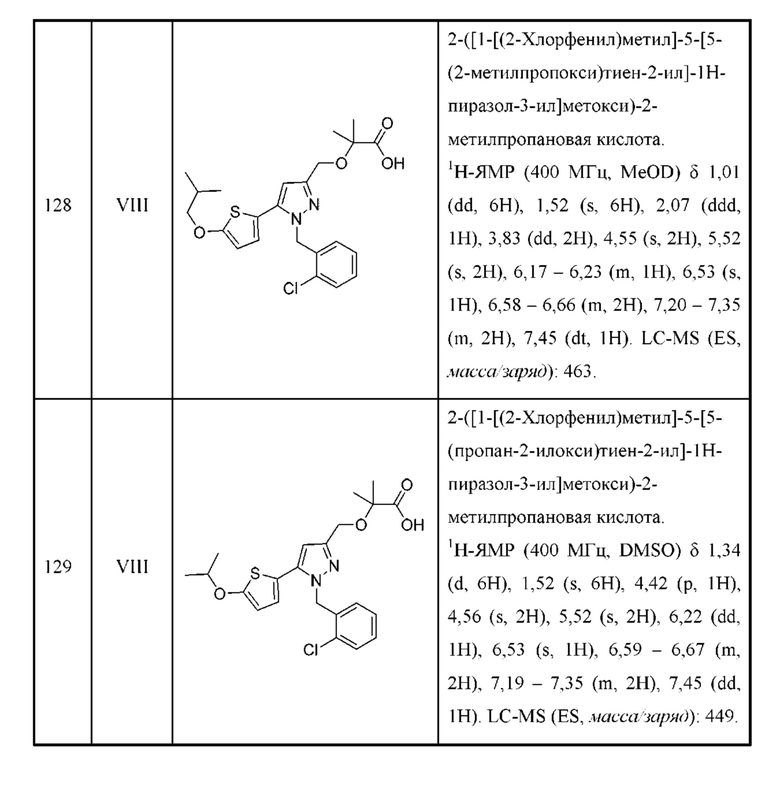
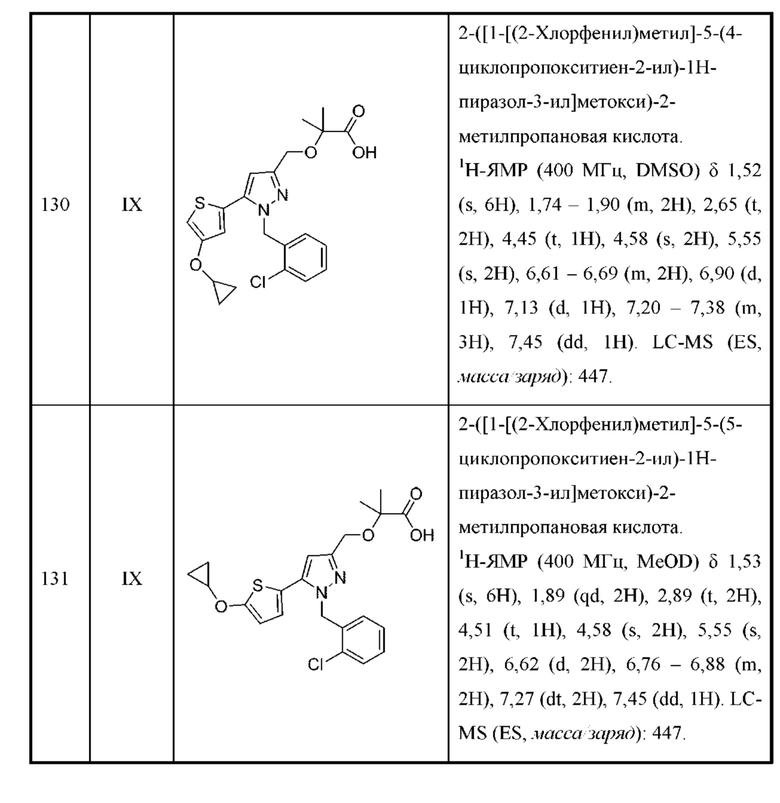
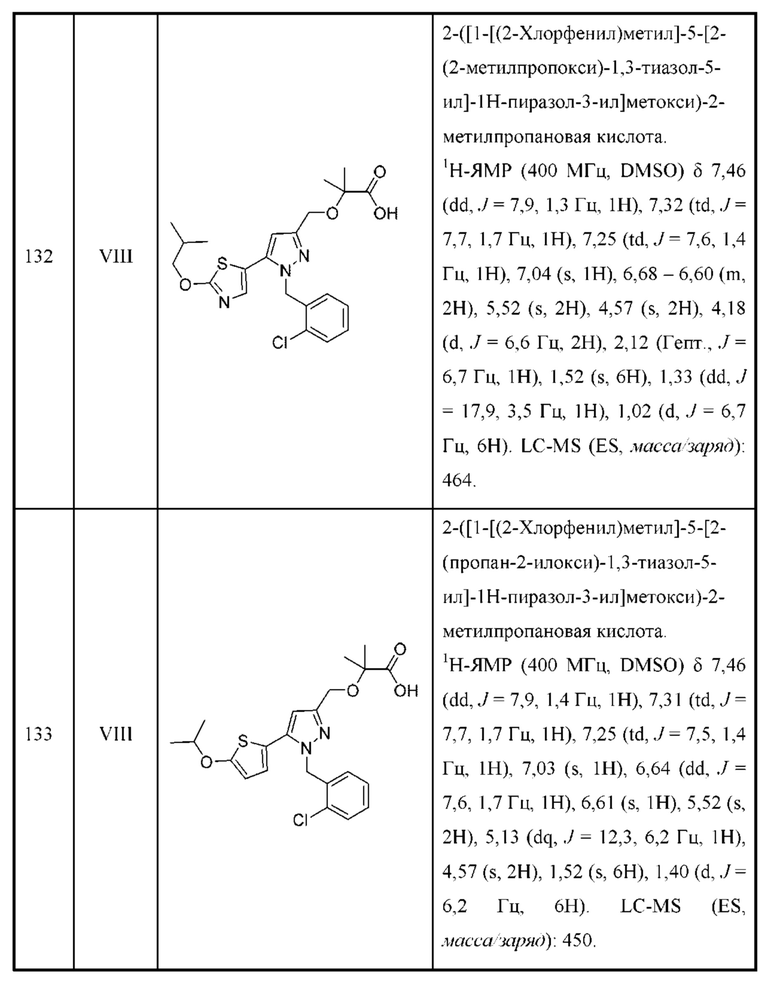
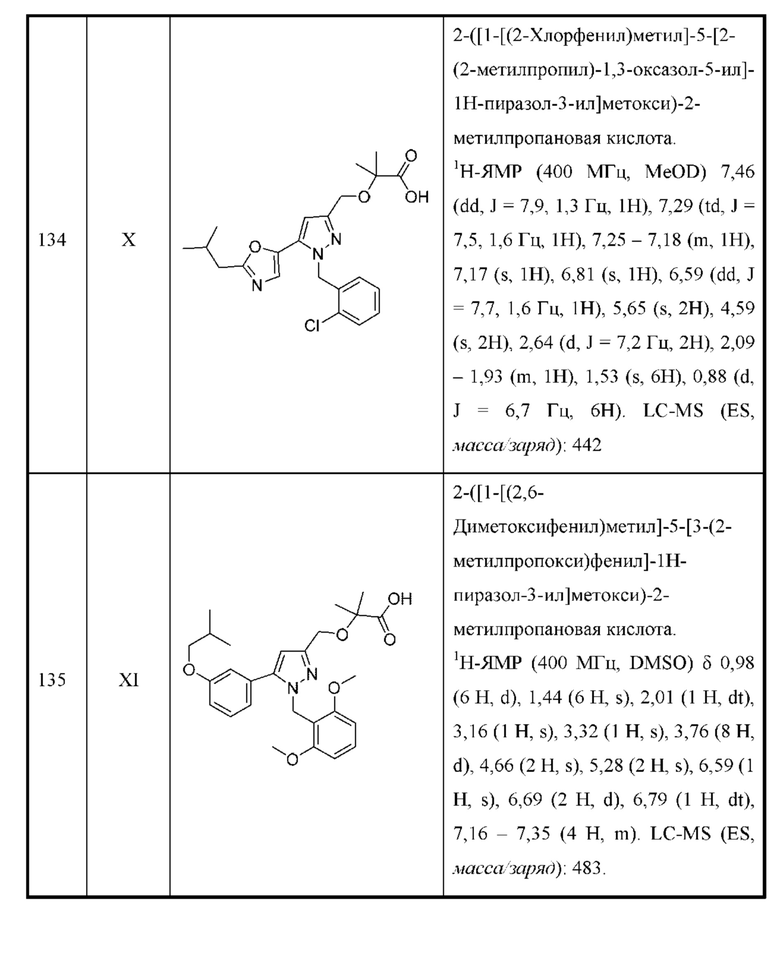
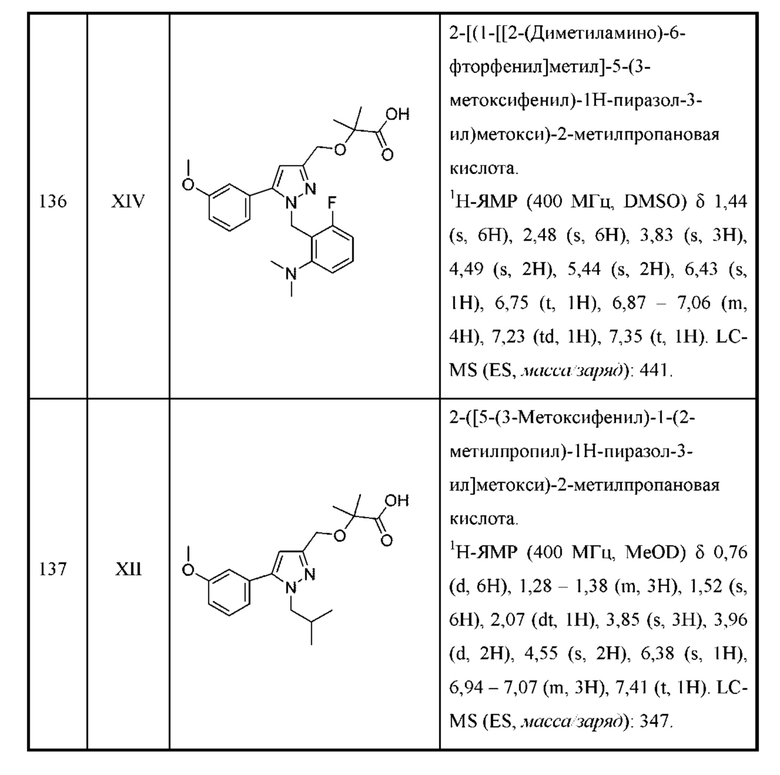
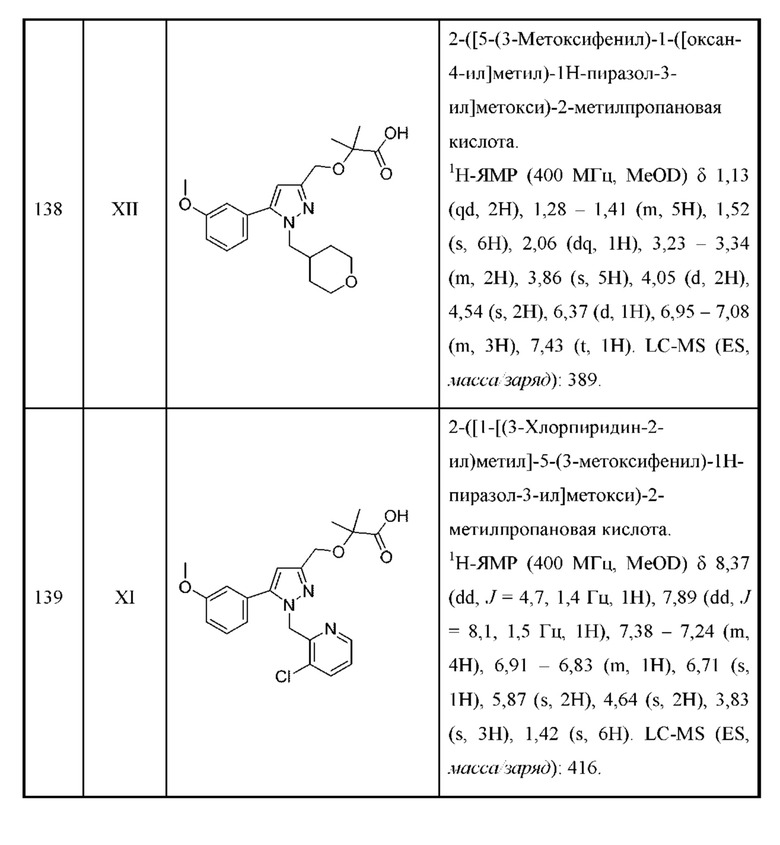
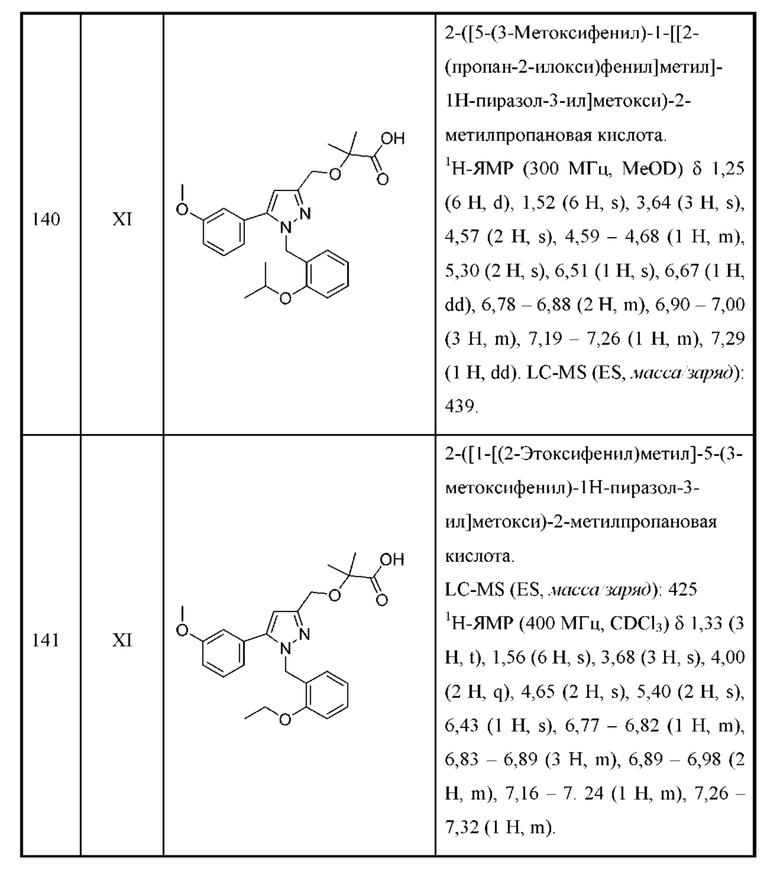
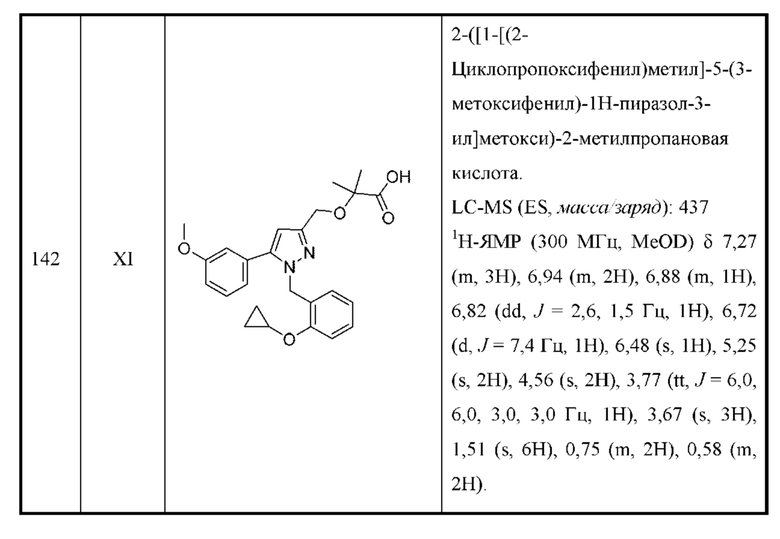
Пример 143: (3Е)-4-[1-[(2-хлорфенил)метил]-5-(3-метоксифенил)-1Н-пиразол-3-ил]-2,2-диметилбут-3-еновая кислота.
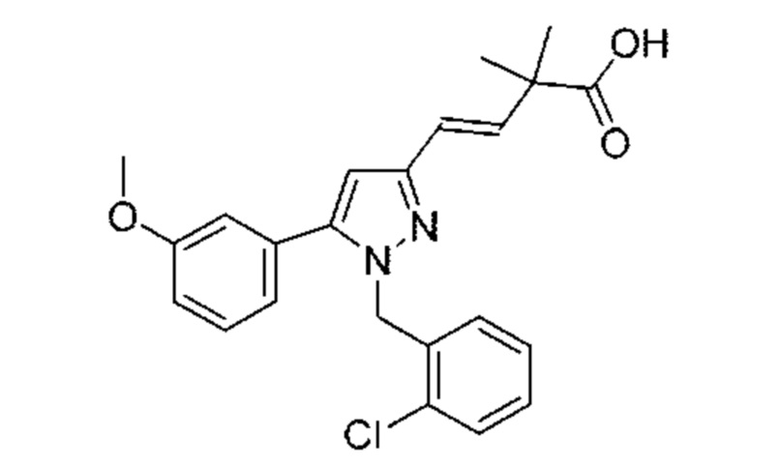
(ii) ([1-[(2-Хлорфенил)метил]-5-(3-метоксифенил)-1Н-пиразол-3-ил]метил)трифенилфосфония бромид. К раствору пром. соед. G-1 (2,4 г, 6,13 ммоль, 1,00 эквив.) в толуоле (20 мл) добавляли PPh3 (2,4 г, 9,15 ммоль, 1,50 эквив.) при комнатной температуре. Полученный раствор перемешивали в течение 3 ч. при 110°С. Твердые вещества собирали посредством фильтрации. Твердое вещество высушивали в печи при пониженном давлении. В результате этого получали указанное в заголовке соединение в виде белого твердого вещества (2,2 г, 55%).
(iii) Метил-(3Е)-4-[1-[(2-хлорфенил)метил]-5-(3-метоксифенил)-1Н-пиразол-3-ил]-2,2-диметилбут-3-еноат. К раствору ([1-[(2-хлорфенил)метил]-5-(3-метоксифенил)-1Н-пиразол-3-ил]метил)трифенилфосфония бромида (500 мг, 0,76 ммоль, 1,00 эквив.) в THF (20 мл) добавляли метил-2,2-диметил-3-оксопропаноат (200 мг, 1,54 ммоль, 2,00 эквив.). За этим следовало добавление частями NaH (50 мг, 1,25 ммоль, 2,00 эквив.) при 0°С. Полученный раствор перемешивали в течение 16 ч. при комнатной температуре, затем реакцию останавливали с помощью добавления воды/льда. Полученный раствор разбавляли 100 мл EtOAc, затем промывали с помощью 2×50 мл солевого раствора. Смесь высушивали над Na2SO4 и концентрировали под вакуумом. Остаток подвергали Prep-TLC с применением EtOAc/петролейного эфира (1:2). В результате этого получали указанное в заголовке соединение в виде бесцветного масла (125 мг, 38%).
(iv) (3Е)-4-[1-[(2-Хлорфенил)метил]-5-(3-метоксифенил)-1Н-пиразол-3-ил]-2,2-диметилбут-3-еновую кислоту получали аналогично, как описано на стадии iv примера 101, с применением метил-(3Е)-4-[1-[(2-хлорфенил)метил]-5-(3-метоксифенил)-1Н-пиразол-3-ил]-2,2-диметилбут-3-еноата в качестве исходного материала. 1H-ЯМР (400 МГц, MeOD) δ 1,42 (s, 6Н), 3,69 (s, 3Н), 5,43 (s, 2Н), 6,49 (d, 1H), 6,56-6,68 (m, 2Н), 6,71-6,79 (m, 1H), 6,84 (dd, 1H), 6,90-7,06 (m, 2Н), 7,23-7,47 (m, 5Н). LC-MS (ES, масса/заряд): 411.
Пример 144: 4-[1-[(2-хлорфенил)метил]-5-(3-метоксифенил)-1Н-пиразол-3-ил]-2,2-диметилбутановая кислота.
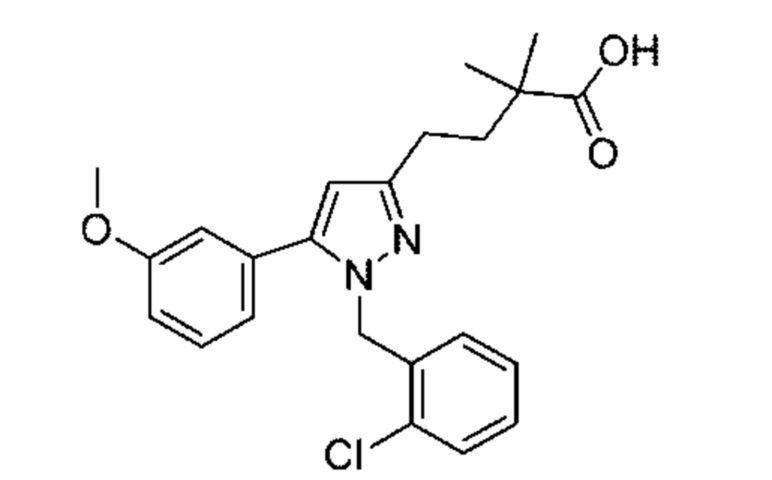
(i) Метил-(3Е)-4-[1-[(2-хлорфенил)метил]-5-(3-метоксифенил)-1Н-пиразол-3-ил]-2,2-диметилбут-3-еноат получали, как на стадиях i-iii примера 143.
(ii) Метил-4-[1-[(2-хлорфенил)метил]-5-(3-метоксифенил)-1Н-пиразол-3-ил]-2,2-диметилбутаноат. К раствору метил-(3Е)-4-[1-[(2-хлорфенил)метил]-5-(3-метоксифенил)-1Н-пиразол-3-ил]-2,2-диметилбут-3-еноата (60 мг, 0,14 ммоль, 1,00 эквив.) в EtOAc/МеОН (10/10 мл) добавляли Pd/C (20 мг). Полученный раствор перемешивали в течение 3 ч. в атмосфере Н2 при комнатной температуре. Твердые вещества удаляли посредством фильтрации. Полученную смесь концентрировали под вакуумом. Остаток очищали с помощью Prep-TLC с применением 20:1 CH2Cl2: МеОН. В результате этого получали указанное в заголовке соединение в виде бесцветного масла (40 мг, 66%).
(iii) 4-[1-[(2-Хлорфенил)метил]-5-(3-метоксифенил)-1Н-пиразол-3-ил]-2,2-диметилбутановую кислоту получали аналогично, как описано на стадии iv примера 101 с применением метил-4-[1-[(2-хлорфенил)метил]-5-(3-метоксифенил)-1Н-пиразол-3-ил]-2,2-диметилбутаноата в качестве исходного материала. 1H-ЯМР (400 МГц, MeOD) δ 1,26-1,38 (m, 6Н), 1,98 (s, 2Н), 2,69 (s, 2Н), 3,68 (s, 3Н), 5,41 (s, 2Н), 6,35 (s, 1H), 6,69 (dd, 1H), 6,81 (dd, 1H), 6,87-7,00 (m, 2Н), 7,23-7,36 (m, 3Н), 7,38-7,45 (m, 1Н). LC-MS (ES, масса/заряд): 413.
Примеры 145-149 намеренно не применялись.
Пример 150: 2-([1-[(2-хлорфенил)метил]-5-(1-этил-1Н-индазол-6-ил)-1Н-пиразол-3-ил]метокси)-2-метилпропановая кислота.
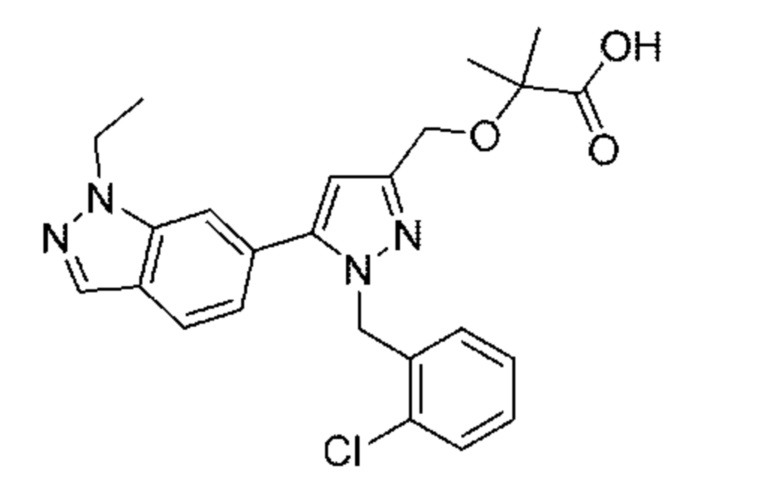
К раствору пром. соед. Н-64 (120 мг, 0,26 ммоль, 1,00 эквив.) в THF/Н2О/МеОН (8/4/4 мл) добавляли частями LiOH (37 мг, 1,54 ммоль, 6,00 эквив.) при комнатной температуре. Полученный раствор перемешивали в течение 2 ч. при комнатной температуре. Уровень рН затем доводили до 3-4 с помощью водн. HCl. Полученный раствор экстрагировали с помощью 100 мл EtOAc и объединенные органические слои высушивали над Na2SO4 и концентрировали под вакуумом. Неочищенный продукт (100 мг) очищали с помощью Prep-HPLC с применением следующих условий (2#-AnalyseHPLC-SHIMADZU(HPLC-10)): колонка, колонка XBridge Prep OBD С18, 30×150 мм, 5 мкм; подвижная фаза, вода (0,1% FA) и ACN (38,0% ACN до 65,0% в течение 7 мин.); детектор, УФ 254/220 нм, с получением 42 мг (36%) указанного в заголовке соединения в виде белого твердого вещества. LC-MS: (ES, масса/заряд): 453. 1Н-ЯМР: (DMSO) δ: 12,70 (s, 1H), 8,09 (d, J=0,9 Гц, 1H), 7,80 (dd, J=8,4, 0,8 Гц, 1H), 7,70 (t, J=1,1 Гц, 1H), 7,48-7,37 (m, 1H), 7,36-7,23 (m, 2Н), 7,14 (dd, J=8,4, 1,3 Гц, 1H), 6,86-6,75 (m, 1H), 6,55 (s, 1H), 5,47 (s, 2Н), 4,46 (s, 2Н), 4,41 (q, J=0,9 Гц, 2Н), 1,42 (s, 6Н), 1,36 (t, J=0,6 Гц, 3Н).
Пример 151: натрия 2-([1-[(2-хлорфенил)метил]-5-(1-этил-1Н-индазол-6-ил)-1Н-пиразол-3-ил]метокси)-2-метилпропаноат
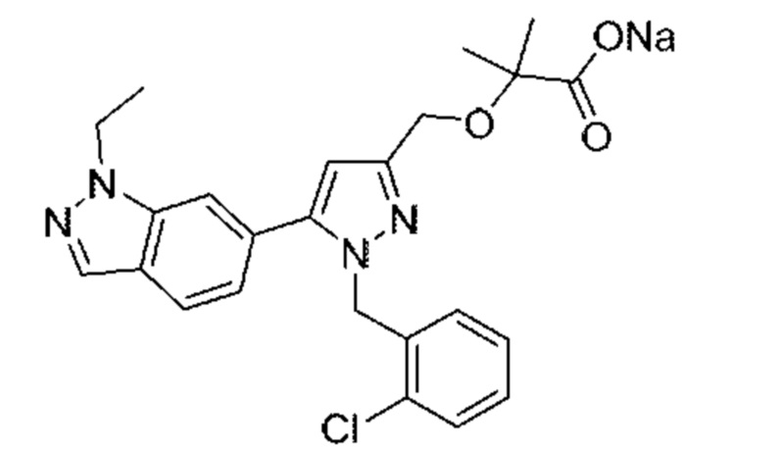
Раствор 2-([1-[(2-хлорфенил)метил]-5-(1-этил-1H-индазол-6-ил)-1H-пиразол-3-ил]метокси)-2-метилпропановой кислоты (пример 150, 50 мг, 0,11 ммоль, 1,00 эквив.) и NaOH (18 мг, 0,45 ммоль, 4,00 эквив.) в МеОН/Н2О (5/2 мл) перемешивали в течение 3 ч. при к.т., затем очищали с помощью Prep-HPLC с применением следующих условий (2#-AnalyseHPLC-SHIMADZU(HPLC-10)): колонка, колонка XBridge Shield RP18 OBD, 5 мкм, 19*150 мм; подвижная фаза, вода (10 ммоль/л NH4HCO3) и МеОН- (15,0% МеОН- до 95,0% в течение 7 мин.); детектор, УФ 254/220 нм, с получением 20,9 мг (40%) указанного в заголовке соединения в виде белого твердого вещества. LC-MS: (ES, масса/заряд): 453,00. 1Н ЯМР (300 МГц, DMSO) δ 8,07 (s, 1H), 7,77 (d, J=8,3 Гц, 1H), 7,65 (s, 1H), 7,41 (m, 1H), 7,28 (m, 2Н), 7,10 (d, J=8,4 Гц, 1H), 6,79 (m, 1H), 6,56 (s, 1H), 5,46 (s, 2Н), 4,49 (s, 2Н), 4,37 (q, J=7,2, 7,2, 7,2 Гц, 2Н), 1,34 (d, J=17,1 Гц, 9Н).
Пример 152: 2-([5-(3-циклопропоксифенил)-1-(1Н-индазол-7-ил)-1Н-пиразол-3-ил]метокси)-2-метилпропановая кислота.
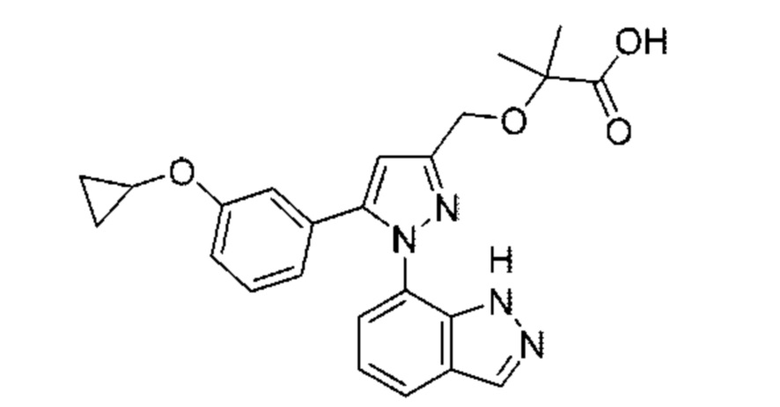
(i) 2-([5-(3-Циклопропоксифенил)-1-(1-[[2-(триметилсилил)этокси]метил]-1H-индазол-7-ил)-1Н-пиразол-3-ил]метокси)-2-метилпропановая кислота. Раствор пром. соед. Н-76 (100 мг, 0,17 ммоль, 1,00 эквив.) и LiOH (20 мг, 0,84 ммоль, 4,00 эквив.) в THF/H2O (4/1 мл) перемешивали в течение 2 ч. при комнатной температуре, затем охлаждали до 0°С. Значение рН доводили до 1 с помощью 1 М HCl. Полученный раствор экстрагировали с помощью 2×100 мл EtOAc и объединенные органические слои промывали с помощью 100 мл солевого раствора, высушивали над Na2SO4 и концентрировали под вакуумом с получением 50 мг (51%) указанного в заголовке соединения в виде белого твердого вещества. LC-MS: (ES, масса/заряд): 563.
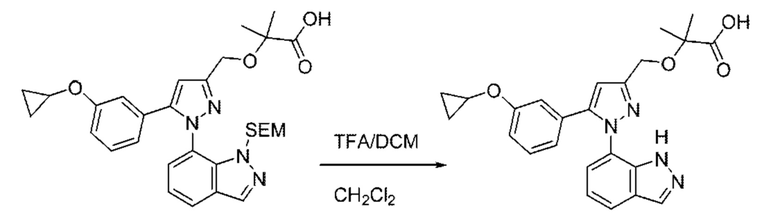
(ii) 2-([5-(3-Циклопропоксифенил)-1-(1Н-индазол-7-ил)-1Н-пиразол-3-ил]метокси)-2-метилпропановая кислота. Раствор продукта из предыдущей стадии (50 мг, 0,09 ммоль, 1,00 эквив.) и TFA (3 мл) в CH2Cl2 (10 мл) перемешивали в течение 5 ч. при комнатной температуре, затем концентрировали под вакуумом. Неочищенный продукт (50 мг) очищали с помощью Prep-HPLC с применением следующих условий (2#-AnalyseHPLC-SHIMADZU(HPLC-10)): колонка, колонка Xselect CSH OBD, 30×150 мм, 5 мкм; n; подвижная фаза, вода (0,1% FA) и ACN (43,0% ACN до 55,0% в течение 7 мин.); детектор, УФ 254/220 нм, с получением 15 мг (39%) указанного в заголовке соединения в виде белого твердого вещества. LC-MS: (ES, масса/заряд): 433. 1Н ЯМР (300 МГц, DMSO-d6) δ 13,09 (s, 1H), 8,18 (s, 1H), 7,81 (dd, J=7,0, 2,0 Гц, 1H), 7,20 (t, 7=7,9 Гц, 1H), 7,14-7,02 (m, 2Н), 6,95-6,85 (m, 2Н), 6,85-6,80 (m, 1H), 6,71 (s, 1H), 4,55 (s, 2Н), 3,45 (tt, J=6,3, 3,0 Гц, 1H), 1,44 (s, 6Н), 0,58-0,43 (m, 2Н), 0,43-0,26 (m, 2Н).
Пример 153: 2-([5-(3-циклопропоксифенил)-1-(1Н-индазол-4-ил)-1Н-пиразол-3-ил]метокси)-2-метилпропановая кислота.
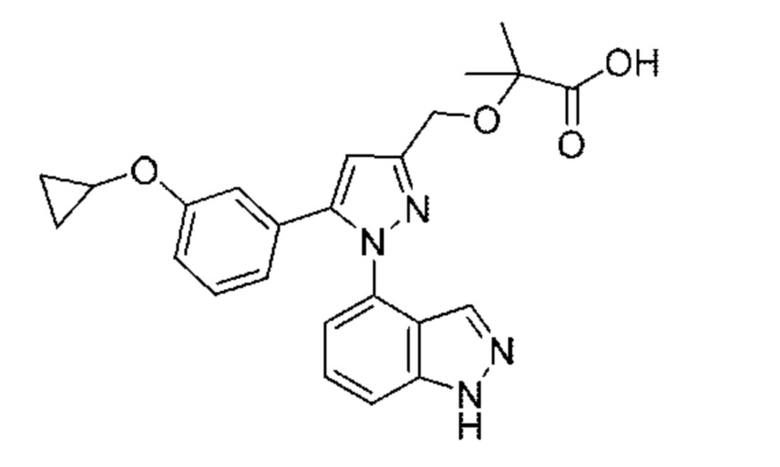
(i) 2-([5-(3-Циклопропоксифенил)-1-(1-[[2-(триметилсилил)этокси]метил]-1H-индазол-4-ил)-1H-пиразол-3-ил]метокси)-2-метилпропановая кислота. Раствор пром. соед. Н-77 (160 мг, 0,28 ммоль, 1,00 эквив.) и LiOH (70 мг, 2,92 ммоль, 10,54 эквив.) в THF/MeOH/H2O (5/1/1 мл) перемешивали в течение 3 ч. при комнатной температуре. Значение рН доводили до 5 с помощью 1 М HCl. Полученный раствор экстрагировали с помощью 3×20 мл EtOAc. Объединенные органические слои концентрировали при пониженном давлении и высушивали с получением 140 мг (90%) указанного в заголовке соединения в виде светло-желтого масла. LC-MS: (ES, масса/заряд): 563,2.
(ii) 2-([5-(3-Циклопропоксифенил)-1-(1Н-индазол-4-ил)-1Н-пиразол-3-ил]метокси)-2-метилпропановая кислота. Раствор продукта из предыдущей стадии (140 мг, 0,25 ммоль, 1,00 эквив.) и HCl/диоксана (5 мл) перемешивали в течение 3 ч. при комнатной температуре, затем концентрировали под вакуумом. Неочищенный продукт (100 мг) очищали с помощью Prep-HPLC с применением следующих условий (2#-AnalyseHPLC-SHIMADZU(HPLC-10)): колонка, колонка Xselect CSH F-Phenyl OBD, 19×150 мм, 5 мкм; n; подвижная фаза, вода (0,1% FA) и ACN (35,0% ACN до 45,0% в течение 7 мин.); детектор, УФ 254/220 нм, с получением 18,9 мг (18%) указанного в заголовке соединения в виде белого твердого вещества. LC-MS: (ES, масса/заряд): 433,05. 1Н ЯМР (300 МГц, DMSO) δ 13,29 (s, 1H), 7,69 (d, J=1,0 Гц, 1H), 7,57 (d, J=8,4 Гц, 1H), 7,35 (dd, J=8,4, 7,3 Гц, 1H), 7,21 (t, J=7,9, 7,9 Гц, 1H), 6,91 (dtd, J=8,3, 5,8, 4,8, 3,0 Гц, 3Н), 6,81 (m, 1H), 6,70 (s, 1H), 4,53 (s, 2H), 3,52 (tt, J=6,2, 6,2, 3,0, 3,0 Гц, 1H), 1,44 (s, 6H), 0,46 (m, 2H), 0,36 (m, 2H).
Пример 154: 2-([5-(3-циклопропоксифенил)-1-(3-метил-1Н-индазол-4-ил)-1Н-пиразол-3-ил]метокси)-2-метилпропановая кислота.
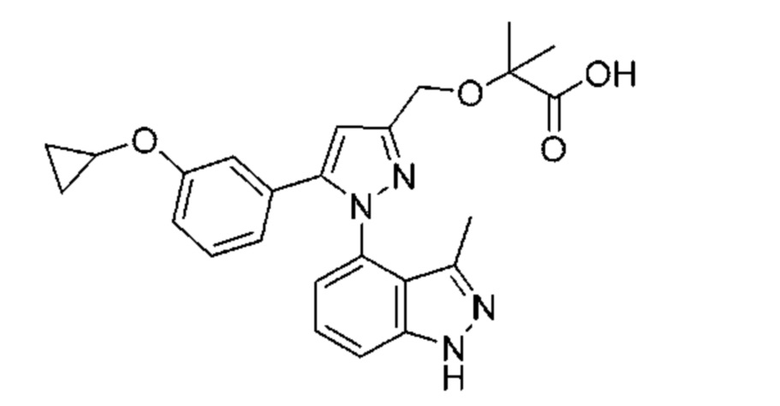
(i) 2-([5-(3-Циклопропоксифенил)-1-(3-метил-1-[[2-(триметилсилил)этокси]метил]-1Н-индазол-4-ил)-1Н-пиразол-3-ил]метокси)-2-метилпропановая кислота. Раствор пром. соед. Н-78 (100 мг, 0,17 ммоль, 1,00 эквив.) и LiOH (40 мг, 1,67 ммоль, 10,00 эквив.) в THF/МеОН/Н2О (5/1/1 мл) перемешивали в течение 3 ч. при комнатной температуре. Значение рН раствора доводили до 5 с помощью 1 М HCl. Полученный раствор экстрагировали с помощью 3×15 мл EtOAc. Объединенные органические слои высушивали над Na2SO4 и концентрировали под вакуумом с получением 80 мг (82%) указанного в заголовке соединения в виде светло-желтого масла. LC-MS: (ES, масса/заряд): 577,3.
(ii) 2-([5-(3-Циклопропоксифенил)-1-(3-метил-1Н-индазол-4-ил)-1Н-пиразол-3-ил]метокси)-2-метилпропановая кислота. Раствор продукта из предыдущей стадии (80 мг, 0,14 ммоль, 1,00 эквив.) в HCl/диоксане (5 мл) перемешивали в течение 3 ч. при комнатной температуре, затем концентрировали под вакуумом. Неочищенный продукт очищали с помощью Prep-HPLC с применением следующих условий (2#-AnalyseHPLC-SHIMADZU(HPLC-10)): колонка, колонка Xselect CSH OBD, 30×150 мм, 5 мкм; n; подвижная фаза, вода (0,1% FA) и ACN (40,0% ACN до 50,0% в течение 7 мин.); детектор, УФ 254/220 нм, с получением 8,2 мг (13%) указанного в заголовке соединения в виде белого твердого вещества. LC-MS: (ES, масса/заряд): 447,15. 1Н ЯМР (300 МГц, MeOD) δ 7,62 (dd, J=8,5, 0,8 Гц, 1H), 7,42 (dd, J=8,5, 7,2 Гц, 1H), 7,17 (t, J=7,9, 7,9 Гц, 1H), 6,99 (m, 2Н), 6,80 (m, 3Н), 4,65 (s, 2Н), 3,25 (dt, J=5,7, 2,6, 2,6 Гц, 1H), 2,07 (s, 3Н), 1,54 (s, 6Н), 0,41 (m, 4Н).
Следующие замещенные пиразолкарбоновые кислоты получали в результате гидролиза с помощью LiOH соответствующих сложных метиловых эфиров.
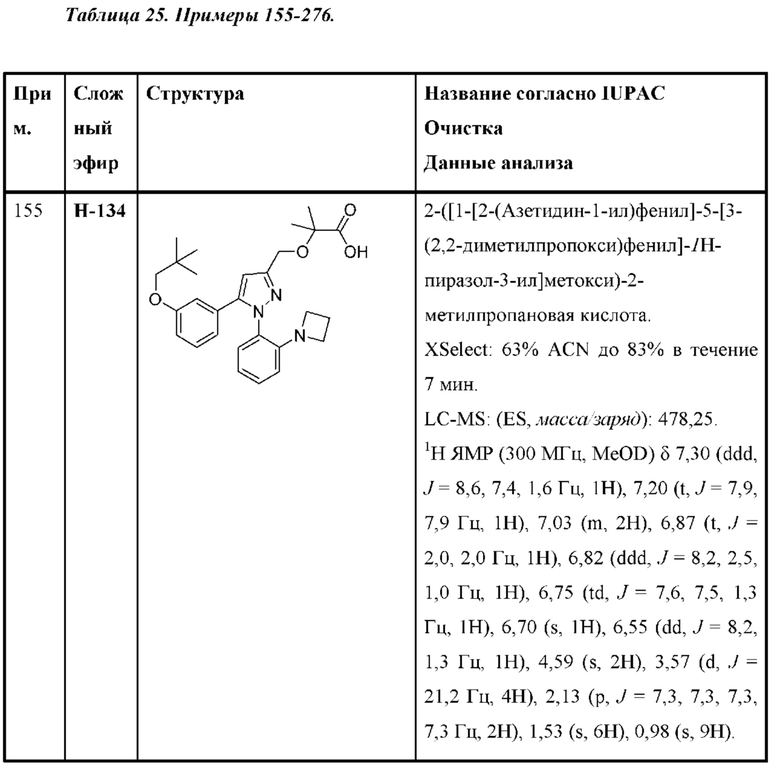
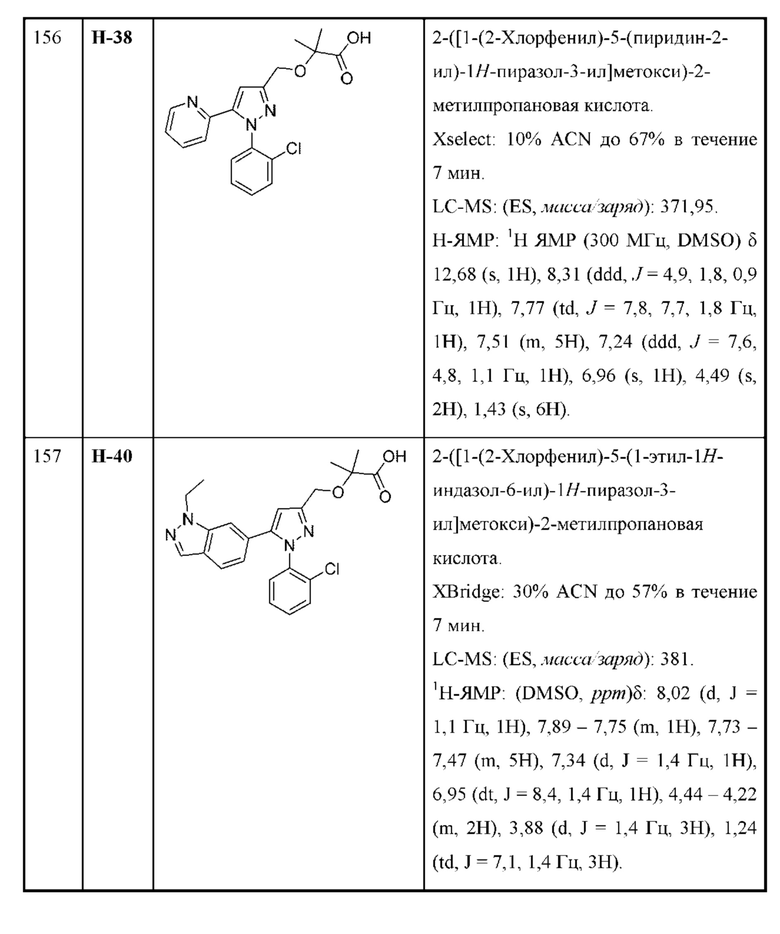

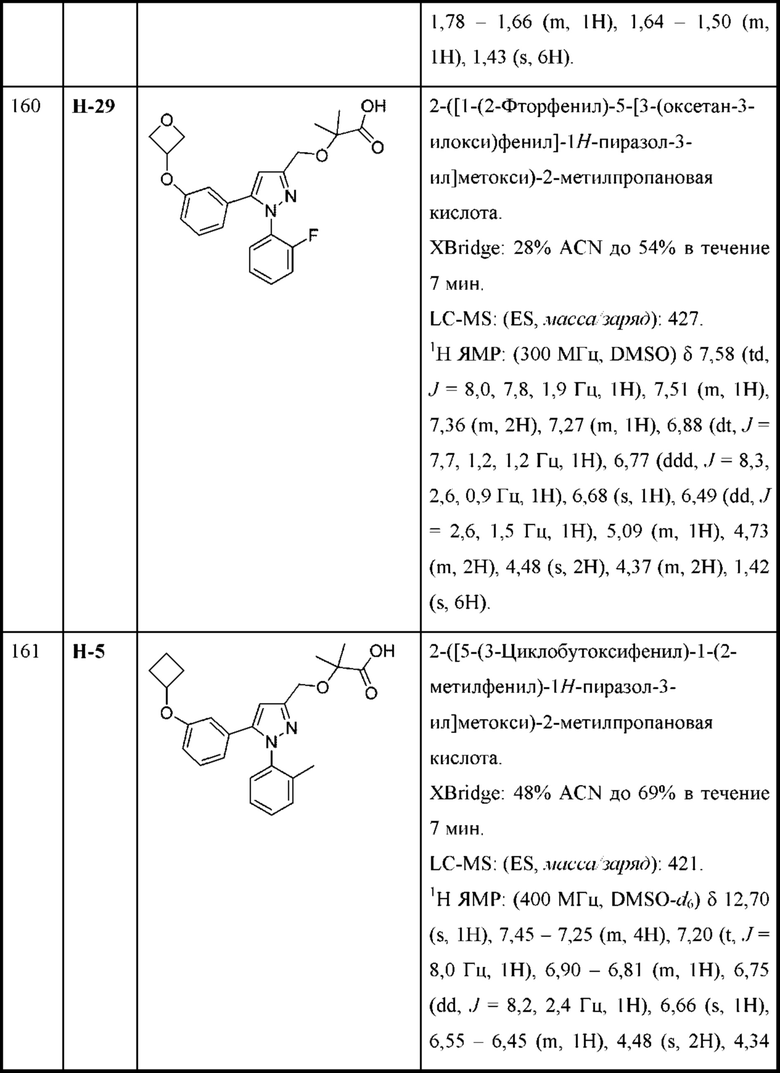
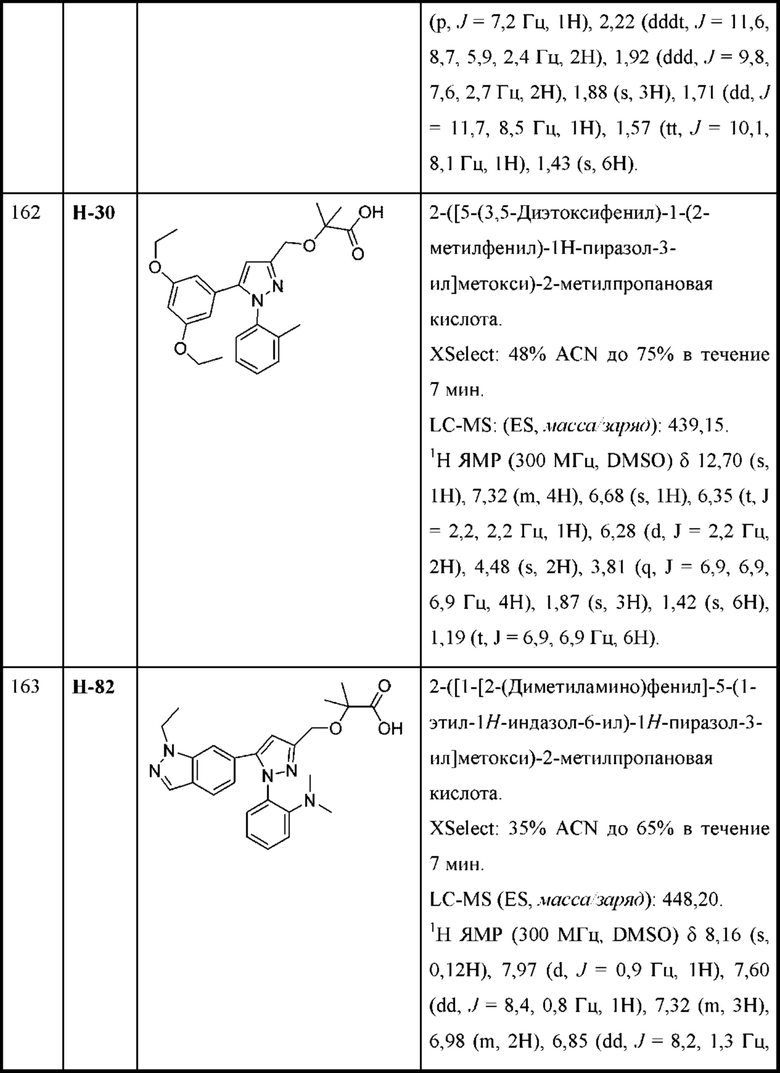
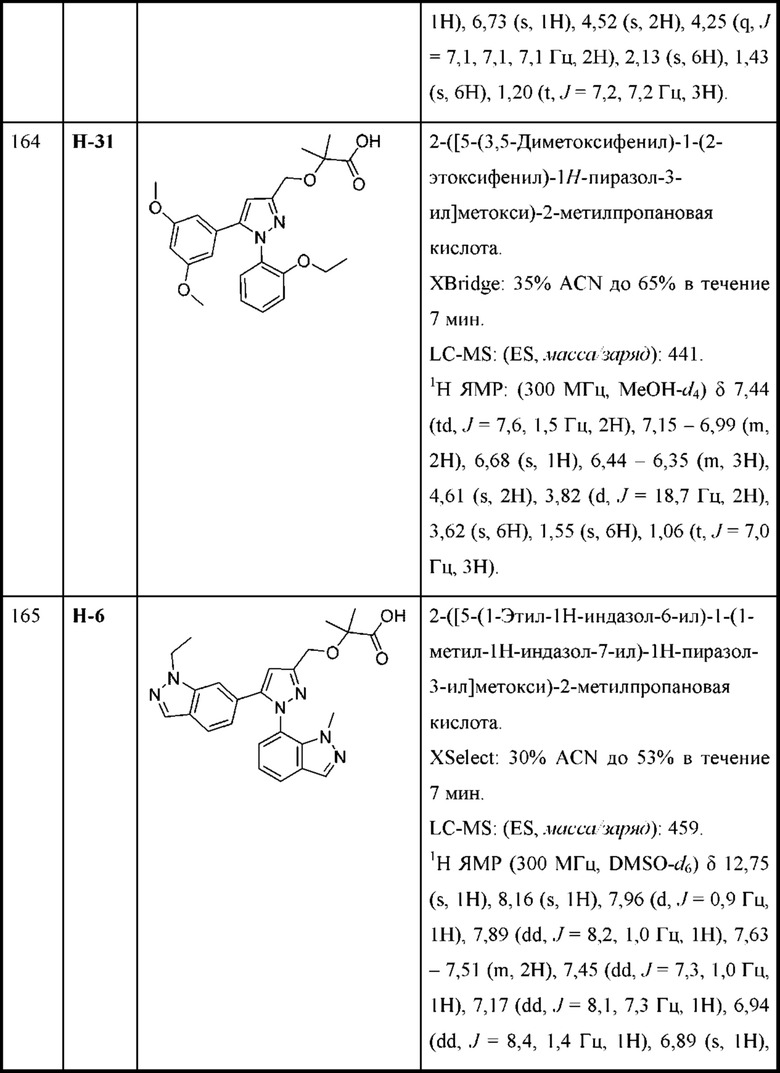
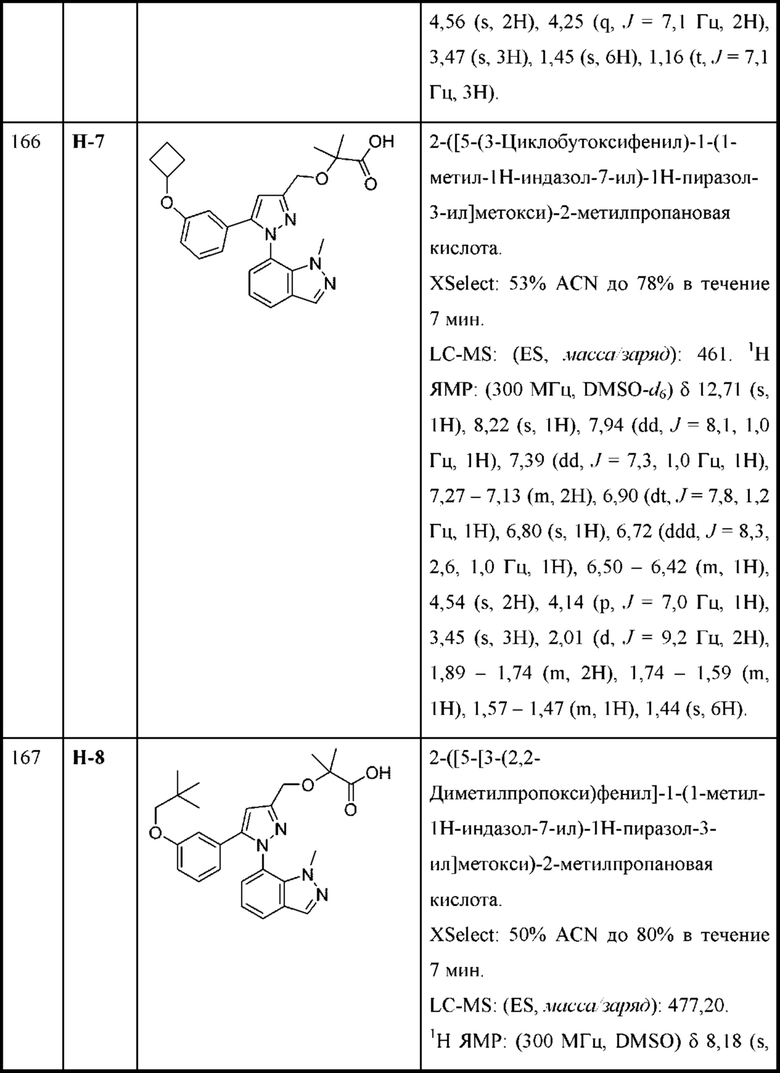
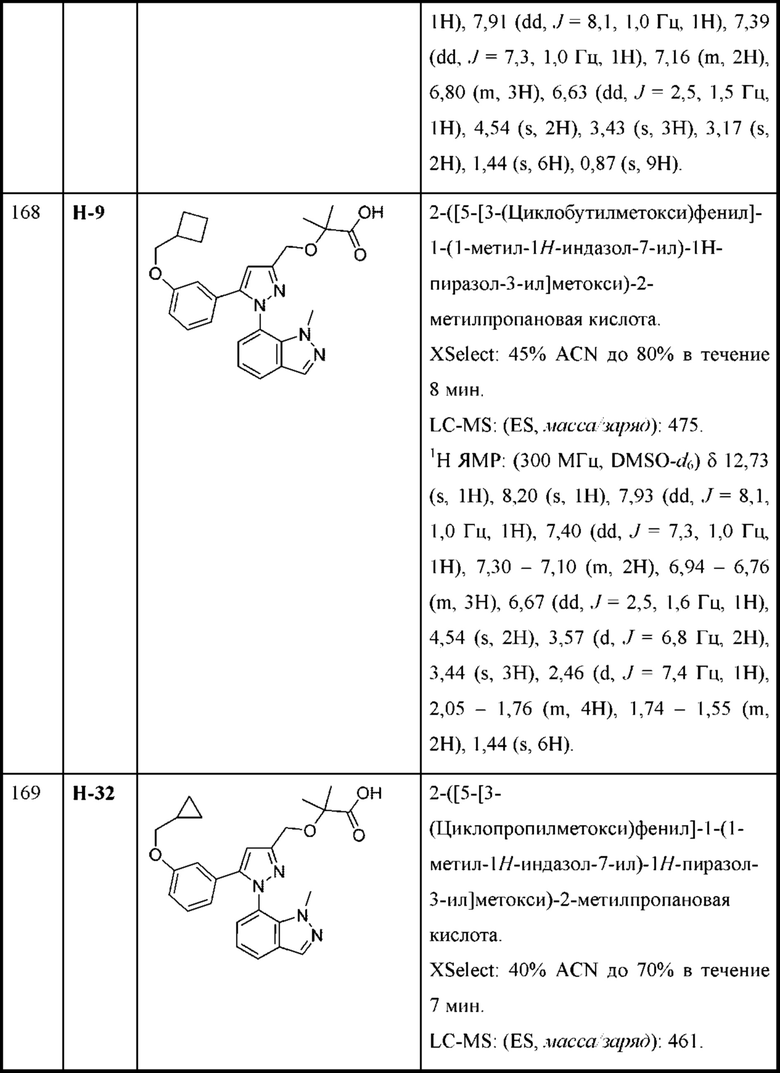
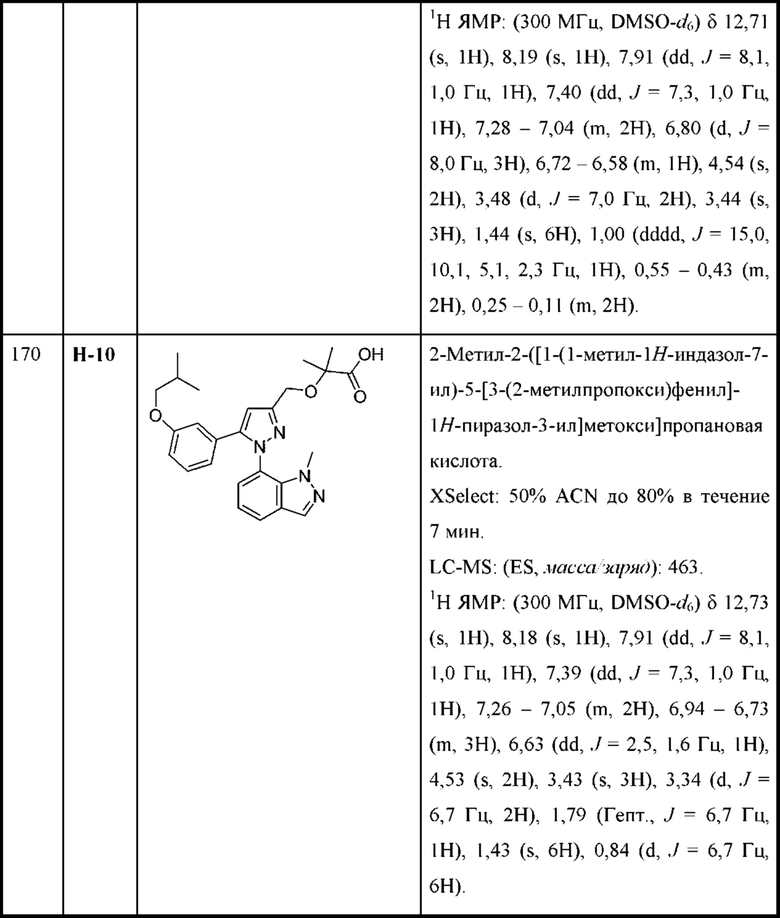
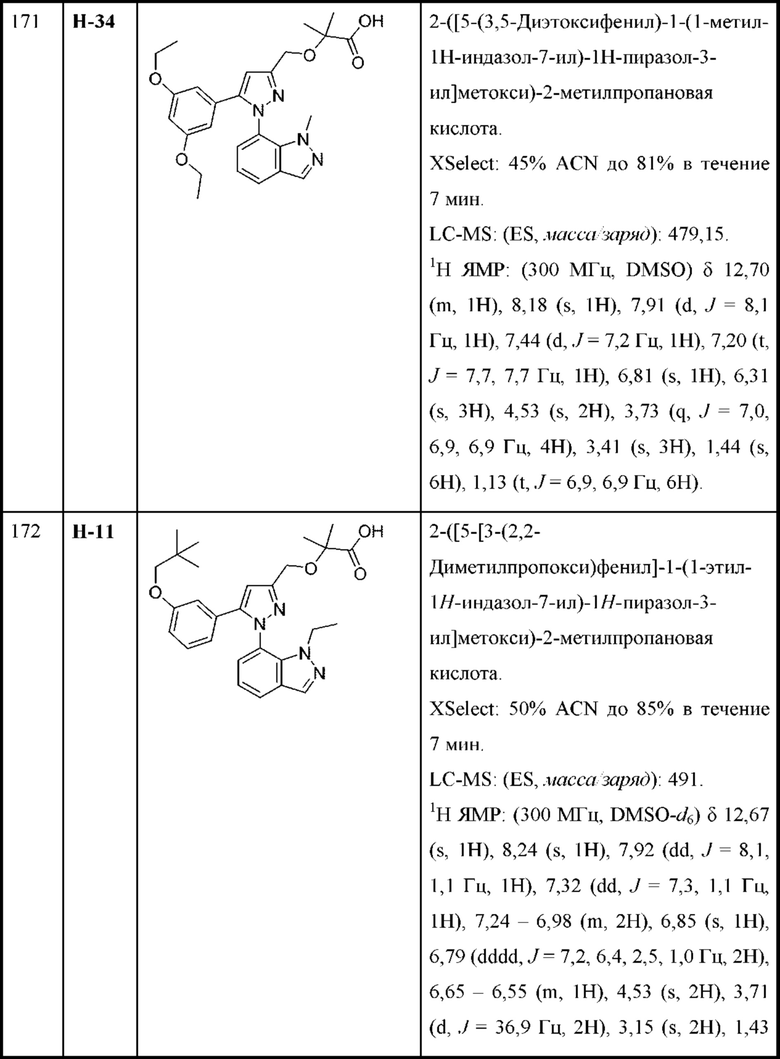
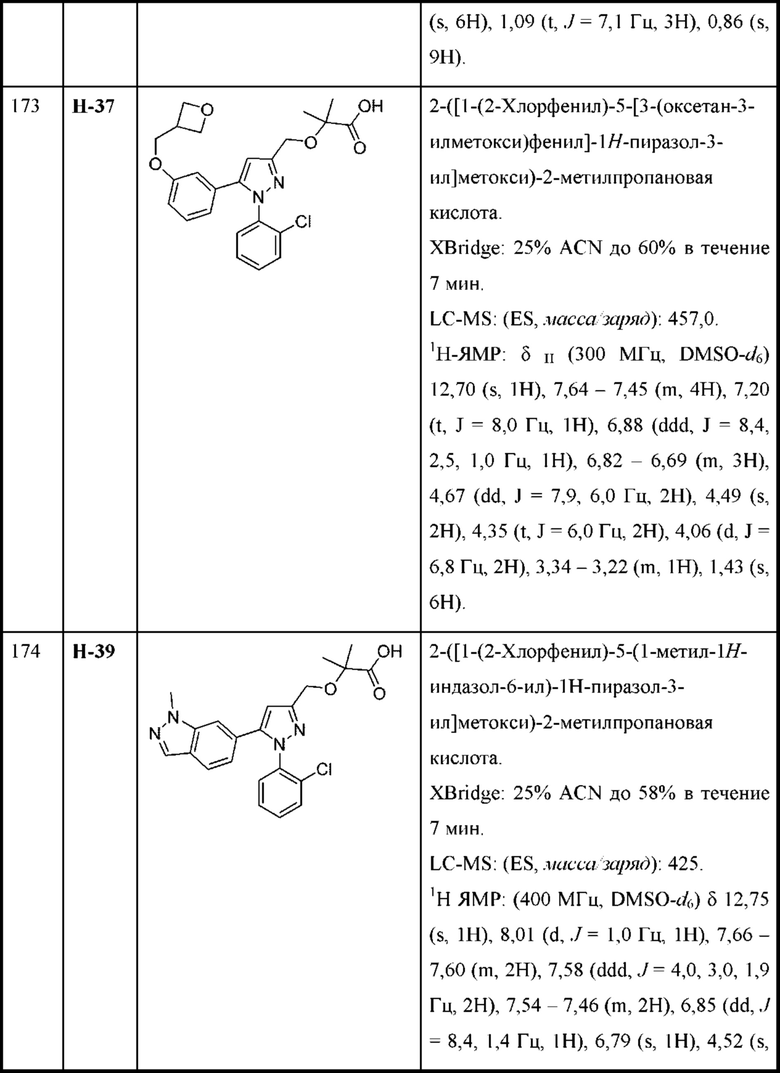
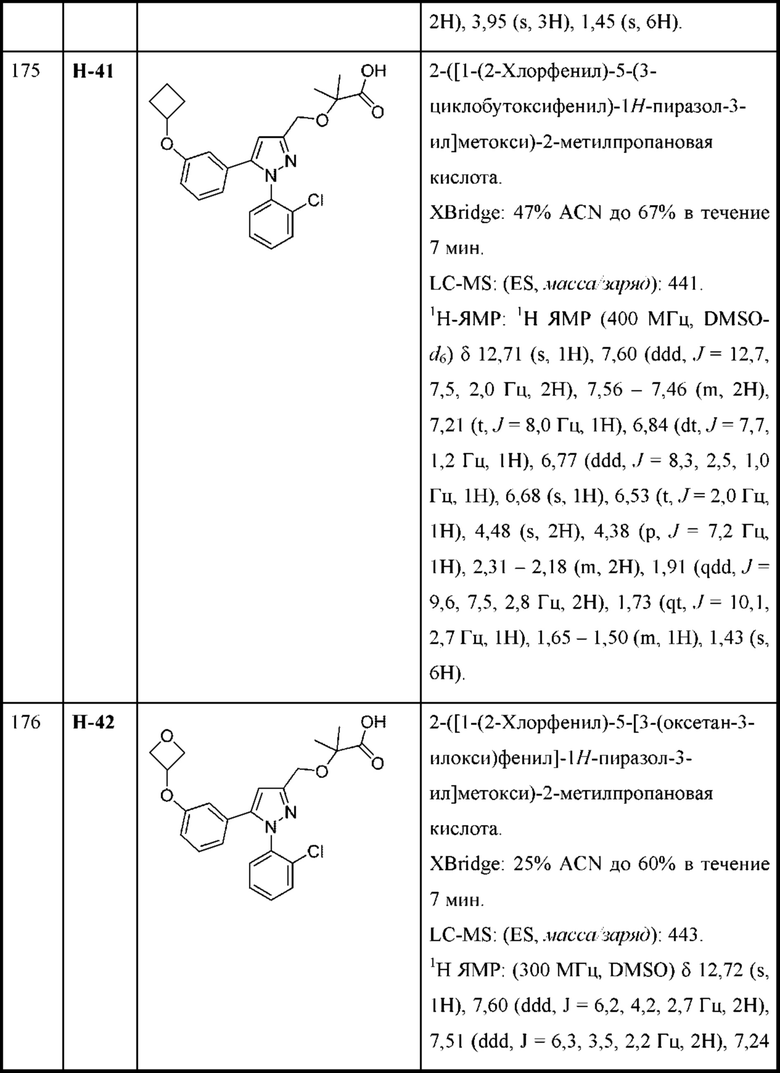
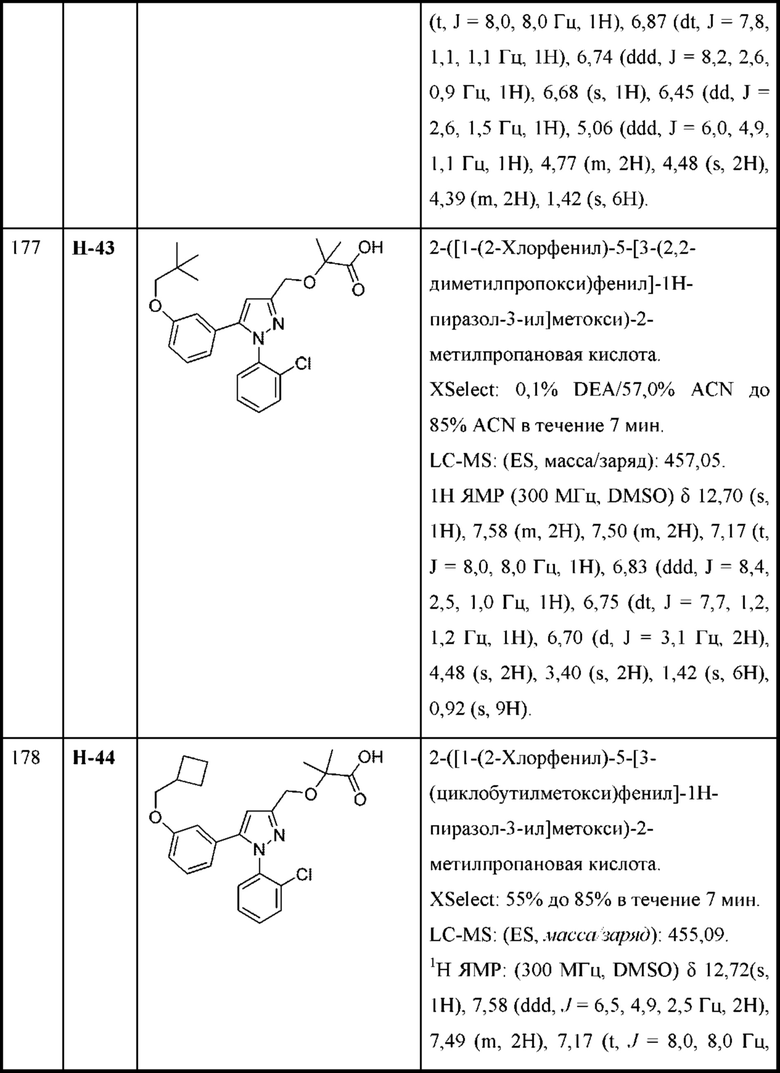
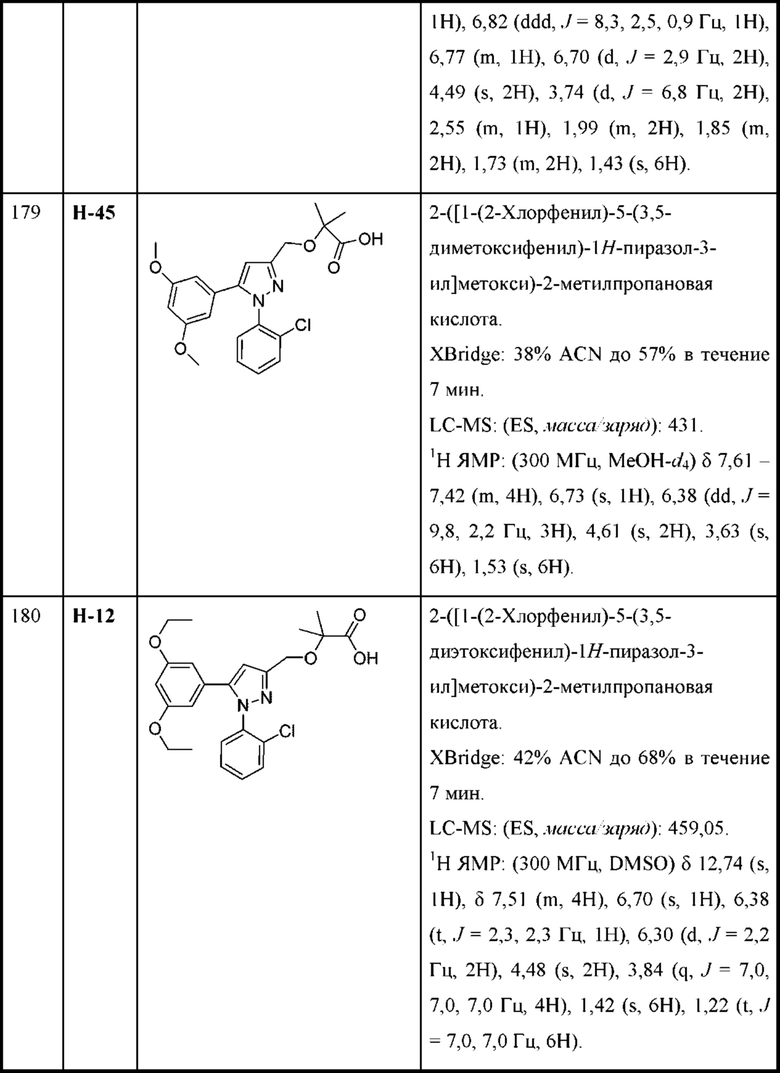
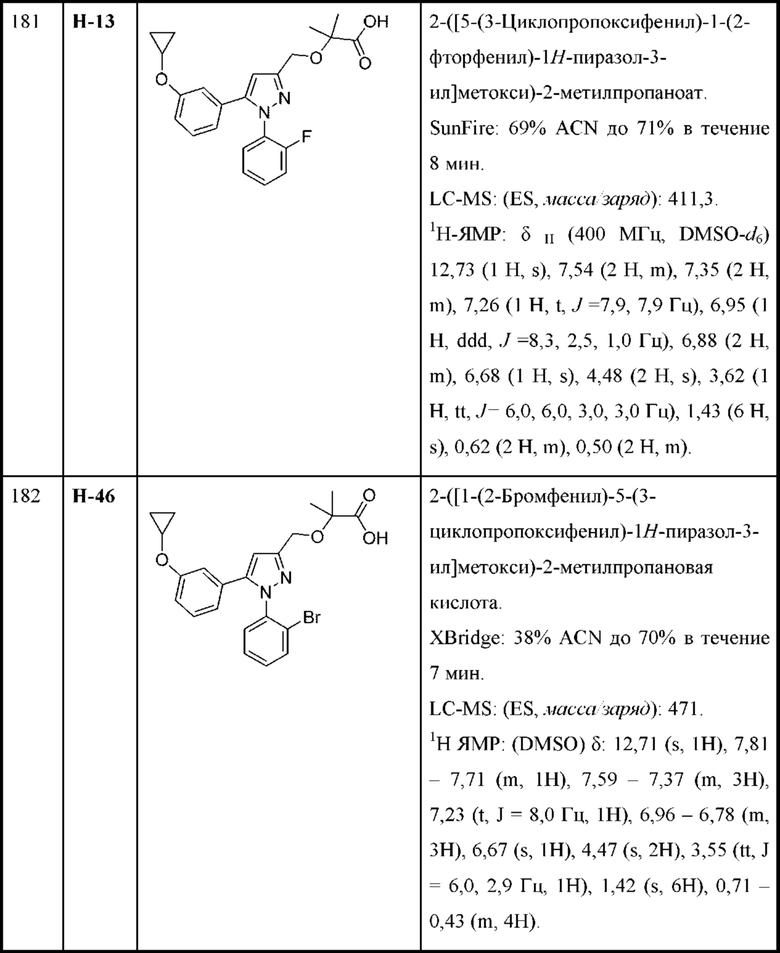
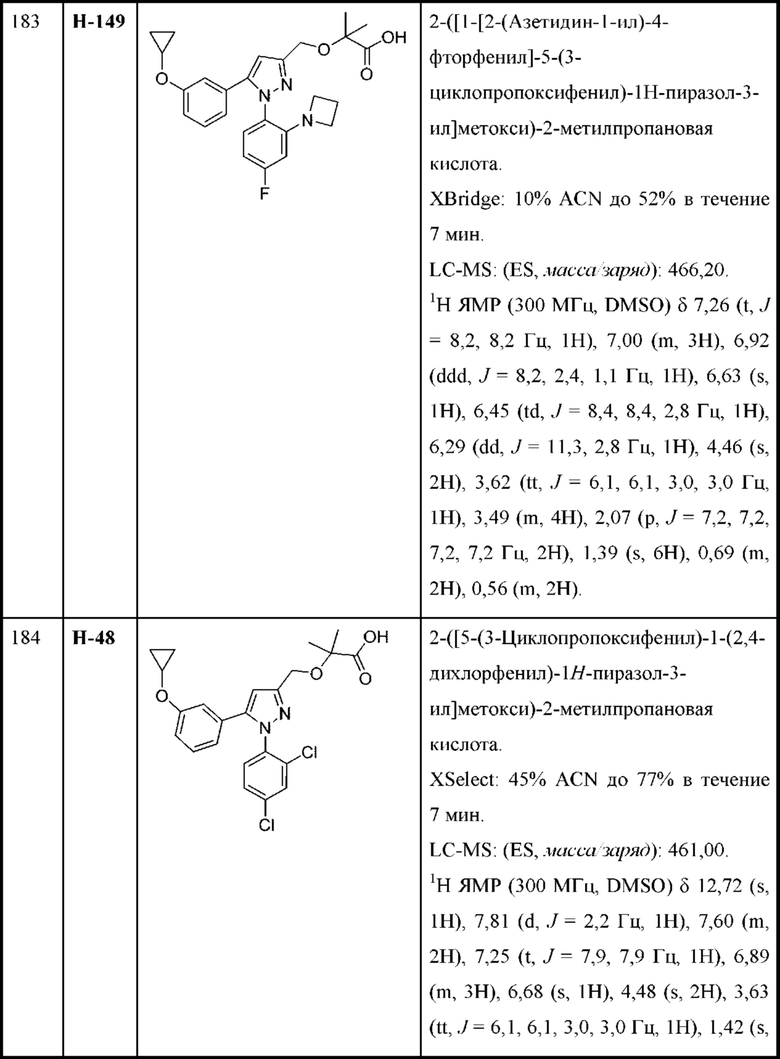
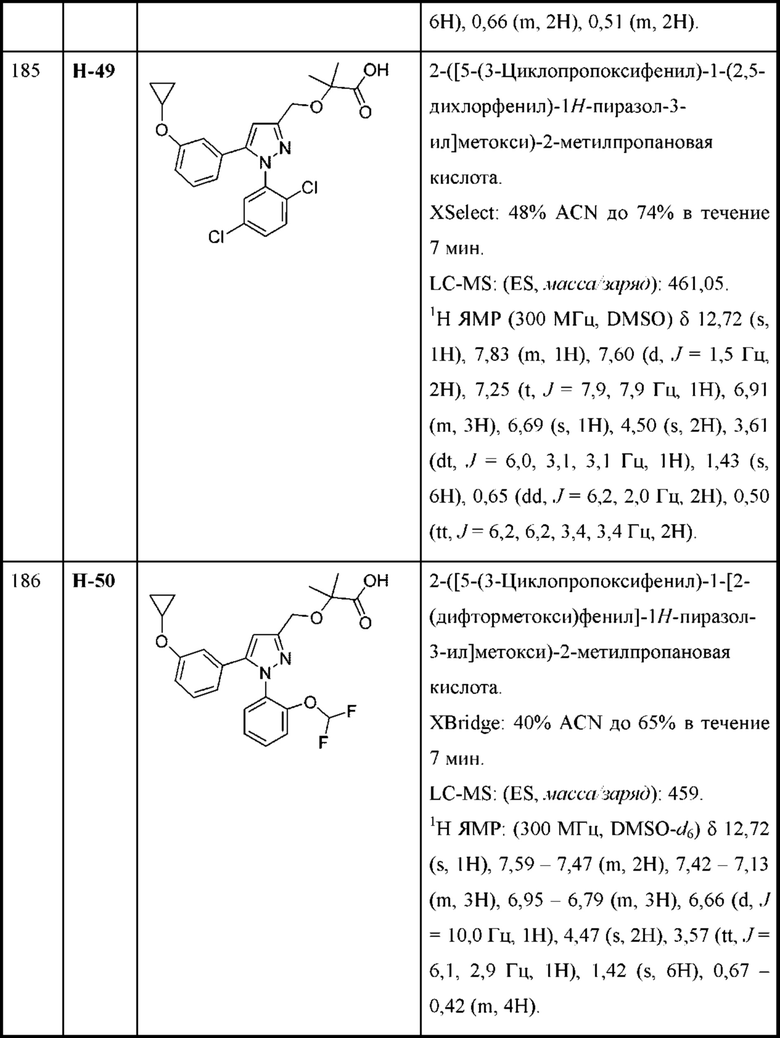
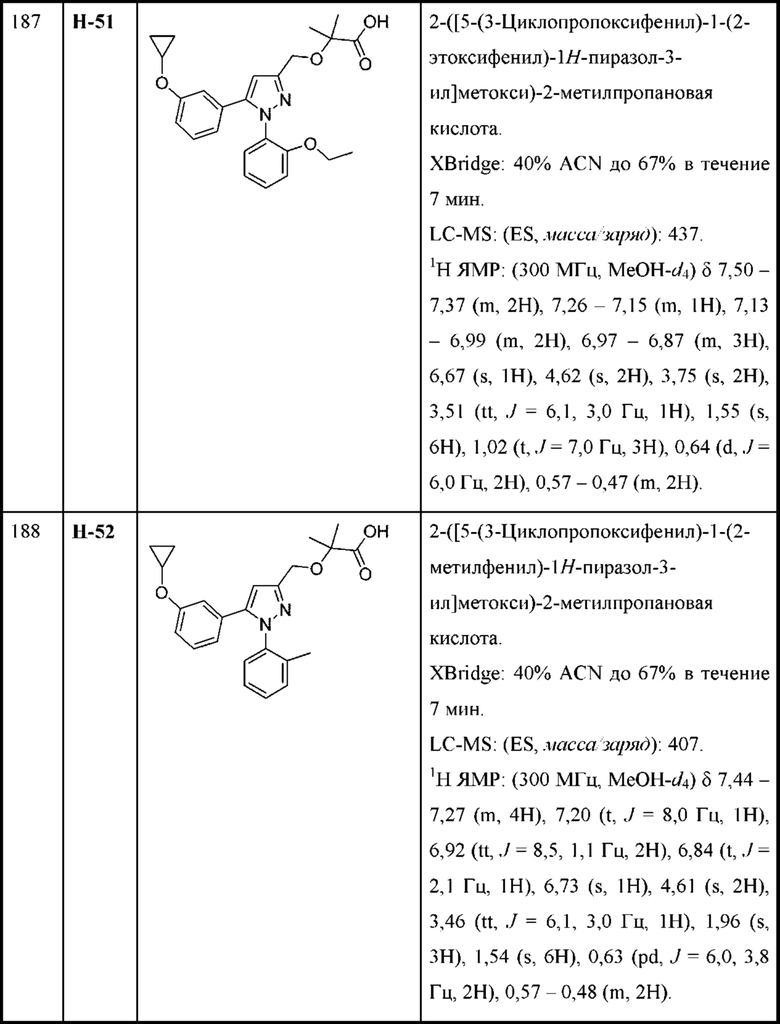
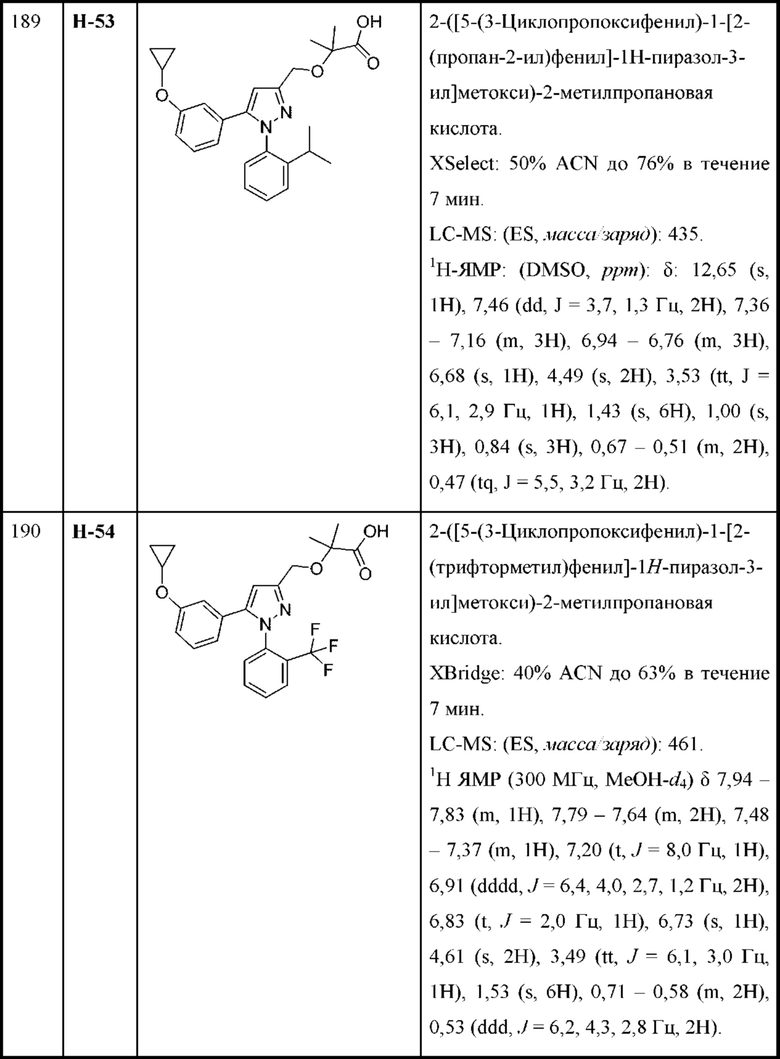
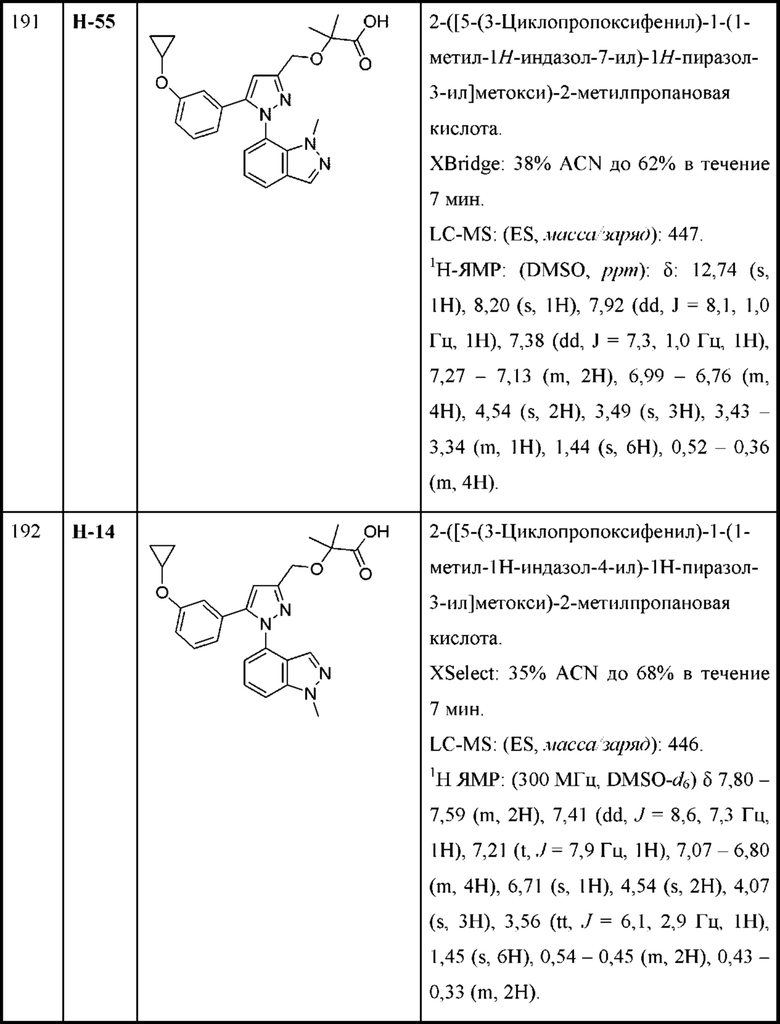
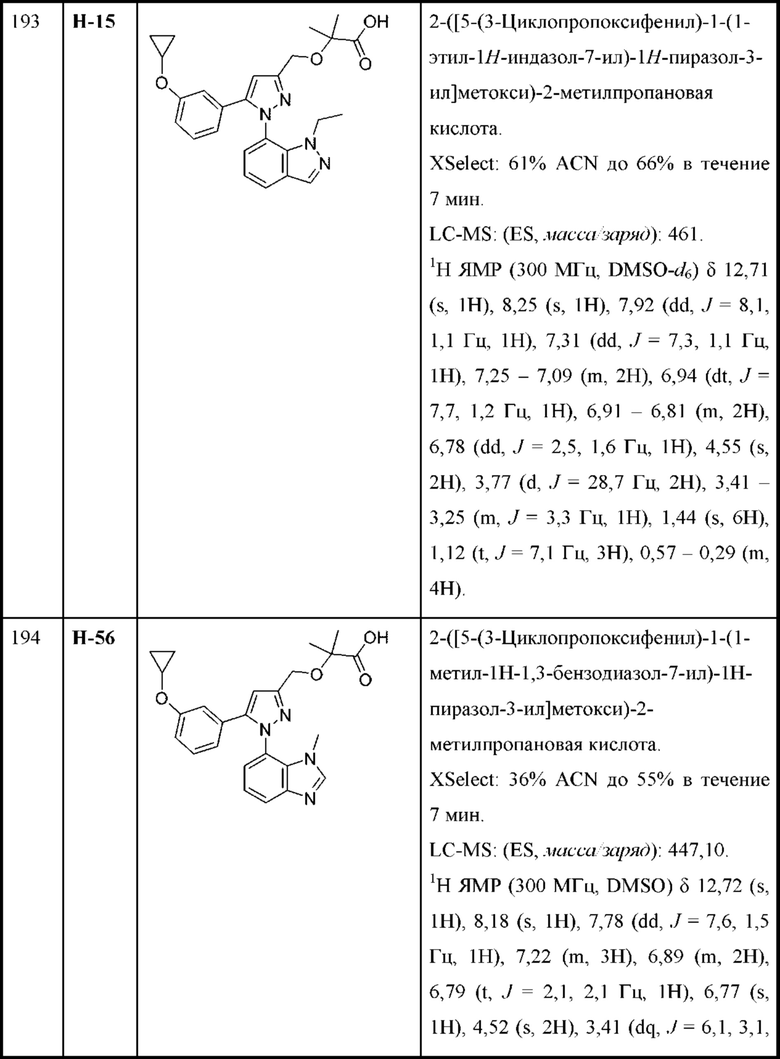
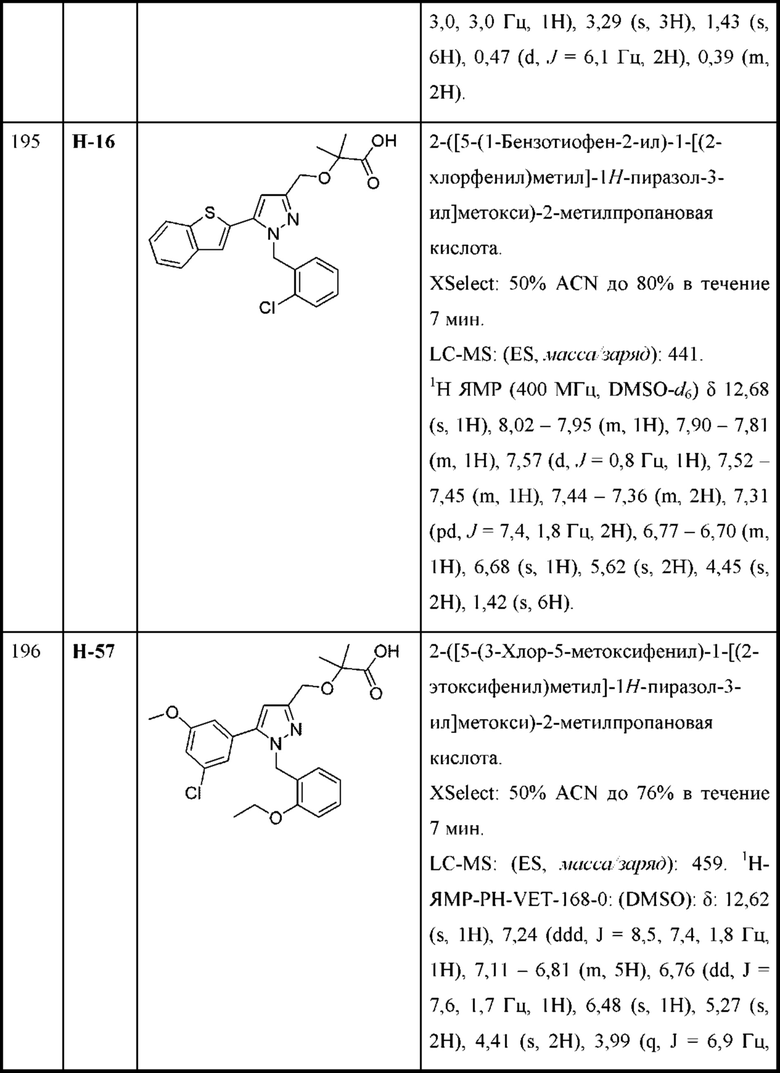
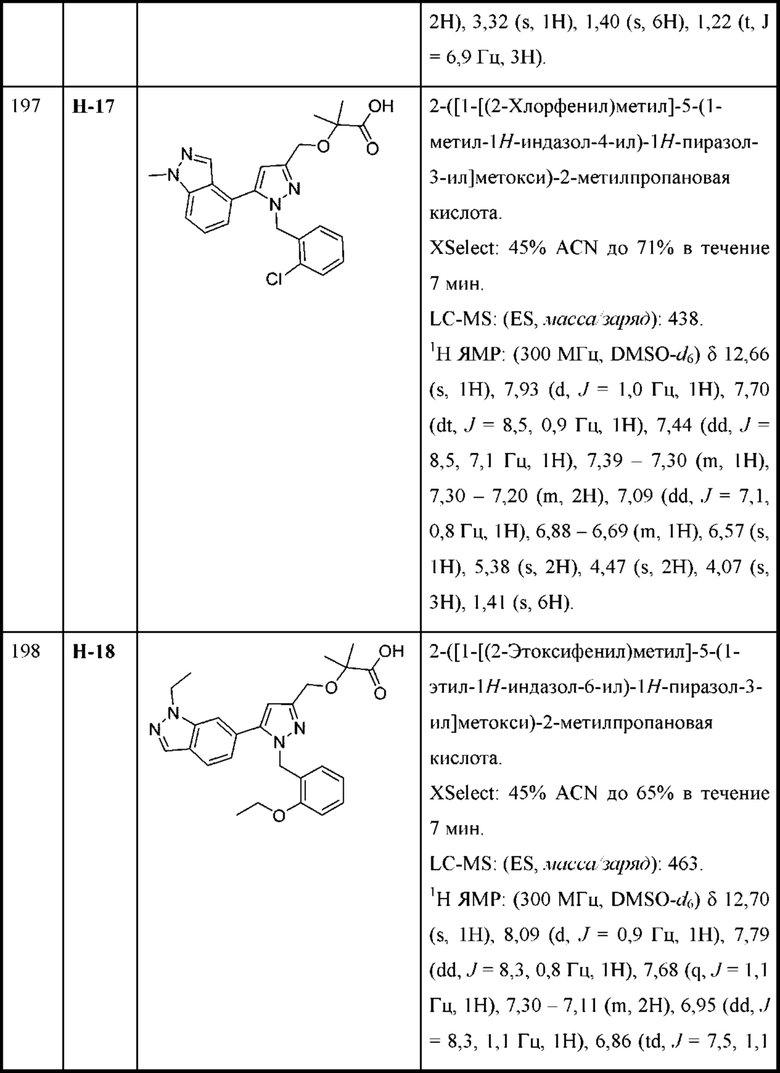
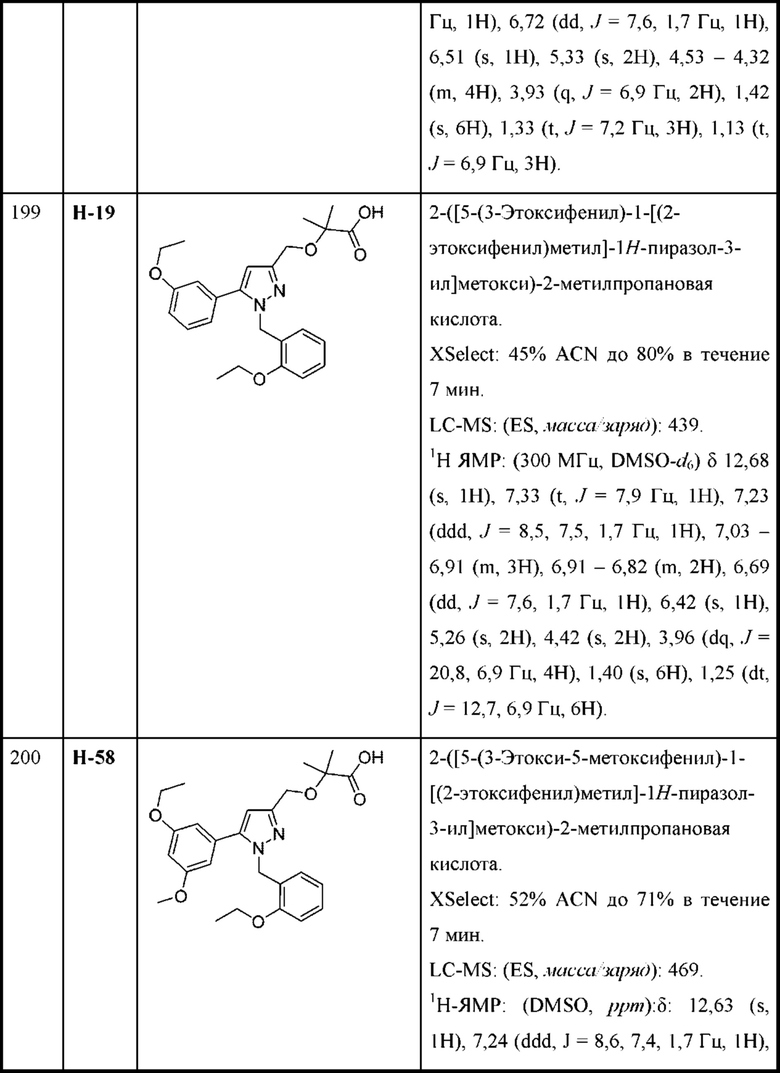
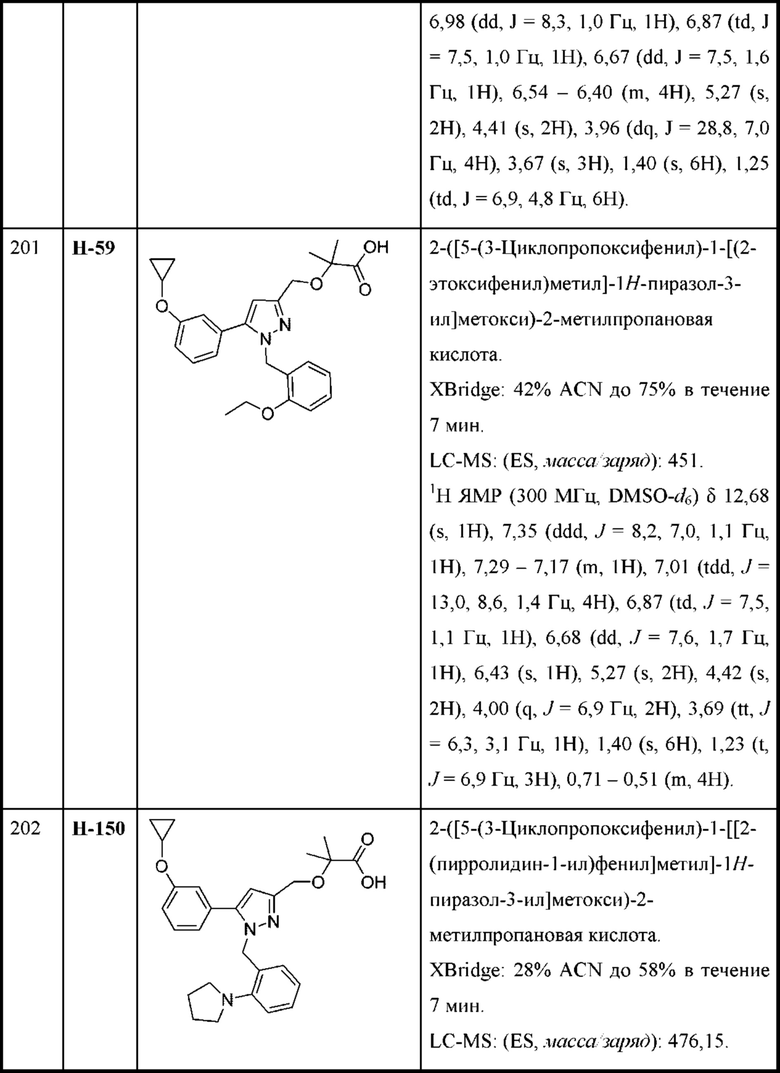
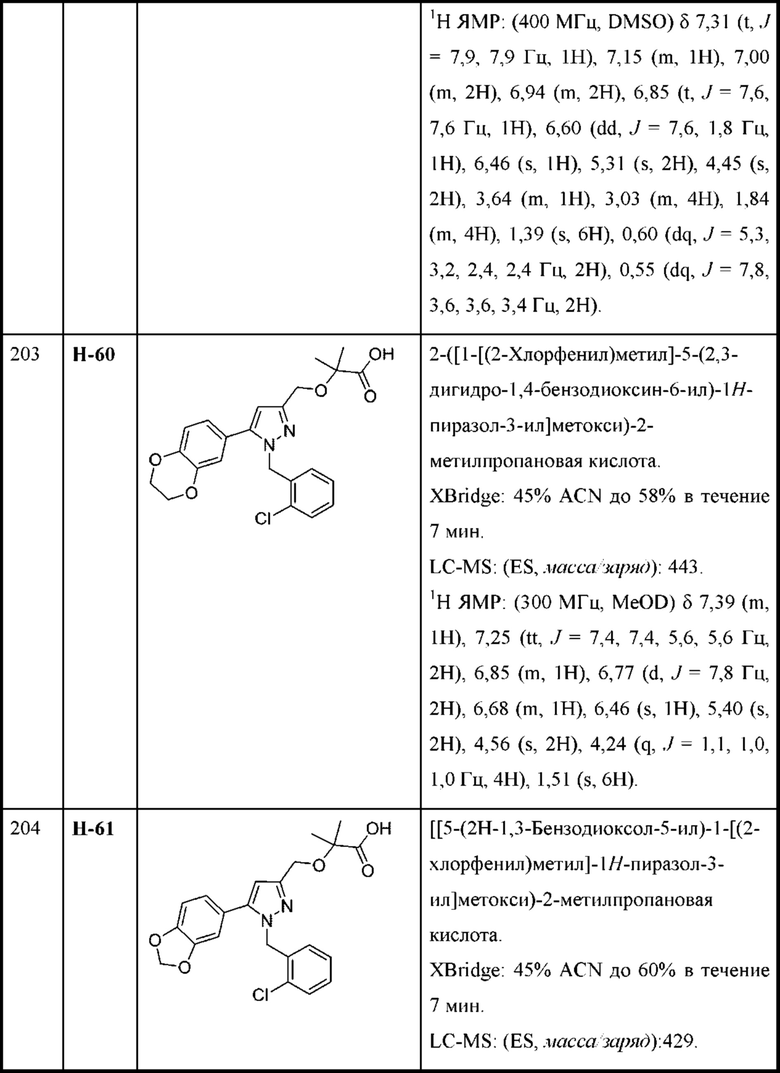
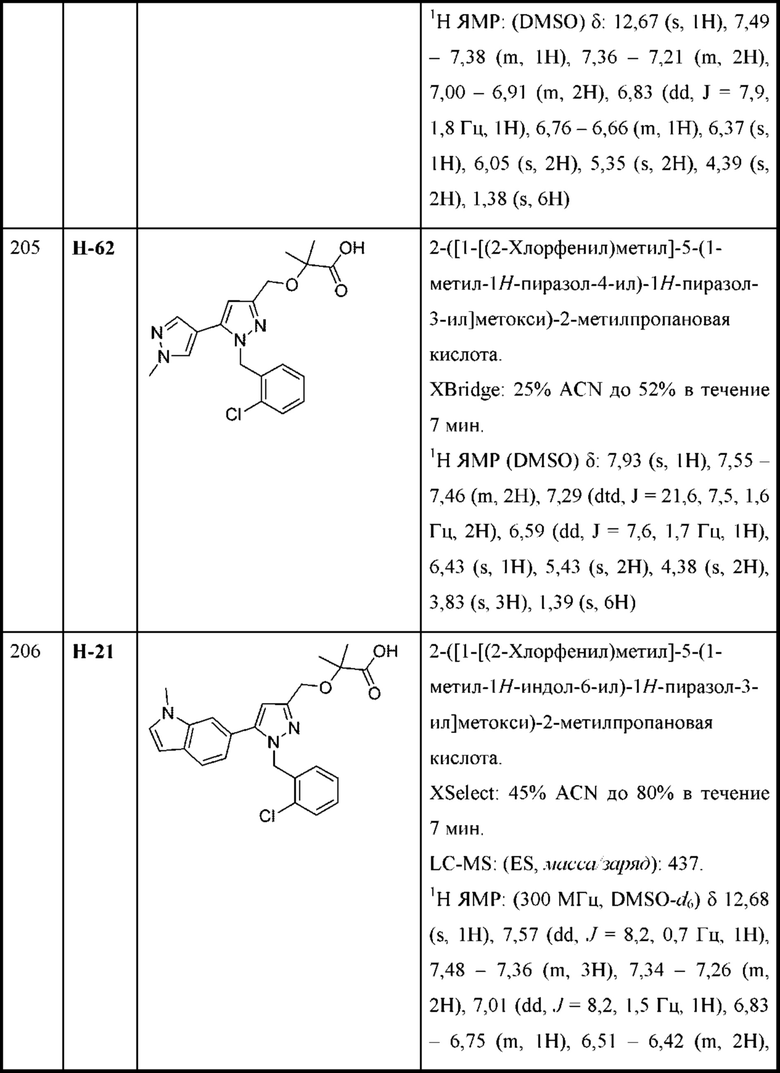
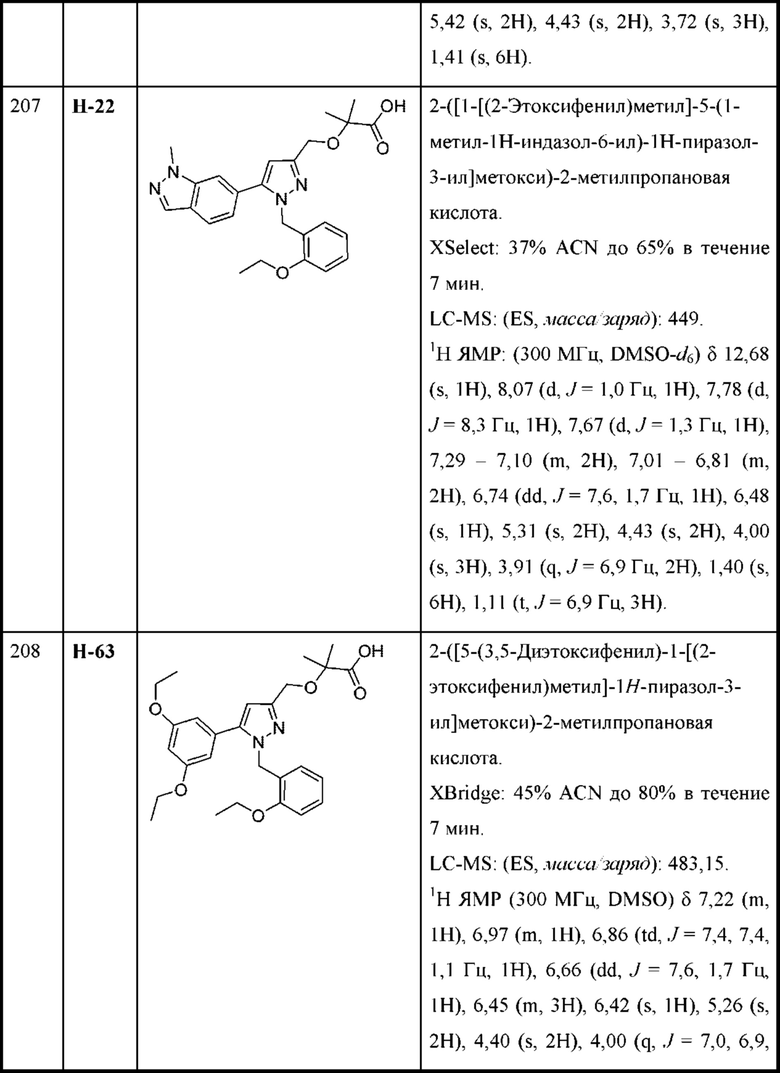
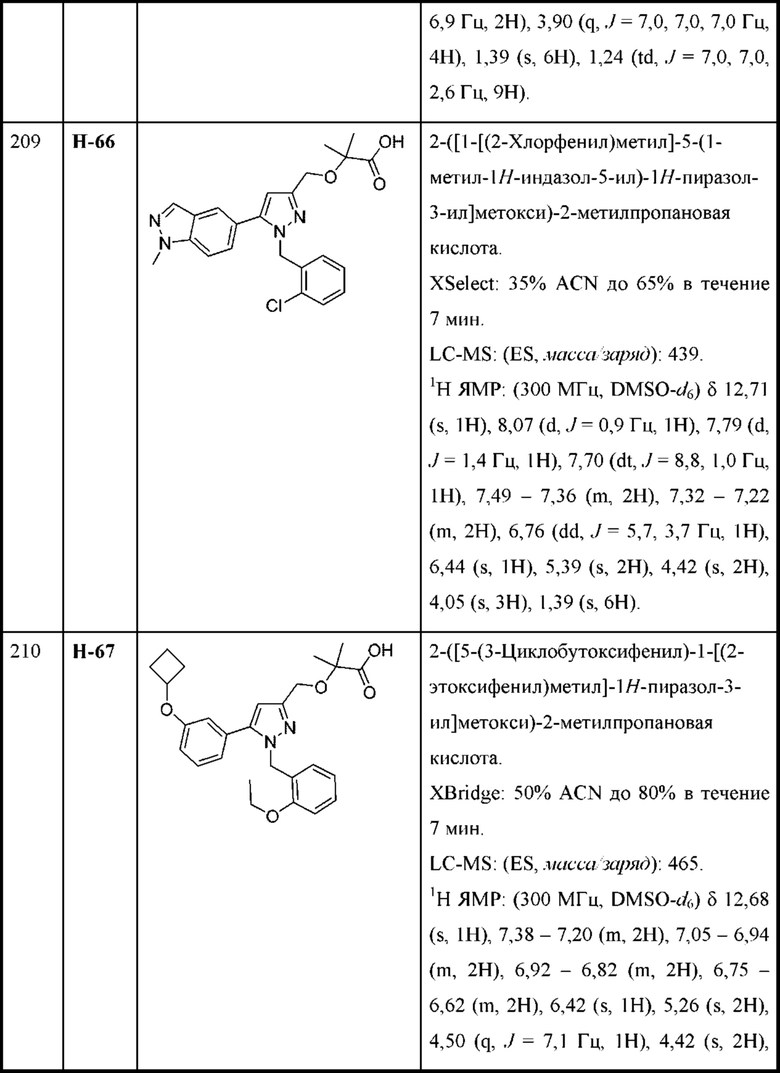
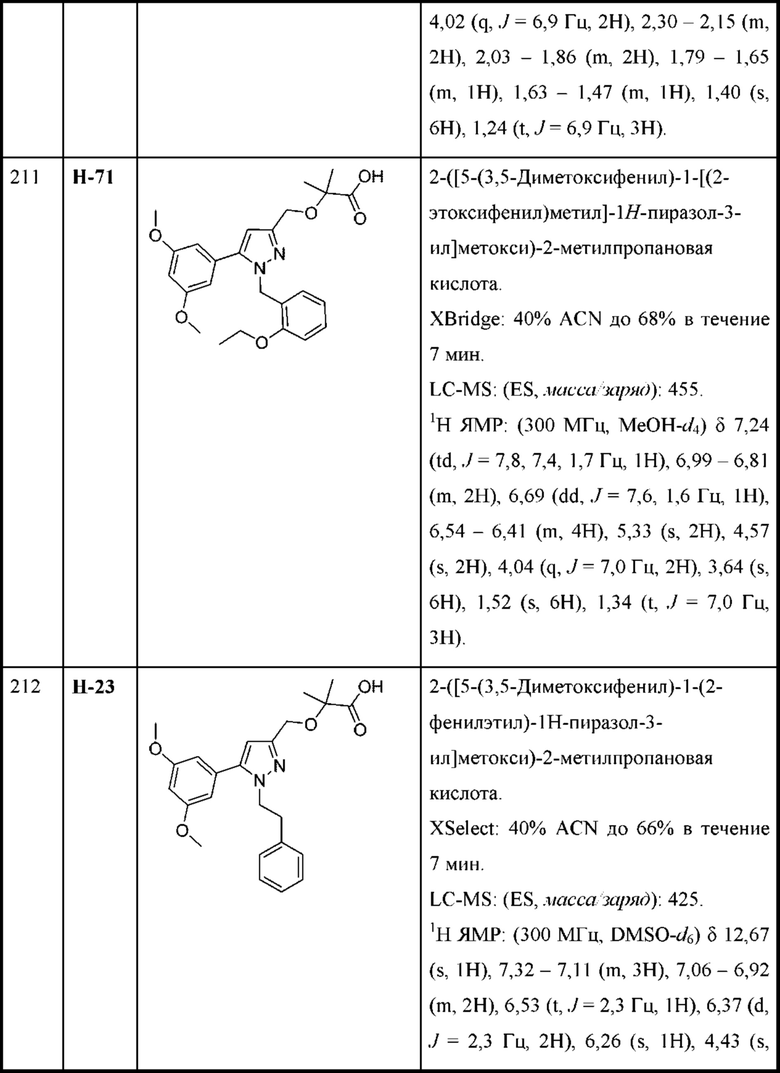
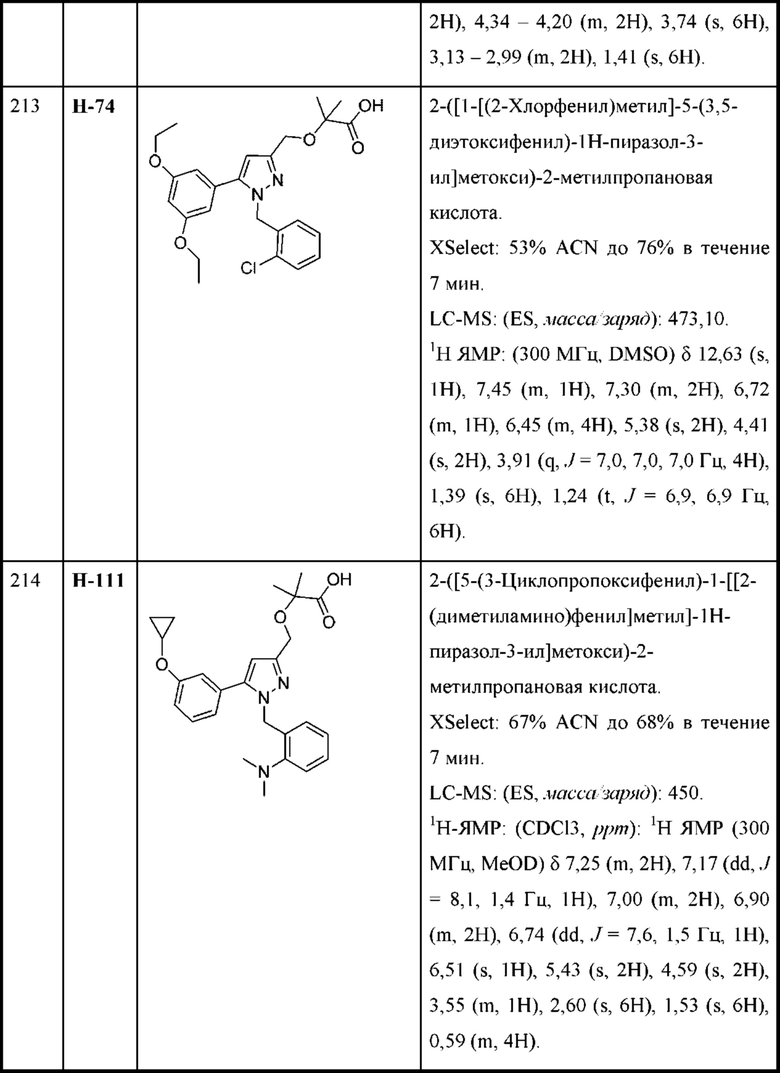
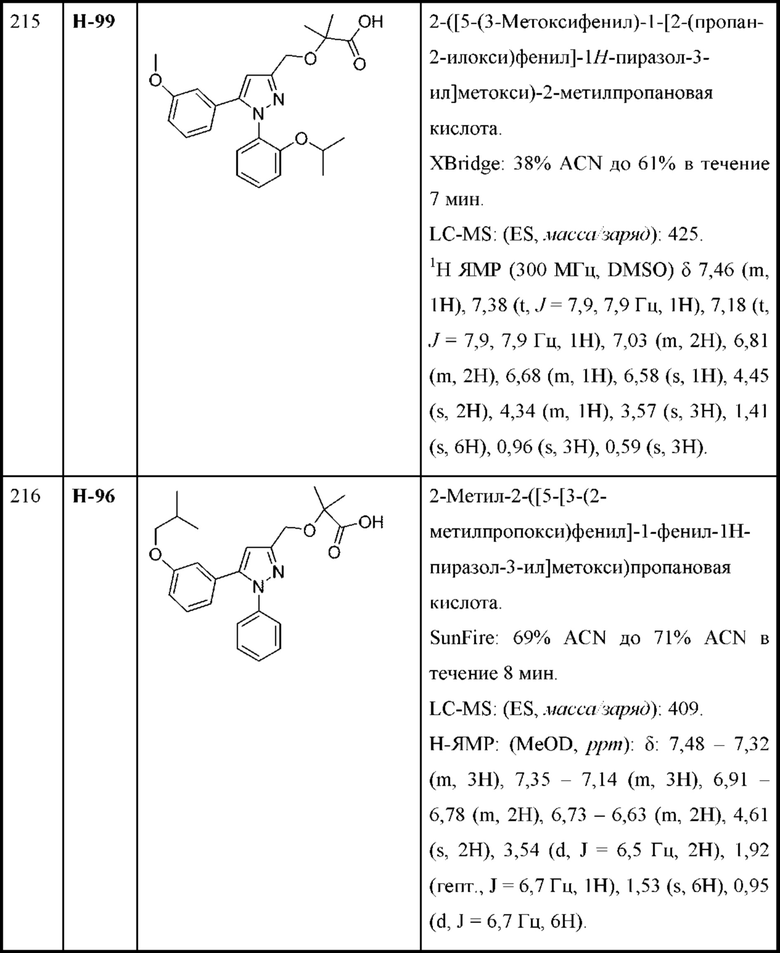
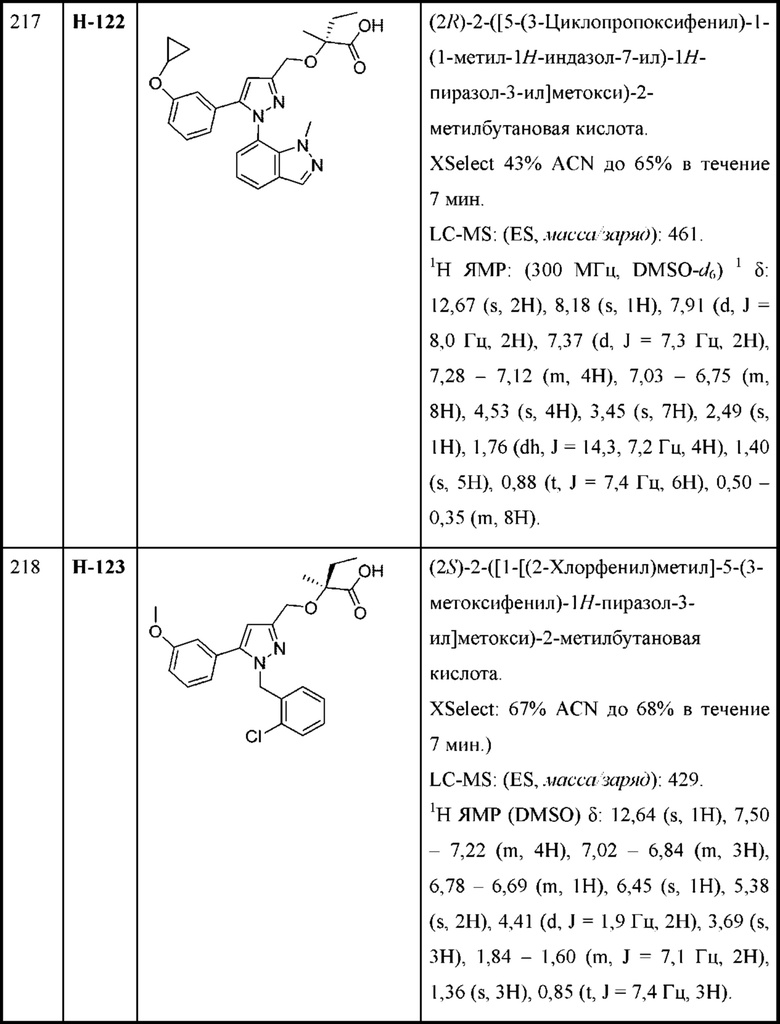
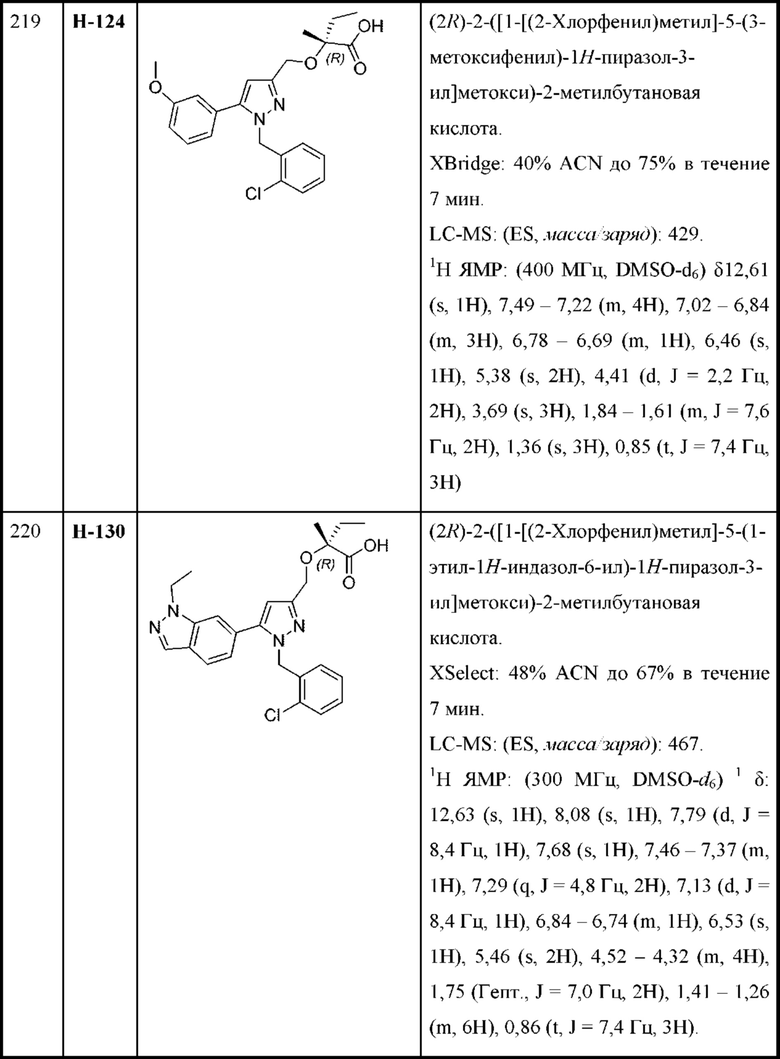
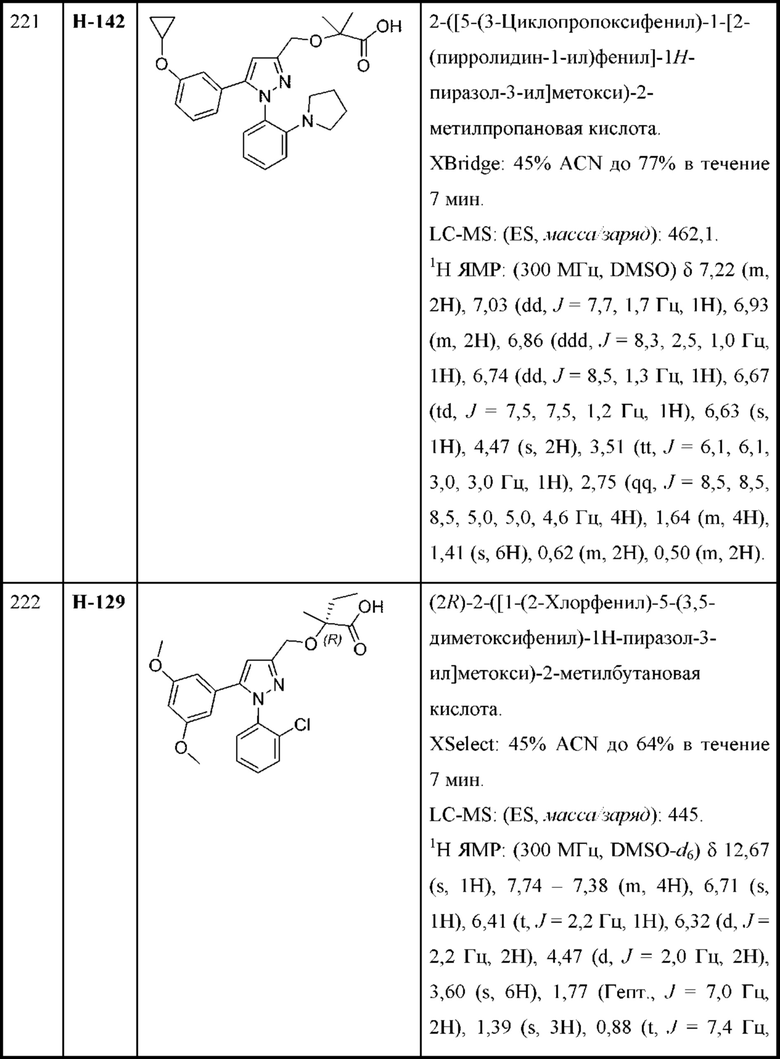
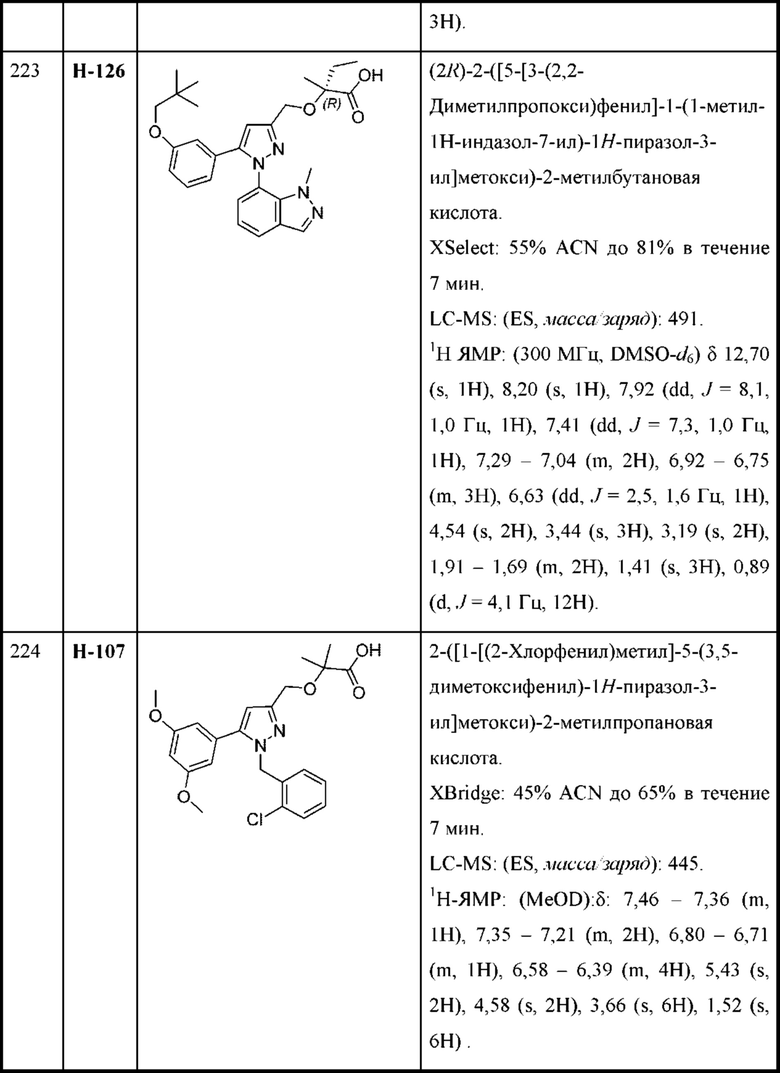
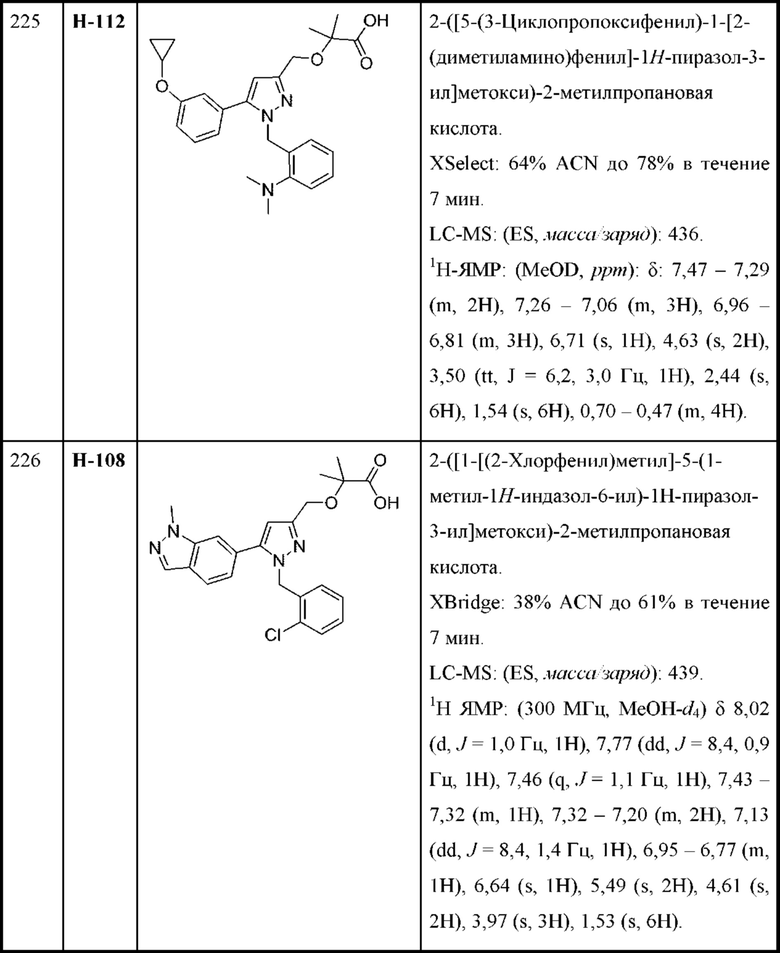
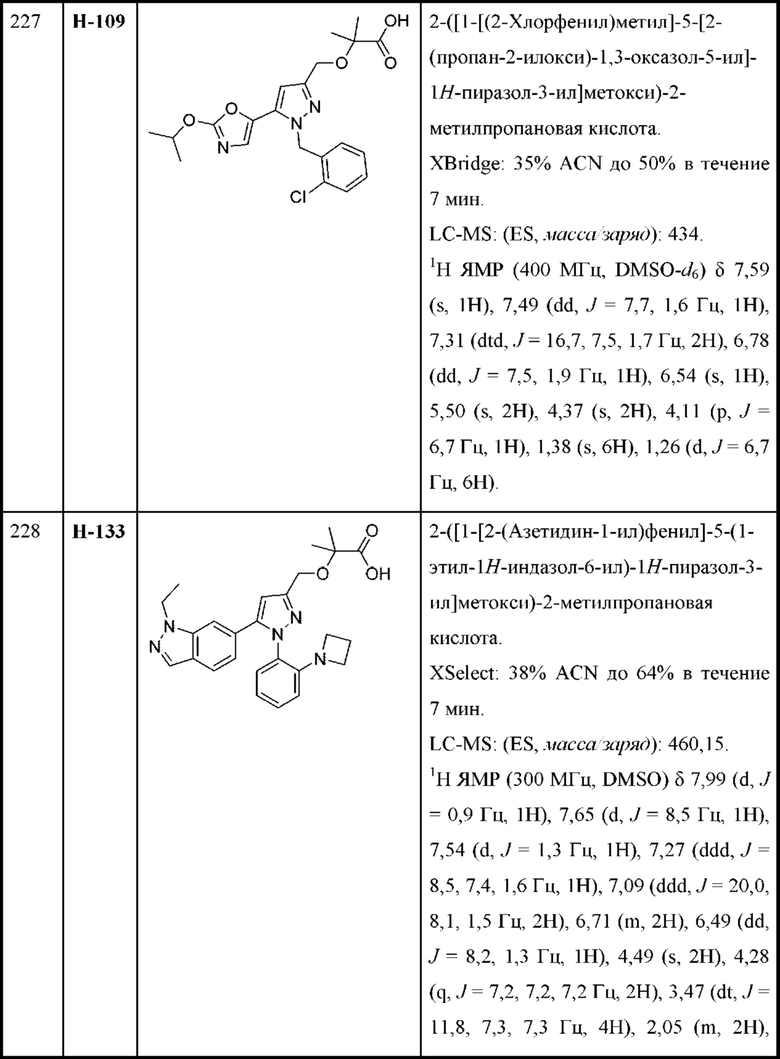
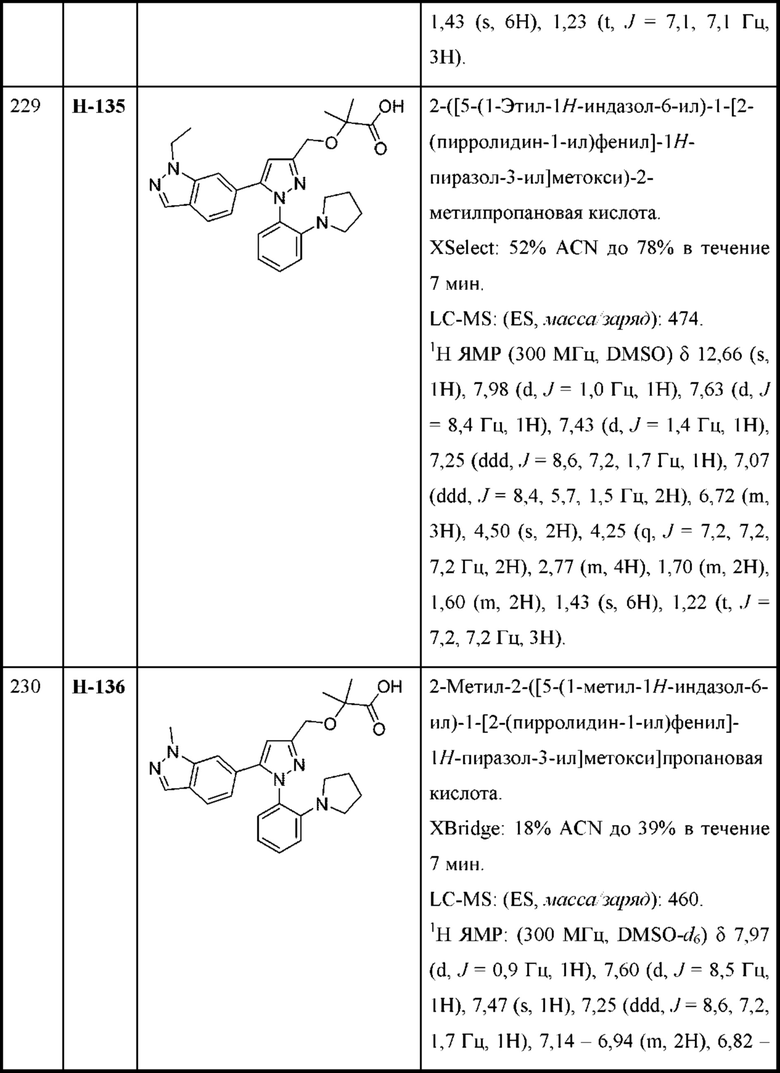
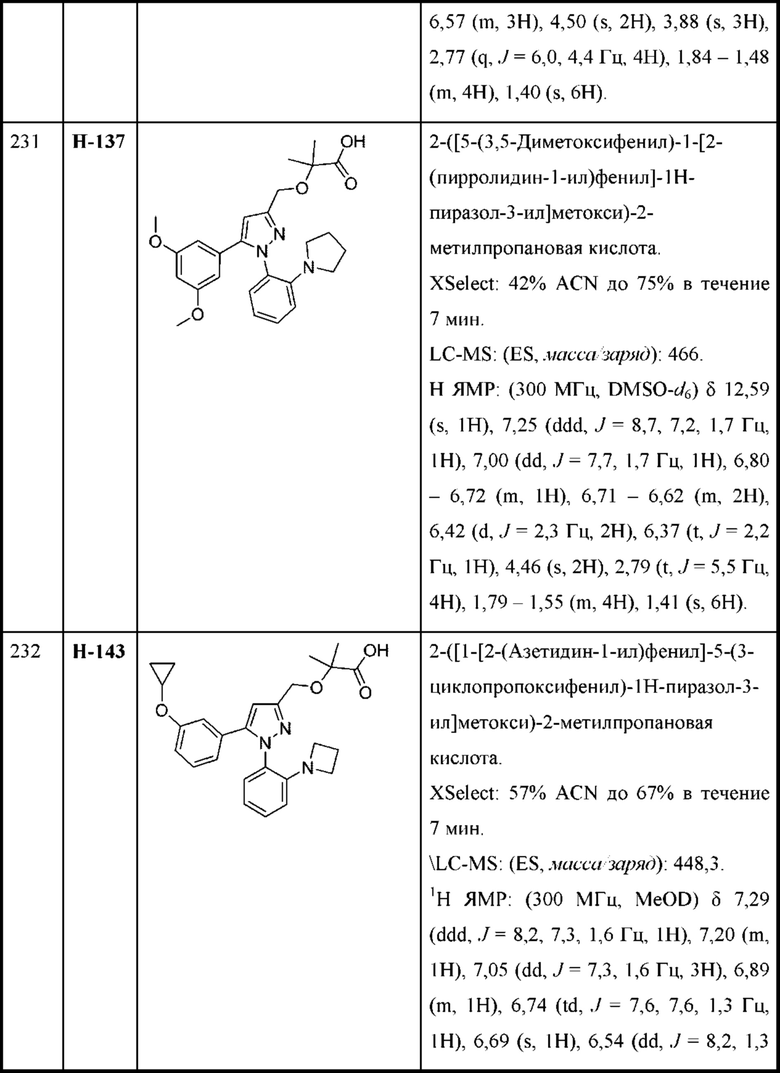
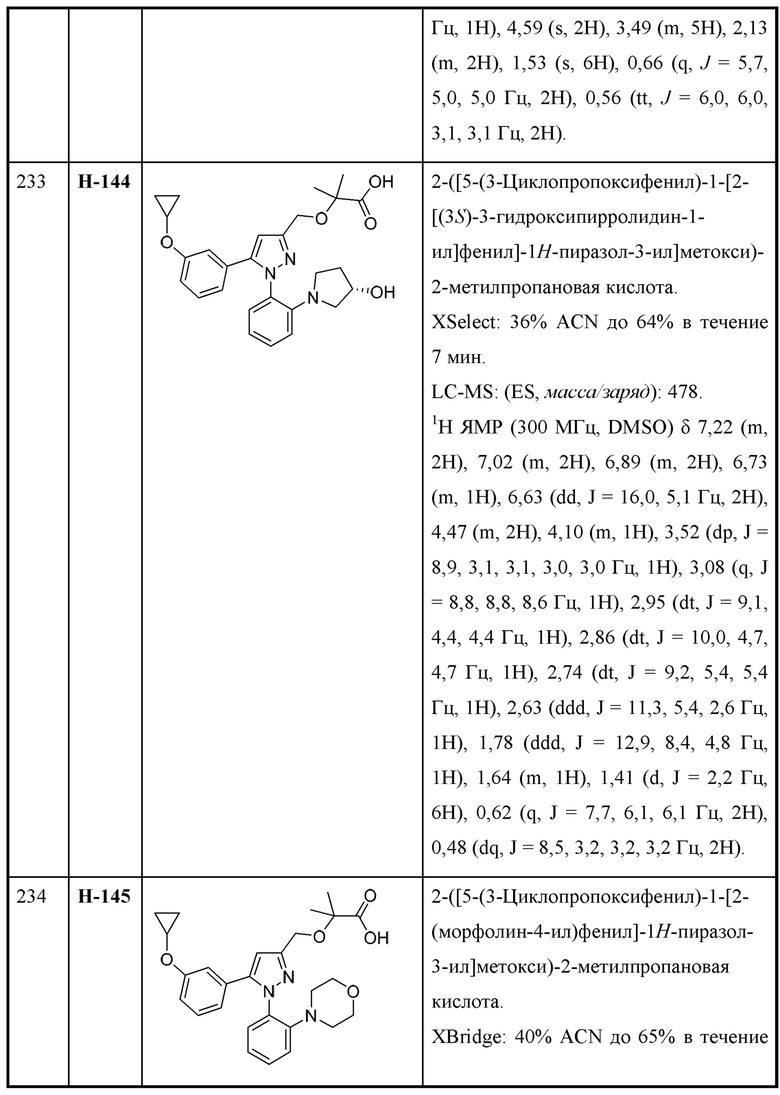
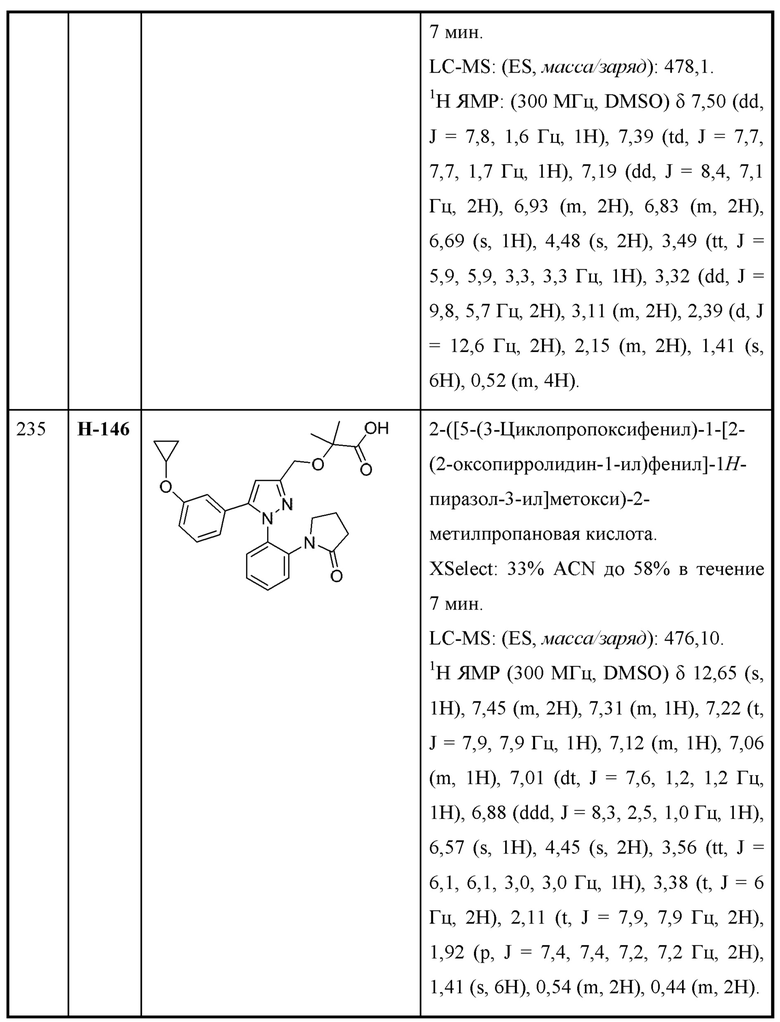
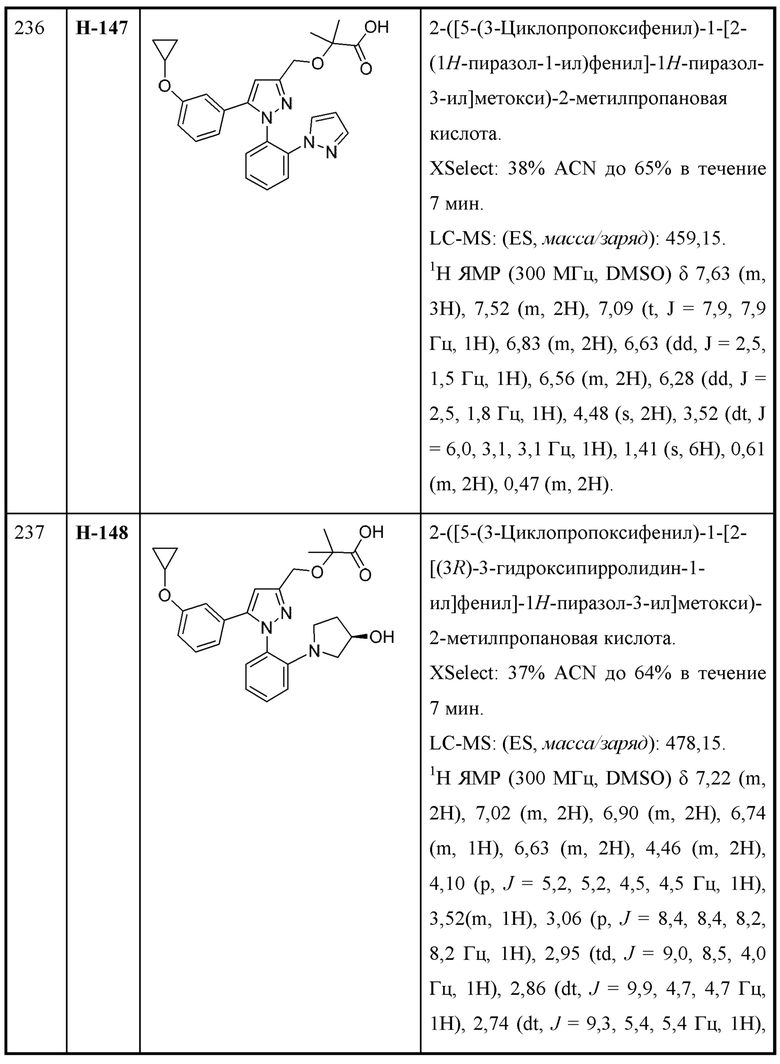
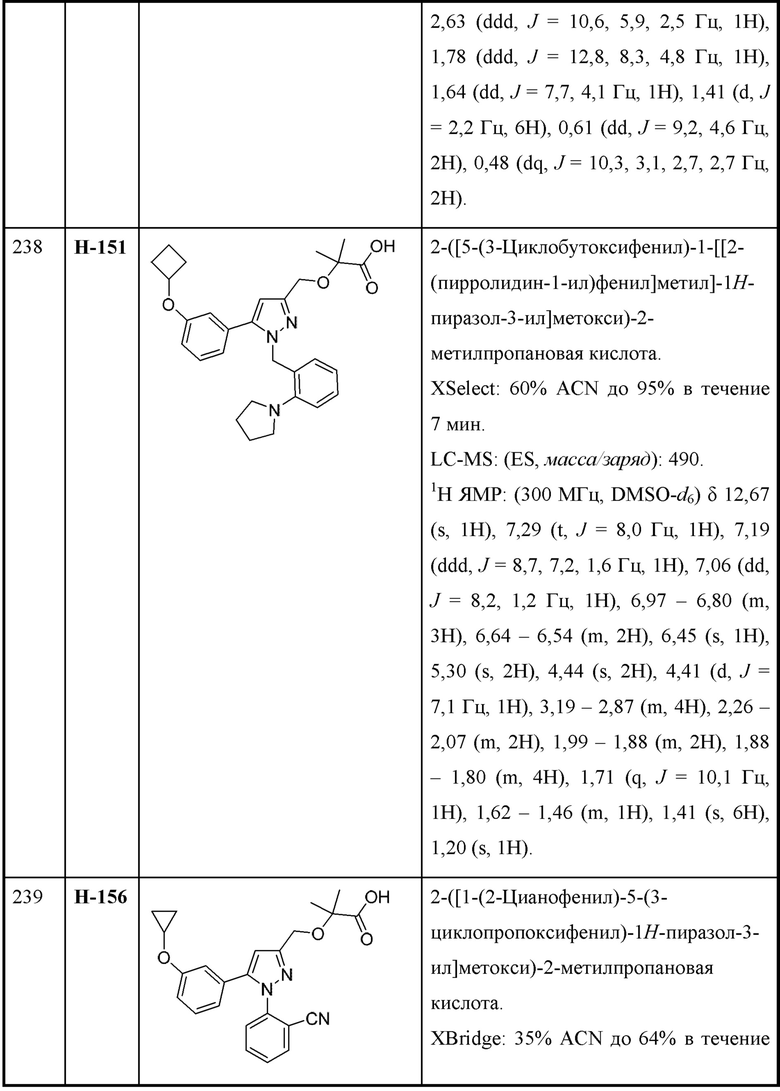
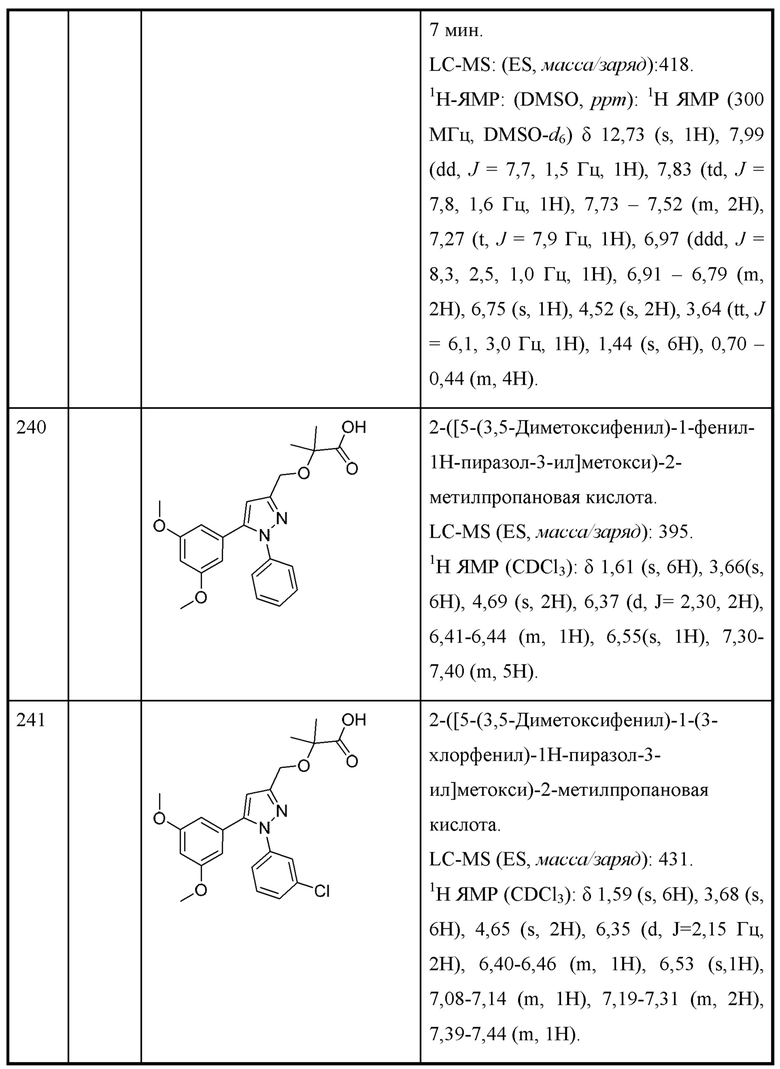
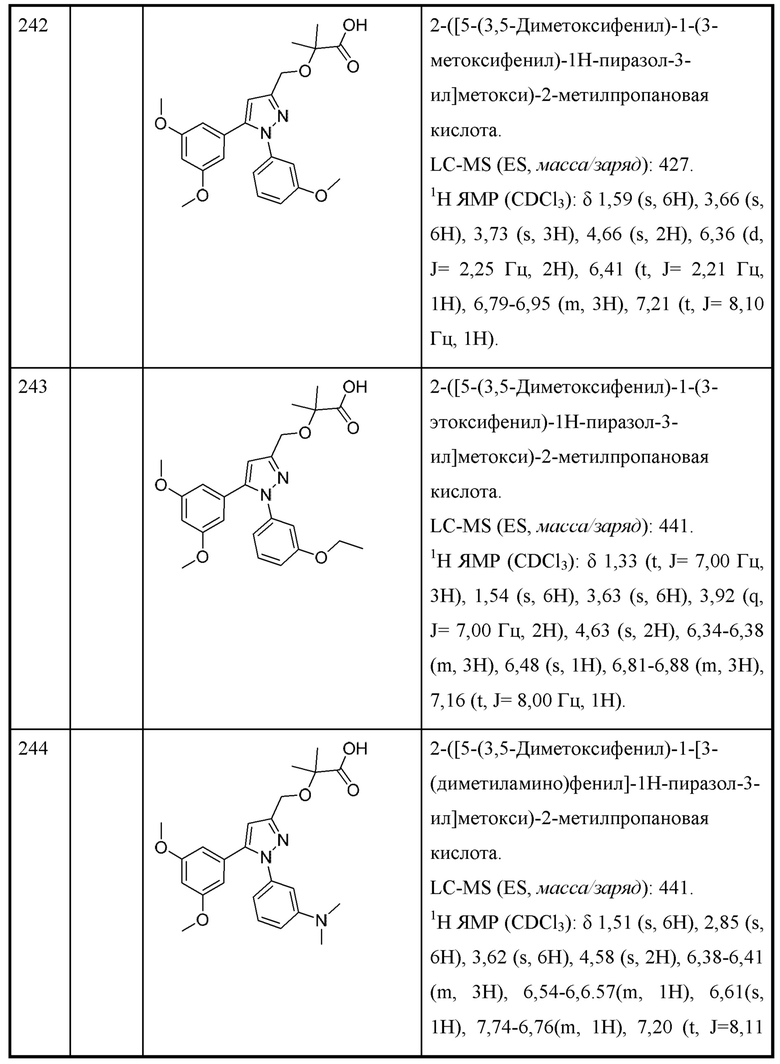
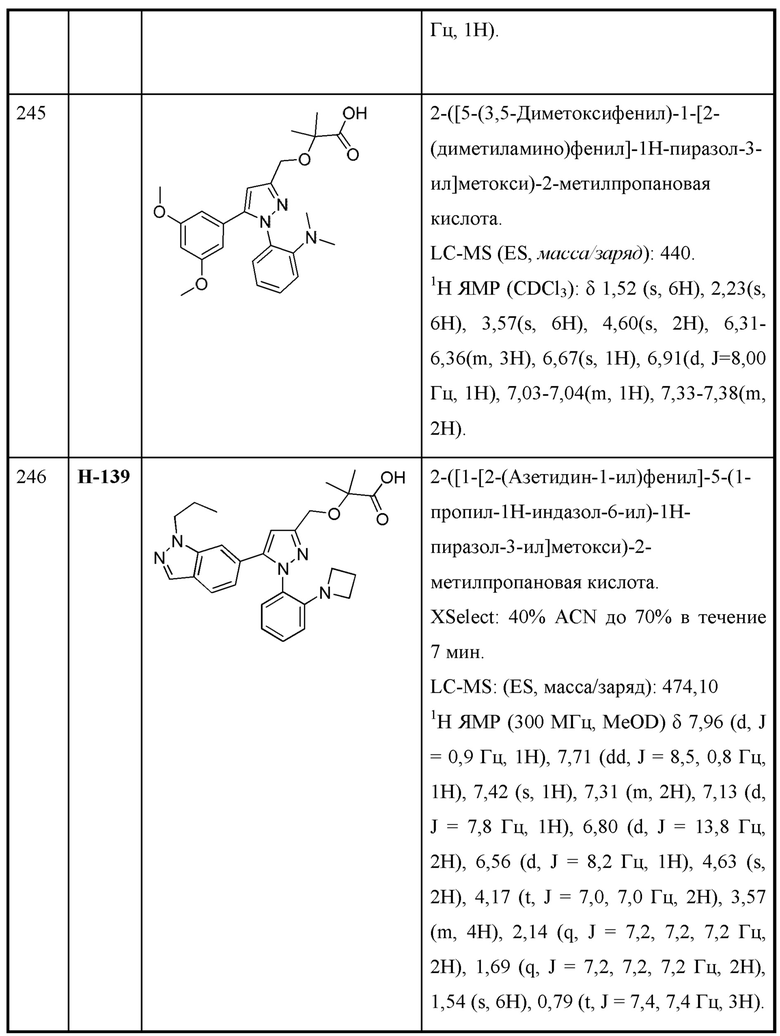
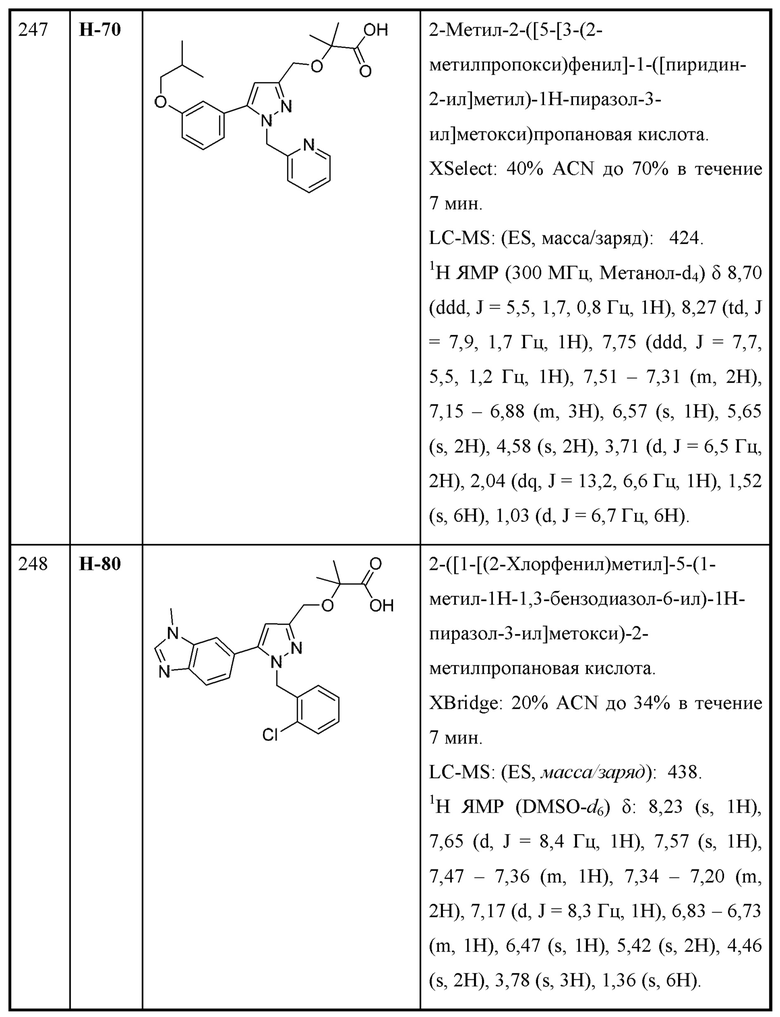
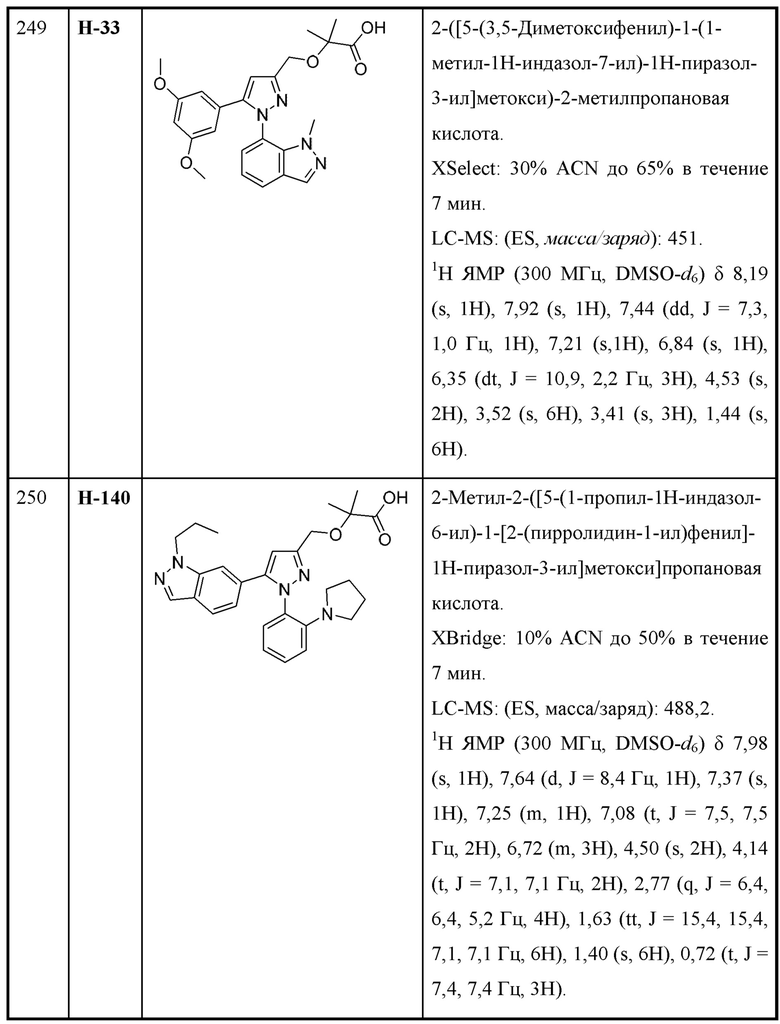
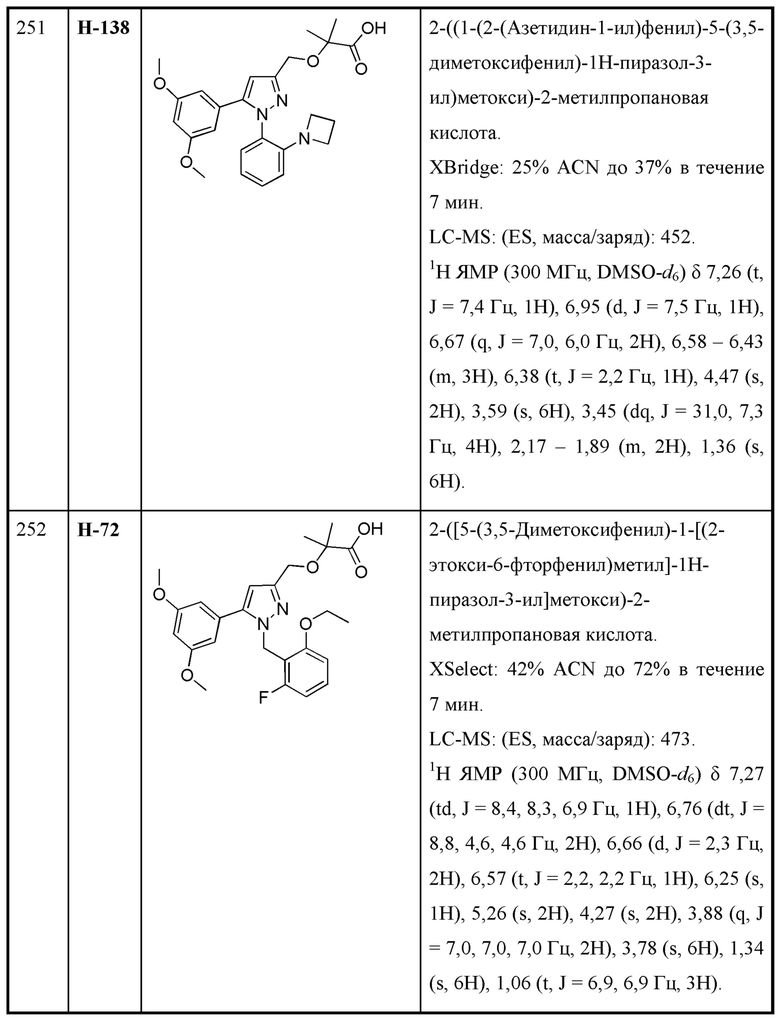
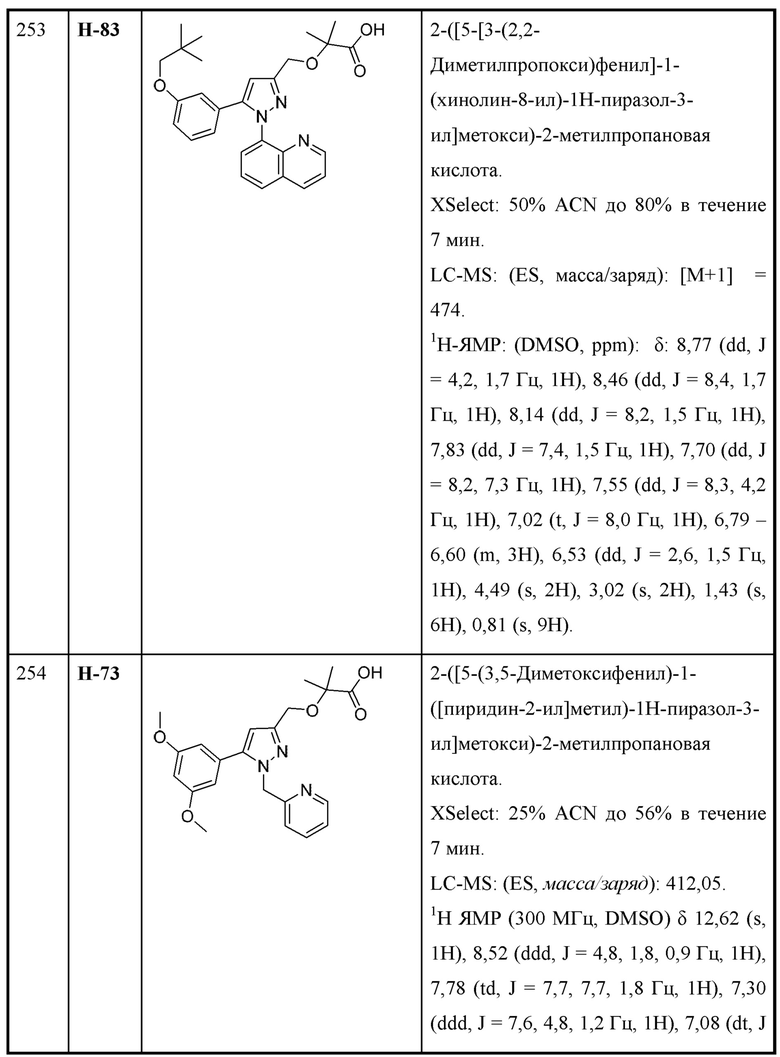
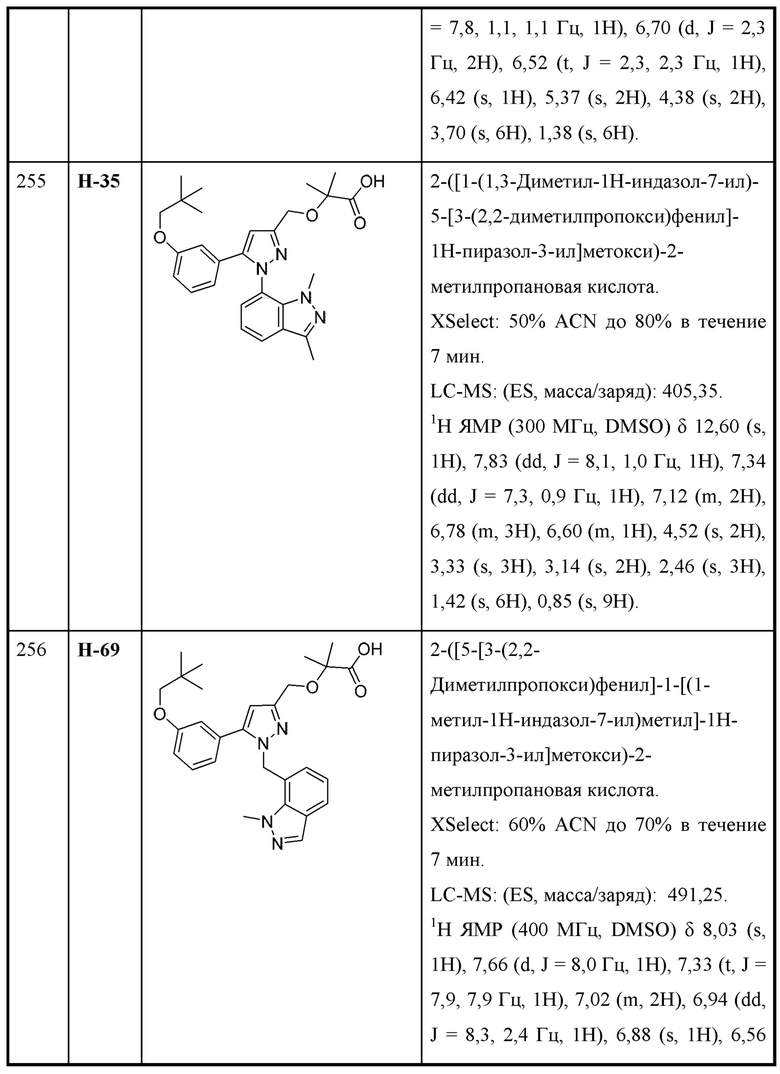
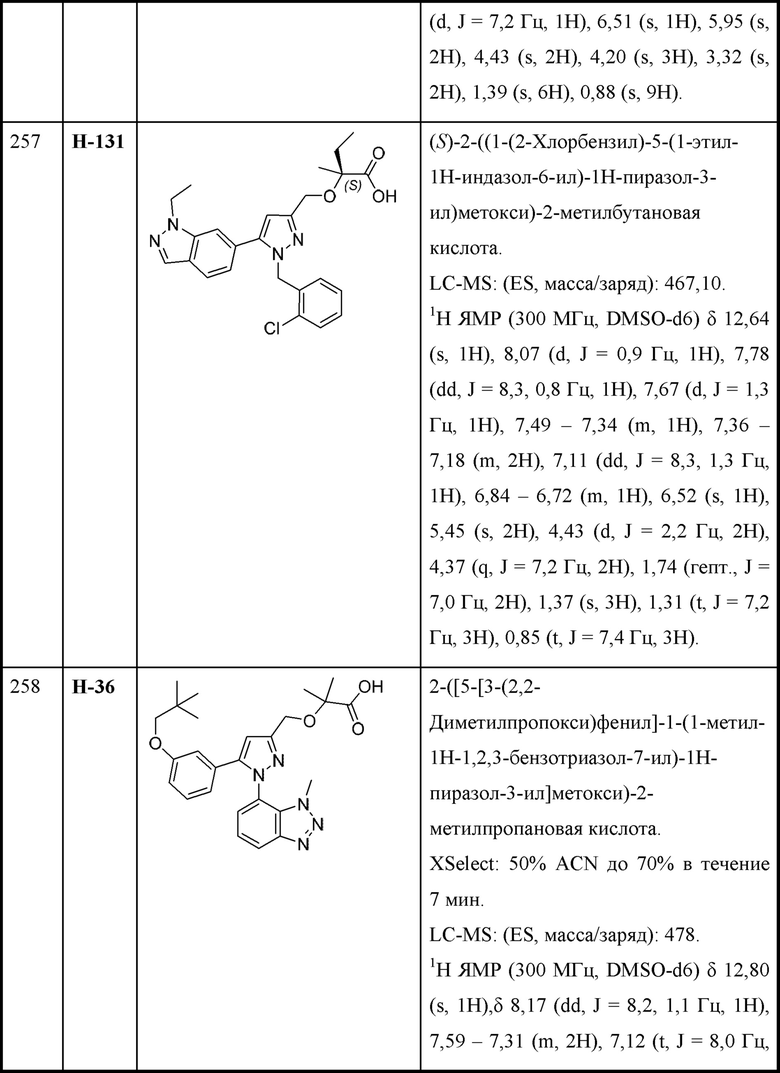
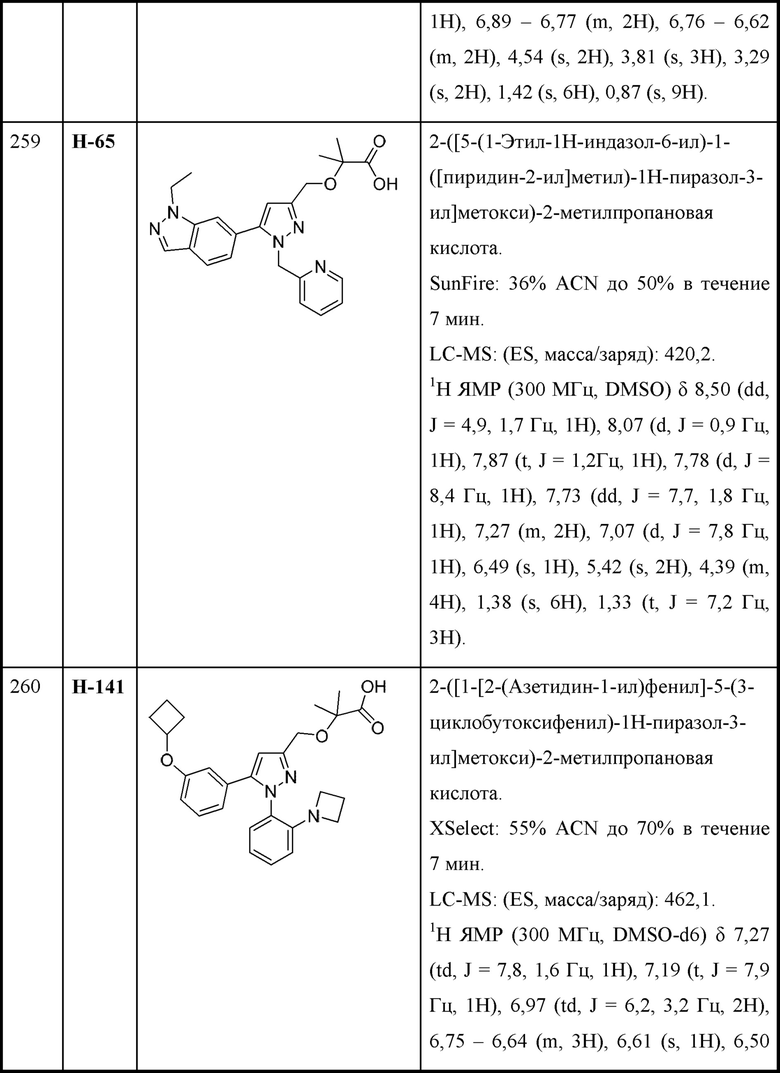
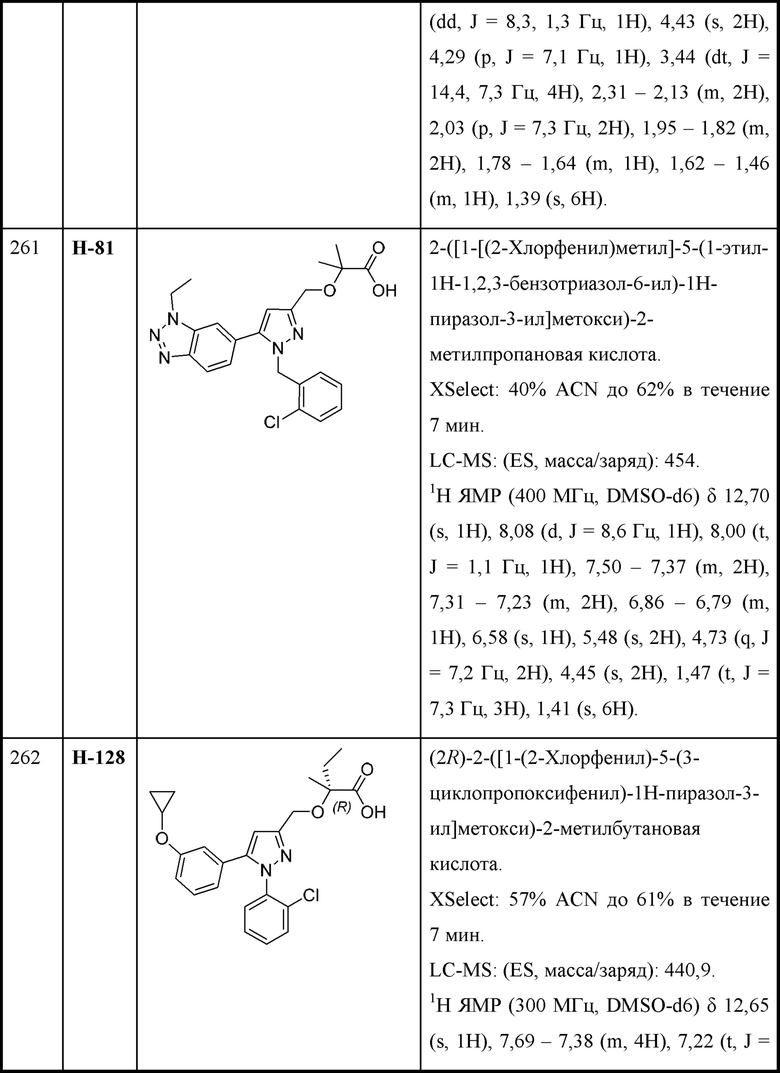
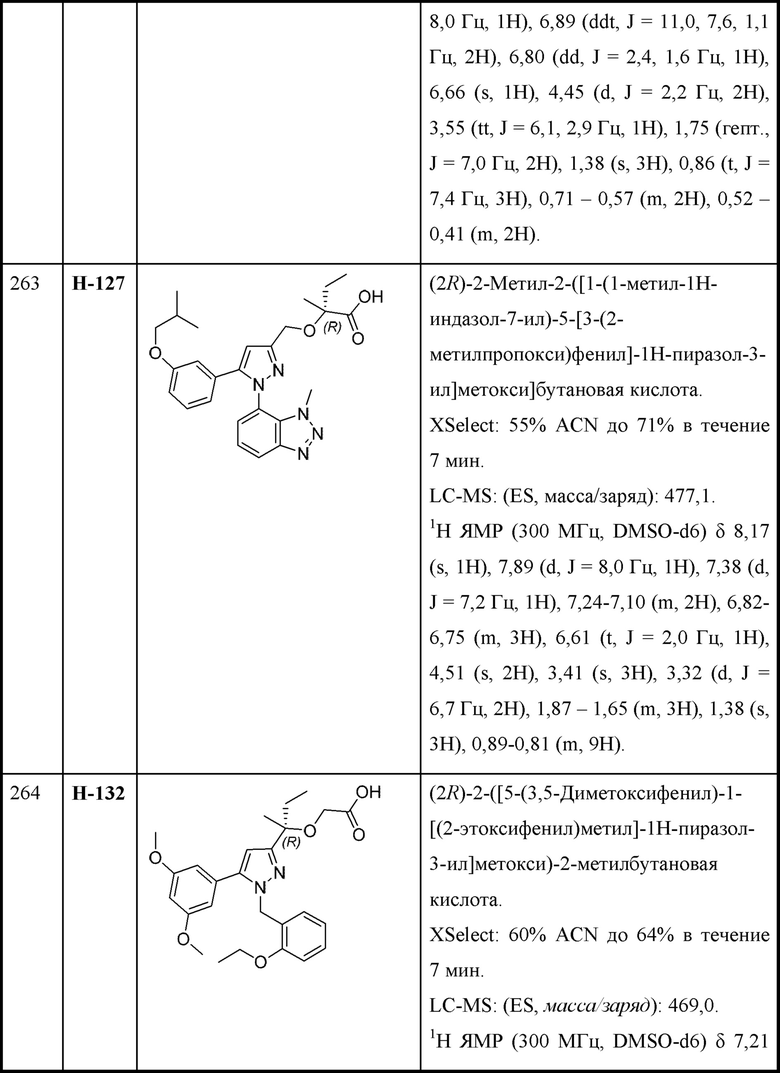
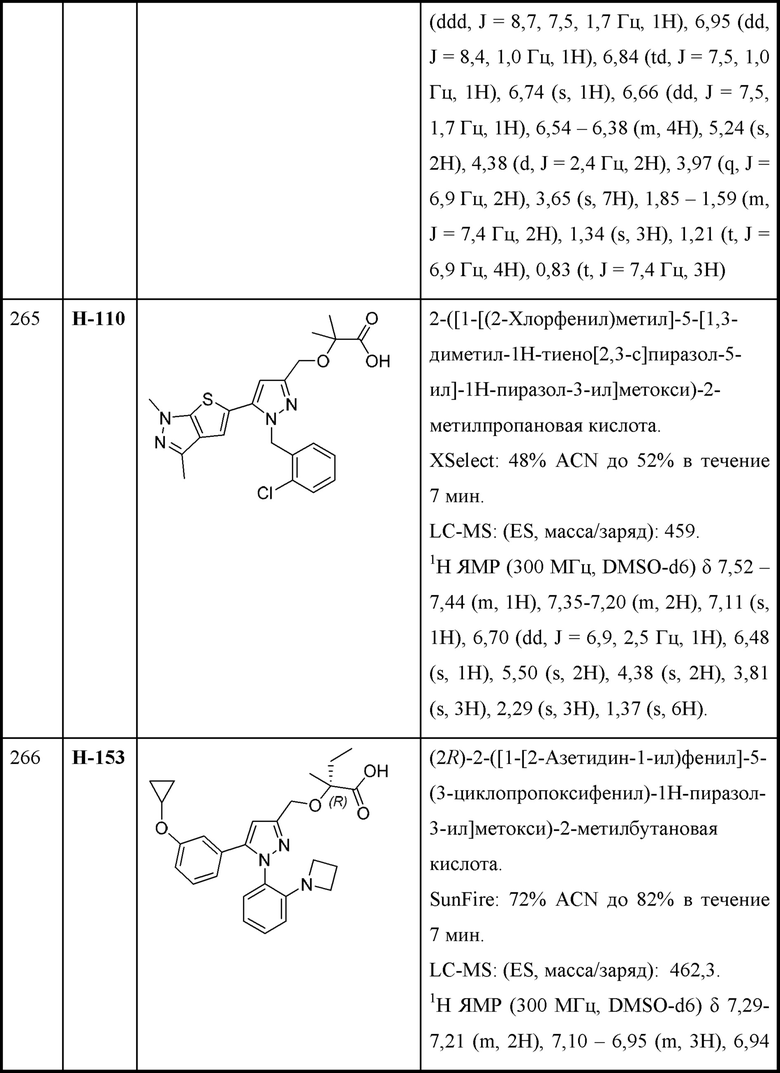
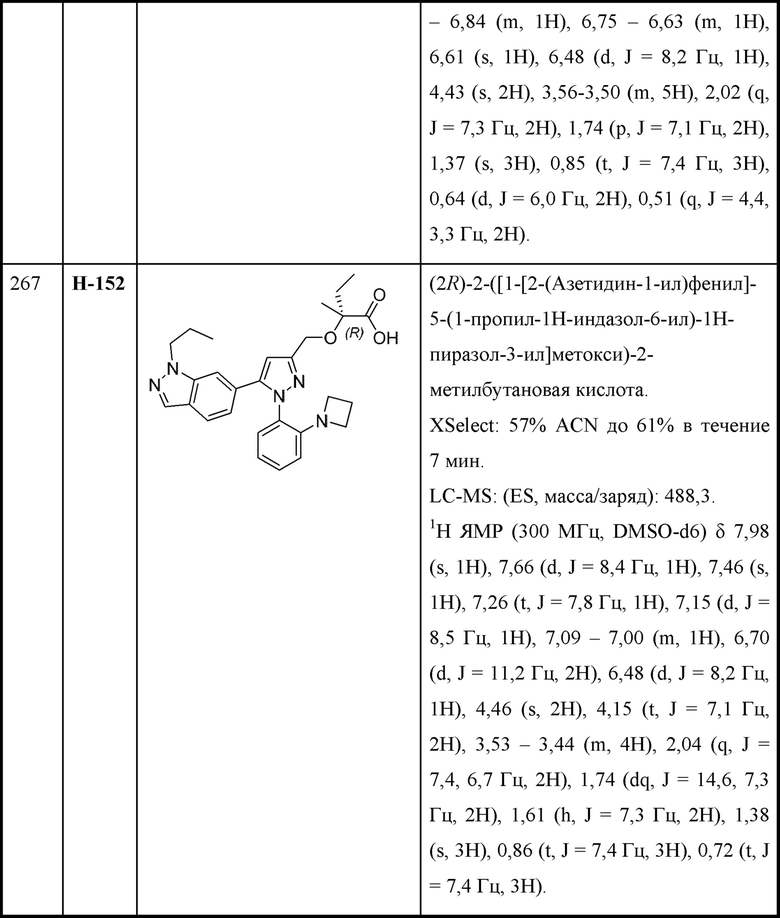
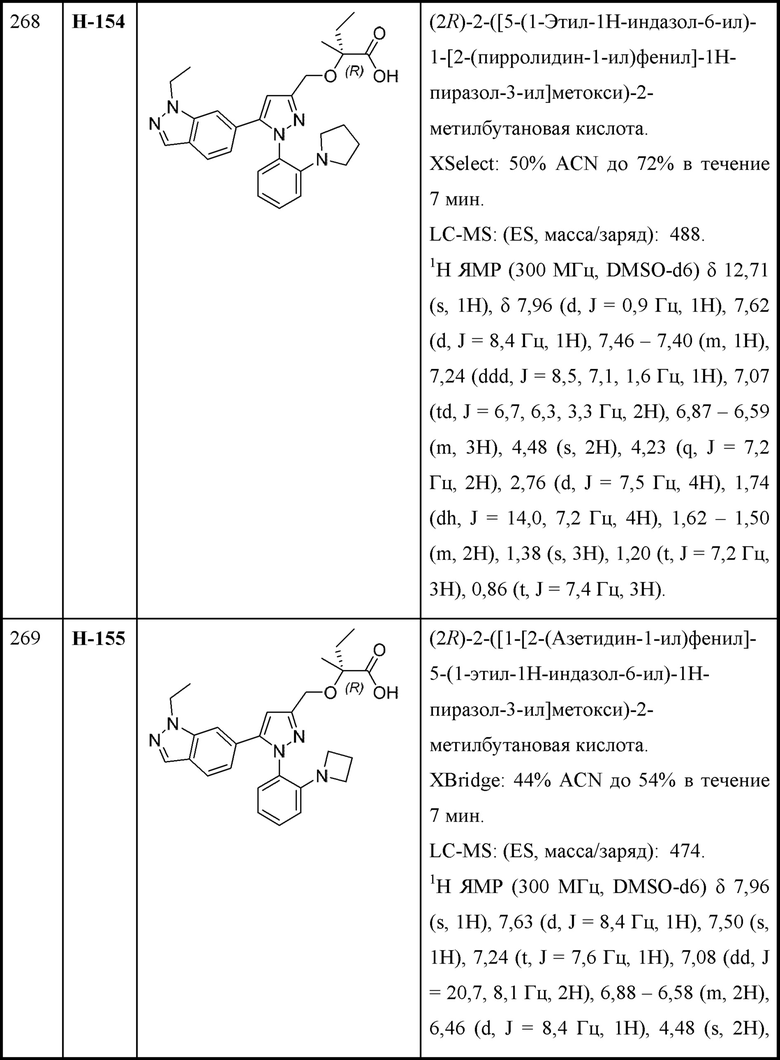

Активность соединений в примерах 1-269 в качестве ингибиторов МСТ4 проиллюстрирована в следующих анализах. Прогнозируют, что другие соединения, перечисленные выше, которые еще не были получены и/или протестированы, также обладают активностью в таких анализах.
Анализы в отношении биологической активности
Ниже представлены анализы, которые могут применяться для оценки биологической эффективности соединений формулы (I) образом, сходным с описанным ранее в отношении МСТ1 и МСТ4, и которые известны специалистам в данной области техники. См., например, Murray, С.М. et al., "Monocarboxylate transporter MCT1 is a target for immunosuppression," Nature chemical biology 1, 371-376 (2005); и Ovens, M.J., et al., "AR-C155858 is a potent inhibitor of monocarboxylate transporters MCT1 and MCT2 that binds to an intracellular site involving transmembrane helices 7-10," The Biochemical Journal 425, 523-530, (2010).
Получение клеток с загрузкой BCECF.
Клетки (~7×106) трипсинизируют (0,05% трипсин-EDTA), осаждают (300g, 5 мин.) и ресуспендируют в 1 мл раствора Тироде, рН 7,4 (119 мМ NaCl, 5 мМ KCl, 25 мМ HEPES, рН 7,4, 2 мМ CaCl2, 2 мМ MgCl2, 6 г/л глюкозы). Добавляют 10 мкл 30 мМ исходного DMSO раствора сложного эфира BCECF-AM (Life Technologies) и клетки инкубируют при 37°С в течение 5 мин. Клетки осаждают (300g, 5 мин.), промывают один раз 1 мл раствора Тироде, рН 7,4, повторно осаждают (300g, 5 мин.) и ресуспендируют в 1 мл раствора Тироде, рН 7,4.
Анализ 1. Транспорт лактата в репрессирующих МСТ4 клетках MDA-MB-453 рака молочной железы.
МСТ4 может стабильно экспрессироваться в клетках MDA-MB-453 рака молочной железы, которые не экспрессируют нативный МСТ1 или МСТ4. Активность МСТ4 можно оценить путем контроля изменения внутриклеточного рН, которое сопровождает симпорт лактата/протонов, с применением рН-чувствительного флуоресцентного красителя 2',7'-бис(карбоксиэтил)-5(6)-карбоксифлюоресцеина (BCECF), образом, сходным с описанным ранее в отношении МСТ1 и МСТ4. Ниже следует иллюстративная процедура проведения анализа в отношении активности МСТ4 соединений формулы (I).
Анализ 2. Опосредованный МСТ4 транспорт лактата в клетках NCI-H358 аденокарциномы легкого.
Клетки NCI-H358 аденокарциномы легкого могут применяться для измерения активности МСТ4 в клетках с высокими нативными уровнями МСТ4 и низкими уровнями МСТ1, и они известны специалистам в данной области техники. Получение клеток с загрузкой BCECF и активность транспорта лактата могут быть определены, как описано для анализа 1.
Анализ 3. Опосредованный МСТ4 транспорт лактата в клетках MDA-MB-231 рака молочной железы.
Клетки MDA-MB-231 рака молочной железы могут применяться для измерения активности МСТ4 в клетках с высокими нативными уровнями МСТ4 и низкими уровнями МСТ1, и они известны специалистам в данной области техники. Активность МСТ4 можно оценить путем контроля изменения внутриклеточного рН, которое сопровождает симпорт лактата/протонов, с применением рН-чувствительного флуоресцентного красителя 2',7'-бис(карбоксиэтил)-5(6)-карбоксифлюоресцеина (BCECF), образом, сходным с описанным ранее в отношении МСТ1 и МСТ4. Ниже следует иллюстративная процедура проведения анализа в отношении активности МСТ4 соединений формулы (I).
Анализ 4. Опосредованный МСТ1 транспорт лактата в клетках ВТ20 рака молочной железы.
Активность МСТ1 можно измерять с применением клеток ВТ-20 рака молочной железы, которые экспрессируют высокие нативные уровни МСТ1, но не экспрессируют МСТ4, и они известны специалистам в данной области техники. Получение клеток с загрузкой BCECF описано для анализа 1. Анализ транспорта лактата является описанным для анализа 1, за исключением добавления 10 мМ L-лактата (а не 50 мМ).
Результаты приведенных выше анализов представлены ниже в таблицах 26 и 27, в которых "ND" означает отсутствие данных. Как можно увидеть, большинство соединений, раскрытых в данном документе, являются более селективными в отношении МСТ4, а не МСТ1.
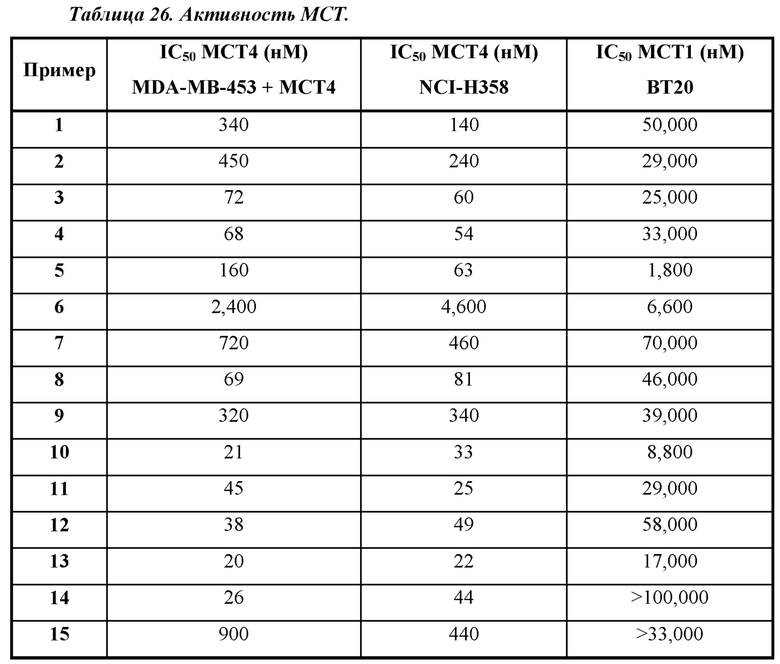
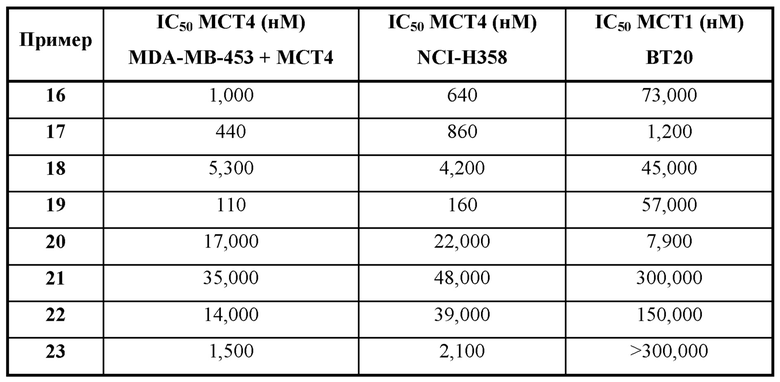
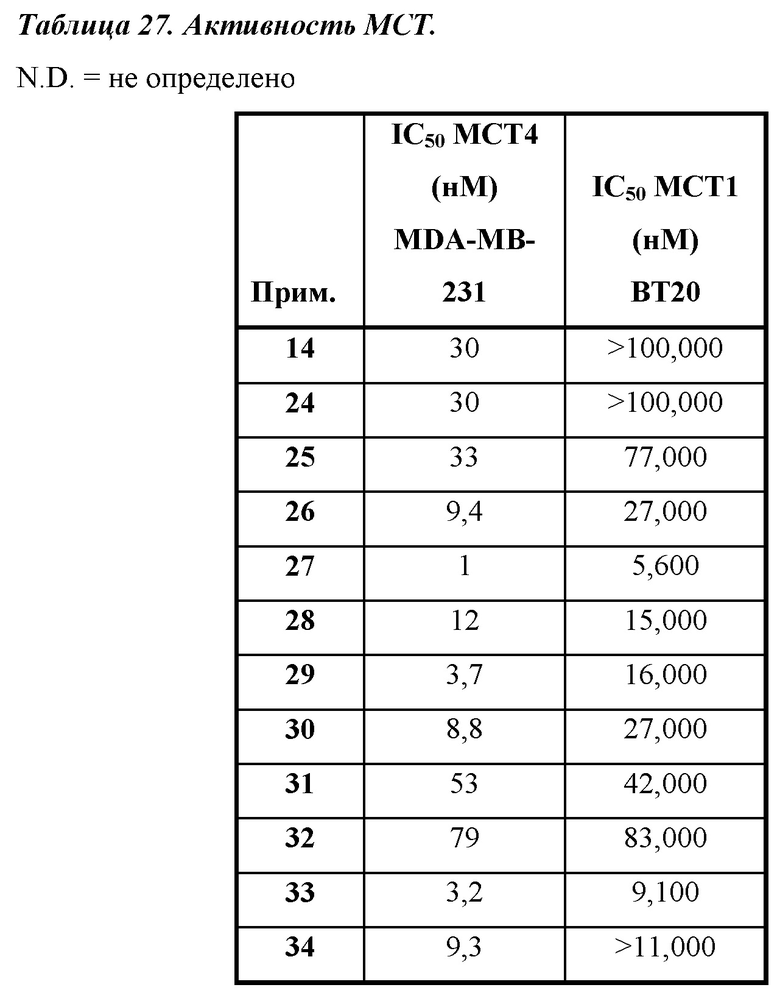
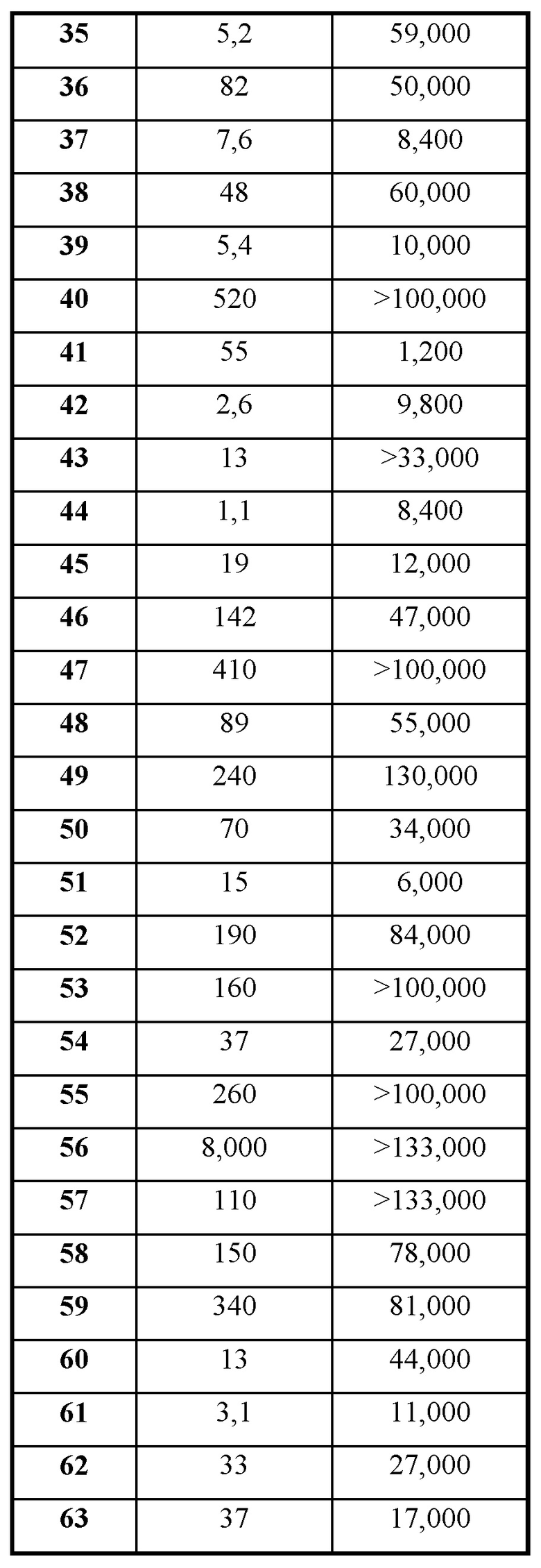
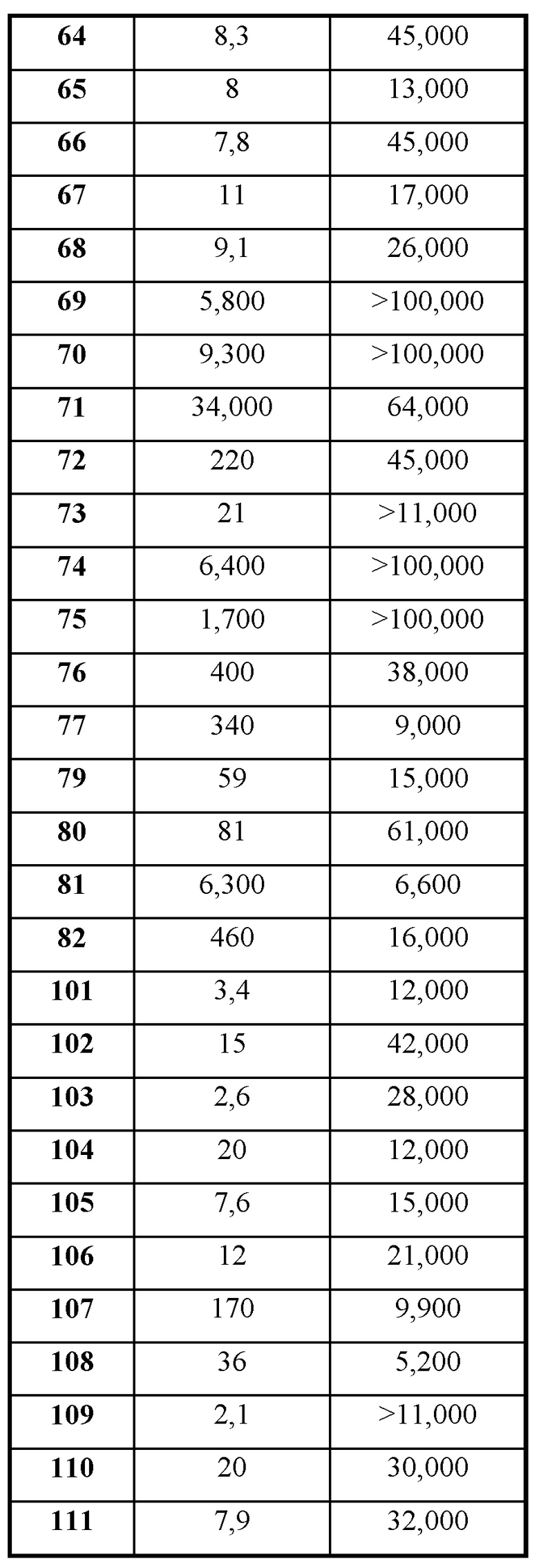
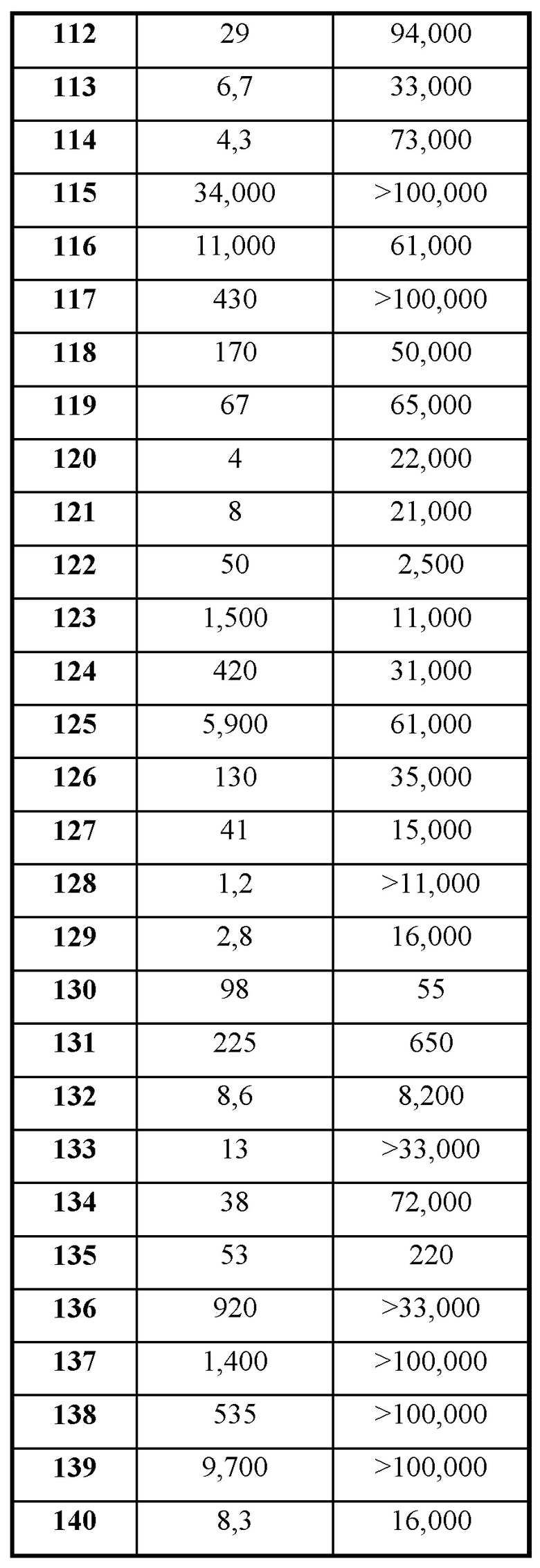
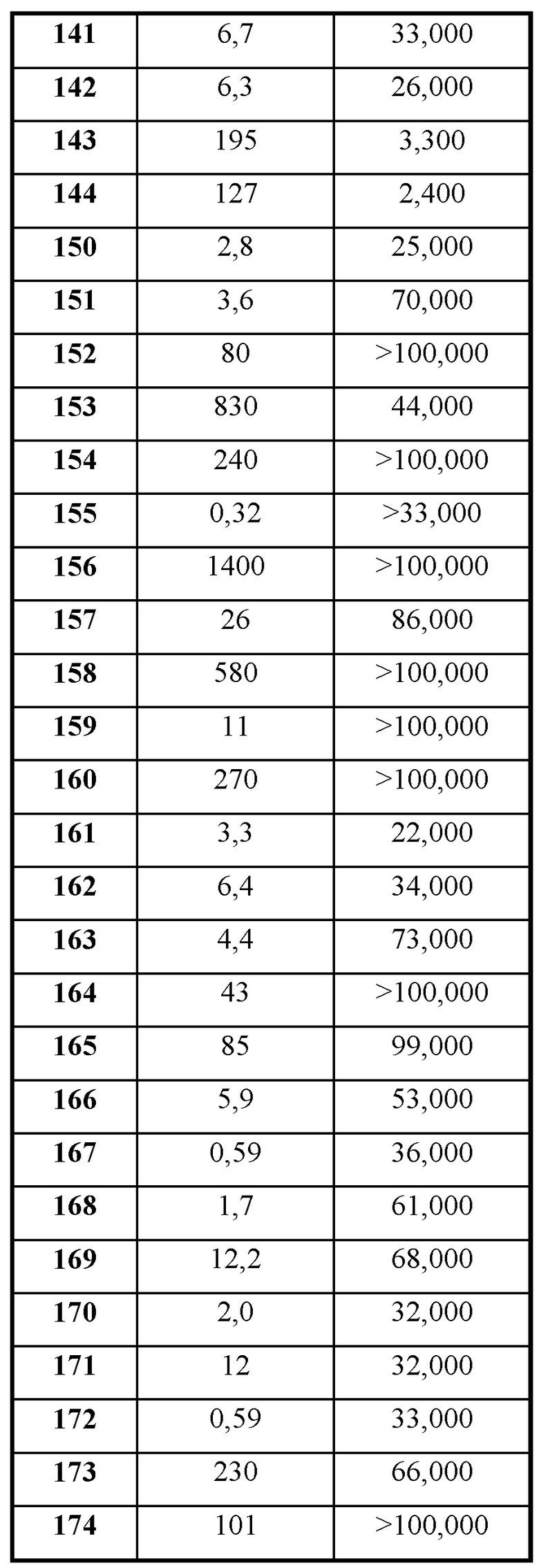
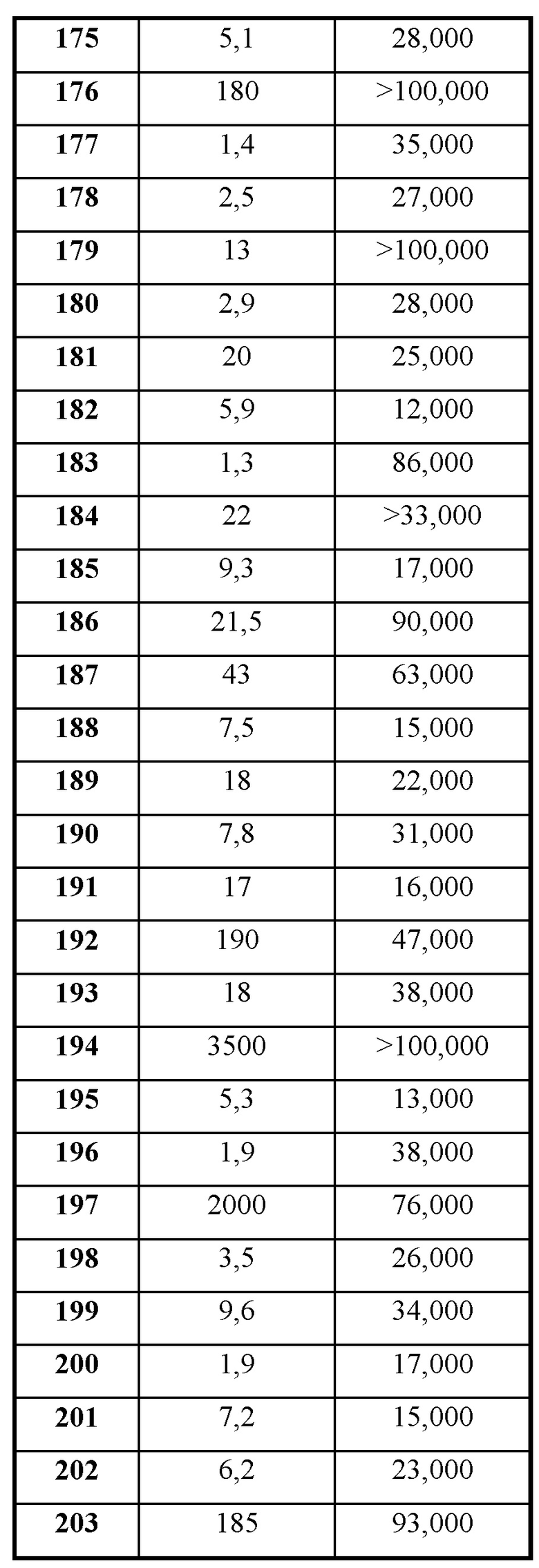
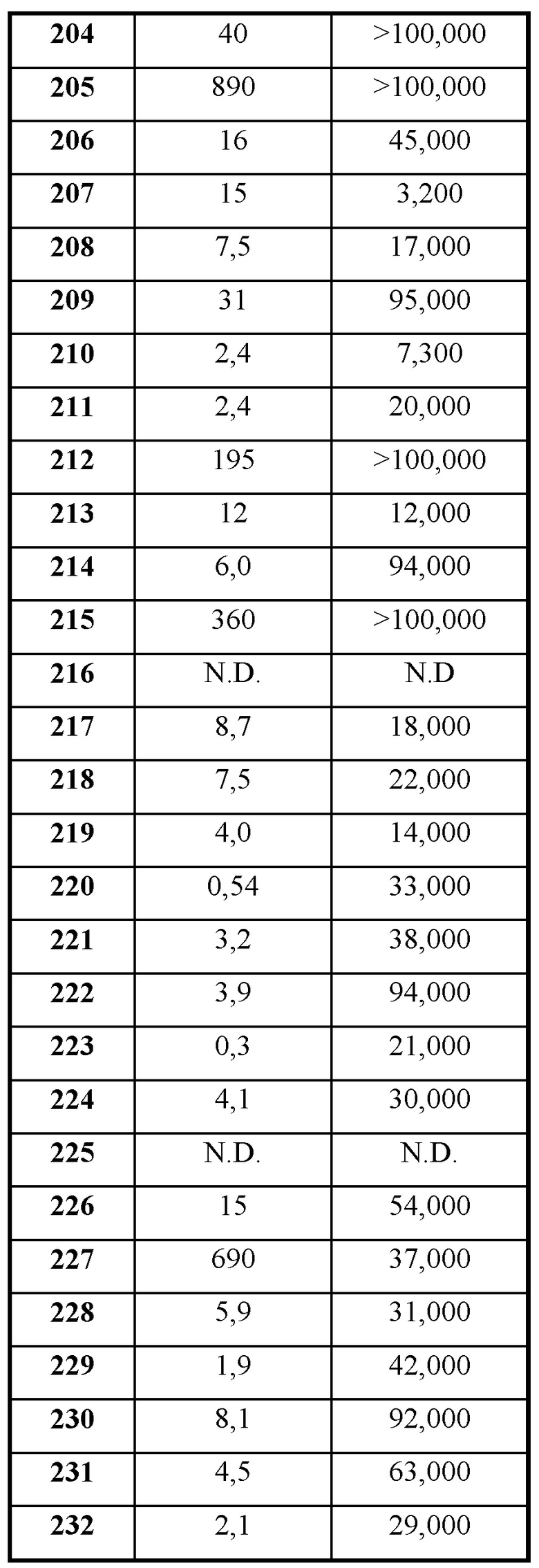
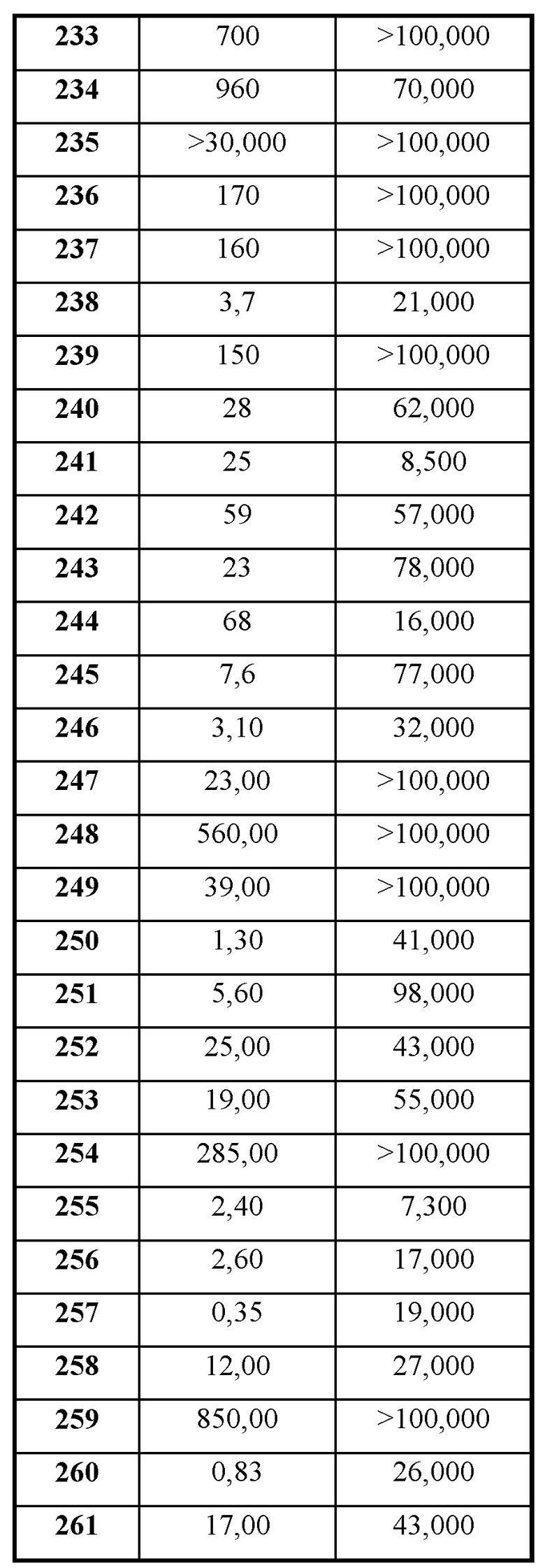
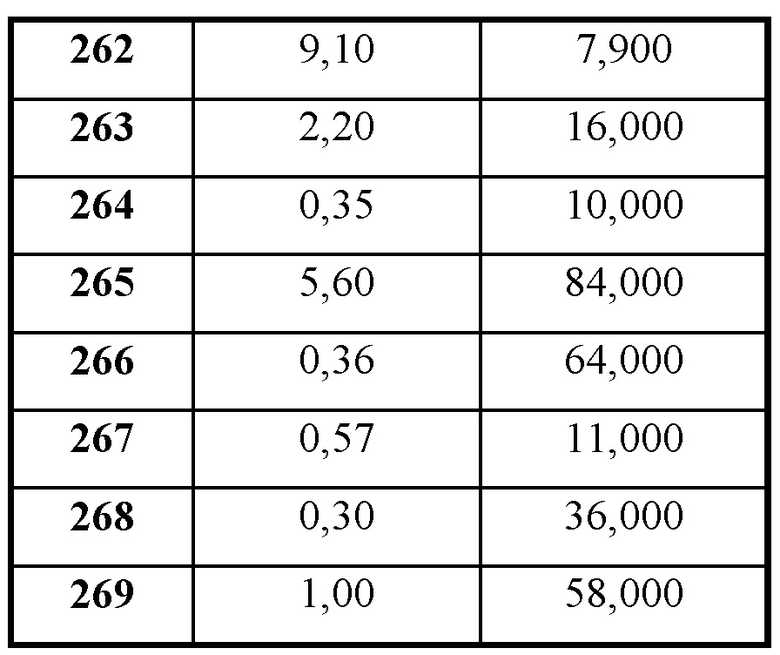
Анализы метаболической стабильности
Ниже представлены анализы, которые можно применять для оценки метаболической стабильности соединений формулы (I) в микросомах человека, крысы или мыши. Анализы соответствуют общепринятой процедуре, изложенной ниже.
1. Исходный раствор: 200 мкл 200 мМ фосфатного буфера, 106 мкл сверхчистой воды, 40 мкл 50 мМ MgCl2 и 10 мкл 20 мг/мл микросом печени (человека, крысы или мыши).
2. Два отдельных эксперимента проводили следующим образом, а) С NADPH: 10 мкл 20 мг/мл микросом печени и 40 мкл 10 мМ NADPH добавляли к инкубациям. Конечные концентрации микросом и NADPH составляли 0,5 мг/мл и 1 мМ соответственно. b) Без NADPH: 10 мкл 20 мг/мл микросом печени и 40 мкл сверхчистой Н2О добавляли к инкубациям. Конечная концентрация микросом составляла 0,5 мг/мл.
3. Проведение реакции начинали с помощью добавления 4 мкл 200 мкМ растворов контрольного соединения или исследуемого соединения. В качестве положительного контроля в данном исследовании применяли верапамил. Конечная концентрация исследуемого соединения или контрольного соединения составляла 2 мкМ.
4. Аликвоты 50 мкл брали из реакционного раствора в моменты 0, 15, 30, 45 и 60 мин. Реакцию останавливали путем добавления 4 объемов холодного ацетонитрила с IS (100 нМ альпразолама, 200 нМ лабеталола и 2 мкМ кетопрофена). Образцы центрифугировали при 3220 g в течение 40 минут. Аликвоту 90 мкл супернатанта смешивали с 90 мкл сверхчистой Н2О и затем применяли для анализа LC-MS/MS.
5. Анализ данных. Все расчеты проводили с применением Microsoft Excel. Площади пиков определяли из полученных ионных хроматограмм. Значение угла наклона, k, определяли с помощью линейной регрессии натурального логарифма оставшейся доли в процентах исходного лекарственного средства относительно кривой времени инкубации. Время полужизни in vitro (in vitro t1/2) определяли на основе значения угла наклона: in vitro t1/2 = -(0,693)/k.
Результаты представлены ниже в таблице 28, где "ND" означает отсутствие данных.
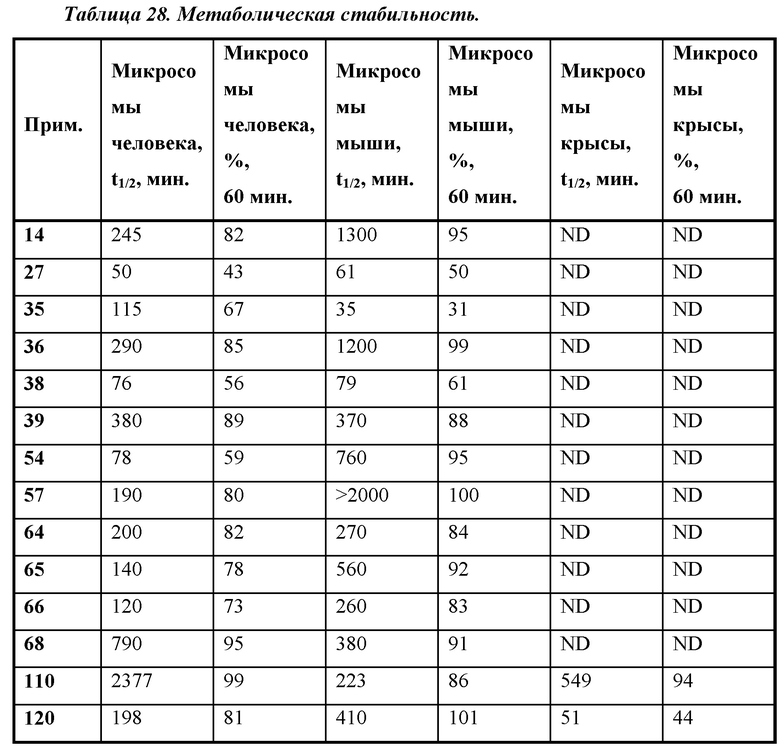
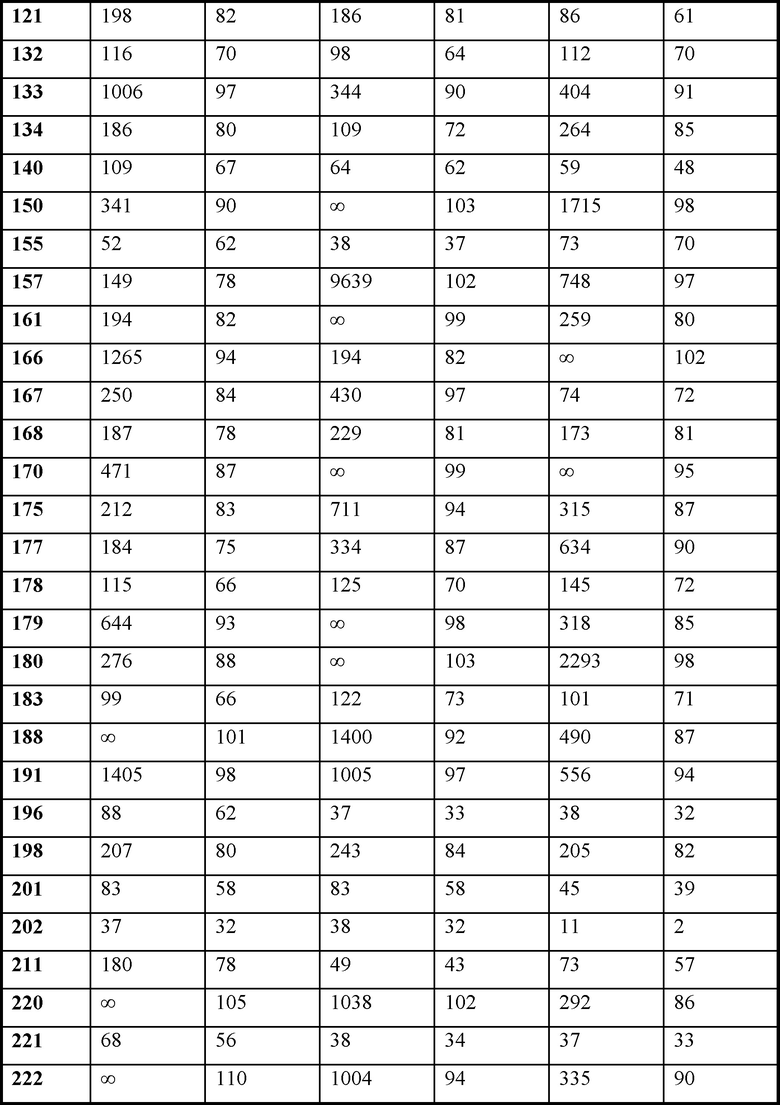

Фармакокинетические анализы у мыши и крысы
Ниже представлены анализы, которые можно применять для оценки фармакокинетических свойств формулы (I) у мыши или крысы. Анализы соответствуют общепринятой процедуре, изложенной ниже.
1. Составы. Для IV, DMSO/PEG400/30%HP-β-CD (10:20:70); Для РО (желудочный зонд для перорального введения), DMSO/PEG400 (10:90). Составы получали свежими в день введения дозы или до введения дозы. Хранение при комнатной температуре.
2. Исследуемые виды. Для мышей: самцы линии CD1, примерно 6-8-недельного возраста, примерно 20-30 г. Для крыс: самцы линии Sprague-Dawley, примерно 6-8- недельного возраста, примерно 200-300 г.
3. Уровень дозы: для IV, 3 мг/кг. для РО, 10 мг/кг.
4. Количество животных: 3 на анализ.
5. Моменты времени PK. Для IV (плазма крови): 5 мин., 15 мин., 1, 2, 4, 6, 8, 24 ч. после введения дозы. Для РО (плазма крови): 15 мин., 30 мин., 1, 2, 4, 6, 8, 24 ч. после введения дозы.
6. Сбор и обработка образцов крови. Кровь собирали (~0,2 мл на момент времени) из яремной вены. Кровь из каждого образца переносили в пластиковые микропробирки для центрифугирования, содержащие антикоагулянт EDTA-K2. Образцы крови центрифугировали при 2000 g в течение 5 минут при 4°C с получением плазмы крови.
7. Анализ образцов. Анализировали образцы плазмы крови с применением способа LC/MS/MS и фармакокинетические параметры (время полужизни: t1/2; биологическая доступность при пероральном введении: F; объем распределения: Vss).
Результаты представлены ниже в таблице 29, где "ND" означает отсутствие данных.
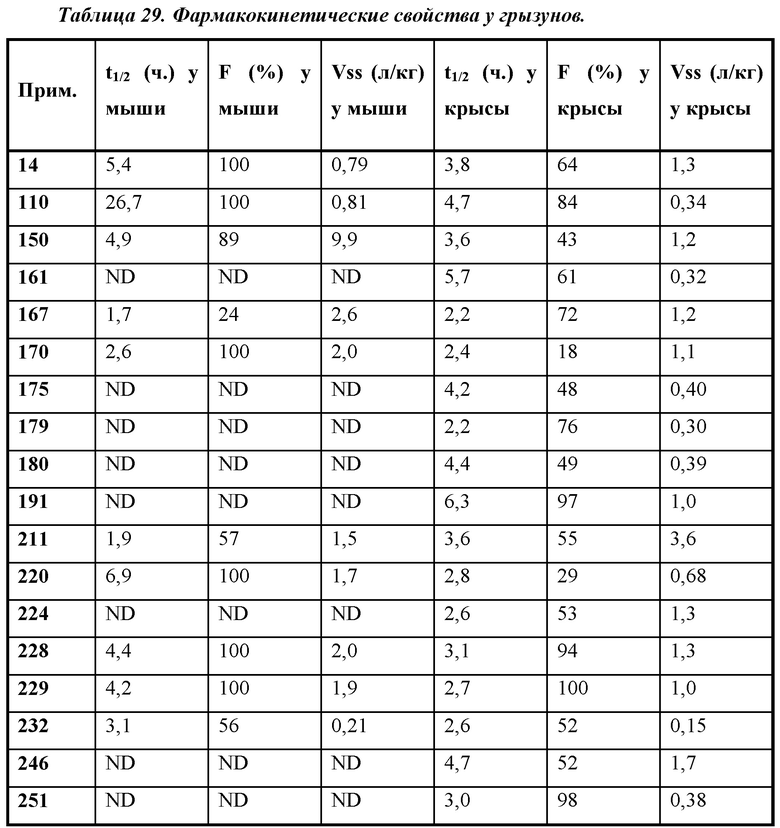
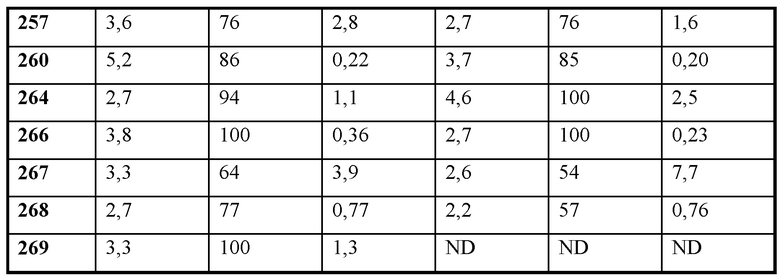
Модель индуцированного адъювантом артрита у крысы
Приведенные ниже анализы применяют для оценки противовоспалительных свойств формулы (I) у крысы. Анализы соответствуют общепринятой процедуре, изложенной ниже.
1. Состав: 0,5% метилцеллюлозы в солевом растворе. Состав получали свежим в день введения дозы.
2. Исследуемые виды. Крыса SD, примерно 6-8-недельного возраста, примерно 200 г.
3. Процедура индуцирования артрита. Полный адъювант Фрейнда (CFA; 50 мкл/крыса, М. Tuberculosis при 4 мг/мл) вводили с помощью субплантарной инъекции в левую лапу.
4. Введение дозы: РО (перорально с помощью желудочного зонда), через 3 дня после инъекции CFA.
5. Вес тела. Значения веса тела всех животных регистрировали во время проведения исследования в день 1 и день 3.
6. Исследование отличия весовой нагрузки (DWB). Распределение веса тела у крыс между инъецированной CFA и противоположной лапами измеряли с помощью изменяющего весовой баланс прибора. Животных тестировали для регистрации весовой нагрузки, приложенной задними лапами, посредством стабилографа, вставленного в пол. Среднюю весовую нагрузку (в г) между инъецированной CFA лапой и противоположной лапой определяли в течение 10 секунд. Измерения проводили три раза, включая исходный уровень перед введением дозы, 1 час и 4 часа после введения дозы в день 3.
7. Исследование механической аллодинии (МА). Механическая аллодиния левой задней лапы будет измерена во время проведения исследования путем определения порога отдергивания от нитей фон Фрея. Нить прикладывали перпендикулярно к плоской поверхности лапы с увеличивающимся усилием. Порог отдергивания лапы рассчитывали путем получения среднего значения от 2-3 повторяющихся стимулов (в г), которые индуцировали рефлекс отдергивания лапы. Измерения проводили три раза, включая исходный уровень перед введением дозы, 1 час и 4 часа после введения дозы в день 3.
8. Минимальную эффективную дозу определяли с помощью сравнения соединений формулы (I) с дексаметазоном, представляющим собой положительный контроль.
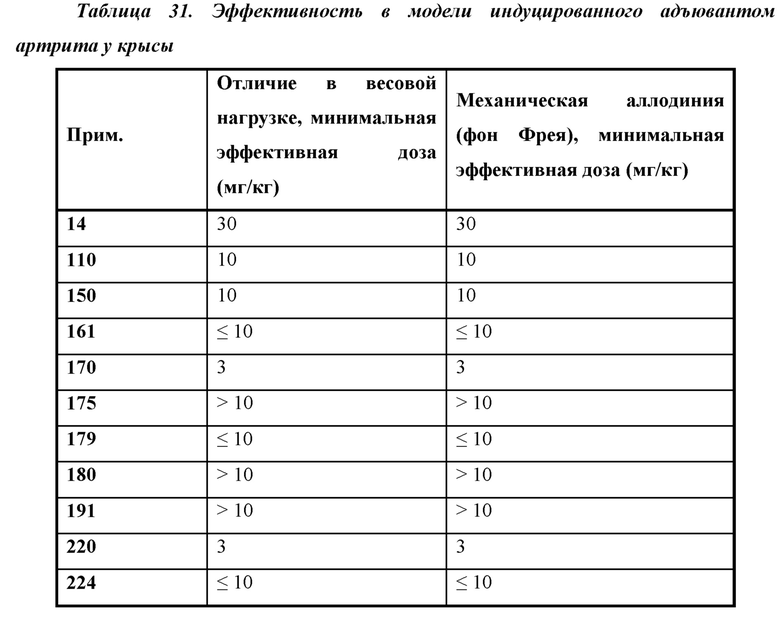
Все ссылки, патенты или заявки на патент, США или иностранные, цитируемые в настоящей заявке, тем самым включены посредством ссылки, как если бы они были написаны в данном документе во всей их полноте. В случае любых несоответствий, материал, раскрытый в данном документе, имеет преимущество.
Из предшествующего описания специалист в данной области техники может легко установить главные характеристики настоящего изобретения и без отступления от его сущности и объема может внести различные изменения и модификации настоящего изобретения с целью его адаптации к различным вариантам применения и условиям.
| название | год | авторы | номер документа |
|---|---|---|---|
| ИНГИБИТОРЫ СЕРИН/ТРЕОНИН КИНАЗЫ ДЛЯ ЛЕЧЕНИЯ ГИПЕРПРОЛИФЕРАТИВНЫХ ЗАБОЛЕВАНИЙ | 2013 |
|
RU2644947C2 |
| ЗАМЕЩЕННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СУЛЬФОНАМИДНЫЕ СОЕДИНЕНИЯ, ПОЛЕЗНЫЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ TRPA 1 | 2014 |
|
RU2675792C2 |
| ИНГИБИТОРЫ КАНАЛОВ С ТРАНЗИТОРНЫМ ПОТЕНЦИАЛОМ НА ОСНОВЕ ОКСАДИАЗОЛОВ | 2019 |
|
RU2818244C2 |
| БИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ, СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ИХ ПРИМЕНЕНИЕ ПРИ ЛЕЧЕНИИ И СПОСОБ ЛЕЧЕНИЯ МЛЕКОПИТАЮЩИХ С ИХ ИСПОЛЬЗОВАНИЕМ | 2002 |
|
RU2310655C2 |
| ЗАМЕЩЕННЫЕ ПИРИДИНОВЫЕ И ПИРАЗИНОВЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ PDE4 | 2014 |
|
RU2668073C2 |
| ПРОИЗВОДНЫЕ ПИРИДОПИРИМИДИНОНА И ИХ ИСПОЛЬЗОВАНИЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ РЕЦЕПТОРА АРОМАТИЧЕСКИХ УГЛЕВОДОРОДОВ | 2021 |
|
RU2818954C1 |
| ИНГИБИТОРЫ ЦИТОЗОЛЬНОЙ ФОСФОЛИПАЗЫ А2 | 2002 |
|
RU2337906C2 |
| ГЕТЕРОАРИЛЬНЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ IRAK И ИХ ПРИМЕНЕНИЕ | 2016 |
|
RU2743360C2 |
| ИНГИБИТОРЫ ТИРОЗИНКИНАЗЫ БРУТОНА | 2013 |
|
RU2619465C2 |
| БИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ МОЧЕВИНЫ, ТИОМОЧЕВИНЫ, ГУАНИДИНА И ЦИАНОГУАНИДИНА, ПРИГОДНЫЕ ДЛЯ ЛЕЧЕНИЯ БОЛИ | 2013 |
|
RU2664541C2 |
Изобретение относится к соединениям формулы VII, где значения W, Y, L, n определены в формуле изобретения. Соединения пригодны в лечении опосредованных МСТ4 заболеваний, таких как пролиферативные и воспалительные заболевания. 2 н. и 10 з.п. ф-лы, 30 табл., 269 пр.
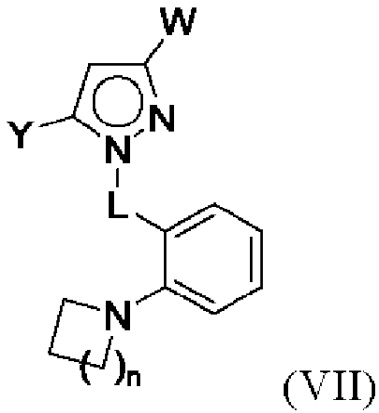
1. Соединение структурной формулы VII
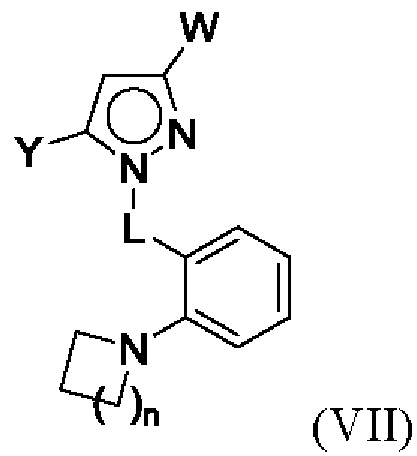
или его фармацевтически приемлемая соль, где L выбран из связи и метилена;
W представляет собой 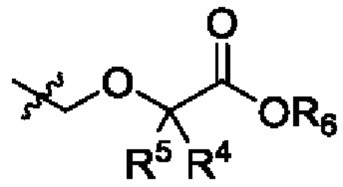 ;
;
Y выбран из 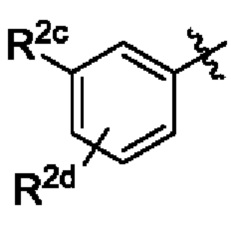 и
и 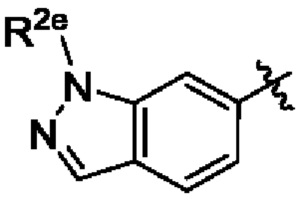 ;
;
R2c выбран из Н, С1-С4алкокси и С1-С4циклоалкокси;
R2d отсутствует или выбран из С1-С4алкокси;
R2e представляет собой С1-С4алкил;
n равняется 1 или 2 (с образованием азетидин-1-ила или пирролидин-1-ила);
R4 и R5 независимо выбраны из C1-С3алкила; и
R6 выбран из Н и С1-С4алкила.
2. Соединение по п. 1, где n равняется 1 с образованием азетидин-1-ила.
3. Соединение по п. 2, где L представляет собой связь.
4. Соединение по п. 1, где соединение характеризуется структурной формулой VIII
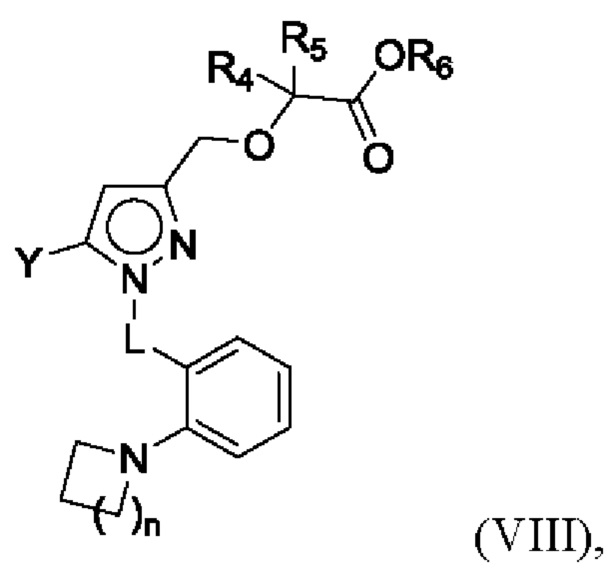
или его фармацевтически приемлемая соль, где L выбран из связи и метилена;
Y выбран из 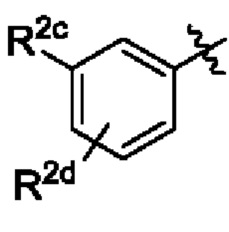 и
и 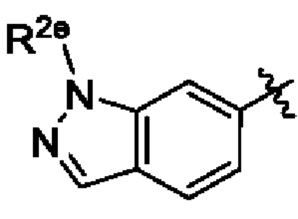 ;
;
n равняется 1 или 2 (с образованием азетидин-1-ила или пирролидин-1-ила);
R2c выбран из Н, С1-С4алкокси и С1-С4циклоалкокси;
R2d отсутствует или выбран из С1-С4алкокси;
R2e представляет собой С1-С4алкил;
R4 и R5 независимо выбраны из C1-С3алкила; и
R6 выбран из Н и С1-С4алкила.
5. Соединение по п. 1, где соединение характеризуется структурной формулой XI
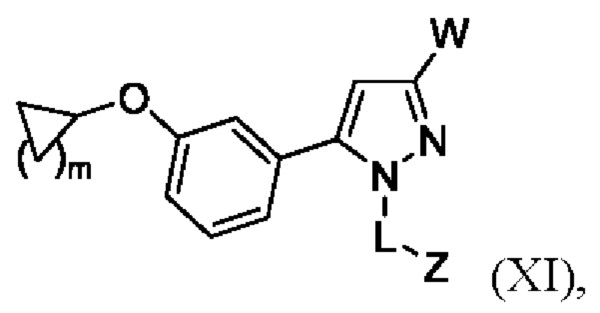
или его фармацевтически приемлемая соль, где
W представляет собой  ;
;
m равняется 1, 2 или 3 (с образованием циклопропила, циклобутила или циклопентила);
L выбран из связи и метилена;
Z представляет собой 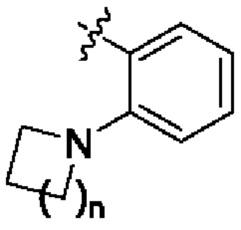 ;
;
n равен 1 или 2 (с образованием азетидин-1-ила или пирролидин-1-ила);
R4 и R5 независимо выбраны из C1-С3алкила; и
R6 выбран из Н и С1-С4алкила.
6. Соединение структурной формулы VII по п. 1, выбранное из
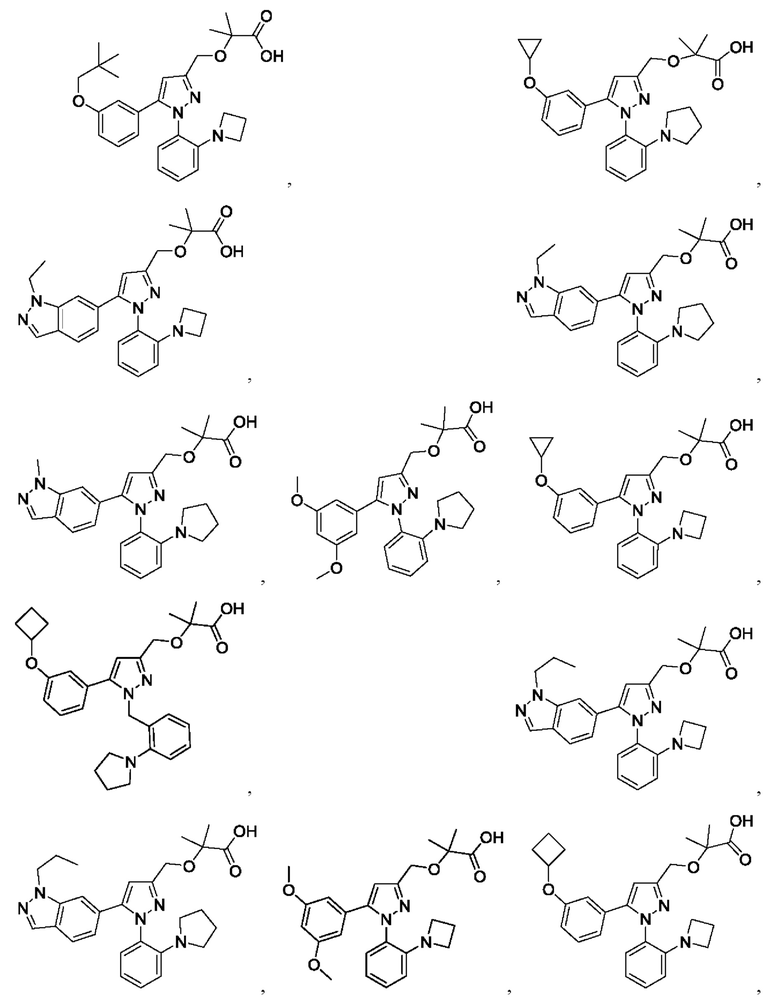
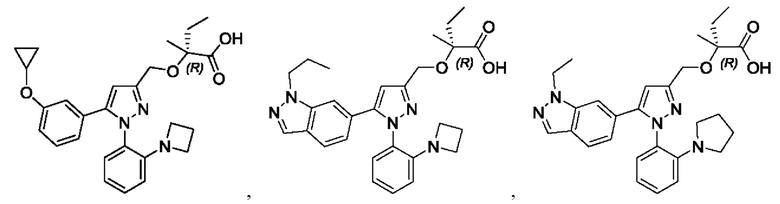
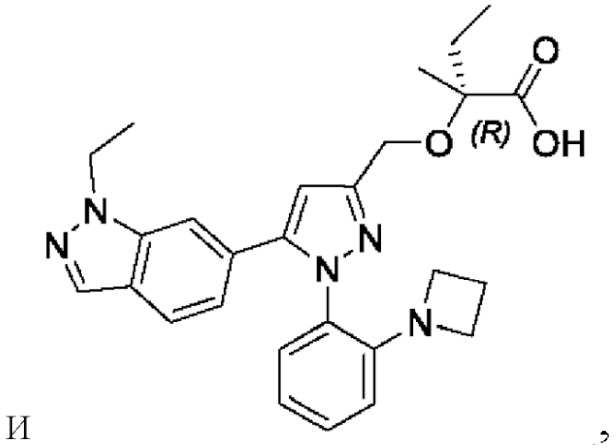
или его фармацевтически приемлемая соль.
7. Применение соединения по любому из пп. 1-6 или его фармацевтически приемлемой соли в лечении опосредованного монокарбоксилат-транспортером МСТ4 нарушения у субъекта, нуждающегося в этом.
8. Применение по п. 7, где опосредованное монокарбоксилат-транспортером МСТ4 нарушение представляет собой пролиферативное нарушение.
9. Применение по п. 8, где пролиферативное нарушение представляет собой рак.
10. Применение по п. 9, где рак выбран из аденокарциномы, Т-клеточного лейкоза/лимфомы у взрослого, рака мочевого пузыря, бластомы, рака кости, рака молочной железы, рака головного мозга, карциномы, миелоидной саркомы, рака шейки матки, колоректального рака, рака пищевода, рака желудочно-кишечного тракта, мультиформной глиобластомы, глиомы, рака желчного пузыря, рака желудка, рака головы и шеи, лимфомы Ходжкина, неходжкинской лимфомы, рака кишечника, рака почки, рака гортани, лейкоза, рака легкого, лимфомы, рака печени, мелкоклеточного рака легкого, немелкоклеточного рака легкого, мезотелиомы, множественной миеломы, рака глаза, опухоли зрительного нерва, рака полости рта, рака яичника, опухоли гипофиза, первичной лимфомы центральной нервной системы, рака предстательной железы, рака поджелудочной железы, фарингеального рака, почечноклеточной карциномы, рака прямой кишки, саркомы, рака кожи, опухоли спинного мозга, рака тонкой кишки, рака желудка, Т-клеточной лимфомы, рака яичка, рака щитовидной железы, рака горла, рака органов мочеполовой системы, уротелиальной карциномы, рака матки, рака влагалища и опухоли Вильмса.
11. Применение по п. 7, где опосредованное монокарбоксилат-транспортером МСТ4 нарушение представляет собой воспалительное нарушение.
12. Применение по п. 11, где воспалительное нарушение выбрано из болезни Крона, язвенного колита, идиопатического легочного фиброза, мышечной дистрофии, ревматоидного артрита и системного склероза (склеродермии).
| WO 2016201426 A1, 15.12.2016 | |||
| WO 2013171317 A1, 21.11.2013 | |||
| EA 201071040 A1, 28.02.2011 | |||
| US 20110160248 A1, 30.06.2011 | |||
| WO 2005054852 A1 (ASTRAZENECA AB), 16.06.2005 | |||
| US 8901314 B2, 02.02.2014 | |||
| RAGALAN et al., "Synthesis and antimicrobial activities of novel 1,5-diaryl pyrazoles", European Journal of Medicinal Chemistry, 2010, vol | |||
| Железобетонный фасонный камень для кладки стен | 1920 |
|
SU45A1 |
Авторы
Даты
2022-05-13—Публикация
2017-12-12—Подача