ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к водному гелю для формирования иммуноизолирующего слоя устройства для заключения клеток или тканей, которое позволяет трансплантировать биологический компонент, который вырабатывает и/или секретирует физиологически активное вещество, такое как гормон или белок, полезный для живого организма, или биологический компонент, который оказывает антитоксичное действие на вредное вещество, и после трансплантации оказывает профилактическое и/или терапевтическое воздействие на заболевания у животных, включая человека, такие как эндокринные заболевания и метаболические заболевания.
УРОВЕНЬ ТЕХНИКИ
Устройством для заключения клетки или ткани, является устройство, которое содержит живые клетки, живую ткань или подобные, и его применяют в качестве замены органа и т.д. больного человека или животного с целью профилактики и/или лечения заболевания у пациента путем подачи пациенту гормона, белка или других физиологически активных веществ, связанных с метаболической функцией, или детоксикации вредного вещества. Устройство для заключения клеток или тканей имеет то преимущество, что живые клетки или живая ткань могут быть защищены иммуноизолирующим слоем от механизма биологической защиты, и, следовательно, в отличие от трансплантации живого органа, можно избежать необходимости введения иммунодепрессанта и связанных с ним побочных эффектов, что операция является менее инвазивной, и что устройство позволяет, помимо трансплантации гомологичного искусственного органа от мертвого донора, трансплантацию различных регенерированных стволовых клеток и трансплантацию гетерологичного искусственного органа, решая проблему нехватки доноров.
В последние годы были проведены исследования устройств для заключения клеток или тканей, содержащих материал, такой как обычный полимер, металл или керамика, в сочетании с живыми клетками или живой тканью или их клеточным препаратом, и такое устройство может применяться для лечения различных заболеваний путем изменения вида клеток или подобного, содержащегося в них.
Например, искусственные панкреатические островки, содержащие инсулин–секретирующие клетки (например, клетки панкреатических островков), применяют для подачи инсулина в качестве гормона пациенту, чтобы улучшить уровень сахара в крови.
Кроме того, искусственные органы, такие как искусственный орган, вырабатывающий фактор свертывания крови, искусственный орган, вырабатывающий гормон роста, искусственный орган, вырабатывающий гормон паращитовидной железы и искусственный орган, вырабатывающий дофамин, находятся на стадии изучения терапии заболеваний, таких как гемофилия, гипофизарная карликовость, гипопаратиреоз и болезнь Паркинсона.
Устройства для заключения клеток или тканей поставляются в различных формах, и их примеры включают устройство, использующее препарат микрокапсул или макрокапсул, в котором живые клетки или живая ткань инкапсулированы в полимер (например, препарат клеток). Такое устройство отличается тем, что прочная сшитая структура полимера защищает клетки или ткань от механизма биологической защиты и что гормон или подобный, выделяемый из клеток или ткани, поступает в живой организм с использованием молекулярной проницаемости полимера.
В последние годы поливиниловый спирт (в дальнейшем может быть сокращенно обозначен как ПВС) привлекает внимание в качестве полимера, используемого для искусственного органа и т. д., в котором используется макрокапсульный клеточный препарат.
ПВС является высоко безопасным материалом, который может быть превращен в гель химической или физической обработкой. ПВС имеет относительно высокую прочность геля, и может быть сформован в разные формы. Примеры применяемой химической обработки включают способ, в котором глутаровый альдегид (сшивающий агент) и хлористоводородную кислоту (катализатор) добавляют в водный раствор, содержащий ПВС (см., например, не патентную литературу 1). Примеры применяемой физической обработки включают способ, в котором водный раствор, содержащий ПВС, превращают в гель быстрым охлаждением при низкой температуре около –20°C (патентная литература 1).
СПИСОК ИСТОЧНИКОВ
Патентная литература
Патентная литература 1: JP 10–43286 A
Патентная литература 2: JP 2004–331643 A
Не патентная литература
Не патентная литература 1: Krystyna Burczak et al., Long–term in vivo performance and biocompatibility of PVA hydrogelmacrocapsules for hybrid–type artificial pancreas, Biomaterials, 1996, vol. 17, 2351–2356
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
ТЕХНИЧЕСКАЯ ПРОБЛЕМА
Способ гелеобразования с использованием химической обработки, как описано выше, имеет проблему повреждения клеток, вызванного сшивающим агентом, остающимся в геле ПВС, или низким уровнем pH после добавления катализатора, что уменьшает количество живых клеток или способность поставлять физиологически активное вещество. В результате, желаемый эффект лечения не может быть получен.
Способ гелеобразования с использованием физической обработки не использует никакого химического агента и не вызывает повреждения сшивающим агентом или катализатором, но быстрое охлаждение при низкой температуре уменьшает количество живых клеток или возможность подачи физиологически активного вещества.
В качестве способа решения этих проблем описан способ, в котором приготовление геля ПВС при низкой температуре проводят в сосуществовании консерванта клеток с живыми клетками (Патентная литература 2). Однако и в этом способе выполняется низкотемпературная (–80°C) обработка в течение 24 часов для приготовления геля ПВС, и поэтому проблема уменьшения количества живых клеток или способности снабжать физиологически активным веществом не может быть в достаточной степени решена.
В свете сложившейся ситуации, описанной выше, целью настоящего изобретения является создание устройства для заключения клеток или тканей, способного обеспечить физиологически активное вещество путем сдерживания сокращения количества живых клеток или живой ткани в процессе приготовления ПВС геля, содержащего живые клетки или живые ткани.
РЕШЕНИЕ ПРОБЛЕМЫ
Для достижения вышеуказанной цели авторы настоящего изобретения провели интенсивные исследования и обнаружили, что при применении полимерного материала, имеющего основную цепь, устойчивую к ферментативному расщеплению in vivo и имеющую активированную карбонильную группу, может применяться менее токсичный сшивающий агент и гелеобразование может проводиться в желаемых (то есть, менее вредных для заключаемых живых клеток или живой ткани) условиях рН и температуры, что обеспечивает гелеобразование в оптимальных условиях для живых клеток или живой ткани. В проверочном эксперименте с использованием геля ПВС в качестве наиболее предпочтительного варианта было подтверждено, что может быть получен ПВС–гелевый препарат клеток (или тканей), имеющий степень высокую выживаемости клеток или ткани в ПВС геле и высокую способность поставлять физиологически активное вещество. Авторы настоящего изобретения провели дополнительную экспертизу и завершили настоящее изобретение.
То есть, данное изобретение относится к следующим (1)–(25).
(1) Устройство для заключения клеток или тканей, имеющее водный гель, служащий в качестве иммуноизолирующего слоя, где водный гель содержит, в качестве компонентов, смолу денатурированного поливинилового спирта, имеющую активированную карбонильную группу (А), и сшивающий агент (В).
(2) Устройство для заключения клеток или тканей согласно представленному выше (1), где водный гель имеет историю гелеобразования при температуре –5°C или выше.
(3) Устройство для заключения клеток или тканей согласно представленному выше (1) или (2), где водный гель имеет натяжение 0,5–100 кПа.
(4) Устройство для заключения клеток или тканей согласно любому из представленных выше (1)–(3), где смолой денатурированного поливинилового спирта, имеющей активированную карбонильную группу (A), является диацетонакриламид–денатурированный поливиниловый спирт.
(5) Устройство для заключения клеток или тканей согласно представленному выше (4), где диацетонакриламид–денатурированный поливиниловый спирт содержит 0,5–15% моль диацетонакриламидных единиц по отношению ко всему денатурированному поливиниловому спирту.
(6) Устройство для заключения клеток или тканей согласно любому из представленных выше (1)–(5), где сшивающим агентом (B) является гидразидное соединение и/или полукарбазидное соединение.
(7) Устройство для заключения клеток или тканей согласно любому из представленных выше (1)–(5), где сшивающим агентом (B) является дигидразид адипиновой кислоты или аминополиакриламид.
(8) Устройство для заключения клеток или тканей согласно любому из представленных выше (1)–(7), где биологический компонент (C) и компонент клеточной культуры (D) встроены в иммуноизолирующий слой.
(9) Устройство для заключения клеток или тканей согласно представленному выше (8), где биологическим компонентом (C) является один или более, выбранный из группы, состоящей из клеток панкреатических островков, клеток панкреатических протоков, клеток печени, нервных клеток, клеток щитовидной железы, клеток паращитовидной железы, клеток почек, клеток надпочечников, питуицитов, клеток селезенки, жировых клеток, клеток костного мозга, мезенхимальных стволовых клеток, ЭС клеток и ИПСК.
(10) Устройство для заключения клеток или тканей согласно представленному выше (8), где биологическим компонентом (C) является клетки панкреатических островков или клетки печени.
(11) Устройство для заключения клеток или тканей согласно любому из представленных выше (8)–(10), где компонентом клеточной культуры (D) является ацетатный или фосфатный буфер, содержащий один или более, выбранный из группы, состоящей из Na, K, Cl, Ca и глюкозы.
(12) Устройство для заключения клеток или тканей согласно любому из представленных выше (1)–(11), имеющее натяжение 0,5–100 кПа.
(13) Устройство для заключения клеток или тканей согласно любому из представленных выше (1)–(12), содержащее подложку (E).
(14) Устройство для заключения клеток или тканей согласно представленному выше (13), где материалом подложки (E) является один или боле материал, выбранный из группы, состоящей из ПЭТ, ПЭ, ПП, Тефлона и металла.
(15) Способ получения устройства для заключения клеток или тканей согласно любому из представленных выше (8)–(14), включающий стадии смешивания водного раствора, содержащего смолу денатурированного поливинилового спирта, имеющую активированную карбонильную группу (A) с сшивающим агентом (B) и компонент клеточной культуры (D), с последующим смешиванием с биологическим компонентом (C) и желатинизацией полученной смеси.
(16) Способ получения устройства для заключения клеток или тканей согласно представленному выше (15), где водный гель получают при температуре –5°C или выше.
(17) Агент, формирующий иммуноизолирующий слой для устройства заключения клеток или тканей, где агент содержит водный гель, содержащий смолу денатурированного поливинилового спирта, имеющую активированную карбонильную группу (A) и сшивающий агент (B), где сшивающим агентом (B) является дигидразид адипиновой кислоты или аминополиакриламид.
(18) Агент согласно представленному выше (17), где смолой денатурированного поливинилового спирта, имеющей активированную карбонильную группу (A) является диацетонакриламид–денатурированный поливиниловый спирт.
(19) Агент согласно представленному выше (18), где диацетонакриламид–денатурированный поливиниловый спирт содержит 0,5–15% моль диацетонакриламидных единиц по отношению ко всему денатурированному поливиниловому спирту.
(20) Применение водного геля согласно любому из представленных выше (1)–(14) и (17)–(19) для получения устройства согласно любому из представленных выше (1)–(13).
(21) Способ профилактики или лечения заболевания у человека или животного, отличающийся тем, что устройство согласно любому из представленных выше (1)–(14) вводят человеку или животному.
(22) Устройство согласно любому из представленных выше (1)–(14) для применения для профилактики или лечения заболевания у человека или животного.
(23) Устройство для заключения клеток или тканей, имеющее водный гель, служащий в качестве иммуноизолирующего слоя, где водный гель содержит смолу денатурированного поливинилового спирта, имеющую активированную карбонильную группу (A) и позволяет проникновение компонента, секретируемого биологическим компонентом (C), заключенным в него, при этом ингибирует проникновение клеток или вещества, связанных с иммунитетом.
(Здесь компонентом, секретируемым биологическим компонентом (C), предпочтительно является физиологически активное вещество, такое как гормон или белок, полезный для живого организма.)
(24) Смесь, содержащая смолу денатурированного поливинилового спирта, имеющую активированную карбонильную группу (A), сшивающий агент (B), биологический компонент (C) и компонент клеточной культуры (D), где смесь обладает свойством гелеобразования при температуре –5°C или выше.
(25) Способ получения защитного гелевого слоя для клеток или тканей, вырабатывающих физиологически активное вещество, где способ включает нанесение водного раствора или золя образующего слой защитного геля материала, содержащего гелеобразующий полимерный материал и сшивающий агент на клетки или ткани, при температуре 60°C или ниже, где гелеобразующий полимерный материал имеет основную цепь, устойчивую к in vivo ферментативному расщеплению, и имеет активированную карбонильную группу, и желатинизацию раствора или золя при температуре –5°C или выше.
ПРЕИМУЩЕСТВЕННЫЕ ЭФФЕКТЫ ИЗОБРЕТЕНИЯ
Поскольку устройство для заключения клеток или тканей в соответствии с данным изобретением получают с использованием гелеобразующего полимерного материала, имеющего основную цепь, устойчивую к in vivo ферментативному расщеплению, при применении в живом организме может быть достигнут длительный срок службы устройства. Кроме того, поскольку устройство для заключения клеток или тканей в соответствии с данным изобретением производится с использованием менее токсичных компонентов, и водный гель может быть образован при рН и температуре (предпочтительно –5°С или выше), менее вредной для заключаемых живых клеток или живой ткани, или с меньшей вероятностью убивающей заключаемые живые клетки или живую ткань, где устройство обладает высокой способностью снабжать физиологически активным веществом, таким как гормон или белок, полезный для пациента.
То есть устройство для заключения клеток или тканей в соответствии с данным изобретением обеспечивает высокую выживаемость клеток или тканей, заключенных в него.
Кроме того, при введении устройства для заключения клеток или тканей в соответствии с данным изобретением пациенту, может осуществляться профилактика и/или лечение заболевания, такого как эндокринное заболевание, метаболическое заболевание, диабет, нейродегенеративное заболевание, гемофилия, заболевание костей и рак, и клетки или ткани могут стабильно удерживаться в живом организме в течение длительного периода времени. Поэтому может быть достигнута высокая скорость вылечивания, и частота трансплантации устройства для заключения клетки или ткани может быть уменьшена.
Более того, водный гель, такой как водный ПВС в качестве типового варианта в соответствии с данным изобретением (здесь может быть обозначен как водный гель в соответствии с данным изобретением) может ингибировать проникновение комплементов в дополнение к лейкоцитам, антителам и т.д., и поэтому может изолировать окружающую среду не только от клеток и антител, участвующих в иммунитете, но также от комплементов, которые способствуют иммунологическим эффектам. То есть, водный ПВС гель в соответствии с данным изобретением позволяет проникновение молекул, имеющих диаметр около 5 нм, что, вероятно, соответствует диаметру максимум одной из различных молекул, которые должны проходить через него, включая кислород, неорганические или органические питательные вещества и различные гормоны (например, физиологически активные вещества, включающие гормоны, такие как инсулин), в то время как водный ПВС гель не позволяет проникать молекулам, имеющим диаметр около 50 нм, что, вероятно, соответствует диаметру минимум одной из клеток и веществ, связанных с иммунитетом (например, антител и комплементов), которые должны проходить через него. Благодаря селективности, водный ПВС гель может применяться в качестве иммуноизолирующего слоя, имеющего превосходное иммунодепрессивное действие.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг. 1 показано временное изменение уровней крови в ткани животных диабетической модели после трансплантации искусственного устройства панкреатических островков из примера 1 и примера 2.
На фиг. 2 показано временное изменение уровней крови в ткани животных диабетической модели после трансплантации замороженных и размороженных устройств панкреатических островков сравнительных примеров 1–5.
На фиг. 3 показано временное изменение уровней крови в ткани животных диабетической модели после трансплантации замороженных и размороженных устройств панкреатических островков сравнительных примеров 6–11.
На фиг. 4 схематически показан вариант способа получения клеток панкреатических островков из поджелудочной железы.
На фиг. 5 показан пример состояния, в котором клетки панкреатических островков обездвижены между двумя ситами, где клетки предохраняют от агрегации.
На фиг. 6 показан один вариант устройства заключения клеток или тканей, имеющего водный гель, служащий в качестве иммуноизолирующего слоя, где водный гель содержит, в качестве компонентов, смолу денатурированного поливинилового спирта, имеющую активированную карбонильную группу (A) и сшивающий агент (B).
На фиг. 7 схематически показан пример состояния, где устройство в соответствии с данным изобретением вводят в и размещают в сети неоваскулярных сосудов.
ОПИСАНИЕ ВАРИАНТОВ
Далее настоящее изобретение будет описано подробно.
Описание охватывает устройство заключения клеток или тканей, имеющее водный гель, служащий в качестве иммуноизолирующего слоя, где водный гель может быть получен в форме водного раствора или золя, содержащего, в качестве его компонентов, гелеобразующий полимерный материал, имеющий основную цепь, устойчивую к ферментному расщеплению in vivo, и активированную карбонильную группу, например, смолу денатурированного поливинилового спирта, имеющую активированную карбонильную группу (A) и сшивающий агент (B), где гелеобразующий полимерный материал способен образовывать гель при температуре –5°C или выше. Для более значительного проявления эффектов данного изобретения, гелеобразующий полимерный материал, имеющий основную цепь, устойчивую к ферментному расщеплению in vivo, и активированную карбонильную группу, представленную смолой денатурированного поливинилового спирта (A), предпочтительно, взаимодействует с сшивающим агентом (B) для получения сшитой 3–мерной сетевой структуры в водном геле или устройстве заключения клеток или тканей.
Типовым вариантом водного геля в соответствии с данным изобретением является водный гель для получения иммуноизолирующего слоя устройства заключения клеток или тканей, где водный гель содержит, в качестве его компонентов, гелеобразующий полимерный материал, имеющий основную цепь, устойчивую к ферментному расщеплению in vivo, и активированную карбонильную группу, например, смолу денатурированного поливинилового спирта, имеющую активированную карбонильную группу (A), и сшивающий агент (B). Водный гель получают снижением температуры водного раствора или золя, содержащего компоненты, до температуры не ниже –5°C.
В этом описании золем предпочтительно является гидрозоль.
Гелеобразующий полимерный материал, имеющий основную цепь, устойчивую к ферментному расщеплению in vivo, и имеющий активированную карбонильную группу
Гелеобразующим полимерным материалом, применяемым в соответствии с данным изобретением, имеющим основную цепь, резистентную к ферментативному расщеплению in vivo и имеющую активированную карбонильную группу, в отличие от желатина и альгиновой кислоты, как в водном гелеобразующем материале, применяемом для той же цели, предпочтительно является полимерный материал, имеющий основную цепь, резистентную к ферментативному расщеплению in vivo и, например, дополнительно имеющий основную цепь, разрываемую на любом или обоих концах, пока основная часть не разорвана. Такой материал представлен полимером, имеющим этиленовую структуру в качестве основной цепи его повторяющихся единиц, в частности, смолой поливинилового спирта и смолой полиакрилового спирта, и среди них, предпочтительным является полимерный материал, имеющий, кроме функциональной группы, улучшающей гидрофильность, активированную карбонильную группу в боковой цепи. Если применяется такой материал, даже если устройство остается в живом организме в течение длительного времени, основная цепь устойчива к ферментному расщеплению in vivo, и поэтому форма устройства может сохраняться в течение длительного времени.
Активированной карбонильной группой предпочтительно является карбонильная группа, которая легко взаимодействует с сшивающим агентом, таким как гидразид и карбазид, имеющим нуклеофильную функциональную группу с высокой нуклеофильной реакционной способностью, для проведения дегидратирующей конденсации или нуклеофильного замещения, приводящего к сшиванию между смолами. В результате, гелеобразование может проводиться при pH и температуре, менее вредной для заключенных живых клеток или живых тканей. Конкретные примеры активированной карбонильной группы включают такие, которые имеют альдегидную структуру или кетоновую структуру, а также могут применяться такие, которые имеют сложную эфирную структуру с высоко десорбирующим спиртовым компонентом.
Далее будет дано подробное описание на основании варианта, когда денатурированный поливиниловый спирт используется в качестве типового варианта осуществления настоящего изобретения.
Смола денатурированного ПВС (A)
В качестве смолы денатурированного поливинилового спирта, имеющей активированную карбонильную группу (A) (далее может быть просто обозначена как “смола денатурированного ПВС (A)”), например, может применяться денатурированный сополимеризацией ПВС, который получают сополимеризацией алифатического винилового эфира с ненасыщенным мономером, имеющим активированную карбонильную группу, и последующим омылением полученного сополимера, или пост–денатурированный ПВС, который получают прямым контактом ПВС или смолы денатурированного ПВС известным способом с соединением, имеющим активированную карбонильную группу, таким как ожиженный дикетен или дикетеновый газ. Однако для лучшей стабильности и безопасности смолы ПВС и для лучшей применимости на стадии гелеобразования, предпочтителен денатурированный сополимеризацией ПВС.
Алифатический виниловый эфир, применяемый в производстве денатурированного сополимеризацией ПВС, особо не ограничен, и его примеры включают винилформиат, винилацетат, винилпропионат и винилпивалат. Среди них, винилацетат является промышленно предпочтительным. Он может быть получен общеизвестным способом полимеризации, таким как полимеризация в массе, полимеризация в растворе, полимеризация в суспензии, полимеризация в эмульсии и т.д. Среди них, полимеризация в растворе с применением спиртового растворителя, такого как метанол, является промышленно предпочтительной.
Ненасыщенный мономер, имеющий активированную карбонильную группу, особенно не ограничен, но диацетонакриламид является промышленно предпочтительным. В качестве денатурированного сополимеризацией ПВС предпочтителен ПВС, денатурированный диацетонакриламидом.
В соответствии с данным изобретением, в сополимеризации алифатического винилового эфира и ненасыщенного мономера, имеющего активированную карбонильную группу, могут применяться другие ненасыщенные мономеры, способные к сополимеризации с алифатическим виниловым эфиром и ненасыщенным мономером, имеющим активированную карбонильную группу, до тех пор, пока эффекты настоящего изобретения не будут ухудшены.
Примеры таких других ненасыщенных мономеров могут включать один или более видов, выбранных из содержащих карбоксильную группу ненасыщенных мономеров, таких как (мет)акриловая кислота, малеиновая кислота, малеиновый ангидрид, фумаровая кислота, кротоновая кислота, итаконовая кислота и ундециленовая кислота; ненасыщенные моноалкиловые эфиры двуосновной кислоты, такие как монометилмалеат и монометилитаконат; содержащие амидную группу ненасыщенные мономеры, такие как акриламид, диметилакриламид, диметиламиноэтилакриламид, диэтилакриламид, диметиламинопропилакриламид, изопропилакриламид, N–метилолакриламид и N–винилацетамид; винилгалогениды, такие как винилхлорид и винилфторид; содержащие глицидиловую группу ненасыщенные мономеры, такие как аллилглицидиловый эфир и глицидилметакрилат; содержащие лактамовую группу ненасыщенные мономеры, такие как N–винилпирролидоны, такие как N–винил–2–пирролидон и N–винилалкилпирролидон, такие как N–винилмоно– или ди–C1–4 алкилпирролидон, такие как N–винил–3–пропил–2–пирролидон, N–винил–5–метил–2–пирролидон, N–винил–5–этил–2–пирролидон, N–винил–5,5–диметил–2–пирролидон и N–винил–3,5–диметил–2–пирролидон; N–аллилпирролидоны, такие как N–аллил–2–пирролидон; N–винилпиперидоны, такие как N–винил–2–пиперидон и N–винилалкилпиперидон, такой как N–винилмоно– или ди–C1–4 алкилпиперидоны, такие как N–винил–6–метил–2–пиперидон и N–винил–6–этил–2–пиперидон; N–винилкапролактамы, такие как N–винил–эпсилон–капролактам и N–винилалкилкапролактам, такой как N–винилмоно– или ди–C1–4 алкилкапролактамы, такие как N–винил–7–метил–2–капролактам и N–винил–7–этил–2–капролактам; алкилвиниловые эфиры, такие как C1–20 алкилвиниловые эфиры, такие как метилвиниловый эфир, н–пропилвиниловый эфир, и–пропилвиниловый эфир, н–бутилвиниловый эфир, и–бутилвиниловый эфир, т–бутилвиниловый эфир, лаурилвиниловый эфир, додецилвиниловый эфир и стеарилвиниловый эфир; нитрилы, такие как акрилонитрил и метакрилонитрил; содержащие гидроксильную группу ненасыщенные мономеры, такие как C1–20 моноалкилаллиловые спирты, такие как аллиловый спирт и изопропенилаллиловый спирт, C1–20 диалкилаллиловый спирты, такие как диметилаллиловый спирт, и гидрокси C1–20 алкилвиниловые эфиры, такие как гидроксиэтилвиниловый эфир и гидроксибутилвиниловый эфир; содержащие ацетильную группу ненасыщенные мономеры, такие как C1–20 алкилаллилацетаты, такие как аллилацетат, диметилаллилацетат и изопропенилаллилацетат; сложные эфиры (мет)акриловой кислоты, такие как алкиловые эфиры (мет)акриловой кислоты, такие как C1–20 алкиловые эфиры (мет)акриловой кислоты, такие как метил (мет)акрилат, этил (мет)акрилат, 2–этилгексилакрилат и н–бутилакрилат; винилсиланы, такие как триметоксивинилсилан, трибутилвинилсилан и дифенилметилвинилсилан; полиоксиалкиленовые (мет)акрилаты, такие как полиоксиэтилен (мет)акрилат и полиоксипропилен (мет)акрилат; полиоксиалкилен (мет)акриламиды, такие как полиоксиэтилен (мет)акриламид и полиоксипропилен (мет)акриламид; полиоксиалкиленвиниловые эфиры, такие как полиоксиэтиленвиниловый эфир и полиоксипропиленвиниловый эфир; полиоксиалкиленалкилвиниловые эфиры, такие как полиоксиэтиленаллиловый эфир, полиоксипропиленаллиловый эфир, полиоксиэтиленбутилвиниловый эфир и полиоксипропиленбутилвиниловый эфир; б–олефины, такие как этилен, пропилен, n–бутен и 1–гексен; бутены, такие как 3,4–дигидрокси–1–бутен, 3,4–диацилокси–1–бутен, 3–ацилокси–4–гидрокси–1–бутен, 4–ацилокси–3–гидрокси–1–бутен и 3,4–диацилокси–2–метил–1–бутен; пентены, такие как 4,5–дигидрокси–1–пентен, 4,5–диацилокси–1–пентен, 4,5–дигидрокси–3–метил–1–пентен и 4,5–диацилокси–3–метил–1–пентен; гексены, такие как 5,6–дигидрокси–1–гексен и 5,6–диацилокси–1–гексен; аминовые ненасыщенные мономеры, такие как N,N–диметилаллиламин, N–аллилпиперазин, этиловый эфир 3–пиперидинакриловой кислоты, 2–винилпиридин, 4–винилпиридин, 2–метил–6–винилпиридин, 5–этил–2–винилпиридин, 5–бутенилпиридин, 4–пентенилпиридин и 2–(4–пиридил)аллиловый спирт; содержащие соединение четвертичного аммония ненасыщенные мономеры, такие как четвертичная соль метилхлорида диметиламиноэтилакрилата, четвертичная соль метилхлорида N,N–диметиламинопропилакриламида и четвертичная соль метилбензолсульфоната N,N–диметиламинопропилакриламида; ароматические ненасыщенные мономеры, такие как стирол; содержащие группу сульфоновой кислоты ненасыщенные мономеры, такие как 2–акриламид–2–метилпропансульфоновая кислота или ее соль щелочного металла, аммониевая соль или органическая аминовая соль, 2–акриламид–1–метилпропансульфоновая кислота или ее соль щелочного металла, аммониевая соль или органическая аминовая соль, 2–метакриламид–2–метилпропансульфоновая кислота или ее соль щелочного металла, аммониевая соль или органическая аминовая соль, винилсульфоновая кислота или ее соль щелочного металла, аммониевая соль или органическая аминовая соль, аллилсульфоновая кислота или ее соль щелочного металла, аммониевая соль или органическая аминовая соль и металлилсульфоновая кислота или ее соль щелочного металла, аммониевая соль или органическая аминовая соль; глицеринмоноаллиловый эфир; 2,3–диацетокси–1–аллилоксипропан; 2–ацетокси–1–аллилокси–3–гидроксипропан; 3–ацетокси–1–аллилокси–3–гидроксипропан; 3–ацетокси–1–аллилокси–2–гидроксипропан; глицеринмоновиниловый эфир; глицеринмоноизопропениловый эфир; акрилоилморфолин; винилэтиленкарбонат; винилимидазол; и винилкарбазол.
Количество таких других ненасыщенных мономеров особо не ограничено, и, например, может составлять 10 моль или менее относительно 100 моль мономера винилового эфира.
Кроме того, до тех пор, пока эффекты настоящего изобретения не будут ухудшены, полученный денатурированный сополимеризацией ПВС может быть пост–денатурирован известным способом с применением реакции, такой как ацетализация, уретанирование, этерификация, привитая сополимеризация, фосфорилирование, ацетоацетилирование, катионизация и т.д.
Катализатор полимеризации, применяемый в получении денатурированного сополимеризацией ПВС, особо не ограничен, и обычно применяют азосоединение или перекись.
Во время полимеризации, органическая кислота, такая как винная кислота, лимонная кислота и уксусная кислота, может быть добавлена с целью предотвращения гидролиза алифатического винилового эфира.
Для окончания полимеризации, терминатор полимеризации может необязательно применяться. Терминатор полимеризации особо не ограничен, и его примеры включают м–динитробензол и т.д.
В сополимеризации алифатического винилового эфира и ненасыщенного мономера, имеющего активированную карбонильную группу в соответствии с данным изобретением, форма сосуда для полимеризации, тип мешалки для полимеризации, температура полимеризации и давление в сосуде полимеризации и т.д. могут быть такими, как в общеизвестном способе.
В данном изобретении, способ омыления сополимера алифатического винилового эфира и ненасыщенного мономера, имеющего активированную карбонильную группу, особо не ограничен, и обычно применяют известный способ. Например, применяют общеизвестный алкоголиз или гидролиз с применением основного катализатора, такого как гидроксид натрия, гидроксид калия и метоксид натрия, или кислого катализатора, такого как хлористоводородная кислота, серная кислота и п–толуолсульфоновая кислота.
Примеры растворителя, применяемого для омыления, включают спирты, такие как метанол и этанол; сложные эфиры, такие как ацетат; кетоны, такие как ацетон и метилэтилкетон; ароматические углеводороды, такие как бензол и толуол; тетрагидрофуран и т.д., и они могут применяться отдельно или в сочетании двух или более видов. Температура омыления, время омыления и т.д. особо не ограничены.
Также способ сушки, измельчения или промывания продукта омыления особо не ограничен, и может применяться общеизвестный способ.
Если ПВС, денатурированный с диацетонакриламидом, применяют в качестве денатурированного ПВС, содержание диацетонакриламидных единиц составляет, например, 0,5–20% моль, предпочтительно, 0,5–15% моль, более предпочтительно, 1–12% моль, и еще более предпочтительно, 2–10% моль (например, 3–8% моль). Если содержание диацетонакриламидные единиц 0,5% моль или более, существует множество реакционных зон с сшивающим агентом, и может быть получено достаточная прочность (натяжение) для устройства заключения клеток или тканей, и если содержание диацетонакриламидных единиц 20% моль или менее, может быть получена улучшенная растворимость в воде. С учетом этих моментов вышеуказанный интервал является предпочтительным.
Степень омыления смолы денатурированного ПВС (A) особо не ограничена, но предпочтительно составляет 80% моль или выше (например, 80–99,9% моль), более предпочтительно, 88% моль или выше (например, 88–99,9% моль) и еще более предпочтительно, 95% моль или выше (например, 95–99,9% моль).
Вязкость смолы денатурированного ПВС (A) может варьироваться, и вязкость 4% масс. водного раствора смолы денатурированного ПВС (A) предпочтительно составляет 2–500 мПа⋅с, более предпочтительно, 3–300 мПа⋅с, и еще более предпочтительно, 5–200 мПа⋅с (например, 5–80 мПа⋅с). Степень омыления и вязкость 4% масс. водного раствора измеряют в соответствии с JIS K–6726.
Сшивающий агент (B)
Сшивающим агентом (B) предпочтительно является такой, который имеет функциональную группу, способную реагировать с карбонильной группой (например, аминогруппой и т.д.).
Примеры сшивающего агента (B) включают соединение гидразида, соединение полукарбазида и подобные. В частности, предпочтительным является соединение гидразида, соединение полукарбазида и подобные, имеющие 2 или более функциональные группы в молекуле, где функциональную группу выбирают из группы, состоящей из следующих формул (1)–(3). Применяемым сшивающим агентом может быть любой тип или два или более типов в сочетании.
–NH–NH2 (1)
–CO–NH–NH2 (2)
–NH–CO–NH–NH2 (3)
Конкретные примеры соединения гидразида включают карбогидразид, дикарбоновый гидразид (алифатический дикарбоновый гидразид, такой как щавелевый дигидразид, малоновый дигидразид, янтарный дигидразид, глутаровый дигидразид, адипиновый дигидразид, пимелиновый дигидразид, пробковый дигидразид, азелаиновый дигидразид, себациновый дигидразид, додекановый дигидразид и гексадекановый дигидразид; ароматический дикарбоновый гидразид, такой как терефталевый дигидразид, изофталевый дигидразид, 2,6–нафтойный дигидразид и 4,4'–бисбензоловый дигидразид; алициклический дикарбоновый гидразид, такой как 1,4–циклогександикарбоновый дигидразид; гидроксилсодержащий дикарбоновый дигидразид, такой как винный дигидразид и яблочный дигидразид; иминодиуксусный дигидразид; итаконовый дигидразид; так далее), 1,3–бис(гидразинокарбоноэтил)–5–изопропилгидантоин, 7,11–октадекадиен–1,18–дикарбогидразид, трис(2–гидразинокарбонилэтил)изоцианурат, лимонный тригидразид, бутантриборгидразид, 1,2,3–бензолтригидразид, этилендиаминтетрауксусный тетрагидразид, 1,4,5,8–нафтойный тетрагидразид, нитрилоуксусный тригидразид, циклогексантрикарбоновый тригидразид, пиромеллитовый тетрагидразид, и т.д.
Примеры соединения полукарбазида включают N,N’–гексаметиленбисполугидразид и биуретри–три(гексаметиленполукарбазид).
Также могут применяться производные, полученные взаимодействием между этими соединениями гидразида или соединениями полукарбазида и кетонами с низкой температурой кипения, такими как ацетон и метилэтилкетон.
Среди указанных выше сшивающих агентов (B) предпочтительны дикарбоновый гидразид, аминополиакриламид и т.д., более предпочтительны адипиновый дигидразид, аминополиакриламид и т.д., и особенно предпочтителен аминополиакриламид с точки зрения низкой токсичности, высокой растворимости в воде и т.д.
В качестве сшивающего агента (B) может применяться один вид или сочетание двух или более видов указанных выше сшивающих агентов.
Количество добавляемого сшивающего агента (B) предпочтительно составляет 1–30 частей массовых, более предпочтительно, 2–25 частей массовых, и еще более предпочтительно, 3–20 частей массовых (например, 4–15 частей массовых) относительно 100 частей массовых смолы денатурированного ПВС (A). Если количество составляет 1 часть массовую или более, может быть получена высокая плотность сшивания и достаточная прочность (натяжение) для устройства заключения клеток или тканей, и если количество составляет 30 частей массовых или менее, остаточное количество непрореагировавшего сшивающего агента может быть снижено. С учетом этих моментов вышеуказанный интервал является предпочтительным.
Если аминополиакриламид применяют в качестве сшивающего агента (B), интервал молекулярной массы особенно не ограничен и может быть скорректирован так, что эффекты данного изобретения не ухудшаются. Средневесовая молекулярная масса (Mw) предпочтительно составляет около 3000–6000000, более предпочтительно, около 5000–1000000 и еще более предпочтительно, около 8000–800000 (например, около 10000–300000, около 10000–200000, около 10000–100000 и т.д.).
Если аминополиакриламид применяют в качестве сшивающего агента (B), степень гидразидирования the аминополиакриламида особо не ограничена, и может быть скорректирована так, что эффекты данного изобретения не ухудшаются. Степень гидразидирования предпочтительно составляет 30% или выше, более предпочтительно, 40% или выше и еще более предпочтительно, 50% или выше (например, 60% или выше).
Молекулярная масса и степень гидразидирования аминополиакриламида может быть соответствующим образом скорректирована в интервале, в котором эффекты данного изобретения не ухудшаются. Корректировка может быть сделана, например, повышением степени гидразидирования для более низкой молекулярной массы, или снижением степени гидразидирования для более высокой молекулярной массы.
Степень сшивания, коэффициент пористости и/или средний диаметр пор водного ПВС геля в соответствии с данным изобретением могут быть скорректированы так, что селективность водного ПВС геля не ухудшается. Селективность водного ПВС геля означает, что водный ПВС гель позволяет проникновение молекул, имеющих диаметр около 5 нм, что, вероятно, соответствует диаметру максимум одной из различных молекул, которые должны проходить через него, включая кислород, неорганические или органические питательные вещества и различные гормоны (например, физиологически активные вещества, включающие гормоны, такие как инсулин), в то время как водный ПВС гель не позволяет проникать молекулам, имеющим диаметр около 50 нм, что, вероятно, соответствует диаметру минимум одной из клеток и веществ, связанных с иммунитетом (например, антител и комплементов), которые должны проходить через него. Примеры способа, применяемого для такой корректировки, включают тест блокирования проникновения комплемента, описанный ниже.
Средний размер пор водного ПВС геля в соответствии с данным изобретением, составляет, например, 5 нм или более и менее 500 нм, предпочтительно, 5 нм или более и менее 200 нм, и более предпочтительно, 5 нм или более и менее 50 нм.
Средний размер пор может быть определен общеизвестным способом. Средний размер пор может быть определен, например, фотографированием (изображение СЭМ, увеличение от 1000× до 5000×) поверхности геля с применением сканирующего электронного микроскопа (Hitachi S–4000 производства Hitachi, Ltd.), импорта полученного изображения в блок обработки изображений (аппарат: ТВ блок обработки изображения TVIP–4100II производства Nippon Avionics Co., Ltd; контрольная программа: команда ТВ блок обработки изображения 4198 производства Ratoc System Engineering Co., Ltd.) для измерения размеров предопределенного количества пор, и затем арифметической обработки размеров.
Альтернативно, средний размер пор может быть определен с применением воздушного сканирующего электронного микроскопа (например, AeroSurf (зарегистрированный товарный знак) 1500 производства Hitachi High–Technologies; и JASM–6200 производства JEOL, Ltd.), или динамическим светорассеянием (например, nano Partica SZ–100–Plus производства Horiba, Ltd.), сканирующим микроскопическим светорассеянием и т.д.
Водный ПВС гель обычно имеет прочность (натяжение) такое, чтобы предотвратить легкое разрушение во время трансплантации. Натяжение варьируется в зависимости от вязкости 4% водного раствора, степени модификации, типа и добавленного количества сшивающего агента и твердой концентрации водного ПВС геля, и поэтому не может быть просто определена, но, например, натяжение составляет 0,5–100 кПа, предпочтительно, 0,6–95 кПа, более предпочтительно, 0,7–90 кПа и еще более предпочтительно, 0,7–85 кПа.
Натяжение водного ПВС геля может быть измерено с применением компактного настольного тестера EZ Test EZ–SX производства Shimadzu Corporation, согласно инструкциям по применению.
Биологический компонент (C)
Заключением биологического компонента (C) в водный гель в соответствии с данным изобретением может быть получено устройство заключения клеток или тканей.
Биологический компонент (C) особо не ограничен, и может быть подходящим образом выбран согласно предполагаемому применению получаемого устройства заключения клеток или тканей.
Биологический компонент (C) предпочтительно является клетками (предпочтительно, живыми клетками) или живой тканью, которая может стабильно храниться при температуре, предпочтительной для производства водного геля в соответствии с данным изобретением (т.е., от –5 до 60°C) так как, в этом случае, может быть получено устройство заключения клеток или тканей, в большой степени способное поставлять физиологически активное вещество независимо от типа клеток или живой ткани.
Как таковые могут применяться клетки, дифференцированные клетки, стволовые клетки или подобные из эктодермы, мезодермы или энтодермы, например.
В качестве дифференцированных клеток могут применяться, например, эпидермальные клетки, клетки гладких мышц, костные клетки, клетки костного мозга, клетки хряща, скелетные миобласты, клетки паренхимы поджелудочной железы, клетки панкреатических островков, эндокринные клетки поджелудочной железы, экзокринные клетки поджелудочной железы, клетки панкреатических протоков, клетки печени (например, гепатоциты), клетки щитовидной железы, клетки паращитовидной железы, клетки надпочечников, питуицит, селезеночные клетки, клетки шишковидной железы, почечные клетки (нефроциты), клетки селезенки, передний питуицит, соматотропные клетки, клетки, продуцирующие дофамин, клетки крови, клетки сердечной мышцы, клетки скелетных мышц, клетки остеобластов, нервные клетки, пигментные клетки, жировые клетки, и т.д. Указанные выше клетки не ограничены клетками, выделенными из живого организма, и могут быть клетками, дифференцированными из стволовых клеток, описанными ниже.
Что касается стволовых клеток (ИПСК и т.д.) и других клеток, которые могут быть дифференцированы, клетки могут быть заключены в устройство, и после введения, дифференцированы в живой организм. Альтернативно, клетки могут быть дифференцированы до и затем заключены в устройство.
Стволовыми клетками могут быть стволовые клетки ткани (например, стволовые клетки эпидермиса, стволовые клетки волосяного фолликула, стволовые клетки поджелудочной железы/прогениторные клетки поджелудочной железы, стволовые клетки печени, нервные стволовые клетки, стволовые клетки сетчатки, гемопоэтические стволовые клетки, мезенхимальные стволовые клетки и т.д.), эмбриональные стволовые клетки (ЭС клетки), ИПСК (индуцированные плюрипотентные стволовые клетки) и т.д., но не ограничены ими.
Эти клетки предпочтительно получают у млекопитающих, таких как человек, свинья, крыса или мышь, и, предпочтительно, они вырабатывают и/или секретируют физиологически активное вещество, такое как гормон или белок, полезные для живого организма, такого как пациент. Тип выбираемых клеток может быть определен в зависимости от типа заболевания в живом организме, таком как пациент, для трансплантации. В случаях, когда эти клетки не являются человеческими клетками, они могут быть клетками, имеющими человеческий ген, введенный в них для терапевтических целей. Гормоны, применяемые для живого организма, могут быть представлены инсулином, тиреотропным гормоном, гормоном щитовидной железы, гормоном паращитовидной железы, гормоном роста, тироксином, глюкокортикоидом, глюкагоном, эстрадиолом и тестостероном. Белок, применяемый для живого организма, может быть представлен, в частности, фактором свертывания крови, комплементом, альбумином, глобулином и различными ферментами (метаболическими ферментами или пищеварительными ферментами, такими как амилаза, протеаза и липаза). Примеры других физиологически активных веществ включают нейтротрансмиттеры, такие как дофамин.
Например, клетками предпочтительно являются клетки поджелудочной железы (клетки панкреатических островков), гепатоциты, клетки, вырабатывающие дофамин и стволовые клетки и их прогениторные клетки, более предпочтительно, клетки поджелудочной железы (клетки панкреатических островков) и панкреатические прогениторные (стволовые) клетки.
Биологический компонент (C), применяемый в соответствии с данным изобретением, может быть клетками или живой тканью, установленной для лабораторного применения, клетками, выделенными из живой ткани, или подобными, и, предпочтительно, дифференцированными не делящимися клетками. Способ разделения особо не ограничен, и разделение может проводиться общеизвестными способом. Желательно, клетки, выделенные из живой ткани, подвергают удалению патогенов, таких как патогенные вирусы.
В устройстве заключения клеток или тканей в соответствии с данным изобретением, количество биологического компонента (C) может быть подходящим образом изменено согласно типу биологического компонента (C) и особо не ограничено. Содержание составляет, например, 1000–1000000 клеток, предпочтительно, 10000–100000 клеток, и более предпочтительно, 20000–50000 клеток на кубический миллиметр пространства включения гелевого устройства.
Доза не может быть точно определена, так как ее определяют в каждом конкретном случае доктор с учетом возраста, пола и состояния пациента, побочных эффектов и т.д., но обычно количество устройств, трансплантируемых в тело взрослого человека, составляет около 1–10. Например, у пациента с диабетом, может быть трансплантировано 1000–100000 IEQ (международная единица количества панкреатических островков: 1 IEQ соответствует объему одного островка диаметром 150 мкм), предпочтительно, 5000–40000 IEQ, более предпочтительно, 10000–20000 IEQ на кг массы тела пациента, содержащихся в одном или более устройствах.
Форма устройства особо не ограничена. Форма может быть дискоидной, глобулярной, цилиндрической, эллипсоидной или подобной, и дискоидная форма предпочтительна. Если устройство является дискоидным, размер может быть представлен как произведение толщины и диаметра. Толщина обычно составляет от 0,1 мм до 10 см, предпочтительно, от 0,1 до 5 мм, и более предпочтительно, от 0,5 до 2 мм, и диаметр обычно составляет от около 1 мм до 50 см, предпочтительно, от около 1 мм до 10см, и более предпочтительно, около 2–4 см.
Общеизвестный материал может применяться в устройстве.
В качестве биологического компонента (C) в соответствии с данным изобретением, в дополнение к описанным выше клеткам или живым тканям, могут быть включены другие компоненты биологического происхождения.
Описание включает случаи, отличные от случаев, в которых клетки или ткани в устройстве заключения клеток или тканей в соответствии с данным изобретением, получают из живых микроорганизмов.
Компонент клеточной культуры (D)
В водном геле в соответствии с данным изобретением, компонент клеточной культуры (D) может быть заключен вместе с биологическим компонентом (C) с получением устройства заключения клеток или тканей.
Компонент клеточной культуры (D) особо не ограничен, и его примеры включают ацетатный или фосфатный буфер, содержащий Na, K, Cl, Ca и глюкозу.
Если Na содержится в компоненте клеточной культуры (D), концентрацию Na предпочтительно доводят до 20–150 мЭкв/л, и более предпочтительно, доводят до 80–140 мЭкв/л.
Если содержится K, концентрацию K предпочтительно доводят до 2,5–130 мЭкв/л, и более предпочтительно, доводят до 3,5–40 мЭкв/л.
Если содержится Cl, концентрацию Cl предпочтительно доводят до 15–170 мЭкв/л, и более предпочтительно, доводят до 100–150 мЭкв/л.
Если содержится Ca, концентрацию Ca предпочтительно доводят до 0,5–5 мЭкв/л, и более предпочтительно, доводят до 1–3 мЭкв/л.
Если содержится глюкоза, концентрацию глюкозы предпочтительно доводят до 1–11 мМ, и более предпочтительно, доводят до 3–7 мМ.
Компонент клеточной культуры (D) особо не ограничен, и его примеры включают общеизвестную клеточную культуральную среду, такую как HBSS (сбалансированный солевой раствор Хэнкса), коммерческий консервирующий раствор, такой как раствор Эуро–Коллинса, CELLBANKER и UW раствор (раствор University of Wisconsin), компонент защиты клеток, такой как диметилсульфоксид (ДМСО) и альбумин сыворотки, компонент для профилактики загрязнения бактериями, такой как антибиотик, компонент для сохранения клеточной активности, такой как витамины, такие как никотинамид и т.д., и предпочтительны общеизвестная клеточная культуральная среда или подобные. Они могут применяться отдельно или в сочетании двух или более типов.
Компонент клеточной культуры (D) может применяться в сочетании с другим компонентом (например, агентом, улучшающим замедленное выделение, корректором тоничности, корректором pH и т.д.).
Так как смола денатурированного ПВС (A) и компонент клеточной культуры (D) находятся в контакте друг с другом в устройстве в соответствии с данным изобретением, если компонент клеточной культуры (D) добавляют в препарат устройства, удобно добавлять компонент клеточной культуры (D) в концентрации не ниже “(объем раствора, содержащего смолу поливинилового спирта (A) + объем сшивающего агента (B) + объем компонента клеточной культуры (D))/объем компонента клеточной культуры (D)” умноженного на конечную концентрацию.
Количество компонента клеточной культуры (D) в этом состоянии особо не ограничено, но содержание предпочтительно такое, что рост, выживание и/или секретирование физиологически активного вещества в клетках или живой ткани не ингибируется, и объект данного изобретения не ухудшается.
Количество компонента клеточной культуры (D), добавляемого в указанном выше состоянии, может составлять, например, около 100–2000 частей массовых, предпочтительно около 150–1000 частей массовых (например, 200–300 частей массовых, 175–300 частей массовых и т.д.) относительно 100 частей массовых смолы денатурированного ПВС (A).
Например, компонент клеточной культуры (D) в концентрации не ниже 10 раз от конечной концентрации, может быть 1 мл относительно 8 мл раствора смолы денатурированного ПВС (A) и 1 мл сшивающего агента (B).
В препарате устройства заключения клеток или тканей могут применяться компоненты, отличные от смолы денатурированного ПВС (A), сшивающего агента (B), биологического компонента (C) и компонента клеточной культуры (D).
Примеры таких других компонентов включают фактор роста клеток, который является веществом, способствующим или контролирующим рост живых клеток, цитокин, который является активным веществом, вырабатываемым клеткой, другим физиологически активным веществом, промотором кровотока, который способствует кровотоку в устройство заключения клеток или тканей, нейтротрофический фактор и т.д. Они могут применяться отдельно или в сочетании двух или более видов.
Примеры фактора роста клеток включают тромбоцитарный фактор роста (ТФР), эпидермальный фактор роста (ЭФР), фибробластный фактор роста (ФФР), гепатоцитарный фактор роста (ГФР), фактор роста сосудистого эндотелия (ФРСЭ), инсулин и т.д.
Примеры цитокина включают гемопоэтический фактор (например, интерлейкины, хемокины, колониестимулирующий фактор и т.д.), фактор некроза опухоли, интерфероны и т.д.
Примеры физиологически активного вещества, отличного от фактора роста клеток и цитокина, включают аминокислоты (например, глицин, фенилалнин, лизин, аспарагиновую кислоту, глутаминовую кислоту и т.д.), витамины (например, биотин, пантотеновую кислоту, витамин D и т.д.), альбумин сыворотки, антибиотик и т.д.
Примеры промоторов кровотока включают цитруллин или его соль, капсаицин и капсаициноиды.
Примеры нейтротрофического фактора включают ФРН (фактор роста нервов), НФГМ (нейротрофический фактор головного мозга; нейтротрофический фактор головного мозга), NT–3 (нейтротрофин–3), NT–4 (нейротрофин–4), НФГК (нейротрофический фактор глиозной клетки), нейртурин, артемин, персефин и т.д.
Количества указанных выше компонентов особо не ограничено.
Водный гель
Водный гель, применяемый в устройстве заключения клеток или тканей в соответствии с данным изобретением, может быть получен, например, следующим образом: получают водный раствор смолы денатурированного ПВС (A) и затем смешивают с сшивающим агентом (B) или водным раствором сшивающего агента (B), полученным заранее. Полученная смеси может быть центрифугирована.
Биологический компонент (C) может быть смешан с водным гелем после получения водного геля. Или альтернативно, если сшивающий агент (B) или его водный раствор добавляют и смешивают с водным раствором смолы денатурированного ПВС (A), биологический компонент (C) также может быть добавлен и смешан с ними.
При добавлении сшивающего агента (B) или водного раствора сшивающего агента (B) и биологического компонента (C) к водному раствору смолы денатурированного ПВС (A), порядок добавления особо не ограничен, и возможно добавлять биологически компонент (C) к смеси, полученной добавлением сшивающего агента (B) или его водного раствора к водному раствору смолы денатурированного ПВС (A), добавлять сшивающий агент (B) или его водный раствор к смеси, полученной добавлением биологического компонента (C) к водному раствору смолы денатурированного ПВС (A), и одновременно добавлять сшивающий агент (B) или его водный раствор и биологический компонент (C) к водному раствору смолы денатурированного ПВС (A).
Что касается компонента клеточной культуры (D), возможно погружать полученный заранее водный гель в раствор, содержащий компонент клеточной культуры (D), и смешивать компонент клеточной культуры (D) со смолой денатурированного ПВС (A) и сшивающим агентом (B) (а также биологическим компонентом (C), при необходимости) при получении водного геля, но для сдерживания сокращения числа живых клеток, компонент клеточной культуры (D) может быть смешан со смолой денатурированного ПВС (A) и сшивающим агентом (B) (а также биологическим компонентом (C), при необходимости) до желатинизации.
В более предпочтительном способе получения водного геля, водный раствор смолы денатурированного ПВС (A), сшивающий агент (B) (или его водный раствор) и компонент клеточной культуры (D) смешивают, туда добавляют биологический компонент (C), и полученную смесь (может быть в состоянии золя) подвергают желатинизации.
Указанные выше другие компоненты, которые могут применяться в соответствии с данным изобретением, могут быть добавлены вместе с или отдельно от биологического компонента (C) и/или компонента клеточной культуры (D), к смоле денатурированного ПВС (A), водному раствору смолы денатурированного ПВС (A), сшивающему агенту (B) и/или водному гелю, и смешаны с ними.
Способ получения водного раствора смолы денатурированного ПВС (A) особо не ограничен, и получение может проводиться, например, общеизвестным способом растворения ПВС, в котором смолу (A) дисперигруют в воде при комнатной температуре, температуру повышают до 80°C или выше при перемешивании, и после полного растворения, раствор охлаждают.
Способ получения водного раствора сшивающего агента (B) особо не ограничен, и получение может проводиться, например, способом, в котором сшивающий агент (B) диспергируют в воде при комнатной температуре, и дисперсию перемешивают при комнатной температуре до растворения, или способом, в котором дисперсию перемешивают при нагревании (например, при 60°C в течение 10 минут) и затем выдерживают при комнатной температуре.
Водный раствор смолы денатурированного ПВС (A) или водный раствор сшивающего агента (B) желательно стерилизовать общеизвестным способом, таким как обработка в автоклаве, обработка УФ или гамма–лучами или подобными, и при смешивании с биологическим компонентом (C) или последующем производстве устройства заключения клеток или тканей, обработку и хранение желательно осуществлять в стерильной среде.
pH смеси сшивающего агента (B) и смолы денатурированного ПВС (A) (а также биологического компонента (C) и/или компонента клеточной культуры (D), примешанного туда при необходимости) предпочтительно доводят до 6,0–8,0, более предпочтительно, 6,2–7,7, и еще более предпочтительно, 6,5–7,5 с применением буфера, такого как HEPES (2–[4–(2–гидроксиэтил)–1–пиперазинил]этансульфоновая кислота). Этот интервал предпочтителен, так как живые клетки или живые ткани, заключаемые в устройство заключения клеток или тканей, с меньшей вероятностью повреждаются, и сдерживается снижение количества живых клеток.
При получении водного геля, смесь водного раствора смолы денатурированного ПВС (A) и сшивающего агента (B) (а также биологического компонента (C) и/или компонента клеточной культуры (D), примешанного туда при необходимости) (или водного раствора смеси) может выстаиваться.
Температура, при которой выстаивают смесь, особо не ограничена, до тех пор, пока температура подходит для хранения живых клеток, и составляет, например, –5°C или выше, предпочтительно, от –5 до 60°C (например, 0–60°C), более предпочтительно, от –3 до 50°C (например, 0–50°C), и еще более предпочтительно, 0–40°C. В этом интервале, снижение количества живых клеток сдерживается, что является предпочтительным. Температура, при которой смесь выстаивается, предпочтительно такая, чтобы водный раствор (может быть в состоянии золя) или водный гель смолы денатурированного ПВС (A) и сшивающего агента (B) не замерзал, и живые клетки или живые могли быть заключены в раствор и водный гель. В данном изобретении, применение смолы денатурированного ПВС (A) делает возможным получать водный гель при относительно низкой температуре, подходящей для хранения живых клеток или живой ткани (например, температуре в указанном выше интервале).
Время выстаивания для получения водного геля может быть соответствующе выбрано в зависимости от концентрации смолы денатурированного ПВС (A), количества сшивающего агента (B), температуры выстаивания или подобных, и обычно составляет от около 1 часа до 3 или 4 дней. Один час выстаивания или более предпочтительны с точки зрения того, чтобы получаемое устройство заключения клеток или тканей не разрушалось легко при попадании в живой организм.
Добавлением pH буфера или подобного к смеси смолы денатурированного ПВС (A) и сшивающего агента (B) (а также биологического компонента (C) и/или компонента клеточной культуры (D) примешанного туда при необходимости) может контролироваться время, требуемое для желатинизации. Более низкий pH системы ведет к снижению времени желатинизации, и более высокий pH ведет к повышению времени желатинизации.
Если доля количества живых клеток в водном геле или устройстве заключения клеток или тканей относительно общего количества живых клеток в биологическом компоненте (C) непосредственно перед заключением в водный гель выше, по сравнению с водным гелем или устройством заключения клеток или тканей, не содержащем в качестве компонентов смолу денатурированного ПВС (A) и сшивающий агент (B), считается, что устройство заключения клеток или тканей в соответствии с данным изобретением достигает высокой степени выживаемости клеток или тканей, заключенных в него.
Доля количества живых клеток в водном геле или устройстве заключения клеток или тканей относительно общего количества живых клеток в биологическом компоненте (C) непосредственно перед заключением в водный гель составляет, например, 60–100%, предпочтительно, 70–100% и более предпочтительно, 80–100%. Количество живых клеток может быть определено, например, цитоплазматическим окрашиванием флуоросцеиндиацетатом и ядерным окрашиванием йодидом пропидия (иногда называемым ФДА/ЙП измерением).
Концентрация твердого вещества в водном геле составляет, например, 0,3–20%, предпочтительно 0,5–10%, и более предпочтительно 1–8% (например, 3–8%). Когда концентрация твердого вещества находится в этом интервале, после того, как устройство заключения клеток или тканей трансплантировано животному, форма и иммуноизолирующая способность устройства могут сохраняться в организме в течение длительного периода времени. С учетом таких моментов, вышеуказанный интервал является предпочтительным. В настоящем документе, способ измерения концентрации твердого вещества особо не ограничен и может представлять собой, например, способ с использованием нагревательно–сушильного анализатора влажности (A&D, MS–70) или подобного, как в описанных ниже примерах.
Полученный водный гель имеет структуру, подходящую для функционирования в качестве иммуноизолирующего слоя, описанного ниже, т.е. структуры, которая стабильно сохраняет клетки, позволяет кислороду, глюкозе, гормонам, полезным для живого организма, таким как инсулин, и другим физиологически активным веществам проходить через нее, и не позволяет белкам, связанным с иммунитетом, проходить через нее.
Форма водного геля особо не ограничена, и ее примеры включают листы, доски, диски, стержни, трубки, шарики и т.д.
Примеры способа придания формы водному гелю включают способ, в котором водный раствор (может быть в состоянии золя), содержащий смолу денатурированного ПВС (A) и сшивающий агент (B) (а также, предпочтительно, биологический компонент (C) и компонент клеточной культуры (D), при желании) выливают в форму, имеющую предполагаемую форму до желатинизации, способ, в котором полученный гель формуют в предполагаемую форму ножом или подобными, и т.д.
Обычно водный раствор, содержащий смолу денатурированного ПВС (A) и сшивающий агент (B) (а также биологический компонент (C) и/или компонент клеточной культуры (D) и т.д. при желании) проходит состояние золя перед тем, как достигает состояния геля. Такое состояние золя должно считаться эквивалентом водному гелю в соответствии с данным изобретением и понятно, что оно также включено в данное изобретение.
Концентрация твердого вещества в водном растворе (может быть в состоянии золя), содержащем смолу денатурированного ПВС (A) и сшивающий агент (B) составляет, например 0,3–20%, предпочтительно, 0,5–10% и более предпочтительно, 1–8%. Когда концентрация твердого вещества находится в этом интервале, после того, как устройство заключения клеток или тканей трансплантировано животному, форма и иммуноизолирующая способность устройства могут сохраняться в организме в течение длительного периода времени. С учетом таких моментов, вышеуказанный интервал является предпочтительным.
Устройство заключения клеток или тканей
Водный гель в соответствии с данным изобретением может применяться в качестве иммуноизолирующего слоя устройства заключения клеток или тканей.
“Иммуноизолирующий слой” означает, означает слой, который позволяет проникновение, например, глюкозы; гормонов, таких как инсулин, тиреотропный гормон, гормон щитовидной железы, гормон паращитовидной железы, гормон роста, тироксин, глюкокортикоид, глюкагон, эстрадиол и тестостерон; белков, таких как фактор свертывания крови, альбумин, глобулин и различные ферменты (метаболические ферменты или пищеварительные ферменты, такие как амилаза, протеаза и липаза); нейротрансмиттеров, таких как дофамин; и т. д., но не допускает проникновения, например, связанных с иммунитетом белков, таких как антитела, комплементы и лейкоциты.
Способ получения устройства заключения клеток или тканей особо не ограничен, и, например, хранением (например, от около 1 часа до 3–4 дней) водного раствора или водного геля, содержащего смолу ПВС (A), содержащего биологический компонент (C) и компонент клеточной культуры (D), в форме, имеющей предполагаемую форму, при температуре 0–40°C (например, 4°C), может быть получено устройство заключения клеток или тканей.
Устройство заключения ткани обычно имеет прочность (натяжение) такую, чтобы предотвратить легкое разрушение во время трансплантации. Натяжение варьируется в зависимости от вязкости 4% водного раствора, степени модификации, типа и добавленного количества сшивающего агента и концентрации твердого вещества в устройстве заключения ткани, и поэтому не может быть просто определено, но, например, натяжение составляет 0,5–100 кПа, предпочтительно, 0,6–95 кПа, более предпочтительно, 0,7–90 кПа, и еще более предпочтительно, 0,7–85 кПа.
Натяжение устройства заключения ткани может быть измерено с применением компактного настольного тестера EZ Test EZ–SX производства Shimadzu Corporation, согласно инструкции по применению.
Устройство заключения клеток или тканей в соответствии с данным изобретением может содержать подложку (E).
Водный гель может применяться в сочетании с подложкой (E), применяемой в качестве усиливающего материала для усиления и/или простоты обращения.
Например, в случаях, когда водный гель формуют в тонкую пленку, желатинизацию предпочтительно проводят на основе (усиливающем материале), таком как пористая полимерная пластина смола для усиления и простоты обращения.
Материал подложки (E) особо не ограничен, и его примеры включают полимеры (например, ПЭТ (полиэтилентерефталат), ПЭ (полиэтилен), ПП (полипропилен), Тефлон (зарегистрированный товарный знак) и т.д.), металлы и подобные. Материал, предпочтительно, не изменяется или не разлагается в живом организме, но может разлагаться через определенный период времени.
Размер отверстий пористой пластины определен так, что отверстия позволяют проникать молекулам, имеющим диаметр около 5 нм, который предположительно соответствует диаметру максимальной из различных молекул, которые должны проходить через нее, включая кислород, неорганические и органические питательные вещества и различные гормоны (например, физиологически активные вещества, включая гормоны, такие как инсулин), в то время как отверстия не позволяют проникать молекулам, имеющим диаметр около 50 нм, что, по–видимому, соответствует диаметру минимальной из клеток, связанных с иммунитетом, и веществ, связанных с иммунитетом (например, антител и комплементов), которые не должны проходить через них. По этой причине размер отверстий обычно составляет 5–100 нм, предпочтительно, 10–50 нм и более предпочтительно, 20–30 нм.
Предпочтительный вариант устройства заключения клеток или тканей в соответствии с данным изобретением имеет, например, конфигурацию, полученную следующим образом. На стеклянную пластину помещают водный раствор или водный гель, содержащий смолу денатурированного ПВС (A) и сшивающий агент (B), содержащий компонент клеточной культуры (D); на него помещают подложку (E), такую как пористый ПЭТ (например, товарный знак: ПЭТ пористая пластина TN120 и т.д. производства SANPLATEC Corp.); на ПЭТ пористую пластину помещают суспензию, полученную суспендированием биологического компонента (C) в водном растворе или в водном геле, содержащем смолу денатурированного ПВС (A) и сшивающий агент (B); суспензию распределяют по ПЭТ пористой пластине с применением головки для загрузки геля и т.д.; затем на нее помещают ПЭТ пористую пластину так, что суспензия находится между ПЭТ пористыми пластинами; затем на ПЭТ пористую пластину помещают водный раствор или водный гель смолы денатурированного ПВС (A) и сшивающего агента (B), содержащий компонент клеточной культуры (D); на него помещают стеклянную пластину; и стеклянные пластины удаляют. До удаления стеклянных пластин устройство заключения клеток или тканей предпочтительно выдерживают при температуре 0–40°C (например, 4°C) в течение 2–72 часов, и более предпочтительно, в течение 3–48 часов.
Устройство заключения клеток или тканей в соответствии с данным изобретением может быть трансплантировано размещением в теле, например, под кожей, под оболочкой мышц, на поверхности печени, на поверхности селезенки, на большом сальнике или в брюшной полости животного, включая человека. Способ размещения устройства особо не ограничен, и может применяться общеизвестный способ. Например, общеизвестным может быть инструмент, применяемый для трансплантации.
Трансплантацией устройства заключения клеток или тканей в соответствии с данным изобретением в животное, включая человека, имеющего эндокринное заболевание (например, болезнь щитовидной железы, болезнь паращитовидной железы, болезнь надпочечников, гипофизарную болезнь, болезнь шишковидной железы и т.д.), метаболическое заболевание (например, дефицит орнитинтранскарбамилазы, гипераммонемию, гиперхолестеринемию, гомоцистинурию, гликогеноз, синдром Криглера–Наджара, болезнь Вильсона и т.д.), диабет (например, диабет 1 типа, диабет 2 степени, панкреатический диабет и т.д.), нейродегенеративное заболевание (например, болезнь Паркинсона, болезнь Альцгеймера, амиотрофический боковой склероз, спиноцеребеллярную дегенерацию и т.д.), гемофилию, заболевание костей (например, остеопороз и т.д.), рак (например, лейкоз и т.д.) и т.д., может быть достигнута профилактика и/или лечение заболеваний. Так как устройство заключения клеток или тканей в соответствии с данным изобретением может сохранять клетки в стабильном состоянии в живом организме, эти заболевания могут быть лечены с высоким уровнем излечения, и частота трансплантации устройства заключения клеток или тканей может быть снижена.
Более того, водный гель в соответствии с данным изобретением может ингибировать проникновение, кроме частиц, имеющих диаметр 5–50 мкм (например, лейкоцитов (например, макрофагов и т.д.), лимфоцитов (например, T–лимфоцитов и т.д.) и т.д.), частиц, имеющих диаметр 0,1–1 мкм (например, комплементов и т.д.). Поэтому устройство заключения клеток или тканей в соответствии с данным изобретением может изолировать окружающую среду от клеток, связанных с иммунитетом, и комплементов, и по этой причине, может применяться в качестве превосходного иммуноизолирующего слоя.
В предпочтительном варианте, описан вариант, где клетками являются клетки панкреатических островков, например.
Как показано на фиг. 4, клетки панкреатических островков хорошего качества отделяют из поджелудочной железы для приготовления панкреатических островков для трансплантации (см. фиг. 4). Для предотвращения агрегации клеток панкреатических островков, клетки фиксируют между описанными выше пористыми пластинами (две пластины) (см. фиг. 5). Из полученных таким образом клеток панкреатических островков в фиксированном состоянии, смолы денатурированного ПВС, имеющей активированную карбонильную группу (A) и сшивающего агента получают устройство в соответствии с данным изобретением, где самым средним слоем является слой клеток панкреатических островков, секретирующих инсулин. Вторым слоем является перфорированный слой, поддерживающий клетки. Наружным слоем является гелевая поверхность, образующая иммуноизолирующую мембрану. Иммуноизолирующая мембрана имеет высокую биосовместимость и позволяет инсулину проходить через нее, но не позволяет веществам, связанным с иммунитетом, проходить через нее (см. фиг. 6).
Устройство в соответствии с данным изобретением может применяться как таковое в живом организме и, например, размещается в сети, построенной из неоваскулярных сосудов, которая могут быть легко предоставлена в соответствии с известным уровнем техники для демонстрации медицинского эффекта. Устройство можно легко вынуть или заменить (см. фиг. 7).
Это устройство может обеспечивать, по крайней мере, одну из следующих характеристик.
(1) Сохранять хорошее качество заключенных клеток.
(2) Подходящим образом изолировать трансплантированные панкреатические островки от иммунной системы хозяина.
(3) Получать кислород и глюкозу и обеспечивать соответствующую реакцию инсулина.
(4) Позволять менее инвазивную трансплантацию и легко удаляться из тела или заменяться, при необходимости.
The устройство заключения клеток или тканей в соответствии с данным изобретением предпочтительно не имеет полупроницаемой мембраны.
ПРИМЕРЫ
Далее настоящее изобретение будет проиллюстрировано более подробно с помощью примеров, но настоящее изобретение не ограничено ими. Специалистами в данной области техники могут быть сделаны различные модификации в рамках технической идеи настоящего изобретения. В примерах «части» и «%» выражают «массовые части» и «% массовый», если не указано иное.
Получение смолы денатурированного ПВС
Пример синтеза 1
В колбу, оборудованную мешалкой, термометром, капельной воронкой и обратным конденсатором помещают 2000 частей винилацетата, 143 части метанола и 3,7 части диацетонакриламида. После замены азота системой, внутреннюю температуру повышают до 60°C. В систему добавляют раствор 0,16 части 2,2–азобисизобутиронитрила, растворенного в 100 частях метанола для начала полимеризации. Пока азот непрерывно пропускают через колбу, раствор 70,1 частей диацетонакриламида, растворенного в 46,7 частях метанола, непрерывно добавляют по каплям с постоянной скоростью с начала полимеризации. Через 210 минут после начала, добавляют м–динитробензол в качестве терминатора полимеризации для остановки полимеризации. Выход в конце полимеризации составляет 47,1%. Полученную реакционную смесь подвергают дистилляции оставшегося винилацетата при постоянном добавлении метанольного пара, и таким образом получают 35% раствор сополимера диацетонакриламида–винилацетата в метаноле. К 500 частям этого раствора добавляют 70 частей метанола, 1 часть ионообменной воды и 29,3 частей 4% раствора гидроксида натрия в метаноле и тщательно перемешивают, и начинают омыление при 45°C. Полученный гелеобразный продукт распыляют, тщательно промывают метанолом и сушат с получением ПВС, денатурированного с диацетонакриламидом. Вязкость 4% водного раствора составляет 53,4 мПа⋅с, степень омыления составляет 98,4% моль и содержание диацетоновых единиц составляет 3,6% моль.
В этом Примере синтеза 1, физические свойства определяли следующим образом.
(1) Вязкость 4% водного раствора: определяют согласно JIS K–6726 (1994).
(2) Степень омыления: определяют согласно JIS K 6726 (1994).
(3) Содержание единиц диацетонакриламида: с применением ДМСО–d6 в качестве растворителя проводят измерение 1H–ЯМР, и содержание рассчитывают из интегрального значения определенного пика.
Примеры синтеза 4–11
ПВС, денатурированные с диацетонакриламидом, показанные в таблице 1, получают по методике Примера синтеза 1, за исключением изменения условий полимеризации, таких как количества применяемого винилацетата, диацетонакриламида, метанола и инициатора, и условий омыления. Для синтеза ПВС, денатурированных с диацетонакриламидом, могут применяться общеизвестные способы (например, способ синтеза, описанный в JP 2015–78324 A и т.д.).
Таблица 1
Получение аминополиакриламида
Пример синтеза 2
К водному раствору, полученному смешиванием 20 г полиакриламида, имеющего средневесовую молекулярную массу около 40000, и 40 г ионообменной смолы добавляют 16 г моногидрата гидразина, и реакцию проводят при 80°C в течение 15 часов. К полученной смеси добавляют этанол, и полученный осадок подвергают фильтрации, промыванию и сушке с получением аминополиакриламида 1. Средневесовая молекулярная масса составляет около 53000 и степень гидразидирования составляет 88%.
Пример синтеза 3
Реакцию проводят по методике Примера синтеза 2 за исключением применения полиакриламида, имеющего средневесовую молекулярную массу около 15000 с получением аминополиакриламида 2. Средневесовая молекулярная масса составляет около 22000 и степень гидразидирования составляет 80%.
Пример синтеза 12
Реакцию проводят по методике Примера синтеза 2 за исключением применения полиакриламида, имеющего средневесовую молекулярную массу около 65000 с получением аминополиакриламида 2. Средневесовая молекулярная масса составляет около 88000 и степень гидразидирования составляет 90%.
В Примерах синтеза 2, 3 и 12, физические свойства определяют следующим образом.
(1) Средневесовая молекулярная масса: определяют эксклюзионной хроматографией.
Условия:
Растворитель: 50 мМ водный раствор дигидрофосфата натрия
Концентрация полимера: 1 мг/мл
Скорость потока: 1,0 мл/мин
Температура колонки: 40°C
Колонка: Shodex OHPack SB–803HQ, Shodex OHPack SB–805HQ
Стандарт: пуллулан
Датчик: RI
(2) Степень гидразидирования: определяют обратным титрованием I2 с применением стандартного раствора тиосульфата натрия. Детали экспериментальной операции были следующими:
Экспериментальная операция:
1. Получают раствор I2/MeOH.
2. Раствор I2/MeOH титруют с 0,1 M стандартного раствора тиосульфата натрия.
(Результат этого измерения: 0,047 M.)
3. Каждый образец полимера точно взвешивают и растворяют в 20 мл ионообменной воды.
4. 0,047 M I2/MeOH раствор добавляют к 2,0 мл раствора 3.
5. Проводят обратное титрование I2 с применением 0,1 M стандартного раствора тиосульфата натрия.
Пример 1
Получение водного раствора смолы денатурированного ПВС (A) и сшивающего агента (B) в состоянии золя
В 25–мл пробирку помещают 8,0 мл 6,25% водный раствор ПВС, денатурированного с диацетонакриламидом, полученный в Примере синтеза 1. Туда добавляют 1,0 мл HBSS (сбалансированного солевого раствора Хэнкса) в 10–кратной концентрации, и пробирку встряхивают вверх и вниз для перемешивания. Затем осаждают с применением центрифуги (торговое наименование: Hybrid high–speed refrigerated centrifuge 6200 производства Kubota Corporation), и пробирку выстаивают при 37°C в течение 10 минут. Туда добавляют 1 мл 5% водного раствора аминополиакриламида 1 (далее обозначенного как APA1), полученного в качестве сшивающего агента в Примере синтеза 2, и пробирку встряхивают вверх и вниз 15 раз. Осаждение проводят с применением центрифуги, и пробирку снова встряхивают вверх и вниз 15 раз. Затем пробирку центрифугируют при 3000 об/мин при 25°C в течение 1 минуты и выстаивают при 37°C. Вязкость полученного водного раствора в состоянии золя проверяют время от времени, и когда время превращения золя в капли достигает 3–4 секунд и соль считается оптимальным состоянием для заключения панкреатических островков, пробирку вынимают из горячей бани и выстаивают на льду в течение 1 минуты. Затем пробирку центрифугируют при 3000 об/мин при 25°C в течение 1 минуты с получением золя, имеющего 5% масс./об. смолы денатурированного ПВС (A) и 0,5% масс./об. сшивающего агента (B). Полученный золь переносят на 3,5–см чашку.
Измерение концентрации твердого вещества в золе
Концентрацию твердого вещества в золе измеряют с применением нагревательно–сушильного анализатора влажности (A&D, MS–70). На пробоотборную чашку анализатора влажности помещают пластину из стекловолокна, и около 1 г золя неоднородно проникает в пластину. Затем содержание твердого вещества в золе измеряют в условиях температуры чашки с образцом 120°C и времени измерения (времени нагревания) 15 минут. При измерении анализатор влаги устанавливают в режим демонстрации содержания твердого вещества (%). Формула расчета содержания твердого вещества: масса после сушки/масса до сушки × 100(%). Рассчитанная концентрация твердого вещества в золе равна 6,5%.
Получение клеток панкреатических островков
Для отделения панкреатических островков применяют 11–14–недельних самцов крыс Lewis (Japan SLC, Inc.). Холодный сбалансированный солевой раствор Хэнкса (HBSS), содержащий растворенные в нем 0,8 мг/мл коллагеназы V типа (производства y Sigma–Aldrich), вводят через общий желчный проток крысы в поджелудочную железу крысы, и поджелудочную железу переваривают при 37°C в течение 12 минут для отделения панкреатических островков от ткани поджелудочной железы. Проводят центрифугирование с градиентом концентрации с применением Histopaque–1119 (производства Sigma–Aldrich) и Lymphoprep (AXIS–SHIELD, Norway), и собирают панкреатические островки. Панкреатические островки культивируют в культуральной среде RPMI 1640, содержащей 5,5 ммоль/л глюкозы и 10% фетальную телячью сыворотку (ФТС) под 5% CO2 при 37°C в течение ночи, и применяют в исследовании Примеров и Сравнительных примеров.
Получение устройства заключения панкреатических островков
На стеклянную пластину помещают 160 мкл полученного выше золя на чашке. На него помещают ПЭТ пластину (торговое наименование: PET mesh sheet TN120 производства SANPLATEC Corp.) и суспензию, полученную суспендированием полученных выше клеток панкреатических островков, из которых компоненты культуральной среды удалены насколько это возможно, в 50 мкл золя помещают на ПЭТ пластину. Суспензию клеток панкреатических островков распределяют по ПЭТ перфорированной пластине с применением с применением головки для загрузки геля, и на нее затем помещают ПЭТ пористую пластину так, что суспензия находится между ПЭТ пористыми пластинами. Затем на ПЭТ пористую пластину помещают 140 мкл золя, и на него помещают стеклянную пластину. Составленный таким образом золь помещают во влажную камеру и выдерживают при 4°C в течение 48 часов с получением устройства заключения панкреатических островков (водного геля).
Стадия хранения устройства заключения панкреатических островков
Устройство заключения панкреатических островков, полученное выше, вынимают из стеклянных пластин, погружают в 5 мл/лунку консервационную среду (RPMI1640 культуральная среда, содержащая глюкозу, доведенную до концентрации 5,5 мМ, и 10% ФТС) в 6–луночном планшете и хранят при 4°C в течение около 16 часов.
Стадия трансплантации
Трансплантацию проводят помещением устройства заключения панкреатических островков (водный гель), после указанного выше хранения, под кожу мыши C57BL/6J с вызванным стрептозотоцином диабетом.
Оценка лечения диабета
После указанной выше трансплантации измеряют времязависимые изменения уровня сахара в крови для исследования лечащего действия (n=7). Среднее ± СО показано на фиг. 1 и в таблице 1. Уровень сахара в крови 200 мг/дл или ниже считают хорошим (диабет излечен) и уровень сахара в крови выше 200 мг/дл считают плохим (состояние диабета).
Пример 2
Оценку лечения диабета проводят (n=4) по методике Примера 1 за исключением того, что аминополиакриламид 2, полученный в Примере синтеза 3, применяют вместо аминополиакриламида 1, полученного в Примере синтеза 2. Среднее ± СО показано на фиг. 1 и в таблице 2.
Как показано на фиг. 1, животные из модели диабета, каждому из которых трансплантировали устройство заключения панкреатических островков в соответствии с данным изобретением, показали снижение уровня сахара в крови сразу после трансплантации, и даже через 185 дней после трансплантации все еще наблюдалось улучшение уровня сахара в крови.
Также были сделаны попытки достать устройство заключения панкреатических островков через 180 дней после трансплантации из–под кожи. В каждом случае Примера 1 (n=7) и Примера 2 (n=4), устройство благополучно сохраняло свою форму без разрушения, демонстрируя, что устройство заключения клеток или тканей в соответствии с данным изобретением достаточно прочное, чтобы не разрушаться в теле.
В случае применения 3% масс./об. смолы денатурированного ПВС (A) и 0,3% масс./об. сшивающего агента (B), по сравнению с применением сшивающего агента (B) из Примера синтеза 12, снижение уровня сахара в крови наблюдают сразу же после трансплантации, и даже через 185 дней после трансплантации все еще наблюдалось улучшение уровня сахара в крови.
Сравнительный пример 1
Композиция раствора ПВС
Для приготовления устройства панкреатических островков для замораживания и размораживания применяют раствор ПВС, содержащий 3% ПВС (имеющего степень полимеризации 5000 и степень омыления 99,3% моль), 10% ФТС (фетальную телячью сыворотку), 5% диметилсульфоксид и 10 мМ никотинамид, полученный растворением растворяемых веществ в растворе ETK (ET–Kyoto).
Стадия заключения клеток панкреатических островков
В 1,5 мл пробирку помещают клетки панкреатических островков крыс Lewis, из которых максимально тщательно удалены компоненты культуральной среды. Туда добавляют 1,0 мл клеточного банкера (Juji Field Inc.) при 4°C, и клетки панкреатических островков суспендируют. После выстаивания клеток на льду в течение 1 минуты, клеточный банкер удаляют. На стеклянную пластину с 1 мм разделителем помещают ПЭТ перфорированную пластину (торговое наименование: PET mesh sheet TN120, 10Ч15 мм, производства SANPLATEC Corp.), с нанесенным на нее указанным выше раствором ПВС. По ПЭТ перфорированной пластине распределяют суспензию, полученную суспендированием только клеток панкреатических островков в 160 мкл раствора ПВС, и на нее помещают ПЭТ перфорированную пластину с нанесенным на нее раствором ПВС. На нее помещают стеклянную пластину, и получают устройство панкреатических островков толщиной 1 мм для замораживания и размораживания.
Стадия заморозки, размораживания и хранения
Полученное устройство панкреатических островков для замораживания и размораживания выстаивают при –80°C в течение 24 часов, убирают стеклянные пластины и размораживают в ледяном UW растворе (University of Wisconsin solution, раствор для консервации органов). Затем устройство погружают в ледяной UW раствор три раза (на 5 минут каждый) для замены раствора в геле на UW раствор, и затем хранят в UW растворе при 4°C в течение 24 часов.
Стадия культивирования
UW раствор с поверхности устройства смывают 10 мл ледяной культуральной среды для культуры панкреатических островков (RPMI1640 культуральная среда, содержащая 5,5 мМ глюкозы, 10% ФТС и антибиотик). Затем устройство погружают в культуральную среду (ледяную) три раза (на 5 минут каждый) для замены раствора в геле культуральной средой, и затем культивируют в 3 мл культуральной среды при 37°C в течение 24 часов.
Стадия трансплантации
Трансплантацию проводят помещением замороженного и размороженного устройства панкреатических островков после хранения в брюшную полость мыши C57BL/6J с вызванным стрептозотоцином диабетом, для изучения выживаемость какого трансплантата у мыши была более успешной, в брюшной полости или под кожей.
Оценка лечения диабета
После трансплантации, по методике Примера 1, уровень сахара в крови измеряют в течение времени, и оценивают эффект заживления. Результаты показаны в таблице 2 и на фиг. 2.
Сравнительные примеры 2–18
Как показано в таблице 2, за исключением замены количества панкреатических островков и количества устройств, которые трансплантируют, получают замороженные и размороженные устройства панкреатических островков и трансплантируют, и лечение диабета оценивают по методике Сравнительного примера 1. Результаты показаны в таблице 2 и на фиг. 2 и 3.
В таблице 2 показаны уровни сахара в крови через 185 дней после трансплантации для Примеров 1 и 2, и уровни сахара в крови через 28 дней после трансплантации показаны для Сравнительных примеров 1–18.
Таблица 2
Таблица 3
В случаях замороженных и размороженных искусственных устройств панкреатических островков из Сравнительных примеров 1–18, во время замораживания и размораживания ПВС геля форма панкреатических островков, заключенных в него, уже разрушена. В эксперименте, в котором устройства были трансплантированы животным с диабетом, как показано на фиг. 2 и 3, хотя временные снижения уровня сахара в крови, связанные с разрушением трансплантата, наблюдались в некоторых случаях, уровень в крови снова повышался через 2 недели после трансплантации во всех случаях. Таким образом оказалось, что замороженные и размороженные устройства панкреатических островков не способны излечивать диабет.
Также, как ясно показано в таблице 3, устройство заключения клеток или тканей из Примера 1 и Примера 2 в соответствии с данным изобретением демонстрирует излечивающее действие на диабет благодаря заключенным в них клеткам панкреатических островков, в то время как Сравнительные примеры 1–18 не демонстрируют вылечивающее действие на диабет. В Сравнительных примерах 1–18, трансплантаты панкреатических островков были значительно повреждены во время трансплантации, и поэтому, даже трансплантированные в брюшную полость, известную как наиболее эффективное место трансплантации, не демонстрируют какое–либо излечивающее действие на диабет. Наоборот, устройство заключения клеток или тканей из Примера 1 и Примера 2 в соответствии с данным изобретением демонстрирует излечивающее действие на диабет даже при трансплантации устройств под кожу, как в наименее эффективное место трансплантации. Эти результаты заслуживают внимания.
Результаты из Примера 1 и Примера 2 показывают, что иммуноизолирующая способность сохраняется, и поэтому активность заключенных клеток благоприятно сохраняется. По этой причине предполагается, что даже когда другие клетки или живую ткань используют в качестве биологического компонента (C), может быть достигнуто сохранение иммуноизолирующей способности и сохранение активность заключенных клеток.
Примеры 3–5
Тест на подтверждение с иммуноизолирующей способности (тест блокирования проникновения комплемента)
Водные гели получают по методике Примера 1 за исключением того, что концентрация твердого вещества в золе составляет 6,5% (Пример 3), 4,3% (Пример 4) и 2,1% (Пример 5). К 680 мкл каждого водного геля добавляют 20 мкл гранул сенсибилизированных эритроцитов овцы (Denka Seamen) и перемешивают, и 170 мкл смеси помещают в лунку чашки со стеклянным дном (диаметр 35 мм, диаметр лунки 12 мм, AGC Techno Glass). Туда помещают ПЭТ перфорированную пластину диаметром 15 мм и ПЭТ перфорированную пластину диаметром 22 мм на обе стороны которых нанесен гель, в этом порядке. Затем на нее помещают 200 мкл геля, чашку выдерживают при 4°C в течение 48 часов. Туда добавляют 2,5 мл/чашку желатинового вероналового буфера, и затем чашку выдерживают при 4°C в течение ночи, водный гель тестируют.
В качестве контроля, не обладающего эффектом блокирования проникновения комплемента, группу коллагенового геля готовят следующим образом. К 680 мкл 0,21% коллагена (Cellmatrix Type I–A, Nitta Gelatin), содержащего 5 мМ NaOH, 26 мМ NaHCO3, 20 мМ HEPES и RPMI 1640, добавляют 20 мкл гранул сенсибилизированных эритроцитов овцы и смешивают. 170 мкл смеси помещают в лунку чашки со стеклянным дном и выдерживают при 37°C в течение 15 минут для желатинизации коллагена. ПЭТ перфорированную пластину диаметром 15 мм и ПЭТ перфорированную пластину диаметром 22 мм, на обе стороны которых нанесен коллаген, помещают на лунку в этом порядке. Затем туда помещают 400 мкл коллагенового геля, чашку выдерживают при 37°C в течение 15 минут. Туда добавляют 2,5 мл/чашку желатинового вероналового буфера, и затем чашку выдерживают при 4°C в течение ночи, гель подвергают тестированию.
Непосредственно до начала теста блокирования проникновения комплемента буфер удаляют из чашек (2 чашки на группу) и туда добавляют 2,5 мл/чашку желатинового вероналового буфера и 100 мкл/чашку сыворотки морской свинки (Denka Seiken) или деактивированной (сыворотку нагревают при 57°C в течение 30 минут для деактивации комплементов) сыворотку морской свинки. Чашки помещают в инкубатор при 28°C и через 10 дней из каждой чашки берут 10 мкл. Абсорбцию при 405 нм каждого раствора измеряют с применением NanoDrop (Thermo Fisher Scientific Inc.), и отношение сыворотки к деактивированной сыворотке определяют для групп каждого Примера и контрольной группы.
Отношение сыворотки к деактивированной сыворотке для Примеров 3, 4 и 5 составляет 1,0, 1,47 и 1,69, соответственно.
Между тем, отношение сыворотки к деактивированной сыворотке группы коллагенового геля в качестве контрольной группы составляет 1,75.
Результаты показывают, что отношения сыворотки к деактивированной сыворотке из Примеров 4 и 5 были ниже, чем отношение контрольной группы, демонстрируя слабый эффект блокирования проникновения комплемента. Таким образом, было показано, что все водные гели из Примеров 3–5 способны блокировать проникновение комплементов небольших размеров и обладают способностью к иммуноизоляции, хотя и в разной степени. В частности, отношение сыворотки к деактивированной сыворотке для Примера 3 составляет 1,0, показывая, что проникновение комплементов было полностью блокировано.
Примеры 6–21
Измерение ДАФ/ЙП
Устройство панкреатических островков, имеющее композицию, показанную в таблице 4, полученное по методике Примера 1, промывают дважды 3 мл/лунку ФРФБ (комнатная температура) в течение 3 минут каждый. К 3 мл ФРФБ в 6–луночном планшете добавляют 15 мкл раствора диацетата флуоресцеина (ДАФ: CalbioChmem, San Diego, USA), растворенного в ацетоне (Wako Pure Chemical Industries, Tokyo, Japan) в количестве 5 мг/мл и 20 мкл раствора йодида пропидия (ЙП: Sigma–Aldrich, St. Louis, MO, USA), растворенного в дистиллированной воде в количестве 0,5 мг/мл с получением окрашивающего раствора ДАФ/ЙП. Туда переносят промытое устройство панкреатических островков и окрашивают в темноте в течение 5 минут и затем промывают 3 мл ФРФБ в течение 3 минут. Устройство панкреатических островков помещают на покровное стекло (Matsunami Glass Ind., Ltd., Osaka, Japan), и с применением флуоресцентного микроскопа (BZ–900: KEYENCE, Tokyo, Japan) наблюдают локализацию ДАФ (длина волны возбуждения 470/40 нм, длина волны абсорбции 525/50) и ЙП (длина волны возбуждения 540/25 нм, длина волны абсорбции 605/60) в панкреатических островках.
При измерении ДАФ (окрашивание), присутствие живых клеток подтверждается (ДАФ (+)) и мертвые клетки почти не наблюдались во всех Примерах. В то же время при измерении ЙП, ядра клеток не окрашены, что свидетельствует о том, что мертвые клетки почти не присутствуют, как и в случае окрашивания ДАФ.
Таблица 4
Концентрация смолы денатурированного ПВС (A): концентрация смолы денатурированного ПВС (A) в устройстве (% масс./об.)
Количество добавленного сшивающего агента (B): количество сшивающего агента (B), добавленного к смоле денатурированного ПВС (A) (% масс./об.)
ДАК: дигидразид адипиновой кислоты
Критерий оценки измерения ДАФ/ЙП: ДАФ: (+) живые клетки существуют, (–) цитоплазма разрушена, ЙП: (+) ядро клетки разрушено, (–) живые клетки существуют
Сравнительный пример 19
Устройство панкреатических островков, полученное в Сравнительном примере 1, подвергают измерению ДАФ/ЙП в Примерах. При измерении ДАФ окрашенные изображения не наблюдали, и при измерении ЙП, окрашенные ядра клеток четко наблюдали. Результаты обоих измерений подтверждают, что панкреатические островки в устройстве Сравнительного примера значительно некротизированы.
Пример 22
Измерение концентрации твердого вещества в водном геле и натяжения
7% водный раствор ПВС, денатурированного с диацетонакриламидом, полученного в Примере синтеза 1, и 10% водный раствор аминополиакриламида 2, полученного в Примере синтеза 3, смешивают в концентрации смолы денатурированного ПВС (A) и добавленного количества сшивающего агента (B), показанной в таблице 5. Смесь заполняют в цилиндрический сосуд диаметром 34 мм и выдерживают при 20°C в течение 24 часов для получения водного геля, имеющего диаметр 34 мм и высоту 17 мм.
Полученный водный гель имеет концентрацию твердого вещества 5,5% и натяжение 4,9 кПа при 20°C.
Концентрацию твердых веществ измеряют с применением нагревательно–сушильного анализатора влажности (A&D, MS–70). На чашке для образцов анализатора влажности помещают пластину из стекловолокна, и около 1 г водного геля однородно проникает в пластину. Затем содержание твердого вещества в водном геле измеряют в условиях температуры тарелки для образца 120°C и времени измерении (времени нагревания) 15 минут. При измерении анализатор влажности устанавливают на режим демонстрации содержания твердого вещества (%). Формула расчета содержания твердого вещества: масса после сушки/масса до сушки × 100(%).
Измерение натяжения проводят с применением компактного настольного тестера EZ Test EZ–SX производства Shimadzu Corporation, согласно инструкциям по применению. Более конкретно, натяжение водного геля, имеющего диаметр 34 мм и высоту 17 мм, измеряют при 20% вдавливании с применением цилиндрического прижима диаметром 20 мм.
Примеры 23–39
Водные гели готовят по методике Примера 22 за исключением соответствующего изменения типа и концентрации смолы ПВС (A), типа и добавляемого количества сшивающего агента (B) и т.д., как показано в Таблице 5, и измеряют концентрацию твердого вещества и натяжение.
Таблица 5
Концентрация смолы денатурированного ПВС (A): концентрация смолы денатурированного ПВС (A) в устройстве (% масс.)
Количество добавленного сшивающего агента (B): количество сшивающего агента (B), добавленного к смоле денатурированного ПВС (A) (% масс.)
ДАК: дигидразид адипиновой кислоты
Пример 40
Измерение концентрации твердого вещества в устройстве заключение ткани и натяжения
7% водный раствор ПВС, денатурированного с диацетонакриламидом, полученного в Примере синтеза 1, и 10% водный раствор аминополиакриламида 2, полученного в Примере синтеза 3, и 10–кратную концентрацию HBSS (сбалансированного солевого раствора Хэнкса) смешивают при концентрации смолы денатурированного ПВС (A), добавленном количестве сшивающего агента (B) и добавленного количества HBSS, показанных в таблице 6. Смесь заполняют в цилиндрический сосуд диаметром 34 мм и выдерживают при 37°C в течение 30 минут и затем при 4°C в течение 48 часов для получения устройства заключения ткани, имеющего диаметр 34 мм и высоту 17 мм.
Полученное устройство заключения ткани имеет концентрацию твердого вещества 6,4% и натяжение 5,3 кПа при 20°C.
Концентрацию твердых веществ измеряют с применением нагревательно–сушильного анализатора влажности (A&D, MS–70). На чашке для образцов анализатора влажности помещают пластину из стекловолокна, и около 1 г устройства заключения ткани однородно проникает в пластину. Затем содержание твердого вещества в устройстве заключения ткани измеряют в условиях температуры тарелки для образца 120°C и времени измерении (времени нагревания) 15 минут. При измерении анализатор влажности устанавливают на режим демонстрации содержания твердого вещества (%). Формула расчета содержания твердого вещества: масса после сушки/масса до сушки × 100(%).
Измерение натяжения проводят с применением компактного настольного тестера EZ Test EZ–SX производства Shimadzu Corporation, согласно инструкциям по применению. Более конкретно, натяжение устройства заключения ткани, которое является водным гелем, имеющего диаметр 34 мм и высоту 17 мм измеряют при 20% вдавливании с применением цилиндрического прижима диаметром 20 мм.
Примеры 41–79
Устройства заключения ткани получают по методике Примера 40 за исключением соответствующего изменения типа и концентрации смолы ПВС (A), типа и добавленного количества сшивающего агента (B), количества HBSS и т.д., как показано в таблице 6, и измеряют концентрацию твердого вещества и натяжение.
Таблица 6
Концентрация смолы денатурированного ПВС (A): концентрация смолы денатурированного ПВС (A) в устройстве (% масс.)
Количество добавленного сшивающего агента (B): количество сшивающего агента (B), добавленного к смоле денатурированного ПВС (A) (% масс.)
Количество добавленного HBSS: концентрация сбалансированного солевого раствора Хэнкса в жидкой смеси (% масс.)
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
Согласно настоящему изобретению водный гель, способный сохранять свою прочную структуру в условиях рН и температуры, менее вредных для заключенных живых клеток или живой ткани, может быть легко сформирован с использованием менее токсичных компонентов и, следовательно, может быть получено устройство для заключения клеток или тканей, которое обладает высокой способностью поставлять физиологически активное вещество, такое как гормон или белок, полезное для пациента и которое изолирует содержащиеся клетки или ткани от механизма биологической защиты.
| название | год | авторы | номер документа |
|---|---|---|---|
| МАКРОГРАНУЛА С СЕКРЕТОРНЫМИ КЛЕТКАМИ, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И СПОСОБ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, ВЫЗВАННЫХ НАРУШЕНИЕМ ФУНКЦИОНИРОВАНИЯ СЕКРЕТОРНЫХ КЛЕТОК | 1995 |
|
RU2177503C2 |
| МАКРОГРАНУЛА С СЕКРЕТОРНЫМИ КЛЕТКАМИ, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И СПОСОБ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, ВЫЗВАННЫХ НАРУШЕНИЕМ ФУНКЦИОНИРОВАНИЯ СЕКРЕТОРНЫХ КЛЕТОК | 1995 |
|
RU2208636C2 |
| АГЕНТЫ ДЛЯ ПОДАВЛЕНИЯ ПОВРЕЖДЕНИЯ ТРАНСПЛАНТИРОВАННЫХ ОСТРОВКОВ ПОСЛЕ ТРАНСПЛАНТАЦИИ ОСТРОВКОВ | 2006 |
|
RU2446826C2 |
| СПОСОБ ПОЛУЧЕНИЯ БИОЛОГИЧЕСКОЙ ТКАНЕПОДОБНОЙ СТРУКТУРЫ | 2020 |
|
RU2815583C2 |
| МУЛЬТИПОТЕНТНЫЕ СТВОЛОВЫЕ КЛЕТКИ ВНЕПЕЧЁНОЧНЫХ ЖЕЛЧНЫХ ПУТЕЙ И СПОСОБЫ ИХ ВЫДЕЛЕНИЯ | 2010 |
|
RU2756584C2 |
| СПОСОБ ПОЛУЧЕНИЯ 4D ТЕРМОЧУВСТВИТЕЛЬНОГО ГИДРОГЕЛЯ НА ОСНОВЕ ХИТОЗАНА | 2020 |
|
RU2805920C2 |
| СПОСОБЫ ИНДУЦИРОВАНИЯ Т-КЛЕТОЧНОЙ ТОЛЕРАНТНОСТИ К ТКАНЕВОМУ ИЛИ ОРГАННОМУ ТРАНСПЛАНТАТУ | 1995 |
|
RU2169009C2 |
| МУЛЬТИПОТЕНТНЫЕ СТВОЛОВЫЕ КЛЕТКИ ВНЕПЕЧЕНОЧНЫХ ЖЕЛЧНЫХ ПУТЕЙ И СПОСОБЫ ИХ ВЫДЕЛЕНИЯ | 2010 |
|
RU2580246C2 |
| Способ приготовления микрокапсул с островками Лангерганса и микрокапсула по предложенному способу | 2023 |
|
RU2822875C1 |
| ПРИМЕНЕНИЕ ОКИСИ УГЛЕРОДА ДЛЯ УЛУЧШЕНИЯ РЕЗУЛЬТАТА ТКАНЕВОЙ И ОРГАННОЙ ТРАНСПЛАНТАЦИИ И ПОДАВЛЕНИЯ АПОПТОЗА | 2002 |
|
RU2376997C2 |
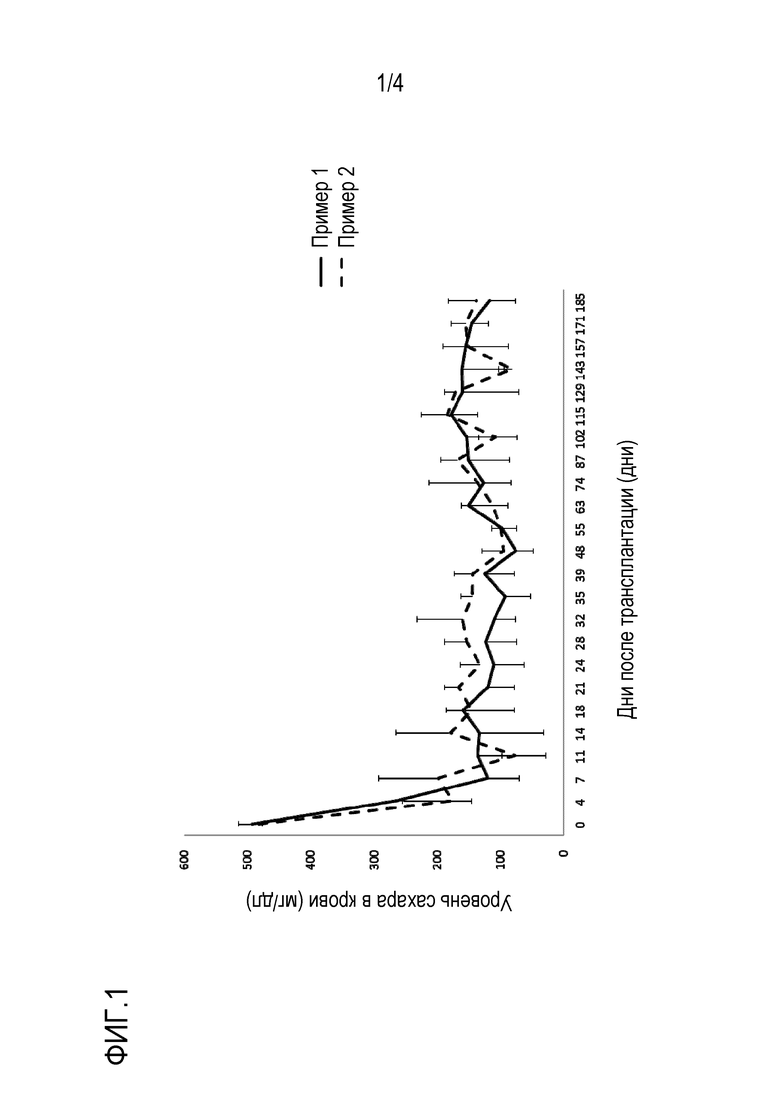
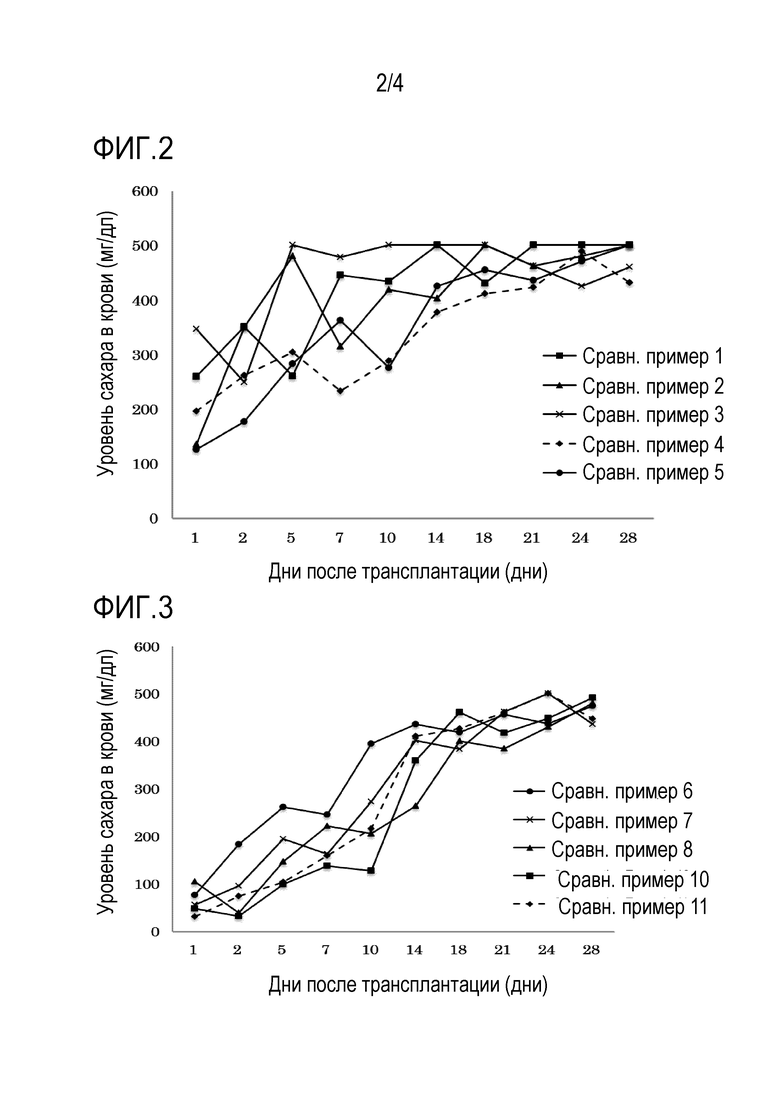
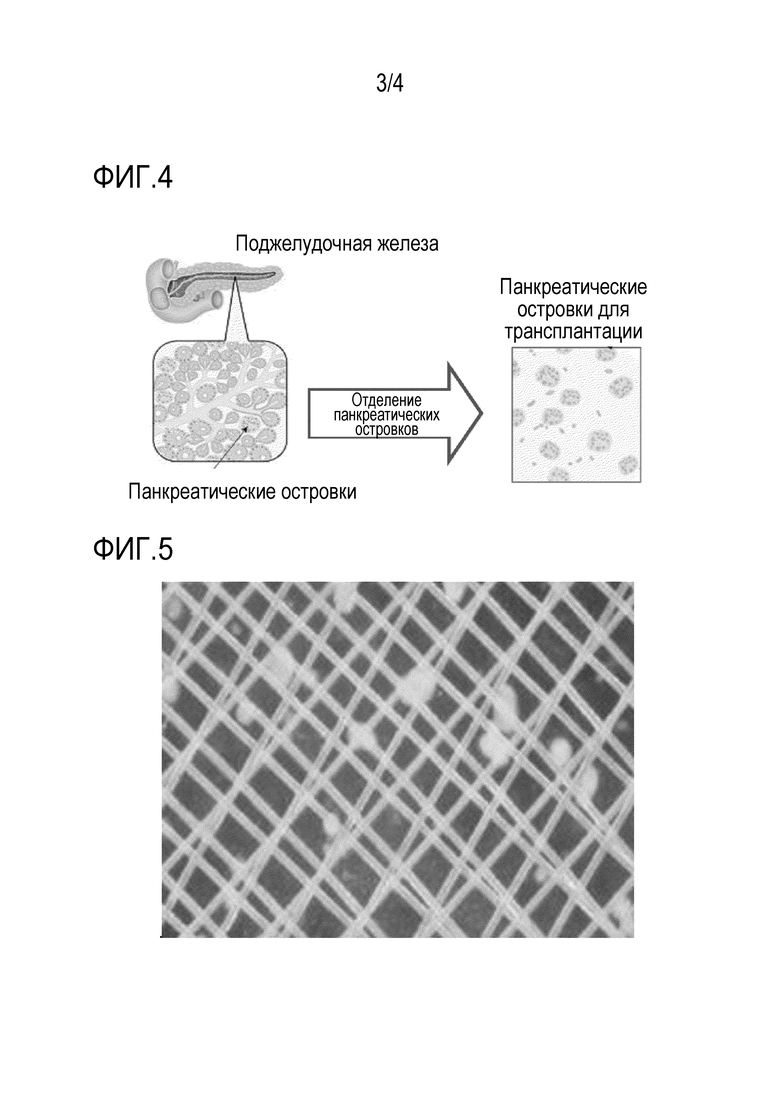
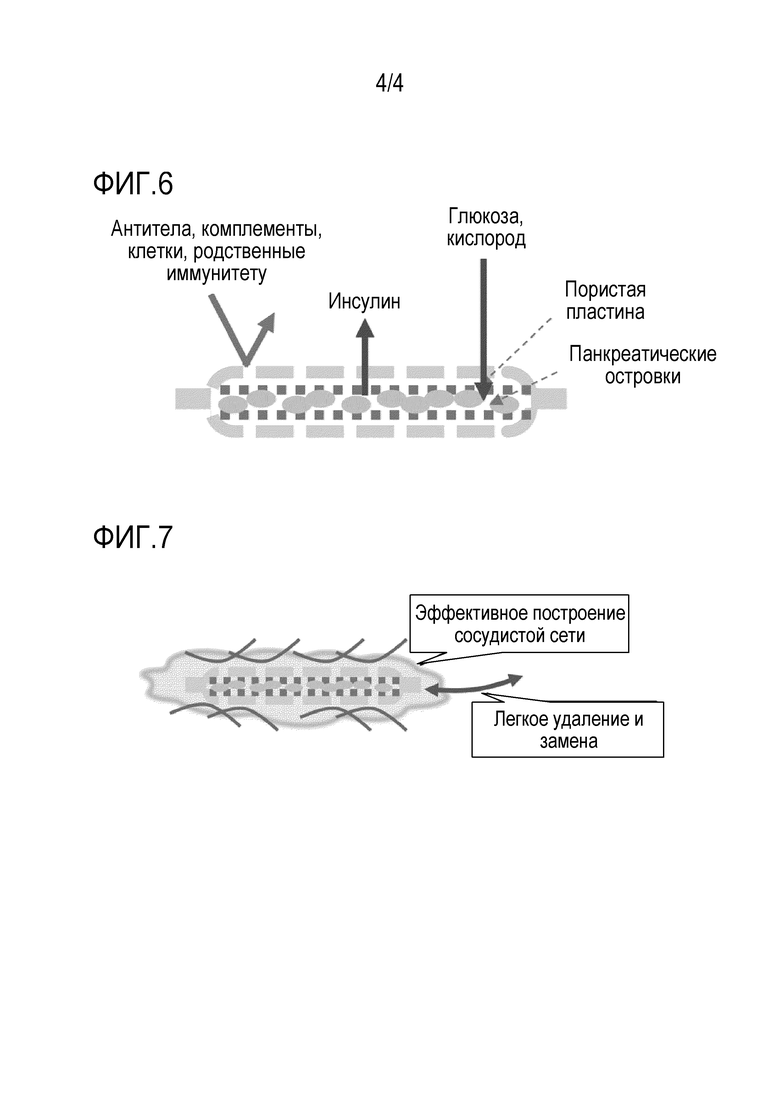
Заявленная группа изобретений относится к области биотехнологии. Описана группа изобретений, включающая устройство заключения клеток или тканей (варианты), способ получения устройства заключения клеток или тканей, формирующий иммуноизолирующий слой агент для устройства заключения клеток или тканей и смесь для сдерживания сокращения количества живых клеток или живой ткани. В одном из вариантов реализации устройство содержит водный гель, служащий в качестве иммуноизолирующего слоя, где указанный водный гель содержит, в качестве его компонентов, смолу денатурированного поливинилового спирта, имеющую активированную карбонильную группу и сшивающий агент, где биологический компонент заключен в иммуноизолирующий слой. Изобретение расширяет арсенал средств для заключения клеток или тканей. 6 н. и 16 з.п. ф-лы, 7 ил., 6 табл., 79 пр.
1. Устройство заключения клеток или тканей, имеющее водный гель, служащий в качестве иммуноизолирующего слоя, где указанный водный гель содержит, в качестве его компонентов, смолу денатурированного поливинилового спирта, имеющую активированную карбонильную группу (A) и сшивающий агент (B), где биологический компонент (С) заключен в иммуноизолирующий слой.
2. Устройство заключения клеток или тканей по п. 1, где водный гель имеет историю желатинизации при температуре –5°C или выше.
3. Устройство заключения клеток или тканей по п. 1 или 2, где водный гель имеет натяжение 0,5–100 кПа.
4. Устройство заключения клеток или тканей по любому из пп. 1–3, где смолой денатурированного поливинилового спирта, имеющей активированную карбонильную группу (A), является диацетонакриламид–денатурированный поливиниловый спирт.
5. Устройство заключения клеток или тканей по п. 4, где диацетонакриламид–денатурированный поливиниловый спирт содержит 0,5–15% моль диацетонакриламидных единиц, относительно всего денатурированного поливинилового спирта.
6. Устройство заключения клеток или тканей по любому из пп. 1–5, где сшивающим агентом (B) является гидразидное соединение и/или полукарбазидное соединение.
7. Устройство заключения клеток или тканей по любому из пп. 1–5, где сшивающим агентом (B) является дигидразид адипиновой кислоты или аминополиакриламид.
8. Устройство заключения клеток или тканей по любому из пп. 1–7, где компонент клеточной культуры (D) заключен в иммуноизолирующий слой.
9. Устройство заключения клеток или тканей по любому из пп. 1–8, где биологический компонент (С) представляет собой дифференцированные клетки или стволовые клетки.
10. Устройство заключения клеток или тканей по любому из пп. 1-9, где биологическим компонентом (C) является один или более, выбранный из группы, состоящей из клеток панкреатических островков, клеток панкреатических протоков, клеток печени, нервных клеток, клеток щитовидной железы, клеток паращитовидной железы, клеток почек, клеток надпочечников, питуицита, клеток селезенки, жировых клеток, клеток костного мозга, мезенхимальных стволовых клеток, эмбриональных стволовых клеток и индуцированных плюрипотентных стволовых клеток.
11. Устройство заключения клеток или тканей по любому из пп. 1-9, где биологическим компонентом (C) является клетка панкреатических островков или клетки печени.
12. Устройство заключения клеток или тканей по любому из пп. 8–11, где компонентом клеточной культуры (D) является ацетатный или фосфатный буфер, содержащий один или более, выбранный из группы, состоящей из Na, K, Cl, Ca и глюкозы.
13. Устройство заключения клеток или тканей по любому из пп. 1–12, имеющее натяжение 0,5–100 кПа.
14. Устройство заключения клеток или тканей по любому из пп. 1–13, содержащее подложку (E).
15. Устройство заключения клеток или тканей по п. 14, где материалом подложки является один или более, выбранный из группы, состоящей из полиэтилентерефталата, полиэтилена, полипропилена, тефлона и металла.
16. Способ получения устройства заключения клеток или тканей по любому из пп. 8–15, включающий получение водного геля посредством стадий смешивания водного раствора, содержащего смолу денатурированного поливинилового спирта, имеющую активированную карбонильную группу (A) с сшивающим агентом (B) и компонентом клеточной культуры (D), с последующим примешиванием туда биологического компонента (C), и желатинизацию полученной смеси.
17. Способ получения устройства заключения клеток или тканей по п. 16, где водный гель получают при температуре –5°C или выше.
18. Формирующий иммуноизолирующий слой агент для устройства заключения клеток или тканей, где агент, содержащий водный гель, содержит смолу денатурированного поливинилового спирта, имеющую активированную карбонильную группу (A) и сшивающий агент (B), где сшивающим агентом (B) является дигидразид адипиновой кислоты или аминополиакриламид.
19. Агент по п. 18, где смолой денатурированного поливинилового спирта, имеющей активированную карбонильную группу (A), является диацетонакриламид–денатурированный поливиниловый спирт.
20. Агент по п. 19, где диацетонакриламид–денатурированным поливиниловым спиртом содержит 0,5–15% моль диацетонакриламидных единиц относительно всего денатурированного поливинилового спирта.
21. Устройство заключения клеток или живых тканей, имеющее водный гель, служащий в качестве иммуноизолирующего слоя, где указанный водный гель содержит смолу денатурированного поливинилового спирта, имеющую активированную карбонильную группу (A), и позволяющий проникновение компонента, секретированного биологическим компонентом (C), заключенным в него, при этом ингибируя проникновение клеток, связанных с иммунитетом, или вещества, связанного с иммунитетом.
22. Смесь для сдерживания сокращения количества живых клеток или живой ткани, содержащая смолу денатурированного поливинилового спирта, имеющую активированную карбонильную группу (A), сшивающий агент (B), биологический компонент (C) и компонент клеточной культуры (D), где смесь имеет свойство формирования геля при температуре –5°C или выше.
| JPH 10287711 A, 27.10.1998 | |||
| SUMI S | |||
| et al., Review: Macro-encapsulation of islets in polyvinyl alcohol hydrogel // Journal of Medical and Biological Engineering, 01.2014, 34 (3), pp.204-210 | |||
| US 20080193536 A1, 14.08.2008 | |||
| US 20150175961 A1, 25.01.2015 | |||
| КОМПОЗИЦИЯ ДЛЯ ПОЛУЧЕНИЯ ПОЛИМЕРНОЙ ПЛЕНКИ ДЛЯ ИММОБИЛИЗАЦИИ МИКРООРГАНИЗМОВ В БИОСЕНСОРНЫХ АНАЛИЗАТОРАХ | 2010 |
|
RU2461625C2 |
Авторы
Даты
2022-05-17—Публикация
2018-02-23—Подача