ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет по предварительной заявке на патент США №62/727,666, поданной 6 сентября 2018 г., и предварительной заявке на патент США №62/837,833, поданной 24 апреля 2019 г., каждая из которых включена в настоящее описание во всей полноте посредством ссылки.
ЗАЯВЛЕНИЕ ОТНОСИТЕЛЬНО ИССЛЕДОВАНИЙ ИЛИ РАЗРАБОТКИ, СПОНСИРУЕМЫХ ФЕДЕРАЛЬНЫМИ ОРГАНАМИ
Настоящее изобретение выполнено при государственной поддержке в рамках грантов NIH №№ AI 085596 и AI 117410, выданных Национальными институтами здравоохранения (NIH). Правительство имеет определенные права на изобретение.
УРОВЕНЬ ТЕХНИКИ
Система комплемента является частью врожденного иммунитета, который играет ключевую роль в защите хозяина. Однако активированный комплемент также может вызывать значительное повреждение и разрушение тканей, к тому же, нарушение регуляции активности комплемента, как было установлено, связано с рядом редких и распространенных заболеваний, таких как пароксизмальная ночная гемоглобинурия (PNH), атипичный гемолитико-уремический синдром, ревматоидный артрит, возрастная дегенерация желтого пятна и т.д. Таким образом, антикомплементная терапия является многообещающим способом лечения этих заболеваний человека.
Комплемент C5 является критическим белком в конечном пути активации комплемента и является белком-предшественником для образования мощного провоспалительного медиатора C5a, а также цитолитического комплекса мембранной атаки (MAC).
Ряд воспалительных и аутоиммунных заболеваний человека опосредуется C5a и/или MAC, и блокирование активации C5 должно предотвращать образование C5a и MAC и иметь терапевтическое значение. Гуманизированное мышиное mAb к человеческому C5, экулизумаб, использовали для лечения двух опосредованных комплементом заболеваний: пароксизмальной ночной гемоглобинурии (PNH) и атипичного гемолитико-уремического синдрома (aHUS). Однако не все пациенты с PNH реагируют на лечение экулизумабом, и одной из причин отсутствия реакции является генетический полиморфизм человеческого C5 с потерей связывания эпитопа с экулизумабом. Кроме того, из-за высокой концентрации C5 в плазме и целенаправленного быстрого удаления антитело, экулизумаб, необходимо вводить пациентам в высоких дозах и с высокой частотой.
Таким образом, в данной области существует потребность в mAb к человеческому C5 с более длительным периодом полувыведения, которые могут ингибировать активность терминальных компонентов комплемента через различные механизмы и участки контакта на C5 и, таким образом, обеспечивать более эффективное и удобное лечение комплемент-зависимых патологий. Настоящее изобретение направлено на удовлетворение и удовлетворяет эти и другие потребности.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В одном из вариантов осуществления изобретение относится к антителу, которое специфически связывается с C5. В одном из вариантов осуществления C5 представляет собой человеческий C5. В одном из вариантов осуществления антитело представляет собой моноклональное антитело. В одном из вариантов осуществления антитело представляет собой гуманизированное антитело. В одном из вариантов осуществления антитело представляет собой химерное антитело. В некоторых вариантах осуществления антитело представляет собой полноразмерное антитело. В некоторых вариантах осуществления антитело представляет собой фрагмент антитела, который включает, без ограничения, Fab, Fab’, F(ab)2, F(ab’)2 и scFv. В некоторых вариантах осуществления антитело является частью конструкции, например слитой конструкции, содержащей антитело и нацеливающий фрагмент или эффекторный фрагмент. В некоторых вариантах осуществления антитело является частью конструкции конъюгата, такой как конструкция конъюгата антитело-лекарственное средство.
В некоторых вариантах осуществления анти-C5 антитело проявляет pH-зависимое связывание с C5. В некоторых вариантах осуществления pH-зависимое анти-C5 антитело сильнее связывается с C5 при более нейтральном pH (например, примерно pH 7,4; который характерен для крови), чем при более кислом pH (например, примерно pH 5.8; который характерен для эндосом). В некоторых вариантах осуществления pH-зависимое анти-C5 антитело быстрее диссоциирует из комплекса с C5 при более кислом pH (например, примерно pH 5,8; который характерен для эндосом), чем при нейтральном pH (например, примерно pH 7,4; который характерен для крови).
В одном из вариантов осуществления pH-зависимое антитело специфически связывается с человеческим C5, причем pH-зависимое антитело содержит по меньшей мере одну из CDR, выбранных из группы, состоящей из: VH-CDR1, содержащей вариант SEQ ID NO: 3, имеющий по меньшей мере одну замену относительно SEQ ID NO: 3; VH-CDR2, содержащей вариант SEQ ID NO: 4, имеющий по меньшей мере одну замену относительно SEQ ID NO: 4, VH-CDR3, содержащей вариант SEQ ID NO: 5, имеющий по меньшей мере одну замену относительно SEQ ID NO: 5; VL-CDR1, содержащей вариант SEQ ID NO: 8, имеющий по меньшей мере одну замену относительно SEQ ID NO: 8; VL-CDR2, содержащей вариант SEQ ID NO: 9, имеющий по меньшей мере одну замену относительно SEQ ID NO: 9; и VL-CDR3, содержащей вариант SEQ ID NO: 10, имеющий по меньшей мере одну замену относительно SEQ ID NO: 10.
В одном из вариантов осуществления антитело содержит по меньшей мере одну из CDR, выбранных из группы, состоящей из: VH-CDR1: SEQ ID NO: 3; VH-CDR2: SEQ ID NO: 4; VH-CDR3: SEQ ID NO: 5; VL-CDR1: SEQ ID NO: 8; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 11 или их варианта или вариантов. В одном из вариантов осуществления антитело содержит CDR: VH-CDR1: SEQ ID NO: 3; VH-CDR2: SEQ ID NO: 4; VH-CDR3: SEQ ID NO: 5; VL-CDR1: SEQ ID NO: 8; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 11 или их вариант или варианты.
В одном из вариантов осуществления антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 2 или ее вариант. В одном из вариантов осуществления антитело содержит легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 13 или ее вариант. В одном из вариантов осуществления антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 2, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 13, или их вариант или варианты.
В одном из вариантов осуществления антитело содержит по меньшей мере одну из CDR, выбранных из группы, состоящей из: VH-CDR1: SEQ ID NO: 3; VH-CDR2: SEQ ID NO: 4; VH-CDR3: SEQ ID NO: 5; VL-CDR1: SEQ ID NO: 14; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их варианта или вариантов. В одном из вариантов осуществления антитело содержит CDR: VH-CDR1: SEQ ID NO: 3; VH-CDR2: SEQ ID NO: 4; VH-CDR3: SEQ ID NO: 5; VL-CDR1: SEQ ID NO: 14; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их вариант или варианты.
В одном из вариантов осуществления антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 2 или ее вариант. В одном из вариантов осуществления антитело содержит легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 16 или ее вариант. В одном из вариантов осуществления антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 2, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 16, или их вариант или варианты.
В одном из вариантов осуществления антитело содержит по меньшей мере одну из CDR, выбранных из группы, состоящей из: VH-CDR1: SEQ ID NO: 17; VH-CDR2: SEQ ID NO: 4; VH-CDR3: SEQ ID NO: 5; VL-CDR1: SEQ ID NO: 8; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их варианта или вариантов. В одном из вариантов осуществления антитело содержит CDR: VH-CDR1: SEQ ID NO: 17; VH-CDR2: SEQ ID NO: 4; VH-CDR3: SEQ ID NO: 5; VL-CDR1: SEQ ID NO: 8; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их вариант или варианты.
В одном из вариантов осуществления антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 19 или ее вариант. В одном из вариантов осуществления антитело содержит легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 7 или ее вариант. В одном из вариантов осуществления антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 19, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 7, или их вариант или варианты.
В одном из вариантов осуществления антитело содержит по меньшей мере одну из CDR, выбранных из группы, состоящей из: VH-CDR1: SEQ ID NO: 20; VH-CDR2: SEQ ID NO: 4; VH-CDR3: SEQ ID NO: 5; VL-CDR1: SEQ ID NO: 23; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их варианта или вариантов. В одном из вариантов осуществления антитело содержит CDR: VH-CDR1: SEQ ID NO: 20; VH-CDR2: SEQ ID NO: 4; VH-CDR3: SEQ ID NO: 5; VL-CDR1: SEQ ID NO: 23; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их вариант или варианты.
В одном из вариантов осуществления антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 22 или ее вариант. В одном из вариантов осуществления антитело содержит легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25 или ее вариант. В одном из вариантов осуществления антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 22, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25, или их вариант или варианты.
В одном из вариантов осуществления антитело содержит по меньшей мере одну из CDR, выбранных из группы, состоящей из: VH-CDR1: SEQ ID NO: 3; VH-CDR2: SEQ ID NO: 26; VH-CDR3: SEQ ID NO: 5; VL-CDR1: SEQ ID NO: 8; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 29 или их варианта или вариантов. В одном из вариантов осуществления антитело содержит CDR: VH-CDR1: SEQ ID NO: 3; VH-CDR2: SEQ ID NO: 26; VH-CDR3: SEQ ID NO: 5; VL-CDR1: SEQ ID NO: 8; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 29 или их вариант или варианты.
В одном из вариантов осуществления антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 28 или ее вариант. В одном из вариантов осуществления антитело содержит легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 31 или ее вариант. В одном из вариантов осуществления антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 28, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 31, или их вариант или варианты.
В одном из вариантов осуществления антитело содержит по меньшей мере одну из CDR, выбранных из группы, состоящей из: VH-CDR1: SEQ ID NO: 3; VH-CDR2: SEQ ID NO: 34; VH-CDR3: SEQ ID NO: 5; VL-CDR1: SEQ ID NO: 8; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их варианта или вариантов. В одном из вариантов осуществления антитело содержит CDR: VH-CDR1: SEQ ID NO: 3; VH-CDR2: SEQ ID NO: 34; VH-CDR3: SEQ ID NO: 5; VL-CDR1: SEQ ID NO: 8; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их вариант или варианты.
В одном из вариантов осуществления антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 36 или ее вариант. В одном из вариантов осуществления антитело содержит легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 7 или ее вариант. В одном из вариантов осуществления антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 36, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 7, или их вариант или варианты.
В одном из вариантов осуществления антитело содержит по меньшей мере одну из CDR, выбранных из группы, состоящей из: VH-CDR1: SEQ ID NO: 37; VH-CDR2: SEQ ID NO: 38; VH-CDR3: SEQ ID NO: 39; VL-CDR1: SEQ ID NO: 23; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их варианта или вариантов. В одном из вариантов осуществления антитело содержит CDR: VH-CDR1: SEQ ID NO: 37; VH-CDR2: SEQ ID NO: 38; VH-CDR3: SEQ ID NO: 39; VL-CDR1: SEQ ID NO: 23; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их вариант или варианты.
В одном из вариантов осуществления антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 41 или ее вариант. В одном из вариантов осуществления антитело содержит легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25 или ее вариант. В одном из вариантов осуществления антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 41, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25, или их вариант или варианты.
В одном из вариантов осуществления антитело содержит по меньшей мере одну из CDR, выбранных из группы, состоящей из: VH-CDR1: SEQ ID NO: 42; VH-CDR2: SEQ ID NO: 43; VH-CDR3: SEQ ID NO: 44; VL-CDR1: SEQ ID NO: 23; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их варианта или вариантов. В одном из вариантов осуществления антитело содержит CDR: VH-CDR1: SEQ ID NO: 42; VH-CDR2: SEQ ID NO: 43; VH-CDR3: SEQ ID NO: 44; VL-CDR1: SEQ ID NO: 23; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их вариант или варианты.
В одном из вариантов осуществления антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 46 или ее вариант. В одном из вариантов осуществления антитело содержит легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25 или ее вариант. В одном из вариантов осуществления антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 46, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25, или их вариант или варианты.
В одном из вариантов осуществления антитело содержит по меньшей мере одну из CDR, выбранных из группы, состоящей из: VH-CDR1: SEQ ID NO: 47; VH-CDR2: SEQ ID NO: 48; VH-CDR3: SEQ ID NO: 49; VL-CDR1: SEQ ID NO: 23; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их варианта или вариантов. В одном из вариантов осуществления антитело содержит CDR: VH-CDR1: SEQ ID NO: 47; VH-CDR2: SEQ ID NO: 48; VH-CDR3: SEQ ID NO: 49; VL-CDR1: SEQ ID NO: 23; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их вариант или варианты.
В одном из вариантов осуществления антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 51 или ее вариант. В одном из вариантов осуществления антитело содержит легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25 или ее вариант. В одном из вариантов осуществления антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 51, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25, или их вариант или варианты.
В одном из вариантов осуществления антитело содержит по меньшей мере одну из CDR, выбранных из группы, состоящей из: VH-CDR1: SEQ ID NO: 52; VH-CDR2: SEQ ID NO: 53; VH-CDR3: SEQ ID NO: 54; VL-CDR1: SEQ ID NO: 23; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их варианта или вариантов. В одном из вариантов осуществления антитело содержит CDR: VH-CDR1: SEQ ID NO: 52; VH-CDR2: SEQ ID NO: 53; VH-CDR3: SEQ ID NO: 54; VL-CDR1: SEQ ID NO: 23; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их вариант или варианты.
В одном из вариантов осуществления антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 56 или ее вариант. В одном из вариантов осуществления антитело содержит легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25 или ее вариант. В одном из вариантов осуществления антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 56, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25, или их вариант или варианты.
В одном из вариантов осуществления антитело содержит по меньшей мере одну из CDR, выбранных из группы, состоящей из: VH-CDR1: SEQ ID NO: 47; VH-CDR2: SEQ ID NO: 57; VH-CDR3: SEQ ID NO: 49; VL-CDR1: SEQ ID NO: 23; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их варианта или вариантов. В одном из вариантов осуществления антитело содержит CDR: VH-CDR1: SEQ ID NO: 47; VH-CDR2: SEQ ID NO: 57; VH-CDR3: SEQ ID NO: 49; VL-CDR1: SEQ ID NO: 23; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их вариант или варианты.
В одном из вариантов осуществления антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 59 или ее вариант. В одном из вариантов осуществления антитело содержит легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25 или ее вариант. В одном из вариантов осуществления антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 59, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25, или их вариант или варианты.
В одном из вариантов осуществления антитело содержит по меньшей мере одну из CDR, выбранных из группы, состоящей из: VH-CDR1: SEQ ID NO: 37; VH-CDR2: SEQ ID NO: 62; VH-CDR3: SEQ ID NO: 39; VL-CDR1: SEQ ID NO: 23; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их варианта или вариантов. В одном из вариантов осуществления антитело содержит CDR: SEQ ID NO: 37; VH-CDR2: SEQ ID NO: 62; VH-CDR3: SEQ ID NO: 39; VL-CDR1: SEQ ID NO: 23; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их вариант или варианты.
В одном из вариантов осуществления антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 64 или ее вариант. В одном из вариантов осуществления антитело содержит легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25 или ее вариант. В одном из вариантов осуществления антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 64, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25, или их вариант или варианты.
В одном из вариантов осуществления антитело содержит по меньшей мере одну из CDR, выбранных из группы, состоящей из: VH-CDR1: SEQ ID NO: 42; VH-CDR2: SEQ ID NO: 65; VH-CDR3: SEQ ID NO: 44; VL-CDR1: SEQ ID NO: 23; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их варианта или вариантов. В одном из вариантов осуществления антитело содержит CDR: SEQ ID NO: 42; VH-CDR2: SEQ ID NO: 65; VH-CDR3: SEQ ID NO: 44; VL-CDR1: SEQ ID NO: 23; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их вариант или варианты.
В одном из вариантов осуществления антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 67 или ее вариант. В одном из вариантов осуществления антитело содержит легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25 или ее вариант. В одном из вариантов осуществления антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 67, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25, или их вариант или варианты.
В одном из вариантов осуществления антитело содержит по меньшей мере одну из CDR, выбранных из группы, состоящей из: VH-CDR1: SEQ ID NO: 52; VH-CDR2: SEQ ID NO: 68; VH-CDR3: SEQ ID NO: 54; VL-CDR1: SEQ ID NO: 23; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их варианта или вариантов. В одном из вариантов осуществления антитело содержит CDR: SEQ ID NO: 52; VH-CDR2: SEQ ID NO: 68; VH-CDR3: SEQ ID NO: 54; VL-CDR1: SEQ ID NO: 23; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их вариант или варианты.
В одном из вариантов осуществления антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 70 или ее вариант. В одном из вариантов осуществления антитело содержит легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25 или ее вариант. В одном из вариантов осуществления антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 70, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25, или их вариант или варианты.
В различных вариантах осуществления любое из представленных в настоящем описании антител по изобретению, имеющее любую из представленных в настоящем описании вариабельных областей, может содержать Fc-фрагмент или Fc-домен. Например, в некоторых вариантах осуществления представленное в настоящем описании антитело содержит Fc-фрагмент иммуноглобулина. Примеры иммуноглобулинов включают, без ограничения, IgG1, IgG2, IgG3, IgG4, IgM, IgA, IgE и IgD. В одном из вариантов осуществления антитело содержит Fc-фрагмент человеческого IgG4. В одном из вариантов осуществления антитело содержит Fc-фрагмент человеческого IgG4, содержащий аминокислотную последовательность SEQ ID NO: 32. В одном из вариантов осуществления антитело содержит Fc-фрагмент человеческого IgG4, имеющий мутацию S108P относительно SEQ ID NO: 32. В одном из вариантов осуществления Fc-фрагмент человеческого IgG4, имеющий мутацию S108P относительно SEQ ID NO: 32, содержит аминокислотную последовательность SEQ ID NO: 33. В одном из вариантов осуществления антитело содержит Fc-фрагмент человеческого IgG4, имеющий мутацию S108P, мутацию M308L и мутацию N314A относительно SEQ ID NO: 32. В одном из вариантов осуществления Fc-фрагмент человеческого IgG4, имеющий мутацию S108P, мутацию M308L и мутацию N314A относительно SEQ I DNO: 32, содержит аминокислотную последовательность SEQ ID NO: 61.
В одном из вариантов осуществления антитело представляет собой по меньшей мере одно, выбранное из группы, состоящей из mAb L3-1, L1-2, H1-4, H1-8/L1-9 и H2-6/L3-5. В одном из вариантов осуществления антитело представляет собой вариант mAb H1-8/L1-9.
В некоторых вариантах осуществления анти-C5 антитело или его антигенсвязывающий фрагмент содержит замену остатка пролина в положении 4 (т.е. P4) в VH CDR2 относительно SEQ ID NO: 4. В различных вариантах осуществления замена в P4 представляет собой P4→F4 (т.е. P4F), P4→L4 (т.е. P4L), P4→M4 (т.е. P4M), P4→W4 (т.е. P4W) или P4→I4 (т.е. P4I).
В некоторых вариантах осуществления анти-C5 антитело или его антигенсвязывающий фрагмент содержит замену остатка треонина в положении 9 (т.е. T9) в VH CDR2 относительно SEQ ID NO: 4. В различных вариантах осуществления замена в T9 представляет собой T9→H9 (т.е. T9H), T9→F9 (т.е. T9F), T9→L9 (т.е. T9L), T9→M9 (т.е. T9M), T9→W9 (т.е. T9W) или T9→I9 (т.е. T9I).
В некоторых вариантах осуществления анти-C5 антитело или его антигенсвязывающий фрагмент включает замену остатка пролина в положении 4 (т.е. P4) в VH CDR2 относительно SEQ ID NO: 4 и замену остатка треонина в положении 9 (т.е. Т9) в VH CDR2 относительно SEQ ID NO: 4. В различных вариантах осуществления замена в P4 представляет собой P4→F4 (т.е. P4F), P4→L4 (т.е. P4L), P4→M4 (т.е. P4M), P4→W4 (т.е. P4W) или P4→I4 (т.е. P4I); и замена в T9 представляет собой T9→H9 (т.е. T9H), T9→F9 (т.е. T9F), T9→L9 (т.е. T9L), T9→M9 (т.е. T9M), T9→W9 (т.е. T9W) или T9→I9 (т.е. T9I).
В некоторых вариантах осуществления анти-C5 антитело или его антигенсвязывающий фрагмент содержит замену остатка валина в положении 16 (т.е. V16) в VH CDR3 относительно SEQ ID NO: 5. В различных вариантах осуществления замена в V16 представляет собой V16→F16 (т.е. V16F), V16→E16 (т.е. V16E) или V16→W16 (т.е. V16W).
В некоторых вариантах осуществления анти-C5 антитело или его антигенсвязывающий фрагмент содержит замену остатка лейцина в положении 9 (т.е. L9) в VH CDR1 относительно SEQ ID NO: 20. В различных вариантах осуществления замена в L9 представляет собой L9→W9 (т.е. L9W), L9→I9 (т.е. L9I), L9→V9 (т.е. L9V), L9→Y9 (т.е. L9Y) или L9→F9 (т.е. L9F).
В некоторых вариантах осуществления анти-C5 антитело или его антигенсвязывающий фрагмент содержит замену в двух или более положениях из группы, состоящей из пролина 4 (т.е. P4) в VH CDR2, относительно SEQ ID NO: 4, треонина 9 (т.е. T9) в VH CDR2 относительно SEQ ID NO: 4, валина 16 (т.е. V16) в VH CDR3 относительно SEQ ID NO: 5 и лейцина 9 (т.е. L9) в VH CDR1 относительно SEQ ID НЕТ: 20. В различных вариантах осуществления анти-C5 антитело или его антигенсвязывающий фрагмент, содержащий замену в двух или более положениях из группы, состоящей из пролина 4 (т.е. P4) в VH CDR2, относительно SEQ ID NO: 4, валина 16 (т.е. V16) в VH CDR3 относительно SEQ ID NO: 5 и лейцина 9 (т.е. L9) в VH CDR1 относительно SEQ ID NO: 20, содержит две или более замен, выбранных из группы, состоящей из L9I/P4M, L9I/P4W, L9I/P4F, L9F/P4M, L9F/P4W, L9F/P4F, L9I/P4M/V16W, L9I/P4W/V16W, L9I/P4F/V16W, L9F/P4M/V16W, L9F/P4W/V16W, L9F/P4F/V16W, L9I/P4M/V16E, L9I/P4W/V16E, L9I/P4F/V16E, L9F/P4M/V16E, L9F/P4W/V16E, L9F/P4F/V16E, L9I/P4M/T9H/V16W, L9I/P4W/T9H/V16W, L9I/P4F/T9H/V16W, L9F/P4M/T9H/V16W, L9F/P4W/T9H/V16W, L9F/P4F/T9H/V16W, L9I/P4M/T9H/V16E, L9I/P4W/T9H/V16E, L9I/P4F/T9H/V16E, L9F/P4M/T9H/V16E, L9F/P4W/T9H/V16E и L9F/P4F/T9H/V16E.
В одном из вариантов осуществления настоящее изобретение относится к способу лечения комплемент-опосредованного заболевания или расстройства у индивидуума, включающему этап введения указанному индивидууму заявленного анти-C5 антитела. В одном из вариантов осуществления заболевание или расстройство выбирают по меньшей мере из группы, состоящей из: дегенерации желтого пятна (MD), возрастной дегенерации желтого пятна (AMD), ишемического реперфузионного повреждения, артрита, ревматоидного артрита, астмы, аллергической астмы, волчанки, язвенного колита, инсульта, синдрома системного воспалительного ответа в послеоперационном периоде, хронической обструктивной болезни легких (COPD), синдрома пароксизмальной ночной гемоглобинурии (PNH), миастении гравис, оптического нейромиелита (NMO), рассеянного склероза, задержки функции трансплантата на фоне антитело-опосредованного отторжения, атипичного гемолитико-уремического синдрома (aHUS), окклюзии центральной вены сетчатки (CRVO), окклюзии центральной артерии сетчатки (CRAO), буллезного эпидермолиза, сепсиса, трансплантации органов, воспаления (включая, помимо прочего, воспаление, связанное с операцией в условиях искусственного кровообращения и диализом почек), гломерулопатии C3, мембранозной нефропатии, нефропатии IgA, гломерулонефрита (включая, помимо прочего, гломерулонефрит, опосредованный цитоплазматическими антителами против нейтрофилов (ANCA), волчаночный нефрит и их комбинацию), ANCA-опосредованного васкулита, HUS, индуцированного Шига-токсином, и потери беременности, вызванной антифосфолипидными антителами, или любых их комбинаций. В некоторых вариантах осуществления AP-опосредованное заболевание представляет собой гломерулопатию C3. В некоторых вариантах осуществления AP-опосредованное заболевание представляет собой дегенерацию желтого пятна, такую как возрастная дегенерация желтого пятна. В одном из вариантов осуществления введение анти-C5 антитела ингибирует образование белка C5a или C5b.
В одном из вариантов осуществления настоящее изобретение относится к способу снижения активности системы комплемента у индивидуума, причем способ включает введение индивидууму антитела способом введения, выбранным из группы, состоящей из энтерального введения, парентерального введения и их комбинации, причем указанное антитело содержит шесть определяющих комплементарность областей, имеющих следующие аминокислотные последовательности: VH-CDR1: SEQ ID NO: 3; VH-CDR2: SEQ ID NO: 4; VH-CDR3: SEQ ID NO: 5; VL-CDR1: SEQ ID NO: 8; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их вариант или варианты. В одном из вариантов осуществления антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В одном из вариантов осуществления настоящее изобретение относится к способу снижения активности системы комплемента у индивидуума, причем способ включает введение индивидууму антитела способом введения, выбранным из группы, состоящей из энтерального введения, парентерального введения и их комбинации, причем указанное антитело содержит шесть определяющих комплементарность областей, имеющих следующие аминокислотные последовательности: VH-CDR1: SEQ ID NO: 3; VH-CDR2: SEQ ID NO: 4; VH-CDR3: SEQ ID NO: 5; VL-CDR1: SEQ ID NO: 8; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 11 или их вариант или варианты. В одном из вариантов осуществления антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В одном из вариантов осуществления настоящее изобретение относится к способу снижения активности системы комплемента у индивидуума, причем способ включает введение индивидууму антитела способом введения, выбранным из группы, состоящей из энтерального введения, парентерального введения и их комбинации, причем указанное антитело содержит шесть определяющих комплементарность областей, имеющих следующие аминокислотные последовательности: VH-CDR1: SEQ ID NO: 3; VH-CDR2: SEQ ID NO: 4; VH-CDR3: SEQ ID NO: 5; VL-CDR1: SEQ ID NO: 14; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их вариант или варианты. В одном из вариантов осуществления антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F (ab)2, F(ab’)2, scFv и их комбинаций.
В одном из вариантов осуществления настоящее изобретение относится к способу снижения активности системы комплемента у индивидуума, причем способ включает введение индивидууму антитела способом введения, выбранным из группы, состоящей из энтерального введения, парентерального введения и их комбинации, причем указанное антитело содержит шесть определяющих комплементарность областей, имеющих следующие аминокислотные последовательности: VH-CDR1: SEQ ID NO: 17; VH-CDR2: SEQ ID NO: 4; VH-CDR3: SEQ ID NO: 5; VL-CDR1: SEQ ID NO: 8; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их вариант или варианты. В одном из вариантов осуществления антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В одном из вариантов осуществления настоящее изобретение относится к способу снижения активности системы комплемента у индивидуума, причем способ включает введение индивидууму антитела способом введения, выбранным из группы, состоящей из энтерального введения, парентерального введения и их комбинации, причем указанное антитело содержит шесть определяющих комплементарность областей, имеющих следующие аминокислотные последовательности: VH-CDR1: SEQ ID NO: 20; VH-CDR2: SEQ ID NO: 4; VH-CDR3: SEQ ID NO: 5; VL-CDR1: SEQ ID NO: 23; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их вариант или варианты. В одном из вариантов осуществления антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В одном из вариантов осуществления настоящее изобретение относится к способу снижения активности системы комплемента у индивидуума, причем способ включает введение индивидууму антитела способом введения, выбранным из группы, состоящей из энтерального введения, парентерального введения и их комбинации, причем указанное антитело содержит шесть определяющих комплементарность областей, имеющих следующие аминокислотные последовательности: VH-CDR1: SEQ ID NO: 3; VH-CDR2: SEQ ID NO: 26; VH-CDR3: SEQ ID NO: 5; VL-CDR1: SEQ ID NO: 8; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 29 или их вариант или варианты. В одном из вариантов осуществления антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В одном из вариантов осуществления настоящее изобретение относится к способу снижения активности системы комплемента у индивидуума, причем способ включает введение индивидууму антитела способом введения, выбранным из группы, состоящей из энтерального введения, парентерального введения и их комбинации, причем указанное антитело содержит шесть определяющих комплементарность областей, имеющих следующие аминокислотные последовательности: VH-CDR1: SEQ ID NO: 37; VH-CDR2: SEQ ID NO: 38; VH-CDR3: SEQ ID NO: 39; VL-CDR1: SEQ ID NO: 23; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их вариант или варианты. В одном из вариантов осуществления антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В одном из вариантов осуществления настоящее изобретение относится к способу снижения активности системы комплемента у индивидуума, причем способ включает введение индивидууму антитела способом введения, выбранным из группы, состоящей из энтерального введения, парентерального введения и их комбинации, причем указанное антитело содержит шесть определяющих комплементарность областей, имеющих следующие аминокислотные последовательности: VH-CDR1: SEQ ID NO: 42; VH-CDR2: SEQ ID NO: 43; VH-CDR3: SEQ ID NO: 44; VL-CDR1: SEQ ID NO: 23; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их вариант или варианты. В одном из вариантов осуществления антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В одном из вариантов осуществления настоящее изобретение относится к способу снижения активности системы комплемента у индивидуума, причем способ включает введение индивидууму антитела способом введения, выбранным из группы, состоящей из энтерального введения, парентерального введения и их комбинации, причем указанное антитело содержит шесть определяющих комплементарность областей, имеющих следующие аминокислотные последовательности: VH-CDR1: SEQ ID NO: 47; VH-CDR2: SEQ ID NO: 48; VH-CDR3: SEQ ID NO: 49; VL-CDR1: SEQ ID NO: 23; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их вариант или варианты. В одном из вариантов осуществления антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В одном из вариантов осуществления настоящее изобретение относится к способу снижения активности системы комплемента у индивидуума, причем способ включает введение индивидууму антитела способом введения, выбранным из группы, состоящей из энтерального введения, парентерального введения и их комбинации, причем указанное антитело содержит шесть определяющих комплементарность областей, имеющих следующие аминокислотные последовательности: VH-CDR1: SEQ ID NO: 52; VH-CDR2: SEQ ID NO: 53; VH-CDR3: SEQ ID NO: 54; VL-CDR1: SEQ ID NO: 23; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их вариант или варианты. В одном из вариантов осуществления антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В одном из вариантов осуществления настоящее изобретение относится к способу снижения активности системы комплемента у индивидуума, причем способ включает введение индивидууму антитела способом введения, выбранным из группы, состоящей из энтерального введения, парентерального введения и их комбинации, причем указанное антитело содержит шесть определяющих комплементарность областей, имеющих следующие аминокислотные последовательности: VH-CDR1: SEQ ID NO: 47; VH-CDR2: SEQ ID NO: 57; VH-CDR3: SEQ ID NO: 49; VL-CDR1: SEQ ID NO: 23; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их вариант или варианты. В одном из вариантов осуществления антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В одном из вариантов осуществления настоящее изобретение относится к способу снижения активности системы комплемента у индивидуума, причем способ включает введение индивидууму антитела способом введения, выбранным из группы, состоящей из энтерального введения, парентерального введения и их комбинации, причем указанное антитело содержит шесть определяющих комплементарность областей, имеющих следующие аминокислотные последовательности: VH-CDR1: SEQ ID NO: 37; VH-CDR2: SEQ ID NO: 62; VH-CDR3: SEQ ID NO: 39; VL-CDR1: SEQ ID NO: 23; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их вариант или варианты. В одном из вариантов осуществления антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В одном из вариантов осуществления настоящее изобретение относится к способу снижения активности системы комплемента у индивидуума, причем способ включает введение индивидууму антитела способом введения, выбранным из группы, состоящей из энтерального введения, парентерального введения и их комбинации, причем указанное антитело содержит шесть определяющих комплементарность областей, имеющих следующие аминокислотные последовательности: VH-CDR1: SEQ ID NO: 42; VH-CDR2: SEQ ID NO: 65; VH-CDR3: SEQ ID NO: 44; VL-CDR1: SEQ ID NO: 23; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их вариант или варианты. В одном из вариантов осуществления антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В одном из вариантов осуществления настоящее изобретение относится к способу снижения активности системы комплемента у индивидуума, причем способ включает введение индивидууму антитела способом введения, выбранным из группы, состоящей из энтерального введения, парентерального введения и их комбинации, причем указанное антитело содержит шесть определяющих комплементарность областей, имеющих следующие аминокислотные последовательности: VH-CDR1: SEQ ID NO: 52; VH-CDR2: SEQ ID NO: 68; VH-CDR3: SEQ ID NO: 54; VL-CDR1: SEQ ID NO: 23; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их вариант или варианты. В одном из вариантов осуществления антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В некоторых вариантах осуществления настоящее изобретение относится к антителу к человеческому C5, причем указанное антитело имеет вариабельную область тяжелой цепи (vH), которая имеет аминокислотную последовательность, которая идентична на более чем примерно 90% (например, более чем 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) SEQ ID NO: 2 или ее варианту. В одном из вариантов осуществления антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В некоторых вариантах осуществления настоящее изобретение относится к антителу к человеческому C5, причем указанное антитело имеет вариабельную область легкой цепи (vL), которая имеет аминокислотную последовательность, которая идентична на более чем примерно 90% (например, более чем 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) SEQ ID NO: 7 или ее варианту. В одном из вариантов осуществления антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В некоторых вариантах осуществления настоящее изобретение относится к антителу к человеческому C5, причем антитело имеет вариабельную область тяжелой цепи (vH) и вариабельную область легкой цепи (vL), причем vH область имеет аминокислотную последовательность, которая идентична на более чем примерно 90% (например, более чем 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) SEQ ID NO: 2, и vL причем область имеет аминокислотную последовательность, которая идентична на более чем примерно 90% (например, более чем 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) SEQ ID NO: 7. В одном из вариантов осуществления антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В некоторых вариантах осуществления настоящее изобретение относится к антителу к человеческому C5, причем указанное антитело имеет вариабельную область легкой цепи (vL), которая имеет аминокислотную последовательность, которая идентична на более чем примерно 90% (например, более чем 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) SEQ ID NO: 13 или ее варианту. В одном из вариантов осуществления антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В некоторых вариантах осуществления настоящее изобретение относится к антителу к человеческому C5, причем указанное антитело имеет вариабельную область тяжелой цепи (vH) и вариабельную область легкой цепи (vL), причем vH область имеет аминокислотную последовательность, которая идентична на более чем примерно 90% (например, более чем 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) SEQ ID NO: 2, и причем vL область имеет аминокислотную последовательность, которая идентична на более чем примерно 90% (например, более чем 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) SEQ ID NO: 13. В одном из вариантов осуществления антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В некоторых вариантах осуществления настоящее изобретение относится к антителу к человеческому C5, причем антитело имеет вариабельную область легкой цепи (vL), которая имеет аминокислотную последовательность, которая идентична на более чем примерно 90% (например, более чем 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) SEQ ID NO: 16. В одном из вариантов осуществления антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В некоторых вариантах осуществления настоящее изобретение относится к антителу к человеческому C5, причем антитело имеет вариабельную область тяжелой цепи (vH) и вариабельную область легкой цепи (vL), причем vH область имеет аминокислотную последовательность, которая идентична на более чем примерно 90% (например, более чем 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) SEQ ID NO: 2, и причем vL область имеет аминокислотную последовательность, которая идентична на более чем примерно 90% (например, более чем 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) SEQ ID NO: 16. В одном из вариантов осуществления антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В некоторых вариантах осуществления настоящее изобретение относится к антителу к человеческому C5, причем антитело имеет вариабельную область тяжелой цепи (vH), которая имеет аминокислотную последовательность, которая идентична на более чем примерно 90% (например, более чем 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) SEQ ID NO: 19. В одном из вариантов осуществления антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В некоторых вариантах осуществления настоящее изобретение относится к антителу к человеческому C5, причем антитело имеет вариабельную область легкой цепи (vL), которая имеет аминокислотную последовательность, которая идентична на более чем примерно 90% (например, более чем 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) SEQ ID NO: 7. В одном из вариантов осуществления антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В некоторых вариантах осуществления настоящее изобретение относится к антителу к человеческому C5, причем антитело имеет вариабельную область тяжелой цепи (vH) и вариабельную область легкой цепи (vL), причем vH область имеет аминокислотную последовательность, которая идентична на более чем примерно 90% (например, более чем 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) SEQ ID NO: 19, и причем vL область имеет аминокислотную последовательность, которая идентична на более чем примерно 90% (например, более чем 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) SEQ ID NO: 7. В одном из вариантов осуществления антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В некоторых вариантах осуществления настоящее изобретение относится к антителу к человеческому C5, причем антитело имеет вариабельную область тяжелой цепи (vH), которая имеет аминокислотную последовательность, которая идентична на более чем примерно 90% (например, более чем 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) SEQ ID NO: 22. В одном из вариантов осуществления антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В одном из вариантов осуществления настоящее изобретение относится к антителу к человеческому C5, причем антитело имеет вариабельную область легкой цепи (vL), которая имеет аминокислотную последовательность, которая идентична на более чем примерно 90% (например, более чем 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) SEQ ID NO: 25. В одном из вариантов осуществления антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В некоторых вариантах осуществления настоящее изобретение относится к антителу к человеческому C5, причем антитело имеет вариабельную область тяжелой цепи (vH) и вариабельную область легкой цепи (vL), причем vH область имеет аминокислотную последовательность, которая идентична на более чем примерно 90% (например, более чем 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) SEQ ID NO: 22, и причем vL область имеет аминокислотную последовательность, которая идентична на более чем примерно 90% (например, более чем 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) SEQ ID NO: 25. В одном из вариантов осуществления антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В некоторых вариантах осуществления настоящее изобретение относится к антителу к человеческому C5, причем антитело имеет вариабельную область тяжелой цепи (vH), которая имеет аминокислотную последовательность, которая идентична на более чем примерно 90% (например, более чем 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) SEQ ID NO: 28. В одном из вариантов осуществления антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В некоторых вариантах осуществления настоящее изобретение относится к антителу к человеческому C5, причем антитело имеет вариабельную область легкой цепи (vL), которая имеет аминокислотную последовательность, которая идентична на более чем примерно 90% (например, более чем 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) SEQ ID NO: 31. В одном из вариантов осуществления антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В некоторых вариантах осуществления настоящее изобретение относится к антителу к человеческому C5, причем антитело имеет вариабельную область тяжелой цепи (vH) и вариабельную область легкой цепи (vL), причем vH область имеет аминокислотную последовательность, которая идентична на более чем примерно 90% (например, более чем 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) SEQ ID NO: 28, и причем vL область имеет аминокислотную последовательность, которая идентична на более чем примерно 90% (например, более чем 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) SEQ ID NO: 31. В одном из вариантов осуществления антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В некоторых вариантах осуществления настоящее изобретение относится к антителу к человеческому C5, причем антитело имеет вариабельную область тяжелой цепи (vH), которая имеет аминокислотную последовательность, которая идентична на более чем примерно 90% (например, более чем 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) SEQ ID NO: 41. В одном из вариантов осуществления антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В некоторых вариантах осуществления настоящее изобретение относится к антителу к человеческому C5, причем антитело имеет вариабельную область тяжелой цепи (vH) и вариабельную область легкой цепи (vL), причем vH область имеет аминокислотную последовательность, которая идентична на более чем примерно 90% (например, более чем 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) SEQ ID NO: 41, и причем vL область имеет аминокислотную последовательность, которая идентична на более чем примерно 90% (например, более чем 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) SEQ ID NO: 25. В одном из вариантов осуществления антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В некоторых вариантах осуществления настоящее изобретение относится к антителу к человеческому C5, причем антитело имеет вариабельную область тяжелой цепи (vH), которая имеет аминокислотную последовательность, которая идентична на более чем примерно 90% (например, более чем 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) SEQ ID NO: 46. В одном из вариантов осуществления антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В некоторых вариантах осуществления настоящее изобретение относится к антителу к человеческому C5, причем антитело имеет вариабельную область тяжелой цепи (vH) и вариабельную область легкой цепи (vL), причем vH область имеет аминокислотную последовательность, которая идентична на более чем примерно 90% (например, более чем 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) SEQ ID NO: 46, и причем vL область имеет аминокислотную последовательность, которая идентична на более чем примерно 90% (например, более чем 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) SEQ ID NO: 25. В одном из вариантов осуществления антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В некоторых вариантах осуществления настоящее изобретение относится к антителу к человеческому C5, причем антитело имеет вариабельную область тяжелой цепи (vH), которая имеет аминокислотную последовательность, которая идентична на более чем примерно 90% (например, более чем 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) SEQ ID NO: 51. В одном из вариантов осуществления антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В некоторых вариантах осуществления настоящее изобретение относится к антителу к человеческому C5, причем антитело имеет вариабельную область тяжелой цепи (vH) и вариабельную область легкой цепи (vL), причем vH область имеет аминокислотную последовательность, которая идентична на более чем примерно 90% (например, более чем 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) SEQ ID NO: 51, и причем vL область имеет аминокислотную последовательность, которая идентична на более чем примерно 90% (например, более чем 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) SEQ ID NO: 25. В одном из вариантов осуществления антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В некоторых вариантах осуществления настоящее изобретение относится к антителу к человеческому C5, причем антитело имеет вариабельную область тяжелой цепи (vH), которая имеет аминокислотную последовательность, которая идентична на более чем примерно 90% (например, более чем 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) SEQ ID NO: 56. В одном из вариантов осуществления антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В некоторых вариантах осуществления настоящее изобретение относится к антителу к человеческому C5, причем антитело имеет вариабельную область тяжелой цепи (vH) и вариабельную область легкой цепи (vL), причем vH область имеет аминокислотную последовательность, которая идентична на более чем примерно 90% (например, более чем 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) SEQ ID NO: 56, и причем vL область имеет аминокислотную последовательность, которая идентична на более чем примерно 90% (например, более чем 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) SEQ ID NO: 25. В одном из вариантов осуществления антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В некоторых вариантах осуществления настоящее изобретение относится к антителу к человеческому C5, причем антитело имеет вариабельную область тяжелой цепи (vH), которая имеет аминокислотную последовательность, которая идентична на более чем примерно 90% (например, более чем 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) SEQ ID NO: 59. В одном из вариантов осуществления антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В некоторых вариантах осуществления настоящее изобретение относится к антителу к человеческому C5, причем антитело имеет вариабельную область тяжелой цепи (vH) и вариабельную область легкой цепи (vL), причем vH область имеет аминокислотную последовательность, которая идентична на более чем примерно 90% (например, более чем 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) SEQ ID NO: 59, и причем vL область имеет аминокислотную последовательность, которая идентична на более чем примерно 90% (например, более чем 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) SEQ ID NO: 25. В одном из вариантов осуществления антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В некоторых вариантах осуществления настоящее изобретение относится к антителу к человеческому C5, причем антитело имеет вариабельную область тяжелой цепи (vH), которая имеет аминокислотную последовательность, которая идентична на более чем примерно 90% (например, более чем 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) SEQ ID NO: 64. В одном из вариантов осуществления антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В некоторых вариантах осуществления настоящее изобретение относится к антителу к человеческому C5, причем антитело имеет вариабельную область тяжелой цепи (vH) и вариабельную область легкой цепи (vL), причем vH область имеет аминокислотную последовательность, которая идентична на более чем примерно 90% (например, более чем 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) SEQ ID NO: 64, и причем vL область имеет аминокислотную последовательность, которая идентична на более чем примерно 90% (например, более чем 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) SEQ ID NO: 25. В одном из вариантов осуществления антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В некоторых вариантах осуществления настоящее изобретение относится к антителу к человеческому C5, причем антитело имеет вариабельную область тяжелой цепи (vH), которая имеет аминокислотную последовательность, которая идентична на более чем примерно 90% (например, более чем 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) SEQ ID NO: 67. В одном из вариантов осуществления антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В некоторых вариантах осуществления настоящее изобретение относится к антителу к человеческому C5, причем антитело имеет вариабельную область тяжелой цепи (vH) и вариабельную область легкой цепи (vL), причем vH область имеет аминокислотную последовательность, которая идентична на более чем примерно 90% (например, более чем 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) SEQ ID NO: 67, и причем vL область имеет аминокислотную последовательность, которая идентична на более чем примерно 90% (например, более чем 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) SEQ ID NO: 25. В одном из вариантов осуществления антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В некоторых вариантах осуществления настоящее изобретение относится к антителу к человеческому C5, причем антитело имеет вариабельную область тяжелой цепи (vH), которая имеет аминокислотную последовательность, которая идентична на более чем примерно 90% (например, более чем 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) SEQ ID NO: 70. В одном из вариантов осуществления антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В некоторых вариантах осуществления настоящее изобретение относится к антителу к человеческому C5, причем антитело имеет вариабельную область тяжелой цепи (vH) и вариабельную область легкой цепи (vL), причем vH область имеет аминокислотную последовательность, которая идентична на более чем примерно 90% (например, более чем 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) SEQ ID NO: 70, и причем vL область имеет аминокислотную последовательность, которая идентична на более чем примерно 90% (например, более чем 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) SEQ ID NO: 25. В одном из вариантов осуществления антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В некоторых вариантах осуществления настоящее изобретение относится к антителу к человеческому C5, причем антитело имеет Fc-фрагмент, который имеет аминокислотную последовательность, котороя идентична на более чем примерно 90% (например, более чем 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) SEQ ID NO: 32. В одном из вариантов осуществления антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В некоторых вариантах осуществления настоящее изобретение относится к антителу к человеческому C5, причем антитело имеет Fc-фрагмент, который имеет аминокислотную последовательность, которая идентична на более чем примерно 90% (например, более чем 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) SEQ ID NO: 33. В одном из вариантов осуществления антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В некоторых вариантах осуществления настоящее изобретение относится к антителу к человеческому C5, причем антитело имеет Fc-фрагмент, который имеет аминокислотную последовательность, которая идентична на более чем примерно 90% (например, более чем 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99%) SEQ ID NO: 61. В одном из вариантов осуществления антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
В одном из вариантов осуществления настоящее изобретение относится к клетке, содержащей по меньшей мере одно из антител, представленных в настоящем описании. В некоторых вариантах осуществления клетка продуцирует антитело, которое представляет собой по меньшей мере одно из антител, представленных в настоящем описании. В одном из вариантов осуществления клетка представляет собой гибридому.
В одном из вариантов осуществления настоящее изобретение представляет собой клеточную линию, содержащую по меньшей мере одно из антител, представленных в настоящем описании. В некоторых вариантах осуществления клеточная линия продуцирует по меньшей мере одно из антител, представленных в настоящем описании. В некоторых вариантах осуществления клеточная линия представляет собой гибридомную клеточную линию.
В одном из вариантов осуществления настоящее изобретение относится к генетически модифицированному животному, не являющемуся человеком. В одном из вариантов осуществления генетически модифицированное животное, не являющееся человеком, экспрессирует человеческий C5. В одном из вариантов осуществления генетически модифицированное животное, не являющееся человеком, представляет собой грызуна. В одном из вариантов осуществления генетически модифицированное животное, не являющееся человеком, представляет собой мышь. В одном из вариантов осуществления генетически модифицированное животное, не являющееся человеком, представляет собой мышь NOD/SCID. В одном из вариантов осуществления генетически модифицированное животное, не являющееся человеком, представляет собой мышь FcRn/SCID.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
Приведенное выше краткое описание, а также нижеследующее подробное описание иллюстративных вариантов осуществления изобретения будут более понятны при их изучении вместе с прилагаемыми чертежами. Однако следует понимать, что изобретение не ограничено точными условиями и порядком, а также техническими средствами, приведенными в вариантах осуществления, показанных на чертежах. На чертежах:
На фиг. 1 показаны нуклеотидные и аминокислотные последовательности вариабельной тяжелой цепи (VH) гуманизированного mAb 2G1 (VH-11801 гуманизированного 2G1) и вариабельной легкой цепи (VL) гуманизированного mAb 2G1 (VL-1901 гуманизированного 2G1). Гуманизация достигалась путем вставки CDR из VH мышиного mAb 2G1 в рамку считывания человеческой VH, кодируемой зародышевой линией (11801), и вставки CDR из VL мышиного mAb 2G1 в рамку считывания человеческой VL, кодируемой зародышевой линией (1901). Аминокислотные последовательности сигнальных пептидов подчеркнуты, и последовательности CDR1, CDR2 и CDR3 выделены жирным шрифтом и заштрихованы.
На фиг. 2 показаны нуклеотидные и аминокислотные последовательности mAb L3-1, гуманизированной VH-11801 и гуманизированной VL-1901 с заменой Q→H в VL-CDR3.
На фиг. 3 показаны нуклеотидные и аминокислотные последовательности mAb L1-2, гуманизированной VH-11801 и гуманизированной VL-1901 с заменой T→H в VL-CDR1.
На фиг. 4 показаны нуклеотидные и аминокислотные последовательности mAb H1-4, гуманизированной VH-11801 и гуманизированной VL-1901 с заменой I→H в VH-CDR1.
На фиг. 5 показаны нуклеотидные и аминокислотные последовательности mAb H1-8/L1-9, гуманизированной VH-11801 и гуманизированной VL-1901 с заменой N→H в VH-CDR1 и заменой Y→H в VL-CDR1.
На фиг. 6 показаны нуклеотидные и аминокислотные последовательности mAb H2-6/L3-5, гуманизированной VH-11801 и гуманизированной VL-1901 с заменой Y→H в VH-CDR2 и заменой E→H в VL-CDR3.
На фиг. 7 показано отслеживание связывания и диссоциации C5 с родительским гуманизированным mAb 11801 (VH-11801 (SEQ ID NO: 2) и VL-1901 (SEQ ID NO: 7)) при pH 5,8 и pH 7,4 с помощью системы Octet.
На фиг. 8 показано отслеживание связывания и диссоциации C5 с mAb L3-1 при pH 5,8 и pH 7,4 с помощью системы Octet.
На фиг. 9 показано отслеживание связывания и диссоциации C5 с mAb L1-2 при pH 5,8 и pH 7,4 с помощью системы Octet.
На фиг. 10 показано отслеживание связывания и диссоциации C5 с mAb H1-4 при pH 5,8 и pH 7,4 с помощью системы Octet.
На фиг. 11 показано отслеживание связывания и диссоциации C5 с mAb H2-6/L3-5 при pH 5,8 и pH 7,4 с помощью системы Octet.
На фиг. 12 показано отслеживание связывания и диссоциации C5 с mAb H1-8/L1-9 при pH 5,8 и pH 7,4 с помощью системы Octet.
На фиг. 13 представлены результаты анализа лизиса эритроцитов барана, опосредованного активацией комплемента по классическому пути, для оценки C5-ингибирующего эффекта родительского гуманизированного mAb 11801 (VH-11801 (SEQ ID NO: 2) и VL-1901 (SEQ ID NO: 7)) и его вариантов mAb L1-2, mAb L3-1 и mAb H2-6/L3-5.
На фиг. 14 представлены результаты анализа лизиса эритроцитов барана, опосредованного активацией комплемента по классическому пути, для оценки C5-ингибирующего эффекта родительского гуманизированного mAb 11801 (VH-11801 (SEQ ID NO: 2) и VL-1901 (SEQ ID NO: 7)) и варианта mAb H1-8/L1-9.
На фиг. 15 представлены результаты анализа лизиса эритроцитов барана, опосредованного активацией комплемента по классическому пути, для оценки C5-ингибирующего эффекта родительского гуманизированного 11801 (VH-11801 (SEQ ID NO: 2) и VL-1901 (SEQ ID NO: 7)) и вариантов mAb H1-4 и mAb L3-1.
На фиг. 16 представлены результаты анализа ELISA для оценки уровня человеческого C5 в плазме мышей NOD/SCID, генетически модифицированных для экспрессии человеческого C5. M1, M3, M4 и M5 обозначают 4 репрезентативных мышей.
На фиг. 17 представлены результаты анализа уровня человеческого IgG4 в плазме мышей NOD/SCID, генетически модифицированных для экспрессии человеческого C5, после инъекции mAb H1-4, H1-8/L1-9, H2-6/L3-5, L3-1 или L1-2.
На фиг. 18 представлены результаты анализа лизиса эритроцитов курицы, опосредованного активацией комплемента по классическому пути, для оценки фармакодинамики родительского гуманизированного mAb 2G1 (VH-11801 (SEQ ID NO: 2) и VL-1901 (SEQ ID NO: 7)) у мышей NOD/SCID, генетически модифицированных для экспрессии человеческого C5.
На фиг. 19 представлены результаты анализа лизиса эритроцитов курицы, опосредованного активацией комплемента по классическому пути, для оценки фармакодинамики mAb L3-1, L1-2, H1-4, H1-8/L1-9 и H2-6/L3-5 у мышей NOD/SCID, генетически модифицированных для экспрессии человеческого C5.
На фиг. 20 представлены результаты анализа ELISA, показывающие улучшенное связывание при pH 7,4 C5 с вариантами mAb H1-8/L1-9 ScFV, имеющими по меньшей мере одну замену лейцина 9 (т.е. L9) в VH CDR1 относительно SEQ ID NO: 20, пролина 4 (т.е. P4) в VH CDR2 относительно SEQ ID NO: 4 и/или валина 16 (т.е. V16) в VH CDR3 относительно SEQ ID NO: 5 (т.е. L9→W9 (т.е. L9W), L9→I9 (т.е. L9I), L9→V9 (т.е. L9V), L9→Y9 (т.е. L9Y), L9→F9 (т.е. L9F), P4→F4 (т.е. P4F), P4→L4 (т.е. P4L), P4→M4 (т.е. P4M), P4→W4 (т.е. P4W), P4→I4 (т.е. P4I), V16→F16 (т.е. V16F), V16→E16 (т.е. V16E) и V16→W16 (т.е. V16W)). Связывание вариантов mAb H1-8/L1-9 ScFV показано в столбцах 3 (OD450) и 4 (подтвержденное OD450), и связывание родительского mAb H1-8/L1-9 ScFV показано в столбце 8 (WT/OD450).
На фиг. 21 представлены результаты анализа с помощью системы Octet, выполненного для оценки относительного сродства связывания C5 с вариантами mAb H1-8/L1-9, экспрессированными в клетках Expi-CHO в виде человеческого IgG4. Клетки Expi-CHO трансфицировали вариантами H1-8 VH, как показано, и L1-9 VL (SEQ ID NO: 23), и супернатант клеточной культуры оценивали через 2 дня после трансфекции. Для данного супернатанта клеточной культуры вычисляли отношение между реакцией на связывание C5 и реакцией на связывание антитела и использовали в качестве меры сродства связывания C5. На фигуре показаны вычисленные отношения из двух отдельных анализов с помощью системы Octet в эксперименте по трансфекции вариантами mAb H1-8/L1-9 IgG4, имеющими по меньшей мере одну замену лейцина 9 (т.е. L9) в VH CDR1 относительно SEQ ID NO: 20, пролина 4 (т.е. P4) в VH CDR2 относительно SEQ ID NO: 4 и/или валина 16 (т.е. V16) в VH CDR3 относительно SEQ ID NO: 5 (т.е. L9→W9 (т.е. L9W), L9→I9 (т.е. L9I), L9→V9 (т.е. L9V), L9→Y9 (т.е. L9Y), L9→F9 (т.е. L9F), P4→F4 (т.е. P4F), P4→L4 (т.е. P4L), P4→M4 (т.е. P4M), P4→W4 (т.е. P4W), P4→I4 (т.е. P4I), V16→F16 (т.е. V16F), V16→E16 (т.е. V16E) и V16→W16 (т.е. V16W)).
На фиг. 22 представлены результаты анализа с помощью системы Octet, выполненного для оценки скорости диссоциации при pH 7,4 и pH 5,8, соответственно, C5 и вариантов mAb H1-8/L1-9. Вычисляли % уменьшения для каждого mAb при pH 7,4 и pH 5,8 относительно пиковой реакции на связывание C5 после перехода из фазы ассоциации в фазу диссоциации. На фигуре показано вычисленное в % уменьшение из двух отдельных анализов с помощью Octet в эксперименте по трансфекции вариантами mAb H1-8/L1-9 IgG4, имеющими по меньшей мере одну замену лейцина 9 (т.е. L9) в VH CDR1 относительно SEQ ID NO: 20, пролина 4 (т.е. P4) в VH CDR2 относительно SEQ ID NO: 4 и/или валина 16 (т.е. V16) в VH CDR3 относительно SEQ ID NO: 5 (т.е. L9→W9 (т.е. L9W), L9→I9 (т.е. L9I), L9→V9 (т.е. L9V), L9→Y9 (т.е. L9Y), L9→F9 (т.е. L9F), P4→F4 (т.е. P4F), P4→L4 (т.е. P4L), P4→M4 (т.е. P4M), P4→W4 (т.е. P4W), P4→I4 (т.е. P4I), V16→F16 (т.е. V16F), V16→E16 (т.е. V16E) и V16→W16 (т.е. V16W)).
На фиг. 23 перечислены 18 комбинированных вариантов замен (например, L9I/P4M, L9I/P4W, L9I/P4F, L9F/P4M, L9F/P4W, L9F/P4F, L9I/P4M/V16W, L9I/P4W/V16W, L9I/P4F/V16W, L9F/P4M/V16W, L9F/P4W/V16W, L9F/P4F/V16W, L9I/P4M/V16E, L9I/P4W/V16E, L9I/P4F/V16E, L9F/P4M/V16E, L9F/P4W/V16E, and L9F/P4F/V16E). Эти комбинированные варианты получали из 7 отдельных вариантов mAb H1-8/L1-9 IgG4 (т.е. L9I, L9F, P4M, P4W, P4F, V16E, V16W), которые показали улучшенное сродство связывания C5 по сравнению с родительским H1-8/L1-9 mAb и в то же время сохранили скорость диссоциации, различающуюся при pH 7,4 и pH 5,8 (см. фиг. 21 и 22).
На фиг. 24 представлены результаты анализа с помощью системы Octet, выполненного для оценки относительного сродства связывания C5 для вариантов mAb H1-8/L1-9, содержащих комбинированные замены, экспрессированных в клетках Expi-CHO в виде человеческого IgG4. Клетки Expi-CHO трансфицировали вариантами, содержащими комбинированные замены H1-8 VH, и супернатант клеточной культуры оценивали через 2 дня после трансфекции. Для данного супернатанта клеточной культуры вычисляли отношение между реакцией на связывание C5 и реакцией на связывание антитела и использовали в качестве меры сродства связывания C5. На фигуре показаны вычисленные отношения в эксперименте по трансфекции вариантами mAb, содержащими комбинированные замены L9I/P4M, L9I/P4W, L9I/P4F, L9F/P4M, L9F/P4W, L9F/P4F, L9I/P4M/V16W, L9I/P4W/V16W, L9I/P4F/V16W, L9F/P4M/V16W, L9F/P4W/V16W, L9F/P4F/V16W, L9I/P4M/V16E, L9I/P4W/V16E, L9I/P4F/V16E, L9F/P4M/V16E, L9F/P4W/V16E, and L9F/P4F/V16E.
На фиг. 25 представлены результаты анализа с помощью системы Octet, выполненного для оценки скорости диссоциации при pH 7,4 и pH 5,8, соответственно, C5 и вариантов mAb H1-8/L1-9, содержащих комбинированные замены. Вычисляли % уменьшения для каждого mAb при pH 7,4 и pH 5,8 относительно пиковой реакции на связывание C5 после перехода из фазы ассоциации в фазу диссоциации. На фигуре показан вычисленный % уменьшения в эксперименте по трансфекции с вариантами mAb H1-8/L1-9, содержащими комбинированные замены IgG4 L9I/P4M, L9I/P4W, L9I/P4F, L9F/P4M, L9F/P4W, L9F/P4F, L9I/P4M/V16W, L9I/P4W/V16W, L9I/P4F/V16W, L9F/P4M/V16W, L9F/P4W/V16W, L9F/P4F/V16W, L9I/P4M/V16E, L9I/P4W/V16E, L9I/P4F/V16E, L9F/P4M/V16E, L9F/P4W/V16E и L9F/P4F/V16E.
На Фиг. 26 представлены результаты экспериментов по оценке сродства связывания C5 при pH 7,4 для дополнительных мутантов scFV в эксперименте по созреванию сродства mAb 1819, включая клон 14C6, который соответствует мутации T в H в положении 9 в VH CDR2.
На фиг. 27 представлены результаты экспериментов по оценке дифференциального сродства связывания C5 при pH 7,4 и pH 5,8 для дополнительных мутантов scFV в эксперименте по созреванию сродства mAb 1819, включая клон 14C6, который соответствует мутации T в H в положении 9 в VH CDR2.
На фиг. 28 представлены результаты экспериментов по ранжированию дополнительных мутантов scFV в эксперименте по созреванию сродства mAb 1819 в соответствии с дифференциальным связыванием при pH 7,4 и pH 5,8, показывающие, что клон 14C6 является мутантом, занимающим первое место в этой группе мутантов. Клон 14C6 соответствует мутации T в H в положении 9 в VH CDR2.
На фиг. 29 показаны нуклеотидные и аминокислотные последовательности варианта IWW-VH mAb H1-8/L1-9 (вверху), гуманизированной VH-11801 с заменами N→H и L→I в VH-CDR1, заменой P→W в VH-CDR2 и заменой V→W в VH-CDR3; а также нуклеотидные и аминокислотные последовательности варианта IFW-VH mAb H1-8/L1-9 (внизу), гуманизированной VH-11801 с заменами N→H и L→I в VH-CDR1, заменой P→F в VH-CDR2 и заменой V→W в VH-CDR3.
На фиг. 30 показаны нуклеотидные и аминокислотные последовательности варианта FME-VH mAb H1-8/L1-9 (вверху), гуманизированной VH-11801 с заменами N→H и L→F в VH-CDR1, заменой P→M в VH-CDR2 и заменой V→E в VH-CDR3; а также нуклеотидные и аминокислотные последовательности варианта FMW-VH mAb H1-8/L1-9 (внизу), гуманизированной VH-11801 с заменами N→H и L→F в VH-CDR1, заменой P→M в VH-CDR2 и заменой V→W в VH-CDR3.
На фиг. 31 показаны нуклеотидные и аминокислотные последовательности варианта FMEH-VH mAb H1-8/L1-9, гуманизированной VH-11801 с заменами N→H и L→F в VH-CDR1, заменами P→M и T→H в VH-CDR2 и заменой V→E в VH-CDR3.
На фиг. 32 показано отслеживание связывания и диссоциации С5 из комплекса с mAb H1-8/L1-9, FMW, IFW, FME и IWW при pH 5,8 и pH 7,4 с помощью системы Octet.
На фиг. 33 показан % диссоциируемого связывания C5 для mAb VH-11801, H1-8/L1-9, FMW, IFW, FME и IWW при pH 7,4 и pH 5,8.
На фиг. 34 представлены результаты анализа лизиса эритроцитов барана, опосредованного активацией комплемента по классическому пути, для оценки C5-ингибирующего эффекта родительского гуманизированного mAb H1-8/L1-9 (VH-11801 (SEQ ID NO: 22) и VL-1901 (SEQ ID NO: 25)), и его вариантов IFW PLA (VH-11801 (SEQ ID NO: 46) и VL-1901 (SEQ ID NO: 25)), FME PLA (SEQ ID NO: 51) и VL-1901 (SEQ ID NO: 25)), IWW PLA (SEQ ID NO: 41) и VL-1901 (SEQ ID NO: 25)) и FMW PLA (SEQ ID NO: 56) и VL-1901 (SEQ ID NO: 25)).
На фиг. 35 показано отслеживание связывания и диссоциации С5 из комплекса с mAb H1-8/L1-9, FME, FMEH, FMW и IFW при pH 5,8 и pH 7,4 с помощью системы Octet.
На фиг. 36 показаны результаты pH-зависимого связывания с чистыми H1-8/L1-9, FME, FMEH, FMW и IFW при pH 5,8 и pH 7,4.
На фиг. 37 представлены результаты лизиса эритроцитов барана, опосредованного активацией комплемента по классическому пути, для оценки ингибирующего эффекта C5 родительского гуманизированного mAb FME PLA (SEQ ID NO: 51) и VL-1901 (SEQ ID NO: 25)), FMEH PLA (SEQ ID NO: 59) и VL-1901 (SEQ ID NO: 25)), FMW PLA (SEQ ID NO: 56) и VL-1901 (SEQ ID NO: 25)) и IFW PLA (VH -11801 (SEQ ID NO: 46) и VL-1901 (SEQ ID NO: 25)).
На фиг. 38 показаны нуклеотидные и аминокислотные последовательности мутаций Fc-домена человеческого IgG4 у C5-гуманизированных мышей FcRn/SCID.
На фиг. 39 показаны результаты C5 в плазме у C5-гуманизированных мышей, полученные путем гидродинамической инъекции кДНК человеческого C5.
На фиг. 40 представлены результаты анализа, выполненного для оценки общего уровня C5 в плазме мышей FcRn/SCID, генетически модифицированных для экспрессии человеческого C5, после инъекции mAb H1-8/L1-9 IFW-PLA, H1-8/L1-9 FMW-PLA или H1-8/L1-9 FMEH-PLA.
На фиг. 41 представлены результаты анализа, выполненного для оценки общего уровня IgG4 в плазме мышей FcRn/SCID, генетически модифицированных для экспрессии человеческого C5, после инъекции mAb H1-8/L1-9 IFW-PLA, H1-8/L1-9 FMW-PLA или H1-8/L1-9 FMEH-PLA.
На фиг. 42 показаны результаты анализа лизиса эритроцитов курицы, опосредованных активацией комплемента по классическому пути, выполненного для оценки фармакодинамики mAb H1-8/L1-9 IFW-PLA, H1-8/L1-9 FMW-PLA или H1-8/L1-9 FMEH-PLA у мышей FcRn/SCID, генетически модифицированных для экспрессии человеческого C5.
На фиг. 43 представлены результаты анализа, выполненного для оценки общего уровня hIgG4 в плазме мышей FcRn/SCID, генетически модифицированных для экспрессии человеческого C5, после инъекции mAb 11801 и FMEH-PLA.
На фиг. 44 показаны результаты анализа лизиса эритроцитов курицы, опосредованных активацией комплемента по классическому пути, выполненного для оценки фармакодинамики mAb 11801 и FMEH-PLA у мышей FcRn/SCID, генетически модифицированных для экспрессии человеческого C5.
На фиг. 45 представлены результаты анализа, выполненного для оценки общего уровня C5 в плазме мышей FcRn/SCID, генетически модифицированных для экспрессии человеческого C5, после инъекции mAb 11801 и FMEH-PLA.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к ингибированию передачи сигнала комплемента с помощью анти-С5 антитела. В некоторых вариантах осуществления анти-С5 антитело проявляет pH-зависимое связывание с C5. В некоторых вариантах осуществления pH-зависимое анти-C5 антитело сильнее связывается с C5 при более нейтральном pH (например, примерно pH 7,4; который характерен для крови), чем при более кислом pH (например, примерно pH 5.8; который характерен для эндосом). В различных вариантах осуществления изобретение относится к композициям и способам лечения комплемент-опосредованного заболевания или комплемент-опосредованного расстройства у индивидуума путем контактирования индивидуума с анти-С5 антителом. Комплемент-опосредованные патологии и состояния, которые можно лечить с помощью композиций и способов по настоящему изобретению, включают, без ограничения, дегенерацию желтого пятна (MD), возрастную дегенерацию желтого пятна (AMD), ишемическое реперфузионное повреждение, артрит, ревматоидный артрит, волчанку, язвенный колит, инсульт, синдром системного воспалительного ответа в послеоперационном периоде, астму, аллергическую астму, хроническую обструктивную болезнь легких (COPD), синдром пароксизмальной ночной гемоглобинурии (PNH), миастению гравис, оптический нейромиелит (NMO), рассеянный склероз, задержку функции трансплантата на фоне антитело-опосредованного отторжения, атипичный гемолитико-уремический синдром (aHUS), окклюзию центральной вены сетчатки (CRVO), окклюзию центральной артерии сетчатки (CRAO), буллезный эпидермолиз, сепсис, трансплантацию органов, воспаление (включая, помимо прочего, воспаление, связанное с операцией в условиях искусственного кровообращения и диализом почек), гломерулопатию C3, мембранозную нефропатию, нефропатию IgA, гломерулонефрит (включая, помимо прочего, гломерулонефрит, опосредованный цитоплазматическими антителами против нейтрофилов (ANCA), волчаночный нефрит и их комбинацию), ANCA-опосредованный васкулит, HUS, индуцированный Шига-токсином, и потерю беременности, вызванную антифосфолипидными антителами, или любые их комбинации.
Определения
Если не указано иное, все технические и научные термины, используемые в настоящем описании, имеют то же значение, в котором их обычно понимает специалист в области, к которой относится настоящее изобретение. Хотя любые методы и материалы, подобные или эквивалентные раскрытым в настоящем описании, могут быть использованы на практике или при тестировании настоящего изобретения, описаны иллюстративные методы и материалы.
Каждый из приведенных ниже терминов, используемый в настоящем описании, имеет значение, связанное с ним в том разделе, в котором он используется.
Единственное число используется в настоящем описании для обозначения одного или более чем одного (т.е. по меньшей мере одного) грамматического объекта статьи. В качестве примера «элемент» означает один или более элементов.
Термины «ингибировать» и «ингибирование» в контексте настоящего описания означают снижение, подавление, уменьшение или блокирование активности или функции по меньшей мере примерно на 10% относительно контрольного значения. В некоторых вариантах осуществления активность подавляется или блокируется на по меньшей мере примерно 50% по сравнению с контрольным значением. В некоторых вариантах осуществления активность подавляется или блокируется на по меньшей мере примерно 75%. В некоторых вариантах осуществления активность подавляется или блокируется на по меньшей мере примерно 95%.
Термины «эффективное количество» и «фармацевтически эффективное количество» относятся к количеству агента, достаточному для обеспечения требуемого биологического результата. Этим результатом может быть уменьшение и/или облегчение признаков, симптомов или причин заболевания или расстройства или любое другое требуемое изменение биологической системы. Специалист в данной области может определить подходящее эффективное количество в любом индивидуальном случае, используя рутинные эксперименты.
Термины «пациент», «субъект», «индивидуум» и т.п. используются в настоящем описании взаимозаменяемо и относятся к любому животному, в некоторых вариантах осуществления к млекопитающему, и в некоторых вариантах осуществления к человеку, имеющему систему комплемента, включая человека, нуждающегося в терапии или подверженного заболеванию или имеющему его последствия. Индивидуум может включать, например, собак, кошек, свиней, коров, овец, коз, лошадей, крыс, обезьян, мышей и людей.
Термин «аномальный», используемый в контексте организмов, тканей, клеток или их компонентов, относится к тем организмам, тканям, клеткам или их компонентам, которые отличаются по меньшей мере одной наблюдаемой или обнаруживаемой характеристикой (например, возрастом, лечением, временем дня и т.д.) от тех организмов, тканей, клеток или их компонентов, которые демонстрируют «нормальные» (ожидаемые/гомеостатические) соответствующие характеристики. Характеристики, которые являются нормальными или ожидаемыми для одного типа клеток, ткани или субъекта, могут быть аномальными для другого типа клеток или ткани.
«Заболевание» представляет собой состояние здоровья субъекта, при котором организм субъекта не может поддерживать гомеостаз и при котором, если болезнь не улучшается, здоровье субъекта продолжает ухудшаться.
Напротив, «расстройство» у субъекта представляет собой состояние здоровья, при котором субъект способен поддерживать гомеостаз, но при котором состояние здоровья субъекта является менее благоприятным, чем было бы при отсутствии этого расстройства. При отсутствии лечения расстройство не обязательно приводит к дальнейшему ухудшению состояния здоровья пациента.
Заболевание или расстройство «облегчается», если снижается тяжесть признака или симптома заболевания или расстройства, частота, наблюдаемого признака или симптома у пациента, или и то и другое вместе.
«Эффективное количество» или «терапевтически эффективное количество» соединения представляет собой такое количество соединения, которое является достаточным для обеспечения благоприятного эффекта у субъекта, которому вводят соединение.
В контексте настоящего описания «инструктивный материал» включает публикацию, запись, схему или любой другой носитель выражения, который может использоваться для сообщения о том, что соединение, композиция, вектор или система доставки по изобретению в наборе является полезной для облегчения различных заболеваний или расстройств, перечисленных в настоящем описании. Необязательно или альтернативно, инструктивный материал может описывать один или более способов облегчения заболеваний или расстройств в клетке или ткани млекопитающего. Инструктивный материал набора по изобретению может, например, быть прикреплен к контейнеру, который содержит идентифицированное соединение, композицию, вектор или систему доставки по изобретению, или может транспортироваться вместе с контейнером, который содержит идентифицированное соединение, композицию, вектор или систему доставки. Альтернативно, инструктивный материал может быть доставлен отдельно от контейнера для совместного использования получателем инструктивного материала и соединения.
Используемый в настоящем описании термин «функционально связанный» или «оперативно связанный» может означать, что экспрессия гена находится под контролем промотора, с которым он пространственно связан. Промотор может быть расположен на 5' (выше) или 3' (ниже) гена, находящегося под его контролем. Расстояние между промотором и геном может быть примерно таким же, как расстояние между этим промотором и контролируемым им геном в гене, из которого получен промотор. Как известно в данной области техники, это расстояние может быть изменено без потери функции промотора.
«Терапевтическое лечение» представляет собой лечение, назначаемое субъекту, у которого проявлены признаки заболевания или расстройства, с целью уменьшения или устранения этих признаков.
В контексте настоящего описания «лечение заболевания или расстройства» означает снижение частоты проявления и/или тяжести признака и/или симптома заболевания или расстройства, которым страдает пациент.
Фраза «биологический образец», «образец» или «проба» в контексте настоящего описания включает любой образец, содержащий клетку, ткань или физиологическую жидкость, в которой может быть обнаружена экспрессия нуклеиновой кислоты или полипептида. Биологический образец может содержать любой биологический материал, подходящий для обнаружения требуемых биомаркеров, и может включать клеточный и/или неклеточный материал, полученный от индивидуума. Примеры таких биологических образцов включают, без ограничения, кровь, лимфу, костный мозг, биопсию и мазки. Образцы, которые являются жидкими по своей природе, в настоящем описании называются «физиологическими жидкостями». Биологические образцы могут быть получены от пациента различными способами, включая, например, соскоб или взятие мазка с какой-либо области или с помощью иглы для получения жидкостей организма. Способы взятия различных образцов тела хорошо известны в данной области.
Используемый в настоящем описании термин «антитело» относится к молекуле иммуноглобулина, которая способна специфически связываться со специфическим эпитопом антигена. Антитела могут быть интактными иммуноглобулинами, происходящими из природных источников, или могут происходить из рекомбинантных источников, и могут представлять собой иммунореактивные части интактных иммуноглобулинов. Антитела в настоящем изобретении могут существовать в различных формах, включая, например, поликлональные антитела, моноклональные антитела, внутриклеточные антитела («интратела»), Fv, Fab, Fab', F(ab)2 и F(ab')2, а также одноцепочечные антитела (scFv), антитела, имеющие только тяжелую цепь, такие как антитела верблюда, и гуманизированные антитела (Harlow et al., 1999, Using Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, NY; Harlow et al., 1989, Antibodies: A Laboratory Manual, Cold Spring Harbor, New York; Houston et al., 1988, Proc. Natl. Acad. Sci. USA 85:5879-5883; Bird et al., 1988, Science 242:423-426).
В контексте настоящего описания термин «синтетическое антитело» означает антитело, которое получено с помощью технологии рекомбинантной ДНК, например, антитело, экспрессируемое бактериофагом. Этот термин также следует толковать как обозначение антитела, которое образовано путем синтеза молекулы ДНК, кодирующей антитело, причем молекула ДНК экспрессирует белок антитела или аминокислотную последовательность, специфичную для антитела, где ДНК или аминокислотная последовательность получены доступным и хорошо известным в данной области методом синтеза ДНК или аминокислотных последовательностей.
В контексте настоящего описания термин «антитело с тяжелой цепью» или «антитела с тяжелой цепью» включает молекулы иммуноглобулина, полученные из камелидов, либо путем иммунизации пептидом и последующим выделением сыворотки, либо путем клонирования и экспрессии последовательностей нуклеиновых кислот, кодирующих такие антитела. Термин «антитело с тяжелой цепью» или «антитела с тяжелой цепью» дополнительно включает молекулы иммуноглобулина, выделенные от субъекта с заболеванием тяжелых цепей или полученные путем клонирования и экспрессии генов VH (вариабельной области тяжелой цепи иммуноглобулина) от субъекта.
«Химерное антитело» относится к типу сконструированного антитела, которое содержит встречающуюся в природе вариабельную область (легкую цепь и тяжелые цепи), полученную из донорного антитела, в ассоциации с константными областями легкой и тяжелой цепей, полученных из акцепторного антитела.
«Гуманизированное антитело» относится к типу сконструированного антитела, содержащего CDR, полученные из нечеловеческого донорного иммуноглобулина, при этом оставшиеся части молекулы, производные иммуноглобулина, происходят из одного (или более) человеческого(их) иммуноглобулина(ов). Кроме того, каркасные опорные остатки могут быть изменены для сохранения сродства связывания (см., например, 1989, Queen et al., Proc. Natl. Acad Sci USA, 86:10029-10032; 1991, Hodgson et al., Bio/Technology, 9:421). Человеческое акцепторное антитело, подходящее по гомологии нуклеотидной и аминокислотной последовательностям донорного антитела, может быть выбрано из общепринятой базы данных, например базы данных KABAT, базы данных Los Alamos и базы данных Swiss Protein. Человеческое антитело, характеризующееся гомологией с каркасными областями донорного антитела (на основе аминокислот), может быть подходящим для обеспечения константной области тяжелой цепи и/или вариабельной каркасной области тяжелой цепи для встраивания донорных CDR. Подходящее акцепторное антитело, способное быть донором константных или вариабельных каркасных областей легкой цепи, может быть выбрано аналогичным образом. Следует отметить, что не требуется, чтобы тяжелая и легкая цепи акцепторного антитела происходили из одного и того же акцепторного антитела. В предшествующем уровне техники описано несколько способов получения таких гуманизированных антител (см., например, EP-A-0239400 и EP-A-054951).
Термин «донорное антитело» относится к антителу (моноклональному и/или рекомбинантному), которое предоставляет аминокислотные последовательности вариабельных областей, CDR или других функциональных фрагментов или аналогов первому партнеру иммуноглобулина, обеспечивая измененную кодирующую область иммуноглобулина и, как результат, экспрессируемое измененное антитело с антигенной специфичностью и нейтрализующей активностью, которые характерны для донорного антитела.
Термин «акцепторное антитело» относится к антителу (моноклональному и/или рекомбинантному), гетерологичному донорному антителу, которое предоставляет все (или любую часть, но в некоторых вариантах осуществления все) аминокислотные последовательности, кодирующие каркасные области тяжелой и/или легкой цепи, и/или константные области тяжелой и/или легкой цепи первому иммуноглобулиновому партнеру. В некоторых вариантах осуществления человеческое антитело является акцепторным антителом.
«CDR» определяют как аминокислотные последовательности определяющей комплементарность области антитела, которые представляют собой гипервариабельные области тяжелой и легкой цепей иммуноглобулина. См., например, Kabat et al., Sequences of Proteins of Immunological Interest, 4th Ed., U.S. Department of Health and Human Services, National Institutes of Health (1987). Вариабельная часть иммуноглобулина содержит три CDR тяжелой цепи и три CDR легкой цепи. Таким образом, в контексте настоящего описания «CDR» относится ко всем трем CDR тяжелой цепи или ко всем трем CDR легкой цепи (или, при необходимости, ко всем CDR тяжелой цепи и всем CDR легкой цепи). Структура и фолдинг антитела могут означать, что другие остатки рассматриваются как часть антигенсвязывающей области, и специалист в данной области должен понимать их именно в таком качестве. См., например, Chothia et al., (1989) Conformations of immunoglobulin hyper variable regions; Nature 342, p.877-883.
Используемый в настоящем описании термин «иммуноанализ» относится к любому анализу связывания, в котором используется антитело, способное специфически связываться с молекулой-мишенью для обнаружения и количественного определения молекулы-мишени.
Термин «специфически связывается», используемый в настоящем описании по отношению к антителу, означает антитело, которое распознает и связывается с конкретной молекулой-мишенью, но по существу не распознает или не связывается с другими молекулами в образце. В некоторых случаях термины «специфическое связывание» или «специфически связывающееся» используются для обозначения того, что распознавание и связывание зависят от присутствия конкретной структуры (например, антигенной детерминанты или эпитопа) в молекуле-мишени. Если, например, антитело специфически связывается с эпитопом «А», присутствие немеченой молекулы, содержащей эпитоп А (или свободный немеченый А), в реакции, содержащей меченый «А» и антитело, снизит количество меченого А, связанного с антителом.
«Кодирующая область» гена состоит из нуклеотидных остатков кодирующей цепи гена и нуклеотидов некодирующей цепи гена, которые гомологичны или комплементарны, соответственно, кодирующей области молекулы мРНК, которая продуцируется в результате транскрипции гена.
«Кодирующая область» молекулы мРНК также состоит из нуклеотидных остатков молекулы мРНК, которые совпадают с антикодоновой областью молекулы транспортной РНК во время трансляции молекулы мРНК или которые кодируют стоп-кодон. Таким образом, кодирующая область может включать нуклеотидные остатки, содержащие кодоны для аминокислотных остатков, которые не присутствуют в зрелом белке, кодируемом молекулой мРНК (например, аминокислотные остатки в сигнальной последовательности для экспорта белка).
«Дифференциально сниженная экспрессия» или «понижающая регуляция» относится к уровням биомаркера продукта, которые на по меньшей мере 10% или более, например на 20%, 30%, 40% или 50%, 60%, 70%, 80%, 90% ниже или меньше и/или в 2,0 раза, 1,8 раза, 1,6 раза, 1,4 раза, 1,2 раза, 1,1 раза ниже или меньше, включая любые целые или дробные значения между указанными выше, относительно контроля.
«Дифференциально повышенная экспрессия» или «повышающая регуляция» относится к уровням биомаркера продукта, которые на по меньшей мере 10% или более, например на 20%, 30%, 40% или 50%, 60%, 70%, 80%, 90% выше или больше и/или в 2,0 раза, 1,8 раза, 1,6 раза, 1,4 раза, 1,2 раза, 1,1 раза выше или больше, включая любые целые или дробные значения между указанными выше, относительно контроля.
Используемый в настоящем описании термин «комплементарный» для обозначения нуклеиновой кислоты относится к комплементарности последовательностей, в широком смысле, между областями двух цепей нуклеиновых кислот или между двумя областями одной и той же цепи нуклеиновой кислоты. Известно, что остаток аденина в первой области нуклеиновой кислоты способен образовывать специфические водородные связи («спариваться») с остатком второй области нуклеиновой кислоты, которая антипараллельна первой области, если остатком является тимин или урацил. Аналогично, известно, что остаток цитозина первой цепи нуклеиновой кислоты способен спариваться с остатком второй цепи нуклеиновой кислоты, которая антипараллельна первой цепи, если остатком является гуанин. Первая область нуклеиновой кислоты комплементарна второй области той же или другой нуклеиновой кислоты, если, когда две области расположены антипараллельно, по меньшей мере, один нуклеотидный остаток первой области способен спариваться с остатком второй области. В некоторых вариантах осуществления первая область содержит первую часть, а вторая область содержит вторую часть, при этом, когда первая и вторая части расположены антипараллельно, по меньшей мере примерно 50% и или по меньшей мере примерно 75%, или по меньшей мере примерно 90% или по меньшей мере примерно 95% нуклеотидных остатков первой части способны спариваться с нуклеотидными остатками во второй части. В некоторых вариантах осуществления все нуклеотидные остатки первой части способны образовывать пары оснований с нуклеотидными остатками второй части.
Используемый в настоящем описании термин «ДНК» определен как дезоксирибонуклеиновая кислота.
«Кодирование» относится к неотъемлемому свойству конкретных последовательностей нуклеотидов в полинуклеотиде, таких как ген, кДНК или мРНК, которые служат в качестве матриц для синтеза других полимеров и макромолекул в биологических процессах, имеющих определенную последовательность нуклеотидов (т.е. рРНК, тРНК и мРНК) или определенную последовательность аминокислот и вытекающие из них биологические свойства. Таким образом, ген кодирует белок, если транскрипция и трансляция мРНК, соответствующей этому гену, генерирует белок в клетке или другой биологической системе. Кодирующая цепь, нуклеотидная последовательность которой идентична последовательности мРНК и обычно представлена в списке последовательностей, и некодирующая цепь, используемая в качестве матрицы для транскрипции гена или кДНК, обе могут упоминаться как кодирующие белок или другой продукт этого гена или кДНК.
Если не указано иное, «нуклеотидная последовательность, кодирующая аминокислотную последовательность» включает все нуклеотидные последовательности, которые являются вырожденными версиями друг друга и кодируют одну и ту же аминокислотную последовательность. Фраза «нуклеотидная последовательность, кодирующая белок или РНК» также может включать интроны в той степени, в которой нуклеотидная последовательность, кодирующая белок, может в некоторой версии содержать интрон(ы).
«Выделенный» означает измененный или извлеченный из естественного состояния. Например, нуклеиновая кислота или пептид, присутствующие в естественном состоянии в обычной для него среде в организме живого субъекта, не является «выделенным», но такая же нуклеиновая кислота или пептид, частично или полностью отделенный от сопутствующих материалов в его естественном состоянии, является «выделенным». Выделенная нуклеиновая кислота или белок могут существовать в практически очищенной форме или могут существовать в чужеродной среде, такой как, например, клетка-хозяин.
Используемый в настоящем описании термин «гибридома» относится к клетке, полученной в результате слияния В-лимфоцита и партнера слияния, такого как миеломная клетка. Гибридому можно клонировать и поддерживать в культуре клеток неограниченное время, и она способна продуцировать моноклональные антитела. Гибридому также можно рассматривать как гибридную клетку.
«Выделенная нуклеиновая кислота» относится к сегменту или фрагменту нуклеиновой кислоты, отделенной от последовательностей, фланкирующих его в естественном состоянии, т.е. фрагменту ДНК, который отделен от последовательностей, прилегающих к этому фрагменту в естественном состоянии, т.е. последовательностей, прилегающих к фрагменту в геноме, в котором он встречается в природе. Этот термин также применяется к нуклеиновым кислотам, которые по существу очищены от других компонентов, которые в естественном состоянии сосуществуют с этой нуклеиновой кислотой, т.е. РНК или ДНК, или белки, которые в естественном состоянии находятся вместе с ней в клетке. Таким образом, термин включает, например, рекомбинантную ДНК, которая включена в вектор, в автономно реплицирующуюся плазмиду или вирус, или в геномную ДНК прокариот или эукариот, или которая существует в виде отдельной молекулы (т.е. в виде кДНК или фрагмента генома или кДНК, полученного с помощью ПЦР или в результате расщепления рестрикционным ферментом) независимо от других последовательностей. Он также включает рекомбинантную ДНК, которая является частью гибридного гена, кодирующего дополнительную полипептидную последовательность.
В контексте настоящего изобретения используются следующие сокращения для обычно встречающихся оснований нуклеиновых кислот. «А» относится к аденозину, «С» относится к цитозину, «G» относится к гуанозину, «Т» относится к тимидину, а «U» относится к уридину.
В контексте настоящего описания термин «полинуклеотид» означает цепь нуклеотидов. Кроме того, нуклеиновые кислоты представляют собой полимеры нуклеотидов. Таким образом, используемые в настоящем описании нуклеиновые кислоты и полинуклеотиды являются взаимозаменяемыми. Специалисту в данной области известно, что нуклеиновые кислоты представляют собой полинуклеотиды, которые можно гидролизовать до мономерных «нуклеотидов». Мономерные нуклеотиды можно гидролизовать до нуклеозидов. В контексте настоящего описания полинуклеотиды включают, без ограничения, все последовательности нуклеиновых кислот, которые получены любыми средствами, доступными в данной области, включая, без ограничения, рекомбинантные средства, т.е. клонирование последовательностей нуклеиновых кислот из рекомбинантной библиотеки или генома клетки с помощью обычных технологий клонирования и метода ПЦР и т.п., а также средства синтеза.
В контексте настоящего описания термины «пептид», «полипептид» и «белок» используются взаимозаменяемо и относятся к соединению, состоящему из аминокислотных остатков, ковалентно связанных пептидными связями. Белок или пептид должен содержать по меньшей мере две аминокислоты, при этом отсутствует ограничение на максимальное количество аминокислот, которые могут составлять последовательность белка или пептида. Полипептиды включают любой пептид или белок, состоящий из двух или более аминокислот, связанных друг с другом пептидными связями. Используемый в настоящем описании термин относится как к коротким цепям, которые в данной области техники также обычно называют, например, пептидами, олигопептидами и олигомерами, так и к более длинным цепям, которые в данной области техники обычно называют белками, которые представлены множеством типов. «Полипептиды» включают, помимо прочего, например, биологически активные фрагменты, практически гомологичные полипептиды, олигопептиды, гомодимеры, гетеродимеры, варианты полипептидов, модифицированные полипептиды, производные, аналоги, гибридные белки. Полипептиды включают природные пептиды, рекомбинантные пептиды, синтетические пептиды или их комбинации.
Используемый в настоящем описании термин «потомство» относится к дочерней сущности или потомству и включает потомство млекопитающего, а также включает дифференцированную или недифференцированную дочернюю клетку, полученную из родительской клетки. В одном из применений термин «потомство» относится к дочерней клетке, которая генетически идентична родительской. В другом применении термин «потомство» относится к дочерней клетке, которая генетически и фенотипически идентична родительской. В еще одном применении термин «потомство» относится к дочерней клетке, которая дифференцировалась из родительской клетки.
Используемый в настоящем описании термин «РНК» определяют как рибонуклеиновая кислота.
Используемый в настоящем описании термин «рекомбинантная ДНК» определяют как ДНК, полученная путем соединения частей ДНК из разных источников.
Используемый в настоящем описании термин «рекомбинантный полипептид» определяют как полипептид, полученный с помощью методов рекомбинантной ДНК.
Используемый в настоящем описании термин «конъюгированный» относится к ковалентному присоединению одной молекулы ко второй молекуле.
Термин «вариант», используемый в настоящем описании, представляет собой последовательность нуклеиновой кислоты или пептидную последовательность, которая отличается от эталонной последовательности нуклеиновой кислоты или пептидной последовательности, соответственно, но сохраняет основные биологические свойства эталонной молекулы. Изменения в последовательности варианта нуклеиновой кислоты могут не приводить к изменению аминокислотной последовательности пептида, кодируемого эталонной нуклеиновой кислотой, или могут приводить к аминокислотным заменам, добавлениям, делециям, слияниям и укорочениям. Изменения в последовательности вариантов пептида обычно ограничены или консервативны настолько, что последовательности эталонного пептида и варианта в целом очень похожи и во многих областях идентичны. Вариантный и эталонный пептид могут отличаться по аминокислотной последовательности одной или более заменами, добавками, делециями в любой комбинации. Вариант нуклеиновой кислоты или пептида может представлять собой встречающийся в природе вариант, такой как аллельный вариант, или может представлять собой вариант, который, как известно, не встречается в природе. Не встречающиеся в природе варианты нуклеиновых кислот и пептидов могут быть получены методами мутагенеза или прямым синтезом. В различных вариантах осуществления последовательность варианта является идентичной эталонной последовательности на по меньшей мере 99%, по меньшей мере 98%, по меньшей мере 97%, по меньшей мере 96%, по меньшей мере 95%, по меньшей мере 94%, по меньшей мере 93%, по меньшей мере 92%, по меньшей мере 91%, по меньшей мере 90%, по меньшей мере 89%, по меньшей мере 88%, по меньшей мере 87%, по меньшей мере 86%, по меньшей мере 85%.
Используемый в настоящем описании термин «регулирование» может означать любой метод изменения уровня или активности субстрата. Неограничивающие примеры регуляции в отношении белка включают влияние на экспрессию (включая транскрипцию и/или трансляцию), влияние на фолдинг, влияние на деградацию или обмен белка и влияние на локализацию белка. Неограничивающие примеры регулирования в отношении фермента дополнительно включают влияние на ферментативную активность. «Регулятор» относится к молекуле, активность которой включает влияние на уровень или активность субстрата. Регулятор может быть прямым или косвенным. Регулятор может активировать, ингибировать или иным образом модулировать свой субстрат.
В контексте настоящего описания «окно сканирования» относится к сегменту из ряда смежных положений, в которых последовательность может быть оценена независимо от любой фланкирующей последовательности. Окно сканирования обычно сдвигают постепенно по длине оцениваемой последовательности, причем каждый новый сегмент оценивают независимо. Пошаговый сдвиг может составлять 1 или более чем одно положение.
В контексте настоящего описания «вектор» может означать последовательность нуклеиновой кислоты, содержащую точку начала репликации. Вектор может быть плазмидой, бактериофагом, бактериальной искусственной хромосомой или дрожжевой искусственной хромосомой. Вектор может быть вектором ДНК или РНК. Вектор может быть либо самореплицирующимся внехромосомным вектором, либо вектором, который интегрирован в геном хозяина.
Диапазоны: в настоящем описании различные аспекты изобретения могут быть представлены в формате диапазона. Следует понимать, что описание в формате диапазона дано просто для удобства и краткости и не должно толковаться как жесткое ограничение объема изобретения. Соответственно, описание диапазона следует рассматривать как конкретное раскрытие всех возможных поддиапазонов, а также отдельных числовых значений в этом диапазоне. Например, описание диапазона, такого как от 1 до 6, следует рассматривать как конкретное раскрытие поддиапазонов, таких как от 1 до 3, от 1 до 4, от 1 до 5, от 2 до 4, от 2 до 6, от 3 до 6 и т.д., а также отдельных чисел в этом диапазоне, например 1, 2, 2,7, 3, 4, 5, 5,3 и 6. Это применимо независимо от величины диапазона.
Описание
Настоящее изобретение относится к ингибированию нарушений передачи сигнала комплемента и связанных с комплементом расстройств с помощью антитела к человеческому C5. В некоторых вариантах осуществления анти-С5 антитело проявляет pH-зависимое связывание с C5. В некоторых вариантах осуществления pH-зависимое анти-C5 антитело сильнее связывается с C5 при более нейтральном pH (например, примерно pH 7,4; который характерен для крови), чем при более кислом pH (например, примерно pH 5.8; который характерен для эндосом). Такое pH-зависимое связывание обеспечивает более длительную живучесть вводимых молекул антител, поскольку иммунные комплексы (т.е. анти-С5 mAb, связанные с C5), захваченные клетками, будут диссоциировать в кислой среде эндосомы и позволят высвободившимся антителам рециркулировать обратно из клетки через неонатальный рецептор Fc (FcRn), где оно может связываться с новой молекулой C5.
В одном из вариантов осуществления изобретение направлено на ингибирование каскада передачи сигналов комплемента путем специфического нацеливания на белок C5, который является компонентом системы комплемента, или фрагмент белка C5a или C5b. В одном из вариантов осуществления изобретение направлено на способы лечения и профилактики воспалений и аутоиммунных заболеваний, опосредованных нежелательной, неконтролируемой, чрезмерной активацией комплемента. В одном из вариантов осуществления изобретение направлено на лечение опосредованного комплементом заболевания или опосредованного комплементом расстройства у индивидуума путем контактирования индивидуума с анти-С5 антителом.
В одном из вариантов осуществления изобретение представляет собой способ лечения комплемент-опосредованного заболевания или расстройства у индивидуума, включающий этап введения указанному индивидууму анти-C5 антитела, тем самым подавляя образование белка C5a или C5b и образование MAC. Примеры опосредованных комплементом патологий, которые можно лечить с помощью способов по настоящему изобретению, включают, без ограничения, дегенерацию желтого пятна (MD), возрастную дегенерацию желтого пятна (AMD), ишемическое реперфузионное повреждение, артрит, ревматоидный артрит, волчанку, язвенный колит, инсульт, синдром системного воспалительного ответа в послеоперационном периоде, астму, аллергическую астму, хроническую обструктивную болезнь легких (COPD), синдром пароксизмальной ночной гемоглобинурии (PNH), миастению гравис, оптический нейромиелит (NMO), рассеянный склероз, задержку функции трансплантата на фоне антитело-опосредованного отторжения, атипичный гемолитико-уремический синдром (aHUS), окклюзию центральной вены сетчатки (CRVO), окклюзию центральной артерии сетчатки (CRAO), буллезный эпидермолиз, сепсис, трансплантацию органов, воспаление (включая, помимо прочего, воспаление, связанное с операцией в условиях искусственного кровообращения и диализом почек), гломерулопатию C3, мембранозную нефропатию, нефропатию IgA, гломерулонефрит (включая, помимо прочего, гломерулонефрит, опосредованный цитоплазматическими антителами против нейтрофилов (ANCA), волчаночный нефрит и их комбинацию), ANCA-опосредованный васкулит, HUS, индуцированный Шига-токсином, и потерю беременности, вызванную антифосфолипидными антителами, или любые их комбинаций. В некоторых вариантах осуществления композиции и способы по изобретению полезны для лечения субъекта, включая субъектов, страдающих PNH, которые не реагируют на лечение экулизумабом. В качестве неограничивающего примера некоторые субъекты могут нести мутацию в альфа-цепи C5, которая может сделать их устойчивыми к лечению экулизумабом (см. Genetic variants in C5 and poor response to eculizumab. Nishimura J, et al., N Engl. J Med. 2014, Feb 13; 370(7):632-9).
Способность иммунной системы различать «собственные» и «чужие» антигены жизненно важна для функционирования иммунной системы в качестве специфической защиты от вторжения микроорганизмов. «Чужие» антигены представляют собой антигены на вещества, которые поступают в организм или присутствуют в нем, которые заметно отличаются или являются чужеродными по отношению к собственным компонентам субъекта, тогда как «собственные» антигены представляют собой антигены, которые у здорового субъекта не отличаются от его собственных компонентов. В различных вариантах осуществления способов ингибируется активация комплемента, которая запускается по меньшей мере одним фактором из группы, состоящей из микробного антигена, небиологической инородной поверхности, измененной собственной ткани или их комбинацией. Одним из примеров небиологической инородной поверхности является кровеносная трубка, такая как трубка, которая используется в хирургии для искусственного кровообращения или при диализе почек. Примеры измененных собственных тканей включают апоптотические, некротические и пораженные ишемией ткани и клетки, ткани и клетки, лишенные функциональных белков, регулирующих комплемент, или их комбинации.
В некоторых вариантах осуществления анти-С5 антитела по изобретению ингибируют нисходящее воздействие активации альтернативного пути комплемента (AP), классического пути (CP) или лектинового пути (LP). Как правило, CP инициируется комплексами антиген-антитело, LP активируется связыванием лектинов с молекулами сахара на микробных поверхностях, в то время как AP постоянно активен на низком уровне, но эта активность может быстро усиливаться на поверхности бактериальных, вирусных и паразитарных клеток из-за отсутствия регуляторных белков. Клетки-хозяева обычно защищены от активации АР-комплемента регуляторными белками. Но в некоторых ситуациях, например, когда регуляторные белки дефектны или отсутствуют, AP также может неконтролируемо активироваться на клетках-хозяевах, приводя к развитию опосредованного комплементом заболевания или расстройства. CP состоит из компонентов C1, C2, C4 и сходится с AP на этапе активации C3. LP состоит из маннозо-связывающих лектинов (MBL) и MBL-ассоциированных сериновых протеаз (Masp) и имеет с CP общие компоненты: C4 и C2. AP состоит из компонентов C3 и нескольких факторов, таких как фактор B, фактор D, пропердин, C5 и фактор H регуляции в жидкой фазе. Активация комплемента состоит из трех этапов: (a) распознавание, (b) ферментативная активация и (c) мембранная атака, приводящая к гибели клеток. Первая фаза активации CP-комплемента начинается с C1. C1 состоит из трех различных белков: субъединицы распознавания, C1q, и субкомпонентов сериновой протеазы, C1r и C1s, которые связаны вместе в кальций-зависимый тетрамерный комплекс C1r2 s2. Для физиологической активации С1 необходим интактный комплекс С1. Активация происходит, когда интактный комплекс С1 связывается с иммуноглобулином в комплексе с антигеном. Это связывание активирует C1s, который затем расщепляет белки C4 и C2 с образованием C4a и C4b, а также C2a и C2b. Фрагменты C4b и C2a объединяются с образованием конвертазы C3, C4b2a, которая, в свою очередь, расщепляет C3 с образованием C3a и C3b. Активация LP инициируется связыванием MBL с определенными сахарами на поверхности-мишени, и это запускает активацию MBL-ассоциированных сериновых протеаз (MASP), которые затем расщепляют C4 и C2 аналогично активности C1s CP, в результате чего происходит образование C3-конвертазы, C4b2a. Таким образом, CP и LP активируются разными механизмами, но они имеют одни и те же компоненты C4 и C2, и оба пути приводят к генерации одной и той же C3 конвертазы, C4b2a. Расщепление C3 с помощью C4b2a на C3b и C3a является центральным событием пути комплемента по двум причинам. Оно инициирует петлю амплификации AP, потому что осажденный на поверхности C3b является центральным промежуточным звеном AP. C3a и C3b, оба являются биологически важными. C3a является провоспалительным и вместе с C5a относится к анафилатоксинам. C3b и продукты его дальнейшего расщепления также связываются с рецепторами комплемента, присутствующими на нейтрофилах, эозинофилах, моноцитах и макрофагах, тем самым облегчают фагоцитоз и клиренс C3b-опсонизированных частиц. Наконец, C3b может связываться с C4b2a с образованием C5-конвертазы CP и LP для активации концевой последовательности комплемента, что приводит к продукции C5a, мощного провоспалительного медиатора, и сборке литического комплекса мембранной атаки (MAC), C5-C9.
В одном из вариантов осуществления активность пути комплемента, которая ингибируется с помощью способа по изобретению, представляет собой активацию пути комплемента, индуцированную по меньшей мере одним компонентом из группы, выбранной из липополисахрида (LPS), липоолигосахарида (LOS), патоген-ассоциированных молекулярных паттернов (PAMP) и молекулярных паттернов, связанных с опасностями (DAMP). В другом варианте осуществления активность передачи сигнала комплемента, которая ингибируется способом по изобретению, представляет собой образование белка C5a. В другом варианте осуществления активность передачи сигнала комплемента, которая ингибируется способом по изобретению, представляет собой образование белка C5b. В другом варианте осуществления активность передачи сигналов комплемента, которая ингибируется способом по изобретению, представляет собой формирование MAC. В другом варианте осуществления активность пути комплемента, которая ингибируется способом по изобретению, зависит от C5.
В одном из вариантов осуществления изобретение представляет собой способ ингибирования инициации активации терминальных компонентов комплемента у индивидуума, включающий этап введения указанному индивидууму анти-С5 антитела, тем самым подавляя у индивидуума инициацию активации терминальных компонентов комплемента, происходящую из активации CP, LP или AP. Примерами этих вариантов осуществления являются пациенты с PNH, которые страдают от опосредованного комплементом гемолиза, и индивидуумы, страдающие от комплемент-опосредованного aHUS, астмы, ишемического/реперфузионного повреждения, ревматоидного артрита и опосредованных ANCA заболеваний почек. В различных вариантах осуществления изобретения заболевания и расстройства, которые можно лечить с помощью композиций и способов по настоящему изобретению, включают, без ограничения, комплемент-опосредованный гемолиз, комплемент-опосредованный aHUS, гломерулопатию C3, оптический нейромиелит, миастению гравис, астму, ишемическое/реперфузионное повреждение, ревматоидный артрит и ANCA-опосредованные заболевания или нарушения почек.
В различных других вариантах осуществления в настоящем описании представлены способы идентификации потенциального анти-С5 антитела, оказывающего ингибирующее действие на активацию терминальных компонентов комплемента. Одним из таких способов является анализ лизиса эритроцитов барана, описанный ниже. Вкратце, эритроциты барана (1×107 клеток на образец для анализа, приготовленный в PBS, Complement Technology Inc) инкубировали при 37°C в течение 20 минут с 50% нормальной сывороткой человека (NHS, от Complement Technology Inc) в желатиновом верональном буфере (GVB2+, Sigma; общий анализируемый объем: 100 мкл). Перед добавлением к эритроцитам барана NHS предварительно инкубировали с анти-С5 mAb в течение 1 часа при 4°C. Реакцию лизиса останавливали добавлением ледяной 40 мМ EDTA в PBS. Смеси для инкубации центрифугировали в течение 5 мин при 1500 об/мин, супернатант собирали и измеряли OD при 405 нм. Образцы без NHS или с добавлением EDTA использовали в качестве отрицательного контроля лизиса, а образец эритроцитов барана, полностью лизированных дистиллированной водой, использовали в качестве положительного контроля (100% лизис), относительно которого нормализовали % лизиса в других образцах. Отдельный способ, который можно использовать для подтверждающего скрининга mAb к человеческому C5, включает этапы: a) покрытия планшета липополисахаридом (LPS); b) промывки планшета для удаления несвязанного LPS; c) добавления бычьего сывороточного альбумина (BSA) в фосфатно-солевой буфер (PBS); d) промывки планшета для удаления несвязанного BSA; e) добавления смеси соединения-кандидата анти-C5 антитела, которое предварительно инкубировали с сывороткой и смешивали с нормальной человеческой сывороткой; f) промывки планшета; g) добавления конъюгированного с HRP антитела к человеческим C5b-9 или антитела к человеческому C6 (антитело к человеческому TCC, клон aE11 или меченное биотином антитело к человеческому C6, оба от Quidel); h) промывки планшета для удаления несвязанного антитела; i) добавления реагента HRP Substrate; j) добавление серной кислоты для остановки реакции; k) измерения оптической плотности при 450 нм; l) сравнения оптической плотности планшета, содержащего соединение-кандидат анти-C5-антитела, с оптической плотностью положительного контроля сравнения и отрицательного контроля сравнения; причем, уменьшение оптической плотности по сравнению с положительным контролем сравнения является идентификатором анти-С5 антитела.
Анти-С5 антитела
В некоторых вариантах осуществления изобретение включает композиции, содержащие антитело, которое специфически связывается с C5. В одном из вариантов осуществления анти-С5 антитело представляет собой поликлональное антитело. В другом варианте осуществления анти-С5 антитело представляет собой моноклональное антитело. В некоторых вариантах осуществления анти-С5 антитело представляет собой химерное антитело. В дополнительных вариантах осуществления анти-С5 антитело представляет собой гуманизированное антитело. В некоторых вариантах осуществления антитело представляет собой фрагмент антитела. В некоторых вариантах осуществления C5 представляет собой человеческий C5.
В некоторых вариантах осуществления анти-С5 антитело проявляет pH-зависимое связывание с C5. В некоторых вариантах осуществления pH-зависимое анти-C5 антитело сильнее связывается с C5 при более нейтральном pH (например, примерно pH 7,4; который характерен для крови), чем при более кислом pH (например, примерно pH 5.8; который характерен для эндосом).
В некоторых вариантах осуществления связывание антитела или фрагмента антитела с человеческим C5 связано с уменьшением образования C5a или C5b и MAC в пути активации комплемента в интактном организме. В некоторых вариантах осуществления изобретение представляет собой белок или полипептид, способный связываться с человеческим C5. В некоторых вариантах осуществления антитело или фрагмент антитела; белок или полипептид связывается с соответствующей частью или фракцией или эпитопом человеческого С5; и связывание антитела или фрагмента антитела, или белка или полипептида с соответствующей частью человеческого C5 связано с уменьшением образования C5a или C5b и MAC в интактном организме.
В некоторых вариантах осуществления антитело, связывающееся с человеческим С5, или фрагмент С5-связывающего антитела дополнительно конъюгирован с белком, пептидом или другим соединением. В некоторых вариантах осуществления антитело, связывающееся с человеческим C5, или фрагмент антитела конъюгирован с белком, пептидом или другим соединением. В некоторых вариантах осуществления белок, пептид или другое соединение, с которым конъюгировано антитело, связывающееся с человеческим C5 или фрагмент антитела, представляет собой нацеливающий фрагмент (т.е. нацеливающий фрагмент специфически связывается с молекулой, отличной от человеческого C5). В некоторых вариантах осуществления белок, пептид или другое соединение, с которым конъюгировано антитело, связывающееся с человеческим С5, или фрагмент антитела, является эффекторной молекулой (например, цитотоксической молекулой).
В различных вариантах осуществления любое из представленных в настоящем описании антител по изобретению, имеющее любую из представленных в настоящем описании вариабельных областей, может содержать Fc-фрагмент или Fc-домен. Например, в некоторых вариантах осуществления представленное в настоящем описании антитело содержит Fc-фрагмент иммуноглобулина. Примеры иммуноглобулинов включают, без ограничения, IgG1, IgG2, IgG3, IgG4, IgM, IgA, IgE и IgD. В одном из вариантов осуществления антитело содержит Fc человеческого IgG4. SEQ ID NO: 32 представляет собой пример аминокислотной последовательности Fc-фрагмента человеческого IgG4. В некоторых вариантах осуществления антитело по изобретению содержит Fc-фрагмент человеческого IgG4, имеющий мутацию S108P относительно SEQ ID NO: 32. SEQ ID NO: 33 представляет собой пример аминокислотной последовательности Fc-фрагмента человеческого IgG4, имеющего мутацию S108P относительно SEQ ID NO: 32. В некоторых вариантах осуществления антитело по изобретению содержит Fc-фрагмент человеческого IgG4, имеющий одну или более мутаций из: мутации S108P, мутации M308L и мутации N314A, относительно SEQ ID NO: 32. В некоторых вариантах осуществления антитело по изобретению содержит Fc-фрагмент человеческого IgG4, имеющий мутацию S108P, мутацию M308L и мутацию N314A относительно SEQ ID NO: 32 (также называемую в настоящем описании мутацией Fc PLA). SEQ ID NO: 61 представляет собой пример аминокислотной последовательности Fc-фрагмента человеческого IgG4, имеющего мутацию S108P, мутацию M308L и мутацию N314A относительно SEQ ID NO: 32.
В одном из вариантов осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит по меньшей мере одну из CDR, выбранных из группы, состоящей из: VH-CDR1: SEQ ID NO: 3; VH-CDR2: SEQ ID NO: 4; VH-CDR3: SEQ ID NO: 5; VL-CDR1: SEQ ID NO: 8; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их варианта или вариантов. В другом варианте осуществления анти-С5 антитело содержит все CDR из группы, состоящей из: VH-CDR1: SEQ ID NO: 3; VH-CDR2: SEQ ID NO: 4; VH-CDR3: SEQ ID NO: 5; VL-CDR1: SEQ ID NO: 8; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их варианта или вариантов.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 3 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2, или 3) аминокислотных замен; и VL-CDR1: SEQ ID NO: 8 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 3; и VL-CDR1: SEQ ID NO: 8.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 4, или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR2: SEQ ID NO: 9 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 4; и VL-CDR2: SEQ ID NO: 9.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 5 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR3: SEQ ID NO: 10 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 5; и VL-CDR3: SEQ ID NO: 10.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 3 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 4 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 5 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 8 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 9 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 10 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 3 или ее вариант, содержащий до примерно 3 (например, примерно любой из 1, 2 или 3) аминокислотных замен; VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 4 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 5; VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 8 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 9 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 10.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 3; VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 4; VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 5; VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 8; VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 9; и VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 10.
В одном из вариантов осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит по меньшей мере одну из CDR, выбранных из группы, состоящей из: VH-CDR1: SEQ ID NO: 3; VH-CDR2: SEQ ID NO: 4; VH-CDR3: SEQ ID NO: 5; VL-CDR1: SEQ ID NO: 8; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 11 или их варианта или вариантов. В другом варианте осуществления анти-С5 антитело содержит все CDR из группы, состоящей из: VH-CDR1: SEQ ID NO: 3; VH-CDR2: SEQ ID NO: 4; VH-CDR3: SEQ ID NO: 5; VL-CDR1: SEQ ID NO: 8; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 11 или их варианта или вариантов.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 3 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2, или 3) аминокислотных замен; и VL-CDR1: SEQ ID NO: 8 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 3; и VL-CDR1: SEQ ID NO: 8.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 4 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR2: SEQ ID NO: 9 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 4; и VL-CDR2: SEQ ID NO: 9.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 5 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR3: SEQ ID NO: 11 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 5; и VL-CDR3: SEQ ID NO: 11.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 3 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 4 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 5 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 8 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 9 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 11 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 3 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 4 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 5; VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 8 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 9 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 11.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 3; VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 4; VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 5; VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 8; VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 9; и VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 11.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 2 или ее вариант. В других вариантах осуществления анти-С5 антитело содержит легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 13 или ее вариант. В другом варианте осуществления анти-С5 антитело представляет собой mAb L3-1 или его вариант. Моноклональное анти-С5 антитело mAb L3-1 содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 2, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 13. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент человеческого IgG4 или его вариант. В одном из вариантов осуществления анти-С5 антитело mAb L3-1 содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 2; легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 13; и Fc-фрагмент человеческого IgG4, содержащий аминокислотную последовательность SEQ ID NO: 32. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент человеческого IgG4, имеющий мутацию S108P относительно SEQ ID NO: 32, или его вариант. В одном из вариантов осуществления анти-C5 антитело mAb L3-1 содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 2; легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 13; и Fc-фрагмент человеческого IgG4, имеющий мутацию S108P относительно SEQ ID NO: 32, содержащий аминокислотную последовательность SEQ ID NO: 33. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент человеческого IgG4, имеющий мутацию S108P, мутацию M308L и мутацию N314A относительно SEQ ID NO: 32, или его вариант. В одном из вариантов осуществления анти-C5 антитело mAb L3-1 содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 2; легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 13; и человеческий IgG4, имеющий мутацию S108P, мутацию M308L и мутацию N314A относительно SEQ ID NO: 32, содержащий аминокислотную последовательность SEQ ID NO: 61. В некоторых вариантах осуществления моноклональное анти-С5 антитело является гуманизированным. В некоторых вариантах осуществления моноклональное анти-С5 антитело представляет собой химерное антитело.
В одном из вариантов осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит по меньшей мере одну из CDR, выбранных из группы, состоящей из: VH-CDR1: SEQ ID NO: 3; VH-CDR2: SEQ ID NO: 4; VH-CDR3: SEQ ID NO: 5; VL-CDR1: SEQ ID NO: 14; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их варианта или вариантов. В другом варианте осуществления анти-С5 антитело содержит все CDR из группы, состоящей из: VH-CDR1: SEQ ID NO: 3; VH-CDR2: SEQ ID NO: 4; VH-CDR3: SEQ ID NO: 5; VL-CDR1: SEQ ID NO: 14; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их варианта или вариантов.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 3 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2, или 3) аминокислотных замен; и VL-CDR1: SEQ ID NO: 14 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 3; и VL-CDR1: SEQ ID NO: 14.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 4 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR2: SEQ ID NO: 9 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 4; и VL-CDR2: SEQ ID NO: 9.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 5 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR3: SEQ ID NO: 10 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 5; и VL-CDR3: SEQ ID NO: 10.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 3 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 4 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 5 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 14 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 9 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 10 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 3 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 4 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 5; VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 14 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 9 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 10.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 3; VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 4; VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 5; VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 14; VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 9; и VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 10.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 2 или ее вариант. В других вариантах осуществления анти-С5 антитело содержит легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 16 или ее вариант. В другом варианте осуществления анти-С5 антитело представляет собой mAb L1-2 или его вариант. Моноклональное анти-С5 антитело mAb L1-2 содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 2, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 16. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент человеческого IgG4 или его вариант. В одном из вариантов осуществления анти-C5 антитело mAb L1-2 содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 2; легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 16; и Fc-фрагмент человеческого IgG4, содержащий аминокислотную последовательность SEQ ID NO: 32. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент человеческого IgG4, имеющий мутацию S108P относительно SEQ ID NO: 32, или его вариант. В одном из вариантов осуществления анти-C5 антитело mAb L1-2 содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 2; легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 16; и Fc-фрагмент человеческого IgG4, имеющий мутацию S108P относительно SEQ ID NO: 32, содержащий аминокислотную последовательность SEQ ID NO: 33. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент человеческого IgG4, имеющий мутацию S108P, мутацию M308L и мутацию N314A относительно SEQ ID NO: 32, или его вариант. В одном из вариантов осуществления анти-C5 антитело mAb L1-2 содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 2; легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 16; и Fc-фрагмент человеческого IgG4, имеющий мутацию S108P, мутацию M308L и мутацию N314A относительно SEQ ID NO: 32, содержащий аминокислотную последовательность SEQ ID NO: 61. В некоторых вариантах осуществления моноклональное анти-С5 антитело является гуманизированным. В некоторых вариантах осуществления моноклональное анти-С5 антитело является химерным антителом.
В одном из вариантов осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит по меньшей мере одну из CDR, выбранных из группы, состоящей из: VH-CDR1: SEQ ID NO: 17; VH-CDR2: SEQ ID NO: 4; VH-CDR3: SEQ ID NO: 5; VL-CDR1: SEQ ID NO: 8; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их варианта или вариантов. В другом варианте осуществления анти-С5 антитело содержит все CDR из группы, состоящей из: VH-CDR1: SEQ ID NO: 17; VH-CDR2: SEQ ID NO: 4; VH-CDR3: SEQ ID NO: 5; VL-CDR1: SEQ ID NO: 8; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их варианта или вариантов.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 17 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2, или 3) аминокислотных замен; и VL-CDR1: SEQ ID NO: 8 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 17; и VL-CDR1: SEQ ID NO: 8.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 4 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR2: SEQ ID NO: 9 или его вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 4; и VL-CDR2: SEQ ID NO: 9.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 5 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR3: SEQ ID NO: 10 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 5; и VL-CDR3: SEQ ID NO: 10.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 17 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 4 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 5 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 8 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 9 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 10 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 17 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 4 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 5; VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 8 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 9 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 10.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 17; VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 4; VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 5; VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 8; VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 9; и VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 10.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 19 или ее вариант. В других вариантах осуществления анти-С5 антитело содержит легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 7 или ее вариант. В другом варианте осуществления анти-С5 антитело представляет собой mAb H1-4 или его вариант. Моноклональное анти-С5 антитело mAb H1-4 содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 19, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 7. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент человеческого IgG4 или его вариант. В одном из вариантов осуществления анти-C5 антитело mAb H1-4 содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 19; легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 7; и Fc-фрагмент человеческого IgG4, содержащий аминокислотную последовательность SEQ ID NO: 32. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент человеческого IgG4, имеющий мутацию S108P относительно SEQ ID NO: 32, или его вариант. В одном из вариантов осуществления анти-C5 антитело mAb H1-4 содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 19; легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 7; и Fc-фрагмент человеческого IgG4, имеющий мутацию S108P относительно SEQ ID NO: 32, содержащий аминокислотную последовательность SEQ ID NO: 33. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент человеческого IgG4, имеющий мутацию S108P, мутацию M308L и мутацию N314A относительно SEQ ID NO: 32, или его вариант. В одном из вариантов осуществления анти-C5 антитело mAb H1-4 содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 19; легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 7; и Fc-фрагмент человеческого IgG4, имеющий мутацию S108P, мутацию M308L и мутацию N314A относительно SEQ ID NO: 32, содержащий аминокислотную последовательность SEQ ID NO: 61. В некоторых вариантах осуществления моноклональное анти-С5 антитело является гуманизированным. В некоторых вариантах осуществления моноклональное анти-С5 антитело представляет собой химерное антитело.
В одном из вариантов осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит по меньшей мере одну из CDR, выбранных из группы, состоящей из: VH-CDR1: SEQ ID NO: 20; VH-CDR2: SEQ ID NO: 4; VH-CDR3: SEQ ID NO: 5; VL-CDR1: SEQ ID NO: 23; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их варианта или вариантов. В другом варианте осуществления анти-С5 антитело содержит все CDR из группы, состоящей из: VH-CDR1: SEQ ID NO: 20; VH-CDR2: SEQ ID NO: 4; VH-CDR3: SEQ ID NO: 5; VL-CDR1: SEQ ID NO: 23; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их варианта или вариантов.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 20 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2, или 3) аминокислотных замен; и VL-CDR1: SEQ ID NO: 23 или его вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 20; и VL-CDR1: SEQ ID NO: 23.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 4 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR2: SEQ ID NO: 9 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 4; и VL-CDR2: SEQ ID NO: 9.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 5 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR3: SEQ ID NO: 10 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 5; и VL-CDR3: SEQ ID NO: 10.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 20 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 4 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 5 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 23 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 9 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 10 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 20 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 4 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 5; VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 23 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 9 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 10.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 20; VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 4; VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 5; VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 23; VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 9; и VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 10.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 22 или ее вариант. В других вариантах осуществления анти-С5 антитело содержит легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25 или ее вариант. В другом варианте осуществления анти-С5 антитело представляет собой анти-С5 антитело mAb H1-8/L1-9 или его вариант. Моноклональное анти-С5-антитело mAb H1-8/L1-9 содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 22, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент человеческого IgG4 или его вариант. В одном из вариантов осуществления анти-С5 антитело mAb H1-8/L1-9 содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 22; легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25; и Fc-фрагмент человеческого IgG4, содержащий аминокислотную последовательность SEQ ID NO: 32. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент человеческого IgG4, имеющий мутацию S108P относительно SEQ ID NO: 32, или его вариант. В одном из вариантов осуществления анти-С5 антитело mAb H1-8/L1-9 содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 22; легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25; и Fc-фрагмент человеческого IgG4, имеющий мутацию S108P относительно SEQ ID NO: 32, содержащий аминокислотную последовательность SEQ ID NO: 33. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент человеческого IgG4, имеющий мутацию S108P, мутацию M308L и мутацию N314A относительно SEQ ID NO: 32, или его вариант. В одном из вариантов осуществления анти-С5 антитело mAb H1-8/L1-9 содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 22; легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25; и Fc-фрагмент человеческого IgG4, имеющий мутацию S108P, мутацию M308L и мутацию N314A относительно SEQ ID NO: 32, содержащий аминокислотную последовательность SEQ ID NO: 61. В некоторых вариантах осуществления моноклональное анти-С5 антитело является гуманизированным. В некоторых вариантах осуществления моноклональное анти-С5 антитело представляет собой химерное антитело.
В одном из вариантов осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит по меньшей мере одну из CDR, выбранных из группы, состоящей из: VH-CDR1: SEQ ID NO: 3; VH-CDR2: SEQ ID NO: 26; VH-CDR3: SEQ ID NO: 5; VL-CDR1: SEQ ID NO: 8; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 29 или их варианта или вариантов. В другом варианте осуществления анти-С5 антитело содержит все CDR из группы, состоящей из: VH-CDR1: SEQ ID NO: 3; VH-CDR2: SEQ ID NO: 26; VH-CDR3: SEQ ID NO: 5; VL-CDR1: SEQ ID NO: 8; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 29 или их варианта или вариантов.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 3 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2, или 3) аминокислотных замен; и VL-CDR1: SEQ ID NO: 8 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 3; и VL-CDR1: SEQ ID NO: 8.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 26 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR2: SEQ ID NO: 9 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 26; и VL-CDR2: SEQ ID NO: 9.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 5 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR3: SEQ ID NO: 29 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 5; и VL-CDR3: SEQ ID NO: 29.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 3 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 26 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 5 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 8 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 9 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 29 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 3 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 26 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 5; VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 8 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 9 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 29.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 3; VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 26; VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 5; VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 8; VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 9; и VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 29.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 28 или ее вариант. В других вариантах осуществления анти-С5 антитело содержит легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 31 или ее вариант. В другом варианте осуществления анти-С5 антитело представляет собой mAb H2-6/L3-5 или его вариант. Моноклональное анти-С5 антитело mAb H2-6/L3-5 содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 28, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 31. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент человеческого IgG4 или его вариант. В одном из вариантов осуществления анти-С5 антитело mAb H2-5/L3-5 содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 28; легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 31; и Fc-фрагмент человеческого IgG4, содержащий аминокислотную последовательность SEQ ID NO: 32. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент человеческого IgG4, имеющий мутацию S108P относительно SEQ ID NO: 32, или его вариант. В одном из вариантов осуществления анти-С5 антитело mAb H2-6/L3-5 содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 28; легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 31; и Fc-фрагмент человеческого IgG4, имеющий мутацию S108P относительно SEQ ID NO: 32, содержащий аминокислотную последовательность SEQ ID NO: 33. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент человеческого IgG4, имеющий мутацию S108P, мутацию M308L и мутацию N314A относительно SEQ ID NO: 32, или его вариант. В одном из вариантов осуществления анти-С5 антитело mAb H2-6/L3-5 содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 28; легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 31; и Fc-фрагмент человеческого IgG4, имеющий мутацию S108P, мутацию M308L и мутацию N314A относительно SEQ ID NO: 32, содержащий аминокислотную последовательность SEQ ID NO: 61. В некоторых вариантах осуществления моноклональное анти-С5 антитело является гуманизированным. В некоторых вариантах осуществления моноклональное анти-С5 антитело представляет собой химерное антитело.
В одном из вариантов осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит по меньшей мере одну из CDR, выбранных из группы, состоящей из: VH-CDR1: SEQ ID NO: 3; VH-CDR2: SEQ ID NO: 34; VH-CDR3: SEQ ID NO: 5; VL-CDR1: SEQ ID NO: 8; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их варианта или вариантов. В другом варианте осуществления анти-С5 антитело включает все CDR из группы, состоящей из: VH-CDR1: SEQ ID NO: 3; VH-CDR2: SEQ ID NO: 34; VH-CDR3: SEQ ID NO: 5; VL-CDR1: SEQ ID NO: 8; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их варианта или вариантов.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 3 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2, или 3) аминокислотных замен; и VL-CDR1: SEQ ID NO: 8 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 3; и VL-CDR1: SEQ ID NO: 8.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 34 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR2: SEQ ID NO: 9 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 34; и VL-CDR2: SEQ ID NO: 9.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 5 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR3: SEQ ID NO: 10 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 5; и VL-CDR3: SEQ ID NO: 10.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 3 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 34 или ее вариант, содержащую до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 5 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 8 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 9 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 10 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 3 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 34 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 5; VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 8 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 9 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 10.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 3; VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 34; VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 5; VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 8; VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 9; и VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 10.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 36 или ее вариант. В других вариантах осуществления анти-С5 антитело содержит легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 7 или ее вариант. В некоторых вариантах осуществления моноклональное анти-С5 антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 36, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 7. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент человеческого IgG4 или его вариант. В одном из вариантов осуществления анти-С5 антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 36; легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 7; и Fc-фрагмент человеческого IgG4, содержащий аминокислотную последовательность SEQ ID NO: 32. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент человеческого IgG4, имеющий мутацию S108P относительно SEQ ID NO: 32, или его вариант. В одном из вариантов осуществления анти-С5 антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 36; легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 7; и Fc-фрагмент человеческого IgG4, имеющий мутацию S108P относительно SEQ ID NO: 32, содержащий аминокислотную последовательность SEQ ID NO: 33. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент человеческого IgG4, имеющий мутацию S108P, мутацию M308L и мутацию N314A относительно SEQ ID NO: 32, или его вариант. В одном из вариантов осуществления анти-С5 антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 36; легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 7; и Fc-фрагмент человеческого IgG4, имеющий мутацию S108P, мутацию M308L и мутацию N314A относительно SEQ ID NO: 32, содержащий аминокислотную последовательность SEQ ID NO: 61. В некоторых вариантах осуществления моноклональное анти-С5 антитело является гуманизированным. В некоторых вариантах осуществления моноклональное анти-С5 антитело представляет собой химерное антитело.
В одном из вариантов осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит по меньшей мере одну из CDR, выбранных из группы, состоящей из: VH-CDR1: SEQ ID NO: 37; VH-CDR2: SEQ ID NO: 38; VH-CDR3: SEQ ID NO: 39; VL-CDR1: SEQ ID NO: 23; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их варианта или вариантов. В другом варианте осуществления анти-С5 антитело содержит все CDR из группы, состоящей из: VH-CDR1: SEQ ID NO: 37; VH-CDR2: SEQ ID NO: 38; VH-CDR3: SEQ ID NO: 39; VL-CDR1: SEQ ID NO: 23; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их варианта или вариантов.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 37 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2, или 3) аминокислотных замен; и VL-CDR1: SEQ ID NO: 23 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 37; и VL-CDR1: SEQ ID NO: 23.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 38 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR2: SEQ ID NO: 9 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 38; и VL-CDR2: SEQ ID NO: 9.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 39 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR3: SEQ ID NO: 10 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 39; и VL-CDR3: SEQ ID NO: 10.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 37 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 38 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 39 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 23 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 9 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 10 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 37 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 38 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 39; VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 23 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 9 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 10.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 37; VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 38; VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 39; VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 23; VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 9; и VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 10.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 41 или ее вариант. В других вариантах осуществления анти-С5 антитело содержит легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25 или ее вариант. В другом варианте осуществления анти-С5 антитело представляет собой вариант IWW mAb H1-8/L1-9 или его вариант. В одном из вариантов осуществления вариант IWW моноклонального анти-С5 антитела mAb H1-8/L1-9 содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 41, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент человеческого IgG4 или его вариант. В одном из вариантов осуществления вариант IWW анти-С5 антитела mAb H1-8/L1-9 содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 41; легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25; и Fc-фрагмент человеческого IgG4, содержащий аминокислотную последовательность SEQ ID NO: 32. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент человеческого IgG4, имеющий мутацию S108P, или его вариант. В одном из вариантов осуществления вариант IWW анти-С5 антитела mAb H1-8/L1-9 содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 41; легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25; и Fc-фрагмент человеческого IgG4, имеющий мутацию S108P относительно SEQ ID NO: 32, содержащий аминокислотную последовательность SEQ ID NO: 33. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент человеческого IgG4, имеющий мутацию S108P, мутацию M308L и мутацию N314A относительно SEQ ID NO: 32, или его вариант. В одном из вариантов осуществления вариант IWW анти-С5 антитела mAb H1-8/L1-9 содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 41; легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25; и Fc-фрагмент человеческого IgG4, имеющий мутацию S108P, мутацию M308L и мутацию N314A относительно SEQ ID NO: 32, содержащий аминокислотную последовательность SEQ ID NO: 61. В некоторых вариантах осуществления моноклональное анти-С5 антитело является гуманизированным. В некоторых вариантах осуществления моноклональное анти-С5 антитело представляет собой химерное антитело.
В одном из вариантов осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит по меньшей мере одну из CDR, выбранных из группы, состоящей из: VH-CDR1: SEQ ID NO: 42; VH-CDR2: SEQ ID NO: 43; VH-CDR3: SEQ ID NO: 44; VL-CDR1: SEQ ID NO: 23; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их варианта или вариантов. В другом варианте осуществления анти-С5 антитело содержит все CDR из группы, состоящей из: VH-CDR1: SEQ ID NO: 42; VH-CDR2: SEQ ID NO: 43; VH-CDR3: SEQ ID NO: 44; VL-CDR1: SEQ ID NO: 23; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их варианта или вариантов.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 42 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2, или 3) аминокислотных замен; и VL-CDR1: SEQ ID NO: 23 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 42; и VL-CDR1: SEQ ID NO: 23.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 43 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR2: SEQ ID NO: 9 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 43; и VL-CDR2: SEQ ID NO: 9.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 44 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR3: SEQ ID NO: 10 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 44; и VL-CDR3: SEQ ID NO: 10.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 42 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 43 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 44 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 23 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 9 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 10 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 42 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR2, содержащий аминокислотную последовательность SEQ ID NO: 43 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 44; VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 23 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 9 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 10.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 42; VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 43; VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 44; VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 23; VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 9; и VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 10.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 46 или ее вариант. В других вариантах осуществления анти-С5 антитело содержит легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25 или ее вариант. В другом варианте осуществления анти-С5 антитело представляет собой вариант IFW mAb H1-8/L1-9 или его вариант. В одном из вариантов осуществления вариант IFW моноклонального анти-C5 антитела mAb H1-8/L1-9 содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 46, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент человеческого IgG4 или его вариант. В одном из вариантов осуществления вариант IFW анти-С5 антитела mAb H1-8/L1-9 содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 46; легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25; и Fc-фрагмент человеческого IgG4, содержащий аминокислотную последовательность SEQ ID NO: 32. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент человеческого IgG4, имеющий мутацию S108P относительно SEQ ID NO: 32, или его вариант. В одном из вариантов осуществления вариант IFW анти-С5 антитела mAb H1-8/L1-9 содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 46; легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25; и Fc-фрагмент человеческого IgG4, имеющий мутацию S108P относительно SEQ ID NO: 32, содержащий аминокислотную последовательность SEQ ID NO: 33. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент человеческого IgG4, имеющий мутацию S108P, мутацию M308L и мутацию N314A относительно SEQ ID NO: 32, или его вариант. В одном из вариантов осуществления вариант IFW анти-С5 антитела mAb H1-8/L1-9 содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 46; легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25; и Fc-фрагмент человеческого IgG4, имеющий мутацию S108P, мутацию M308L и мутацию N314A относительно SEQ ID NO: 32, содержащий аминокислотную последовательность SEQ ID NO: 61. В некоторых вариантах осуществления моноклональное анти-С5 антитело является гуманизированным. В некоторых вариантах осуществления моноклональное анти-С5 антитело представляет собой химерное антитело.
В одном из вариантов осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит по меньшей мере одну из CDR, выбранных из группы, состоящей из: VH-CDR1: SEQ ID NO: 47; VH-CDR2: SEQ ID NO: 48; VH-CDR3: SEQ ID NO: 49; VL-CDR1: SEQ ID NO: 23; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их варианта или вариантов. В другом варианте осуществления анти-С5 антитело содержит все CDR из группы, состоящей из: VH-CDR1: SEQ ID NO: 47; VH-CDR2: SEQ ID NO: 48; VH-CDR3: SEQ ID NO: 49; VL-CDR1: SEQ ID NO: 23; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их варианта или вариантов.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 47 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2, или 3) аминокислотных замен; и VL-CDR1: SEQ ID NO: 23 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 47; и VL-CDR1: SEQ ID NO: 23.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 48 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR2: SEQ ID NO: 9 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 48; и VL-CDR2: SEQ ID NO: 9.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 49 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR3: SEQ ID NO: 10 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 49; и VL-CDR3: SEQ ID NO: 10.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 47 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR2, содержащий аминокислотную последовательность SEQ ID NO: 48 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 49 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 23 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 9 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 10 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 47 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 48 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 49; VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 23 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 9 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 10.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 47; VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 48; VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 49; VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 23; VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 9; и VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 10.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 51 или ее вариант. В других вариантах осуществления анти-С5 антитело содержит легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25 или ее вариант. В другом варианте осуществления анти-С5 антитело представляет собой вариант FME mAb H1-8/L1-9 или его вариант. В одном из вариантов осуществления вариант FME моноклонального анти-С5 антитела mAb H1-8/L1-9 содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 51, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент человеческого IgG4 или его вариант. В одном из вариантов осуществления вариант FME анти-С5 антитела mAb H1-8/L1-9 содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 51; легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25; и Fc-фрагмент человеческого IgG4, содержащий аминокислотную последовательность SEQ ID NO: 32. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент человеческого IgG4, имеющий мутацию S108P относительно SEQ ID NO: 32, или его вариант. В одном из вариантов осуществления вариант FME анти-С5 антитела mAb H1-8/L1-9 содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 51; легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25; и Fc-фрагмент человеческого IgG4, имеющий мутацию S108P относительно SEQ ID NO: 32, содержащий аминокислотную последовательность SEQ ID NO: 33. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент человеческого IgG4, имеющий мутацию S108P, мутацию M308L и мутацию N314A относительно SEQ ID NO: 32, или его вариант. В одном из вариантов осуществления вариант FME анти-С5 антитела mAb H1-8/L1-9 содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 51; легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25; и Fc-фрагмент человеческого IgG4, имеющий мутацию S108P, мутацию M308L и мутацию N314A относительно SEQ ID NO: 32, содержащий аминокислотную последовательность SEQ ID NO: 61. В некоторых вариантах осуществления моноклональное анти-С5 антитело является гуманизированным. В некоторых вариантах осуществления моноклональное анти-С5 антитело представляет собой химерное антитело.
В одном из вариантов осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит по меньшей мере одну из CDR, выбранных из группы, состоящей из: VH-CDR1: SEQ ID NO: 52; VH-CDR2: SEQ ID NO: 53; VH-CDR3: SEQ ID NO: 54; VL-CDR1: SEQ ID NO: 23; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их варианта или вариантов. В другом варианте осуществления анти-С5 антитело включает все CDR из группы, состоящей из: VH-CDR1: SEQ ID NO: 52; VH-CDR2: SEQ ID NO: 53; VH-CDR3: SEQ ID NO: 54; VL-CDR1: SEQ ID NO: 23; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их варианта или вариантов.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 52 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2, или 3) аминокислотных замен; и VL-CDR1: SEQ ID NO: 23 или его вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 52; и VL-CDR1: SEQ ID NO: 23.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 53 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR2: SEQ ID NO: 9 или его вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 53; и VL-CDR2: SEQ ID NO: 9.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 54 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR3: SEQ ID NO: 10 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 54; и VL-CDR3: SEQ ID NO: 10.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 52 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 53 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 54 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 23 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 9 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 10 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 52 или ее вариант, содержащий до примерно 3 (например, примерно любой из 1, 2 или 3) аминокислотные замены; VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 53 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 54; VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 23 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 9 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 10.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 52; VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 53; VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 54; VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 23; VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 9; и VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 10.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 56 или ее вариант. В других вариантах осуществления анти-С5 антитело содержит легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25 или ее вариант. В другом варианте осуществления анти-С5 антитело представляет собой вариант FMW mAb H1-8/L1-9 или его вариант. В одном из вариантов осуществления вариант FMW моноклонального анти-C5 антитела mAb H1-8/L1-9 содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 56, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент человеческого IgG4 или его вариант. В одном из вариантов осуществления изобретения вариант FMW анти-С5 антитела H1-8/L1-9 содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 56; легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25; и Fc-фрагмент человеческого IgG4, содержащий аминокислотную последовательность SEQ ID NO: 32. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент человеческого IgG4, имеющий мутацию S108P относительно SEQ ID NO: 32, или его вариант. В одном из вариантов осуществления изобретения вариант FMW анти-С5 антитела H1-8/L1-9 содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 56; легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25; и Fc-фрагмент человеческого IgG4, имеющий мутацию S108P относительно SEQ ID NO: 32, содержащий аминокислотную последовательность SEQ ID NO: 33. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент человеческого IgG4, имеющий мутацию S108P, мутацию M308L и мутацию N314A относительно SEQ ID NO: 32, или его вариант. В одном из вариантов осуществления изобретения вариант FMW анти-С5 антитела H1-8/L1-9 содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 56; легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25; и Fc-фрагмент человеческого IgG4, имеющий мутацию S108P, мутацию M308L и мутацию N314A относительно SEQ ID NO: 32, содержащий аминокислотную последовательность SEQ ID NO: 61. В некоторых вариантах осуществления моноклональное анти-С5 антитело является гуманизированным. В некоторых вариантах осуществления моноклональное анти-С5 антитело представляет собой химерное антитело.
В одном из вариантов осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит по меньшей мере одну из CDR, выбранных из группы, состоящей из: VH-CDR1: SEQ ID NO: 47; VH-CDR2: SEQ ID NO: 57; VH-CDR3: SEQ ID NO: 49; VL-CDR1: SEQ ID NO: 23; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их варианта или вариантов. В другом варианте осуществления анти-С5 антитело содержит все CDR из группы, состоящей из: VH-CDR1: SEQ ID NO: 47; VH-CDR2: SEQ ID NO: 57; VH-CDR3: SEQ ID NO: 49; VL-CDR1: SEQ ID NO: 23; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их варианта или вариантов.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 57 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR2: SEQ ID NO: 9 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 57; и VL-CDR2: SEQ ID NO: 9.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 47 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 57 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 49 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 23 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 9 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 10 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 47 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 57 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 49; VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 23 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 9 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 10.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 47; VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 57; VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 49; VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 23; VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 9; и VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 10.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 59 или ее вариант. В других вариантах осуществления анти-С5 антитело содержит легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25 или ее вариант. В другом варианте осуществления анти-С5 антитело представляет собой вариант FMEH mAb H1-8/L1-9 или его вариант. В одном из вариантов осуществления вариант FMEH моноклонального анти-C5 антитела mAb H1-8/L1-9 содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 59, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент человеческого IgG4 или его вариант. В одном из вариантов осуществления вариант FMEH анти-С5 антитела mAb H1-8/L1-9 содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 59; легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25; и Fc-фрагмент человеческого IgG4, содержащий аминокислотную последовательность SEQ ID NO: 32. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент человеческого IgG4, имеющий мутацию S108P относительно SEQ ID NO: 32, или его вариант. В одном из вариантов осуществления вариант FMEH анти-С5 антитела mAb H1-8/L1-9 содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 59; легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25; и Fc-фрагмент человеческого IgG4, имеющий мутацию S108P относительно SEQ ID NO: 32, содержащий аминокислотную последовательность SEQ ID NO: 33. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент человеческого IgG4, имеющий мутацию S108P, мутацию M308L и мутацию N314A относительно SEQ ID NO: 32, или его вариант. В одном из вариантов осуществления вариант FMEH анти-C5 антитела mAb H1-8/L1-9 содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 59; легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25; и Fc-фрагмент человеческого IgG4, имеющий мутацию S108P, мутацию M308L и мутацию N314A относительно SEQ ID NO: 32, содержащий аминокислотную последовательность SEQ ID NO: 61. В некоторых вариантах осуществления моноклональное анти-С5 антитело является гуманизированным. В некоторых вариантах осуществления моноклональное анти-С5 антитело представляет собой химерное антитело.
В одном из вариантов осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит по меньшей мере одну из CDR, выбранных из группы, состоящей из: VH-CDR1: SEQ ID NO: 37; VH-CDR2: SEQ ID NO: 62; VH-CDR3: SEQ ID NO: 39; VL-CDR1: SEQ ID NO: 23; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их варианта или вариантов. В другом варианте осуществления анти-С5 антитело содержит все CDR из группы, состоящей из: VH-CDR1: SEQ ID NO: 37; VH-CDR2: SEQ ID NO: 62; VH-CDR3: SEQ ID NO: 39; VL-CDR1: SEQ ID NO: 23; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их варианта или вариантов.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 62 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотные замены; и VL-CDR2: SEQ ID NO: 9 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 62; и VL-CDR2: SEQ ID NO: 9.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 37 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 62 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 39 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 23 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 9 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 10 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 37 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 62 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 39; VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 23 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 9 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 10.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 37; VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 62; VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 39; VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 23; VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 9; и VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 10.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 64 или ее вариант. В других вариантах осуществления анти-С5 антитело содержит легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25 или ее вариант. В другом варианте осуществления анти-С5 антитело представляет собой вариант IWWH mAb H1-8/L1-9 или его вариант. В одном из вариантов осуществления вариант IWWH моноклонального анти-С5 антитела mAb H1-8/L1-9 содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 64, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент человеческого IgG4 или его вариант. В одном из вариантов осуществления вариант IWWH анти-C5 антитела mAb H1-8/L1-9 содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 64; легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25; и Fc-фрагмент человеческого IgG4, содержащий аминокислотную последовательность SEQ ID NO: 32. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент человеческого IgG4, имеющий мутацию S108P относительно SEQ ID NO: 32, или его вариант. В одном из вариантов осуществления вариант IWWH анти-C5 антитела mAb H1-8/L1-9 содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 64; легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25; и Fc-фрагмент человеческого IgG4, имеющий мутацию S108P относительно SEQ ID NO: 32, содержащий аминокислотную последовательность SEQ ID NO: 33. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент человеческого IgG4, имеющий мутацию S108P, мутацию M308L и мутацию N314A относительно SEQ ID NO: 32, или его вариант. В одном из вариантов осуществления вариант IWWH анти-C5-антитела mAb H1-8/L1-9 содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 64; легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25; и Fc-фрагмент человеческого IgG4, имеющий мутацию S108P, мутацию M308L и мутацию N314A относительно SEQ ID NO: 32, содержащий аминокислотную последовательность SEQ ID NO: 61. В некоторых вариантах осуществления моноклональное анти-С5 антитело является гуманизированным. В некоторых вариантах осуществления моноклональное анти-С5 антитело представляет собой химерное антитело.
В одном из вариантов осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит по меньшей мере одну из CDR, выбранных из группы, состоящей из: VH-CDR1: SEQ ID NO: 42; VH-CDR2: SEQ ID NO: 65; VH-CDR3: SEQ ID NO: 44; VL-CDR1: SEQ ID NO: 23; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их варианта или вариантов. В другом варианте осуществления анти-С5 антитело содержит все CDR из группы, состоящей из: VH-CDR1: SEQ ID NO: 42; VH-CDR2: SEQ ID NO: 65; VH-CDR3: SEQ ID NO: 44; VL-CDR1: SEQ ID NO: 23; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их варианта или вариантов.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 65 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR2: SEQ ID NO: 9 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 65; и VL-CDR2: SEQ ID NO: 9.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 42 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 65 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 44 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 23 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 9 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 10 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 42 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 65 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 44; VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 23 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 9 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 10.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 42; VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 65; VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 44; VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 23; VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 9; и VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 10.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 67 или ее вариант. В других вариантах осуществления анти-С5 антитело содержит легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25 или ее вариант. В другом варианте осуществления анти-С5 антитело представляет собой вариант IFWH mAb H1-8/L1-9 или его вариант. В одном из вариантов осуществления вариант IFWH моноклонального анти-С5 антитела mAb H1-8/L1-9 содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 67, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент человеческого IgG4 или его вариант. В одном из вариантов осуществления вариант IFWH анти-C5 антитела mAb H1-8/L1-9 содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 67; легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25; и Fc-фрагмент человеческого IgG4, содержащий аминокислотную последовательность SEQ ID NO: 32. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент человеческого IgG4, имеющий мутацию S108P относительно SEQ ID NO: 32, или его вариант. В одном из вариантов осуществления вариант IFWH анти-C5 антитела mAb H1-8/L1-9 содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 67; легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25; и Fc-фрагмент человеческого IgG4, имеющий мутацию S108P относительно SEQ ID NO: 32, содержащий аминокислотную последовательность SEQ ID NO: 33. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент человеческого IgG4, имеющий мутацию S108P, мутацию M308L и мутацию N314A относительно SEQ ID NO: 32, или его вариант. В одном из вариантов осуществления вариант IFWH анти-C5 антитела mAb H1-8/L1-9 содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 67; легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25; и Fc-фрагмент человеческого IgG4, имеющий мутацию S108P, мутацию M308L и мутацию N314A относительно SEQ ID NO: 32, содержащий аминокислотную последовательность SEQ ID NO: 61. В некоторых вариантах осуществления моноклональное анти-С5 антитело является гуманизированным. В некоторых вариантах осуществления моноклональное анти-С5 антитело представляет собой химерное антитело.
В одном из вариантов осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит по меньшей мере одну из CDR, выбранных из группы, состоящей из: VH-CDR1: SEQ ID NO: 52; VH-CDR2: SEQ ID NO: 68; VH-CDR3: SEQ ID NO: 54; VL-CDR1: SEQ ID NO: 23; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их варианта или вариантов. В другом варианте осуществления анти-С5 антитело содержит все CDR из группы, состоящей из: VH-CDR1: SEQ ID NO: 52; VH-CDR2: SEQ ID NO: 68; VH-CDR3: SEQ ID NO: 54; VL-CDR1: SEQ ID NO: 23; VL-CDR2: SEQ ID NO: 9; и VL-CDR3: SEQ ID NO: 10 или их варианта или вариантов.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 68 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR2: SEQ ID NO: 9 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен. В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 68; и VL-CDR2: SEQ ID NO: 9.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 52 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 68 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 54 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 23 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 9 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 10 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 52 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 68 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 54; VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 23 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 9 или ее вариант, содержащий до примерно 3 (например, примерно 1, 2 или 3) аминокислотных замен; и VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 10.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит: VH-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 52; VH-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 68; VH-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 54; VL-CDR1, содержащую аминокислотную последовательность SEQ ID NO: 23; VL-CDR2, содержащую аминокислотную последовательность SEQ ID NO: 9; и VL-CDR3, содержащую аминокислотную последовательность SEQ ID NO: 10.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 70 или ее вариант. В других вариантах осуществления анти-С5 антитело содержит легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25 или ее вариант. В другом варианте осуществления анти-С5 антитело представляет собой вариант FMWH mAb H1-8/L1-9 или его вариант. В одном варианте осуществления вариант FMWH моноклонального анти-C5-антитела mAb H1-8/L1-9 содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 70, и легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент человеческого IgG4 или его вариант. В одном из вариантов осуществления изобретения вариант FMWH анти-С5 антитела mAb H1-8/L1-9 содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 70; легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25; и Fc-фрагмент человеческого IgG4, содержащий аминокислотную последовательность SEQ ID NO: 32. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент человеческого IgG4, имеющий мутацию S108P относительно SEQ ID NO: 32, или его вариант. В одном из вариантов осуществления изобретения вариант FMWH анти-С5 антитела mAb H1-8/L1-9 содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 70; легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25; и Fc-фрагмент человеческого IgG4, имеющий мутацию S108P относительно SEQ ID NO: 32, содержащий аминокислотную последовательность SEQ ID NO: 33. В одном из вариантов осуществления анти-С5 антитело содержит Fc-фрагмент человеческого IgG4, имеющий мутацию S108P, мутацию M308L и мутацию N314A относительно SEQ ID NO: 32, или его вариант. В одном из вариантов осуществления изобретения вариант FMWH анти-С5 антитела mAb H1-8/L1-9 содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 70; легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25; и Fc-фрагмент человеческого IgG4, имеющий мутацию S108P, мутацию M308L и мутацию N314A относительно SEQ ID NO: 32, содержащий аминокислотную последовательность SEQ ID NO: 61. В некоторых вариантах осуществления моноклональное анти-С5 антитело является гуманизированным. В некоторых вариантах осуществления моноклональное анти-С5 антитело представляет собой химерное антитело.
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит замену пролина в положении 4 (т.е. P4) в VH CDR2 относительно SEQ ID NO: 4. В различных вариантах осуществления замена в P4 представляет собой P4→F4 (т.е. P4F), P4→L4 (т.е. P4L), P4→M4 (т.е. P4M), P4→W4 (т.е. P4W) или P4→I4 (т.е. P4I).
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит замену треонина в положении 9 (т.е. T9) в VH CDR2 относительно SEQ ID NO: 4. В различных вариантах осуществления замена в T9 представляет собой T9→H9 (т.е. T9H), T9 представляет собой T9→F9 (т.е. T9F), T9→L9 (т.е. T9L), T9→M9 (т.е. T9M), T9→W9 (т.е. T9W) или T9→I9 (т.е. T9I).
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит замену пролина в положении 4 (т.е. P4) в VH CDR2 относительно SEQ ID NO: 4; и замену треонина в положении 9 (т.е. Т9) в VH CDR2 относительно SEQ ID NO: 4. В различных вариантах осуществления замена в P4 представляет собой P4→F4 (т.е. P4F), P4→L4 (т.е. P4L), P4→M4 (т.е. P4M), P4→W4 (т.е. P4W) или P4→I4 (т.е. P4I); и замена в T9 представляет собой T9→H9 (т.е. T9H), T9→F9 (т. е. T9F), T9→L9 (т. е. T9L), T9→M9 (т.е. T9M), T9→W9 (т.е. T9W) или T9→I9 (т.е. T9I).
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит замену валина в положении 16 (т.е. V16) в VH CDR3 относительно SEQ ID NO: 5. В различных вариантах осуществления замена в V4 представляет собой V16→F16 (т.е. V16F), V16→E16 (т.е. V16E) или V16→W16 (т.е. V16W).
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит замену аспарагина в положении 8 (т.е. N8) в VH CDR1 относительно SEQ ID NO: 3. В различных вариантах осуществления замена в N8 представляет собой N8→H8 (т.е. N8H), N8→W8 (т.е. N8W), N8→I8 (т.е. N8I), N8→V8 (т.е. N8V), N8→Y8 (т.е. N8Y) или N8→F8 (т.е. N8F).
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит замену лейцина в положении 9 (т.е. L9) в VH CDR1 относительно SEQ ID NO: 20. В различных вариантах осуществления замена в L9 представляет собой L9→W9 (т.е. L9W), L9→I9 (т.е. L9I), L9→V9 (т.е. L9V), L9→Y9 (т.е. L9Y) или L9→F9 (т.е. L9F).
В некоторых вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент содержит замену двух или более аминокислотных остатков из группы, состоящей из пролина 4 (т.е. P4) в VH CDR2 относительно SEQ ID NO: 4, треонина 9 (т.е. T9) в VH CDR2 относительно SEQ ID NO: 4, валина 16 (т.е. V16) в VH CDR3 относительно SEQ ID NO: 5 и лейцина 9 (т.е. L9) в VH CDR1 относительно SEQ ID НЕТ: 20. В различных вариантах осуществления анти-С5 антитело или его антигенсвязывающий фрагмент, содержащий замену в двух или более положениях из группы, состоящей из пролина 4 (т.е. P4) в VH CDR2, относительно SEQ ID NO: 4, треонина 9 (т.е. T9) в VH CDR2 относительно SEQ ID NO: 4, валина 16 (т.е. V16) в VH CDR3 относительно SEQ ID NO: 5 и лейцина 9 (т.е. L9) в VH CDR1 относительно SEQ ID NO: 20, содержит две или более замены, выбранные из группы, состоящей из L9I/P4M, L9I/P4W, L9I/P4F, L9F/P4M, L9F/P4W, L9F/P4F, L9I/P4M/V16W, L9I/P4W/V16W, L9I/P4F/V16W, L9F/P4M/V16W, L9F/P4W/V16W, L9F/P4F/V16W, L9I/P4M/V16E, L9I/P4W/V16E, L9I/P4F/V16E, L9F/P4M9/V16E/P4W/V16E, L9F/P4F/V16E, L9I/P4M/T9H/V16W, L9I/P4W/T9H/V16W, L9I/P4F/T9H/V16W, L9F/P4M/T9H/V16W, L9F/P416/T9H, L9F/P4F/T9H/V16W, L9I/P4M/T9H/V16E, L9I/P4W/T9H/V16E, L9I/P4F/T9H/V16E, L9F/P4M/T9H/V16E, L9F/P4W/T9H/V16E и L9F/P4F/T9H/V16E.
В некоторых вариантах осуществления антитело представляет собой химерное антитело. В некоторых вариантах осуществления антитело к человеческому С5 может содержать константные области человеческой легкой цепи и человеческой тяжелой цепи в комбинации с последовательностями CDR вариабельной области, представленными в настоящем описании выше. Специалист в данной области сможет приготовить и получить химерное антитело с помощью известных методов замены релевантных доменов конкретных представляющих интерес антител. Такое антитело легко получить путем прививки доменов гетерогенного антитела путем введения одной или более последовательностей CDR, представленных в настоящей заявке. Используя известные рекомбинантные методы, можно получить и приготовить рекомбинантное антитело, содержащее константные области тяжелой и легкой цепи, кодируемые последовательностями нуклеиновых кислот константных областей человеческих тяжелой и легкой цепей; и вариабельные области тяжелой и легкой цепей, содержащие CDR, кодируемые последовательностями нуклеиновых кислот, соответствующими последовательностям CDR, раскрытым в настоящем описании. Специалист в данной области может получить антитело к человеческому C5, содержащее одну или более последовательностей CDR, раскрытых в настоящем описании, где части только легкой цепи или части только тяжелой цепи заменены областями из антитела, принадлежащего другому виду, например человеку. Антитело к человеческому С5, содержащее вариабельные области, имеющие одну или более последовательностей CDR, выбранных из SEQ ID NO: 3-5, 8-11, 14, 17, 20, 23, 26, 29, 34, 37-39, 42-44, 47-49, 52-54, 57, 62, 65 и 68 или их варианта или вариантов, в комбинации со структурными элементами мышиных или немышиных антител вне областей CDR, могут быть получены стандартными методами, известными в данной области техники. В некоторых вариантах осуществления антитела или фрагменты антител дополнительно гуманизируют с помощью известных в данной области методов.
В некоторых вариантах осуществления анти-С5 антитело включает антитело, имеющее по меньшей мере примерно 85% (например, по меньшей мере примерно 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100%) идентичности аминокислотной последовательности с раскрытой в настоящем описании последовательностью CDR, приведенной в SEQ ID NO: 3-5, 8-11, 14, 17, 20, 23, 26, 29, 34, 37-39, 42-44, 47-49, 52-54, 57, 62, 65 и 68.
В одном из вариантов осуществления настоящее изобретение относится к анти-С5 антителу, имеющему последовательности CDR, имеющие по меньшей мере примерно 85% (например, по меньшей мере примерно любую из 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100%) идентичности с последовательностями CDR, раскрытыми в настоящем описании выше. В одном из вариантов осуществления антитело к человеческому C5 имеет вариабельную область тяжелой цепи (vH) и вариабельную область легкой цепи (vL), причем vH область имеет аминокислотную последовательность, которая имеет более примерно 90% (например, более примерно 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100%) идентичности последовательности с одной из последовательностей, выбранных из SEQ ID NO: 2, 19, 22, 28, 36, 41, 46, 51, 56, 59, 64, 67 и 70, и причем vL область имеет аминокислотную последовательность, которая имеет более примерно 90% (например, более примерно 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100%) идентичности последовательности с одной из последовательностей, выбранных из SEQ ID NO: 7, 13, 16, 17, 25 и 31.
В некоторых вариантах осуществления антитело или фрагмент антитела модифицированы. В некоторых вариантах осуществления модификации включают слияние антитела или его антигенсвязывающего фрагмента с частями другого белка или фрагмента белка. В некоторых вариантах осуществления антитело или его фрагмент по изобретению модифицированы для увеличения периода полувыведения из кровотока in vivo. Например, для стабилизации антитела in vivo фрагмент антитела может быть слит с молекулой FcRn, которая также известна как неонатальный Fc-рецептор. (Nature Reviews Immunology 7:715-725). В некоторых вариантах осуществления антитело или его антигенсвязывающий фрагмент конъюгирован (например, слит) с эффекторной молекулой и/или другим нацеливающим фрагментом (таким как антитело или фрагмент антитела, распознающий другую молекулу, другой антиген или другой эпитоп).
Специалист в данной области сможет получить одноцепочечный вариабельный фрагмент (scFv), связывающийся с человеческим C5, содержащий по меньшей мере одну специфическую последовательность CDR, выбранную из SEQ ID NO: 3-5, 8-11, 14, 17, 20, 23, 26, 29, 34, 37-39, 42-44, 47-49, 52-54, 57, 62, 65 и 68 или их варианта или вариантов. ScFv может содержать последовательности вариабельной области тяжелой цепи, приведенные в SEQ ID NO: 3-5, 17, 20, 26, 34, 37-39, 42-44, 47-49, 52-54, 57, 62, 65 и 68, или их вариант или варианты, и вариабельные области легкой цепи, приведенные в SEQ ID NO: 8-11, 14, 23 и 29, или их вариант или варианты. Последовательности CDR, включенные в scFv, имеющие по меньшей мере примерно 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности аминокислотной последовательности с последовательностями CDR, приведенными в настоящем описании, входят в объем настоящего изобретения.
В некоторых вариантах осуществления выделенное антитело связывается с человеческим C5, причем антитело связывается с эпитопом человеческого C5. В некоторых вариантах осуществления антитело к человеческому C5 по изобретению представляет собой антитело, которое связывается со специфическим эпитопом человеческого C5. В некоторых вариантах осуществления эпитоп включает по меньшей мере одну аминокислоту в α-цепи C5. В некоторых вариантах осуществления эпитоп включает по меньшей мере одну аминокислоту в β-цепи C5.
Скрининговые анализы
Настоящее изобретение находит применение в различных скрининговых анализах, включая определение, может ли анти-С5 антитело-кандидат ингибировать активность комплемента.
В некоторых вариантах осуществления уровень активности комплемента в присутствии анти-С5 антитела-кандидата сравнивают с активностью комплемента, детектируемой в положительном контроле сравнения. Положительный контроль сравнения включает активацию комплемента в отсутствие добавленного тестируемого соединения. В некоторых вариантах осуществления анти-С5 антитело-кандидат идентифицируют как ингибитор комплемента, когда активность комплемента в присутствии анти-С5 антитела-кандидата составляет менее примерно 70% активности комплемента, детектируемой в положительном контроле сравнения; это соответствует более чем примерно 30% ингибирования активности комплемента в присутствии тестируемого соединения. В других вариантах осуществления анти-С5 антитело-кандидат идентифицируют как ингибитор комплемента, когда активность комплемента в присутствии анти-С5 антитела-кандидата составляет менее примерно 80% активности комплемента, детектируемой в положительном контроле сравнения; это соответствует более чем примерно 20% ингибирования активности комплемента в присутствии тестируемого соединения. В других вариантах осуществления анти-С5 антитело-кандидат идентифицируют как ингибитор комплемента, когда активность комплемента в присутствии анти-C5 антитела-кандидата составляет менее примерно 90% активности комплемента, детектируемой в положительном контроле сравнения; это соответствует более чем примерно 10% ингибирования активности комплемента в присутствии тестируемого соединения. В некоторых вариантах осуществления уровень ингибирования комплемента анти-C5 антителом-кандидатом сравнивают с уровнем ингибирования, детектируемым в отрицательном контроле сравнения.
В настоящем изобретении можно применять методы иммуноанализа различных форматов, включая конкурентный и неконкурентный формат иммуноанализа, анализы захвата антигена, сэндвич-анализы с двумя антителами и сэндвич-анализы с тремя антителами (Self et al., 1996, Curr. Opin. Biotechnol. 7:60-65). Изобретение не следует рассматривать как ограниченное каким-либо одним типом известного или ранее неизвестного анализа, при условии, что анализ позволяет обнаруживать ингибирование комплемента.
В способах по настоящему изобретению применимы иммуноферментные анализы (ELISA). Для использования в способе по настоящему изобретению фермент, такой как, помимо прочего, пероксидаза хрена (HRP), щелочная фосфатаза, бета-галактозидаза или уреаза, может быть связан, например, с анти-С5 антителом или со вторичным антителом. Можно использовать систему обнаружения на основе пероксидазы хрена, например, с хромогенным субстратом тетраметилбензидином (TMB), который дает растворимый продукт в присутствии пероксида водорода, детектируемый при 450 нм. Другие удобные фермент-связанные системы включают, например, систему обнаружения щелочной фосфатазы, которую можно использовать с хромогенным субстратом п-нитрофенилфосфатом с получением растворимого продукта, легко детектируемого при 405 нм. Аналогичным образом, можно использовать систему обнаружения бета-галактозидазы с хромогенным субстратом о-нитрофенил-бета-D-галактопиранозид (ONPG) с получением растворимого продукта, детектируемого при 410 нм. В качестве альтернативы можно использовать систему обнаружения уреазы с таким субстратом, как мочевина-бромкрезоловый пурпурный (Sigma Immunochemicals, St. Louis, MO). Подходящие фермент-связанные первичные и вторичные антитела можно получить из любого количества коммерческих источников.
Для обнаружения ингибирования терминального пути комплемента также можно использовать хемилюминесцентное детектирование. Хемилюминесцентные вторичные антитела можно получить из любого числа коммерческих источников.
Флуоресцентное детектирование также полезно для детектирования ингибирования терминальных компонентов комплемента. Подходящие флуорохромы включают, без ограничения, DAPI, флуоресцеин, Hoechst 33258, R-фикоцианин, B-фикоэритрин, R-фикоэритрин, родамин, техасский красный и антитела, меченные лиссамином, флуоресцеином или родамином.
В способах по настоящему изобретению также можно использовать радиоиммуноанализы (RIA). Такие анализы хорошо известны в данной области и описаны, например, у Brophy et al. (1990, Biochem. Biophys. Res. Comm. 167:898-903) и Guechot et al. (1996, Clin. Chem. 42:558-563). Радиоиммуноанализы проводят, например, используя меченные йодом-125 первичные или вторичные антитела (Harlow et al., см. выше, 1999).
Сигнал, испускаемый детектируемым антителом, анализируют, например, с помощью спектрофотометра для детектирования цвета хромогенного субстрата; счетчик излучения для детектирования излучения, такой как счетчик гамма-излучения для детектирования йода-125; или флуорометр для детектирования флуоресценции в присутствии света определенной длины волны. Если используется фермент-связанный анализ, количественный анализ выполняют с помощью спектрофотометра. Понятно, что анализы по изобретению можно выполнять вручную или, при желании, можно автоматизировать, и что сигнал, испускаемый из множества образцов, можно детектировать одновременно во многих коммерчески доступных системах.
Способы по изобретению также включают использование иммуноанализов на основе капиллярного электрофореза (CEIA), которые при желании можно автоматизировать. Иммуноанализы также можно использовать в сочетании с лазерно-индуцированной флуоресценцией, описанной, например, в Schmalzing et al. (1997, Electrophoresis 18:2184-2193) и Bao (1997, J. Chromatogr. B. Biomed. Sci. 699:463-480). В соответствии со способами по настоящему изобретению также можно использовать иммуноанализы на основе липосом, такие как проточные иммуноанализы на основе липосом и липосомальные иммуносенсоры, (Rongen et al., 1997, J. Immunol. Methods 204:105-133).
Для определения уровня ингибирования терминальных компонентов комплемента в способах по настоящему изобретению также можно использовать количественный вестерн-блоттинг. Для количественного определения, используя вестерн-блоты, используют хорошо известные методы, такие как сканирующая денситометрия (Parra et al., 1998, J. Vasc. Surg. 28: 669-675).
Способы введения
Способы по настоящему изобретению включают введение терапевтически эффективного количества по меньшей мере одного анти-С5 антитела или его связывающего фрагмента (такого как любое из антител или их фрагментов, представленных в настоящем описании) человеку, у которого установлено наличие комплемент-опосредованного заболевания или расстройства. В одном из вариантов осуществления индивидуум является млекопитающим, имеющим систему комплемента. В одном из вариантов осуществления индивидуум является человеком. В различных вариантах осуществления по меньшей мере одно анти-С5 антитело или его связывающий фрагмент вводят местно, регионально или системно.
В различных вариантах осуществления заболевание или расстройство по меньшей мере выбирают из группы, состоящей из: дегенерации желтого пятна (MD), возрастной дегенерации желтого пятна (AMD), ишемического реперфузионного повреждения, артрита, ревматоидного артрита, астмы, аллергической астмы, волчанки, язвенного колита, инсульта, синдрома системного воспалительного ответа в послеоперационном периоде, астмы, аллергической астмы, хронической обструктивной болезни легких (COPD), синдрома пароксизмальной ночной гемоглобинурии (PNH), миастении гравис, оптического нейромиелита (NMO), рассеянного склероза, задержки функции трансплантата на фоне антитело-опосредованного отторжения, атипичного гемолитико-уремического синдрома (aHUS), окклюзии центральной вены сетчатки (CRVO), окклюзии центральной артерии сетчатки (CRAO), буллезного эпидермолиза, сепсиса, трансплантации органов, воспаления (включая, помимо прочего, воспаление, связанное с операцией в условиях искусственного кровообращения и диализом почек), гломерулопатии C3, мембранозной нефропатии, нефропатии IgA, гломерулонефрита (включая, помимо прочего, гломерулонефрит, опосредованный цитоплазматическими антителами против нейтрофилов (ANCA), волчаночный нефрит и их комбинацию), ANCA-опосредованного васкулита, HUS, индуцированного Шига-токсином, и потери беременности, вызванной антифосфолипидными антителами, или любых их комбинаций. В некоторых вариантах осуществления комплемент-опосредованное заболевание представляет собой гломерулопатию C3. В некоторых вариантах осуществления комплемент-опосредованное заболевание представляет собой дегенерацию желтого пятна, такую как возрастная дегенерация желтого пятна. В одном варианте осуществления введение анти-С5 антитела ингибирует образование белка C5a или C5b. В некоторых вариантах осуществления композиции и способы по изобретению полезны для лечения субъекта, включая субъектов, страдающих PNH, которые не реагируют на лечение экулизумабом. В качестве неограничивающего примера, некоторые субъекты могут нести мутацию в альфа-цепи C5, которая может сделать их устойчивыми к лечению экулизумабом (см. Genetic variants in C5 and poor response to eculizumab (Nishimura J, et al., N Engl. J Med.2014, Feb 13; 370 (7):632-9)).
Способы по настоящему изобретению могут включать введение по меньшей мере одного анти-С5 антитела или его связывающего фрагмента, но настоящее изобретение никоим образом не следует истолковывать как ограниченное раскрытыми в настоящем описании анти-С5 антителами, а скорее следует толковать как охватывающее любые анти-С5 антитела, известные и неизвестные, которые ослабляют или уменьшают активацию комплемента.
Способ по изобретению включает введение терапевтически эффективного количества по меньшей мере одного анти-С5 антитела или его связывающего фрагмента индивиду, причем композиция по настоящему изобретению содержит по меньшей мере одно анти-С5 антитело или его связывающий фрагмент, либо отдельно или в комбинации по меньшей мере с одним другим терапевтическим агентом. Изобретение можно использовать в комбинации с другими способами лечения, такими как, например, противовоспалительная терапия и т.п. Примеры противовоспалительной терапии, которую можно использовать в комбинации со способами по изобретению, включают, например, терапию, в которой используются стероидные препараты, а также способы лечения, в которых используются нестероидные препараты.
Способ по настоящему изобретению включает введение субъекту терапевтически эффективного количества анти-С5 антитела или его антигенсвязывающего фрагмента. В некоторых вариантах осуществления изобретение охватывает способ лечения заболеваний, связанных с C5, включая нарушение регуляции передачи сигналов комплемента, путем введения терапевтически эффективного количества антитела по изобретению или терапевтически эффективного количества его фрагмента, такого, что у субъекта происходит уменьшение образование C5a или C5b или MAC. В некоторых вариантах осуществления изобретение охватывает способ лечения заболеваний, связанных с C5, включая нарушение регуляции передачи сигнала комплемента, путем введения терапевтически эффективного количества антитела или фрагмента антитела. В некоторых вариантах осуществления изобретение включает способ лечения заболеваний, связанных с C5, включая нарушение регуляции передачи сигнала комплемента, путем введения субъекту эффективного количества антитела, фрагмента антитела, полипептида, пептида, конъюгированного пептида, такого, что у субъекта происходит уменьшение активации пути комплемента. В некоторых вариантах осуществления способ лечения включает введение субъекту системно эффективной дозы антитела или фрагмента антитела, в результате чего у субъекта происходит системное уменьшение образования C5a или C5b или MAC.
Фармацевтические композиции, полезные для практического применения изобретения, можно вводить для доставки дозы, составляющей по меньшей мере примерно 1 нг/кг, по меньшей мере примерно 5 нг/кг, по меньшей мере примерно 10 нг/кг, по меньшей мере примерно 25 нг/кг, по меньшей мере примерно 50 нг/кг, по меньшей мере примерно 100 нг/кг, по меньшей мере примерно 500 нг/кг, по меньшей мере примерно 1 мкг/кг, по меньшей мере примерно 5 мкг/кг, по меньшей мере примерно 10 мкг/кг, по меньшей мере примерно 25 мкг/кг, по меньшей мере примерно 50 мкг/кг, по меньшей мере примерно 100 мкг/кг, по меньшей мере примерно 500 мкг/кг, по меньшей мере примерно 1 мг/кг, по меньшей мере примерно 5 мг/кг, по меньшей мере примерно 10 мг/кг, по меньшей мере примерно 25 мг/кг, по меньшей мере примерно 50 мг/кг, по меньшей мере примерно 100 мг/кг, по меньшей мере примерно 200 мг/кг, по меньшей мере примерно 300 мг/кг, по меньшей мере примерно 400 мг/кг и по меньшей мере примерно 500 мг/кг веса тела субъекта. В одном из вариантов осуществления изобретения вводят дозу, которая приводит к концентрации анти-C5 антитела по настоящему изобретению в организме индивидуума, составляющей по меньшей мере примерно 1 пМ, по меньшей мере примерно 10 пМ, по меньшей мере примерно 100 пМ, по меньшей мере примерно 1 нМ, при по меньшей мере примерно 10 нМ, по меньшей мере примерно 100 нМ, по меньшей мере примерно 1 мкМ, по меньшей мере примерно 2 мкМ, по меньшей мере примерно 3 мкМ, по меньшей мере примерно 4 мкМ, по меньшей мере примерно 5 мкМ, по меньшей мере примерно 6 мкМ, по меньшей мере примерно 7 мкМ, по меньшей мере примерно 8 мкМ, по меньшей мере примерно 9 мкМ и, по меньшей мере примерно 10 мкМ. В другом варианте осуществления изобретение предусматривает введение дозы, которая приводит к концентрации анти-C5-антитела по настоящему изобретению в плазме индивидуума, находящейся в пределах от по меньшей мере примерно 1 пМ, по меньшей мере примерно 10 пМ, по меньшей мере примерно 100 пМ, по меньшей мере примерно 1 нМ, по меньшей мере примерно 10 нМ, по меньшей мере примерно 100 нМ, по меньшей мере примерно 1 мкМ, по меньшей мере примерно 2 мкМ, по меньшей мере примерно 3 мкМ, по меньшей мере примерно 4 мкМ, по меньшей мере примерно 5 мкМ, по меньшей мере примерно 6 мкМ, по меньшей мере примерно 7 мкМ, по меньшей мере примерно 8 мкМ, по меньшей мере примерно 9 мкМ до по меньшей мере примерно 10 мкМ.
В некоторых вариантах осуществления фармацевтические композиции, полезные для практического применения изобретения, можно вводить для доставки дозы, составляющей не более примерно 1 нг/кг, не более примерно 5 нг/кг, не более примерно 10 нг/кг, не более примерно 25 нг/кг, не более примерно 50 нг/кг, не более примерно 100 нг/кг, не более примерно 500 нг/кг, не более примерно 1 мкг/кг, не более примерно 5 мкг/кг, не более примерно 10 мкг/кг, не более примерно 25 мкг/кг, не более примерно 50 мкг/кг, не более примерно 100 мкг/кг, не более примерно 500 мкг/кг, не более примерно 1 мг/кг, не более примерно 5 мг/кг, не более примерно 10 мг/кг, не более примерно 25 мг/кг, не более примерно 50 мг/кг, не более примерно 100 мг/кг, не более примерно 200 мг/кг, не более примерно 300 мг/кг, не более примерно 400 мг/кг и не более примерно 500 мг/кг веса тела субъекта. В одном из вариантов осуществления изобретения вводят дозу, которая приводит к концентрации анти-C5 антитела по настоящему изобретению в организме индивидуума, составляющей не более примерно 1 пМ, не более примерно 10 пМ, не более примерно 100 пМ, не более примерно 1 нМ, не более примерно 10 нМ, не более примерно 100 нМ, не более примерно 1 мкМ, не более примерно 2 мкМ, не более примерно 3 мкМ, не более примерно 4 мкМ, не более более примерно 5 мкМ, не более примерно 6 мкМ, не более примерно 7 мкМ, не более примерно 8 мкМ, не более примерно 9 мкМ и не более примерно 10 мкМ. В другом варианте осуществления изобретение предусматривает введение дозы, которая приводит к концентрации анти-C5 антитела по настоящему изобретению в плазме индивидуума, находящейся в пределах от не более примерно 1 пМ, не более примерно 10 пМ, не более примерно 100 пМ, не более примерно 1 нМ, не более примерно 10 нМ, не более примерно 100 нМ, не более примерно 1 мкМ, не более примерно 2 мкМ, не более примерно 3 мкМ, не более примерно 4 мкМ, не более 5 мкМ, не более 6 мкМ, не более 7 мкМ, не более 8 мкМ, не более 9 мкМ до не более 10 мкМ. Также предусмотрены диапазоны доз между любыми из описанных здесь доз.
В некоторых вариантах осуществления обычно дозировки, которые можно вводить субъекту в способе по изобретению, находятся в диапазоне от 0,5 мкг до примерно 50 мг на килограмм веса тела субъекта. При этом, точная вводимая доза будет меняться в зависимости от любого количества факторов, включая, без ограничения, тип субъекта и тип болезненного состояния, подлежащего лечению, возраста субъекта и путь введения. В некоторых вариантах осуществления доза соединения будет меняться в пределах от примерно 1 мкг до примерно 10 мг на килограмм веса тела субъекта. В других вариантах осуществления доза будет меняться от примерно 3 мкг до примерно 1 мг на килограмм веса тела субъекта.
Антитело можно вводить субъекту несколько раз в сутки или реже, например, один раз в сутки, два раза в сутки, три раза в сутки, один раз в неделю, два раза в неделю, три раза в неделю, один раз каждые две недели, два раза в две недели, три раза каждые две недели, один раз в месяц, два раза в месяц, три раза в месяц или даже реже, например, один раз в несколько месяцев или даже один или несколько раз в год или реже. Частота приема дозы будет очевидна для квалифицированного специалиста и будет зависеть от любого количества факторов, таких как, без ограничения, типа и тяжести заболевания, подлежащего лечению, типа и возраста пациента и т.д. Составы фармацевтических композиций могут быть приготовлены любым способом, известным или разработанным в дальнейшем в области фармакологии. Как правило, такие способы приготовления включают этап объединения активного ингредиента с носителем или одним или несколькими другими вспомогательными ингредиентами, и затем, если необходимо или желательно, этап придания формы или упаковки продукта в требуемую однодозовую или многодозовую лекарственную форму.
Хотя описание фармацевтических композиций, представленных в настоящем описании, в основном направлено на фармацевтические композиции, которые подходят для этичного введения людям, квалифицированному специалисту будет понятно, что такие композиции обычно подходят для введения субъектам всех видов. Модификация подходящих для введения людям фармацевтических композиций, позволяющая сделать эти композиции подходящими для введения различным субъектам, хорошо известна, и ветеринар-фармаколог с обычной квалификацией может разработать и осуществить такую модификацию путем обычного экспериментирования, при необходимости. Индивидуумы, которым предполагается введение фармацевтических композиций по изобретению, включают, помимо прочего, людей и других приматов, млекопитающих, включая коммерчески значимых млекопитающих, таких как нечеловеческие приматы, крупный рогатый скот, свиньи, лошади, овцы, кошки и собаки.
Фармацевтические композиции, применимые в способах по настоящему изобретению, могут быть приготовлены, упакованы или проданы в составах, подходящих для офтальмологического, перорального, ректального, вагинального, парентерального, местного, легочного, интраназального, буккального, внутриглазного, интравитреального, внутримышечного, внутрикожного и внутривенного способа введения. Другие предполагаемые составы включают проектируемые наночастицы, липосомальные препараты, «запечатанные» (resealed) эритроциты, содержащие активный ингредиент, и составы на иммунологической основе.
Фармацевтическая композиция по настоящему изобретению может быть приготовлена, упакована или продана оптом, в виде единичной лекарственной формы или в виде множества единичных лекарственных форм. Лекарственная форма представляет собой дискретное количество фармацевтической композиции, содержащей заранее определенное количество активного ингредиента. Количество активного ингредиента, как правило, равно дозе активного ингредиента, которую можно вводить индивидууму, или удобной части такой дозы, такой как, например, половина или одна треть такой дозы.
Относительные количества активного ингредиента, фармацевтически приемлемого носителя и любых дополнительных ингредиентов в фармацевтической композиции по изобретению будут меняться в зависимости от идентичности, размера и состояния пациента, подлежащего лечению, и, кроме того, в зависимости от пути введения композиции. В качестве примера композиция может содержать от 0,1% до 100% (мас./мас.) активного ингредиента. В различных вариантах осуществления композиция содержит по меньшей мере примерно 1%, по меньшей мере примерно 2%, по меньшей мере примерно 3%, по меньшей мере примерно 4%, по меньшей мере примерно 5%, по меньшей мере примерно 6%, по меньшей мере примерно 7%, по меньшей мере примерно 8%, по меньшей мере примерно 9%, по меньшей мере примерно 10%, по меньшей мере примерно 11%, по меньшей мере примерно 12%, по меньшей мере примерно 13%, по меньшей мере примерно 14%, по меньшей мере примерно 15%, по меньшей мере примерно 16%, по меньшей мере примерно 17%, по меньшей мере примерно 18%, по меньшей мере примерно 19%, по меньшей мере примерно 20%, по меньшей мере примерно 21%, по меньшей мере примерно 22%, по меньшей мере примерно 23%, по меньшей мере примерно 24%, по меньшей мере примерно 25%, по меньшей мере примерно 26%, по меньшей мере примерно 27%, по меньшей мере примерно 28%, по меньшей мере примерно 29%, по меньшей мере примерно 30%, по меньшей мере примерно 31%, по меньшей мере примерно 32%, по меньшей мере примерно 33%, по меньшей мере примерно 34%, по меньшей мере примерно 35%, по меньшей мере примерно 36%, по меньшей мере примерно 37%, по меньшей мере примерно 38%, по меньшей мере примерно 39%, по меньшей мере примерно 40%, по меньшей мере примерно 41%, по меньшей мере примерно 42%, по меньшей мере, примерно 43%, по меньшей мере примерно 44%, по меньшей мере, примерно 45%, по меньшей мере примерно 46%, по меньшей мере, примерно 47%, по меньшей мере примерно 48%, по меньшей мере примерно 49%, по меньшей мере примерно 50%, по меньшей мере примерно 51%, по меньшей мере примерно 52%, по меньшей мере примерно 53%, по меньшей мере примерно 54%, по меньшей мере примерно 55%, по меньшей мере примерно 56%, по меньшей мере примерно 57%, по меньшей мере примерно 58%, по меньшей мере примерно 59%, по меньшей мере примерно 60%, по меньшей мере примерно 61%, по меньшей мере примерно 62%, по меньшей мере примерно 63%, по меньшей мере примерно 64%, по меньшей мере примерно 65%, по меньшей мере примерно 66%, по меньшей мере примерно 67%, по меньшей мере примерно 68%, по меньшей мере примерно 69%, по меньшей мере примерно 70%, по меньшей мере примерно 71%, по меньшей мере примерно 72%, по меньшей мере примерно 73%, по меньшей мере примерно 74%, по меньшей мере примерно 75%, по меньшей мере примерно 76%, по меньшей мере примерно 77%, по меньшей мере примерно 78%, по меньшей мере примерно 79%, по меньшей мере примерно 80%, по меньшей мере примерно 81%, по меньшей мере примерно 82%, по меньшей мере примерно 83%, по меньшей мере примерно 84%, по меньшей мере примерно 85%, по меньшей мере примерно 86%, по меньшей мере примерно 87%, по меньшей мере примерно 88%, по меньшей мере примерно 89%, по меньшей мере примерно 90%, по меньшей мере примерно 91%, по меньшей мере примерно 92%, по меньшей мере примерно 93%, по меньшей мере примерно 94%, по меньшей мере примерно 95%, по меньшей мере примерно 96%, по меньшей мере примерно 97%, по меньшей мере примерно 98%, по меньшей мере примерно 99% или по меньшей мере примерно 100% (мас./мас.) активного ингредиента.
В дополнение к активному ингредиенту фармацевтическая композиция по изобретению может дополнительно содержать один или более дополнительных фармацевтически активных агентов.
Составы фармацевтической композиции по изобретению с контролируемым или замедленным высвобождением могут быть получены с помощью общепринятой технологии.
Парентеральное введение фармацевтической композиции включает любой путь введения, характеризующийся созданием физического отверстия в ткани индивидуума и введением фармацевтической композиции через это отверстие в ткани. Парентеральное введение может быть местным, региональным или системным. Таким образом, парентеральное введение включает, без ограничения, введение фармацевтической композиции путем инъекции композиции, путем нанесения композиции через хирургический разрез, путем нанесения композиции через проникающую в ткань нехирургическую рану и т.п. В частности, предполагается, что парентеральное введение включает, без ограничения, внутривенное, внутриглазное, интравитреальное, подкожное, внутрибрюшинное, внутримышечное, внутрикожное, внутригрудинное введение и введение внутрь опухоли.
Составы фармацевтической композиции, подходящие для парентерального введения, включают активный ингредиент, объединенный с фармацевтически приемлемым носителем, таким как стерильная вода или стерильный изотонический солевой раствор. Такие составы могут быть приготовлены, упакованы или проданы в форме, подходящей для болюсного введения или для непрерывного введения. Композиции для инъекций могут быть приготовлены, упакованы или проданы в виде однодозовой лекарственной формы, такой как ампулы, или в виде многодозовых контейнеров, содержащих консервант. Составы для парентерального введения включают, без ограничения, суспензии, растворы, эмульсии в масляных или водных носителях, пасты и имплантируемые составы с замедленным высвобождением или биоразлагаемые составы. Такие составы могут дополнительно включать один или более дополнительных ингредиентов, включая, без ограничения, суспендирующие, стабилизирующие или диспергирующие агенты. В одном из вариантов осуществления составов для парентерального введения активный ингредиент предоставляется в сухом виде (т.е. в виде порошка или гранул) для восстановления подходящим носителем (например, стерильной апирогенной водой) перед парентеральным введением восстановленной композиции.
Фармацевтические композиции могут быть приготовлены, упакованы или проданы в форме стерильной водной или масляной суспензии или раствора для инъекций. Эта суспензия или раствор могут быть составлены в соответствии с известным уровнем техники и могут содержать, помимо активного ингредиента, дополнительные ингредиенты, такие как диспергирующие агенты, смачивающие агенты или суспендирующие агенты. Такие стерильные составы для инъекций могут быть приготовлены с использованием нетоксичного парентерально приемлемого разбавителя или растворителя, такого как, например, вода или 1,3-бутандиол. Другие приемлемые разбавители и растворители включают, без ограничения, раствор Рингера, изотонический раствор хлорида натрия и жирные масла, такие как синтетические моно- или диглицериды. Другие пригодные для парентерального введения составы включают составы, которые содержат активный ингредиент в микрокристаллической форме, в липосомальном препарате или в качестве компонента биоразлагаемых полимерных систем. Композиции для замедленного высвобождения или имплантации могут содержать фармацевтически приемлемые полимерные или гидрофобные материалы, такие как эмульсия, ионообменная смола, труднорастворимый полимер или труднорастворимая соль.
Фармацевтическая композиция по изобретению может быть приготовлена, упакована или продана в составе, подходящем для легочного введения через ротовую полость. Такой состав может содержать сухие частицы, которые содержат активный ингредиент и которые имеют диаметр в диапазоне от примерно 0,5 до примерно 7 нанометров, а в некоторых вариантах осуществления от примерно 1 до примерно 6 нанометров. Такие композиции обычно находятся в форме сухих порошков для введения с помощью устройства, содержащего резервуар для сухого порошка, в который может быть направлен поток пропеллента для диспергирования порошка, или с помощью с самораспыляющего контейнера с растворителем/порошком, такого как устройство, содержащее активный ингредиент, растворенный или суспендированный в низкокипящем пропелленте в герметичном контейнере. В некоторых вариантах осуществления такие порошки содержат частицы, в которых по меньшей мере 98% частиц по массе имеют диаметр более 0,5 нанометров, и по меньшей мере 95% частиц по количеству имеют диаметр менее 7 нанометров. В некоторых вариантах осуществления по меньшей мере 95% частиц по массе имеют диаметр более 1 нанометра и по меньшей мере 90% частиц по количеству имеют диаметр менее 6 нанометров. В некоторых вариантах осуществления композиции сухого порошка включают разбавитель в виде твердого мелкодисперсного порошка, такого как сахар, и обычно предоставляются в виде единичной дозы.
Низкокипящие пропелленты обычно включают жидкие пропелленты, имеющие точку кипения ниже 65°F (18,3°С) при атмосферном давлении. Обычно пропеллент может составлять от 50 до 99,9% (мас./мас.) композиции, и активный ингредиент может составлять от 0,1 до 20% (мас./мас.) композиции. Пропеллент может дополнительно содержать дополнительные ингредиенты, такие как жидкое неионогенное или твердое анионное поверхностно-активное вещество или твердый разбавитель (в некоторых вариантах осуществления с размером частиц того же порядка, что и частицы, содержащие активный ингредиент).
Фармацевтические композиции по изобретению, составленные для доставки в легкие, также могут содержать активный ингредиент в форме капель раствора или суспензии. Такие составы могут быть приготовлены, упакованы или проданы в виде водных или разбавленных спиртовых растворов или суспензий, необязательно стерильных, содержащих активный ингредиент, и могут быть удобно введены с помощью любого небулайзера или распыляющего устройства. Такие составы могут дополнительно содержать один или более дополнительных ингредиентов, включая, помимо прочего, ароматизатор, такой как сахарин натрия, летучее масло, буферный агент, поверхностно-активный агент или консервант, такой как метилгидроксибензоат. В некоторых вариантах осуществления капли, полученные при таком способе введения, имеют средний диаметр в диапазоне от примерно 0,1 до примерно 200 нанометров.
Составы также применимы для интраназальной доставки фармацевтической композиции по изобретению.
Другой состав, подходящий для назального введения, представляет собой крупнозернистый порошок, содержащий активный ингредиент и имеющий средний размер частиц от примерно 0,2 до 500 микрометров. Такой состав вводят таким же способом, как нюхательный табак, т.е. путем быстрого вдыхания через носовой проход из контейнера с порошком, который держат близко к ноздрям.
Составы, подходящие для назального введения, могут, например, содержать от примерно 0,1% (мас./мас.) до 100% (мас./мас.) активного ингредиента и могут дополнительно содержать один или более дополнительных ингредиентов.
Фармацевтическая композиция по изобретению может быть приготовлена, упакована или продана в составе, подходящем для буккального введения. Такие составы могут быть, например, в форме таблеток или лепешек, изготовленных с помощью обычных методов, и могут, например, содержать от 0,1 до 20% (мас./мас.) активного ингредиента, остаток включает перорально растворимую или разлагаемую композицию и, необязательно, один или более дополнительных ингредиентов. Альтернативно, составы, подходящие для буккального введения, могут включать порошок или аэрозольный или распыленный раствор или суспензию, содержащие активный ингредиент. В некоторых вариантах осуществления такие порошкообразные, аэрозольные или аэрозольные составы при диспергировании имеют средний размер частиц или капель в диапазоне от примерно 0,1 до примерно 200 нанометров и могут дополнительно содержать один или несколько дополнительных ингредиентов.
Используемые в настоящем описании «дополнительные ингредиенты» включают, без ограничения, одно или более из следующего: наполнители; поверхностно-активные вещества; диспергирующие агенты; инертные разбавители; гранулирующие агенты и разрыхлители; связующие агенты; лубриканты; подсластители; ароматизаторы; красители; консерванты; физиологически разлагаемые композиции, такие как желатин; водные носители и растворители; масляные носители и растворители; суспендирующие агенты; диспергирующие или смачивающие агенты; эмульгаторы, деэмульгаторы; буферы; соли; загустители; наполнители; эмульгаторы; антиоксиданты; антибиотики; противогрибковые средства; стабилизаторы; и фармацевтически приемлемые полимерные или гидрофобные материалы. Другие «дополнительные ингредиенты», которые могут быть включены в фармацевтические композиции по изобретению, известны в данной области и описаны, например, в Remington's Pharmaceutical Sciences (1985, Genaro, ed., Mack Publishing Co., Easton, PA), включенной в настоящее описание в качестве ссылки.
Клетки, продуцирующие антитела и их антигенсвязывающие фрагменты
В некоторых вариантах осуществления изобретение относится к клетке или клеточной линии (например, клетке-хозяину), которая продуцирует по меньшей мере одно из анти-С5 антител или антигенсвязывающих фрагментов, представленных в настоящем описании. В одном из вариантов осуществления клетка или клеточная линия представляет собой генетически модифицированную клетку, которая продуцирует по меньшей мере одно из анти-C5-антител или антигенсвязывающих фрагментов, представленных в настоящем описании. В одном из вариантов осуществления клетка или клеточная линия представляет собой гибридому, которая продуцирует по меньшей мере одно из анти-C5 антител или антигенсвязывающих фрагментов, представленных в настоящем описании.
Гибридные клетки (гибридомы) обычно получают из массовых слияний между мышиными спленоцитами, которые сильно обогащены B-лимфоцитами, и миеломными «клетками-партнерами по слиянию» (Alberts et al., Molecular Biology of the Cell (Garland Publishing, Inc. 1994); Harlow et al., Antibodies. A Laboratory Manual (Cold Spring Harbor Laboratory, Cold Spring Harbor, 1988). Слитые клетки впоследствии распределяют по пулам, которые можно анализировать на предмет продуцирования антител с требуемой специфичностью. Пулы, которые в тесте дают положительный результат, можно делить дальше до тех пор, пока не будут идентифицированы клоны отдельных клеток, которые продуцируют антитела с требуемой специфичностью. Антитела, продуцируемые такими клонами, называются моноклональными антителами.
Также предусмотрены нуклеиновые кислоты, кодирующие любое из антител или фрагментов антител, раскрытых в настоящем описании, а также векторы, содержащие нуклеиновые кислоты. Таким образом, антитела и фрагменты по изобретению могут быть получены путем экспрессии нуклеиновой кислоты в клетке или клеточной линии, такой как клеточные линии, обычно используемые для экспрессии рекомбинантных или гуманизированных иммуноглобулинов. Таким образом, антитела и фрагменты по изобретению также могут быть получены путем клонирования нуклеиновых кислот в один или более векторов экспрессии и трансформации вектора в клеточную линию, такую как клеточные линии, обычно используемые для экспрессии рекомбинантных или гуманизированных иммуноглобулинов.
Гены, кодирующие тяжелые и легкие цепи иммуноглобулинов или их фрагменты, могут быть сконструированы в соответствии с методами, включая, без ограничения, полимеразную цепную реакцию (ПЦР), известную в данной области (см., например, Sambrook et al., Molecular Cloning: A Laboratory Manual, 2nd ed., Cold Spring Harbor, N.Y., 1989; Berger & Kimmel, Methods in Enzymology, Vol. 152: Guide to Molecular Cloning Techniques, Academic Press, Inc., San Diego, Calif., 1987; Co et al., 1992, J. Immunol. 148:1149). Например, гены, кодирующие тяжелые и легкие цепи или их фрагменты, могут быть клонированы из геномной ДНК клетки, секретирующей антитела, или продуцируют кДНК обратной транскрипцией клеточной РНК. Клонирование выполняют обычными методами, включая использование праймеров для ПЦР, которые гибридизуют с последовательностями, фланкирующими или перекрывающими гены или сегменты генов, подлежащих клонированию.
Нуклеиновые кислоты, кодирующие антитело по изобретению или тяжелую цепь, или легкую цепь, или их фрагменты, могут быть получены и использованы в соответствии с методами рекомбинантных нуклеиновых кислот для получения специфического иммуноглобулина, цепи иммуноглобулина или его фрагмента или варианта в различных клетках-хозяевах или в системе трансляции in vitro. Например, нуклеиновые кислоты, кодирующие антитело или его фрагменты, могут быть помещены в подходящие векторы прокариот или эукариот, например векторы экспрессии, и введены в подходящую клетку-хозяин соответствующим методом, например трансформацией, трансфекцией, электропорацией, инфекцией таким образом, чтобы нуклеиновая кислота была функционально связана с одним или более элементами контроля экспрессии, например, в векторе или была интегрирована в геном клетки-хозяина.
В некоторых вариантах осуществления тяжелая и легкая цепи или их фрагменты могут быть введены в два разных вектора экспрессии, которые можно использовать для котрансфекции клетки-реципиента. В некоторых вариантах осуществления каждый вектор может содержать два или более селектируемых гена, один для селекции в бактериальной системе и один для селекции в эукариотической системе. Эти векторы делают возможным продуцирование и амплификацию генов в бактериальной системе, и последующую котрансфекцию эукариотических клеток и отбор котрансфицированных клеток. Процедуру отбора можно использовать для отбора для экспрессии нуклеиновых кислот антител, введенных в эукариотическую клетку в двух разных ДНК-векторах.
Альтернативно, нуклеиновые кислоты, кодирующие тяжелую и легкую цепи или их фрагменты, могут быть экспрессированы из одного вектора. Хотя легкая и тяжелая цепи кодируются отдельными генами, их можно соединить с помощью рекомбинантных методов. Например, два полипептида могут быть соединены синтетическим линкером, который позволяет им существовать в виде одной белковой цепи, в которой участки VL и VH образуют пары с образованием одновалентных молекул (известных как одноцепочечный Fv (scFv); см., например, Bird et al., 1988, Science 242:423-426; и Huston et al., 1988, Proc. Natl. Acad. Sci. USA 85:5879-5883).
Изобретение относится к выделенной молекуле нуклеиновой кислоты, содержащей последовательность нуклеиновой кислоты, кодирующую тяжелую цепь и/или легкую цепь, а также их фрагменты. Молекула нуклеиновой кислоты, содержащая последовательности, кодирующие как легкую, так и тяжелую цепи или их фрагменты, может быть сконструирована таким образом, чтобы она содержала синтетическую сигнальную последовательность для секреции антитела или фрагмента при продуцировании в клетке. Кроме того, молекула нуклеиновой кислоты может содержать специфические связи ДНК, которые позволяют вставлять последовательности других антител и поддерживать трансляционную рамку считывания, чтобы не изменять аминокислоты, обычно присутствующие в последовательностях антител.
В соответствии с настоящим изобретением последовательности нуклеиновых кислот, кодирующие антитело, могут быть вставлены в соответствующий вектор экспрессии. В различных вариантах осуществления вектор экспрессии содержит необходимые элементы для транскрипции и трансляции вставленной нуклеиновой кислоты, кодирующей антитело, для получения молекул рекомбинантной ДНК, которые направляют экспрессию последовательностей антител для образования антитела или его фрагмента.
Нуклеиновые кислоты, кодирующие антитела или их фрагменты, могут быть подвергнуты различным методам получения рекомбинантных нуклеиновых кислот, известным специалистам в данной области, таким как сайт-направленный мутагенез.
Для экспрессии нуклеиновых кислот в клетке можно использовать различные методы. Нуклеиновые кислоты можно клонировать в несколько типов векторов. Однако настоящее изобретение не следует рассматривать как ограниченное каким-либо конкретным вектором. Напротив, настоящее изобретение следует рассматривать как охватывающее широкий спектр векторов, которые являются легко доступными и/или известными в данной области. Например, нуклеиновая кислота по изобретению может быть клонирована в вектор, включая, без ограничения, плазмиду, фагмиду, производное фага, вирус животного и космиду. Векторы, представляющие особый интерес, включают векторы экспрессии, векторы репликации, векторы генерации зондов и векторы секвенирования.
В конкретных вариантах осуществления вектор экспрессии выбирают из группы, состоящей из вирусного вектора, бактериального вектора и вектора из клеток млекопитающих. Существуют многочисленные системы векторов экспрессии, которые включают, по меньшей мере, часть или все композиции, описанные выше. Для получения полинуклеотидов или родственных им полипептидов с настоящим изобретением могут быть использованы системы на основе векторов прокариот и/или эукариот. Многие такие системы являются коммерчески широкодоступными.
Технология вирусных векторов хорошо известна в данной области и описана, например, Sambrook et al. (2012) и Ausubel et al. (1999), а также в других руководствах по вирусологии и молекулярной биологии. Вирусы, которые можно использовать в качестве векторов, включают, без ограничения, ретровирусы, аденовирусы, аденоассоциированные вирусы, вирусы герпеса и лентивирусы. В некоторых вариантах осуществления для экспрессии требуемой нуклеиновой кислоты используют вектор вируса мышиных стволовых клеток (MSCV). Было продемонстрировано, что векторы MSCV эффективно экспрессируют требуемые нуклеиновые кислоты в клетках. Однако изобретение не следует ограничивать только использованием вектора MSCV, напротив, изобретение включает любой способ ретровирусной экспрессии. Другими примерами вирусных векторов являются векторы на основе вируса мышиного лейкоза Молони (MoMuLV) и HIV. В некоторых вариантах осуществления подходящий вектор содержит точку начала репликации, функционирующую по меньшей мере в одном организме, промоторную последовательность, удобные сайты для эндонуклеаз рестрикции и один или более селектируемых маркеров. (См., например, WO 01/96584; WO 01/29058; и патент США №6,326,193).
Для модуляции частоты инициации транскрипции можно использовать дополнительные регуляторные элементы, например энхансеры. Промотор может быть естественным образом связан с геном или последовательностью нуклеиновой кислоты, что может быть получено путем выделения 5’-некодирующих последовательностей, расположенных выше кодирующего сегмента и/или экзона. Такой промотор можно назвать «эндогенным». Точно так же энхансер может быть энхансером, естественным образом связанным с последовательностью нуклеиновой кислоты и расположенным ниже или выше этой последовательности. Альтернативно, определенные преимущества можно получить путем размещения кодирующего сегмента нуклеиновой кислоты под контролем рекомбинантного или гетерологичного промотора, который относится к промотору, обычно не связанному с последовательностью нуклеиновой кислоты в ее естественном окружении. Рекомбинантный или гетерологичный энхансер также относится к энхансеру, обычно не связанному с последовательностью нуклеиновой кислоты в ее естественном окружении. Такие промоторы или энхансеры могут включать промоторы или энхансеры других генов, и промоторы или энхансеры, выделенные из любых других прокариотических, вирусных или эукариотических клеток, и промоторы или энхансеры, не «встречающиеся в природе», например, содержащие различные элементы различных регуляторных областей транскрипции и/или мутации, изменяющие экспрессию. Помимо получения путем синтеа последовательностей нуклеиновых кислот промоторов и энхансеров, последовательности могут быть получены с помощью технологии рекомбинантного клонирования и/или амплификации нуклеиновых кислот, включая ПЦР, в связи с композициями, раскрытыми в настоящем описании (патент США №4,683,202, патент США № 5,928,906). Кроме того, предусматривается возможность использования контрольных последовательностей, которые управляют транскрипцией и/или экспрессией последовательностей в неядерных органеллах, таких как митохондрии, хлоропласты и т.п.
Естественно, важно использовать промотор и/или энхансер, который эффективно управляет экспрессией сегмента ДНК в типе клетки, органелле и организме, выбранных для экспрессии. Специалисты в области молекулярной биологии обычно знают, как использовать промоторы, энхансеры и комбинации типов клеток для экспрессии белка, например, см. Sambrook et al. (2012). Используемые промоторы могут быть конститутивными, тканеспецифическими, индуцируемыми и/или полезными в соответствующих условиях для управления высокоуровневой экспрессией введенного сегмента ДНК, что является преимуществом при крупномасштабном производстве рекомбинантных белков и их фрагментов.
Примером промотора является последовательность немедленно-раннего промотора цитомегаловируса (CMV). Эта последовательность промотора представляет собой сильную конститутивную последовательность промотора, способную управлять высокими уровнями экспрессии любой полинуклеотидной последовательности, функционально связанной с ней. Однако можно также использовать другие конститутивные промоторные последовательности, включая, помимо прочего, ранний промотор обезьяньего вируса 40 (SV40), промотор вируса опухоли молочной железы мыши (MMTV), промотор длинного концевого повтора (LTR) вируса иммунодефицита человека (HIV), промотор вируса Молони, промотор вируса птичьего лейкоза, немедленно-ранний промотор вируса Эпштейна-Барра, промотор вируса саркомы Рауса, а также промоторы генов человека, такие как, помимо прочего, промотор актина, промотор миозина, промотор гемоглобина и промотор креатина в мышцах. Кроме того, изобретение не следует ограничивать применением конститутивных промоторов. Индуцируемые промоторы также включены в изобретение. Использование индуцируемого промотора в изобретении обеспечивает молекулярный переключатель, способный включать экспрессию полинуклеотидной последовательности, с которой она функционально связана, когда такая экспрессия желательна, или выключать экспрессию, когда экспрессия нежелательна. Примеры индуцируемых промоторов включают, без ограничения, промотор металлотионина, промотор глюкокортикоида, промотор прогестерона и промотор тетрациклина. Кроме того, изобретение включает использование тканеспецифического промотора или промотора, специфичного для клеточного типа, который является промотором, активным только в требуемой ткани или клетке. Тканеспецифические промоторы хорошо известны в данной области и включают, без ограничения, промотор HER-2 и промоторные последовательности, ассоциированные с PSA.
Для оценки экспрессию нуклеиновых кислот, вектор экспрессии, предназначенный для введения в клетку, также может содержать либо селективный маркерный ген, либо репортерный ген, либо и то, и другое, чтобы облегчить идентификацию и отбор экспрессирующих клеток из популяции клеток, которые должны быть трансфицированы или инфицированы вирусными векторами. В других вариантах осуществления селективный маркер может находиться на отдельной нуклеиновой кислоте и использоваться в процедуре котрансфекции. Как селективные маркерные гены, так и репортерные гены могут быть фланкированы соответствующими регуляторными последовательностями для обеспечения экспрессии в клетках-хозяевах. Подходящие селективные маркеры известны в данной области и включают, например, гены устойчивости к антибиотикам, такие как neo и т.п.
Репортерные гены используются для идентификации потенциально трансфицированных клеток и для оценки функциональности регуляторных последовательностей. Репортерные гены, кодирующие легко анализируемые белки, хорошо известны в данной области. Как правило, репортерный ген представляет собой ген, который не присутствует или не экспрессируется в организме или тканях реципиента и который кодирует белок, экспрессия которого проявляется до некоторым легко детектируемым свойством, например ферментативной активностью. Экспрессию репортерного гена анализируют в подходящее время после ведения ДНК в клетки-реципиенты.
Подходящие репортерные гены могут включать гены, кодирующие люциферазу, бета-галактозидазу, хлорамфениколацетилтрансферазу, секретируемую щелочную фосфатазу или ген зеленого флуоресцентного белка (см., например, Ui-Tei et al., 2000 FEBS Lett. 479:79-82). Подходящие системы экспрессии хорошо известны и могут быть получены с помощью хорошо известных методов или являются коммерчески доступными. Как правило, в качестве промотора идентифицируют конструкцию с минимальной 5'-фланкирующей областью, показывающей наивысший уровень экспрессии репортерного гена. Такие промоторные области могут быть связаны с репортерным геном и использоваться для оценки способности агентов модулировать управляемую промотором транскрипцию.
Способы введения и экспрессии нуклеиновых кислот в клетку известны в данной области. В контексте вектора экспрессии вектор может быть легко введен в клетку-хозяин, например, в клетку млекопитающих, бактерий, дрожжей или насекомых, любым способом в данной области. Например, вектор экспрессии может быть перенесен в клетку-хозяин физическими, химическими или биологическими способами.
Физические способы введения полинуклеотида в клетку-хозяина включают осаждение фосфатом кальция, липофекцию, бомбардировку частицами, микроинъекцию, электропорацию, лазеропорацию и т.п. Способы получения клеток, содержащих векторы и/или экзогенные нуклеиновые кислоты, хорошо известны в данной области. См., например, Sambrook et al. (2012) и Ausubel et al. (1999).
Биологические способы введения представляющей интерес нуклеиновой кислоты в клетку-хозяина включают использование векторов ДНК и РНК. Вирусные векторы, и особенно ретровирусные векторы, стали наиболее широко используемым средством встраивания генов в клетки млекопитающих, например, в клетки человека. Другие вирусные векторы могут происходить из лентивируса, поксвирусов, вируса простого герпеса I, аденовирусов и аденоассоциированных вирусов и т.п. См., например, патенты США №№5,350,674 и 5,585,362.
Химические средства для введения нуклеиновой кислоты в клетку-хозяина включают коллоидные дисперсионные системы, такие как комплексы макромолекул, нанокапсулы, микросферы, гранулы и системы на основе липидов, включая эмульсии масло-в-воде, мицеллы, смешанные мицеллы и липосомы. Предпочтительной коллоидной системой для использования в качестве средства доставки in vitro и in vivo является липосома (например, искусственная мембранная везикула). Приготовление и использование таких систем хорошо известно в данной области.
Независимо от способа, используемого для введения экзогенных нуклеиновых кислот в клетку-хозяина или иного воздействия на клетку нуклеиновой кислоты по настоящему изобретению, для подтверждения присутствия последовательности рекомбинантной ДНК в клетке-хозяине может быть выполнено множество анализов. Такие анализы включают, например, «молекулярно-биологические» анализы, хорошо известные специалистам в данной области, такие как Саузерн- и Нозерн-блоттинг, ОТ-ПЦР и ПЦР; «биохимические» анализы, такие как детектирование наличия или отсутствия конкретного пептида, например, иммунологическими методами (ELISA и вестерн-блоттинг) или анализами, раскрытыми в настоящем описании, для идентификации агентов, входящих в объем изобретения.
Отличные от человека животные, экспрессирующие человеческий С5
Изобретение также включает генетически модифицированное животное, отличное от человека, которое экспрессирует человеческий C5. В некоторых вариантах осуществления генетически модифицированное животное, отличное от человека, которое экспрессирует человеческий С5, также экспрессирует С5 животного, отличного от человека. В некоторых вариантах осуществления генетически модифицированное животное, отличное от человека, которое экспрессирует человеческий С5, не экспрессирует С5 животного, отличного от человека. В одном из вариантов осуществления изобретение относится к генетически модифицированному животному, отличному от человека, которое экспрессирует человеческий C5 из эндогенных регуляторных элементов животного, отличного от человека, но не экспрессирует C5 животного, отличного от человека. В некоторых вариантах осуществления животное, отличное от человека, является млекопитающим. В некоторых вариантах осуществления животное, отличное от человека, представляет собой грызуна. В некоторых вариантах осуществления животное, отличное от человека, представляет собой крысу или мышь. В некоторых вариантах осуществления мышь представляет собой мышь с иммунодефицитом. В некоторых вариантах осуществления мышь представляет собой мышь NOD/SCID. В некоторых вариантах осуществления мышь представляет собой мышь FcRn/SCID.
Для создания генетически модифицированного животного, отличного от человека, нуклеиновая кислота, кодирующая человеческий белок C5, может быть включена в рекомбинантный вектор экспрессии в форме, подходящей для экспрессии человеческого белка C5 в клетке-хозяине. Термин «в форме, подходящей для экспрессии слитого белка в клетке-хозяине» предназначен для обозначения того, что рекомбинантный вектор экспрессии включает одну или более регуляторных последовательностей, оперативно связанных с нуклеиновой кислотой, кодирующей человеческий белок C5, способом, позволяющим интеграцию в геном животных, отличных от человека, для обеспечения стабильной и постоянной транскрипции нуклеиновой кислоты в мРНК и трансляции мРНК в человеческий белок C5. Термин «регуляторная последовательность» известен в данной области и включает промоторы, энхансеры и другие элементы контроля экспрессии (например, сигналы полиаденилирования, элементы транспозона PiggyBac и Sleeping Beauty). Такие регуляторные последовательности известны специалистам в данной области и описаны в 1990, Goeddel, Gene Expression Technology: Methods in Enzymology 185, Academic Press, San Diego, Calif and in Nakanishi H, Higuchi Y, Kawakami S, Yamashita F, Hashida M. Mol Ther. 2010 Apr;18(4):707-14. doi: 10.1038/mt.2009.302. Epub 2010 Jan 26.; Hudecek M, Ivics Z. Curr Opin Genet Dev. 2018 Jun 22;52:100-108. doi: 10.1016/j.gde.2018.06.003. [Epub до выхода в печать] Обзор. Следует понимать, что конструкция вектора экспрессии может зависеть от таких факторов, как выбор клетки-хозяина и животных, подлежащих трансфекции, и/или количества экспрессируемого человеческого белка C5.
Генетически модифицированное животное, отличное от человека, может быть создано, например, путем введения нуклеиновой кислоты, кодирующей человеческий белок C5 (обычно связанной с соответствующими регуляторными элементами, такими как конститутивный или тканеспецифический энхансер), в ооцит, например, с помощью микроинъекции, и обеспечения возможности ооциту развиваться в организме самки мыши-основателя. Такие животные также могут быть созданы путем введения нуклеиновой кислоты, кодирующей человеческий белок C5 (обычно связанной с соответствующими регуляторными элементами, такими как конститутивный или тканеспецифический энхансер и/или транспозонные элементы PiggyBac и Sleeping Beauty), животным путем гидродинамической инъекции через хвостовую вену, как описано в Suda T, Liu D. Mol Ther. 2007 Dec; 15(12):2063-9. Epub 2007 Oct 2. Обзор. В трансген также могут быть включены интронные последовательности и сигналы полиаденилирования для повышения эффективности экспрессии трансгена. Способы создания генетически модифицированных животных, таких как мыши, стали общепринятыми в данной области техники и описаны, например, в патентах США №№ 4,736,866 и 4,870,009 и 1986, Hogan et al., A Laboratory Manual, Cold Spring Harbor, N.Y., Cold Spring Harbor Laboratory. Генетически модифицированное животное-основатель можно использовать для разведения дополнительных субъектов, несущих трансген, если трансген введен в ооциты. Генетически модифицированные животные, несущие трансген, кодирующий белок C5, полученный путем инъекции в ооциты по изобретению, могут быть дополнительно скрещены с другими генетически модифицированными животными, несущими другие трансгены, или с другими животными с нокаутом, например, с нокаутной мышью, которая не экспрессирует мышиный ген C5. Генетически модифицированные животные, несущие трансген, кодирующий белок C5, полученный путем гидродинамической инъекции в хвостовую вену, могут быть легко получены с помощью нокаутов других генов или путем использования трансгенных мышей, например мышей FcRn/SCID, для экспериментального использования. Следует понимать, что в дополнение к генетически модифицированным животным систему можно использовать для создания других субъектов, экспрессирующих человеческий C5.
В одном из вариантов осуществления генетически модифицированное животное, отличное от человека, которое экспрессирует человеческий C5 из регуляторных элементов, не относящихся к человеку, можно получить с помощью системы, которая заменяет последовательности экзона C5 животного, отличного от человека (или последовательности экзона и интрона), на последовательности экзона человеческого C5 (или последовательности экзона и интрона), но оставляет без изменений одну, несколько или все нативные регуляторные элементы животного, отличного от человека (например, промотор, энхансеры, фланкирующие области, интроны и т. д.). Хотя можно использовать любую подходящую систему, одной из иллюстративных систем, позволяющих таким образом получать генетически модифицированное животное, отличное от человека, является система CRISPR/Cas9. Система «CRISPR/Cas» относится к широко распространенному классу бактериальных систем для защиты от чужеродных нуклеиновых кислот. Системы CRISPR/Cas обнаружены в широком спектре эубактериальных и архейных организмов. Системы CRISPR/Cas включают подтипы типа I, II и III. В системах CRISPR/Cas дикого типа II типа используется РНК-опосредованная нуклеаза Cas9 в комплексе с направляющей и активирующей РНК для распознавания и расщепления чужеродной нуклеиновой кислоты. Гомологи Cas9 обнаружены у большого количества эубактерий, включая, помимо прочего, бактерии следующих таксономических групп: Actinobacteria, Aquificae, Bacteroidetes- Chlorobi, Chlamydiae-Verrucomicrobia, Chlroflexi, Cyanobacteria, Firmicutes, Proteobacteria, Spirochaetes и Thermotogae. Примером белка Cas9 является белок Cas9 Streptococcus pyogenes. Дополнительные белки Cas9 и их гомологи описаны, например, в Chylinksi, et al., RNA Biol. 2013 May 1; 10(5):726-737; Nat. Rev. Microbiol. 2011 June; 9(6):467-477; Hou, et al., Proc Natl Acad Sci U S A. 2013 Sep 24; 110(39):15644-9; Sampson et al., Nature. 2013 May 9; 497(7448):254-7; и Jinek, et al., Science. 2012 Aug 17; 337(6096):816-21.
В одном из вариантов осуществления генетически модифицированное животное, отличное от человека, по настоящему изобретению экспрессирует человеческий C5 с эндогенным промотором. Примеры промоторов, используемых в изобретении, включают, без ограничения, нативный промотор мыши, промотор ДНК pol II, промотор PGK, промотор убиквитина, промотор альбумина, промотор глобина, промотор овальбумина, ранний промотор SV40, промотор вируса саркомы Рауса (RSV), промотор β-актина, LTR ретровируса и LTR лентивируса. Системы экспрессии промотора и энхансера, применимые в изобретении, также включают индуцируемые и/или тканеспецифические системы экспрессии.
В некоторых вариантах осуществления генетически модифицированное животное, отличное от человека, по настоящему изобретению, которое экспрессирует человеческий C5, используется для скрининга, тестирования, анализа или оценки анти-С5 антител. В некоторых вариантах осуществления генетически модифицированное животное, отличное от человека, по настоящему изобретению, которое экспрессирует человеческий C5, используется для скрининга, тестирования, анализа или оценки характеристик, свойств или активности анти-C5 антител.
Наборы
Изобретение также включает набор, содержащий анти-С5 антитело, или его комбинации по изобретению и инструктивный материал, который описывает, например, введение анти-С5 антитела или его комбинации индивиду в качестве терапевтического лечения или применение без лечения, как раскрыто в настоящем описании. В одном из вариантов осуществления этот набор дополнительно включает (необязательно стерильный) фармацевтически приемлемый носитель, подходящий для растворения или суспендирования терапевтической композиции, содержащий анти-С5 антитело, или его комбинации по изобретению, например, перед введением антитела индивидууму. Необязательно набор включает аппликатор для введения антитела.
--->
Последовательности
VH-11801 гуманизированного 2G1
cagcatatgatcagtgtcctctccaaagtccttgaacatagactctaaccatggactggacc
M D W T
tgggtctttctcttcctcctgtcagtaactgcaggtgtccactcccaggttcagctggtg
W V F L F L L S V T A G V H S Q V Q L V
cagtctggagctgaggtgaagaagcctggggcctcagtgaaggtctcctgcaaggcttct
Q S G A E V K K P G A S V K V S C K A S
ggatacacaatcacagactacaatttggactgggtgcgacaggcccctggacaagggctt
G Y T I T D Y N L D W V R Q A P G Q G L CDR1(SEQ ID NO:3)
gagtggatgggagatattagtcctaactatggttatactatctacaaccagaaattcaag
E W M G D I S P N Y G Y T I Y N Q K F K CDR2(SEQ ID NO:4)
gacagagtcaccatgaccacagacacatccacgagcacagcctacatggagctgaggagc
D R V T M T T D T S T S T A Y M E L R S
ctgagatctgacgacacggccgtgtattactgtgcgagaagggacattcgttactccggt
L R S D D T A V Y Y C A R R D I R Y S G CDR3(SEQ ID NO:5)
Aattcctacaaatggtacttcgatgtctggggccaagggacaatggtcaccgtctcttca (SEQ ID NO:1)
N S Y K W Y F D V W G Q G T M V T V S S (SEQ ID NO:2)
VL-1901 гуманизированного 2G1
gtcagagccctggggaggaactgctcagttaggacccagagggaaccatggaagccccagct
M E A P A
cagcttctcttcctcctgctactctggctcccagataccaccggagacatccagttgacc
Q L L F L L L L W L P D T T G D I Q L T
cagtctccatccttcctgtctgcatctgtaggagacagagtcaccatcacttgcaggaca
Q S P S F L S A S V G D R V T I T C R T CDR1(SEQ ID NO:8)
agtaagagcataagcaaatatttagcctggtatcagcaaaaaccagggaaagcccctaag
S K S I S K Y L A W Y Q Q K P G K A P K
ctcctgatctattctggatccaccttgcaatctggggtcccatcaaggttcagcggcagt
L L I Y S G S T L Q S G V P S R F S G S CDR2(SEQ ID NO:9)
ggatctgggacagaattcactctcacaatcagcagcctgcagcctgaagattttgcaact
G S G T E F T L T I S S L Q P E D F A T
tattactgtcaacaacataatgaatacccgtacacgtttggccaggggaccaagctggag
Y Y C Q Q H N E Y P Y T F G Q G T K L E CDR3(SEQ ID NO:10)
Atcaaa (SEQ ID NO:6)
I K (SEQ ID NO:7)
Вариант VL-1901 (Q->H мутация в CDR3) гуманизированного 2G1
gtcagagccctggggaggaactgctcagttaggacccagagggaaccatggaagccccagct
M E A P A
cagcttctcttcctcctgctactctggctcccagataccaccggagacatccagttgacc
Q L L F L L L L W L P D T T G D I Q L T
cagtctccatccttcctgtctgcatctgtaggagacagagtcaccatcacttgcaggaca
Q S P S F L S A S V G D R V T I T C R T CDR1(SEQ ID NO:8)
agtaagagcataagcaaatatttagcctggtatcagcaaaaaccagggaaagcccctaag
S K S I S K Y L A W Y Q Q K P G K A P K
ctcctgatctattctggatccaccttgcaatctggggtcccatcaaggttcagcggcagt
L L I Y S G S T L Q S G V P S R F S G S CDR2(SEQ ID NO:9)
ggatctgggacagaattcactctcacaatcagcagcctgcagcctgaagattttgcaact
G S G T E F T L T I S S L Q P E D F A T
tattactgtcatcaacataatgaatacccgtacacgtttggccaggggaccaagctggag
Y Y C H Q H N E Y P Y T F G Q G T K L E CDR3(SEQ ID NO:11)
Atcaaa (SEQ ID NO:12)
I K (SEQ ID NO:13)
Вариант VL-1901 (T->H мутация в CDR1) гуманизированного 2G1
gtcagagccctggggaggaactgctcagttaggacccagagggaaccatggaagccccagct
M E A P A
cagcttctcttcctcctgctactctggctcccagataccaccggagacatccagttgacc
Q L L F L L L L W L P D T T G D I Q L T
cagtctccatccttcctgtctgcatctgtaggagacagagtcaccatcacttgcaggcat
Q S P S F L S A S V G D R V T I T C R H CDR1(SEQ ID NO:14)
agtaagagcataagcaaatatttagcctggtatcagcaaaaaccagggaaagcccctaag
S K S I S K Y L A W Y Q Q K P G K A P K
ctcctgatctattctggatccaccttgcaatctggggtcccatcaaggttcagcggcagt
L L I Y S G S T L Q S G V P S R F S G S CDR2(SEQ ID NO:9)
ggatctgggacagaattcactctcacaatcagcagcctgcagcctgaagattttgcaact
G S G T E F T L T I S S L Q P E D F A T
tattactgtcaacaacataatgaatacccgtacacgtttggccaggggaccaagctggag
Y Y C Q Q H N E Y P Y T F G Q G T K L E CDR3(SEQ ID NO:10)
Atcaaa (SEQ ID NO:15)
I K (SEQ ID NO:16)
Вариант VH-11801 (I->H мутация в CDR1) гуманизированного 2G1
cagcatatgatcagtgtcctctccaaagtccttgaacatagactctaaccatggactggacc
M D W T
tgggtctttctcttcctcctgtcagtaactgcaggtgtccactcccaggttcagctggtg
W V F L F L L S V T A G V H S Q V Q L V
cagtctggagctgaggtgaagaagcctggggcctcagtgaaggtctcctgcaaggcttct
Q S G A E V K K P G A S V K V S C K A S
ggatacacacatacagactacaatttggactgggtgcgacaggcccctggacaagggctt
G Y T H T D Y N L D W V R Q A P G Q G L CDR1(SEQ ID NO:17)
gagtggatgggagatattagtcctaactatggttatactatctacaaccagaaattcaag
E W M G D I S P N Y G Y T I Y N Q K F K CDR2(SEQ ID NO:4)
gacagagtcaccatgaccacagacacatccacgagcacagcctacatggagctgaggagc
D R V T M T T D T S T S T A Y M E L R S
ctgagatctgacgacacggccgtgtattactgtgcgagaagggacattcgttactccggt
L R S D D T A V Y Y C A R R D I R Y S G CDR3(SEQ ID NO:5)
Aattcctacaaatggtacttcgatgtctggggccaagggacaatggtcaccgtctcttca (SEQ ID NO:18)
N S Y K W Y F D V W G Q G T M V T V S S (SEQ ID NO:19)
Вариант VH-11801 (N->H мутация в CDR1) гуманизированного 2G1
cagcatatgatcagtgtcctctccaaagtccttgaacatagactctaaccatggactggacc
M D W T
tgggtctttctcttcctcctgtcagtaactgcaggtgtccactcccaggttcagctggtg
W V F L F L L S V T A G V H S Q V Q L V
cagtctggagctgaggtgaagaagcctggggcctcagtgaaggtctcctgcaaggcttct
Q S G A E V K K P G A S V K V S C K A S
ggatacacaatcacagactaccatttggactgggtgcgacaggcccctggacaagggctt
G Y T I T D Y H L D W V R Q A P G Q G L CDR1(SEQ ID NO:20)
gagtggatgggagatattagtcctaactatggttatactatctacaaccagaaattcaag
E W M G D I S P N Y G Y T I Y N Q K F K CDR2(SEQ ID NO:4)
gacagagtcaccatgaccacagacacatccacgagcacagcctacatggagctgaggagc
D R V T M T T D T S T S T A Y M E L R S
ctgagatctgacgacacggccgtgtattactgtgcgagaagggacattcgttactccggt
L R S D D T A V Y Y C A R R D I R Y S G CDR3(SEQ ID NO:5)
Aattcctacaaatggtacttcgatgtctggggccaagggacaatggtcaccgtctcttca (SEQ ID NO:21)
N S Y K W Y F D V W G Q G T M V T V S S (SEQ ID NO:22)
Вариант VL-1901 (Y->H мутация в CDR1) гуманизированного 2G1
gtcagagccctggggaggaactgctcagttaggacccagagggaaccatggaagccccagct
M E A P A
cagcttctcttcctcctgctactctggctcccagataccaccggagacatccagttgacc
Q L L F L L L L W L P D T T G D I Q L T
cagtctccatccttcctgtctgcatctgtaggagacagagtcaccatcacttgcaggaca
Q S P S F L S A S V G D R V T I T C R T CDR1(SEQ ID NO:23)
agtaagagcataagcaaacatttagcctggtatcagcaaaaaccagggaaagcccctaag
S K S I S K H L A W Y Q Q K P G K A P K
ctcctgatctattctggatccaccttgcaatctggggtcccatcaaggttcagcggcagt
L L I Y S G S T L Q S G V P S R F S G S CDR2(SEQ ID NO:9)
ggatctgggacagaattcactctcacaatcagcagcctgcagcctgaagattttgcaact
G S G T E F T L T I S S L Q P E D F A T
tattactgtcaacaacataatgaatacccgtacacgtttggccaggggaccaagctggag
Y Y C Q Q H N E Y P Y T F G Q G T K L E CDR3(SEQ ID NO:10)
Atcaaa (SEQ ID NO:24)
I K (SEQ ID NO:25)
Вариант VH-11801 (Y->H мутация в CDR2) гуманизированного 2G1
cagcatatgatcagtgtcctctccaaagtccttgaacatagactctaaccatggactggacc
M D W T
tgggtctttctcttcctcctgtcagtaactgcaggtgtccactcccaggttcagctggtg
W V F L F L L S V T A G V H S Q V Q L V
cagtctggagctgaggtgaagaagcctggggcctcagtgaaggtctcctgcaaggcttct
Q S G A E V K K P G A S V K V S C K A S
ggatacacaatcacagactacaatttggactgggtgcgacaggcccctggacaagggctt
G Y T I T D Y N L D W V R Q A P G Q G L CDR1(SEQ ID NO:3)
gagtggatgggagatattagtcctaaccatggttatactatctacaaccagaaattcaag
E W M G D I S P N H G Y T I Y N Q K F K CDR2(SEQ ID NO:26)
gacagagtcaccatgaccacagacacatccacgagcacagcctacatggagctgaggagc
D R V T M T T D T S T S T A Y M E L R S
ctgagatctgacgacacggccgtgtattactgtgcgagaagggacattcgttactccggt
L R S D D T A V Y Y C A R R D I R Y S G CDR3(SEQ ID NO:5)
Aattcctacaaatggtacttcgatgtctggggccaagggacaatggtcaccgtctcttca (SEQ ID NO:27)
N S Y K W Y F D V W G Q G T M V T V S S (SEQ ID NO:28)
Вариант VL-1901 (E->H мутация в CDR3) гуманизированного 2G1
gtcagagccctggggaggaactgctcagttaggacccagagggaaccatggaagccccagct
M E A P A
cagcttctcttcctcctgctactctggctcccagataccaccggagacatccagttgacc
Q L L F L L L L W L P D T T G D I Q L T
cagtctccatccttcctgtctgcatctgtaggagacagagtcaccatcacttgcaggaca
Q S P S F L S A S V G D R V T I T C R T CDR1(SEQ ID NO:8)
agtaagagcataagcaaatatttagcctggtatcagcaaaaaccagggaaagcccctaag
S K S I S K Y L A W Y Q Q K P G K A P K
ctcctgatctattctggatccaccttgcaatctggggtcccatcaaggttcagcggcagt
L L I Y S G S T L Q S G V P S R F S G S CDR2(SEQ ID NO:9)
ggatctgggacagaattcactctcacaatcagcagcctgcagcctgaagattttgcaact
G S G T E F T L T I S S L Q P E D F A T
tattactgtcaacaacataatcattacccgtacacgtttggccaggggaccaagctggag
Y Y C Q Q H N H Y P Y T F G Q G T K L E CDR3(SEQ ID NO:29)
Atcaaa (SEQ ID NO:30)
I K (SEQ ID NO:31)
Вариант VH-11801 (T->H мутация в CDR2) гуманизированного 2G1
cagcatatgatcagtgtcctctccaaagtccttgaacatagactctaaccatggactggacc
M D W T
tgggtctttctcttcctcctgtcagtaactgcaggtgtccactcccaggttcagctggtg
W V F L F L L S V T A G V H S Q V Q L V
cagtctggagctgaggtgaagaagcctggggcctcagtgaaggtctcctgcaaggcttct
Q S G A E V K K P G A S V K V S C K A S
ggatacacaatcacagactacaatttggactgggtgcgacaggcccctggacaagggctt
G Y T I T D Y N L D W V R Q A P G Q G L CDR1(SEQ ID NO:3)
gagtggatgggagatattagtcctaactatggttatcatatctacaaccagaaattcaag
E W M G D I S P N Y G Y H I Y N Q K F K CDR2(SEQ ID NO:34)
gacagagtcaccatgaccacagacacatccacgagcacagcctacatggagctgaggagc
D R V T M T T D T S T S T A Y M E L R S
ctgagatctgacgacacggccgtgtattactgtgcgagaagggacattcgttactccggt
L R S D D T A V Y Y C A R R D I R Y S G CDR3(SEQ ID NO:5)
Aattcctacaaatggtacttcgatgtctggggccaagggacaatggtcaccgtctcttca (SEQ ID NO:35)
N S Y K W Y F D V W G Q G T M V T V S S (SEQ ID NO:36)
Последовательность тяжелой цепи варианта IWW mAb H1-8/L1-9 (L->I
мутация в CDR1, P->W мутация в CDR2, V->W мутация в CDR3)
IWW-VH
cagcatatgatcagtgtcctctccaaagtccttgaacatagactctaaccatggactggacc
M D W T
tgggtctttctcttcctcctgtcagtaactgcaggtgtccactcccaggttcagctggtg
W V F L F L L S V T A G V H S Q V Q L V
cagtctggagctgaggtgaagaagcctggggcctcagtgaaggtctcctgcaaggcttct
Q S G A E V K K P G A S V K V S C K A S
ggatacacaatcacagactaccatatcgactgggtgcgacaggcccctggacaagggctt
G Y T I T D Y H I D W V R Q A P G Q G L CDR1(SEQ ID NO:37)
gagtggatgggagatattagttggaactatggttatactatctacaaccagaaattcaag
E W M G D I S W N Y G Y T I Y N Q K F K CDR2(SEQ ID NO:38)
gacagagtcaccatgaccacagacacatccacgagcacagcctacatggagctgaggagc
D R V T M T T D T S T S T A Y M E L R S
ctgagatctgacgacacggccgtgtattactgtgcgagaagggacattcgttactccggt
L R S D D T A V Y Y C A R R D I R Y S G CDR3(SEQ ID NO:39)
aattcctacaaatggtacttcgattggtggggccaagggacaatggtcaccgtctcttca(SEQ ID NO:40)
N S Y K W Y F D W W G Q G T M V T V S S (SEQ ID NO:41)
Последовательность тяжелой цепи варианта IFW mAb H1-8/L1-9 (L->I
мутация в CDR1, P->F мутация в CDR2, V->W мутация в CDR3)
IFW-VH
cagcatatgatcagtgtcctctccaaagtccttgaacatagactctaaccatggactggacc
M D W T
tgggtctttctcttcctcctgtcagtaactgcaggtgtccactcccaggttcagctggtg
W V F L F L L S V T A G V H S Q V Q L V
cagtctggagctgaggtgaagaagcctggggcctcagtgaaggtctcctgcaaggcttct
Q S G A E V K K P G A S V K V S C K A S
ggatacacaatcacagactaccatatcgactgggtgcgacaggcccctggacaagggctt
G Y T I T D Y H I D W V R Q A P G Q G L CDR1(SEQ ID NO:42)
gagtggatgggagatattagtttcaactatggttatactatctacaaccagaaattcaag
E W M G D I S F N Y G Y T I Y N Q K F K CDR2(SEQ ID NO:43)
gacagagtcaccatgaccacagacacatccacgagcacagcctacatggagctgaggagc
D R V T M T T D T S T S T A Y M E L R S
ctgagatctgacgacacggccgtgtattactgtgcgagaagggacattcgttactccggt
L R S D D T A V Y Y C A R R D I R Y S G CDR3(SEQ ID NO:44)
aattcctacaaatggtacttcgattggtggggccaagggacaatggtcaccgtctcttca(SEQ ID NO:45)
N S Y K W Y F D W W G Q G T M V T V S S (SEQ ID NO:46)
Последовательность тяжелой цепи варианта FME mAb H1-8/L1-9 (L->F
мутация в CDR1, P->M мутация в CDR2, V->E мутация в CDR3)
FME-VH
cagcatatgatcagtgtcctctccaaagtccttgaacatagactctaaccatggactggacc
M D W T
tgggtctttctcttcctcctgtcagtaactgcaggtgtccactcccaggttcagctggtg
W V F L F L L S V T A G V H S Q V Q L V
cagtctggagctgaggtgaagaagcctggggcctcagtgaaggtctcctgcaaggcttct
Q S G A E V K K P G A S V K V S C K A S
ggatacacaatcacagactaccatttcgactgggtgcgacaggcccctggacaagggctt
G Y T I T D Y H F D W V R Q A P G Q G L CDR1(SEQ ID NO:47)
gagtggatgggagatattagtatgaactatggttatactatctacaaccagaaattcaag
E W M G D I S M N Y G Y T I Y N Q K F K CDR2(SEQ ID NO:48)
gacagagtcaccatgaccacagacacatccacgagcacagcctacatggagctgaggagc
D R V T M T T D T S T S T A Y M E L R S
ctgagatctgacgacacggccgtgtattactgtgcgagaagggacattcgttactccggt
L R S D D T A V Y Y C A R R D I R Y S G CDR3(SEQ ID NO:49)
aattcctacaaatggtacttcgatgagtggggccaagggacaatggtcaccgtctcttca(SEQ ID NO:50)
N S Y K W Y F D E W G Q G T M V T V S S (SEQ ID NO:51)
Последовательность тяжелой цепи варианта FMW mAb H1-8/L1-9
(L->F мутация в CDR1, P->M мутация в CDR2, V->W мутация в CDR3)
FMW-VH
cagcatatgatcagtgtcctctccaaagtccttgaacatagactctaaccatggactggacc
M D W T
tgggtctttctcttcctcctgtcagtaactgcaggtgtccactcccaggttcagctggtg
W V F L F L L S V T A G V H S Q V Q L V
cagtctggagctgaggtgaagaagcctggggcctcagtgaaggtctcctgcaaggcttct
Q S G A E V K K P G A S V K V S C K A S
ggatacacaatcacagactaccatttcgactgggtgcgacaggcccctggacaagggctt
G Y T I T D Y H F D W V R Q A P G Q G L CDR1(SEQ ID NO:52)
gagtggatgggagatattagtatgaactatggttatactatctacaaccagaaattcaag
E W M G D I S M N Y G Y T I Y N Q K F K CDR2(SEQ ID NO:53)
gacagagtcaccatgaccacagacacatccacgagcacagcctacatggagctgaggagc
D R V T M T T D T S T S T A Y M E L R S
ctgagatctgacgacacggccgtgtattactgtgcgagaagggacattcgttactccggt
L R S D D T A V Y Y C A R R D I R Y S G CDR3(SEQ ID NO:54)
aattcctacaaatggtacttcgattggtggggccaagggacaatggtcaccgtctcttca(SEQ ID NO:55)
N S Y K W Y F D W W G Q G T M V T V S S (SEQ ID NO:56)
Последовательность тяжелой цепи варианта FMEH mAb H1-8/L1-9
(L->F мутация в CDR1, P->M и T->H мутация в CDR2, V->E мутация в CDR3)
FMEH-VH
cagcatatgatcagtgtcctctccaaagtccttgaacatagactctaaccatggactggacc
M D W T
tgggtctttctcttcctcctgtcagtaactgcaggtgtccactcccaggttcagctggtg
W V F L F L L S V T A G V H S Q V Q L V
cagtctggagctgaggtgaagaagcctggggcctcagtgaaggtctcctgcaaggcttct
Q S G A E V K K P G A S V K V S C K A S
ggatacacaatcacagactaccatttcgactgggtgcgacaggcccctggacaagggctt
G Y T I T D Y H F D W V R Q A P G Q G L CDR1(SEQ ID NO:47)
gagtggatgggagatattagtatgaactatggttatcatatctacaaccagaaattcaag
E W M G D I S M N Y G Y H I Y N Q K F K CDR2(SEQ ID NO:57)
gacagagtcaccatgaccacagacacatccacgagcacagcctacatggagctgaggagc
D R V T M T T D T S T S T A Y M E L R S
ctgagatctgacgacacggccgtgtattactgtgcgagaagggacattcgttactccggt
L R S D D T A V Y Y C A R R D I R Y S G CDR3(SEQ ID NO:49)
aattcctacaaatggtacttcgatgagtggggccaagggacaatggtcaccgtctcttca(SEQ ID NO:58)
N S Y K W Y F D E W G Q G T M V T V S S (SEQ ID NO:59)
Последовательность тяжелой цепи варианта IWWH mAb H1-8/L1-9
(L->I мутация в CDR1, P->W и T->H мутация в CDR2, V->W мутация в CDR3)
IWWH-VH
cagcatatgatcagtgtcctctccaaagtccttgaacatagactctaaccatggactggacc
M D W T
tgggtctttctcttcctcctgtcagtaactgcaggtgtccactcccaggttcagctggtg
W V F L F L L S V T A G V H S Q V Q L V
cagtctggagctgaggtgaagaagcctggggcctcagtgaaggtctcctgcaaggcttct
Q S G A E V K K P G A S V K V S C K A S
ggatacacaatcacagactaccatatcgactgggtgcgacaggcccctggacaagggctt
G Y T I T D Y H I D W V R Q A P G Q G L CDR1(SEQ ID NO:37)
gagtggatgggagatattagttggaactatggttatcatatctacaaccagaaattcaag
E W M G D I S W N Y G Y H I Y N Q K F K CDR2(SEQ ID NO:62)
gacagagtcaccatgaccacagacacatccacgagcacagcctacatggagctgaggagc
D R V T M T T D T S T S T A Y M E L R S
ctgagatctgacgacacggccgtgtattactgtgcgagaagggacattcgttactccggt
L R S D D T A V Y Y C A R R D I R Y S G CDR3(SEQ ID NO:39)
aattcctacaaatggtacttcgattggtggggccaagggacaatggtcaccgtctcttca(SEQ ID NO:63)
N S Y K W Y F D W W G Q G T M V T V S S (SEQ ID NO:64)
Последовательность тяжелой цепи варианта IFWH mAb H1-8/L1-9
(L->I мутация в CDR1, P->F и T->H мутация в CDR2, V->W мутация в CDR3)
IFWH-VH
cagcatatgatcagtgtcctctccaaagtccttgaacatagactctaaccatggactggacc
M D W T
tgggtctttctcttcctcctgtcagtaactgcaggtgtccactcccaggttcagctggtg
W V F L F L L S V T A G V H S Q V Q L V
cagtctggagctgaggtgaagaagcctggggcctcagtgaaggtctcctgcaaggcttct
Q S G A E V K K P G A S V K V S C K A S
ggatacacaatcacagactaccatatcgactgggtgcgacaggcccctggacaagggctt
G Y T I T D Y H I D W V R Q A P G Q G L CDR1(SEQ ID NO:42)
gagtggatgggagatattagtttcaactatggttatcatatctacaaccagaaattcaag
E W M G D I S F N Y G Y H I Y N Q K F K CDR2(SEQ ID NO:65)
gacagagtcaccatgaccacagacacatccacgagcacagcctacatggagctgaggagc
D R V T M T T D T S T S T A Y M E L R S
ctgagatctgacgacacggccgtgtattactgtgcgagaagggacattcgttactccggt
L R S D D T A V Y Y C A R R D I R Y S G CDR3(SEQ ID NO:44)
aattcctacaaatggtacttcgattggtggggccaagggacaatggtcaccgtctcttca(SEQ ID NO:66)
N S Y K W Y F D W W G Q G T M V T V S S (SEQ ID NO:67)
Последовательность тяжелой цепи варианта FMWH mAb H1-8/L1-9
(L->F мутация в CDR1, P->M и T->H мутация в CDR2, V->W мутация в CDR3)
FMWH-VH
cagcatatgatcagtgtcctctccaaagtccttgaacatagactctaaccatggactggacc
M D W T
tgggtctttctcttcctcctgtcagtaactgcaggtgtccactcccaggttcagctggtg
W V F L F L L S V T A G V H S Q V Q L V
cagtctggagctgaggtgaagaagcctggggcctcagtgaaggtctcctgcaaggcttct
Q S G A E V K K P G A S V K V S C K A S
ggatacacaatcacagactaccatttcgactgggtgcgacaggcccctggacaagggctt
G Y T I T D Y H F D W V R Q A P G Q G L CDR1(SEQ ID NO:52)
gagtggatgggagatattagtatgaactatggttatcatatctacaaccagaaattcaag
E W M G D I S M N Y G Y H I Y N Q K F K CDR2(SEQ ID NO:68)
gacagagtcaccatgaccacagacacatccacgagcacagcctacatggagctgaggagc
D R V T M T T D T S T S T A Y M E L R S
ctgagatctgacgacacggccgtgtattactgtgcgagaagggacattcgttactccggt
L R S D D T A V Y Y C A R R D I R Y S G CDR3(SEQ ID NO:54)
aattcctacaaatggtacttcgattggtggggccaagggacaatggtcaccgtctcttca(SEQ ID NO:69)
N S Y K W Y F D W W G Q G T M V T V S S (SEQ ID NO:70)
Аминокислотная последовательность константной области тяжелой цепи
человеческого IgG4
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Ser Cys Pro Ala Pro
100 105 110
Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
165 170 175
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
305 310 315 320
Leu Ser Leu Ser Pro Gly Lys (SEQ ID NO:32)
325
Аминокислотная последовательность константной области тяжелой цепи
человеческого IgG4 с мутацией S108P (относительно SEQ ID NO: 32)
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
100 105 110
Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
165 170 175
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
305 310 315 320
Leu Ser Leu Ser Pro Gly Lys (SEQ ID NO:33)
325
Последовательности Fc-домена человеческого IgG4 с мутацией PLA
gctagcaccaagggcccatcggtcttccccctggcgccctgctccaggagcacctccgag
A S T K G P S V F P L A P C S R S T S E
agcacagccgccctgggctgcctggtcaaggactacttccccgaaccggtgacggtgtcg
S T A A L G C L V K D Y F P E P V T V S
tggaactcaggcgccctgaccagcggcgtgcacaccttcccggctgtcctacagtcctca
W N S G A L T S G V H T F P A V L Q S S
ggactctactccctcagcagcgtggtgaccgtgccctccagcagcttgggcacgaagacc
G L Y S L S S V V T V P S S S L G T K T
tacacctgcaacgtagatcacaagcccagcaacaccaaggtggacaagagagttgagtcc
Y T C N V D H K P S N T K V D K R V E S
aaatatggtcccccatgcccaccatgcccagcacctgagttcctggggggaccatcagtc
K Y G P P C P P C P A P E F L G G P S V
ttcctgttccccccaaaacccaaggacactctcatgatctcccggacccctgaggtcacg
F L F P P K P K D T L M I S R T P E V T
tgcgtggtggtggacgtgagccaggaagaccccgaggtccagttcaactggtacgtggat
C V V V D V S Q E D P E V Q F N W Y V D
ggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagttcaacagcacgtac
G V E V H N A K T K P R E E Q F N S T Y
cgtgtggtcagcgtcctcaccgtcctgcaccaggactggctgaacggcaaggagtacaag
R V V S V L T V L H Q D W L N G K E Y K
tgcaaggtctccaacaaaggcctcccgtcctccatcgagaaaaccatctccaaagccaaa
C K V S N K G L P S S I E K T I S K A K
gggcagccccgagagccacaggtgtacaccctgcccccatcccaggaggagatgaccaag
G Q P R E P Q V Y T L P P S Q E E M T K
aaccaggtcagcctgacctgcctggtcaaaggcttctaccccagcgacatcgccgtggag
N Q V S L T C L V K G F Y P S D I A V E
tgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtgctggactcc
W E S N G Q P E N N Y K T T P P V L D S
gacggctccttcttcctctacagcaggctcaccgtggacaagagcaggtggcaggagggg
D G S F F L Y S R L T V D K S R W Q E G
aatgtcttctcatgctccgtgctgcatgaggctctgcacgcccactacacacagaagagc
N V F S C S V L H E A L H A H Y T Q K S
Ctctccctgtctctgggtaaatga (SEQ ID NO:60)
L S L S L G K - (SEQ ID NO:61)
<---
ЭКСПЕРИМЕНТАЛЬНЫЕ ПРИМЕРЫ
Теперь изобретение описано со ссылкой на приведенные ниже примеры. Эти примеры предоставлены только с целью иллюстрации, и изобретение никоим образом не следует истолковывать как ограниченное этими примерами; скорее его следует толковать как охватывающее любые и все изменения, которые становятся очевидными в результате раскрытия, приведенного в настоящем описании.
Предполагается, что специалист в данной области сможет, без дополнительного описания, используя приведенное выше описание и представленные ниже иллюстративные примеры, получить и применить соединения по настоящему изобретению, а также осуществить на практике заявленные способы. Поэтому приведенные ниже рабочие примеры не следует рассматривать как ограничивающие каким-либо образом оставшуюся часть раскрытия.
Пример 1
Создавали варианты гуманизированного 2G1 (VH-11801 (SEQ ID NO: 2) и VL-1901 (SEQ ID NO: 7)) (см. фиг. 1) для разработки вариантов с улучшенным связыванием с C5 при pH 7,4 и уменьшенным связыванием с C5 при pH 5,8.
Представленный в настоящем описании подход основан на понимании того, что сродство mAb и эффективность блокирования, измеренные in vitro, не обязательно коррелируют с его периодом полувыведения in vivo, PK или PD. Это, по меньшей мере частично, связано с тем, что растворимый антиген, который присутствует в высокой концентрации в крови, такой как C5, образует иммунный комплекс (т.е. mAb, связанное с антигеном), который нацелен на удаление из организма. Следовательно, как правило, для блокирования активности таких растворимых антигенов in vivo требуются высокие концентрации антител в крови.
Представленный в настоящем описании подход основан на понимании того, что эффективность терапевтического антитела in vivo может быть увеличена за счет увеличения рециклинга или периода полувыведения антитела (и, следовательно, PK) и за счет ускорения внутриклеточной деградации антигена за счет генерации mAb, которые имеют свойства «pH-зависимого» связывания. Требуемым свойством в этом отношении является то, что терапевтическое mAb должно хорошо связываться с антигеном (например, C5) при pH, близком к нейтральному (pH ~7,4), который характерен для крови. Таким образом, оно эффективно блокирует активность антигена (например, C5). Затем иммунный комплекс захватывается клетками, где он перемещается в эндосому для протеолитической деградации. Для ранней эндосомы характерен кислый рН (pH ~6,0). Таким образом, когда терапевтическое mAb плохо связывается со своим антигеном при кислом pH, mAb диссоциирует из иммунного комплекса и затем может поглощаться неонатальным Fc-рецептором (FcRn) и может вернуться в плазму. Таким образом, только антиген (например, C5) деградирует через эндосомный протеолитический путь, тогда как рециклинг mAb через FcRn способствует его более длительному персистированию в плазме.
Из-за своей склонности к протонированию при кислом pH (H+) mAb, содержащие остатки гистдина в своих CDR, могут иметь ослабленное сродство связывания при протонировании при кислом pH. В раскрытом в настоящем описании подходе использовали «гистидиновое сканирование» всех остатков CDR (т.е. замену каждого остатка гистидина в CDR). Затем для измерения диссоциации mAb и C5 при pH 7,4 и pH 5,8 использовали прибор Octet (Pall ForteBio), чтобы идентифицировать варианты с заменой гистидина, которые имели относительно более быструю диссоциацию при pH 5,8 и относительно более медленную диссоциацию при pH 7,4.
Родительское гуманизированное mAb 2G1 (VH-11801 (SEQ ID NO: 2) и VL-1901 (SEQ ID NO: 7)), по-видимому, обладает более высоким сродством к C5 при pH 5,8 (см. фиг. 7). Создавали варианты с одной заменой, имеющие замену гистидина в каждом остатке в каждом из шести CDR mAb (VH-11801 (SEQ ID NO: 2) и VL-1609 (SEQ ID NO: 7)), и оценивали их свойство pH-зависимого связывания. Для каждого варианта конструировали плазмиды VH и VL, и затем осуществляли временную трансфекцию в клетки HEK. mAb в супернатанте клеточной культуры тестировали на связывание при pH 5,8 и pH 7,4.
Из этих вариантов с одной заменой три варианта (mAb L3-1, L1-2 и H1-4) показали некоторое улучшение pH-зависимого связывания. Последовательности L3-1 показаны на фиг. 2 (SEQ ID NO: 1-5, 8, 9 и 11-13). Последовательности L1-2 показаны на фиг. 3 (SEQ ID NO: 1-5, 9, 10 и 14-16). Последовательности H1-4 показаны на фиг. 4 (SEQ ID NO: 4, 5, 6-10 и 17-19).
Помимо создания вариантов с одной заменой, легкие цепи и тяжелые цепи с одной заменой объединяли для создания вариантов с двумя заменами. Из этих вариантов с двумя заменами два варианта (mAb H1-8/L1-9 и H2-6/L3-5) показали некоторое улучшение pH-зависимого связывания. Последовательности H1-8/L1-9 показаны на фиг. 5 (SEQ ID NO: 4, 5, 9, 10 и 20-25). Последовательности H2-6/L3-5 показаны на фиг. 6 (SEQ ID NO: 3, 5, 8, 9 и 26-31).
Отслеживание связывания и диссоциации C5 родительского гуманизированного mAb 2G1 с VH-11801 SEQ ID NO: 2 и VL-1901 SEQ ID NO: 7, а также различных одинарных и двойных гистидиновых мутантов с помощью системы Octet показаны на фиг. 7-12. Их относительная активность по блокированию функции C5 сравнивали с родительскими гуманизированными mAb 2G1 (VH-11801/VL-1901), как показано на фиг. 13 и фиг. 14, с помощью анализа лизиса эритроцитов барана. За исключением mAb L3-1, которое показало равную или улучшенную активность по сравнению с родительским гуманизированным mAb 2G1, все другие мутанты показали пониженную активность. В случае двух вариантов с двойной заменой, их активность значительно снижается, поскольку H1-8/L1-9 по существу полностью теряет С5-блокирующую активность. Это неудивительно, потому что, несмотря на наблюдаемую некоторую желаемую более быструю диссоциацию mAb H1-8/L1-9 и H2-6/L3-5 при pH 5,8, их диссоциация при pH 7,4 также резко ускоряется (что объясняет потерю активности).
Даже несмотря на то, что указанные выше варианты с заменой гистидина становятся менее активными in vitro, их период полувыведения in vivo может быть улучшен, и, следовательно, их PK/PD-свойства могут быть улучшены по сравнению с родительским mAb в результате пониженной деградации благодаря pH-зависимому связыванию.
Для тестирования in vivo PK/PD получали C5-гуманизированную мышь путем создания мышей NOD/SCID, постоянно экспрессирующих человеческий C5, путем гидродинамической инъекции через хвостовую вену кДНК человеческого C5, содержащую элементы транспозона Sleeping Beauty. Мыши NOD являются по природе дефицитными по C5, поэтому эндогенный мышиный C5 не будет мешать анализу фармакодинамики (PD). Генетический фон SCID гарантирует, что трансгенно экспрессируемый человеческий C5 не будет вызывать иммунного ответа на человеческий C5. C5-гуманизированную мышь создавали путем гидродинамической инъекции плазмиды человеческого C5, содержащей элементы последовательности транспозона Sleeping Beauty, для стабильной интеграции в геном. Репрезентативные данные, подтверждающие высокий уровень экспрессии человеческого C5 у мышей NOD/SCID, показаны на фиг.16. Обычно наблюдаемые концентрации C5 в плазме находились в пределах от 50 до 120 мкг/мл. Это сопоставимо с концентрацией C5 в плазме человека, которая составляет около 80 мкг/мл.
Пять вариантов с заменой гистидина (т.е. mAb L3-1, L1-2, H1-4, H1-8/L1-9 и H2-6/L3-5) оценивали на PK/PD. Два варианта с двумя заменами (т.е. MAb H1-8/L1-9 и H2-6/L3-5) показали наибольшую устойчивость. Из трех вариантов с одной заменой mAb H1-4 и L1-2 показали более высокую устойчивость, чем mAb L3-1 (фиг. 17). Таким образом, хотя L3-1 имел лучшее сродство при pH 7,4 и блокирующую активность in vitro по отношению к человеческому C5, у него наблюдали самый короткий период полувыведения. Интересно, что за исключением mAb H1-8/L1-9, которое не показало блокирующей активности in vivo, все другие варианты имели улучшенный профиль PD по сравнению с родительским гуманизированным mAb 2G1 (VH-11801, VL-1901) (см. фиг. 18 и фиг. 19).
Учитывая, что вариант mAb H1-8/L1-9 показал наилучшее pH-дифференциальное связывание (т.е. диссоциация антигена происходила намного быстрее при pH 5,8, чем при pH 7,4 (см. фиг. 12)) и, при этом, потерял большую часть своей блокирующей активности (поскольку диссоциация антигена при pH 7,4 также увеличилась), выполнили экономный мутагенез для случайной замены каждого остатка в 6 CDR H1-8/L1-9 (при сохранении гистидиновых замен H1-8 и L1-9). В VH были идентифицированы три «горячие точки», которые значительно улучшили связывание при pH 7,4 в анализах конструктов ScFV на планшете ELISA. Эти остатки представляли собой лейцин в положении 9 (т.е. L9) в VH CDR1 относительно SEQ ID NO: 20, пролин в положении 4 (т.е. P4) в VH CDR2 относительно SEQ ID NO: 4 и валин в положение 16 (т.е. V16) в VH CDR3 относительно SEQ ID NO: 5. Замены, демонстрирующие максимальное улучшение связывания, были следующими: L9→W9 (т.е. L9W), L9→I9 (т.е. L9I), L9→V9 (т.е. L9V), L9→Y9 (т.е. L9Y), L9→F9 (т.е. L9F), P4→F4 (т.е. P4F), P4→L4 (т.е. P4L), P4→M4 (т.е. P4M), P4→W4 (т.е. P4W), P4→I4 (т.е. P4I), V16→F16 (т.е. V16F), V16→E16 (т.е. V16E) и V16→W16 (т.е. V16W) (см. фиг. 20).
Получали эти 13 замен (т.е. L9→W9 (т.е. L9W), L9→I9 (т.е. L9I), L9→V9 (т.е. L9V), L9→Y9 (т.е. L9Y), L9→F9 (т.е. L9F), P4→F4 (т.е. P4F), P4→L4 (т.е. P4L), P4→M4 (т.е. P4M), P4→W4 (т.е. P4W), P4→I4 (т.е. P4I), V16→F16 (т.е. V16F), V16→E16 (т.е. V16E) и V16→W16 (т.е. V16W)) и оценивали на предмет их pH-зависимой связывающей способности как IgG. Для каждого варианта конструировали плазмиду VH и VL, и затем осуществляли временную трансфекцию в клетки Expi-CHO. mAb в супернатанте клеточной культуры тестировали на связывание при pH 5,8 и pH 7,4. На фиг. 21 и фиг. 22 суммированы свойства связывания C5 этих вариантов. На фиг. 21 показано отношение связывания C5 относительно сигналов связывания mAb, и на фиг. 22 показано уменьшение в % сигнала связывания относительно пикового значения при pH 7,4 и pH 5,8 после перехода из фазы ассоциации в фазу диссоциации. Для любого данного мутанта на фиг. 21 предпочтительно высокое отношение; и на фиг.22 предпочтительны более низкий % диссоциации при pH 7,4 (заштриховые столбцы) и более высокий % диссоциации при pH 5,8 (клетчатые столбцы).
Из этого скрининга 13 вариантов mAb H1-8/L1-9 с одной заменой гистидина было выбрано семь вариантов для создания 18 вариантов комбинированными заменами, перечисленными на фиг. 23 (т.е. L9I/P4M, L9I/P4W, L9I/P4F, L9F/P4M, L9F/P4W, L9F/P4F, L9I/P4M/V16W, L9I/P4W/V16W, L9I/P4F/V16W, L9F/P4M/V16W, L9F/P4W/V16W, L9F/P4F/V16W, L9I/P4M/V16E, L9I/P4W/V16E, L9I/P4F/V16E, L9F/P4M/V16E, L9F/P4W/V16E и L9F/P4F/V16E). Получали эти 18 вариантов с комбинационными заменами и оценивали на свойство pH-зависимого связывания. Для каждого варианта конструировали плазмиду VH и VL, и затем осуществляли временную трансфекцию в клетки Expi-CHO. mAb в супернатанте клеточной культуры тестировали на связывание при pH 5,8 и pH 7,4.
На фиг. 24 и 25 суммированы свойства связывания C5 этих 18 вариантов с комбинированными заменами. На фиг. 24 показано отношение связывания C5 к сигналам связывания mAb, и на фиг. 25 показано уменьшение сигнала связывания в % от пикового значения при pH 7,4 и pH 5,8, соответственно, после перехода из фазы ассоциации в фазу диссоциации. На фиг. 25 показано уменьшение сигнала связывания в % от пикового значения при pH 7,4 и pH 5,8 после перехода из фазы ассоциации в фазу диссоциации. Для любого данного мутанта на фиг. 24 предпочтительно высокое отношение; и на фиг.25 предпочтительны более низкий % диссоциации при pH 7,4 (заштриховые столбцы) и более высокий % диссоциации при pH 5,8 (клетчатые столбцы).
Пример 2
Выполняли дополнительный анализ и проекта по сбору данных по созреванию сродства, и идентифицировали мутацию T в His в положении 9 CDR2 как еще одну многообещающую случайную мутацию для восстановления связывания V1-8/L1-9 при pH 7,4 (фиг.26-28). Также выполняли системное изменение каждого остатка в CDR VH и VL на гистидин, и каждый мутант протестировали на связывание человеческого C5 при pH 7,4 и pH 5,8. Цель заключалась в нахождении мутантов, которые демонстрируют максимальную разницу pH-зависимого связывания, но сохраняют активность блокирования C5. Таким образом, было охарактеризовано и протестировано несколько мутантов, включая двойной мутант VH1-8/VL1-9, несущий мутацию His в аминокислоты 8 в CDR1 VH и аминокислоты 9 в CDR1 VL (фиг.5, фиг. 30 и фиг. 31). Двойной мутант (обозначенный как «H1-8/L1-9»; фиг. 5) показал наибольшую разницу рН-зависимого связывания, но потерял большую часть своей активности. Следовательно, для идентификации ряда случайных мутантов в CDR H1-8/L1-9, у которых наблюдали увеличение связывания при pH 7,4 (связывание pH 7,4 коррелирует с активностью блокирования C5), при этом сохраняя разницу между связыванием при pH 7,4 и при pH 5,8, использовали процесс созревания сродства.
Кроме того, получали ряд двойных и тройных мутантов H1-8/L1-9 путем комбинирования одинарных мутантов с самым высоким рейтингом. Профили связывания этих двойных и тройных мутантов при pH 7,4 и pH 5,8 тестировали и характеризовали, используя супернатант культуры клеток, подвергнутых временной трансфекции. На основании максимальной разницы связывания при pH 7,4 и при pH 5,8 и наилучшего связывания при pH 7,4 в качестве 4 лучших тройных мутантных клонов V1-8/L1-9 были выбраны IWW, IFW, FME и FMW. Экспрессировали IWW, IFW, FME и FMW, и белки очищали для подтверждения свойств pH-зависимого связывания. C5-ингибирующую активность тестировали в гемолитическом анализе (фиг. 29, фиг. 30, фиг. 32-34).
Вышеописанные тройные мутанты дополнительно объединяли с новой мутацией His (CDR2 VH, положение 9, мутация T в H) для получения мутантов с 4 мутациями (IWWH, IFWH, FMEH и FMWH; например, фиг. 31). Эти новые мутанты тестировали на свойство pH-зависимого связывания и C5-ингибирующую активность. Из них мутант FMEH с четырьмя мутациями был идентифицирован как улучшенный мутант по сравнению с родительской молекулой FME, являющейся тройным мутантном (фиг. 35-37).
В дополнение к C5-гуманизированным мышам, полученным из мышей NOD/SCID, описанным в примере 1, путем гидродинамической инъекции для тестирования in vivo PK/PD некоторых из сконструированных мутантов анти-С5 mAb, создавали C5-гуманизированных мышей на основе трансгенных мышей SCID/FcRn (нокаутные по FcRn трансгенные мыши с человеческим FcRn). Последний штамм позволил протестировать комбинированный эффект pH-зависимых мутантов анти-С5 mAb с дополнительно сконструированным Fc-доменом конструкции IgG4 антитела (три мутации в Fc-домене) (фиг. 38 и фиг. 39).
Используя C5-гуманизированных мышей, полученных на основе SCID/FcRn трансгенных мышей, также тестировали PK/PD тройных мутантов H1-8/L1-9 IFW, FMW и FMEH в формате IgG4 с тремя мутациями остатков в Fc-домене (PLA). Данные показали значительно улучшенную PK/PD активность по сравнению с родительским гуманизированным анти-С5 mAb 11801 (из которого получали H1-8/L1-9) (фиг. 40-42).
Пример 3
Выполняли in vivo эксперименты для сравнения уровней PK, PD и C5 родительского mAb 11801 и сконструированного mAb H1-8/L1-9 FMEH-PLA. Эксперименты выполняли для оценки уровня общего hIgG4 в плазме мышей FcRn/SCID, которые были генетически модифицированы для экспрессии человеческого C5 после инъекции мышам mAb11801 и mAb H1-8/L1-9 FMEH-PLA (фиг. 44). Кроме того, выполняли анализ для оценки фармакодинамики mAb11801 и mAb H1-8/L1-9 FMEH-PLA у мышей FcRn/SCID, которые были генетически модифицированы для экспрессии человеческого C5, используя анализ лизиса эритроцитов курицы, опосредованного активацией комплемента по классическому пути. Кроме того, выполняли анализ для изучения уровня общего C5 в плазме мышей FcRn/SCID, которые были генетически модифицированы для экспрессии человеческого C5 после инъекции мышам mAb11801 и mAb H1-8/L1-9 FMEH-PLA (фиг. 45).
Ниже описаны материалы и методы, использованные в этих примерах.
Сэндвич-ELISA для обнаружения человеческого C5 у мышей
Сэндвич-ELISA для обнаружения человеческого C5 у мышей NOD/SCID или FcRn/SCID, экспрессирующих человеческий C5, после гидродинамической инъекции плазмиды кДНК человеческого C5: 96-луночные планшеты покрывали антителом к человеческому C5 (Quidel, A217) с конечной концентрацией 2 мкг/мл в бикарбонатном буфере при 37°C в течение 1 часа. После промывок PBS, содержащим 0,05% твин-20, планшеты инкубировали с разбавленными образцами плазмы в блокирующем растворе при комнатной температуре в течение 1 часа. После промывки планшеты инкубировали с биотинилированным mAb 9G6 к человеческому C5 в блокирующем растворе при комнатной температуре в течение 1 часа, снова промывали и инкубировали с авидином или стрептавидином, конъюгированными с пероксидазой хрена (BD Pharmigen), в блокирующем растворе при комнатной температуре в течение 1 часа. После окончательной промывки планшеты проявляли субстратом HRP в течение 3 мин. Реакцию останавливали 2 н. H2SO4, и планшет считывали при 450 нм в считывающем устройстве для микропланшетов. Сэндвич-ELISA для обнаружения человеческого IgG4 у мышей.
Сэндвич-ИФА для обнаружения человеческого IgG4
Сэндвич-ELISA для обнаружения человеческого IgG4 у мышей, обработанных IgG4 mAb к человеческому C5: 96-луночные планшеты покрывали антителом к легкой каппа-цепи человека (Antibody Solutions, AS75-P) с конечной концентрацией 2 мкг/мл в бикарбонатном буфере при 37°C в течение 1 часа. После трех промывок PBS, содержащим 0,05% твин-20, планшеты инкубировали с разбавленными образцами плазмы в блокирующем растворе при комнатной температуре в течение 1 часа. После промывки планшеты инкубировали с античеловеческим IgG4, конъюгированным с HRP (разведение 1:2000, Invitrogen, A10654), в блокирующем растворе при комнатной температуре в течение 1 часа. После промывки планшеты проявляли субстратом HRP в течение 3 мин. Реакцию останавливали 2 н. H2SO4, и планшет считывали при 450 нм в считывающем устройстве для микропланшетов.
Тест на лизис эритроцитов барана
Эритроциты барана (1×107 клеток на образец для анализа, приготовленный в PBS, Complement Technology Inc.) инкубировали при 37°C в течение 20 мин с 50% нормальной сывороткой человека (NHS, от Complement Technology Inc) в желатиновом верональном буфере (GVB2+, Sigma; общий анализируемый объем: 100 мкл). Перед добавлением к эритроцитам барана NHS предварительно инкубировали с анти-С5 mAb в течение 1 часа при 4°C. Реакцию лизиса останавливали добавлением ледяной 40 мМ EDTA в PBS. Смеси для инкубации центрифугировали в течение 5 мин при 1500 об/мин, супернатант собирали и измеряли OD при 405 нм. Образцы без NHS или с добавлением EDTA использовали в качестве отрицательного контроля лизиса, а образец эритроцитов барана, полностью лизированных дистиллированной водой, использовали в качестве положительного контроля (100% лизис), относительно которого нормализовали % лизиса в других образцах.
Анализ лизиса эритроцитов курицы
Эритроциты курицы (Rockland Immunochemicals Inc # R401-0050) сенсибилизировали антителом к куриным эритроцитам (Rockland Immunochemicals Inc # 103-4139) (150 мкг/мл) в течение 30 минут и дважды промывали буфером GVB. Плазму с лепирудином C5-гуманизированных мышей, предварительно обработанную mAb BB5.1 для блокирования активности мышиного C5, и образцы сыворотки человека, обедненные по C5 (Quidel # A501), разбавляли до 10% в буфере GVB (т.е. до конечного аналитического объема от 5 до 50 мл) и смешивали с 5 мл сенсибилизированных антителами клеток cRBC ul (5*10E8/мл) в конечном объеме 50 мл, и инкубировали при 37°C в течение 30 мин. Реакцию останавливали 100 мл холодного 10 мМ EDTA в PBS. Клетки центрифугировали при 1500 об/мин в течение 5 мин при 4°C. OD собранного супернатанта измеряли при 405.
Конструирование плазмиды транспозона человеческого С5
кДНК C5 из pCMV Sport6 субклонировали в вектор pCAGGS по сайту EcoRI. Последовательность распознавания транспозона SB IR/DR(L) клонировали в 5’-участок энхансера на участке Hinc II и последовательность распознавания транспозона SB IR/DR(R) клонировали в 3’-участок после участка rBG Stu I методом инфузионного клонирования. Для гидродинамической инъекции мышам NOD/SCD или мышам FcRn/SCID (B6.Cg-Fcgrttm1Dcr Prkdcscid Tg(FCGRT)32Dcr/DcrJ) инъецировали 2 мкг плазмиды pCMV-T7-SB100 и 25 мкг hC5 в сайты pCAGGS с участками транспозона в хвостовую вену. Эффективность трансфекции проверяли через день 1 с помощью hC5 ELISA. Стабильную интеграцию и постоянную экспрессию человеческого C5 снова проверяли с помощью hC5 ELISA через 2 недели после инъекции.
Гистидиновое сканирование
Гистидиновое сканирование гуманизированного mAb 2G1 (VH-11801 и VL-1901): клетки HEK в 24-луночных планшетах трансфицировали 1 мкг VH и 2 мкг плазмиды VL с использованием 8 мкл реагента для трансфекции ДНК X-TremeGene HP (Roche # 6366546001). Супернатант собирали через 2 дня после трансфекции и использовали для анализа с помощью системы Octet. pH-зависимую диссоциацию гистидиновых мутантов 11801 анализировали методом биослойной интерферометрии на приборе Octet Red E (ForteBio Inc.). Биосенсоры к человеческому IgG (ForteBio № 18-5060). Антитела захватывали сенсорами, погружая их в 200 мкл супернатанта для трансфекции на 600 секунд. Позже эти биосенсоры инкубировали с hC5 в течение 600 секунд, после чего диссоциировали при pH 7,4 и pH 5,8.
Экономный мутагенез
Для идентификации точечной мутации в виде замены аминокислоты, которая улучшает связывание C5 при pH 7,4, все 6 определяющих комплементарность областей (CDR) mAb H1-8/L1-9 отдельно мутировали на другие 19 аминокислот методом сайт-направленного мутагенеза. Олигонуклеотиды, кодирующие сгенерированную мутацию для каждого положения, использовали для введения мутаций в целевое положение CDR с помощью QuikChange® (Agilent) или сайт-направленного мутагенеза Q5® (NEB). Для скрининга варианта с улучшенным связыванием отбирали 88 клонов из каждой трансфицированной реакции, и scFv, секретируемый клетками E. coli в среду, тестировали с помощью ELISA с захватом. В ELISA с захватом титрованное количество анти-Fd антитела использовали для покрытия лунок для захвата scFv из супернатанта бактерий. После этого следовала инкубация с биотинилированным антигеном. Сигнал связывания детектировали с помощью конъюгированного с HRP анти-Lc антитела с последующей инкубацией с субстратом тетра-метилбензидина (TMB). Реакцию останавливали добавлением 0,2 М H2SO4, и планшеты считывали при 450 нм. Отбирали клоны, демонстрирующие сигнал оптической плотности (OD) при 450 нм выше, чем у родительского клона. ScFv из повторно выращенного супернатанта повторно анализировали с помощью ELISA (как указано выше) в двух экземплярах для подтверждения положительных результатов. Клоны с улучшенным связыванием дополнительно подтверждали с помощью ELISA в формате прямого связывания, где антигеном покрывали лунки планшета для ELISA, и использовали рассчитанное количество scFv, определенное количественным анализом scFv ELISA. Клоны, которые неоднократно демонстрировали более высокое связывание, чем родительский scFv, секвенировали.
Измерение pH-зависимого связывания/диссоциации
pH-зависимое связывание мутантов H1-8L1-9 с созревшим сродством: 2-3×10E6/мл ExpiCHO высевали в 24-луночные планшеты и трансфицировали 2 мкг VH и 4 мкг плазмиды VL с использованием 8 мкл реагента для трансфекции ДНК X-TremeGene HP. (Roche № 6366546001). Супернатант собирали через 2 дня после трансфекции и использовали для анализа с помощью системы Octet. pH-зависимую диссоциацию гистидиновых мутантов анализировали с помощью биослойной интерферометрии на приборе Octet Red E (ForteBio Inc.). Стрептавидиновые биосенсоры (ForteBio № 18-5019) покрывали 3 мкг/мл биотинилированным Fab античеловеческого IgG4 (Thermo fisher # 7102902100) на 250-300 секунд и гасили 2 мМ биоцитином в течение 600 секунд. Эти биосенсоры инкубировали с 10 мкг/мл hC5 (Complement tech # A320) в течение 600 секунд для насыщения неспецифического связывания hC5 с биосенсорами. Антитела захватывали сенсорами, погружая их в 200 мкл супернатанта для трансфекции на 600 секунд. Позже эти биосенсоры инкубировали с hC5 в течение 600 секунд, после чего диссоциировали при pH 7,4 и pH 5,8.
Крупномасштабная трансфекция
Протокол крупномасштабной трансфекции ExpiCHO: для крупномасштабного производства mAb для исследования in vivo использовали систему трансфекции ExpiCHO (Gibco # A29133) в соответствии с инструкциями производителя, используя протокол максимального титра. Для 200 мл среды Expi CHO для трансфекции использовали 150 мкг VH и 300 мкг VL.
In vivo эксперименты по фармакокинетике (PK) и фармакодинамике (PD)
Мышей NOD/SCID или FcRn/SCID, экспрессирующих человеческий C5 в результате гидродинамической инъекции кДНК человеческого C5 в хвостовую вену, подвергали скринингу, и мышей, у которых экспрессия человеческого C5 в крови составляла 75-100 мкг/мл, использовали для PK/PD исследований. Мышам вводили mAb (формат человеческого IgG4) внутривенно в дозе 40 мг/кг, и образцы крови с антикоагулянтом Лепирудином (Lepirudin) собирали ретроорбитальным способом до инъекции mAb и в различные моменты времени после инъекции. Уровни в плазме человеческих IgG и C5 в собранных образцах определяли с помощью ELISA, а фармакодинамику введенных mAb оценивали с помощью теста лизиса эритроцитов курицы.
Раскрытие всех без исключения патентов, патентных заявок и публикаций, цитируемых в настоящем описании, тем самым полностью включены в настоящее описание посредством ссылки.
Хотя настоящее изобретение было раскрыто со ссылкой на конкретные варианты осуществления, очевидно, что другие варианты осуществления и изменения настоящего изобретения могут быть разработаны другими специалистами в данной области без отклонения от сути и объема изобретения. Прилагаемая формула изобретения включает всех таких вариантов осуществления и эквивалентных изменений.
--->
СПИСКИ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ДЗЕ ТРАСТИЗ ОФ ДЗЕ ЮНИВЕРСИТИ ОФ ПЕНСИЛЬВАНИЯ
СУН, Вэньчао
МИВА, Такаси
ГУЛЛИПАЛЛИ, Дамодар
ЦЗУИ, Пин
<120> ГУМАНИЗИРОВАННЫЕ АНТИ-C5 АНТИТЕЛА И ИХ ПРИМЕНЕНИЕ
<130> 046483-6167-00WO
<150> 62/727,666
<151> 2018-09-06
<150> 62/837,833
<151> 2019-04-24
<160> 70
<170> PatentIn version 3.5
<210> 1
<211> 482
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность VH-11801 гуманизированного 2G1
<400> 1
cagcatatga tcagtgtcct ctccaaagtc cttgaacata gactctaacc atggactgga 60
cctgggtctt tctcttcctc ctgtcagtaa ctgcaggtgt ccactcccag gttcagctgg 120
tgcagtctgg agctgaggtg aagaagcctg gggcctcagt gaaggtctcc tgcaaggctt 180
ctggatacac aatcacagac tacaatttgg actgggtgcg acaggcccct ggacaagggc 240
ttgagtggat gggagatatt agtcctaact atggttatac tatctacaac cagaaattca 300
aggacagagt caccatgacc acagacacat ccacgagcac agcctacatg gagctgagga 360
gcctgagatc tgacgacacg gccgtgtatt actgtgcgag aagggacatt cgttactccg 420
gtaattccta caaatggtac ttcgatgtct ggggccaagg gacaatggtc accgtctctt 480
ca 482
<210> 2
<211> 144
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность VH-11801 гуманизированного 2G1
<400> 2
Met Asp Trp Thr Trp Val Phe Leu Phe Leu Leu Ser Val Thr Ala Gly
1 5 10 15
Val His Ser Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys
20 25 30
Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Ile
35 40 45
Thr Asp Tyr Asn Leu Asp Trp Val Arg Gln Ala Pro Gly Gln Gly Leu
50 55 60
Glu Trp Met Gly Asp Ile Ser Pro Asn Tyr Gly Tyr Thr Ile Tyr Asn
65 70 75 80
Gln Lys Phe Lys Asp Arg Val Thr Met Thr Thr Asp Thr Ser Thr Ser
85 90 95
Thr Ala Tyr Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val
100 105 110
Tyr Tyr Cys Ala Arg Arg Asp Ile Arg Tyr Ser Gly Asn Ser Tyr Lys
115 120 125
Trp Tyr Phe Asp Val Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
130 135 140
<210> 3
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR1 VH-11801 гуманизированного
2G1
<400> 3
Gly Tyr Thr Ile Thr Asp Tyr Asn Leu Asp
1 5 10
<210> 4
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR2 VH-11801 гуманизированного
2G1
<400> 4
Asp Ile Ser Pro Asn Tyr Gly Tyr Thr Ile Tyr Asn Gln Lys Phe Lys
1 5 10 15
Asp
<210> 5
<211> 16
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR3 VH-11801 гуманизированного
2G1
<400> 5
Arg Asp Ile Arg Tyr Ser Gly Asn Ser Tyr Lys Trp Tyr Phe Asp Val
1 5 10 15
<210> 6
<211> 428
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность VL-1901 гуманизированного 2G1
<400> 6
gtcagagccc tggggaggaa ctgctcagtt aggacccaga gggaaccatg gaagccccag 60
ctcagcttct cttcctcctg ctactctggc tcccagatac caccggagac atccagttga 120
cccagtctcc atccttcctg tctgcatctg taggagacag agtcaccatc acttgcagga 180
caagtaagag cataagcaaa tatttagcct ggtatcagca aaaaccaggg aaagccccta 240
agctcctgat ctattctgga tccaccttgc aatctggggt cccatcaagg ttcagcggca 300
gtggatctgg gacagaattc actctcacaa tcagcagcct gcagcctgaa gattttgcaa 360
cttattactg tcaacaacat aatgaatacc cgtacacgtt tggccagggg accaagctgg 420
agatcaaa 428
<210> 7
<211> 127
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность VL-1901 гуманизированного 2G1
<400> 7
Met Glu Ala Pro Ala Gln Leu Leu Phe Leu Leu Leu Leu Trp Leu Pro
1 5 10 15
Asp Thr Thr Gly Asp Ile Gln Leu Thr Gln Ser Pro Ser Phe Leu Ser
20 25 30
Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Thr Ser Lys Ser
35 40 45
Ile Ser Lys Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro
50 55 60
Lys Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro Ser
65 70 75 80
Arg Phe Ser Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser
85 90 95
Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Asn
100 105 110
Glu Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
115 120 125
<210> 8
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR1 VL-1901 гуманизированного
2G1
<400> 8
Arg Thr Ser Lys Ser Ile Ser Lys Tyr Leu Ala
1 5 10
<210> 9
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR2 VL-1901 гуманизированного
2G1
<400> 9
Ser Gly Ser Thr Leu Gln Ser
1 5
<210> 10
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR3 VL-1901 гуманизированного
2G1
<400> 10
Gln Gln His Asn Glu Tyr Pro Tyr Thr
1 5
<210> 11
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR3 варианта VL-1901
(мутация Q->H в CDR3) гуманизированного 2G1
<400> 11
His Gln His Asn Glu Tyr Pro Tyr Thr
1 5
<210> 12
<211> 428
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность варианта VL-1901
(мутация Q->H в CDR3) гуманизированного 2G1
<400> 12
gtcagagccc tggggaggaa ctgctcagtt aggacccaga gggaaccatg gaagccccag 60
ctcagcttct cttcctcctg ctactctggc tcccagatac caccggagac atccagttga 120
cccagtctcc atccttcctg tctgcatctg taggagacag agtcaccatc acttgcagga 180
caagtaagag cataagcaaa tatttagcct ggtatcagca aaaaccaggg aaagccccta 240
agctcctgat ctattctgga tccaccttgc aatctggggt cccatcaagg ttcagcggca 300
gtggatctgg gacagaattc actctcacaa tcagcagcct gcagcctgaa gattttgcaa 360
cttattactg tcatcaacat aatgaatacc cgtacacgtt tggccagggg accaagctgg 420
agatcaaa 428
<210> 13
<211> 127
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность варианта VL-1901
(мутация Q->H в CDR3) гуманизированного 2G1
<400> 13
Met Glu Ala Pro Ala Gln Leu Leu Phe Leu Leu Leu Leu Trp Leu Pro
1 5 10 15
Asp Thr Thr Gly Asp Ile Gln Leu Thr Gln Ser Pro Ser Phe Leu Ser
20 25 30
Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Thr Ser Lys Ser
35 40 45
Ile Ser Lys Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro
50 55 60
Lys Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro Ser
65 70 75 80
Arg Phe Ser Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser
85 90 95
Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys His Gln His Asn
100 105 110
Glu Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
115 120 125
<210> 14
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR1 варианта VL-1901 (мутация T-
>H в CDR1) гуманизированного 2G1
<400> 14
Arg His Ser Lys Ser Ile Ser Lys Tyr Leu Ala
1 5 10
<210> 15
<211> 428
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность варианта VL-1901
(мутация T->H в CDR1) гуманизированного 2G1
<400> 15
gtcagagccc tggggaggaa ctgctcagtt aggacccaga gggaaccatg gaagccccag 60
ctcagcttct cttcctcctg ctactctggc tcccagatac caccggagac atccagttga 120
cccagtctcc atccttcctg tctgcatctg taggagacag agtcaccatc acttgcaggc 180
atagtaagag cataagcaaa tatttagcct ggtatcagca aaaaccaggg aaagccccta 240
agctcctgat ctattctgga tccaccttgc aatctggggt cccatcaagg ttcagcggca 300
gtggatctgg gacagaattc actctcacaa tcagcagcct gcagcctgaa gattttgcaa 360
cttattactg tcaacaacat aatgaatacc cgtacacgtt tggccagggg accaagctgg 420
agatcaaa 428
<210> 16
<211> 127
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность варианта VL-1901
(мутация T->H в CDR1) гуманизированного 2G1
<400> 16
Met Glu Ala Pro Ala Gln Leu Leu Phe Leu Leu Leu Leu Trp Leu Pro
1 5 10 15
Asp Thr Thr Gly Asp Ile Gln Leu Thr Gln Ser Pro Ser Phe Leu Ser
20 25 30
Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg His Ser Lys Ser
35 40 45
Ile Ser Lys Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro
50 55 60
Lys Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro Ser
65 70 75 80
Arg Phe Ser Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser
85 90 95
Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Asn
100 105 110
Glu Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
115 120 125
<210> 17
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR1 варианта VH-11801
(мутация I->H в CDR1) гуманизированного 2G1
<400> 17
Gly Tyr Thr His Thr Asp Tyr Asn Leu Asp
1 5 10
<210> 18
<211> 482
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность варианта VH-11801
(мутация I->H в CDR1) гуманизированного 2G1
<400> 18
cagcatatga tcagtgtcct ctccaaagtc cttgaacata gactctaacc atggactgga 60
cctgggtctt tctcttcctc ctgtcagtaa ctgcaggtgt ccactcccag gttcagctgg 120
tgcagtctgg agctgaggtg aagaagcctg gggcctcagt gaaggtctcc tgcaaggctt 180
ctggatacac acatacagac tacaatttgg actgggtgcg acaggcccct ggacaagggc 240
ttgagtggat gggagatatt agtcctaact atggttatac tatctacaac cagaaattca 300
aggacagagt caccatgacc acagacacat ccacgagcac agcctacatg gagctgagga 360
gcctgagatc tgacgacacg gccgtgtatt actgtgcgag aagggacatt cgttactccg 420
gtaattccta caaatggtac ttcgatgtct ggggccaagg gacaatggtc accgtctctt 480
ca 482
<210> 19
<211> 144
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность варианта VH-11801
(мутация I->H в CDR1) гуманизированного 2G1
<400> 19
Met Asp Trp Thr Trp Val Phe Leu Phe Leu Leu Ser Val Thr Ala Gly
1 5 10 15
Val His Ser Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys
20 25 30
Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr His
35 40 45
Thr Asp Tyr Asn Leu Asp Trp Val Arg Gln Ala Pro Gly Gln Gly Leu
50 55 60
Glu Trp Met Gly Asp Ile Ser Pro Asn Tyr Gly Tyr Thr Ile Tyr Asn
65 70 75 80
Gln Lys Phe Lys Asp Arg Val Thr Met Thr Thr Asp Thr Ser Thr Ser
85 90 95
Thr Ala Tyr Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val
100 105 110
Tyr Tyr Cys Ala Arg Arg Asp Ile Arg Tyr Ser Gly Asn Ser Tyr Lys
115 120 125
Trp Tyr Phe Asp Val Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
130 135 140
<210> 20
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR1 варианта VH-11801
(мутация N->H в CDR1) гуманизированного 2G1
<400> 20
Gly Tyr Thr Ile Thr Asp Tyr His Leu Asp
1 5 10
<210> 21
<211> 482
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность варианта VH-11801 (мутация N->H
в CDR1) гуманизированного 2G1
<400> 21
cagcatatga tcagtgtcct ctccaaagtc cttgaacata gactctaacc atggactgga 60
cctgggtctt tctcttcctc ctgtcagtaa ctgcaggtgt ccactcccag gttcagctgg 120
tgcagtctgg agctgaggtg aagaagcctg gggcctcagt gaaggtctcc tgcaaggctt 180
ctggatacac aatcacagac taccatttgg actgggtgcg acaggcccct ggacaagggc 240
ttgagtggat gggagatatt agtcctaact atggttatac tatctacaac cagaaattca 300
aggacagagt caccatgacc acagacacat ccacgagcac agcctacatg gagctgagga 360
gcctgagatc tgacgacacg gccgtgtatt actgtgcgag aagggacatt cgttactccg 420
gtaattccta caaatggtac ttcgatgtct ggggccaagg gacaatggtc accgtctctt 480
ca 482
<210> 22
<211> 144
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность варианта VH-11801 (мутация N->H
в CDR1) гуманизированного 2G1
<400> 22
Met Asp Trp Thr Trp Val Phe Leu Phe Leu Leu Ser Val Thr Ala Gly
1 5 10 15
Val His Ser Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys
20 25 30
Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Ile
35 40 45
Thr Asp Tyr His Leu Asp Trp Val Arg Gln Ala Pro Gly Gln Gly Leu
50 55 60
Glu Trp Met Gly Asp Ile Ser Pro Asn Tyr Gly Tyr Thr Ile Tyr Asn
65 70 75 80
Gln Lys Phe Lys Asp Arg Val Thr Met Thr Thr Asp Thr Ser Thr Ser
85 90 95
Thr Ala Tyr Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val
100 105 110
Tyr Tyr Cys Ala Arg Arg Asp Ile Arg Tyr Ser Gly Asn Ser Tyr Lys
115 120 125
Trp Tyr Phe Asp Val Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
130 135 140
<210> 23
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR1 варианта VL-1901
(мутация Y->H в CDR1) гуманизированного 2G1
<400> 23
Arg Thr Ser Lys Ser Ile Ser Lys His Leu Ala
1 5 10
<210> 24
<211> 428
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность варианта VL-1901 (мутация Y->H
в CDR1) гуманизированного 2G1
<400> 24
gtcagagccc tggggaggaa ctgctcagtt aggacccaga gggaaccatg gaagccccag 60
ctcagcttct cttcctcctg ctactctggc tcccagatac caccggagac atccagttga 120
cccagtctcc atccttcctg tctgcatctg taggagacag agtcaccatc acttgcagga 180
caagtaagag cataagcaaa catttagcct ggtatcagca aaaaccaggg aaagccccta 240
agctcctgat ctattctgga tccaccttgc aatctggggt cccatcaagg ttcagcggca 300
gtggatctgg gacagaattc actctcacaa tcagcagcct gcagcctgaa gattttgcaa 360
cttattactg tcaacaacat aatgaatacc cgtacacgtt tggccagggg accaagctgg 420
agatcaaa 428
<210> 25
<211> 127
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность варианта VL-1901 (мутация Y->H
в CDR1) гуманизированного 2G1
<400> 25
Met Glu Ala Pro Ala Gln Leu Leu Phe Leu Leu Leu Leu Trp Leu Pro
1 5 10 15
Asp Thr Thr Gly Asp Ile Gln Leu Thr Gln Ser Pro Ser Phe Leu Ser
20 25 30
Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Thr Ser Lys Ser
35 40 45
Ile Ser Lys His Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro
50 55 60
Lys Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro Ser
65 70 75 80
Arg Phe Ser Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser
85 90 95
Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Asn
100 105 110
Glu Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
115 120 125
<210> 26
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR2 варианта VH-11801
(мутация Y->H в CDR2) гуманизированного 2G1
<400> 26
Asp Ile Ser Pro Asn His Gly Tyr Thr Ile Tyr Asn Gln Lys Phe Lys
1 5 10 15
Asp
<210> 27
<211> 482
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность варианта VH-11801 (мутация Y->H
в CDR2) гуманизированного 2G1
<400> 27
cagcatatga tcagtgtcct ctccaaagtc cttgaacata gactctaacc atggactgga 60
cctgggtctt tctcttcctc ctgtcagtaa ctgcaggtgt ccactcccag gttcagctgg 120
tgcagtctgg agctgaggtg aagaagcctg gggcctcagt gaaggtctcc tgcaaggctt 180
ctggatacac aatcacagac tacaatttgg actgggtgcg acaggcccct ggacaagggc 240
ttgagtggat gggagatatt agtcctaacc atggttatac tatctacaac cagaaattca 300
aggacagagt caccatgacc acagacacat ccacgagcac agcctacatg gagctgagga 360
gcctgagatc tgacgacacg gccgtgtatt actgtgcgag aagggacatt cgttactccg 420
gtaattccta caaatggtac ttcgatgtct ggggccaagg gacaatggtc accgtctctt 480
ca 482
<210> 28
<211> 144
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность варианта VH-11801 (мутация Y->H
в CDR2) гуманизированного 2G1
<400> 28
Met Asp Trp Thr Trp Val Phe Leu Phe Leu Leu Ser Val Thr Ala Gly
1 5 10 15
Val His Ser Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys
20 25 30
Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Ile
35 40 45
Thr Asp Tyr Asn Leu Asp Trp Val Arg Gln Ala Pro Gly Gln Gly Leu
50 55 60
Glu Trp Met Gly Asp Ile Ser Pro Asn His Gly Tyr Thr Ile Tyr Asn
65 70 75 80
Gln Lys Phe Lys Asp Arg Val Thr Met Thr Thr Asp Thr Ser Thr Ser
85 90 95
Thr Ala Tyr Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val
100 105 110
Tyr Tyr Cys Ala Arg Arg Asp Ile Arg Tyr Ser Gly Asn Ser Tyr Lys
115 120 125
Trp Tyr Phe Asp Val Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
130 135 140
<210> 29
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR3 варианта VL-1901
(мутация E->H в CDR3) гуманизированного 2G1
<400> 29
Gln Gln His Asn His Tyr Pro Tyr Thr
1 5
<210> 30
<211> 428
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность варианта VL-1901 (мутация E->H
в CDR3) гуманизированного 2G1
<400> 30
gtcagagccc tggggaggaa ctgctcagtt aggacccaga gggaaccatg gaagccccag 60
ctcagcttct cttcctcctg ctactctggc tcccagatac caccggagac atccagttga 120
cccagtctcc atccttcctg tctgcatctg taggagacag agtcaccatc acttgcagga 180
caagtaagag cataagcaaa tatttagcct ggtatcagca aaaaccaggg aaagccccta 240
agctcctgat ctattctgga tccaccttgc aatctggggt cccatcaagg ttcagcggca 300
gtggatctgg gacagaattc actctcacaa tcagcagcct gcagcctgaa gattttgcaa 360
cttattactg tcaacaacat aatcattacc cgtacacgtt tggccagggg accaagctgg 420
agatcaaa 428
<210> 31
<211> 127
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность варианта VL-1901 (мутация E->H
в CDR3) гуманизированного 2G1
<400> 31
Met Glu Ala Pro Ala Gln Leu Leu Phe Leu Leu Leu Leu Trp Leu Pro
1 5 10 15
Asp Thr Thr Gly Asp Ile Gln Leu Thr Gln Ser Pro Ser Phe Leu Ser
20 25 30
Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Thr Ser Lys Ser
35 40 45
Ile Ser Lys Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro
50 55 60
Lys Leu Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly Val Pro Ser
65 70 75 80
Arg Phe Ser Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser
85 90 95
Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln His Asn
100 105 110
His Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
115 120 125
<210> 32
<211> 327
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность константной области
тяжелой цепи человеческого IgG4
<400> 32
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Ser Cys Pro Ala Pro
100 105 110
Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
165 170 175
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
305 310 315 320
Leu Ser Leu Ser Pro Gly Lys
325
<210> 33
<211> 327
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность константной области
тяжелой цепи человеческого IgG4 с мутацией S228P
<400> 33
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
100 105 110
Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
165 170 175
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
305 310 315 320
Leu Ser Leu Ser Pro Gly Lys
325
<210> 34
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR2 варианта VH-11801
(мутация T->H в CDR2) гуманизированного 2G1
<400> 34
Asp Ile Ser Pro Asn Tyr Gly Tyr His Ile Tyr Asn Gln Lys Phe Lys
1 5 10 15
Asp
<210> 35
<211> 482
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность варианта VH-11801 (мутация T->H
в CDR2) гуманизированного 2G1
<400> 35
cagcatatga tcagtgtcct ctccaaagtc cttgaacata gactctaacc atggactgga 60
cctgggtctt tctcttcctc ctgtcagtaa ctgcaggtgt ccactcccag gttcagctgg 120
tgcagtctgg agctgaggtg aagaagcctg gggcctcagt gaaggtctcc tgcaaggctt 180
ctggatacac aatcacagac tacaatttgg actgggtgcg acaggcccct ggacaagggc 240
ttgagtggat gggagatatt agtcctaact atggttatca tatctacaac cagaaattca 300
aggacagagt caccatgacc acagacacat ccacgagcac agcctacatg gagctgagga 360
gcctgagatc tgacgacacg gccgtgtatt actgtgcgag aagggacatt cgttactccg 420
gtaattccta caaatggtac ttcgatgtct ggggccaagg gacaatggtc accgtctctt 480
ca 482
<210> 36
<211> 144
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность варианта VH-11801 (мутация T->H
в CDR2) гуманизированного 2G1
<400> 36
Met Asp Trp Thr Trp Val Phe Leu Phe Leu Leu Ser Val Thr Ala Gly
1 5 10 15
Val His Ser Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys
20 25 30
Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Ile
35 40 45
Thr Asp Tyr Asn Leu Asp Trp Val Arg Gln Ala Pro Gly Gln Gly Leu
50 55 60
Glu Trp Met Gly Asp Ile Ser Pro Asn Tyr Gly Tyr His Ile Tyr Asn
65 70 75 80
Gln Lys Phe Lys Asp Arg Val Thr Met Thr Thr Asp Thr Ser Thr Ser
85 90 95
Thr Ala Tyr Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val
100 105 110
Tyr Tyr Cys Ala Arg Arg Asp Ile Arg Tyr Ser Gly Asn Ser Tyr Lys
115 120 125
Trp Tyr Phe Asp Val Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
130 135 140
<210> 37
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR1 последовательности тяжелой
цепи варианта IWW mAb H1-8/L1-9 (мутация L->I в CDR1, мутация P->W в
CDR2, мутация V->W в CDR3)
<400> 37
Gly Tyr Thr Ile Thr Asp Tyr His Ile Asp
1 5 10
<210> 38
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR2 последовательности тяжелой
цепи варианта IWW mAb H1-8/L1-9 (мутация L->I в CDR1, мутация P->W в
CDR2, мутация V->W в CDR3)
<400> 38
Asp Ile Ser Trp Asn Tyr Gly Tyr Thr Ile Tyr Asn Gln Lys Phe Lys
1 5 10 15
Asp
<210> 39
<211> 16
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR3 последовательности тяжелой
цепи варианта IWW mAb H1-8/L1-9 (мутация L->I в CDR1, мутация P->W в
CDR2, мутация V->Wв CDR3)
<400> 39
Arg Asp Ile Arg Tyr Ser Gly Asn Ser Tyr Lys Trp Tyr Phe Asp Trp
1 5 10 15
<210> 40
<211> 482
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность последовательности тяжелой цепи
варианта IWW mAb H1-8/L1-9 (мутация L->Iв CDR1, мутация P->W в CDR2,
мутация V->W в CDR3)
<400> 40
cagcatatga tcagtgtcct ctccaaagtc cttgaacata gactctaacc atggactgga 60
cctgggtctt tctcttcctc ctgtcagtaa ctgcaggtgt ccactcccag gttcagctgg 120
tgcagtctgg agctgaggtg aagaagcctg gggcctcagt gaaggtctcc tgcaaggctt 180
ctggatacac aatcacagac taccatatcg actgggtgcg acaggcccct ggacaagggc 240
ttgagtggat gggagatatt agttggaact atggttatac tatctacaac cagaaattca 300
aggacagagt caccatgacc acagacacat ccacgagcac agcctacatg gagctgagga 360
gcctgagatc tgacgacacg gccgtgtatt actgtgcgag aagggacatt cgttactccg 420
gtaattccta caaatggtac ttcgattggt ggggccaagg gacaatggtc accgtctctt 480
ca 482
<210> 41
<211> 144
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность последовательности тяжелой цепи
варианта IWW mAb H1-8/L1-9 (мутация L->I в CDR1, мутация P->W в CDR2,
мутация V->W в CDR3)
<400> 41
Met Asp Trp Thr Trp Val Phe Leu Phe Leu Leu Ser Val Thr Ala Gly
1 5 10 15
Val His Ser Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys
20 25 30
Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Ile
35 40 45
Thr Asp Tyr His Ile Asp Trp Val Arg Gln Ala Pro Gly Gln Gly Leu
50 55 60
Glu Trp Met Gly Asp Ile Ser Trp Asn Tyr Gly Tyr Thr Ile Tyr Asn
65 70 75 80
Gln Lys Phe Lys Asp Arg Val Thr Met Thr Thr Asp Thr Ser Thr Ser
85 90 95
Thr Ala Tyr Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val
100 105 110
Tyr Tyr Cys Ala Arg Arg Asp Ile Arg Tyr Ser Gly Asn Ser Tyr Lys
115 120 125
Trp Tyr Phe Asp Trp Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
130 135 140
<210> 42
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR1 последовательности тяжелой
цепи варианта IFW mAb H1-8/L1-9 (мутация L->I в CDR1, мутация P->F в
CDR2, мутация V->W в CDR3)
<400> 42
Gly Tyr Thr Ile Thr Asp Tyr His Ile Asp
1 5 10
<210> 43
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR2 последовательности тяжелой
цепи варианта IFW mAb H1-8/L1-9 (мутация L->I в CDR1, мутация P->F в
CDR2, мутация V->W в CDR3)
<400> 43
Asp Ile Ser Phe Asn Tyr Gly Tyr Thr Ile Tyr Asn Gln Lys Phe Lys
1 5 10 15
Asp
<210> 44
<211> 16
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR3 последовательности тяжелой
цепи варианта IFW mAb H1-8/L1-9 (мутация L->I в CDR1, мутация P->F в
CDR2, мутация V->W в CDR3)
<400> 44
Arg Asp Ile Arg Tyr Ser Gly Asn Ser Tyr Lys Trp Tyr Phe Asp Trp
1 5 10 15
<210> 45
<211> 482
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность последовательности тяжелой цепи
варианта IFW mAb H1-8/L1-9 (мутация L->I в CDR1, мутация P->F в CDR2,
мутация V->W в CDR3)
<400> 45
cagcatatga tcagtgtcct ctccaaagtc cttgaacata gactctaacc atggactgga 60
cctgggtctt tctcttcctc ctgtcagtaa ctgcaggtgt ccactcccag gttcagctgg 120
tgcagtctgg agctgaggtg aagaagcctg gggcctcagt gaaggtctcc tgcaaggctt 180
ctggatacac aatcacagac taccatatcg actgggtgcg acaggcccct ggacaagggc 240
ttgagtggat gggagatatt agtttcaact atggttatac tatctacaac cagaaattca 300
aggacagagt caccatgacc acagacacat ccacgagcac agcctacatg gagctgagga 360
gcctgagatc tgacgacacg gccgtgtatt actgtgcgag aagggacatt cgttactccg 420
gtaattccta caaatggtac ttcgattggt ggggccaagg gacaatggtc accgtctctt 480
ca 482
<210> 46
<211> 144
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность последовательности тяжелой цепи
варианта IFW mAb H1-8/L1-9 (мутация L->I в CDR1, мутация P->F в CDR2,
мутация V->W в CDR3)
<400> 46
Met Asp Trp Thr Trp Val Phe Leu Phe Leu Leu Ser Val Thr Ala Gly
1 5 10 15
Val His Ser Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys
20 25 30
Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Ile
35 40 45
Thr Asp Tyr His Ile Asp Trp Val Arg Gln Ala Pro Gly Gln Gly Leu
50 55 60
Glu Trp Met Gly Asp Ile Ser Phe Asn Tyr Gly Tyr Thr Ile Tyr Asn
65 70 75 80
Gln Lys Phe Lys Asp Arg Val Thr Met Thr Thr Asp Thr Ser Thr Ser
85 90 95
Thr Ala Tyr Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val
100 105 110
Tyr Tyr Cys Ala Arg Arg Asp Ile Arg Tyr Ser Gly Asn Ser Tyr Lys
115 120 125
Trp Tyr Phe Asp Trp Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
130 135 140
<210> 47
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR1 последовательности тяжелой
цепи варианта FME mAb H1-8/L1-9 (мутация L->F в CDR1, мутация P->M в
CDR2, мутация V->E в CDR3)
<400> 47
Gly Tyr Thr Ile Thr Asp Tyr His Phe Asp
1 5 10
<210> 48
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR2 последовательности тяжелой
цепи варианта FME mAb H1-8/L1-9 (мутация L->F в CDR1, мутация P->M в
CDR2, мутация V->E в CDR3)
<400> 48
Asp Ile Ser Met Asn Tyr Gly Tyr Thr Ile Tyr Asn Gln Lys Phe Lys
1 5 10 15
Asp
<210> 49
<211> 16
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR3 последовательности тяжелой
цепи варианта FME mAb H1-8/L1-9 (мутация L->F в CDR1, мутация P->M в
CDR2, мутация V->E в CDR3)
<400> 49
Arg Asp Ile Arg Tyr Ser Gly Asn Ser Tyr Lys Trp Tyr Phe Asp Glu
1 5 10 15
<210> 50
<211> 482
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность последовательности тяжелой цепи
варианта FME mAb H1-8/L1-9 (мутация L->F в CDR1, мутация P->M в
CDR2, мутация V->E в CDR3)
<400> 50
cagcatatga tcagtgtcct ctccaaagtc cttgaacata gactctaacc atggactgga 60
cctgggtctt tctcttcctc ctgtcagtaa ctgcaggtgt ccactcccag gttcagctgg 120
tgcagtctgg agctgaggtg aagaagcctg gggcctcagt gaaggtctcc tgcaaggctt 180
ctggatacac aatcacagac taccatttcg actgggtgcg acaggcccct ggacaagggc 240
ttgagtggat gggagatatt agtatgaact atggttatac tatctacaac cagaaattca 300
aggacagagt caccatgacc acagacacat ccacgagcac agcctacatg gagctgagga 360
gcctgagatc tgacgacacg gccgtgtatt actgtgcgag aagggacatt cgttactccg 420
gtaattccta caaatggtac ttcgatgagt ggggccaagg gacaatggtc accgtctctt 480
ca 482
<210> 51
<211> 144
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность последовательности тяжелой цепи
варианта FME mAb H1-8/L1-9 (мутация L->F в CDR1, мутация P->M в
CDR2, мутация V->E в CDR3)
<400> 51
Met Asp Trp Thr Trp Val Phe Leu Phe Leu Leu Ser Val Thr Ala Gly
1 5 10 15
Val His Ser Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys
20 25 30
Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Ile
35 40 45
Thr Asp Tyr His Phe Asp Trp Val Arg Gln Ala Pro Gly Gln Gly Leu
50 55 60
Glu Trp Met Gly Asp Ile Ser Met Asn Tyr Gly Tyr Thr Ile Tyr Asn
65 70 75 80
Gln Lys Phe Lys Asp Arg Val Thr Met Thr Thr Asp Thr Ser Thr Ser
85 90 95
Thr Ala Tyr Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val
100 105 110
Tyr Tyr Cys Ala Arg Arg Asp Ile Arg Tyr Ser Gly Asn Ser Tyr Lys
115 120 125
Trp Tyr Phe Asp Glu Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
130 135 140
<210> 52
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR1 последовательности тяжелой
цепи варианта FMW mAb H1-8/L1-9 (мутация L->F в CDR1, мутация P->M в
CDR2, мутация V->W в CDR3)
<400> 52
Gly Tyr Thr Ile Thr Asp Tyr His Phe Asp
1 5 10
<210> 53
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR2 последовательности тяжелой
цепи варианта FMW mAb H1-8/L1-9 (мутация L->F в CDR1, мутация P->M в
CDR2, мутация V->W в CDR3)
<400> 53
Asp Ile Ser Met Asn Tyr Gly Tyr Thr Ile Tyr Asn Gln Lys Phe Lys
1 5 10 15
Asp
<210> 54
<211> 16
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR3 последовательности тяжелой
цепи варианта FMW mAb H1-8/L1-9 (мутация L->F в CDR1, мутация P->M в
CDR2, мутация V->W в CDR3)
<400> 54
Arg Asp Ile Arg Tyr Ser Gly Asn Ser Tyr Lys Trp Tyr Phe Asp Trp
1 5 10 15
<210> 55
<211> 482
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность последовательности тяжелой цепи
варианта FMW mAb H1-8/L1-9 (мутация L->F в CDR1, мутация P->M в
CDR2, мутация V->W в CDR3)
<400> 55
cagcatatga tcagtgtcct ctccaaagtc cttgaacata gactctaacc atggactgga 60
cctgggtctt tctcttcctc ctgtcagtaa ctgcaggtgt ccactcccag gttcagctgg 120
tgcagtctgg agctgaggtg aagaagcctg gggcctcagt gaaggtctcc tgcaaggctt 180
ctggatacac aatcacagac taccatttcg actgggtgcg acaggcccct ggacaagggc 240
ttgagtggat gggagatatt agtatgaact atggttatac tatctacaac cagaaattca 300
aggacagagt caccatgacc acagacacat ccacgagcac agcctacatg gagctgagga 360
gcctgagatc tgacgacacg gccgtgtatt actgtgcgag aagggacatt cgttactccg 420
gtaattccta caaatggtac ttcgattggt ggggccaagg gacaatggtc accgtctctt 480
ca 482
<210> 56
<211> 144
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность последовательности тяжелой цепи
варианта FMW mAb H1-8/L1-9 (мутация L->F в CDR1, мутация P->M в
CDR2, мутация V->W в CDR3)
<400> 56
Met Asp Trp Thr Trp Val Phe Leu Phe Leu Leu Ser Val Thr Ala Gly
1 5 10 15
Val His Ser Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys
20 25 30
Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Ile
35 40 45
Thr Asp Tyr His Phe Asp Trp Val Arg Gln Ala Pro Gly Gln Gly Leu
50 55 60
Glu Trp Met Gly Asp Ile Ser Met Asn Tyr Gly Tyr Thr Ile Tyr Asn
65 70 75 80
Gln Lys Phe Lys Asp Arg Val Thr Met Thr Thr Asp Thr Ser Thr Ser
85 90 95
Thr Ala Tyr Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val
100 105 110
Tyr Tyr Cys Ala Arg Arg Asp Ile Arg Tyr Ser Gly Asn Ser Tyr Lys
115 120 125
Trp Tyr Phe Asp Trp Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
130 135 140
<210> 57
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR2 последовательности тяжелой
цепи варианта FMEH mAb H1-8/L1-9 (мутация L->F в CDR1, мутации P->M
и T->H в CDR2, мутация V->E в CDR3)
<400> 57
Asp Ile Ser Met Asn Tyr Gly Tyr His Ile Tyr Asn Gln Lys Phe Lys
1 5 10 15
Asp
<210> 58
<211> 482
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность последовательности тяжелой цепи
варианта FMEH mAb H1-8/L1-9 (мутация L->F в CDR1, мутации P->M
и T->H в CDR2, мутация V->E в CDR3)
<400> 58
cagcatatga tcagtgtcct ctccaaagtc cttgaacata gactctaacc atggactgga 60
cctgggtctt tctcttcctc ctgtcagtaa ctgcaggtgt ccactcccag gttcagctgg 120
tgcagtctgg agctgaggtg aagaagcctg gggcctcagt gaaggtctcc tgcaaggctt 180
ctggatacac aatcacagac taccatttcg actgggtgcg acaggcccct ggacaagggc 240
ttgagtggat gggagatatt agtatgaact atggttatca tatctacaac cagaaattca 300
aggacagagt caccatgacc acagacacat ccacgagcac agcctacatg gagctgagga 360
gcctgagatc tgacgacacg gccgtgtatt actgtgcgag aagggacatt cgttactccg 420
gtaattccta caaatggtac ttcgatgagt ggggccaagg gacaatggtc accgtctctt 480
ca 482
<210> 59
<211> 144
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность последовательности тяжелой цепи
варианта FMEH mAb H1-8/L1-9 (мутация L->F в CDR1, мутации P->M
и T->H в CDR2, мутация V->E в CDR3)
<400> 59
Met Asp Trp Thr Trp Val Phe Leu Phe Leu Leu Ser Val Thr Ala Gly
1 5 10 15
Val His Ser Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys
20 25 30
Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Ile
35 40 45
Thr Asp Tyr His Phe Asp Trp Val Arg Gln Ala Pro Gly Gln Gly Leu
50 55 60
Glu Trp Met Gly Asp Ile Ser Met Asn Tyr Gly Tyr His Ile Tyr Asn
65 70 75 80
Gln Lys Phe Lys Asp Arg Val Thr Met Thr Thr Asp Thr Ser Thr Ser
85 90 95
Thr Ala Tyr Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val
100 105 110
Tyr Tyr Cys Ala Arg Arg Asp Ile Arg Tyr Ser Gly Asn Ser Tyr Lys
115 120 125
Trp Tyr Phe Asp Glu Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
130 135 140
<210> 60
<211> 984
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность с мутацией PLA в Fc-домене
человеческого IgG4
<400> 60
gctagcacca agggcccatc ggtcttcccc ctggcgccct gctccaggag cacctccgag 60
agcacagccg ccctgggctg cctggtcaag gactacttcc ccgaaccggt gacggtgtcg 120
tggaactcag gcgccctgac cagcggcgtg cacaccttcc cggctgtcct acagtcctca 180
ggactctact ccctcagcag cgtggtgacc gtgccctcca gcagcttggg cacgaagacc 240
tacacctgca acgtagatca caagcccagc aacaccaagg tggacaagag agttgagtcc 300
aaatatggtc ccccatgccc accatgccca gcacctgagt tcctgggggg accatcagtc 360
ttcctgttcc ccccaaaacc caaggacact ctcatgatct cccggacccc tgaggtcacg 420
tgcgtggtgg tggacgtgag ccaggaagac cccgaggtcc agttcaactg gtacgtggat 480
ggcgtggagg tgcataatgc caagacaaag ccgcgggagg agcagttcaa cagcacgtac 540
cgtgtggtca gcgtcctcac cgtcctgcac caggactggc tgaacggcaa ggagtacaag 600
tgcaaggtct ccaacaaagg cctcccgtcc tccatcgaga aaaccatctc caaagccaaa 660
gggcagcccc gagagccaca ggtgtacacc ctgcccccat cccaggagga gatgaccaag 720
aaccaggtca gcctgacctg cctggtcaaa ggcttctacc ccagcgacat cgccgtggag 780
tgggagagca atgggcagcc ggagaacaac tacaagacca cgcctcccgt gctggactcc 840
gacggctcct tcttcctcta cagcaggctc accgtggaca agagcaggtg gcaggagggg 900
aatgtcttct catgctccgt gctgcatgag gctctgcacg cccactacac acagaagagc 960
ctctccctgt ctctgggtaa atga 984
<210> 61
<211> 327
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность с мутацией PLA в Fc-домене
человеческого IgG4
<400> 61
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
100 105 110
Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
165 170 175
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Leu His Glu Ala Leu His Ala His Tyr Thr Gln Lys Ser
305 310 315 320
Leu Ser Leu Ser Leu Gly Lys
325
<210> 62
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR2 последовательности тяжелой
цепи варианта IWWH mAb H1-8/L1-9 (мутация L->I в CDR1, мутации
P->W и T->H в CDR2, мутация V->W в CDR3)
<400> 62
Asp Ile Ser Trp Asn Tyr Gly Tyr His Ile Tyr Asn Gln Lys Phe Lys
1 5 10 15
Asp
<210> 63
<211> 482
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность последовательности тяжелой цепи
варианта IWWH mAb H1-8/L1-9 (мутация L->I в CDR1, мутации P->W и
T->H в CDR2, мутация V->W в CDR3)
<400> 63
cagcatatga tcagtgtcct ctccaaagtc cttgaacata gactctaacc atggactgga 60
cctgggtctt tctcttcctc ctgtcagtaa ctgcaggtgt ccactcccag gttcagctgg 120
tgcagtctgg agctgaggtg aagaagcctg gggcctcagt gaaggtctcc tgcaaggctt 180
ctggatacac aatcacagac taccatatcg actgggtgcg acaggcccct ggacaagggc 240
ttgagtggat gggagatatt agttggaact atggttatca tatctacaac cagaaattca 300
aggacagagt caccatgacc acagacacat ccacgagcac agcctacatg gagctgagga 360
gcctgagatc tgacgacacg gccgtgtatt actgtgcgag aagggacatt cgttactccg 420
gtaattccta caaatggtac ttcgattggt ggggccaagg gacaatggtc accgtctctt 480
ca 482
<210> 64
<211> 144
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность последовательности тяжелой цепи
варианта IWWH mAb H1-8/L1-9 (мутация L->I в CDR1, мутации P->W и
T->H в CDR2, мутация V->W в CDR3)
<400> 64
Met Asp Trp Thr Trp Val Phe Leu Phe Leu Leu Ser Val Thr Ala Gly
1 5 10 15
Val His Ser Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys
20 25 30
Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Ile
35 40 45
Thr Asp Tyr His Ile Asp Trp Val Arg Gln Ala Pro Gly Gln Gly Leu
50 55 60
Glu Trp Met Gly Asp Ile Ser Trp Asn Tyr Gly Tyr His Ile Tyr Asn
65 70 75 80
Gln Lys Phe Lys Asp Arg Val Thr Met Thr Thr Asp Thr Ser Thr Ser
85 90 95
Thr Ala Tyr Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val
100 105 110
Tyr Tyr Cys Ala Arg Arg Asp Ile Arg Tyr Ser Gly Asn Ser Tyr Lys
115 120 125
Trp Tyr Phe Asp Trp Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
130 135 140
<210> 65
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR2 последовательности тяжелой
цепи варианта IFWH mAb H1-8/L1-9 (мутации L->I в CDR1, мутаций P->F и
T->H в CDR2, мутации V->W в CDR3)
<400> 65
Asp Ile Ser Phe Asn Tyr Gly Tyr His Ile Tyr Asn Gln Lys Phe Lys
1 5 10 15
Asp
<210> 66
<211> 482
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность последовательности тяжелой цепи
варианта IFWH mAb H1-8/L1-9 (мутации L->I в CDR1, мутаций P->F и
T->H в CDR2, мутации V->W в CDR3)
<400> 66
cagcatatga tcagtgtcct ctccaaagtc cttgaacata gactctaacc atggactgga 60
cctgggtctt tctcttcctc ctgtcagtaa ctgcaggtgt ccactcccag gttcagctgg 120
tgcagtctgg agctgaggtg aagaagcctg gggcctcagt gaaggtctcc tgcaaggctt 180
ctggatacac aatcacagac taccatatcg actgggtgcg acaggcccct ggacaagggc 240
ttgagtggat gggagatatt agtttcaact atggttatca tatctacaac cagaaattca 300
aggacagagt caccatgacc acagacacat ccacgagcac agcctacatg gagctgagga 360
gcctgagatc tgacgacacg gccgtgtatt actgtgcgag aagggacatt cgttactccg 420
gtaattccta caaatggtac ttcgattggt ggggccaagg gacaatggtc accgtctctt 480
ca 482
<210> 67
<211> 144
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность последовательности тяжелой цепи
варианта IFWH mAb H1-8/L1-9 (мутации L->I в CDR1, мутаций P->F и
T->H в CDR2, мутации V->W в CDR3)
<400> 67
Met Asp Trp Thr Trp Val Phe Leu Phe Leu Leu Ser Val Thr Ala Gly
1 5 10 15
Val His Ser Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys
20 25 30
Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Ile
35 40 45
Thr Asp Tyr His Ile Asp Trp Val Arg Gln Ala Pro Gly Gln Gly Leu
50 55 60
Glu Trp Met Gly Asp Ile Ser Phe Asn Tyr Gly Tyr His Ile Tyr Asn
65 70 75 80
Gln Lys Phe Lys Asp Arg Val Thr Met Thr Thr Asp Thr Ser Thr Ser
85 90 95
Thr Ala Tyr Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val
100 105 110
Tyr Tyr Cys Ala Arg Arg Asp Ile Arg Tyr Ser Gly Asn Ser Tyr Lys
115 120 125
Trp Tyr Phe Asp Trp Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
130 135 140
<210> 68
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность CDR2 последовательности тяжелой
цепи варианта FMWH mAb H1-8/L1-9 (мутация L->F в CDR1, мутации
P->M и T->H в CDR2, мутация V->W в CDR3)
<400> 68
Asp Ile Ser Met Asn Tyr Gly Tyr His Ile Tyr Asn Gln Lys Phe Lys
1 5 10 15
Asp
<210> 69
<211> 482
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность последовательности тяжелой цепи
варианта FMWH mAb H1-8/L1-9 (мутация L->F в CDR1, мутации P->M и
T->H в CDR2, мутация V->W в CDR3)
<400> 69
cagcatatga tcagtgtcct ctccaaagtc cttgaacata gactctaacc atggactgga 60
cctgggtctt tctcttcctc ctgtcagtaa ctgcaggtgt ccactcccag gttcagctgg 120
tgcagtctgg agctgaggtg aagaagcctg gggcctcagt gaaggtctcc tgcaaggctt 180
ctggatacac aatcacagac taccatttcg actgggtgcg acaggcccct ggacaagggc 240
ttgagtggat gggagatatt agtatgaact atggttatca tatctacaac cagaaattca 300
aggacagagt caccatgacc acagacacat ccacgagcac agcctacatg gagctgagga 360
gcctgagatc tgacgacacg gccgtgtatt actgtgcgag aagggacatt cgttactccg 420
gtaattccta caaatggtac ttcgattggt ggggccaagg gacaatggtc accgtctctt 480
ca 482
<210> 70
<211> 144
<212> Белок
<213> Искусственная последовательность
<220>
<223> Аминокислотная последовательность последовательности тяжелой цепи
варианта FMWH mAb H1-8/L1-9 (мутация L->F в CDR1, мутации P->M и
T->H в CDR2, мутация V->W в CDR3)
<400> 70
Met Asp Trp Thr Trp Val Phe Leu Phe Leu Leu Ser Val Thr Ala Gly
1 5 10 15
Val His Ser Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys
20 25 30
Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Ile
35 40 45
Thr Asp Tyr His Phe Asp Trp Val Arg Gln Ala Pro Gly Gln Gly Leu
50 55 60
Glu Trp Met Gly Asp Ile Ser Met Asn Tyr Gly Tyr His Ile Tyr Asn
65 70 75 80
Gln Lys Phe Lys Asp Arg Val Thr Met Thr Thr Asp Thr Ser Thr Ser
85 90 95
Thr Ala Tyr Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val
100 105 110
Tyr Tyr Cys Ala Arg Arg Asp Ile Arg Tyr Ser Gly Asn Ser Tyr Lys
115 120 125
Trp Tyr Phe Asp Trp Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
130 135 140
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИ-C5 АНТИТЕЛА И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2774716C2 |
| АНТИ-C5a-АНТИТЕЛА И ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2773779C2 |
| НЕВИРУСНЫЙ ИММУНОТАРГЕТИНГ | 2020 |
|
RU2833379C2 |
| АНТИТЕЛА, НАЦЕЛЕННЫЕ НА АНТИГЕН СОЗРЕВАНИЯ В-КЛЕТОК, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2766094C2 |
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА К TIM-3 ЧЕЛОВЕКА | 2019 |
|
RU2777336C1 |
| БЕЛКИ, СВЯЗЫВАЮЩИЕ ГЛЮКАГОНОВЫЕ РЕЦЕПТОРЫ, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2820628C2 |
| ЛЕЧЕНИЕ РАКА С ИСПОЛЬЗОВАНИЕМ ХИМЕРНОГО АНТИГЕННОГО РЕЦЕПТОРА CLL-1 | 2015 |
|
RU2741120C2 |
| БИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО | 2020 |
|
RU2814713C2 |
| Анти-LAG-3 антитела | 2016 |
|
RU2760582C2 |
| АНТИТЕЛА ПРОТИВ ПРЕДСТАВИТЕЛЯ А5 СЕМЕЙСТВА 19 СО СХОДСТВОМ ПОСЛЕДОВАТЕЛЬНОСТЕЙ И СПОСОБ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2785436C2 |


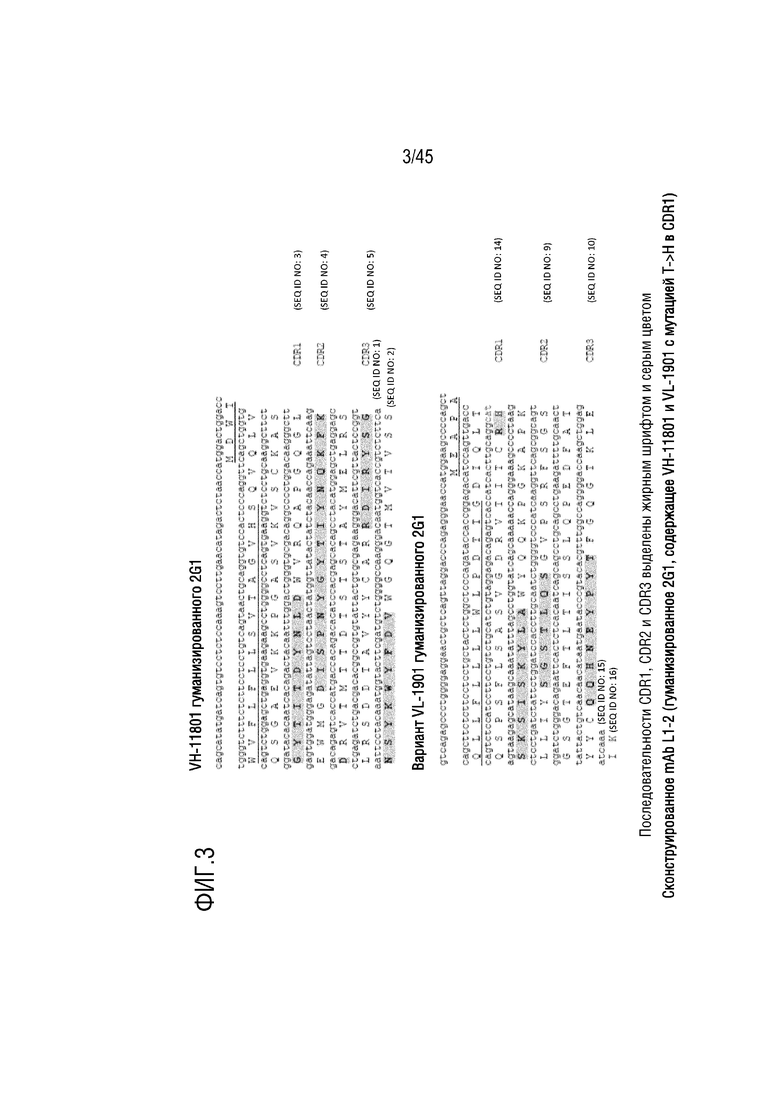



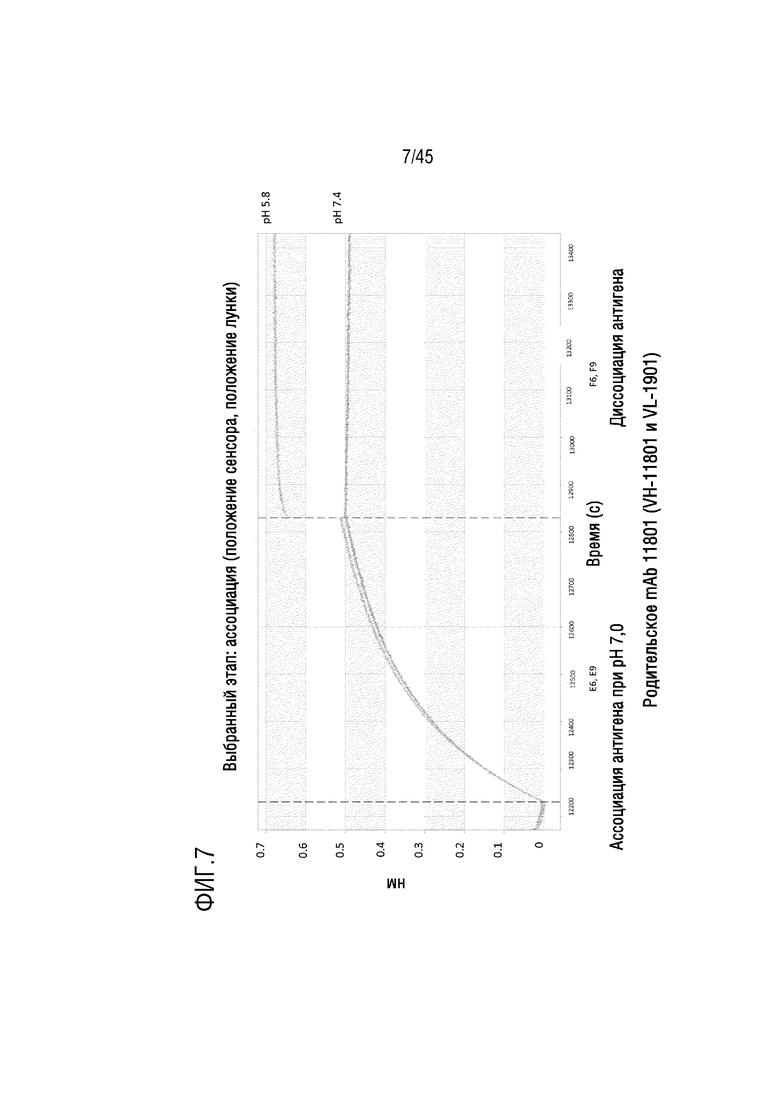
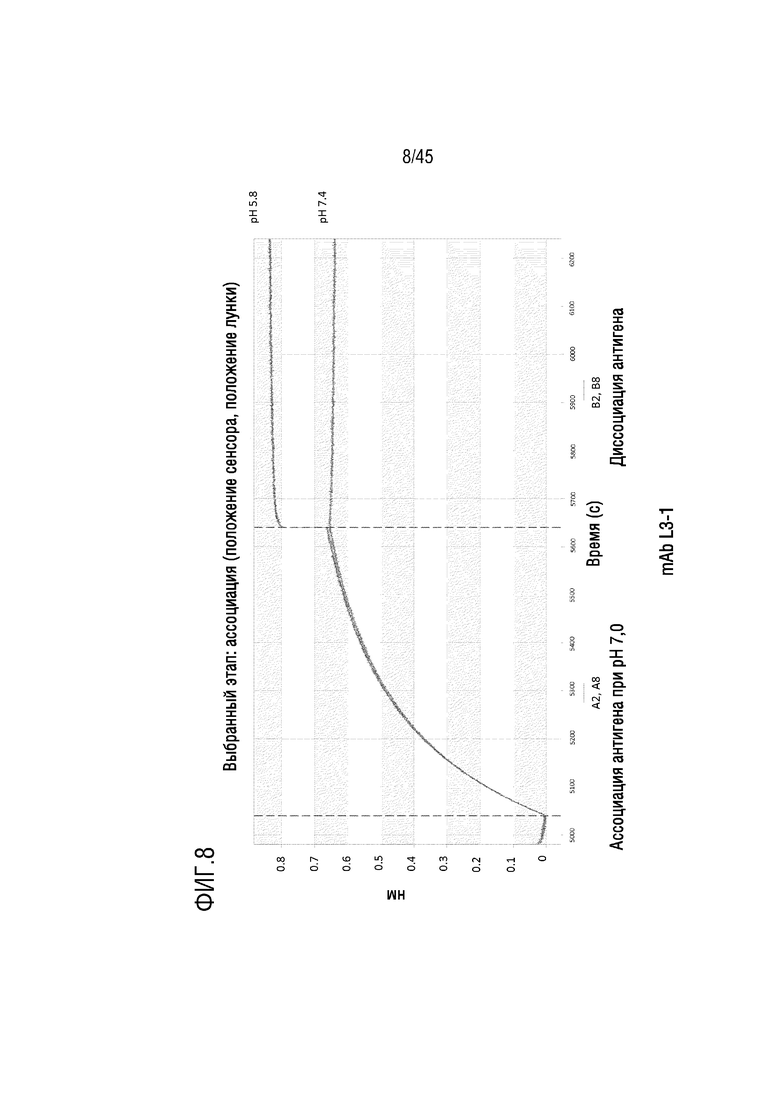
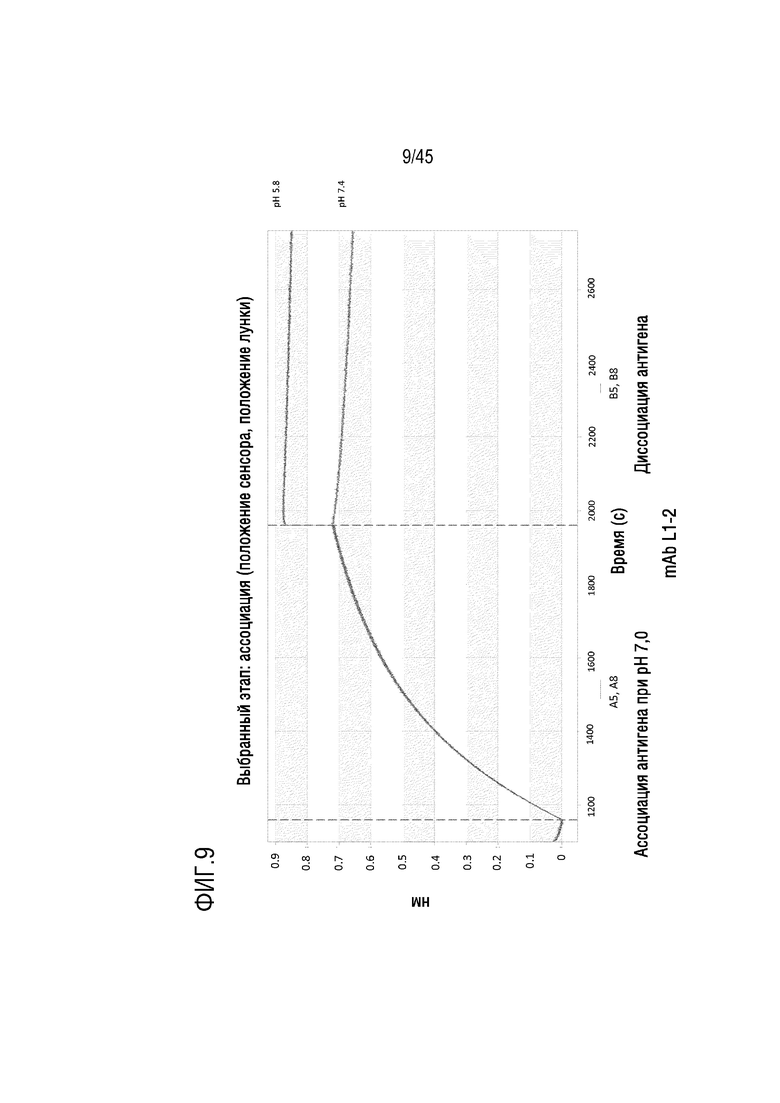
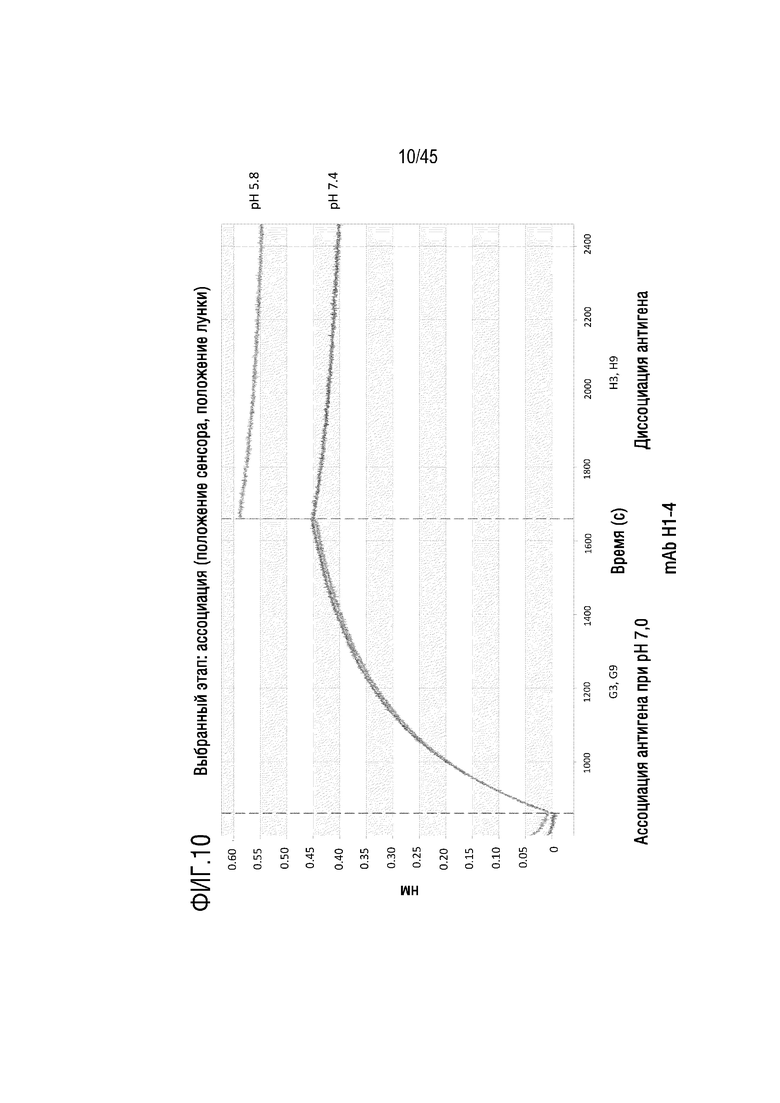
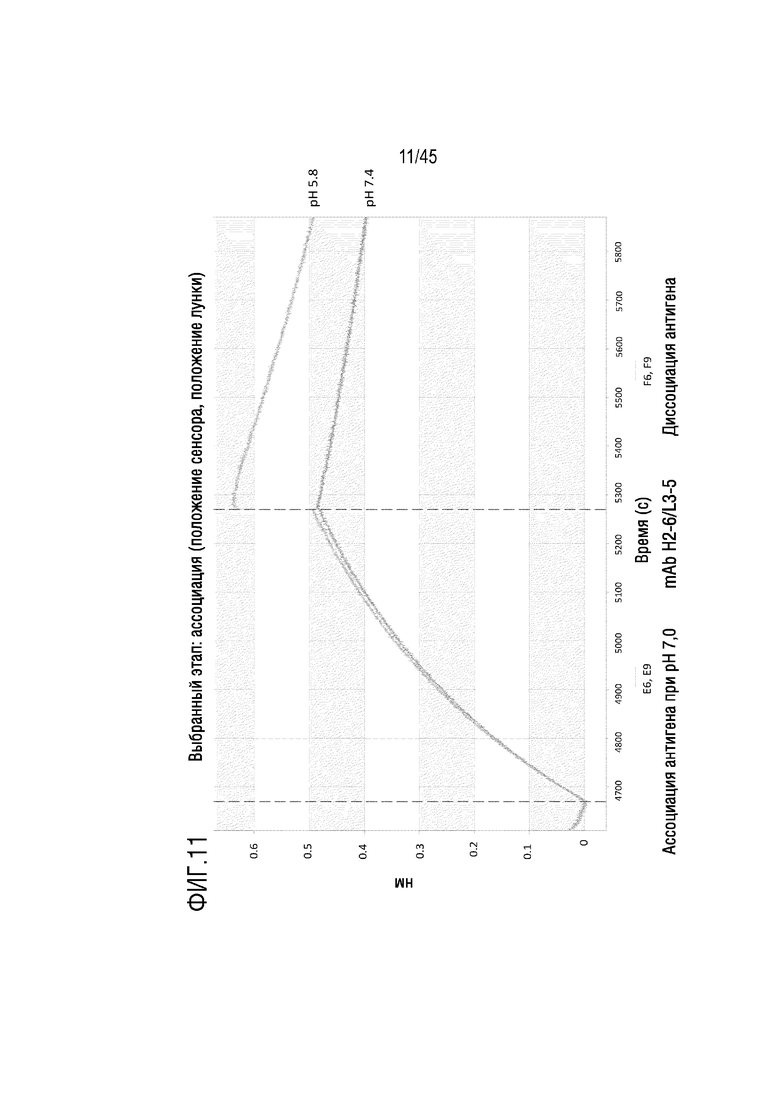
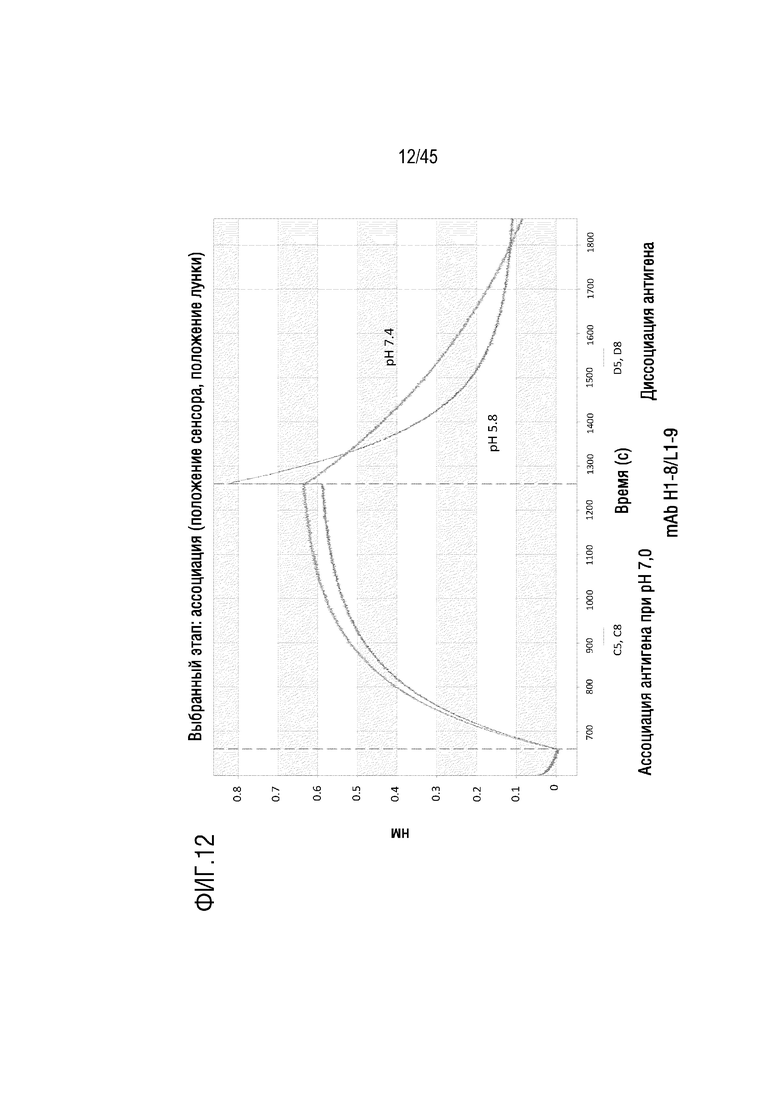
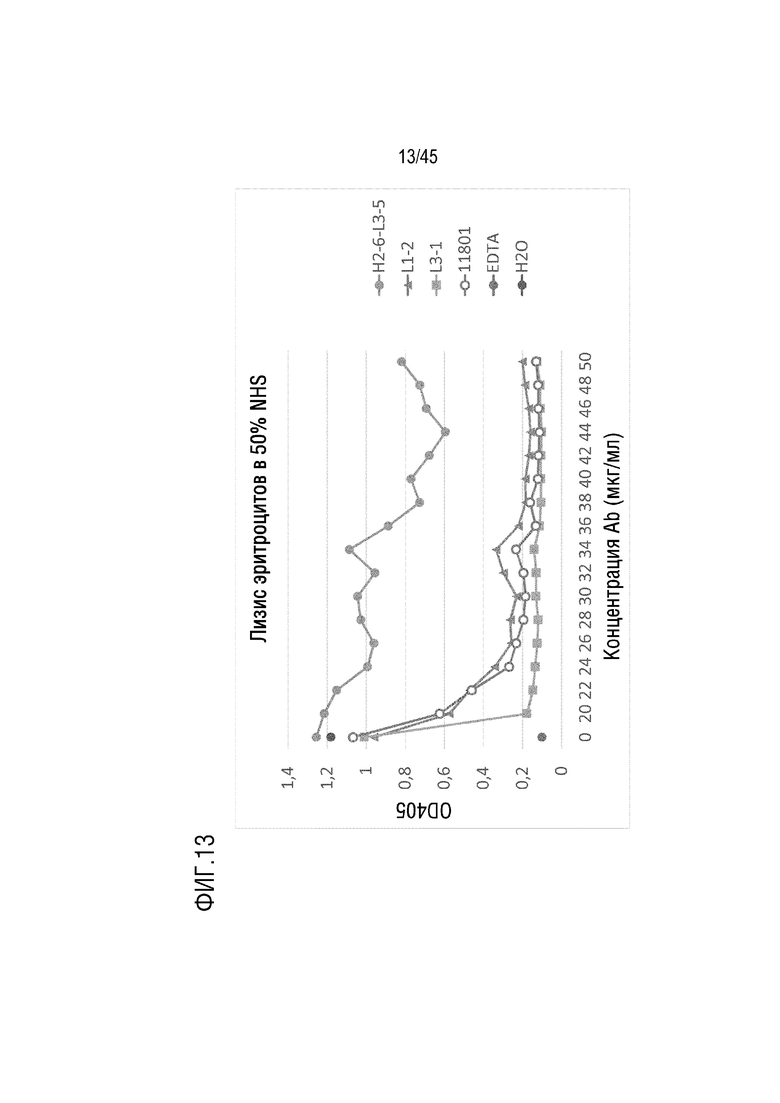
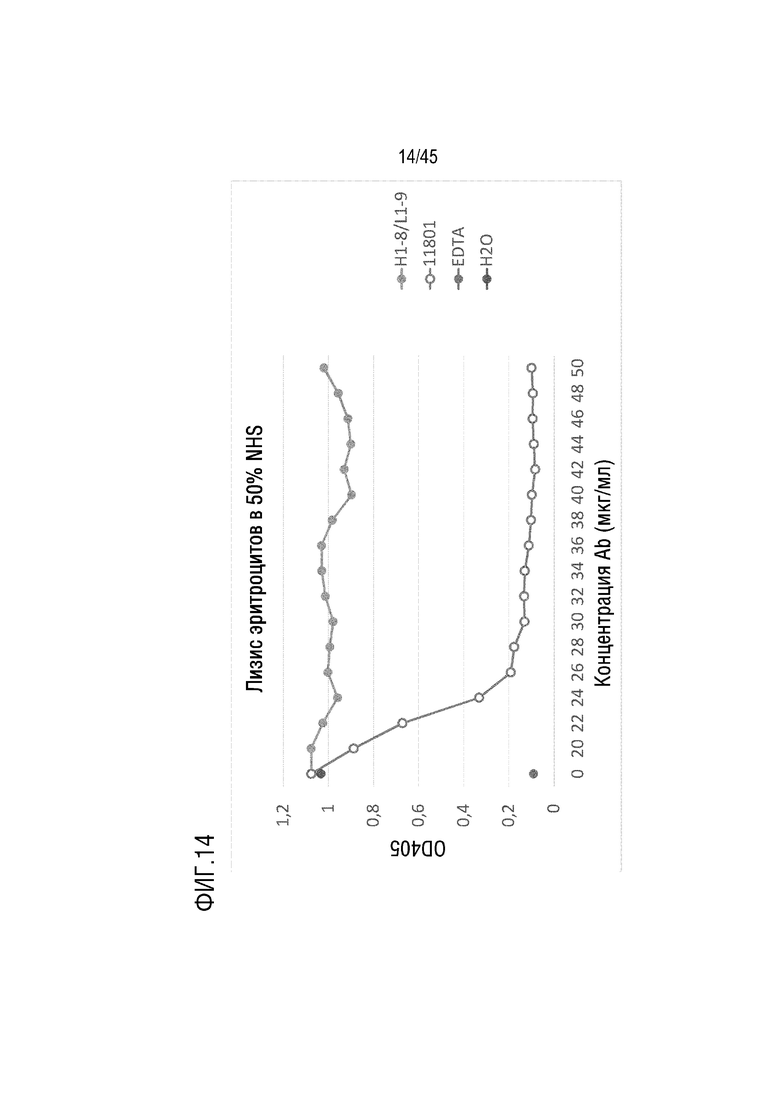
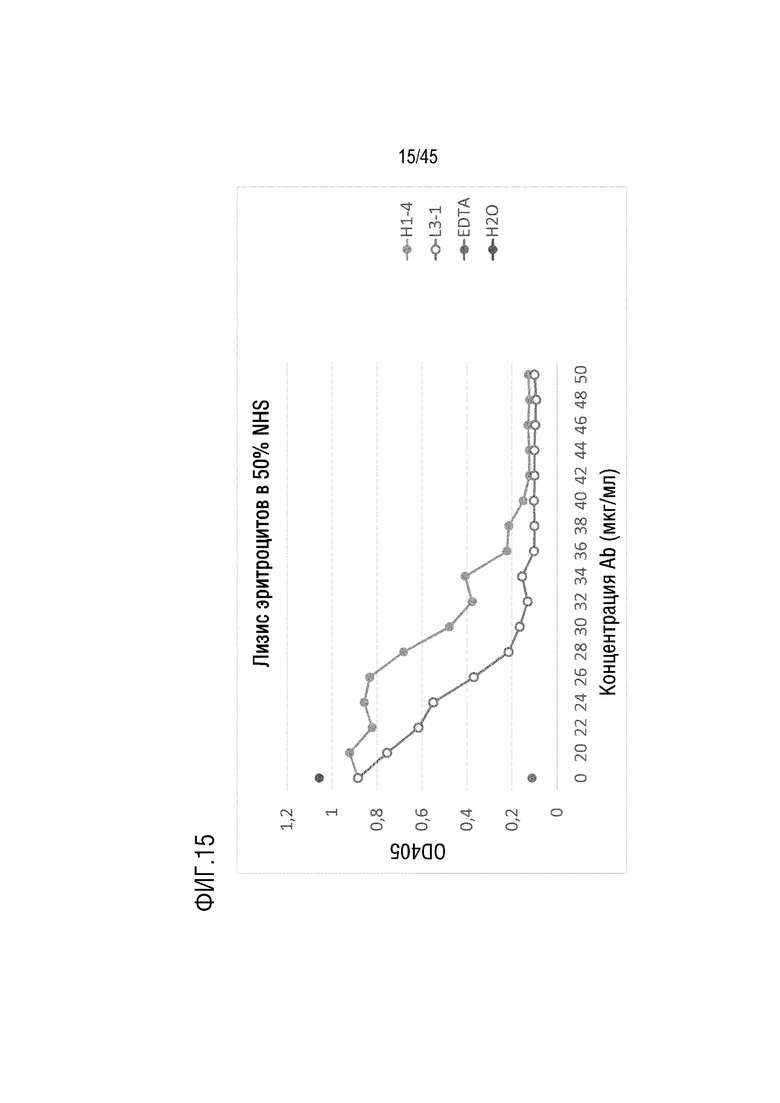
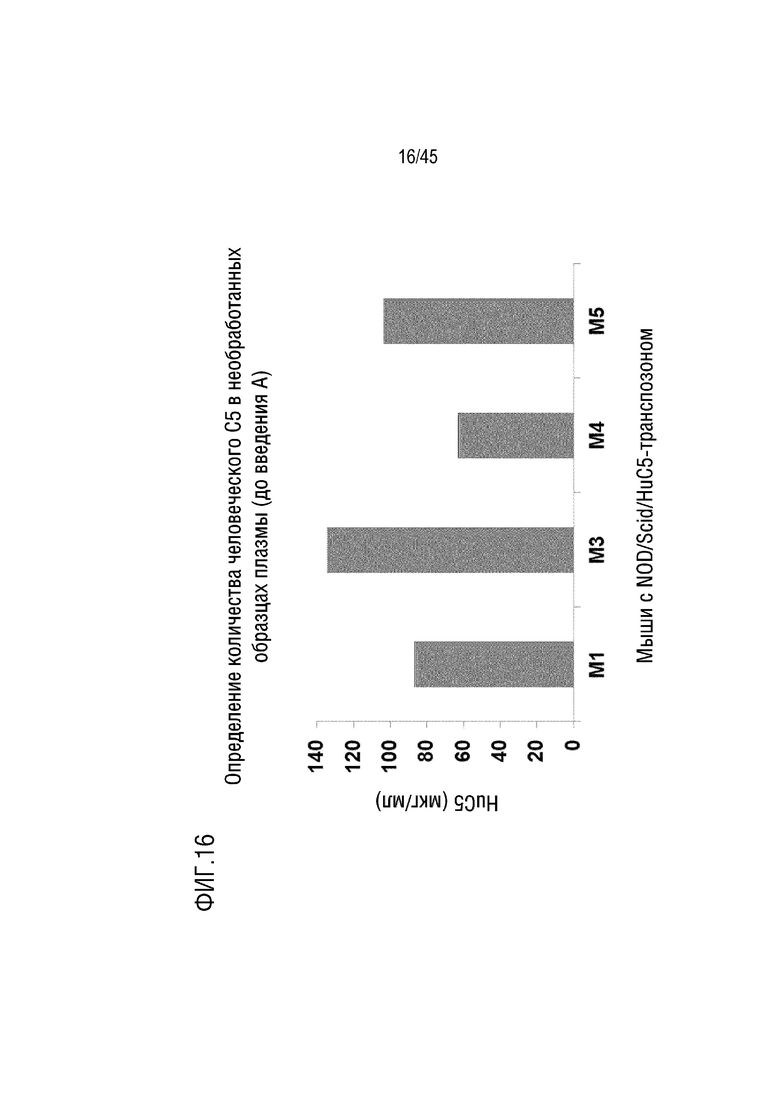
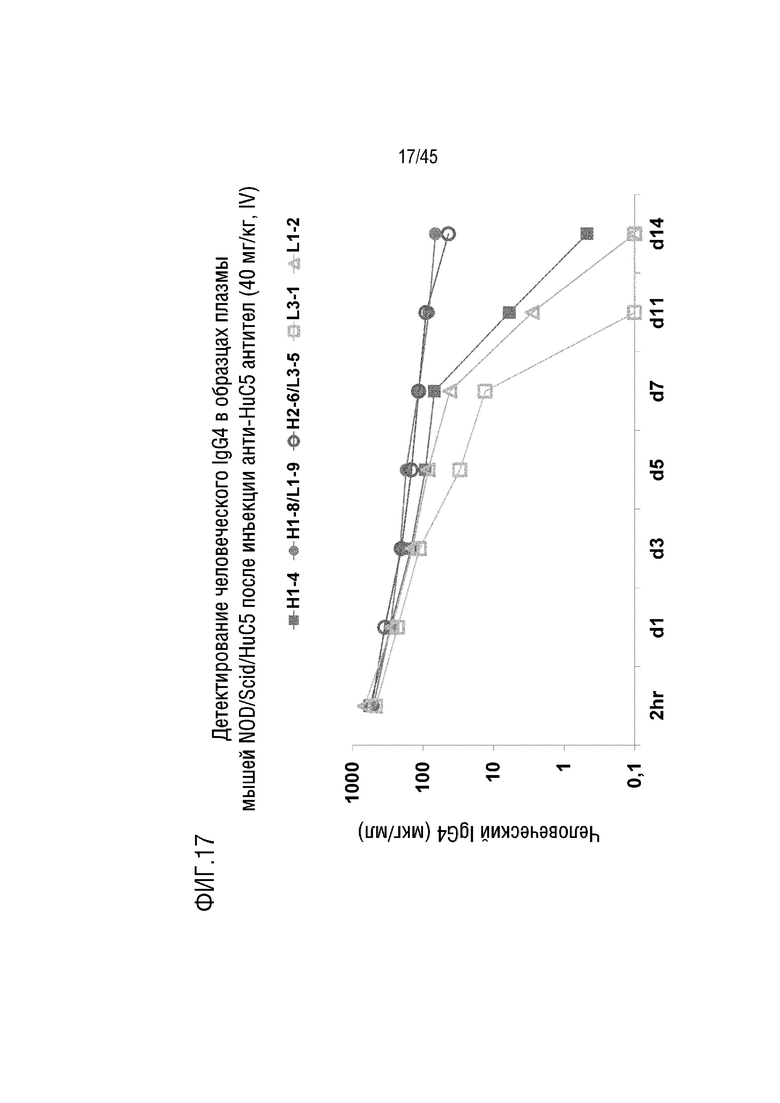
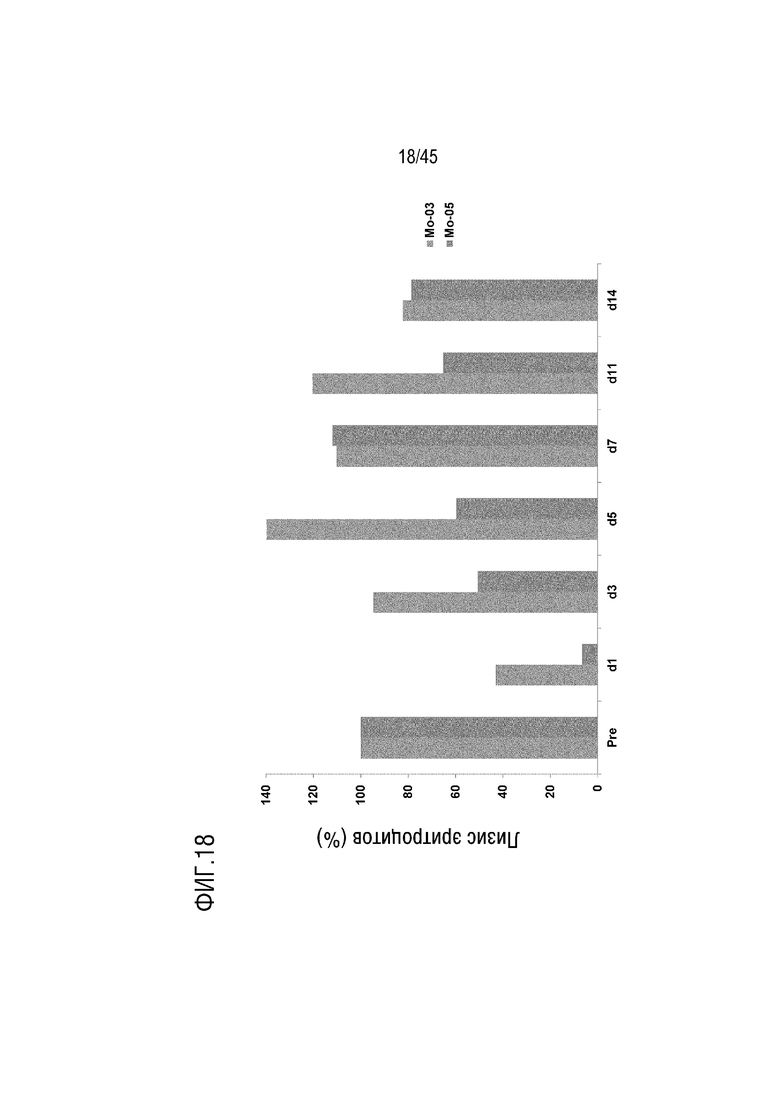
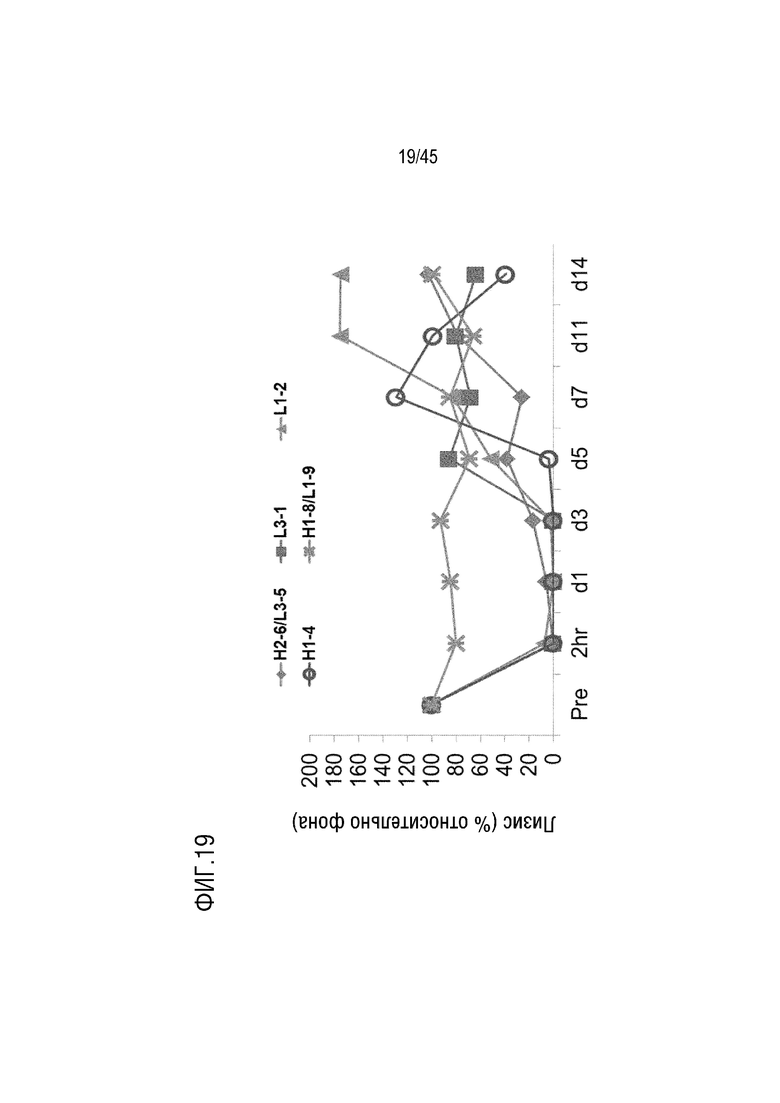

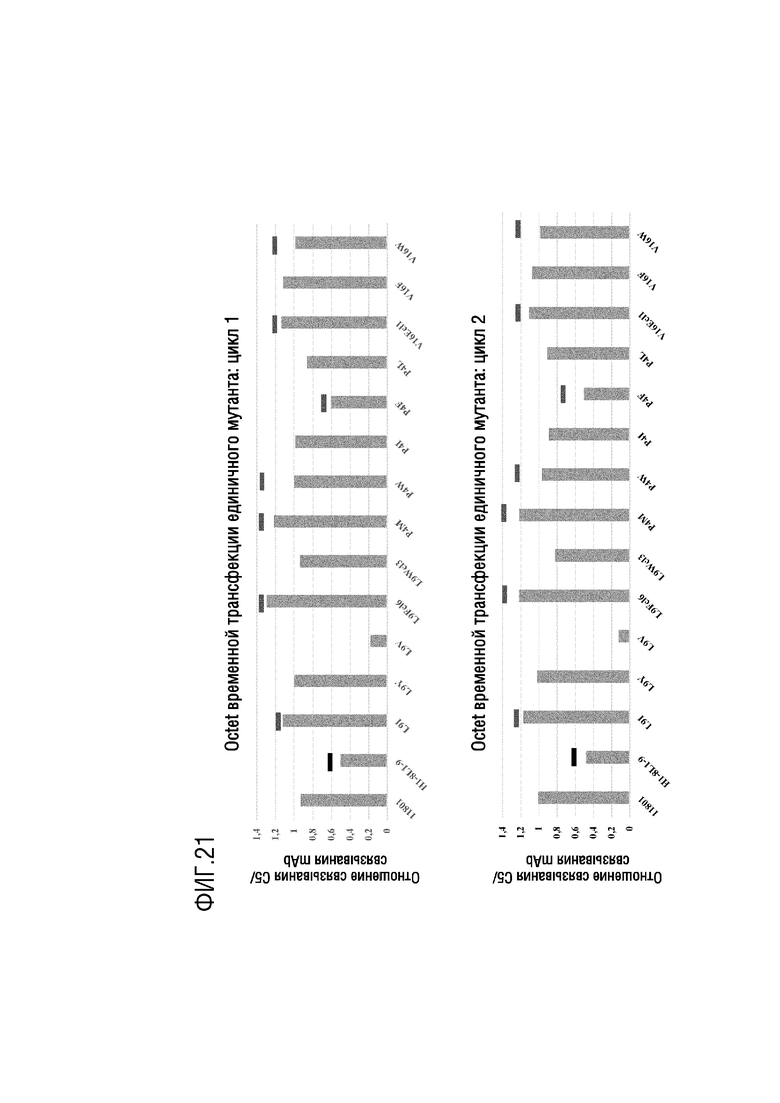


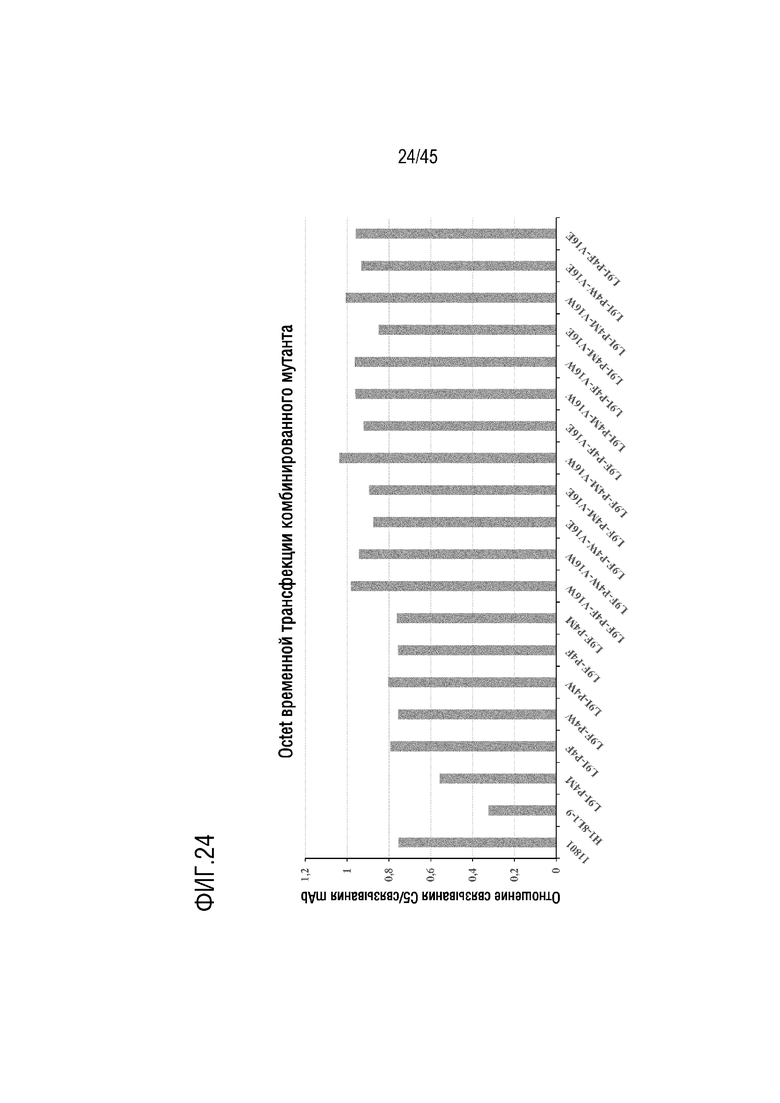
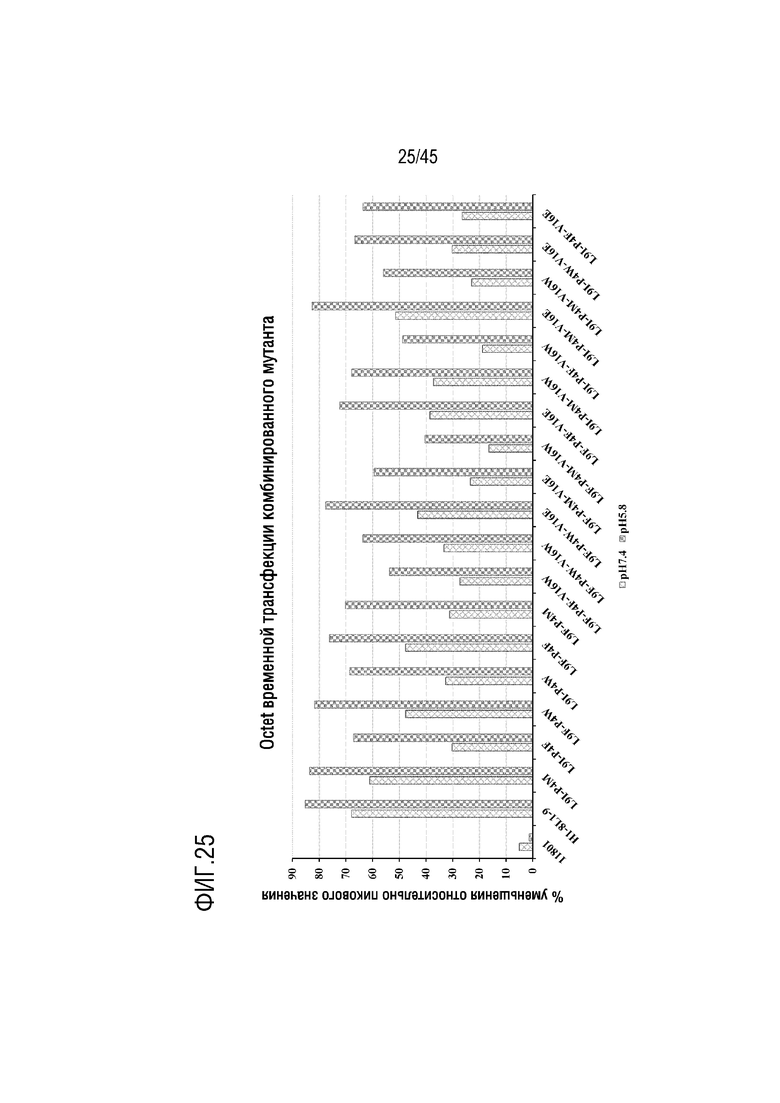
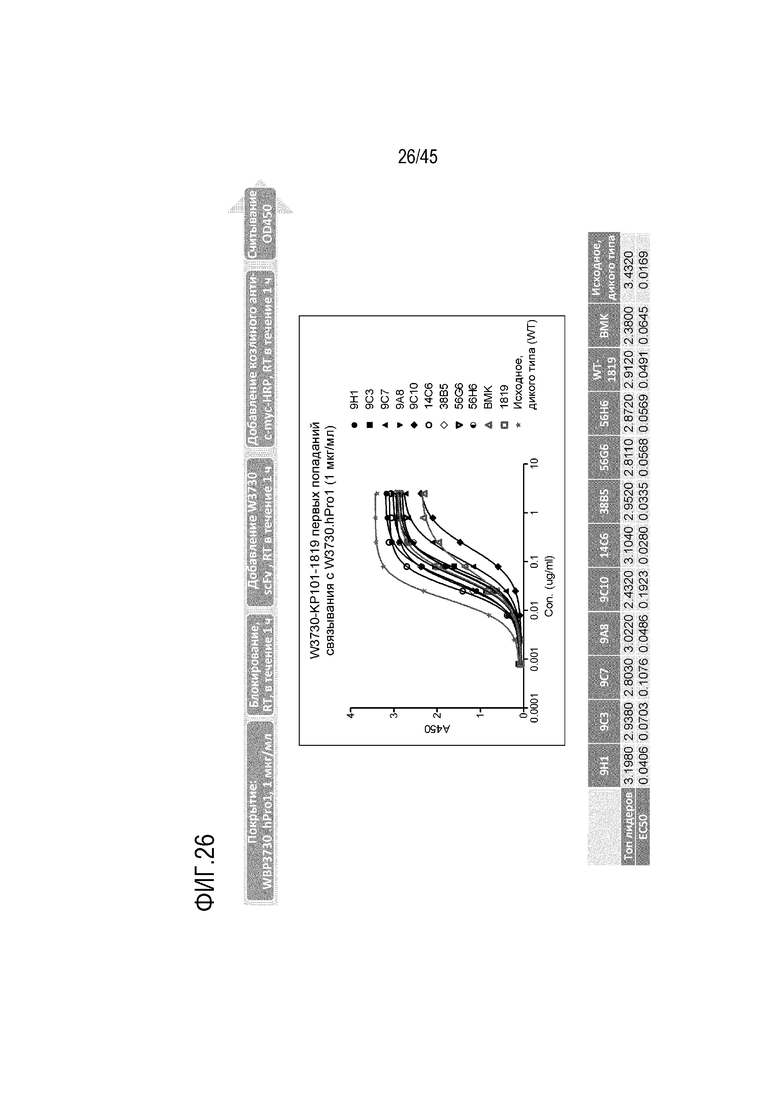





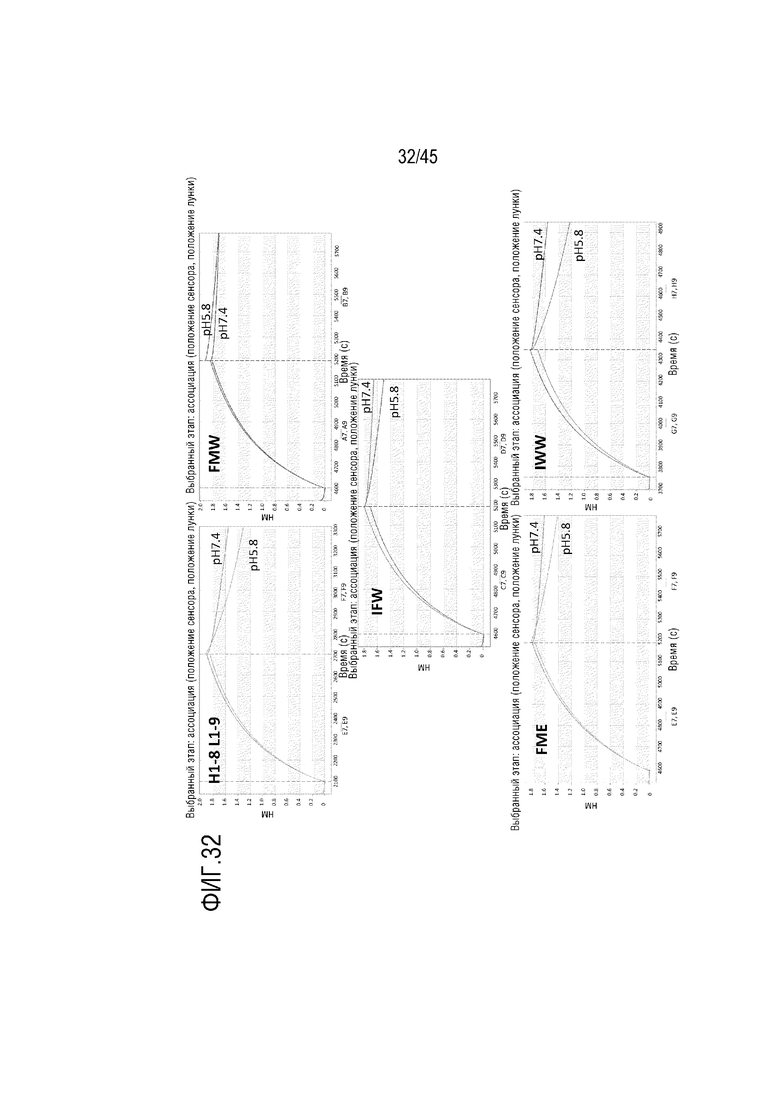
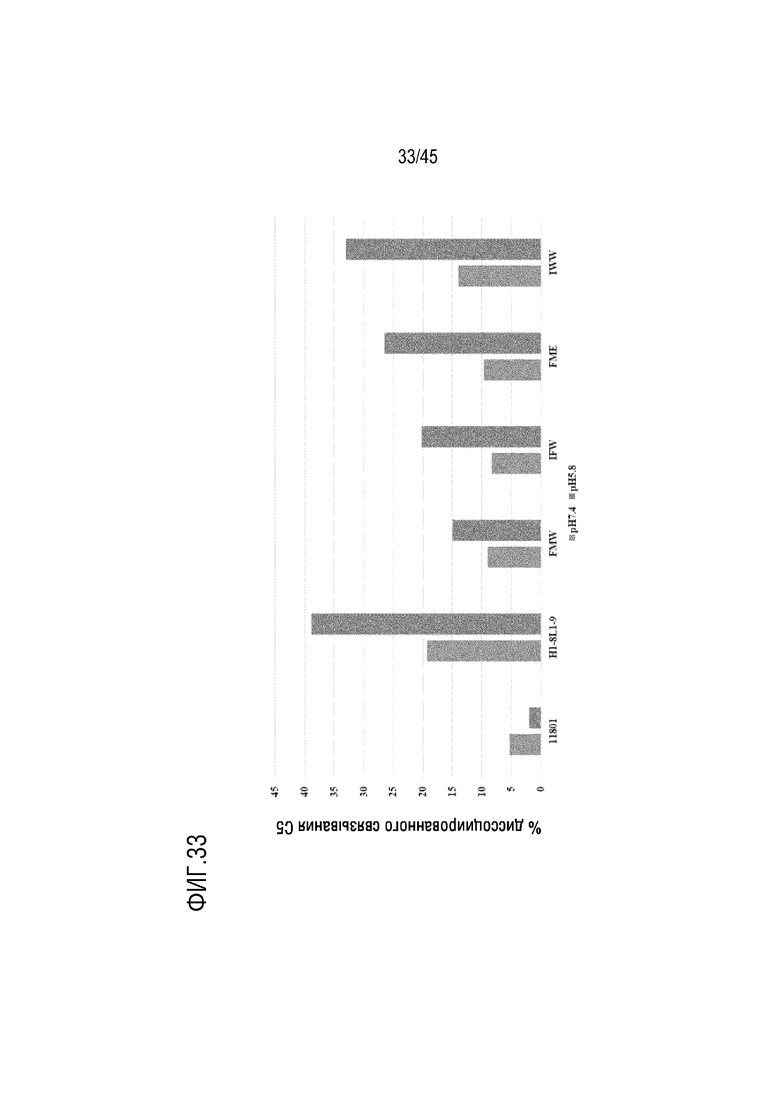
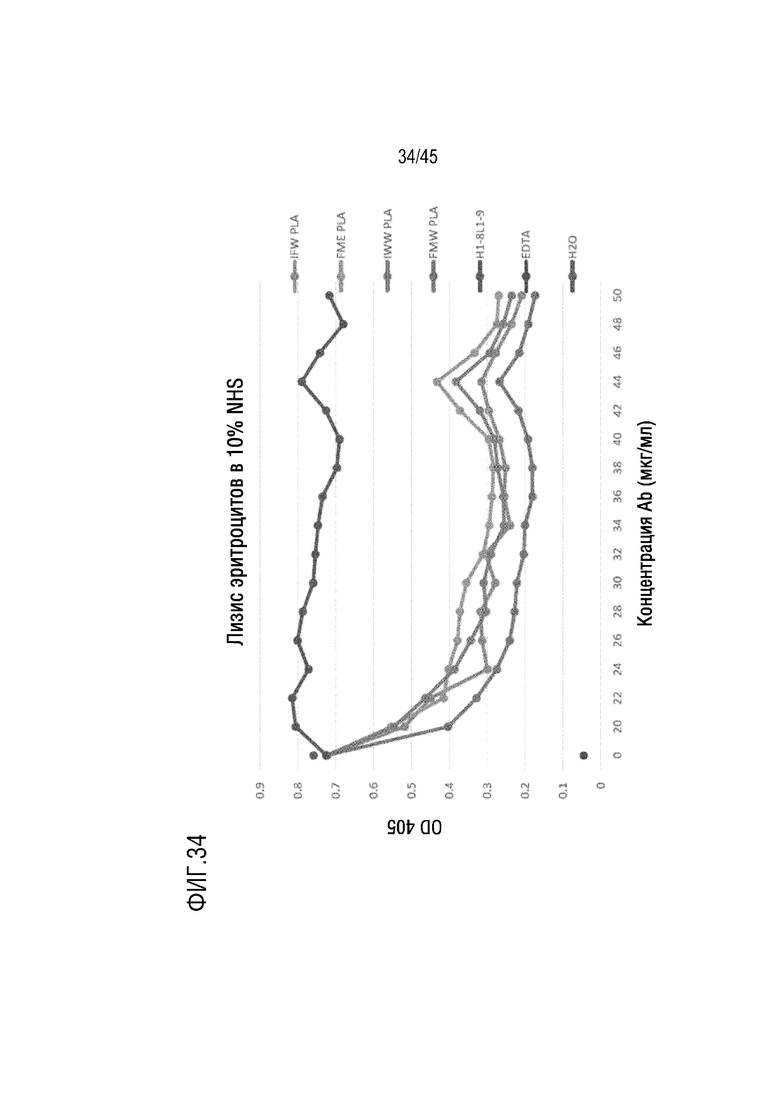
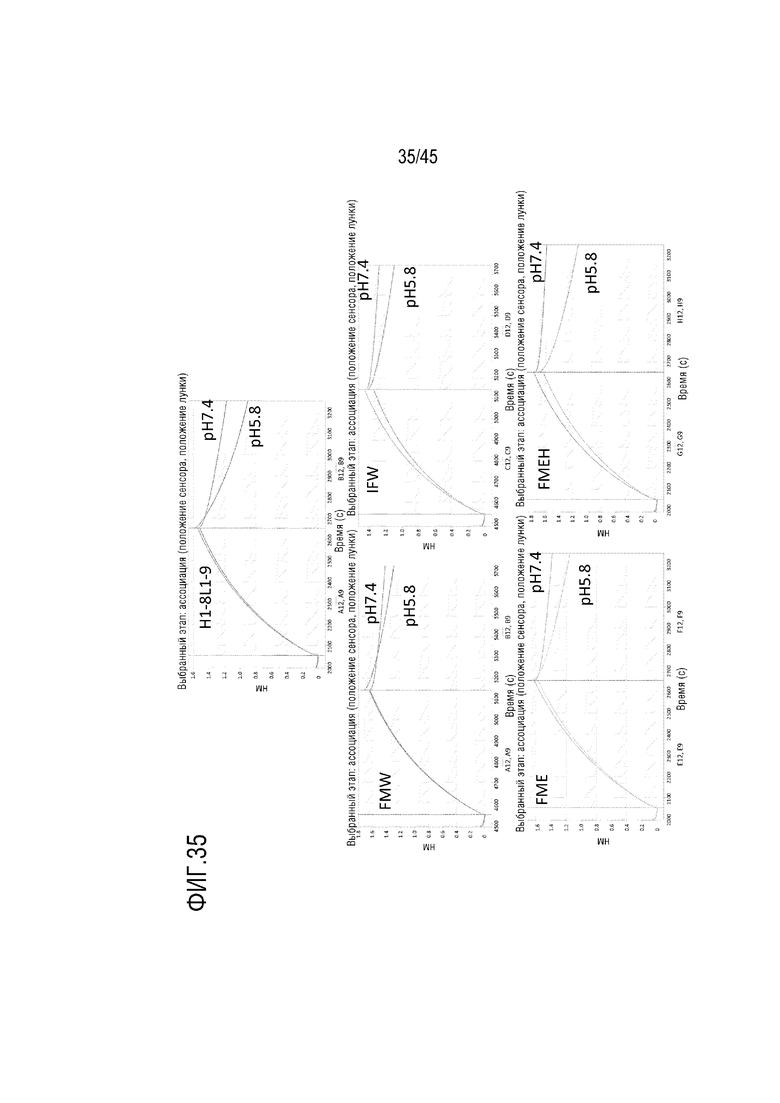
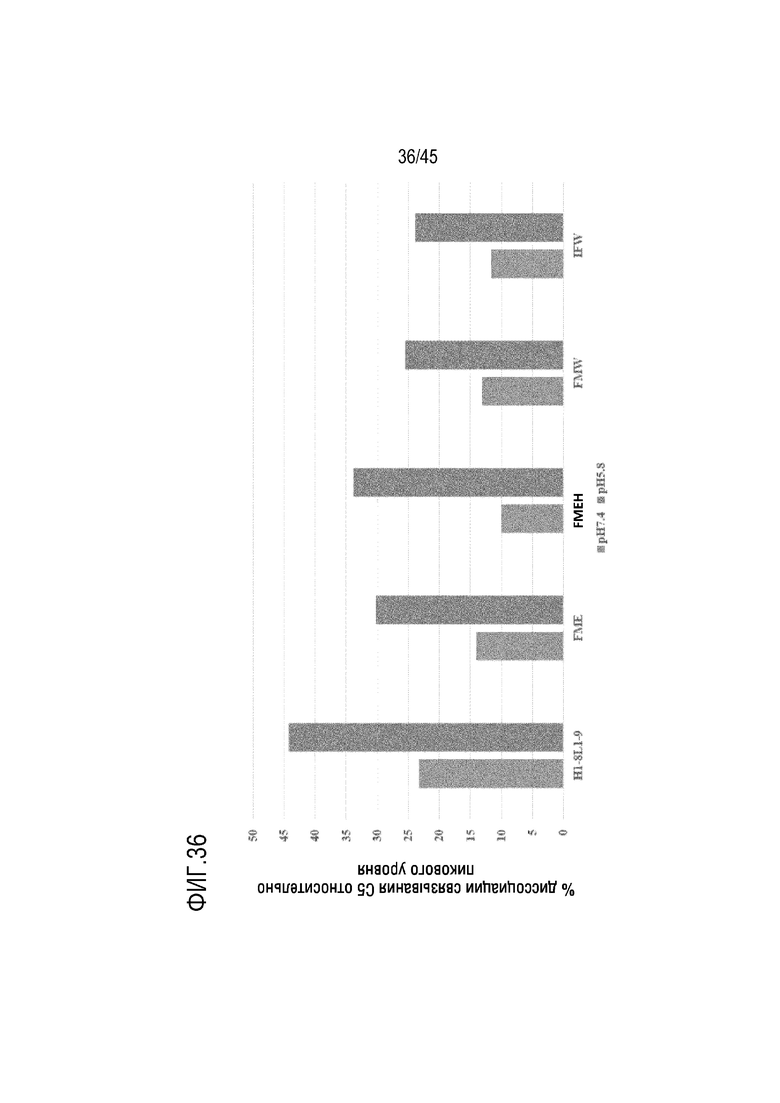
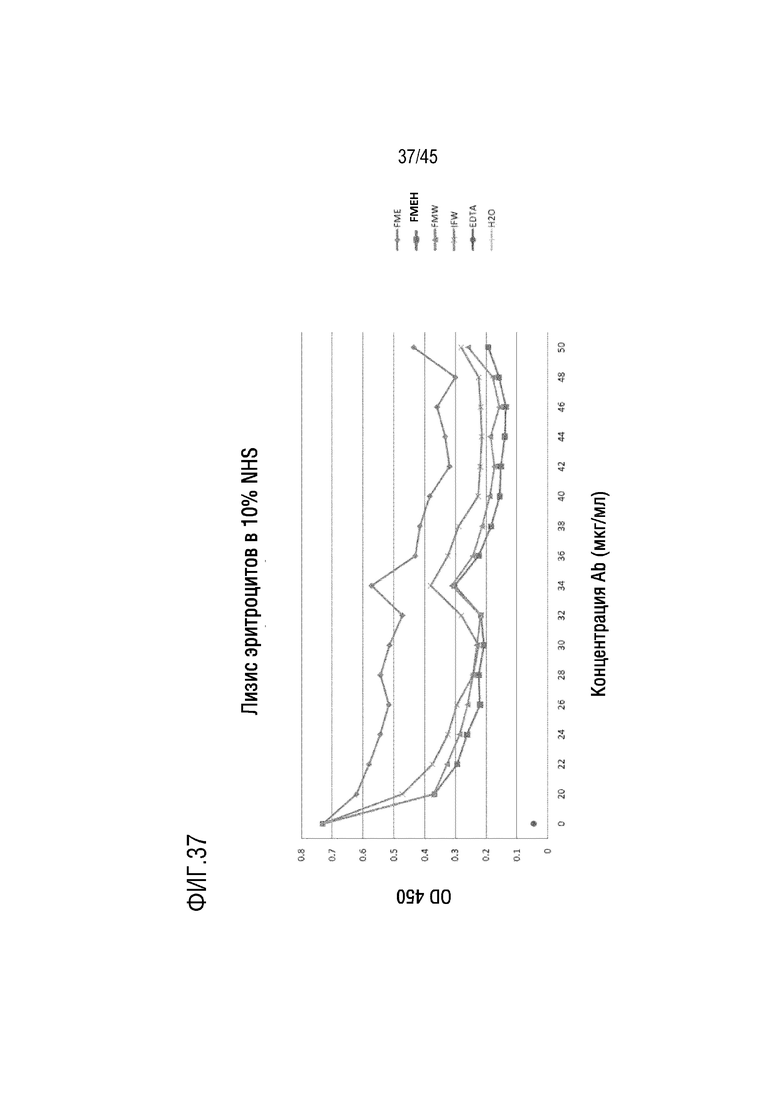


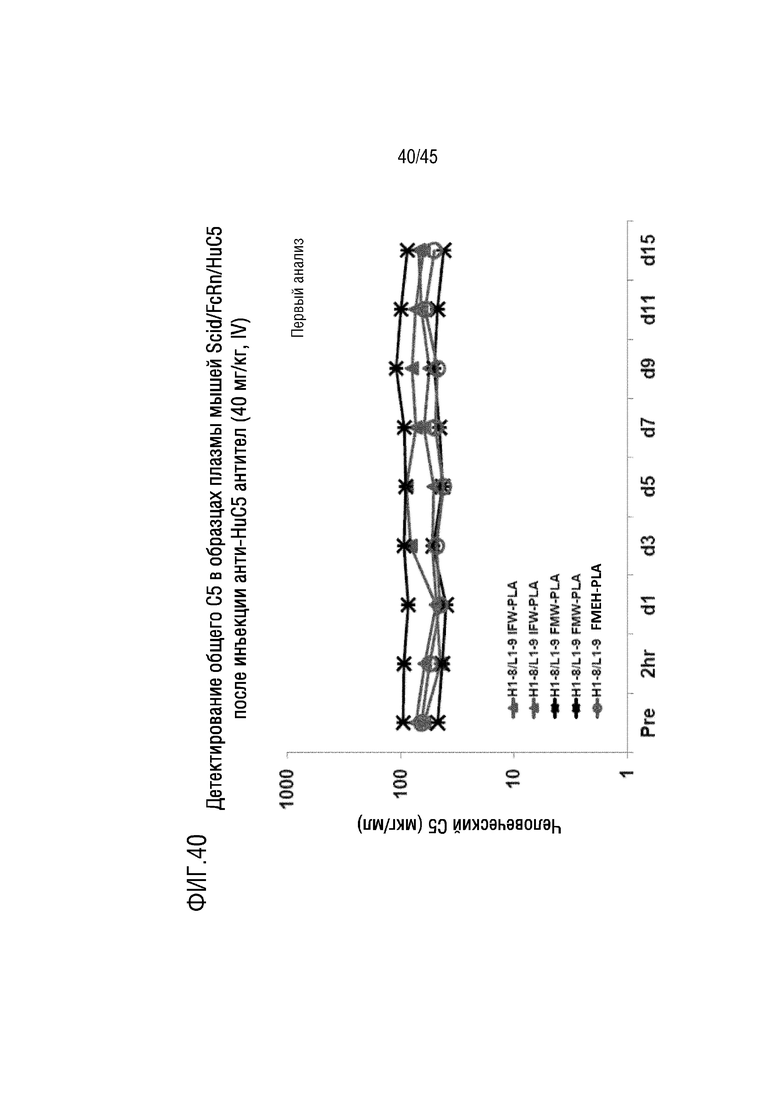
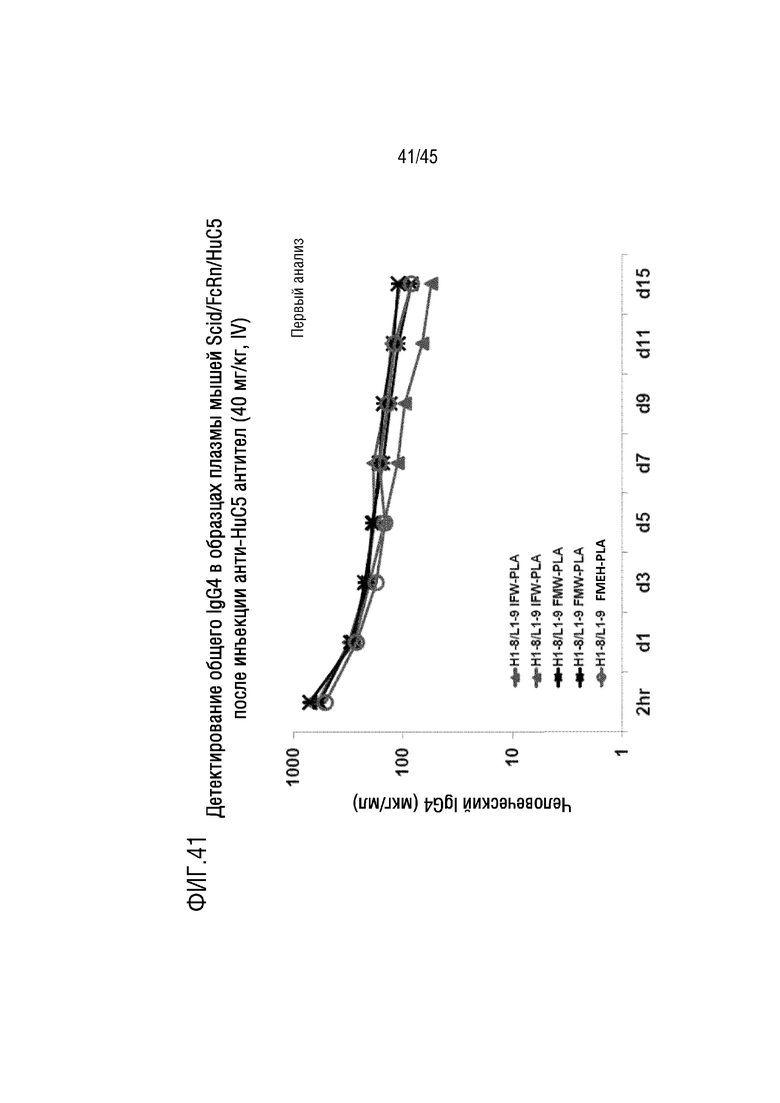
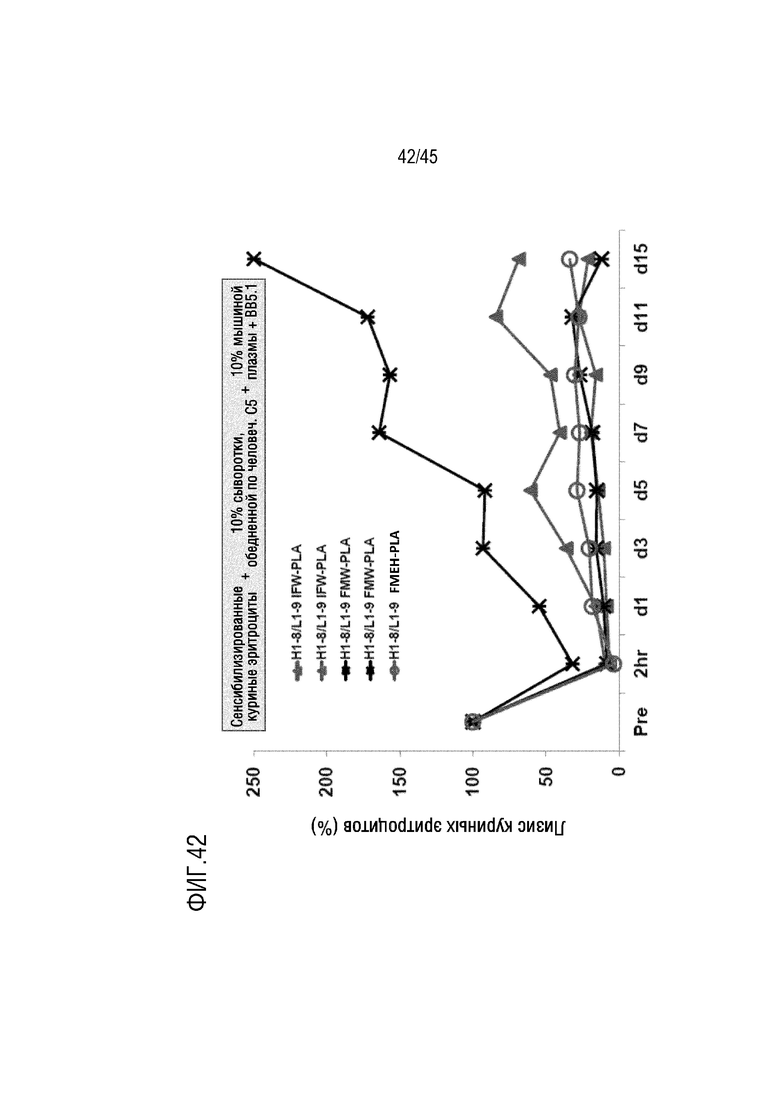
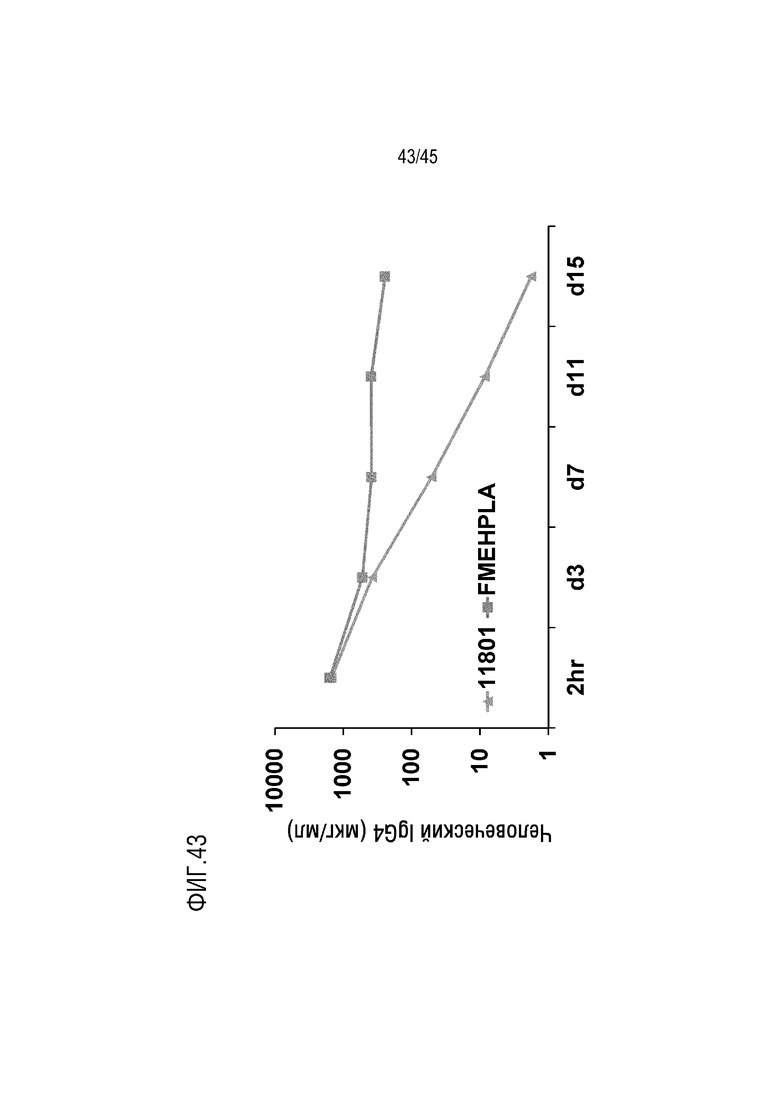
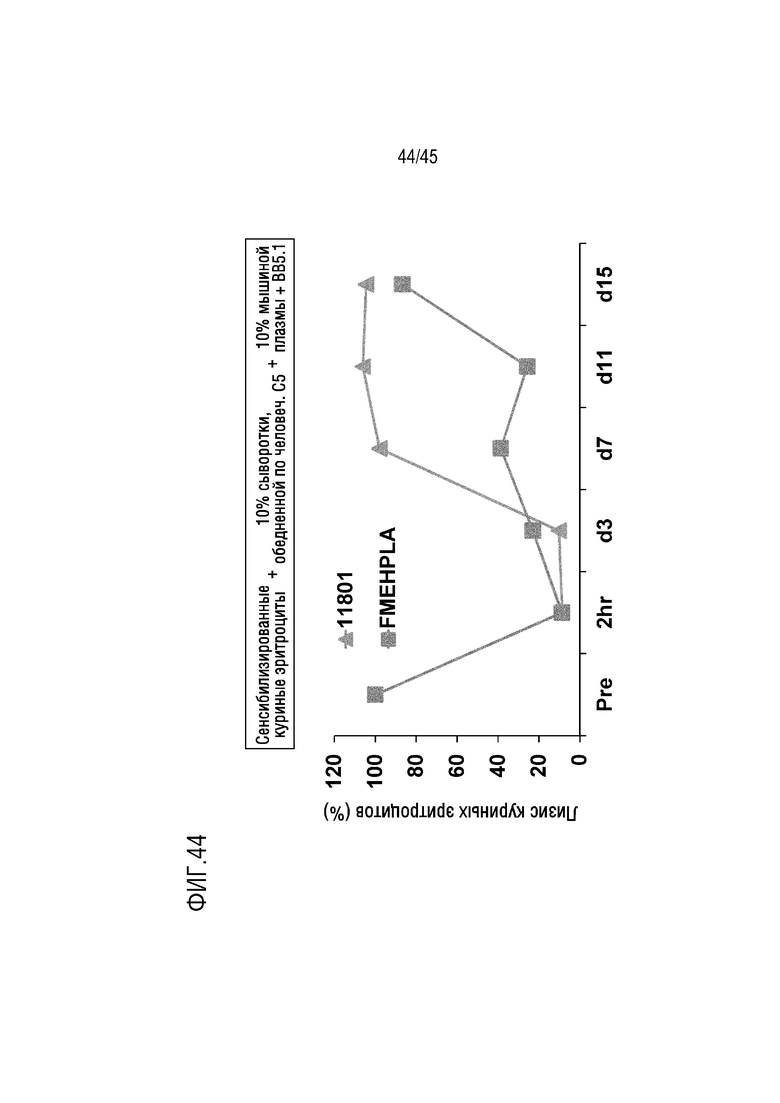
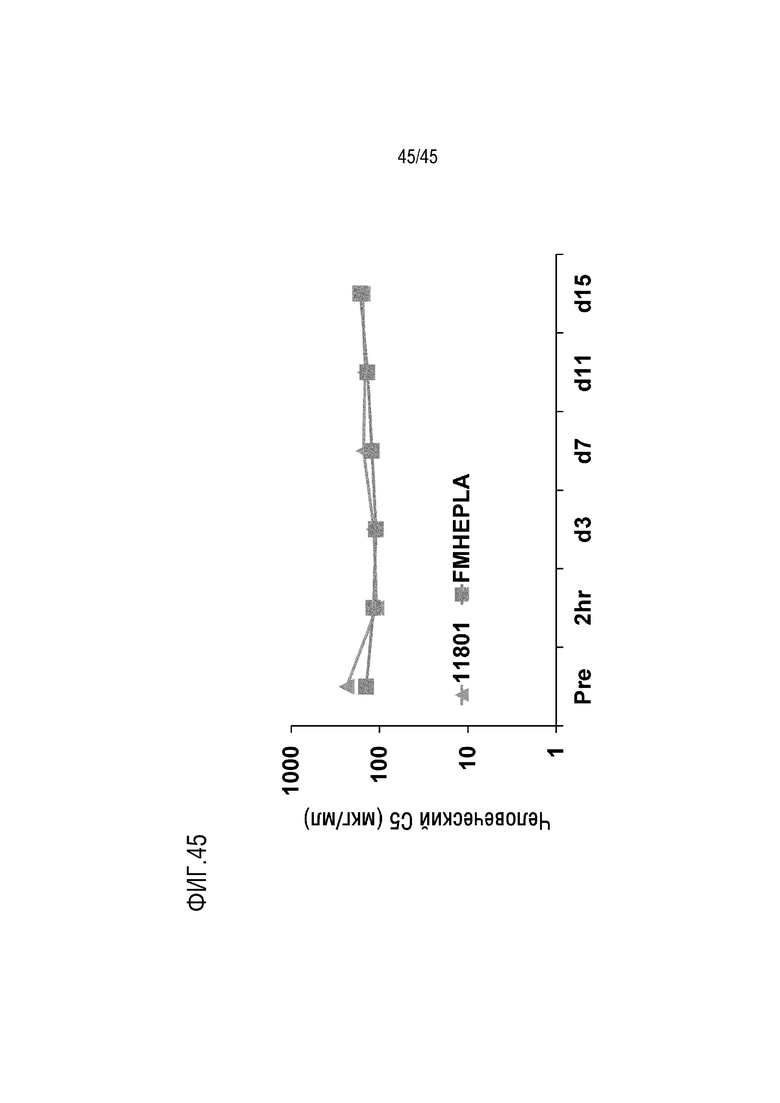
Изобретение относится к биотехнологии, в частности к ингибированию передачи сигнала комплемента с помощью анти-С5 антитела. В частности, изобретение относится к способам лечения комплемент-опосредованного заболевания или комплемент-опосредованного расстройства у индивидуума путем контактирования индивидуума с анти-С5 антителом. 6 н. и 65 з.п. ф-лы, 45 ил., 3 пр.
1. pH-Зависимое антитело, которое специфически связывается с C5 человека,
где pH-зависимое антитело содержит:
VH-CDR1, содержащей вариант SEQ ID NO: 3 с по меньшей мере одной заменой относительно SEQ ID NO: 3;
VH-CDR2, содержащей вариант SEQ ID NO: 4 с по меньшей мере одной заменой относительно SEQ ID NO: 4;
VH-CDR3, содержащей вариант SEQ ID NO: 5 с по меньшей мере одной заменой относительно SEQ ID NO: 5;
VL-CDR1, содержащей вариант SEQ ID NO: 8 с по меньшей мере одной заменой относительно SEQ ID NO: 8;
VL-CDR2, содержащей вариант SEQ ID NO: 9 с по меньшей мере одной заменой относительно SEQ ID NO: 9; и
VL-CDR3, содержащей вариант SEQ ID NO: 10 с по меньшей мере одной заменой относительно SEQ ID NO: 10.
2. Антитело по п.1, где связывание антитела зависит от pH,
где антитело сильнее связывается с C5 при нейтральном pH, чем при кислом pH.
3. Антитело по п.1 или 2, где антитело содержит CDR:
VH-CDR1: SEQ ID NO: 47;
VH-CDR2: SEQ ID NO: 57;
VH-CDR3: SEQ ID NO: 49;
VL-CDR1: SEQ ID NO: 23;
VL-CDR2: SEQ ID NO: 9; и
VL-CDR3: SEQ ID NO: 10 или
их вариант или варианты.
4. Антитело по п.1 или 2, где антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 59 или ее вариант.
5. Антитело по п.1 или 2, где антитело содержит
тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 59, и
легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25, или
их вариант или варианты.
6. Антитело по п.1 или 2, где антитело содержит CDR:
VH-CDR1: SEQ ID NO: 3;
VH-CDR2: SEQ ID NO: 4;
VH-CDR3: SEQ ID NO: 5;
VL-CDR1: SEQ ID NO: 8;
VL-CDR2: SEQ ID NO: 9; и
VL-CDR3: SEQ ID NO: 11 или
их вариант или варианты.
7. Антитело по п.1 или 2, где антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 2 или ее вариант.
8. Антитело по п.1 или 2, где антитело содержит легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 13 или ее вариант.
9. Антитело по п.1 или 2, где антитело содержит
тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 2, и
легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 13, или
их вариант или варианты.
10. Антитело по п.1 или 2, где антитело содержит CDR:
VH-CDR1: SEQ ID NO: 3;
VH-CDR2: SEQ ID NO: 4;
VH-CDR3: SEQ ID NO: 5;
VL-CDR1: SEQ ID NO: 14;
VL-CDR2: SEQ ID NO: 9; и
VL-CDR3: SEQ ID NO: 10 или
их вариант или варианты.
11. Антитело по п.1 или 2, где антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 2 или ее вариант.
12. Антитело по п.1 или 2, где антитело содержит легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 16 или ее вариант.
13. Антитело по п.1 или 2, где антитело содержит
тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 2, и
легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 16, или
их вариант или варианты.
14. Антитело по п.1 или 2, где антитело содержит CDR:
VH-CDR1: SEQ ID NO: 17;
VH-CDR2: SEQ ID NO: 4;
VH-CDR3: SEQ ID NO: 5;
VL-CDR1: SEQ ID NO: 8;
VL-CDR2: SEQ ID NO: 9; и
VL-CDR3: SEQ ID NO: 10
или их вариант или варианты.
15. Антитело по п.1 или 2, где антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 19 или ее вариант.
16. Антитело по п.1 или 2, где антитело содержит легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 7 или ее вариант.
17. Антитело по п.1 или 2, где антитело содержит
тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 19, и
легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 7, или
их вариант или варианты.
18. Антитело по п.1 или 2, где антитело содержит CDR:
VH-CDR1: SEQ ID NO: 20;
VH-CDR2: SEQ ID NO: 4;
VH-CDR3: SEQ ID NO: 5;
VL-CDR1: SEQ ID NO: 23;
VL-CDR2: SEQ ID NO: 9; и
VL-CDR3: SEQ ID NO: 10 или
их вариант или варианты.
19. Антитело по п.1 или 2, где антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 22 или ее вариант.
20. Антитело по п.1 или 2, где антитело содержит легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25 или ее вариант.
21. Антитело по п.1 или 2, где антитело содержит
тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 22, и
легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25,
или их вариант или варианты.
22. Антитело по п.1 или 2, где антитело содержит CDR:
VH-CDR1: SEQ ID NO: 3;
VH-CDR2: SEQ ID NO: 26;
VH-CDR3: SEQ ID NO: 5;
VL-CDR1: SEQ ID NO: 8;
VL-CDR2: SEQ ID NO: 9; и
VL-CDR3: SEQ ID NO: 29
или их вариант или варианты.
23. Антитело по п.1 или 2, где антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 28 или ее вариант.
24. Антитело по п.1 или 2, где антитело содержит легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 31 или ее вариант.
25. Антитело по п.1 или 2, где антитело содержит
тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 28, и
легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 31,
или их вариант или варианты.
26. Антитело по п.1 или 2, где антитело содержит CDR:
VH-CDR1: SEQ ID NO: 3;
VH-CDR2: SEQ ID NO: 34;
VH-CDR3: SEQ ID NO: 5;
VL-CDR1: SEQ ID NO: 8;
VL-CDR2: SEQ ID NO: 9; и
VL-CDR3: SEQ ID NO: 10
или их вариант или варианты.
27. Антитело по п.1 или 2, где антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 36 или ее вариант.
28. Антитело по п.1 или 2, где антитело содержит
тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 36, и
легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 7,
или их вариант или варианты.
29. Антитело по п.1 или 2, где антитело содержит CDR:
VH-CDR1: SEQ ID NO: 37;
VH-CDR2: SEQ ID NO: 38;
VH-CDR3: SEQ ID NO: 39;
VL-CDR1: SEQ ID NO: 23;
VL-CDR2: SEQ ID NO: 9; и
VL-CDR3: SEQ ID NO: 10 или
их вариант или варианты.
30. Антитело по п.1 или 2, где антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 41 или ее вариант.
31. Антитело по п.1 или 2, где антитело содержит
тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 41, и
легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25,
или их вариант или варианты.
32. Антитело по п.1 или 2, где антитело содержит CDR:
VH-CDR1: SEQ ID NO: 42;
VH-CDR2: SEQ ID NO: 43;
VH-CDR3: SEQ ID NO: 44;
VL-CDR1: SEQ ID NO: 23;
VL-CDR2: SEQ ID NO: 9; и
VL-CDR3: SEQ ID NO: 10 или
их вариант или варианты.
33. Антитело по п.1 или 2, где антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 46 или ее вариант.
34. Антитело по п.1 или 2, где антитело содержит
тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 46, и
легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25,
или их вариант или варианты.
35. Антитело по п.1 или 2, где антитело содержит CDR:
VH-CDR1: SEQ ID NO: 47;
VH-CDR2: SEQ ID NO: 48;
VH-CDR3: SEQ ID NO: 49;
VL-CDR1: SEQ ID NO: 23;
VL-CDR2: SEQ ID NO: 9; и
VL-CDR3: SEQ ID NO: 10 или
их вариант или варианты.
36. Антитело по п.1 или 2, где антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 51 или ее вариант.
37. Антитело по п.1 или 2, где антитело содержит
тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 51, и
легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25,
или их вариант или варианты.
38. Антитело по п.1 или 2, где антитело содержит CDR:
VH-CDR1: SEQ ID NO: 52;
VH-CDR2: SEQ ID NO: 53;
VH-CDR3: SEQ ID NO: 54;
VL-CDR1: SEQ ID NO: 23;
VL-CDR2: SEQ ID NO: 9; и
VL-CDR3: SEQ ID NO: 10 или
их вариант или варианты.
39. Антитело по п.1 или 2, где антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 56 или ее вариант.
40. Антитело по п.1 или 2, где антитело содержит
тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 56, и
легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25, или их вариант или варианты.
41. Антитело по п.1 или 2, где антитело содержит CDR:
VH-CDR1: SEQ ID NO: 37;
VH-CDR2: SEQ ID NO: 62;
VH-CDR3: SEQ ID NO: 39;
VL-CDR1: SEQ ID NO: 23;
VL-CDR2: SEQ ID NO: 9; и
VL-CDR3: SEQ ID NO: 10
или их вариант или варианты.
42. Антитело по п.1 или 2, где антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 64 или ее вариант.
43. Антитело по п.1 или 2, где антитело содержит
тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 64, и
легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25,
или их вариант или варианты.
44. Антитело по п.1 или 2, где антитело содержит CDR:
VH-CDR1: SEQ ID NO: 42;
VH-CDR2: SEQ ID NO: 65;
VH-CDR3: SEQ ID NO: 44;
VL-CDR1: SEQ ID NO: 23;
VL-CDR2: SEQ ID NO: 9; и
VL-CDR3: SEQ ID NO: 10 или
их вариант или варианты.
45. Антитело по п.1 или 2, где антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 67 или ее вариант.
46. Антитело по п.1 или 2, где антитело содержит
тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 67, и
легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25, или их вариант или варианты.
47. Антитело по п.1 или 2, где антитело содержит CDR:
VH-CDR1: SEQ ID NO: 52;
VH-CDR2: SEQ ID NO: 68;
VH-CDR3: SEQ ID NO: 54;
VL-CDR1: SEQ ID NO: 23;
VL-CDR2: SEQ ID NO: 9; и
VL-CDR3: SEQ ID NO: 10
или их вариант или варианты.
48. Антитело по п.1 или 2, где антитело содержит тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 70 или ее вариант.
49. Антитело по п.1 или 2, где антитело содержит
тяжелую цепь, содержащую аминокислотную последовательность SEQ ID NO: 70, и
легкую цепь, содержащую аминокислотную последовательность SEQ ID NO: 25,
или их вариант или варианты.
50. Антитело по пп.3, 7, 11, 15, 19, 23, 26, 29, 32, 35, 38, 41, 44 или 47, где антитело содержит замену пролина 4 (P4) в VH CDR2 относительно SEQ ID NO: 4.
51. Антитело по п.50, где замена пролина 4 (P4) представляет собой одну замену, выбранную из группы, состоящей из P4→F4 (P4F), P4→L4 (P4L), P4→M4 (P4M), P4→W4 (P4W) и P4→I4 (P4I).
52. Антитело по п.51, где антитело содержит замену пролина 4 (P4) в VH CDR2 относительно SEQ ID NO: 4 и замену треонина 9 в VH CDR2 относительно SEQ ID NO: 4.
53. Антитело по п.52, где замена пролина 4 (P4) представляет собой одну замену, выбранную из группы, состоящей из P4→F4 (P4F), P4→L4 (P4L), P4→M4 (P4M), P4→W4 (P4W) и P4→I4 (P4I); и замена треонина 9 (T9) представляет собой одну замену, выбранную из группы, состоящей из T9→H9 (T9H), T9→F9 (T9F), T9→L9 (T9L), T9→M9 (T9M), T9→W9 (T9W) и T9→I9 (T9I).
54. Антитело по пп.3, 7, 11, 15, 19, 23, 26, 29, 32, 35, 38, 41, 44 или 47, где антитело содержит замену валина 16 (V16) в VH CDR3 относительно SEQ ID NO: 5.
55. Антитело по п.54, где замена валина 16 (V16) представляет собой одну замену, выбранную из группы, состоящей из V16→F16 (V16F), V16→E16 (V16E) и V16→W16 (V16W).
56. Антитело по пп.15, 19, 23, 26, 29, 32, 35, 38, 41, 44 или 47, где антитело содержит замену лейцина 9 (L9) в VH CDR1 относительно SEQ ID NO: 20.
57. Антитело по п.56, где замена лейцина 9 (L9) представляет собой одну замену, выбранную из группы, состоящей из L9→W9 (L9W), L9→I9 (L9I), L9→V9 (L9V), L9→Y9 (L9Y) и L9→F9 (L9F).
58. Антитело по пп.3, 7, 11, 15, 19, 23, 26, 29, 32, 35, 38, 41, 44 или 47, где антитело содержит замену из двух или более замен, выбранных из группы состоящей из
пролина 4 (P4) в VH CDR2 относительно SEQ ID NO: 4,
треонина 9 (T9) в VH CDR2 относительно SEQ ID NO: 4,
валина 16 (V16) в VH CDR3 относительно SEQ ID NO: 5 и
лейцина 9 (L9) в VH CDR1 относительно SEQ ID NO: 20.
59. Антитело по п.58, где антитело содержит две или более замен, выбранных из группы, состоящей из L9I/P4M, L9I/P4W, L9I/P4F, L9F/P4M, L9F/P4W, L9F/P4F, L9I/P4M/V16W, L9I/P4W/V16W, L9I/P4F/V16W, L9F/P4M/V16W, L9F/P4W/V16W, L9F/P4F/V16W, L9I/P4M/V16E, L9I/P4W/V16E, L9I/P4F/V16E, L9F/P4M/V16E, L9F/P4W/V16E, L9F/P4F/V16E, L9I/P4M/T9H/V16W, L9I/P4W/T9H/V16W, L9I/P4F/T9H/V16W, L9F/P4M/T9H/V16W, L9F/P4W/T9H/V16W, L9F/P4F/T9H/V16W, L9I/P4M/T9H/V16E, L9I/P4W/T9H/V16E, L9I/P4F/T9H/V16E, L9F/P4M/T9H/V16E, L9F/P4W/T9H/V16E и L9F/P4F/T9H/V16E.
60. Антитело по п.1 или 2, где антитело содержит Fc-фрагмент.
61. Антитело по п.60, где антитело содержит Fc-фрагмент IgG4 человека, содержащий аминокислотную последовательность SEQ ID NO: 32.
62. Антитело по п.60, где антитело содержит Fc-фрагмент IgG4 человека с мутацией S108P относительно SEQ ID NO: 32, содержащий аминокислотную последовательность SEQ ID NO: 33.
63. Антитело по п.60, где антитело содержит Fc-фрагмент IgG4 человека с мутацией S108P, мутацией M308L и мутацией N314A относительно SEQ ID NO: 32, содержащий аминокислотную последовательность SEQ ID NO: 61.
64. Способ лечения комплемент-опосредованного заболевания или расстройства у индивидуума, включающий стадию введения указанному индивидууму анти-C5 антитела по любому из пп.1-63.
65. Способ по п.64, в котором заболевание или расстройство по меньшей мере выбирают из группы, состоящей из: дегенерации желтого пятна (MD), возрастной дегенерации желтого пятна (AMD), ишемического реперфузионного повреждения, артрита, ревматоидного артрита, волчанки, язвенного колита, инсульта, синдрома системного воспалительного ответа в послеоперационном периоде, астмы, аллергической астмы, хронической обструктивной болезни легких (COPD), синдрома пароксизмальной ночной гемоглобинурии (PNH), миастении гравис, оптического нейромиелита (NMO), рассеянного склероза, задержки функции трансплантата на фоне антитело-опосредованного отторжения, атипичного гемолитико-уремического синдрома (aHUS), окклюзии центральной вены сетчатки (CRVO), окклюзии центральной артерии сетчатки (CRAO), буллезного эпидермолиза, сепсиса, трансплантации органов, воспаления (включая, помимо прочего, воспаление, связанное с операцией в условиях искусственного кровообращения и диализом почек), гломерулопатии C3, мембранозной нефропатии, нефропатии IgA, гломерулонефрита (включая, помимо прочего, гломерулонефрит, опосредованный цитоплазматическими антителами против нейтрофилов (ANCA), волчаночный нефрит и их комбинацию), ANCA-опосредованного васкулита, HUS, индуцированного Шига-токсином, и потери беременности, вызванной антифосфолипидными антителами, или любых их комбинаций.
66. Способ снижения активности системы комплемента у индивидуума, включающий введение антитела индивиду способом введения, выбранным из группы, состоящей из энтерального введения, парентерального введения и их комбинации, где антитело представляет собой антитело по любому из пп.1-63.
67. Способ по п.66, где антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из Fab, Fab’, F(ab)2, F(ab’)2, scFv и их комбинаций.
68. Молекула нуклеиновой кислоты, кодирующая антитело по любому из пп.1-63.
69. Вектор экспрессии, содержащий молекулу нуклеиновой кислоты по п.68.
70. Клетка для получения антитела по меньшей мере по любому из пп.1-63, где клетка содержит вектор по п.69.
71. Клетка по п.70, где клетка является гибридомой.
| WO 2015009856 A2 22.01.2015 | |||
| WO 2016028656 A1 25.02.2016 | |||
| НОВЫЕ АНТИ-PD-L1 АНТИТЕЛА | 2017 |
|
RU2744959C2 |
Авторы
Даты
2023-03-21—Публикация
2019-09-06—Подача