ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к последовательности нуклеиновой кислоты, приводящей к специфической экспрессии гена в клетках пигментного эпителия сетчатки (RPE).
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Для целей экспрессии рекомбинантные гены обычно трансфицируют в целевые клетки, популяции клеток или ткани в виде конструкций кДНК в составе активной кассеты экспрессии для обеспечения транскрипции гетерологичного гена. Конструкция ДНК распознается клеточной системой транскрипции в процессе, в который вовлечена активность множества действующих в транс-положении транскрипционных факторов (TF) в регуляторных элементах, действующих в цис-положении, включая энхансеры, сайленсеры, инсуляторы и промоторы (в данном документе называемых в совокупности "промоторами").
Промотор гена вовлечен во все из этих уровней регуляции, выступая в роли детерминанты в транскрипции гена за счет интеграции влияний последовательности ДНК, связывания транскрипционных факторов и эпигенетических свойств. Они определяют силу, например, экспрессии трансгена, который кодируется плазмидным вектором, а также то, в каком типе или типах клеток указанный трансген будет экспрессироваться.
Наиболее распространенные промоторы, применяемые для управления экспрессией гетерологичных генов в клетках млекопитающих, представляют собой промоторы основного немедленно-раннего гена цитомегаловирусов (CMV) человека и мыши. Они обеспечивают сильную экспрессию и доказали надежность в нескольких типах клеток. Другие вирусные промоторы, такие как промотор немедленно-раннего гена SV40 и промотор гена длинного концевого повтора (LTR) вируса саркомы Рауса (RSV), также часто применяются в кассетах экспрессии.
Вместо вирусных промоторов также можно применять клеточные промоторы. К известным промоторам относятся промоторы генов "домашнего хозяйства", кодирующих интенсивно транскрибируемые клеточные транскрипты, таких как ген бета-актина, ген фактора элонгации 1-альфа (EF-l-альфа) или ген убиквитина. По сравнению с вирусными промоторами экспрессия эукариотических генов является более сложной и требует точной координации многих различных факторов.
Одним из аспектов, касающихся применения эндогенных регуляторных элементов для экспрессии трансгена, является образование стабильной мРНК, и данная экспрессия может происходить в нативном окружении клетки-хозяина, в котором соответственно обеспечиваются действующие в транс-положении транскрипционные факторы. Поскольку экспрессия эукариотических генов контролируется сложной системой действующих в цис- и транс-положении регуляторных элементов, для большинства клеточных промоторов отсутствует подробная функциональная характеристика. Части эукариотического промотора обычно расположены непосредственно выше своей транскрибируемой последовательности и служат в качестве точки инициации транскрипции. Сайт начала транскрипции (TSS) непосредственно окружен коровым промотором, который является достаточным для распознавания системой транскрипции. Проксимальный промотор предусматривает область выше корового промотора и содержит TSS, а также другие элементы последовательности, необходимые для регуляции транскрипции. Транскрипционные факторы действуют специфически в отношении последовательности путем связывания с регуляторными мотивами в промоторной и энхансерной последовательности, за счет чего обеспечивается активация ферментов, модифицирующих хроматин и гистоны, что изменяет структуру нуклеосом и их положение, что, в конечном итоге, обеспечивает инициацию транскрипции. Идентификация функционального промотора в основном зависит от присутствия ассоциированных энхансерных элементов, расположенных выше или ниже.
Другим критически важным аспектом, касающимся применения эндогенных регуляторных элементов для экспрессии трансгенов, является то, что некоторые промоторы могут действовать специфически в отношении клеток, и это будет приводить к экспрессии трансгена в клетках специфического типа или, в зависимости от промотора, в клетках конкретной подгруппы.
Следовательно, одна из целей настоящего изобретения заключается в получении новых последовательностей, подходящих для экспрессии рекомбинантных генов в клетках сетчатки млекопитающего при высоких уровнях экспрессии и специфически в отношении типа клеток.
Такая последовательность удовлетворит существующую в данной области техники потребность в промоторе, специфическом в отношении клеток сетчатки, который требуется для разработки систем исследования нейродегенеративных нарушений, восстановления зрения, разработки лекарственных средств, видов терапии опухолей и диагностики нарушений.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В данной ситуации авторы настоящего изобретения по счастливой случайности обнаружили, что искусственный промотор, который, как было известно, управляет специфической экспрессией гена в амакриновых клетках сетчатки на мышиной модели, описанной в WO 2015/118507, неожиданно и нетипично характеризуется совершенно иной специфичностью у приматов. У приматов данный промотор управляет специфической экспрессией гена в клетках пигментного эпителия сетчатки (RPE). Данная специфичность особенно применима для направления и нацеливания экспрессии гена в клетки пигментного эпителия сетчатки при поражениях сетчатки, например, у пациентов с возрастной макулярной дегенерацией, пигментной дистрофией сетчатки, диабетической ретинопатией или гипертрофией пигментного эпителия сетчатки.
Последовательность нуклеиновой кислоты данного промотора представляет собой: TCAAGCCTCCTACCGCCTTTGTTATGCAAACATATCAAACGCCCTCCTTTGTTATGCAAAAGGGCTGGAACGGGGCCTTTGTTATGCAAATCGCCCTCCCCGATCCCTTTGTTATGCAAATTTGACGAATTCCCACCTTTGTTATGCAAACAAATCTCCTACCCTCCTTTGTTATGCAAAGTGAGAGGGGCTGCACCTTTGTTATGCAAAATGCGGCCCCTGAGACCTTTGTTATGCAAAAACCATGTACGCTTGCCTTTGTTATGCAAACCGCCTGTTGCTTGGCCTTTGTTATGCAAAGCCACGCGATTGGCGCCTTTGTTATGCAAAGCTCGGTTATGTACACCTTTGTTATGCAAAGCTACTTTAAACTTGCCTTTGTTATGCAAATCACGACCTGACCGTCCTTTGTTATGCAAAAACGGTTGAAATAGTCCTTTGTTATGCAAAATGATATTGAATAGTCCTTTGTTATGCAAAAATTTAGATGCCGACCCTTTGTTATGCAAAGGAATGGGCGTGCTGCCTTTGTTATGCAAATTTTCGCTGCGACAGCCTTTGTTATGCAAACATGCTCGCCACTCACCTTTGTTATGCAAAGGTCTAACAATGACCCCTTTGTTATGCAAACTACGTGGAATAGATCCTTTGTTATGCAAACCCCGAGTTTTTGAACCTTTGTTATGCAAAATCAGTAACTTCATTCCTTTGTTATGCAAAATGTGACTTAACCTCCCTTTGTTATGCAAA (SEQ ID NO:1).
Следовательно, в настоящем изобретении предусмотрен способ специфической экспрессии экзогенного гена в клетках пигментного эпителия сетчатки примата, причем указанный способ включает стадию доставки выделенной молекулы нуклеиновой кислоты, содержащей последовательность нуклеиновой кислоты под SEQ ID NO:1 или состоящий из нее, или состоящей из последовательности нуклеиновой кислоты из по меньшей мере 400 п. о., характеризующейся по меньшей мере 80% общей идентичностью с указанной последовательностью под SEQ ID NO:1, в клетки пигментного эпителия сетчатки указанного примата, где указанная выделенная молекула нуклеиновой кислоты приводит к специфической экспрессии экзогенного гена в клетках пигментного эпителия сетчатки приматов, если последовательность нуклеиновой кислоты, кодирующая указанный экзогенный ген, функционально связана с указанной выделенной молекулой нуклеиновой кислоты. Выделенная молекула нуклеиновой кислоты может дополнительно содержать минимальный промотор, например, минимальный промотор под SEQ ID NO:2, функционально связанный с указанной выделенной молекулой нуклеиновой кислоты. Выделенная молекула нуклеиновой кислоты может быть частью кассеты экспрессии, которая в свою очередь может быть частью вектора, например, вирусного вектора.
В настоящем изобретении также предусмотрено применение выделенной молекулы нуклеиновой кислоты, содержащей последовательность нуклеиновой кислоты под SEQ ID NO:1 или состоящей из нее, или состоящей из последовательности нуклеиновой кислоты из по меньшей мере 400 п. о., характеризующейся по меньшей мере 80% общей идентичностью с указанной последовательностью под SEQ ID NO:1, где указанная выделенная молекула нуклеиновой кислоты приводит к специфической экспрессии экзогенного гена в клетках пигментного эпителия сетчатки приматов, если последовательность нуклеиновой кислоты, кодирующая указанный экзогенный ген, функционально связана с указанной выделенной молекулой нуклеиновой кислоты, для специфической экспрессии экзогенного гена в клетках пигментного эпителия сетчатки примата. В случае данного применения выделенная молекула нуклеиновой кислоты может дополнительно содержать минимальный промотор, например, минимальный промотор под SEQ ID NO:2. Выделенная молекула нуклеиновой кислоты может быть частью кассеты экспрессии, которая может быть частью вектора, например, вирусного вектора.
В настоящем изобретении дополнительно предусмотрена выделенная молекула нуклеиновой кислоты, содержащая последовательность нуклеиновой кислоты под SEQ ID NO:1 или состоящая из нее, или состоящая из последовательности нуклеиновой кислоты из по меньшей мере 400 п. о., характеризующейся по меньшей мере 80% общей идентичностью с указанной последовательностью под SEQ ID NO:1, где указанная выделенная молекула нуклеиновой кислоты приводит к специфической экспрессии экзогенного гена в клетках пигментного эпителия сетчатки приматов, если последовательность нуклеиновой кислоты, кодирующая указанный экзогенный ген, функционально связана с указанной выделенной молекулой нуклеиновой кислоты, для применения при лечении заболевания, ассоциированного с пигментным эпителием сетчатки. Заболевание, ассоциированное с пигментным эпителием сетчатки, может быть выбрано из группы, состоящей из возрастной макулярной дегенерации, пигментной дистрофии сетчатки, диабетической ретинопатии и гипертрофии пигментного эпителия сетчатки.
Выделенная молекула нуклеиновой кислоты, содержащая последовательность нуклеиновой кислоты под SEQ ID NO:1 или состоящая из нее или последовательности нуклеиновой кислоты из по меньшей мере 400 п. о., характеризующейся по меньшей мере 80% общей идентичностью с указанной последовательностью нуклеиновой кислоты под SEQ ID NO:1, где указанная выделенная молекула нуклеиновой кислоты приводит к специфической экспрессии в клетках пигментного эпителия сетчатки приматов гена, функционально связанного с указанной последовательностью нуклеиновой кислоты, кодирующей указанный ген, может состоять из по меньшей мере 400 п. о., по меньшей мере 500 п. о., по меньшей мере 600 п. о., по меньшей мере 700 п. о., по меньшей мере 750 п. о., по меньшей мере 800 п. о., по меньшей мере 900 п. о., по меньшей мере 1000 п. о., по меньшей мере 1100 п. о., по меньшей мере 1200 п. о., по меньшей мере 1300 п. о., по меньшей мере 1400 п. о., по меньшей мере 1500 п. о., по меньшей мере 1600 п. о., по меньшей мере 1700 п. о., по меньшей мере 1800 п. о., по меньшей мере 1900 п. о. или по меньшей мере 2000 п. о. и характеризуется по меньшей мере 80% идентичностью с указанной последовательностью нуклеиновой кислоты под SEQ ID NO:1. В некоторых вариантах осуществления последовательность нуклеиновой кислоты состоит из по меньшей мере 400 п. о., по меньшей мере 500 п. о., по меньшей мере 600 п. о., по меньшей мере 700 п. о., по меньшей мере 800 п. о., по меньшей мере 900 п. о., по меньшей мере 1000 п. о., по меньшей мере 1100 п. о., по меньшей мере 1200 п. о., по меньшей мере 1300 п. о., по меньшей мере 1400 п. о., по меньшей мере 1500 п. о., по меньшей мере 1600 п. о., по меньшей мере 1700 п. о., по меньшей мере 1800 п. о., по меньшей мере 1900 п. о. или по меньшей мере 2000 п. о. и характеризуется по меньшей мере 85% общей идентичностью с указанной последовательностью нуклеиновой кислоты под SEQ ID NO:1. В некоторых вариантах осуществления последовательность нуклеиновой кислоты состоит из по меньшей мере 400 п. о., по меньшей мере 500 п. о., по меньшей мере 600 п. о., по меньшей мере 700 п. о., по меньшей мере 800 п. о., по меньшей мере 900 п. о., по меньшей мере 1000 п. о., по меньшей мере 1100 п. о., по меньшей мере 1200 п. о., по меньшей мере 1300 п. о., по меньшей мере 1400 п. о., по меньшей мере 1500 п. о., по меньшей мере 1600 п. о., по меньшей мере 1700 п. о., по меньшей мере 1800 п. о., по меньшей мере 1900 п. о. или по меньшей мере 2000 п. о. и характеризуется по меньшей мере 90% общей идентичностью с указанной последовательностью нуклеиновой кислоты под SEQ ID NO:1. В некоторых вариантах осуществления последовательность нуклеиновой кислоты состоит из по меньшей мере 400 п. о., по меньшей мере 500 п. о., по меньшей мере 600 п. о., по меньшей мере 700 п. о., по меньшей мере 800 п. о., по меньшей мере 900 п. о., по меньшей мере 1000 п. о., по меньшей мере 1100 п. о., по меньшей мере 1200 п. о., по меньшей мере 1300 п. о., по меньшей мере 1400 п. о., по меньшей мере 1500 п. о., по меньшей мере 1600 п. о., по меньшей мере 1700 п. о., по меньшей мере 1800 п. о., по меньшей мере 1900 п. о. или по меньшей мере 2000 п. о. и характеризуется по меньшей мере 95% общей идентичностью с указанной последовательностью нуклеиновой кислоты под SEQ ID NO:1. В некоторых вариантах осуществления последовательность нуклеиновой кислоты состоит из по меньшей мере 400 п. о., по меньшей мере 500 п. о., по меньшей мере 600 п. о., по меньшей мере 700 п. о., по меньшей мере 800 п. о., по меньшей мере 900 п. о., по меньшей мере 1000 п. о., по меньшей мере 1100 п. о., по меньшей мере 1200 п. о., по меньшей мере 1300 п. о., по меньшей мере 1400 п. о., по меньшей мере 1500 п. о., по меньшей мере 1600 п. о., по меньшей мере 1700 п. о., по меньшей мере 1800 п. о., по меньшей мере 1900 п. о. или по меньшей мере 2000 п. о. и характеризуется по меньшей мере 96% общей идентичностью с указанной последовательностью нуклеиновой кислоты под SEQ ID NO:1. В некоторых вариантах осуществления последовательность нуклеиновой кислоты состоит из по меньшей мере 400 п. о., по меньшей мере 500 п. о., по меньшей мере 600 п. о., по меньшей мере 700 п. о., по меньшей мере 800 п. о., по меньшей мере 900 п. о., по меньшей мере 1000 п. о., по меньшей мере 1100 п. о., по меньшей мере 1200 п. о., по меньшей мере 1300 п. о., по меньшей мере 1400 п. о., по меньшей мере 1500 п. о., по меньшей мере 1600 п. о., по меньшей мере 1700 п. о., по меньшей мере 1800 п. о., по меньшей мере 1900 п. о. или по меньшей мере 2000 п. о. и характеризуется по меньшей мере 97% общей идентичностью с указанной последовательностью нуклеиновой кислоты под SEQ ID NO:1. В некоторых вариантах осуществления последовательность нуклеиновой кислоты состоит из по меньшей мере 400 п. о., по меньшей мере 500 п. о., по меньшей мере 600 п. о., по меньшей мере 700 п. о., по меньшей мере 800 п. о., по меньшей мере 900 п. о., по меньшей мере 1000 п. о., по меньшей мере 1100 п. о., по меньшей мере 1200 п. о., по меньшей мере 1300 п. о., по меньшей мере 1400 п. о., по меньшей мере 1500 п. о., по меньшей мере 1600 п. о., по меньшей мере 1700 п. о., по меньшей мере 1800 п. о., по меньшей мере 1900 п. о. или по меньшей мере 2000 п. о. и характеризуется по меньшей мере 98% общей идентичностью с указанной последовательностью нуклеиновой кислоты под SEQ ID NO:1. В некоторых вариантах осуществления последовательность нуклеиновой кислоты состоит из по меньшей мере 400 п. о., по меньшей мере 500 п. о., по меньшей мере 600 п. о., по меньшей мере 700 п. о., по меньшей мере 800 п. о., по меньшей мере 900 п. о., по меньшей мере 1000 п. о., по меньшей мере 1100 п. о., по меньшей мере 1200 п. о., по меньшей мере 1300 п. о., по меньшей мере 1400 п. о., по меньшей мере 1500 п. о., по меньшей мере 1600 п. о., по меньшей мере 1700 п. о., по меньшей мере 1800 п. о., по меньшей мере 1900 п. о. или по меньшей мере 2000 п. о. и характеризуется по меньшей мере 99% общей идентичностью с указанной последовательностью нуклеиновой кислоты под SEQ ID NO:1. В некоторых вариантах осуществления последовательность нуклеиновой кислоты состоит из по меньшей мере 400 п. о., по меньшей мере 500 п. о., по меньшей мере 600 п. о., по меньшей мере 700 п. о., по меньшей мере 800 п. о., по меньшей мере 900 п. о., по меньшей мере 1000 п. о., по меньшей мере 1100 п. о., по меньшей мере 1200 п. о., по меньшей мере 1300 п. о., по меньшей мере 1400 п. о., по меньшей мере 1500 п. о., по меньшей мере 1600 п. о., по меньшей мере 1700 п. о., по меньшей мере 1800 п. о., по меньшей мере 1900 п. о. или по меньшей мере 2000 п. о. и характеризуется 100% общей идентичностью с указанной последовательностью нуклеиновой кислоты под SEQ ID NO:1.
Выделенная молекула нуклеиновой кислоты по настоящему изобретению может содержать минимальный промотор, например, минимальный промотор SV40, например, минимальный промотор SV40 gctcgagatctgcgatctgcatctcaattagtcagcaaccatagtcccgcccctaactccgcccatcccgcccctaactccgcccagttccgcccattctccgccccatcgctgactaattttttttatttatgcagaggccgaggccgcctcggcctctgagctattccagaagtagtgaggaggcttttttggaggcctaggcttttgcaaa (SEQ ID NO:2), предпочтительно функционально связанный с указанной выделенной молекулой нуклеиновой кислоты.
Типичный ген, который может быть функционально связан с промотором по настоящему изобретению, представляет собой ген, кодирующий фоторецептор. Например, это может быть фоточувствительная молекула, такая как канальный родопсин или галородопсин.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фигура 1. Целенаправленная экспрессия в клетках пигментного эпителия сетчатки в сетчатке примата за счет промотора, содержащего SEQ ID NO:1. Полученные с помощью лазерного сканирующего конфокального микроскопа фотографии экспрессии EGFP за счет промотора, содержащего SEQ ID NO:1, через 3 месяца после субретинальной инъекции AAV-synP12-ChR2-EGFP в глаза взрослого макака (Macaca mulatta). Можно наблюдать индуцированную экспрессию в клетках пигментного эпителия сетчатки. Зеленый=EGFP, управляемый SEQ ID NO:3. Белый=краситель Hoechst.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В данной ситуации авторы настоящего изобретения по счастливой случайности обнаружили, что искусственный промотор, который, как было известно, управляет специфической экспрессией гена в амакриновых клетках сетчатки на мышиной модели, описанной в WO 2015/118507, неожиданно и нетипично характеризуется совершенно иной специфичностью у приматов. У приматов данный промотор управляет специфической экспрессией гена в клетках пигментного эпителия сетчатки. Данная специфичность особенно применима для направления и нацеливания экспрессии гена в клетки пигментного эпителия сетчатки при поражениях сетчатки, например, у пациентов с возрастной макулярной дегенерацией, пигментной дистрофией сетчатки, диабетической ретинопатией или гипертрофией пигментного эпителия сетчатки.
Последовательность нуклеиновой кислоты данного промотора представляет собой: TCAAGCCTCCTACCGCCTTTGTTATGCAAACATATCAAACGCCCTCCTTTGTTATGCAAAAGGGCTGGAACGGGGCCTTTGTTATGCAAATCGCCCTCCCCGATCCCTTTGTTATGCAAATTTGACGAATTCCCACCTTTGTTATGCAAACAAATCTCCTACCCTCCTTTGTTATGCAAAGTGAGAGGGGCTGCACCTTTGTTATGCAAAATGCGGCCCCTGAGACCTTTGTTATGCAAAAACCATGTACGCTTGCCTTTGTTATGCAAACCGCCTGTTGCTTGGCCTTTGTTATGCAAAGCCACGCGATTGGCGCCTTTGTTATGCAAAGCTCGGTTATGTACACCTTTGTTATGCAAAGCTACTTTAAACTTGCCTTTGTTATGCAAATCACGACCTGACCGTCCTTTGTTATGCAAAAACGGTTGAAATAGTCCTTTGTTATGCAAAATGATATTGAATAGTCCTTTGTTATGCAAAAATTTAGATGCCGACCCTTTGTTATGCAAAGGAATGGGCGTGCTGCCTTTGTTATGCAAATTTTCGCTGCGACAGCCTTTGTTATGCAAACATGCTCGCCACTCACCTTTGTTATGCAAAGGTCTAACAATGACCCCTTTGTTATGCAAACTACGTGGAATAGATCCTTTGTTATGCAAACCCCGAGTTTTTGAACCTTTGTTATGCAAAATCAGTAACTTCATTCCTTTGTTATGCAAAATGTGACTTAACCTCCCTTTGTTATGCAAA (SEQ ID NO:1).
Следовательно, в настоящем изобретении предусмотрен способ специфической экспрессии экзогенного гена в клетках пигментного эпителия сетчатки примата, причем указанный способ включает стадию доставки выделенной молекулы нуклеиновой кислоты, содержащей последовательность нуклеиновой кислоты под SEQ ID NO:1 или состоящий из нее, или состоящей из последовательности нуклеиновой кислоты из по меньшей мере 400 п. о., характеризующейся по меньшей мере 80% общей идентичностью с указанной последовательностью под SEQ ID NO:1, в клетки пигментного эпителия сетчатки указанного примата, где указанная выделенная молекула нуклеиновой кислоты приводит к специфической экспрессии экзогенного гена в клетках пигментного эпителия сетчатки приматов, если последовательность нуклеиновой кислоты, кодирующая указанный экзогенный ген, функционально связана с указанной выделенной молекулой нуклеиновой кислоты. Выделенная молекула нуклеиновой кислоты может дополнительно содержать минимальный промотор, например, минимальный промотор под SEQ ID NO:2. Выделенная молекула нуклеиновой кислоты может быть частью кассеты экспрессии, которая в свою очередь может быть частью вектора, например, вирусного вектора.
В настоящем изобретении также предусмотрено применение выделенной молекулы нуклеиновой кислоты, содержащей последовательность нуклеиновой кислоты под SEQ ID NO:1 или состоящей из нее, или состоящей из последовательности нуклеиновой кислоты из по меньшей мере 400 п. о., характеризующейся по меньшей мере 80% общей идентичностью с указанной последовательностью под SEQ ID NO:1, где указанная выделенная молекула нуклеиновой кислоты приводит к специфической экспрессии экзогенного гена в клетках пигментного эпителия сетчатки приматов, если последовательность нуклеиновой кислоты, кодирующая указанный экзогенный ген, функционально связана с указанной выделенной молекулой нуклеиновой кислоты, для специфической экспрессии экзогенного гена в клетках пигментного эпителия сетчатки примата. В случае данного применения выделенная молекула нуклеиновой кислоты может дополнительно содержать минимальный промотор, например, минимальный промотор под SEQ ID NO:2. Выделенная молекула нуклеиновой кислоты может быть частью кассеты экспрессии, которая может быть частью вектора, например, вирусного вектора.
В настоящем изобретении дополнительно предусмотрена выделенная молекула нуклеиновой кислоты, содержащая последовательность нуклеиновой кислоты под SEQ ID NO:1 или состоящая из нее, или состоящая из последовательности нуклеиновой кислоты из по меньшей мере 400 п. о., характеризующейся по меньшей мере 80% общей идентичностью с указанной последовательностью под SEQ ID NO:1, где указанная выделенная молекула нуклеиновой кислоты приводит к специфической экспрессии экзогенного гена в клетках пигментного эпителия сетчатки приматов, если последовательность нуклеиновой кислоты, кодирующая указанный экзогенный ген, функционально связана с указанной выделенной молекулой нуклеиновой кислоты, для применения при лечении заболевания, ассоциированного с пигментным эпителием сетчатки. Заболевание, ассоциированное с пигментным эпителием сетчатки, может быть выбрано из группы, состоящей из возрастной макулярной дегенерации, пигментной дистрофии сетчатки, диабетической ретинопатии и гипертрофии пигментного эпителия сетчатки.
Выделенная молекула нуклеиновой кислоты, содержащая последовательность нуклеиновой кислоты под SEQ ID NO:1 или состоящая из нее или последовательности нуклеиновой кислоты из по меньшей мере 400 п. о., характеризующейся по меньшей мере 80% общей идентичностью с указанной последовательностью нуклеиновой кислоты под SEQ ID NO:1, где указанная выделенная молекула нуклеиновой кислоты приводит к специфической экспрессии в клетках пигментного эпителия сетчатки приматов гена, функционально связанного с указанной последовательностью нуклеиновой кислоты, кодирующей указанный ген, может состоять из по меньшей мере 400 п. о., по меньшей мере 500 п. о., по меньшей мере 600 п. о., по меньшей мере 700 п. о., по меньшей мере 750 п. о., по меньшей мере 800 п. о., по меньшей мере 900 п. о., по меньшей мере 1000 п. о., по меньшей мере 1100 п. о., по меньшей мере 1200 п. о., по меньшей мере 1300 п. о., по меньшей мере 1400 п. о., по меньшей мере 1500 п. о., по меньшей мере 1600 п. о., по меньшей мере 1700 п. о., по меньшей мере 1800 п. о., по меньшей мере 1900 п. о. или по меньшей мере 2000 п. о. и характеризуется по меньшей мере 80% идентичностью с указанной последовательностью нуклеиновой кислоты под SEQ ID NO:1. В некоторых вариантах осуществления последовательность нуклеиновой кислоты состоит из по меньшей мере 400 п. о., по меньшей мере 500 п. о., по меньшей мере 600 п. о., по меньшей мере 700 п. о., по меньшей мере 800 п. о., по меньшей мере 900 п. о., по меньшей мере 1000 п. о., по меньшей мере 1100 п. о., по меньшей мере 1200 п. о., по меньшей мере 1300 п. о., по меньшей мере 1400 п. о., по меньшей мере 1500 п. о., по меньшей мере 1600 п. о., по меньшей мере 1700 п. о., по меньшей мере 1800 п. о., по меньшей мере 1900 п. о. или по меньшей мере 2000 п. о. и характеризуется по меньшей мере 85% общей идентичностью с указанной последовательностью нуклеиновой кислоты под SEQ ID NO:1. В некоторых вариантах осуществления последовательность нуклеиновой кислоты состоит из по меньшей мере 400 п. о., по меньшей мере 500 п. о., по меньшей мере 600 п. о., по меньшей мере 700 п. о., по меньшей мере 800 п. о., по меньшей мере 900 п. о., по меньшей мере 1000 п. о., по меньшей мере 1100 п. о., по меньшей мере 1200 п. о., по меньшей мере 1300 п. о., по меньшей мере 1400 п. о., по меньшей мере 1500 п. о., по меньшей мере 1600 п. о., по меньшей мере 1700 п. о., по меньшей мере 1800 п. о., по меньшей мере 1900 п. о. или по меньшей мере 2000 п. о. и характеризуется по меньшей мере 90% общей идентичностью с указанной последовательностью нуклеиновой кислоты под SEQ ID NO:1. В некоторых вариантах осуществления последовательность нуклеиновой кислоты состоит из по меньшей мере 400 п. о., по меньшей мере 500 п. о., по меньшей мере 600 п. о., по меньшей мере 700 п. о., по меньшей мере 800 п. о., по меньшей мере 900 п. о., по меньшей мере 1000 п. о., по меньшей мере 1100 п. о., по меньшей мере 1200 п. о., по меньшей мере 1300 п. о., по меньшей мере 1400 п. о., по меньшей мере 1500 п. о., по меньшей мере 1600 п. о., по меньшей мере 1700 п. о., по меньшей мере 1800 п. о., по меньшей мере 1900 п. о. или по меньшей мере 2000 п. о. и характеризуется по меньшей мере 95% общей идентичностью с указанной последовательностью нуклеиновой кислоты под SEQ ID NO:1. В некоторых вариантах осуществления последовательность нуклеиновой кислоты состоит из по меньшей мере 400 п. о., по меньшей мере 500 п. о., по меньшей мере 600 п. о., по меньшей мере 700 п. о., по меньшей мере 800 п. о., по меньшей мере 900 п. о., по меньшей мере 1000 п. о., по меньшей мере 1100 п. о., по меньшей мере 1200 п. о., по меньшей мере 1300 п. о., по меньшей мере 1400 п. о., по меньшей мере 1500 п. о., по меньшей мере 1600 п. о., по меньшей мере 1700 п. о., по меньшей мере 1800 п. о., по меньшей мере 1900 п. о. или по меньшей мере 2000 п. о. и характеризуется по меньшей мере 96% общей идентичностью с указанной последовательностью нуклеиновой кислоты под SEQ ID NO:1. В некоторых вариантах осуществления последовательность нуклеиновой кислоты состоит из по меньшей мере 400 п. о., по меньшей мере 500 п. о., по меньшей мере 600 п. о., по меньшей мере 700 п. о., по меньшей мере 800 п. о., по меньшей мере 900 п. о., по меньшей мере 1000 п. о., по меньшей мере 1100 п. о., по меньшей мере 1200 п. о., по меньшей мере 1300 п. о., по меньшей мере 1400 п. о., по меньшей мере 1500 п. о., по меньшей мере 1600 п. о., по меньшей мере 1700 п. о., по меньшей мере 1800 п. о., по меньшей мере 1900 п. о. или по меньшей мере 2000 п. о. и характеризуется по меньшей мере 97% общей идентичностью с указанной последовательностью нуклеиновой кислоты под SEQ ID NO:1. В некоторых вариантах осуществления последовательность нуклеиновой кислоты состоит из по меньшей мере 400 п. о., по меньшей мере 500 п. о., по меньшей мере 600 п. о., по меньшей мере 700 п. о., по меньшей мере 800 п. о., по меньшей мере 900 п. о., по меньшей мере 1000 п. о., по меньшей мере 1100 п. о., по меньшей мере 1200 п. о., по меньшей мере 1300 п. о., по меньшей мере 1400 п. о., по меньшей мере 1500 п. о., по меньшей мере 1600 п. о., по меньшей мере 1700 п. о., по меньшей мере 1800 п. о., по меньшей мере 1900 п. о. или по меньшей мере 2000 п. о. и характеризуется по меньшей мере 98% общей идентичностью с указанной последовательностью нуклеиновой кислоты под SEQ ID NO:1. В некоторых вариантах осуществления последовательность нуклеиновой кислоты состоит из по меньшей мере 400 п. о., по меньшей мере 500 п. о., по меньшей мере 600 п. о., по меньшей мере 700 п. о., по меньшей мере 800 п. о., по меньшей мере 900 п. о., по меньшей мере 1000 п. о., по меньшей мере 1100 п. о., по меньшей мере 1200 п. о., по меньшей мере 1300 п. о., по меньшей мере 1400 п. о., по меньшей мере 1500 п. о., по меньшей мере 1600 п. о., по меньшей мере 1700 п. о., по меньшей мере 1800 п. о., по меньшей мере 1900 п. о. или по меньшей мере 2000 п. о. и характеризуется по меньшей мере 99% общей идентичностью с указанной последовательностью нуклеиновой кислоты под SEQ ID NO:1. В некоторых вариантах осуществления последовательность нуклеиновой кислоты состоит из по меньшей мере 400 п. о., по меньшей мере 500 п. о., по меньшей мере 600 п. о., по меньшей мере 700 п. о., по меньшей мере 800 п. о., по меньшей мере 900 п. о., по меньшей мере 1000 п. о., по меньшей мере 1100 п. о., по меньшей мере 1200 п. о., по меньшей мере 1300 п. о., по меньшей мере 1400 п. о., по меньшей мере 1500 п. о., по меньшей мере 1600 п. о., по меньшей мере 1700 п. о., по меньшей мере 1800 п. о., по меньшей мере 1900 п. о. или по меньшей мере 2000 п. о. и характеризуется 100% общей идентичностью с указанной последовательностью нуклеиновой кислоты под SEQ ID NO:1.
Выделенная молекула нуклеиновой кислоты по настоящему изобретению может содержать минимальный промотор, например, минимальный промотор SV40, например, минимальный промотор SV40 gctcgagatctgcgatctgcatctcaattagtcagcaaccatagtcccgcccctaactccgcccatcccgcccctaactccgcccagttccgcccattctccgccccatcgctgactaattttttttatttatgcagaggccgaggccgcctcggcctctgagctattccagaagtagtgaggaggcttttttggaggcctaggcttttgcaaa (SEQ ID NO:2).
Типичный ген, который может быть функционально связан с промотором по настоящему изобретению, представляет собой ген, кодирующий фоторецептор. Например, это может быть фоточувствительная молекула, такая как канальный родопсин или галородопсин.
Экспрессию экзогенных генов с применением промотора по настоящему изобретению можно осуществлять in vitro, in vivo или ex vivo.
Применяемый в данном документе термин "промотор" относится к любым действующим в цис-положении регуляторным элементам, в том числе энхансерам, сайленсерам, инсуляторам и промоторам. Промотор представляет собой область ДНК, которая обычно расположена выше (в направлении области 5'-конца) гена, который необходимо транскрибировать. Промотор обеспечивает надлежащую активацию или репрессию гена, который находится под его контролем. В контексте настоящего изобретения промоторы приводят к специфической экспрессии генов, функционально связанных с ними в промежуточных нейронах. "Специфическая экспрессия", также называемая "экспрессией только в определенном типе клеток", означает, что по меньшей мере более 75% клеток, экспрессирующих представляющий интерес ген, относятся к указанному типу, т. е. в данном случае представляют собой клетки пигментного эпителия сетчатки (RPE).
Пигментный слой сетчатки или пигментный эпителий сетчатки (RPE), также известный как pigmentum nigrum, представляет собой слой пигментированных клеток, находящийся в непосредственной близости от нейросенсорной сетчатки, который питает светочувствительные клетки сетчатки и прочно прикреплен к нижележащей сосудистой оболочке и вышележащим светочувствительным клеткам сетчатки. RPE состоит из одного слоя гексагональных клеток, которые плотно заполнены пигментными гранулами. В зубчатом крае RPE продолжается в виде мембраны, проходящей через цилиарное тело и продолжающейся как задняя поверхность радужки. Он образует волокна мышцы-расширителя. Непосредственно под данным эпителием находится нейроэпителий (т. е. палочки и колбочки), который проходит в тесной связи с RPE. Согласно представлениям оба в совокупности представляют собой цилиарный эпителий эмбриона. Продолжением переднего конца сетчатки является задний эпителий радужки, который приобретает пигмент при входе в радужку. При взгляде с наружной поверхности эти клетки являются гладкими и имеют гексагональную форму. При рассмотрении в разрезе каждая клетка состоит из наружной непигментированной части, содержащей крупное овальное ядро, и внутренней пигментированной части, которая выступает в виде ряда прямых нитевидных отростков между палочками, особенно в случае, когда глаз подвергается воздействию света. RPE выполняет несколько функций, а именно: поглощение света, эпителиальный транспорт, пространственную буферизацию ионов, зрительный цикл, фагоцитоз, секрецию и иммуномодуляцию.
Как правило, кассеты экспрессии вводят в вектор, который облегчает введение кассеты экспрессии в клетку-хозяина и поддержание кассеты экспрессии в клетке-хозяине. Такие векторы являются общеупотребительными и хорошо известны специалистам в данной области техники. Многие такие векторы являются коммерчески доступными, например, от Invitrogen, Stratagene, Clontech и т. д., и описаны во многих руководствах, таких как Ausubel, Guthrie, Strathem или Berger, все из которых приведены выше. Как правило, такие векторы содержат промоторы, сигналы полиаденилирования и т. д., в сочетании с несколькими сайтами клонирования, а также дополнительные элементы, такие как точки начала репликации, гены селектируемых маркеров (например, LEU2, URA3, TRP1, HIS3, GFP), центромерные последовательности и т. д.
Вирусные векторы, например, AAV, PRV или лентивирус, подходят для нацеливания и доставки генов в клетки пигментного эпителия сетчатки с применением промотора по настоящему изобретению.
Выход клеток сетчатки можно измерять с применением электрического способа, такого как мультиэлектродная матрица или пэтч-кламп, или с применением визуального способа, такого как обнаружение флуоресценции.
Способы с применением последовательности нуклеиновой кислоты по настоящему изобретению можно применять для идентификации терапевтических средств для лечения неврологического нарушения или патологии сетчатки, с вовлечением клеток RPE, причем указанный способ включает стадии приведения тестируемого соединения в контакт с клетками пигментного эпителия сетчатки, экспрессирующими один или несколько трансгенов под контролем промотора по настоящему изобретению, и сравнения по меньшей мере одного выхода клеток пигментного эпителия сетчатки, полученных в присутствии указанного тестируемого соединения, с таким же выходом, полученным в отсутствие указанного тестируемого соединения.
Более того, способы с применением промоторов по настоящему изобретению можно также применять для in vitro тестирования восстановления зрения, причем указанный способ включает стадии приведения клеток пигментного эпителия сетчатки, экспрессирующих один или несколько трансгенов под контролем промотора по настоящему изобретению, в контакт со средством и сравнения по меньшей мере одного выхода, полученного после контакта с указанным средством, с тем же выходом, полученным перед указанным контактом с указанным средством.
Канальные родопсины представляют собой подсемейство белков опсинов, которые функционируют в качестве регулируемых светом ионных каналов. Они служат в качестве сенсорных фоторецепторов у одноклеточных зеленых водорослей, контролируя фототаксис, т. е. движение в ответ на свет. При экспрессии в клетках других организмов они способны использовать свет для контроля внутриклеточной кислотности, поступления кальция, электрической возбудимости и других клеточных процессов. В настоящее время известны по меньшей мере три "природных" канальных родопсина: канальный родопсин 1 (ChR1), канальный родопсин 2 (ChR2) и канальный родопсин вольвокса (VChR1). Более того, также существуют некоторые модифицированные/улучшенные варианты этих белков. Все известные канальные родопсины представляют собой неспецифические катионные каналы, проводящие ионы H+, Na+, K+ и Ca2+.
Галородопсин представляет собой управляемый светом ионный насос, специфический в отношении ионов хлора, и встречается у филогенетически древних "бактерий" (архей), известных как галобактерии. Он представляет собой белок с семью трансмембранными фрагментами из семейства ретинилиденовых белков, гомологичный управляемому светом протонному насосу бактериородопсину и схожий по третичной структуре (но не по первичной структуре последовательности) c родопсинами позвоночных, пигментами, которые воспринимают свет в сетчатке. Галородопсин также характеризуется сходством последовательности с канальным родопсином, управляемым светом ионным каналом. Галородопсин содержит полностью транс-ретиналь, наиболее важное изомеризующееся на свету производное витамина А. Галородопсин является одним из небольшого числа мембранных белков, кристаллическая структура которых известна. Изоформы галородопсина могут встречаться у многих видов галобактерий, включая H. salinarum и N. pharaonis. Во многих продолжающихся исследованиях изучаются эти различия и их применение для тщательного анализа фотоциклических и насосных свойств. По видимому, галородопсин является наиболее изученным опсином I типа (микробным) после бактериородопсина. Максимальное поглощение галородопсинового комплекса в сетчатке составляет приблизительно 570 нм. В последнее время галородопсин стал инструментом в оптогенетике. Подобно тому, как обнаружилось, что активируемый синим светом ионный канал, канальный родопсин 2, способен активировать возбудимые клетки (такие как нейроны, мышечные клетки, клетки поджелудочной железы и клетки иммунной системы) под действием коротких импульсов синего света, обнаружилось, что галородопсин способен подавлять возбудимые клетки под действием коротких импульсов желтого света. Таким образом, галородопсин и канальный родопсин вместе обеспечивают многоцветную оптическую активацию, подавление и десинхронизацию активности нейронов, создавая высокоэффективный инструментарий для нейроинженерии.
В некоторых вариантах осуществления промотор является частью вектора, нацеленного на сетчатку, причем указанный вектор экспрессирует по меньшей мере один репортерный ген, который можно обнаруживать в живых клетках пигментного эпителия сетчатки. Такие репортерные гены могут указывать на функционирующую нейронную сеть. Примерами таких векторов являются сенсоры активности или радужные вирусы (Nature Methods 6, 127-130 (2009)). Примерами таких вирусов являются ретроградные транссинаптические вирусы псевдобешенства (PRV) с генетически закодированными сенсорами активности, которые оптическим образом сообщают об активности связанных нейронов среди пространственно сплетенных нейронов в головном мозге. Такой сенсор активности может представлять собой выделенный транссинаптический вирус, экспрессирующий экзогенный флуоресцентный сенсор активности. Транссинаптический вирус может представлять собой рабдовирус, например, вирус бешенства, или герпесвирус, например, альфагерпесвирус, например, вирус псевдобешенства.
Флуоресцентный экзогенный сенсор активности может представлять собой флуоресцентный белковый сенсор Ca2+, например, желтый камелеон, камгару, G-CaMP/перикам или TN-L15, или флуоресцентный белковый сенсор напряжения, например, FlaSh, SPARC или VSP, предпочтительно VSP1.
Подходящие для настоящего изобретения вирусные векторы широко известны в данной области техники. Например AAV, PRV или лентивирус подходят для нацеливания и доставки генов в клетки пигментного эпителия сетчатки.
При работе с изолированной сетчаткой оптимальной вирусной доставки в фоторецепторы можно достичь при ее прикреплении стороной с ганглионарными клетками вниз так, чтобы фоторецепторная сторона сетчатки была обнажена и, за счет чего, могла лучше подвергать трансфекции. Другой методикой является разрезание, например, с помощью лезвия бритвы, внутренней пограничной мембраны сетчатки, вследствие чего доставляемые вирусы могут проникать через внутренние мембраны. Дополнительный способ представляет собой заключение сетчатки в агар, разрезание указанной сетчатки и нанесение вирусов для доставки со стороны разреза.
Выход трансфицированных клеток можно измерять с применением широко известных способов, например, с применением электрического способа, такого как мультиэлектродная матрица или пэтч-кламп, или с применением визуального способа, такого как обнаружение флуоресценции. В некоторых случаях внутреннюю пограничную мембрану удаляют с помощью микрохирургии внутренней пограничной мембраны. В других случаях регистрацию осуществляют через разрезы, выполняемые во внутренней пограничной мембране.
Источником клеток сетчатки для применения в настоящем изобретении является примат. В некоторых вариантах осуществления настоящего изобретения клетки сетчатки получены из сетчатки человека или находятся в ней. В других вариантах осуществления сетчатка принадлежит другому примату из любой из двух различных линий: полуобезьян и обезьян. Сетчатку человека можно легко получать из банков роговицы, где указанные образцы сетчатки обычно выбрасывают после препарирования роговицы. Сетчатка взрослого человека имеет большую поверхность (приблизительно 1100 мм2) и, следовательно, легко может быть разделена на целый ряд экспериментальных подобластей. Кроме того, образцы сетчатки также можно применять в качестве превосходной модели синаптической передачи, поскольку сетчатка имеет синапсы, которые идентичны синапсам в остальной части головного мозга.
Применяемый в данном документе термин "животное" применяется в данном документе для охвата всех животных. В некоторых вариантах осуществления животное, отличное от человека, является позвоночным животным. Примерами животных являются человек, мыши, крысы, коровы, свиньи, лошади, куры, утки, гуси, кошки, собаки и т. д. Термин "животное" также включает отдельное животное на всех стадиях развития, включая стадии эмбриона и плода. "Генетически модифицированное животное" представляет собой любое животное, содержащее одну или несколько клеток, несущих генетическую информацию, измененную или полученную, напрямую или опосредованно, посредством преднамеренной генетической манипуляции на субклеточном уровне, например, посредством целенаправленной рекомбинации, микроинъекции или инфицирования рекомбинантным вирусом. Считается, что термин "генетически модифицированное животное" не включает классическое скрещивание или оплодотворение in vitro, а подразумевает охват животных, у которых одна или несколько клеток изменены с помощью рекомбинантной молекулы ДНК или получают ее. Рекомбинантная молекула ДНК может специфически нацеливаться в определенный генетический локус, может случайно интегрироваться в хромосому, или она может представлять собой внехромосомно реплицируемую ДНК. Термин "животное с генетически модифицированной зародышевой линией" относится к генетически модифицированному животному, у которого генетическое изменение или генетическая информация были введены в клетки зародышевой линии, за счет чего обеспечивается способность передавать генетическую информацию его потомству. Если такое потомство действительно обладает частью такого изменения или генетической информации или ими всеми, то они также являются генетически модифицированными животными.
Изменение или генетическая информация могут быть чужеродными для вида животного, к которому принадлежит реципиент, или чужеродными только для конкретного отдельного реципиента, или могут представлять собой генетическую информацию, которой реципиент уже обладает. В последнем случае измененный или введенный ген может экспрессироваться иным образом, чем нативный ген, или может не экспрессироваться вообще.
Гены, применяемые для изменения целевого гена, можно получать с помощью самых разнообразных методик, которые включают без ограничения выделение из геномных источников, получение кДНК из выделенных матриц мРНК, прямой синтез или их комбинацию.
Одним типом целевых клеток для введения трансгенов являются ES-клетки. ES-клетки можно получать из предимплантационных эмбрионов, культивируемых in vitro, и сливать с эмбрионами (Evans et al. (1981), Nature 292:154-156; Bradley et al. (1984), Nature 309:255-258; Gossler et al. (1986), Proc. Natl. Acad. Sci. USA 83:9065-9069; Robertson et al. (1986), Nature 322:445-448; Wood et al. (1993), Proc. Natl. Acad. Sci. USA 90:4582- 4584). Трансгены можно эффективно вводить в ES-клетки посредством стандартных методик, таких как трансфекция ДНК с применением электропорации или опосредованная ретровирусами трансдукция. Затем полученные трансформированные ES-клетки можно объединять с морулами посредством агрегации или инъецировать в бластоцисты от отличного от человека животного. После этого введенные ES-клетки колонизируют эмбрион и участвуют в образовании зародышевой линии полученного химерного животного (Jaenisch (1988), Science 240:1468-1474). Применение ES-клеток, подвергнутых целенаправленному изменению гена, для получения генетически модифицированных мышей с целенаправленным изменением гена было описано в 1987 году (Thomas et al. (1987), Cell 51:503-512) и обзор этого приведен в других работах (Frohman et al. (1989), Cell 56:145-147; Capecchi (1989), Trends in Genet. 5:70-76; Baribault et al. (1989), Mol. Biol. Med. 6:481-492; Wagner (1990), EMBO J. 9:3025-3032; Bradley et al. (1992), Bio/Technology 10:534-539).
Доступны методики инактивации любой генетического области или ее изменения с получением любой необходимой мутации с применением нацеленной гомологической рекомбинации для введения специфических изменений в аллели хромосом.
Применяемый в данном документе термин "подвергнутый целенаправленному изменению ген" представляет собой последовательность ДНК, введенную в зародышевую линию отличного от человека животного посредством вмешательства человека, включая без ограничения способы, описанные в данном документе. Подвергнутые целенаправленному изменению гены по настоящему изобретению включают последовательности ДНК, которые разработаны для специфического изменения когнатных эндогенных аллелей.
В настоящем изобретении "выделенный" относится к материалу, извлеченному из своего исходного окружения (например, естественного окружения, если он встречается в природе) и, таким образом, измененному "в результате воздействия человека" по сравнению со своим естественным состоянием. Например, выделенный полинуклеотид может являться частью вектора или композиции, или может содержаться в клетке и по-прежнему быть "выделенным", поскольку этот вектор, композиция или конкретная клетка не представляют собой исходное окружение полинуклеотида. Термин "выделенный" не относится к геномным библиотекам или библиотекам кДНК, общим препаратам цельных клеток или препаратам мРНК, препаратам геномной ДНК (включая препараты, разделенные с помощью электрофореза и перенесенные на мембраны для блоттинга), препаратам геномной ДНК цельных клеток, фрагментированной в результате гидродинамического сдвига, или другим композициям, где в соответствии с данной областью техники не показаны отличительные признаки полинуклеотида/последовательностей по настоящему изобретению. Дополнительные примеры выделенных молекул ДНК включают рекомбинантные молекулы ДНК, поддерживаемые в гетерологичных клетках-хозяевах, или очищенные (частично или практически полностью) молекулы ДНК в растворе. Выделенные молекулы РНК включают in vivo или in vitro РНК-транскрипты молекул ДНК по настоящему изобретению. Однако нуклеиновая кислота, содержащаяся в клоне, который является членом библиотеки (например, библиотеки геномной ДНК или кДНК), который не был отделен от других членов библиотеки (например, в форме гомогенного раствора, содержащего клон и другие члены библиотеки), или хромосома, извлеченная из клетки или клеточного лизата (например, "хромосомный препарат", как в кариотипе), или препарат случайным образом фрагментированной в результате гидродинамического сдвига геномной ДНК, или препарат геномной ДНК, разрезанной с помощью одного или нескольких рестрикционных ферментов, не являются "выделенными" для целей настоящего изобретения. Как обсуждается далее в данном документе, выделенные молекулы нуклеиновой кислоты в соответствии с настоящим изобретением могут быть получены естественным путем, рекомбинантным путем или синтетическим путем.
"Полинуклеотиды" могут состоять из одно- или двухнитевой ДНК, ДНК, которая представляет собой смесь одно и двухнитевых областей, одно- и двухнитевой РНК и РНК, которая представляет собой смесь одно- и двухнитевых областей, гибридных молекул, содержащих ДНК и РНК, которые могут быть однонитевыми или, что более типично, двухнитевыми, или смесью однонитевых и двухнитевых областей. Кроме того, полинуклеотиды могут состоять из трехнитевых областей, содержащих РНК или ДНК, или как РНК, так и ДНК. Полинуклеотиды могут также содержать одно или несколько модифицированных оснований или остовы ДНК или РНК, модифицированные для повышения стабильности или по другим причинам. "Модифицированные" основания включают, например, тритилированные основания и нестандартные основания, такие как инозин. Множество модификаций можно осуществлять в отношении ДНК и РНК; таким образом, термин "полинуклеотид" включает формы, модифицированные химическим путем, ферментативным путем или метаболическим путем.
Выражение "полинуклеотид, кодирующий полипептид" охватывает полинуклеотид, который содержит только кодирующую последовательность полипептида, а также полинуклеотид, который содержит дополнительную кодирующую и/или некодирующую последовательность.
"Жесткие условия гибридизации" относится к инкубации в течение ночи при 42 градусах C в растворе, содержащем 50% формамида, 5x SSC (750 мM NaCl, 75 мM трехзамещенного цитрата натрия), 50 мМ фосфата натрия (pH 7,6), 5x раствор Денхардта, 10% сульфата декстрана и 20 мкг/мл денатурированной, фрагментированной в результате гидродинамического сдвига ДНК из спермы лосося, с последующим промыванием фильтров в 0,1x SSC при приблизительно 50 градусах C. Изменения условий жесткости гибридизации и обнаружения сигнала в основном осуществляют посредством манипуляции с концентрацией формамида (более низкие значения процента формамида приводят к сниженной жесткости); солевыми условиями или температурой. Например, условия умеренно высокой жесткости включают инкубацию в течение ночи при 37 градусах C в растворе, содержащем 6X SSPE (20X SSPE=3 M NaCl; 0,2 M NaH2PO4; 0,02 M EDTA, pH 7,4), 0,5% SDS, 30% формамида, 100 мкг/мл блокирующей ДНК из спермы лосося; с последующими промываниями при 50 градусах C с помощью 1XSSPE, 0,1% SDS. Кроме того, для обеспечения еще более низкой жесткости промывания, осуществляемые после жесткой гибридизации, можно осуществлять при более высоких концентрациях солей (например, 5X SSC). Изменения приведенных выше условий можно осуществлять посредством включения альтернативных блокирующих реагентов, применяемых для подавления фона в экспериментах по гибридизации, и/или замены на них. Типичные блокирующие реагенты включают раствор Денхардта, BLOTTO, гепарин, денатурированную ДНК из спермы лосося и коммерчески доступные запатентованные составы. Включение специфических блокирующих реагентов может потребовать модификации условий гибридизации, описанных выше, из-за проблем с совместимостью.
Термины "фрагмент", "производное" и "аналог" в отношении полипептидов означают полипептиды, которые сохраняют практически такую же биологическую функцию или такую же активность, что и данные полипептиды. Аналог включает пробелок, который может быть активирован за счет отщепления части пробелка с образованием активного зрелого полипептида.
Термин "ген" означает сегмент ДНК, вовлеченный в продуцирование полипептидной цепи; он включает области перед кодирующей областью и после нее, "лидерную и трейлерную последовательности", а также промежуточные последовательности (интроны) между отдельными кодирующими сегментами (экзонами).
Полипептиды могут состоять из аминокислот, соединенных друг с другом пептидными связями или модифицированными пептидными связями, т. е. пептидными изостерами, и они могут содержать аминокислоты, отличные от 20 кодируемых генами аминокислот. Полипептиды могут быть модифицированы как с помощью естественных процессов, таких как посттрансляционный процессинг, так и с помощью методик химической модификации, которые хорошо известны в данной области техники. Такие модификации подробно описаны в базовых пособиях и более подробных монографиях, а также в обширной научной литературе. Модификации могут происходить в любом месте в полипептиде, включая пептидный остов, боковые цепи аминокислот и амино- или карбоксильные концы. Следует понимать, что один и тот же тип модификации может присутствовать в одинаковой или различной степенях в нескольких сайтах в данном полипептиде. Также данный полипептид может содержать множество типов модификаций. Полипептиды могут быть разветвленными, например, в результате убиквитинирования, и они могут быть циклическими с разветвлением или без него. Циклические, разветвленные и разветвленные циклические полипептиды могут быть результатом посттрансляционных естественных процессов или могут быть получены с помощью синтетических способов. Модификации включают без ограничения ацетилирование, ацилирование, биотинилирование, АДФ-рибозилирование, амидирование, ковалентное присоединение флавина, ковалентное присоединение фрагмента гема, ковалентное присоединение нуклеотида или производного нуклеотида, ковалентное присоединение липида или производного липида, ковалентное присоединение фосфотидилинозитола, перекрестное сшивание, циклизацию, дериватизацию посредством известных защитных/блокирующих групп, образование дисульфидных связей, деметилирование, образование ковалентных перекрестных сшивок, образование цистеина, образование пироглутамата, формилирование, гамма-карбоксилирование, гликозилирование, образование GPI-якоря, гидроксилирование, йодирование, связывание с молекулой антитела или другим клеточным лигандом, метилирование, ацилирование остатком миристиновой кислоты, окисление, пегилирование, протеолитический процессинг (например, расщепление), фосфорилирование, пренилирование, рацемизацию, селеноилирование, сульфатизацию, опосредованное транспортной РНК добавление аминокислот к белкам, например, аргинилирование, и убиквитинирование. (См., например, PROTEINS-STRUCTURE AND MOLECULAR PROPERTIES, 2nd Ed., T. E. Creighton, W. H. Freeman and Company, New York (1993); POSTTRANSLATIONAL COVALENT MODIFICATION OF PROTEINS, B. C. Johnson, Ed., Academic Press, New York, pgs. I-12 (1983); Seifter et al. , Meth Enzymol 182:626-646 (1990); Rattan et al., Ann NY Acad Sci 663:48-62 (1992).)
Фрагмент полипептида, "обладающий биологической активностью", относится к полипептидам, проявляющим активность, аналогичную, но необязательно идентичную активности исходного полипептида, включая зрелые формы, измеренную в конкретном биологическом анализе, с зависимостью от дозы или без таковой. В том случае, если существует зависимость от дозы, она не обязательно должна быть идентична таковой у полипептида, а скорее практически аналогична с зависимостью от дозы у данной активности по сравнению с исходным полипептидом (т. е. кандидатный полипептид будет проявлять большую активность и не более, чем в приблизительно 25 раз меньшую, и в некоторых вариантах осуществления не более, чем в приблизительно десять раз меньшую, или не более, чем в приблизительно три раза меньшую активность относительно исходного полипептида.)
Гомологи от других биологических видов можно выделять и идентифицировать путем получения подходящих зондов или праймеров из последовательностей, предусмотренных в данном документе, и скрининга подходящего источника нуклеиновой кислоты в отношении необходимого гомолога.
"Вариант" относится к полинуклеотиду или полипептиду, отличающемуся от исходного полинуклеотида или полипептида, однако сохраняющему его существенные свойства. Как правило, варианты в целом являются очень сходными и во многих областях идентичны исходному полинуклеотиду или полипептиду.
На практике то, являются ли какая-либо конкретная молекула нуклеиновой кислоты или полипептид на по меньшей мере 80%, 85%, 90%, 92%, 95%, 96%, 97%, 98%, 99% или 100% идентичными нуклеотидной последовательности по настоящему изобретению, можно стандартным образом определять с применением известных компьютерных программ. Предпочтительный способ определения наилучшего общего соответствия между запрашиваемой последовательностью (последовательностью по настоящему изобретению) и рассматриваемой последовательностью, также называемый глобальным выравниванием последовательностей, можно определить с применением компьютерной программы FASTDB на основе алгоритма Brutlag et al. (Comp. App. Biosci. (1990) 6:237-245). При выравнивании последовательностей как запрашиваемая, так и рассматриваемая последовательности являются последовательностями ДНК. Последовательность РНК можно сравнивать при превращении U в T. Результатом указанного глобального выравнивания последовательностей является процент идентичности. Предпочтительные параметры, применяемые при выравнивании последовательностей ДНК с применением FASTDB для расчета процента идентичности, представляют собой: матрица=унитарная, k-участок=4, штрафной балл за несовпадение=1, штрафной балл за связывание=30, длина группы рандомизации=0, граничный балл=l, штрафной балл за гэп=5, штрафной балл за удлинение гэпа=0,05, размер окна=500 или длина рассматриваемой нуклеотидной последовательности, в зависимости от того, что короче. Если рассматриваемая последовательность короче, чем запрашиваемая последовательность, вследствие делеций 5'- или 3'-конце, а не вследствие внутренних делеций, то для результатов необходимо провести ручную коррекцию. Это происходит потому, что программа FASTDB не учитывает усечения на 5'- и 3'-конце рассматриваемой последовательности при расчете процента идентичности. В случае рассматриваемых последовательностей, усеченных на 5'- или 3'-концах по сравнению с запрашиваемой последовательностью, процент идентичности корректируют путем подсчета количества оснований запрашиваемой последовательности, которые находятся на 5'- и 3'-конце рассматриваемой последовательности, которые не совпадают/не выравнены, в виде процента от всех оснований запрашиваемой последовательности. Является ли нуклеотид совпадающим/выравненным, определяют по результатам выравнивания последовательности с помощью FASTDB. Затем этот процент вычитают из процента идентичности, рассчитанного с помощью вышеуказанной программы FASTDB с применением указанных параметров, с получением конечного показателя процента идентичности. Этот скорректированный показатель является показателем, который применяется для целей настоящего изобретения. Только основания за пределами оснований на 5'- и 3'-конце рассматриваемой последовательности, как показано с помощью выравнивания FASTDB, которые не совпадают/не выравнены с запрашиваемой последовательностью, подсчитывают для целей ручной коррекции показателя процента идентичности. Например, рассматриваемую последовательность из 90 оснований выравнивают с запрашиваемой последовательностью из 100 оснований для определения процента идентичности. Делеции находятся на 5'-конце рассматриваемой последовательности и, следовательно, выравнивание FASTDB не показывает совпадения/выравнивания первых 10 оснований на 5'-конце. Эти 10 "выпавших" оснований представляют собой 10% последовательности (количество оснований на 5'- и 3'-концах, которые не совпадают/общее количество оснований в запрашиваемой последовательности), таким образом, 10% вычитают из показателя процента идентичности, рассчитанного с помощью программы FASTDB. Если оставшиеся 90 оснований полностью совпали, то конечный процент идентичности будет составлять 90%. В другом примере рассматриваемую последовательность из 90 оснований сравнивают с запрашиваемой последовательностью из 100 оснований. В этом случае делеции представляют собой внутренние делеции, то есть они не представляют собой основания на 5'- или 3'-конце рассматриваемой последовательности, которые не совпадают/не выравнены с запрашиваемой последовательностью. В этом случае процент идентичности, рассчитанный с помощью FASTDB, не корректируется вручную. Подчеркнем снова, только основания на 5'- и 3'-конце рассматриваемой последовательности, которые не совпадают/не выравнены относительно запрашиваемой последовательности, корректируют вручную. Тем не менее, в конкретном случае общая идентичность относится только к частям последовательности, которые характеризуются по меньшей мере некоторой степенью сходства с последовательностью, например, SEQ ID NO:1. Другими словами, идентичность последовательности, рассчитанная для запрашиваемой последовательности из 2000 п. о., будет рассчитываться только для части последовательности, содержащей SEQ ID NO:1, или очень похожей на нее части.
В случае полипептида с аминокислотной последовательностью, которая, например, на по меньшей мере 95% "идентична" запрашиваемой аминокислотной последовательности по настоящему изобретению, подразумевается, что аминокислотная последовательность рассматриваемого полипептида идентична с запрашиваемой последовательностью, за исключением того, что рассматриваемая полипептидная последовательность полипептида может включать вплоть до пяти изменений аминокислот на каждые 100 аминокислот запрашиваемой аминокислотной последовательности. Другими словами, для получения полипептида с аминокислотной последовательностью, которая на по меньшей мере 95% идентична запрашиваемой аминокислотной последовательности, в рассматриваемую последовательность могут быть введены, удалены или заменены другой аминокислотой вплоть до 5% аминокислотных остатков. Эти изменения эталонной последовательности могут находиться в амино- или карбоксиконцевом положениях эталонной аминокислотной последовательности или в любом месте между этими концевыми положениями, могут чередоваться с остатками в эталонной последовательности, как по отдельности, так и в виде одной или нескольких непрерывных групп в пределах эталонной последовательности.
На практике то, является ли любой конкретный полипептид на по меньшей мере 80%, 85%, 90%, 92%, 95%, 96%, 97%, 98%, 99% или 100% идентичным, например, аминокислотным последовательностям, показанным в последовательности, или аминокислотной последовательности, кодируемой депонированным клоном ДНК, можно стандартным образом определять с применением известных компьютерных программ. Предпочтительный способ определения наилучшего общего соответствия между запрашиваемой последовательностью (последовательностью по настоящему изобретению) и рассматриваемой последовательностью, также называемый глобальным выравниванием последовательностей, можно определить с применением компьютерной программы FASTDB на основе алгоритма Brutlag et al. (Comp. App. Biosci. (1990) 6:237-245). При выравнивании последовательностей как запрашиваемая, так и рассматриваемая последовательности либо обе являются нуклеотидными последовательностями, либо обе являются аминокислотными последовательностями. Результатом указанного глобального выравнивания последовательностей является процент идентичности. Предпочтительные параметры, применяемые для выравнивания аминокислот с помощью FASTDB, представляют собой: матрица=PAM 0, k-участок=2, штрафной балл за несовпадение=I, штрафной балл за связывание=20, длина группы рандомизации=0, граничный балл=l, размер окна=длина последовательности, штрафной балл за гэп=5, штрафной балл за удлинение гэпа=0,05, размер окна=500 или длина рассматриваемой аминокислотной последовательности, в зависимости от того, что короче. Если рассматриваемая последовательность короче, чем запрашиваемая последовательность, вследствие делеций на N- или C-конце, а не вследствие внутренних делеций, то для результатов необходимо провести ручную коррекцию. Это происходит потому, что программа FASTDB не учитывает усечения на N- или C-конце рассматриваемой последовательности при расчете глобального процента идентичности. В случае рассматриваемых последовательностей, усеченных на N- и C-концах по сравнению с запрашиваемой последовательностью, процент идентичности корректируют посредством подсчета количества остатков запрашиваемой последовательности, которые находятся на N- и C-концах рассматриваемой последовательности, которые не совпадают/не выравнены с соответствующим остатком рассматриваемой последовательности, в виде процента от всех оснований запрашиваемой последовательности. Является ли остаток совпадающим/выравненным определяют по результатам выравнивания последовательности с помощью FASTDB. Затем этот процент вычитают из процента идентичности, рассчитанного с помощью вышеуказанной программы FASTDB с применением указанных параметров, с получением конечного показателя процента идентичности. Этот конечный показатель процента идентичности является показателем, который применяется для целей настоящего изобретения. Только остатки на N- и C-концах рассматриваемой последовательности, которые не совпадают/не выравнены с запрашиваемой последовательностью, учитываются для целей ручной коррекции показателя процента идентичности. Иными словами, учитываются только положения остатков в запрашиваемой последовательности за пределами самых дальних N- и C-концевых остатков рассматриваемой последовательности. Только положения остатков за пределами N- и C-терминальных концов рассматриваемой последовательности, как показано при выравнивании FASTDB, которые не совпадают/не выравнены с запрашиваемой последовательностью, корректируют вручную. Никакие другие ручные коррекции не выполняются для целей настоящего изобретения.
Встречающиеся в природе варианты белков называются "аллельными вариантами" и относятся к одной из нескольких альтернативных форм гена, занимающего данный локус в хромосоме организма. (Genes 11, Lewin, B., ed., John Wiley & Sons, New York (1985).) Эти аллельные варианты могут варьироваться на уровне полинуклеотида и/или полипептида. В качестве альтернативы, не встречающиеся в природе варианты можно получать с помощью методик мутагенеза или с помощью прямого синтеза.
"Метка" относится к средствам, которые способны обеспечивать обнаруживаемый сигнал, как непосредственно, так и посредством взаимодействия с одним или несколькими дополнительными членами системы образования сигнала. Метки, которые обнаруживаются непосредственно и могут применяться в настоящем изобретении, включают флуоресцентные метки. Специфические флуорофоры включают флуоресцеин, родамин, BODIPY, цианиновые красители и т. п.
"Флуоресцентная метка" относится к любой метке, обладающей способностью испускать свет определенной длины волны при активации светом другой длины волны.
"Флуоресценция" относится к любой обнаруживаемой характеристике флуоресцентного сигнала, включая интенсивность, спектр, длину волны, внутриклеточное распределение и т. д.
"Обнаружение" флуоресценции относится к оцениванию флуоресценции клетки с применением качественных или количественных способов. В некоторых вариантах осуществления настоящего изобретения флуоресценцию будут обнаруживать качественным образом. Другими словами, или флуоресцентный маркер присутствует, что указывает на экспрессию рекомбинантного слитого белка, или нет. В других случаях флуоресценцию можно определять с применением количественных способов, например, измерения интенсивности, спектра или внутриклеточного распределения флуоресценции, позволяющих проводить статистическое сравнение значений, полученных в различных условиях. Уровень также можно определять с применением качественных способов, таких как визуальный анализ и сравнение человеком нескольких образцов, например, образцов, обнаруживаемых с помощью флуоресцентного микроскопа или другого оптического детектора (например, системы анализа изображений и т. д.). "Изменение" или "модуляция" флуоресценции относится к любой обнаруживаемой разнице в интенсивности, внутриклеточном распределении, спектре, длине волны или другом аспекте флуоресценции при конкретном условии по сравнению с другим условием. Например, "изменение" или "модуляцию" обнаруживают количественно, а разница представляет собой статистически значимую разницу. Любые "изменения" или "модуляции" флуоресценции можно обнаруживать с помощью стандартного инструмента, такого как флуоресцентный микроскоп, CCD или любой другой флуоресцентный детектор, и можно обнаруживать с применением автоматической системы, такой как интегрированные системы, или они могут отражать субъективное обнаружение изменения наблюдателем-человеком.
"Зеленый флуоресцентный белок" (GFP) представляет собой белок, состоящий из 238 аминокислот (26,9 кДа), изначально выделенный из медузы Aequorea victoria/Aequorea aequorea/Aequorea forskalea, которая флуоресцирует зеленым светом при воздействии синего света. GFP из A. victoria характеризуется главным пиком возбуждения при длине волны 395 нм и второстепенным пиком при 475 нм. Его пик излучения наблюдается при 509 нм, что находится в нижней зеленой части видимого спектра. GFP из морского пера (Renilla reniformis) характеризуется одним главным пиком возбуждения при 498 нм. Вследствие потенциальной возможности широкого применения и растущих потребностей исследователей было сконструировано множество различных мутантов GFP. Первым главным улучшением была точечная мутация (S65T), описанная Roger Tsien в 1995 году в Nature. Эта мутация значительно улучшила спектральные характеристики GFP, что привело к повышенной флуоресценции, фотостабильности и сдвигу главного пика возбуждения на 488 нм, при этом пик излучения сохранялся при 509 нм. Добавление к этому остову точечной мутации (F64L), повышающей эффективность фолдинга при 37°C, привело к получению GFP с повышенной эффективностью (EGFP). EGFP характеризуется коэффициентом экстинкции (обозначается как ε), также известным как его оптическое сечение, составляющим 9,13×10-21 м²/молекула, также приводимым как 55000 л/(моль⋅см). Superfolder-GFP, серия мутаций, которые позволяют GFP претерпевать быстрый фолдинг и созревать даже при слиянии с пептидами, характеризующимися затруднительным фолдингом, был описан в 2006 году.
"Желтый флуоресцентный белок" (YFP) является генетическим мутантным вариантом зеленого флуоресцентного белка, полученного из Aequorea victoria. Его пик возбуждения составляет 514 нм, а пик излучения составляет 527 нм.
Применяемые в данном документе формы единственного числа включают ссылку на формы множественного числа, если контекст явно не указывает на обратное.
"Вирус" представляет собой субмикроскопический инфекционный агент, который не способен расти или размножаться за пределами клетки-хозяина. Каждая вирусная частица, или вирион, состоит из генетического материала, ДНК или РНК, в пределах защитной белковой оболочки, называемой капсидом. Форма капсида варьируется от простых спиральных и икосаэдрических (полиэдральных или почти сферических) форм до более сложных структур с хвостами или оболочкой. Вирусы инфицируют клеточные формы жизни, и их объединяют в группы животных, растительных и бактериальных вирусов в соответствии с типом инфицируемого хозяина.
Применяемый в данном документе термин "транссинаптический вирус" относится к вирусам, способным мигрировать из одного нейрона в другой связанный нейрон через синапс. Примерами таких транссинаптических вирусов являются рабдовирусы, например вирус бешенства, и альфагерпесвирусы, например вирус псевдобешенства или вирус простого герпеса. Применяемый в данном документе термин "транссинаптический вирус" также охватывает вирусные субъединицы, которые сами по себе обладают способностью мигрировать из одного нейрона в другой связанный нейрон через синапс, и биологические векторы, такие как модифицированные вирусы, включающие такую субъединицу и демонстрирующие способность мигрировать из одного нейрона в другой связанный нейрон через синапс.
Транссинаптическая миграция может быть как антероградной, так и ретроградной. Во время ретроградной миграции вирус будет перемещаться из постсинаптического нейрона в пресинаптический нейрон. Соответственно, во время антероградной миграции вирус будет перемещаться из пресинаптического нейрона в постсинаптический нейрон.
Гомологи относятся к белкам, которые имеют общего предшественника. Аналоги не имеют общего предшественника, однако обладают некоторым функциональным (а не структурным) сходством, которое приводит к включению их в отдельный класс (например, трипсин-подобные сериновые протеиназы и субтилизины явно не являются родственными, их структуры вне активного сайта полностью различные, однако они имеют фактически геометрически идентичные активные сайты и, таким образом, считаются примером конвергентной эволюции в аналоги).
Существует два подкласса гомологов - ортологи и паралоги. Ортологи представляют собой один и тот же ген (например, цитохром 'c') у различных биологических видов. Два гена у одного и того же организма не могут быть ортологами. Паралоги являются результатом дупликации генов (например, гемоглобин бета и дельта). Если два гена/белка гомологичны и находятся в одном и том же организме, они являются паралогами.
Применяемый в данном документе термин "нарушение" относится к недомоганию, заболеванию, болезни, клиническому состоянию или патологическому состоянию.
Применяемый в данном документе термин "фармацевтически приемлемый носитель" относится к среде-носителю, которая не затрагивает эффективность биологической активности активного ингредиента, является химически инертной и не является токсичной для пациента, которому ее вводят.
Применяемый в данном документе термин "фармацевтически приемлемое производное" относится к любому гомологу, аналогу или фрагменту средства, например, идентифицированному с применением способа скрининга по настоящему изобретению, которые являются относительно нетоксичными для субъекта.
Термин "терапевтическое средство" относится к любой молекуле, соединению или лечению, которые способствуют предупреждению или лечению нарушений или осложнений нарушений.
Композиции, содержащие такое средство, составленное в совместимом фармацевтическом носителе, можно получать, упаковывать и маркировать для лечения.
Если комплекс является водорастворимым, то его можно составлять в подходящем буфере, например, в забуференном фосфатом солевом растворе или других физиологически совместимых растворах.
В качестве альтернативы, если полученный комплекс характеризуется слабой растворимостью в водных растворителях, то его можно составлять с неионогенным поверхностно-активным веществом, таким как Tween или полиэтиленгликоль. Таким образом, соединения и их физиологически приемлемые сольваты можно составлять для введения посредством ингаляции или инсуффляции (либо через рот, либо через нос) или путем перорального, буккального, парентерального, ректального введения или, в случае опухолей, непосредственной инъекции в солидную опухоль.
В случае перорального введения фармацевтический препарат может находиться в жидкой форме, например, растворах, сиропах или суспензиях, или может присутствовать в виде лекарственного продукта для разбавления водой или другой подходящей средой-носителем перед применением. Такие жидкие препараты можно получать общепринятыми способами с фармацевтически приемлемыми добавками, такими как суспендирующие средства (например, сорбитный сироп, производные целлюлозы или гидрогенизированные пищевые жиры); эмульгирующие средства (например, лецитин или аравийская камедь); неводные среды-носители (например, миндальное масло, жирные сложные эфиры или фракционированные растительные масла) и консерванты (например, метил- или пропил-п-гидроксибензоаты или сорбиновая кислота). Фармацевтические композиции могут быть в форме, например, таблеток или капсул, полученных общепринятыми способами с фармацевтически приемлемыми вспомогательными веществами, такими как связывающие средства (например, прежелатинизированный кукурузный крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза); наполнители (например, лактоза, микрокристаллическая целлюлоза или гидрофосфат кальция); смазывающие средства (например, стеарат магния, тальк или диоксид кремния); разрыхлители (например, картофельный крахмал или крахмалгликолят натрия) или увлажняющие средства (например, лаурилсульфат натрия). Таблетки можно покрывать с помощью способов, широко известных в данной области техники.
Препараты для перорального введения можно подходящим образом составлять для обеспечения контролируемого высвобождения активного соединения.
В случае введения посредством ингаляции соединения для применения в соответствии с настоящим изобретением удобно доставлять в форме спрея-аэрозоля из пакетов под давлением или с помощью небулайзера с применением подходящего пропеллента, например, дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, диоксида углерода или другого подходящего газа. В случае аэрозоля под давлением единица дозирования может определяться за счет обеспечения клапана для доставки отмеренного количества. В случае применения в ингаляторе или инсуффляторе, например, капсулы и картриджи из желатина можно составлять содержащими порошковую смесь соединения и подходящую порошковую основу, такую как лактоза или крахмал.
Соединения можно составлять для парентерального введения путем инъекции, например, болюсной инъекции или непрерывной инфузии. Составы для инъекции могут быть представлены в стандартной лекарственной форме, например, в ампулах или многодозовых контейнерах с добавленным консервантом.
Композиции могут быть в таких формах как суспензии, растворы или эмульсии в масляных или водных средах-носителях, и могут содержать вспомогательные вещества для составления, такие как суспендирующие, стабилизирующие и/или диспергирующие средства. В качестве альтернативы, активный ингредиент может находиться в форме порошка для разбавления подходящей средой-носителем, например, стерильной апирогенной водой, перед применением.
Соединения также можно составлять в виде средства для местного нанесения, такого как крем или лосьон.
В дополнение к составам, описанным ранее, соединения также можно составлять в виде депо-препарата. Такие составы длительного действия можно вводить путем имплантации (например, внутриглазной, подкожной или внутримышечной) или путем внутриглазной инъекции.
Таким образом, например, соединения можно составлять с подходящими полимерными или гидрофобными материалами (например, в виде эмульсии в приемлемом масле) или ионообменными смолами, или в виде умеренно растворимых производных, например, в виде умеренно растворимой соли. Липосомы и эмульсии являются широко известными примерами сред-носителей для доставки или носителей для гидрофильных лекарственных средств.
При необходимости композиции могут присутствовать в упаковке или дозирующем устройстве, которые могут содержать одну или несколько стандартных лекарственных форм, содержащих активный ингредиент. Например, упаковка может предусматривать металлическую или пластиковую фольгу, например, блистерную упаковку. Упаковка или дозирующее устройство могут сопровождаться инструкциями по введению.
В настоящем изобретении также предусмотрены наборы для осуществления терапевтических схем введения по настоящему изобретению. Такие наборы содержат в одном или нескольких контейнерах терапевтически или профилактически эффективные количества композиций в фармацевтически приемлемой форме.
Композиция во флаконе из набора может находиться в форме фармацевтически приемлемого раствора, например, в комбинации со стерильным солевым раствором, раствором декстрозы или буферным раствором или другой фармацевтически приемлемой стерильной жидкостью. В качестве альтернативы, комплекс может быть лиофилизированным или высушенным; в этом случае набор необязательно дополнительно содержит в контейнере фармацевтически приемлемый раствор (например, солевой раствор, раствор декстрозы и т. д.), предпочтительно стерильный, для разбавления комплекса с образованием раствора для инъекционных целей.
В другом варианте осуществления набор дополнительно содержит иглу или шприц, предпочтительно упакованные в стерильной форме, для осуществления инъекции комплекса, и/или упакованный пропитанный спиртом тампон. Необязательно включены инструкции для введения композиций врачом или пациентом.
Если не определено иное, все технические и научные термины, применяемые в данном документе, имеют то же значение, которое обычно понятно среднему специалисту в области техники, к которой относится настоящее изобретение. Хотя при осуществлении на практике или тестировании настоящего изобретения можно применять способы и материалы, аналогичные или эквивалентные описанным в данном документе, ниже описываются подходящие способы и материалы. В случае противоречия настоящее описание, включая определения, будет иметь преимущественную силу. Кроме того, материалы, способы и примеры являются исключительно иллюстративными и не предполагаются как ограничивающие.
ПРИМЕРЫ
Генетическая конструкция
Промотор, применяемый в данном примере (964 п. о.; SEQ ID NO:3), состоит из одной SEQ ID NO:1, соединенной с минимальным промотором SV40, промотором под SEQ ID NO:2. Кодирующую последовательность ChR2-eGFP вставляли непосредственно после данных промоторов и оптимизированной последовательности Козак (GCCACC), а за ней располагался посттранскрипционный регуляторный элемент вируса гепатита сурков (WPRE) и сайт полиаденилирования SV40. Нацеливание на нейроны сетчатки осуществляли с применением AAV серотипа 2/8 при титре, составляющем 2,9E+10 GC/мл.
Вирусная трансфекция и получение ткани
Для введения AAV в глаза анестезированных животных осуществляли прокол склеры недалеко от хрусталика с помощью острой иглы 30 калибра. 2 мкл суспензии частиц AAV инъецировали субретинально с помощью шприца Гамильтона. Через 3 недели образцы выделенной сетчатки фиксировали в течение 30 мин в 4% PFA в PBS, с последующей стадией промывания в PBS при 4 градусах C. Сетчатки целиком обрабатывали с помощью 10% нормальной сыворотки крови осла (NDS), 1% BSA, 0,5% Triton X-100 в PBS в течение 1 ч при комнатной температуре. Обработку моноклональными Ab крысы к GFP (Molecular Probes Inc.; 1:500) и поликлональными антителами козы к ChAT (Millipore: 1:200) в 3% NDS, 1% BSA, 0,5% Triton X-100 в PBS осуществляли в течение 5 дней при комнатной температуре. Обработку вторичными Ab осла к антителам крысы, конъюгированными с Alexa Fluor-488 (Molecular Probes Inc.; 1:200), антителами к антителам козы, конъюгированными с Alexa Fluor-633, и красителем Hoechst осуществляли в течение 2 ч. Срезы промывали, монтировали с реагентом ProLong Gold, препятствующим выгоранию флуоресценции (Molecular Probes Inc.), на предметных стеклах и фотографировали с помощью лазерного сканирующего конфокального микроскопа Zeiss LSM 700 Axio Imager Z2 (Carl Zeiss Inc.).
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Friedrich Miescher for Biomedical Research
<120> Промотор, специфический в отношении клеток пигментного эпителия
сетчатки приматов
<130> 57957
<160> 3
<170> PatentIn версия 3.5
<210> 1
<211> 750
<212> ДНК
<213> Mus musculus
<400> 1
tcaagcctcc taccgccttt gttatgcaaa catatcaaac gccctccttt gttatgcaaa 60
agggctggaa cggggccttt gttatgcaaa tcgccctccc cgatcccttt gttatgcaaa 120
tttgacgaat tcccaccttt gttatgcaaa caaatctcct accctccttt gttatgcaaa 180
gtgagagggg ctgcaccttt gttatgcaaa atgcggcccc tgagaccttt gttatgcaaa 240
aaccatgtac gcttgccttt gttatgcaaa ccgcctgttg cttggccttt gttatgcaaa 300
gccacgcgat tggcgccttt gttatgcaaa gctcggttat gtacaccttt gttatgcaaa 360
gctactttaa acttgccttt gttatgcaaa tcacgacctg accgtccttt gttatgcaaa 420
aacggttgaa atagtccttt gttatgcaaa atgatattga atagtccttt gttatgcaaa 480
aatttagatg ccgacccttt gttatgcaaa ggaatgggcg tgctgccttt gttatgcaaa 540
ttttcgctgc gacagccttt gttatgcaaa catgctcgcc actcaccttt gttatgcaaa 600
ggtctaacaa tgaccccttt gttatgcaaa ctacgtggaa tagatccttt gttatgcaaa 660
ccccgagttt ttgaaccttt gttatgcaaa atcagtaact tcattccttt gttatgcaaa 720
atgtgactta acctcccttt gttatgcaaa 750
<210> 2
<211> 214
<212> ДНК
<213> sv40
<400> 2
gctcgagatc tgcgatctgc atctcaatta gtcagcaacc atagtcccgc ccctaactcc 60
gcccatcccg cccctaactc cgcccagttc cgcccattct ccgccccatc gctgactaat 120
tttttttatt tatgcagagg ccgaggccgc ctcggcctct gagctattcc agaagtagtg 180
aggaggcttt tttggaggcc taggcttttg caaa 214
<210> 3
<211> 964
<212> ДНК
<213> Mus musculus
<400> 3
tcaagcctcc taccgccttt gttatgcaaa catatcaaac gccctccttt gttatgcaaa 60
agggctggaa cggggccttt gttatgcaaa tcgccctccc cgatcccttt gttatgcaaa 120
tttgacgaat tcccaccttt gttatgcaaa caaatctcct accctccttt gttatgcaaa 180
gtgagagggg ctgcaccttt gttatgcaaa atgcggcccc tgagaccttt gttatgcaaa 240
aaccatgtac gcttgccttt gttatgcaaa ccgcctgttg cttggccttt gttatgcaaa 300
gccacgcgat tggcgccttt gttatgcaaa gctcggttat gtacaccttt gttatgcaaa 360
gctactttaa acttgccttt gttatgcaaa tcacgacctg accgtccttt gttatgcaaa 420
aacggttgaa atagtccttt gttatgcaaa atgatattga atagtccttt gttatgcaaa 480
aatttagatg ccgacccttt gttatgcaaa ggaatgggcg tgctgccttt gttatgcaaa 540
ttttcgctgc gacagccttt gttatgcaaa catgctcgcc actcaccttt gttatgcaaa 600
ggtctaacaa tgaccccttt gttatgcaaa ctacgtggaa tagatccttt gttatgcaaa 660
ccccgagttt ttgaaccttt gttatgcaaa atcagtaact tcattccttt gttatgcaaa 720
atgtgactta acctcccttt gttatgcaaa gctcgagatc tgcgatctgc atctcaatta 780
gtcagcaacc atagtcccgc ccctaactcc gcccatcccg cccctaactc cgcccagttc 840
cgcccattct ccgccccatc gctgactaat tttttttatt tatgcagagg ccgaggccgc 900
ctcggcctct gagctattcc agaagtagtg aggaggcttt tttggaggcc taggcttttg 960
caaa 964
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| SYNP161, ПРОМОТОР ДЛЯ СПЕЦИФИЧЕСКОЙ ЭКСПРЕССИИ ГЕНОВ В ПАЛОЧКОВЫХ ФОТОРЕЦЕПТОРАХ | 2016 |
|
RU2758211C2 |
| SYNP198, ПРОМОТОР ДЛЯ СПЕЦИФИЧЕСКОЙ ЭКСПРЕССИИ ГЕНОВ В ГАНГЛИОНАРНЫХ КЛЕТКАХ СЕТЧАТКИ, ИЗБИРАТЕЛЬНЫХ В ОТНОШЕНИИ НАПРАВЛЕНИЯ | 2017 |
|
RU2766353C2 |
| ВИРИОНЫ АДЕНОАССОЦИИРОВАННОГО ВИРУСА С ВАРИАНТНЫМ КАПСИДОМ И СПОСОБЫ ИХ ИСПОЛЬЗОВАНИЯ | 2017 |
|
RU2742724C1 |
| ВИРИОНЫ АДЕНОАССОЦИИРОВАННОГО ВИРУСА С ВАРИАНТНЫМ КАПСИДОМ И СПОСОБЫ ИХ ИСПОЛЬЗОВАНИЯ | 2012 |
|
RU2611202C2 |
| ПРОТЕИН, СВЯЗАННЫЙ С ЗАБОЛЕВАНИЕМ | 2002 |
|
RU2384586C2 |
| МИНИ-БЕЛОК USH2A, НУКЛЕИНОВАЯ КИСЛОТА, КОДИРУЮЩАЯ МИНИБЕЛОК USH2A, И СОДЕРЖАЩИЙ ЕЕ ЭКСПРЕССИОННЫЙ ВЕКТОР ДЛЯ ГЕННОЙ ТЕРАПИИ | 2023 |
|
RU2822884C1 |
| ПОЛИПЕПТИДЫ, ПРОИСХОДЯЩИЕ ИЗ ТРИПТОФАНИЛ-ТРНК-СИНТЕТАЗЫ, И ИХ ПРИМЕНЕНИЕ ДЛЯ РЕГУЛЯЦИИ РАЗВИТИЯ КРОВЕНОСНЫХ СОСУДОВ | 2002 |
|
RU2297425C2 |
| ВАРИАНТЫ B4GALT1 И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2805557C2 |
| ВЕКТОР АДЕНОАССОЦИИРОВАННОГО ВИРУСА | 2015 |
|
RU2743382C2 |
| ВЕКТОРЫ AAV | 2018 |
|
RU2793112C2 |
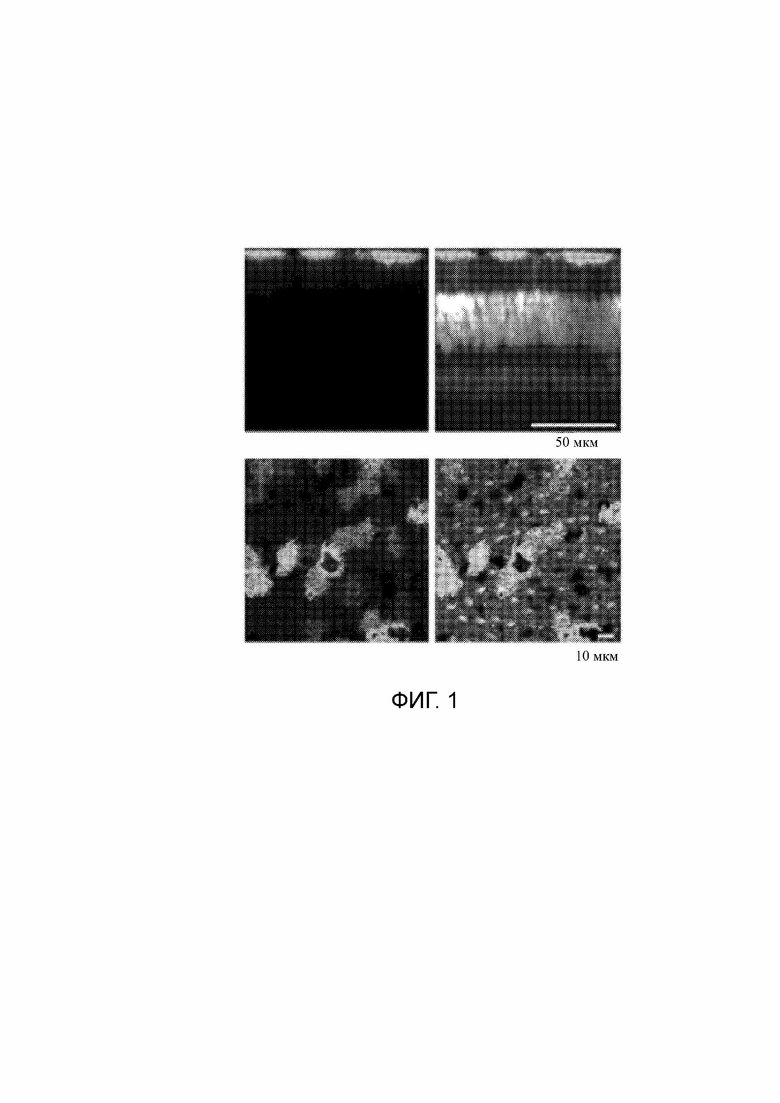
Группа изобретений относится к биотехнологии, в частности к применению выделенной молекулы нуклеиновой кислоты для экспрессии экзогенного гена в клетке пигментного эпителия сетчатки примата и для лечения заболевания, ассоциированного с пигментным эпителием сетчатки. Осуществляют доставку выделенной молекулы нуклеиновой кислоты, содержащей последовательность нуклеиновой кислоты под SEQ ID NO: 1 или состоящей из нее, в клетки пигментного эпителия сетчатки примата, причем указанная выделенная молекула нуклеиновой кислоты функционально связана с последовательностью нуклеиновой кислоты, кодирующей экзогенный ген. Изобретение обеспечивает специфическую экспрессию экзогенного гена в клетках пигментного эпителия сетчатки приматов и может быть применимо для направления и нацеливания экспрессии гена в клетки пигментного эпителия сетчатки при поражениях сетчатки, например, у пациентов с возрастной макулярной дегенерацией, пигментной дистрофией сетчатки, диабетической ретинопатией или гипертрофией пигментного эпителия сетчатки. 2 н. и 14 з.п. ф-лы, 1 ил., 1 пр.
1. Применение выделенной молекулы нуклеиновой кислоты для экспрессии экзогенного гена в клетке пигментного эпителия сетчатки примата, где выделенная молекула нуклеиновой кислоты содержит последовательность нуклеиновой кислоты под SEQ ID NO: 1 или состоит из нее, и где указанная выделенная молекула нуклеиновой кислоты является эффективной для управления экспрессией экзогенного гена в клетке пигментного эпителия сетчатки примата, если последовательность нуклеиновой кислоты, кодирующая указанный экзогенный ген, функционально связана с указанной выделенной молекулой нуклеиновой кислоты.
2. Применение по п. 1, где указанная выделенная молекула нуклеиновой кислоты дополнительно содержит минимальный промотор.
3. Применение по п. 2, где минимальный промотор содержит последовательность нуклеиновой кислоты SEQ ID NO: 2.
4. Применение по любому из пп. 1-3, где указанная выделенная молекула нуклеиновой кислоты является частью кассеты экспрессии.
5. Применение по п. 4, где указанная кассета экспрессии является частью вектора.
6. Применение по п. 5, где указанный вектор представляет собой вирусный вектор.
7. Применение по п. 6, где вирусный вектор представляет собой вектор на основе аденоассоциированного вектора (AAV).
8. Применение выделенной молекулы нуклеиновой кислоты для лечения заболевания, ассоциированного с пигментным эпителием сетчатки, где выделенная молекула нуклеиновой кислоты содержит последовательность нуклеиновой кислоты под SEQ ID NO: 1 или состоит из нее, и где указанная выделенная молекула нуклеиновой кислоты является эффективной для управления экспрессией экзогенного гена в клетке пигментного эпителия сетчатки примата, если последовательность нуклеиновой кислоты, кодирующая указанный экзогенный ген, функционально связана с указанной выделенной молекулой нуклеиновой кислоты.
9. Применение по п. 8, где указанное заболевание, ассоциированное с пигментным эпителием сетчатки, выбрано из группы, состоящей из возрастной макулярной дегенерации, пигментной дистрофии сетчатки, диабетической ретинопатии и гипертрофии пигментного эпителия сетчатки.
10. Применение по п. 8 или 9, где указанная молекула выделенной нуклеиновой кислоты дополнительно содержит минимальный промотор.
11. Применение по п. 10, где минимальный промотор содержит последовательность нуклеиновой кислоты SEQ ID NO: 2.
12. Применение по любому из пп. 8-11, где указанная выделенная молекула нуклеиновой кислоты является частью кассеты экспрессии.
13. Применение по п. 12, где указанная кассета экспрессии является частью вектора.
14. Применение по п. 13, где указанный вектор представляет собой вирусный вектор.
15. Применение по п. 13, где вирусный вектор представляет собой вектор на основе аденоассоциированного вектора (AAV).
16. Применение по любому из пп. 1-13, где экзогенный ген кодирует канальный родопсин или галородопсин.
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| WO 2012051599 A2, 19.04.2012 | |||
| WO 2016174624 A1, 03.11.2016 | |||
| WO 2014033095 A1, 06.03.2014 | |||
| ВЕКТОРЫ, УСЛОВНО ЭКСПРЕССИРУЮЩИЕ ТЕРАПЕВТИЧЕСКИЕ БЕЛКИ, КЛЕТКИ-ХОЗЯЕВА, СОДЕРЖАЩИЕ УКАЗАННЫЕ ВЕКТОРЫ, И ИХ ПРИМЕНЕНИЕ | 2011 |
|
RU2612788C2 |
| CARVALHO, LIVIA S, AND LUK H VANDENBERGHE | |||
| Promising and delivering gene therapies for vision loss | |||
| Vision research, 2015, v.111, Pt B, pp.124-33, doi:10.1016/j.visres.2014.07.013. | |||
Авторы
Даты
2022-06-14—Публикация
2018-11-15—Подача