Сахарный диабет 2 типа - сложное заболевание с клиническими проявлениями, напрямую связанными с более общей группой состояний, называемой метаболическим синдромом. Диабетические нарушения, характеризующиеся гипергликемией, являются результатом сочетания факторов: инсулинорезистентности, недостаточной секреции инсулина и чрезмерной или несоответствующей секреции глюкагона. В последние два десятилетия появился новый класс многообещающих антидиабетических фармакологических мишеней, состоящий из подсемейства ядерных рецепторов, активируемых пролифераторами пероксисом (PPAR). Активация этих рецепторов продемонстрировала нормализацию метаболических дисфункций и снижение сердечно-сосудистых факторов риска, связанных с диабетом 2 типа [Brown, J.D.; Plutzky, J. Peroxisome proliferator-activated receptors as transcriptional nodal points and therapeutic targets. Circulation 2007, 115, 518-533.]. Среди различных активаторов особый интерес для лечения метаболического синдрома представляют двойные агонисты PPAR-α, γ (глитазары), поскольку они сочетают в себе гиполипидемические и гипогликемические свойства соответственно α- и γ-агонистов [Massaro,M.; Scoditti,E.; Pellegrino,M.; Carluccio, M.A.; Calabriso,N.; Wabitsch,M.; Storelli,C.; Wright,M.; De,C.R.Therapeutic potential of the dual peroxisome proliferator activated receptor (PPAR)α/γ agonist aleglitazar in attenuating TNF-α-mediated iflammation and insulin resistance in human adipocytes. Pharmacol. Res. 2016, 107, 125-136]. Ряд двойных агонистов PPAR, продемонстрировавших многообещающие результаты в исследованиях на животных, были протестированы в клиниках. Однако на сегодняшний день только один - сароглитазар, был одобрен в Индии [Agrawal, R. The First Approved Agent in the Glitazar’s Class: Saroglitazar. Curr. Drug Targets 2014, 15, 151-155]. Все остальные - рагаглитазар, мураглитазар, тезаглитазар, алеглитазар, не получили одобрения регулирующих органов, в основном из-за побочных эффектов, в том числе гепатотоксичности, кардиотоксичности и токсичности для желудочно-кишечного тракта [Balakumar, P.; Mahadevan, N.; Sambathkumar, R. A Contemporary Overview of PPARα/γ Dual Agonists for the Management of Diabetic Dyslipidemia. Curr. Mol. Pharmacol. 2019, 12, 195-201; Xi, Y.; Zhang, Y.; Zhu, S.; Luo, Y.; Xu, P.; Huang, Z. PPAR-Mediated Toxicology and Applied Pharmacology. Cells 2020, 9, 352].
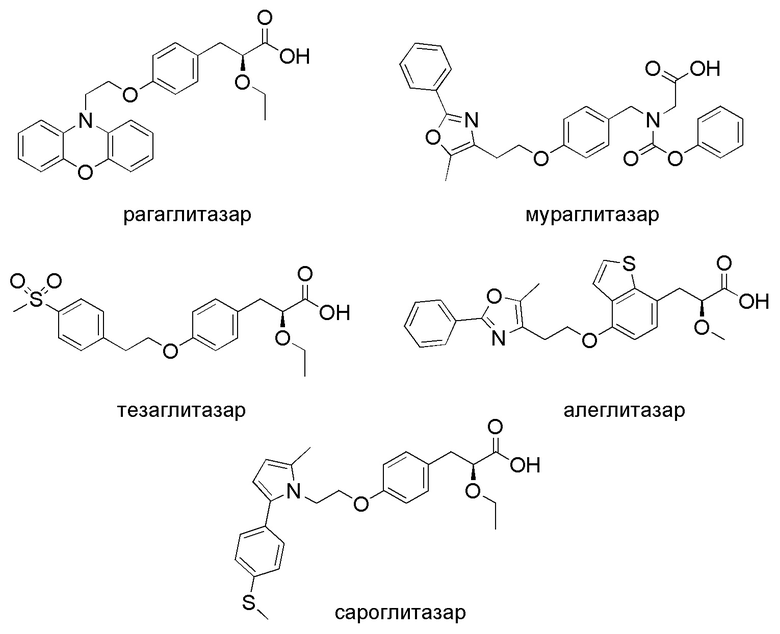
Неблагоприятные побочные эффекты глитазаров в принципе могут быть уменьшены путем химического изменения их фармакофорных групп и тонкого «тюнинга» структуры. Среди возможных модификаций особый интерес представляет введение фрагментов, полученных из природных соединений. Природные соединения - хорошо известная отправная точка для синтеза многих лекарств [Newman, D.; Cragg, G. Natural Products as Sources of New Drugs from 1981 to 2014. J.Nat. Prod. 2016, 79, 629-661], и введение природных фармакофоров может значительно улучшить присущие им свойства. Липофильные фрагменты представляют особый интерес в случае синтеза новых агонистов PPAR, поскольку PPAR активно экспрессируются в печени и жировой ткани [Michalik, L.; Auwerx, J.; Berger, J.; Chatterjee, V.; Glass, C.; Gonzalez, F.; Grimaldi, P.; Kadowaki, T.; Lazar, M.; O’Rahilly, S.; et al. International Union of Pharmacology. LXI. Peroxisome Proliferator-Activated Receptors. Pharmacol. Rev. 2006, 58, 726-741]. Бетулоновая кислота сама по себе и ее производные обладают антидиабетическими и гепатопротекторными свойствами [Semenov, D.; Zhukova, N.; Ivanova, E.; Sorokina, I.; Baiev, D.; Nepomnyashchikh, G.; Tolstikova, T.; Biryukova, M. Hepatoprotective Properties of Betulonic Acid Amide and Heptral in Toxic Liver Injury Induced by Carbon Tetrachloride in Combination with Ethanol. Bull. Exp. Biol. Med. 2015, 158, 336-341]. Также стоит отметить, что тритерпеновые кислоты малотоксичны [Afrose,S.;Hossain,M.;Maki,T.;Tsujii,H.Karaya root saponin exerts a hypocholesterolemic response in rats fed a high-cholesterol diet. Nutr. Res. 2009, 29, 350-354]. Эти многообещающие характеристики можно объяснить присутствием стероидного ядра, которое, как считается, важно для сильных гипогликемических эффектов [Figueroa-Valverde, L.; Diaz-Cedillo, F.; Lopez-Ramos, M.; Garcia-Cervera, E.; Pool-Gomez, E.; Cardena-Arredondo, C.; Ancona- Leon, G. Glibenclamide-pregnenolone derivative has greater hypoglycemic effects and biodistribution than glibenclamide-OH in alloxan-rats. Biomed. Pap. 2012, 156, 122-127] и их значительной липофильности. Было показано, что некоторые тритерпеноиды лупанового типа, такие как бетулоновая и дигидробетулоновая кислоты, обладают активностью по ингибированию альфа-глюкозидазы [Mbaze, L.; Poumale, H.; Wansi, J.; Lado, J.; Khan, S.; Iqbal, M.; Ngadjui, B.; Laatsch, H. α-Glucosidase inhibitory pentacyclic triterpenes from the stem bark of Fagaratess mannii (Rutaceae). Phytochemistry 2007, 68, 591-595; Chukwujekwu, J.; Rengasamy, K.; De Kock, C.; Smith, P.;  , L.; Van Staden, J. Alpha-glucosidase inhibitory and antiplasmodial properties of terpenoids from the leaves of Buddle jasaligna Willd. J.EnzymeInhib. Med. Chem. 2015, 31, 63-66].
, L.; Van Staden, J. Alpha-glucosidase inhibitory and antiplasmodial properties of terpenoids from the leaves of Buddle jasaligna Willd. J.EnzymeInhib. Med. Chem. 2015, 31, 63-66].
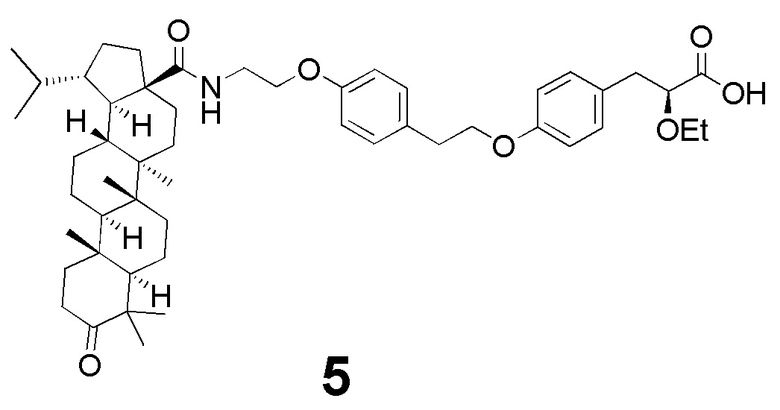
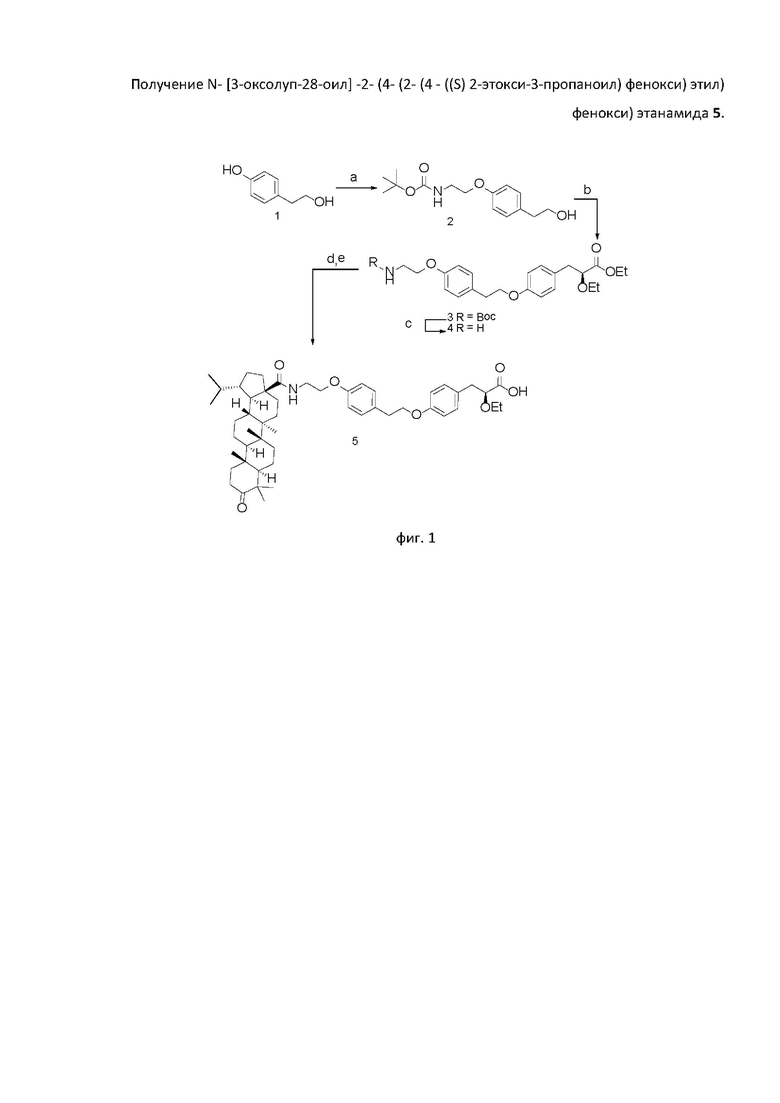
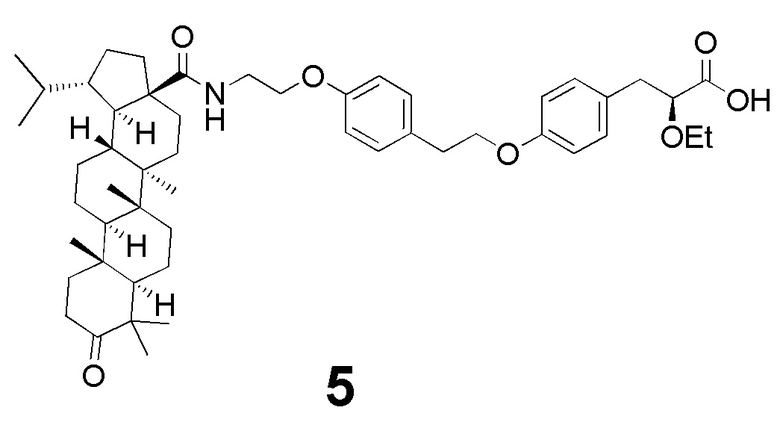
В качестве основы для синтеза новых соединений использован фармакофорный фрагмент 2-этокси-3-фенилпропановой кислоты, который является обычным структурным фрагментом для большинства глитазаров, испытанных в клинике. Схема синтеза представлена на фиг 1. Синтезированное впервые производное дигидробетулоновой кислоты - соединение 5 (N- [3-оксолуп-28-оил] -2- (4- (2- (4 - ((S) 2-этокси-3-пропаноил) фенокси) этил) фенокси) этанамид), было протестировано на способность улучшать гликемический контроль и противодействовать липидным аномалиям in vivo у мышей C57Bl/6, содержащихся на диете с высоким содержанием жиров.
Наш подход к тонкой настройке фармакологической активности заключался в модификации фрагмента глитазарфармакофоров на уровне фенольной гидроксильной группы во фрагменте тирозола, как показано на примере тезаглитазара.
Мы предположили, что, как и в случае с другими существующими глитазарами, модификации в этой части молекулы не должны влиять на ее связывание с рецептором, но могут привести к улучшению фармакокинетических и фармакодинамических свойств. Выбор амидной связи в качестве способа присоединения к новым фармакофорам основан на ее известной стабильности в биологической среде, доступных протоколах создания амидных связей и возможности включения многочисленных кислот природного происхождения. Наличие спейсера важно по двум причинам. С одной стороны, это придает молекуле некоторую гибкость для усиленного связывания с рецептором. С другой стороны, это относится к тому факту, что аминоэтанольный фрагмент представляет собой минимально возможный спейсер для образования амидной связи, связывающей фрагмент глитазарфармакофора на уровне фенольной гидроксильной группы.
Синтезированый амид тритерпеновой кислоты - дигидробетулоновой кислоты, включающий фрагмент фармакофора 2-этокси-3-фенилпропановой кислоты, показал при биологических испытаниях, по сравнению с прототипом - тезаглитазаром, аналогичное действие в эквивалентной дозе. Синтезированное соединение 5 вызывало незначительные токсические эффекты на протяжении всего эксперимента. Значительное снижение уровня глюкозы в крови животных, соответствующее уровням в контрольной группе, находящейся на стандартной диете, наблюдалось у животных, получавших либо эталонный препарат - тезаглитазар, либо вновь синтезированное производное дигидробетулоновой кислоты 5. Связанное с HF-диетой (диета с высоким содержанием жиров) увеличение общего холестерина (TC), липопротеинов-носителей (HDL) в крови и снижение уровня триглицеридов (TG) эффективно предотвращалось введением вновь синтезированного соединения 5 с полной или частичной нормализацией этих показателей в крови. Введение прототипа - тезаглитазара вызвало дальнейшее снижение уровня триглицеридов (TG) и повышение уровня общего холестерина и щелочной фосфатазы (ALP), свидетельствующие о его токсическом влиянии на печень.
Таким образом, впервые синтезированное производное дигидробетулоновой кислоты - соединение 5 (N- [3-оксолуп-28-оил] -2- (4- (2- (4 - ((S) 2-этокси-3-пропаноил) фенокси) этил) фенокси) этанамид), способно улучшать как липидный, так и углеводный обмен и, вследствие этого, является многообещающим кандидатом для предотвращения и терапии метаболического синдрома.
Изобретение иллюстрируется следующими примерами.
Авторы выражают благодарность Химическому исследовательскому центру коллективного пользования СО РАН за проведение спектральных и аналитических измерений.
Пример 1. Синтез трет-бутил-N-[2-[4-(2-гидроксиэтил)фенокси]этил]карбамата 2 (фиг. 1)
Получение соединения 2 проиллюстрировано на фиг. 1, стадия a.
Трет-бутил-N-[2-[4-(2-гидроксиэтил)фенокси]этил]карбамат 2 был получен с выходом 88% реакцией тирозола 1 с избытком трет-бутил-2-бромоэтоксиэтилкарбамата (BocNHCH2CH2Br) в ДМФ в присутствии избытка карбоната калия и каталитическим количеством бромида тетра-н-бутиламмония (TBAB). Условия реакции являются обычными для реакции нуклеофильного замещения, однако проведение реакции при повышенной температуре приводит к снижению выхода целевого соединения из-за побочных реакций бромида, а снижение температуры реакции приводит к значительному увеличению времени реакции. Оптимальными условиями проведения реакции являются выдерживание реакционной смеси при интенсивном перемешивании в течение 7 дней при 40°C.
В колбе объемом 250 мл смешали 34.2 г (153 ммоль) трет-бутил-2-бромоэтоксиэтилкарбамата и 15.1 г (110 ммоль) 4-(2-гидроксиэтил)фенола 1 в 100 мл ДМФА, 30.2 г (350 ммоль) K2CO3 и каталитическое количество TBAB. Реакция протекала в течение 7 дней при 40 °C при интенсивном перемешивании в инертной атмосфере. Реакцию контролировали методом ТСХ в системе CHCl3: MeOH: EtOAc - 8: 1: 1. Реакционную смесь выливали в 600 мл воды, перемешивая в течение 15 минут, экстрагировали 3 × 250 мл Et2O, эфирный слой промывали раствором КОН, сушили над MgSO4. Очистку проводили осаждением в охлажденном Et2O. Получен белый порошок массой 27.5 г. с выходом 88%.Тпл: 96-98°С. 1Н-ЯМР (400 MHz, CDCl3): 1.42 (s, 9H), 2.78 (t, J=6.6, 2H), 3.49 (d, J=4.9, 2H), 3.78 (t, J=6.5, 2H), 3.96 (t, J=5.0, 2H), 5.03 (br.s., 1H), 6.81 (d, J=8.6, 2H), 7.11 (d, J=8.4, 2H). 13CЯМР: 28.34 (3С), 66.24, 67.01, 68.67, 79.35, 80.21, 129.85 (2С), 130.47 (2С), 130.86, 155.85, 157.21. Найдено: m/z 281.1627 [M]+. C15H23NO4. Рассчитано: M 281.1625.
Пример 2. Синтез 2 - (4 - (2 -(4 -((S)2 -этокси- 3- пропаноат) -фенокси)-этил)- фенокси) этанамина 4
Получение соединения 4 проиллюстрировано на фиг. 1, стадии b, c.
Соединение 4 было получено с выходом 85% по адаптированной методике [doi:10.1016/j.ejmech.2018.08.082] реакцией производного тирозола 2 с (S)-этил-2-этокси-3-(4-гидроксифенил)пропаноатом в присутствии диизопропилазодикарбоксилата (DIAD) и трифенилфосфина в THF. Cнятие Boc-защитной группы и получение амина 4 из промежуточно полученного (S)-этил- 3- (4-(4-(2- (трет-бутоксикарбониламино)- этокси)- фенокси)- фенил)-2- этоксипропаноата 3 проводили по общепринятой методике, а именно с 2М HCl в уксусной кислоте.
В колбу на 1 л поместили 19.1 г (68 ммоль) трет-бутил-2-(4-(2-гидроксиэтил)фенокси)этилкарбамата 2, 17.8 г (75 ммоль) (S)-этил-2-этокси-3-(4-гидроксифенил)пропаноата и 19.6 г (75 ммоль) PPh3, растворили содержимое в 600 мл ТГФ. Затем 14.7 мл (75 ммоль) DIAD добавляли по каплям к охлажденному раствору при 0°C и перемешивали 24 часа при комнатной температуре. Реакцию контролировали методом ТСХ в системе CHCl3: MeOH: EtOAc - 8: 1: 1. Реакционную смесь экстрагировали EtOAc, промывали насыщенным раствором NaCl. Органический слой сушили над MgSO4. Очистку проводили методом двухстадийной колоночной хроматографии на силикагеле: на первой стадии в системе гексан: EtOAc - 4: 1, затем в системе CHCl3: MeOH -100: 2. Получили (S)-этил- 3- (4-(4-(2- (трет-бутоксикарбониламино)- этокси)- фенокси)- фенил)-2- этоксипропаноат 3, желтоватое масло массой 28.9 г с выходом 85%. 1H-ЯМР (300 MHz, CDCl3): 1.17 (t, J=7.0, 3H), 1.23 (t, J=7.1, 3H), 1.46 (s, 9H), 2.95 (d, J=6.6, 2H), 3.03 (t, J=7.1, 2H), 3.35 (dd, J=9.1, 7.0, 1H), 3.48 - 3.67 (m, 2H), 3.93 - 4.05 (m, 3H), 4.07 - 4.22 (m, 4H), 4.92 - 5.10 (m, 1H), 6.78 - 6.89 (m, 4H), 7.15 (d, J=8.6, 2H), 7.20 (d, J=8.6, 2H).13C ЯМР: 14.09, 14.95, 28.26 (3C), 34.77, 38.34, 40.00, 60.64, 66.04, 67.02, 68.69, 79.32, 80.27, 114.25 (4C), 129.13, 129.89 (2C), 130.25 (2C), 130.63, 155.78, 157.12, 157.44, 172.41. Найдено: m/z 501.2726 C28H39NO7[M]+. Расcчитано: M 501.2725.
В колбе на 250 мл растворяли 2.5 г (5 ммоль) (S)-этил- 3- (4-(4-(2- (трет-бутоксикарбониламино)- этокси)- фенокси)- фенил)-2- этоксипропаноата 3 в минимальном количестве уксусной кислоты (около 50 мл), охлаждали в бане со льдом не допуская замерзания раствора и прибавляли при интенсивном перемешивании 6.5 мл 2М HCl в уксусной кислоте, реакционной смеси дали нагреться, перемешивали 2 часа при комнатной температуре и упарили под вакуумом на ротационном испарителе при температуре не выше 40 °C, соупаривали с водой до полного исчезновения запаха уксусной кислоты. Полученный продукт использовали без дополнительной очистки. Желтое масло, 2.14 г, выход 92%. 1Н-ЯМР(400 MHz, CDCl3): 1.13 (t, J=7.0, 3H), 1.25 (t, J=7.1, 3H), 2.98 (d, J=6.6, 2H), 3.03 (t, J=7.1, 2H), 3.35 (dd, J=9.1, 7.0, 1H), 3.76 (m, 2H), 3.89 - 4.01 (m, 3H), 4.02 - 4.18 (m, 4H), 4.92 - 5.10 (br.s, 2H) 6.79 (m, 4H), 7.15 (d, J=8.6, 2H), 7.13 (d, J=8.6, 2H). 13C-ЯМР: 14.15, 14.87, 34.78, 38.41, 40.11, 60.67, 66.09, 67.04, 68.63, 80.25, 114.19 (4C), 129.15, 129.89 (2C), 130.24 (2C), 130.64, 157.15, 157.47, 172.42. Найдено: m/z 401.2202 [M]+. C23H31NO5. Вычислено: M 401.2201.
Пример 3. Синтез N- [3-оксолуп-28-оил] -2- (4- (2- (4 - ((S) 2-этокси-3-пропаноил) фенокси) этил) фенокси) этанамида 5
Получение соединения 5 проиллюстрировано на фиг. 1, стадии d, e.
В круглодонной колбе на 50 мл растворяли 1.1 г (2,75 ммоль) амина 4 и 1.15 г (2,5 ммоль) дигидробетулоновой кислоты в 20 мл ДМФ. Добавляли 0.72 г (1.9 ммоль) HBTU, а затем по каплям добавляли 0.54 г (4.2 ммоль) DIPEA при охлаждении на ледяной бане. Реакционную смесь продували аргоном и перемешивали при комнатной температуре в течение 5 часов. Затем ее выливали в воду, подкисляли 10%-ной соляной кислотой до pH ~ 2-3 и экстрагировали EtOAc. Органический слой промывали насыщенным раствором NaHCO3, сушили над MgSO4. Очистку проводили методом колоночной хроматографии на силикагеле в системе гексан:EtOAc - 3:1. Получили этиловый эфир соединения 5, желтое масло массой 1.72 г, выход 78%. 1Н-ЯМР (400 MHz, CDCl3): 0.70 (s, 3H), 0.88 (s, 6H), 1.07 - 1.31 (m, 21H), 2.06 (s, 3H), 2.17 (dd, J=12.9, 4.1, 1H), 2.36 (s, 1H), 2.76 - 2.97 (m, 6H), 3.01 (t, J=7.0, 2H), 3.28 - 3.40 (m, 1H), 3.52 - 3.64 (m, 1H), 3.64 - 3.74 (m, 2H), 3.95 (m, J=6.7, 6.7, 1H), 4.00 - 4.22 (m, 7H), 4.52 (dd, J=11.4, 5.0, 1H), 5.70 (s, 1H), 6.10 (t, J=5.6, 1H), 6.80 (d, J=8.7, 2H), 6.87 (d, J=8.6, 2H), 7.14 (d, J=8.6, 2H), 7.19 (d, J=8.6, 2H). 13C- ЯМР: 14.21, 15.06, 16.41, 16.66, 17.33, 18.60, 21.32, 23.30, 23.53, 26.34, 28.01, 28.37, 29.50, 31.51, 31.79, 32.64, 34.86, 36.90, 37.40, 38.01, 38.45, 38.76, 39.08, 41.75, 43.12, 43.65, 45.31, 47.93, 54.97, 60.78, 61.69, 66.17, 66.76, 68.78, 77.20, 80.39, 80.57, 114.25 (2C), 114.50 (2C), 128.48, 129.22, 130.04 (2C), 130.35 (2C), 130.83, 157.09, 157.52, 169.06, 171.03, 172.56, 175.98, 199.88. Найдено: m/z 895.5598 [M]+. C55H77NO9. Вычислено: M 895.5596.
Гидролиз этилового эфира с получением N- [3-оксолуп-28-оил] -2- (4- (2- (4 - ((S) 2-этокси-3-пропаноил) фенокси) этил) фенокси) этанамида 5. В колбе на 25 мл растворяли 0.51 ммоль этилового эфира соединения 5 в системе MeOH: THF: H2O - 1: 2: 1. Раствор охлаждали до 0 °C и добавляли порциями 2.3 ммоль LiOH×H2O при интенсивном перемешивании. Через 2 часа MeOH выпаривали, реакционную смесь выливали в воду, экстрагировали EtOAc и водный слой подкисляли 10% соляной кислотой до pH ~ 2-3. Органический слой сушили MgSO4. Очистку проводили методом колоночной хроматографии в системе CHCl3: MeOH - 100: 2. Получили белый порошок массой 0.34 с, выход 84%. Тпл: 119-120°С. 1Н-ЯМР (400 MHz, CDCl3): 0.71 - 1.01 (m, 18H), 1.17 (t, J=7.0, 3H), 1.50 - 1.92 (m, 7H), 2.15 - 2.29 (m, 1H), 2.29 - 2.53 (m, 3H), 2.86 - 3.11 (m, 4H), 3.34 - 3.48 (m, 1H), 3.55 - 3.77 (m, 3H), 3.97 - 4.06 (m, 3H), 4.10 (t, J=7.1, 2H), 6.14 (t, J=5.5, 1H), 6.76 - 6.90 (m, 4H), 7.11 - 7.24 (m, 4H). 13C- ЯМР: 14.26, 14.44, 15.12, 15.76, 15.85, 19.34, 19.57, 20.91, 21.32, 25.76, 26.54, 29.32, 30.77, 33.45, 33.63, 34.05, 34.82, 36.76, 37.74, 37.87, 38.21, 38.64, 39.52, 40.55, 42.45, 46.86, 47.21, 49.82, 54.84, 55.76, 60.42, 66.63, 66.94, 68.75, 79.71, 109.41, 114.34 (2C), 114.45 (2C), 128.72, 130.09, 130.48 (2C), 130.87 (2C), 150.67, 157.14, 157.61, 176.44, 218.66. Найдено: m/z 811.5387 [M]+. C51H73NO7. Вычислено: M 811.5387.
Пример 4. Биологические испытания N- [3-оксолуп-28-оил] -2- (4- (2- (4 - ((S) 2-этокси-3-пропаноил) фенокси) этил) фенокси) этанамида 5
Мыши C57Bl/6 массой 20-25 г были получены из вивария SPF ИЦиГ СО РАН. Животных содержали в стандартных условиях со свободным доступом к воде и пище, с влажностью и температурным контролем, с 12-часовыми циклами света и темноты. Все манипуляции с животными проводились в строгом соответствии с законодательством РФ, Приказом Минздрава РФ № 199н от 01.04.2016 г. и положениями Директивы 2010/63 / ЕС Европейского союза Парламента и Совета Европейского Союза от 22.09.2010 г. о защите животных, используемых в научных целях. Каждая экспериментальная группа состояла из 8 животных.
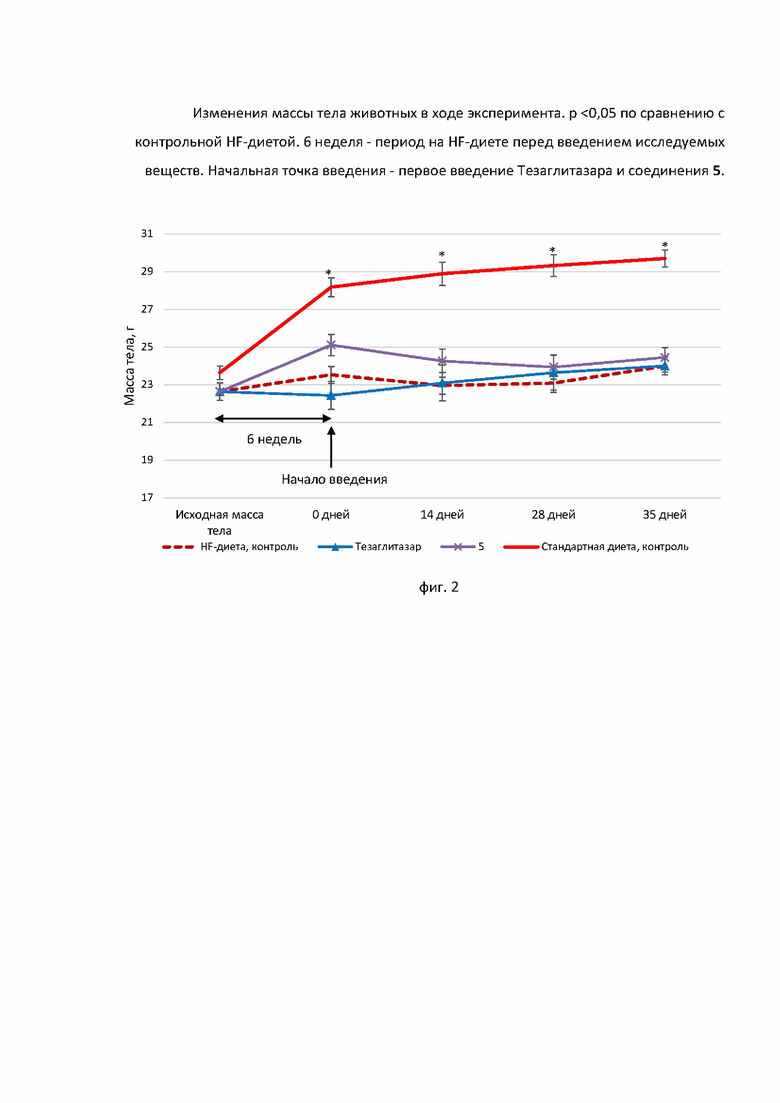
Диета с высоким содержанием жиров (HF-диета). Для приготовления рациона использовали стандартный гранулированный корм, содержащий 250 ккал/100 г, с добавлением 2.5% холестерина (CAS 57885, Acros Organics), 0.5% холевой кислоты (CAS 81254, ABCR), 0.1% 6-пропил-2-тиоуроцила. (CAS 51525, Sigma-Aldrich) и 20% жиров в виде сливочного масла. Конечная калорийность корма составила 545 Ккал / 100 г. Тезаглитазар 6 использовался в качестве контроля по причине единого фармакофорного фрагмента с исследуемым соединением, а именно - (S)-этил-2-этокси-3-(4-гидроксифенил)пропаноатного фрагмента. Животные содержались на этой диете в течение 6 недель, после чего их разделили на группы: 1) диета с высоким содержанием жиров (HF-диета); 2) диета с высоким содержанием жиров (HF-диета) + тезаглитазар 15 мг/кг (доза ниже, чем у 5, учитывая его более низкую молекулярную массу (примерно в 2 раза)); 3) диета с высоким содержанием жиров (HF-диета) + соединение 5 30 мг/кг; 4) Стандартный корм + средство доставки (вода + две капли твин 80). Тестируемые вещества смешивали с 2 каплями Tween 80, затем разводили в дистиллированной воде и вводили через желудочный зонд в течение 5 недель.
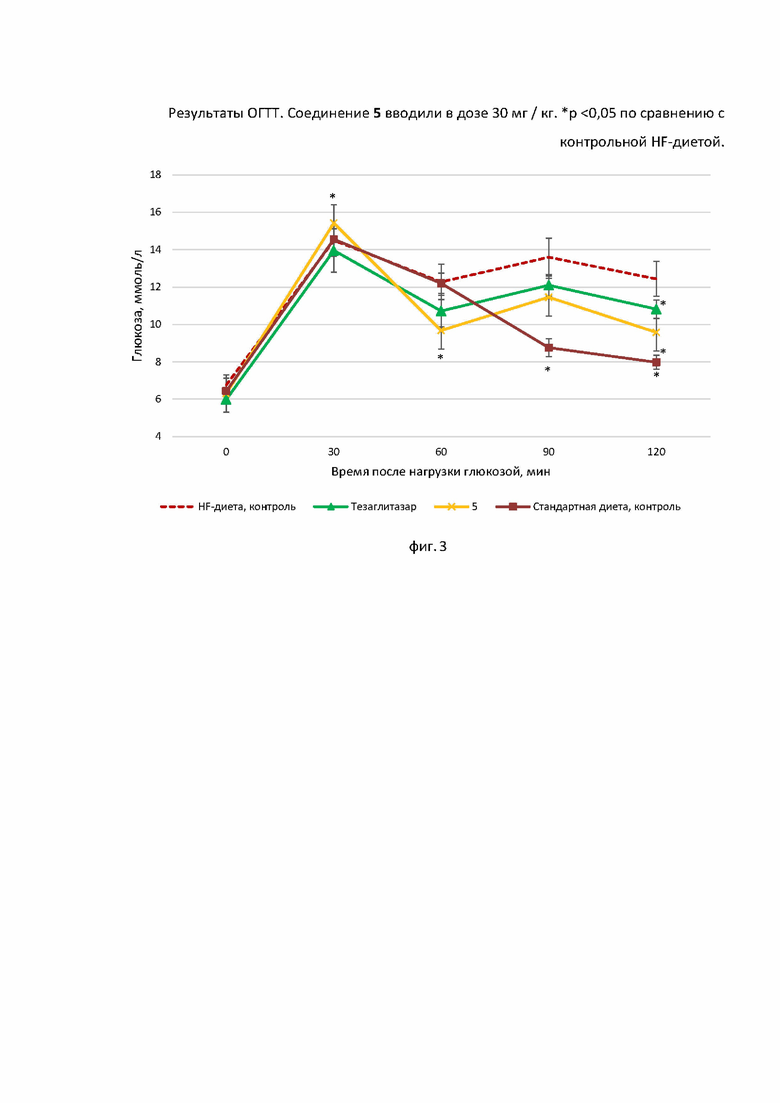
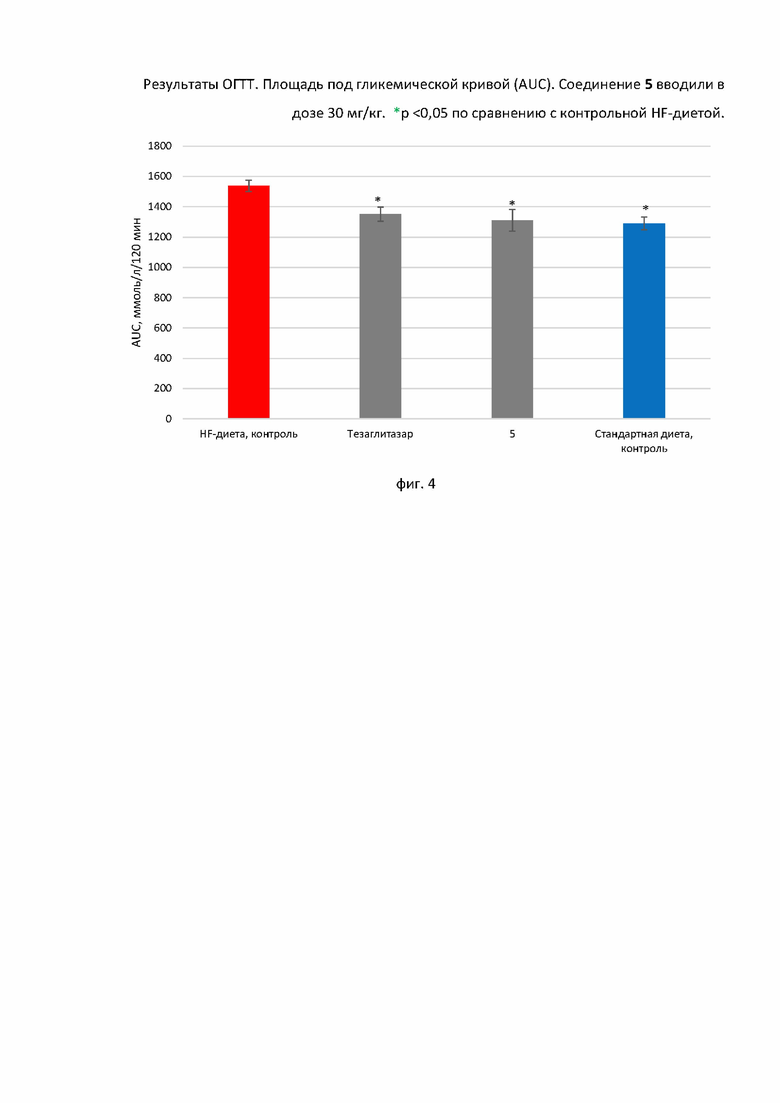
Оральный тест толерантности к глюкозе (ОГТТ). Испытание проводили на 32-е сутки эксперимента, через сутки после последнего введения, натощак (12-часовое голодание). Пероральная нагрузка глюкозой (2,5 г/кг) выполнялась для всех экспериментальных групп. Значения глюкозы в крови измеряли с помощью глюкометра ONE TOUCH Select (LIFESCAN Inc., США) перед введением (0) и через 30, 60, 90, 120 минут после нагрузки глюкозой. Площадь под гликемической кривой рассчитывалась с использованием модели Тая [Tai, M. A Mathematical Model for the Determination of Total Area Under Glucose Tolerance and Other Metabolic Curves. Diabetes Care, 1994, 17(2), 152-154].
Биохимическое исследование. После 5 недель эксперимента мышей умерщвляли, кровь собирали из яремных вен и сыворотку отделяли центрифугированием при 3000 об/мин/15 мин. Уровни общего холестерина (TC), триглицеридов (TG), липопротеинов высокой и низкой плотности (HDL и LDL), глюкозы (Glu) и щелочной фосфатазы (ALP) во всех группах оценивались с использованием стандартных диагностических наборов (Вектор Бест, Россия) и спектрофотометра Stat Fax 3300 (США). Статистический анализ проводился с использованием U-критерия Манна - Уитни. Данные представлены как Среднее ± SEM. Р <0,05 считали статистически значимым.
За изменениями массы тела животных следили на протяжении всего эксперимента (фиг. 2).
Результаты ОГТТ, проведенного через 32 дня после введения тестируемых соединений, представлены на фиг. 3 и 4. Результаты биохимического анализа крови, проведенного в конце эксперимента (36й день) представлены в Таблице 1.
Биохимические показатели крови по окончании эксперимента (36 дней). TC - общий холестерин, TG - триглицериды, HDL - липопротеины высокой плотности, LDL - липопротеины низкой плотности, GLU - глюкоза, ALP - щелочная фосфатаза, HF-диета с высоким содержанием жиров, SD - стандартная диета. * P <0,05 по сравнению с HF-диетой.
Таблица 1
| название | год | авторы | номер документа |
|---|---|---|---|
| (2S)-3-(4-{ 2-[4-(2-{ [(1R,4aR,7S)-7-этинил-1,4a,7-триметил-1,2,3,4,4a,4b,5,6,7,8,10,10a-додекагидрофенантрен-1-ил]формамидо} этокси)фенил]этокси} фенил)-2-этокси-пропановая кислота для терапии и профилактики метаболического синдрома | 2023 |
|
RU2813464C1 |
| Монотерпензамещенные (S)-2-этокси-3-(4-(4-гидроксифенетокси)-фенил)-пропановые кислоты для терапии метаболического синдрома | 2024 |
|
RU2831554C1 |
| НОВЫЕ ПРОИЗВОДНЫЕ И АНАЛОГИ 3-АРИЛПРОПИОНОВОЙ КИСЛОТЫ | 1999 |
|
RU2243214C2 |
| ПРОИЗВОДНЫЕ ХИНОЛИН-2-ОНА В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗЫ C-KIT | 2016 |
|
RU2754858C2 |
| 1-(2-ИЗОПРОПОКСИЭТИЛ)-2-ТИОКСО-1,2,3,5-ТЕТРАГИДРО-ПИРРОЛО[3,2-d]ПИРИМИДИН-4-ОН И ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ | 2005 |
|
RU2409578C2 |
| 2-ОКСИНДОЛЬНЫЕ СОЕДИНЕНИЯ | 2017 |
|
RU2743747C2 |
| 3,6-ДИАМИНОПИРИДАЗИН-3-ИЛЬНЫЕ ПРОИЗВОДНЫЕ, СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ПРОАПОПТОТИЧЕСКИХ СРЕДСТВ | 2020 |
|
RU2830186C2 |
| 3-Имино-N-арил-2-хлорофуро[2,3-b]пиридин-2-карбоксамиды в качестве антидотов 2,4-Д на подсолнечнике и способ их получения | 2024 |
|
RU2829740C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЦИС-1-{2-[4-(6-МЕТОКСИ-2-ФЕНИЛ-1,2,3,4-ТЕТРАГИДРОНАФТАЛИН-1-ИЛ)ФЕНОКСИ]ЭТИ Л}ПИРРОЛИДИНА И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ | 2000 |
|
RU2195445C2 |
| 4-(ИМИДАЗО[1,2-а]ПИРИДИН-3-ИЛ)-ПИРИМИДИНОВЫЕ ПРОИЗВОДНЫЕ | 2020 |
|
RU2822388C2 |
Изобретение относится к области органической химии и фармацевтики и предназначено для терапии и профилактики метаболического синдрома. Представлено новое соединение N-[3-оксолуп-28-оил]-2-(4-(2-(4-((S)2-этокси-3-пропаноил)фенокси)этил)фенокси)этанамид структуры 5. Технический результат: эффективный липидный и гликемический контроль. 4 ил., 1 табл., 4 пр.
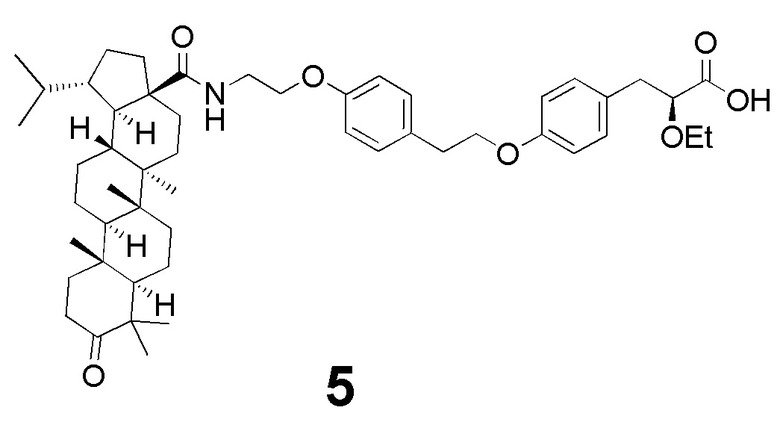
N-[3-оксолуп-28-оил]-2-(4-(2-(4-((S)2-этокси-3-пропаноил)фенокси)этил)фенокси)этанамид структуры 5
 .
.
| БИОКОНЪЮГАТЫ ТРИТЕРПЕНОВЫХ КИСЛОТ ЛУПАНОВОГО РЯДА С ГИДРАЗИДОМ КИСЛОТЫ "ТРОЛОКС", СПОСОБ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИММУНОТРОПНЫХ И ПРОТИВОВОСПАЛИТЕЛЬНЫХ ВЕЩЕСТВ | 2010 |
|
RU2464273C2 |
| СПОСОБ ПОЛУЧЕНИЯ (2RS)-2,5,7,8-ТЕТРАМЕТИЛ-2-[(4RS,8RS)-4,8,12-ТРИМЕТИЛТРИДЕЦИЛ]-ХРОМАН-6-ИЛ-N-[3-ОКСОЛУП-20(29)-ЕН-28-ОИЛ]-ГЛИЦИНАТА | 2008 |
|
RU2440366C2 |
| N-[3-ОКСО-ЛУПАНО-28-ИЛ]-ПИПЕРИДИН-СРЕДСТВО С ПРОТИВООПУХОЛЕВОЙ, АНТИМЕТАСТАТИЧЕСКОЙ, ПРОТИВОВОСПАЛИТЕЛЬНОЙ И ЦИТОПРОТЕКТОРНОЙ АКТИВНОСТЬЮ | 2011 |
|
RU2466136C1 |
| WO 2014078610 A1, 22.05.2014 | |||
| Sorokina I.V | |||
| et al | |||
| Antitumor activity of amides of dihydrobetulonic acid in vitro and in vivo, Russian Journal of Bioorganic Chemistry, 01.03.2013 | |||
| Vol | |||
| Машина для изготовления проволочных гвоздей | 1922 |
|
SU39A1 |
| No | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Кран машиниста для автоматических тормозов с сжатым воздухом | 1921 |
|
SU194A1 |
Авторы
Даты
2022-06-21—Публикация
2021-06-25—Подача