Метаболический синдром (МС) - это комплекс нарушений, включающий повышенный уровень сахара в крови и аномальный уровень холестерина (снижение уровня липопротеинов высокой плотности и/или повышение уровня триглицеридов, что приводит к гипертонии и ожирению и повышает риск развития сердечно-сосудистых заболеваний, инсульта и инфаркта [Rochlani, Y.; Pothineni, N. V.; Kovelamudi, S.; Mehta, J. L. Metabolic syndrome: pathophysiology, management, and modulation by natural compounds. Therapeutic Advances in Cardiovascular Disease. 2017, 11(8), 215-225]. До недавнего времени метаболическим синдромом страдали преимущественно пожилые люди (старше 60 лет). За последние 20 лет картина значительно изменилась. В некоторых странах доля взрослых, страдающих от этих симптомов, достигает 25%. За последние 20 лет число людей в мире с метаболическим синдромом увеличилось более чем на 100 миллионов - на треть.
Существует два основных риска при этом заболевании:
1. Сахарный диабет 2 типа. Если не изменить образ жизни и не взять под контроль избыточный вес, может развиться резистентность к инсулину, что может привести к повышению уровня сахара в крови. В конечном итоге это приводит к диабету 2 типа.
2. Высокий уровень холестерина и высокое кровяное давление способствуют образованию бляшек в артериях. Эти бляшки сужают артерии, что может привести к сердечному приступу или инсульту.
Недавно были успешно разработаны препараты из новой группы, направленные на решение обеих проблем - глитазары [Hong, F.; Xu, P.; Zhai, Y. The Opportunities and Challenges of Peroxisome Proliferator-Activated Receptors Ligands in Clinical Drug Discovery and Development. Int. J. Mol. Sci. 2018, 19, 2189.]. Первоначально эти соединения классифицировались как глитазоны, но иной механизм действия, активация не только PPAR-гамма, но и PPAR-альфа рецепторов, а также изменения в особенностях структуры позволили выделить их в группу глитазаров. Препараты эффективно влияют на восстановление углеводного и жирового метаболизма у пациентов с диабетом 1 и 2 типов, оказывают благоприятное действие на профилактику и течение сосудистых осложнений [Varga, T.; Czimmerer, Z.; Nagy, L. PPARs are a unique set of fatty acid regulated transcription factors controlling both lipid me-tabolism and inflammation. Biochimica et Biophysica Acta (BBA) - Molecular Basis of Disease. 2011, 1812(8), 1007-1022].
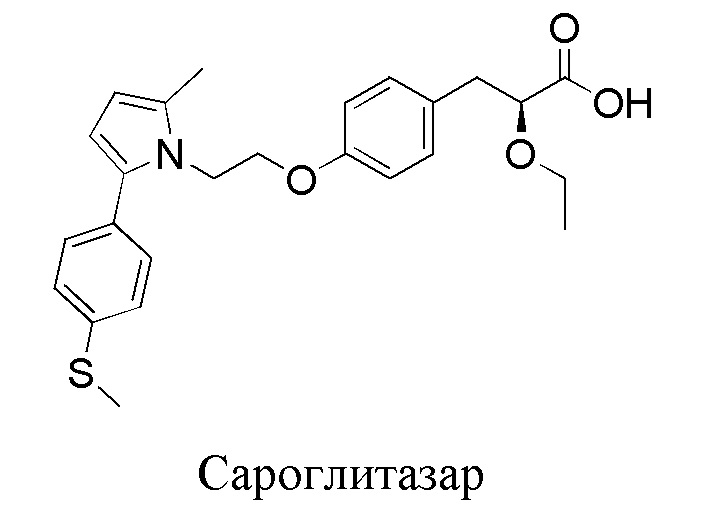
(S)-2-Этокси-3-фенилпропаноиновая кислота считается фармакофорным фрагментом, общим для глитазаров. Главной особенностью этого фрагмента является его связывание с рецепторами PPAR-альфа и PPAR-гамма, что позволяет соединениям этого класса препаратов эффективно регулировать не только углеводный, но и липидный обмен. Ряд двойных агонистов PPAR, показавших многообещающие результаты в исследованиях на животных, были протестированы в клиниках. Все они содержат один и тот же фрагмент "головной молекулы", но разные "хвосты". На сегодняшний день только один из них, сароглитазар, был одобрен в Индии [Agrawal, R. The First Approved Agent in the Glitazar’s Class: Saroglitazar. Curr. Drug Targets 2014, 15, 151-155]. Все остальные - рагаглитазар, мураглитазар, тесаглитазар, алеглитазар - не получили одобрения регулирующих органов, в основном из-за неблагоприятных побочных эффектов, которые включают гепатотоксичность, кардиотоксичность и желудочно-кишечную токсичность [Balakumar, P.; Mahadevan, N.; Sambathkumar, R. A Contemporary Overview of PPARα/γ Dual Agonists for the Management of Diabetic Dyslipidemia. Curr. Mol. Pharmacol. 2019, 12, 195-201; Xi, Y.; Zhang, Y.; Zhu, S.; Luo, Y.; Xu, P.; Huang, Z. PPAR-Mediated Toxicology and Applied Pharmacology. Cells 2020, 9, 352].
Недавно мы предположили, что разнообразные побочные эффекты фармакологических агентов обусловлены структурными различиями в "хвостовой" части молекулы глитазара.
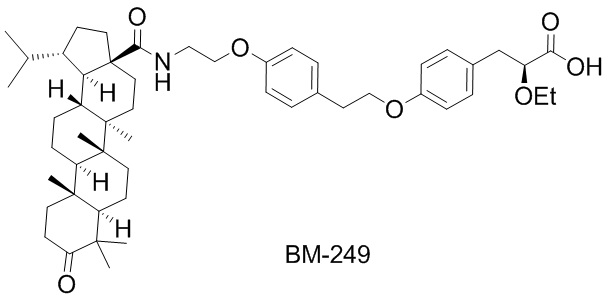
В недавней работе мы показали, что использование фрагментов тритерпеновых кислот в качестве хвостовой части молекулы дает соединения с гипогликемическими и гиполипидемическими свойствами [Fomenko, V.; Blokhin, M.; Kuranov, S.; Khvostov, M.; Baev, D.; Borisova, M.S.; Luzina, O.; Tolstikova, T.G.; Salakhutdinov, N.F. Triterpenic Acid Amides as a Promising Agent for Treatment of Metabolic Syndrome. Sci. Pharm. 2021, 89, 4.]. Синтезированное соединение N-[3-оксолуп-28-оил]-2-(4-(2-(4-((S)2-этокси-3-пропаноил)фенокси)этил)фенокси)этанамид (BM-249) с фрагментом дигидробетулоновой кислоты, соединенным с (S)-2-этокси-3-фенилпропановой кислотой через амидную связь с аминоэтаноловым спейсером, при пероральном введении в дозе 30 мг/кг в течение 5 недель мышам на диете с высоким содержанием жиров и холестерина (HF диета) показало относительно безопасный профиль в исследованиях на животных, эффект в снижении уровня глюкозы, общего холестерина (TC) и липопротеина высокой плотности (HDL) в крови.
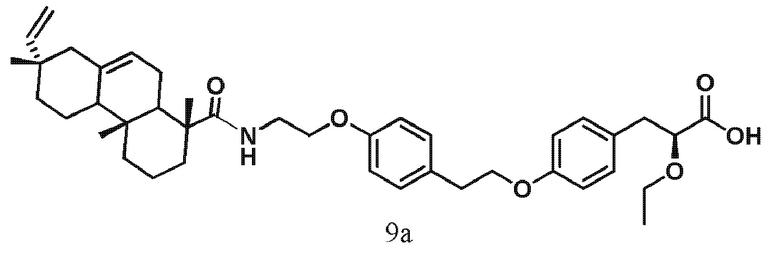
В настоящем изобретении был синтезирован улучшенный аналог соединения BM-249, (2S)-3-(4-{2-[4-(2-{[(1R,4aR,7S)-7-этинил-1,4a,7-триметил-1,2,3,4,4a,4b,5,6,7,8,10,10a-додекагидрофенантрен-1-ил]формамидо}этокси)фенил]этокси}фенил)-2-этокси-пропановая кислота (9а), содержащий другой терпеновый фрагмент, и изучены его гипогликемические и гиполипидемические свойства. Впервые синтезированное соединение 9а обеспечивает возможность выбора при терапии метаболического синдрома. Изучение его фармакологической активности у мышей с ожирением и СД2 (C57Bl/6Ay) продемонстрировало, что соединение 9а обладает эффектами, характерными для двойных агонистов PPAR-альфа и гамма. Его введение в дозе 30 мг/кг в течение одного месяца привело к снижению уровня триглицеридов в печени и жировой ткани мышей за счет увеличения катаболизма и к гипогликемическому эффекту, связанному с улучшением чувствительности тканей мышей к инсулину. Кроме того, показано, что вещество не оказывает токсического воздействия на печень.
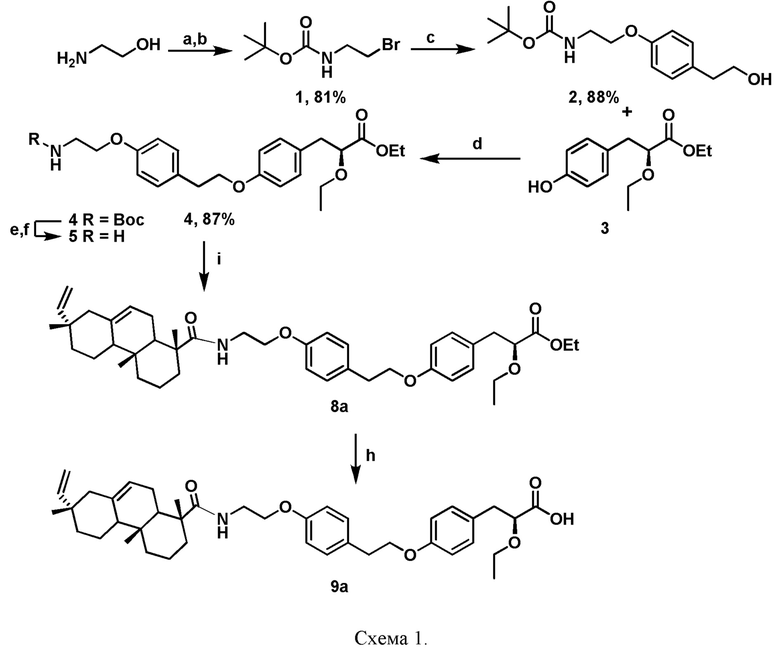
Синтез соединения 9а осуществлялся по ранее описанной методике [Fomenko, V.; Blokhin, M.; Kuranov, S.; Khvostov, M.; Baev, D.; Borisova, M.S.; Luzina, O.; Tolstikova, T.G.; Salakhutdinov, N.F. Triterpenic Acid Amides as a Promising Agent for Treatment of Metabolic Syndrome. Sci. Pharm. 2021, 89, 4; Mikhail E. Blokhin; Sergey O. Kuranov; Mikhail V. Khvostov; Vladislav V. Fomenko; Olga A. Luzina; Natalia A. Zhukova; Cham Elhajjar; Tatiana G. Tolstikova; Nariman F. Salakhutdinov Curr. Issues Mol. Biol. 2023, 45(3), 2230-2247] с тем отличием, что вместо дигидробетулоновой кислоты в конденсацию вводилась изопимаровая кислота (Схема 1).
Пример 1. Синтез соединения 9а
(S)-2-этокси-3-(4-гидроксифенил) пропаноатный фрагмент был синтезирован в соответствии с литературными методами [Astrazeneca. Process for The Preparation of 2-Ethoxy-3-[4-(2-(Methanesulphonyloxyphenyl)-Ethoxy) Phenyl] Propanoic Acid. World Patent WO2003082812A2, 8 January 2003.]. Амин 5, содержащий этил (S)-2-этокси-3-(4-гидроксифенил) пропаноатный фрагмент, был синтезирован в соответствии с процедурой, описанной ранее [Fomenko, V.; Blokhin, M.; Kuranov, S.; Khvostov, M.; Baev, D.; Borisova, M.S.; Luzina, O.; Tolstikova, T.G.; Salakhutdinov, N.F. Triterpenic Acid Amides as a Promising Agent for Treatment of Metabolic Syndrome. Sci. Pharm. 2021, 89, 4.]. Полученные спектральные данные совпадают с литературными.
Синтез амида 8a.
Амин 5 1,1 г (2,75 ммоль) и изопимаровая кислота 756 мг (2,5 ммоль) были растворены в 20 мл DMF в 50-мл круглодонной колбе. Добавили HBTU 0,72 г (1,9 ммоль), затем добавляли по каплям при охлаждении в ледяной бане DIPEA 0,54 г (4,2 ммоль). Смесь продували аргоном и перемешивали при комнатной температуре в течение 5 ч. Затем ее вылили в воду, подкислили 10% соляной кислотой до pH~2-3 и экстрагировали EtOAc. Органическую фазу промывали насыщенным раствором NaHCO3 и сушили над MgSO4. Очистку проводили колоночной хроматографией на силикагеле с использованием системы гексан:EtOAc-3:1.
Этил(2S)-3-(4-{2-[4-(2-{[(1R,4aR,7S)-7-этенил-1,4a,7-триметил-1,2,3,4,4a,4b,5,6,7, 8,10,10a-додекагидрофенантрен-1-ил]формамидо}этокси)фенил]этокси}фенил)-2-этоксипропаноат, 8a. Желтое масло, выход 79%. 1Н-NMR: 0.78-0.88 (8H, m), 1.15-1.18 (8H, m), 1.20-1.25 (3H, m), 1.25-1.99 (12H, m), 2.87-2.93 (2H, m), 3.05 (2H, m), 3.25-3.36 (1H, m), 3.51-3.71 (3H, m), 3.98 (3H, m), 4.03-4.16 (4H, m), 4.83 (2H, m), 5.23 (1H, m), 5.81 (1H, m), 6.19-6.28 (1H, m), 6.79 (4H, dd, J=14.4, 8.7), 7.07-7.19 (4H, m). 13C-NMR: 14.2, 15.0, 15.3, 17.2, 17.9, 19.9, 21.4, 24.7, 25.1, 34.8, 36.0, 36.7, 38.7, 39.1, 44.9, 45.6, 44.9, 46.0, 46.3, 51.9, 60.7, 66.1, 66.8, 68.7, 80.3, 109.2, 114.2 (2C), 114.5 (2C), 120.6, 129.2, 130.0 (2C), 130.3 (2C), 130.9, 135.5, 150.3, 157.1, 157.4, 172.5, 178.9. Найдено m/z 685.4342 [M]+. C43H59NO6. Вычислено: M 685.4343.
Гидролиз соединеня 8a.
Гидролиз сложноэфирной группы полученного соединения проводили в соответствии с процедурой, описанной в нашей предыдущей работе [Fomenko, V.; Blokhin, M.; Kuranov, S.; Khvostov, M.; Baev, D.; Borisova, M.S.; Luzina, O.; Tolstikova, T.G.; Salakhutdinov, N.F. Triterpenic Acid Amides as a Promising Agent for Treatment of Metabolic Syndrome. Sci. Pharm. 2021, 89, 4.].
(2S)-3-(4-{2-[4-(2-{[(1R,4aR,7S)-7-этенил-1,4a,7-триметил-1,2,3,4,4a,4b,5,6,7, 8,10,10a-додекагидрофенантрен-1-ил]формамидо}этокси)фенил]этокси}фенил)-2-этокси-пропановая кислота, 9a.
Желтое масло, 85% выход. 1H-NMR: 0.78-0.89 (6H, m), 1.05-1.16 (5H, m), 1.27-1.38 (2H, m), 1.39-1.58 (7H, m), 1.58-2.04 (9H, m), 2.84-3.05 (4H, m), 3.37 (1H, dd, J=8.8, 7.3), 3.52-3.66 (3H, m), 3.93-4.01 (3H, m), 4.07 (2H, t, J=7.0), 4.80-4.93 (2H, m), 5.14-5.31 (1H, m), 5.71-5.82 (1H, m), 6.25 (1H, t, J=5.2), 6.80 (4H, dd, J=16.5, 8.4), 7.09-7.21 (4H, m). 13C-NMR: 15.0, 15.3, 17.3, 17.5, 19.9, 21.4, 21.2, 24.7, 34.8, 36.0, 36.7, 38.4, 38.7, 39.2, 45.6, 46.0, 52.0, 66.1, 66.8, 68.7, 80.3, 109.2, 114.2 (2C), 114.5 (2C), 120.8, 120.9, 129.2, 1230.0 (2C), 130.3 (2C), 130.8, 135.5, 135.6, 150.2, 157.1, 157.5, 172.5, 178.9. Найдено: m/z 657.4029 [M]+. C41H55NO6. Вычислено: M 657.4028.
Пример 2. Биологические испытания (2S)-3-(4-{2-[4-(2-{[(1R,4aR,7S)-7-этинил-1,4a,7-триметил-1,2,3,4,4a,4b,5,6,7,8,10,10a-додекагидрофенантрен-1-ил]-формамидо}-этокси)-фенил]-этокси}фенил)-2-этокси-пропановой кислоты (9а)
Вещество 9а было исследовано на мышах с ожирением и нарушенной толерантностью к глюкозе (линия C57Bl/6Ay, мыши AY).
Масса тела и потребление корма
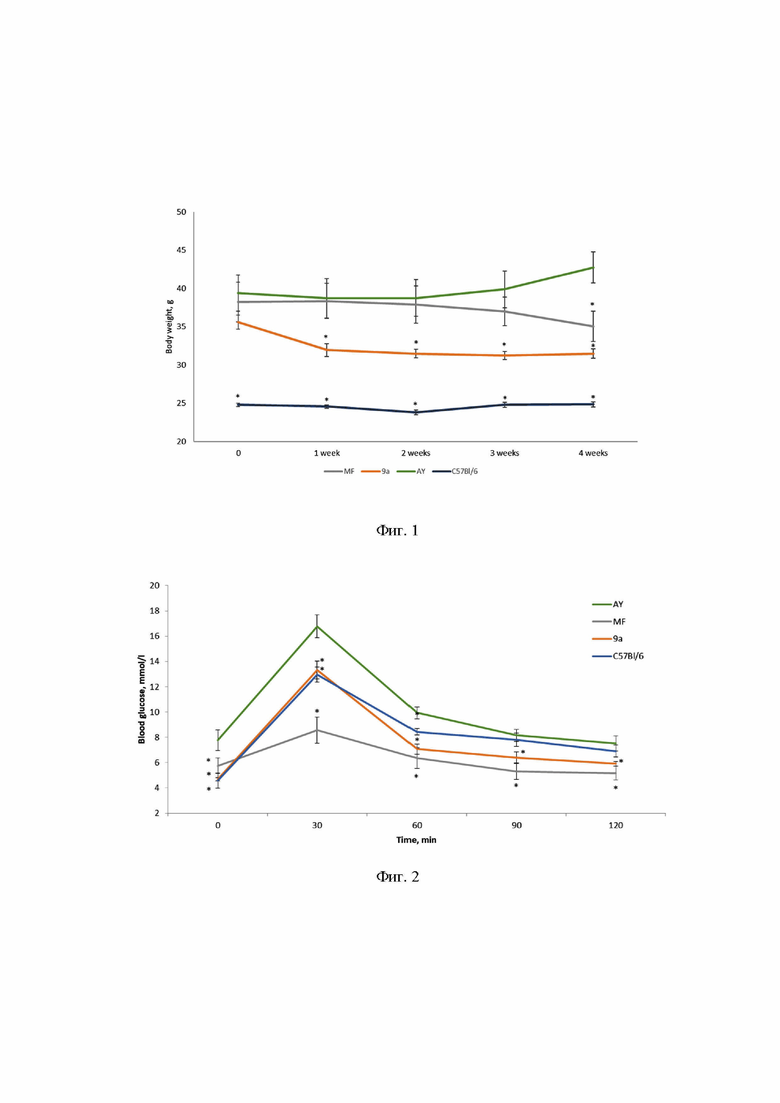
В течение первых 2 недель эксперимента у всех животных наблюдалось снижение массы тела, что можно объяснить стрессом от ежедневного введения веществ, затем у мышей AY (отрицательный контроль) масса тела начала увеличиваться и к концу эксперимента была выше, чем в начале. У мышей C57Bl/6 (интактный контроль) она вернулась к исходному уровню к четвертой неделе эксперимента. У мышей, получавших метформин (положительный контроль) и IPG, наблюдалось устойчивое снижение массы тела к концу эксперимента (Фиг. 1. Изменение массы тела в ходе эксперимента. *p<0,05 по сравнению с мышами AY). Стоит отметить, что потребление корма мышами группы 9а было на том же уровне, что и у мышей группы AY, в то время как мыши, получавшие метформин, потребляли больше корма в первые две недели (Фиг. 1, Таблица 1).
Оральный тест толерантности к глюкозе (ОТТГ)
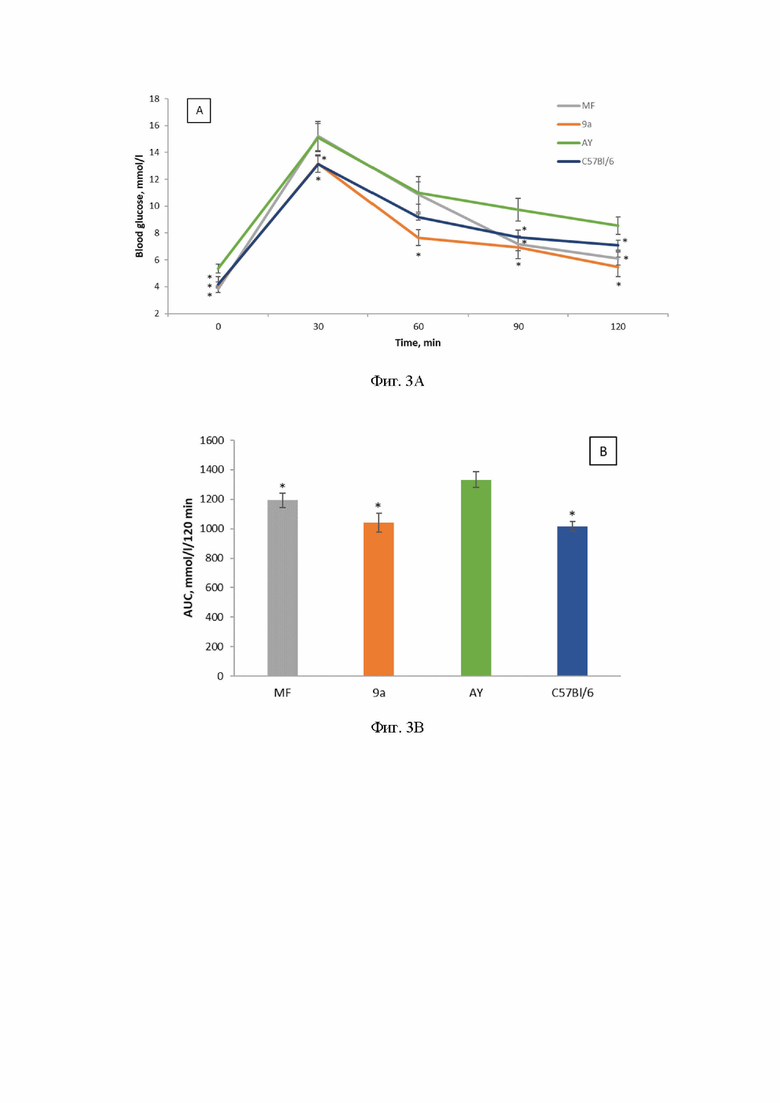
Первое исследование толерантности к глюкозе у мышей было проведено через 14 дней после введения 9а. Был обнаружен значительный гипогликемический эффект, который, однако, уступал эффекту метформина (Фиг. 2. Результаты ОГТТ. Тест проведен после 14 дней лечения мышей AY соединением 9a. Дозы: 9а - 30 мг/кг, MF - 250 мг/кг. *p < 0,05 по сравнению с мышами AY).
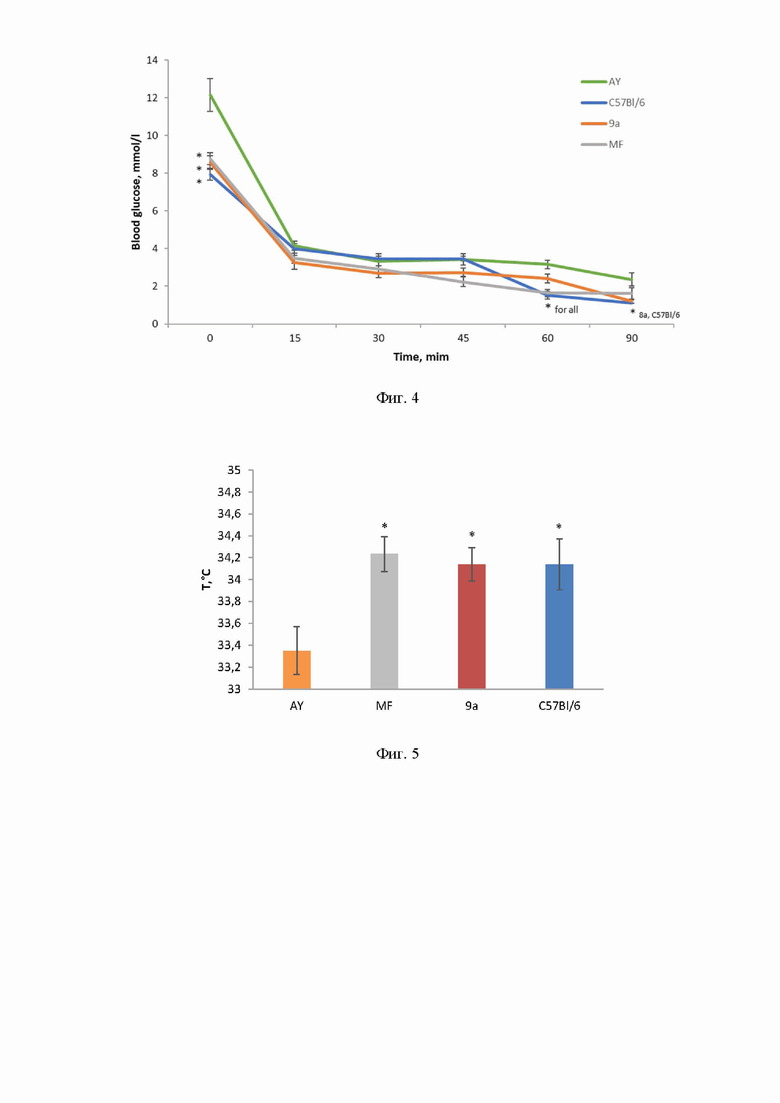
Второй ОТТГ проводился через 28 дней после введения 9а, и, в отличие от предыдущего теста, исследуемые вещества не вводились за 30 мин до нагрузки глюкозой, а оценивался кумулятивный эффект на протяжении всего эксперимента. Как видно из Фиг. 3 (Фиг. 3A. Результаты ОТТГ. Тест проведен после 28 дней лечения мышей AY с использованием соединения 9a, Фиг. 3В. AUC, рассчитанная по данным ОТТГ после 28 дней лечения мышей AY с использованием соединения 9a. Дозы: 9a - 30 мг/кг, MF - 250 мг/кг. *p < 0,05 по сравнению с мышами AY), наибольший гипогликемический эффект был обнаружен у мышей, получавших 9a, эффект метформина проявлялся только через 90 мин после введения глюкозы.
ИТТ в конце эксперимента
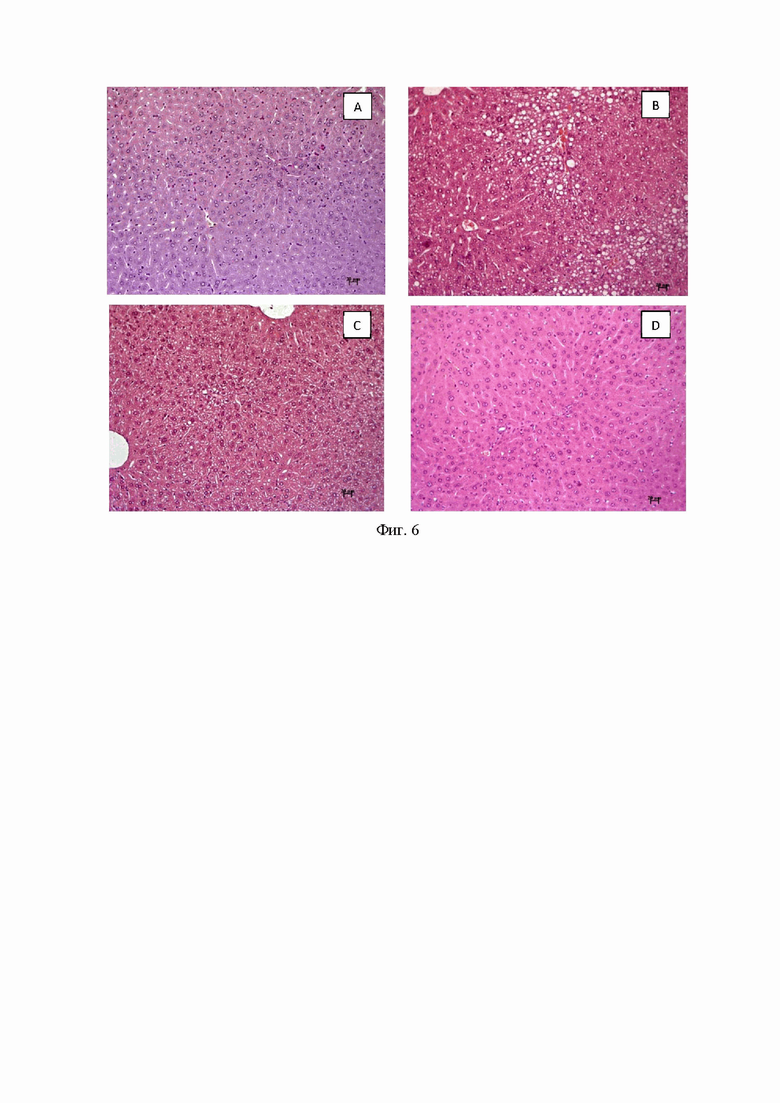
В конце эксперимента был проведен ИТТ (инсулинотолерантный тест) для определения чувствительности мышей к инсулину. Как видно из Фиг. 4 (Фиг. 4. Уровень глюкозы в крови в ИТТ через 29 дней после начала эксперимента. *p<0,05 по сравнению с мышами AY), у всех животных введение инсулина приводит к заметному снижению уровня глюкозы в крови, но только у интактного контроля и мышей 9а он падает до 1,2 ммоль/л, что является пределом обнаружения глюкометра.
Температура тела
В конце эксперимента мы измерили температуру тела животных неинвазивным способом. Было обнаружено, что введение 9a и метформина значительно повышало температуру тела мышей, выравнивая ее со значением для мышей C57Bl/6 (Фиг. 5. Температура тела мышей в конце эксперимента. *p<0,05 по сравнению с мышами AY).
Оценка биохимических параметров крови и массы тканей
В конце эксперимента у животных оценивали массу печени и жировой ткани. Было обнаружено, что масса печени в группе 9а не отличалась от AY мышей других групп. В то время как масса белой и коричневой жировой ткани была значительно ниже (Таблица 2). Биохимический анализ крови показал снижение уровня лактата и АЛТ у мышей, получавших 9a (Таблица 3).
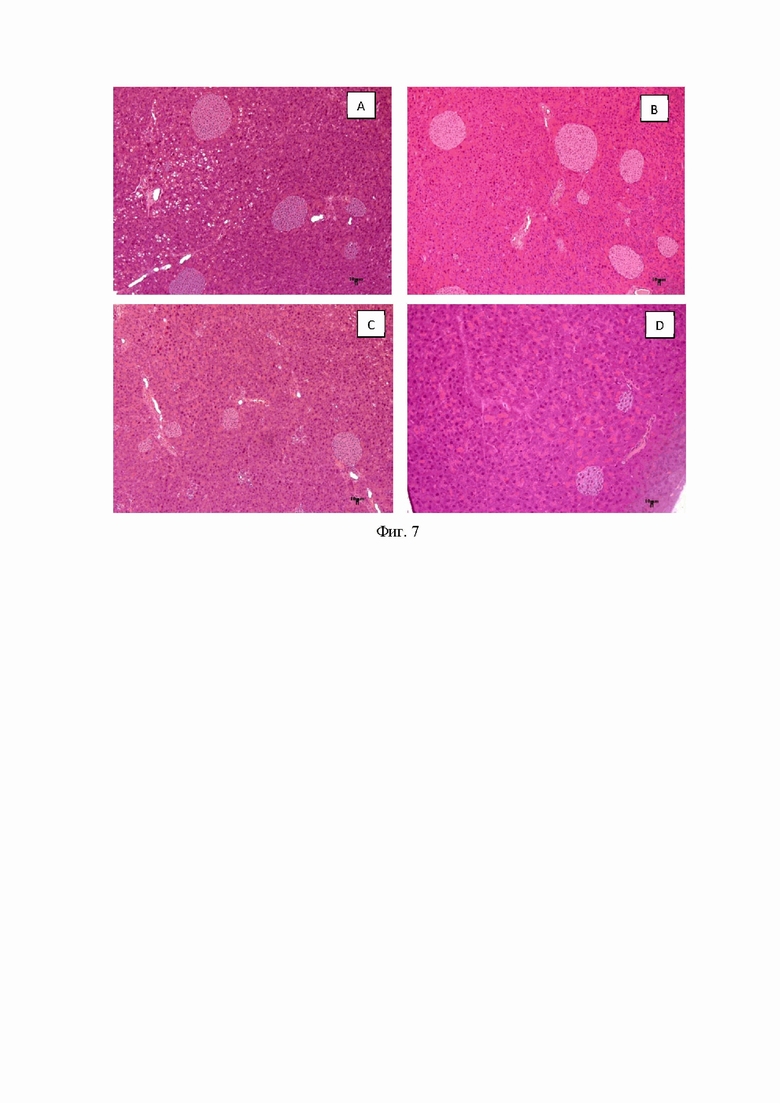
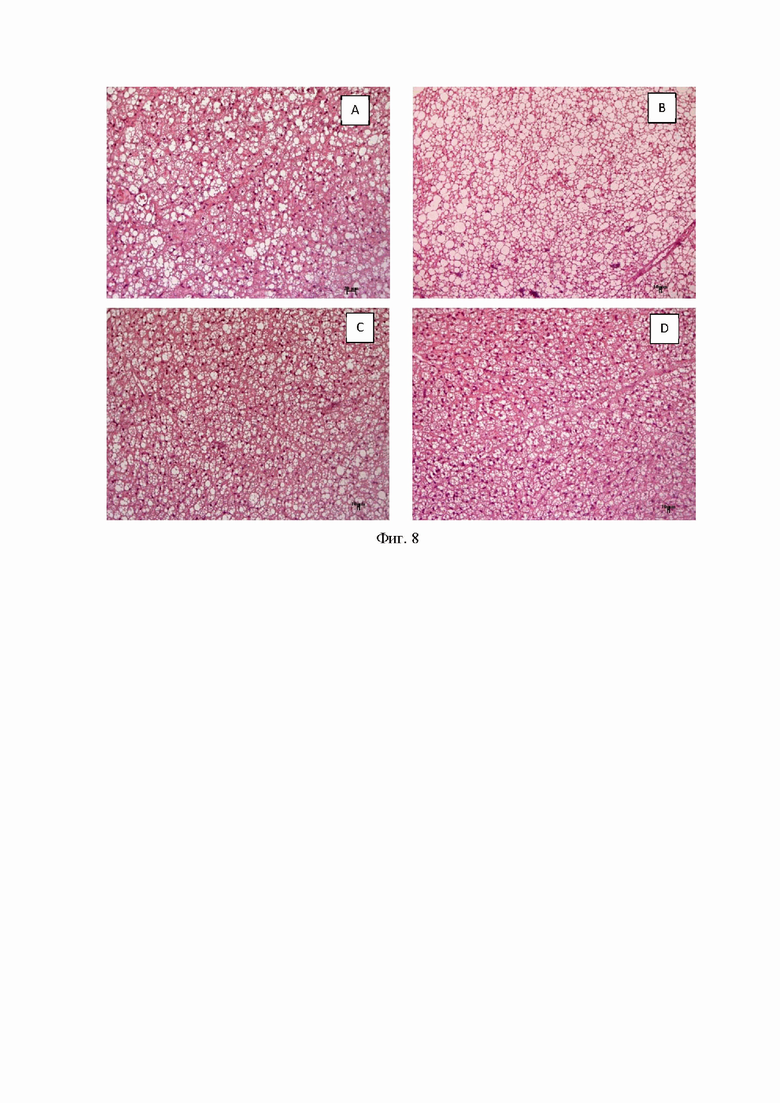
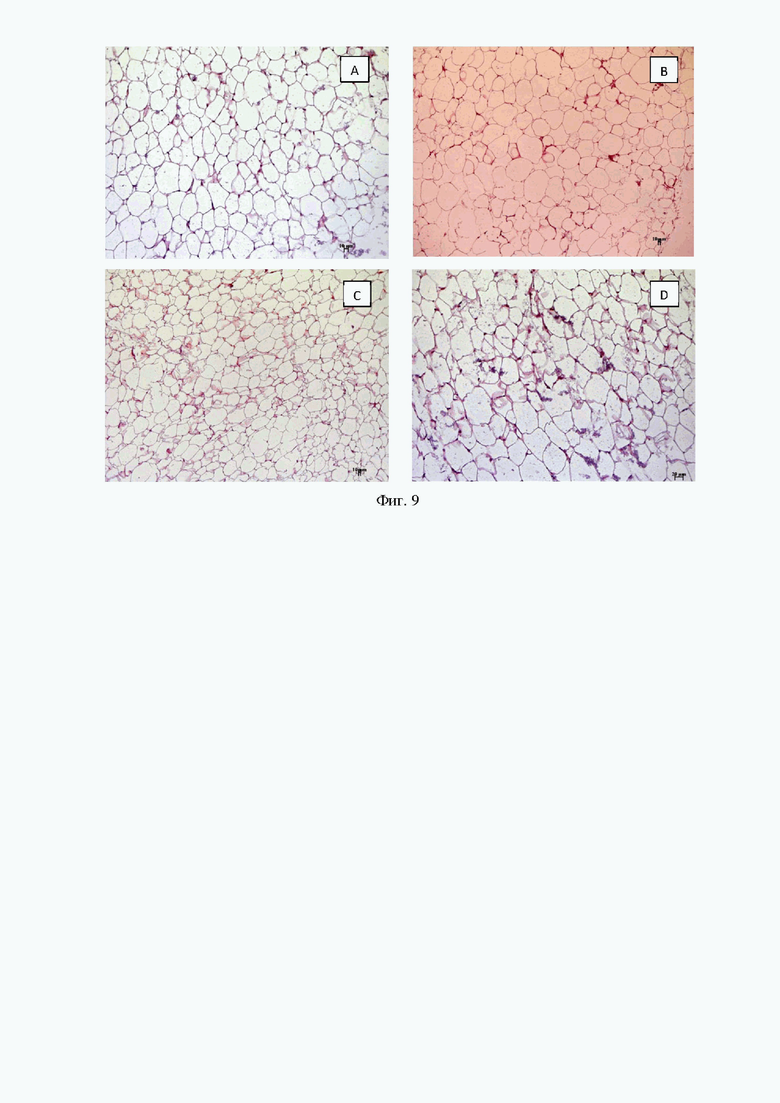
Гистологический анализ
У мышей AY наблюдалось развитие жирового гепатоза (Фиг. 6В) (Фиг. 6. Гистологическая оценка печени у мышей после 4 недель эксперимента. A - мыши AY, обработанные соединением 9a в дозе 30 мг/кг, B - мыши AY (без лечения), C - мыши AY, обработанные метформином в дозе 250 мг/кг, D - C57Bl/6 (здоровый контроль). Окрашивание гематоксилином и эозином, x200)). В эндокринной части поджелудочной железы наблюдалась выраженная гиперплазия островкового аппарата (Фиг. 7B (Фиг. 7. Гистологическая оценка поджелудочной железы у мышей после 4 недель эксперимента. A - мыши AY, обработанные соединением 9a в дозе 30 мг/кг, B - мыши AY (без лечения), C - мыши AY, обработанные метформином в дозе 250 мг/кг, D - C57Bl/6 (здоровый контроль). Окрашивание гематоксилином и эозином, x100)). В бурой жировой ткани наблюдалось выраженное увеличение содержания жира в адипоцитах. Крупные жировые капли сливались друг с другом, образуя жировые кисты (Фиг. 8B (Фиг. 8. Гистологическая оценка бурого жира у мышей после 4 недель эксперимента. A - мыши AY, обработанные соединением 9a в дозе 30 мг/кг, B - мыши AY (без лечения), C - мыши AY, обработанные метформином в дозе 250 мг/кг, D - C57Bl/6 (здоровый контроль). Окрашивание гематоксилином и эозином, x100)). В белой жировой ткани также наблюдалось резкое увеличение размеров адипоцитов и их слияние в жировые кисты (Фиг. 9B (Фиг. 9. Гистологическая оценка бурого жира у мышей после 4 недель эксперимента. A - мыши AY, обработанные соединением 9a в дозе 30 мг/кг, B - мыши AY (без лечения), C - мыши AY, обработанные метформином в дозе 250 мг/кг, D - C57Bl/6 (здоровый контроль). Окрашивание гематоксилином и эозином, x100)). У мышей, получавших метформин, наблюдалось улучшение метаболических отклонений (Фиг. 6-9, C).
У животных, получавших 9а, морфологическая картина в исследуемых органах практически полностью соответствует таковой в группе интактных животных. Архитектоника печени и поджелудочной железы имела типичное строение, выраженных инфильтративно-некротических, гемодинамических изменений не обнаружено (Фиг. 6А, 7А). В бурой и белой жировой ткани содержание жира в адипоцитах было сопоставимо с интактной группой (Фиг. 8А, 9А).
Соединение 9а было исследовано на мышах с ожирением и нарушенной толерантностью к глюкозе (C57Bl/6Ay). У этих мышей наблюдается антагонизм меланокортиновых рецепторов белком agouti, который является результатом мутации гена agouti (Ay/a). У мышей она вызывает желтую пигментацию, ожирение в позднем возрасте и гиперинсулинемию. Эти метаболические изменения делают мышей AY удобной животной моделью для изучения гипогликемических эффектов и связанного с ними влияния на липидный обмен. Фармакологические эффекты соединения 9а в нашем эксперименте на животных характерны для действия PPAR-альфа и гамма агонистов. Во-первых, продемонстрировано значительное уменьшение жирового гепатоза, снижение массы белой и бурой жировой ткани. Все это указывает на ускорение катаболизма триглицеридов, происходящее при активации PPAR-альфа. В бурой жировой ткани усиленный катаболизм жирных кислот обычно приводит к увеличению выработки тепла из-за активации белка, не связывающего триглицериды (UCP1), и мы продемонстрировали повышение температуры тела мышей в конце эксперимента (Фиг. 5). Активация PPAR-гамма обычно связана с повышением чувствительности тканей к действию инсулина и, как следствие, снижением уровня гликемии. Введение соединения 9a привело к заметному снижению обоих уровней глюкозы натощак и значительно улучшило толерантность мышей к глюкозе (Фиг. 2, 3). Наиболее выраженный эффект был достигнут после четырех недель применения препарата. Это связано с повышением чувствительности тканей животных к инсулину, что дополнительно подтверждается результатами ИТТ (Фиг. 4) и снижением уровня лактата в крови (Таблица 3). Лактат в больших количествах синтезируется жировыми клетками при ожирении, а его повышенный уровень в крови связан с инсулинорезистентностью, поэтому его снижение можно рассматривать как дополнительное свидетельство улучшения чувствительности тканей к инсулину. Данные гистологического исследования, вес печени и биохимический анализ крови (снижение уровня АЛТ, Таблица 3) продемонстрировали отсутствие токсического повреждения печени, вызванного соединением 9a.
ммоль/л
ммоль/л
ммоль/л
U/l, U/l
U/l
| название | год | авторы | номер документа |
|---|---|---|---|
| Монотерпензамещенные (S)-2-этокси-3-(4-(4-гидроксифенетокси)-фенил)-пропановые кислоты для терапии метаболического синдрома | 2024 |
|
RU2831554C1 |
| Средство для повышения чувствительности тканей к инсулину при сахарном диабете 2го типа | 2022 |
|
RU2798603C1 |
| N-[3-ОКСОЛУП-28-ОИЛ]-2-(4-(2-(4-((S)-2-ЭТОКСИ-3-ПРОПАНОИЛ)ФЕНОКСИ)ЭТИЛ)ФЕНОКСИ)ЭТАНАМИД ДЛЯ ТЕРАПИИ И ПРОФИЛАКТИКИ МЕТАБОЛИЧЕСКОГО СИНДРОМА | 2021 |
|
RU2774591C1 |
| ИЗМЕЛЬЧЕННАЯ ФОРМА (S)-2-ЭТОКСИ-3-[4-(2-{4-МЕТАНСУЛЬФОНИЛОКСИФЕНИЛ}ЭТОКСИ)ФЕНИЛ]ПРОПАНОВОЙ КИСЛОТЫ | 2000 |
|
RU2248966C2 |
| НОВЫЙ ПЕПТИД, УЧАСТВУЮЩИЙ В ЭНЕРГЕТИЧЕСКОМ ГОМЕОСТАЗЕ | 2006 |
|
RU2409590C2 |
| ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ 2-{4-[(3S)-ПИПЕРИДИН-3-ИЛ]ФЕНИЛ}-2Н-ИНДАЗОЛ-7-КАРБОКСАМИДА | 2009 |
|
RU2495035C2 |
| 2-ГИДРОКСИ-4-ОКСО-4-ФЕНИЛ-2-БУТЕНОАТ БЕНЗОТИАЗОЛИЛАММОНИЯ, ОБЛАДАЮЩИЙ ГИПОГЛИКЕМИЧЕСКОЙ АКТИВНОСТЬЮ | 2009 |
|
RU2412177C2 |
| КРИСТАЛЛИЧЕСКАЯ ФОРМА (S)-2-ЭТОКСИ-3-[4-(2-{4-МЕТАНСУЛЬФОНИЛОКСИФЕНИЛ}ЭТОКСИ)ФЕНИЛ]ПРОПАНОВОЙ КИСЛОТЫ | 2000 |
|
RU2268880C2 |
| 2-ГИДРОКСИ-4-МЕТИЛФЕНИЛ-4-ОКСО-2-БУТЕНОАТ ТИАЗОНИЛАММОНИЯ, ОБЛАДАЮЩИЙ ГИПОГЛИКЕМИЧЕСКОЙ И НООТРОПНОЙ АКТИВНОСТЬЮ | 2011 |
|
RU2512291C2 |
| КОМБИНАЦИЯ, СОДЕРЖАЩАЯ НОВОЕ ПРОИЗВОДНОЕ 3-(4-(БЕНЗИЛОКСИ)ФЕНИЛ)ГЕКС-4-ИНОВОЙ КИСЛОТЫ И ДРУГОЙ АКТИВНЫЙ ИНГРЕДИЕНТ, ДЛЯ АКТИВИРОВАНИЯ ФЕРМЕНТА РЕЦЕПТОРА G-БЕЛКА 40 | 2015 |
|
RU2680248C1 |
Изобретение относится к области органической химии и фармакологии, а именно к новому соединению, применяемому для терапии и профилактики метаболического синдрома. Раскрывается (2S)-3-(4-{2-[4-(2-{[(1R,4aR,7S)-7-этинил-1,4a,7-триметил-1,2,3,4,4a,4b,5,6,7,8,10,10a-додекагидрофенантрен-1-ил]формамидо}этокси)фенил]этокси}фенил)-2-этокси-пропановая кислота в качестве средства для терапии и профилактики метаболического синдрома. Использование изобретения обеспечивает эффективную терапию и профилактику метаболического синдрома. 10 ил., 3 табл., 2 пр.
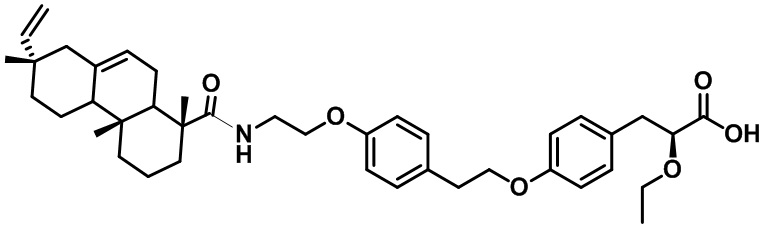
Соединение (2S)-3-(4-{2-[4-(2-{[(1R,4aR,7S)-7-этинил-1,4a,7-триметил-1,2,3,4,4a,4b,5,6,7,8,10,10a-додекагидрофенантрен-1-ил]формамидо}этокси)фенил]этокси}фенил)-2-этокси-пропановая кислота
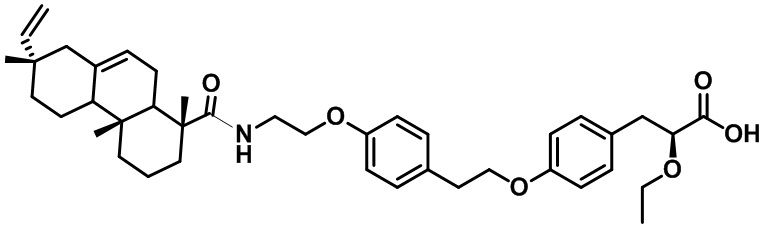
9а
в качестве средства для терапии и профилактики метаболического синдрома.
| Приспособление для ограничения силы тормозного тока при электродинамическом торможении моторных повозок электрических железных дорог | 1928 |
|
SU20140A1 |
| N-[3-ОКСОЛУП-28-ОИЛ]-2-(4-(2-(4-((S)-2-ЭТОКСИ-3-ПРОПАНОИЛ)ФЕНОКСИ)ЭТИЛ)ФЕНОКСИ)ЭТАНАМИД ДЛЯ ТЕРАПИИ И ПРОФИЛАКТИКИ МЕТАБОЛИЧЕСКОГО СИНДРОМА | 2021 |
|
RU2774591C1 |
| ПОДВИЖНОЕ УСТРОЙСТВО ДЛЯ УБОРКИ СНЕГА С ЖЕЛЕЗНОДОРОЖНЫХ ПУТЕЙ | 1931 |
|
SU38665A1 |
| Прибор для снятия с досок слоя материала определенной толщины и длины | 1929 |
|
SU20310A1 |
| FOMENKO V | |||
| et al | |||
| Triterpenic Acid Amides as a Promising Agent for Treatment of Metabolic Syndrome | |||
| Scientia Pharmaceutica, 2020, 89(1), p | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
Авторы
Даты
2024-02-12—Публикация
2023-07-03—Подача