Область техники
Изобретение относится к биотехнологии и фармацевтике, а также медицине, ветеринарии и стоматологии, может быть использовано в лечении костных дефектов, вызванных различными причинами, связанными с утратой некоторого объема костного материала.
Уровень техники
Проблема устранения костных дефектов, при которых утрачивается часть костного материала, известна науке давно. Хирургическое введение слоновой кости или костного материала животного происхождения практиковалось во многих традиционных культурах мира и в медицине нового времени. Однако, технология имплантации может иметь недостатки на этапах приживления импланта и его ремоделирования в функциональную костную ткань.
Так, известны способы получения костных имплантов из губчатой ткани, при котором фрагменты костного материала обрабатывают перекисью водорода, смесью этанола и хлороформа, подвергают заморозке и стерилизации и упаковывают с последующей радиационной стерилизацией (RU 2172104) либо на фрагменты губчатой ткани с отверстиями воздействуют липосистемами, ультразвуком и вакуумом, промывают, упаковывают и подвергают радиационной стерилизации (RU 2366173). Другим потенциальным материалом для остеопластики являются коллагеновые импланты, которые могут быть получены из сухожилий, связок, фасций, твердой мозговой оболочки, перикарда, хрящей человека и животных, ступенчато обработанных растворами Triton х-100, дезоксихолата натрия, гидроксида натрия, соляной кислоты, хлорида натрия, хлорида натрия и фосфатного буфера, фосфатного буфера, с последующей промывкой дистиллированной водой (RU 2360690).
Существует группа биоимплантов из искусственных материалов на основе углеволокнистых стержней с антибиотикнесущими вставками из костного цемента (RU 165598), сплавов титана, ниобия и тантала (RU 2302261) или вязкотекучего композиционного материала, содержащего альгинат натрия и кальций-фосфатный наполнитель (RU 2723217).
Для повышения вероятности приживления используют имплантационные материалы формы, совпадающей с костным дефектом (изобретения RU 2723217, RU 2022105699), или применяют их в форме мелкой крошки (RU 2172104).
Описанные материалы обладают некоторым потенциалом для приживления и могут замещать места костных дефектов, однако не доказана их способность к ремоделированию, что в последующем может приводить к инкапсулированию и возникновению персистирующего воспаления, снижению механической прочности в данном месте.
Переходным этапом между технологией имплантов и технологией скаффолдов могут считаться способы получения имплантационных материалов, связанные с насыщением их клетками крови. Так, известно изобретение, в котором имплантат выполнен в виде блока цилиндрической или призматической формы, основа которого выполнена из композиционного материала, содержащего многонаправленный армирующий каркас из стержней, сформованных из углеродных волокон, расположенных вдоль оси указанных стержней и углеродную матрицу, и покрыта слоем богатой тромбоцитами аутоплазмы крови (RU 88952).
Скаффолд-технология предполагает культивирование клеток на трехмерных подложках-носителях естественного или искусственного происхождения с целью пространственного формирования будущего клеточного состава органа или его фрагмента для трансплантата.
Известен отечественный способ получения минерализованного композитного микроскаффолда для регенерации костной ткани на основе фиброина шелка и желатина (7:3) с последующим криоизмельчением и минерализацией за счет добавления к полупродукту хлоридов натрия, кальция и магния, а также гидрокарбоната и гидрофосфата натрия в умеренно-кислой среде (RU 2660558). Полученные описанным способом минерализованные композитные микроскаффолды, по данным авторов, обладают усиленной стимуляцией остеогенеза в отсутствии каких-либо индукторов, а также усиленной реорганизацией актинового цитоскелета, необходимой для успешной адгезии и дифференцировки остеобластов.
Также известны зарубежные аналоги реализации скаффолд-технологии. Так, в стоматологии применяется скаффолд-система для наращивания альвеолярной кости, представляющая собой пористый аугментационный (наращиваемый) скаффолд, изготовленный методом 3D-печати с использованием композитных материалов, механическую разделительную пластину, обернутую вокруг пористого скаффолда с биомиметической структурой с соответствующим размером пор (US 20230119400). Другим примером реализации скаффолд-систем является изобретение WO 2019104392, которое представляет собой модульные взаимосвязываемые компоненты и обосновывает геометрические параметры продукта.
Описанные скаффолд-технологии представляют собой перспективные средства для остеопластики, однако необходимы более эффективные средства для регенерации костной ткани.
Аналогом заявленного изобретения является патент KR 20230028901, в котором описано средство для регенерации сосцевидной кости, состоящее из трехмерного пористого скаффолда, биологически активных компонентов жировой ткани и плазму крови. Эффект регенерации достигается за один шаг во время операции. Данное изобретение обладает функцией ускорения регенерации костной ткани, однако крайне узко направлено. Возможна разработка технологии, которая применялась бы для восстановления более широкого спектра костей за счет более универсальных компонентов в ее составе.
Сущность изобретения
Настоящее изобретение решает задачу расширения спектра и повышения качества имплантируемых материалов для замещения костных дефектов в остеопластике и стоматологии путем разработки способа получения ремоделируемых в костную ткань 3D-скаффолдов за счет их использования в качестве носителя стволовых или прогениторных клеток, имеющих потенциал к остеодифференцировке.
Технический результат получения высокоэффективных 3D-скаффолдов, способных к остеоиндукции и остеокондукции, обладающих высокой биосовместимостью, достигается за счет синергии приемов, использованных при осуществлении заявленного способа, сочетания физических и химических методов воздействия на сырье и полупродукты, включения в описываемую технологию этапа сведения полупродукта с кондиционной средой от культивирования алло- или ксеногенных мезенхимальных стволовых клеток не менее 3го пассажа или мезенхимальных стволовых клеток, преддифференцированных в остеогенном направлении с помощью приемлемого индуктора, что совместно с частичным протеолизом и промораживанием материала приводит к снижению антигенных свойств белковых компонентов матрикса, а также обеспечивает благоприятную нишу для заселения скаффолда клетками.
Наращивание костей с помощью скаффолд-технологии строится на двух процессах: остеокондукция - формирование матрицы или каркаса, на котором костные клетки откладывают новообразованную кость; остеоиндукция -стимуляция остеогенеза посредством активации местных (собственных) факторов в зоне роста дефекта. Осуществление данных процессов возможно при условии отсутствия иммунного ответа на вносимые в кость материалы, сопровождающегося воспалением и инкапсулированием внесенного материала, то есть при условии биосовместимости.
Получаемые заявленным способом 3D-скаффолды не являются цитотоксичными для стволовых и прогениторных клеток, но при этом, улучшают их адгезивные свойства in vitro и in vivo, что доказывает их остеокондуктивные свойства. Внесение в состав 3D-скаффолдов компонентов, продуцируемых стволовыми клетками, не только способствует формированию ниши для рекрутирования прогениторных клеток кости и остеобластов, то есть обеспечивает остеиндуктивные свойства, но и способствует локальной супрессии иммунного ответа, что наряду с процессами делипидизации, денуклеинизации и частичной депротеинизации, а также криогенной обработки снижают иммунореактивность данных материалов и улучшает их биосовместимость.
Описываемое изобретение представляет собой способ изготовления способных поддерживать остеогенную нишу и вступать в ремоделирование для наращивания кости 3D-скаффолдов, получаемых из алло- или ксеногенной костной ткани, путем ступенчатой обработки сырья физическими и химическими методами, сведения с биологически активными компонентами (секретомом) мезенхимальных стволовых или прогениторных костных клеток.
Описываемый способ осуществляют следующим образом: Подготовка материала. Проводят очистку материала - костной ткани аллогенного или ксеногенного происхождения - от остатков мягких тканей и хряща и его промывку водой температуры (55±5)°С. Затем фрагментам костного материала придают необходимую форму и размер - макроблоки или тонкие уплощенные куски (слайсы), или пластины кортикальной костной ткани, или микроблоки размером до 8 мм (костную крошку), или костную муку.
Химическая обработка материала. Проводят обработку 6% раствором перекиси водорода в соотношении от 1:3 до 1:5 в течение 36-72 ч. при комнатной температуре с заменой раствора на свежий каждые 12 ч. и промывкой водой очищенной после обработки. С целью делипидизации обрабатывают смесью хлороформа и диэтилового эфира в соотношении 1:1 в течение 24-48 ч. с заменой раствора на свежий каждые 12 ч. и промывкой водой очищенной после обработки. Осуществляют гипотенизацию 0,075 М раствора хлорида калия для разрушения мембран ядер в соотношении 1:1 в течение 24-48 ч. с заменой раствора на свежий каждые 12 ч. и промывкой водой очищенной после обработки. Для денуклеинизации полуфабрикат обрабатывают 0,3 М раствором соляной кислоты при температуре 2-4°С в течение 4-6 ч. с последующей ее нейтрализацией, а для частичной депротеинизации помещают его на 2-3 ч. в 0,05% раствора трипсина.
Получение лиофилизированного полупродукта. Производят замораживание обработанного материала в жидком азоте с 1-3% ДМСО не менее чем на 2 суток с последующим размораживанием. Размороженные полуфабрикаты выдерживают в течение 12 ч. в 2-3 М растворе гидрофосфата натрия, а затем - в течение 12 ч. в фосфатно-солевого буферном растворе. Обработанные холодом и фосфатами полупродукты подвергают лиофилизации, упаковке и стерилизации, например, радиационным методом.
Получение готового продукта. Готовый продукт включает полуфабрикат в виде частично депротеинезированных скаффолдов из кости пропитанный биологически активными веществами, выделяемыми в процессе культивирования стволовыми клетками.
Сведение полученного полуфабриката с кондиционной средой от культивирования алло- или ксеногенных мезенхимальных стволовых клеток не менее 3го пассажа или мезенхимальных стволовых клеток, преддифференцированных в остеогенном направлении с помощью приемлемого индуктора, проводят в асептических условиях в соотношении 1:1. Для макроисполнений данный этап проводится проводится путем замачивания с постоянным перемешиванием в течение 12-24 ч при температуре 2-4°С. Обработанный полупродукт подвергают повторной лиофилизации в асептических условиях.
Контроль качества продукта. Каждую партию полученных 3D-скаффолдов оценивают по влиянию на адгезию и пролиферацию мезенхимальных стволовых клеток, преддифференцированных в остеогенном направлении, с помощью приемлемого индуктора, при сокультивировании, а также по цитотоксическим свойствам in vitro.
Краткое описание иллюстративного материала
Изобретение поясняется таблицами и рисунками.
Рисунок 1. Общий вид разных исполнений 3D-скаффолдов.
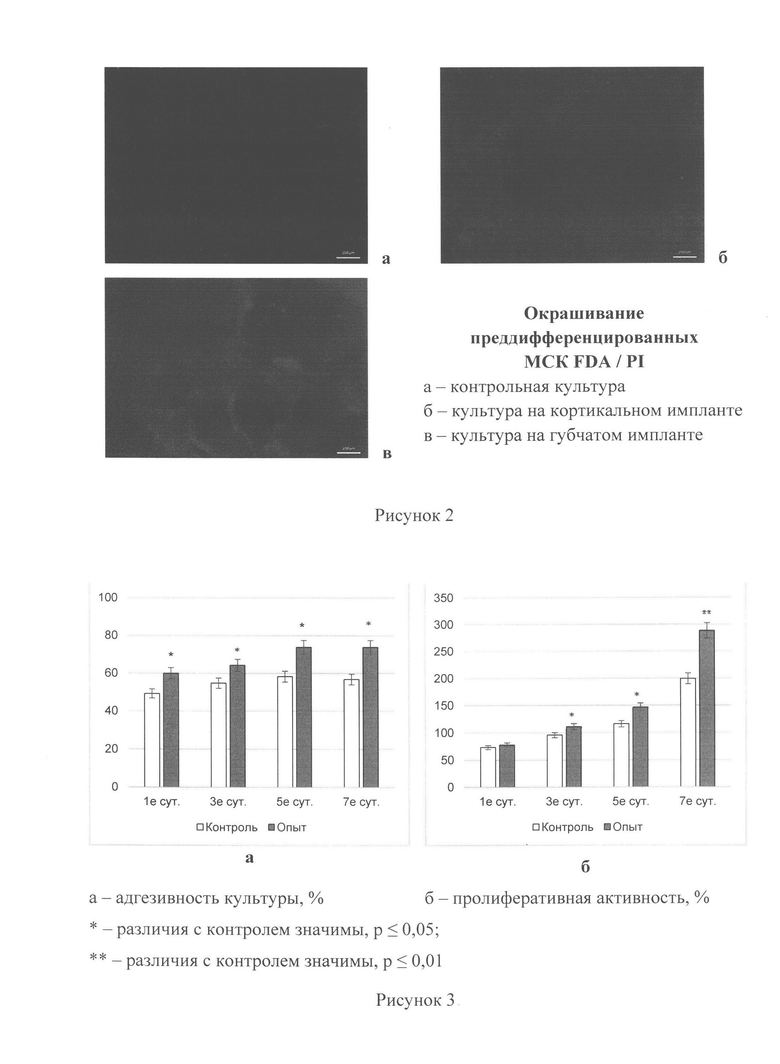
Рисунок 2. Оценка остеотропных свойств 3D-скаффолдов in vitro.
Рисунок 3. Морфология мезенхимальных стволовых клеток.
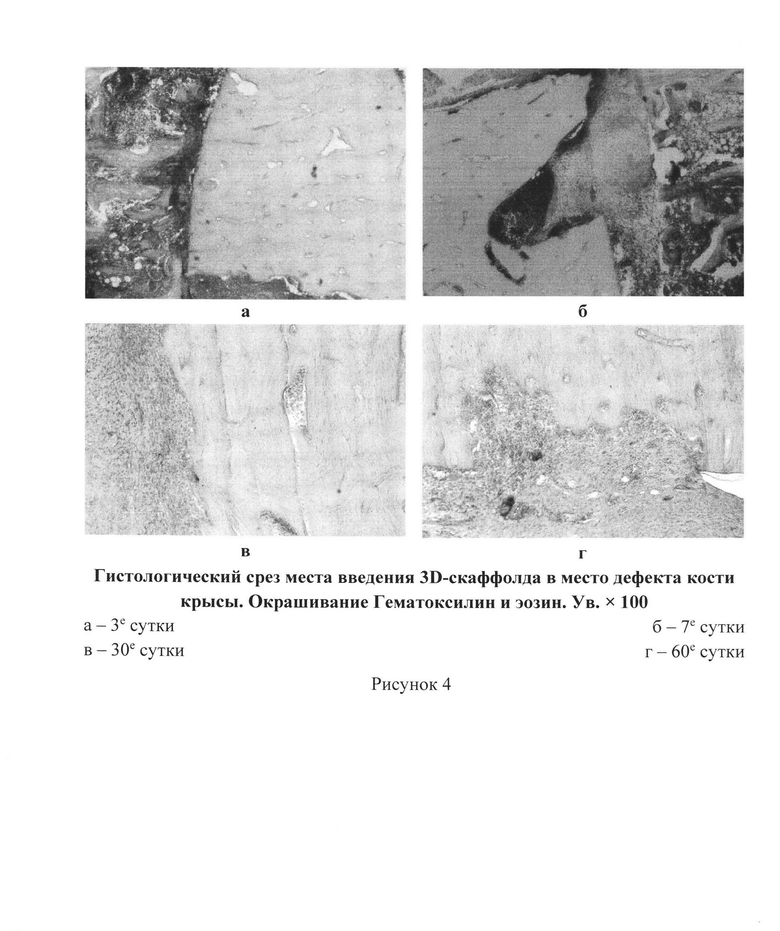
Рисунок 4. Оценка остеотропных свойств 3D-скаффолдов in vivo.
Возможность осуществления изобретения и эффективность его применения поясняется примерами.
Пример 1. Получение 3D-скаффолдов в разных исполнениях
Костную ткань свиней с бойни очистили от остатков мягких тканей и хряща и промыли теплой водой температуры 55°С. Отмытые фрагменты костной ткани измельчили в соответствии с типом исполнения 3D-скаффолда, получив заготовки макро- (макроблоки, рис. 1а, слайсы, рис 1г, пластины кортикальной костной ткани, рис. 1д) и микроизделий (микроблоки, рис. 1в, костная мука, рис. 1б).
Макроизделия обрабатывали при комнатной температуре 6% раствором перекиси водорода в соотношении от 1:4 течение 48 ч с заменой раствора на свежий каждые 12 ч и промывкой водой очищенной после обработки. Затем заготовки помещали на 36 ч в смесь хлороформа и диэтилового эфира в соотношении 1:1 с заменой раствора на свежий каждые 12 ч и промывкой водой очищенной после обработки. Гипотенизацию 0,075 М раствором хлорида калия в соотношении 1:1 выполняли при комнатной температуре в течение 36 ч с заменой раствора на свежий каждые 12 ч и промывкой водой очищенной после обработки. При температуре 2-4°С в течение 6 ч заготовки обрабатывали 0,3 М раствором соляной кислоты, после чего по иониметру нейтрализовали 0,3 М раствором гидроокиси натрия. Затем в аналогичных температурных условиях полупродукты помещали на 3 ч в 0,05% раствора трипсина.
Микроизделия обрабатывали при комнатной температуре 6% раствором перекиси водорода в соотношении от 1:4 течение 36 ч с заменой раствора на свежий каждые 12 ч и промывкой водой очищенной. Затем заготовки помещали на 24 ч в смесь хлороформа и диэтилового эфира в соотношении 1:1 с заменой раствора на свежий каждые 12 ч и промывкой водой очищенной после обработки. Гипотенизацию 0,075 М раствором хлорида калия в соотношении 1:1 выполняли при комнатной температуре в течение 24 ч с заменой раствора на свежий каждые 12 ч и промывкой водой очищенной после обработки. При температуре 2-4°С в течение 4 ч заготовки обрабатывали 0,3 М раствором соляной кислоты, после чего по иониметру нейтрализовали 0,3 М раствором гидроокиси натрия. Затем в аналогичных температурных условиях полупродукты помещали на 2 ч в 0,05% раствора трипсина.
К полученным таким образом полуфабрикатам добавляли 2% ДМСО (макроизделия обрабатывали реагентом 2 ч при постоянном помешивании) и замораживали на 2 суток в жидком азоте. Размороженные полуфабрикаты выдерживали в течение 12 ч в 3 М растворе гидрофосфата натрия, а затем - в течение 12 ч в фосфатно-солевого буферном растворе. Обработанные холодом и фосфатами полупродукты подвергали лиофилизации в режиме, соответствующему типу исполнения, упаковывали в пакеты из полимерной пленки или стеклянные флаконы и передавали на стерилизацию на радиационной установке.
Обработанные стерильные полуфабрикаты в асептических условиях сводили с кондиционной средой от культивирования ксеногенных мезенхимальных стволовых клеток 3 го пассажа в соотношении 1:1. Для макроисполнений проводили замачивание в кондиционной среде с постоянным перемешиванием в течение 24 ч при температуре 2-4°С. Обработанный полупродукт подвергали повторной лиофилизации в асептических условиях (рис. 1е и рис. 1ж)
Было исследовано влияние полученных 3D-скаффолдов на адгезию и пролиферацию мезенхимальных стволовых клеток, преддифференцированных в остеогенном направлении с помощью 10 ммоль/л глицерин-2-фосфата, 50 мкг/мл L-аскорбиновой кислоты и 100 нмоль/л дексаметазона, при сокультивировании, а также по цитотоксическим свойствам in vitro (пример 2), а также биосовместимость остеоиндуктивные и остеокондуктивные свойства in vivo (пример 3).
Пример 2. Оценка цитотоксичности 3D-скаффолдов и их влияния на адгезивные и ростовые свойства клеток in vitro
Произведенные 3D-скаффолды были протестированы in vitro путем сокультивирования с мезенхимальными стволовыми клетками, преддифференцированных в остеогенном направлении. Культура предшественников остеобластов была получена путем добавления в питательную среду индуктора, содержащего 10 ммоль/л глицерин-2-фосфата, 50 мкг/мл L-аскорбиновой кислоты и 100 нмоль/л дексаметазона. Обработка индуктором проводилась в течение 7 суток.
Оценка цитотоксичности была проведена на двух типах 3D-скаффолдов (кортикального и губчатого). Сокультивирование мезенхимальных стволовых клеток, преддифференцированных в остеогенном направлении, с образцами проводилось в течение 7 суток. По истечении 7 суток культивирования производили окрашивание смесью двух красителей FDA (зеленый цвет) - окрашивает живые клетки, PI (красный цвет) - указывает на мертвые клетки (рис. 2). Было показано отсутствие цитотоксического эффекта на остеогенные стволовые клетки, что указывает, с одной стороны, на безопасность данных медицинских изделий, а с другой - на возможность совместного применения разработанных 3D-скаффолдов с данными клетками.
Оценку влияния 3D-скаффолдов на адгезивность и пролиферацию мезенхимальных стволовых клеток, преддифференцированных в остеогенном направлении, проводили путем сокультивирования описанных объектов в течение 7 суток. Опытная культура проявляла статистически значимо более высокий уровень адгезии по сравнению с контрольной в течение всего периода наблюдения (рис. 3а). Также применение 3D-скаффолдов повышало пролиферацию остеогенных стволовых клеток (рис. 3б). Начиная с 3х суток наблюдения, усиление деления клеток было значимо, а к 7 м суткам еще и значительным.
Таким образом, исследование in vitro показало отсутствие цитотоксического действия 3D-скаффолдов на преддифференцированные в остеогенном направлении мезенхимальные стволовые клетки. Более того, напротив, наблюдалось улучшение адгезивных и ростовых свойств указанной культуры.
Пример 3. Оценка биосовместимости, остеоиндуктивных и остеокондуктивных свойств 3D-скаффолдов in vivo
Оценка биосовместимости, остеоиндуктивных и остеокондуктивных свойств 3D-скаффолдов in vivo проводилась на модели стандартного дырчатого дефекта. После моделирования патологии в место дефекта костной ткани вносили ксеногенные 3D-скаффолды в сочетании с аллогенными мезенхимальными стволовыми клетками костномозгового происхождения.
Выведение животных из эксперимента и гистологическое исследование образцов проводили на 3и, 7е, 30е и 60е сутки после моделирования патологии и введения 3D-скаффолдов. Аксиальные гистологические срезы коленных суставов изготавливали насанном микротоме, окрашивали гематоксилином Вейгерта и эозином, пикрофуксином по Ван-Гизону и анализировали под микроскопом на увеличении ×100.
Как показало гистологическое исследование, на 3и сутки 3D-скаффолд сохраняет форму и располагается «без смещения», на 7е сутки 3D-скаффолд плотно окружен тканями реципиента, начинается интеграция, спустя 30 суток наблюдается полная интеграция 3D-скаффолда с тканями реципиента, а через 60 суток остеогенная ткань крысы-реципиента активно прорастает в костный 3D-скаффолд - происходит процесс ремоделирования (перестройки 3D-скаффолда в собственную кость реципиента).
Таким образом, была доказана биосовместимость 3D-скаффолдов, а также их высокие остеоиндуктивные и остеокондуктивные свойства.

Изобретение может быть использовано в лечении костных дефектов, вызванных различными причинами, связанными с утратой объема костного материала. Способ получения 3D-скаффолдов включает промывку аллогенного или ксеногенного костного материала, придание необходимых размеров и формы, последовательную обработку костного материала: 6% раствором перекиси водорода в соотношении от 1:3 до 1:5 в течение 36-72 ч при комнатной температуре; смесью хлороформа и диэтилового эфира в соотношении 1:1 в течение 24-48 ч; гипотенизацию 0,075 М раствором хлорида калия в соотношении 1:1 в течение 24-48 ч; промывку водой очищенной; обработку при температуре 2-4°С 0,3 М раствором соляной кислоты в течение 4-6 ч с последующей ее нейтрализацией и обработкой 2-3 ч 0,05% раствором трипсина. При обработке материала производят замену раствора на свежий каждые 12 ч. Затем обработанный материал подвергают замораживанию в жидком азоте с 1-3% ДМСО не менее чем на 2 суток с последующим размораживанием и выдерживанием по 12 ч в 2-3 М растворе гидрофосфата натрия и фосфатно-солевом буферном растворе. После этого осуществляют лиофилизацию, упаковку и стерилизацию. Затем осуществляют добавление в асептических условиях кондиционной среды от культивирования алло- или ксеногенных мезенхимальных стволовых клеток не менее 3-го пассажа, преддифференцированных в остеогенном направлении с помощью приемлемого индуктора, в соотношении 1:1, повторную лиофилизацию в асептических условиях. Также проводят контроль влияния 3D-скаффолдов каждой партии на адгезию и пролиферацию мезенхимальных стволовых клеток при сокультивировании и оценку цитотоксических свойств in vitro. Способ обеспечивает получение 3D-скаффолдов, способных к остеоиндукции и остеокондукции, обладающих высокой биосовместимостью. 1 н. и 3 з.п. ф-лы, 4 ил., 3 пр.
1. Способ получения 3D-скаффолдов, включающий промывку аллогенного или ксеногенного костного материала, придание необходимых размеров и формы микроблоков размером до 8 мм, костной крошки, или костной муки, либо макроблоков, тонких уплощенных кусков, слайсов, или пластин кортикальной костной ткани; обработку: при комнатной температуре - 6% раствором перекиси водорода в соотношении от 1:3 до 1:5 в течение 36-72 ч; смесью хлороформа и диэтилового эфира в соотношении 1:1 в течение 24-48 ч; гипотенизацию 0,075 М раствором хлорида калия в соотношении 1:1 в течение 24-48 ч; промывку водой очищенной; обработку при температуре 2-4°С - 0,3 М раствором соляной кислоты в течение 4-6 ч с последующей ее нейтрализацией и обработкой 2-3 ч 0,05% раствором трипсина; при обработке материала производят замену раствора на свежий каждые 12 ч; замораживание в жидком азоте с 1-3% ДМСО не менее чем на 2 суток с последующим размораживанием и выдерживанием по 12 ч в 2-3 М растворе гидрофосфата натрия и фосфатно-солевом буферном растворе; лиофилизацию, упаковку и стерилизацию; добавление в асептических условиях кондиционной среды от культивирования алло- или ксеногенных мезенхимальных стволовых клеток не менее 3-го пассажа, преддифференцированных в остеогенном направлении с помощью приемлемого индуктора, в соотношении 1:1, повторную лиофилизацию в асептических условиях; контроль влияния 3D-скаффолдов каждой партии на адгезию и пролиферацию мезенхимальных стволовых клеток при сокультивировании, а также оценку цитотоксических свойств in vitro.
2. Способ по п. 1, отличающийся тем, что добавление в асептических условиях кондиционной среды от культивирования алло- или ксеногенных мезенхимальных стволовых клеток не менее 3-го пассажа, преддифференцированных в остеогенном направлении с помощью приемлемого индуктора, в соотношении 1:1 при получении макроблоков включает замачивание полупродукта в указанной кондиционной среде с постоянным перемешиванием в течение 24 ч при температуре 2-4°С.
3. Способ по п. 1 или 2, отличающийся тем, что стерилизацию проводят радиационным методом.
4. Способ по п. 1 или 2, отличающийся тем, что контроль влияния 3D-скаффолдов каждой партии на адгезию и пролиферацию проводят на мезенхимальных стволовых клетках, преддифференцированных в остеогенном направлении с помощью приемлемого индуктора.
| БИОРЕЗОРБИРУЕМЫЙ БИОЛОГИЧЕСКИЙ МАТРИКС ДЛЯ ЗАМЕЩЕНИЯ ДЕФЕКТОВ КОСТНОЙ ТКАНИ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2017 |
|
RU2665962C1 |
| Способ получения биологически активных имплантатов | 2016 |
|
RU2619870C1 |
| СПОСОБ ПОЛУЧЕНИЯ И КОНСЕРВАЦИИ МИНЕРАЛИЗОВАННОГО КОСТНОГО МАТРИКСА | 2012 |
|
RU2495567C1 |
| СПОСОБ ИЗГОТОВЛЕНИЯ ИМПЛАНТАТОВ ИЗ ГУБЧАТОЙ КОСТНОЙ ТКАНИ | 2000 |
|
RU2172104C1 |
| СПОСОБ ПОЛУЧЕНИЯ МИНЕРАЛИЗОВАННЫХ КОМПОЗИТНЫХ МИКРОСКАФФОЛДОВ ДЛЯ РЕГЕНЕРАЦИИ КОСТНОЙ ТКАНИ | 2016 |
|
RU2660558C2 |
| СПОСОБ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ ВЫСОКООЧИЩЕННОГО МИНЕРАЛЬНОГО МАТРИКСА В ВИДЕ СЕГМЕНТОВ И ГРАНУЛ С ОСТЕОИНДУКТИВНЫМИ СВОЙСТВАМИ ДЛЯ ЗАМЕЩЕНИЯ КОСТНЫХ ДЕФЕКТОВ | 2018 |
|
RU2693606C1 |
| KR 20230028901 A, 03.03.2023 | |||
| CN 1903382 A, 31.01.2007 | |||
| CN 105617462 A, 01.06.2016. | |||
Авторы
Даты
2025-06-05—Публикация
2024-07-17—Подача