Область техники, к которой относится изобретение
Изобретение относится к биотехнологии и может найти применение в области биомедицинских исследований и разработок для поиска новых подходов к лечению социально значимых заболеваний. Изобретение позволяет получить трехмерные клеточные конструкты (сфероиды), в которых воспроизведены качественный состав и взаимное расположение основных клеточных компонентов (эпителиальных, стромальных и иммунных клеток) высоко- и умеренно дифференцированного плоскоклеточного рака кожи или органов головы и шеи человека из нескольких клеточных культур или линий.
Уровень техники
По данным Международного агентства по изучению рака (МАИР) Всемирной организации здравоохранения (International Agency for Research on Cancer, World Health Organization) в 2020 году в мире было выявлено более 19 млн новых случаев онкологических заболеваний и зарегистрировано почти 10 млн смертельных исходов. При сохранении имеющихся тенденций в 2040 году количество новых диагностированных случаев онкозаболеваний возрастет до 30,4 млн, а число умерших от них людей превысит 16 млн в год [1].
Несмотря на значительную поддержку, которую оказывает МАИР в области развития новых научных стратегий борьбы против онкологических заболеваний, лишь незначительная часть разрабатываемых методов доказывает свою безопасность и эффективность по результатам клинических испытаний [2]. Очевидно, что одним из необходимых условий для поиска более эффективных терапевтических подходов является использование релевантной, доступной и легко воспроизводимой доклинической модели.
На сегодняшний день самой распространенной in vitro моделью опухолевой ткани являются адгезивные или суспензионные клеточные линии, которые в силу своей относительно невысокой ресурсозатратности широко используются на первичных этапах исследования терапевтических агентов с потенциальной противоопухолевой активностью. Например, Национальный институт онкологии США использует для скрининга таких агентов коллекцию из 60 клеточных линий опухолей человека, а Национальный онкологический центр Японии – коллекцию из 39 клеточных линий [3, 4]. В то же время стандартизованные опухолевые клеточные линии не в полной мере отражают всю сложность организации опухолевой ткани человека, т.к. не способны воспроизвести ее клеточную гетерогенность и особенности архитектоники [5], при этом именно взаимодействие различных типов клеток, составляющих микроокружение опухоли, во многом определяет прогрессирование заболевания и, соответственно, эффективность терапевтического воздействия [6].
Второе место по распространенности среди онкологических заболеваний человека занимает плоскоклеточная карцинома (плоскоклеточный рак), к которым относятся новообразования слизистых оболочек органов головы и шеи, а также кожи, в большинстве случаев, также локализованных в области головы и шеи [7]. Согласно гистологической модели прогрессирования заболевания плоскоклеточная карцинома развивается из эпителия слизистой оболочки или эпидермиса, проходя стадии гиперплазии, дисплазии, карциномы in situ и, наконец, инвазивной карциномы. Особенности прогрессирования опухолей данных органов обычно приводят к поздней диагностике, когда заболевание выявляют уже на стадии инвазивной карциномы [8].
К настоящему времени известно несколько аналогов изобретения, представляющих собой способы получения клеточных моделей плоскоклеточного рака кожи, органов головы и шеи, пищевода или иных органов человека.
Для in vitro исследования плоскоклеточной карциномы человека известны охарактеризованные панели клеточных линий: например, панель для моделирования опухолей органов головы и шеи, рекомендуемая биобанком ATCC (American Type Culture Collection), включает в себя линию карциномы слюнных желез A-253, линии карциномы языка SCC-15, SCC-25 и SCC-9, линию карциномы гортаноглотки FaDu и линию карциномы глотки Detroit 562. Всего же в биобанках по всему миру хранятся десятки клеточных линий, полученных из новообразований органов головы и шеи человека [9].
При переводе подобных линий из 2D в 3D культуру получают многоклеточные сфероиды, напоминающие аваскулированные опухолевые узлы или микрометастазы, которые за счет изменения взаимодействий «клетка-клетка» и «клетка-внеклеточный матрикс» ближе к исходной опухолевой ткани и позволяют получить новую информацию при тестировании лекарств с противоопухолевой активностью [10, 11]. В то же время такие сфероиды не могут быть использованы, например, в радиобиологии для оценки ширины «терапевтического окна», определяемого формой и относительным положением кривых доза-эффект на дозовой шкале для контроля над опухолевыми клетками и повреждением нормальной ткани перитуморальной области, т.к. состоят только из опухолевых клеток и не содержат стромальные и иммунные клетки пациента [12]. При этом лучевая терапия (в том числе в комбинации с хирургическим лечением или химиотерапией) применяется для лечения подавляющего большинства больных плоскоклеточным раком кожи или органов головы и шеи [13, 14].
Известно аналогичное по назначению изобретение, представляющее собой способ получения ортотопической модели плоскоклеточного рака пищевода человека для исследования лучевой терапии в эксперименте (патент RU 2 760 084 C1, дата публикации 22.11.2021), который предполагает ксенотрансплантацию фрагмента опухолевой ткани иммунодефицитным мышам линии Balb/c Nude и позволяет сохранить исходную архитектонику опухолевой ткани. Известно похожее изобретение, предполагающее ксенотрансплантацию фрагмента опухоли пищевода человека иммунодефицитным животным: (патент RU 2 738 308 C1, дата публикации 11.12.2020). Основным недостатком данной группы изобретений является необходимость использования ксенографтной трансплантации, которая сложна и дорога в исполнении, обладает низкой воспроизводимостью и исключает возможность исследования вклада иммунного компонента [15].
Известен способ применения первичной клеточной культуры, выделенной из плоскоклеточной карциномы полости рта человека, для оценки цитотоксического действия коллоидного раствора наночастиц серебра в сочетании с СВЧ-облучением (патент RU 2 468 447 C1, дата публикации 27.11.2012). Данный способ позволяет сохранить исходную гетерогенность клеточных субпопуляций опухолевой ткани, однако в значительной степени искажает архитектонику ткани за счет 2D культивирования.
Известен способ получения сфероидов при сокультивировании клеточной линии карциномы гортаноглотки человека FaDu и линии фибробластов MeWo, выделенных из меланомы кожи человека, которые были использованы для оценки эффективности фотоактивных противоопухолевых лекарств [16]. Достоинством этой модели является возможность изучения взаимодействия стромального и опухолевого клеточных компонентов. Однако существенными недостатками данного способа являются несоблюдение особенностей 3D локализации различных типов клеток, а также полное отсутствие иммунного компонента, что не позволяет считать данный гетерогенный сфероид релевантной моделью плоскоклеточной карциномы гортаноглотки.
Таким образом, сформировалась потребность в создании более релевантной трехмерной in vitro модели плоскоклеточной карциномы, которая по составу и архитектонике клеточных компонентов (эпителиальных опухолевых клеток, клеток стромы и иммунной системы) была бы более приближена к исходной опухолевой ткани, но при этом сохраняла доступность и простоту исполнения.
Раскрытие изобретения
Технической проблемой является отсутствие способа получения in vitro модели высоко- или умеренно дифференцированных плоскоклеточных карцином в виде трехмерных клеточных конструктов (сфероидов), в которых была бы воспроизведена архитектоника опухолевой ткани: качественный состав и взаимное расположение основных клеточных компонентов, а именно эпителиальных, стромальных и иммунных клеток.
Техническим результатом, на достижение которого направлено заявленное изобретение, является возможность получения более релевантной in vitro модели высоко- и умеренно дифференцированного плоскоклеточного рака кожи или органов головы и шеи человека, в которой воспроизведена архитектоника опухолевой ткани путем создания многокомпонентных клеточных конструктов, имеющих следующее строение: в центре сфероида расположены эпителиальные опухолевые клетки, которые окружены стромальными клетками, а иммунные клетки инфильтрируют весь сфероид.
Для достижения указанного технического результата в способе получения многокомпонентных сфероидов для in vitro моделирования высоко- и умеренно дифференцированного плоскоклеточного рака кожи или органов головы и шеи человека эпителиальные опухолевые клетки, в качестве которых могут быть использованы иммортализованные линии человека или клеточные культуры, выделенные из опухолевой ткани пациентов с диагностированной плоскоклеточной карциномой, стромальные клетки, в качестве которых могут быть использованы иммортализованные линии человека или клеточные культуры, выделенные из стромы слизистой оболочки органов головы и шеи или дермы, иммунные клетки, в качестве которых могут быть использованы иммортализованные линии человека или культуры мононуклеарных клеток, выделенные из периферической крови пациентов, наращивают в ростовой среде DMEM/F12, содержащей 10% эмбриональной телячьей сыворотки и необязательно дополненной факторами роста FGF2 до 5 нг/мл и EGF до 50 нг/мл, после чего клеточные культуры открепляют от подложки, осаждают центрифугированием при 200g, ресуспендируют в ростовой среде, определяют их концентрацию и жизнеспособность с помощью клеточного анализатора и разводят до конечной концентрации 100 тысяч живых клеток в 1 мл среды, после чего суспензии эпителиальных и иммунных клеток соединяют в пропорции 9:1 и переносят из расчета суммарно 100 тысяч живых клеток в 1 мл среды в культуральную посуду с ультранизким адгезивным покрытием, которую помещают в СО2-инкубатор, обеспечивающий стандартные культуральные условия 37°С, 5% СО2 и насыщенную влажность, затем через 48 часов после начала культивирования удаляют одиночные клетки, не вошедшие в состав образовавшихся сфероидов, без использования центрифугирования, для чего суспензию переносят в коническую центрифужную пробирку, ожидают осаждения сфероидов под действием силы тяжести и отбирают надосадочную среду, содержащую одиночные клетки, после чего соединяют суспензии стромальных и иммунных клеток человека в соотношении 9:1 и вносят в культуральную посуду с ультранизким адгезивным покрытием, в которой находятся уже сформированные из эпителиальных опухолевых и иммунных клеток сфероиды, из расчета суммарно 100 тысяч живых клеток в 1 мл среды, и продолжают культивирование, а еще через 48 часов удаляют одиночные клетки, не вошедшие в состав образовавшихся многокомпонентных сфероидов, без использования центрифугирования, для чего суспензию переносят в коническую центрифужную пробирку, ожидают осаждения сфероидов под действием силы тяжести и отбирают надосадочную среду, содержащую одиночные клетки.
Краткое описание чертежей
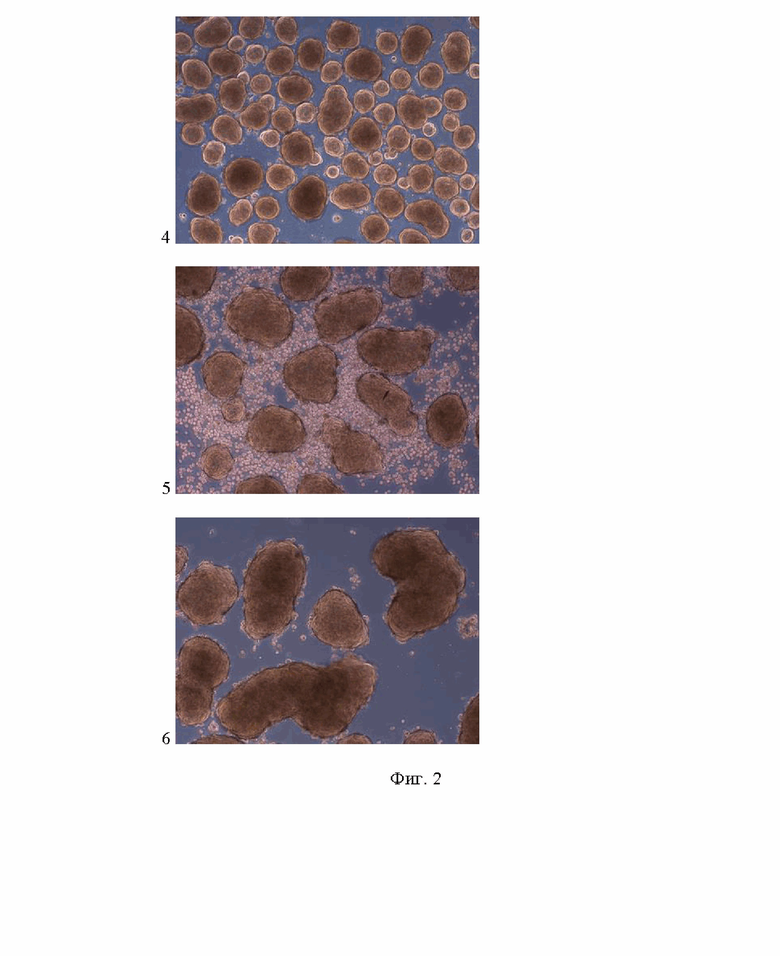
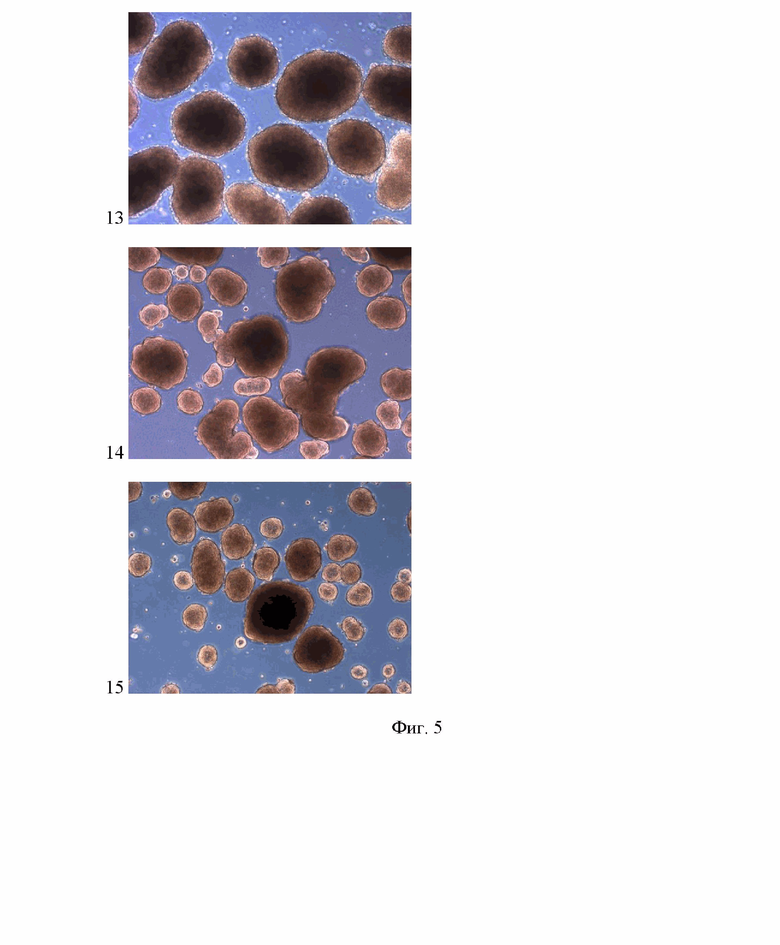
Изобретение поясняется фотографиями, где на фиг.1 представлен внешний вид используемых для получения многокомпонентных сфероидов клеточных культур и линий, на фиг. 2 пошагово представлены этапы формирования многокомпонентных сфероидов, на фиг. 3 представлена характерная для моделируемой опухолевой ткани гистологическая картина распределения основных клеточных типов (эпителиальных опухолевых клеток, стромальных и иммунных клеток), на фиг. 4 продемонстрировано соответствие строения полученного многокомпонентного сфероида и моделируемой опухолевой ткани, на фиг. 5 продемонстрированы многокомпонентные сфероиды, полученные на основе различных комбинаций эпителиальных, стромальных и иммунных клеток. Позициями на фигурах обозначены: 1 – внешний вид эпителиальных опухолевых клеток (клеточная линия карциномы человека А431) при оптическом увеличении ×50; 2 – внешний вид стромальных клеток (клеточная культура дермальных фибробластов человека) при оптическом увеличении ×50; 3 – внешний вид иммунных клеток (клеточная линия моноцитов ТНР-1) при оптическом увеличении ×50; 4 – внешний вид сфероидов из эпителиальных опухолевых клеток и иммунных клеток через 48 ч после начала культивирования при оптическом увеличении ×50; 5 – внешний вид сфероидов после добавления к ним суспензии стромальных и иммунных клеток через 48 ч после внесения в культуральную посуду при оптическом увеличении ×50; 6 – внешний вид многокомпонентных сфероидов после удаления одиночных клеток, не вошедших в состав 3D конструктов при оптическом увеличении ×50; 7 – микрофотография окрашенного гематоксилином и эозином криосреза опухолевой ткани, полученная при совмещении светлопольной и фазово-контрастной микроскопии при увеличении ×200; 8 – микрофотография окрашенного с антителами к маркеру эпителиальных опухолевых клеток цитокератину 17 криосреза опухолевой ткани, полученная при совмещении флуоресцентной и фазово-контрастной микроскопии при увеличении ×200; 9 – микрофотография окрашенного с антителами к маркеру стромальных клеток виментину криосреза опухолевой ткани, полученная при совмещении флуоресцентной и фазово-контрастной микроскопии при увеличении ×200; 10 – микрофотография окрашенного с антителами к маркеру макрофагов CD68 криосреза опухолевой ткани, полученная при совмещении флуоресцентной и фазово-контрастной микроскопии при увеличении ×200; 11 – микрофотографии криосреза сфероида, полученные с помощью темнопольной или флуоресцентной микроскопии при увеличении ×100, на которой зеленым цветом обозначена локализация эпителиальных опухолевых клеток, меченных витальным трейсером РКН67, красным цветом обозначена локализация стромальных клеток, меченных витальным трейсером РКН26, синим цветом обозначена локализация иммунных клеток, меченных красителем Hoechst 33258; 12 – микрофотография криосреза сфероида, полученная с помощью совмещения темнопольной и флуоресцентной микроскопии при увеличении ×100, на которой зеленым цветом обозначена локализация эпителиальных опухолевых клеток, красным цветом обозначена локализация стромальных клеток, синим цветом обозначена локализация иммунных клеток; 13 – многокомпонентные сфероиды, полученные из клеток линии карциномы А431, клеток линии фибробластов BJ-5ta и клеток линии моноцитов ТНР-1, при оптическом увеличении ×50; 14 – многокомпонентные сфероиды, полученные из клеток линии карциномы А431, культуры клеток фибробластов дермы и клеток линии моноцитов ТНР-1, при оптическом увеличении ×50; 15 – многокомпонентные сфероиды, полученные из клеток линии карциномы А431, культуры клеток фибробластов дермы и мононуклеарных клеток периферической крови, при оптическом увеличении ×50; 16 – многокомпонентные сфероиды, полученные из культуры выделенных из плоскоклеточной карциномы эпителиальных клеток, клеток линии фибробластов BJ-5ta и клеток линии моноцитов ТНР-1, при оптическом увеличении ×50; 17 – многокомпонентные сфероиды, полученные из культуры выделенных из плоскоклеточной карциномы эпителиальных клеток, культуры клеток фибробластов дермы и клеток линии моноцитов ТНР-1, при оптическом увеличении ×50; 18 – многокомпонентные сфероиды, полученные из культуры выделенных из плоскоклеточной карциномы эпителиальных клеток, культуры клеток фибробластов дермы и мононуклеарных клеток периферической крови, при оптическом увеличении ×50
Осуществление изобретения
В процессе проведения исследований была установлена значимость следующих принципиальных моментов на различных этапах реализации изобретения:
• в качестве эпителиальных опухолевых клеток могут быть использованы иммортализованные линии человека (например, линия карциномы кожи А431) или клеточные культуры, выделенные из опухолевой ткани пациентов с диагностированной плоскоклеточной карциномой;
• в качестве стромальных клеток могут быть использованы иммортализованные линии человека (например, линия фибробластов человека BJ-5ta) или культуры, выделенные из стромы слизистой оболочки органов головы и шеи или дермы;
• в качестве иммунных клеток могут быть использованы иммортализованные линии человека (например, линия моноцитов ТНР-1) или культуры мононуклеарных клеток, выделенные из периферической крови;
• в процессе экспансии всех трех типов клеток (эпителиальных, стромальных, иммунных) используют один состав культуральной среды, который впоследствии будет применен для культивирования полученных из этих культур многокомпонентных сфероидов, чтобы предотвратить негативные последствия, которые могут возникнуть для любого из компонентов вследствие одномоментной смены состава ростовой среды;
• в качестве культуральной используют среду DMEM/F12, содержащую 10% эмбриональной телячьей сыворотки (ЭТС), необязательно дополненную факторами роста FGF2 до 5 нг/мл и EGF до 50 нг/мл;
• для осаждения клеток используют щадящий режим центрифугирования (200g) для предотвращения повреждения клеточных мембран;
• для формирования сфероидов суспензию клеток переносят в культуральный пластик с ультранизким адгезивным покрытием из расчета суммарно 100 тысяч живых клеток в 1 мл среды, т.к. меньшая концентрация приводит к низкой эффективности образования сфероидов, а при более высокой концентрации происходит слияние отдельных сфероидов в конгломераты неправильной формы;
• для формирования сфероидов не используют одновременное соединение всех типов клеточных компонентов, поскольку это приводит к случайному распределению клеток в составе 3D конструкта;
• на первом этапе формирования сфероидов в условиях 3D культивирования с использованием культурального пластика с ультранизким адгезивным покрытием соединяют эпителиальные и иммунные клетки в соотношении 9:1;
• после формирования 3D конструктов не вошедшие в них одиночные клетки удаляют без использования центрифугирования, для чего суспензию переносят в коническую центрифужную пробирку, ожидают осаждения сфероидов под действием силы тяжести и отбирают надосадочную среду, содержащую одиночные клетки;
• на втором этапе формирования сфероидов в условиях 3D культивирования с использованием культурального пластика с ультранизким адгезивным покрытием соединяют полученные на первом этапе сфероиды, состоящие из эпителиальных и иммунных клеток, и суспензию стромальных и иммунных клеток в соотношении 9:1;
• после формирования 3D конструктов не вошедшие в них одиночные клетки удаляют без использования центрифугирования описанным выше способом;
Соблюдение всех указанных особенностей процесса позволяет получить технический результат, а именно создать многокомпонентные сфероиды с четкой локализацией клеточных компонентов: в центре расположены эпителиальные опухолевые клетки, которые окружены стромальными клетками, а иммунные клетки инфильтрируют весь сфероид.
Примеры реализации изобретения
Возможность объективного достижения технического результата подтверждена данными, приведенными в примере, представляющем собой протокол получения многокомпонентных трехмерных клеточных конструктов (сфероидов) (пример 1), в примере, содержащем сведения экспериментального характера, касающиеся характеристики сфероидов, полученных с использованием представленного в примере 1 протокола (пример 2), а также в примере, содержащем сведения экспериментального характера, касающиеся эффективности получения многокомпонентных сфероидов при использовании различных комбинаций клеточных культур и клеточных линий (пример 3).
Пример 1. Протокол получения многокомпонентных трехмерных клеточных конструктов (сфероидов)
1. Экспансия эпителиальных опухолевых клеток
Для культивирования эпителиальных опухолевых клеток используют среду DMEM/F12, дополненную 10% эмбриональной телячьей сывороткой (далее – среда). После достижения 80% конфлуентности монослоя клетки открепляют от подложки 0,25% раствором трипсина-ЭДТА. После осаждения при 200g клетки ресуспендируют в среде, определяют их концентрацию и жизнеспособность с помощью клеточного анализатора и разводят до конечной концентрации 100 тысяч живых клеток в 1 мл среды.
2. Экспансия иммунных клеток
Для культивирования иммунных клеток используют ростовую среду, описанную в п.1. В случае использования адгезивных культур после достижения 80% конфлуентности монослоя клетки открепляют от подложки 0,25% раствором трипсина-ЭДТА. В случае использования суспензионных культур клетки собирают из культуральной посуды. После осаждения при 200g клетки ресуспендируют в среде, определяют их концентрацию и жизнеспособность с помощью клеточного анализатора и разводят до конечной концентрации 100 тысяч живых клеток в 1 мл среды.
3. Первый этап сборки многокомпонентных сфероидов
Суспензии эпителиальных опухолевых клеток и иммунных клеток соединяют в соотношении 9:1 и переносят в культуральную посуду с ультранизким адгезивным покрытием из расчета 100 тысяч живых клеток в 1 мл среды. Культуральную посуду помещают в СО2-инкубатор (стандартные условия 37°С, 5% СО2, насыщенная влажность). Динамику формирования сфероидов оценивают с помощью инвертированного микроскопа. Через 48 часов после начала культивирования удаляют одиночные клетки, не вошедшие в состав образовавшихся сфероидов. Для этого суспензию клеток и сфероидов переносят в коническую центрифужную пробирку, ожидают осаждения сфероидов под действием силы тяжести и отбирают надосадочную среду, содержащую одиночные клетки.
4. Экспансия стромальных клеток
Для экспансии культуры стромальных клеток человека используют ростовую среду, описанную в п.1. После достижения клетками 80% конфлуентности монослоя клетки открепляют от подложки 0,25% раствором трипсина-ЭДТА. После осаждения при 200g клетки ресуспендируют в среде, определяют их концентрацию и жизнеспособность с помощью клеточного анализатора и разводят до конечной концентрации 100 тысяч живых клеток в 1 мл среды.
5. Второй этап сборки многокомпонентных сфероидов
Суспензии стромальных клеток и иммунных клеток соединяют в соотношении 9:1 и переносят в культуральную посуду с ультранизким адгезивным покрытием, в которой находятся сфероиды, полученные по п.3, из расчета 100 тысяч живых клеток в 1 мл среды. Культуральную посуду помещают в СО2-инкубатор (стандартные условия 37°С, 5% СО2, насыщенная влажность). Динамику формирования сфероидов оценивают с помощью инвертированного микроскопа. Через 48 часов после начала культивирования удаляют одиночные клетки, не вошедшие в состав образовавшихся сфероидов. Для этого суспензию клеток и сфероидов переносят в коническую центрифужную пробирку, ожидают осаждения сфероидов под действием силы тяжести и отбирают надосадочную среду, содержащую одиночные клетки.
Пример 2. Характеристика сфероидов, полученных с использованием представленного в примере 1 Протокола получения многокомпонентных трехмерных клеточных конструктов (сфероидов)
При использовании протокола, представленного в примере 1, были успешно получены многокомпонентные сфероиды, воспроизводящие архитектонику опухолевой ткани при высоко- и умеренно дифференцированной плоскоклеточной карциноме кожи или органов головы и шеи человека.
Клеточные культуры и линии, использованные для получения многокомпонентных сфероидов, представлены на фиг.1
Динамика формирования многокомпонентных сфероидов представлена на фиг. 2.
В качестве примера верификации сфероидов приведены гистологические характеристики биоптата опухолевой ткани от донора с плоскоклеточным раком органов головы и шеи и многокомпонентных сфероидов, строение которых воспроизводит данный тип опухоли. При исследовании ткани была выявлена характерная для плоскоклеточного рака (плоскоклеточной карциномы) гистологическая картина: обильный инвазивный рост эпителия, представленного крупными цитокератин 17+ клетками с эозинофильной цитоплазмой, формирующего скопления и окруженного рыхлой волокнистой соединительной тканью стромы, визуализируемой по экспрессии виментина, при этом ткань инфильтрируют иммунные CD68+ клетки (фиг. 3).
Многокомпонентные сфероиды, полученные по протоколу из примера 1, имеют сходное строение: скопление эпителиальных опухолевых клеток, окруженных стромальными клетками, при этом иммунные клетки инфильтрируют весь сфероид (фиг. 4).
Таким образом, экспериментальные данные подтверждают соответствие основных свойств (клеточный состав, архитектоника ткани) высоко- и умеренно дифференцированного плоскоклеточного рака кожи или органов головы и шеи человека и полученной in vitro трехмерной клеточной модели, что свидетельствуют о ее высокой релевантности.
Пример 3. Получение сфероидов при использовании различных комбинаций клеточных культур и клеточных линий в соответствии с представленным в примере 1 Протоколом получения многокомпонентных трехмерных клеточных конструктов (сфероидов)
При использовании протокола, представленного в примере 1, были успешно получены многокомпонентные сфероиды на основе различных комбинаций эпителиальных, стромальных и иммунных клеток.
При использовании клеток линии карциномы А431 в качестве эпителиальных клеток, клеток линии фибробластов BJ-5ta в качестве стромальных клеток и клеток линии моноцитов ТНР-1 в качестве иммунных клеток, культивируемых в среде DMEM/F12 с добавлением ЭТС до 10%, многокомпонентные сфероиды были успешно получены (фиг. 5, позиция 13).
При использовании клеток линии карциномы А431 в качестве эпителиальных клеток, культуры клеток фибробластов дермы в качестве стромальных клеток и клеток линии моноцитов ТНР-1 в качестве иммунных клеток, культивируемых в среде DMEM/F12 с добавлением ЭТС до 10%, многокомпонентные сфероиды были успешно получены (фиг. 5, позиция 14).
При использовании клеток линии карциномы А431 в качестве эпителиальных клеток, культуры клеток фибробластов дермы в качестве стромальных клеток и мононуклеарных клеток периферической крови в качестве иммунных клеток, культивируемых в среде DMEM/F12 с добавлением ЭТС до 10%, многокомпонентные сфероиды были успешно получены (фиг. 5, позиция 15).
При использовании культуры эпителиальных клеток, выделенных из плоскоклеточной карциномы, в качестве эпителиальных клеток, клеток линии фибробластов BJ-5ta в качестве стромальных клеток и клеток линии моноцитов ТНР-1 в качестве иммунных клеток, культивируемых в среде DMEM/F12 с добавлением ЭТС до 10%, FGF2 до 5 нг/мл и EGF до 50 нг/мл, многокомпонентные сфероиды были успешно получены (фиг. 5, позиция 16).
При использовании культуры эпителиальных клеток, выделенных из плоскоклеточной карциномы, в качестве эпителиальных клеток, культуры клеток фибробластов дермы в качестве стромальных клеток и клеток линии моноцитов ТНР-1 в качестве иммунных клеток, культивируемых в среде DMEM/F12 с добавлением ЭТС до 10%, FGF2 до 5 нг/мл и EGF до 50 нг/мл, многокомпонентные сфероиды были успешно получены (фиг. 5, позиция 17).
При использовании культуры эпителиальных клеток, выделенных из плоскоклеточной карциномы, в качестве эпителиальных клеток, культуры клеток фибробластов дермы в качестве стромальных клеток и мононуклеарных клеток периферической крови в качестве иммунных клеток, культивируемых в среде DMEM/F12 с добавлением ЭТС до 10%, FGF2 до 5 нг/мл и EGF до 50 нг/мл, многокомпонентные сфероиды были успешно получены (фиг. 5, позиция18).
Список литературы
1. https://www.iarc.who.int/
2. Fogel DB. Factors associated with clinical trials that fail and opportunities for improving the likelihood of success: A review. Contemp. Clin. Trials Commun. 2018, 11:156–164.
3. Niu N, Wang L. In vitro human cell line models to predict clinical response to anticancer drugs. Pharmacogenomics. 2015;16(3):273–85.
4. Kong D, Yamori T. JFCR39, a panel of 39 human cancer cell lines, and its application in the discovery and development of anticancer drugs. Bioorg Med Chem. 2012;20(6):1947–51.
5. Gillet JP, Varma S, Gottesman MM. The Clinical Relevance of Cancer Cell Lines. J. Natl. Cancer Inst. 2013, 105:452–458.
6. Hinshaw DC, Shevde LA. The tumor microenvironment innately modulates cancer progression. Cancer Res. 2019, 79:4557–4566.
7. Caruntu A, Moraru L, Lupu M, Ciubotaru DA, Dumitrescu M, Eftimie L, Hertzog R, Zurac S, Caruntu C, Voinea OC. Assessment of Histological Features in Squamous Cell Carcinoma Involving Head and Neck Skin and Mucosa. J Clin Med. 2021;10(11):2343.
8. Johnson DE, Burtness B, Leemans CR, Lui V, Bauman J, Grandis J. Head and neck squamous cell carcinoma. Nat Rev Dis Primers. 2020, 6:92.
9. Chaves P, Garrido M, Oliver J, Pérez-Ruiz E, Barragán I, Rueda-Domínguez A. Preclinical models in Head and Neck Squamous Cell Carcinoma. Preprints 2022, 2022030391. doi: 10.20944/preprints202203.0391.v1.
10. Kochanek SJ, Close DA, Camarco DP, Johnston PA. Maximizing the Value of Cancer Drug Screening in Multicellular Tumor Spheroid Cultures: A Case Study in Five Head and Neck Squamous Cell Carcinoma Cell Lines. SLAS Discov. 2020;25(4):329-349.
11. Tinhofer I, Braunholz D, Klinghammer K. Preclinical models of head and neck squamous cell carcinoma for a basic understanding of cancer biology and its translation into efficient therapies. Cancers Head Neck. 2020;5:9.
12. Nagle PW, Coppes RP. Current and Future Perspectives of the Use of Organoids in Radiobiology. Cells. 2020;9(12):2649.
13. Soydemir GP, Kandaz M, Melikoğlu M. The results of radiotherapy for squamous cell carcinomas of the skin. Dermatol Ther. 2019;32(5):e13058.
14. Schick U, Huguet F, Pointreau Y, Pradier O. Radiotherapy for head and neck squamous cell carcinoma: State of the art and future directions. Cancer Radiother. 2017;21(6-7):498-504.
15. Olson B, Li Y, Lin Y, Liu ET, Patnaik A. Mouse Models for Cancer Immunotherapy Research. Cancer Discov. 2018, 8:1358–1365.
16. Yakavets I, Jenard S, Francois A, Maklygina Y, Loschenov V, Lassalle HP, Dolivet G, Bezdetnaya L. Stroma-Rich Co-Culture Multicellular Tumor Spheroids as a Tool for Photoactive Drugs Screening. J Clin Med. 2019;8(10):1686.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения тканеинженерной in vitro модели плоскоклеточного рака головы и шеи человека | 2023 |
|
RU2825474C1 |
| Способ получения органоидов из опухолевой ткани органов головы и шеи | 2021 |
|
RU2787378C1 |
| Способ увеличения пролиферативного потенциала трехмерных опухолевых клеточных культур | 2021 |
|
RU2782600C1 |
| Биокомпозитный сфероид для восстановления костей и способ его получения | 2020 |
|
RU2744732C1 |
| Способ скрининга противоопухолевых препаратов in vitro на многокомпонентной клеточной тест-системе | 2018 |
|
RU2695568C1 |
| Трансплантат - тканеинженерная надхрящница для восстановления хряща субъекта | 2023 |
|
RU2822238C1 |
| Способ получения тканеинженерной надкостницы из клеточных сфероидов для восстановления костных дефектов субъекта | 2022 |
|
RU2819284C2 |
| Способ сокультивирования трехмерных клеточных культур нижних дыхательных путей человека для получения клеточной модели для исследований in vitro | 2023 |
|
RU2814138C1 |
| Способ получения тканеинженерной надкостницы из клеточных сфероидов для восстановления костных дефектов пациентов | 2023 |
|
RU2818176C1 |
| Способ получения трансплантата - тканеинженерной надхрящницы на основе клеточных сфероидов | 2022 |
|
RU2807692C2 |





Изобретение относится к биотехнологии, в частности к способу получения многокомпонентных сфероидов, включающему в себя выделение клеток, наращивание клеточных культур, открепление от подложки, центрифугирование, ресуспендирование, определение концентрации и жизнеспособности, перенос в культуральную среду с ультранизким адгезивным покрытием, удаление одиночных клеток, не вошедших в состав сфероидов, соединение суспензии стромальных и иммунных клеток человека и их внесение в культуральную посуду с ультранизким адгезивным покрытием, в которой находятся уже сформированные из эпителиальных опухолевых и иммунных клеток сфероиды. Изобретение эффективно для получения многокомпонентных трехмерных клеточных конструктов. 5 ил., 2 пр.
Способ получения многокомпонентных сфероидов для in vitro моделирования высоко- и умеренно дифференцированного плоскоклеточного рака кожи или органов головы и шеи человека, характеризующийся тем, что эпителиальные опухолевые клетки, в качестве которых используют иммортализованные линии человека или клеточные культуры, выделенные из опухолевой ткани пациентов с диагностированной плоскоклеточной карциномой, стромальные клетки, в качестве которых используют иммортализованные линии человека или клеточные культуры, выделенные из стромы слизистой оболочки органов головы и шеи или дермы, иммунные клетки, в качестве которых используют иммортализованные линии человека или культуры мононуклеарных клеток, выделенные из периферической крови пациентов, наращивают по отдельности в ростовой среде DMEM/F12, содержащей 10% эмбриональной телячьей сыворотки и необязательно дополненной факторами роста FGF2 до 5 нг/мл и EGF до 50 нг/мл, после чего переходят к первому этапу сборки многокомпонентных сфероидов, на котором эпителиальные и иммунные клетки открепляют от подложки, осаждают центрифугированием при 200g, ресуспендируют в ростовой среде, определяют их концентрацию и жизнеспособность с помощью клеточного анализатора и разводят до конечной концентрации 100 тысяч живых клеток в 1 мл среды, после чего суспензии эпителиальных и иммунных клеток соединяют в пропорции 9:1 и переносят в культуральную посуду с ультранизким адгезивным покрытием, которую помещают в СО2-инкубатор, обеспечивающий стандартные культуральные условия 37°С, 5% СО2 и насыщенную влажность, затем через 48 ч после начала культивирования удаляют одиночные клетки, не вошедшие в состав образовавшихся сфероидов, без использования центрифугирования, для чего суспензию переносят в коническую центрифужную пробирку, ожидают осаждения сфероидов под действием силы тяжести и отбирают надосадочную среду, содержащую одиночные клетки, после чего переходят ко второму этапу сборки многокомпонентных сфероидов, на котором стромальные и иммунные клетки открепляют от подложки, осаждают центрифугированием при 200g, ресуспендируют в ростовой среде, определяют их концентрацию и жизнеспособность с помощью клеточного анализатора и разводят до конечной концентрации 100 тысяч живых клеток в 1 мл среды, после чего суспензии стромальных и иммунных клеток соединяют в пропорции 9:1 и вносят в культуральную посуду с ультранизким адгезивным покрытием, в которой находятся сфероиды из эпителиальных опухолевых и иммунных клеток, сформированные во время выполнения первого этапа сборки, из расчета суммарно 100 тысяч живых клеток в 1 мл среды, и продолжают культивирование в СО2-инкубаторе, обеспечивающем стандартные культуральные условия 37°С, 5% СО2 и насыщенную влажность, а еще через 48 ч удаляют одиночные клетки, не вошедшие в состав образовавшихся многокомпонентных сфероидов, без использования центрифугирования, для чего суспензию переносят в коническую центрифужную пробирку, ожидают осаждения сфероидов под действием силы тяжести и отбирают надосадочную среду, содержащую одиночные клетки.
| Способ получения ортотопической PDX-модели плоскоклеточного рака пищевода человека для исследования лучевой терапии в эксперименте | 2021 |
|
RU2760084C1 |
| YAKAVETS I et al., Stroma-rich co-culture multicellular tumor spheroids as a tool for photoactive drugs screening, J Clin Med., 2019, 8 (10), 1686, doi: 10.3390/jcm8101686 | |||
| БОЛОТИНА Л.В | |||
| и др., Оптимальная лечебная стратегия терапии больных с прогрессирующим плоскоклеточным раком органов головы и шеи, Исследования и | |||
Авторы
Даты
2023-06-23—Публикация
2022-11-16—Подача