Область техники
Настоящее изобретение относится к способу выявления присутствия продуцирующих карбапенемазу представителей Enterobacteriales, Pseudomonas и Acinetobacter в образце и к наборам для применения в таких способах.
Уровень техники
Карбапенемазы представляют собой группу β-лактамаз, которые являются активными в отношении различных антибиотиков, в том числе в отношении карбапенемов. Карбапенемазы относятся к трем классам бета-лактамаз, а именно к классу А по Ambler, классу В по Ambler и классу D по Ambler. Эти три класса карбапенемаз придают важным с клинической точки зрения бактериям устойчивость к карбапенемам или пониженную чувствительность к карбапенемам. Таким образом, бактерии, которые продуцируют карбапенемазу, представляют интерес с клинической точки зрения, и способы их раннего выявления требуются для того, чтобы предотвратить их распространение и снизить множественную лекарственную устойчивость и устойчивость ко всем лекарственным средствам.
Для выявления продуцирующих карбапенемазу бактерий в клинической практике широко применяют два теста: «Etest®» и другие продукты в виде текст-полосок для определения MIC (минимальная ингибирующая концентрация) и «модифицированный тест Ходжа» (Modified Hodge-Test). В тесте «Etest®» индикаторный карбапенем и карбапенем вместе с противомикробными средствами-ингибиторами фермента, действующими против исследуемого микроорганизма, обеспечены в виде противоположно направленных предварительно определенных градиентов на агаре, и их применяют для определения минимальной ингибирующей концентрации (MIC) противомикробного средства и соотношения ингибирующих концентраций. В «модифицированном тесте Ходжа» продуцирующих карбапенемазу бактерий выявляют, когда исследуемая бактерия растет в направлении содержащего карбапенем диска, образуя характерную картину роста по типу «клеверного листа» вокруг диска. Это явление может опосредоваться инактивирующими карбапенем ферментами, продуцируемыми исследуемым изолятом. Также применялись методики молекулярного выявления для генов карбапенемаз. Тем не менее, все три теста имеют свои недостатки. «Etest®» и «модифицированный тест Ходжа» не являются ни достаточно специфичными, ни достаточно чувствительными, в то время как методики молекулярного выявления являются сложными и дорогостоящими. Более того, все три способа выявления требуют очень больших временных затрат, при этом типичные сроки для определения того, содержит ли образец продуцирующие карбапенемазу бактерии, составляют вплоть до 24 часов. Это является неудовлетворительным в случае контроля инфекций, приобретенных во внутрибольничных условиях, и переноса устойчивости к лекарственным средствам.
Недавно были разработаны ацидо-колориметрические методики для выявления продуцирующих карбапенемазу бактерий, которые, как сообщается, существенно снижают время анализа по сравнению с «Etest®», «модифицированным тестом Ходжа» и методиками молекулярного выявления. В международной заявке WO 2012/175637 описан такой способ, в котором, в частности, сообщается о сроках проведения анализа, составляющих менее чем 2 часа. Тем не менее, современные быстрые фенотипические тесты демонстрируют слабую чувствительность и специфичность в отношении выявления продуцирующих карбапенемазу представителей Pseudomonas (Heinrichs et at., 2015) и Acinetobacter в образце. В частности, могут быть получены ложноотрицательные сигналы.
Кроме того, быстрое выявление продуцирующих карбапенемазу представителей Enterobacteriaceae является ключом к ограничению распространения этих организмов, и несмотря на то что для их выявления доступны как фенотипические, так и молекулярные методы, ни один отдельный метод выявления не зарекомендовал себя как идеальный для всех ситуаций (Lutgring et Limbago, 2016). Согласно недавним таксономическим исследованиям Европейского комитета по определению чувствительности к антимикробным препаратам (European Committee on Antimicrobial Susceptibility Testing) (EUCAST, 2018) определение семейства Enterobacteriaceae было сужено. Следовательно, Enterobacteriales представляют собой порядок грамотрицательных бактерий, который включает в себя только одно семейство - Enterobacteriaceae. Таким образом, настоящее изобретение будет ссылаться на порядок Enterobacteriales.
Следовательно, существует потребность в обеспечении способа выявления присутствия продуцирующих карбапенемазу представителей Enterobacteriales, Pseudomonas и Acinetobacter в образце, который является не только высокоспецифическим и чувствительным, но также может легко применяться в клинических условиях.
Сущность изобретения
Авторы настоящего изобретения обнаружили, что при проведении фенотипического теста с применением хромогенного цефалоспорина, (7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновой кислоты или ее соли, представляется возможным выявить присутствие продуцирующих карбапенемазу представителей Enterobacteriales, Pseudomonas и Acinetobacter в очень короткие сроки.
В частности, процесс выявления, установленный авторами настоящего изобретения, не требует предварительного воздействия на изоляты какими-либо средствами, которые могут индуцировать или ингибировать экспрессию, до проведения теста в отношении присутствия карбапенемазы, что, следовательно, требует дополнительного периода получения информации.
В соответствии с одним аспектом авторы настоящего изобретения обнаружили, что представляется возможным выявить присутствие продуцирующих карбапенемазу представителей Enterobacteriales, Pseudomonas и Acinetobacter в образцах от пациентов с подозрением на инфекцию такими бактериями с применением хромогенного цефалоспорина, (7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновой кислоты или ее соли.
Таким образом, в соответствии с первым аспектом настоящее изобретение относится к способу выявления присутствия продуцирующих карбапенемазу представителей Enterobacteriales, Pseudomonas и Acinetobacter в образце от пациента, предусматривающему: обеспечение образца, в котором предполагается присутствие продуцирующих карбапенемазу представителей Enterobacteriales, Pseudomonas или Acinetobacter, обеспечение реакции образца с раствором (7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновой кислоты или ее соли и выявление изменения цвета в реакционной среде, причем изменение цвета с желтого на красный указывает на присутствие продуцирующих карбапенемазу представителей Enterobacteriales, Pseudomonas или Acinetobacter в исследуемом образце.
В соответствии со вторым аспектом настоящее изобретение относится к применению (7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновой кислоты или ее соли для выявления присутствия продуцирующих карбапенемазу представителей Enterobacteriales, Pseudomonas и Acinetobacter в образце.
В соответствии с третьим аспектом настоящее изобретение также относится к набору для определения того, продуцирует ли микроорганизм гидролизующую карбапенем β-лактамазу, содержащему диск для анализа, пропитанный (7R)-7-[(2)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновой кислотой или ее солью и ингибитором β-лактамазы расширенного спектра (ESBL), ингибитором AmpC или их смесью.
Настоящее изобретение также относится к микротитровальному планшету, содержащему лунку или серию лунок, содержащих (7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновую кислоту или ее соль, и к его применению в выявлении присутствия продуцентов карбапенемазы в исследуемом образце.
Настоящее изобретение также относится к флаконам или микроцентрифужным пробиркам, содержащим (7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновую кислоту или ее соль, и к их применению в выявлении присутствия продуцентов карбапенемазы в исследуемом образце.
Подробное описание изобретения
Способы, которые обеспечивают возможность быстрого выявления продуцирующих карбапенемазу бактерий, необходимы для того, чтобы предпринимать необходимые действия для предотвращения распространения устойчивости к антибиотикам и для сохранения эффективности антибиотиков, таких как пенемы и карбапенемы. Способ согласно настоящему изобретению удовлетворяет эту потребность посредством обеспечения пользователя интерпретируемыми результатами для быстрого и достоверного определения того, содержит ли образец продуцирующие карбапенемазу бактерии.
В частности, способ может быть подходящим для обеспечения быстрого и достоверного фенотипического теста для выявления присутствия продуцирующих карбапенемазу представителей Enterobacteriales, Pseudomonas и Acinetobacter spp. Соответственно, настоящее изобретение преимущественно относится к способу, подходящему для обеспечения быстрого и достоверного фенотипического теста для выявления присутствия продуцирующих карбапенемазу бактерий, таких как Pseudomonas aeruginosa, тест в отношении которых нельзя быстро и достоверно провести с применением других известных способов и/или тестов.
Таким образом, в соответствии с первым аспектом настоящее изобретение относится к способу выявления присутствия продуцирующих карбапенемазу представителей Enterobacteriales, Pseudomonas и Acinetobacter в образце, предусматривающему: обеспечение образца, в котором предполагается присутствие продуцирующих карбапенемазу представителей Enterobacteriales, Pseudomonas или Acinetobacter, обеспечение реакции образца с раствором (7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновой кислоты или ее соли и выявление изменения цвета в реакционной среде, когда продуцирующие карбапенемазу представители Enterobacteriales, Pseudomonas или Acinetobacter присутствуют в исследуемом образце.
Способ согласно настоящему изобретению может характеризоваться 100% чувствительностью и 100% специфичностью в отношении выявления продуцирования карбапенемазы у представителей Enterobacteriales, Pseudomonas и Acinetobacter spp.
Способ согласно настоящему изобретению основан на идее, что (7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновая кислота или ее соль могут гидролизоваться β-лактамазой, такой как карбапенемаза. Гидролиз ([(7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновой кислоты приводит в результате к наблюдаемому изменению цвета с желтого на красный.
Предпочтительно, способ согласно настоящему изобретению осуществляют на образцах, полученных от субъекта с подозрением на инфекцию продуцирующими карбапенемазу бактериями. Образец может представлять собой любой биологический образец, полученный от субъекта, такой как образцы жидкостей, тканей или клеток. Предпочтительно, образец может происходить из выделенной клеточной культуры или представляет собой образец мочи. Образец может быть получен с помощью известных способов от субъекта, который может представлять собой млекопитающее. Предпочтительно, субъект, от которого получают образец, представляет собой человека.
Способ согласно настоящему изобретению можно применять для выявления любых продуцирующих карбапенемазу бактерий-представителей Enterobacteriales, Pseudomonas или Acinetobacter. Предпочтительно, продуцирующие карбапенемазу бактерии являются важными с клинической точки зрения, как например, бактерии, которые являются ответственными за внутрибольничные или внебольничные инфекции.
Как правило, концентрация (7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновой кислоты или ее соли - субстрата, применяемого в способе согласно настоящему изобретению, составляет от 0,1 мг/мл до 10 мг/мл, более предпочтительно, от 1 мг/мл до 5 мг/мл и, еще более предпочтительно, от 2 мг/мл до 3 мг/мл.
В соответствии с некоторыми вариантами осуществления продуцирующие карбапенемазу бактерии лизируют до реакции с (7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновой кислотой или ее солью. Лизис бактерий можно осуществлять с помощью любой известной методики. Необязательно, количество представителей Enterobacteriales, Pseudomonas или Acinetobacter spp. можно ресуспендировать в буфере/реактиве для экстракции белка в микроцентрифужной пробирке или флаконе перед смешиванием. Смешивание можно осуществлять посредством перемешивания на вихревой мешалке в течение подходящего периода для обеспечения полного смешивания. Предпочтительно, смешивание может быть достигнуто посредством перемешивания образца на вихревой мешалке в течение периода от около 2 до около 10 секунд, например, в течение 5 секунд. Пробирку затем можно инкубировать в течение периода от 5 до 30 минут при подходящей температуре. Необязательно, пробирку можно инкубировать в течение периода, составляющего около 10 минут. Подходящие температуры могут составлять от около 25°С до около 45°С. Предпочтительно, пробирку можно инкубировать при температуре от около 35°С до около 37°С.
В соответствии с некоторыми вариантами осуществления лизис образца облегчают с помощью комбинации полимиксинового, гликопептидного и полипептидного антибиотика.
Реакцию образца, который может представлять собой лизированный образец, с (7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновой кислотой или ее солью можно осуществлять в течение периода времени, достаточного для наблюдения изменения цвета. Предпочтительно, изменение цвета должно наблюдаться менее чем за 1 час. Более предпочтительно, изменение цвета можно наблюдать менее чем за 30 минут. Наиболее предпочтительно, изменение цвета можно наблюдать за период от около 5 до около 20 минут.
Реакцию образца с (7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновой кислотой или ее солью можно осуществлять при любой подходящей температуре. Предпочтительно, реакцию можно осуществлять при температуре от около 5°С до около 40°С. Например, реакцию можно осуществлять при температуре от около 15°С до около 30°С, как например, при комнатной температуре. Предпочтительно, реакцию можно осуществлять при температуре от около 20°С до около 37°С и, наиболее предпочтительно, при 35°С.
Хромогенный цефалоспорин, (7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновая кислота или ее соль, также является чувствительным к гидролизу бета-лактамазами расширенного спектра (ESBL) и AmpC. Тем не менее, воздействие ферментов ESBL и AmpC можно исключить посредством добавления подходящих соединений-ингибиторов. Соответственно, когда присутствуют такие ингибиторы, изменение цвета указывает на присутствие карбапенемазы.
Соответственно, в соответствии с одним вариантом осуществления способом дополнительно предусмотрен ингибитор β-лактамазы расширенного спектра (ESBL), ингибитор AmpC или их смесь. Можно применять любой подходящий ингибитор. Некоторые подходящие ингибиторы включают в себя клавулановую кислоту, клоксациллин и их смеси. Необязательно, ингибитор содержит по меньшей мере одно из клавулановой кислоты в концентрации от около 30 мкг/мл до около 50 мкг/мл и клоксациллина в концентрации от около 300 мкг/мл до около 500 мкг/мл. В случае, когда ингибитор содержит клавулановую кислоту и клоксациллин, их можно смешать в равных частях с получением на выходе смеси ингибиторов. В качестве альтернативы, можно применять отличающиеся количества и/или дополнительные компоненты. Кроме того, любой карбапенем или пенем можно применять отдельно или в комбинациях как с ингибиторами ESBL, так и с ингибиторами AmpC для дополнительного исключения активности ESBL и AmpC.
Выбор ингибиторов, которые ингибируют бета-лактамазы расширенного спектра (ESBL) и AmpC, обеспечивает возможность визуализации полного спектра экспрессии карбапенемаз.
В соответствии с одним вариантом осуществления настоящего изобретения (7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновую кислоту или ее соль можно растворить в растворе, содержащем по меньшей мере одно из органического растворителя, органической кислоты и сульфата цинка. Необязательно, органический растворитель может представлять собой полярный апротонный растворитель. Подходящий растворитель может представлять собой DMSO. Органическая кислота может представлять собой любую подходящую органическую кислоту. Подходящие органические кислоты могут включать в себя органические кислоты из группы линейных насыщенных дикарбоновых кислот, таких как щавелевая кислота, малоновая кислота, янтарная кислота, глутаровая кислота, адипиновая кислота, пимелиновая кислота, субериновая кислота, азелаиновая кислота или себациновая кислота.
Будет понятно, что реакцию образца можно осуществлять с использованием последовательного ряда стадий, например, включающих в себя по меньшей мере некоторые из получения смеси ингибиторов, растворения (7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновой кислоты или ее соли в растворе, содержащем по меньшей мере одно из органического растворителя, органической кислоты и сульфата цинка, суспендирования количества продуцирующих карбапенемазу представителей Enterobacteriales, Pseudomonas и Acinetobacter в количестве реактива для экстрагирования белка для исследования и/или подогрева суспендированных продуцирующих карбапенемазу представителей Enterobacteriales, Pseudomonas и Acinetobacter с получением живого образца и добавления к образцу лизированного материала раствора (7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновой кислоты (или ее соли) с количеством смеси ингибиторов.
В соответствии с другими вариантами осуществления процесс реакции можно осуществлять посредством процесса реакции, отличного от последовательного, при котором три или более из (7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновой кислоты или ее соли, органического растворителя, органической кислоты, сульфата цинка добавляют к образцу продуцирующих карбапенемазу представителей Enterobacteriales, Pseudomonas и Acinetobacter и лизируют in situ одновременно с процессом реакции.
Например, реакцию образца можно осуществлять с использованием «однореакторной» методики синтеза, при которой можно обеспечивать реакцию нелизированного образца с (7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновой кислотой или ее солью, органическим растворителем и органической солью. Необязательно, органический растворитель может представлять собой DMSO, а органическая кислота может представлять собой линейную насыщенную дикарбоновую кислоту, такую как янтарная кислота.
В соответствии со вторым аспектом настоящее изобретение относится к применению (7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновой кислоты или ее соли для выявления присутствия продуцирующих карбапенемазу представителей Enterobacteriales, Pseudomonas или Acinetobacter в образце.
Необязательно, (7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновая кислота или ее соль может иметь форму порошка. ([(7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновую кислоту или ее соль можно растворить в смеси DMSO и янтарной кислоты с последующим добавлением сульфата цинка. Например, (7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновую кислоту или ее соль можно растворить в 1 части DMSO с 3-20 частями янтарной кислоты с последующим добавлением сульфата цинка, получая конечную концентрацию от 0,1 мМ до 10 мМ. Предпочтительно, (7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновую кислоту или ее соль можно растворить в 1 части DMSO с 5-9 частями янтарной кислоты. Необязательно, (7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновую кислоту или ее соль можно растворить в 1 части DMSO с 7 частями янтарной кислоты с последующим добавлением сульфата цинка, получая конечную концентрацию 1 мМ.
Количество лизированного образца или цельноклеточного образца можно добавлять приблизительно в равных частях к раствору (7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновой кислоты или ее соли. Лизированный или цельноклеточный образец можно добавлять к раствору (7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновой кислоты или ее соли при комнатной температуре. Необязательно, можно применять от около 20 мкл до около 100 мкл лизированного образца и раствора (7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновой кислоты или ее соли.
Также можно добавлять количество ингибитора. Можно применять любой подходящий ингибитор или их смеси в количествах от 20 мкл до около 200 мкл. Предпочтительно, можно применять от около 50 мкл до около 150 мкл ингибитора. Необязательно, можно добавлять около 100 мкл ингибитора, содержащего в равных частях клавулановую кислоту и клоксациллин, доведенные до конечной концентрации около 40 мкг/мл и 400 мкг/мл.
В качестве альтернативы, отличающийся ингибитор или смесь ингибиторов или их смесь в отличающихся соотношениях можно добавлять в эквивалентной конечной концентрации.
За содержимым полученного в результате раствора можно следить в течение периода времени вплоть до часа и, предпочтительно, вплоть до 30 минут, для определения того, происходит ли изменение цвета. Предпочтительно, за раствором может быть необходимо следить только в течение периода, составляющего от 5 до 30 минут.
Появление изменения цвета с желтого на оранжевый/красный может указывать на присутствие продуцирующих карбапенемазу представителей Enterobacteriales, Pseudomonas или Acinetobacter в исследуемом образце.
Для того чтобы исследовать, присутствует ли продуцирующий карбапенемазу представитель Enterobacteriales, Pseudomonas или Acinetobacter в исследуемом образце, количество представителя Enterobacteriales, Pseudomonas или Acinetobacter spp. можно суспендировать в буфере/реактиве для экстракции белка. Раствор затем можно смешать и инкубировать с получением лизированного образца. Порцию лизированного образца можно добавить к количеству (7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновой кислоты или ее соли и, необязательно, к количеству смеси ингибиторов, причем положительный тест подтверждается наблюдением изменения цвета.
Применяемое количество представителей Enterobacteriales, Pseudomonas или Acinetobacter spp. может составлять от около 0,1 мкл до около 10 мкл. Например, можно применять около 0,2 мкл, 0,5 мкл, 1 мкл, 2 мкл или 5 мкл. Применяемое количество реактива для экстрагирования белка может составлять от 50 до 250 мкл. Например, можно применять около 50 мкл, 75 мкл, 100 мкл, 150 мкл. Предпочтительно, можно применять около 1 мкл представителя Enterobacteriales, Pseudomonas или Acinetobacter spp. и около 100 мкл буфера/реактива для экстрагирования белка. Можно применять любой подходящий буфер/реактив для экстрагирования белка.
Смешивание может быть достигнуто с применением любой подходящей методики, в том числе, без ограничения, с применением перемешивания, встряхивания и перемешивания на вихревой мешалке. Например, раствор можно перемешивать на вихревой мешалке в течение периода от около 1 до 60 секунд, как например, в течение около 5 секунд. Смешивание может происходить до и/или во время инкубирования с получением лизированного образца. Инкубирование можно осуществлять при любой подходящей температуре и в течение любого подходящего периода времени. Например, инкубирование можно осуществлять при температуре от около 30 до 45°С, предпочтительно, около 35-37°С, в течение от около 1 до около 30 минут, предпочтительно, в течение около 10 минут.
Необязательно, тест можно осуществлять на нелизированном образце.
Любую подходящую порцию лизированного (или нелизированного) образца можно добавить к любому подходящему количеству раствора (7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновой кислоты или ее соли, необязательно, с количеством смеси ингибиторов. Необязательно, от около 10 мкл до около 100 мкл, например, около 50 мкл, лизированного (или нелизированного) образца можно добавлять к раствору (7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновой кислоты или ее соли в количестве от около 20 мкл до около 100 мкл, например, около 50 мкл, необязательно, дополнительно к около 20-200 мкл, например, около 100 мкл, смеси ингибиторов.
Предпочтительно, образец, раствор (7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновой кислоты или ее соли и, необязательно, смесь ингибиторов можно добавлять при комнатной температуре.
В соответствии с третьим аспектом настоящее изобретение относится к набору для определения того, продуцирует ли микроорганизм гидролизующую карбапенем β-лактамазу, он может содержать диск для анализа, пропитанный ([(7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновой кислотой) или ее солью и ингибитором β-лактамаз расширенного спектра (ESBL), ингибитором AmpC или их смесью.
В соответствии с дополнительным аспектом настоящее изобретение относится к микроструйному устройству или к электрохимическому сенсорному устройству для выявления присутствия продуцирующих карбапенемазу представителей Enterobacteriales, Pseudomonas или Acinetobacter, причем устройство содержит субстрат, который представляет собой (7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновую кислоту или ее соль.
Микроструйное устройство может представлять собой любое устройство, выдающее результаты, которые могут быть считаны как фенотипическая характеристика. Например, микроструйное устройство может представлять собой микрокапиллярную пленку.
Электрохимическое сенсорное устройство может представлять собой любое устройство, которое будет подавать сигнал после гидролиза (7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновой кислоты или ее соли. Например, электрохимическое сенсорное устройство может представлять собой электрод, чип, набор или заряженную ионами мембрану.
Реакцию лизированного образца с набором реактивов проводят в течение периода времени, достаточного для наблюдения изменения цвета в растворе (7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновой кислоты или ее соли, когда продуцирующие карбапенемазу представители Enterobacteriales, Pseudomonas или Acinetobacter присутствуют в исследуемом образце. Как правило, изменение цвета наблюдают менее чем через 1 час и, более предпочтительно, менее чем через 30 минут с момента смешивания образца с буфером/реактивом. Как правило, реакцию образца с набором реактивов осуществляют при температуре, включающей от 5°С до 40°С, предпочтительно, от 15°С до 30°С и, более предпочтительно, при комнатной температуре.
Набор реактивов можно применять для обеспечения очень быстрого пути идентификации инфекции продуцирующими карбапенемазу бактериями-представителями Enterobacteriaceae, Pseudomonas или Acinetobacter с высокой достоверностью и точностью в соответствии со способом согласно настоящему изобретению.
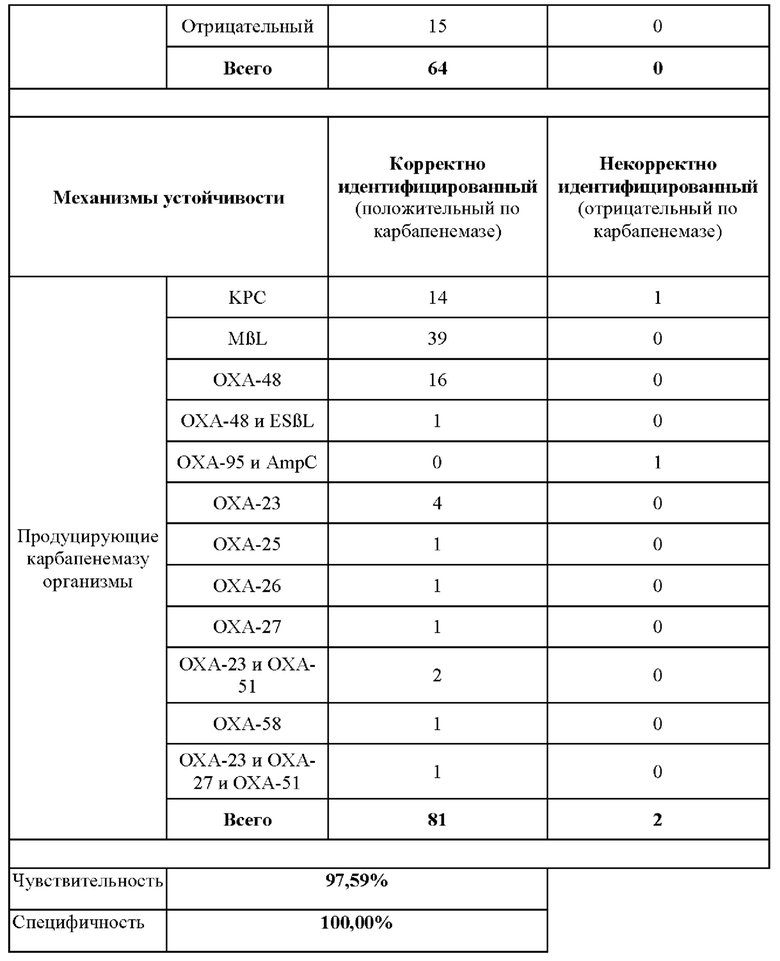
На фиг. 1 представлены результаты фенотипического исследования в отношении Pseudomonas spp.
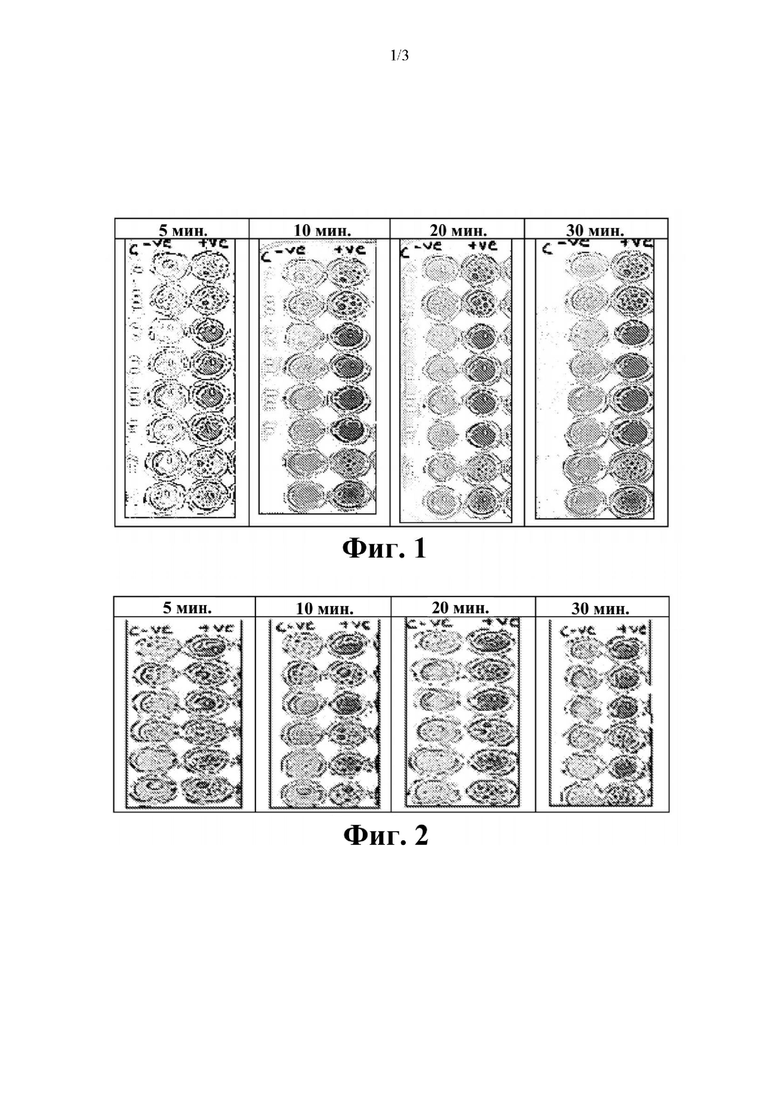
На фиг. 2 представлены результаты фенотипического исследования в отношении Acinetobacter baumanii.
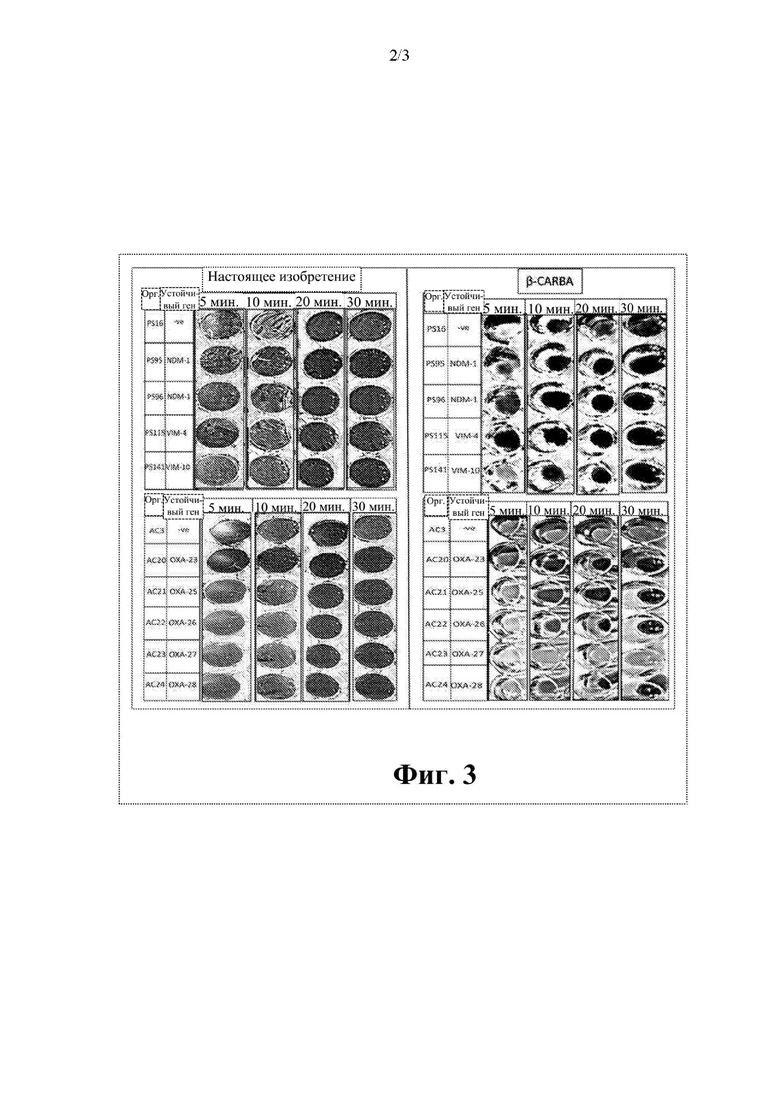
На фиг. 3 представлено сравнительное исследование Pseudomonas и Acinetobacter spp. с применением способа согласно настоящему изобретению и стандартной методики.
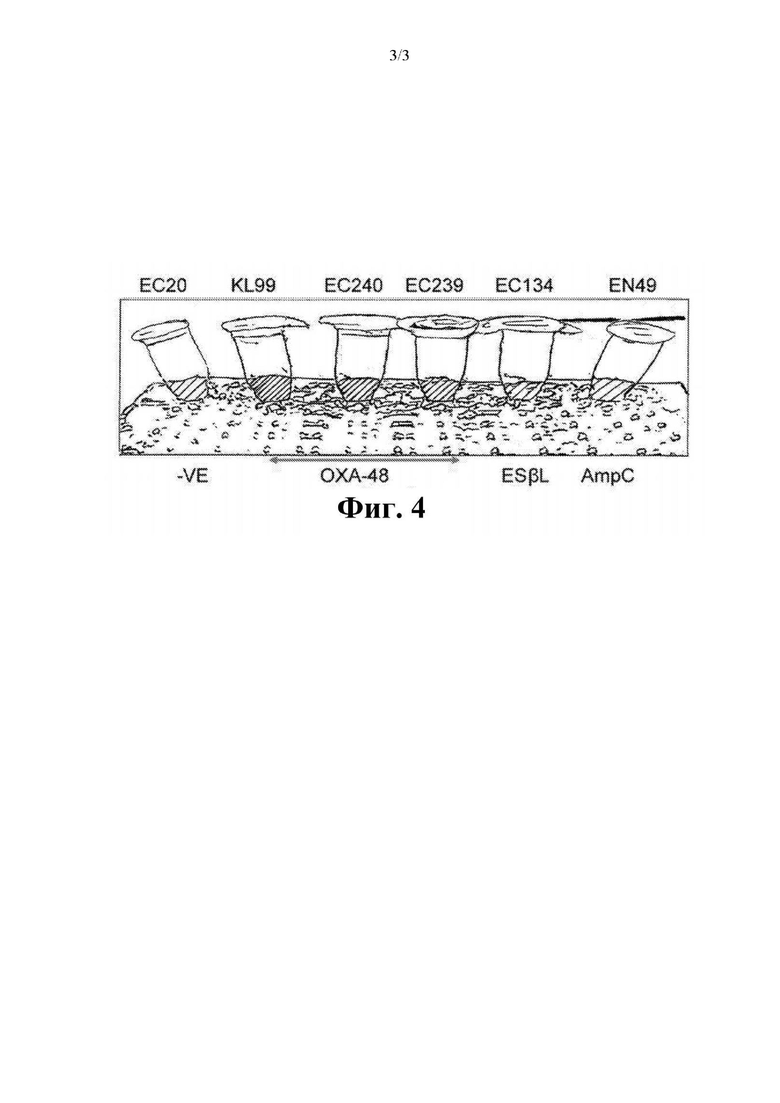
На фиг. 4 представлены результаты фенотипического исследования для выявления продуцирующих карбапенемазу представителей Enterobacteriales.
Настоящее изобретение будет дополнительно проиллюстрировано с учетом следующих примеров.
ПРИМЕРЫ
Пример 1
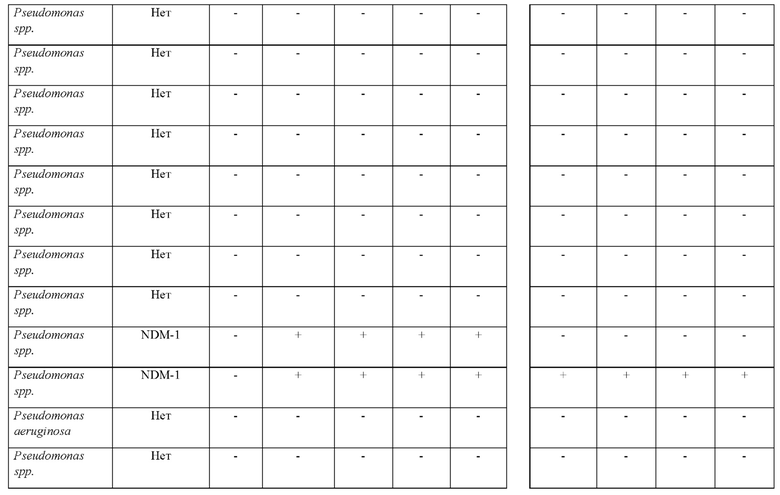
Исследуемый раствор, содержащий смесь ингибиторов и ([(7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновую кислоту получали и применяли для определения присутствия продуцирующих карбапенемазу представителей Pseudomonas или Acinetobacter в ряде исследуемых образцов, как изложено в таблицах 1 и 2.
Исследуемый раствор составляли следующим образом:
1) клавулановую кислоту и клоксациллин составляли в конечной концентрации 40 мкг/мл и 400 мкг/мл и смешивали вместе в равных частях с получением на выходе смеси ингибиторов;
2) (7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновую кислоту или ее соль в форме порошка растворяли в 1 части DMSO с 7 частями дикарбоновой кислоты с последующим добавлением сульфата цинка до конечной концентрации 1 мМ;
3) 1 мкл образцов либо Pseudomonas, либо Acinetobacter spp. с петли для посева суспендировали в 100 мкл коммерчески доступного буфера/реактива для экстрагирования белка или в 100 мкл буфера для экстрагирования, содержащего 50 мМ Tris HCl, 100 мМ NaCl и 1% Triton X100, в микроцентрифужной пробирке;
4) суспендированных представителей Pseudomonas или Acinetobacter spp. смешивали посредством перемешивания на вихревой мешалке в течение периода 5 секунд перед нагреванием образца в микроцентрифуге до 35°С-37°С и инкубированием в течение периода 10 минут с получением лизированного образца;
5) 50 мкл лизированного образца добавляли к 50 мкл раствора (7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновой кислоты или ее соли и 100 мкл смеси ингибиторов в лунке 96-луночного микротитровального планшета при комнатной температуре;
6) содержимое лунки смешивали посредством пипетирования во время добавления клеточного лизата;
7) образец отслеживали визуально в течение периода до 30 минут, фиксируя цвет раствора через 5, 10, 20 и 30 минут с момента смешивания образца с раствором ([(7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновой кислоты или ее соли.
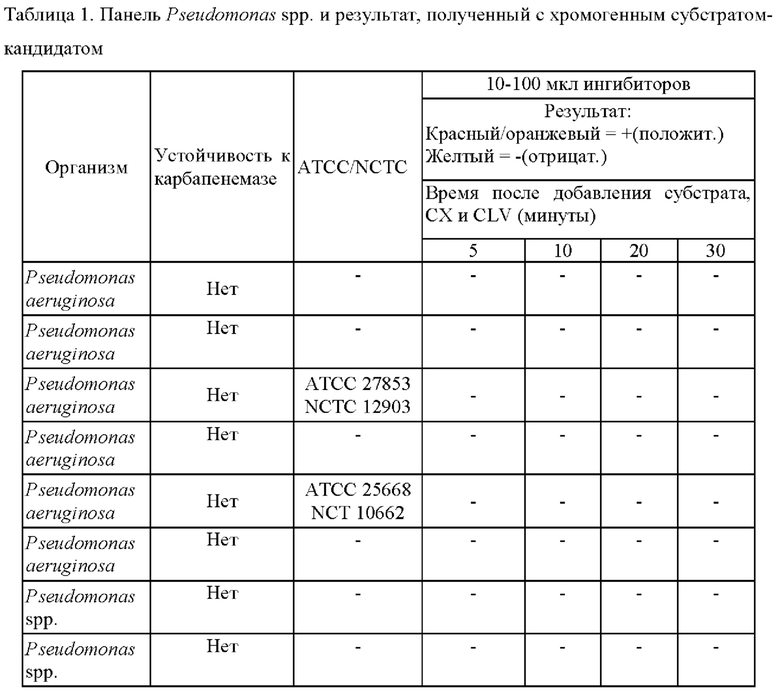
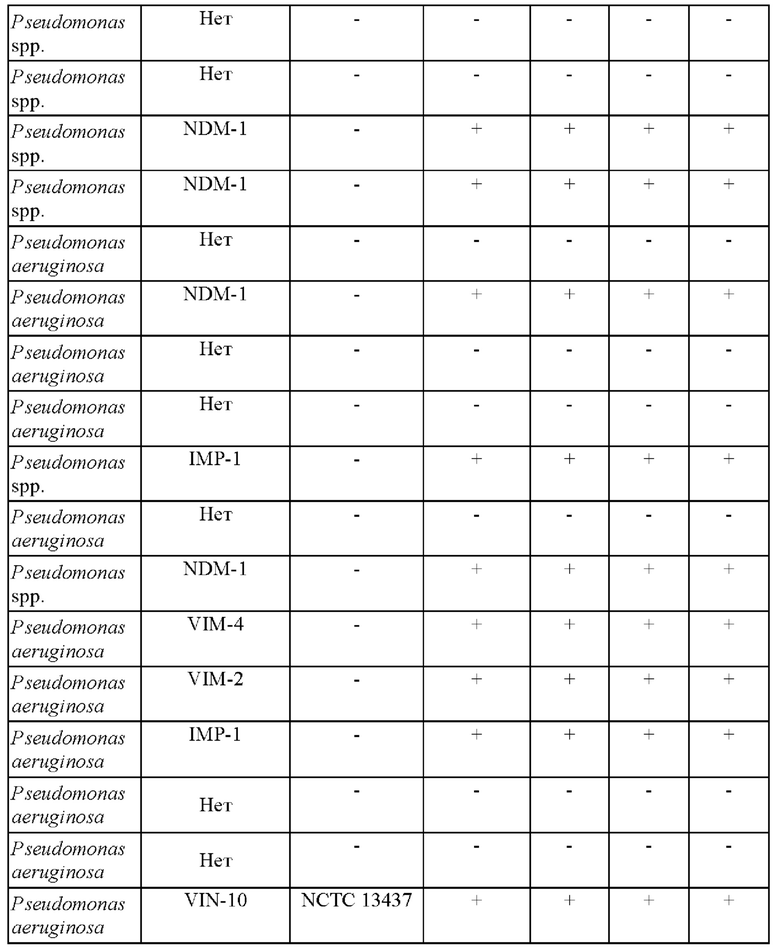
Как показано в таблице 1, (7R)-7-[(Z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновая кислота или ее соль успешно выявляли все 9 продуцирующих карбапенемазу Pseudomonas spp. Чувствительность способа согласно настоящему изобретению составляла 100%, также как и специфичность.
Соответствующие фенотипические результаты для Pseudomonas spp. представлены на фиг. 1.
Эти тесты показывают, что способ согласно настоящему изобретению является очень чувствительным в отношении выявления NDM-1, IMP и VIM у Pseudomonas spp. Более того, показано, что желтый цвет раствора (7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновой кислоты или ее соли подвергается существенному изменению на красный цвет в течение 5 минут после добавления образцов лизированных бактерий при комнатной температуре. Несмотря на то что более насыщенный красный цвет может проявляться в течение более длительных периодов времени, изменение цвета спустя 5 минут является достаточным для того, чтобы показать положительную реакцию.
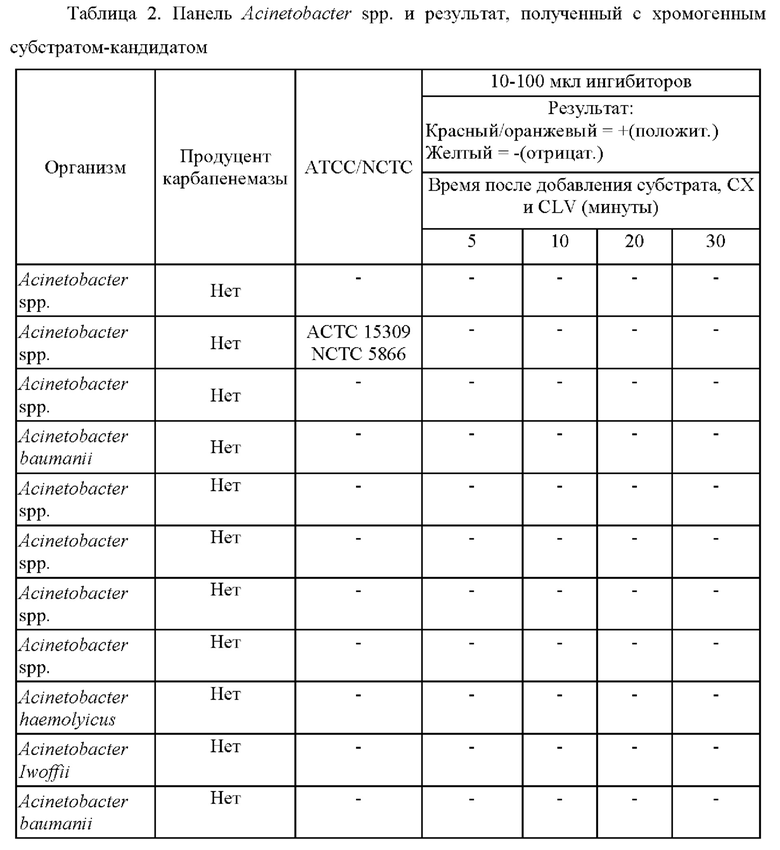
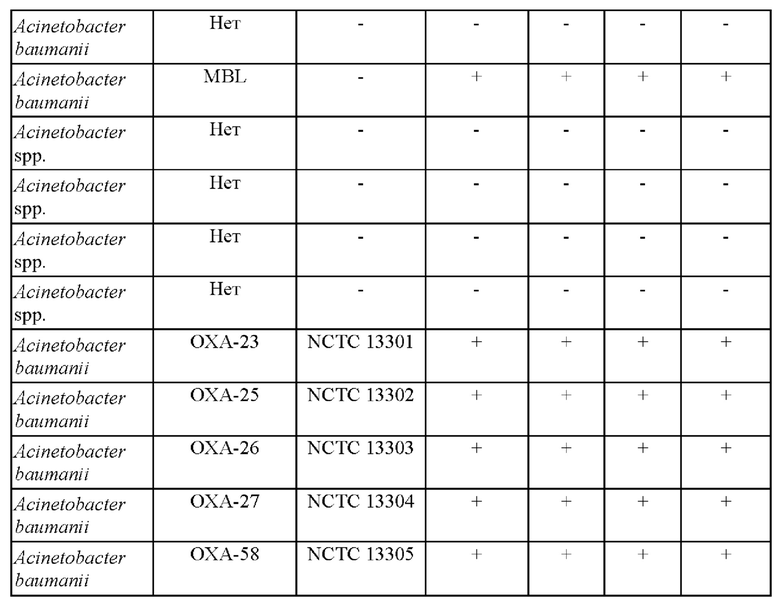
Как показано в таблице 2, (7R)-7-[(Z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновая кислота или ее соль успешно выявляли все 5 продуцирующих карбапенемазу Acinetobacter baumanii. Чувствительность способа согласно настоящему изобретению составляла 100%, также как и специфичность.
Соответствующие фенотипические результаты для Acinetobacter baumanii представлены на фиг. 2.
Эти тесты показывают, что способ согласно настоящему изобретению является очень чувствительным в отношении выявления ОХА у Acinetobacter spp. Более того, показано, что желтый цвет раствора (7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновой кислоты или ее соли подвергается существенному изменению на красный цвет в течение 5 минут после добавления образцов лизированных бактерий при комнатной температуре. Несмотря на то что более насыщенный красный цвет может проявляться в течение более длительных периодов времени, изменение цвета спустя 5 минут является достаточным для того, чтобы показать положительную реакцию.
Пример 2
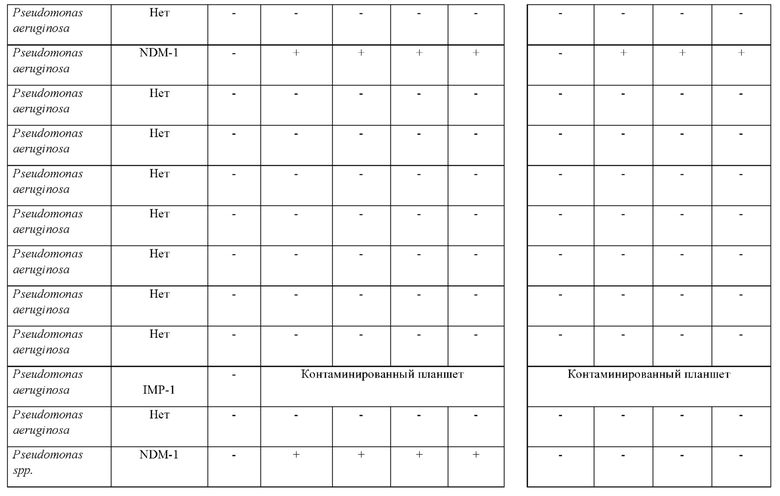
Исследуемый раствор составляли в соответствии со способом из примера 1 и применяли для исследования пяти изолятов Pseudomonas; из которых 4 изолята являлись устойчивыми к карбапенемам, и 1 представлял собой организм, не являющийся продуцентом карбапенемазы. Из 4 продуцирующих карбапенемазу изолятов Pseudomonas 2 представляли собой NDM-1, в то время как остальные 2 представляли собой VIM. Также исследовали шесть изолятов Acinetobacter, из которых 5 изолятов являлись устойчивыми к карбапенемам, и 1 представлял собой организм, не являющийся продуцентом карбапенемазы. Все 5 продуцирующих карбапенемазу изолятов Acinetobacter представляли собой ОХА.
Соответствующие тесты для каждого изолята Pseudomonas и Acinetobacter также проводили с применением коммерчески доступного колориметрического теста для выявления штаммов с пониженной чувствительностью к карбапенемам, известного квалифицированному специалисту в данной области техники. Следуя стандартной инструкции, сравнительные исследования на основе колориметрической методики осуществляли при 35°С-37°С, в то время как тесты, проводимые в соответствии со способом согласно настоящему изобретению, осуществляли при комнатной температуре.
Результаты этих тестов представлены в таблице 3, при этом наблюдаемые изменения цвета представлены на фиг. 3.
Тест включал в себя отрицательный контрольный изолят Pseudomonas и Acinetobacter, состоящий из отрицательного по карбапенемазе изолята Pseudomonas aeruginosa и Acinetobacter iwoffi. Все остальные изоляты являлись продуцентами карбапенемазы.
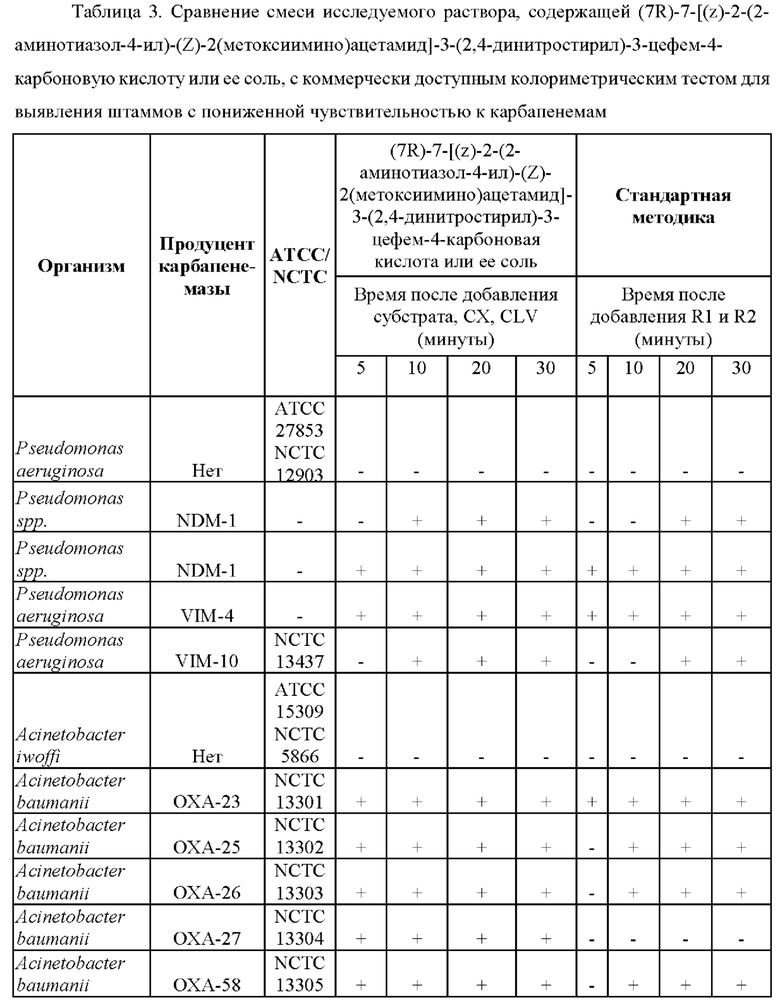
Как показано в таблице 3, из 11 организмов, исследуемых в ходе сравнения (7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновой кислоты или ее соли и коммерчески доступного рН-зависимого диагностического способа, (7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновая кислота или ее соль успешно выявляли все девять из продуцирующих карбапенемазу изолятов Pseudomonas и Acinetobacter, в то время как тесты с применением стандартной методики не выявляли продуцирование карбапенемазы в одном изоляте Acinetobacter (выделен в таблице). Ложноотрицательный результат, который был неправильно идентифицирован с применением стандартного теста, представлял собой ОХА-27.
Соответственно, показано, что стандартная методика характеризуется специфичностью, составляющей 100%, но только 89% чувствительностью, в то время как способ согласно настоящему изобретению характеризуется чувствительностью и специфичностью, составляющими 100%. Таким образом, способ согласно настоящему изобретению обеспечивает быстрый способ выявления присутствия продуцирующих карбапенемазу представителей Pseudomonas или Acinetobacter в исследуемом образце с улучшенной чувствительностью по сравнению с чувствительностью известных методик.
Пример 3
Два исследуемых раствора составляли в соответствии со способом из примера 1. Один из растворов являлся точно таким, как описано в примере 1, а в другом растворе использовали хромогенный цефалоспорин HMRZ-86 вместо (7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновой кислоты или ее соли.
Оба исследуемых раствора затем применяли для исследования 68 изолятов Pseudomonas; из которых 8 изолятов являлись устойчивыми к карбапенемам, и 60 не являлись продуцентами карбапенемазы. Из 8 продуцирующих карбапенемазу изолятов Pseudomonas 4 представляли собой NDM-1, 2 представляли собой VIM, в то время как остальные 2 представляли собой IMP.
Исследование с обоими растворами, в которых применяли или HMRZ-86, или (7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновую кислоту, осуществляли в соответствии со способом согласно настоящему изобретению (осуществляемым при комнатной температуре). Результаты тестов изложены в таблице 4.
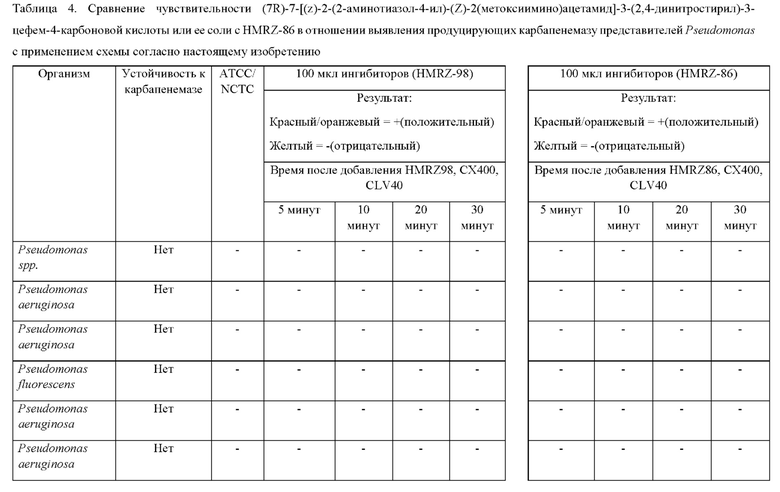
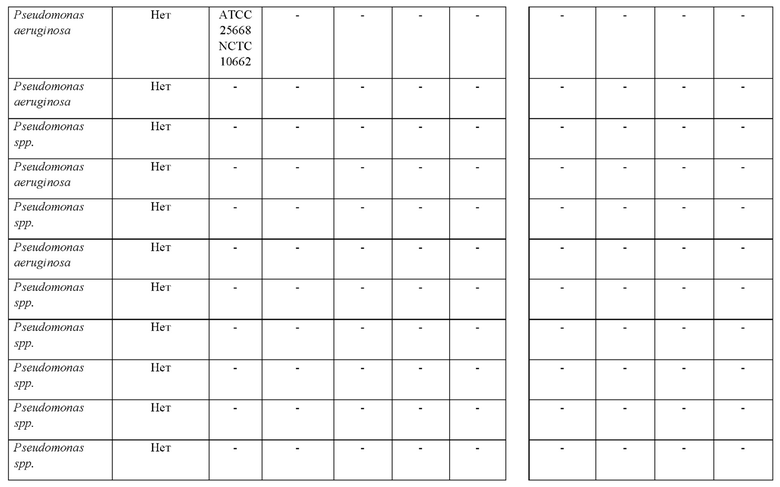
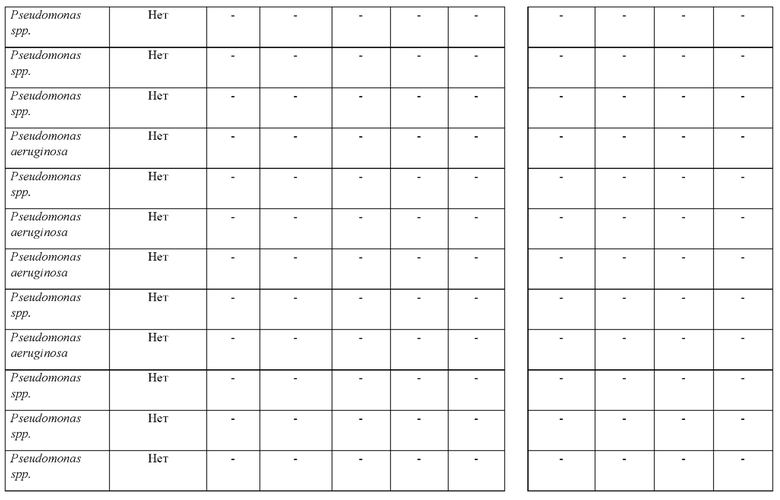
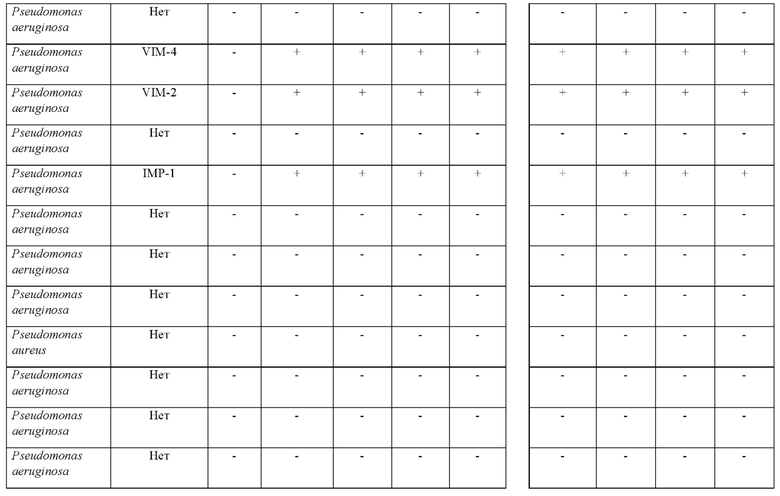

Как представлено в таблице 4, из 8 продуцирующих карбапенемазу организмов из рода Pseudomonas, исследуемых в ходе сравнения (7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновой кислоты с HMRZ, (7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновая кислота успешно выявляла все восемь из продуцирующих карбапенемазу изолятов Pseudomonas, в то время как тесты с применением HMRZ-86 вместо (7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновой кислоты не выявили два продуцирующих NDM-1 изолята (выделено в таблице 4).
Соответственно, показано, что методика согласно настоящему изобретению характеризуется чувствительностью и специфичностью, составляющими 100%, в то время как хромогенный субстрат-кандидат HMRZ-86 дает результате 75% чувствительность. Таким образом, способ согласно настоящему изобретению с использованием (7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновой кислоты отличается более высокой чувствительностью в случае быстрого выявления продуцирующих карбапенемазу представителей Pseudomonas или Acinetobacter в исследуемых образцах.
Пример 4
Стабилизированный буфером виде дикарбоновой кислоты исследуемый раствор, содержащий ([(7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновую кислоту, смесь ингибиторов, сульфат цинка и наполнитель, получали и применяли для определения присутствия продуцирующих карбапенемазу представителей Enterobacteriales, Pseudomonas или Acinetobacter в 147 исследуемых изолятах, как изложено в таблице 5.
Исследуемый раствор составляли следующим образом:
1) (7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновую кислоту в форме порошка растворяли в 1 части DMSO с 7 частями дикарбоновой кислоты;
2) раствор со стадии 1 выше затем стабилизировали буфером посредством дополнительного добавления дикарбоновой кислоты в соотношении, составляющем 1 часть исследуемого раствора к 4 частям дикарбоновой кислоты;
3) клавулановую кислоту и клоксациллин составляли в конечной концентрации 40 мкг/мл и 400 мкг/мл и смешивали вместе в равных частях с получением на выходе смеси ингибиторов;
4) сульфат цинка и PEG 8000 добавляли к смеси ингибиторов до конечных концентраций, составляющих 1 мМ и 0,5%, соответственно;
5) смесь, содержащую 2 мМ полимиксиновый, 4 мМ гликопептидный и 1,5 мМ полипептидный антибиотики также растворяли в растворе, содержащем смесь ингибиторов;
6) объемы, составляющие 2,8 мл раствора, содержащего смесь ингибиторов, сульфат цинка, PEG 8000 и смесь антибиотиков, описанную на стадии 5 выше, затем лиофилизировали в виде осадков в течение 72 часов.
Затем осуществляли определение присутствия карбапенемазы, как описано ниже:
(a) восстановить осадок посредством добавления 3,5 мл исследуемого раствора со стадии 2 выше;
(b) обеспечить полное растворение осадка при комнатной температуре в течение 1 минуты и смешать содержимое посредством легкого перешивания на вихревой мешалке в течение 10 секунд;
(c) восстановленный раствор должен быть желтым, если раствор имеет какой-либо другой цвет, не применять его;
(d) дозировать 500 мкл восстановленного раствора в микроцентрифужные пробирки; Одна пробирка на анализ.
(e) используя чистую свежую культуру исследуемого организма, добавить 1 мкл образец организма с петли для посева в микроцентрифужную пробирку и хорошо перемешать с помощью вихревой мешалки в течение 10 секунд;
(f) инкубировать при 35-37°С в течение 10 минут и записать цвет исследуемого раствора.
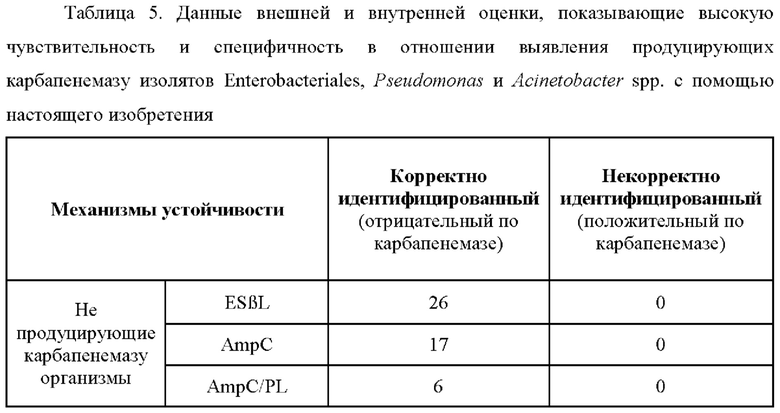
Исследовали 110 представителей Enterobacteriales; из которых 72 изолята являлись продуцентами карбапенемазы, а 38 не являлись продуцентами карбапенемазы. 57 из исследуемых изолятов представляли собой Klebsiella spp. [12 ESBL, 5 AmpC, 10 OXA, 13 KPC и 17 MβL (6 NDM, 6 IMP и 5 VIM)], 24 представляли собой Escherichia coli [8 ESBL, 5 AmpC, 5 OXA, 1 KPC и 5 MβL(2 VIM, 2 NDM и 1 IMP)], 23 представляли собой Enterobacter spp. [6 ESBL, 10 AmpC, 2 OXA, 4 MβL (2 VIM, 2 NDM и 1 KPC)], 3 - Citrobacter spp. [все NDM], 1 - Kluvyera spp. [продуцент NDM], и исследовали 2 изолята Salmonella spp.; оба из которых являлись продуцентами AmpC [ферменты, отличные от карбапенемаз].
- Исследовали 23 изолята Pseudomonas spp.; из которых 8 изолятов являлись продуцентами карбапенемазы MβL, содержащими 2 NDM, 2 IMP и 4 VIM. 15 изолятов Pseudomonas не являлись продуцентами карбапенемазы [14 из них не имели никакого опосредуемого ферментом механизма, в то время как один изолят являлся продуцентом AmpC].
- Исследовали 14 изолятов Acinetobacter spp.; из которых 13 изолятов являлись продуцентами карбапенемазы, а один не являлся продуцентом карбапенемазы. Среди продуцентов карбапенемазы присутствовало 12 продуцирующих оксациллиназу изолятов [4 OXA-23, 1 ОХА-25, 1 ОХА-26, 1 ОХА-27, 1 ОХА-58 и сопродуценты, такие как 2 ОХА23 + ОХА-51, 1 ОХА-23 + ОХА-27 + ОХА-51 и 1 ОХА-95 + AmpC]. Один из продуцирующих карбапенемазу изолятов Acinetobacter являлся продуцентом MβL.
Как показано в таблице 5, из общего количества 147 исследуемых изолятов способ согласно настоящему изобретению выявлял 81 из 83 продуцирующих карбапенемазу изолятов Enterobacteriales, Pseudomonas и Acinetobacter. Это коррелирует с общей чувствительностью, составляющей 97,59%, и 100% специфичностью в отношении широкого спектра грамотрицательных бактерий. В то же время коммерчески доступный набор посчитали неподходящим для применения с Pseudomonas aeruginosa (Henrichs et at, 2015), тогда как другой набор-основной конкурент, в котором предполагается применение хромогенного HMRZ-86, продемонстрировал только 64,9% чувствительность и 90% специфичность в отношении выявления продуцирующих карбапенемазу представителей Enterobacteriaceae (Mancini et at, 2017). Следовательно, на данный момент настоящее изобретение является единственным способом быстрого колориметрического выявления карбапенемазы с очень высокой чувствительностью и специфичностью, который является подходящим не только для применения с изолятами Pseudomonas и Acinetobacter spp., но также распространяется на представителей Enterobacteriales.
Изобретение относится к выявлению присутствия продуцирующих карбапенемазу Enterobacteriales, Pseudomonas и Acinetobacter в биологическом образце. Предложен способ выявления присутствия продуцирующих карбапенемазу Enterobacteriales, Pseudomonas и Acinetobacter в биологическом образце, включающий обеспечение образца, в котором предполагается присутствие продуцирующих карбапенемазу Enterobacteriales, Pseudomonas или Acinetobacter, реагирование указанного образца с раствором (7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновой кислоты) или ее соли. При этом реакцию осуществляют в присутствии ингибитора β-лактамаз расширенного спектра (ESBL), ингибитора AmpC или их смеси. Выявляют изменение цвета с желтого на оранжевый/красный в реакционной среде, когда продуцирующие карбапенемазу Enterobacteriales, Pseudomonas или Acinetobacter присутствуют в исследуемом образце. При этом изменение цвета происходит в течение 1 ч реагирования образца. Предложены также применение (7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновой кислоты) или ее соли для выявления присутствия продуцирующих карбапенемазу Enterobacteriales, Pseudomonas и Acinetobacter в образце, и набор для определения того, продуцирует ли микроорганизм гидролизующую карбапенем β-лактамазу, содержащий (7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновую кислоту) или ее соль. Изобретение обеспечивает высокую чувствительность и специфичность. 3 н. и 12 з.п. ф-лы, 4 ил., 5 табл., 4 пр.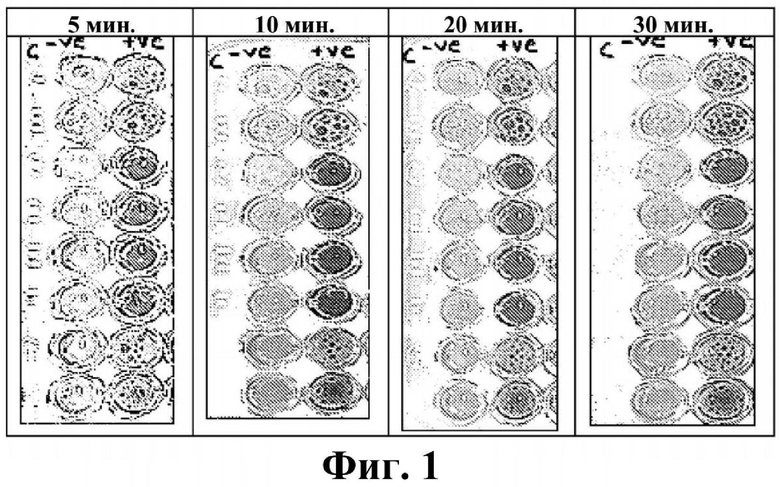
1. Способ выявления присутствия продуцирующих карбапенемазу Enterobacteriales, Pseudomonas и Acinetobacter в биологическом образце, включающий:
обеспечение образца, в котором предполагается присутствие продуцирующих карбапенемазу Enterobacteriales, Pseudomonas или Acinetobacter, реагирование указанного образца с раствором (7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновой кислоты) или ее соли, причем реакцию осуществляют в присутствии ингибитора β-лактамаз расширенного спектра (ESBL), ингибитора AmpC или их смеси, и выявление изменения цвета с желтого на оранжевый/красный в реакционной среде, когда продуцирующие карбапенемазу Enterobacteriales, Pseudomonas или Acinetobacter присутствуют в исследуемом образце, причем изменение цвета происходит в течение 1 часа реагирования образца.
2. Способ по п. 1, причем биологический образец является выбранным из группы, состоящей из такого биологического образца, как моча, или, как правило, из выделенной клеточной культуры.
3. Способ по любому предыдущему пункту, причем способ дополнительно включает стадию лизиса образца до или одновременно с реакцией с (7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновой кислотой) или ее солью.
4. Способ по пп. 1, 2, причем лизис образца происходит в присутствии (7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновой кислоты) или ее соли.
5. Способ по п. 4, причем лизис образца облегчают с помощью комбинации полимиксинового, гликопептидного и полипептидного антибиотика.
6. Cпособ по любому предыдущему пункту, причем реакцию образца с ([(7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновой кислотой) или ее солью осуществляют в течение периода времени, достаточного для наблюдения изменения цвета, причем указанный период времени составляет менее 30 мин и предпочтительно от около 5 до около 20 мин.
7. Способ по любому предыдущему пункту, причем реакцию образца с ([(7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновой кислотой) или ее солью осуществляют при температуре от около 5°C до около 40°C, более предпочтительно от около 20°C до около 37°C и наиболее предпочтительно при 35°C.
8. Способ по любому предыдущему пункту, причем ([(7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновую кислоту) или ее соль применяют в комбинации с карбапенемом или пенемом отдельно или в комбинации с ингибитором β-лактамаз расширенного спектра (ESBL), ингибитором AmpC или их смесью.
9. Способ по любому предыдущему пункту, причем ингибитор расширенного спектра представляет собой клавулановую кислоту, и ингибитор AmpC представляет собой клоксациллин или их смесь.
10. Способ по любому предыдущему пункту, причем ингибитор содержит по меньшей мере одно из клавулановой кислоты в концентрации от около 30 мкг/мл до около 50 мкг/мл и клоксациллин в концентрации от около 300 мкг/мл до около 500 мкг/мл.
11. Способ по любому предыдущему пункту, причем ([(7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновую кислоту) или ее соль растворяют в растворе, содержащем по меньшей мере одно из органического растворителя, органической кислоты и сульфата цинка.
12. Способ по п. 8, причем органический растворитель представляет собой полярный апротонный растворитель, предпочтительно DMSO, и при этом органическая кислота представляет собой линейную насыщенную дикарбоновую кислоту.
13. Применение ([(7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновой кислоты) или ее соли для выявления присутствия продуцирующих карбапенемазу Enterobacteriales, Pseudomonas и Acinetobacter в образце.
14. Применение ([(7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновой кислоты) или ее соли по п. 13, причем ([(7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновая кислота) или ее соль применяются в сочетании с карбапенемом или пенемом отдельно или в комбинации с ингибитором β-лактамаз расширенного спектра (ESBL), AmpC или их смесью.
15. Набор для определения того, продуцирует ли микроорганизм гидролизующую карбапенем β-лактамазу, содержащий флакон, который содержит ([(7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновую кислоту) или ее соль, микротитровальный планшет, имеющий лунки, которые покрыты ([(7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновой кислотой) или ее солью, или диск для анализа, пропитанный HMRZ-98 ([(7R)-7-[(z)-2-(2-аминотиазол-4-ил)-(Z)-2(метоксиимино)ацетамид]-3-(2,4-динитростирил)-3-цефем-4-карбоновой кислотой) или ее солью, причем флакон, микротитровальный планшет и/или диск для анализа содержат ингибитор β-лактамаз расширенного спектра (ESBL), ингибитор AmpC или их смесь.
| Устройство для испытания на сдвиг регулируемым усилием узлов, установленных на кабельном стволе | 1988 |
|
SU1557473A1 |
| FR 2956866 A1, 02.09.2011 | |||
| WO 2009051838 A1, 23.04.2009 | |||
| WO 2017089823 A1, 01.06.2017 | |||
| EP 1325923 A1, 09.07.2003 | |||
| HANAKI H | |||
| ET AL | |||
| Пюпитр для работы на пишущих машинах | 1922 |
|
SU86A1 |
| J Antimicrob Chemother | |||
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
Авторы
Даты
2022-07-27—Публикация
2018-08-07—Подача