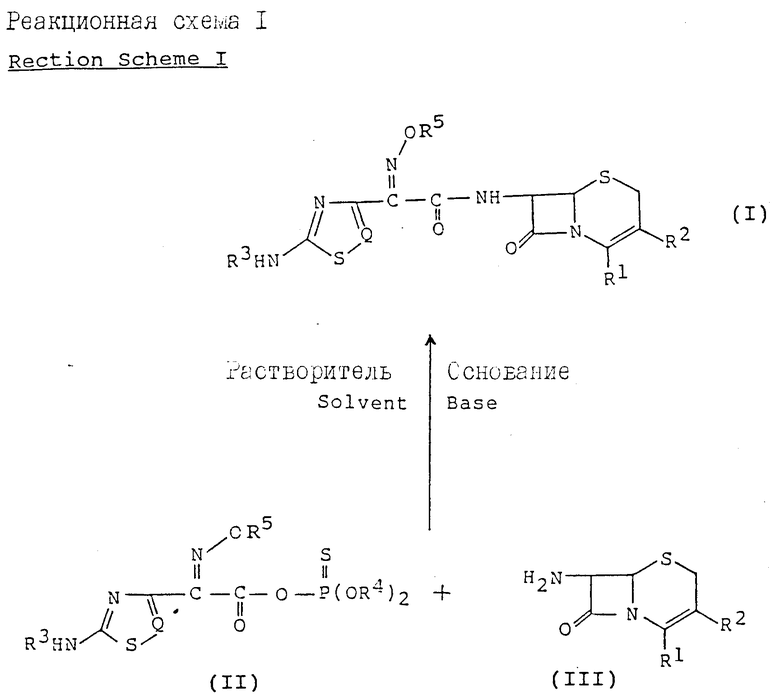
Изобретение относится к новому способу получения цефалоспориновых соединений, которые можно использовать как антибиотики. Более конкретно, изобретение относится к новому способу получения цефемных производных, представленных следующей общей формулой (I), которые имеют в положении 7 цефемного ядра 2-[аминотиа(диа)золил] -2-метоксииминоацетамидную группу, отличающуюся тем, что реакционноспособное тиофосфатное производное тиа(диа)золуксусной кислоты со следующей общей формулой (II) ацилируют производным 7-АЦК (7-аминоцефалоспорановой кислоты)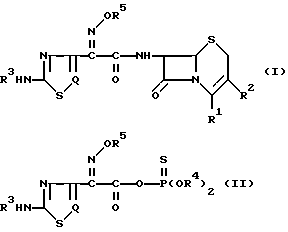
в котором R1 представляет карбоксигруппу или защищенную карбоксигруппу, которая может образовывать соль -COO-M+ с ионом щелочного металла (M+), такого, как натрий, или может представлять -COO-, когда R2 имеет заместитель с положительным электрическим зарядом, такой как пиридиний, пиримидиний или тиазолий;
R2 представляет водород, ацилоксиметил, гетероциклический метил или гетероциклический тиометил, каждый из которых может быть замещен надлежащими заместителями;
R3 представляет водород или аминозащищающую группу;
R4 представляет C1-C4-алкил или фенил, или вместе с атомом кислорода или фосфора, к которому он присоединен, может образовывать 5- или 6-членное гетероциклическое кольцо;
R5 представляет водород, C1-C4-алкил или -C(Ra)(Rb)CO2Rc, где Ra и Rb в группе -C(Ra)(Rb)CO2Rc для R5 идентичны или отличаются друг от друга и представляют водород или C1-C4-алкил, или Ra и Rb вместе с атомом углерода, с которым они связаны, могут образовывать C3-C7-циклоалкильную группу, и Rc
водород или карбоксизащищающая группа;
Q представляет N или CH.
Кроме того, изобретение относится к новому реакционноспособному тиофосфатному производному тиа(диа)золуксусной кислоты с формулой (II), как определено выше, которое можно использовать как исходный материал в способе получения цефалоспориновых соединений с формулой (I), и к способу его получения.
В основном в предшествующих публикациях и описаниях патентов описано много способов получения β -лактамных антибиотиков. В таких предшествующих способах обычно соединения b -лактамных антибиотиков получают исходя из органической кислотой, представленной следующей общей формулой (IV), которую превращают в ее реакционноспособное соединение, после чего подвергают реакции ациллирования по аминогруппе b -лактамного ядра: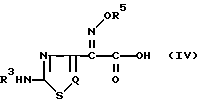
где R3, R5 и Q определены так, как было описано ранее.
Реакционноспособные производные соединения с формулой (IV), которые известны из вышеописанных предшествующих способов, включают хлорангидрид кислоты, реакционноспособный сложный эфир, реакционноспособный амид, смешанный ангидрид кислоты и т.п. Однако реакционноспособное производное в форме хлорангидрида кислоты или смешанного ангидрида получают в строгих условиях реакции и, кроме того, оно нестабильно, так что его можно использовать для реакции ацилирования in-situ без выделения. Это может быть главной причиной образования побочных продуктов. Кроме того, реакционноспособный сложный эфир и реакционноспособный амид соединения с формулой (IV) также обладают недостатками, заключающимися в том, что их получают с низким выходом, их реакционная способность очень низкая, что требует долгого времени проведения реакции, и, кроме того, побочные продукты реакции, например гидроксипроизводное, такое как 1-гидроксибензотриазол и тиольное производное, такое как 2-меркаптобензотиазол, трудно удалять.
Кроме того, в опубликованной для ознакомления японской публикации патента N (sho) 25-175196 описано соединение с формулой (А), которое можно получить из органической кислоты с формулой (IV) и хлорфосфатного производного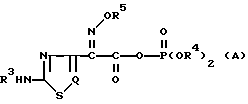
В вышеприведенной формуле (А) R3, R4, R5 и Q определены так, как было описано выше.
Однако соединение с формулой (А) является нестабильным реакционноспособным смешанным ангидридом кислоты, который нельзя выделить, и поэтому он может отрицательно влиять на реакцию по следующей стадии.
Таким образом, авторы изобретения постоянно проводили исследования с целью найти способ, который может решить проблемы, связанные с известными реакционноспособными производными, описанными ранее. В результате с помощью удобного способа из органической кислоты с формулой (IV) и хлортиофосфатного производного нам удалось с высоким выходом и с высокой чистотой получить новое реакционноспособное тиофосфатное производное тиа(диа)золуксусной кислоты с формулой (II), определенной выше, которое обладает подходящей реакционной способностью и стабильностью.
Мы также обнаружили, что цефалоспориновое производное с формулой (I), применимое в качестве антибиотика, можно более экономично получить исходя из указанного нового реакционноспособного тиофосфатного производного тиа(диа)золуксусной кислоты и затем завершили изобретение.
Цель изобретения предложить новый способ получения цефемных производных, представленных общей формулой (I), определенной выше, отличающийся тем, что новое реакционноспособное тиофосфатное производное тиа(диа)золуксусной кислоты с формулой (II), определенной выше, ацилируют производным 7-АЦК с формулой (III), определенной выше в присутствии растворителя и основания.
Другой целью изобретения было предложить новое реакционноспособное тиофосфатное производное тиа(диа)золуксусной кислоты с общей формулой (II), определенной выше, которое можно использовать как исходный материал при получении цефемного производного с формулой (I), определенной выше.
Еще одной целью изобретения было предложить способ получения нового реакционноспособного тиофосфатного производного тиа(диа)золуксусной кислоты с формулой (II), определенной выше.
Предшествующий материал наметил некоторые из наиболее уместных целей изобретения. Эти цели следует толковать как просто иллюстрирующие некоторые из более подходящих отличительных признаков и применений изобретения. Много других полезных результатов можно получить при применении изобретения в другом виде или модификацией изобретения в рамках объема раскрытия его сущности. Соответственно, другие цели и более подробное понимание изобретения могут быть поняты при обращении к раскрытию сущности изобретения в дополнение к его объему, определенному формулой изобретения.
В одном из своих аспектов изобретение относится к новому способу получения цефемных производных, представленных следующей общей формулой (I), отличающимся тем, что реакционноспособное тиофосфатное производное тиа(диа)золуксусной кислоты с формулой (II) ацилируют производным 7-АЦК с формулой (III) в присутствии растворителя и основания в соответствии со следующей реакционной схемой 1:
В вышеприведенной реакционной схеме
R1 представляет карбоксигруппу или защищенную карбоксигруппу, которая может образовывать соль -COO-M+ с ионом щелочного металла (M+), такого как натрий, или может представлять -COO-, когда R2 имеет заместитель с положительным электрическим зарядом, такой как пиридиний, пиримидиний или тиазолий;
R2 представляет водород, ацилоксиметил, гетероциклический метил или гетероциклический тиометил, каждый из которых может быть замещен надлежащими заместителями;
R3 представляет водород или аминозащищающую группу;
R4 представляет C1-C4-алкил или фенил, или вместе с атомом кислорода или фосфора, к которому он присоединен, может образовывать 5- или 6-членное гетероциклическое кольцо;
R5 представляет водород, C1-C4-алкил или -C(Ra)(Rb)CO2Rc, где Ra и Rb в группе -C(Ra)(Rb)CO2Rc в качестве R5 идентичны или отличаются друг от друга и представляют водород или C1-C4-алкил, или Ra и Rb вместе с атомом углерода, с которым они связаны, могут образовывать C3-C7-циклоалкильную группу и Rc водород или карбоксизащищающая группа;
Q представляет N или CH.
В термине "ацилоксиметил", используемом в описании изобретения, определение "ацил" включает любую обычно известную в области бета-лактамов ацильную группу, такую как карбамоил, алифатические ацильные группы, ацильные группы с ароматическим или гетероциклическим кольцом и т.д. Предпочтительный пример ацильной группы может включать C1-C4-алканоил, такой как формил, ацетил, пропионил, бутирил и т.д. в особенности C1-C2-алканоил.
В терминах "гетероциклический метил" и "гетероциклический тиометил" определение "гетероциклический" может включать насыщенный или ненасыщенный 3-7-членный моноцикл, содержащий по меньшей мере один гетероатом, выбранный из числа атомов азота, кислорода и серы, в кольце, или полицикл, образованный конденсацией двух или более определенных выше моноциклов. Типичным примером указанного гетероцикла является пирролидинил, имидазолинил, пиперидино, пиперазинил, морфолинил, тиазолидинил, пирролил, пирролинил, имидазолил, пиразолил, пиридил, пиримидинил, пиразинил, пиридазинил, тиазолил (например, 4H-1,2,4-триазолил и т.д.), оксазолил, изоксазолил, оксадиазолил (например, 1,2,4-оксадиазолил и т. д.), тиазолил, тиазолинил, тиадиазолил (например, 1,2,4-тиадиазолил), тиенил, индолил, изоиндолил, индолинил, бензотриазолил, тетразолопиридил, хинолил, изохинолил, бензоксазолил, бензотиазолил и т. д. который может, если возможно, нести в кольце положительный заряд как в случае пиридиния, пиримидиния, тиазолия и т.д. а также может быть замещен от 1 до 4 подходящими заместителями. В этом случае предпочтительный пример подходящих заместителей может включать C1-C4-алкил (например, метил, этил, пропил, изопропил, трет-бутил и т.д.), C2-C4-алкенил (например, этенил, 1-пропенил, аллил, 1,3-бутадиенил и т.д.), C2-C4-алкинил (например, этинил, 1- или 2-пропинил, и т.д.), C3-C6-циклоалкил (например, циклопропил, циклопентил и т.д.), галоген (например, хлор, фтор, иод и т.д.), замещенную или незамещенную аминогруппу (например, амино-, метиламино-, этиламино-, N, N-диметиламино-N, N-диэтиламиногруппу и т.д.), фенил, который замещен или незамещен гидроксигруппой, и т.д.
Способ по изобретению, изображенный на реакционной схеме 1, отличается использованием реакционноспособного тиофосфатного производного с формулой (II) с подходящей реакционной способностью и стабильностью в качестве реакционноспособного производного органической кислоты и поэтому может быть широко использован для синтеза известных в настоящее время цефалоспориновых соединений, содержащих 2-[амино-тиа(диа)золил] -2-метоксииминоацетамидную группу в положении 7 цефемового ядра.
В реакции способа по изобретению реакционноспособное тиофосфатное производное органической кислоты с формулой (II) выгодно использовать в слегка избыточном количестве по отношению к соединению с формулой (III) с целью доведения реакции до конца, как правило, реакционноспособное тиофосфатное производное органической кислоты с формулой (II) можно использовать в количестве от 1,0 до 1,5 эквивалентного веса по отношению к соединению с формулой (III). Однако с точки зрения доведения реакции до конца и экономии предпочтительно использовать реакционноспособное тиосфатное производное с формулой (II) в количестве от 1,0 до 1,2 эквивалентного веса по отношению к соединению с формулой (III).
В качестве основания в реакции по изобретению предпочтительно могут быть использованы как неорганическое основание, так и органическое основание. Неорганическое основание, которое можно использовать для этой цели, может включать карбонаты и бикарбонаты щелочноземельного металла, также как гидрокарбонат натрия, карбонат натрия, гидрокарбонат калия, карбонат калия и т. д. В качестве органического основания можно использовать третичный амин, такой как триэтиламин, три-н-бутиламин, диизопропилэтиламин, пиридин, N, N-диметиланилин и т.д. Из этих оснований наиболее предпочтительно можно использовать гидрокарбонат натрия, триэтиламин, три-н-бутиламин и т.п.
Хотя используемое количество основания может изменяться в зависимости от типа заместителя R2, обычно основание применяют в количестве от 1,5 до 3,5 эквивалентного веса, предпочтительно от 2,0 до 3,0 эквивалентного веса по отношению к соединению с формулой (III).
В качестве растворителя в реакции по изобретению можно отдельно использовать любой полярный или неполярный растворитель, такой как дихлорметан, дихлорэтан, хлороформ, четыреххлористый углерод, толуол, ксилол, ацетонитрил, этилацетат, диоксан, тетрагидрофуран, ацетон, N, N-диметилформамид, N, N-диметилацетамид, спирты, такие как метиловый спирт, этиловый спирт или изопропиловый спирт, вода и т.д. Однако для оптимизации реакционной способности и выделения продукта реакции также можно эффективно использовать смешанный растворитель из двух или более выбранных из числа вышеупомянутых растворителей, например смешанный растворитель спирт-вода, в особенности смешанный растворитель этиловый спирт-вода.
Хотя используемое количество растворителя не является критичным, обычно растворитель используют в количестве от 8 до 50 мл, предпочтительно от 10 до 30 мл относительно 10 ммоль исходного материала.
Температура реакции по изобретению не должна быть ограничена, если выбранная температура не влияет отрицательно на реакцию по изобретению. Однако для того чтобы быстро получить желаемое соединение, обычно реакция может быть завершена в течение 2-6 ч при 0-30oC, в частности, даже в диапазоне комнатной температуры от 20 до 25oC.
Когда R3 представляет аминозащищающую группу, при желании в вышеприведенной реакционной схеме 1 полученное в результате реакции ацильное соединение можно ввести в реакцию по снятию защиты для удаления защитной группы и получения желаемого соединения с формулой (1), где R3 представляет водород.
Типичный пример соединения, которое можно получить в соответствии со способом по изобретению, может включать следующие:
3-ацетоксиметил-7-[2-(2-амино-4-тиазолил)-2-метоксиимино] ацетамидо-3-цефем-4-карбоновую кислоту (цефотаксим);
7-[[2-(2-амино-4-тиазолил)-2-(Z)-метоксиимино] ацетамидо] -3-[(2,5-дигидро-6-гидрокси-2-метил-5-оксо-1,2,4-триазин-3-ил) тиометил] -3-цефем-4-карбоновую кислоту (цефтриаксон);
7-[[L-(2-амино-4-тиазолил)-2-(Z)-метоксиимино] ацетамидо] -3-[(1-метил-1H-тетразол-5-ил)-тиометил]-цефем-4-карбоновую кислоту (цефменоксим);
7-[2-метоксиимино-2-(2-амино-1,3-тиазол-4-ил)ацетамидо] -3-цефем-4-карбоновую кислоту (цефтизоксим);
7-[[2-(2-амино-4-тиазолил)-2-(Z)-метоксиимино]ацетамидо] -3-(2,3-дициклопентенопиридинийметил)-3-цефем-4-карбоксилат (цефпиром);
7-[[2-(2-амино-4-тиазолил)-2-метоксиимино] ацетамидо] -3-(1-метилпирролидинийметил)-3-цефем-4-карбоксилат (цефепим);
7-[[(Z)-2-(2-амино-4-тиазолил)-2-метоксиимино] ацетамидо] -3-(4,6-диамино-1,1-диметилпиримидиний-2-ил)тиометил-3- цефем-4-карбоксилат;
7-[[(Z)-2-(2-амино-1,2,4-тиазол-3-ил)-2-метоксиимино] -ацетамидо[-3-(4,6-диамино-1-метилпиримидиний-2-ил)тиометил-3-цефем-4-карбоксилат;
7-[[(Z)-2-(2-амино-1,2,4-тиазол-3-ил)-2-метоксиимино] -ацетамидо[-3-(4,6-диамино-1-этилпиримидиний-2-ил)тиометил-3-цефем-4-карбоксилат;
7-[[(Z)-2-(2-амино-4-тиазолил)-2-метоксиимино] -ацетамидо] -3-(1,4,6-триаминопиримидиний-2-ил)тиометил-3-цефем-4-карбоксилат;
7-[[(Z)-2-(2-амино-4-тиазолил)-2-метоксиимино] -ацетамидо] -3-(4,6-диамино-1,5-диметилпиримидиний-2-ил)тиометил-3-цефем-4-карбоксилат;
7-[[(Z)-2-(2-амино-4-тиазолил)-2-метоксиимино] -ацетамидо] -3-(2,6-диамино-1-метилпиримидиний-4-ил)тиометил-3-цефем-4-карбоксилат;
7-[[(Z)-2-(2-амино-4-тиазолил)-2-метоксиимино] -ацетамидо] -3-(2,6-диамино-1-этилпиримидиний-4-ил)тиометил-3-цефем-4-карбоксилат;
7-[[(Z)-2-(2-амино-4-тиазолил)-2-метоксиимино] -ацетамидо-3-(2,6-диамино-3-этилпиримидиний-4-ил)тиометил-3-цефем -4-карбоксилат;
7-[[(Z)-2-(2-амино-4-тиазолил)-2-метоксиимино] -ацетамидо] -3-(2,6-диамино-3-метилпиримидиний-4-ил)тиометил-3-цефем -4-карбоксилат;
7-[[(Z)-2-(2-амино-4-тиазолил)-2-метоксиимино] -ацетамидо] -3-(4,5,6-триамино-1-метилпиримидиний-2-ил)тиометил-3-цефем -4-карбоксилат;
7-[[(Z)-2-(2-амино-4-тиазолил)-2-метоксиимино] -ацетамидо] -3-(4-амино-1-метилпиримидиний-2-ил)тиометил-3-цефем -4-карбоксилат;
7-[[(Z)-2-(2-амино-4-тиазолил)-2-метоксиимино] -ацетамидо] -3-(4-амино-1-метилпиримидиний-2-ил)тиометил-3-цефем -4-карбоксилат;
7-[[(Z)-2-(2-амино-4-тиазолил)-2-метоксиимино] -ацетамидо] -3-(4-амино-1-карбоксиметилпиримидиний-2-ил)тиометил-3-цефем -4-карбоксилат;
7-[[(Z)-2-(2-амино-4-тиазолил)-2-метоксиимино] -ацетамидо] -3-(4-амино-1-аминопиридиний-2-ил)тиометил-3-цефем -4-карбоксилат;
7-[[(Z)-2-(2-амино-4-тиазолил)-2-метоксиимино] -ацетамидо] -3-(1,4,5-триаминопиримидиний-2-ил)тиометил-3-цефем -4-карбоксилат;
7-[[(Z)-2-(2-амино-4-тиазолил)-2-метоксиимино] -ацетамидо] -3-(4-амино-1-метил-6-(N, N-диметил)аминопиримидиний-2-ил)тиометил-3-цефем -4-карбоксилат;
7-[[(Z)-2-(2-амино-4-тиазолил)-2-метоксиимино] -ацетамидо] -3-(1,4,5,6-тетрааминопиримидиний-2-ил)тиометил-3-цефем-4-карбоксилат;
7-[[(Z)-2-(2-амино-4-тиазолил)-2-метоксиимино] -ацетамидо] -3-(1,4-диамино-5-метилпиримидиний-2-ил)тиометил-3-цефем-4-карбоксилат;
7-[[(Z)-2-(2-амино-4-тиазолил)-2-метоксиимино] -ацетамидо] -3-(1,4-диамино-5-этилпиримидиний-2-ил)тиометил-3-цефем-4-карбоксилат;
7-[[(Z)-2-(2-амино-4-тиазолил)-2-метоксиимино] -ацетамидо] -3-(1,4-диамино-6-(N-метил)аминопиримидиний-2-ил)тиометил-3-цефем-4-карбоксилат;
7-[[(Z)-2-(2-амино-4-тиазолил)-2-метоксиимино] -ацетамидо] -3-(1,4-диамино-5-метил-6-(N-метил)аминопиримидиний-2-ил)тиометил-3-цефем-4-карбоксилат;
7-[[(Z)-2-(2-амино-4-тиазолил)-2-метоксиимино] -ацетамидо] -3-(3,4-диамино-3,5,6,7-тетрагидроциклопентапиримидиний-2-ил)тиометил-3-цефем-4-карбоксилат;
7-[[(Z)-2-(2-амино-4-тиазолил)-2-метоксиимино] -ацетамидо] -3-(2-амино-1-метил-1,5,6,7-тетрагидроциклопентапиримидиний-4-ил) тиометил-3-цефем-4-карбоксилат;
7-[[(Z)-2-(2-амино-4-тиазолил)-2-метоксиимино] -ацетамидо]-3-(1,2-диамино-1,5,6,7-тетрагидроциклопентапиримидиний-4-ил)тиометил-3-цефем-4-карбоксилат;
7-[[(Z)-2-(2-амино-4-тиазолил)-2-метоксиимино] -ацетамидо] -3-(7-амино-1-метил[1,2,4] триазоло или [1,5-с] пиримидиний-5-ил) тиометил-3-цефем-4-карбоксилат;
7-[[(Z)-2-(2-амино-4-тиазолил)-2-метоксиимино] -ацетамидо] -3-(1-метил[1,3]имидазо[1,2-с]пиримидний-5-ил)тиометил-3-цефем-4-карбоксилат;
В соответствии со второй целью изобретения в нем также предложено новое реакционноспособное тиофосфатное производное тиа(диа)золуксусной кислоты, представленное следующей общей формулой (II), которое используется как исходный материал в новом способе получения цефемных призводных с вышеприведенной формулой (I):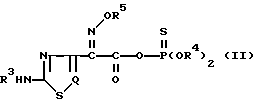 ,
,
где R3 представляет водород или аминозащищающую группу;
R4 представляет C1-C4-алкил или фенил, или вместе с атомом кислорода или фосфора, к которому он присоединен, может образовывать 5- или 6-членное генероциклическое кольцо;
R5 представляет водород, C1-C4-алкил или -C(Ra)(Rb)CO2Rc, где Ra и Rb в группе -C(Ra)(Rb)CO2Rc в качестве R5 идентичны или отличаются друг от друга и представляют водород или C1-C4-алкил, или Ra и Rb вместе с атомом углерода, с которым они связаны, могут образовывать C3-C7-циклоалкильную группу, а Rc водород или карбоксизащищающая группа;
Q представляет N или CH.
По третьему аспекту изобретения оно представляет способ получения нового реакционноспособного тиофосфатного производного, представленного следующей общей формулой (II):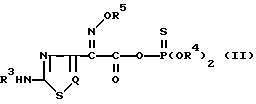 ,
,
где R3, R4, R5 и Q определены так, как было описано ранее, отличающийся тем, что органическую кислоту со следующей общей формулой (IV):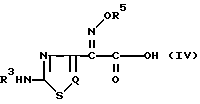 ,
,
где R3, R5 и Q определены так, как было описано ранее, вводят в реакцию с хлортиофосфатным производным со следующей общей формулой (V):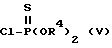 ,
,
где R4 определен так, как было описано ранее, в растворителе в присутствии основания и катализатора.
В соединении с формулой (II) по изобретению предпочтительно R3 представляет водород или трифенилметил, R4 представляет метил, этил или фенил, а R5 представляет водород, метил, этил или трет-бутоксикарбонилизопропил.
Более предпочтительными соединениями с формулой (II) по изобретению являются следующие: диэтилтиофосфорил-(Z)-(2-аминотиазол-4-ил)метоксииминоацетат; диэтилтиофосфорил-(Z)-2-трифенилметиламинотиазол-4-ил) метоксииминоацетат; диэтилтиофосфорил-(Z)-(2-аминотиазол-4-ил)-2-(трет-бутоксикарбонил)-изопропоксииминоацетат; диэтилтиофосфорил- (Z)-(2-аминотиазол-4-ил)этоксииминоацетат; диэтилтиофосфорил-(Z)-(2-трифенилметиламинотиазол-4-ил)этоксииминоацетат; диэтилтиофосфорил-(Z)-(2-трифенилметиламинотиазол-4-ил)-2-(трет-бутоксикарбонил)изопропоксииминоацетат или диэтилтиофосфорил-(Z)-(3-амино-1,2,4-тиадиазол-5-ил)этоксииминоацетат.
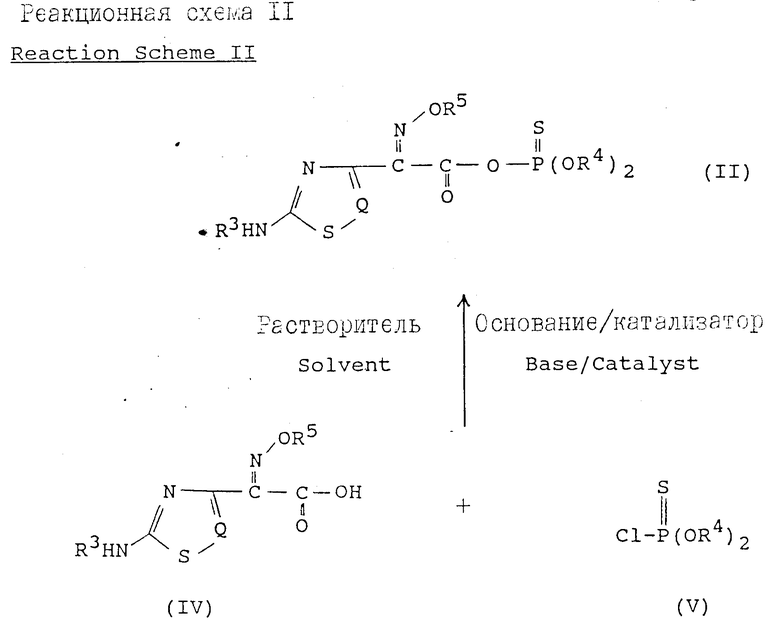
Способ получения реакционноспособного тиофосфатного производного органической кислоты с формулой (II) по изобретению можно представить следующей схемой реакции II:
где R3, R4, R5 и Q определены так, как было описано ранее.
В вышеприведенной схеме реакции аминозащищающая группа в качестве R3 обозначает обычную аминозащищающую группу, такую как замещенный или незамещенный ацил, замещенный или незамещенный арил(низший)алкил (например, бензил, дифенилметил, трифенилметил, 4-метоксибензил и т.д.), галоид(низший)алкил (например, трихлорметил, трихлорэтил и т.д.), тетрагидропиранил, замещенная фенилтиогруппа, замещенный алкилиден, замещенный арилалкилиден, замещенный циклоалкилиден и т. п. Подходящим ацилом в качестве аминозащищающей группы может быть алифатическая ацильная группа или ацильная группа с ароматическим или гетероциклическим фрагментом. Такая ацильная группа включает, например, низший алканоил с 1-6 атомами углерода (например, формил, ацетил и т.д.), алкоксикарбонил с 2-6 атомами углерода (например, метоксикарбонил, этоксикарбонил и т.д.), низший алкансульфонил (например, метансульфонил, этансульфонил и т.д.) или арил(низший)-алкоксикарбонил (например, бензилоксикарбонил и т.д.) и подобные. Вышеупомянутая ацильная группа может содержать от одного до трех подходящих заместителей, выбранных из числа галогена, гидрокси-, циано-, нитрогруппы и т.п. Кроме того, в качестве аминозащищающей группы может выступать продукт реакции аминогруппы с силаном, бораном, соединением фосфора и т.п.
Когда в группе -C(Ra)(Rb)CO2(Rc), в качестве R5 и Rc является карбоксилзащищающей группой, подходящие примеры карбоксилзащищающей группы включают (низший)алкиловый сложный эфир (например, метиловый сложный эфир, трет-бутиловый сложный эфир и т. д.), (низший)алкениловый сложный эфир (например, виниловый сложный эфир, аллиловый сложный эфир и т.д.), (низший)алкокси(низший)алкиловый сложный эфир (например, метоксиметиловый сложный эфир и т. д. ), (низший)-алкилтио(низший)алкиловый сложный эфир (например, метилтиометиловый сложный эфир и т.д.), галоген(низший)алкиловый сложный эфир (например, 2,2,2-трихлорэтиловый сложный эфир и т.д.), замещенный или незамещенный арилалкиловый сложный эфир (например, бензиловый сложный эфир, пара-нитробензиловый сложный эфир и т.д.) или силиловый сложный эфир и т.п.
При получении реакционноспособного тиофосфатного производного с формулой (II) в соответствии со способом по изобретению, изображенным на вышеприведенной схеме реакции (II), соединение с формулой (V) обычно используют в количестве от 0,5 до 2,0 эквивалентного веса предпочтительно от 1,0 до 1,3 эквивалентного веса по отношению к органической кислоте с формулой (IV). Кроме того, реакцию можно осуществлять в отсутствии какого-либо катализатора. Однако реакция в отсутствии катализатора требует долгого времени проведения и может приводить к некоторым побочным продуктам. Наоборот, в том случае, когда реакцию осуществляют в присутствии подходящего катализатора, реакция завершается за короткое реакционное время, в мягких условиях и без образования побочных продуктов.
Хотя подходящий катализатор, который можно использовать в реакции в соответствии с реакционной схемой (II), включает третичные амины, четвертичные аммонийные или фосфониевые соединения и т.п. в любом случае нужно выбирать катализатор с оптимальными свойствами, поскольку скорость реакции может изменяться в зависимости от используемой органической кислоты с формулой (IV), типа и количества катализатора и т.п. Примеры катализатора третичного амина могут включать 2,4-диметил-2,4-диазапентан, 2,5-диметил-2,5-диагагексан, N, N- N', N'-тетраметил-1,2-диаминоциклогексан, 1,4-диметил-1,4- диазациклогексан, 2,7-диметил-2,7-диаза-4-октан, 1,4-диазабицикло[2,2,2] октан, 2,6-диметил-2,6-диазагептан, 2,9-диметил-2,9-диазадекан, 2,5,8,11-тетраметил-2,5,8,11-тетраазадодекан и т.п. Подходящий пример четвертичного аммонийного соединения может включать тетра-н-бутиламмонийбромид, тетра-н-бутиламмонийхлорид, цетилтриметиламмонийбромид, тетра-н-бутиламмонийиодид, метилтри(C8-C10)алкиламмонийхлорид, метил-три-2-метилфениламмонийхлорид и т. п. Кроме того, в качестве фосфониевого соединения предпочтительно использовать тетра-н-бутилфосфонийбромид. Обычно катализатор используют в соотношении от 0,1 до 50% предпочтительно от 0,5 до 5% на основе мольного количества по отношению к органической кислоте с формулой (IV).
В реакции в соответствии с реакционной схемой II изобретения в качестве растворителя можно использовать полярный или неполярный органический растворитель, такой как дихлорметан, дихлорэтан, хлороформ, четыреххлористый углерод, толуол, ксилол, ацетонитрил, этилацетат, диоксан, тетрагидрофуран, ацетон, N, N-диметилформамид, N, N-диметилацетамид и т.п. Однако для того, чтобы обеспечить оптимальную реакционную способность и наивысший выход продукта реакции, можно также использовать смешанный растворитель из двух или более выбранных вышеприведенных растворителей.
Подходящее основание, которое может быть использовано в схеме реакции II, включает неорганическое основание, например карбонаты или гидрокарбонаты щелочноземельного металла, такие как гидрокарбонат натрия, карбонат натрия, гидрокарбонат калия, карбонат калия и т.п. и органическое основание, например третичный амин, такой как триэтилендиамин, три-н-бутиламин, диизопропилэтиламин; пиридин, N, N-диметиланилин и т.д. Наиболее предпочтительно использовать диизопропилэтиламин или три-н-бутиламин.
В реакции в соответствии с реакционной схемой II температура может изменяться в диапазоне от -40 до 60oC, предпочтительно от -15 до 25oC. В частности, когда температуру реакции регулируют от 0 до 20oC, реакцию можно завершить за 1-3 ч и легко получить желаемое соединение с формулой (II) в мягких условиях.
Реакционноспособное тиофосфатное производное органической кислоты с формулой (II), полученное в соответствии со способом изобретения, обладает уникальным физико-химическим свойством. Точнее, реакционноспособное тиофосфатное производное органической кислоты с формулой (II) обладает хорошей растворимостью в полярном или неполярном органическом растворителе, а также обладает хорошей стабильностью, так что его нельзя разложить с образованием органической кислоты (IV) даже тогда, когда реакционноспособное тиофосфатное производное органической кислоты, растворенное в таком растворителе, промывают кислой, щелочной или нейтральной водой. Кроме того, когда реакционноспособное тиофосфатное производное органической кислоты с формулой (II) используют в реакции ацилирования с аминогруппой β -лактамного ядра, эту реакцию можно легко провести даже в мягких условиях, и производное тиофосфорной кислоты, образующееся как побочный продукт, присутствует в водном слое в растворенном состоянии и, следовательно, может быть легко удалено.
Кроме того, в реакции по изобретению, хотя соединение с формулой (II) можно ввести в реакцию ацилирования после защиты группы R3 аминозащищающей группой, ацилирование также можно провести с соединением с формулой (II) без аминозащищающей группы без каких-либо ограничений. Соответственно, когда способ по изобретению применяют к получению соединения с формулой (I) в промышленном масштабе, существует большое преимущество в том, что конечные b -лактамные антибиотики можно легко синтезировать с высоким выходом и с высокой чистотой.
Далее изобретение будет более конкретно пояснено на основе последующих примеров. Однако поскольку основной отличительный признак изобретения содержится в реакционноспособном тиофосфатном производном органической кислоты с формулой (II) и его применении для получения желаемого соединения, описанного выше, технический объем изобретения не следует ограничивать последующими примерами, если данный состав отличий изобретения не будет изменен.
Пример 1. Синтез диэтилтиофосфорил-(Z)-(2-аминотиазол-4-ил)- метоксииминоацетата
(Z)-(2-аминотиазол-4-ил)-матоксииминоуксусную кислоту (20,1 г), три-н-бутиламин (24,10 г) и 1,4-диазабицикло[2,2,2] октан (0,11 г) суспендировали в сухом дихлорметане (200 мл) и затем к ним по каплям в течение 20 мин добавляли диэтилхлортиофосфат (24,52 г) при содержании смеси при 0-5oC в охлажденной бане в атмосфере азота. Реакционную смесь перемешивали дополнительно 2 ч. После завершения реакции к реакционному раствору добавляли дистиллированную воду (300 мл), после чего смесь перемешивали 5 мин. Органический слой отделяли, промывали последовательно 5%-ным водным раствором бикарбоната натрия (300 мл) и насыщенным солевым раствором 300 мл, осушали сульфатом магния, фильтровали и затем концентрировали при пониженном давлении. К концентрированному раствору добавляли нормальный гексан (400 мл) для отверждения продукта, который затем отфильтровывали, промывали нормальным гексаном (100 мл) и осушали; получено 33,2 г (выход 94,0%) указанного в заголовке соединения в виде бледно-желтого твердого вещества.
Температура плавления: 87-88oC.
ЯМР (V, CDCI3): 1,38 (т, 6Н), 4,05 (с, 3Н), 4,31 (м, 4Н), 5,49 (шс, 2Н), 6,87 (с, 1Н).
Пример 2. Синтез диэтилтиофосфорил-(Z)-(2-аминотиазол-4-ил)-2-(трет-бутоксикарбонил) изопропоксииминоацетата
(Z)-(2-аминотиазол-4-ил)-2-(трет-бутоксикарбонил)изопропоксииминоуксусную кислоту (32,9 г), три-н-бутиламин (22,25 г) и 1,4-диазабицикло [2,2,2]октан (0,11 г) растворяли в сухом N, N -диметилацетамиде (100 мл) и затем к ним по каплям в течение 20 мин добавляли диэтилхлортиофосфат (22,63 г) при содержании реакционного раствора при 0-5oC в охлаждающей бане. Реакционную смесь дополнительно перемешивали 2 ч. К реакционному раствору добавляли этилацетат (300 мл) и дистиллированную воду (300 мл), после чего смесь перемешивали 5 мин. Органический слой отделяли, промывали последовательно 5%-ным водным раствором бикарбоната натрия (300 мл) и насыщенным солевым раствором (300 мл), осушали сульфатом магния, фильтровали и затем концентрировали при пониженном давлении. К концентрирированному раствору добавляли циклогексан (100 мл) для отверждения продукта, который затем отфильтровывали, промывали циклогексаном (50 мл) и сушили; получено 44,26 г (выход 92%) указанного в заголовке соединения в виде бледного белого вещества.
Температура плавления: 114-115oC.
ЯМР (V, CDCI3): 1,39 (т, 6Н), 1,46 (с, 9Н), 1,50 (с, 6Н), 4,32 (м, 4Н), 6,74 (с,1Н), 6,79 (шс, 2Н).
Пример 3. Синтез диэтилтиофосфорил-(Z)-(2-аминотиазол-4-ил)- этоксииминоацетата
Исходя из (Z)-(2-аминотиазол-4-ил)-этоксииминоуксусной кислоты (21,5 г) получено 33,04 г (выход 90%) указанного в заголовке соединения в соответствии с методикой, аналогичной примеру 2.
Температура плавления: 118-119oC.
ЯМР (V, CDCI3): 1,35 (м, 9Н), 4,32 (м, 6Н), 5,67 (шс, 2Н), 6,82 (с, 1Н).
Пример 4. Синтез диэтилтиофосфорил-(Z)-(2-трифенилметиламинотиазол-4-ил)этоксииминоацетата
Исходя из (Z)-(2-трифенилметиламинотиазол-4-ил)этоксииминоуксусной кислоты (45,7 г) получено 57,2 г указанного в заголовке соединения в соответствии с методикой, аналогичной примеру 1.
Температура плавления: 98-99oC.
ЯМР (V, CDCI3): 1,35 (м, 9Н), 4,32 (м, 6Н), 6,62 (с, 1Н), 7,02 (шс, 2Н), 7,32 (м, 15Н).
Пример 5. Синтез диэтилтиофосфорил-(Z)-(2-трифенилметиламино-тиазол-4-ил)метоксииминоацетата
Исходя из (Z)-(2-трифенилметиламинотиазол-4-ил)метоксииминоуксусной кислоты (44,3 г) получено 57,4 г указанного в заголовке соединения в соответствии с методикой, аналогичной примеру 1.
Температура плавления: 101-103oC.
ЯМР (V, CDCI3): 1,32 (м, 6Н), 4,02 (с, 3Н), 4,28 (м, 4Н), 6,62 (с, 1Н), 7,00 (шс, 1Н), 7,28 (м, 15Н).
Пример 6. Синтез диэтилтиофосфорил-(Z)-(2-трифенилметиламино-тиазол-4-ил) -2-(трет-бутоксикарбонил)изопропоксииминоацетата
Исходя из (Z)-(2-трифенилметиламинотиазол-4-ил)-2-(трет-бутоксикарбонил)изопропоксииминоуксусной кислоты (57,1 г) получено 68,46 г указанного в заголовке соединения в соответствии с методикой, аналогичной примеру 1.
Температура плавления: 101-103oC.
ЯМР (V, CDCI3): 1,33 (т, 6Н), 1,41 (с, 9Н), 1,52 (с, 6Н), 4,30 (м, 4Н), 6,63 (с, 1Н), 6,80 (шс, 1Н), 7,25 (м, 15Н).
Пример 7. Синтез диэтилтиофосфорил-(Z)-(3-амино-1,2,4-тиадиазол-5-ил)этоксииминоацетата
Исходя из (Z)-(3-амино-1,2,4-тиадиазол-5-ил)этоксииминоуксусной кислоты (21,6 г) получено 33 г указанного в заголовке соединения в соответствии с методикой, аналогичной примеру 1.
Температура плавления: 132-133oC.
ЯМР (V, CDCI3): 1,37 (м, 9Н), 4,36 (м, 6Н), 6,49 (шс, 2Н).
Пример 8. Синтез 3-ацетоксиметил-7-[2-(2-амино-4-тиазолил)-2-метоксиимино]-ацетамидо-3-цефем-4-карбоновой кислоты (цефотаксим)
К дистиллированной воде (200 мл) и тетрагидрофурану (200 мл) и однолитровой круглодонной колбе при перемешивании последовательно добавляли 7-аминоцефалоспорановую кислоту (54,46 г) и диэтилтиофосфорил-(Z)-(2-аминотиазол-4-ил)-метоксииминоацетат (77,74 г). После добавления три-н-бутиламина (74,15 г) реакционную смесь перемешивали 3 ч, поддерживая температуру от 20 до 25oC, после чего проводили экстракцию 12%-ным водным раствором бикарбоната натрия (453 г) и этилацетатом (100 м) для удаления органического слоя. Отделенный водный слой снова экстрагировали этилацетатом (100 мл) для удаления органического слоя. После этого водный слой нейтрализовали до pH 6 20% -ным водным раствором серной кислоты. К нейтрализованному водному раствору добавляли активный уголь (10 г) и затем смесь перемешивали 30 мин и фильтровали. Фильтрат насыщали хлоридом натрия. pH насыщенного водного раствора доводили до 4 путем добавления 20%-ного водного раствора серной кислоты. После добавления малого количества указанного в заголовке соединения pH смеси доводили до 2,5 путем дальнейшего добавления 20%-ного водного раствора серной кислоты. Тщательно осаждали кристалл, отфильтровывали, промывали водой и затем осушали; получено 83,3 г (выход 92%) указанного в заголовке соединения в виде бледно-желтого твердого вещества.
Чистота по ЖХВД: 98,5%
Пример 9. Синтез 3-ацетоксиметил-7-[2-(2-амино-4-тиазолил)-2-метоксиимино]-ацетамидо-3-цефем-4-карбоновой кислоты (цефотаксим)
Дистиллированную воду (200 мл), 7-аминоцефалоспорановую кислоту (54,46 г) и гидрокарбонат натрия (33,6 г) помещали в однолитровую круглодонную колбу и оставляли при перемешивании при комнатной температуре до полного растворения. К этому реакционному раствору добавляли тетрагидрофуран (200 мл) и диэтилтиофосфорил-(Z)-(2-аминотиазол-4-ил)-метоксииминоацетат (77,74 г) и смесь перемешивали 5 ч при температуре от 20 до 25oC. Реакционный раствор экстрагировали этилацетатом (100 мл) для удаления органического слоя, и отделенный водный слой снова экстрагировали этилацетатом (100 мл) и затем нейтрализовали до pH 6 путем добавления 20%-ного водного раствора серной кислоты. К нейтрализованному водному раствору добавляли активный уголь (10 г) и затем смесь перемешивали в течение 30 мин и фильтровали. Фильтрат насыщали хлоридом натрия. pH насыщенного водного раствора доводили до 4 путем добавления 20%-ного водного раствора серной кислоты. После добавления малого количества указанного в заголовке соединения смесь снова доводили до pH 2,5 путем дальнейшего добавления 20%-ного водного раствора серной кислоты. После того, как кристалл был тщательно осажден, его фильтровали, промывали водой и затем осушали; получено 81,07 г (выход 89%) указанного в заголовке соединения в виде бледно-желтого твердого вещества.
Чистота по ЖХВД: 98,6%
Пример 10. Синтез 3-ацетоксиметил-7-[2-(2-амино-4-тиазолил)-2-метоксиимино]-ацетамидо-3-цефем-4-карбоновой кислоты (цефотаксим)
77,43 г (выход 85%) указанного в заголовке соединения было получено по той же методике, как в примере 9, за исключением того, что вместо гидрокарбоната натрия использовали триэтиламин (40,48 г).
Чистота по ЖХВД: 98,4%
Пример 11. Синтез 3-ацетоксиметил-7-[2-(2-амино-4-тиазолил)-2-метоксиимино]ацетамидо-3-цефем-4-карбоновой кислоты (цефотаксим)
82,0 г (выход 90%) указанного в заголовке соединения было получено по той же методике, как в примере 8, за исключением того, что вместо дистиллированной воды и тетрагидрофурана использовали N, N -диметилацетамид (100 мл) и дихлорметан (400 мл), а вместо этилацетата как экстрагирующего растворителя использовали дихлорметан (100 мл).
Чистота по ЖХВД: 98,6%
Пример 12. Синтез 3-ацетоксиметил-7-[2-(2-амино-4-тиазолил)-2-метоксиимино]-ацетамидо-3-цефем-4-карбоновой кислоты (цефотаксим)
К 95% -ному этиловому спирту (400 мл) в однолитровой круглодонной колбе при перемешивании последовательно добавляли 7-аминоцефалоспорановую кислоту (54,46 г) и диэтилтиофосфорил-(Z)-(2-аминотиазол-4-ил)метоксииминоацетат (77,74 г). После добавления триэтиламино (40,48 г) реакционную смесь перемешивали 3 ч, поддерживая температуру от 20 до 25oC и затем к ней добавляли концентрированную соляную кислоту (31,25 г), разбавленную 95%-ным этиловым спиртом (200 мл). Для того чтобы тщательно осадить кристаллы, смесь энергично перемешивали около 1 ч. Выпавшие кристаллы отфильтровывали, промывали водой и затем сушили; получено 83,8 г (выход 92%) указанного в заголовке соединения в виде белого твердого вещества.
Чистота по ЖХВД: 98,6%
Пример 13. Синтез 3-ацетоксиметил-7-[2-(2-амино-4-тиазолил)-2-метоксиимино]-ацетамидо-3-цефем-4-карбоновой кислоты (цефотаксим)
82,0 г (выход 90%) указанного в заголовке соединения было получено по той же методике, как в примере 12, за исключением того, что вместо этилового спирта использовали дистиллированную воду (100 мл) и изопропиловый спирт (400 мл).
Чистота по ЖХВД: 98,4%
Пример 14. Синтез 7-[[2-(2-амино-4-тиазолил)-2-(Z)-метоксиимино]-ацетамидо] -3-[(2,5-дигидро-6-гидрокси-2-метил-5-оксо-1,2,4-триазин-3-ил)-тиометил]-3-цефем-4-карбоновой кислоты (цефтриаксон)
К дистиллированной воде (200 мл) и тетрагидрофурану (200 мл) в однолитровой круглодонной колбе при перемешивании последовательно добавляли 7-амино-3-[(2,5-дигидро-6-гидроокси-2-метил-5-оксо-1,2,4-триазин-3-ил)- тиометил] -3-цефем-4-карбоновую кислоту (37,1 г), диэтилтиофосфорил-(Z)-(2-аминотиазол-4-ил)метоксииминоацетат (38,8 г) и три-н-бутиламин (55,7 г). Данный реакционный раствор перемешивали 3 ч, поддерживая температуру от 20 до 25oC, после чего к нему добавили толуол (200 мл) для удаления органического слоя. Водный слой был доведен до pH 3 с помощью 20%-ного водного раствора серной кислоты. Раствор, содержащий осадившийся продукт, тщательно перемешивали один час при охлаждении льдом. Полученный продукт отфильтровывали, промывали водой и затем сушили; получено 50,7 г (выход 91,5%) указанного в заголовке соединения.
Чистота по ЖХВД: 99,3%
Пример 15. Синтез 7-[[2-(2-амино-4-тиазолил)-2-(Z)-метоксиимино]-ацетамидо] -3-[(2,5-дигидро-6-гидрокси-2-метил-5-оксо-1,2,4-триазин-3-ил)-тиометил]-3-цефем-4-карбоновой кислоты (цефтриаксон)
К 95% -ному этиловому спирту (400 мл) в однолитровой круглодонной колбе при перемешивании последовательно добавляли 7-амино-3-[(2,5-дигидро-6-гидроокси-2-метил-5-оксо-1,2,4-триазин -3-ил)тиометил] -3-цефем-4-карбоновую кислоту (37,1 г), диэтилтиофосфорил-(Z)-(2-аминотиазол-4-ил)метоксииминоацетат (38,8 г) и триэтиламин (30,36 г). Этот реакционный раствор перемешивали 3 ч, поддерживая температуру от 20 до 25oC, а затем к нему добавляли концентрированную соляную кислоту (26,04 г), разбавленную 95% -ным этиловым спиртом (200 мл). Раствор, содержащий осадившийся продукт, тщательно перемешивали один час при охлаждении льдом. Полученный продукт отфильтровывали, промывали водой и сушили; получено 50,7 г (выход 91,5%) указанного в заголовке соединения.
Чистота по ЖХВД: 99,3%
Пример 16. Синтез 7-[[2-(2-амино-4-тиазолил)-2-(Z)-метоксиимино]-ацетамидо] -3-[(1-метил-1Н-тетразол-5-ил)тиометил] -3-цефем-4-карбоновой кислоты (цефменоксим)
В однолитровую круглодонную колбу добавили дистиллированную воду (100 мл), 7-амино-3-[(1-метил-1Н-тетразол-5-ил)-тиометил] -3-цефем-4-карбоновую кислоту (32,8 г) и гидрокарбонат натрия (16,8 г), и смесь оставляли перемешиваться при комнатной температуре до полного растворения. Затем к ней добавляли диэтилтиофосфорил-(Z)-(2-аминотиазол-4-ил)метоксииминоацетат (38,8 г), растворенный в тетрагидрофуране (100 мл), и реакционную смесь перемешивали 5 ч при 20-25oC. К реакционному раствору добавляли этилацетат (2 х 100 мл) для отделения органического слоя. Затем водный слой доводили до pH 3,1 с помощью 2 н. водного раствора соляной кислоты и перемешивали один час при охлаждении льдом. Полученный осадок отфильтровывали, промывали водой и сушили; получено 46,3 г (выход 90,6%) указанного в заголовке соединения.
Чистота по ЖХВД: 99,4%
Пример 17. Синтез 7-[[2-(2-амино-4-тиазолил)-2-(Z)-метоксиимино]-ацетамидо] -3-[(1-метил-1Н-тетразол-5-ил)тиометил] -3-цефем-4-карбоновой кислоты (цефменоксим)
К 95% -ному этиловому спирту (400 мл) в однолитровой круглодонной колбе при перемешивании последовательно добавляли 7-амино-3-[(1-метил-1Н-тетразол-5-ил)тиометил] -3-цефем-4-карбоновую кислоту (32,8 г), диэтилтиофосфорил-(Z)-2-(2-аминотиазол-4-ил)метоксииминоацетат (38,8 г) и триэтиламин (20,24 г). Затем смесь перемешивали 5 ч при 20-25oC и к ней добавляли концентрированную соляную кислоту (15,63 г), разбавленную 95%-ным этиловым спиртом (200 мл). Реакционную смесь перемешивали один час при охлаждении льдом. Полученный осадок отфильтровывали, промывали водой и затем сушили; получили 46,3 г (выход 90,6%) указанного в заголовке соединения.
Чистота по ЖХВД: 99,4%
Пример 18. Синтез 7-[[2-метоксиимино-2-(2-амино-1,3-тиазол-4-ил)]ацетамидо]-3-цефем-4-карбоновой кислоты (цефтизоксим)
В однолитровую круглодонную колбу добавляли дистиллированную воду (100 мл), 7-амино-3-цефем-4-карбоновую кислоту (20 г) и гидрокарбонат натрия (16,8 г), и смесь оставляли перемешиваться при комнатной температуре до полного растворения. Затем к ней добавляли диэтилтиофосфорил-(Z)-2-(2-аминотиазол-4-ил)метоксииминоацетат (38,8 г), растворенный в тетрагидрофуране (100 мл), и реакционную смесь перемешивали при 20-25oC в течение 5 ч. К реакционному раствору добавляли этилацетат (2 х 100 мл) для отделения органического слоя. Затем водный слой доводили до pH 3 с использованием 2 н. водного раствора соляной кислоты и перемешивали один час при охлаждении льдом. Полученный осадок отфильтровывали, промывали водой и затем сушили; получено 35,8 г (выход 93,4%) указанного в заголовке соединения.
Чистота по ЖХВД: 98,4%
Пример 19. Синтез 7-[[2-метоксиимино-2-(2-амино-1,3-тиазол-4-ил)]ацетамидо]-3-цефем-4-карбоновой кислоты (цефтизоксим)
К 95% -ному этиловому спирту (400 мл) в однолитровой круглодонной колбе при перемешивании последовательно добавляли 7-амино-3-цефем-4-карбоновую кислоту (20 г), диэтилтиофосфорил-(Z)-2-(2-аминотиазол-4-ил)метоксииминоацетат (38,8 г) и триэтиламин (20,24 г). Затем реакционную смесь перемешивали при 20-25oC в течение 5 ч и к ней добавляли концентрированную соляную кислоту (15,63 г), разбавленную 95%-ным этиловым спиртом (200 мл). Реакционную смесь перемешивали один час при охлаждении льдом. Полученный осадок отфильтровывали, промывали водой и затем сушили; получено 35,8 г (выход 93,4%) указанного в заголовке соединения.
Чистота по ЖХВД: 98,4%
Пример 20. Синтез соли 7-[[2-(2-амино-4-тиазолил)-2-(Z) -метоксииминоацетамидо] -3-(2,3-циклопентенопиридинийметил)-3-цефем-4-карбоксилата (цефпиром) с серной кислотой
К дистиллированной воде (100 мл) и тетрагидрофурану (100 мл) в однолитровой круглодонной колбе при перемешивании последовательно добавляли гидроиодид 7-амино-3-(2,3-циклопентенопиридинийметил)-3-цефем-4-карбоксилата (45,9 г), диэтилтиофосфорил-(Z)-(2-аминотиазол-4-ил)метоксииминоацетат (38,8 г) и три-н-бутиламин (37,2 г). Этот реакционный раствор перемешивали 3 ч, поддерживая температуру от 20 до 25oC и затем к нему добавляли этилацетат (2 х 100 мл) для удаления органического слоя. Водный слой доводили до pH 1,2 с помощью 20%-ного раствора серной кислоты. К этому раствору медленно добавляли этиловый спирт (300 мл), поддерживая температуру от 0 до 5oC и затем смесь тщательно перемешивали 1 ч. Полученный осадок отфильтровывали, промывали водой и затем сушили; получено 47,1 г (выход 76,9%) указанного в заголовке соединения.
Чистота по ЖХВД: 98,1%
Пример 21. Синтез соли 7-[[2-(2-амино-4-тиазолил)-2-(Z) -метоксиимино] ацетамидо] -3-(2,3-циклопентенопиридинийметил)-3-цефем-4-карбоксилата (цефпиром) с серной кислотой
К 95% -ному этиловому спирту (400 мл) в однолитровой круглодонной колбе при перемешивании последовательно добавляли гидроиодид 7-амино-3-(2,3-циклопентенопиридинийметил)-3-цефем-4-карбоксилата (45,9 г), диэтилтиофосфорил-(Z)-(2-аминотиазол-4-ил)метоксииминоацетат (38,8 г) и триэтиламин (20,2 г). Реакционный раствор перемешивали 3 ч, поддерживая температуру от 20 до 25oC и затем к нему добавляли концентрированную серную кислоту (12,25 г), разбавленную 95%-ным этиловым спиртом (300 мл). Смесь перемешивали один час, поддерживая температуру от 0 до 5oC. Полученный осадок отфильтровывали, промывали водой и затем сушили; получено 47,1 г (выход 76,9% указанного в заголовке соединения.
Чистота по ЖХВД: 98,1%
Пример 22. Синтез соли 7-[[2-(2-амино-4-тиазолил)-2-метоксиимино]ацетамидо] -3-(1-метилпирролидинийметил)-3-цефем-карбоксилата (цефепим) с серной кислотой
К дистиллированной воде (100 мл) и тетрагидрофурану 100 в однолитровой круглодонной колбе при перемешивании последовательно добавляли гидроиодид 7-амино-3-(1-метилпирролидинийметил)-3- цефем-4-карбоксилата (43,4 г), диэтилтиофосфорил-(Z)-(2-аминотиазол-4-ил)метоксииминоацетат (38,8 г) и триэтиламин (20,2 г). Этот реакционный раствор перемешивали 4 ч, поддерживая температуру от 20 до 25oC и затем к нему добавляли этилацетат (2 х 100 мл) для удаления органического слоя. К водному слою добавляли активный уголь (5 г) и смесь перемешивали 30 мин, а затем фильтровали. Фильтрат доводили до pH 1,2 с помощью 20%-ного водного раствора серной кислоты и затем к нему медленно добавляли ацетон (400 мл). Смесь перемешивали один час. Полученный осадок отфильтровывали, промывали водой и затем сушили; получено 45,1 г (выход 78%) указанного в заголовке соединения.
Чистота по ЖХВД: 97,1%
Пример 23. Синтез соли 7-[[2-(2-амино-4-тиазолил)-2-метоксиимино]-ацетамидо]-3-(1-метилпирролидинийметил)-3-цефем-4-карбоксилата (цефепим) с серной кислотой
К 95% -ному этиловому спирту (400 мл) в однолитровой круглодонной колбе при перемешивании последовательно добавляли гидроиодид 7-амино -3-(1-метилпирролидинийметил)-3-цефем-4-карбоксилата (43,4 г), диэтилтиофосфорил-(Z)-(2-аминотиазол-4-ил)метоксииминоацетат (38,8 г) и триэтиламин (20,2 г). Реакционный раствор перемешивали 4 ч, поддерживая температуру от 20 до 25oC и затем к нему добавляли активный уголь (5 г). После этого смесь перемешивали 30 минут и затем фильтровали. К фильтрату добавляли концентрированную серную кислоту (12,25 г), разбавленную 95%-ным этиловым спиртом (400 мл), и смесь перемешивали один час, поддерживая температуру от 0 до 5oC. Полученный осадок отфильтровывали, промывали водой и затем сушили; получено 45,1 г (выход 78%) указанного в заголовке соединения.
Чистота по ЖХВД: 97,1%
Хотя изобретение было описано в его предпочтительной форме с определенной степенью конкретности, специалистам понятно, что описание предпочтительной формы было сделано только путем примера и что можно прибегнуть к различным изменениям в деталях структуры, комбинации и расположения его частей без отхода от сущности и объема изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ЦЕФАЛОСПОРИНА И ИХ ФАРМАКОЛОГИЧЕСКИ ПРИЕМЛЕМЫЕ НЕТОКСИЧНЫЕ СОЛИ, ФИЗИОЛОГИЧЕСКИ ГИДРОЛИЗУЕМЫЕ СЛОЖНЫЕ ЭФИРЫ, СИН-ИЗОМЕРЫ И ОПТИЧЕСКИЕ ИЗОМЕРЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1994 |
|
RU2091384C1 |
| СОЕДИНЕНИЯ ЦЕФАЛОСПОРИНА, ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ НЕТОКСИЧНЫЕ СОЛИ, ФИЗИОЛОГИЧЕСКИ ГИДРОЛИЗУЕМЫЕ СЛОЖНЫЕ ЭФИРЫ, ИЗОМЕРЫ, ИМЕЮЩИЕ Е-КОНФИГУРАЦИЮ ДВОЙНОЙ СВЯЗИ В ПРОПЕНИЛЬНОЙ ГРУППЕ, СИН-ИЗОМЕРЫ И ОПТИЧЕСКИЕ ИЗОМЕРЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1994 |
|
RU2098420C1 |
| Способ получения производных цефалоспорина | 1985 |
|
SU1303029A3 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ЦЕФЕМА | 1989 |
|
RU2007408C1 |
| Способ получения производных цефалоспорина | 1983 |
|
SU1250173A3 |
| Способ получения производных 2-низший алкил-7-ациламидо-3-цефем-4-карбоновой кислоты или их солей | 1977 |
|
SU856387A3 |
| Способ получения производных цефема или их фармацевтически приемлемых солей | 1986 |
|
SU1538898A3 |
| Способ получения цефемовых соединений или их аддитивных солей с кислотами | 1988 |
|
SU1787158A3 |
| Способ получения производного 7 @ -[(Z)-2-(2-аминотиазол-4-ил)-2-оксииминоацетамидо]-3-цефем-4-карбоновой кислоты или его соли щелочного металла | 1984 |
|
SU1324586A3 |
| Способ получения производныхцЕфАлОСпОРиНА или иХ СОлЕй | 1974 |
|
SU795481A3 |
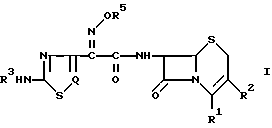
В изобретении предлагается способ получения цефемных производных со следующей общей формулой (I):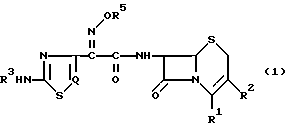 ,
,
в которой R1 представляет карбоксигруппу или защищенную карбоксигруппу, которая может образовывать соль -COO-M+ с ионом щелочного металла (M+), такого как натрий, или может представлять -COO-, когда R2 имеет заместитель с положительным электрическим зарядом, такой как пиридиний, пиримидиний или тиазолий, R2 представляет водород, ацилоксиметил, гетероциклический метил или гетероциклический тиометил, каждый из которых может быть замещен надлежащими заместителями, R3 представляет водород или аминозащищающую группу, R5 представляет водород, C1-C4-алкил или -C(Ra)(Rb)CO2Rc, где Ra и Rb в группе -C(Ra)(Rb)CO2Rc в качестве R5 идентичны или отличаются друг от друга и представляют H или C1-C4-алкил, или вместе с атомом углерода, с которым они связаны, образуют C3-C7-циклоалкильную группу, Rc - водород или карбоксизащищающая группа, Q - атом азота или CH. 2 с. и 13 з.п. ф-лы.
где R1 карбоксигруппа или защищенная карбоксигруппа, которая может образовывать соль COO-M+ с ионом щелочного металла (М+), или может представлять -СОО-, когда R2 имеет заместитель с положительным электрическим зарядом;
R2 атом водорода, С1 С4-алканоилоксиметил, гетероциклический метил или гетероциклический тиометил, причем указанный гетероциклический радикал выбирают из группы, содержащей пирролидинил, имидазолинил, пиперидинил, пиперазинил, морфолинил, тиазолидинил, пирролил, пирролинил, имидазолил, пиразолил, пиридил, пиримидинил, пиразинил, пиридазинил, тиазолил, оксазолил, изоксазолил, оксидиазолил, тиазолинил, тиадиазолил, тиенил, индолил, изоиндолил, индолинил, бензотриазолил, тетразолопиридил, хинолил, изохинолил, бензоксазолил, бензотиазолил, 2,3-дициклопентенопиридинил, 3,5,6,7-тетрагидроциклопентапиримидинил, 1,5,6,7-тетрагидроциклопентапиримидинил и 1,2,4-триазоло-(1,5-с)-пиримидинил, которые могут быть при необходимости замещены от 1 до 4 заместителями, выбранных из ряда, содержащего С1 -С4-алкил, С2 С4-алкенил, С3 С6-циклоалкил, атом галогена, замещенную или незамещенную алкильным радикалом аминогруппу и фенил, который может быть замещен гидроксигруппой;
R3 водород или аминозащищающая группа;
R5 С1 С4-алкил или группа
-С(Ra) (Rb)CO2Rc,
где Ra и Rb в группе С(Ra) (Rb)CO2Rc идентичны или отличаются друг от друга, атом водорода или С1 С4-алкил;
Rc водород или карбоксизащищающая группа;
Q N или СН,
отличающийся тем, что реакционноспособное тиофосфатное производное тиа- (или диа-)золуксусной кислоты общей формулы II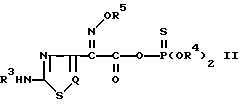
где R3, R5 и Q имеют указанные значения;
R4 С1 С4-алкил,
ацилируют производные 7-аминоцефалоспорановой кислоты общей формулы III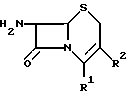
где R1 и R2 имеют указанные значения,
в присутствии растворителя и основания.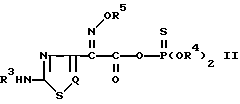
где R3 водород или аминозащающая группа;
R4 С1 С4-алкил;
R5 С1 С4-алкил или группа
-С(Ra) (Rb)-CO2Rc,
где Ra и Rb в группе -C(Ra) (Rb)CO2Rc идентичны или отличаются друг от друга, водород или С1 С4-алкил;
Rc водород или карбоксизащищающая группа;
Q N или СН.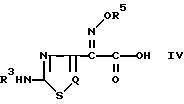
где R3, R5 и Q имеют указанные значения,
подвергают реакции с хлортиофосфатным производным общей формулы V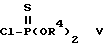
где R4 имеет указанное значение,
в растворителе в присутствии основания и катализатора, выбранного из группы, включающей третичные амины, четвертичные аммониевые или фосфониевые соединения.
| EP, патент, 88454, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| EP, патент, 59486, кл | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
1997-11-27—Публикация
1994-12-09—Подача