Изобретение относится к области органической химии, а именно к способу получения новых биологически активных 2-амино-6-гидрокси-7-(3-оксодигидрохиноксалин-2-ил)-7а-фенилпирроло[2,1-b][1,3,4]тиадиазол-5(7aH)-онам формулы:

обладающих противовоспалительной активностью, что позволяет предположить их использование в фармакологии и в медицине в качестве лекарственных средств с противовоспалительным эффектом.
Известен структурный аналог заявляемых соединений - (2)-7а-(4-фторфенил)-2-(3-метокси-4-(4-метил-1H-имидазол-1-ил)стирил)гексагидро-5H-пирроло[1,2-6][1,2,4]триазол-5-он, обладающий противовоспалительным эффектом (International Publication Number WO 2008/153793 A2. 18.12.2008 // Gamma secretase modulators. PCT/US 2008/006734. Zhu Zh., Greenlee W.J., Huang X., McKittrick B.A., Clader J.W., McBriar M.D., Palani A.).

Задачей изобретения является синтез новых замещенных 2-амино-6-гидрокси-7-(3-оксодигидрохиноксалин-2-ил)-7а-фенилпирроло[2,1-b][1,3,4]тиадиазол-5(7aH)-онов, обладающих противовоспалительным действием и расширение арсенала средств воздействия на живой организм.
Поставленная задача достигается получением 2-амино-6-гидрокси-7-(3-оксодигидрохиноксалин-2-ил)-7а-фенилпирроло[2,1-b][1,3,4]тиадиазол-5(7aH)-онов, которые обладают противовоспалительной активностью.
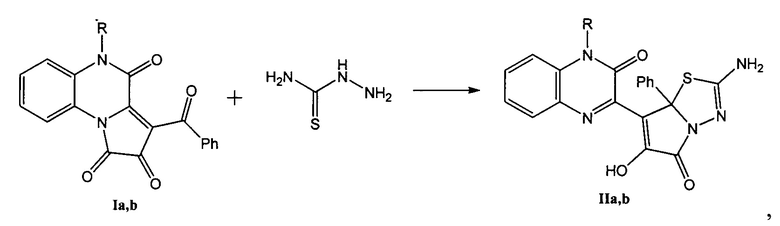
где R1=H (a), Ph (b).
Исходные 3-ароил-2,4-дигидро-1H-пирроло[2,1-с][1,4]хиноксалин(5H)-1,2,4-трионы Ia, b подвергают взаимодействию с тиосемикарбазидом в среде безводного ацетонитрила с последующим выделением целевых продуктов IIa, b. Процесс ведут при кипячении (нагревании до 83°С).
Из патентной и технической литературы не были выявлены способы получения 2-амино-6-гидрокси-7-(3-оксодигидрохиноксалин-2-ил)-7а-фенилпирроло[2,1-b][1,3,4]тиадиазол-5(7aH)-онов, имеющие сходные признаки с заявленным способом, а именно не использовались исходные продукты, растворитель, в котором проходит реакция, на основании чего можно сделать вывод о соответствии заявленного технического решения критерию «новизна» и «изобретательский уровень».
Изобретение иллюстрируется следующими примерами.
Пример 1. Получение 2-амино-6-гидрокси-7-(3-оксо-2,4-дигидрохиноксалин-2-ил)-7а-фенилпирроло[2,1-b][1,3,4]тиадиазол-5(7aH)-она (IIa).
К раствору 0.5 ммоль 3-бензоилпирроло[1,2-а]хиноксалин-1,2,4(5H)-триона (Ia) в 3 мл безводного ацетонитрила добавляли 0.5 ммоль тиосемикарбазида. Реакционную массу кипятили в течение 4 часов, образовавшийся осадок отфильтровывали. Выход 53%, т. пл. 248-249°С (ацетонитрил). Соединение (IIa) C19H13N5O3S.
Найдено, %: С, 58.36; Н, 3.34; N, 17.87; S, 8.21
Вычислено, %: С, 58.31; Н, 3.35; N, 17.89; S, 8.19
Соединение (IIa) - красное кристаллическое вещество, легкорастворимое в ДМСО, ДМФА, растворимое в дихлорметане, хлороформе, ацетоне, спиртах, нерастворимое в воде и алканах. Устойчиво при хранении в обычных условиях.
В ИК спектре соединения (Па), записанном в виде пасты в вазелиновом масле, присутствуют полосы валентных колебаний 3490 см-1, 3365 см-1 (NH2), 3256 см-1 (ОНенол.), 1743 см-1 (С5=O), 1645 см-1 (СО).
Спектр ЯМР 1Н (400 МГц, DMSO-d6, δ, м.д.): 14.43 с (1Н), 13.27 с (1Н), 9.01 с (1H), 7.58-7.47 м (4Н), 7.37-7.18 м (5Н), 6.64 с (1H).
Пример 2. Получение 2-амино-6-гидрокси-7-(3-оксо-4-фенил-3,4-дигидрохиноксалин-2-ил)-7а-фенилпирроло[2,1-b][1,3,4]тиадиазол-5(7aH)-она (IIb).
К раствору 0.5 ммоль 3-бензоил-5-фенилпирроло[1,2-а]хиноксалин-1,2,4(5H)-триона (Ib) в 3 мл безводного ацетонитрила добавляли 0.5 ммоль тиосемикарбазида. Реакционную массу кипятили в течение 4 часов, образовавшийся осадок отфильтровывали. Выход 61%, т. пл. 199-201°С (ацетонитрил). Соединение (IIb) C25H17N5O3S.
Найдено, %: С 64.19; Н 3.67; N 14.99; S 6.84
Вычислено, %: С 64.23; Н 3.67; N 14.98; S 6.86
Соединение (IIb) - красное кристаллическое вещество, легкорастворимое в ДМСО, ДМФА, растворимое в дихлорметане, хлороформе, ацетоне, спиртах, нерастворимое в воде и алканах. Устойчиво при хранении в обычных условиях.
В ИК спектре соединения (IIb), записанном в виде пасты в вазелиновом масле, присутствуют полосы валентных колебаний 3494 см-1, 3376 см-1 (NH2), 3263 см-1 (ОНенол.), 1741 см-1 (С5=O), 1669 см-1 (С=Оамид).
Спектр ЯМР 1H (400 МГц, DMSO-d6, δ, м.д.): 13.68 с (1Н), 9.00 с (1Н), 7.81-7.73 м (4Н), 7.69-7.55 м (5Н), 7.49-7.22 м (5Н), 6.51 с (1H)
Пример 3. Фармакологическое исследование соединений IIa, b на наличие противовоспалительной активности.
В эксперименте использовались белые лабораторные аутбредные крысы стока линии Wistar (25.06.2021) и белые лабораторные аутбредные мыши стока линии ICR (CD-1) (21.06.21, 22.06.21). Подготовка животных включала отбор по полу, возрасту и состоянию здоровья. В рамках выделенной субпопуляции был выполнен рандомизированный отбор с использованием генератора случайных чисел в экспериментальные группы по 6 животных (для крыс и для мышей) (21.06.2021 - 4 экспериментальные группы, 1 контрольная, 1 группа препарата сравнения; 22.06.2021 - 4 экспериментальные группы, 1 контрольная, 1 группа препарата сравнения; 25.06.21 - 4 экспериментальные группы (соединения-лидеры в предыдущих экспериментах), 1 контрольная, 1 группа препарата сравнения) [1]. Животные в группах маркировались методом нанесения сквозных индивидуальных меток на основании хвоста по внутрилабораторному стандарту. Проверка качества рандомизации выполнялась на основе тестирования значимости сдвигов масс и гомогенности дисперсий - до эксперимента.
Исследуемые вещества суспензировали в 2% крахмальном растворе, и вводили животным внутрибрюшинно в дозе 50 мг/кг (внутрилабораторный стандарт скрининговой дозы) за 40 минут до субплантарного введения 1% раствора каррагенина. В качестве препарата сравнения использовали таблетки диклофенака 0,05 г, покрытые кишечнорастворимой оболочкой производства ООО «Озон» г. Жигулевск. В качестве эквистрессового воздействия животным в контрольной группе вводился 2% крахмальный раствор. В таблице представлены данные массометрии животных, особенности приготовления растворов для в/б введения, и объемы введения для экспериментов на лабораторных крысах и мышах соответственно.
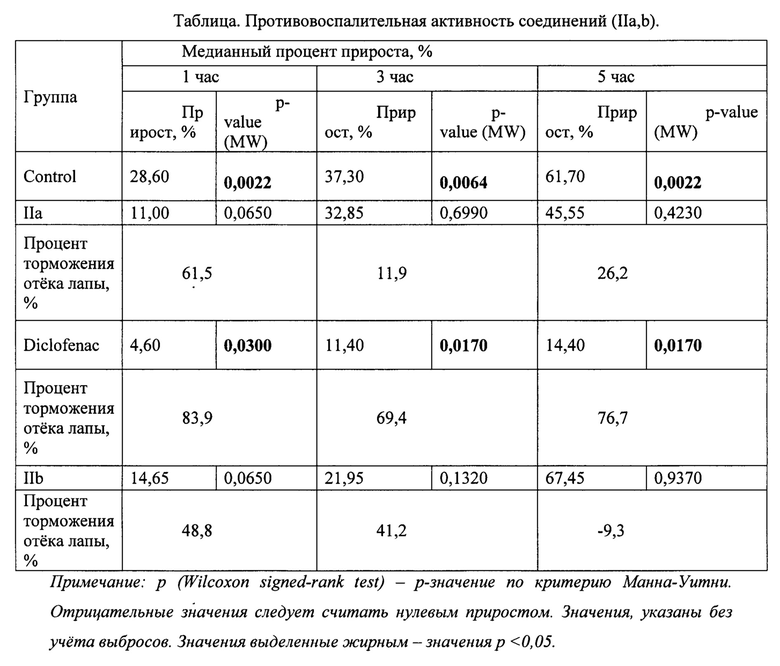
Проведенные исследования показали (Таблица), что у исследованных соединений в дозе 50 мг/кг обнаружена противовоспалительная активность.
Вещество под шифром IIa обладает коротким периодом действия. Процент торможения отека для 1 часа после введения индуктора воспаления 61,5% (р=0,0650). По прошествии 3 и 5 часов после введения индуктора воспаления значимой противовоспалительной активности не обнаружено.
Вещество IIb обладает противовоспалительной активностью ниже уровня эталона (диклофенак 10 мг/кг). Значения процента подавления отека: 48,8% (р=0.0650) для 1 часа после введения индуктора воспаления и 21,95% (р=0,1320) для 3 часа после введения индуктора воспаления.
Заявляемые ранее неописанные в литературе 2-амино-6-гидрокси-7-(3-оксодигидрохиноксалин-2-ил)-7а-фенилпирроло[2,1-b][1,3,4]тиадиазол-5(7aH)-оны могут найти применение-в фармакологии в качестве потенциальных лекарственных средств с противовоспалительными свойствами.
Список литературы.
1. Anglemyer A., Horvath Н. Т., Bero L. Healthcare outcomes assessed with observational study, designs compared with those assessed in randomized trials //Cochrane Database of Systematic Reviews. - 2014. - №. 4.
Изобретение относится к области органической химии и фармакологии, а именно к 2-амино-6-гидрокси-7-(3-оксодигидрохиноксалин-2-ил)-7а-фенилпирроло[2,1-b][1,3,4]тиадиазол-5(7aH)-ону общей формулы

где R1=Н (a), Ph (b). Также изобретение относится к способу их получения путем взаимодействия 3-бензоил-2,4-дигидро-1H-пирроло[2,1-с][1,4]хиноксалин(5H)-1,2,4-трионов с тиосемикарбазидом в среде безводного ацетонитрила при кипячении в течение 4 часов и последующим выделением целевых продуктов. Технический результат - получены новые соединения, обладающие противовоспалительной активностью, которые могут быть использованы в фармакологии в качестве потенциальных лекарственных средств с противовоспалительными свойствами. 2 н.п. ф-лы, 1 табл., 3 пр.
1. 2-Амино-6-гидрокси-7-(3-оксодигидрохиноксалин-2-ил)-7а-фенилпирроло[2,1-b][1,3,4]тиадиазол-5(7aH)-оны, общей формулы:
 ,
,
где R=Н (a), Ph (b), обладающие противовоспалительной активностью.
2. Способ получения соединения IIa,b, характеризующийся тем, что 3-ароил-2,4-дигидро-1H-пирроло[2,1-с][1,4]хиноксалин(5H)-1,2,4-трионы подвергают взаимодействию с тиосемикарбазоном в среде безводного ацетонитрила при кипячении в течение 4 часов с последующим выделением целевых продуктов:

где R1=H (a), Ph (b).
| 2-Арил-2,4-дигидрокси-2,5-дигидро-3-гетерил-5-оксо-1Н-пиррол-1-ил-4-метилбелзолсульфаниламиды, обладающие анальгетической активностью | 2015 |
|
RU2626650C2 |
| КОМБИНАЦИЯ АГОНИСТА АЛЬФА-2-АДРЕНЕРГИЧЕСКИХ РЕЦЕПТОРОВ И НЕСТЕРОИДНОГО ПРОТИВОВОСПАЛИТЕЛЬНОГО СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ ИЛИ ПРОФИЛАКТИКИ ВОСПАЛИТЕЛЬНОГО ПОРАЖЕНИЯ КОЖИ | 2010 |
|
RU2532388C2 |
| WO 2008153793 A2, 18.12.2008 | |||
| Sherine N | |||
| Khattab и др.: "Reaction of phthalaldehydic acid with different substituted aniline as well as hydrazine derivatives", 44(3), 2007, 617-626 | |||
| И | |||
| В | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
Авторы
Даты
2022-08-15—Публикация
2021-07-05—Подача