[ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ]
[0001] Настоящее изобретение относится к новым кристаллическим формам (кристаллическое вещество типа I, кристаллическое вещество типа II и кристаллическое вещество типа III) (E)–2–(7–трифторметилхроман–4–илиден)–N–((7R)–7–гидрокси–5,6,7,8–тетрагидронафталин–1–ил)ацетамида (в настоящем описании иногда называемого Соединением (1)), который является одним из производных гетероциклиденацетамида, который обладает превосходным антагонизмом к транзиторному рецепторному потенциалу ваниллоида 1 (в настоящем описании «TRPV1») и является пригодным в качестве профилактического и/или терапевтического средства от боли и подобного, способу получения данных кристаллических веществ и фармацевтической композиции, содержащей данные кристаллические вещества. Оно также относится к способу получения фармацевтической композиции, содержащей данные кристаллические вещества, и к применению данных кристаллических веществ при изготовлении фармацевтической композиции.
[УРОВЕНЬ ТЕХНИКИ]
[0002] В 1997 году при исследовании механизма возникновения боли был клонирован рецептор капсаицина (TRPV1), который является основным компонентом острого вкуса перца чили, (Непатентный Документ 1). TRPV1, который является рецептором, распознающим капсаицин, в большом количестве экспрессирован в первичных сенсорных нейронах, вовлеченных в ощущение боли, также как в афферентных сенсорных волокнах, содержащих нервные окончания С–типа волокон, и в дальнейшем было клонировано множество членов семейства TRP.
[0003] Члены семейства TRP структурно схожи, имеют 6 трансмембранных доменов, и N–концевые и С–концевые молекулы расположены внутри клетки. TRPV1 обеспечивает поток катионов, таких как ион кальция и ион натрия, в клетку в ответ на стимуляцию капсаицином или кислотой (pH 6,0 или менее), нагреванием (43°C или более) или высоким осмотическим давлением. Соответственно, изучение сайтов экспрессии рецептора TRPV1 и действие капсаицина привело к предположению о значительном вкладе рецептора TRPV1 в нервное возбуждение. Кроме того, вклад TRPV1 в живой организм также был разъяснен во многих существующих сообщениях, и в частности, участие TRPV1 в развитии боли подтверждается фактом, что у мышей, у которых удален TRPV1 (мыши с нокаутом TRPV1), не возникает термическая гиперчувствительность вследствие невропатической боли, фактом, что развитие отека подавляется в модели воспалительной боли, вызываемой полным адъювантом Фрейнда (ПАФ) (Непатентный Документ 2), и фактом, что десенсибилизирующее действие ранее отмеченного агониста TRPV1 проявляло анальгетический эффект в модели невропатической боли и модели воспалительной боли (Непатентный Документ 3).
[0004] TRPV1, называемый рецептором капсаицина, является известной целью терапии для лечения боли, особенно острой боли, хронической боли, невропатической боли и висцеральной боли. TRPV1 стимулируется, в частности, ваниллоидами, такими как капсаицин, и нагреванием, протонами и высоким осмотическим давлением и играет центральную роль при возникновении боли. Он также важен при многочисленных других физиологических и патофизиологических процессах и является целью многих исследований, направленных на поиск методов лечения заболеваний или нарушений, таких как мигрень, депрессия, нейродегенеративное заболевание, когнитивные расстройства, тревожность, эпилепсия, кашель, диарея, зуд, глазная боль, воспаление, нарушения сердечно–сосудистой системы, расстройства пищевого поведения, лекарственная зависимость, неправильное применение лекарственных средств, и непроизвольное мочеиспускание, и подобное, например.
[0005] В соответствии с Примером 71 WO 2007/010383 (Патентный Документ 1) соединение (1), обладающее превосходным антагонизмом к TRPV1, получали в виде твердого вещества.
[ДОКУМЕНТ ПРЕДШЕСТВУЮЩЕГО УРОВНЯ ТЕХНИКИ]
[ПАТЕНТНЫЙ ДОКУМЕНТ]
[0006]
[Патентный Документ 1] WO 2007/010383
[НЕПАТЕНТНЫЙ ДОКУМЕНТ]
[0007]
[Непатентный Документ 1] Caterina MJ, Schumacher MA, Tominaga M, Rosen TA, Levine JD, Julius D: Nature, (389), pp. 816–824, 1997
[Непатентный Документ 2] Szabo A, Helyes Z, Sandor K, Bitte A, Pinter E, Nemeth J, Banvolgyi A, Bolcskei K, Elekes K, Szolcsanyi J: Journal of Pharmacology and Experimental Therapeutics, (314), pp. 111–119, 2005
[Непатентный Документ 3] Rashid MH, Inoue M, Kondo S, Kawashima T, Bakoshi S, Ueda H: Journal of Pharmacology and Experimental Therapeutics, (304), pp. 940–948, 2003
[СУЩНОСТЬ ИЗОБРЕТЕНИЯ]
[Проблема, решаемая изобретением]
[0008] Целью настоящего изобретения является предоставление соединения (1), обладающего превосходным антагонизмом к TRPV1 и пригодного в качестве терапевтического и/или профилактического средства в отношении боли и подобного, высокочистого кристаллического вещества, подходящего в качестве активного фармацевтического ингредиента и имеющего, по меньшей мере, один признак, выбранный из группы, состоящей из стабильности при хранении, фотостабильности и термодинамической стабильности, и имеющего, в частности, превосходную фотостабильность. Другая цель заключается в предоставлении способа получения, посредством которого данное кристаллическое может быть получено в промышленности простыми способами с высокой воспроизводимостью и выходом. Еще одной целью является предоставление фармацевтической композиции с превосходной стабильностью и подобным.
Более определенно, например, наличие термодинамической стабильности означает, что кристаллические полиморфные превращения в процессе фармацевтического производства заранее предотвращаются и качество фармацевтического ингредиента и фармацевтического продукта сохраняется. Например, наличие стабильности при хранении означает, что, поскольку кристаллическое вещество является химически и физически стабильным и не гигроскопичным, его качество в виде фармацевтического ингредиента поддерживается в пределах стандарта в течение длительного периода времени, и его можно легко переработать в фармацевтический продукт и использовать в фармацевтических препаратах. Кроме того, например, наличие фотостабильности означает, что, когда кристаллическое вещество в качестве активного фармацевтического ингредиента подвергается облучению светом, оно не подвергается фоторазложению, биологическая активность фармацевтического ингредиента не уменьшается, и, следовательно, его биодоступность не изменяется, свойства состава фармацевтического продукта могут оставаться стабильными, и продукт потенциально может храниться в течение длительного периода времени.
С кристаллическими веществами соединений, используемых в фармацевтических препаратах, иногда может быть трудно получить ту же самую кристаллическую форму, даже используя те же методы, которые давали данную форму в прошлом, вследствие разнообразия условий кристаллизации. Следовательно, существует потребность в промышленно применимом способе изготовления кристаллического вещества, посредством которого стабильное снабжение кристаллического вещества может быть получено эффективно и воспроизводимо и простыми способами.
Кроме того, при снабжении кристаллического вещества соединения (1), такого как описано выше, также возможно обеспечить высокостабильную фармацевтическую композицию.
[0009] «Полиморфизм» означает наличие двух или более кристаллических форм (кристаллических структур) вещества. Различные кристаллические формы определенного вещества также называют «полиморфные модификации». Обычно «полиморфизм» проявляется как различия в расположении атомов в кристаллических решетках различных полиморфных модификаций, связанные или с изменениями в стерической конформации, или с эффектами внутримолекулярных или межмолекулярных взаимодействий (в частности, связывание водорода). С другой стороны, общая внешняя форма вещества называется его «формой» и представляет собой внешнюю форму кристалла и его поверхности независимо от его внутренней структуры. Кристаллы могут проявлять различные структуры в зависимости от различных условий (таких как скорость роста, метод перемешивания (скорость, температура), наличие примесей и подобные).
[0010] Поскольку различный «полиморфизм» вещества может иметь различные энергии кристаллической решетки, полиморфизм в твердом состоянии может также проявлять различные физические свойства (такие как форма, плотность, температура плавления, цвет, стабильность, растворимость, скорость растворения и подобные). Данные физические свойства могут влиять на стабильность, растворимость и биодоступность (эффект абсорбции в организме, действие лекарственного средства и т. д.) определенных полиморфных модификаций, когда они используются в лекарственном средстве, или фармацевтической композиции, или подобном, также как на срок хранения, свойства состава и технологические характеристики фармацевтического продукта. Поскольку скорость абсорбции в организме может различаться в зависимости от полиморфных модификаций, может быть получена более высокая или более низкая биологическая активность по сравнению с полученной первоначально.
[0011] При кристаллическом полиморфизме фармацевтических продуктов существование множества полиморфных модификаций означает, что полиморфные превращения могут происходить в процессе изготовления или хранения. Более того, если одна полиморфная модификация является более термодинамически стабильной, чем другие, она может быть более подходящей, чем другие полиморфные модификации в процессе получения, и, следовательно, термодинамическая стабильность должна быть проверена.
[СРЕДСТВА ДЛЯ РЕШЕНИЯ ПРОБЛЕМЫ]
[0012] В результате серьезного исследования, направленного на решение данных проблем, изобретателям удалось кристаллизовать соединение (1) и обнаружить существование трех кристаллических форм (три кристаллические формы, описанные в данном описании, называются кристаллическим веществом типа I, кристаллическим веществом типа II и кристаллическим веществом типа III, и кристаллическое вещество типа I также может быть названо Формой I, кристаллическое вещество типа II также может быть названо Формой II и кристаллическое вещество типа III также может быть названо Формой III).
[0013] Было также обнаружено, что из трех кристаллических форм соединения (1) кристаллическое вещество типа I может быть подходящим в качестве активного фармацевтического ингредиента, поскольку оно термодинамически стабильно, оно также стабильно в различных тестах на стабильность (исследование длительного хранения, ускоренное испытание, исследование фотостабильности) и показало отличную стабильность в исследовании фотостабильности в частности. Настоящее изобретение было усовершенствовано на основании данных результатов.
[0014] Кристаллическое вещество типа I соединения (1) настоящего изобретения представляет собой соединение, обладающее антагонизмом к TRPV1, и обеспечивает эффект улучшения при заболеваниях, связанных с TRPV1 (таких как, например, боль), с помощью вызывания антагонизма к TRPV1.
Фармацевтическая композиция, содержащая кристаллическое вещество типа I соединения (1) настоящего изобретения в качестве активного ингредиента, обещает быть профилактическим и/или терапевтическим средством при заболеваниях, связанных с TRPV1.
[ЭФФЕКТЫ ИЗОБРЕТЕНИЯ]
[0015] Кристаллическое вещество типа I соединения (1) настоящего изобретения представляет собой соединение, обладающее антагонистической активностью в отношении TRPV1, имеет низкую токсичность и является пригодным в качестве фармацевтического продукта.
Кристаллическое вещество типа I соединения (1) настоящего изобретения предпочтительно представляет собой термодинамически стабильное кристаллическое вещество, посредством которого кристаллические полиморфные превращения в процессе фармацевтического производства заранее предотвращаются и качество активного фармацевтического ингредиента и фармацевтического продукта сохраняется.
Кроме того, наличие стабильности при хранении предпочтительно означает, что кристаллическое вещество является химически и физически стабильным и не гигроскопичным, так что его качество в виде фармацевтического ингредиента может поддерживаться в пределах стандарта в течение длительного периода времени, и его можно легко переработать в фармацевтический продукт и использовать в фармацевтических препаратах.
Кроме того, наличие превосходной фотостабильности предпочтительно означает, что, поскольку не происходит фоторазложения или изомеризации структуры соединения и не происходит снижения биоактивности, биодоступность соединения не изменяется, свойства состава фармацевтического продукта могут оставаться стабильными и долгосрочное хранение также возможно.
Способ получения кристаллического вещества типа I соединения (1) изобретения предпочтительно представляет собой простой и промышленно применимый способ, посредством которого высокочистое кристаллическое вещество типа I может быть получено с высоким выходом и воспроизводимостью.
Поскольку кристаллическое вещество типа I соединения (1) изобретения является превосходным, по меньшей мере, в одном признаке, выбранном из группы, состоящей из стабильности при хранении, фотостабильности и термодинамической стабильности, оно может обеспечить фармацевтическую композицию превосходной стабильностью и подобным.
[КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ]
[0016]
[ФИГ. 1] На ФИГ. 1 представлена порошковая рентгеновская дифрактограмма кристаллического вещества типа I Соединения (1) Примера 1.
[ФИГ. 2] На ФИГ. 2 представлена микроскопическая фотография кристаллического вещества типа I Соединения (1) Примера 1.
[ФИГ. 3] На ФИГ. 3 представлены данные ИК–Фурье–спектра для кристаллического вещества типа I Соединения (1) Примера 1.
[ФИГ. 4] На ФИГ. 4 представлены данные термического анализа ДСК для кристаллического вещества типа I Соединения (1) Примера 1.
[ФИГ. 5] На ФИГ. 5 представлена порошковая рентгеновская дифрактограмма кристаллического вещества типа II Соединения (1) Примера 3.
[ФИГ. 6] На ФИГ. 6 представлена микроскопическая фотография кристаллического вещества типа II Соединения (1) Примера 3.
[ФИГ. 7] На ФИГ. 7 представлены данные ИК–Фурье–спектра для кристаллического вещества типа II Соединения (1) Примера 3.
[ФИГ. 8] На ФИГ. 8 представлены данные термического анализа ДСК для кристаллического вещества типа II Соединения (1) Примера 3.
[ФИГ. 9] На ФИГ. 9 представлена порошковая рентгеновская дифрактограмма кристаллического вещества типа III Соединения (1) Примера 4.
[СПОСОБ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ]
[0017] Настоящее изобретение относится к кристаллическому веществу типа I (E)–2–(7–трифторметилхроман–4–илиден)–N–((7R)–7–гидрокси–5,6,7,8–тетрагидронафталин–1–ил)ацетамиду (Соединение (1)) и способу получения кристаллического вещества и фармацевтической композиции, содержащей кристаллическое вещество. Оно также относится к способу получения фармацевтической композиции, содержащей данное кристаллическое вещество, и к применению данного кристаллического вещества при изготовлении фармацевтической композиции.
Кроме того, настоящее изобретение также относится к способам получения кристаллического вещества типа II и кристаллического вещества типа III Соединения (1).
[0018] Настоящее изобретение включает следующие варианты осуществления [1]–[31].
В данном описании любое из кристаллических веществ, описанных в любом из вариантов осуществления [1]–[14], также можно назвать «кристаллическое вещество (E)–2–(7–трифторметилхроман–4–илиден)–N–((7R)–7–гидрокси–5,6,7,8–тетрагидронафталин–1–ил)ацетамида изобретения», «кристаллическое вещество Соединения (1)» или «кристаллическое вещество изобретения».
Любое из кристаллических веществ, описанных в любом из вариантов осуществления [1]–[6], также можно назвать «кристаллическим веществом типа I изобретения».
Любое из кристаллических веществ, описанных в любом из вариантов осуществления [7]–[11], также можно назвать «кристаллическим веществом типа II изобретения».
Любое из кристаллических веществ, описанных в любом из вариантов осуществления [12]–[14], также можно назвать «кристаллическим веществом типа III изобретения».
[0019] [1] Первый вариант осуществления изобретения представляет собой кристаллическое вещество типа I (E)–2–(7–трифторметилхроман–4–илиден)–N–((7R)–7–гидрокси–5,6,7,8–тетрагидронафталин–1–ил)ацетамид, имеющий характеристические пики, по меньшей мере, при углах дифракции (2Ɵ) приблизительно 7,9, приблизительно 10,3, приблизительно 15,8, приблизительно 16,4, приблизительно 17,2, приблизительно 19,5, приблизительно 19,9, приблизительно 21,6, приблизительно 23,9, приблизительно 25,0 и приблизительно 26,7 (°) в порошковой рентгеновской дифракции.
[1–1] Вариант осуществления 1–1 изобретения представляет собой кристаллическое вещество типа I (E)–2–(7–трифторметилхроман–4–илиден)–N–((7R)–7–гидрокси–5,6,7,8–тетрагидронафталин–1–ил)ацетамид, имеющий характеристические пики при углах дифракции (2Ɵ) приблизительно 7,9, приблизительно 8,9, приблизительно 10,3, приблизительно 12,0, приблизительно 15,8, приблизительно 16,4, приблизительно 17,2, приблизительно 17,6, приблизительно 18,3, приблизительно 19,5, приблизительно 19,9, приблизительно 20,8, приблизительно 21,6, приблизительно 23,9, приблизительно 24,6, приблизительно 25,0, приблизительно 26,3, приблизительно 26,7, приблизительно 27,7, приблизительно 28,6, приблизительно 29,5, приблизительно 31,4, приблизительно 32,4, приблизительно 33,2, приблизительно 33,8 и приблизительно 34,8 (°) в порошковой рентгеновской дифракции.
[0020] [2] Второй вариант осуществления изобретения представляет собой кристаллическое вещество типа I (E)–2–(7–трифторметилхроман–4–илиден)–N–((7R)–7–гидрокси–5,6,7,8–тетрагидронафталин–1–ил)ацетамид, характеризующийся порошковой рентгеновской дифрактограммой, показанной на ФИГ. 1.
[0021] [3] Третий вариант осуществления изобретения представляет собой кристаллическое вещество типа I (E)–2–(7–трифторметилхроман–4–илиден)–N–((7R)–7–гидрокси–5,6,7,8–тетрагидронафталин–1–ил)ацетамид, имеющий углы дифракции (2Ɵ) и относительные интенсивности (%), показанные в Таблицах 2 или 3, в порошковой рентгеновской дифракции.
[0022] [4] Четвертый вариант осуществления изобретения представляет собой кристаллическое вещество типа I (E)–2–(7–трифторметилхроман–4–илиден)–N–((7R)–7–гидрокси–5,6,7,8–тетрагидронафталин–1–ил)ацетамид и предпочтительно кристаллическое вещество типа I по любому одному из вышеприведенных вариантов осуществления [1]–[3], характеризующееся наличием экстраполированной температуры начала пика плавления 232°C при измерении дифференциальной сканирующей калориметрии (измерение ДСК).
[0023] [5] Пятый вариант осуществления изобретения представляет собой кристаллическое вещество типа I (E)–2–(7–трифторметилхроман–4–илиден)–N–((7R)–7–гидрокси–5,6,7,8–тетрагидронафталин–1–ил)ацетамид и предпочтительно кристаллическое вещество типа I по любому одному из вышеприведенных вариантов осуществления [1]–[4], характеризующееся диаграммой ИК–Фурье–спектра, показанной на ФИГ. 3, и/или значениями данных (см–1), приведенными в Таблице 4.
[0024] [6] Шестой вариант осуществления изобретения представляет собой кристаллическое вещество типа I по любому одному из вышеприведенных вариантов осуществления [1]–[5], имеющее морфологию игольчатого кристалла.
[0025] [7] Седьмой вариант осуществления изобретения представляет собой кристаллическое вещество типа II (E)–2–(7–трифторметилхроман–4–илиден)–N–((7R)–7–гидрокси–5,6,7,8–тетрагидронафталин–1–ил)ацетамид, имеющий характеристические пики, по меньшей мере, при углах дифракции (2Ɵ) приблизительно 10,5, приблизительно 12,2, приблизительно 12,7, приблизительно 16,1, приблизительно 17,1, приблизительно 18,4, приблизительно 19,1, приблизительно 20,6, приблизительно 22,4 и приблизительно 23,8 (°) в порошковой рентгеновской дифракции.
[0026] [8] Восьмой вариант осуществления изобретения представляет собой кристаллическое вещество типа II (E)–2–(7–трифторметилхроман–4–илиден)–N–((7R)–7–гидрокси–5,6,7,8–тетрагидронафталин–1–ил)ацетамид, характеризующийся порошковой рентгеновской дифрактограммой, показанной на ФИГ. 5.
[0027] [9] Девятый вариант осуществления изобретения представляет собой кристаллическое вещество типа II (E)–2–(7–трифторметилхроман–4–илиден)–N–((7R)–7–гидрокси–5,6,7,8–тетрагидронафталин–1–ил)ацетамид, имеющий углы дифракции (2Ɵ) и относительные интенсивности (%), показанные в Таблице 5, в порошковой рентгеновской дифракции.
[0028] [10] Десятый вариант осуществления изобретения представляет собой кристаллическое вещество типа II (E)–2–(7–трифторметилхроман–4–илиден)–N–((7R)–7–гидрокси–5,6,7,8–тетрагидронафталин–1–ил)ацетамид и предпочтительно кристаллическое вещество типа II по любому одному из вышеприведенных вариантов осуществления [7]–[9], характеризующееся диаграммой ИК–Фурье–спектра, показанной на ФИГ. 7, и/или значениями данных (см–1), приведенными в Таблице 6.
[0029] [11] Одиннадцатый вариант осуществления изобретения представляет собой кристаллическое вещество типа II по любому одному из вышеприведенных вариантов осуществления [7]–[10], имеющее морфологию столбчатого кристалла.
[0030] [12] Двенадцатый вариант осуществления изобретения представляет собой кристаллическое вещество типа III (E)–2–(7–трифторметилхроман–4–илиден)–N–((7R)–7–гидрокси–5,6,7,8–тетрагидронафталин–1–ил)ацетамид, имеющий характеристические пики при углах дифракции (2Ɵ) приблизительно 6,9, приблизительно 13,0, приблизительно 16,6, приблизительно 17,6, приблизительно 19,9, приблизительно 20,6, приблизительно 21,3, приблизительно 22,2, приблизительно 24,0, приблизительно 27,2 и приблизительно 27,8 (°) в порошковой рентгеновской дифракции.
[0031] [13] Тринадцатый вариант осуществления изобретения представляет собой кристаллическое вещество типа III (E)–2–(7–трифторметилхроман–4–илиден)–N–((7R)–7–гидрокси–5,6,7,8–тетрагидронафталин–1–ил)ацетамид, характеризующийся порошковой рентгеновской дифрактограммой, показанной на ФИГ. 9.
[0032] [14] Четырнадцатый вариант осуществления изобретения представляет собой кристаллическое вещество типа III (E)–2–(7–трифторметилхроман–4–илиден)–N–((7R)–7–гидрокси–5,6,7,8–тетрагидронафталин–1–ил)ацетамид, имеющий углы дифракции (2Ɵ) и относительные интенсивности (%), показанные в Таблице 7, в порошковой рентгеновской дифракции.
[0033] [15] Пятнадцатый вариант осуществления изобретения представляет собой способ получения кристаллического вещества типа I по любому одному из вышеприведенных вариантов осуществления [1]–[6], который представляет собой способ получения кристаллического вещества типа I (E)–2–(7–трифторметилхроман–4–илиден)–N–((7R)–7–гидрокси–5,6,7,8–тетрагидронафталин–1–ил)ацетамида по любому одному из вышеприведенных вариантов осуществления [1]–[6], включающий стадию растворения (E)–2–(7–трифторметилхроман–4–илиден)–N–((7R)–7–гидрокси–5,6,7,8–тетрагидронафталин–1–ил)ацетамида при нагревании с растворителем, выбранным из спиртовых растворителей и смешанных растворителей спиртовых растворителей и ацетона, добавления воды при нагревании и перемешивании и затем охлаждения смешанного раствора, содержащего воду, при перемешивании до комнатной температуры с получением кристаллических веществ.
[0034] [15–1] Растворитель в вышеприведенном варианте осуществления [15] представляет собой предпочтительно смешанный растворитель из спиртового растворителя и ацетона.
[15–2] Спиртовой растворитель в вышеприведенном варианте осуществления [15] или [15–1] представляет собой предпочтительно метанол, этанол или 2–пропанол, или более предпочтительно метанол или этанол, или еще более предпочтительно этанол.
[15–3] Соотношение компонентов в смеси смешанного растворителя из спиртового растворителя и ацетона в способе получения по любому одному из вышеприведенных вариантов осуществления [15]–[15–2] выбирается соответствующим образом из диапазона от 1:9 до 9:1 (объем:объем, об./об.). Более определенно, соотношение может представлять собой этанол:ацетон=от 1:1 до 3:7 или подобное. Соотношение количества воды, используемой вместе с данным смешанным растворителем, составляет смешанный растворитель:вода=от 3:1 до 2:1. Часть смешанного растворителя также может быть смешана с водой и использована. Например, предполагая, что соотношение смешанный растворитель:вода=20:10, соединение может быть растворено при нагревании с 15 частями смешанного растворителя, и затем 5 частей смешанного растворителя могут быть смешаны и соответствующим образом использованы с 10 частями воды. Количество используемого смешанного растворителя составляет приблизительно 10 мл на 1 г (в виде твердого вещества) соединения, которое должно быть растворено.
[15–4] В способе получения по любому одному из вышеприведенных вариантов осуществления [15]–[15–3] воду предпочтительно добавляют постепенно, а не все сразу. Скорость добавления особым образом не ограничена.
[15–5] Время охлаждения до комнатной температуры в вышеприведенном варианте осуществления [15] особым образом не ограничено в том случае, если достаточно времени для восстановления температуры растворителя до комнатной температуры.
[0035] [16] Шестнадцатый вариант осуществления изобретения представляет собой способ получения кристаллического вещества типа II по любому одному из вышеприведенных вариантов осуществления [7]–[11], который представляет собой способ получения кристаллического вещества типа II (E)–2–(7–трифторметилхроман–4–илиден)–N–((7R)–7–гидрокси–5,6,7,8–тетрагидронафталин–1–ил)ацетамида по любому одному из вышеприведенных вариантов осуществления [7]–[11], включающий стадию растворения (E)–2–(7–трифторметилхроман–4–илиден)–N–((7R)–7–гидрокси–5,6,7,8–тетрагидронафталин–1–ил)ацетамида при комнатной температуре с растворителем, выбранным из сложноэфирных растворителей, спиртовых растворителей и смешанных растворителей из сложноэфирных растворителей и спиртовых растворителей, и затем концентрирования при пониженном давлении с получением кристаллических веществ.
[0036] [17] Семнадцатый вариант осуществления изобретения представляет собой способ получения кристаллического вещества типа III по любому одному из вышеприведенных вариантов осуществления [12]–[14], который представляет собой способ получения кристаллического вещества типа III (E)–2–(7–трифторметилхроман–4–илиден)–N–((7R)–7–гидрокси–5,6,7,8–тетрагидронафталин–1–ил)ацетамида по любому одному из вышеприведенных вариантов осуществления [12]–[14], включающий или стадию растворения (E)–2–(7–трифторметилхроман–4–илиден)–N–((7R)–7–гидрокси–5,6,7,8–тетрагидронафталин–1–ил)ацетамида при комнатной температуре в полярном растворителе и затем добавления смешанного растворителя из воды и полярного растворителя при перемешивании при комнатной температуре, или стадию растворения при нагревании в изопропаноле и затем охлаждения смеси.
[0037] [18] Восемнадцатый вариант осуществления изобретения представляет собой фармацевтическую композицию, содержащую кристаллическое вещество по любому одному из вышеприведенных вариантов осуществления [1]–[14] в качестве активного ингредиента.
[18–1] Кристаллическое вещество вышеприведенного варианта осуществления [18] представляет собой предпочтительно кристаллическое вещество типа I по любому одному из вышеприведенных вариантов осуществления [1]–[6].
[0038] [19] Девятнадцатый вариант осуществления изобретения представляет собой лекарственное средство для лечения, по меньшей мере, одного заболевания, выбранного из группы, состоящей из острой боли; хронической боли; невропатической боли; постгерпетической невралгии; тригеминальной невралгии; боли в пояснице; боли после спинномозговой травмы; боли в ногах; каузалгии; диабетической невралгии; боли, вызванной отеком, ожогами, растяжениями, переломами костей и подобным; боли после хирургических операций; плечелопаточного периартрита; остеоартрита; артрита; боли при ревматоидном артрите; воспалительной боли; раковой боли; мигрени; головных болей; зубных болей; невралгии; боли в мышцах; гипералгезии; боли, вызванной стенокардией, менструацией и подобным; невропатии; повреждения нерва; нейродегенерации; хронической обструктивной болезни легких (ХОБЛ); астмы; гиперчувствительности дыхательных путей; стридора; кашля; ринита; воспаления слизистой оболочки, такой как глаза; нервного дерматита; воспалительных кожных заболеваний, таких как псориаз и экзема; отека; аллергических заболеваний; гастродуоденальной язвы; язвенного колита; синдрома раздраженной толстой кишки; болезни Крона; недержания мочи; ургентного недержания мочи; гиперактивности мочевого пузыря; цистита; нефрита; панкреатита; увеита; болезни внутренних органов; ишемии; апоплексии; дистонии; ожирения; сепсиса и зуда, которое представляет собой фармацевтическую композицию, содержащую кристаллическое вещество по любому одному из вышеприведенных вариантов осуществления [1]–[14] в качестве активного ингредиента в количестве, эффективном для лечения данных заболеваний.
[19–1] Кристаллическое вещество в вышеприведенном варианте осуществления [19] представляет собой предпочтительно кристаллическое вещество типа I по любому одному из вариантов осуществления [1]–[6].
[0039] Если не указано иначе, «лечение», как в «лечении заболевания» в данном описании означает выздоровление, или ослабление, или подавление «заболевания» или одного или более «заболеваний».
В зависимости от состояния пациента «предотвращение» в данном описании означает предотвращение возникновения «заболевания» или предотвращение возникновения любых симптомов, связанных с данным «заболеванием». Оно включает не только предотвращение «заболевания», но также уменьшение степени тяжести «заболевания» до его возникновения или уменьшение степени тяжести его любых симптомов.
[0040] [20] Двадцатый вариант осуществления изобретения представляет собой фармацевтическую композицию для лечения, по меньшей мере, одного заболевания по девятнадцатому варианту осуществления изобретения, содержащую кристаллическое вещество по любому одному из вышеприведенных вариантов осуществления [1]–[14] в качестве активного ингредиента в количестве, эффективном для антагонизма TRPV1.
[20–1] Кристаллическое вещество вышеприведенного варианта осуществления [20] представляет собой предпочтительно кристаллическое вещество типа I по любому одному из вышеприведенных вариантов осуществления [1]–[6].
[0041] [21] Двадцать первый вариант осуществления изобретения представляет собой профилактическое и/или терапевтическое средство для лечения, по меньшей мере, одного состояния, выбранного из состояний, описанных в девятнадцатом варианте осуществления изобретения, содержащее кристаллическое вещество по любому одному из вышеприведенных вариантов осуществления [1]–[14] в качестве активного ингредиента.
[0042] [21–1] Вышеприведенный вариант осуществления [21] представляет собой предпочтительно профилактическое и/или терапевтическое средство для лечения болевого состояния, содержащее кристаллическое вещество по любому одному из вышеприведенных вариантов осуществления [1]–[14] в качестве активного ингредиента.
[21–2] Кристаллическое вещество в вышеприведенных вариантах осуществления [21] и [21–1] представляет собой предпочтительно кристаллическое вещество типа I по любому одному из вышеприведенных вариантов осуществления [1]–[6].
[0043] [22] Двадцать второй вариант осуществления изобретения представляет собой терапевтическое средство для лечения, по меньшей мере, одного заболевания, выбранного из заболеваний, описанных в девятнадцатом варианте осуществления изобретения, содержащее кристаллическое вещество по любому одному из вариантов осуществления [1]–[14] в качестве активного ингредиента.
[0044] [22–1] Вышеприведенный вариант осуществления [22] представляет собой предпочтительно терапевтическое средство для лечения болевого состояния, содержащее кристаллическое вещество по любому одному из вышеприведенных вариантов осуществления [1]–[14] в качестве активного ингредиента.
[22–2] Кристаллическое вещество в вышеприведенных вариантах осуществления [22] и [22–1] представляет собой предпочтительно кристаллическое вещество типа I по любому одному из вышеприведенных вариантов осуществления [1]–[6].
[0045] [23] Двадцать третий вариант осуществления изобретения представляет собой профилактическое и/или терапевтическое средство для лечения заболевания, связанного с TRPV1, характеризующееся содержанием кристаллического вещества по любому одному из вышеприведенных вариантов осуществления [1]–[14] в качестве активного ингредиента.
[23–1] Кристаллическое вещество в вышеприведенном варианте осуществления [23] представляет собой предпочтительно кристаллическое вещество типа I по любому одному из вышеприведенных вариантов осуществления [1]–[6].
[0046] [24] Двадцать четвертый вариант осуществления изобретения представляет собой терапевтическое средство для лечения заболевания, связанного с TRPV1, характеризующееся содержанием кристаллического вещества по любому одному из вышеприведенных вариантов осуществления [1]–[14] в качестве активного ингредиента.
[24–1] Кристаллическое вещество вышеприведенного варианта осуществления [24] представляет собой предпочтительно кристаллическое вещество типа I по любому одному из вышеприведенных вариантов осуществления [1]–[6].
[0047] [25] Двадцать пятый вариант осуществления изобретения является антагонистом TRPV1, который представляет собой фармацевтическую композицию, содержащую кристаллическое вещество по любому одному из вышеприведенных вариантов осуществления [1]–[14] в качестве активного ингредиента.
[25–1] Кристаллическое вещество в вышеприведенном варианте осуществления [25] представляет собой предпочтительно кристаллическое вещество типа I по любому одному из вышеприведенных вариантов осуществления [1]–[6].
[0048] [26] Двадцать шестой вариант осуществления изобретения представляет собой применение кристаллического вещества по любому одному из вышеприведенных вариантов осуществления [1]–[14] в качестве фармацевтической композиции.
[26–1] Кристаллическое вещество в вышеприведенном варианте осуществления [26] представляет собой предпочтительно кристаллическое вещество типа I по любому одному из вышеприведенных вариантов осуществления [1]–[6].
[0049] [27] Двадцать седьмой вариант осуществления изобретения представляет собой применение кристаллического вещества по любому одному из вышеприведенных вариантов осуществления [1]–[14] при изготовлении фармацевтической композиции.
[27–1] Кристаллическое вещество в вышеприведенном варианте осуществления [27] представляет собой предпочтительно кристаллическое вещество типа I по любому одному из вышеприведенных вариантов осуществления [1]–[6].
[0050] [28] Двадцать восьмой вариант осуществления изобретения представляет собой применение кристаллического вещества по любому одному из вышеприведенных вариантов осуществления [1]–[14] в качестве антагониста TRPV1.
[28–1] Кристаллическое вещество в вышеприведенном варианте осуществления [28] представляет собой предпочтительно кристаллическое вещество типа I по любому одному из вышеприведенных вариантов осуществления [1]–[6].
[0051] [29] Двадцать девятый вариант осуществления изобретения представляет собой применение кристаллического вещества по любому одному из вышеприведенных вариантов осуществления [1]–[14] при изготовлении антагониста TRPV1.
[29–1] Кристаллическое вещество в вышеприведенном варианте осуществления [29] представляет собой предпочтительно кристаллическое вещество типа I по любому одному из вышеприведенных вариантов осуществления [1]–[6].
[0052] [30] Тридцатый вариант осуществления изобретения представляет собой способ лечения, по меньшей мере, одного заболевания, выбранного из группы заболеваний, описанных в девятнадцатом варианте осуществления изобретения, включающий введение кристаллического вещества по любому одному из вышеприведенных вариантов осуществления [1]–[14] объекту, нуждающемуся в лечении такого состояния, в количестве, эффективном для лечения заболевания.
[30–1] Кристаллическое вещество в вышеприведенном варианте осуществления [30] представляет собой предпочтительно кристаллическое вещество типа I по любому одному из вышеприведенных вариантов осуществления [1]–[6].
[0053] [31] Тридцать первый вариант осуществления изобретения представляет собой способ лечения, по меньшей мере, одного заболевания, выбранного из группы заболеваний, описанных в девятнадцатом варианте осуществления изобретения, включающий введение кристаллического вещества по любому одному из вышеприведенных вариантов осуществления [1]–[14] объекту, нуждающемуся в лечении такого состояния, в количестве, эффективном для антагонизма TRPV1.
[31–1] Кристаллическое вещество в вышеприведенном варианте осуществления [31] представляет собой предпочтительно кристаллическое вещество типа I по любому одному из вышеприведенных вариантов осуществления [1]–[6].
[0054] Антагонистическая активность в отношении TRPV1 кристаллического вещества по любому одному из вариантов осуществления [1]–[14] изобретения может быть измерена соответствующим образом выбранными методами, такими как методы Фармакологического экспериментального примера 1 ниже (антагонистическая активность в отношении человеческого TRPV1).
[0055] Кристаллическое вещество по любому одному из вариантов осуществления [1]–[14] изобретения обладает превосходной антагонистической активностью в отношении TRPV1 в Фармакологическом экспериментальном примере 1 (антагонистическая активность в отношении человеческого TRPV1).
[0056] Настоящее изобретение подробно поясняется ниже.
Все кристаллические формы кристаллических веществ (E)–2–(7–трифторметилхроман–4–илиден)–N–((7R)–7–гидрокси–5,6,7,8–тетрагидронафталин–1–ил)ацетамида в настоящем изобретении не являются гидратами или, другими словами, являются ангидридами.
[0057] Все кристаллические формы кристаллических веществ (E)–2–(7–трифторметилхроман–4–илиден)–N–((7R)–7–гидрокси–5,6,7,8–тетрагидронафталин–1–ил)ацетамида в настоящем изобретении также могут быть дейтерированы.
[0058] В данном описании методы анализа кристаллических веществ с помощью рентгеновской дифракции обычно используют для анализа полученных кристаллических веществ. Механические методы или оптические методы (такие как методы Фурье–Раман–спектра или спектра ЯМР твердого тела) или подобные также можно использовать для определения ориентации кристаллов. Термический анализ кристаллических веществ (дифференциальная сканирующая калориметрия (ДСК)), анализ инфракрасного спектра поглощения (ИК) (метод KBr, метод растворителей) и подобные также можно проводить стандартными способами.
[0059] По своей природе спектральные пики, полученные с помощью данных методов анализа, неизменно содержат определенные погрешности измерения. Значения спектральных пиков в пределах диапазонов погрешности также включены в кристаллическое вещество изобретения.
В отношении углов дифракции (2θ) порошковой рентгеновской дифракции, например, различные образцы определенной кристаллической формы будут иметь одинаковые главные пики при одинаковых углах дифракции (2θ), но различия во вторичных пиках могут возникать в порошковой рентгеновской дифрактограмме. Это означает, что погрешности «±0,2» или «±0,1» в углах дифракции (2θ) допустимы в порошковой рентгеновской дифракции. Обычно углы дифракции в порошковой рентгеновской дифракции (2θ) имеют погрешности в диапазоне ±0,2°. Следовательно, если не указано иначе, «угол дифракции (2θ) (приблизительно) X°» в настоящем изобретении означает угол дифракции (2Ɵ) от ((X–0,2) до (X+0,2))°. В настоящее изобретение включены не только кристаллические вещества, которые точно соответствуют углу дифракции в порошковой рентгеновской дифракции, но также кристаллические вещества, которые соответствуют углу дифракции в пределах диапазона погрешности ±0,2°.
[0060] «Характерный пик» при угле дифракции (2θ) в порошковой рентгеновской дифракции в данном описании означает пик максимального поглощения при угле дифракции (2θ) со значением, приведенным в Таблицах 2, 3, 5 или 7. Относительная интенсивность (%) при определенном угле дифракции (2θ) в порошковой рентгеновской дифракции может отличаться в зависимости от условий измерения, поскольку интенсивность рентгеновских лучей при каждом пике может изменяться или может не появляться вообще в некоторых случаях в зависимости от размера и направления кристаллов.
[0061] Погрешности «±0,2» или «±0,1» допустимы в отношении инфракрасного поглощения (см–1) в ИК–Фурье–спектре, и погрешности «±1» допустимы в температуре измерения ДСК (°C).
[0062] Кристаллическое вещество типа I изобретения характеризуется наличием экстраполированной температуры начала пика плавления 232°C при измерении дифференциальной сканирующей калориметрии (измерение ДСК) в условиях скорости повышения температуры 10°С/мин.
[0063] Кристаллическое вещество типа II изобретения характеризуется тем, что некоторое поглощение тепла может быть подтверждено при приблизительно от 170°C до 200°C при измерении ДСК, изменение кристаллической формы подтверждается под микроскопом, наблюдается переход к кристаллическому веществу типа I, и экстраполированная температура начала пика плавления близка к температуре плавления типа I.
[0064] Кристаллическое вещество типа III изобретения характеризуется тем, что наблюдается переход к кристаллическому веществу типа I при приблизительно 170°C во время повышения температуры в порошковой рентгеновской дифракции в условиях переменной температуры.
[0065] Кристаллическое вещество типа I (E)–2–(7–трифторметилхроман–4–илиден)–N–((7R)–7–гидрокси–5,6,7,8–тетрагидронафталин–1–ил)ацетамид изобретения может быть получен путем перехода в кристаллическое вещество (например, кристаллическое вещество типа II и/или кристаллическое вещество типа III) (E)–2–(7–трифторметилхроман–4–илиден)–N–((7R)–7–гидрокси–5,6,7,8–тетрагидронафталин–1–ил)ацетамид, который включает множество морфологий кристаллов. Например, переход от кристаллического вещества типа II или кристаллического вещества типа III к кристаллическому веществу типа I может быть вызван нагреванием кристаллического вещества при температуре, по меньшей мере, 170°C.
[0066] В данном описании кристаллический переход представляет собой явление, при котором кристаллическая структура изменяется при применении нагревания или давления.
Примеры «методов перехода кристаллического вещества» включают методы, которые хорошо известны, такие как, например, методы кристаллизации из раствора (такие как методы концентрирования, методы медленного охлаждения, методы взаимодействия (диффузионный метод, метод электролиза), методы гидротермального роста и методы слияния агентов), методы кристаллизации из пара (такие как методы газификации (метод запаянной пробирки, газовый паровой метод), методы газофазной реакции и методы химического транспортирования), методы кристаллизации из расплава (такие как методы нормальной кристаллизации (метод осаждения, метод градиента температур, метод Бриджмена), методы зонной плавки (метод горизонтальной зонной плавки, метод плавающей зоны) и специальные методы выращивания кристаллов (ПЖК–метод, жидкофазная эпитаксия)), методы транспирации (методы растворения кристаллов в растворителе, фильтрование и испарение растворителя при атмосферных условиях), суспензионные методы (методы добавления кристаллов в растворитель, так что избыток твердого вещества остается для получения суспензии, и перемешивание при комнатной температуре или при нагревании и охлаждении для сбора твердого вещества с помощью фильтрования) и вакуумная сушка, растирание, измельчение, повышение давления и подобные.
[0067] В способе получения кристаллического вещества типа I изобретения (вышеприведенный вариант осуществления [15]) спиртовой растворитель в растворителе, используемом для получения кристаллического вещества типа I, представляет собой предпочтительно метанол, этанол или 2–пропанол, или более предпочтительно метанол или этанол, или еще более предпочтительно этанол.
В способе получения кристаллического вещества типа I изобретения (вышеприведенный вариант осуществления [15]) предпочтительным является смешанный растворитель из спиртового растворителя и ацетона в качестве растворителя, используемого для получения кристаллического вещества типа I. Примеры включают спиртовые растворители, такие как метанол или этанол, и смешанные растворители из спиртовых растворителей с ацетоном. Смешанный растворитель из этанола и ацетона является предпочтительным с точки зрения растворимости и выхода.
[0068] В способе изготовления кристаллического вещества типа I изобретения (вышеприведенный вариант осуществления [15]) соотношение компонентов смеси из смешанного растворителя из спиртового растворителя и ацетона, может быть выбрано соответствующим образом в пределах диапазона от 1:9 до 9:1 (объем:объем, об./об.). Более определенно, соотношение этанол:ацетон может составлять 1:1, 3:7 или подобное. Для соотношения количества воды, используемой с данным смешанным растворителем, соотношение смешанный растворитель:вода составляет от 3:1 до 2:1. Часть смешанного растворителя также может быть использована в смеси с водой. Например, если соотношение смешанный растворитель:вода составляет 20:10, соединение может быть растворено при нагревании с 15 частями смешанного растворителя, и затем 5 частей смешанного растворителя могут быть смешаны и соответствующим образом использованы с 10 частями воды. Количество используемого смешанного растворителя составляет приблизительно 10 мл на 1 г (в виде твердого вещества) соединения, которое должно быть растворено.
[0069] Вода в способе получения кристаллического вещества типа I изобретения (вышеприведенный вариант осуществления [15]) предпочтительно добавляется постепенно, а не все сразу. Скорость добавления особым образом не ограничена.
Время охлаждения до комнатной температуры в способе получения кристаллического вещества типа I изобретения (вышеприведенный вариант осуществления [15]) особым образом не ограничено в том случае, если достаточно времени для восстановления температуры растворителя до комнатной температуры.
[0070] В способе получения кристаллического вещества типа I изобретения (вышеприведенный вариант осуществления [15]) условия, состоящие из растворителя или смешанного растворителя, используемого при получении кристаллического вещества типа I, соотношения компонентов смеси воды с растворителем или смешанным растворителем, количества используемого смешанного растворителя, добавления воды и времени охлаждения до комнатной температуры, можно комбинировать и устанавливать соответствующим образом.
[0071] В способе получения кристаллического вещества типа II изобретения (вышеприведенный вариант осуществления [16]) растворитель, используемый для получения кристаллического вещества типа II, может быть сложноэфирным растворителем, спиртовым растворителем или смешанным растворителем из сложноэфирного растворителя и спиртового растворителя.
[0072] Для растворителя в способе получения кристаллического вещества типа II изобретения (вышеприведенный вариант осуществления [16]) этилацетат является предпочтительным в качестве сложноэфирного растворителя, метанол является предпочтительным в качестве спиртового растворителя и смешанный растворитель из этилацетата и метанола является наиболее предпочтительным.
[0073] При использовании смешанного растворителя из этилацетата и метанола в способе получения кристаллического вещества типа II изобретения (вышеприведенный вариант осуществления [16]), например, твердое вещество сначала суспендируют в 9:1 (объем:объем, об./об.) смешанного растворителя этилацетат:метанол при комнатной температуре и затем добавляют метанол до растворения твердого вещества. Конечное соотношение компонентов смеси этилацетат:метанол представляет собой этилацетат:метанол=от 3:1 до 4:1 или предпочтительно 3,6:1. Используемое количество смешанного растворителя из этилацетата и метанола составляет приблизительно от 40 до 50 мл на 1 г количества твердого вещества соединения, которое должно быть растворено.
[0074] В способе получения кристаллического вещества типа II изобретения (вышеприведенный вариант осуществления [16]), условия, состоящие из растворителя или смешанного растворителя, используемого при получении кристаллического вещества типа II, соотношения компонентов смеси смешанного растворителя и количества используемого смешанного растворителя, можно комбинировать и устанавливать соответствующим образом.
[0075] Полярный растворитель в способе получения кристаллического вещества типа III изобретения (вышеприведенный вариант осуществления [17]) представляет собой предпочтительно диметилсульфоксид. Соотношение полярного растворителя и смешанного растворителя из полярного растворителя и воды составляет предпочтительно 1:2. Смешанный растворитель из полярного растворителя и воды представляет собой предпочтительно смешанный растворитель из диметилсульфоксида и воды, и соотношение компонентов (объем:объем, об./об.) диметилсульфоксида и воды составляет предпочтительно от 1:1 до 1:2 или более предпочтительно 1:2. Добавленные количества диметилсульфоксида и воды превышают предпочтительно в 1–2 раза или более предпочтительно в 1,5 раза объем диметилсульфоксида, используемый для растворения твердого вещества. Начальное количество диметилсульфоксида, используемое для растворения твердого вещества, составляет приблизительно 10 мл на 1 г количества твердого вещества соединения, которое должно быть растворено.
[0076] В способе получения кристаллического вещества типа III изобретения (вышеприведенный вариант осуществления [17]), условия, состоящие из полярного растворителя, соотношения компонентов смеси из полярного растворителя и воды, добавленных количеств полярного растворителя и воды и начального количества диметилсульфоксида, используемого для растворения твердого вещества при получении кристаллического вещества типа III, можно комбинировать и устанавливать соответствующим образом.
[0077] В способе получения кристаллического вещества изобретения кристаллизацию проводят при температуре от приблизительно –30°С до 80°С, и в случае кристаллического вещества типа I предпочтительно проводят после того, как температура была повышена от комнатной температуры (от 1°С до 30°С) до от 60°С до 70°С, и кристаллизуемое соединение было растворено при температуре, при которой соединение полностью растворяется, тогда как в случае кристаллического вещества типа II и типа III предпочтительно проводят при комнатной температуре (от 1°С до 30°С).
[0078] В настоящем изобретении кристаллическое вещество типа I получают в виде игольчатых кристаллов, таких как кристаллы, показанные на ФИГ. 2, с помощью кристаллизации при определенных условиях.
[0079] В настоящем изобретении кристаллическое вещество типа II получают в виде столбчатых кристаллов, таких как кристаллы, показанные на ФИГ. 6, с помощью кристаллизации при определенных условиях.
[0080] Однако очевидно, что данные морфологии могут формировать другие кристаллические формы при определенных условиях, и такие кристаллические формы также включены в объем изобретения.
[0081] Если не указано иначе, в данном описании «игольчатый» означает игольчатую призму, и данная форма также называется «игольная нить».
[0082] Если не указано иначе, в данном описании «столбчатый» означает кристалл, выращенный параллельно в одном направлении и предполагающий длинную тонкую призматическую столбчатую форму.
[0083] Химическая чистота кристаллического вещества типа I, кристаллического вещества типа II и кристаллического вещества типа III в настоящем изобретении предпочтительно составляет от приблизительно 95% до 100%, или более предпочтительно от приблизительно 97% до 100%, или еще более предпочтительно от приблизительно 99% до 100%.
[0084] В настоящем изобретении кристаллическое вещество типа I, в частности является пригодным в качестве фармацевтического продукта, поскольку оно демонстрирует хорошие результаты, по меньшей мере, в одном виде испытаний, выбранных из группы, состоящей из исследований длительного хранения, ускоренных испытаний и других исследований стабильности и фотостабильности, и предпочтительно не имеет проблем с гигроскопичностью.
[0085] В настоящем изобретении кристаллическое вещество типа I, в частности является пригодным в качестве кристаллического вещества, поскольку оно обладает превосходной термодинамической стабильностью и, следовательно, удобно в обращении, и потому что полиморфные переходы кристаллов в процессе фармацевтического производства могут быть предотвращены заранее, так что качество активного фармацевтического ингредиента и фармацевтического продукта может поддерживаться, и может быть изготовлена твердая фармацевтическая композиция (фармацевтический препарат) с высокой воспроизводимостью.
[0086] В настоящем изобретении кристаллическое вещество типа I, в частности обладает чрезвычайно высокой химической и физической стабильностью и может быть использовано в качестве терапевтического и/или профилактического средства от боли, обладающей антагонистической активностью в отношении TRPV1.
[0087] В данном описании «боль» является признаком многих внешних повреждений и болезненных состояний. Когда происходит реальное повреждение тканей тела вследствие болезни или внешнего повреждения, характеристики активации ноцицептора изменяются, и это приводит к гиперчувствительности в поврежденном месте и в соседней нормальной ткани. Определенные примеры боли включают, но не ограничиваются ими, боль при остеоартрите, боль при артрите, невропатическую боль, послеоперационную боль, боль в пояснице, диабетическую невропатию, боль во время операции, боль при раке, вызванную химиотерапией боль, головную боль (включая кластерную головную боль, головную боль напряжения и головную боль при мигрени), тригеминальную невралгию, боль при опоясывающем герпесе, постгерпетическую невралгию, туннельный синдром запястья, воспалительную боль, боль от ревматоидного артрита, боль от колита или интерстициального цистита, висцеральную боль, боль от камней в почках, боль от камней в желчном пузыре, боль в горле, фибромиалгию, хронический болевой синдром, таламический синдром, боль от инсульта, фантомную боль в конечностях, солнечный ожог, радикулопатию, комплексный регионарный болевой синдром, ВИЧ–сенсорную невропатию, болевой синдром при расстройстве центральной нервной системы, боль при рассеянном склерозе, боль при болезни Паркинсона, боль от спинномозговой травмы, менструальную боль, зубную боль, боль от костного метастаза, боль от эндометриоза, боль от миомы матки, ноцицептивную боль, гипералгезию, и боль от височно–нижнечелюстного остеоартрита, и подобное.
[0088] [Способ получения (E)–2–(7–трифторметилхроман–4–илиден)–N–((7R)–7–гидрокси–5,6,7,8–тетрагидронафталин–1–ил)ацетамида (Соединение (1))]
Соединение (1) можно получить путем оптического разделения серого твердого соединения (Е)–2–(7–трифторметилхроман–4–илиден)–N–(7–гидрокси–5,6,7,8–тетрагидронафталин–1–ил)ацетамида (Соединение А), полученного в Примере 70 WO 2007/010383 в соответствии со способами, описанными в Примерах 71 и 72 WO 2007/010383. Данное оптическое разделение может быть соответствующим образом выполнено с помощью стандартных способов специалистом в данной области техники с использованием, например, оптической препаративной хроматографии, и условия оптического разделения также могут быть установлены соответствующим образом.
[0089] Более определенно, соответствующие энантиомеры указанного в заголовке соединения могут быть получены в виде первой фракции (69 мг, белое твердое вещество, 99,9% э.и., время удерживания 9,9 мин: Cоединение A–1) и второй фракции (71 мг, белое твердое вещество, 99,3% э.и., время удерживания 17,3 мин: Cоединение A–2), подвергая Cоединение A (160 мг) оптическому разделению с использованием препаративной хроматографии (колонка: Daicel Chemical Industries, Ltd. Chiralpak AD–H, растворитель: EtOH:Et2NH=100:0,1).
[0090] Первая фракция, разделенная колонкой оптического разделения (Соединение A–1), представляет собой (E)–2–(7–трифторметилхроман–4–илиден)–N–((7R)–7–гидрокси–5,6,7,8–тетрагидронафталин–1–ил)ацетамид (Соединение (1)), тогда как вторая фракция (Соединение A–2) представляет собой (E)–2–(7–трифторметилхроман–4–илиден)–N–((7S)–7–гидрокси–5,6,7,8–тетрагидронафталин–1–ил)ацетамид.
[0091] Структурная формула для Соединения (1) показана ниже.
[ХИМИЧЕСКАЯ ФОРМУЛА 1]
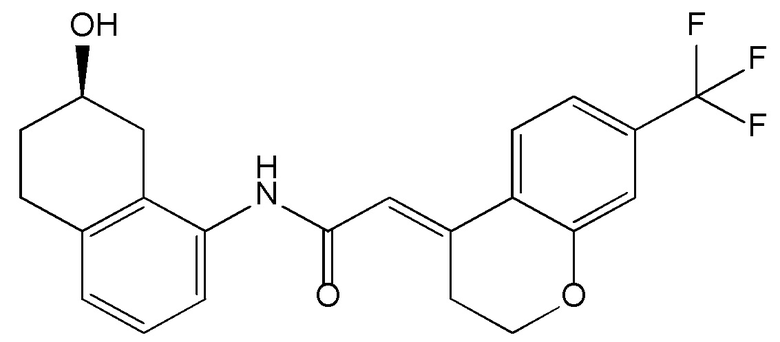
Соединение (1)
[0092] [Комбинированные лекарственные средства, используемые с кристаллическим веществом или фармацевтической композицией изобретения]
Кристаллическое вещество или его фармацевтическая композиция изобретения также может быть использована в комбинации с другими лекарственными средствами или лекарственными препаратами стандартными способами, используемыми в области фармацевтики. Примеры таких лекарственных средств включают анальгетики, такие как опиоидные агонисты, например, морфин; габапентин, прегабалин и дулоксетин и антидепрессанты, такие как амитриптилин; противоэпилептические средства, такие как карбамазепин и фенитоин; антиаритмические средства, такие как мексилетин и подобные, которые иногда направляются на невропатическую боль и назначаются; и НПВС, такие как диклофенак, индометацин, ибупрофен и напроксен, и противовоспалительные средства, включая ингибиторы ЦОГ–2, такие как Целебрекс. Предпочтительными примерами являются морфин, габапентин или прегабалин, диклофенак и Целебрекс.
[0093] Кристаллическое вещество или его фармацевтическая композиция изобретения может быть использована не только в комбинации с другими лекарственными средствами, но также при лечении в комбинации с другими видами терапии. Определенные примеры включают акупунктуру, лазерную терапию, терапию нервной блокады и подобные.
Для заболеваний или состояний, отличных от боли, которые связаны с TRPV1, кристаллическое вещество изобретения или его фармацевтическая композиция могут быть использованы в комбинации с другими лекарственными средствами, применяемыми в соответствующей области. Например, его можно комбинировать с обычно используемыми НПВС, БМАРП, антителами к ФНО–α, растворимыми рецепторами ФНО–α, стероидами, иммунодепрессантами и подобными при лечении хронического ревматоидного артрита. Его также можно комбинировать с агонистами β–2 рецепторов, стероидами и другими обычно используемыми терапевтическими средствами при лечении ХОБЛ и аллергических состояний. Его также можно комбинировать с антихолинергическими средствами при лечении гиперактивности мочевого пузыря и недержания мочи.
[0094] При использовании кристаллического вещества с существующим лекарственным средством при лечении вышеприведенных заболеваний оно позволяет уменьшить введенное количество существующего лекарственного средства и ослабить побочные эффекты существующего лекарственного средства. Конечно, комбинированные способы с использованием данных лекарственных средств не ограничиваются вышеперечисленными заболеваниями и комбинированные лекарственные средства не ограничиваются вышеперечисленными соединениями.
[0095] Когда кристаллическое вещество изобретения используют вместе с комбинированным лекарственным средством, они могут представлять собой или отдельные препараты, или смесь. В случае отдельных препаратов их можно вводить одновременно или вводить в шахматном порядке.
[0096] [Фармацевтическая композиция кристаллического вещества изобретения]
Фармацевтическая композиция кристаллического вещества настоящего изобретения содержит кристаллическое вещество (Е)–2–(7–трифторметилхроман–4–илиден)–N–((7R)–7–гидрокси–5,6,7,8–тетрагидронафталин–1–ил)ацетамид в комбинации с фармацевтически приемлемыми вспомогательными веществами.
Более определенно, эксципиенты (такие как лактоза, сахароза, маннит, кристаллическая целлюлоза, кремниевая кислота, кукурузный крахмал и картофельный крахмал), связующие вещества (такие как целлюлоза (гидроксипропилцеллюлоза (ГПЦ)), гидроксипропилметилцеллюлоза (ГПМЦ)), кристаллическая целлюлоза, сахара (лактоза, маннит, сахароза, сорбит, эритрит, ксилит), крахмалы (кукурузный крахмал, картофельный крахмал), прежелатинизированный крахмал, декстрин, поливинилпирролидон (ПВП), макрогол и поливиниловый спирт (ПВС)), скользящие вещества (такие как стеарат магния, стеарат кальция, тальк и карбоксиметилцеллюлоза), дезинтегрирующие вещества (такие как крахмалы (кукурузный крахмал, картофельный крахмал), карбоксиметилкрахмал натрия, кармеллоза, кармеллоза кальция, кроскармеллоза натрия, кросповидон), покрывающие вещества (такие как целлюлоза (гидроксипропилцеллюлоза (ГПЦ), гидроксипропилметилцеллюлоза (ГПМЦ), аминоалкилметакрилатный сополимер Е и метакриловый сополимер LD), пластификаторы (такие как триэтилцитрат и макрогол), маскирующие вещества (такие как оксид титана), красители, ароматизирующие вещества, консерванты (такие как бензалкония хлорид и сложный эфир параоксибензойной кислоты), изотонические агенты (такие как глицерин, хлорид натрия, хлорид кальция, маннит и глюкоза), регуляторы рН (такие как гидроксид натрия, гидроксид калия, карбонат натрия, хлористоводородная кислота, серная кислота и буферные вещества, такие как фосфатные буферы), стабилизаторы (такие как сахара, сахарные спирты и ксантановая камедь), диспергирующие вещества, антиоксиданты (такие как аскорбиновая кислота, бутилгидроксианизол (ВНА), пропилгаллат и d1–α–токоферол), буферные вещества, консерванты (такие как парабен, бензиловый спирт и бензалкония хлорид), ароматические вещества (такие как ванилин, 1–ментол и розовое масло), солюбилизирующие вещества (такие как отвержденное полиоксиэтиленом касторовое масло, полисорбат 80, полиэтиленгликоль, фосфолипидный холестерин и триэтаноламин), стимуляторы абсорбции (такие как гликолят натрия, эдетат натрия, капрат натрия, ацилкарнитины и лимонен), гелеобразующие агенты, суспендирующие агенты или эмульгаторы и обычно используемые виды соответствующих вспомогательных веществ и растворителей могут быть соответствующим образом объединены с кристаллическим веществом изобретения для получения различных лекарственных форм.
[0097] Примеры различных лекарственных форм включают таблетки, капсулы, гранулы, порошки, пилюли, аэрозоли, ингаляторы, мази, пластыри, суппозитории, инъекции, пастилки, жидкости, спиртовые растворы, суспензии, экстракты, эликсиры и подобное. Введение пациенту может быть пероральным, подкожным, внутримышечным, интраназальным, чрескожным, внутривенным, внутриартериальным, периневральным, эпидуральным, интратекальным, интрацеребровентрикулярным, ректальным или ингаляционным введением или подобным.
[0098] Доза кристаллического вещества изобретения обычно составляет от 0,005 мг до 3,0 г для взрослого человека в день, или более предпочтительно от 0,05 мг до 2,5 г, или еще более предпочтительно от 0,1 мг до 1,5 г и может быть соответствующим образом увеличена или уменьшена в соответствии с симптомами и путем введения.
Целая доза может вводиться перорально или парентерально за одно или от двух до шести введений или может вводиться непрерывно внутривенным вливанием или подобным образом.
[0099] [Фармакологические экспериментальные примеры]
Настоящее изобретение подробно поясняется ниже с использованием экспериментальных примеров, но настоящее изобретение не ограничивается данными примерами.
В следующем фармакологическом экспериментальном примере 1 предоставлен способ проверки эффективности кристаллического вещества изобретения.
[Фармакологический экспериментальный пример 1: Измерение индуцированного капсаицином притока Са в человеческой трансформированной TRPV1 клеточной линии СНО]
(1) Создание человеческой трансформированной TRPV1 клеточной линии СНО
кДНК человеческого ванилоидного рецептора 1 (hTRPV1) клонировали из мозга человека. Клонированную кДНК hTRPV1 вставляли в вектор pCAGGS, который затем генетически вводили в клеточную линию CHO–K1 для трансформации клеток. Клоны, полученные путем предельного разведения, стимулировали капсаицином, и клоны с высокой чувствительностью отбирали на основании увеличенной концентрации Ca. Выбранные клоны затем использовали для следующего эксперимента.
[0100] (2) Измерение притока Ca с использованием FDSS–6000
Человеческие трансформированные TRPV1 клетки СНО высевали с плотностью 40000 клеток на лунку в 96–луночный планшет (черные стенки, прозрачное дно/изготовленный Greiner Bio–One International GmbH). Клетки культивировали в течение ночи при условиях 37°С, 5% СО2, после чего загрузочный раствор набора для анализа FLIPR Calcium 3 (изготовленный Molecular Devices, LLC) с добавлением 2,5 ммоль/л пробенецида добавляли в каждую лунку в том же количестве, что и среда, и клетки культивировали при 37°С в течение 60 минут. Изменения внутриклеточной концентрации Ca измеряли в течение 3 минут после стимуляции капсаицином (от 1 нмоль/л до 1 мкмоль/л) с помощью FDSS–6000 (λвозб.: 480 нм, λэм.: 540 нм, Hamamatsu Photonics K.K.). Были рассчитаны интегральные значения соответствующих скоростей увеличения внутриклеточной концентрации Ca в группе со средой и в группе, обработанной кристаллическим веществом изобретения, и были получены кривые реакции концентрации капсаицина. Была рассчитана концентрация (значение А2) кристаллического вещества изобретения, которая привела к сдвигу в правую сторону в два раза кривой реакции концентрации капсаицина во время обработки в группе со средой, и ингибирующий эффект исследуемого соединения был подтвержден на основании данного значения.
[0101] Антагонистическая активность в отношении TRPV1 исследуемого соединения (E)–2–(7–трифторметилхроман–4–илиден)–N–((7R)–7–гидрокси–5,6,7,8–тетрагидронафталин–1–ил)ацетамида была показана в Таблице 1 исходя из значения А2.
[0102]
[Таблица 1]
(Значение А2: менее 100 нмоль/л)
[0103] Данные результаты показали, что кристаллическое вещество изобретения обладало превосходной антагонистической активностью в отношении TRPV1.
[0104] Таким образом, ожидается, что в качестве превосходного антагониста TRPV1 кристаллическое вещество изобретения будет использоваться в качестве профилактического и/или терапевтического средства для лечения, по меньшей мере, одного заболевания, выбранного из группы, состоящей из острой боли; хронической боли; невропатической боли; постгерпетической невралгии; тригеминальной невралгии; боли в пояснице; боли после спинномозговой травмы; боли в ногах; каузалгии; диабетической невралгии; боли, вызванной отеком, ожогами, растяжениями, переломами костей и подобным; боли после хирургических операций; плечелопаточного периартрита; остеоартрита; артрита; боли при ревматоидном артрите; воспалительной боли; раковой боли; мигрени; головных болей; зубных болей; невралгии; боли в мышцах; гипералгезии; боли, вызванной стенокардией, менструацией и подобным; невропатии; повреждения нерва; нейродегенерации; хронической обструктивной болезни легких (ХОБЛ); астмы; гиперчувствительности дыхательных путей; стридора; кашля; ринита; воспаления слизистой оболочки, такой как глаза; нервного дерматита; воспалительных кожных заболеваний, таких как псориаз и экзема; отека; аллергических заболеваний; гастродуоденальной язвы; язвенного колита; синдрома раздраженной толстой кишки; болезни Крона; недержания мочи; ургентного недержания мочи; гиперактивности мочевого пузыря; цистита; нефрита; панкреатита; увеита; болезни внутренних органов; ишемии; апоплексии; дистонии; ожирения; сепсиса и зуда.
[0105] Литература и публикации, процитированные в данном описании, тем самым включены в настоящее описание посредством ссылки в полном объеме, независимо от их целей. Данная спецификация также охватывает раскрытие формулы изобретения, спецификации и чертежей каждой из японской патентной заявки № 2017–108017 (поданной 31 мая 2017 года, Япония) и предварительной заявки на патент США № 62/512775 (поданной 31 мая 2017 года, США), на котором основано притязание на приоритет настоящей заявки.
[ПРИМЕР]
[0106] Далее настоящее изобретение более подробно поясняется ниже на основании примеров и примеров исследования, но данные примеры являются просто формами осуществления, которые не ограничивают настоящее изобретение, и могут изменяться, не выходя за рамки объема настоящего изобретения.
[0107] «Комнатная температура» в примерах означает температуру обычно от 1°С до 30°С (как установлено Японской фармакопеей).
[0108] Коммерческие растворители использовали без очистки для кристаллизации в примерах.
[0109] Анализ с использованием порошковой рентгеновской дифракции проводили с использованием D8 Discover с GADDS CS (Bruker Corporation) с помощью метода Брэгга–Брентано (источник рентгеновского излучения: 40 кВ, 40 мА, длина волны: 1,5418 Å (CuK альфа), длина камеры: 250 мм, температура: комнатная температура, положение Phi: 0 градусов, время воздействия: 2 минуты, тета 1:7 градусов, тета 2:7 градусов).
[0110] Измерение с использованием дифференциальной сканирующей калориметрии (ДСК) проводили с применением дифференциального сканирующего калориметра DSC6220 (Seiko Instruments Inc.) в диапазоне от 50°C до 300°C при скорости изменения 10°C/минуту. ИК–Фурье–измерение проводили с использованием FT–720 (Horiba, Ltd.) методом KBr. Микроскопические изображения измеряли с помощью MTFP82HT (Mettler–Toledo International Inc.).
[0111] Измерение химической чистоты проводили с использованием колонки Develosoil ODS–HG–5 (размер 4,6 × 150 мм). Подвижная фаза представляла собой ацетонитрил:вода=1:1.
[0112] (Ссылочный пример) Синтез (E)–2–(7–трифторметилхроман–4–илиден)–N–((7R)–7–гидрокси–5,6,7,8–тетрагидронафталин–1–ил)ацетамида
(E)–2–(7–трифторметилхроман–4–илиден)–N–(7–гидрокси–5,6,7,8–тетрагидронафталин–1–ил)ацетамид (Соединение A) Примера 70 WO 2007/010383 подвергают оптическому разделению с помощью препаративной хроматографии (колонка: Daicel Chemical Industries, Ltd. Chiralpak AD–H, 10 см ID × 25 см, растворитель метанол:ацетонитрил 9:1, скорость потока 189 мл/мин, температура колонки 40°C, концентрация образца 7 г/л (EtOH)) с получением Соединения (1).
[0113] (Пример 1) Кристаллическое вещество типа I (E)–2–(7–трифторметилхроман–4–илиден)–N–((7R)–7–гидрокси–5,6,7,8–тетрагидронафталин–1–ил)ацетамид
Соединение (1) (165,2 г) растворяли при нагревании при от 60°С до 70°С в смеси ацетон/этанол (99,5%) (1/1, 1,6 л). При перемешивании добавляли воду (600 мл) и смесь охлаждали до комнатной температуры при перемешивании. Осажденное кристаллическое вещество отфильтровывали и промывали последовательно смесью этанол/вода (1/1) и водой. Полученное кристаллическое вещество высушивали при пониженном давлении с получением белого кристаллического вещества (146,7 г) в виде кристаллического вещества типа I.
[0114] На ФИГ. 1 показаны результаты измерения порошковой рентгеновской дифракции кристаллического вещества типа I, пики кристаллического вещества типа I показаны в Таблице 2, и характеристические пики показаны в Таблице 3. На ФИГ. 2 показана микроскопическая фотография кристаллического вещества типа I. Данные ИК–Фурье–спектра для кристаллического вещества типа I показаны на ФИГ. 3 и Таблице 4. На ФИГ. 4 показаны данные термического анализа ДСК для кристаллического вещества типа I. В данных термического анализа ДСК не наблюдается очевидного зависимого от температуры эндотермического/экзотермического пика между комнатной температурой и температурой плавления.
[0115]
[Таблица 2]
Таблица 2: Данные анализа порошковой рентгеновской дифракции для кристаллического вещества типа I
[0116]
[Таблица 3]
Таблица 3: Данные анализа порошковой рентгеновской дифракции для кристаллического вещества типа I (характеристические данные)
[0117]
[Таблица 4]
Таблица 4: Данные ИК–Фурье–спектра для кристаллического вещества типа I
[0118] (Пример 2)
Соединение (1) (200 мг) растворяли при нагревании при 60°C в смеси ацетон/этанол (99,5%) (7/3, 15 мл) и добавляли воду (14 мл) при нагревании в течение 20 минут. Затем охлаждали до комнатной температуры. Осажденное кристаллическое вещество отфильтровывали и промывали последовательно смесью этанол/вода (1/1) и водой. Полученное кристаллическое вещество высушивали при пониженном давлении с получением белого кристаллического вещества (188 мг) в виде кристаллического вещества типа I.
Когда кристаллическое вещество измеряли с помощью порошковой рентгеновской дифракции, наблюдали характеристические пики кристаллического вещества типа I, как показано в Таблице 3.
[0119] (Пример 3) Кристаллическое вещество типа II (E)–2–(7–трифторметилхроман–4–илиден)–N–((7R)–7–гидрокси–5,6,7,8–тетрагидронафталин–1–ил)ацетамид
Соединение (1) (40,0 г) растворяли в смеси этилацетат/метанол (1440 мл/400 мл) и концентрировали при пониженном давлении. Добавляли этилацетат и суспендированный раствор отфильтровывали и затем высушивали при пониженном давлении с получением белого кристаллического вещества (33,6 г) в виде кристаллического вещества типа II.
[0120] Результаты измерения порошковой рентгеновской дифракции для кристаллического вещества типа II показаны на ФИГ. 5, и характеристические пики кристаллического вещества типа II в Таблице 5. На ФИГ. 6 показана микроскопическая фотография кристаллического вещества. Данные ИК–Фурье–спектра для кристаллического вещества показаны на ФИГ. 7 и Таблице 6. Данные термического анализа ДСК для кристаллического вещества показаны на ФИГ. 8.
В термическом анализе ДСК некоторое поглощение тепла было подтверждено при приблизительно от 170 до 200°С, и изменение кристаллической формы было подтверждено под микроскопом.
[0121]
[Таблица 5]
Таблица 5: Данные анализа порошковой рентгеновской дифракции для кристаллического вещества типа II
[0122]
[Таблица 6]
Таблица 6: Данные ИК–Фурье–спектра для кристаллического вещества типа II
[0123] (Пример 4) Кристаллическое вещество типа III (E)–2–(7–трифторметилхроман–4–илиден)–N–((7R)–7–гидрокси–5,6,7,8–тетрагидронафталин–1–ил)ацетамид
Соединение (1) (1,5 г) растворяли в диметилсульфоксиде (15 мл). Диметилсульфоксид/вода (1/2, 22,5 мл) добавляли при перемешивании при комнатной температуре в три добавления и смесь перемешивали в течение 30 минут. Полученное кристаллическое вещество отфильтровывали и результирующее кристаллическое вещество промывали смесью этанол/вода (1/4, 3 мл, 2 раза), водой (3 мл, 2 раза) и этанолом (3 мл). Кристаллическое вещество высушивали при пониженном давлении в течение 2 часов при 40°С с получением белого кристаллического вещества (1,41 г) в виде кристаллического вещества типа III.
[0124] Результаты измерения порошковой рентгеновской дифракции для кристаллического вещества типа III показаны на ФИГ. 9. Характеристические пики кристаллического вещества типа III показаны в Таблице 7.
[0125]
[Таблица 7]
Таблица 7: Данные анализа порошковой рентгеновской дифракции для кристаллического вещества типа III
[0126] (Экспериментальный пример 1) Исследование суспензии растворителя смеси кристаллических форм
Соответствующие кристаллические формы (кристаллическое вещество типа I, кристаллическое вещество типа II) (E)–2–(7–трифторметилхроман–4–илиден)–N–((7R)–7–гидрокси–5,6,7,8–тетрагидронафталин–1–ил)ацетамида, полученного кристаллизацией, смешивали в равных количествах для приготовления смеси кристаллических форм, и данную смесь кристаллических форм смешивали с различными растворителями (ацетонитрилом, этанолом или 2–пропанолом), и суспендировали (с образованием суспензии), и перемешивали в течение 5 дней при 25°С. Кристаллические вещества отфильтровывали, и с помощью порошковой рентгеновской дифрактограммы было подтверждено, что все представляли собой кристаллические вещества типа I.
Данные результаты ясно показали, что кристаллическое вещество типа I изобретения было термодинамически стабильным в суспензии в условиях 25°С. Следовательно, используя кристаллическое вещество типа I настоящего изобретения в фармацевтическом продукте, можно заранее предотвращать кристаллические превращения в процессе производства фармацевтических препаратов и поддерживать качество активного фармацевтического ингредиента и фармацевтического продукта.
[0127] (Экспериментальный пример 2) Исследование стабильности при хранении
Кристаллические вещества типа I и типа II (E)–2–(7–трифторметилхроман–4–илиден)–N–((7R)–7–гидрокси–5,6,7,8–тетрагидронафталин–1–ил)ацетамида, полученные кристаллизацией (приблизительно 30 мг), помещали в стеклянные бутылки и хранили при различных условиях. После окончания периода хранения образцы удаляли, их химическую чистоту измеряли с помощью высокоэффективной жидкостной хроматографии и кристаллические формы подтверждали с помощью анализа порошковой рентгеновской дифракции. Результаты показаны в Таблице 8.
[0128]
[Таблица 8]
Таблица 8: Стабильность порошка
[0129] (Экспериментальный пример 3) Исследование стабильности при длительном хранении
Кристаллическое вещество типа I (E)–2–(7–трифторметилхроман–4–илиден)–N–((7R)–7–гидрокси–5,6,7,8–тетрагидронафталин–1–ил)ацетамид, полученный с помощью кристаллизации (400 мг), помещали в двойной мешок из ПЭНП (полиэтилена низкой плотности), помещали в фибровый барабан и хранили при условиях, описанных в Таблице 9. После окончания периода хранения образцы удаляли, их химическую чистоту измеряли с помощью высокоэффективной жидкостной хроматографии и кристаллические формы подтверждали с помощью анализа порошковой рентгеновской дифракции. Результаты показаны в Таблице 9.
[0130]
[Таблица 9]
Таблица 9: Стабильность порошка
[0131] Результаты (Экспериментальный пример 2) и (Экспериментальный пример 3) показали, что кристаллическое вещество типа I изобретения было химически и физически стабильным в течение всего периода исследования. Более того, в течение данного периода не наблюдалось поглощения влаги кристаллическим веществом типа I.
Следовательно, качество лекарственного средства поддерживается в пределах стандарта в течение длительного периода времени, и в течение данного периода оно может легко превращаться в фармацевтический продукт и использоваться в качестве фармацевтического препарата.
[0132] (Экспериментальный пример 4) Исследование фотостабильности
Кристаллическое вещество типа I и кристаллическое вещество типа II (приблизительно 2 г каждое) (E)–2–(7–трифторметилхроман–4–илиден)–N–((7R)–7–гидрокси–5,6,7,8–тетрагидронафталин–1–ил)ацетамид, полученный с помощью кристаллизации, помещали в стеклянные чашеобразные контейнеры и подвергали исследованию фотостабильности в соответствии с ICH Q1B (Руководство по исследованию фотостабильности новых лекарственных средств и новых составов) (образцы для исследования фотостабильности хранятся под отдельной лампой, излучающей видимый свет и УФ–А излучение, и суммарное воздействие устанавливается на 1,2 миллиона люкс–час и 200 Вт⋅час/м2 или более при 25°C; 10–дневное исследование показано как 1ICH). После завершения исследования каждый образец удаляли, его химическую чистоту измеряли с помощью высокоэффективной жидкостной хроматографии и кристаллическую форму подтверждали с помощью анализа порошковой рентгеновской дифракции. Результаты показаны в Таблице 10.
[0133]
[Таблица 10]
Таблица 10: Фотостабильность
[0134] Данные результаты ясно показали, что кристаллическое вещество типа II изобретения было нестабильным по отношению к свету, тогда как кристаллическое вещество типа I обладало чрезвычайно высокой химической и физической стабильностью. Следовательно, кристаллическое вещество типа I является удобным в обращении в качестве активного фармацевтического ингредиента в процессе фармацевтического производства и подходит для фармацевтических ингредиентов и фармацевтических препаратов. Кроме того, поскольку оно не подвергается фоторазложению или структурной изомеризации соединения или какому–либо снижению биологической активности, его биодоступность не изменяется, его свойства состава в качестве фармацевтического продукта остаются стабильными, и его можно хранить в течение длительного периода времени.
Соединение (1) настоящего изобретения имеет структуру хроман–4–илидена, и имеет место опасение, что данная структура может переходить в структуру 2Н–хромена при воздействии света. Снижение биологической активности также является проблемой при таких обстоятельствах.
[0135] Примеры составов
Примеры фармацевтической композиции изобретения приведены ниже.
Пример Состава 1: Таблетки
Вышеуказанные ингредиенты взвешивают и смешивают равномерно. Полученную смесь прессуют для приготовления таблетки, имеющей массу 150 мг.
[0136] Пример Состава 2: Капсулы
Вышеуказанные ингредиенты взвешивают и затем гомогенно перемешивают. Затем 300 мг полученной смеси заполняют в соответствующую твердую капсулу с помощью устройства для закрытия капсул, что позволяет приготовить капсулу.
[0137] Пример Состава 3: Капсулы
Тальк
2 г
Вышеуказанные ингредиенты взвешивают. Кристаллическое вещество типа I Примера 1, лактозу и кукурузный крахмал затем гомогенно перемешивают и к смеси добавляют водный раствор гидроксипропилцеллюлозы. Гранулы получают с помощью метода влажного гранулирования. Затем тальк гомогенно смешивают с гранулами. В дальнейшем 200 мг полученной смеси заполняют в соответствующую твердую капсулу, что позволяет приготовить капсулу.
[0138] Пример Состава 4: Порошок
Вышеуказанные ингредиенты взвешивают и затем гомогенно перемешивают. Таким образом, получают 20% порошковый лекарственный препарат.
[ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ]
[0139] Поскольку оно обладает превосходным антагонизмом в отношении TRPV1, кристаллическое вещество изобретения может предоставлять профилактическое и/или терапевтическое средство, которое клинически пригодно при заболеваниях, таких как боль.
Более того, кристаллическое вещество изобретения является превосходным, по меньшей мере, в одном признаке, выбранном из группы, состоящей из стабильности при хранении, фотостабильности и термодинамической стабильности, предпочтительно может быть получено с промышленно высокой воспроизводимостью, выходом и чистотой и является пригодным в качестве кристаллического вещества активного фармацевтического ингредиента. Более того, предпочтительно способ получения кристаллического вещества изобретения может легко предоставить данное кристаллическое вещество с хорошим выходом, воспроизводимым и промышленным образом, и также является пригодным для получения стабильных поставок для фармацевтического производства. Более того, кристаллическое вещество Соединения (1), такое как описанное выше, является пригодным, поскольку оно позволяет получить превосходно стабильную фармацевтическую композицию.
[0140] Некоторые определенные варианты осуществления настоящего изобретения были подробно объяснены выше, но специалист в данной области техники может внести различные модификации и изменения в них до такой степени, пока они не будут значительно отклоняться от идей и преимуществ изобретения. Следовательно, такие модификации и изменения все включены в сущность и объем настоящего изобретения, как представлено в Формуле изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВОЕ ПРОИЗВОДНОЕ ГЕТЕРОЦИКЛИДЕН АЦЕТАМИДА | 2006 |
|
RU2451014C2 |
| СПОСОБ ПОЛУЧЕНИЯ ГЕТЕРОЦИКЛИДЕНОВОГО АЦЕТАМИДНОГО ПРОИЗВОДНОГО | 2020 |
|
RU2813203C2 |
| НЕГИГРОСКОПИЧЕСКАЯ КРИСТАЛЛИЧЕСКАЯ МАЛЕАТНАЯ СОЛЬ 5-[(Z)-(5-ФТОР-2-ОКСО-1,2-ДИГИДРО-3H-ИНДОЛ-3-ИЛИДЕН)МЕТИЛ]-N-[(2S)-2-ГИДРОКСИ-3-МОРФОЛИН-4-ИЛПРОПИЛ]-2,4-ДИМЕТИЛ-1H-ПИРРОЛ-3-КАРБОКСАМИДА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ РАКА | 2004 |
|
RU2319702C2 |
| КРИСТАЛЛИЧЕСКИЕ ФОРМЫ СОЕДИНЕНИЯ 3-КАРБОКСИПРОПИЛ-АМИНОТЕТРАЛИНА | 2009 |
|
RU2512390C2 |
| НОВАЯ СОЛЬ I | 2006 |
|
RU2417220C2 |
| КРИСТАЛЛЫ | 2010 |
|
RU2556206C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПИРИМИДИНОВЫХ ПРОИЗВОДНЫХ | 2011 |
|
RU2576619C2 |
| Твёрдые формы цефтолозана | 2014 |
|
RU2703457C2 |
| СОЛЬ АГОНИСТА ОПИОИДНОГО РЕЦЕПТОРА (MOR), КРИСТАЛЛИЧЕСКАЯ ФОРМА I ЕГО ФУМАРАТНОЙ СОЛИ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2018 |
|
RU2779119C2 |
| СОЛЬ И ПОЛИМОРФ ФЕНИЛ-ПИРИМИДОНОВОГО СОЕДИНЕНИЯ, ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ПРИМЕНЕНИЕ | 2018 |
|
RU2761213C2 |
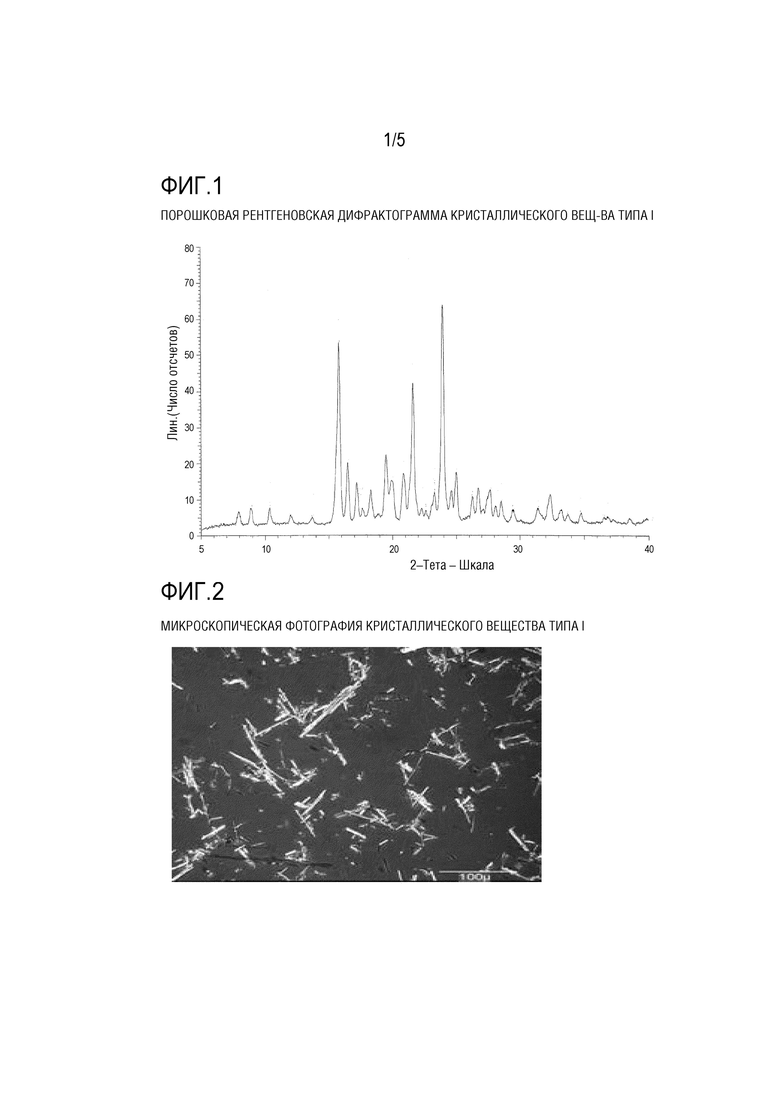
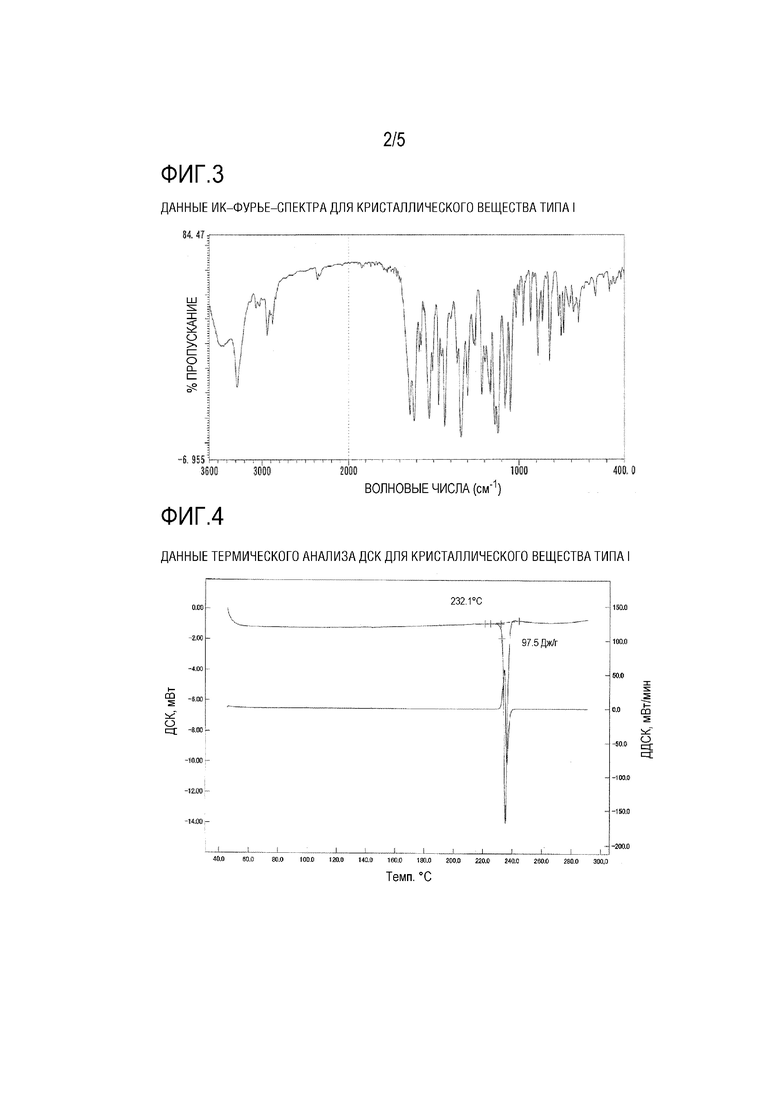
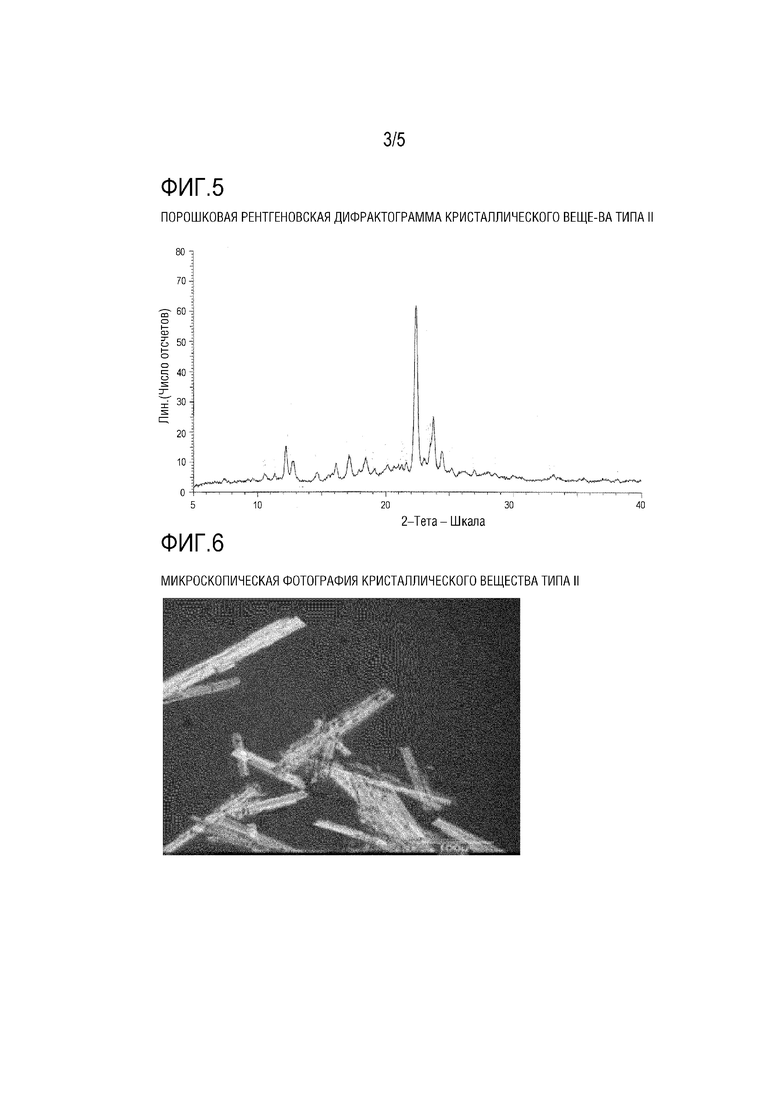
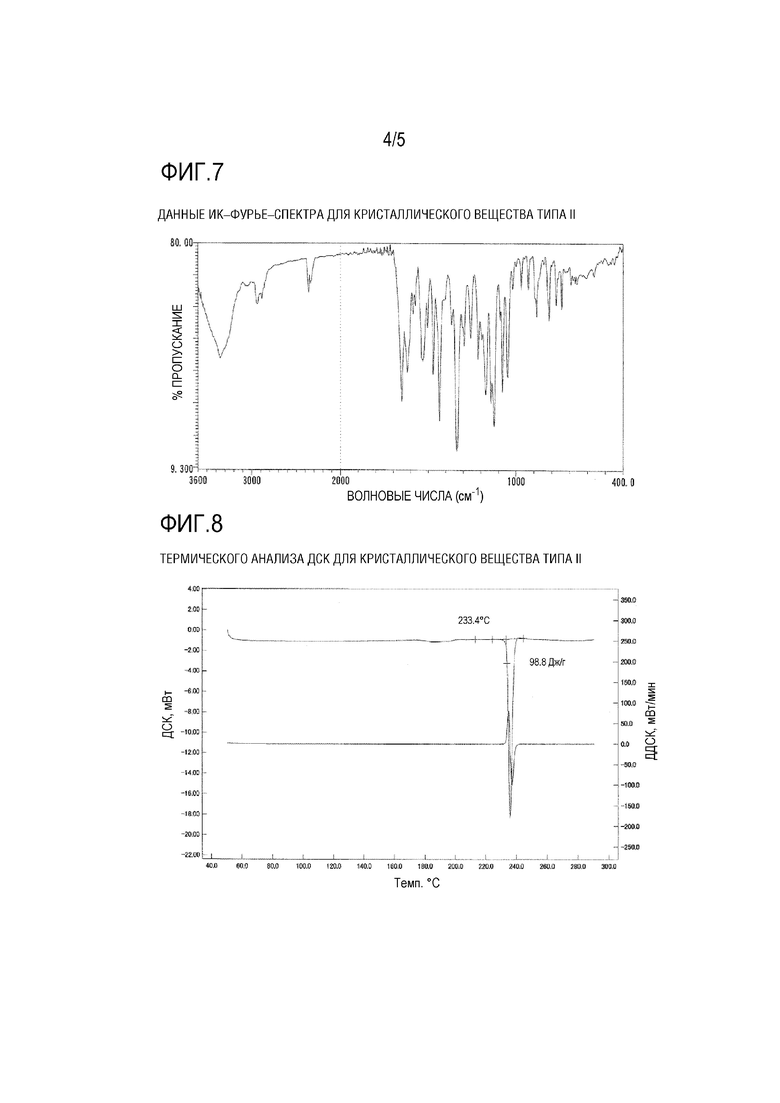
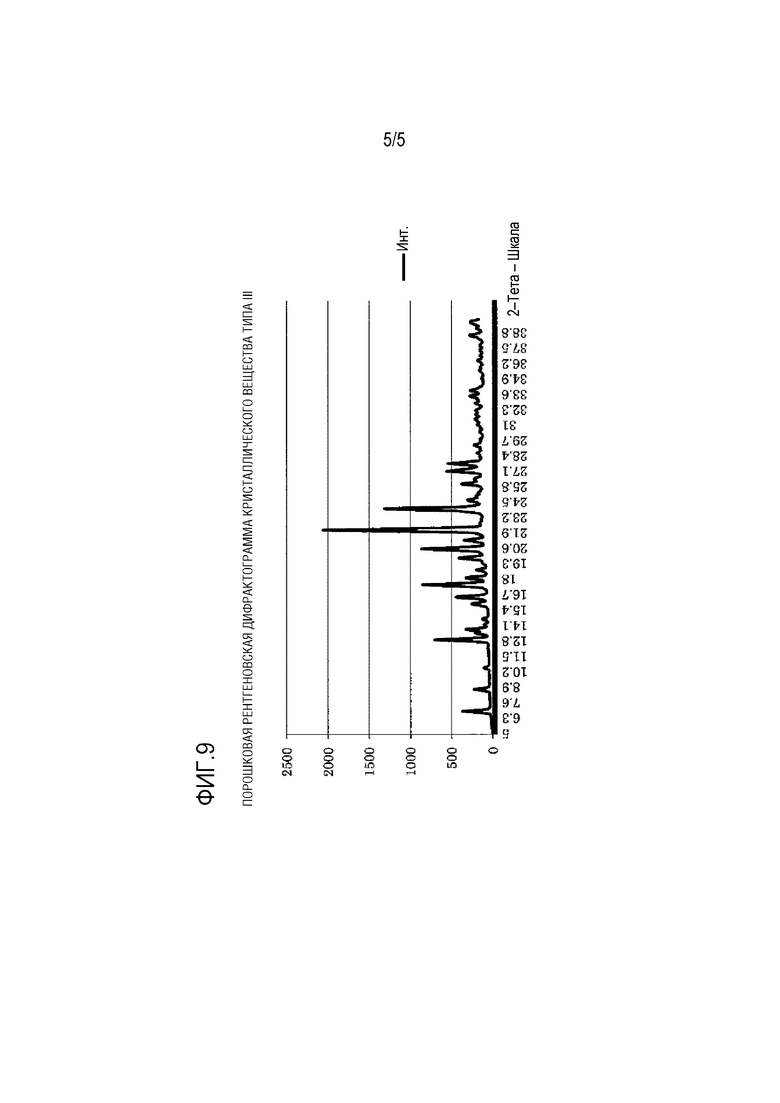
Изобретение относится к способу получения кристаллического вещества типа I (E)–2–(7–трифторметилхроман–4–илиден)–N–((7R)–7–гидрокси–5,6,7,8–тетрагидронафталин–1–ил)ацетамида, имеющего характеристические пики, по меньшей мере, при углах дифракции (2Ɵ) 7,9±0,2, 10,3±0,2, 15,8±0,2, 16,4±0,2, 17,2±0,2, 19,5±0,2, 19,9±0,2, 21,6±0,2, 23,9±0,2, 25,0±0,2 и 26,7±0,2 (°) в порошковой рентгеновской дифракции (Cu–Ka), включающий стадию растворения (E)–2–(7–трифторметилхроман–4–илиден)–N–((7R)–7–гидрокси–5,6,7,8–тетрагидронафталин–1–ил)ацетамида при нагревании до 60°C-70°C со смешанными растворителями из спиртового растворителя и ацетона, добавления воды при нагревании и перемешивании и затем охлаждения смешанного раствора, содержащего воду, при перемешивании до комнатной температуры с получением кристаллических веществ. Спиртовым растворителем является метанол, этанол или 2-пропанол. Технический результат - кристаллическое вещество типа I (E)–2–(7–трифторметилхроман–4–илиден)–N–((7R)–7–гидрокси–5,6,7,8–тетрагидронафталин–1–ил)ацетамида, который обладает свойством стабильности при хранении, фотостабильности. 2 н. и 3 з.п. ф-лы. 10 табл., 9 ил., 11 пр.
1. Способ получения кристаллического вещества типа I (E)–2–(7–трифторметилхроман–4–илиден)–N–((7R)–7–гидрокси–5,6,7,8–тетрагидронафталин–1–ил)ацетамида, имеющего характеристические пики, по меньшей мере, при углах дифракции (2θ) 7,9±0,2, 10,3±0,2, 15,8±0,2, 16,4±0,2, 17,2±0,2, 19,5±0,2, 19,9±0,2, 21,6±0,2, 23,9±0,2, 25,0±0,2 и 26,7±0,2 (°) в порошковой рентгеновской дифракции (Cu–Ka),
включающий стадию растворения (E)–2–(7–трифторметилхроман–4–илиден)–N–((7R)–7–гидрокси–5,6,7,8–тетрагидронафталин–1–ил)ацетамида при нагревании до 60°C-70°C со смешанными растворителями из спиртового растворителя и ацетона, добавления воды при нагревании и перемешивании и затем охлаждения смешанного раствора, содержащего воду, при перемешивании до комнатной температуры с получением кристаллических веществ.
2. Способ получения кристаллического вещества типа I (E)–2–(7–трифторметилхроман–4–илиден)–N–((7R)–7–гидрокси–5,6,7,8–тетрагидронафталин–1–ил)ацетамида, имеющего характеристические пики, по меньшей мере, при углах дифракции (2θ) 7,9±0,2, 8,9±0,2, 10,3±0,2, 12,0±0,2, 15,8±0,2, 16,4±0,2, 17,2±0,2, 17,6±0,2, 18,3±0,2, 19,5±0,2, 19,9±0,2, 20,8±0,2, 21,6±0,2, 23,9±0,2, 24,6±0,2, 25,0±0,2, 26,3±0,2, 26,7±0,2, 27,7±0,2, 28,6±0,2, 29,5±0,2, 31,4±0,2, 32,4±0,2, 33,2±0,2, 33,8±0,2 и 34,8±0,2 (°) в порошковой рентгеновской дифракции (Cu–Ka),
включающий стадию растворения (E)–2–(7–трифторметилхроман–4–илиден)–N–((7R)–7–гидрокси–5,6,7,8–тетрагидронафталин–1–ил)ацетамида при нагревании до 60°C-70°C со смешанными растворителями из спиртового растворителя и ацетона, добавления воды при нагревании и перемешивании и затем охлаждения смешанного раствора, содержащего воду, при перемешивании до комнатной температуры с получением кристаллических веществ.
3. Способ по п.1 или 2, в котором спиртовым растворителем является метанол, этанол или 2-пропанол.
4. Способ по любому из пп.1-3, где кристаллическое вещество типа I имеет экстраполированную температуру начала пика плавления 232°C при измерении дифференциальной сканирующей калориметрии (измерение ДСК).
5. Способ по любому из пп.1-4, где кристаллическое вещество типа I имеет морфологию игольчатого кристалла.
| НОВОЕ ПРОИЗВОДНОЕ ГЕТЕРОЦИКЛИДЕН АЦЕТАМИДА | 2006 |
|
RU2451014C2 |
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| MINO R | |||
| CAIRA: "Crystalline Polymorphism of Organic Compounds", TOPICS IN CURRENT CHEMISTRY, 1998, vol.198, pp.163-208 | |||
| SHERRY L | |||
| MORISETTE et al.: "High-throughput crystallization: polymorphs, salts, co-crystals and solvates of pharmaceutical solids", Advanced drug delivery reviews, 2004, | |||
Авторы
Даты
2022-09-05—Публикация
2018-05-30—Подача