Изобретение относится к медицинской иммунологии, а именно к способу определения специфического клеточного иммунного ответа и может быть использовано в медицине для определения специфического клеточного иммунного ответа к вирусу SARS-CoV-2 у переболевших и привитых пациентов.
Известно, что наряду с гуморальным, клеточный иммунитет играет важную роль в защите организма от вирусов, но на сегодняшний момент нет стандартного, удобного в исполнении метода оценки специфического клеточного иммунного ответа. При исследованиях специфического клеточного иммунного ответа на вирус SARS-CoV-2, которые проводились при испытании вакцин в разных странах, а также при обследовании пациентов, перенесших COVID-19, чаще всего использовались следующие методы: ELISPOT [1] и внутриклеточное мечение различных цитокинов на лимфоцитах [2]. Оба этих метода трудоемки, требуют высокотехнологичного оборудования, дорогих реагентов и высококвалифицированного персонала.
Методы, используемые для оценки антиген-специфического Т-клеточного иммунитета многообразны, так как характеризуют различные активности Т-клеток, запускаемые при их контакте с антигеном: способность пролиферировать, продуцировать различные цитокины (например, ИФНγ), лизировать клетки-мишени с помощью перфорина или гранзимов, накапливать перфорин, гранзимы А и В в виде гранул внутри Т-клетки. Почти все они требуют выделения лимфоцитов из крови обследуемого человека. Несколько вариантов таких методов реализуются на базе технологии проточной цитофлуориметрии (метод тетрамеров [3], [4], [5], метод внутриклеточного мечения [6], [7], метод дегрануляции лимфоцитов [8], [4], [9]). Для реализации этих методов требуются дорогостоящие высокоочищенные эпитопы антигенов, а в большинстве случаев еще и молекулы главного комплекса гистосовместимости. Данные методы очень точны и специфичны, но малопригодны для массовых исследований из-за трудоемкости и/или высокой стоимости.
Антигенспецифическая пролиферация Т-клеток также может быть реализована на платформе проточной цитофлуориметрии, однако, чаще оценивается по включению радионуклидной метки [10].
Для метода ELISPOT требуется специальное оборудование, где в планшетах с мембраной, содержащей антитела против ИФНγ, определяется количество Т-клеток, распознавших антиген и продуцирующих ИФНγ [11].
Общим ограничением перечисленных способов, затрудняющим массовые исследования Т-клеточного иммунного ответа, сравнимые по масштабам с определением гуморального иммунного ответа, является генетическая рестрикция распознавания антигенов Т-клетками. Это означает, что лимфоциты людей, генетически различающихся по антигенам главного комплекса гистосовместимости (HLA), в одном и том же белке распознают разные эпитопы.
Таким образом, существуют сложности при создании тест-системы, подходящей для всех людей и каждый вариант надо конкретизировать.
Это затруднение преодолевается несколькими способами.
Во-первых, можно для активации лимфоцитов использовать целую «библиотеку» перекрывающихся эпитопов белка или надмолекулярной белковой структуры. Тогда в этом наборе с большой вероятностью найдется эпитоп, который способны распознать Т-клетки памяти любого человека. Этот вариант используется только для научной работы.
Во-вторых, если необходимо выявить Т-клетки памяти у максимально возможного числа людей, в коммерческую тест-систему в качестве стимулирующего антигена добавляется набор из 3-7 эпитопов, которые способны распознать 50-80% всех людей. Таким образом, организованы тест-системы ELISPOT для диагностики состояния Т-клеток при инфекциях, вызываемых вирусами герпес-группы, как важных для исхода трансплантаций или лечения цитостатиками.
В-третьих, для стимуляции можно использовать целые белковые антигены, вирусные частицы и т.п., однако не все эпитопы, против которых в организме сформированы Т-клетки памяти, находятся на поверхности таких крупных антигенов. В этом случае необходимо предусмотреть условия для того, чтобы крупные антигены могли пройти процессинг в антигенпредставляющих клетках и были представлены Т-клеткам памяти в доступной для них форме. Такими условиями является наличие в клеточной взвеси не только лимфоцитов, среди которых надо выявить Т-клетки памяти, но и элементов, способных трансформироваться в антигенпредставляющую клетку (например, моноциты).
Для разработки метода мониторинга Т-клеточного иммунитета, предполагающего массовые обследования людей, подходит только этот последний вариант стимуляции, однако при этом должны соблюдаться и иные условия.
В российской и иностранной научной литературе предлагаются различные методы для мониторинга Т-клеток памяти у пациентов, вакцинированных той или иной вакциной, в частности, против SARS-CoV-2. Для этого среди лимфоцитов привитых людей определяют процент клеток с иммунофенотипом Т-клеток памяти [12], [13], [14], [15], [16], [17], [18], [19]. В настоящее время существуют коммерчески доступные реагенты (флуоресцентно меченные моноклональные антитела), которые позволяют провести такой анализ в лабораториях, имеющих оборудование для проточной цитофлуориметрии
В наиболее простом варианте реализации данного подхода проводят сравнение количества лимфоцитов, имеющих иммунофенотип Т-клеток памяти до проведения вакцинации и после нее. Такая оценка неточна, т.к. клетки памяти к конкретному антигену (набору антигенов) составляют доли процента от общего количества таких клеток у взрослого человека [17], [18], [19].
Более специфичной является оценка, основанная на том же методе, но включающая этап стимуляции лимфоцитов привитого человека вакцинными антигенами. При добавлении этого этапа клетки, которые в покое слабо экспрессируют на клеточной поверхности маркеры Т-клеток памяти, после стимуляции могут быть выявлены более точно. После проведения проточной цитофлуориметрии вычисляется коэффициент стимуляции экспрессии указанных маркеров примененным антигеном (смесью антигенов) [20], [21]. В обоих вариантах метод предполагает использование дорогостоящих реагентов и возможен только при оценке эффекта от вакцинации, т.к. предполагает сравнение с исходным (до вакцинации) уровнем реакции.
Антигенная стимуляция вакцинным антигеном в этой группе известных методов не предполагает типирования лимфоцитов человека в отношении антигенов главного комплекса гистосовместимости, что с одной стороны удешевляет процедуру, делая ее пригодной для массовых обследований, но одновременно и снижает специфичность оценки по сравнению с методами, перечисленными выше и предназначенными в основном для научных исследований.
Наиболее близким аналогом настоящего изобретения является технология QuantiFERON. Она, как и ELISPOT, относится к группе технологий IGRA (interferon gamma releasing assay - тесты, основанные на регистрации антиген-стимулированного выделения интерферона гамма(IFNγ)). Первоначально эта технология имела коммерческую реализацию в виде набора для диагностики Т-клеточного иммунитета против туберкулеза (QuantiFERON-TB Gold), затем для диагностики Т-клеточного иммунитета против цитомегаловирусной инфекции (QuantiFERON- CMV), а в настоящее время и против SARS-CoV-2 (QuantiFERON SARS-CoV-2) [22].
Набор реагентов QuantiFERON-SARS-CoV-2 предназначен для определения клеточного ответа к пептидным антигенам S1 S2 RBD из спайкового белка короновируса SARS-CoV-2 по уровню продукции IFNγ в образцах цельной гепаринизированной крови. Для реализации метода цельную кровь делят на 4 порции: негативный контроль, позитивный контроль, антиген S1, антиген S2 RBD. Полученные 4 пробирки (по 1 мл крови в каждой) сутки инкубируют в термостате, затем отделяют плазму центрифугированием. Уровень продукции IFNγ определяют методом иммуноферментного анализа.
Однако реализация данного метода требует использования реагентов от зарубежных производителей, что делает его неэкономичным и усложняет его применение для массовых исследований. Кроме того, в стандартном наборе QuantiFERON- SARS-CoV-2 отсутствует отрицательный контроль специфичности.
Сущность изобретения
Задачей настоящего изобретения является разработка простого, эффективного и удобного в применении способа оценки специфического клеточного иммунного ответа на антигены коронавируса SARS-CoV-2 на основе специфической антигенстимулированной продукции IFNγ.
Для решения поставленной задачи настоящее изобретение предлагает способ определения специфического клеточного иммунного ответа на антигены коронавируса SARS-CoV-2, включающий выделение мононуклеаров крови, стимуляцию выделенных мононуклеаров крови в лунках полистироловых планшетов с сорбированными в них антигенами SARS-CoV-2, сбор надосадочной жидкости по окончании стимуляции и последующее определение концентрации интерферона гамма (IFNγ) в надосадочной жидкости методом иммуноферментного анализа (ИФА).
Предложенный способ имеет следующие преимущества, которые делают его пригодным для мониторинга Т-клеточного ответа в популяции:
1. Способ является более экономичным по сравнению с наиболее близким аналогом, так как не требует дорогостоящего оборудования и может быть реализован с использованием реагентов российских производителей, т.е. способ не сопряжен с риском задержки поставок.
2. Способ позволяет использовать готовые полистироловые планшеты ИФА-тест-систем, прошедших регистрацию для медицинских целей, с фиксированным антигеном вируса SARS-CoV-2, которые применяются для титрования антител соответствующей специфичности, что позволяет дополнительно стандартизовать метод.
3. Способ подходит для людей с любым гаплотипом по антигенам главного комплекса гистосовместимости (HLA) и может быть осуществлен в течение суток.
Подробное описание изобретения
В описании данного изобретения термины «включает», «включающий» и «включает в себя» следует понимать, как «включает, помимо всего прочего». Указанные термины не предназначены для того, чтобы их истолковывали как «состоит только из». Если не определено отдельно, технические и научные термины в данной заявке имеют стандартные значения, общепринятые в научной и технической литературе.
Нижеследующие примеры приведены в целях иллюстрации настоящего изобретения и не ограничивают объем изобретения.
Пример осуществления изобретения 1.
Определение специфического клеточного иммунного ответа на антигены коронавируса SARS-CoV-2 в образцах крови доноров, перенесших COVID-19 (диагноз подтвержден методом ПЦР и серологически) весной и летом 2020 г. (группа 1), и в образцах крови доноров, не болевших COVID-19 (группа 2).
Методика исследования.
3 мл крови, взятой в гепарин, смешивали с 3 мл раствора ЗФР (забуференный фосфатами физиологический раствор, рН=7,2) и центрифугировали в градиенте плотности (d=1,077) при 400g 20 минут. По окончании центрифугирования из интерфазы собирали слой мононуклеаров. Эти клетки отмывали культуральной средой RPMI-164 0 путем центрифугирования при 1100 об/мин 10 минут. Полученный клеточный осадок разводили полной культуральной средой (среда RPMI-1640 с гентамицином и 10% эмбриональной телячьей сывороткой). Рабочая концентрация лимфоцитов в лунке - 2,5×105 клеток.
Для антигенной стимуляции мононуклеаров использовали полистироловые планшеты с сорбированным цельновирионным инактивированным антигеном SARS-CoV-2, предназначенные для выявления IgG-антител к SARS-CoV-2 (производство ФБУН ГНЦ «Вектор», № РЗН 2020/10017 от 10.04.2020, далее Антиген 1). Планшет инкубировали при 37°С в атмосфере 5% CO2 24 часа (на тест-системе производства ФБУН ГНЦ «Вектор»).
Для контроля специфичности использовали полистироловые планшеты с сорбированным вирусом Денге (тип 1 штамм Гавайи, тип 2 Новая Гвинея, тип 3 штамм Н87 и тип 4 штамм Н241), предназначенные для выявления IgG-антител к вирусу Денге (производство Vircell, S.L., Испания,REF-G1018).
Контрольный образец представлял собой пробу, инкубированную в аналогичных условиях без антигена.
Собранные через 24 часа культивирования супернатанты хранили до исследования в замороженном состоянии (-40°С). Концентрацию IFNγ определяли на ИФА-тест-системах (производство ООО «Вектор-Бест», № РЗН 2017/16008 от 24.07.2017).
Результаты учитывали как разницу между антиген индуцированной и спонтанной продукцией IFNγ (Δ). Полученные данные представлены в таблицах 1-3.
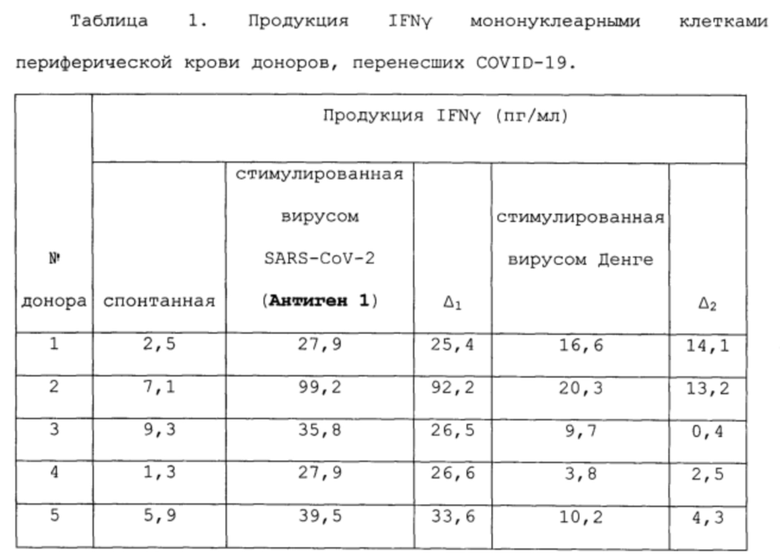
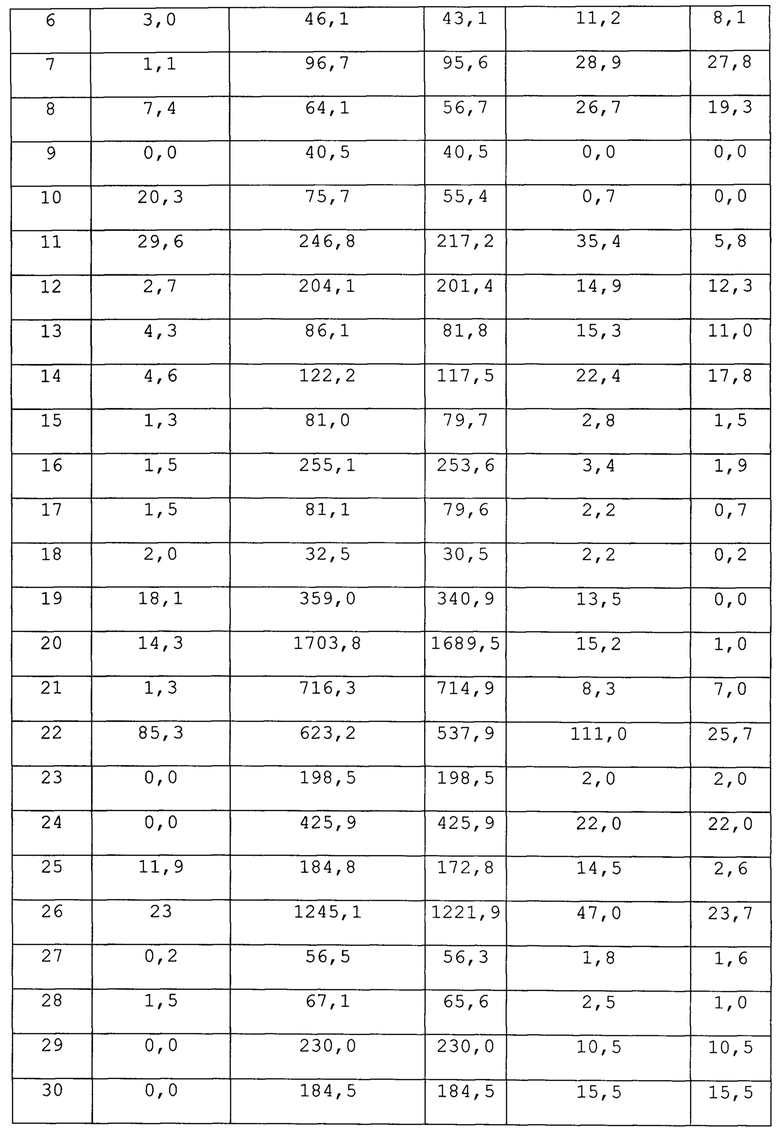

В таблице 1 для каждого из обследованных людей, перенесших COVID-19, увеличение продукции ИФНγ при стимуляции их мононуклеаров на ИФА-планшете, содержащем цельновирионный антиген SARS-COV-2, превышает таковую при стимуляции на планшете с антигенами вируса Денге в 1,5-4 0 раз, а само увеличение этого ответа на вирус Денге у половины доноров не превышает 5 пг/мл.


Из таблицы 2 видно, что у лиц, не болевших COVID-19 реакция мононуклеаров на антигены SARS-CoV-2 практически такая же низкая, как и на антигены вируса Денге.
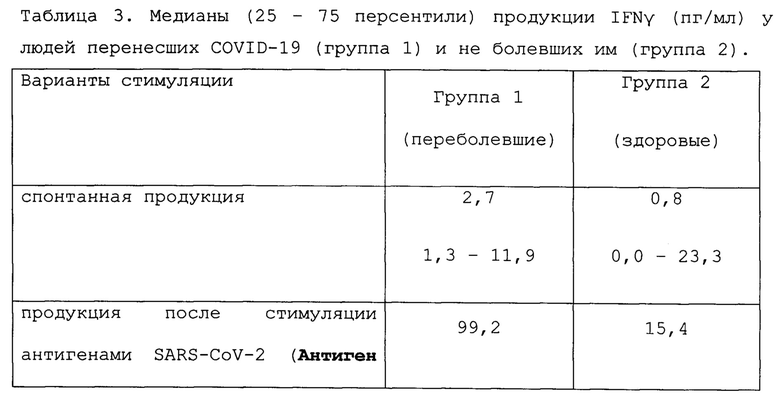
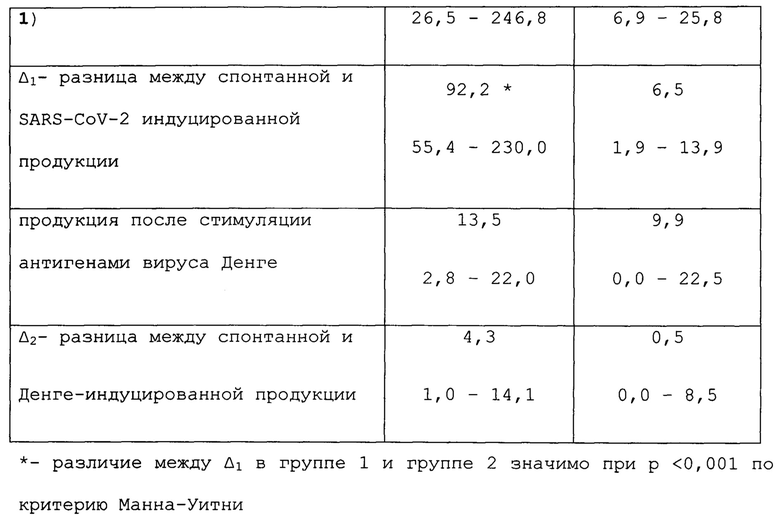
Статистическая обработка результатов данного примера, приведенная в таблице 3, показывает, что после стимуляции in vitro антигенами SARS-CoV-2 продукция IFNγ мононуклеарными клетками периферической крови доноров, не болевших COVID-19, значимо ниже, чем у лиц, перенесших это заболевание. На стимуляцию посторонним антигеном (вирус Денге) реакция мононуклеаров в обеих группах была низкой и практически одинаковой.
Пример осуществления изобретения 2.
Определение специфического клеточного иммунного ответа на антигены коронавируса SARS-CoV-2 в образцах крови доноров, перенесших COVID-19.
Методика исследования.
Приготовление взвеси мононуклеаров осуществлялось как в примере 1.
Для антигенной стимуляции мононуклеаров использовали полистироловые планшеты:
• с иммобилизованным рекомбинантным антигеном SARS-CoV-2(полноразмерным поверхностным гликопротеином S, включающим рецептор-связывающий домен (RBD)), предназначенные для выявления IgG-антител к SARS-CoV-2 (SARS-CoV-2- IgG-ИФА-БЕСТ, производство АО Вектор-Бест, Россия, № РЗН 2020/10388 от 18.05.2020, далее Антиген 2),
• с сорбированным антигеном SARS-CoV-2, предназначенные для выявления IgG к рецептор-связывающему домену (RBD) поверхностного гликопротеина S (spike) коронавируса SARS-CoV-2 («SARS-CoV-2-RBD-ИФА-Гамалеи», производство ФГБУ "НИЦЭМ им. Н.Ф. Гамалеи" Минздрава России (филиал "Медгамал"), № РЗН 2020/10393 от 18.05.2020, далее Антиген 3).
Для контроля специфичности использовали полистироловые планшеты с сорбированным вирусом Денге (тип 1 штамм Гавайи, тип 2 Новая Гвинея, тип 3 штамм Н87 и тип 4 штамм Н241), предназначенные для выявления IgG-антител к вирусу Денге (производство Vircell, S.L., Испания,REF-G1018).
Контрольный образец представлял собой пробу, инкубированную в аналогичных условиях без антигена.
Все планшеты инкубировали при 37°С в атмосфере 5% CO2 72 часа.
Сбор супернатантов, определение концентрации IFNγ и учет результатов выполняли как в примере 1.
Полученные данные представлены в таблице 4.
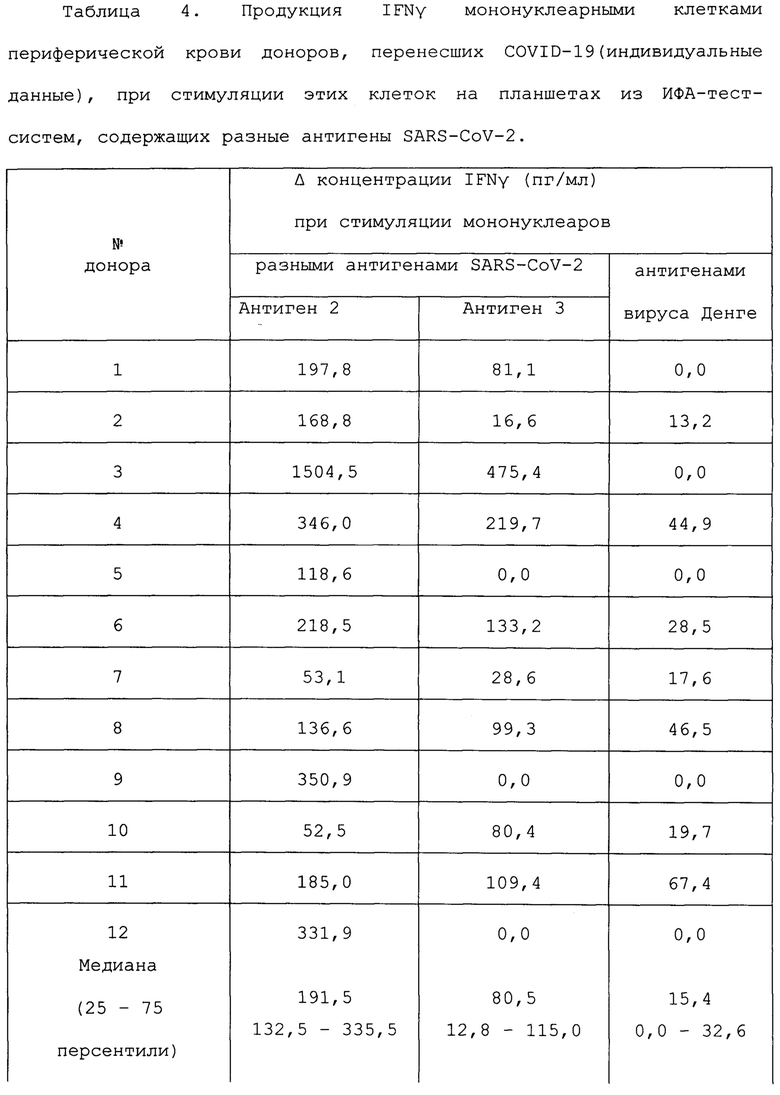
В строках таблицы 4 можно видеть как мононуклеары одного и того же человека, переболевшего COVID-19, отвечают на два различающихся по размеру и структуре антигена SARS-COV-2: Антиген 2 (рекомбинантный поверхностный гликопротеин S (spike) коронавируса SARS-CoV-2) и Антиген 3 (рекомбинантный рецептор-связывающий домен (RBD) поверхностного гликопротеина S (spike) коронавируса SARS-CoV-2.
Так же, как и в таблице 1, увеличение продукции ИФНγ при стимуляции мононуклеаров переболевших людей на ИФА-планшетах, содержащих тот или иной антиген SARS-COV-2, превышает таковую при стимуляции на планшете с антигенами вируса Денге. У всех переболевших мононуклеары реагировали на Антиген 2 и у 9 из 12 реагировали (примерно на том же уровне, что и на Антиген 2) на Антиген 3, являющийся небольшим фрагментом Антигена 2. Из научной литературы известно, что, в ходе заболевания (а не вакцинации), не у всех переболевших образуется Т-клеточная память к рецептор-связывающему домену (RBD) поверхностного гликопротеина S [23].
Таким образом, предложенный метод является специфичным, достаточно чувствительным и гораздо более доступным, чем методы оценки специфического клеточного иммунного ответа к вирусу SARS-CoV-2, используемые в настоящее время.
Список цитируемых публикаций
1. Feng-Cai Zhu, Xu-Hua Guan, Yu-Hua Li, Jian-Ying Huang, Tao Jiang, et al. Immunogenicity and safety of a recombinant adenovirus type-5-vectored COVID-19 vaccine in healthy adults aged 18 years or older: a randomised, double-blind, placebocontrolled, phase 2 trial. Lancet 2020; 396: 479-488, DOI:10.1016/S0140-6736(20)31605-6
2. DiPiazza А.Т., Graham B.S. and Ruckwardt T.J. T cell immunity to SARS-CoV-2 following natural infection and vaccination. Biochemical and Biophysical Research Communications, https://doi.org/10.1016/j.bbrc.2020.10.060
3. Kostense S., Ogg G.S., Manting E.H., Gillespie G., Joling J., Vandenberghe K., Veenhof E. Z., van Baarle D., Jurriaans S., Klein M. R., Miedema F. High viral burden in the presence of major HIV-specific CD8+ T cell expansions: evidence for impaired CTL effector function Eur J Immunol. 2001 Mar;31(3):677-86. doi: 10.1002/1521-4141(200103)31:3<677::aid-immu677>3.0.со;2-m.
4. Ndhlovu Z.M., Oelke M., Schneck J.P., and Griffin D.E. Dynamic regulation of functionally distinct virus-specific T cells PNAS, February, 2010, vol. 107, no. 8, 3669-3674
5. Callan M.F.C., Fazou C, Yang H., Rostron Т., Poon K., Hatton C., and McMichael A. J.. CD8+ T-cell selection, function, and death in the primary immune response in vivo J. Clin. Invest. 106:1251-1261 (2000).
6. Badovinac V.P., Harty J.T. Intracellular staining for TNF and IFN-gamma detects different frequencies of antigen-specific CD8(+) T cells J Immunol Methods. 2000 Apr 21;238(1-2):107-17. doi: 10.1016/s0022-1759(00)00153-8.
7. Won DI, Park JR. Flow cytometric measurements of TB-specific T Cells comparing with QuantiFERON-TB gold. Cytometry Part В 2010; 78B: 71-80.
8. Laing K.J., Magaret A.S., Mueller D.E., Zhao L., Johnston C, De Rosa S.C., Koelle D.M., Wald A., Corey L.. Diversity in CD8+ T Cell Function and Epitope Breadth Among Persons with Genital Herpes J Clin Immunol. 2010 September; 30(5): 703-722.
9. Мордовская Л.И., Владимирский М.А., Аксенова В.А. Иммунологические показатели как критерий оценки туберкулезного процесса у инфицированных микобактериями туберкулеза и больных туберкулезом легких детей и подростков Бюллетень ВСНЦ СО РАМН, 2011, 2 (78), 206
10. Edelman K., Не Q., Makinen J, Sahlberg A., Haanpera M., Schuerman L.,Wolter J., and Jussi Mertsolal Immunity to Pertussis 5 Years after Booster Immunization during Adolescence Clinical Infectious Diseases 2007; 44:1271-7 DOI: 10.1086/514338
11. Moormann A.M., Heller K.N., Chelimo K., Embury P., Ploutz-Snyder R., Otieno J.A., Oduor, C.  M., and Rochford R.. Children with Endemic Burkitt Lymphoma are Deficient in EBNA1-Specific IFN-γ T Cell Responses, Int J Cancer. 2009 April 1; 124(7): 1721-1726. doi:10.1002/ijc.24014.
M., and Rochford R.. Children with Endemic Burkitt Lymphoma are Deficient in EBNA1-Specific IFN-γ T Cell Responses, Int J Cancer. 2009 April 1; 124(7): 1721-1726. doi:10.1002/ijc.24014.
12. McElhaney J.E., Pinkoski M.J., Meneilly G.S. Changes in CD45 isoform expression vary according to the duration of T-cell memory after vaccination // Clin. Diagn. Lab. Immunol. 1995; 2: 73-81.
13. Waldrop S.L., Pitcher C.J., Peterson D.M., Maino V.C., Picker L.J. Determination of antigenspecific memory/effector CD4+ T cell frequencies by flow cytometry: evidence for a novel, antigenspecific homeostatic mechanism in HIV-associated immunodeficiency // J. Clin. Invest. 1997; 99: 1739-1750.
14. Sallusto F., Lanzavecchia A. Exploring pathways for memory T cell generation // J. Clin. Invest. 2001; 108: 805-806.
15. Sallusto F., Geginat J., Lanzavecchia A. Central Memory and Effector Memory T Cell Subsets: Function, Generation, and Maintenance // Annu. Rev. Immunol. 2004; 22: 745-763.
16. Williams M.A., Bevan M.J. Effector and Memory CTL Differentiation // Annu. Rev. Immunol. 2007; 25: 171-192.
17. Найхин А.Н., Кореньков Д.А., Петухова Г.Д. Оценка Т-клеточной иммунологической памяти по экспрессии молекул CD4 5 у людей, привитых живой реассортантной гриппозной вакциной. Медицинская иммунология. 2008; 10 (6): 535-42.
18. Щуковская Т.Н., Смолькова Е.А., Шмелькова Т.П. Индуцированная продукция INF-g и IL-4 как показатель функциональной активности Th1- и Th2-клеток у вакцинированных против чумы людей. Эпидемиология и вакцинопрофилактика. 2011; 6 (61): 78-83.
19. Найхин А.Н., Донина С.А., Лосев И.В., Петухова Г.Д., Кореньков Д.А., Стукова М.А., Ерофеева М.К., Коншина О.С., Смолоногина Т.А., Дорошенко Е.М., Григорьева Е.П., Руденко Л.Г. Гомологичный и гетерологичный гуморальный и т-клеточный иммунный ответ людей на живые реассортантные гриппозные вакцины A(H5N2) и A(H7N3). // Медицинская иммунология. 2015; 17 (1): 59-70.
20. Богачева Н.В., Крючков А.В., Дармов И.В., Воробьев К.А., Печенкин Д.В., Елагин Г.Д., Колесников Д.П. Экспериментальна я оценка методом проточной цитофлюориметрии уровня клеточной иммунологической памяти у лиц, вакцинированных против чумы и сибирской язвы. // Клиническая лабораторная диагностика. 2013; 11: 48-53.
21. Куличенко А.Н., Абзаева Н.В., Гостищева С.Е., Ракитина Е.Л., Пономаренко Д.Г., Костюченко М.В. Использование антигенспецифических клеточных тестов in vitro для оценки формирования поствакцинального противочумного иммунитета. // Инфекция и иммунитет. 2017; 7 (2): 203-208.
22. https://www.qiagen.com/us/products/diagnostics-and-clinical-research/infectious-disease/quantiferon-sars-cov-2-ruo/?clear=true#orderinginformation
23. Ling Ni, Fang Ye, Meng-Li Cheng, Yu Feng, et al. Detection of SARS-CoV-2-Specific Humoral and Cellular Immunity in COVID-19 Convalescent Individuals/ Immunity. 2020; 52, 971-977.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ определения и количественной оценки специфического клеточного иммунитета к антигенам S-белка вируса SARS-COV-2 | 2021 |
|
RU2762616C1 |
| Способ определения и количественной оценки специфического клеточного иммунитета к антигенам N-белка вируса SARS-COV-2 | 2023 |
|
RU2818080C1 |
| Способ иммуноферментного определения уровня антигенраспознающих рецепторов В-лимфоцитов, представленных мембранными, специфическими к RBD PROTEIN SARS-CoV-2, IgG антителами | 2021 |
|
RU2760438C1 |
| Тест-система и способ дифференцированного выявления антител к SARS-CoV-2 | 2021 |
|
RU2754340C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ОСЛОЖНЕНИЯ ПОСЛЕ COVID-19 У ЛИЦ С КОМОРБИДНЫМ ФОНОМ В АРКТИЧЕСКОМ РЕГИОНЕ | 2023 |
|
RU2812780C1 |
| Вакцина на основе вирусоподобных частиц (VLP) для профилактики COVID-19 для парентерального применения | 2024 |
|
RU2834060C1 |
| Способ выявления заражения людей и животных SARS CoV2 и диагностический набор для осуществления способа | 2021 |
|
RU2776295C1 |
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИИ S-АНТИГЕНА В ЦЕЛЬНОВИРИОННЫХ ИНАКТИВИРОВАННЫХ АДСОРБИРОВАННЫХ НА ГИДРООКИСИ АЛЮМИНИЯ, СУБЪЕДИНИЧНЫХ НА ОСНОВЕ S-БЕЛКА, РЕКОМБИНАНТНЫХ ИЛИ ПОЛИПЕПТИДНЫХ, СОДЕРЖАЩИХ ДОМЕН RBD SPIKE-БЕЛКА ВИРУСА SARS-COV ВАКЦИНАХ ДЛЯ ПРОФИЛАКТИКИ КОРОНАВИРУСНОЙ ИНФЕКЦИИ COVID-19 И/ИЛИ ДРУГИХ КОРОНАВИРУСНЫХ ИНФЕКЦИЙ | 2023 |
|
RU2825291C1 |
| СПОСОБ ИСПОЛЬЗОВАНИЯ РЕКОМБИНАНТНЫХ БЕЛКОВ SARS-COV-2 В СОСТАВЕ ТЕСТ-СИСТЕМЫ ДЛЯ ИММУНОФЕРМЕНТНОГО АНАЛИЗА С ОПРЕДЕЛЕНИЕМ УРОВНЕЙ АНТИТЕЛ КЛАССОВ IgM, IgG, IgA В СЫВОРОТКЕ/ПЛАЗМЕ КРОВИ БОЛЬНЫХ COVID-19 | 2020 |
|
RU2730897C1 |
| Конъюгат белка рецепторсвязывающего домена (RBD) поверхностного гликопротеина S вируса SARS-CoV-2 с полимером полиглюкин-спермидин (PGS) и вакцинный комплекс против коронавирусной инфекции COVID-19 на основе указанного конъюгата и плазмидной ДНК pVAX-RBD | 2022 |
|
RU2781294C1 |
Изобретение относится к медицине, а именно к иммунологии, и может быть использовано для определения специфического клеточного иммунного ответа на антигены коронавируса SARS-CoV-2. Осуществляют выделение мононуклеаров крови, стимуляцию выделенных мононуклеаров крови в лунках полистироловых планшетов с сорбированными в них антигенами SARS-CoV-2, сбор надосадочной жидкости по окончании стимуляции и последующее определение концентрации интерферона гамма (IFNγ) в надосадочной жидкости методом иммуноферментного анализа (ИФА). Стимуляцию выделенных мононуклеаров крови могут проводить путем их инкубации при 37°С в атмосфере 5% СО2 с добавлением полной культуральной среды RPMI-1640 с гентамицином и 10% эмбриональной телячьей сыворотки (ЭТС) до рабочей концентрации в лунке планшета 2,5×105 клеток. Концентрацию IFNγ в надосадочной жидкости определяют как разницу между антиген-индуцированной и спонтанной продукцией IFNγ. Способ обеспечивает возможность простой, эффективной и удобной оценки специфического клеточного иммунного ответа на антигены коронавируса SARS-CoV-2 за счет определения специфической антигенстимулированной продукции IFNγ. 1 з.п. ф-лы, 4 табл.
1. Способ определения специфического клеточного иммунного ответа на антигены коронавируса SARS-CoV-2, включающий выделение мононуклеаров крови, стимуляцию выделенных мононуклеаров крови в лунках полистироловых планшетов с сорбированными в них антигенами SARS-CoV-2, сбор надосадочной жидкости по окончании стимуляции и последующее определение концентрации интерферона гамма (IFNγ) в надосадочной жидкости методом иммуноферментного анализа (ИФА).
2. Способ по п. 1, где стимуляцию выделенных мононуклеаров крови проводят путем их инкубации при 37°С в атмосфере 5% СО2 с добавлением полной культуральной среды RPMI-1640 с гентамицином и 10% эмбриональной телячьей сыворотки (ЭТС) до рабочей концентрации в лунке планшета 2,5×105 клеток и где концентрацию IFNγ в надосадочной жидкости определяют как разницу между антиген-индуцированной и спонтанной продукцией IFNγ.
| WO 2021163398 A1, 19.08.2021 | |||
| ЖДАНОВ Д.Д | |||
| Роль эндонуклеазы EndoG в регуляции альтернативного сплайсинга пре-мРНК апоптотических белков | |||
| Диссер | |||
| Способ восстановления спиралей из вольфрамовой проволоки для электрических ламп накаливания, наполненных газом | 1924 |
|
SU2020A1 |
| SHYDLOVDKA O.A | |||
| et al | |||
| Nanoparticles of cerium dioxide increase activity of recombinant tumor necrosis factor-alpha | |||
| Shevchenkivska Vesna: Biology | |||
| XIV international scientific | |||
Авторы
Даты
2022-09-21—Публикация
2021-12-29—Подача