Изобретение относится к медицинской иммунологии, а именно к способам определения и количественной оценки специфического клеточного иммунитета.
Изобретение может быть использовано в медицине для определения специфического клеточного иммунного ответа к S-белку вируса SARS-COV-2 и его количественной оценки у переболевших COVID-19 и привитых от этой инфекции людей.
Специфический противовирусный иммунный ответ осуществляется за счет двух основных механизмов: гуморального, представленного вируснейтрализующими антителами, и клеточного, осуществляемого специфическими CD8+ цитотоксическими Т-лимфоцитами. При этом антитела играют вспомогательную роль, поскольку они могут связывать вирус только во внеклеточном пространстве - кровь, лимфа, тканевая жидкость и т.д., тогда как жизненный цикл вируса происходит внутриклеточно. Именно специфические CD8+ цитотоксические Т-лимфоциты способны распознать клетки, зараженные вирусом и уничтожить их вместе с размножающимся в них вирусом. Другая часть Т-лимфоцитов - специфические CD4+ хелперы помогают и организовывают гармоничность работы разных звеньев иммунного ответа. Для измерения уровня антител используется общепризнанный стандартный метод иммуноферментного анализа, существующий в нескольких модификациях. В то же время, для оценки специфического клеточного иммунитета нет такого стандартного метода.
Суть имеющихся подходов к определению специфического клеточного иммунитета сводится к выделению мононуклеаров периферической крови исследуемого донора, в состав которых входят лимфоциты и моноциты, и добавление в культуру этих клеток антигенов изучаемого вируса. После инкубации необходимо определить количество ответивших на антиген вируса клеток. Для этого определения используют разные способы. Так, например, используют метод тетрамеров - специальных конструкций, несущих HLA в комплексе с антигенным пептидом вируса, меченных флюорохромом [1]. Недостатком метода является то, что система HLA очень гетерогенна, при этом разработаны всего несколько вариантов тетрамеров, поэтому невозможно использовать этот подход для широкого, тем более популяционного исследования клеточного иммунитета. Метод тетрамеров подходит только для научных исследований небольших групп, специально отобранных доноров, идентичных по 3-5 вариантам HLA. Кроме того, создание тетрамеров весьма трудоемкое и дорогое дело.
Другим методом оценки специфического распознавания Т-лимфоцитами антигена является продукция интерферона-γ (IFN-γ). Этот цитокин участвует в организации противовирусного иммунного ответа. Используют методы оценки продукции IFN-γ Т-лимфоцитами в культуре в присутствии вирусного антигена (оценка качественная: да/нет, т.к. количественно продукция IFN-γ зависит от индивидуальных особенностей каждою человека), метод внутриклеточного окрашивания IFN-γ с последующим подсчетом процента ответивших клеток на проточном цитометре [2]. Этот метод позволяет количественно измерить клеточный ответ и выделить ответ именно CD8+ лимфоцитов. Однако данный метод требует процедуры пермеабелизации клеток и серии отмывок, в результате чего изрядная часть клеток теряется, что может приводить к неточным результатам. Достаточно распространен метод оценки продукции IFN-γ ELISpot, позволяющий подсчитать количество лимфоцитов, продуцирующих IFN-γ в ответ на распознавание вирусного антигена [3,4]. Все эти методы имеют ограничение, связанное с тем, что IFN-γ продуцируют и натуральные киллеры, и CD4+, и CD8+ лимфоциты.
Существуют методы выделения, например, только CD8+ лимфоцитов, но для этого требуется большой объем крови (порядка 20 мл на каждый антиген) и дополнительные достаточно дорогие импортные реактивы. Кроме того, метод ELISpot требует дорогостоящих импортных тест-систем (отечественных аналогов нет) и специализированного дорогостоящего оборудования, которое имеется в наличии только в нескольких лабораториях нашей страны. Важно, что сам IFN-γ лишь участвует в организации противовирусного клеточного иммунитета, но не является цитотоксическим веществом, поэтому может лишь косвенно свидетельствовать о наличии специфического клеточного цитотоксического иммунитета.
Для оценки активации Т-лимфоцитов используют также экспрессию маркера CD69 на поверхности распознавших антиген клеток [5]. Этот маркер появляется па поверхности только активированных клеток. С помощью проточной цитометрии можно подсчитать процент таких клеток и именно CD8+ лимфоцитов. Недостатком этого метода оценки является то, что молекула CD69 появляется при распознавании антигена как на Т-клетках памяти, так и на наивных лимфоцитах, способных, в принципе, ответить на данный антиген, что затрудняет оценку количества именно клеток памяти. Кроме того, в пределах популяции CD8+ есть центральные клетки памяти, помнящие образ врага, для активации которых типична экспрессия CD69, и клетки - эффекторы, которые, собственно, и осуществляют цитотоксические реакции для защиты от вируса и не экспрессируют CD69. Данный метод не позволяет определить их количество.
Известно, что цитотоксические CD8+ лимфоциты имеют гранулы, нагруженные цитотоксическими веществами. На внутренней поверхности мембран этих гранул экспрессирована молекула CD107a. В покое эта молекула отсутствует на внешней мембране клетки. При специфическом распознавании комплекса HLA-антигенный пептид, цитотоксические CD8+ лимфоциты активируются и атакуют, выбрасывая содержимое цитотоксических гранул. При этом мембрана цитотоксической гранулы сливается с внешней мембраной цитотоксического CD8+ лимфоцита и на его поверхности па некоторое время появляются молекулы CD107a. Этот эффект легко зафиксировать с помощью флюоресцентно меченых моноклональных антител с последующим подсчетом CD107a+ цитотоксических CD8+ лимфоцитов на проточном цитометре. Поэтому экспрессия CD107a на поверхности цитотоксических CD8+ лимфоцитов после инкубации с антигеном может быть использована в качестве способа оценки и количественного подсчета специфического клеточного иммунитета.
В качестве аналога предлагаемого метода можно рассматривать статью O.-W.Ng et al. [6], в которой изучали клеточный иммунитет к вирусу SARS, эпидемия которого случилась в 2003 г. Авторами было показано, что клеточный иммунитет к вирусу SARS сохранялся более 10 лет после инфекции, тогда как антитела к этому вирусу не определялись уже после 3 лет. В отличие от нашего метода, стимуляцию цитотоксических лимфоцитов проводили синтетическими пептидами, аналогичными по своей структуре пептидам различных белков вируса SARS. Такой способ стимуляции интересен с научной точки зрения, но имеет тот недостаток, что все люди различаются по молекулам HLA, которые презентируют антигенные пептиды для распознавания цитотоксическими CD8+ лимфоцитами. Один и тот же пептид может успешно встраиваться в молекулу HLA одного варианта и не укладываться в молекулу другого варианта. Кроме того, в обсуждаемой работе использовали пептиды разных белков вируса SARS, что обосновано в случае научного исследования клеточного иммунитета после заболевания, но не подходит для оценки поствакцинального иммунитета.
В качестве прототипа выбран патент РФ №2464571 [7].
Способ предусматривает инкубацию суспензии выделенных из крови мононуклеаров, 10 мкМ моненсина, меченных флюорохромом моноклональных антител к CD107a и индукторов дегрануляции цитотоксических Т-лимфоцитов - вирусов кори или краснухи в полной культуральной среде RPMI-1640 с добавлением 2 мМ L-глутамина, гентамицина и 10% эмбриональной телячьей сыворотки в течение 15 часов при 37°С в атмосфере 5% CO2 и 100% влажности. После инкубации осуществляют окрашивание Т-лимфоцитов меченными флюорохромом антителами к CD8 и регистрацию на проточном цитофлюорометре субпопуляции Т-лимфоцитов, экспрессирующих CD8hiqh и CD107a. Различия состоят в том, что в указанном патенте стимуляцию проводили белками вирусов кори и краснухи, а в заявленном способе использован S-белок вируса SARS-COV-2. Кроме того, в прототипе антигенные белки вирусов добавлялись в культуру клеток в растворе, тогда как в нашей разработке S-белок был сорбирован на дно лунок 96-луночного планшета.
Технической проблемой, решаемой изобретением, является разработка простого и удобного способа определения и оценки специфического клеточного иммунитета к антигенам S-белка коронавируса SARS-COV-2, позволяющего количественно определять специфический клеточный компонент иммунного ответа как у переболевших COVID-19, так и у привитых.
Поставленная задача достигается путем разработки способа определения и оценки специфического клеточного иммунного ответа на S-белок коронавируса SARS-COV-2 на основании экспрессии молекул CD107a на поверхности распознавших антигены S-белка коронавируса SARS-COV-2 CD8+ цитотоксических Т-лимфоцитов, определяемой методом проточной цитометрии.
Изначально не было ясно, можно ли использовать для стимуляции лимфоцитов S-антиген, сорбированный на дне лунки 96-луночного планшета. Расчет был сделан на то, что моноциты при культивировании прикрепляются к дну лунки и перемещаются по нему, собирая и поглощая все, что находят. Также не было понятно, какой срок инкубации будет достаточным для того, чтобы моноциты поглотили сорбированный антигенный S-белок, спроцессировали его, презентировали полученные пептиды в комплексе HLA, a CD8+ цитотоксические лимфоциты распознали этот комплекс, активировались и выбросили цитотоксические гранулы. Проведенные предварительные исследования показали, что можно использовать полноразмерный S-белок вируса SARS-COV-2, сорбированный на дне лунок в качестве антигена для стимуляции лимфоцитов. Присутствующие в выделенной фракции мононуклеаров периферической крови моноциты способны поглощать S-белок, сорбированный на дне лунок, процессировать его и презентировать полученные пептиды в комплексе HLA. При этом у каждого человека будут презентированы пептиды, оптимально подходящие именно для его комплекса HLA. Было отработано оптимальное время инкубации (20 часов) для проявления реакции распознавания CD8+ лимфоцитами антигенов S-белка коронавируса. Преимуществом заявленного способа оценки специфического клеточного иммунитета к вирусу SARS-COV-2 является то, что нет необходимости закупать антигенный S-белок, тем более, что его не продают, а можно использовать лунки 96-луночного планшета от набора для определения антител к S-белку вируса SARS-COV-2 методом ИФА, в которых на дно лунок сорбирован полноразмерный S-белок, согласно инструкции производителя. Использован набор «SARS-CoV-2-IgG-ИФА-БЕСТ» (АО Вектор-Бест, Новосибирск РФ).
Технический результат заключается в том, что заявленный способ определения и оценки специфического клеточного иммунного ответа на S-белок коронавируса SARS-COV-2, осуществляемый на основании выявления экспрессии CD107a на поверхности распознающих антигены S-белка коронавируса SARS-COV-2 CD8+ Т-лимфоцитов, позволяет количественно определить клеточный компонент иммунной защиты против коронавируса SARS-COV-2 как у переболевших COVID-19, так и у привитых людей. Разработанный способ оценки специфического клеточного иммунного ответа на S-белок коронавируса SARS-COV-2 позволяет не только подтвердить наличие клеточного компонента иммунной защиты от вируса SARS-COV-2 в дополнение к специфическим антителам, которые рутинно определяются методом ИФА, но и в случае отсутствия таких антител решить вопрос, болел ли данный человек COVID-19, имеется ли у него клеточный иммунитет к коронавирусу SARS-COV-2. При этом предложенный метод позволяет оценить процент именно цитотоксических Т-лимфоцитов, специфически распознающих антигены S-белка коронавируса SARS-COV-2 и уничтожающих клетки, зараженные вирусом SARS-COV-2, а не вообще клетки, способные распознать антигены S-белка, как это происходит при других методах оценки.
Данный способ позволяет с чувствительностью 93,75% и специфичностью 100% выявить специфический клеточный иммунный ответ на антигены S-белка коронавируса SARS-CoV-2.
Сущность изобретения заключается в следующем:
Для определения специфического клеточного иммунитета к антигенам S-белка коронавируса SARS-COV-2 были сформированы 3 группы обследованных. В группу 1 вошли 15 человек, переболевших COVID-19 с подтвержденным диагнозом методом ПЦР. Давность заболевания составила от 2 до 6 месяцев. В группу 2 вошли 16 человек, прошедших двукратную вакцинацию вакциной Спутник V и предоставившие стандартный сертификат о вакцинации. От второй прививки до момента исследования прошло 2-3 месяца. Группу 3 составили 12 человек, не болевших COVID-19, не имевших антител к антигенам вируса SARS-COV-2 и не прививавшихся от коронавируса (контрольная группа). Кровь для анализа получали из локтевой вены в вакуумные пробирки с напылением гепарина. Фракцию мононуклеаров периферической крови выделяли методом градиентного центрифугирования в стерильных условиях и отмывали от тромбоцитов центрифугированием при 600g 10 мин в 8 мл среды RPMI-1640. Отмытые клетки ресуспендировали в 1 мл среды RPMI-1640 с добавлением 2 мМ L-глютамина, гентамицина и 10% эмбриональной телячьей сыворотки. В лунку плоскодонного стерильного 96-луночного планшета вносили суспензию мононуклеаров (3x105 на лунку), раствор моненсина в конечной концентрации К) мкМ и моноклональные антитела к антигену CD107a-PE-Су5 в конечном разведении 1:100 (контрольная проба). Для опытной пробы использовали лунки 96-луночного планшета от набора для определения антител к S-белку вируса SARS-COV-2 методом ИФА, в которых на дно лунок сорбирован полноразмерный S-белок, согласно инструкции производителя. Использован набор «SARS-CoV-2-IgG-HOA-BECT» (АО Вектор-Бест, Новосибирск РФ). Поскольку лунки набора для ИФА не стерильны, перед постановкой эксперимента они были простерилизованы с помощью ультрафиолетового облучения в стерильных условиях в течение 30 минут После стерилизации в лунку вносили так же суспензию мононуклеаров (3x103 на лунку), раствор моненсина в конечной концентрации 10 мкМ и моноклональные антитела к антигену CD107a-PE-Су5 в конечном разведении 1:100, как и в контроле. Далее контрольные и опытные пробы инкубировали 20 часов при 37°С во влажной атмосфере и 5% CO2. По окончании инкубации клетки ресуспендировали, переносили в пробирки типа эппендорф и отмывали центрифугированием (300g 3 мин) в забуференном фосфатами физиологическом растворе с добавлением 0,02% азида натрия и 0,02% Na2-ЭДТА. Супернатант аккуратно отбирали пипеткой, а клетки окрашивали антителами к антигену CD8-FITC 20 минут в темноте при 4°С, затем повторно отмывали центрифугированием при тех же условиях, добавляли CellWash раствор для цитометрии и ресуспендировали. Полученную суспензию клеток анализировали на проточном цитометре. Для такого анализа подходит любой проточный цитометр, мы использовали BD FACS Canto II (технологии и программное обеспечение Becton Dickinson, США). Подсчитывали в каждой пробе 50 тысяч клеток, поскольку количество специфических цитотоксических лимфоцитов к каждой инфекции невелико. Для анализа выделяли лимфоидный гейт, в нем в режиме FITC-SSS выделяли гейт лимфоцитов, высоко экспрессирующих антиген CD8 (CD8high) - это субпопуляция цитотоксических Т-лимфоцитов. Далее на графике CD107a-PE-Су5 против CD8-FITC регистрировали облако дважды положительных клеток. Полученное число отражает процент цитотоксических лимфоцитов, распознавших антигены S-белка коронавируса и ответивших атакой (цитотоксической реакцией, заключающейся в выделении содержимого цитотоксических гранул) относительно общего количества CD8+ цитотоксических Т-лимфоцитов. Поскольку пребывание клеток в условиях культивирования может вызывать небольшую спонтанную активацию лимфоцитов, для нивелирования этого эффекта из результата, полученного в опытной лунке, вычитали соответствующий результат в контроле.
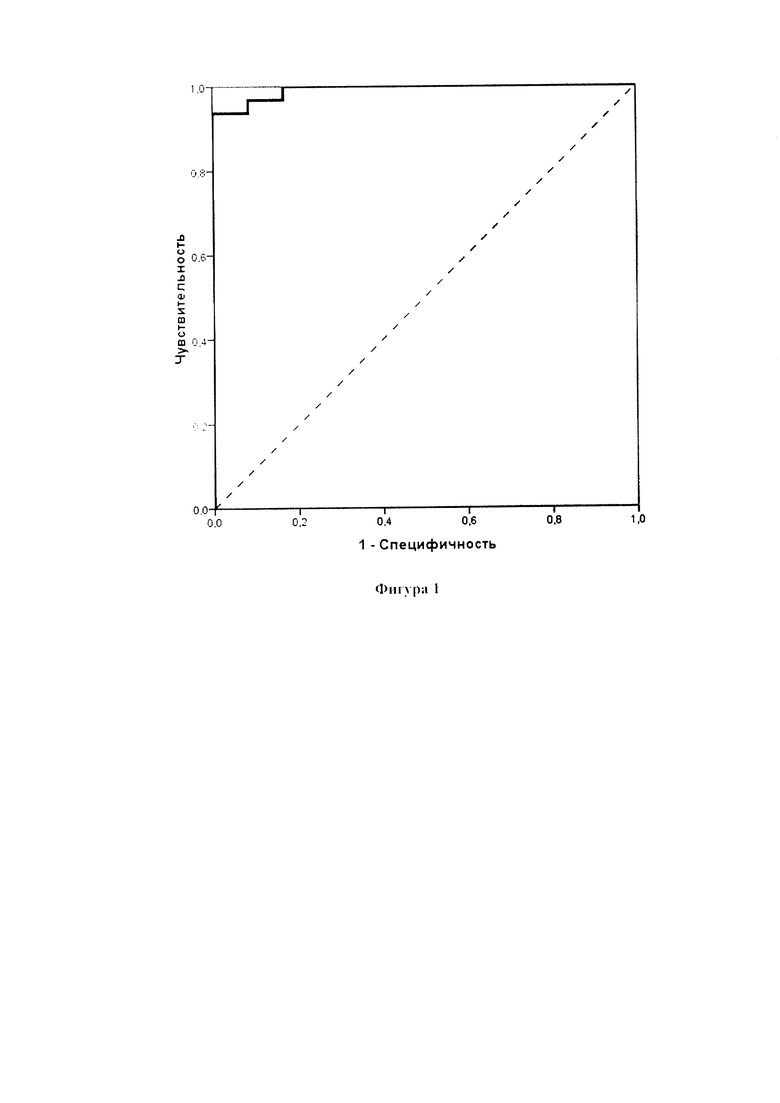
Для выяснения информативности предложенного метода оценки специфического клеточного иммунитета к антигенам коронавируса SARS-CoV-2, был проведен ROC-анализ полученных данных - метод построения операционных характеристических кривых (Receiver Operating Characteristic curve, сокращенно ROC-кривых), позволяющих оценить диагностическую эффективность метода. Была продемонстрирована высокая вероятность правильного разделения группы переболевших CoVID-19 и привитых против этой инфекции от здоровых людей контрольной группы. Площадь под ROC-кривой (AUC) составила 0,992 (0,975-1,009), (р<0,05) (Фиг. 1).
Далее был произведен расчет уровня порогового значения (cut off) для критерия экспрессии антигена CD107a на CD8high Т-лимфоцитах в ответ на индукцию антигенами S-белка вируса SARS-CoV-2 за вычетом показателя спонтанной экспрессии этого антигена. В результате был получен уровень cut-off=0,765%, который с чувствительностью 93,75% и специфичностью 100% позволяет выявить специфический клеточный иммунитет на антигены S-белка вируса SARS-CoV-2.
Таким образом, если у обследуемого человека рассчитанный критерий (процент экспрессии антигена CD107a на CD8high Т-лимфоцитах в ответ на индукцию антигенами S-белка вируса SARS-CoV-2 за вычетом спонтанной экспрессии этого антигена) превышает уровень cut off (0,765%), то данный человек имеет специфический клеточный иммунитет на антигены S-белка вируса SARS-CoV-2. Чем больше полученное число, тем выше клеточный иммунитет к коронавирусу. Дополнительным критерием правильности выполненного теста является то, что уровень спонтанной экспрессии антигена CD107a на CD8high Т-лимфоцитах не превышает 1%.
Осуществление способа изобретения поясняется на следующем примере.
Пример. В качестве примера в Таблице 1 приведены результаты измерения уровней экспрессии антигена CD107a на CD8high Т-лимфоцитах (спонтанный и индуцированный антигенами S-белка вируса SARS-CoV-2) у 10-и человек с неизвестным анамнезом относительно вируса SARS-CoV-2.
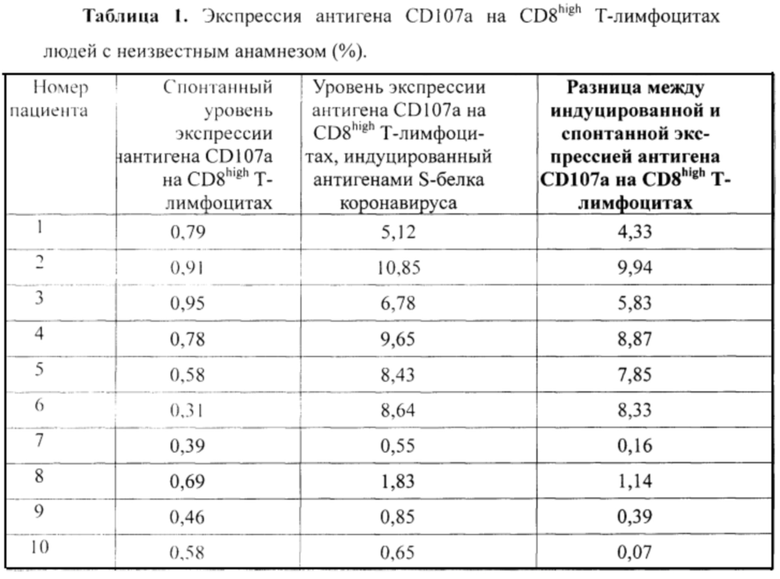
Во всех приведенных случаях спонтанный уровень экспрессии антигена CD107a на CD8high Т-лимфоцитах не превышает 1%, что свидетельствует о правильности проведенной оценки.
Используя значение порогового критерия 0,765% для оценки полученной разницы между индуцированной и спонтанной экспрессией антигена CD107a на CD8high Т-лимфоцитах (правая колонка таблицы), находим, что пациенты под номером 1-6 и 8 имеют значения этого показателя выше значения cut off, что свидетельствует о наличии специфического клеточного иммунитета к антигенам S-белка вируса SARS-CoV-2. При этом, чем выше полученное значение рассчитанного показателя (правая колонка таблицы), тем более выражен специфический клеточный иммунитет к антигенам S-белка вируса SARS-CoV-2. Так у людей под номером 2, 4, 5 и 6 выявлен высокий уровень специфического клеточного иммунитета к коронавирусу, у людей под номером 1 и 3 - средний уровень, у человека под номером 8 -невысокий, но положительный уровень специфического клеточного иммунного ответа на коронавирус. В то же время, у людей №7,9 и 10 рассчитанный показатель оказался ниже значения cut off=0,765%), что говорит об отсутствии у данных людей специфического клеточного иммунитета к антигенам S-белка вируса SARS-CoV-2.
Таким образом, используя предложенный нами способ, по уровню индуцированной антигенами S-белка вируса SARS-CoV-2 экспрессии антигена CD107a на CD8high Т-лимфоцитах за вычетом спонтанного уровня экспрессии антигена CD107a, можно выявлять наличие и количественно оценивать специфический клеточный иммунитет к антигенам S-белка вируса SARS-CoV-2. Рассчитанный пороговый критерий (cut off=0,765%) позволяет с чувствительностью 93,75% и специфичностью 100% разделять людей имеющих и не имеющих специфический клеточный иммунитет к антигенам S-белка вируса SARS-CoV-2. Метод прост в исполнении и позволяет получать количественные результаты на следующий день после взятия крови на анализ.
ЛИТЕРАТУРА
1. Kared Н., Redd А.D., Bloch E.M., Bonny T.S., Sumatoh H., Kairi F., Carbajo D., Abel В., Newell E.W., Bettinotti M.P., Benner S.E., Patel E.U., Littlefield K.,
Laeyendecker O., Shoham S., Sullivan D., Casadevall A., Pekosz A., Nardin A., Fehlings M, Tobian A.A.R., Quinn Т.C. SARS-CoV-2-specific CD8+ T cell responses in convalescent COVID-19 individuals J Clin Invest. 2021; 131(5):e 145476. https://doi.org/10.1172/JCI145476.
2. Wang F., Hou H, Luo Y., Tang G., Wu S., Huang M, Liu W., Zhu Y, Lin Q., Mao L., Fang M., Zhang H., Sun Z. The laboratory tests and host immunity of COVID-19 patients with different severity of illness. JCI Insight. 2020;5(10):e137799. https://doi.org/l 0.1172/jci.insight.137799.
3. Ni L., Ye F, Cheng M.-L, Feng Y, Deng Y.-Q., Zhao H., Wei P., Ge J., Gou M., Li X., Sun L., Cao T, Wang P., Zhou C., Zhang R., Liang P., Guo H., Wang X., Qin C.-F, Chen F., Dong C. Detection of SARS-CoV-2-Specific Humoral and Cellular Immunity in COVID-19 Convalescent Individuals. Immunity 52, 971-977, https://doi.org/10.1016/j.immuni. 2020.04.023.
4. Cassaniti I., Percivalle E., Bergami F., Piralla A., Comolli G., Bruno R., Vecchia M., Sambo M., Colaneri M., Zuccaro V, Benazzo M., Robotti C, Calastri A., Maiorano E., Ferrari A., Cambi G., Baldanti F. SARS-CoV-2 specific T-cell immunity in COVID-19 convalescent patients and unexposed controls measured by ex vivo ELISpot assay, Clinical Microbiology and Infection, https://doi.org/10.1016/j.cmi.2021.03.010.
5. Бочкарева С.С., Караулов А.В., Алешкин А.В., Новикова Л.И., Федорова И.М., Бляхер М.С., Котелева С.И., Капустин И.В.//Методические подходы к оценке некоторых параметров гуморального и клеточного иммунного ответа на бактериофаги/ Клиническая лабораторная диагностика. - 2019. - т.64. -№4. - С.237 - 242. DOI: 10.18821 /0869-2084-2019-64-4-237-242.
6. Ng O.-W., Chia A., Tan A.T., Jadi R.S., Leong H.N., Bertoletti A., Tan Y.-J. Memory T cell responses targeting the SARS coronavirus persist up to 11 years post-infection Vaccine 34 (2016) 2008-2014 http://dx.doi.org/10.1016/j.vaccine.2016.02.063.
7. Патент 2464571 Российская Федерация МПК G01N 33/533. Способ определения специфического клеточного иммунного ответа к антигенам вируса кори и краснухи. /Топтыгина А.П., Алешкин В.А., заявитель и патентообладатель ФБУН МНИИЭМ им. Г.Н. Габричевского Роспотребнадзора (RU)/ - №2011124362/10; заявл 17.06.11 опубл. 20.10.2012. Бюл. 29 - 7 с.: с ил.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ определения и количественной оценки специфического клеточного иммунитета к антигенам N-белка вируса SARS-COV-2 | 2023 |
|
RU2818080C1 |
| Способ определения специфического клеточного иммунного ответа на антигены коронавируса (SARS-COV-2) | 2021 |
|
RU2780369C1 |
| Вакцина на основе вирусоподобных частиц (VLP) для профилактики COVID-19 для парентерального применения | 2024 |
|
RU2834060C1 |
| Способ иммуноферментного определения уровня антигенраспознающих рецепторов В-лимфоцитов, представленных мембранными, специфическими к RBD PROTEIN SARS-CoV-2, IgG антителами | 2021 |
|
RU2760438C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ОСЛОЖНЕНИЯ ПОСЛЕ COVID-19 У ЛИЦ С КОМОРБИДНЫМ ФОНОМ В АРКТИЧЕСКОМ РЕГИОНЕ | 2023 |
|
RU2812780C1 |
| Тест-система и способ дифференцированного выявления антител к SARS-CoV-2 | 2021 |
|
RU2754340C1 |
| Плазмидная ДНК-матрица и молекула мРНК, используемая для создания вакцины против коронавируса, полученная с использованием ДНК-матрицы и обеспечивающая экспрессию гена искусственного полиэпитопного белка-иммуногена, содержащего консервативные эпитопы антигенов вируса SARS-Cov-2 и индуцирующего SARS-Cov-2-специфический иммунитет | 2024 |
|
RU2839372C1 |
| Средство для индукции специфического иммунитета против вируса тяжелого острого респираторного синдрома SARS-CoV-2 в жидкой форме (варианты) | 2021 |
|
RU2743963C1 |
| РЕКОМБИНАНТНЫЙ ВИРУС ГРИППА, ПРЕДНАЗНАЧЕННЫЙ ДЛЯ ПРОФИЛАКТИКИ COVID-19 И ГРИППА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2022 |
|
RU2802058C1 |
| Вирусоподобные химерные частицы для индукции специфического иммунитета против вируса тяжелого острого респираторного синдрома SARS-CoV-2, содержащие белки коронавируса и ротавируса | 2022 |
|
RU2779810C1 |
Изобретение относится к области медицинской иммунологии и предназначено для определения и количественной оценки специфического клеточного иммунитета к антигенам S-белка вируса SARS-COV-2. Выделенные из крови пациента мононуклеары инкубируют в лунках 96-луночного планшета, на дне которых сорбирован полноразмерный S-белок, в качестве опытной пробы. На проточном цитофлюорометре осуществляют регистрацию процента субпопуляции дважды позитивных Т-лимфоцитов CD8hiqhCD107a+ в контрольной и опытной пробе. Из полученного значения процента Т-лимфоцитов CD8hiqhCD107a+ в опытной пробе вычитают значение процента Т-лимфоцитов CD8hiqhCD107a+ в контрольной пробе и полученную разницу процентов сравнивают со значением cut off, равным 0,765%. Если полученная разница превышает 0,765%, судят о наличии у пациента специфического клеточного иммунитета к антигенам S-белка вируса SARS-COV-2 в количестве, равном полученной разнице. Если полученная разница составляет менее 0,765%, судят об отсутствии у пациента специфического клеточного иммунитета. Изобретение позволяет количественно определить клеточный компонент иммунной защиты против коронавируса SARS-COV-2 как у переболевших COVID-19, так и у привитых людей. 1 ил., 1 табл., 1 пр.
Способ определения и количественной оценки специфического клеточного иммунитета к антигенам S-белка вируса SARS-COV-2, отличающийся тем, что выделенные из крови пациента мононуклеары инкубируют в присутствии 10 мкМ моненсина, меченных флюорохромом моноклональных антител к антигену CD107a в полной культуральной среде RPMI-1640 с добавлением 2 мМ L-глутамина, гентамицина и 10% эмбриональной телячьей сыворотки в течение 20 часов при 37°С в атмосфере 5% СО2 и 100% влажности в лунках 96-луночного планшета в качестве контрольной пробы и в лунках 96-луночного планшета от набора для определения антител к S-белку вируса SARS-COV-2 методом ИФА, в которых на дно лунок сорбирован полноразмерный S-белок, в качестве опытной пробы; затем осуществляют последующее окрашивание лимфоцитов меченными флюорохромом антителами к CD8 и регистрацию на проточном цитофлюорометре процента субпопуляции дважды позитивных Т-лимфоцитов CD8hiqhCD107a+ в контрольной и опытной пробе; после чего из полученного значения процента Т-лимфоцитов CD8hiqhCD107a+ в опытной пробе вычитают значение процента Т-лимфоцитов CD8hiqhCD107a+ в контрольной пробе и полученную разницу процентов Т-лимфоцитов CD8hiqhCD107a+ в опытной и контрольной пробе сравнивают со значением cut off, равным 0,765%; при этом, если полученная разница превышает 0,765%, это свидетельствует о наличии у пациента специфического клеточного иммунитета к антигенам S-белка вируса SARS-COV-2 в количестве, равном полученной разнице, а если полученная разница составляет менее 0,765%, это свидетельствует об отсутствии у пациента специфического клеточного иммунитета к антигенам S-белка вируса SARS-COV-2.
| СПОСОБ ОПРЕДЕЛЕНИЯ СПЕЦИФИЧЕСКОГО КЛЕТОЧНОГО ИММУННОГО ОТВЕТА К АНТИГЕНАМ ВИРУСА КОРИ И КРАСНУХИ | 2011 |
|
RU2464571C1 |
| WO 2021163398 A1, 19.08.2021 | |||
| БУРБЕЛЛО А.Т | |||
| и др | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Однопутный снегоочиститель для железных дорог | 1912 |
|
SU864A1 |
| Современная фармацевтика: теория, | |||
Авторы
Даты
2021-12-21—Публикация
2021-09-22—Подача