[0001] Данная заявка заявляет приоритет по предварительной заявке США № 62/579449, поданной 31 октября 2017 года, которая включена в данное описание посредством ссылки во всей своей полноте.
ОБЛАСТЬ ТЕХНИКИ
[0002] Данное раскрытие относится к антителам, которые специфически связываются с ApoC3 (например, ApoC3 человека), и к способам их применения.
УРОВЕНЬ ТЕХНИКИ
[0003] Повышенные уровни триглицеридов в крови (гипертриглицеридемия) являются причиной развития атеросклероза и повышают риск сердечно-сосудистых событий, таких как сердечно-сосудистая смерть, стенокардия (angina), инфаркт миокарда и инсульт.
[0004] ApoC3 - это белок, который циркулирует при очень высоких концентрациях (более 10 мкМ) в крови, в основном он связан с липопротеинами, обогащенными триглицеридами (TRL - triglyceride rich lipoprotein), остатками TRL и липопротеинами высокой плотности. ApoC3 является важным регулятором уровня триглицеридов в крови. Например, было продемонстрировано, что уровни ApoC3 у людей положительно коррелируют с уровнями триглицеридов в крови, а повышенные уровни ApoC3 связаны с гипертриглицеридемией. Кроме того, было продемонстрировано, что ApoC3 ингибирует активность липопротеинлипазы (фермента, который гидролизует триглицериды в TRL), а также ингибирует поглощение печенью остатков TRL, оба этих процесса вызывают повышение уровней триглицеридов в крови.
[0005] Для лечения гипертриглицеридемии было одобрено несколько методов лечения, таких как фибраты, ниацин и омега-3 жирные кислоты. Однако эти методы лечения лишь незначительно снижают уровень триглицеридов в плазме. Соответственно, в данной области существует потребность в улучшенных способах снижения уровня триглицеридов в плазме.
КРАТКОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0006] Данное изобретение относится к антителам, которые специфически связываются с ApoC3 (например, ApoC3 человека) и ингибируют функцию ApoC3. Также предоставлены фармацевтические композиции, содержащие эти антитела, нуклеиновые кислоты, кодирующие эти антитела, векторы экспрессии и клетки-хозяева для получения этих антител, и способы лечения субъекта с использованием этих антител.
[0007] В определенных вариантах осуществления анти-ApoC3-антитела, раскрытые в данном документе, могут ослаблять способность ApoC3 ингибировать поглощение TRL гепатоцитами и могут вызывать быстрое и устойчивое снижение уровней ApoC3 и ApoB в сыворотке при введении субъекту. Соответственно, раскрытые антитела против ApoC3 полезны для лечения и профилактики гипертриглицеридемии и связанных с ней заболеваний (например, сердечно-сосудистых заболеваний и панкреатита).
[0008] Соответственно, в одном аспекте данное изобретение обеспечивает изолированное антитело, которое специфически связывается с ApoC3 с первой константой диссоциации (K D) при рН 7,4 и со второй KD при рН 5,5, при этом соотношение между второй KD и первой КD, по меньшей мере около 5, 10, 20, или 50. В определенных вариантах осуществления первая KD составляет менее 10, 5, 2, 1, 0,5, 0,2, или 0,1 нМ. В определенных вариантах осуществления, период полураспада антител у мышей, экспрессирующих ApoC3 составляет по меньшей мере около 3, 7, 14, 21, или 28 дней.
[0009] В определенных вариантах осуществления данного изобретения указанное антитело ослабляет способность ApoC3 ингибировать поглощение гепатоцитами липопротеинов очень низкой плотности (ЛПОНП - VLDL - very low density lipoprotein). В определенных вариантах осуществления указанное антитело способно увеличивать скорость выведения ApoC3 из крови у субъекта. В определенных вариантах осуществления указанное антитело способно увеличивать скорость выведения ApoB из крови у субъекта. В определенных вариантах осуществления указанное антитело способно снижать уровень ApoC3 в крови у субъекта. В определенных вариантах осуществления указанное антитело способно снижать уровень ApoC3 в крови у субъекта по меньшей мере на 40% в течение по меньшей мере 2 недель. В определенных вариантах осуществления указанное антитело способно снижать уровень ApoB в крови у субъекта. В определенных вариантах осуществления указанное антитело способно снижать уровень ApoB в крови у субъекта по меньшей мере на 20% в течение по меньшей мере 2 недель. В определенных вариантах осуществления указанное антитело способно ингибировать постпрандиальную липемию у субъекта. В определенных вариантах осуществления указанное антитело способно связываться с липид-связанным ApoC3.
[0010] В определенных вариантах осуществления указанное антитело связывается с эпитопом в аминокислотной последовательности, представленной в SEQ ID NO: 2. В определенных вариантах осуществления указанный эпитоп содержит по меньшей мере одну из аминокислот в положении 2, 5, 6, 8 или 10 последовательности SEQ ID NO: 2. В определенных вариантах осуществления указанный эпитоп содержит аминокислоты в положениях 5 и 6 SEQ ID NO: 2. В определенных вариантах осуществления указанный эпитоп содержит аминокислоты в положениях 2, 5, 6 и 8 SEQ ID NO: 2. В определенных вариантах осуществления указанный эпитоп содержит аминокислоты в положении 10 SEQ ID NO: 2. В определенных вариантах осуществления указанный эпитоп содержит аминокислоты в положениях 6, 8 и 10 SEQ ID NO: 2. В определенных вариантах осуществления указанный эпитоп содержит аминокислоты в положениях 6 и 8 SEQ ID NO: 2.
[0011] В определенных вариантах осуществления антитело (например, гуманизированное антитело) содержит вариабельный участок тяжелой цепи, имеющий определяющие комплементарность участки CDRH1, CDRH2 и CDRH3, и вариабельный участок легкой цепи, имеющий определяющие комплементарность участки CDRL1, CDRL2 и CDRL3, и при этом: (а) CDRH1 содержит аминокислотную последовательность TYSMR (SEQ ID NO: 3); (b) CDRH2 содержит аминокислотную последовательность SIHTX 1 X 2 GGTAYRDSVKG, где X 1 представляет собой G, E или D и X 2 представляет собой G или A (SEQ ID NO: 87); (с) CDRH3 содержит аминокислотную последовательность AGYSD (SEQ ID NO: 10); (d) CDRL1 содержит аминокислотную последовательность KTSQGLVHSXGKTYFY, где Х представляет собой D или G (SEQ ID NO: 88); (е) CDRL2 содержит аминокислотную последовательность QVSNRAS (SEQ ID NO: 7); и (f) CDRL3 содержит аминокислотную последовательность AXGTYYPHT, где Х представляет собой Q или Н (SEQ ID NO: 8), и, необязательно, при этом CDRH1, CDRH2 и CDRH3 указанного антитела не являются SEQ ID NO: 3, 9 10; 3, 11, 10; 3, 9, 12; или 3, 11, 12 соответственно.
[0012] В определенных вариантах осуществления, CDRH2 содержит аминокислотную последовательность SIHTGGGGTAYRDSVKG (SEQ ID NO: 36), SIHTEAGGTAYRDSVKG (SEQ ID NO: 37), SIHTDAGGTAYRDSVKG (SEQ ID NO: 38) или SIHTEGGGTAYRDSVK (39). В определенных вариантах осуществления, CDRL1 содержит аминокислотную последовательность KTSQGLVHSDGKTYFY (SEQ ID NO: 6) или KTSQGLVHSGGKTYFY (SEQ ID NO: 40). В определенных вариантах осуществления CDRL3 содержит аминокислотную последовательность AHGTYYPHT (SEQ ID NO: 14) или AQGTYYPHT (SEQ ID NO: 13).
[0013] В определенных вариантах осуществления CDRH1, CDRH2, CDRH3, CDRL1, CDRL2 и CDRL3 содержат аминокислотные последовательности, указанные в SEQ ID NO: 3, 36, 10, 6, 7 и 14; 3, 37, 10, 40, 7 и 14; 3, 38, 10, 40, 7 и 14;, 3, 38, 10, 6, 7 и 14; 3, 39, 10, 6, 7 и 14; или 3, 37, 10, 40, 7 и 13 соответственно. В определенных вариантах осуществления вариабельный участок тяжелой цепи содержит аминокислотные последовательности, выбранные из группы, состоящей из SEQ ID NO: 42-53. В определенных вариантах осуществления вариабельный участок легкой цепи содержит аминокислотные последовательности, выбранные из группы, состоящей из SEQ ID NO: 54-65. В определенных вариантах осуществления, вариабельный участок тяжелой цепи и вариабельный участок легкой цепи, соответственно, содержат аминокислотные последовательности, указанные в SEQ ID NO: 42 и 54, 43 и 55, 44 и 56, 45 и 57, 46 и 58, 46 и 54, 47 и 58, 47 и 54, 48 и 58, 48 и 54, 49 и 59, 49 и 60, 50 и 59, 50 и 60, 51 и 61, 52 и 62, 53 и 62, 43 и 63, 44 и 64, или 45 и 65.
[0014] В определенных вариантах осуществления антитело содержит вариабельный участок тяжелой цепи, имеющий определяющие комплементарность участки CDRH1, CDRH2 и CDRH3, и вариабельный участок легкой цепи, содержащий определяющие комплементарность участки CDRL1, CDRL2 и CDRL3, и при этом: (а) CDRH1 содержит аминокислотную последовательность TYSMR (SEQ ID NO: 3); (b) CDRH2 содержит аминокислотную последовательность из SIX1TDGGGTAYRDSVKG, где Х1 представляет собой S или Н (SEQ ID NO: 4); (с) CDRH3 содержит аминокислотную последовательность X2 GYSD, где Х2 представляет собой Н или (SEQ ID NO: 5); (d) CDRL1 содержит аминокислотную последовательность KTSQGLVHSDGKTYFY (SEQ ID NO: 6); (е) CDRL2 содержит аминокислотную последовательность QVSNRAS (SEQ ID NO: 7); и (f) CDRL3 содержит аминокислотную последовательность AX3 GTYYPHT, где Х3 представляет собой Q или Н (SEQ ID NO: 8), и при этом, по меньшей мере, один из Х 1, Х 2 и Х 3 представляет собой Н.
[0015] В определенных вариантах осуществления CDRH1, CDRH2, CDRH3, CDRL1, CDRL2 и CDRL3 содержат аминокислотные последовательности, указанные в SEQ ID NO: 3, 11, 10, 6, 7 и 13; 3, 9, 12, 6, 7 и 13; 3, 9, 10, 6, 7 и 14; 3, 11, 10, 6, 7 и 14; 3, 9, 12, 6, 7 и 14; 3, 11, 12, 6, 7 и 13; или 3, 11, 12, 6, 7 и 13 соответственно. В определенных вариантах осуществления вариабельный участок тяжелой цепи содержит аминокислотные последовательности, выбранные из группы, состоящей из SEQ ID NO: 16-18. В определенных вариантах осуществления вариабельный участок легкой цепи содержит аминокислотную последовательность, представленную в SEQ ID NO: 20. В определенных вариантах осуществления вариабельный участок тяжелой цепи и вариабельный участок легкой цепи, соответственно, содержат аминокислотные последовательности, представленные в SEQ ID NO: 16 и 19, 17 и 19, 18 и 19, 15 и 20, 16 и 20 17 и 20 или 18 и 20 соответственно.
[0016] В другом аспекте данное изобретение обеспечивает выделенное антитело (например, гуманизированное антитело) которое специфически связывается с ApoC3, содержащее вариабельный участок тяжелой цепи, имеющий определяющие комплементарность участки CDRH1, CDRH2 и CDRH3, и вариабельный участок легкой цепи, имеющий определяющие комплементарность участки CDRL1, CDRL2 и CDRL3, в котором: (а) CDRH1 содержит аминокислотную последовательность TYSMR (SEQ ID NO: 3); (b) CDRH2 содержит аминокислотную последовательность SIHTX1 X2 GGTAYRDSVKG, где X1 представляет собой G, E или D и X 2 представляет собой G или A (SEQ ID NO: 87); (с) CDRH3 содержит аминокислотную последовательность AGYSD (SEQ ID NO: 10); (d) CDRL1 содержит аминокислотную последовательность KTSQGLVHSXGKTYFY, где Х представляет собой D или G (SEQ ID NO: 88); (е) CDRL2 содержит аминокислотную последовательность QVSNRAS (SEQ ID NO: 7); и (f) CDRL3 содержит аминокислотную последовательность AXGTYYPHT, где Х представляет собой Q или Н (SEQ ID NO: 8).
[0017] В определенных вариантах осуществления, CDRH2 содержит аминокислотную последовательность SIHTGGGGTAYRDSVKG (SEQ ID NO: 36), SIHTEAGGTAYRDSVKG (SEQ ID NO: 37), SIHTDAGGTAYRDSVKG (SEQ ID NO: 38) или SIHTEGGGTAYRDSVK (39). В определенных вариантах осуществления, CDRL1 содержит аминокислотную последовательность KTSQGLVHSDGKTYFY (SEQ ID NO: 6) или KTSQGLVHSGGKTYFY (SEQ ID NO: 40). В определенных вариантах осуществления CDRL3 содержит аминокислотную последовательность AHGTYYPHT (SEQ ID NO: 14) или AQGTYYPHT (SEQ ID NO: 13). В определенных вариантах осуществления CDRH1, CDRH2, CDRH3, CDRL1, CDRL2 и CDRL3 содержат аминокислотные последовательности, указанные в SEQ ID NO: 3, 36, 10, 6, 7 и 14; 3, 37, 10, 40, 7 и 14; 3, 38, 10, 40, 7 и 14; 3, 38, 10, 6, 7 и 14; 3, 39, 10, 6, 7 и 14; или 3, 37, 10, 40, 7 и 13 соответственно.
[0018] В другом аспекте данное изобретение обеспечивает выделенное антитело (например, гуманизированное антитело) которое специфически связывается с ApoC3, при этом указанное антитело содержит вариабельный участок тяжелой цепи, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 42- 53.
[0019] В другом аспекте данное изобретение обеспечивает выделенное антитело (например, гуманизированное антитело) которое специфически связывается с ApoC3, при этом указанное антитело содержит вариабельный участок легкой цепи, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 54- 65.
[0020] В другом аспекте данное изобретение обеспечивает выделенное антитело (например, гуманизированное антитело) которое специфически связывается с ApoC3, при этом указанное антитело содержит вариабельный участок тяжелой цепи и вариабельный участок легкой цепи, в котором вариабельный участок тяжелой цепи и вариабельный участок легкой цепи, соответственно, содержат аминокислотные последовательности, указанные в SEQ ID NO: 42 и 54, 43 и 55, 44 и 56, 45 и 57, 46 и 58, 46 и 54, 47 и 58, 47 и 54, 48 и 58, 48 и 54, 49 и 59, 49 и 60, 50 и 59, 50 и 60, 51 и 61, 52 и 62, 53 и 62, 43 и 63, 44 и 64 или 45 и 65.
[0021] В другом аспекте данное изобретение относится к выделенному антителу, которое специфически связывается с ApoC3, содержащему вариабельный участок тяжелой цепи, имеющий определяющие комплементарность участки CDRH1, CDRH2 и CDRH3, и вариабельный участок легкой цепи, имеющий определяющие комплементарность участки CDRL1, CDRL2 и CDRL3, при этом : (а) CDRH1 содержит аминокислотную последовательность TYSMR (SEQ ID NO: 3); (b) CDRH2 содержит аминокислотную последовательность из SIX1TDGGGTAYRDSVKG, где Х1 представляет собой S или Н (SEQ ID NO: 4); (с) CDRH3 содержит аминокислотную последовательность X2 GYSD, где Х2 представляет собой Н или (SEQ ID NO: 5); (d) CDRL1 содержит аминокислотную последовательность KTSQGLVHSDGKTYFY (SEQ ID NO: 6); (е) CDRL2 содержит аминокислотную последовательность QVSNRAS (SEQ ID NO: 7); и (f) CDRL3 содержит аминокислотную последовательность AX3 GTYYPHT, где Х3 представляет собой Q или Н (SEQ ID NO: 8), и при этом, по меньшей мере, один из Х1, Х2 и Х3 представляет собой H.
[0022] В определенных вариантах осуществления CDRH1, CDRH2, CDRH3, CDRL1, CDRL2 и CDRL3 содержат аминокислотные последовательности, указанные в SEQ ID NO: 3, 11, 10, 6, 7 и 13; 3, 9, 12, 6, 7 и 13; 3, 9, 10, 6, 7 и 14; 3, 11, 10, 6, 7 и 14; 3, 9, 12, 6, 7 и 14; 3, 11, 12, 6, 7 и 13; или 3, 11, 12, 6, 7 и 13 соответственно.
[0023] В другом аспекте данное изобретение относится к выделенному антителу, которое специфически связывается с ApoC3, при этом указанное антитело содержит вариабельный участок тяжелой цепи, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 16-18.
[0024] В другом аспекте данное изобретение относится к выделенному антителу, которое специфически связывается с ApoC3, при этом указанное антитело содержит вариабельный участок легкой цепи, содержащий аминокислотную последовательность, представленную в SEQ ID NO: 20.
[0025] В другом аспекте данное изобретение относится к выделенному антителу, которое специфически связывается с ApoC3, при этом указанное антитело содержит вариабельный участок тяжелой цепи и вариабельный участок легкой цепи, при этом вариабельный участок тяжелой цепи и вариабельный участок легкой цепи, соответственно, содержат аминокислотные последовательности приведенные в SEQ ID NO: 16 и 19, 17 и 19, 18 и 19, 15 и 20, 16 и 20, 17 и 20 или 18 и 20 соответственно.
[0026] В определенных вариантах осуществления любого из вышеупомянутых аспектов антитело дополнительно содержит человеческий или гуманизированный константный участок. В определенных вариантах осуществления указанный константный участок представляет собой вариант константного участка тяжелой цепи человеческого иммуноглобулина дикого типа, и при этом вариантный константный участок тяжелой цепи человеческого иммуноглобулина имеет повышенную аффинность к неонатальному Fc-рецептору человека (FcRn) при pH 6 относительно аффинности константного участка тяжелой цепи человеческого иммуноглобулина дикого типа для человеческого FcRn при рН 6. В определенных вариантах осуществления указанный константный участок представляет собой константный участок тяжелой цепи IgG человека. В определенных вариантах осуществления указанный константный участок представляет собой константный участок тяжелой цепи IgG 1, IgG2 или IgG 4 человека.
[0027] В определенных вариантах осуществления указанный константный участок содержит аминокислоты K, F и Y в положениях EU 433, 434 и 436 соответственно. В определенных вариантах осуществления указанный константный участок содержит аминокислоты Y, T и E в положениях EU 252, 254 и 256 соответственно. В определенных вариантах осуществления указанный константный участок содержит аминокислоты L и S в положениях EU 428 и 434 соответственно. В определенных вариантах осуществления указанный константный участок содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 22-24, 76-78 и 81-86.
[0028] В определенных вариантах осуществления выделенное антитело содержит тяжелую цепь, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 66-73. В определенных вариантах осуществления выделенное антитело содержит легкую цепь, содержащую аминокислотную последовательность, представленную в SEQ ID NO: 74. В определенных вариантах осуществления выделенное антитело содержит тяжелую цепь и легкую цепь, при этом тяжелая цепь и легкая цепь, соответственно, содержат аминокислотные последовательности, указанные в SEQ ID NO: 66 и 74, 67 и 74, 68 и 74 69 и 74, 70 и 74, 71 и 74, 72 и 74 или 73 и 74 соответственно.
[0029] В другом аспекте данное раскрытие относится к фармацевтической композиции, содержащей антитело, раскрытое в данном документе, и фармацевтически приемлемый носитель.
[0030] В другом аспекте данное раскрытие относится к полинуклеотиду, кодирующему вариабельный участок тяжелой цепи или вариабельный участок легкой цепи антитела, как описано в данном документе. В другом аспекте данное раскрытие относится к экспрессионному вектору, содержащему полинуклеотид, раскрытый в данном документе. В другом аспекте данное раскрытие относится к клетке-хозяину, содержащей вектор экспрессии, как раскрыто в данном документе.
[0031] В другом аспекте данное раскрытие относится к способу получения антитела, которое связывается с ApoC3, причем этот способ включает культивирование клетки-хозяина, как описано в данном документе, в условиях, которые позволяют экспрессию антитела.
[0032] В другом аспекте данное раскрытие относится к способу ингибирования активности ApoC3 у субъекта, включающему введение субъекту эффективного количества антитела или фармацевтической композиции, как описано в данном документе. В другом аспекте данное раскрытие относится к способу снижения уровней триглицеридов в крови субъекта, включающему введение субъекту эффективного количества антитела или фармацевтической композиции, как описано в данном документе. В другом аспекте данное раскрытие относится к способу ингибирования постпрандиальной липемии у субъекта, включающему введение субъекту эффективного количества антитела или фармацевтической композиции, как описано в данном документе. В другом аспекте данное изобретение относится к способу лечения гипертриглицеридемии у субъекта, включающему введение субъекту эффективного количества антитела или фармацевтической композиции, как описано в данном документе. В другом аспекте данное раскрытие относится к способу лечения хиломикронемии у субъекта, включающему введение субъекту эффективного количества антитела или фармацевтической композиции, как описано в данном документе.
[0033] В другом аспекте данное изобретение относится к способу снижения риска сердечно-сосудистых заболеваний у субъекта с гипертриглицеридемией, причем указанный способ включает введение субъекту эффективного количества антитела или фармацевтической композиции, как описано в данном документе. В определенных вариантах осуществления указанное сердечно-сосудистое заболевание представляет собой инфаркт миокарда. В определенных вариантах осуществления указанное сердечно-сосудистое заболевание представляет собой стенокардию. В определенных вариантах осуществления указанное сердечно-сосудистое заболевание представляет собой инсульт. В определенных вариантах осуществления указанное сердечно-сосудистое заболевание представляет собой атеросклероз.
[0034] В определенных вариантах осуществления вышеупомянутых аспектов, относящихся к способам лечения, антитело снижает уровни хиломикрона или остатков хиломикрона в крови субъекта. В определенных вариантах субъект получает дополнительный липидоснижающий агент. В определенных вариантах осуществления дополнительный липидоснижающий агент представляет собой ингибитор HMG-CoA-редуктазы. В определенных вариантах осуществления ингибитор HMG-CoA-редуктазы представляет собой аторвастатин, флувастатин, ловастатин, питавастатин, правастатин, розувастатин или симвастатин. В определенных вариантах осуществления дополнительный липидоснижающий агент представляет собой ингибитор PCSK9. В определенных вариантах осуществления ингибитор PCSK9 представляет собой алирокумаб, эволокумаб или бокоцизумаб. В определенных вариантах осуществления дополнительный липидоснижающий агент представляет собой эзетимиб. В определенных вариантах осуществления дополнительный липидоснижающий агент представляет собой комбинацию эзетимиба и ингибитора HMG-CoA-редуктазы. В определенных вариантах осуществления дополнительный липидоснижающий агент представляет собой комбинацию эзетимиба, ингибитора HMG-CoA-редуктазы и ингибитора PCSK9.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0035] Фиг. 1А, 1В и 1С представляют собой серию графиков, демонстрирующих, что 5E5WT (Фиг. 1А), 5E5VH5_VL8 (Фиг. 1В) и 5E5VHWT_VL8 («VL8»), 5E5VH12_VLWT («VH12»), 5E5VH5_VLWT («VH5»), 5E5VH5_VL8 («VH5_VL8») (Фиг. 1C) антитела ослабляли способность ApoC3 ингибировать поглощение липопротеинов очень низкой плотности (ЛПОНП) клетками HepG2. Клетки HepG2 инкубировали с DiI ЛПОНП и очищенным ApoC3 либо отдельно, либо в присутствии антитела против ApoC3, как указано. DiI ЛПОНП, поглощенный клетками HepG2, измеряли флуоресцентной спектроскопией красителя DiI. Клетки HepG2, инкубированные только с DiI ЛПОНП («ЛПОНП»), служили в качестве положительного контроля, а клетки HepG2, инкубированные с DiI ЛПОНП и очищенным ApoC3 в отсутствие антитела против ApoC3 («ApoC3»), служили в качестве отрицательного контроля.
[0036] Фиг. 2А представляет собой график, демонстрирующий уровни в сыворотке в различные моменты времени после инъекции двух антител анти-ApoC3, 5E5 и 5E5VH5_VL8, а также IgG1 антител человека (HyHEL5) против лизоцима куриных яиц, в ApoC3 мышиной модели AAV8-человека.
[0037] Фиг. 2В представляет собой график, демонстрирующий влияние 5E5 и 5E5VH5_VL8 на уровень циркулирующего ApoC3 человека в ApoC3 мышиной модели AAV8-человека.
[0038] Фиг. 2С представляет собой график, демонстрирующий влияние 5E5 и 5E5VH5_VL8 на уровень циркулирующего ApoB в ApoC3 мышиной модели AAV8-человека.
[0039] Фиг. 3 представляет собой серию сенсограмм поверхностного плазмонного резонанса (SPR), демонстрирующих кинетику связывания двадцати гуманизированных антител против ApoC3 (mAb1-mAb20) для ApoC3 человека, когда ApoC3 человека иммобилизован на биосенсорной микросхеме. Сенсограммы с пунктирными и сплошными линиями соответствуют рН анализа 7,4 и 5,5 соответственно. Для справки, сенсограммы, соответствующие 5E5VH5_VL8 при концентрации 25 нМ, включены в каждый график (пунктирная линия при pH 7,4 и длинная пунктирная линия при pH 5,5).
[0040] Фиг. 4 представляет собой серию сенсограмм SPR, демонстрирующих кинетику связывания двадцати гуманизированных антител против ApoC3 (mAb1-mAb20) ApoC3 человека, когда антитела ApoC3 иммобилизованы на биосенсорной микросхеме. Сенсограммы пунктирной и сплошной линиями соответствуют рН анализа 7,4 и 5,5 соответственно. Для справки, сенсограммы, соответствующие 5E5VH5_VL8 при 600 нМ целевой концентрации nhuApoC3, включены в каждый график (пунктирная линия при pH 7,4 и длинные пунктирные линии при pH 5,5).
[0041] Фиг. 5А-С представляют собой график, демонстрирующий процентную активность выбранных гуманизированных антител и 5E5VH5_VL8 после инкубации антител при указанных температурах в течение 1 часа, относительно активности соответствующих антител, инкубированных при 4°С в течение 1 часа. Активность измеряли как скорость ассоциации на Фиг. 5А и измеряли как максимальное значение ОЕ (R0) на Фиг. 5В и 5С.
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0042] Данное изобретение относится к антителам, которые специфически связываются с ApoC3 (например, ApoC3 человека) и ингибируют функцию ApoC3. Также предоставлены фармацевтические композиции, содержащие эти антитела, нуклеиновые кислоты, кодирующие эти антитела, векторы экспрессии и клетки-хозяева для получения этих антител, и способы лечения субъекта с использованием этих антител. В определенных вариантах осуществления анти-ApoC3-антитела, раскрытые в данном документе, могут ослаблять способность ApoC3 ингибировать поглощение TRL гепатоцитами и могут вызывать быстрое и устойчивое снижение уровней ApoC3 и ApoB в сыворотке при введении субъекту. Соответственно, раскрытые антитела против ApoC3 полезны для лечения и профилактики гипертриглицеридемии и связанных с ней заболеваний (например, сердечно-сосудистых заболеваний и панкреатита).
1. Определения
[0043] Используемый в данном документе термин «ApoC3» относится к белку аполипопротеину C3. В определенных вариантах осуществления ApoC3 представляет собой ApoC3 человека. Типичная аминокислотная последовательность ApoC3 человека представлена в RefSeq с инвентарным номером NP_000031.1. Зрелая аминокислотная последовательность NP_000031.1 является следующей:
SEAEDASLLSFMQGYMKHATKTAKDALSSVQESQVAQQARGWVTDGFSSLKDYWSTVKDKFSEFWDLDPEVRPTSAVAA (SEQ ID NO: 1).
[0044] Используемые в данном документе термины «антитело» и «антитела» включают антитела полной длины, антигенсвязывающие фрагменты антител полной длины и молекулы, содержащие CDR антитела, области VH или области VL. Примеры антител включают моноклональные антитела, рекомбинантно продуцируемые антитела, моноспецифические антитела, полиспецифические антитела (включая биспецифичные антитела), человеческие антитела, гуманизированные антитела, химерные антитела, иммуноглобулины, синтетические антитела, тетрамерные антитела, содержащие две молекулы тяжелой цепи и две молекулы легкой цепи, мономер легкой цепи антитела, мономер тяжелой цепи антитела, димер легкой цепи антитела, димер тяжелой цепи антитела, пару тяжелой цепи антитела легкой цепи антитела, гетероконъюгатные антитела, однодоменные антитела, моновалентные антитела, одноцепочечные антитела или одноцепочечные Fv антитела (scFv), scFv-Fc, антитела верблюдовых (например, антитела ламы), верблюдизированные антитела, аффитела, фрагменты Fab, фрагменты F (ab') 2, дисульфид-связанные Fv (sdFv), антиидиотипические (анти-Id))антитела (включая, например, анти-анти-Id-антитела) и антигенсвязывающие фрагменты любого из вышеуказанного. В определенных вариантах осуществления указанные антитела, раскрытые в данном документе, относятся к популяциям поликлональных антител. Антитела могут быть любого типа (например, IgG, IgE, IgM, IgD, IgA или IgY), любого класса (например, IgG1, IgG2, IgG3, IgG4, IgA1 или IgA2) или любого подкласса (например, IgG2a или IgG2b) молекулы иммуноглобулина. В определенных вариантах осуществления указанные антитела, раскрытые в данном документе, представляют собой антитела IgG или их класс (например, человеческий IgG1 или IgG4) или их подкласс. В конкретном варианте осуществления указанное антитело представляет собой гуманизированное моноклональное антитело.
[0045] Используемый в данном документе термин «выделенное антитело» относится к антителу, которое было идентифицировано и отделено и/или извлечено, по меньшей мере, из одного компонента его естественной среды. Термин «выделенное антитело» включает антитело in situ в рекомбинантной клетке-хозяине.
[0046] Используемый в данном документе термин «CDR» или «область, определяющая комплементарность» означает несмежные сайты объединения антигенов, обнаруженные в вариабельных участках полипептидов как тяжелой, так и легкой цепи. Эти конкретные участки были описаны Kabat et al., J. Biol. Chem. 252, 6609-6616 (1977) и Kabat et al., Sequences of protein of immunological interest. (1991), Чотиа et al., J. Mol. Biol. 196: 901-917 (1987) и MacCallum et al., J. Mol. Biol. 262: 732-745 (1996), все из которых включены посредством ссылки во всей их полноте, где определения включают перекрывающиеся или наборы аминокислотных остатков при сравнении друг с другом. В определенных вариантах осуществления термин «CDR» представляет собой CDR, как определено Kabat et al., J. Biol. Chem. 252, 6609-6616 (1977) и Kabat et al., Sequences of protein of immunological interest. (1991). CDRH1, CDRH2 и CDRH3 обозначают CDR тяжелой цепи, а CDRL1, CDRL2 и CDRL3 обозначают CDR легкой цепи.
[0047] Используемый в данном документе термин «аминокислотные остатки каркаса (FR)» относится к аминокислотам в каркасном участке цепи иммуноглобулина. Термин «каркасный участок» или «FR-участок», используемый в данном документе, включает аминокислотные остатки, которые являются частью вариабельного участка, но не являются частью CDR (например, с использованием определения CDR по Кабату).
[0048] Используемые в данном документе термины «вариабельный участок» и «вариабельный домен» используются взаимозаменяемо и являются общими в данной области техники. Вариабельный участок обычно относится к части антитела, обычно к части легкой или тяжелой цепи, обычно к аминоконцу от 110 до 120 аминокислот или от 110 до 125 аминокислот в зрелой тяжелой цепи и от около 90 до 115 аминокислоты в зрелой легкой цепи, которые сильно различаются по последовательности среди антител и используются в связывании и специфичности конкретного антитела для его конкретного антигена. Изменчивость в последовательности сконцентрирована в тех участках, которые называются участками, определяющими комплементарность (CDR), в то время как более высоко консервативные участки в вариабельном домене называются каркасными участками (FR). Не желая быть связанными каким-либо конкретным механизмом или теорией, полагают, что CDR легкой и тяжелой цепей в первую очередь ответственны за взаимодействие и специфичность антитела с антигеном. В определенных вариантах осуществления вариабельный участок представляет собой вариабельный участок человека. В определенных вариантах осуществления вариабельный участок содержит CDR грызунов или мышей и каркасные участки человека (FR). В конкретных вариантах осуществления вариабельный участок представляет собой вариабельный участок приматов (например, приматов, не являющихся человеком). В определенных вариантах осуществления вариабельный участок содержит CDR грызунов или мышей и каркасные участки (FR) приматов (например, приматов, не являющихся человеком).
[0049] Термины «VL» и «домен VL» используются взаимозаменяемо для обозначения вариабельного участка легкой цепи антитела.
[0050] Термины «VH» и «домен VH» используются взаимозаменяемо для обозначения вариабельного участка тяжелой цепи антитела.
[0051] Используемые в данном документе термины «константный участок» и «константный домен» являются взаимозаменяемыми и распространены в данной области техники. Константный участок представляет собой часть антитела, например карбоксильную концевую часть легкой или тяжелой цепи, которая непосредственно не участвует в связывании антитела с антигеном, но которая может проявлять различные эффекторные функции, такие как взаимодействие с Fc-рецептором. Константный участок молекулы иммуноглобулина обычно имеет более консервативную аминокислотную последовательность относительно вариабельного домена иммуноглобулина.
[0052] Используемый в данном документе термин «тяжелая цепь» при использовании в отношении антитела может относиться к любому отдельному типу, например, альфа (α), дельта (δ), эпсилон (ε), гамма (γ) и мю (μ), на основе аминокислотной последовательности константного домена, которая приводит к классам антител IgA, IgD, IgE, IgG и IgM соответственно, включая подклассы IgG, например, IgG1, IgG2, IgG3 и IgG4.
[0053] Используемый в данном документе термин «легкая цепь» при использовании в отношении антитела может относиться к любому отдельному типу, например, каппа (κ) или лямбда (γ) на основе аминокислотной последовательности константных доменов. Аминокислотные последовательности легкой цепи хорошо известны в данной области. В конкретных вариантах осуществления легкая цепь представляет собой легкую цепь человека.
[0054] Используемый в данном документе термин «позиция EU» относится к аминокислотному положению в соответствии с соглашением о нумерации EU для константных участков антитела, как описано в Edelman, G.M. et al., Proc. Natl. Acad. USA, 63, 78-85 (1969) and Kabat et al., in "Sequences of Proteins of Immunological Interest", U.S. Dept. Health и Human Services, 5th edition, 1991, каждая из которых включена в данное описание посредством ссылки во всей своей полноте.
[0055] Используемый в данном документе термин «специфически связывается с» относится к способности антитела связываться с антигеном с константой диссоциации (K D) менее чем около 1 × 10-6 М, 1 × 10-7 М, 1. × 10-8 М, 1 × 10-9 М, 1 × 10-10 М, 1 × 10-11 М, 1 × 10-12 М или менее, или связываются с антигеном со сродством, которое по меньшей мере в два раза превышает его сродство к неспецифическому антигену.
[0056] Используемый в данном документе термин «эпитоп» относится к локализованной области антигена, с которой антитело может специфически связываться. Эпитоп может быть, например, смежными аминокислотами полипептида (линейного или смежного эпитопа) или эпитоп, например, может быть образован из двух или более несмежных областей полипептида или полипептидов (конформационных, нелинейный, прерывистый или несмежный эпитоп). В определенных вариантах осуществления указанный эпитоп, с которым связывается антитело, может быть определен, например, с помощью ЯМР-спектроскопии, исследований рентгеновской дифракционной кристаллографии, анализов ИФА, обмена водорода/дейтерий в сочетании с масс-спектрометрией (например, масс-спектрометрией с жидкостной хроматографией, электрораспылительной массспектрометрией), пептид сканирующие анализы или картирование мутагенезом (например, картирование сайт-направленым мутагенезом).
[0057] Используемый в данном документе термин «лечить», «лечение» и «применение лечения» относится к терапевтическим или профилактическим мерам, раскрытым в данном документе. Способы «лечения» включают введение антитела против ApoC3 субъекту, имеющему заболевание или расстройство или предрасположенному к такому заболеванию или расстройству, для предотвращения, лечения, задержки, уменьшения тяжести, снижения риска развития или ослабления одного или нескольких симптомов заболевания или расстройства или повторяющегося заболевания или расстройства, или для того, чтобы продлить выживаемость субъекта сверх ожидаемого в отсутствие такого лечения.
[0058] Используемый в данном документе термин «эффективное количество» в контексте введения терапии субъекту относится к количеству терапии, которое достигает желаемого профилактического или терапевтического эффекта.
[0059] Используемый в данном документе термин «субъект» включает в себя любое животное или животное отличное от человека.
[0060] Используемый в данном документе термин «или» означает и/или.
[0061] Используемые в данном документе термины «около» и «приблизительно», когда используются для изменения числового значения или числового диапазона, указывают, что отклонения от 5% до 10% выше и от 5% до 10% ниже значения или диапазона остаются в пределах предполагаемого значения приведенного значения или диапазона.
2. Антитела против ApoC3
[0062] Данное изобретение относится к выделенным антителам (например, гуманизированным антителам), которые специфически связываются с ApoC3 (например, ApoC3 человека) и ингибируют функцию ApoC3.
[0063] В определенных вариантах осуществления выделенные антитела связываются с белком ApoC3 млекопитающего. В определенных вариантах осуществления выделенные антитела связываются с ApoC3 человека. В определенных вариантах осуществления выделенные антитела связываются с ApoC3 Macaca flavicularis (обезьяна яванский макак).
[0064] В определенных вариантах осуществления выделенные антитела связываются с ApoC3 (например, ApoC3 человека) с более высокой аффинностью при физиологическом pH (например, pH 7,4), чем при кислотном pH (например, pH от 5,5 до pH 6). Способы получения таких рН-зависимых антител хорошо известны в данной области. Например, в одном типичном способе один или несколько аминокислотных остатков в CDR тяжелой и/или легкой цепи антитела против ApoC3 заменяют остатком гистидина, как описано в: Igawa et al., Nat Biotechnol. (2010) 28 (11): 1203-1207; Chaparro-Riggers et al., J Biol Chem. (2012) 287 (14): 11090-11097; Патенте США № 9096651 и Патенте США № US 20110111406 A1, каждая/ый из которых включен/а в данное описание посредством ссылки в полном объеме. Однако, хотя такие способы хорошо известны в данной области, специалист в данной области поймет, что для любого данного антитела точные аминокислоты CDR, которые могут быть мутированы в гистидин для достижения рН-зависимого связывания с антигеном, не нарушая сродство антитела к антигену. может быть определено только эмпирически (см., например, Edgcomb and Murphy, Proteins (2002) 49: 1-6, которая полностью включена в данное описание посредством ссылки).
[0065] Специалист в данной области поймет, что аффинность антитела к антигену может указываться константой диссоциации (KD), где меньший KD указывает на более высокую аффинность. Соответственно, в определенных вариантах осуществления указанные антитела против ApoC3 связываются с ApoC3 (например, ApoC3 человека) с первым KD при pH 7,4 и со вторым KD при pH 5,5, где соотношение между вторым KD и первым KD равно по меньшей мере 1 (например, по меньшей мере 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2, 2,5, 3, 3,5, 4, 4,5, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 20, 25, 30, 35, 40, 45, 50, 60, 70, 80, 90 или 100).
[0066] В определенных вариантах осуществления первый KD составляет менее 100 нМ (например, менее 50, 20, 10, 5, 2, 1, 0,5, 0,2 или 0,1 нМ). В определенных вариантах осуществления второе KD составляет более 1 нМ (например, более 2, 5, 10, 20 или 50 нМ или более 0,1, 0,2, 0,5, 1, 2, 5, 10, 20, 50 или 100 мкМ). В определенных вариантах осуществления первый KD составляет менее 100 нМ (например, менее 50, 20, 10, 5, 2, 1, 0,5, 0,2 или 0,1 нМ), а период полураспада антитела у животного (например, человека или мыши), экспрессирующий ApoC3 (например, ApoC3 человека), составляет, по меньшей мере, приблизительно 1 день (например, по меньшей мере, приблизительно 2, 3, 4, 5, 6 или 7 дней или больше, чем приблизительно 1, 2, 3, 4, 6 или 8 недель). В определенных вариантах осуществления ApoC3 представляет собой ApoC3 человека, а животное, экспрессирующее ApoC3, представляет собой человека. В определенных вариантах осуществления ApoC3 представляет собой ApoC3 человека, а животное, экспрессирующее ApoC3, представляет собой мышь, экспрессирующую ApoC3 человека.
[0067] В определенных вариантах осуществления выделенные антитела, описанные в данном документе, ослабляют способность ApoC3 ингибировать поглощение TRL (например, ЛПОНП) или TRL остатков гепатоцитами (in vivo или in vitro). В определенных вариантах осуществления данного изобретения выделенные антитела, раскрытые в данном описании ослабляют способность ApoC3 ингибировать поглощение TRL (например, ЛПОНП) или TRL остатков гепатоцитами, по меньшей мере, 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 98% или 99%, как оценивается способами, раскрытыми в данном документе, или способами, известными специалисту в данной области. В определенных вариантах осуществления данного изобретения выделенные антитела, раскрытые в данном описании ослабляют способность ApoC3 ингибировать поглощение TRL (например, ЛПОНП) или TRL остатков гепатоцитами, по меньшей мере, приблизительно в 1,1 раза, 1,2 раза, 1,3 раза, 1,4 раза, 1,5 раза, 2 раза, 2,5 раза, 3 раза, 3,5 раза, 4 раза, 4,5 раза, 5 раз, 6 раз, 7 раз, 8 раз, 9 раз, 10 раз, 15 раз, 20 раз, 30 раз, 40 раз, 50 раз, 60 раз, 70 раз, 80 раз, 90 раз или 100 раз, по оценке с помощью способов, раскрытых в данном документе, или способов, известных специалисту в данной области.
[0068] В определенных вариантах осуществления раскрытые в данном документе выделенные антитела способны ингибировать постпрандиальную липемию у субъекта при введении субъекту до, во время или после приема пищи. В определенных вариантах осуществления анти-ApoC3-антитела, раскрытые в данном документе, способны ингибировать постпрандиальную липемию у субъекта по меньшей мере на 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 98% или 99%, как оценивается способами, раскрытыми в данном документе, или способами, известными для специалиста в данной области техники. В определенных вариантах осуществления анти-ApoC3-антитела, раскрытые в данном документе, способны ингибировать постпрандиальную липемию у субъекта по меньшей мере примерно в 1,1 раза, в 1,2 раза, в 1,3 раза, в 1,4 раза, в 1,5 раза, в 2 раза, в 2,5 раза, в 3 раза, 3,5 раза, 4 раза, 4,5 раза, 5 раз, 6 раз, 7 раз, 8 раз, 9 раз, 10 раз, 15 раз, 20 раз, 30 раз, 40 раз, 50 раз, 60 раз, 70 раз, 80 раз, в 90 раз или в 100 раз, что оценивается способами, раскрытыми в данном документе, или способами, известными специалисту в данной области.
[0069] В определенных вариантах осуществления раскрытые в данном документе выделенные антитела способны снижать уровни постпрандиального хиломикрона или остатков хиломикрона у субъекта при введении субъекту до, во время или после приема пищи. В определенных вариантах осуществления анти-ApoC3-антитела, раскрытые в данном документе, способны снижать уровни постпрандиального хиломикрона или остатков хиломикрона у субъекта по меньшей мере на 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 98% или 99%, согласно оценке раскрытыми в данном документе способами или способами, известными специалисту в данной области. В определенных вариантах осуществления анти-ApoC3-антитела, раскрытые в данном документе, способны снижать уровни постпрандиального хиломикрона или остатков хиломикрона у субъекта по меньшей мере около в 1,1 раза, в 1,2 раза, в 1,3 раза, в 1,4 раза, в 1,5 раза, в 2 раза, 2,5 раза, 3 раза, 3,5 раза, 4 раза, 4,5 раза, 5 раза, 6 раза, 7 раза, 8 раза, 9 раза, 10 раз, 15 раз, 20 раз, 30 раз, 40 раз, 50 раз, 60 раз, в 70 раз, в 80 раз, в 90 раз или в 100 раз, что оценивается способами, раскрытыми в данном документе, или способами, известными специалисту в данной области.
[0070] В определенных вариантах осуществления раскрытые в данном документе выделенные антитела способны увеличивать скорости выведения ApoC3 и/или ApoB (например, ApoB48 и/или ApoB100) из крови у субъекта. В определенных вариантах осуществления указанные антитела против ApoC3 способны увеличивать скорости выведения ApoC3 и/или ApoB (например, ApoB48 и/или ApoB100) из крови у субъекта по меньшей мере на 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 98% или 99%, по оценке способами, раскрытыми в данном документе, или способами, известными специалисту в данной области. В определенных вариантах осуществления анти-ApoC3-антитела, раскрытые в данном документе, способны увеличивать скорости выведения ApoC3 и/или ApoB (например, ApoB48 и/или ApoB100) из крови у субъекта по меньшей мере примерно в 1,1 раза, в 1,2 раза, 1,3 раз, 1,4 раза, 1,5 раза, 2 раза, 2,5 раза, 3 раза, 3,5 раза, 4 раза, 4,5 раза, 5 раз, 6 раз, 7 раз, 8 раз, 9 раз, 10 раз, 15 раз, 20 раз 30 раз, 40 раз, 50 раз, 60 раз, 70 раз, 80 раз, 90 раз или 100 раз, по оценке способами, раскрытыми в данном документе, или способами, известными специалисту в данной области. Методы оценки клиренса ApoC3 и/или ApoB (например, ApoB48 и/или ApoB100) включают в себя, без ограничения, методы отслеживания изотопов, в которых изотоп может быть либо радиоактивным, либо стабильным.
[0071] В определенных вариантах осуществления раскрытые в данном документе выделенные антитела способны снижать уровни ApoC3 и/или ApoB (например, ApoB48 и/или ApoB100) в крови у субъекта. В определенных вариантах осуществления указанные антитела против ApoC3 способны снижать уровни ApoC3 и/или ApoB (например, ApoB48 и/или ApoB100) в крови у субъекта по меньшей мере на 5%, 10%, 15%, 20%. 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 98% или 99%, согласно оценкам способами, раскрытыми в данном документе, или способами, известными специалисту в данной области. В определенных вариантах осуществления анти-ApoC3-антитела, раскрытые в данном документе, способны снижать уровни ApoC3 и/или ApoB (например, ApoB48 и/или ApoB100) в крови у субъекта по меньшей мере примерно в 1,1 раза, в 1,2 раза, в 1,3 раза, 1,4 раза, 1,5 раза, 2 раза, 2,5 раза, 3 раза, 3,5 раза, 4 раза, 4,5 раза, 5 раз, 6 раз, 7 раз, 8 раз, 9 раз, 10 раз, 15 раз, 20 раз, 30 раз, 40 раз, 50 раз, 60 раз, 70 раз, 80 раз, 90 раз или 100 раз по оценке согласно методам, раскрытым в данном описании, или методам, известным специалистам в данной области. В определенных вариантах осуществления снижение уровней ApoC3 и/или ApoB (например, ApoB48 и/или ApoB100) в крови у субъекта поддерживается в течение по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8., 9, 10, 15, 20, 25, 30, 35, 40, 45 или 50 дней или, по меньшей мере, 1, 2, 3, 4, 5, 6, 7 или 8 недель.
[0072] В определенных вариантах осуществления выделенные антитела, раскрытые в данном документе, способны связываться с липид-связанным ApoC3 (например, ApoC3 связанным с триглицеридом, TRL (например, ЛПОНП) или TRL остатков). В определенных вариантах осуществления указанные выделенные антитела, раскрытые в данном документе не ингибируют связывание ApoC3 с липидом или липопротеином. В определенных вариантах осуществления указанные антитела, раскрытые в данном документе, не конкурируют за связывание ApoC3 с липидом или липопротеином. В определенных вариантах осуществления указанный липид содержит цепь жирной кислоты. В определенных вариантах осуществления указанный липид содержит фосфатидильную группу. В определенных вариантах осуществления данного изобретения липид включает фосфатидилхолин (например, DMPC), фосфатидилсерин, фосфатидилэтаноламин, фосфатидилинозитол или фосфатидилглицерин. В определенных вариантах осуществления данного изобретения липид представляет собой триглицерид. В определенных вариантах осуществления липопротеин представляет собой TRL (например, ЛПОНП) или остаток TRL. В определенных вариантах осуществления указанная способность ApoC3 связываться с липидами и липопротеинами (например, триглицеридами, TRL (например, ЛПОНП) или TRL остатками) в присутствии антитела анти-ApoC3 раскрытого в данном документе составляет по меньшей мере, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 98% или 99% способности ApoC3 связываться с теми же липидами и липопротеинами в отсутствие антитела против ApoC3, по оценке способами, раскрытыми в данном документе, или способами, известными специалисту в данной области.
[0073] В определенных вариантах осуществления выделенные антитела, раскрытые в данном документе ослабляют способность ApoC3 ингибировать поглощение TRL (например, ЛПОНП) или TRL остатков гепатоцитами. В определенных вариантах осуществления поглощение TRL (например, ЛПОНП) или остатков TRL гепатоцитами (например, клетками HepG2) в присутствии антитела против ApoC3, как описано в данном документе, составляет по меньшей мере 1,1, 1,2, 1,3, 1,4, 1,5, 1,6. В 1,7, 1,8, 1,9, 2, 2,5, 3, 3,5, 4, 4,5 или 5 раз выше, чем поглощение TRL (например, ЛПОНП) или остатков TRL гепатоцитами (например, клетками HepG2) в отсутствие анти-ApoC3 антитела.
[0074] В определенных вариантах осуществления данного изобретения выделенные антитела, раскрытые в данном документе, ослабляют способность ApoC3 ингибировать поглощение гепатоцитами TRL (например, ЛПОНП) или остатков TRL и способны связываться с липид-связанным ApoC3 (например, ApoC3, связанным с триглицеридом), TRL (например,, ЛПОНП) или остатками TRL.
[0075] В определенных вариантах осуществления раскрытые в данном документе выделенные антитела связываются с эпитопом ApoC3 в пределах аминокислотной последовательности FSEFWDLDPE (SEQ ID NO: 2). В определенных вариантах осуществления указанный эпитоп содержит, по меньшей мере, одну аминокислоту в пределах SEQ ID NO: 2 и, необязательно, содержит одну или несколько аминокислот из SEQ ID NO: 1, смежных с SEQ ID NO: 2. В определенных вариантах осуществления указанный эпитоп содержит по меньшей мере одну аминокислоту в положении 2, 5, 6, 8 или 10 последовательности SEQ ID NO: 2. В определенных вариантах осуществления указанный эпитоп содержит по меньшей мере две аминокислоты в положении 2, 5, 6, 8 или 10 последовательности SEQ ID NO: 2. В определенных вариантах осуществления указанный эпитоп содержит по меньшей мере три аминокислоты в положении 2, 5, 6, 8 или 10 последовательности SEQ ID NO: 2. В определенных вариантах осуществления указанный эпитоп содержит по меньшей мере четыре аминокислоты в положении 2, 5, 6, 8 или 10 последовательности SEQ ID NO: 2. В определенных вариантах осуществления указанный эпитоп содержит аминокислоты в положениях 5 и 6 SEQ ID NO: 2. В определенных вариантах осуществления указанный эпитоп содержит аминокислоты в положениях 2, 5 и 6 SEQ ID NO: 2. В определенных вариантах осуществления указанный эпитоп содержит аминокислоты в положениях 2, 5 и 8 SEQ ID NO: 2. В определенных вариантах осуществления указанный эпитоп содержит аминокислоты в положениях 2, 5, 6 и 8 SEQ ID NO: 2. В определенных вариантах осуществления указанный эпитоп содержит аминокислоту в положении 10 SEQ ID NO: 2. В определенных вариантах осуществления указанный эпитоп содержит аминокислоты в положениях 6 и 10 SEQ ID NO: 2. В определенных вариантах осуществления указанный эпитоп содержит аминокислоты в положениях 8 и 10 SEQ ID NO: 2. В определенных вариантах осуществления указанный эпитоп содержит аминокислоты в положениях 6 и 8 SEQ ID NO: 2. В определенных вариантах осуществления указанный эпитоп содержит аминокислоты в положениях 6, 8 и 10 SEQ ID NO: 2. В определенных вариантах осуществления указанные антитела способны связываться с липид-связанным ApoC3 (например, ApoC3 связанным с триглицеридом, TRL (например, ЛПОНП) или TRL остатками). В определенных вариантах осуществления указанные антитела не способны ослабить способность ApoC3 ингибировать липопротеинлипаз-опосредованный липолиз TRL (например, ЛПОНП). В определенных вариантах осуществления указанные антитела также ослабляют способность ApoC3 ингибировать поглощение гепатоцитами TRL (например, ЛПОНП) или TRL остатков. В определенных вариантах осуществления указанные антитела также способны ингибировать постпрандиальную липемию у субъекта при введении субъекту до, во время или после приема пищи. В определенных вариантах осуществления указанные антитела, раскрытые в данном документе, также способны снижать уровни постпрандиального хиломикрона или остатков хиломикрона у субъекта при введении субъекту до, во время или после приема пищи.
[0076] Любые подходящие анализы могут быть использованы для измерения вышеуказанных функциональных активностей антител, раскрытых в данном документе. Иллюстративные анализы включают, но не ограничиваются ими, функциональные анализы, раскрытые в Примерах, приведенных в данном документе.
[0077] Аминокислотные последовательности иллюстративных антител против ApoC3 приведены в Таблицах 1-13 данного изобретения.
Таблица 1. Аминокислотная последовательность CDR тяжелой цепи иллюстративных антител против ApoC3
Таблица 2. Аминокислотная последовательность CDR легкой цепи иллюстративных антител против ApoC3
Таблица 3. Аминокислотные последовательности VH иллюстративных антител против ApoC3
Таблица 4. Аминокислотные последовательности VL иллюстративных антител против ApoC3
Таблица 5. Последовательности VH и VL иллюстративных антител против ApoC3
Таблица 6. Последовательности иллюстративных константных участков тяжелой цепи и легкой цепи
Таблица 7. Полная последовательность тяжелой цепи и легкой цепи иллюстративных антител против ApoC3
полная легкая цепь
[0078] Аминокислотные последовательности иллюстративных гуманизированных антител против ApoC3 приведены в Таблицах 8-13 данного описания.
Таблица 8. Аминокислотные последовательности CDR тяжелой цепи иллюстративных гуманизированных антител против ApoC3
Таблица 9. Аминокислотные последовательности CDR легкой цепи иллюстративных гуманизированных антител против ApoC3
Таблица 10. Аминокислотные последовательности VH иллюстративных гуманизированных антител против ApoC3
X2 представляет собой G или S;
X3 представляет собой V или A;
X4 представляет собой G, E или D;
X5 представляет собой G или A;
X6 представляет собой A или S;
X7 представляет собой S или N;
X8 представляет собой R или K;
X9 представляет собой A или P;
Х10 представляет собой I или V; и
X11 представляет собой L или Q
Х2 представляет собой V или А;
X3 представляет собой G, E или D;
X4 представляет собой G или A;
X5 представляет собой S или N;
X6 представляет собой R или K;
X7 представляет собой A или P;
Х8 представляет собой I или V; и
X9 представляет собой L или Q
Таблица 11. Аминокислотные последовательности VL иллюстративных гуманизированных антител против ApoC3
X2 представляет собой P или S;
Х3 представляет собой Т или V;
X4 представляет собой D или G;
X5 представляет собой Q или L;
Х6 представляет собой S или Т;
X7 представляет собой R или G;
Х 8 представляет собой К или Е;
X9 представляет собой A или V;
Х10 представляет собой Н или Q; и
X11 представляет собой Q или S
в котором Х1 представляет собой L или G;
X2 представляет собой P или S;
Х3 представляет собой Т или V;
X4 представляет собой D или G;
Х5 представляет собой S или Т;
X6 представляет собой R или G;
Х7 представляет собой К или Е;
Х8 представляет собой А или V;
X9 представляет собой H или Q; и
X10 представляет собой Q или S
Таблица 12. Последовательности VH и VL иллюстративных гуманизированных антител против ApoC3
Таблица 13. Последовательности полной тяжелой цепи и легкой цепи иллюстративных гуманизированных антител против ApoC3
[0079] В определенных вариантах осуществления данное изобретение относится к выделенному антителу, которое специфически связывается с ApoC3 (например, ApoC3 человека), причем указанное антитело содержит домен VH, содержащий один, два или все три CDR домена VH, представленных в Таблице 3, или 10 в данном документе. В определенных вариантах осуществления указанное антитело содержит CDRH1 одного из доменов VH, представленных в Таблице 3 или 10. В определенных вариантах осуществления указанное антитело содержит CDRH2 одного из доменов VH, представленных в Таблице 3 или 10. В определенных вариантах осуществления указанное антитело содержит CDRH3 одного из доменов VH, представленных в Таблице 3 или 10.
[0080] В определенных вариантах осуществления данное изобретение относится к выделенному антителу, которое специфически связывается с ApoC3 (например, ApoC3 человека), причем указанное антитело содержит домен VL, содержащий один, два или все три из CDR домена VL, раскрытого в Таблице 4 или 11 данного описания. В определенных вариантах осуществления указанное антитело содержит CDRL1 одного из доменов VL, представленных в Таблице 4 или 11. В определенных вариантах осуществления указанное антитело содержит CDRL2 одного из доменов VL, представленных в Таблице 4 или 11. В определенных вариантах осуществления указанное антитело содержит CDRL3 одного из доменов VL, представленных в Таблице 4 или 11.
[0081] В определенных вариантах осуществления данное изобретение относится к выделенному антителу, которое специфически связывается с ApoC3 (например, ApoC3 человека), при этом указанное антитело содержит вариабельный участок тяжелой цепи, имеющий определяющие комплементарность участки CDRH1, CDRH2 и CDRH3, и вариабельный участок легкой цепи, имеющий определяющие комплементарность участки CDRL1, CDRL2 и CDRL3, причем CDRH1, CDRH2, CDRH3, CDRL1, CDRL2 и CDRL3 содержат аминокислотные последовательности участков CDRH1, CDRH2, CDRH3, CDRL1, CDRL2 и CDRL3, соответственно, антитела, представленного в Таблицах 5 или 12.
[0082] В определенных вариантах осуществления CDR антитела могут быть определены в соответствии с Kabat et al., J. Biol. Chem. 252, 6609-6616 (1977) and Kabat et al., Sequences of protein of immunological interest (1991). В определенных вариантах осуществления CDR легкой цепи антитела определяют согласно Кабату, а CDR тяжелой цепи антитела определяют согласно МакКалум (MacCallum) (см. выше).
[0083] В определенных вариантах осуществления CDR антитела могут быть определены согласно схеме нумерации Чотиа (Chothia), которая относится к расположению структурных петель иммуноглобулина (см., например, Chothia C & Lesk AM, (1987), J Mol Biol 196: 901-917; Al-Lazikani B et al., (1997) J Mol Biol 273: 927-948; Чотиа C et al., (1992) J Mol Biol 227: 799-817; Tramontano A et al., (1990) J Mol Biol 215(1): 175-82; и патент США № 7709226). Как правило, при использовании соглашения о нумерации Кабата петля Чотиа CDRH1 присутствует в аминокислотах тяжелой цепи 26-32, 33 или 34, петля CDRH2 Чотиа присутствует в аминокислотах тяжелой цепи 52-56, и петля Чотиа CDRH3 присутствует в аминокислотах тяжелой цепи с 95 по 102, в то время как петля Чотиа CDRL1 присутствует в аминокислотах легкой цепи 24-34, петля Чотиа CDRL2 присутствует в аминокислотах легкой цепи с 50 по 56, а петля Чотиа CDRL3 присутствует в аминокислотах легкой цепи от 89 до 97. Конец петли Чотиа CDRH1 при нумерации с использованием соглашения о нумерации Кабата варьируется между H32 и H34 в зависимости от длины цикла (это связано с тем, что схема нумерации Kabat размещает вставки в H35A и H35B; если нет ни 35A, ни 35B, цикл заканчивается в 32, если присутствует только 35А, цикл заканчивается в 33; если присутствуют оба 35А и 35В, цикл заканчивается в 34).
[0084] В определенных вариантах осуществления CDR антитела могут быть определены в соответствии с системой нумерации IMGT, как описано в Lefranc MP, (1999), Immunologist 7: 132-136 и Lefranc MP et al. (1999) Nucleic Acids Res 27: 209-212. Согласно схеме нумерации IMGT, CDRH1 находится в положениях с 26 по 35, CDRH2 находится в положениях с 51 по 57, CDRH3 находится в положениях с 93 по 102, CDRL1 находится в положениях с 27 по 32, CDRL2 находится в положениях с 50 по 52 и CDRL3 находится в положениях с 89 по 97.
[0085] В определенных вариантах осуществления CDR антитела могут быть определены согласно схеме нумерации AbM, которая относится к гипервариабельным участкам AbM, которые представляют собой компромисс между структурными петлями CDR Кабата и Чотиа, и используются программным обеспечением для моделирования антител AbM Oxford Molecular (Oxford Molecular Group, Inc.).
[0086] В определенных вариантах осуществления CDR антитела могут быть определены в соответствии с MacCallum RM et al. (1996) J Mol Biol. 262: 732-745. Смотрите также, например, Martin A. «Protein Sequence and Structure Analysis of Antibody Variable Domains», in Antibody Engineering, Kontermann and Dübel, eds., Chapter 31, pp. 422-439, Springer-Verlag, Berlin (2001).
[0087] В определенных вариантах осуществления данное раскрытие обеспечивает выделенное антитело, которое специфически связывается с ApoC3 (например, ApoC3 человека), при этом указанное антитело содержит вариабельный участок тяжелой цепи, содержащий аминокислотные последовательности CDRH1, CDRH2 и CDRH3 участков из домена VH, продемонстрированого в Таблице 3, и вариабельный участок легкой цепи, содержащий аминокислотные последовательности CDRL1, CDRL2 и CDRL3 участков домена VL, продемонстрированого в Таблице 4, где каждый CDR независимо определен в соответствии с Кабатом, Чотиа, IMGT, МакКалум или AbM определением CDR, как раскрыто в данном документе.
[0088] В определенных вариантах осуществления данное изобретение относится к выделенному антителу (например, гуманизированному антителу), которое специфически связывается с ApoC3 (например, ApoC3 человека), причем указанное антитело содержит вариабельный участок тяжелой цепи, имеющий определяющие комплементарность участки CDRH1, CDRH2 и CDRH3, и вариабельный участок легкой цепи, имеющий определяющие комплементарность участки CDRL1, CDRL2 и CDRL3, при этом:
(а) CDRH1 содержит аминокислотную последовательность TYSMR (SEQ ID NO: 3);
(b) CDRH2 содержит аминокислотную последовательность SIX1TX2X3GGTAYRDSVKG, где X1 представляет собой S или H, X2 представляет собой G, E или D и X3 представляет собой G или A (SEQ ID NO: 93) ;
(c) CDRH3 содержит аминокислотную последовательность X4 GYSD, где X4 представляет собой A или H (SEQ ID NO: 5);
(d) CDRL1 содержит аминокислотную последовательность KTSQGLVHSX5 GKTYFY, где X5 представляет собой D или G (SEQ ID NO: 88);
(e) CDRL2 содержит аминокислотную последовательность QVSNRAS (SEQ ID NO: 7); и
(f) CDRL3 содержит аминокислотную последовательность AX6GTYYPHT, где X6 представляет собой Q или H (SEQ ID NO: 8),
и при этом по меньшей мере один из X1, X4 и X6 представляет собой H.
[0089] В определенных вариантах осуществления CDRH2 содержит аминокислотную последовательность SIHTGGGGTAYRDSVKG (SEQ ID NO: 36), SIHTEAGGTAYRDSVKG (SEQ ID NO: 37), SIHTDAGGTAYRDSVKG (SEQ ID NO: 38), SIHTEGGGTAYRDSVKG (SEQ ID NO: 39), IST SISTDGGGTAYRDSVKG (SEQ ID NO: 9) или SIHTDGGGTAYRDSVKG (SEQ ID NO: 11).
[0090] В определенных вариантах осуществления CDRH3 содержит аминокислотную последовательность AGYSD (SEQ ID NO: 10) или HGYSD (SEQ ID NO: 12).
[0091] В определенных вариантах осуществления, CDRL1 содержит аминокислотную последовательность KTSQGLVHSDGKTYFY (SEQ ID NO: 6) или KTSQGLVHSGGKTYFY (SEQ ID NO: 40).
[0092] В определенных вариантах осуществления, CDRL3 включает аминокислотные последовательности AHGTYYPHT (SEQ ID NO: 14) или AQGTYYPHT (SEQ ID NO: 13).
[0093] В определенных вариантах осуществления данное изобретение относится к выделенному антителу (например, гуманизированному антителу), которое специфически связывается с ApoC3 (например, ApoC3 человека), при этом указанное антитело содержит домен VH, содержащий аминокислотные последовательности CDRH1, CDRH2 и CDRH3, представленные в SEQ ID NO: 3, 36 и 10; 3, 37 и 10; 3, 38 и 10; 3, 39 и 10; 3, 9 и 10; 3, 11 и 10; 3, 9 и 12; или 3, 11 и 12 соответственно.
[0094] В определенных вариантах осуществления данное изобретение относится к выделенному антителу, которое специфически связывается с ApoC3 (например, ApoC3 человека), при этом указанное антитело содержит домен VL, содержащий аминокислотные последовательности CDRL1, CDRL2 и CDRL3, указанные в SEQ ID NO: 6, 7. и 14; 40, 7 и 14; 40, 7 и 13; или 6, 7 и 13 соответственно.
[0095] В определенных вариантах осуществления данное раскрытие обеспечивает выделенное антитело (например, гуманизированное антитело), которое специфически связывается с ApoC3 (например, ApoC3 человека), содержащее вариабельный участок тяжелой цепи, содержащий аминокислотную последовательность, которая по меньшей мере на 75%, 80%, 85%, 90%, 95% или 100% (например, по меньшей мере, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99%) идентична аминокислотной последовательности, представленной в SEQ ID NO: 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 15, 16, 17 или 18. В определенных вариантах осуществления данного изобретения указанное антитело содержит вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность представленную в SEQ ID NO: 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 15, 16, 17 или 18.
[0096] В определенных вариантах осуществления данное раскрытие обеспечивает выделенное антитело (например, гуманизированное антитело), которое специфически связывается с ApoC3 (например, ApoC3 человека), содержащее вариабельный участок легкой цепи, содержащий аминокислотную последовательность, которая по меньшей мере на 75%, 80%, 85%, 90%, 95% или 100% (например, по меньшей мере, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99%) идентична аминокислотной последовательности, представленной в SEQ ID NO: 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 19 или 20. В определенных вариантах осуществления данного изобретения указанное антитело содержит вариабельный участок легкой цепи, имеющий аминокислотную последовательность приведенную в SEQ ID NO: 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 19 или 20.
[0097] В определенных вариантах осуществления данное раскрытие обеспечивает выделенное антитело (например, гуманизированное антитело), которое специфически связывается с ApoC3 (например, ApoC3 человека), содержащее вариабельный участок тяжелой цепи, содержащий аминокислотную последовательность, которая является по меньшей мере на 75%, 80%, 85%, 90%, 95% или 100% (например, по меньшей мере на 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99%) идентичной аминокислотной последовательности, представленной в SEQ ID NO: 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 15, 16, 17 или 18, и вариабельный участок легкой цепи, содержащий аминокислотную последовательность, которая по меньшей мере на 75%, 80%, 85%, 90%, 95% или 100% (например, по меньшей мере на 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99%) идентична аминокислотной последовательности, представленной в SEQ ID NO: 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 19 или 20. В определенных вариантах осуществления указанное антитело содержит вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность представленную в SEQ ID NO: 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 15, 16, 17, или 18, и вариабельный участок легкой цепи, имеющий аминокислотную последовательность представленную в SEQ ID NO: 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 19 или 20.
[0098] В определенных вариантах осуществления данное изобретение относится к выделенному антителу (например, гуманизированному антителу), которое специфически связывается с ApoC3 (например, ApoC3 человека), причем указанное антитело содержит вариабельный участок тяжелой цепи, имеющий определяющие комплементарность участки CDRH1, CDRH2 и CDRH3, и вариабельный участок легкой цепи, имеющий определяющие комплементарность участки CDRL1, CDRL2 и CDRL3, при этом:
(а) CDRH1 содержит аминокислотную последовательность TYSMR (SEQ ID NO: 3);
(b) CDRH2 содержит аминокислотную последовательность SIHTX1X2GGTAYRDSVKG, где X1 представляет собой G, E или D и X2 представляет собой G или A (SEQ ID NO: 87);
(c) CDRH3 содержит аминокислотную последовательность AGYSD (SEQ ID NO: 10);
(d) CDRL1 содержит аминокислотную последовательность KTSQGLVHSXGKTYFY, где Х представляет собой D или G (SEQ ID NO: 88);
(e) CDRL2 содержит аминокислотную последовательность QVSNRAS (SEQ ID NO: 7); и
(f) CDRL3 содержит аминокислотную последовательность AXGTYYPHT, где Х представляет собой Q или Н (SEQ ID NO: 8).
[0099] В определенных вариантах осуществления данное изобретение относится к выделенному антителу (например, гуманизированному антителу), которое специфически связывается с ApoC3 (например, ApoC3 человека), причем указанное антитело содержит вариабельный участок тяжелой цепи, имеющий определяющие комплементарность участки CDRH1, CDRH2 и CDRH3, и вариабельный участок легкой цепи, имеющий определяющие комплементарность участки CDRL1, CDRL2 и CDRL3, при этом:
(а) CDRH1 содержит аминокислотную последовательность TYSMR (SEQ ID NO: 3);
(b) CDRH2 содержит аминокислотную последовательность SIHTGGGGTAYRDSVKG (SEQ ID NO: 36), SIHTEAGGTAYRDSVKG (SEQ ID NO: 37), SIHTDAGGTAYRDSVKG (SEQ ID NO: 38), или SIHTEGGGTAYRDSVKG (SEQ ID NO: 39);
(c) CDRH3 содержит аминокислотную последовательность AGYSD (SEQ ID NO: 10);
(d) CDRL1 содержит аминокислотную последовательность KTSQGLVHSDGKTYFY (SEQ ID NO: 6) или KTSQGLVHSGGKTYFY (SEQ ID NO: 40);
(e) CDRL2 содержит аминокислотную последовательность QVSNRAS (SEQ ID NO: 7); и
(f) CDRL3 содержит аминокислотную последовательность AHGTYYPHT (SEQ ID NO: 14) или AQGTYYPHT (SEQ ID NO: 13).
[00100] В определенных вариантах осуществления CDRH2 содержит аминокислотную последовательность SIHTGGGGTAYRDSVKG (SEQ ID NO: 36), SIHTEAGGTAYRDSVKG (SEQ ID NO: 37), SIHTDAGGTAYRDSVKG (SEQ ID NO: 38) или SEHTEGGGDR (SEHTEGGGRAY), В определенных вариантах осуществления CDRH2 содержит аминокислотную последовательность SIHTGGGGTAYRDSVKG (SEQ ID NO: 36), SIHTEAGGTAYRDSVKG (SEQ ID NO: 37) или SIHTDAGGTAYRDSVKG (SEQ ID NO: 38). В определенных вариантах осуществления CDRH2 содержит аминокислотную последовательность SIHTGGGGTAYRDSVKG (SEQ ID NO: 36). В определенных вариантах осуществления CDRH2 содержит аминокислотную последовательность SIHTEAGGTAYRDSVKG (SEQ ID NO: 37). В определенных вариантах осуществления CDRH2 содержит аминокислотную последовательность SIHTDAGGTAYRDSVKG (SEQ ID NO: 38). В определенных вариантах осуществления CDRH2 содержит аминокислотную последовательность SIHTEGGGTAYRDSVKG (SEQ ID NO: 39).
[00101] В определенных вариантах осуществления, CDRL1 содержит аминокислотную последовательность KTSQGLVHSDGKTYFY (SEQ ID NO: 6) или KTSQGLVHSGGKTYFY (SEQ ID NO: 40). В определенных вариантах осуществления, CDRL1 содержит аминокислотную последовательность KTSQGLVHSDGKTYFY (SEQ ID NO: 6). В определенных вариантах осуществления, CDRL1 содержит аминокислотную последовательность KTSQGLVHSGGKTYFY (SEQ ID NO: 40).
[00102] В определенных вариантах осуществления CDRL3 содержит аминокислотную последовательность H AHGTYYPHT (SEQ ID NO: 14) или AQGTYYPHT (SEQ ID NO: 13). В определенных вариантах осуществления CDRL3 содержит аминокислотную последовательность H AHGTYYPHT (SEQ ID NO: 14). В определенных вариантах осуществления, CDRL3 содержит аминокислотную последовательность AQGTYYPHT (SEQ ID NO: 13).
[00103] В определенных вариантах осуществления данное изобретение относится к выделенному антителу (например, гуманизированному антителу), которое специфически связывается с ApoC3 (например, ApoC3 человека), при этом указанное антитело содержит домен VH, содержащий аминокислотные последовательности CDRH1, CDRH2 и CDRH3, представленные в SEQ ID NO: 3, 36 и 10; 3, 37 и 10; 3, 38 и 10; или 3, 39 и 10 соответственно. В определенных вариантах осуществления домен VH содержит аминокислотные последовательности CDRH1, CDRH2 и CDRH3, представленные в SEQ ID NO: 3, 36 и 10 соответственно. В определенных вариантах осуществления домен VH содержит аминокислотные последовательности CDRH1, CDRH2 и CDRH3, представленные в SEQ ID NO: 3, 37 и 10 соответственно. В определенных вариантах осуществления домен VH содержит аминокислотные последовательности CDRH1, CDRH2 и CDRH3, представленные в SEQ ID NO: 3, 38 и 10 соответственно.
[00104] В определенных вариантах осуществления данное изобретение относится к выделенному антителу, которое специфически связывается с ApoC3 (например, ApoC3 человека), при этом указанное антитело содержит домен VL, содержащий аминокислотные последовательности CDRL1, CDRL2 и CDRL3, указанные в SEQ ID NO: 6, 7. и 14; 40, 7 и 14; или 40, 7 и 13 соответственно. В определенных вариантах осуществления домен VL содержит аминокислотные последовательности CDRL1, CDRL2 и CDRL3, представленные в SEQ ID NO: 6, 7 и 14 соответственно. В определенных вариантах осуществления домен VL содержит аминокислотные последовательности CDRL1, CDRL2 и CDRL3, представленные в SEQ ID NO: 40, 7 и 14 соответственно.
[00105] В определенных вариантах осуществления данное изобретение относится к выделенному антителу (например, гуманизированному антителу), которое специфически связывается с ApoC3 (например, ApoC3 человека), при этом указанное антитело содержит вариабельный участок тяжелой цепи, содержащий CDRH1, CDRH2 и CDRH3 участки, и вариабельный участок легкой цепи, содержащий CDRL1, CDRL2 и CDRL3 участки, в котором CDRH1, CDRH2, CDRH3, CDRL1, CDRL2 и CDRL3 участки содержат аминокислотные последовательности, указанные в SEQ ID NO: 3, 36, 10, 6, 7 и 14; 3, 37, 10, 40, 7 и 14; 3, 38, 10, 40, 7 и 14; 3, 39, 10, 6, 7 и 14; 3, 37, 10, 40, 7 и 13; или 3, 38, 10, 40, 7 и 13, соответственно. В определенных вариантах осуществления CDRH1, CDRH2, CDRH3, CDRL1, CDRL2 и CDRL3 участки содержат аминокислотные последовательности, указанные в SEQ ID NO: 3, 36, 10, 6, 7 и 14, соответственно. В определенных вариантах осуществления CDRH1, CDRH2, CDRH3, CDRL1, CDRL2 и CDRL3 участки содержат аминокислотные последовательности, указанные в SEQ ID NO: 3, 37, 10, 40, 7 и 14, соответственно. В определенных вариантах осуществления CDRH1, CDRH2, CDRH3, CDRL1, CDRL2 и CDRL3 участки содержат аминокислотные последовательности, указанные в SEQ ID NO: 3, 38, 10, 40, 7 и 14, соответственно.
[00106] В определенных вариантах осуществления данное раскрытие обеспечивает выделенное антитело (например, гуманизированное антитело), которое специфически связывается с ApoC3 (например, ApoC3 человека), содержащее вариабельный участок тяжелой цепи, содержащий аминокислотную последовательность, которая по меньшей мере на 75%, 80%, 85%, 90%, 95% или 100% (например, по меньшей мере на 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99%) идентична аминокислотной последовательности представленной в SEQ ID NO: 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 89, или 90. В определенных вариантах осуществления данного изобретения указанное антитело содержит вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность представленную в SEQ ID NO: 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 89 или 90. В определенных вариантах осуществления данного изобретения указанное антитело содержит вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность представленную в SEQ ID NO: 42. В определенных вариантах осуществления данного изобретения указанное антитело содержит вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность представленную в SEQ ID NO: 43. В определенных вариантах осуществления данного изобретения указанное антитело содержит вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность представленную в SEQ ID NO: 44. В определенных вариантах осуществления данного изобретения указанное антитело содержит вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность представленную в SEQ ID NO: 45. В определенных вариантах осуществления данного изобретения указанное антитело содержит вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность представленную в SEQ ID NO: 46. В определенных вариантах осуществления данного изобретения указанное антитело содержит вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность представленную в SEQ ID NO: 47. В определенных вариантах осуществления данного изобретения указанное антитело содержит вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность представленную в SEQ ID NO: 48. В определенных вариантах осуществления данного изобретения указанное антитело содержит вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность представленную в SEQ ID NO: 49. В определенных вариантах осуществления данного изобретения указанное антитело содержит вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность представленную в SEQ ID NO: 50. В определенных вариантах осуществления данного изобретения указанное антитело содержит вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность представленную в SEQ ID NO: 51. В определенных вариантах осуществления данного изобретения указанное антитело содержит вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность представленную в SEQ ID NO: 52. В определенных вариантах осуществления данного изобретения указанное антитело содержит вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность представленную в SEQ ID NO: 53. В определенных вариантах осуществления данного изобретения указанное антитело содержит вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность представленную в SEQ ID NO: 89, необязательно, в которой вариабельный участок тяжелой цепи не содержит аминокислотной последовательности представленной в SEQ ID NO: 15, 16, 17 или 18. В определенных вариантах осуществления данного изобретения указанное антитело содержит вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность представленную в SEQ ID NO: 90, необязательно, при этом вариабельный участок тяжелой цепи не содержит аминокислотной последовательности представленной в SEQ ID NO: 15, 16, 17 или 18.
[00107] В определенных вариантах осуществления данное раскрытие обеспечивает выделенное антитело (например, гуманизированное антитело), которое специфически связывается с ApoC3 (например, ApoC3 человека), содержащее вариабельный участок легкой цепи, содержащий аминокислотную последовательность, которая по меньшей мере на 75%, 80%, 85%, 90%, 95% или 100% (например, по меньшей мере, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99%) идентична аминокислотной последовательности, представленной в SEQ ID NO: 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 91 или 92. В определенных вариантах осуществления данного изобретения указанное антитело содержит вариабельный участок легкой цепи, имеющий аминокислотную последовательность приведенную в SEQ ID NO: 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 91 или 92. В определенных вариантах осуществления данного изобретения указанное антитело содержит вариабельный участок легкой цепи, имеющий аминокислотную последовательность представленную в SEQ ID NO: 54. В определенных вариантах осуществления данного изобретения указанное антитело содержит вариабельный участок легкой цепи, имеющий аминокислотную последовательность представленную в SEQ ID NO: 55. В определенных вариантах осуществления данного изобретения указанное антитело содержит вариабельный участок легкой цепи, имеющий аминокислотную последовательность представленную в SEQ ID NO: 56. В определенных вариантах осуществления данного изобретения указанное антитело содержит вариабельный участок легкой цепи, имеющий аминокислотную последовательность представленную в SEQ ID NO: 57. В определенных вариантах осуществления данного изобретения указанное антитело содержит вариабельный участок легкой цепи, имеющий аминокислотную последовательность представленную в SEQ ID NO: 58. В определенных вариантах осуществления данного изобретения указанное антитело содержит вариабельный участок легкой цепи, имеющий аминокислотную последовательность представленную в SEQ ID NO: 59. В определенных вариантах осуществления данного изобретения указанное антитело содержит вариабельный участок легкой цепи, имеющий аминокислотную последовательность представленную в SEQ ID NO: 60. В определенных вариантах осуществления данного изобретения указанное антитело содержит вариабельный участок легкой цепи, имеющий аминокислотную последовательность представленную в SEQ ID NO: 61. В определенных вариантах осуществления данного изобретения указанное антитело содержит вариабельный участок легкой цепи, имеющий аминокислотную последовательность представленную в SEQ ID NO: 62. В определенных вариантах осуществления данного изобретения указанное антитело содержит вариабельный участок легкой цепи, имеющий аминокислотную последовательность представленную в SEQ ID NO: 63. В определенных вариантах осуществления данного изобретения указанное антитело содержит вариабельный участок легкой цепи, имеющий аминокислотную последовательность представленную в SEQ ID NO: 64. В определенных вариантах осуществления данного изобретения указанное антитело содержит вариабельный участок легкой цепи, имеющий аминокислотную последовательность представленную в SEQ ID NO: 65. В определенных вариантах осуществления данного изобретения указанное антитело содержит вариабельный участок легкой цепи, имеющий аминокислотную последовательность представленную в SEQ ID NO: 91. В определенных вариантах осуществления данного изобретения указанное антитело содержит вариабельный участок легкой цепи, имеющий аминокислотную последовательность представленную в SEQ ID NO: 92.
[00108] В определенных вариантах осуществления данное раскрытие обеспечивает выделенное антитело (например, гуманизированное антитело), которое специфически связывается с ApoC3 (например, ApoC3 человека), содержащие вариабельный участок тяжелой цепи, содержащий аминокислотную последовательность, которая по меньшей мере на 75%, 80%, 85%, 90%, 95% или 100% (например, по меньшей мере, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99%) идентична аминокислотной последовательности, указанной в SEQ ID NO: 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 89, или 90, и вариабельный участок легкой цепи, содержащий аминокислотную последовательность, которая по меньшей мере на 75%, 80%, 85%, 90%, 95% или 100% (например, по меньшей мере на 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99%) идентична аминокислотной последовательности, представленной в SEQ ID NO: 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 91 или 92. В определенных вариантах осуществления указанное антитело содержит вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность представленную в SEQ ID NO: 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 89, или 90, и вариабельный участок легкой цепи, имеющий аминокислотную последовательности представленную в SEQ ID NO: 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 91 или 92. В определенных вариантах осуществления указанное антитело содержит вариабельный участок тяжелой цепи и вариабельный участок легкой цепи, имеющие аминокислотные последовательности, указанные в SEQ ID NO: 42 и 54, 43 и 55, 44 и 56, 45 и 57, 46 и 58, 46 и 54, 47 и 58, 47 и 54, 48 и 58, 48 и 54, 49 и 59, 49 и 60, 50 и 59, 50 и 60, 51 и 61, 52 и 62, 53 и 62, 43 и 63, 44 и 64, 45 и 65, 89 и 91 или 90 и 92 соответственно. В определенных вариантах осуществления указанное антитело содержит вариабельный участок тяжелой цепи и вариабельный участок легкой цепи, имеющие аминокислотные последовательности, указанные в SEQ ID NO: 42 и 54, соответственно. В определенных вариантах осуществления указанное антитело содержит вариабельный участок тяжелой цепи и вариабельный участок легкой цепи, имеющие аминокислотные последовательности, указанные в SEQ ID NO: 43 и 55, соответственно. В определенных вариантах осуществления указанное антитело содержит вариабельный участок тяжелой цепи и вариабельный участок легкой цепи, имеющие аминокислотные последовательности, указанные в SEQ ID NO: 44 и 56, соответственно. В определенных вариантах осуществления указанное антитело содержит вариабельный участок тяжелой цепи и вариабельный участок легкой цепи, имеющие аминокислотные последовательности, указанные в SEQ ID NO: 45 и 57, соответственно. В определенных вариантах осуществления указанное антитело содержит вариабельный участок тяжелой цепи и вариабельный участок легкой цепи, имеющие аминокислотные последовательности, указанные в SEQ ID NO: 46 и 58, соответственно. В определенных вариантах осуществления указанное антитело содержит вариабельный участок тяжелой цепи и вариабельный участок легкой цепи, имеющие аминокислотные последовательности, указанные в SEQ ID NO: 46 и 54, соответственно. В определенных вариантах осуществления указанное антитело содержит вариабельный участок тяжелой цепи и вариабельный участок легкой цепи, имеющие аминокислотные последовательности, указанные в SEQ ID NO: 47 и 58, соответственно. В определенных вариантах осуществления указанное антитело содержит вариабельный участок тяжелой цепи и вариабельный участок легкой цепи, имеющие аминокислотные последовательности, указанные в SEQ ID NO: 47 и 54, соответственно. В определенных вариантах осуществления указанное антитело содержит вариабельный участок тяжелой цепи и вариабельный участок легкой цепи, имеющие аминокислотные последовательности, указанные в SEQ ID NO: 48 и 58, соответственно. В определенных вариантах осуществления указанное антитело содержит вариабельный участок тяжелой цепи и вариабельный участок легкой цепи, имеющие аминокислотные последовательности, указанные в SEQ ID NO: 48 и 54, соответственно. В определенных вариантах осуществления указанное антитело содержит вариабельный участок тяжелой цепи и вариабельный участок легкой цепи, имеющие аминокислотные последовательности, указанные в SEQ ID NO: 49 и 59, соответственно. В определенных вариантах осуществления указанное антитело содержит вариабельный участок тяжелой цепи и вариабельный участок легкой цепи, имеющие аминокислотные последовательности, указанные в SEQ ID NO: 49 и 60, соответственно. В определенных вариантах осуществления указанное антитело содержит вариабельный участок тяжелой цепи и вариабельный участок легкой цепи, имеющие аминокислотные последовательности, указанные в SEQ ID NO: 50 и 59, соответственно. В определенных вариантах осуществления указанное антитело содержит вариабельный участок тяжелой цепи и вариабельный участок легкой цепи, имеющие аминокислотные последовательности, указанные в SEQ ID NO: 50 и 60, соответственно. В определенных вариантах осуществления указанное антитело содержит вариабельный участок тяжелой цепи и вариабельный участок легкой цепи, имеющие аминокислотные последовательности, указанные в SEQ ID NO: 51 и 61, соответственно. В определенных вариантах осуществления указанное антитело содержит вариабельный участок тяжелой цепи и вариабельный участок легкой цепи, имеющие аминокислотные последовательности, указанные в SEQ ID NO: 52 и 62, соответственно. В определенных вариантах осуществления указанное антитело содержит вариабельный участок тяжелой цепи и вариабельный участок легкой цепи, имеющие аминокислотные последовательности, указанные в SEQ ID NO: 53 и 62, соответственно. В определенных вариантах осуществления указанное антитело содержит вариабельный участок тяжелой цепи и вариабельный участок легкой цепи, имеющие аминокислотные последовательности, указанные в SEQ ID NO: 43 и 63, соответственно. В определенных вариантах осуществления указанное антитело содержит вариабельный участок тяжелой цепи и вариабельный участок легкой цепи, имеющие аминокислотные последовательности, указанные в SEQ ID NO: 44 и 64, соответственно. В определенных вариантах осуществления указанное антитело содержит вариабельный участок тяжелой цепи и вариабельный участок легкой цепи, имеющие аминокислотные последовательности, указанные в SEQ ID NO: 45 и 65, соответственно. В определенных вариантах осуществления указанное антитело содержит вариабельный участок тяжелой цепи и вариабельный участок легкой цепи, имеющие аминокислотные последовательности приведенные в SEQ ID NO: 89 и 91, соответственно,, необязательно при этом вариабельный участок тяжелой цепи не содержит аминокислотную последовательность представленую в SEQ ID NO: 15, 16, 17, или 18. В определенных вариантах осуществления указанное антитело содержит вариабельный участок тяжелой цепи и вариабельный участок легкой цепи, имеющие аминокислотные последовательности приведенные в SEQ ID NO: 90 и 92, соответственно, необязательно, при этом вариабельный участок тяжелой цепи не содержит аминокислотную последовательность представленую в SEQ ID NO: 15, 16, 17, или 18.
[00109] В определенных вариантах осуществления данное изобретение относится к выделенному антителу, которое специфически связывается с ApoC3 (например, ApoC3 человека), при этом указанное антитело содержит вариабельный участок тяжелой цепи, имеющий определяющие комплементарность участки CDRH1, CDRH2 и CDRH3, и вариабельный участок легкой цепи, имеющий определяющие комплементарность участки CDRL1, CDRL2 и CDRL3 и при этом:
(а) CDRH1 содержит аминокислотную последовательность TYSMR (SEQ ID NO: 3);
(b) CDRH2 содержит аминокислотную последовательность SIX1TDGGGTAYRDSVKG, где X1 представляет собой S или H (SEQ ID NO: 4);
(c) CDRH3 содержит аминокислотную последовательность X2 GYSD, где X2 представляет собой A или H (SEQ ID NO: 5);
(d) CDRL1 содержит аминокислотную последовательность KTSQGLVHSDGKTYFY (SEQ ID NO: 6);
(e) CDRL2 содержит аминокислотную последовательность QVSNRAS (SEQ ID NO: 7); и/или
(f) CDRL3 содержит аминокислотную последовательность AX 3 GTYYPHT, где X3 представляет собой Q или H (SEQ ID NO: 8).
[00110] В определенных вариантах осуществления данное изобретение относится к выделенному антителу, которое специфически связывается с ApoC3 (например, ApoC3 человека), при этом указанное антитело содержит вариабельный участок тяжелой цепи, имеющий определяющие комплементарность участки CDRH1, CDRH2 и CDRH3, и вариабельный участок легкой цепи, имеющий определяющие комплементарность участки CDRL1, CDRL2 и CDRL3 и при этом:
(а) CDRH1 содержит аминокислотную последовательность TYSMR (SEQ ID NO: 3);
(b) CDRH2 содержит аминокислотную последовательность SIX1TDGGGTAYRDSVKG, где X1 представляет собой S или H (SEQ ID NO: 4);
(c) CDRH3 содержит аминокислотную последовательность X2 GYSD, где X2 представляет собой A или H (SEQ ID NO: 5);
(d) CDRL1 содержит аминокислотную последовательность KTSQGLVHSDGKTYFY (SEQ ID NO: 6);
(e) CDRL2 содержит аминокислотную последовательность QVSNRAS (SEQ ID NO: 7); и
(f) CDRL3 содержит аминокислотную последовательность AX3GTYYPHT, где X3 представляет собой Q или H (SEQ ID NO: 8),
и при этом по меньшей мере один из X1, X2 и X3 представляет собой H.
[00111] В определенных вариантах осуществления данное изобретение относится к выделенному антителу, которое специфически связывается с ApoC3 (например, ApoC3 человека), причем указанное антитело содержит:
(а) CDRH1, содержащий аминокислотную последовательность SEQ ID NO: 3;
(b) CDRH2, содержащий аминокислотную последовательность SEQ ID NO: 9 или 11;
(c) CDRH3, содержащий аминокислотную последовательность SEQ ID NO: 10 или 12;
(d) CDRL1, содержащий аминокислотную последовательность SEQ ID NO: 6;
(е) CDRL2, содержащий его аминокислотной последовательности SEQ ID NO: 7; и/или
(f) CDRL3, содержащий аминокислотную последовательность SEQ ID NO: 13 или 14.
[00112] В определенных вариантах осуществления данное изобретение относится к выделенному антителу, которое специфически связывается с ApoC3 (например, ApoC3 человека), причем указанное антитело содержит:
(а) CDRH1, содержащий аминокислотную последовательность SEQ ID NO: 3;
(b) CDRH2, содержащий аминокислотную последовательность SEQ ID NO: 9 или 11;
(c) CDRH3, содержащий аминокислотную последовательность SEQ ID NO: 10 или 12;
(d) CDRL1, содержащий аминокислотную последовательность SEQ ID NO: 6;
(е) CDRL2, содержащий аминокислотную последовательность SEQ ID NO: 7; и
(f) CDRL3, содержащий аминокислотную последовательность SEQ ID NO: 13 или 14,
и при этом выделенное антитело не содержит последовательностей CDRH1, CDRH2, CDRH3, CDRL1, CDRL2 и CDRL3, указанных в SEQ ID NO: 3, 9, 10, 6, 7 и 13 соответственно.
[00113] В определенных вариантах осуществления данное изобретение относится к выделенному антителу, которое специфически связывается с ApoC3 (например, ApoC3 человека), при этом указанное антитело содержит домен VH, содержащий аминокислотные последовательности CDRH1, CDRH2 и CDRH3, указанные в SEQ ID NO: 3, 9 и 10; 3, 11 и 10; 3, 9 и 12; или 3, 11 и 12 соответственно. В определенных вариантах осуществления домен VH содержит аминокислотные последовательности CDRH1, CDRH2 и CDRH3, представленные в SEQ ID NO: 3, 11 и 10 соответственно. В определенных вариантах осуществления домен VH содержит аминокислотные последовательности CDRH1, CDRH2 и CDRH3, представленные в SEQ ID NO: 3, 9 и 12 соответственно. В определенных вариантах осуществления домен VH содержит аминокислотные последовательности CDRH1, CDRH2 и CDRH3, представленные в SEQ ID NO: 3, 11 и 12 соответственно.
[00114] В определенных вариантах осуществления данное изобретение относится к выделенному антителу, которое специфически связывается с ApoC3 (например, ApoC3 человека), при этом указанное антитело содержит домен VL, содержащий аминокислотные последовательности CDRL1, CDRL2 и CDRL3, указанные в SEQ ID NO: 6, 7. и 13; или 6, 7 и 14 соответственно. В определенных вариантах осуществления домен VL содержит аминокислотные последовательности CDRL1, CDRL2 и CDRL3, представленные в SEQ ID NO: 6, 7 и 14 соответственно.
[00115] В определенных вариантах осуществления данное изобретение относится к выделенному антителу, которое специфически связывается с ApoC3 (например, ApoC3 человека), при этом указанное антитело содержит вариабельный участок тяжелой цепи, содержащий CDRH1, CDRH2 и CDRH3 участки, и вариабельный участок легкой цепи, содержащий CDRL1, CDRL2 и CDRL3 участки, при этом CDRH1, CDRH2, CDRH3, CDRL1, CDRL2 и CDRL3 участки содержат аминокислотные последовательности, указанные в SEQ ID NO: 3, 11, 10, 6, 7 и 13; 3, 9, 12, 6, 7 и 13; 3, 9, 10, 6, 7 и 14; 3, 11, 10, 6, 7 и 14; 3, 9, 12, 6, 7 и 14; 3, 11, 12, 6, 7 и 13; или 3, 11, 12, 6, 7 и 13 соответственно. В определенных вариантах осуществления CDRH1, CDRH2, CDRH3, CDRL1, CDRL2 и CDRL3 участки содержат аминокислотные последовательности, указанные в SEQ ID NO: 3, 11, 10, 6, 7 и 14 соответственно. В определенных вариантах осуществления CDRH1, CDRH2, CDRH3, CDRL1, CDRL2 и CDRL3 участки содержат аминокислотные последовательности, указанные в SEQ ID NO: 3, 9, 12, 6, 7 и 14 соответственно.
[00116] В определенных вариантах осуществления данное раскрытие обеспечивает выделенное антитело, которое специфически связывается с ApoC3 (например, ApoC3 человека), содержащее вариабельный участок тяжелой цепи, содержащий аминокислотную последовательность, которая по меньшей мере, на 75%, 80%, 85%, 90%, 95% или 100% (например, по меньшей мере, на 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99%), идентична аминокислотной последовательности представленной в SEQ ID NO: 15, 16, 17 или 18. В определенных вариантах осуществления данного изобретения указанное антитело содержит вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность представленную в SEQ ID NO: 15, 16, 17, или 18. В определенных вариантах осуществления данного изобретения указанное антитело содержит вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность представленную в SEQ ID NO: 16. В определенных вариантах осуществления данного изобретения указанное антитело содержит вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность представленную в SEQ ID NO: 17. В определенных вариантах осуществления данного изобретения указанное антитело содержит вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность представленную в SEQ ID NO: 18.
[00117] В определенных вариантах осуществления данное раскрытие обеспечивает выделенное антитело, которое специфически связывается с ApoC3 (например, ApoC3 человека), содержащее вариабельный участок легкой цепи, содержащий аминокислотную последовательность, которая по меньшей мере, на 75%, 80%, 85%, 90%, 95% или 100% (например, по меньшей мере, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99%), идентична аминокислотной последовательности представленной в SEQ ID NO: 19 или 20. В определенных вариантах осуществления данного изобретения указанное антитело содержит вариабельный участок легкой цепи, имеющий аминокислотную последовательность представленную в SEQ ID NO: 20.
[00118] В определенных вариантах осуществления данное раскрытие обеспечивает выделенное антитело, которое специфически связывается с ApoC3 (например, ApoC3 человека), содержащее вариабельный участок тяжелой цепи, содержащий аминокислотную последовательность, которая по меньшей мере, на 75%, 80%, 85%, 90%, 95% или 100% (например, по меньшей мере, на 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99%), идентична аминокислотной последовательности представленной в SEQ ID NO: 15, 16, 17, или 18, и вариабельный участок легкой цепи, содержащий аминокислотную последовательность, которая по меньшей мере, на 75%, 80%, 85%, 90%, 95%, или 100% (например, по меньшей мере на 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99%) идентична аминокислотной последовательности, представленной в SEQ ID NO: 19 или 20. В определенных вариантах осуществления указанное антитело содержит вариабельный участок тяжелой цепи, имеющий аминокислотную последовательность представленную в SEQ ID NO: 15, 16, 17, или 18, и вариабельный участок легкой цепи, имеющий аминокислотную последовательность, приведенную в Q SEQ ID NO: 19 или 20. В определенных вариантах осуществления указанное антитело содержит вариабельный участок тяжелой цепи и вариабельный участок легкой цепи, имеющие аминокислотные последовательности, указанные в SEQ ID NO: 16 и 19, 17 и 19, 18 и 19, 15 и 20, 16 и 20, 17 и 20 или 18 и 20 соответственно. В определенных вариантах осуществления указанное антитело содержит вариабельный участок тяжелой цепи и вариабельный участок легкой цепи, имеющие аминокислотные последовательности, указанные в SEQ ID NO: 16 и 20 соответственно. В определенных вариантах осуществления указанное антитело содержит вариабельный участок тяжелой цепи и вариабельный участок легкой цепи, имеющие аминокислотные последовательности, указанные в SEQ ID NO: 17 и 20 соответственно.
[00119] Любой константный участок Ig может быть использован в выделенных антителах, описанных в данном документе. В определенных вариантах осуществления указанный константный участок Ig представляет собой константный участок молекулы иммуноглобулина (Ig) IgG человека, IgE, IgM, IgD, IgA или IgY и/или константный участок любого класса (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) или любого подкласса (например, IgG2a и IgG2b) молекулы иммуноглобулина. В определенных вариантах осуществления указанный константный участок Ig представляет собой константный участок Ig человека или гуманизированного Ig.
[00120] В определенных вариантах осуществления, константный участок представляет собой вариант дикого типа константного участка тяжелой цепи Ig человека (например, IgG), и при этом вариант константного участка тяжелой цепи Ig человека обладает повышенной аффинностью (например, увеличение, по меньшей мере, в 1,5, 2, 2,5, 3, 4, 5, 6, 7, 8, 9, 10, 15 или 20 раз) к человеческому Fc-рецептору новорожденных (FcRn) при кислотном pH (например, pH от 5,5 до pH 6) относительно сродства соответствующего константного участка тяжелой цепи Ig человека дикого типа к FcRn человека в тех же условиях. В определенных вариантах осуществления вариантный константный участок тяжелой цепи Ig человека имеет сходную или пониженную аффинность (например, повышенную не более чем в 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9 или в 2 раза, что равную или пониженную) для человеческого Fc-рецептора новорожденного (FcRn) при физиологическом pH (например, при pH 7,4) относительно сродства константного участка тяжелой цепи Ig человека дикого типа к FcRn человека в тех же условиях. В определенных вариантах осуществления указанный константный участок содержит одну, две или более аминокислот (например, имеющих одну или несколько замен, вставок или делеций) из константного домена Ig (например, IgG) дикого типа или его FcRn-связывающего фрагмента (например, фрагмента Fc-домена или шарнир-Fc-домена). В определенных вариантах осуществления период полураспада антитела с вариабельной константной областью in vivo увеличивается относительно периода полураспада соответствующего антитела с константным доменом дикого типа или его FcRn-связывающим фрагментом in vivo. См., например, международные публикации № WO 02/060919; WO 98/23289; и WO 97/34631; и патенты США № 5869046, 6121022, 6277375, 6165745, 8088376 и 8163881, каждая/ый из которых полностью включен в данное описание посредством ссылки, для примеров мутаций, которые увеличивают период полураспада антитела in vivo. В определенном варианте осуществления одна или несколько разных аминокислот находятся во втором константном (CH2) домене (остатки 231-340 IgG1 человека) и/или в третьем константном (CH3) домене (остатки 341-447 IgG1 человека) пронумерованы по системе нумерации EU. В определенных вариантах осуществления указанный константный участок IgG (например, IgG1, IgG2 или IgG4) антитела, раскрытого в данном документе, содержит аминокислоты тирозин (Y), треонин (Т) и глутаминовую кислоту (Е) в положениях 252, 254 и 256, соответственно, пронумерованые в соответствии с системой нумерации EU. См. патент США № 7658921, который полностью включен в данное описание посредством ссылки. Показано, что этот тип IgG, называемый «YTE IgG», демонстрирует четырехкратное увеличение периода полувыведения по сравнению с версиями того же антитела дикого типа (см. Dall'Acqua WF et al., (2006) J Biol Chem 281: 23514-24, которая полностью включена в данное описание посредством ссылки). В определенных вариантах осуществления указанный константный участок IgG (например, IgG1) антитела, раскрытого в данном документе, содержит аминокислоту аланин (A), серин (S), тирозин (Y) или фенилаланин (F) в положении 434 по нумерации в соответствии с системой нумерации EU. В определенных вариантах осуществления указанный константный участок IgG (например, IgG1, IgG2 или IgG4) антитела, раскрытого в данном документе, содержит аминокислоты лизин (K), фенилаланин (F) и тирозин (Y) в положениях 433, 434 и 436, соответственно, пронумерованых в соответствии с системой нумерации EU. В определенных вариантах осуществления указанный константный участок IgG (например, IgG1, IgG2 или IgG4) антитела, раскрытого в данном документе, содержит аминокислоты лейцин (L) и серин (S) в положениях 428 и 434, соответственно, пронумерованных в соответствии с системой нумерации EU. Дополнительные константные участки IgG, которые могут иметь повышенное сродство к FcRn в кислых условиях, описаны в Ward et al., Mol. Immunol. (2015) 67 (200): 131-41, которая полностью включена в данный документ посредством ссылки. В определенных вариантах осуществления указанное антитело содержит константный домен IgG, содержащий одну, две, три или более аминокислотных замен аминокислотных остатков в положениях 251-257, 285-290, 308-314, 385-389 и 428-436, пронумерованных в соответствии с системой нумерации EU. В определенных вариантах осуществления данного изобретения, выделенные антитела, раскрытые в данном документе, содержат константный участок тяжелой цепи, содержащий аминокислотную последовательность представленнную в SEQ ID NO: 21, 22, 23, 24, 75, 76, 77, 78, 79, 80, 81 82, 83, 84, 85 или 86. В определенных вариантах осуществления указанные выделенные антитела, описанные в данном документе, содержат константный участок легкой цепи, содержащий аминокислотную последовательность аминокислоты представленную в SEQ ID NO: 25 или 26.
[00121] В определенных вариантах осуществления данное раскрытие обеспечивает выделенное антитело, которое специфически связывается с ApoC3 (например, ApoC3 человека), содержащее тяжелую цепь, содержащую аминокислотную последовательность представленную в SEQ ID NO: 66, 67, 68, 69, 70, 71, 72 или 73. В определенных вариантах осуществления данное раскрытие обеспечивает выделенное антитело, которое специфически связывается с ApoC3 (например, ApoC3 человека), содержащее легкую цепь, содержащую аминокислотную последовательность представленную в SEQ ID NO: 74, В определенных вариантах осуществления данное раскрытие обеспечивает выделенное антитело, которое специфически связывается с ApoC3 (например, ApoC3 человека), содержащее тяжелую цепь и легкую цепь, содержащие аминокислотные последовательности представлены в SEQ ID NO: 66 и 74, 67 и 74, 68 и 74, 69 и 74, 70 и 74, 71 и 74, 72 и 74, или 73 и 74 соответственно.
[00122] В определенных вариантах осуществления данное раскрытие обеспечивает выделенное антитело, которое специфически связывается с ApoC3 (например, ApoC3 человека), содержащее тяжелую цепь, содержащую аминокислотную последовательность представленную в SEQ ID NO: 27, 28, 29, 30, 31, 32, 33 или 34. В определенных вариантах осуществления данное раскрытие обеспечивает выделенное антитело, которое специфически связывается с ApoC3 (например, ApoC3 человека), содержащее легкую цепь, содержащую аминокислотную последовательность представленную в SEQ ID NO: 35. В определенных вариантах осуществления данное раскрытие обеспечивает выделенное антитело, которое специфически связывается с ApoC3 (например, ApoC3 человека), содержащее тяжелую цепь и легкую цепь, содержащую аминокислотные последовательности представленные в SEQ ID NO: 27 и 35, 28 и 35, 29 и 35, 30 и 35, 31 и 35, 32 и 35, 33 и 35, или 34 и 35 соответственно.
3. Способы применения
[00123] ApoC3 ингибирует поглощение и выведение TRL (например, ЛПОНП) и TRL-остатков гепатоцитами и ингибирует липопротеин-липаз-опосредованный липолиз TRL (например, ЛПОНП), тем самым функционируя для повышения уровня триглицеридов в крови субъекта. В определенных вариантах осуществления анти-ApoC3-антитела, раскрытые в данном документе, могут ослаблять способность ApoC3 ингибировать поглощение и выведение остатков TRL (например, ЛПОНП) и TRL гепатоцитами или ослаблять способность ApoC3 ингибировать липопротеин-липаз-опосредованный липолиз TRL (например, ЛПОНП). Соответственно, в определенных вариантах осуществления данное раскрытие обеспечивает способ ингибирования активности ApoC3 в крови субъекта, причем указанный способ включает введение субъекту эффективного количества антитела против ApoC3 или фармацевтической композиции, раскрытой в данном документе. В определенных вариантах осуществления активность ApoC3 представляет собой ингибирование захвата и выведения остатков TRL (например, ЛПОНП) и TRL гепатоцитами. В определенных вариантах осуществления активность ApoC3 представляет собой ингибирование липопротеин-липаз-опосредованного липолиза TRL. В определенных вариантах осуществления активность ApoC3 заключается в ингибировании захвата и выведения остатков TRL (например, ЛПОНП) и TRL гепатоцитами и ингибировании липопротеин-липаз-опосредованного липолиза TRL.
[00124] Антитела против ApoC3, раскрытые в данном документе, полезны для увеличения скорости выведения ApoC3 и/или ApoB (например, ApoB48 и/или ApoB100) из крови у субъекта. Соответственно, в некоторых вариантах осуществления данное раскрытие обеспечивает способ увеличения скорости выведения ApoC3 и/или ApoB (например, ApoB48 и/или ApoB100) из крови у субъекта, причем указанный способ включает введение субъекту эффективного количества антитела против ApoC3 или фармацевтической композиции, раскрытой в данном документе.
[00125] Антитела против ApoC3, раскрытые в данном описании, полезны для снижения уровня ApoC3 и/или ApoB (например, ApoB48 и/или ApoB100) в крови субъекта. Соответственно, в определенных вариантах осуществления данное изобретение обеспечивает способ снижения уровня ApoC3 и/или ApoB (например, ApoB48 и/или ApoB100) в крови субъекта, причем указанный способ включает введение субъекту эффективного количества антитела против ApoC3 или фармацевтической композиции, раскрытой в данном документе. В определенных вариантах осуществления указанный способ снижает уровень ApoC3 и/или ApoB (например, ApoB48 и/или ApoB100) в крови субъекта по меньшей мере на 5%, 10%, 15%, 20%, 25%, 30%. 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 98% или 99%, по оценке способами, раскрытыми в данном документе, или способами, известными специалисту в данной области. В определенных вариантах осуществления указанный способ снижает уровни ApoC3 и/или ApoB (например, ApoB48 и/или ApoB100) в крови у субъекта по меньшей мере в около 1,1 раза, в 1,2 раза, в 1,3 раза, в 1,4 раза, в 1,5 раза, в 2 раза, в 2,5 раза, в 3 раза, в 3,5 раза, в 4 раза, в 4,5 раза, в 5 раз, в 6 раз, в 7 раз, в 8 раз, в 9 раз, в 10 раз, в 15 раз, в 20 раз, в 30 раз, в 40 раз, в 50 раз, в 60 раз, в 70 раз, в 80 раз, в 90 раз или в 100 раз, по оценке способами, раскрытыми в данном документе, или способами, известными специалисту в данной области. В определенных вариантах осуществления снижение уровней ApoC3 и/или ApoB (например, ApoB48 и/или ApoB100) в крови у субъекта поддерживается в течение по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8., 9, 10, 15, 20, 25, 30, 35, 40, 45 или 50 дней или, по меньшей мере, 1, 2, 3, 4, 5, 6, 7 или 8 недель.
[00126] Антитела против ApoC3, раскрытые в данном описании, полезны для снижения уровней триглицеридов в крови субъекта. Соответственно, в определенных вариантах осуществления данное изобретение обеспечивает способ снижения уровней триглицеридов в крови субъекта, причем указанный способ включает введение субъекту эффективного количества антитела против ApoC3 или фармацевтической композиции, раскрытой в данном документе.
[00127] Антитела против ApoC3, раскрытые в данном описании, полезны для лечения гипертриглицеридемии. Соответственно, в определенных вариантах осуществления данное изобретение обеспечивает способ лечения гипертриглицеридемии у субъекта, включающий введение субъекту эффективного количества антитела против ApoC3 или фармацевтической композиции, раскрытой в данном документе. В определенных вариантах осуществления данное изобретение относится к способу лечения хиломикронемии у субъекта, включающему введение субъекту эффективного количества антитела против ApoC3 или фармацевтической композиции, раскрытой в данном документе. В определенных вариантах осуществления данное изобретение относится к способу лечения синдрома хиломикронемии у субъекта, включающему введение субъекту эффективного количества антитела против ApoC3 или фармацевтической композиции, раскрытой в данном документе.
[00128] Антитела против ApoC3, раскрытые в данном описании, полезны для лечения и профилактики постпрандиальной липемии у субъекта. Соответственно, в определенных вариантах осуществления данное изобретение обеспечивает способ ингибирования постпрандиальной липемии у субъекта, включающий введение субъекту эффективного количества антитела против ApoC3 или фармацевтической композиции, раскрытой в данном документе. Антитело против ApoC3 можно вводить субъекту до, во время или после приема пищи.
[00129] Не желая быть связанными теорией, заявители полагают, что в определенных вариантах осуществления указанные антитела, раскрытые в данном документе, способны снижать уровни постпрандиальных остатков хиломикрона или хиломикрона у субъекта при введении субъекту до, во время или после приема пищи. Соответственно, в определенных вариантах осуществления данное раскрытие обеспечивает способ снижения уровней постпрандиальных остатков хиломикрона или хиломикрона у субъекта, причем указанный способ включает введение субъекту эффективного количества антитела против ApoC3 или фармацевтической композиции, раскрытой в данном документе. Антитело против ApoC3 можно вводить субъекту до, во время или после приема пищи.
[00130] Снижение уровня триглицеридов в крови у пациентов с гипертриглицеридемией может снизить риск развития панкреатита. Соответственно, в определенных вариантах осуществления данное раскрытие обеспечивает способ снижения риска панкреатита у субъекта с гипертриглицеридемией, причем указанный способ включает введение субъекту эффективного количества антитела против ApoC3 или фармацевтической композиции, раскрытой в данном документе.
[00131] Антитела против ApoC3, раскрытые в данном описании, полезны для снижения риска сердечно-сосудистых заболеваний у субъекта. Соответственно, в определенных вариантах осуществления данное раскрытие обеспечивает способ снижения риска сердечно-сосудистых заболеваний у субъекта с гипертриглицеридемией, причем указанный способ включает введение субъекту эффективного количества антитела против ApoC3 или фармацевтической композиции, раскрытой в данном документе. Риск развития любого сердечно-сосудистого заболевания, связанного или вызванного гипертриглицеридемией или чрезмерной постпрандиальной липемией, может быть уменьшен путем введения антитела против ApoC3 или фармацевтической композиции, раскрытой в данном документе. Сердечно-сосудистые заболевания, для которых риск может быть уменьшен, включают без ограничения ишемическую болезнь сердца, атеросклероз, стенокардию, инфаркт миокарда и инсульт.
[00132] Антитела против ApoC3 или фармацевтические композиции, раскрытые в данном описании, можно вводить отдельно или в комбинации с дополнительным терапевтическим агентом. В определенных вариантах осуществления дополнительный терапевтический агент представляет собой другой липидоснижающий агент. Любой один или несколько гиполипидемических средств может быть использован в комбинации с анти-ApoC3-антителом или фармацевтической композицией, раскрытой в данном документе. Подходящие липидоснижающие агенты включают без ограничения ингибиторы HMG-CoA-редуктазы (например, аторвастатин, флувастатин, ловастатин, питавастатин, правастатин, розувастатин или симвастатин), фибраты, ниацин, секвестранты желчных кислот (например, холестирамин, колестипол, колесевилам) ингибиторы поглощения холестерина пищи (например, эзетимиб), ингибиторы микросомального белка-переносчика триглицеридов (MTP) (например, ломитапид), фитостерины, ингибиторы панкреатической липазы (например, орлистат), ингибиторы белка-переносчика холестеринового эфира, ингибиторы сквален-синтазы (например, TAK-475, зарагозовая (zaragozic) кислота и RPR 107393), ApoA-1 Milano, сукцинобукол (AGI-1067), ингибиторы апопротеина-B (например, мипомерсен) и ингибиторы пропротеин-конвертазы субтилизин/кексин типа 9 (PCSK9) (например, алирокумаб, эволокумаб и бокоцизумаб). В определенных вариантах осуществления дополнительный липидоснижающий агент представляет собой комбинацию эзетимиба и ингибитора HMG-CoA-редуктазы. В определенных вариантах осуществления данного изобретения липидоснижающий агент представляет собой комбинацию эзетимиба, ингибитора HMG-CoA-редуктазы и ингибитора PCSK9.
[00133] Описанные в данном документе антитела против ApoC3 или фармацевтические композиции могут быть доставлены субъекту различными путями. Они включают, но не ограничиваются ими, парентеральные, внутрикожные, внутримышечные, внутрибрюшинные, внутривенные и подкожные пути. В определенных вариантах осуществления, антитело или фармацевтическая композиция, описанные в данном документе, доставляется подкожно или внутривенно.
[00134] Количество анти-ApoC3-антитела или фармацевтической композиции, раскрытое в данном описании, которое будет эффективным при лечении или профилактике состояния, будет зависеть от природы заболевания и может быть определено эмпирически с помощью стандартных клинических методик. Точная доза, применяемая в композиции, также будет зависеть от пути введения и серьезности вызванной ею инфекции или заболевания, и ее следует выбирать в соответствии с мнением практикующего врача и обстоятельствами каждого субъекта. Например, эффективные дозы также могут варьироваться в зависимости от способа введения, целевого участка, физиологического состояния пациента (включая возраст, массу тела и состояние здоровья), от того, является ли пациент человеком или животным, других вводимых лекарств или от того, является ли лечение профилактическим или терапевтическим. Антитела против ApoC3 или фармацевтические композиции, описанные в данном документе, могут вводиться с любой частотой (например, примерно каждую неделю, каждые две недели, каждые три недели, каждые четыре недели, каждый месяц или каждые два месяца). Обычно пациентом является человек, но млекопитающие, не являющиеся человеком, включая трансгенных млекопитающих, также могут лечиться. Дозировки и схемы лечения оптимально подбираются для оптимизации безопасности и эффективности.
[00135] Анти-ApoC3 антитела, описанные в данном документе, могут быть также использованы для анализа ApoC3 (например, ApoC3 человека) уровни белка в биологическом образце с использованием классических иммуногистологических методов, известных специалистам в данной области техники, в том числе иммуноанализов, таких как иммуно-ферментный анализ (ИФА), иммунопреципитация или вестерн-блоттинг. Подходящие метки для анализа антител известны в данной области и включают ферментные метки, такие как глюкозооксидаза; радиоизотопы, такие как йод (125I, 121I), углерод (14C), сера (35S), тритий (3H), индий (121In) и технеций (99Tc); люминесцентные метки, такие как люминол; и флуоресцентные метки, такие как флуоресцеин и родамин, и биотин. Такие метки могут быть использованы для метки антитела, раскрытого в данном документе. Альтернативно, второе антитело, которое распознает антитело против ApoC3, раскрытое в данном документе, может быть помечено и использовано в сочетании с антителом против ApoC3 для определения уровней белка ApoC3 (например, ApoC3 человека).
[00136] Предполагается, что анализ уровня экспрессии белка ApoC3 (например, ApoC3 человека) включает качественное или количественное измерение или оценку уровня белка ApoC3 (например, ApoC3 человека) в первом биологическом образце либо напрямую (например, путем определения или оценки абсолютного уровня белка) или относительно (например, путем сравнения с уровнем белка, ассоциированным с заболеванием, во втором биологическом образце). Уровень экспрессии полипептида ApoC3 (например, ApoC3 человека) в первом биологическом образце можно измерить или оценить и сравнить со стандартным уровнем белка ApoC3 (например, ApoC3 человека), причем этот стандарт взят из второго биологического образца, полученного от индивидуума, не имеющего расстройство или определяется путем усреднения уровней от популяции людей, не имеющих расстройства. Как будет понятно в данной области техники, когда известен «стандартный» уровень полипептида ApoC3 (например, ApoC3 человека), его можно многократно использовать в качестве стандарта для сравнения.
[00137] Используемый в данном документе термин «биологический образец» относится к любому биологическому образцу, полученному от субъекта, клеточной линии, ткани или другого источника клеток, потенциально экспрессирующих ApoC3 (например, ApoC3 человека)». Способы получения биопсии тканей и биологических жидкостей у животных (например, людей) хорошо известны в данной области. Биологические образцы включают периферические мононуклеарные клетки крови.
[00138] Антитела против ApoC3, раскрытые в данном документе, могут быть использованы для прогностических, диагностических, мониторинговых и скрининговых применений, включая применения in vitro и in vivo, хорошо известные и стандартные для квалифицированного специалиста и основанные на данном описании. Прогностический, диагностический, мониторинг и скрининговые анализы и наборы для оценки in vitro и оценки состояния иммунной системы или иммунного ответа могут использоваться для прогнозирования, диагностики и мониторинга для оценки образцов пациентов, в том числе тех, о которых известно, что они подозреваются на наличие или имеют повышенную активность ApoC3. В одном варианте осуществления указанное антитело против ApoC3 можно использовать в иммуногистохимии образцов биопсии. В другом варианте осуществления указанное антитело против ApoC3 можно использовать для определения уровней ApoC3 (например, ApoC3 человека), которые затем могут быть связаны с определенными симптомами заболевания. Антитела против ApoC3, раскрытые в данном документе, могут иметь обнаруживаемую или функциональную метку. Когда используются флуоресцентные метки, доступная в настоящее время микроскопия и проточная цитометрия (FACS - fluorescence-activated cell sorter analysis) или комбинация обоих методов, известных в данной области техники, могут использоваться для идентификации и количественного определения специфических связывающих элементов. Антитела против ApoC3, раскрытые в данном документе, могут иметь флуоресцентную метку. Типичные флуоресцентные метки включают, например, реактивные и конъюгированные зонды, например, Aminocoumarin, Fluorescein и Texas red, красители Alexa Fluor, красители Cy и красители DyLight. Антитело против ApoC3 может нести радиоактивную метку, такую как изотопы 3H, 14C, 32P, 35S, 36Cl, 51Cr, 57Co, 58Co, 59Fe, 67Cu, 90Y, 99Tc, 111In, 117Lu, 121I, 124I, 125I, 131I, 198Au, 211At, 213Bi, 225Ac и 186Re. Когда используются радиоактивные метки, доступные в настоящее время процедуры подсчета, известные в данной области, могут использоваться для идентификации и количественного определения специфического связывания антитела против ApoC3 с ApoC3 (например, ApoC3 человека). В случае, когда метка представляет собой фермент, обнаружение может быть выполнено любым из используемых в настоящее время колориметрических, спектрофотометрических, флуороспектрофотометрических, амперометрических или газометрических методов, известных в данной области техники. Это может быть достигнуто путем контакта образца или контрольного образца с антителом против ApoC3 в условиях, которые позволяют образовать комплекс между антителом и ApoC3 (например, ApoC3 человека). Любые комплексы, образованные между антителом и ApoC3 (например, ApoC3 человека), выявляют и сравнивают в образце и контроле. Раскрытые в данном документе антитела также можно использовать для очистки ApoC3 (например, ApoC3 человека) посредством иммуноаффинной очистки. Также сюда включена система анализа, которая может быть приготовлена в форме набора для тестирования для количественного анализа степени присутствия, например, ApoC3 (например, ApoC3 человека). Система или набор для тестирования могут содержать меченый компонент, например меченое антитело ApoC3, и один или несколько дополнительных иммунохимических реагентов.
4. Фармацевтические композиции
[00139] В данном документе представлены фармацевтические композиции, содержащие антитело против ApoC3, раскрытое в данном документе, имеющее желаемую степень чистоты в физиологически приемлемом носителе, наполнителе или стабилизаторе (Remington's Pharmaceutical Sciences (1990) Mack Publishing Co., Истон, Пасадена). Приемлемые носители, наполнители или стабилизаторы являются нетоксичными для реципиентов при используемых дозировках и концентрациях и включают буферы, такие как фосфат, цитрат и другие органические кислоты; антиоксиданты, включая аскорбиновую кислоту и метионин; консерванты (такие как октадецилдиметилбензиламмонийхлорид; гексаметонийхлорид; бензалконийхлорид, бензетонийхлорид; фенол, бутил или бензиловый спирт; алкилпарабены, такие как метил или пропилпарабен; катехол; резорцинол; циклогексанол; 3-пентанол; и м-крезол); низкомолекулярные (менее чем около 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатообразующие агенты, такие как ЭДТА; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы металлов (например, комплексы Zn-белок); или неионные поверхностно-активные вещества, такие как TWEEN™, PLURONICS™ или полиэтиленгликоль (PEG).
[00140] В конкретном варианте осуществления фармацевтические композиции содержат антитело против ApoC3, раскрытое в данном документе, и, необязательно, один или несколько дополнительных профилактических или терапевтических агентов в фармацевтически приемлемом носителе. В конкретном варианте осуществления фармацевтические композиции содержат эффективное количество антитела, раскрытого в данном документе, и, необязательно, один или несколько дополнительных профилактических или терапевтических агентов в фармацевтически приемлемом носителе. В некоторых вариантах осуществления указанное антитело является единственным активным ингредиентом, включенным в фармацевтическую композицию. Раскрытые в данном документе фармацевтические композиции могут быть полезны для ингибирования активности ApoC3 и лечения состояния, такого как рак или инфекционное заболевание.
[00141] Фармацевтически приемлемые носители, используемые в парентеральных препаратах, включают водные носители, неводные носители, антимикробные агенты, изотонические агенты, буферы, антиоксиданты, местные анестетики, суспендирующие и диспергирующие агенты, эмульгирующие агенты, изолирующие или хелатирующие агенты и другие фармацевтически приемлемые вещества. Примеры водных носителей включают инъекцию хлорида натрия, инъекцию Рингера, инъекцию изотонической декстрозы, инъекцию стерильной воды, инъекцию декстрозы и лактата Рингера. Неводные парентеральные носители включают жирные масла растительного происхождения, хлопковое масло, кукурузное масло, кунжутное масло и арахисовое масло. Противомикробные агенты в бактериостатических или фунгистатических концентрациях могут быть добавлены к парентеральным препаратам, упакованным в контейнеры с множественными дозами, которые включают фенолы или крезолы, ртутные средства, бензиловый спирт, сложные эфиры хлорбутанола, метил и пропил п-гидроксибензойной кислоты, тимеросал, хлорид бензалкония и хлорид бензетония. Изотонические агенты включают хлорид натрия и декстрозу. Буферы включают фосфат и цитрат. Антиоксиданты включают бисульфат натрия. Местные анестетики включают прокаин гидрохлорид. Суспендирующие и диспергирующие агенты включают карбоксиметилцеллюлозу натрия, гидроксипропилметилцеллюлозу и поливинилпирролидон. Эмульгаторы включают полисорбат 80 (TWEEN®80). Секвестрирующий или хелатообразующий агент ионов металлов включает ЭДТА. Фармацевтические носители также включают этиловый спирт, полиэтиленгликоль и пропиленгликоль для смешивающихся с водой носителей; и гидроксид натрия, соляная кислота, лимонная кислота или молочная кислота для регулирования pH.
[00142] Фармацевтическая композиция может быть составлена для любого пути введения субъекту. Конкретные примеры путей введения включают интраназальный, оральный, легочный, трансдермальный, интрадермальный и парентеральный. Парентеральное введение, характеризуемое либо подкожной, внутримышечной или внутривенной инъекцией, также рассматривается в данном документе. Инъецируемые препараты могут быть приготовлены в обычных формах, либо в виде жидких растворов или суспензий, твердых форм, подходящих для раствора или суспензии в жидкости перед инъекцией, либо в виде эмульсий. Инъецируемые, растворы и эмульсии также содержат один или несколько наполнителей. Подходящими эксципиентами являются, например, вода, физиологический раствор, декстроза, глицерин или этанол. Кроме того, при желании фармацевтические композиции для введения могут также содержать незначительные количества нетоксичных вспомогательных веществ, таких как смачивающие или эмульгирующие агенты, рН-буферные агенты, стабилизаторы, усилители растворимости и другие такие агенты, как, например, натрий ацетат, сорбитанмонолаурат, триэтаноламин олеат и циклодекстрины.
[00143] Препараты для парентерального введения антитела включают стерильные растворы, готовые для инъекции, стерильные сухие растворимые продукты, такие как лиофилизированные порошки, готовые к объединению с растворителем непосредственно перед использованием, включая таблетки для подкожных инъекций, стерильные суспензии, готовые для инъекции, стерильные сухие нерастворимые продукты готовые к использованию вместе с транспортным средством непосредственно перед использованием и стерильные эмульсии. Растворы могут быть водными или неводными.
[00144] При внутривенном введении подходящие носители включают физиологический солевой раствор или физиологический раствор с фосфатным буфером (PBS) и растворы, содержащие загущающие и солюбилизирующие агенты, такие как глюкоза, полиэтиленгликоль и полипропиленгликоль, и их смеси.
[00145] Смеси для местного применения, содержащие антитело, готовят, как описано для местного и системного введения. Полученная смесь может представлять собой раствор, суспензию, эмульсию или тому подобное и может быть составлена в виде кремов, гелей, мазей, эмульсий, растворов, эликсиров, лосьонов, суспензий, настоек, паст, пен, аэрозолей, ирригационных средств, спреев, суппозиториев, повязок, кожных пластырей или любых других препаратов, подходящих для местного применения.
[00146] Описанное в данном документе антитело против ApoC3 может быть приготовлено в виде аэрозоля для местного применения, например, путем ингаляции (см., например, патенты США №№ 4044126, 4414209 и 4364923, в которых описаны аэрозоли для доставки стероида, полезного для лечения воспалительных заболеваний. особенно астмы). Эти составы для введения в дыхательные пути могут быть в форме аэрозоля или раствора для небулайзера или в виде мелкодисперсного порошка для инсуффляций, отдельно или в комбинации с инертным носителем, таким как лактоза. В таком случае частицы препарата в одном варианте имеют диаметр менее 50 микрон, в одном варианте - менее 10 микрон.
[00147] Описанное в данном документе антитело против ApoC3 может быть приготовлено для локального или местного применения, например, для местного применения на коже и слизистых оболочках, таких как в глазах, в форме гелей, кремов и лосьонов и для нанесения на глаза или для внутрицистернального или интраспинального применения. Местное введение предназначено для трансдермальной доставки, а также для введения в глаза или слизистую оболочку или для ингаляционной терапии. Также могут вводиться назальные растворы антитела отдельно или в комбинации с другими фармацевтически приемлемыми наполнителями.
[00148] Трансдермальные пластыри, включая ионофоретические и электрофоретические устройства, хорошо известные специалистам в данной области и могут быть использованы для введения антитела. Например, такие патчи раскрыты в патентах США 6267983, 6261595, 6256533, 6167301, 6024975, 6010715, 5985317, 5983134, 5948433 и 5860957.
[00149] В определенных вариантах осуществления фармацевтическая композиция, содержащая раскрытый в данном документе материал, представляет собой лиофилизированный порошок, который может быть восстановлен для введения в виде растворов, эмульсий и других смесей. Это может также быть восстановлено и сформулировано как твердые вещества или гели. Лиофилизированный порошок получают растворением антитела, раскрытого в данном документе, или его фармацевтически приемлемого производного в подходящем растворителе. В некоторых вариантах осуществления лиофилизированный порошок является стерильным. Растворитель может содержать наполнитель, который улучшает стабильность, или другой фармакологический компонент порошка или восстановленного раствора, приготовленного из порошка. Вспомогательные вещества, которые могут быть использованы, включают, но не ограничиваются ими, декстрозу, сорбит, фруктозу, кукурузный сироп, ксилит, глицерин, глюкозу, сахарозу или другой подходящий агент. Растворитель также может содержать буфер, такой как цитрат, фосфат натрия или калия, или другой такой буфер, известный специалистам в данной области техники, в одном варианте осуществления с приблизительно нейтральным pH. Последующая стерильная фильтрация раствора с последующей лиофилизацией в стандартных условиях, известных специалистам в данной области, дает желаемый состав. В одном варианте осуществления полученный раствор будет распределен во флаконы для лиофилизации. Каждый флакон будет содержать одну дозу или несколько доз соединения. Лиофилизированный порошок можно хранить в подходящих условиях, например при температуре от около 4°С до комнатной температуры. Восстановление этого лиофилизированного порошка водой для инъекций обеспечивает состав для применения при парентеральном введении. Для восстановления лиофилизированный порошок добавляют в стерильную воду или другой подходящий носитель. Точное количество зависит от выбранного соединения. Такое количество может быть определено опытным путем.
[00150] Антитела против ApoC3, раскрытые в данном документе, и другие композиции, представленные в данном документе, также могут быть составлены для нацеливания на конкретную ткань, рецептор или другую область тела субъекта, подлежащего лечению. Многие такие способы нацеливания хорошо известны специалистам в данной области. Все такие способы нацеливания рассматриваются в данном документе для применения в быстрорастворимых композициях. Для не ограничивающих примеров методов таргетинга, см, например, патент США № 6316652, 6274552, 6271359, 6253872, 6139865, 6131570, 6120751, 6071495, 6060082, 6048736, 6039975, 6004534, 5985307, 5972366, 5900252, 5840674, 5759542 и 5709874.
[00151] Композиции, используемые для введения in vivo, могут быть стерильными. Это легко достигается путем фильтрации через, например, стерильные фильтрующие мембраны.
5. Полинуклеотиды, векторы и способы получения антител против ApoC3
[00152] В другом аспекте в данном документе представлены полинуклеотиды, содержащие нуклеотидную последовательность, кодирующую антитело против ApoC3, раскрытое в данном документе (например, вариабельный участок легкой цепи или вариабельный участок тяжелой цепи), и векторы, например векторы, содержащие такие полинуклеотиды для рекомбинантной экспрессии в клетках-хозяевах (например, E. coli и клетках млекопитающих).
[00153] Используемый в данном документе термин «выделенный» полинуклеотид или молекула нуклеиновой кислоты представляет собой молекулу, которая отделена от других молекул нуклеиновой кислоты, которые присутствуют в природном источнике (например, у мыши или человека) молекулы нуклеиновой кислоты. Кроме того, «выделенная» молекула нуклеиновой кислоты, такая как молекула кДНК, может быть по существу свободной от другого клеточного материала или культуральной среды, если она произведена рекомбинантными методами, или, по существу, не содержать химических предшественников или других химических веществ, когда химически синтезирована. Например, выражение «по существу свободный от» включает препараты полинуклеотида или молекулы нуклеиновой кислоты, имеющие менее чем около 15%, 10%, 5%, 2%, 1%, 0,5% или 0,1% (в частности, менее чем около 10%) другого материала, например клеточного материала, культуральной среды, других молекул нуклеиновой кислоты, химических предшественников или других химических веществ. В конкретном варианте осуществления молекула(ы) нуклеиновой кислоты, кодирующая антитело, раскрытое в данном документе, выделяется или очищается.
[00154] В конкретных аспектах в данном документе представлены полинуклеотиды, содержащие нуклеотидные последовательности, кодирующие антитела, которые специфически связываются с полипептидом ApoC3 (например, ApoC3 человека) и содержат аминокислотную последовательность, как описано в данном документе, а также антитела, которые конкурируют с такими антителами за связывание с ApoC3 (например, ApoC3 человека) (например, в зависимости от дозы) или который связывается с тем же эпитопом, что и эпитоп таких антител.
[00155] В определенных аспектах в данном документе представлены полинуклеотиды, содержащие нуклеотидную последовательность, кодирующую легкую цепь или тяжелую цепь антитела, раскрытого в данном документе. Полинуклеотиды могут содержать нуклеотидные последовательности, кодирующие VH, VL или CDR антител, раскрытых в данном документе (см., например, Таблицы 1-4 в данном документе).
[00156] В данном документе также представлены полинуклеотиды, кодирующие антитело против ApoC3, которые оптимизируются, например, путем оптимизации кодонов/РНК, замены гетерологичными сигнальными последовательностями и удаления элементов нестабильности мРНК. Способы получения оптимизированных нуклеиновых кислот, кодирующих антитело против ApoC3 (например, легкую цепь, тяжелую цепь, домен VH или домен VL) для рекомбинантной экспрессии путем внесения изменений кодонов или устранения ингибирующих областей в мРНК, могут быть выполнены путем адаптации оптимизации способов, описанных, например, в патентах США № 5965726; 6174666; 6291664; 6414132; и 6794498 соответственно. Например, потенциальные сайты сплайсинга и элементы нестабильности (например, богатые A/T или A/U элементы) в РНК могут быть мутированы без изменения аминокислот, кодируемых последовательностями нуклеиновых кислот, для повышения стабильности РНК для рекомбинантной экспрессии. Изменения используют вырожденность генетического кода, например, использование альтернативного кодона для идентичной аминокислоты. В некоторых вариантах осуществления может быть желательно изменить один или несколько кодонов для кодирования консервативной мутации, например, аналогичной аминокислоты с аналогичной химической структурой и свойствами или функцией как исходной аминокислоты. Такие способы могут увеличить экспрессию анти-ApoC3 по меньшей мере в 1, 2, 3, 4, 5, 10, 20, 30, 40 раз, 50 раз, 60 раз, 70 раз, 80 раз, 90 раз или 100 раз или более относительно экспрессии антитела против ApoC3, кодируемого полинуклеотидами, которые не были оптимизированы.
[00157] В определенных вариантах осуществления оптимизированная полинуклеотидная последовательность, кодирующая антитело против ApoC3, раскрытое в данном документе (например, домен VL или домен VH), может гибридизоваться с антисмысловым (например, комплементарным) полинуклеотидом неоптимизированной полинуклеотидной последовательности, кодирующей антитело против ApoC3, раскрытое в данном документе (например, домен VL или домен VH). В конкретных вариантах осуществления оптимизированная нуклеотидная последовательность, кодирующая антитело против ApoC3, раскрытое в данном документе, или его фрагмент, гибридизуется в условиях высокой жесткости с антисмысловым полинуклеотидом неоптимизированной полинуклеотидной последовательности, кодирующей антитело против ApoC3, раскрытое в данном документе. В конкретном варианте осуществления оптимизированная нуклеотидная последовательность, кодирующая антитело против ApoC3, раскрытое в данном документе, гибридизуется в условиях гибридизации высокой жесткости, промежуточной или более низкой жесткости с антисмысловым полинуклеотидом неоптимизированной нуклеотидной последовательности, кодирующей антитело против ApoC3, раскрытое в данном документе. Информация, касающаяся условий гибридизации, была описана, см., например, публикацию патентной заявки США № US 2005/0048549 (например, параграфы 72-73), которая включена в данный документ посредством ссылки.
[00158] Полинуклеотиды могут быть получены, и нуклеотидная последовательность полинуклеотидов может быть определена любым способом, известным в данной области. Нуклеотидные последовательности, кодирующие антитела, раскрытые в данном документе, например, антитела, описанные в Таблице 1, и модифицированные версии этих антител могут быть определены с использованием методов, хорошо известных в данной области техники, то есть нуклеотидные кодоны, которые, как известно, кодируют конкретные аминокислоты, собираются таким образом, чтобы генерировать нуклеиновую кислоту, которая кодирует антитело. Такой полинуклеотид, кодирующий антитело, может быть собран из химически синтезированных олигонуклеотидов (например, как описано в Kutmeier G et al., (1994), BioTechniques 17: 242-6), что, вкратце, включает синтез перекрывающихся олигонуклеотидов, содержащих части последовательности, кодирующей антитело, отжиг и лигирование этих олигонуклеотидов, а затем амплификацию лигированных олигонуклеотидов с помощью ПЦР.
[00159] Альтернативно, полинуклеотид, кодирующий антитело, раскрытое в данном документе, может быть получен из нуклеиновой кислоты из подходящего источника (например, гибридомы) с использованием способов, хорошо известных в данной области (например, ПЦР и другие методы молекулярного клонирования). Например, амплификация ПЦР с использованием синтетических праймеров, гибридизующихся с 3' и 5' концами известной последовательности, может быть выполнена с использованием геномной ДНК, полученной из клеток гибридомы, продуцирующих интересующее антитело. Такие методы амплификации ПЦР можно использовать для получения нуклеиновых кислот, содержащих последовательность, кодирующую легкую цепь или тяжелую цепь антитела. Такие способы ПЦР-амплификации можно использовать для получения нуклеиновых кислот, содержащих последовательность, кодирующую вариабельный участок легкой цепи или вариабельный участок тяжелой цепи антитела. Амплифицированные нуклеиновые кислоты могут быть клонированы в векторы для экспрессии в клетках-хозяевах и для дальнейшего клонирования, например, для генерирования химерных и гуманизированных антител.
[00160] Если клон, содержащий нуклеиновую кислоту, кодирующую конкретное антитело, недоступен, но последовательность молекулы антитела известна, нуклеиновую кислоту, кодирующую иммуноглобулин, можно химически синтезировать или получить из подходящего источника (например, библиотеки кДНК антитела или библиотека кДНК, созданной из нуклеиновых кислот или, предпочтительно, полиА+РНК, выделенной из любой ткани или клеток, экспрессирующих антитело, таких как клетки гибридомы, отобранные для экспрессии антитела, раскрытого в данном документе), путем амплификации ПЦР с использованием синтетических праймеров, гибридизующихся с 3' и 5' концов последовательности или путем клонирования с использованием олигонуклеотидного зонда, специфичного для конкретной последовательности гена, для идентификации, например, клона кДНК из библиотеки кДНК, которая кодирует антитело. Амплифицированные нуклеиновые кислоты, полученные с помощью ПЦР, могут быть затем клонированы в реплицируемые клонирующие векторы с использованием любого метода, хорошо известного в данной области.
[00161] ДНК, кодирующая анти-ApoC3 (например, ApoC3 человека) антитела, раскрытые в данном документе, может быть легко выделена и сиквенирована с использованием обычных процедур (например, с использованием олигонуклеотидных зондов, которые способны специфически связываться с генами, кодирующими тяжелые и легкие цепи анти-ApoC3 (например, ApoC3 человека) антитела). Клетки гибридомы могут служить источником такой ДНК. После выделения ДНК может быть помещена в экспрессирующие векторы, которые затем трансфицируются в клетки-хозяева, такие как клетки E. coli, клетки обезьян COS, клетки яичника китайского хомяка (CHO) (например, клетки CHO из системы CHO GS ™ (Lonza))) или клетки миеломы, которые иначе не продуцируют белок иммуноглобулина, для получения синтеза антител против ApoC3 (например, ApoC3 человека) в рекомбинантных клетках-хозяевах.
[00162] Для генерации целых антител можно использовать праймеры ПЦР, включающие нуклеотидные последовательности VH или VL, сайт рестрикции и фланкирующую последовательность для защиты сайта рестрикции, для амплификации последовательностей VH или VL в клонах scFv. Используя методы клонирования, известные специалистам в данной области, амплифицированные с помощью ПЦР домены VH могут быть клонированы в векторы, экспрессирующие константный участок тяжелой цепи, например константный участок гамма-4 человека, и амплифицированные с помощью ПЦР домены VL могут быть клонированы в векторы, экспрессирующие константный участок легкой цепи, например константные участки каппа или лямбда человека. В определенных вариантах осуществления векторы для экспрессии доменов VH или VL содержат промотор EF-1α, сигнал секреции, сайт клонирования для вариабельного участка, константные домены и маркер селекции, такой как неомицин. Домены VH и VL также могут быть клонированы в один вектор, экспрессирующий необходимые константные участки. Затем векторы превращения тяжелой цепи и векторы превращения легкой цепи совместно трансфицируют в клеточные линии, чтобы генерировать стабильные или временные клеточные линии, которые экспрессируют антитела полной длины, например, IgG, с использованием методов, известных специалистам в данной области.
[00163] ДНК также может быть модифицирована, например, путем замены кодирующей последовательности для константных доменов тяжелой и легкой цепи человека вместо мышиных последовательностей или путем ковалентного присоединения к кодирующей последовательности иммуноглобулина всей или части кодирующей последовательности полипептида не иммуноглобулина.
[00164] Также предоставлены полинуклеотиды, которые гибридизуются в условиях гибридизации высокой жесткости, средней или низкой жесткости с полинуклеотидами, которые кодируют антитело, раскрытое в данном документе. В конкретных вариантах осуществления полинуклеотиды, раскрытые в данном документе, гибридизуются в условиях гибридизации высокой жесткости, промежуточной или более низкой жесткости с полинуклеотидами, кодирующими домен VH или домен VL, предоставленные в данном документе.
[00165] Условия гибридизации были описаны в данной области техники и известны специалисту в данной области. Например, гибридизация в строгих условиях может включать гибридизацию с ДНК, связанной с фильтром, в 6× хлориде натрия/цитрате натрия (SSC) при температуре около 45°C с последующей одной или несколькими промывками в 0,2×SSC/0,1% SDS при температуре около 50-65°C; гибридизация в очень жестких условиях может включать гибридизацию с нуклеиновой кислотой, связанной с фильтром, в 6×SSC при температуре около 45°C с последующей одной или несколькими промывками в 0,1×SSC/0,2% SDS при температуре около 68°C. Гибридизация в других жестких условиях гибридизации известна специалистам в данной области техники и были описаны, см., например, Ausubel FM et al., eds., (1989) Current Protocols in Molecular Biology, Vol. I, Green Publishing Associates, Inc. и John Wiley & Sons, Inc., New York на страницах 6.3.1-6.3.6 и 2.10.3.
[00166] В определенных аспектах в данном документе представлены клетки (например, клетки-хозяева), экспрессирующие (например, рекомбинантные) антитела, раскрытые в данном документе, которые специфически связываются с ApoC3 (например, ApoC3 человека) и родственными полинуклеотидами и векторами экспрессии. В данном документе представлены векторы (например, векторы экспрессии), содержащие полинуклеотиды, содержащие нуклеотидные последовательности, кодирующие антитела против ApoC3 (например, ApoC3 человека), или фрагмент для рекомбинантной экспрессии в клетках-хозяевах, предпочтительно в клетках млекопитающих. В данном документе также представлены клетки-хозяева, содержащие такие векторы для рекомбинантной экспрессии антител против ApoC3 (например, ApoC3 человека), раскрытых в данном документе (например, человеческого или гуманизированного антитела). В конкретном аспекте в данном документе представлены способы получения антитела, раскрытого в данном документе, включающие экспрессию такого антитела из клетки-хозяина.
[00167] Раскрытая в данном документе рекомбинантная экспрессия антитела (например, полноразмерного антитела, тяжелой или легкой цепи антитела или одноцепочечного антитела, раскрытого в данном документе), которое специфически связывается с ApoC3 (например, ApoC3 человека), включает конструирование вектора экспрессии, содержащего полинуклеотид, который кодирует антитело. Как только полинуклеотид, кодирующий молекулу антитела, тяжелую или легкую цепь антитела (например, вариабельные области тяжелой или легкой цепи), раскрытый в данном документе, получен, вектор для получения молекулы антитела может быть получен с помощью технологии рекомбинантной ДНК с использованием методик хорошо известных в данной области техники. Таким образом, в данном документе описаны способы получения белка путем экспрессии полинуклеотида, содержащего антитело или фрагмент антитела (например, легкую цепь или тяжелую цепь), кодирующий нуклеотидную последовательность. Методы, которые хорошо известны специалистам в данной области, могут быть использованы для конструирования экспрессионных векторов, содержащих последовательности, кодирующие антитело или фрагмент антитела (например, легкую цепь или тяжелую цепь), и соответствующие сигналы контроля транскрипции и трансляции. Эти способы включают, например, методы рекомбинантной ДНК in vitro, методы синтеза и генетическую рекомбинацию in vivo. Также предоставлены реплицируемые векторы, содержащие нуклеотидную последовательность, кодирующую молекулу антитела, описанную в данном документе, тяжелую или легкую цепь антитела, вариабельный участок тяжелой или легкой цепи антитела или CDR тяжелой или легкой цепи, функционально связанные с промотором. Такие векторы могут, например, содержать нуклеотидную последовательность, кодирующую константный участок молекулы антитела (см., например, международные публикации №№ WO 86/05807 и WO 89/01036; и патент США № 5122464) и вариабельные области указанного антитела могут быть клонированы в такой вектор для экспрессии целой тяжелой цепи, целой легкой цепи или как целой тяжелой, так и целой легкой цепи.
[00168] Вектор экспрессии может быть перенесен в клетку (например, клетку-хозяина) обычными методами, и полученные клетки затем могут быть культивированы традиционными методами для получения антитела, раскрытого в данном документе. Таким образом, в данном документе представлены клетки-хозяева, содержащие полинуклеотид, кодирующий антитело, раскрытое в данном документе, или его тяжелую или легкую цепь, или его фрагмент, или одноцепочечное антитело, раскрытое в данном документе, функционально связанные с промотором для экспрессии таких последовательностей в клетке-хозяине. В определенных вариантах осуществления для экспрессии антител с двойной цепью векторы, кодирующие как тяжелую, так и легкую цепи, по отдельности, могут совместно экспрессироваться в клетке-хозяине для экспрессии всей молекулы иммуноглобулина, как подробно описано ниже. В определенных вариантах осуществления клетка-хозяин содержит вектор, содержащий полинуклеотид, кодирующий как тяжелую цепь, так и легкую цепь антитела, раскрытого в данном документе. В конкретных вариантах осуществления клетка-хозяин содержит два разных вектора, первый вектор, содержащий полинуклеотид, кодирующий вариабельный участок тяжелой цепи или тяжелой цепи антитела, раскрытого в данном документе, или его фрагмент, и второй вектор, содержащий полинуклеотид, кодирующий легкую цепь или вариабельный участок легкой цепи антитела, раскрытого в данном документе, или его фрагмент. В других вариантах осуществления первая клетка-хозяин содержит первый вектор, содержащий полинуклеотид, кодирующий вариабельный участок тяжелой цепи или тяжелой цепи антитела, раскрытого в данном документе, или его фрагмент, и вторая клетка-хозяин содержит второй вектор, содержащий полинуклеотид, кодирующий вариабельный участок легкой цепи или легкую цепь антитела, раскрытого в данном документе. В конкретных вариантах осуществления вариабельный участок тяжелой цепи/тяжелая цепь, экспрессируемая первой клеткой, ассоциируется с вариабельной областью легкой цепи/легкой цепью второй клетки, с образованием антитела против ApoC3, раскрытого в данном документе. В определенных вариантах осуществления в данном документе представлена популяция клеток-хозяев, содержащая такую первую клетку-хозяин и такую вторую клетку-хозяин.
[00169] В конкретном варианте осуществления в данном документе представлена популяция векторов, включающая первый вектор, содержащий полинуклеотид, кодирующий вариабельный участок легкой цепи/легкую цепь анти-ApoC3-антитела, раскрытого в данном документе, и второй вектор, содержащий полинуклеотид, кодирующий тяжелую цепь/вариабельный участок тяжелой цепи антитела против ApoC3, раскрытого в данном документе.
[00170] Для экспрессии молекул антител, описанных в данном документе, можно использовать множество векторных систем экспрессии хозяина (см., например, патент США № 5807155). Такие системы экспрессии хозяина представляют собой носители, с помощью которых интересующие кодирующие последовательности могут быть получены и впоследствии очищены, но также представляют собой клетки, которые при трансформации или трансфекции соответствующими нуклеотидными кодирующими последовательностями могут экспрессировать молекулу антитела, раскрытую в данном документе in situ. Они включают, но не ограничиваются ими, микроорганизмы, такие как бактерии (например, E.coli и B. subtilis), трансформированные рекомбинантными ДНК бактериофагов, плазмидными ДНК или векторами экспрессии космидной ДНК, содержащими кодирующие последовательности антител; дрожжи (например, Saccharomyces Pichia), трансформированные рекомбинантными дрожжевыми экспрессирующими векторами, содержащими кодирующие последовательности антител; системы клеток насекомых, инфицированные векторами экспрессии рекомбинантного вируса (например, бакуловируса), содержащие кодирующие последовательности антител; системы растительных клеток (например, зеленые водоросли, такие как Chlamydomonas reinhardtii), инфицированные векторами экспрессии рекомбинантного вируса (например, вирусом мозаики цветной капусты, CaMV; вирусом мозаики табака, TMV) или трансформированные векторами экспрессии рекомбинантной плазмиды (например, плазмиды Ti), содержащие кодирующие антитела последовательности; или клеточные системы млекопитающих (например, COS (например, COS1 или COS), CHO, BHK, MDCK, HEK 293, NS0, PER.C6, VERO, CRL7O3O, HsS78Bst, HeLa и NIH 3T3, HEK-293T, HepG2, SP210 Клетки R1.1, BW, LM, BSC1, BSC40, YB/20 и BMT10), несущие рекомбинантные экспрессирующие конструкции, содержащие промоторы, полученные из генома клеток млекопитающих (например, промотор металлотионеина) или вирусы млекопитающих (например, поздний промотор аденовируса; промотор вируса коровьей оспы 7.5К). В конкретном варианте осуществления данного изобретения клетки для экспрессии антител, раскрытые в данном документе, представляют собой клетки CHO, например клетки CHO из системы CHO GS™ (Lonza). В конкретном варианте осуществления данного изобретения клетки для экспрессии антител, раскрытые в данном документе, представляют собой клетки человека, например линии клеток человека. В конкретном варианте осуществления вектор экспрессии млекопитающего представляет собой pOptiVEC™ или pcDNA3.3. В конкретном варианте осуществления бактериальные клетки, такие как Escherichia coli, или эукариотические клетки (например, клетки млекопитающих), особенно для экспрессии молекулы целого рекомбинантного антитела, используют для экспрессии молекулы рекомбинантного антитела. Например, клетки млекопитающих, такие как клетки яичника китайского хомячка (СНО), в сочетании с вектором, таким как основной промежуточный ранний промоторный элемент гена из цитомегаловируса человека, является эффективной системой экспрессии антител (Foecking MK & Hofstetter H (1986) Gene 45): 101-5 и Cockett MI et al., (1990) Biotechnology 8 (7): 662-7). В определенных вариантах осуществления указанные антитела, раскрытые в данном документе, продуцируются клетками СНО или клетками NS0. В конкретном варианте осуществления экспрессия раскрытых в данном документе нуклеотидных последовательностей, кодирующих антитела, которые специфически связывают ApoC3 (например, ApoC3 человека), регулируется конститутивным промотором, индуцибельным промотором или тканеспецифичным промотором.
[00171] В бактериальных системах ряд векторов экспрессии может быть преимущественно выбран в зависимости от применения, предназначенного для экспрессируемой молекулы антитела. Например, когда должно быть произведено большое количество такого антитела, для создания фармацевтических композиций молекулы антитела могут быть желательны векторы, которые обеспечивают экспрессию высоких уровней продуктов слитого белка, которые легко очищаются. Такие векторы включают, но не ограничиваются ими, вектор экспрессии E.coli pUR278 (Ruether U & Mueller-Hill B (1983) EMBO J 2: 1791-1794), в котором кодирующая последовательность антитела может быть лигирована индивидуально в вектор в рамке с кодирующей областью lac Z, так что образуется слитый белок; векторы pIN (Inouye S & Inouye M (1985) Nuc Acids Res 13: 3101-3109; Van Heeke G & Schuster SM (1989) J Biol Chem 24: 5503-5509); и тому подобное. Например, векторы pGEX также можно использовать для экспрессии чужеродных полипептидов в виде белков слияния с глутатион-5-трансферазой (GST). Как правило, такие слитые белки растворимы и могут быть легко очищены от лизированных клеток путем адсорбции и связывания с матриксными гранулами глутатион-агарозы с последующим элюированием в присутствии свободного глутатиона. Векторы pGEX конструируют так, чтобы они содержали сайты расщепления протеазой тромбина или фактора Ха, чтобы клонированный продукт гена-мишени мог высвобождаться из фрагмента GST.
[00172] В системе насекомых, например, вирус ядерного полиэдроза Autographa californica (AcNPV) может использоваться в качестве вектора для экспрессии чужеродных генов. Вирус растет в клетках Spodoptera frugiperda. Кодирующая последовательность антитела может быть индивидуально клонирована в несущественные области (например, ген полиэдрина) вируса и помещена под контроль промотора AcNPV (например, промотора полиэдрина).
[00173] В клетках-хозяевах млекопитающих может быть использован ряд вирусных систем экспрессии. В случаях, когда аденовирус используется в качестве вектора экспрессии, представляющая интерес кодирующая последовательность антитела может быть лигирована с комплексом контроля транскрипции/трансляции аденовируса, например поздней промоторной и трехсторонней лидерной последовательностью. Этот химерный ген затем может быть вставлен в геном аденовируса путем рекомбинации in vitro или in vivo. Вставка в несущественную область вирусного генома (например, область E1 или E3) приведет к получению рекомбинантного вируса, который является жизнеспособным и способен экспрессировать молекулу антитела в инфицированных хозяевах (например, см. Logan J & Shenk T (1984). PNAS 81 (12): 3655-9). Специфические сигналы инициации также могут потребоваться для эффективной трансляции кодирующих последовательностей встроенных антител. Эти сигналы включают инициирующий кодон ATG и смежные последовательности. Кроме того, инициирующий кодон должен находиться в фазе с рамкой считывания желаемой кодирующей последовательности, чтобы обеспечить трансляцию всей вставки. Эти экзогенные трансляционные контрольные сигналы и инициирующие кодоны могут иметь различное происхождение, как естественное, так и синтетическое. Эффективность экспрессии может быть повышена путем включения соответствующих элементов энхансера транскрипции, терминаторов транскрипции и т.д. (см., например, Bitter G et al., (1987) Methods Enzymol. 153: 516-544).
[00174] Кроме того, может быть выбрана линия клетки-хозяина, которая модулирует экспрессию вставленных последовательностей или модифицирует и обрабатывает продукт гена определенным желаемым образом. Такие модификации (например, гликозилирование) и процессинг (например, расщепление) белковых продуктов могут быть важными для функции белка. Различные клетки-хозяева имеют характерные и специфические механизмы для посттрансляционного процессинга и модификации белков и генных продуктов. Подходящие клеточные линии или системы-хозяева могут быть выбраны для обеспечения правильной модификации и процессинга экспрессированного чужеродного белка. С этой целью могут быть использованы эукариотические клетки-хозяева, которые обладают клеточным механизмом для правильной обработки первичного транскрипта, гликозилирования и фосфорилирования генного продукта. Такие клетки-хозяева млекопитающих включают, но не ограничиваются ими, CHO, VERO, BHK, Hela, MDCK, HEK 293, NIH 3T3, W138, BT483, Hs578T, HTB2, BT2O и T47D, NS0 (клеточная линия мышиной миеломы, которая не эндогенно продуцирует любые цепи иммуноглобулина), CRL7O3O, COS (например, COS1 или COS), PER.C6, VERO, HsS78Bst, HEK-293T, HepG2, SP210, R1.1, BW, LM, BSC1, BSC40, YB/20, BMT10 и HsS78Bst клетки. В определенных вариантах осуществления анти-ApoC3 (например, ApoC3 человека) антитела, раскрытые в данном документе, продуцируются в клетках млекопитающих, таких как клетки CHO.
[00175] В конкретном варианте осуществления указанные антитела, раскрытые в данном документе, имеют пониженное содержание фукозы или отсутствие содержания фукозы. Такие антитела могут быть получены с использованием методик, известных специалисту в данной области. Например, антитела могут быть экспрессированы в клетках, дефицитных или не обладающих способностью фукозилировать. В конкретном примере клеточные линии с нокаутом обоих аллелей α1,6-фукозилтрансферазы можно использовать для получения антител с пониженным содержанием фукозы. Система Potelligent® (Lonza) является примером такой системы, которую можно использовать для получения антител с пониженным содержанием фукозы.
[00176] Для длительного получения рекомбинантных белков с высоким выходом могут быть получены стабильно экспрессирующие клетки. Например, могут быть сконструированы клеточные линии, которые стабильно экспрессируют антитело против ApoC3, раскрытое в данном документе. В конкретных вариантах осуществления клетка, представленная в данном документе, стабильно экспрессирует вариабельный участок легкой цепи/легкую цепь и вариабельный участок тяжелой цепи/тяжелую цепь, которые связываются с образованием антитела, раскрытого в данном документе.
[00177] В определенных аспектах вместо применения векторов экспрессии, которые содержат вирусные точки инициации репликации, клетки-хозяева могут трансформироваться ДНК, контролируемой соответствующими элементами контроля экспрессии (например, промоторными, энхансерными последовательностями, терминаторами транскрипции, сайтами полиаденилирования и т.д.) пригодным для селекции маркером. После введения чужеродной ДНК/полинуклеотида сконструированные клетки могут расти в течение 1-2 дней в обогащенной среде, а затем переключаются на селективную среду. Пригодный для селекции маркер в рекомбинантной плазмиде придает устойчивость к селекции и позволяет клеткам стабильно интегрировать плазмиду в свои хромосомы и расти, образуя очаги, которые, в свою очередь, могут быть клонированы и размножены в клеточные линии. Этот способ может преимущественно использоваться для конструирования клеточных линий, которые экспрессируют антитело против ApoC3, раскрытое в данном документе. Такие сконструированные клеточные линии могут быть особенно полезны при скрининге и оценке композиций, которые прямо или косвенно взаимодействуют с молекулой антитела.
[00178] Можно использовать ряд систем отбора, включая, но не ограничиваясь этим, тимидинкиназу вируса простого герпеса (Wigler M et al., (1977) Cell 11 (1): 223-32), гипоксантингуанинфосфорибозилтрансферазу (Szybalska EH & Szybalski W (1962) PNAS 48 (12): 2026-2034) и гены аденинфосфорибозилтрансферазы (Lowy I et al., (1980) Cell 22 (3): 817-23) в tk-, hgprt- или aprt-клетках соответственно. Кроме того, устойчивость к антиметаболитам может быть использована в качестве основы для отбора следующих генов: dhfr, который придает устойчивость к метотрексату (Wigler M et al., (1980) PNAS 77 (6): 3567-70; O'Hare K et al. (1981) PNAS 78: 1527-31); gpt, который придает устойчивость к микофенольной кислоте (Mulligan RC & Berg P (1981) PNAS 78 (4): 2072-6); neo, который придает устойчивость к аминогликозиду G-418 (Wu GY & Wu CH (1991) Biotherapy 3: 87-95; Tolstoshev P (1993) Ann Rev Pharmacol Toxicol 32: 573-596; Mulligan RC (1993) Science 260: 926-932 и Morgan RA & Anderson WF (1993) Ann Rev Biochem 62: 191-217; Nabel GJ & Felgner PL (1993) Trends Biotechnol 11 (5): 211-5); и hygro, который придает устойчивость к гигромицину (Santerre RF et al., (1984) Gene 30 (1-3): 147-56). Методы, общеизвестные в области технологии рекомбинантных ДНК, могут обычно применяться для выбора желаемого рекомбинантного клона, и такие методы описаны, например, в Ausubel FM et al., (eds.), Current Protocols in Molecular Biology, John Wiley & Sons, NY (1993); Kriegler M, Gene Transfer and Expression, A Laboratory Manual, Stockton Press, NY (1990); и в Разделах 12 и 13, Dracopoli NC et al., (eds.), Current Protocols in Human Genetics, John Wiley & Sons, NY (1994); Colbère-Garapin F et al., (1981) J Mol Biol 150: 1-14, которые полностью включены в данное описание посредством ссылки.
[00179] Уровни экспрессии молекулы антитела могут быть увеличены посредством векторной амплификации (для обзора см. Bebbington CR & Hentschel CCG, The use of vectors based on gene amplification for the expression of cloned genes in mammalian cells in DNA cloning, Vol. 3 (Academic Press, New York, 1987)). Когда маркер в векторной системе, экспрессирующей антитело, является амплифицируемым, увеличение уровня ингибитора, присутствующего в культуре клетки-хозяина, приведет к увеличению количества копий маркерного гена. Поскольку амплифицированная область связана с геном антитела, продукция антитела также будет увеличиваться (Crouse GF et al., (1983) Mol Cell Biol 3: 257-66).
[00180] Клетка-хозяин может быть совместно трансфицирована двумя или более векторами экспрессии, описанными в данном документе, первый вектор, кодирующий полипептид, полученный из тяжелой цепи, и второй вектор, кодирующий полипептид, полученный из легкой цепи. Два вектора могут содержать идентичные пригодные для селекции маркеры, которые обеспечивают равную экспрессию полипептидов тяжелой и легкой цепи. Клетки-хозяева можно совместно трансфицировать различными количествами двух или более векторов экспрессии. Например, клетки-хозяева могут быть трансфицированы любым из следующих соотношений первого вектора экспрессии и второго вектора экспрессии: 1:1, 1:2, 1:3, 1:4, 1:5, 1:6, 1:7, 1:8, 1:9, 1:10, 1:12, 1:15, 1:20, 1:25, 1:30, 1:35, 1:40, 1:45 или 1:50.
[00181] Альтернативно, можно использовать один вектор, который кодирует и способен экспрессировать полипептиды как тяжелой, так и легкой цепи. В таких ситуациях легкую цепь следует поместить перед тяжелой цепью, чтобы избежать избытка свободной от токсинов тяжелой цепи (Proudfoot NJ (1986) Nature 322: 562-565; и Köhler G (1980) PNAS 77: 2197-2199). Кодирующие последовательности для тяжелых и легких цепей могут включать кДНК или геномную ДНК. Вектор экспрессии может быть моноцистронным или мультицистронным. Мультицистронная конструкция нуклеиновой кислоты может кодировать 2, 3, 4, 5, 6, 7, 8, 9, 10 или более, или в диапазоне 2-5, 5-10 или 10-20 генов/нуклеотидных последовательностей. Например, бицистронная конструкция нуклеиновой кислоты может содержать в следующем порядке промотор, первый ген (например, тяжелую цепь антитела, раскрытого в данном документе) и второй ген и (например, легкую цепь антитела, раскрытого в данном документе). В таком экспрессионном векторе транскрипция обоих генов может управляться промотором, тогда как трансляция мРНК из первого гена может осуществляться с помощью зависимого от кэпа механизма сканирования, а трансляция мРНК со второго гена может быть по механизму, независимому от кэпа, например, IRES.
[00182] Как только молекула антитела, раскрытая в данном документе, получена рекомбинантной экспрессией, она может быть очищена любым способом, известным в данной области, для очистки молекулы иммуноглобулина, например, хроматографией (например, ионобменной, аффинной, в частности, по аффинности к специфическому антигену после белка А, и эксклюзионная хроматография), центрифугирование, дифференциальная растворимость или любой другой стандартный метод очистки белков. Кроме того, антитела, раскрытые в данном документе, могут быть слиты с гетерологичными полипептидными последовательностями, раскрытыми в данном документе, или другими способами, известными в данной области, для облегчения очистки.
[00183] В конкретных вариантах осуществления указанное антитело, раскрытое в данном документе, является выделенным или очищенным. Обычно изолированное антитело представляет собой антитело, которое по существу не содержит других антител с антигенной специфичностью, отличных от выделенного антитела. Например, в конкретном варианте осуществления препарат антитела, раскрытый в данном документе, по существу не содержит клеточного материала или химических предшественников. Формулировка «по существу не содержит клеточного материала» включает препараты антитела, в которых антитело отделено от клеточных компонентов клеток, из которых оно выделено или рекомбинантно продуцировано. Таким образом, антитело, которое по существу не содержит клеточного материала, включает препараты антитела, имеющие менее чем около 30%, 20%, 10%, 5%, 2%, 1%, 0,5% или 0,1% (по сухой массе) гетерологичного белка (также называемого в данном документе «загрязняющим белком») или варианты антитела, например, различные посттрансляционные модифицированные формы антитела или другие разные варианты антитела (например, фрагменты антитела). Когда антитело получают рекомбинантным способом, оно также обычно практически не содержит культуральной среды, то есть культуральная среда составляет менее чем около 20%, 10%, 2%, 1%, 0,5% или 0,1% от объема белкового препарата. Когда антитело получают химическим синтезом, оно, как правило, по существу не содержит химических предшественников или других химических веществ, то есть его отделяют от химических предшественников или других химических веществ, которые участвуют в синтезе белка. Соответственно, такие препараты антитела содержат менее чем приблизительно 30%, 20%, 10% или 5% (по сухой массе) химических предшественников или соединений, отличных от представляющего интерес антитела. В конкретном варианте осуществления указанные антитела, раскрытые в данном документе, являются выделенными или очищенными.
[00184] Антитела, которые специфически связываются с ApoC3 (например, ApoC3 человека), могут быть получены любым известным в данной области способом синтеза антител, например химическим синтезом или методами рекомбинантной экспрессии. Способы, раскрытые в данном документе, используют, если не указаны иные, традиционные методики в области молекулярной биологии, микробиологии, генетического анализа, рекомбинантных ДНК, органической химии, биохимии, ПЦР, синтеза и модификации олигонуклеотидов, гибридизации нуклеиновых кислот, и связанных с ними областей в пределах данной области. Эти методики описаны, например, в ссылках, цитируемых в данном документе, и полностью объяснены в литературе. См., например, Maniatis T et al., (1982) Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press; Sambrook J et al., (1989), Molecular Cloning: A Laboratory Manual, Second Edition, Cold Spring Harbor Laboratory Press; Sambrook J et al., (2001) Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY; Ausubel FM et al., Current Protocols in Molecular Biology, John Wiley & Sons (1987 и ежегодгые обновления); Current Protocols in Immunology, John Wiley & Sons (1987 и ежегодгые обновления) Gait (ed.) (1984) Oligonucleotide Synthesis: A Practical Approach, IRL Press; Eckstein (ed.) (1991) Oligonucleotides and Analogues: A Practical Approach, IRL Press; Birren B et al., (eds.) (1999) Genome Analysis: A Laboratory Manual, Cold Spring Harbor Laboratory Press.
[00185] В конкретном варианте осуществления указанное антитело, раскрытое в данном документе, представляет собой антитело (например, рекомбинантное антитело), полученное, экспрессированное, созданное или выделенное любым способом, который включает создание, например, посредством синтеза, генной инженерии последовательностей ДНК. В определенных вариантах осуществления такое антитело содержит последовательности (например, последовательности ДНК или аминокислотные последовательности), которые в природе не существуют в репертуаре зародышевой линии антитела животного или млекопитающего (например, человека) in vivo.
[00186] В одном аспекте в данном документе представлен способ получения антитела, которое специфически связывается с ApoC3 (например, ApoC3 человека), включающий культивирование клетки или клетки-хозяина, раскрытых в данном документе. В определенном аспекте в данном документе предлагается способ получения антитела, которое специфически связывается с ApoC3 (например, ApoC3 человека), включающий экспрессию (например, рекомбинантную экспрессию) антитела с использованием клетки или клетки-хозяина, раскрытых в данном документе (например, клетки или клетка-хозяина, содержащей полинуклеотиды, кодирующие антитело, раскрытое в данном документе). В конкретном варианте осуществления клетка представляет собой изолированную клетку. В конкретном варианте осуществления экзогенные полинуклеотиды были введены в клетку. В конкретном варианте осуществления указанный способ дополнительно включает стадию очистки антитела, полученного из клетки или клетки-хозяина.
[00187] Способы получения поликлональных антител известны в данной области (см., например, главу 11 в: Short Protocols in Molecular Biology, (2002) 5th Ed., Ausubel FM et al., eds., John Wiley and Sons, New York),
[00188] Моноклональные антитела могут быть получены с использованием широкого спектра методик, известных в данной области, включая использование технологий гибридомной, рекомбинантной и фаговой индикации или их комбинации. Например, моноклональные антитела могут быть получены с использованием гибридомных методов, включая те, которые известны в данной области техники и описаны, например, в Harlow E & Lane D, Antibodies: A Laboratory Manual, (Cold Spring Harbor Laboratory Press, 2nd ed. 1988); Hammerling GJ et al., В: Monoclonal Antibodies and T-Cell Hybridomas 563 681 (Elsevier, NY, 1981). Используемый в данном документе термин «моноклональное антитело» не ограничивается антителами, полученными с помощью гибридомной технологии. Например, моноклональные антитела могут быть получены рекомбинантно из клеток-хозяев, экзогенно экспрессирующих антитело, раскрытое в данном документе, например, легкую цепь или тяжелую цепь такого антитела.
[00189] В конкретных вариантах осуществления «моноклональное антитело», как используется в данном документе, представляет собой антитело, продуцируемое одной клеткой (например, гибридомой или клеткой-хозяином, продуцирующей рекомбинантное антитело), при этом указанное антитело специфически связывается с ApoC3 (например, ApoC3 человека), как определено например, с помощью ИФА или другого антигенсвязывающего или конкурентного связывающего анализа, известного в данной области или в приведенных в данном документе примерах. В конкретных вариантах осуществления моноклональное антитело может представлять собой химерное антитело или гуманизированное антитело. В определенных вариантах осуществления моноклональное антитело представляет собой моновалентное антитело или многовалентное (например, двухвалентное) антитело. В конкретных вариантах осуществления моноклональное антитело представляет собой моноспецифическое или мультиспецифическое антитело (например, биспецифическое антитело). Моноклональные антитела, раскрытые в данном документе, могут, например, быть получены гибридомным способом, как описано в Kohler G & Milstein C (1975) Nature 256: 495, или, например, могут быть выделены из фаговых библиотек с использованием методик, описанных в данном документе, например. Другие способы получения клональных клеточных линий и экспрессируемых ими моноклональных антител хорошо известны в данной области (см., например, главу 11 Short Protocols in Molecular Biology, (2002) 5th Ed., Ausubel FM et al., выше).
[00190] Способы получения и скрининга специфических антител с использованием гибридомной технологии являются обычными и хорошо известны в данной области. Например, в гибридомном способе мышь или другое подходящее животное-хозяин, такое как овца, коза, кролик, крыса, хомяк или макака, иммунизируют для выявления лимфоцитов, которые продуцируют или способны продуцировать антитела, которые специфически связываются с белоком (например, ApoC3 (например, ApoC3 человека)), используемым для иммунизации. Альтернативно, лимфоциты могут быть иммунизированы in vitro. Затем лимфоциты сливают с клетками миеломы с использованием подходящего агента слияния, такого как полиэтиленгликоль, для образования клетки гибридомы (Goding JW (Ed), Monoclonal Antibodies: Principles and Practice, pp. 59-103 (Academic Press, 1986)). Кроме того, для иммунизации животного может быть использована методика RIMMS (повторная иммунизация в нескольких сайтах - repetitive immunization multiple sites) (Kilpatrick KE et al., (1997) Hybridoma 16: 381-9, полностью включена посредством ссылки).
[00191] В некоторых вариантах осуществления мыши (или другие животные, такие как крысы, обезьяны, ослы, свиньи, овцы, хомяки или собаки) могут быть иммунизированы антигеном (например, ApoC3 (например, ApoC3 человека)), и если иммунный ответ обнаружен, например, антитела, специфичные для антигена, обнаружены в сыворотке мыши, селезенка мыши собирается и выделяются спленоциты. Спленоциты затем сливают хорошо известными способами с любыми подходящими клетками миеломы, например клетками линии клеток SP20, доступными из Американской коллекции типовых культур (ATCC®) (Manassas, VA), для образования гибридом. Гибридомы отбирают и клонируют лимитирующим разведением. В определенных вариантах осуществления лимфатические узлы иммунизированных мышей собирают и сливают с клетками миеломы NS0.
[00192] Полученные таким образом клетки гибридомы высевают и выращивают в подходящей культуральной среде, которая предпочтительно содержит одно или несколько веществ, которые ингибируют рост или выживание не слитых клеток родительской миеломы. Например, если в клетках родительской миеломы отсутствует фермент гипоксантин-гуанин-фосфорибозилтрансфераза (HGPRT или HPRT), культуральная среда для гибридом обычно включает гипоксантин, аминоптерин и тимидин (среда HAT), которые предотвращают рост HGPRT-негативных клеток.
[00193] В конкретных вариантах осуществления используют клетки миеломы, которые эффективно сливаются, поддерживают стабильную продукцию антител на высоком уровне выбранными антителопродуцирующими клетками и чувствительны к среде, такой как среда HAT. Среди этих линий клеток миеломы имеются линии мышиной миеломы, такие как линия клеток NS0 или линии, полученные из опухолей мышей MOPC-21 и MPC-11, доступные в Центре распределения клеток Институт Солк, Сан-Диего, Калифорния, США, и SP-2 или X63.Ag8.653 клетки, доступные из Американской коллекции типовых культур, Роквил, Мэрилэнд, США. Линии клеток человеческой миеломы и гетеромиеломы мыши и человека также были описаны для получения человеческих моноклональных антител (Kozbor D (1984) J. Immunol. 133: 3001-5; Brodeur et al.,., Monoclonal Antibody Production Techniques and Applications, pp. 51-63 (Marcel Dekker, Inc., New York, 1987)).
[00194] Культуральную среду, в которой растут клетки гибридомы, анализируют на продуцирование моноклональных антител, направленных против ApoC3 (например, ApoC3 человека). Специфичность связывания моноклональных антител, продуцируемых клетками гибридомы, определяют способами, известными в данной области, например, иммунопреципитацией или анализом связывания in vitro, таким как радиоиммуноанализ (RIA) или иммунферментный анализ (ИФА).
[00195] После того, как будут идентифицированы клетки гибридомы, которые продуцируют антитела желаемой специфичности, аффинности или активности, клоны могут быть субклонированы путем процедуры лимитирующего разведения и выращены стандартными методами (Goding JW (Ed), Monoclonal Antibodies: Principles and Practice, выше). Подходящие культуральные среды для этой цели включают, например, среду D-MEM или RPMI 1640. Кроме того, клетки гибридомы могут быть выращены in vivo в виде асцитных опухолей у животного.
[00196] Моноклональные антитела, секретируемые субклонами, подходящим образом отделяют от культуральной среды, асцитной жидкости или сыворотки с помощью обычных процедур очистки иммуноглобулина, таких как, например, хроматография на белок А-сефарозе, гидроксилапатитная хроматография, гель-электрофорез, диализ или аффинная хроматография.
[00197] Антитела, раскрытые в данном документе, включают фрагменты антител, которые распознают специфический ApoC3 (например, ApoC3 человека) и могут быть получены любым способом, известным специалистам в данной области. Например, фрагменты Fab и F(ab') 2, описанные в данном документе, могут быть получены путем протеолитического расщепления молекул иммуноглобулина с использованием ферментов, таких как папаин (для получения фрагментов Fab) или пепсин (для получения фрагментов F(ab')2). Фрагмент Fab соответствует одному из двух идентичных плеч молекулы антитела и содержит полную легкую цепь в паре с доменами VH и CH1 тяжелой цепи. Фрагмент F(ab')2 содержит два антигенсвязывающих плеча молекулы антитела, связанных дисульфидными связями в шарнирной области.
[00198] Кроме того, антитела, раскрытые в данном документе, также могут быть получены с использованием различных способов фагового дисплея, известных в данной области. В способах фагового дисплея функциональные домены антител отображаются на поверхности фаговых частиц, которые несут кодирующие их полинуклеотидные последовательности. В частности, последовательности ДНК, кодирующие домены VH и VL, амплифицируются из библиотек кДНК животных (например, библиотек кДНК человека или мыши пораженных тканей). ДНК, кодирующая домены VH и VL, рекомбинируется вместе с линкером scFv с помощью ПЦР и клонируется в фагмидный вектор. Вектор электропорируется в E.coli, а кишечная палочка инфицируется фагом-помощником. Фаг, используемый в этих способах, обычно представляет собой нитевидный фаг, включая fd и M13, и домены VH и VL обычно рекомбинантно сливаются с геном фага III или геном VIII. Фаг, экспрессирующий антигенсвязывающий домен, который связывается с конкретным антигеном, может быть выбран или идентифицирован с антигеном, например, с использованием меченого антигена или антигена, связанного или захваченного на твердой поверхности или грануле. Примеры способов фагового дисплея, которые можно использовать для получения антител, раскрытых в данном документе, включают способы, раскрытые в Brinkman U et al., (1995) J Immunol Methods 182: 41-50; Ames RS et al., (1995) J Immunol Methods 184: 177-186; Kettleborough CA et al., (1994) Eur J Immunol 24: 952-958; Persic L et al., (1997) Gene 187: 9-18; Burton DR & Barbas CF (1994) Advan Immunol 57: 191-280; PCT Application No. PCT/GB91/001134; International Publication №№ WO 90/02809, WO 91/10737, WO 92/01047, WO 92/18619, WO 93/1 1236, WO 95/15982, WO 95/20401 и WO 97/13844; и патенты США №№ 5698426, 5223409, 5403484, 5580717, 5427908, 5750753, 5821047, 5571698, 5427908, 5516637, 5780225, 5658727, 5733743 и 5969108.
[00199] Как описано в приведенных выше ссылках, после отбора фага кодирующие области антитела из фага могут быть выделены и использованы для генерации целых антител, включая антитела человека или любой другой желательный антигенсвязывающий фрагмент, и экспрессированы в любом желаемом хозяине, включая клетки млекопитающих клетки насекомых, клетки растений, дрожжи и бактерии, например, как описано ниже. Методы рекомбинантного получения фрагментов антител, таких как фрагменты Fab, Fab' и F (ab') 2, также могут быть использованы с использованием методов, известных в данной области, таких как раскрытые в публикации РСТ № WO 92/22324; Mullinax RL et al., (1992) BioTechniques 12 (6): 864-9; Sawai H et al., (1995) Am J Reprod Immunol 34: 26-34; и Better M et al., (1988) Science 240: 1041-1043.
[00200] В определенных вариантах осуществления для генерации целых антител могут быть использованы праймеры ПЦР, включающие нуклеотидные последовательности VH или VL, сайт рестрикции и фланкирующую последовательность для защиты сайта рестрикции, для амплификации последовательностей VH или VL из матрицы, например клонов scFv. Используя методы клонирования, известные специалистам в данной области, амплифицированные с помощью ПЦР домены VH могут быть клонированы в векторы, экспрессирующие константный участок VH, и амплифицированные с помощью ПЦР домены VL могут быть клонированы в векторы, экспрессирующие константный участок VL, например человеческие каппа или лямбда-константные участки. Домены VH и VL также могут быть клонированы в один вектор, экспрессирующий необходимые константные участки. Затем векторы превращения тяжелой цепи и векторы превращения легкой цепи совместно трансфицируют в клеточные линии, чтобы генерировать стабильные или временные клеточные линии, которые экспрессируют антитела полной длины, например, IgG, с использованием методов, известных специалистам в данной области.
[00201] Химерное антитело представляет собой молекулу, в которой разные части антитела получены из разных молекул иммуноглобулина. Например, химерное антитело может содержать вариабельный участок моноклонального антитела мыши или крысы, слитый с константной областью антитела человека. Способы получения химерных антител известны в данной области. См., например, Morrison SL (1985) Science 229: 1202-7; Oi VT & Morrison SL (1986) BioTechniques 4: 214-221; Gillies SD et al., (1989) J. Immunol. Methods 125: 191-202; и патенты США №№ 5807715, 4816567, 4816397 и 6331415.
[00202] Гуманизированное антитело способно связываться с заранее определенным антигеном и содержит каркасную область, имеющую по существу аминокислотную последовательность человеческого иммуноглобулина, и CDR, имеющие по существу аминокислотную последовательность нечеловеческого иммуноглобулина (например, мышиного иммуноглобулина). В конкретных вариантах осуществления гуманизированное антитело также содержит, по меньшей мере, часть константного участка иммуноглобулина (Fc), обычно таковой иммуноглобулина человека. Антитело также может включать области тяжелой цепи СН1, шарнир, СН2, СН3 и СН4. Гуманизированное антитело может быть выбрано из любого класса иммуноглобулинов, включая IgM, IgG, IgD, IgA и IgE, и любого изотипа, включая IgG1, IgG2, IgG3 и IgG4. Гуманизированные антитела могут быть получены с использованием различных методов, известных в данной области, включая, но не ограничиваясь этим, прививку CDR (европейский патент № EP 239400; международная публикация № WO 91/09967; и патенты США № 5225539, 5530101, и 5585089), венирование или изменение поверхности (европейские патенты №№ EP 592106 и EP 519596; Padlan EA (1991) Mol Immunol. 28 (4/5): 489-498; Studnicka GM et al., (1994) Prot Engineering 7 (6).): 805-814 и Roguska MA et al., (1994) PNAS 91: 969-973), перетасовка цепей (патент США № 5565332) и способы, раскрытые, например, в патенте США № 6407213, пат. № 5766886, международной публикации № WO 93/17105; Tan P et al., (2002) J. Immunol. 169: 1119-25; Caldas C et al., (2000) Protein Eng. 13 (5): 353-60; Morea V et al., (2000) Methods 20 (3): 267-79; Baca M et al., (1997) J Biol Chem 272 (16): 10678-84; Roguska MA et al., (1996) Protein Eng 9 (10): 895 904; Couto JR et al., (1995) Cancer Res. 55 (23 Supp.): 5973-5977; Couto JR et al., (1995) Cancer Res 55 (8): 1717-22; Sandhu JS (1994) Gene 150 (2): 409-10 и Pedersen JT et al., (1994) J Mol Biol 235 (3): 959-73. См. также публикацию заявки США № US 2005/0042664 A1 (24 февраля 2005 г.), которая полностью включена в данное описание посредством ссылки.
[00203] Способы получения полиспецифичных (например, биспецифичных антител) были описаны, см., например, патенты США №№ 7951917; 7183076; 8227577; 5837242; 5989830; 5869620; 6132992 и 8586713.
[00204] Однодоменные антитела, например антитела, лишенные легких цепей, могут быть получены способами, хорошо известными в данной области. См. Riechmann L & Muyldermans S (1999) J. Immunol. 231: 25-38; Nuttall SD et al., (2000) Curr Pharm Biotechnol 1 (3): 253-263; Muyldermans S, (2001) J Biotechnol 74 (4): 277-302; Патент США №6005079; и международные публикации №№ WO 94/04678, WO 94/25591 и WO 01/44301.
[00205] Кроме того, антитела, которые специфически связываются с ApoC3 (например, ApoC3 человека), могут, в свою очередь, использоваться для создания антиидиотипических антител, которые «имитируют» антиген, используя методы, хорошо известные специалистам в данной области. (См., например, Greenspan NS & Bona CA (1989) FASEB J 7 (5): 437-444; и Nissinoff A (1991) J Immunol 147 (8): 2429-2438).
[00206] В конкретных вариантах осуществления указанное антитело, раскрытое в данном документе, которое связывается с тем же эпитопом ApoC3 (например, ApoC3 человека), что и антитело против ApoC3, раскрытое в данном документе, представляет собой антитело человека. В конкретных вариантах осуществления указанное антитело, раскрытое в данном документе, которое конкурентно блокирует (например, дозозависимым способом) любое из антител, раскрытых в данном документе, от связывания с ApoC3 (например, ApoC3 человека), представляет собой антитело человека. Человеческие антитела могут быть получены любым способом, известным в данной области. Например, можно использовать трансгенных мышей, которые не способны экспрессировать функциональные эндогенные иммуноглобулины, но которые могут экспрессировать гены человеческого иммуноглобулина. В частности, генные комплексы иммуноглобулинов тяжелой и легкой цепей человека могут быть введены случайным образом или путем гомологичной рекомбинации в эмбриональные стволовые клетки мыши. Альтернативно, вариабельный участок человека, константный участок и область разнообразия могут быть введены в эмбриональные стволовые клетки мыши в дополнение к генам тяжелой и легкой цепи человека. Гены иммуноглобулинов тяжелой и легкой цепей мыши могут стать нефункциональными по отдельности или одновременно с введением локусов иммуноглобулина человека путем гомологичной рекомбинации. В частности, гомозиготная делеция области J H предотвращает выработку эндогенных антител. Модифицированные эмбриональные стволовые клетки размножаются и микроинъецируются в бластоцисты для получения химерных мышей. Затем химерных мышей разводят для получения гомозиготного потомства, которое экспрессирует человеческие антитела. Трансгенных мышей иммунизируют обычным образом выбранным антигеном, например, всем или частью антигена (например, ApoC3 (например, ApoC3 человека)). Моноклональные антитела, направленные против антигена, могут быть получены от иммунизированных трансгенных мышей с использованием обычной технологии гибридомы. Трансгены иммуноглобулина человека, несущие трансгенных мышей, перестраиваются во время дифференцировки В-клеток и впоследствии подвергаются переключению классов и соматическим мутациям. Таким образом, используя такую методику, можно получить терапевтически полезные антитела IgG, IgA, IgM и IgE. Для обзора этой технологии для производства человеческих антител см. Lonberg N & Huszar D (1995) Int Rev Immunol 13: 65-93. Подробное обсуждение этой технологии получения антител человека и моноклональных антител человека и протоколов получения таких антител см., например, международные публикации №№ WO 98/24893, WO 96/34096 и WO 96/33735; и патенты США №№ 5413923, 5625126, 5633425, 5569825, 5661016, 5545806, 5814318 и 5939598. Примеры мышей, способных продуцировать человеческие антитела, включают Xenomouse™ (Abgenix, Inc.; патенты США № 6075181 и 6150184), HuAb-Mouse™ (Mederex, Inc./Gen Pharm; патенты США №№ 5545806 и 5569825), Trans Chromo Mouse™ (Кирин) и KM Mouse™ (Медарекс/Кирин).
[00207] Человеческие антитела, которые специфически связываются с ApoC3 (например, ApoC3 человека), могут быть получены различными способами, известными в данной области, включая способы фагового дисплея, описанные выше, с использованием библиотек антител, полученных из последовательностей человеческого иммуноглобулина. См. также патенты США № 4444887, 4716111 и 5885793; и международные публикации №№ WO 98/46645, WO 98/50433, WO 98/24893, WO 98/16654, WO 96/34096, WO 96/33735 и WO 91/10741.
[00208] В некоторых вариантах осуществления указанные антитела человека могут быть получены с использованием гибридом мыши-человека. Например, лимфоциты периферической крови человека, трансформированные вирусом Эпштейна-Барра (EBV), могут быть слиты с клетками миеломы мыши для получения гибридом мыши-человека, секретирующих человеческие моноклональные антитела, и эти гибридомы мыши-человека могут быть подвергнуты скринингу для определения тех, которые секретируют моноклональные антитела человека, которые специфически связываются с антигеном-мишенью (например, ApoC3 (например, ApoC3 человека)). Такие способы известны и описаны в данной области, см., например, Shinmoto H et al., (2004) Cytotechnology 46: 19-23; Naganawa Y et al., (2005) Human Antibodies 14: 27-31.
6. Наборы
[00209] Также предоставлены наборы, содержащие одно или несколько антител, раскрытых в данном документе, или фармацевтическую композицию или их конъюгаты. В конкретном варианте осуществления в данном документе предоставляется фармацевтическая упаковка или набор, содержащий один или несколько контейнеров, заполненных одним или несколькими ингредиентами фармацевтических композиций, раскрытых в данном документе, такими как одно или несколько антител, представленных в данном документе. В некоторых вариантах осуществления наборы содержат фармацевтическую композицию, раскрытую в данном документе, и любое профилактическое или терапевтическое средство, такое как те, которые раскрыты в данном документе. Опционально с таким контейнером(ами) может быть связано уведомление в форме, предписанной государственным органом, регулирующим производство, использование или продажу фармацевтических препаратов или биологических продуктов, причем это уведомление отражает одобрение агентства по производству, использованию или продаже для введения человеком.
[00210] Также предоставлены наборы, которые можно использовать в описанных выше способах. В одном варианте осуществления набор содержит раскрытое в данном документе антитело, предпочтительно очищенное антитело, в одном или нескольких контейнерах. В конкретном варианте осуществления раскрытые в данном документе наборы содержат по существу изолированный антиген ApoC3 (например, ApoC3 человека) в качестве контроля. В другом конкретном варианте осуществления раскрытые в данном документе наборы дополнительно содержат контрольное антитело, которое не реагирует с антигеном ApoC3 (например, ApoC3 человека). В другом конкретном варианте осуществления раскрытые в данном документе наборы содержат один или несколько элементов для обнаружения связывания антитела с антигеном ApoC3 (например, ApoC3 человека) (например, антитело может быть конъюгировано с детектируемым субстратом, таким как флуоресцентное соединение, ферментативный субстрат радиоактивное соединение или люминесцентное соединение или второе антитело, которое распознает первое антитело, может быть конъюгировано с обнаруживаемым субстратом). В конкретных вариантах осуществления набор, представленный в данном документе, может включать рекомбинантно продуцированный или химически синтезированный антиген ApoC3 (например, ApoC3 человека). Антиген ApoC3 (например, ApoC3 человека), представленный в наборе, также может быть прикреплен к твердой подложке. В более конкретном варианте осуществления средство обнаружения описанного выше набора включает твердую подложку, к которой присоединен антиген ApoC3 (например, ApoC3 человека). Такой набор также может включать неприкрепленное меченое репортером антитело против антител человека или антитело против антител мыши/крысы. В этом варианте осуществления связывание антитела с антигеном ApoC3 (например, ApoC3 человека) может быть обнаружено по связыванию указанного репортерно-меченного антитела.
ПРИМЕРЫ
[00211] Ранее идентифицированный клон антитела, 5E5, связывается с ApoC3 с высоким сродством при pH 7,4 и слегка сниженным сродством при pH 5,5 (см. предварительную заявку США 62/36084). Данное раскрытие обеспечивает новые производные клона 5E5, которые проявляют высокую аффинность связывания с ApoC3 при pH 7,4, но значительно снижают аффинность к ApoC3 при pH 5,5 относительно 5E5. Следующие примеры описывают характеризацию новых производных 5E5. Аминокислотные последовательности 5E5 приведены в предварительной заявке США 62/360,084, а аминокислотные последовательности новых производных 5E5 приведены в Таблицах 1-7.
[00212] Примеры в этом разделе предоставлены, чтобы дополнительно разъяснить преимущества и особенности данной заявки, но не предназначены для ограничения области применения. Примеры приведены только в иллюстративных целях.
Пример 1. Характеризация in vitro антител против ApoC3 scFv-Fc
[00213] Этот пример описывает эксперименты на основе поверхностного плазмонного резонанса (SPR) для определения антигенсвязывающей кинетики, как при pH 7,4, так и при pH 5,5, анти-ApoC3 scFv-Fc антител.
[00214] Панель новых производных антитела клона 5E5 была получена путем замены одной или нескольких аминокислот CDR в VH и/или VL 5E5 гистидином. Антиген-связывающую кинетику, как при pH 7,4, так и при pH 5,5, каждого производного 5E5 оценивали, используя метод на основе SPR, описанный ниже, и клоны, демонстрирующие высокое сродство, связываются с ApoC3 при pH 7,4, но значительно снижают сродство к ApoC3 при pH 5,5 относительно 5E5 были выбраны для дальнейшей характеризации. Связывающая кинетика иллюстративных 5E5 производных 5E5VH5_VLWT, 5E5VH12_VLWT и 5E5VHWT_VL8 приведена в Таблице 14.
[00215] Тестируемые антитела были получены из трансфицированных клеток HEK293 в небольших культурах объемом 50 мл и очищены с помощью хроматографии на белке А с использованием системы чистой хроматографии ÄKTA. Качество и выход очищенных фрагментов антител определяли с помощью спектрофотометрии и SDS-PAGE.
[00216] Применяли метод на основе SPR, в котором биотинилированный ApoC3 человека захватывали на чипе, покрытом стрептавидином (SA), и кинетику связывания тестируемых антител с чипом с покрытием измеряли при pH 7,4 и pH 5,5. Вкратце, 20 мкл биотинилированного ApoC3 человека инъецировали в концентрации 10 мкг/мл для достижения поверхностной плотности приблизительно 500 ОЕ (RU). 60 мкл каждого тестируемого антитела разводили в буфере HBS-EP (GE, кат. № BR-1008-26; 0,010 М HEPES, 0,150 М NaCl, 3 мМ EDTA, 0,05% (об./об.) Поверхностно-активного вещества P20, pH 7,4) и вводили в концентрации 1-100 нМ. Тестируемые антитела пропускали через проточные ячейки со скоростью потока 30 мкл/мин, после чего следовала промывка без потока при рН 7,4 или рН 5,5 в течение 5 минут. Полученные сенсограммы были проанализированы с использованием программного обеспечения BIAevaluation 4.1 с применением модели связывания Ленгмюра 1:1 для получения кинетики связывания. Данные корректировались на ноль, и сенсограммы эталонной ячейки вычитались.
Таблица 14. Кинетика связывания анти-ApoC3 scFv-Fc антител при рН 7,4 и рН 5,5
KD pH 7,4
[00217] Все протестированные антитела ScFv-Fc продемонстрировали более высокую афинность к ApoC3 при рН 7,4, чем при рН 5,5, а антителом 5E5VH12_VLWT продемонстрировало наиболее выраженное рН-зависимое связывание (см. Таблицу 14). Величина рН - зависимого связывания положительно коррелирует со скоростью диссоциации в кислых условиях.
Пример 2. In vitro характеризация анти-ApoC3 IgG1 антител человека
[00218] На основании результатов в Примере 1 тестовые антитела scFv-Fc были получены в виде антител IgG 1 человека. Использовали анализ на основе SPR, в котором белок ApoC3 человека иммобилизовали на чипе CM5, и кинетику связывания тестируемых антител с чипом с покрытием измеряли при pH 7,4 и pH 5,5. Вкратце, готовили раствор 50 мкг/мл нативного ApoC3 человека в 10 мМ ацетатном буфере при pH 4,5 и вводили до тех пор, пока поверхностная плотность не достигла приблизительно 500 ОЕ. 60 мкл каждого тестируемого антитела разводили в буфере HBS-EP (GE, кат. № BR-1008-26; 0,010 М HEPES, 0,150 М NaCl, 3 мМ EDTA, 0,05% (об./об.) поверхностно-активного вещества P20, pH 7,4) и вводили в концентрации, как описано в Таблице 9. Тестируемые антитела пропускали через проточные ячейки со скоростью потока 30 мкл/мин, после чего следовала промывка без потока при рН 7,4 или рН 5,5 в течение 5 минут. Полученные сенсограммы были проанализированы с использованием программного обеспечения BIAevaluation 4.1 с применением модели связывания Ленгмюра 1:1 для получения кинетики связывания. Данные корректировались на ноль, и сенсограммы эталонной ячейки вычитались.
Таблица 15. Кинетика связывания анти-ApoC3 антител человека IgG 1 при рН 7,4 и рН 5,5
05
05
VLWT
05
05
VLWT
05
05
VL8
05
05
05
05
VL8
05
05
04
05
05
[00219] Все протестированные антитела связывались с ApoC3 человека при pH 7,4 и имели пониженное сродство к ApoC3 при pH 5,5 (см. Таблицу 15). 5E5VH5_VLWT, 5E5VH12_VLWT, 5E5VH5_VL8 и 5E5VH12_VL8 показывают особенно выраженную зависимость от pH.
Пример 3. Влияние антител против ApoC3 на поглощение ЛПОНП гепатоцитами
[00220] В этом примере была определена способность антител против ApoC3 ослаблять поглощение ЛПОНП гепатоцитами.
[00221] Вкратце, клетки HepG2 (ATCC HB-8065) культивировали на поверхности, покрытой поли-d-лизином, в полной минимальной основной среде (MEM) с добавлением 10% FCS в течение 24 часов и в полной MEM с добавлением 0,0125% бычьего сывороточного альбумина (Среда MEM-BSA) еще 24 часа. Клетки предварительно инкубировали с 3 мкМ человеческого белка ApoC3 (Athens Research and Technology) и 3 мкМ тестируемого антитела в формате IgG1 в течение 15 минут в свежей среде MEM-BSA и 30 мкг/мл ApoC3-обедненного DiI-. В среду добавляли меченый ЛПОНП (Kalen Biomedical, LLC # 770130-9). После 4-часовой инкубации клетки дополнительно инкубировали со свежим полным MEM с добавлением 1% интралипида в течение 20 минут. Количество DiI-меченого ЛПОНП, поглощенного клетками, определяли путем лизиса клеток с изопропанолом при комнатной температуре в течение 15 минут, измерения флуоресценции DiI-метки в лизате (ex=520 нм; em=580), расчета количества DiI-меченого ЛПОНП с использованием стандартной кривой и нормализации данных на основе количества общего белка в лизате. Данные были получены с использованием GraphPad Prism 6 и представлены как среднее значение +/- SEM. Односторонний ANOVA с множественными сравнениями рассчитывали с использованием GraphPad Prism 6.
[00222] Как продемонстрировано на Фиг.1А, 1В и 1С, антитела 5E5WT, 5E5VHWT_VL8, 5E5VH5_VLWT, 5E5VH12_VLWT и 5E5VH5_VL8 увеличивали поглощение ЛПОНП клетками HepG2. В частности, антитела 5E5VHWT_VL8, 5E5VH5_VLWT, 5E5VH12_VLWT и 5E5VH5_VL8 полностью восстановили поглощение ЛПОНП в присутствии ApoC3.
Пример 4. Фармакокинетика и фармакодинамика антител против ApoC3.
[00223] В этом примере описывается характеристика in vivo антитела 5E5VH5_VL8 с использованием мышиной модели с нарушенным клиренсом триглицеридов из-за трансгенной экспрессии ApoC3 человека.
4.1 Получение мышиной модели
[00224] Самцов мышей дикого типа C57BL/6 в возрасте 60-63 дня, получавших стандартную пищу, инфицировали 3×10 11 вирусных частиц вектора AAV8, несущего ген ApoC3 человека, функционально связанный с промотором тироксинсвязывающего глобулина (TBG) (RegenXBio), с помощью внутрибрюшинное введение. Через двенадцать дней после введения образцы крови были взяты из ретроорбитального синуса, и уровни ApoC3 человека в образцах крови были измерены с помощью ИФА с использованием первичного антитела против ApoC3 (поликлональное антитело кролика против ApoC3 Abcam № ab21032) и вторичного антитела к ApoC3 (поликлональное биотин-конъюгированное козье ApoC3 Abcam № ab21024). У инфицированных мышей средний уровень сывороточного ApoC3 человека составлял 9,9 мкМ. Средний уровень циркулирующего триглицерида после четырехчасового голодания у этих мышей составил 163 мг/дл, тогда как средний уровень циркулирующего триглицерида у контрольных мышей составил 109 мг/дл (р=0,0065).
[00225] Затем мышей сгруппировали так, чтобы все группы имели одинаковые средние уровни ApoC3 в день 12. Через четырнадцать дней после AAV-инфекции были взяты образцы крови из ретроорбитального синуса для установления базовых (T=0) уровней ApoC3. 25 мг/кг тестируемого анти-ApoC3 IgG1 антитела человека вводили каждой мыши путем инъекции подкожное пространство на спинне. Анти-лизоцим куриного яйца IgG1 антитело человека (HyHEL5) использовали в качестве изотипического контроля. Образцы крови отбирали из ретроорбитального синуса через 0, 2, 4, 8 и 24 часа после введения тестируемых антител и примерно каждые 2 дня после этого в течение 30 дней. Все исследования на животных проводились в соответствии с рекомендациями Руководства по уходу и использованию лабораторных животных Национальных институтов здравоохранения (Guide for the Care and Use of Laboratory Animals of the National Institutes of Health). Все процедуры были одобрены Институциональным комитетом по уходу и использованию животных Vascumab, LLC.
4.2 Фармакокинетика антител против ApoC3
[00226] Мышей, экспрессирующих ApoC3 человека, получали и обрабатывали, как описано в разделе 4.1. Уровни в плазме IgG 1 антител человека определяли с помощью анализа ИФА. В частности, 96-луночный планшет (Griener № 655061) покрывали в течение ночи при 4°С 50 мкл первичного антитела IgG (поликлональное козье анти-человеческое Fc IgG Fitzgerald 41-XG57), разведенного в PBS. Планшет 4 раза промывали 200 мкл TBS-T и блокировали 200 мкл блокирующего буфера, состоящего из 3% BSA (без протеазы BSA фракции V Roche № 03117332001) плюс чистое молоко (блокатор из чистого молока Pierce № 37587) в PBS в течение 90 минут при 30°C. Блокирующий буфер удаляли и добавляли 50 мкл тестируемого образца, разведенного в блокирующем буфере, и оставляли инкубироваться в течение 2 часов при комнатной температуре с вращением при 300 об/мин. Планшет промывали четыре раза 200 мкл TBS-T и добавляли 50 мкл вторичного антитела (поликлональное козье анти-человеческое IgG-Fc (биотин) Abcam № ab97223), разведенного в блокирующем буфере, и оставляли инкубироваться в течение 1 часа при комнатной температуре с вращением при 300 об/мин. Планшет один раз промывали TBS-T и добавляли 50 мкл SA-HRP (Abcam № 64269), разведенного в 100 раз в PBS, и оставляли инкубироваться в течение 30 минут при комнатной температуре с вращением при 300 об/мин. Затем планшет 4 раза промывали 200 мкл TBS-T и проявляли 80 мкл TMB. Хромогенную реакцию прекращали с помощью 50 мкл 0,5 Н HCL. Поглощение считывали на длине волны 450 нм. Количества IgG человека в тестовых лунках рассчитывали по подгонке по 4 параметрам стандартной кривой (Molecular Devices), построенной с использованием очищенного тестируемого антитела. Этот метод специфически обнаруживает ApoC3 человека и не перекрестно реагирует с ApoC3 мыши.
[00227] Как продемонстрировано на Фиг. 2А, антитело 5E5 быстро разлагается у мышей, экспрессирующих ApoC3 человека. Это может быть объяснено быстрым оборотом ApoC3 за счет поглощения ApoC3-содержащих липидных частиц. Антитело 5E5VH5_VL8, которое имеет пониженное сродство к ApoC3 при более низком pH, может диссоциировать от ApoC3 в кислых органеллах и возвращаться в кровоток посредством эндосомной рециркуляции. Период полураспада 5E5VH5_VL8 составляет около одной недели, что аналогично периоду полураспада контрольного антитела изотипа HyHel5 (антитело, которое не связывается со специфическим антигеном у мышей). Уровень в плазме 5E5VH5_VL8 вернулся к исходному уровню примерно через месяц после инъекции. Увеличенный период полураспада 5E5VH5_VL8 делает это антитело отличным кандидатом для клинического применения из-за низкой частоты введения, необходимой для поддержания терапевтического уровня антитела в сыворотке.
4.3 Фармакодинамика антител против ApoC3
[00228] Мышей, экспрессирующих ApoC3 человека, получали и обрабатывали, как описано в разделе 4.1. Уровни ApoC3 и ApoB человека в плазме определяли с помощью анализа ИФА. В частности, 96-луночный планшет (Griener № 655061) покрывали в течение ночи при 4°С 50 мкл первичного антитела ApoC3 (кроличьи поликлональные антитела против ApoC3 Abcam № ab21032) или 50 мкл первичного антитела ApoB (поликлональные козьи анти-ApoB человека Meridian Life Sciences № K45253G), разведенного в PBS. Планшет 4 раза промывали 200 мкл TBS-T и блокировали 200 мкл блокирующего буфера (Pierce Clear Milk Blocker № 37587 в PBS) в течение 90 минут при 30°C. Блокирующий буфер удаляли и добавляли 50 мкл тестируемого образца, разведенного в блокирующем буфере, и оставляли инкубироваться в течение 2 часов при комнатной температуре с вращением при 300 об/мин. Планшет промывали четыре раза 200 мкл TBS-T и 50 мкл вторичного антитела ApoC3 (козий поликлональный биотин-конъюгат ApoC3 Abcam № ab21024) или вторичного антитела ApoB (поликлональный биотин-конъюгат козы ApoB48/100 Meridian Life Sciences № 34003G), разведенного в блокирующем буфере добавляли и оставляли инкубироваться в течение 1 часа при комнатной температуре с вращением при 300 об/мин. Планшет один раз промывали TBS-T и добавляли 50 мкл SA-HRP (Abcam № 64269), разведенного в 100 раз в PBS, и оставляли инкубироваться в течение 30 минут при комнатной температуре с вращением при 300 об/мин. Затем планшет 4 раза промывали 200 мкл TBS-T и обрабатывали 80 мкл TMB (Thermo Ultra-TMB ELISA № 34028) с последующим добавлением 50 мкл 0,5 Н HCL. Поглощение считывалось при 450 нм. Количество ApoC3 в тестовых лунках рассчитывали по подгонке по 4 параметрам стандартной кривой (Molecular Devices), построенной с использованием очищенного ApoC3 (Athens Research and Technology). Количество ApoB в тестовых лунках рассчитывали по подгонке по 4 параметрам стандартной кривой (Molecular Devices), построенной с использованием ЛПОНП мыши, выделенных центрифугированием (предполагается, что содержание ApoB составляет 20% от общего содержания белка). Данные рассчитывали и наносили на график в виде процентных значений относительно соответствующих уровней у мышей, получавших контрольное антитело HyHel5.
[00229] Как продемонстрировано на Фиг. 2В и 2С, антитело 5Е5 первоначально снижало уровни ApoC3 и ApoB в плазме человека, но уровни возвращались к норме примерно через 2 дня. Напротив, 5E5VH5_VL8 снижал уровни ApoC3 и ApoB в плазме человека примерно на один месяц. Эта длительная эффективность соответствовала длительному периоду полураспада 5E5VH5_VL8 и подтвердила, что 5E5VH5_VL8 будет отличным клиническим кандидатом.
Пример 5. Гуманизация антител против ApoC3
[00230] Гуманизированные варианты 5E5VH5_VL8 были получены в соответствии со способами «зародышеобразования (germlining)», описанными в WO 2012123586 A1. Вкратце, сегменты генов зародышевой линии человека с той же канонической структурой при сворачивании и самой высокой аминокислотной идентичностью последовательности к VH и VL областею 5E5VH5_VL8 были идентифицированы по сравнению с известными последовательностями генов зародышевой линии человека. Наиболее близкими последовательностями зародышевой линии тяжелой цепи и легкой цепи человека были IGHV3-23 * 01 человека и IGKV2-28 * 01 человека соответственно. Была сконструирована Fab-библиотека фагового дисплея вариантов 5E5VH5_VL8, которая содержала гуманизирующие мутации в аминокислотных остатках 5E5VH5_VL8, отличающихся от зародышевых последовательностей человека IGHV3-23 * 01 и IGKV2-28 * 01, при этом остатки ламы и человека в каждой целевой позиции были в равной степени представлены в библиотеке. Мутации для удаления мотивов последовательностей библиотек DG, DS, NR или M также были включены в библиотеку. Гуманизированные варианты 5E5VH5_VL8 с лучшими характеристиками связывания с мишенью (например, с высокой аффинностью связывания с ApoC3 при pH 7,4, но значительно сниженной аффинностью с ApoC3 при pH 5,5) были идентифицированы после нескольких раундов селекционного фагового дисплея.
[00231] Двадцать гуманизированных антител против ApoC3, которые сохранили высокое сродство и рН-зависимое связывание, были идентифицированы в результате первоначального отбора и скрининга, описанного выше. Кодирующие последовательности VH и Vκ этих антител были клонированы в вектор экспрессии, и наработаны в клетках ExpiCHO-S в качестве полноразмерных молекул IgG1. Затем антитела очищали с использованием колонки Hitrap MabSelect Sure (GE, кат. № 11-0034-94) на системе ÄKTA Pure. Антитела элюировали, используя 1,0 мл 0,1 М цитратного буфера при рН 3,0, и элюированные фракции собирают в пробирки, содержащие 0,1 мл трис-HCl pH 9,0 для нейтрализации. Фракции, содержащие антитела, объединяли и обессоливали в 1х фосфатно-солевом растворе (PBS; NaCl 137 мМ, KCl 3 мМ, Na2HPO4 8 мМ, KH2PO4 15 мМ, pH 7,4) с использованием обессоливающей колонки HiTrap в системе ÄKTA Pure. Концентрации белка определяли путем измерения поглощения при 280 нм и коррекции с коэффициентом экстинкции следующим образом: (A280 нм-A340 нм)/ε (коэффициент экстинкции в г/л). Очищенные образцы были исследованы с помощью SDS-PAGE в восстанавливающих и невосстанавливающих условиях для подтверждения правильного размера и чистоты образцов.
[00232] Два различных анализа поверхностного плазмонного резонанса (SPR) проводили для оценки pH-зависимых параметров ассоциации и диссоциации гуманизированных антител против ApoC3. Методы и результаты двух анализов описаны ниже.
5.1 SPR-анализ связывания гуманизированного антитела против ApoC3 с иммобилизованным ApoC3
[00233] Биотинилированный нативный ApoC3 человека собирали на покрытом стрептавидином SPR-чипе (GE Healthcare, кат. № BR100032) при pH 7,4 в соответствии с методом, предоставленным Biacore, путем инъекции 20 мкл 10 мкг/мл биотинилированного нативного ApoC3 человека, достигающего поверхностной плотности около 500 ОЕ. 60 мкл тестируемого антитела в диапазоне 1-50 нМ разводят в буфере HBS-EP (GE, кат. № BR-1008-26; 0,010 М HEPES, 0,150 М NaCl, 3 мМ EDTA, 0,05% (об./об.) cурфактанта P20, рН 7,4) инъецировали и пропускали через проточные ячейки со скоростью потока 30 мкл/мин с последующей промывкой без протока при рН 7,4 в течение 5 мин. После диссоциации поверхности проточной ячейки регенерировали путем введения 10 мкл 10 мМ NaOH/1 М NaCl и 10 мкл 10 мМ глицина при рН 1,5. Анализ повторяли при pH 5,5, используя тот же общий протокол, где буфер для проб и разведения образца заменяли буфером HBS-EP с добавлением цитратного буфера до конечной концентрации 10 мМ и pH доводили до 5,5.
[00234] Полученные сенсограммы были проанализированы с использованием программного обеспечения BIAevaluation 4.1 с использованием модели связывания Ленгмюра 1: 1 для определения кинетики связывания. Данные корректировались на ноль, и сенсограммы эталонной ячейки вычитались. Сенсограммы были дважды связаны с пробой без аналитов. Установленные параметры считались неприменимыми, если значения отклонения были ниже предела обнаружения оборудования kd: 1 × 10 -6 1/с.
[00235] Обзор рассчитанных кинетических параметров представлен в Таблице 16 для сгенерированных гуманизированных антител. На Фиг. 3 продемонстрированы наложенные сенсограммы для каждого сгенерированного гуманизированного mAb при двух значениях pH анализа и при одинаковых концентрациях 25 нМ mAb.
Таблица 16. SPR-анализ связывания гуманизированного антитела ApoC3 с иммобилизованным ApoC3
* анализ при pH 7,4 привел к показанию отклонения от нормы ниже предела обнаружения оборудования
н. п. - не применимо
[00236] Как продемонстрировано на Фиг. 3, от mAb1 до mAb6 продемонстрировали очень низкие off-коэфициенты при pH 7,4 и pH 5,5. Их очевидная аффинность при рН 5,5 была улучшена по сравнению с 5E5VH5_VL8, и связывание с мишенью в зависимости от рН не наблюдалось. Антитело mAb7 демонстрирует четкое рН-зависимое связывание с мишенью с высокой скоростью диссоциации при рН 5,5. Однако значения Rmax в фазе связывания при обоих значениях pH были выше, чем значения 5E5VH5_VL8. Антитела от mAb8 до mAb12 продемонстрировали очень низкие скорости выключения при рН 7,4 и более высокие уровни Rmax при рН 5,5, чем при рН 7,4. Их очевидная аффинность при рН 5,5 была улучшена по сравнению с 5E5VH5_VL8, и связывание с мишенью в зависимости от рН не наблюдалось. Антитела mAb13 и mAb14 были получены путем прививки последовательностей HCDR и LCDR в наиболее близкие каркасные последовательности человеческой зародышевой линии и продемонстрировали четкие рН-зависимые характеристики связывания мишени, однако их аффинность к человеческому ApoC3 была снижена при pH 7,4 относительно 5E5VH5_VL8. Антитела mAb15, mAb17 и mAb19 не содержали остатка гистидина на LCDR3 (Q90H), но демонстрировали желаемые характеристики связывания с рН-зависимой мишенью в данном скрининге. Последовательности антител mAb16, mAb18 и mAb20 были идентичны mAb15, mAb17 и mAb19 соответственно, за исключением того, что остаток, соответствующий H90 5E5VH5_VL8, представлял собой гистидин. Как продемонстрировано на Фиг. 3, mAb16, mAb18 и mAb20 продемонстрировали четкое рН-зависимое связывание с мишенью из-за пониженного сродства к мишени при рН 5,5 и повышенном off-коэфициенте при рН 7,4.
5.2 SPR-анализ связывания ApoC3 с иммобилизованными гуманизированными антителами против ApoC3
[00237] Был разработан анализ с инвертированным SPR, в котором тестируемое антитело захватывали на чипе SPR, инъецировали белок ApoC3 человека и измеряли связывание ApoC3 с антителом. В частности, козье анти-человеческое IgG-Fc-специфичное антитело (Jackson ImmunoResearch, кат. № 109-005-098) иммобилизовали на поверхности чипа CM5 (GE Healthcare, кат. № BR100012). Иммобилизацию проводили в соответствии с методом, предоставленным Biacore/GE, с использованием набора NHS/EDC (Biacore AB, кат. № BR-1000-50): после активации чипа готовили раствор 30 мкг/мл антитела против человеческого Fcγ в 10 мМ ацетатном буфере с pH 5,0 и вводили до тех пор, пока поверхностная плотность не достигла приблизительно 10000 ОЕ. Аналитический цикл состоял из следующих этапов:
(1) захват антител: инъекция антитела в концентрации 50 нМ при рН 7,4 или рН 5,5, разведенном в буфере HBS-EP (GE, кат. № BR-1008-26; 0,010 М HEPES, 0,150 М NaCl, 3 мМ ЭДТА, 0,05% (об./об.) поверхностно-активное вещество Р20, рН 7,4) инкубация для захватывата высокоаффинным анти-huFcγ-антителом до 800 ОЕ;
(2) стабилизация начальных параметров: инъекция 100 мкл буфера HBS-EP при скорости потока 30 мкл/мл;
(3) связывание с мишенью: инъекция 60 мкл целевого белка ApoC3, разведенного в буфере HBS-EP, в концентрациях 400 нМ, 200 нМ, 100 нМ и 50 нМ;
(4) промывка при off-коэфициенте: инъекция буфера HBS-EP при скорости потока 30 мкл/мл в течение 5 минут для оценки фазы диссоциации;
(5) регенерация чипа путем введения 20 мкл 10 мМ глицина при рН 1,5.
[00238] Полученные сенсограммы были проанализированы с использованием программного обеспечения BIAevaluation 4.1 с использованием модели связывания Ленгмюра 1: 1 для определения кинетики связывания. Данные корректировались на ноль, сенсограммы эталонных клеток вычитались, и анализ на отсутствие аналита использовался для двойной ссылки на сенсограммы, соответствующие инъекциям аналита. Сенсограммы фаз диссоциации и ассоциации были подобраны отдельно для 4 различных кривых концентрации. Сенсограммы были исключены из подгонки, если достигнутые максимальные значения ОЕ были ниже предела обнаружения оборудования (<5ОЕ), Biacore 3000 (Biacore AB).
[00239] Обзор рассчитанных кинетических параметров представлен в Таблице 17 для сгенерированных гуманизированных антител. На Фиг. 4 продемонстрированы характеристики связывания для сгенерированных вариантов. Скорость диссоциации каждого антитела была увеличена в этих условиях из-за различной презентации целевого белка.
Таблица 17. SPR-анализ связывания ApoC3 с иммобилизованными гуманизированными антителами против ApoC3
Из сенсограм вычетали пустой канал и дважды соотносили с пробой без аналитов.
н/п: не применимо
* за исключением сенсограммы 400 нМ
** за исключением сенсограммы 200 нМ
[00240] Как продемонстрировано на Фиг. 4, mAb1-mAb6 продемонстрировали улучшенную кажущуюся аффинность к ApoC3 при pH 7,4, и наблюдали зависимое от pH связывание мишени. Антитело mAb7 показало четкое рН-зависимое связывание с мишенью с высокой скоростью дисбаланса при обоих значениях рН. Значение Rmax при рН 5,5 в фазе ассоциации было увеличено относительно 5E5VH5_VL8. Антитела от mAb8 до mAb12 продемонстрировали более низкие скорости смещения при pH 7,4, чем у 5E5VH5_VL8, более высокие уровни Rmax при pH 5,5, чем при pH 7,4, более высокие скорости смещения при pH 5,5, чем у 5E5VH5_VL8, и рН-зависимое связывание с мишенью. Антитела mAb13 и mAb14 (полученные путем прививки последовательностей HCDR и LCDR к ближайшим каркасным последовательностям зародышевой линии человека) продемонстрировали потерю связывания при обоих уровнях pH, и, следовательно, значения аффинности при pH 5,5 не рассчитывали. Антитела mAb16, mAb18 и mAb20 демонстрировали четкое рН-зависимое связывание с мишенью из-за сниженного сродства к мишени при рН 5,5, однако их отклонения при рН 7,4 также увеличивались.
[00241] Таким образом, следующие результаты профиля связывания были идентифицированы для гуманизированных антител в соответствии с результатами анализа SPR:
Группа 1: mAb 1, 2, 3, 4, 5, 6, 8, 9, 10, 11 и 12;
Группа 2: mAb15, 17 и 19;
Группа 3: mAb 16, 18 и 20;
Группа 4 содержала mAb 7; и
Группа 5: mAb 13 и 14.
[00242] Внутри каждой группы все варианты демонстрировали сходную профиль асоциации и диссоциации SPR. Таким образом, репрезентативное антитело из каждой группы было выбрано для оценки их термотолерантности, как одного из параметров их развития, на основе критериев самого высокого процента гомологии человека.
5.3 Характеризация термотолерантности выбранных гуманизированных антител против ApoC3
[00243] Термотолерантность гуманизированных антител оценивали после инкубации при различных температурах в диапазоне от 56 до 68°С в течение 1 часа. Активность антител определяли в анализе SPR, в котором 500 ОЕ нативного белка huApoC3 иммобилизовали на чипе CM5 (GE Healthcare, кат. № BR100012). Иммобилизацию проводили в соответствии с методом, предоставленным Biacore с использованием набора NHS/EDC (Biacore AB): после активации чипа готовили раствор 60 мкг/мл ApoC3 человека в 10 мМ ацетатном буфере при pH 4,5 и вводили до тех пор, пока поверхностная плотность не достигла приблизительно 500 ОЕ.
[00244] 100 мкл тестируемого антитела в концентрации 10 нМ, разведенного в буфере HBS-EP (GE, кат. № BR-1008-26; 0,010 М HEPES, 0,150 М NaCl, 3 мМ ЭДТА, 0,05% (об./об.) сурфактанта P20, pH 7,4) впрыскивают и пропускают через проточные кюветы со скоростью потока 30 мкл/мин с последующей промывкой без потока буфером HBS-EP при pH 7,4 в течение 10 мин. После диссоциации поверхности проточной ячейки регенерировали путем введения 10 мкл 10 мМ NaOH/1 М NaCl и 10 мкл 10 мМ глицина при рН 1,5.
[00245] Скорость ассоциации и максимальное значение ОЕ, достигнутое в фазе связывания, были измерены как параметр считывания. Скорость ассоциации (наклон) оценивали в начальной фазе связывания вплоть до 200 с, а максимальное значение ОЕ (R0) считывали в начале фазы диссоциации через 345 с. Процент функциональных антител рассчитывали на основании контрольного значения (образец, инкубированный при 4°С), установленного на 100%. Температуру плавления каждого антитела определяли как точку перегиба на кривых зависимости активности от температуры.
[00246] Как продемонстрировано на Фиг.5А и 5В и как указано в Таблице 18, большинство протестированных гуманизированных антител продемонстрировали значительно улучшенные температуры плавления по сравнению с родительским клоном 5E5VH5_VL8. Однако mAb14 имел значительно более низкую температуру плавления, чем 5E5VH5_VL8.
Таблица 18. Температуры плавления гуманизированных антител против ApoC3
[00247] Термотолерантность mAb13 также оценивали в вышеупомянутом анализе, чтобы определить, связано ли наблюдаемое изменение термотолерантности с каркасной последовательностью зародышевой линии, которая была использована для прививки CDR вариантов 13 и 14. Анализ выполняли в расширенном температурном диапазоне, чтобы охватить ожидаемую температуру гуманизированных антител и 5E5VH5_VL8 (анализ в качестве контроля). Как продемонстрировано на Фиг. 5С, mAb13 и mAb14 имели схожие кривые термостойкости и демонстрировали температуры плавления около 57°С, примерно на 6°С ниже, чем у 5E5VH5_VL8.
[00248] Изобретение не должно быть ограничено в объеме конкретными вариантами осуществления, раскрытыми в данном документе. Действительно, различные модификации изобретения в дополнение к описанным станут очевидными для специалистов в данной области техники из предшествующего описания и сопровождающих фигур. Такие модификации предназначены для попадания в объем прилагаемой формулы изобретения.
[00249] Все ссылки (например, публикации или патенты или патентные заявки), цитированные в данном документе, включены в данный документ посредством ссылки во всей их полноте и для всех целей в той же степени, как если бы каждая отдельная ссылка (например, публикация или патент или заявка на патент) была конкретно и индивидуально продемонстрирована включенной посредством ссылки во всей своей полноте для всех целей.
Другие варианты осуществления находятся в пределах следующей формулы изобретения.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> STATEN BIOTECHNOLOGY B.V.
<120> АНТИ-APOC3 АНТИТЕЛА И СПОСОБЫ ИХ ИСПОЛЬЗОВАНИЯ
<130> 606962: SBW-007PC
<140> PCT/IB2018/058564
<141> 2018-10-31
<150> 62/579,449
<151> 2017-10-31
<160> 93
<170> PatentIn версия 3.5
<210> 1
<211> 79
<212> БЕЛОК
<213> Homo sapiens
<400> 1
Ser Glu Ala Glu Asp Ala Ser Leu Leu Ser Phe Met Gln Gly Tyr Met
1 5 10 15
Lys His Ala Thr Lys Thr Ala Lys Asp Ala Leu Ser Ser Val Gln Glu
20 25 30
Ser Gln Val Ala Gln Gln Ala Arg Gly Trp Val Thr Asp Gly Phe Ser
35 40 45
Ser Leu Lys Asp Tyr Trp Ser Thr Val Lys Asp Lys Phe Ser Glu Phe
50 55 60
Trp Asp Leu Asp Pro Glu Val Arg Pro Thr Ser Ala Val Ala Ala
65 70 75
<210> 2
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<400> 2
Phe Ser Glu Phe Trp Asp Leu Asp Pro Glu
1 5 10
<210> 3
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
пептид"
<400> 3
Thr Tyr Ser Met Arg
1. 5
<210> 4
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
пептид"
<220>
<221> MOD_RES
<222> (3)..(3)
<223> S или H
<400> 4
Ser Ile Xaa Thr Asp Gly Gly Gly Thr Ala Tyr Arg Asp Ser Val Lys
1 5 10 15
Gly
<210> 5
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
пептид"
<220>
<221> MOD_RES
<222> (1)..(1)
<223> A или H
<400> 5
Xaa Gly Tyr Ser Asp
1 5
<210> 6
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
пептид"
<400> 6
Lys Thr Ser Gln Gly Leu Val His Ser Asp Gly Lys Thr Tyr Phe Tyr
1 5 10 15
<210> 7
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
пептид"
<400> 7
Gln Val Ser Asn Arg Ala Ser
1 5
<210> 8
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
пептид"
<220>
<221> MOD_RES
<222> (2)..(2)
<223> Q или H
<400> 8
Ala Xaa Gly Thr Tyr Tyr Pro His Thr
1 5
<210> 9
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
пептид"
<400> 9
Ser Ile Ser Thr Asp Gly Gly Gly Thr Ala Tyr Arg Asp Ser Val Lys
1 5 10 15
Gly
<210> 10
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
пептид"
<400> 10
Ala Gly Tyr Ser Asp
1 5
<210> 11
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
пептид"
<400> 11
Ser Ile His Thr Asp Gly Gly Gly Thr Ala Tyr Arg Asp Ser Val Lys
1 5 10 15
Gly
<210> 12
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
пептид"
<400> 12
His Gly Tyr Ser Asp
1 5
<210> 13
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
пептид"
<400> 13
Ala Gln Gly Thr Tyr Tyr Pro His Thr
1 5
<210> 14
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
пептид"
<400> 14
Ala His Gly Thr Tyr Tyr Pro His Thr
1 5
<210> 15
<211> 114
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 15
Gln Leu Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Gly Thr Tyr
20 25 30
Ser Met Arg Trp Val Arg Gln Val Pro Arg Lys Ala Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Thr Asp Gly Gly Gly Thr Ala Tyr Arg Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Asn Leu Lys Pro Glu Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Val Ile Ala Gly Tyr Ser Asp Trp Gly Gln Gly Thr Gln Val Thr Val
100 105 110
Ser Ser
<210> 16
<211> 114
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 16
Gln Leu Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Gly Thr Tyr
20 25 30
Ser Met Arg Trp Val Arg Gln Val Pro Arg Lys Ala Leu Glu Trp Val
35 40 45
Ser Ser Ile His Thr Asp Gly Gly Gly Thr Ala Tyr Arg Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Asn Leu Lys Pro Glu Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Val Ile Ala Gly Tyr Ser Asp Trp Gly Gln Gly Thr Gln Val Thr Val
100 105 110
Ser Ser
<210> 17
<211> 114
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 17
Gln Leu Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Gly Thr Tyr
20 25 30
Ser Met Arg Trp Val Arg Gln Val Pro Arg Lys Ala Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Thr Asp Gly Gly Gly Thr Ala Tyr Arg Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Asn Leu Lys Pro Glu Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Val Ile His Gly Tyr Ser Asp Trp Gly Gln Gly Thr Gln Val Thr Val
100 105 110
Ser Ser
<210> 18
<211> 114
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 18
Gln Leu Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Gly Thr Tyr
20 25 30
Ser Met Arg Trp Val Arg Gln Val Pro Arg Lys Ala Leu Glu Trp Val
35 40 45
Ser Ser Ile His Thr Asp Gly Gly Gly Thr Ala Tyr Arg Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Asn Leu Lys Pro Glu Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Val Ile His Gly Tyr Ser Asp Trp Gly Gln Gly Thr Gln Val Thr Val
100 105 110
Ser Ser
<210> 19
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 19
Ala Thr Met Leu Thr Gln Ser Pro Gly Ser Leu Ser Val Val Pro Gly
1 5 10 15
Glu Ser Ala Ser Ile Ser Cys Lys Thr Ser Gln Gly Leu Val His Ser
20 25 30
Asp Gly Lys Thr Tyr Phe Tyr Trp Phe Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Gln Leu Ile Tyr Gln Val Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Gly Val Lys Ala Glu Asp Ala Gly Val Tyr Tyr Cys Ala Gln Gly
85 90 95
Thr Tyr Tyr Pro His Thr Phe Gly Ser Gly Thr Arg Leu Glu Ile Lys
100 105 110
<210> 20
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 20
Ala Thr Met Leu Thr Gln Ser Pro Gly Ser Leu Ser Val Val Pro Gly
1 5 10 15
Glu Ser Ala Ser Ile Ser Cys Lys Thr Ser Gln Gly Leu Val His Ser
20 25 30
Asp Gly Lys Thr Tyr Phe Tyr Trp Phe Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Gln Leu Ile Tyr Gln Val Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Gly Val Lys Ala Glu Asp Ala Gly Val Tyr Tyr Cys Ala His Gly
85 90 95
Thr Tyr Tyr Pro His Thr Phe Gly Ser Gly Thr Arg Leu Glu Ile Lys
100 105 110
<210> 21
<211> 330
<212> БЕЛОК
<213> Homo sapiens
<400> 21
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu
225 230 235 240
Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330
<210> 22
<211> 330
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 22
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Tyr Ile Thr Arg Glu Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu
225 230 235 240
Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330
<210> 23
<211> 330
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 23
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu
225 230 235 240
Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu Lys Phe His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330
<210> 24
<211> 330
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 24
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu
225 230 235 240
Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Leu His Glu Ala Leu His Ser His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330
<210> 25
<211> 107
<212> БЕЛОК
<213> Homo sapiens
<400> 25
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
1 5 10 15
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
20 25 30
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
35 40 45
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
50 55 60
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
65 70 75 80
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
85 90 95
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 26
<211> 106
<212> БЕЛОК
<213> Homo sapiens
<400> 26
Gly Gln Pro Lys Ala Asn Pro Thr Val Thr Leu Phe Pro Pro Ser Ser
1 5 10 15
Glu Glu Leu Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp
20 25 30
Phe Tyr Pro Gly Ala Val Thr Val Ala Trp Lys Ala Asp Gly Ser Pro
35 40 45
Val Lys Ala Gly Val Glu Thr Thr Lys Pro Ser Lys Gln Ser Asn Asn
50 55 60
Lys Tyr Ala Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys
65 70 75 80
Ser His Arg Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val
85 90 95
Glu Lys Thr Val Ala Pro Thr Glu Cys Ser
100 105
<210> 27
<211> 444
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 27
Gln Leu Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Gly Thr Tyr
20 25 30
Ser Met Arg Trp Val Arg Gln Val Pro Arg Lys Ala Leu Glu Trp Val
35 40 45
Ser Ser Ile His Thr Asp Gly Gly Gly Thr Ala Tyr Arg Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Asn Leu Lys Pro Glu Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Val Ile Ala Gly Tyr Ser Asp Trp Gly Gln Gly Thr Gln Val Thr Val
100 105 110
Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser
115 120 125
Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys
130 135 140
Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu
145 150 155 160
Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu
165 170 175
Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr
180 185 190
Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val
195 200 205
Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro
210 215 220
Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
290 295 300
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg
340 345 350
Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440
<210> 28
<211> 444
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 28
Gln Leu Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Gly Thr Tyr
20 25 30
Ser Met Arg Trp Val Arg Gln Val Pro Arg Lys Ala Leu Glu Trp Val
35 40 45
Ser Ser Ile His Thr Asp Gly Gly Gly Thr Ala Tyr Arg Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Asn Leu Lys Pro Glu Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Val Ile Ala Gly Tyr Ser Asp Trp Gly Gln Gly Thr Gln Val Thr Val
100 105 110
Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser
115 120 125
Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys
130 135 140
Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu
145 150 155 160
Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu
165 170 175
Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr
180 185 190
Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val
195 200 205
Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro
210 215 220
Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Tyr Ile Thr Arg Glu Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
290 295 300
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg
340 345 350
Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440
<210> 29
<211> 444
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 29
Gln Leu Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Gly Thr Tyr
20 25 30
Ser Met Arg Trp Val Arg Gln Val Pro Arg Lys Ala Leu Glu Trp Val
35 40 45
Ser Ser Ile His Thr Asp Gly Gly Gly Thr Ala Tyr Arg Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Asn Leu Lys Pro Glu Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Val Ile Ala Gly Tyr Ser Asp Trp Gly Gln Gly Thr Gln Val Thr Val
100 105 110
Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser
115 120 125
Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys
130 135 140
Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu
145 150 155 160
Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu
165 170 175
Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr
180 185 190
Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val
195 200 205
Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro
210 215 220
Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
290 295 300
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg
340 345 350
Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu Lys Phe His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440
<210> 30
<211> 444
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 30
Gln Leu Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Gly Thr Tyr
20 25 30
Ser Met Arg Trp Val Arg Gln Val Pro Arg Lys Ala Leu Glu Trp Val
35 40 45
Ser Ser Ile His Thr Asp Gly Gly Gly Thr Ala Tyr Arg Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Asn Leu Lys Pro Glu Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Val Ile Ala Gly Tyr Ser Asp Trp Gly Gln Gly Thr Gln Val Thr Val
100 105 110
Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser
115 120 125
Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys
130 135 140
Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu
145 150 155 160
Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu
165 170 175
Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr
180 185 190
Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val
195 200 205
Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro
210 215 220
Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
290 295 300
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg
340 345 350
Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Leu His Glu Ala Leu His Ser His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440
<210> 31
<211> 444
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 31
Gln Leu Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Gly Thr Tyr
20 25 30
Ser Met Arg Trp Val Arg Gln Val Pro Arg Lys Ala Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Thr Asp Gly Gly Gly Thr Ala Tyr Arg Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Asn Leu Lys Pro Glu Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Val Ile His Gly Tyr Ser Asp Trp Gly Gln Gly Thr Gln Val Thr Val
100 105 110
Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser
115 120 125
Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys
130 135 140
Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu
145 150 155 160
Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu
165 170 175
Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr
180 185 190
Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val
195 200 205
Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro
210 215 220
Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
290 295 300
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg
340 345 350
Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440
<210> 32
<211> 444
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 32
Gln Leu Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Gly Thr Tyr
20 25 30
Ser Met Arg Trp Val Arg Gln Val Pro Arg Lys Ala Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Thr Asp Gly Gly Gly Thr Ala Tyr Arg Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Asn Leu Lys Pro Glu Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Val Ile His Gly Tyr Ser Asp Trp Gly Gln Gly Thr Gln Val Thr Val
100 105 110
Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser
115 120 125
Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys
130 135 140
Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu
145 150 155 160
Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu
165 170 175
Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr
180 185 190
Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val
195 200 205
Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro
210 215 220
Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Tyr Ile Thr Arg Glu Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
290 295 300
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg
340 345 350
Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440
<210> 33
<211> 444
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 33
Gln Leu Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Gly Thr Tyr
20 25 30
Ser Met Arg Trp Val Arg Gln Val Pro Arg Lys Ala Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Thr Asp Gly Gly Gly Thr Ala Tyr Arg Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Asn Leu Lys Pro Glu Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Val Ile His Gly Tyr Ser Asp Trp Gly Gln Gly Thr Gln Val Thr Val
100 105 110
Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser
115 120 125
Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys
130 135 140
Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu
145 150 155 160
Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu
165 170 175
Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr
180 185 190
Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val
195 200 205
Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro
210 215 220
Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
290 295 300
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg
340 345 350
Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu Lys Phe His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440
<210> 34
<211> 444
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 34
Gln Leu Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Gly Thr Tyr
20 25 30
Ser Met Arg Trp Val Arg Gln Val Pro Arg Lys Ala Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Thr Asp Gly Gly Gly Thr Ala Tyr Arg Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Asn Leu Lys Pro Glu Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Val Ile His Gly Tyr Ser Asp Trp Gly Gln Gly Thr Gln Val Thr Val
100 105 110
Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser
115 120 125
Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys
130 135 140
Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu
145 150 155 160
Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu
165 170 175
Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr
180 185 190
Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val
195 200 205
Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro
210 215 220
Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
290 295 300
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg
340 345 350
Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Leu His Glu Ala Leu His Ser His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440
<210> 35
<211> 219
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 35
Ala Thr Met Leu Thr Gln Ser Pro Gly Ser Leu Ser Val Val Pro Gly
1 5 10 15
Glu Ser Ala Ser Ile Ser Cys Lys Thr Ser Gln Gly Leu Val His Ser
20 25 30
Asp Gly Lys Thr Tyr Phe Tyr Trp Phe Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Gln Leu Ile Tyr Gln Val Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Gly Val Lys Ala Glu Asp Ala Gly Val Tyr Tyr Cys Ala His Gly
85 90 95
Thr Tyr Tyr Pro His Thr Phe Gly Ser Gly Thr Arg Leu Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
115 120 125
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
130 135 140
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
145 150 155 160
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
180 185 190
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
195 200 205
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 36
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
пептид"
<400> 36
Ser Ile His Thr Gly Gly Gly Gly Thr Ala Tyr Arg Asp Ser Val Lys
1 5 10 15
Gly
<210> 37
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
пептид"
<400> 37
Ser Ile His Thr Glu Ala Gly Gly Thr Ala Tyr Arg Asp Ser Val Lys
1 5 10 15
Gly
<210> 38
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
пептид"
<400> 38
Ser Ile His Thr Asp Ala Gly Gly Thr Ala Tyr Arg Asp Ser Val Lys
1 5 10 15
Gly
<210> 39
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
пептид"
<400> 39
Ser Ile His Thr Glu Gly Gly Gly Thr Ala Tyr Arg Asp Ser Val Lys
1 5 10 15
Gly
<210> 40
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
пептид"
<400> 40
Lys Thr Ser Gln Gly Leu Val His Ser Gly Gly Lys Thr Tyr Phe Tyr
1 5 10 15
<210> 41
<400> 41
000
<210> 42
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 42
Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu
1 5 10 15
Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr Ser Met
20 25 30
Arg Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ser Ser
35 40 45
Ile His Thr Gly Gly Gly Gly Thr Ala Tyr Arg Asp Ser Val Lys Gly
50 55 60
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr Leu Gln
65 70 75 80
Met Asn Asn Leu Arg Ala Glu Asp Thr Ala Ile Tyr Tyr Cys Val Ile
85 90 95
Ala Gly Tyr Ser Asp Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
100 105 110
<210> 43
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 43
Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu
1 5 10 15
Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Gly Thr Tyr Ser Met
20 25 30
Arg Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ser Ser
35 40 45
Ile His Thr Glu Ala Gly Gly Thr Ala Tyr Arg Asp Ser Val Lys Gly
50 55 60
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr Leu Gln
65 70 75 80
Met Asn Asn Leu Lys Ala Glu Asp Thr Ala Ile Tyr Tyr Cys Val Ile
85 90 95
Ala Gly Tyr Ser Asp Trp Gly Gln Gly Thr Gln Val Thr Val Ser Ser
100 105 110
<210> 44
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 44
Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu
1 5 10 15
Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr Ser Met
20 25 30
Arg Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ser Ser
35 40 45
Ile His Thr Glu Ala Gly Gly Thr Ala Tyr Arg Asp Ser Val Lys Gly
50 55 60
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr Leu Gln
65 70 75 80
Met Asn Asn Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Val Ile
85 90 95
Ala Gly Tyr Ser Asp Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
100 105 110
<210> 45
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 45
Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu
1 5 10 15
Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr Ser Met
20 25 30
Arg Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ser Ser
35 40 45
Ile His Thr Asp Ala Gly Gly Thr Ala Tyr Arg Asp Ser Val Lys Gly
50 55 60
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr Leu Gln
65 70 75 80
Met Asn Asn Leu Arg Pro Glu Asp Thr Ala Val Tyr Tyr Cys Val Ile
85 90 95
Ala Gly Tyr Ser Asp Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
100 105 110
<210> 46
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 46
Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu
1 5 10 15
Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Gly Thr Tyr Ser Met
20 25 30
Arg Trp Val Arg Gln Val Pro Gly Lys Gly Leu Glu Trp Val Ser Ser
35 40 45
Ile His Thr Glu Gly Gly Gly Thr Ala Tyr Arg Asp Ser Val Lys Gly
50 55 60
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr Leu Gln
65 70 75 80
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Ile Tyr Tyr Cys Val Ile
85 90 95
Ala Gly Tyr Ser Asp Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
100 105 110
<210> 47
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 47
Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu
1 5 10 15
Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Gly Thr Tyr Ser Met
20 25 30
Arg Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ser Ser
35 40 45
Ile His Thr Glu Gly Gly Gly Thr Ala Tyr Arg Asp Ser Val Lys Gly
50 55 60
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr Leu Gln
65 70 75 80
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Ile Tyr Tyr Cys Val Ile
85 90 95
Ala Gly Tyr Ser Asp Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
100 105 110
<210> 48
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 48
Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu
1 5 10 15
Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Gly Thr Tyr Ser Met
20 25 30
Arg Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ser Ser
35 40 45
Ile His Thr Glu Gly Gly Gly Thr Ala Tyr Arg Asp Ser Val Lys Gly
50 55 60
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr Leu Gln
65 70 75 80
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Val Ile
85 90 95
Ala Gly Tyr Ser Asp Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
100 105 110
<210> 49
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 49
Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu
1 5 10 15
Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr Ser Met
20 25 30
Arg Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ser Ser
35 40 45
Ile His Thr Asp Ala Gly Gly Thr Ala Tyr Arg Asp Ser Val Lys Gly
50 55 60
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr Leu Gln
65 70 75 80
Met Asn Asn Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Val Ile
85 90 95
Ala Gly Tyr Ser Asp Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
100 105 110
<210> 50
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 50
Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu
1 5 10 15
Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr Ser Met
20 25 30
Arg Trp Val Arg Gln Val Pro Gly Lys Gly Leu Glu Trp Val Ser Ser
35 40 45
Ile His Thr Glu Gly Gly Gly Thr Ala Tyr Arg Asp Ser Val Lys Gly
50 55 60
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr Leu Gln
65 70 75 80
Met Asn Asn Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Val Ile
85 90 95
Ala Gly Tyr Ser Asp Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
100 105 110
<210> 51
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 51
Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu
1 5 10 15
Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr Ser Met
20 25 30
Arg Trp Val Arg Gln Val Pro Gly Lys Gly Leu Glu Trp Val Ser Ser
35 40 45
Ile His Thr Asp Ala Gly Gly Thr Ala Tyr Arg Asp Ser Val Lys Gly
50 55 60
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr Leu Gln
65 70 75 80
Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Ile Tyr Tyr Cys Val Ile
85 90 95
Ala Gly Tyr Ser Asp Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
100 105 110
<210> 52
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 52
Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu
1 5 10 15
Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr Ser Met
20 25 30
Arg Trp Val Arg Gln Val Pro Gly Lys Gly Leu Glu Trp Val Ser Ser
35 40 45
Ile His Thr Glu Gly Gly Gly Thr Ala Tyr Arg Asp Ser Val Lys Gly
50 55 60
Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln
65 70 75 80
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Val Ile
85 90 95
Ala Gly Tyr Ser Asp Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
100 105 110
<210> 53
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 53
Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu
1 5 10 15
Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Gly Thr Tyr Ser Met
20 25 30
Arg Trp Val Arg Gln Val Pro Gly Lys Gly Leu Glu Trp Val Ser Ser
35 40 45
Ile His Thr Glu Gly Gly Gly Thr Ala Tyr Arg Asp Ser Val Lys Gly
50 55 60
Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln
65 70 75 80
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Val Ile
85 90 95
Ala Gly Tyr Ser Asp Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
100 105 110
<210> 54
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 54
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Ser Ala Ser Ile Ser Cys Lys Thr Ser Gln Gly Leu Val His Ser
20 25 30
Asp Gly Lys Thr Tyr Phe Tyr Trp Phe Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Gln Leu Ile Tyr Gln Val Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Lys Ala Glu Asp Ala Gly Val Tyr Tyr Cys Ala His Gly
85 90 95
Thr Tyr Tyr Pro His Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys
100 105 110
<210> 55
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 55
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Ser Ala Ser Ile Ser Cys Lys Thr Ser Gln Gly Leu Val His Ser
20 25 30
Gly Gly Lys Thr Tyr Phe Tyr Trp Phe Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Gln Leu Ile Tyr Gln Val Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Ala Gly Val Tyr Tyr Cys Ala His Gly
85 90 95
Thr Tyr Tyr Pro His Thr Phe Gly Ser Gly Thr Arg Leu Glu Ile Lys
100 105 110
<210> 56
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 56
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Lys Thr Ser Gln Gly Leu Val His Ser
20 25 30
Gly Gly Lys Thr Tyr Phe Tyr Trp Phe Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Gln Leu Ile Tyr Gln Val Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Ala Gly Val Tyr Tyr Cys Ala His Gly
85 90 95
Thr Tyr Tyr Pro His Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys
100 105 110
<210> 57
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 57
Asp Ile Val Met Thr Gln Ser Pro Gly Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Lys Thr Ser Gln Gly Leu Val His Ser
20 25 30
Gly Gly Lys Thr Tyr Phe Tyr Trp Phe Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Gln Leu Ile Tyr Gln Val Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Gly Val Glu Ala Glu Asp Ala Gly Val Tyr Tyr Cys Ala His Gly
85 90 95
Thr Tyr Tyr Pro His Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys
100 105 110
<210> 58
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 58
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Ser Ala Ser Ile Ser Cys Lys Thr Ser Gln Gly Leu Val His Ser
20 25 30
Asp Gly Lys Thr Tyr Phe Tyr Trp Phe Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Gln Leu Ile Tyr Gln Val Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Lys Ala Glu Asp Ala Gly Val Tyr Tyr Cys Ala His Gly
85 90 95
Thr Tyr Tyr Pro His Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys
100 105 110
<210> 59
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 59
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Ser Val Val Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Lys Thr Ser Gln Gly Leu Val His Ser
20 25 30
Asp Gly Lys Thr Tyr Phe Tyr Trp Phe Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Gln Leu Ile Tyr Gln Val Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ala His Gly
85 90 95
Thr Tyr Tyr Pro His Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys
100 105 110
<210> 60
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 60
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Lys Thr Ser Gln Gly Leu Val His Ser
20 25 30
Asp Gly Lys Thr Tyr Phe Tyr Trp Phe Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Gln Leu Ile Tyr Gln Val Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ala His Gly
85 90 95
Thr Tyr Tyr Pro His Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys
100 105 110
<210> 61
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 61
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Lys Thr Ser Gln Gly Leu Val His Ser
20 25 30
Asp Gly Lys Thr Tyr Phe Tyr Trp Phe Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Gln Leu Ile Tyr Gln Val Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Lys Ala Glu Asp Val Gly Val Tyr Tyr Cys Ala His Gly
85 90 95
Thr Tyr Tyr Pro His Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys
100 105 110
<210> 62
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 62
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Lys Thr Ser Gln Gly Leu Val His Ser
20 25 30
Asp Gly Lys Thr Tyr Phe Tyr Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Gln Val Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ala His Gly
85 90 95
Thr Tyr Tyr Pro His Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys
100 105 110
<210> 63
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 63
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Ser Ala Ser Ile Ser Cys Lys Thr Ser Gln Gly Leu Val His Ser
20 25 30
Gly Gly Lys Thr Tyr Phe Tyr Trp Phe Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Gln Leu Ile Tyr Gln Val Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Ala Gly Val Tyr Tyr Cys Ala Gln Gly
85 90 95
Thr Tyr Tyr Pro His Thr Phe Gly Ser Gly Thr Arg Leu Glu Ile Lys
100 105 110
<210> 64
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=»»Описание искусственной последовательности: синтетический
полипептид”
<400> 64
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Lys Thr Ser Gln Gly Leu Val His Ser
20 25 30
Gly Gly Lys Thr Tyr Phe Tyr Trp Phe Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Gln Leu Ile Tyr Gln Val Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Ala Gly Val Tyr Tyr Cys Ala Gln Gly
85 90 95
Thr Tyr Tyr Pro His Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys
100 105 110
<210> 65
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 65
Asp Ile Val Met Thr Gln Ser Pro Gly Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Lys Thr Ser Gln Gly Leu Val His Ser
20 25 30
Gly Gly Lys Thr Tyr Phe Tyr Trp Phe Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Gln Leu Ile Tyr Gln Val Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Gly Val Glu Ala Glu Asp Ala Gly Val Tyr Tyr Cys Ala Gln Gly
85 90 95
Thr Tyr Tyr Pro His Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys
100 105 110
<210> 66
<211> 441
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 66
Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu
1 5 10 15
Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr Ser Met
20 25 30
Arg Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ser Ser
35 40 45
Ile His Thr Gly Gly Gly Gly Thr Ala Tyr Arg Asp Ser Val Lys Gly
50 55 60
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr Leu Gln
65 70 75 80
Met Asn Asn Leu Arg Ala Glu Asp Thr Ala Ile Tyr Tyr Cys Val Ile
85 90 95
Ala Gly Tyr Ser Asp Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
100 105 110
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
115 120 125
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
130 135 140
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
145 150 155 160
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
165 170 175
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
180 185 190
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
195 200 205
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
210 215 220
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
225 230 235 240
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
245 250 255
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
260 265 270
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
275 280 285
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
290 295 300
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
305 310 315 320
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
325 330 335
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu
340 345 350
Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
355 360 365
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
370 375 380
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
385 390 395 400
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
405 410 415
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
420 425 430
Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440
<210> 67
<211> 441
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 67
Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu
1 5 10 15
Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr Ser Met
20 25 30
Arg Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ser Ser
35 40 45
Ile His Thr Gly Gly Gly Gly Thr Ala Tyr Arg Asp Ser Val Lys Gly
50 55 60
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr Leu Gln
65 70 75 80
Met Asn Asn Leu Arg Ala Glu Asp Thr Ala Ile Tyr Tyr Cys Val Ile
85 90 95
Ala Gly Tyr Ser Asp Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
100 105 110
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
115 120 125
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
130 135 140
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
145 150 155 160
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
165 170 175
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
180 185 190
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
195 200 205
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
210 215 220
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
225 230 235 240
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
245 250 255
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
260 265 270
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
275 280 285
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
290 295 300
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
305 310 315 320
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
325 330 335
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu
340 345 350
Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
355 360 365
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
370 375 380
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
385 390 395 400
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
405 410 415
Val Phe Ser Cys Ser Val Leu His Glu Ala Leu His Ser His Tyr Thr
420 425 430
Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440
<210> 68
<211> 441
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 68
Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu
1 5 10 15
Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr Ser Met
20 25 30
Arg Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ser Ser
35 40 45
Ile His Thr Gly Gly Gly Gly Thr Ala Tyr Arg Asp Ser Val Lys Gly
50 55 60
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr Leu Gln
65 70 75 80
Met Asn Asn Leu Arg Ala Glu Asp Thr Ala Ile Tyr Tyr Cys Val Ile
85 90 95
Ala Gly Tyr Ser Asp Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
100 105 110
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
115 120 125
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
130 135 140
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
145 150 155 160
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
165 170 175
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
180 185 190
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
195 200 205
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
210 215 220
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
225 230 235 240
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
245 250 255
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
260 265 270
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
275 280 285
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
290 295 300
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
305 310 315 320
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
325 330 335
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu
340 345 350
Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
355 360 365
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
370 375 380
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
385 390 395 400
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
405 410 415
Val Phe Ser Cys Ser Val Met His Glu Ala Leu Lys Phe His Tyr Thr
420 425 430
Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440
<210> 69
<211> 441
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 69
Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu
1 5 10 15
Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr Ser Met
20 25 30
Arg Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ser Ser
35 40 45
Ile His Thr Gly Gly Gly Gly Thr Ala Tyr Arg Asp Ser Val Lys Gly
50 55 60
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr Leu Gln
65 70 75 80
Met Asn Asn Leu Arg Ala Glu Asp Thr Ala Ile Tyr Tyr Cys Val Ile
85 90 95
Ala Gly Tyr Ser Asp Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
100 105 110
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
115 120 125
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
130 135 140
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
145 150 155 160
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
165 170 175
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
180 185 190
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
195 200 205
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
210 215 220
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
225 230 235 240
Lys Pro Lys Asp Thr Leu Tyr Ile Thr Arg Glu Pro Glu Val Thr Cys
245 250 255
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
260 265 270
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
275 280 285
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
290 295 300
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
305 310 315 320
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
325 330 335
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu
340 345 350
Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
355 360 365
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
370 375 380
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
385 390 395 400
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
405 410 415
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
420 425 430
Gln Lys Ser Leu Ser Leu Ser Pro Gly
435 440
<210> 70
<211> 438
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 70
Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu
1 5 10 15
Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr Ser Met
20 25 30
Arg Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ser Ser
35 40 45
Ile His Thr Gly Gly Gly Gly Thr Ala Tyr Arg Asp Ser Val Lys Gly
50 55 60
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr Leu Gln
65 70 75 80
Met Asn Asn Leu Arg Ala Glu Asp Thr Ala Ile Tyr Tyr Cys Val Ile
85 90 95
Ala Gly Tyr Ser Asp Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
100 105 110
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
115 120 125
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
130 135 140
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
145 150 155 160
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
165 170 175
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
180 185 190
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
195 200 205
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
210 215 220
Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
225 230 235 240
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
245 250 255
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
260 265 270
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
275 280 285
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
290 295 300
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
305 310 315 320
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
325 330 335
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
340 345 350
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
355 360 365
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
370 375 380
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
385 390 395 400
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
405 410 415
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
420 425 430
Leu Ser Leu Ser Leu Gly
435
<210> 71
<211> 438
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 71
Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu
1 5 10 15
Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr Ser Met
20 25 30
Arg Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ser Ser
35 40 45
Ile His Thr Gly Gly Gly Gly Thr Ala Tyr Arg Asp Ser Val Lys Gly
50 55 60
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr Leu Gln
65 70 75 80
Met Asn Asn Leu Arg Ala Glu Asp Thr Ala Ile Tyr Tyr Cys Val Ile
85 90 95
Ala Gly Tyr Ser Asp Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
100 105 110
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
115 120 125
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
130 135 140
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
145 150 155 160
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
165 170 175
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
180 185 190
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
195 200 205
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
210 215 220
Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
225 230 235 240
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
245 250 255
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
260 265 270
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
275 280 285
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
290 295 300
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
305 310 315 320
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
325 330 335
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
340 345 350
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
355 360 365
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
370 375 380
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
385 390 395 400
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
405 410 415
Cys Ser Val Leu His Glu Ala Leu His Ser His Tyr Thr Gln Lys Ser
420 425 430
Leu Ser Leu Ser Leu Gly
435
<210> 72
<211> 438
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 72
Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu
1 5 10 15
Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr Ser Met
20 25 30
Arg Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ser Ser
35 40 45
Ile His Thr Gly Gly Gly Gly Thr Ala Tyr Arg Asp Ser Val Lys Gly
50 55 60
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr Leu Gln
65 70 75 80
Met Asn Asn Leu Arg Ala Glu Asp Thr Ala Ile Tyr Tyr Cys Val Ile
85 90 95
Ala Gly Tyr Ser Asp Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
100 105 110
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
115 120 125
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
130 135 140
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
145 150 155 160
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
165 170 175
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
180 185 190
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
195 200 205
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
210 215 220
Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
225 230 235 240
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
245 250 255
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
260 265 270
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
275 280 285
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
290 295 300
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
305 310 315 320
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
325 330 335
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
340 345 350
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
355 360 365
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
370 375 380
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
385 390 395 400
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
405 410 415
Cys Ser Val Met His Glu Ala Leu Lys Phe His Tyr Thr Gln Lys Ser
420 425 430
Leu Ser Leu Ser Leu Gly
435
<210> 73
<211> 438
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 73
Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu
1 5 10 15
Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Thr Tyr Ser Met
20 25 30
Arg Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ser Ser
35 40 45
Ile His Thr Gly Gly Gly Gly Thr Ala Tyr Arg Asp Ser Val Lys Gly
50 55 60
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr Leu Gln
65 70 75 80
Met Asn Asn Leu Arg Ala Glu Asp Thr Ala Ile Tyr Tyr Cys Val Ile
85 90 95
Ala Gly Tyr Ser Asp Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
100 105 110
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
115 120 125
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
130 135 140
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
145 150 155 160
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
165 170 175
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
180 185 190
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
195 200 205
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
210 215 220
Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
225 230 235 240
Asp Thr Leu Tyr Ile Thr Arg Glu Pro Glu Val Thr Cys Val Val Val
245 250 255
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
260 265 270
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
275 280 285
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
290 295 300
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
305 310 315 320
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
325 330 335
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
340 345 350
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
355 360 365
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
370 375 380
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
385 390 395 400
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
405 410 415
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
420 425 430
Leu Ser Leu Ser Leu Gly
435
<210> 74
<211> 219
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 74
Asp Ile Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Ser Ala Ser Ile Ser Cys Lys Thr Ser Gln Gly Leu Val His Ser
20 25 30
Asp Gly Lys Thr Tyr Phe Tyr Trp Phe Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Gln Leu Ile Tyr Gln Val Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Lys Ala Glu Asp Ala Gly Val Tyr Tyr Cys Ala His Gly
85 90 95
Thr Tyr Tyr Pro His Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
115 120 125
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
130 135 140
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
145 150 155 160
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
180 185 190
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
195 200 205
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 75
<211> 329
<212> БЕЛОК
<213> Homo sapiens
<400> 75
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu
225 230 235 240
Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly
325
<210> 76
<211> 329
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 76
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Tyr Ile Thr Arg Glu Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu
225 230 235 240
Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly
325
<210> 77
<211> 329
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 77
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu
225 230 235 240
Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu Lys Phe His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly
325
<210> 78
<211> 329
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 78
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu
225 230 235 240
Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Leu His Glu Ala Leu His Ser His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly
325
<210> 79
<211> 327
<212> БЕЛОК
<213> Homo sapiens
<400> 79
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
100 105 110
Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
165 170 175
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
305 310 315 320
Leu Ser Leu Ser Leu Gly Lys
325
<210> 80
<211> 326
<212> БЕЛОК
<213> Homo sapiens
<400> 80
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
100 105 110
Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
165 170 175
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
305 310 315 320
Leu Ser Leu Ser Leu Gly
325
<210> 81
<211> 327
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 81
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
100 105 110
Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Tyr Ile Thr Arg Glu Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
165 170 175
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
305 310 315 320
Leu Ser Leu Ser Leu Gly Lys
325
<210> 82
<211> 326
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 82
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
100 105 110
Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Tyr Ile Thr Arg Glu Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
165 170 175
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
305 310 315 320
Leu Ser Leu Ser Leu Gly
325
<210> 83
<211> 327
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 83
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
100 105 110
Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
165 170 175
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Met His Glu Ala Leu Lys Phe His Tyr Thr Gln Lys Ser
305 310 315 320
Leu Ser Leu Ser Leu Gly Lys
325
<210> 84
<211> 326
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 84
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
100 105 110
Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
165 170 175
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Met His Glu Ala Leu Lys Phe His Tyr Thr Gln Lys Ser
305 310 315 320
Leu Ser Leu Ser Leu Gly
325
<210> 85
<211> 327
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 85
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
100 105 110
Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
165 170 175
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Leu His Glu Ala Leu His Ser His Tyr Thr Gln Lys Ser
305 310 315 320
Leu Ser Leu Ser Leu Gly Lys
325
<210> 86
<211> 326
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<400> 86
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
100 105 110
Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
165 170 175
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Leu His Glu Ala Leu His Ser His Tyr Thr Gln Lys Ser
305 310 315 320
Leu Ser Leu Ser Leu Gly
325
<210> 87
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
пептид"
<220>
<221> MOD_RES
<222> (5)..(5)
<223> G, E или D
<220>
<221> MOD_RES
<222> (6)..(6)
<223> G или A
<400> 87
Ser Ile His Thr Xaa Xaa Gly Gly Thr Ala Tyr Arg Asp Ser Val Lys
1 5 10 15
Gly
<210> 88
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
пептид"
<220>
<221> MOD_RES
<222> (10)..(10)
<223> D или G
<400> 88
Lys Thr Ser Gln Gly Leu Val His Ser Xaa Gly Lys Thr Tyr Phe Tyr
1 5 10 15
<210> 89
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<220>
<221> MOD_RES
<222> (3)..(3)
<223> V или L
<220>
<221> MOD_RES
<222> (28)..(28)
<223> G или S
<220>
<221> MOD_RES
<222> (38)..(38)
<223> V или A
<220>
<221> MOD_RES
<222> (52)..(52)
<223> G, E или D
<220>
<221> MOD_RES
<222> (53)..(53)
<223> G или A
<220>
<221> MOD_RES
<222> (73)..(73)
<223> A или S
<220>
<221> MOD_RES
<222> (83)..(83)
<223> S или N
<220>
<221> MOD_RES
<222> (85)..(85)
<223> R или K
<220>
<221> MOD_RES
<222> (86)..(86)
<223> A или P
<220>
<221> MOD_RES
<222> (91)..(91)
<223> I или V
<220>
<221> MOD_RES
<222> (107)..(107)
<223> L или Q
<400> 89
Gln Leu Xaa Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu
1 5 10 15
Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Xaa Thr Tyr Ser Met
20 25 30
Arg Trp Val Arg Gln Xaa Pro Gly Lys Gly Leu Glu Trp Val Ser Ser
35 40 45
Ile His Thr Xaa Xaa Gly Gly Thr Ala Tyr Arg Asp Ser Val Lys Gly
50 55 60
Arg Phe Thr Ile Ser Arg Asp Asn Xaa Lys Asn Thr Leu Tyr Leu Gln
65 70 75 80
Met Asn Xaa Leu Xaa Xaa Glu Asp Thr Ala Xaa Tyr Tyr Cys Val Ile
85 90 95
Ala Gly Tyr Ser Asp Trp Gly Gln Gly Thr Xaa Val Thr Val Ser Ser
100 105 110
<210> 90
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<220>
<221> MOD_RES
<222> (28)..(28)
<223> G или S
<220>
<221> MOD_RES
<222> (38)..(38)
<223> V или A
<220>
<221> MOD_RES
<222> (52)..(52)
<223> G, E или D
<220>
<221> MOD_RES
<222> (53)..(53)
<223> G или A
<220>
<221> MOD_RES
<222> (83)..(83)
<223> S или N
<220>
<221> MOD_RES
<222> (85)..(85)
<223> R или K
<220>
<221> MOD_RES
<222> (86)..(86)
<223> A или P
<220>
<221> MOD_RES
<222> (91)..(91)
<223> I или V
<220>
<221> MOD_RES
<222> (107)..(107)
<223> L или Q
<400> 90
Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser Leu
1 5 10 15
Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Xaa Thr Tyr Ser Met
20 25 30
Arg Trp Val Arg Gln Xaa Pro Gly Lys Gly Leu Glu Trp Val Ser Ser
35 40 45
Ile His Thr Xaa Xaa Gly Gly Thr Ala Tyr Arg Asp Ser Val Lys Gly
50 55 60
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr Leu Gln
65 70 75 80
Met Asn Xaa Leu Xaa Xaa Glu Asp Thr Ala Xaa Tyr Tyr Cys Val Ile
85 90 95
Ala Gly Tyr Ser Asp Trp Gly Gln Gly Thr Xaa Val Thr Val Ser Ser
100 105 110
<210> 91
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<220>
<221> MOD_RES
<222> (9)..(9)
<223> L или G
<220>
<221> MOD_RES
<222> (12)..(12)
<223> P или S
<220>
<221> MOD_RES
<222> (14)..(14)
<223> T или V
<220>
<221> MOD_RES
<222> (33)..(33)
<223> D или G
<220>
<221> MOD_RES
<222> (51)..(51)
<223> Q или L
<220>
<221> MOD_RES
<222> (68)..(68)
<223> S или T
<220>
<221> MOD_RES
<222> (82)..(82)
<223> R или G
<220>
<221> MOD_RES
<222> (84)..(84)
<223> K или E
<220>
<221> MOD_RES
<222> (88)..(88)
<223> A или V
<220>
<221> MOD_RES
<222> (95)..(95)
<223> H или Q
<220>
<221> MOD_RES
<222> (105)..(105)
<223> Q или S
<400> 91
Asp Ile Val Met Thr Gln Ser Pro Xaa Ser Leu Xaa Val Xaa Pro Gly
1 5 10 15
Glu Ser Ala Ser Ile Ser Cys Lys Thr Ser Gln Gly Leu Val His Ser
20 25 30
Xaa Gly Lys Thr Tyr Phe Tyr Trp Phe Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Xaa Leu Ile Tyr Gln Val Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Xaa Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Xaa Val Xaa Ala Glu Asp Xaa Gly Val Tyr Tyr Cys Ala Xaa Gly
85 90 95
Thr Tyr Tyr Pro His Thr Phe Gly Xaa Gly Thr Arg Leu Glu Ile Lys
100 105 110
<210> 92
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
полипептид"
<220>
<221> MOD_RES
<222> (9)..(9)
<223> L или G
<220>
<221> MOD_RES
<222> (12)..(12)
<223> P или S
<220>
<221> MOD_RES
<222> (14)..(14)
<223> T или V
<220>
<221> MOD_RES
<222> (33)..(33)
<223> D или G
<220>
<221> MOD_RES
<222> (68)..(68)
<223> S или T
<220>
<221> MOD_RES
<222> (82)..(82)
<223> R или G
<220>
<221> MOD_RES
<222> (84)..(84)
<223> K или E
<220>
<221> MOD_RES
<222> (88)..(88)
<223> A или V
<220>
<221> MOD_RES
<222> (95)..(95)
<223> H или Q
<220>
<221> MOD_RES
<222> (105)..(105)
<223> Q или S
<400> 92
Asp Ile Val Met Thr Gln Ser Pro Xaa Ser Leu Xaa Val Xaa Pro Gly
1 5 10 15
Glu Ser Ala Ser Ile Ser Cys Lys Thr Ser Gln Gly Leu Val His Ser
20 25 30
Xaa Gly Lys Thr Tyr Phe Tyr Trp Phe Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Gln Leu Ile Tyr Gln Val Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Xaa Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Xaa Val Xaa Ala Glu Asp Xaa Gly Val Tyr Tyr Cys Ala Xaa Gly
85 90 95
Thr Tyr Tyr Pro His Thr Phe Gly Xaa Gly Thr Arg Leu Glu Ile Lys
100 105 110
<210> 93
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание=""Описание искусственной последовательности: синтетический
пептид"
<220>
<221> MOD_RES
<222> (3)..(3)
<223> S или H
<220>
<221> MOD_RES
<222> (5)..(5)
<223> G, E или D
<220>
<221> MOD_RES
<222> (6)..(6)
<223> G или A
<400> 93
Ser Ile Xaa Thr Xaa Xaa Gly Gly Thr Ala Tyr Arg Asp Ser Val Lys
1 5 10 15
Gly
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИТЕЛА К РЕЦЕПТОРУ IL4 ДЛЯ ПРИМЕНЕНИЯ В ВЕТЕРИНАРИИ | 2019 |
|
RU2837141C2 |
| БИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО ПРОТИВ ВИРУСА БЕШЕНСТВА И ЕГО ПРИМЕНЕНИЕ | 2019 |
|
RU2764740C1 |
| АНТИ-IL31 АНТИТЕЛА ДЛЯ ПРИМЕНЕНИЯ В ВЕТЕРИНАРИИ | 2020 |
|
RU2835543C1 |
| Биспецифическое антитело анти-HER2/анти-4-1BB и его применение | 2020 |
|
RU2831838C2 |
| ТЕРАПЕВТИЧЕСКИЕ АНТИТЕЛА ПРОТИВ ЛИГАНДА CD40 | 2018 |
|
RU2770209C2 |
| НАЦЕЛЕННЫЕ НА ОПУХОЛЬ АГОНИСТИЧЕСКИЕ CD28-АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ | 2019 |
|
RU2837821C1 |
| ИНДУЦИРУЮЩИЙ ЦИТОТОКСИЧНОСТЬ ТЕРАПЕВТИЧЕСКИЙ АГЕНТ | 2015 |
|
RU2743464C2 |
| АНТИТЕЛО К CLDN-18.2 И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2829997C1 |
| КОНСТРУКЦИИ СЛИТОГО БЕЛКА ДЛЯ ЗАБОЛЕВАНИЯ, СВЯЗАННОГО С КОМПЛЕМЕНТОМ | 2019 |
|
RU2824402C2 |
| БИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО АНТИ-EGFR/АНТИ-4-1ВВ И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2831836C2 |
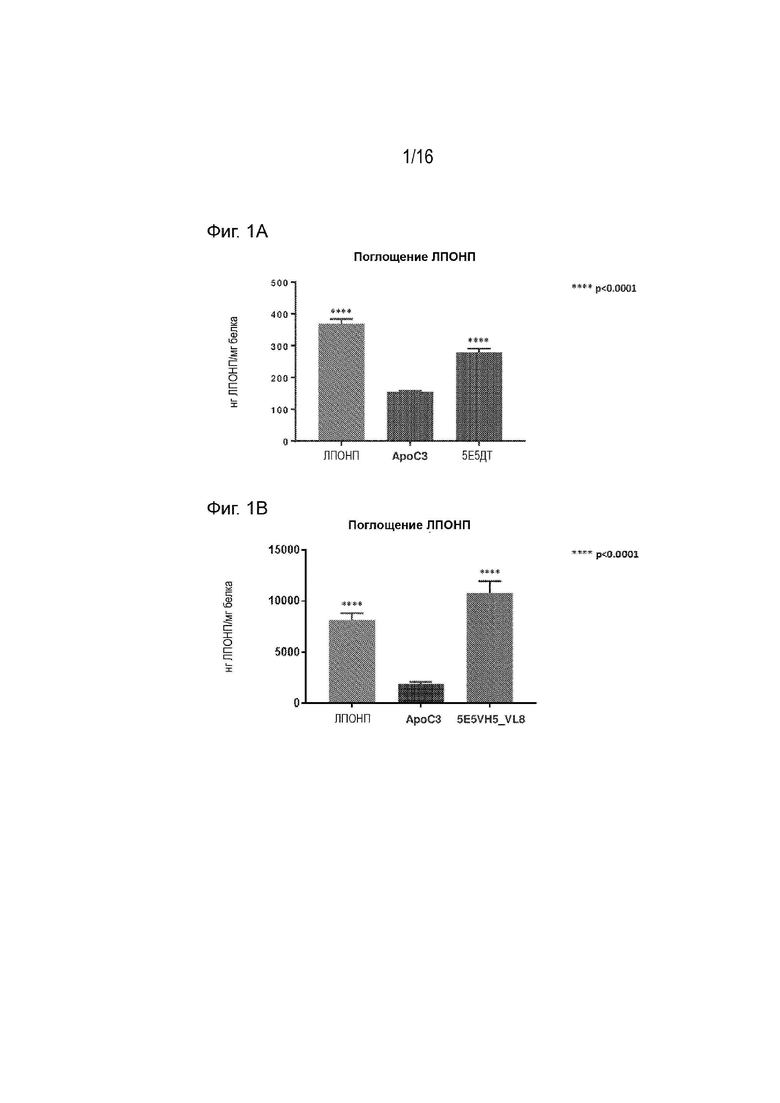
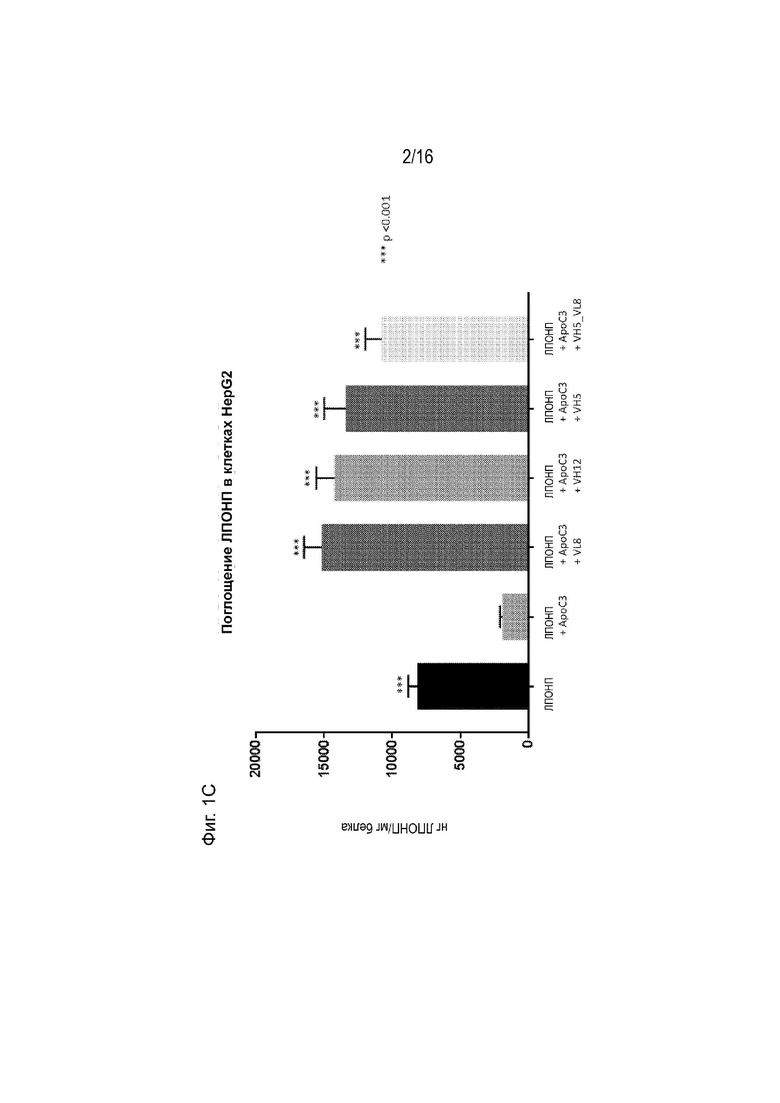
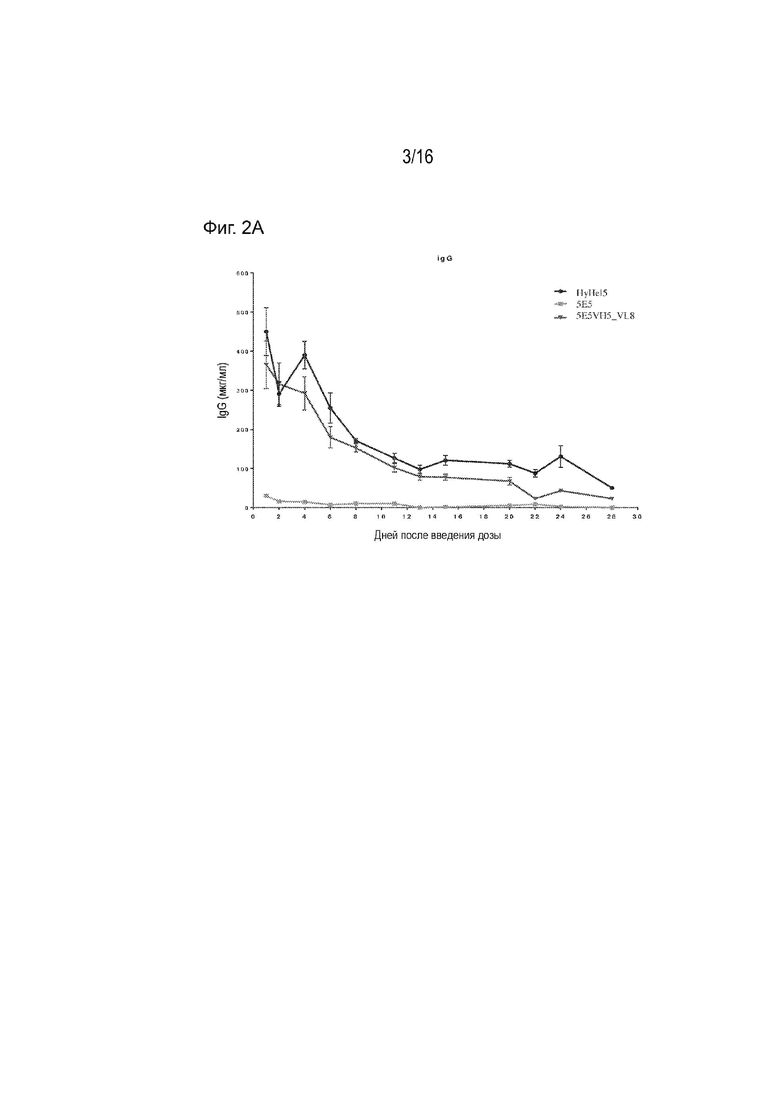
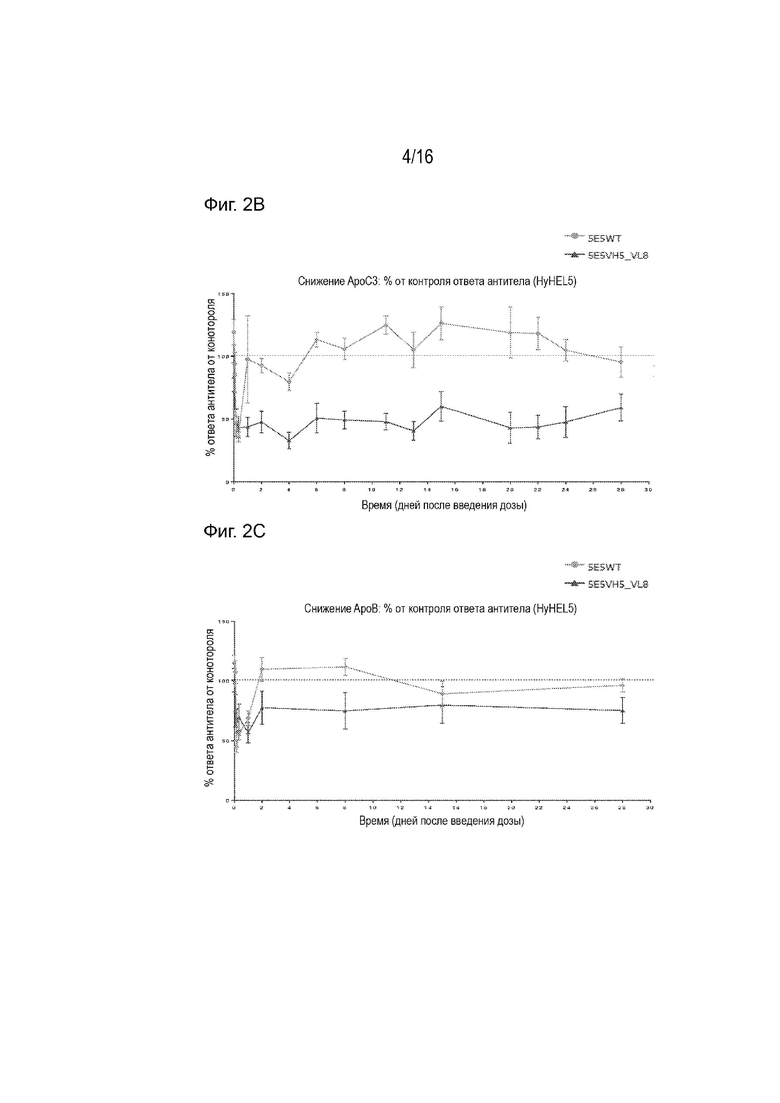
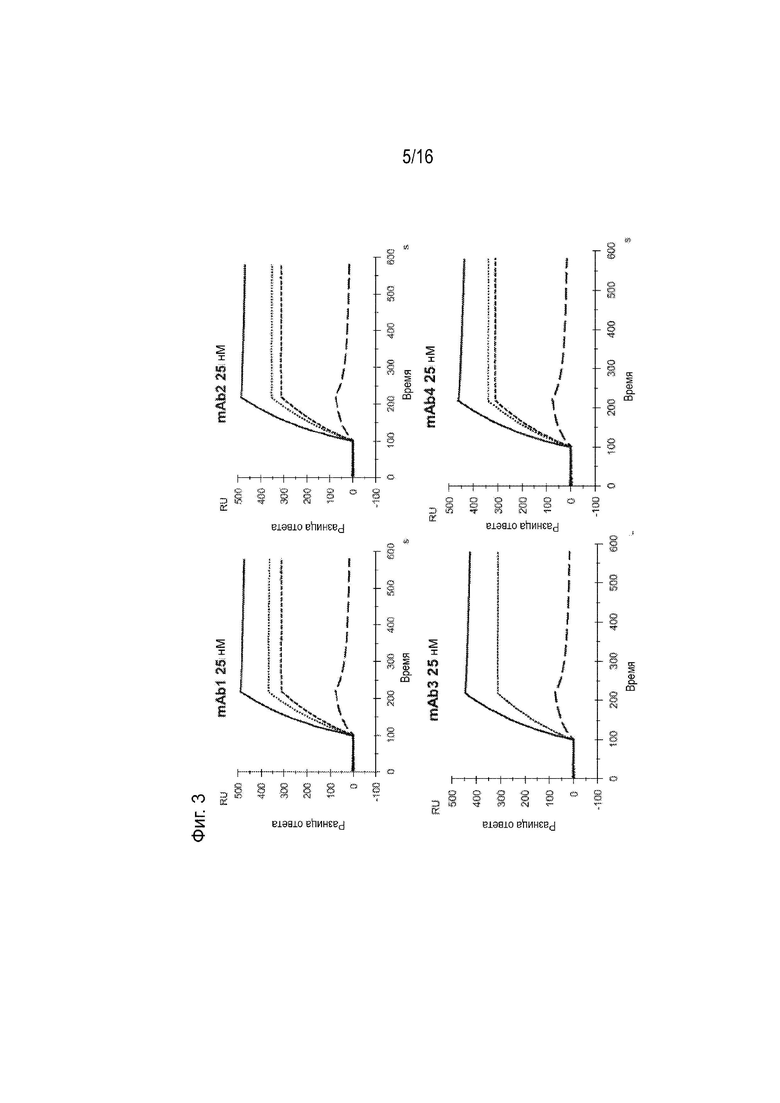
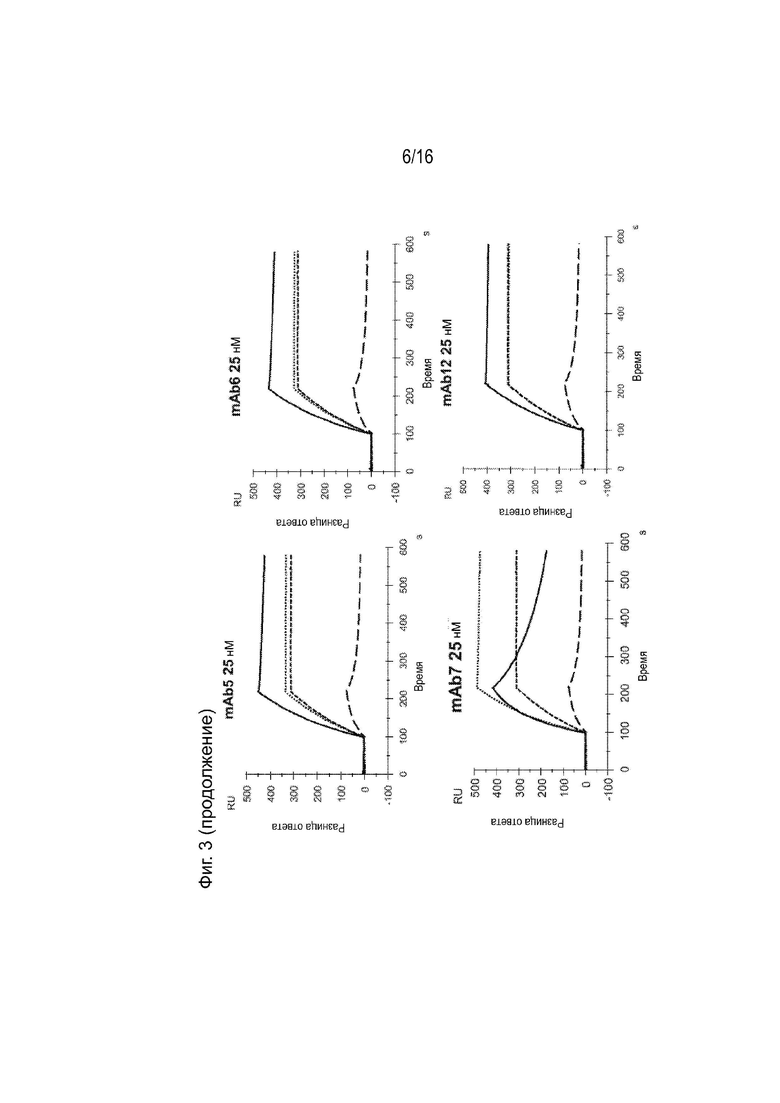
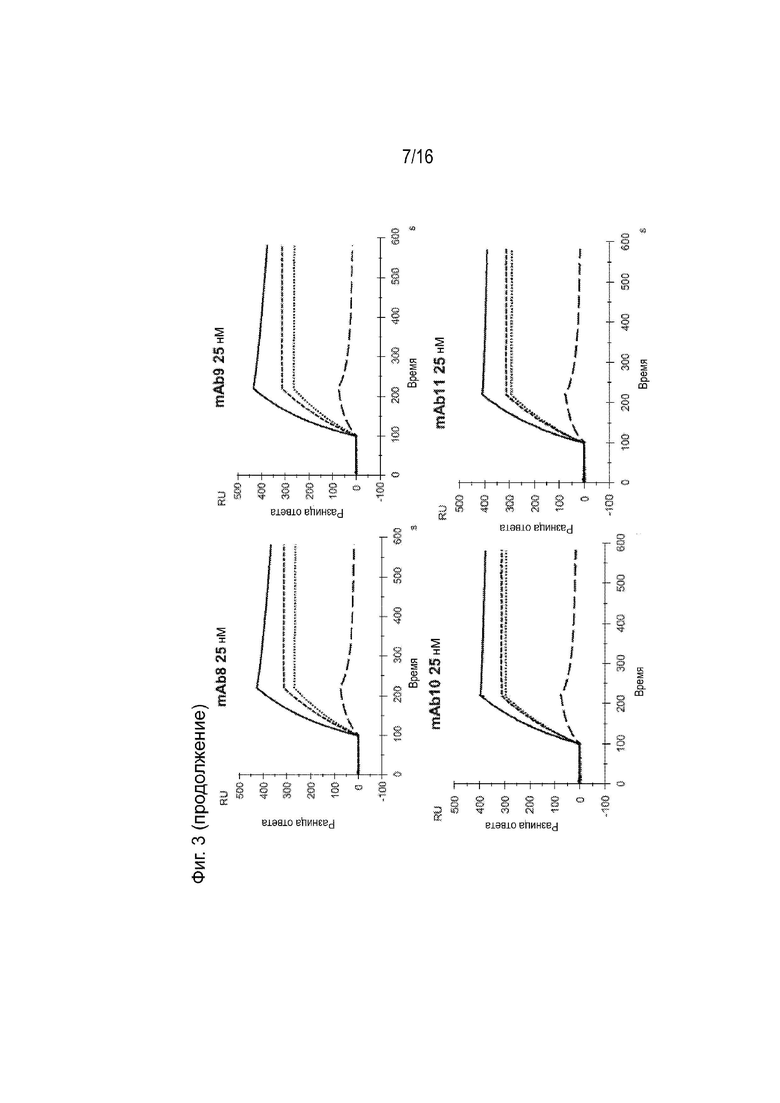
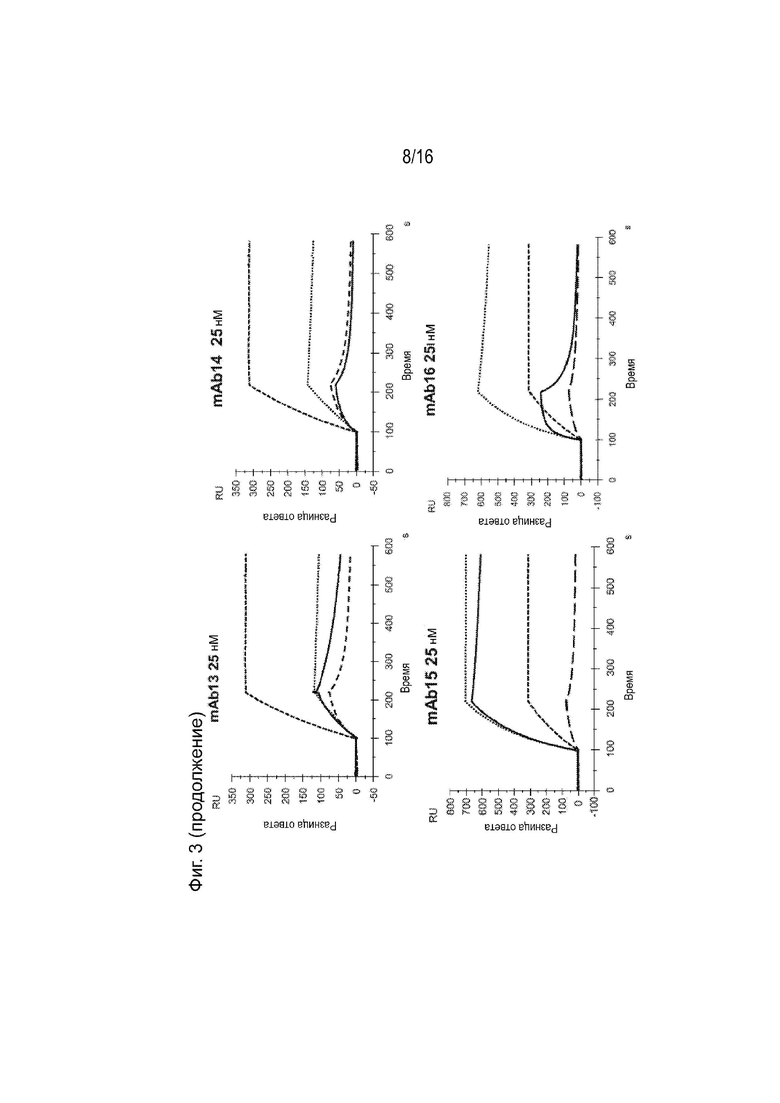
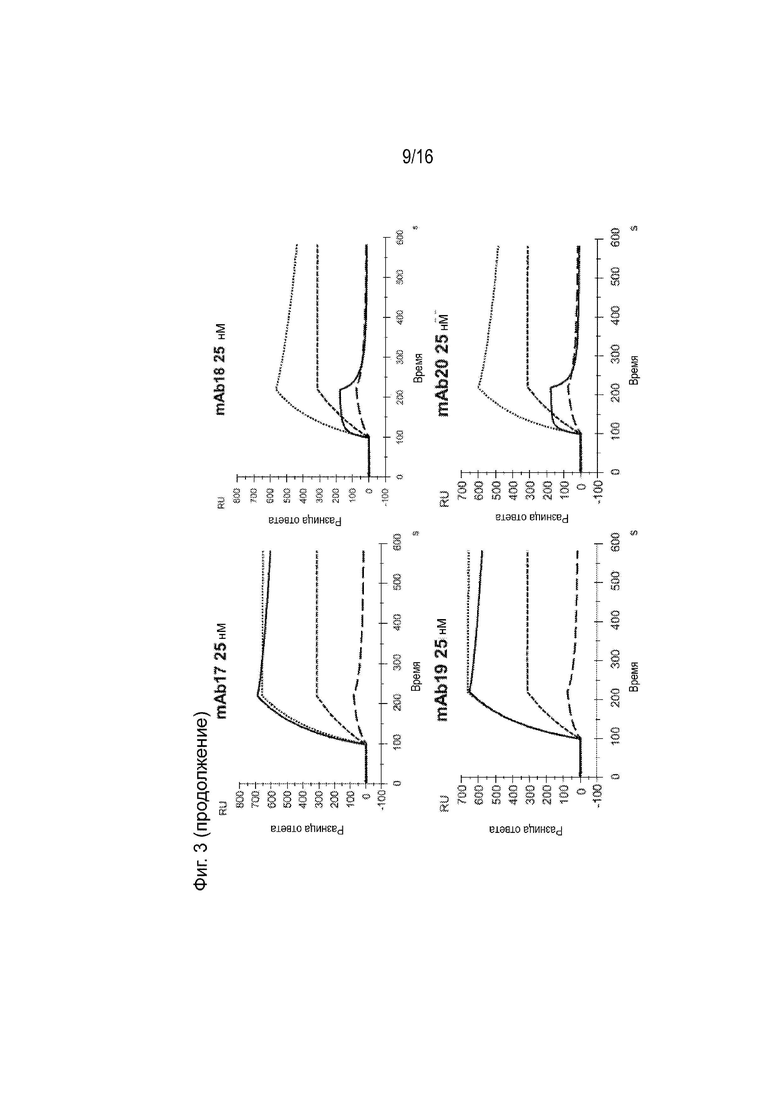
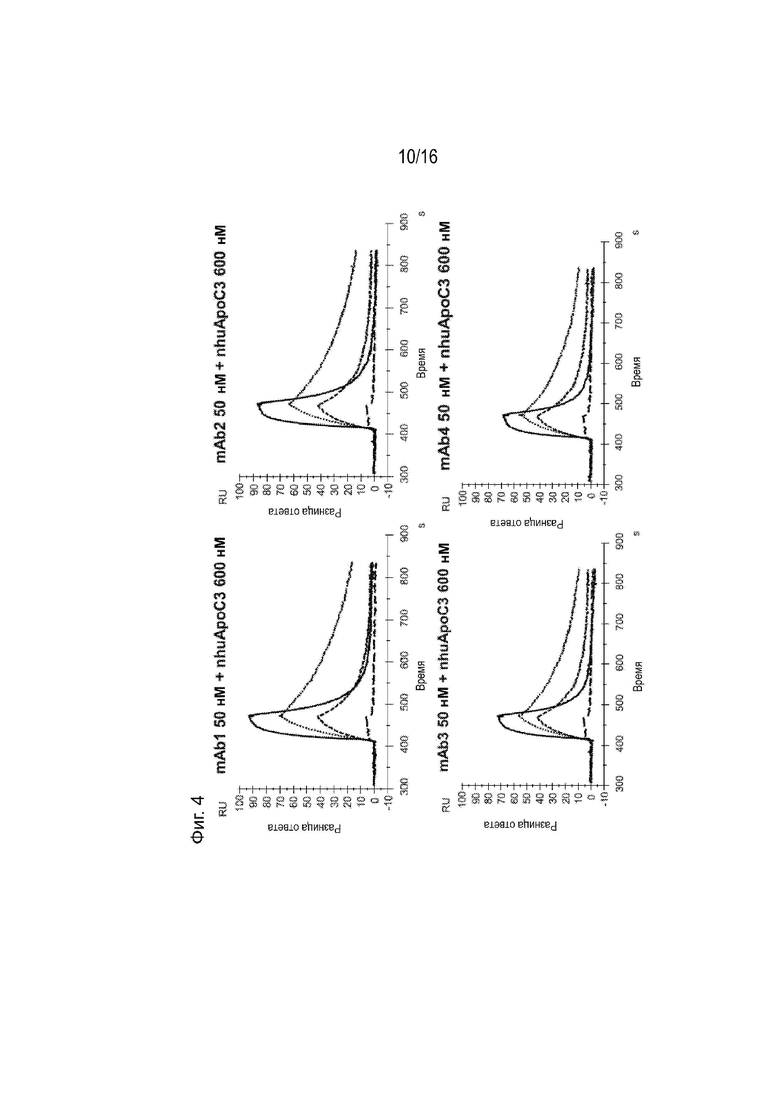
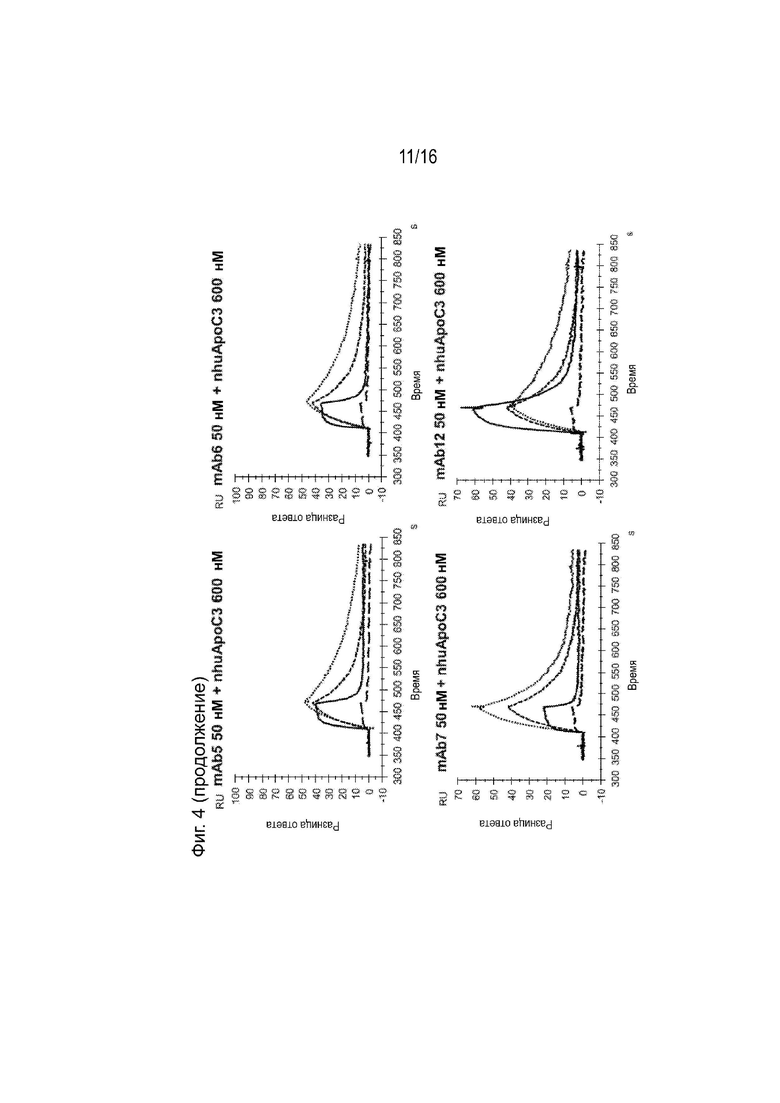
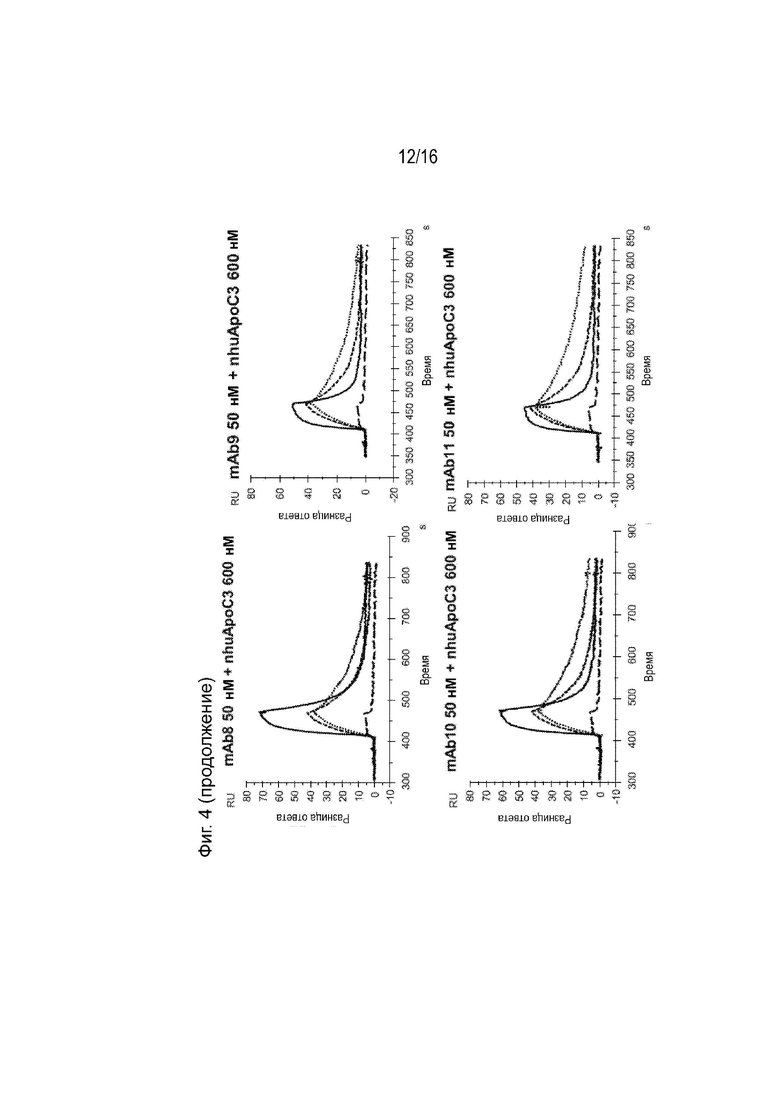
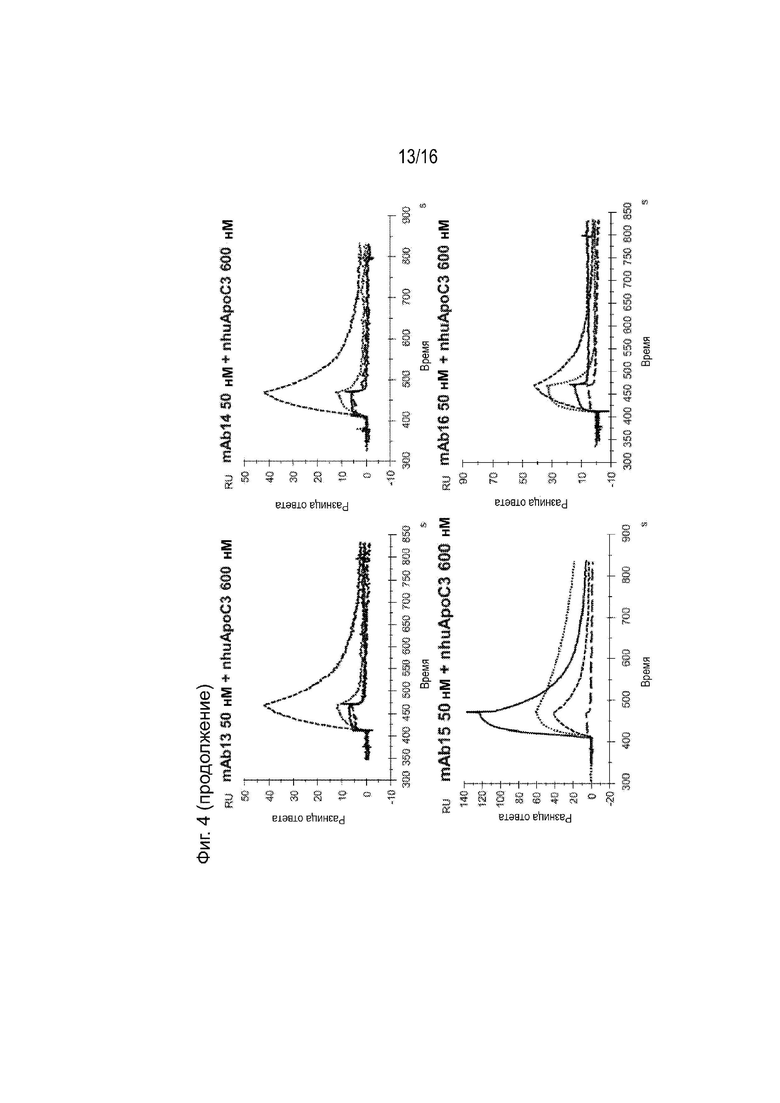
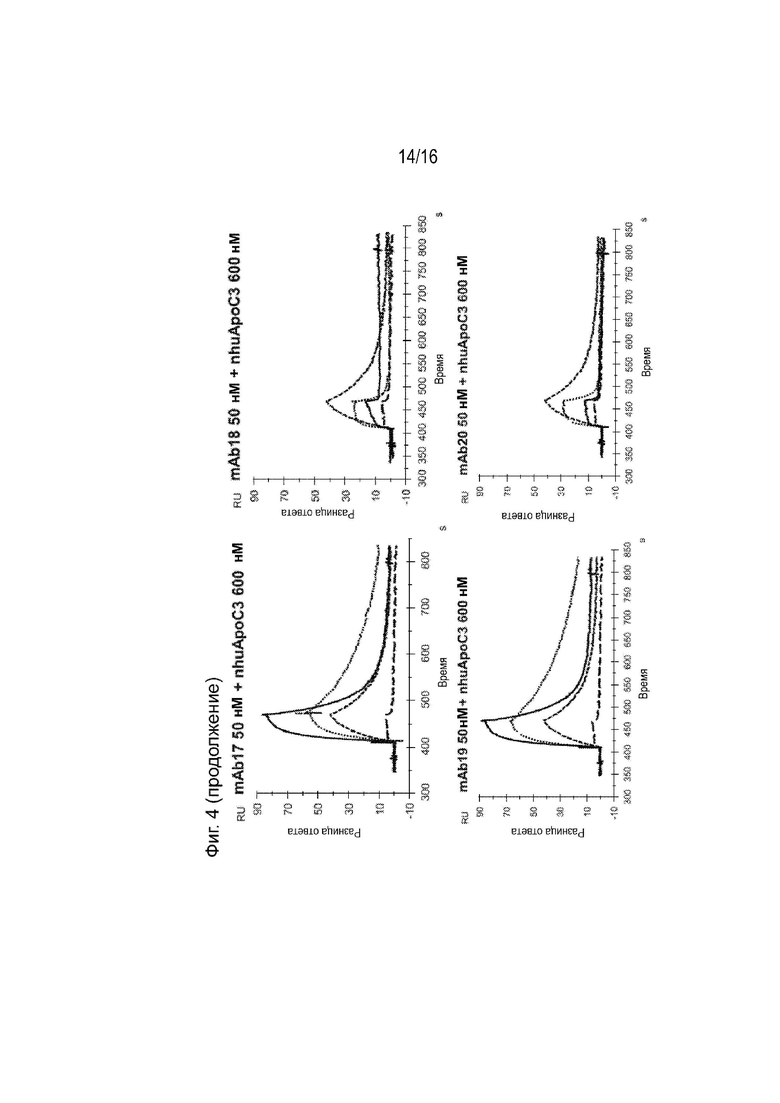
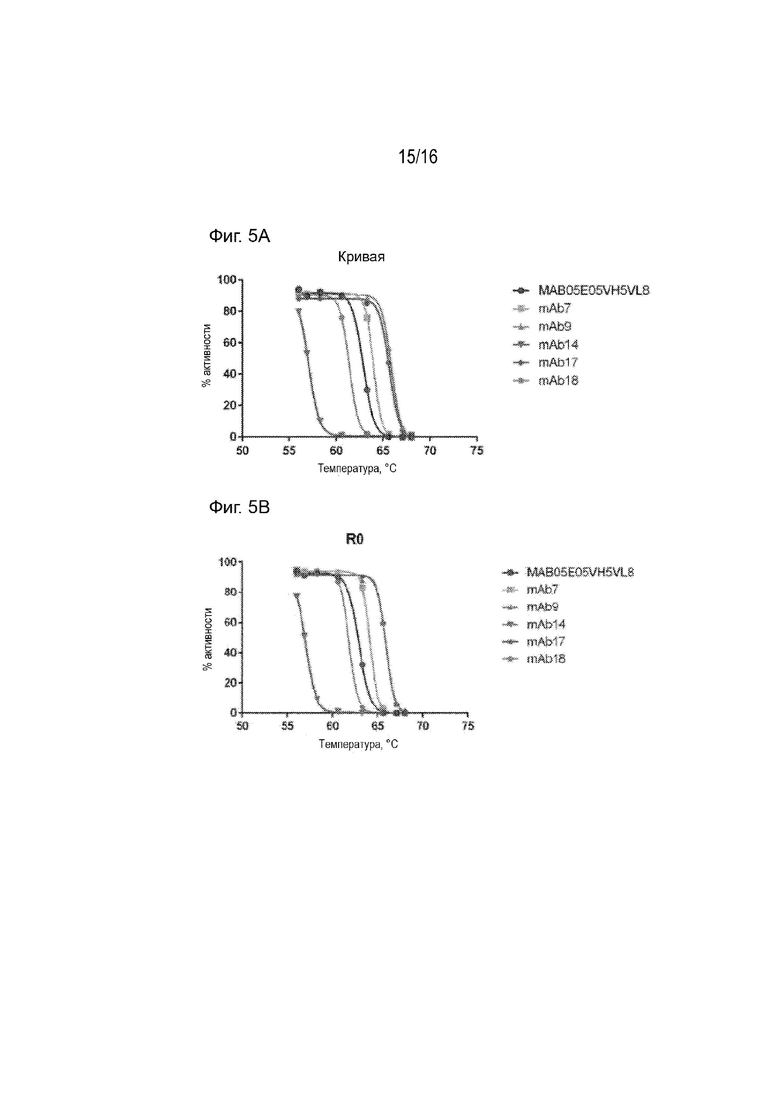
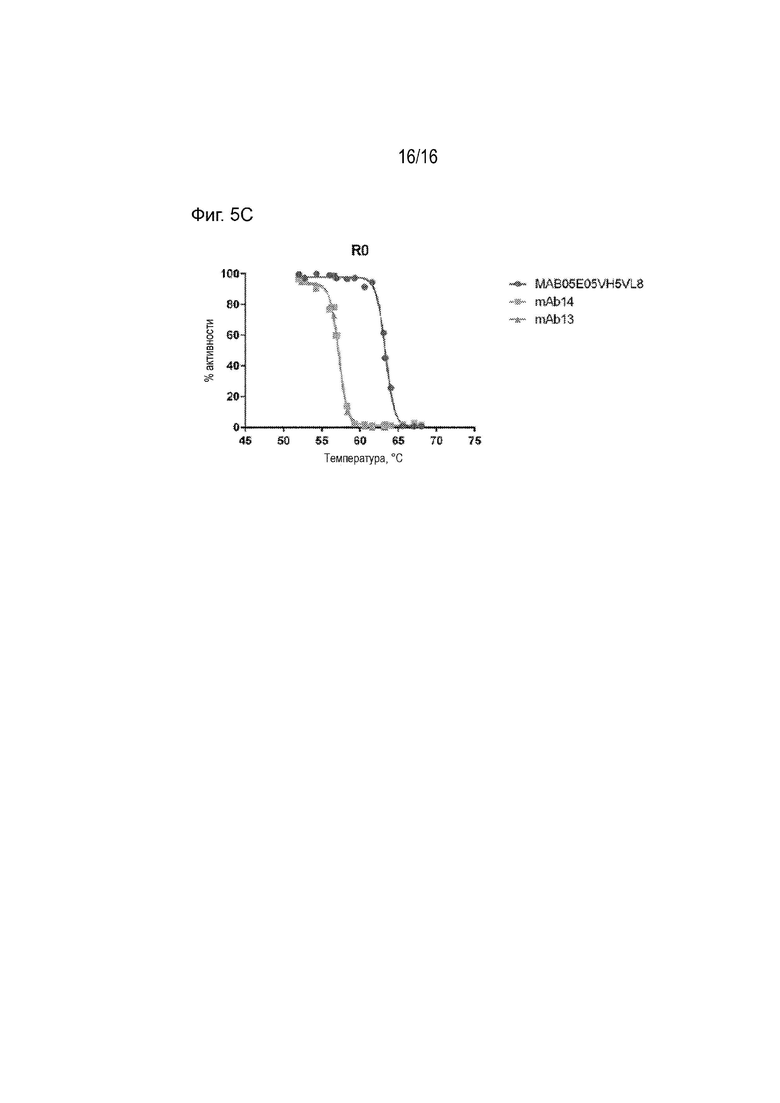
Изобретение относится к области биотехнологии, в частности к выделенному антителу, которое специфически связывается с ApoC3, содержащей его фармацевтической композиции, а также к способу получения указанного антитела. Также раскрыт полинуклеотид, кодирующий вариабельную область тяжелой и/или легкой цепи антитела, специфически связывающегося с ApoC3, а также клетка, его содержащая. Изобретение эффективно для ингибирования активности ApoC3 у пациента. 7 н. и 10 з.п. ф-лы, 5 ил., 18 табл., 5 пр.
1. Выделенное антитело, которое специфически связывается с ApoC3, где антитело содержит
вариабельный участок тяжелой цепи, содержащий определяющие комплементарность участки CDRH1, CDRH2 и CDRH3, и
вариабельный участок легкой цепи, содержащий определяющие комплементарность участки CDRL1, CDRL2 и CDRL3, где:
(а) CDRH1 содержит аминокислотную последовательность TYSMR (SEQ ID NO:3);
(b) CDRH2 содержит аминокислотную последовательность SIHTX1X2 GGTAYRDSVKG,
где X1 представляет собой G, E или D и X2 представляет собой G или A (SEQ ID NO:87);
(с) CDRH3 содержит аминокислотную последовательность AGYSD (SEQ ID NO:10);
(d) CDRL1 содержит аминокислотную последовательность KTSQGLVHSXGKTYFY,
где Х представляет собой D или G (SEQ ID NO:88);
(е) CDRL2 содержит аминокислотную последовательность QVSNRAS (SEQ ID NO:7); и
(f) CDRL3 содержит аминокислотную последовательность AXGTYYPHT,
где Х представляет собой Q или Н (SEQ ID NO:8), и
где CDRH1, CDRH2 и CDRH3 указанного антитела не являются SEQ ID NO:3, 11, 10, соответственно.
2. Выделенное антитело по п.1, где
(a) CDRH2 содержит аминокислотную последовательность SIHTGGGGTAYRDSVKG (SEQ ID NO:36),
SIHTEAGGTAYRDSVKG (SEQ ID NO:37),
SIHTDAGGTAYRDSVKG (SEQ ID NO:38) или
SIHTEGGGTAYRDSVKG (SEQ ID NO:39);
(b) CDRL1 содержит аминокислотную последовательность
KTSQGLVHSDGKTYFY (SEQ ID NO:6) или
KTSQGLVHSGGKTYFY (SEQ ID NO:40); и/или
(c) CDRL3 содержит аминокислотную последовательность
AHGTYYPHT (SEQ ID NO:14) или
AQGTYYPHT (SEQ ID NO:13).
3. Выделенное антитело по п.1 или 2, где CDRH1, CDRH2, CDRH3, CDRL1, CDRL2 и CDRL3 содержат аминокислотные последовательности SEQ ID NO: 3, 36, 10, 6, 7 и 14; 3, 37, 10, 40, 7 и 14; 3, 38, 10, 40, 7 и 14; 3, 38, 10, 6, 7 и 14; 3, 39, 10, 6, 7 и 14; или 3, 37, 10, 40, 7 и 13, соответственно.
4. Выделенное антитело по любому из предшествующих пунктов, где вариабельный участок тяжелой цепи содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:42-53, и/или вариабельный участок легкой цепи содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:54-65.
5. Выделенное антитело по любому из предшествующих пунктов, где вариабельный участок тяжелой цепи и вариабельный участок легкой цепи, соответственно, содержат аминокислотные последовательности SEQ ID NO:42 и 54, 43 и 55, 44 и 56, 45 и 57, 46 и 58, 46 и 54, 47 и 58, 47 и 54, 48 и 58, 48 и 54, 49 и 59, 49 и 60, 50 и 59, 50 и 60, 51 и 61, 52 и 62, 53 и 62, 43 и 63, 44 и 64 или 45 и 65.
6. Выделенное антитело по любому из предыдущих пунктов, где:
(а) антитело представляет собой гуманизированное антитело; и/или
(b) ApoC3 представляет собой ApoC3 человека.
7. Выделенное антитело по любому из предшествующих пунктов, где антитело содержит константную область человека, необязательно, где:
(a) константная область представляет собой вариант константной области тяжелой цепи иммуноглобулина человека дикого типа, и где вариантная константная область тяжелой цепи иммуноглобулина человека имеет повышенное сродство к человеческому неонатальному рецептору Fc (FcRn) при pH 6 по сравнению с аффинностью соответствующего константного участка тяжелой цепи иммуноглобулина дикого типа человека для FcRn человека при pH 6;
(b) константная область представляет собой IgG человека, необязательно, IgG1, IgG2 или IgG4 человека;
(c) константная область содержит аминокислоты K, F и Y в положениях EU 433, 434 и 436, соответственно;
(d) константная область содержит аминокислоты Y, T и E в положениях EU 252, 254 и 256, соответственно;
(e) константная область содержит аминокислоты L и S в положениях ЕС 428 и 434, соответственно; или
(f) константная область содержит аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:22-24, 76-78 и 81-86.
8. Выделенное антитело по любому из предшествующих пунктов, содержащее тяжелую цепь, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO:66-73, и/или легкую цепь, содержащую аминокислотную последовательность SEQ ID NO:74.
9. Выделенное антитело по любому из предшествующих пунктов, содержащее тяжелую цепь и легкую цепь, где тяжелая цепь и легкая цепь, соответственно, содержат аминокислотные последовательности SEQ ID NO:66 и 74, 67 и 74, 68 и 74, 69 и 74, 70 и 74, 71 и 74, 72 и 74 или 73 и 74, соответственно.
10. Фармацевтическая композиция для ингибирования активности ApoC3 у пациента, содержащая антитело по любому из предшествующих пунктов и фармацевтически приемлемый носитель.
11. Полинуклеотид, кодирующий вариабельную область тяжелой цепи антитела по любому из пп.1-9, где полинуклеотид необязательно находится в экспрессионном векторе.
12. Полинуклеотид, кодирующий вариабельную область легкой цепи антитела по любому из пп.1-9, где полинуклеотид необязательно находится в экспрессионном векторе.
13. Полинуклеотид, кодирующий вариабельную область тяжелой цепи и вариабельную область легкой цепи антитела по любому из пп.1-9, где полинуклеотид необязательно находится в экспрессионном векторе.
14. Клетка-хозяин для получения антитела, содержащая:
(а) полинуклеотид по п.13;
(b) выделенный полинуклеотид, кодирующий вариабельную область тяжелой цепи антитела по любому из пп.1-9; и выделенный полинуклеотид, кодирующий вариабельную область легкой цепи антитела по любому из пп.1-9; или
(c) выделенный полинуклеотид, кодирующий тяжелую цепь антитела по любому из пп.1-9, и выделенный полинуклеотид, кодирующий легкую цепь антитела по любому из пп.1-9.
15. Способ получения антитела, которое связывается с ApoC3, где способ включает культивирование клетки-хозяина по п.14 в условиях, которые обеспечивают экспрессию антитела.
16. Антитело по любому из пп.1-9 для применения в способе:
(а) ингибирования активности ApoC3 у индивида;
(b) снижения уровней триглицеридов в крови индивида;
(c) ингибирования постпрандиальной липемии у индивида;
(d) лечения гипертриглицеридемии у индивида;
(e) лечения хиломикронемии у индивида; или
(f) снижения риска сердечно-сосудистого заболевания у индивида с гипертриглицеридемией, где сердечно-сосудистым заболеванием необязательно является инфаркт миокарда, стенокардия, инсульт или атеросклероз.
17. Антитело для применения по п.14, где:
(а) антитело снижает уровни хиломикронов или остатков хиломикронов в крови субъекта; или
(b) индивид получает дополнительный гиполипидемический агент, необязательно, где дополнительный гиполипидемический агент представляет собой
(i) ингибитор HMG-CoA редуктазы, необязательно, аторвастатин, флувастатин, ловастатин, питавастатин, правастатин, розувастатин или симвастатин,
(ii) ингибитор PCSK9, необязательно, алирокумаб, эволокумаб или бокоцизумаб, или
(iii) эзетимиб; комбинацию эзетимиба и ингибитора HMG-CoA редуктазы; или комбинацию эзетимиба, ингибитора HMG-CoA редуктазы и ингибитора PCSK9.
| WO 2014131008 A1, 28.08.2014 | |||
| SUMEET A KHETARPAL et al., A human APOC3 missense variant and monoclonal antibody accelerate apoC-III clearance and lower triglyceride-rich lipoprotein levels, Nat Med, 2017 September, 23(9), pp | |||
| РЕВЕРСИВНЫЙ КОЛОВРАТНЫЙ ДВИГАТЕЛЬ | 1921 |
|
SU1086A1 |
| MENGDIE LUO et al., The emerging role of apolipoprotein C-III: beyond effects on triglyceride metabolism, Luo | |||
Авторы
Даты
2022-10-05—Публикация
2018-10-31—Подача