Область изобретения
Изобретение относится к препарату, содержащему фермент коллагеназу с различной степенью активности, т.е. препарату с коллагеназной активностью, который может применяться для деструкции коллагеновой ткани и образований из нее, при этом препарат является концентрированным и имеет активность более 1000 КЕ/мг, в частности, от 1000 до 10000 КЕ на ампулу.
Предшествующий уровень техники
В настоящее время шрамы и келоидные рубцы представляют собой состояние, при котором в месте образования наблюдается утолщение коллагеновой ткани. Существуют различные методы лечения таких образований, например, лазерная шлифовка кожи, применение местных препаратов, чаще всего мазей с гиалуронидазой, гепарином или коллагенолитических протеаз, а также препараты для местного введения в виде инъекций. Активным веществом таких препаратов является коллагеназа - фермент, относящийся к протеолитическим средствам, расщепляющим пептидные связи в определенных участках спирализованных областей коллагена, избирательно действует на коллаген, полипептидную цепь, вызывая его деструкцию.
В настоящее время известны препараты, содержащие коллагеназы различных типов. Одним из таких препаратов является Коллализин®, включающий коллагеназу в количестве от 100 до 1000 коллагеназных единиц на препарат (ампулу). Однако, данный препарат представляет собой смесь коллагеназ различных типов, которая достаточно трудно подвергается стандартизации, а также может содержать примеси, которые могут снижать стабильность получаемого препарата или его терапевтическую активность. Важным с точки зрения очистки получаемых препаратов коллагеназ является низкое содержание клострипаина - фермента, в присутствии которого коллагеназа разрушается, и препарат при хранении теряет свою активность.
В настоящее время известны различные способы получения коллагеназ. Данные способы включают получение коллагеназ как при культивировании клостридиальных штаммов, например, Clostridium histolyticum, так и при использовании генно-модифицированных организмов (E.coli и других) (Конон А.Д., Петровский С.В., Шамбурова М.Ю., Уварова А.В., Козлова Ю.О., Григорьева М.В., Москвичев Б.В. Особенности биотехнологий клостридиальных коллагеназ - перспективных ферментов медицинского назначения // Медицина экстремальных ситуаций. 2016. №2 (56)).
Согласно патенту РФ № 2687973, известен способ получения Коллализина®- препарата, содержащего комплекс коллагеназ, включающий путем культивирования продуцента Clostridium histolyticum в анаэробных условиях на питательной среде Рамона с последующим отделением микробной массы путем фильтрации, отличающийся тем, что для культивирования используют продуцент Clostridium histolyticum 468 или продуцент Clostridium histolyticum SK В-8362, а отделение микробной массы проводят с помощью каскада глубинных фильтров с диаметром пор от 3,0-0,8 до 0,3-0,1 мкм с исключением попадания культуры в нативный раствор, применяя номинальную и абсолютную стерилизующую фильтрацию нативного раствора с дальнейшей ультрафильтрацией, концентрированием и хроматографической очисткой на основе сорбента Sephacryl S-100. Дальнейшую очистку и концентрирование коллагеназы проводили при помощи тангенциальной ультрафильтрации с кассетами с порогом отсечения 50 кДа, подвергали микрофильтрации (0,45 мкм) концентрата коллагеназ перед подачей на хроматографическую колонку, содержащую сорбент Sephacryl S-100, и концентрировали на ультрафильтрационной установке с применением кассет 5 кДа. Однако, получаемый препарат коллагеназ имеет достаточное высокое количество низкомолекулярных примесей, что может приводить к повышенным аллергическим реакциям и нестабильности препарата, что может проявляться во время хранения продукта в виде тенденции к снижению показателей активности. Кроме того, сам способ получения не является рациональным в виду использования сложного многостадийного оборудования и потерь при передаче продукта со стадии на стадию.
Таким образом, представляется актуальным и необходимым разработка высокоочищенного концентрированного препарата с коллагеназной активностью, который бы имел стабильность и малую потерю терапевтической активности при длительном хранении.
Описание чертежей
На Фиг. 1 показана электрофореграмма коллагеназ I и II типа:
1 - маркер молекулярного веса; 2 - фракция с коллагеназами I и II типа.
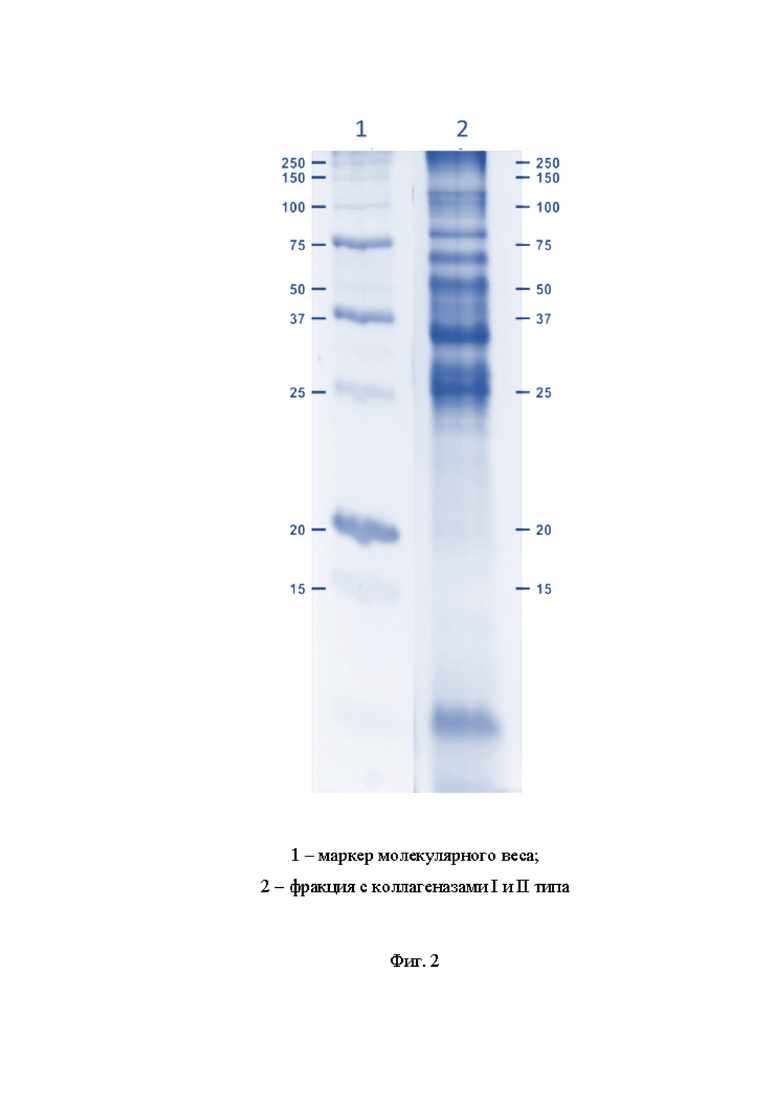
На Фиг. 2. показана электрофореграмма коллагеназ I и II типа после гель-фильтрации: 1 - маркер молекулярного веса; 2 - фракция с коллагеназами I и II типа.
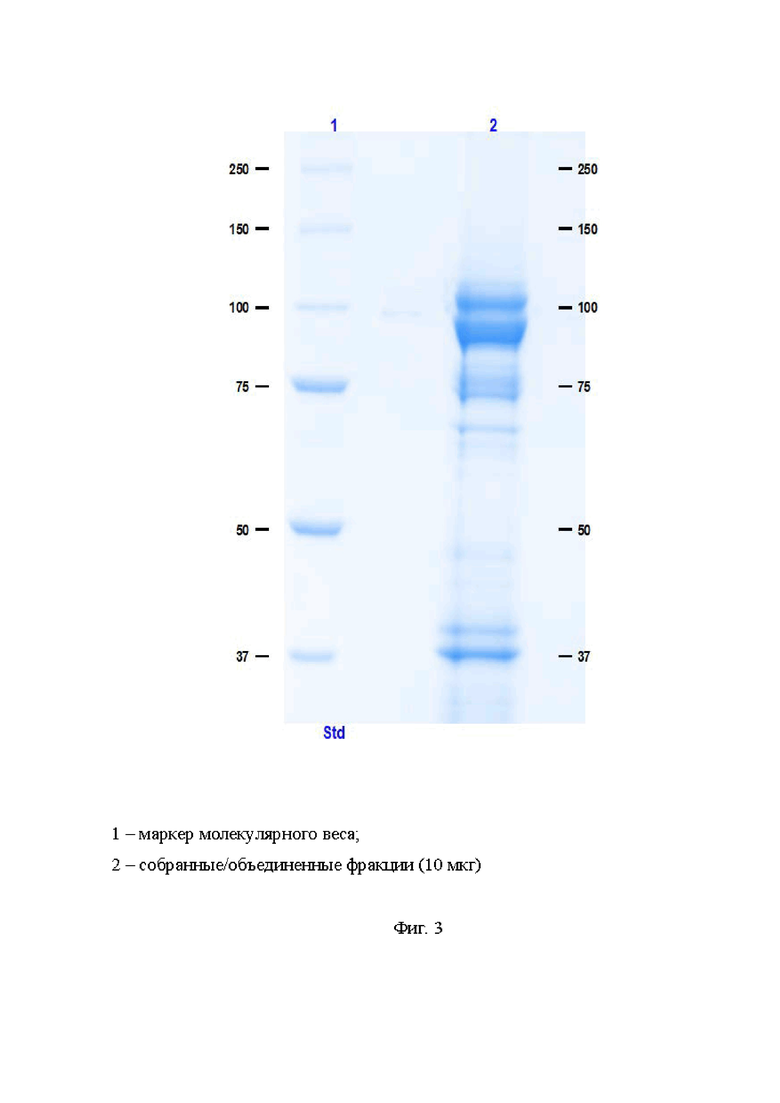
На Фиг. 3 приведена электрофореграмма препарата коллагеназ, получаемых способом согласно изобретению, после очистки на сорбенте CHT™ Type II:
1 - маркер молекулярного веса;
2 - собранные/объединенные фракции (10 мкг).
На Фиг. 4 показана электрофореграмма препарата коллагеназ, получаемых способом согласно изобретению, после очистки на ионообменном сорбенте SP Sepharose HP: 1 - маркер молекулярного веса; 2 - собранная фракция № 1 с SP Sepharose HP (10 мкг); 3 - собранная фракция №2 с SP Sepharose HP (10 мкг).
Описание изобретения
Предложен способ получения готового концентрированного препарата коллагеназ, включающий
- культивирование продуцента Clostridium histolyticum 468 или оригинального продуцента Clostridium histolyticum SK В-8362 в анаэробных условиях на питательной среде Рамона;
- последующее отделение микробной массы путем фильтрации с помощью каскада глубинных фильтров с диаметром пор от 3,0 - 0,8 до 0,3 - 0,1 мкм;
- ультрафильтрацию;
- концентрирование;
- микрофильтрацию;
- хроматографическую очистку;
- концентрирование очищенного концентрата коллагеназ,
при этом способ отличается тем, что проводят объединение фракций, содержащих максимальное количество коллагеназ I и II типов, проводят концентрирование очищенного концентрата коллагеназ на ультрафильтрационной установке, получая очищенные коллагеназы I и II типа, смешивания компонентов и стабилизаторов при получении препарата.
Максимальное количество коллагеназ I и II типов означает, что количество коллагеназы по данным хроматографии, превышает 70% мас. от общей массы фракции.
В качестве стабилизаторов могут быть добавлены фармацевтически приемлемые стабилизаторы, такие как сахара, например, сахароза, маннит, сорбит, или стабилизаторы иной природы, например, трометамол. Данные стабилизаторы могут добавляться в количествах, традиционно используемых в данной области, например, в количестве от 0,5% до 20% от массы конечного состава.
Предлагаемый согласно изобретению, способ дополнительно включает стадию лиофилизации после получения концентрированного препарата коллагеназ и стабилизаторов.
Концентрированный препарат коллагеназ обозначает препарат коллагеназ, имеющий коллагеназную активность от 1000 КЕ (коллагеназных единиц) на препарат (ампулу или мг) и более, например, от 1000 КЕ до 10000 КЕ.
Таким образом, согласно данному способу можно получить концентрированный препарат коллагеназ, включающий коллагеназы I и II типа, и имеющий повышенную степень чистоты и активности.
Следует отметить, что по сравнению с ранее разработанными способами получения препаратов коллагеназ, например, препарата Коллализин®, получение которого описано в патенте РФ № 2687973, способ получения концентрированного препарата коллагеназ согласно настоящему изобретению имеет следующие отличия:
- двустадийная ионообменная хроматографическая очистка позволяет рационализировать процесс очистки и сделать его более технологичным и экономически выгодным.
- использование сорбента для очистки, например, мультимодального сорбента CHT™ Type II (Bio-Rad), способствует значительному снижению высокомолекулярных и низкомолекулярных примесей в растворе элюата, а также повышает разрешающую способность хроматографического разделения примесей и целевого промежуточного продукта.
- Введение последующей стадии очистки с использованием катионообменной хроматографии, например, на сорбенте SP Sepharose HP, способствует значительному уменьшению количества примесей, оставшихся после предыдущей стадии очистки (где это видно, на каком рисунке??) (фиг. 4),
- на стадии ультрафильтрации на мембранах с порогом задержания веществ по молекулярной массе 50 кДа дополнительно введен этап диафильтрации буфером, использована двустадийная хроматографическая очистка (на мультимодальном сорбенте CHT™ Type II и на катионообменном сорбенте SP Sepharose HP) с отбором фракций, контролируемым по методу электрофореза, содержащих коллагеназы I и II типа. Последующее концентрирование и диафильтрация на ультрафильтрационной кассете с порогом отсечения 50 кДа позволяет добиться не только концентрирования, но получить более очищенный препарат за счет дополнительного удаления низкомолекулярных примесей, образующихся в ходе технологического процесса, по сравнению с препаратом, полученным при использовании ультрафильтрационной кассеты с порогом отсечения 5 кДа. Необходимо также отметить, что повышение чистоты активных компонентов (коллагеназ I и II типа) целенаправленного действия значительно снижает появление побочных реакций на препарат коллагеназ. Таким образом, способ получения препарата коллагеназ позволяет получить концентрированный препарат коллагеназ I и II типа в виде препарата с меньшим количеством примесей, с более низкими показателями аллергенности, и более длительным сроком хранения.
Важным этапом рационализации процесса стала стадия добавления стабилизаторов при лиофильном высушивании концентрированного препарата для сохранения терапевтических свойств при сопутствующем увеличении срока годности. Внесение сахарозы и трометамола в состав готового препарата потенциально позволит увеличить срок хранения.
Получение нового высокоочищенного концентрированного препарата, содержащего коллагеназы I и II типа, позволило расширить область применения. Ранее препарат Коллализин® был рекомендован в качестве средства профилактики и лечения симблефарона, рубцовых изменений кожи век (келоидные рубцы), конъюнктивы глазного яблока после ожога, при стриктурах слезоотводящих путей (слезные канальцы и слезноносовой канал), помутнениях роговицы, пластическом иридоциклите (в стадии стихания воспалительных явлений), вторичной катаракте, помутнении стекловидного тела, рубцах сетчатки, при травматическом кровоизлиянии в стекловидное тело, занимающем более 1/2 его объема и в срок от 3 суток после образования гемофтальма.
Далее изобретение будет рассмотрено на примерах, которые не являются ограничивающими объем изобретения.
Пример 1
Получение препарат коллагеназ
Для получения данного препарата культивировали штамм Clostridium histolyticum 468 или оригинальный продуцент Clostridium histolyticum SK В-8362, отделяли микробную массу через каскад глубинных фильтров, полученный фильтрат подвергали тангенциальной фильтрации с кассетами 50 кДа с последующей микрофильтрации на мембранах с размером пор 0,45 мкм и очищением методом гель-фильтрации на хроматографической колонке, заполненной сорбентом на основе Sephacryl S-100, как описано в патенте № 2687973.
Сбор фракций осуществляли равными аликвотами. Начало сбора фракций определяли по результатам измерений оптической плотности элюата при длине волны 280 нм. Во фракциях контролировали содержание белка по методу Бредфорда и/или Лоури, коллагеназную активность, а также чистоту и соотношение коллагеназ I и II типа посредством денатурирующего электрофореза в полиакриламидном геле в невосстановленных условиях с концентрацией геля 10 %. Далее, на основе полученных данных, после визуализации по SDS-PAGE, объединяли фракции, содержащие количество коллагеназ I и II типа более 70% мас. от общей массы фракции. Для этого отбирали фракции, при анализе которых выявляли наиболее яркие бэнды на уровне белка с молекулярной массой 112-114 кДа, что свидетельствовало о нахождении коллагеназ в соответствующих фракциях (Фиг. 2).
Полученный промежуточный продукт, содержащий смесь высокоактивных коллагеназ, подвергали концентрированию на ультрафильтрационной установке при помощи мембран с размером пор 50 кДа в 10 раз от исходного объема. Продукт подавали со скоростью от 4,0 до 6,0 л/ч, при температуре (5 ± 3) °С, затем передавали на стадию объединения препарата со стабилизаторами. В качестве стабилизаторов использовали сахарозу в виде 0,5 М раствора (до концентрации 37 мг/мл в сведенном препарате) и трометамол в виде 0,1 М раствора (до концентрации 2,4 мг/мл в сведенном препарате). Полученный препарат стерилизовали с использованием мембранных фильтров с размером пор 0,2 мкм, разливали в ампулы или флаконы и лиофильно высушивали.
Способ позволял получить препарат, содержащий смесь коллагеназ I и II типа, со стабильность всех показателей качества в течение установленного срока годности.
Пример 2
Получение препарата коллагеназ
Для получения данного препарата культивировали штамм Clostridium histolyticum 468 или оригинальный продуцент Clostridium histolyticum SK В-8362, отделяли микробную массу через каскад глубинных фильтров, полученный фильтрат подвергали тангенциальной фильтрации с кассетами 50 кДа.
После концентрирования перед первой стадией хроматографической очистки проводили диафильтрацию с применением буфера 20 мМ NaPB pH 6,8. Первую стадию хроматографической очистки на мультимодальном сорбенте CHT™ Type II проводили с применением фосфатных буферов для градиентного элюирования: Буфер нанесения - 20 мМ NaPB pH 6,8 и Буфер элюции - 500 мМ NaPB pH 6,8. Сбор фракций осуществляли аликвотами равного объема. Во фракциях контролировали содержание белка и коллагеназную активность спектрофотометрическим методом, а также чистоту и соотношение коллагеназ I и II типа посредством денатурирующего электрофореза в 8 % - ом полиакриламидном геле в невосстанавливающих условиях (Фиг. 3).
Собранные/объединенные фракции дополнительно очищали на катионообменном сорбенте SP Sepharose HP, предварительно переведя фракции с белком в буфер нанесения. В ходе хроматографии применяли следующие буферы для градиентного элюирования: Буфер нанесения - 20 mM NaAcO pH 4,0 и Буфер элюции - 20 mM NaAcO, 1 M NaCl pH 4,0.
Во фракциях контролировали содержание белка и коллагеназную активность спектрофотометрическим методом, а также чистоту и соотношение коллагеназ I и II типа посредством денатурирующего электрофореза в 8 % - ом полиакриламидном геле в невосстанавливающих условиях с концентрацией полиакриламидного геля (Фиг. 4). Как видно из данных, представленных на Фиг. 4, удалось значительно снизить концентрацию остаточных примесей, в том числе и клострипаина.
Полученный промежуточный продукт концентрировали на ультрафильтрационной кассете с порогом отсечения 50 кДа и получали препарат коллагеназ согласно примеру 1.
Предложенный способ позволял получить концентрированный препарат, содержащий коллагеназы I и II типа, со стабильностью всех показателей качества в течение установленного срока годности.
Пример 3
Определение коллагеназной активности
Определение полученной коллагеназной активности проводили по методу, описанному в патенте RU 2709513.
Полученный препарат коллагеназы анализировали на образце окрашенного коллагена, полученного как описано в патенте выше. Коллаген из бычьих сухожилий измельчали на мельнице ДМ-6, отбирали 5 г продукта и помещали в колбу объемом 500 мл, добавляли 80 мл воды очищенной. В эту же колбу вносили 50 мл раствора, содержащего 0,1 г красителя RO16. Смесь перемешивали на шейкере при 40°С при 130 об/мин, через 15 мин добавляли дважды 50 мл 6% раствора натрия хлорида, через 25 мин добавляли еще 37,5 мл 2% раствора карбоната натрия и выдерживали 2 часа. Затем полученную реакционную смесь помещали на сито и промывают 3 л воды. После удаления избытка воды полученный субстрат помещали на чашку Петри, замораживали при температуре - 40°С и лиофилизировали. Высушенную смесь измельчали на мельнице 20 мин при 1100 об/мин. Конечный субстрат представлял собой волокна в виде ваты оранжевого цвета; рН суспензии окрашенного коллагена при измерении в воде был равен 7,9; размер частиц не более 2 мм. Спектр поглощения кислотного гидролизата образца окрашенного коллагена проявлял максимум при 212 нм, 288 нм, 361 нм и 480 нм.
Далее измеряли коллагеназную активность полученного препарата путем измерения количества продуктов ферментативного гидролиза в растворе. На основании полученных экспериментальных данных вычисляли специфическую активность коллагеназы, которая выражается в единицах коллагеназной активности. За единицу коллагеназной активности (ЕД) принято количество коллагеназы, приводящее к увеличению оптической плотности при длине волны 490 нм, вызванному ферментативным расщеплением 1 мг коллагена, окрашенного красителем реактивным оранжевым RO16 в стандартных условиях реакции.
При анализе полученного препарата коллагеназы была определена активность как 1020 ЕД на 1 мг. (минимально). После получения серии активность из 5 образцов была определена как средняя и составила не менее 1200 Ед на 1 мг.
Пример 4
Определение стабильности готового концентрированного препарата
Стабильность коллагеназной активности определяли, как описано в Примере 3, в течение времени хранения. Использовали тест при ускоренном старении: флаконы с лиофилизатом готового препарата коллагеназ хранили в течение 3 мес., при температуре 55°С, с отбором флакона каждый мес. на анализ коллагеназной активности. Дополнительно, в качестве объекта сравнения использовали образец препарата коллагеназы, полученный по способу согласно RU 2687973. По истечение 3 мес. определяли коллагеназную активность образцов, хранимых в условиях повышенной температуры, а также при комнатной температуре.
Результаты определения коллагеназной активности приведены в таблице ниже.
RU 2687973
Таким образом, на основании полученных результатов видно, что концентрированный препарат коллагеназ, полученный согласно изобретению, имеет более высокую коллагеназную активность, а также более продолжительный срок хранения, в связи с чем срок годности может быть увеличен.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ЛЕКАРСТВЕННОГО СРЕДСТВА КОЛЛАЛИЗИН&αχιρχ;, ЛИОФИЛИЗАТА ДЛЯ ПРИГОТОВЛЕНИЯ РАСТВОРА ДЛЯ МЕСТНОГО И ПАРЕНТЕРАЛЬНОГО ПРИМЕНЕНИЯ ДЛЯ ЛЕЧЕНИЯ ФИБРОПРОЛИФЕРАТИВНЫХ ЗАБОЛЕВАНИЙ | 2018 |
|
RU2687973C1 |
| ШТАММ CLOSTRIDIUM HISTOLYTICUM - ПРОДУЦЕНТ КОЛЛАГЕНАЗЫ | 2018 |
|
RU2684220C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОЛЛАГЕНАЗЫ | 1999 |
|
RU2180002C2 |
| Штамм Clostridium sporogenes B-14642 - продуцент коллагеназы | 2024 |
|
RU2835110C1 |
| СПОСОБ ВЫДЕЛЕНИЯ ПРОТЕОЛИТИЧЕСКОГО ФЕРМЕНТА ТЕРРИЛИТИНА | 2015 |
|
RU2584601C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА КОЛЛАГЕНАЗЫ | 2003 |
|
RU2236460C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОЛЛАГЕНОЛИТИЧЕСКОГО ФЕРМЕНТА | 2020 |
|
RU2758788C1 |
| СУБСТАНЦИЯ ДЛЯ ДЕРМАТОЛОГИЧЕСКИХ ЛЕКАРСТВЕННЫХ СРЕДСТВ НА ОСНОВЕ КОЛЛАГЕНАЗЫ МИКРОБНОГО ПРОИСХОЖДЕНИЯ "УЛЬТРАЛИЗИН" | 2007 |
|
RU2340371C1 |
| Способ получения окрашенного коллагена и определения активности коллагеназы | 2019 |
|
RU2709513C1 |
| СПОСОБ ПОЛУЧЕНИЯ ФЕРМЕНТАТИВНОГО КОМПЛЕКСНОГО ПРЕПАРАТА, ОБЛАДАЮЩЕГО КОЛЛАГЕНАЗНОЙ АКТИВНОСТЬЮ | 2008 |
|
RU2412997C2 |


Изобретение относится к способу получения концентрированного препарата коллагеназ, включающему культивирование продуцента Clostridium histolyticum 468 или продуцента Clostridium histolyticum SK В-8362 в анаэробных условиях на питательной среде Рамона, последующее отделение микробной массы путем фильтрации с помощью каскада глубинных фильтров с диаметром пор от 3,0-0,8 до 0,3-0,1 мкм, ультрафильтрацию, концентрирование, микрофильтрацию, хроматографическую очистку и концентрирование очищенного концентрата коллагеназ, при этом способ отличается тем, что проводят объединение фракций, содержащих количество коллагеназ I и II типов более 70% мас. от общей массы фракции, проводят концентрирование очищенного концентрата коллагеназ на ультрафильтрационной установке, получая очищенные коллагеназы I и II типа, смешивание полученного препарата со стабилизаторами. 2 з.п. ф-лы, 4 ил., 1 табл., 4 пр.
1. Способ получения концентрированного препарата коллагеназ, включающий
- культивирование продуцента Clostridium histolyticum 468 или продуцента Clostridium histolyticum SK В-8362 в анаэробных условиях на питательной среде Рамона;
- последующее отделение микробной массы путем фильтрации с помощью каскада глубинных фильтров с диаметром пор от 3,0–0,8 до 0,3–0,1 мкм;
- ультрафильтрацию;
- концентрирование;
- микрофильтрацию;
- хроматографическую очистку; и
- концентрирование очищенного концентрата коллагеназ,
при этом способ отличается тем, что проводят объединение фракций, содержащих количество коллагеназ I и II типов более 70% мас. от общей массы фракции, проводят концентрирование очищенного концентрата коллагеназ на ультрафильтрационной установке, получая очищенные коллагеназы I и II типа, и смешивают полученный препарат со стабилизаторами.
2. Способ по п. 1, отличающийся тем, что в качестве стабилизаторов используют сахарозу и трометамол в фармацевтически приемлемых количествах.
3. Способ по пп. 1, 2, дополнительно включающий стадию лиофилизации после получения концентрированного препарата, включающего смесь коллагеназ и стабилизаторы.
| GRANT N.H | |||
| et al., Studies on the collagenases of Clostridium histolyticum, Archives of Biochemistry and Biophysics, 1959, Vol.82, N2, pp.245-255 | |||
| BOND M.D | |||
| et al., Relationship between the individual collagenases of Clostridium histolyticum: evidence for evolution by gene duplication, Biochemistry, 1984, Vol.23, N13, pp.3092-3099 | |||
| MANDL I | |||
| et |
Авторы
Даты
2022-10-11—Публикация
2021-04-12—Подача