Изобретение относится к биотехнологии, в частности к области получения высокоочищенных и высокоактивных ферментных препаратов, которые могут быть использованы в медицине, косметологии, дерматологии, биохимии и пищевой промышленности, а также для исследовательских целей.
В настоящее время особый интерес представляют ферменты, применяемые при “мягком” терапевтическом лечении ферментативными методами гипертрофических, келоидных и гипертрофических келоидных рубцов различной этиологии. Большинство медицинских препаратов, используемых для этой цели, не обладают лечебной активностью по отношению к застарелым рубцам. Крайне актуальным поэтому является поиск ферментативных препаратов, способных деградировать модифицированный коллаген застарелых плоских рубцов и рубцов различной этиологии. Не все известные коллагеназы способны эффективно гидролизовать рубцовую ткань человека. Поскольку ряд рубцов таких видов, как гипертрофический и келоидный имеют композитную структуру, в состав которой входит химически модифицированный коллаген, многие известные коллагеназы не оказывают заметного лечебного действия при их терапии.
Способность коллагеназ разрушать коллаген используется в медицине для лечения ожогов, гнойно-трофических язв, послеоперационных рубцов, остеохондрозов и др. В настоящее время известно довольно много ферментных препаратов с коллагенолитическим действием. Коллагеназы беспозвоночных обнаружены у пиявок, различных насекомых, у креветок, различных видов крабов. Однако далеко не все они являются источниками коллагеназ, применяемых в медицине. Это иногда связано с ограниченным количеством исходного материала, поэтому поиск новых, нетрадиционных источников коллагеназ имеет большое значение.
У беспозвоночных животных коллагеназы широко распространены и, в отличие от тканевых коллагеназ высших млекопитающих, используются в процессе пищеварения. Например, из морской звезды Pycnopodia helianthoides были выделены две протеиназы с коллагенолитическим действием. Одна из них отнесена к классу металлопротеиназ, а другая с меньшей молекулярной массой - химотрипсинового типа. Оба фермента разрушали меченый коллаген из шкуры гвинейской свиньи, но были практически неактивны по субстрату клостридиопептидазы PZ-Pro-Leu-Gly-Pro-D-Arg. M.E.Alexander, M.N.Dresden, Comp.Biochem.Physiol. 1980, V. 67B, p. 505-509.
Наиболее изучены и применяются для практических целей коллагеназы и комплексные ферментные препараты, полученные из представителей семейства Decapoda.
Препарат РНМ-101, содержащий протеиназы криля, был использован для лечения язв и эррозий, образовавшихся в результате ожога 4 н щелочью роговицы кроликов. Через 28 сут. лечения в 45% случаев наблюдали восстановление эпителия (без препарата - в 33% случаях), еще через 7 сут. лечения препаратом язвы роговицы уменьшились в размере, на основании чего делается вывод о целесообразности применения препарата из криля при лечении дефектов склеры глаза. Это один из немногих примеров применения коллагеназ членистоногих за рубежом. Sangwan V.S., Akpek E.K., Voo I., Zhao Т., Pinar V., Yang J., Christen W., Baltasar S., Wild R., Foster C.S //Cornea. 1999. V.I 8. P. 707-11.
Известен способ получения коллагеназы из головного отдела различных видов пиявок, приведенный в патенте WO 87/00860, опубл. 1987.02.12.
Согласно указанному патенту замороженный головной отдел пиявки гомогенизируют в дистиллированной воде 10 мин при 4°С. Суспензию далее центрифугируют 10 мин при 4°С и собирают супернатант. Осадок ресуспендируют и центрифугируют вновь. Супернатанты объединяют. Фермент высаливают сульфатом аммония 40% насыщения и центрифугируют 20 мин при 4°С. К супернатанту добавляют сульфат аммония до 80% насыщения и центрифугируют в тех же условиях. Осадок ресуспендируют в 50% -ном сульфате аммония и диализуют против дистиллированной воды при 4°С.
Активность во всех фракциях определяют, инкубируя 100 мкл каждой фракции в 100 мкл раствора коллагена 24 ч. После инкубации растворы помещают в лед на 30 мин и в надосадочной жидкости определяют коллагеназную активность. 2 мл образца из последнего осадка наносят на колонку с Сефадексом G-75 superfine и определяют активность в каждом белковом пике.
Выходы по активности и степени очистки не приводятся. Для дальнейших исследований используют самые активные фракции. Кроме коллагеназы авторы выделяли ингибиторы 400000, 45000 и 600 дальтон.
Коллагеназы пиявок не дают побочных эффектов и действуют прямо на один из основных стимуляторов аггрегации тромбоцитов.
Кроме того, в связи с тем, что коллагеназы пиявок разрушают коллаген только по одной связи, это дает возможность применять этот фермент вместе с другими активными факторами в микрохирургии при длительной остановке кровотечений или для сохранения циркуляции крови у застойных трансплантатов или лоскутов кожи и ткани (на ножке).
Недостатком известного способа является длительность и трудоемкость способа получения коллагеназы из этого вида сырья.
Известны очищенные препараты коллагеназ, выпускаемые зарубежными фирмами Sigma, ICN. Эти ферментные препараты приготовлены из культуральной жидкости Clostridium hystolyticum, патогенного микроорганизма, являющегося возбудителем газовой гангрены, поэтому требуют тщательной очистки в специальных условиях.
В процессе выделения ферментов производят отделение пигментов, токсина, бактериальной ДНК и сопутствующих протеолитических ферментов.
Выделенный раствор суммарного препарата белков наносят на хроматографическую колонку с гидроксиапатитом, и в дальнейшем проводят очистку путем гель-фильтрации и повторной хроматографии на Reactive Red 120-агарозе при рН 7,5.
Способ дорогостоящий из-за применения Red-12-агарозы и многостадийный, что приводит к снижению выхода активных ферментов и повышения их стоимости. Полученные таким образом препараты дороги, их применение в пищевой и медицинской промышленности невозможно из-за опасности микробного заражения, а также наличия токсина.
К недостаткам способа следует отнести также использование сырья, которое не содержит коллагеназ, способных оказывать заметное терапевтическое действие на застарелые рубцы различной этиологии (PCT/US 94/24272, C 12 N 9/52, 27.10.1994).
Известен также способ получения коллагеназы из ультраконцентрата культуральной жидкости Streptomyces lavendulae ИНМИ-36-SV, приведенный в патенте РФ №2075219 (С 12 N 9/58, 27.03.1996 г.). Согласно указанному патенту культуральную жидкость отделяют от мицелия фильтрованием, из фильтраты получают ультраконцентрат, из которого высаживают белок добавлением сульфата аммония до 60% насыщения. Осадок отделяют центрифугированием, растворяют и диализуют против трис-НСl буфера и пропускают через колонку с ДЕАЕ-целлюлозой. Активные фракции концентрируют, подвергают гельфильтрации на сефадексе G-100, объединяют и лиофилизируют. Полученный препарат имеет более высокую коллагеназную активность, чем препарат из Clostridium histolyticum, однако способ имеет ряд недостатков, в частности его многостадийность, использование дорогостоящего сефадекса для обессоливания. Более того, в патенте не указывается конечный выход по активности, что не дает возможности оценить эффективность способа.
В России активно разрабатывались суммарные препараты протеиназ из гепатопанкреаса промысловых видов крабов. Интерес к этому объекту связан с утилизацией отходов краболовства. Кроме того, немаловажным преимуществом по сравнению с коллагеназой из С. histolyticum, бактерии - возбудителя газовой гангрены является относительная безвредность препаратов коллагеназ из краба для человека. Препараты, полученные разными способами из гепатопанкреаса, значительно различаются по степени чистоты и активности, а также по ферментному составу.
На основе вышеуказанных препаратов ферментов создано большое количество лечебных форм в виде порошков, мазей и иммобилизованных на перевязочных материалах ферментов для лечения гнойных ран, язв, рубцов.
Наиболее близким к заявляемому является способ получения препарата коллагеназы из гепатопанкреаса промысловых видов краба Paralithodes Camtschatica, включающий гомогенизацию его в 0,1М ацетате аммония, содержащем 0,1-1,0 мМ ацетата кальция, рН 6,4, отделение супернатанта центрифугированием и осаждение препарата сульфатом аммония 60-70% насыщения. Осадок, содержащий коллагеназу, отделяют центрифугированием, растворяют в 0,1М ацетате аммония рН 5,2-6,4 с добавлением 0,1-1,0 мМ Са2+. Затем проводят ионообменную хроматографию на аминированных силикатных материалах при рН 5,2-6,4, коллагеназу элюируют буферным раствором, содержащим 1 М Nad в присутствии 15-25% изопропанола, при рН 7,0-8,5. Для дополнительной очистки и концентрации фермента коллагеназу высаливают из элюирующего раствора, насыщая его сульфатом аммония до 60%. Слой, содержащий активную коллагеназу, отделяют, диализируют и лиофильно высушивают.
В качестве аминированных силикатных материалов используют аминосилохром, аминоаэросил, аминосиликагель. Выход коллагеназы составляет 50%, очистка в 40 раз.
К недостаткам способа следует отнести невысокий выход и недостаточную очистку целевого продукта. Последнее особенно важно при медицинском применении препарата. Кроме того, применение анионообменной хроматографии приводит к потере ценных компонентов, изоэлектрическая точка которых выше 5. Обессоливание препарата коллагеназ диализом приводит к потере ферментов, т.к. коллагеназа за время диализа (2 суток) частично гидролизует диализные мешки. Длительное пребывание ферментов в дистиллированной воде с рН 5,6 приводит к частичной инактивации ряда протеолитических ферментов. Более того, полученные препараты не оказывают заметное терапевтическое действие на застарелые рубцы различной этимологии. Патент РФ №2008353, C 12 N 9/64, 28.02.94 г.
Задачей изобретения является создание способа получения новой формы препарата коллагеназы, обладающей большой удельной активностью по отношению к рубцовой ткани человека различной этиологии.
Другой задачей изобретения является повышение выхода препарата и сокращение времени проведения процесса.
Поставленные задачи решаются тем, что в способе получения препарата коллагеназы, включающем гомогенизацию исходного коллагенсодержащего сырья, отделение экстракта центрифугированием, хроматографическую очистку на ионообменном сорбенте и последующие элюцию активных ферментов, диализ элюата и лиофильную сушку препарата, в качестве исходного коллагенсодержащего сырья используют личинки жуков-кожеедов рода Dermestes, гомогенизацию проводят в растворе хлорида натрия с добавлением азида натрия при объемном соотношении биомассы и раствора 1:2-2,5, при этом хроматографическую очистку ведут на ДЕАЕ-сефарозе, уравновешенной MES-буфером с добавлением 0,005М хлорида кальция, а элюцию - трисовым буфером с добавлением хлорида натрия, хлорида кальция и этилового спирта.
Обычно, гомогенизацию проводят в 3-4%-ном растворе хлорида натрия с добавлением 1-5 мкМ/л азида натрия при рН 6-7.
Предпочтительно проводить элюцию буферным раствором, содержащим 1,5 М хлорида натрия, 0,005 М хлорида кальция, и 20%-ного этилового спирта, а диализ - в 0,005 М растворе хлорида натрия при 2-6°С.
Сущность предлагаемого способа заключается в следующем. В качестве источника коллагеназы используют личинки жуков-кожеедов рода Dermestes, способных в качестве пищевого субстрата использовать мумифицированные трупы крупных животных. Личинки кожеедов используются на той стадии развития, когда активность коллагеназы максимальная.
Личинки обезглавливают микроножницами, из тела личинки вынимают пищеварительную трубку и гомогенизацию проводят в 3-4%-ном растворе хлористого натрия с добавлением следовых количеств азида натрия, не более 1-5 мкМ/л для уничтожения микрофлоры раствора.
Очистку супернатанта ведут ионообменной хроматографией, при этом сорбцию коллагеназы осуществляют на ДЭАЭ-сефарозе в присутствии 50 мМ MES-буфера, (рН=6,4), с 0,005М хлоридом кальция, а элюцию - трисовым буфером рН=8-8,5 с 1,5 М хлоридом натрия и 20% этиловым спиртом, содержащим 0,005 М хлорид кальция.
Обессоливание и концентрирование целевого препарата осуществляют диализом с последующим лиофильным высушиванием.
Суммарный выход активного продукта составляет - 50-75% в зависимости от гетерогенности используемого сырья.
Удельная активность коллагеназы по рубцам различной этиологии повышается в 5-10 раз.
Пример 1.
Пищеварительные тракты из 1000 личинок гомогенизируют в 3%-ном растворе хлорида натрия с добавлением азида натрия в количестве 3 мкМ/л, рН-6-7, в стеклянном механическом гомогенизаторе при объемном соотношении биомассы и раствора, равном 1:2 в течение 15 мин при комнатной температуре.
Полученный гомогенат подвергают центрифугированию при 10000 об/мин. Получают 100 мл суммарного препарата белков пищеварительного тракта личинок кожеедов.
Из полученного раствора 10 мл наносят на колонку (1,5х20 см) с ДЭАЭ-сефарозой, уравновешенной MES-буфером, рН=6,4, с 0,005 М хлорида кальция.
Элюцию активных ферментов проводят 0,05М трисовым буфером при рН=8, с 1,5 М хлорида натрия, 0,005М хлорида кальция и 20% по объему этилового спирта.
Элюат подвергают диализу против 0,005М раствора хлорида кальция в течение суток при +4°С, затем лиофильно высушивают. Выход ферментного препарата составляет 60%. Удельная активность полученного ферментного препарата 25 мг рубцовой ткани /сутки на 0,1 мг препарата.
Пример 2.
Исследование влияния препарата белков пищеварительного тракта личинок кожеедов на гипертрофические келоидные рубцы человека проводят in vitro по нижеприведенной методике.
Для исследования берут образцы рубцов трех пациентов:
1 - 2-летний гипертрофический рубец
2 - 2-х летний гипертрофический келоидный рубец
3 - 2,5 летний келоидный рубец.
Для каждого образца рубца делают 4 навески ткани массой 50 мг каждая. Навески помещают в буфер для коллагенолиза.
Готовят растворы трипсина (отрицательный контроль) и клостридиальной коллагеназы (положительный контроль) с концентрацией, равной и рассчитанной для коллагеназы в исследуемом препарате. Определение концентрации всех белков производят по методу Бредфорд.
Трипсин используют для проверки интактности рубцовой ткани, клостридиальную коллагеназу - в качестве эталона коллагеназной активности.
Коллагенолиз проводят в закрытых стеклянных бюксах на качалке при 36°С, 96 час.
Результаты коллагенолиза приведены на чертежах.
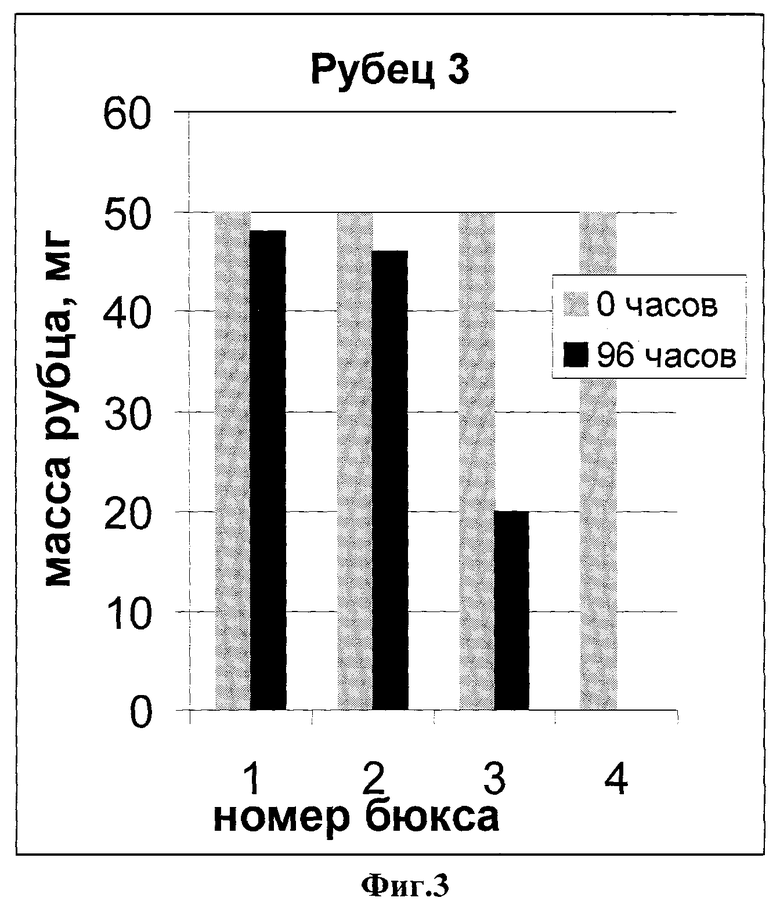
На фиг.1 показана динамика расщепления 2-х летнего гипертрофического рубца.
На фиг 2 показана динамика расщепления 2-х летнего гипертрофического келоидного рубца.
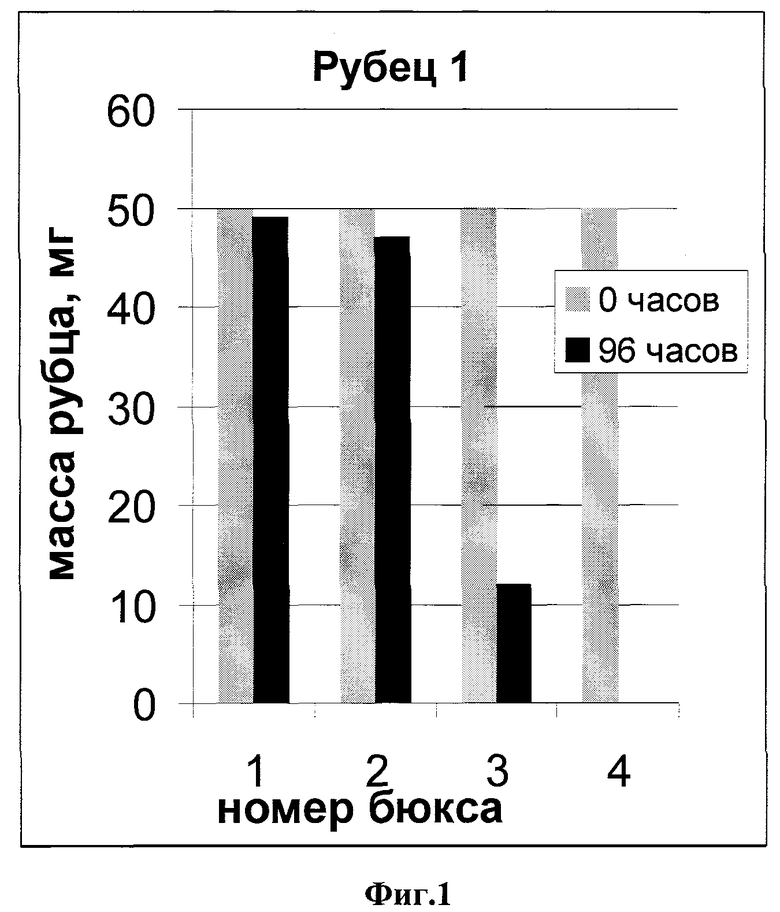
На фиг.3 показана динамика расщепления 2,5 летнего келоидного рубца.
На всех чертежах номера бюксов соответствуют:
№1 - буфер для коллагенолиза
№2 - трипсин
№3 - клостридиальная коллагеназа
№4 -препарат коллагеназы личинок кожеедов
Как видно из рисунков, исследуемый препарат эффективнее клостридиальной коллагеназы во всех случаях: навески 1 и 3 рубцов полностью растворились за 48 часов.
На фиг.4 приведены данные сравнения активности препаратов при расщеплении застарелого гипертрофического келоидного рубца (2,5 года) в процентном соотношении.
Столбиками показана остаточная масса навески рубца в процентах после расщепления.
Столбик 1 - контроль - без фермента
Столбик 2 - добавлялась клостридиопептидаза
Столбик 3 - с препаратом коллагеназы из личинок Dermestes
Столбик 4 -с препаратом Морикраза.
Таким образом, предлагаемый способ позволяет получать коллагеназу из личинок жуков кожеедов с выходом до 75%, повысить удельную активность в 5-10 раз, сократить время процесса за счет сокращения общего числа стадий выделения препарата и сделать способ достаточно экономным за счет применения более дешевого сорбента для хроматографической очистки.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ФЕРМЕНТАТИВНОГО КОМПЛЕКСНОГО ПРЕПАРАТА, ОБЛАДАЮЩЕГО КОЛЛАГЕНАЗНОЙ АКТИВНОСТЬЮ | 2008 |
|
RU2412997C2 |
| Способ получения протеолитического препарата для медицинского применения | 2015 |
|
RU2610669C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИНГИБИТОРА КОЛЛАГЕНАЗЫ С ПРОТИВООПУХОЛЕВЫМ ДЕЙСТВИЕМ ИЗ ГЕПАТОПАНКРЕАСА КАМЧАТСКОГО КРАБА | 2009 |
|
RU2412995C1 |
| СПОСОБ ПОЛУЧЕНИЯ КАРБОКСИПЕПТИДАЗЫ B ИЗ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ СВИНЬИ | 2007 |
|
RU2354696C1 |
| СПОСОБ ПОЛУЧЕНИЯ ФЕРМЕНТА ПЕРОКСИДАЗЫ ИЗ КОРНЕЙ ХРЕНА | 2007 |
|
RU2353652C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА КОЛЛАГЕНАЗЫ | 1991 |
|
RU2008353C1 |
| СПОСОБ ПОЛУЧЕНИЯ ВЫСОКООЧИЩЕННОГО КОНЦЕНТРИРОВАННОГО ПРЕПАРАТА С КОЛЛАГЕНАЗНОЙ АКТИВНОСТЬЮ | 2021 |
|
RU2781289C1 |
| Композиция антимикробных пептидов, полученных из личинок Musca domestica, и способ ее получения | 2018 |
|
RU2714128C1 |
| Способ получения @ - @ -галактозидазы | 1982 |
|
SU1082812A1 |
| СПОСОБ ОЧИСТКИ КОЛЛАЗЫ | 1996 |
|
RU2121503C1 |


Изобретение относится к биотехнологии, может быть использовано в медицине, косметологии, дерматологии, биохимии и пищевой промышленности, а также для исследовательских целей. Способ получения препарата коллагеназы включает гомогенизацию исходного коллагенсодержащего сырья, отделение экстракта центрифугированием, хроматографическую очистку на ионообменном сорбенте и последующие элюцию активных ферментов, диализ элюата и лиофильную сушку препарата. В качестве исходного коллагенсодержащего сырья используют личинки жуков-кожеедов рода Dermestes, гомогенизацию проводят в растворе хлорида натрия с добавлением азида натрия при объемном соотношении биомассы и раствора 1:2-2,5, при этом хроматографическую очистку ведут на ДЕАЕ-сефарозе, уравновешенной MES-буфером с добавлением 0,005 М хлорида кальция, а элюцию – трисовым буфером, с добавлением хлорида натрия, хлорида кальция и этилового спирта. Изобретение обеспечивает высокий выход коллагеназы, повышает удельную активность в 5-10 раз, сокращает продолжительность процесса получения. 3 з.п. ф-лы, 4 ил.
| СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА КОЛЛАГЕНАЗЫ | 1991 |
|
RU2008353C1 |
| СПОСОБ ОЧИСТКИ КОЛЛАЗЫ | 1996 |
|
RU2121503C1 |
| СПОСОБ ПОЛУЧЕНИЯ ФЕРМЕНТНОГО ПРЕПАРАТА, ОБЛАДАЮЩЕГО КОЛЛАГЕНОЛИТИЧЕСКОЙ АКТИВНОСТЬЮ | 1996 |
|
RU2096456C1 |
| Бесколесный шариковый ход для железнодорожных вагонов | 1917 |
|
SU97A1 |
| EP 0402321, 12.12.1990. | |||
Авторы
Даты
2004-09-20—Публикация
2003-05-20—Подача