Изобретение относится к экспериментальной медицине и может быть использовано для моделирования локального тромбоза с целью изучения естественного течения, патофизиологии и патоморфологии тромбоза, разработки методов диагностики и лечения локальных тромбозов, а также оценки эффективности терапии.
Тромбозы разных локализаций ассоциированы со многими распространенными заболеваниями, имеющих большое социальное и экономическое значение, и являются причиной инвалидизации и смертности населения, включая пациентов трудоспособного возраста. К таким заболеваниям и относятся острый инфаркт миокарда, ишемический инсульт головного мозга, тромбоэмболия легочной артерии, тромбоз периферических артерий, в том числе – с развитием критической ишемии. В общей популяции частота тромбозов глубоких вен нижних конечностей ежегодно достигает порядка 160 на 100 000 человек, в ближайший месяц от легочной тромбоэмболии погибает около 30% из них, в течение последующих двух лет рецидив заболевания развивается еще у 20% пациентов (Диагностика и лечение тромбоза глубоких вен нижних конечностей: учебно-методические рекомендации под ред. Ю.Л. Шевченко. – Москва, 2006. – ФГУ «НМЦХ им. Н.И. Пирогова Росздрава». – 24 с.; Prevention of venous thromboembolism. Geerts W.H., Pineo G.F., Heit J.A. et al. The Seventh ACCP Conference on Antithrombotic and Thrombotic Therapy. Chest. 2004; 126:338-400). В дальнейшем до 50% страдают от проявлений посттромботической болезни, требующей пролонгированной и пожизненной терапии (Epidemiology of the post-thrombotic syndrome. Galanaud J.P., Monreal M., Kahn S.R. Thromb Res. 2018 Apr;164:100-109). Текущая пандемия COVID-19 также показала ведущее значение тромбоза в развитии жизнеугрожающих осложнений новой коронавирусной инфекции (Prevalence of venous thromboembolism in patients with severe novel coronavirus pneumonia. Cui S., Chen S., Li X., Liu S., Wang F. J Thromb Haemost. 2020;18(6):1421-1424).
Для повышения эффективности и безопасности профилактики и лечения тромбозов проводится апробация лекарственных препаратов и разработка новых методов и технологий, причем обязательным компонентом исследования является доклинический этап, проводимый в том числе в условиях эксперимента, поэтому актуальным является создание адекватных и разноплановых моделей тромбозов.
В настоящее время известны различные способы моделирования тромбозов.
Механические или лигатурные методы, основанные на экстравазальном способе прекращения кровотока, позволяют достичь окклюзии сосуда при перевязке или клипировании.
Преимуществами этих методов является возможность создать тромбоз при прекращении кровотока и отсутствии воспаления стенки сосуда. Модель позволяет оценить состояние венозной стенки и тромботических масс и полезна при изучении их взаимодействия с целью наблюдения перехода острого процесса в хронический.
Недостатками метода являются травматичность доступа (Venostasis-induced thrombosis in rats is not influenced by circulating platelet or leukocyte number. Reyers I., Gaetano de G., Donati M.B. Agents Actions 1989; 28:1-2:137-141), рассечение и расслоение паравазальных тканей и компрессия всех слоев стенки сосуда с их ишемией и нарушением вегетативной иннервации, т.к. формирование венозного тромба в естественных условиях часто происходит при отсутствии циркулярной компрессии и нарушения кровотока по vasa vasorum, а также без повреждения периферических элементов симпатической и парасимпатической нервной системы. Нарушается хронология развития сосудистой патологии, а вследствие полного отсутствия кровотока формируется препятствие оптимальному воздействию на тромб и венозную стенку системно вводимых терапевтических препаратов.
Тромбообразование может быть достигнуто при введении веществ, провоцирующих формирование тромба (Biologic assay of a thrombosis-inducing activity in human serum. Wessler S., Reimer S.M., Sheps M.C. J Appl Physiol. 1959 Nov;14:943-946). Однако такие препараты могут повреждать сосуд на всем протяжении и, проникая в системный кровоток, вызывать нежелательные явления. Для включения в процесс других компонентов триады Вирхова необходимо также дополнительно моделировать механический флебостаз (Importance of platelets in experimental venous thrombosis in the rat. Herbert J.M., Bernat A., Maffrand J.P. Blood 1992;80:9:2281-2286).
Модель тромбоза, инициированная лазером, позволяет сохранить контакт с кровью проксимального и дистального участков тромбоза, что дает возможность изучать действие системно вводимых терапевтических препаратов на патологически измененную зону и не исключает адекватную работу аутофибринолитической системы. Кроме того возникает постепенное нарастание тромба, что более физиологично.
Однако имеются следующие недостатки метода: происходит перегрев окружающих тканей, разрушение сосудистой стенки в ходе лазерного воздействия, а также имеется высокая вероятность вымывания клеточных конгломератов с миграцией их в системный кровоток (Antithrombotic effects of aspirin and LMWH in a laser-induced model of arterials and venous thrombosis. Imbault P., Doutremepuich F., Aguejouf O., Doutremepuich C. Thromb Res 1996;82(6):469-478; Experimental retinal branch vein occlusion in rhesus monkeys. I. Hamilton A.M., Kohner E.M., Rosen D., Bird A.C., Dollery C.T. Clinical appearances. Br J Ophthalmol. 1979 Jun; 63(6):377-387).
В качестве прототипа изобретения был выбран известный метод тромбообразования – фотохимически-индуцированный тромбоз (Induction of reproducible brain infarction by photochemically initiated thrombosis. Watson B.D., Dietrich W.D., Busto R., Wachtel M.S., Ginsberg M.D. Ann Neurol. 1985 May;17(5):497-504). Указанный способ осуществляется следующим образом. Обнажается череп экспериментального животного в зоне участка планируемого тромбообразования. Для индукции тромбоза через канюлю в хвостовую вену крысы вводят раствор фотосенсибилизируемого красителя – бенгальского розового, после чего проводят облучение участка сосуда зеленым светом (длина волны – 560 нм) в течение 20 минут. Фотодинамическое воздействие создает выраженное цитотоксическое и антипролиферативное влияние на биологические мембраны вследствие светоиндуцированной реакции активизации фотосенсибилизатора. В последующем при морфологичнском исследовании тромбоз был подтвержден. Однако этот способ имеет ряд недостатков.
1. Фотосенсибилизируемый краситель не фиксируется в одном месте, что требует избыточного введения препарата экспериментальному животному и значительно затрудняет расчеты.
2. Облученный светом активированный фотосенсибилизируемый краситель вымывается в системный кровоток, вызывая повреждение стенок сосудов не только в области, выбранной для экспериментальной модели тромбоза, но и вне ее.
3. При данной методике происходит миграция вазоактивных и провоспалительных метаболитов из зоны воздействия активированного фотосенсибилизируемого красителя в микроциркуляторное русло, замедляя формирование тромбоза.
4. Длительное воздействие способствует перегреванию тканей, что искажает картину эксперимента и требует дополнительного охлаждения зоны воздействия.
Задачей предлагаемого изобретения является создание модели локального тромбоза.
Технический результат – создание модели локального управляемого фототромбоза на ухе кролика с повреждением стенок только целевых сосудов без миграции вазоактивных и провоспалительных метаболитов из зоны воздействия активированного фотосенсибилизируемого красителя в микроциркуляторное русло и перегревания окружающих сосуд тканей.
Технический результат достигается тем, что приготавливают мелкодисперсную взвесь 1 см2 гемостатической коллагеновой антисептической губки в 1 мл 0,9%-ного водного раствора хлорида натрия, смешивают в пропорции 1:1 с 1 мл 3%-ного раствора фотосенсибилизируемого красителя бенгальского розового, пережимают только краевую вену уха кролика с сохранением артериального кровотока, через катетер внутривенно вводят полученную тромбогенную смесь, проводят облучение выбранного сосуда от зоны пережатия до катетера зеленым светом длиной волны 560 нм в течение 15 минут, после чего прекращают пережатие сосуда.
Предлагаемый способ осуществляют следующим образом: в стерильных условиях приготавливают мелкодисперсную взвесь 1 см2 гемостатической коллагеновой антисептической губки в 1 мл 0,9%-ного водного раствора хлорида натрия. Для индукции фототромбоза приготавливают 1 мл 3%-ного раствора фотосенсибилизируемого красителя бенгальского розового. Полученные препараты смешивают в пропорции 1:1. Пережимают краевую вену уха кролика с сохранением артериального кровотока, через катетер внутривенно вводят тромбогенную смесь в необходимом для его заполнения количестве. Проводят облучение выбранного сосуда от зоны пережатия до катетера, временно препятствующего проксимальному оттоку содержимого вены, зеленым светом (длина волны – 560 нм) в течение 15 минут, после чего прекращают пережатие сосуда, удаляют катетер и регистрируют отсутствие кровотока в зоне облучения.
Данный способ позволяет фиксировать фотосенсибилизируемый краситель в зоне эксперимента, избегая попадания в системный кровоток и распространения по всему кровеносному руслу, что позволяет снизить вводимую дозу препарата.
Активированный фотосенсибилизируемый краситель не вымывается в системный кровоток, что исключает повреждение стенок сосудов за пределами выбранной для эксперимента области. В предлагаемом способе возникает препятствие для попадания фотосенсибилизируемого красителя в микроциркуляторное русло, однако кровоток в проксимальном отделе остается сохранным, что исключает препятствие аутотромболизису и, в комплексе, позволяет уменьшить зону повреждения, что соответствует естественному течению тромбоза.
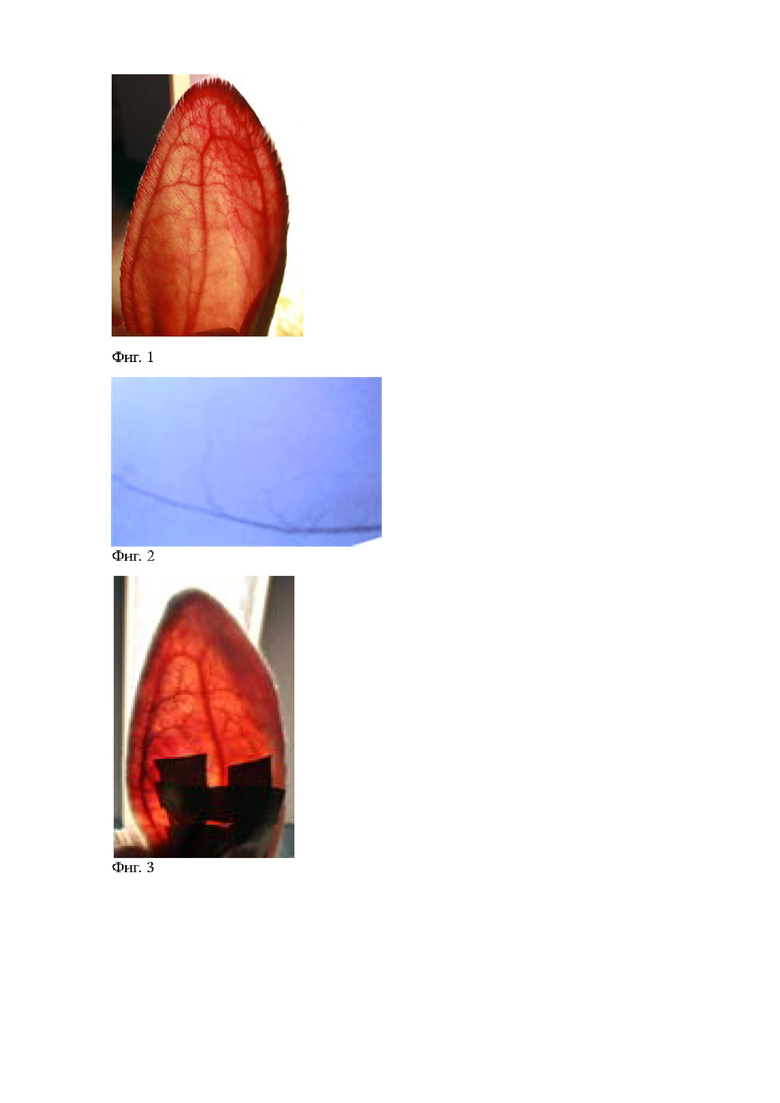
Пример. Эксперимент с целью ангиографического подтверждения гемодинамической состоятельности комбинированного тромбоза краевой вены правого уха кролика. Кролик массой 3,123 кг. С целью определения зоны катетеризации вены для введения тромбогенной смеси выполнено визуальное исследование кровеносного русла уха кролика в проходящем свете. Хорошо выражены краевые и центральная вены. (фиг. 1). Для подтверждения проходимости вены и наличия кровотока проведена катетеризация краевой вены правого уха в его основании и введен контраст Йопамиро 370, 2 мл, после чего выполнена рентгенскопия. На рентгенконтрастном изображении вен правого уха контрастируется краевая вена правого уха и ее притоки (фиг. 2). С целью моделирования комбинированного тромбоза краевой вены правого уха кролика в стерильных условиях подготовлена мелкодисперсная взвесь 1 см2 гемостатической коллагеновой антисептической губки в 1 мл 0,9% водного раствора хлорида натрия. Для индукции фототромбоза приготовили 1 мл 3%-ного раствора фотосенсибилизируемого красителя бенгальского розового. Полученные препараты смешали в пропорции 1:1. В области верхушки правого уха краевая вена пережата на границе верхней и средней трети, через катетер внутривенно введена подготовленная тромбогенная смесь до заполнения краевой вены до области пережатия. Катетер перекрыт. Проведено облучение краевой вены от зоны пережатия до катетера, препятствующего проксимальному оттоку содержимого вены, зеленым светом (длина волны – 560 нм) в течение 15 минут. Для верификации клинических признаков воспалительной реакции в зоне облучения выполнено визуальное исследование кровеносного русла уха кролика в проходящем свете. При визуальном исследовании кровеносного русла правого уха кролика в проходящем свете видно усиление сосудистого рисунка усиление контрастности краевой вены правого уха и гиперемия окружающих ее тканей (фиг. 3).
С целью гемодинамической оценки наличия тромбоза сосуда выполнена ангиография краевой вены правого уха с введением контраста Йопамиро 370, 2 мл, ретроградно через имеющийся катетер краевой вены правого уха. При рентгеноскопии получено отчетливое изображение постепенно контрастируемого проксимального участка краевой вены в зоне ее катетеризации, отсутствие контрастирования средней трети краевой вены и притоков сосуда в этой области (фиг. 4), что соответствует зоне моделированного тромбоза.
Предлагаемый способ позволяет фиксировать фотосенсибилизируемый краситель в зоне эксперимента, избегая попадания в системный кровоток и распространения по всему кровеносному руслу, что позволяет снизить вводимую дозу препарата.
Активированный фотосенсибилизируемый краситель не вымывается в системный кровоток, что исключает повреждение стенок сосудов за пределами выбранной для эксперимента области. В предлагаемом способе возникает препятствие для попадания активированного фотосенсибилизируемого красителя в микроциркуляторное русло, однако кровоток в проксимальном отделе остается сохранным, что исключает препятствие аутотромболизису и, в комплексе, позволяет уменьшить зону повреждения, что соответствует естественному течению тромбоза.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ МОДЕЛИРОВАНИЯ ТРОМБООБРАЗОВАНИЯ У МЫШЕЙ ДЛЯ ОЦЕНКИ ДЕЙСТВИЯ ПРЕПАРАТОВ АНТИКОАГУЛЯНТА | 2014 |
|
RU2570162C1 |
| Способ моделирования тромбоза легочной артерии в условиях венозного тромбоза | 2021 |
|
RU2770355C1 |
| СПОСОБ ОЦЕНКИ СОСТОЯНИЯ СОСУДОВ МИКРОЦИРКУЛЯТОРНОГО РУСЛА | 2014 |
|
RU2555397C1 |
| ФЕРМЕНТНЫЙ ПРЕПАРАТ ТРОМБОЛИТИЧЕСКОГО И ФИБРИНОЛИТИЧЕСКОГО ДЕЙСТВИЯ ИЗ БАЗИДИАЛЬНОГО ГРИБА РОДА Coprinus | 2010 |
|
RU2435848C1 |
| Способ моделирования недостаточности маточно-плацентарного кровообращения | 1980 |
|
SU956982A1 |
| Способ хирургического лечения рака правой почки с опухолевым тромбозом нижней полой вены тип 3-4 в условиях вено-венозного обходного шунтирования и in situ нормотермической изолированной перфузии печени | 2024 |
|
RU2837006C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ТРОМБОЭМБОЛИЧЕСКИХ ОСЛОЖНЕНИЙ ПРИ ЭНДОПРОТЕЗИРОВАНИИ КРУПНЫХ СУСТАВОВ НИЖНИХ КОНЕЧНОСТЕЙ | 2004 |
|
RU2272560C1 |
| Способ увеличения объема повреждения миокарда желудочков при радиочастотной аблации | 2022 |
|
RU2802151C1 |
| СПОСОБ ЛЕЧЕНИЯ ИШЕМИЧЕСКИХ НАРУШЕНИЙ ПЕЧЕНИ | 2014 |
|
RU2563796C1 |
| Способ лечения тромбоза и стеноза артериального анастомоза после трансплантации печени | 2020 |
|
RU2736905C1 |

Изобретение относится к экспериментальной медицине и может быть использовано для моделирования локального тромбоза с целью изучения естественного течения, патофизиологии и патоморфологии тромбоза, разработки методов диагностики и лечения локальных тромбозов, а также оценки эффективности терапии. Приготавливают мелкодисперсную взвесь 1 см2 гемостатической коллагеновой антисептической губки в 1 мл 0,9%-ного водного раствора хлорида натрия, смешивают в пропорции 1:1 с 1 мл 3%-ного раствора фотосенсибилизируемого красителя бенгальского розового. Пережимают краевую вену уха кролика с сохранением артериального кровотока. Через катетер внутривенно вводят полученную тромбогенную смесь. Проводят облучение выбранного сосуда от зоны пережатия до катетера зеленым светом длиной волны 560 нм в течение 15 минут, после чего прекращают пережатие сосуда. Способ позволяет создать локальный фототромбоз на ухе кролика с повреждением стенок только целевых сосудов без миграции вазоактивных и провоспалительных метаболитов из зоны воздействия активированного фотосенсибилизируемого красителя в микроциркуляторное русло и перегревания окружающих сосуд тканей. 4 ил., 1 пр.
Способ моделирования локального фототромбоза на ухе кролика, включающий индукцию фототромбоза внутривенным введением 3%-ного раствора фотосенсибилизируемого красителя бенгальского розового, с последующим проведением облучения участка сосуда зеленым светом с длиной волны 560 нм, отличающийся тем, что 1 мл 3%-ного раствора фотосенсибилизируемого красителя бенгальского розового смешивают в пропорции 1:1 с мелкодисперсной взвесью 1 см2 гемостатической коллагеновой антисептической губки в 1 мл 0,9%-ного водного раствора хлорида натрия, пережимают краевую вену уха кролика с сохранением артериального кровотока, через катетер внутривенно вводят полученную тромбогенную смесь, проводят облучение сосуда от зоны пережатия до катетера зеленым светом длиной волны 560 нм в течение 15 минут, после чего прекращают пережатие сосуда.
| СПОСОБ МОДЕЛИРОВАНИЯ ТРОМБООБРАЗОВАНИЯ У МЫШЕЙ ДЛЯ ОЦЕНКИ ДЕЙСТВИЯ ПРЕПАРАТОВ АНТИКОАГУЛЯНТА | 2014 |
|
RU2570162C1 |
| СПОСОБЫ ЛЕЧЕНИЯ НЕВРОЛОГИЧЕСКИХ СОСТОЯНИЙ С ПРИМЕНЕНИЕМ ГЕМАТОПОЭТИЧЕСКИХ ФАКТОРОВ РОСТА | 2003 |
|
RU2353385C2 |
| ГРИШАЧЕВА Т.Г | |||
| Влияние фотоактивированного бенгальского розового на микроциркуляцию // Biomedical Photonics., 2017, т | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
| СЫСОЕВ Ю.И | |||
| и др | |||
| Использование моделей ишемического инсульта у кроликов в биомедицинских исследованиях / Формула фармации, 2019, т | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
Авторы
Даты
2022-10-21—Публикация
2022-03-25—Подача