ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] В настоящей заявке испрашивается приоритет по предварительной заявке на патент США №62/378,978, поданной 24 августа 2016 г. и предварительной заявке на патент США №62/443,981, поданной 9 января 2017 г., содержание которых включено в настоящий документ посредством ссылки в полном объеме.
ЗАЯВЛЕНИЕ О ПРАВАХ НА ИЗОБРЕТЕНИЯ, СДЕЛАННЫЕ В ХОДЕ ФИНАНСИРУЕМЫХ ИЗ ФЕДЕРАЛЬНОГО БЮДЖЕТА ИССЛЕДОВАНИЙ
[0002] Не применимо.
ОБЛАСТЬ ТЕХНИКИ
[0003] Настоящее изобретение относится к области конструирования полипептидов и геномной инженерии, и гомологичной рекомбинации.
УРОВЕНЬ ТЕХНИКИ
[0004] Искусственные нуклеазы, такие как сконструированные нуклеазы с цинковыми пальцами (ZFN), подобные активаторам транскрипции эффекторные нуклеазы (TALEN), система CRISPR/Cas со сконструированной cr-РНК/tracr-РНК («одиночной направляющей РНК'»), также называемые РНК-направляемыми нуклеазами; и/или нуклеазы на основе системы Argonaute (например, из T. thermophilus, известная как «TtAgo», (Swarts et al (2014) Nature 507(7491): 258-261) содержат ДНК-связывающие домены (нуклеотидные или полипептидные), ассоциированные или функционально связанные с доменами расщепления, и указанные молекулы использовали для направленного изменения геномных последовательностей. Например, нуклеазы применяли для встраивания экзогенных последовательностей, инактивации одного или более эндогенных генов, получения организмов (например, сельскохозяйственных культур) и линий клеток с измененными паттернами генной экспрессии, и т.п. См., например, патенты США №9,255,250; №9,200,266; №9,0457,63; №9,005,973; №8,956,828; №8,945,868; №8,703,489; №8,586,526; №6,534,261; №6,599,692; №6,503,717; №6,689,558; №7,067,317; №7,262,054; №7,888,121; №7,972,854; №7,914,796; №7,951,925; №8,110,379; №8,409,861; патентные публикации США 20030232410; 20050208489; 20050026157; 20050064474; 20060063231; 20080159996; 201000218264; 20120017290; 20110265198; 20130137104; 20130122591; 20130177983 и 20130177960 и 20150056705. Например, для расщепления геномных последовательностей можно применять пару нуклеаз (например, нуклеаз с цинковыми пальцами, TALEN, гибридных dCas-Fok). Каждый член указанной пары обычно включает сконструированный (не встречающийся в природе) ДНК-связывающий белок, соединенный с одним или более доменами (или полудоменами) расщепления нуклеазы. Когда указанные ДНК-связывающие белки связываются со своим целевым сайтом, домены расщепления, которые соединены с указанными ДНК-связывающими белками, располагаются таким образом, что может происходить их димеризация и последующее расщепление генома.
[0005] Как правило, межмолекулярные ионные пары (солевые мостики) имеют существенное значение для многих взаимодействий ДНК с белком. Часто заряженные боковые цепи аминокислот (т.е. -NH3+, =NH2+) взаимодействуют с отрицательно заряженными фосфатными группами остова ДНК с образованием солевого мостика. Указанные ионные пары могут быть достаточно динамичными и переключаться между прямым спариванием двух ионов и спариванием, которое представляет собой «разделенную растворителем ионную пару», где между двумя ионами встроен растворитель (например, молекула воды) (Chen et al (2015) J Phys Chem Lett 6:2733-2737).
[0006] В случае белков с цинковыми пальцами специфичность ZFP в отношении целевой последовательности ДНК зависит от специфических, определяемых последовательностью контактов между доменами с цинковыми пальцами и определенными основаниями ДНК. Кроме того, домены с цинковыми пальцами также содержат остатки аминокислот, принимающие участие в неспецифических взаимодействиях ионных пар с фосфатами остова ДНК. Elrod-Erickson с соавторами (Elrod-Erickson et al (1996). Structure 4:1171) продемонстрировали путем совместной кристаллизации белка с цинковыми пальцами и когнатной ДНК-мишени наличие специфических аминокислот, способных взаимодействовать с фосфорными группами в остове ДНК за счет образования водородных связей. Белки с цинковыми пальцами, в которые входит хорошо известный остов Zif268, как правило, содержат аргинин в качестве аминоконцевого остатка второй цепи β-складки, который также расположен во втором положении в направлении карбоксильного конца относительно второго инвариантного цистеина (см. Фиг. 5A). Указанное положение в составе каждого домена с цинковыми пальцами может называться (-5), поскольку представляет собой 5-й предшествующий началу α-спирали остаток (Фиг. 5A). Аргинин в указанном положении может взаимодействовать с фосфатом на остове ДНК за счет образования заряженной водородной связи с гуанидиновой группой боковой цепи. Белки с цинковыми пальцами с остовом Zif268 также часто содержат лизин в положении 4-го по счету остатка в направлении аминоконца от первого инвариантного цистеина. Указанное положение в составе каждого «пальца» может называться (-14), поскольку представляет собой 14-й остаток, предшествующий началу α-спирали для цинковых пальцев с двумя остатками между координирующими цинк остатками цистеина (Фиг. 5A). Лизин может взаимодействовать с фосфатом на остове ДНК за счет образования опосредованной водой заряженной водородной связи с аминогруппой боковой цепи. Поскольку фосфатные группы располагаются по всей длине остова ДНК, указанный тип взаимодействия между цинковыми пальцами и молекулой ДНК обычно считают неспецифическим в отношении последовательности (J. Miller, Massachusetts Institute of Technology Ph.D. Thesis, 2002).
[0007] В ходе недавних исследований было выдвинуто предположение, что неспецифический контакт фосфата с боковыми цепями в некоторых нуклеазах может также объяснять некоторую часть неспецифической расщепляющей активности указанных нуклеаз (Kleinstiver et al, (2016) Nature 529(7587):490-5; Guilinger et al (2014) Nat Meth: 429-435). Исследователи предположили, что указанные нуклеазы могут обладать «избыточной энергией связывания ДНК», что означает, что они могут отличаться большей аффинностью в отношении своей ДНК-мишени, чем по существу необходимо для связывания и расщепления целевого сайта. Соответственно, были предприняты попытки уменьшения катионных зарядов в ДНК-связывающем домене TALE (Guilinger, там же) или ДНК-связывающем домене Cas9 (Kleinstiver, там же) для снижения энергии связывания ДНК указанных нуклеаз, что приводило к увеличению специфичности расщепления in vitro. Однако дополнительные исследования (Sternberg et al (2015) Nature 527(7576):110-113) также указывают на роль в правильной укладке и активации домена нуклеазы Cas9, которую играют некоторые катионные аминокислоты, мутированные при исследовании ДНК-связывающего домена Cas9, проведенном Kleinstiver. Таким образом, точная роль указанных аминокислот в активности Cas9 неизвестна.
[0008] Для оптимальной специфичности расщепления селективной по последовательности (искусственной) нуклеазой желательно создание условий, обеспечивающих не насыщающие целевое связывание и активность. В насыщающих условиях - по определению - используют количество нуклеазы, избыточное относительно необходимого для достижения полной активности в отношении мишени. Указанный избыток не обеспечивает преимуществ в отношении мишени, но может, тем не менее, приводить к увеличению расщепления в нецелевом сайте. В случае мономерных нуклеаз, насыщающих условий можно легко избежать путем проведения простого исследования зависимости «доза-ответ», чтобы идентифицировать и избежать плато насыщения на кривой титрования. Однако в случае димерной нуклеазы, такой как ZFN, TALEN или dCas-Fok, идентифицировать и избежать насыщающих условий может быть сложнее, если аффинность связывания индивидуальных мономеров неодинакова. В таких случаях исследование «доза-ответ» с применением простого отношения нуклеаз 1:1 обнаруживает только точку насыщения для мономера, отличающегося более слабым связыванием. В таком сценарии, если, например, аффинность мономеров отличается на один порядок, в точке насыщения, идентифицированной в титрационном исследовании 1:1, мономер с большей аффинностью будет присутствовать в концентрации, в 10 раз превышающей необходимую. Итоговый избыток мономера с большей аффинностью может, в свою очередь, приводить к увеличению нецелевой активности без обеспечения какого-либо благоприятного увеличения расщепления в предусмотренной мишени, что потенциально может приводить к уменьшению общей специфичности для любой заданной пары нуклеаз.
[0009] Для уменьшения нецелевого расщепления были разработаны сконструированные облигатные гетеродимерные полудомены расщепления. См., например, патенты США №7,914,796; №8,034,598; №8,961,281 и №8,623,618; патентные публикации США №20080131962 и №20120040398. Указанные облигатные гетеродимеры димеризуются и расщепляют мишени только в том случае, если ZFP обеспечивает размещение различающихся сконструированных доменов расщепления в подходящем целевом сайте, таким образом уменьшая и/или элиминируя мономерное нецелевое расщепление.
[0010] Тем не менее, сохраняется потребность в дополнительных способах и композициях, на основе системы расщепления сконструированными нуклеазами, для уменьшения нецелевой расщепляющей активности.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0011] Согласно настоящему изобретению предложены способы и композиции для увеличения специфичности нуклеазы (например, пары нуклеаз) в отношении предусмотренной мишени по отношению к другим, непредусмотренным сайтам расщепления, также известных как нецелевые сайты. Соответственно, в настоящем документе описаны искусственные нуклеазы (например, нуклеазы с цинковыми пальцами (ZFN), TALEN, CRISPR/Cas-нуклеазы) содержащие мутации в одной или более областей ДНК-связывающего домена (например, в остове белка с цинковыми пальцами или TALE), и/или одну или более мутаций в домене расщепления или полудомене расщепления нуклеазы FokI. Кроме того, в настоящем документе описаны способы увеличения специфичности расщепляющей активности при применении указанных новых нуклеаз (например, ZFN, TALEN и т.п.) и/или при независимом титрованим сконструированных партнеров - полудоменов расщепления нуклеазного комплекса. При индивидуальном применении или применении в комбинации способы и композиции согласно настоящему изобретению удивительным образом обеспечивают неожиданное увеличение специфичности к мишени за счет снижения нецелевой расщепляющей активности. Согласно настоящему изобретению также предложены способы применения указанных композиций для нацеленного расщепления клеточного хроматина в представляющей интерес области и/или интеграции трансгена путем нацеленной интеграции в заранее заданную представляющую интерес область в клетках.
[0012] Соответственно, согласно одному аспекту в настоящем документе предложен сконструированный нуклеазный полудомен расщепления, содержащий одну или более мутаций по сравнению с исходным доменом расщепления (например, доменом дикого типа), из которого получены указанные мутантные формы. Согласно некоторым вариантам реализации указанные одна или более мутаций представляют собой одну или более из мутаций, представленных в любых из прилагаемых к данному документу таблиц и чертежей, в том числе любую комбинацию указанных мутантов друг с другом и с другими мутантами (такими как мутанты домена димеризации и/или каталитического домена, а также никазные мутации). Мутации согласно описанию в настоящем документе включают, не ограничиваясь перечисленными, мутации, изменяющие заряд домена расщепления, например мутации положительно заряженных остатков с заменой на не заряженные положительно остатки (например, мутации остатков K и R (например, мутации с заменой на S); остатков N (например, →D) и остатков Q (например, →E); мутаций остатков, для которых на основании молекулярного моделирования предсказано близкое расположение к остову ДНК и которые демонстрируют вариативность в гомологах FokI (Фиг. 1 и 17); и/или мутации других остатков (например, патент США №8,623,618 и Guo et al, (2010) J. Mol. Biol. 400(1):96-107).
[0013] Наиболее многообещающие мутации были обнаружены с применением второго критерия. Изначально многообещающими мутациями были положительно заряженные остатки, для которых было предсказано близкое расположение к остову ДНК при связывании FokI с ДНК. Описанные в настоящем документе домены расщепления могут включать одну, две, три, четыре, пять или более мутаций, описанных в настоящем документе, и могут дополнительно включать дополнительные известные мутации. Соответственно, мутации согласно настоящему изобретению не включают специфические мутации, раскрытые в патенте США №8,623,618 (например, N527D, S418P, K448M, Q531R и т.п.), при их использовании по отдельности; однако согласно настоящему изобретению предложены новые мутанты, которые можно применять в комбинации с мутантами из патента США №8,623,618. Никазные мутанты, отличающиеся тем, что один из каталитических доменов нуклеазы в димерной паре содержит одну или более мутаций, делающих его каталитически неактивным (см. патенты США №8,703,489; №9,200,266; и №9,631,186) могут также применяться в комбинации с любыми из мутантов, описанных в настоящем документе. Никазы могут представлять собой ZFN-никазы, TALEN-никазы и системы CRISPR/dCas.
[0014] Согласно некоторым вариантам реализации сконструированные полудомены расщепления получены из FokI или гомологов FokI и содержат мутацию в одном или более из остатков аминокислот 416, 422, 447, 448 и/или 525, при нумерации, соответствующей полноразмерному FokI дикого типа, как показано в SEQ ID NO: 1 или соответствующим остаткам в гомологах FokI (см. Фиг. 17). Согласно другим вариантам реализации полудомены расщепления, происходящие из FokI, содержат мутацию в одном или более из остатков аминокислот 414-426, 443-450, 467-488, 501-502, и/или 521-531, в том числе одном или более из 387, 393, 394, 398, 400, 416, 418, 422, 427, 434, 439, 441, 442, 444, 446, 448, 472, 473, 476, 478, 479, 480, 481, 487, 495, 497, 506, 516, 523, 525, 527, 529, 534, 559, 569, 570 и/или 571. Мутации могут включать мутации остатков, обнаруживаемых в естественных ферментах рестрикции, гомологичных FokI, в соответствующих положениях (Фиг. 17). Согласно некоторым вариантам реализации указанные мутации представляют собой замены, например, замену остатка молекулы дикого типа любой другой аминокислотой, например, аланином (A), цистеином (C), аспарагиновой кислотой (D), глутаминовой кислотой (E), гистидином (H), фенилаланином (F), глицином (G), аспарагином (N), серином (S) или треонином (T). Предусмотрена любая комбинация мутантов, в том числе, но не ограничиваясь перечисленными, представленные в прилагаемых таблицах и чертежах. Согласно некоторым вариантам реализации нуклеазный домен FokI содержит мутацию в одном или более из положений 416, 422, 447, 479 и/или 525 (при нумерации, соответствующей молекуле дикого типа, SEQ ID NO: 1). Указанные нуклеазные домены могут также содержать одну или более мутаций в положениях 418, 432, 441, 448, 476, 481, 483, 486, 487, 490, 496, 499, 523, 527, 537, 538 и 559, в том числе, но не ограничиваясь перечисленными, ELD, KKR, ELE, KKS. См., например, патент США №8,623,618. Согласно другим дополнительным вариантам реализации указанный домен расщепления включает мутации одного или более остатков, представленных в таблице 15 (например, 419, 420, 425, 446, 447, 470, 471, 472, 475, 478, 480, 492, 500, 502, 521, 523, 526, 530, 536, 540, 545, 573 и/или 574). Согласно некоторым вариантам реализации варианты доменов расщепления, описанных в настоящем документе, включают мутации остатков, вовлеченных в димеризацию нуклеаз (мутации доменов димеризации), и одну или более дополнительных мутаций; например, контактирующих с фосфатом остатков: например, мутанты димеризации (такие как ELD, KKR, ELE, KKS и т.п.) в комбинации с одной, двумя, тремя, четырьмя, пятью, шестью или более мутациями в положениях аминокислот вне домена димеризации, например, в остатках аминокислот, которые могут участвовать в контактах с фосфатными группами. Согласно предпочтительному варианту реализации мутация в положениях 416, 422, 447, 448 и/или 525 включает замену положительно заряженной аминокислоты на незаряженную или отрицательно заряженную аминокислоту. Согласно другим вариантам реализации вводят мутации в положениях 446, 472 и/или 478 (и необязательно дополнительные остатки, например, в доменах димеризации или каталитических доменах).
[0015] Согласно другим вариантам реализации сконструированный полудомен расщепления содержит мутации в домене димеризации, например, в остатках аминокислот 490, 537, 538, 499, 496 и 486 помимо мутаций, описанных в настоящем документе. Согласно предпочтительному варианту реализации настоящего изобретения предложены гибридные белки, в которых сконструированный полудомен расщепления содержит полипептид, в котором остаток Gln (Q), присутствующий в положении 486 молекулы дикого типа, заменен на остаток Glu (E), остаток Ile (I), присутствующий в положении 499 молекулы дикого типа, заменен на остаток Leu (L) и остаток Asn (N), присутствующий в положении 496 молекулы дикого типа, заменен на остаток Asp (D) или Glu (E) («ELD» или «ELE»), помимо одной или более мутаций, описанных в настоящем документе. Согласно другому варианту реализации сконструированные полудомены расщепления получены на основе полудомена расщепления FokI дикого типа или гомолога FokI, и содержат мутации в остатках аминокислот 490, 538 и 537, при нумерации, соответствующей FokI дикого типа (SEQ ID NO: 1), помимо одной или более мутаций остатков аминокислот 416, 422, 447, 448 или 525. Согласно предпочтительному варианту реализации настоящего изобретения предложен гибридный белок, в котором сконструированный полудомен расщепления содержит полипептид, в котором остаток Glu (E), присутствующий в положении 490 молекулы дикого типа, заменен на остаток Lys (K), остаток Ile (I), присутствующий в положении 538 молекулы дикого типа, заменен на остаток Lys (K); и остаток His (H), присутствующий в положении 537 молекулы дикого типа, заменен на остаток Lys (K) или остаток Arg (R) («KKK» или «KKR») (см. патент США №8,962,281, включенный посредством ссылки в настоящий документ), помимо одной или более мутаций, описанных в настоящем документе.
[0016] Согласно другому варианту реализации сконструированные полудомены расщепления происходят из полудомена расщепления FokI дикого типа или его гомологов, и содержат мутации в остатках аминокислот 490 и 538, при нумерации, соответствующей FokI дикого типа помимо одной или более мутаций остатков аминокислот 416, 422, 447, 448 или 525. Согласно предпочтительному варианту реализации настоящего изобретения предложен гибридный белок, в котором сконструированный полудомен расщепления содержит полипептид, в котором остаток Glu (E), присутствующий в положении 490 молекулы дикого типа, заменен на остаток Lys (K), и остаток Ile (I), присутствующий в положении 538 молекулы дикого типа, заменен на остаток Lys (K) («KK»), помимо одной или более мутаций в положениях 416, 422, 447, 448 или 525. Согласно предпочтительному варианту реализации настоящего изобретения предложен гибридный белок, в котором сконструированный полудомен расщепления содержит полипептид, в котором остаток Gln (Q), присутствующий в положении 486 молекулы дикого типа, заменен на остаток Glu (E), а остаток Ile (I), присутствующий в положении 499 молекулы дикого типа, заменен на остаток Leu (L) («EL») (см. патент США №8,034,598, включенный посредством ссылки в настоящий документ), помимо одной или более мутаций в положениях 416, 422, 447, 448 или 525.
[0017] Согласно одному аспекту настоящего изобретения предложены гибридные молекулы, в которых сконструированный полудомен расщепления содержит полипептид, в котором остаток аминокислоты молекулы дикого типа в одном или более из положений 387, 393, 394, 398, 400, 402, 416, 422, 427, 434, 439, 441, 446, 447, 448, 469, 472, 478, 487, 495, 497, 506, 516, 525, 529, 534, 559, 569, 570, 571 в каталитическом домене FokI мутированы. Согласно некоторым вариантам реализации указанные одна или более мутаций изменяют положительно заряженные остаток аминокислоты молекулы дикого типа на нейтральный остаток или отрицательно заряженный остаток. Согласно любому из указанных вариантов реализации описанные мутанты могут также быть внесены в домен FokI, содержащий одну или более дополнительных мутаций. Согласно предпочтительным вариантам реализации указанные дополнительные мутации находятся в домене димеризации, например, в положениях 499, 496, 486, 490, 538 и 537. Мутации включают замены, инсерции и/или делеции одного или более остатков аминокислот.
[0018] Согласно еще одному аспекту любые из сконструированных полудоменов расщепления, описанных выше, могут быть включены в искусственные нуклеазы, например, путем их связывания с ДНК-связывающим доменом, в том числе, но не ограничиваясь указанным, нуклеазы с цинковыми пальцами, TALEN, CRISPR/Cas-нуклеазы и т.п. Белки с цинковыми пальцами нуклеаз с цинковыми пальцами могут содержать неканонические координирующие цинк остатки (например, CCHC, а не каноническая конфигурация C2H2, см. патент США №9,234,187).
[0019] Согласно другому аспекту предложены гибридные молекулы, содержащие ДНК-связывающий домен и сконструированный полудомен расщепления FokI или его гомолог согласно описанию в настоящем документе, которые продуцируют искусственную нуклеазу. Согласно некоторым вариантам реализации указанный ДНК-связывающий домен гибридной молекулы представляет собой связывающий домен с цинковыми пальцами (например, сконструированный связывающий домен с цинковыми пальцами). Согласно другим вариантам реализации указанный ДНК-связывающий домен представляет собой ДНК-связывающий домен TALE. Согласно другим дополнительным вариантам реализации указанный ДНК-связывающий домен содержит ДНК-связывающую молекулу (например, направляющую РНК) и каталитически неактивный белок Cas9 или Cfp1 (dCas9 или dCfp1). Согласно некоторым вариантам реализации сконструированные гибридные молекулы образуют нуклеазный комплекс с каталитически неактивным сконструированным полудоменом расщепления таким образом, что димерная нуклеаза способна к расщеплению только одной цепи двуцепочечный молекулы ДНК, образуя никазу (см. патент США №9,200,266).
[0020] Способы и композиции согласно настоящему изобретению также охватывают мутации одной или более аминокислот в составе ДНК-связывающего домена вне остатков, которые распознают нуклеотиды целевой последовательности (например, одной или более мутаций в «остове ZFP» (вне спиральной области распознавания ДНК) или в «остове TALE» (вне RVD)), которые могут неспецифически взаимодействовать с фосфатами на остове ДНК. Соответственно, согласно некоторым вариантам реализации настоящее изобретение охватывает мутации катионных остатков аминокислот в остове ZFP, не являющиеся необходимыми для специфичности в отношении нуклеотидов мишени. Согласно некоторым вариантам реализации указанные мутации в остове ZFP включают мутацию катионного остатка аминокислоты с заменой на нейтральный или анионный остаток аминокислоты. Согласно некоторым вариантам реализации мутации в остове ZFP содержат мутацию полярного остатка аминокислоты с заменой на нейтральный или неполярный остаток аминокислоты. Согласно предпочтительным вариантам реализации мутации вводят в положение (-5), (-9) и/или в положение (-14) относительно ДНК-связывающей спирали. Согласно некоторым вариантам реализации цинковый палец может содержать одну или более мутаций в положении (-5), (-9) и/или (-14). Согласно дополнительным вариантам реализации один или более цинковых пальцев в белке с множеством цинковых пальцев может содержать мутации в положении (-5), (-9) и/или (-14). Согласно некоторым вариантам реализации аминокислоты в положениях (-5), (-9) и/или (-14) (например, аргинин (R) или лизин (K)) мутированы с заменой на аланин (A), лейцин (L), Ser (S), Asp (N), Glu (E), Tyr (Y) и/или глутамин (Q).
[0021] Согласно другому аспекту предложены полинуклеотиды, кодирующие любые из сконструированных полудоменов расщепления или гибридных белков согласно описанию в настоящем документе.
[0022] Согласно еще одному аспекту также предложены клетки, содержащие любые из нуклеаз, полипептидов (например, гибридные молекулы или гибридные полипептиды) и/или полинуклеотидов согласно описанию в настоящем документе. Согласно одному варианту реализации указанные клетки содержат пару гибридных полипептидов, один из которых содержит, помимо одной или более мутаций в остатках аминокислот 393, 394, 398, 416, 421, 422, 442, 444, 447, 448, 473, 480, 530 и/или 525, полудомен расщепления ELD или ELE; а другой содержит, помимо одной или более мутаций по остаткам 393, 394, 398, 416, 421, 422, 442, 444, 446, 447, 448, 472, 473, 478, 480, 530 и/или 525, полудомен расщепления KKK или KKR (см. патент США №8,962,281).
[0023] В любых из указанных гибридных полипептидов, описанных в настоящем документе, партнеры ZFP могут дополнительно содержать мутации в ДНК-связывающем домене с цинковыми пальцами в положениях (-5), (-9) и/или (-14). Согласно некоторым вариантам реализации Arg (R) в положении -5 заменяют на Tyr (Y), Asp (N), Glu (E), Leu (L), Gln (Q) или Ala (A). Согласно другим вариантам реализации Arg (R) в положении (-9) заменен на Ser (S), Asp (N) или Glu (E). Согласно дополнительным вариантам реализации Arg (R) в положении (-14) заменен на Ser (S) или Gln (Q). Согласно другим вариантам реализации указанные гибридные полипептиды могут содержать мутации в ДНК-связывающем домене с цинковыми пальцами, где аминокислоты в положениях (-5), (-9) и/или (-14) заменяют на любые из вышеперечисленных аминокислот в любой комбинации.
[0024] Также согласно настоящему изобретению предложены клетки, которые были модифицированы полипептидами и/или полинуклеотидами согласно настоящему изобретению. Согласно некоторым вариантам реализации в указанных клетках происходит опосредованное нуклеазой встраивание трансгена или опосредованный нуклеазой нокаут гена. Указанные модифицированные клетки, и любые клетки, происходящие из указанных модифицированных клеток, не обязательно содержат нуклеазы согласно настоящему изобретению более чем в течении некоторого времени, однако геномные модификации, опосредованные такими нуклеазами, сохраняются.
[0025] Согласно еще одному аспекту предложены способы нацеленного расщепления клеточного хроматина в представляющей интерес области; способы стимуляции гомологичной рекомбинации в клетке; способы лечения инфекции; и/или способы лечения заболевания. Указанные способы могут быть реализованы in vitro, ex vivo или in vivo, или может быть реализована комбинация перечисленного. Указанные способы задействуют расщепление клеточного хроматина в заранее определенной представляющей интерес области в клетках путем экспрессии пары гибридных полипептидов согласно описанию в настоящем документе (т.е. пары гибридных полипептидов, в которой один или оба гибридных полипептидов содержит сконструированные полудомены расщепления согласно описанию в настоящем документе). Согласно некоторым вариантам реализации нацеленное расщепление целевого сайта увеличивается по меньшей мере на 50% - 200% (или на любую промежуточную величину) или более, в том числе на 50-60% (или на любую промежуточную величину), 60% - 70% (или на любую промежуточную величину), 70% - 80% (или на любую промежуточную величину), 80% - 90% (или на любую промежуточную величину, 90% - 200% (или на любую промежуточную величину), по сравнению с доменами расщепления без мутаций согласно описанию в настоящем документе. Аналогичным образом, при применении способов и композиций согласно описанию в настоящем документе расщепление нецелевого сайта снижается 1-100-кратно или более, в том числе, но не ограничиваясь перечисленным, 1-50-кратно (или на любую промежуточную величину).
[0026] Сконструированные полудомены расщепления, описанные в настоящем документе, можно применять в способах нацеленного расщепления клеточного хроматина в представляющей интерес области и/или гомологичной рекомбинации в заранее заданной представляющей интерес области в клетках. Клетки включают культивируемые клетки, линии клеток, клетки в организме, клетки, извлеченные из организма для лечения/обработки в тех случаях, когда указанные клетки и/или их потомство возвращают в организм после лечения, и клетки, извлеченные из организма, модифицированные с применением гибридных молекул согласно настоящему изобретению, которые затем возвращают в организм согласно способу лечения (клеточной терапии). Представляющая интерес область клеточного хроматина может представлять собой, например, геномную последовательность или ее часть. Композиции включают гибридные молекулы или полинуклеотиды, кодирующие гибридные молекулы, которые содержат ДНК-связывающую молекулу (например, сконструированный связывающий домен с цинковыми пальцами, или связывающий домен TALE, или сконструированную направляющую РНК CRISPR) и полудомен расщепления согласно описанию.
[0027] Гибридная молекула может быть экспрессирована в клетке, например, путем доставки указанной гибридной молекулы в указанную клетку в виде полипептида, или путем доставки в клетку полинуклеотида, кодирующего указанную гибридную молекулу, при этом указанный полинуклеотид, если он представляет собой ДНК, транскрибируется и транслируется с получением гибридной молекулы. В свою очередь, если полинуклеотид представляет собой мРНК, кодирующую гибридную молекулу, после доставки указанной мРНК в клетку указанная мРНК транслируется, с получением таким образом гибридной молекулы.
[0028] Согласно другим аспектам настоящего изобретения предложены способы и композиции для увеличения специфичности сконструированных нуклеаз. Согласно одному аспекту предложены способы увеличения общей целевой специфичности расщепления путем уменьшения нецелевой расщепляющей активности. Согласно некоторым вариантам реализации сконструированные партнеры - полудомены расщепления сконструированного нуклеазного комплекса используют для контакта с клеткой, причем каждый партнер указанного комплекса используют в соотношении с другим партнером, отличном от 1:1. Согласно некоторым вариантам реализации используемое соотношение указанных двух партнеров (полудоменов расщепления) соответствует 1:2, 1:3, 1:4, 1:5, 1:6, 1:8, 1:9, 1:10 или 1:20, или любому промежуточному варианту. Согласно другим вариантам реализации соотношение указанных двух партнеров превышает 1:30. Согласно другим вариантам реализации указанные два партнера задействованы в выбранном соотношении, отличающемся от 1:1. Согласно некоторым аспектам каждый партнер доставляют в указанную клетку в виде мРНК, или доставляют в вирусном или невирусном векторе, при этом доставляют разные количества мРНК или вектора, кодирующего каждый из партнеров. Согласно дополнительным вариантам реализации оба партнера в нуклеазном комплексе могут содержаться в одном вирусном или невирусном векторе, однако преднамеренно экспрессируются таким образом, что один партнер экспрессируется на более высоком или более низком уровне, чем другой, что в конечном итоге обеспечивает доставку в клетку полудомены расщепления в соотношении, отличном от 1:1. Согласно некоторым вариантам реализации все полудомены расщепления экспрессируются с применением разных промоторов, обеспечивающих разную эффективность экспрессии. Согласно другим вариантам реализации указанные два домена расщепления доставляют в указанную клетку с применением вирусного или невирусного вектора, оба из которых экспрессируются с одной открытой рамки считывания, однако гены, кодирующие указанные два партнера, разделены последовательностью (например, саморасщепляющейся последовательностью 2A или IRES) что приводит к более низкому уровню экспрессии 3’-партнера, таким образом, что соотношение указанных двух партнеров составляет 1:2, 1:3, 1:4, 1:5, 1:6, 1:8, 1:9, 1:10 или 1:20, или соответствует любому промежуточному варианту. Согласно другим вариантам реализации указанные два партнера задействованы в выбранном соотношении, отличающемся от 1:1.
[0029] Также предложены способы уменьшения нецелевой нуклеазной активности при использовании комплексов двух или более нуклеаз. Например, согласно настоящему изобретению предложены способы варьирования соотношения ДНК-связывающих молекул при использовании комплексов двух или более нуклеаз. Согласно некоторым вариантам реализации указанные ДНК-связывающие молекулы представляют собой полипептидные ДНК-связывающие домены (например, ZFN, TALEN, dCas-Fok, мега-TAL, мегануклеазы), тогда как согласно другим вариантам указанные ДНК-связывающие молекулы представляют собой направляющие РНК для применения с РНК-направляемыми нуклеазами. Согласно предпочтительным вариантам реализации соотношение указанных двух или более ДНК-связывающих молекул составляет 1:2, 1:3, 1:4, 1:5, 1:6, 1:8, 1:9, 1:10 или 1:20, или соответствует любому промежуточному варианту. Согласно другим вариантам реализации указанные две ДНК-связывающие молекулы задействованы в выбранном соотношении, отличающемся от 1:1. Согласно некоторым аспектам не равное 1:1 соотношение достигается путем изменения соотношения направляющих РНК, используемых для трансфекции клетки. Согласно другим аспектам указанное соотношение изменяют путем изменения соотношения каждого комплекса белка Cas9/ направляющей РНК, используемого для обработки представляющих интерес клеток. Согласно еще одному дополнительному аспекту измененное соотношение достигается путем применения различных соотношений ДНК, кодирующих направляющие РНК (вирусные или невирусные) для обработки клеток, или путем применения промоторов, обеспечивающих экспрессию разной силы для дифференциальной экспрессии ДНК-связывающих молекул в клетках. Возникновение нецелевых событий может быть снижено в 2-1000 раз (или на любую промежуточную величину) или более, в том числе, но не ограничиваясь перечисленными, по меньшей мере в 10, 50, 60, 70, 80, 100, 150, 200, 250, 300, 350, 400, 450, 500, 600, 700, 800, 900, 1000 раз (или на любую промежуточную величину) или более.
[0030] Соответственно, согласно другому аспекту способ расщепления клеточного хроматина в представляющей интерес области может включать: (a) выбор первой последовательности в представляющей интерес области; (b) конструирование первой ДНК-связывающей молекулы для специфического связывания с первой последовательностью; (c) экспрессию в клетке первой гибридной молекулы, содержащей первую ДНК-связывающую молекулу (например, молекулу с цинковыми пальцами, TALE, онРНК) и домен расщепления (или полудомен); и (d) экспрессию в клетке второго гибридного белка, при этом вторая гибридная молекула содержит второй ДНК-связывающий домен и второй домен расщепления (или полудомен), причем по меньшей мере одна из гибридных молекулы содержит линкер согласно описанию в настоящем документе; также при этом первая гибридная молекула связывается с первой последовательностью, а вторая гибридная молекула связывается с второй последовательностью, расположенной на расстоянии 2-50 нуклеотидов от первой последовательности, таким образом, чтобы могло происходить формирование активного нуклеазного комплекса и расщепление клеточного хроматина в представляющей интерес области. Согласно некоторым вариантам реализации обе гибридные молекулы содержат линкер согласно описанию в настоящем документе между ДНК-связывающим доменом и каталитическим нуклеазным доменом.
[0031] Также предложены способы изменения области клеточного хроматина, например, для введения нацеленных мутаций. Согласно некоторым вариантам реализации способы изменения клеточного хроматина включает введение в указанную клетку одной или более нацеленных нуклеаз для обеспечения двуцепочечного разрыва в клеточном хроматине в заранее заданном сайте, и донорного полинуклеотида, гомологичного последовательности нуклеотидов клеточного хроматина в области разрыва. Процессы репарации клеточной ДНК активируются при наличии двуцепочечного разрыва; донорный полинуклеотид применяют в качестве матрицы для репарации разрыва, что приводит к введению всей или части последовательности нуклеотидов донора в клеточный хроматин. Соответственно, последовательность в клеточном хроматине может быть изменена и, согласно некоторым вариантам реализации, может быть конвертирована в последовательность, присутствующую в донорном полинуклеотиде.
[0032] Нацеленные изменения включают, не ограничиваясь перечисленными, точечные мутации (т.е. конверсию одной пары оснований в другую пару оснований), замены (т.е. конверсию нескольких пар оснований в другую последовательность идентичной длины), инсерций одной или более пар оснований, делеций одной или более пар оснований; и любую комбинацию вышеупомянутых изменений последовательностей. Изменения могут также включать конверсию пар оснований, входящих в состав кодирующей последовательности, таким образом, что изменяется кодируемая аминокислота.
[0033] Донорный полинуклеотид может представлять собой ДНК или РНК, может быть линейным или кольцевым, и может быть одноцепочечным или двуцепочечным. Он может быть доставлен в клетку в виде депротеинизированной нуклеиновой кислоты, в виде комплекса с одним или более агентами для доставки (например, липосомами, наночастицами, полоксамерами) или в основе для вирусной доставки, такой как, например, аденовирус, лентивирус или аденоассоциированный вирус (AAV). Длина донорных последовательностей может варьировать от 10 до 1000 нуклеотидов (или соответствовать любому промежуточному целому числу нуклеотидов) или более. Согласно некоторым вариантам реализации указанная донорная молекула содержит полноразмерный ген, фланкированный областями гомологии с целевым сайтом расщепления. Согласно некоторым вариантам реализации в указанной донорной последовательности отсутствуют гомологичные области и она встроена в целевой локус за счет независимого от гомологии механизма (т.е. NHEJ). Согласно другим вариантам реализации указанная донорная молекула содержит отрезок нуклеиновой кислоты меньшего размера, фланкированной гомологичными областями для применения в клетке (т.е. для генной коррекции). Согласно некоторым вариантам реализации указанная донорная молекула содержит ген, кодирующий функциональный или структурный компонент, такой как мшРНК, РНК-интерференция, микроРНК или т.п. Согласно другим вариантам реализации указанная донорная молекула содержит последовательности, кодирующие регуляторный элемент, который связывается с представляющим интерес геном и/или модулирует его экспрессию. Согласно другим вариантам реализации указанный донор представляет собой представляющий интерес регуляторный белок (например, ТФ ZFP, ТФ TALE или ТФ CRISPR/Cas), который связывается с представляющим интерес геном и/или модулирует его экспрессию.
[0034] В любом из вышеупомянутых способов клеточный хроматин может находиться в геноме хромосомы, эписомы или органеллы. Клеточный хроматин может находиться в клетках любого типа, в том числе, но не ограничиваясь перечисленными, прокариотические и эукариотические клетки, клетки грибов, клетки растений, клетки животных, клетки млекопитающих, клетки приматов и клетки человека.
[0035] Согласно еще одному аспекту изобретения также предложены клетки, содержащие любые из полипептидов (например, гибридные молекулы) и/или полинуклеотидов согласно описанию в настоящем документе. Согласно одному варианту реализации указанные клетки содержат пару гибридных молекул, каждая из которых содержит домен расщепления согласно описанию в настоящем документе. Клетки включают культивированные клетки, клетки в организме и клетки, которые были извлечены из организма для лечения/обработки, в тех случаях, когда указанные клетки и/или их потомство возвращают в организм после лечения. Представляющая интерес область клеточного хроматина может представлять собой, например, геномную последовательность или ее часть.
[0036] Согласно другому аспекту, в настоящем документе описан набор, содержащий гибридный белок согласно описанию в настоящем документе, или полинуклеотид, кодирующий один или более белков с цинковыми пальцами, домены расщепления и/или гибридные белки согласно описанию в настоящем документе; вспомогательные реагенты; и, необязательно, инструкции и подходящие контейнеры. Указанный набор может также включать одну или более нуклеаз или полинуклеотиды, кодирующие такие нуклеазы.
[0037] Указанные и другие аспекты будут хорошо понятны специалисту в свете приведенного описания в целом.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0038] На Фиг. 1 приведена последовательность аминокислот (SEQ ID NO: 1) и последовательность нуклеотидов (SEQ ID NO: 2) части нуклеазы FokI дикого типа. Последовательность отражает каталитический нуклеазный домен FokI, и нумерация соответствует белку FokI дикого типа, используемого для получения кристаллических структур 1FOK.pdb и 2FOK.pdb (Wah, там же) (аминокислота Q нуклеазного домена начинается в положении 384). Заключенные в рамку положения указывают на возможные сайты мутаций.
[0039] На Фиг. 2A-2C представлены схематические изображения моделей взаимодействия домена FokI с молекулой ДНК. На Фиг. 2A показана локализация аминокислот R422, R416 и K525. На Фиг. 2B показана локализация аминокислот R447, K448 и R422. Фиг. 2C иллюстрирует подгруппу разных типов ZFN, которые могут быть получены путем включения 1, 2 или 3 (1×, 2× или 3×, соответственно) мутаций (либо R → Q, либо R → L) в остов с цинковыми пальцами. Черными стрелками обозначены положения мутаций.
[0040] На Фиг. 3A и 3B показана активность BCL11A-специфических ZFN, несущих новые мутации FokI, описанные в настоящем документе. На Фиг. 3A показана нацеленная модификация в клетках CD34+ для BCL11A-специфических ZFN SBS#51857-ELD/SBS#51949-KKR против когнатной мишени BCL11A (обозначенных уникальным идентификатором - «регистрационным знаком» PRJIYLFN, SEQ ID NO: 13) и двух нецелевых сайтов, также обозначенных идентификаторами - «регистрационными знаками» NIFMAEVG (SEQ ID NO: 14) и PEVYOHIU (SEQ ID NO: 20). ZFP описаны в PCT/US 2016/032049. Все эксперименты проводили с 2 мкг мРНК каждой ZFN для доставки нуклеаз; значения отражают процент ридов последовательностей, которые содержат инсерции и делеции (% инделей), соответствующие нуклеазной активности. На Фиг. 3A приведены результаты замены остатком серина в положениях 416, 422, 447, 448 и 525 домена FokI в одной или обеих ZFN. На Фиг. 3B приведен аналогичный набор данных, за исключением того, что остовы гетеродимерного домена димеризации FokI поменяны местами, т.е. на Фиг. 3A приведены результаты при использовании мутаций в паре SBS#51857-ELD/SBS#51949-KKR, тогда как на Фиг. 3B приведены результаты при использовании мутаций в паре SBS#51857-KKR/SBS#51949-ELD.
[0041] На Фиг. 4 представлен график целевой и нецелевой активности для ряда TCRA-специфических (нацеленных на константную область, также известную как TRAC) вариантов ZFN FokI (PCT-публикация WO 2017106528). За исключением двух репликатов исходной пары ZFN, домен FokI в одной из двух ZFN несет мутацию положительно заряженного остатка. Рассчитывали расстояние между альфа-углеродом мутированного остатка FokI и ближайшим кислородом фосфата в остове ДНК в молекулярной модели ZFN-ДНК (Miller et al (2007) Nat Biotech 25(7):778-785); точки данных обозначены цветом на основании указанного вычисленного расстояния (либо <10 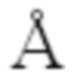 : серый цвет; либо >10
: серый цвет; либо >10 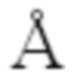 : черный цвет). Каждая точка данных соответствует целевой активности и объединенной нецелевой активности для разных пар ZFN, несущих мутации FokI на одной из ZFN в паре. Указаны точки данных, соответствующие исходной паре.
: черный цвет). Каждая точка данных соответствует целевой активности и объединенной нецелевой активности для разных пар ZFN, несущих мутации FokI на одной из ZFN в паре. Указаны точки данных, соответствующие исходной паре.
[0042] На Фиг. 5A и 5B схематически изображена область остова цинкового пальца. На Фиг. 5A (SEQ ID NO: 3) показаны аминокислоты второго пальца белка Zif268 с отмеченными бета-складчатыми и альфа-спиральными структурами. Также показана локализация аминокислот, вовлеченных в распознавание специфических оснований ДНК (-1-6). Положительно заряженные остатки, обладающие потенциалом для взаимодействия с фосфатным остовом ДНК, отмечены рамками. Подчеркнуты инвариантные остатки цистеина, вовлеченные в координацию цинка. На Фиг. 5B представлено увеличенное трехмерное изображение одного пальца (сплошная сфера представляет собой координированный ион цинка), и показаны тенденции взаимодействия с ДНК разных областей каждого цинкового пальца. ДНК представлена на диаграмме, где фосфаты обозначены символом «P», а основания ДНК заключены в рамки со скругленными углами. Серыми стрелками обозначены приблизительные положения остатков, обозначенных рамками, а черными стрелками обозначены взаимодействия между белком с цинковыми пальцами и ДНК.
[0043] На Фиг. 6 (SEQ ID NO: 4-6) показано сохранение аминокислот в каждом положении в составе цинкового пальца. В первых строках представлено выравнивание последовательностей аминокислот в хорошо известных цинковых пальцах из Zif268 и Sp1 (палец 2 из Zif268 (SEQ ID NO: 4), палец 3 из Zif268 (SEQ ID NO: 5) и палец 2 Sp1 (SEQ ID NO: 6)). Координирующие цинк остатки цистеина и гистидина заключены в рамки, как и спирали распознавания. Положительно заряженные остатки аргинина (R) и лизина (K), которые контактируют с фосфатами остова ДНК, также заключены в рамки. Числа под первыми тремя строками представляют собой частоты встречаемости каждой аминокислоты в каждом положении в 4867 разных проанализированных встречающихся в природе цинковых пальцев. Символы слева от диаграммы представляют собой однобуквенные коды, соответствующие остаткам аминокислот, частоты встречаемости которых приведены в таблице. В контактирующем с фосфатом положении было идентифицировано три незаряженные аминокислоты, аланин, лейцин и глутамин (заключены в овалы) с низкой, однако ненулевой частотой встречаемости.
[0044] На Фиг. 7A и 7B (SEQ ID NO: 7 и 8) приведены изображения остовов ZFP, в том числе модули белка либо с шестью цинковыми пальцами (Фиг. 7A, SEQ ID NO: 7), либо с пятью цинковыми пальцами (Фиг. 7B, SEQ ID NO: 8). Символы над некоторыми заключенными в рамку положениями указывают на мутации, которые тестировали в указанном положении. Каждый палец идентифицирован метками F1-F6. Каждый из указанных белков собирают из трех разных «модулей», обозначенных «Модуль A», «Модуль B» и «Модуль C». Мутации в положениях -14, -9 и -5 N-концевого пальца в каждом модуле могут быть внесены путем изменения последовательности ПЦР-праймера, используемого в процессе сборки.
[0045] На Фиг. 8A-8C приведены графики, отражающие целевую и нецелевую расщепляющую активность TCRA (TRAC)-специфической ZFN (PCT-публикация WO 2017106528), содержащей новый остов с мутациями цинковых пальцев согласно настоящему изобретению. Обе TCRA (TRAC)-специфические ZFN содержат 6 повторов с цинковыми пальцами; для простоты эксперимента мутации в положении -5 вводили только в N-концевой палец каждого модуля (например, F1, F3 или F5 в полноразмерном ZFN). Соответственно, каждая индивидуальная ZFN может содержать 0, 1, 2 или 3 мутации, и пара ZFN целиком может содержать в общей сложности до 6 мутаций (например, 0, 1, 2, 3, 4, 5 или 6 мутаций). Значения на графике отражают средние значения для всех протестированных пар ZFN с заданным числом и типом мутаций в положении -5. Стандартная ошибка среднего обозначена планками погрешностей. Для каждой пары ZFN измеряли активность в отношении трех нецелевых мишеней, указанных в таблице 3; нецелевые значения, усредненные для получения нанесенных на график значений, включают относительную активность исходных TCRA (TRAC) ZFN в отношении каждой из указанных трех нецелевых мишеней для каждой конструкции. На Фиг. 8A приведена относительная активность исходных TCRA (TRAC) ZFN, где наборы данных отражают изменения либо целевой (черные столбцы), либо нецелевой (серые столбцы) активности в результате замены указанных аминокислот в положении -5 в одном или более повторах цинковых пальцев только в одной из двух ZFN в паре. На Фиг. 8B представлен относительный уровень активности при введении указанной замены аргинин-аланин в один или оба партнера ZFN одновременно. Левая половина Фиг. 8B соответствует парам ZFN, где указанное число мутаций происходит только в одной ZFN в паре (и соответствует левой трети Фиг. 8A), а правая половина Фиг. 8B соответствует парам ZFN, где такое же число мутаций вводили в обе ZFN в паре (например, 2 соответствует одной мутации в каждой ZFN в паре, 4 соответствует двум мутациям в каждой ZFN в паре, а 6 соответствует трем мутациям в каждой ZFN в паре. Эксперименты, представленные на Фиг. 8A и 8B, проводили в CD34+ клетках с дозой 6 мкг на эксперимент. На Фиг. 8C приведены данные, аналогичные двум правым третям Фиг. 8A, при этом дозировка РНК составляла 2 мкг на эксперимент.
[0046] На Фиг. 9 приведен график, отражающий целевая (черные столбцы) и нецелевую (серые столбцы) расщепляющую активность в нецелевом сайте NIFMAEVG BCL11A-специфических ZFN, содержащие новые мутации остова с цинковыми пальцами согласно настоящему изобретению (в указанном случае используют трехбуквенное сокращение и указание на количество остатков аргинина в положении -5, мутированных с заменой на указанный остаток; например, «6 Gln» означает, что в паре ZFN было мутировано 6 аргининов (по 3 на ZFN) с заменой на 6 глутаминов). Стандартная ошибка обозначена планками погрешностей. Эксперименты проводили на клетках CD34+ в дозе 2 мкг мРНК на ZFN на эксперимент.
[0047] На Фиг. 10 приведено изображение вестерн-блота для детекции экспрессии BCL11A-специфической ZFN в клетках CD34+ после трансфекции либо мРНК, кодирующей оба партнера ZFN на одном полинуклеотиде, соединенные последовательностью 2A (51857-2a-51949), либо дозирования мРНК, кодирующими ZFN по отдельности; либо смесью двух мРНК, кодирующих каждый партнер, в указанных дозах. Белки детектировали антителом к Flag, и было продемонстрировано, что количество белка, экспрессируемое после трансфекции мРНК, согласуется с использованным количеством мРНК. Как и ожидалось, конструкция с 2a обеспечивала большее количество 5’ ZFN SBS#51857 по сравнению с 3’ZFN, SBS#51949.
[0048] На Фиг. 11 показано титрование дозы для двух партнеров BCL11A-специфической ZFN 51949 и 51857 либо при целевой локализации (BCL11A, левая панель), либо при нецелевой локализации NIFMAEVG (правая панель). Результаты демонстрируют, что изменение соотношений партнеров ZFN может обеспечивать сохранение целевой активности наряду с уменьшением нецелевой активности (сравнение активности в отношении целевой мишени BCL11A при обработке 60 мкг каждой мРНК (целевая активность - 85,92% инделей, против целевой активности 86,42% при обработке 60 мкг 51949, 6,6 мкг 51857) с уменьшенной нецелевой активностью (нецелевая активность 27,34% при использовании 60 мкг каждой мРНК; против 4,21% инделей при использовании 60 мкг 51949 и 6,6 мкг 51857)).
[0049] На Фиг. 12 приведена таблица, где представлена целевая и нецелевая расщепляющая активность BCL11A-специфических ZFN при обработке CD34+ клеток либо одной мРНК, кодирующей оба партнера ZFN согласно описанию выше, (51857/51949 2a), либо титрованными дозами партнеров ZFN, где один партнер (51949) содержит мутацию FokI R→S в положении 416. Идентифицирующие «регистрационные знаки» приведены в таблице 1 из примера 2 (SEQ ID NO: 13-53). Данные, соответствующие PRJIYLFN, отражают относительный уровень ридов последовательностей в предусмотренной мишени BCL11A, содержащих индели, согласующиеся с активностью ZFN. Данные, соответствующие всем другим идентифицирующим «регистрационным знакам», приведенным в левом столбце, соответствует подтвержденным или предполагаемым нецелевым локусам для пары ZFN 51857/51949. Соотношения в правом столбце соответствуют активности в образце, обработанном 51857/51949 2a, разделенному на активность в образце, обработанном титрованными 51857/51949 R416S, в указанном локусе.
[0050] На Фиг. 13 приведены результаты несмещенного анализа захвата для сравнения двух пар ZFN. На левой панели («исходная пара ZFN») представлены результаты применения пары SBS51857 и SBS51949, а на правой панели («вариант пары ZFN») представлен результат применения SBS63014 и SBS65721), содержащей исходную пару и, дополнительно, мутации остова ZFP согласно описанию в настоящем документе, а также мутацию FokI R416S в конструкции SBS65721. В частности, во варианте пары каждая ZFN указанной пары содержит три мутации R→Q в пальцах, а конструкция SBS65721 дополнительно содержит мутацию FokI R416S. Данные демонстрируют, что указанные мутации уменьшают число уникальных захватов с 21 локализаций для исходной пары до 4 для указанного варианта. Кроме того, если партнеры в парах ZFN вводят в неравных количествах, число захватов также уменьшается. В случае исходной пары число захватов снижается с 21 (равные дозы) до 13 (неравные дозы) локализаций (с 28% до 3,4% нецелевых агрегатов, соответственно), а в случае варианта пары число захватов снижается с 4 до 2 (от 0,26% до 0,08% совокупного нецелевого расщепления, соответственно). Комбинация указанных двух подходов приводит к общему уменьшению с 21 локализации для исходной пары до 2 для варианта при дозировании партнерами в неравных концентрациях, с уменьшением с 28% нецелевых событий в совокупности для исходной пары до 0,08% нецелевых событий в совокупности для варианта.
[0051] На Фиг. 14 представлены результаты, демонстрирующие снижение нецелевого расщепления при использовании ZFN согласно описанию в настоящем документе при получении в условиях крупномасштабного производства. Использованная пара ZFN включала SBS63014 и SBS65722.
[0052] На Фиг. 15A-15D показаны результаты, демонстрирующие снижение нецелевого расщепления при использовании мутантов ZFN (нацеленных на AAVS1) согласно описанию в настоящем документе. На Фиг. 15A представлены результаты активности исходных ZFN 30035/30054. На Фиг. 15B представлена целевая активность и соотношение целевой/нецелевая расщепляющей активности для трех наборов мутантов FokI: мутантов FokI ELD, содержащих дополнительные одиночные мутации (левый набор данных); мутантов FokI KKR, содержащих дополнительные одиночные мутации (набор данных посередине); и мутантов FokI ELD и KKR, содержащих такие же дополнительные одиночные мутации (правый набор данных). На Фиг. 15C приведена матрица целевой активности, где домены FokI ELD или KKR содержат две мутации, а на Фиг. 15D приведены соотношения целевой/нецелевой активности для данных, представленных на Фиг. 15C.
[0053] На Фиг. 16A и 16B приведены результаты, демонстрирующие снижение нецелевого расщепления при использовании примеров нацеленных на AAVS1 мутантов ZFN согласно описанию в настоящем документе. На Фиг. 16A представлены мутанты в контексте ELD и KKR, а на Фиг. 16B представлены мутанты в контексте ELD-KKR.
[0054] На Фиг. 17 показано выравнивание FokI и гомологов FokI (SEQ ID NO: 54-64). Штриховкой показана степень сохранения. Нумерация соответствует домену FokI дикого типа (SEQ ID NO: 1).
[0055] На Фиг. 18 представлены примеры мутаций, положения которых сопоставлены с FokI или гомологами FokI, представленными на Фиг. 17.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0056] Согласно настоящему изобретению предложены способы и композиции для увеличения специфичности целевого расщепления сконструированными нуклеазами за счет дифференциального уменьшения нецелевого расщепления. Указанные способы включают уменьшение неспецифических взаимодействий между доменом расщепления FokI и ДНК, уменьшение неспецифических взаимодействий между остовом с цинковыми пальцами и ДНК, и изменение соотношений каждого партнера - полудомена расщепления относительно соотношения по умолчанию, равного 1:1.
Общее описание
[0057] При практической реализации способов, а также при получении и применении композиций согласно описанию в настоящем документе используют, если не указано иное, стандартные методики молекулярной биологии, биохимии, структуры и анализа хроматина, вычислительной химии, клеточных культур, рекомбинантной ДНК и связанных областей, известные из уровня техники. Указанные методики подробно описаны в опубликованных источниках. См., например, источники: Sambrook et al. MOLECULAR CLONING: A LABORATORY MANUAL, второе издание, Cold Spring Harbor Laboratory Press, 1989; и третье издание, 2001; Ausubel et al., CURRENT PROTOCOLS IN MOLECULAR BIOLOGY, John Wiley & Sons, New York, 1987 и периодические обновления; серия: METHODS IN ENZYMOLOGY, Academic Press, San Diego; Wolffe, CHROMATIN STRUCTURE AND FUNCTION, Third edition, Academic Press, San Diego, 1998; METHODS IN ENZYMOLOGY, Vol. 304, “Chromatin” (P.M. Wassarman and A.P. Wolffe, eds.), Academic Press, San Diego, 1999; METHODS IN MOLECULAR BIOLOGY, Vol. 119, “Chromatin Protocols” (P.B. Becker, ed.) Humana Press, Totowa, 1999.
Определения
[0058] Термины «нуклеиновая кислота», «полинуклеотид» и «олигонуклеотид» используются взаимозаменяемо и относятся к дезоксирибонуклеотидному или рибонуклеотидному полимеру, в линейной или кольцевой конформации, в одноцепочечной или двуцепочечной форме. Для целей настоящего изобретения указанные термины не являются ограничивающими применительно к длине полимера. Термины могут включать известные аналоги естественных нуклеотидов, а также нуклеотиды, модифицированные по фрагментам оснований, сахаров и/или фосфатов (например, фосфотиоатные остовы). В целом, аналог конкретного нуклеотида обладает такой же специфичностью в отношении спаривания оснований; т.е. аналог A будет спариваться с основанием T.
[0059] Термины «полипептид», «пептид» и «белок» используются взаимозаменяемо для обозначения полимера из остатков аминокислот. Указанный термин также применим к полимерам аминокислот, в которых одна или более аминокислот представляют собой химические аналоги или модифицированные производные соответствующих встречающихся в природе аминокислот.
[0060] «Связывание» относится к специфическому в отношении последовательности нековалентном взаимодействию между макромолекулами (например, между белком и нуклеиновой кислотой). Не все компоненты связывающего взаимодействия обязательно должны быть специфическими в отношении последовательности (например, контакты с остатками фосфата в остове ДНК), при условии, что взаимодействие в целом остается специфическим в отношении последовательности. Такие взаимодействия обычно характеризуются константой диссоциации (Kd), составляющей 10-6 M-1 или менее. «Аффинность» относится к силе связывания: увеличенная аффинность связывания коррелирует с более низкой Kd. «Неспецифическое связывание» относится к нековалентным взаимодействиям, которые происходят между любой представляющей интерес молекулой (например, сконструированной нуклеазой) и макромолекулой (например, ДНК), и не зависят от целевой последовательности.
[0061] «Связывающий белок» представляет собой белок, который способен нековалентно связываться с другой молекулой. Связывающий белок может связываться, например, с молекулой ДНК (ДНК-связывающий белок), молекулой РНК (РНК-связывающий белок) и/или белковой молекулой (белок-связывающий белок). В случае белок-связывающего белка последний может связываться сам с собой (с образованием гомодимеров, гомотримеров и т.п.) и/или может связываться с одной или более молекул другого белка или белков. Связывающий белок может обладать более чем одним типом связывающей активности. Например, белки с цинковыми пальцами обладают ДНК-связывающей, РНК-связывающей и белок-связывающей активностью. В случае РНК-направляемой нуклеазной системы, РНК-направляющая гетерологична нуклеазному компоненту (Cas9 или Cfp1); оба могут быть сконструированы.
[0062] «ДНК-связывающая молекула» представляет собой молекулу, которая может связываться с ДНК. Такая ДНК-связывающая молекула может представлять собой полипептид, домен белка, домен в составе белка большего размера или полинуклеотид. Согласно некоторым вариантам реализации указанный полинуклеотид представляет собой ДНК, тогда как согласно другим вариантам реализации указанный полинуклеотид представляет собой РНК. Согласно некоторым вариантам реализации указанная ДНК-связывающая молекула представляет собой белковый домен нуклеазы (например, домен FokI), тогда как согласно другим вариантам реализации указанная ДНК-связывающая молекула представляет собой направляющий РНК-компонент РНК-направляемой нуклеазы (например, Cas9 или Cfp1).
[0063] «ДНК-связывающий белок» (или связывающий домен) представляет собой белок, или домен в составе белка большего размера, который связывает ДНК специфическим в отношении последовательности образом, например, посредством одного или более цинковых пальцев или за счет взаимодействия с одним или более RVD в белке с цинковыми пальцами или TALE, соответственно. Термин «ДНК-связывающий белок с цинковыми пальцами» часто сокращают до белка с цинковыми пальцами или ZFP.
[0064] «ДНК-связывающий белок с цинковыми пальцами» (или связывающий домен) представляет собой белок или домен в составе белка большего размера, который связывает ДНК специфическим в отношении последовательности образом посредством одного или более цинковых пальцев, которые представляют собой области последовательности аминокислот в составе связывающего домена, структура которого стабилизирована за счет координации иона цинка. Термин «ДНК-связывающий белок с цинковыми пальцами» часто сокращают до белка с цинковыми пальцами или ZFP.
[0065] «ДНК-связывающий домен TALE», или «TALE» представляет собой полипептид, содержащий один или более доменов/единиц повтора TALE. Домены повтора вовлечены в связывание TALE с когнатной целевой последовательностью ДНК. Длина одной «единицы повтора» (также называемой «повтором») составляет, как правило, 33-35 аминокислот, и она демонстрирует по меньшей мере некоторую гомологию последовательности другим последовательностям повторов TALE в составе встречающегося в природе белка TALE. См., например, патент США №8,586,526, включенный в настоящий документ полностью посредством ссылки.
[0066] ДНК-связывающие домены с цинковыми пальцами и TALE могут быть «сконструированы» для связывания с заранее заданной последовательностью нуклеотидов, например, посредством конструирования (изменения одной или более аминокислот) спиральной области распознавания встречающегося в природе белка с цинковыми пальцами или путем конструирования аминокислот, вовлеченных в ДНК-связывание («двойной остаток вариабельного повтора», или область RVD). Соответственно, сконструированные белки с цинковыми пальцами или белки TALE представляют собой белки, не встречающиеся в природе. Неограничивающие примеры способов конструирования белков с цинковыми пальцами и TALE представлены дизайном и выбором. Полученный путем дизайна белок представляет собой белок, не встречающийся в природе, дизайн/состав которого является результатом применения преимущественно рациональных критериев. Рациональные критерии дизайна включают применение правил замены и компьютерных алгоритмов для обработки информации из базы данных, где хранится информация о дизайне существующих ZFP или TALE и данные о связывании. См., например, патенты США № №8,586,526; №6,140,081; №6,453,242; и №6,534,261; см. также WO 98/53058; WO 98/53059; WO 98/53060; WO 02/016536 и WO 03/016496.
[0067] «Выбранными» («отобранными») являются белок с цинковыми пальцами, белок TALE или система CRISPR/Cas, не встречающиеся в природе, получаемые в основном в результате применения эмпирического способа, такого как фаговый дисплей, двухгибридная система «interaction trap», рациональный дизайн или гибридная селекция. См. например, US 5,789,538; US 5,925,523; US 6,007,988; US 6,013,453; US 6,200,759; WO 95/19431; WO 96/06166; WO 98/53057; WO 98/54311; WO 00/27878; WO 01/60970; WO 01/88197 и WO 02/099084.
[0068] «TtAgo» представляет собой прокариотический белок Argonaute, предположительно вовлеченный в сайленсинг генов. TtAgo происходит из бактерий Thermus thermophilus. См., например, Swarts et al, там же; G. Sheng et al., (2013) Proc. Natl. Acad. Sci. U.S.A. 111, 652). «Система TtAgo» включает все необходимые компоненты, в том числе, например, направляющие ДНК для расщепления ферментом TtAgo.
[0069] «Рекомбинация» относится к процессу обмена генетической информацией между двумя полинуклеотидами, в том числе, но не ограничиваясь перечисленными, захвату путем негомологичного соединения концов («non-homologous end joining», NHEJ) и гомологичной рекомбинации. Для целей настоящего изобретения «гомологичная рекомбинация (HR)» относится к специализированной форме такого обмена, происходящей, например, во время репарации двуцепочечных разрывов в клетках за счет направляемых гомологией механизмов репарации. Для указанного процесса необходима гомология последовательностей нуклеотидов, он задействует «донорную» молекулу для репарации «целевой» молекулы (т.е. молекулы, в которой произошел двуцепочечный разрыв) с матрицы; и также известен как «некроссоверная конверсия генов» или «конверсия генов с короткими трактами», поскольку приводит к переносу генетической информации от донора к мишени. Без связи с конкретной теорией, такой перенос может задействовать коррекцию несовпадений гетеродуплексной ДНК, которая образуется между разорванной мишенью и донором, и/или «синтез-зависимое аннелирование цепи», при котором используют донор для ресинтеза генетической информации, которая становится частью мишени, и/или родственные процессы. Такая специализированная HR часто приводит к изменению последовательности целевой молекулы таким образом, чтобы происходило включение части последовательности или всей последовательности донорного полинуклеотида в состав целевого полинуклеотида.
[0070] В определенных способах согласно настоящему описанию одна или более нацеленных нуклеаз согласно описанию в настоящем документе создают двуцепочечный разрыв (ДЦР) в целевой последовательности (например, клеточного хроматина) в заранее заданном сайте (например, представляющем интерес гене или локусе). ДЦР опосредует интеграцию конструкции (например, донорной) согласно описанию в настоящем документе. Указанная конструкция необязательно гомологична последовательности нуклеотидов в области разрыва. Экспрессионная конструкция может быть физически интегрирована; или, как вариант, используют экспрессионную кассету в качестве матрицы для репарации разрыва за счет гомологичной рекомбинации, что приводит к введению всей последовательности нуклеотидов или части последовательности нуклеотидов из экспрессионной кассеты в клеточный хроматин. Соответственно, первая последовательность в клеточном хроматине может быть изменена и, согласно некоторым вариантам реализации, может быть конвертирована в последовательность, присутствующую в экспрессионной кассете. Соответственно, применение терминов «заменять» или «замена» может относиться к замене одной последовательности нуклеотидов на другую (т.е. замене последовательности в информационном смысле), и не обязательно требует физической или химической замены одного полинуклеотида на другой.
[0071] В любом из способов, описанных в настоящем документе, могут применяться дополнительные сконструированные нуклеазы для дополнительного расщепления двух цепей (двухцепочечного расщепления) в дополнительном целевом сайте внутри клетки.
[0072] Согласно определенным вариантам реализации способов нацеленной рекомбинации, и/или замены, и/или изменения последовательности в представляющей интерес области в клеточном хроматине хромосомную последовательность изменяют путем гомологичной рекомбинации с экзогенной «донорной» последовательностью нуклеотидов. Такую гомологичную рекомбинацию стимулирует двуцепочечный разрыв в клеточном хроматине в случае присутствия последовательностей, гомологичных области разрыва.
[0073] В любом из способов, описанных в настоящем документе, первая последовательность нуклеотидов («донорная последовательность») может содержать последовательности, гомологичные, однако не идентичные геномным последовательностям в представляющей интерес области, что стимулирует гомологичную рекомбинацию со встраиванием неидентичной последовательности в представляющей интерес области. Соответственно, согласно некоторым вариантам реализации части донорной последовательности, гомологичные последовательностям в представляющей интерес области, демонстрируют приблизительно 80-99% (или соответствующую любому промежуточному целочисленному значению) идентичность последовательностей подлежащей замене геномной последовательности. Согласно другим вариантам реализации гомология между донорной и геномной последовательностями превышает 99%, например, в тех случаях, когда на протяжении 100 непрерывных пар оснований донорные и геномные последовательности различаются только 1 нуклеотидом. В определенных случаях негомологичная часть донорной последовательности может содержать последовательности, не присутствующие в представляющей интерес области, соответственно, в представляющую интерес область вводят новые последовательности. В указанных случаях негомологичная последовательность обычно фланкирована последовательностями, имеющими длину 50-1000 пар оснований (или длину, соответствующую любому промежуточному целочисленному значению) или длину, соответствующую любому числу пар оснований, превышающему 1000, гомологичными или идентичными последовательностям в представляющей интерес области. Согласно другим вариантам реализации донорная последовательность не гомологична первой последовательности и встроена в геном за счет механизмов негомологичной рекомбинации.
[0074] Любые из способов, описанных в настоящем документе, могут применяться для частичной или полной инактивации одной или более целевых последовательностей в клетке путем нацеленной интеграции донорной последовательности, или посредством расщепления целевой последовательности или последовательностей с последующей допускающей ошибки NHEJ-опосредованной репарацией, разрушающей экспрессию представляющего интерес гена или генов. Также предложены линии клеток с частично или полностью инактивированными генами.
[0075] Кроме того, способы нацеленной интеграции согласно описанию в настоящем документе могут также применяться для интеграции одной или более экзогенных последовательностей. Указанная экзогенная последовательность нуклеиновой кислоты может содержать, например, один или более генов, или одну или более молекул кДНК, или любой тип кодирующей или некодирующей последовательности, а также один или более контрольных элементов (например, промоторов). Кроме того, экзогенная последовательность нуклеиновой кислоты может продуцировать одну или более молекул РНК (например, малые шпилечные РНК (мшРНК), ингибиторные РНК (РНКи), микроРНК (миРНК) и т.п.).
[0076] «Расщепление» относится к разрыву ковалентного остова молекулы ДНК. Расщепление может быть инициировано различными способами, в том числе, но не ограничиваясь перечисленным, ферментативным или химическим гидролизом фосфодиэфирной связи. Возможно расщепление как одной цепи, так и двух цепей, и расщепление двух цепей может происходить в результате двух отдельных расщеплений одной цепи. Расщепление ДНК может приводить к образованию либо «тупых» концов, либо ступенчатых концов. Согласно некоторым вариантам реализации гибридные полипептиды используют для нацеленного расщепления двуцепочечной ДНК.
[0077] «Полудомен расщепления» представляет собой последовательность полипептида, которая в сочетании с вторым полипептидом (идентичным или отличающимся) образует комплекс, обладающий расщепляющей активностью (предпочтительно двуцепочечной (с расщеплением обеих цепей) расщепляющей активностью). Термины «первый и второй полудомены расщепления»; «+ и - полудомены расщепления» и «правый и левый полудомены расщепления» используются взаимозаменяемо для обозначения пар полудоменов расщепления, которые димеризуются. Термин «домен расщепления» применяют взаимозаменяемо с термином «полудомен расщепления». Термин «домен расщепления FokI» включает последовательность FokI, представленную в последовательности SEQ ID NO: 1, а также любые гомологи FokI, в том числе, но не ограничиваясь указанными, последовательности, представленные на Фиг. 17.
[0078] «Сконструированный полудомен расщепления» представляет собой полудомен расщепления, модифицированный таким образом, чтобы образовывать облигатные гетеродимеры с другим полудоменом расщепления (например, другим сконструированным полудоменом расщепления).
[0079] Термин «последовательность» относится к последовательности нуклеотидов любой длины, которая может быть представлена ДНК или РНК; может быть линейной, кольцевой или разветвленной, и может быть либо одноцепочечной, либо двуцепочечной. Термин «трансген» относится к последовательности нуклеотидов, которая встроена в геном. Трансген может иметь любую длину, например, от 2 до 100 000 000 нуклеотидов (или длину, соответствующую любому промежуточному или большему целочисленному значению), предпочтительно от приблизительно 100 до 100 000 нуклеотидов (или длину, соответствующую любому промежуточному целочисленному значению), более предпочтительно - длину от приблизительно 2000 до 20 000 нуклеотидов (или длину, соответствующую любому промежуточному целочисленному значению); еще более предпочтительно - длину от приблизительно 5 до 15 кБ (или длину, соответствующую любому промежуточному целочисленному значению).
[0080] «Хромосома» представляет собой комплекс хроматина, содержащие полный геном или часть генома клетки. Геном клетки часто характеризуют по кариотипу, который представляет собой совокупность всех хромосом, которые содержатся в геноме клетки. Геном клетки может содержать одну или более хромосом.
[0081] «Эписома» представляет собой реплицирующуюся нуклеиновую кислоту, нуклеопротеиновый комплекс или другую структуру, содержащую нуклеиновую кислоту, которая не входит в состав хромосомного кариотипа клетки. Примеры эписом включают плазмиды, миникольца и определенные вирусные геномы. Специфические для печени конструкции, описанные в настоящем документе, могут поддерживаться в эписомной форме или, как вариант, могут быть стабильно встроены в клетку.
[0082] «Экзогенная» молекула представляет собой молекулу, которая в норме не присутствует в клетке, однако может быть введена в клетку с применением одного или более генетических, биохимических или других способов. «Присутствие в клетке в норме» определяют для указанной клетки применительно к конкретной стадии развития и конкретным условиям окружающей среды. Соответственно, например, молекула, которая присутствует только во время эмбрионального развития мышц, представляет собой экзогенную молекулу применительно к взрослой мышечной клетке. Аналогичным образом, молекула, индуцируемая тепловым шоком, представляет собой экзогенную молекулу применительно к клетке, не подвергавшейся тепловому шоку. Экзогенная молекула может включать, например, функциональный вариант неправильно функционирующей эндогенной молекулы или неправильно функционирующий вариант нормально функционирующей эндогенной молекулы.
[0083] Экзогенная молекула может представлять собой, в том числе, малую молекулу, например, полученную с применением способа комбинаторной химии, или макромолекулу, такую как белок, нуклеиновая кислота, углевод, липид, гликопротеин, липопротеин, полисахарид, любое модифицированное производное вышеуказанных молекул, или любой комплекс, содержащий одну или более из вышеуказанных молекул. Нуклеиновые кислоты включают ДНК и РНК, могут быть одно- или двуцепочечными; линейными, разветвленными или кольцевыми; и могут иметь любую длину. Нуклеиновые кислоты включают способные к образованию дуплексов, а также образующие триплексы нуклеиновые кислоты. См., например, патенты США №5,176,996 и №5,422,251. Белки включают, не ограничиваясь перечисленными, ДНК-связывающие белки, транскрипционные факторы, факторы ремоделирования хроматина, связывающие метилированную ДНК белки, полимеразы, метилазы, деметилазы, ацетилазы, деацетилазы, киназы, фосфатазы, лигазы, деубиквитиназы, интегразы, рекомбиназы, лигазы, топоизомеразы, гиразы и геликазы.
[0084] Экзогенная молекула может относится к тому же типу молекулы, что и эндогенная молекула, например, экзогенный белок или нуклеиновая кислота. Например, экзогенная нуклеиновая кислота может содержать инфицирующий вирусный геном, плазмиду или эписому, введенную в клетку, или хромосому, которая в норме не присутствует в указанной клетке. Способы введения экзогенных молекул в клетки известны специалистам в данной области техники и включают, не ограничиваясь перечисленными, опосредованный липидами перенос (т.е. липосомы, в том числе с нейтральными и катионными липидами), электропорацию, прямую инъекцию, слияние клеток, бомбардировку частицами, ко-осаждение с фосфатом кальция, опосредованный DEAE-декстраном перенос и опосредованный вирусными векторами перенос. Также экзогенная молекула может относиться к тому же типу молекулы, что и эндогенная молекула, но происходить из вида, отличного от того, к которому относится клетка. Например, последовательность нуклеиновой кислоты человека может быть введена в клетку линии, изначально происходящей из организма мыши или хомяка. Способы введения экзогенных молекул в клетки растений известны специалистам в данной области техники и включают, не ограничиваясь перечисленными, трансформацию протопластов, применение карбида кремния (например, WHISKERS™), опосредованную Agrobacterium трансформацию, опосредованный липидами перенос (т.е. липосомы, в том числе с нейтральными и катионными липидами), электропорацию, прямую инъекцию, слияние клеток, бомбардировку частицами (например, с применением «генной пушки»), ко-осаждение с фосфатом кальция, опосредованный DEAE-декстраном перенос и опосредованный вирусными векторами перенос.
[0085] Напротив, «эндогенная» молекула представляет собой молекулу, в норме присутствующую в конкретной клетке на конкретной стадии развития в конкретных условиях окружающей среды. Например, эндогенная нуклеиновая кислота может включать хромосому, геном митохондрии, хлоропласта или другой органеллы, или встречающуюся в природе эписомную нуклеиновую кислоту. Дополнительные эндогенные молекулы могут включать белки, например, транскрипционные факторы и ферменты.
[0086] В настоящем документе термин «продукт экзогенной нуклеиновой кислоты» включает как полинуклеотидные, так и полипептидные продукты, например, продукты транскрипции (полинуклеотиды, такие как РНК) и продукты трансляции (полипептиды).
[0087] «Гибридная» молекула представляет собой молекулу, в которой две или более субъединичных молекул соединены, предпочтительно, ковалентно соединены. Субъединичные молекулы могут относиться к молекулам одного химического типа, или могут относиться к молекулам разных химических типах. Примеры гибридных молекул включают, не ограничиваясь перечисленными, гибридные белки (например, белковый ДНК-связывающий домен, гибридный с доменом расщепления), гибридный полинуклеотидный ДНК-связывающий домен (например, онРНК), функционально связанный с доменом расщепления, и гибридные нуклеиновые кислоты (например, нуклеиновая кислота, кодирующая гибридный белок).
[0088] Экспрессия гибридного белка в клетке может быть результатом доставки указанного гибридного белка в указанную клетку, или доставки полинуклеотида, кодирующего указанный гибридный белок, в клетку, где указанный полинуклеотид транскрибируется, и транскрипт транслируется с получением указанного гибридного белка. В экспрессии белка в клетке могут также быть задействованы транс-сплайсинг, расщепление полипептидов и лигирование полипептидов. Способы доставки полинуклеотидов и полипептидов в клетки описаны в различных разделах настоящего документа.
[0089] «Ген» для целей настоящего изобретения включает область ДНК, кодирующую генный продукт (см. ниже), а также все области ДНК, которые регулируют продуцирование указанного генного продукта, при этом такие регуляторные последовательности могут быть как смежными, так и несмежными кодирующим и/или транскрибируемым последовательностям. Соответственно, ген включает, однако не обязательно ограничен перечисленным, промоторные последовательности, терминаторы, последовательности регуляции трансляции, такие как сайты связывания рибосом и участки внутренней посадки рибосомы, энхансеры, сайленсеры, инсуляторы, граничные элементы, точки начала репликации, сайты прикрепления к матриксу и локус-контролирующие элементы.
[0090] «Генная экспрессия» относится к конверсии информации, содержащейся в гене, в генный продукт. Генный продукт может представлять собой продукт прямой транскрипции гена (например, мРНК, тРНК, рРНК, антисмысловую РНК, рибозим, структурную РНК или любой другой тип РНК) или белок, продуцированный путем трансляции мРНК. Генные продукты также включают РНК, модифицированные в результате таких процессов, как кэпирование, полиаденилирование, метилирование и редактирование, а также белки, модифицированные, например, при метилировании, ацетилировании, фосфорилировании, убиквитинировании, АДФ-рибозилировании, миристоилировании и гликозилировании.
[0091] «Модуляция» генной экспрессии относится к изменению активности гена. Модуляция экспрессии может включать, однако не ограничивается перечисленным, активацию генов и репрессию генов. Для модуляции экспрессии может применяться редактирование генома (например, расщепление, изменение, инактивация, случайная мутация). Инактивация генов относится к любому снижению генной экспрессии по сравнению с экспрессией в клетке, которая содержит ZFP, TALE или систему CRISPR/Cas согласно описанию в настоящем документе. Соответственно, инактивация генов может быть частичной или полной.
[0092] «Представляющая интерес область» представлена любой областью клеточного хроматина, такой как, например, ген или некодирующая последовательность в составе гена или смежная с геном, с которой требуется связать экзогенную молекулу. Связывание может проводиться для нацеленного расщепления ДНК и/или нацеленной рекомбинации. Представляющая интерес область может находиться, например, в хромосоме, в эписоме, в геноме органеллы (например, митохондрии, хлоропласта) или инфицирующем вирусной геноме. Представляющая интерес область может входить в состав кодирующей области гена, в состав транскрибируемых некодирующих областей, таких как, например, лидерные последовательности, трейлерные последовательности или интроны, или в состав нетранскрибируемых областей, в 5'-направлении или в 3'-направлении от кодирующей области. Длина представляющей интерес области может составлять всего одну пару нуклеотидов или до 2000 пар нуклеотидов, или соответствовать любому целому числу пар нуклеотидов.
[0093] Локус типа «безопасная гавань» представляет собой локус в составе генома, куда может быть встроен ген без каких-либо пагубных эффектов для клетки-хозяина. Наиболее предпочтителен локус типа «безопасная гавань», экспрессия встроенной генной последовательности в котором не нарушается какой-либо сквозной экспрессией соседних генов. Неограничивающие примеры локусов типа «безопасная гавань» для нацеливания нуклеазы или нуклеаз, включают CCR5, HPRT, AAVS1, Rosa и альбумин. См., например, патенты США №7,951,925; №8,771,985; №8,110,379; №7,951,925; публикации США №20100218264; №20110265198; №20130137104; №20130122591; №20130177983; №20130177960; №20150056705 и №20150159172.
[0094] «Репортерный ген» или «репортерная последовательность» относится к любой последовательности, которая продуцирует белковый продукт, который легко измерить, предпочтительно, хотя не обязательно, с применением рутинного анализа. Подходящие репортерные гены включают, не ограничиваясь перечисленными, последовательности, кодирующий белки, опосредующие устойчивость к антибиотикам (например, устойчивость к ампициллину, устойчивость к неомицину, устойчивость к G418, устойчивость к пуромицину), последовательности, кодирующие окрашенные, или флуоресцентные, или люминесцентный белки (например, зеленый флуоресцентный белок, усиленный зеленый флуоресцентный белок, красный флуоресцентный белок, люциферазу), и белки, опосредующие усиленный рост клеток и/или амплификацию генов (например, дигидрофолатредуктазу). Эпитопные метки включают, например, одну или более копий FLAG, His, myc, Tap, HA или любой детектируемой последовательности аминокислот. «Экспрессионные метки» включают последовательности, кодирующие репортеры, которые могут быть функционально связаны с требуемой генной последовательностью для мониторинга экспрессии представляющего интерес гена.
[0095] «Эукариотические» клетки включают, не ограничиваясь перечисленными, клетки грибов (таких как дрожжи), клетки растений, клетки животных, клетки млекопитающих и клетки человека (например, T-клетки), в том числе стволовые клетки (плюрипотентные и мультипотентные).
[0096] Термины «функциональная связь» и «функционально связанный» используются взаимозаменяемо в отношении взаимного расположения двух или более компонентов (таких как элементы последовательности), при котором указанные компоненты организованы таким образом, чтобы обеспечивать нормальное функционирование обоих компонентов и возможность опосредования по меньшей мере одним компонентом функции, осуществляемой в отношении по меньшей мере одного другого компонента. Например, последовательность регуляции транскрипции, такая как промотор, функционально связана с кодирующей последовательностью, если указанная последовательность регуляции транскрипции контролирует уровень транскрипции указанной кодирующей последовательности в ответ на присутствие или отсутствие одного или более факторов регуляции транскрипции. Последовательность регуляции транскрипции обычно функционально цис-связана с кодирующей последовательностью, однако не обязательно непосредственно смежна с указанной кодирующей последовательностью. Например, энхансер представляет собой последовательность регуляции транскрипции, которая функционально связана с кодирующей последовательностью, даже если они не расположены непрерывно.
[0097] «Функциональный фрагмент» белка, полипептида или нуклеиновой кислоты представляет собой белок, полипептид или нуклеиновую кислоту с последовательностью, не идентичной полноразмерному белку, полипептиду или полноразмерной нуклеиновой кислоте, но сохраняющий(ая) ту же функцию, что и полноразмерный белок, полипептид или нуклеиновая кислота. Функциональный фрагмент может содержать большее, меньшее или такое же число остатков, что и соответствующая природная молекула, и/или может содержать одну или более замен аминокислот или нуклеотидов. Способы определения функции нуклеиновой кислоты или белка (например, анализ кодирующей функции, способности гибридизоваться с другой нуклеиновой кислотой, ферментативной активности) хорошо известны в данной области техники.
[0098] Полинуклеотидный «вектор» или «конструкция» способны переносить последовательности генов в целевые клетки. Как правило, «векторная конструкция», «экспрессионный вектор», «экспрессионная конструкция», «экспрессионная кассета», и «вектор для переноса генов» означают любую конструкцию нуклеиновой кислоты, способную направлять экспрессию представляющего интерес гена и переносить последовательности гена в целевые клетки. Соответственно, указанный термин включает основы для клонирования и экспрессии, а также интегрирующие векторы.
[0099] Термины «субъект» и «пациент» используются взаимозаменяемо и относятся к млекопитающим, таким как пациенты-люди и не являющиеся человеком приматы, а также к таким экспериментальным животным, как кролики, собаки, кошки, крысы, мыши; и другим животным. Соответственно, термин «субъект» или «пациент» в настоящем документе означает любого пациента или субъекта - млекопитающего, которому могут быть введены экспрессионные кассеты согласно настоящему изобретению. Субъекты согласно настоящему изобретению включают субъектов, страдающих расстройством.
[0100] Термины «лечить» (или «обрабатывать») и «лечение» (или «обработка») в настоящем документе относятся к снижению тяжести и/или частоты симптомов, элиминации симптомов и/или первопричины, предотвращению возникновения симптомов и/или их первопричины, и облегчению или устранению повреждения. Рак, моногенные заболевания и болезнь «трансплантат против хозяина» являются неограничивающими примерами состояний, лечение которых может быть проведено с применением композиций и способов, описанных в настоящем документе.
[0101] «Хроматин» представляет собой нуклеопротеиновую структуру, содержащую клеточный геном. Клеточный хроматин содержит нуклеиновую кислоту, в первую очередь ДНК, и белок, в том числе гистоны и негистоновые хромосомные белки.  часть хроматина эукариотических клеток находится в форме нуклеосом, при этом нуклеосомный кор содержит приблизительно 150 пар оснований ДНК, ассоциированных с октамером, содержащим по две копии каждого из гистонов H2A, H2B, H3 и H4; и линкерную ДНК (вариабельной длины в зависимости от организма), расположенную между нуклеосомными корами. Молекула гистона H1 обычно ассоциирована с линкерной ДНК. Подразумевается, что для целей настоящего изобретения термин «хроматин» охватывает все типы клеточных нуклеопротеинов, как прокариотических, так и эукариотических. Клеточный хроматин включает как хромосомный, так и эписомный хроматин.
часть хроматина эукариотических клеток находится в форме нуклеосом, при этом нуклеосомный кор содержит приблизительно 150 пар оснований ДНК, ассоциированных с октамером, содержащим по две копии каждого из гистонов H2A, H2B, H3 и H4; и линкерную ДНК (вариабельной длины в зависимости от организма), расположенную между нуклеосомными корами. Молекула гистона H1 обычно ассоциирована с линкерной ДНК. Подразумевается, что для целей настоящего изобретения термин «хроматин» охватывает все типы клеточных нуклеопротеинов, как прокариотических, так и эукариотических. Клеточный хроматин включает как хромосомный, так и эписомный хроматин.
[0102] «Доступная область» представляет собой сайт в клеточном хроматине, где целевой сайт, присутствующий в нуклеиновой кислоте, может быть связан экзогенной молекулой, которая распознает указанный целевой сайт. Без связи с конкретной теорией, считается, что доступная область представляет собой область, не упакованную в нуклеосомную структуру. Отличительная структура доступной области часто может быть детектирована по чувствительности к химическим и ферментативным зондам, например, нуклеазам.
[0103] «Целевой сайт» или «целевая последовательность» представляет собой последовательность нуклеиновой кислоты, определяющая часть нуклеиновой кислоты, с которой связывается связывающая молекула, если имеются условия, достаточные для связывания. Например, последовательность 5’GAATTC3’ представляет собой целевой сайт рестрикционной эндонуклеазы Eco RI. «Предусмотренная» или «целевая» последовательность представляет собой последовательность, с которой связывающая молекула предположительно будет связываться, а «непредусмотренная» или «нецелевая» последовательность включает любую последовательность, связываемую связывающей молекулой и не являющуюся предусмотренной мишенью.
ДНК-связывающие молекулы/домены
[0104] В настоящем документе описаны композиции, содержащие ДНК-связывающую молекулу/домен, которая(ый) специфически связывается с целевым сайтом в любом представляющем интерес гене или локусе. Любая(ой) ДНК-связывающая(ий) молекула/домен может быть использован(а) в композициях и способах согласно описанию в настоящем документе, в том числе, но не ограничиваясь перечисленным, ДНК-связывающий домен с цинковыми пальцами, ДНК-связывающий домен TALE, ДНК-связывающая часть CRISPR/нуклеазы Cas (направляющие или онРНК) или ДНК-связывающий домен из мегануклеазы.
[0105] Согласно некоторым вариантам реализации указанный ДНК-связывающий домен содержит белок с цинковыми пальцами. Предпочтительно, указанный белок с цинковыми пальцами не встречается в природе, в том смысле, что он сконструирован для связывания с выбранным целевым сайтом. См., например, источники: Beerli et al. (2002) Nature Biotechnol. 20:135-141; Pabo et al. (2001) Ann. Rev. Biochem. 70:313-340; Isalan et al. (2001) Nature Biotechnol. 19:656-660; Segal et al. (2001) Curr. Opin. Biotechnol. 12:632-637; Choo et al. (2000) Curr. Opin. Struct. Biol. 10:411-416; патенты США №6,453,242; №6,534,261; №6,599,692; №6,503,717; №6,689,558; №7,030,215; №6,794,136; №7,067,317; №7,262,054; №7,070,934; №7,361,635; №7,253,273; и патентные публикации США №2005/0064474; №2007/0218528; №2005/0267061, каждый из которых включен в настоящий документ полностью посредством ссылки. Согласно некоторым вариантам реализации указанный ДНК-связывающий домен содержит белок с цинковыми пальцами, описанный в патентной публикации США №2012/0060230 (например, в таблице 1), включенном в настоящий документ полностью посредством ссылки.
[0106] Сконструированный связывающий домен с цинковыми пальцами может обладать новой специфичностью связывания по сравнению с встречающимся в природе белком с цинковыми пальцами. Способы конструирования включают, не ограничиваясь перечисленными, рациональный дизайн и различные типы отбора. Рациональный дизайн включает, например, использование баз данных, содержащих триплетные (или квадруплетные) последовательности нуклеотидов и индивидуальные последовательности аминокислот цинковых пальцев, где каждая триплетная или квадруплетная последовательность нуклеотидов ассоциирована с одной или более последовательностей аминокислот цинковых пальцев, который связывают конкретный триплетную или квадруплетную последовательность. См., например, патенты США 6,453,242 и 6,534,261, полностью включенные посредством ссылки в настоящий документ.
[0107] Примеры способов выбора, в том числе с применением фагового дисплея и двухгибридных систем, описаны в патентах США 5,789,538; 5,925,523; 6,007,988; 6,013,453; 6,410,248; 6,140,466; 6,200,759; и 6,242,568; а также WO 98/37186; WO 98/53057; WO 00/27878; WO 01/88197 и GB 2,338,237. Кроме того, повышение специфичности связывания для связывающих доменов с цинковыми пальцами было описано, например, в патенте США №6,794,136.
[0108] Кроме того, согласно описанию в указанном и других источниках, домены с цинковыми пальцами и/или белки с множеством цинковых пальцев могут быть соединены друг с другом с применением любых подходящих линкерных последовательностей, в том числе, например, линкеров длиной 5 или более аминокислот. См. также примеры линкерных последовательностей длиной 6 или более аминокислот в патентах США №6,479,626; №6,903,185; и №7,153,949. Белки, описанные в настоящем документе, могут содержать любую комбинацию подходящих линкеров между индивидуальными цинковыми пальцами указанного белка. Кроме того, повышение специфичности связывания для связывающих доменов с цинковыми пальцами было описано, например, в патенте США №6,794,136.
[0109] Выбор целевого сайта; ZFP и способы дизайна и конструирования гибридных белков (и кодирующих их полинуклеотидов) известны специалистам в данной области техники и подробно описаны в патентах США №6,140,081; №5,789,538; №6,453,242; №6,534,261; №5,925,523; №6,007,988; №6,013,453; №6,200,759; WO 95/19431; WO 96/06166; WO 98/53057; WO 98/54311; WO 00/27878; WO 01/60970 WO 01/88197; WO 02/099084; WO 98/53058; WO 98/53059; WO 98/53060; WO 02/016536 и WO 03/016496.
[0110] Кроме того, согласно описанию в указанном и других источниках, домены с цинковыми пальцами и/или белки с множеством цинковых пальцев могут быть соединены друг с другом с применением любых подходящих линкерных последовательностей, в том числе например, линкеров длиной 5 или более аминокислот. См. также примеры линкерных последовательностей длиной 6 или более аминокислот в патентах США №6,479,626; №6,903,185; и №7,153,949. Описанные в настоящем документе белки могут включать любую комбинацию подходящих линкеров между индивидуальными цинковыми пальцами указанного белка.
[0111] Обычно ZFP включают по меньшей мере три пальца. Определенные ZFP включают четыре, пять или шесть пальцев. ZFP, которые включают три пальца, как правило распознают целевой сайт, который включает 9 или 10 нуклеотидов; ZFP, которые включают четыре пальца, как правило, распознают целевой сайт, который включает от 12 до 14 нуклеотидов; тогда как ZFP, содержащие шесть пальцев, способен распознавать целевые сайты, которые включают от 18 до 21 нуклеотидов. ZFP могут также представлять собой гибридные белки, которые включают один или более регуляторных доменов, которые могут представлять собой домены активации или репрессии транскрипции.
[0112] Согласно некоторым вариантам реализации указанный ДНК-связывающий домен может происходить из нуклеазы. Например, известны последовательности распознавания хоуминг-эндонуклеазами и мегануклеазами, такими как I-SceI, I-CeuI, PI-PspI, PI-Sce, I-SceIV, I-CsmI, I-PanI, I-SceII, I-PpoI, I-SceIII, I-CreI, I-TevI, I-TevII и I-TevIII. См. также патент США №5,420,032; патент США №6,833,252; Belfort et al. (1997) Nucleic Acids Res. 25:3379-3388; Dujon et al. (1989) Gene 82:115-118; Perler et al. (1994) Nucleic Acids Res. 22, 1125-1127; Jasin (1996) Trends Genet. 12:224-228; Gimble et al. (1996) J. Mol. Biol. 263:163-180; Argast et al. (1998) J. Mol. Biol. 280:345-353 и каталог New England Biolabs. Кроме того, ДНК-связывающая специфичность хоуминг-эндонуклеаз и мегануклеаз может быть сконструирована для связывания не встречающегося в природе целевого сайта. См., например, Chevalier et al. (2002) Molec. Cell 10:895-905; Epinat et al. (2003) Nucleic Acids Res. 31:2952-2962; Ashworth et al. (2006) Nature 441:656-659; Paques et al. (2007) Current Gene Therapy 7:49-66; патентную публикацию США №20070117128.
[0113] Согласно некоторым вариантам реализации белок с цинковыми пальцами, используемый с мутантными доменами расщепления, описанными в настоящем документе, содержит одну или более мутаций (замен, делеций и/или инсерций) в областях остова (например, области вне спиральной области распознавания размером 7 аминокислот, пронумерованных от -1 до 6), например, в одном или более из положений -14, -9 и/или -5 (см., например, Фиг. 5A). Остаток молекулы дикого типа в одном или более указанных положениях может быть делетирован, заменен на любой остаток аминокислоты и/или включает один или более дополнительных остатков. Согласно некоторым вариантам реализации Arg (R) в положении -5 заменяют на Tyr (Y), Asp (N), Glu (E), Leu (L), Gln (Q) или Ala (A). Согласно другим вариантам реализации Arg (R) в положении (-9) заменен на Ser (S), Asp (N) или Glu (E). Согласно дополнительным вариантам реализации Arg (R) в положении (-14) заменен на Ser (S) или Gln (Q). Согласно другим вариантам реализации гибридные полипептиды могут содержать мутации в ДНК-связывающем домене с цинковыми пальцами, при этом аминокислоты в положениях (-5), (-9) и/или (-14) заменяют на любые из вышеперечисленных аминокислот в любой комбинации.
[0114] Согласно другим вариантам реализации ДНК-связывающий домен содержит сконструированный домен из подобного активатору транскрипции (TAL) эффектора (TALE), аналогичный происходящим из патогенов растений Xanthomonas (см. Boch et al, (2009) Science 326: 1509-1512; и Moscou and Bogdanove, (2009) Science 326: 1501) и Ralstonia (см. Heuer et al (2007) Applied and Environmental Microbiology 73(13): 4379-4384); патентные публикации США №20110301073 и №20110145940. Патогенные бактерии растений из рода Xanthomonas, как известно, вызывают множество заболеваний важных сельскохозяйственных растений. Патогенность Xanthomonas зависит от консервативной системы секреции III типа (T3S), которая вводит более чем 25 разных эффекторных белков в растительную клетку. Среди указанных введенных белков - подобные активаторам транскрипции эффекторы (TALE), имитирующие активаторы транскрипции растений и манипулирующие транскриптомом растений (см. Kay et al (2007) Science 318:648-651). Указанные белки содержат ДНК-связывающий домен и домен активации транскрипции. Один из наиболее хорошо описанных TALE представлен AvrBs3 из Xanthomonas campestgris pv. Vesicatoria (см. Bonas et al (1989) Mol Gen Genet 218: 127-136 и WO 2010079430). TALE содержат расположенный по центру домен из тандемных повторов, где каждый повтор содержит приблизительно 34 аминокислот, играющих ключевую роль в ДНК-связывающей специфичности указанных белков. Кроме того, они содержат последовательность ядерной локализации и кислый домен активации транскрипции (см. обзор в источнике: Schornack S, et al (2006) J Plant Physiol 163(3): 256-272). Кроме того, у фитопатогенных бактерий Ralstonia solanacearum, в штамме GMI1000 биовара 1 и в штамме RS1000 биовара 4 R. solanacearum, обнаружены два гена, гомологичных семейству AvrBs3 Xanthomonas, называемые brg11 и hpx17 (см. Heuer et al (2007) Appl and Envir Micro 73(13): 4379-4384). Указанные гены на 98,9% идентичны друг другу по последовательности нуклеотидов, но различаются делецией 1575 пар оснований в домене с повторами hpx17. Однако оба генных продукта обладают менее чем 40% идентичностью последовательностей семейству белков AvrBs3 Xanthomonas.
[0115] Специфичность указанных TAL-эффекторов зависит от последовательностей, обнаруживаемых в тандемных повторах. Повторяющаяся последовательность содержит приблизительно 102 пар оснований, и повторы, как правило, на 91-100% гомологичны друг другу (Bonas et al, там же). Полиморфизм повторов обычно локализован в положениях 12 и 13, и, по-видимому, имеется взаимно однозначное соответствие между идентичностью гипервариабельных двойных остатков (двойной остаток вариабельного повтора, или область RVD) в положениях 12 и 13, и идентичностью непрерывных нуклеотидов в целевой последовательности TAL-эффектора (см. Moscou and Bogdanove, (2009) Science 326:1501 и Boch et al (2009) Science 326:1509-1512). В условиях эксперимента было определено, что в естественном коде для распознавания ДНК указанных TAL-эффекторов последовательность HD в положениях 12 и 13 (двойной остаток вариабельного повтора, или RVD) приводит к связыванию с цитозином (C), NG связывается с T, NI с A, C, G или T, NN связывается с A или G, и ING связывается с T. Указанные ДНК-связывающие повторы были собраны в белки с новыми комбинациями и числом повторов, с получением искусственных транскрипционных факторов, способных взаимодействовать с новыми последовательностями и активировать экспрессию неэндогенного репортерного гена в клетках растений (Boch et al, там же). Сконструированные белки TAL соединяли с полудоменом расщепления FokI, получая гибридизованы с нуклеазным доменом TAL-эффектор (TALEN), в том числе TALEN с атипичными RVD. См., например, патент США №8,586,526.
[0116] Согласно некоторым вариантам реализации TALEN содержит домен расщепления или полудомен расщепления эндонуклеазы (например, FokI). Согласно другим вариантам реализации TALE-нуклеаза представляет собой мега-TAL. Указанные мега-TAL-нуклеазы представляют собой гибридные белки, содержащие ДНК-связывающий домен TALE и домен расщепления мегануклеазы. Домен расщепления мегануклеазы активен в форме мономера и не требует димеризации для активности. (См. Boissel et al., (2013) Nucl Acid Res: 1-13, doi: 10.1093/nar/gkt1224).
[0117] Согласно другим дополнительным вариантам реализации нуклеаза содержит компактный TALEN. Это одноцепочечные гибридные белки, где ДНК-связывающий домен TALE соединен с нуклеазным доменом TevI. Указанный гибридный белок может либо функционировать в качестве никазы с локализацией, определяемой областью TALE, либо может создавать двуцепочечный разрыв, в зависимости от того, где локализован ДНК-связывающий домен TALE относительно нуклеазного домена TevI (см. Beurdeley et al (2013) Nat Comm: 1-8 DOI: 10.1038/ncomms2782). Кроме того, нуклеазный домен может также проявлять ДНК-связывающие функции. Любые TALEN могут применяться в комбинации с дополнительными TALEN (например, с одним или более TALEN (cTALEN или FokI-TALEN) с одним или более мега-TALE.
[0118] Кроме того, согласно описанию в указанных и других источниках, домены с цинковыми пальцами и/или белки с несколькими цинковыми пальцами или TALE могут быть соединены между собой с применением любых подходящих линкерных последовательностей, в том числе, например, линкеров длиной 5 или более аминокислот. См. также примеры линкерных последовательностей длиной 6 или более аминокислот в патентах США №6,479,626; №6,903,185; и №7,153,949. Описанные в настоящем документе белки могут содержать любую комбинацию подходящих линкеров между индивидуальными цинковыми пальцами белка. Кроме того, повышение специфичности связывания для связывающих доменов с цинковыми пальцами было описано, например, в патенте США №6,794,136. Согласно некоторым вариантам реализации ДНК-связывающий домен входит в состав системы CRISPR/нуклеаза Cas, включающей одиночную направляющую РНК (онРНК) ДНК-связывающую молекулу, которая связывается с ДНК. См., например, патент США №8,697,359 и патентные публикации США №20150056705 и №20150159172. Локус CRISPR (кластеризованные регулярно распределенные короткие палиндромные повторы), который кодирует РНК компоненты указанной системы, и локус Cas (CRISPR-ассоциированный), который кодирует белки (Jansen et al., 2002. Mol. Microbiol. 43: 1565-1575; Makarova et al., 2002. Nucleic Acids Res. 30: 482-496; Makarova et al., 2006. Biol. Direct 1: 7; Haft et al., 2005. PLoS Comput. Biol. 1: e60) составляют последовательности генов системы CRISPR/нуклеаза Cas. Локусы CRISPR хозяев-микроорганизмов содержат комбинацию CRISPR-ассоциированных (Cas) генов, а также некодирующие РНК-элементы, способные к программированию специфичности опосредованного CRISPR расщепления нуклеиновых кислот.
[0119] Согласно некоторым вариантам реализации указанный ДНК-связывающий домен входит в состав системы TtAgo (см. Swarts et al, там же; Sheng et al, там же). У эукариот сайленсинг генов опосредован белками семейства Argonaute (Ago). Согласно указанной парадигме Ago связан с малыми (19-31 нуклеотид) РНК. Указанный сайленсирующий комплекс белка и РНК распознает целевые РНК посредством спаривания оснований по Уотсону-Крику между малой РНК и мишенью, и эндонуклеолитически расщепляет целевую РНК (Vogel (2014) Science 344:972-973). Напротив, прокариотические белки Ago связываются с малыми одноцепочечными фрагментами ДНК; их функция, предположительно, заключается в детекции и удалении чужеродной (часто вирусной) ДНК (Yuan et al., (2005) Mol. Cell 19, 405; Olovnikov, et al. (2013) Mol. Cell 51, 594; Swarts et al., там же). Примеры прокариотических белков Ago включают белки из Aquifex aeolicus, Rhodobacter sphaeroides и Thermus thermophilus.
[0120] Один из наиболее хорошо охарактеризованных прокариотических белков Ago представлен белком из T. thermophilus (TtAgo; Swarts et al. там же). TtAgo связывается с одноцепочечными фрагментами ДНК длиной 15 нуклеотидов или 13-25 нуклеотидов с 5' фосфатными группами. Указанная «направляющая ДНК», связанная TtAgo, служит для направления комплекса белок-ДНК для связывания комплементарной по Уотсону-Крику последовательности ДНК в сторонней молекуле ДНК. После того как информация о последовательности в указанных направляющих ДНК обеспечила идентификацию целевой ДНК, комплекс TtAgo/направляющая ДНК расщепляет целевую ДНК. Такой механизм также поддерживается структурой комплекса TtAgo/направляющая ДНК, когда он связан с целевой ДНК (G. Sheng et al., там же). Ago из Rhodobacter sphaeroides (RsAgo) обладает аналогичным свойствами (Olivnikov et al., там же).
[0121] Экзогенными направляющими ДНК произвольной последовательности ДНК может быть нагружен белок TtAgo (Swarts et al. там же.). Поскольку специфичностью расщепления TtAgo управляет направляющая ДНК, комплекс TtAgo/ДНК, образованный с участием экзогенной выбранной исследователем направляющей ДНК, соответственно, направляет целевое расщепление ДНК TtAgo на целевую ДНК, комплементарную выбранной исследователем. Таким образом может быть создан нацеленный двуцепочечный разрыв в ДНК. Применение системы TtAgo/направляющая ДНК (или ортологичных систем Ago/направляющая ДНК из других организмов) позволяет обеспечить нацеленное расщепление геномной ДНК в клетках. Такое расщепление может быть одно- или двуцепочечным. Для расщепления геномной ДНК млекопитающих предпочтительно применение варианта TtAgo, кодон-оптимизированного для экспрессии в клетках млекопитающих. Кроме того, может быть предпочтительной обработка клетки комплексом TtAgo-ДНК, образованным in vitro, в котором белок TtAgo гибридизован с проникающим в клетки пептидом. Кроме того, может быть предпочтительным применение варианта белка TtAgo, который был изменен посредством мутагенеза, обеспечивающего повышенную активность при 37°C. Ago/РНК-опосредованное расщепление ДНК может применяться для влияния на множество исходов, в том числе нокаута генов, нацеленного добавления генов, коррекции генов, нацеленной делеции генов с применением стандартных в данной области техники методик, использующих разрывы ДНК.
[0122] Соответственно, может применяться любая ДНК-связывающая молекула/любой ДНК-связывающий домен.
Гибридные молекулы
[0123] Также предложены гибридные молекулы, содержащие ДНК-связывающие домены (например, ZFP или TALE, компоненты CRISPR/Cas, такие как одиночная направляющая РНК) согласно описанию в настоящем документе, и гетерологичный регуляторный (функциональный) домен (или его функциональный фрагмент). Распространенные домены включают, например, домены транскрипционных факторов (активаторов, репрессоров, коактиваторов, корепрессоров), сайленсеры, онкогены (например, представители семейства myc, jun, fos, myb, max, mad, rel, ets, bcl, myb, mos и т.п.); ферменты репарации ДНК и ассоциированные с ними факторы и модификаторы; ферменты перестройки ДНК и ассоциированные с ними факторы и модификаторы; ассоциированные с хроматином белки и их модификаторы (например, киназы, ацетилазы и деацетилазы); а также модифицирующие ДНК ферменты (например, метилтрансферазы, топоизомеразы, геликазы, лигазы, киназы, фосфатазы, полимеразы, эндонуклеазы) и ассоциированные с ними факторы и модификаторы. См. подробное описание гибридных ДНК-связывающих доменов и нуклеазных доменов расщепления в патентных публикациях США №20050064474; №20060188987 и №2007/0218528, включенных в настоящий документ полностью посредством ссылки.
[0124] Подходящие домены для обеспечения активации включают домен активации HSV VP16 (см., например, Hagmann et al., J. Virol. 71, 5952-5962 (1997)), ядерные рецепторы гормонов (см., например, Torchia et al., Curr. Opin. Cell. Biol. 10:373-383 (1998)); субъединицу p65 ядерного фактора каппа-B (Bitko & Barik, J. Virol. 72:5610-5618 (1998) и Doyle & Hunt, Neuroreport 8:2937-2942 (1997)); Liu et al., Cancer Gene Ther. 5:3-28 (1998)); или искусственные химерные функциональные домены, например, VP64 (Beerli et al., (1998) Proc. Natl. Acad. Sci. USA 95:14623-33); и дегрон (Molinari et al., (1999) EMBO J. 18, 6439-6447). Дополнительные примеры доменов активации включают Oct 1, Oct-2A, Sp1, AP-2 и CTF1 (Seipel et al., EMBO J. 11, 4961-4968 (1992), а также p300, CBP, PCAF, SRC1 PvALF, AtHD2A и ERF-2. См., например, Robyr et al. (2000) Mol. Endocrinol. 14:329-347; Collingwood et al. (1999) J. Mol. Endocrinol. 23:255-275; Leo et al. (2000) Gene 245:1-11; Manteuffel-Cymborowska (1999) Acta Biochim. Pol. 46:77-89; McKenna et al. (1999) J. Steroid Biochem. Mol. Biol. 69:3-12; Malik et al. (2000) Trends Biochem. Sci. 25:277-283; и Lemon et al. (1999) Curr. Opin. Genet. Dev. 9:499-504. Дополнительные примеры доменов активации включают, не ограничиваясь перечисленными, OsGAI, HALF-1, C1, AP1, ARF-5, -6, -7 и -8, CPRF1, CPRF4, MYC-RP/GP и TRAB1. См., например, Ogawa et al. (2000) Gene 245:21-29; Okanami et al. (1996) Genes Cells 1:87-99; Goff et al. (1991) Genes Dev. 5:298-309; Cho et al. (1999) Plant Mol. Biol. 40:419-429; Ulmason et al. (1999) Proc. Natl. Acad. Sci. USA 96:5844-5849; Sprenger-Haussels et al. (2000) Plant J. 22:1-8; Gong et al. (1999) Plant Mol. Biol. 41:33-44; и Hobo et al. (1999) Proc. Natl. Acad. Sci. USA 96:15,348-15,353.
[0125] Специалистам в данной области техники будет ясно, что при образовании гибридного белка (или кодирующей его нуклеиновой кислоты) между ДНК-связывающим доменом и функциональным доменом для применения в качестве функционального домена подходит либо домен активации, либо молекула, которая взаимодействует с доменом активации. По существу любая молекула, способная к рекрутингу активирующего комплекса и/или активирующей активности (такой как, например, ацетилирование гистонов) в отношении целевого гена, подходит для применения в качестве активирующего домена гибридного белка. Инсуляторные домены, домены локализации, и белки ремоделирования хроматина, такие как ISWI-содержащие домены, и/или содержащие метил-связывающие домены белки, подходящие для применения в качестве функциональных доменов в гибридных молекулах, описаны, например, в патентных публикациях США 2002/0115215 и 2003/0082552, а также в WO 02/44376.
[0126] Примеры репрессорных доменов включают, не ограничиваясь перечисленными, KRAB A/B, KOX, индуцируемый ТФР-бета ранний ген (TIEG), v-erbA, SID, MBD2, MBD3, представители семейства DNMT (например, DNMT1, DNMT3A, DNMT3B), Rb и MeCP2. См., например, Bird et al. (1999) Cell 99:451-454; Tyler et al. (1999) Cell 99:443-446; Knoepfler et al. (1999) Cell 99:447-450; и Robertson et al. (2000) Nature Genet. 25:338-342. Дополнительные примеры репрессорных доменов включают, не ограничиваясь перечисленными, ROM2 и AtHD2A. См., например, Chem et al. (1996) Plant Cell 8:305-321; и Wu et al. (2000) Plant J. 22:19-27.
[0127] Гибридные молекулы конструируют с применением способов клонирования и биохимической конъюгации, хорошо известных специалистам в данной области техники. Гибридные молекулы содержат ДНК-связывающий домен и функциональный домен (например, домен активации или репрессии транскрипции). Гибридные молекулы также необязательно содержат сигналы ядерной локализации (такие как, например, сигналы среднего T-антигена SV40) и эпитопные метки (такие как, например, FLAG и гемагглютинин). Гибридные белки (и кодирующие их нуклеиновые кислоты) получают путем дизайна таким образом, чтобы у всех гибридных компонентов сохранялась трансляционная рамка считывания.
[0128] Продукты слияния полипептидного компонента функционального домена (или его функциональным фрагментом) с одной стороны, и небелкового ДНК-связывающего домена (например, антибиотика, интеркалятора, связывающегося с малой бороздкой компонента, нуклеиновой кислоты) с другой стороны конструируют с применением способов биохимической конъюгации, известных специалистам в данной области техники. См., например, каталог Pierce Chemical Company (Рокфорд, Иллинойс). Были описаны способы и композиции для получения гибридизованого с полипептидом связывающегося с малой бороздкой компонента. Mapp et al. (2000) Proc. Natl. Acad. Sci. USA 97:3930-3935. Кроме того, одиночная направляющая РНК системы CRISPR/Cas связывается с функциональными доменами с образованием активных регуляторов транскрипции и нуклеаз.
[0129] Согласно некоторым вариантам реализации целевой сайт находится в доступной области клеточного хроматина. Доступные области могут быть определены согласно описанию, например, в патентах США №7,217,509 и №7,923,542. В тех случаях, когда целевой сайт не находится в доступной области клеточного хроматина, одна или более доступных областей могут быть получены согласно описанию в патентах США №7,785,792 и №8,071,370. Согласно дополнительным вариантам реализации ДНК-связывающий домен гибридной молекулы способен к связыванию с клеточным хроматином независимо от того, находится его целевой сайт в доступной области или нет. Например, такие ДНК-связывающие домены способны к связыванию с линкерной ДНК и/или нуклеосомной ДНК. Примеры указанного типа «пионерных» ДНК-связывающих доменов можно найти в определенных стероидных рецепторах и в ядерном факторе 3 гепатоцитов (HNF3) (Cordingley et al. (1987) Cell 48:261-270; Pina et al. (1990) Cell 60:719-731; и Cirillo et al. (1998) EMBO J. 17:244-254).
[0130] Гибридная молекула может быть введена в состав вместе с фармацевтически приемлемым носителем, как известно специалистам в данной области техники. См., например, Remington’s Pharmaceutical Sciences, 17th ed., 1985; и патенты США №6,453,242 и №6,534,261.
[0131] Функциональный компонент/домен гибридной молекулы может быть выбран из любых из множества разных компонентов, способных оказывать влияние на транскрипцию гена после того, как гибридная молекула связалась с целевой последовательностью посредством ее ДНК-связывающего домена. Таким образом, указанный функциональный компонент может включать, не ограничиваясь перечисленными, домены различных транскрипционных факторов, таких как активаторы, репрессоры, коактиваторы, корепрессоры и сайленсеры.
[0132] Дополнительные примеры функциональных доменов описаны, например, в патентах США №6,534,261 и №6,933,113.
[0133] Могут также быть выбраны функциональные домены, регулируемые экзогенными малыми молекулами или лигандами. Например, может применяться технология RheoSwitch®, согласно которой функциональный домен переходит в активную конформацию только в присутствии внешнего лиганда RheoChem™ (см., например, US 20090136465). Соответственно, ZFP может быть функционально связана с поддающимся регуляции функциональным доменом, при этом итоговая активность ZFP-ТФ контролирует внешний лиганд.
Нуклеазы
[0134] Согласно некоторым вариантам реализации гибридный белок содержит ДНК-связывающий домен и домен расщепления (нуклеазный домен). Соответственно, модификация гена может быть достигнута с применением нуклеазы, например, сконструированной нуклеазы. Технология сконструированных нуклеаз основана на конструировании встречающихся в природе ДНК-связывающих белков. Например, было описано конструирование хоуминг-эндонуклеаз с индивидуализированной ДНК-связывающей специфичностью. Chames et al. (2005) Nucleic Acids Res 33(20):e178; Arnould et al. (2006) J. Mol. Biol. 355:443-458. Кроме того, также было описано конструирование ZFP. См., например, патенты США №6,534,261; №6607882; №6824978; №6979539; №6933113; №7163824; и №7013219.
[0135] Кроме того, ZFP и/или TALE сливали с нуклеазными доменами для получения ZFN и TALEN - функционального объекта, способного распознавать предусмотренную целевую нуклеиновую кислоту за счет сконструированного ДНК-связывающего домена (ZFP или TALE) и приводить к разрезанию ДНК возле сайта связывания ДНК за счет нуклеазной активности. См., например, Kim et al. (1996) Proc Nat'l Acad Sci USA 93(3):1156-1160. В последнее время такие нуклеазы применяли для модификации генома в различных организмах. См., например, патентные публикации США 20030232410; 20050208489; 20050026157; 20050064474; 20060188987; 20060063231; и международную публикацию WO 07/014275.
[0136] Соответственно, описанные в настоящем документе способы и композиции широко применимы и могут задействовать любую представляющую интерес нуклеазу. Неограничивающие примеры нуклеаз включают мегануклеазы, TALEN и нуклеазы с цинковыми пальцами. Указанная нуклеаза может содержать гетерологичные ДНК-связывающий домен и домен расщепления (например, нуклеазы с цинковыми пальцами; ДНК-связывающие домены мегануклеазы с гетерологичными доменами расщепления); или, как вариант, ДНК-связывающий домен встречающейся в природе нуклеазы может быть изменен таким образом, чтобы связываться с выбранным целевым сайтом (например, мегануклеаза, сконструированная таким образом, чтобы связываться с сайтом, отличным от когнатного сайта связывания).
[0137] Любая из описанных в настоящем документе нуклеаз может содержать сконструированный ДНК-связывающий домен TALE и нуклеазный домен (например, домен эндонуклеазы и/или мегануклеазы), также называемые TALEN. Способы и композиции для конструирование указанных белков TALEN для устойчивого сайт-специфического взаимодействия с выбранной пользователем целевой последовательностью были описаны в опубликованных источниках (см. патент США №8,586,526). Согласно некоторым вариантам реализации указанный TALEN содержит домен расщепления или полудомен расщепления эндонуклеазы (например, FokI). Согласно другим вариантам реализации указанная TALE-нуклеаза представляет собой мега-TAL. Указанные мега-TAL-нуклеазы представляют собой гибридные белки, содержащие ДНК-связывающий домен TALE и домен расщепления мегануклеазы. Указанный домен расщепления мегануклеазы активен в форме мономера, и для его активности не требуется димеризация. (См. Boissel et al., (2013) Nucl Acid Res: 1-13, doi: 10.1093/nar/gkt1224.) Кроме того, нуклеазный домен может также проявлять ДНК-связывающие функции.
[0138] Согласно другим дополнительным вариантам реализации нуклеаза содержит компактный TALEN (cTALEN). Это одноцепочечные гибридные белки, где ДНК-связывающий домен TALE соединен с нуклеазным доменом TevI. Указанный гибридный белок может функционировать либо в качестве никаз с локализацией, определяемой областью TALE, или может производить двуцепочечный разрыв, в зависимости от того, где локализован ДНК-связывающий домен TALE относительно нуклеазного домена TevI (см. Beurdeley et al (2013) Nat Comm: 1-8 DOI: 10.1038/ncomms2782). Любые TALEN могут применяться в комбинации с дополнительными TALEN (например, одним или более TALEN (cTALEN или FokI-TALEN) с одним или более мега-TAL) или другими расщепляющими ДНК ферментами.
[0139] Согласно некоторым вариантам реализации нуклеаза содержит мегануклеазу (хоуминг-эндонуклеазу) или ее часть, проявляющую расщепляющую активность. Встречающиеся в природе мегануклеазы распознают сайты расщепления длиной 15-40 пар оснований и их, как правило, группируют в четыре семейства: семейство LAGLIDADG, семейство GIY-YIG, семейство His-Cyst-бокс и семейство HNH. Примеры хоуминг-эндонуклеаз включают I-SceI, I-CeuI, PI-PspI, PI-Sce, I-SceIV, I-CsmI, I-PanI, I-SceII, I-PpoI, I-SceIII, I-CreI, I-TevI, I-TevII и I-TevIII. Известны последовательности их распознавания. См. также патент США №5,420,032; патент США №6,833,252; Belfort et al. (1997) Nucleic Acids Res. 25:3379-3388; Dujon et al. (1989) Gene 82:115-118; Perler et al. (1994) Nucleic Acids Res. 22, 1125-1127; Jasin (1996) Trends Genet. 12:224-228; Gimble et al. (1996) J. Mol. Biol. 263:163-180; Argast et al. (1998) J. Mol. Biol. 280:345-353 и каталог New England Biolabs.
[0140] ДНК-связывающие домены из встречающихся в природе мегануклеаз, в первую очередь из семейства LAGLIDADG, применялись для содействия сайт-специфической модификации генома у растений, дрожжей, Drosophila, в клетках млекопитающих и мышей, однако указанный подход был ограничен модификацией либо гомологичных генов, сохраняющих последовательность распознавания мегануклеазы (Monet et al. (1999), Biochem. Biophysics. Res. Common. 255: 88-93), либо заранее сконструированных геномов, в которые была введена последовательность распознавания (Route et al. (1994), Mol. Cell. Biol. 14: 8096-106; Chilton et al. (2003), Plant Physiology. 133: 956-65; Puchta et al. (1996), Proc. Natl. Acad. Sci. USA 93: 5055-60; Rong et al. (2002), Genes Dev. 16: 1568-81; Gouble et al. (2006), J. Gene Med. 8(5):616-622). Соответственно, были предприняты попытки сконструировать мегануклеазы, проявляющие новую специфичность связывания в релевантных с медицинской или биотехнологической точки зрения сайтах (Porteus et al. (2005), Nat. Biotechnol. 23: 967-73; Sussman et al. (2004), J. Mol. Biol. 342: 31-41; Epinat et al. (2003), Nucleic Acids Res. 31: 2952-62; Chevalier et al. (2002) Molec. Cell 10:895-905; Epinat et al. (2003) Nucleic Acids Res. 31:2952-2962; Ashworth et al. (2006) Nature 441:656-659; Paques et al. (2007) Current Gene Therapy 7:49-66; патентные публикации США №20070117128; №20060206949; №20060153826; №20060078552; и №20040002092). Кроме того, встречающиеся в природе или сконструированные ДНК-связывающие домены из мегануклеаз могут быть функционально связаны с доменом расщепления из гетерологичной нуклеазы (например, FokI), и/или домены расщепления из мегануклеаз могут быть функционально связаны с гетерологичным ДНК-связывающим доменом (например, ZFP или TALE).
[0141] Согласно другим вариантам реализации указанная нуклеаза представляет собой нуклеазу с цинковыми пальцами (ZFN) или ДНК-связывающий домен TALE, гибридизованый с нуклеазой (TALEN). ZFN и TALEN содержат ДНК-связывающий домен (белок с цинковыми пальцами или ДНК-связывающий домен TALE), сконструированный таким образом, чтобы связываться с целевым сайтом в выбранном гене и доменом расщепления или полудоменом расщепления (например, из рестрикционной нуклеазы и/или мегануклеазы согласно описанию в настоящем документе).
[0142] Согласно подробному описанию выше, связывающие домены с цинковыми пальцами и ДНК-связывающие домены TALE могут быть сконструированы таким образом, чтобы связываться с выбранной последовательностью. См., например, Beerli et al. (2002) Nature Biotechnol. 20:135-141; Pabo et al. (2001) Ann. Rev. Biochem. 70:313-340; Isalan et al. (2001) Nature Biotechnol. 19:656-660; Segal et al. (2001) Curr. Opin. Biotechnol. 12:632-637; Choo et al. (2000) Curr. Opin. Struct. Biol. 10:411-416. Сконструированный связывающий домен с цинковыми пальцами или белок TALE может обладать новой специфичностью связывания по сравнению с встречающимся в природе белком. Способы конструирования включают, не ограничиваясь перечисленными, рациональный дизайн и различные типы отбора. Рациональный дизайн включает, например, использование баз данных, содержащих триплеты (или квадруплеты) последовательностей нуклеотидов и индивидуальные последовательности аминокислот цинковых пальцев или TALE, где каждая триплетная или квадруплетная последовательность нуклеотидов ассоциирована с одной или более последовательностей аминокислот цинковых пальцев или единиц повторов TALE, связывающих конкретную триплетную или квадруплетную последовательность. См., например, патенты США №6,453,242 и №6,534,261, полностью включенные в настоящий документ посредством ссылки.
[0143] Выбор целевого сайта, а также способы дизайна и конструирования гибридных белков (и кодирующих их полинуклеотидов) известны специалистам в данной области техники и подробно описаны в патентах США №7,888,121 и №8,409,861, полностью включенных посредством ссылки в настоящий документ.
[0144] Кроме того, согласно описанию в указанном и других источниках, домены с цинковыми пальцами, TALE и/или белки с множеством цинковых пальцев могут быть соединены друг с другом с применением любых подходящих линкерных последовательностей, в том числе например, линкеров длиной 5 или более аминокислот (например, TGEKP (SEQ ID NO: 9), TGGQRP (SEQ ID NO: 10), TGQKP (SEQ ID NO: 11) и/или TGSQKP (SEQ ID NO: 12). См., например, примеры линкерных последовательностей длиной 6 или более аминокислот в патентах США №6,479,626; №6,903,185; и №7,153,949. Описанные в настоящем документе белки могут включать любую комбинацию подходящих линкеров между индивидуальными цинковыми пальцами указанного белка. См. также патент США №8,772,453.
[0145] Соответственно, нуклеазы, такие как ZFN, TALEN и/или мегануклеазы, могут содержать любой ДНК-связывающий домен и любой нуклеазный (расщепляющий) домен (домен расщепления, полудомен расщепления). Как отмечалось выше, домен расщепления может быть гетерологичным относительно ДНК-связывающего домена, например, может быть использован цинковый палец или ДНК-связывающий домен TAL-эффектора, и домен расщепления из нуклеазы, или ДНК-связывающий домен мегануклеазы и домен расщепления из другой нуклеазы. Гетерологичные домены расщепления могут быть получены из любой эндонуклеазы или экзонуклеазы. Примеры эндонуклеаз, из которых может происходить домен расщепления, включают, не ограничиваясь перечисленными, рестрикционные эндонуклеазы и хоуминг-эндонуклеазы. См., например, каталог 2002-2003 гг. New England Biolabs, Беверли, Массачусетс; и Belfort et al. (1997) Nucleic Acids Res. 25:3379-3388. Известны дополнительные ферменты, который расщепляют ДНК (например, нуклеаза S1; нуклеаза бобов мунг; панкреатическая ДНКаза I; нуклеаза микрококков; дрожжевая эндонуклеаза HO; см. также Linn et al. (eds.) Nucleases, Cold Spring Harbor Laboratory Press,1993). Один или более из указанных ферментов (или их функциональных фрагментов) могут применяться в качестве источника доменов расщепления и полудоменов расщепления.
[0146] Аналогичным образом, полудомен расщепления может происходить из любой нуклеазы или ее части, согласно описанию выше, для расщепляющей активности которой требуется димеризация. В целом, два гибридных белка необходимы для расщепления, если указанные гибридные белки содержат полудомены расщепления. Как вариант, может быть использован один белок, содержащий два полудомена расщепления. Указанные два полудомена расщепления могут происходить из одной и той же эндонуклеазы (или ее функциональных фрагментов), или каждый полудомен расщепления может происходить из другой эндонуклеазы (или ее функциональных фрагментов). Кроме того, целевые сайты двух гибридных белков предпочтительно распределены относительно друг друга таким образом, что связывание указанных двух гибридных белков с соответствующими целевыми сайтами приводит к пространственной ориентации полудоменов расщепления друг относительно друга, позволяющей указанным полудоменам расщепления образовывать функциональный домен расщепления, например, путем димеризации. Соответственно, согласно некоторым вариантам реализации ближние края целевых сайтов разделены 5-10 нуклеотидами или 15-18 нуклеотидами. Однако между двумя целевыми сайтами может располагаться любое целое число нуклеотидов или пар нуклеотидов (например, от 2 до 50 пар нуклеотидов или более). В целом, сайт расщепления располагается между целевыми сайтами.
[0147] Рестрикционные эндонуклеазы (рестрикционные ферменты) присутствуют у многих видов и способны к специфическому в отношении последовательности связыванию с ДНК (в сайте распознавания) и расщеплению ДНК в сайте или возле сайта связывания. Определенные рестрикционные ферменты (например, типа IIS) расщепляют ДНК в сайтах, удаленных от сайта распознавания, и содержат разделяемые домены связывания и расщепления. Например, фермент Fok I типа IIS катализирует двухцепочечное расщепление ДНК, на расстоянии 9 нуклеотидов от сайта распознавания на одной цепи и 13 нуклеотидов от сайта распознавания на другой цепи. См., например, патенты США 5,356,802; 5,436,150 и 5,487,994; а также Li et al. (1992) Proc. Natl. Acad. Sci. USA 89:4275-4279; Li et al. (1993) Proc. Natl. Acad. Sci. USA 90:2764-2768; Kim et al. (1994a) Proc. Natl. Acad. Sci. USA 91:883-887; Kim et al. (1994b) J. Biol. Chem. 269:31,978-31,982. Соответственно, согласно одному варианту реализации гибридные белки содержат домен расщепления (или полудомен расщепления) по меньшей мере из одного рестрикционного фермента типа IIS, и один или более связывающих доменов с цинковыми пальцами, которые могут быть сконструированными или нет.
[0148] Примером рестрикционного фермента типа IIS, домен расщепления которого может быть отделен от связывающего домена, является Fok I. Указанный конкретный фермент активен в форме димера. Bitinaite et al. (1998) Proc. Natl. Acad. Sci. USA 95: 10,570-10,575. Соответственно, для целей настоящего изобретения часть фермента Fok I, используемую в описанных гибридных белках, считают полудоменом расщепления. Соответственно, для нацеленного двухцепочечного расщепления (расщепления двух цепей) и/или нацеленной замены клеточных последовательностей с применением гибридных c цинковыми пальцами Fok I могут быть использованы два гибридных белка, каждый из которых содержит полудомен расщепления FokI, с восстановлением каталитически активного домена расщепления. Как вариант, может также применяться одна полипептидная молекула, содержащая связывающий домен с цинковыми пальцами и два полудомена расщепления Fok I. Параметры для нацеленного расщепления и нацеленного изменения последовательности с применением гибридизованых c цинковыми пальцами Fok I описаны в различных разделах настоящего документа.
[0149] Домен расщепления или полудомен расщепления может быть представлен любой частью белка, которая сохраняет расщепляющую активность или способность к мультимеризации (например, димеризуется) с образованием функционального домена расщепления.
[0150] Примеры рестрикционных ферментов типа IIS описаны в международной заявке WO 07/014275, полностью включенной в настоящий документ. Дополнительные рестрикционные ферменты также содержат разделяемые домены связывания и расщепления; указанные ферменты предусмотрены настоящим изобретением. См., например, Roberts et al. (2003) Nucleic Acids Res. 31:418-420.
[0151] Согласно некоторым вариантам реализации домен расщепления включает домен расщепления FokI, используемый для получения кристаллических структур 1FOK.pdb и 2FOK.pdb (см. Wah et al (1997) Nature 388:97-100), с последовательностью, приведенной ниже:
Полудомен расщепления FokI дикого типа (SEQ ID NO: 1)
QLVKSELEEKKSELRHKLKYVPHEYIELIEIARNSTQDRILEMKVMEFFMKVYGYRGKHLGGSRKPDGAIYTVGSPIDYGVIVDTKAYSGGYNLPIGQADEMQRYVEENQTRNKHINPNEWWKVYPSSVTEFKFLFVSGHFKGNYKAQLTRLNHITNCNGAVLSVEELLIGGEMIKAGTLTLEEVRRKFNNGEINF
[0152] Полудомены расщепления, происходящие из FokI, могут содержать мутацию в одном или более остатках аминокислот, как показано в последовательности SEQ ID NO: 1. Мутации включают замены (остатка аминокислоты молекулы дикого типа на другой остаток), инсерции (одного или более остатков аминокислот) и/или делеции (одного или более остатков аминокислот). Согласно некоторым вариантам реализации один или более остатков 414-426, 443-450, 467-488, 501-502 и/или 521-531 (при нумерации, соответствующей SEQ ID NO: 1 и последовательностям, представленным на Фиг. 17) мутированы, поскольку указанные остатки локализованы близко к остову ДНК в молекулярной модели ZFN, связанной с целевым сайтом, описанной в источнике: Miller et al. ((2007) Nat Biotechnol 25:778-784). Согласно некоторым вариантам реализации один или более остатков в положениях 416, 422, 447, 448 и/или 525 мутированы. Согласно некоторым вариантам реализации указанная мутация включает замену остатка молекулы дикого типа на любой другой остаток, например, остаток аланина (A), остаток цистеина (C), остаток аспарагиновой кислоты (D), остаток глутаминовой кислоты (E), остаток гистидина (H), остаток фенилаланина (F), остаток глицина (G), остаток аспарагина (N), остаток серина (S) или остаток треонина (T). Согласно другим вариантам реализации остатки молекулы дикого типа в одном или более из положений 416, 418, 422, 446, 448, 476, 479, 480, 481 и/или 525 заменены на любые другие остатки, в том числе, но не ограничиваясь перечисленными, R416D, R416E, S418E, S418D, R422H, S446D, K448A, N476D, I479Q, I479T, G480D, Q481A, Q481E, K525S, K525A, N527D, R416E+R422H, R416D+R422H, R416E+K448A, R416D+R422H, K448A+I479Q, K448A+Q481A, K448A+K525A.
[0153] Согласно некоторым вариантам реализации домен расщепления содержит один или более сконструированных полудоменов расщепления (также называемых мутантами доменов димеризации), которые минимизируют или предотвращают гомодимеризацию, согласно описанию, например, в патентах США №7,914,796; №8,034,598 и №8,623,618; и патентной публикации США №20110201055, содержание которых полностью включено посредством ссылки в настоящий документ. Остатки аминокислот в положениях 446, 447, 479, 483, 484, 486, 487, 490, 491, 496, 498, 499, 500, 531, 534, 537 и 538 Fok I (при нумерации, соответствующей SEQ ID NO: 1 и последовательностям, представленным на Фиг. 17) представляют собой мишени для воздействия на димеризацию полудоменов расщепления Fok I. Указанные мутации могут включать мутации остатков, обнаруживаемых в естественных рестрикционных ферментах, гомологичных FokI. Согласно предпочтительному варианту реализации мутация в положениях 416, 422, 447, 448 и/или 525 (при нумерации, соответствующей SEQ ID NO: 1 и последовательностей представленных на Фиг. 17) включает замену положительно заряженные аминокислоты на незаряженную или отрицательно заряженную аминокислоту. Согласно другому варианту реализации сконструированные полудомены расщепления содержат мутации в остатках аминокислот 499, 496 и 486 помимо мутаций в одном или более остатках аминокислот 416, 422, 447, 448 или 525; вся нумерация соответствует SEQ ID NO: 1 или последовательностям, представленным на Фиг. 17.
[0154] Согласно некоторым вариантам реализации композиции, описанные в настоящем документе, включают сконструированные полудомены расщепления Fok I, которые образуют облигатные гетеродимеры согласно описанию, например, в патентах США №7,914,796; №8,034,598; №8,961,281 и №8,623,618; и патентных публикациях США №20080131962 и №20120040398. Соответственно, согласно одному предпочтительному варианту реализации настоящего изобретения предложены гибридные белки, в которых сконструированный полудомен расщепления содержит полипептид, в котором остаток Gln (Q), присутствующий в положении 486 молекулы дикого типа, заменен на остаток Glu (E), остаток Ile (I), присутствующий в положении 499 молекулы дикого типа, заменен на остаток Leu (L); и остаток Asn (N), присутствующий в положении 496 молекулы дикого типа, заменен на остаток Asp (D) или Glu (E) («ELD» или «ELE»), помимо одной или более мутаций в положениях 416, 422, 447, 448 или 525 (при нумерации, соответствующей SEQ ID NO: 1 и последовательностям, представленным на Фиг. 17). Согласно другому варианту реализации сконструированные полудомены расщепления происходят из полудомена расщепления FokI дикого типа и содержат мутации в остатках аминокислот 490, 538 и 537, при нумерации, соответствующей FokI дикого типа (SEQ ID NO: 1 и последовательности, представленные на Фиг. 17), помимо одной или более мутаций остатков аминокислот 416, 422, 447, 448 или 525. Согласно предпочтительному варианту реализации настоящего изобретения предложен гибридный белок, в котором сконструированный полудомен расщепления содержит полипептид, в котором остаток Glu (E), присутствующий в положении 490 молекулы дикого типа, заменен на остаток Lys (K), остаток Ile (I), присутствующий в положении 538 молекулы дикого типа, заменен на остаток Lys (K), а остаток His (H), присутствующий в положении 537 молекулы дикого типа, заменен на остаток Lys (K) или остаток Arg (R) («KKK» или «KKR») (см. US8962281, включенный в настоящий документ посредством ссылки), помимо одной или более мутаций в положениях 416, 422, 447, 448 или 525. См., например, патенты США №7,914,796; №8,034,598 и №8,623,618, содержание которых включено посредством ссылки полностью для любых целей. Согласно другим вариантам реализации сконструированные полудомены расщепления содержат «Sharkey» и/или мутации «Sharkey» (см. Guo et al, (2010) J. Mol. Biol. 400(1):96-107).
[0155] Согласно другому варианту реализации сконструированные полудомены расщепления происходят из полудомена расщепления FokI дикого типа и содержат мутации в остатках аминокислот 490 и 538, при нумерации, соответствующей FokI дикого типа или гомологу FokI, помимо одной или более мутаций остатков аминокислот 416, 422, 447, 448 или 525. Согласно предпочтительному варианту реализации настоящего изобретения предложен гибридный белок, отличающийся тем, что сконструированный полудомен расщепления содержит полипептид, в котором остаток Glu (E), присутствующий в положении 490 молекулы дикого типа, заменен на остаток Lys (K), и остаток Ile (I), присутствующий в положении 538 молекулы дикого типа, заменен на остаток Lys (K) («KK»), помимо одной или более мутаций в положениях 416, 422, 447, 448 или 525. Согласно предпочтительному варианту реализации настоящего изобретения предложен гибридный белок, в котором сконструированный полудомен расщепления содержит полипептид, в котором остаток Gln (Q), присутствующий в положении 486 молекулы дикого типа, заменен на остаток Glu (E), и остаток Ile (I), присутствующий в положении 499 молекулы дикого типа, заменен на остаток Leu (L) («EL») (см. US8034598, включенный в настоящий документ посредством ссылки), помимо одной или более мутаций в положениях 416, 422, 447, 448 или 525.
[0156] Согласно одному аспекту настоящего изобретения предложен гибридный белок, в котором сконструированный полудомен расщепления содержит полипептид, в котором мутирован остаток аминокислоты молекулы дикого типа в одном или более из положений 387, 393, 394, 398, 400, 402, 416, 422, 427, 434, 439, 441, 447, 448, 469, 487, 495, 497, 506, 516, 525, 529, 534, 559, 569, 570, 571 в каталитическом домене FokI. Предложены нуклеазные домены, содержащие одну или более мутаций, представленных в любых из прилагаемых таблиц и чертежей. Согласно некоторым вариантам реализации указанная одна или более мутаций изменяют аминокислоту молекулы дикого типа с заменой положительно заряженного остатка на нейтральный остаток или отрицательно заряженный остаток. Согласно любому из указанных вариантов реализации описанные мутанты могут также быть внесены в домен FokI, содержащий одну или более дополнительные мутаций. Согласно предпочтительным вариантам реализации указанные дополнительные мутации находятся в домене димеризации, например, в положениях 418, 432, 441, 481, 483, 486, 487, 490, 496, 499, 523, 527, 537, 538 и/или 559. Неограничивающие примеры мутаций включают мутации (например, замены) остатков молекулы дикого типа любого домена расщепления (например, FokI или гомолога FokI) в положениях 393, 394, 398, 416, 421, 422, 442, 444, 472, 473, 478, 480, 525 или 530 с заменой на любой остаток аминокислоты (например, K393X, K394X, R398X, R416S, D421X, R422X, K444X, S472X, G473X, S472, P478X, G480X, K525X и A530X, где первый остаток соответствует молекуле дикого типа, а X относится к любой аминокислоте, которой заменяют остаток молекулы дикого типа). Согласно некоторым вариантам реализации X представляет собой E, D, H, A, K, S, T, D или N. Другие примеры мутаций включают S418E, S418D, S446D, K448A, I479Q, I479T, Q481A, Q481N, Q481E, A530E и/или A530K, где нумерация остатков аминокислот соответствует полноразмерному домену расщепления FokI дикого типа и его гомологам (Фиг. 17). Согласно некоторым вариантам реализации комбинации могут включать 416 и 422, мутацию в положении 416 и K448A, K448A и I479Q, K448A и Q481A; и/или K448A и мутацию в положении 525. Согласно одному варианту реализации остаток, присутствующий в положении 416 молекулы дикого типа, может быть заменен на остаток Glu (E) (R416E), остаток, присутствующий в положении 422 молекулы дикого типа, заменен на остаток His (H) (R422H), и остаток, присутствующий в положении 525 молекулы дикого типа, заменен на остаток Ala (A). Домены расщепления согласно описанию в настоящем документе могут также включать дополнительные мутации, в том числе, но не ограничиваясь перечисленными, мутации в положениях 432, 441, 483, 486, 487, 490, 496, 499, 527, 537, 538 и/или 559, например мутанты домена димеризации (например, ELD, KKR) и/или никазные мутанты (мутации каталитического домена). Полудомены расщепления с мутациями согласно описанию в настоящем документе образуют гетеродимеры, как известно в данной области техники.
[0157] Как вариант, нуклеазы могут быть собраны in vivo в целевом сайте нуклеиновой кислоты с применением так называемой технологии «разъединенных ферментов» (см., например, патентную публикацию США №20090068164). Компоненты таких разъединенных ферментов могут быть экспрессированы либо на отдельных экспрессионных конструкциях, либо могут быть соединены в одной открытой рамке считывания, при этом индивидуальные компоненты разделены, например, саморасщепляющимся пептидом 2A или последовательностью IRES. Компоненты могут представлять собой индивидуальные связывающие домены с цинковыми пальцами или домены связывающего нуклеиновую кислоту домена мегануклеазы.
[0158] Перед применением может быть проведен скрининг активности нуклеаз (например, ZFN и/или TALEN), например, в дрожжевой хромосомной системе согласно описанию в патенте США №8,563,314.
[0159] Согласно некоторым вариантам реализации указанная нуклеаза содержит систему CRISPR/Cas. Локус CRISPR («clustered regularly interspaced short palindromic repeats», кластеризованные регулярно распределенные короткие палиндромные повторы), который кодирует РНК-компоненты системы, и локус Cas («CRISPR-ассоциированный»), который кодирует белки (Jansen et al., 2002. Mol. Microbiol. 43: 1565-1575; Makarova et al., 2002. Nucleic Acids Res. 30: 482-496; Makarova et al., 2006. Biol. Direct 1: 7; Haft et al., 2005. PLoS Comput. Biol. 1: e60) составляют генные последовательности системы CRISPR/ нуклеазы Cas. Локусы CRISPR у хозяев-микроорганизмов содержат комбинацию CRISPR-ассоциированных (Cas) генов, а также некодирующие РНК-элементы, способные к программированию специфичности опосредованного CRISPR расщепления нуклеиновых кислот.
[0160] CRISPR II типа представляет собой одну из наиболее хорошо охарактеризованных систем; она осуществляет нацеленный двухцепочечный разрыв ДНК в ходе четырех последовательных этапов. Сначала из локуса CRISPR транскрибируют две некодирующих РНК, массив пре-cr-РНК и tracr-РНК. На втором этапе tracr-РНК гибридизуется с областями повторов пре-cr-РНК и опосредует процессинг пре-cr-РНК в зрелые cr-РНК, содержащие индивидуальные спейсерные последовательности. На третьем этапе зрелый комплекс cr-РНК:tracr-РНК направляет Cas9 к целевой ДНК за счет спаривания оснований по Уотсону-Крику между спейсером на cr-РНК и протоспейсером на целевой ДНК рядом с мотивом, смежным с протоспейсером (PAM) - дополнительное требование для распознавания мишени. Наконец, Cas9 опосредует расщепление целевой ДНК с получением двуцепочечного разрыва в пределах протоспейсера. Активность системы CRISPR/Cas состоит из трех этапов: (i) встраивание чужеродных ДНК последовательностей в массив CRISPR для предотвращения будущих атак в ходе процесса, называемого «адаптацией», (ii) экспрессия релевантных белков, а также экспрессия и процессинг указанного массива с последующей (iii) РНК-опосредованной интерференцией с чужеродной нуклеиновой кислотой. Соответственно, в бактериальной клетке ряд так называемых белков «Cas» вовлечен в естественную функцию системы CRISPR/Cas и играют роль в таких функциях, как встраивание чужеродной ДНК и т.п.
[0161] Согласно некоторым вариантам реализации используют систему CRISPR-Cpf1. Система CRISPR-Cpf1, идентифицированная у Francisella spp, представляет собой систему CRISPR-Cas класса 2, которая опосредует устойчивую интерференцию с ДНК в клетках человека. Хотя Cpf1 и Cas9 функционально консервативны, они различаются во многих аспектах, в том числе направляющими РНК и субстратной специфичностью (см. Fagerlund et al, (2015) Genom Bio 16:251). Основное различие между белками Cas9 и Cpf1 заключается в том, что Cpf1 не задействует tracr-РНК и, соответственно, требуется только cr-РНК. Длина cr-РНК FnCpf1 составляет 42-44 нуклеотидов (19-нуклеотидный повтор и 23-25-нуклеотидный спейсер) и они содержат одну «петлю-на-стебле», которая позволяет вносить в последовательность изменения с сохранением вторичной структуры. Кроме того, cr-РНК Cpf1 значимо короче, чем сконструированные онРНК размером ~100-нуклеотидов, которые требуются для Cas9, а требования к PAM для FnCpfl представлены 5'-TTN-3'и 5'-CTA-3' на замещаемой цепи. Хотя и Cas9, и Cpf1 создают двуцепочечные разрывы в целевой ДНК, Cas9 использует RuvC- и HNH-подобные домены для создания разрезов с тупыми концами в пределах затравочной последовательности направляющей РНК, тогда как Cpf1 использует RuvC-подобный домен для получения ступенчатых разрезов вне затравочной последовательности. Поскольку Cpf1 производит ступенчатые разрезы за пределами критической затравочной области, NHEJ не разрушает целевой сайт, таким образом, Cpf1 может продолжать производить разрезы в том же сайте до тех пор, пока не произойдет требуемая рекомбинация HDR. Соответственно, следует понимать, что в способах и композициях, описанных в настоящем документе, термин «Cas» включает и белки Cas9, и белки Cfp1. Соответственно, в настоящем документе «система CRISPR/Cas» относится как к CRISPR/Cas, так и/или к системам CRISPR/Cfp1, включающим системы как нуклеаз, так и/или транскрипционных факторов.
[0162] Согласно некоторым вариантам реализации белок Cas может представлять собой «функциональное производное» встречающегося в природе белка Cas. «Функциональное производное» природной последовательности полипептида представляет собой соединение, обладающее характеристическим биологическим свойством, общим с природной последовательностью полипептида. «Функциональные производные» включают, не ограничиваясь перечисленными, фрагменты природной последовательности и производные природной последовательности полипептида и его фрагментов, при условии, что они обладают биологической активностью, общей с соответствующей природной последовательностью полипептида. Предусмотренная настоящим изобретением биологическая активность представлена способностью функционального производного гидролизовать ДНК-субстрат с образованием фрагментов. Термин «производное» охватывает и варианты последовательности аминокислот полипептида, и ковалентные модификации, и гибридные продукты, такие как производные белки Cas. Подходящие производные полипептида Cas или его фрагмента включают, не ограничиваясь перечисленными, мутанты, гибридные продукты, ковалентные модификации белка Cas или его фрагмента. Белок Cas, который включает белок Cas или его фрагмент, а также производные белка Cas или его фрагмента, может быть получен из клетки или синтезирован химически, или получен с применением комбинации указанных двух процедур. Указанная клетка может представлять собой клетку, которая естественным образом продуцирует белок Cas, или клетку, которая естественным образом продуцирует белок Cas и генетически сконструирована для продуцирования эндогенного белка Cas с более высоким уровнем экспрессии, или для продуцирования белка Cas с экзогенно введенной нуклеиновой кислотой, которая кодирует Cas, идентичный или отличный от эндогенного Cas. В некоторых случаях клетка естественным образом не продуцирует белок Cas и генетически сконструирована для продуцирования белка Cas. Согласно некоторым вариантам реализации указанный белок Cas представляет собой малый ортолог Cas9 для доставки с помощью вектора AAV (Ran et al (2015) Nature 510, p. 186).
[0163] Указанная нуклеаза или нуклеазы могут производить один или более двуцепочечных и/или одноцепочечных разрезов в целевом сайте. Согласно некоторым вариантам реализации указанная нуклеаза содержит каталитически неактивный домен расщепления (например, FokI и/или белка Cas). См., например, патент США №9,200,266; №8,703,489 и Guillinger et al. (2014) Nature Biotech. 32(6):577-582. Каталитически неактивный домен расщепления может, в комбинации с каталитически активным доменом, действовать как никаза, производя одноцепочечный разрез. Соответственно, две никазы могут применяться в комбинации для получения двуцепочечного разреза в специфической области. Дополнительные никазы также известны в данной области техники, например, источник: McCaffery et al. (2016) Nucleic Acids Res. 44(2):e11. doi: 10,1093/nar/gkv878. Epub 2015 Oct 19.
Доставка
[0164] Белки (например, нуклеазы), полинуклеотиды и/или композиции, содержащие белки и/или полинуклеотиды согласно описанию в настоящем документе, могут быть доставлены в целевую клетку любыми подходящими способами, в том числе, например, путем инъекции указанных белковых и/или мРНК-компонентов.
[0165] Подходящие клетки включают, не ограничиваясь перечисленными, эукариотические и прокариотические клетки и/или линии клеток. Неограничивающие примеры таких клеток или линий клеток, полученных из таких клеток, включают T-клетки, клетки COS, CHO (например, CHO-S, CHO-K1, CHO-DG44, CHO-DUXB11, CHO-DUKX, CHOK1SV), VERO, MDCK, WI38, V79, B14AF28-G3, BHK, HaK, NS0, SP2/0-Ag14, HeLa, HEK293 (например, HEK293-F, HEK293-H, HEK293-T) и perC6, а также клетки насекомых, таких как Spodoptera fugiperda (Sf), или клетки грибов, таких как Saccharomyces, Pichia и Schizosaccharomyces. Согласно некоторым вариантам реализации указанная линия клеток представляет собой линию клеток CHO-K1, MDCK или HEK293. Подходящие клетки также включают стволовые клетки, такие как, например, эмбриональные стволовые клетки, индуцированные плюрипотентные стволовые клетки (клетки иПСК), гематопоэтические стволовые клетки, нервные стволовые клетки и мезенхимальные стволовые клетки.
[0166] Способы доставки белков, содержащих ДНК-связывающие домены согласно описанию в настоящем документе, описаны, например, в патентах США №6,453,242; №6,503,717; №6,534,261; №6,599,692; №6,607,882; №6,689,558; №6,824,978; №6,933,113; №6,979,539; №7,013,219; и №7,163,824; содержание всех перечисленных патентов полностью включено посредством ссылки в настоящий документ.
[0167] ДНК-связывающие домены и гибридные белки, содержащие указанные ДНК-связывающие домены согласно описанию в настоящем документе, могут также быть доставлены с применением векторов, содержащих последовательности, кодирующие один или более ДНК-связывающих белков. Кроме того, с помощью указанных векторов также могут быть доставлены дополнительные нуклеиновые кислоты (например, донорные). Могут применяться любые векторные системы, в том числе, но не ограничиваясь перечисленными, плазмидные векторы, ретровирусные векторы, лентивирусные векторы, аденовирусные векторы, поксвирусные векторы; герпесвирусные векторы, векторы на основе аденоассоциированного вируса; и т.п. См. также патенты США №6,534,261; №6,607,882; №6,824,978; №6,933,113; №6,979,539; №7,013,219; и №7,163,824, полностью включенные посредством ссылки в настоящий документ. Кроме того, понятно, что любые из указанных векторов могут, при необходимости, содержать одну или более кодирующих ДНК-связывающий белок последовательностей и/или дополнительных нуклеиновых кислот. Соответственно, при введении в клетку одного или более ДНК-связывающих белков согласно описанию в настоящем документе и, при необходимости, дополнительных ДНК, их может переносить один и тот же вектор или разные векторы. При использовании нескольких векторов каждый вектор может содержать последовательность, кодирующую один или несколько ДНК-связывающих белков и, при необходимости, дополнительных нуклеиновых кислот.
[0168] Для введения нуклеиновых кислот, кодирующих сконструированные ДНК-связывающие белки, в клетки (например, клетки млекопитающих) и целевые ткани и, при необходимости, для совместного введения дополнительных последовательностей нуклеотидов могут применяться стандартные вирусные или невирусные способы переноса генов. Такие способы могут также применяться для введения нуклеиновых кислот (например, кодирующих ДНК-связывающие белки и/или донорных НК) в клетки in vitro. Согласно некоторым вариантам реализации нуклеиновые кислоты вводят для применения в генной терапии in vivo или ex vivo. Невирусные векторные системы доставки включают ДНК-плазмиды, депротеинизированные нуклеиновые кислоты и комплексы нуклеиновых кислот с основой для доставки, такой как липосома или полоксамер. Вирусные векторные системы доставки включают ДНК- и РНК-вирусы, который содержат либо эписомные, либо интегрированные геномы после доставки в клетку. Обзорную информацию о процедурах генной терапии можно найти в источниках: Anderson, Science 256:808-813 (1992); Nabel & Felgner, TIBTECH 11:211-217 (1993); Mitani & Caskey, TIBTECH 11:162-166 (1993); Dillon, TIBTECH 11:167-175 (1993); Miller, Nature 357:455-460 (1992); Van Brunt, Biotechnology 6(10):1149-1154 (1988); Vigne, Restorative Neurology and Neuroscience 8:35-36 (1995); Kremer & Perricaudet, British Medical Bulletin 51(1):31-44 (1995); Haddada et al., в издании: Current Topics in Microbiology and Immunology, Doerfler and  (eds.) (1995); и Yu et al., Gene Therapy 1:13-26 (1994).
(eds.) (1995); и Yu et al., Gene Therapy 1:13-26 (1994).
[0169] Способы невирусной доставки нуклеиновых кислот включают электропорацию, липофекцию, микроинъекцию, биолистику, виросомы, липосомы, иммунолипосомы, поликатионы или конъюгаты липидов с нуклеиновыми кислотами, депротеинизированную ДНК, мРНК, искусственные вирионы и усиленное агентами поглощение ДНК. Для доставки нуклеиновых кислот может также применяться сонопорация с применением, например, системы Sonitron 2000 (Rich-Mar). Согласно предпочтительному варианту реализации одну или более нуклеиновых кислот доставляют в виде мРНК. Также предпочтительно применение кэпированных мРНК для увеличения эффективности трансляции и/или стабильности мРНК. В частности, предпочтительными являются аналоги кэпов без возможности включения в обратной ориентации (ARCA, «anti-reverse cap analog») или их варианты. См. патенты США №.7,074,596 и №8,153,773, включенные в настоящий документ посредством ссылки.
[0170] Дополнительные примеры систем доставки нуклеиновых кислот включают поставляемые Amaxa Biosystems (Кельн, Германия), Maxcyte, Inc. (Роквилл, Мэриленд), BTX Molecular Delivery Systems (Холлистон, Массачусетс) и Copernicus Therapeutics Inc, (см., например US6008336). Липофекция описана, например, в US 5049386, US 4946787; и US 4897355); в продаже имеются реагенты для липофекции (например, Трансфектам™, Липофектин™ и Липофектамин™ (Lipofectamine RNAiMAX). Катионные и нейтральные липиды, которые подходят для эффективной липофекции полинуклеотидами с распознаванием рецепторами, включают описанные Felgner (WO 91/17424, WO 91/16024). Может осуществляться доставка в клетки (введение ex vivo) или в целевые ткани (введение in vivo).
[0171] Получение комплексов липидов с нуклеиновой кислотой, в том числе нацеленных липосом, таких как иммунолипидные комплексы, хорошо известно специалисту в данной области техники (см., например, Crystal, Science 270:404-410 (1995); Blaese et al., Cancer Gene Ther. 2:291-297 (1995); Behr et al., Bioconjugate Chem. 5:382-389 (1994); Remy et al., Bioconjugate Chem. 5:647-654 (1994); Gao et al., Gene Therapy 2:710-722 (1995); Ahmad et al., Cancer Res. 52:4817-4820 (1992); патенты США №4,186,183, №4,217,344, №4,235,871, №4,261,975, №4,485,054, №4,501,728, №4,774,085, №4,837,028 и №4,946,787).
[0172] Дополнительные способы доставки включают упаковку доставляемых нуклеиновых кислот в основы для доставки EnGeneIC (EDV). Указанные EDV специфически доставляют в целевые ткани с применением биспецифических антител; одно «плечо» указанного антитела обладает специфичностью в отношении целевой ткани, а другое обладает специфичностью в отношении EDV. Указанное антитело транспортирует EDV на поверхность целевой клетки, после чего EDV попадает внутрь указанной клетки путем эндоцитоза. После попадания в клетку содержимое высвобождается (см. MacDiarmid et al (2009) Nature Biotechnology 27(7) p. 643).
[0173] Применение РНК или ДНК на основе вирусных систем доставки нуклеиновых кислот, кодирующих сконструированные ДНК-связывающие белки, и/или доноров (например, CAR или ACTR), при необходимости, обеспечивает преимущество, заключающееся в усовершенствованных процессах нацеливания вируса на специфические клетки в организме и транспортировки вирусной нагрузки в ядро. Вирусные векторы могут быть введены непосредственно пациентам (in vivo) или могут применяться для обработки клеток in vitro, после чего модифицированные клетки вводят пациентам (ex vivo). Стандартные системы доставки нуклеиновых кислот на основе вирусов включают, не ограничиваясь перечисленными, ретровирусные, лентивирусные, аденовирусные векторы, векторы для переноса генов на основе аденоассоциированного вируса, вируса осповакцины и простого герпеса. Интеграция в геном хозяина возможна с применением способов переноса генов на основе ретровирусов, лентивирусов и аденоассоциированного вируса, часто обеспечивающих долгосрочную экспрессию встроенного трансгена. Кроме того, наблюдалась высокая эффективность трансдукции в клетках и целевых тканях множества разных типов.
[0174] Тропизм ретровируса может быть изменен путем включения чужеродных белков оболочки, с расширением потенциальной популяции целевых клеток. Лентивирусные векторы представляют собой ретровирусные векторы, способные трансдуцировать или инфицировать неделящиеся клетки и, как правило, обеспечивающие получение высоких вирусных титров. Выбор ретровирусной системы переноса генов зависит от целевой ткани. Ретровирусные векторы состоят из цис-действующих длинных концевых повторов с пакующей емкостью до 6-10 Кб чужеродной последовательности. Минимальные цис-действующие LTR достаточны для репликации и упаковки векторов, которые затем используют для интеграции терапевтического гена в целевую клетку с обеспечением постоянной трансгенной экспрессии. Широко используемые ретровирусные векторы включают векторы на основе вируса лейкоза мышей (MuLV), вируса лейкоза гиббонов (GaLV), вируса иммунодефицита обезьян (SIV), вируса иммунодефицита человека (ВИЧ) и их комбинаций (см., например, Buchscher et al., J. Virol. 66:2731-2739 (1992); Johann et al., J. Virol. 66:1635-1640 (1992); Sommerfelt et al., Virol. 176:58-59 (1990); Wilson et al., J. Virol. 63:2374-2378 (1989); Miller et al., J. Virol. 65:2220-2224 (1991); PCT/US94/05700).
[0175] В вариантах применения, согласно которым предпочтительна транзиентная экспрессия, могут применяться системы на основе аденовирусов. Векторы на основе аденовирусов способны обеспечивать очень высокую эффективность трансдукции во многих типах клеток и не требуют деления клеток. При использовании таких векторов были получены высокие титры и высокие уровни экспрессии. Указанный вектор может быть получен в  количествах в относительно простой системе. Векторы на основе аденоассоциированного вируса («AAV») также применяют для трансдукции клеток целевыми нуклеиновыми кислотами, например, при получении нуклеиновых кислот и пептидов in vitro и при процедурах генной терапии in vivo и ex vivo (см., например, West et al., Virology 160:38-47 (1987); патент США №4,797,368; WO 93/24641; Kotin, Human Gene Therapy 5:793-801 (1994); Muzyczka, J. Clin. Invest. 94:1351 (1994). Конструирование рекомбинантных AAV-векторов описано в ряде публикаций, в том числе в патенте США №5,173,414; у Tratschin et al., Mol. Cell. Biol. 5:3251-3260 (1985); Tratschin, et al., Mol. Cell. Biol. 4:2072-2081 (1984); Hermonat & Muzyczka, PNAS USA 81:6466-6470 (1984); и Samulski et al., J. Virol. 63:03822-3828 (1989).
количествах в относительно простой системе. Векторы на основе аденоассоциированного вируса («AAV») также применяют для трансдукции клеток целевыми нуклеиновыми кислотами, например, при получении нуклеиновых кислот и пептидов in vitro и при процедурах генной терапии in vivo и ex vivo (см., например, West et al., Virology 160:38-47 (1987); патент США №4,797,368; WO 93/24641; Kotin, Human Gene Therapy 5:793-801 (1994); Muzyczka, J. Clin. Invest. 94:1351 (1994). Конструирование рекомбинантных AAV-векторов описано в ряде публикаций, в том числе в патенте США №5,173,414; у Tratschin et al., Mol. Cell. Biol. 5:3251-3260 (1985); Tratschin, et al., Mol. Cell. Biol. 4:2072-2081 (1984); Hermonat & Muzyczka, PNAS USA 81:6466-6470 (1984); и Samulski et al., J. Virol. 63:03822-3828 (1989).
[0176] В настоящее время в клинических испытаниях используют по меньшей мере шесть подходов для переноса генов на основе вирусных векторов, задействующих подходы, которые включают комплементацию дефектных векторов генами, встроенными в клетки хелперных линий для получения трансдуцирующего агента.
[0177] pLASN и MFG-S представляют собой примеры ретровирусных векторов, которые применялись в клинических испытаниях (Dunbar et al., Blood 85:3048-305 (1995); Kohn et al., Nat. Med. 1:1017-102 (1995); Malech et al., PNAS USA 94:22 12133-12138 (1997)). PA317/pLASN был первым терапевтическим вектором, использованным в испытаниях генной терапии. (Blaese et al., Science 270:475-480 (1995)). Эффективность трансдукции 50% или выше наблюдалась для упакованных векторов MFG-S. (Ellem et al., Immunol Immunother. 44(1):10-20 (1997); Dranoff et al., Hum. Gene Ther. 1:111-2 (1997).
[0178] Рекомбинантные векторы на основе аденоассоциированного вируса (rAAV) представляют собой многообещающую альтернативную систему доставки генов, основанную на дефектной непатогенном аденоассоциированном парвовирусе 2 типа. Все векторы происходят из плазмиды, в которой сохранены только инвертированные концевые повторы AAV длиной 145 пар оснований, фланкирующие несущую трансген экспрессионную кассету. Эффективный перенос генов и стабильная доставка трансгенов за счет интеграции в геномы трансдуцированных клеток являются ключевыми признаками указанной векторной системы. (Wagner et al., Lancet 351:9117 1702-3 (1998), Kearns et al., Gene Ther. 9:748-55 (1996)). Другие серотипы AAV, в том числе AAV1, AAV3, AAV4, AAV5, AAV6, AAV8, AAV8.2, AAV9 и AAVrh10 и псевдотипированные AAV, такие как AAV2/8, AAV2/5 и AAV2/6, могут также применяться в соответствии с настоящим изобретением.
[0179] Дефектные по репликации рекомбинантные аденовирусные векторы (Ad) могут быть получены с высокими титрами и легко инфицируют ряд разных типов клеток. Большинство аденовирусных векторов конструируют таким образом, что трансген заменяет гены Ad E1a, E1b и/или E3; затем дефектный по репликации вектор размножают в клетках 293 человека, которые обеспечивают функцию делетированного гена транс-активным образом. Ad-векторами можно трансдуцировать несколько типов тканей in vivo, в том числе неделящиеся дифференцированные клетки, например, присутствующие в печени, почках и мышцах. Стандартные Ad-векторы обладают значительной несущей способностью. Пример применения Ad-вектора в ходе клинического испытания включал терапию полинуклеотидами для противоопухолевой иммунизации путем внутримышечной инъекции (Sterman et al., Hum. Gene Ther. 7:1083-9 (1998)). Дополнительные примеры применения аденовирусных векторов для переноса генов в клинических испытаниях включают описанные в источниках: Rosenecker et al., Infection 24:1 5-10 (1996); Sterman et al., Hum. Gene Ther. 9:7 1083-1089 (1998); Welsh et al., Hum. Gene Ther. 2:205-18 (1995); Alvarez et al., Hum. Gene Ther. 5:597-613 (1997); Topf et al., Gene Ther. 5:507-513 (1998); Sterman et al., Hum. Gene Ther. 7:1083-1089 (1998).
[0180] Пакующие клетки используют для получения вирусных частиц, способных инфицировать клетку-хозяина. Такие клетки включают клетки 293, пакующие аденовирусы, и клетки ψ2 или клетки PA317, пакующие ретровирусы. Вирусные векторы для применения в генной терапии обычно получают в линии клеток-продуцентов, пакующих вектор с нуклеиновой кислотой в вирусную частицу. Указанные векторы, как правило, содержат минимальные вирусные последовательности, необходимые для упаковки и последующей интеграции в геном хозяина (в подходящих случаях); другие вирусные последовательности заменены экспрессионной кассетой, кодирующей белок, который нужно экспрессировать. Отсутствующие вирусные функции восполняются за счет транс-активности клетками линии пакующих клеток. Например, AAV-векторы, применяемые в генной терапии, как правило, содержат только последовательности инвертированных концевых повторов (ITR) из генома AAV, необходимые для упаковки и интеграции в геном хозяина. Вирусную ДНК пакуют клетки линии, содержащей хелперную плазмиду, кодирующую другие гены AAV, а именно, rep и cap, однако не содержащую последовательности ITR. Указанную линию клеток также инфицируют аденовирусом в качестве хелперного вируса. Хелперный вирус способствует репликации AAV-вектора и экспрессии генов AAV с хелперной плазмиды. Хелперная плазмида не пакуется в значимых количествах ввиду отсутствия последовательностей ITR. Заражение аденовирусом может быть снижено с помощью, например, термообработки, к которой аденовирус более чувствителен, чем AAV.
[0181] Во многих вариантах применения для генной терапии желательна доставка вектора для генной терапии с высокой степенью специфичности в конкретный тип ткани. Соответственно, вирусный вектор может быть модифицирован таким образом, чтобы обладать специфичностью в отношении определенного типа клеток, за счет экспрессии лиганда в виде белка, гибридизованого с белком вирусной оболочки на внешней поверхности вируса. Выбирают лиганд, обладающий аффинностью в отношении рецептора, который, как известно, присутствует на клетке представляющего интерес типа. Например, Han с соавторами (Han et al., Proc. Natl. Acad. Sci. USA 92:9747-9751 (1995)) сообщают, что вирус лейкоза мышей Молони может быть модифицирован для экспрессии херегулина человека, гибридизованого с gp70, и что указанный рекомбинантный вирус инфицирует определенные клетки рака молочной железы человека, экспрессирующие рецептор эпидермального фактора роста человека. Указанный принцип может быть распространен на другие пары вирус/целевая клетка, в которых целевая клетка экспрессирует рецептор, а вирус экспрессирует гибридный белок, содержащий лиганд рецептора на поверхности клетки. Например, может быть сконструирован нитчатый фаг для дисплея фрагментов антитела (например, FAB или Fv), обладающих специфической аффинностью связывания в отношении практически любого выбранного клеточного рецептора. Хотя описание выше относится в первую очередь к вирусным векторам, те же принципы могут применяться в отношении невирусных векторов. Могут быть сконструированы такие векторы, содержащие специфические последовательности для поглощения, способствующие поглощению специфическими целевыми клетками.
[0182] Способы доставки систем CRISPR/Cas могут включать способы, описанные выше. Например, в моделях на животных транскрибированная in vitro кодирующая Cas мРНК или рекомбинантный белок Cas могут быть инъецированы непосредственно в эмбрионы животных с редактируемым геномом на стадии одной клетки с применением стеклянных игл. Как правило, для экспрессии Cas и направляющих РНК в клетках in vitro клетки трансфицируют плазмидами, которые их кодируют, посредством липофекции или электропорации. Также может быть получен комплекс рекомбинантного белка Cas с транскрибированной in vitro направляющей РНК, при этом рибонуклеопротеин Cas и направляющей РНК поглощается представляющими интерес клетками (Kim et al (2014) Genome Res 24(6):1012). При терапевтическом применении Cas и направляющие РНК могут быть доставлены с помощью комбинации вирусных и невирусных методик. Например, мРНК, кодирующая Cas, может быть доставлена с помощью наночастиц, а направляющие РНК и любой требуемый трансген или матрицу для репарации доставляют с помощью AAV (Yin et al (2016) Nat Biotechnol 34(3) p. 328).
[0183] Геннотерапевтические векторы могут быть доставлены in vivo путем введения индивидуальному пациенту, как правило, путем системного введения (например, внутривенной, внутрибрюшинной, внутримышечной, субдермальной или интракраниальной инфузии) или местного применения согласно приведенному ниже описанию. Как вариант, векторы могут быть доставлены в клетки ex vivo, например, в клетки, эксплантированные из организма индивидуального пациента (например, лимфоциты, аспират костного мозга, биоптаты ткани), или универсальные донорные гематопоэтические стволовые клетки, с последующей реимплантацией клеток пациенту, обычно после отбора клеток, включивших указанный вектор.
[0184] Трансфекция клеток ex vivo для диагностики, исследований, трансплантации или для генной терапии (например, посредством реинфузии трансфицированных клеток в организм хозяина) хорошо известна специалистам в данной области техники. Согласно предпочтительному варианту реализации клетки выделяют из организма субъекта, трансфицируют нуклеиновой кислотой ДНК-связывающих белков (генной или кДНК), и повторно инфузируют в организм субъекта (например, пациента). Различные типы клеток, подходящие для трансфекции ex vivo, хорошо известных специалистам в данной области техники (см., например, обсуждение способов выделения и культивирования клеток, полученных от пациентов, в руководстве: Freshney et al., Culture of Animal Cells, A Manual of Basic Technique (3rd ed. 1994)) и в упоминаемых в настоящем документе источниках).
[0185] Согласно одному варианту реализации стволовые клетки используют в процедурах ex vivo для трансфекции клеток и генной терапии. Преимущество применения стволовых клеток заключается в том, что они могут дифференцировать в другие типы клеток in vitro, или могут быть введены млекопитающему (например, донору клеток), где приживутся в костном мозге. Известны способы дифференцировки CD34+ клеток in vitro в клинически важные типы иммунных клеток с применением цитокинов, таких как ГМ-КСФ, ИФН-γ и ФНО-α (см. Inaba et al., J. Exp. Med. 176:1693-1702 (1992)).
[0186] Стволовые клетки выделяют для трансдукции и дифференцировки с применением известных способов. Например, стволовые клетки выделяют из клеток костного мозга путем пэннинга клеток костного мозга с антителами, которые связывают нежелательные клетки, такие как CD4+ и CD8+ (T-клетки), CD45+ (пан-B клетки), GR-1 (гранулоциты) и Iad (дифференцированные антигенпрезентирующие клетки) (см. Inaba et al., J. Exp. Med. 176:1693-1702 (1992)).
[0187] Согласно некоторым вариантам реализации могут также применяться стволовые клетки, которые были модифицированы. Например, в качестве терапевтических композиций могут применяться нервные стволовые клетки, которым была придана устойчивость к апоптозу, и при это также содержащие ТФ ZFP согласно настоящему изобретению. Устойчивость к апоптозу может быть обеспечена, например, путем нокаута BAX и/или BAK с применением BAX- или BAK-специфических ZFN (см. патент США №8,597,912) в стволовых клетках, или разрушения каспазы, опять же, с применением, например, каспаза-6-специфических ZFN.
[0188] Векторы (например, ретровирусы, аденовирусы, липосомы и т.п.), содержащие терапевтические ДНК-связывающие белки (или нуклеиновые кислоты, кодирующие указанные белки) могут также быть введены непосредственно в организм для трансдукции клеток in vivo. Как вариант, может быть введена депротеинизированная ДНК. Введение осуществляют через любой маршрут, обычно используемый для приведения молекулы в максимальный контакт с кровью или тканевыми клетками, в том числе, но не ограничиваясь перечисленными, путем инфекции, инфузии, местного применения и электропорации. Подходящие способы введения таких нуклеиновых кислот доступны и хорошо известны специалистам в данной области техники; при этом, хотя для введения конкретной композиции может быть использован более чем один маршрут, часто какой-либо конкретный маршрут может обеспечивать более быструю и более эффективную реакцию по сравнению с другим маршрутом.
[0189] Способы введения ДНК в гематопоэтические стволовые клетки описаны, например, в патенте США №5,928,638. Векторы, подходящие для введения трансгенов в гематопоэтические стволовые клетки, например, CD34+ клетки, включают аденовирус типа 35.
[0190] Векторы, подходящие для введения трансгенов в иммунные клетки (например, T-клетки), включают неинтегрируемые лентивирусные векторы. См., например, Ory et al. (1996) Proc. Natl. Acad. Sci. USA 93:11382-11388; Dull et al. (1998) J. Virol. 72:8463-8471; Zuffery et al. (1998) J. Virol. 72:9873-9880; Follenzi et al. (2000) Nature Genetics 25:217-222.
[0191] Фармацевтически приемлемые носители определяют отчасти с учетом конкретной композиции для введения, а также конкретного способа, используемого для введения указанной композиции. Соответственно, доступен широкий спектр подходящих составов фармацевтических композиций согласно приведенному ниже описанию (см., например, Remington’s Pharmaceutical Sciences, 17th ed., 1989).
[0192] Как отмечалось выше, описанные способы и композиции подходят для применения в клетках любого типа, в том числе, но не ограничиваясь перечисленными, прокариотических клетках, клетках грибов, клетках архей, клетках растений, клетках насекомых, клетках животных, клетках позвоночных, клетках млекопитающих и клетках человека, в том числе T-клетках и стволовых клетках любого типа. Подходящие линии клеток для экспрессии белка известны специалистам в данной области техники и включают, не ограничиваясь перечисленными, COS, CHO (например, CHO-S, CHO-K1, CHO-DG44, CHO-DUXB11), VERO, MDCK, WI38, V79, B14AF28-G3, BHK, HaK, NS0, SP2/0-Ag14, HeLa, HEK293 (например, HEK293-F, HEK293-H, HEK293-T), perC6, клетки насекомых, таких как Spodoptera fugiperda (Sf), и клетки грибов, таких как Saccharomyces, Pichia и Schizosaccharomyces. Могут также применяться потомство, варианты и производные клеток указанных линий.
Варианты применения
[0193] Применение сконструированных нуклеаз для лечения и предотвращения заболевания предположительно будет представлять собой в ближайшие годы одну из областей наиболее значимого прогресса в медицине. Описанные в настоящем документе способы и композиции служат для увеличения специфичности указанных новых инструментов, позволяющей обеспечить, чтобы требуемый целевой сайт представлял собой первичное место расщепления. Для полной реализации потенциала всех вариантов применения указанной технологии in vitro, in vivo и ex vivo требуется минимизация или элиминация нецелевого расщепления.
[0194] Примеры генетических заболеваний включают, не ограничиваясь перечисленными, ахондроплазию, ахроматопсию, дефицит кислой мальтазы, дефицит аденозиндезаминазы (OMIM №102700), адренолейкодистрофию, синдром Экарди, дефицит альфа-1-антитрипсина, альфа-талассемию, синдром нечувствительности к андрогенам, синдром Аперта, аритмогенную дисплазию правого желудочка, дисплазию, атаксию-телеангиэктазию, синдром Барта, бета-талассемию, синдром синего пузырчатого невуса, болезнь Канавана, хронические гранулематозные заболевания (CGD), синдром кошачьего крика, кистозный фиброз, болезнь Деркума, эктодермальную дисплазию, анемию Фанкони, прогрессирующую оссифицирующую фибродисплазию, синдром ломкой X-хромосомы, галактоземию, болезнь Гоше, генерализованные ганглиозидозы (например, GM1), гемохроматоз, мутацию гемоглобина C в 6 кодоне бета-глобина (HbC), гемофилию, болезнь Гентингтона, синдром Гурлер, гипофосфатазию, синдром Клайнфельтера, болезнь Краббе, синдром Лангера-Гидиона, недостаточность адгезии лейкоцитов (LAD, OMIM №116920), лейкодистрофию, синдром удлиненного QT, синдром Марфана, синдром Мебиуса, мукополисахаридоз (MPS), синдром ногтей-надколенника, нефрогенный несахарный диабет, нейрофиброматоз, болезнь Ниманна-Пика, несовершенный остеогенез, фенилкетонурию (PKU), порфирию, синдром Прадера-Вилли, прогерию, синдром Протея, ретинобластому, синдром Ретта, синдром Рубинштейна-Тэйби, синдром Санфилиппо, тяжелый комбинированный иммунодефицит (ТКИД), синдром Швачмана, серповидноклеточную болезнь (серповидноклеточную анемию), синдром Смит-Магенис, синдром Стиклера, болезнь Тея-Сакса, синдром тромбоцитопении с отсутствием лучевой кости (TAR), синдром Тричера-Коллинза, трисомию, туберозный склероз, синдром Тернера, расстройство цикла мочевины, болезнь фон Гиппеля-Линдау, синдром Ваарденбурга, синдром Вильямса, болезнь Вильсона, синдром Вискотта-Олдрича, Х-сцепленный лимфопролиферативный синдром (XLP, OMIM №308240).
[0195] Дополнительные примеры заболеваний, лечение которых может проводиться путем нацеленного расщепления и/или гомологичной рекомбинации ДНК включают приобретенный иммунодефицит, лизосомные болезни накопления (например, болезнь Гоше, ганглиозидоз GM1, болезнь Фабри и болезнь Тея-Сакса), мукополисахаридоз (например, болезнь Хантера, болезнь Гурлер), гемоглобинопатии (например, серповидноклеточные анемии, HbC, α-талассемию, β-талассемию) и гемофилии.
[0196] Такие способы также позволяют проводить лечение инфекций (вирусных или бактериальных) у хозяина (например, путем блокирования экспрессии вирусных или бактериальных рецепторов, с предотвращением таким образом инфекции и/или распространения в организме хозяина) для лечения генетических заболеваний.
[0197] Для лечения вирусных инфекций у хозяина может применяться нацеленное расщепление геномов инфицирующих или интегрированных вирусов. Кроме того, для блокирования экспрессии таких рецепторов может применяться нацеленное расщепление генов, кодирующих рецепторы вирусов, с предотвращением таким образом вирусной инфекции и/или распространения вируса в организме-хозяина. Нацеленный мутагенез генов, кодирующих вирусные рецепторы (например, рецепторы ВИЧ CCR5 и CXCR4), может применяться для придания указанным рецепторам неспособности связываться с вирусом, с предотвращением таким образом новой инфекции и блокированием распространения существующей инфекции. См. патентную публикацию США №2008/015996. Неограничивающие примеры вирусов или вирусных рецепторов, которые могут быть целевыми, включают вирус простого герпеса (HSV), такой как HSV-1 и HSV-2, вирус ветряной оспы (VZV), вирус Эпштейна-Барра (EBV) и цитомегаловирус (CMV), HHV6 и HHV7. Семейство вирусов гепатита включает вирус гепатита A (HAV), вирус гепатита B (HBV), вирус гепатита C (HCV), вирус гепатита дельта (HDV), вирус гепатита E (HEV) и вирус гепатита G (HGV). Может быть осуществлено нацеливание на другие вирусы или их рецепторы, в том числе, но не ограничиваясь перечисленными, Picornaviridae (например, полиовирусы и т.п.); Caliciviridae; Togaviridae (например, вирус краснухи, вирус денге и т.п.); Flaviviridae; Coronaviridae; Reoviridae; Birnaviridae; Rhabodoviridae (например, вирус бешенства и т.п.); Filoviridae; Paramyxoviridae (например, вирус эпидемического паротита, вирус кори, респираторно-синцитиальный вирус и т.п.); Orthomyxoviridae (например, вирус гриппа типа A, B и C и т.п.); Bunyaviridae; Arenaviridae; Retroviradae; лентивирусы (например, HTLV-I; HTLV-II; ВИЧ-1 (также известный как HTLV-III, LAV, ARV, hTLR и т.п.), ВИЧ-II); вирус иммунодефицита обезьян (SIV), папилломавирус человека (HPV), вирус гриппа и вирусы клещевого энцефалита. См., например, описание указанных и других вирусов в источниках: Virology, 3rd Edition (W.K. Joklik ed. 1988); Fundamental Virology, 2nd Edition (B.N. Fields и D.M. Knipe, eds. 1991). Рецепторы ВИЧ, например, включают CCR-5 и CXCR-4.
[0198] Соответственно, варианты гетеродимерных доменов расщепления согласно описанию в настоящем документе находят широкое применение для повышения специфичности ZFN, используемых для модификации генов. Указанные варианты доменов расщепления могут быть легко включены в любой существующий ZFN с помощью либо сайт-направленного мутагенеза, либо субклонирования с повышением специфичности любых димеров ZFN in vivo.
[0199] Как отмечалось выше, композиции и способы, описанные в настоящем документе, могут применяться для модификации генов, генной коррекции и разрушения генов. Неограничивающие примеры модификации генов включают нацеленную интеграцию на основе направляемой гомологией репарации (HDR); генную коррекцию на основе HDR; модификация генов на основе HDR; разрушение генов на основе HDR; разрушение генов на основе NHEJ и/или комбинации HDR, NHEJ, и/или одноцепочечный отжиг (SSA). Одноцепочечный отжиг (SSA) относится к репарации двуцепочечного разрыва между двумя повторяющимися последовательностями в одинаковой ориентации путем вырезания ДЦР 5’-3’-экзонуклеазами с экспонированием 2 комплементарных областей. Затем одиночные цепи, кодирующие 2 прямых повтора, аннелируют между собой, и аннелированный промежуточный продукт может быть процессирован таким образом, что одноцепочечные «хвосты» (часть одноцепочечной ДНК, не аннелированная с какой-либо последовательностью) отщепляются, пропуски заполняются ДНК-полимеразой, и концы ДНК вновь соединяются. Это приводит к делеции последовательностей, локализованных между указанными прямыми повторами.
[0200] Композиции, содержащие домены расщепления (например, ZFN, TALEN, системы CRISPR/Cas), и способы, описанные в настоящем документе, могут также применяться в лечении различных генетических заболеваний и/или инфекционных заболеваний.
[0201] Указанные композиции и способы могут также применяться во вариантах терапии на основе стволовых клеток, в том числе, но не ограничиваясь перечисленным: для коррекции мутаций соматических клеток путем конверсии генов короткими последовательностями или нацеленной интеграции для моногенной генной терапии; для разрушения доминантно-негативных аллелей; для разрушения генов, необходимых для попадания в клетки или продуктивной инфекции патогенов в клетках; улучшенной тканевой инженерии, например, путем модификации активности гена, способствующей дифференцировке или формированию функциональных тканей; и/или разрушения активности гена, способствующего дифференцировке или формированию функциональных тканей; блокирования или индукции дифференцировки, например, путем разрушения генов, блокирующих дифференцировку, способствующего дифференцировке стволовых клеток в направлении специфической линии, нацеленного встраивания гена или экспрессионной кассеты с малой интерферирующей РНК (миРНК), которые могут стимулировать дифференцировку стволовых клеток, нацеленного встраивания гена или экспрессионной кассеты с миРНК, которые могут блокировать дифференцировку стволовых клеток и обеспечивать лучшее размножение и поддержание плюрипотентности, и/или для нацеленного встраивания репортерного гена внутрь рамки с эндогенным геном, представляющего собой маркер плюрипотентности или статуса дифференцировки, обеспечивающий удобный маркер для оценки статуса дифференцировки стволовых клеток и того, как изменения среды, цитокины, условия роста, экспрессия генов, экспрессия молекул миРНК, мшРНК или микроРНК, воздействие антителами к маркерам клеточной поверхности или лекарственные средства изменяют указанный статус; для переноса ядер соматических клеток, например, могут быть выделены собственные соматические клетки пациента, предусмотренный целевой ген модифицирован подходящим образом, получены клоны клеток (и проведен контроль качества для обеспечения безопасности генома) и ядра из указанных клеток выделены и перенесены в неоплодотворенные яйцеклетки для получения пациент-специфических клеток чЭСК, которые могут быть прямо инъецированы или дифференцированы перед прививкой пациенту, с уменьшением или элиминацией таким образом отторжения ткани; для получения универсальных стволовых клеток путем нокаута рецепторов MHC (например, для получения клеток с ослабленной или полностью устраненной иммунологической идентичностью). Типы клеток для указанной процедуры включают, не ограничиваясь перечисленными, T-клетки, B-клетки, гематопоэтические стволовые клетки и эмбриональные стволовые клетки. Кроме того, могут применяться индуцированные плюрипотентные стволовые клетки (иПСК), которые также получают из собственных соматических клеток пациента. Соответственно, указанные стволовые клетки или их производные (дифференцированные типы клеток или тканей) могут быть потенциально привиты любому человеку независимо от их происхождения или гистосовместимости.
[0202] Указанные композиции и способы могут также применяться для соматической клеточной терапии, обеспечивая таким образом получение запасов клеток, которые были модифицированы для усиления их биологических свойств. Такие клетки могут быть инфузированы различным пациентам независимо от донорского источника указанных клеток и их гистосовместимости с реципиентом.
[0203] Помимо терапевтического применения повышенная специфичность, обеспечиваемая описанными в настоящем документе вариантами, при их применении в сконструированных нуклеазах, может быть использована для конструирования сельскохозяйственных культур, конструирования линий клеток и конструирования моделей заболеваний. Облигатно гетеродимерные полудомены расщепления обеспечивают простой способ улучшения свойств нуклеаз.
[0204] Описанные сконструированные полудомены расщепления могут также применяться в протоколах модификации гена, требующих одновременного расщепления по нескольким мишеням, либо для делеции промежуточной области, либо для одновременного изменения двух специфических локусов. Расщепление по двум мишеням требует клеточной экспрессии четырех ZFN или TALEN, что потенциально может давать 10 разных комбинаций активных ZFN или TALEN. В таких вариантах применения замена нуклеазного домена дикого типа на указанные новые варианты элиминирует активность нежелательных комбинаций и снижает вероятность нецелевого расщепления. В тех случаях, когда для расщепления по определенной требуемой ДНК-мишени требуется активность пары нуклеаз A+B, а для одновременного расщепления по второй требуемой ДНК-мишень требуется активность пары нуклеаз X+Y, использование описанных в настоящем документе мутаций может предотвращать спаривание A с A, A с X, A с Y, и так далее. Соответственно, указанные мутации FokI уменьшают неспецифическую расщепляющую активность в результате образования «незаконных» пар и обеспечивают получение более эффективных ортогональных мутантных пар нуклеаз (см. совместные патентные публикации США №20080131962 и №20090305346).
ПРИМЕРЫ
Пример 1: Получение ZFN
[0205] ZFN, нацеленные на сайты в генах BCL11A и TCRA (нацеленные на константную область, также известную как TRAC) получали путем дизайна и включали в плазмидные векторы по существу согласно описанию в источниках: Urnov et al. (2005) Nature 435(7042):646-651, Perez et al (2008) Nature Biotechnology 26(7): 808-816, а также патентной PCT-публикации WO 2016183298 и PCT-публикации WO 2017106528. Также использовали ZFN, нацеливаемые AAVS1, согласно описанию в публикации США №20150110762.
Пример 2: Мутанты по остаткам FokI, нацеливающие взаимодействие с фосфатами
[0206] С применением моделей домена расщепления FokI (Miller et al (2007) Nat Biotech 25(7):778-85), идентифицировали положительно заряженные остатки аминокислот аргинина или лизина (Фиг. 1), которые потенциально взаимодействуют с фосфатами на остове ДНК.
[0207] Указанные идентифицированные положения в домене FokI (аминокислоты 416, 422, 447, 448 и 525) затем специфически изменяли (мутировали) на остатки серина для элиминации взаимодействия между оригинальной положительно заряженной аминокислоты и отрицательно заряженными фосфатами на ДНК (см. Фиг. 2A и 2B). Если указанные мутации содержат оба партнера ZFN, возможно возникновение ряда различных комбинаций (см. иллюстрацию на Фиг. 2C). Указанные новые мутанты FokI получали в партнере «KKR» FokI гетеродимеров ELD/KKR (см. патент США №8,962,281), и затем соединяли с парой ZFN, специфической в отношении энхансерной области BCL11A, SBS#51857 ELD/SBS#51949 KKR или SBS#51857_KKR/SBS#51949_ELD; «исходные» белки на Фиг. 3 выделены серым. Получали мутации в каждом партнере, а затем тестировали на расщепляющую активность в отношении оригинальной мишени BCL11A в клетках CD34+ в различных комбинациях, как показано на Фиг. 3. Нецелевые сайты были идентифицированы ранее с применением несмещенного анализа захвата (патентная PCT-публикация WO 2016/183298). Указанные нецелевые сайты перечислены ниже в таблице 1, где каждый сайт идентифицирован с использованием уникального сгенерированного случайным образом идентифицирующего буквенного «регистрационного знака», где «регистрационным знаком» PRJIYLFN обозначена предусмотренная целевая последовательность BCL11A. В приведенной ниже таблице также указан локус каждого сайта (координаты приведены в соответствии со сборкой hg38 из базы последовательностей U.C. Santa Cruz Human Genome Browser (Kent et al (2002), Genome Res.12(6):996-1006).
Таблица 1: Идентифицированные сайты расщепления SBS#51857/SBS#51949
(предусмотренная мишень)
[0208] Представленные на Фиг. 3 данные продемонстрировали, что определенные мутации уменьшали активность белков в отношении когнатного целевого сайта BCL11A, при соразмерном падении нецелевой расщепляющей активности (см., например, 51857-ELD/51949-KKR_R447S: целевая активность снижена до 11,60% инделей против 80,59% для исходных последовательностей; активность в нецелевом NIFMAEVG также падала до 0,05% против значения 9,04% для исходных последовательностей, а активность в нецелевом PEVYOHIU падала до 0,03% со значения 0,65% для исходных последовательностей ((Фиг. 3A)). Однако при других мутациях целевая расщепляющая активность оставалась устойчивой при уменьшении по существу активности в обоих оцениваемых нецелевых сайтах. Например, пара 51857-ELD/51949-KKR_R416S проявляла целевую активность в отношении BCL11A, в значительной степени аналогичную активности исходных белков (80,63% инделей для мутантной пары против 80,59% для исходной пары при дозе 2 мкг (20 мкг/мл)), тогда как активность в двух нецелевых сайтах по существу уменьшалась (0,75% в нецелевом сайте NIFMAEVG для мутантной пары против 9,04% для исходников, и 0,08% в нецелевом сайте PEVYOHIU для мутантной пары против 0,65% для исходников) (Фиг. 3A).
[0209] Также собирали мутантные белки, используя противоположную ориентацию гетеродимерных доменов FokI, т.е. на Фиг. 3A показаны результаты для 51857-ELD/51949-KKR, а на Фиг. 3B представлены результаты для 51857-KKR/51949-ELD. И в этих случаях также некоторые пары обеспечивали поддержание устойчивой целевой активности (например 51857-KKR/51949-ELD_K448S), аналогичной активности исходной пары (83,02% против 88,28%, соответственно), однако в нецелевых локализациях наблюдалось уменьшение активности (1,00% против 9,26% для NIFMAEVG; 0,33% против 0,87% для PEVYOHIU (Фиг. 3B).
[0210] Также проводили эксперименты с применением пары TCRA (TRAC)-специфических ZFN: SBS#52742_ELD/SBS#52774_KKR (патентная публикация США № US-2017-0211075-A1). Указанные эксперименты проводили в клетках K562, которые обрабатывали либо 100, либо 400 нг мРНК, кодирующей каждую ZFN. Указанные пары ZFN состояли из мутированного партнера из приведенных в таблице 2 ниже, и одного немутированного партнера. В указанных экспериментах все положительно заряженные аминокислоты, указанные на Фиг. 1, были мутированы с заменой на серин (S). Вкратце, использовали 2 × 10e5 клеток на трансфекцию, при этом мРНК доставляли в указанную клетку с применением 96-луночной челночной системы Amaxa. Трансфицированные клетки собирали на 3 день после трансфекции и обрабатывали для анализа MiSeq (Illumina) стандартными способами. Указанные данные приведены в таблице 2; они демонстрируют, что при некоторых мутациях сохранялась устойчивая целевая активность, тогда как другие (например, 52742 ELD_K469S, идентифицированный как остаток активного сайта, на Фиг. 1) нокаутировали расщепляющую активность.
Таблица 2: Целевые результаты для нацеленной на TCRA (TRAC) ZFN с мутациями FokI
[0211] Также проводили анализ нецелевых мишеней для определения наиболее частых нецелевых сайтов расщепления по оценке с применением несмещенного анализа захвата (патентная PCT-публикация WO 2016/183298). Четыре геномных локуса (предусмотренная мишень в TCRA (TRAC) и три нецелевых локуса), идентифицированные для указанной пары ZFN с применением несмещенного анализа захвата, представлены ниже в таблице 3.
Таблица 3: Сайты расщепления для TCRA (TRAC)-специфической ZFN
[0212] Анализировали нуклеазную активность в двух нецелевых сайтах (называемых OT11, или XVFENVRX и OT16, или XSKWTVWD, представленных выше в таблице 3) при дозе 400 нг мРНК каждой ZFN, при этом один партнер в паре ZFN содержал указанную мутацию, тогда как в другом сохранялся немодифицированный домен FokI ELD или KKR. Представленные данные (Таблица 4) отражают процент инделей (активность), наблюдаемый при применении 400 нг каждого партнера ZFN. Указанные данные также показали, что при некоторых мутациях сохранялась почти эквивалентная целевая активность наряду с уменьшением нецелевой активности. Например, для SBS#52774_KKR_K387S наблюдалась целевая активность, равная 89,06% инделей при использовании 400 нг (по сравнению с 89,08 для исходного 52774_KKR), и комбинированная нецелевая активность в OT11 и OT16, равная 6,39% инделей (по сравнению с 15,07% для исходного 52774_KKR). Результаты включали мутации FokI, протестированные в BCL11A-специфических ZFN, где изменение положительных зарядов в положениях 416, 422, 447, 448 и 525 снижало нецелевую активность.
Таблица 4: Нецелевое расщепление TRAC ZFN, мутантными по FokI
[0213] Затем указанные данные сравнивали с расчетным расстоянием между мутированным остатком аминокислоты и молекулой ДНК для изучения эффекта как на целевое, так и на нецелевое расщепление (Фиг. 4). Активность каждой пары ZFN представлена одной точкой данных; было продемонстрировано, что белки с наиболее желательными профилями (высокая целевая активность и низкая нецелевая активность) были представлены белками с мутациями в пределах 10  от молекулы ДНК (Фиг. 4). Отмечены точки данных, соответствующие парам ZFN, где одна ZFN несет мутацию FokI в положении 416, 422, 447, 448 или 525.
от молекулы ДНК (Фиг. 4). Отмечены точки данных, соответствующие парам ZFN, где одна ZFN несет мутацию FokI в положении 416, 422, 447, 448 или 525.
[0214] Указанные результаты продемонстрировали, что мутации одного или более остатков 416, 422, 447, 448 или 525 может увеличивать целевую активность наряду с уменьшением нецелевой активности.
Пример 3: Дизайн новых сконструированных мутаций остова с цинковыми пальцами
[0215] Предыдущие исследования указывают на возможность некоторого взаимодействия между положительно заряженными остатками аминокислот в «остове» с цинковыми пальцами (области структуры, не вовлеченные в сайт-специфическое распознавание нуклеотидов ДНК) и фосфатами на молекуле ДНК (Elrod-Erickson et al, там же), см. Фиг. 5A. Аминокислоты в положениях -14, -9 и -5 (все положения указаны относительно стандартной нумерации альфа-спиральной области) часто положительно заряжены и могут взаимодействовать с отрицательно заряженными фосфатами в остове ДНК (см. Фиг. 5B). Соответственно, анализировали 4867 последовательностей цинковых пальцев на присутствие остатков аминокислот в каждом положении в последовательности пальца (см. Фиг. 6). В положении -5 с низкой, однако ненулевой частотой наблюдали нейтральные аминокислоты аланин, лейцин и глутамин, таким образом, указанные аминокислоты использовали при модификациях пальцев остова. Положения в ZFP с 6 и 5 пальцами также идентифицировали наряду с потенциальными заменами (Фиг. 7A и 7B).
[0216] Осуществляли мутации в TCRA (TRAC)-специфической паре ZFN SBS#52774/SBS#52742 (см. PCT-публикацию WO 2017106528). Для указанных белков получали в общей сложности 21 вариант каждого партнера ((F1, F3, F5, F1+F3, F1+F5, F3+F5, F1+F3+F5) × (R→A, R→Q, R→L)). Репрезентативная подборка данных (таблица 5) показала, что многие пары демонстрировали уменьшение нецелевой активности в отношении трех проанализированных нецелевых мишеней. В указанной таблице ZFN 52774 комбинировали с вариантами ZFN 52742, несущими указанные мутации в положении -5 пальца 1 (F1), пальца 3 (F3) и пальца 5 (F5). Также указан тип мутации; все мутанты в указанном наборе данных представлены мутантами с заменой аргинина (R) на глутамина (Q). Например, белок, обозначенный как 52742-F1RQ, соответствует мутанту, где аргинин в положении -5 в пальце 1 был изменен на глутамин. В верхней части таблицы приведена активность, представленная как % инделей, а в нижней половине таблице показана активность, представленная как относительный уровень среднего значения активности двух репликатов исходной пары ZFN 52774/52742. Эти эксперименты продемонстрировали, что указанные мутации могут оказывать влияние на нецелевое расщепление. Например, для мутанта 52742-F1RQ; F3RQ; F5RQ при сохранении устойчивого уровня целевого расщепления (целевая активность 69,96% относительно активности 62,59% для исходных белков при дозе 6 мкг) уровень нецелевого расщепления падал (для OT16 показана расщепляющая активность 19,16% для исходных белков и активность 1,43% у тройного мутанта).
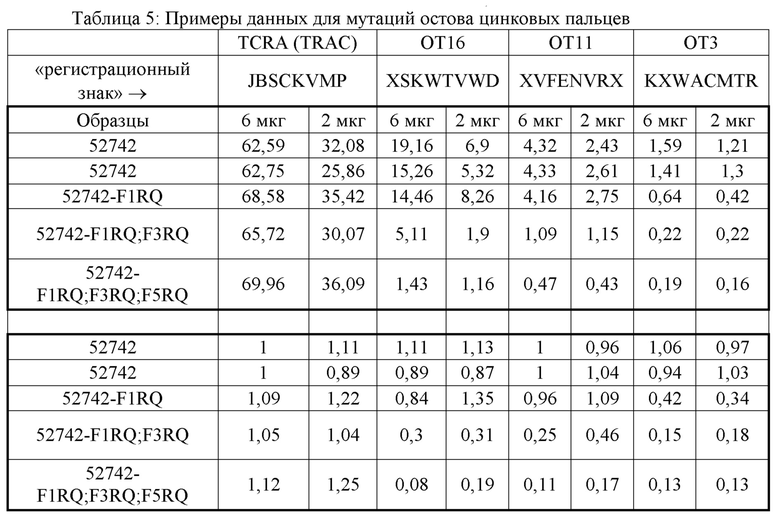
[0217] Начиная с TCRA (TRAC)-специфических исходных ZFN 52742 и 52774, аргинины (R) в первом пальце каждого модуля заменяли на аланин (A), глутамин (Q) или лейцин (L). Указанные конструкции тестировали в клетках CD34+, обрабатывая их 6 мкг мРНК, кодирующей каждый партнер ZFN (см. Фиг. 8A). В указанных наборах данных каждый столбец соответствует среднему значению данных для всех мутаций каждого типа, а стандартная ошибка обозначена планками погрешностей. Например, на Фиг. 8A левый столбец черного цвета, соответствующий целевой активности, указывает на значение, представляющее собой среднее значение целевой активности для всех 6 мутантов в паре ZFN которые могут содержать одиночную мутацию. На диаграмме на Фиг. 7 указанные мутации включают, соответственно, одиночную мутацию в N-концевом пальце модуля A 52742 (F1 в полноразмерном белке), одиночную мутацию в N-концевом пальце модуля B 52742 (F3 в полноразмерном белке), одиночную мутацию в N-концевом пальце модуля C 52742 (F5 в полноразмерном белке) и аналогичный набор мутаций в партнере - белке 52774. Объединенный уровень целевой активности на втором столбце черного цвета (соответствующем целевой активности) представлен средним значением для всех белков с 2 мутациями (набор из 6 возможных вариантов при внесении мутаций в один партнер ZFN), а на третьем столбце черного цвета объединенный уровень целевой активности представлен средним значением для 2 возможных вариантов с мутациями во всех трех модулях левой или правой ZFN. Для данных по нецелевой активности, которым соответствуют серые столбцы, получали аналогичные объединенные уровни, за исключением того, что данные для трех нецелевых сайтов комбинировали таким образом, что каждая совокупность объединенных данных для одиночных или двойных мутаций в наборе данных о нецелевой активности включала 18 точек данных, а совокупность объединенных данных для трех мутаций включала 6 точек данных. Указанные мутации обеспечивали уменьшение нецелевой активности вплоть до 4,8-кратного.
[0218] Также проводили эксперименты, в которых оба партнера в паре ZFN были мутированы аналогичным образом (правая половина Фиг. 8B). Например, если N-концевой палец в модуле A изменен на аланин, (52742-F1RA), белок-партнер также мутирован в N-концевом пальце в модуле A (52774-F1RA), что дает в общей сложности 2 мутации в димере ZFN. Замены только на аланин тестировали одновременно в обеих ZFN в димере; указанные данные приведены на правой половине Фиг. 8B (обозначенные как 2, 4 или 6). Мутации R→A вводят только в одну ZFN в димере (обозначенную как 1, 2 или 3) из левой трети Фиг. 8A, для сравнения еще раз приведенной на левой половине Фиг. 8B. Фиг. 8C аналогична правой части Фиг. 8A за исключением использования только 2 мкг (20 мкг/мл) РНК. Эти эксперименты продемонстрировали что указанные мутации могут обеспечивать 27-кратное уменьшение нецелевой активности при наличии в общей сложности шести мутаций в обеих ZFN в димере.
[0219] Указанные эксперименты также проводили с BCL11A-специфической парой ZFN 51857-ELD/51949-KKR, описанной выше. Дизайн экспериментов был аналогичен описанному для TCRA (TRAC)-специфической пары ZFN; результаты приведены на Фиг. 9A. Представленные данные отражают результаты для пар, содержащих либо мутации R→Q (Gln), либо мутации R→L (Leu) при использовании в дозе 2 мкг (20 мкг/мл), при этом для нецелевой активности приведены только результаты для одного нецелевого сайта (NIFMAEVG, см. таблицу 1).
[0220] Дополнительные варианты аминокислот в положении -5 получали путем замены R на E, N, Y, A или L. Помимо изменения аминокислот в положении -5 вводили ряд мутаций в положения -9 и -14 в Пальце 1 BCL11A-специфической пары ZFN 51857/51949. Указанные мутации тестировали на целевую и нецелевую активность согласно описанию выше, отдельно и в комбинации с изменениями в положении -5 в пальцах 2-6. Данные приведены ниже в таблице 6. Каждый белок содержал одинаковые ДНК-специфичные спиральные области согласно описанию для исходных белков выше, но получал новый идентификационный номер SBS, отражающий мутации остова ZFP. Вкратце, полные названия белков отражают перечисленные варианты мутаций в пальце. Соответственно, «cR»-часть полного названия относится к изменениям, вносимым в C-концевой палец модуля с двумя пальцами (см. Фиг. 7), а «nR» относится к изменениям, вносимым в N-концевой палец модуля с двумя пальцами. Описание «rQa» соответствует изменениям, вносимым в положении -5 в модуле A, а палец, в который были внесены указанные изменения, обозначен либо как cR, либо как nR. Соответственно, SBS#65461 (полное название 51857-NELD-cR-5Qa) представляет собой производное SBS#51857, где изменения внесены в C-концевой палец в положении -5, при этом Q заменяет R в модуле A. Указанные обозначения использованы также в таблице, в ячейках, где Q присутствует в колонке -5 для F2. При внесении изменений в положении -14, как в случае SBS#65459 (полное название 51857-NELD-nR-14Q-5Qabc), это указано в таблице. Соответственно, SBS#65459 представляет собой производное SBS#51857, где изменения в модулях внесены в N-концевой палец, при этом R заменена на Q в положении -14 Пальца 1 и в положениях -5 в N-концевом пальце модулей A, B и C. В случае SBS#65460, в положении -14 Пальца 1 R заменена на S. Это также отражено в таблице. Обозначения «NELD» и «CKKR» указывают на тип нуклеазных доменов FokI (вариант домена FokI «ELD» или «KKR») и другие аспекты указанного вектора (см. PCT-публикацию WO 2017/136049). В таблице 6A приведены подборки пар мутаций, введены в производные партнеров SBS#51857, с любым из партнеров: SBS#51949 или SBS#51949, содержащим изменения с инсерциями Q в N-концевых пальцах в положениях -5 в модулях A, B и C, где указанный партнер дополнительно содержит мутацию R416S в домене FokI, при этом эксперименты проводили с использованием 2 мкг мРНК, кодирующей каждый ZFN. Указанные эксперименты проводили также с использованием мутаций в белке SBS#51949 (см. таблицу 6B), при этом мутации взаимодействующих с фосфатом аминокислот домена FokI тестировали также в комбинации с мутациями остова. Эти данные показывают, что дополнительные изменения были способны оказывать влияние на специфичность пар ZFN.
Таблица 6A: Изменения в положениях в остове ZFN SBS#51857
Таблица 6B: Изменения в других положениях в остове и FokI в ZFN SBS#51949
* 63022-R416S также известен как SBS#65721.
** 63022-K525S также известен как SBS#65722.
[0221] Эксперименты повторяли на CD34+ клетках, при этом РНК доставляли в указанные клетки с применением системы трансфекция BTX в условиях, оптимизированных в соответствии с инструкциями изготовителя. Использовали три концентрации РНК: конечную концентрацию 60, 20 и 5 мкг/мл. Данные приведены ниже в таблице 6C и демонстрируют, что устойчивое целевое расщепление может быть детектировано даже при очень низких уровнях мРНК ZFN, таким образом, нецелевое расщепление по существу снижается (>100x). Мутации обозначены согласно номенклатуре на Фиг. 2C. Эксперимент повторяли с применением только исходной пары и пары 3x(R→Q)/3x(R→Q) из таблицы 6C ниже для определения устойчивости результатов. Как видно из таблицы 6D, результаты отличались высокой воспроизводимостью.
Таблица 6C: Целевые и нецелевые эффекты при титровании:
SBS63014
SBS65721
SBS63014
SBS65526
SBS63014
SBS65527
Числа в скобках соответствуют значениям, при которых не было обнаружено признаков нуклеазного расщепления.
* показывает, что правая ZFN дополнительно содержала дополнительную мутацию R416S в нуклеазном домене FokI.
Таблица 6D: Повторные измерения целевой активности
SBS63014
SBS65721
* показывает, что правая ZFN дополнительно содержала дополнительную мутацию R416S в нуклеазном домене FokI.
Пример 4: Титрование партнеров ZFN для оптимальной целевой активности
[0222] Индивидуальное титрование каждого партнера в паре ZFN может обеспечить определение оптимальной концентрации каждого партнера ZFN, и, соответственно, максимальную целевую модификацию указанной парой наряду с минимизацией нецелевых модификаций. Каждый индивидуальный полудомен ZFN может обладать собственной кинетикой связывания с когнатной ДНК-мишенью, таким образом, оптимальная активность может быть достигнута путем отдельного титрования каждого полудомена. Соответственно, использовали BCL11A-специфическую пару SBS#51949/SBS#51857 для исследования титрования в клетках CD34+ с применением ZFN, введенных в виде мРНК, при этом использовали высокие концентрации ZFN, позволяющие детектировать нецелевое расщепление. В ходе экспериментов (таблица 7, ниже) было обнаружено, что титрование партнера SBS#51857 приводило к уменьшению нецелевого расщепления (приблизительно 8-кратно) при сохранении устойчивого целевого расщепления. Например, при использовании 60 мкг/мл мРНК 51949 в комбинации с 6,6 мкг/мл мРНК 51857, уровень целевой модификации оставался приблизительно таким же, как и при использовании 60 мкг/мл каждой из ZFN (76,1% инделей при использовании 60 мкг/мл каждой из ZFN, 78,3% инделей при использовании 60 мкг/мл 51949 в комбинации с 6,6 мкг/мл 51857), тогда как совокупный уровень нецелевой модификации опускался с 32,4% инделей до 4,0%. Отметим, что уменьшение введения мРНК обеих ZFN в равной степени приводило к постепенному снижению уровня целевой модификации, тогда как уровень нецелевой модификации по существу снижался только при снижении уровня целевой модификации.
Таблица 7: Титрование одной ZFN
OT1
OT2
OT3
OT4
OT5
[0223] Также проводили анализ методом вестерн-блоттинга, чтобы продемонстрировать, что экспрессия каждого партнера ZFN коррелировала с количеством доставляемой кодирующей ZFN мРНК (Фиг. 10). В указанном эксперименте CD34+ клетки трансфицировали указанными ZFN и через 24 часа детектировали экспрессию белков ZFN с применением антитела против Flag (экспрессионные конструкции содержали закодированную метку Flag). Также анализировали экспрессию двух белков при совместном введении указанных ZFN в виде одной РНК, разделенной саморасщепляющийся пептидной последовательностью 2a (см. дорожку 2 на Фиг. 10).
[0224] Титрование повторяли с вариациями обеих ZFN независимо друг от друга, чтобы обнаружить какой-либо эффект на целевую или нецелевую расщепляющую активность. Результаты (Фиг. 11) показали, что титрование со снижением дозы обоих партнеров уменьшало нецелевое расщепление, но максимальный эффект наблюдался для SBS#51857. На Фиг. 11 в таблице для мишени BCL11A в рамки заключены ячейки, соответствующие сохранению расщепляющей активности в отношении предусмотренной мишени BCL11A при использовании 60 мкг мРНК SBS#51949 либо с 6,6 мкг, либо с 60 мкг мРНК SBS#51857, при этом нецелевая активность в сайте NIFMAEVG при уменьшении дозы SBS#51857 опускалась с 27 до 4% инделей.
Пример 5: Комбинирование титрования партнеров ZFN и мутаций контактирующих с фосфатом остатков FokI
[0225] Затем проводили анализы для измерения активности при титровании партнеров ZFN в комбинации с примерами мутаций FokI. BCL11A-специфические ZFN, содержащие мутации Fok, использовали в соотношениях, показанных выше, для сохранения целевой активности наряду с уменьшением уровня нецелевых разрезов. Указанные эксперименты проводили в клетках CD34+, трансфицированных мРНК, кодирующими указанные ZFN. Указанные данные представлены ниже в таблице 8. «Соотношение целевого/нецелевого расщепления» означает соотношение целевой и полной объединенной нецелевой активности для указанного образца. Мутант FokI с комбинацией 6,6 мкг/мл SBS#51857 и 60 мкг/мл SBS#51949-R416S обеспечивал аналогичные уровни целевой активности (84,85% против 78,17% для 60 мкг обеих исходных ZFN) при резком снижении активности во всех пяти отслеживаемых нецелевых сайтах, что давало 32-кратное повышение соотношения целевого/нецелевого расщепления (89,52 против 2,76 для 60 мкг/мл каждой из исходных ZFN).
Таблица 8: Комбинирование мутантов FokI и титрования партнеров ZFN со снижением дозы:
% активности NHEJ
OT1
OT2
OT3
OT4
OT5
[0226] Все нецелевые сайты, перечисленные выше в таблице 1, изучали на предмет эффекта на нецелевую активность путем комбинирования титрования и подхода с мутантами FokI (см. Фиг. 12).
[0227] Данные продемонстрировали приблизительно 30-кратное совокупное уменьшение нецелевой активности.
[0228] Данные также анализировали в отношении числа захватов, детектируемых с помощью несмещенного анализа захвата, описанного выше, после расщепления. Использовали BCL11A-специфические пары, описанные выше в таблице 6D, как исходную пару (SBS51857/SBS51949), так и вариант пары (SBS63014/SBS65721), и анализировали число нецелевых захватов. В указанном эксперименте ZFN вводили в CD34+ клетки либо в равных количествах (конечная концентрация 60 мкг/мл), либо в конечной концентрации 6,6 мкг и 60 мкг, для исходной пары, и 20 мкг и 60 мкг для варианта.
[0229] Результаты приведены на Фиг. 13 и демонстрируют, что, хотя и исходная пара, и вариант продемонстрировали устойчивую расщепляющую активность в обоих вариантах концентраций (>80% инделей), число нецелевых захватов было значительно снижено, в частности, для варианта пары при доставке в неравных дозах. Комбинация мутаций FokI ZFN и неравных концентраций партнеров ZFN приводила к 350-кратному увеличению специфичности расщепления.
Пример 6: Комбинирование мутаций остова ZFP с мутациями контактирующих с фосфатом остатков FokI
[0230] Авторы также получали ZFN, содержащие мутации остова с цинковыми пальцами, описанного в примере 3 с мутациями контактирующих с фосфатом остатков FokI, описанными в примере 2. Указанную комбинацию тестировали с BCL11A-специфической парой ZFN в клетках CD34+ в двух дозах: 6 мкг или 2 мкг. Результаты представлены ниже в таблице 9 и демонстрируют, что комбинирование указанных двух типов подходов может значимо влиять на уровень нецелевой активности. В указанной таблице мутации остова представлены как тип мутации на модуль (A, B и/или C, см. Фиг. 7). Например, в образце, обозначенном как 51949 LeuABC R416S, белок содержал замены R→L в остове пальцев 1 (модуль A), 3 (модуль B), и 5 (модуль C), и дополнительно нес мутацию FokI R416S. В нескольких примерах пары ZFN демонстрировали отсутствие детектируемой нецелевой активности при сохранении полной целевой активности. Указанные примеры заключены в рамку в таблице 9.
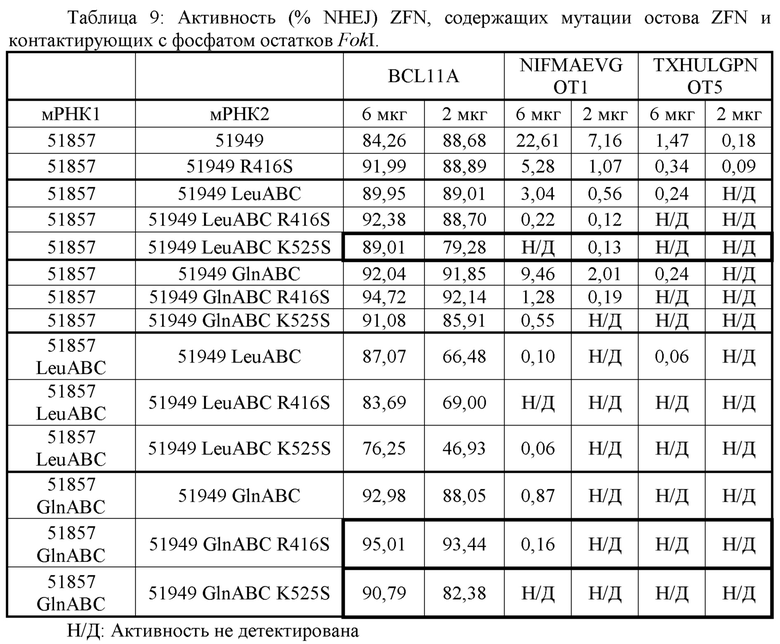
Пример 7: Комбинирование титрования партнеров, мутаций остова ZFP и контактирующих с фосфатом остатков FokI
[0231] Также проводили измерения активности при комбинировании оптимальных вариантов титрования партнеров с ZFN, содержащими мутации остова ZFP и мутации FokI ZFN. Указанные ZFN тестируют в клетках CD34+ согласно описанию выше; они демонстрируют увеличение специфичности пары ZFN за счет уменьшения уровня нецелевой активности.
Пример 8: Специфичность ZFN в клетках CD34+ в клиническом масштабе
[0232] Специфичность в отношении BCL11A варианта пары SBS63014/SBS65722 также тестировали в ходе крупномасштабной процедуры, подходящей для получения клеточных материалов для клинического испытания. Вкратце, трансдуцировали приблизительно 95-130 млн CD34+ клеток на партию с применением устройства Maxcyte в соответствии со спецификацией производителя. Использовали 80 мкг/мл мРНК SBS63014 и 20 мкг/мл мРНК SBS#65722, и нецелевое расщепление в клетках анализировали через два дней с применением несмещенного анализа захвата.
[0233] Результаты показали, что при ПЦР-анализе 47 разных потенциальных локусов захвата (см. Фиг. 14) не было детектировано значимых модификаций, за исключением целевой локализации, где было обнаружено 79,54% инделей. Указанный данные демонстрируют, что нуклеазы согласно описанию в настоящем документе высокоспецифичны даже при использовании в крупномасштабной производственной процедуре.
Пример 9: Дополнительные исследования специфичности
[0234] Исследования специфичности также проводили с применением AAVS1-нацеленных ZFN с различными мутациями согласно описанию выше. В частности, для анализов активность согласно описанию выше использовали ZFN SBS#30035 и SBS#30054 согласно описанию в публикации США №20150110762 для исследования различных мутантов, в том числе мутантов домена димеризации (например, ELD, KKR и дополнительных мутантов), других мутаций (например, Sharkey), а также мутантов по контактирующих с фосфатами остаткам.
[0235] Для получения результатов, представленных в таблицах ниже, указанный(ые) мутант(ы) FokI вводили либо в домен FokI ELD SBS 30035 (обозначен как ELD_X, где X представляет собой мутацию FokI), домен FokI KKR SBS 30054 (обозначен как KKR_X, где X представляет собой собой мутацию FokI), либо в домены FokI обеих конструкций (обозначен как ELD_KKR_X, где X представляет собой одну и ту же мутацию FokI, введенную в оба домена FokI ELD и KKR). Результаты для комбинации немодифицированных «исходных конструкций» 30035 и 30054 отмечены как «исходные», «исходники», «исходные ZFN» или т.п. Более низкая доза каждой исходной конструкции часто обозначены как «полудоза». Отрицательный контроль без нуклеаз обычно обозначен как «GFP». Соотношение, представляющее собой % инделей в предусмотренном локусе (часто обозначенных как «AAVS1»), разделенный на сумму % инделей во всех нецелевых локусах по оценке в определенном эксперименте часто обозначают как «соотношение», «соотношение целевого/нецелевого расщепления» и т.п.
[0236] Локализация целевой мишени AAVS1 и нецелевых мишеней показана ниже, где «hg38» означает данные сборки генома в соответствии с базой данных UCSC Genome Browser, вариант компоновки hg38:
[0237] В таблицах 10A-10C представлены результаты расщепления в 2 разных экспериментах целевой мишени (AAVS1) и трех нецелевых мишеней (OT1, OT2, OT3), а также соотношение целевого и нецелевого расщепления для мутантов димеризации ELD, KKR и ELD-KKR с дополнительной мутацией замены (каждой аминокислоты на АК молекулы дикого типа) по R416 или K525. Также приведены результаты для мутантов ELD_S418D, ELD_N476D, ELD_I479T, ELD_Q481E, ELD_N527D, и ELD_Q531R.
Таблица 10A
Таблица 10B
Таблица 10C
[0238] В таблицах 11A-11C представлены результаты расщепления в 2 разных экспериментах целевой мишени (AAVS1) и трех нецелевых мишеней (OT1, OT2, OT3), а также соотношение целевого и нецелевого расщепления для указанных мутантов, в том числе мутантов с заменами в положениях 418, 422 и 525 в комбинации с мутантами домена димеризации ELD и/или KKR.
Таблица 11A
Таблица 11B
Таблица 11C
[0239] В таблицах 12A-12C представлены результаты расщепления в 2 разных экспериментах целевой мишени (AAVS1) и трех нецелевых мишеней (OT1, OT2, OT3), а также соотношение целевого и нецелевого расщепления для указанных мутантов.
Таблица 12A
Таблица 12B
Таблица 12C
[0240] В таблицах 13A-13C представлено целевое и нецелевое расщепление при применением нацеленных на AAVS1 ZFN с указанными мутациями (ELD, KKR, ELD/KKR и другие указанные мутации).
Таблица 13A
Таблица 13B
Таблица 13C
[0241] В таблицах 14A-14C приведены результаты для указанных мутантов.
Таблица 14A
Таблица 14B
Таблица 14C
[0242] В таблицах 15A-15C приведены результаты экспериментов в двух повторностях с указанными мутантами.
Таблица 15A
Таблица 15B
Таблица 15C
Таблица 16B
[0243] В таблицах 17A-17C приведены результаты при использовании указанных примеров мутантов, в том числе двойных мутантов.
Таблица 17A
Таблица 17B
Таблица 17C
[0244] В таблицах 18A-18C приведены результаты применения указанных мутантных доменов расщепления.
Таблица 18A
Таблица 18B
Таблица 18C
[0245] На Фиг. 15 и 16 также приведена обзорная информация о выбранных результатах с указанными мутантами.
[0246] Указанные результаты демонстрируют высокоспецифичное расщепление при использовании мутантов, описанных в настоящем документе.
[0247] Все патенты, патентные заявки и публикации, упоминаемые в настоящем документе, полностью включены в настоящий документ посредством ссылок.
Хотя настоящее изобретение было достаточно подробно описано с привлечением иллюстративного материала и примеров для ясности понимания, специалистам в данной области техники будет понятно, что могут быть внесены различные изменения и модификации без отступления от существа или объема настоящего изобретения. Соответственно, приведенные выше описания и примеры не должны быть истолкованы как ограничивающие.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> SANGAMO THERAPEUTICS, INC./САНГАМО ТЕРАПЬЮТИКС, ИНК.
<120> ENGINEERED TARGET SPECIFIC NUCLEASES/СКОНСТРУИРОВАННЫЕ
МИШЕНЬ-СПЕЦИФИЧЕСКИЕ НУКЛЕАЗЫ
<130> 8325-0156.40
<140> PCT/US2017/048409
<141> 2017-08-24
<150> 62/443981
<151> 2017-01-09
<150> 62/378978
<151> 2016-08-24
<160> 72
<170> PatentIn, верс. 3.5
<210> 1
<211> 196
<212> PRT/БЕЛОК
<213> Неизвестен
<220>
<223> Описание неизвестной последовательности:
Полудомен расщепления FokI дикого типа
<400> 1
Gln Leu Val Lys Ser Glu Leu Glu Glu Lys Lys Ser Glu Leu Arg His
1 5 10 15
Lys Leu Lys Tyr Val Pro His Glu Tyr Ile Glu Leu Ile Glu Ile Ala
20 25 30
Arg Asn Ser Thr Gln Asp Arg Ile Leu Glu Met Lys Val Met Glu Phe
35 40 45
Phe Met Lys Val Tyr Gly Tyr Arg Gly Lys His Leu Gly Gly Ser Arg
50 55 60
Lys Pro Asp Gly Ala Ile Tyr Thr Val Gly Ser Pro Ile Asp Tyr Gly
65 70 75 80
Val Ile Val Asp Thr Lys Ala Tyr Ser Gly Gly Tyr Asn Leu Pro Ile
85 90 95
Gly Gln Ala Asp Glu Met Gln Arg Tyr Val Glu Glu Asn Gln Thr Arg
100 105 110
Asn Lys His Ile Asn Pro Asn Glu Trp Trp Lys Val Tyr Pro Ser Ser
115 120 125
Val Thr Glu Phe Lys Phe Leu Phe Val Ser Gly His Phe Lys Gly Asn
130 135 140
Tyr Lys Ala Gln Leu Thr Arg Leu Asn His Ile Thr Asn Cys Asn Gly
145 150 155 160
Ala Val Leu Ser Val Glu Glu Leu Leu Ile Gly Gly Glu Met Ile Lys
165 170 175
Ala Gly Thr Leu Thr Leu Glu Glu Val Arg Arg Lys Phe Asn Asn Gly
180 185 190
Glu Ile Asn Phe
195
<210> 2
<211> 588
<212> DNA/ДНК
<213> Неизвестен
<220>
<223> Описание неизвестной последовательности:
Полудомен расщепления FokI дикого типа
<400> 2
cagctggtga agagcgagct ggaggagaag aagtccgagc tgcggcacaa gctgaagtac 60
gtgccccacg agtacatcga gctgatcgag atcgccagga acagcaccca ggaccgcatc 120
ctggagatga aggtgatgga gttcttcatg aaggtgtacg gctacagggg aaagcacctg 180
ggcggaagca gaaagcctga cggcgccatc tatacagtgg gcagccccat cgattacggc 240
gtgatcgtgg acacaaaggc ctacagcggc ggctacaatc tgcctatcgg ccaggccgac 300
gagatgcaga gatacgtgga ggagaaccag acccggaata agcacatcaa ccccaacgag 360
tggtggaagg tgtaccctag cagcgtgacc gagttcaagt tcctgttcgt gagcggccac 420
ttcaagggca actacaaggc ccagctgacc aggctgaacc acatcaccaa ctgcaatggc 480
gccgtgctga gcgtggagga gctgctgatc ggcggcgaga tgatcaaagc cggcaccctg 540
acactggagg aggtgcggcg caagttcaac aacggcgaga tcaacttc 588
<210> 3
<211> 28
<212> PRT/БЕЛОК
<213> Неизвестен
<220>
<223> Описание неизвестной последовательности:
Белок с цинковыми пальцами
<400> 3
Lys Pro Phe Gln Cys Arg Ile Cys Met Arg Asn Phe Ser Arg Ser Asp
1 5 10 15
His Leu Thr Thr His Ile Arg Thr His Thr Gly Glu
20 25
<210> 4
<211> 23
<212> PRT/БЕЛОК
<213> Неизвестен
<220>
<223> Описание неизвестной последовательности:
Белок с цинковыми пальцами
<400> 4
Phe Gln Cys Arg Ile Cys Met Arg Asn Phe Ser Arg Ser Asp His Leu
1 5 10 15
Thr Thr His Ile Arg Thr His
20
<210> 5
<211> 23
<212> PRT/БЕЛОК
<213> Неизвестен
<220>
<223> Описание неизвестной последовательности:
Белок с цинковыми пальцами
<400> 5
Phe Ala Cys Asp Ile Cys Gly Arg Lys Phe Ala Arg Ser Asp Glu Arg
1 5 10 15
Lys Arg His Thr Lys Ile His
20
<210> 6
<211> 23
<212> PRT/БЕЛОК
<213> Неизвестен
<220>
<223> Описание неизвестной последовательности:
Белок с цинковыми пальцами
<400> 6
Phe Ala Cys Pro Glu Cys Pro Lys Arg Phe Met Arg Ser Asp His Leu
1 5 10 15
Ser Lys His Ile Lys Thr His
20
<210> 7
<211> 179
<212> PRT/БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<220>
<221> MOD_RES/МОДИФИЦИРОВАННЫЕ ОСТАТКИ
<222> (8)..(8)
<223> Q, S или R
<220>
<221> MOD_RES/МОДИФИЦИРОВАННЫЕ ОСТАТКИ
<222> (13)..(13)
<223> E, N, S или R
<220>
<221> MOD_RES/МОДИФИЦИРОВАННЫЕ ОСТАТКИ
<222> (17)..(17)
<223> A, Q, L, E, N, Y или R
<220>
<221> MOD_RES/МОДИФИЦИРОВАННЫЕ ОСТАТКИ
<222> (21)..(27)
<223> Любая аминокислота
<220>
<221> MOD_RES/МОДИФИЦИРОВАННЫЕ ОСТАТКИ
<222> (45)..(45)
<223> A, Q, L или R
<220>
<221> MOD_RES/МОДИФИЦИРОВАННЫЕ ОСТАТКИ
<222> (49)..(55)
<223> Любая аминокислота
<220>
<221> MOD_RES/МОДИФИЦИРОВАННЫЕ ОСТАТКИ
<222> (70)..(70)
<223> E, N, S или R
<220>
<221> MOD_RES/МОДИФИЦИРОВАННЫЕ ОСТАТКИ
<222> (74)..(74)
<223> A, Q, L, E, N, Y или R
<220>
<221> MOD_RES/МОДИФИЦИРОВАННЫЕ ОСТАТКИ
<222> (78)..(84)
<223> Любая аминокислота
<220>
<221> MOD_RES/МОДИФИЦИРОВАННЫЕ ОСТАТКИ
<222> (102)..(102)
<223> A, Q, L или R
<220>
<221> MOD_RES/МОДИФИЦИРОВАННЫЕ ОСТАТКИ
<222> (106)..(112)
<223> Любая аминокислота
<220>
<221> MOD_RES/МОДИФИЦИРОВАННЫЕ ОСТАТКИ
<222> (127)..(127)
<223> E, N, S или R
<220>
<221> MOD_RES/МОДИФИЦИРОВАННЫЕ ОСТАТКИ
<222> (131)..(131)
<223> A, Q, L, E, N, Y или R
<220>
<221> MOD_RES/МОДИФИЦИРОВАННЫЕ ОСТАТКИ
<222> (135)..(141)
<223> Любая аминокислота
<220>
<221> MOD_RES/МОДИФИЦИРОВАННЫЕ ОСТАТКИ
<222> (159)..(159)
<223> A, Q, L или R
<220>
<221> MOD_RES/МОДИФИЦИРОВАННЫЕ ОСТАТКИ
<222> (163)..(169)
<223> Любая аминокислота
<400> 7
Val Pro Ala Ala Met Ala Glu Xaa Pro Phe Gln Cys Xaa Ile Cys Met
1 5 10 15
Xaa Asn Phe Ser Xaa Xaa Xaa Xaa Xaa Xaa Xaa His Ile Arg Thr His
20 25 30
Thr Gly Glu Lys Pro Phe Ala Cys Asp Ile Cys Gly Xaa Lys Phe Ala
35 40 45
Xaa Xaa Xaa Xaa Xaa Xaa Xaa His Thr Lys Ile His Thr Gly Ser Gln
50 55 60
Lys Pro Phe Gln Cys Xaa Ile Cys Met Xaa Asn Phe Ser Xaa Xaa Xaa
65 70 75 80
Xaa Xaa Xaa Xaa His Ile Arg Thr His Thr Gly Glu Lys Pro Phe Ala
85 90 95
Cys Asp Ile Cys Gly Xaa Lys Phe Ala Xaa Xaa Xaa Xaa Xaa Xaa Xaa
100 105 110
His Thr Lys Ile His Thr Gly Ser Gln Lys Pro Phe Gln Cys Xaa Ile
115 120 125
Cys Met Xaa Asn Phe Ser Xaa Xaa Xaa Xaa Xaa Xaa Xaa His Ile Arg
130 135 140
Thr His Thr Gly Glu Lys Pro Phe Ala Cys Asp Ile Cys Gly Xaa Lys
145 150 155 160
Phe Ala Xaa Xaa Xaa Xaa Xaa Xaa Xaa Thr His Thr Lys Ile His Leu
165 170 175
Arg Gly Ser
<210> 8
<211> 151
<212> PRT/БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<220>
<221> MOD_RES/МОДИФИЦИРОВАННЫЕ ОСТАТКИ
<222> (8)..(8)
<223> Q, S или R
<220>
<221> MOD_RES/МОДИФИЦИРОВАННЫЕ ОСТАТКИ
<222> (13)..(13)
<223> E, N, S или R
<220>
<221> MOD_RES/МОДИФИЦИРОВАННЫЕ ОСТАТКИ
<222> (17)..(17)
<223> A, Q, L, E, N, Y или R
<220>
<221> MOD_RES/МОДИФИЦИРОВАННЫЕ ОСТАТКИ
<222> (21)..(27)
<223> Любая аминокислота
<220>
<221> MOD_RES/МОДИФИЦИРОВАННЫЕ ОСТАТКИ
<222> (42)..(42)
<223> E, N, S или R
<220>
<221> MOD_RES/МОДИФИЦИРОВАННЫЕ ОСТАТКИ
<222> (46)..(46)
<223> A, Q, L, E, N, Y или R
<220>
<221> MOD_RES/МОДИФИЦИРОВАННЫЕ ОСТАТКИ
<222> (50)..(56)
<223> Любая аминокислота
<220>
<221> MOD_RES/МОДИФИЦИРОВАННЫЕ ОСТАТКИ
<222> (74)..(74)
<223> A, Q, L или R
<220>
<221> MOD_RES/МОДИФИЦИРОВАННЫЕ ОСТАТКИ
<222> (78)..(84)
<223> Любая аминокислота
<220>
<221> MOD_RES/МОДИФИЦИРОВАННЫЕ ОСТАТКИ
<222> (99)..(99)
<223> E, N, S или R
<220>
<221> MOD_RES/МОДИФИЦИРОВАННЫЕ ОСТАТКИ
<222> (103)..(103)
<223> A, Q, L, E, N, Y или R
<220>
<221> MOD_RES/МОДИФИЦИРОВАННЫЕ ОСТАТКИ
<222> (107)..(113)
<223> Любая аминокислота
<220>
<221> MOD_RES/МОДИФИЦИРОВАННЫЕ ОСТАТКИ
<222> (131)..(131)
<223> A, Q, L или R
<220>
<221> MOD_RES/МОДИФИЦИРОВАННЫЕ ОСТАТКИ
<222> (135)..(141)
<223> Любая аминокислота
<400> 8
Val Pro Ala Ala Met Ala Glu Xaa Pro Phe Gln Cys Xaa Ile Cys Met
1 5 10 15
Xaa Lys Phe Ala Xaa Xaa Xaa Xaa Xaa Xaa Xaa His Thr Lys Ile His
20 25 30
Thr Gly Ser Gln Lys Pro Phe Gln Cys Xaa Ile Cys Met Xaa Asn Phe
35 40 45
Ser Xaa Xaa Xaa Xaa Xaa Xaa Xaa His Ile Arg Thr His Thr Gly Glu
50 55 60
Lys Pro Phe Ala Cys Asp Ile Cys Gly Xaa Lys Phe Ala Xaa Xaa Xaa
65 70 75 80
Xaa Xaa Xaa Xaa His Thr Lys Ile His Thr Gly Ser Gln Lys Pro Phe
85 90 95
Gln Cys Xaa Ile Cys Met Xaa Asn Phe Ser Xaa Xaa Xaa Xaa Xaa Xaa
100 105 110
Xaa His Ile Arg Thr His Thr Gly Glu Lys Pro Phe Ala Cys Asp Ile
115 120 125
Cys Gly Xaa Lys Phe Ala Xaa Xaa Xaa Xaa Xaa Xaa Xaa Thr His Thr
130 135 140
Lys Ile His Leu Arg Gly Ser
145 150
<210> 9
<211> 5
<212> PRT/БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 9
Thr Gly Glu Lys Pro
1 5
<210> 10
<211> 6
<212> PRT/БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 10
Thr Gly Gly Gln Arg Pro
1 5
<210> 11
<211> 5
<212> PRT/БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 11
Thr Gly Gln Lys Pro
1 5
<210> 12
<211> 6
<212> PRT/БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 12
Thr Gly Ser Gln Lys Pro
1 5
<210> 13
<211> 76
<212> DNA/ДНК
<213> Homo sapiens
<400> 13
ctaatcagag gccaaaccct tcctggagcc tgtgataaaa gcaactgtta gcttgcacta 60
gactagcttc aaagtt 76
<210> 14
<211> 76
<212> DNA/ДНК
<213> Homo sapiens
<400> 14
cttcctgcgg ggttttgtgc aaataaccca tgctcgggag cgaggccctg ggaaggagta 60
tctcgcttct ttgggt 76
<210> 15
<211> 76
<212> DNA/ДНК
<213> Homo sapiens
<400> 15
cctaccccca ccacctcacc ttccctcagc cttgtgtttc agccccagtt agctgccctt 60
agttgctgat gtattg 76
<210> 16
<211> 76
<212> DNA/ДНК
<213> Homo sapiens
<400> 16
agcacgtttc tccagtttcc agcctggggc ctggctataa agcaaatgct cagtccagca 60
ttgcggaatg caaggg 76
<210> 17
<211> 76
<212> DNA/ДНК
<213> Homo sapiens
<400> 17
acagcaccgt gctgcacggc gtcctccggc cttgctgcct ggcaatgggt agccacctgg 60
cgtctgtctc agaata 76
<210> 18
<211> 76
<212> DNA/ДНК
<213> Homo sapiens
<400> 18
ttcccagaag gcgattgaac ctgaagctgc gcctggcgcg tgagcctgtg ggggggacgc 60
ggctgagggg ctttga 76
<210> 19
<211> 76
<212> DNA/ДНК
<213> Homo sapiens
<400> 19
tatcccttcc ccaagtgcaa ccaacagttg ctctaaagct aggctggtgg agttggggaa 60
agggccagca agtgag 76
<210> 20
<211> 76
<212> DNA/ДНК
<213> Homo sapiens
<400> 20
tcctccatgc tcagaaagcc tttcttggag ccaggcacac aggaaatgtt agctagttag 60
cattggctct aatact 76
<210> 21
<211> 76
<212> DNA/ДНК
<213> Homo sapiens
<400> 21
tagctgggga gagattgcct ctctcagggc ctagccagtt cctagaaata gcaagggctc 60
agctgagagc atgctt 76
<210> 22
<211> 76
<212> DNA/ДНК
<213> Homo sapiens
<400> 22
tcccccggaa gtgtccgcac ctcctagagc ccagcgagcg agcgtttgtg cttttgtcct 60
ttgaaccggg tgtggt 76
<210> 23
<211> 76
<212> DNA/ДНК
<213> Homo sapiens
<400> 23
gactcattca tccactcatt ctgagcactt gctgcacact aggccctggg ctggggcttc 60
agcccaggag ttcact 76
<210> 24
<211> 76
<212> DNA/ДНК
<213> Homo sapiens
<400> 24
atgtagtctg acggccgcga ctggttcgta gcttttgagt gaggcggcgg gaagggagcg 60
agggaagagc ggcagt 76
<210> 25
<211> 76
<212> DNA/ДНК
<213> Homo sapiens
<400> 25
tcatgttatg gaagtggctt ctttccttaa gccttatgaa taagcctctg ctagcttcaa 60
actttgtgtg cagctt 76
<210> 26
<211> 76
<212> DNA/ДНК
<213> Homo sapiens
<400> 26
cataaagcac ttacaacagt gcctggcaaa tgcctagtgc acagcaagtg ttagctattg 60
ttaatgacta tccatt 76
<210> 27
<211> 76
<212> DNA/ДНК
<213> Homo sapiens
<400> 27
atttttgccc ctgtcttctc ttttcctcct ttgctgcatc ccaggctcca gcctttcagc 60
cctatttgca gtaccc 76
<210> 28
<211> 76
<212> DNA/ДНК
<213> Homo sapiens
<400> 28
acaaggggtt caaggttatg aataacctgt gctaatccca gaggccccag gacagagtaa 60
gtgggaacaa acactg 76
<210> 29
<211> 76
<212> DNA/ДНК
<213> Homo sapiens
<400> 29
cggaagttaa tatgatcatt gctaacattt gctgtgtttc aggcactgta agcatgtata 60
tgggtcctta aaggga 76
<210> 30
<211> 76
<212> DNA/ДНК
<213> Homo sapiens
<400> 30
tgagcccaga aaccccttac ccttcctcct gcctcttgag aggccagtgt taggtgttag 60
ccggggtgca aagctc 76
<210> 31
<211> 76
<212> DNA/ДНК
<213> Homo sapiens
<400> 31
aacctggtgc gagcagcccg ggctacaggg ttgcctgagg tgtgggtccc aggatggagg 60
agccccaggc cggcgg 76
<210> 32
<211> 76
<212> DNA/ДНК
<213> Homo sapiens
<400> 32
acttcggtga aggaagtcat cagtgcagtt gccgacaagc tgggctccgg ggagggcctg 60
atcatagtca agatga 76
<210> 33
<211> 76
<212> DNA/ДНК
<213> Homo sapiens
<400> 33
ggggccaggc aggaagaaca gctaactcta gctcacctgc aaggctcagc actgggttca 60
tttgaagtag tgtcct 76
<210> 34
<211> 76
<212> DNA/ДНК
<213> Homo sapiens
<400> 34
ctcctttggg tgtggacggg actaacactt gctccatgtc agggctgcag gacctcctgg 60
ctgttgacag caggca 76
<210> 35
<211> 76
<212> DNA/ДНК
<213> Homo sapiens
<400> 35
gatgtttgaa aagcgctgag cctggcctgg cacctaaaca gctcagcaag tgttagccag 60
gatcactagc agtaat 76
<210> 36
<211> 76
<212> DNA/ДНК
<213> Homo sapiens
<400> 36
accctgccga tttccttcca gttgctcgct ggggcaaccg gctaggctgg aggaagggcg 60
aggacggtgt cacccc 76
<210> 37
<211> 76
<212> DNA/ДНК
<213> Homo sapiens
<400> 37
gaacatggtg aggacaaaat gatgtccagg agccttttct ttggccattg ctagcctgag 60
acgaaaagtc agtggc 76
<210> 38
<211> 76
<212> DNA/ДНК
<213> Homo sapiens
<400> 38
agtctgtcag tctatcgtcc ctacctgcag cccaaagcat aagcaacatc ttgcccagct 60
cagaggtgac aacctc 76
<210> 39
<211> 76
<212> DNA/ДНК
<213> Homo sapiens
<400> 39
caccgaccca aggaccactc cttccaggaa cctagcctaa agcaaaggtg cagacagccc 60
ggggccaccg ctgacc 76
<210> 40
<211> 76
<212> DNA/ДНК
<213> Homo sapiens
<400> 40
ttgcaaaagg aagtttgaag ctagcagagg ctgattcatg aggttcaagg aaagaagtca 60
tctctgtaac ataaaa 76
<210> 41
<211> 76
<212> DNA/ДНК
<213> Homo sapiens
<400> 41
cgtcccccag agtcctgttt cctctccttc agcccccaaa tgagcaaagg ttaggcccca 60
cccctgctga gtcagc 76
<210> 42
<211> 76
<212> DNA/ДНК
<213> Homo sapiens
<400> 42
gtcaggggac agggtttcct agcatccgcg agccttacag aaaggcaact gtgcagtgct 60
ccagctggct ttctca 76
<210> 43
<211> 76
<212> DNA/ДНК
<213> Homo sapiens
<400> 43
accatcagag aagctaacct ttcctgaggc ctaactactt tgcaggtcct gtattatgtc 60
ctctatagac attagg 76
<210> 44
<211> 76
<212> DNA/ДНК
<213> Homo sapiens
<400> 44
gatcatttca aagaaaacat tctggaacag ttgcctatgg gcacggcagg gtgacggtgc 60
tgcttctggg tttgac 76
<210> 45
<211> 76
<212> DNA/ДНК
<213> Homo sapiens
<400> 45
gaagggcaga gaactataat gacacagttg ctttattgct ggacccagga cagtttatac 60
agcagttcgg aaaggc 76
<210> 46
<211> 76
<212> DNA/ДНК
<213> Homo sapiens
<400> 46
acttattgta agtgacgcat gtgaccagtt gccaattgtt caggctacag cttggatctg 60
ttagcatcct cattta 76
<210> 47
<211> 76
<212> DNA/ДНК
<213> Homo sapiens
<400> 47
cccaggggct gtgggacact cagagagcct atgcctgtgc cctgggctcc gggaggggag 60
aggatctggg ggccag 76
<210> 48
<211> 77
<212> DNA/ДНК
<213> Homo sapiens
<400> 48
ccccaggggc tgtgggacac tcagagagcc tatgcctgtg ccctgggctc cgggagggga 60
gaggatctgg gggccag 77
<210> 49
<211> 42
<212> DNA/ДНК
<213> Homo sapiens
<400> 49
agcttcctgc agcctccctc aaagcagatg ttagcactat ta 42
<210> 50
<211> 42
<212> DNA/ДНК
<213> Homo sapiens
<400> 50
cctcacctag aacctgggcc cctgcaactg taacctgtgg ca 42
<210> 51
<211> 42
<212> DNA/ДНК
<213> Homo sapiens
<400> 51
ccagaggaag aacagttgct tgggtctagg cctcaggaag gg 42
<210> 52
<211> 43
<212> DNA/ДНК
<213> Homo sapiens
<400> 52
cctgtgctgg ggcctgggag gcaggcggct gctagccatc ctg 43
<210> 53
<211> 42
<212> DNA/ДНК
<213> Homo sapiens
<400> 53
tgacttagga agcagttgct acctgccagg ccccaggcta gg 42
<210> 54
<211> 40
<212> DNA/ДНК
<213> Homo sapiens
<400> 54
tcagtgattg ggttccgaat cctcctcctg aaagtggccg 40
<210> 55
<211> 40
<212> DNA/ДНК
<213> Homo sapiens
<400> 55
ccatatgcag aaaacagaaa ctgtacccct tccttacacc 40
<210> 56
<211> 40
<212> DNA/ДНК
<213> Homo sapiens
<400> 56
tggccctttg cagaaaaggt tgttgaaccc taccgtaaac 40
<210> 57
<211> 40
<212> DNA/ДНК
<213> Homo sapiens
<400> 57
ccggagagaa ggctccggtt cagcactgag atcaggacgg 40
<210> 58
<211> 195
<212> PRT/БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 58
Leu Val Lys Gly Glu Met Glu Lys Lys Lys Ser Asp Leu Arg His Lys
1 5 10 15
Leu Lys His Val Pro His Glu Tyr Ile Glu Leu Ile Glu Ile Ala Gln
20 25 30
Asp Ser Lys Gln Asn Arg Leu Phe Glu Phe Lys Val Val Glu Phe Leu
35 40 45
Lys Glu Val Tyr Asp Tyr Asn Gly Lys His Leu Gly Gly Ser Arg Lys
50 55 60
Pro Asp Gly Ala Leu Tyr Thr Asn Gly Leu Lys Thr Asp Tyr Gly Ile
65 70 75 80
Ile Leu Asp Thr Lys Ala Tyr Lys Asp Gly Tyr Ser Leu Pro Ile Ser
85 90 95
Gln Ala Asp Glu Met Gln Arg Tyr Val Asp Glu Asn Asn Asn Arg Asn
100 105 110
Ala Ile Ile Asn Pro Asn Glu Trp Trp Lys Val Tyr Pro Asn Ser Ile
115 120 125
Leu Asp Phe Lys Phe Leu Phe Val Ser Gly Phe Phe Lys Gly Asp Tyr
130 135 140
Lys Lys Gln Leu Ala Arg Val Ser Asn Leu Thr Lys Arg Lys Gly Ala
145 150 155 160
Val Leu Ser Val Glu Gln Leu Leu Leu Gly Gly Glu Lys Ile Lys Asp
165 170 175
Gly Ser Leu Thr Leu Glu Asp Val Gly Asp Lys Phe Asn Asn Asp Glu
180 185 190
Ile Ile Phe
195
<210> 59
<211> 192
<212> PRT/БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 59
Gln Ile Val Lys Ser Ser Ile Glu Met Ser Lys Ala Asn Met Arg Asp
1 5 10 15
Asn Leu Gln Met Leu Pro His Asp Tyr Ile Glu Leu Ile Glu Ile Ser
20 25 30
Gln Asp Pro Tyr Gln Asn Arg Ile Phe Glu Met Lys Val Met Asp Leu
35 40 45
Phe Ile Asn Glu Tyr Gly Phe Ser Gly Ser His Leu Gly Gly Ser Arg
50 55 60
Lys Pro Asp Gly Ala Met Tyr Ala His Gly Phe Gly Val Ile Val Asp
65 70 75 80
Thr Lys Ala Tyr Lys Asp Gly Tyr Asn Leu Pro Ile Ser Gln Ala Asp
85 90 95
Glu Met Glu Arg Tyr Val Arg Glu Asn Ile Asp Arg Asn Glu His Val
100 105 110
Asn Ser Asn Arg Trp Trp Asn Ile Phe Pro Glu Asp Thr Asn Glu Tyr
115 120 125
Lys Phe Leu Phe Val Ser Gly Phe Phe Lys Gly Asn Phe Glu Lys Gln
130 135 140
Leu Glu Arg Ile Ser Ile Asp Thr Gly Val Gln Gly Gly Ala Leu Ser
145 150 155 160
Val Glu His Leu Leu Leu Gly Ala Glu Tyr Ile Lys Arg Gly Ile Leu
165 170 175
Thr Leu Tyr Asp Phe Lys Asn Ser Phe Leu Asn Lys Glu Ile Gln Phe
180 185 190
<210> 60
<211> 189
<212> PRT/БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 60
Lys Ser Ser Thr Glu Glu Leu Lys Ala Gln Leu Arg Thr Gln Leu Thr
1 5 10 15
Asn Ile Ser Leu Asp Tyr Leu Gln Leu Val Asp Ile Ser Thr Asp Ser
20 25 30
Lys Gln Asn Arg Leu Phe Glu Met Lys Val Met Asp Leu Phe Ile Asn
35 40 45
Glu Leu Asp Phe Lys Gly Ser His Leu Gly Gly Gly Arg Lys Pro Asp
50 55 60
Gly Ala Val Tyr Thr Thr Asn Tyr Gly Ile Ile Val Asp Thr Lys Ala
65 70 75 80
Tyr Lys Asp Gly Tyr Asn Leu Pro Ile Ser Gln Ala Asp Glu Met Glu
85 90 95
Arg Tyr Val Arg Glu Asn Ile Asp Arg Asn Lys Gly Ile Asn Pro Asn
100 105 110
Glu Trp Trp Thr Ile Phe Pro Ser Ser Ile Asn Asp Phe Thr Phe Leu
115 120 125
Phe Val Ser Gly Tyr Phe Lys Gly Asn Phe Glu Gly Gln Leu Gln Arg
130 135 140
Ile Ser Met Ser Thr Gly Ile Lys Gly Gly Ala Ile Gly Val Glu His
145 150 155 160
Leu Leu Leu Cys Ala Glu Tyr Tyr Lys Arg Gly Ile Leu Ser His Gln
165 170 175
Asp Ile Arg Asp Ser Phe Lys Asn Ala Glu Ile Glu Phe
180 185
<210> 61
<211> 192
<212> PRT/БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 61
Ile Lys Ser Asn Ile Ser Leu Leu Lys Asp Glu Leu Arg Gly Gln Ile
1 5 10 15
Ser His Ile Ser His Glu Tyr Leu Ser Leu Ile Asp Leu Ala Phe Asp
20 25 30
Ser Lys Gln Asn Arg Leu Phe Glu Met Lys Val Leu Glu Leu Leu Val
35 40 45
Asn Glu Tyr Gly Phe Lys Gly Arg His Leu Gly Gly Ser Arg Lys Pro
50 55 60
Asp Gly Ile Val Tyr Ser Thr Thr Leu Glu Asp Asn Phe Gly Ile Ile
65 70 75 80
Val Asp Thr Lys Ala Tyr Ser Glu Gly Tyr Ser Leu Pro Ile Ser Gln
85 90 95
Ala Asp Glu Met Glu Arg Tyr Val Arg Glu Asn Ser Asn Arg Asp Glu
100 105 110
Glu Val Asn Pro Asn Lys Trp Trp Glu Asn Phe Ser Glu Glu Val Lys
115 120 125
Lys Tyr Tyr Phe Val Phe Ile Ser Gly Ser Phe Lys Gly Lys Phe Glu
130 135 140
Glu Gln Leu Arg Arg Leu Ser Met Thr Thr Gly Val Asn Gly Ser Ala
145 150 155 160
Val Asn Val Val Asn Leu Leu Leu Gly Ala Glu Lys Ile Arg Ser Gly
165 170 175
Glu Met Thr Ile Glu Glu Leu Glu Arg Ala Met Phe Asn Asn Ser Glu
180 185 190
<210> 62
<211> 186
<212> PRT/БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 62
Lys Leu Ala Lys Ser Ser Gln Ser Glu Thr Lys Glu Lys Leu Arg Glu
1 5 10 15
Lys Leu Arg Asn Leu Pro His Glu Tyr Leu Ser Leu Val Asp Leu Ala
20 25 30
Tyr Asp Ser Lys Gln Asn Arg Leu Phe Glu Met Lys Val Ile Glu Leu
35 40 45
Leu Thr Glu Glu Cys Gly Phe Gln Gly Leu His Leu Gly Gly Ser Arg
50 55 60
Arg Pro Asp Gly Val Leu Tyr Thr Ala Gly Leu Thr Asp Asn Tyr Gly
65 70 75 80
Ile Ile Leu Asp Thr Lys Ala Tyr Ser Ser Gly Tyr Ser Leu Pro Ile
85 90 95
Ala Gln Ala Asp Glu Met Glu Arg Tyr Val Arg Glu Asn Gln Thr Arg
100 105 110
Asp Glu Leu Val Asn Pro Asn Gln Trp Trp Glu Asn Phe Glu Asn Gly
115 120 125
Leu Gly Thr Phe Tyr Phe Leu Phe Val Ala Gly His Phe Asn Gly Asn
130 135 140
Val Gln Ala Gln Leu Glu Arg Ile Ser Arg Asn Thr Gly Val Leu Gly
145 150 155 160
Ala Ala Ala Ser Ile Ser Gln Leu Leu Leu Leu Ala Asp Ala Ile Arg
165 170 175
Gly Gly Arg Met Asp Arg Glu Arg Leu Arg
180 185
<210> 63
<211> 190
<212> PRT/БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 63
Lys Ile Ser Lys Thr Asn Ile Leu Glu Leu Lys Asp Lys Val Arg Asp
1 5 10 15
Lys Leu Lys Tyr Val Asp His Arg Tyr Leu Ala Leu Ile Asp Leu Ala
20 25 30
Tyr Asp Gly Thr Ala Asn Arg Asp Phe Glu Ile Gln Thr Ile Asp Leu
35 40 45
Leu Ile Asn Glu Leu Lys Phe Lys Gly Val Arg Leu Gly Glu Ser Arg
50 55 60
Lys Pro Asp Gly Ile Ile Ser Tyr Asn Ile Asn Gly Val Ile Ile Asp
65 70 75 80
Asn Lys Ala Tyr Ser Thr Gly Tyr Asn Leu Pro Ile Asn Gln Ala Asp
85 90 95
Glu Met Ile Arg Tyr Ile Glu Glu Asn Gln Thr Arg Asp Glu Lys Ile
100 105 110
Asn Ser Asn Lys Trp Trp Glu Ser Phe Asp Glu Lys Val Lys Asp Phe
115 120 125
Asn Tyr Leu Phe Val Ser Ser Phe Phe Lys Gly Asn Phe Lys Asn Asn
130 135 140
Leu Lys His Ile Ala Asn Arg Thr Gly Val Asn Gly Gly Ala Ile Asn
145 150 155 160
Val Glu Asn Leu Leu Tyr Phe Ala Glu Glu Leu Lys Ala Gly Arg Ile
165 170 175
Ser Tyr Leu Asp Ser Phe Lys Met Tyr Asn Asn Asp Glu Ile
180 185 190
<210> 64
<211> 190
<212> PRT/БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 64
Val Lys Ser Glu Val Ser Val Phe Lys Asp Tyr Leu Arg Thr His Leu
1 5 10 15
Thr His Val Asp His Arg Tyr Leu Ile Leu Val Asp Leu Gly Phe Asp
20 25 30
Gly Ser Ser Asp Arg Asp Tyr Glu Met Lys Thr Ala Glu Leu Phe Thr
35 40 45
Ala Glu Leu Gly Phe Met Gly Ala Arg Leu Gly Asp Thr Arg Lys Pro
50 55 60
Asp Val Cys Val Tyr His Gly Ala Asn Gly Leu Ile Ile Asp Asn Lys
65 70 75 80
Ala Tyr Gly Lys Gly Tyr Ser Leu Pro Ile Lys Gln Ala Asp Glu Ile
85 90 95
Tyr Arg Tyr Ile Glu Glu Asn Lys Glu Arg Asp Ala Arg Leu Asn Pro
100 105 110
Asn Gln Trp Trp Lys Val Phe Asp Glu Ser Val Thr His Phe Arg Phe
115 120 125
Ala Phe Ile Ser Gly Ser Phe Thr Gly Gly Phe Lys Asp Arg Ile Glu
130 135 140
Leu Ile Ser Met Arg Ser Gly Ile Cys Gly Ala Ala Val Asn Ser Val
145 150 155 160
Asn Leu Leu Leu Met Ala Glu Glu Leu Lys Ser Gly Arg Leu Asp Tyr
165 170 175
Glu Glu Trp Phe Gln Tyr Phe Asp Asn Asp Glu Ile Ser Phe
180 185 190
<210> 65
<211> 192
<212> PRT/БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 65
Gln Glu Leu Lys Asp Glu Gln Ala Glu Lys Arg Lys Ala Lys Phe Leu
1 5 10 15
Lys Glu Thr Asn Leu Pro Met Lys Tyr Ile Glu Leu Leu Asp Ile Ala
20 25 30
Tyr Asp Gly Lys Arg Asn Arg Asp Phe Glu Ile Val Thr Met Glu Leu
35 40 45
Phe Arg Asn Val Tyr Arg Leu His Ser Lys Leu Leu Gly Gly Gly Arg
50 55 60
Lys Pro Asp Gly Leu Leu Tyr Gln Asp Arg Phe Gly Val Ile Val Asp
65 70 75 80
Thr Lys Ala Tyr Gly Lys Gly Tyr Ser Lys Ser Ile Asn Gln Ala Asp
85 90 95
Glu Met Ile Arg Tyr Ile Glu Asp Asn Lys Arg Arg Asp Glu Asn Arg
100 105 110
Asn Pro Ile Lys Trp Trp Glu Ala Phe Pro Asp Thr Ile Pro Glu Phe
115 120 125
Tyr Phe Met Trp Val Ser Ser Lys Phe Ile Gly Lys Phe Gln Glu Gln
130 135 140
Leu Asp Tyr Thr Ser Asn Glu Thr Gln Ile Lys Gly Ala Ala Leu Asn
145 150 155 160
Val Glu Gln Leu Leu Leu Gly Ala Asp Leu Val Leu Lys Gly Gln Leu
165 170 175
His Ile Ser Asp Leu Pro Ser Tyr Phe Gln Asn Lys Glu Ile Glu Phe
180 185 190
<210> 66
<211> 189
<212> PRT/БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 66
Lys Val Ser Lys Thr Asn Ile Leu Glu Leu Lys Asp Asn Thr Arg Glu
1 5 10 15
Lys Leu Val Tyr Leu Asp His Arg Tyr Leu Ser Leu Phe Asp Leu Ala
20 25 30
Tyr Asp Asp Lys Ala Ser Arg Asp Phe Glu Ile Gln Thr Ile Asp Leu
35 40 45
Leu Ile Asn Glu Leu Gln Phe Lys Gly Leu Arg Leu Gly Glu Arg Arg
50 55 60
Lys Pro Asp Gly Ile Ile Tyr Gly Val Asn Gly Val Ile Ile Asp Asn
65 70 75 80
Lys Ala Tyr Ser Lys Gly Tyr Asn Leu Pro Ile Arg Gln Ala Asp Glu
85 90 95
Met Ile Arg Tyr Ile Gln Glu Asn Gln Ser Arg Asp Glu Lys Leu Asn
100 105 110
Pro Asn Lys Trp Trp Glu Asn Phe Glu Glu Glu Thr Ser Lys Phe Asn
115 120 125
Tyr Leu Phe Ile Ser Ser Lys Phe Ile Ser Gly Phe Lys Lys Asn Leu
130 135 140
Gln Tyr Ile Ala Asp Arg Thr Gly Val Asn Gly Gly Ala Ile Asn Val
145 150 155 160
Glu Asn Leu Leu Cys Phe Ala Glu Met Leu Lys Ser Gly Lys Leu Glu
165 170 175
Tyr Asn Asp Phe Phe Asn Gln Tyr Asn Asn Asp Glu Ile
180 185
<210> 67
<211> 185
<212> PRT/БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
полипептид
<400> 67
Ile Glu Glu Gln Lys Ala Ile Phe Leu Gln Lys Thr Lys Leu Pro Leu
1 5 10 15
Ser Tyr Ile Glu Leu Leu Glu Ile Ala Arg Asp Gly Lys Arg Ser Arg
20 25 30
Asp Phe Glu Phe Ile Thr Met Glu Leu Phe Lys Asn Ile Tyr Lys Ile
35 40 45
Asn Ala Arg Ile Leu Gly Gly Ala Arg Lys Pro Asp Gly Val Leu Tyr
50 55 60
Met Pro Glu Phe Gly Val Ile Val Asp Thr Lys Ala Tyr Ala Asp Gly
65 70 75 80
Tyr Ser Lys Ser Ile Ala Gln Ala Asp Glu Met Ile Arg Tyr Ile Glu
85 90 95
Asp Asn Lys Arg Arg Asp Pro Ser Arg Asn Ser Thr Lys Trp Trp Glu
100 105 110
His Phe Pro Thr Ser Ile Asn Asn Phe Tyr Phe Leu Trp Val Ser Ser
115 120 125
Val Phe Val Asn Lys Phe His Glu Gln Leu Ser Tyr Thr Ala Gln Glu
130 135 140
Thr Gln Thr Val Gly Ala Ala Leu Ser Val Glu Gln Leu Leu Leu Gly
145 150 155 160
Ala Asp Ser Val Leu Lys Gly Asn Leu Thr Thr Glu Lys Phe Ile Asp
165 170 175
Ser Phe Lys Asn Gln Glu Ile Val Phe
180 185
<210> 68
<211> 9
<212> PRT/БЕЛОК
<213> Неизвестен
<220>
<223> Описание неизвестной последовательности:
Последовательность пептидного мотива семейства "LAGLIDADG"
<400> 68
Leu Ala Gly Leu Ile Asp Ala Asp Gly
1 5
<210> 69
<211> 4
<212> PRT/БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 69
Asn Glu Leu Asp
1
<210> 70
<211> 4
<212> PRT/БЕЛОК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
пептид
<400> 70
Cys Lys Lys Arg
1
<210> 71
<211> 18
<212> DNA/ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
олигонуклеотид
<400> 71
tgtcaggatt gggttccg 18
<210> 72
<211> 18
<212> DNA/ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический
олигонуклеотид
<400> 72
ctcctgaaag tggccggg 18
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИГЕНСВЯЗЫВАЮЩИЕ ПОЛИПЕПТИДНЫЕ КОНСТРУКЦИИ, СОДЕРЖАЩИЕ ЛЕГКИЕ ЦЕПИ КАППА И ЛЯМБДА, И ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2824193C2 |
| МОЛЕКУЛЫ АНТИТЕЛ ПРОТИВ ВИРУСА BK | 2021 |
|
RU2835801C1 |
| ТАУ-ПЕПТИДНЫЕ ИММУНОГЕННЫЕ КОНСТРУКЦИИ | 2018 |
|
RU2798972C2 |
| НОВАЯ ИЗОФОРМА ТРИПСИНА И ЕЕ ПРИМЕНЕНИЕ | 2016 |
|
RU2814729C2 |
| АНТИТЕЛА К CD40 И ПУТИ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2752049C2 |
| НОВЫЕ ИЗОФОРМЫ ТРИПСИНА И ИХ ПРИМЕНЕНИЕ | 2016 |
|
RU2739945C2 |
| ТРОМБОЛИТИКИ ДЛЯ ВНУТРИСОСУДИСТЫХ ТРОМБОВ | 2020 |
|
RU2822136C1 |
| СПОСОБЫ ДЛЯ БЕСШОВНОГО ВНЕСЕНИЯ ЦЕЛЕВЫХ МОДИФИКАЦИЙ В НАПРАВЛЕННЫЕ ВЕКТОРЫ | 2020 |
|
RU2771374C1 |
| МЫШИ, СОДЕРЖАЩИЕ МУТАЦИИ, ВСЛЕДСТВИЕ КОТОРЫХ ЭКСПРЕССИРУЕТСЯ УКОРОЧЕННЫЙ НА С-КОНЦЕ ФИБРИЛЛИН-1 | 2017 |
|
RU2721125C1 |
| СТАБИЛИЗИРОВАННЫЕ ПРЕПАРАТЫ, СОДЕРЖАЩИЕ АНТИТЕЛА ПРОТИВ NGF | 2019 |
|
RU2728575C1 |

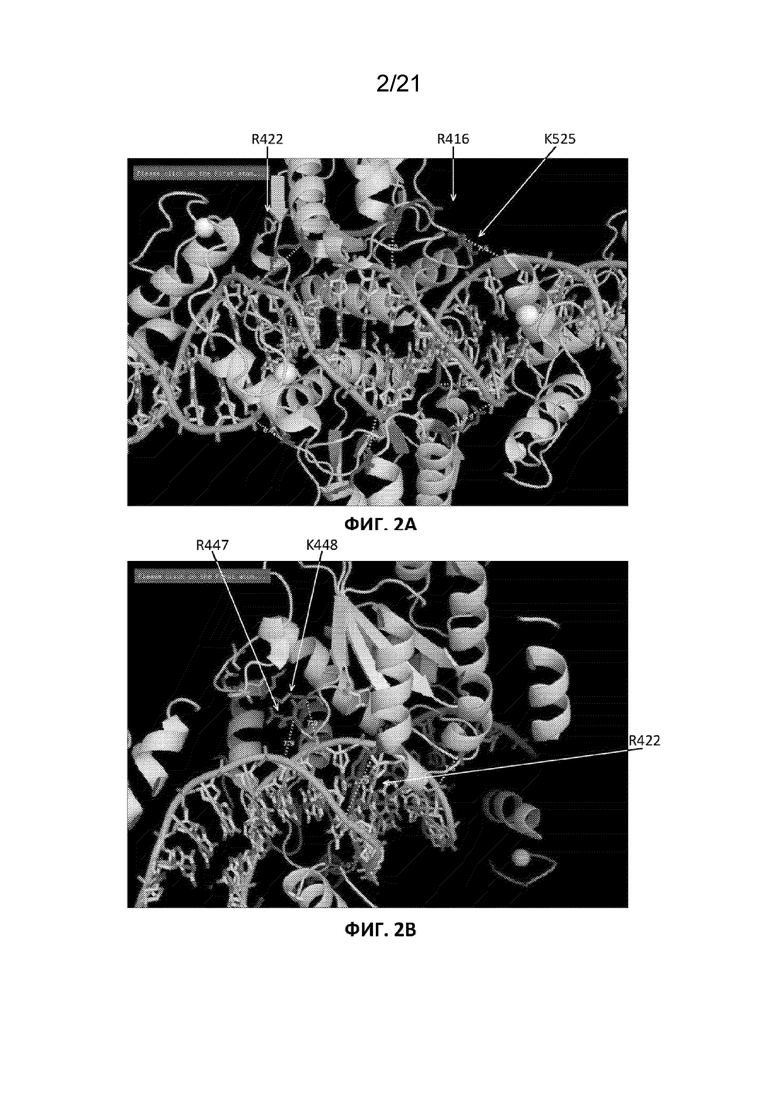
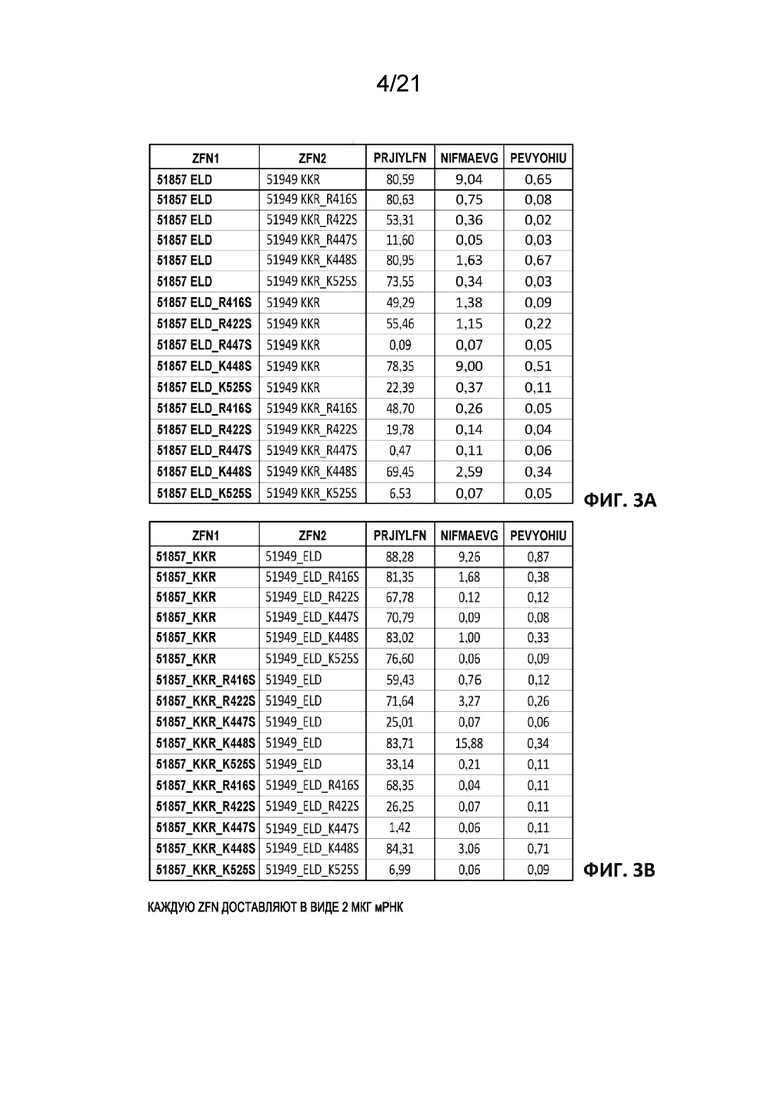
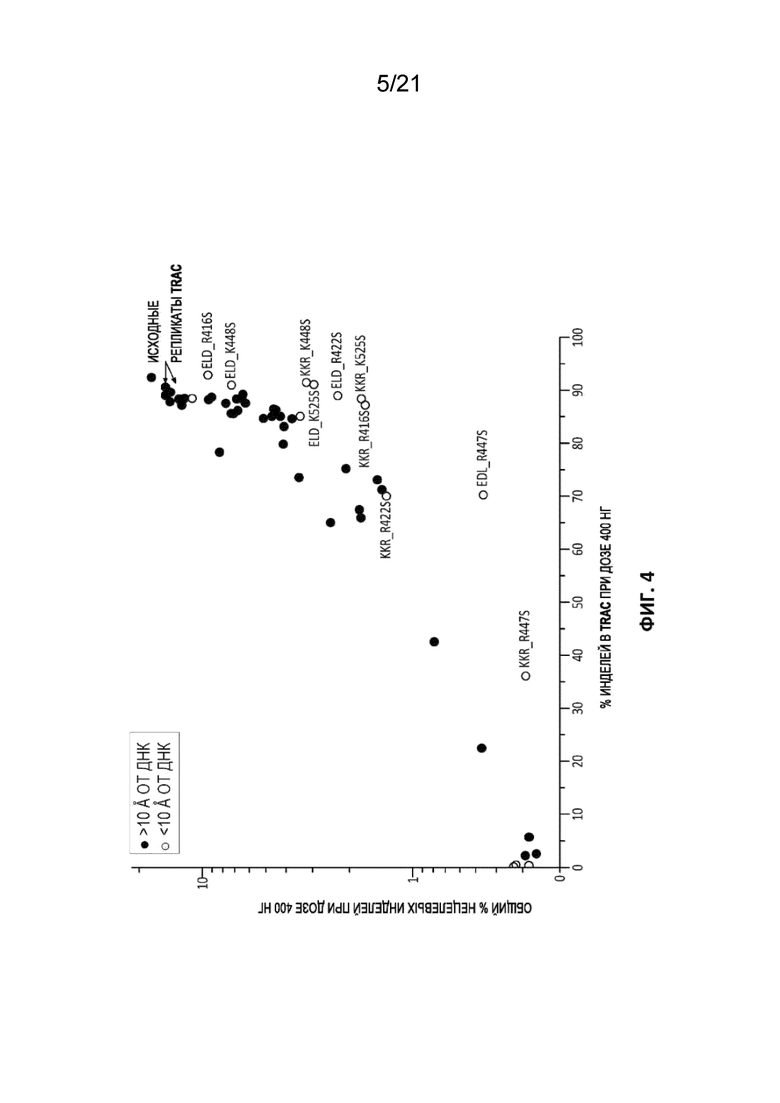
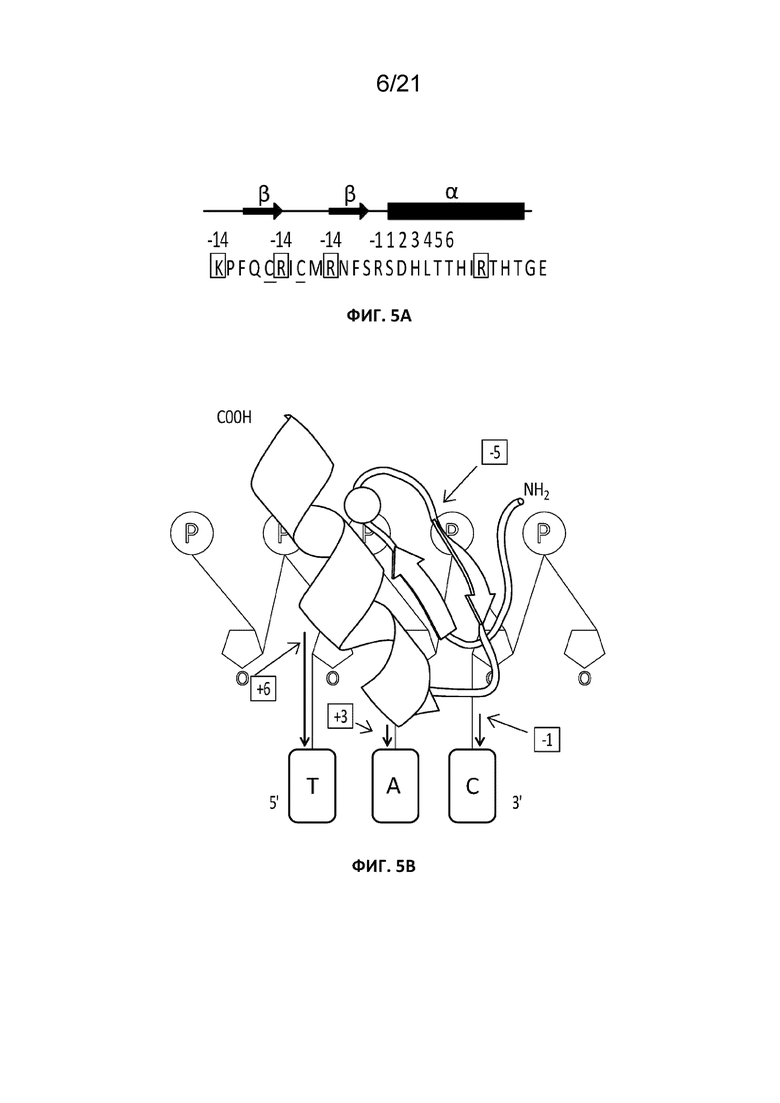
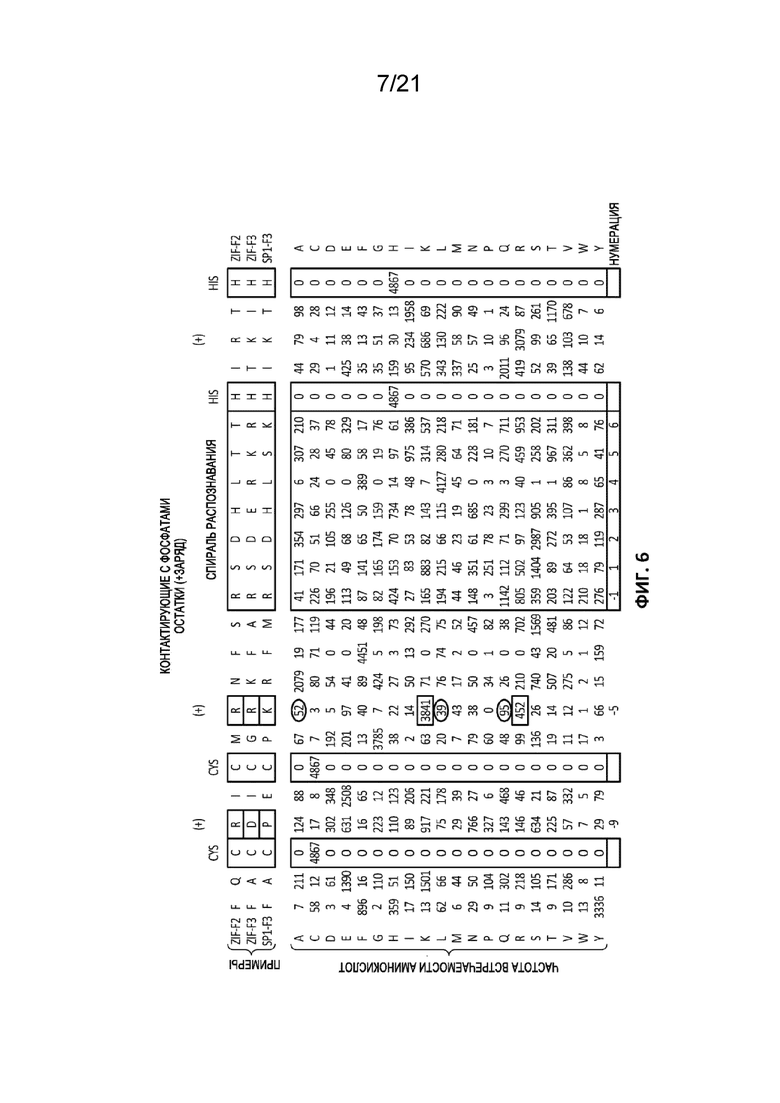
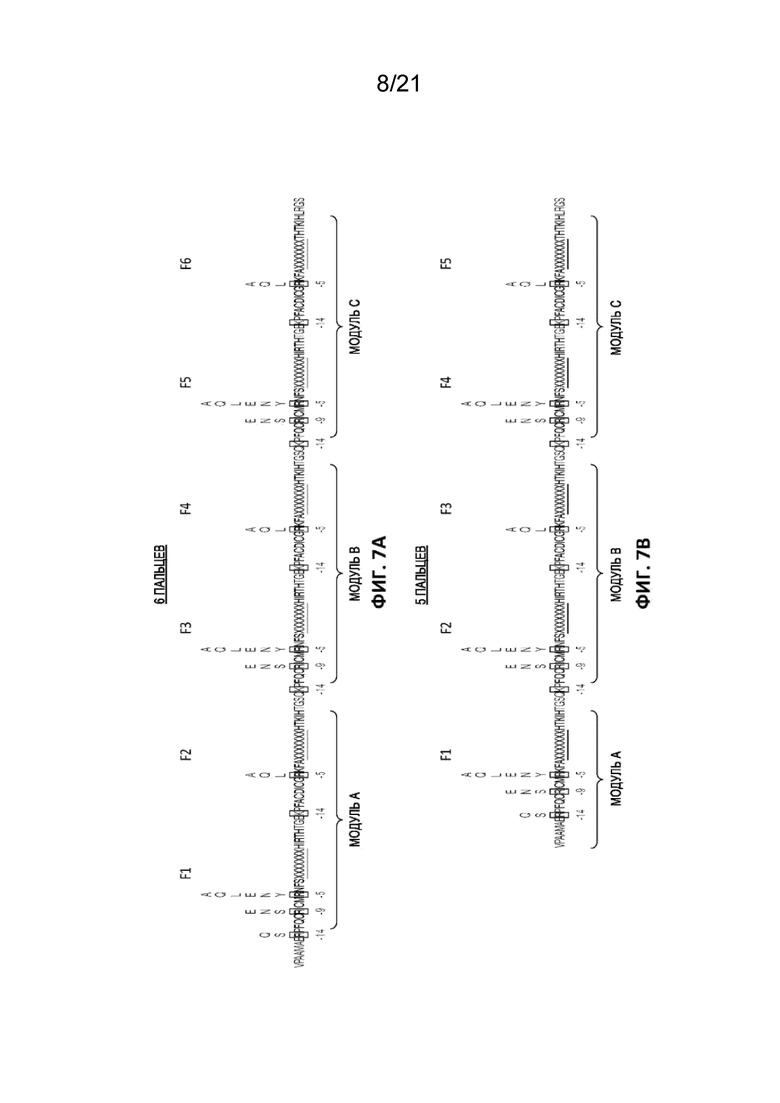
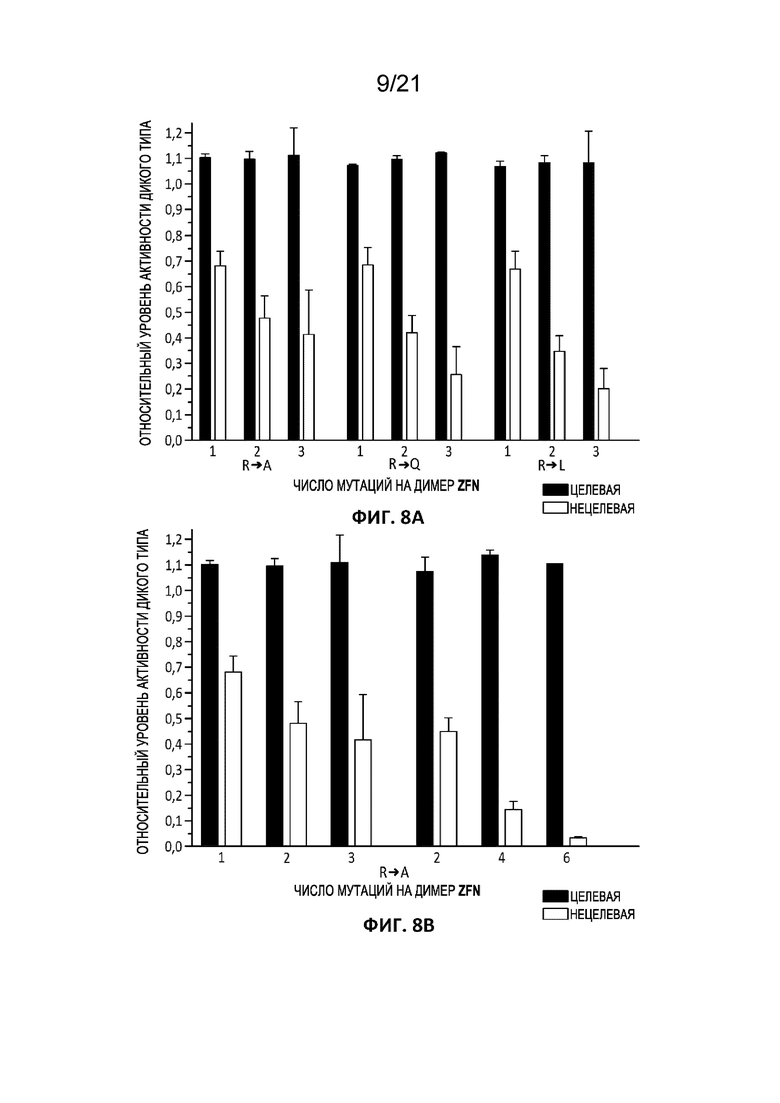
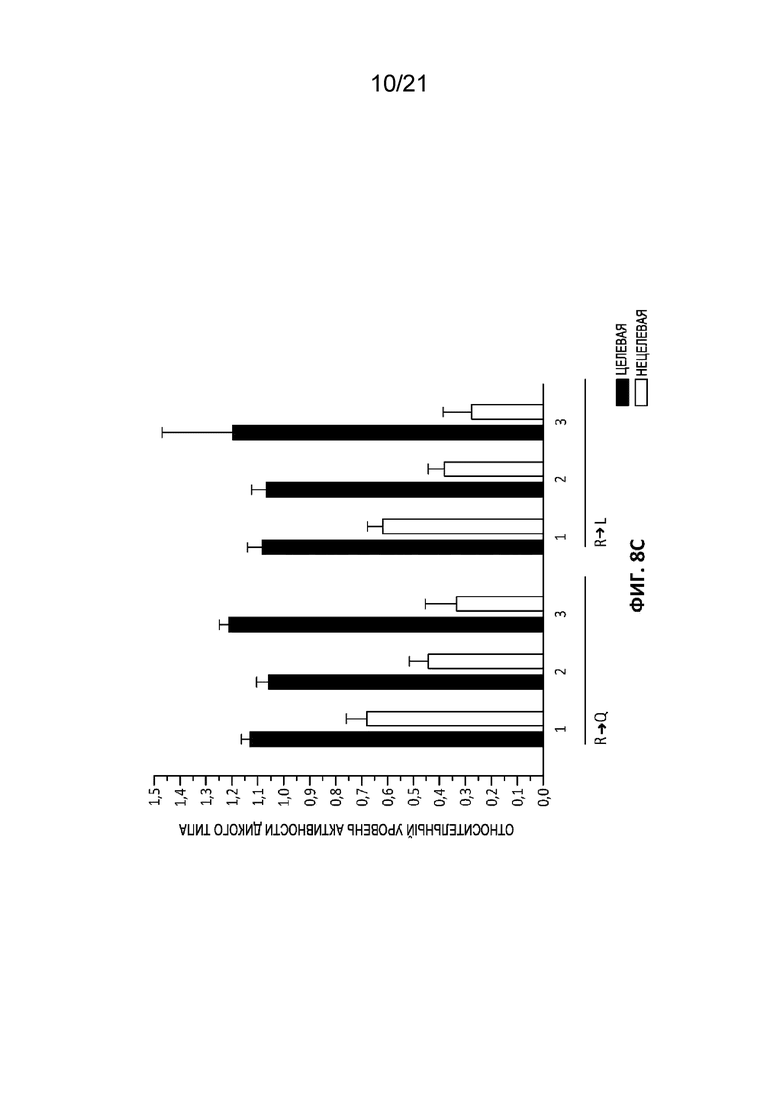
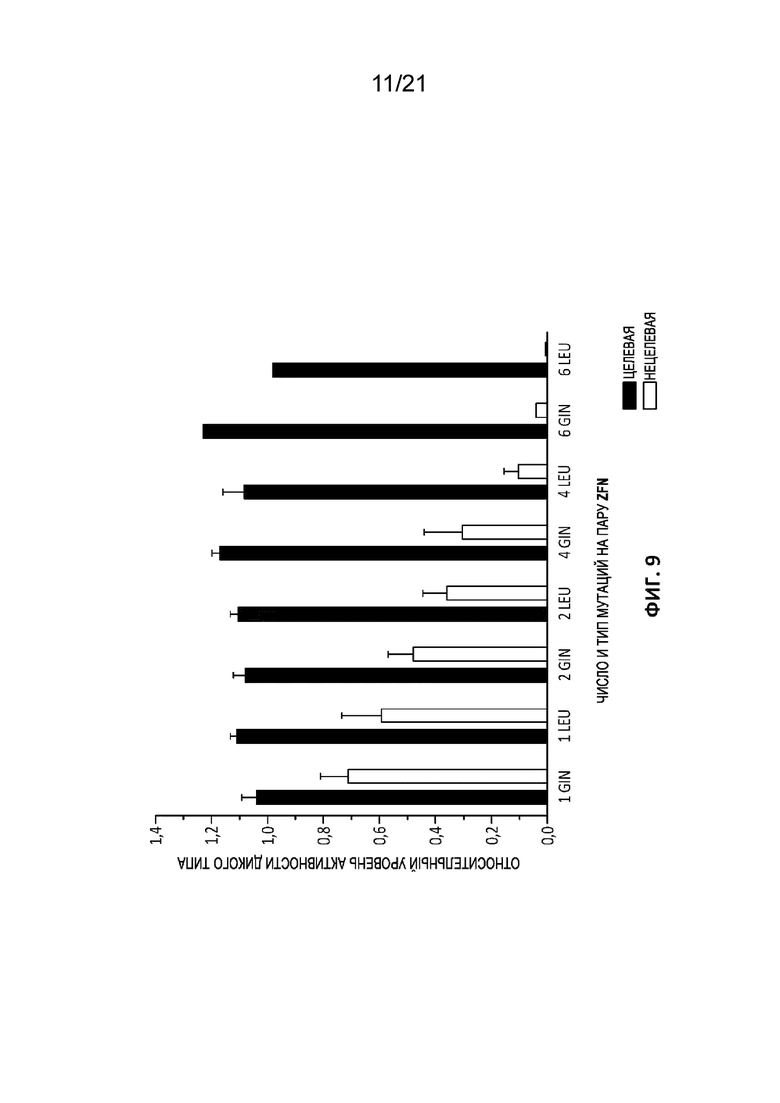
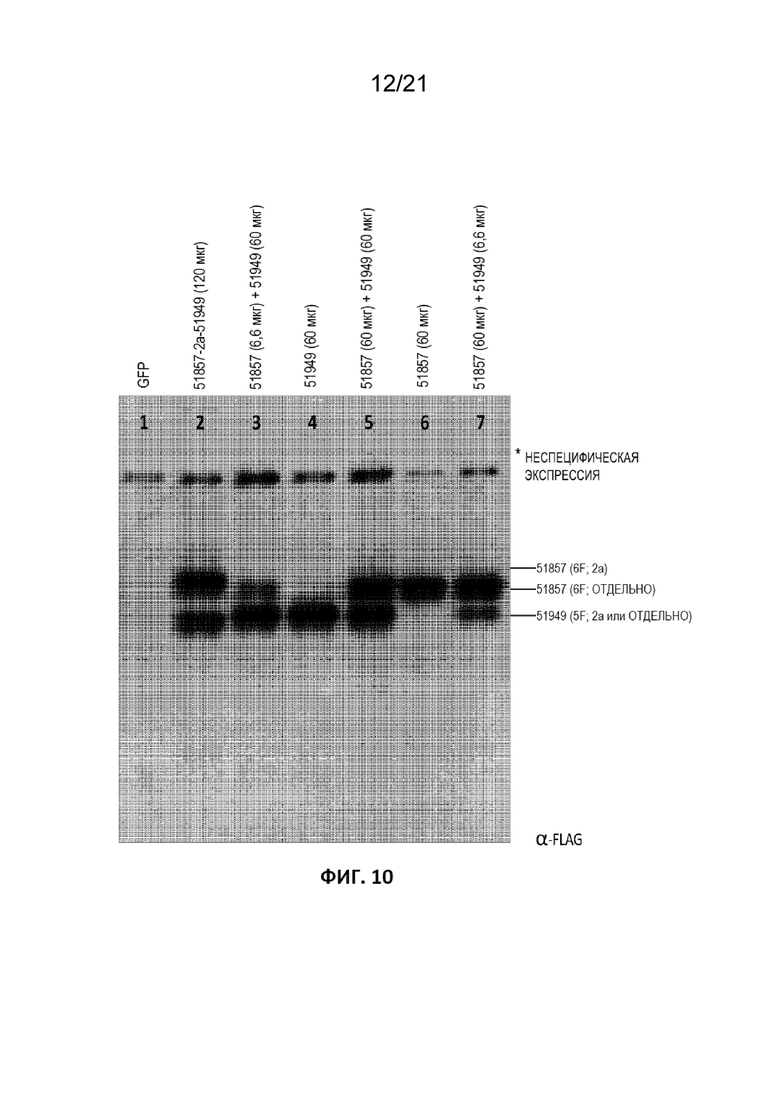

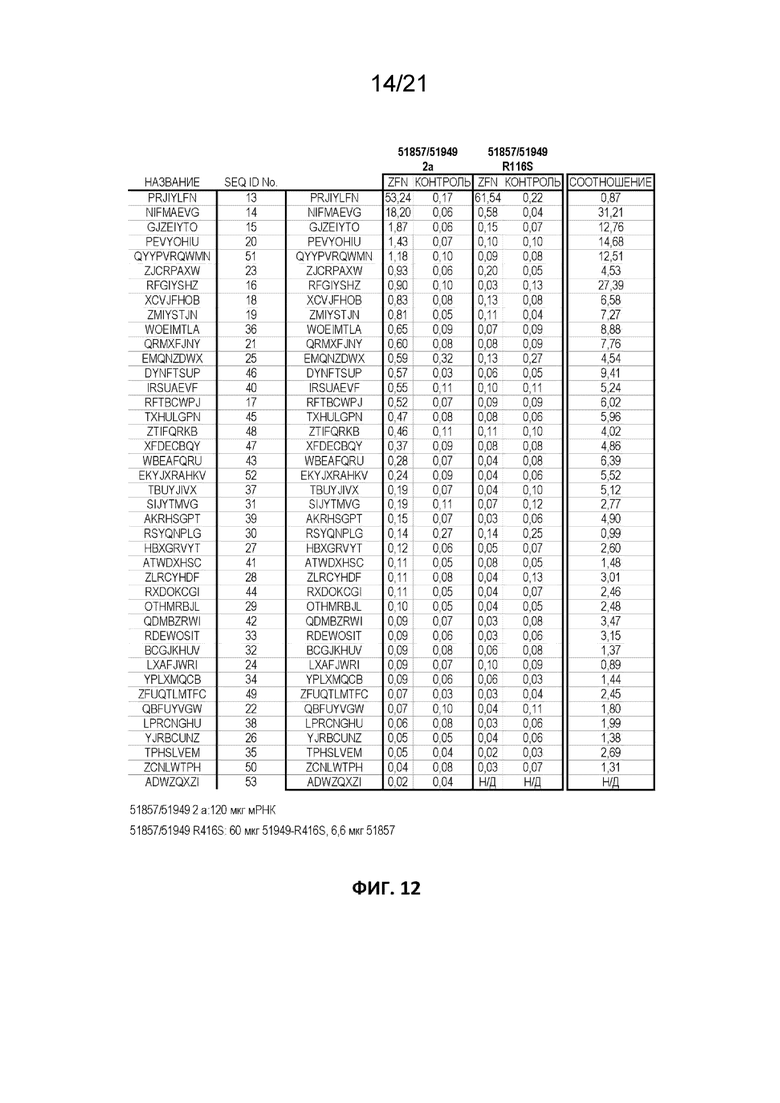
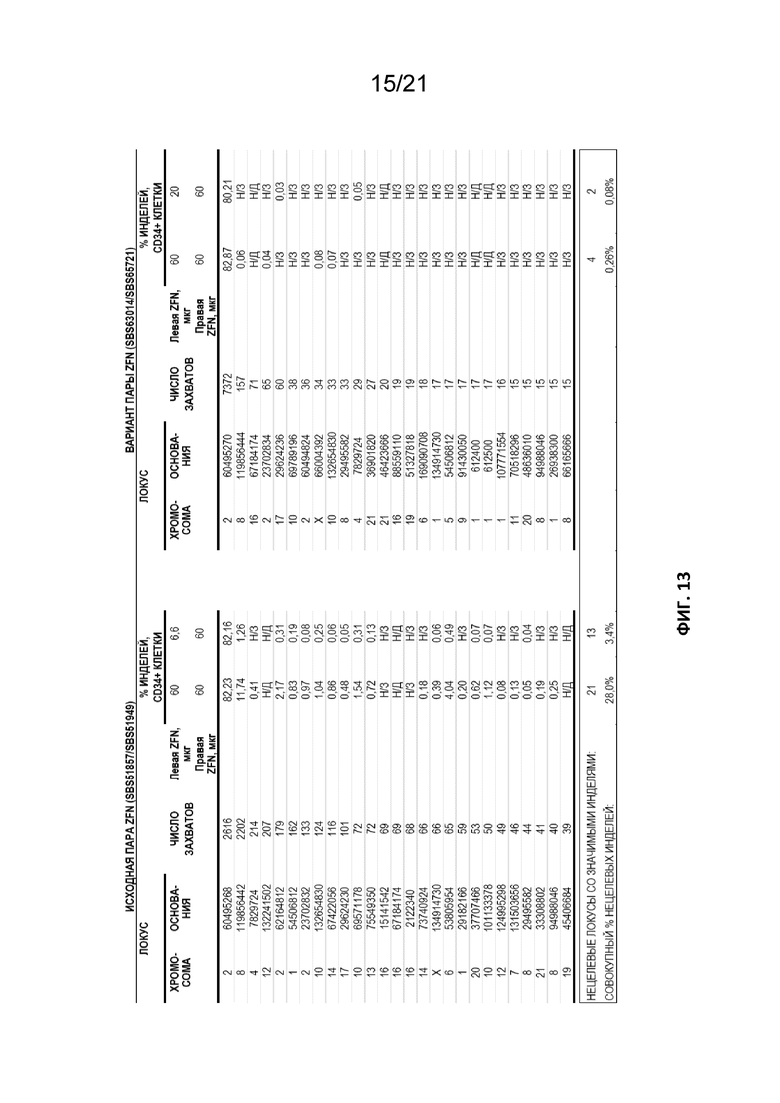
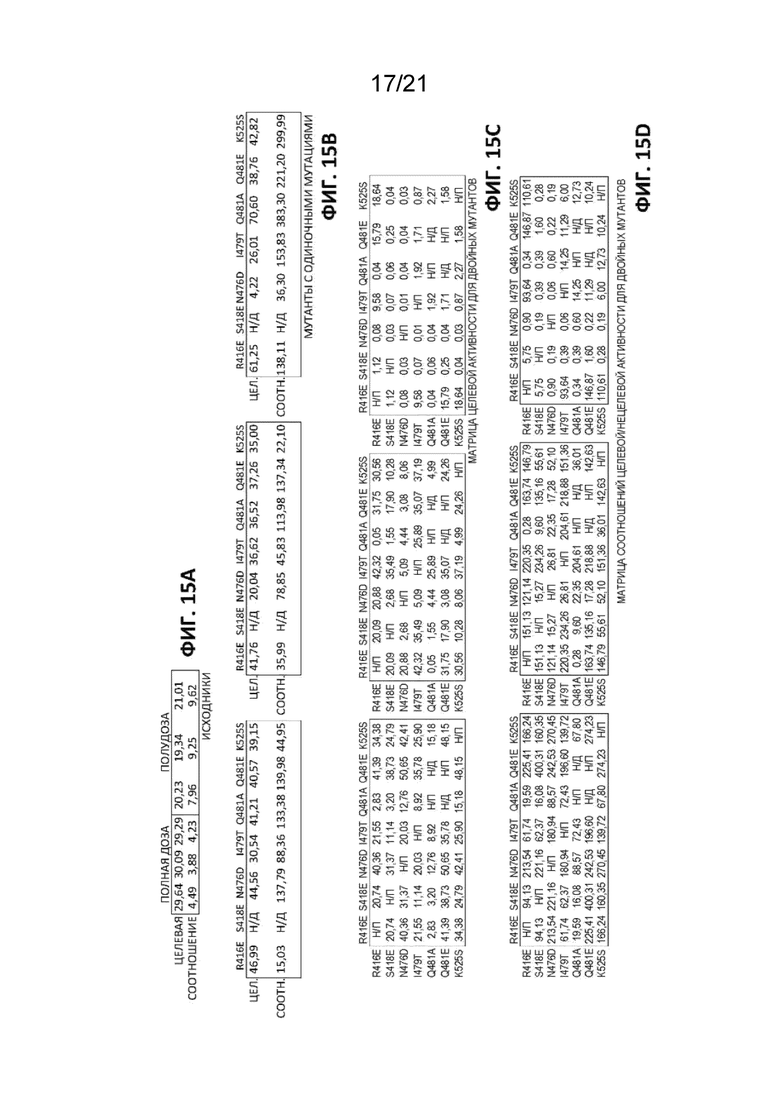



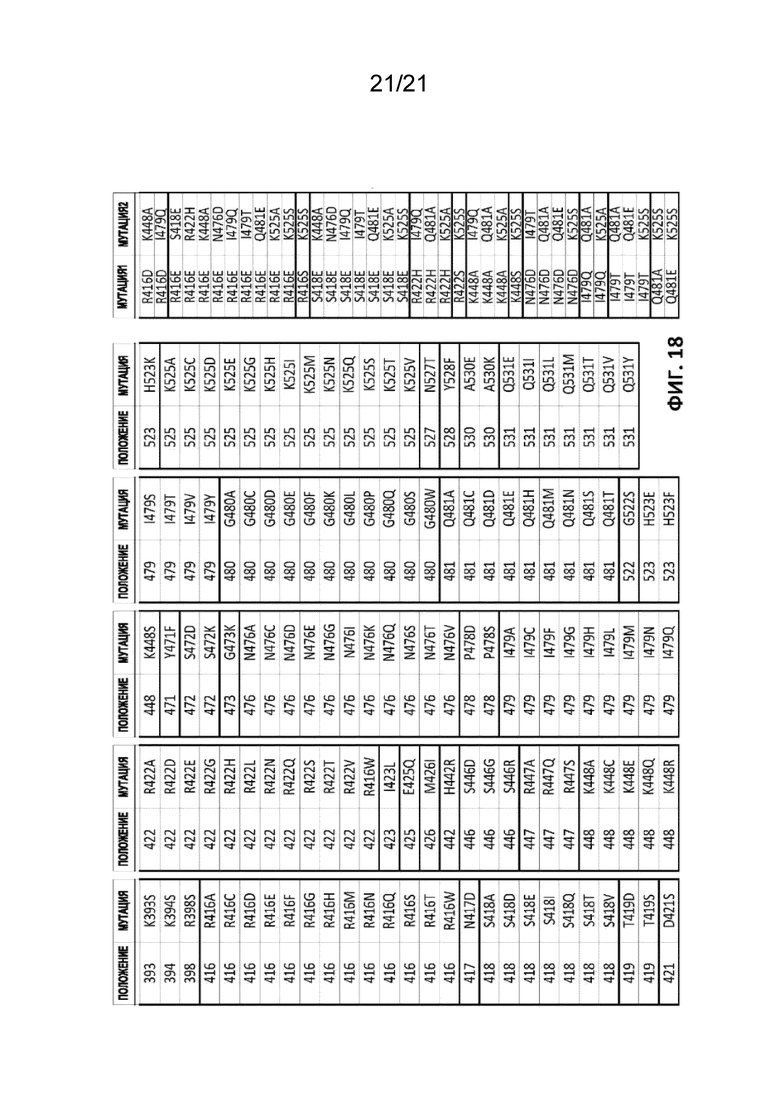
Изобретение относится к биотехнологии и медицине и представляет собой сконструированный полудомен расщепления FokI. Изобретение относится также к сконструированной нуклеазе, содержащей указанный домен расщепления, а также представляет собой способ расщепления геномного клеточного хроматина в представляющей интерес области, включающий экспрессию искусственной нуклеазы, содержащей cконструированный домен расщепления в клетке, причем нуклеаза сайт–специфически расщепляет последовательность нуклеотидов в представляющей интерес области геномного клеточного хроматина. Изобретение обеспечивает получение эффективной системы расщепления для уменьшения нецелевой расщепляющей активности. 11 н. и 6 з.п. ф-лы, 18 ил., 18 табл., 9 пр.
1. Cконструированный полудомен расщепления FokI, причем cконструированный полудомен расщепления содержит одну или более из следующих мутаций в форме замен:
(i) остаток Gln (Q) дикого типа в положении 481 заменен остатком Ala (A), Cys (C), Asp (D), Ser (S) или Glu (E) (Q481A, Q481C, Q481D, Q481S или Q481E);
(ii) остаток Ser (S) дикого типа в положении 418 заменен остатком Glu (E) или Asp (D) (S418E или S418D);
(iii) остаток Ile (I) дикого типа в положении 479 заменен остатком Gln (Q) или Thr (T) (I479Q или I479T);
(iv) остаток Pro (P) дикого типа в положении 478 заменен остатком Asp (D) (P478D);
(v) остаток Lys (K) дикого типа в положении 525 заменен остатком Ala (A), Cys (C), Glu (E), Ile (I), Ser (S), Thr (T) или Val (V) (K525A, K525C, K525E, K525I, K525S, K525T или K525V);
(vi) остаток Arg (R) дикого типа в положении 416 заменен остатком Asp (D), Glu (E), His (H) или Asn (N) (R416D, R416E, R416H или R416N);
(vii) остаток Gly (G) дикого типа в положении 480 заменен остатком Asp (D) (G480D);
(viii) остаток Ser (S) дикого типа в положении 472 заменен остатком Asp (D) (S472D);
(ix) остаток Asn (N) дикого типа в положении 476 заменен остатком Glu (E) или остатком Gly (G) (N476E или N476G);
(x) остаток Asn (N) дикого типа в положении 527 заменен остатком Asp (D) (N527D);
(xi) остаток Gln (Q) дикого типа в положении 531 заменен остатком Arg (R) или Thr (T) (Q531R или Q531T);
(xii) остаток Arg (R) дикого типа в положении 422 заменен остатком His (H) (R422H);
(xiii) остаток Ser (S) дикого типа в положении 446 заменен остатком Asp (D) (S446D);
(xiv) остаток дикого типа в положении 448 заменен остатком Ala (A) (K448A);
(xv) остаток His (H) дикого типа в положении 523 заменен остатком Glu (E) (H523E);
(xvi) остаток Leu (L) дикого типа в положении 424 заменен остатком Phe (F) (L424F); и/или
(xvii) остаток Asn (N) дикого типа в положении 542 заменен остатком Asp (D) (N542D),
причем нумерация остатков аминокислот соответствует полноразмерному домену расщепления FokI дикого типа, как показано в SEQ ID NO: 1, и причем, кроме того, в дополнение к одной или более мутации в форме замен (i) - (xvii) cконструированный домен расщепления в случае необходимости дополнительно содержит добавочную мутацию аминокислоты в одном или более из положений 432, 441, 483, 486, 487, 490, 496, 499, 527, 537, 538 и 559.
2. Cконструированный полудомен расщепления по п. 1, содержащий следующие мутации: мутации R416E и R422H; мутации R416D и R422H; мутации R416E и K448A; мутации K448A и I479Q; мутации K448A и Q481A; или мутации K448A и K525A.
3. Cконструированный полудомен расщепления по п. 1, в котором остаток дикого типа в положении 481 заменен на Ala (A).
4. Гетеродимер, содержащий
(i) первый белок, содержащий cконструированный полудомен расщепления FokI по любому из пп. 1-3, и
(ii) второй белок, содержащий дикого типа или cконструированный полудомен расщепления FokI, причем гетеродимер сайт-специфически расщепляет нуклеотидную последовательность.
5. Искусственная нуклеаза, содержащая cконструированный полудомен расщепления по любому из пп. 1-3, и ДНК-связывающий домен, причем ДНК-связывающий домен содержит белок с цинковыми пальцами (ZFP), домен TALE-эффектора или одиночную направляющую РНК (онРНК).
6. Искусственная нуклеаза по п. 5, в которой ДНК-связывающий домен представляет собой ZFP и искусственная нуклеаза представляет собой нуклеазу с цинковыми пальцами (ZFN), включающую первую и вторую ZFN.
7. Искусственная нуклеаза по п. 6, в которой указанный белок с цинковыми пальцами первой или второй ZFN содержит одну или более мутацию в положениях -14, -9 и -5.
8. Полинуклеотид для получения искусственной нуклеазы, кодирующий искусственную нуклеазу по любому из пп. 5-7.
9. Композиция для доставки полинуклеотидов в целевую клетку, содержащая первый и второй полинуклеотиды, кодирующие гетеродимер по п. 4.
10. Выделенная клетка, содержащая композицию по п. 9, в которой гетеродимер сайт-специфически расщепляет нуклеотидную последовательность в клетке.
11. Способ расщепления геномного клеточного хроматина в представляющей интерес области, включающий:
экспрессию искусственной нуклеазы, содержащей cконструированный домен расщепления по любому из пп. 5-7, в клетке,
причем нуклеаза сайт-специфически расщепляет последовательность нуклеотидов в представляющей интерес области геномного клеточного хроматина.
12. Способ по п. 11, дополнительно включающий приведение клетки в контакт с донорным полинуклеотидом; причем расщепление клеточного хроматина облегчает гомологичную рекомбинацию между донорным полипептидом и клеточным хроматином.
13. Способ по п. 11, в котором искусственная нуклеаза представляет собой ZFN, включающую первую и вторую ZFN, экспрессируемую из первого и второго полинуклеотидов, и в котором соотношение первой и второй ZFN не составляет один к одному и необязательно представляет собой соотношение 1:2, 1:3, 1:4, 1:5, 1:6, 1:8, 1:9, 1:10, 1:20 или 1:30.
14. Способ расщепления по меньшей мере двух целевых сайтов в геномном клеточном хроматине, включающий
расщепление по меньшей мере первого и второго целевого сайта в геномном клеточном хроматине, причем каждый целевой сайт расщепляют с использованием композиции, содержащей две или более искусственных нуклеазы по любому из пп. 5-7.
15. Выделенная клетка для получения искусственной нуклеазы, содержащая искусственную нуклеазу по любому из пп. 5-7.
16. Линия клеток для получения гетеродимера, содержащая композицию по п. 9.
17. Композиция для сайт-специфического расщепления нуклеотидной последовательности в клетке, содержащая первый и второй полинуклеотиды, кодирующие соответственно первую и вторую ZFN по п. 7 или п. 8, причем соотношение первой и второй ZFN не составляет один к одному, необязательно представляет собой соотношение 1:2, 1:3, 1:4, 1:5, 1:6, 1:8, 1:9, 1:10, 1:20 или 1:30.
| US 20080131962 A1, 05.06.2008 | |||
| US 20130130350 A1, 23.05.2013 | |||
| US 5356802 A1, 18.10.1994 | |||
| US 20180340189 A1, 29.11.2018 | |||
| RU 2014145942 A1, 10.06.2016. |
Авторы
Даты
2022-11-02—Публикация
2017-08-24—Подача