Изобретение относится к медицине, а именно к способам неинвазивного воздействия на ткани мозга и устройствам для его осуществления, и может быть использовано для восстановления и защиты функциональных свойств нейрональных тканей при нейродегенеративных нарушениях, в частности, при болезни Паркинсона.
Болезнь Паркинсона (БП) - второе по распространенности нейродегенеративное заболевание после болезни Альцгеймера, характеризующееся потерей дофаминергических нейронов в черной субстанции с последующей обширной потерей не дофаминергических нейронов (Gandhi S. et al. PINK1-associated Parkinson's disease is caused by neuronal vulnerability to calcium-induced cell death // Molecularcell. - 2009. - V. 33. - №. 5. - P. 627-638). Симптомы ранней БП обычно трудно распознать, при этом латентный период от потери дофаминергических нейронов до появления симптомов составляет около 5 лет. В дополнение к таким тяжелым проявлениям БП как тремор, брадикинезия, беспокойство, депрессия и когнитивные нарушения, люди с БП страдают многочисленными сопутствующими заболеваниями: частыми инфекционными болезнями, сердечными, психическими и желудочно-кишечными расстройствами, вегетативными дисфункциями, затруднениями глотания, нарушениями сна, речи, а также травмами, связанными с потерей координации. Перед появлением симптомов у пациентов развиваются патологические изменения в головном мозге на клеточном уровне, которые не выявляются при скрининговой диагностике, например, методом магнитно-резонансной томографии. БП главным образом поражает пожилых людей и поэтому становится проблемой с высоким приоритетом из-за тенденции общего старения населения. В Европе распространенность БП составляет примерно 160 случаев на 100000 человек в возрасте старше 65 лет, и эта частота заболеваемости имеет тенденцию к росту в ближайшие годы (Dorsey Е.R. et al. Projected number of people with Parkinson disease in the most populous nations, 2005 through 2030 // Neurology. - 2007. - V. 68. - №. 5. - P. 384-386).
В настоящий момент существует несколько одобренных лекарственных препаратов, облегчающих ограниченное число симптомов БП. Недостатком таких средств является отсутствие возможности изменения патологических процессов, лежащих в основе БП.
Одним из перспективных направлений по устранению патологических состояний, вызванных БП, является применение фотобиомодуляции (ФБМ) для предотвращения процессов гибели клеток нейрональных тканей мозга.
Первые попытки лечения заболеваний центральной и периферической нервной системы с применением излучения аргонового лазера для защиты клеток тканей от гибели были предприняты в 1960-х годах (Fork R.L. Laser stimulation of nerve cells in Aplysia // Science. - 1971. - V. 171. - №. 3974. - P. 907-908), вскоре после этого была опубликована работа о положительном воздействии излучения рубинового лазера (Mester Е. et al. The stimulating effect of low power laser rays on biological systems. - Medical Univ., Budapest, 1968).
Для ФБМ характерно использование красного или ближнего инфракрасного оптического излучения на уровнях интенсивности, которые не приводят к существенному нагреву ткани. Внедрение светодиодов сделало этот подход более доступным, так как светодиоды безопаснее и дешевле, чем ранее использовавшиеся лазерные источники. Еще одним фактором, который привел ФБМ к более широкому распространению, является существенный прогресс в понимании механизмов действия лазерного излучения на молекулярном и клеточном уровнях. В частности, понимание молекулярных механизмов функционирования мозга позволяет оценить возможные эффекты воздействия оптического излучения на нервные клетки. Одним из физиологических примеров естественной ФБМ является регуляция секреции мелатонина эпифизом под воздействием видимого света для поддержания циркадного ритма и сна (Hattar S. et al. Melanopsin-containing retinal ganglion cells: architecture, projections, and intrinsic photosensitivity // Science. - 2002. - V. 295. - №. 5557. - P. 1065-1070).
Несмотря на то, что в развитие нейродегенеративных заболеваний вовлечены разные типы тканей и клеток, в большинстве случаев инициирующие факторы их возникновения связаны с митохондриальными патологиями (Lezi Е., Swerdlow R.Н. Mitochondria in neurodegeneration //Advances in Mitochondrial Medicine. - 2012. - №942. - P. 269-286). Известны три белковые структуры, способные поглощать свет в диапазоне инфракрасного излучения: гемоглобин, миоглобин и цитохром с-оксидаза (Jobsis F.F. et al. Reflectance spectrophotometry of cytochrome aa3 in vivo // Journal of applied physiology. - 1977. - V. 43. - №. 5. - P. 858-872; Cooper С.E., Springett R. Measurement of cytochrome oxidase and mitochondrial energetics by near-infrared spectroscopy // Philosophical Transactions of the Royal Society of London. Series B: Biological Sciences. - 1997. - V. 352. - №. 1354. - P. 669-676, Galkin A. et al. Synthesis of optically active amino acids from alpha-keto acids with Escherichia coli cells expressing heterologous genes // Applied and environmental microbiology. - 1997. - V. 63. - №. 12. - P. 4651-4656). В то же время, только цитохром с-оксидаза напрямую связана с митохондриальной функцией и воздействие на нее потенциально может иметь терапевтический эффект для предотвращения и лечения нейродегенеративных заболеваний.
Цитохром с-оксидаза (комплекс IV митохондриальной электронной транспортной цепи) - терминальный фермент аэробной дыхательной цепи, катализирующий окисление цитохрома-с и восстановление молекулярного кислорода до воды. Комплекс IV вместе с комплексами I и III активно переносит протоны из митохондриального матрикса в межмембранное пространство, создавая протонный, а также электростатический градиенты. Обратный поток протонов управляет синтезом аденозинтрифосфата (АТФ) из аденозиндифосфата (АДФ) и фосфата комплексом V. Известно, что атомы меди в цитохром с-оксидазе поглощают свет в видимом и инфракрасном диапазонах спектра (Gibson Q.Н. etal. The reaction of cytochrome oxidase with cytochrome с // Journal of Biological Chemistry. - 1965. - V. 240. - №. 2. - P. 888-894, Karu T. Primary and secondary mechanisms of action of visible to near-IR radiation on cells // Journal of Photochemistry and photobiology B: Biology. - 1999. - V. 49. - №. 1. - P. 1-17). Таким образом, воздействие лазерного излучения на данный фермент является одним из главных возможных механизмов ФБМ живых клеток.
Имеется относительно мало работ по влиянию ФБМ на первичные нейроны, главным образом, вследствие того, что последние являются технически сложными для культивирования объектами. В то же время первичные культуры нейронов являются более адекватной моделью для исследования эффектов от влияющих агентов, чем клеточные линии, большинство из которых имеют раковое происхождение.
В работе по ФБМ на первичных нейронах (Wong-Riley М. Т. Т. etal. Photobiomodulation directly benefits primary neurons functionally inactivated by toxins: role of cytochrome с oxidase //Journal of Biological Chemistry. - 2005. - V. 280. - №. 6. - P. 4761-4771) были исследованы эффекты от воздействия инфракрасным излучением на культивируемые нейроны. Среди протестированных длин волн (670, 728, 770, 830 и 880 нм) наиболее эффективные (830 и 670 нм) соответствовали спектру поглощения окисленной цитохром с-оксидазы в ближнем инфракрасном диапазоне. Обнаруженные эффекты от облучения объяснялись поглощением цитохром с-оксидазой и увеличением продукции активных форм кислорода (АФК). Работа выполнялась на первичных культивируемых нейронах зрительной коры, подвергнутых воздействию излучения светодиодами различных длин волн. Повышение концентрации АТФ в клетке связано с клеточным метаболизмом и считается показателем жизнеспособности и здоровья клетки. Эти результаты показывают положительное влияние оптического излучения на клеточный метаболизм в культурах нейронных клеток in vitro.
ФБМ стимулирует синтез АТФ главным образом за счет активации цитохром с-оксидазы, при этом ингибитор этого фермента должен ослаблять действие ФБМ дозозависимым образом. Цианид (KCN) - известный мощный ингибитор цитохром с-оксидазы (Wikstrom М., Krab K.., Saraste М. Cytochromeoxidase-a synthesis. - AcademicPress, New York, 1981; (b) MF, 1981) - является цитотоксичным веществом. Даже в концентрации 10 MKMKCN вызывает значительное снижение активности данного фермента в культивируемых первичных нейронах. В концентрации от 10 до 10000 мкМ KCN индуцирует прогрессирующее снижение активности ферментов и жизнеспособности клеток. Ранее было показано, что воздействие лазерного излучения с длиной волны 670 нм, мощностью 4 Дж/см2 в течение 80 секунд два раза в день в течение 5 дней подряд способно компенсировать токсическое действие KCN (10-100 мкМ) на активность ферментов в первичных нейронах. Однако внесение более высоких концентраций KCN (более 1000 мкМ) приводило к увеличению гибели нейронов и компенсировало любое положительное воздействие лазерного излучения (Wong-Riley М. Т. Т. et al. Photobiomodulation directly benefits primary neurons functionally inactivated by toxins: role of cytochrome с oxidase // Journal of Biological Chemistry. - 2005. - V. 280. - №. 6. - P. 4761-4771).
В работе (Sharma S.K. et al. Dose response effects of 810 nm laser light on mouse primary cortical neurons // Lasers in surgery and medicine. - 2011. - V. 43. - №. 8. - P. 851-859) было установлено, что воздействие дозой 3 Дж/см2 лазерного излучения с длиной волны 810 нм дает улучшенную стимуляцию нейронов коры головного мозга. ФБМ повышала митохондриальный мембранный потенциал (ММП) выше исходного уровня, с повышением уровня АТФ и снижением продукции АФК и оксида азота (NO). Однако, если доза превышает оптимальные значения (в 100 раз больше в Дж/см2) ММП и продукция АТФ снижаются ниже исходного уровня, то наблюдается повышение уровней АФК и NO. Если клетки подвергаются негативным воздействиям, таким как окислительный стресс или эксайтотоксичность, снижающим уровень АТФ и жизнеспособность клеток, эффект ФБМ заключается в поднятии ММП до исходного уровня и увеличении уровня АТФ. Так как нейроны - это клетки с высоким уровнем метаболизма и более высокой активностью митохондрий в сравнении со многими другими типами клеток, положительные эффекты ФБМ в них могут быть более выражены, чем в других клетках. Возможно, это является причиной, почему ткани мозга лучше реагирует на ФБМ.
Потеря способности к апоптозу у клеток является основой в развитии многих патологических процессов, включая канцерогенез и неконтролируемую пролиферацию. Существует механизм индукции и ингибирования апоптоза с помощью синглетного кислорода. Синглетный кислород является АФК, участвующей в клеточной сигнализации таких процессов, как экспрессия генов, фотостарение и апоптоз (Zhuang S., Demirs J.Т., Kochevar I.E. Proteinkinase С inhibits singlet oxygen-induced apoptosis by decreasing caspase-8 activation // Oncogene. - 2001. - V. 20. - №. 46. - P. 6764-6776). Синглетный кислород - это общее название электронно-возбужденного состояния триплетного кислорода, которое менее стабильно, чем молекулярный кислород в основном электронном состоянии. Несмотря на высокую реакционную способность, время жизни синглетного кислорода в водных растворах выше, чем у большинства других АФК, за исключением перекиси водорода. С учетом этого синглетный кислород может участвовать в ряде физиологических процессов в качестве сигнальной и стимулирующей молекулы или в тех же реакциях, что и триплетный кислород, но с более высокой реакционной способностью. Имеются данные, что синглетный кислород образуется в клеточных ферментативных реакциях в ряде пероксидазных ферментов, включая миелопероксидазу, лактопероксидазу, хлоропероксидазу, во время реакций, катализируемых липоксигеназой (Davies М.J. Reactive species formed on proteins exposed to singlet oxygen // Photochemical & Photobiological Sciences. - 2004. - V. 3. - №. 1. - P. 17-25). Потенциально синглетный кислород может выделяться при разложении гидропероксидных липидов. Кроме того, синглетный кислород может образовываться в клетках под воздействием оптического излучения в присутствии фотосенсибилизаторов, которые способны продуцировать ряд других АФК. Данное свойство лежит в основе механизма их фототоксичности, которая может использована для селективного повреждения опухолевых тканей.
Такой подход активно применяется в фотодинамической терапии опухолевых заболеваний (Soleymani Т., Abrouk М., Kelly К. М. An analysis of laser therapy for the treatment of nonmelanoma skin cancer // Dermatologic surgery: official publication for American Society for Dermatologic Surgery [et al.]. - 2017. - V. 43. - №. 5. - P. 615).
Низкие дозы синглетного кислорода могут запускать физиологический митохондриальный биогенез за счет производства супероксида из убисемихинона, при этом более длительное окислительное воздействие является токсичным (Cadenas Е., Davies K. J. A. Mitochondrial free radical generation, oxidative stress, and aging // Free radical biology and medicine. - 2000. - V. 29. - №. 3-4. - P. 222-230). Способность инфракрасного лазерного излучения с длиной волны 1267 нм производить синглетный кислород в органическом растворе и в линии раковых клеток была продемонстрирована в работе по исследованию продукции синглетного кислорода (Anquez, F. Chapter 4 Production of Singlet Oxygen by Direct Photoactivation of Molecular Oxygen / F. Anquez, A. Sivery, I.E. Yazidi-Belkoura, J. Zemmouri, P. Suret, S. Randoux, E. Courtade // Singlet Oxygen: Applications in Biosciences and Nanosciences, Volume 1. The Royal Society of Chemistry. - 2016. - V. 1. - P. 75-91). Также показано, что глубина проникновения оптического излучения в интервале 1000-1350 нм по сравнению с излучением в интервале 700-1000 нм выше на 10% для тканей костей черепа и кожи, и на 35% - для тканей мозга (GolovynskyiS. et al. Optical windows for head tissues in near-infrared and short-wave infrared regions: Approaching transcranial light applications //Journal of biophotonics. - 2018. - T 11. - №. 12. - P. e201800141).
Для проведения ФБМ с целью предотвращения процессов нейродегенерации (патент US 2009254154, МПК A61F 7/00; A61N 5/06, 2009 г.) предлагается использовать лазерную импульсную терапию на длине волны 808 нм. Предложенным способом было достигнуто снижение амилоидной нагрузки в тканях мозга трансгенных мышей, склонных формировать амилоидные фибриллы к 6-месячному возрасту, приводящих к развитию болезни Альцгеймера. Недостатком данного метода является необходимость длительного курса облучения, в течение двух минут 3 раза в неделю на протяжении 6 месяцев, кроме этого, эффективность фототерапии доказана только при развитии начальных стадий патологии, которые на сегодняшний день не могут быть диагностированы в большинстве случаев.
Известен метод лечения неврологических расстройств, который осуществляется посредством воздействия с длинами волн от 200 до 2000 нм с мощностью от 10,01 до 20,00 Вт с одновременной терапией кетамином. Длительность каждой процедуры воздействия варьируется от 30 с до 30 мин, и может проводиться как в непрерывном, так и в импульсном режиме в ближнем инфракрасном диапазоне для минимизации нагрева поверхности ткани. Также предлагается использовать импульсное управление с периодом 1-1000 мс при дозе лазерного излучения ближнего инфракрасного диапазона 0,64-1,95 Дж/см2 (патент US 20180111004, МПК А61В 6/00; А61В 6/03; A61K 31/135; A61N 5/06, 2018 г.).
Недостатком данного метода является применение инфузий кетамина с целью активации внутренних процессов восстановления мозга, так как сопряжено с рисками угнетения дыхательного центра и центральной нервной системы.
Наиболее близким по технической сущности решением является способ, заключающийся в применении лазерного излучения с длиной волны 808 нм и мощностью 50 мВт/см2 на нейрональных клетках-предшественниках человека, который позволяет достичь двукратного повышения жизнеспособности клеток в сравнении с интактной культурой (патент US 2010105977; МПК А61Н 21/00, 2001 г.).
Недостатком указанного способа является то, что предлагаемая длина волны имеет не самую высокую проникающую способность в ткани головы в сравнении с другими используемыми областями ближнего инфракрасного излучения.
Известно устройство для обработки стволовых клеток с целью улучшения клеточной терапии для восстановления неврологических функций пациента при поражениях мозга, представленное лазером с длиной волны 808 нм и мощностью 50 мВт/см2, направленным с помощью адаптера и волоконно-оптического кабеля к поверхности клеточной культуры и позволяющим увеличить реакцию стволовых клеток на факторы дифференциации (например, факторы роста) по сравнению с контрольными клетками и повысить устойчивость к неблагоприятным факторам, таким как гипоксия (патент US 10913943 B2; МПК A61N 5/06, C12N 13/00, 2010 г.).
Также известно устройство для проведения стимуляции митогенных факторов и выживаемости клеточных культур, характеризующееся применением источника лазерного излучения, который имеет длину волны около 810 нм, плотность мощности около 1 мВт/см2, 50 мВт/см2 или 100 мВт/см2 и общую дозу излучения около 0,2-10 Дж (патент WO 2006105254 А2; МПК H01L 27/00, 2005 г.)
Общими недостатками указанных выше устройств является отсутствие данных в примере реализации изобретения об эффективности воздействия лазерного излучения на клетках, имеющих патологические изменения, что не может быть подтверждением заявляемых терапевтических свойств при поражении тканей мозга. Кроме этого, устройства не позволяют контролировать изменения температуры поверхности стекла с клеточной культурой, что затрудняет интерпретацию полученных результатов в связи с возможностью изменения исследуемых параметров под действием теплового эффекта от воздействия лазерного излучения.
Известно устройство для измерения температуры, позволяющее измерять температуру с контактной поверхности, содержащее датчики температуры, скомпонованные на различных глубинах относительно контактной поверхности (патент RU 2489690 C2; МПК G01K 1/16, МПК G01K 7/42,2013 г.).
Недостатком данного устройства является трудность его применения для измерения температуры тонкой стеклянной подложки с культурой живых клеток мозга при облучении лазерным излучением.
Технической задачей изобретения является защита нейронов и повышение их жизнеспособности на примере БП, благодаря восстановлению митохондриальной функции клеток мозга.
Поставленная задача защиты нейронов при БП достигается облучением клеточной культуры лазерным излучением ближнего инфракрасного диапазона с длиной волны 1267 нм, имеющим высокую проникающую способность в комплекс тканей головы, при выходной мощности от 65 до 187 Дж/см2 с дополнительным контролем температуры, для генерации низких доз синглетного кислорода. После облучения клетки выдерживаются в течение суток в инкубаторе для накопления эффекта от ФБМ. Для реализации поставленной задачи используется устройство для защиты нейронов при нейродегенеративных заболеваниях, содержащее персональный компьютер (ПК) с программным обеспечением, параллельно соединенные с ним драйверы, каждый из которых соединен с соответствующим блоком питания и через соответствующий источник непрерывного лазерного излучения подключен к волоконно-оптическому кабелю, соединенному с коллиматором, а также последовательно соединенные прецизионный датчик температуры, включенный в разработанную мостовую схему измерения с компенсацией нелинейности функции преобразования, аналого-цифровой преобразователь (АЦП) платы сбора данных и последовательно соединенные фотодиодный детектор и измеритель мощности.
Технический результат заключается в повышении выживаемости в iPSC-производных нейронах человека с мутациями, связанными с различными наследственными формами, при их облучении лазерным излучением с длиной волны 1267 нм в сравнении с клетками, которые не подвергались облучению.
Сущность изобретения поясняется следующими графическими материалами.
На фиг. 1 представлена схема устройства для защиты нейронов при нейродегенеративных заболеваниях; на фиг. 2 - график изменения температуры под воздействием лазерного излучения в области исследования; на фиг. 3 - график контроля индуцирования синглетного кислорода в культуре клеток под воздействием лазерного излучения; на фиг. 4 - гистограммы контроля клеточной смерти после воздействия лазерного излучения.
Способ осуществляют путем облучения клеточной культуры с помощью разработанного устройства (фиг. 1), содержащего источники 1 и 2, выходы которых через волоконно-оптический кабель 3 связаны с коллиматором 4. Вход источника 1 через драйвер 5 соединен с выходом ПК 6, а вход источника 2 через драйвер 7 соединен с другим выходом ПК 6, при этом вход драйвера 5 связан с блоком 8 питания, а вход драйвера 7 - с блоком 9 питания. Для контроля мощности лазерного излучения на выходе коллиматора 4в процессе проведения исследований установлен измеритель мощности 10, соединенный с фотодиодным детектором 11 для регистрации излучения в спектральном диапазоне 200-1100 нм и ПК 6. Для контроля изменения температуры к ПК 6 подключены последовательно соединенные прецизионный датчик 12 температуры (М622 Pt 2000, Heraeus, Германия), включенный в мостовую схему 13 измерения с компенсацией нелинейности функции преобразования и АЦП 14и ПК 6.
В качестве источников 1 и 2 непрерывного лазерного изучения используются лазерные диоды LD-1267-PM-500 и LD-1122-РМ-500 (Innolume GmbH, Германия), обеспечивающие воздействие на длинах волн 1276 и 1122 нм соответственно. Источник 2 с длиной волны 1122 нм добавлен в качестве контрольного лазера сравнения с целью обоснования использования длины волны 1267 нм источника 1 для выработки синглетного кислорода. Для питания источников 1 и 2 и изменения режимов их работы применяются специализированные драйверы 5и 7 с блоками 8 и 9 питания (SF8150-ZIF14, OOO «МАЙМАН ЭЛЕКТРОНИКС», Россия) соответственно. Управление работой источников 1 и 2 осуществляют через ПК 6 с помощью программного обеспечения MaimanBenchSoft. Доставку лазерного излучения от источников 1 и 2 к объекту исследования осуществляют с применением специально изготовленного волоконно-оптического кабеля 3с использованием кварцевого волокна, обеспечивающего передачу излучения с минимальным затуханием сигнала в спектральном диапазоне 400-2000 нм и числовой апертурой NA=0,22. Для формирования параллельного пучка световых лучей после волоконно-оптического кабеля 3 установлен коллиматор 4 (F280FC-C, ThorLabs, Inc., Германия). Применение коллиматора 4 позволяет обеспечить воспроизводимость экспериментальных исследований за счет исключения зависимости изменения освещенности объекта исследования от расстояния до торца волоконно-оптического кабеля 3 при расходящемся световом пучке. Диаметр пучка лазерного излучения на выходе коллиматора 4 при проведении исследований составляет 3,4 мм.
Перед проведением исследований была установлена зависимость между оптической мощностью на выходе волоконно-оптического кабеля 3и током блоков питания 8 и 9 для каждого из источников лазерного излучения 1 и 2 с помощью измерителя мощности 10 (РМ400, ThorLabs, Inc., Германия), соединенного с фотодиодным детектором 11(S122C, ThorLabs, Inc., Германия).
Важным параметром при проведении исследований, объектом которых выступают клеточные культуры, является температура среды, которая не должна превышать 37°С, в противном случае регистрируемые параметры и исследуемые механизмы будут изменяться под действием теплового эффекта. Для исключения данного фактора предварительно определена зависимость изменения температуры на поверхности покровного стекла с исследуемой культурой клеток от воздействия лазерного излучения с помощью прецизионного датчика 12 температуры (М622 Pt 2000, Heraeus, Германия), с инерционностью 0,25 с, порогом чувствительности 0,05°С, имеющего габаритные размеры 5,9×2,1 мм. Аналоговый сигнал, поступающий через АЦП 12 платы сбора данных (National Instruments, США) в ПК 13, обрабатывался в последнем с помощью разработанной программы в среде LabVIEW.
Полученные результаты (фиг. 2) показали, что воздействие лазерного излучения провоцировало изменение температуры в области исследования, однако уровень температуры в момент воздействия лазерного излучения был ниже 37°С, при этом прирост температуры (ΔT) составлял менее 6°С (ΔT (1267 нм, кривая 15) = 5,44°С; ΔT (1122 нм, кривая 16) = 2,14°С).
Для контроля генерации синглетного кислорода (фиг. 3) в культуре клеток под воздействием лазерного изучения (кривые 17 и 18 на длинах волн 1267 и 1122 нм соответственно) был использован флуоресцентный зонд Singlet Oxygen Sensor Green (SOSG) (Thermo Fisher Scientific Inc., США), который является коммерчески доступным флуоресцентным зондом. По данным, предоставленным компанией Thermo Fisher Scientific Inc., SOSG отличается высокой селективностью по отношению к синглетному кислороду и не проявляет заметной активности в отношении других АФК, включая гидроксильный радикал и супероксид (Singlet Oxygen Sensor Green Reagent, Product Information. // Molecular Probes / Thermo Fisher Scientific. - 2004. - 1-2 p.). Изначально зонд обладает слабой синей флуоресценцией с максимумами возбуждения 372 и 393 нм и эмиссией с максимумами 395 и 416 нм. При взаимодействии с синглетным кислородом, происходит его окисление, продукт которого характеризуется зеленой флуоресценцией, близкой к испусканию флуоресцеина (полосы возбуждения/испускания - 504/525 нм). Так как SOSG деградирует со временем, это обстоятельство было учтено в проведении эксперимента. Каждый раз использовался свежеприготовленный раствор SOSG. Регистрацию флуоресценции зонда осуществляли с помощью конфокального микроскопа ZEISS LSM 900 с системой Airyscan 2 (CarlZeiss AG, Германия) при возбуждении на длине волны 488 нм.
Загрузка клеточной культуры SOSG (10 мМ) приводит к медленному окислению этого зонда. При включении лазерного излучения с длиной волны 1267 нм наблюдалось резкое возрастание интенсивности флуоресценции. При облучении клеточной культуры лазерным излучением с длиной волны 1122 нм интенсивность флуоресценции SOSG практически не изменилась.
Нейропротекторный эффект от воздействия лазерным излучением с длиной волны 1267 нм исследовался на человеческих нейронах, полученных из индуцированных плюрипотентных стволовых клеток (iPSCs), которые, в свою очередь, получены из фибробластов пациентов с наследственными формами БП, а именно с мутацией гена, кодирующего PINK1 (homozygous p.Try90Leufsxl2) и мутацией гена, кодирующего альфа-синуклеин (SNCA х3). Все iPSCs были получены от доноров, которые дали подписанное информированное согласие на вывод линий iPSCs из биопсии кожи (1М1 программа ЕС StemBANCC). Для репрограммирования фибробластов применяли набор CytoTune-iPS (ThermoFisher Scientificlnc, США) посредством экспрессии ОСТ4, SOX2, KLF4 и c-MYC четырьмя отдельными вирусными векторами Sendai. Наличие мутаций у пациентов подтверждено последовательностью Сенгера (GENEWIZ). iPSCs культивировали на Geltrex (ThermoFisher Scientificlnc, США) в среде Essential 8 (ThermoFisher Scientific Inc., США) с добавлением 0,5 мМ EDTA (Thermo Fisher Scientific Inc., США). Нейрональная индукция была выполнена через SMAD-ингибирование с использованием SB431542 (Tocris, Великобритания) и дигидрохлорида дорсоморфина (Tocris, Великобритания) в средах N2B27 - DMEM (Gibco, США); F12 + глутамакс, нейробазальная среда, с добавлением В28, N2, глутамакса, инсулина, незаменимых аминокислот, 2-меркаптоэтанол, пенициллина/стрептомицина. Клетки были сначала пассированы с диспазой (Thermo Fisher Scientiric Inc., США) на 10 день после первого появления нейроэпителиального листка. При появлении нейронных розеток на 20-21 день клетки снова пересаживали с использованием диспазы. Клетки были пересажены еще три раза, прежде чем использовались в эксперименте на 70-90 день культивирования. Все линии были протестированы на наличие микоплазмы.
ФБМ лазерным излучением с длиной волны 1267 нм оценивали по клеточной смерти (фиг. 4) в интактной группе 19 и группах с разными дозами облучения 20 и 21, соответствующие 65 и 187 Дж/см2, через 24 часа после воздействия. Клетки инкубировали cPI (Invitrogen, США) и Hoechst 33342 (Invitrogen, США) в течение 30 минут при температуре 30-37°С. По истечении времени исследуемые клетки подвергали трехкратной отмывке раствором Хенкса (Gibco, США). Жизнеспособные клетки не способны накапливать красный флуоресцентный Р1, который аккумулируется в ядрах клеток с нарушенной проницаемостью плазматической мембраны, тогда как Hoechst (Invitrogen, США) окрашивает ДНК во всех клетках, что позволяет количественно определять мертвые клетки по отношению к общему количеству клеток. Интенсивность флуоресценции используемых красителей оценивали с помощью конфокального микроскопа ZEISS LSM 900 с системой Airyscan 2 (CarlZeiss AG, Германия) в двухволновом режиме (длины волн возбуждения - 405 и 561 нм). Для обработки результатов по оценке жизнеспособности культуры клетки подсчитывали в «синем» (Hoechst (Invitrogen, США)) и «красном» (PI (Invitrogen, США)) каналах с помощью программы ImageJ плагина Cell Counter.
По итогам полученных данных были построены соответствующие графические зависимости. Данные клеточной смерти представлены в виде гистограммы процента нежизнеспособных клеток от общего числа клеток в исследуемом участке в каждой экспериментальной группе. Каждый из представленных на гистограмме (фиг. 4) столбцов является средним из трех независимых экспериментов, в каждом из которых было исследовано не менее 100 клеток.
Значимость статистических различий выборок была оценена с помощью однофакторного дисперсионного анализа (One-way ANOVA). Уровень значимости р<0,01 считался существенным. В результате исследования выявлено, что заявляемый способ защиты нейронов при болезни Паркинсона с помощью использования лазерного излучения с длиной волны 1267 нм, обладает большой эффективностью. Повышение выживаемости клеток достигалось за счет того, что лазерное излучение с длиной волны 1267 нм вызывает генерацию синглетного кислорода в исследуемой культуре клеток, который оказывает воздействие на биоэнергетику клетки.
Способ защиты нейронов для защиты нейронов при нейродегенеративных заболеваниях может быть, проиллюстрирован на следующих примерах.
Пример 1.
Для изучения нейропротекторных свойств низких доз синглетного кислорода, вырабатывающихся после воздействия лазерным излучением с длиной волны 1267 нм, были использована нейроны человека с мутацией PINK 1 (homozygous p.Try90Leufsxl2), связанной с аутосомно-рецессивной БП. При данной патологии клетки имеют значительные нарушения в биоэнергетике клетки, включая снижение ММП, изменения окислительно-восстановительных процессов, а также нарушения процессов дыхания клетки и повышенную чувствительность к стимуляции кальцием и связанное с этим открытие митохондриальных пор.
При оценке влияния лазерного излучения с длиной волны 1267 нм было зарегистрировано снижение клеточной смерти на 33% при использовании мощности, равной 65 Дж/см2 и на 44% при 187 Дж/см2. В сравнении с клетками, которые не подвергались облучению (фиг. 4).
Пример 2.
Нейропротекторный эффект от воздействия лазерным излучением с длиной волны 1267 нм исследовался на нейронах человека с мутацией альфа-синуклеина (SNCA x3), ответственного за аутосомно-доминантную БП.
Ген SNCA кодирует белок, состоящий из 140 аминокислот под названием альфа-синуклеин. Мутации в гене SNCA приводят к агрегации альфа-синуклеина. Патологическое отложение агрегированного альфа-синуклеина приводит к нарушениям протеасомной деградации, стрессу эндоплазматического ретикулума, повышению внутриклеточного кальция и ухудшению митохондриальной эффективности.
При оценке влияния лазерного излучения с длиной волны 1267 нм было зарегистрировано снижение клеточной смерти на 42% при выходной мощности, равной 65 Дж/см2 и 58% при 187 Дж/см2, в сравнении с клетками, которые не подвергались облучению (фиг. 4).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ФОТОИММУНОТЕРАПИИ ФОТОСЕНСИБИЛИЗАТОРОМ, АКТИВИРУЕМЫМ ВОЛНОВОЙ ЭНЕРГИЕЙ ВНЕ ОРГАНИЗМА ЧЕЛОВЕКА | 2006 |
|
RU2345803C2 |
| СПОСОБ ОЦЕНКИ СОДЕРЖАНИЯ ПЕРОКСИДА ВОДОРОДА В ОПУХОЛЕВЫХ КЛЕТКАХ ПРИ ФОТОДИНАМИЧЕСКОМ ВОЗДЕЙСТВИИ | 2018 |
|
RU2700421C1 |
| Способ фотодинамической терапии базально-клеточного рака кожи I стадии | 2022 |
|
RU2826594C2 |
| СПОСОБ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ ОПУХОЛЕЙ | 2012 |
|
RU2519936C2 |
| УСТРОЙСТВО ДЛЯ СПЕКТРАЛЬНО-ФЛУОРЕСЦЕНТНОГО КОНТРОЛЯ СОСТОЯНИЯ БИОЛОГИЧЕСКИХ ТКАНЕЙ В ПРОЦЕССЕ ФОТОДИНАМИЧЕСКОГО ВОЗДЕЙСТВИЯ С ПРИМЕНЕНИЕМ ФОТОСЕНСИБИЛИЗАТОРОВ НА ОСНОВЕ ХЛОРИНА E6 | 2022 |
|
RU2807133C1 |
| КОВАЛЕНТНЫЕ КОНЪЮГАТЫ НА ОСНОВЕ ФТАЛОЦИАНИНОВ И МЕТИЛФЕОФОРБИДА а, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ИСПОЛЬЗОВАНИЯ В МЕДИЦИНЕ | 2019 |
|
RU2722309C1 |
| СПОСОБ СТИМУЛЯЦИИ ОЧИСТИТЕЛЬНОЙ ФУНКЦИИ ЛИМФАТИЧЕСКОЙ СИСТЕМЫ МОЗГА | 2020 |
|
RU2766527C1 |
| СПОСОБ ЛАЗЕРНОГО ПОДАВЛЕНИЯ РОСТА И ЭЛИМИНАЦИИ ЗЛОКАЧЕСТВЕННЫХ ОБРАЗОВАНИЙ | 2006 |
|
RU2325200C2 |
| СПОСОБ ПОВЫШЕНИЯ ПРОДУКТИВНОСТИ МИКРООРГАНИЗМОВ | 2002 |
|
RU2208049C1 |
| СПОСОБ ПОДАВЛЕНИЯ РОСТА ПОЛИРЕЗИСТЕНТНЫХ ШТАММОВ MYCOBACTERIUM TUBERCULOSIS В ЭКСПЕРИМЕНТЕ | 2016 |
|
RU2628624C1 |



Группа изобретений относится к медицине и может быть использована для восстановления и защиты функциональных свойств нейрональных тканей при нейродегенеративных нарушениях, в частности при болезни Паркинсона. Способ исследования защиты нейронов при нейродегенеративных заболеваниях характеризуется облучением клеточной культуры лазерным излучением ближнего инфракрасного диапазона с длиной волны 1267 нм, при дозе облучения от 65 до 187 Дж/см2 с дополнительным контролем температуры поверхности покровного стекла с исследуемой культурой клеток для генерации низких доз синглетного кислорода. Устройство для исследования защиты нейронов при нейродегенеративных заболеваниях содержит персональный компьютер с программным обеспечением, параллельно соединенные с ним драйверы, каждый из которых соединен с соответствующим блоком питания и через соответствующий источник непрерывного лазерного излучения подключен к волоконно-оптическому кабелю, соединенному с коллиматором, а также последовательно соединенные прецизионный датчик температуры, включенный в мостовую схему измерения с компенсацией нелинейности функции преобразования, аналого-цифровой преобразователь платы сбора данных и последовательно соединенные фотодиодный детектор и измеритель мощности. Применение данной группы изобретений позволит повысить выживаемость в iPSC-производных нейронах человека с мутациями, связанными с различными наследственными формами. 2 н.п. ф-лы, 4 ил., 2 пр.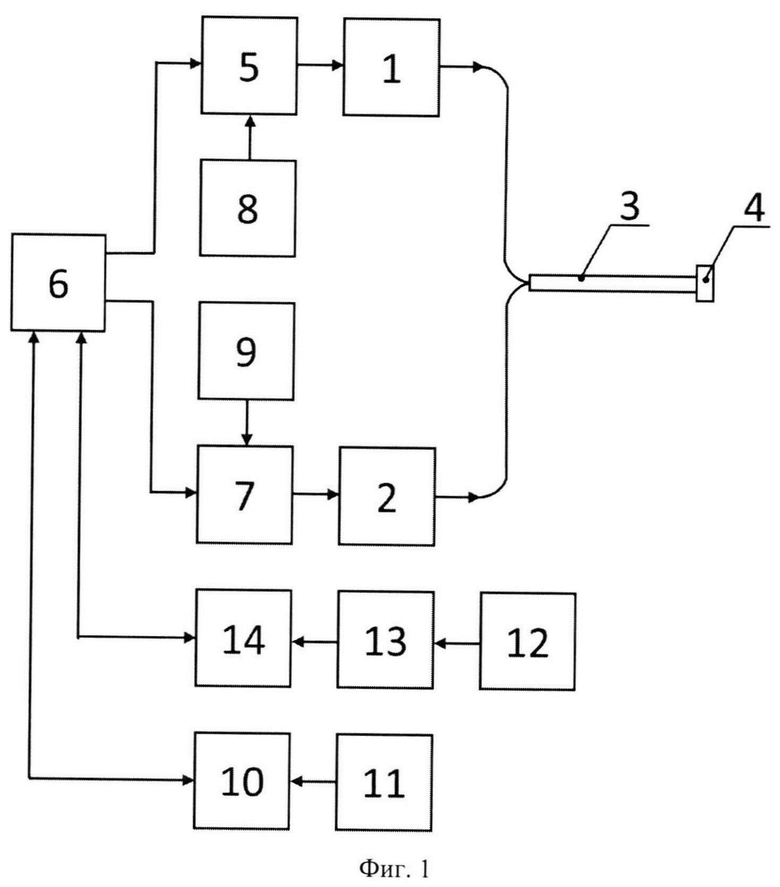
1. Способ исследования защиты нейронов при нейродегенеративных заболеваниях, характеризующийся облучением клеточной культуры лазерным излучением ближнего инфракрасного диапазона с длиной волны 1267 нм, при дозе облучения от 65 до 187 Дж/см2 с дополнительным контролем температуры поверхности покровного стекла с исследуемой культурой клеток для генерации низких доз синглетного кислорода.
2. Устройство для исследования защиты нейронов при нейродегенеративных заболеваниях, содержащее персональный компьютер с программным обеспечением, параллельно соединенные с ним драйверы, каждый из которых соединен с соответствующим блоком питания и через соответствующий источник непрерывного лазерного излучения подключен к волоконно-оптическому кабелю, соединенному с коллиматором, а также последовательно соединенные прецизионный датчик температуры, включенный в мостовую схему измерения с компенсацией нелинейности функции преобразования, аналого-цифровой преобразователь платы сбора данных и последовательно соединенные фотодиодный детектор и измеритель мощности.
| СТРУКТУРА ДАТЧИКА ТЕМПЕРАТУРЫ | 2009 |
|
RU2489690C2 |
| СПОСОБ ЛАЗЕРНОЙ БИОМОДУЛЯЦИИ И ПОВЫШЕНИЯ ПРОНИЦАЕМОСТИ ГЕМАТОЭНЦЕФАЛИЧЕСКОГО БАРЬЕРА | 2019 |
|
RU2740123C1 |
| СПОСОБ ИНТРАОПЕРАЦИОННОЙ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ В КОМБИНИРОВАННОМ ЛЕЧЕНИИ МЕСТНО-РАСПРОСТРАНЕННЫХ САРКОМ МЯГКИХ ТКАНЕЙ | 2020 |
|
RU2737704C2 |
| СПОСОБ УПРАВЛЯЕМОЙ ЛАЗЕРНОЙ ЛОКАЛЬНОЙ ГИПЕРТЕРМИИ КЛЕТОК ИЛИ МИКРООРГАНИЗМОВ | 2019 |
|
RU2731813C1 |
Авторы
Даты
2022-11-09—Публикация
2021-07-28—Подача