Изобретение относится к области органической химии, а именно к применению индивидуальных соединений класса 2-[(R-бензилиден)гидразоно]-8-гидрокси-6-(2-гидроксифенил)-9-ароил-1-тиа-3,6-диазаспиро[4.4]нона-8-ен-4,7-дионов в качестве средств, обладающих противовоспалительной активностью, которые могут быть использованы в качестве исходных продуктов для синтеза новых гетероциклических систем и в фармакологии.
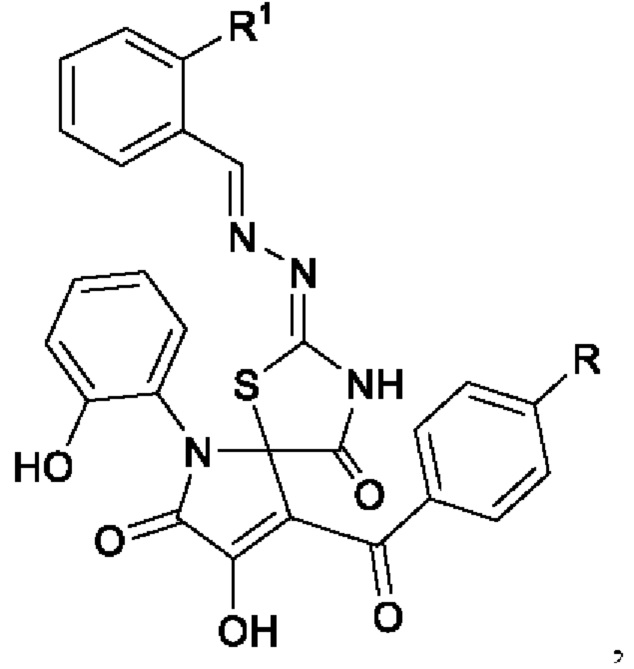
где R=R1=Н(a), R=СН3, R1=F(b)
Заявленные соединения 2-[(R-бензилиден)гидразоно]-8-гидрокси-6-(2-гидроксифенил)-9-ароил-1-тиа-3,6-диазаспиро[4.4]нона-8-ен-4,7-дионы, способ синтеза их производных и противомикробная, анальгетическая активность известны из уровня техники. Данные соединения являются продуктами взаимодействия 3-ароил-1H-бензо[b]пирроло[1,2-d][1,4]оксазин-1,2,4-трионов с тиосемикарбазонами ароматических и гетероароматических альдегидов («Антиноцицептивная и противомикробная активность продуктов взаимодействия пирролобензоксазинтрионов с тиосемикарбазонами ароматических и гетероароматических альдегидов», Лукманова Д.Н., Баландина С.Ю., Махмудов P.P., Машевская И.В., Химико-фармацевтический журнал, 2020, 54, №3, 27-31. [Antinociceptive and antimicrobial activity of products from reactions of pyrrolobenzoxazinetriones with thiosemicarbazones of aromatic and heteroaromatic aldehydes, Lukmanova D.N., Balandina S.Yu., Makhmudov R.R., Mashevskaya I.V. Pharmaceutical Chemistry Journal, 2020, 54, 236-240. DOI 10.1007/s11094-020-02186-y]), образуются no следующей схеме:
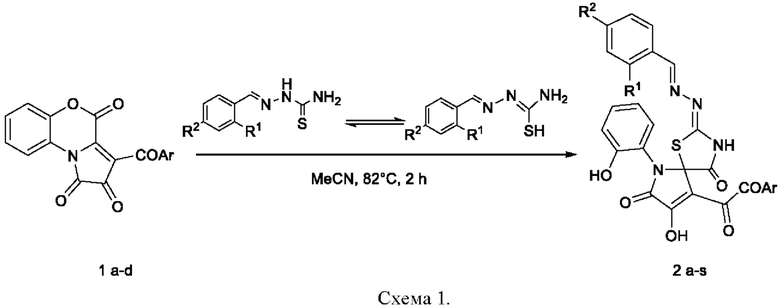
1: Ar=Ph(a), C6H4Me-4(b), C6H4Br-4(c), C6H4NO2-4(d); 2: Ar=Ph, R1=R2=H(a); Ar=C6H4Me-4, R1=R2=H(b); Ar=C6H4Br-4 R1=R2=H(c); Ar=C6H4NO2-4, R1=R2=H(d); Ar=Ph, R1=F, R2=H(e); Ar=C6H4Me-4, R1=F, R2=H(f); Ar=C6H4Br-4, R1=F, R2=H(g); Ar=C6H4NO2-4, R1=F, R2=H(h); Ar=Ph, R1=OH, R2=H(i); Ar=C6H4Me-4, R1=OH, R2=H(j); Ar=C6H4Br-4, R1=OH, R2=H(k); Ar=C6H4NO2-4, R1=OH, R2=H(l); Ar=Ph, R1=NO2, R2=H(m); Ar=C6H4Me-4, R1=NO2, R2=H(n); Ar=C6H4Br-4, R1=NO2, R2=H(o); Ar=C6H4NO2-4, R1=NO2, R2=H(p); Ar=Ph, R1=H, R2 R2=OH(q); Ar=C6H4Me-4, R1=H, R2=OH(r); Ar=C6H4Br-4, R1=H, R2=OH(s).
Противовоспалительная активность 2-[(R-бензилиден)гидразоно]-8-гидрокси-6-(2-гидроксифенил)-9-ароил-1-тиа-3,6-диазаспиро[4.4]нона-8-ен-4,7-дионов ранее не была исследована.
Задачей изобретения является изыскание новых соединений, обладающих противовоспалительной активностью, и расширение арсенала средств воздействия на живой организм.
Технический результат выявлена ранее не известная противовоспалительная активность соединений класса 2-[(R-бензилиден)гидразоно]-8-гидрокси-6-(2-гидроксифенил)-9-ароил-1-тиа-3,6-диазаспиро[4.4]нона-8-ен-4,7-дионов.
Поставленная задача решается тем, что соединения 2-[(R-бензилиден)гидразоно]-8-гидрокси-6-(2-гидроксифенил)-9-ароил-1-тиа-3,6-диазаспиро[4.4]нона-8-ен-4,7-дионы проявляют выраженную противовоспалительную активность.
Синтезируют заявляемые соединение путем взаимодействия 3-ароилпирроло[1,2-с]-[4,1]бензоксазин-1,2,4-трионов с тиосемикарбазонами бензальдегида и о-фторбензальдегида в среде растворителя с последующим выделением целевого продукта, по следующей схеме:
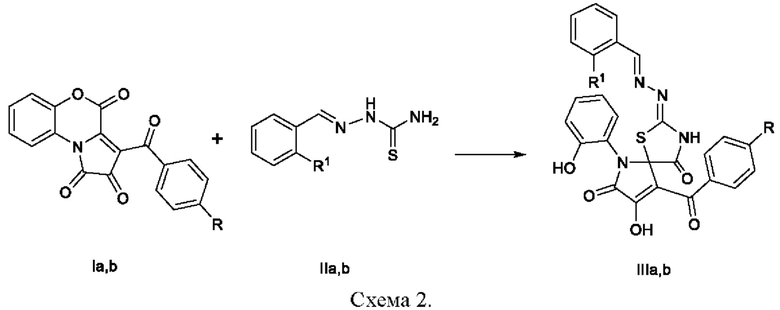
где R=R1=H(a), R=СН3, R1=F(b)
Процесс ведут при кипячении, в качестве растворителя используют безводный ацетонитрил.
Изобретение иллюстрируется следующими примерами.
Пример 1. Получение 9-бензоил-2-(бензилиденгидразоно)-8-гидрокси-6-(2-гидроксифенил)-1-тиа-3,6-диазаспиро[4.4]нона-8-ен-4,7-диона (IIIa).
Раствор 0.5 ммоль 3-бензоил-1H-бензо[b]пирроло[1,2-d][1,4]оксазин-1,2,4-триона (Ia) и 0.5 ммоль тиосемикарбазона бензальдегида (IIa) в 10 мл безводного ацетонитрила кипятили при перемешивании в течение 2 часов, затем охлаждали, образовавшийся осадок отфильтровывали. Выход 72%. Т.пл. 190-192°С (ацетонитрил). Соединение (IIIa) C26H18N4O5S.
Найдено, %: С 62.83; Н 3.71; N 11.09; S 6.50.
Вычислено, %: С 62.64; Н 3.64; N 11.24; S 6.43.
Соединение (IIIa) - бледно-желтое кристаллическое вещество с высокой температурой плавления, плавящееся с разложением, растворимое в ацетонитриле, 1,4-диоксане, этилацетате, легкорастворимое в ДМСО, ДМФА, ацетоне, нерастворимое в алканах и воде. Устойчиво при хранении в обычных условиях.
В ИК-спектре соединения (IIIa), записанном в виде пасты в вазелиновом масле, присутствуют полосы валентных колебаний гидроксильной и амидной групп (3470, 3417 см-1), 2 лактамных и 1 ароильной карбонильных групп (1743, 1709, 1629 см-1).
Спектр ЯМР 1H (400 МГц, DMSO-d6, δ, м.д.): 12.45 с (1H), 9.73 с (1H), 8.34 с (1H), 7.86-7.77 м (2Н), 7.70-7.60 м (3Н), 7.56-7.50 м (2Н), 7.45-7.36 м (3Н), 7.34-7.26 м (1H), 7.07-6.93 м (2Н), 6.92-6.83 м (1Н). Одна из ОН-групп невидима в спектре ЯМР 1Н
Пример 2. Получение 2-[2-(2-фторбензилиден)гидразоно]-8-гидрокси-6-(2-гидроксифенил)-9-(4-метилбензоил)-1-тиа-3,6-диазаспиро[4.4]нона-8-ен-4,7-диона (IIIb).
Раствор 0.5 ммоль 3-(4-метилбензоил)-1H-бензо[b]пирроло[1,2-d][1,4]оксазин-1,2,4-триона (Ib) и 0.5 ммоль тиосемикарбазона о-фторбензальдегида (IIb) в 10 мл безводного ацетонитрила кипятили при перемешивании в течение 2 часов, затем охлаждали, образовавшийся осадок отфильтровывали. Выход 74%. Т.пл. 194-196°С (ацетонитрил).Соединение (IIIb) C27H19FN4O5S.
Найдено, %: С 61.41; Н 3.56; F 3.62, N 10.64; S 6.09.
Вычислено, %: С 61.13; Н 3.61; F 3.58, N 10.56; S 6.04.
Соединение (IIIb) - бледно-желтое кристаллическое вещество с высокой температурой плавления, плавящееся с разложением, растворимое в ацетонитриле, 1,4-диоксане, этилацетате, легкорастворимое в ДМСО, ДМФА, ацетоне, нерастворимое в алканах и воде. Устойчиво при хранении в обычных условиях.
В ИК-спектре соединения (IIIb), записанном в виде пасты в вазелиновом масле, присутствуют полосы валентных колебаний гидроксильной и амидной групп (3525, 3182 см-1), 2 лактамных и 1 ароильной карбонильных групп (1727, 1712, 1634 см-1).
Спектр ЯМР 1H (400 МГц, DMSO-d6, δ, м.д.): 12.53 с (1H), 9.72 с (1H), 8.43 с (1H), 7.81-7.68 м (3Н), 7.52-7.44 м (1H), 7.35-7.19 м (6Н), 7.05-6.94 м (2Н), 6.91-6.83 м (1H), 2.40 с (3Н). Одна из ОН-групп невидима в спектре ЯМР 1H
Пример 3. Фармакологическое исследование соединений (IIIa,b) на наличие противовоспалительной активности.
1. В эксперименте использовались белые лабораторные аутбредные крысы - самки стока линии Wistar. Подготовка животных включала отбор по полу, возрасту и состоянию здоровья. В рамках выделенной субпопуляции был выполнен рандомизированный отбор с использованием генератора случайных чисел в экспериментальные группы по 6 животных (15.02.2022: 6 экспериментальных групп, 1 контрольная, 1 группа препарата сравнения; 17.02.2022: 5 экспериментальных групп, 1 контрольная, 1 группа препарата сравнения) [Anglemyer A., Horvath Н.Т., Bero L. Healthcare outcomes assessed with observational study designs compared with those assessed in randomized trials // Cochrane Database of Systematic Reviews. - 2014. - №. 4]. Животные в группах маркировались методом нанесения сквозных индивидуальных меток на основании хвоста по внутрилабораторному стандарту [СОП 7.5.17.19 Маркировка лабораторных животных]. Проверка качества рандомизации выполнялась на основе тестирования значимости сдвигов масс и гомогенности дисперсий - до эксперимента.
Исследуемые вещества суспензировали в 2% крахмальном растворе, и вводили животным внутрибрюшинно в дозе 50 мг/кг (внутрилабораторный стандарт скрининговой дозы) за 40 минут до субплантарного введения индуктора отека - 1% раствора каррагенина (SIGMA ALDRICH, США). В качестве препарата сравнения использовали таблетки диклофенака 0,05 г, покрытые кишечнорастворимой оболочкой производства ООО «Озон» г. Жигулевск. В качестве эквистрессового воздействия животным в контрольной группе вводился 2% крахмальный раствор. В таблицах 1 и 2 представлены данные массометрии животных, особенности приготовления растворов для в/б введения, и объемы введения для экспериментов на лабораторных крысах в экспериментах от 15.02.2022 и 17.02.2022 соответственно.
Проведенные исследования показали (Таблица), что у исследованных соединений в дозе 50 мг/кг обнаружена противовоспалительная активность.
Вещество под шифром IIIa обладает продолжительным периодом действия. Процент торможения отека для 1 часа после введения индуктора воспаления 65,6% (р=0,015). По прошествии 3 часов после введения индуктора воспаления процент торможения отека составил 25,6% (р=0,004), для 5 часов - 31,7% (р=0,041).
Вещество IIIb обладает ярко выраженной противовоспалительной активностью. Значения процента подавления отека: 67,2% (р=0.002) для 1 часа после введения индуктора воспаления, 71,0% (р=0,009) для 3 часов после введения индуктора воспаления и 55,9% (р=0,015) для 5 часов после введения индуктора воспаления.
Предлагаемые вещества 2-[(R-бензилиден)гидразоно]-8-гидрокси-6-(2-гидроксифенил)-9-ароил-1-тиа-3,6-диазаспиро[4.4]нона-8-ен-4,7-дионы (IIIa,b) обладают фармакологической активностью, а именно противовоспалительной активностью, и может найти применение в фармакологии в качестве потенциального лекарственного средства.
Изобретение относится к области органической химии и фармацевтики, а именно к применению соединений класса 2-[(R-бензилиден)гидразоно]-8-гидрокси-6-(2-гидроксифенил)-9-ароил-1-тиа-3,6-диазаспиро[4.4]нона-8-ен-4,7-дионов. Раскрыто применение 2-[(R-бензилиден)гидразоно]-8-гидрокси-6-(2-гидроксифенил)-9-ароил-1-тиа-3,6-диазаспиро[4.4]нона-8-ен-4,7-дионов, где R=R1=Н(a), R=СН3, R1=F(b), в качестве средств, обладающих противовоспалительной активностью. Изобретение обеспечивает выраженный противовоспалительный эффект. 1 табл., 3 пр.
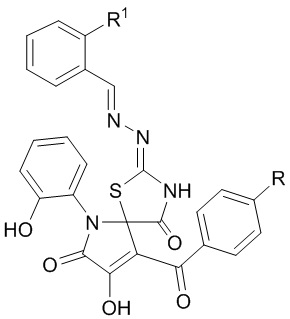
Применение 2-[(R-бензилиден)гидразоно]-8-гидрокси-6-(2-гидроксифенил)-9-ароил-1-тиа-3,6-диазаспиро[4.4]нона-8-ен-4,7-дионов
 ,
,
где R=R1=H(a), R=CH3, R1=F(b),
в качестве средств, обладающих противовоспалительной активностью.
| RU 2004122109 A, 10.06.2005 | |||
| 3'-Ароил-4'-гидрокси-1'-(2-гидроксиметилфенил)-2Н,4Н-спиро[1,4-бензотиазин-2,2'-пиррол]-3,5'(1'Н)-дионы, обладающие анальгетической активностью | 2019 |
|
RU2714511C1 |
| LUKMANOVA D.N | |||
| et al | |||
| Antinociceptive and Antimicrobial Activity of Products from Reactions of Pyrrolobenzoxazinetriones with Thiosemicarbazones of Aromatic and Heteroaromatic Aldehydes | |||
| Pharm Chem J, 2020, n.54, pp.236-240 | |||
| D.N | |||
| LUKMANOVA et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
Авторы
Даты
2022-11-10—Публикация
2022-02-28—Подача