Область техники
Настоящее изобретение относится к области иммунологии, более конкретно к биспецифическому антителу против CD3, способному опосредовать уничтожение Т-клеток, и к применению этого типа антител, особенно к их применению при лечении рака.
Уровень техники
Множественная миелома является второй по распространенности злокачественной гематологической опухолью, неконтролируемая пролиферация моноклональных плазматических клеток в костном мозге приводит к перепроизводству моноклонального иммуноглобулина и иммуносупрессии, а также к остеолизу и терминальному повреждению органа. В настоящее время существует два моноклональных антитела, имеющих разрешение на клиническое использование, схемы лечения множественной миеломы значительно улучшили выживаемость пациентов за последнее десятилетие. Несмотря на это, существующие схемы лечения по-прежнему не удовлетворяют текущие потребности в лечении, особенно для пациентов с рецидивом / рефрактерной терапией, которые устойчивы к текущему способу лечения.
Антиген созревания В-клеток (ВСМА) представляет собой специфический антиген плазматических клеток, который играет важную роль в регулировании созревания и дифференцировки В-клеток в плазматические клетки, участвуя в лиганде, индуцирующем пролиферацию (APRI). Экспрессия ВСМА ограничена в линии В-клеток и в основном существует на плазматических клетках и плазмобластах и в определенной степени существует на В-клетках памяти, но не существует по существу на периферических и ювенильных В-клетках, поскольку не экспрессируется в других нормальных тканевых клетках. ВСМА также экспрессируется на клетках множественной миеломы и участвует в лейкемии и лимфоме. Вместе с членами своего семейства TACI (трансмембранный активатор и лиганд-интерактор рецептора циклофилина) и BAFF-R (рецептор фактора активации В-клеток) ВСМА регулирует различные аспекты гуморального иммунитета, развитие В-клеток и гомеостаз. Экспрессия ВСМА появляется на более поздней стадии дифференцировки В-клеток и способствует долгосрочному выживанию плазмобластов и плазматических клеток в костном мозге. Целевая делеция гена ВСМА у мышей привела к значительному снижению количества долгоживущих плазматических клеток в костном мозге, что указывает на то, что ВСМА важен для его выживания. Сверхэкспрессия ВСМА или стимуляция APRIL с помощью ВСМА в клетках множественной миеломы напрямую активирует ключевые молекулы иммунных контрольных точек, которые могут способствовать иммуносупрессии микросреды костного мозга.
Т-лимфоциты играют важную роль в процессе клеточного иммунитета. Клеточный иммунитет, опосредованный Т-клетками, специфически распознает антигенные пептиды, представленные главным комплексом гистосовместимости (МНС) на поверхности клетки, прежде всего через Т-клеточный рецептор (TCR) играет важную роль в устранении больных клеток в организме на присутствие инфекции и предотвращении возникновения опухолей. Поскольку экспрессия МНС на поверхности большинства раковых клеток подавляется или даже удаляется, позволяя опухолевым клеткам избегать иммунного уничтожения, тем самым развиваются опухоли.
Т- клеточное биспецифическое антитело (Т cell-engaging bispecific antibodies, ТСВ) представляет собой очень эффективный способ перенаправления активированных цитотоксических Т-клеток в опухоли. CD3, экспрессируемый в зрелых Т-клетках, как часть рецептора Т-клеток, может передавать сигнал активации, генерируемый TCR, распознающий антиген. ТСВ способны связываться с поверхностным опухолевым антигеном и субъединицей CD3 s рецептора Т-клеток одновременно, обеспечивая физическую связь между Т-клетками и опухолевыми клетками, таким образом эффективно активируя покоящиеся Т-клетки для уничтожения опухолевых клеток, достигая эффекта лечения опухолей в состоянии покоя (Smits NC, Sentman CL, Journal of Clinical Oncology, 2016:JCO649970). Поскольку T-клеточный биспецифический обход требует костимуляции распознавания антигена TCR и активации Т-клеток, они устраняют необходимость в опухолеспецифическом иммунитете и преодолевают многие препятствия, с которыми сталкиваются Т-клетки в микросреде опухоли.
В последние годы, чтобы решить проблему правильной сборки двух разных полуантител, ученые спроектировали и разработали биспецифические антитела с множеством структур. В общем, есть два типа, один тип биспецифического антитела не содержит область Fc, но включает в себя BiTE, DART, TrandAbs, bi-Nanobody и т.д. Преимущество структуры этого типа биспецифического антитела заключается в небольшой молекулярной массе, структура может быть экспрессирована в прокариотических клетках без учета проблемы правильной сборки. Недостаток заключается в том, что отсутствие сегмента Fc антитела, низкая молекулярная масса приводят к понижению периода полувыведения. Более того, этот тип биспецифического антитела легко полимеризуется, имеет плохую стабильность и низкую экспрессию, поэтому его клиническое применение в некоторой степени ограничено. Другой тип биспецифического антитела сохраняет Fc-домен, например конфигурацию Triomabs, kih IgG, Cross-mab, orthoFab IgG, DVD IgG, IgG scFv, scFv2-Fc и т.д. Этот тип биспецифического антитела образует IgG- подобную структуру с крупной молекулярной структурой, а процесс эндоцитоза и рециркуляции, опосредованный FcRn, увеличивает время полувыведения; при сохранении некоторых или всех эффекторных функций, опосредованных Fc, таких как антителозависимая клеточно-опосредованная цитотоксичность (ADCC), комплемент -зависимая цитотоксичность (CDC) и антителозависимый фагоцитоз (ADCP). Однако этот тип биспецифического антитела не может полностью предотвратить образование несовпадающих продуктов, в то время как остаточные фракции любых несовпадающих молекул трудно отделить от продуктов, и этот способ требует большого количества модификаций генной инженерии, таких как мутации в отношении двух последовательностей антител, что не может обеспечить простоту и универсальность.
Таким образом, настоящее изобретение направлено на разработку биспецифической молекулы ВСМА, отличающейся улучшенными характеристиками в отношении периода полувыведения, стабильности, безопасности и продуктивности продукта.
Сущность изобретения
Целью настоящего изобретения является предоставление молекулы четырехвалентного гомодимерного биспецифического антитела, нацеленной на антиген иммунных эффекторных клеток CD3 и опухолевый антиген ВСМА, такое биспецифическое антитело может значительно ингибировать или убивать опухолевые клетки в организме, но его неспецифическое убивающее действие на нормальные клетки при низкой экспрессии ВСМА значительно снижается, в то же время повышается управляемость токсических и побочных эффектов, вызванных сверхактивацией эффекторных клеток, его физико-химические свойства и стабильность в организме значительно улучшаются.
В частности, в первом аспекте настоящего изобретения раскрывается биспецифическое антитело, молекула которого состоит из двух идентичных полипептидных цепей, ковалентно связанных с образованием четырехвалентного гомодимера, каждая из полипептидных цепей от N-конца до С-конца последовательно содержит первый одноцепочечный Fv, специфически связывающийся с опухолевым антигеном ВСМА, второй одноцепочечный Fv, специфически связывающийся с эффекторным клеточным антигеном CD3, и Fc-фрагмент, где n первый одноцепочечный Fv и второй одноцепочечный Fv Цепной Fv связан связывающим пептидом, а второй одноцепочечный Fv и Fc-фрагмент связаны напрямую или связывающим пептидом, и Fc-фрагмент не имеет эффекторных функций, таких как CDC, ADCC и ADCP.
При этом первый одноцепочечный Fv содержит домен VH и домен VL, эти домены соединенные связывающим пептидом L1. Аминокислотная последовательность связывающего пептида L1 представляет собой (GGGGX)n, При этом X содержит Ser или Ala, n представляет собой натуральное число от 1 до 5; X предпочтительно представляет собой Ser, n предпочтительно равно 3.
В предпочтительном примере реализации настоящего изобретения аминокислотная последовательность связывающего пептида L1 представляет собой (GGGGS)3, а в других предпочтительных примерах реализации аминокислотная последовательность связывающего пептида L1 тажке содержит (GGGGS)1 или (GGGGS)2 или (GGGGS)4, или (GGGGS)5, или (GGGGA)1, или (GGGGA)2, или (GGGGA)3, или (GGGGA)4, или (GGGGA)5.
Предпочтительно первый одноцепочечный Fv содержит:
(1) домен VH, содержащий HCDR1, HCDR2 и HCDR3, как показано в SEQ ID NO: 1, 2 и 3 соответственно, или последовательность, имеющую не мене 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или больше сходства с вышеуказанной последовательностью или имеющую одну или несколько аминокислотных замен (например, консервативные замены); и
(2) домен VL, содержащий LCDR1, LCDR2 и LCDR3, как показано в SEQ ID NO: 4, 5 и
6, соответственно, или последовательность, имеющую не мене 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или больше сходства с вышеуказанными последовательностями или имеющую одну или несколько аминокислотных замен (например, консервативные замены).
Более предпочтительно, первый одноцепочечный Fv содержит:
(1) домен VH, имеющий аминокислотную последовательность, как показано в SEQ ID NO: 7, или последовательность, имеющую не мене80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или больше сходства с вышеуказанными последовательностями или имеющую одну или несколько аминокислотных замен (например, консервативные замены); и
(2) домен VL, имеющий аминокислотные последовательности, показанные в SEQ ID NO: 8, или последовательность, имеющую не мене 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или больше сходства с вышеуказанными последовательностями или имеющую одну или несколько аминокислотных замен (например, консервативные замены). При этом связывающий пептид L2, соединяющий первый одноцепочечный Fv и второй одноцепочечный Fv, предложенный в настоящем изобретении, состоит из гибкого пептида и жесткого пептида.
Кроме того, гибкий пептид содержит две или более аминокислот и предпочтительно состоит из следующих аминокислот: Gly (G), Ser (S), Ala (А) и Thr (T). Более предпочтительно, гибкий пептид содержит остатки G и S. Еще более предпочтительно, общая структурная формула аминокислот гибкого пептида представляет собой GxSy (GGGGS)z, При этом х, у и z являются целыми числами, которые больше или равны 0, а х + у + z представляют собой ≥ 1. Например, в предпочтительном примере реализации, аминокислотная последовательность гибкого пептида представляет собой G2 (GGGGS)3.
Кроме того, жесткий пептид происходит из полноразмерной последовательности, состоящей из аминокислот в положениях от 118 до 145 на карбоксильном конце β-субъединицы природного хор ионического гонадотропина человека (как показано в SEQ ID NO: 9) или их усеченных фрагментов (в дальнейшем вместе именуемый СТР). Предпочтительно, жесткий пептид СТР1 содержит 10 аминокислот HaN-конце SEQ ID NO: 9, а именно SSSSKAPPPS; или жесткий пептид СТР2 содержит 14 аминокислот на конце С SEQ ID NO: 9, а именно SRLPGPSDTPILPQ; Жесткий пептид СТРЗ содержит 16 аминокислот на N-конце SEQ ID NO: 9, а именно SSSSKAPPPSLPSPSR; Жесткий пептид СТР4 содержит 28 аминокислот и начинается в положении 118 р-субъединицы хорионического гонадотропина человека и заканчивается в положении 145, а именно SSSSKAPPPSLPSPSRLPGPSDTPILPQ.
В предпочтительном примере реализации настоящего изобретения жесткий пептид представляет собой SSSSKAPPPS, а именно жесткий пептид СТР1. В других предпочтительных примерах реализации жесткая пептидная последовательность также содержит СТР2 (SRLPGPSDTPILPQ), СТР3 (SSSSKAPPPSLPSPSR), CTPPS4 (SSSSKAPPSLPSRPGG).
В предпочтительном примере реализации настоящего изобретения аминокислотная последовательность связывающего пептида L2 показана в SEQ ID NO: 10, аминокислота его гибкого пептида состоит из G2 (GGGGS)3, и аминокислота его жесткого пептида состоит из SSSSKAPPPS, а именно жесткий пептид СТР1.
При этом второй одноцепочечный Fv биспецифического антитела специфически связывается с CD3 и связывается с эффекторными клетками со значением ЕС50 более 50 нМ, или более 100 нМ, или более 300 нМ, или более 500 нМ в лабораторных условиях FACS при анализе связывания; Более предпочтительно, второй одноцепочечный Fv биспецифического антитела может не только связываться с CD3 человека, но также специфически связываться с CD3 макака-крабоеда или макака - резуса. В предпочтительном примере реализации настоящего изобретения биспецифическое антитело специфически связывается с эффекторными клетками со значением ЕС50 -132,3 нМ.
Предпочтительно второй одноцепочечный Fv содержит:
(1) домен VH, содержащий HCDR1, HCDR2 и HCDR3, как показано в SEQ ID NO: 1, 2 и 3 соответственно, или последовательность, имеющую не мене 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или больше сходства с вышеуказанными последовательностями или имеющую одну или несколько аминокислотных замен (например, консервативные замены); а также
(2) домен VL, содержащий LCDR1, LCDR2 и LCDR3, как показано в SEQ ID NO: 14, 15 и 16, соответственно, или последовательность, имеющую не мене80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или больше сходства с вышеуказанными последовательностями или имеющую одну или несколько аминокислотных замен (например, консервативные замены).
Более предпочтительно, что второй одноцепочечный Fv содержит домен VH, имеющий аминокислотную последовательность, как показано в SEQ ID NO: 17, или последовательность, имеющую не мене 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или больше сходства с вышеуказанными последовательностями или имеющую одну или несколько аминокислотных замен (например, консервативные замены); а также
Домен VL, имеющий аминокислотную последовательность, как показано в SEQ ID NO: 18, или последовательность, имеющую не менее 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или больше сходства с вышеуказанными последовательностями или имеющую одну или несколько аминокислотных замен (например, консервативные замены).
Предпочтительно, VH-домен и VL-домен второго одно цепочечного Fv связаны связывающим пептидом L3, a VH, L3 и VL расположены в порядке VH-L3-VL или VL-L3-VH., аминокислотная последовательность связывающего пептида L3 представляет собой (GGGGX) n, при этом х представляет собой Ser или Ala, а n представляет собой натуральное число 1-5; X предпочтительно представляет собой Ser, n предпочтительно равно 3.
В предпочтительном примере реализации настоящего изобретения аминокислотная последовательность связывающего пептида L3 представляет собой (GGGGS)3, в других предпочтительных примерах реализации аминокислотная последовательность связывающего пептида L3 также содержит (GGGGS)1 или (GGGGS)2 или (GGGGS)4, или (GGGGS)5, или (GGGGA)1, или (GGGGA)2, или (GGGGA)3, или (GGGGA)4, или (GGGGA)5.
При этом Fc-фрагмент, предложенный в настоящем изобретении, связан со вторым одноцепочечным Fv напрямую или связывающим пептидно-связывающим пептидом L4, а связывающий пептидно-связывающий пептид L4 содержит 1-20 аминокислот и предпочтительно происходит из следующих аминокислот: Gly (G), Ser (S), Ala (А) и Thr (T); более предпочтительно, связывающий пептидный связывающий пептид L4 происходит из Gly (G) и Ser (S); более предпочтительно, связывающий пептидно-связывающий пептид L4 состоит из (GGGGS)n и n = 1, 2, 3 или 4. В предпочтительном примере реализации настоящего изобретения Fc-фрагмент непосредственно связан со вторым одноцепочечным Fv. В другом предпочтительном примере реализации этот Fc-фрагмент соединен со вторым одноцепочечным Fv связывающим пептидным пептидом L4, и аминокислотная последовательность соединительного пептида L4 включает (GGGGS)1, или (GGGGS)2, или (GGGGS)3, mni(GGGGS)4.
Fc-фрагмент, предложенный в настоящем изобретении, содержит шарнирную область, домен СН2 и СН3, происходящий из константной области тяжелой цепи иммуноглобулина человека, например, в некоторых примерах реализации, Fc-фрагмент, предложенный в настоящем изобретении, происходит из константной области тяжелой цепи, например из человеческих клеток IgG1, IgG2, IgG3, IgG4, IgM, IgA1, IgA2, IgD и IgE; в частности, происходит из константных областей тяжелой цепи, например из человеческих клеток IgG1, IgG2, IgG3 и IgG4, более конкретно из константных областей тяжелой цепи человеческих клеток IgG1 или IgG4; и Fc-фрагмент имеет одну или несколько аминокислотных замен, делеций или добавлений (например, не более 20, не более 15, не более 10 или не более 5 замен, делеций или добавлений) по сравнению с его исходной природной последовательностью.
Fc- фрагмент, имеющий аминокислотную последовательность, показанную в SEQ ID NO: 19, по сравнению с его исходной природной последовательностью, имеющий замен или замен следующих 6 аминокислотных, определенных в соответствии со схемой нумерации ЕС: L234A/L235A/N297A/P331S/ T250Q/M428L, обусловленные отсутствием или удалением фрагментов K447, определенных в соответствии со схемой нумерации ЕС. Для получения подробной информации о схеме нумерации ЕС, посетите веб-сайт: http://www.imgt.org/imgtscientific chart/numbering/Hu_iggnber.htm.
В некоторых предпочтительных примерах реализации Fc- фрагмент изменен, например, мутирован, чтобы изменить свойства молекулы биспецифического антитела, предложенного в настоящем изобретении (например, для изменения одного или нескольких из следующих характеристик: связывание с рецептором Fc, гликозилирование антитела, функция эффекторных клеток или функция комплемента).
Например, биспецифическое антитело, предложенное в настоящем изобретении, содержат варианты Fc с аминокислотными заменами, делециями или добавлениями с измененными эффекторными функциями (например, восстановлением или элиминацией). Fc-область антитела опосредует несколько важных эффекторных функций, например ADCC, ADCP, CDC и т.д. Способ изменения эффекторной функции путем замены аминокислотных остатков в Fc-области антитела для изменения аффинности антитела к эффекторному лиганду (например, FcγR или комплемент C1q) известен в данной области (например ЕР 388,151 А1; US 564,8260; US 562,4821; Natsume А и т.д., Cancer Res, 68: 3863-3872, 2008; Idusogie ЕЕ и т.д., J. Immunol., 166: 2571-2575, 2001; Lazar GA и т.д., PNAS, 103: 4005-4010, 2006; Shields RL и т.д., JBC, 276: 6591-6604, 2001; Stavenhagen JB и т.д., Cancer Res., 67: 8882-8890, 2007; Stavenhagen JB и т.д., Advan. Enzyme. Regul., 48: 152-164, 2008; Alegre ML и т.д., J. Immunol, 148: 3461-3468, 1992; и Kaneko E и т.д., Biodrugs, 25: 1-11, 2011). В некоторых предпочтительных примерах реализации настоящего изобретения аминокислота L235 (нумерация EU) в константной области антитела модифицирована для изменения взаимодействия с рецептором Fc, например L235E или L235A. В других предпочтительных примерах реализации аминокислоты 234 и 235 в константной области антитела модифицируются одновременно, например, L234A и L235A (L234A / L235A) (по схеме нумерации EU).
Например, биспецифическое антитело, предлагаемое в настоящем изобретении, может включать варианты Fc с заменой, делецией или добавлением аминокислот с увеличенным периодом полувыведения в кровотоке. Исследования показали, что M252Y / S254T / Т256Е, M428L / N434S или T250Q / M428L могут продлить период полувыведения антитела у приматов. Прочитайте китайские патенты на изобретения CN 201280066663.2, US 2005/0014934 А1, WO 97/43316, патент США. No 5869046, патент США. №5747,03 и WO 96/32478 для получения более подробной информации о сайтах - направленных мутагенезах, содержащихся в вариантах Fc высокогоаффинного связывания с неонатальным рецептором (FcRn). В некоторых предпочтительных примерах реализации настоящего изобретения аминокислота М428 (по схеме нумерации EU) в константной области антитела модифицирована для повышения аффинности связывания рецептора FcRn, например M428L. В других предпочтительных примерах реализации аминокислоты 250 и 428 (по схеме нумерации EU) в константной области антитела модифицируются одновременно, например, T250Q и M428L (T250Q / M428L).
Например, биспецифическое антитело, предложенное в настоящем изобретении, может также содержать варианты Fc с аминокислотными заменами, делециями или добавлениями, которые могут снижать или устранять гликозилирование Fc. Например, варианты Fc включают пониженное гликозилирование N- связанных гликанов, обычно присутствующих в положении аминокислоты 297 (по схеме нумерации EU). Гликозилирование по N297 имеет большое влияние на активность IgG. Если гликозилирование по N297 удалено, это повлияет на конформацию верхней половины части СН2 молекулы IgG, тем самым потеряв способность связывания с FcγR и влияя на биологическую активность антитела. В некоторых предпочтительных примерах реализации настоящего изобретения аминокислота N297 (по схеме нумерации EU) в константной области человеческих клеток IgG модифицирована, чтобы избежать гликозилирования антитела, например N297A.
Например, биспецифическое антитело, предлагаемое в настоящем изобретении, может также содержать варианты Fc с заменой, делецией или добавлением аминокислот для устранения гетерогенности заряда. Многие посттрансляционные модификации в процессе экспрессии инженерных клеток вызывают зарядовую гетерогенность моноклональных антител, и гетерогенность лизина на С-конце антитела IgG является одной из основных причин, лизин K на С-конце тяжелой цепи может отсутствовать в определенной пропорции во время продукции антител, что приводит к гетерогенности заряда, тем самым влияя на стабильность, эффективность, иммуногенность или фармакокинетику антител. В некоторых предпочтительных примерах реализации настоящего изобретения K447 (по схеме нумерации EU) на С-конце антитела IgG удаляется или делетируется, чтобы устранить гетерогенность заряда антитела и улучшить однородность продукта экспрессии.
По сравнению с биспецифическим антителом, содержающим Fc-область человеческих клеток IgG дикого типа, Fc- фрагмент, содержащийся в биспецифическом антителе, предложенном в настоящем изобретении, демонстрирует пониженную аффинность не менее к одной из человеческих FcγR (FcγRI, FcγRIIa или FcγRIIIa) и C1q, и обладает пониженной функцией эффекторных клеток или функцию комплемента. Например, в предпочтительном примере реализации настоящего изобретения Fc-фрагмент, содержащийся в биспецифическом антителе, происходящий из человеческих клеток IgGl, имеющий замены L234A и L235A (L234A / L235A), демонстрирует пониженную способность связывания с FcγRI; Кроме того, Fc- фрагмент, содержащийся в биспецифическом антителе, предложенном в настоящем изобретении, может также включать аминокислотные замены, которые изменяют одну или несколько других характеристик (например, способность связываться с рецептором FcRn, гликозилирование антитела или гетерогенность заряда антитела и т.д.). Например, в предпочтительном примере реализации настоящего изобретения аминокислотная последовательность Fc-фрагмента представлена как SEQ ID NO: 19, в которой имеется аминокислотная замена или замена L234a / L235a / T250Q / N297a / P331s / M428L по сравнению с его исходной природной последовательностью, и К447 отсутствуют или удалены.
Молекула биспецифического антитела, предложенного в настоящем изобретении, образуется путем объединения двух идентичных полипептидных цепей через межцепочечные дисульфидные связи в шарнирных областях Fc-фрагментов с образованием четырехвалентного гомодимера, и каждая полипептидная цепь состоит из ScFv против ВСМА, связывающего пептида, scFv против CD3 и Fc-фрагмент в последовательности от N-конца до С-конца.
В предпочтительном примере реализации настоящего изобретения биспецифическое антитело связывается с человеческими белками ВСМА и CD3, и его аминокислотная последовательность заключается в следующем:
(1) Последовательность, показанная в SEQ ID NO: 20;
(2) По сравнению с последовательностью, показанной в SEQ ID NO: 20, последовательность, последовательность, имеющая одну или несколько замен, делеций или добавлений (например, 1, 2, 3, 4 или 5замен, делеций или добавлений); или же
(3) Последовательность, имеющая не менее 80%, не менее 85%, не менее 90%, не менее 91%, не менее 92%, не менее 93%, не менее 94%, не менее 95%, не менее 96%, не менее 97%, не менее 98%, не менее 99% или 100% идентичности с последовательностью, показанной в SEQ ID NO: 20.
В некоторых предпочтительных примерах реализации замена, описанная в (2), является консервативной заменой.
Во втором аспекте настоящего изобретения предоставляется молекула ДНК, кодирующая указанное выше биспецифическое антитело.
В предпочтительном примере реализации настоящего изобретения молекула ДНК, кодирующая указанное выше биспецифическое антитело, имеет нуклеотидную последовательность, показанную в SEQ ID NO:
В третьем аспекте настоящего изобретения предоставляется вектор, содержащий вышеуказанную молекулу ДНК.
В четвертом аспекте настоящего изобретения предоставляется клетка-хозяин, содержащая вышеуказанный вектор; Клетки-хозяева включают прокариотические клетки, дрожжевые клетки или клетки млекопитающих, предпочтительно указанные клетки-хозяева представляют собой клетки млекопитающих, такие как клетки СНО, клетки NS0 или другие клетки млекопитающих, более предпочтительно клетки СНО.
В пятом аспекте настоящего изобретения предоставляется фармацевтическая композиция, содержащая вышеуказанное биспецифическое антитело и фармацевтически приемлемый наполнитель, и/или вектор, и/или разбавитель.
В шестом аспекте настоящего изобретения также предоставляется способ получения биспецифического антитела, предложенного в настоящем изобретении, включающий:
(а) получение слитого гена биспецифического антитела, конструирование вектора экспрессии биспецифического антитела;
(б) трансфекцию вышеуказанного вектора экспрессии в клетку-хозяина способом генной инженерии;
(в) культивирование вышеуказанной клетки-хозяина в условиях, позволяющих продуцировать биспецифическое антитело;
(г) разделение и очистка продуцированного антитела.
При этом вектор экспрессии, описанный на стадии (а), происходит из одной или нескольких плазмид, бактерий и вирусов, предпочтительно вектор экспрессии представляет собой плазмиду, более предпочтительно вектор экспрессии представляет собой PCDNA3.1;
При этом на стадии (б) сконструированный вектор трансфицируют в клетку хозяина способом генной инженерии, клетка-хозяин включает прокариотические клетки, дрожжевые клетки или клетки млекопитающих, предпочтительно клетка-хозяин представляет собой клетку млекопитающего, такую как клетки СНО, Клетки NS0 или другие клетки млекопитающих, более предпочтительно представляют собой клетки СНО.
При этом на стадии (г) биспецифическое антитело отделяют и очищают с помощью обычных способов очистки иммуноглобулинов, включая аффинную хроматографию с протеином А и ионообменную, гидрофобную хроматографию или способ молекулярного сита.
В седьмом аспекте настоящего изобретения предоставляется применение биспецифического антитела в лекарственных средствах для лечения или облегчения симптомов нарушений плазматических клеток и других нарушений В-клеток и аутоиммунных заболеваний, связанных с экспрессией ВСМА, где нарушения плазматических клеток включают в себя, но не ограничиваются следующими болезнями: множественная миелома, плазмоцитома, лейкоз плазматических клеток, макроглобулинемия, амилоидоз, макроглобулинемия Вальденстрема, плазмоцитома солитарной кости, экстрамедуллярная плазмоцитома, остеосклеротическая миелома, болезнь тяжелых цепей, моноклональная гаммопатия неопределенного значения и тлеющая множественная миелома.
Техническая схема, предложенная в настоящем изобретении, дает положительный технический эффект:
1. Биспецифическое антитело, предложенное в настоящем изобретении, нелегко связывается с нормальными клетками со слабой или низкой экспрессией ВСМА, что снижает неспецифическое уничтожение, но специфичность связывания с клетками со сверхэкспрессией или высокой экспрессией ВСМА существенно не уменьшаются, дает хороший эффект уничтожения в организме. Поэтому, когда антиген-мишень экспрессируется только на опухолевых клетках или биспецифическое антитело, предложенное в настоящем изобретении специфически комбинируется только с опухолевыми клетками, сверхэкспрессирующими целевой антиген, иммунные эффекторные клетки активируются только в тканях клеток-мишеней. В результате этого неспецифическое уничтожение нормальных клеток и сопутствующее ему высвобождение цитокинов биспецифическим антителом будут сведены к минимуму, что снизит токсические и побочные эффекты при клиническом лечении.
2. scFv против CD3, выбранный биспецифическим антителом, предложенным в настоящем изобретении, специфически связывается с эффекторными клетками низкоаффинного связывания (значение ЕС50 больше 50 нМ, больше 100 нМ или больше 300 нМ, или более 500 нМ). Кроме того, жесткий пептид СТР, содержащийся в связывающем пептиде L3, встроенный между scFv и Fc против ВСМА и расположенный на его n-конце, и Fc-фрагмент, расположенный на его с-конце, оба частично «покрывают» или «защищают» антиген связывающий домен scFv против -CD3, и этот стерический эффект заставляет его связываться с CD3 с более слабым сродством связывания (например, более 1 мкМ), что ослабляет его способность стимулировать активацию Т-клеток, тем самым ограничивая чрезмерное высвобождение цитокинов. Следовательно, он имеет более высокий уровень безопасности.
3. Биспецифическое антитело, предложенное в настоящем изобретении, творчески применяет двухвалентную структуру против CD3 scFv, что позволяет биспецифическому антителу избегать асимметричной структуры гетеродимерного типа (содержащаяся структура против СD3 scFv одновалентная), обычно принятой в предшествующем уровне техники в конструкции конфигурации, так что исключает возможность несоответствия между тяжелыми цепями, упрощает дальнейшую стадию очистки; Неожиданно неспецифическое связывание scFv против CD3 с Т-клетками не наблюдалось в тесте связывания клеток в лабораторных условиях, степень активации клеток (высвобождение цитокинов, таких как IL-2) контролировалась в безопасном и эффективном диапазоне, то есть двухвалентная структура scFv против -CD3, предложенная в настоящем изобретении, не приведет к сверхактивации Т-клеток, независимых от антигена. Для других биспецифического антитела, которые содержат двухвалентные домены анти-CD3, обычно гиперактивация Т-клеток не контролируемая. Поэтому биспецифические антитела против CD3 обычно разрабатываются так, чтобы избежать введения двухвалентной структуры против CD3.
4. Модифицированный Fc -фрагмент, содержащийся в биспецифическом антителе, предложенном в настоящем изобретении, не обладает способностью связываться с FcγR, что позволяет избежать системной активации Т-клеток, опосредованной FcγR, позволяет активировать иммунные эффекторные клетки только в ткани-мишени.
5. Биспецифическое антитело, предложенное в настоящем изобретении, является гомодимерным, исключает возможность несоответствия между тяжелой цепью и легкой цепью, обеспечивает стабильный последующий производственный процесс, простые и эффективные стадии очистки, однородные продукты экспрессии, что значительно повышает физико-химическую стабильность и стабильность в организме.
Подробное описание изобретения
Сокращения и определения
ВСМ Антиген созревания В-клеток
А
BiAb биспецифическое антитело (bispecific antibody)
CDR Определяющие комплементарность области в вариабельных областях иммуноглобулина, определенные схемой нумерации Kabat
ЕС50 Концентрация, обеспечивающая 50% максимального эффекта или связывания
ELIS Иммуносорбентный анализ с применением фиксированных ферментов
А
FR Каркасная область антитела: вариабельная область иммуноглобулина, исключая область CDR
HRP Пероксидаза хрена.
IL-2 Интерлейкин 2
IFN Интерферон
IC50 Концентрация, обеспечивающая 50%-ное ингибирование
IgG Иммунный глобулин G
Kabat Схема нумерации и выравнивания иммуноглобулинов, предложенная Элвином А.Кабатом
mAb Моноклональное антитело
PCR Полимеразная цепная реакция
V Сегменты цепи IgG с вариабельной последовательностью между различными антителами. Они простираются до 109-го остатка Кабата легкой цепи и 113-го остатка тяжелой цепи.
VH Вариабельная область тяжелой цепи иммуноглобулина
VK Вариабельная область легкой цепи к иммуноглобулина
KD Константа равновесной диссоциации
ka Константа скорости ассоциации
kd Константа скорости диссоциации.
Если не указано иное, все технические и научные термины, используемые здесь, имеют такое же значение, как обычно понимаемое средним специалистом в данной области, к которой принадлежит изобретение. Антитела или их фрагменты, используемые в настоящем изобретении, могут использовать обычные способы, известные в данной области, по отдельности или в комбинации (например, способы делеций, вставки, замены, добавления и/или рекомбинации и/или других модификаций аминокислот) для дальнейшей модификации. Способ введения такой модификации в его последовательность ДНК на основе аминокислотной последовательности антитела хорошо известен специалистам в данной области; См., Например, Sambrook, «Молекулярное клонирование: лабораторное руководство», Cold Spring Harbor Laboratory (1989) N.Y. Упомянутые модификации предпочтительно выполняются на уровне нуклеиновых кислот. Между тем для лучшего понимания настоящего изобретения ниже приведены определения и объяснения связанных терминов.
«ВСМА» представляет собой антиген созревания В-клеток, принадлежащий к члену суперсемейства рецепторов фактора некроза опухоли, который предпочтительно экспрессируется в зрелых В-лимфоцитах, экспрессируется на поверхности плазмобластов (т.е. предшественников плазматических клеток) и плазматических клеток. RNA ВСМА может быть обнаружена в селезенке, лимфатическом узле, тимусе, надпочечниках и печени, уровень RNA ВСМА во многих линиях В-клеток также повышается после созревания. ВСМА связан со многими заболеваниями, такими как лейкоз, лимфома (например, лимфома Ходжкина), множественная миелома, аутоиммунные заболевания (например, системная красная волчанка) и другие связанные заболевания, поэтому он используется в качестве потенциальной мишени болезней, связанных с В-клеточками. Заболевания, связанные с мишенью ВСМА, также включают другие родственные заболевания или расстройства, обнаруженные в предшествующем уровне техники и в будущем. Этот термин также включает любые варианты, изоформы и видовые гомологи ВСМА, которые в естественных условиях экспрессируются клетками, включая опухолевые клетки, или экспрессируются клетками, трансфицированными генами ВСМА или кДНК.
Молекулы CD3 являются важным антигеном дифференцировки на Т-клеточной мембране, характерным маркером зрелых Т-клеток, состоят из шести пептидных цепей, которые образуют комплекс TCR-CD3 с нековалентной связью и рецептором Т-клеточного антигена (TCR). Т.е. эти молекулы не только участвуют во внутрицитоплазматической сборке комплекса TCR-CD3, но также передают сигналы стимуляции антигена через мотив активации иммунного рецептора на основе тирозина (Immunoreceptor Tyrosine-based Activation Motif, ITAM) в цитоплазматической области каждой полипептидной цепи. Основные функции молекулы CD3 заключаются в следующем: стабилизация структуры TCR, передача сигнала активации Т-клеток, когда TCR специфически распознает и связывается с антигеном, CD3 участвует в передаче сигнала в цитоплазму Т-клеток, что является первым сигналом, вызывающим активацию Т-клеток, играет чрезвычайно важную роль в распознавании антигена Т-клеток и иммунном ответе.
«CD3» относится к части комплекса рецепторов Т-клеток, который состоит из трех различных цепей: CD3ε, CD3δ и CD3γ. Кластеризация (clustering) CD3 на Т-клетках, вызванная какой-то причиной, включая иммобилизации анти-CD3-антител, включая, но не ограничиваясь им, приводит к активации Т-клеток, которая аналогична активации, опосредованной рецептором Т-клеток, но не зависит от специфичности клонов TCR. Большинство антител к CD3 распознают ε-цепь CD3. Второй функциональный домен биспецифического антитела, предложенного в настоящем изобретении, специфически распознающий рецептор CD3 на поверхности Т-клеток, особо не ограничивается, пока он может специфически распознавать CD3, такие как антитела против CD3: US 7,994,289, US 6,750,325; US 6,706,265; US 5,968,509; US 8076459; US 7,728,114, US 20100183615, упомянутые в следующих патентах, включая но не ограничиваясь ими; Предпочтительно, антитела против CD3 человека, используемые в настоящем изобретении, были перекрестно реактивными с макаком-крабоедом и/или макаком-резусом,, такими как антитела против CD3 человека, упомянутые в следующих патентах: 2016130726, США. 20050176028, WO 2007042261 или WO 2008119565, включая, но не ограничиваясь ими,. Этот термин также включает любые варианты, изоформы, производные и видовые гомологи CD3, которые естественным образом экспрессируются клетками или экспрессируются на клетках, трансфицированных генами или кДНК, кодирующими вышеупомянутые цепи.
Термин «антитело», в частности, включает моноклональные антитела, поликлональные антитела и антител оподобные полипептиды, такие как химерные антитела и гуманизированные антитела. «Антигенсвязывающий фрагмент» включает фрагменты, полученные с помощью любых известных способов, таких как способы ферментативного расщепления, пептидного синтеза и рекомбинации. Некоторые антигенсвязывающие фрагменты состоят из интактных частей антител, которые сохраняют антигенсвязывающую специфичность исходных молекул антител. Например, антигенсвязывающий фрагмент может содержать не менее одну вариабельную область (вариабельную область тяжелой цепи или легкой цепи) или одну или несколько CDR антитела, о котором известно, что оно связывается с конкретным антигеном. Примеры подходящих антигенсвязывающих фрагментов включают, но не ограничиваются следующими, тела биспецифического антитела и одноцепочечные молекулы, а также молекулы Fab, F (ab') 2, Fc, Fabc и Fv, одноцепочечные (Sc) антитела, отдельные легкие цепи антитела, отдельные тяжелые цепи антитела, химерные слияния между цепями антитела или CDR и другим белком, белковые каркасы, мономеры или димеры тяжелой цепи, мономеры или димеры легкой цепи, димер, состоящий из одной тяжелой цепи и одной легкой цепи, одновалентое антитело, состоящее из домены VL, VH, CL и СН1, или как описано в WO 2007059782, содержат двухвалентный фрагмент из двух Fab-фрагментов, соединенных дисульфидной связью в шарнирной области, фрагмент Fd, состоящий по существу из доменов VH и СН1; Фрагмент Fv, фрагмент dAb, который по существу состоит из доменов VL и VH одного плеча антитела (Ward и соавтора, Nature, 1989, 341: 544-54), он по существу состоит из домена VH, также называемого доменом антитела. (Holt и соавтор, Trends Biotechnology. 2003, 21 (11): 484-90); или наночастицы (Revets и соавтор; Expert Opin Biol Ther, 2005, январь; 5 (1): 111-24); Изолированные области, определяющие комплементарность (CDR) и т.д. Все изотипы антител могут использоваться для получения антигенсвязывающих фрагментов. Кроме того, антигенсвязывающие фрагменты могут содержать белковый каркас, не связанный с антителами, который может успешно включать полипептидные фрагменты в ориентацию, которая придает аффинность данному интересующему антигену (например, белковый каркас). Антигенсвязывающий фрагмент могут получиться рекомбинантно или продуцировать ферментативным или химическим расщеплением интактного антитела. Термин «антитело или его антигенсвязывающий фрагмент» может использоваться для обозначения того, что данный антигенсвязывающий фрагмент включен в один или несколько аминокислотных фрагментов антитела, упомянутого во фразе.
Термин «гипервариабельная область», или «область CDR», или «определяющая комплементарность область» относится к аминокислотному остатку антитела, ответственному за связывание антигена, который представляет собой прерывистую аминокислотную последовательность. Последовательность области CDR представляет собой аминокислотные остатки в вариабельной области, определенные методами IMGT, Kabat, Chothia и AbM, идентифицируемые любым методом определения последовательности области CDR, хорошо известным в данной области. Например, гипервариабельная область содержит следующие аминокислотные остатки: аминокислотные остатки, происходящие из «определяющей комплементарность области» или «CDR», определенной выравниванием последовательностей, например, остатки 24-34 (L1), 50-56 (L2) и 89-97 (L3) вариабельного домена легкой цепи и остатки 31-35 (H1), 50-65 (Н2) и 95-102 (Н3) вариабельного домена тяжелой цепи, смотри Kabat и соавтор, 1991, Sequences of Proteins of Immunological Interest, 5-е издание, Public Health Service, National Institutes of Health, Bethesda, Md.; и/или остатки из «гипервариабельного кольца» (HVL), определенные в соответствии со структурой, например, остатки 26-32 (L1), 50-52 (L2) и 91-96 (L3) вариабельного домена легкой цепи и остатки 26-32 (H1), 53-55 (Н2) и 96-101 (Н3) вариабельного домена тяжелой цепи, см. Chothia and Leskl, J. Mol. Biol., 196: 901-917, 1987. «Каркасные» остатки или остатки «FR» представляют собой остатки вариабельного домена, отличные от остатков гипервариабельной области, как определено в данном документе. В некоторых примерах реализации, содержащиеся в антителе или антигенсвязывающем фрагменте, предложенном в настоящем изобретении, CDR предпочтительно определяются с помощью системы нумерации Kabat, Chothia или IMGT. Специалисты в данной области могут явно присвоить каждой системе любую последовательность вариабельного домена, не полагаясь на какие-либо экспериментальные данные, помимо самой последовательности. Например, схема нумерации остатков по Кабату данного антитела может быть определена путем сравнения последовательности антитела с каждой «стандартной» последовательностью нумерации. На основе нумерации представленных здесь последовательностей схема нумерации для определения любой последовательности вариабельной области в списке последовательностей полностью находится в пределах обычных технических возможностей специалистов в данной области.
Термин «одноцепочечное антитело против Fv» (или «scFv-антитело») относится к фрагменту антитела, содержащему домены VH и VL- антитела, которое представляет собой рекомбинантный белок вариабельной области тяжелой цепи (VH) и вариабельной области легкой цепи (VL), соединенный линкером (linker), два домена линкера перекрестно связанны с помощью ликера, в результате этого образованы сайты связывания антигена, связывающая последовательность обычно состоит из гибкого пептида, включаяС2 (GGGGS)3, но не ограничиваясь им. Размер ScFv обычно составляет 1/6 размера интактного антитела. Одноцепочечное антитело предпочтительно представляет собой последовательность аминокислотной цепи, кодируемую нуклеотидной цепью. Для получения информации о scFv, прочитайте PluckThun (1994) The Pharmacology of Monoclonal Antibodies (Фармакология моноклональных антител), Том 113, редактор: Rosenburg и Springer-Verlag, New Yor, стр. 269-315, также публикацию международной патентной заявки № WO 88/01649 и патенты США №№4,946,778 и 5,260,203.
Термин «Fab-фрагмент» состоит из СН1 и вариабельных областей одной легкой цепи и одной тяжелой цепи. Тяжелая цепь молекулы Fab не может образовывать дисульфидную связь с другой молекулой тяжелой цепи. Размер «Fab-антитела» составляет 1/3 от размера интактного антитела, он содержит только один сайт связывания антигена.
Термин «фрагмент F (ab') 2» содержит домены VH и СН1 двух легких цепей и двух тяжелых цепей, а также часть константной области между доменами СН1 и СН2, тем самым образуя межцепочечную дисульфидную связь между двумя тяжелыми цепями. Следовательно, фрагмент F (ab') 2 состоит из двух фрагментов Fab', удерживаемых вместе дисульфидными связями между двумя тяжелыми цепями.
Термин «Fc-область» относится к фрагменту константной области тяжелой цепи антитела, который включает, не менее, шарнирную область, домен СН2 и СН3.
Термин «Fv-область» включает вариабельные области как тяжелой, так и легкой цепей, но не имеет константных областей, представляет собой наименьший фрагмент, включающий интактные сайты распознавания и связывания антигена.
Термин «Fd-фрагмент» состоит из СН1 и вариабельной области тяжелой цепи, представляет собой часть тяжелой цепи, оставшуюся после удаления легкой цепи из Fab-фрагмента.
Термин «белок стабильности дисульфидной связи (dsFv)» вводит одну точку мутации цистеина в областях VH и VL соответственно, в результате этото образуется дисульфидная связь между VH и VL для достижения структурной стабильности.
Термин «связывающий пептид» относится к пептиду, соединяющему два полипептида, где, связывающий пептид может представлять собой две вариабельные области иммуноглобулина или одну вариабельную область. Длина связывающего пептида может составлять 0-30 аминокислот или 0-40 аминокислот. В некоторых примерах реализации связывающий пептид может иметь длину 0-25, 0-20 или 0-18 аминокислот. Некоторых примерах реализации связывающий пептид может быть пептидом длиной не более 14, 13, 12, 11, 10, 9, 8, 7, 6 или 5 аминокислот. В других примерах реализации связывающий пептид может иметь длину 0-25, 5-15, 10-20, 15-20, 20-30 или 30-40 аминокислот. В других примерах реализации связывающий пептид может быть примерно 0, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, В длину 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 аминокислот, связывающие пептиды известны специалистам в данной области. Связывающий пептид может быть получен любым способом в данной области, например, связывающий пептид может быть химически синтезирован.
Термин «константная область тяжелой цепи» включает аминокислотные последовательности, полученные из тяжелых цепей иммуноглобулина. Полипептиды, включающие константные области тяжелой цепи, содержат не менее один из следующих видов: домен СН1, шарнирный (например, верхний шарнирный участок, средний шарнирный участок и/или нижний шарнирный участок) домен, домен СН2, домен СН3 или их варианты или фрагменты. Например, антигенсвязывающий полипептид, используемый в настоящей заявке, может включать полипептидную цепь с доменом СН1; полипептиды с доменом СН1, по крайней мере, частью шарнирного домена и домена СН2; полипептидную цепь с доменом СН1 и доменом СН3; полипептидную цепь с доменом СН1, по крайней мере, часть шарнирного домена и домен СН3, или полипептидную цепь с доменом СН1, по крайней мере, часть шарнирной структуры, домен СН2 и домен СН3. В другом примере реализации, полипептид, предложенный в настоящей заявке, включает полипептидную цепь, имеющую домен СН3. Кроме того, в антителах, используемых в настоящей заявке, может отсутствовать по крайней мере часть домена СН2 (например, весь домен СН2 или его часть). Как упоминалось выше, специалистам в данной области должно быть понятно, что константные области тяжелой цепи могут быть модифицированы так, чтобы они отличались от встречающихся в природе молекул иммуноглобулинов по аминокислотной последовательности.
Термин «константная область легкой цепи» включает аминокислотную последовательность легкой цепи антитела. Предпочтительно константная область легкой цепи включает не менее один из константного kappa-домена и константного lambda-домена.
Термин «домен VH» включает аминоконцевой вариабельный домен тяжелой цепи иммуноглобулина, а термин «домен СН1» включает первую (в основном аминоконцевую) константную область тяжелой цепи иммуноглобулина. Домен СН1 примыкает к домену VH и является аминоконцом шарнирной области молекулы тяжелой цепи иммуноглобулина.
Термин «шарнирная область» включает ту часть молекулы тяжелой цепи, которая соединяет домен СН1 с доменом СН2. Шарнирная область содержит около 25 остатков и является гибкой, поэтому две N-концевые антигенсвязывающие области перемещаются независимо. Шарнирную область можно разделить на три разных домена: верхний, средний и нижний шарнирные домены (Roux КН и соавтор, J. Immunol., 161: 4083, 1998).
Термин «дисульфидная связь» включает ковалентную связь, образованную между двумя атомами серы. Аминокислота цистеин содержит сульфгидрильную группу, которая может образовывать дисульфидную связь или мостик со второй сульфгидрильной группой. В большинстве встречающихся в природе молекул IgG области СН1 и CK связаны дисульфидными связями, а две тяжелые цепи связаны двумя дисульфидными связями в 239 и 242 (положение 226 или 229, схема нумерации ЕС), что соответствует схеме нумерации Kabat.
«Связывание» определяет аффинное взаимодействие между специфическим эпитопом на антигене и его соответствующим антителом, которое обычно понимается как «специфическое распознавание». «Специфическое распознавание» означает, что биспецифическое антитело, предложенное в настоящем изобретении, не перекрестно реагирует или по существу не перекрестно реагирует с любым полипептидом, кроме антигена-мишени. Степень специфичности можно судить иммунологическими способами, включая, но не ограничиваясь следующими: иммуноблоттинг, иммуноаффинная хроматография, проточная цитометрия и т.п. В настоящем изобретении конкретное предпочтение распознавания определяется проточной цитометрией, в то время как стандарт конкретного распознавания в конкретных случаях может оцениваться общим техническим персоналом в этой области в соответствии с их знаниями в этой области.
Термин «биспецифическое антитело» относится к биспецифическому антителу, предложенному в настоящем изобретении, например, к антителу против Her2 или его антигенсвязывающему фрагменту, может быть дериватизировано или связано с другой функциональной молекулой, например с другим пептидом или белком (например, ТАА, цитокины и рецепторы клеточной поверхности) для создания биспецифических молекул, которые связываются по крайней мере с двумя разными сайтами связывания или молекулами-мишенями. Для создания биспецифической молекулы, предложенной в настоящем изобретении, антитело, предложенное в настоящем изобретении, может быть функционально связано (например, путем химического связывания, слияния генов, нековалентного связывания или другими способами) с одной или несколькими другими связывающими молекулами, такими как другая антитело, фрагмент антитела, пептид или миметик связывания с получением биспецифической молекулы. «Биспецифическое антитело» относится к включению двух вариабельных доменов или единиц scFv, так что полученное антитело распознает два разных антигена. В данной области известно множество различных форм и применений биспецифического антитела (Chames Р и соавтор, Curr. Opin. Drag disc. Dev., 12: 276, 2009; Spiess С и соавтор, Mol. Immunol., 67: 95 - 106, 2015).
Термин «биспецифическое антитело» относится к биспецифическому антителу, предложенному в настоящем изобретении, например, к антителу против Her2 или его антигенсвязывающему фрагменту, может быть дериватизировано или связано с другой функциональной молекулой, например с другим пептидом или белком (например, ТАА, цитокины и рецепторы клеточной поверхности) для создания биспецифических молекул, которые связываются по крайней мере с двумя разными сайтами связывания или молекулами-мишенями. Для создания биспецифической молекулы, предложенной в настоящем изобретении, антитело, предложенное в настоящем изобретении, может быть функционально связано (например, путем химического связывания, слияния генов, нековалентного связывания или другими способами) с одной или несколькими другими связывающими молекулами, такими как другая антитело, фрагмент антитела, пептид или миметик связывания с получением биспецифической молекулы. Например, «биспецифическое антитело» означает, что оно содержит два вариабельных домена или единицы scFv, так что полученное антитело распознает два разных антигена. В данной области известно множество различных форм и применений биспецифического антитела (Chames Р и соавтор, Curr. Opin. Drug disc. Dev., 12: 276, 2009; Spiess С и соавтор, Mol. Immunol, 67: 95 -106, 2015).
Термин «карбоксиконцевой пептид hCG-β (СТР)» представляет собой короткий пептид от карбоксильного конца β-субъединицы хорионического гонадотропина человека (hCG). Четыре вида полипептидных гормона, связанные с репродукцией, фолликул о стимулирующий гормон (ФСГ), лютеинизирующий гормон (ЛГ), тиреотропный гормон (ТТГ) и хорионический гонадотропин (ХГЧ), содержат одну и ту же α-субъединицу и соответствующие им специфические β-субъединицы. По сравнению с тремя другими гормонами, период полувыведения ХГЧ в организме явно продлен, что в основном происходит из специфического карбоксильного концевого пептида (СТР) на его β-субъединице. СТР содержит 37 аминокислотных остатков с 4 сайтами О-гликозилирования, конец боковой цепи сахара - это остатки сиаловой кислоты. Отрицательно заряженный СТР с высоким содержанием слюны способен противостоять почечному клиренсу, тем самым продлевая период полувыведения белка в организме (Fares FA и соавтор, Proc. Natl. Acad. Sci. USA, 89: 4304-4308, 1992).
Термин «гликозилирование» относится к присоединению олигосахаридов (углеводов, содержащих два или более моносахаридов, связанных вместе, например, от 2 до примерно 12 связанных вместе моносахаридов) с образованием гликопротеинов. Боковые цепи олигосахаридов обычно связаны с основной цепью гликопротеинов N- или О-связью. Олигосахариды антител, описанные в данном документе, обычно связаны с доменом СН2 области Fc как N-связанные олигосахариды. «N-связанное гликозилирование» относится к углеводным фрагментам, связанным с остатками аспарагина гликопротеиновых цепей. Например, специалист может распознать, что каждый из доменов СН2 мышиного IgG1, IgG2a, IgG2b и IgG3 и человеческих клеток IgG1, IgG2, IgG3, IgG4, IgA и IgD, имеет единственный сайт для N-связанного гликозилирования по остатку 297.
Гомологичные антитела, в другом аспекте аминокислотные последовательности, содержащиеся в вариабельных областях тяжелой цепи и легкой цепи антитела, предложенного в настоящем изобретении, гомологичны аминокислотным последовательностям предпочтительных антител, описанных в настоящем документе, и где указанное антитело сохраняет, например, желаемые функциональные свойства биспецифического антитела Her2 × CD3.
Антитела с консервативной модификацией, термин «консервативная модификация» относится к модификациям аминокислот, не существенно влияющие или изменяющие характеристики связывания антител, содержащих аминокислотную последовательность. Такие консервативные модификации включают аминокислотные замены, добавления и делеций. Модификация может быть достигнута стандартными методами, известными в данной области. Например, преимущества сайт-направленного мутагенеза и посредничества PCR вводятся в антитело, предложенное в настоящем изобретении. Консервативная аминокислотная замена относится к замене аминокислотного остатка на аминокислотный остаток, имеющий аналогичную боковую цепь. Семейства аминокислотных остатков, имеющих аналогичные боковые цепи, подробно описаны в данной области. Эти семейства включают: аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин), кислотными боковыми цепями (например, аспарагиновая кислота, глутаминовая кислота), незаряженные полярные боковые цепи (например, глицин, аспарагин, глутамин, серии, треонин, тирозин, цистеин, триптофан), неполярные боковые цепи (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин), β-разветвленные боковые цепи (например, треонин, валин, изолейцин) и ароматические боковые цепи (например, тирозин, фенилаланин, триптофан, гистидин). Следовательно, один или несколько аминокислотных остатков в области CDR антитела, предложенные в настоящем изобретении, могут быть заменены другими аминокислотными остатками из того же семейства боковых цепей.
Вариант Fc с измененной аффинностью связывания с неонатальным рецептором (FcRn), как здесь используется, «FcRn» относится к белку, кодируемому не менее частично геном FcRn, который связывается с областью Fc антитела IgG. FcRn может происходить из любого организма, как человека, проэфконийнен, крысу, кролика и обезьяну, включая, но не ограничиваясь ими. Функциональный белок FcRn содержит два полипептида, которые часто называют тяжелой цепью и легкой цепью: легкая цепь представляет собой β-2-микроглобулин, а тяжелая цепь кодируется геном FcRn.
Настоящее изобретение относится к антителу с регулируемым связыванием с FcRn (регуляция включает как увеличение, так и уменьшение связывания). Например: в некоторых случаях повышенное связывание заставит клетку рециклировать антитела и тем самым продлить период полувыведения в организме, например, терапевтических антител. Иногда желательно уменьшить связывание FcRn, например, в качестве диагностического антитела или терапевтического антитела, содержащего радиоактивную метку. Кроме того, в настоящем изобретении, могут использоваться антитела, демонстрирующие повышенное связывание с FcRn при изменении связывания с другими рецепторами Fc, например Feγ Rs.
Настоящая заявка относится к антителам, содержащим модификации аминокислот, которые регулируют связывание с FcRn. Особое значение имеет то, что при более низком рН аффинность связывания с FcRn возрастает, в то время как при более высоком рН связывание не показывает изменение минимального включения антител или их функциональных вариантов в домен Fc.
Для варианта Fc высокоаффиного связывания с неонатальным рецептором (FcRn), период полувыведения в плазме которого зависит от его связывания с FcRn, связывание обычно происходит при рН 6,0, диссоциация происходит при рН 7,4 (рН плазмы). Посредством изучения сайтов связывания сайты связывания IgG на FcRn был модифицированы для увеличения его связывающей способности при рН 6. Было показано, что мутации некоторых остатков домена Fey человека, важных для связывания с FcRn, могут увеличивать период полувыведения в сыворотке. Сообщалось, что мутации в Т250, М252, S254, Т256, V308, Е380, М428 и N434 (нумерация EU) могут увеличивать или уменьшать аффинность связывания FcRn (Roopenian DC и соавтор, Nat. Rev. Immunol., 7: 715-725, 2007). Патент Республики Кореи № KR 10-1027427 раскрывает варианты трастузумаба (Герцептин, Genentech) высокоаффиного связывания FcRn, и эти варианты включают варианты, выбранные из 257С, 257М, 257L, 257N, 257Y, 279Q, одной или нескольких модификаций аминокислот 279Y, 308F и 308Y. В корейской патентной публикации № KR 2010-0099179 представлены варианты бевацизумаба (авастин, Genentech), и эти варианты демонстрируют увеличенный период полувыведения в организме за счет аминокислотных модификаций, содержащихся в N434S, M252Y / M428L, M252Y / N434S и M428L / N434S. Кроме того, Hinton и соавтор также обнаружили, что мутанты T250Q и M428L2 увеличивают связывание с FcRn в 3 и 7 раз соответственно. Мутация двух сайтов одновременно увеличивала связывание в 28 раз. У макака-резуса мутанты M428L или T250QM / 428L показали 2-кратное увеличение периода полувыведения в плазме (Hinton PR и соавтор, J. Immunol., 176: 346-356, 2006). Для получения более подробной информации о сайтах мутации, содержащихся в вариантах Fс высокоаффиного связывания с неонатальным рецептором (FcRn), изучите китайский патент на изобретение CN 201280066663.2. Кроме того, исследования на мутации T250Q / M428L в сегменте Fc 5 гуманизированных антител были проведены, эти мутации предназначены для улучшения взаимодействия между Fc и FcRn, в последующих фармакокинетических испытаниях в организме было обнаружено, что при введении подкожной инъекции мутантное антитело Fc имеет улучшенные фармакокинетические параметры по сравнению с антителом дикого типа.
Другие точки мутации, которые могут увеличивать сродство антитела, предложенные в настоящем изобретении к FcRn, включают, но не ограничиваются следующими модификациями аминокислот:: 226, 227, 230, 233, 239, 241, 243, 246, 259, 264, 265, 267, 269, 270, 276, 284, 285, 288, 289, 290, 291, 292, 294, 298, 299, 301, 302, 303, 305, 307, 309, 311, 315, 317, 320, 322, 325, 327, 330, 332, 334, 335, 338, 340, 342, 343, 345, 347, 350, 352, 354, 355, 356, 359, 360, 361, 362, 369, 370, 371, 375, 378, 382, 383, 384, 385, 386, 387, 389, 390, 392, 393, 394, 395, 396, 397, 398, 399, 400, 401, 403, 404, 408, 411, 412, 414, 415, 416, 418, 419, 420, 421, 422, 424, 426, 433, 438, 439, 440, 443, 444, 445, 446, где, номер аминокислоты в области Fc представляет собой номер индекса ЕС в Kabat.
Варианты Fс высокоаффиного связывания с FcRn также содержат все другие известные сайты модификации аминокислот и неоткрытые сайты модификации аминокислот.
В альтернативных вариантах осуществления варианты IgG могут быть оптимизированы так, чтобы иметь повышенную или пониженную аффинность FcRn и повышенную или пониженную человеческую FcγR, включая, но не ограничиваясь следующими, аффинность FcγRI, FcγRIIa, FcγRIIb, FcγRIIc, FcγRIIIa и FcγRIIIb, также аффинность аллельных вариантов к FcγRIIIb
Предпочтительно, специфичность Fc-лиганда варианта IgG будет определять его терапевтическое применение. Использование данного варианта IgG в терапевтических целях будет зависеть от эпитопа или формы антигена-мишени, а также заболевания или показания, которое необходимо лечить. Для большинства целей и показаний к применению повышенное связывание FcRn может быть более предпочтительным, поскольку усиленное связывание FcRn может привести к увеличению периода полувыведения в сыворотке. Более длительный период полувыведения в сыворотке позволяет применять более низкую частоту и дозу во время лечения. Эта характеристика может быть особенно предпочтительной, когда терапевтическое средство вводят в ответ на показания, требующие повторного введения. Для некоторых целей и показаний к применению сниженная аффинность FcRN может быть особенно предпочтительной, когда требуется, чтобы вариант Fc имел увеличенный клиренс или уменьшенный период полувыведения в сыворотке, например, когда полипептид FC используется в качестве проявителя или радиотерапевтического агента.
Замены Fc с увеличенным периодом полувыведения, как описано в данном документе, «изменение Fc с увеличенным периодом полувыведения» относится к изменению периода полувыведения в организме белка в полипептидной цепи Fc, содержащейся в удлинении полипептидной цепи Fc по сравнению с периодом полувыведения аналогичного белка Fc, который содержит тот же полипептид Fc, но не содержит замен. Замены могут заключаться в полипептидной цепи Fc, являющейся частью биспецифического антитела. Замены T250Q, M252Y, S254T и Т256Е (треонин в положении 250 заменен на глутамин; метионин в положении 252 заменен на тирозин. Серии в положении 254 заменен на треонин. А треонин в положении 256 заменен на глутаминовую кислоту. Номер определен по схеме нумерации ЕС) представляют собой замены Fc с увеличением периода полувыведения, могут использоваться в комбинации, по отдельности или в любой комбинации. Эти изменения и некоторые другие изменения подробно описаны в патентах США No. №7083 784. Части патента США No. 7083784, описывающие такое изменение, включены здесь посредством ссылки.
Аналогичным образом, M428L и N434S представляют собой замену Fc с увеличенным периодом полувыведения и могут использоваться в комбинации, по отдельности или в любой комбинации. Эти изменения и другие изменения подробно описаны в публикации заявки на патент США 2010/0234575 и патенте США No. №7670600. Части текста публикации заявки на патент США 2010/0234575 и патента США No. 7670600 описывающих такие изменения, включены здесь посредством ссылки.
Кроме того, согласно приведенному здесь значению, любая замена в одном из следующих сайтов может рассматриваться как изменение Fc с увеличением периода полувыведения: 250, 251, 252, 259, 307, 308, 332, 378, 380, 428, 430, 434, 436. Каждое из этих изменений или комбинация этих изменений могут использоваться для продления периода полувыведения биспецифического антитела, описанных здесь. Другие изменения, которые могут использоваться для продления периода полувыведения, были подробно описаны в международной заявке PCT/US 2012/070146 от 17 декабря 2012 г. (номер публикации: WO 2013/096221). Части этой заявки, описывающие вышеупомянутые изменения, включены здесь посредством ссылки.
Изменения Fc с увеличенным периодом полувыведения также включают известные технологии и сайты, которые могут быть обнаружены в будущем, и их модификации.
Fc может происходить из любого организма, включая, но не ограничиваясь следующими, человека, мышей, крысу, кролика и обезьяну.
Нуклеиновые кислоты, кодирующие биспецифические антитела, с использованием терапевтических агентов и антител или фрагментов антител, описанных в данном документе, специалисты в данной области могут легко сконструировать несколько клонов, содержащих функционально эквивалентные нуклеиновые кислоты (например, нуклеиновые кислоты, имеющие разные последовательности, но кодирующие идентичные эффекторные части или последовательности антител). Следовательно, настоящее изобретение предлагает биспецифическое антитело, нуклеиновые кислоты, варианты нуклеиновых кислот, производные и видовые гомологи, кодирующие антитела, фрагменты и конъюгаты антител и их слитые белки.
Многие последовательности нуклеиновых кислот, кодирующие области иммуноглобулина, содержащие области VH, VL, шарнирные, CH1, СН2, СН3 и СН4, известны в данной области. Например, последовательности, описанные в работе Kabat и соавтора, Sequences of Proteins of Immunological Interest, Public Health Service NIH, Bethesda, MD, 1991. Согласно предложениям в настоящем документе, специалисты в данной области могут комбинировать последовательности нуклеиновых кислот и/или другие последовательности нуклеиновых кислот, известные в данной области для построения последовательностей нуклеиновых кислот, кодирующих биспецифические антитела, предложенные в настоящем изобретении. Типичные нуклеотиды, кодирующие биспецифическое антитело, предложенное в настоящем изобретении, включают SEQ ID NO: 21.
Кроме того, на основе аминокислотных последовательностей, представленных здесь и в других местах, и общих знаний в этой области специалисты в данной области могут определить последовательность нуклеиновой кислоты, кодирующую биспецифическое антитело, предложенное в настоящем изобретении. В дополнение к традиционным способам получения клонированных фрагментов ДНК, кодирующих определенные аминокислотные последовательности, в таких компаниях, как DNA 2.0 (Menlo Park, СА, USA), Blue Heron (Bothell, WA, USA) обычно используется способ химического синтеза для получения ДНК размером с гена в любом желаемом порядке, что упрощает процесс получения ДНК.
При получении биспецифического антитела, предложенного в настоящем изображении, любые способы, известные в данной области могут использоваться. Традиционные способы получения биспецифического антитела представляют собой способ химической сшивки или способ гибридной сшивки или способ четырехвалентной сшивки (например, Staerz UD и соавтор, Nature, 314: 628-31, 1985; Milstein С и соавтор, Nature, 305: 537-540, 1983; Karpovsky В и соавтор, J. Exp.Med., 160: 1686-1701, 1984). Способ химического сопряжения заключается в соединении двух разных моноклональных антител вместе способом химического связывания для получения биспецифических моноклональных антител. Например, химическое связывание двух разных моноклональных антител или, например, химическое связывание двух фрагментов антител, таких как два Fab-фрагмента. Способ гибридной сшивки позволяет получать биспецифические моноклональные антитела путем клеточной гибридизации или тройной гибридомы, эти клеточные гибридомы или тройные гибридомы получают путем слияния установленных гибридом или слияния установленных гибридом с лимфоцитами, полученными от мышей. Хотя эти технологии используются для производства BiAb, различные проблемы затрудняют использование таких комплексов, такие как получение смешанных популяций, содержащих различные комбинации сайтов связывания антигена, трудности в аспекте экспрессии белка, необходимость в чистоте BiAb-мишени, низкий выход, высокая стоимость производства и др.
В последних способах используются генно-инженерные конструкции, которые могут производить гомогенный продукт из одного BiAb без необходимости тщательной очистки для удаления нежелательных побочных продуктов. Такие конструкции включают тандемный scFv, вторичное антитело, тандемное вторичное антитело, антитело, содержащееся 2 вариабельного домена, гетеродимер с использованием таких мотивов, как домен Chi / Ck или DNL ТМ (Chames & Baty, Curr. Opin. Drug. Discov. Devel., 12: 276- 83, 2009; Chames & Baty, mAbs, 1: 539-47). Соответствующие способы очистки хорошо известны.
Способ моноклонального антитела к лимфоцитам также может быть использован для получения антител путем клонирования и экспрессии кДНК в вариабельной области иммуноглобулина, продуцируемой отдельными лимфоцитами, выбранными для продуцирования специфических антител, например, Babcook J и соаватор., Proc. Natl. Acad. Sci. USA 93: 7843-7848, 1996; способы, описанные в WO 92/02551; WO 2004/051268 и WO 2004/106377.
Полипептиды антигена, используемые, например, для получения антител для иммунизации хозяина или для пэннинга, таких как антитела для фагового дисплея (или экспрессии на поверхности дрожжевых клеток или бактериальных клеток), могут быть получены из клеток-хозяев, модифицированных генной инженерией, содержащего систему экспрессии, способами, способы получения могут известными способами в данной области, или они могут быть извлечены из природных биологических источников. Например, нуклеиновые кислоты, кодирующие одну или две полипептидные цепи биспецифического антитела, могут быть введены в культивируемые клетки-хозяева различными известными способами (такими как трансформация, трансфекция, электропорация, бомбардировка частицами, покрытыми нуклеиновой кислотой, и т.д.). В некоторых примерах реализации нуклеиновая кислота, кодирующая биспецифическое антитело, может быть вставлена в вектор, подходящий для экспрессии в клетке-хозяине, перед введением в клетку-хозяина. Типичный вектор может содержать элементы последовательности, которые позволяют встроенной нуклеиновой кислоте экспрессироваться на уровнях RNA и белка.
Указанные векторы хорошо известны в данной области, и многие из них коммерчески доступны. Клетки-хозяева, содержащие нуклеиновую кислоту, могут культивироваться в условиях, позволяющих клетке экспрессировать нуклеиновую кислоту, и полученный BiAb могут быть собран из популяции клеток или культуральной среды. Альтернативно, BiAb может продуцироваться в организме, например, в листьях растений (см., например, Scheller J и соавтор., Nature Biotechnol., 19: 573-577, 2001 и цитируемые там ссылки), в птичьих яйцах (см., например, Zhu L и соавтор, Nature Biotechnol., 23: 1159-1169, 2005 и цитируемые там ссылки) или в молоке млекопитающих (см., например, Laible G и соавтор., Reprod. Fertil. Dev., 25: 315, 2012).
Используемые различные клетки-хозяева, включают, например, прокариотические клетки, эукариотические клетки, бактериальные клетки (такие как Escherichia coli или Bacillus stearothermophilus), клетки грибов (такие как Saccharomyces cerevisiae или Pichia pastoris), клетки насекомых (такие как клетки насекомых Lepidoptera, включая клетки Spodoptera fruticosa) или клетки млекопитающих (такие как клетки яичника китайского хомячка (СНО), клетки NS0, клетки почек детенышей хомячка (ВНК), клетки почек обезьян, клетки Hela, клетки гепатоцеллюлярной карциномы человека или клетки 293, так далее.).
Биспецифические антитела могут получиться путем подходящих субъектов иммуногенными препаратами биспецифических антигенов (например, кроликов, коз, мышей или других млекопитающих, включая трансгенных и отвергнутых вышеупомянутых млекопитающих). Подходящие иммуногенные препараты также могут содержать, например, химически синтезированные или рекомбинантно экспрессированные биспецифические антигены. Препараты могут также содержать адъювант, например полный адъювант Фрейнда или неполный адъювант, или аналогичные иммуностимулирующие соединения. Кроме того, при использовании для получения антител, особенно путем иммунизации в организме, биспецифические антигены, предложенные в настоящем изобретении, могут использоваться отдельно или предпочтительно в виде конъюгатов с векторными белками. Такой способ усиления ответа антител хорошо известен в данной области. В зависимости от необходимых антител для иммунизации в организме могут использоваться разных животных-хозяев. Может использоваться хозяин, который сам по себе экспрессирует полезные эндогенные антигены, или может использоваться хозяин, который вызвал дефекты полезных эндогенных антигенов.
Биспецифические антитела могут получиться путем комбинирования вышеуказанных способов.
Молекула биспецифического антитела, предложенные в настоящем изобретении, может использоваться в качестве моноклонального антитела (MAb) для каждой мишени. В некоторых примерах реализации антитело является химерным, гуманизированным или полностью человеческим.
Моноклональное антитело может быть получено любым способом, известным в данной области, таким как способ гибридомы (Kohler & Milstein, Nature, 256: 495-497, 1975), способ гибридомы из 3 источников, способ гибридомы В-клеток человека (Kozbor D и соавтор др., Immunology Today, 4: 72, 1983) и способ EBV-гибридомы (Cole SPC и соавтор, Monoclonal Antibodies and Cancer Therapy, PP77-96, Alan RLIS, Inc., 1985).
Биспецифическое антитело или его части, предложенные в настоящем изобретении, могут анализироваться с помощью общепринятых способов иммунологического анализа для обнаружения любого или всех этих антигенов (например, в биологических образцах, таких как сыворотка или плазма) таких как иммуноферментный анализ (ELISA), радиоиммуноанализ (RTA) или метод тканевой иммуногистохимии. Настоящее изобретение предлагает способ анализа антигена в биологическом образце, анализ проводится в следующей последовательности: приведение биологического образца в контакт с биспецифическим антителом или антигенсвязывающий фрагментом, предложенным в настоящем изобретении, который может специфически распознавать антиген, проверка антитела или его части, которое связывается с антигеном или не связывающим антителом или его частью, тем самым проверка антиген в биологическом образце. Антитело прямо или косвенно метят определяемым веществом, чтобы облегчить обнаружение связанных или несвязанных антител. Подходящие обнаруживаемые вещества включают различные ферменты, репарационные группы, флуоресцентные вещества, люминесцентные вещества и радиоактивные вещества. Примеры подходящих ферментов включают пероксидазу хрена, щелочную фосфатазу, β-галактозидазу, ацетилхолинэстеразу; Примеры подходящих комплексов репарационных групп включают стрептавидин/биотин и авидин/биотин; Примеры подходящих флуоресцентных веществ включают 7-гидроксикумарин, флуоресцеин, флуоресцеинизотиоцианат, родамин В, дихлортриазинамин, флуоресцеин, дансилхлорид или фикоэритрин; Примеры люминесцентных веществ включают 3-аминофталевый гидразид; Примеры подходящих радиоактивных веществ включают I125, I131, 35S или 3Н.
Фармацевтические композиции, биспецифическое антитело, предложенные в настоящем изобретении, или нуклеиновые кислоты или полинуклеотиды, кодирующие антитела, могут использоваться для приготовления фармацевтических композиций или стерильных композиций, например, биспецифические антитела смешивают с фармацевтически приемлемыми векторами, наполнителями или стабилизаторами. Фармацевтические композиции могут содержать одно или комбинацию (например, дух или несколько разных) биспецифического антитела, предложенного в настоящем изобретении. Например, фармацевтическая композиция, предложенная в настоящем изобретении, может содержать комбинацию антител или фрагментов антител (или иммуноконъюгатов) с комплементарными активностями, которые связываются с различными эпитопами на антигене-мишени. Препараты терапевтических и диагностических агентов могут быть приготовлены путем смешивания с фармацевтически приемлемыми векторами, наполнителями или стабилизаторами в форме, например, лиофилизированного порошка, взвеси, водного раствора или суспензии.
Термин «фармацевтически приемлемый» относится к свойствам молекулярных тел, молекулярных фрагментов или композиций, вызывающим нежелательных, аллергических или других побочных эффектов при правильном введении в организме животных или людей. Конкретные примеры некоторых веществ, которые могут использоваться в качестве фармацевтически приемлемых векторов или их компонентов, включают сахара (например, лактозу), крахмал, целлюлозу и их производные, растительные масла, желатин, полиолы (такие как пропиленгликоль), альгиновую кислоту и т.д.
Биспецифические антитела или нуклеиновые кислоты или полинуклеотиды, кодирующие антитела, предложенные в настоящем изобретении, могут быть связаны с вышеуказанными фармацевтически приемлемыми векторами или некоторыми веществами их компонентов (в виде иммунных комплексов) или могут применяться отдельно от них. В последнем случае биспецифическое антитело или нуклеиновую кислоту или полинуклеотид, кодирующие антитело, предложенное в настоящем изобретении, может применяться до, после или вместе с некоторыми веществами вышеуказанного фармацевтически приемлемого вектора или его компонентов, или может применяться вместе с другими известными способы лечения (например, противораковая терапия, например лучевая терапия).
Композиции, предложенные в настоящем изобретении, могут быть в различных формах, таких как жидкие, полутвердые и твердые лекарственные формы, например жидкие растворы (например, растворы для инъекций и инфузий), диспергирующие или суспензионные таблетки, пилюли, порошки, липосомы и суппозитории. Предпочтительный способ зависит от способа применения и терапевтического использования. Типичные предпочтительные композиции представляют собой инъекционные или нерастворимые в воде растворы, например, те композиции, которые аналогичны другим антителам, вызывающие пассивную иммунизацию человека. Путь введения может иметь множество форм, таких как пероральный, ректальный, трансмукозальный, энтеральный, парентеральный; внутримышечный, подкожный, внутрикожный, интрамедуллярный, интратекальный, внутрисердечный, внутривенный, внутрибрюшинный, интраназальный, внутриглазной, ингаляционный, инсуффляционный, местный, кожный, чрескожный или внутриартериальный. Предпочтительные формы введения парентеральные (например, внутривенные, подкожные, внутрибрюшинные, внутримышечные). В предпочтительном примере реализации, антитело вводят внутривенно или подкожно. В другом предпочтительном примере реализации, антитело вводят внутримышечно или подкожно.
Вышеупомянутые комбинированные способы, способы лечения и способы применения хорошо известны и также включают комбинации, лечения и способы введения, которые могут быть разработаны в будущем.
Фармацевтическая композиция, предложенная в настоящем изобретении, может представлять собой комбинацию двух лекарственных средств или комбинацию с имеющимися на рынке продуктами с аналогичными функциями либо продуктами с повышенным терапевтическим эффектом.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг. 1. Результаты испытаний SEC-HPLC очищенных образцов АР163.
Фиг. 2. Результаты электрофореза в SDS-PAGE очищенных образцов АР163.
Фиг. 3. Определение связывающей способности биспецифического антитела с ВСМА-положительными клетками.
Фиг. 4. Определение связывающей способности биспецифического антитела с различными Т-клетками.
Фиг. 5. Определение способности биспецифического антитела связывать клетки-мишени и эффекторные клетки одновременно.
Фиг. 6. Активация CD4 + Т-клеток / CD8 + Т-клеток, опосредованных биспецифическим антителом.
Фиг. 7. Определение способности биспецифического антитела активировать Т-клетки Jurkat штаммов клеток репортерного гена.
Фиг. 8. Определение способности Т-клеток, опосредованных биспецифическим антителом, убивать опухолевые клетки.
Фиг. 9. Определение способности Т-клеток, опосредованных биспецифическим антителом, убивать ВСМА-положительные клетки при различных соотношениях клеток эффекторов/мишеней.
Фиг. 10. Противоопухолевый эффект биспецифического антитела в организме, определенный по модели трансплантированной опухоли NCI-H929 при подкожной прививке клеток CIK и клеток миеломы человека в мышах NPG мышей NPG
Примечание: стрелка представляет время каждого введения лекарства; * * * указывает на наличие существенных различий.
Фиг. 11. Противоопухолевый эффект биспецифического антитела в организме, определенный по модели трансплантированной опухоли Raji при подкожной прививке клеток CIK и клеток лимфомы Burkkit's человека в мышах NPG
Примечание: стрелка показывает время каждого введения лекарства; * * * указывает на наличие существенных различий.
Описание примеров реализации
Настоящее изобретение также проиллюстрировано следующими примерами реализации, которые не следует рассматривать как также ограничение. Содержание всех чертежей и всех ссылок, патентов и опубликованных патентных заявок, цитируемых в всей настоящей заявке, включено в настоящий документ посредством ссылки.
В каждом из следующих примеров реализации, используемые в эксперименте, могут быть приобретены или приготовлены в соответствии с существующей опубликованной технологией; Все материалы, источники и спецификации которых не указаны, коммерчески доступны; различные процессы и методы, которые не описаны подробно, представлены общеизвестный в технике нормальный метод.
Пример реализации 1. Конструирование вектора молекулярной экспрессии биспецифического антитела.
Биспецифическое антитело АР163 состоит из последовательно соединенных scFv против-ВСМА, связывающего пептида L2, scFv против CD3 и фрагмента Fc. VH и VL, распложенные в местах между scFv против -ВСМА и scFv против -CD3, связаны связывающими пептидами L1 и L3 соответственно. Аминокислотные последовательности VH и VL scFv против ВСМА, содержащиеся в АР163, показаны в SEQ ID NO: 7 и SEQ ID NO: 8 соответственно. Аминокислотные последовательности VH и VL против CD3-scFv, содержащиеся в АР163, показаны в SEQ ID NO: 17 и SEQ ID NO: 18 соответственно, a VH и VL соединены посредством (GGGGS)3. Fc-фрагмент, содержащийся в АР163, происходит из человеческих клеток IgG1, имеет несколько аминокислотных смещений/замен, соответственно L234A, L235A, T250Q, N297A, P331S и M428L (по схеме нумерации EU), K447 на с-конце фрагмента Fc отсутствует/удален (по схеме нумерации EU). Его связывающий пептид (L2) состоит из гибкого пептида и жесткого пептида, гибкий пептид представляет собой G2 (GGGGS)3, а жесткий пептид - SSSSKAPPPS. Состав связывающих пептидов L1 и L3 в каждом scFv составляет (GGGGS)3.
Синтезируют кодирующие гены вышеупомянутых биспецифических антител в соответствии с общепринятыми методами молекулярной биологии, и вставляют кодирующие кДНК полученных гибридных генов в соответствующие сайты рестрикции эукариотической экспрессионной плазмиды рСМАВ2М, модифицированной PCDNA3.1. Плазмида рСМАВ2М также содержит селективные маркеры, поэтому она может иметь устойчивость к канамицину у бактерий и может иметь устойчивость к G418 в клетках млекопитающих. Кроме того, когда клетка-хозяин имеет недостаточную экспрессию гена DHFR, вектор экспрессии рСМАВ2М содержит ген дигидрофолатредуктазы (DHFR) мышей, так что ген-мишень и ген DHFR могут быть коамплифицированы в присутствии метотрексата (МТХ) (см. США 4399216).
Пример реализации 2. Экспрессия молекул биспецифического антитела
Конструированная выше экспрессионная плазмида трансфицируется в линию клеток-хозяев млекопитающих для экспрессии биспецифического антитела. Линия клеток-хозяев представляет собой СНО-клетку с дефицитом фермента DHFR (см. патент США No. US 4818679), в этом примере в качестве клетки-хозяина выбрана производная от СНО клеточная линия DXB11.
Предпочтительный способ трансфекции представляет собой электропорацию, но также могут быть использованы другие способы, включающие кальцийфосфатного соосаждения и липофекцией. Во время электропорации используйте электропоратор Gene Pulser (Bio-Rad Laboratories, Hercules, CA), настроенный на электрическое поле 300 В и емкость 1500 мкФд, и добавьте 50 мкг плазмидной ДНК экспрессионного вектора к 5×107 клеткам в кювете. Через два дня после трансфекции культуральную среду заменяют на питательную среду, содержащую 0,6 мг/мл G418. Субклонированные трансфектанты разбавляют до предельной концентрации, скорость секреции каждой клеточной линии определяют с помощью ELISA. Производят скрининг клеточных штаммов, экспрессирующих биспецифическое антитело на высоком уровне.
Ко амплификация производится с использованием гена DHFR, ингибируемого препаратами МТХ, основные стадии заключаются в следующем: в ростовой среде, содержащей МТХ, концентрация которого непрерывно повысится, осуществляется коамплификация трансфицированного гена гибридного белка с геном DHFR. Производится максимально допустимое разведение субклонов, положительно экспрессиующих DHFR, при постепенном повышении давления производится скрининг трансфектантов, которые могут расти в среде МТХ до 6 мкМ, определяется скорость их секреции, затем выполняется скрининг клеточных линий, которые сильно экспрессируют чужеродные белки. В бессывороточной среде производится адаптивная суспензионной культура клеточных линий, скорость секреции которых превысит 5 (предпочтительно около 15) мкг/106 (то есть один миллион) клеток/24 ч. Собирается клеточный супернатант, и производится отделение, очистка биспецифического антитела.
Пример реализации 3. Очистка биспецифического антитела
Очистка биспецифического антитела АР163 осуществляется трехступенчатой хроматографией. Этими тремя стадиями являются аффинная хроматография, гидроксиапатитная хроматография и анионообменная хроматография (прибор для очистки белка, используемый в этом примере реализации, представляет собой АКТА pure 25М, производимый GE, США. Все реагенты, использованные в этом примере реализации, приобретены у Sinopharm Chemical Reagent Co., Ltd., отвечают требованиям к аналитической чистоте).
Стадия 1, аффинная хроматография. Используется среду для аффинной хроматографии MabSelect Sure компании GE (MabSelect Sure, приобретенную у компании GE) или другую коммерчески доступную среду для аффинной хроматографии (например, Diamond Protein А от Boglong и т.д.), производится захват образцов, концентрирование и удаление некоторых примесей. Сначала колонка уравновешивается при линейной скорости потока 50-100 см/ч с помощью 3-5 объемов колонки (CV) равновесного буфера (2 РВ, 140 mM NaCl, рН 7,4); Осветленный ферментационный бульон загружают на колонку из расчета не более 20 мг / м3 при линейной скорости потока 100-200 см/ч. После загрузки колонку уравновешивают с помощью 3-5 CV равновесного буфера (2 РВ, 140 mM NaCl, рН 7,4) при линейной скорости потока 100-200 см/ч для отмывки несвязавшихся материалов. Затем колонку промывают с помощью 3-5 CV дезактивирующего буфера buffer 1 (50 mM NaAc-HAc, 1 М NaCl, рН 5.0) при линейной скорости потока 100-200 см/ч для удаления некоторых загрязнителей; Колонку промывают с помощью 3-5 CV дезактивирующего буфера buffer 2 (50 mM NaAc-HAc, 1 М NaCl, рН 5.0), при линейной скорости потока 100-200 см/ч. Элюирование целевого продукта осуществляется буфером для элюирования (40 мМ NaAc-HAc, рН 3,5) при линейной скорости потока не более 100 см/ч, и целевой пик собирается.
Вторая стадия, гидроксиапатит хроматографию: используя среду гидроксиапатита СНТ Туре II компании Bio-Rad или другую коммерчески доступную среду гидроксиапатита (СНТ Туре II, приобретенный у компании Bio-Rad), производится промежуточная очистка, чтобы уменьшить содержание полимера. После полимеризации целевого белка наблюдаются различия в свойствах полимера и мономера, включая характеристики заряда, а также хелатирование ионов кальция. Мы используем разницы в характеристиках заряда и других характеристиках, чтобы разделить и то и другое. Сначала используется равновесный буфер (20 мМ РВ, рН 7,0) для уравновешивания 3-5 объемов колонки (CV) хроматографической колонки при линейной скорости потока 100-200 см/ч; целевой белок, полученный с помощью аффинной хроматографии на первой студии, доводят до рН 7,0, затем загружают образец из расчета не более 5 мг / мл; После загрузки образца промывают хроматографическую колонку на 3-5 объемов колонки (CV) при линейной скорости потока 100-200 см/ч балансирующим буфером (20 мМ РВ, рН 7,0); наконец, целевой белок элюируют элюирующим буфером (20 мМ РВ, 1М NaCL, рН 7,0) с градиентом 0-50% и 10 объемов колонки (CV) при линейной скорости потока не выше 100 см/ч, элюированные компоненты собирают в секции и отправляют в SEC-HPLC на проверку. Объединяют целевые компоненты с процентным содержанием мономера более 95% для следующей хроматографии.
Третья стадия, анионообменная хроматография. Используя среду для анионообменной хроматографии Q-HP от Burglon (Q-HP, приобретенная у Burglon) или другую коммерчески доступную среду для анионообменной хроматографии (например, Q HP приобретенная у GE, Toyopearl GigaCap Q-650, приобретенная у TOSOH, DEAE Beads 6FF, приобретенная у компании Тяньдижэньхэ, Generik MC-Q, приобретенная у научной компании Сайфэнь, Fractogel EMD ТМАЕ, приобретенная у Merck, Q Ceramic HyperD F приобретенная у Pall), производится тонкая очистка для дальнейшего удаления НСР, ДНК и других загрязняющих веществ. Сначала промывает колонку уравновешивали при линейной скорости потока 100-200 см/ч с помощью 3-5 объемов колонки (CV) равновесного буфера (20 мМ РВ, 0,15 М NaCL, рН 7,0); Загружают целевой белок, полученный на второй стадии хроматографии на гидроксиапатите, собирают проточную жидкость. После загрузки колонку промывают с помощью 3-5 CV равновесного буфера при линейной скорости потока 100-200 см/ч; Собирают компоненты проточной жидкости, отдельно производится отбор пробы, производятся испытания методами SEC-HPLC и электрофореза.
Результаты проверки чистоты SEC-HPLC и результаты проверки образцов методом SDS-PAGE электрофореза показаны на фиг. 1 и фиг. 2, соответственно, где результаты SEC-HPLC показывают, что чистота основного пика биспецифического антитела после трехступенчатой хроматографии превышает 95%, а диаграмма полос электрофореза SDS-PAGE соответствует ожиданиям, получают образцы после невосстанавливающегося электрофореза SDS-PAGE (180 кДа), после восстановления получится четкая (90 кДа) одноцепочечная полоса.
Пример реализации 4. Оценка биологической функции биспецифического антитела против ВСМА × CD3 в лабораторных условиях.
(1) Связывающая активность биспецифического антитела с ВСМА-положительной клетками и Т-клетками.
Культивируют клетки миеломы человека NCI-H929, клетки Jurkat-LUC человека, клетки HUT-78 лейкоза Т-лимфоцитов человека, клетки миеломы MM.1S человека, клетки промиелоцитарного лейкоза человека HL60T-клетки человека и Т-клетки Макака-крабоеда, собирают клетки центрифугированием и ресуспендируют в 1% DPBS (фосфатный буфер Дюшенна), и плотность клеток доводят до 2×10 6 клеток/мл соответственно, помещают в 96-луночный планшеты при объеме 100 мкл на лунку. Тестируемое биспецифическое антитело АР163 разбавляют градиентом до объема 100 мкл на лунку, инкубируют в инкубаторе с 5% CO2 при 37°С в течение 1 часа. Центрифугируют, добавляют 200 мкл 1% DPBS в каждую лунку, промывают 2 раза, центрифугируют для удаления супернатанта, добавляют 100 мкл флуоресцентного вторичного антитела (козье антитело против человеческих клеток IgG (Н+L) Alexa Fluor® 647) в каждую лунку, инкубируют в течение 1 часа в инкубаторе с 5% CO2 при 37°С. Производится центрифуга для удаления супернатанта, дважды промываю планшет раствором 1% DPBS, добавляют 100 мкл 1% DPBS в каждую лунку для ресуспендирования и определяют интенсивность сигнала с помощью проточного цитофлуориметра. Затем на оси Y отображается средняя интенсивность флуоресценции, а на оси X - концентрация антител. Программное обеспечение GraphPad Prism 6 используется для анализа активности связывания АР163 с клетками ВСМА + и с клетками CD3+.
Как показано на фиг. 3, фиг. 4, на клеточном уровне АР163 может специфически связываться с ВСМА-положительными клетками, проявляет зависимость доза-эффект; в то же время АР163 специфически и в высокой степени связывается как с Т-клетками человека, так и с Т-клетками макака-крабоеда, проявляет зависимость доза-эффект.
(2) Определение связывающей способности и перекрестной реактивности биспецифического антитела с белками CD3 и ВСМА семейства приматов.
CD3 и ВСМА семейства приматов, покрытые антигеном, разбавляют до 0,1 мкг/мл с помощью PBS, добавляют в 96-луночный планшет, покрытый при 2-8°С в течение дня. Жидкость в планшете удаляют, добавляют PBST, содержащий сухое обезжиренное молоко, для герметизации при комнатной температуре в течение 2 часов, PBST дважды промывают планшет. Тестируемое биспецифическое антитело разбавляют в 4 раза 12 градиентами, для каждой концентрации используют по 2 лунки, добавляют со скоростью 100 мкл/лунку в 96-луночный планшет и инкубируют при комнатной температуре в течение 2 часов. Несвязавшееся биспецифическое антитело смывают PBST, биотинилированный белок ВСМА человека или белок CD3 человека разбавляют до 0,1 мкг/мл, и меченный HRP стрептавидин (BD, товарный номер 554066) смешивают в соотношении 1: 1000 и добавляют к 96%. планшет с лунками при объеме 100 мкл/лунку, инкубируют в течение 1 ч при комнатной температуре. После этого 96-луночный планшет промывают PBST, добавляют ТМВ при объеме 100 мкл/лунку, цвет проявлялся при комнатной температуре в темноте в течение 2-3 минут, затем добавляют 1 М HCl для остановки цветной реакции. Поглощение OD450 нм определяют с помощью иммуноферментного контрольно-измерительного прибора. Отображая логарифмическое значение концентрации образца на абсциссе и значение абсорбции на ординате, составляется четырехпараметрическая нелинейная регрессия и уравнение переменного наклона. Рассчитывают значение ЕС50 связывания биспецифического антитела с антигеном. Результаты экспериментов показаны в таблице 1, значение ЕС50 связывания биспецифического антитела с человеческим CD3 и белком ВСМА и белком CD3 и ВСМА макака-крабоеда очень мало, связывающая способность биспецифического антитела с антигенами разных видов в основном одинакова.
Таблица 1. Результат определения связывающей способности и перекрестной
реактивности биспецифического антитела с белками CD3 и ВСМА семейства приматов.
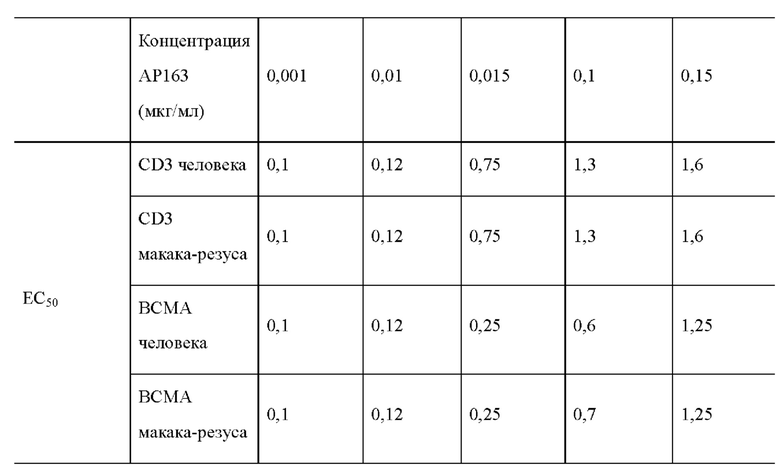
(3) Определение способности биспецифического антитела связывать клетки-мишени и эффекторные клетки одновременно.
Нормальные культивируемые клетки миеломы человека NCI-H929 используют в качестве клеток-мишеней, метят окрашивающим реагентом РКН26, клетки ресуспендировают в полной культуральной среде 1640, плотность клеток доводят до 1×105 клеток/мл и 50 мкл/лунку добавляют в 96-луночный планшет для культивирования клеток. Биспецифическое антитело разбавляют градиентом культуральной среды, добавляя 50 мкл/лунку. Добавляют эффекторные клетки (амплифицировать культивируемые Т-клетки) в 5 раз больше, чем клеток-мишеней, 50 мкл/лунку. Инкубируют в инкубаторе с 5% CO2 при 37°С в течение 1 часа, чтобы тестируемый образец и клетки полностью перемешались и произошла мостиковая реакция. Промывают 96-луночный планшет DPBS, определяют его с помощью проточной цитометрии и захватят Т-клетки, затем Т-клетки с сигналом PKH26 представляют собой мостиковые клетки, рассчитывают коэффициент связывания по статистическим данным. Как показано на фигуре 5, АР163 может вызывать особую реакцию на мостик между онкологическими клетками и клетками мишенями, между ними существует зависимость доза-эффект.
(4) Активация CD4+ Т-клеток / CD8+ Т-клеток, опосредованная биспецифическим антителом.
Были набраны три здоровых добровольных донора крови, периферическая кровь была извлечена, и РВМС были извлечены, CD4 + Т-клетки и CD8 + Т-клетки в РВМС были разделены и обогащены набором для разделения CD4 + Т-клеток и набором для разделения CD8 + Т-клеток, клетки были суспендировали в полной культуральной среде 1640, содержащей 10% FBS, и плотность клеток доводили до 1×106 клеток / мл, и добавляли в 96-луночный планшет для культивирования клеток с концентрацией 50 мкл / лунку. Клетки миеломы человека NCI-H929 культивировали, плотность клеток доводили до 1×105 клеток / мл, добавляли по 50 мкл в каждую лунку. Биспецифическое антитело разбавляли градиентом и добавляли в 96-луночный планшет при концентрации 50 мкл / лунку и инкубировали в инкубаторе при 37°С в течение 24 часов. Супернатант собирал методом центрифугирования, и высвободившееся количество гранзима в супернатанте определяли с помощью набора для определения гранзима ELISA. Анализ выполняли с помощью программного обеспечения GraphPad Prism 6, и рассчитывали ЕС50 активации CD4 + Т-клеток / CD8 + Т-клеток, опосредованной биспецифическими антителами.
Как показано на фиг. 6 и таблице 2, АР163 может опосредовать высвобождение гранзима, когда CD4 + Т-клетки и CD8 + Т-клетки у трех здоровых добровольцев убивают опухолевые клетки, демонстрирует зависимость доза-эффект.
(5) Оценка способности биспецифического антитела активации Т-клетки.
Т-клетки Jurkat, содержащие репортерный ген NFAT RE (приобретенный у BPS Bioscience), могут сверхэкспрессировать люциферазу в присутствии биспецифических антител и ВСМА-положительных клеток, степень активации Т-клеток Jurkat может быть определена количественно путем определения активности люциферазы. В частности, клетки Н929 методом центрифугирования ресуспендировали, плотность клеток доводили до 2×105 клеток / мл и 40 мкл / лунку добавляли в 96-луночный планшет для культивирования клеток. Плотность клеток NFAT- Jurkat доводили до 2×10 6 клеток / мл и добавляли 40 мкл в каждую лунку. Биспецифическое антитело АР163 разбавляли до 50 мкг / мл культуральной средой, после 10-кратного разбавления добавляли по 20 мкл в каждую лунку и инкубировали в инкубаторе с 5% СО2 при 37°С в течение 48 часов. После промывки планшета соответственно добавляли 100 мкл / лунку люциферазы Steady-Glo® и через 5 минут реакции значение холодной люминесценции регистрировали иммуноферментным контрольно-измерительным прибором. Концентрация биспецифического антитела отображается на абсциссе, интенсивность флуоресцеина отображается на ординате, ЕС50 Т-клеток, активированных биспецифическим антителом, рассчитывали с помощью программного обеспечения GraphPad Prism 6.
Как показано на фиг. 7, АР163 может специфически активировать клетки NFAT- Jurkat, значение ЕС50 составляет 3,161 нг / мл, и его концентрация пропорциональна интенсивности сигнала.
(6) Способность Т-клеток убивать опухолевые клетки, опосредованные биспецифическими антителами.
Т-клетки человека и макака-резуса культивировали, плотность клеток доводили до 106 клеток / мл и 50 мкл / лунку добавляли в 96-луночные планшеты для культивирования клеток соответственно. Нормальные культивируемые клетки миеломы человека NCI-H929 использовали в качестве клеток-мишеней, плотность клеток доводили до 1×105 клеток / мл и добавляли 50 мкл / лунку. Затем в каждую лунку добавляли 50 мкл градиентно разведенного биспецифического антитела АР163 и инкубировали в течение 24 часов в инкубаторе с 5% СО2 при 37°С. Добавьте 40 мкл реагента Bright-Glo в каждую лунку и дайте ему постоять в течение 3 минут при комнатной температуре в темноте. Значение RLU определяли с помощью многофункционального иммуноферментного контрольно-измерительного прибора и анализировали с помощью программного обеспечения GraphPad Prism 6, и рассчитывали значение ЕС50 для уничтожения клеток Н929, опосредованного биспецифическим антителом.
Как показано на фиг. 8,значение ЕС50 способности Т-клеток человека, опосредованных АР163, убивать опухолевые клетки, составляло 0,239 пМ, а значение ЕС50 Т-клеток макака-крабоеда, опосредованных АР163, убивать опухолевые клетки, составляло 0,278 пМ. АР163 может специфически опосредовать Т-клетки человека и макака-крабоеда, чтоб уничтожить опухолевые клетки, а клетки Н929, имеющиеся высокую экспрессию ВСМА, показали значительный эффект уничтожения, показали зависимость доза-эффект.
(7) Оценка высвобождения цитокинов, вызванного биспецифическим антителом.
Для оценки способности высвобождения цитокинов, вызванного биспецифическим антителом путем отдельной активизации или активации Т-клеток с помощью клеток-мишеней
Сначала Т-клетки культивировали, методом центрифугирования собирали и ресуспендировали в 1% PBSB, плотность клеток доводили до 1×106 клеток / мл, соответственно, и помещали в 96-луночный планшет с 90 мкл / лунку. Материнское моноклональное антитело АВ314 (подробности см. в патентном документе WO 2007042261) и биспецифическое антитело АР163, которые распознают CD3, разбавляли до 10000 нг / мл культуральной средой соответственно. После 10-кратного градиентного разбавления в 96-луночный планшет добавляли 10 мкл / лунку, а затем культивирвали в инкубаторе с 5% СО2 при 37°С. После инкубации в течение 24 и 48 часов супернатанты собирали и анализировали с помощью набора LEGENDplex ТМ Human Th1 / Th2, а интенсивность сигнала определяли с помощью прибора проточной цитометрии. Концентрация цитокинов отображается на оси ординат и концентрация антител на абсциссе, в отсутствие клеток-мишеней АВ314 активировал первичные Т-клетки в течение 24 часов, что вызывало высвобождение цитокинов IL-4, IL-5 и TNF-α; однако АР163 активировал первичные Т-клетки, и не наблюдалось значительного высвобождения цитокинов через 24 и 48 часов.
Т-клетки человека культивировали, методом центрифугирования собирали и суспендировали в полной культуральной среде 1640 с 10% FBS, плотность клеток доводили до 1×106 клеток / мл и помещали в 96-луночный планшет с 50 мкл / мл. Плотность клеток миеломы человека NCI-H929 доводили до 1×105 клеток / мл и добавляли 50 мкл / лунку. После градиентного разведения АР163 добавляли в 96-луночный планшет при 37°С в инкубаторе с 5% CO2 в течение 1,2,3,4,5,6,24 ч соответственно. После инкубации из каждой лунки отбирали 50 мкл супернатанта, и количество высвобождения 8 цитокинов в супернатанте детектировали с помощью набора для определения 8 цитокинов. Результаты экспериментов показывают, что АР163 может активировать Т-клетки для высвобождения IL-5, IL-13, IL-2, IL-6, IL-10, IFN-γ, TNF-α и IL-4, показали зависимости от времени, как показано в таблице 3.
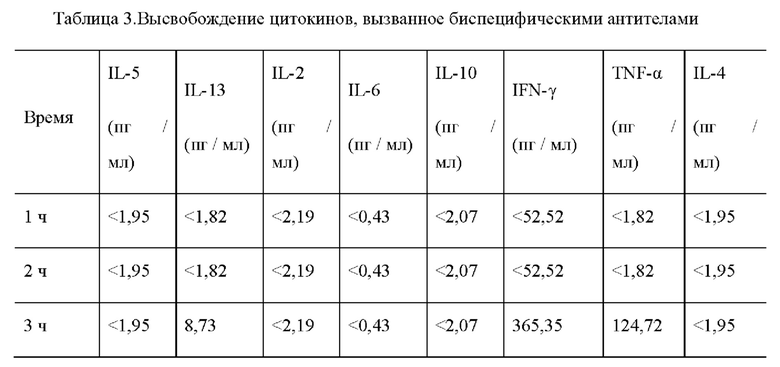
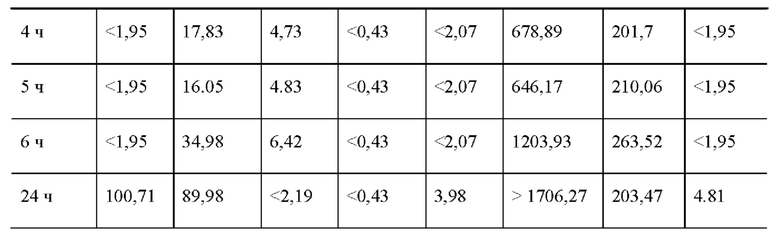
(8) Определение способности Т-клеток, опосредованных биспецифическим антителом, убивать ВСМА-положительные клетки при различных соотношениях клеток эффекторов/мишеней.
Культивировали Т-клетки человека, плотность клеток доводили до 2×107 клеток / мл, 1×107 клеток / мл, 1×106 клеток / мл, 1×105 клеток / мл, 1×104 клеток / мл и 1×103 клеток / мл, по 50 мкл на лунку добавляли в 96-луночные планшеты для культивирования клеток. В качестве клеток-мишеней использовали клетки миеломы человека NCI-H929, плотность клеток доводили до 1×105 клеток / мл и добавляли по 50 мкл / лунку. Затем в каждую лунку добавляли 50 мкл градиентно разведенного АР163 и инкубировали в течение 24 часов в инкубаторе с 5% CO2 при 37°С. Добавляли 40 мкл реагента Bright-Glo в каждую лунку и дайте ему постоять в течение 3 минут при комнатной температуре в темноте. Значение RLU определяли с помощью многофункционального иммуноферментного контрольно-измерительного прибора и анализировали с помощью программного обеспечения GraphPad Prism 6, и рассчитывали значение ЕС50 способности Т-клеток опосредованного биспецифическим антителом, убивать клетки Н929.
Как показано на фиг. 9, когда соотношение клеток эффекторов/мишеней (Е / Т) выше 1/1, эффективность уничтожения опухолевых клеток, опосредованных АР163, Т-лимфоцитами может достигать 100% уничтожения; Когда Е / Т ниже 1/1, значение ЕС50 постепенно увеличивается с уменьшением Е / Т.
(9) Оценка эффектов дексаметазона и индометацина на способность РВМС, опосредованных АР163, убивать опухолевые клетки.
Было набрано двенадцать здоровых добровольных доноров крови, периферическая кровь была извлечена и РВМС, клетки были суспендированы в полной культуральной среде 1640, содержащей 10% FBS, и плотность клеток была доведена до 3×10б клеток / мл. По 50 мкл на лунку добавляли в 96-луночный планшет для культивирования клеток. Готовили разбавители дексаметазона и индометацина, и по 50 мкл на лунку добавляли в 96-луночный планшет для инкубации РВМС в течение 1 и 14 часов соответственно; в контрольную группу добавляли такой же объем буфера. Скорректированная плотность клеток миеломы человека NCI-H929 составляла 1×105 клеток / мл, по 50 мкл на лунку. Затем в каждую лунку добавляли 50 мкл градиентно разведенного АР163 и инкубировали в инкубаторе с 5% СО2 при 37°С в течение 4, 8, 12, 24, 48 часов соответственно, в каждую лунку добавляли 40 мкл реагента Bright-GLO., Анализ данных показал, что инкубация РВМС с дексаметазоном или индометацином дала небольшой эффект на способность РВМС, опосредованных АР163, убивать опухолевые клетки.
Пример реализации 5: Фармакодинамическое исследование биспецифического антитела против ВСМА × CD3 на модели трансплантированной опухоли на мышах.
(1)Модель трансплантированной опухоли NCI-H929 при подкожной прививке клеток CIK и клеток миеломы человека в мышах NPG
Миеломы NCI-H929 клетки человека и клетки CIK (на 10-й день после активации, амплификации, индуцированной человеческими РВМС) прививали подкожно в правом переднем фланге женского NPG мышея в различных пропорциях. Через час после инокуляции мышей случайным образом делили на 4 группы по 4 мыши в каждой группе. Введение лекарства начинали в день группирования, и способ введения лекарства для каждых групп представляет собой внутрибрюшинную инъекцию, в то время как контрольной группе вводили раствор PBS того же объема, а доза АР163 составляла 0,2 мг / кг. Лекарства вводили два раза в неделю в течение 4 недель. Объем и размер опухоли измеряли один раз через каждые три дня, а также регистрировали вес и размер опухоли мышей. В конце эксперимента всех животных умерщвляли, опухоли вынимали, взвешивали и фотографировали, и рассчитывали относительную степень ингибирования опухоли (TGI%).
Как показано в таблице 4, в конце эксперимента средний размер опухоли животных в контрольной группе 1/1 составлял 1501±351 мм3, средний размер опухоли животных контрольной группе 1/2 составлял 1555±244 мм3; Средний размер опухоли животных в экспериментальной группе 1/1 АР163 составляли 99±38 мм3, TGI% составлял 93%.Средний размер опухоли животных в экспериментальной группе 1/2 АР163 составляли 481±215 мм3, TGI % составлял 70,2%.Вышеупомянутые результаты показали, что АР163 обладает очевидным ингибирующим действием на опухоль, и в то же время АР163 безопасен, не оказывает явного токсического действия на лабораторных животных.
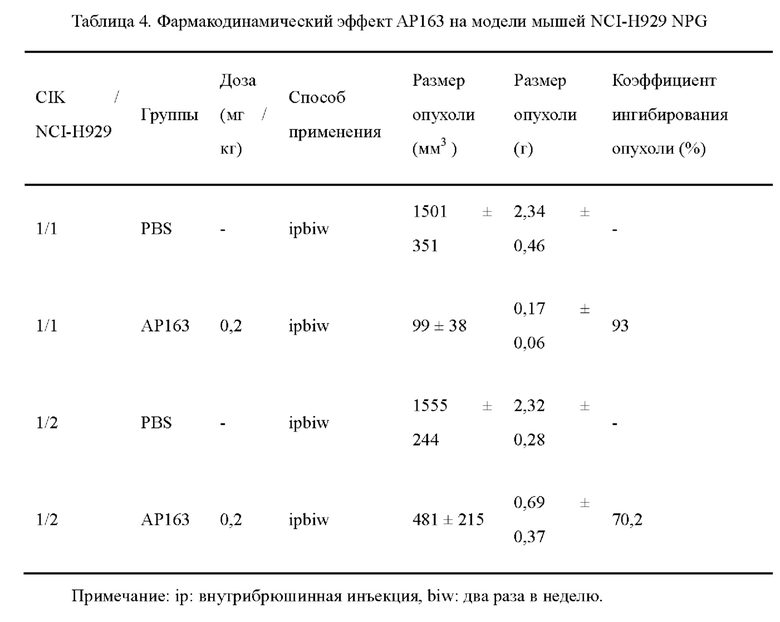
(2)Модель трансплантированной опухоли Raji при подкожной прививке клеток CIK и клеток лимфомы Burkkit's человека в мышах NPG
Клетки Raji лимфомы Burkkit человека смешали с CIK после культивирования и амплификации (соотношение клеток Raji к клеткам CIK составляло 1:1), и смешали с Matrigel в объемном соотношении 1:1, вводили их подкожно на правую спину самок мышей NPG. Через час после инокуляции мышей случайным образом делили на 4 группы в соответствии с их массой тела. В тот же день экспериментальным группам задали препарат, контрольной группе вводили такой же объем раствора PBS, доза АР163 для животных в экспериментальных группах составила 1 мг / кг, 0,1 мг / кг и 0,01 мг / кг соответственно. Животным в каждых группах вводят путем внутрибрюшинной инъекции. Лекарства вводили два раза в неделю в течение 3 недель. Объем и размер опухоли измеряли один раз через каждые три дня, а также регистрировали вес и размер опухоли мышей. В конце эксперимента всех животных умерщвляли, опухоли вынимали, взвешивали и фотографировали, и рассчитывали относительную степень ингибирования опухоли (TGI %).
Результаты приведены в таблице 5, в конце эксперимента, средний размер опухоли животных в контрольной группе составил 1750±653 мм3; средний размер опухоли животных в экспериментальных группах АР163 1 мг / кг, 0,1 мг / кг и 0,01 мг / кг составил 0,00±0,00 мм соответственно, что значительно отличалось от такового в контрольной группе (Р<0,05), TGI трех групп составлял 100%, что указывает на чрезвычайно значительный противоопухолевый эффект биспецифического антитела АР163.
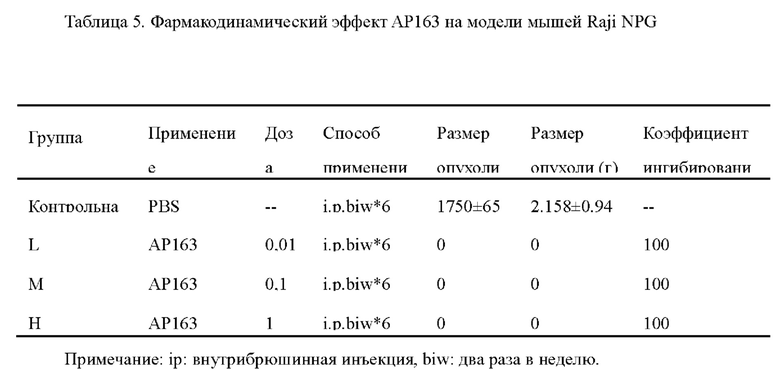
(3) Модель трансплантированной опухоли при подкожной прививке клеток CIK и клеток миеломы человека RPMI-8226 в мышах NPG
Клетки миеломы человека RPMI-8226 и CIK вводили подкожно на правую спину самок мышей NPG, после инокуляции в течение 1 часа их случайным образом делили в соответствии с массой мышей, и лекарство вводили в тот же день. В первой группе было 7 мышей, а в остальных двух группах - 8 мышей. В тот же день экспериментальным группам задали препарат, контрольной группе вводили такой же объем раствора PBS, а доза АР163 для животных в экспериментальных группах составила 1 мг / кг и 0,1 мг / кг соответственно. Животным в каждых группах вводят путем внутрибрюшинной инъекции. Сделали инъекции 1 раз через 2 дня, количество непрерывного введения препарата составляет 8. Эксперимент закончился через 18 дней после последнего введения. Объем и размер опухоли измеряли 2 раза в течение недели, а также регистрировали вес и размер опухоли мышей. В конце эксперимента всех животных умерщвляли, опухоли вынимали, взвешивали и фотографировали, и рассчитывали относительную степень ингибирования опухоли (TGI %).
Как показано на фиг. 10, в конце эксперимента (через 32 дня после первого введения лекарства) вес животных в каждой группе увеличился, и не было существенной разницы в весе животных в разных группах (Р>0,05). Средний размер опухоли животных в контрольной группе составил 1647,79±247,90 мм3; средний размер опухоли животных в экспериментальной группе АР163 1 мг / кг составлял 0,00±0,00 мм3, a TGI% составлял 100%, средний размер опухоли животных в экспериментальной группе АР163 0,1 мг / кг составлял 8,00±5,24 мм3, a TGI% составлял 99,51%. Результаты экспериментов показывают, что антитело АР163 обладает очень значительным противоопухолевым действием. В условиях эксперимента АР163 при всех концентрациях значительно ингибировал рост опухоли, и АР163 также характеризуется высокой безопасностью, не токсичен для лабораторных животных.
(4) Модель трансплантированной опухоли при подкожной прививке клеток CIK и клеток Daudi лимфомы Burkkit's человека в мышах NPG
Клетки Daudi лимфомы Burkkit's человека смешивали с CIK (плотность клеток Daudi составляет 5×106 клеток / мл, плотность клеток CIK составляет 1×106 клеток / мл), с матригелем в объемном соотношении 1: 1. и вводили подкожно на правую спину самок мышей NPG. Через час после инокуляции мышей случайным образом делили на 6 групп в соответствии с их массой тела. В тот же день группирования контрольные животные получали эквивалентный объем PBS, доза АР163 для животных в экспериментальных группах составляла 1 мг / кг, 0,2 мг / кг и 0,04 мг / кг соответственно. Животным в каждых группах вводят путем внутрибрюшинной инъекции. Сделали инъекции 1 раз через 2 дня, количество непрерывного введения препарата составляет 8. Эксперимент закончился спустя 10 дней после последнего введения. Объем и размер опухоли измеряли 2 раза в течение недели, а также регистрировали вес и размер опухоли мышей. В конце эксперимента всех животных умерщвляли, опухоли вынимали, взвешивали и фотографировали, и рассчитывали относительную степень ингибирования опухоли (TGI%).
Результаты показаны на фиг. 11. В конце эксперимента (через 25 дней после первого введения лекарства) вес животных в каждой группе увеличился, не было существенной разницы по сравнению с контрольной группой (Р>0,05). В конце эксперимента средний размер опухоли животных в контрольной группе составил 970,83±165,40 мм3; средний размер опухоли животных в экспериментальных группах АР163 1 мг / кг, 0,2 мг / кг и 0,04 мг / кг составлял 171,99±32,60 мм3, 190,82±53,60 мм3 и 228,68±44,96 мм3 соответственно, а TGI % составлял 82,28%, 80,34% и 76,44%соответственно, и по сравнению с контрольной группой, противоопухолевые эффекты значительно различались (Р<0,05), следовательно, АР163 при всех концентрациях может значительно ингибировать рост опухоли, и он более безопасный и не токсичен для лабораторных животных
Пример реализации 6.Испытание на безопасность биспецифического антитела против ВСМА × CD3
При оценке токсичного действия на организм, внутривенно вводили АР163 в организм макака-крабоеда два раза в неделю в течение 2 недель, чтоб определять диапазон безопасных доз и экспериментальные параметры токсикометрии. 6 макаков - крабоедов, включая 3 самца и 3 самки, были разделены на 3 группы, каждая группа состоит из 1 самцы и1 самки. Доза АР163 для животных в каждых группах (№1, 2, 3)составляла 0,1, 0,5 и 2,5 мг / кг соответственно. Скорость инфузии составляла 30 мл / кг / ч, дозировка составляла 10 мл / кг. Проводили эвтаназию всех животных через 14 дней после истечения периода введения.
В течение периода испытания периодически проверяли клинические симптомы животных, массу тела, потребление пищи, температуру тела, электрокардиограмму, артериальное давление, клинико-патологические показатели (количество клеток крови, показатели функции свертывания крови и биохимический анализ крови), субпопуляции лимфоцитов, цитокины и концентрации лекарств в плазме крови, проводили токсикологический анализ. Все животные были грубо препарированы. При макроанатомическом исследовании не было выявлено явных отклонений от нормы, гистопатологическое исследование не проводилось. Результаты показали, что в экспериментальных условиях АР163 в дозе 0,1, 0,5 и 2,5 мг / кг (внутривенная инъекция, два раза в неделю в течение 2 недель, и) у всех животных не было обнаружено смерти или околосмертного состояния. Временное повышение Neut, CD3-CD20 +, TNF-α, IL-2 и IL-6 и уменьшение лимфатических, CD3 +, CD3-CD16 + / CD56 + и уменьшение лимфатических, CD3 +, CD3-CD16 + / CD56 + наблюдались у животных в каждых группах после первого введения лекарства; Максимальная переносимая доза (МПД) ≥ 2,5 мг / кг.
Пример реализации 7. Фармакокинетический тест на антитела против ВСМА × CD3
Эксперименты проводили на макаках-крабоедах. 6 животных (включая 3 самца и 3 самки) были разделены на 3 группы, каждая группа состоит из 1 самцы и 1 самки. Доза АР163 для животных в каждых группах составляет 0,1, 0,5 и 2,5 мг / кг соответственно. Забрали образцы токсичной крови (приблизительно 1 мл) из места подкожной вены задних конечностей животного (за исключением мест инъекции), собирали их в пробирку без антикоагулянта. Точки времени отбора проб крови каждых животных в группах №13: до первого и последнего введения, сразу после окончания введения (±1 минута), через 1 ч, 3 ч, 6 ч, 8 ч, 24 ч, 48 ч, 72 ч после начала введения.
Центрифужную пробирку (без антикоагулянта) перед использованием хранили в бане с ледяной водой; образцы крови переносили в указанную выше центрифужную пробирку после сбора, а затем центрифугировали со скоростью вращения 3000×g при 2~8°С в течение 10 мин. После разделения образца сыворотки разделили образцы на 2 части, хранили при температуре ниже -70°С. Отбор образцов крови до завершения центрифугирования должен быть завершен в течение 2 часов.
Метод ELISA был использован для определения и анализа концентрации АР163 в сыворотке, а метод некомпартментной модели (NCA) программного обеспечения WinNonlin 8.0 был использован для расчета кинетических параметров. Результаты фармакокинетических параметров каждых групп представлены в таблице 6. Результаты показали, что период полувыведения в организме АР163 в дозах 0,1, 0,5 и 2,5 мг / кг составлял 7,08, 8,95 и 11,42 часа соответственно.
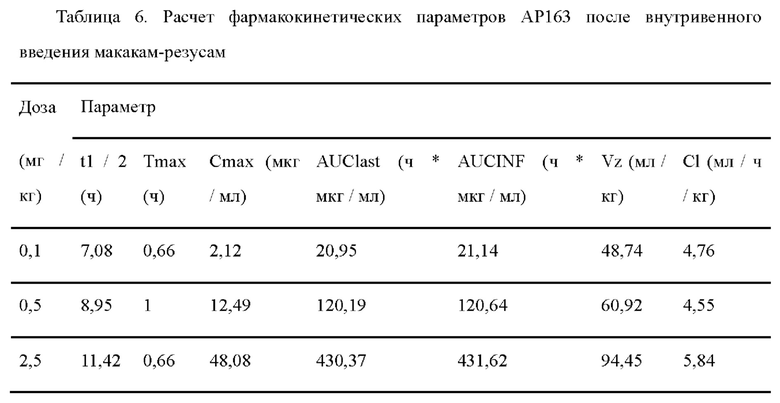
Хотя на прилагаемых фигурах проиллюстрированы предпочтительные примеры реализации настоящего изобретения, следует понимать, что специалисты в данной области техники могут вносить различные изменения в свете изложенных здесь идей, не выходя за пределы объема настоящего изобретения.
Все документы, упомянутые в настоящем изобретении, настоящим включены посредством ссылки в том же объеме, как если бы каждый из этих документов был отдельно изложен по ссылке. Следует понимать, что после прочтения вышеизложенных идей настоящего изобретения, которые также подпадают под объем прилагаемой к ним формулы изобретения, специалистами в данной области могут быть сделаны различные изменения и модификации.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
SEQUENCE LISTING
<110> Anyuan Pharmaceutical Technology (Shanghai) Co., Ltd.
<120> BISPECIFIIC ANTIBODY AND USE THEREOF
<140> PCT/CN2019/108057
<141> 2019-09-26
<150> CN201811294887.4
<151> 2018-11-01
<160> 27
<170> PatentIn version 3.5
<210> 1
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> HCDR1 of first single chain Fv of bispecific antibody targeting CD3 and BCMA
<400> 1
Asn Tyr Trp Met His
1 5
<210> 2
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> HCDR2 of first single chain Fv of bispecific antibody targeting CD3 and BCMA
<400> 2
Ala Thr Tyr Arg Gly His Ser Asp Thr Tyr Tyr Asn Gln Lys Phe Lys
1 5 10 15
Gly
<210> 3
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> HCDR3 of first single chain Fv of bispecific antibody targeting CD3 and BCMA
<400> 3
Gly Ala Ile Tyr Asp Gly Tyr Asp Val Leu Asp Asn
1 5 10
<210> 4
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> LCDR1 of first single chain Fv of bispecific antibody targeting CD3 and BCMA
<400> 4
Ser Ala Ser Gln Asp Ile Ser Asn Tyr Leu Asn
1 5 10
<210> 5
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> LCDR2 of first single chain Fv of bispecific antibody targeting CD3 and BCMA
<400> 5
Tyr Thr Ser Asn Leu His Ser
1 5
<210> 6
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> LCDR3 of first single chain Fv of bispecific antibody targeting CD3 and BCMA
<400> 6
Gln Gln Tyr Arg Lys Leu Pro Trp Thr
1 5
<210> 7
<211> 121
<212> PRT
<213> Artificial Sequence
<220>
<223> VH domain of first single chain Fv of bispecific antibody targeting CD3 and BCMA
<400> 7
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Asn Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ala Thr Tyr Arg Gly His Ser Asp Thr Tyr Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Ala Ile Tyr Asp Gly Tyr Asp Val Leu Asp Asn Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 8
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> VL domain of first single chain Fv of bispecific antibody targeting CD3 and BCMA
<400> 8
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Ser Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Asn Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Arg Lys Leu Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 9
<211> 28
<212> PRT
<213> Artificial Sequence
<220>
<223> full-length sequence consisting of amino acids at positions 118 to 145
derived from the carboxyl terminal of natural human chorionic gonadotropin beta subunit
<400> 9
Ser Ser Ser Ser Lys Ala Pro Pro Pro Ser Leu Pro Ser Pro Ser Arg
1 5 10 15
Leu Pro Gly Pro Ser Asp Thr Pro Ile Leu Pro Gln
20 25
<210> 10
<211> 27
<212> PRT
<213> Artificial Sequence
<220>
<223> linker peptide L2
<400> 10
Gly Gly Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
1 5 10 15
Ser Ser Ser Ser Ser Lys Ala Pro Pro Pro Ser
20 25
<210> 11
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> HCDR1 of second single chain Fv of bispecific antibody targeting CD3 and BCMA
<400> 11
Thr Tyr Ala Met Asn
1 5
<210> 12
<211> 19
<212> PRT
<213> Artificial Sequence
<220>
<223> HCDR2 of second single chain Fv of bispecific antibody targeting CD3 and BCMA
<400> 12
Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp Ser
1 5 10 15
Val Lys Asp
<210> 13
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> HCDR3 of second single chain Fv of bispecific antibody targeting CD3 and BCMA
<400> 13
His Gly Asn Phe Gly Asn Ser Tyr Val Ser Trp Phe Ala Tyr
1 5 10
<210> 14
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> LCDR1 of second single chain Fv of bispecific antibody targeting CD3 and BCMA
<400> 14
Arg Ser Ser Thr Gly Ala Val Thr Thr Ser Asn Tyr Ala Asn
1 5 10
<210> 15
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> LCDR2 of second single chain Fv of bispecific antibody targeting CD3 and BCMA
<400> 15
Gly Thr Asn Lys Arg Ala Pro
1 5
<210> 16
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> LCDR3 of second single chain Fv of bispecific antibody targeting CD3 and BCMA
<400> 16
Ala Leu Trp Tyr Ser Asn Leu Trp Val
1 5
<210> 17
<211> 125
<212> PRT
<213> Artificial Sequence
<220>
<223> VH domain of second single chain Fv of bispecific antibody targeting CD3 and BCMA
<400> 17
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asn Thr Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala Asp
50 55 60
Ser Val Lys Asp Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn Thr
65 70 75 80
Ala Tyr Leu Gln Met Asn Asn Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Val Arg His Gly Asn Phe Gly Asn Ser Tyr Val Ser Trp Phe
100 105 110
Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 18
<211> 109
<212> PRT
<213> Artificial Sequence
<220>
<223> VL domain of second single chain Fv of bispecific antibody targeting CD3 and BCMA
<400> 18
Glu Leu Val Val Thr Gln Glu Pro Ser Leu Thr Val Ser Pro Gly Gly
1 5 10 15
Thr Val Thr Leu Thr Cys Arg Ser Ser Thr Gly Ala Val Thr Thr Ser
20 25 30
Asn Tyr Ala Asn Trp Val Gln Gln Lys Pro Gly Gln Ala Pro Arg Gly
35 40 45
Leu Ile Gly Gly Thr Asn Lys Arg Ala Pro Gly Thr Pro Ala Arg Phe
50 55 60
Ser Gly Ser Leu Leu Gly Gly Lys Ala Ala Leu Thr Leu Ser Gly Val
65 70 75 80
Gln Pro Glu Asp Glu Ala Glu Tyr Tyr Cys Ala Leu Trp Tyr Ser Asn
85 90 95
Leu Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105
<210> 19
<211> 226
<212> PRT
<213> Artificial Sequence
<220>
<223> Fc fragment
<400> 19
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly
1 5 10 15
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Gln Leu Met
20 25 30
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
35 40 45
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
50 55 60
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Ala Ser Thr Tyr
65 70 75 80
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
85 90 95
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Ser Ile
100 105 110
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
115 120 125
Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
130 135 140
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
145 150 155 160
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
165 170 175
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
180 185 190
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Leu
195 200 205
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
210 215 220
Pro Gly
225
<210> 20
<211> 764
<212> PRT
<213> Artificial Sequence
<220>
<223> amino acid sequence of bispecific antibody, which binds to human BCMA and CD3
<400> 20
Met Arg Ser Leu Gly Ala Leu Leu Leu Leu Leu Ser Ala Cys Leu Ala
1 5 10 15
Val Ser Ala Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys
20 25 30
Pro Gly Ser Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe
35 40 45
Ser Asn Tyr Trp Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu
50 55 60
Glu Trp Met Gly Ala Thr Tyr Arg Gly His Ser Asp Thr Tyr Tyr Asn
65 70 75 80
Gln Lys Phe Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser
85 90 95
Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val
100 105 110
Tyr Tyr Cys Ala Arg Gly Ala Ile Tyr Asp Gly Tyr Asp Val Leu Asp
115 120 125
Asn Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly
130 135 140
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Gln Met Thr
145 150 155 160
Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile
165 170 175
Thr Cys Ser Ala Ser Gln Asp Ile Ser Asn Tyr Leu Asn Trp Tyr Gln
180 185 190
Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Tyr Thr Ser Asn
195 200 205
Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr
210 215 220
Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr
225 230 235 240
Tyr Tyr Cys Gln Gln Tyr Arg Lys Leu Pro Trp Thr Phe Gly Gln Gly
245 250 255
Thr Lys Leu Glu Ile Lys Gly Gly Gly Gly Gly Gly Ser Gly Gly Gly
260 265 270
Gly Ser Gly Gly Gly Gly Ser Ser Ser Ser Ser Lys Ala Pro Pro Pro
275 280 285
Ser Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly
290 295 300
Gly Ser Leu Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asn Thr
305 310 315 320
Tyr Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp
325 330 335
Val Ala Arg Ile Arg Ser Lys Tyr Asn Asn Tyr Ala Thr Tyr Tyr Ala
340 345 350
Asp Ser Val Lys Asp Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Asn
355 360 365
Thr Ala Tyr Leu Gln Met Asn Asn Leu Lys Thr Glu Asp Thr Ala Val
370 375 380
Tyr Tyr Cys Val Arg His Gly Asn Phe Gly Asn Ser Tyr Val Ser Trp
385 390 395 400
Phe Ala Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly
405 410 415
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Leu Val
420 425 430
Val Thr Gln Glu Pro Ser Leu Thr Val Ser Pro Gly Gly Thr Val Thr
435 440 445
Leu Thr Cys Arg Ser Ser Thr Gly Ala Val Thr Thr Ser Asn Tyr Ala
450 455 460
Asn Trp Val Gln Gln Lys Pro Gly Gln Ala Pro Arg Gly Leu Ile Gly
465 470 475 480
Gly Thr Asn Lys Arg Ala Pro Gly Thr Pro Ala Arg Phe Ser Gly Ser
485 490 495
Leu Leu Gly Gly Lys Ala Ala Leu Thr Leu Ser Gly Val Gln Pro Glu
500 505 510
Asp Glu Ala Glu Tyr Tyr Cys Ala Leu Trp Tyr Ser Asn Leu Trp Val
515 520 525
Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Asp Lys Thr His Thr Cys
530 535 540
Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val Phe Leu
545 550 555 560
Phe Pro Pro Lys Pro Lys Asp Gln Leu Met Ile Ser Arg Thr Pro Glu
565 570 575
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
580 585 590
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
595 600 605
Pro Arg Glu Glu Gln Tyr Ala Ser Thr Tyr Arg Val Val Ser Val Leu
610 615 620
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
625 630 635 640
Val Ser Asn Lys Ala Leu Pro Ala Ser Ile Glu Lys Thr Ile Ser Lys
645 650 655
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
660 665 670
Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys
675 680 685
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
690 695 700
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
705 710 715 720
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
725 730 735
Gln Gly Asn Val Phe Ser Cys Ser Val Leu His Glu Ala Leu His Asn
740 745 750
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
755 760
<210> 21
<211> 2313
<212> DNA
<213> Artificial Sequence
<220>
<223> DNA sequence of bispecific antibody, which binds to human BCMA and CD3
<400> 21
actagtcgcc accatgagga gcctcggggc cctgctcttg ctgctgagcg cctgcctggc 60
ggtgagcgct caggtgcagc tggtgcagtc tggcgctgag gtgaagaagc ccggcagctc 120
tgtgaaggtg tcttgtaagg cctccggcgg caccttctcc aactattgga tgcattgggt 180
gcgccaggct cctggccagg gcctggagtg gatgggagct acctacaggg gacactccga 240
cacatattac aatcagaagt ttaagggcag ggtgacaatc accgctgata agtctacatc 300
caccgcctac atggagctgt ccagcctgcg gagcgaggac accgccgtgt attactgcgc 360
cagaggcgct atctacgatg gctatgacgt gctggataac tggggccagg gcacactggt 420
gaccgtgtct tccggaggag gaggatctgg aggaggaggc tccggaggag gaggaagcga 480
tatccagatg acccagagcc caagctctct gtccgcctct gtgggcgata gggtgacaat 540
cacctgttcc gccagccagg acatctctaa ctacctgaat tggtatcagc agaagcccgg 600
caaggctcct aagctgctga tctattacac cagcaatctg cattctggag tgccttcccg 660
cttctctggc tccggaagcg gaacagactt tacactgacc atctccagcc tgcagccaga 720
ggatttcgcc acttactact gccagcagta caggaagctg ccctggacct ttggccaggg 780
taccaagctg gagatcaagg gtggcggcgg tggaggatcc ggcggtggag gtagcggcgg 840
aggcggtagc tccagctcta gtaaagctcc ccctccttcc gaggtgcagc tgctggagtc 900
cggaggagga ctggtgcagc caggaggctc cctgaagctg agctgtgctg cctctggctt 960
taccttcaac acatatgcca tgaattgggt gcggcaggct ccaggcaagg gactggagtg 1020
ggtggctagg atcaggtcta agtacaacaa ttatgccacc tactatgctg attccgtgaa 1080
ggacaggttc accatctccc gcgacgatag caagaacaca gcctacctgc agatgaacaa 1140
tctgaagacc gaggataccg ccgtgtacta ctgcgtgaga catggcaact ttggcaatag 1200
ctacgtgtcc tggttcgctt actggggaca gggcaccctg gtcacagtga gctctggagg 1260
aggaggatct ggaggaggag gctccggagg aggaggaagc gagctggtgg tgacccagga 1320
gccatctctg acagtgtccc ccggcggcac agtgaccctg acatgtagat ccagcaccgg 1380
cgccgtgacc acatccaact acgctaattg ggtgcagcag aagccaggac aggctccaag 1440
gggactgatc ggaggaacca acaagagggc tcctggaaca ccagctcggt ttagcggatc 1500
tctgctggga ggcaaggctg ccctgaccct gtccggagtg cagccagagg atgaggccga 1560
gtattattgc gctctgtggt atagcaatct gtgggtgttc ggaggaggaa ccaagctgac 1620
agtgctggac aagacccata catgcccacc atgccctgcc cctgaagccg ccggaggacc 1680
ttccgtgttc ctgttccctc ccaagccaaa agatcagctg atgatctcta gaacccccga 1740
agtcacctgc gtggtcgtcg acgtgtccca tgaggaccct gaagtcaagt tcaactggta 1800
cgtggacggt gtcgaagtcc acaacgccaa gaccaagcct agggaggagc agtatgccag 1860
cacataccgg gtggtgtctg tgctgaccgt gctgcatcag gattggctga atggcaagga 1920
atataaatgt aaggtgagca ataaggctct gccggctagc attgaaaaaa ccatttccaa 1980
ggctaagggc cagcccaggg agcctcaggt ctacaccctg cctccatcta gagatgaact 2040
gaccaaaaac caggtgagcc tgacttgcct ggtcaaaggc ttctacccca gcgacattgc 2100
cgtggagtgg gagtctaatg gccagcctga aaataactac aaaactaccc ctcctgtgct 2160
ggactctgat ggctccttct ttctgtactc taaactgacc gtggacaagt ctcgctggca 2220
gcagggtaac gtgttttctt gctccgtgct gcacgaggct ctgcataacc attacaccca 2280
gaagagcctg tctctgtccc caggatagaa ttc 2313
<210> 22
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> linker sequence
<400> 1
Gly Gly Gly Gly Ser
1 5
<210> 23
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> linker sequence
<220>
<223> Amino acid position 5: X = Ser or Ala
<400> 1
Gly Gly Gly Gly Xaa
1 5
<210> 24
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> CPT1
<400> 1
Ser Ser Ser Ser Lys Ala Pro Pro Pro Ser
1 5 10
<210> 25
<211> 14
<212> PRT
<213> Artificial Sequence
<220>
<223> CPT2
<400> 1
Ser Arg Leu Pro Gly Pro Ser Asp Thr Pro Ile Leu Pro Gln
1 5 10
<210> 26
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> CPT3
<400> 1
Ser Ser Ser Ser Lys Ala Pro Pro Pro Ser Leu Pro Ser Pro Ser Arg
1 5 10 15
<210> 27
<211> 28
<212> PRT
<213> Artificial Sequence
<220>
<223> CPT4
<400> 1
Ser Ser Ser Ser Lys Ala Pro Pro Pro Ser Leu Pro Ser Pro Ser Arg
1 5 10 15
Leu Pro Gly Pro Ser Asp Thr Pro Ile Leu Pro Gln
20 25
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| БИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2839153C2 |
| МОЛЕКУЛЫ, СВЯЗЫВАЮЩИЕ BCMA, И ПУТИ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2812322C2 |
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕ CD3 | 2017 |
|
RU2807216C2 |
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕ CD3 | 2017 |
|
RU2790288C2 |
| АНТИТЕЛО К CD3 И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2019 |
|
RU2802272C2 |
| БИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО ПРОТИВ CD3E/BCMA И ЕГО ПРИМЕНЕНИЕ | 2019 |
|
RU2800164C2 |
| ИНДУЦИРУЮЩИЙ ЦИТОТОКСИЧНОСТЬ ТЕРАПЕВТИЧЕСКИЙ АГЕНТ | 2022 |
|
RU2824285C2 |
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕ CD3 | 2017 |
|
RU2779489C2 |
| КЛЕТКИ, ЭКСПРЕССИРУЮЩИЕ ХИМЕРНЫЕ АКТИВИРУЮЩИЕ РЕЦЕПТОРЫ И ХИМЕРНЫЕ СТИМУЛИРУЮЩИЕ РЕЦЕПТОРЫ, И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2780020C2 |
| МОДИФИЦИРОВАННАЯ J-ЦЕПЬ | 2015 |
|
RU2761118C2 |
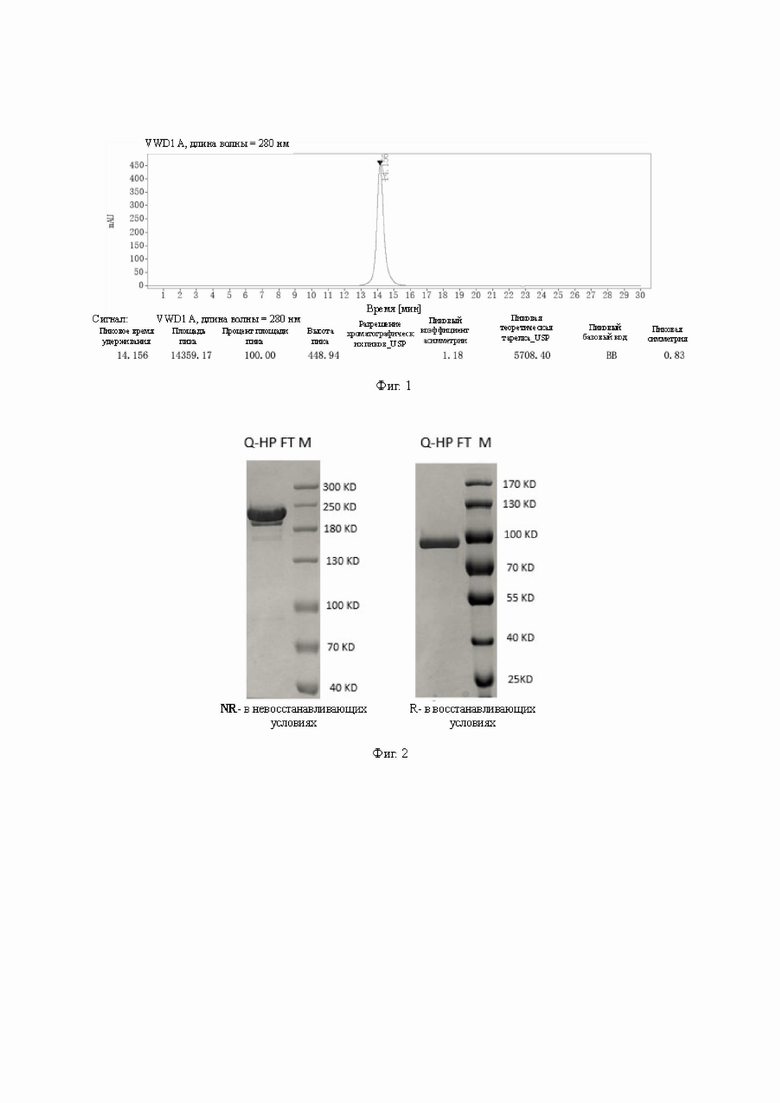
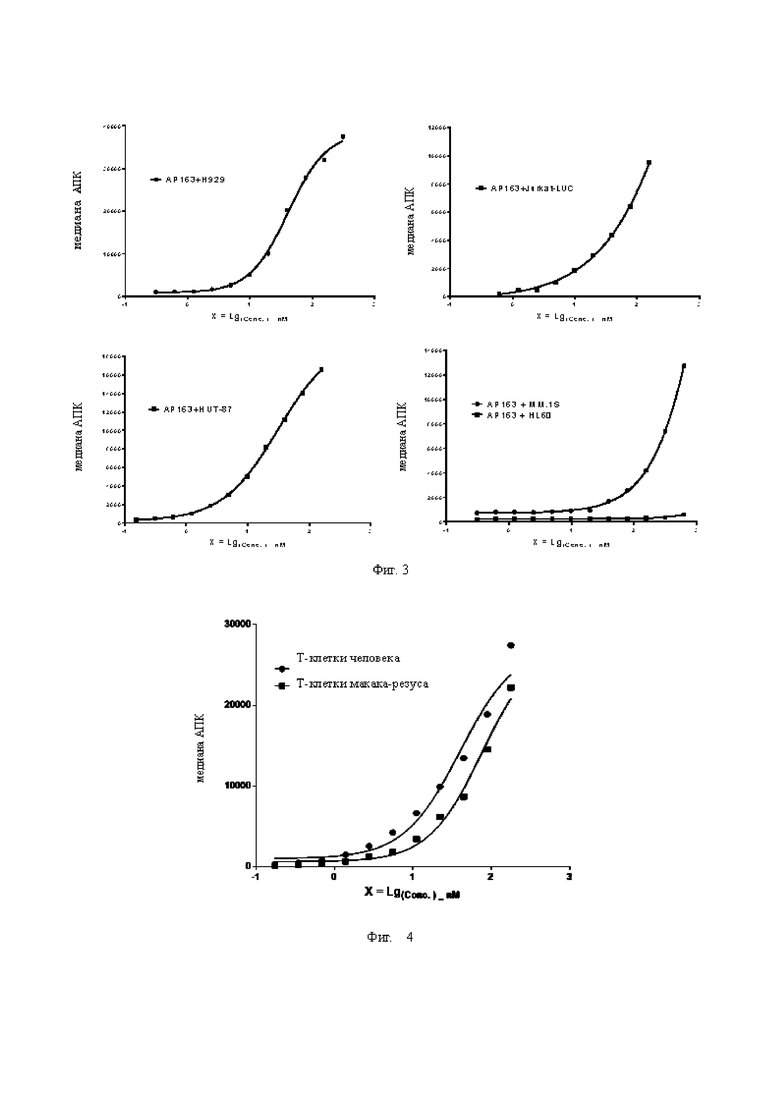
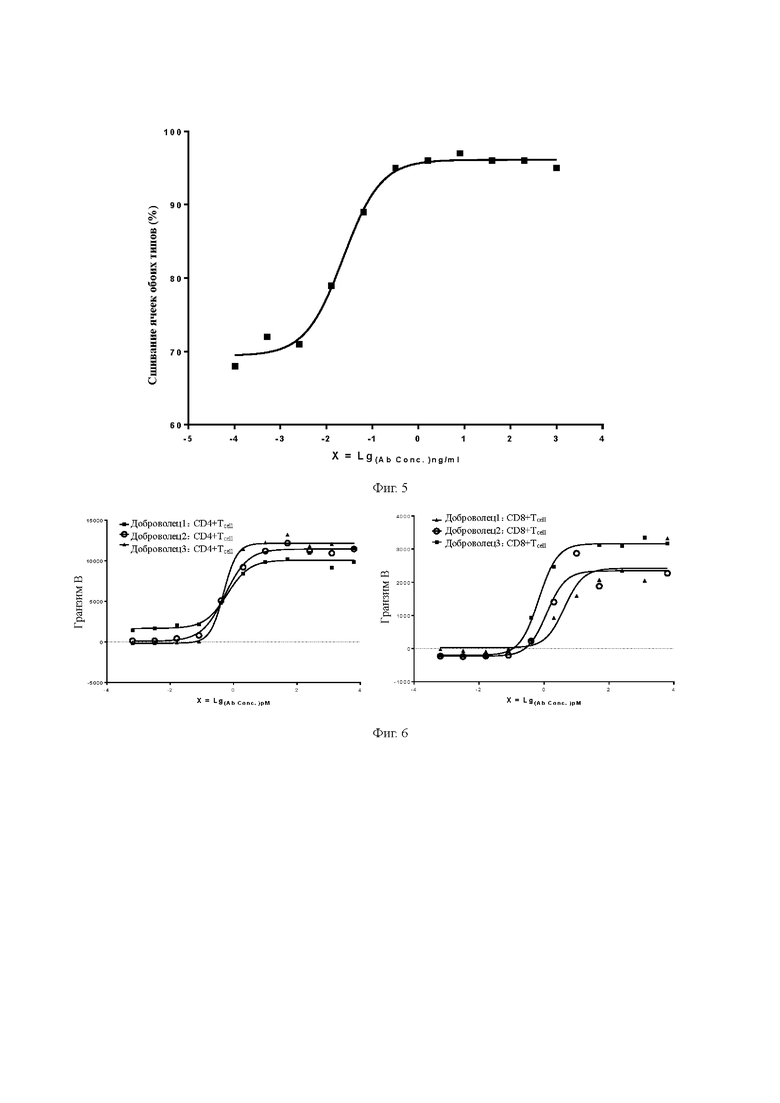
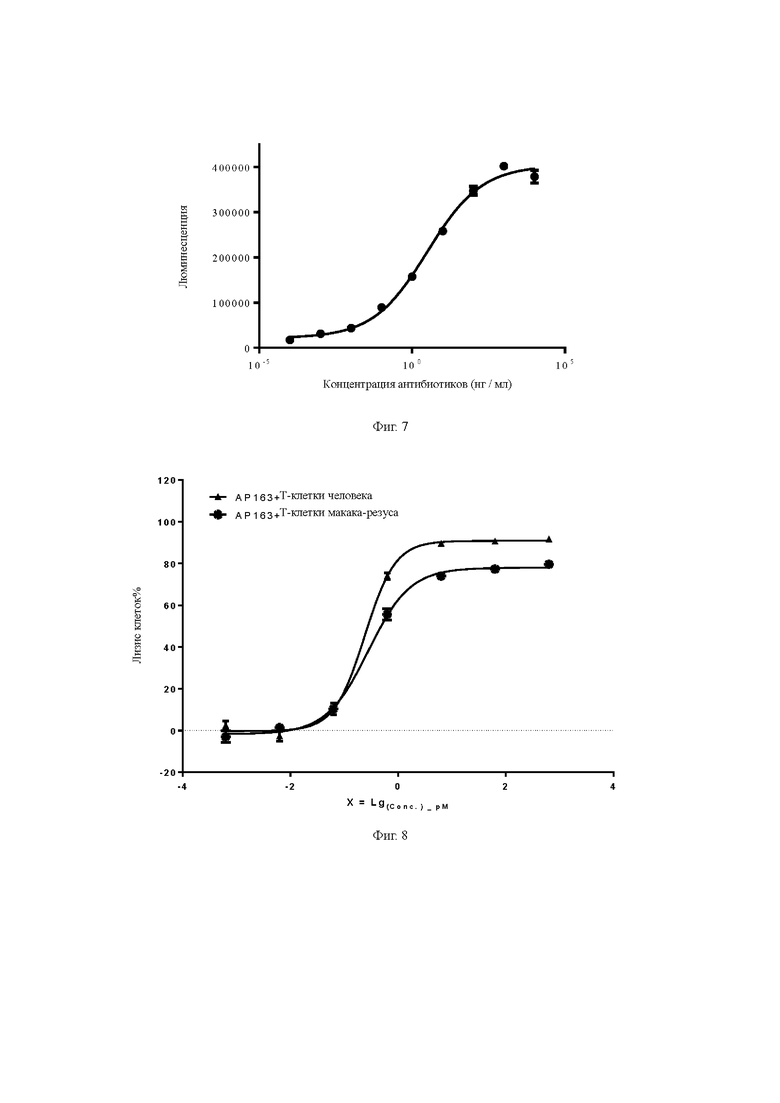
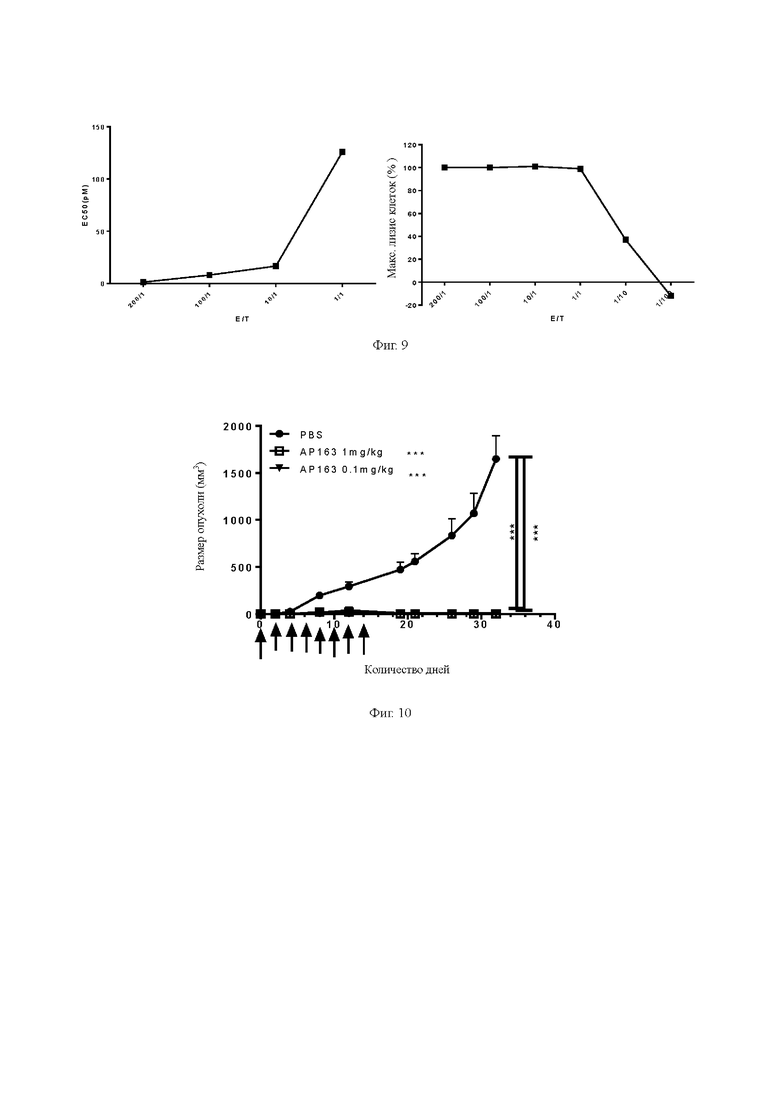
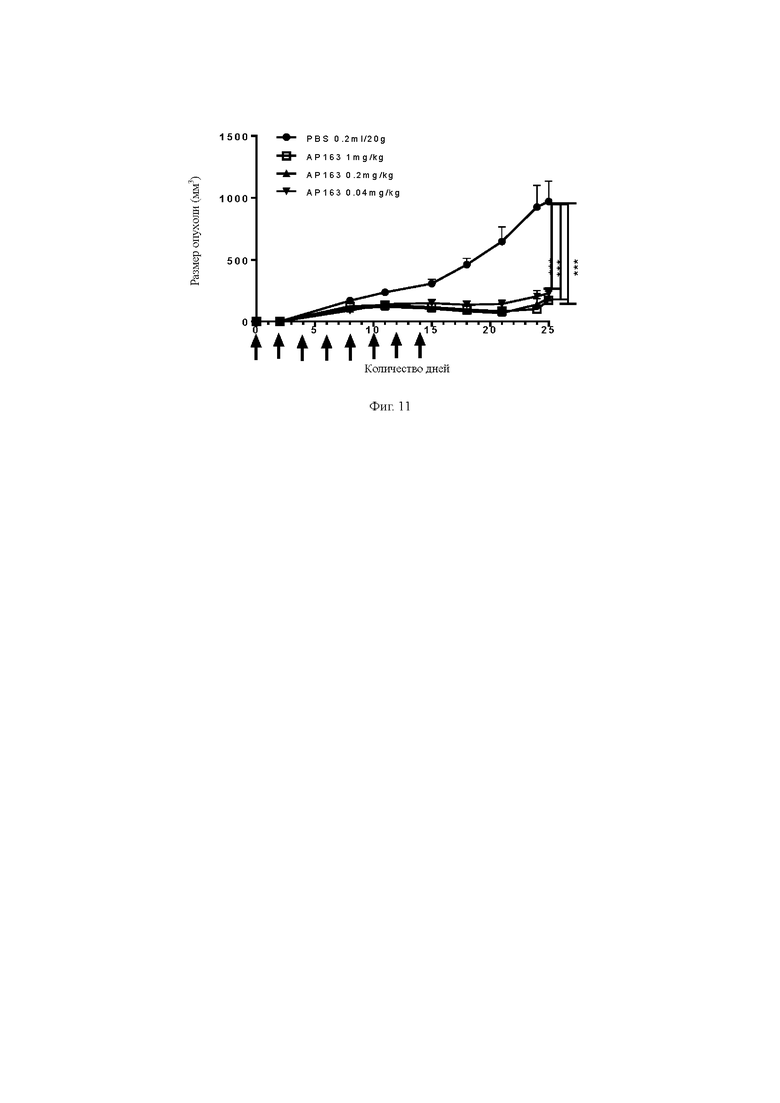
Настоящее изобретение относится к области биотехнологии, в частности к новым биспецифическим антителам, и может быть использовано в медицинской практике. Изобретение раскрывает биспецифическое антитело, специфически связывающееся с поверхностным антигеном CD3 иммунных клеток и антигеном ВСМА на поверхности опухолевых клеток. Такое антитело способно с высокой аффинностью связываться с человеческими клетками CD3 и индуцировать пролиферацию иммунных Т-клеток, тем самым способствуя уничтожению клеток злокачественных опухолей в организме субъекта. Изобретение может быть применимо в изготовлении лекарственного средства, предназначенного для лечения или облегчения симптомов нарушений плазматических клеток и других нарушений B-клеток, а также для лечения аутоиммунных заболеваний, связанных с экспрессией BCMA, в том числе и множественной миеломы. 7 н. и 18 з.п. ф-лы, 11 ил., 6 табл., 7 пр.
1. Биспецифическое антитело, нацеленное на антиген иммунных эффекторных клеток CD3 и опухолевый антиген ВСМА, в котором молекула состоит из двух идентичных полипептидных цепей, ковалентно связанных с образованием четырехвалентного гомодимера, где каждая из полипептидных цепей содержит
первый одноцепочечный Fv, специфически связывающийся с опухолевым антигеном ВСМА,
второй одноцепочечный Fv, специфически связывающийся с антигеном эффекторной клетки CD3, и
Fc-фрагмент,
где первый одноцепочечный Fv и второй одноцепочечный Fv соединены связывающим пептидом, а указанные второй одноцепочечный Fv и Fc- фрагмент соединены напрямую или связывающим пептидом;
где первый одноцепочечный Fv содержит:
(1) домен VH, содержащий HCDR1, HCDR2 и HCDR3, имеющие последовательности, показанные в SEQ ID NO: 1, 2 и 3, соответственно, и
(2) домен VL, содержащий LCDR1, LCDR2 и LCDR3, имеющие последовательности, показанные в SEQ ID NO: 4, 5 и 6, соответственно;
и второй одноцепочечный Fv содержит:
(1) домен VH, содержащий HCDR1, HCDR2 и HCDR3, имеющие последовательности, показанные в SEQ ID NO: 11, 12 и 13, соответственно, и
(2) домен VL, содержащий LCDR1, LCDR2 и LCDR3, имеющие последовательности, показанные в SEQ ID NO: 14, 15 и 16, соответственно.
2. Биспецифическое антитело по п. 1, отличающееся тем, что Fc-фрагмент не имеет эффекторных функций CDC, ADCC и ADCP.
3. Биспецифическое антитело по п. 1, отличающееся тем, что первый одноцепочечный Fv содержит домен VH и домен VL, соединенные связывающим пептидом, и аминокислотная последовательность связывающего пептида представляет собой (GGGGX)n, где
X представляет собой Ser или Ala, n равно натуральному числу от 1 до 5;
X предпочтительно представляет собой Ser, n предпочтительно равно 3.
4. Биспецифическое антитело по п. 1, отличающееся тем, что первый одноцепочечный Fv содержит:
(1) домен VH, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 7, или последовательность, имеющую не менее 80% сходства с вышеуказанной последовательностью или имеющую одну или несколько консервативных аминокислотных замен последовательностей; и
(2) домен VL, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 8, или последовательность, имеющую не менее 80% сходства с вышеуказанной последовательностью или имеющую одну или несколько консервативных аминокислотных замен последовательностей.
5. Биспецифическое антитело по п. 1, отличающееся тем, что домен VH и домен VL, содержащиеся во втором одноцепочечном Fv, соединены связывающим пептидом, и аминокислотная последовательность связывающего пептида представляет собой (GGGGX)n,
где
X представляет собой Ser или Ala, n равно натуральному числу от 1 до 5;
X предпочтительно представляет собой Ser, n предпочтительно равно 3.
6. Биспецифическое антитело по п. 1, отличающееся тем, что второй одноцепочечный Fv содержит:
1) домен VH, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 17, или последовательность, имеющую не менее 80% сходства с вышеуказанной последовательностью или имеющую одну или несколько консервативных аминокислотных замен последовательностей; а также
2) домен VL, содержащий аминокислотную последовательность, показанную в SEQ ID NO: 18, или последовательность, имеющую не менее 80% сходства с вышеуказанной последовательностью или имеющую одну или несколько консервативных аминокислотных замен последовательностей.
7. Биспецифическое антитело по п. 1, отличающееся тем, что второй одноцепочечный FV способен специфически связываться с CD3 человека, макака-крабоеда или макака-резуса.
8. Биспецифическое антитело по п. 1, отличающееся тем, что связывающий пептид, связывающий первый одноцепочечный Fv и второй одноцепочечный Fv, состоит из гибкого пептида и жесткого пептида; и гибкий пептид содержит 2 или более аминокислот и предпочтительно состоит из любой комбинации двух или более из следующих аминокислот: Gly (G), Ser (S), Ala (A) и Thr (T); более предпочтительно гибкий пептид содержит остатки G и S; ещё более предпочтительно общая структурная формула аминокислот гибкого пептида представляет собой GxSy(GGGGS)z, где x, y и z являются целыми числами, большими или равными 0, и (x + y + z) ≥ 1; указанный жесткий пептид происходит из полноразмерной последовательности, состоящей из аминокислот в положениях от 118 до 145 на карбоксильном конце β-субъединицы природного хорионического гонадотропина человека или ее укороченного фрагмента; и предпочтительно жесткий пептид содержит аминокислотную последовательность SSSSKAPPPS.
9. Биспецифическое антитело по п. 8, отличающееся тем, что связывающий пептид содержит аминокислотную последовательность, показанную в SEQ ID NO: 10.
10. Биспецифическое антитело по п. 1, отличающееся тем, что связывающий пептид, связывающий Fc-фрагмент и второй одноцепочечный Fv, содержит 1-20 аминокислот и предпочтительно состоит из любой повторяющейся комбинации следующих аминокислот: Gly (G), Сер (S), Ala (A) и Thr (T); более предпочтительно состоит из любой повторяющейся комбинации Gly (G) и Ser (S); ещё более предпочтительно связывающий пептид состоит из (GGGGS)n, где n равен 1, 2, 3 или 4.
11. Биспецифическое антитело по п. 1, отличающееся тем, что Fc-фрагмент содержит шарнирную область, домены CH2 и CH3, происходящие из константной области тяжелой цепи иммуноглобулина человека; предпочтительно Fc-фрагмент состоит из константных областей тяжелой цепи человеческих клеток IgG1, IgG2, IgG3, IgG4, IgM, IgA1, IgA2, IgD и IgE; предпочтительно Fc-фрагмент состоит из константных областей тяжелой цепи человеческих клеток IgG1, IgG2, IgG3 и IgG4; и более предпочтительно Fc-фрагмент состоит из константной области тяжелой цепи человеческих клеток IgG1 или IgG4.
12. Биспецифическое антитело по п. 11, отличающееся тем, что Fc-фрагмент содержит замену, делецию или добавление одной или более аминокислот по сравнению с его исходной природной последовательностью.
13. Биспецифическое антитело по п. 11, отличающееся тем, что Fc-фрагмент содержит аминокислотные замены, делеции или добавления, обеспечивающие уменьшение или устранение эффекторных функций.
14. Биспецифическое антитело по п. 13, отличающееся тем, что Fc-фрагмент содержит аминокислотные замены L234A/L235A/P331S, определённые в соответствии со схемой нумерации EU.
15. Биспецифическое антитело по п. 13 или 14, отличающееся тем, что Fc-фрагмент также содержит замены, делеции или добавления аминокислот, обеспечивающие одно или несколько из следующих свойств:
(1) повышенная аффинность связывания с неонатальным рецептором FcRn;
(2) уменьшенное или устраненное гликозилирование;
(3) уменьшение или устранение неоднородности заряда.
16. Биспецифическое антитело по п. 15, отличающееся тем, что Fc-фрагмент дополнительно содержит одну или несколько аминокислотных замен, делеций или добавлений, указанных ниже:
(1) аминокислотные замены M428L, T250Q/M428L, M428L/N434S или M252Y/S254T/T256E, определенные в соответствии со схемой нумерации ЕС; и/или
(2) аминокислотные замены N297A, определенные в соответствии со схемой нумерации ЕС; и/или
(3) делеции аминокислоты K447, определенные в соответствии со схемой нумерации ЕС.
17. Биспецифическое антитело по п. 15, отличающееся тем, что Fc-фрагмент содержит аминокислотную последовательность, показанную в SEQ ID NO: 19, и по сравнению с его исходной природной последовательностью Fc-фрагмент имеет смещения или замены следующих 6 аминокислот, определенных в соответствии со схемой нумерации ЕС: L234A/L235A/N297A/P331S/T250Q/M428L; и имеет делецию K447, определенных в соответствии со схемой нумерации ЕС.
18. Биспецифическое антитело по п. 1, отличающееся тем, что оно связывается с ВСМА и CD3 человека и содержит следующие аминокислотные последовательности:
(1) последовательность, показанную в SEQ ID NO: 20; или
(2) последовательность, имеющую одну или несколько замен, делеций или добавлений по сравнению с последовательностью, показанной в SEQ ID NO: 20; или
(3) последовательность, имеющую не менее 80%, не менее 85%, не менее 90%, не менее 91%, не менее 92%, не менее 93%, не менее 94%, не менее 95%, не менее 96%, не менее 97%, не менее 98%, не менее, 99% или 100% идентичности с последовательностью, показанной в SEQ ID NO: 20.
19. Молекула ДНК, отличающаяся тем, что она кодирует биспецифическое антитело по любому из пп. 1-18.
20. Молекула ДНК по п. 19, отличающаяся тем, что она имеет нуклеотидную последовательность, показанную в SEQ ID NO: 21.
21. Вектор экспрессии, отличающийся тем, что он содержит молекулу ДНК по п. 19 или 20.
22. Клетка-хозяин для экспрессии биспецифического антитела, нацеленного на антиген иммунных эффекторных клеток CD3 и опухолевый антиген ВСМА, отличающаяся тем, что она трансформирована вектором экспрессии по п. 21, предпочтительно клетка-хозяин представляет собой прокариотическую клетку или дрожжевую клетку или клетку млекопитающего, более предпочтительно клетка–хозяин представляет собой клетку млекопитающего, и еще более предпочтительно клетка млекопитающего представляют собой клетки СНО или клетки NS0.
23. Фармацевтическая композиция, обладающая способностью специфически опосредовать Т-клетки для уничтожения опухолевых клеток, содержащая эффективное количество биспецифического антитела по любому из пп. 1-18 и фармацевтически приемлемый наполнитель, носитель и/или разбавитель.
24. Способ получения биспецифического антитела по любому из пп. 1-18, отличающийся тем, что он содержит:
(а) получение слитого гена, кодирующего указанное биспецифическое антитело, и конструирование вектора экспрессии указанного биспецифического антитела;
(б) трансфекцию вышеуказанного вектора экспрессии в клетку хозяина способом генной инженерии;
(в) культивирование вышеуказанной клетки хозяина в условиях, позволяющих продуцировать биспецифическое антитело;
(г) отделение и очистка антитела.
25. Применение биспецифического антитела по любому из пп. 1-18 в изготовлении лекарственного средства, предназначенного для лечения или облегчения симптомов нарушений плазматических клеток и других нарушений B-клеток и аутоиммунных заболеваний, связанных с экспрессией BCMA, где нарушения плазматических клеток включают, но не ограничиваются ими: множественная миелома, плазмоцитома, лейкоз плазматических клеток, макроглобулинемия, амилоидоз, макроглобулинемия Вальденстрема, плазмоцитома солитарной кости, экстрамедуллярная плазмоцитома, остеосклеротическая миелома, болезнь тяжелых цепей, моноклональная гаммопатия неопределенного значения и тлеющая множественная миелома.
| WO 2017134134 A1, 10.08.2017 | |||
| WO 2017223111 A1, 28.12.2017 | |||
| WO 2012066058 A1, 24.05.2012 | |||
| CN 105658668 A, 08.06.2016 | |||
| CN 107759694 A, 06.03.2018 | |||
| Устройство для проволочной радиофикации домов | 1929 |
|
SU28162A1 |
Авторы
Даты
2022-12-06—Публикация
2019-09-26—Подача