ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к области фармацевтического синтеза и, в частности, к производному 1,2,3,4-тетрагидрохиноксалина, способу его получения и его применению.
УРОВЕНЬ ТЕХНИКИ
Семейство орфанных рецепторов (ROR), связанных с ретиноевой кислотой (RAR), состоит из трех членов: RORα, RORβ и RORγ. Рецептор RORα крайне важен для развития мозжечка, а рецептор RORβ экспрессируется главным образом в головном мозге и сетчатке глаза. Оба рецептора играют важную роль в нормальном развитии сетчатки. В зависимости от сайтов сплайсинга во время транскрипции, рецептор RORγ может относиться к одному из двух подтипов, RORγ1 и RORγ2 (RORγt), первый из которых экспрессируется главным образом в печени, скелетных мышцах и почках. RORγt экспрессируется главным образом в органах иммунной системы. У мышей с дефицитом RORγt отсутствуют лимфатические узлы, пейеровы бляшки и другие лимфоидные органы. Кроме того, такой дефицит негативно влияет на процессы развития и созревания Т-клеток, а количество различных Т-клеток снижено по сравнению с таковыми у нормальных мышей.
Т-хелперы играют важнейшую роль в иммунной системе человека. Под действием различных цитокинов, индуцируемых на этапе развития организма, CD4-положительные Т-хелперы могут дифференцироваться с образованием ряда регуляторных хелперных клеток, таких как Th1, Th2, Th17 и Treg. Th1 и Th2 играют важную роль в процессах распознавания антигенов, презентации антигенов и активации Т-эффекторных клеток. Treg представляют собой класс регуляторных клеток, которые способствуют подавлению иммунного ответа. Th17 представляют собой относительно новую разновидность Т-хелперных клеток, обнаруженных в последние годы, для которых характерна секреция цитокина интерлейкина 17 (IL-17). Вначале считалось, что клетки Th17 выполняют свои иммунные функции, преимущественно участвуя в борьбе с бактериальными и грибковыми инфекциями посредством мобилизации нейтрофилов. Результаты более поздних исследований показали, что эти клетки тесно связаны с развитием аутоиммунных заболеваний и злокачественных новообразований. Поэтому лечение аутоиммунных заболеваний путем подавления дифференцировки клеток Th17 и лечение злокачественных новообразований путем активации дифференцировки клеток Th17 стали привлекать повышенный интерес как в плане фундаментальных и трансляционных исследований иммунных заболеваний, так и со стороны специалистов в области онкологии.
RORγt является ключевым транскрипционным фактором в дифференцировке CD4+ Th17-клеток, а модуляция активности RORγt посредством низкомолекулярных соединений может напрямую влиять на число и активность Th17-клеток. После активации RORγt значительно повышается уровень цитокинов, секретируемых Th17-клетками (таких как IL-17A), и существенно увеличиваются выживаемость Th17-клеток и их способность к иммунной активации. Вместе с тем, повышенная активация Th17-клеток может приводить к снижению числа иммуносупрессорных Treg-клеток, и экспрессии иммуносупрессорных рецепторов (таких как PD-1) в опухоль-инфильтрирующих лимфоцитах. Исходя из механизма действия, низкомолекулярный агонист RORγt, предназначенный для приема внутрь, может увеличивать способность иммунной системы распознавать и уничтожать опухолевые клетки посредством активации Th17-клеток, благодаря чему он может стать новым низкомолекулярным противоопухолевым препаратом после успеха антител против PD-1/PD-L1.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Задачей настоящего изобретения является создание низкомолекулярного агониста RORγt.
Первый аспект настоящего изобретения относится к соединению формулы (I), стереоизомеру, пролекарству или фармацевтически приемлемой соли:
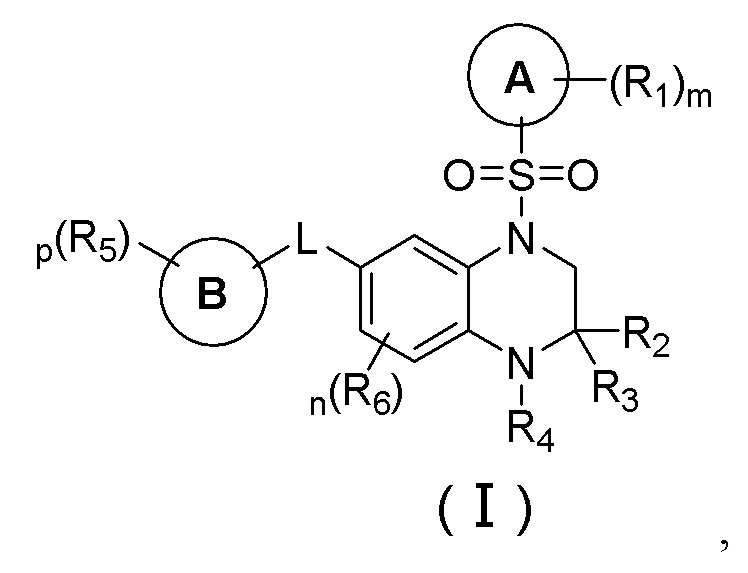
где
L выбран из группы, состоящей из связи, -C(R7)=C(R8)-, -(CR9R10)m1-, -(CR11R12)m2-O-, -O-(CR13R14)m3-, -N(R15)-C(O)-, -C(O)-N(R16)-, -(CR17R18)m4-N(R19)-, -N(R20)-(CR21R22)m5-, -(CR23R24)m6-S(O)r- и -S(O)r-(CR25R26)m7-;
цикл A представляет собой 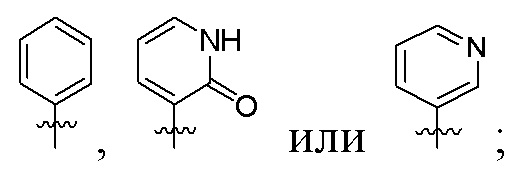
цикл B представляет собой  где Y представляет собой -O- или -N(R27)-;
где Y представляет собой -O- или -N(R27)-;
R1 выбран из группы, состоящей из водорода, дейтерия, галогена, циано, нитро, азидо, C1-10 алкила, C2-10 алкенила, C2-10 алкинила, C3-10 циклоалкила, 3-10-членного гетероциклила, C5-10 арила, 5-10-членного гетероарила, -C0-8-S(O)rR28, -C0-8-O-R29, -C0-8-C(O)OR29, -C0-8-C(O)R30, -C0-8-O-C(O)R30, -C0-8-NR31R32, -C0-8-C(O)NR31R32 и -C0-8-N(R31)-C(O)R30, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогена, циано, нитро, азидо, C1-10 алкила, C1-10 галогеналкила, C1-10 дейтероалкила, C2-10 алкенила, C2-10 алкинила, C3-10 циклоалкила, 3-10-членного гетероциклила, C5-10 арила, 5-10-членного гетероарила, =O, -C0-8-S(O)rR28, -C0-8-O-R29, -C0-8-C(O)OR29, -C0-8-C(O)R30, -C0-8-O-C(O)R30, -C0-8-NR31R32, -C0-8-C(O)NR31R32 и -C0-8-N(R31)-C(O)R30;
R2 и R3 каждый независимо выбран из группы, состоящей из водорода, дейтерия, галогена, циано, нитро, азидо, C1-10 алкила, C2-10 алкенила, C2-10 алкинила, C3-10 циклоалкила, 3-10-членного гетероциклила, C5-10 арила, 5-10-членного гетероарила, -C0-8-S(O)rR28, -C0-8-O-R29, -C0-8-C(O)OR29, -C0-8-C(O)R30, -C0-8-O-C(O)R30, -C0-8-NR31R32, -C0-8-C(O)NR31R32 и -C0-8-N(R31)-C(O)R30, или R2 и R3, вместе с атомом углерода, непосредственно присоединенным к ним, образуют C(O), 3-10-членного циклоалкила или 3-10-членного гетероциклила, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогена, циано, нитро, азидо, C1-10 алкила, C2-10 алкенила, C2-10 алкинила, C1-10 галогеналкила, C1-10 дейтероалкила, C3-10 циклоалкила, 3-10-членного гетероциклила, C5-10 арила, 5-10-членного гетероарила, =O, -C0-8-S(O)rR28, -C0-8-O-R29, -C0-8-C(O)OR29, -C0-8-C(O)R30, -C0-8-O-C(O)R30, -C0-8-NR31R32, -C0-8-C(O)NR31R32 и -C0-8-N(R31)-C(O)R30;
R4 выбран из группы, состоящей из водорода, дейтерия, гидрокси, C1-4 алкила, винила, пропенила, аллила, этинила, C3-6 циклоалкила, 3-6-членного гетероциклила, фенила, бензила, диазола, триазола, метилсульфонила, изопропилсульфонила, аминосульфонила, карбоксила, метоксикарбонила, этоксикарбонила и ацетила, упомянутый C1-4 алкил, C3-6 циклоалкил, 3-6-членный гетероциклил, фенил, бензил, диазол и триазол опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогена, циано, метила, этила, изопропила, трифторметила, дифторметила, тридейтерометила, циклопропила, оксациклобутила, =O, метокси, карбоксила, метоксикарбонила, ацетила, амино, диметиламино и ацетиламино,
или R4 и R3, вместе с атомом углерода, непосредственно присоединенным к ним, образуют 5-10-членный гетероциклил, 5-10-членный гетероциклил опционально замещен одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогена, циано, нитро, азидо, C1-10 алкила, C2-10 алкенила, C2-10 алкинила, C1-10 галогеналкила, C1-10 дейтероалкила, C3-10 циклоалкила, 3-10-членного гетероциклила, C5-10 арила, 5-10-членного гетероарила, =O, -C0-8-S(O)rR28, -C0-8-O-R29, -C0-8-C(O)OR29, -C0-8-C(O)R30, -C0-8-C(S)R30, -C0-8-O-C(O)R30, -C0-8-NR31R32, -C0-8-C(O)NR31R32 и -C0-8-N(R31)-C(O)R30, вышеуказанные группы в свою очередь опционально замещены одним или несколькими заместителями, выбранными из группы, состоящей из дейтерия, галогена, циано, нитро, азидо, C1-10 алкила, C2-10 алкенила, C2-10 алкинила, C1-10 галогеналкила, C1-10 дейтероалкила, C3-10 циклоалкила, 3-10-членного гетероциклила, C5-10 арила, 5-10-членного гетероарила, =O, -C0-8-S(O)rR28, -C0-8-O-R29, -C0-8-C(O)OR29, -C0-8-C(O)R30, -C0-8-C(S)R30, -C0-8-O-C(O)R30, -C0-8-NR31R32, -C0-8-C(O)NR31R32 и -C0-8-N(R31)-C(O)R30;
каждый R5 независимо выбран из группы, состоящей из водорода, дейтерия, галогена, циано, нитро, азидо, C1-10 алкила, C2-10 алкенила, C2-10 алкинила, C3-10 циклоалкила, 3-10-членного гетероциклила, C5-10 арила, 5-10-членного гетероарила, -SF5, -C0-8-S(O)rR28, -C0-8-O-R29, -C0-8-C(O)OR29, -C0-8-C(O)R30, -C0-8-O-C(O)R30, -C0-8-NR31R32, -C0-8-C(O)NR31R32 и -C0-8-N(R31)-C(O)R30, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогена, циано, нитро, азидо, C1-10 алкила, C2-10 алкенила, C2-10 алкинила, C1-10 галогеналкила, C1-10 дейтероалкила, C3-10 циклоалкила, 3-10-членного гетероциклила, C5-10 арила, 5-10-членного гетероарила, =O, -C0-8-S(O)rR28, -C0-8-O-R29, -C0-8-C(O)OR29, -C0-8-C(O)R30, -C0-8-O-C(O)R30, -C0-8-NR31R32, -C0-8-C(O)NR31R32 и -C0-8-N(R31)-C(O)R30;
каждый R6 независимо выбран из группы, состоящей из водорода, дейтерия, галогена, циано, нитро, азидо, C1-10 алкила, C2-10 алкенила, C2-10 алкинила, C3-10 циклоалкила, 3-10-членного гетероциклила, C5-10 арила, 5-10-членного гетероарила, -C0-8-S(O)rR28, -C0-8-O-R29, -C0-8-C(O)OR29, -C0-8-C(O)R30, -C0-8-O-C(O)R30, -C0-8-NR31R32, -C0-8-C(O)NR31R32 и -C0-8-N(R31)-C(O)R30, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогена, циано, нитро, азидо, C1-10 алкила, C2-10 алкенила, C2-10 алкинила, C1-10 галогеналкила, C1-10 дейтероалкила, C3-10 циклоалкила, 3-10-членного гетероциклила, C5-10 арила, 5-10-членного гетероарила, =O, -C0-8-S(O)rR28, -C0-8-O-R29, -C0-8-C(O)OR29, -C0-8-C(O)R30, -C0-8-O-C(O)R30, -C0-8-NR31R32, -C0-8-C(O)NR31R32 и -C0-8-N(R31)-C(O)R30;
R7 и R8 каждый независимо выбраны из группы, состоящей из водорода, дейтерия, фтора, C1-4 алкила, C1-4 дейтероалкила и C1-4 фторалкила;
R9, R10, R11, R12, R13, R14, R17, R18, R21, R22, R23, R24, R25 и R26 каждый независимо выбраны из группы, состоящей из водорода, дейтерия, галогена, циаоно, нитро, азидо, C1-10 алкила, C2-10 алкенила, C2-10 алкинила, C3-10 циклоалкила, 3-10-членного гетероциклила, C5-10 арила, 5-10-членного гетероарила, -C0-8-S(O)rR28, -C0-8-O-R29, -C0-8-C(O)OR29, -C0-8-C(O)R30, -C0-8-O-C(O)R30, -C0-8-NR31R32, -C0-8-C(O)NR31R32 и -C0-8-N(R31)-C(O)R30, или R9 и R10, R11 и R12, R13 и R14, R17 и R18, R21 и R22, R23 и R24, R25 и R26, вместе с атомом углерода, непосредственно присоединенным к ним, каждый независимо образуют C(O), 3-6-членный циклоалкил, 3-6-членный гетероциклил, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогена, циано, нитро, азидо, C1-10 алкила, C2-10 алкенила, C2-10 алкинила, C1-10 галогеналкила, C1-10 дейтероалкила, C3-10 циклоалкила, 3-10-членного гетероциклила, C5-10 арила, 5-10-членного гетероарила, =O, -C0-8-S(O)rR28, -C0-8-O-R29, -C0-8-C(O)OR29, -C0-8-C(O)R30, -C0-8-O-C(O)R30, -C0-8-NR31R32, -C0-8-C(O)NR31R32 и -C0-8-N(R31)-C(O)R30;
R15, R16, R19, R20 и R27 каждый независимо выбраны из группы, состоящей из водорода, дейтерия, C1-10 алкила, C2-10 алкенила, C2-10 алкинила, C3-10 циклоалкила, 3-10-членного гетероциклила, C5-10 арила, 5-10-членного гетероарила, -C0-8-S(O)rR28, -C0-8-C(O)OR29 и -C0-8-C(O)R30, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогена, циано, нитро, азидо, C1-10 алкила, C2-10 алкенила, C2-10 алкинила, C1-10 галогеналкила, C1-10 дейтероалкила, C3-10 циклоалкила, 3-10-членного гетероциклила, C5-10 арила, 5-10-членного гетероарила, =O, -C0-8-S(O)rR28, -C0-8-O-R29, -C0-8-C(O)OR29, -C0-8-C(O)R30, -C0-8-O-C(O)R30, -C0-8-NR31R32, -C0-8-C(O)NR31R32 и -C0-8-N(R31)-C(O)R30;
каждый R28 независимо выбран из группы, состоящей из водорода, дейтерия, гидрокси, C1-10 алкила, C1-10 алкокси, C2-10 алкенила, C3-10 циклоалкила, C3-10 циклоалкилокси, 3-10-членного гетероциклила, 3-10-членного гетероциклилокси, C5-10 арила, C5-10 арилокси, 5-10-членного гетероарила, 5-10-членного гетероарилокси и -NR31R32, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогена, гидрокси, =O, C1-10 алкила, C1-10 алкокси, C3-10 циклоалкила, C3-10 циклоалкилокси, 3-10-членного гетероциклила, 3-10-членного гетероциклилокси, C5-10 арила, C5-10 арилокси, 5-10-членного гетероарила, 5-10-членного гетероарилокси и -NR31R32;
каждый R29 независимо выбран из группы, состоящей из водорода, дейтерия, C1-10 алкила, C2-10 алкенила, C3-10 циклоалкила, 3-10-членного гетероциклила, C5-10 арила и 5-10-членного гетероарила, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогена, гидрокси, =O, циано, C1-10 алкила, C1-10 алкокси, C3-10 циклоалкила, C3-10 циклоалкилокси, 3-10-членного гетероциклила, 3-10-членного гетероциклилокси, C5-10 арила, C5-10 арилокси, 5-10-членного гетероарила, 5-10-членного гетероарилокси и -NR31R32;
каждый R30 независимо выбран из группы, состоящей из водорода, дейтерия, гидрокси, C1-10 алкила, C1-10 алкокси, C2-10 алкенила, C2-10 алкинила, C3-10 циклоалкила, C3-10 циклоалкилокси, 3-10-членного гетероциклила, 3-10-членного гетероциклилокси, C5-10 арила, C5-10 арилокси, 5-10-членного гетероарила, 5-10-членного гетероарилокси и -NR31R32, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогена, гидрокси, циано, C1-10 алкила, C1-10 алкокси, C3-10 циклоалкила, C3-10 циклоалкилокси, 3-10-членного гетероциклила, 3-10-членного гетероциклилокси, C5-10 арила, C5-10 арилокси, 5-10-членного гетероарила, 5-10-членного гетероарилокси и -NR31R32;
R31 и R32 каждый независимо выбраны из группы, состоящей из водорода, дейтерия, гидрокси, C1-10 алкила, C2-10 алкенила, C2-10 алкинила, C3-10 циклоалкила, 3-10-членного гетероциклила, C5-10 арила, 5-10-членного гетероарила, сульфонила, метилсульфонила, изопропилсульфонила, циклопропилсульфонила, п-толуолсульфонила, амино, моноалкиламино, диалкиламино и C1-10 алканоила, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогена, гидрокси, карбоксила, C1-8 алкила, C1-10 алкокси, C3-10 циклоалкила, C3-10 циклоалкилокси, 3-10-членного гетероциклила, 3-10-членного гетероциклилокси, C5-10 арила, C5-10 арилокси, 5-10-членного гетероарила, 5-10-членный гетероарилокси, амино, моноалкиламино, диалкиламино и C1-10 алканоила;
или R31 и R32 вместе с атомом азота, непосредственно присоединенным к ним, образуют 4-10-членный гетероциклил, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогена, гидрокси, C1-10 алкила, C1-10 алкокси, C3-10 циклоалкила, C3-10 циклоалкилокси, 3-10-членного гетероциклила, 3-10-членного гетероциклилокси, C5-10 арила, C5-10 арилокси, 5-10-членного гетероарила, 5-10-членный гетероарилокси, амино, моноалкиламино, диалкиламино и C1-10 алканоила;
m представляет собой целое число от 0 до 5; n представляет собой целое число от 0 до 3; p представляет собой целое число от 0 до 5;
m1, m3, m5 и m7 каждый независимо принимает значения 1 или 2;
m2, m4 и m6 каждый независимо принимает значения 0, 1 или 2;
каждый r независимо принимает значения 0, 1 или 2.
В предпочтительном варианте осуществления изобретения, в соединении формулы (I), его стереоизомере, пролекарстве или фармацевтически приемлемой соли каждый R6 независимо выбран из группы, состоящей из водорода, дейтерия, галогена, циано, нитро, азидо, C1-4 алкила, C2-4 алкенила, C2-4 алкинила, C3-6 циклоалкила, 3-6-членного гетероциклила, C5-8 арила, 5-8-членного гетероарила, -C0-4-S(O)rR28, -C0-4-O-R29, -C0-4-C(O)OR29, -C0-4-C(O)R30, -C0-4-O-C(O)R30, -C0-4-NR31R32, -C0-4-C(O)NR31R32 и -C0-4-N(R31)-C(O)R30, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогена, циано, нитро, азидо, C1-4 алкила, C2-4 алкенила, C2-4 алкинила, C1-4 галогеналкила, C1-4 дейтероалкила, C3-6 циклоалкила, 3-6-членного гетероциклила, C5-8 арила, 5-8-членного гетероарила, =O, -C0-4-S(O)rR28, -C0-4-O-R29, -C0-4-C(O)OR29, -C0-4-C(O)R30, -C0-4-O-C(O)R30, -C0-4-NR31R32, -C0-4-C(O)NR31R32 и -C0-4-N(R31)-C(O)R30; R28, R29, R30, R31 и R32 соответствуют таковым в соединении формулы (I).
В еще одном предпочтительном варианте осуществления изобретения, в соединении формулы (I), его стереоизомере, пролекарстве или фармацевтически приемлемой соли каждый R6 выбран из группы, состоящей из водорода, дейтерия, фтора, хлора, циано, метила, этила, изопропила, винила, аллила, этинила, циклопропила, 3-оксациклобутила, 3-азациклобутила, фенила, пиридила, диазола, триазола, метилсульфонила, аминосульфонила, метокси, метоксиацила, карбоксила, ацетила, ацетокси, амино, диметиламино, аминоацила и ацетиламино, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, фтора, хлора, циано, метила, трифторметила, циклопропила, фенила, пиридила, метилсульфонила, гидрокси, метокси, карбоксила и амино.
В еще одном предпочтительном варианте осуществления изобретения, в соединении формулы (I), его стереоизомере, пролекарстве или фармацевтически приемлемой соли соединение формулы (I) представляет собой соединение с формулой (IIa):
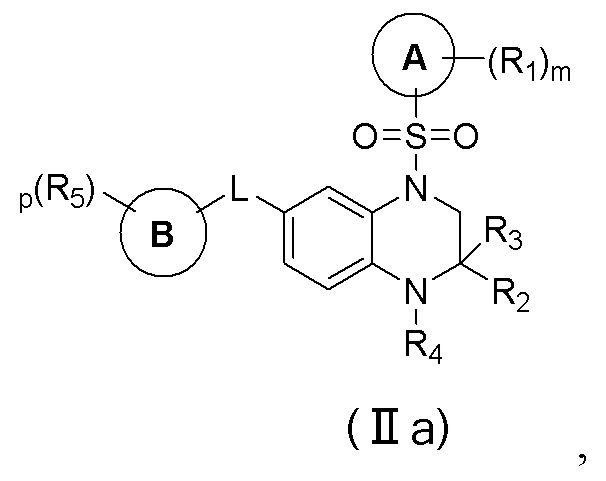
где R2 и R3 каждый независимо выбраны из группы, состоящей из водорода, дейтерия, галогена, циано, нитро, азидо, C1-4 алкила, C2-4 алкенила, C2-4 алкинила, C3-6 циклоалкила, 3-6-членного гетероциклила, C5-8 арила, 5-8-членного гетероарила, -C0-4-S(O)rR28, -C0-4-O-R29, -C0-4-C(O)OR29, -C0-4-C(O)R30, -C0-4-O-C(O)R30, -C0-4-NR31R32, -C0-4-C(O)NR31R32 и -C0-4-N(R31)-C(O)R30, или R2 и R3, вместе с атомом углерода, непосредственно присоединенным к ним, образуют C(O), 3-10-членный циклоалкил или 3-10-членный гетероциклил;
R4 выбран из группы, состоящей из водорода, дейтерия, гидрокси, C1-4 алкила, C3-6 циклоалкила, 3-6-членного гетероциклила, фенила, метилсульфонила, изопропилсульфонила, аминосульфонила, карбокси, метоксикарбонила, этоксикарбонила и ацетила, и упомянутый C1-4 алкил, C3-6 циклоалкил, 3-6-членный гетероциклил и фенил опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, фтора, хлора, циано, метила, этила, изопропила, трифторметила, дифторметила, тридейтерометила, циклопропила, оксациклобутила, метокси, карбокси, метоксикарбонила, ацетила, амино, диметиламино и ацетиламино;
цикл A, цикл B, L, R1, R5, R28, R29, R30, R31, R32, r, m и p соответствуют таковым в соединении формулы (I).
В еще одном предпочтительном варианте осуществления изобретения, в соединении формулы (I), его стереоизомере, пролекарстве или фармацевтически приемлемой соли соединение формулы (I) представляет собой соединение с формулой (IIIa1), формулой (IIIa2), формулой (IIIa3) или формулой (IIIa4) как описано ниже:
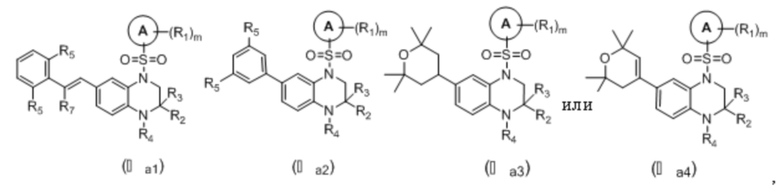
или
где R2 и R3 каждый независимо выбраны из группы, состоящей из водорода, дейтерия, C1-4 алкила, C3-6 циклоалкила, 3-6-членного гетероциклила, -C0-4-O-R29, -C0-4-C(O)OR29, -C0-4-C(O)R30 и -C0-4-O-C(O)R30, или R2 и R3, вместе с атомом углерода, непосредственно присоединенным к ним, образуют C(O), 3-6-членный циклоалкил или 3-6-членный гетероциклил;
R4 выбран из группы, состоящей из водорода, дейтерия, C1-4 алкила, C3-6 циклоалкила и 3-6-членного гетероциклила, упомянутый C1-4 алкил, C3-6 циклоалкил, 3-6-членный гетероциклил опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, фтора, хлора, циано, метила, этила, изопропила, трифторметила, дифторметила, тридейтерометила, циклопропила, оксациклобутила, метокси, карбокси, метоксикарбонила, ацетила, амино, диметиламино и ацетиламино;
каждый R5 независимо выбран из группы, состоящей из водорода, дейтерия, галогена, циано, C1-4 алкила, C3-6 циклоалкила, 3-6-членного гетероциклила и -O-R29, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, фтора, хлора, циано, метила, этила, изопропила, трифторметила, дифторметила, тридейтерометила, дидейтерометила, циклопропила, оксациклобутила, =O, метокси и карбокси;
R7 выбран из группы, состоящей из водорода, дейтерия, фтора, метила, этила, трифторметила, дифторметила, тридейтерометила и дидейтерометила;
цикл A, R1, R29, R30 и m соответствуют таковым в соединении формулы (I).
В еще одном предпочтительном варианте осуществления изобретения, в соединении формулы (I), его стереоизомере, пролекарстве или фармацевтически приемлемой соли соединение формулы (I) представляет собой соединение с формулой (IIb):
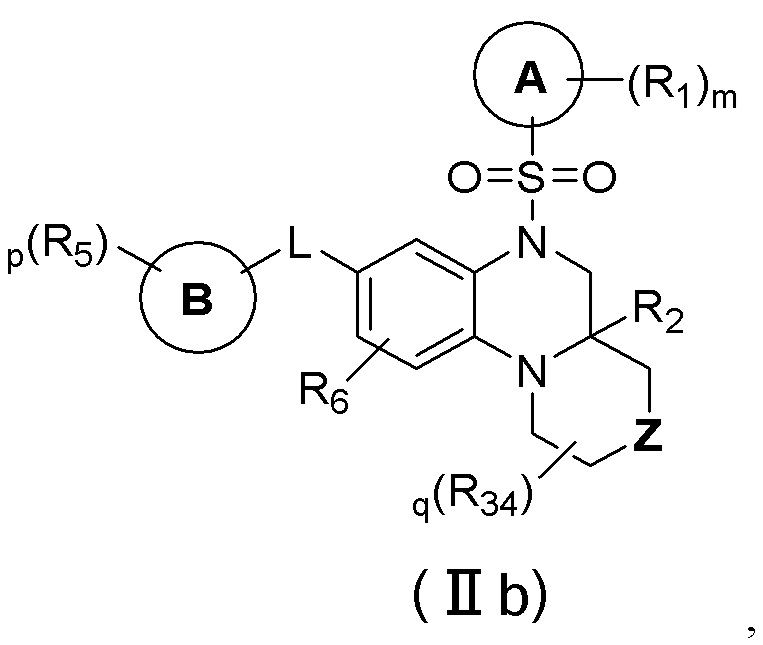
где Z выбран из группы, состоящей из связи, -O-, -S-, -S(O)-, -S(O)2-, -N(R33)- и -(CR35R36)-;
R33 выбран группы, состоящей из водорода, дейтерия, C1-4 алкила, C2-4 алкенила, C2-4 алкинила, C1-4 галогеналкила, C1-4 дейтероалкила, C3-6 циклоалкила, 3-6-членного гетероциклила, C5-8 арила, 5-8-членного гетероарила, -C0-4-S(O)rR28, -C0-4-O-R29, -C0-4-C(O)OR29, -C0-4-C(O)R30, -C0-4-C(S)R30, -C0-4-O-C(O)R30 и -C0-4-C(O)NR31R32, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогена, циано, нитро, азидо, C1-4 алкила, C2-4 алкенила, C2-4 алкинила, C1-4 галогеналкила, C1-4 дейтероалкила, C3-6 циклоалкила, 3-6-членного гетероциклила, C5-8 арила, 5-8-членного гетероарила, =O, -C0-4-S(O)rR28, -C0-4-O-R29, -C0-4-C(O)OR29, -C0-4-C(O)R30, -C0-4-C(S)R30, -C0-4-O-C(O)R30 и -C0-4-C(O)NR31R32;
каждый R34 независимо выбран из группы, состоящей из водорода, дейтерия, галогена, циано, нитро, азидо, C1-4 алкила, C2-4 алкенила, C2-4 алкинила, C1-4 галогеналкила, C1-4 дейтероалкила, C3-6 циклоалкила, 3-6-членного гетероциклила, C5-8 арила, 5-8-членного гетероарила, -C0-4-S(O)rR28, -C0-4-O-R29, -C0-4-C(O)OR29, -C0-4-C(O)R30, -C0-4-O-C(O)R30, -C0-4-NR31R32, -C0-4-C(O)NR31R32 и -C0-4-N(R31)-C(O)R30, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогена, циано, нитро, азидо, C1-4 алкила, C2-4 алкенила, C2-4 алкинила, C1-4 галогеналкила, C1-4 дейтероалкила, C3-6 циклоалкила, 3-6-членного гетероциклила, C5-8 арила, 5-8-членного гетероарила, =O, -C0-4-S(O)rR28, -C0-4-O-R29, -C0-4-C(O)OR29, -C0-4-C(O)R30, -C0-4-O-C(O)R30, -C0-4-NR31R32, -C0-4-C(O)NR31R32 и -C0-4-N(R31)-C(O)R30;
R35 выбран из группы, состоящей из водорода, дейтерия, галогена, C1-4 алкила, C2-4 алкенила, C2-4 алкинила, C1-4 галогеналкила, C1-4 дейтероалкила, C3-6 циклоалкила, 3-6-членного гетероциклила, C5-8 арила, 5-8-членного гетероарила, -C0-4-S(O)rR28, -C0-4-O-R29, -C0-4-C(O)OR29, -C0-4-C(O)R30, -C0-4-C(S)R30 и -C0-4-O-C(O)R30, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогена, циано, нитро, азидо, C1-4 алкила, C2-4 алкенила, C2-4 алкинила, C1-4 галогеналкила, C1-4 дейтероалкила, C3-6 циклоалкила, 3-6-членного гетероциклила, C5-8 арила, 5-8-членного гетероарила, =O, -C0-4-S(O)rR28, -C0-4-O-R29, -C0-4-C(O)OR29, -C0-4-C(O)R30, -C0-4-O-C(O)R30, -C0-4-NR31R32, -C0-4-C(O)NR31R32 и -C0-4-N(R31)-C(O)R30;
R36 выбран группы, состоящей из водорода, дейтерия, галогена, C1-4 алкила, C2-4 алкенила, C2-4 алкинила, C1-4 галогеналкила, C1-4 дейтероалкила, C3-6 циклоалкила, 3-6-членного гетероциклила, C5-8 арила, 5-8-членного гетероарила, -C0-4-S(O)rR28, -C0-4-O-R29, -C0-4-C(O)OR29, -C0-4-C(O)R30, -C0-4-C(S)R30 и -C0-4-O-C(O)R30, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогена, циано, нитро, азидо, C1-4 алкила, C2-4 алкенила, C2-4 алкинила, C1-4 галогеналкила, C1-4 дейтероалкила, C3-6 циклоалкила, 3-6-членного гетероциклила, C5-8 арила, 5-8-членного гетероарила, =O, -C0-4-S(O)rR28, -C0-4-O-R29, -C0-4-C(O)OR29, -C0-4-C(O)R30, -C0-4-O-C(O)R30, -C0-4-NR31R32, -C0-4-C(O)NR31R32 и -C0-4-N(R31)-C(O)R30;
q представляет собой целое число от 0 до 4; цикл A, цикл B, L, R1, R2, R5, R6, R28, R29, R30, R31, R32, m, r и p соответствуют таковым в соединении формулы (I).
В еще одном предпочтительном варианте осуществления изобретения, в соединении формулы (I), его стереоизомере, пролекарстве или фармацевтически приемлемой соли соединение формулы (I) представляет собой соединение с формулой (IIIb1), формулой (IIIb2), формулой (IIIb3), формулой (IIIb4) или формулой (IIIb5) как описано ниже:
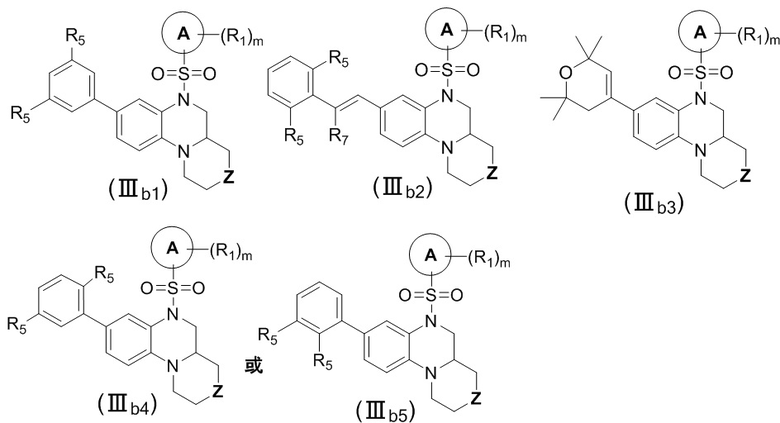

или
где Z выбран из группы, состоящей из связи, -O-, -S-, -S(O)-, -S(O)2-, -N(R33)- и -(CR35R36)-;
каждый R5 независимо выбран из группы, состоящей из водорода, дейтерия, галогена, циано, C1-4 алкила, C3-6 циклоалкила, 3-6-членного гетероциклила и -O-R29, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, фтора, хлора, циано, метила, этила, изопропила, трифторметила, дифторметила, тридейтерометила, дидейтерометила, циклопропила, оксациклобутила, =O, метокси и карбокси;
R7 выбран из группы, состоящей из водорода, дейтерия, фтора, метила, этила, трифторметила, дифторметила, тридейтерометила и дидейтерометила;
R33 выбран группы, состоящей из водорода, дейтерия, C1-4 алкила, C2-4 алкенила, C2-4 алкинила, C1-4 галогеналкила, C1-4 дейтероалкила, C3-6 циклоалкила, 3-6-членного гетероциклила, -C0-4-S(O)rR28, -C0-4-O-R29, -C0-4-C(O)OR29, -C0-4-C(O)R30, -C0-4-C(S)R30, -C0-4-O-C(O)R30 и -C0-4-C(O)NR31R32, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогена, циано, нитро, азидо, C1-4 алкила, C2-4 алкенила, C2-4 алкинила, C1-4 галогеналкила, C1-4 дейтероалкила, C3-6 циклоалкила, 3-6-членного гетероциклила, =O, -C0-4-S(O)rR28, -C0-4-O-R29, -C0-4-C(O)OR29, -C0-4-C(O)R30, -C0-4-O-C(O)R30 и -C0-4-C(O)NR31R32;
R35 выбран группы, состоящей из водорода, дейтерия, галогена, C1-4 алкила, C1-4 галогеналкила, C1-4 дейтероалкила, C3-6 циклоалкила, 3-6-членного гетероциклила, -O-R29, -C(O)OR29, -O-C(O)R30 и -C(O)NR31R32, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогена, циано, нитро, азидо, C1-4 алкила, C1-4 галогеналкила, C1-4 дейтероалкила, C3-6 циклоалкила, 3-6-членного гетероциклила, =O, -S(O)rR28, -C0-4-O-R29, -C(O)OR29, -C(O)R30 и -C(O)NR31R32;
R36 выбран группы, состоящей из водорода, дейтерия, галогена, C1-4 алкила, C2-4 алкенила, C2-4 алкинила, C1-4 галогеналкила, C1-4 дейтероалкила и C3-6 циклоалкила, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, фтора, хлора, циано, нитро, азидо, метила, этила, гидрокси, метокси и карбокси;
цикл A, R1, R28, R29, R30, R31, R32 и m соответствуют таковым в соединении формулы (I).
В еще одном предпочтительном варианте осуществления изобретения, в соединении формулы (I), его стереоизомере, пролекарстве или фармацевтически приемлемой соли цикл А вместе с -(R1)m-, образуют следующие структуры:
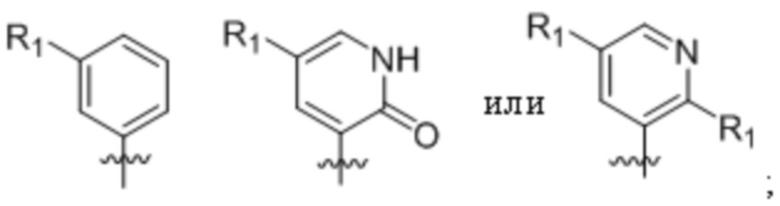
где каждый R1 независимо выбран из группы, состоящей из водорода, дейтерия, галогена, циано, C1-4 алкила, C3-6 циклоалкила, 3-6-членного гетероциклила и -O-R29, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, фтора, хлора, циано, метила, этила, изопропила, трифторметила, дифторметила, тридейтерометила, дидейтерометила, циклопропила, оксациклобутила, =O, метокси, карбокси, метоксикарбонила, ацетила, амино, диметиламино и ацетиламино;
каждый R28 независимо выбран из группы, состоящей из водорода, дейтерия, C1-4 алкила, C2-4 алкенила, C3-8 циклоалкила, 3-8-членного гетероциклила, C5-8 арила, 5-8-членного гетероарила и -NR31R32, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогена, гидрокси, =O, циано, C1-4 алкила, C1-4 алкокси, C3-8 циклоалкила, C3-8 циклоалкокси и 3-8-членного гетероциклила;
каждый R29 независимо выбран из группы, состоящей из водорода, дейтерия, C1-4 алкила, C2-4 алкенила, C3-8 циклоалкила, 3-8-членного гетероциклила, C5-8 арила и 5-8-членного гетероарила, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогена, гидрокси, =O, циано, C1-4 алкила, C1-4 алкокси, C3-8 циклоалкила, C3-8 циклоалкокси и 3-8-членного гетероциклила;
каждый R30 независимо выбран из группы, состоящей из водорода, дейтерия, гидрокси, C1-4 алкила, C1-4 алкокси, C2-4 алкенила, C2-4 алкинила, C3-8 циклоалкила, C3-8 циклоалкилокси, 3-8-членного гетероциклила, 3-8-членного гетероциклилокси, C5-8 арила, C5-8 арилокси, 5-8-членного гетероарила, 5-8-членного гетероарилокси и -NR31R32, вышеуказанные группы опционально замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из дейтерия, галогена, гидрокси, циано, C1-4 алкила, C1-4 алкокси, C3-8 циклоалкила, C3-8 циклоалкилокси, 3-8-членного гетероциклила, 3-8-членного гетероциклилокси, C5-8 арила, C5-8 арилокси, 5-8-членного гетероарила, 5-8-членного гетероарилокси и -NR31R32;
R31 и R32 каждый независимо выбраны из группы, состоящей из водорода, дейтерия, гидрокси, C1-4 алкила, C2-4 алкенила, C2-4 алкинила, C3-8 циклоалкила, 3-8-членного гетероциклила, амино, моноалкиламино и диалкиламино.
В наиболее предпочтительном варианте осуществления изобретения соединение формулы (I), его стереоизомер, пролекарство или фармацевтически приемлемая соль включает, помимо прочего, следующие соединения: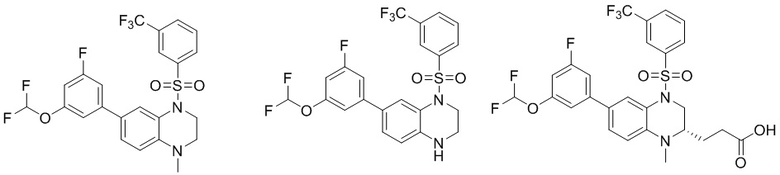
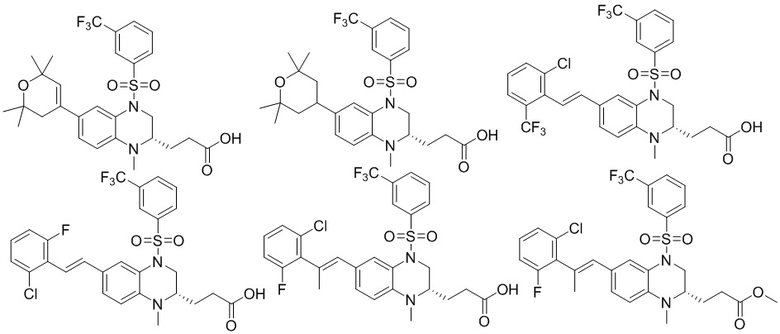
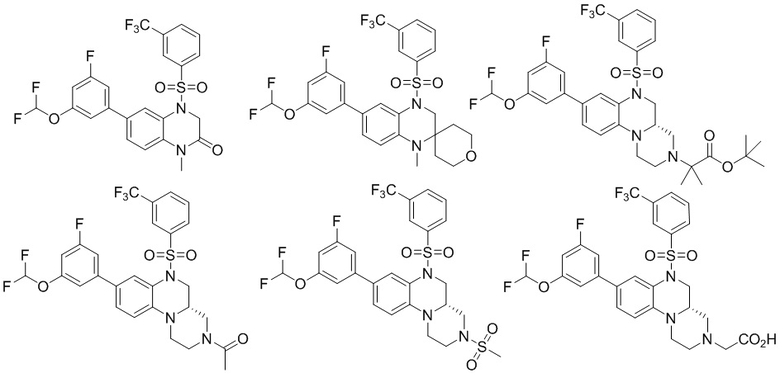
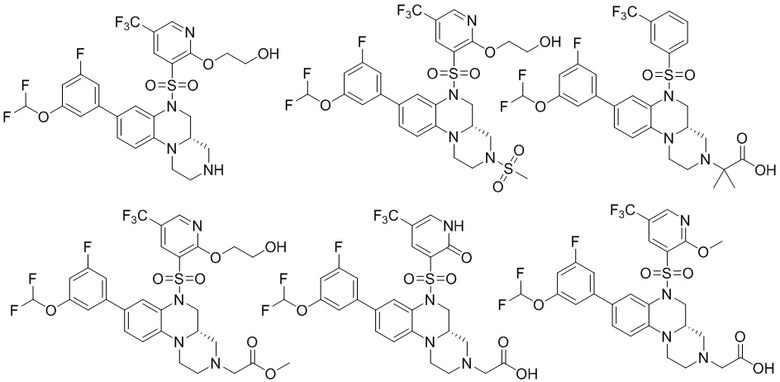
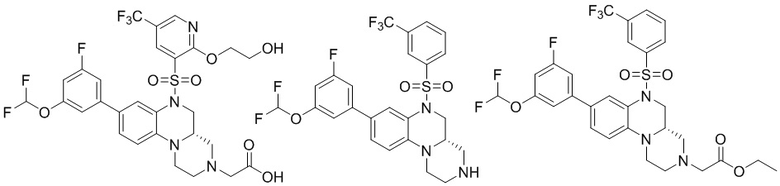
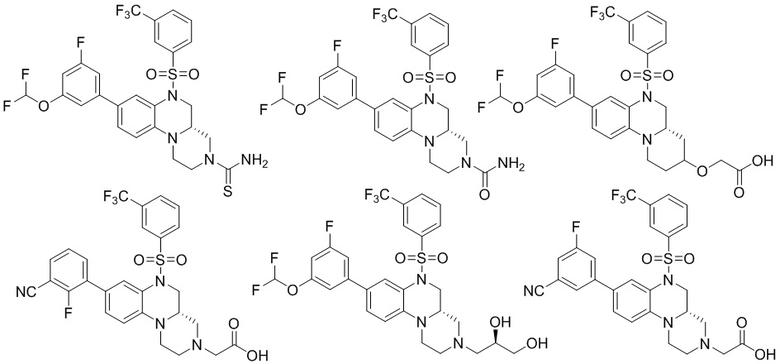
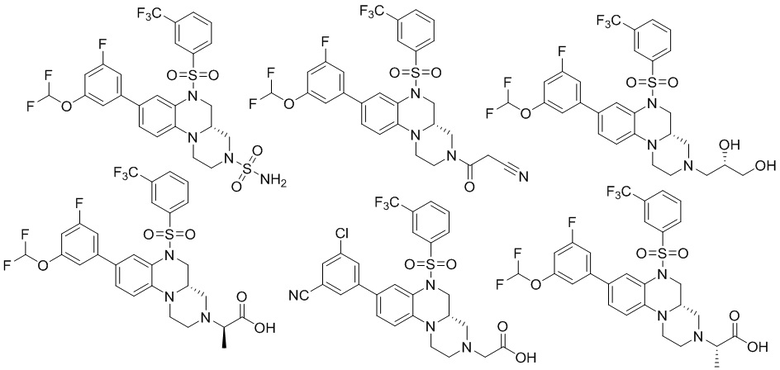
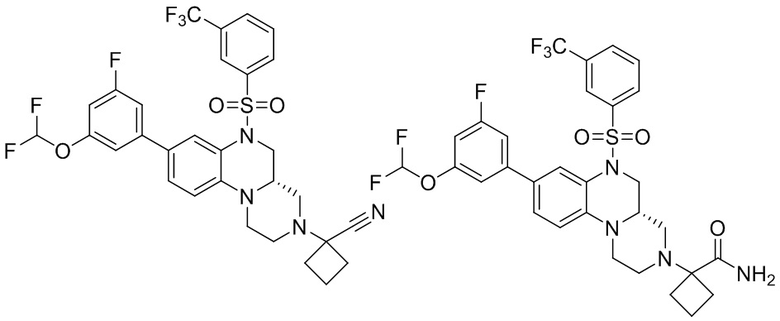
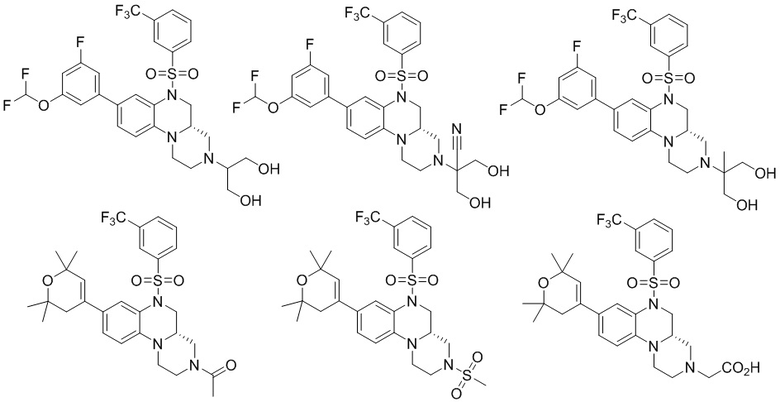
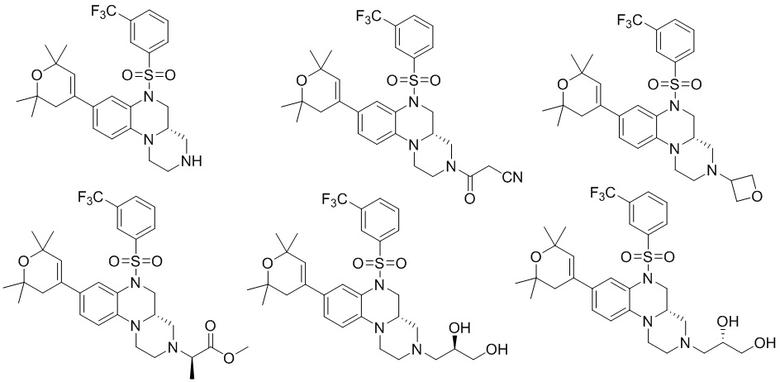
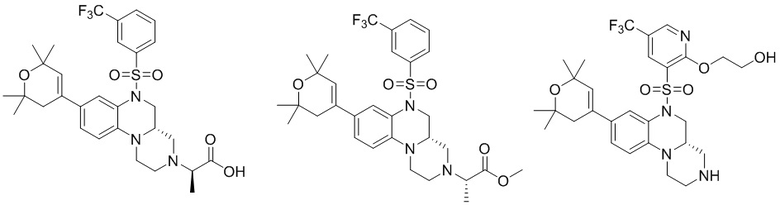
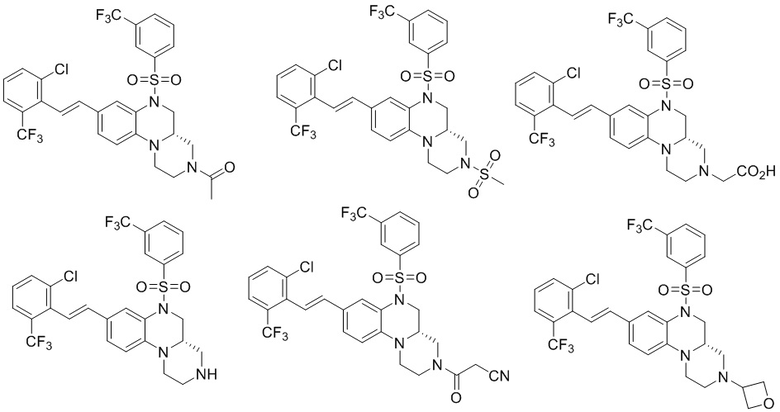
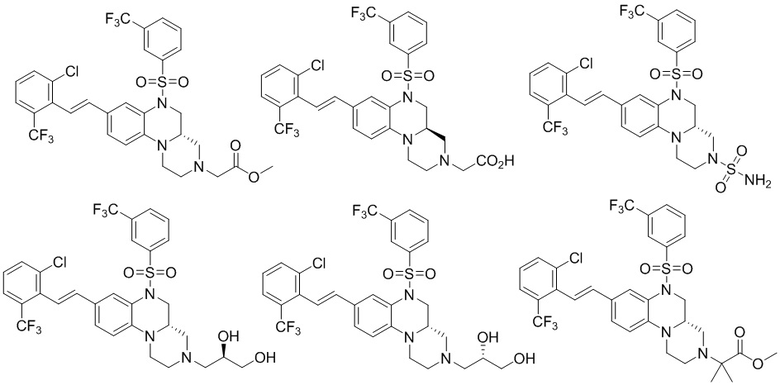
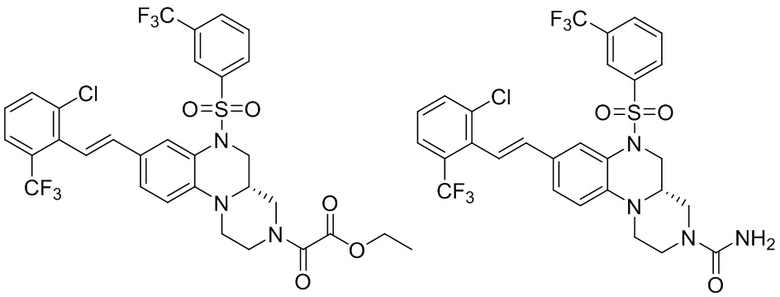
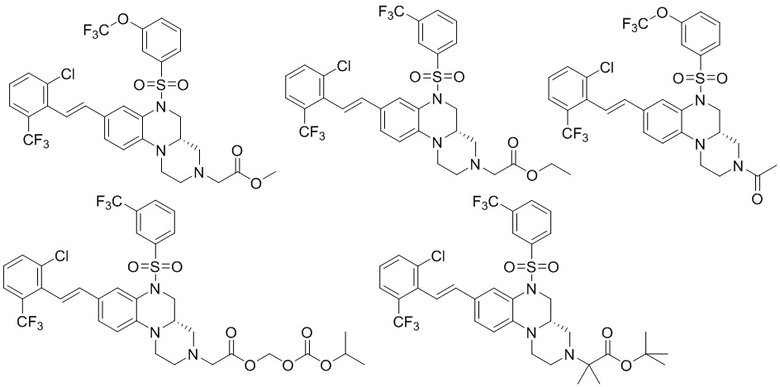
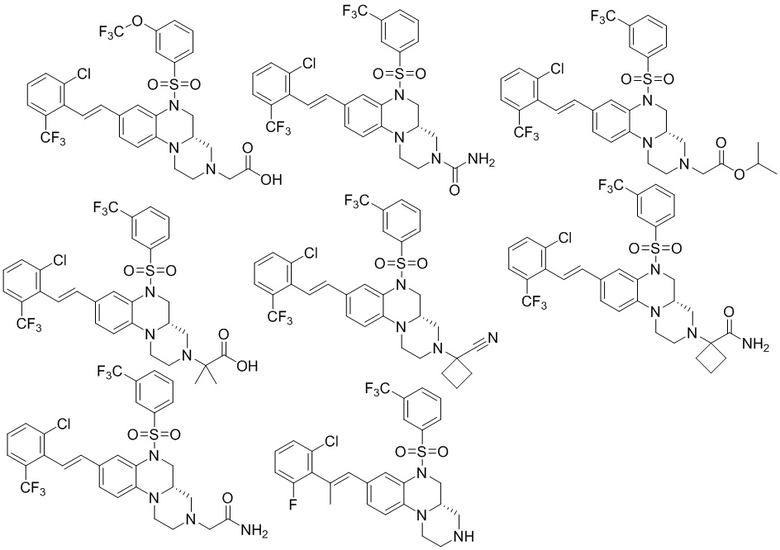
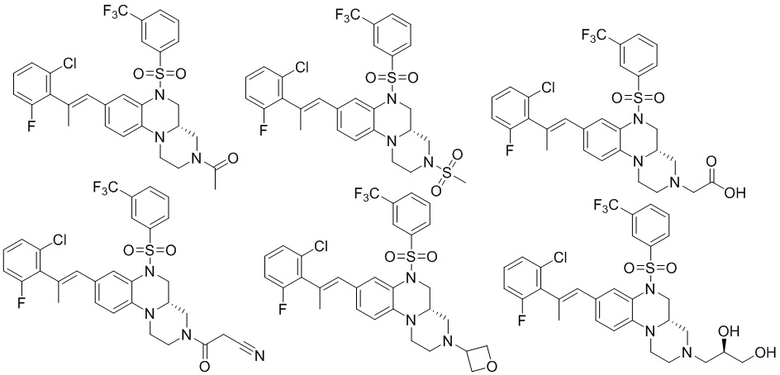
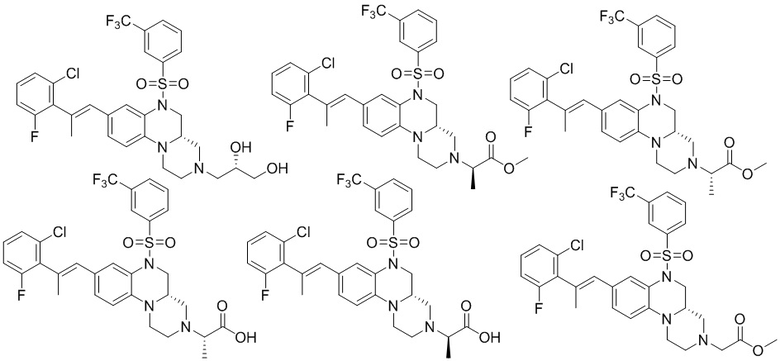
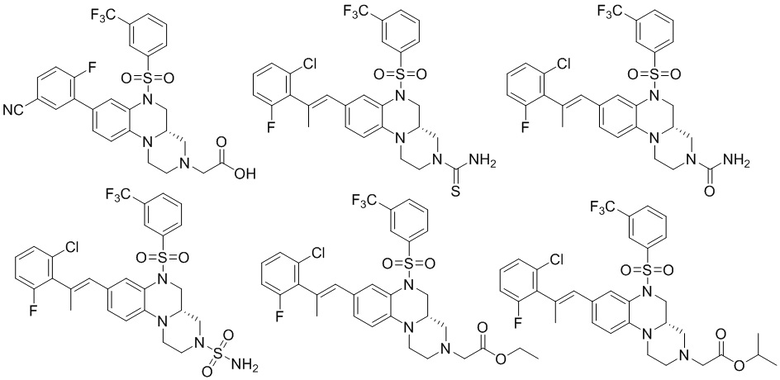
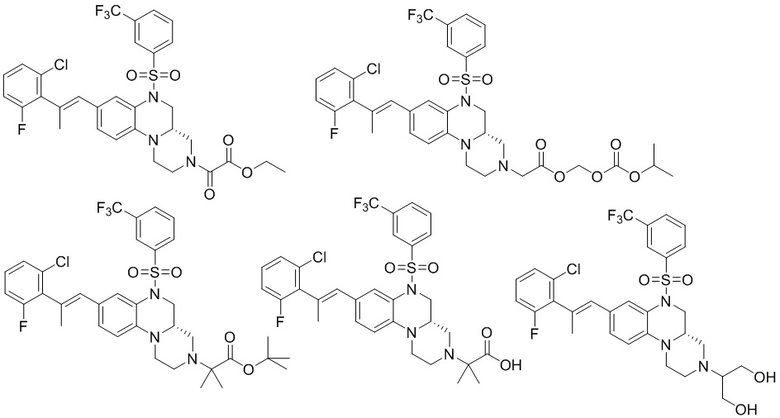
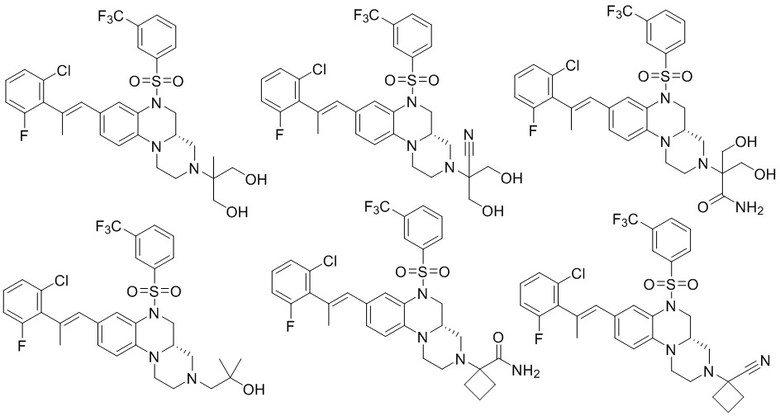
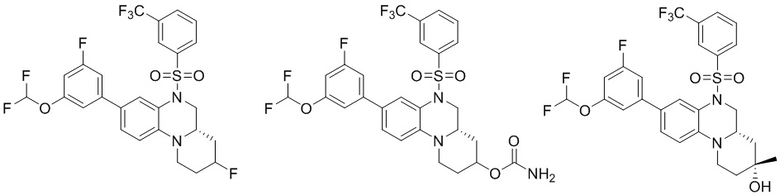
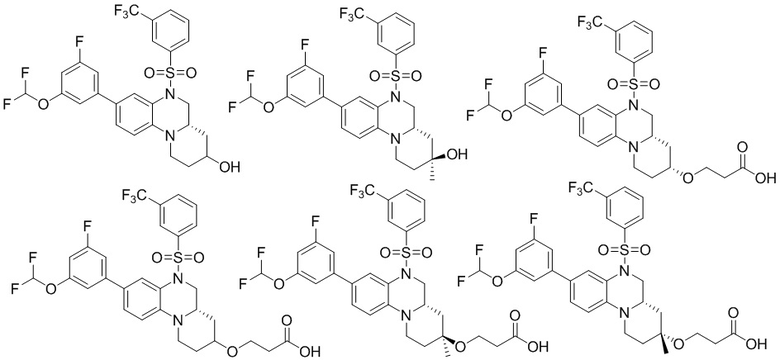
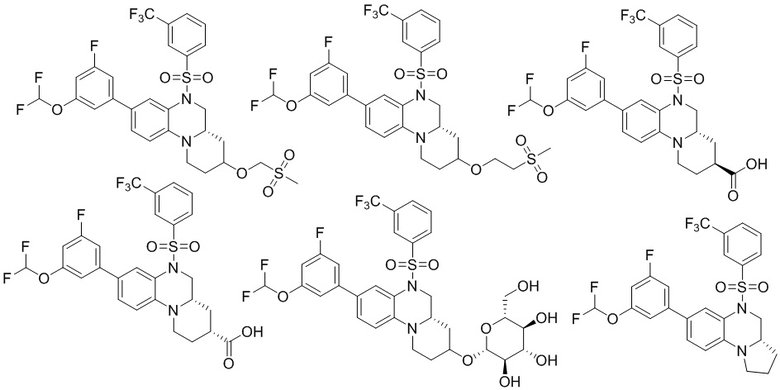
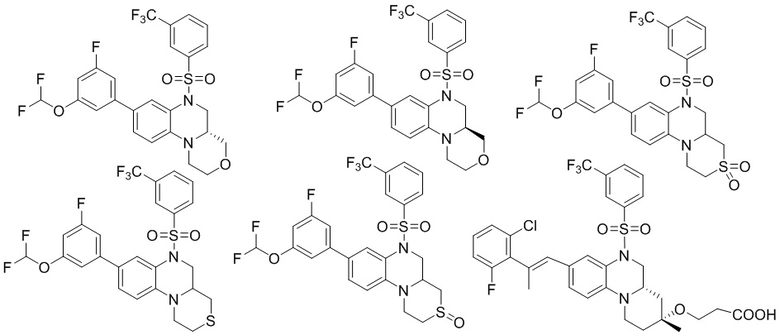
или 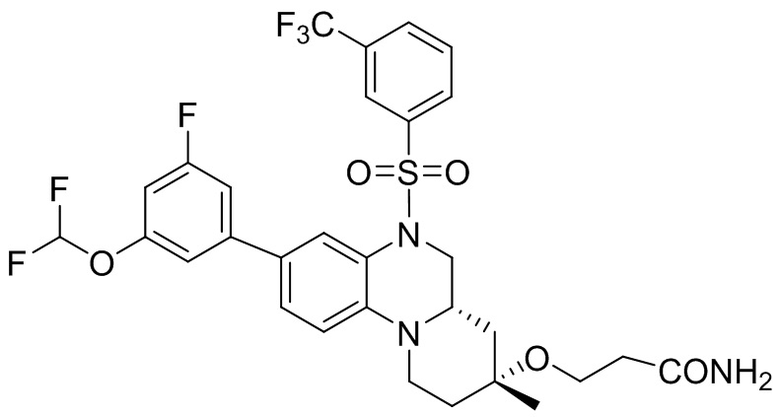 .
.
Вторым аспектом настоящего изобретения является метод получения вышеупомянутого соединения формулы (I), его стереоизомера, пролекарства или фармацевтически приемлемой соли, включающий следующие стадии:
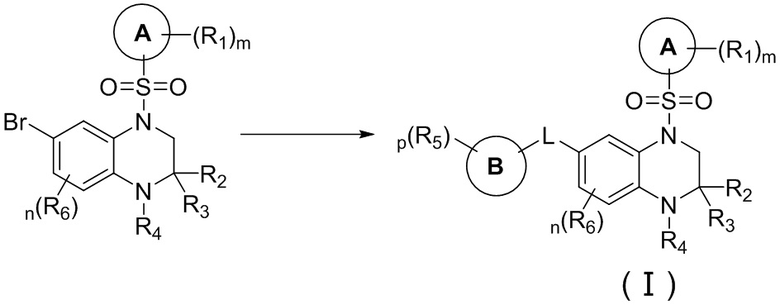 ;
;
или,
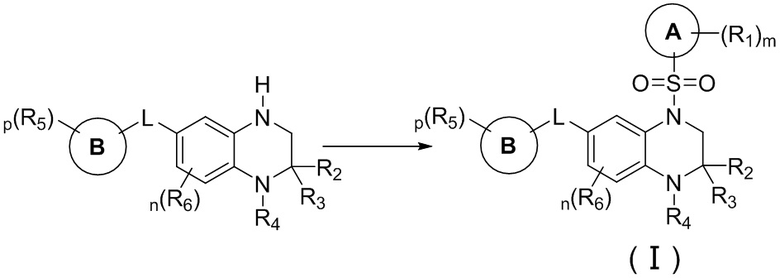 ;
;
опционально, соединение формулы (I) может быть получено по реакции последующего замещения в соответствии с определениями заместителей R2, R3 и R4;
где цикл A, цикл B, L, R1, R2, R3, R4, R5, R6, m, n и p соответствуют таковым в соединении формулы (I).
Третьим аспектом настоящего изобретения является фармацевтическая композиция, содержащая соединение формулы (I), его стереоизомер, пролекарство или фармацевтически приемлемую соль и фармацевтически приемлемый носитель.
Четвертым аспектом настоящего изобретения является применение вышеупомянутого соединения формулы (I), его стереоизомера, пролекарства или фармацевтически приемлемой соли для изготовления препаратов для лечения одного или нескольких видов опухолей, злокачественных новообразований, метаболических заболеваний и аутоиммунных заболеваний или нарушений.
В предпочтительном варианте осуществления изобретения, метаболическое заболевание и аутоиммунное заболевание или нарушение выбраны из группы, включающей в себя атопический дерматит, контактный дерматит, аллергический дерматит, комедон, акне, муковисцидоз, отторжение аллотрансплантата, рассеянный склероз, склеродермию, системную красную волчанку (СКВ), псориаз, хронический лимфоцитарный тиреоидит, артрит, ревматоидный артрит, псориатический артрит, ювенильный идиопатический артрит, ювенильный ревматоидный артрит, остеоартрит, анкилозирующий спондилит, псориатический артрит (ПсА), аутоиммунный диабет, сахарный диабет 1-го типа, сахарный диабет 2-го типа, ожирение, жировую дегенерацию печени, воспаление, связанное с жировой тканью, панкреатит, тиреоидит, аутоиммунное заболевание щитовидной железы, билиарный цирроз печени, фиброз печени, неалкогольную жировую болезнь печени (НЖБП), язвенный колит, болезнь Крона, регионарный энтерит, воспалительное заболевание кишечника (ВЗК), синдром воспаленного кишечника (СВК), синдром Стивенса-Джонсона (ССД), первичный склерозирующий холангит, аутоиммунный полиэндокринный синдром 1-го типа, аутоиммунный полиэндокринный синдром 2-го типа, целиакию, неврит, системный склероз, эндометриоз, синдром Бехчета, миокардит, дерматомиозит, полимиозит, реакцию «трансплантат против хозяина», саркоидоз, инфаркт миокарда, легочную гипертензию, кожный лейшманиоз, болезнь Крона, аутоиммунное заболевание глаз, неврит зрительного нерва, нейромиелит зрительного нерва, ксерофтальмию, увеит, инсулинорезистентность, миастению гравис, возрастную макулодистрофию, синдром Гийена-Барре, гломерулонефрит, склерит, большое депрессивное расстройство, сезонное аффективное расстройство, посттравматическое стрессовое расстройство (ПТСР), биполярное расстройство, аутизм, эпилепсию, болезнь Альцгеймера, бронхиальную астму, хроническую обструктивную болезнь легких (ХОБЛ), бронхит, сенную лихорадку, аллергический ринит, стероидрезистентную бронхиальную астму, токсический диффузный зоб, синдром обструктивного апноэ во сне (СОАС), полипы носовых пазух и нарушение со стороны нервной системы, связанное с изменениями сна и/или циркадного ритма.
В предпочтительном варианте осуществления изобретения, опухоль или злокачественное новообразование выбраны из группы, включающей в себя опухоли маточных труб, опухоли яичников, опухоли брюшины, меланому 4-й стадии, солидные опухоли, глиому, глиобластому, папиллярную карциному почек, опухоли головы и шеи, лимфому, миелому, неходжкинскую лимфому, диффузную В-клеточную крупноклеточную лимфому, фолликулярную лимфому, синовиальную саркому, гепатоцеллюлярную карциному, рак молочной железы, рак матки, рак толстой кишки, рак легких, рак желудка, рак прямой кишки, рак поджелудочной железы, рак головного мозга, рак кожи, рак полости рта, рак простаты, рак костей, рак почек, рак яичников, рак мочевого пузыря, рак печени, лейкоз и немелкоклеточный рак легкого.
Пятым аспектом настоящего изобретения является применение вышеупомянутого соединения формулы (I), его стереоизомера, пролекарства или фармацевтически приемлемой соли в качестве препаратов для лечения одного или нескольких видов опухолей, злокачественных новообразований, метаболических заболеваний, аутоиммунных заболеваний или нарушений.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
После проведения всесторонних и углубленных исследований авторы настоящего изобретения впервые разработали производное 1,2,3,4-тетрагидрохиноксалина со структурой, описываемой формулой (I), а также способ его получения и его применение. Соединение по настоящему изобретению обладает выраженной способностью подавлять активность киназы RORγt, может найти широкое применение для изготовления лекарственных препаратов и, как ожидается, послужит основой для разработки агонистов RORγt нового поколения. Настоящее изобретение осуществлено на этой основе.
Подробное описание: если не указано иное, следующие термины, используемые в описании и формуле изобретения, имеют следующие значения.
«Алкил» относится к линейным или разветвленным насыщенным алифатическим алкильным группам, например «C1-8 алкил» относится к линейному алкилу или разветвленному алкилу, содержащему от 1 до 8 атомов углерода, который включает, помимо прочего, метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, втор-бутил, н-пентил, 1,1-диметилпропил, 1,2-диметилпропил, 2,2-диметилпропил, 1-этилпропил, 2-метилбутил, 3-метилбутил, н-гексил, 1-этил-2-метилпропил, 1,1,2-триметилпропил, 1,1-диметилбутил, 1,2-диметилбутил, 2,2-диметилбутил, 1,3-диметилбутил, 2-этилбутил, 2-метилпентил, 3-метилпентил, 4-метилпентил, 2,3-диметилбутил, н-гептил, 2-метилгексил, 3-метилгексил, 4-метилгексил, 5-метилгексил, 2,3-диметилпентил, 2,4- диметилпентил, 2,2-диметилпентил, 3,3-диметилпентил, 2-этилпентил, 3-этилпентил, н-октил, 2,3-диметилгексил, 2,4-диметилгексил, 2,5-диметилгексил, 2,2-диметилгексил, 3,3-диметилгексил, 4,4-диметилгексил, 2-этилгексил, 3-этилгексил, 4-этилгексил, 2-метил-2-этилпентил, 2-метил-3-этилпентил или их различные разветвленные изомеры и т.д.
Алкил может быть опционально замещенным или незамещенным, и когда он замещен, то заместителем предпочтительно является одна или несколько (предпочтительно 1, 2, 3 или 4) групп, независимо выбранных из группы, состоящей из дейтерия, галогена, циано, нитро, азидо, C1-10 алкила, C1-10 галогеналкила, C1-10 дейтероалкила, C2-10 алкенила, C2-10 алкинила, C3-10 циклоалкила, 3-10-членного гетероциклила, C5-10 арила, 5-10-членного гетероарила, =O, -C0-8-S(O)rR28, -C0-8-O-R29, -C0-8-C(O)OR29, -C0-8-C(O)R30, -C0-8-O-C(O)R30, -C0-8-NR31R32, -C0-8-C(O)NR31R32 и -C0-8-N(R31)-C(O)R30.
«Циклоалкил» относится к моноциклическим или полициклическим углеводородным заместителям, которые являются насыщенными или частично ненасыщенными, например, «C3-10 циклоалкил» относится к циклоалкилу, содержащему от 3 до 10 атомов углерода, который может быть моноциклическим циклоалкилом и полициклическим циклоалкилом, где
моноциклический циклоалкил включает, помимо прочего, циклопропил, циклобутил, циклопентил, циклопентенил, циклогексил, циклогексенил, циклогексадиенил, циклогептил, циклогептатриенил, циклооктил и т.д.;
полициклический циклоалкил включает спироциклоалкил, конденсированный циклоалкил и мостиковый циклоалкил. «Спироциклоалкил» относится к полициклической группе, в которой атом углерода (называемый спироатомом) является общим для моноциклических колец, причем эти кольца могут содержать одну или несколько (предпочтительно 1, 2 или 3) двойных связей, но ни у одной из них нет полностью сопряженной π-электронной системы. В соответствии с числом спироатомов, общих для колец, спироциклоалкил может быть моноспироциклоалкилом, биспироциклоалкилом или полиспироциклоалкилом, включая, помимо прочего:
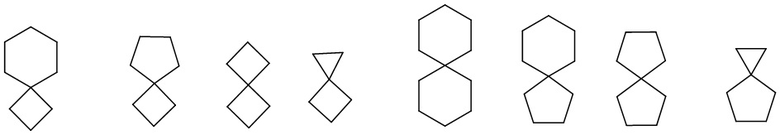 .
.
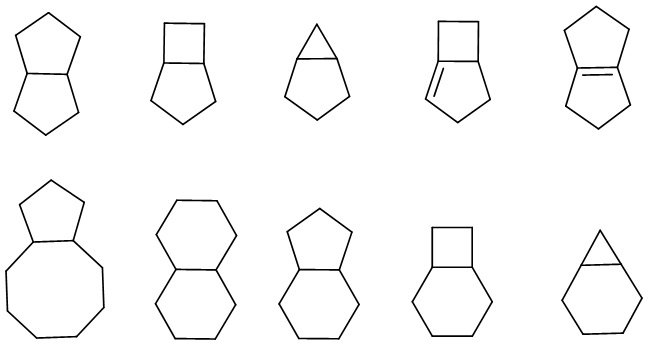
«Конденсированный циклоалкил» относится к полностью углеродной полициклической группе, в которой каждое цикл имеет два общих соседних атома углерода с другими кольцами в системе, причем одно или несколько (предпочтительно 1 или 2) колец могут содержать одну или несколько (предпочтительно 1, 2 или 3) двойных связей, но ни у одной из них нет полностью сопряженной π-электронной системы. В зависимости от количества образованных колец конденсированный циклоакил может быть бициклическим, трициклическим, тетрациклическим или полициклическим, включая, помимо прочего:
 .
.
«Мостиковый циклоалкил» относится к полностью углеродной полициклической группе, в которой любые два кольца имеют два атома углерода, которые не связаны непосредственно друг с другом, причем эти кольца могут содержать одну или несколько (предпочтительно 1, 2 или 3) двойных связей, но ни у одной из них нет полностью сопряженной π-электронной системы. В зависимости от количества образованных колец мостиковый циклоалкил может быть бициклическим, трициклическим, тетрациклическим или полициклическим, включая, помимо прочего:
 .
.
Циклоалкильное цикл может быть конденсировано с арильным, гетероарильным или гетероциклоалкильным кольцом, где цикл, присоединенное к исходной структуре, представляет собой циклоалкил, который включает, помимо прочего, инданил, тетрагидронафтил, бензоциклогептил и т.д.
Циклоалкил может быть опционально замещенным или незамещенным, и когда он замещен, то заместителем предпочтительно является одна или несколько (предпочтительно 1, 2, 3 или 4) групп, независимо выбранных из группы, состоящей из дейтерия, галогена, циано, нитро, азидо, C1-10 алкила, C1-10 галогеналкила, C1-10 дейтероалкила, C2-10 алкенила, C2-10 алкинила, C3-10 циклоалкила, 3-10-членного гетероциклила, C5-10 арила, 5-10-членного гетероарила, =O, -C0-8-S(O)rR28, -C0-8-O-R29, -C0-8-C(O)OR29, -C0-8-C(O)R30, -C0-8-O-C(O)R30, -C0-8-NR31R32, -C0-8-C(O)NR31R32 и -C0-8-N(R31)-C(O)R30.
«Гетероциклил» относится к моноциклическому или полициклическому углеводородному заместителю, который является насыщенным или частично ненасыщенным, где один или несколько (предпочтительно 1, 2, 3 или 4) атомов кольца представляют собой гетероатомы, выбранные из азота, кислорода или S(O)r (где r представляет собой целое число 0, 1 или 2), исключая части кольца -O-O-, -O-S- или -S-S-, а остальные атомы кольца являются атомами углерода. Например, «5-10-членный гетероциклил» относится к циклической группе, содержащей от 5 до 10 атомов кольца, а «3-10-членный гетероциклил» относится к циклической группе, содержащей от 3 до 10 атомов кольца.
Моноциклический гетероциклил включает, помимо прочего, пирролидинил, пиперидинил, пиперазинил, морфолинил, тиоморфолинил, гомопиперазинил и т.д.
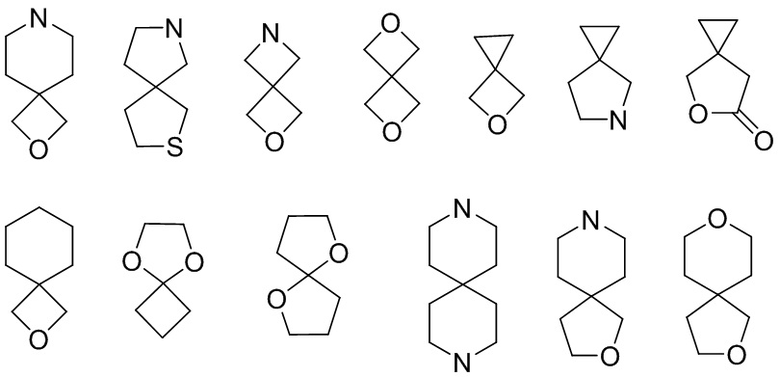
Полициклический гетероциклил включает спирогетероциклил, конденсированный гетероциклил и мостиковый гетероциклил. «Спирогетероциклил» относится к полициклической гетероциклильной группе, в которой атом (называемый спироатом) является общим для моноциклических колец, где один или несколько кольцевых атомов представляют собой гетероатомы, выбранные из азота, кислорода или S(O)r (где r представляет собой целое число 0, 1 или 2), а остальные атомы кольца являются атомами углерода. Эти кольца могут содержать одну или несколько (предпочтительно 1, 2, 3 или 4) двойных связей, но ни у одной из них нет полностью сопряженной π-электронной системы. В соответствии с количеством спироатомов, общих для колец, спирогетероциклил может быть моноспирогетероциклилом, биспирогетероциклилом или полиспирогетероциклилом. Спирогетероциклил включает, помимо прочего:
 .
.
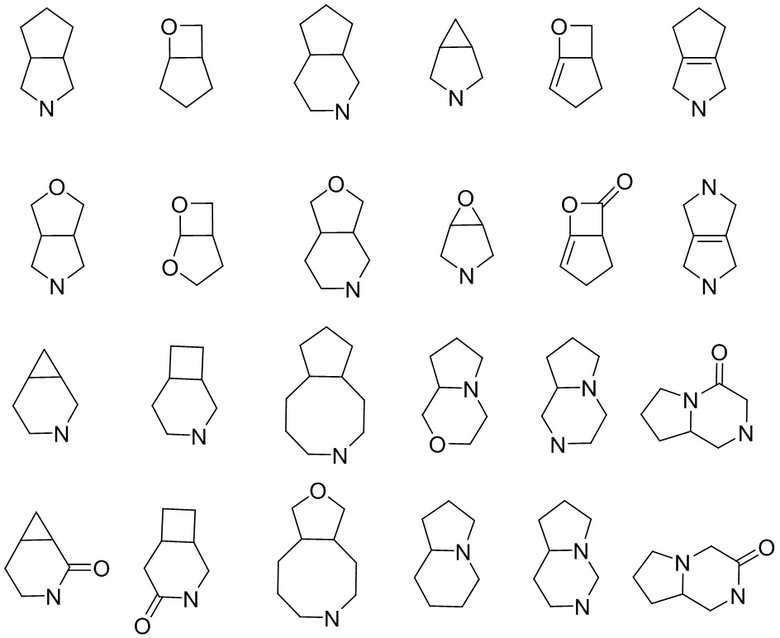
«Конденсированный гетероциклил» относится к полициклическому гетероциклилу, в котором каждое цикл имеет два общих соседних атома с другими кольцами в системе, причем одно или несколько (предпочтительно 1 или 2) колец могут содержать одну или несколько (предпочтительно 1, 2 или 3) двойных связей, но ни у одного из них нет полностью сопряженной π-электронной системы, в которой один или несколько (предпочтительно 1, 2, 3 или 4) атомов кольца представляют собой гетероатомы, выбранные из азота, кислорода или S(O)r (где r представляет собой целое число 0, 1 или 2), а остальные атомы кольца представляют собой атомы углерода. В зависимости от количества образованных колец конденсированный гетероциклил может быть бициклическим, трициклическим, тетрациклическим или полициклическим, включая, помимо прочего:
 .
.
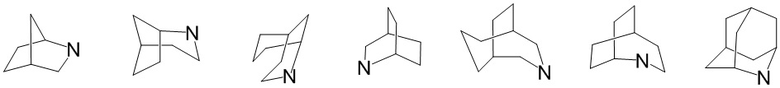
«Мостиковый гетероциклил» относится к полициклическому гетероциклилу, в котором любые два кольца имеют два атома углерода, которые не связаны непосредственно друг с другом, причем эти кольца могут содержать одну или несколько (предпочтительно 1, 2 или 3) двойных связей, но ни у одной из них нет полностью сопряженной π-электронной системы, где один или несколько (предпочтительно 1, 2, 3 или 4) атомов кольца представляют собой гетероатомы, выбранные из азота, кислорода или S(O)r (где r представляет собой целое число 0, 1 или 2), а остальные атомы кольца представляют собой атомы углерода. В зависимости от количества образованных колец связанный гетероциклил может быть бициклическим, трициклическим, тетрациклическим или полициклическим, включая, помимо прочего:
 .
.
Гетероциклильное цикл может быть конденсировано с арильным, гетероарильным или циклоалкильным кольцом, где цикл, присоединенное к исходной структуре, представляет собой гетероциклила, включая, помимо прочего:
 .
.
Гетероциклил может быть опционально замещенным или незамещенным, и когда он замещен, то заместителем предпочтительно является одна или несколько (предпочтительно 1, 2, 3 или 4) групп, независимо выбранных из группы, состоящей из дейтерия, галогена, циано, нитро, азидо, C1-10 алкила, C1-10 галогеналкила, C1-10 дейтероалкила, C2-10 алкенила, C2-10 алкинила, C3-10 циклоалкила, 3-10-членного гетероциклила, C5-10 арила, 5-10-членного гетероарила, =O, -C0-8-S(O)rR28, -C0-8-O-R29, -C0-8-C(O)OR29, -C0-8-C(O)R30, -C0-8-O-C(O)R30, -C0-8-NR31R32, -C0-8-C(O)NR31R32 и -C0-8-N(R31)-C(O)R30.
«Арил» относится к полностью углеродной моноциклической или конденсированной полициклической группе (т.е. кольца, имеющие два общих соседних атома углерода) и полициклическую группу, имеющую сопряженную π-электронную систему (то есть кольца с двумя соседними атомами углерода), например, «C5-10 арил» относится к полностью углеродному арилу, содержащему от 5 до 10 атомов углерода, и «5-10-членный арил» относится к полностью углеродному арилу, содержащему от 5 до 10 атомов углерода, включая, помимо прочего, фенил и нафтил. Арильный цикл может быть конденсирован с гетероарильным, гетероциклильным или циклоалкильным кольцом, где цикл, присоединенный к исходной структуре, представляет собой арильный цикл, включая, помимо прочего:
 .
.
Арил может быть замещенным или незамещенным, и когда он замещен, то заместителем предпочтительно является одна или несколько (предпочтительно 1, 2, 3 или 4) групп, независимо выбранных из группы, состоящей из дейтерия, галогена, циано, нитро, азидо, C1-10 алкила, C1-10 галогеналкила, C1-10 дейтероалкила, C2-10 алкенила, C2-10 алкинила, C3-10 циклоалкила, 3-10-членного гетероциклила, C5-10 арила, 5-10-членного гетероарила, =O, -C0-8-S(O)rR28, -C0-8-O-R29, -C0-8-C(O)OR29, -C0-8-C(O)R30, -C0-8-O-C(O)R30, -C0-8-NR31R32, -C0-8-C(O)NR31R32 и -C0-8-N(R31)-C(O)R30.
«Гетероарил» относится к гетероароматической системе, содержащей от 1 до 4 гетероатомов, и гетероатомы включают гетероатомы, выбранные из азота, кислорода или S(O)r (где r представляет собой целое число 0, 1 или 2), например, 5-8-членный гетероарил относится к гетероароматической системе, содержащей от 5 до 8 атомов кольца, а 5-10-членный гетероарил относится к гетероароматической системе, содержащей от 5 до 10 атомов кольца, включая, помимо прочего, фурил, тиофенил, пиридил, пирролил, N-алкилпирролил, пиримидинил, пиразинил, имидазолил, тетразолил и т.д. Гетероарильное цикл может быть конденсировано с арильным, гетероциклильным или циклоалкильным кольцом, где цикл, присоединенное к исходной структуре, представляет собой гетероарильное цикл, включая, помимо прочего:
 .
.
Гетероарил может быть опционально замещенным или незамещенным, и когда он замещен, то заместителем предпочтительно является одна или несколько групп, независимо выбранных из группы, состоящей из дейтерия, галогена, циано, нитро, азидо, C1-10 алкила, C1-10 галогеналкила, C1-10 дейтероалкила, C2-10 алкенила, C2-10 алкинила, C3-10 циклоалкила, 3-10-членного гетероциклила, C5-10 арила, 5-10-членного гетероарила, =O, -C0-8-S(O)rR28, -C0-8-O-R29, -C0-8-C(O)OR29, -C0-8-C(O)R30, -C0-8-O-C(O)R30, -C0-8-NR31R32, -C0-8-C(O)NR31R32 и -C0-8-N(R31)-C(O)R30.
«Алкенил» относится к алкилу, определенному выше, содержащему не менее двух атомов углерода и не менее одной двойной связи углерод-углерод, например, «C2-8 алкенил» относится к линейному или разветвленному алкенилу, содержащему от 2 до 8 атомов углерода. Алкенил включает, помимо прочего, винил, 1-пропенил, 2-пропенил, 1-, 2- или 3-бутенил и т.д.
Алкенил может быть замещенным или незамещенным, и когда он замещен, то заместителем предпочтительно является одна или несколько (предпочтительно 1, 2, 3 или 4) групп, независимо выбранных из группы, состоящей из дейтерия, галогена, циано, нитро, азидо, C1-10 алкила, C1-10 галогеналкила, C1-10 дейтероалкила, C2-10 алкенила, C2-10 алкинила, C3-10 циклоалкила, 3-10-членного гетероциклила, C5-10 арила, 5-10-членного гетероарила, =O, -C0-8-S(O)rR28, -C0-8-O-R29, -C0-8-C(O)OR29, -C0-8-C(O)R30, -C0-8-O-C(O)R30, -C0-8-NR31R32, -C0-8-C(O)NR31R32 и -C0-8-N(R31)-C(O)R30.
«Алкинил» относится к алкилу, определенному выше, содержащему не менее двух атомов углерода и не менее одной тройной связи углерод-углерод, например «C2-8 алкинил» относится к линейному или разветвленному алкинилу, содержащему от 2 до 8 атомов углерода. Алкинил включает, помимо прочего, этинил, 1-пропинил, 2-пропинил, 1-, 2-или 3-бутинил и т. д.
Алкинил может быть замещенным или незамещенным, и когда он замещен, то заместителем предпочтительно является одна или несколько (предпочтительно 1, 2, 3 или 4) групп, независимо выбранных из группы, состоящей из дейтерия, галогена, циано, нитро, азидо, C1-10 алкила, C1-10 галогеналкила, C1-10 дейтероалкила, C2-10 алкенила, C2-10 алкинила, C3-10 циклоалкила, 3-10-членного гетероциклила, C5-10 арила, 5-10-членного гетероарила, =O, -C0-8-S(O)rR28, -C0-8-O-R29, -C0-8-C(O)OR29, -C0-8-C(O)R30, -C0-8-O-C(O)R30, -C0-8-NR31R32, -C0-8-C(O)NR31R32 и -C0-8-N(R31)-C(O)R30.
«Алкокси» относится к -O-(алкилу), где алкил соответствует вышеприведенному определению, например «C1-8 алкокси» относится к алкоксирадикалу, содержащему от 1 до 8 атомов углерода, включая, помимо прочего, метокси-, этокси-, пропокси-, бутоксирадикал и т.д.
Алкокси может быть опционально замещенным или незамещенным, и когда он замещен, то заместителем предпочтительно является одна или несколько (предпочтительно 1, 2, 3 или 4) групп, независимо выбранных из группы, состоящей из дейтерия, галогена, циано, нитро, азидо, C1-10 алкила, C1-10 галогеналкила, C1-10 дейтероалкила, C2-10 алкенила, C2-10 алкинила, C3-10 циклоалкила, 3-10-членного гетероциклила, C5-10 арила, 5-10-членного гетероарила, =O, -C0-8-S(O)rR28, -C0-8-O-R29, -C0-8-C(O)OR29, -C0-8-C(O)R30, -C0-8-O-C(O)R30, -C0-8-NR31R32, -C0-8-C(O)NR31R32 и -C0-8-N(R31)-C(O)R30.
«Циклоалкилокси» относится к -O-(незамещенному циклоалкилу), где циклоалкил соответствует вышеприведенному определению, например «С3-10 циклоалкилокси» относится к циклоалкилоксирадикалу, содержащему от 3 до 10 атомов углерода, включая, помимо прочего, циклопропилокси-, циклобутилокси-, циклопентилокси-, циклогексилоксирадикал и т.д.
Циклоалкилокси может быть замещенным или незамещенным, и когда он замещен, то заместителем предпочтительно является одна или несколько (предпочтительно 1, 2, 3 или 4) групп, независимо выбранных из группы, состоящей из дейтерия, галогена, циано, нитро, азидо, C1-10 алкила, C1-10 галогеналкила, C1-10 дейтероалкила, C2-10 алкенила, C2-10 алкинила, C3-10 циклоалкила, 3-10-членного гетероциклила, C5-10 арила, 5-10-членного гетероарила, =O, -C0-8-S(O)rR28, -C0-8-O-R29, -C0-8-C(O)OR29, -C0-8-C(O)R30, -C0-8-O-C(O)R30, -C0-8-NR31R32, -C0-8-C(O)NR31R32 и -C0-8-N(R31)-C(O)R30.
«3-10-членный гетероциклилокси» относится к -O-(незамещенному 3-10-членному гетероциклилу), где 3-10-членный гетероциклил соответствует вышеприведенному определению. 3-10-членный гетероциклилокси может быть опционально замещенным или незамещенным, и когда он замещен, то заместителем предпочтительно является одна или несколько (предпочтительно 1, 2, 3 или 4) групп, независимо выбранных из группы, состоящей из дейтерия, галогена, циано, нитро, азидо, C1-10 алкила, C1-10 галогеналкила, C1-10 дейтероалкила, C2-10 алкенила, C2-10 алкинила, C3-10 циклоалкила, 3-10-членного гетероциклила, C5-10 арила, 5-10-членного гетероарила, =O, -C0-8-S(O)rR28, -C0-8-O-R29, -C0-8-C(O)OR29, -C0-8-C(O)R30, -C0-8-O-C(O)R30, -C0-8-NR31R32, -C0-8-C(O)NR31R32 и -C0-8-N(R31)-C(O)R30.
«C5-10 арилокси» относится к -O-(незамещенному C5-10 арилу), где C5-10 арил соответствует вышеприведенному определению. C5-10 арилокси может быть опционально замещенным или незамещенным, и когда он замещен, то заместителем предпочтительно является одна или несколько групп, независимо выбранных из группы, состоящей из дейтерия, галогена, циано, нитро, азидо, C1-10 алкила, C1-10 галогеналкила, C1-10 дейтероалкила, C2-10 алкенила, C2-10 алкинила, C3-10 циклоалкила, 3-10-членного гетероциклила, C5-10 арила, 5-10-членного гетероарила, =O, -C0-8-S(O)rR28, -C0-8-O-R29, -C0-8-C(O)OR29, -C0-8-C(O)R30, -C0-8-O-C(O)R30, -C0-8-NR31R32, -C0-8-C(O)NR31R32 и -C0-8-N(R31)-C(O)R30.
«5-10-членный гетероарилокси» относится к -O-(незамещенному 5-10-членному гетероарилу), где 5-10-членный гетероарил соответствует вышеприведенному определению. 5-10-членный гетероарилокси может быть замещенным или незамещенным, и когда он замещен, то заместителем предпочтительно является одна или несколько (предпочтительно 1, 2, 3 или 4) групп, независимо выбранных из группы, состоящей из дейтерия, галогена, циано, нитро, азидо, C1-10 алкила, C1-10 галогеналкила, C1-10 дейтероалкила, C2-10 алкенила, C2-10 алкинила, C3-10 циклоалкила, 3-10-членного гетероциклила, C5-10 арила, 5-10-членного гетероарила, =O, -C0-8-S(O)rR28, -C0-8-O-R29, -C0-8-C(O)OR29, -C0-8-C(O)R30, -C0-8-O-C(O)R30, -C0-8-NR31R32, -C0-8-C(O)NR31R32 и -C0-8-N(R31)-C(O)R30.
«C1-8 алканоил» относится к одновалентной атомной группе, которая получается после удаления гидроксигруппы из C1-8 алкильной кислоты, и также обычно обозначается как «C0-7-C(O)-», например «C1-C(O)-» относится к ацетилу; «C2-C(O)-» «относится к пропионилу; и «C3-C(O)-» относится к бутирилу или изобутирилу.
«-C0-8-S(O)rR28» означает, что атом серы в -S(O)rR28 присоединен к C0-8 алкилу, где C0 алкила относится к связи, а C1-8 алкила соответствует вышеприведенному определению.
«-C0-8-O-R29» означает, что атом кислорода в -OR29 присоединен к C0-8 алкилу, где C0 алкила относится к связи, а C1-8 алкила соответствует вышеприведенному определению.
«-C0-8-C(O)OR29» означает, что карбонильная группа в -C(O)OR29 присоединена к C0-8 алкилу, где C0 алкил относится к связи, а C1-8 алкил соответствует вышеприведенному определению.
«-C0-8-C(O)OR30» означает, что карбонильная группа в -C(O)R30 присоединена к C0-8 алкилу, где C0 алкил относится к связи, а C1-8 алкил соответствует вышеприведенному определению.
«-C0-8-O-C(O)R30» означает, что атом кислорода в -O-C(O)R30 присоединен к C0-8 алкилу, где C0 алкила относится к связи, а C1-8 алкила соответствует вышеприведенному определению.
«-C0-8-NR31R32» означает, что атом азота в -NR31R32 присоединен к C0-8 алкилу, где C0 алкила относится к связи, а C1-8 алкила соответствует вышеприведенному определению.
«-C0-8-C(O)NR31R32» означает, что карбонильная группа в -C(O)NR31R32 присоединена к C0-8 алкилу, где C0 алкил относится к связи, а C1-8 алкил соответствует вышеприведенному определению.
«-C0-8-N(R31)-C(O)R30» означает, что атом азота в -N(R31)-C(O)R30 присоединен к C0-8 алкилу, где C0 алкил относится к связи, а C1-8 алкил соответствует вышеприведенному определению.
«C1-8 галогеналкил» относится к алкилу, содержащему от 1 до 8 атомов углерода, в котором алкильные атомы водорода опционально замещены атомом фтора, хлора, брома или йода, включая, помимо прочего, дифторметил, дихлорметил, дибромметил, трифторметил, трихлорметил, трибромметил и т.д.
«C1-8 галогеналкокси» относится к алкоксирадикалу, содержащему от 1 до 8 атомов углерода, в котором алкильные атомы водорода опционально замещены атомом фтора, хлора, брома или йода, включая, помимо прочего, дифторметокси-, дихлорметокси-, дибромметокси-, трифторметокси-, трихлорметокси-, трибромометоксирадикал и т.д.
«Галоген» относится к фтору, хлору, брому или йоду. «ДХМ» относится к дихлорметану. «ПЭ» относится к петролейному эфиру. «ЭА/ЭтАц» относится к этилацетату. «ТГФ» относится к тетрагидрофурану. «ПЭ» относится к петролейному эфиру. «ДМСО» относится к диметилсульфоксиду. «MeCN» относится к ацетонитрилу. «ДМЭ» относится к диметиловому эфиру. «Pd(dppf)Cl2» относится к палладий[1,1'-дикис(дифенилфосфор)ферроцен]хлориду.
Термин «опциональный» или «опционально» означает, что описанное далее событие или обстоятельство может происходить, но не обязательно произойдет, и что описание включает случаи, когда событие или обстоятельство происходит или не происходит. Например, «гетероциклильная группа, опционально замещенная алкилом» означает, что алкил может, но не обязательно, присутствовать, и что описание включает случаи, когда гетероциклильная группа замещена или не замещена алкилом.
Термин «замещенный» означает, что один или несколько атомов водорода в группе независимо замещены соответствующим числом заместителей. Само собой разумеется, что заместитель находится только в своем возможном химическом положении, и специалисты в данной области смогут определить (экспериментально или на основе теории) возможную или невозможную замену без приложения чрезмерных усилий. Например, возможна нестабильность в случае, если аминогруппа или гидроксигруппа, имеющие свободный водород, связаны с атомом углерода, имеющим ненасыщенную связь (например, олефин).
«Фармацевтическая композиция» относится к смеси, содержащей одно или несколько соединений, описанных в настоящем документе, или его физиологически/фармацевтически приемлемой соли или пролекарству, а также другим химическим компонентам, например физиологически/фармацевтически приемлемым носителям и вспомогательным веществам. Цель этой фармацевтической композиции состоит в том, чтобы облегчать введение препарата в организм, улучшая всасывание действующего вещества и тем самым способствуя проявлению его биологической активности.
Далее представлено подробное объяснение настоящего изобретения со ссылкой на варианты его осуществления, которые не предназначены для ограничения настоящего изобретения; при этом настоящее изобретение не ограничивается представленными вариантами.
Структура соединения по настоящему изобретению определяется с помощью ядерного магнитного резонанса (ЯМР) и/или жидкостной хроматографии в комбинации с масс-спектрометрией (ЖХ-МС). Химические сдвиги ЯМР-спектров (δ) приведены в частях на миллион (ppm). Определение по ЯМР-спектру проводят с использованием установки ядерного магнитного резонанса Bruker AVANCE-400 или Bruker AVANCE-500 с дейтерированным диметилсульфоксидом (ДМСО-d6), дейтерированным метанолом (CD3OD) и дейтерированным хлороформом (CDCl3) в качестве растворителей и тетраметилсиланом (ТМС) в качестве внутреннего стандарта.
Определение с помощью ЖХ-МС проводят с использованием масс-спектрометра Agilent 6120. Определение с помощью ВЭЖХ проводят с использованием жидкостного хроматографа высокого давления Agilent 1200 DAD (хроматографическая колонка Sunfire C18 150×4,6 мм) и жидкостного хроматографа высокого давления Waters 2695-2996 (хроматографическая колонка Gimini C18 150×4,6 мм).
В качестве пластины для тонкослойной хроматографии (ТСХ) используется пластина с силикагелем Yantai Yellow Sea HSGF254 или Qingdao GF254. В спецификации для ТСХ установлено значение 0,15-0,20 мм, а в спецификации для тонкослойной хроматографии для разделения и очистки продуктов установлено значение 0,4-0,5 мм. В качестве носителя для колоночной хроматографии обычно используют силикагель Yantai Yellow Sea размером частиц 200-300 меш.
Исходные материалы в примерах осуществления настоящего изобретения известны и имеются в продаже или могут быть синтезированы методами, известными в данной области техники или в соответствии с ними.
Если не указано иное, то все реакции по настоящему изобретению проводят в атмосфере сухого азота или аргона с непрерывным перемешиванием на магнитной мешалке, где растворитель представляет собой сухой растворитель, а температура реакции указана в градусах Цельсия (°C).
I. Получение промежуточных веществ
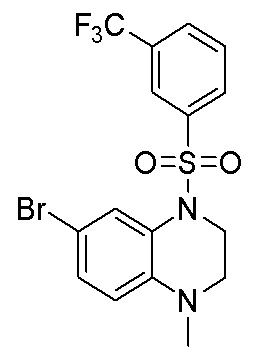
1. Получение 6-бром-1-метил-4-((3-(трифторметил)фенил)сульфонил)-1,2,3,4-тетрагидрохиноксалина
Этап 1. Синтез 2-((4-бром-2-нитрофенил)(метил)амино)этан-1-ола

4-бром-1-фтор-2-нитробензол (2,50 г, 11,4 ммоль), 2-(метиламино)этан-1-ол (2,13 г, 28,4 ммоль), карбонат калия (4,70 г, 34,1 ммоль) и N,N-диметилформамид (10 мл) добавляли в одногорлую колбу вместимостью 250 мл, реакционную смесь перемешивали при температуре 60°C в течение 2 часов. Реакционную смесь охлаждали, а затем разбавляли водой (50 мл) и экстрагировали этилацетатом (50 мл × 2). Органические фазы промывали солевым раствором (50 мл), сушили над безводным сульфатом натрия, а затем фильтровали и концентрировали с получением 2-((4-бром-2-нитрофенил)(метил)амино)этан-1-ола (3,20 г, выход: 100%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 275,0 [M+1]+.
Этап 2. Синтез 2-((2-амино-4-бромфенил)(метил)амино)этан-1-ола

2-((4-бром-2-нитрофенил)(метил)амино)этан-1-ол (3,20 г, 99%, 11,6 ммоль), воду (50 мл), железный порошок (2,35 г, 41,9 ммоль) и хлорид аммония (626 мг, 11,6 ммоль) добавляли в одногорлую колбу вместимостью 100 мл. Реакцию проводили в течение ночи при температуре 105°C, реакционную смесь охлаждали до температуры 40-50°C и фильтровали через целит, а отфильтрованный осадок промывали этилацетатом (20 мл × 4). Фильтрат разделяли на слои и водный слой дополнительно экстрагировали этилацетатом (50 мл). Органические фазы объединяли и сушили над безводным сульфатом натрия, а затем фильтровали и концентрировали. Неочищенный продукт разделяли с помощью колоночной хроматографии на силикагеле [элюент : петролейный эфир : этилацетат = 2:1-1:3] с получением 2-((2-амино-4-бромфенил)(метил)амино)этан-1-ола (2,30 г, выход: 76,9%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 245,0 [M+1]+.
Этап 3. Синтез 4-бром-N1-(2-хлорэтил)-N1-метилбензол-1,2-диамина
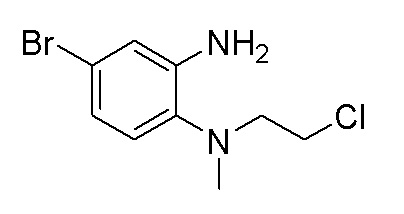
2-((2-амино-4-бромфенил)(метил)амино)этан-1-ол (2,30 г, 95%, 8,91 ммоль) и дихлорметан (50 мл) добавляли в одногорлую колбу вместимостью 250 мл, затем в ледяной бане по каплям добавляли тионилхлорид (1,27 г, 10,7 ммоль), а затем добавляли две капли N,N-диметилформамида. Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 1 ч, а затем нагревали до температуры 35°C и перемешивали в течение 2,5 ч. После концентрирования к ней добавляли водный раствор гидроксида натрия (1N), и раствор смеси экстрагировали дихлорметаном. Органические фазы промывали солевым раствором, сушили над безводным сульфатом натрия, фильтровали и концентрировали. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля [элюент : петролейный эфир : этилацетат = 0:100-15:85] с получением 4-бром-N1-(2-хлорэтил)-N1-метилбензол-1,2-диамина (1,84 г, выход: 74,4%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 263,0 [M+1]+.
Этап 4. Синтез 6-бром-1-метил-1,2,3,4-тетрагидрохиноксалина
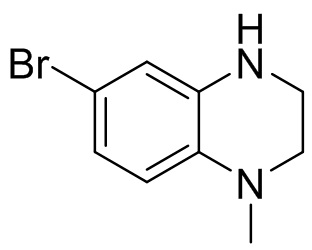
4-бром-N1-(2-хлорэтил)-N1-метилбензол-1,2-диамин (1,84 г, 95%, 6,63 ммоль) растворяли в N,N-диметилформамиде (20 мл) и добавляли к раствору карбонат калия (1,83 г, 13,3 ммоль). Реакционную смесь перемешивали при температуре 80°C в течение 1 ч, затем нагревали до температуры 100°C и перемешивали в течение 1,5 ч. Раствор смеси охлаждали до комнатной температуры, разбавляли водой (50 мл) и экстрагировали этилацетатом (50 мл). Органические фазы однократно промывали насыщенным хлоридом натрия (80 мл). Органические фазы сушили и фильтровали, фильтрат концентрировали; остаток отделяли с помощью быстрой хроматографии на колонке силикагеля [элюент : петролейный эфир : этилацетат = 0:100-70:30] с получением 6-бром-1-метил-1,2,3,4-тетрагидрохиноксалина (750 мг, выход: 47,3%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 227,0 [M+1]+.
Этап 5. Синтез 6-бром-1-метил-4-((3-(трифторметил)фенил)сульфонил)-1,2,3,4-тетрагидрохиноксалина

6-бром-1-метил-1,2,3,4-тетрагидрохиноксалин (375 мг, 95%, 1,57 ммоль), 3-(трифторметил) -бензолсульфонилхлорид (422 мг, 1,73 ммоль) растворяли в дихлорметане (15 мл) и добавляли в раствор 4-диметиламинопиридин (375 мг, 95%, 1,57 ммоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре; завершение реакции подтверждали с помощью ЖХ-МС. Реакционную смесь концентрировали до сухого остатка, а остаток отделяли с помощью быстрой хроматографии на колонке силикагеля [элюент : ЭтАц : ПЭ = 0-80%] с получением 6-бром-1-метил-4-((3-(трифторметил)фенил)сульфонил)-1,2,3,4-тетрагидрохиноксалина (480 мг, выход: 66,7%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 435,0 [M+1]+.
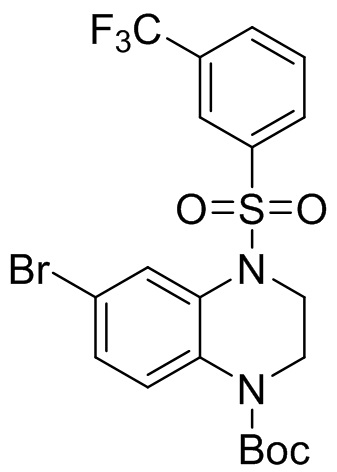
2. Получение трет-бутил 6-бром-4-((3-(трифторметил)фенил)сульфонил)-3,4-дигидрохиноксалин-1(2H)-карбоксилата
Этап 1. Синтез метил-(4-бром-2-нитрофенил)глицината
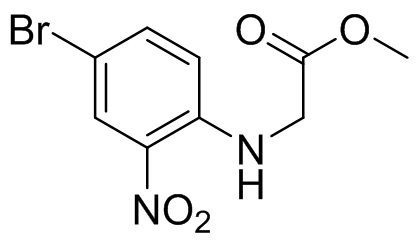
4-бром-1-фтор-2-нитробензол (2,0 г, 9,09 ммоль), гидрохлорид метилового эфира глицина (1,26 г, 10,0 ммоль), диизопропилэтиламин (2,5 мл, 14,5 ммоль) и ацетонитрил (30 мл) добавляли в одногорлую колбу вместимостью 250 мл; реакционную смесь перемешивали при температуре 80°C в течение 2 ч. Реакционную смесь охлаждали, а затем разбавляли водой (40 мл) и экстрагировали этилацетатом (70 мл × 2). Органические фазы промывали солевым раствором (50 мл), сушили над безводным сульфатом натрия, фильтровали и концентрировали с получением метил-(4-бром-2-нитрофенил)глицината (2,1 г, выход: 71,9%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 289,0 [M+1]+.
Этап 2. Синтез 7-бром-3,4-дигидрохиноксалин-2(1H)-она

Метил (4-бром-2-нитрофенил)глицинат (1,8 г, 90%, 5,6 ммоль), уксусную кислоту (20 мл) и железный порошок (1,57 г, 28,0 ммоль) добавляли в одногорлую колбу вместимостью 100 мл. Затем проводили реакцию при температуре 60°C в течение 2,5 ч. Раствор смеси охлаждали до температуры 40-50°C и фильтровали через целит, а отфильтрованный осадок промывали этилацетатом (20 мл × 4). Фильтрат разделяли на слои и водный слой дополнительно экстрагировали этилацетатом (50 мл). Органические фазы объединяли, последовательно промывали солевым раствором (50 мл × 2) и раствором насыщенного бикарбоната натрия (50 мл × 2), сушили над безводным сульфатом натрия, фильтровали и концентрировали. Остаток отделяли с помощью колоночной хроматографии на силикагеле [элюент : петролейный эфир : этилацетат = 95:5-1:100] с получением 7-бром-3,4-дигидрохиноксалин-2(1H)-она (1,0 г, выход: 74,7%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 227,0 [M+1]+.
Этап 3. Синтез трет-бутил-6-бром-3-оксо-3,4-дигидрохиноксалин-1(2H)-карбоксилата
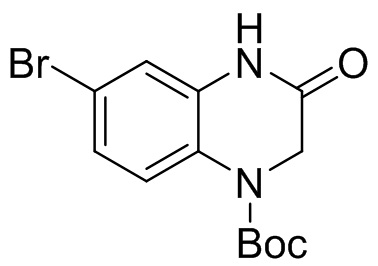
7-бром-3,4-дигидрохиноксалин-2(1H)-он (500 мг, 95%, 2,1 ммоль), дихлорметан (15 мл), ди-трет-бутилдикарбонат (684 мг, 3,14 ммоль) и 4-диметиламинопиридин (684 мг, 3,14 ммоль) добавляли в одногорлую колбу вместимостью 100 мл. Реакционную смесь нагревали до 40°C и перемешивали в течение 2 ч. Раствор смеси концентрировали, а остаток отделяли с помощью быстрой хроматографии на колонке силикагеля [элюент : петролейный эфир : этилацетат = 0:100-40:60] с получением трет-бутил-6-бром-3-оксо -3,4-дигидрохиноксалин-1(2H)-карбоксилата (580 мг, выход: 80,0%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 349,0 [M+23]+, 271,0 [M-56]+.
Этап 4. Синтез трет-бутил-6-бром-3,4-дигидрохиноксалин-1(2H)-карбоксилата
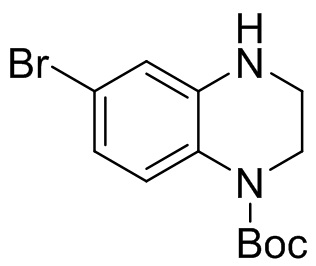
Трет-бутил-6-бром-3-оксо-3,4-дигидрохиноксалин-1(2H)-карбоксилат (260 мг, 95%, 0,75 ммоль) растворяли в безводном тетрагидрофуране (6 мл) и к раствору добавляли боран-диметилсульфидный комплекс (2M раствор тетрагидрофурана, 1,13 мл, 2,26 ммоль). Реакционную смесь перемешивали при температуре 50°C в течение 1,5 ч. Завершение реакции подтверждали с помощью ЖХ-МС; для остановки реакции добавляли метанол (10 мл) и перемешивали при температуре 40°C в течение 1 ч. Смесь концентрировали, а остаток отделяли с помощью быстрой хроматографии на колонке силикагеля [элюент : петролейный эфир : этилацетат = 0:100-50:50] с получением трет-бутил-6-бром-3,4-дигидрохиноксалин-1(2H)-карбоксилата (210 мг, выход: 84,9%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 313,0 [M+1]+.
Этап 5. Синтез трет-бутил 6-бром-4-((3-(трифторметил)фенил)сульфонил)-3,4-дигидрохиноксалин-1(2H)-карбоксилата
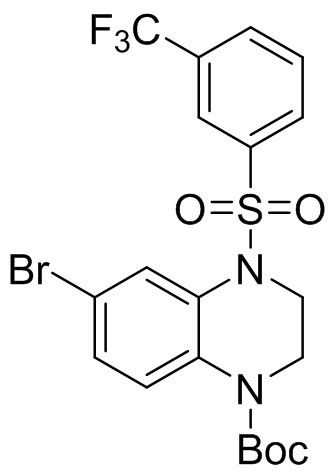
Трет-бутил-6-бром-3,4-дигидрохиноксалин-1(2H)-карбоксилат (210 мг, 95%, 0,64 ммоль), 3-(трифторметил)бензолсульфонил хлорид (171 мг, 0,70 ммоль) растворяли в дихлорметане (10 мл) и добавляли к раствору 4-диметиламинопиридин (78 мг, 0,64 ммоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре; завершение реакции подтверждали с помощью ЖХ-МС. Реакционную смесь концентрировали до сухого остатка, а остаток отделяли с помощью быстрой хроматографии на колонке силикагеля [элюент : ЭтАц : ПЭ = 0-60%)] с получением бледно-желтого маслянистого трет-бутил-6-бром-4-((3-(трифторметил)фенил)сульфонил)-3,4-дигидрохиноксалин-1(2H)-карбоксилата (277 мг, выход: 79,2%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 421,0 [M+1]+.
3. Получение метил-(S)-3-(6-бром-1-метил-4-((3-(трифторметил)фенил)сульфонил)-1,2,3,4-тетрагидрохиноксалин-2-ил)пропаноата
Этап 1. Синтез диметил (4-бром-2-нитрофенил)-L-глутамата
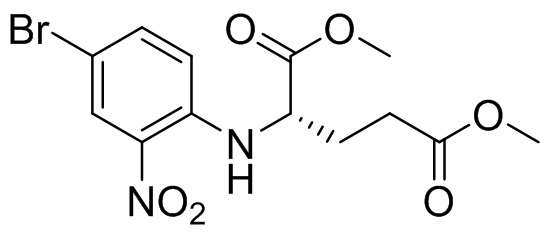
4-бром-1-фтор-2-нитробензол (10,0 г, 45,4 ммоль), диметил D-глутамата гидрохлорид (11,5 г, 54,5 ммоль), карбонат калия (25,1 г, 182 ммоль), N,N-диметилформамид (50 мл) добавляли в одногорлую колбу вместимостью 250 мл, и реакционную смесь перемешивали при температуре 80°C в течение 18 ч. Реакционную смесь охлаждали, а затем разбавляли водой (100 мл) и экстрагировали этилацетатом (150 мл × 2). Органические фазы промывали солевым раствором (200 мл × 2), отделяли, сушили над безводным сульфатом натрия и фильтровали, а остаток отделяли с помощью колоночной хроматографии на силикагеле [элюент : петролейный эфир : этилацетат = 100:0-20:80] с получением диметил-(4-бром-2-нитрофенил)-L-глутамата (6,0 г, выход: 32,8%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 375,0 [M+1]+.
Этап 2. Синтез метил-(S)-3-(6-бром-3-оксо-1,2,3,4-тетрагидрохиноксалин-2-ил) пропаноата и (S)-7-бром-3,3a-дигидропирроло[1,2-a]хиноксалин-1,4(2H,5H)-диона
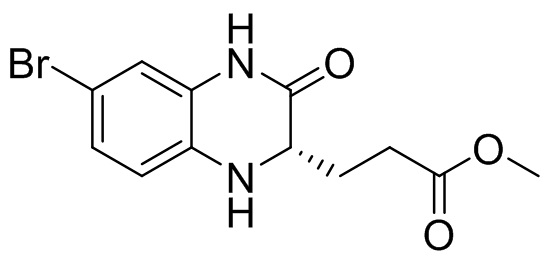
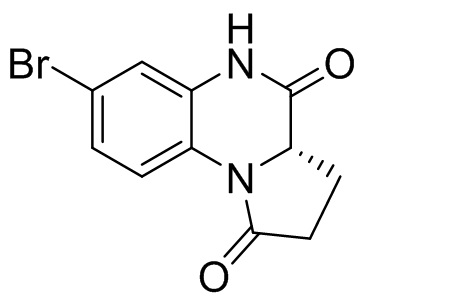
Диметил (4-бром-2-нитробензол)-L-глутамат (6,0 г, 93%, 14,9 ммоль), уксусную кислоту (30 мл) и железный порошок (4,17 г, 74,5 ммоль) добавляли в одногорлую колбу вместимостью 250 мл, затем проводили реакцию при температуре 60°C в течение 2 ч, охлаждали до 40-50°C и фильтровали через целит, а отфильтрованный осадок промывали этилацетатом (30 мл × 5). Фильтрат разделяли на слои и водный слой дополнительно экстрагировали этилацетатом (50 мл). Объединенные органические фазы последовательно промывали водой (100 мл), солевым раствором (100 мл) и раствором насыщенного бикарбоната натрия (100 мл × 3), а затем сушили над безводным сульфатом натрия, фильтровали и концентрировали. Остаток отделяли с помощью колоночной хроматографии на силикагеле [элюент : петролейный эфир : этилацетат = 100:0-0:100] с получением метил (S)-3-(6-бром-3-оксо-1,2,3,4-тетрагидрохиноксалин-2-ил)пропаноата (1,7 г) (ESI-MS: 313,0 [M+1]+) и (S)-7-бром-3,3a-дигидропирроло[1,2-a]хиноксалин-1,4(2H,5H)-диона (500 мг) (ESI-MS: 281,0 [M+1]+).
Этап 3. Синтез метил-(S)-3-(6-бром-1-метил-3-оксо-1,2,3,4-тетрагидрохиноксалин-2-ил) пропаноата
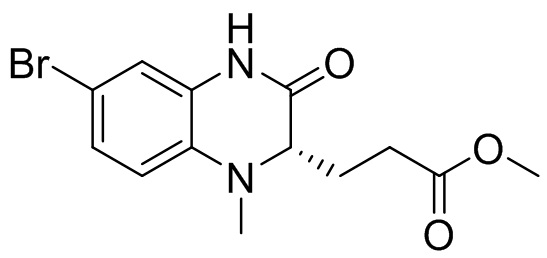
Метил-(S)-3-(6-бром-3-оксо-1,2,3,4-тетрагидрохиноксалин-2-ил)пропаноат (1,70 г, 5,16 ммоль) и N,N-диметилформамид (10 мл) добавляли в одногорлую колбу вместимостью 250 мл. К раствору добавляли водный формальдегид (3,9 г, 40%, 51,6 ммоль) и несколько капель уксусной кислоты, и реакционную смесь перемешивали при комнатной температуре в течение 1,5 ч. К смеси добавляли цианоборгидрид натрия (1,62 г, 25,8 ммоль) и перемешивали в течение 18 ч. После разведения этилацетатом (150 мл) раствор смеси промывали солевым раствором (100 мл × 2), сушили над безводным сульфатом натрия, фильтровали и концентрировали. Остаток отделяли с помощью с помощью быстрой хроматографии на колонке силикагеля [элюент : петролейный эфир : этилацетат = 0:100-15:85] с получением метил-(S)-3-(6-бром-1-метил-3-оксо-1,2,3,4-тетрагидрохиноксалин-2-ил)пропаноата (660 мг, выход: 34,4%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 263,0 [M+1]+.
Этап 4. Синтез метил-(S)-3-(6-бром-1-метил-1,2,3,4-тетрагидрохиноксалин-2-ил) пропаноата
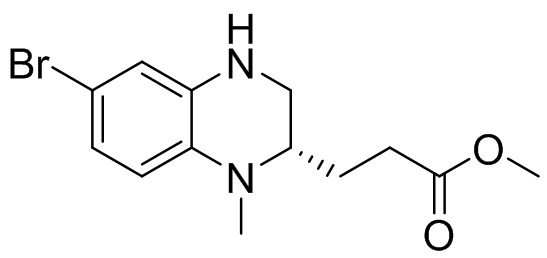
Метил (S)-3-(6-бром-1-метил-3-оксо-1,2,3,4-тетрагидрохиноксалин-2-ил)пропаноат (660 мг, 1,78 ммоль) растворяли в безводном тетрагидрофуране (10 мл) и к раствору добавляли боран-диметилсульфидный комплекс (2M раствор тетрагидрофурана, 2,2 мл, 4,44 ммоль). Реакционную смесь перемешивали при температуре 40°C в течение 3 ч; завершение реакции подтверждали с помощью ЖХ-МС и пластин ТСХ; для остановки реакции добавляли метанол (10 мл), а реакционную смесь нагревали до температуры 50°C и перемешивали в течение 1 ч. Смесь концентрировали, а остаток отделяли с помощью быстрой хроматографии на колонке силикагеля [элюент : петролейный эфир : этилацетат = 0:100-40:60] с получением метил-(S)-3-(6-бром-1-метил-1,2,3,4-тетрагидрохиноксалин-2-ил)пропаноата (360 мг, выход: 61,4%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 313,0 [M+1]+.
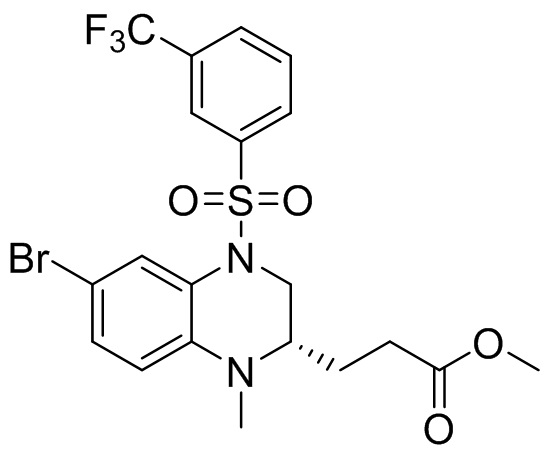
Этап 5. Синтез метил-(S)-3-(6-бром-1-метил-4-((3-(трифторметил)фенил)сульфонил)-1,2,3,4-тетрагидрохиноксалин-2-ил)пропаноата
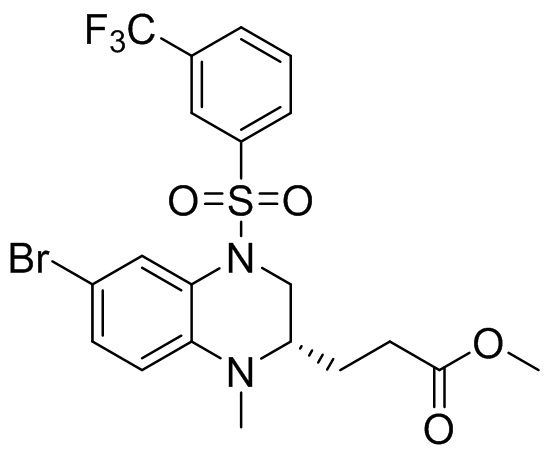
Метил-(S)-3-(6-бром-1-метил-1,2,3,4-тетрагидрохиноксалин-2-ил)пропаноат (360 мг, 1,09 ммоль) и 3-(трифторметил)бензолсульфонил хлорид (538 мг, 2,19 ммоль) растворяли в пиридине (8 мл) и к раствору добавляли 4-диметиламинопиридин (199 мг, 1,64 ммоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре 50°C. Завершение реакции подтверждали с помощью ЖХ-МС. Реакционную смесь концентрировали до сухого остатка, а остаток отделяли с помощью быстрой хроматографии на колонке силикагеля (0-80% ЭтАц : ПЭ) с получением (S)-3-(6-бром-1-метил-4-((3-(трифторметил)фенил)сульфонил)-1,2,3,4-тетрагидрохиноксалин-2-ил)пропаноата (560 мг, выход: 93,6%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 521,2 [M+1]+.
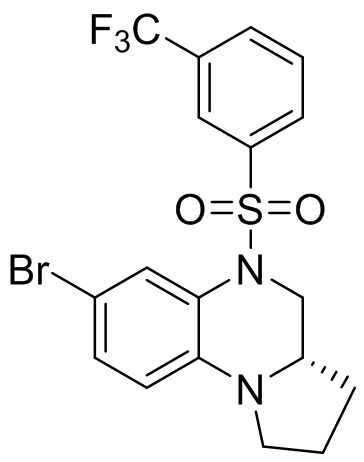
4. Получение (S)-7-бром-5-((3-(трифторметил)фенил)сульфонил)-1,2,3,3a,4,5-гексагидропирроло[1,2-a]хиноксалина
Этап 1. Синтез (S)-7-бром-1,2,3,3a,4,5-гексагидропирроло[1,2-a]хиноксалина
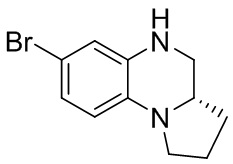
(S)-7-бром-3,3a-дигидропирроло[1,2-a]хиноксалин-1,4(2H,5H)-дион (170 мг, 0,57 ммоль) растворяли в безводном тетрагидрофуране (3 мл) и к раствору добавляли боран-диметилсульфидный комплекс (2M раствор тетрагидрофурана, 0,86 мл, 1,72 ммоль). Реакционную смесь перемешивали при температуре 50°C в течение 2 ч. Завершение реакции подтверждали с помощью ЖХ-МС; для остановки реакции добавляли метанол (10 мл) и перемешивали при температуре 50°C в течение 1 ч. Смесь концентрировали, а остаток отделяли с помощью быстрой хроматографии на колонке силикагеля [элюент : петролейный эфир : этилацетат = 0:100-50:50] с получением (S)-7-бром-1,2,3,3a,4,5-гексагидропирроло[1,2-a]хиноксалина (100 мг, выход: 65,9%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 253,0 [M+1]+.
Этап 2. Синтез (S)-7-бром-5-((3-(трифторметил)фенил)сульфонил)-1,2,3,3a,4,5-гексагидропирроло[1,2-a]хиноксалина
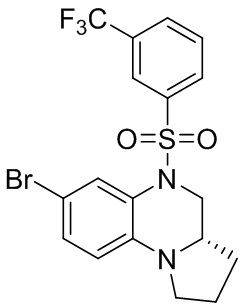
(S)-7-бром-1,2,3,3a,4,5-гексагидропирроло[1,2-a]хиноксалин (100 мг, 0,375 ммоль) и 3-(трифторметил)бензолсульфонил хлорид (137 мг, 0,563 ммоль) растворяли в дихлорметане (5 мл) и добавляли к раствору 4-диметиламинопиридин (46 мг, 0,375 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. ЖХ-МС показала практически полное завершение реакции. Реакционную смесь концентрировали до сухого остатка, и отделяли остаток с помощью быстрой хроматографии на колонке силикагеля (0-30% ЭтАц : ПЭ) с получением (S)-7-бром-5-((3-(трифторметил) фенил)сульфонил)-1,2,3,3a,4,5-гексагидропирроло[1,2-a]хиноксалина (160 мг, 93%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 461,0 [M+1]+.
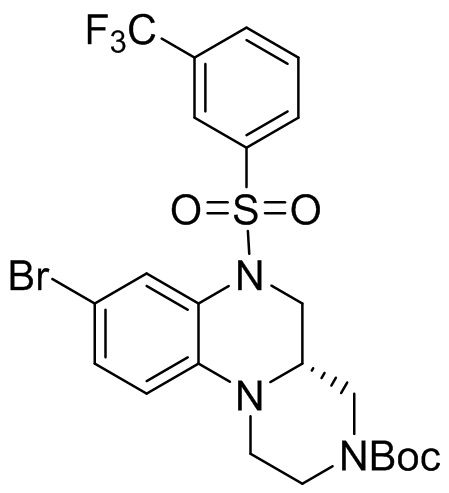
5. Получение трет-бутил-(S)-8-бром-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-карбоксилата
Этап 1. Синтез (S)-1-(4-бром-2-нитрофенил)-4-(трет-бутоксикарбонил)пиперазин-2-карбоновой кислоты
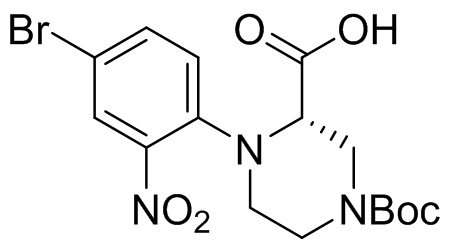
4-бром-1-фтор-2-нитробензол (2,2 г, 10 ммоль) растворяли в N,N-диметилформамиде (20 мл) и в раствор добавляли карбонат цезия (9,75 г, 30 ммоль) и 1-(трет-бутил)3-метил-(S)-пиперазин-1,3-дикарбоксилат (2,44 мг, 10 ммоль). Реакционную смесь перемешивали при температуре 70°C в течение 16 ч. Для удаления растворителя реакционную смесь концентрировали. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля с получением (S)-1-(4-бром-2-нитрофенил)-4-(трет-бутоксикарбонил)пиперазин-2-карбоновой кислоты (310 мг, 7,2%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 374 [M-55]+.
Этап 2. Синтез трет-бутил-(S)-8-бром-5-оксо-1,2,4,4a,5,6-гексагидро-3H-пиразино [1,2-a] хиноксалин-3-карбоксилата
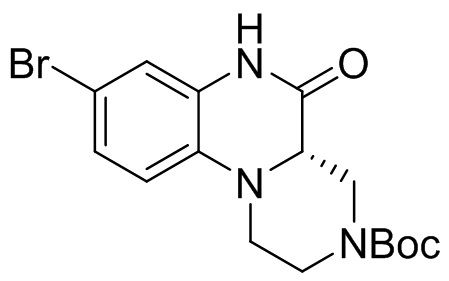
(S)-1-(4-бром-2-нитрофенил)-4-(трет-бутоксикарбонил)пиперазин-2-карбоновую кислоту (890 мг, 2,0 ммоль) растворяли в уксусной кислоте (10 мл) и к раствору добавляли железный порошок (560 мг, 10 ммоль). Раствор смеси перемешивали при температуре 70°C в течение 2 ч, фильтровали и концентрировали для удаления растворителя. Остаток промывали раствором насыщенного бикарбоната натрия, экстрагировали этилацетатом, сушили, концентрировали, а затем отделяли с помощью быстрой хроматографии на колонке силикагеля с получением трет-бутил (S)-8-бром-5-оксо-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-карбоксилата (325 мг, 43%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 326 [M-55]+.
Этап 3. Синтез трет-бутил-(R)-8-бром-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a] хиноксалина-3-карбоксилата
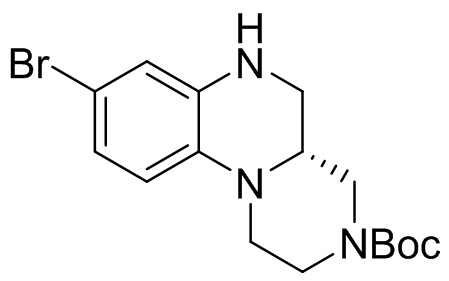
Трет-бутил-(S)-8-бром-5-оксо-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-карбоксилат (325 мг, 0,85 ммоль) растворяли в тетрагидрофуране (15 мл) и к полученному раствору добавляли раствор боран-диметилсульфида в тетрагидрофуране (1,3 мл, 2M). Реакционную смесь перемешивали при температуре 50°C в течение 16 ч, затем охлаждали до 0°C, добавляли метанол для остановки реакции и концентрировали для удаления растворителя. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля с получением трет-бутил-(R)-8-бром-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a] хиноксалин-3-карбоксилата (250 мг, 80%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 312 [M-55]+.
Этап 4. Синтез трет-бутил-(S)-8-бром-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-карбоксилата

Трет-бутил (R)-8-бром-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-карбоксилат (250 мг, 0,68 ммоль) растворяли в пиридине (4 мл) и к раствору добавляли 3-(трифторметил)бензолсульфонилхлорид (332 мг, 1,36 ммоль). Реакционную смесь перемешивали при температуре 70°C в течение 5 ч. Для удаления растворителя реакционную смесь концентрировали. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля с получением трет-бутил-(S)-8-бром-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-карбоксилата (340 мг, 96%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 520 [M-55]+.
6. Получение 2-(3-(дифторметокси)-5-фторфенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана
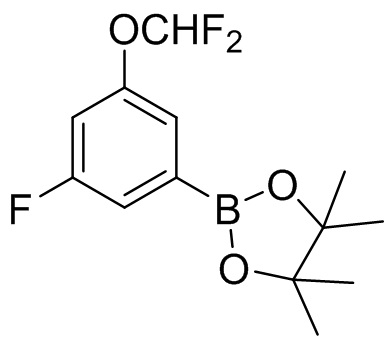
Этап 1. Синтез 1-бром-3-(дифторметокси)-5-фторбензола
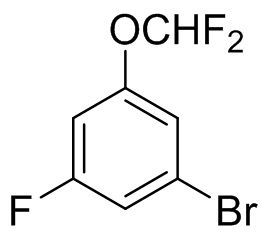
3-фтор-5-бромфенол (8,69 г, 45,5 ммоль) растворяли в N,N-диметилформамиде (30 мл); к полученному раствору добавляли карбонат калия (16,00 г, 115,8 ммоль), и раствор смеси перемешивали при комнатной температуре в течение 30 мин. В реакционную смесь добавляли воду (8,2 мл) и дифторхлорацетат натрия (11,98 г, 78,6 ммоль) и реакционную смесь перемешивали при температуре 100°C в атмосфере азота в течение 3 дней; реакционную смесь охлаждали до комнатной температуры, а затем разбавляли этилацетатом (30 мл) и промывали солевым раствором (100 мл × 3). Органические фазы сушили над безводным сульфатом магния. Реакционную смесь фильтровали, концентрировали и разделяли с помощью колоночной хроматографии [элюент : ЭА : ПЭ = 2%) с получением 1-бром-3-(дифторметокси)-5-фторбензола (4,624 г, 42%), который без дополнительной обработки использовали на следующем этапе.
Этап 2. Синтез 2-(3-(дифторметокси)-5-фторфенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана

1-бром-3-(дифторметокси)-5-фторбензол (4,62 г, 19,1 ммоль), пинакол-диборон (9,79 г, 38,6 мМ), ацетат калия (7,56 г, 77,0 ммоль) и 1,1'-бис(дифенилфосфино)ферроцен-палладий хлорид (1,51 г, 2,1 ммоль) растворяли в диоксане (45 мл) и проводили реакцию в атмосфере азота при температуре 80°C в течение 17 ч. Реакционную смесь охлаждали до комнатной температуры, сразу же концентрировали и разделяли с помощью колоночной хроматографии [элюент : ЭА : ПЭ = 0%-10%) с получением 2-(3-(дифторметокси)-5-фторфенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана (3,63 г, 66%), который без дополнительной обработки использовали на следующем этапе.
7. Получение (E)-2-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана
Этап 1. Синтез 1-хлор-2-этинил-3-фторбензола
2-хлор-6-фторбензальдегид (1,0 г, 6,3 ммоль) растворяли в метаноле (40 мл) и добавляли к раствору диметил-(1-диазо-2-оксопропил)-фосфонат (1,2 мл, 7,9 ммоль) и карбонат калия (2,16 г, 15,75 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, концентрировали, добавляли метил-трет-бутиловый эфир (50 мл), экстрагировали водой (50 мл × 3) и промывали солевым раствором (50 мл). Органическую фазу сушили над безводным сульфатом натрия, фильтровали и концентрировали с получением 1-хлор-2-этинил-3-фторбензола (0,8 г, 82%), который без дополнительной обработки использовали на следующем этапе.
Этап 2. Синтез (E)-2-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана
Пинакол-диборон (1,45 г, 5,7 ммоль), CuCl (0,05 г, 0,5 ммоль) и 4,5-бис(ди-трет-бутилфосфино)-9,9-диметилксантен (0,30 г, 0,5 ммоль) перемешивали в тетрагидрофуране (50 мл) и проводили реакцию в атмосфере азота в течение 5 мин. Трет-бутоксид натрия (0,55 г, 5,7 ммоль) растворяли в тетрагидрофуране (5 мл), добавляли в реакционную смесь и перемешивали в течение 5 мин. В реакционную смесь добавляли 1-хлор-2-этинил-3-фторбензол (0,80 г, 5,2 ммоль) и йодметан (2,96 г, 20,8 ммоль), проводили реакцию в течение ночи при комнатной температуре, а затем концентрировали и разделяли с помощью колоночной хроматографии [элюент : петролейный эфир - петролейный эфир/этилацетат (98:2)] с получением (E)-2-(2-(2-хлор-6-фторфенил) проп-1-ен-1-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана (0,5 г, 33%), который без дополнительной обработки использовали на следующем этапе.
8. Получение промежуточного вещества B3: (E)-2-(2-хлор-6-(трифторметил)стирил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана

Этап 1. Синтез 1-хлор-2-этинил-3-трифторметилбензола
2-хлор-6-трифторметил бензальдегид (3,65 г, 17,4 ммоль) и диметил(1-диазо-2-оксопропил) фосфонат (2,85 г, 14,9 ммоль) растворяли в метаноле (30 мл). К раствору добавляли карбонат калия (8,28 г, 59,9 мМ) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли метил-трет-бутиловым эфиром (100 мл) и промывали насыщенным водным раствором хлорида натрия (30 мл × 3). Органические фазы объединяли, сушили над безводным сульфатом магния, фильтровали и концентрировали с получением неочищенного 1-хлор-2-этинил-3-трифторметилбензола (3,471 г, 98%), который без дополнительной обработки использовали на следующем этапе.
Этап 2. Синтез (E)-2-(2-хлор-6-(трифторметил)стирил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана
Неочищенный продукт 1-хлор-2-этинил-3-трифторметилбензол (3,47 г, 17,0 ммоль) и 4,4,5,5-тетраметил-1,3,2-диоксаборолан (6,75 г, 52,7 ммоль) растворяли в толуоле (26 мл) и к раствору добавляли карбонил хлортрис-(трифенилфосфин)-рутений (0,96 г, 1,0 ммоль), после чего раствор смеси перемешивали в атмосфере азота при температуре 50°C в течение ночи. Реакционную смесь охлаждали до комнатной температуры, разбавляли этилацетатом (80 мл) и промывали солевым раствором (30 мл × 3). Органические фазы объединяли, сушили над безводным сульфатом магния, фильтровали, концентрировали и разделяли с помощью колоночной хроматографии [элюент : ЭА : ПЭ = 0%-10%) с получением (E)-2-(2-хлор-6-(трифторметил)стирил)-4,4,5,5-тетраметил-1,3,2-диоксаборолана (3,096 г, 55%), который без дополнительной обработки использовали на следующем этапе.
9. Получение 4,4,5,5-тетраметил-2-(2,2,6,6-тетраметил-3,6-дигидро-2H-пиран-4-ил)-1,3, 2-диоксаборолана
Этап 1. Синтез 2,2,6,6-тетраметил-3,6-дигидро-2H-пиран-4-ил-4,4,4,4,4,4,4,4,4-нонафтор -4λ12-бут-1,3-диин-1-сульфоната
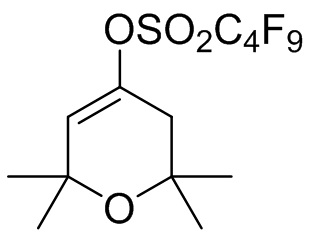
LDA (4,1 г, 2N, 38,4 ммоль) добавляли в раствор в атмосфере азота. Раствор охлаждали до -78°C; к охлажденному раствору медленно по каплям добавляли раствор 2,2,6,6-тетраметилтетрагидро-4H-пиран-4-она (5,0 г, 32,0 ммоль) в ТГФ (80 мл). Реакционную смесь перемешивали при температуре -78°C в течение 1 ч; затем к смеси добавляли 1,1,2,2,3,3,4,4,4-нонафторбутан-1-сульфонилфторид (11,6 г, 38,4 ммоль). Реакционную смесь перемешивали при температуре от -78°C до приблизительно 0°C в течение 16 ч. После завершения реакции реакционную смесь гасили насыщенным NaHCO3 (100 мл). Раствор смеси экстрагировали этилацетатом (3×50 мл). Органические фазы объединяли, промывали солевым раствором (50 мл), сушили над сульфатом магния и фильтровали. Фильтрат концентрировали, а остаток отделяли с помощью быстрой хроматографии на колонке силикагеля (ПЭ : ЭА = 0-20%) с получением 2,2,6,6-тетраметил-3,6-дигидро-2H-пиран-4-ил 4,4,4,4,4,4,4,4,4-нонафтор-4λ12-бут-1,3-диин-1-сульфоната (10 г, 71%), который без дополнительной обработки использовали на следующем этапе.
Этап 2. Синтез 4,4,5,5-тетраметил-2-(2,2,6,6-тетраметил-3,6-дигидро-2H-пиран-4-ил)-1, 3,2-диоксаборолана

2,2,6,6-тетраметил-3,6-дигидро-2H-пиран-4-ил-4,4,4,4,4,4,4,4,4-нонафтор-4λ12-бут-1,3-диин-1-сульфонат (10,0 г, 22,8 ммоль), бис(пинаколато) диборон (6,3 г, 25,1 ммоль), Pd(dppf)Cl2 (930 мг, 1,14 ммоль) и ацетат калия (6,7 г, 68,4 ммоль) перемешивали в ДМЭ (100 мл). Реакционную смесь перемешивали при температуре 80°C в атмосфере азота в течение 16 ч. После завершения реакции реакционную смесь фильтровали через целит. Фильтрат концентрировали, а остаток отделяли с помощью быстрой хроматографии на колонке силикагеля (элюент: ПЭ : ЭА = 0-5%] с получением продукта 4,4,5,5-тетраметил-2-(2,2,6,6-тетраметил-3,6-дигидро-2H-пиран-4-ил)-1,3,2-диоксаборолана (2,3 г, 38%), который без дополнительной обработки использовали на следующем этапе.
10. Получение трет-бутил-(R)-8-бром-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a, 5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-карбоксилата
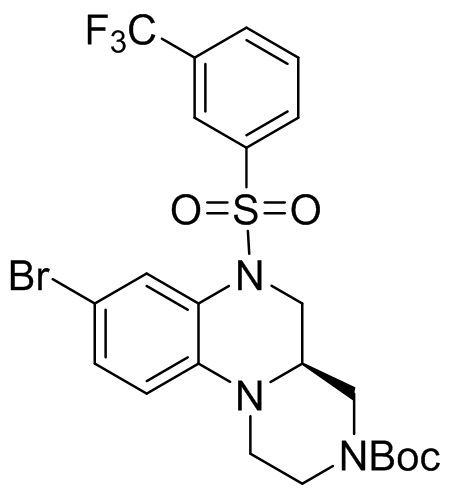
Дана ссылка на получение трет-бутил-(S)-8-бром-6-((3-(трифторметил)фенил) сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-карбоксилата.
11. Получение (S,E)-8-(2-хлор-6-(трифторметил)стирил)-6-((3-(трифторметокси)фенил) сульфонил)-2,3,4,4a,5,6-гексагидро-1H-пиразино[1,2-a]хиноксалина
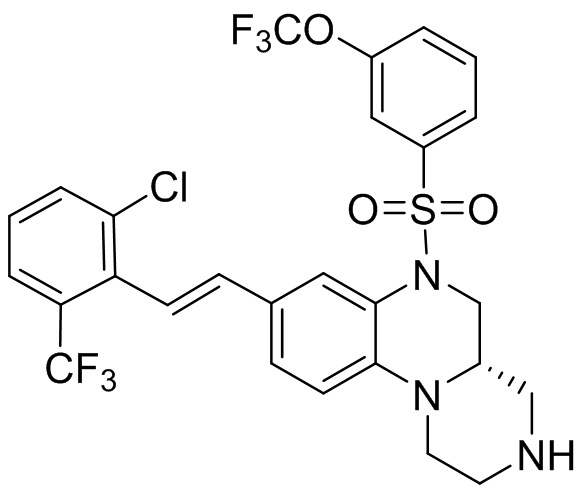
Этап 1. Синтез трет-бутил-(S)-8-бром-6-((3-(трифторметокси)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-карбоксилата
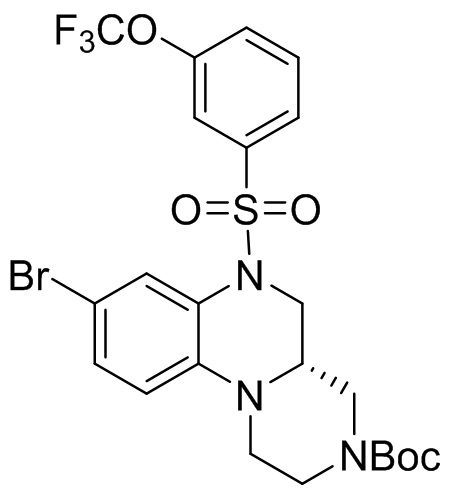
Трет-бутил (R)-8-бром-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-карбоксилат (1,2 г, 3,2 ммоль) растворяли в пиридине (10 мл) и к раствору добавляли 3-(трифторметокси)бензолсульфонилхлорид (1,3 г, 4,8 ммоль). Реакционную смесь перемешивали при температуре 50°C в течение 20 ч. Растворитель удаляли путем концентрирования с получением неочищенного трет-бутил (S)-8-бром-6-((3-(трифторметокси)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-карбоксилата, который без дополнительной обработки использовали на следующем этапе.
Этап 2. Синтез трет-бутил(S,E)-8-(2-хлор-6-(трифторметил)стирил)-6-((3-(трифторметокси) фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a] хиноксалин-3-карбоксилата
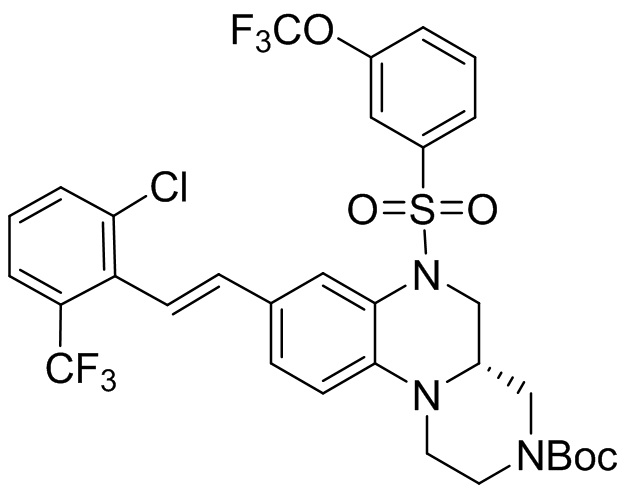
Перемешивали неочищенный трет-бутил (S)-8-бром-6-((3-(трифторметокси)фенил) сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-карбоксилат, тетракис (трифенилфосфин)палладий (0,67 г, 0,58 ммоль), карбонат натрия (1,1 г, 16,8 ммоль) и (E)-2-(2-хлор-6-(трифторметил)стирил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан (1,6 г, 5,0 ммоль); добавляли толуол (18 мл), этанол (12 мл) и воду (6 мл). Трижды вводили азот для замещения воздуха путем откачки. Раствор смеси нагревали до 90°C и проводили реакцию в течение 20 ч. После завершения реакции для удаления растворителя реакционную смесь концентрировали, промывали солевым раствором (60 мг) и экстрагировали этилацетатом (30 мл × 3). Органические фазы объединяли, сушили, фильтровали и концентрировали, остаток отделяли с помощью быстрой хроматографии на колонке силикагеля с получением трет-бутил (S,E)-8-(2-хлор-6-(трифторметил) стирил)-6-((3-(трифторметокси)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-карбоксилата (235 мг, 10%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 618 [M-Boc+H]+.
Этап 3. Синтез (S,E)-8-(2-хлор-6-(трифторметил)стирил)-6-((3-(трифторметокси)фенил) сульфонил)-2,3,4,4a,5,6-гексагидро-1H-пиразино[1,2-a]хиноксалина
Трет-бутил (S,E)-8-(2-хлор-6-(трифторметил)стирил)-6-((3-(трифторметокси)фенил) сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-карбоксилат (235 мг, 0,33 ммоль) растворяли в растворе HCl в диоксане (6 мл, 4M). Реакционную смесь перемешивали при комнатной температуре в течение 5 ч. Растворитель удаляли путем концентрирования с получением (S,E)-8-(2-хлор-6-(трифторметил)стирил)-6-((3-(трифторметокси)фенил)сульфонил)-2,3,4,4a,5,6-гексагидро-1H-пиразино[1,2-a]хиноксалина (219 мг, 100%), который без дополнительной обработки использовали на следующем этапе.
12. Получение трет-бутил (S)-8-(3-(дифторметокси)-5-фторфенил)-6-((2-(2-гидроксиэтокси)-5-(трифторметил)пиридин-3-ил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-карбоксилата
Этап 1. Синтез 3-бром-2-(2-((трет-бутилдиметилсилил)окси)этокси)-5-(трифторметил) пиридина
2-(трет-бутилдиметилсилил)окси)этанол (9,7 г, 55,0 ммоль) растворяли в безводном ТГФ (60 мл) и порциями добавляли NaH (3,0 г, 60% в масле, 75,0 ммоль). Реакционную смесь перемешивали при температуре 24°C в атмосфере азота в течение 30 мин. Добавляли раствор 3-бром-2-хлор-5-(трифторметил)пиридина (13,0 г, 50,0 ммоль) в безводном ТГФ (20 мл) и реакционную смесь перемешивали при температуре 80°C в течение 3 ч; завершение реакции подтверждали с помощью ЖХ-МС. Реакционную смесь гасили насыщенным хлоридом аммония (100 мл). Смесь экстрагировали этилацетатом (3×100 мл). Органические фазы объединяли, сушили над сульфатом магния и фильтровали. Фильтрат концентрировали и отделяли с помощью быстрой хроматографии на колонке силикагеля (элюент: ПЭ : ЭА = 0-50%] с получением 3-бром-2-(2-((трет-бутилдиметилсилил)окси) этокси)-5-(трифторметил)пиридина (9,8 г, 49%).
1H ЯМР (500 МГц, CDCl3) δ 8,25 (dd, J=2,5, 1,3 Гц, 1H), 7,92 (d, J=2,4 Гц, 1H), 4,42 (t, J=5,8 Гц, 2H), 3,91 (t, J=5,8 Гц, 2H), 0,80 (s, 9H), 0,00 (s, 6H). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 400 [M+H]+.
Этап 2. Синтез 3-(бензилтио)-2-(2-((трет-бутилдиметилсилил)окси)этокси)-5-(трифторметил)пиридина
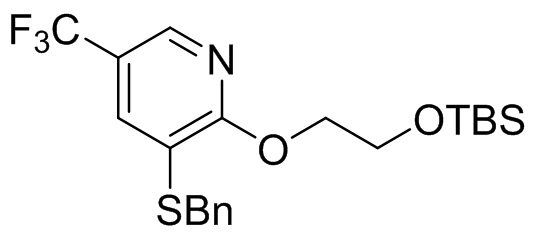
3-бром-2-(2-((трет-бутилдиметилсилил)окси)этокси)-5-(трифторметил)пиридин (3,0 г, 7,5 ммоль), бензилтиол (930 мг, 7,5 ммоль), Pd2(dba)3 (300 мг), ксантфос (300 мг) и диизопропилэтиламин (1,9 г, 15,0 ммоль) перемешивали в 1,4-диоксане (50 мл). Реакционную смесь перемешивали при температуре 100°C в атмосфере азота в течение 16 ч; завершение реакции подтверждали с помощью ЖХ-МС. Реакционную смесь концентрировали, а остаток отделяли с помощью быстрой хроматографии на колонке силикагеля с получением 3-(бензилтио)-2-(2-((трет-бутилдиметилсилил)окси)этокси)-5-(трифторметил)пиридина (2,8 г, 84%) (ПЭ : ЭА = 0-5%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 444 [M+H]+.
Этап 3. Синтез 2-(2-гидроксиэтокси)-5-(трифторметил)пиридин-3-сульфонилхлорида
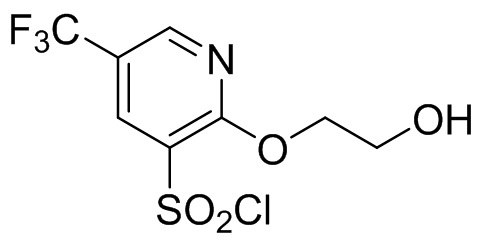
3-(бензилтио)-2-(2-((трет-бутилдиметилсилил)окси)этокси)-5-(трифторметил)пиридин (2,8 г, 6,32 ммоль) и дихлоргидантоин (2,7 г, 13,9 ммоль) растворяли в уксусной кислоте (50 мл) и H2O (15 мл). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч; завершение реакции подтверждали с помощью ЖХ-МС. Реакционную смесь концентрировали. Остаток растворяли в ДХМ (100 мл), последовательно промывали насыщенным NaHCO3 (50 мл), H2O (50 мл) и солевым раствором (50 мл). Органические фазы сушили над сульфатом магния и фильтровали. Фильтрат концентрировали, остаток отделяли с помощью быстрой хроматографии на колонке силикагеля с получением 2-(2-гидроксиэтокси)-5-(трифторметил)пиридин-3-сульфонилхлорида (930 мг, 48%) (ДХМ : MeOH = 0-5%).
1H ЯМР (500 МГц, CDCl3) δ 8,68 (d, J=2,3 Гц, 1H), 8,40 (d, J=2,3 Гц, 1H), 4,70 (t, J=5,8 Гц, 2H), 4,00 (t, J=5,8 Гц, 2H), 2,14 (br, 1H). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 306 [M+H]+.
Этап 4. Синтез трет-бутил-(S)-8-бром-6-((2-(2-гидроксиэтокси)-5-(трифторметил) пиридин-3-ил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-карбоксилата
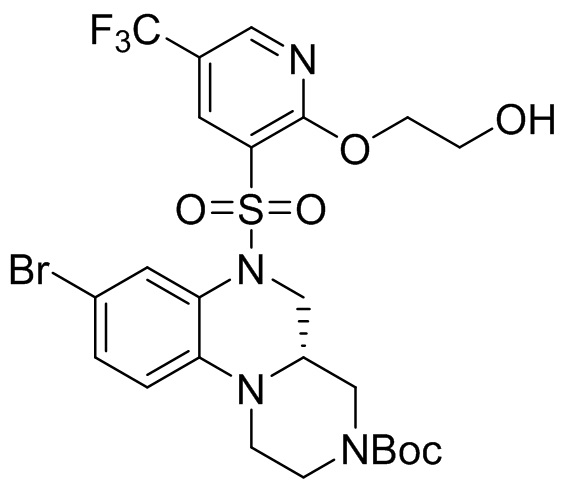
2-(2-гидроксиэтокси)-5-(трифторметил)пиридин-3-сульфонилхлорид (170 мг, 0,56 ммоль), трет-бутил-(R)-8-бром-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-карбоксилат (205 мг, 0,56 ммоль) и диизопропилэтиламин (145 мг, 1,11 ммоль) растворяли в ацетонитриле (10 мл). Реакционную смесь перемешивали при температуре 50°C в течение 16 ч; завершение реакции подтверждали с помощью ЖХ-МС. Реакционную смесь концентрировали, а остаток отделяли с помощью быстрой хроматографии на колонке силикагеля с получением трет-бутил-(S)-8-бром-6-((2-(2-гидроксиэтокси)-5-(трифторметил)пиридин-3-ил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-карбоксилата (350 мг, 90%) (ПЭ : ЭА = 0-25%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 637 [M+H]+.
Этап 5. Синтез трет-бутил (S)-8-(3-(дифторметокси)-5-фторфенил)-6-((2-(2-гидроксиэтокси)-5-(трифторметил)пиридин-3-ил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-карбоксилата
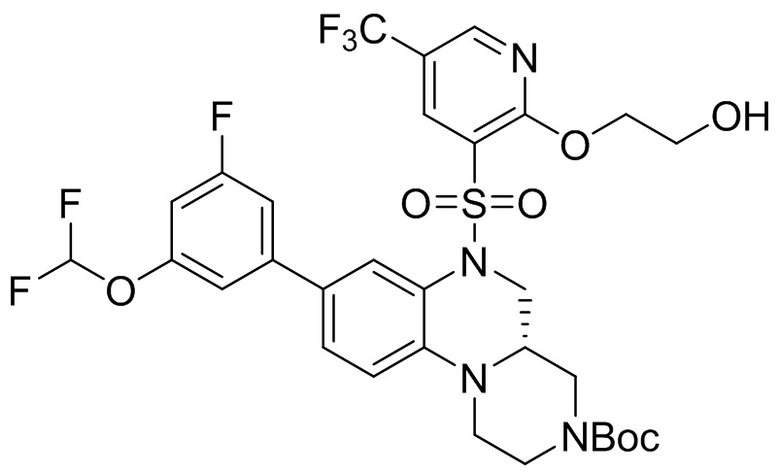
Трет-бутил (S)-8-бром-6-((2-(2-гидроксиэтокси)-5-(трифторметил)пиридин-3-ил) сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-карбоксилат (350 мг, 0,55 ммоль), пинакол 3-дифторметокси-5-фторбензолборат (237 мг, 0,82 ммоль), Pd(dppf)Cl2 (50 мг) и карбонат калия (228 мг, 1,65 ммоль) добавляли в 1,4-диоксан (15 мл) и H2O (5 мл). Реакционную смесь перемешивали при температуре 100°C в атмосфере азота в течение 16 ч; завершение реакции подтверждали с помощью ЖХ-МС. Реакционную смесь концентрировали. Остаток растворяли в ДХМ (50 мл) и H2O (50 мл). Органические фазы сушили над сульфатом магния и фильтровали. Фильтрат концентрировали, остаток отделяли с помощью быстрой хроматографии на колонке силикагеля (элюент: ПЭ : ЭА = 0-25%] с получением трет-бутил (S)-8-(3-(дифторметокси)-5-фторфенил)-6-((2-(2-гидроксиэтокси)-5-(трифторметил)пиридин-3-ил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-карбоксилата (280 мг, 71%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 719 [M+H]+.
13. Трет-бутил-(S)-6-((2-(2-гидроксиэтокси)-5-(трифторметил)пиридин-3-ил) сульфонил)-8-(2,2,6, 6-тетраметил-3,6-дигидро-2H-пиран-4-ил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-карбоксилат
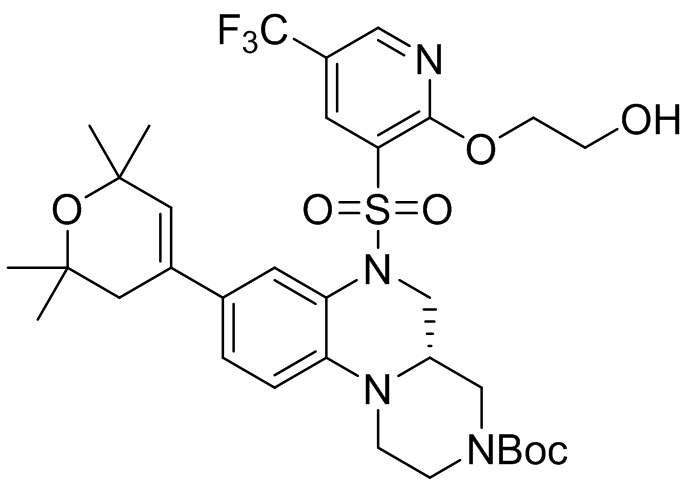
Дана ссылка на получение трет-бутил (S)-8-(3-(дифторметокси)-5-фторфенил)-6-((2-(2-гидроксиэтокси)-5-(трифторметил)пиридин-3-ил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-карбоксилата. Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 697 [M+H]+.
14. Получение (S)-2-(8-бром-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)уксусной кислоты
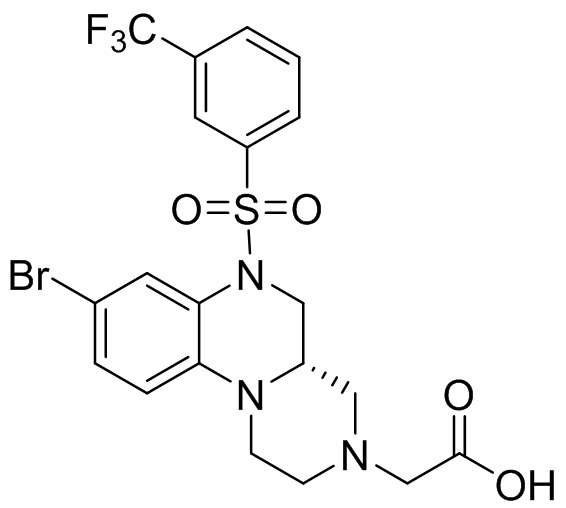
Этап 1. Синтез (S)-8-бром-6-((3-(трифторметил))фенил)сульфонил)-2,3,4,4a,5,6-гексагидро-1H-пиразино[1,2-a]хиноксалина
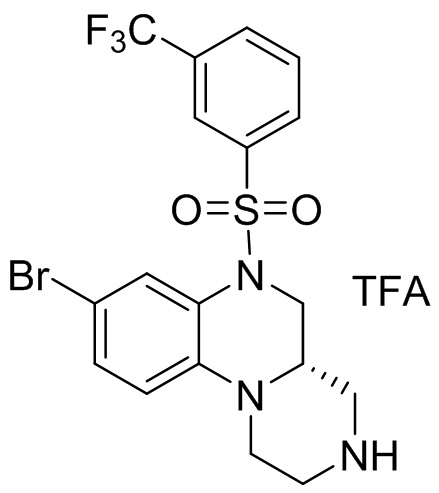
Трет-бутил (S)-8-бром-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-карбоксилат (350 мл, 0,6 ммоль) растворяли в дихлорметане (3 мл). К раствору добавляли трифторуксусную кислоту (1 мл). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Растворитель удаляли путем концентрирования с получением неочищенного (S)-8-бром-6-((3-(трифторметил) фенил)сульфонил)-2,3,4,4a,5,6-гексагидро-1H-пиразино[1,2-a]хиноксалина (360 мг, неочищенный). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 476,0 [M+H]+.
Этап 2. Синтез метил-(S)-2-(8-бром-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a, 5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)ацетата
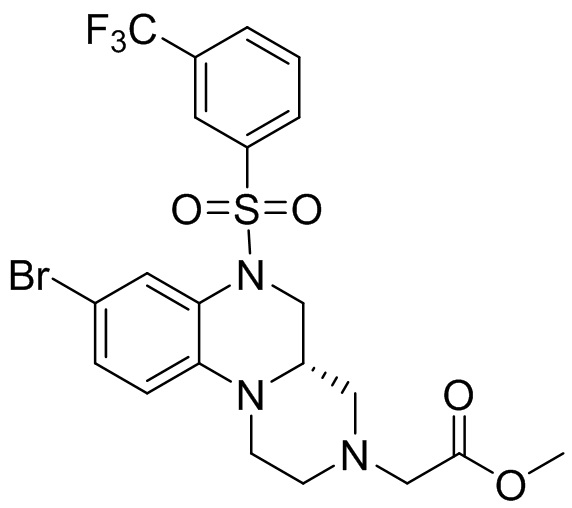
(S)-8-бром-6-((3-(трифторметил)фенил)сульфонил)-2,3,4,4a,5,6-гексагидро-1H-пиразино[1,2-a]хиноксалин (300 мг, 0,52 ммоль) растворяли в диметилсульфоксиде (3 мл). Добавляли карбонат калия (215 мг, 1,56 ммоль) и метилбромацетат (159 мг, 1,04 ммоль). Реакционную смесь перемешивали при температуре 50°C в течение 2 ч. После завершения реакции в реакционную смесь добавляли воду (10 мл) и экстрагировали этилацетатом (10 м × 3). Органические фазы объединяли, трижды промывали водой (20 мл × 3), сушили над безводным сульфатом натрия и концентрировали. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля [элюент : ЭтАц : ПЭ = 0-30%] с получением метил-(S)-2-(8-бром-6-((3-(трифторметил)фенил)сульфонил)-1, 2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)ацетата (210 мг, 73%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 548,2 [M+H]+.
Этап 3. Синтез (S)-2-(8-бром-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)уксусной кислоты

Метил-(S)-2-(8-бром-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)ацетат (210 мг, 0,38 ммоль) растворяли в тетрагидрофуране (6 мл) и воде (2 мл). Добавляли литий гидроксид моногидрат (92 мг, 3,8 ммоль). Раствор смеси перемешивали при комнатной температуре в течение 16 ч, концентрировали для удаления растворителя и окисляли разбавленной соляной кислотой. Остаток отделяли с помощью обращенно-фазовой колоночной хроматографии [элюент : H2O : MeCN = 0-50%] с получением (S)-2-(8-бром-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)уксусной кислоты (130 мг, 63%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 534,2 [M+H]+.
15. Получение 2-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензонитрила
3-бром-2-фторбензонитрил (500 мг, 2,5 ммоль), бис(пинаколато)борат (950 мг, 3,5 ммоль), [1,1'-бис(дифенилфосфино)ферроцен]палладия хлорид (185 мг, 0,25 ммоль) и ацетат калия (491 мг, 5,0 ммоль) перемешивали в 1,4-диоксане (6 мл). Трижды вводили азот для замещения воздуха путем откачки. Реакцию в растворе смеси проводили при температуре 100°C в течение 4 ч. После завершения реакции реакционную смесь фильтровали через целит. Фильтрат концентрировали, а остаток отделяли с помощью быстрой хроматографии на колонке силикагеля (элюент: ЭтАц : ПЭ = 0-20%] с получением 2-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензонитрила (450 мг, 73%).
1H ЯМР (400 МГц, CDCl3) δ 7,98 (ddd, J=7,5, 5,6, 1,9 Гц, 1H), 7,71 (ddd, J=7,9, 6,3, 1,9 Гц, 1H), 7,26 (d, J=7,6 Гц, 1H), 1,37 (s, 12H).
16. Получение 3-фтор-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензонитрила
Дана ссылка на получение 2-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил) бензонитрила.
1H ЯМР (400 МГц, CDCl3) δ 7,88 (t, J=1,1 Гц, 1H), 7,71 (dd, J=8,6, 2,7 Гц, 1H), 7,55-7,45 (m, 1H), 1,35 (s, 12H).
17. Получение 4-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензонитрила
Дана ссылка на получение 2-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил) бензонитрила.
1H ЯМР (400 МГц, CDCl3) δ 8,08 (dd, J=5,3, 2,2 Гц, 1H), 7,35 (s, 1H), 7,14 (t, J=8,6 Гц, 1H), 1,37 (s, 12H).
18. Получение 3-хлор-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензонитрила
Дана ссылка на получение 2-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил) бензонитрила.
1H ЯМР (400 МГц, CDCl3) δ 7,97 (dt, J=7,3, 1,1 Гц, 1H), 7,79-7,66 (m, 2H), 1,35 (s, 6H), 1,26 (s, 6H).
19. Получение (R)-8-бром-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-[1,4]оксазино[4,3-a]хиноксалина
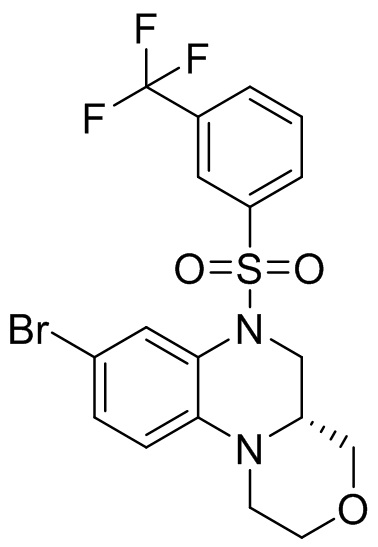
Этап 1. Синтез (S)-4-(4-бром-2-нитрофенил)-морфолин-3-карбоновой кислоты
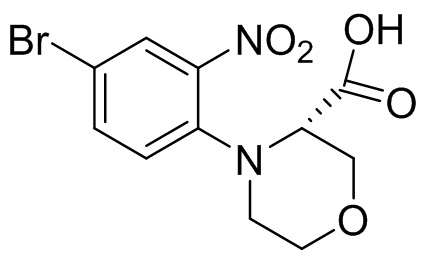
4-бром-1-фтор-2-нитробензол (2,2 г, 10,3 ммоль) растворяли в диметилсульфоксиде (20 мл). Добавляли карбонат цезия (6,6 г, 20,4 ммоль) и (S)-морфолин-3-карбоновую кислоту (0,9 г, 6,8 ммоль). Реакционную смесь перемешивали при температуре 110°C в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры, а затем разбавляли 40 мл этилацетата и промывали солевым раствором (20 мл × 3). Органический слой сушили и концентрировали для удаления растворителя. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля с получением (S)-4-(4-бром-2-нитрофенил)-морфолин-3-карбоновой кислоты (2,0 г, выход: 88,8%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 329, 331[M-H]-.
Этап 2. Синтез (S)-8-бром-1,2,4,4a-тетрагидро-[1,4]оксазино[4,3-a]хиноксалин-5(6H)-она
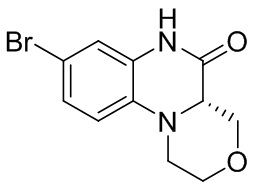
(S)-4-(4-бром-2-нитрофенил)-морфолин-3-карбоновую кислоту (2,0 г, 6,0 ммоль) растворяли в этаноле (20 мл). Добавляли железный порошок (1,7 г, 30 ммоль). Раствор смеси перемешивали при температуре 80°C в течение 2 ч, фильтровали и концентрировали для удаления растворителя. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля с получением (S)-8-бром-1,2,4,4a-тетрагидро-[1,4]оксазино[4,3-a] хиноксалин-5(6H)-она (230 мг, выход: 13,5%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 283, 285 [M+H]+.
Этап 3. Синтез (R)-8-бром-1,2,4,4a,5,6-гексагидро-[1,4]оксазино[4,3-a]хиноксалина
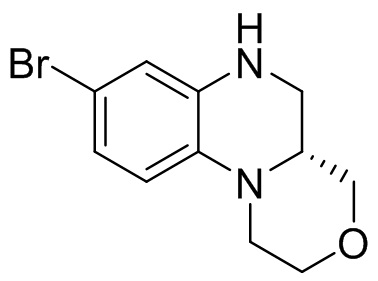
(S)-8-бром-1,2,4,4a-тетрагидро-[1,4]оксазино[4,3-a]хиноксалин-5(6H)-он (230 мг, 0,81 ммоль) растворяли в тетрагидрофуране (15 мл). Добавляли раствор боран-диметилсульфида в тетрагидрофуране (1,3 мл, 2M в ТГФ). Реакционную смесь перемешивали при температуре 30°C в течение 2 ч, охлаждали до 0°C, для остановки реакции добавляли метанол и концентрировали для удаления растворителя. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля с получением (R)-8-бром-1,2,4,4a,5,6-гексагидро-[1,4]оксазино[4,3-a]хиноксалина (190 мг, выход: 87,6%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 269, 271 [M+H]+.
Этап 4. Синтез (R)-8-бром-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-[1,4]оксазино[4,3-a]хиноксалина

(R)-8-бром-1,2,4,4a,5,6-гексагидро-[1,4]оксазино[4,3-a]хиноксалин (190 мг, 0,71 ммоль) растворяли в дихлорметане (5 мл). В раствор добавляли 0,5 мл пиридина и 3-(трифторметил)-бензолсульфонил хлорида (259 мг, 1,06 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Для удаления растворителя реакционную смесь концентрировали. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля с получением (R)-8-бром-6-((3- (трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-[1,4]оксазино[4,3-a]хиноксалина (270 мг, выход: 79,5%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 477, 479 [M+H]+.
20. Получение (S)-8-бром-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-[1,4]оксазино[4,3-a]хиноксалина
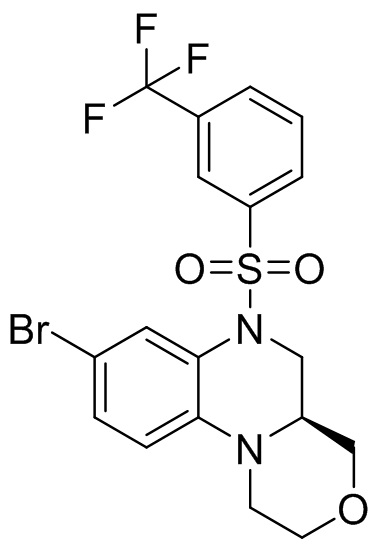
Дана ссылка на получение (R)-8-бром-6-((3-(трифторметил)фенил)сульфонил)-1,2,4, 4a,5,6-гексагидро-[1,4]оксазино[4,3-a]хиноксалина. Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 477, 479 [M+H]+.
21. Получение 8-бром-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро -[1,4]тиазино[4,3-a]хиноксалина
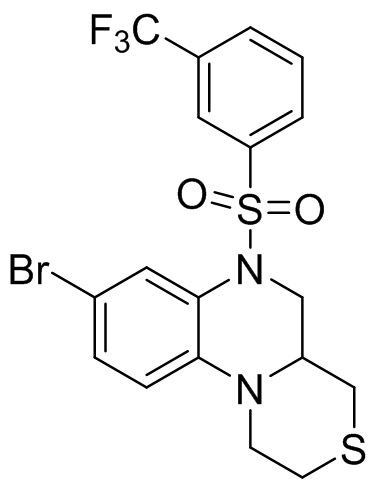
Дана ссылка на получение (R)-8-бром-6-((3-(трифторметил)фенил)сульфонил)-1,2,4, 4a,5,6-гексагидро-[1,4]оксазино[4,3-a]хиноксалина. Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 493, 495 [M+H]+.
22. Получение (6aS)-3-бром-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-ола
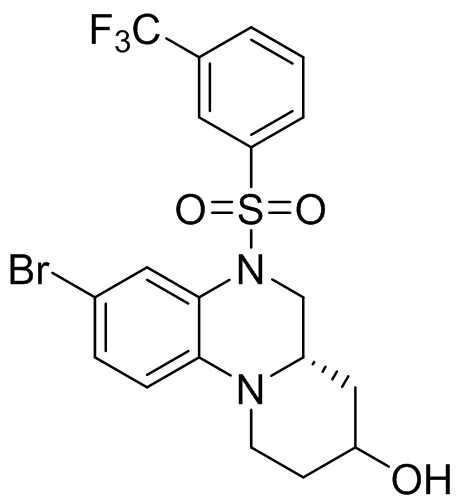
Этап 1. Синтез (S)-1-(4-бром-2-нитрофенил)-4-оксопиперидин-2-карбоновой кислоты

(S)-1-(трет-бутоксикарбонил)-4-оксопиперидин-2-карбоновую кислоту (5,0 г, 20,5 ммоль) растворяли в 4M растворе хлористого водорода в диоксане (20 мл) и перемешивали при температуре 25°C в течение 1 ч. Растворитель удаляли путем концентрирования. Остаток растворяли в диметилсульфоксиде (20 мл). К раствору добавляли карбонат цезия (16,7 г, 51,2 ммоль) и 4-бром-1-фторо-2-нитробензол. Реакцию останавливали после перемешивания раствора смеси при температуре 100°C в течение 2 ч, охлаждали до комнатной температуры, разбавляли 40 мл этилацетата, промывали водой (20 мл × 2), солевым раствором (20 мл × 2), сушили над безводным сульфатом натрия и концентрировали для удаления растворителя. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля с получением (S)-1-(4-бром-2-нитрофенил)-4-оксопиперидин-2-карбоновой кислоты (4,0 г, выход: 56,9%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 341, 343 [M-H]-.
Этап 2. Синтез (2S)-1-(4-бром-2-нитрофенил)-4-гидроксипиперидин-2-карбоновой кислоты

(S)-1-(4-бром-2-нитрофенил)-4-оксопиперидин-2-карбоновую кислоту (4,0 г, 11,6 ммоль) растворяли в метаноле (20 мл). Добавляли боргидрид натрия (1,3 г, 34,8 ммоль). Раствор смеси перемешивали при температуре 25°C в течение 2 ч и концентрировали для удаления растворителя. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля с получением (2S)-1-(4-бром-2-нитрофенил)-4-гидроксипиперидин-2- карбоновой кислоты (3,4 г, выход: 85,0%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 343, 345 [M-H]-.
Этап 3. Синтез (6aS)-3-бром-8-гидрокси-7,8,9,10-тетрагидро-5H-пиридо[1,2-a] хиноксалин-6(6aH)-она
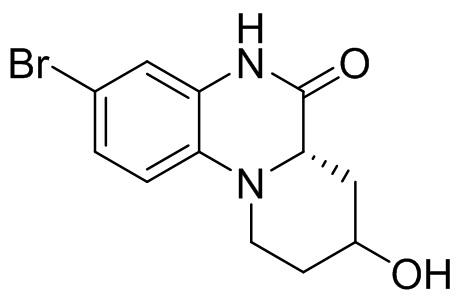
(2S)-1-(4-бром-2-нитрофенил)-4-гидроксипиперидин-2-карбоновую кислоту (3,4 г, 9,8 ммоль) растворяли в этаноле (20 мл). Добавляли железный порошок (2,7 мг, 49,0 ммоль) и хлорид аммония (2,6 мг, 49,0 ммоль). Раствор смеси перемешивали при температуре 80°C в течение 2 ч, фильтровали и концентрировали для удаления растворителя. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля с получением (6aS)-3-бром-8-гидрокси-7,8,9,10-тетрагидро-5H-пиридо[1,2-a]хиноксалин-6(6aH)-она (2,0 г, выход: 68,9%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 297, 299 [M+H]+.
Этап 4. Синтез (6aS)-3-бром-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-ола
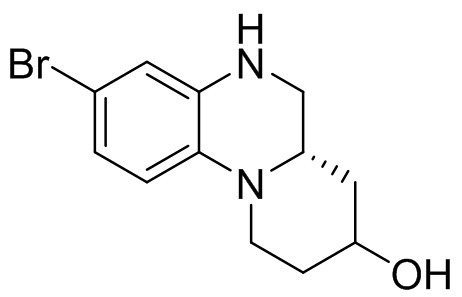
(6aS)-3-бром-8-гидрокси-7,8,9,10-тетрагидро-5H-пиридо[1,2-a]хиноксалин-6(6aH)-он (2,0 г, 6,7 ммоль) растворяли в 4M боран-тетрагидрофуране (20 мл). Реакционную смесь перемешивали при температуре 30°C в течение 2 ч. Для завершения реакции по каплям добавляли метанол. Для удаления растворителя реакционную смесь концентрировали. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля с получением (6aS)-3-бром-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-ола (1,7 г, выход: 89,5%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 283, 285 [M+H]+.
Этап 5. Синтез (6aS)-3-бром-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-ола
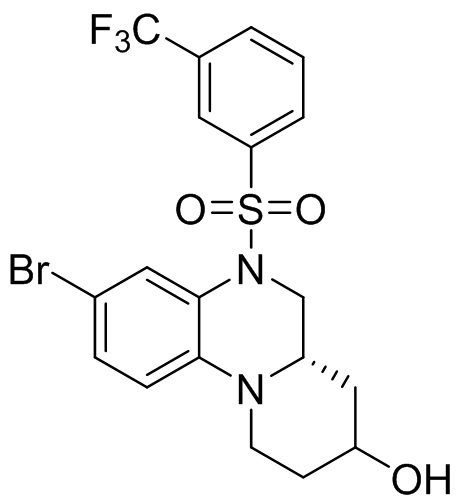
(6aS)-3-бром-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-ол (1,7 мг, 6,0 ммоль) растворяли в дихлорметане (20 мл). Добавляли пиридин (1,0 мл), диметиламинопиридин (0,15 г, 1,2 ммоль) и 3-(трифторметил)бензолсульфонилхлорид (1,47 г, 6,0 ммоль). Реакцию в растворе смеси проводили при температуре 25°C в течение 4 ч. Растворитель удаляли путем концентрирования. Остаток растворяли в этилацетате (30 мл), последовательно промывали водой (20 мл), насыщенным водным раствором гидрокарбоната натрия (20 мл) и солевым раствором (20 мл), сушили над безводным сульфатом натрия, а затем концентрировали для удаления растворителя. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля с получением (6aS)-3-бром-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-ола (1,6 г, выход: 54,2%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 491, 493 [M+1]+.
23. Получение (S)-3-бром-5-((3-(трифторметил)фенил)сульфонил)-5,6,6a,7,9,10-гексагидро-8H-пиридо[1,2-a]хиноксалин-8-она
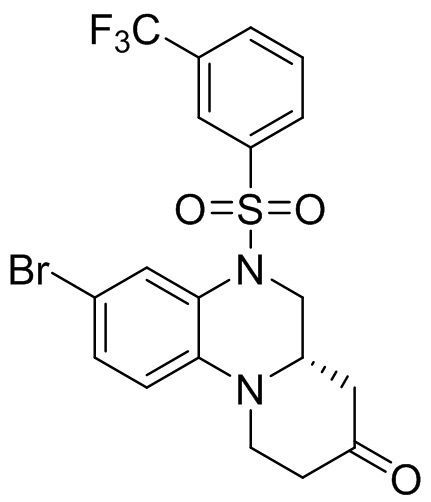
(6aS)-3-бром-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-ол (250 мг, 0,5 ммоль) растворяли в дихлорметане (10 мл). Добавляли окислитель Десса - Мартина (318 мг, 0,75 ммоль). Реакцию в растворе смеси проводили при температуре 25°C в течение 4 ч. Реакционную смесь фильтровали для удаления нерастворимого материала. Раствор промывали раствором бикарбоната натрия (15 мл) и концентрировали для удаления растворителя. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля с получением (S)-3-бром-5-((3-(трифторметил)фенил)сульфонил)-5,6,6a,7,9,10-гексагидро-8H-пиридо[1,2-a]хиноксалин-8-она (240 мг, выход: 98,3%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 489, 491 [M+1]+.
II. Получение соединений в качестве примеров
Пример 1. Получение 6-(3-(дифторметокси)-5-фторфенил)-1-метил-4-((3-(трифторметил)фенил)сульфонил)-1,2,3,4-тетрагидрохиноксалина
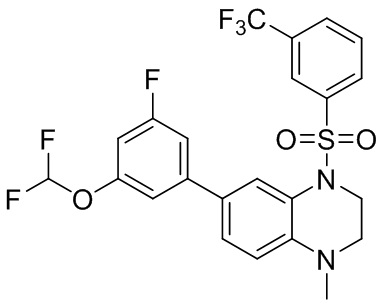
6-Бром-1-метил-4-((3-(трифторметил)сульфонил)-1,2,3,4-тетрагидрохиноксалин (100 мг, 95%, 0,23 ммоль) и 2-(3-(дифторметокси)-5-фторфенил)-4,4,5,5-тетраметил-1,3,2- диоксаборолан (90 мг, 95%, 0,30 ммоль) растворяли в смеси растворителей толуол : этанол : вода = 3:2:2 (14 мл). Добавляли карбонат натрия (66 мг, 0,62 ммоль) и тетракис(трифенилфосфин)палладий (27 мг, 0,023 ммоль). Реакционную смесь нагревали до температуры 90°C в течение ночи; реакционную смесь охлаждали, а затем разбавляли этилацетатом и промывали солевым раствором (30 мл). Органические фазы сушили над безводным сульфатом натрия, фильтровали и концентрировали. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля [элюент : ЭА : ПЭ = 0-50%] с получением 6-(3-(дифторметокси)-5-фторфенил)-1-метил-4-((3-(трифторфенил)фенил) сульфонил)-1,2,3,4-тетрагидрохиноксалина (5,1 мг, 95%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 517,2 [M+1]+.
1H ЯМР (400 МГц, CDCl3) δ 7,81-7,78 (m, 3H), 7,73 (d, J=8,0 Гц, 1H), 7,56 (t, J=8,0 Гц, 1H), 7,35 (dd, J=8,8, 2,0 Гц, 1H), 7,16-7,13 (m, 1H), 7,11 (s, 1H), 6,79-6,76 (m, 1H),6,63 (d, J=8,8 Гц, 1H), 6,57 (t, J=73,2 Гц, 1H), 3,90 (t, J=5,6 Гц, 1H), 2,92 (t, J=5,6 Гц, 1H), 2,66 (s, 3H).
Пример 2. Получение 7-(3-(дифторметокси)-5-фторфенил)-1-((3-(трифторметил)фенил) сульфонил)-1,2,3,4-тетрагидрохиноксалина

Этап 1. Синтез трет-бутил 6-(3-(дифторметокси)-5-фторфенил)-4-((3-(трифторметил) фенил)сульфонил)-3,4-дигидрохиноксалин-1(2H)-карбоксилата
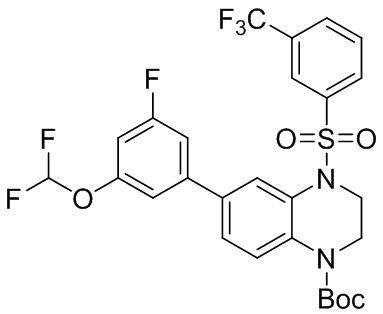
Трет-бутил-6-бром-4-((3-(трифторметил)фенил)сульфонил)-3,4-дигидрохиноксалин-1(2H)-карбоксилат (277 мг, 95%, 0,50 ммоль) и 2-(3-(дифторметокси)-5-фторфенил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан (229 мг, 95%, 0,75 ммоль) растворяли в смеси растворителей толуол : этанол : вода = 3:2:2 (14 мл). Добавляли карбонат натрия (106 мг, 1,0 ммоль) и тетракис(трифенилфосфин)палладий (60 мг, 0,05 ммоль). Реакционную смесь нагревали до температуры 90°C в течение ночи; реакционную смесь охлаждали, а затем разбавляли этилацетатом и промывали солевым раствором (30 мл). Органические фазы сушили над безводным сульфатом натрия, фильтровали и концентрировали. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля [элюент : ЭА : ПЭ = 0-60%] с получением трет-бутил 6-(3-(дифторметокси)-5-фторфенил)-4-((3- (трифторметил) фенил)сульфонил)-3,4-дигидрохиноксалин-1(2H)-карбоксилата (100 мг, 88%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 503,2 [M-100]+.
Этап 2. Синтез 7-(3-(дифторметокси)-5-фторфенил)-1-((3-(трифторметил)фенил) сульфонил)-1,2,3,4-тетрагидрохиноксалина
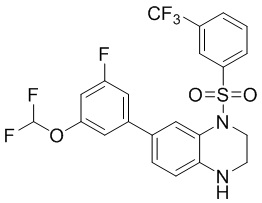
Трет-бутил 6-(3-(дифторметокси)-5-фторфенил)-4-((3-(трифторметил)фенил) сульфонил)-3,4-дигидрохиноксалин-1(2H)-карбоксилат (100 мг, 88%, 0,146 ммоль) растворяли в дихлорметане (5 мл). Добавляли раствор хлористого водорода (4N в 1,4-диоксане) (0,12 мл, 0,438 ммоль). Реакцию оставляли протекать в течение ночи при комнатной температуре. Реакционную смесь концентрировали; добавляли к ней этилацетат (30 мл). Раствор промывали насыщенным бикарбонатом натрия (10 мл × 2). Органические фазы сушили над безводным сульфатом натрия, фильтровали и концентрировали. Остаток отделяли с помощью обращенно-фазовой колоночной хроматографии [C18, 45 г, 0-100% ацетонитрил : 0,01 мМ трифторуксусная кислота / вода] с получением 7-(3-(дифторметокси)-5-фторфенил)-1-((3-(трифторметил)фенил)сульфонил)-1,2,3,4-дигидрохиноксалина (8,2 мг, 95%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 503,2 [M+1]+.
1H ЯМР (400 МГц, метанол-d4) δ 7,92 (d, J=7,6 Гц, 1H), 7,84 (d, J=8,0 Гц, 1H), 7,82 (d, J=2,4 Гц, 1H), 7,76 (s, 1H), 7,71 (t, J=8,0 Гц, 1H), 7,30 (dd, J=8,4, 2,0 Гц, 1H), 7,18-7,11 (m, 2H), 6,93 (t, J=74 Гц, 1H), 6,84-6,81 (m, 1H), 6,59 (d, J=8,4 Гц, 1H), 3,83 (t, J=5,2 Гц, 2H), 2,93 (t, J=5,2 Гц, 2H).
Пример 3. Получение (S,E)-3-(6-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-1-метил-4-((3- (трифторметил)фенил)сульфонил)-1,2,3,4-тетрагидрохиноксалин-2-ил)пропановой кислоты
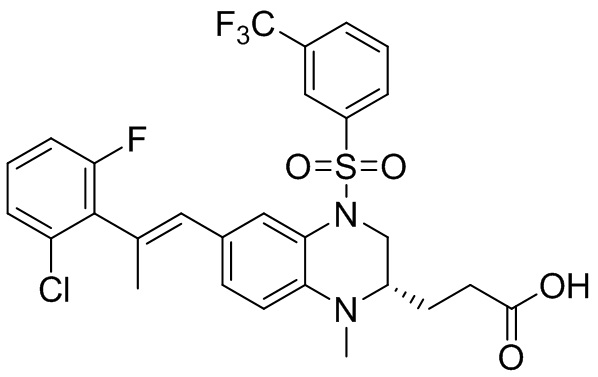
Этап 1. Синтез (S,E)-3-(6-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-1-метил-4-((3-(трифторметил)фенил)сульфонил)-1,2,3,4-тетрагидрохиноксалин-2-ил)пропаноата
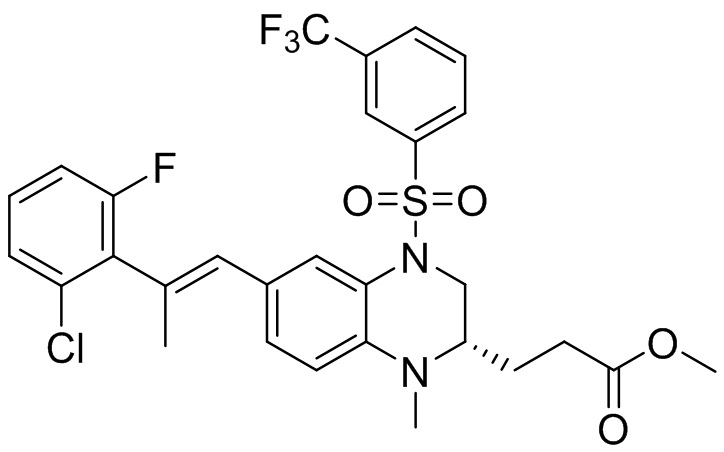
Метил (S)-3-(6-бром-1-метил-4-((3-(трифторметил)фенил)сульфонил)-1,2,3,4-тетрагидрохиноксалин-2-ил)пропаноат (60 мг, 95%, 0,11 ммоль) и (E)-2-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан (52 мг, 95%, 0,16 ммоль) растворяли в смеси растворителей толуол : этанол : вода = 3:2:2 (7 мл). Добавляли карбонат натрия (18 мг, 0,17 ммоль) и тетракис(трифенилфосфин)палладий (10 мг, 0,01 ммоль). Реакционную смесь нагревали до температуры 90°C в течение ночи. Реакционную смесь охлаждали. Добавляли несколько капель разбавленной соляной кислоты (1N), чтобы довести pH реакционной смеси приблизительно до 7. Органические фазы отделяли и концентрировали. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля [элюент : ЭА : ПЭ = 0-80%] с получением (S,E)-3-(6-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-1-метил-4-((3-(трифторметил)фенил)сульфонил)-1,2,3,4-тетрагидрохиноксалин-2-ил)пропаноата (15 мг, выход: 21,2%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 611,3 [M+1]+.
Этап 2. Синтез (S,E)-3-(6-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-1-метил-4-((3-(трифторметил)фенил)сульфонил)-1,2,3,4-тетрагидрохиноксалин-2-ил)пропановой кислоты
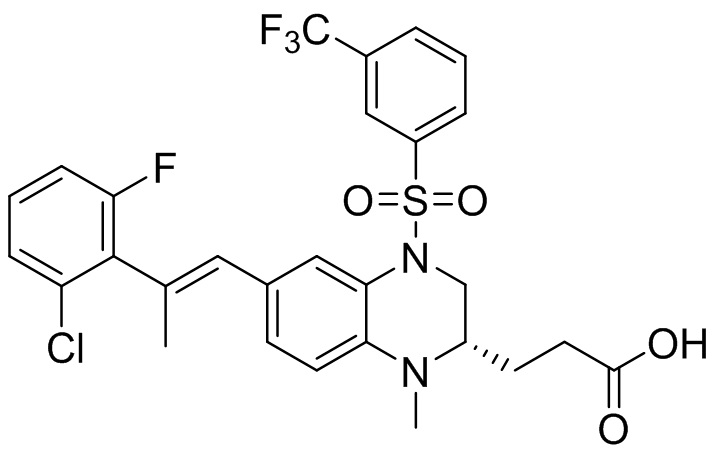
Метил (S,E)-3-(6-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-1-метил-4-((3-(трифторметил) фенил)сульфонил)-1,2,3,4-тетрагидрохиноксалин-2-ил)пропаноат (15 мг, 0,023 ммоль) растворяли в смеси растворителей тетрагидрофуран - вода (3:1, 2 мл). Добавляли литий гидроксид моногидрат (10 мг, 0,23 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь охлаждали до температуры 0°C. Добавляли несколько капель разбавленной соляной кислоты (1N), чтобы довести pH реакционной смеси приблизительно до 6. Органические фазы отделяли и концентрировали. Остаток отделяли с помощью препаративной ТСХ [элюент : MeOH : ДХМ = 10%] с получением (S,E)-3-(6-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-1-метил-4-((3-(трифторметил) фенил)сульфонил)-1,2,3,4-тетрагидрохиноксалин-2-ил)пропановой кислоты (5,1 мг, выход 35,3%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 597,3 [M+1]+.
1H ЯМР (400 МГц, ДМСО-d6) δ 8,15-8,09 (m, 2H), 7,91-7,87 (m, 2H), 7,37-7,32 (m, 2H), 7,27-7,23 (m, 1H),7,18 (d, J=1,6 Гц, 1H), 7,06 (dd, J=8,8, 1,6 Гц, 1H), 6,66 (d, J=8,8 Гц, 1H), 6,23 (s, 1H), 4,01-3,96 (m, 1H), 3,81-3,77 (m, 1H), 3,35-3,24 (m, 2H),2,72 (s, 3H), 2,27-2,21 (m, 2H), 1,97 (s, 3H), 1,84-1,81 (m, 1H), 1,58-1,53 (m, 1H).
Примеры 4-6 получали методом синтеза, указанным в примере 1 или 3.
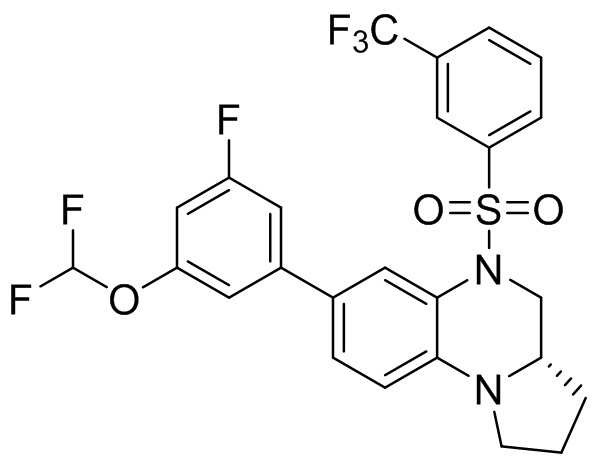
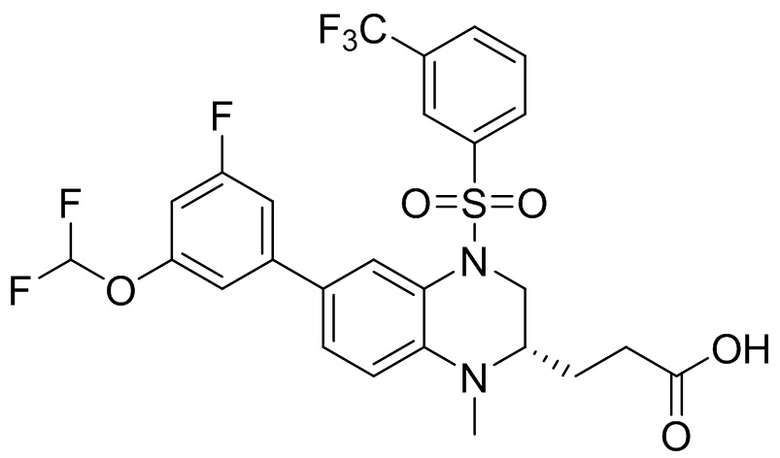
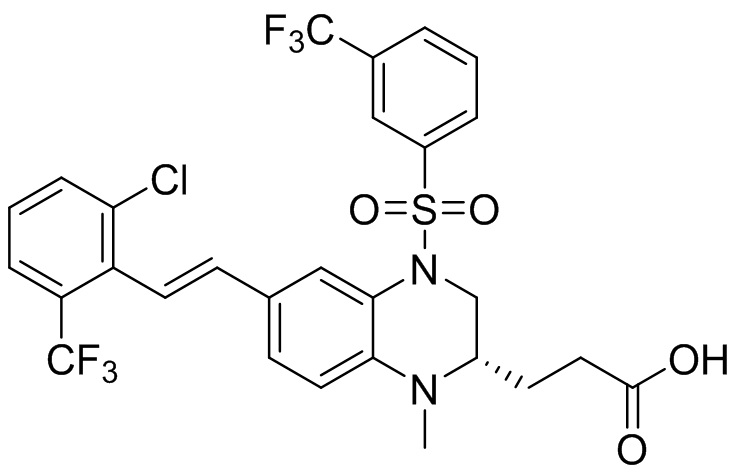
1Данные о соединении, полученные методом ЯМР-спектроскопии на ядрах 1Н, полученном в примерах 4-6:
Пример 4. 1H ЯМР (400 МГц, ДМСО-d6) δ 7,91-7,86 (m, 3H), 7,80 (s, 1H), 7,69 (t, J=8,0 Гц, 1H), 7,42 (dd, J=8,0,2,0 Гц, 1H), 7,18-7,11 (m, 2H), 7,10-6,74 (m, 2H), 6,60 (d, J=8,8 Гц, 1H), 4,62-4,58 (m, 1H), 3,35-3,31 (m, 1H), 2,95-2,87 (m, 1H), 2,72-2,66 (m, 1H), 2,07-1,99 (m, 2H), 1,81-1,68 (m, 1H), 1,38-1,28 (m, 1H).
Пример 5. 1H ЯМР (400 МГц, ДМСО-d6) δ 8,11 (t, J=8,0 Гц, 2H), 7,87 (t, J=8,0 Гц, 2H), 7,54-7,18 (m, 3H), 7,16-7,14 (m, 1H), 7,06 (s, 1H), 7,02-7,00 (m, 1H),6,71 (d, J=8,8 Гц, 1H), 3,95-3,89 (m, 1H), 3,84-3,79 (m, 1H), 3,25-3,21 (m, 2H), 2,69 (s, 3H), 2,25-2,21 (m, 2H), 1,84-1,81 (m, 1H), 1,58-1,52 (m,1H).
Пример 6. 1H ЯМР (400 МГц, ДМСО-d6) δ 8,17 (d, J=8,0 Гц, 1H), 8,09 (d, J=8,0 Гц, 1H), 7,93 (s, 1H), 7,90-7,80 (m, 2H), 7,78-7,75 (m, 1H), 7,51-7,48 (m, 1H),7,29 (d, J=2,0 Гц, 1H), 7,23 (d, J=8,4 Гц, 1H), 6,70 (s, 2H), 6,63 (d, J=8,8 Гц, 1H), 4,03-3,99 (m, 1H), 3,32-3,30 (m, 1H), 2,74 (s, 3H), 2,21-2,15 (m, 2H), 1,85-1,82 (m, 1H), 1,56-1,52 (m, 1H).
Пример 7. Получение (S)-1-(8-(3-(дифторметокси)-5-фторфенил)-6-((3-(трифторметил) фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)этан-1-она
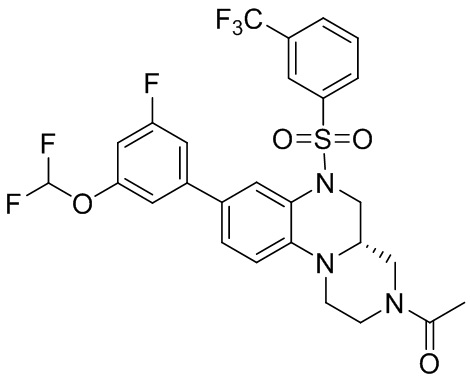
Этап 1. Синтез трет-бутил-(S)-8-(3-(дифторметокси)-5-фторфенил)-6-((3-(трифторметил) фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a] хиноксалин-3-карбоксилата
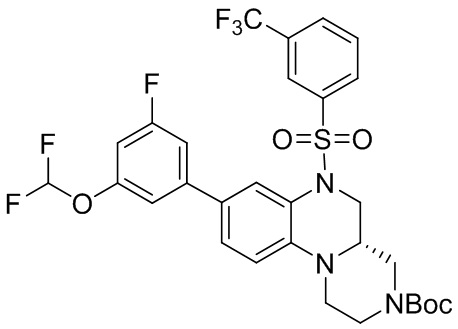
Трет-бутил (S)-8-бром-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-карбоксилат (340 мг, 0,59 ммоль), [1,1'-бис (дифенилфосфино)ферроцен]палладия хлорид (50 мг, 0,059 ммоль), карбонат калия (244 мг, 1,77 ммоль) и 2-(3-(дифторметокси)-5-фторфенил)-4,4,5,5-тетраметил-1,3-диоксалан (221 мг, 0,77 ммоль) помещали в пробирку для проведения реакций под воздействием микроволнового излучения; добавляли 1,4-диоксан (4 мл) и воду (1 мл). Трижды вводили азот для замещения воздуха путем откачки в микроволновом реакторе. Раствор смеси нагревали до температуры 100°C и проводили реакцию в течение получаса. После завершения реакции для удаления растворителя реакционную смесь концентрировали. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля с получением трет-бутил (S)-8-(3-(дифторметокси)-5-фторфенил)-6-((3-(трифторметил)фенил) сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-карбоксилата (300 мг, 77%).
Этап 2. Синтез (S)-8-(3-(дифторметокси)-5-фторфенил)-6-((3-(трифторметил) фенил) сульфонил)-2,3,4,4a,5,6-гексагидро-1H-пиразино[1,2-a]хиноксалина
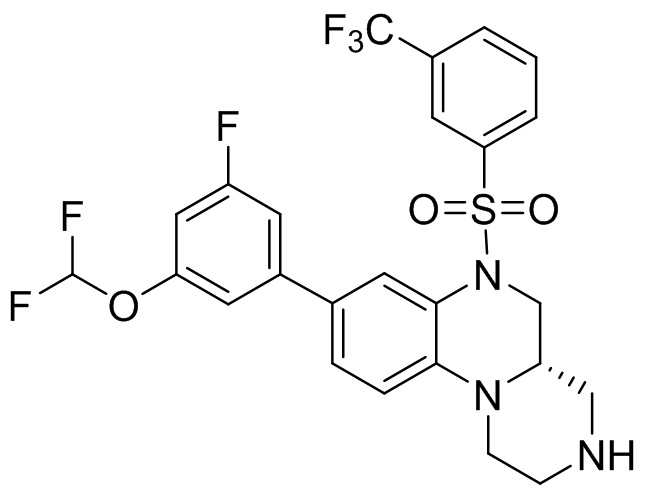
Трет-бутил (S)-8-(3-(дифторметокси)-5-фторфенил)-6-((3-(трифторметил)фенил) сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-карбоксилат (300 мг, 0,46 ммоль) растворяли в дихлорметане (5 мл). К раствору добавляли трифторуксусную кислоту (1 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Для удаления растворителя реакционную смесь концентрировали. Остаток промывали насыщенным раствором гидрокарбоната натрия, экстрагировали этилацетатом, сушили и концентрировали с получением (S)-8-(3-(дифторметокси)-5-фторфенил)-6-((3-(трифторметил)фенил)сульфонил)-2,3,4,4a,5,6-гексагидро-1H-пиразино[1,2-a]хиноксалина (240 мг, 93%).
Этап 3. Синтез (S)-1-(8-(3-(дифторметокси)-5-фторфенил)-6-((3-(трифторметил)фенил) сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)этан-1-она
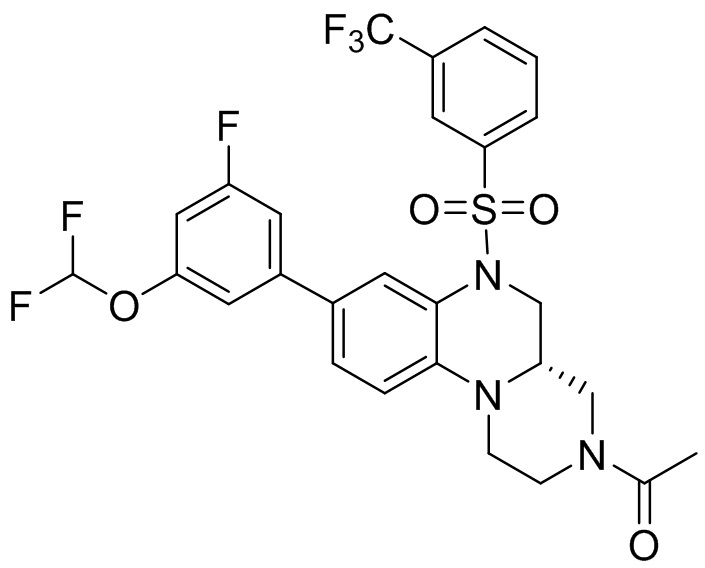
(S)-8-(3-(дифторметокси)-5-фторфенил)-6-((3-(трифторметил)фенил)сульфонил)-2,3,4,4a,5,6-гексагидро-1H-пиразино[1,2-a]хиноксалин (50 мг, 0,09 ммоль) растворяли в пиридине (1 мл), раствор смеси охлаждали до температуры 0°C. Добавляли ацетилхлорид (0,2 мл). Реакционную смесь перемешивали при температуре 0°C в течение получаса, добавляли метанол для остановки реакции и концентрировали для удаления растворителя. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля с получением (S)-1-(8-(3-(дифторметокси)-5-фторфенил)-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)этан-1-она (24 мг, 44%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 600 [M+1]+.
1H ЯМР (500 МГц, CDCl3) δ 7,92-7,56 (m, 5H), 7,38 (dd, J=8,8, 2,2 Гц, 1H), 7,16-7,09 (m, 2H), 6,84-6,74 (m, 2H), 6,57 (t, J=73,3 Гц, 1H), 4,48 (s, 1H), 4,28 (dd, J=14,3, 4,4 Гц, 1H), 3,78-3,57 (m, 2H), 3,34 (m, 1H), 3,15 (m, 0,5H), 2,72-2,82 (m, 1H), 2,59 (m, 1H), 2,08-2,38 (m,1,5H), 2,08 (s, 3H).
Пример 8. Получение (S)-8-(3-(дифторметокси)-5-фторфенил)-3-(метилсульфонил)-6- ((3-(трифторметил)фенил)сульфонил)-2,3,4,4a,5,6-гексагидро-1H-пиразино[1,2-a]хиноксалина
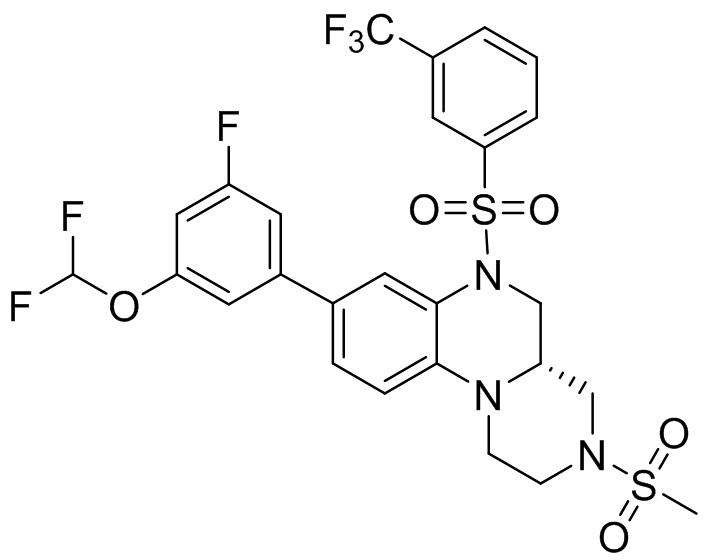
(S)-8-(3-(дифторметокси)-5-фторфенил)-6-((3-(трифторметил)фенил)сульфонил)-2,3,4,4a,5,6-гексагидро-1H-пиразино[1,2-a]хиноксалин (50 мг, 0,09 ммоль) растворяли в пиридине (1 мл), раствор смеси охлаждали до температуры 0°C. Добавляли метансульфонилхлорид (0,2 мл). Реакционную смесь перемешивали при температуре 0°C в течение получаса, добавляли метанол для остановки реакции и концентрировали для удаления растворителя. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля с получением (S)-8-(3-(дифторметокси)-5-фторфенил)-3-(метилсульфонил)-6-((3-(трифторметил)фенил)сульфонил)-2,3,4,4a,5,6-гексагидро-1H-пиразино[1,2-a]хиноксалина (20 мг, 35%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 636 [M+1]+.
1H ЯМР (500 МГц, CDCl3) δ 7,89-7,77 (m, 3H), 7,70-7,61 (m, 2H), 7,38 (dd, J=8,8, 2,2 Гц, 1H), 7,17-7,08 (m, 2H), 6,81 (dd, J=11,0, 8,9 Гц, 2H), 6,57 (t, J=73,3 Гц, 1H), 4,26 (dd, J=14,4, 4,6 Гц, 1H), 3,76-3,59 (m, 3H), 3,39 (dd, J=14,4, 9,8 Гц, 1H), 2,80-2,65 (m, 5H), 2,49 (td, J=12,4, 3,3 Гц, 1H), 2,37 (t, J=10,8 Гц, 1H).
Пример 9. Получение (S)-2-(8-(3-(дифторметокси)-5-фторфенил)-6-((3-(трифторметил) фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)уксусной кислоты
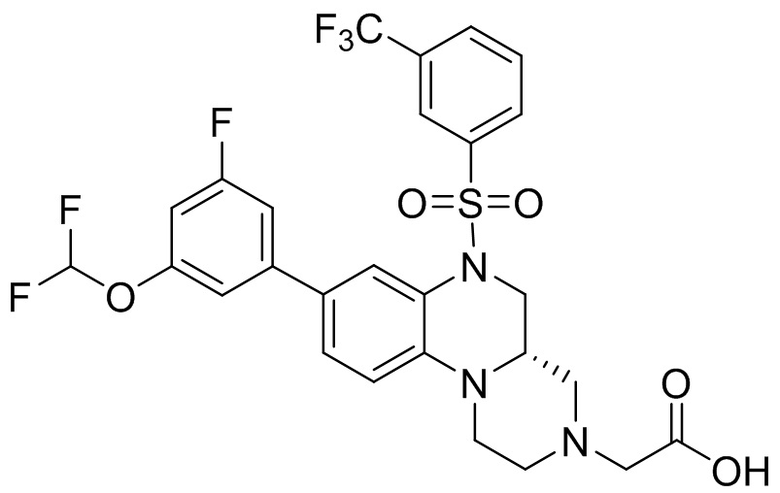
Этап 1. Синтез метил (S)-2-(8-(3-(дифторметокси)-5-фторфенил)-6-((3-(трифторметил) фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)ацетата
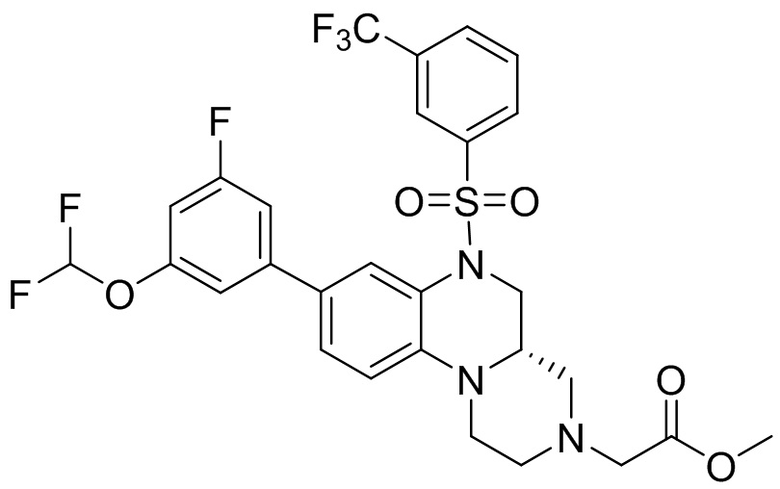
(S)-8-(3-(дифторметокси)-5-фторфенил)-6-((3-(трифторметил)фенил)сульфонил)-2,3,4,4a,5,6-гексагидро-1H-пиразино[1,2-a]хиноксалин (50 мг, 0,09 ммоль) растворяли в N,N-диметилформамиде (2 мл). К раствору добавляли карбонат цезия (88 мг, 0,27 ммоль) и метилбромацетат (14 мг, 0,45 ммоль). Реакционную смесь перемешивали при температуре 95°C в течение 5 ч. Для удаления растворителя реакционную смесь концентрировали. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля с получением неочищенного метил-(S)-2-(8-(3-(дифторметокси)-5-фторфенил)-6-((3-(трифторметил) фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)ацетата.
Этап 2. Синтез (S)-2-(8-(3-(дифторметокси)-5-фторфенил)-6-((3-(трифторметил)фенил) сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)уксусной кислоты

Неочищенный метил-(S)-2-(8-(3-(дифторметокси)-5-фторфенил)-6-((3-(трифторметил) фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)ацетат растворяли в метаноле (2 мл). К раствору добавляли литий гидроксид моногидрат (38 мг) и воду (1 мл). Раствор смеси перемешивали при комнатной температуре в течение 4 ч. Для удаления растворителя реакционную смесь концентрировали и окисляли разбавленной соляной кислотой. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля с получением (S)-2-(8-(3-(дифторметокси)-5-фторфенил)-6-((3-(трифторметил) фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)уксусной кислоты (5 мг, 9%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 616 [M+1]+.
1H ЯМР (500 МГц, CDCl3) δ 7,88 (s, 1H), 7,80 (d, J=9,1 Гц, 2H), 7,64 (s, 2H), 7,04 (d, J=13,5 Гц, 2H), 6,79 (d, J=10,1 Гц, 2H), 6,54 (m, 1H), 4,24 (s, 1H), 3,41 (m, 7H), 2,78 (m, 1H), 2,57 (s, 1H), 2,29 (s, 1H).
Пример 10. Получение (S,E)-8-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-6-((3-(трифторметил)фенил)сульфонил)-2,3,4,4a,5,6-гексагидро-1H-пиразино[1,2-a]хиноксалина

Этап 1. Синтез трет-бутил (S,E)-8-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-карбоксилата
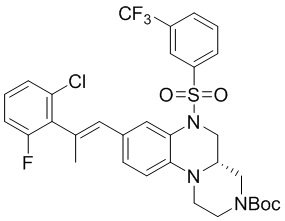
Трет-бутил (S)-8-бром-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-карбоксилат (340 мг, 0,59 ммоль), [1,1'-бис (дифенилфосфино)ферроцен]палладий хлорид (98 мг, 0,12 ммоль), карбонат калия (244 мг, 1,77 ммоль) и (E)-2-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-4,4,5,5-тетраметил-1,3,2-диоксаборолан (209 мг, 0,71 ммоль) помещали в реакционную колбу. Добавляли толуол (4 мл), этанол (2 мл) и воду (2 мл). Трижды вводили азот для замещения воздуха путем откачки. Раствор смеси нагревали до 90°C в течение 2 ч. После завершения реакции для удаления растворителя реакционную смесь концентрировали. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля с получением трет-бутил (S,E)-8-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-карбоксилата (285 мг, 73%).
Этап 2. Синтез (S,E)-8-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-6-((3-(трифторметил) фенил)сульфонил)-2,3,4,4a,5,6-гексагидро-1H-пиразино[1,2-a]хиноксалина

Трет-бутил (S,E)-8-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-6-((3-(трифторметил) фенил) сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-карбоксилат (250 мг, 0,38 ммоль) растворяли в дихлорметане (5 мл). К раствору добавляли трифторуксусную кислоту (1 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Для удаления растворителя реакционную смесь концентрировали. Остаток промывали насыщенным растворе гидрокарбоната натрия, экстрагировали этилацетатом, сушили и концентрировали с получением (S,E)-8-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-6-((3-(трифторметил)фенил)сульфонил)-2,3,4,4a,5,6-гексагидро-1H-пиразино[1,2-a]хиноксалина (200 мг, 93%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 566 [M+H]+.
1H ЯМР (500 МГц, CDCl3) δ 8,22 (s, 1H), 7,80-7,84 (m, 2H), 7,75 (s, 1H), 7,62-7,67 (m, 2H), 7,17-7,26 (m, 3H), 7,02 (t, J=8,4 Гц, 1H), 6,71 (d, J=8,7 Гц, 1H), 6,35 (s, 1H), 4,21-4,23 (m,, 1H), 3,61 (d, J=12,6 Гц, 1H), 3,36 (t, J=12,1 Гц, 1H), 3,06-3,15 (m, 2H), 2,78-2,81 (m, 2H), 2,46-2,54 (m,, 2H), 2,19 (s, 3H).
Примеры 11, 12 и 13 получали методом синтеза, указанным в примере 10.
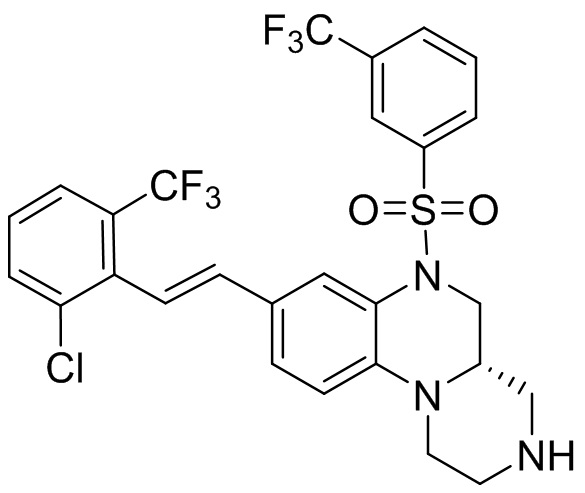
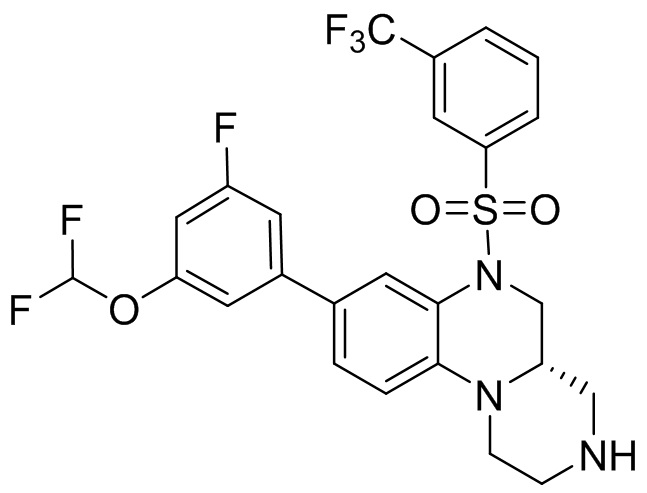
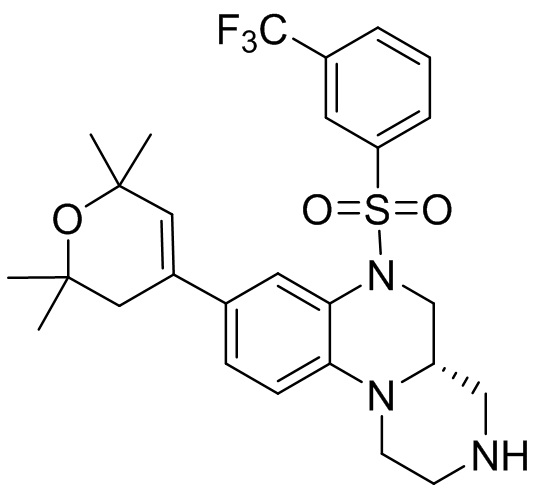
Данные о соединении, полученные методом ЯМР-спектроскопии на ядрах 1H, полученном в примерах с 11 по 13:
Пример 11. 1H ЯМР (500 МГц, CDCl3) δ 7,873-7,82 (m, 4H), 7,63-7,61 (m , 3H), 7,33-7,26 (m , 2H), 6,97 (d, J=16,6 Гц, 1H), 6,80 (d, J=16,6 Гц, 1H), 6,71 (d, J=8,5 Гц, 1H), 4,23 (dd, J=14,2, 4,3 Гц, 1H), 3,58 (d, J=12,6 Гц, 1H), 3,30-3,36 (m , 1H), 3,08-3,00 (m , 2H), 2,75 (t, J=12,5 Гц, 2H), 2,55 - 2,32 (m, 2H).
Пример 12. 1H ЯМР (400 МГц, метанол-d4) δ 8,04 (d, J=7,9 Гц, 1H), 7,99 (d, J=7,9 Гц, 1H), 7,87-7,77 (m, 2H), 7,65 (s, 1H), 7,51 (dd, J=8,7, 2,2 Гц, 1H), 7,22-7,14 (m, 2H), 6,95 (t, 1H), 7,04 (d, J=8,7 Гц, 1H), 6,90 (dt, J=9,6, 2,3 Гц, 1H), 4,44 (dd, J=14,5, 4,4 Гц, 1H), 4,03 (d, J=14,4 Гц, 1H), 3,49-3,34 (m, 3H), 3,05 (qd, J=14,8, 13,7, 3,5 Гц, 2H), 2,78 (t, J=11,9 Гц, 1H), 2,68-2,56 (m, 1H).
Пример 13. 1H ЯМР (500 МГц, CDCl3) δ 7,81 (t, J=7,4 Гц, 2H), 7,72 (s, 1H), 7,65-7,57 (m, 2H), 7,20 (d, J=8,6 Гц, 1H), 6,67 (d, J=8,8 Гц, 1H), 5,96 (s, 1H), 4,19 (dd, J=14,2, 4,3 Гц, 1H), 3,53 (d, J=12,6 Гц, 1H), 3,32 (dd, J=14,2, 9,9 Гц, 1H), 3,05 (d, J=12,5 Гц, 1H), 2,98 (d, J=12,0 Гц, 2H), 2,76-2,63 (m, 2H), 2,46-2,35 (m, 2H), 2,31 (s, 2H), 1,32 (d, J=11,6 Гц, 12H).
Примеры 14, 15 и 16 получали методом синтеза, указанным в примере 7.
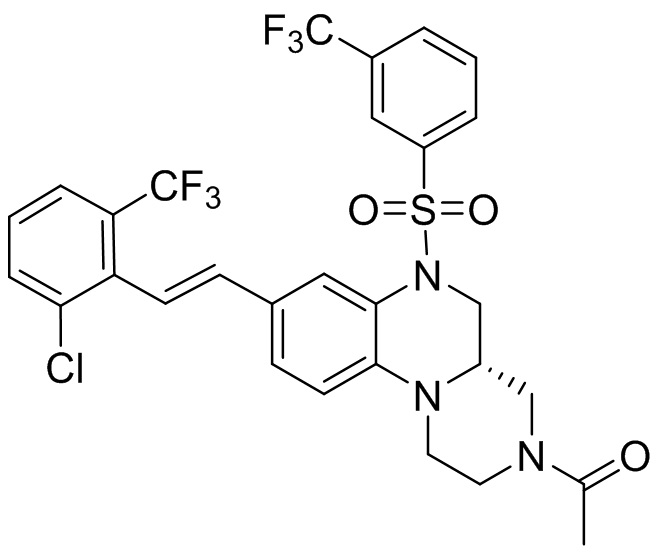
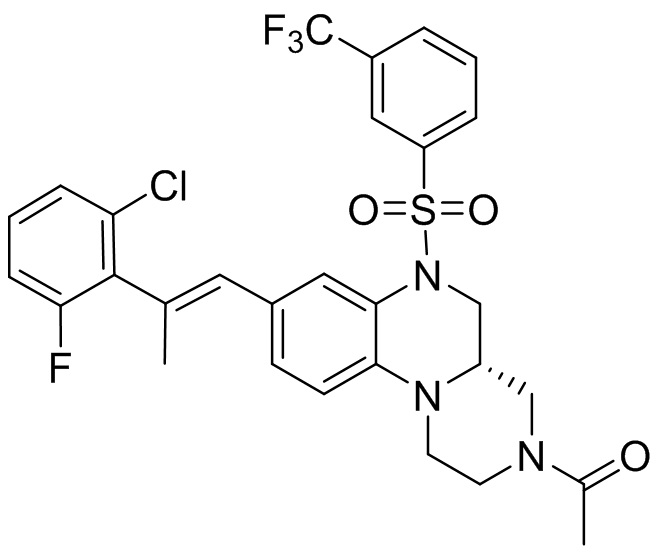

Данные о соединении, полученные методом ЯМР-спектроскопии на ядрах 1H, полученном в примерах с 14 по 16:
Пример 14. 1H ЯМР (500 МГц, CDCl3) δ 7,92-7,71 (m, 4H), 7,68-7,59 (m, 3H), 7,39-7,30 (m, 2H), 7,02-6,98 (m, 1H), 6,89-6,67 (m, 2H), 4,59-4,41 (m, 1H), 4,30 (dd, J=14,3, 4,5 Гц, 1H), 3,81-3,55 (m, 2H), 3,36 (dt, J=14,2, 10,3 Гц, 1H), 3,18-3,12 (m, 0,5H), 2,88-2,83 (m, 0,5H), 2,81-2,58 (m, 1,5H), 2,49-2,25 (m, 1,5H), 2,11 (d, J=4,0 Гц, 3H).
Пример 15. 1H ЯМР (500 МГц, CDCl3) δ 7,83-7,69 (m, 2H), 7,68-7,59 (m, 2H), 7,56-7,52 (m, 1H), 7,18-7,08 (m, 3H), 6,99-6,90 (m, 1H), 6,66 (dd, J=22,1, 8,6 Гц, 1H), 6,29 (d, J=1,7 Гц, 1H), 4,40 (t, J=14,3 Гц, 1H), 4,19 (dd, J=14,2, 4,5 Гц, 1H), 3,69-3,45 (m, 2H), 3,28 (dt, J=14,4, 9,2 Гц, 1H), 3,06 (t, J=10,8 Гц, 0,5H), 2,82-2,67 (m, 0,5H), 2,67-2,43 (m, 1,5H), 2,37-2,16 (m, 1,5H), 2,14 (d, J=1,6 Гц, 3H), 2,01 (d, J=5,0 Гц, 3H).
Пример 16. 1H ЯМР (500 МГц, CDCl3) δ 7,92-7,78 (m, 2H), 7,76-7,67 (m, 1H), 7,67-7,58 (m, 2H), 7,24 (td, J=5,9, 2,9 Гц, 1H), 6,71 (dd, J=22,1, 8,7 Гц, 1H), 6,03-5,95 (m, 1H), 4,55-4,43 (m, 1H),4,32-4,20 (m, 1H), 3,76-3,54 (m, 2H), 3,36 (ddd, J=14,3, 9,9, 7,5 Гц, 1H), 3,19-3,05 (m, 0,5H), 2,82(dd, J=12,8, 10,9 Гц, 0,5H), 2,73-2,50 (m, 1,5H), 2,42-2,23 (m, 3,5H), 2,09 (d, J=4,7 Гц, 3H), 1,35 (d, J=11,8 Гц, 12H).
Примеры 17, 18 и 19 получали методом синтеза, указанным в примере 8.
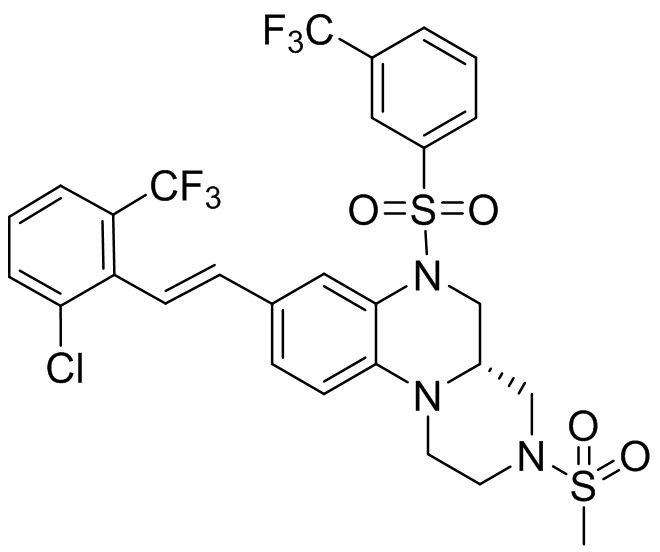
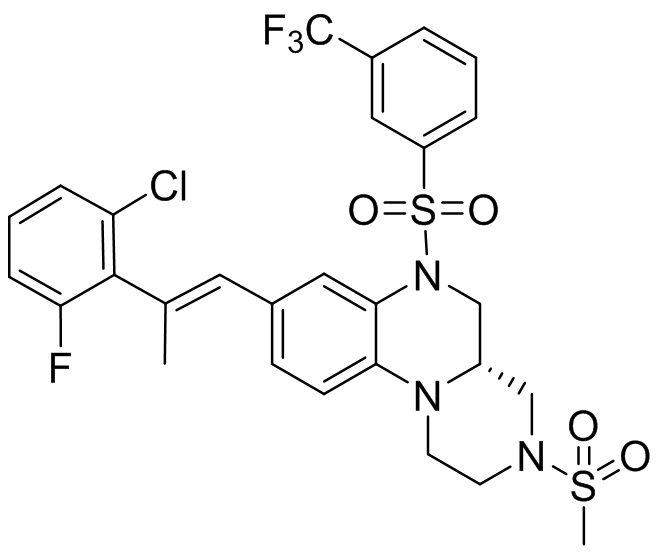
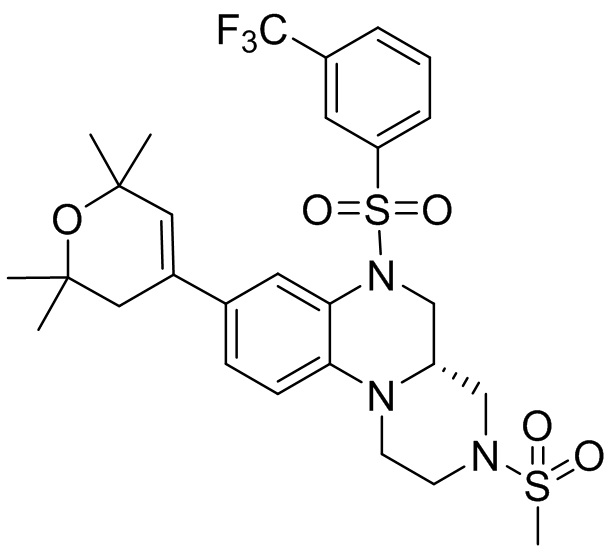
Данные о соединении, полученные методом ЯМР-спектроскопии на ядрах 1H, полученном в примерах с 17 по 19:
Пример 17. 1H ЯМР (500 МГц, CDCl3) δ 7,90-7,81 (m, 2H), 7,80-7,72 (m, 2H), 7,69-7,61 (m, 3H), 7,39-7,30 (m, 2H), 7,05-6,96 (m, 1H), 6,85-6,73 (m, 2H), 4,27 (dd, J=14,3, 4,7 Гц, 1H), 3,77-3,63 (m, 3H), 3,42 (dd, J=14,3, 9,5 Гц, 1H), 2,86-2,81 (m, 1H), 2,80 (s, 3H), 2,70 (td, J=11,7, 3,2 Гц, 1H), 2,54 (td, J=12,3, 3,3 Гц, 1H), 2,40 (t, J=10,9 Гц, 1H).
Пример 18. 1H ЯМР (500 МГц, CDCl3) δ 7,87-7,79 (m, 2H), 7,75 (d, J=1,8 Гц, 1H), 7,68 (d, J=2,1 Гц,1H), 7,63 (t, J=7,8 Гц, 1H), 7,25-7,15 (m, 3H), 7,04-7,02 (m, 1H), 6,73 (d, J=8,7 Гц, 1H), 6,36 (d, J=1,9 Гц, 1H), 4,23 (dd, J=14,2, 4,7 Гц, 1H), 3,66 (dddd, J=19,2, 9,2, 4,9, 2,4 Гц,3H), 3,41 (dd, J=14,3, 9,6 Гц, 1H), 2,77 (s, 4H), 2,66 (td, J=11,6, 2,8 Гц, 1H), 2,49 (td, J=12,2, 3,0 Гц, 1H), 2,37 (dd, J=11,3, 10,4 Гц, 1H), 2,20 (d, J=1,5 Гц, 3H).
Пример 19. 1H ЯМР (500 МГц, ДМСО-d6) δ 8,09 (d, J=7,7 Гц, 1H), 7,97 (d, J=8,0 Гц, 1H), 7,86 (t, J=7,9 Гц,1H), 7,66 (d, J=1,8 Гц, 1H), 7,42 (d, J=2,2 Гц, 1H), 7,26 (dd, J=8,7, 2,2 Гц, 1H), 6,90 (d, J=8,8 Гц,1H), 6,02 (d, J=1,4 Гц, 1H), 4,38 (dd, J=14,4, 4,6 Гц, 1H), 3,89-3,75 (m, 1H), 3,57 (dt, J=11,4, 2,5 Гц, 1H), 3,34 (s, 1H), 3,32-3,28 (m, 1H), 2,85 (s, 3H), 2,65 (td, J=11,8, 3,1 Гц, 1H), 2,60-2,52 (m,1H), 2,36 (t, J=10,9 Гц, 1H), 2,30-2,15 (m, 3H), 1,24 (d, J=16,2 Гц, 12H).
Примеры 20, 21 и 22 получали методом синтеза, указанным в примере 9.
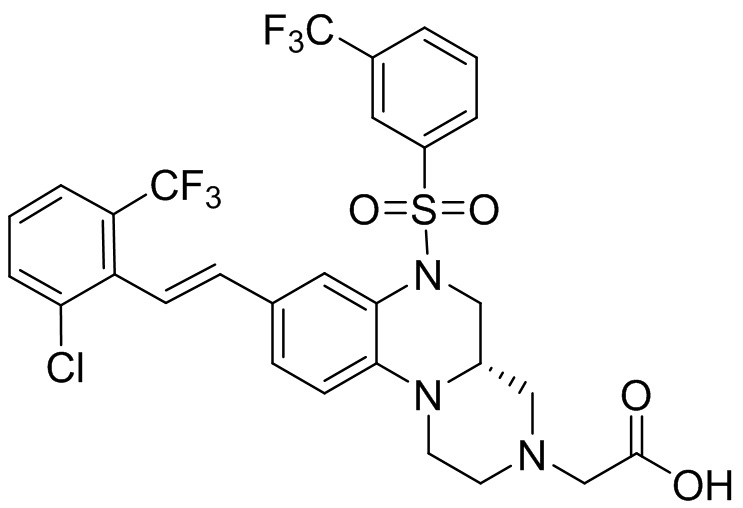
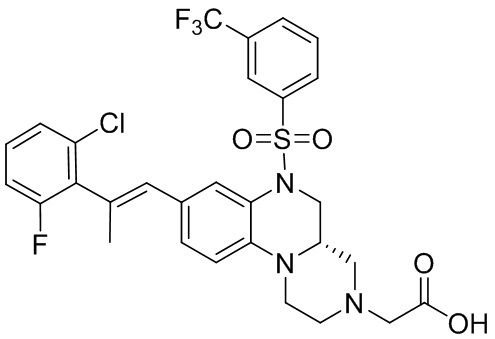
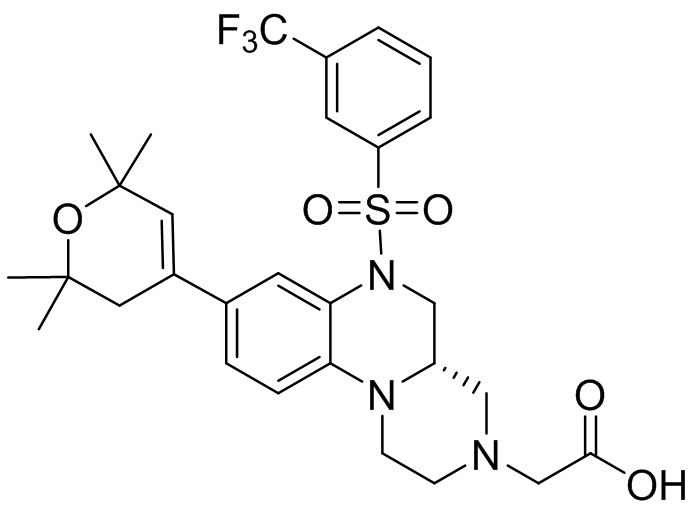
Данные о соединении, полученные методом ЯМР-спектроскопии на ядрах 1H, полученном в примерах с 20 по 22:
Пример 20. 1H ЯМР (500 МГц, CDCl3) δ 7,78 (d, J=8,0 Гц, 1H), 7,73 (s, 1H), 7,68 (d, J=8,0 Гц, 1H),7,55-7,47 (m, 4H), 7,22-7,14 (m, 2H), 6,80 (dd, J=16,7, 1,9 Гц, 1H), 6,68-6,58 (m, 2H), 4,14 (dd, J=14,0, 4,2 Гц, 1H), 3,56 (d, J=12,9 Гц, 1H), 3,39-3,09 (m, 6H), 2,74 (q, J=15,1, 13,8 Гц, 1H), 2,51 (s, 1H), 2,25 (s, 1H).
Пример 21. 1H ЯМР (500 МГц, CDCl3) δ 7,79-7,81 (m, 3H), 7,55-7,64 (m,, 2H), 7,15-7,23 (m, 3H), 7,02-6,99 (m, 1H), 6,72 (s, 1H), 6,30 (s, 1H), 4,24 (s, 1H), 3,67 (s, 2H), 3,43 (s, 3H), 3,20 (s, 3H), 2,63 (s, 1H), 2,35 (s, 1H), 2,14 (s, 3H).
Пример 22. 1H ЯМР (500 МГц, CDCl3) δ 7,80 (s, 3H), 7,62 (s, 2H), 7,18 (d, J=8,0 Гц, 1H), 6,67 (s, 1H),5,93 (s, 1H), 4,20 (s, 1H), 3,57 (s, 1H), 3,30 (d, J=62,0 Гц, 3H), 2,94 (s, 3H), 2,65-2,63 (m, 3H), 2,39 (s, 1H), 2,12 (s, 1H),1,31 (d, J=12,6 Гц, 12H).
Пример 23. Получение метил 2-((S)-8-((E)-2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-6-((3- (трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)пропаноата
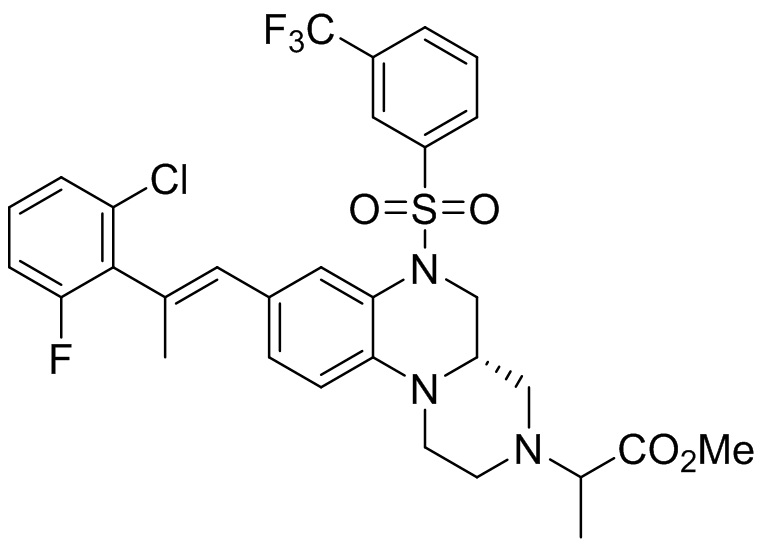
(S,E)-8-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-6-((3-(трифторметил)фенил)сульфонил)-2,3,4,4a,5,6-гексагидро-1H-пиразино[1,2-a]хиноксалин (60 мг, 0,106 ммоль), метил (S)-2-хлорпропаноат (115 мг, 1,06 ммоль) и карбонат калия (44 мг, 0,318 ммоль) перемешивали в ацетонитриле (2 мл), после чего проводили реакцию под воздействием микроволнового излучения при температуре 60°C в течение 12 ч. Реакционную смесь отделяли с помощью быстрой обращенно-фазовой колоночной хроматографии с получением метил 2-((S)-8-((E)-2-(2-хлор-6-фротфенил)проп-1-ен-1-ил)-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)пропаноата (15 мг, 22%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 652 [M+H]+.
1H ЯМР (500 МГц, CDCl3): δ 7,82-7,77 (m, 2H), 7,74 (d, J=7,9 Гц, 1H),7,71 (d, J=2,1 Гц, 1H), 7,59 (t, J=7,7 Гц, 1H), 7,25-7,12 (m, 3H), 7,07-6,97 (m, 1H), 6,69 (d, J=8,6 Гц, 1H), 6,35 (d, J=1,8 Гц, 1H), 4,20 (dd, J=14,1, 4,5 Гц, 1H), 3,70 (s, 3H), 3,53-3,44 (m, 1H), 3,37-3,22 (m, 2H), 2,78-2,74 (m, 2H), 2,44-2,40 (m, 1H), 2,37-2,26 (m, 2H), 2,21 (d, J=1,5 Гц, 3H), 1,99 (t, J=10,6 Гц, 1H), 1,26 (d, J=6,8 Гц, 3H).
Пример 24 получали методом синтеза, указанным в примере 23.
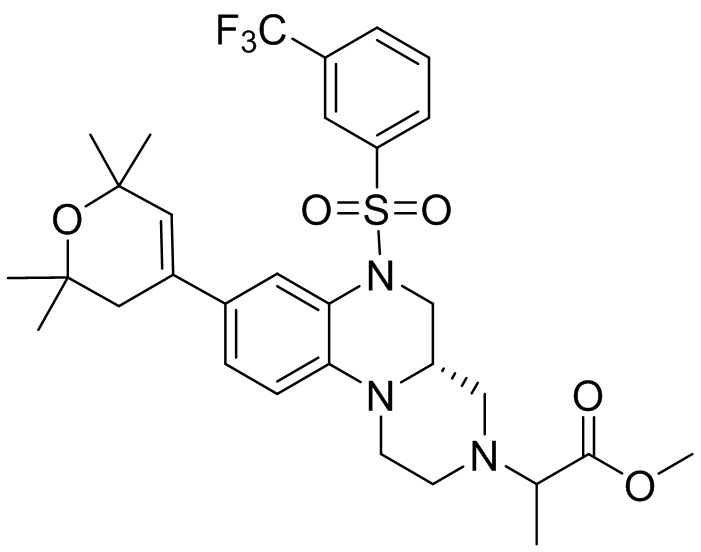
1H ЯМР (500 МГц, CDCl3) δ 7,76 (t, J=11,7 Гц, 3H), 7,63 (d, J=2,2 Гц, 1H), 7,58 (t, J=7,8 Гц, 1H), 7,18 (dd, J=8,6, 2,2 Гц, 1H), 6,65 (d, J=8,8 Гц, 1H), 5,95 (d, J=1,4 Гц, 1H), 4,18 (dd, J=14,1, 4,4 Гц, 1H), 3,69 (s, 3H), 3,46 (d, J=11,5 Гц, 1H), 3,36-3,30 (m, 1H), 3,28 (d, J=7,8 Гц, 1H), 2,75 (t, J=9,5 Гц, 2H), 2,56 (s, 1H), 2,39 (dt, J=37,2, 10,5 Гц, 2H), 2,31 (d, J=1,6 Гц, 2H), 1,97 (t, J=10,6 Гц, 1H), 1,32 (d, J=11,2 Гц, 12H), 1,27 (d, J=7,1 Гц, 3H).
Пример 25. Получение 2-((S)-8-((E)-2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-6-((3- (трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)пропановой кислоты
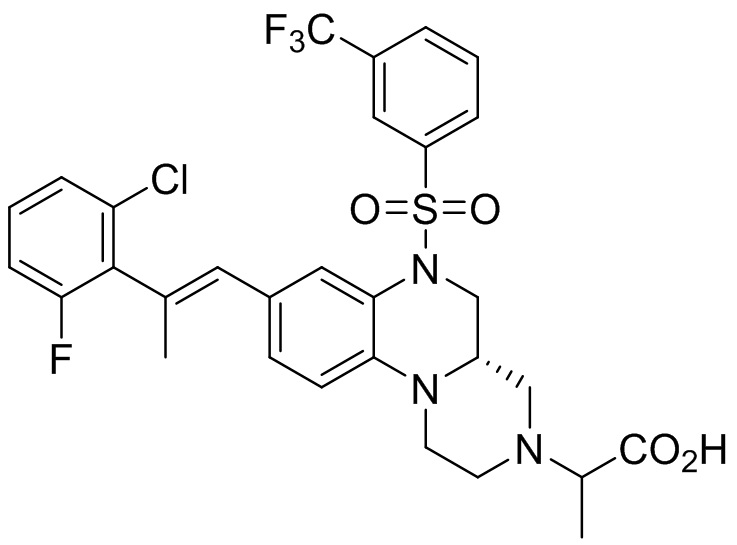
Метил 2-((S)-8-((E)-2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-6-((3-(трифторметил) фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)пропаноат (13 мг, 0,02 ммоль) и лития гидроксид (5 мг, 0,1 ммоль) перемешивали в метаноле (2 мл). Добавляли по каплям воду. Реакционную смесь перемешивали при температуре 40°C в течение ночи. pH реакционной смеси доводили примерно до 5 разбавленной соляной кислотой. Полученную смесь разделяли с помощью быстрой обращенно-фазовой колоночной хроматографии с получением 2-((S)-8-((E)-2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)пропановой кислоты (7,5 мг, 58%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 638 [M+H]+.
1H ЯМР (500 МГц, CDCl3): δ 7,86-7,76 (m, 3H), 7,62-7,60 (m, 2H), 7,22-7,15 (m, 3H), 7,01 (t, J=8,3 Гц, 1H), 6,71 (d, J=8,4 Гц, 1H), 6,32 (s, 1H), 4,19 (d, J=13,3 Гц, 1H), 3,58 (d, J=10,5 Гц 1H), 3,44-3,18 (m, 2H), 2,80-2,20 (m, 5H), 2,17 (s, 3H), 2,07 (brs, 1H), 1,39-1,18 (m, 3H).
Примеры 26-27 получали методом синтеза, указанным в примере 25.
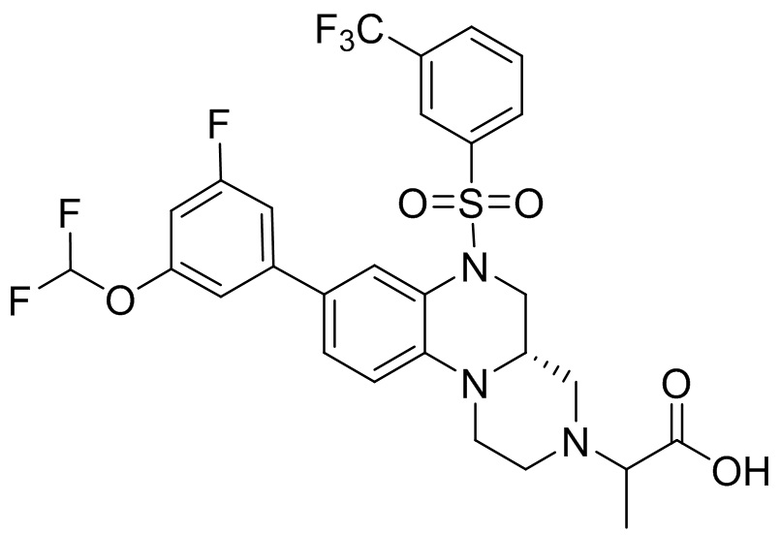
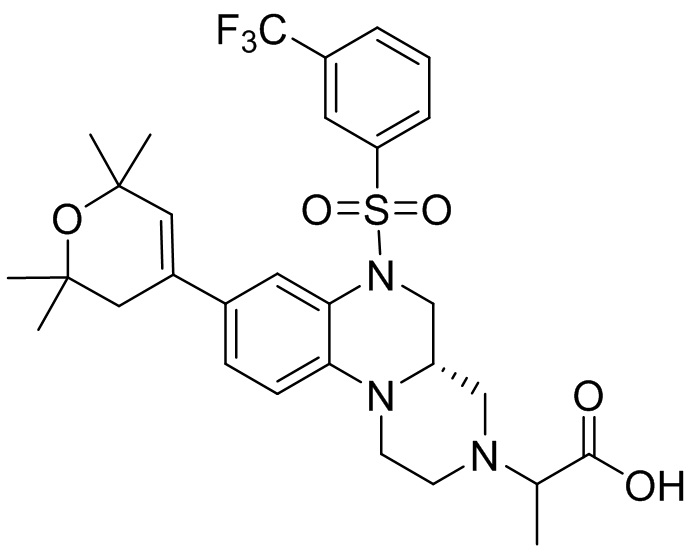
Данные о соединении, полученные методом ЯМР-спектроскопии на ядрах 1H, полученном в примерах с 26 по 27:
Пример 26. 1H ЯМР (400 МГц, метанол-d4) δ 8,02 (dd, J=14,5, 7,8 Гц, 2H), 7,85-7,79 (m, 2H), 7,69 (d, J=4,6 Гц, 1H), 7,51 (dd, J=8,7, 2,2 Гц, 1H), 7,22-7,15 (m, 2H), 6,95 (t, 1H), 7,04 (dd, J=8,9, 2,5 Гц, 1H), 6,93-6,88 (m, 1H), 4,47 (ddd, J=14,2, 8,5, 4,3 Гц, 1H), 4,10 (d, J=9,6 Гц, 2H), 3,66-3,51 (m, 2H), 3,42 (ddd, J=14,6, 9,9, 5,4 Гц, 1H), 3,24-3,05 (m, 2H), 3,00-2,70 (m, 2H), 1,61 (d, J=7,3 Гц, 3H).
Пример 27. 1H ЯМР (400 МГц, CDCl3) δ 7,82 (d, J=15,2 Гц, 3H), 7,61 (d, J=8,1 Гц, 2H), 7,17 (d, J=9,4 Гц, 1H), 6,65 (s, 1H), 5,93 (s, 1H), 4,27-4,12 (m, 1H), 3,56 (ddd, J=16,1, 8,2, 4,6 Гц, 1H), 3,44-3,27 (m, 2H), 2,97-2,68 (m, 3H), 2,49 (d, J=32,6 Гц, 2H), 2,31-2,22 (m, 3H), 2,19-2,03 (m, 3H), 1,32 (s, 6H), 1,30 (s, 6H).
Пример 28. Получение (S)-3-(8-(3-(дифторметокси)-5-фторфенил)-6-((3-(трифторметил) фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)-3-оксопропаннитрила
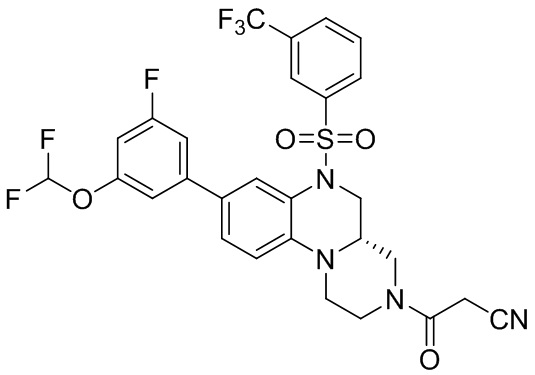
(S)-8-(3-(дифторметокси)-5-фторфенил)-6-((3-(трифторметил)фенил)сульфонил)-2,3,4,4a,5,6-гексагидро-1H-пиразино[1,2-a]хиноксалин (50 мг, 0,09 ммоль) растворяли в ацетонитриле (2 мл); к раствору добавляли 2-циануксусную кислоту (96 мг, 1,13 ммоль), 2-(7-оксибензотриазол)-N,N,N',N'-тетраметилуронийгексафторфосфат (108 мг, 0,28 ммоль) и N,N-диизопропилэтиламин (148 мг, 1,15 ммоль). Реакционную смесь перемешивали при температуре 50°C в течение 5 ч. Для удаления растворителя реакционную смесь концентрировали. Остаток отделяли с помощью ТСХ [растворитель : метанол : дихлорметан = 1 : 20], затем отделяли с помощью обращенно-фазовой колоночной хроматографии [элюент : ацетонитрил : вода (0,5% HCl) = 0%-60%] с получением (S)-3-(8-(3-(дифторметокси)-5-фторфенил)-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)-3-оксопропаннитрила (27,4 мг, 49%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 625 [M+H]+.
1H ЯМР (400 МГц, метанол-d4) δ 7,92 (t, J=8,4 Гц, 2H), 7,83 (d, J=2,3 Гц, 1H), 7,74 (t, J=7,9 Гц, 1H), 7,65 (d, J=6,2 Гц, 1H), 7,48 (dd, J=8,7, 2,3 Гц, 1H), 7,23-7,15 (m, 2H), 6,94 (t, 1H), 6,94 (d, J=8,7 Гц, 1H), 6,88 (dt, J=9,5, 2,3 Гц, 1H), 4,47-4,24 (m, 2H), 3,91 (dd, J=18,6, 2,9 Гц, 1H), 3,81 (d, J=18,6 Гц, 1H), 3,78-3,65 (m, 2H), 3,37 (td, J=10,5, 5,1 Гц, 1H), 2,90-2,60 (m, 2H), 2,47-2,31 (m, 1H), 2,03 (s, 1H).
Примеры 29, 30 и 31 получали методом синтеза, указанным в примере 28.
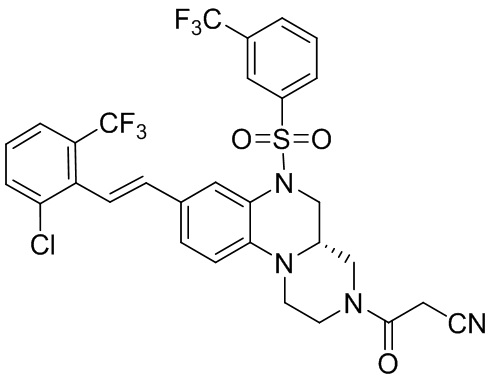
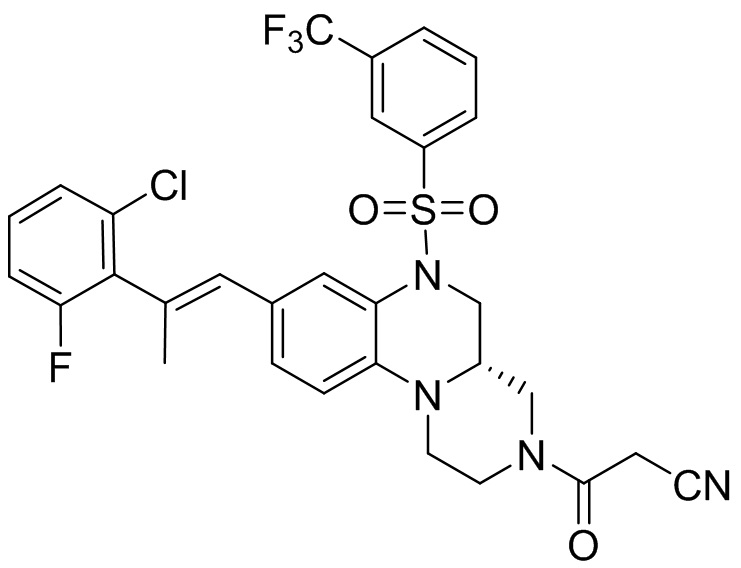
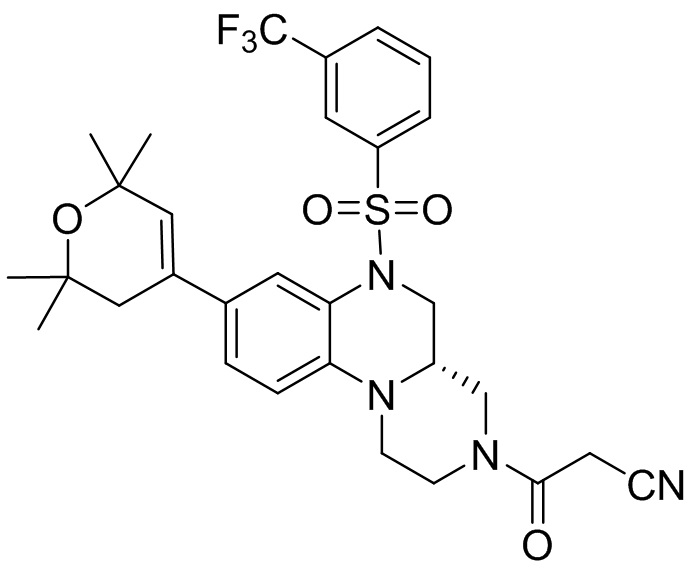
Данные о соединении, полученные методом ЯМР-спектроскопии на ядрах 1H, полученном в примерах с 29 по 31:
Пример 29. 1H ЯМР (500 МГц, CDCl3) δ 7,79 (d, J=7,8 Гц, 1H), 7,75 (d, J=7,9 Гц, 1H), 7,70-7,69 (m, 1H), 7,63-7,62(m, 1H), 7,55-7,58 (m, 3H), 7,30-7,21 (m, 2H), 6,93-6,89 (m, 1H), 6,74-6,64 (m, 2H), 4,39-4,34 (m, 1H), 4,27-4,19 (m, 1H), 3,65-3,51 (m, 2H), 3,48-3,37 (m, 2H), 3,34-3,16 (m, 1,5H), 2,91-2,86 (m, 0,5H), 2,76-2,70 (m , 1H), 2,63-2,60 (m, 0,5H), 2,50-2,40 (m, 0,5H), 2,39-2,28 (m, 1H).
Пример 30. 1H ЯМР (500 МГц, CDCl3): δ 7,85-7,75 (m, 2H), 7,68 (s, 1H), 7,64-7,52 (m, 2H), 7,18-7,08 (m, 3H), 7,01-6,91 (m, 1H), 6,67 (dd, J=16,5, 8,6 Гц, 1H), 6,29 (s, 1H), 4,36 (d, J=13,0 Гц, 1H), 4,38-4,19 (m, 1H), 3,60-3,45 (m, 2H), 3,45-3,23 (m, 3H), 3,19-3,14 (m, 0,5H), 2,95-2,84 (m, 0,5H), 2,76-2,52 (m, 1,5H), 2,46-2,23 (m, 1,5H), 2,13 (d, J=1,8 Гц, 3H).
Пример 31. 1H ЯМР (500 МГц, CDCl3) δ 7,85 (d, J=6,8 Гц, 1H), 7,81 (d, J=7,8 Гц, 1H), 7,71 (s, 1H), 7,63 (t, J=7,9 Гц, 1H), 7,60-7,56 (m, 1H), 7,24-7,19 (m, 1H), 6,70 (dd, J=16,0, 8,7 Гц, 1H), 5,97 (s, 1H), 4,42 (d, J=13,1 Гц, 1H), 4,27 (ddd, J=19,3, 14,3, 4,4 Гц, 1H), 3,60 (dd, J=26,2, 12,3 Гц, 2H), 3,52-3,40 (m, 2H), 3,39-3,31 (m, 1H), 3,24 (t, J=11,7 Гц, 1H), 2,97-2,89 (m, 1H), 2,80-2,69 (m, 1H), 2,61 (s, 1H), 2,47 (t, J=11,1 Гц, 1H), 2,40-2,34 (m, 1H), 2,30 (s, 2H), 1,32 (d, J=12,1 Гц, 12H).
Пример 32. Получение (S,E)-8-(2-хлор-6-(трифторметил)стирил)-3-(оксетан-3-ил)-6-((3- (трифторметил)фенил)сульфонил)-2,3,4,4a,5,6-гексагидро-1H-пиразино[1,2-a]хиноксалина
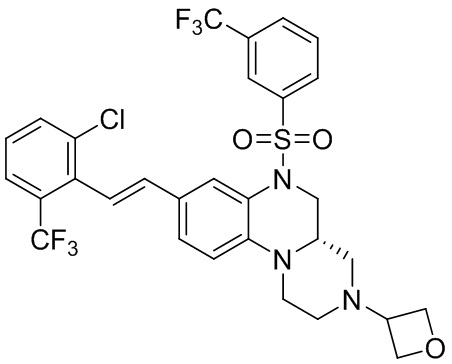
(S,E)-8-(2-хлор-6-(трифторметил)стирил)-6-((3-(трифторметил)фенил)сульфонил)-2,3,4,4a,5,6-гексагидро-1H-пиразино[1,2-a]хиноксалин (50 мг, 0,083 ммоль) растворяли в N,N-диметилформамиде (2 мл). В раствор добавляли оксетан-3-он (12 мг, 0,166 ммоль) и одну каплю уксусной кислоты. Реакционную смесь перемешивали при комнатной температуре в течение 0,5 ч, а затем добавляли цианоборгидрид натрия (10 мг, 0,166 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Остаток отделяли с помощью быстрой обращенно-фазовой колоночной хроматографии с получением (S,E)-8-(2-хлор-6-(трифторметил)стирил)-3-(оксетан-3-ил)-6-((3-(трифторметил) фенил)сульфонил)-2,3,4,4a,5,6-гексагидро-1H-пиразино[1,2-a]хиноксалин (14,7 мг, 27%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 658 [M+1]+.
1H ЯМР (500 МГц, CDCl3) δ 7,83-7,77 (m, 3H), 7,75 (d, J=2,1 Гц, 1H), 7,65-7,59 (m, 3H),7,34-7,28 (m, 2H), 6,97 (dd, J=16,7, 1,9 Гц, 1H), 6,80 (d, J=16,6 Гц, 1H), 6,71 (d, J=8,6 Гц, 1H),4,65 (q, J=6,2 Гц, 2H), 4,56 (td, J=6,0, 3,7 Гц, 2H), 4,21 (dd, J=14,1, 4,4 Гц, 1H), 3,59-3,49 (m,1H), 3,45 (q, J=6,3 Гц, 1H), 3,34 (dd, J=14,1, 9,9 Гц, 1H), 2,74 (dd, J=4,5, 2,8 Гц, 1H), 2,67 (d, J=11,1 Гц, 1H), 2,61 (dt, J=10,5, 2,5 Гц, 1H), 2,52 (td, J=12,0, 3,1 Гц, 1H), 1,88 (td, J=11,5, 3,2 Гц,1H), 1,60 (d, J=10,5 Гц, 1H).
Примеры 33-34 получали методом синтеза, указанным в примере 32.
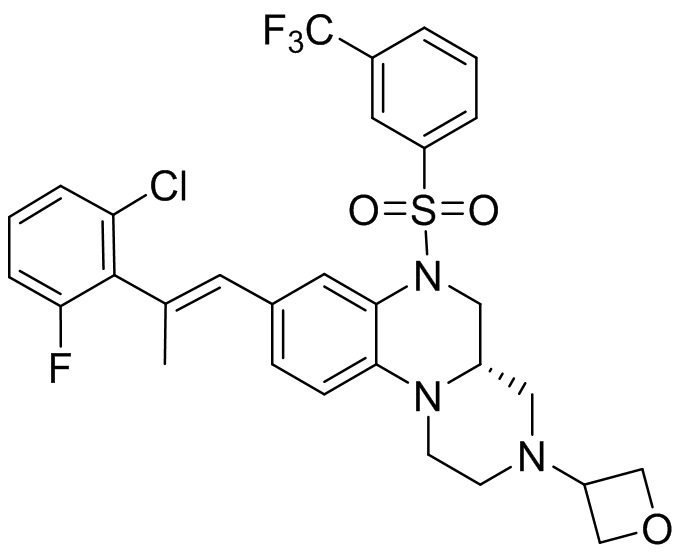
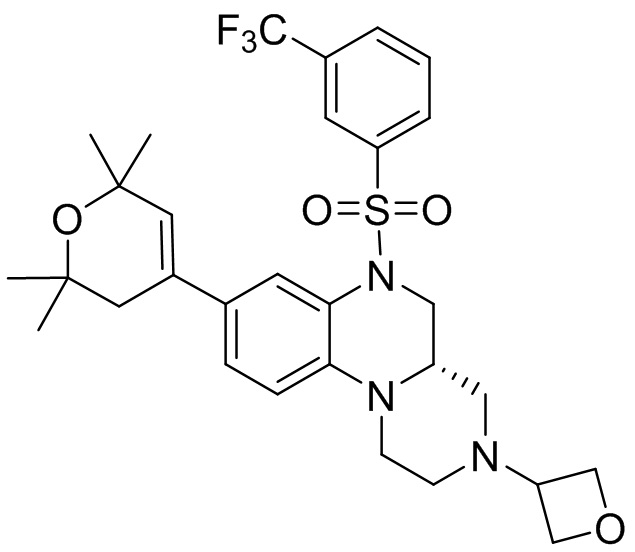
Данные о соединении, полученные методом ЯМР-спектроскопии на ядрах 1H, полученном в примерах с 33 по 34:
Пример 33. 1H ЯМР (500 МГц, CDCl3): 7,83-7,73 (m, 3H), 7,72 (d, J=2,1 Hz, 1H), 7,60 (t, J=7,8 Hz, 1H), 7,24-7,14 (m, 3H), 7,07-6,97 (m, 1H), 6,71 (d, J=8,7 Hz, 1H), 6,36 (d, J=1,6 Hz, 1H), 4,65 (q, J=6,3 Hz, 2H), 4,55 (q, J=5,9 Hz, 2H), 4,18 (dd, J=14,2, 4,4 Hz, 1H), 3,52 (dt, J=12,2, 2,8 Hz, 1H), 3,47-3,38 (m, 1H), 3.36 (dd, J=13,5, 10,0 Hz, 1H), 2,67-2,60 (m, 2H), 2,60 (dt, J=10,5, 2,5 Hz, 1H), 2,49 (td, J=12,0, 3,1 Hz, 1H), 2,21 (d, J=1,5 Hz, 3H), 1,86 (td, J=11,4, 3,2 Hz, 1H), 1,62-1,50 (m, 1H).
Пример 34. 1H ЯМР (500 МГц, CDCl3) δ 7,80 (d, J=7,8 Гц, 1H), 7,77 (d, J=9,3 Гц, 2H), 7,63 (d, J=2,2 Гц, 1H), 7,60 (t, J=7,8 Гц, 1H), 7,19 (dd, J=8,7, 2,2 Гц, 1H), 6,67 (d, J=8,8 Гц, 1H), 5,96 (t, J=1,4 Гц, 1H), 4,64 (q, J=6,2 Гц, 2H), 4,55 (td, J=6,2, 4,3 Гц, 2H), 4,17 (dd, J=14,1, 4,5 Гц, 1H), 3,49 (d, J=12,1 Гц, 1H), 3,42 (t, J=6,3 Гц, 1H), 3,34 (dd, J=14,1, 9,8 Гц, 1H), 2,72-2,62 (m, 2H), 2,59 (d, J=10,6 Гц, 1H), 2,48 (td, J=11,9, 3,0 Гц, 1H), 2,31 (d, J=1,4 Гц, 2H), 1,85 (td, J=11,4, 3,2 Гц, 1H), 1,55 (d, J=10,4 Гц, 1H), 1,32 (d, J=11,4 Гц, 12H).
Пример 35. Получение (R)-3-((S)-8-((E)-2-хлор-6-(трифторметил)стирил)-6-((3- (трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)пропан-1,2-диола
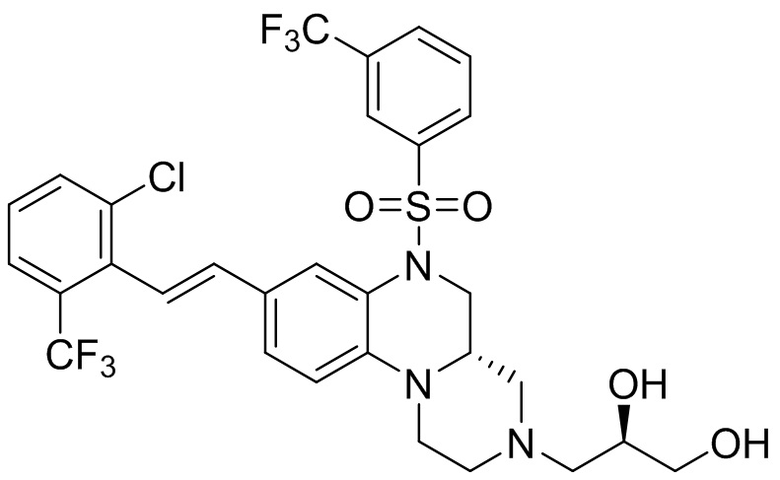
(S,E)-8-(2-хлор-6-(трифторметил)стирил)-6-((3-(трифторметил)фенил)сульфонил)-2,3,4,4a,5,6-гексагидро-1H-пиразино[1,2-a]хиноксалин (40 мг, 0,067 ммоль) растворяли в ацетонитриле (2 мл). Добавляли карбонат калия (27 мг, 0,201 ммоль) и йодид натрия (30 мг, 0,201 ммоль). Реакционную смесь перемешивали при температуре 60°C в течение 0,5 ч и добавляли (S)-3-хлорпропан-1,2-диол (15 мг, 0,133 ммоль). Реакционную смесь перемешивали при температуре 60°C в течение еще 16 ч. Остаток отделяли с помощью быстрой колоночной хроматографии с получением (R)-3-((S)-8-((E)-2-хлор-6- (трифторметил)стирил)-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)пропан-1,2-диола (14,7 мг, 27%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 676 [M+1]+.
1H ЯМР (500 МГц, CDCl3) δ 7,77 (s, 1H), 7,73 (d, J=7,9 Гц, 1H), 7,70-7,64 (m, 2H), 7,58 -7,48 (m, 3H), 7,25-7,20 (m , 2H), 6,90 (d, J=16,6 Гц, 1H), 6,73 (d, J=16,6 Гц, 1H), 6,64 (d, J=8,7 Гц, 1H), 4,13 (dd, J=14,2, 4,2 Гц, 1H), 3,70 (d, J=11,9 Гц, 2H), 3,52-3,36 (m, 2H), 3,27 (dd, J=14,1, 10,0 Гц, 1H), 2,82 (d, J=10,9 Гц, 1H), 2,71 (d, J=11,0 Гц, 1H), 2,60 (s, 1H), 2,51 (t, J=11,1 Гц, 1H), 2,40 (t, J=11,9 Гц, 1H), 2,31-2,17 (m, 2H), 1,67 (t, J=10,7 Гц, 1H).
Примеры 36-42 получали методом синтеза, указанным в примере 35.
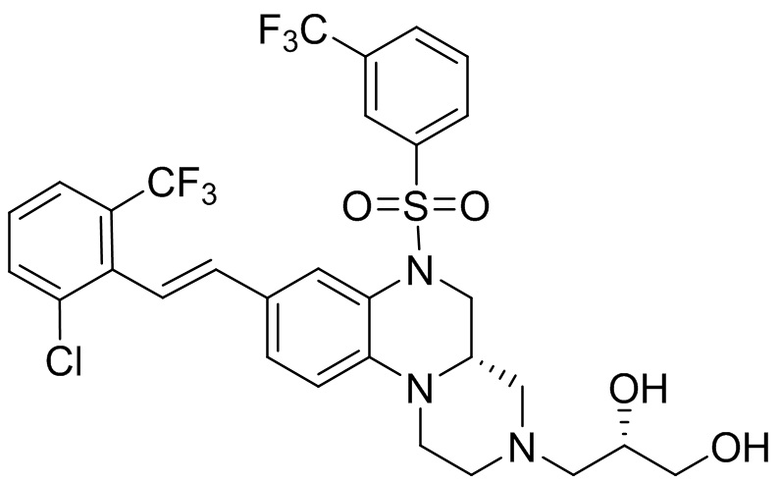
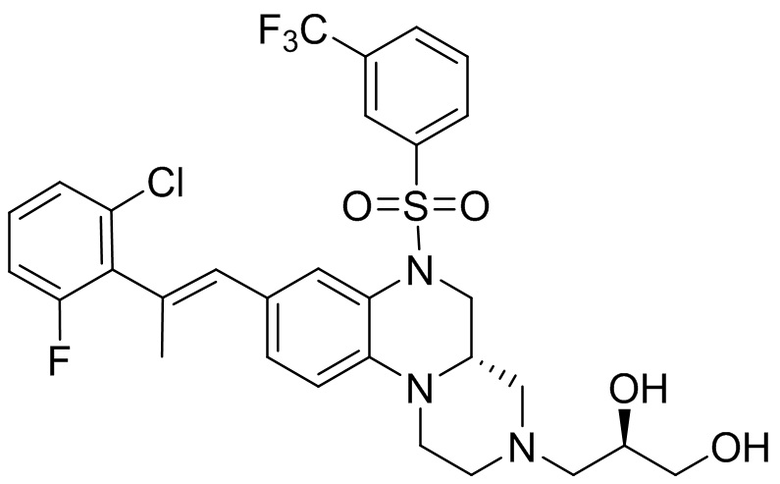
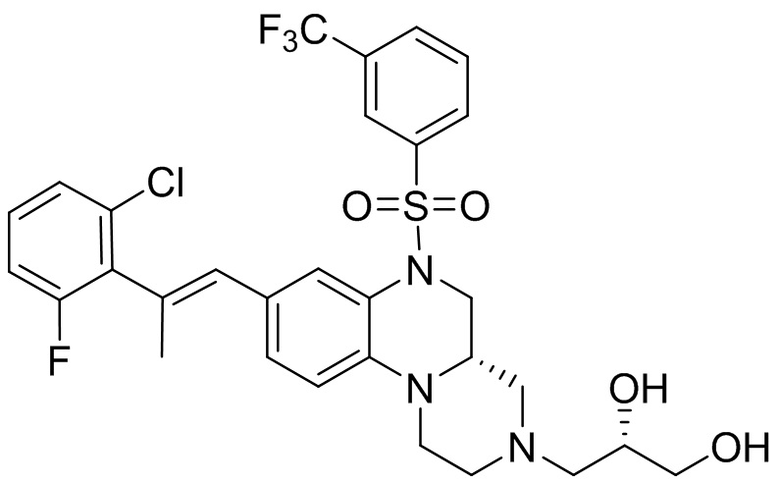
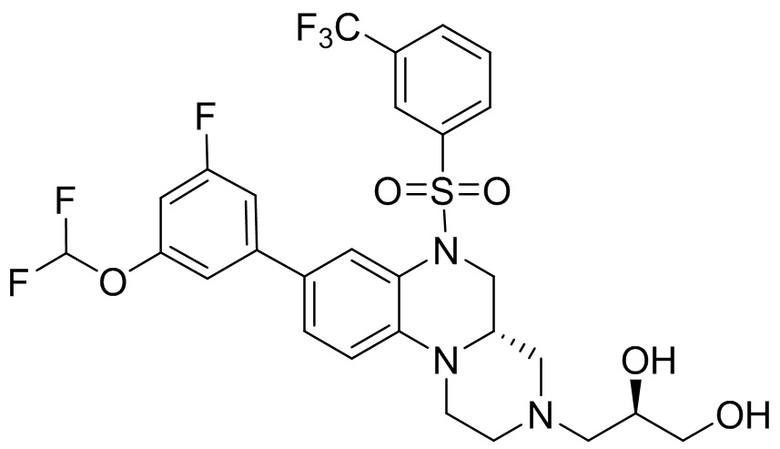
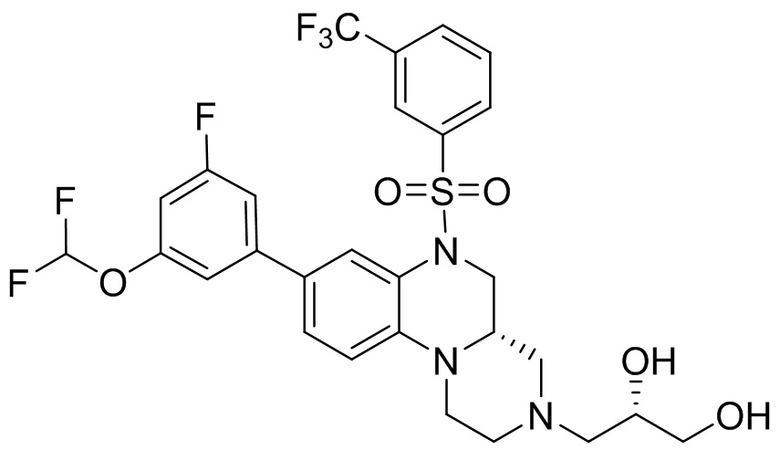

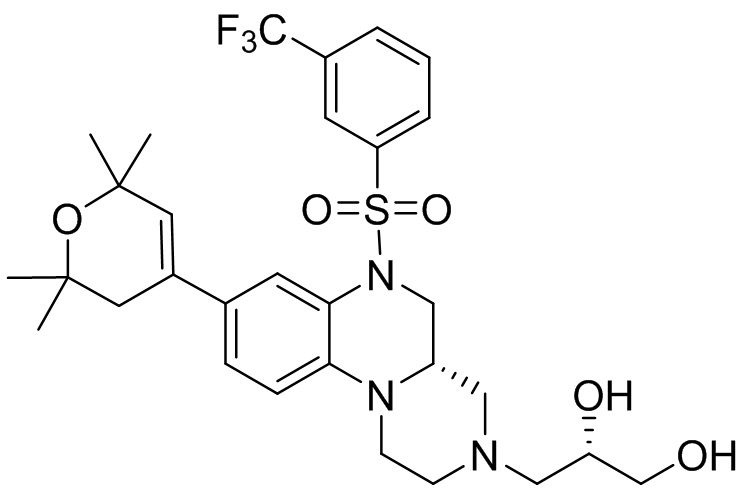
Данные о соединении, полученные методом ЯМР-спектроскопии на ядрах 1H, полученном в примерах с 36 по 42:
Пример 36. 1H ЯМР (500 МГц, CDCl3) δ 7,86 (s, 1H), 7,83 (d, J=7,9 Гц, 1H), 7,79-7,74 (m, 2H), 7,67-7,58 (m, 3H), 7,36-7,29 (m, 2H), 7,00 (d, J=16,4 Гц, 1H), 6,83 (d, J=16,6 Гц, 1H), 6,73 (d, J=8,6 Гц, 1H), 4,23 (dd, J=14,2, 4,1 Гц, 1H), 3,84-3,76 (m , 2H), 3,57 (d, J=12,2 Гц, 1H), 3,52 (dd, J=11,4, 4,2 Гц, 1H), 3,36 (dd, J=14,1, 10,1 Гц, 1H), 2,97 (d, J=11,3 Гц, 1H), 2,77 (d, J=11,6 Гц, 2H), 2,60 (t, J=11,1 Гц, 1H), 2,45 (t, J=11,4 Гц, 1H), 2,39-2,34 (m, 1H), 2,05 (dt, J=21,2, 11,0 Гц, 2H).
Пример 37. 1H ЯМР (500 МГц, CDCl3): δ 7,83 (s, 1H), 7,80 (d, J=8,0 Гц, 1H), 7,76-7,66 (m, 2H), 7,58 (t, J=7,8 Гц, 1H), 7,25-7,10 (m, 3H), 7,07-6,97 (m, 1H), 6,71 (d, J=8,5 Гц, 1H), 6,36 (d, J=1,6 Гц, 1H), 4,19 (dd, J=14,2, 4,3 Гц, 1H), 3,83-3,71 (m, 2H), 3,61-3,44 (m, 2H), 3,35 (dd, J=14,2, 9,9 Гц, 1H), 2,94 (d, J=11,4 Гц, 1H), 2,78-2,60 (m, 2H), 2,57 (dd, J=12,5, 9,7 Гц, 1H), 2,45-2,26 (m, 2H), 2,21 (d, J=1,5 Гц, 3H), 2,08-1,92 (m, 2H).
Пример 38. 1H ЯМР (500 МГц, CDCl3): δ 7,83 (s, 1H), 7,80 (d, J=8,0 Гц, 1H), 7,76-7,70 (m, 2H), 7,58 (t, J=7,8 Гц, 1H), 7,25-7,14 (m, 3H), 7,07-6,97 (m, 1H), 6,71 (d, J=8,9 Гц, 1H), 6,36 (d, J=1,7 Гц, 1H), 4,18 (dd, J=14,1, 4,4 Гц, 1H), 3,84-3,68 (m, 2H), 3,57-3,43 (m, 2H), 3,35 (dd, J=14,2, 10,0 Гц, 1H), 2,85 (d, J=11,1 Гц,1H), 2,76 (d, J=11,1 Гц, 1H), 2,65-2,50 (m, 2H), 2,43 (td, J=12,0, 3,0 Гц, 1H), 2,36-2,23 (m, 2H), 2,21 (d, J=1,5 Гц, 3H), 1,72 (t, J=10,6 Гц, 1H).
Пример 39. 1H ЯМР (400 МГц, метанол-d4) δ 8,07 (d, J=7,9 Гц, 1H), 8,01 (d, J=7,9 Гц, 1H), 7,89-7,80 (m, 2H), 7,69 (d, J=6,3 Гц, 1H), 7,52 (dd, J=8,7, 2,2 Гц, 1H), 7,21 (d, J=9,7 Гц, 1H), 7,17 (s, 1H), 6,97 (t, 1H), 7,06 (d, J=8,7 Гц, 1H), 6,93 (dt, J=9,5, 2,3 Гц, 1H), 4,48 (ddd, J=14,4, 6,9, 4,3 Гц, 1H), 4,09 (td, J=12,1, 10,8, 6,0 Гц, 2H), 3,74-3,63 (m, 2H), 3,58 (tt, J=11,3, 6,1 Гц, 2H), 3,50-3,41 (m, 1H), 3,31-3,23 (m, 2H), 3,23-3,07 (m, 2H), 2,94-2,82 (m, 1H), 2,82-2,69 (m, 1H).
Пример 40. 1H ЯМР (400 МГц, метанол-d4) δ 8,06 (d, J=7,9 Гц, 1H), 7,99 (d, J=7,9 Гц, 1H), 7,87-7,79 (m, 2H), 7,64 (d, J=5,3 Гц, 1H), 7,50 (dd, J=8,7, 2,3 Гц, 1H), 7,21-7,14 (m, 2H), 7,05 (d, J=8,8 Гц, 1H), 6,95 (t, 1H), 6,90 (dt, J=9,5, 2,3 Гц, 1H), 4,47 (ddd, J=13,2, 8,4, 4,3 Гц, 1H), 4,13-4,02 (m, 2H), 3,69 (t, J=14,1 Гц, 2H), 3,56 (qd, J=11,3, 5,0 Гц, 2H), 3,43 (ddd, J=13,2, 9,9, 2,9 Гц, 1H), 3,24 (dd, J=13,6, 3,6 Гц, 2H), 3,20-3,06 (m, 2H), 2,93-2,69 (m, 2H).
Пример 41. 1H ЯМР (500 МГц, CDCl3) δ 7,83-7,69 (m, 3H), 7,65-7,55 (m, 2H), 7,20 (dd, J=8,7, 2,2 Гц, 1H), 6,67 (d, J=8,8 Гц, 1H), 5,96 (s, 1H), 4,16 (dd, J=14,2, 4,4 Гц, 1H), 3,84-3,73 (m, 2H), 3,53-3,45 (m, 2H), 3,34 (dd, J=14,2, 9,9 Гц, 1H), 2,81 (dd, J=51,6, 10,9 Гц, 2H), 2,64-2,51 (m, 2H), 2,42 (d, J=12,2 Гц, 1H), 2,29 (d, J=19,8 Гц, 3H), 1,71 (t, J=10,5 Гц, 2H), 1,32 (d, J=11,6 Гц, 12H).
Пример 42. 1H ЯМР (500 МГц, CDCl3) δ 7,79 (d, J=8,0 Гц, 1H), 7,74 (d, J=7,9 Гц, 1H), 7,68 (s, 1H), 7,60 (t, J=7,9 Гц, 1H), 7,49 (d, J=2,2 Гц, 1H), 7,12 (dd, J=8,6, 2,2 Гц, 1H), 6,60 (d, J=8,8 Гц, 1H), 5,88 (d, J=1,4 Гц, 1H), 4,13 (dd, J=14,1, 4,2 Гц, 1H), 3,96 (s, 1H), 3,68 (dd, J=11,5, 4,1 Гц, 1H), 3,58-3,44 (m, 2H), 3,35 (dd, J=14,2, 9,0 Гц, 1H), 3,23-2,93 (m, 3H), 2,84- 2,48 (m, 3H), 2,33-2,13 (m, 4H), 1,25 (d, J=12,0 Гц, 12H).
Пример 43. Получение этил (S,E)-2-(8-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-6-((3- (трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин -3-ил)ацетата
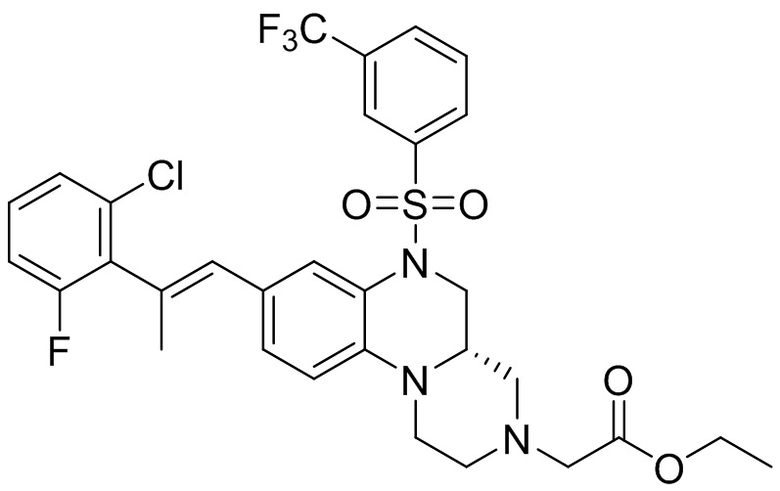
(S,E)-8-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-6-((3-(трифторметил)фенил)сульфонил)-2,3,4,4a,5,6-гексагидро-1H-пиразино[1,2-a]хиноксалин (40 мг, 0,71 ммоль) растворяли в ацетонитриле (3 мл). Добавляли карбонат калия (29 мг, 0,212 ммоль) и этилбромацетат (18 мг, 0,106 ммоль). Реакцию проводили в микроволновом реакторе при температуре 60°C в течение 12 ч. Реакционную смесь концентрировали и отделяли с помощью быстрой колоночной хроматографии с получением этил (S,E)-2-(8-(2-(2-хлор-6-фторфенил) проп-1-ен-1-ил)-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)ацетата (10,5 мг, 23%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 652 [M+H]+.
1H ЯМР (400 МГц, CDCl3) δ 7,74-7,69 (m, 2H), 7,69-7,63 (m, 2H), 7,52 (t, J=7,8 Гц, 1H), 7,11 (ddd, J=13,7, 9,5, 5,5 Гц, 3H), 6,95 (t, J=8,2 Гц, 1H), 6,63 (d, J=8,6 Гц, 1H), 6,29 (s, 1H), 4,11(q, J=7,4 Гц, 3H), 3,42 (d, J=12,2 Гц, 1H), 3,29 (dd, J=14,2, 9,8 Гц, 1H), 3,11 (d, J=4,2 Гц, 2H), 2,75 (q, J=16,0, 13,3 Гц, 3H), 2,53-2,42 (m, 1H),2,18-2,14 (m, 4H), 1,86 (s, 1H), 1,20 (d, J=7,2 Гц, 3H).
Примеры 44-48 получали методом синтеза, указанным в примере 43.
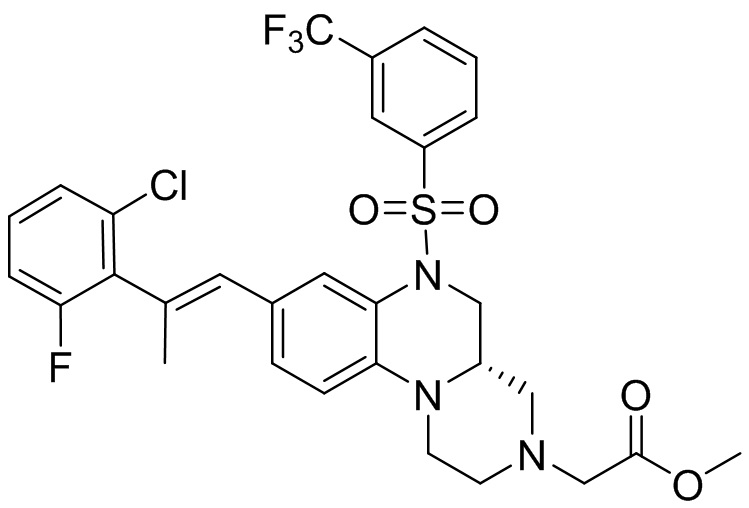

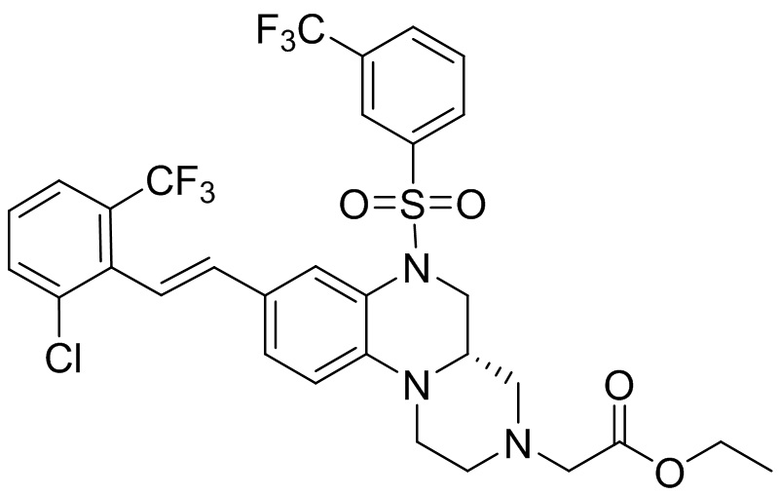
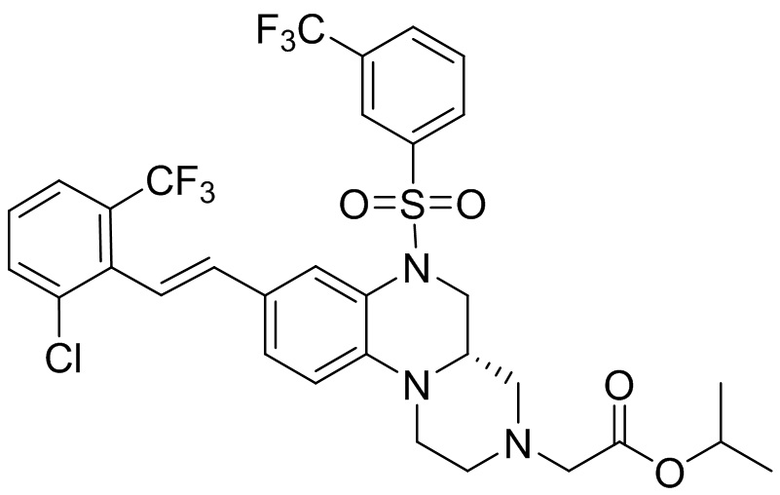
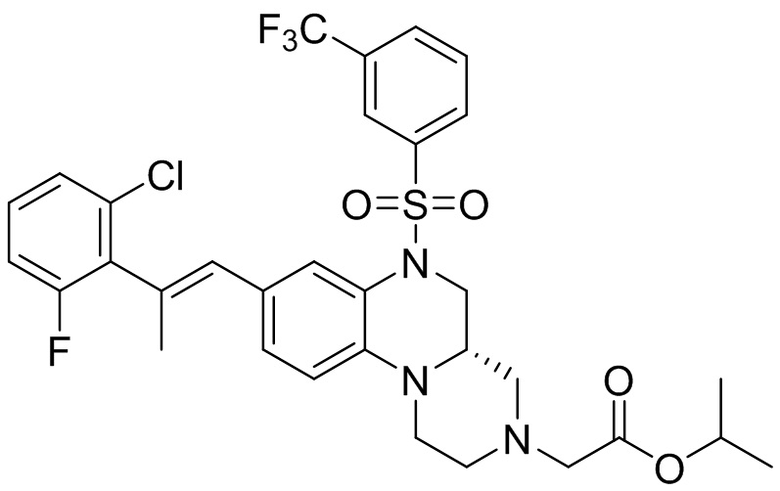
Данные о соединении, полученные методом ЯМР-спектроскопии на ядрах 1H, полученном в примерах с 44 по 48:
Пример 44. 1H NMR1H ЯМР (400 МГц, CDCl3) δ 7,76-7,62 (m, 4H), 7,52 (t, J=7,8 Гц, 1H), 7,18-7,06 (m, 3H), 6,99-6,89 (m, 1H), 6,63 (d, J=8,7 Гц, 1H), 6,29 (s, 1H), 4,12 (dd, J=14,1, 4,5 Гц, 1H), 3,65 (s, 3H), 3,42 (d, J=12,3 Гц, 1H), 3,29 (dd, J=14,2, 9,7 Гц, 1H), 3,21-3,04 (m, 2H), 2,83-2,60 (m, 3H), 2,48 (td, J=11,9, 2,8 Гц, 1H), 2,21-2,10 (m, 4H), 1,85 (t, J=10,3 Гц, 1H).
Пример 45. 1H ЯМР (400 МГц, CDCl3) δ 7,86-7,75 (m, 4H), 7,67-7,57 (m, 3H), 7,35-7,29 (m, 2H), 6,99 (d, J=16,9 Гц, 1H), 6,82 (d, J=16,5 Гц, 1H), 6,71 (d, J=8,7 Гц, 1H), 4,22 (dd, J=14,2, 4,4 Гц, 1H), 3,74 (s, 3H), 3,53 (d, J=12,2 Гц, 1H), 3,35 (dd, J=14,1, 9,9 Гц, 1H), 3,29-3,14 (m, 2H), 2,85 (t, J=9,8 Гц, 3H), 2,64-2,52 (m, 1H), 2,32-2,19 (m, 1H), 2,02-1,87 (m, 1H).
Пример 46. 1H ЯМР (400 МГц, CDCl3) δ 7,85-7,73 (m, 4H), 7,65-7,56 (m, 3H), 7,34-7,28 (m, 2H), 7,02-6,92 (m, 1H), 6,80 (d, J=16,5 Гц, 1H), 6,70 (d, J=8,7 Гц, 1H), 4,27-4,12 (m, 3H), 3,51 (d, J=12,4 Гц, 1H), 3,34 (dd, J=14,2, 9,9 Гц, 1H), 3,18 (d, J=3,6 Гц, 2H), 2,85 (dd, J=10,5, 8,1 Гц, 3H), 2,64-2,51 (m, 1H), 2,26 (dd, J=11,5, 3,2 Гц, 1H), 2,02-1,87 (m, 1H), 1,28 (t, J=7,1 Гц, 3H).
Пример 47. 1H ЯМР (400 МГц, CDCl3) δ 7,85-7,72 (m, 4H), 7,64-7,56 (m, 3H), 7,31 (dd, J=10,3, 3,0 Гц, 2H), 6,80 (d, J=16,5 Гц, 1H), 6,70 (d, J=8,6 Гц, 1H), 5,05 (m, 1H), 4,21 (dd, J=14,2, 4,3 Гц, 1H), 3,51 (d, J=12,2 Гц, 1H), 3,34 (dd, J=14,2, 10,0 Гц, 1H), 3,15 (d, J=3,3 Гц, 2H), 2,84 (s,3H), 2,64-2,50 (m, 1H), 2,24 (t, J=10,6 Гц, 1H), 1,94 (t, J=10,5 Гц, 1H), 1,25 (d, J=6,2 Гц, 6H).
Пример 48. 1H ЯМР (400 МГц, CDCl3) δ 7,72 (t, J=6,8 Гц, 2H), 7,66 (s, 2H), 7,52 (t, J=7,9 Гц, 1H), 7,17-7,07 (m, 3H), 6,95 (t, J=8,3 Гц, 1H), 6,63 (d, J=8,6 Гц, 1H), 6,29 (s, 1H), 4,98 (m, 1H), 4,12 (dd, J=14,2, 4,6 Гц, 1H), 3,41 (d, J=12,2 Гц, 1H), 3,28 (dd, J=14,2, 9,8 Гц, 1H), 3,15-3,00 (m, 2H), 2,81-2,65 (m, 3H), 2,53-2,42 (m, 1H), 2,18-2,14 (m, 4H), 1,85 (t, J=10,4 Гц, 1H), 1,18 (d, J=6,2 Гц, 6H).
Пример 49. Получение ((изопропоксикарбонил)окси)метил (S,E)-2-(8-(2-(2-хлор-6- фторфенил)проп-1-ен-1-ил)-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)ацетата
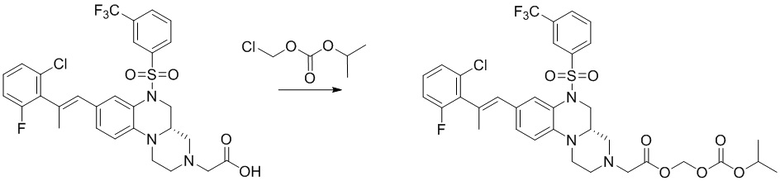
(S,E)-2-(8-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)уксусную кислоту (15 мг, 0,024 ммоль) растворяли N,N-диметилформамиде (2 мл). Добавляли триэтиламин (12 мг, 0,12 ммоль) и хлорметил-изопропил-карбонат (18 мг, 0,12 ммоль). Реакционную смесь перемешивали при температуре 60°C в течение 3 ч. Реакционную смесь отделяли с помощью быстрой колоночной хроматографии с получением ((изопропоксикарбонил) окси)метил (S,E)-2-(8-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-6-((3-(трифторметил)фенил) сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)ацетата (39,2 мг, 56%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 740 [M+1]+.
1H ЯМР (400 МГц, CDCl3) δ 7,83-7,80 (m, 2H), 7,75 (d, J=5,2 Гц, 2H), 7,63-7,61 (m, 1H), 7,27-7,17 (m, 3H), 7,04 (t, J=8,3 Гц, 1H), 6,72 (d, J=8,6 Гц, 1H), 6,38 (s, 1H), 5,80 (s, 2H), 4,98-4,92 (m, 2H), 4,20 (dd, J=14,2, 4,5 Гц, 1H), 3,51 (d, J=12,2 Гц, 1H), 3,37 (dd, J=14,3, 9,9 Гц, 1H), 3,29 (s, 2H), 2,83 (t, J=11,4 Гц, 2H), 2,75 (s, 1H), 2,53 (t, J=11,5 Гц, 1H), 2,31 (dd, J=13,5, 10,5 Гц, 1H), 2,23 (s, 3H), 2,01 (t, J=10,3 Гц, 1H), 1,38-1,32 (d, J=10 Гц, 6H).
Пример 50. Получение ((изопропоксикарбонил)окси)метил (S,E)-2-(8-(2-хлор-6- (трифторметил)стирил)-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)ацетата
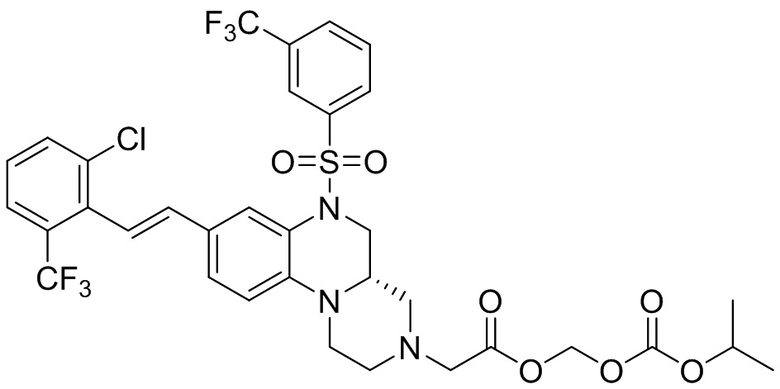
Пример 50 получали методом синтеза, указанным в примере 49. Масс- спектрометрия с ионизацией электрораспылением (ESI-MS): 776 [M+1]+.
1H ЯМР (400 МГц, CDCl3) δ 7,84-7,73 (m, 4H), 7,62 (dd, J=8,2, 3,0 Гц, 3H), 7,33-7,28 (m, 2H), 7,02-6,93 (m, 1H), 6,80 (d, J=16,5 Гц, 1H), 6,69 (d, J=8,7 Гц, 1H), 5,78 (s, 2H), 4,93 (m, 1H), 4,20 (dd, J=14,1, 4,4 Гц, 1H), 3,51 (d, J=12,3 Гц, 1H), 3,33 (dd, J=14,1, 10,0 Гц, 1H), 3,30-3,27 (m, 2H), 2,82 (q, J=10,0, 9,2 Гц, 3H), 2,54 (td, J=12,0, 3,0 Гц, 1H), 2,37-2,25 (m, 1H), 2,01 (t, J=10,4 Гц, 1H), 1,33 (d, J=6,3 Гц, 6H).
Пример 51. Получение трет-бутил (S)-2-(8-(3-(дифторметокси)-5-фторфенил)-6-((3- (трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)-2-метилпропаноата

(S)-8-(3-(дифторметокси)-5-фторфенил)-6-((3-(трифторметил)фенил)сульфонил)-2,3,4,4a,5,6-гексагидро-1H-пиразино[1,2-a]хиноксалин (110 мг, 0,20 ммоль) растворяли в ацетонитриле (5 мл). Добавляли йодид натрия (120 мг, 0,80 ммоль), трет-бутил 2-бром-2-метилпропаноат (362 мг, 1,6 ммоль) и N,N-диизопропилэтиламин (80,8 мг, 0,63 ммоль). Проводили реакцию в микроволновом реакторе при температуре 120°С в течение 2,5 ч. Для удаления растворителя реакционную смесь концентрировали. Остаток отделяли с помощью обращенно-фазовой колоночной хроматографии [элюент : ацетонитрил : вода (0,5% HCl) = 0%-49%] с получением трет-бутил (S)-2-(8-(3-(дифторметокси)-5-фторфенил)-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)-2-метилпропаноата (26 мг, 83%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 700 [M+H]+.
1H ЯМР (400 МГц, CDCl3) δ 8,16 (s, 1H), 7,90 (s, 1H), 7,84 (d, J=7,4 Гц, 1H), 7,77 (s, 1H), 7,53 (d, J=10,2 Гц, 1H), 7,38-7,34 (m, 1H), 7,14-7,07 (m, 2H), 6,84 (d, J=9,3 Гц, 1H), 6,77 (s, 1H), 6,59 (t, 1H), 4,29 (d, J=13,8 Гц, 1H), 4,08 (s, 1H), 3,69 (d, J=10,0 Гц,1H), 3,50 (m, 5H), 3,23 (s, 1H), 1,85 (s, 6H), 1,59 (d, J=16,7 Гц, 9H).
Примеры 52-53 получали методом синтеза, указанным в примере 51.
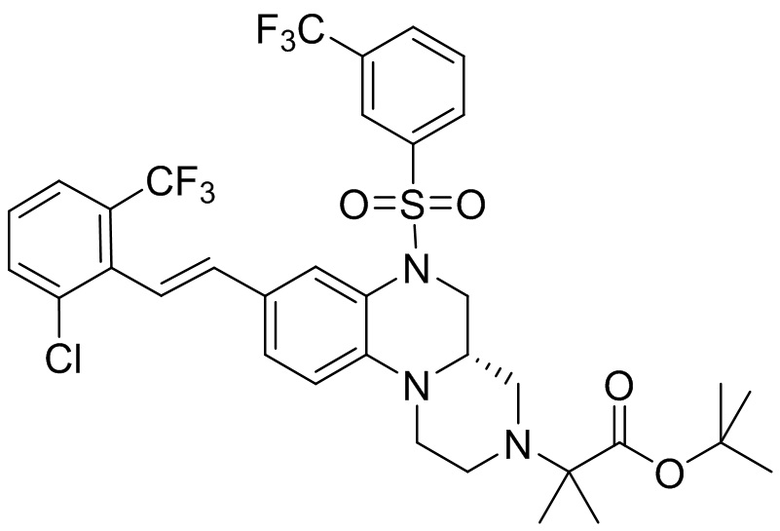
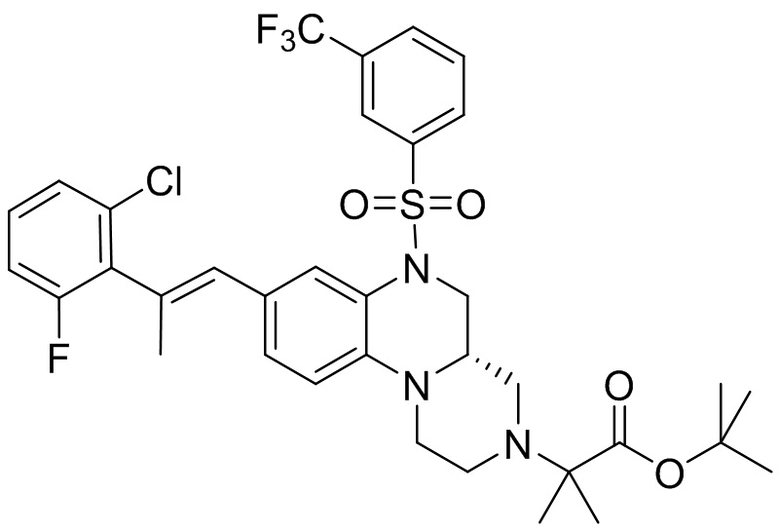
Данные о соединении, полученные методом ЯМР-спектроскопии на ядрах 1H, полученном в примерах с 52 по 53:
Пример 52. 1H ЯМР (400 МГц, CDCl3) δ 7,87 (s, 1H), 7,83-7,74 (m, 3H), 7,67-7,57 (m, 3H), 7,32 (dd, J=8,5, 2,3 Гц, 2H), 6,99 (d, J=16,6 Гц, 1H), 6,82 (d, J=16,6 Гц, 1H), 6,71 (d, J=8,6 Гц, 1H), 4,24 (dd, J=14,0, 4,1 Гц, 1H), 3,54 (d, J=11,7 Гц, 1H), 3,32 (dd, J=14,0, 10,4 Гц, 1H), 2,99-2,87 (m, 2H), 2,66-2,56 (m, 1H), 2,47-2,37 (m, 1H), 2,34-2,25 (m, 1H), 1,98 (t, J=10,5 Гц, 1H), 1,46 (s, 9H), 1,26 (s, 6H).
Пример 53. 1H ЯМР (400 МГц, CDCl3) δ 7,86 (s, 1H), 7,81 (d, J=7,8 Гц, 1H), 7,76-7,71 (m, 2H), 7,59 (t, J=7,9 Гц, 1H), 7,26-7,15 (m, 3H), 7,07-7,01 (m, 1H), 6,72 (d, J=8,6 Гц, 1H), 6,37 (s, 1H), 4,21 (dd, J=14,1, 4,2 Гц, 1H), 3,52 (d, J=11,5 Гц, 1H), 3,34 (dd, J=14,1, 10,3 Гц, 1H), 2,91 (dd, J=19,6, 11,1 Гц, 2H), 2,62-2,50 (m, 1H), 2,39 (td, J=11,6, 2,8 Гц, 1H), 2,34-2,26 (m, 1H), 2,23 (d, J=1,4 Гц, 3H), 1,97 (t, J=10,4 Гц, 1H), 1,46 (s, 9H), 1,25 (s, 6H).
Пример 54. Получение (S)-2-(8-(3-(дифторметокси)-5-фторфенил)-6-((3-(трифторметил) фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)-2-метилпропановой кислоты
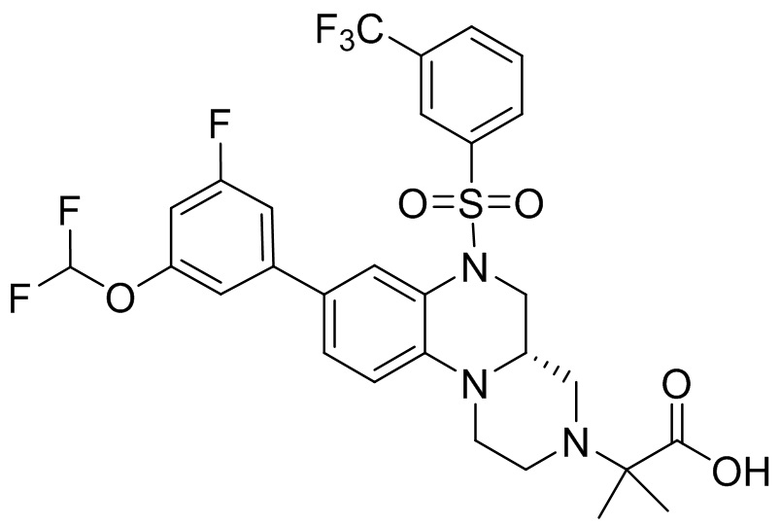
Трет-бутил (S)-2-(8-(3-(дифторметокси)-5-фторфенил)-6-((3-(трифторметил)фенил) сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)-2-метилпропаноат (21 мг, 0,03 ммоль) растворяли в растворе хлористого водорода в диоксане (3 мл, 4 M). Реакционный раствор перемешивали при комнатной температуре в течение 12 ч. Для удаления растворителя реакционную смесь концентрировали. Остаток отделяли с помощью обращенно-фазовой колоночной хроматографии [элюент : ацетонитрил : вода (0,5% HCl) = 0%-46%] с получением (S)-2-(8-(3-(дифторметокси)-5-фторфенил)-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)-2-метилпропановой кислоты (10 мг, 52%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 644 [M+H]+.
1H ЯМР (400 МГц, метанол-d4) δ 8,02 (dd, J=15,4, 7,9 Гц, 2H), 7,85-7,78 (m, 2H), 7,69 (s, 1H), 7,51 (dd, J=8,7, 2,2 Гц, 1H), 7,22-7,15 (m, 2H), 6,95 (t, 1H), 7,04 (d, J=8,8 Гц, 1H), 6,91 (d, J=9,5 Гц, 1H), 4,47 (dd, J=14,4, 4,2 Гц, 1H), 4,09 (d, J=13,9 Гц, 1H), 3,53 (t, J=9,7 Гц, 2H), 3,42 (dd, J=14,4, 10,0 Гц, 1H), 3,15 (d, J=13,2 Гц, 2H), 2,90 (t, J=11,4 Гц, 1H), 2,82 (t, J=12,7 Гц, 1H), 1,60 (s, 6H).
Примеры 55-56 получали методом синтеза, указанным в примере 54.
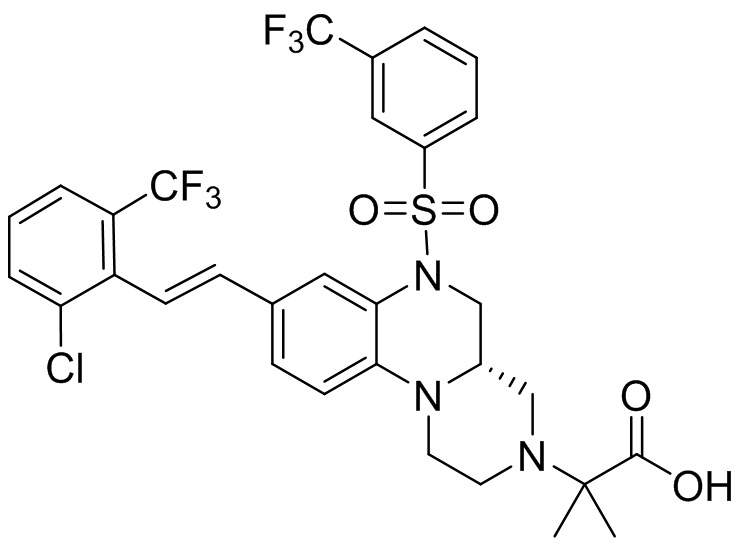
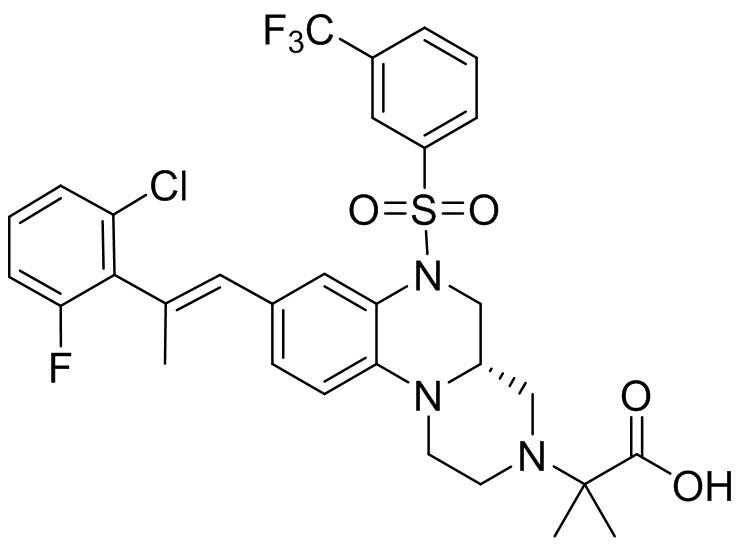
Данные о соединении, полученные методом ЯМР-спектроскопии на ядрах 1H, полученном в примерах с 55 по 56:
Пример 55. 1H ЯМР (400 МГц, метанол-d4) δ 7,92 (d, J=7,9 Гц, 1H), 7,86 (d, J=7,9 Гц, 1H), 7,72-7,68 (m , 1H), 7,67-7,59 (m, 3H), 7,56 (s, 1H), 7,35-7,31 (m, 1H), 7,25 (dd, J=8,6, 2,0 Гц, 1H), 6,90 (dd, J=16,6, 2,1 Гц, 1H), 6,81 (d, J=8,7 Гц, 1H), 6,67 (d, J=16,5 Гц, 1H), 4,32 (dd, J=14,3, 4,3 Гц, 1H), 3,81 (d, J=13,2 Гц, 1H), 3,29 (dd, J=14,3, 10,0 Гц, 2H), 3,12 (d, J=12,1 Гц, 1H), 2,95 (s, 1H), 2,77-2,69 (m, 1H), 2,62-2,54 (m, 1H), 2,45 (t, J=11,1 Гц, 1H), 1,31 (s, 6H).
Пример 56. 1H ЯМР (400 МГц, метанол-d4) δ 7,96 (d, J=7,9 Гц, 1H), 7,90 (d, J=7,9 Гц, 1H), 7,73 (t, J=7,9 Гц, 1H), 7,62-7,55 (m, 2H), 7,19 (q, J=3,6 Гц, 2H), 7,11 (dd, J=8,6, 2,0 Гц, 1H), 7,02 (td, J=5,9, 3,0 Гц, 1H), 6,86 (d, J=8,7 Гц, 1H), 6,23 (s, 1H), 4,37 (dd, J=14,3, 4,2 Гц, 1H), 3,96 (d, J=14,4 Гц, 1H), 3,43 (t, J=10,5 Гц, 2H), 3,34 (dd, J=14,4, 9,9 Гц, 1H), 3,14-3,01 (m, 2H), 2,85-2,66 (m, 2H), 2,06 (d, J=1,4 Гц, 3H), 1,51 (d, J=2,2 Гц, 6H).
Пример 57. Получение этил (S,E)-2-(8-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-6-((3- (трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин -3-ил)-2-оксоацетата
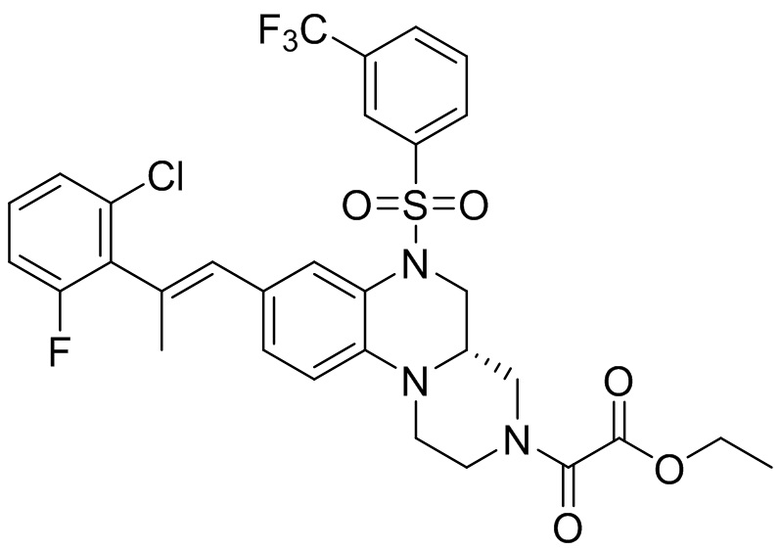
(S,E)-8-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-6-((3-(трифторметил)фенил)сульфонил)-2,3,4,4a,5,6-гексагидро-1H-пиразино[1,2-a]хиноксалин (40 мг, 0,071 ммоль) растворяли в дихлорметане (3 мл). Триэтиламин (22 мг, 0,212 ммоль) и моноэтиловый эфир оксалилхлорида (15 мг, 0,106 ммоль) добавляли в раствор при температуре 0°C. Реакционную смесь перемешивали при комнатной температуре и реакцию проводили в течение ночи. Раствор смеси концентрировали и отделяли с помощью обращенно-фазовой колоночной хроматографии с получением (S,E)-2-(8-(2-(2-хлор-6-фторфенил)проп-1- ен-1-ил)-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)-2-оксоацетата (24,6 мг, 52%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 666,2 [M+H]+.
1H ЯМР (400 МГц, CDCl3) δ 7,92-7,58 (m, 5H), 7,24-7,15 (m, 3H), 7,02 (t, J=8,6 Гц, 1H), 6,73 (dd, J=19,3, 8,6 Гц, 1H), 6,36 (s, 1H), 4,44-4,19 (m, 4H), 3,64 (dt, J=21,8, 11,8 Гц, 2H), 3,37 (td, J=13,9, 9,7 Гц, 1H), 3,17 (t, J=12,0 Гц, 1H), 2,88-2,60 (m, 2H), 2,39 (dt, J=33,4, 11,4 Гц, 2H), 2,20 (s, 3H), 1,39 (dt, J=14,8, 7,0 Гц, 3H).
Пример 58. Получение этил (S,E)-2-(8-(2-хлор-6-(трифторметил)стирил)-6-((3- (трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)-2-оксоацетата
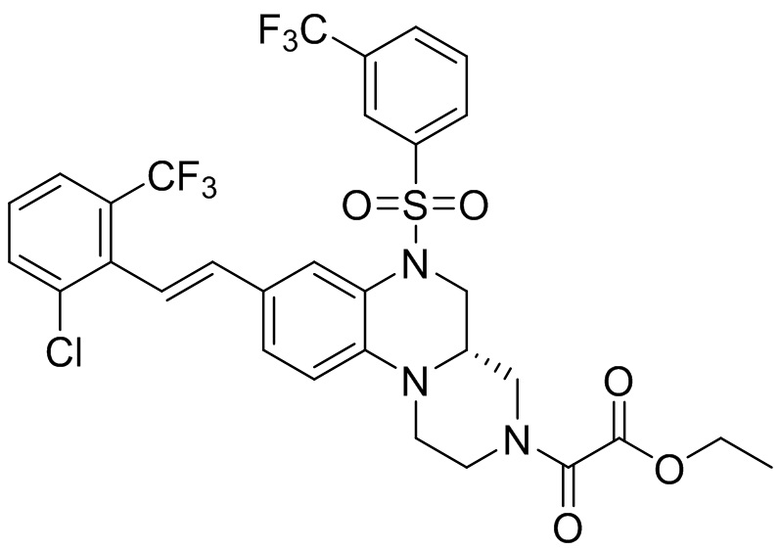
Пример 58 получали методом синтеза, указанным в примере 57. Масс- спектрометрия с ионизацией электрораспылением (ESI-MS): 702,2 [M+H]+.
1H ЯМР (400 МГц, CDCl3) δ 7,90 (d, J=8,0 Гц, 0,5H), 7,86-7,79 (m, 2H), 7,77-7,70 (m, 1,5H), 7,67-7,61 (m, 3H), 7,38-7,31 (m, 2H), 6,99 (d, J=13,7 Гц, 1H), 6,85-6,70 (m, 2H), 4,46-4,24 (m, 4H), 3,73-3,60 (m, 2H), 3,43-3,30 (m, 1H), 3,19 (d, J=11,1 Гц, 0,5H), 2,91-2,69 (m, 2H), 2,44 (dd, J=24,2, 11,7 Гц, 1,5H), 1,41 (dt, J=15,5, 7,2 Гц, 3H).
Пример 59. Получение (S,E)-2-(8-(2-хлор-6-(трифторметил)стирил)-6-((3- (трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)ацетамида
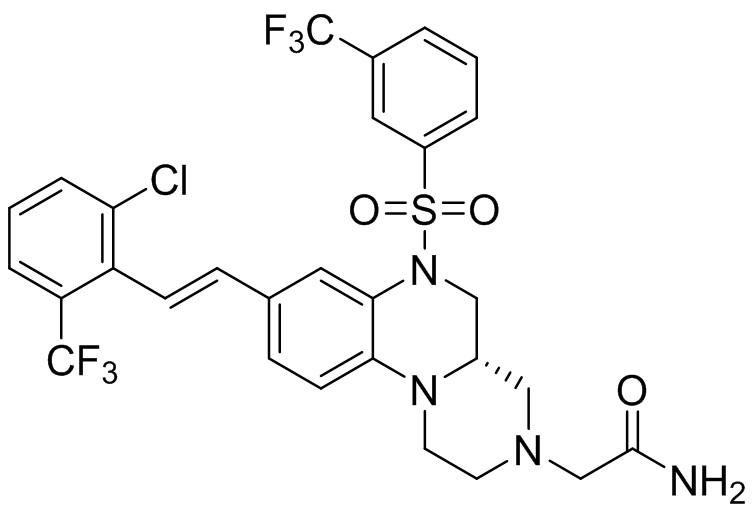
Метил-(S,E)-2-(8-(2-хлор-6-(трифторметил)стирил)-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)ацетат (150 мг, 0,23 ммоль) растворяли в растворе аммиака в метаноле (3 мл, 7N). Реакционную смесь нагревали до температуры 85°С в герметичном сосуде и перемешивали в течение 48 ч. Для удаления растворителя реакционную смесь концентрировали. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля с получением (S,E)-2-(8-(2-хлор-6-(трифторметил)стирил)-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)ацетамида (38,5 мг, 84%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 659 [M+1]+.
1H ЯМР (400 МГц, метанол-d4) δ 7,95 (d, J=7,8 Гц, 1H), 7,92-7,87 (m, 1H), 7,79-7,70 (m, 5H), 7,46-7,42 (m , 1H), 7,34 (dd, J=8,7, 2,1 Гц, 1H), 7,01 (dd, J=16,5, 2,0 Гц, 1H), 6,86 (d, J=8,7 Гц, 1H), 6,79 (d, J=16,7 Гц, 1H), 4,31 (dd, J=14,3, 4,5 Гц, 1H), 3,64 (d, J=12,5 Гц, 1H), 3,41-3,34 (m, 1H), 3,01 (d, J=2,5 Гц, 2H), 2,85 (ddt, J=9,7, 5,1, 2,2 Гц, 2H), 2,77 (ddt, J=10,2, 5,7, 2,8 Гц, 1H), 2,46 (td, J=12,2, 3,0 Гц, 1H), 2,16 (td, J=11,6, 3,1 Гц, 1H), 1,87 (t, J=10,6 Гц, 1H).
Пример 60. Получение (S,E)-8-(2-хлор-6-(трифторметил)стирил)-6-((3-(трифторметил) фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-карбоксамида
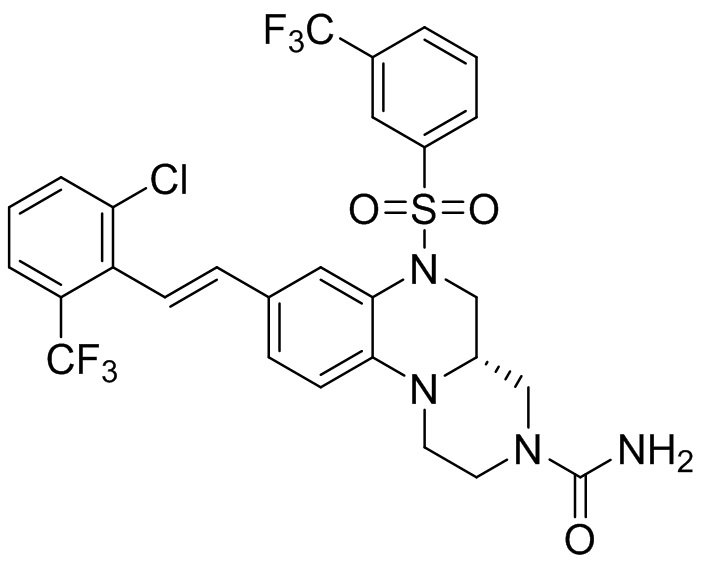
(S,E)-8-(2-хлор-6-(трифторметил)стирил)-6-((3-(трифторметил)фенил)сульфонил)-2,3,4,4a,5,6-гексагидро-1H-пиразино[1,2-a] хиноксалин (50 мг, 0,083 ммоль) и изоцианатотриметилсилан (50 мг, 0,083 ммоль) нагревали до температуры 90°C и перемешивали в течение 2 ч. Для остановки реакции добавляли метанол. Раствор смеси отделяли с помощью быстрой обращенно-фазовой колоночной хроматографии с получением (S,E)-8-(2-хлор-6-(трифторметил)стирил)-6-((3-(трифторметил)фенил)сульфонил) -1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-карбоксамида (24,2 мг, 14%). Масс- спектрометрия с ионизацией электрораспылением (ESI-MS): 645 [M+1]+.
1H ЯМР (400 МГц, CDCl3) δ 7,82-7,64 (m, 3H), 7,72 (d, J=2,0 Гц, 1H), 7,64 (dd,J=8,1, 2,5 Гц, 3H), 7,37-7,28 (m, 2H), 7,03-6,94 (m, 1H), 6,81 (d, J=16,5 Гц, 1H), 6,72 (d, J=8,7 Гц, 1H), 4,50 (s, 2H), 4,28 (dd, J=14,2, 4,5 Гц, 1H), 3,79 (dd, J=27,1, 12,6 Гц, 2H), 3,64-3,53 (m,1H), 3,33 (dd, J=14,3, 10,0 Гц, 1H), 3,08-2,93 (m, 1H), 2,75 (dd, J=8,5, 5,1 Гц, 1H), 2,59 (dd, J=12,4, 10,7 Гц, 1H), 2,48 (td, J=11,8, 3,4 Гц, 1H).
Примеры 61-62 получали методом синтеза, указанным в примере 60.
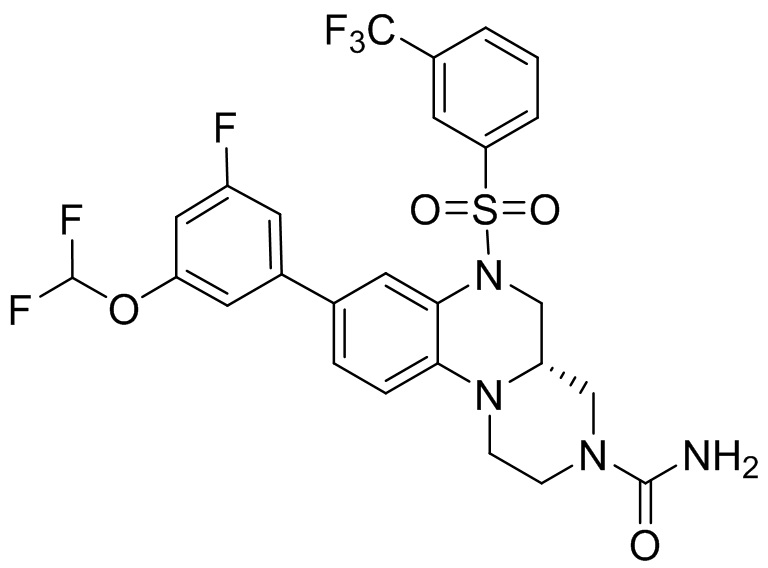
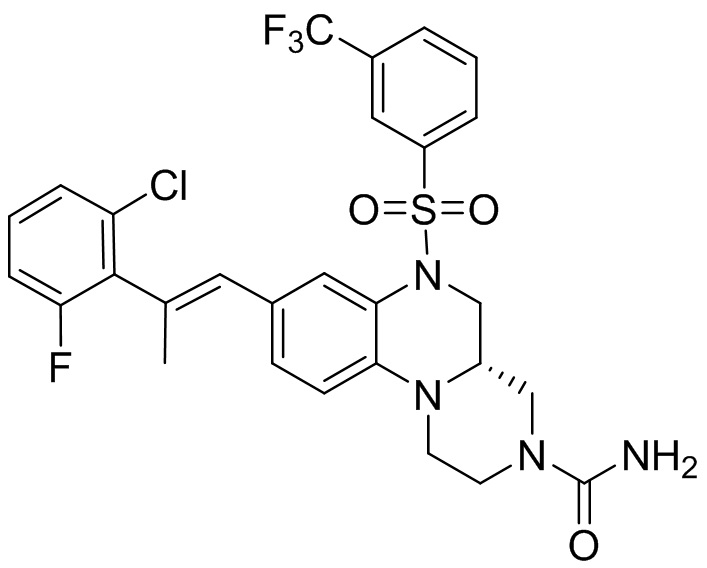
Данные о соединении, полученные методом ЯМР-спектроскопии на ядрах 1H, полученном в примерах с 61 по 62:
Пример 61. 1H ЯМР (400 МГц, метанол-d4) δ 7,93 (d, J=7,9 Гц, 1H), 7,87 (d, J=8,0 Гц, 1H), 7,83 (d, J=2,3 Гц, 1H), 7,74 (t, J=7,9 Гц, 1H), 7,64 (s, 1H), 7,48 (dd, J=8,7, 2,3 Гц, 1H), 7,21 (dt, J=9,8, 1,9 Гц, 1H), 7,18 (d, J=1,9 Гц, 1H), 6,95 (t, 1H), 6,93 (d, J=8,8 Гц, 1H), 6,88 (dt, J=9,5, 2,3 Гц, 1H), 4,36 (dd, J=14,5, 3,6 Гц, 1H), 3,92-3,82 (m, 2H), 3,68 (dt, J=12,6, 3,1 Гц, 1H), 3,38-3,32 (m, 1H), 2,89 (td, J=13,0, 12,4, 3,4 Гц, 1H), 2,60-2,49 (m, 2H), 2,26 (td, J=12,0, 3,3 Гц, 1H).
Пример 62. 1H ЯМР (400 МГц, CDCl3) δ 7,81 (t, J=6,2 Гц, 2H), 7,76 (s, 1H), 7,68 (d, J=1,9 Гц, 1H), 7,61 (t, J=7,9 Гц, 1H), 7,25-7,14 (m, 3H), 7,02 (t, J=8,5 Гц, 1H), 6,72 (d, J=8,6 Гц, 1H), 6,36 (s, 1H), 4,50 (s, 2H), 4,25 (dd, J=14,3, 4,5 Гц, 1H), 3,77 (dd, J=23,3, 12,6 Гц, 2H), 3,56 (dt, J=12,5, 3,3 Гц, 1H), 3,33 (dd, J=14,3, 9,8 Гц, 1H), 3,04-2,90 (m, 1H), 2,68 (d, J=10,0 Гц, 1H), 2,56 (t, J=11,5 Гц, 1H), 2,43 (td, J=11,8, 3,3 Гц, 1H), 2,20 (s, 3H).
Пример 63. Получение (S,E)-8-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-карботиоамида
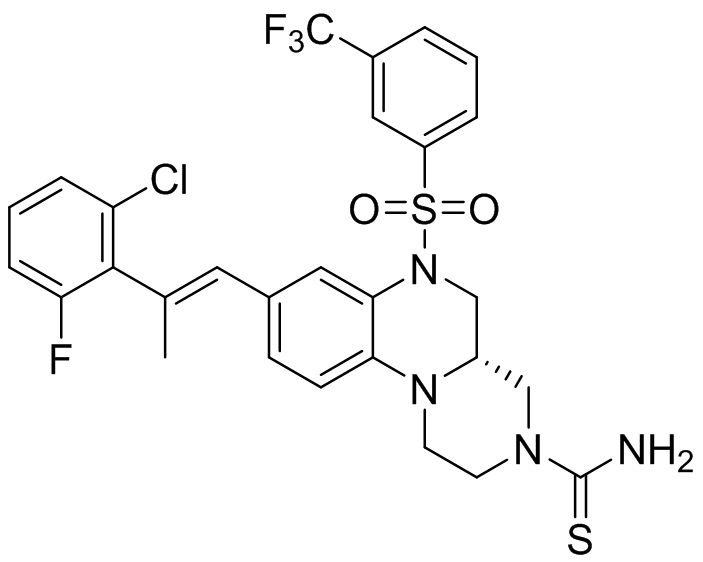
(S,E)-8-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-6-((3-(трифторметил)фенил)сульфонил)-2,3,4,4a,5,6-гексагидро-1H-пиразино[1,2-a]хиноксалин (50 мг, 0,088 ммоль), изотиоцианатотриметилсилан (0,5 мл) нагревали до температуры 90°C и перемешивали в течение 2 ч; для остановки реакции добавляли метанол. Раствор смеси отделяли с помощью быстрой обращенно-фазовой колоночной хроматографии с получением (S,E)-8-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино [1,2-a]хиноксалин-3-карботиоамида (10,3 мг, 18,7%) Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 625 [M+1]+.
1H ЯМР (400 МГц, CDCl3) δ 7,84 (dd, J=19,9, 7,9 Гц, 2H), 7,76 (s, 1H), 7,65-7,62 (m, 2H), 7,26-7,21 (m , 3H), 7,02 (t, J=8,5 Гц, 1H), 6,69 (d, J=8,6 Гц, 1H), 6,36 (s, 1H), 5,75 (s, 2H), 4,38 (d, J=11,8 Гц, 1H), 4,29 (dd, J=14,2, 4,3 Гц, 1H), 4,16 (d, J=13,3 Гц, 1H), 3,59 (dd, J=10,7, 6,2 Гц, 1H), 3,47 (t, J=12,2 Гц, 1H), 3,32 (dd, J=14,2, 9,5 Гц, 1H), 3,01-2,84 (m, 2H), 2,75-2,61 (m, 1H), 2,19 (s, 3H).
Примеры 64-65 получали методом синтеза, указанным в примере 63.
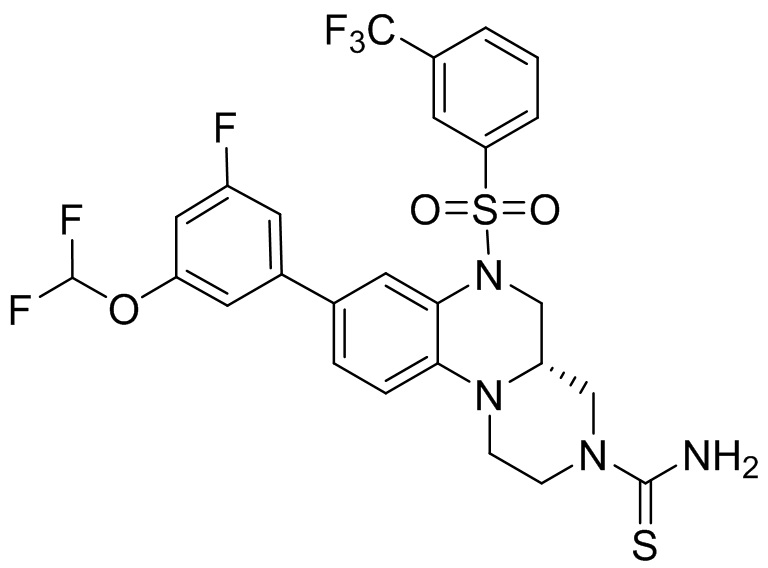
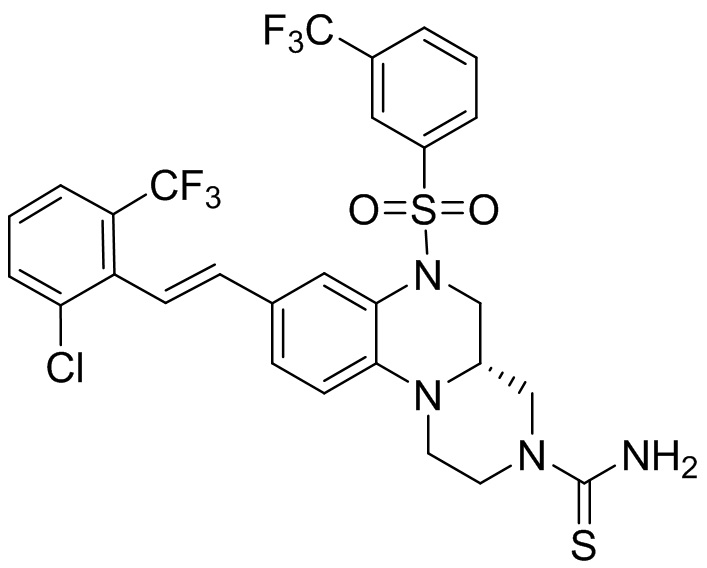
Данные о соединении, полученные методом ЯМР-спектроскопии на ядрах 1H, полученном в примерах с 64 по 65:
Пример 64. 1H ЯМР (400 МГц, метанол-d4) δ 7,92 (t, J=8,1 Гц, 2H), 7,84 (d, J=2,3 Гц, 1H), 7,75 (t, J=7,9 Гц, 1H), 7,60 (s, 1H), 7,49 (dd, J=8,7, 2,3 Гц, 1H), 7,24-7,16 (m, 2H), 6,95 (t, 1H), 6,94-6,85 (m, 2H), 4,49 (d, J=20,2 Гц, 1H), 4,37 (dd, J=14,4, 4,3 Гц, 2H), 3,67 (dt, J=12,5, 3,7 Гц, 1H), 3,35 (d, J=10,3 Гц, 1H), 3,28-3,21 (m, 1H), 2,83-2,74 (m, 1H), 2,69 (tt, J=10,8, 3,7 Гц, 1H), 2,41 (ddd, J=13,3, 10,6, 3,4 Гц, 1H).
Пример 65. 1H ЯМР (400 МГц, CDCl3) δ 7,81 (d, J=7,9 Гц, 1H), 7,78-7,69 (m, 2H), 7,63-7,52 (m, 4H), 7,31-7,21 (m, 2H), 6,94-6,84 (m, 1H), 6,73 (d, J=16,5 Гц, 1H), 6,61 (d, J=8,6 Гц, 1H), 5,66 (s, 2H), 4,31 (d, J=12,4 Гц, 1H), 4,24 (dd, J=14,2, 4,4 Гц, 1H), 4,08 (d, J=13,3 Гц, 1H), 3,54 (dt, J=12,3, 4,4 Гц, 1H), 3,45 (t, J=11,3 Гц, 1H), 3,23 (dd, J=14,2, 9,8 Гц, 1H), 3,01-2,90 (m, 1H), 2,84 (t, J=11,6 Гц, 1H), 2,71-2,59 (m, 1H).
Пример 66. Получение (R,E)-8-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-сульфонамида
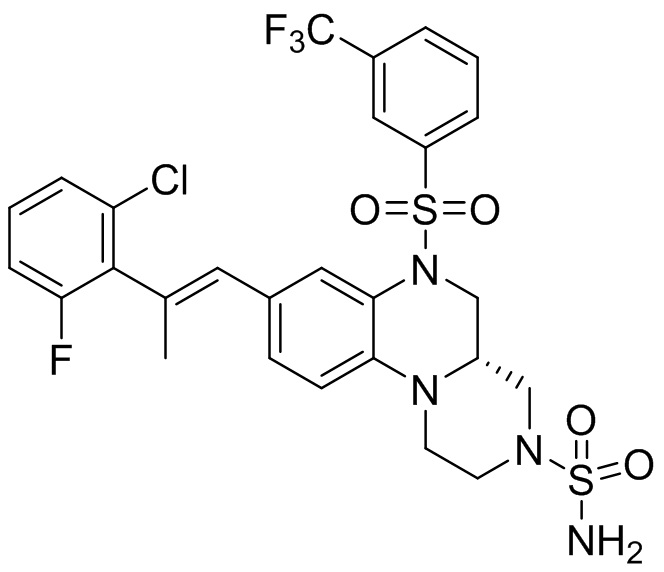
(S,E)-8-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-6-((3-(трифторметил)фенил)сульфонил)-2,3,4,4a,5,6-гексагидро-1H-пиразино[1,2-a]хиноксалин (40 мг, 0,071 ммоль) растворяли в диметиловом эфире этиленгликоля (3 мл). Добавляли сульфонамид (40 мг, 0,417 ммоль). Реакционную смесь нагревали до температуры 85°C и перемешивали в течение ночи, а затем концентрировали для удаления растворителя. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля с получением (R,E)-8-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-сульфонамида (8,8 мг, 19%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 645,2 [M+1]+.
1H ЯМР (400 МГц, CDCl3) δ 7,82 (d, J=7,9 Гц, 2H), 7,75 (s, 1H), 7,69 (s, 1H), 7,63 (s, 1H), 7,20 (dd, J=12,3, 4,5 Гц, 3H), 7,02 (t, J=8,7 Гц, 1H), 6,74 (d, J=8,6 Гц, 1H), 6,36 (s, 1H), 4,36 (s, 2H), 4,23 (dd, J=14,3, 4,6 Гц, 1H), 3,71-3,50 (m, 3H), 3,40 (dd, J=14,3, 9,6 Гц, 1H), 2,80-2,70 (m, 1H), 2,65 (t, J=10,7 Гц, 1H), 2,57-2,44 (m, 1H), 2,35 (t, J=10,8 Гц, 1H), 2,20 (s, 3H).
Примеры 67-68 получали методом синтеза, указанным в примере 66.
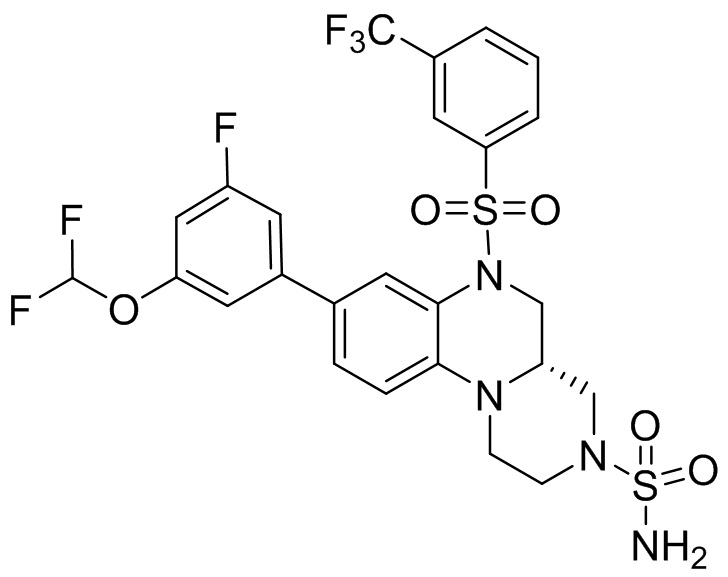
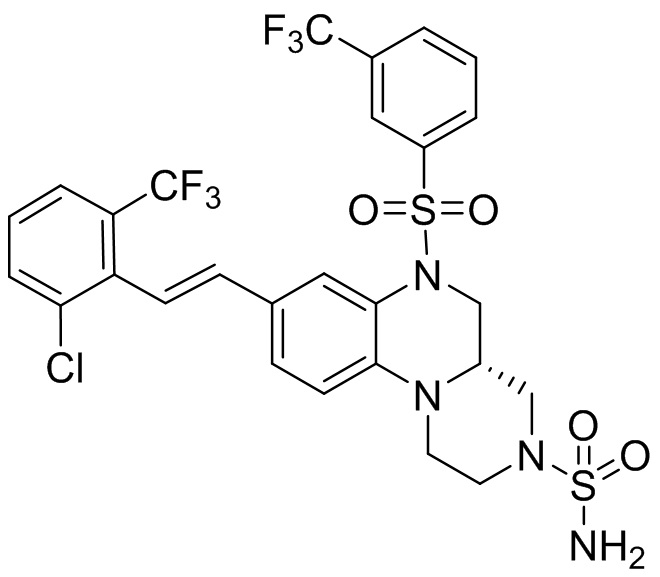
Данные о соединении, полученные методом ЯМР-спектроскопии на ядрах 1H, полученном в примерах с 67 по 68:
Пример 67. 1H ЯМР (400 МГц, метанол-d4) δ 8,00 (s, 1H), 7,90-7,81 (m, 2H), 7,77-7,65 (m, 2H), 7,49 (dd, J=8,7, 2,3 Гц, 1H), 7,24-7,16 (m, 2H), 6,95 (t, 1H), 6,98 (dd, J=8,8, 2,8 Гц, 1H), 6,89 (dt, J=9,4, 2,3 Гц, 1H), 4,42 (dt, J=14,7, 4,0 Гц, 1H), 4,22 (t, J=10,9 Гц, 1H), 3,80 (t, J=11,4 Гц, 1H), 3,67 (dd, J=21,4, 12,9 Гц, 1H), 3,43-3,34 (m, 3H), 2,86-2,67 (m, 1H), 2,47-2,36 (m, 1H).
Пример 68. 1H ЯМР (400 МГц, CDCl3) δ 7,82 (d, J=8,9 Гц, 2H), 7,79-7,70 (m, 2H), 7,66 -7,59 (m, 3H), 7,36-7,29 (m, 2H), 6,98 (dd, J=15,2, 3,0 Гц, 1H), 6,84-6,70 (m, 2H), 4,36 (s, 2H), 4,25 (dd, J=14,3, 4,6 Гц, 1H), 3,72-3,53 (m, 3H), 3,39 (dd, J=14,3, 9,6 Гц, 1H), 2,82 (t, J=3,9 Гц, 1H), 2,74-2,62 (m, 1H), 2,59-2,49 (m, 1H), 2,36 (t, J=10,9 Гц, 1H).
Пример 69. Получение (S,E)-2-(8-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)пропан-1,3-диол
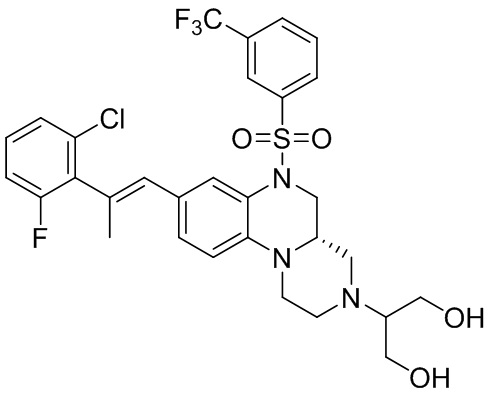
Этап 1. Синтез (S,E)-8-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-3-(2,2-диметил-1,3-диоксан-5-ил)-6-((3-(трифторметил)фенил)сульфонил)-2,3,4,4a,5,6-гексагидро-1H-пиразино[1,2-a]хиноксалина
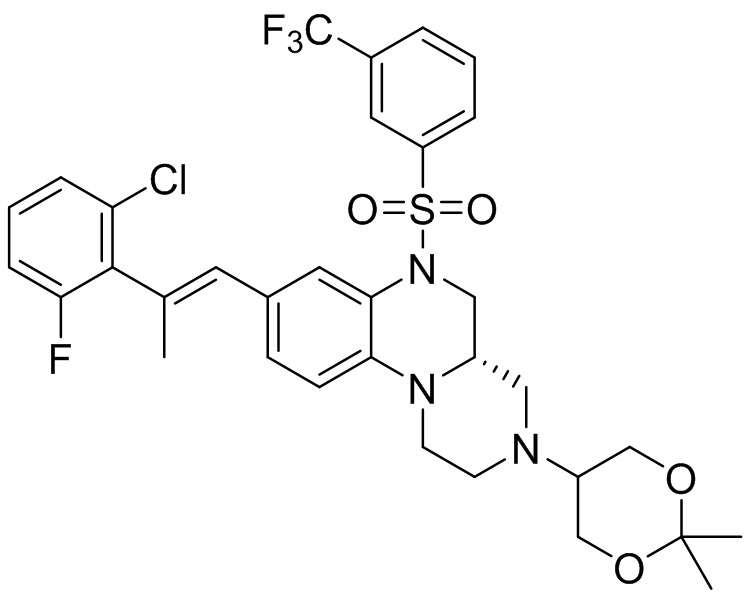
(S,E)-8-(2-хлор-6-(трифторметил)стирил)-6-((3-(трифторметил)фенил)сульфонил)-2,3,4,4a,5,6-гексагидро-1H-пиразино[1,2-a]хиноксалин (56 мг, 0,1 ммоль) растворяли в N,N-диметилформамиде (2 мл); к раствору добавляли 2,2-диметил-1,3-диоксан-5-он (26 мг, 0,2 ммоль) и одну каплю уксусной кислоты. Реакционную смесь перемешивали при комнатной температуре в течение 3 ч, а затем добавляли цианоборгидрид натрия (7 мг, 0,12 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Остаток отделяли с помощью быстрой обращенно-фазовой колоночной хроматографии с получением (S,E)-8-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-3-(2,2-диметил-1,3-диоксан-5-ил)-6-((3-(трифторметил)фенил)сульфонил)-2,3,4,4a,5,6-гексагидро-1H-пиразино[1,2-а]хиноксалина (30 мг, 44%), который без дополнительной обработки использовали на следующем этапе.
Пример 2. Получение (S,E)-2-(8-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)пропан-1,3-диола
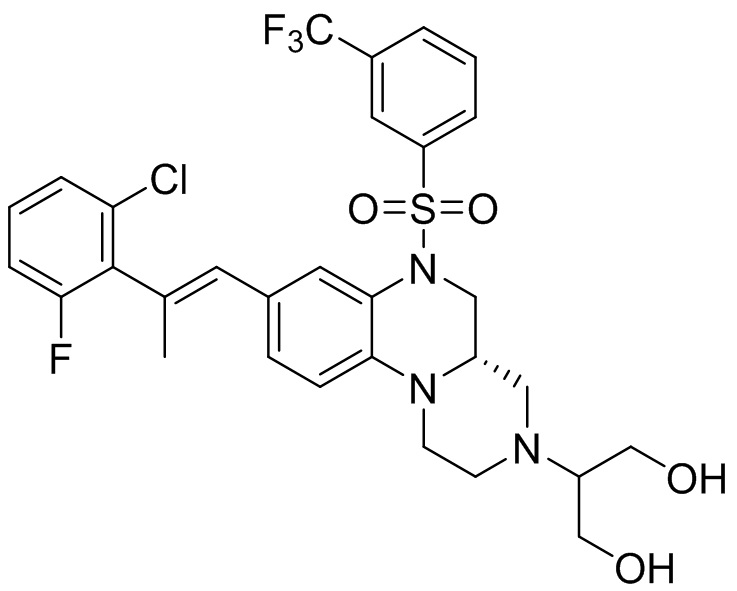
(S,E)-8-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-3-(2,2-диметил-1,3-диоксан-5-ил)-6-((3-(трифторметил)фенил)сульфонил)-2,3,4,4a,5,6-гексагидро-1H-пиразино[1,2-a] хиноксалин (30 мг, 0,044 ммоль) и раствор трифторуксусной кислоты (1 мл) в воде (1 мл) перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь нейтрализовали 15%-ным водным раствором гидроксида натрия и отделяли с помощью быстрой обращенно-фазовой колоночной хроматографии с получением (S,E)-2-(8-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)пропан-1,3-диола (4,5 мг, 16%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 640 [M+1]+.
1H ЯМР (400 МГц, метанол-d4) δ 7,94 (d, J=7,8 Гц, 1H), 7,92-7,86 (m, 1H), 7,76 (t, J=7,9 Гц, 1H), 7,71-7,66 (m, 2H), 7,34-7,26 (m, 2H), 7,20-7,10 (m, 2H), 6,84 (d, J=8,7 Гц, 1H), 6,34 (d, J=1,7 Гц, 1H), 4,29 (dd, J=14,3, 4,4 Гц, 1H), 3,71-3,57 (m, 5H), 3,41-3,36 (m, 1H), 2,87 (ddd, J=12,9, 6,3, 3,7 Гц, 2H), 2,66-2,50 (m, 3H), 2,36 (dd, J=11,9, 3,1 Гц, 1H), 2,28-2,18 (m, 4H).
Пример 70 получали методом синтеза, указанным в примере 69.
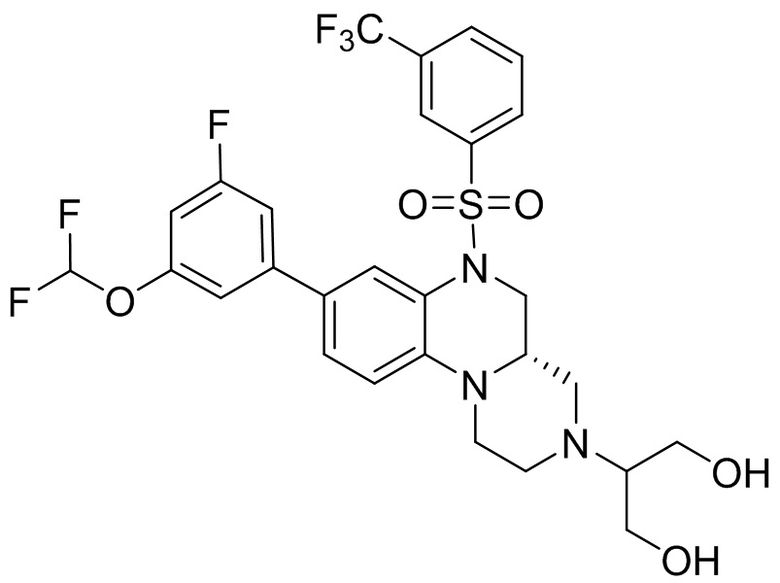
Данные о соединении, полученные методом ЯМР-спектроскопии на ядрах 1H, полученном в примере 70:
Пример 70. 1H ЯМР (400 МГц, метанол-d4) δ 8,05 (d, J=7,9 Гц, 1H), 8,00 (d, J=7,8 Гц, 1H), 7,87-7,77 (m, 2H), 7,68 (s, 1H), 7,52 (dd, J=8,7, 2,3 Гц, 1H), 7,26-7,16 (m, 2H), 6,96 (t, 1H), 7,04 (d, J=8,7 Гц, 1H), 6,92 (dd, J=9,5, 2,3 Гц, 1H), 4,45 (dd, J=14,4, 4,2 Гц, 1H), 4,02 (d, J=13,8 Гц, 1H), 3,91 (d, J=5,0 Гц, 4H), 3,60 (d, J=11,8 Гц, 2H), 3,46 (dd, J=14,4, 9,8 Гц, 1H), 3,37 (s, 1H), 3,28 (s, 1H), 3,21-3,10 (m, 1H), 3,03 (d, J=11,8 Гц, 1H), 2,77 (t, J=13,1 Гц, 1H).
Пример 71. Получение (S,E)-2-(8-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)-2-метилпропан-1,3-диола
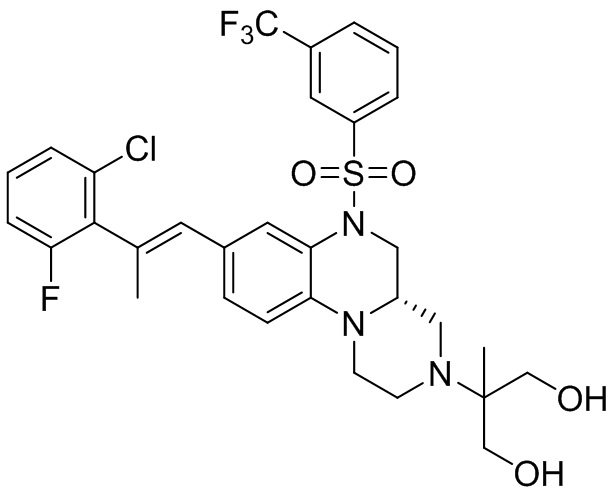
Этап 1. Синтез диметил (S,E)-2-(8-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)-2-метилмалоната
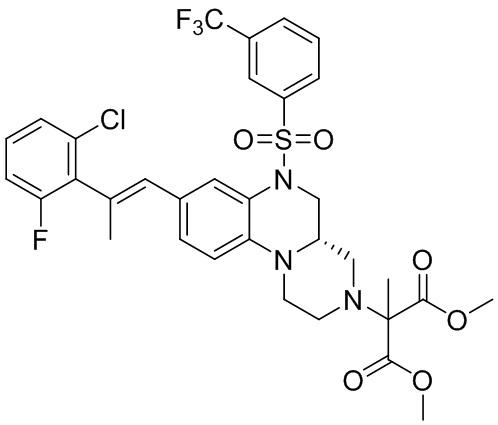
(S,E)-8-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-6-((3-(трифторметил)фенил)сульфонил)-2,3,4,4a,5,6-гексагидро-1H-пиразино[1,2-a]хиноксалин (150 мг, 0,27 ммоль) растворяли в диметилсульфоксиде (2 мл). К раствору добавляли диизопропилэтиламин (70 мг, 0,53 ммоль) и диметил-2-бром-2-метилмалонат (280 мг, 0,53 ммоль). Реакционную смесь перемешивали в микроволновом реакторе при температуре 60°C в течение 8 ч, а затем отделяли с помощью быстрой обращенно-фазовой колоночной хроматографии с получением диметил-(S,E)-2-(8-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино [1,2-а]хиноксалин-3-ил)-2-метилмалоната (120 мг, 60%), который без дополнительной обработки использовали на следующем этапе.
Этап 2. Синтез (S,E)-2-(8-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-6-((3-(трифторметил) фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)-2-метилпропан-1,3-диола
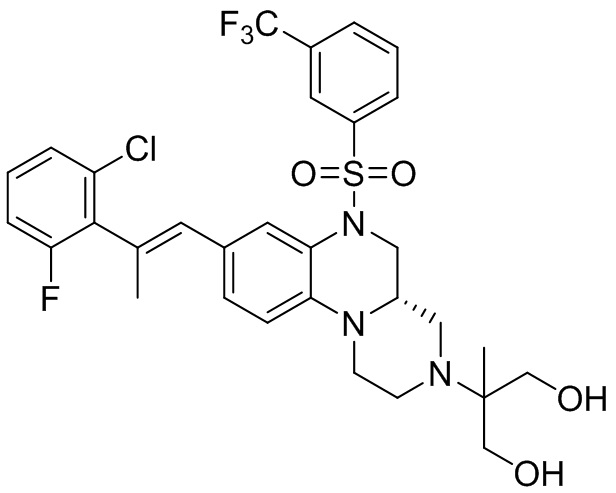
Диметил-(S,E)-2-(8-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)-2-метилмалонат (120 мг, 0,16 ммоль) растворяли в тетрагидрофуране (4 мл). К раствору добавляли боргидрид лития (30 мг, 1,6 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь промывали водой, экстрагировали этилацетатом, сушили и концентрировали. Остаток отделяли с помощью быстрой обращенно-фазовой колоночной хроматографии с получением (S,E)-2-(8-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)-2-метилпропан-1,3-диола (10,8 мг, 10%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 654 [M+1]+.
1H ЯМР (400 МГц, метанол-d4) δ 8,01-7,80 (m, 2H), 7,82-7,64 (m, 3H), 7,38-7,23 (m, 2H), 7,23-7,08 (m, 2H), 6,83 (d, J=8,7 Гц, 1H), 6,34 (d, J=1,7 Гц, 1H), 4,28 (dd, J=14,2, 4,4 Гц, 1H), 3,63-3,50 (m, 5H), 3,44-3,35 (m, 1H), 3,00 (d, J=10,6 Гц, 2H), 2,58 (s, 1H), 2,52-2,29 (m, 2H), 2,21 (d, J=1,5 Гц, 3H), 2,11 (t, J=10,7 Гц, 1H), 0,98 (s, 3H).
Пример 72 получали методом синтеза, указанным в примере 71.
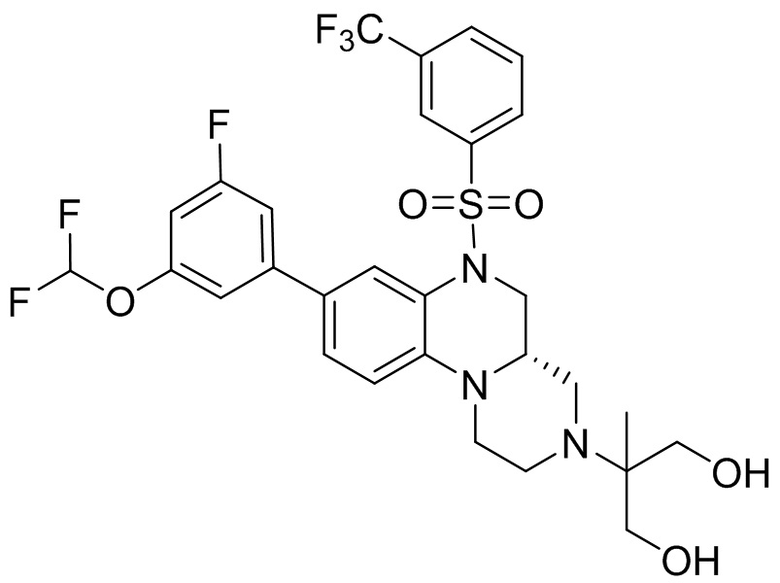
Данные о соединении, полученные методом ЯМР-спектроскопии на ядрах 1H, полученном в примере с 72:
Пример 72. 1H ЯМР (400 МГц, метанол-d4) δ 7,91 (dd, J=12,9, 7,9 Гц, 2H), 7,83 (d, J=2,2 Гц, 1H), 7,74 (t, J=7,9 Гц, 1H), 7,65 (s, 1H), 7,45 (dd, J=8,6, 2,3 Гц, 1H), 7,22-7,14 (m, 2H), 6,94 (t, 1H), 6,92-6,84 (m, 2H), 4,31 (dd, J=14,3, 4,2 Гц, 1H), 3,68 (d, J=11,9 Гц, 1H), 3,58 (qd, J=11,6, 2,3 Гц, 4H), 3,36 (dd, J=14,4, 10,1 Гц, 1H), 3,11 (d, J=11,2 Гц, 2H), 2,71 (t, J=9,7 Гц, 1H), 2,52 (dt, J=46,4, 11,7 Гц, 2H), 2,26 (t, J=10,8 Гц, 1H), 1,01 (s, 3H).
Пример 73. Получение (S,E)-2-(8-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)-3-гидрокси-2-(гидроксиметил)пропаннитрила
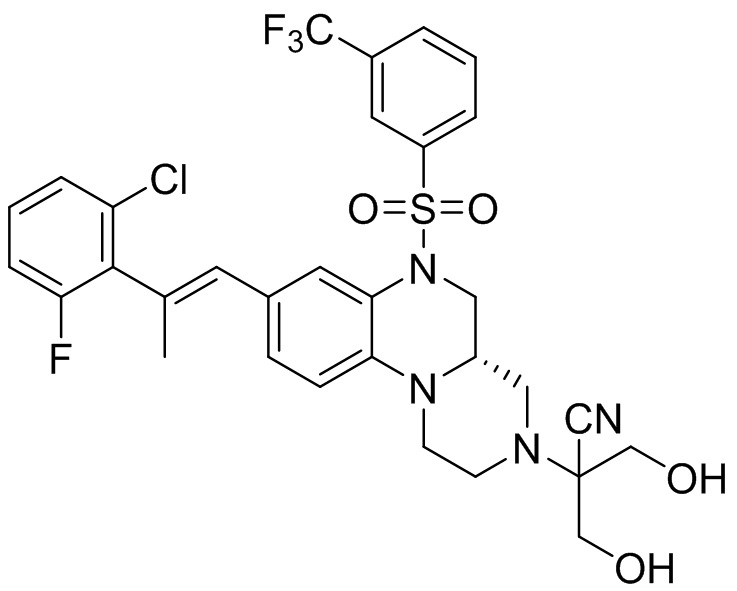
Этап 1. Синтез (S,E)-5-(8-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-6-((3-(трифторметил) фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)-2,2-диметил-1,3-диоксан-5-карбонитрила
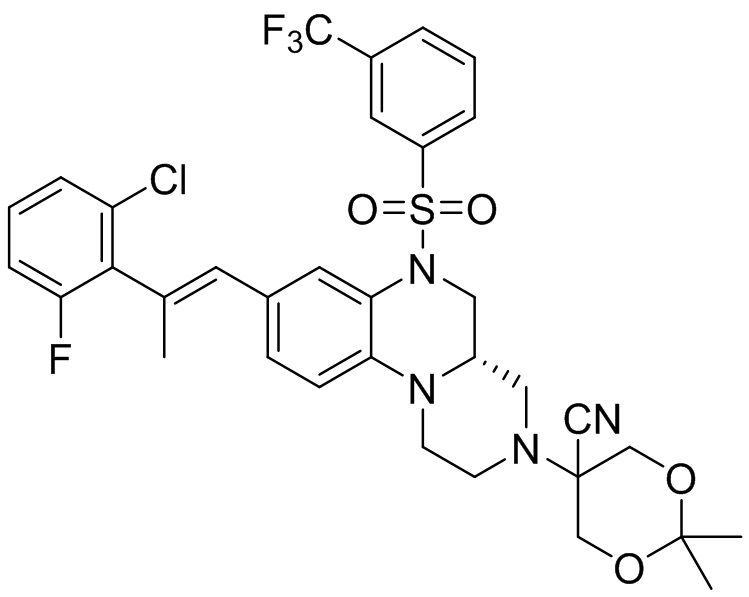
(S,E)-8-(2-хлор-6-(трифторметил)стирил)-6-((3-(трифторметил)фенил)сульфонил)-2,3,4,4a,5,6-гексагидро-1H-пиразино[1,2-a]хиноксалин (100 мг, 0,18 ммоль) растворяли в уксусной кислоте (5 мл), и раствор смеси охлаждали до температуры 0°C; добавляли 2,2-диметил-1,3-диоксан-5-он (69 мг, 0,53 ммоль) и триметилсиланкарбонитрил (52 мг, 0,53 ммоль) и перемешивали при комнатной температуре в течение 18 ч. Реакционную смесь нейтрализовали до pH > 7, а затем отделяли с помощью быстрой обращенно-фазовой колоночной хроматографии с получением (S,E)-5-(8-(2-(2-хлор-6-фторфенил)проп-1-ен)-1-ил)-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)-2,2-диметил-1,3-диоксан-5-карбонитрила (90 мг, 71%), который без дополнительной обработки использовали на следующем этапе.
Этап 2. Синтез (S,E)-2-(8-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-6-((3-(трифторметил) фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)-3-гидрокси-2-(гидроксиметил)пропаннитрила

(S,E)-5-(8-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)-2,2-диметил-1,3-диоксан-5-карбонитрил (90 мг, 0,128 ммоль) и раствор трифторуксусной кислоты (2 мл) в воде (2 мл) перемешивали при комнатной температуре в течение 24 ч. Реакционную смесь нейтрализовали 15%-ным водным раствором гидроксида натрия, а затем отделяли с помощью быстрой обращенно-фазовой колоночной хроматографии с получением (S,E)-2-(8-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)-3-гидрокси-2-(гидроксиметил)пропаннитрила (50 мг, 58,8%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 665 [M+1]+.
1H ЯМР (400 МГц, метанол-d4) δ 8,01-7,87 (m, 2H), 7,83-7,63 (m, 3H), 7,36-7,27 (m, 2H), 7,24-7,09 (m, 2H), 6,86 (d, J=8,7 Гц, 1H), 6,35 (d, J=1,7 Гц, 1H), 4,31 (dd, J=14,3, 4,4 Гц, 1H), 3,93-3,75 (m, 4H), 3,65 (dt, J=11,6, 2,5 Гц, 1H), 3,41 (dd, J=14,4, 10,1 Гц, 1H), 3,07 (dd, J=10,7, 2,3 Гц, 2H), 2,63 (tdd, J=10,1, 4,4, 2,5 Гц, 1H), 2,35 (dtd, J=38,3, 11,7, 2,7 Гц, 2H), 2,21 (d, J=1,5 Гц, 3H), 2,00 (t, J=10,6 Гц, 1H).
Пример 74. Получение (S)-2-(8-(3-(дифторметокси)-5-фторфенил)-6-((3-(трифторметил) фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)-3-гидрокси-2-(гидроксиметил)пропаннитрила
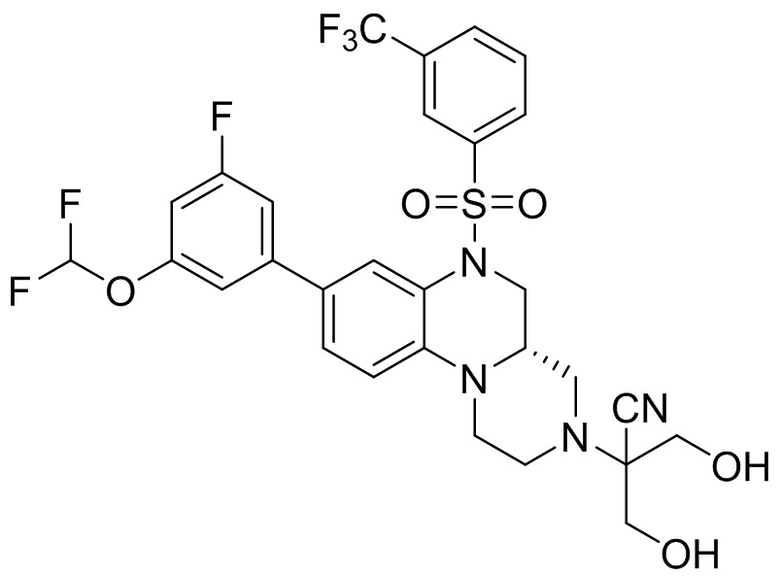
Пример 74 получали методом синтеза, указанным в примере 73. Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 657 [M+1]+.
1H ЯМР (400 МГц, метанол-d4) δ 7,91 (t, J=8,1 Гц, 2H), 7,85 (d, J=2,2 Гц, 1H), 7,74 (t, J=7,9 Гц, 1H), 7,61 (s, 1H), 7,46 (dd, J=8,7, 2,2 Гц, 1H), 7,23-7,15 (m, 2H), 6,94 (t, 1H), 6,89 (dd, J=16,2, 9,0 Гц, 2H), 4,31 (dd, J=14,4, 4,5 Гц, 1H), 3,84 (dd, J=11,5, 8,7 Гц, 2H), 3,76 (dd, J=11,5, 4,7 Гц, 2H), 3,67 (d, J=11,9 Гц, 1H), 3,37 (dd, J=14,4, 10,2 Гц, 1H), 3,06 (d, J=10,8 Гц, 2H), 2,64 (d, J=11,2 Гц, 1H), 2,45-2,34 (m, 1H), 2,29 (dd, J=12,7, 9,9 Гц, 1H), 1,99 (q, J=11,3, 10,5 Гц, 1H).
Пример 75. Получение (S,E)-2-(8-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-6-((3-(трифторметил)фенил) сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a] хиноксалин-3-ил)-3-гидрокси-2-(гидроксиметил)пропанамида
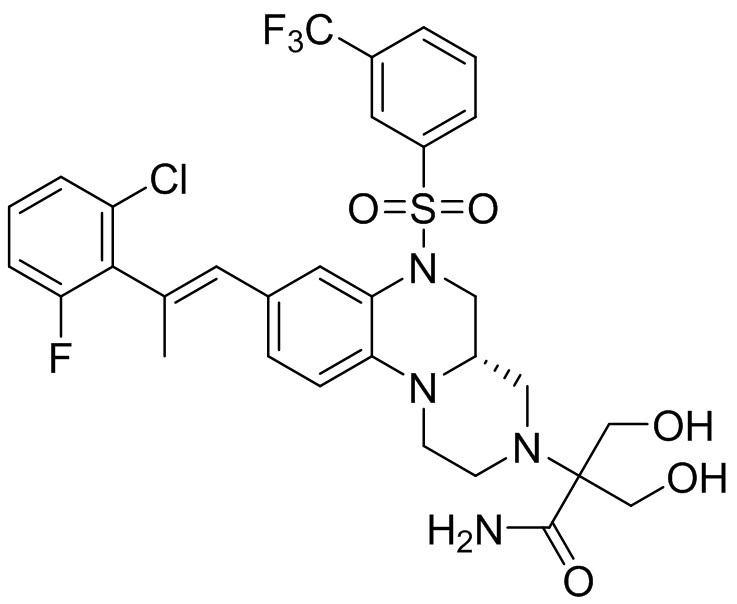
(S,E)-2-(8-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)-3-гидрокси-2-(гидроксиметил)пропаннитрил (30 мг, 0,045 ммоль) растворяли в диметилсульфоксиде (2 мл); раствор смеси охлаждали до температуры 0°C. К раствору добавляли карбонат калия (100 мг) и перекись водорода (0,5 мл, 30 %масс.) и перемешивали при комнатной температуре в течение 18 ч. Реакционную смесь отделяли с помощью быстрой обращенно-фазовой колоночной хроматографии с получением (S,E)-2-(8-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)-3-гидрокси-2-(гидроксиметил)пропанамида (27,5 мг, 92%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 683 [M+1]+.
1H ЯМР (400 МГц, метанол-d4) δ 7,95 (d, J=7,8 Гц, 1H), 7,92-7,85 (m, 1H), 7,77 (t, J=7,9 Гц, 1H), 7,73-7,66 (m, 2H), 7,34-7,26 (m, 2H), 7,21-7,09 (m, 2H), 6,84 (d, J=8,7 Гц, 1H), 6,34 (d, J=1,7 Гц, 1H), 4,28 (dd, J=14,2, 4,3 Гц, 1H), 3,91 (dd, J=11,9, 6,4 Гц, 2H), 3,81 (d, J=11,8 Гц, 2H), 3,66-3,55 (m, 1H), 3,42-3,34 (m, 1H), 2,95 (dt, J=9,0, 3,0 Гц, 2H), 2,74-2,64 (m, 1H), 2,58 (t, J=3,4 Гц, 1H), 2,44-2,30 (m, 2H), 2,21 (d, J=1,4 Гц, 3H).
Пример 76. Получение (S,E)-1-(8-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)циклобутан-1-карбонитрила
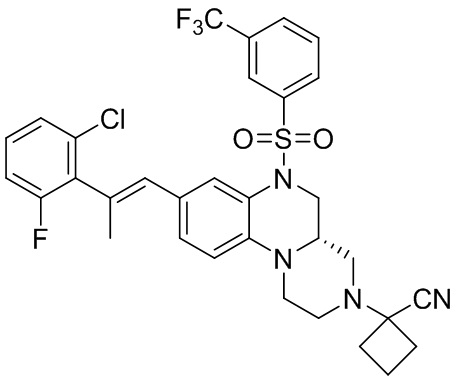
(S,E)-8-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-6-((3-(трифторметил)фенил)сульфонил)-2,3,4,4a,5,6-гексагидро-1H-пиразино[1,2-a]хиноксалин (300 мг, 0,53 ммоль) растворяли в уксусной кислоте (5 мл) и раствор смеси охлаждали до температуры 0°C. К раствору добавляли циклобутанон (186 мг, 2,65 ммоль) и триметилсиланкарбонитрил (262 мг, 2,65 ммоль) и перемешивали при комнатной температуре в течение 18 ч. Реакционную смесь нейтрализовали до pH>7, а затем отделяли с помощью быстрой обращенно-фазовой колоночной хроматографии с получением (S,E)-1-(8-(2-(2-хлор-6-фторфенил)проп-1-ен)-1-ил)-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)циклобутан-1-карбонитрила (315 мг, 92%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 645 [M+1]+.
1H ЯМР (400 МГц, метанол-d4) δ 7,94 (d, J=7,9 Гц, 1H), 7,86 (d, J=7,9 Гц, 1H), 7,76-7,74 (m, 1H), 7,70-7,68 (m , 2H), 7,29-7,27 (m, 2H), 7,18 (dd, J=8,6, 2,1 Гц, 1H), 7,14-7,07 (m, 1H), 6,86 (d, J=8,6 Гц, 1H), 6,33 (s, 1H), 4,30 (dd, J=14,5, 4,4 Гц, 1H), 3,69 (dt, J=12,1, 2,6 Гц, 1H), 3,43-3,34 (m, 1H), 2,82-2,68 (m, 2H), 2,53-2,48 (m, 1H), 2,42-2,17 (m, 8H), 2,14-1,85 (m, 3H), 1,68 (t, J=10,4 Гц, 1H).
Примеры 77-78 получали методом синтеза, указанным в примере 76.
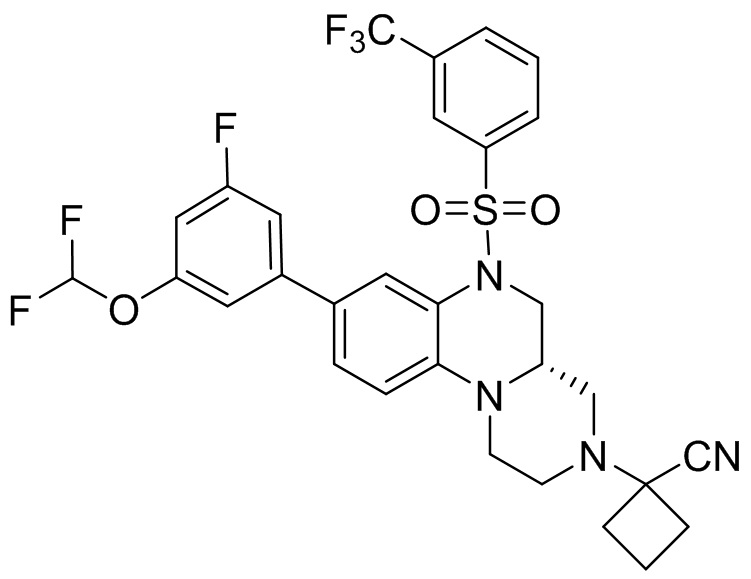
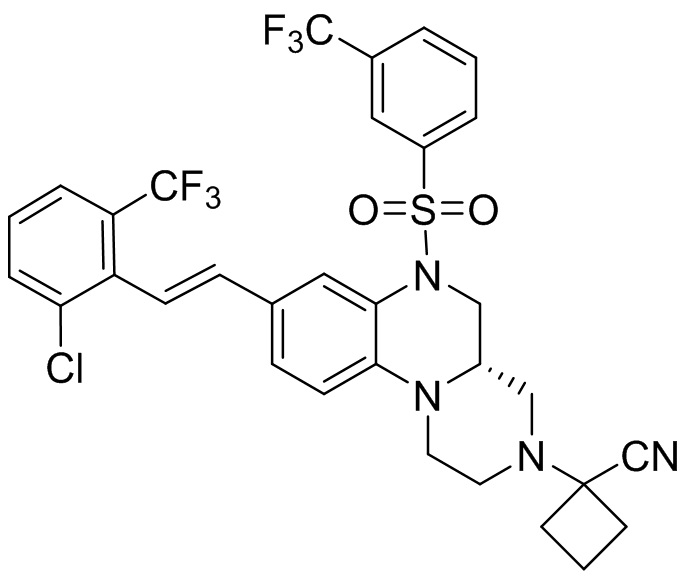
Данные о соединении, полученные методом ЯМР-спектроскопии на ядрах 1H, полученном в примерах с 77 по 78:
Пример 77. 1H ЯМР (400 МГц, метанол-d4) δ 7,94 (d, J=7,8 Гц, 1H), 7,88-7,83 (m, 2H), 7,75 (t, J=7,8 Гц, 1H), 7,67 (d, J=1,8 Гц, 1H), 7,50-7,44 (m, 1H), 7,24-7,17 (m, 2H), 6,95 (t, 1H), 6,95-6,85 (m, 2H), 4,36-4,29 (m, 1H), 3,73 (d, J=12,2 Гц, 1H), 3,40-3,32 (m, 1H), 2,75 (t, J=10,3 Гц, 2H), 2,50 (ddt, J=10,3, 7,3, 3,4 Гц, 1H), 2,42-2,32 (m, 2H), 2,32-1,86 (m, 6H), 1,67 (t, J=10,5 Гц, 1H).
Пример 78. 1H ЯМР (400 МГц, CDCl3) δ 7,84-7,82 (m , 3H), 7,74 (d, J=2,1 Гц, 1H), 7,67-7,63 (m , 3H), 7,36-7,29 (m, 2H), 7,00 (dd, J=16,6, 2,0 Гц, 1H), 6,82 (d, J=16,5 Гц, 1H), 6,74 (d, J=8,7 Гц, 1H), 4,25 (dd, J=14,1, 4,3 Гц, 1H), 3,70-3,51 (m, 1H), 3,40-3,34 (m , 1H), 2,80-2,59 (m, 3H), 2,47-2,40 (m , 3H), 2,28-2,07 (m, 4H), 1,96 (d, J=2,4 Гц, 1H), 1,81 (t, J=10,4 Гц, 1H).
Пример 79. Получение (S,E)-1-(8-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)циклобутан-1-карбоксамида
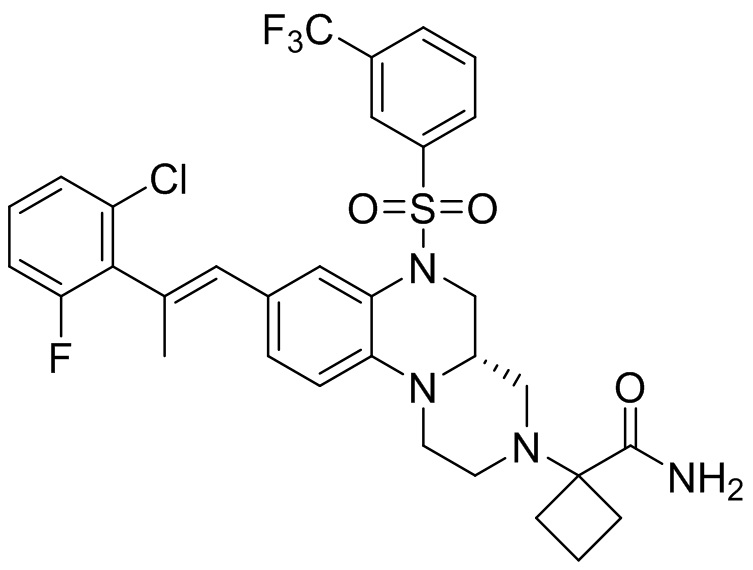
(S,E)-1-(8-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)циклобутан-1-карбонитрил (300 мг, 0,465 ммоль) растворяли в диметилсульфоксиде (5 мл) и раствор смеси охлаждали до температуры 0°C. К раствору добавляли карбонат калия (12,8 мг, 0,093 ммоль) и пероксид водорода (0,5 мл, 30% %масс.) и перемешивали при комнатной температуре в течение 72 ч. Реакционную смесь отделяли с помощью быстрой обращенно-фазовой колоночной хроматографии с получением (S,E)-1-(8-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)циклобутан-1-карбоксамида (179,7 мг, 58%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 663 [M+1]+.
1H ЯМР (400 МГц, метанол-d4) δ 7,93 (d, J=7,8 Гц, 1H), 7,83 (d, J=7,9 Гц, 1H), 7,79-7,66 (m, 3H), 7,33-7,25 (m, 2H), 7,20-7,07 (m, 2H), 6,83 (d, J=8,6 Гц, 1H), 6,32 (s, 1H), 4,25 (dd, J=14,3, 4,4 Гц, 1H), 3,60 (d, J=12,0 Гц, 1H), 3,41-3,33 (m, 1H), 2,76 (d, J=11,0 Гц, 2H), 2,55 - 2,47 (m, 1H), 2,34-2,03 (m, 9H), 1,83-1,72 (m, 3H).
Примеры 80-81 получали методом синтеза, указанным в примере 79.
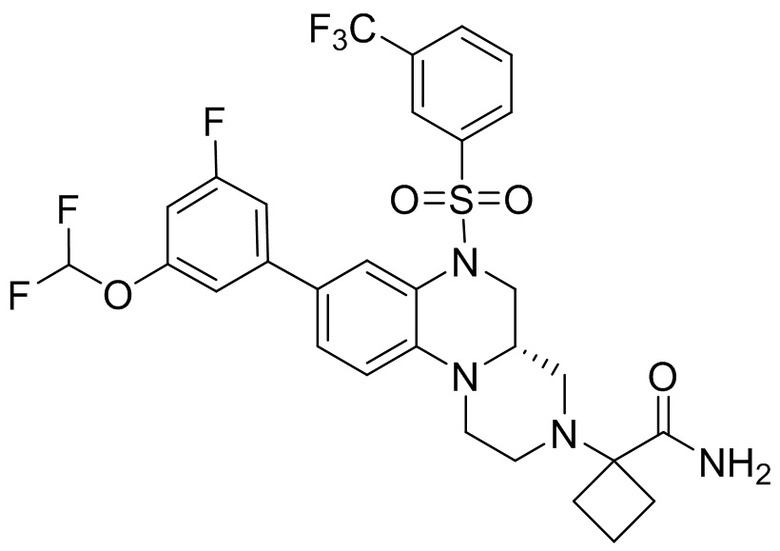
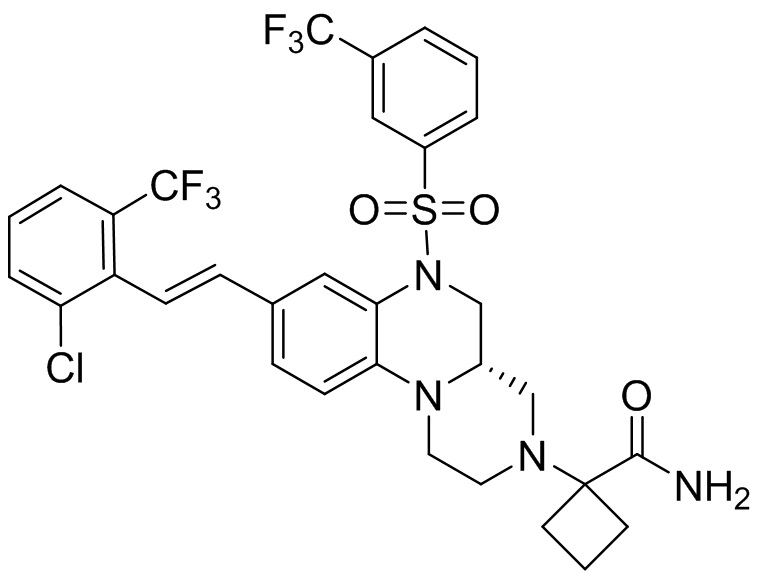
Данные о соединении, полученные методом ЯМР-спектроскопии на ядрах 1H, полученном в примерах с 80 по 81:
Пример 80. 1H ЯМР (400 МГц, метанол-d4) δ 7,94 (d, J=7,7 Гц, 1H), 7,86-7,80 (m, 2H), 7,74 (t, J=7,9 Гц, 1H), 7,68 (d, J=1,9 Гц, 1H), 7,45 (dd, J=8,7, 2,3 Гц, 1H), 7,23-7,16 (m, 2H), 6,94 (t, 1H), 6,92-6,83 (m, 2H), 4,27 (dd, J=14,4, 4,4 Гц, 1H), 3,67-3,59 (m, 1H), 3,39-3,32 (m, 1H), 2,81-2,74 (m, 2H), 2,54-2,44 (m, 1H), 2,32 (td, J=11,9, 2,9 Гц, 1H), 2,27-2,19 (m, 2H), 2,17-2,12 (m, 1H), 2,12-2,03 (m, 2H), 1,81-1,70 (m, 3H).
Пример 81. 1H ЯМР (400 МГц, метанол-d4) δ 7,95 (d, J=7,8 Гц, 1H), 7,88-7,83 (m, 1H), 7,79-7,70 (m, 5H), 7,44 (t, J=8,0 Гц, 1H), 7,35 (dd, J=8,7, 2,1 Гц, 1H), 7,01 (dd, J=16,6, 2,0 Гц, 1H), 6,88-6,75 (m, 2H), 4,29 (dd, J=14,3, 4,4 Гц, 1H), 3,69-3,61 (m, 1H), 3,40-3,35 (m, 1H), 2,85-2,75 (m, 2H), 2,56 (dd, J=4,4, 2,7 Гц, 1H), 2,39-2,31 (m, 1H), 2,30-2,21 (m, 2H), 2,20-2,08 (m, 3H), 1,84-1,74 (m, 3H).
Пример 82. Получение (S,E)-1-(8-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)-2-метилпропан-2-ола

(S,E)-8-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-6-((3-(трифторметил)фенил)сульфонил)-2,3,4,4a,5,6-гексагидро-1H-пиразино[1,2-a]хиноксалин (100 мг, 0,18 ммоль) растворяли в диметилсульфоксиде (2 мл). Добавляли карбонат цезия (172 мг, 0,531 ммоль), йодид калия (88 мг, 0,531 ммоль) и 1-бром-2-метилпропан-2-ол (134 мг, 0,88 ммоль). Реакционную смесь перемешивали в микроволновом реакторе при температуре 80°C в течение 15 ч и отделяли с помощью быстрой обращенно-фазовой колоночной хроматографии с получением (S,E)-1-(8-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)-2-метилпропан-2-ола (20,5 мг, 18,2%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 638 [M+1]+.
1H ЯМР (400 МГц, CDCl3) δ 7,89 (s, 1H), 7,83 (d, J=7,9 Гц, 1H), 7,75 (d, J=2,0 Гц, 1H), 7,71 (d, J=7,9 Гц, 1H), 7,59 (t, J=7,8 Гц, 1H), 7,25 (d, J=8,0 Гц, 1H), 7,29-7,17 (m , 2H), 7,04 (t, J=8,3 Гц, 1H), 6,72 (d, J=8,6 Гц, 1H), 6,38 (s, 1H), 4,17 (dd, J=14,2, 4,3 Гц, 1H), 3,48 (d, J=11,9 Гц, 1H), 3,35 (dd, J=14,1, 10,1 Гц, 1H), 2,83 (dd, J=23,1, 11,3 Гц, 2H), 2,67-2,60 (m, 1H), 2,48-2,41 (m, 1H), 2,35 (dd, J=11,4, 2,8 Гц, 1H), 2,31 (s, 2H), 2,24 (d, J=1,4 Гц, 3H), 2,04 (t, J=10,6 Гц, 1H), 1,17 (s, 6H).
Пример 83. Получение (R,E)-2-(8-(2-хлор-6-(трифторметил)стирил)-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)уксусной кислоты
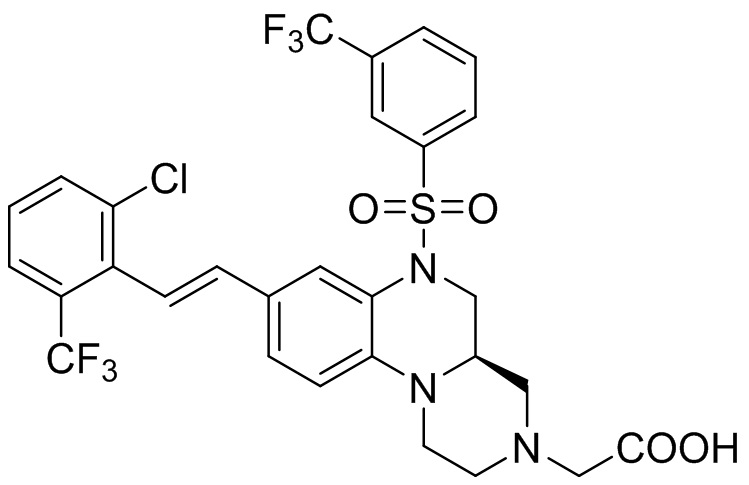
Этап 1. Синтез трет-бутил (R,E)-8-(2-хлор-6-(трифторметил)стирил)-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-карбоксилата
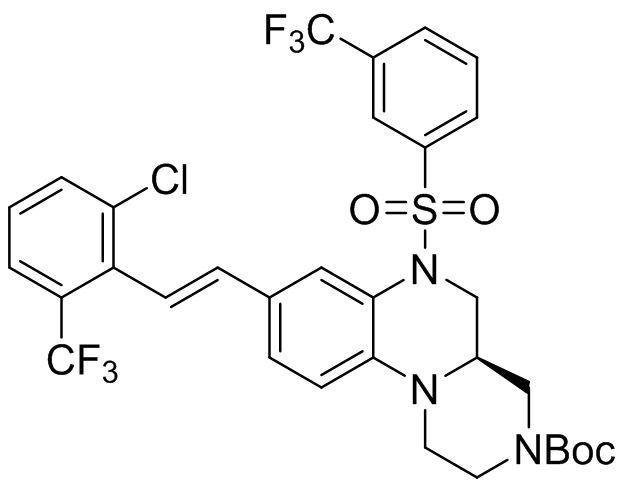
Трет-бутил (R)-8-бром-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-карбоксилат (100 мг, 0,17 ммоль), (E)-2-(3-хлор-5-(трифторметил)стирил)-4,4,5-триметил-1,3,2-диоксаборолан (67 мг, 0,21 ммоль), [1,1'-бис(дифенилфосфино)ферроцен]палладия хлорид (13 мг, 0,017 ммоль) и карбонат калия (47 мг, 0,34 ммоль) перемешивали в 1,4-диоксане (6 мл) и воде (3 мл). Трижды вводили азот для замещения воздуха путем откачки. Реакцию в растворе смеси проводили при температуре 90°C в течение 2 ч. После завершения реакции к реакционной смеси добавляли воду (20 мл) и трижды экстрагировали этилацетатом (20 мл × 3). Органические фазы объединяли, промывали солевым раствором (30 мл), сушили над безводным сульфатом натрия, фильтровали и концентрировали. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля [элюент : ЭтАц : ПЭ = 0-20%] с получением трет-бутил (R,E)-8-(2-хлор-6-(трифторметил)стирил)-6-((3-(трифторметил)фенил) сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-карбоксилата (105 мг, 86%). Масс- спектрометрия с ионизацией электрораспылением (ESI-MS): 702,3 [M+H]+.
Этап 2. Синтез (R, E)-8-(2-хлор-6-(трифторметил)стирил)-6-((3-(трифторметил)фенил) сульфонил)-2,3,4,4a,5,6-гексагидро-1H-пиразино[1,2-a]хиноксалина
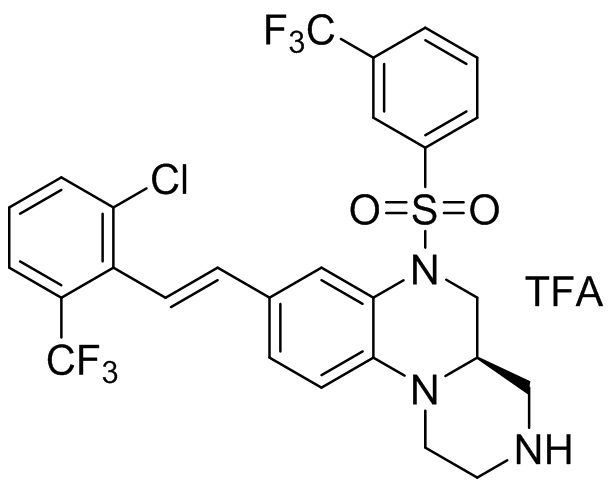
Трет-бутил (R,E)-8-(2-хлор-6-(трифторметил)стирил)-6-((3-(трифторметил)фенил) сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-карбоксилат (210 мг, 0,3 ммоль) растворяли в дихлорметане (5 мл). К раствору добавляли трифторуксусную кислоту (2 мл). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Растворитель удаляли путем концентрирования с получением неочищенного (R,E)-8-(2-хлор-6-(трифторметил)стирил)-6-((3-(трифторметил)фенил)сульфонил)-2,3,4,4a,5,6-гексагидро-1H-пиразино[1,2-a]хиноксалина (300 мг, неочищенный). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 602,2 [M+H]+.
Этап 3. Синтез метил (R,E)-2-(8-(2-хлор-6-(трифторметил)стирил)-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)ацетата
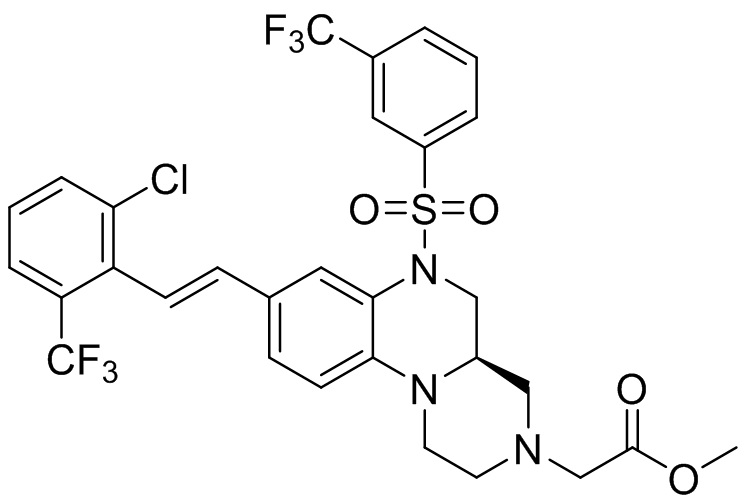
(R,E)-8-(2-хлор-6-(трифторметил)стирил)-6-((3-(трифторметил)фенил)сульфонил)-2,3,4,4a,5,6-гексагидро-1H-пиразино[1,2-a] хиноксалин (300 мг, 0,75 ммоль) растворяли в диметилсульфоксиде (5 мл). Добавляли карбонат калия (311 мг, 2,25 ммоль) и метилбромацетат (230 мг, 1,5 ммоль). Реакционную смесь перемешивали при температуре 50°C в течение 2 ч. После завершения реакции к реакционной смеси добавляли воду (20 мл) и трижды экстрагировали этилацетатом (20 мл × 3), органические фазы объединяли, трижды промывали водой (30 мл × 3), сушили над безводным сульфатом натрия, фильтровали и концентрировали. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля [элюент : ЭтАц : ПЭ = 0-20%] с получением метил (R,E)-2-(8-(2-хлор-6-(трифторметил)стирил)-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)ацетата (250 мг, 86%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 674,2 [M+H]+.
Этап 4. Синтез (R,E)-2-(8-(2-хлор-6-(трифторметил)стирил)-6-((3-(трифторметил) фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)уксусной кислоты

Метил (R,E)-2-(8-(2-хлор-6-(трифторметил)стирил)-6-((3-(трифторметил)фенил) сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)ацетат (250 мг, 0,37 ммоль) растворяли в метаноле (5 мл) и воде (1 мл). Добавляли литий гидроксид моногидрат (36 мг, 1,5 ммоль). Раствор смеси перемешивали при комнатной температуре в течение 2 ч, а затем концентрировали для удаления растворителя и окисляли разбавленной соляной кислотой. Остаток отделяли с помощью обращенно-фазовой колоночной хроматографии [элюент : H2O : MeCN = 0-70%] с получением (R,E)-2-(8-(2-хлор-6-(трифторметил)стирил)-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)уксусной кислоты (80 мг, 33%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 660,3 [M+H]+.
1H ЯМР (400 МГц, CDCl3) δ 7,92-7,74 (m, 3H), 7,70-7,55 (m, 4H), 7,29 (t, J=7,8 Гц, 2H), 6,94 (d, J=16,5 Гц, 1H), 6,84-6,64 (m, 2H), 4,23 (d, J=14,3 Гц, 1H), 3,63 (s, 1H), 3,35 (s, 3H), 3,09 (s, 3H), 2,73 (s, 1H), 2,49 (s, 1H).
Пример 84. Получение (S,E)-1-(8-(2-хлор-6-(трифторметил)стирил)-6-((3-(трифторметокси)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)этан-1-она
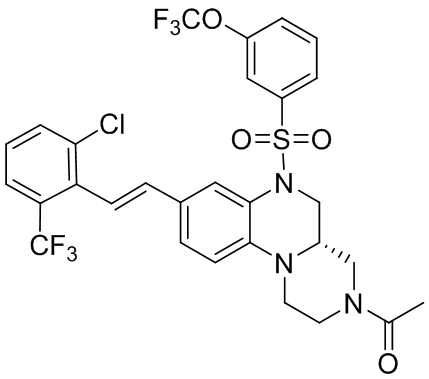
Пример 84 получали методом синтеза, указанным в примере 7. Масс- спектрометрия с ионизацией электрораспылением (ESI-MS): 660 [M+H]+.
1H ЯМР (400 МГц, метанол-d4) δ 7,75 (d, J=2,1 Гц, 1H), 7,73-7,68 (m, 2H), 7,61 (t, J=8,5 Гц, 1H), 7,55 (d, J=8,0 Гц, 1H), 7,46 (s, 1H), 7,44-7,32 (m, 2H), 7,20 (d, J=14,7 Гц, 1H), 7,00 (d, J=16,7 Гц, 1H), 6,89 (d, J=8,9 Гц, 1H), 6,79-6,72 (m, 1H), 4,45-4,36 (m, 1H), 4,28 (d, J=22,3 Гц, 1H), 3,76 (t, J=11,1 Гц, 1H), 3,48 (s, 1H), 3,16 (d, J=21,2 Гц, 1H), 2,69 (s, 3H), 2,08 (d, J=6,4 Гц, 2H), 2,04 (d, J=7,9 Гц, 2H).
Пример 85. Получение метил (S,E)-2-(8-(2-хлор-6-(трифторметил)стирил)-6-((3-(трифторметокси)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)ацетата
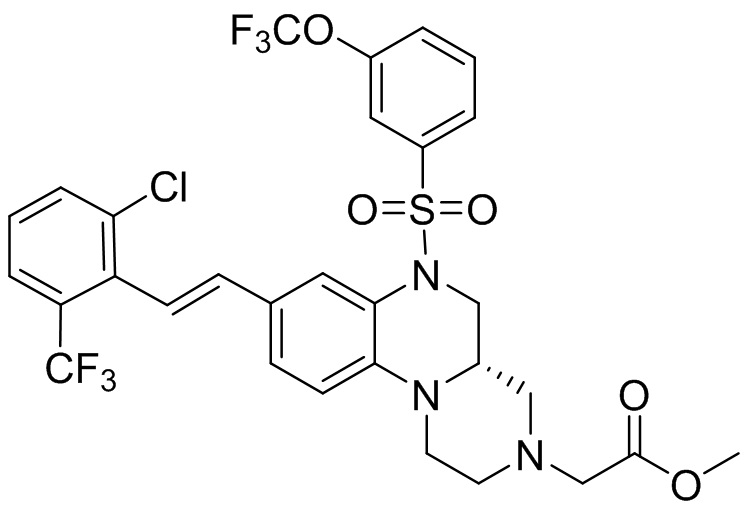
Пример 85 получали методом синтеза, указанным в примере 44. Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 690 [M+H]+.
1H ЯМР (400 МГц, CDCl3) δ 7,78 (d, J=2,1 Гц, 1H), 7,63 (d, J=2,3 Гц, 1H), 7,61 (d, J=2,2 Гц, 1H), 7,57 (dt, J=7,9, 1,4 Гц, 1H), 7,53-7,49 (m, 1H), 7,40-7,36 (m, 2H), 7,31 (d, J=2,0 Гц, 1H), 7,29 (d, J=1,6 Гц, 1H), 7,01-6,94 (m, 1H), 6,80 (d, J=16,5 Гц, 1H), 6,71 (d, J=8,7 Гц, 1H), 4,23 (dd, J=14,1, 4,1 Гц, 1H), 3,73 (s, 3H), 3,56 (d, J=12,3 Гц, 1H), 3,33-3,26 (m, 1H), 3,22 (d, J=3,1 Гц, 2H), 2,89-2,76 (m, 3H), 2,59 (td, J=12,1, 3,1 Гц, 1H), 2,29 (td, J=11,5, 3,2 Гц, 1H), 2,01-1,91 (m, 1H).
Пример 86. Получение (S,E)-2-(8-(2-хлор-6-(трифторметил)стирил)-6-((3-(трифторметокси)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)уксусной кислоты
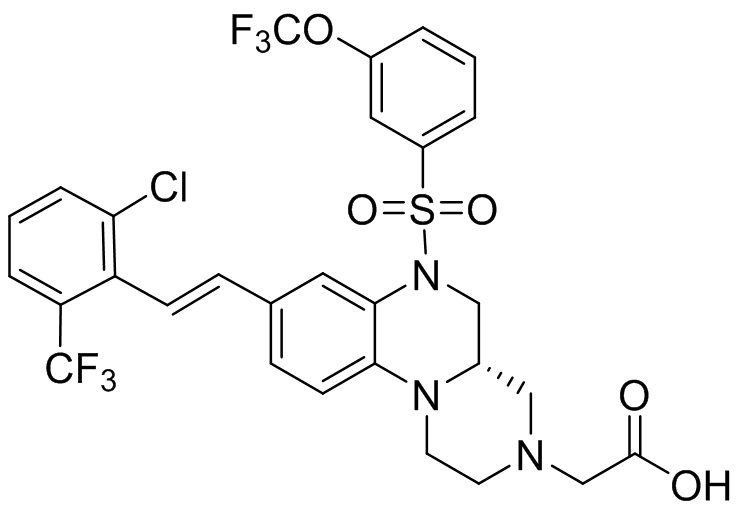
Пример 86 получали методом синтеза, указанным в примере 9. Масс- спектрометрия с ионизацией электрораспылением (ESI-MS): 676 [M+H]+.
1H ЯМР (400 МГц, метанол-d4) δ 7,78-7,62 (m, 5H), 7,59 (d, J=8,7 Гц, 1H), 7,51-7,19 (m, 3H), 7,15-6,92 (m, 2H), 6,76 (d, J=16,6 Гц, 1H), 4,53-4,36 (m, 1H), 4,00 (d, J=13,8 Гц, 1H), 3,74 (d, J=22,8 Гц, 2H), 3,50 (d, J=12,4 Гц, 2H), 3,41-3,37 (m, 1H), 3,16-3,02 (m, 1H), 2,96 (t, J=12,2 Гц, 1H), 2,67 (q, J=11,2, 10,1 Гц, 2H).
Пример 87. Получение (S)-2-((3-((8-(3-(дифторметокси)-5-фторфенил)-1,2,3,4,4a,5-гексагидро-6H-пиразино[1,2-a]хиноксалин-6-ил)сульфонил)-5-(трифторметил)пиридин-2-ил)окси)этан-1-ола
Трет-бутил (S)-8-(3-(дифторметокси)-5-фторфенил)-6-((2-(2-гидроксиэтокси)-5-(трифторметил)пиридин-3-ил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-карбоксилат (280 мг, 0,39 ммоль) растворяли в HCl/диоксане (10 мл, 4M). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. После завершения реакции реакционную смесь концентрировали с получением неочищенного продукта (230 мг, 82%), который без дополнительной обработки использовали на следующем этапе. Неочищенный продукт (30 мг) отделяли с помощью обращенно-фазовой колоночной хроматографии [элюент : H2O : MeCN = 0-80%] с получением (S)-2-((3-((8-(3-(дифторметокси)-5-фторфенил)-1,2,3,4,4a,5-гексагидро-6H-пиразино[1,2-a]хиноксалин-6-ил)сульфонил)-5-(трифторметил)пиридин-2-ил)окси)этан-1-ола (7,6 мг, 25%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 619 [M+H]+.
1H ЯМР (400 МГц, CDCl3) δ 9,63 (s, 1H), 8,53 (d, J=28,1 Гц, 2H), 7,27 (s, 1H), 7,14 (s, 1H), 6,88 (s, 2H), 6,78 (d, J=9,1 Гц, 1H), 6,51 (t, J=73,2 Гц, 1H), 4,66 (d, J=30,7 Гц, 3H), 4,02 (s, 4H), 3,80 (s, 2H), 3,49 (s, 2H), 3,03 (s, 2H).
Пример 88. (S)-2-((3-((8-(2,2,6,6-тетраметил-3,6-дигидро-2H-пиран-4-ил)-1,2,3,4,4a,5-гексагидро-6H-пиразино[1,2-a]хиноксалин-6-ил)сульфонил)-5-(трифторметил)пиридин-2-ил)окси)этан-1-ол
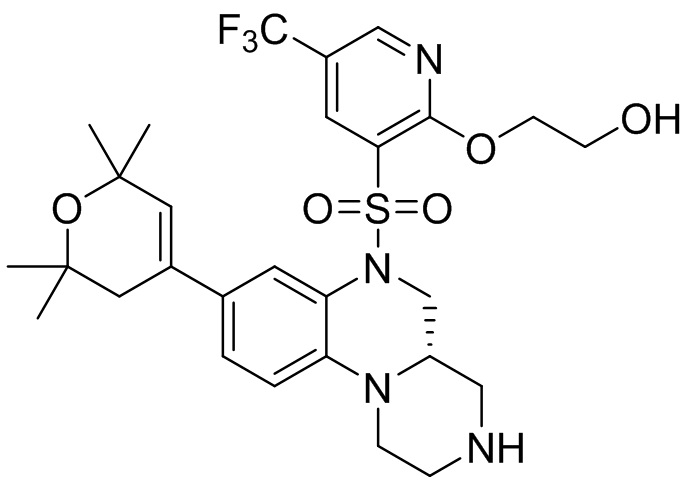
Пример 88 получали методом синтеза, указанным в примере 87.
1H ЯМР (400 МГц, метанол-d4) δ 8,76 (d, J=2,3 Гц, 1H), 8,51 (d, J=2,3 Гц, 1H), 7,17 (dd, J=8,7, 2,1 Гц, 1H), 7,12 (d, J=2,0 Гц, 1H), 6,99 (d, J=8,7 Гц, 1H), 5,86 (s, 1H), 4,68 (dt, J=10,4, 4,9 Гц, 1H), 4,57 (dt, J=11,7, 4,5 Гц, 1H), 4,43 (dd, J=13,9, 3,5 Гц, 1H), 4,17 (d, J=13,5 Гц, 1H), 3,85 (t, J=4,8 Гц, 2H), 3,77 (dd, J=13,9, 8,2 Гц, 1H), 3,58-3,44 (m, 3H), 3,20 (td, J=12,5, 3,0 Гц, 1H), 3,15-3,04 (m, 1H), 2,97 (t, J=12,3 Гц, 1H), 2,17 (s, 2H), 1,27 (s, 6H), 1,25 (s, 6H). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 597 [M+H]+.
Пример 89. Получение (S)-2-((3-((8-(3-(дифторметокси)-5-фторфенил)-3-(метилсульфонил)-1,2,3,4,4a,5-гексагидро-6H-пиразино[1,2-а]хиноксалин-6-ил)сульфонил)-5-(трифторметил)пиридин-2-ил)окси)этан-1-ола
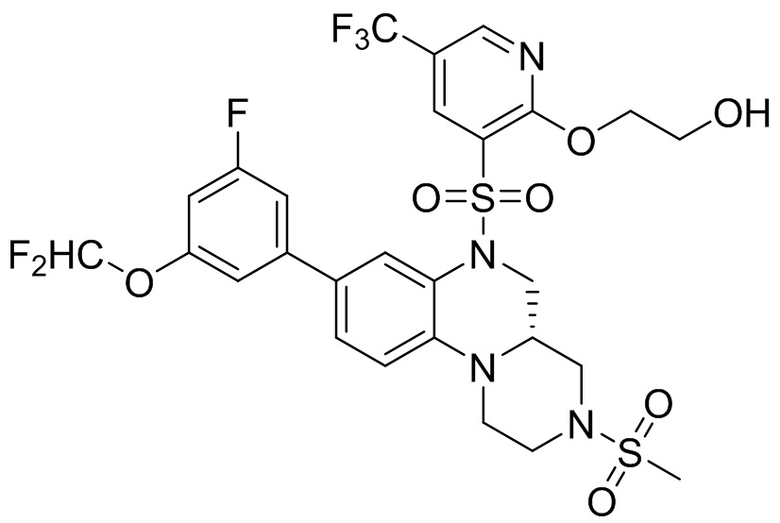
Этап 1. Синтез (S)-6-((2-(2-((трет-бутилдиметилсилил)окси)этокси)-5-(трифторметил)пиридин-3-ил)сульфонил)-8-(3-(дифторметокси))-5-фторфенил)-2,3,4,4a,5,6-гексагидро-1H-пиразино[1,2-a]хиноксалина
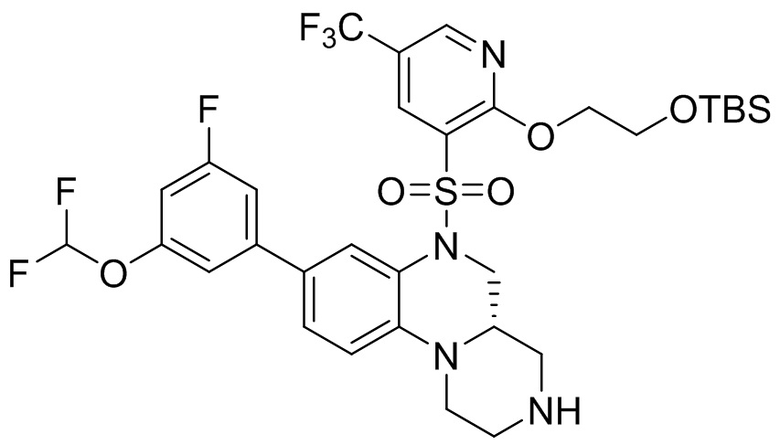
(S)-2-((3-((8-(3-(дифторметокси)-5-фторфенил)-1,2,3,4,4a,5-гексагидро-6H-пиразино[1,2-a] хиноксалин-6-ил)сульфонил)-5-(трифторметил)пиридин-2-ил)окси)этан-1-ол (200 мг, 0,32 ммоль), TBSCl (150 мг, 0,97 ммоль), имидазол (220 мг, 3,23 ммоль) перемешивали с безводным дихлорметаном (10 мл). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч; после завершения реакции реакционную смесь промывали насыщенным NaHCO3 (10 мл), H2O (10 мл) и солевым раствором (10 мл). Органические фазы сушили над сульфатом магния и фильтровали. Фильтрат концентрировали, остаток отделяли с помощью быстрой хроматографии на колонке силикагеля с получением (S)-6-((2-(2-((трет-бутилдиметилсилил)окси)этокси)-5-(трифторметил)пиридин-3)-ил)сульфонил)-8-(3-(дифторметокси)-5-фторфенил)-2,3,4,4a,5,6-гексагидро-1H-пиразино[1,2-a]хиноксалина (180 мг, 77%) (ПЭ : ЭА = 0-30%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 733 [M+H]+.
Этап 2. Синтез (S)-6-((2-(2-((трет-бутилдиметилсилил)окси)этокси)-5-(трифторметил) пиридин-3-ил)сульфонил)-8-(3-(дифторметокси)-5-фторфенил)-3-(метилсульфонил)-2,3,4,4a,5,6-гексагидро-1H-пиразино[1,2-a] хиноксалина
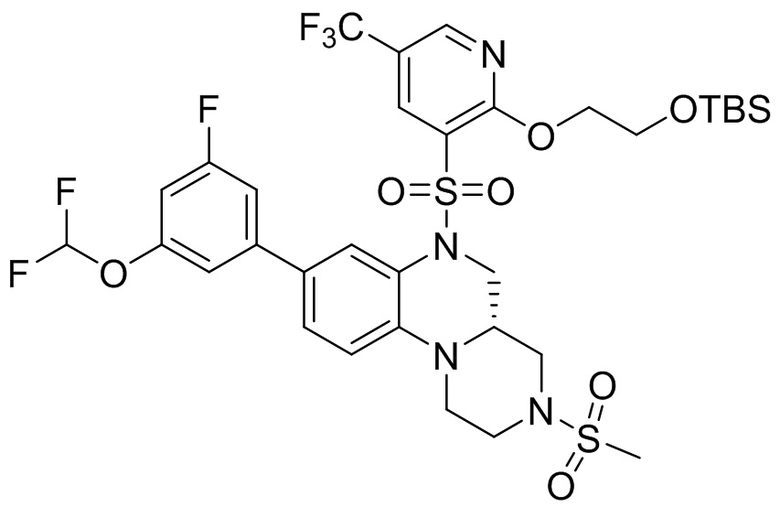
(S)-6-((2-(2-((трет-бутилдиметилсилил)окси)этокси)-5-(трифторметил)пиридин-3-ил)сульфонил)-8-(3-(дифторметокси)-5-фторфенил)-2,3,4,4a,5,6-гексагидро-1H-пиразино[1,2-a]хиноксалин (40 мг, 5,46×10-2 ммоль), диизопропилэтиламин (71 мг, 0,55 ммоль) и метансульфонилхлорид (31мг, 0,27 ммоль) перемешивали с ДХМ (5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. После завершения реакции реакционную смесь промывали насыщенным NaHCO3 (5 мл), H2O (5 мл) и солевым раствором (5 мл). Органические фазы сушили над сульфатом магния и фильтровали. Фильтрат концентрировали с получением неочищенного (S)-6-((2-(2-((трет- бутилдиметилсилил)окси)этокси)-5-(трифторметил)пиридин-3-ил)сульфонил)-8-(3-(дифторметокси)-5-фторфенил)-3-(метилсульфонил)-2,3,4,4a,5,6-гексагидро-1H-пиразино[1,2-a]хиноксалина (45 мг, 95%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 811 [M+H]+. Неочищенный продукт без дополнительной обработки использовали на следующем этапе.
Этап 3. Синтез (S)-2-((3-((8-(3-(дифторметокси)-5-фторфенил)-3-(метилсульфонил)-1,2, 3,4,4a,5-гексагидро-6H-пиразино[1,2-a]хиноксалин-6-ил)сульфонил)-5-(трифторметил)пиридин-2-ил)окси)этан-1-ола
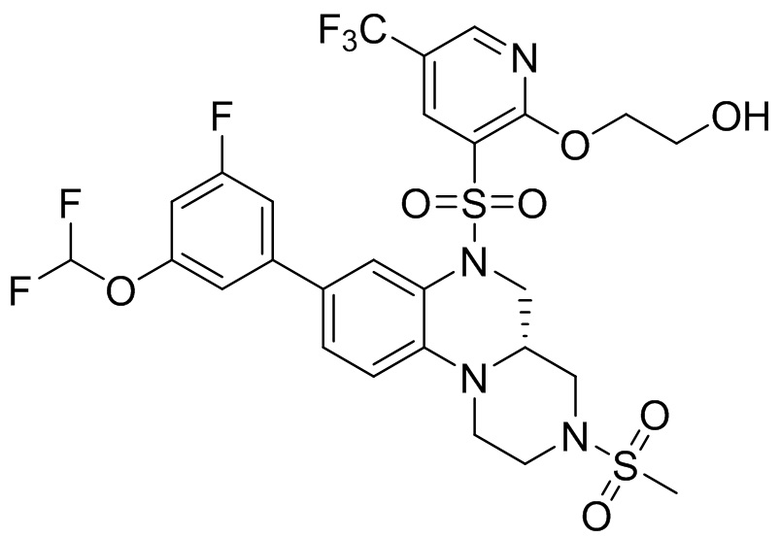
(S)-6-((2-(2-((трет-бутилдиметилсилил)окси)этокси)-5-(трифторметил)пиридин-3-ил)сульфонил)-8-(3-(дифторметокси)-5-фторфенил)-3-(метилсульфонил)-2,3,4,4a,5,6-гексагидро-1H-пиразино[1,2-a]хиноксалин (45 мг, 5,46×10-2 ммоль) растворяли в HCl/диоксане (5 мл, 4M). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. После завершения реакции реакционную смесь концентрировали с получением неочищенного продукта, который вначале отделяли с помощью препаративной ТСХ (ДХМ : MeOH = 15:1), а затем - с помощью обращенно-фазовой колоночной хроматографии [элюент : H2O : MeCN = 0-80%] с получением (S)-2-((3-((8-(3- (дифторметокси)-5-фторфенил)-3-(метилсульфонил)-1,2,3,4,4a,5-гексагидро-6H-пиразино[1,2-а]хиноксалин-6-ил)сульфонил)-5-(трифторметил)пиридин-2-ил)окси)этан-1-ола (6,7 мг, 17%).
1H ЯМР (400 МГц, CDCl3) δ 8,53 (s, 1H), 8,40 (d, J=2,3 Гц, 1H), 7,49 (d, J=1,9 Гц, 1H), 7,22 (d, J=2,0 Гц, 1H), 6,93 (dd, J=8,2, 2,0 Гц, 2H), 6,82 (d, J=8,6 Гц, 1H), 6,73 (d, J=9,1 Гц, 1H), 6,47 (t, J=73,3 Гц, 1H), 4,51 (s, 2H), 4,23 (d, J=12,6 Гц, 1H), 3,79 (dd, J=17,8, 10,9 Гц, 5H), 3,57 (s, 1H), 3,18 (s, 1H), 2,87 (q, J=13,3, 12,3 Гц, 2H), 2,76 (s, 3H), 2,50 (s, 1H). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 697 [M+H]+.
Пример 90. Получение метил (S)-2-(8-(3-(дифторметокси)-5-фторфенил)-6-((2-(2-гидроксиэтокси)-5-(трифторметил)пиридин-3-ил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)ацетата
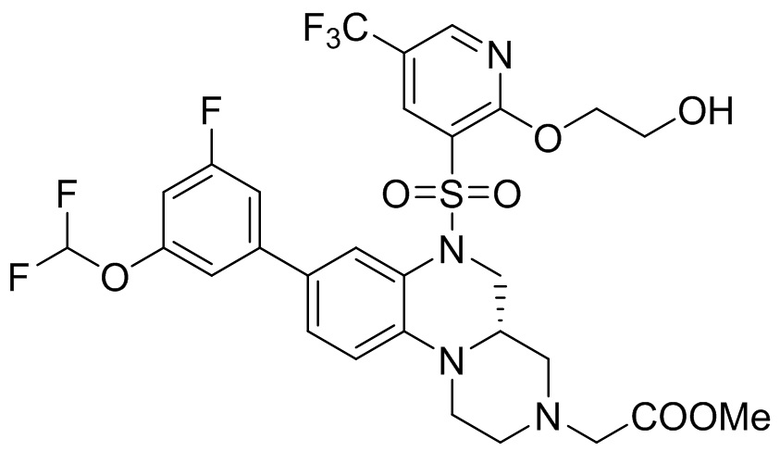
Этап 1. Синтез метил (S)-2-(6-((2-(2-((трет-бутилдиметилсилил)окси)этокси)-5-(трифторметил)пиридин-3-ил)сульфонил)-8-(3-(дифторметокси)-5-фторфенил)-1,2,4,4a,5,6-гексагидро-3H-пиразино [1,2-a]хиноксалин-3-ил)ацетата
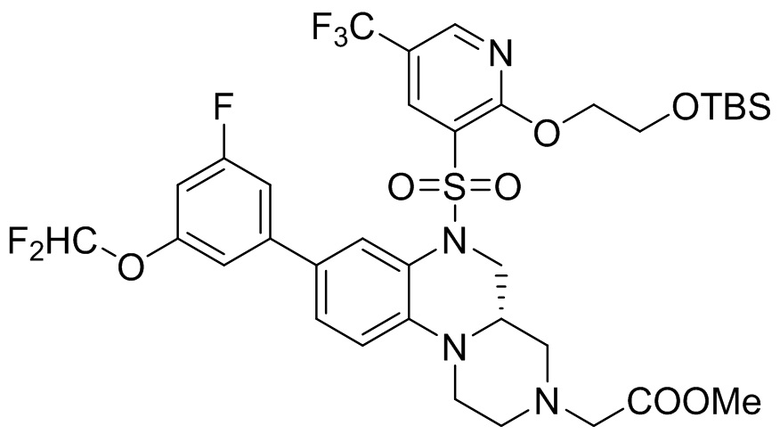
(S)-6-((2-(2-((трет-бутилдиметилсилил)окси)этокси)-5-(трифторметил)пиридин-3-ил)сульфонил)-8-(3-(дифторметокси)-5-фторфенил)-2,3,4,4a,5,6-гексагидро-1H-пиразино[1,2-a]хиноксалин (85 мг, 0,12 ммоль), метилбромацетат (88 мг, 0,58 ммоль) и карбонат калия (80 мг 0,58 ммоль) перемешивали в 10 мл ацетонитрила. Реакционную смесь перемешивали при температуре 80°C в течение 2 ч; завершение реакции подтверждали с помощью ЖХ-МС; реакционную смесь концентрировали. Остаток растворяли в ДХМ (10 мл), промывали насыщенным NaHCO3 (5 мл), H2O (5 мл) и солевым раствором (5 мл). Органические фазы сушили над сульфатом магния и фильтровали. Фильтрат концентрировали с получением неочищенного метил (S)-2-(6-((2-(2-((трет-бутилдиметилсилил)окси)этокси)-5-(трифторметил)пиридин-3-ил)сульфонил)-8-(3-(дифторметокси)-5-фторфенил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)ацетата (90 мг, 95%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 805 [M+H]+. Неочищенный продукт без дополнительной обработки использовали на следующем этапе.
Этап 2. Синтез метил (S)-2-(8-(3-(дифторметокси)-5-фторфенил)-6-((2-(2-гидроксиэтокси)-5-(трифторметил)пиридин-3-ил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)ацетата
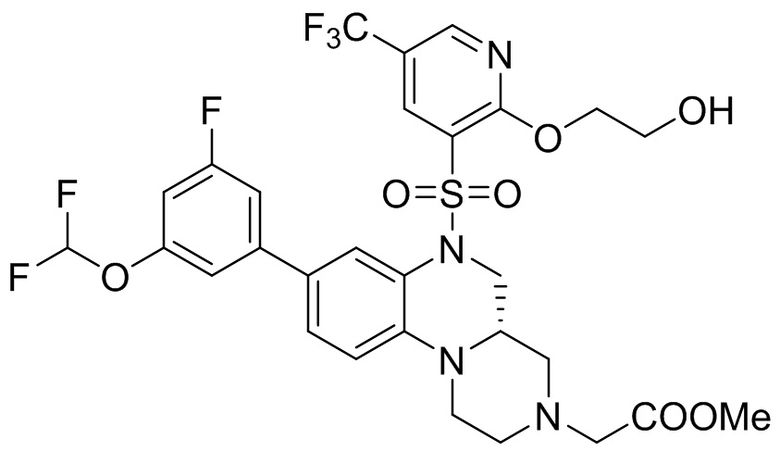
Метил (S)-2-(6-((2-(2-((трет-бутилдиметилсилил)окси)этокси)-5-(трифторметил) пиридин-3-ил)сульфонил)-8-(3-(дифторметокси)-5-фторфенил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)ацетат (90 мг, 0,11 ммоль) растворяли в HCl/диоксане (5 мл, 4M). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. После завершения реакции реакционную смесь концентрировали с получением неочищенного продукта (80 мг), неочищенный продукт (50 мг) использовали без дополнительной обработки на следующем этапе, а оставшийся неочищенный продукт (30 мг) вначале отделяли с помощью препаративной ТСХ [элюент : ДХМ : MeOH = 15:1], а затем - с помощью обращенно-фазовой колоночной хроматографии [элюент : H2O : MeCN = 0-80%] с получением метил (S)-2-(8-(3-(дифторметокси)-5-фторфенил)-6-((2-(2-гидроксиэтокси)-5-(трифторметил)пиридин-3-ил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)ацетата (5,7 мг, 7%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 691 [M+H]+.
1H ЯМР (400 МГц, CDCl3) δ 8,57 (s, 1H), 8,44 (s, 1H), 7,66 (s, 1H), 7,22 (ddd, J=6,9, 4,5, 1,7 Гц, 1H), 6,97 (s, 2H), 6,81 (d, J=9,2 Гц, 2H), 6,54 (t, J=73,2 Гц, 1H), 4,82 (s, 1H), 4,66 (s, 2H), 4,19 (s, 1H), 4,02 (d, J=31,0 Гц, 5H), 3,87 (s, 3H), 3,74-3,52 (m, 5H), 3,20 (s, 1H).
Пример 91. Получение (S)-2-(8-(3-(дифторметокси)-5-фторфенил)-6-((2-(2-гидроксиэтокси)-5-(трифторметил)пиридин-3-ил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)уксусной кислоты

Этап 1. Синтез трет-бутил (S)-2-(6-((2-(2-((трет-бутилдиметилсилил)окси)этокси)-5- (трифторметил)пиридин-3-ил)сульфонил)-8-(3-(дифторметокси)-5-фторфенил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)ацетата
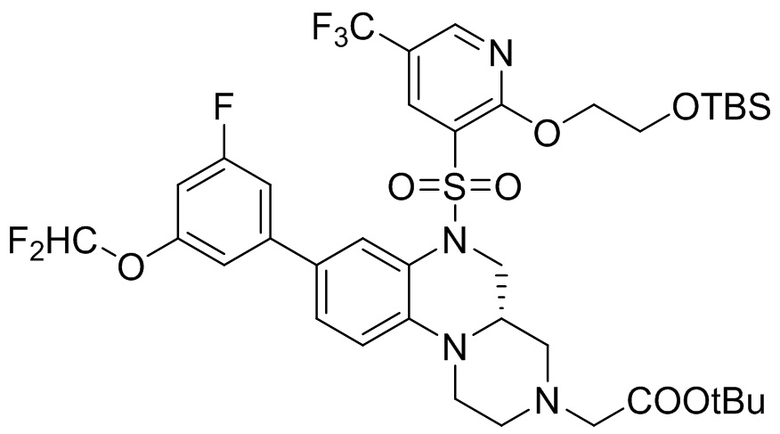
Вещество получали методом, указанным в примере 90. Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 847 [M+H]+.
Этап 2. Синтез (S)-2-(8-(3-(дифторметокси)-5-фторфенил)-6-((2-(2-гидроксиэтокси)-5-(трифторметил)пиридин-3-ил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)уксусной кислоты

Вещество получали методом, указанным в примере 90. Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 677 [M+H]+.
1H ЯМР (400 МГц, метанол-d4) δ 8,76 (d, J=2,4 Гц, 1H), 8,55 (d, J=2,4 Гц, 1H), 7,48-7,36 (m, 2H), 7,11 (d, J=8,8 Гц, 1H), 7,07-7,02 (m, 2H), 6,90 (t, J=73,2 Гц, 1H), 6,87 (d, J=9,5 Гц, 1H), 4,67 (dt, J=10,4, 4,9 Гц, 1H), 4,58-4,48 (m, 1H), 4,45 (dd, J=14,0, 3,4 Гц, 1H), 4,25 (d, J=11,5 Гц, 1H), 4,11 (s, 2H), 3,80 (t, J=4,8 Гц, 2H), 3,79-3,67 (m, 3H), 3,59 (s, 1H), 3,23 (d, J=11,3 Гц, 2H), 3,01 (t, J=11,7 Гц, 1H).
Примеры 92 и 93. Получение 2-((4aS)-8-(3-(дифторметокси)-5-фторфенил)-6-((2-оксо-5-(трифторметил)-2,3-дигидропиридин-3-ил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)уксусной кислоты и (S)-2-(8-(3-(дифторметокси)-5-фторфенил)-6-((2-метокси-5-(трифторметил)пиридин-3-ил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-а]хиноксалин-3-ил)уксусной кислоты
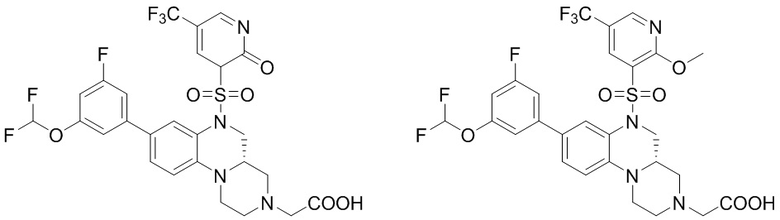
Метил (S)-2-(8-(3-(дифторметокси)-5-фторфенил)-6-((2-(2-гидроксиэтокси)-5-(трифторметил)пиридин-3-ил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино [1,2-a] хиноксалин-3-ил)ацетат (50 мг, 0,07 ммоль) и литий гидроксид моногидрат (30 мг, 0,7 ммоль) перемешивали в метаноле (5 мл) и H2O (5 мл). Реакционную смесь перемешивали при температуре 80°C в течение 1 ч; завершение реакции подтверждали с помощью ЖХ-МС; реакционную смесь концентрировали до сухого остатка и к остатку добавляли ДХМ (10 мл) и H2O (10 мл). Органические фазы отделяли и концентрировали. Остаток вначале отделяли с помощью препаративной ТСХ [элюент : ДХМ : MeOH = 15:1], а затем - с помощью обращенно-фазовой колоночной хроматографии [элюент : H2O : MeCN = 0-70%] с получением 2-((4aS)-8-(3-(дифторметокси)-5-фторфенил)-6-((2-оксо-5-(трифторметил)-2,3-дигидропиридин-3-ил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)уксусной кислоты (1,8 мг, 4%).
(Пример 92). 1H ЯМР (400 МГц, метанол-d4) δ 8,44 (d, J=2,7 Гц, 1H), 8,21 (dd, J=2,8, 1,3 Гц, 1H), 7,66 (d, J=2,2 Гц, 1H), 7,36 (dd, J=8,7, 2,2 Гц, 1H), 7,08 (dd, J=11,4, 3,0 Гц, 3H), 6,91 (t, J=73,2 Гц, 1H), 6,87 (d, J=9,5 Гц, 1H), 4,41 (dd, J=13,7, 3,5 Гц, 1H), 4,23 (d, J=11,0 Гц, 1H), 4,14 (s, 2H), 3,77 (t, J=10,1 Гц, 3H), 3,61 (dd, J=13,8, 8,3 Гц, 1H), 3,30-3,20 (m, 2H), 3,07 (t, J=11,6 Гц, 1H). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 633 [M+H]+, и
(S)-2-(8-(3-(дифторметокси)-5-фторфенил)-6-((2-метокси-5-(трифторметил)пиридин-3-ил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)уксусной кислоты (3,5 мг, 8%).
(Пример 93). 1H ЯМР (400 МГц, метанол-d4) δ 8,80-8,72 (m, 1H), 8,56 (d, J=2,4 Гц, 1H), 7,54 (d, J=2,1 Гц, 1H), 7,42 (dd, J=8,7, 2,2 Гц, 1H), 7,13 (d, J=8,7 Гц, 1H), 7,10-7,04 (m, 2H), 6,91 (t, J=73,2 Гц, 1H), 6,87 (d, J=9,5 Гц, 1H), 4,34 (dd, J=13,9, 3,5 Гц, 1H), 4,25 (d, J=11,6 Гц, 1H), 4,05 (d, J=3,7 Гц, 2H), 3,97 (s, 3H), 3,70 (t, J=9,3 Гц, 2H), 3,58 (dd, J=13,9, 8,8 Гц, 1H), 3,50-3,41 (m, 1H), 3,24-3,11 (m, 2H), 2,94 (t, J=11,6 Гц, 1H). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 647 [M+H]+.
Пример 94. Получение (S)-2-(8-(3-циано-2-фторфенил)-6-((3-(трифторметил)фенил) сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)уксусной кислоты
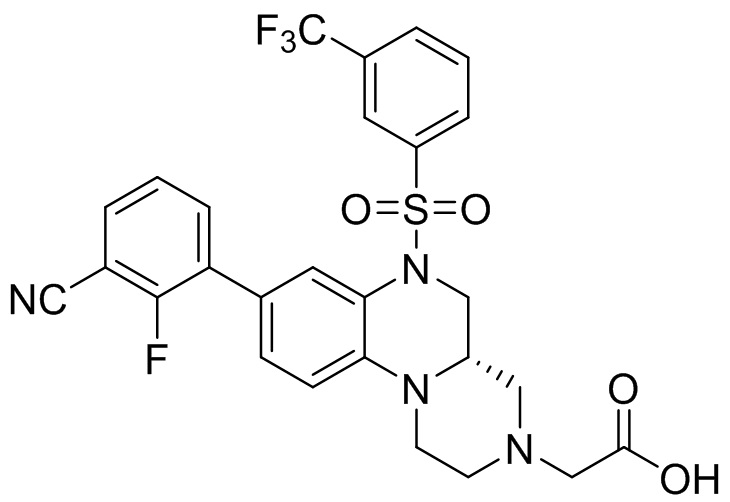
(S)-2-(8-бром-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)уксусную кислоту (30 мг, 0,056 ммоль), 2-фтор-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензонитрил (17 мг, 0,067 ммоль), [1,1'-бис(дифенилфосфино)ферроцен]палладия хлорид (4 мг, 0,0056 ммоль) и карбонат калия (15 мг, 0,112 ммоль) перемешивали в 1,4-диоксане (3 мл) и воде (1 мл). Трижды вводили азот для замещения воздуха путем откачки. Реакцию в растворе смеси проводили при температуре 90°C в течение 2 ч. После завершения реакции к реакционной смеси добавляли воду (20 мл) и трижды экстрагировали этилацетатом (20 мл × 3), органические фазы объединяли, промывали солевым раствором (30 мл), сушили над безводным сульфатом натрия, фильтровали и концентрировали. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля [элюент : MeOH : ДХМ = 0-40%] с получением (S)-2-(8-(3- циано-2-фторфенил)-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)уксусной кислоты, а затем отделяли с помощью обращенно-фазовой колоночной хроматографии [элюент : H2O : MeCN = 0-60%, HCOOH] с получением (S)-2-(8-(3-циано-2-фторфенил)-6-((3-(трифторметил)фенил)сульфонил)-1,2, 4,4a,5,6-гексагидро-3H-пиразино[1,2-a]хиноксалин-3-ил)уксусной кислоты (3,5 мг, 11%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 575,2 [M+H]+.
1H ЯМР (400 МГц, метанол-d4) δ 7,98 (dd, J=19,5, 7,9 Гц, 2H), 7,85-7,76 (m, 3H), 7,70 (td, J=6,7, 5,7, 1,6 Гц, 1H), 7,62 (s, 1H), 7,48-7,36 (m, 2H), 6,99 (d, J=8,8 Гц, 1H), 4,39 (dd, J=14,4, 4,2 Гц, 1H), 3,86 (d, J=12,3 Гц, 1H), 3,41 (d, J=12,5 Гц, 2H), 3,36 (d, J=9,6 Гц, 3H), 2,97 (d, J=16,5 Гц, 1H), 2,70-2,56 (m, 2H), 2,36 (t, J=11,2 Гц, 1H).
Примеры 95, 96 и 97 получали методом синтеза, указанным в примере 94.
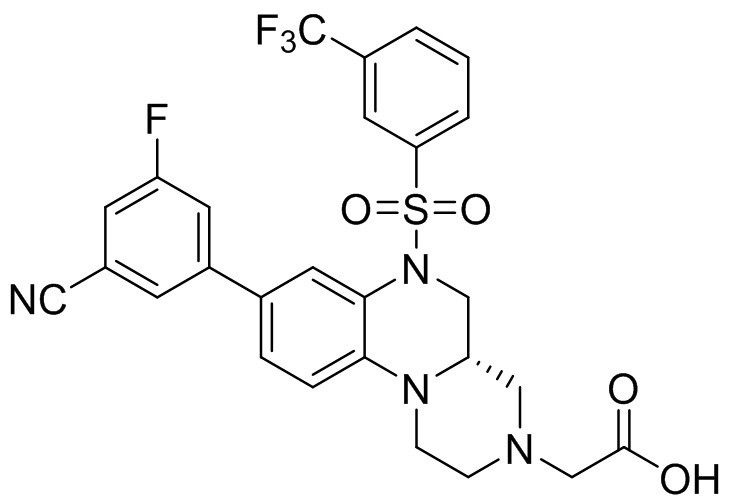
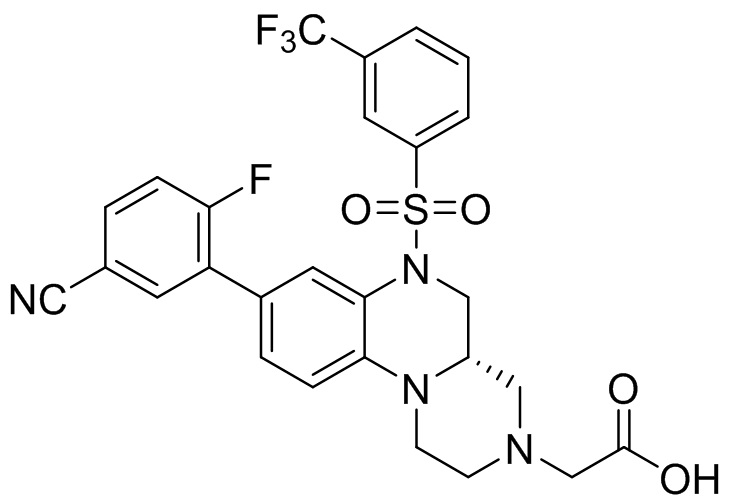
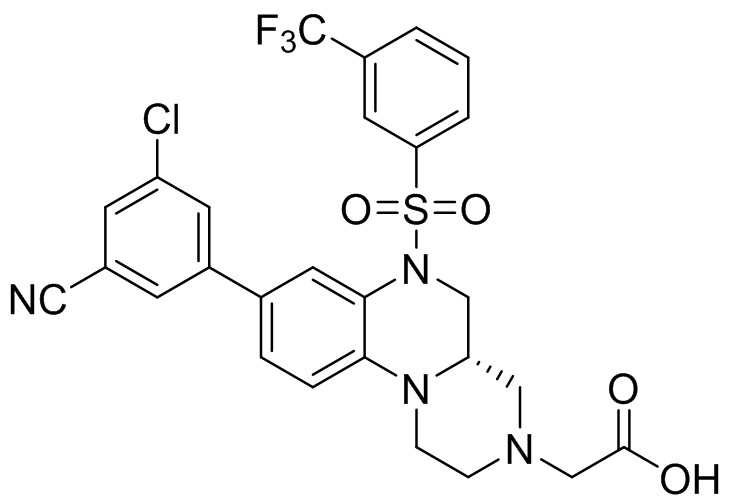
Данные о соединении, полученные методом ЯМР-спектроскопии на ядрах 1H, полученном в примерах 95, 96 и 97:
Пример 95. 1H ЯМР (400 МГц, метанол-d4) δ 7,97 (t, J=7,2 Гц, 2H), 7,87 (d, J=2,3 Гц, 1H), 7,83-7,75 (m, 2H), 7,66 (dt, J=10,1, 2,0 Гц, 1H), 7,60 (s, 1H), 7,53 (dd, J=8,7, 2,3 Гц, 1H), 7,47 (dt, J=8,1, 1,8 Гц, 1H), 6,99 (d, J=8,8 Гц, 1H), 4,36 (dd, J=14,5, 4,4 Гц, 1H), 3,92-3,73 (m, 1H), 3,36 (s, 3H), 3,22 (d, J=10,0 Гц, 2H), 2,88 (s, 1H), 2,57 (d, J=9,3 Гц, 2H), 2,28 (t, J=11,1 Гц, 1H).
Пример 96. 1H ЯМР (400 МГц, метанол-d4) δ 8,00 (d, J=7,9 Гц, 1H), 7,95 (d, J=7,9 Гц, 1H), 7,87 (dd, J=7,3, 2,1 Гц, 1H), 7,80 (d, J=8,8 Гц, 2H), 7,73 (ddd, J=8,6, 4,5, 2,1 Гц, 1H), 7,62 (s, 1H), 7,40 (dd, J=10,4, 8,4 Гц, 2H), 6,97 (d, J=8,8 Гц, 1H), 4,37 (dd, J=14,9, 4,0 Гц, 1H), 3,81 (d, J=9,4 Гц, 1H), 3,39-3,32 (m, 3H), 3,22 (d, J=10,1 Гц, 2H), 2,94 (s, 1H), 2,57 (d, J=8,7 Гц, 2H), 2,28 (d, J=11,5 Гц, 1H).
Пример 97. 1H ЯМР (400 МГц, метанол-d4) δ 7,99 (t, J=6,9 Гц, 2H), 7,90-7,86 (m, 2H), 7,84 (d, J=2,3 Гц, 1H), 7,80 (t, J=7,9 Гц, 1H), 7,72 (t, J=1,6 Гц, 1H), 7,64 (s, 1H), 7,53 (dd, J=8,7, 2,3 Гц, 1H), 7,02 (d, J=8,8 Гц, 1H), 4,39 (dd, J=14,5, 4,4 Гц, 1H), 3,92 (d, J=13,3 Гц, 1H), 3,59 (s, 2H), 3,40-3,33 (m, 3H), 2,96 (s, 1H), 2,78 (dd, J=13,4, 10,2 Гц, 1H), 2,63 (t, J=12,5 Гц, 1H), 2,47 (t, J=11,2 Гц, 1H).
Пример 98. Получение (R)-8-(3-(дифторметокси)-5-фторфенил)-6-((3-(трифторметил) фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-[1,4]оксазино[4,3-a]хиноксалина
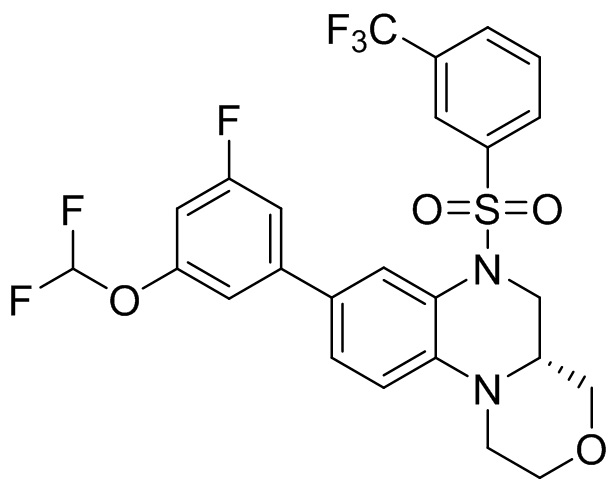
(R)-8-бром-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-[1,4]оксазино [4,3-a]хиноксалин (80 мг, 0,16 ммоль), [1,1'-бис(дифенилфосфино)ферроцен]палладий хлорид (58 мг, 0,08 ммоль), карбонат калия (58 мг, 0,42 ммоль) и 2-(3- (дифторметокси)-5-фторфенил)-4,4,5,5-тетраметил-1,3,2-пинаколборан (221 мг, 0,77 ммоль) помещали в трехгорлую колбу. Добавляли 1,4-диоксан (4 мл) и воду (2 мл). Трижды вводили азот для замещения воздуха путем откачки. Раствор смеси нагревали до 100°C в течение 2 ч. После завершения реакции растворитель удаляли путем концентрирования. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля с получением (R)-8-(3-(дифторметокси)-5-фторфенил)-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-[1,4]оксазино[4,3-a]хиноксалина (60 мг, выход: 64,5%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 559,5 [M+H]+.
1H ЯМР (500 МГц, метанол-d4) δ 7,95 (d, J=7,8 Гц, 1H), 7,88 (d, J=2,3 Гц, 1H), 7,86 (d, J=8,1 Гц, 1H), 7,75 (t, J=7,9 Гц, 1H), 7,65 (s, 1H), 7,47 (dd, J=8,7, 2,3 Гц, 1H), 7,22 (dt, J=9,9, 1,9 Гц, 1H), 7,19 (d, J=2,0 Гц, 1H), 7,1-6,8 (t, 1H), 6,91-6,86 (m, 2H), 4,25 (dd, J=14,4, 4,3 Гц, 1H), 3,77 (ddd, J=31,8, 11,3, 3,3 Гц, 2H), 3,55-3,37 (m, 2H), 3,29-3,24 (m, 1H), 3,08-2,98 (m, 1H), 2,55-2,30 (m, 2H).
Пример 99 получали методом синтеза, указанным в примере 98.
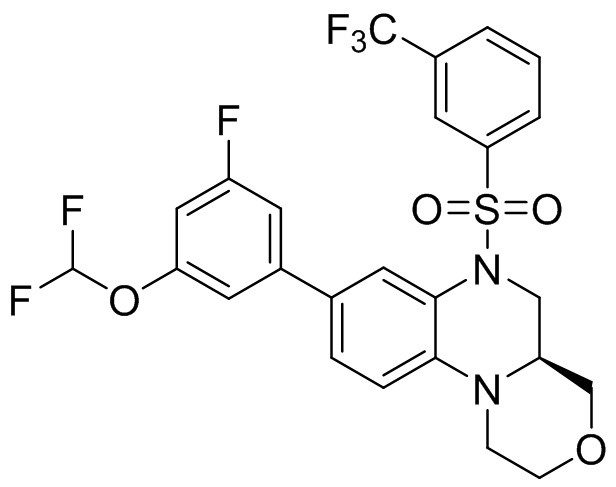
Данные о соединении, полученные методом ЯМР-спектроскопии на ядрах 1H, полученном в примере 99:
Пример 99. 1H ЯМР (500 МГц, метанол-d4) δ 7,95 (d, J=7,7 Гц, 1H), 7,88 (d, J=2,2 Гц, 1H), 7,86 (d, J=8,0 Гц, 1H), 7,75 (t, J=7,9 Гц, 1H), 7,65 (s, 1H), 7,47 (dd, J=8,7, 2,3 Гц, 1H), 7,22 (dt, J=9,9, 1,9 Гц, 1H), 7,19 (d, J=2,0 Гц, 1H), 7,1-6,81 (t, 1H), 6,91-6,85 (m, 2H), 4,25 (dd, J=14,4, 4,3 Гц, 1H), 3,77 (ddd, J=32,0, 11,3, 3,4 Гц, 2H), 3,55-3,37 (m, 2H), 3,28-3,24 (m, 1H), 3,03 (t, J=10,7 Гц, 1H), 2,58-2,31 (m, 2H).
Пример 100. Получение 8-(3-(дифторметокси)-5-фторфенил)-6-((3-(трифторметил) фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-[1,4]тиазино[4,3-а]хиноксалина
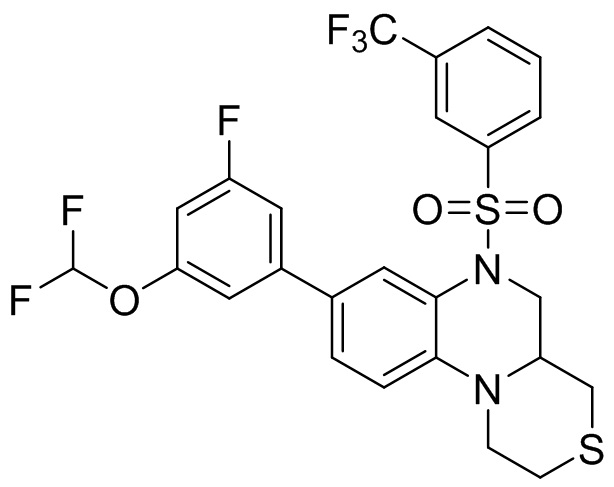
8-бром-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-[1,4]тиазино[4,3-a]хиноксалин (200 мг, 0,41 ммоль), [1,1'-бис(дифенилфосфино)ферроцен]палладий хлорид (58 мг, 0,08 ммоль), карбонат калия (138 мг, 1,0 ммоль) и 2-(3-(дифторметокси)-5-фторфенил)-4,4,5,5-тетраметил-1,3,2-пинаколборан (115 мг, 0,4 ммоль) помещали в трехгорлую колбу; добавляли 1,4-диоксан (6 мл) и воду (3 мл). Трижды вводили азот для замещения воздуха путем откачки. Раствор смеси нагревали до 100°C в течение 2 ч; после завершения реакции растворитель удаляли путем концентрирования. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля с получением 8-(3-(дифторметокси)-5-фторфенил)-6-((3-(трифторметил) фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-[1,4]тиазино[4,3-a]хиноксалина (230 мг, выход: 98,7%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 575,2 [M+H]+.
1H ЯМР (500 МГц, CDCl3) δ 7,84 (dd, J=12,1, 7,8 Гц, 2H), 7,74-7,69 (m, 2H), 7,64 (t, J=7,9 Гц, 1H), 7,36 (dd, J=8,7, 2,3 Гц, 1H), 7,12 (dt, J=9,5, 2,0 Гц, 1H), 7,09 (d, J=2,0 Гц, 1H), 6,80 (dt, J=9,2, 2,3 Гц, 1H), 6,78-6,71 (m, 1H), 6,74-6,38 (t, 1H), 4,28 (dd, J=14,4, 5,3 Гц, 1H), 3,93-3,80 (m, 1H), 3,41 (dd, J=14,4, 10,0 Гц, 1H), 3,09-2,95 (m, 1H), 2,79-2,64 (m, 1H), 2,59-2,47 (m, 1H), 2,47-2,31 (m, 3H).
Пример 101. Получение 8-(3-(дифторметокси)-5-фторфенил)-6-((3-(трифторметил) фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-[1,4]тиазино [4,3-a]хиноксалин-3-оксида
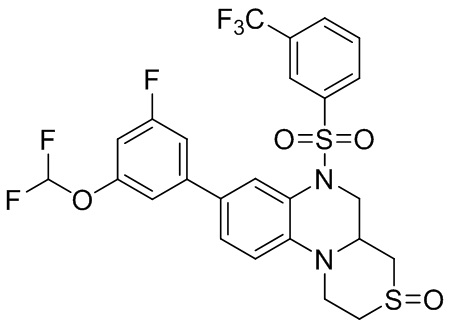
8-(3-(дифторметокси)-5-фторфенил)-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-[1,4]тиазино[4,3-a]хиноксалин (60 мг, 0,1 ммоль) растворяли в дихлорметане (5 мл). Добавляли 3-хлорпербензойную кислоту (18 мг, 0,1 ммоль). Реакционный раствор перемешивали при комнатной температуре в течение 16 ч и промывали насыщенным водным раствором сульфита натрия. Растворитель удаляли путем концентрирования. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля с получением 8-(3-(дифторметокси)-5-фторфенил)-6-((3-(трифторметил)фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-[1,4]тиазино [4,3-a]хиноксалин-3-оксида (40 мг, выход: 67,7%). Масс- спектрометрия с ионизацией электрораспылением (ESI-MS): 591,2 [M+H]+.
1H ЯМР (400 МГц, CDCl3) δ 7,94 (dd, J=55,9, 7,3 Гц, 2H), 7,80-7,58 (m, 3H), 7,42-7,32 (m, 1H), 7,13-7,01 (m, 2H), 6,91-6,77 (m, 2H), 6,75-6,37 (t, J=3,3 Гц, 1H), 4,14 (d, J=13,8 Гц, 1H), 3,97 (s, 1H), 3,75 (d, J=13,8 Гц, 1H), 3,52 (d, J=13,8 Гц, 1H),3,34(s, 1H), 3,08(s, 1H), 2,80 (t, J=15,7 Гц, 1H), 2,73-2,53 (m, 1H), 2,44 (s, 1H).
Пример 102. Получение 8-(3-(дифторметокси)-5-фторфенил)-6-((3-(трифторметил) фенил)сульфонил)-1,2,4,4a,5,6-гексагидро-[1,4]тиазино[4,3-a]хиноксалина 3,3-диоксида
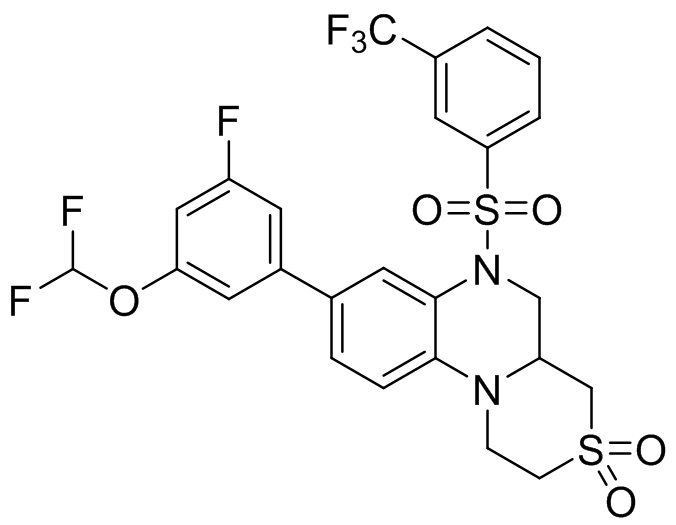
Вещество получали методом синтеза, указанным в примере 101. Использовали 3 эквивалента 3-хлорпербензойной кислоты. Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 591,2 [M+H]+.
1H ЯМР (400 МГц, CDCl3) δ 8,14-8,00 (m, 3H), 8,00-7,91 (m, 2H), 7,78 (t, J=7,7 Гц, 1H), 7,50 (d, J=8,3 Гц, 1H), 7,12-7,02 (m, 2H), 6,96 (d, J=9,0 Гц, 1H), 6,76-6,41(t, J=3,1 Гц, 1H), 4,99 (s, 1H), 4,68 (s, 1H), 4,47 (t, J=13,5 Гц, 1H), 4,20 (d, J=21,0 Гц, 3H), 3,81 (t, J=12,4 Гц, 1H), 3,19 (d, J=14,5 Гц, 1H), 3,02 (d, J=13,6 Гц, 1H).
Пример 103. Получение (6aS)-3-(3-(дифторметокси)-5-фторфенил)-8-фтор-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a] хиноксалина
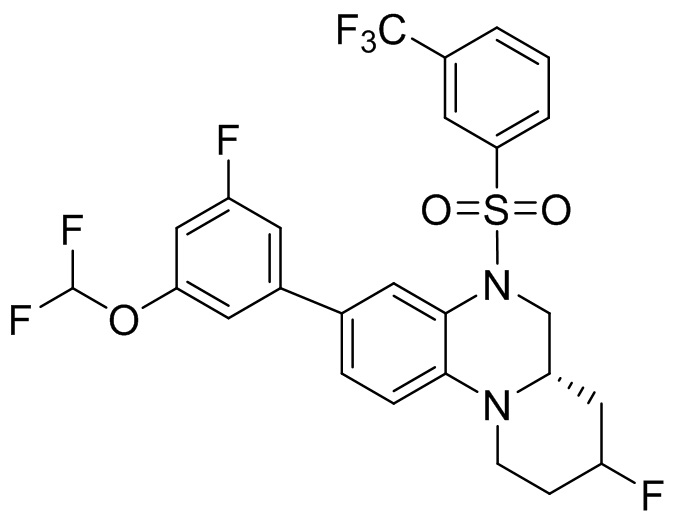
Этап 1. Синтез (6aS)-3-бром-8-фтор-7,8,9,10-тетрагидро-5H-пиридо[1,2-a]хиноксалин -6(6aH)-она
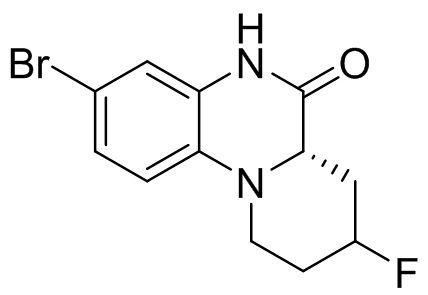
(6aS)-3-бром-8-гидрокси-7,8,9,10-тетрагидро-5H-пиридо[1,2-a]хиноксалин-6(6aH)-он (60 мг, 0,2 ммоль) растворяли в дихлорметане (5 мл) и раствор смеси охлаждали до температуры -70°C. К раствору добавляли DAST (33 мг, 0,2 ммоль). Раствор смеси перемешивали при температуре -30°C в течение 2 ч, затем естественным образом нагревали до комнатной температуры и перемешивали в течение 16 ч. Раствор смеси разбавляли 15 мл этилацетата, промывали солевым раствором (15 мл × 3), сушили над безводным сульфатом натрия, фильтровали и концентрировали для удаления растворителя. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля с получением (6aS)-3-бром-8-фтор-7,8,9,10-тетрагидро-5H-пиридо[1,2-a]хиноксалин-6(6aH)-она (40 мг, выход: 66,8%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 299, 300 [M+H]+.
Этап 2. Синтез (6aS)-3-бром-8-фтор-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a] хиноксалина
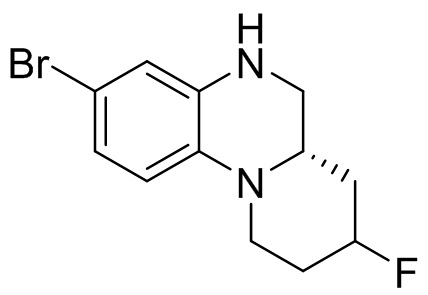
(6aS)-3-бром-8-фтор-7,8,9,10-тетрагидро-5H-пиридо[1,2-a]хиноксалин-6(6aH)-он (40 мг, 0,12 ммоль) растворяли в 4M боран-тетрагидрофуране (5 мл). Реакционную смесь перемешивали при температуре 30°C в течение 2 ч. Для завершения реакции по каплям добавляли метанол. Для удаления растворителя реакционную смесь концентрировали. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля с получением (6aS)-3-бром-8-фтор-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалина (17 мг, выход: 49,7%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 285, 287 [M+H]+.
Этап 3. Синтез (6aS)-3-бром-8-фтор-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалина
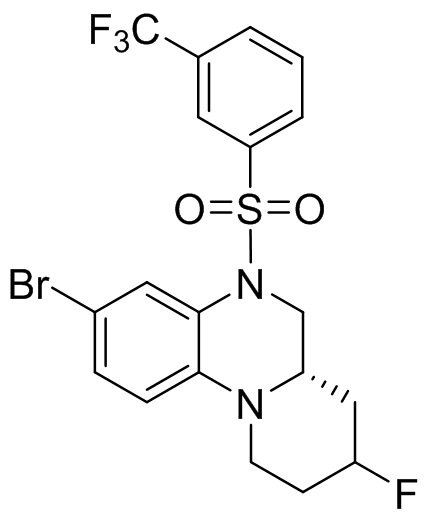
(6aS)-3-бром-8-фтор-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин (17 мг, 0,059 ммоль) растворяли в дихлорметане (5 мл). Добавляли пиридин (0,2 мл), диметиламинопиридин (1 мг, 0,005 ммоль) и 3-(трифторметил)бензолсульфонилхлорид (18 мг, 0,072 ммоль). Реакцию в растворе смеси проводили при температуре 25°C в течение 4 ч. Растворитель удаляли путем концентрирования. Остаток растворяли в этилацетате (15 мл), последовательно промывали водой (10 мл), насыщенным водным раствором гидрокарбоната натрия (10 мл) и солевым раствором (10 мл), сушили над безводным сульфатом натрия, фильтровали, а затем концентрировали для удаления растворителя. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля с получением (6aS)-3-бром-8-фтор-5((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалина (30 мг, выход: 100%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 493, 495 [M+H]+.
Этап 4. Синтез (6aS)-3-(3-(дифторметокси)-5-фторфенил)-8-фтор-5-((3-(трифторметил) фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалина

(6aS)-3-бром-8-фтор-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин (30 мг, 0,059 ммоль), [1,1'-бис(дифенилфосфино)ферроцен] палладий хлорид (29 мг, 0,04 ммоль), карбонат калия (21 мг, 0,15 ммоль) и 2-(3-(дифторметокси)-5-фторфенил)-4,4,5,5-тетраметил-1,3-диоксалан (17 мг, 0,06 ммоль) помещали в трехгорлую колбу; добавляли 1,4-диоксан (4 мл) и воду (2 мл). Трижды вводили азот для замещения воздуха путем откачки. Раствор смеси нагревали до 60°C в течение 2 ч. После завершения реакции для удаления растворителя реакционную смесь концентрировали. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля с получением (6aS)-3-(3-(дифторметокси)-5-фторфенил)-8-фтор-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалина (15 мг, выход: 44,3%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 575,6 [M+1]+.
1H ЯМР (400 МГц, CDCl3) δ 7,86-7,73 (m, 4H), 7,61 (t, J=7,8 Гц, 1H), 7,35 (dd, J=8,7, 2,3 Гц, 1H), 7,12 (dt, J=9,5, 1,9 Гц, 1H), 7,09 (d, J=2,1 Гц, 1H), 6,90 (d, J=8,7 Гц, 1H), 6,81 (dt, J=9,3, 2,3 Гц, 1H), 6,75-6,38 (t, J=73,3 Гц, 1H), 4,45 (ddt, J=48,6, 10,5, 5,6 Гц, 1H), 4,29 (dd, J=14,4, 4,3 Гц, 1H), 3,82-3,70 (m, 1H), 3,41 (dd, J=14,4, 10,4 Гц, 1H), 2,62 (s, 1H), 2,30 (t, J=12,7 Гц, 1H), 2,14 (s, 2H), 1,65 (m, 1H), 1,37 (m, 1H).
Пример 104. Получение (6aS)-3-(3-(дифторметокси)-5-фторфенил)-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-а]хиноксалин-8-ил-карбамата

Этап 1. Синтез (6aS)-3-бром-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-ил-карбамата
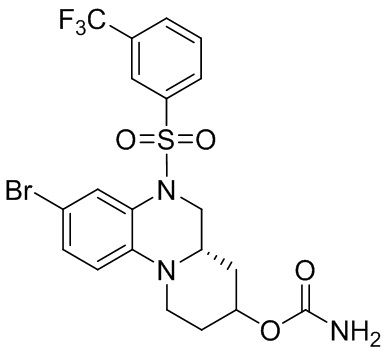
(6aS)-3-бром-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-ол (40 мг, 0,08 ммоль) растворяли в тетрагидрофуране (5 мл). Добавляли карбонилдиимидазол (20 мг, 0,12 ммоль). Раствор смеси перемешивали при температуре 25°C в течение 16 ч. К раствору добавляли раствор аммиака (2 мл). Реакционную смесь перемешивали еще 2 ч, разбавляли 15 мл этилацетата, промывали водой (15 мл × 3), сушили над безводным сульфатом натрия, фильтровали и концентрировали для удаления растворителя. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля с получением (6aS)-3-бром-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-ил-карбамата (45 мг, выход: 100%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 534, 536 [M+H]+.
Этап 2. Синтез (6aS)-3-(3-(дифторметокси)-5-фторфенил)-5-((3-(трифторметил) фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо [1,2-а]хиноксалин-8-ил-карбамата

(6aS)-3-бром-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-ил-карбамат (45 мг, 0,08 ммоль), [1,1'-бис(дифенилфосфино) ферроцен]палладия хлорид (29 мг, 0,04 ммоль), карбонат калия (28 мг, 0,2 ммоль) и 2-(3-(дифторметокси)-5-фторфенил)-4,4,5,5-тетраметил-1,3-диоксалан (23 мг, 0,08 ммоль) помещали в трехгорлую колбу; добавляли 1,4-диоксан (4 мл) и воду (2 мл). Трижды вводили азот для замещения воздуха путем откачки. Раствор смеси нагревали до 60°C в течение 2 ч. После завершения реакции для удаления растворителя реакционную смесь концентрировали. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля с получением (6aS)-3-(3-(дифторметокси)-5-фторфенил)-5-((3-(трифторметил) фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-а]хиноксалин-8-ил-карбамата (20 мг, выход: 40,6%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 616,6 [M+1]+.
1H ЯМР (400 МГц, CDCl3) δ 7,82 (t, J=7,0 Гц, 2H), 7,79 (d, J=2,2 Гц, 1H), 7,67 (s, 1H), 7,63 (t, J=7,7 Гц, 1H), 7,38-7,31 (m, 1H), 7,13 (dd, J=9,6, 2,2 Гц, 1H), 7,10 (s, 1H), 6,80 (d, J=9,1 Гц, 1H), 6,75-6,38 (t, 1H), 6,66 (d, J=73,3 Гц, 1H), 4,54 (d, J=15,3 Гц, 2H), 4,25 (dd, J=14,4, 4,3 Гц, 1H), 3,77 (d, J=13,7 Гц, 1H), 3,37 (dd, J=14,4, 10,1 Гц, 2H), 2,59 (s, 1H), 2,28 (t, J=12,8 Гц, 1H), 2,04 (s, 2H).
Пример 105. Получение (6aS)-3-(3-(дифторметокси)-5-фторфенил)-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-а]хиноксалин-8-ола
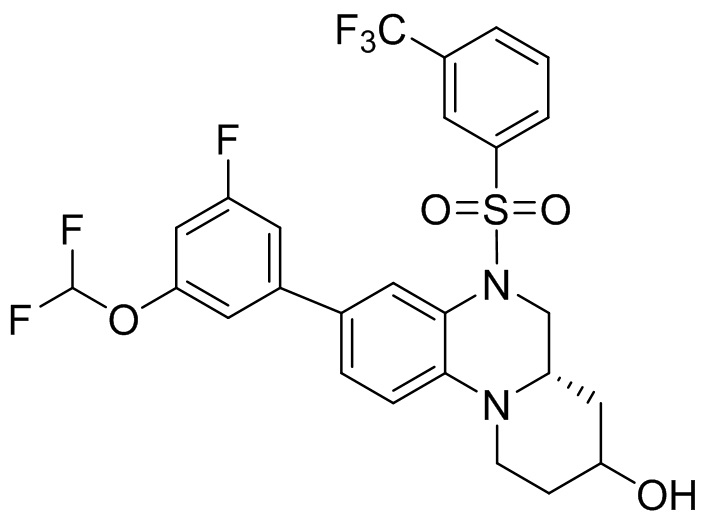
(6aS)-3-бром-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-ол (50 мг, 0,1 ммоль), [1,1'-бис(дифенилфосфино)ферроцен]палладий хлорид (29 мг, 0,04 ммоль), карбонат калия (35 мг, 0,25 ммоль) и 2-(3-(дифторметокси)-5-фторфенил)-4,4,5,5-тетраметил-1,3-диоксалан (29 мг, 0,1 ммоль) помещали в трехгорлую колбу; добавляли 1,4-диоксан (4 мл) и воду (2 мл). Трижды вводили азот для замещения воздуха путем откачки. Раствор смеси нагревали до 60°C в течение 2 ч. После завершения реакции для удаления растворителя реакционную смесь концентрировали. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля с получением (6aS)-3-(3-(дифторметокси)-5-фторфенил)-5-((3-(трифторметил) фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-а]хиноксалин-8-ола (50 мг, выход: 87,3%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 573,5 [M+1]+.
1H ЯМР (400 МГц, CDCl3) δ 7,82 (d, J=8,4 Гц, 3H), 7,76 (d, J=7,9 Гц, 1H), 7,60 (t, J=7,7 Гц, 1H), 7,35 (dd, J=8,7, 2,3 Гц, 1H), 7,15-7,06 (m, 2H), 6,96 (s, 1H), 6,82 (d, J=9,1 Гц, 1H), 6,75-6,38 (t, 1H), 4,28 (dd, J=14,4, 4,2 Гц, 1H), 3,79-3,58 (m, 2H), 3,50 (s, 1H), 2,66 (s, 1H), 2,05 (s, 2H), 1,47 (d, J=12,6 Гц, 2H), 1,23 (d, J=12,7 Гц, 1H).
Пример 106. Получение 2-(((6aS)-3-(3-(дифторметокси)-5-фторфенил)-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-ил)окси)уксусной кислоты
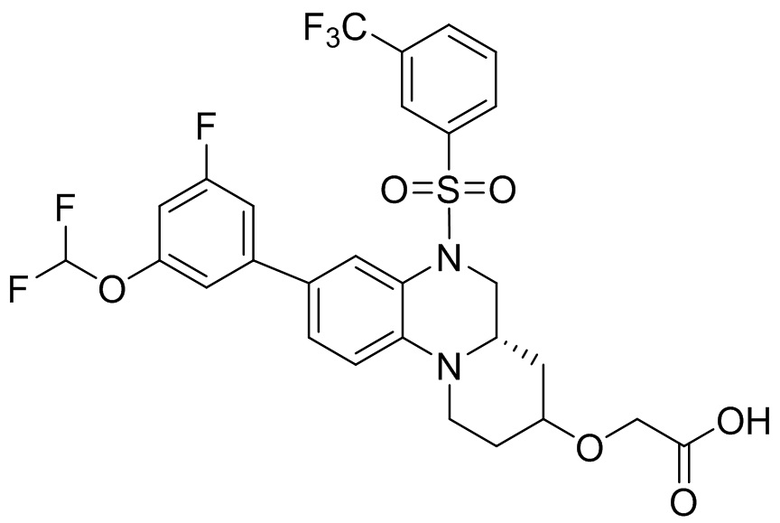
Этап 1. Синтез трет-бутил 2-(((6aS)-3-бром-5-((3-(трифторметил)фенил) сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-а]хиноксалин-8-ил)окси)ацетата
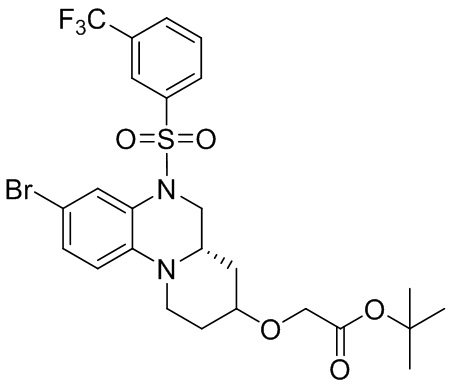
(6aS)-3-бром-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-ол (40 мг, 0,08 ммоль) растворяли в толуоле (5 мл) и к раствору добавляли 2M водный раствор гидроксида натрия (5 мл), тетрабутиламмоний бромид (129 мг, 0,4 ммоль) и трет-бутилбромацетат (78 мг, 0,4 ммоль). Раствор смеси перемешивали при температуре 25°C в течение 24 ч. Реакционную смесь разбавляли 15 мл этилацетата, промывали водой (15 мл × 3), сушили над безводным сульфатом натрия, фильтровали и концентрировали для удаления растворителя. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля с получением трет-бутил 2-(((6aS)-3-бром-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-ил)окси)ацетата (35 мг, выход: 72,3%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 605, 607 [M+H]+.
Этап 2. Синтез 2-(((6aS)-3-бром-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10- гексагидро-5H-пиридо[1,2-a]хиноксалин-8-ил)окси)уксусной кислоты
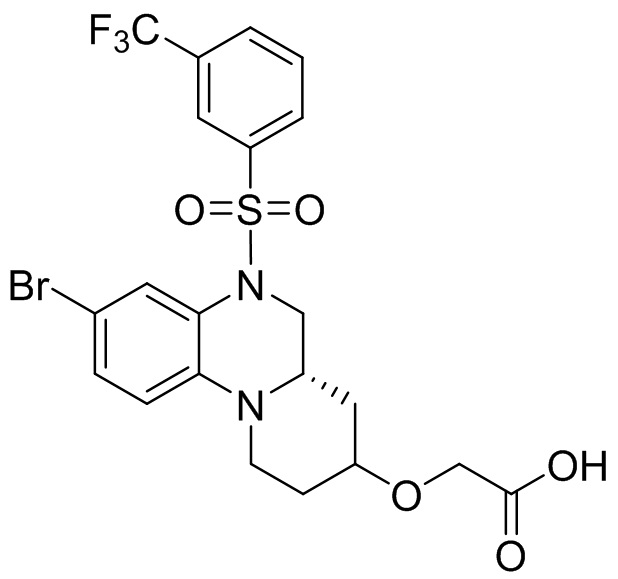
Трет-бутил 2-(((6aS)-3-бром-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a] хиноксалин-8-)окси)ацетат (35 мг, 0,057 ммоль) растворяли в дихлорметане (3 мл). К раствору добавляли 4М раствора HCl в диоксане (3 мл). Раствор смеси перемешивали при температуре 25°C в течение 1 ч и концентрировали для удаления растворителя. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля с получением 2-(((6aS)-3-бром-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-ил)окси)уксусной кислоты (30 мг, выход: 95,8%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 547, 549 [M-H]-.
Этап 3. Синтез 2-(((6aS)-3-(3-(дифторметокси)-5-фторфенил)-5-((3-(трифторметил) фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-ил)окси)уксусной кислоты

2-(((6aS)-3-бром-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-ил)окси)уксусную кислоту (30 мг, 0,054 ммоль), [1,1'-бис (дифенилфосфино)ферроцен]палладий хлорид (15 мг, 0,02 ммоль), карбонат калия (18 мг, 0,14 ммоль) и 2-(3-(дифторметокси)-5-фторфенил)-4,4,5,5-тетраметил-1,3-диоксалан (16 мг, 0,054 ммоль) помещали в трехгорлую колбу; добавляли 1,4-диоксан (4 мл) и воду (2 мл). Трижды вводили азот для замещения воздуха путем откачки. Раствор смеси нагревали до 60°C в течение 2 ч. После завершения реакции растворитель удаляли путем концентрирования. Остаток вначале отделяли с помощью быстрой хроматографии на колонке силикагеля, а затем - с помощью обращенно-фазовой колоночной хроматографии с получением 2-(((6aS)-3-(3-(дифторметокси)-5-фторфенил)-5-((3-(трифторметил)фенил) сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-ил)окси)уксусной кислоты (9,8 мг, выход: 28,7%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 631,6 [M+1]+.
1H ЯМР (400 МГц, CDCl3) δ 7,82 (d, J=6,7 Гц, 2H), 7,79-7,73 (m, 2H), 7,60 (t, J=8,0 Гц, 1H), 7,35 (dd, J=8,6, 2,3 Гц, 1H), 7,11 (d, J=9,5 Гц, 1H), 7,08 (s, 1H), 6,87 (d, J=8,8 Гц, 1H), 6,80 (d, J=9,2 Гц, 1H), 6,74 (s, 1H), 6,74-6,38(t, 1H)4,28 (dd, J=14,4, 4,1 Гц, 1H), 4,15 (s, 2H), 3,79 (d, J=13,1 Гц, 1H), 3,38 (d, J=10,4 Гц, 2H), 2,58 (s, 1H), 2,24 (d, J=13,2 Гц, 1H), 2,08 (s, 2H), 1,25-1,15(d, J=11,24,1H), 1,21 (d, J=11,2 Гц, 1H).
Пример 107. Получение (6aS,8R)-3-(3-(дифторметокси)-5-фторфенил)-8-метил-5-((3- (трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин -8-ола
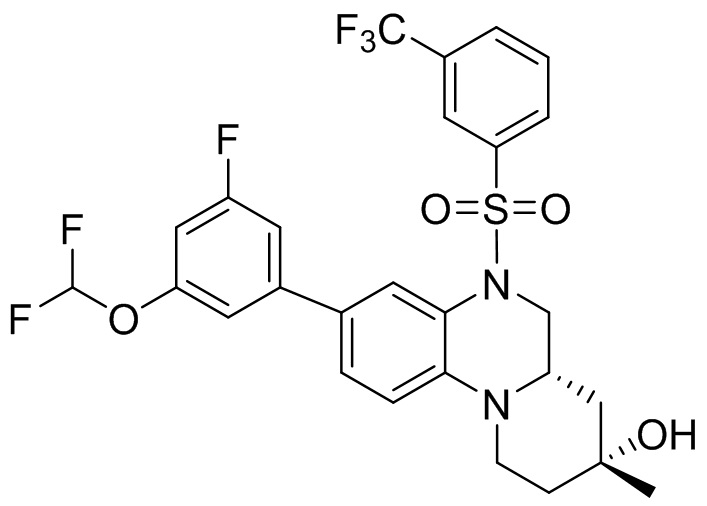
Этап 1. Синтез (6aS,8R)-3-бром-8-метил-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7, 8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-ола
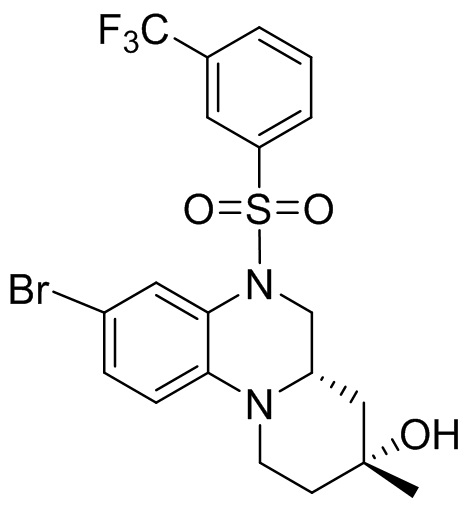
(S)-3-бром-5-((3-(трифторметил)фенил)сульфонил)-5,6,6a,7,9,10-гексагидро-8H-пиридо[1,2-a]хиноксалин-8-он (50 мг, 0,1 ммоль) растворяли в тетрагидрофуране (5 мл), и раствор смеси охлаждали до температуры -15°C. Добавляли 3M раствора метилмагнийбромида в диметилтетрагидрофуране (0,04 мл, 0,12 ммоль) в атмосфере азота. Раствор смеси естественным образом нагревали до температуры 25°C и перемешивали в течение 2 ч, для остановки реакции добавляли хлорид аммония, разбавляли 15 мл этилацетата, промывали солевым раствором (15 мл × 3), сушили над безводным сульфатом натрия, фильтровали и концентрировали для удаления растворителя. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля с получением (6aS,8R)-3-бром-8- метил-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-ола (25 мг, выход: 50,0%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 505, 507 [M+H]+.
Этап 2. Синтез (6aS,8R)-3-(3-(дифторметокси)-5-фторфенил)-8-метил-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-ола
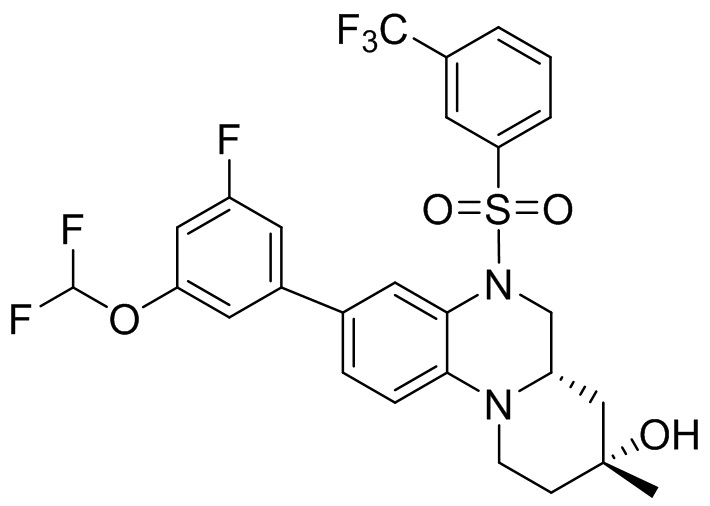
(6aS,8R)-3-бром-8-метил-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-а]хиноксалин-8-ол (25 мг, 0,049 ммоль), [1,1'-бис(дифенилфосфино) ферроцен]палладия хлорид (15 мг, 0,02 ммоль), карбонат калия (17 мг, 0,12 ммоль) и 2-(3-(дифторметокси)-5-фторфенил)-4,4,5,5-тетраметил-1,3-диоксалан (14 мг, 0,049 ммоль) помещали в трехгорлую колбу; добавляли 1,4-диоксан (4 мл) и воду (2 мл). Трижды вводили азот для замещения воздуха путем откачки. Раствор смеси нагревали до 60°C в течение 2 ч. После завершения реакции растворитель удаляли путем концентрирования. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля, а затем - с помощью обращенно-фазовой колоночной хроматографии с получением (6aS,8R)-3-(3-(дифторметокси)-5-фторфенил)-8-метил-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-ола (3,8 мг, выход: 13,2%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 587 [M+H]+.
1H ЯМР (400 МГц, CDCl3) δ 7,82 (dd, J=7,7, 5,3 Гц, 3H), 7,67 (d, J=7,8 Гц, 1H), 7,58 (t, J=7,7 Гц, 1H), 7,35 (dd, J=8,7, 2,3 Гц, 1H), 7,14 (dt, J=9,6, 1,9 Гц, 1H), 7,11 (d, J=2,1 Гц, 1H), 6,81 (t, J=8,9 Гц, 2H), 6,75-6,38 (t, 1H), 4,23 (dd, J=14,4, 4,0 Гц, 1H), 3,70 (dt, J=13,0, 4,1 Гц, 1H), 3,25 (dd, J=14,4, 10,4 Гц, 1H), 2,39 (t, J=11,2 Гц, 1H), 2,22 (td, J=12,6, 3,7 Гц, 1H), 1,27 (q, J=11,7, 11,1 Гц, 2H), 1,07 (s, 3H).
Пример 108 получали методом синтеза, указанным в примере 107.
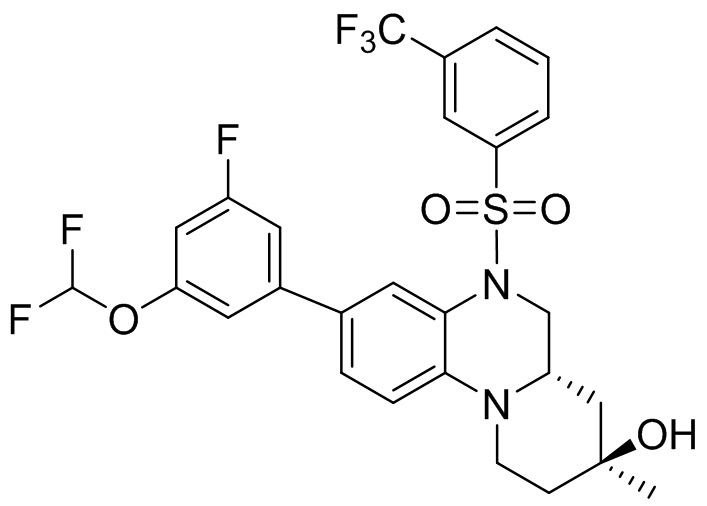
Данные о соединении, полученные методом ЯМР-спектроскопии на ядрах 1H, полученном в примере 108:
Пример 108. 1H ЯМР (400 МГц, CDCl3) δ 7,83-7,75 (m, 3H), 7,70 (d, J=7,9 Гц, 1H), 7,57 (t, J=8,1 Гц, 1H), 7,33 (dd, J=8,7, 2,3 Гц, 1H), 7,14 (dt, J=9,5, 1,9 Гц, 1H), 7,11 (d, J=2,1 Гц, 1H), 6,79 (t, J=8,9 Гц, 2H), 6,75-6,38 (t, 1H), 4,20 (dd, J=14,3, 4,3 Гц, 1H), 3,72 (q, J=7,0 Гц, 1H), 3,49 (s, 1H), 3,27 (dd, J=14,3, 10,4 Гц, 1H), 2,84 (td, J=11,5, 9,1, 5,4 Гц, 1H), 2,49 (td, J=12,0, 4,1 Гц, 1H), 1,3 (m, 1H), 1,23 (s, 3H), 1,15 (t, J=12,4 Гц, 1H).
Пример 109. Получение 3-(((6aS)-3-(3-(дифторметокси)-5-фторфенил)-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-ил)окси)пропановой кислоты
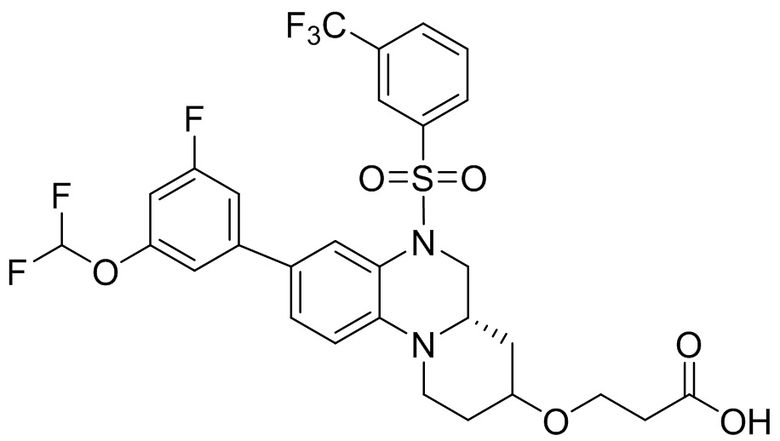
Этап 1. Синтез трет-бутил-3-(((6aS)-3-бром-5-((3-(трифторметил)фенил) сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-ил)окси)пропаноата
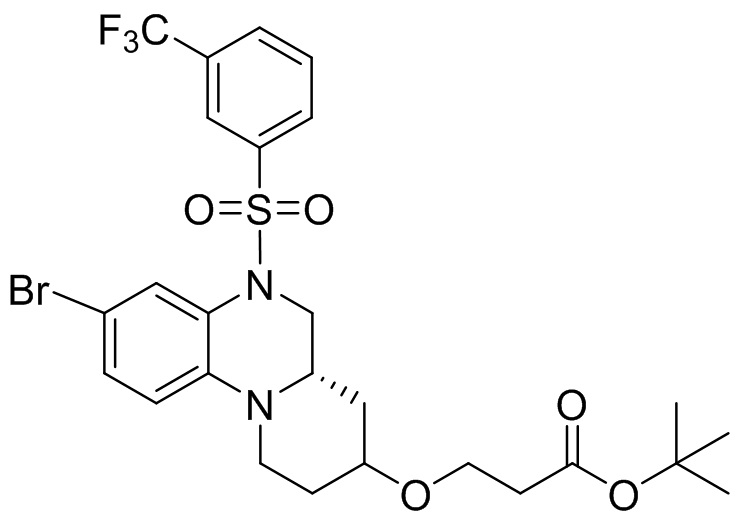
(6aS)-3-бром-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-ол (150 мг, 0,3 ммоль) растворяли в толуоле (5 мл). Добавляли гидроксид калия (17 мг, 0,3 ммоль) и трет-бутилакрилат (192 мг, 1,5 ммоль). Раствор смеси перемешивали при температуре 110°C в течение 24 ч. Реакционную смесь охлаждали, а затем разбавляли 15 мл этилацетата, промывали водой (15 мл × 3), сушили над безводным сульфатом натрия, фильтровали и концентрировали для удаления растворителя. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля с получением трет-бутил-3-(((6aS)-3-бром-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-ил)окси)пропаноата (110 мг, выход: 59,2%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 619, 621 [M+H]+.
Этап 2. Синтез трет-бутил 3-(((6aS)-3-(3-(дифторметокси)-5-фторфенил)-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-ил)окси)пропаноата
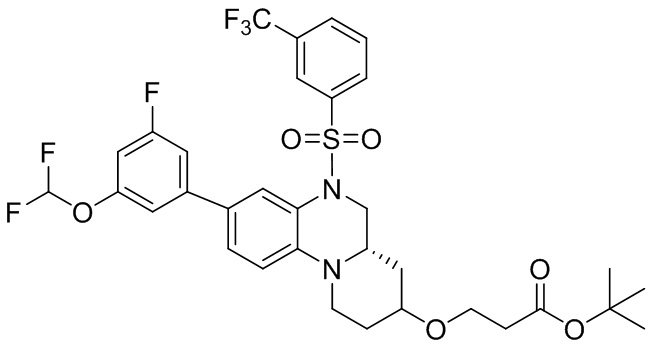
Трет-бутил 3-(((6aS)-3-бром-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a] хиноксалин-8-ил)окси)пропаноат (110 мг, 0,17 ммоль), [1,1'-бис(дифенилфосфино)ферроцен]палладий хлорид (22 мг, 0,03 ммоль), карбонат калия (59 мг, 0,43 ммоль) и 2-(3-(дифторметокси)-5-фторфенил)-4,4,5,5-тетраметил-1,3-диоксалан (51 мг, 0,17 ммоль) помещали в трехгорлую колбу; добавляли 1,4-диоксан (4 мл) и воду (2 мл). Трижды вводили азот для замещения воздуха путем откачки. Раствор смеси нагревали до 60°C в течение 2 ч. После завершения реакции растворитель удаляли путем концентрирования. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля, а затем - с помощью обращенно-фазовой колоночной хроматографии с получением трет-бутил 3-(((6aS)-3-(3-(дифторметокси)-5-фторфенил)-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-ил)окси)пропаноата (100 мг, выход: 84,0%), который без дополнительной обработки использовали на следующем этапе.
Этап 3. Синтез 3-(((6aS)-3-(3-(дифторметокси)-5-фторфенил)-5-((3-(трифторметил) фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-ил)окси)пропановой кислоты

Трет-бутил 3-(((6aS)-3-(3-(дифторметокси)-5-фторфенил)-5-((3-(трифторметил)фенил) сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-ил)окси)пропаноат (100 мг, 0,14 ммоль) растворяли в дихлорметане (3 мл). К раствору добавляли трифторуксусную кислоту (3 мл). Раствор смеси перемешивали при температуре 25°C в течение 1 ч и концентрировали для удаления растворителя. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля с получением 3-(((6aS)-3-(3-(дифторметокси)-5-фторфенил)-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-ил)окси)пропановой кислоты (30 мг, выход: 33,3%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 645,2 [M+1]+.
1H ЯМР (500 МГц, CDCl3) δ 7,84-7,71 (m, 4H), 7,59 (t, J=7,8 Гц, 1H), 7,33 (dd, J=8,7, 2,3 Гц, 1H), 7,12 (dt, J=9,5, 2,0 Гц, 1H), 7,09 (d, J=2,0 Гц, 1H), 6,85-6,76 (m, 2H), 6,74-6,37 (t, 1H), 4,25 (dd, J=14,4, 4,3 Гц, 1H), 3,73 (t, J=6,1 Гц, 3H), 3,31 (dd, J=14,4, 10,3 Гц, 1H), 3,21 (td, J=10,7, 5,2 Гц, 1H), 2,61 (t, J=6,1 Гц, 2H), 2,50 (t, J=10,7 Гц, 1H), 2,18 (t, J=12,5 Гц, 1H), 1,99 (d, J=12,2 Гц, 2H), 1,36 (qd, J=12,7, 4,5 Гц, 1H), 1,05 (q, J=11,5 Гц, 1H).
Пример 110. Получение (6aS)-3-(3-(дифторметокси)-5-фторфенил)-8-((метилсульфонил)метокси)-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалина
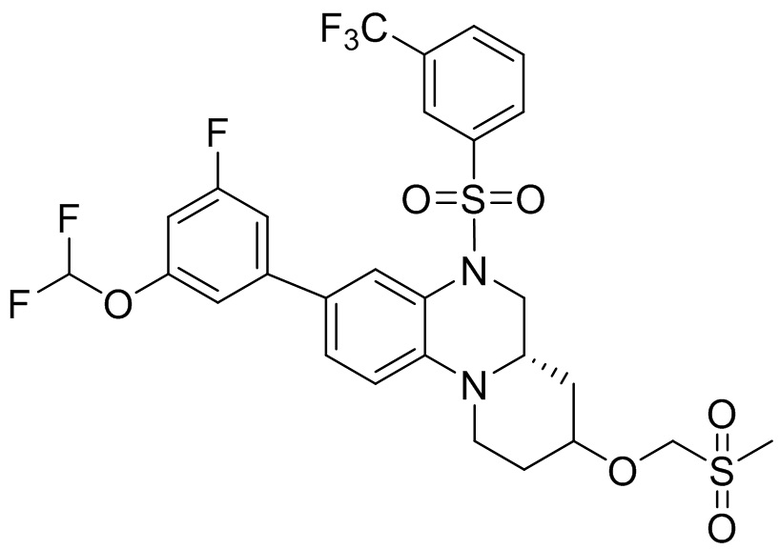
Этап 1. Синтез (6aS)-3-бром-8-((метилтио)метокси)-5-((3-(трифторметил)фенил) сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалина

(6aS)-3-бром-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-ол (60 мг, 0,12 ммоль) растворяли в диметилсульфоксиде (3 мл). К раствору добавляли уксусный ангидрид (3 мл) и уксусную кислоту (1 мл). Раствор смеси перемешивали при температуре 25°C в течение 16 ч. Реакционную смесь разбавляли 15 мл этилацетата, промывали водой (15 мл × 3), сушили над безводным сульфатом натрия, фильтровали и концентрировали для удаления растворителя. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля с получением (6aS)-3-бром-8-((метилтио)метокси)-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалина (60 мг, выход: 90,7%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 551, 553 [M+H]+.
Этап 2. Синтез (6aS)-3-(3-(дифторметокси)-5-фторфенил)-8-((метилтио)метокси)-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалина
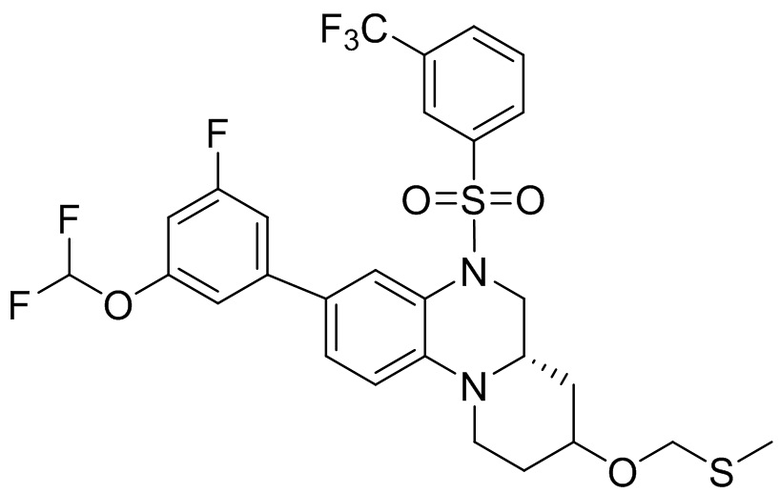
(6aS)-3-бром-8-((метилтио)метокси)-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин (60 мг, 0,10 ммоль), [1,1'-бис (дифенилфосфино)ферроцен]палладий хлорид (15 мг, 0,02 ммоль), карбонат калия (35 мг, 0,25 ммоль) и 2-(3-(дифторметокси)-5-фторфенил)-4,4,5,5-тетраметил-1,3-диоксалан (29 мг, 0,10 ммоль) помещали в трехгорлую колбу. Добавляли 1,4-диоксан (4 мл) и воду (2 мл). Трижды вводили азот для замещения воздуха путем откачки. Раствор смеси нагревали до 60°C в течение 2 ч. После завершения реакции растворитель удаляли путем концентрирования. Остаток вначале отделяли с помощью быстрой хроматографии на колонке силикагеля, а затем - с помощью обращенно-фазовой колоночной хроматографии с получением (6aS)-3-(3-(дифторметокси)-5-фторфенил)-8-((метилтио)метокси)-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалина (40 мг, выход: 63,3%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 633 [M+H]+.
Этап 3. Синтез (6aS)-3-(3-(дифторметокси)-5-фторфенил)-8-((метилсульфонил) метокси)-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалина

(6aS)-3-(3-(дифторметокси)-5-фторфенил)-8-((метилтио)метокси)-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин (40 мг, 0,06 ммоль) растворяли в дихлорметане (3 мл); к раствору добавляли 3-хлорпероксибензойную кислоту (21 мг, 0,1 ммоль). Раствор смеси перемешивали при температуре 25°C в течение 16 часов, добавляли насыщенный водный раствор сульфита натрия (5 мл) и перемешивали в течение 30 мин. Органический слой высушивали, концентрировали и отделяли с помощью быстрой хроматографии на колонке силикагеля с получением (6aS)-3-(3-(дифторметокси)-5-фторфенил)-8-((метилсульфонил)метокси)-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалина (5,4 мг, выход: 13,5%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 665,4 [M+1]+.
1H ЯМР (500 МГц, CDCl3) δ 7,82 (d, J=7,9 Гц, 2H), 7,76 (d, J=2,3 Гц, 1H), 7,71 (s, 1H), 7,62 (t, J=7,9 Гц, 1H), 7,34 (d, J=8,7 Гц, 1H), 7,12 (d, J=10,2 Гц, 1H), 7,09 (s, 1H), 6,84-6,76 (m, 2H), 6,74-638 (t, J=73,4 Гц, 1H), 4,41 (d, J=24,4 Гц, 2H), 4,26 (dd, J=14,5, 4,5 Гц, 1H), 3,87-3,74 (m, 2H), 3,36 (dd, J=14,4, 10,0 Гц, 1H), 2,89 (s, 3H), 2,54 (s, 1H), 2,30-2,14 (m, 1H), 2,09 (d, J=12,9 Гц, 2H), 1,46-1,37 (m, 1H), 1,15 (q, J=11,6 Гц, 1H).
Пример 111. Получение (6aS)-3-(3-(дифторметокси)-5-фторфенил)-8-((метилсульфонил)этокси)-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a] хиноксалина

(6aS)-3-(3-(дифторметокси)-5-фторфенил)-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-ол (50 мг, 0,07 ммоль) растворяли в толуоле. К раствору добавляли метилсульфонилэтилен (37 мг, 0,35 ммоль) и гидрид натрия (5 мг, 0,11 ммоль). Реакцию в растворе смеси проводили при температуре 25°C в течение 16 ч, а затем концентрировали для удаления растворителя. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля с получением (6aS)-3-(3-(дифторметокси)-5-фторфенил)-8-((метилсульфонил)этокси)-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалина (10 мг, выход: 21,1%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 679,2 [M+1]+.
1H ЯМР (500 МГц, CDCl3) δ 7,86-7,70 (m, 4H), 7,61(s, 1H), 7,34 (s, 1H), 7,11 (d, J=9,5 Гц, 1H), 7,08 (s, 1H), 6,85 (s, 1H), 6,80 (d, J=9,2 Гц, 1H), 6,74-6,38 (t, 1H), 4,27 (d, J=14,4 Гц, 1H), 3,90 (s, 2H), 3,78 (s, 1H), 3,38 (s, 1H), 3,28 (s, 1H), 3,21 (s, 2H), 2,97 (s, 3H), 2,56 (s, 1H), 2,24 (s, 1H), 2,04 (s, 2H), 1,40 (s, 1H), 1,11 (s, 1H).
Пример 112. Получение (2R,3R,4S,5S,6R)-2-(((6aS)-3-(3-(дифторметокси)-5-фторфенил)-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-ил)окси)-6- (гидроксиметил)тетрагидро-2H-пиран-3,4,5-триола
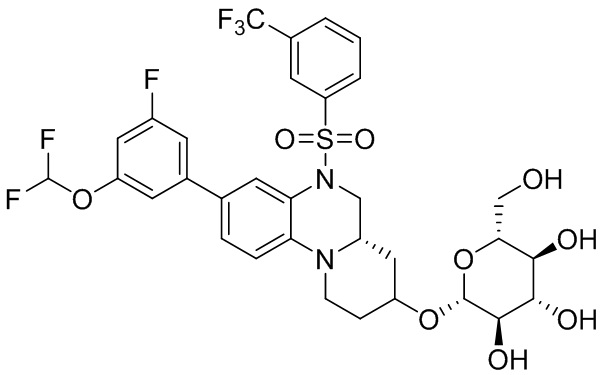
Этап 1. Синтез (2R,3R,4S,5R)-2-(ацетоксиметил)-6-(2,2,2-трихлор-1-иминоэтокси) тетрагидро-2H-пиран-3,4,5-триил-триацетата.
(2R,3R,4S,5R)-2-(ацетоксиметил)-6-гидрокситетрагидро-2H-пиран-3,4,5-триил-триацетат (350 мг, 1,0 ммоль) растворяли в дихлорметане. К раствору добавляли одну каплю DBU и трихлорацетонитрил (450 мг, 3,0 ммоль). Реакцию в растворе смеси проводили при температуре 25°C в течение 6 ч, а затем концентрировали для удаления растворителя. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля с получением (2R,3R,4S,5R)-2-(ацетоксиметил)-6-(2,2,2-трихлор-1-иминоэтокси)тетрагидро-2H-пиран-3,4,5-триил-триацетата (390 мг, выход: 79,1%), который без дополнительной обработки использовали на следующем этапе.
Этап 2. Синтез (2R,3R,4S,5R,6R)-2-(ацетоксиметил)-6-(((6aS)-3-бром-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-ил) окси)тетрагидро-2H-пиран-3,4,5-триил-триацетата
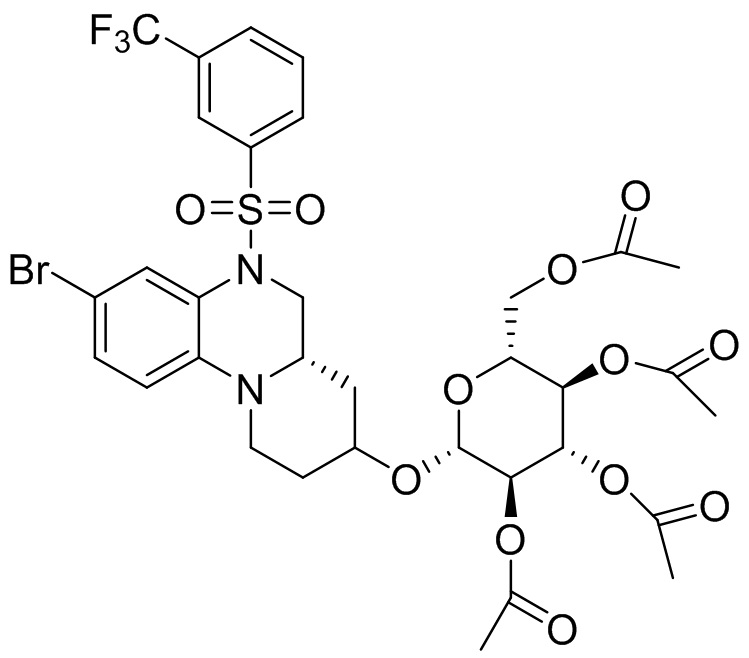
(2R,3R,4S,5R)-2-(ацетоксиметил)-6-гидрокситетрагидро-2H-пиран-3,4,5-триилтриацетат (2R,3R,4S,5R)-2-(ацетоксиметил)-6-(2,2,2-трихлор-1-иминоэтокси)тетрагидро-2H-пиран-3,4,5-триилтриацетат (390 мг, 0,79 ммоль) растворяли в дихлорметане, TMSOTF (176 мг, 0,79 ммоль) и (6aS)-3-бром-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-оле (387 мг, 0,79 ммоль). Реакцию в растворе смеси проводили при температуре 25°C в течение 6 ч, а затем концентрировали для удаления растворителя. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля с получением (2R,3R,4S,5R,6R)-2-ацетоксиметил)-6-(((6aS)-3-бром-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-а]хиноксалин-8-ил)окси)тетрагидро-2H-пиран-3,4,5-триил-триацетата (250 мг, выход: 38,5%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 821, 823 [M+H]+.
Этап 3. Синтез (2R,3R,4S,5R,6R)-2-(ацетоксиметил)-6-(((6aS)-3-(3-(дифторметокси)-5- фторфенил)-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-ил)окси)тетрагидро-2H-пиран-3,4,5-триил-триацетата
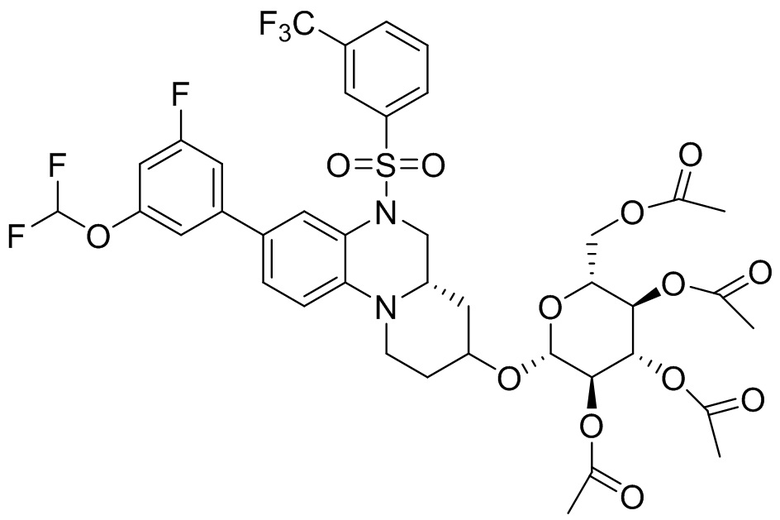
(2R,3R,4S,5R,6R)-2-(ацетоксиметил)-6-(((6aS)-3-бром-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-ил)окси)тетрагидро-2H-пиран-3,4,5-триилтриацетат (250 мг, 0,3 ммоль) растворяли в смеси растворителей 1,4-диоксана (4 мл) и воды (2 мл). Добавляли 2-(3-(дифторметокси)-5-фторфенил)-4,4,5,5-тетраметил-1, 3,2-диоксаборолан (87 мг, 0,3 ммоль), [1,1'-бис(дифенилфосфино)ферроцен]палладий хлорид (29 мг, 0,04 ммоль) и карбонат калия (105 мг, 0,75 ммоль). Раствор смеси помещали в трехгорлую колбу. Трижды вводили азот для замещения воздуха путем откачки. Раствор смеси нагревали до 60°C в течение 2 ч. После завершения реакции растворитель удаляли путем концентрирования. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля с получением (2R,3R,4S,5R,6R)-2-(ацетоксиметил)-6-(((6aS)-3-(3-(дифторметокси)-5-фторфенил)-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-ил)окси)тетрагидро-2H-пиран-3,4,5-триил-триацетата (60 мг, выход: 22,2%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 903 [M+H]+.
Этап 4. Синтез (2R,3R,4S,5S,6R)-2-(((6aS)-3-(3-(дифторметокси)-5-фторфенил)-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-ил)окси)-6- (гидроксиметил)тетрагидро-2H-пиран-3,4,5-триола
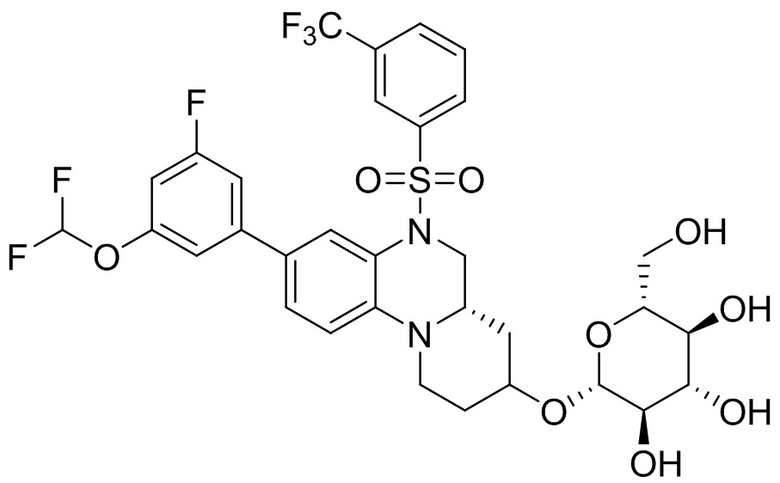
(2R,3R,4S,5R,6R)-2-(ацетоксиметил)-6-(((6aS)-3-(3-(дифторметокси)-5-фторфенил)-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a] хиноксалин- 8-ил)окси)тетрагидро-2H-пиран-3,4,5-триил-триацетат (60 мг, 0,066 ммоль) растворяли в метаноле (5 мл). Добавляли метоксид натрия (11 мг, 0,2 ммоль). Реакцию в растворе смеси проводили при температуре 25°C в течение 1 ч; после завершения реакции по каплям добавляли соляную кислоту, чтобы довести pH до ~7,0, а растворитель удаляли путем концентрирования. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля с получением (2R,3R,4S,5S,6R)-2-(((6aS)-3-(3-(дифторметокси)-5-фторфенил)-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-ил)окси)-6-(гидроксиметил)тетрагидро-2H-пиран-3,4,5-триола (13,2 мг, выход: 27,2%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 735,2 [M+1]+.
1H ЯМР (500 МГц, ДМСО-d6) δ 8,09 (d, J=7,9 Гц, 1H), 7,97 (d, J=8,0 Гц, 1H), 7,86 (t, J=7,9 Гц, 1H), 7,72-7,64 (m, 1H), 7,60 (d, J=6,3 Гц, 1H), 7,53 (dd, J=8,7, 2,3 Гц, 1H), 7,41 (d, J=6,7 Гц, 1H), 7,30 (dd, J=11,6, 9,5 Гц, 1H), 7,21 (s, 1H), 7,04 (dd, J=12,3, 9,1 Гц, 2H), 4,90 (dd, J=8,3, 4,9 Гц, 3H), 4,44 (dt, J=11,7, 5,9 Гц, 1H), 4,31-4,17 (m, 2H), 3,89 (d, J=13,0 Гц, 1H), 3,68 (dd, J=11,5, 5,8 Гц, 1H), 3,57-3,41 (m, 2H), 2,89 (s, 1H), 3,1(m, 4H), 2,52-2,43(d, 1H), 2,02 (dt, J=29,3, 14,8 Гц, 3H), 1,31-1,10 (m, 1H), 1,03 (q, J=11,6 Гц, 1H).
Пример 113. Получение 3-(((6aS,8R)-3-(3-(дифторметокси)-5-фторфенил)-8-метил-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-ил)окси)пропановой кислоты
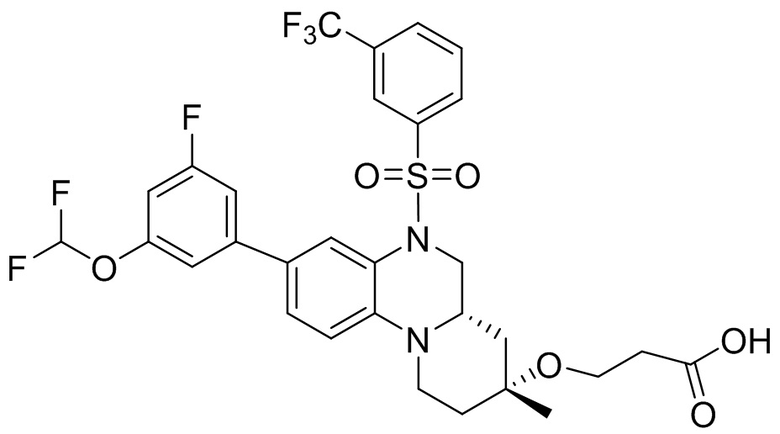
Этап 1. Синтез трет-бутил-3-(((6aS,8R)-3-бром-8-метил-5-((3-(трифторметил) фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a] хиноксалин-8-ил)окси) пропаноата

(6aS,8R)-3-бром-8-метил-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-а]хиноксалин-8-ол (40 мг, 0,13 ммоль) растворяли в толуоле (5 мл). Добавляли гидроксид калия (4 мг, 0,06 ммоль) и трет-бутилакрилат (166 мг, 1,3 ммоль). Раствор смеси перемешивали при температуре 110°C в течение 24 ч. Реакционную смесь охлаждали, а затем разбавляли 15 мл этилацетата, промывали водой (15 мл × 3), сушили над безводным сульфатом натрия, фильтровали и концентрировали для удаления растворителя. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля с получением трет-бутил 3-(((6aS,8R)-3-бром-8-метил-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-ил)окси)пропаноата (25 мг, выход: 30,3%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 633, 635 [M+H]+.
Этап 2. Синтез трет-бутил 3-(((6aS,8R)-3-(3-(дифторметокси)-5-фторфенил)-8-метил-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-ил)окси)пропаноата
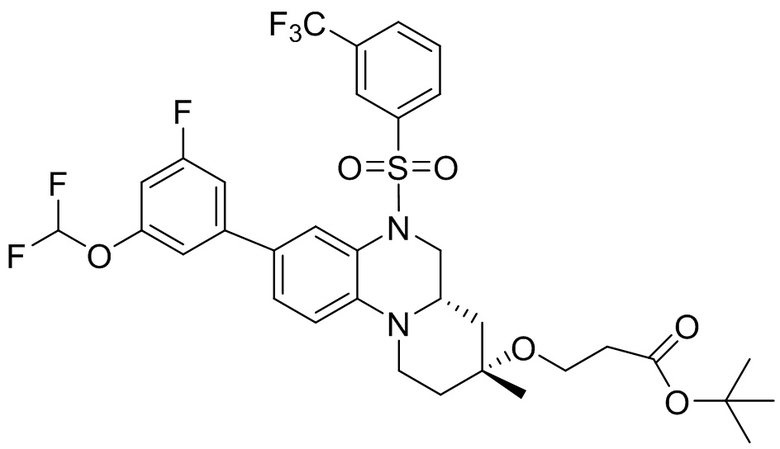
Трет-бутил 3-(((6aS,8R)-3-бром-8-метил-5-((3-(трифторметил)фенил)сульфонил)-6,6a, 7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-ил)окси)пропаноат (25 мг, 0,039 ммоль), [1,1'-бис(дифенилфосфино)ферроцен]палладий хлорид (22 мг, 0,03 ммоль), карбонат калия (14 мг, 0,1 ммоль) и 2-(3-(дифторметокси)-5-фторфенил)-4,4,5,5-тетраметил-1,3-диоксалан (12 мг, 0,039 ммоль) помещали в трехгорлую колбу. Добавляли 1,4-диоксан (4 мл) и воду (2 мл). Трижды вводили азот для замещения воздуха путем откачки. Раствор смеси нагревали до 60°C в течение 2 ч. После завершения реакции растворитель удаляли путем концентрирования. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля, а затем - с помощью обращенно-фазовой колоночной хроматографии с получением трет-бутил 3-(((6aS,8R)-3-(3-(дифторметокси)-5-фторфенил)-8-метил-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-ил)окси)пропаноата (27,8 мг, выход: 100%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 715 [M+H]+.
Этап 3. Синтез 3-(((6aS,8R)-3-(3-(дифторметокси)-5-фторфенил)-8-метил-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-ил)окси)пропановой кислоты
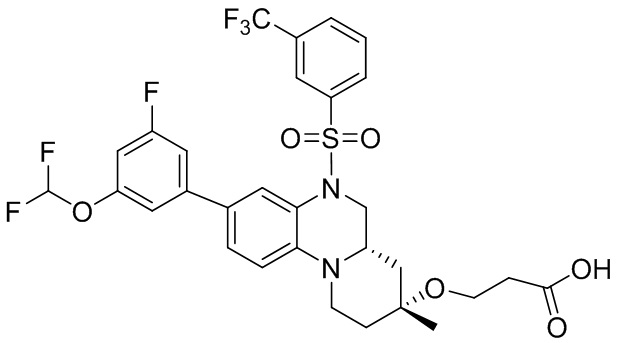
Трет-бутил 3-(((6aR)-3-(3-(дифторметокси)-5-фторфенил)-5-((3-(трифторметил)фенил) сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8)окси)пропаноат (27,8 мг, 0,039 ммоль) растворяли в дихлорметане (3 мл). К раствору добавляли трифторуксусную кислоту (3 мл). Раствор смеси перемешивали при температуре 25°C в течение 1 ч и концентрировали для удаления растворителя. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля с получением 3-(((6aS,8R)-3-(3-(дифторметокси)-5-фторфенил)-8-метил-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-ил)окси)пропановой кислоты (5,5 мг, выход: 21,4%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 659,5 [M+1]+.
1H ЯМР (500 МГц, CDCl3) δ 7,86-7,77 (m, 3H), 7,65 (d, J=7,9 Гц, 1H), 7,58 (t, J=7,8 Гц, 1H), 7,34 (dd, J=8,6, 2,3 Гц, 1H), 7,14 (dd, J=9,6, 1,9 Гц, 1H), 7,11 (s, 1H), 6,80 (d, J=8,7 Гц, 2H), 6,75-6,38 (t, J=73,4 Гц, 1H), 4,22 (dd, J=14,4, 4,0 Гц, 1H), 3,69 (s, 1H), 3,64 (t, J=6,3 Гц, 2H), 3,23 (dd, J=14,4, 10,4 Гц, 1H), 2,56 (t, J=6,1 Гц, 2H), 2,44-2,36 (m, 1H), 2,26-2,18 (m, 1H), 1,61 (s, 3H), 1,25 (t, J=12,1 Гц, 1H), 1,03 (s, 3H).
Пример 114 получали методом синтеза, указанным в примере 113.
1H ЯМР (500 МГц, CDCl3) δ 7,85-7,75 (m, 3H), 7,70 (s, 1H), 7,61 (t, J=7,8 Гц, 1H), 7,32 (dd, J=8,6, 2,3 Гц, 1H), 7,12 (dt, J=9,6, 1,9 Гц, 1H), 7,09 (s, 1H), 6,78 (d, J=8,9 Гц, 2H), 6,74-6,37 (t, 1H), 4,18 (dd, J=14,2, 4,3 Гц, 1H), 3,51 (t, J=6,2 Гц, 2H), 3,49-3,39 (m, 1H), 3,26 (dd, J=14,2, 10,2 Гц, 1H), 2,82 (s, 1H), 2,50 (t, J=6,0 Гц, 3H), 1,81 (dd, J=13,9, 2,9 Гц, 1H), 1,73 (dt, J=13,3, 2,7 Гц, 1H), 1,36 (td, J=13,4, 4,7 Гц, 1H), 1,15 (s, 3H), 1,04 (dd, J=13,4, 11,6 Гц, 1H).
Пример 115 получали методом синтеза, указанным в примере 109.
1H ЯМР (400 МГц, CDCl3) δ 7,82-7,74 (m, 3H), 7,71 (s, 1H), 7,60 (t, J=7,9 Гц, 1H), 7,32 (dd, J=8,7, 2,3 Гц, 1H), 7,13 (dt, J=9,8, 1,9 Гц, 1H), 7,09 (d, J=2,0 Гц, 1H), 6,78 (dd, J=9,1, 2,1 Гц, 2H), 6,74-6,38 (t, J=73,5 Гц, 1H), 4,19 (dd, J=14,3, 4,3 Гц, 1H), 3,74-3,57 (m, 3H), 3,43 (d, J=10,5 Гц, 1H), 3,25 (dd, J=14,3, 10,5 Гц, 1H), 2,83 (t, J=10,9 Гц, 1H), 2,58 (t, J=6,0 Гц, 2H), 2,51-2,44 (m, 1H), 1,89-1,77 (m, 2H), 1,55 (t, J=13,8 Гц, 1H), 1,27-1,17 (m, 1H).
Пример 116. Получение (6aS,8S)-3-(3-(дифторметокси)-5-фторфенил)-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-карбоновой кислоты
Этап 1. Синтез (6aS, 8S)-3-бром-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10- гексагидро-5H-пиридо[1,2-a]хиноксалин-8-карбонитрила
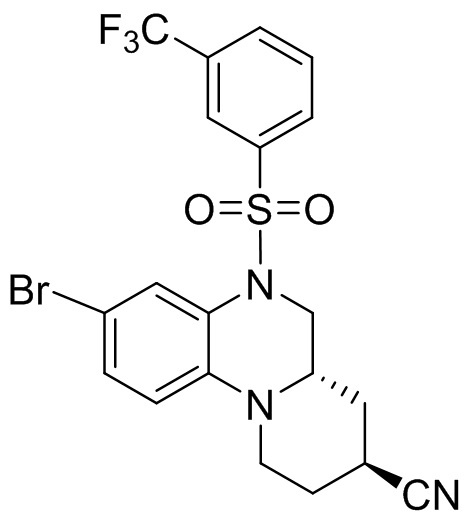
(S)-3-бром-5-((3-(трифторметил)фенил)сульфонил)-6a,7,9,10-тетрагидро-5H-пиридо[1,2-a]хиноксалин-8(6H)-он (100 мг, 0,2 ммоль) растворяли в тетрагидрофуране (10 мл). Добавляли трет-бутоксид калия (25 мг, 0,22 ммоль) и раствор смеси перемешивали при температуре 25°C в течение 30 мин, затем добавляли 1-((изоцианометил) сульфонил)-4-метилбензол (43 мг, 0,22 ммоль) и раствор смеси перемешивали при температуре 25°C в течение 16 ч. Реакционную смесь разбавляли 15 мл этилацетата, промывали солевым раствором (15 мл × 3), сушили над безводным сульфатом натрия, фильтровали и концентрировали для удаления растворителя. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля с получением (6aS,8S)-3-бром-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-карбонитрила (35 мг, выход: 35%), который без дополнительной обработки использовали на следующем этапе.
Этап 2. Синтез (6aS,8S)-3-бром-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-карбоновой кислоты
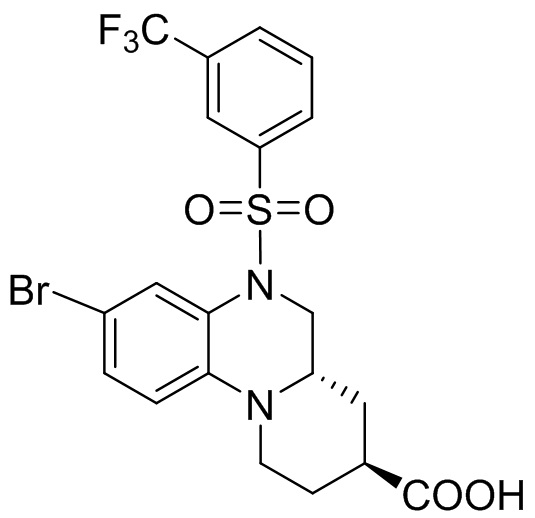
(6aS,8S)-3-бром-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-карбонитрил (35 мг, 0,07 ммоль) растворяли в метаноле (10 мл). Тионилхлорид (25 мг, 0,22 ммоль) добавляли на ледяной бане. Раствор смеси нагревали до температуры 65°C и перемешивали в течение 16 ч, а затем концентрировали для удаления растворителя. К остатку добавляли 2M водный раствор гидроксида калия (15 мл), перемешивали при температуре 80°C в течение 4 ч, охлаждали до комнатной температуры, для доведения pH до 6 добавляли водный раствор HCl, экстрагировали этилацетатом, промывали солевым раствором (15 мл × 3), сушили над безводным сульфатом натрия, фильтровали и концентрировали для удаления растворителя. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля с получением (6aS,8S)-3-бром-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-карбоновой кислоты (30 мг, выход: 82,5%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 519, 521 [M+H]+.
Этап 3. Синтез (6aS, 8S)-3-(3-(дифторметокси)-5-фторфенил)-5-((3-(трифторметил) фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-карбоновой кислоты

(6aS,8S)-3-бром-5-((3-(трифторметил)фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-карбоновую кислоту (30 мг, 0,057 ммоль), [1,1'-бис (дифенилфосфино)ферроцен]палладия хлорид (22 мг, 0,03 ммоль), карбонат калия (20 мг, 0,14 ммоль) и 2-(3-(дифторметокси)-5-фторфенил)-4,4,5,5-тетраметил-1,3-диоксалан (17 мг, 0,057 ммоль) помещали в трехгорлую колбу. Добавляли 1,4-диоксан (4 мл) и воду (2 мл). Трижды вводили азот для замещения воздуха путем откачки. Раствор смеси нагревали до 60°C в течение 2 ч. После завершения реакции растворитель удаляли путем концентрирования. Остаток вначале отделяли с помощью быстрой хроматографии на колонке силикагеля, а затем - с помощью обращенно-фазовой колоночной хроматографии с получением (6aS,8S)-3-(3-дифторметокси)-5-фторфенил)-5-((3-(трифторметил) фенил)сульфонил)-6,6a,7,8,9,10-гексагидро-5H-пиридо[1,2-a]хиноксалин-8-карбоновой кислоты (15 мг, выход: 43,8%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 599,4 [M-1]+.
1H ЯМР (500 МГц, ДМСО-d6) δ 8,08 (d, J=7,7 Гц, 1H), 7,92 (d, J=8,0 Гц, 1H), 7,84 (t, J=7,8 Гц, 1H), 7,71 (d, J=2,3 Гц, 1H), 7,64 (s, 1H), 7,59-7,22 (t,1H), 7,53 (dd, J=8,8, 2,4 Гц, 1H), 7,32 (dt, J=10,2, 1,8 Гц, 1H), 7,22 (d, J=2,8 Гц, 1H), 7,05 (dt, J=9,6, 2,3 Гц, 1H), 6,99 (d, J=8,9 Гц, 1H), 4,26 (dd, J=14,5, 4,5 Гц, 1H), 3,85 (d, J=12,6 Гц, 1H), 2,36 (s, 2H), 2,11-1,95 (m, 2H), 1,83 (dd, J=26,3, 13,3 Гц, 2H), 1,39-1,22 (m, 1H), 1,03 (q, J=12,1 Гц, 1H).
Пример 117 получали методом синтеза, указанным в примере 116.
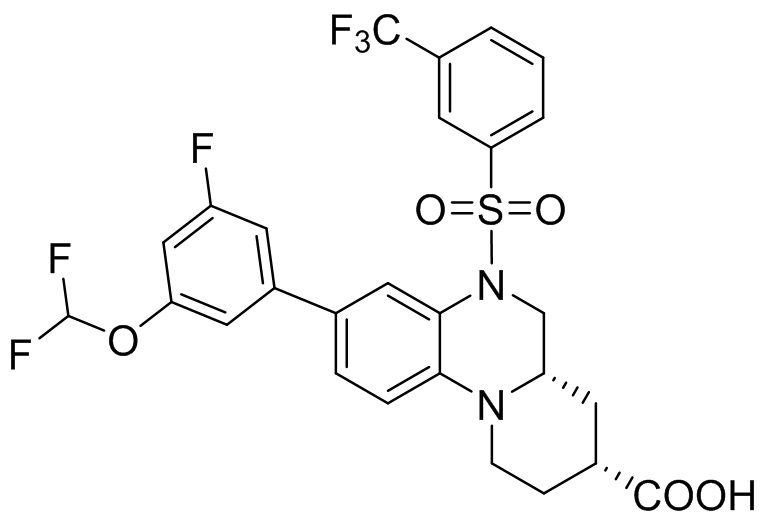
1H ЯМР (400 МГц, ДМСО-d6) δ 8,08 (d, J=7,7 Гц, 1H), 7,92 (d, J=8,0 Гц, 1H), 7,84 (t, J=7,8 Гц, 1H), 7,71 (d, J=2,3 Гц, 1H), 7,64 (s, 1H), 7,59-7,22(t, 1H), 7,53 (dd, J=8,8, 2,4 Гц, 1H), 7,32 (dt, J=10,2, 1,8 Гц, 1H), 7,22 (d, J=2,8 Гц, 1H), 7,05 (dt, J=9,6, 2,3 Гц, 1H), 6,99 (d, J=8,9 Гц, 1H), 4,26 (dd, J=14,5, 4,5 Гц, 1H), 3,85 (d, J=12,6 Гц, 1H), 2,36 (s, 2H), 2,11-1,95 (m, 2H), 1,83 (dd, J=26,3, 13,3 Гц, 2H), 1,39-1,22 (m, 1H), 1,03 (q, J=12,1 Гц, 1H).
Пример 118. Получение (S)-3-(1-метил-6-(2,2,6,6-тетраметил-3,6-дигидро-2H-пиран-4-ил)-4-((3-(трифторметил)фенил)сульфонил)-1,2,3,4-тетрагидрохиноксалин-2-ил)пропановой кислоты
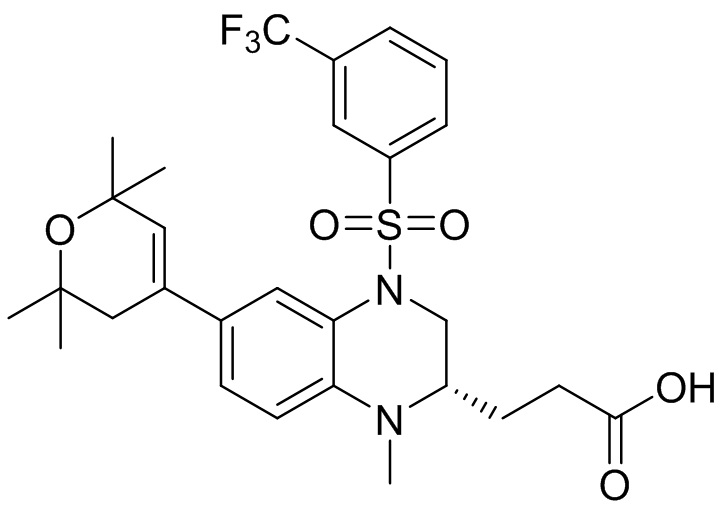
Этап 1. Синтез метил (S)-3-(1-метил-6-(2,2,6,6-тетраметил-3,6-дигидро-2H-пиран-4-ил)-4-((3-(трифторметил)фенил)сульфонил)-1,2,3,4-тетрагидрохиноксалин-2-ил)пропаноата
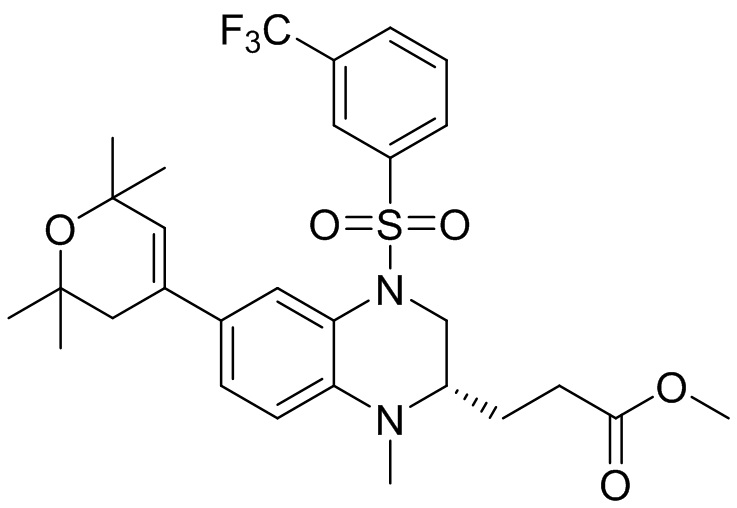
Метил (S)-3-(6-бром-1-метил-4-((3-(трифторметил)фенил)сульфонил)-1,2,3,4-тетрагидрохиноксалин-2-ил)пропаноат (160 мг, 0,307 ммоль) растворяли в смеси растворителей толуол : этанол : вода = 2:1:1 (12 мл). Карбонат натрия (50 мг, 0,460 ммоль), 4,4,5,5-тетраметил-2-(2,2,6,6-тетраметил-3,6-дигидро-2H-пиран-4-ил)-1,3,2-диоксаборолан (123 мг, 0,460 ммоль) и тетракис(трифенилфосфин)палладий (50 мг) добавляли в атмосфере азота, раствор смеси нагревали до температуры 80°C и перемешивали в течение 5 ч, затем охлаждали и дважды экстрагировали раствор смеси: водой и этилацетатом. Органические фазы сушили над безводным сульфатом натрия, фильтровали и концентрировали для удаления растворителя. Неочищенный продукт отделяли с помощью быстрой хроматографии на колонке силикагеля с получением метил (S)-3-(1-метил-6-(2,2,6,6-тетраметил-3,6-дигидро-2H-пиран-4-ил)-4-((3-(трифторметил)фенил)сульфонил)-1,2,3,4-тетрагидрохиноксалин-2-ил)пропаноата (85 мг, 48%).
Этап 2. Синтез (S)-3-(1-метил-6-(2,2,6,6-тетраметил-3,6-дигидро-2H-пиран-4-ил)-4-((3-(трифторметил)фенил)сульфонил)-1,2,3,4-тетрагидрохиноксалин-2-ил)пропановой кислоты

Метил (S)-3-(1-метил-6-(2,2,6,6-тетраметил-3,6-дигидро-2H-пиран-4-ил)-4-((3-(трифторметил)фенил)сульфонил)-1,2,3,4-тетрагидрохиноксалин-2-ил)пропаноат (85 мг, 0,146 ммоль) растворяли в смеси растворителей тетрагидрофуран : метанол : вода = 1:1:1 (10 мл). Добавляли литий гидроксид моногидрат (31 мг). Раствор смеси перемешивали в течение ночи при комнатной температуре. Для удаления растворителя реакционную смесь концентрировали и подкисляли разбавленной соляной кислотой. Остаток отделяли с помощью быстрой хроматографии на колонке силикагеля с получением (S)-3-(1-метил-6-(2,2,6,6-тетраметил-3,6-дигидро-2H-пиран-4-ил)-4-((3-(трифторметил)фенил)сульфонил)-1,2,3,4-тетрагидрохиноксалин-2-ил)пропановой кислоты (45 мг, 54%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 567,6 [M+H]+.
1H ЯМР (500 МГц, ДМСО-d6) δ 8,41 (s, 1H), 8,13 (dd, J=16,5, 7,9 Гц, 2H), 7,90 (dd, J=17,1, 9,2 Гц,2H), 7,11 (dd, J=8,6, 2,2 Гц, 1H), 7,05 (d, J=2,1 Гц, 1H), 6,60 (d, J=8,8 Гц, 1H), 5,80 (d, J=1,5 Гц,1H), 4,00 (dd, J=13,6, 5,3 Гц, 1H), 3,70 (dd, J=13,6, 4,0 Гц, 1H), 3,26 (d, J=9,0 Гц, 1H), 2,71 (s, 3H), 2,23 (dt, J=14,3, 8,3 Гц, 2H), 2,15-2,03 (m, 2H), 1,82 (d, J=7,7 Гц, 1H), 1,60-1,51 (m, 1H), 1,21 (d, J=4,3 Гц, 6H), 1,17 (s, 6H).
Пример 119. Получение (S)-3-(1-метил-6-(2,2,6,6-тетраметилтетрагидро-2H-пиран-4-ил)-4-((3-(трифторметил)фенил)сульфонил)-1,2,3,4-тетрагидрохиноксалин-2-ил)пропановой кислоты
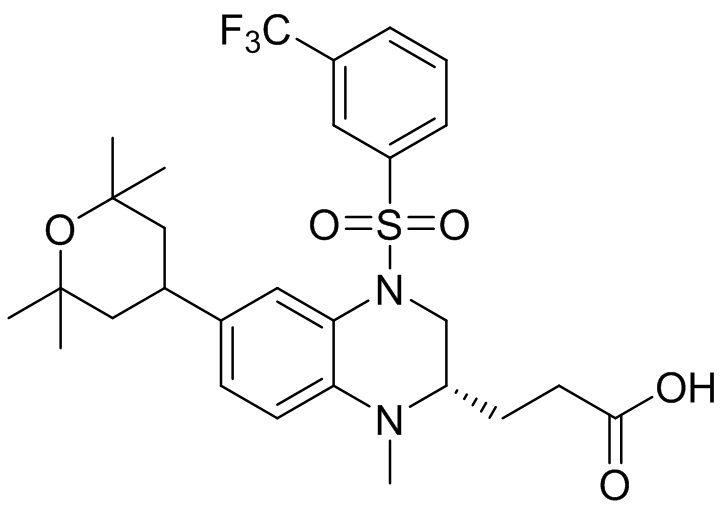
(S)-3-(1-метил-6-(2,2,6,6-тетраметил-3,6-дигидро-2H-пиран-4-ил)-4-((3-(трифторметил)фенил)сульфонил)-1,2,3,4-тетрагидрохиноксалин-2-ил)пропановую кислоту (30 мг, 0,053 ммоль) растворяли в метаноле (10 мл) и добавляли 10%-ный влажный палладий на угле (10 мг). Реакционную смесь перемешивали в течение ночи при комнатной температуре в атмосфере водорода. Реакционную смесь фильтровали, концентрировали для удаления растворителя и лиофилизировали с получением (S)-3-(1-метил-6-(2,2,6,6-тетраметилтетрагидро-2H-пиран-4-ил)-4-((3-(трифторметил)фенил)сульфонил)-1,2,3,4-тетрагидрохиноксалин-2-ил)пропановой кислоты (17,3 мг, 57%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 569,5 [M+H]+.
1H ЯМР (500 МГц, ДМСО-d6) δ 8,09 (t, J=8,5 Гц, 2H), 7,87 (t, J=7,8 Гц, 1H), 7,77 (s, 1H), 6,99 (d, J=2,1 Гц, 1H), 6,92 (dd, J=8,5, 2,1 Гц, 1H), 6,53 (d, J=8,5 Гц, 1H), 3,88-3,74(m, 2H), 3,15 (s, 1H), 2,96 -2,87 (m, 1H), 2,59 (s, 3H), 2,24-2,09 (m, 2H), 1,78 (d, J=11,5 Гц, 1H), 1,63-1,44 (m, 3H), 1,26 (s, 6H), 1,18 (dd, J=18,5, 12,8 Гц, 2H), 1,12 (d, J=7,3 Гц, 6H).
Пример 120. Получение (S,E)-3-(6-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-1-метил-4- ((3-(трифторметил)фенил)сульфонил)-1,2,3,4-тетрагидрохиноксалин-2-ил)пропаноата
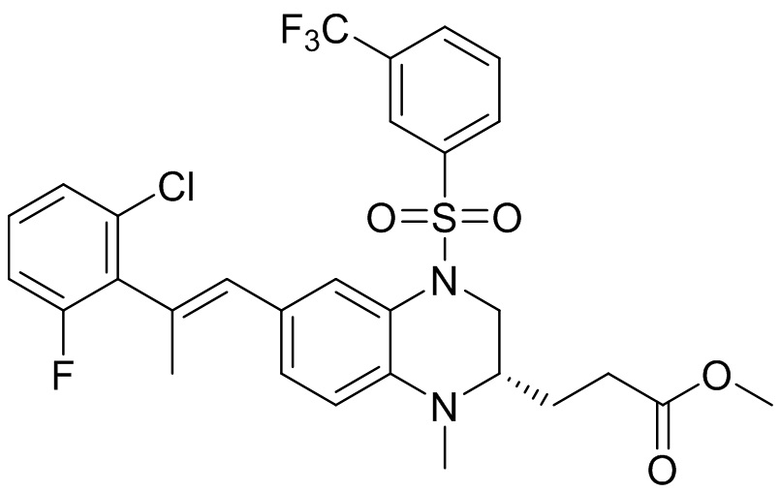
Метил (S)-3-(6-бром-1-метил-4-((3-(трифторметил)фенил)сульфонил)-1,2,3,4-тетрагидрохиноксалин-2-ил)пропаноат (1,4 г, 2,69 ммоль) растворяли в смеси растворителей толуол : этанол : вода = 2:1:1 (30 мл). Добавляли карбонат натрия (286 мг, 2,69 ммоль), (E)-2-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-4,4,5,5-тетраметил-1,3,2- диоксаборолан (1,6 г, 5,38 ммоль) и тетракис(трифенилфосфин)палладий (200 мг). Раствор смеси нагревали до температуры 80°C в атмосфере азота и перемешивали в течение ночи, затем охлаждали и дважды экстрагировали : водой и этилацетатом. Органические фазы сушили над безводным сульфатом натрия, фильтровали и концентрировали для удаления растворителя. Неочищенный продукт отделяли с помощью быстрой хроматографии на колонке силикагеля с получением метил (S,E)-3-(6-(2-(2-хлор-6-фторфенил)проп-1-ен-1-ил)-1-метил-4-((3-(трифторметил)фенил)сульфонил)-1,2,3,4-тетрагидрохиноксалин-2-ил)пропаноата (1,0 г, 61%). Масс-спектрометрия с ионизацией электрораспылением (ESI-MS): 610,7 [M+1]+.
1H ЯМР (500 МГц, CDCl3) δ 7,91 (s, 1H), 7,83 (d, J=8,0 Гц, 1H), 7,74 (d, J=8,0 Гц, 1H), 7,55 (t, J=7,7 Гц, 1H), 7,35 (d, J=2,0 Гц, 1H), 7,16-7,08 (m, 2H), 7,04 (dd, J=8,6, 2,1 Гц, 1H), 6,97-6,91 (m, 1H), 6,52 (d, J=8,5 Гц, 1H), 6,22 (d, J=1,6 Гц, 1H), 3,81 (dd, J=5,3, 2,5 Гц, 2H), 3,63 (s, 3H), 3,19-3,10 (m, 1H), 2,65 (d, J=3,8 Гц, 3H), 2,39-2,21 (m, 2H), 2,05 (d, J=1,5 Гц, 3H), 1,92-1,89 (m, 1H), 1,73-1,66 (m, 1H).
Пример 121 получали методом синтеза, указанным в примере 113.
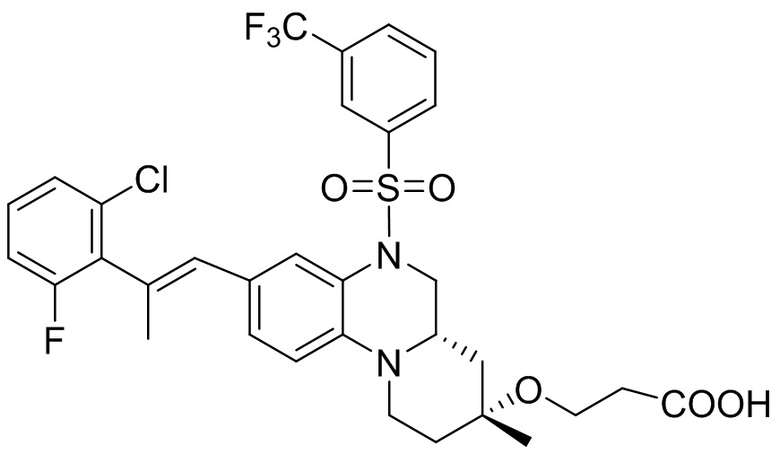
1H ЯМР (400 МГц, CDCl3) δ 7,95-7,88 (s, 1H), 7,85-7,78 (d, J=7,7 Гц, 1H), 7,74-7,70 (d, J=1,9 Гц, 1H), 7,70-7,64 (d, J=7,9 Гц, 1H), 7,62-7,55 (t, J=7,8 Гц, 1H), 7,23-7,20 (m, 1H), 7,20 -7,13 (ddd, J=9,1, 4,9, 2,4 Гц, 2H), 7,06-6,97 (m, 1H), 6,90-6,76 (s, 1H), 6,38-6,32 (d, J=1,7 Гц, 1H), 4,28-4,16 (dd, J=14,4, 3,8 Гц, 1H), 3,69-3,60 (t, J=6,1 Гц, 3H), 3,47-3,29 (s, 1H), 2,65-2,55 (t, J=6,1 Гц, 2H), 2,53-2,26 (d, J=77,6 Гц, 2H), 2,25-2,17 (d, J=1,4 Гц, 3H), 1,75-1,66(m, 3H), 1,38-1,26 (s, 1H), 1,10-1,01 (s, 3H).
Пример 122 получали методом синтеза, указанным в примере 59.
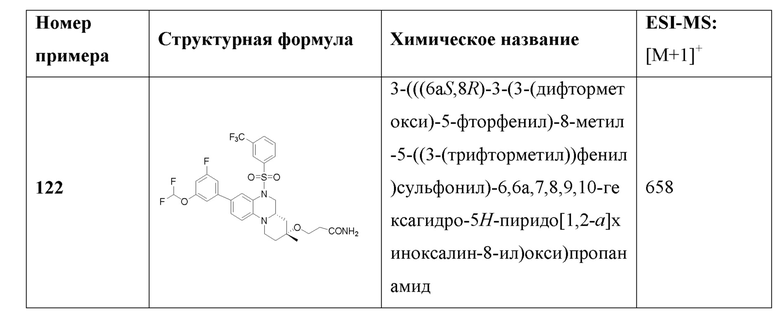
1H ЯМР (400 МГц, ДМСО-d6) δ 8,14-8,07 (d, J=7,9 Гц, 1H), 7,89-7,81 (t, J=7,8 Гц, 1H), 7,81-7,72 (dd, J=8,5, 6,3 Гц, 3H), 7,60-7,23 (t, 1H), 7,58-7,51 (dd, J=8,8, 2,3 Гц, 1H), 7,42-7,38 (s, 0H), 7,38-7,30 (dt, J=10,0, 1,9 Гц, 1H), 7,28-7,17 (m, 2H), 7,09-6,98 (m, 2H), 6,77-6,69 (s, 1H), 4,29-4,18 (m, 1H), 3,88-3,75 (d, J=13,3 Гц, 1H), 3,54-3,45 (t, J=6,6 Гц, 2H),3,3-3,2(m, 1H), 2,24-2,13 (t, J=6,4 Гц, 3H), 2,12-2,00 (dd, J=13,9, 11,0 Гц, 1H), 1,74-1,64 (d, J=12,7 Гц, 1H), 1,64-1,52 (d, J=12,8 Гц, 1H), 1,49-1,36 (dt, J=15,2, 7,5 Гц, 1H), 1,14-1,04 (t, J=12,1 Гц, 1H), 0,94-0,86 (s, 3H).
Оценка в ходе биологического анализа
I. Резонансный перенос энергии флуоресценции с разрешением во времени (TR-FRET)
Настоящий эксперимент представлял собой скрининговый эксперимент для агонистов ядерных рецепторов RORγt на основе технологии TR-FRET. Связывание His-меченного рецептора RORγt-LBD с агонистами рецептора может увеличивать рекрутинг коактиваторных пептидов, меченных биотином. Европий-His-RORγt-LBD опосредованно метится донором (Eu) путем связывания с антителом к Eu-His. После активации Eu источником энергии (например, вспышкой света или лазером) энергия передается коактиватору, опосредованно меченному аллофикоцианином путем связывания аллофикоцианина - стрептавидина и коактиватора, меченного биотином.
1. Готовили 10-кратный (10X) буфер (500 мМ Tris-HCl, 500 мМ KCl и 10 мМ Na-EDTA), pH доводили до 7,0. Буфер хранили при температуре 4°C для последующего использования и перед экспериментом доводили до комнатной температуры.
2. 10X буфер разбавляли чистой водой до 1-кратной (1X) концентрации. Для приготовления буфера для анализа добавляли Тритон X-100 до конечной концентрации 0,01% и ДТТ (дитиотреитол) до конечной концентрации 1 мМ.
3. Для приготовления 1000-кратного (1000X) маточного раствора вещества использовали ДМСО. Раствор вещества серийно разводили 5 раз для получения 7 вариантов концентраций от максимальной концентрации от 1000 нМ до 10 000 нМ. После этого готовили 10-кратный раствор вещества на основе буфера для анализа. В систему объемом 20 мкл вносили аликвоту объемом 2 мкл.
4. 5X раствор белка RORγt-LBD размораживали и готовили раствор с 5-кратной концентрацией на основе буфера для анализа для получения конечной концентрации 30 нМ. Весь процесс осуществляли на льду.
5. 5X раствор пептида SRC размораживали и готовили раствор с 5-кратной концентрацией на основе буфера для анализа для получения конечной концентрации 500 нМ. Весь процесс осуществляли на льду.
6. В лунки для исследуемых образцов 384-луночного планшета вносили по 4 мкл рецептора RORγt-LBD на лунку, а в контрольные лунки вносили такое же количество буфера для анализа без RORγt-LBD.
7. В каждую лунку 384-луночного планшета вносили по 2 мкл вещества.
8. В каждую лунку 384-луночного планшета вносили по 4 мкл пептида SRC.
9. 2X Eu-анти-6X His / APC-стрептавидин разбавляли буфером для детекции Lance до конечной концентрации 0,25 нМ и 5 нМ соответственно, а затем в каждую лунку 384-луночного планшета вносили по 10 мкл 2X Eu-анти-6X His / APC-стрептавидина.
10. Раствор после перемешивания инкубировали при температуре 4°C в течение ночи.
11. Утром следующего дня 384-луночный планшет инкубировали при комнатной температуре в течение 1 ч. Затем соответствующие значения сигналов считывали с помощью планшетного анализатора PerkinElmer EnVision при длине волны 665/615 нМ. Агонистическую активность соответствующего вещества рассчитывали с помощью программного обеспечения Graphpad Prism 7.0. Результаты конкретных экспериментов приведены в таблице 1.
II. Анализ для обнаружения репортерного гена RORγt в клетках
В ходе этого эксперимента метод обнаружения репортерного гена RORγt использовали для оценки способности различных соединений активировать и специфически взаимодействовать с RORγt в клетках. Плазмиды pFN26A-RORγt-LBD и pGl4.35 (Promega, № по каталогу E1370) использовали для котрансфекции клеток HEK 293 (№ по каталогу GNHu18). Эффективность различных соединений оценивали в присутствии антагониста урсоловой кислоты (Selleck, № по каталогу S2370-100 мг). Подробное описание эксперимента приведено ниже.
1. Клетки, котрансфицированные плазмидами, инокулировали в 96-луночный планшет (Corning, № по каталогу 3610) в свежей среде DMEM (Gibco, № по каталогу 1773536), содержащей 10%-ную эмбриональную телячью сыворотку (Gibco, № по каталогу 10099-141), в количестве 30000 клеток / 40 мкл / лунку.
2. Добавляли 5 мкл среды, содержащей урсоловую кислоту в концентрации 20 мкМ.
3. Эффект дозы оценивали посредством 4-кратного разведения исследуемого вещества, начиная с 50 мкМ.
4. Добавляли 5 мкл среды, содержащей вещество с концентрацией, в 10 раз превышавшей его конечную исследуемую концентрацию.
5. После инкубации клеток при температуре 37°C и 5% CO2 в течение 24 ч добавляли 50 мкл проявляющего реагента для обнаружения флуоресценции люциферазы светлячков с помощью планшетного анализатора PerkinElmer EnVision; также добавляли 50 мкл второго проявляющего реагента для обнаружения флуоресценции белка из организма Renilla reniformis.
6. Для определения концентрации, требующейся для активации рецептора на 50% (EC50), а также верхнего предела активации (Amax), для каждого вещества использовали четырехпараметрическую кривую, смоделированную в программе Graphpad Prism. Результаты конкретных экспериментов приведены в таблице 1.
Результаты испытаний
соединения (примера)
2. Вышеуказанные значения являются средними значениями, полученными на основе одного или нескольких измерений.
На основе данных по биохимической и клеточной активности соединений в конкретных примерах можно сделать вывод о том, что некоторые соединения по настоящему изобретению обладают выраженной агонистической активностью и специфичностью в отношении ядерного рецептора RORγt и, как ожидается, послужат основой для разработки агонистов RORγt нового поколения, что позволит удовлетворить потребности медицины.
Все документы, упомянутые в настоящем изобретении, включены в виде ссылок, и каждый документ цитируется индивидуально в виде ссылки. Кроме того, следует понимать, что специалисты в данной области, ознакомившись с вышеизложенными идеями настоящего изобретения, могут внести различные модификации или изменения, и эти эквивалентные формы также входят в объем формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОНДЕНСИРОВАННЫЕ С ГЕТЕРОАРИЛКЕТОНАМИ АЗАДЕКАЛИНЫ - МОДУЛЯТОРЫ ГЛЮКОКОРТИКОИДНЫХ РЕЦЕПТОРОВ | 2013 |
|
RU2639867C2 |
| СОЕДИНЕНИЕ НА ОСНОВЕ СУЛЬТАМА И СПОСОБ ЕГО ПРИМЕНЕНИЯ | 2017 |
|
RU2741915C2 |
| КОНДЕНСИРОВАННЫЕ ТРИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛОВ В КАЧЕСТВЕ МОДУЛЯТОРОВ АКТИВНОСТИ TNF | 2014 |
|
RU2689777C1 |
| ЗАМЕЩЕННЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СУЛЬФОНАМИДНЫЕ СОЕДИНЕНИЯ, ПОЛЕЗНЫЕ В КАЧЕСТВЕ МОДУЛЯТОРОВ TRPA 1 | 2014 |
|
RU2675792C2 |
| ОКТАГИДРО КОНДЕНСИРОВАННЫЕ АЗАДЕКАЛИНОВЫЕ МОДУЛЯТОРЫ ГЛЮКОКОРТИКОИДНОГО РЕЦЕПТОРА | 2014 |
|
RU2674983C1 |
| КОНДЕНСИРОВАННЫЕ ТРИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ ИМИДАЗОЛА В КАЧЕСТВЕ МОДУЛЯТОРОВ АКТИВНОСТИ TNF | 2014 |
|
RU2679914C9 |
| ПРОИЗВОДНОЕ N-(АЗААРИЛ)ЦИКЛОЛАКТАМ-1-КАРБОКСАМИДА, МЕТОД ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ | 2018 |
|
RU2765785C2 |
| МОДУЛЯТОРЫ МОНОАЦИЛГЛИЦЕРИНЛИПАЗЫ | 2019 |
|
RU2797323C2 |
| ДИАЗАБЕНЗОФТОРАНТРЕНОВЫЕ СОЕДИНЕНИЯ | 2016 |
|
RU2697513C2 |
| ЗАМЕЩЕННОЕ ГЕТЕРОЦИКЛИЧЕСКОЕ КОНДЕНСИРОВАННОЕ ЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2020 |
|
RU2815814C1 |
Группа изобретений относится к соединению формулы (IIb), его стереоизомеру или фармацевтически приемлемой соли
 также относится к способу получения соединения формулы (IIb), его стереоизомера или фармацевтически приемлемой соли, также относится к применению соединения формулы (IIb), его стереоизомера или фармацевтически приемлемой соли для изготовления препаратов для лечения одного или нескольких видов опухолей, злокачественных новообразований, метаболических заболеваний, аутоиммунных заболеваний или нарушений, ассоциированных с RORγt. Группа изобретений обеспечивает разработку низкомолекулярного агониста RORγt, имеющего структуру формулы (IIb). 4 н. и 8 з.п. ф-лы, 1 табл., 122 пр.
также относится к способу получения соединения формулы (IIb), его стереоизомера или фармацевтически приемлемой соли, также относится к применению соединения формулы (IIb), его стереоизомера или фармацевтически приемлемой соли для изготовления препаратов для лечения одного или нескольких видов опухолей, злокачественных новообразований, метаболических заболеваний, аутоиммунных заболеваний или нарушений, ассоциированных с RORγt. Группа изобретений обеспечивает разработку низкомолекулярного агониста RORγt, имеющего структуру формулы (IIb). 4 н. и 8 з.п. ф-лы, 1 табл., 122 пр.
1. Соединение формулы (IIb), его стереоизомер или фармацевтически приемлемая соль:

где L представляет собой связь или -C(R7)=C(R8)-;
Z выбран из группы, состоящей из связи, -O-, -S-, -S(O)-, -S(O)2-, -N(R33)- и -(CR35R36)-;
цикл A, вместе с -(R1)m, образует следующую структуру:
 или
или ;
;
где каждый R1 выбирается независимо из C1-4 алкила и -O-R29, вышеуказанные группы не замещены или замещены тремя фторами;
цикл B представляет собой  где Y представляет собой -O-;
где Y представляет собой -O-;
R2 представляет собой водород;
каждый R5 независимо выбран из галогена, циано, C1-10 алкила и -C0-8-O-R29, вышеуказанные группы не замещены или замещены тремя галогенами,
R6 представляет собой водород;
R7 и R8 каждый независимо выбраны из водорода и C1-4 алкила,
R33 выбран группы, состоящей из водорода, C1-4 алкила, C3-6 циклоалкила, оксетана, -C0-4-S(O)rR28, -C0-4-O-R29, -C0-4-C(O)OR29, -C0-4-C(O)R30, -C0-4-C(S)R30 и -C0-4-C(O)NR31R32, вышеуказанные группы не замещены или замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из циано, =O, -C0-4-O-R29, -C0-4-O-C(O)R30 и -C0-4-C(O)NR31R32;
каждый R34 представляет собой водород;
R35 выбран из группы, состоящей из галогена, -C0-4-O-R29, -C0-4-C(O)OR29 и -C0-4-O-C(O)R30, вышеуказанные группы не замещены или замещены одним или несколькими дополнительными заместителями, выбранными из группы, состоящей из -C0-4-S(O)rR28, -C0-4-O-R29, -C0-4-C(O)OR29 и -C0-4-C(O)NR31R32;
R36 представляет собой водород или C1-4 алкил;
каждый R28 независимо представляет собой C1-4 алкил или -NR31R32;
каждый R29 независимо выбран из водорода, C1-4 алкила и 6-членного гетероциклила, вышеуказанные группы не замещены или замещены одним или несколькими дополнительными заместителями, выбранными из галогена и гидрокси;
каждый R30 независимо выбран из C1-4 алкила, C1-4 алкокси и -NR31R32, вышеуказанные группы не замещены или замещены одной циано группой;
каждый R31 и каждый R32 независимо представляет собой водород;
p представляет собой целое число от 0 до 5
q представляет собой целое число от 0 до 4;
каждый r независимо принимает значения 2;
когда нет специального определения, гетероатом «гетероциклила» в упомянутых выше заместителях представляет собой 1 атом кислорода.
2. Соединение формулы (IIb), его стереоизомер или фармацевтически приемлемая соль по п. 1, где соединение формулы (IIb) представляет собой соединение с формулой (IIIb1), формулой (IIIb2), формулой (IIIb3), формулой (IIIb4) или формулой (IIIb5) как описано ниже:
или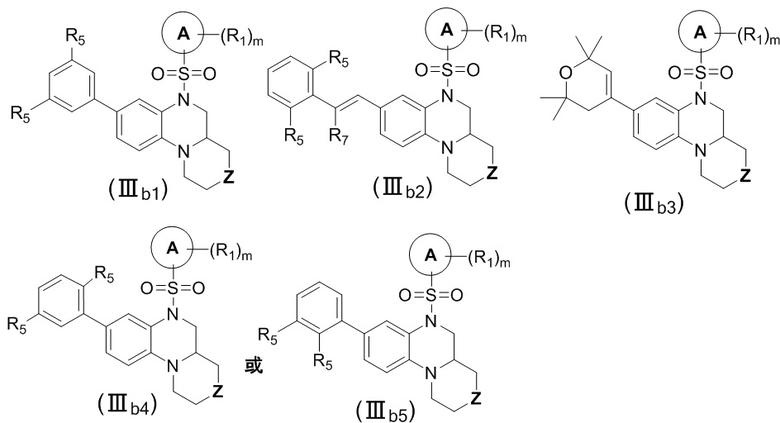 ,
,
где Z выбран из группы, состоящей из связи, -O-, -S-, -S(O)-, -S(O)2-, -N(R33)- и -(CR35R36)-;
каждый R5 независимо выбран из группы, состоящей из галогена, циано, C1-4 алкила и -O-R29, вышеуказанные группы не замещены или замещены тремя дополнительными заместителями, выбранными из группы, состоящей из фтора и хлора;
R7 выбран из группы, состоящей из водорода, метила и этила;
R33 выбран группы, состоящей из водорода, C1-4 алкила, C3-6 циклоалкила, оксетана, -C0-4-S(O)rR28, -C0-4-O-R29, -C0-4-C(O)OR29, -C0-4-C(O)R30, -C0-4-C(S)R30 и -C0-4-C(O)NR31R32, вышеуказанные группы не замещены или замещены одним или несколькими дополнительными заместителями, выбранными из циано, =O, -C0-4-O-R29, -C0-4-O-C(O)R30 и -C0-4-C(O)NR31R32;
R35 выбран группы, состоящей из галогена, -O-R29, -C(O)OR29 и -O-C(O)R30, вышеуказанные группы не замещены или замещены одним или несколькими дополнительными заместителями, выбранными из -S(O)rR28, -C0-4-O-R29, -C(O)OR29 и -C(O)NR31R32;
R36 представляет собой водород;
цикл A, R1, R28, R29, R30, R31, R32, r и m соответствуют определениям в п. 1.
3. Соединение формулы (IIb), его стереоизомер или фармацевтически приемлемая соль по любому из пп. 1 или 2, где соединение выбрано из следующих соединений:
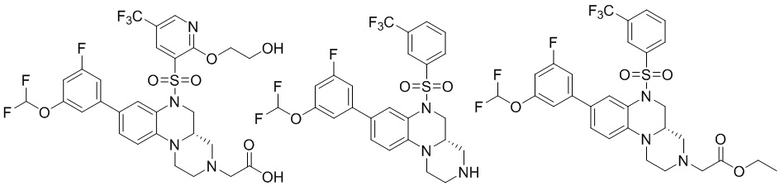
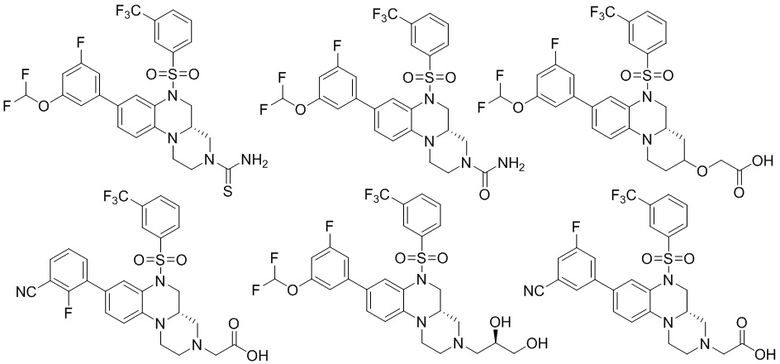
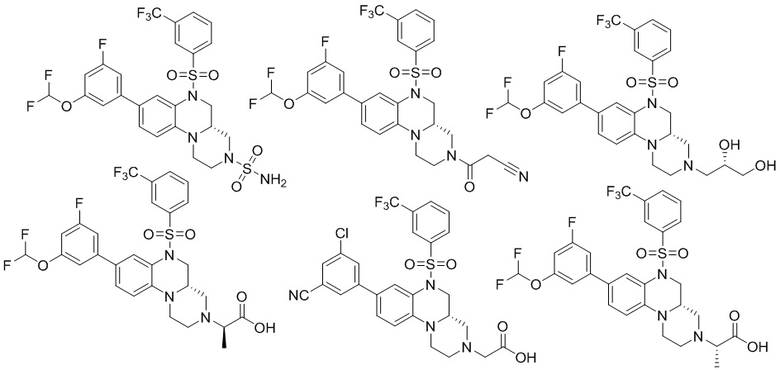
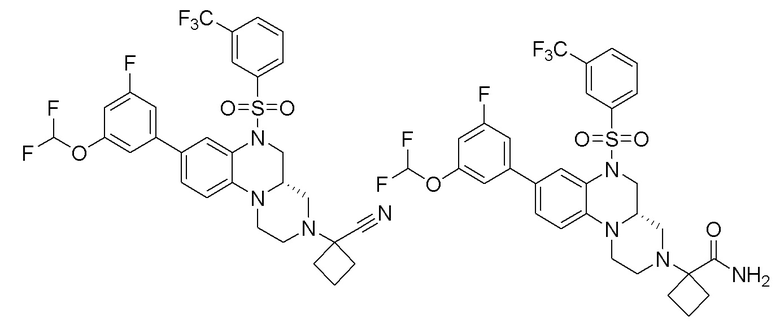
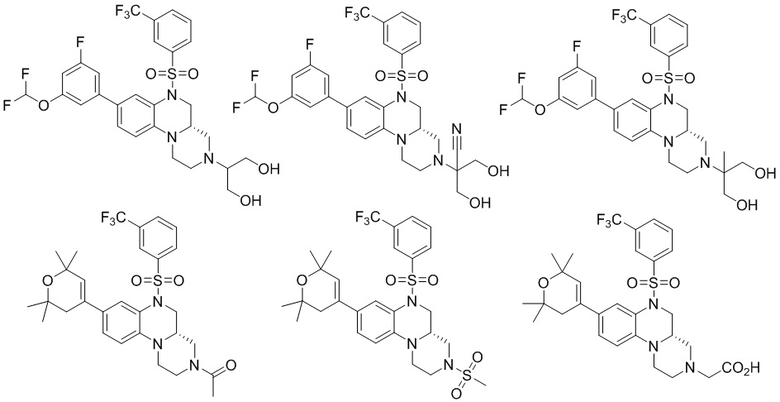
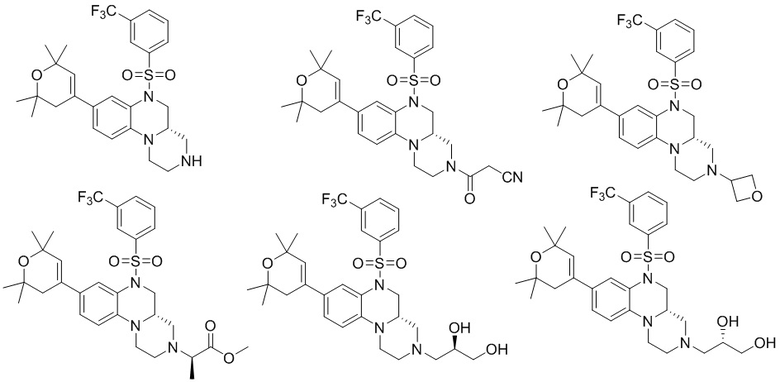
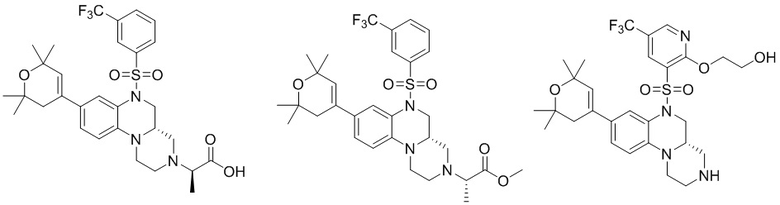
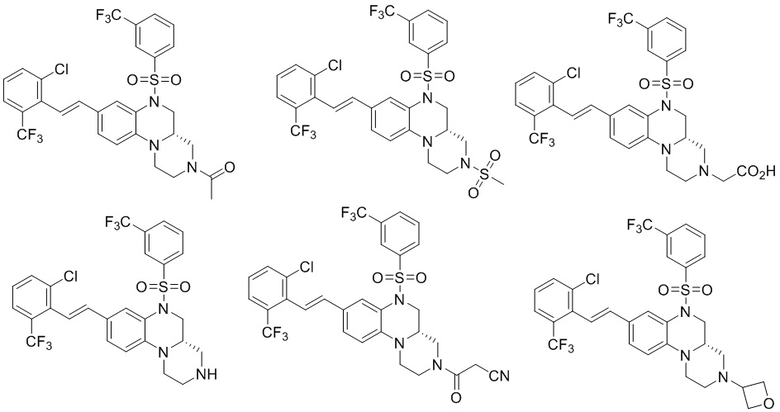
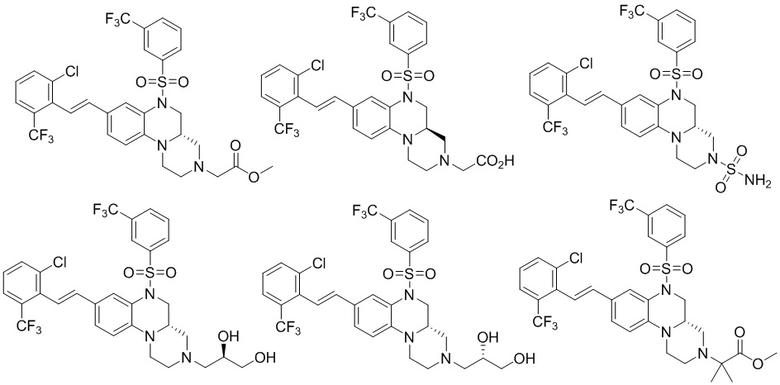
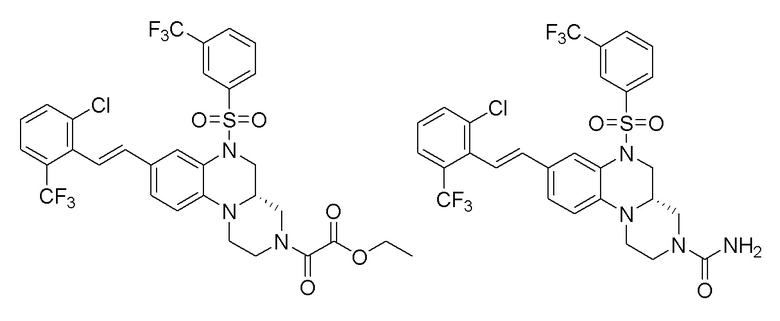
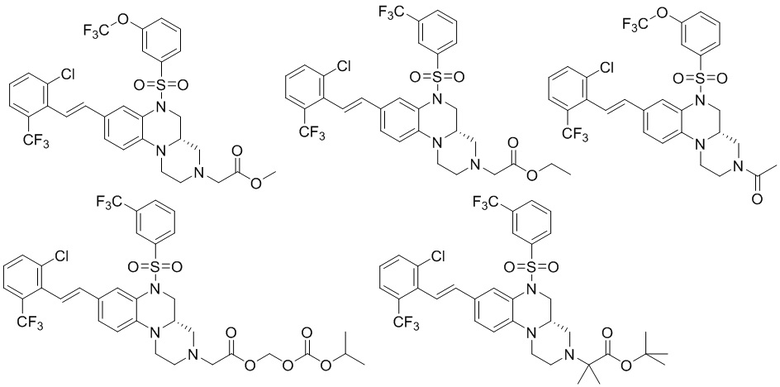
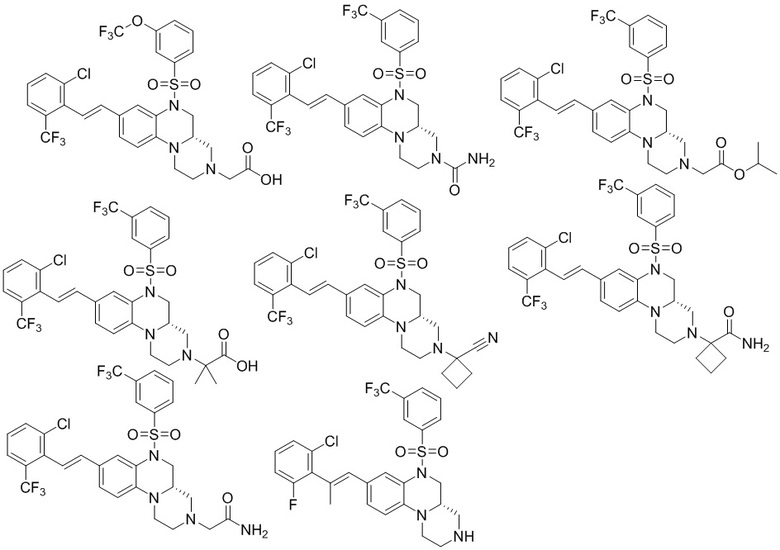
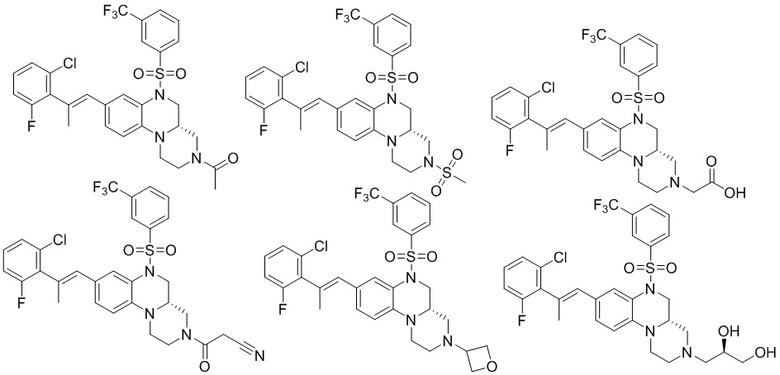
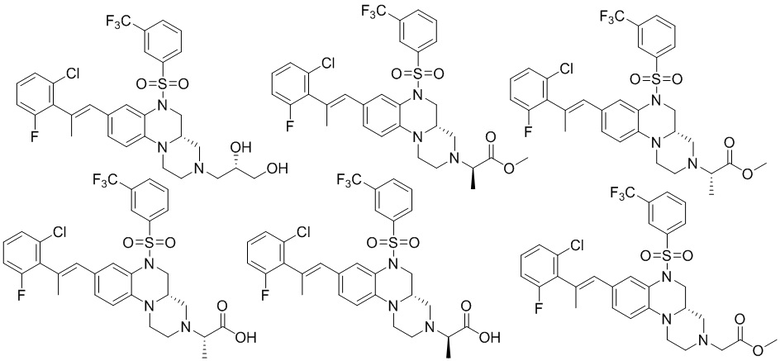
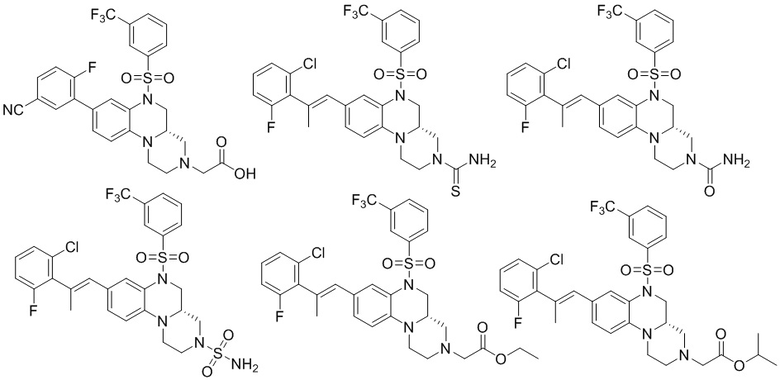
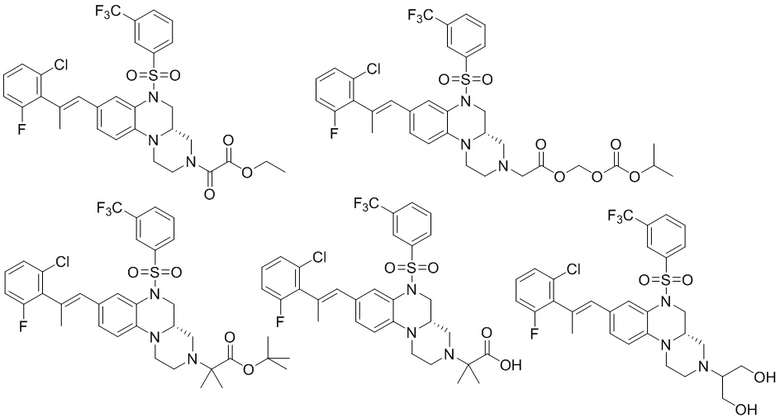

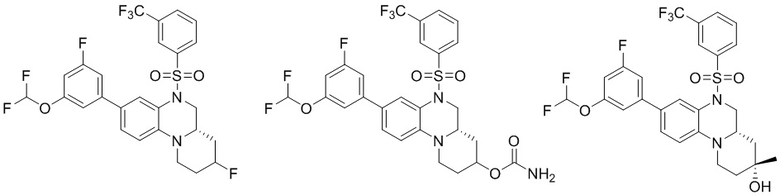
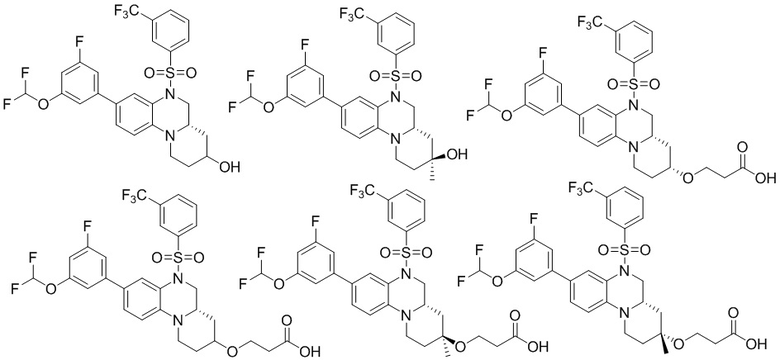
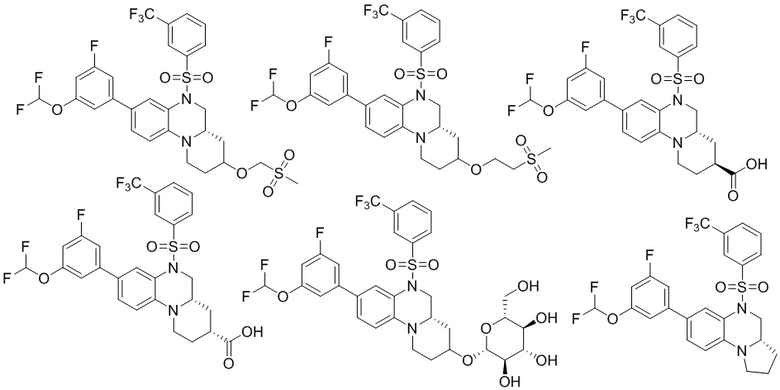
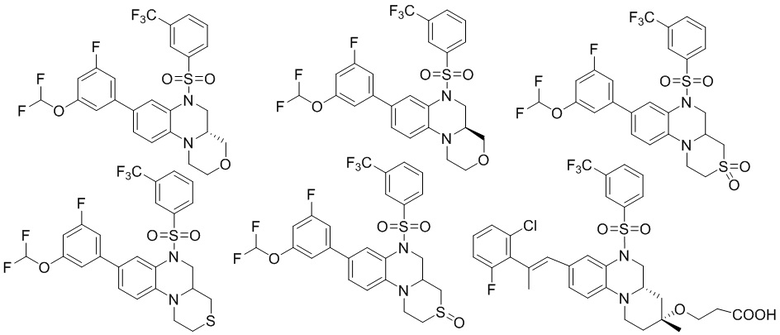 или
или 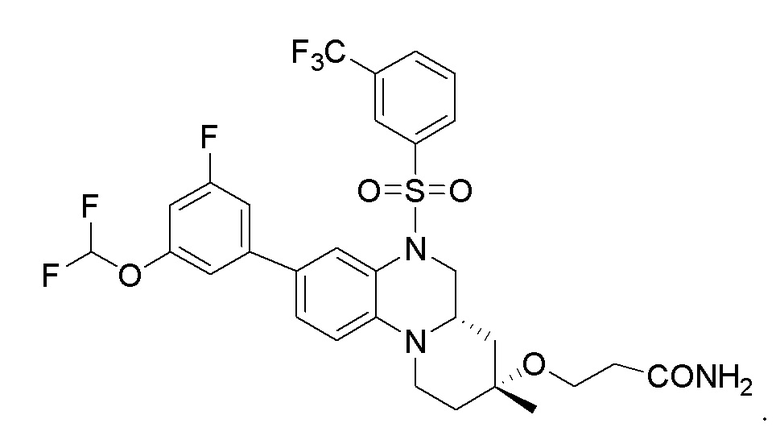
4. Способ получения соединения формулы (IIb), его стереоизомера или фармацевтически приемлемой соли по любому из пп. 1-3, включающий следующие стадии:
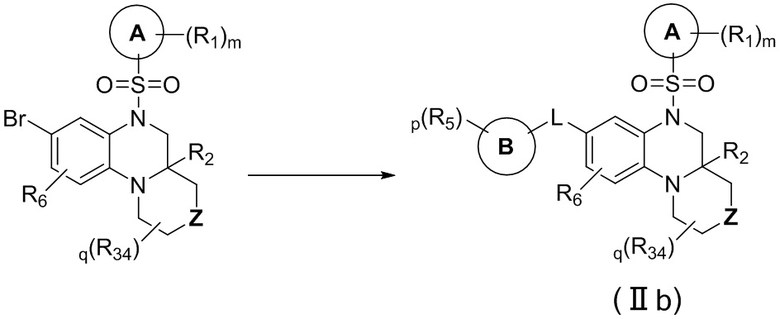 ;
;
где цикл A, цикл B, L, Z, R1, R2, R5, R6, R34, m, p и q соответствуют определениям в п. 1.
5. Применение соединения формулы (IIb), его стереоизомера или фармацевтически приемлемой соли по любому из пп. 1-3 для изготовления препаратов для лечения одного или нескольких видов опухолей, злокачественных новообразований, метаболических заболеваний, аутоиммунных заболеваний или нарушений, ассоциированных с RORγt.
6. Применение по п. 5, где метаболическое заболевание и аутоиммунное заболевание или нарушение выбраны из группы, включающей в себя атопический дерматит, контактный дерматит, аллергический дерматит, комедон, акне, муковисцидоз, отторжение аллотрансплантата, рассеянный склероз, склеродермию, системную красную волчанку (СКВ), псориаз, хронический лимфоцитарный тиреоидит, артрит, ревматоидный артрит, псориатический артрит, ювенильный идиопатический артрит, ювенильный ревматоидный артрит, остеоартрит, анкилозирующий спондилит, псориатический артрит (ПсА), аутоиммунный диабет, сахарный диабет 1-го типа, сахарный диабет 2-го типа, ожирение, жировую дегенерацию печени, воспаление, связанное с жировой тканью, панкреатит, тиреоидит, аутоиммунное заболевание щитовидной железы, билиарный цирроз печени, фиброз печени, неалкогольную жировую болезнь печени (НЖБП), язвенный колит, болезнь Крона, регионарный энтерит, воспалительное заболевание кишечника (ВЗК), синдром воспаленного кишечника (СВК), синдром Стивенса–Джонсона (ССД), первичный склерозирующий холангит, аутоиммунный полиэндокринный синдром 1-го типа, аутоиммунный полиэндокринный синдром 2-го типа, целиакию, неврит, системный склероз, эндометриоз, синдром Бехчета, миокардит, дерматомиозит, полимиозит, реакцию «трансплантат против хозяина», саркоидоз, инфаркт миокарда, легочную гипертензию, кожный лейшманиоз, болезнь Крона, аутоиммунное заболевание глаз, неврит зрительного нерва, нейромиелит зрительного нерва, ксерофтальмию, увеит, инсулинорезистентность, миастению гравис, возрастную макулодистрофию, синдром Гийена–Барре, гломерулонефрит, склерит, большое депрессивное расстройство, сезонное аффективное расстройство, посттравматическое стрессовое расстройство (ПТСР), биполярное расстройство, аутизм, эпилепсию, болезнь Альцгеймера, бронхиальную астму, хроническую обструктивную болезнь легких (ХОБЛ), бронхит, сенную лихорадку, аллергический ринит, стероидрезистентную бронхиальную астму, токсический диффузный зоб, синдром обструктивного апноэ во сне (СОАС), полипы носовых пазух и нарушение со стороны нервной системы, связанное с изменениями сна и/или циркадного ритма.
7. Применение по п. 5, где опухоль или злокачественное новообразование выбраны из группы, включающей в себя опухоли маточных труб, опухоли яичников, опухоли брюшины, меланому 4-й стадии, солидные опухоли, глиому, глиобластому, папиллярную карциному почек, опухоли головы и шеи, лимфому, миелому, неходжкинскую лимфому, диффузную В-клеточную крупноклеточную лимфому, фолликулярную лимфому, синовиальную саркому, гепатоцеллюлярную карциному, рак молочной железы, рак матки, рак толстой кишки, рак легких, рак желудка, рак прямой кишки, рак поджелудочной железы, рак головного мозга, рак кожи, рак полости рта, рак простаты, рак костей, рак почек, рак яичников, рак мочевого пузыря, рак печени, лейкоз и немелкоклеточный рак легкого.
8. Применение соединения формулы (IIb), его стереоизомера или фармацевтически приемлемой соли по любому из пп. 1-3 в качестве препаратов для лечения одного или нескольких видов опухолей, злокачественных новообразований, метаболических заболеваний, аутоиммунных заболеваний или нарушений, ассоциированных с RORγt.
| WO 2012064744 A2, 18.05.2012 | |||
| WO 2016201225 A1, 15.12.201 | |||
| WO 2015171610 A2, 12.11.2015 | |||
| ИМИДАЗОХИНОКСАЛИНЫ | 1992 |
|
RU2092487C1 |
Авторы
Даты
2023-09-26—Публикация
2019-09-12—Подача