ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка испрашивает приоритет предварительной заявки на патент США 62/269,044, поданной 17 декабря 2015 года, предварительной заявки на патент США 62/331,371, поданной 3 мая 2016 года, предварительной заявки на патент США 62/344,784, поданной 2 июня 2016 года, предварительной заявки на патент США 62/347,331, поданной 8 июня 2016 года, предварительной заявки на патент США 62/359,781, поданной 8 июля 2016 года, предварительной заявки на патент США 62/381,384, поданной 30 августа 2016 года, предварительной заявки на патент США 62/400,787, поданной 28 сентября 2016 года, предварительной заявки на патент США 62/414,128, поданной 28 октября 2016 года, и предварительной заявки на патент США 62/431,846, поданной 9 декабря 2016 года. Содержание вышеуказанных заявок настоящим полностью включено посредством отсылки.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Настоящая заявка содержит Список последовательностей, который был представлен в электронном виде в формате ASCII и настоящим полностью включен посредством отсылки. Указанная копия ASCII, созданная 14 декабря 2016 года, обозначена C2160-7015WO_SL.txt и имеет размер 280741 байт.
УРОВЕНЬ ТЕХНИКИ
Способность Т-клеток опосредовать иммунный ответ против антигена требует двух различных сигнальных взаимодействий (Viglietta, V. et al. (2007) Neurotherapeutics 4:666-675; Korman, A. J. et al. (2007) Adv. Immunol. 90:297-339). Во-первых, антиген, который был экспонирован на поверхности антигенпрезентирующих клеток (АПК), презентируется антигенспецифичной наивной CD4+ Т-клетке. Такая презентация подает сигнал через Т-клеточный рецептор (TCR), который направляет Т-клетку для инициации иммунного ответа, специфичного в отношении презентированного антигена. Во-вторых, различные костимулирующие и ингибирующие сигналы, опосредуемые при взаимодействиях между АПК и определенными молекулами Т-клеточной поверхности, вызывают активацию и пролиферацию Т-клеток и, в конечном счете, их ингибирование.
Иммунная система строго контролируется сетью костимулирующих и коингибирующих лигандов и рецепторов. Эти молекулы обеспечивают второй сигнал для активации Т-клеток и обеспечивают сбалансированную сеть положительных и отрицательных сигналов для максимального усиления иммунных ответов против инфекции и вместе с этим ограничения аутоиммунитета (Wang, L. et al. (Epub Mar. 7, 2011) J. Exp. Med. 208(3):577-92; Lepenies, B. et al. (2008) Endocrine, Metabolic & Immune Disorders--Drug Targets 8:279-288). Примеры костимулирующих сигналов включают связывание между лигандами АПК B7.1 (CD80) и B7.2 (CD86) и CD28 и CTLA-4 рецепторами CD4+ Т-лимфоцита (Sharpe, A. H. et al. (2002) Nature Rev. Immunol. 2:116-126; Lindley, P. S. et al. (2009) Immunol. Rev. 229:307-321). Связывание B7.1 или B7.2 с CD28 стимулирует активацию Т-клеток, тогда как связывание B7.1 или B7.2 с CTLA-4 ингибирует такую активацию (Dong, C. et al. (2003) Immunolog. Res. 28(1):39-48; Greenwald, R. J. et al. (2005) Ann. Rev. Immunol. 23:515-548). CD28 конститутивно экспрессируется на поверхности Т-клеток (Gross, J., et al. (1992) J. Immunol. 149:380-388), тогда как экспрессия CTLA-4 быстро повышается после активации Т-клеток (Linsley, P. et al. (1996) Immunity 4:535-543).
Другие лиганды рецептора CD28 включают группу родственных B7 молекул, также известных как "суперсемейство B7" (Coyle, A. J. et al. (2001) Nature Immunol. 2(3):203-209; Sharpe, A. H. et al. (2002) Nature Rev. Immunol. 2:116-126; Collins, M. et al. (2005) Genome Biol. 6:223.1-223.7; Korman, A. J. et al. (2007) Adv. Immunol. 90:297-339). Известны несколько представителей суперсемейства B7, в том числе B7.1 (CD80), B7.2 (CD86), индуцируемый костимулирующий лиганд (ICOS-L), лиганд программируемой смерти 1 (PD-L1; B7-H1), лиганд программируемой смерти 2 (PD-L2; B7-DC), B7-H3, B7-H-4 и B7-H6 (Collins, M. et al. (2005) Genome Biol. 6:223.1-223.7).
Белок программируемой смерти 1 (PD-1) является ингибиторным белком, представителем большого семейства CD28/CTLA-4 регуляторов Т-клеток (Okazaki et al. (2002) Curr Opin Immunol 14: 391779-82; Bennett et al. (2003) J. Immunol. 170:711-8). Другие представители семейства CD28 включают CD28, CTLA-4, ICOS и BTLA. PD-1 предположительно существует в виде мономера, поскольку не содержит неспаренный остаток цистеина, характерный для других членов семейства CD28. PD-1 экспрессируется на активированных В-клетках, Т-клетках и моноцитах.
Ген PD-1 кодирует трансмембранный белок I типа массой 55 кДа (Agata et al. (1996) Int Immunol. 8:765-72). Хотя PD-1 структурно подобен CTLA-4, он не содержит мотив MYPPY (SEQ ID NO: 236), который важен для связывания B7-1 и B7-2. Были идентифицированы два лиганда PD-1, PD-L1 (B7-H1) и PD-L2 (B7-DC), которые, как было показано, понижали активацию Т-клеток после связывания с PD-1 (Freeman et al. (2000) J. Exp. Med. 192:1027-34; Carter et al. (2002) Eur. J. Immunol. 32:634-43). PD-L1 и PD-L2 являются гомологами B7, которые связываются с PD-1, но не связываются с другими членами семейства CD28. PD-L1 распространен в различных раковых опухолях человека (Dong et al. (2002) Nat. Med. 8:787-9).
PD-1 известен как иммуноингибиторный белок, который негативно регулирует сигналы TCR (Ishida, Y. et al. (1992) EMBO J. 11:3887-3895; Blank, C. et al. (Epub 2006 Dec. 29) Immunol. Immunother. 56(5):739-745). Взаимодействие между PD-1 и PD-L1 может действовать как иммунная контрольная точка, что может приводить, например, к уменьшению инфильтрирующих опухоль лимфоцитов, уменьшению опосредованной Т-клеточным рецептором пролиферации и/или иммунному ускользанию раковых клеток (Dong et al. (2003) J. Mol. Med. 81:281-7; Blank et al. (2005) Cancer Immunol. Immunother. 54:307-314; Konishi et al. (2004) Clin. Cancer Res. 10:5094-100). Иммунная супрессия может быть снята при ингибировании локального взаимодействия PD-1 с PD-L1 или PD-L2; эффект является аддитивным, когда также заблокировано взаимодействие PD-1 с PD-L2 (Iwai et al. (2002) Proc. Nat'l. Acad. Sci. USA 99:12293-7; Brown et al. (2003) J. Immunol. 170:1257-66).
С учетом важности путей иммунных контрольных точек в регуляции иммунного ответа, существует потребность в разработке новых комбинированных терапий, которые модулируют активность иммуноингибиторных белков, таких как PD-1, что приводит к активации иммунной системы. Такие средства могут применяться, например, для иммунотерапии рака и лечения других состояний, таких как хроническая инфекция.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В настоящей заявке раскрыты, по меньшей мере частично, молекулы антител (например, молекулы гуманизированных антител), которые связываются с белком программируемой смерти 1 (PD-1) с высокой аффинностью и специфичностью. Также предложены молекулы нуклеиновых кислот, кодирующие молекулы антител, векторы экспрессии, клетки-хозяева и способы получения молекул антител. Также предложены фармацевтические композиции и дозированные лекарственные формы, включающие молекулы антител. Молекулы антител против PD-1, раскрытые в настоящей заявке, могут применяться (отдельно или в комбинации с другими средствами или методами лечения) для лечения, предотвращения и/или диагностики нарушений, таких как онкологических нарушений (например, солидных опухолей и опухолей мягких тканей), а также инфекционных заболеваний (например, хронических инфекционных нарушений или сепсиса). Таким образом, в настоящей заявке раскрыты композиции и способы обнаружения PD-1, а также способы лечения различных нарушений, включающих рак и/или инфекционные заболевания, с применением молекул антител против PD-1. В некоторых вариантах осуществления молекулу антитела против PD-1 вводят или применяют в постоянной или фиксированной дозе.
Таким образом, в одном аспекте изобретения представлен способ лечения (например, ингибирования, снижения, уменьшения тяжести или предотвращения) нарушения, например, гиперпролиферативного состояния или нарушения (например, рака) у субъекта. Способ включает введение субъекту молекулы антитела против PD-1, например, молекулы антитела против PD-1, описанного в настоящей заявке, в дозе от приблизительно 300 мг до 400 мг один раз в три недели или один раз в четыре недели. В некоторых вариантах осуществления молекулу антитела против PD-1 вводят в дозе приблизительно 300 мг один раз в три недели. В других вариантах осуществления молекулу антитела против PD-1 вводят в дозе приблизительно 400 мг один раз в четыре недели. В некоторых вариантах осуществления нарушением является рак, например, рак, описанный в настоящей заявке. В некоторых вариантах осуществления рак является раком кожи, например, раком из клеток Меркеля или меланомой. В одном варианте осуществления рак является раком из клеток Меркеля. В других вариантах осуществления рак является меланомой. В других вариантах осуществления рак является раком молочной железы, например, трижды негативным раком молочной железы (ТНРМЖ) или HER2-негативным раком молочной железы. В других вариантах осуществления рак является раком почки, например, почечно-клеточной карциномой (например, светлоклеточной почечно-клеточной карциномой (CCRCC) или несветлоклеточной почечно-клеточной карциномой (nccRCC)). В других вариантах осуществления рак является раком щитовидной железы, например, анапластической карциномой щитовидной железы (ATC). В других вариантах осуществления рак является нейроэндокринной опухолью (NET), например, атипичной легочной карциноидной опухолью или NET в поджелудочной железе, желудочно-кишечном тракте (ЖКТ) или легком. В некоторых вариантах осуществления рак является раком легкого, например, немелкоклеточным раком легкого (НМРЛ) (например, плоскоклеточным НМРЛ или неплоскоклеточным НМРЛ). В некоторых вариантах осуществления рак является раком яичника. В некоторых вариантах осуществления рак является раком фаллопиевой трубы. В некоторых вариантах осуществления рак является раком толстой и прямой кишки (CRC) (например, раком толстой и прямой кишки с высокой микросателлитной нестабильностью (MSI-H CRC) или микросателлитно стабильный рак толстой и прямой кишки (MSS CRC)). В некоторых вариантах осуществления рак является лейкозом (например, острым миелоидным лейкозом (ОМЛ), например, рецидивирующим или рефракторным ОМЛ или de novo ОМЛ). В некоторых вариантах осуществления рак является миелодиспластическим синдромом (МДС) (например, МДС с высоким риском).
В некоторых вариантах осуществления молекулу антитела против PD-1 вводят в дозе приблизительно 400 мг один раз в четыре недели или приблизительно 300 мг один раз в три недели для лечения рака легкого, например, немелкоклеточного рака легкого (НМРЛ) (например, плоскоклеточного НМРЛ или неплоскоклеточного НМРЛ). В некоторых вариантах осуществления молекулу антитела против PD-1 вводят в дозе приблизительно 300 мг один раз в три недели для лечения рака легкого, например, немелкоклеточного рака легкого (НМРЛ) (например, плоскоклеточного НМРЛ или неплоскоклеточного НМРЛ). В некоторых вариантах осуществления молекулу антитела против PD-1 вводят в дозе приблизительно 400 мг один раз в четыре недели для лечения рака кожи, например, рака из клеток Меркеля или меланомы. В некоторых вариантах осуществления молекулу антитела против PD-1 вводят в дозе приблизительно 400 мг один раз в четыре недели для лечения рака из клеток Меркеля. В других вариантах осуществления молекулу антитела против PD-1 вводят в дозе приблизительно 400 мг один раз в четыре недели для лечения меланомы. В некоторых вариантах осуществления молекулу антитела против PD-1 вводят в дозе приблизительно 400 мг один раз в четыре недели для лечения рака молочной железы, например, трижды негативного рака молочной железы (ТНРМЖ) или HER2-негативного рака молочной железы. В некоторых вариантах осуществления молекулу антитела против PD-1 вводят в дозе приблизительно 400 мг один раз в четыре недели для лечения рака щитовидной железы, например, анапластической карциномы щитовидной железы (ATC). В некоторых вариантах осуществления молекулу антитела против PD-1 вводят в дозе приблизительно 400 мг один раз в четыре недели для лечения нейроэндокринной опухоли (NET), например, атипичной легочной карциноидной опухоли или NET в поджелудочной железе, желудочно-кишечном тракте (ЖКТ) или легком. В некоторых вариантах осуществления молекулу антитела против PD-1 вводят в дозе приблизительно 400 мг один раз в четыре недели для лечения рака почки, например, почечно-клеточной карциномы (например, светлоклеточной почечно-клеточной карциномы (CCRCC) или несветлоклеточной почечно-клеточной карциномы (nccRCC)). В некоторых вариантах осуществления молекулу антитела против PD-1 вводят в дозе приблизительно 400 мг один раз в четыре недели для лечения рака яичника. В некоторых вариантах осуществления молекулу антитела против PD-1 вводят в дозе приблизительно 400 мг один раз в четыре недели для лечения рака фаллопиевой трубы. В некоторых вариантах осуществления молекулу антитела против PD-1 вводят в дозе приблизительно 400 мг один раз в четыре недели для лечения рака толстой и прямой кишки (например, рака толстой и прямой кишки с высокой микросателлитной нестабильностью (MSI-H CRC) или микросателлитно стабильного рака толстой и прямой кишки (MSS CRC)). В некоторых вариантах осуществления молекулу антитела против PD-1 вводят в дозе приблизительно 400 мг один раз в четыре недели для лечения лейкоза (например, ОМЛ, например, рецидивирующего или рефракторного ОМЛ или de novo ОМЛ). В некоторых вариантах осуществления молекулу антитела против PD-1 вводят в дозе приблизительно 400 мг один раз в четыре недели для лечения миелодиспластического синдрома (МДС) (например, МДС с высоким риском).
В некоторых вариантах осуществления молекулу антитела против PD-1 вводят путем инъекции (например, подкожно или внутривенно) в дозе (например, постоянной дозе) приблизительно от 100 мг до 600 мг, например, приблизительно от 200 мг до 500 мг, например, приблизительно от 100 мг до 300 мг, приблизительно от 250 мг до 450 мг, приблизительно от 300 мг до 400 мг, приблизительно от 250 мг до 350 мг, приблизительно от 350 мг до 450 мг или приблизительно 100 мг, приблизительно 200 мг, приблизительно 300 мг или приблизительно 400 мг. Схема введения (например, схема введения постоянных доз) может изменяться, например, от одного раза в неделю до одного раза в 2, 3, 4, 5 или 6 недель. В одном варианте осуществления молекулу антитела против PD-1 вводят в дозе приблизительно от 300 мг до 400 мг один раз в три недели или один раз в четыре недели. В одном варианте осуществления молекулу антитела против PD-1 вводят в дозе приблизительно от 300 мг один раз в три недели. В одном варианте осуществления молекулу антитела против PD-1 вводят в дозе приблизительно от 400 мг один раз в четыре недели. В одном варианте осуществления молекулу антитела против PD-1 вводят в дозе приблизительно от 300 мг один раз в четыре недели. В одном варианте осуществления молекулу антитела против PD-1 вводят в дозе приблизительно от 400 мг один раз в три недели.
В другом аспекте изобретения представлен способ снижения активности (например, роста, выживания или жизнеспособности, или любой) гиперпролиферативной (например, раковой) клетки. Способ включает контакт клетки с молекулой антитела против PD-1, например, молекулой антитела против PD-1, описанного в настоящей заявке. Способ могут применять у субъекта, например, в качестве части терапевтического протокола, например, в дозе приблизительно от 300 мг до 400 мг молекулы антитела против PD-1 один раз в три недели или один раз в четыре недели. В некоторых вариантах осуществления доза составляет приблизительно 300 мг молекулы антитела против PD-1 один раз в три недели. В других вариантах осуществления доза составляет приблизительно 400 мг молекулы антитела против PD-1 один раз в четыре недели. Раковая клетка может быть, например, клеткой рака, описанного в настоящей заявке, такого как рак легкого (плоскоклеточный), рак легкого (аденокарцинома), рак головы и шеи, рак шейки матки (плоскоклеточный), рак желудка, рак щитовидной железы, рак кожи, меланома, рак носоглотки (например, дифференцированный или недифференцированный метастатический или локально рецидивирующая карцинома носоглотки), рак почки, нейроэндокринная опухоль (NET), рак яичника, рак фаллопиевой трубы, рак толстой и прямой кишки или рак молочной железы. В некоторых вариантах осуществления рак является раком кожи, например, раком из клеток Меркеля или меланомой. В одном варианте осуществления рак является раком из клеток Меркеля. В других вариантах осуществления рак является меланомой. В других вариантах осуществления рак является раком молочной железы, например, трижды негативным раком молочной железы (ТНРМЖ) или HER2-негативным раком молочной железы. В других вариантах осуществления рак является раком почки, например, почечно-клеточной карциномой (например, светлоклеточной почечно-клеточной карциномой (CCRCC) или несветлоклеточной почечно-клеточной карциномой (nccRCC)). В других вариантах осуществления рак является раком щитовидной железы, например, анапластической карциномой щитовидной железы (ATC). В других вариантах осуществления рак является нейроэндокринной опухолью (NET), например, атипичной легочной карциноидной опухолью или NET в поджелудочной железе, желудочно-кишечном тракте (ЖКТ) или легком. В некоторых вариантах осуществления рак является раком легкого, например, немелкоклеточным раком легкого (НМРЛ) (например, плоскоклеточным НМРЛ или неплоскоклеточным НМРЛ). В некоторых вариантах осуществления рак является раком яичника. В некоторых вариантах осуществления рак является раком фаллопиевой трубы. В некоторых вариантах осуществления рак является раком толстой и прямой кишки (CRC) (например, раком толстой и прямой кишки с высокой микросателлитной нестабильностью (MSI-H CRC) или микросателлитно стабильным раком толстой и прямой кишки (MSS CRC)). В некоторых вариантах осуществления рак является лейкозом (например, острым миелоидным лейкозом (ОМЛ), например, рецидивирующим или рефракторным ОМЛ или de novo ОМЛ). В некоторых вариантах осуществления рак является миелодиспластическим синдромом (МДС) (например, МДС с высоким риском).
В другом аспекте изобретения предложена композиция (например, одна или более композиций или дозированных лекарственных форм), которая включает молекулу антитела против PD-1 (например, молекулу антитела против PD-1, как описано в настоящей заявке). В настоящей заявке также описаны лекарственные формы, например, дозированные лекарственные формы и наборы, например, терапевтические наборы, которые включают молекулу антитела против PD-1 (например, молекулу антитела против PD-1, как описано в настоящей заявке). В некоторых вариантах осуществления композиция или лекарственная форма включает 300 мг или 400 мг молекулы антитела против PD-1 (например, молекулы антитела против PD-1, как описано в настоящей заявке). В некоторых вариантах осуществления композицию или лекарственную форму вводят или применяют один раз в три недели или один раз в четыре недели.
Также в настоящей заявке раскрыты способы и композиции, включающие комбинацию двух, трех или более терапевтических средств, выбранных из одной, двух или всех следующих категорий (i)-(iii): (i) средство, которое увеличивает презентацию антигена (например, презентацию опухолевого антигена); (ii) средство, которое усиливает ответ эффекторных клеток (например, активацию и/или мобилизацию В-клеток и/или Т-клеток); или (iii) средство, которое уменьшает опухолевую иммуносупрессию. В некоторых вариантах осуществления комбинация включает ингибитор PD-1 (например, молекулу антитела против PD-1, как описано в настоящей заявке). В некоторых вариантах осуществления молекулу антитела против PD-1 вводят или применяют в постоянной или фиксированной дозе.
Без ограничения теорией, считается, что терапевтические методы, которые усиливают противоопухолевый иммунитет, действуют эффективнее, когда иммунный ответ оптимизирован посредством направленного воздействия на множество компонентов на одной или более стадиях иммунного ответа, например, противоопухолевого иммунного ответа. Например, методы, которые увеличивают презентацию антигена, например, при активации и/или созревании дендритных клеток, комбинируют с методами, которые усиливают клеточные и гуморальные иммунные ответы (например, путем стимуляции, например активации, фагоцитов и/или инфильтрирующих опухоль лимфоцитов (например, NK-клеток и Т-клеток)), с одновременным блокированием опухолевых иммуносупрессорных сигналов (например, в результате увеличения поляризации макрофагов, увеличения истощения Treg и/или уменьшения миелоидных супрессорных клеток (МСК)) могут приводить к более эффективной и/или продолжительной терапевтической реакции. Таким образом, в настоящей заявке раскрыты комбинированные терапии, которые оптимизируют одно, два или все из: (i) презентации антигена, например, увеличения презентации антигена (например, посредством увеличения одного или более из активности или созревания дендритных клеток, захвата антигена или процессинга антигена); (ii) ответа эффекторных клеток, например, усиления ответа эффекторных клеток (например, увеличения активации и/или мобилизации В-клеток и/или Т-клеток, например, в лимфатическом узле); или (iii) опухолевой иммуносупрессии, например, уменьшения опухолевой иммуносупрессии (например, увеличения инфильтрации Т-клеток и уничтожения опухолевых клеток). Комбинации, описанные в настоящей заявке, могут обеспечивать превосходное благоприятное воздействие, например, при лечении нарушения, такое как усиленное противоопухолевое действие, сниженная токсичность и/или уменьшенные побочные эффекты, по сравнению с применением монотерапии терапевтических средств в комбинации. Например, одно или более терапевтических средств в комбинации можно вводить в более низкой дозе или в течение более короткого периода применения, чем было бы необходимо для достижения такого же терапевтического эффекта по сравнению с применением монотерапии. Таким образом, раскрыты композиции и способы лечения рака и других иммунологических нарушений с применением вышеуказанной комбинированной терапии.
Таким образом, в одном аспекте изобретения предложен способ лечения (например, ингибирования, снижения, уменьшения тяжести или предотвращения) нарушения, например, гиперпролиферативного состояния или нарушения (например, рака) у субъекта. Способ включает введение субъекту комбинации двух, трех или более терапевтических средств, выбранных из одной, двух или всех следующих категорий (i)-(iii): (i) средство, которое увеличивает презентацию антигена (например, опухолевого антигена); (ii) средство, которое усиливает ответ эффекторных клеток (например, активацию и/или мобилизацию В-клеток и/или Т-клеток); или (iii) средство, которое уменьшает опухолевую иммуносупрессию, в результате чего осуществляется лечение нарушения, например, гиперпролиферативного состояния или нарушение (например, рака). В некоторых вариантах осуществления комбинация включает ингибитор PD-1 (например, молекулу антитела против PD-1, как описано в настоящей заявке). Подвергаемый лечению рак может быть, например, раком, описанным в настоящей заявке, таким как рак легкого (плоскоклеточный), рак легкого (аденокарцинома), рак головы и шеи, рак шейки матки (плоскоклеточный), рак желудка, рак щитовидной железы, рак кожи, меланома, рак носоглотки (например, дифференцированная или недифференцированная метастатическая или локально рецидивирующая карцинома носоглотки), рак почки, нейроэндокринная опухоль (NET) или рак молочной железы. В некоторых вариантах осуществления рак является раком кожи, например, раком из клеток Меркеля или меланомой. В одном варианте осуществления рак является раком из клеток Меркеля. В других вариантах осуществления рак является меланомой. В других вариантах осуществления рак является раком молочной железы, например, трижды негативным раком молочной железы (ТНРМЖ) или HER2-негативным раком молочной железы. В других вариантах осуществления рак является раком почки, например, почечно-клеточной карциномой (например, светлоклеточной почечно-клеточной карциномой (CCRCC) или несветлоклеточной почечно-клеточной карциномой (nccRCC)). В других вариантах осуществления рак является раком щитовидной железы, например, анапластической карциномой щитовидной железы (ATC). В других вариантах осуществления рак является нейроэндокринной опухолью (NET), например, атипичной легочной карциноидной опухолью или NET в поджелудочной железе, желудочно-кишечном тракте (ЖКТ) или легком. В некоторых вариантах осуществления рак является раком легкого, например, немелкоклеточным раком легкого (НМРЛ) (например, плоскоклеточным НМРЛ или неплоскоклеточным НМРЛ). В некоторых вариантах осуществления рак является раком яичника. В некоторых вариантах осуществления рак является раком фаллопиевой трубы. В некоторых вариантах осуществления рак является раком толстой и прямой кишки (CRC) (например, раком толстой и прямой кишки с высокой микросателлитной нестабильностью (MSI-H CRC) или микросателлитно стабильным раком толстой и прямой кишки (MSS CRC)). В некоторых вариантах осуществления рак является лейкозом (например, острым миелоидным лейкозом (ОМЛ), например, рецидивирующим или рефракторным ОМЛ или de novo ОМЛ). В некоторых вариантах осуществления рак является миелодиспластическим синдромом (МДС) (например, МДС с высоким риском).
В другом аспекте изобретения предложен способ снижения активности (например, роста, выживания или жизнеспособности или любой) гиперпролиферативной (например, раковой) клетки. Способ включает контакт клетки с комбинацией двух, трех или более терапевтических средств, выбранных из одной, двух или всех следующих категорий (i)-(iii): (i) средство, которое увеличивает презентацию антигена (например, опухолевого антиген); (ii) средство, которое усиливает ответ эффекторных клеток (например, активацию и/или мобилизацию В-клеток и/или Т-клеток); или (iii) средство, которое уменьшает опухолевую иммуносупрессию, что приводит к уменьшению активности гиперпролиферативной клетки. В некоторых вариантах осуществления комбинация включает ингибитор PD-1 (например, молекулу антитела против PD-1, как описано в настоящей заявке). Способ может быть применен у субъекта, например, как часть терапевтического протокола. Раковая клетка может быть, например, клеткой рака, описанного в настоящей заявке, такого как рак легкого (плоскоклеточный), рак легкого (аденокарцинома), рак головы и шеи, рак шейки матки (плоскоклеточный), рак желудка, рак щитовидной железы, рак кожи, меланома, рак носоглотки (например, дифференцированная или недифференцированная метастатическая или локально рецидивирующая карцинома носоглотки), рак почки, нейроэндокринная опухоль (NET), рак яичника, рак фаллопиевой трубы, рак толстой и прямой кишки или рак молочной железы. В некоторых вариантах осуществления рак является раком кожи, например, раком из клеток Меркеля или меланомой. В одном варианте осуществления рак является раком из клеток Меркеля. В других вариантах осуществления рак является меланомой. В других вариантах осуществления рак является раком молочной железы, например, трижды негативным раком молочной железы (ТНРМЖ) или HER2-негативным раком молочной железы. В других вариантах осуществления рак является раком почки, например, почечно-клеточной карциномой (например, светлоклеточной почечно-клеточной карциномой (CCRCC) или несветлоклеточной почечно-клеточной карциномой (nccRCC)). В других вариантах осуществления рак является раком щитовидной железы, например, анапластической карциномой щитовидной железы (ATC). В других вариантах осуществления рак является нейроэндокринной опухолью (NET), например, атипичной легочной карциноидной опухолью или NET в поджелудочной железе, желудочно-кишечном тракте (ЖКТ) или легком. В некоторых вариантах осуществления рак является раком легкого, например, немелкоклеточным раком легкого (НМРЛ) (например, плоскоклеточным НМРЛ или неплоскоклеточным НМРЛ). В некоторых вариантах осуществления рак является раком яичника. В некоторых вариантах осуществления рак является раком фаллопиевой трубы. В некоторых вариантах осуществления рак является раком толстой и прямой кишки (CRC) (например, раком толстой и прямой кишки с высокой микросателлитной нестабильностью (MSI-H CRC) или микросателлитно стабильным раком толстой и прямой кишки (MSS CRC)). В некоторых вариантах осуществления рак является лейкозом (например, острым миелоидным лейкозом (ОМЛ), например, рецидивирующим или рефракторным ОМЛ или de novo ОМЛ). В некоторых вариантах осуществления рак является миелодиспластическим синдромом (МДС) (например, МДС с высоким риском).
В некоторых вариантах осуществления способов, раскрытых в настоящей заявке, способ дополнительно включает определение у субъекта уровня иммуноклеточного (например, Т-клеточного) инфильтрата (например, уровня инфильтрирующих опухоль лимфоцитов (TIL)). В одном варианте осуществления уровень иммуноклеточного инфильтрата определяют in vivo, например, неинвазивным методом (например, при обнаружении антитела к Т-клеточному маркеру, меченого детектируемой меткой, при помощи подходящего метода визуализации, например, сканирования методом позитронно-эмиссионной томографии (ПЭТ)). В других вариантах осуществления уровень иммуноклеточного инфильтрата определяют в образце (например, биоптате опухоли), полученном от субъекта (например, при использовании иммуногистохимических методов). В вариантах осуществления, чувствительных к низкому или не поддающемуся обнаружению уровню опухолевого инфильтрата у субъекта, вводят одно или более средств категорий (i) и/или (ii). В других вариантах осуществления, чувствительных к поддающемуся обнаружению уровню или повышенному уровню опухолевого инфильтрата у субъекта, вводят одно или более средств категории (iii). Этапы обнаружения также могут применяться, например, для контроля эффективности терапевтического средства, описанного в настоящей заявке. Например, этап обнаружения может применяться для контроля эффективности терапевтических средств категорий (i), (ii) и/или (iii).
В другом аспекте изобретения предложена композиция (например, одна или более композиций или дозированных лекарственных форм), которая включает комбинацию двух, трех или более терапевтических средств, выбранных из одной, двух или всех следующих категорий (i)-(iii): (i) средство, которое увеличивает презентацию антигена (например, опухолевого антигена); (ii) средство, которое усиливает ответ эффекторной клетки (например, активацию и/или мобилизацию В-клетки и/или Т-клетки); или (iii) средство, которое уменьшает опухолевую иммуносупрессию. В некоторых вариантах осуществления комбинация включает ингибитор PD-1 (например, молекулу антитела против PD-1, как описано в настоящей заявке).
В еще одном аспекте изобретения предложена композиция (например, одна или более композиций или дозированных лекарственных форм, как описано в настоящей заявке) для применения в лечении нарушения, например, рака. В вариантах осуществления композиция для применения включает комбинацию двух, трех или более терапевтических средств, выбранных из одной, двух или всех следующих категорий (i)-(iii): (i) средство, которое увеличивает презентацию антигена (например, опухолевого антигена); (ii) средство, которое усиливает ответ эффекторной клетки (например, активацию и/или мобилизацию В-клетки и/или Т-клетки); или (iii) средство, которое уменьшает опухолевую иммуносупрессию. В некоторых вариантах осуществления применяемая комбинация включает ингибитор PD-1 (например, молекулу антитела против PD-1, как описано в настоящей заявке). Рак может быть, например, раком, описанным в настоящей заявке, таким как рак легкого (плоскоклеточный), рак легкого (аденокарцинома), рак головы и шеи, рак шейки матки (плоскоклеточный), рак желудка, рак щитовидной железы, рак кожи, меланома, рак носоглотки (например, дифференцированная или недифференцированная метастатическая или локально рецидивирующая карцинома носоглотки), рак почки, нейроэндокринная опухоль (NET), рак яичника, рак фаллопиевой трубы, рак толстой и прямой кишки или рак молочной железы. В некоторых вариантах осуществления рак является раком кожи, например, раком из клеток Меркеля или меланомой. В одном варианте осуществления рак является раком из клеток Меркеля. В других вариантах осуществления рак является меланомой. В других вариантах осуществления рак является раком молочной железы, например, трижды негативным раком молочной железы (ТНРМЖ) или HER2-негативным раком молочной железы. В других вариантах осуществления рак является раком почки, например, почечно-клеточной карциномой (например, светлоклеточной почечно-клеточной карциномой (CCRCC) или несветлоклеточной почечно-клеточной карциномой (nccRCC)). В других вариантах осуществления рак является раком щитовидной железы, например, анапластической карциномой щитовидной железы (ATC). В других вариантах осуществления рак является нейроэндокринной опухолью (NET), например, атипичной легочной карциноидной опухолью или NET в поджелудочной железе, желудочно-кишечном тракте (ЖКТ) или легком. В некоторых вариантах осуществления рак является раком легкого, например, немелкоклеточным раком легкого (НМРЛ) (например, плоскоклеточным НМРЛ или неплоскоклеточным НМРЛ). В некоторых вариантах осуществления рак является раком яичника. В некоторых вариантах осуществления рак является раком фаллопиевой трубы. В некоторых вариантах осуществления рак является раком толстой и прямой кишки (CRC) (например, раком толстой и прямой кишки с высокой микросателлитной нестабильностью (MSI-H CRC) или микросателлитно стабильным раком толстой и прямой кишки (MSS CRC)). В некоторых вариантах осуществления рак является лейкозом (например, острым миелоидным лейкозом (ОМЛ), например, рецидивирующим или рефракторным ОМЛ или de novo ОМЛ). В некоторых вариантах осуществления рак является миелодиспластическим синдромом (МДС) (например, МДС с высоким риском).
Лекарственные формы, например дозированные лекарственные формы, и наборы, например терапевтические наборы, которые включают комбинацию двух, трех или более терапевтических средств, выбранных из одной, двух или всех следующих категорий (i)-(iii): (i) средство, которое увеличивает презентацию антигена (например, опухолевого антигена); (ii) средство, которое усиливает ответ эффекторной клетки (например, активацию и/или мобилизацию В-клетки и/или Т-клетки); или (iii) средство, которое уменьшает опухолевую иммуносупрессию, что приводит к уменьшению активности в клетке, и (необязательно) также раскрыты инструкции по применению. В некоторых вариантах осуществления комбинация включает ингибитор PD-1 (например, молекулу антитела против PD-1, как описано в настоящей заявке).
Комбинации терапевтических средств, раскрытых в настоящей заявке, включают два или более терапевтических средств, описанных в настоящей заявке. Терапевтические средства в комбинации могут относиться к одной и той же категории, например, два или более терапевтических средств категории (i), или могут включать по меньшей мере одно средство из двух или более категорий (например, терапевтическое средство категории (i) в комбинации с терапевтическим средством категории (ii)), как описано ниже. Некоторые терапевтические средства могут относиться к двум или более категориям из категорий (i)-(iii). Например, терапевтическое средство (например, агонист GITR, антагонист IDO, ингибитор TGF-b, помимо прочих) может действовать как терапевтическое средство во многих категориях.
Дополнительные признаки или варианты осуществления способов, композиций, дозированных лекарственных форм и наборов, описанных в настоящей заявке, включают одно или более из следующего:
Комбинации
В некоторых вариантах осуществления комбинация включает один, два, три, четыре или больше терапевтических средства, которые увеличивают презентацию антигена (например, опухолевого антигена) (указана в настоящей заявке как "антигенпрезентирующая комбинация"). В некоторых вариантах осуществления антигенпрезентирующая комбинация включает одно или более из: средства, которое увеличивает презентацию антигена (например, вакцину, например, вакцину на основе клеток или антигенов); средства, которое увеличивает лизис опухолевых клеток (например, онколитический вирус); средства, которое стимулирует (например, активирует) фагоцит, например, активатор интерферона I типа (IFN) (например, агонист TLR, агонист RIG-I-подобного рецептора (RLR)), и/или средства, которое активирует и/или рекрутирует дендритную клетку или макрофаг (например, макрофаг I), например, би- или триспецифичные активаторы клеток.
В некоторых вариантах осуществления антигенпрезентирующая комбинация включает одно, два, три, четыре, пять или более терапевтических средств, выбранных из: (i) агониста стимулятора интерфероновых генов (агонист STING), (ii) агониста Толл-подобного рецептора (TLR) (например, агонист TLR-3, -4, -5, -7, -8 или -9), (iii) модулятора TIM-3 (например, молекулы антитела против TIM-3), (iv) ингибитора рецептора фактора роста эндотелия сосудов (VEGFR), (v) ингибитора c-Met, (vi) ингибитора TGFb (например, антитела против TGFb), (vii) ингибитора IDO/TDO, (viii) антагониста A2AR, (ix) онколитического вируса, (x) вакцины (например, скаффолд-вакцины) или (xi) би- или триспецифичный активатор клеток. Любая комбинация вышеуказанных средств (i)-(xi) может применяться в антигенпрезентирующей комбинации. В одном примере осуществления антигенпрезентирующая комбинация включает агонист STING. В другом примере осуществления антигенпрезентирующая комбинация включает агонист TLR (например, агонист TLR7). В другом примере осуществления антигенпрезентирующая комбинация включает агонист STING и агонист TLR (например, агонист TLR7). В некоторых вариантах осуществления антигенпрезентирующая комбинация выбрана из агониста STING, агониста TLR, антагониста A2AR или онколитического вируса или их комбинации и, необязательно, одного или более из (iii)-(vii) или (x)-(xi). В некоторых вариантах осуществления антигенпрезентирующая комбинация выбрана из агониста STING или агониста TLR или их комбинации и, необязательно, одного или более из (iii)-(xi). В другом варианте осуществления антигенпрезентирующая комбинация включает агонист STING, агонист TLR (например, агонист TLR7) и модулятор TIM-3 (например, ингибитор TIM-3). В другом варианте осуществления антигенпрезентирующая комбинация включает агонист STING, агонист TLR (например, агонист TLR7) и ингибитор VEGFR. В другом варианте осуществления антигенпрезентирующая комбинация включает агонист STING, агонист TLR (например, агонист TLR7) и ингибитор c-MET. В других вариантах осуществления антигенпрезентирующая комбинация включает онколитический вирус. В других вариантах осуществления антигенпрезентирующая комбинация включает онколитический вирус и цитокин, например, онколитический вирус, экспрессирующий один или более из ГМ-КСФ или М-КСФ (например, CSF1 или CSF2). В некоторых вариантах осуществления антигенпрезентирующая комбинация включает би- или триспецифичный активатор клеток, например, молекулу би- или триспецифичного антитела к CD47 и CD19, с или без Fc-домена. В некоторых вариантах осуществления антигенпрезентирующая комбинация включает ингибитор TGFb (например, антитело против TGFb). В других вариантах осуществления антигенпрезентирующая комбинация включает ингибитор IDO/TDO. В других вариантах осуществления антигенпрезентирующая комбинация включает антагонист A2AR. В других вариантах осуществления антигенпрезентирующая комбинация включает вакцину (например, IL-2 в комбинации с MUC1 или вакцину на основе дендритных клеток (например, Provenge®)). В других вариантах осуществления антигенпрезентирующая комбинация включает вакцину и агонист TLR (например, агонист TLR, как описано в настоящей заявке). В определенном варианте осуществления антигенпрезентирующая комбинация включает вакцину и агонист STING. В определенном варианте осуществления антигенпрезентирующая комбинация включает вакцину, агонист STING и агонист TLR.
В некоторых вариантах осуществления комбинация включает одно, два, три, четыре, пять или более терапевтических средств, которые усиливают ответ эффекторной клетки (указана в настоящей заявке как "комбинация эффекторной клетки"). В некоторых вариантах осуществления комбинация эффекторной клетки включает активатор лимфоцитов, например, активатор NK-клеток и/или активатор Т-клеток. В некоторых вариантах осуществления комбинация эффекторной клетки активирует (например, деингибирует) инфильтрирующий опухоль лимфоцит (TIL), например, NK-клетку или Т-клетку. В некоторых вариантах осуществления комбинация эффекторной клетки включает модулятор NK-клеток, выбранный из модулятора (например, молекулы антитела) NK рецептора (например, модулятора одного или более из NKG2A, KIR3DL, NKp46, MICA или CEACAM1); интерлейкина или варианта интерлейкина (например, цитокин IL-2, IL-15, IL-21, IL-13R или IL-12 или их вариант, или их комбинация); би- или триспецифичного активатора клеток (например, молекулы биспецифичного антитела NKG2A и CD138 или молекулы биспецифичного антитела CD3 и TCR); NK-клеточной терапии; или вакцины, которая включает NK-клетки и антиген/иммунный стимулятор. В некоторых вариантах осуществления комбинация эффекторной клетки включает иммуномодулятор (например, один или более из: активатора костимулирующей молекулы или ингибитора молекулы иммунной контрольной точки, как описано в настоящей заявке). В некоторых вариантах осуществления комбинация эффекторной клетки включает модулятор Т-клеток, выбранный из ингибитора ингибитора контрольной точки (например, ингибитора одного или более из: PD-1, PD-L1, TIM-3, LAG-3, VISTA, DKG-α, B7-H3, B7-H-4, TIGIT, CTLA-4, BTLA, CD160, TIM1, IDO, LAIR1, IL-12 или их комбинации, например, ингибитора PD-1 и TIM-3, или ингибитора PD-1 и LAG-3). В одном варианте осуществления ингибитор ингибитора контрольной точки является молекулой антитела (например, моно- или биспецифичным антителом или его фрагментом, как описано в настоящей заявке). Например, ингибитор ингибитора контрольной точки является молекулой антитела против PD-1, PD-L1, TIM-3, LAG-3, VISTA, B7-H-4, CTLA-4 или TIGIT или их любой комбинацией (например, комбинацией, как описано в настоящей заявке). В некоторых вариантах осуществления комбинация эффекторной клетки включает модулятор Т-клеток, выбранный из агониста или активатора костимулирующей молекулы. В одном варианте осуществления агонист костимулирующей молекулы выбран из агониста (например, агонистического антитела или его антигенсвязывающего фрагмента или растворимой слитой конструкции) GITR, OX40, ICOS, SLAM (например, SLAMF7), HVEM, СВЕТ, CD2, CD27, CD28, CD, ICAM-1, LFA-1 (CD11a/CD18), ICOS (CD278), 4-1BB (CD137), CD30, CD40, BAFFR, CD7, NKG2C, NKp80, CD160, B7-H3 или лиганда CD83. В других вариантах осуществления комбинация эффекторной клетки включает биспецифичный активатор Т-клеток (например, молекулу биспецифичного антитела, которое связывается с CD3 и опухолевым антигеном (например, EGFR, PSCA, PSMA, EpCAM, HER2, помимо прочих).
В некоторых вариантах осуществления комбинация эффекторной клетки включает одно, два, три, четыре, пять или более терапевтических средств, выбранных из: (i) модулятора GITR (например, агониста GITR), (ii) ингибитора PD-1 (например, молекулы антитела против PD-1, как описано в настоящей заявке), (iii) ингибитора PD-L1, (iv) ингибитора IAP (белка-ингибитора апоптоза), (v) ингибитора EGFR (рецептора эпидермального фактора роста), (vi) ингибитора мишени рапамицина (mTOR), (vii) IL-15 или его варианта, (viii) ингибитора CTLA-4, (ix) биспецифичного активатора Т-клеток (например, молекулы биспецифичного антитела, которое связывается с CD3 и опухолевым антигеном (например, EGFR, PSCA, PSMA, EpCAM, HER2, помимо прочего), (x) агониста CD40 (например, молекулы антитела против CD40), (xi) агониста OX40 (например, молекулы антитела против OX40) или (xii) агониста CD27 (например, молекулы антитела против CD27). Любая комбинация вышеуказанных средств может применяться в комбинации эффекторной клетки. В одном примере осуществления комбинация эффекторной клетки включает агонист GITR. В другом варианте осуществления комбинация эффекторной клетки включает ингибитор PD-1 (например, молекулу антитела против PD-1, как описано в настоящей заявке). В другом варианте осуществления комбинация эффекторной клетки включает ингибитор PD-L1. В других вариантах осуществления комбинация эффекторной клетки включает агонист GITR и ингибитор PD-1 (например, молекулу антитела против PD-1, как описано в настоящей заявке). В других вариантах осуществления комбинация эффекторной клетки включает агонист GITR и ингибитор PD-L1. В других вариантах осуществления комбинация эффекторной клетки включает агонист GITR, ингибитор PD-1 (например, молекулу антитела против PD-1, как описано в настоящей заявке) и ингибитор PD-L1. В других вариантах осуществления комбинация эффекторной клетки включает ингибитор PD-1 (например, молекулу антитела против PD-1, как описано в настоящей заявке) и ингибитор PD-L1. В одном варианте осуществления комбинация эффекторной клетки включает агонист GITR и ингибитор IAP. В другом варианте осуществления комбинация эффекторной клетки включает агонист GITR и ингибитор ингибитора EGFR. В еще одном варианте осуществления комбинация эффекторной клетки включает агонист GITR и ингибитор ингибитора mTOR. В одном варианте осуществления комбинация эффекторной клетки включает IL-15 или его вариант. В одном варианте осуществления комбинация эффекторной клетки включает ингибитор CTLA-4. В одном варианте осуществления комбинация эффекторной клетки включает биспецифичный активатор Т-клеток (например, молекулу биспецифичного антитела, которая связывается с CD3 и опухолевым антигеном (например, EGFR, PSCA, PSMA, EpCAM, HER2, помимо прочего). В одном варианте осуществления комбинация эффекторной клетки включает агонист CD40 (например, молекулу антитела против CD40). В одном варианте осуществления комбинация эффекторной клетки включает агонист OX40 (например, молекулу антитела против OX40). В одном варианте осуществления комбинация эффекторной клетки включает агонист CD27 (например, молекулу антитела против CD27).
В некоторых вариантах осуществления комбинация включает одно, два, три, четыре, пять или более терапевтических средств, которые уменьшают опухолевую иммуносупрессию (указана в настоящей заявке как "комбинация против опухолевой иммуносупрессии"). В некоторых вариантах осуществления комбинация модулирует активность или уровень одного или более из Treg, макрофага 2 или МСК. В некоторых вариантах осуществления комбинация увеличивает одно или более из поляризации M2, истощения Treg или рекрутинга Т-клеток. В некоторых вариантах осуществления комбинация против опухолевой иммуносупрессии включает одно, два, три, четыре, пять или более терапевтических средств, выбранных из: (i) иммуномодулятора (например, одного или более из: активатора костимулирующей молекулы (например, агониста GITR), или ингибитора молекулы иммунной контрольной точки (например, одного или более из PD-1, PD-L1, LAG-3, TIM-3 или CTLA-4), как описано в настоящей заявке), (ii) ингибитора CSF-1/1R (например, ингибитора макрофагального колониестимулирующего фактора (М-КСФ)), (iii) ингибитора IL-17, (iv) ингибитора IL-1β, (v) ингибитора CXCR2, (vi) ингибитора фосфоинозитид-3-киназы (PI3K, например, PI3Kγ или PI3Kδ), (vii) ингибитора BAFF-R, (viii) ингибитора MALT-1/BTK, (ix) ингибитора JAK, (x) ингибитора CRTH2, (xi) ингибитора VEGFR, (xiii) IL-15 или его варианта, (xiv) ингибитора CTLA-4, (xv) ингибитора IDO/TDO, (xvi) антагониста A2AR, (xvii) ингибитора TGFb, или (xviii) ингибитора PFKFB3. В некоторых вариантах осуществления иммуномодулятор является ингибитором молекулы иммунной контрольной точки (например, ингибитором PD-1, PD-L1, LAG-3, TIM-3, CEACAM (например, CEACAM-1, -3 и/или -5) или CTLA-4 или их любой комбинацией). Любая комбинация вышеуказанных средств может применяться в комбинации опухолевой иммуносупрессии. В одном примере осуществления комбинация против опухолевой иммуносупрессии включает одно, два, три, четыре, пять или более терапевтических средств, выбранных из ингибитора PD-1 (например, молекулы антитела против PD-1, как описано в настоящей заявке), ингибитора PD-L1, ингибитора LAG-3, модулятора TIM-3 (например, ингибитора TIM-3), агониста GITR, ингибитора CSF-1/1R (например, ингибитора М-КСФ), ингибитора IL-17, ингибитора IL-1β или ингибитора CXCR2. В одном варианте осуществления комбинация против опухолевой иммуносупрессии включает один, два или все из ингибитора CSF-1/1R (например, ингибитора М-КСФ), ингибитора IL-17, ингибитора IL-1β. В одном варианте осуществления комбинация против опухолевой иммуносупрессии включает ингибитор IL-17, ингибитор CXCR2, ингибитор CRTH2, антагонист A2AR или ингибитор PFKFB3 или их комбинацию.
В некоторых вариантах осуществления комбинация включает одно или более терапевтических средств антигенпрезентирующей комбинации. В других вариантах осуществления комбинация включает одно или более терапевтических средств комбинации эффекторной клетки. В других вариантах осуществления комбинация включает одно или более терапевтических средств комбинации против опухолевой иммуносупрессии. В других вариантах осуществления комбинация включает одно или более терапевтических средств антигенпрезентирующей комбинации и одно или более терапевтических средств комбинации эффекторной клетки. В других вариантах осуществления комбинация включает одно или более терапевтических средств антигенпрезентирующей комбинации и одно или более терапевтических средств комбинации против опухолевой иммуносупрессии. В других вариантах осуществления комбинация включает одно или более терапевтических средств антигенпрезентирующей комбинации, одно или более терапевтических средств комбинации эффекторной клетки и одно или более терапевтических средств комбинации против опухолевой иммуносупрессии. В других вариантах осуществления комбинация включает одно или более терапевтических средств антигенпрезентирующей комбинации, одно или более терапевтических средств комбинации эффекторной клетки и одно или более терапевтических средств комбинации против опухолевой иммуносупрессии.
В некоторых вариантах осуществления комбинация включает:
(i) одно или более терапевтических средств антигенпрезентирующей комбинации, выбранных из одного, двух или всех из агониста STING, агониста TLR (например, агониста TLR7) или модулятора TIM-3 (например, ингибитора TIM-3);
(ii) одно или более терапевтических средств комбинации эффекторной клетки, выбранных из одного, двух или всех из модулятора GITR (например, агониста GITR), ингибитора PD-1 (например, молекулы антитела против PD-1, как описано в настоящей заявке) или ингибитора PD-L1;
(iii) одно или более терапевтических средств комбинации против опухолевой иммуносупрессии, выбранных из одного, двух или всех из CSF-1/1R ингибитора (например, ингибитора М-КСФ), ингибитора IL-17 или ингибитора IL-1β:
(iv) комбинацию (i) и (ii);
(v) комбинацию (i) и (iii);
(vi) комбинацию (ii) и (iii); или
(vii) комбинацию (i), (ii) и (iii).
Комбинация может применяться для лечения рака, как описано в настоящей заявке, такого как рак легкого (плоскоклеточный), рак легкого (аденокарцинома), рак головы и шеи, рак шейки матки (плоскоклеточный), рак желудка, рак щитовидной железы, рак кожи, меланома (например, распространенная меланома), рак носоглотки, рак почки, нейроэндокринная опухоль (NET), рак яичника, рак фаллопиевой трубы, рак толстой и прямой кишки или рак молочной железы. В некоторых вариантах осуществления рак является раком кожи, например, раком из клеток Меркеля или меланомой. В одном варианте осуществления рак является раком из клеток Меркеля. В других вариантах осуществления рак является меланомой. В других вариантах осуществления рак является раком молочной железы, например, трижды негативным раком молочной железы (ТНРМЖ) или HER2-негативным раком молочной железы. В других вариантах осуществления рак является раком почки, например, почечно-клеточной карциномой (например, светлоклеточной почечно-клеточной карциномой (CCRCC) или несветлоклеточной почечно-клеточной карциномой (nccRCC)). В других вариантах осуществления рак является раком щитовидной железы, например, анапластической карциномой щитовидной железы (ATC). В других вариантах осуществления рак является нейроэндокринной опухолью (NET), например, атипичной легочной карциноидной опухолью или NET в поджелудочной железе, желудочно-кишечном тракте (ЖКТ) или легком. В некоторых вариантах осуществления рак является раком легкого, например, немелкоклеточным раком легкого (НМРЛ) (например, плоскоклеточным НМРЛ или неплоскоклеточным НМРЛ). В некоторых вариантах осуществления рак является раком яичника. В некоторых вариантах осуществления рак является раком фаллопиевой трубы. В некоторых вариантах осуществления рак является раком толстой и прямой кишки (CRC) (например, раком толстой и прямой кишки с высокой микросателлитной нестабильностью (MSI-H CRC) или микросателлитно стабильным раком толстой и прямой кишки (MSS CRC)). В некоторых вариантах осуществления рак является лейкозом (например, острым миелоидным лейкозом (ОМЛ), например, рецидивирующим или рефракторным ОМЛ или de novo ОМЛ). В некоторых вариантах осуществления рак является миелодиспластическим синдромом (МДС) (например, МДС с высоким риском).
В других вариантах осуществления комбинация включает терапевтическое средство из антигенпрезентирующей комбинации (например, одно или более из агониста STING, агониста TLR, вакцины или онколитического вируса) в комбинации с терапевтическим средством из комбинации эффекторной клетки и/или комбинации против опухолевой иммуносупрессии (например, ингибитором ингибитора контрольной точки, например, ингибитором PD-1, PD-L1, LAG-3, TIM-3, CEACAM (например, CEACAM-1, -3 и/или -5) или CTLA-4 или их любой комбинацией. В одном варианте осуществления одно или более из агониста STING, агониста TLR, вакцины или онколитического вируса применяют в комбинации с молекулой антитела против PD-1, как описано в настоящей заявке. В одном варианте осуществления агонист STING и/или вакцину применяют в комбинации с молекулой антитела против PD-1, как описано в настоящей заявке. В одном варианте осуществления онколитический вирус применяют в комбинации с молекулой антитела против PD-1, как описано в настоящей заявке. Комбинация может применяться для лечения рака, как описано в настоящей заявке, такого как рак легкого (плоскоклеточный), рак легкого (аденокарцинома), рак головы и шеи, рак шейки матки (плоскоклеточный), рак желудка, рак щитовидной железы, рак кожи, меланома (например, распространенная меланома), рак носоглотки, рак почки, нейроэндокринная опухоль (NET), рак яичника, рак фаллопиевой трубы, рак толстой и прямой кишки или рак молочной железы. В некоторых вариантах осуществления рак является раком кожи, например, раком из клеток Меркеля или меланомой. В одном варианте осуществления рак является раком из клеток Меркеля. В других вариантах осуществления рак является меланомой. В других вариантах осуществления рак является раком молочной железы, например, трижды негативным раком молочной железы (ТНРМЖ) или HER2-негативным раком молочной железы. В других вариантах осуществления рак является раком почки, например, почечно-клеточной карциномой (например, светлоклеточной почечно-клеточной карциномой (CCRCC) или несветлоклеточной почечно-клеточной карциномой (nccRCC)). В других вариантах осуществления рак является раком щитовидной железы, например, анапластической карциномой щитовидной железы (ATC). В других вариантах осуществления рак является нейроэндокринной опухолью (NET), например, атипичной легочной карциноидной опухолью или NET в поджелудочной железе, желудочно-кишечном тракте (ЖКТ) или легком. В некоторых вариантах осуществления рак является раком легкого, например, немелкоклеточным раком легкого (НМРЛ) (например, плоскоклеточным НМРЛ или неплоскоклеточным НМРЛ). В некоторых вариантах осуществления рак является раком яичника. В некоторых вариантах осуществления рак является раком фаллопиевой трубы. В некоторых вариантах осуществления рак является раком толстой и прямой кишки (CRC) (например, раком толстой и прямой кишки с высокой микросателлитной нестабильностью (MSI-H CRC) или микросателлитно стабильным раком толстой и прямой кишки (MSS CRC)). В некоторых вариантах осуществления рак является лейкозом (например, острым миелоидным лейкозом (ОМЛ), например, рецидивирующим или рефракторным ОМЛ или de novo ОМЛ). В некоторых вариантах осуществления рак является миелодиспластическим синдромом (МДС) (например, МДС с высоким риском).
В некоторых вариантах осуществления комбинация включает комбинацию терапевтических средств, как представлено в разделе под заголовком "Примеры антигенпрезентирующих комбинаций, комбинаций эффекторной клетки и комбинаций против опухолевой иммуносупрессии", представленном в Подробном описании.
В некоторых вариантах осуществления комбинация включает ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекулу антитела против PD-1, описанного в настоящей заявке) и ингибитор IAP, (S)-N-(S)-1-циклогексил-2-(S)-2-(4-(4-фторбензоил)тиазол-2-ил)пирролидин-1-ил)-2-оксоэтил)-2-(метиламино)пропанамид (Соединение A21), или соединение, раскрытое в патенте США 8,552,003. В некоторых вариантах осуществления ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекулу антитела против PD-1), вводят в дозе от 200 мг до 600 мг (например, в дозе 400 мг), например, один раз в 4 недели, например, внутривенно. В некоторых вариантах осуществления ингибитор IAP, (S)-N-(S)-1-циклогексил-2-(S)-2-(4-(4-фторбензоил)тиазол-2-ил)пирролидин-1-ил)-2-оксоэтил)-2-(метиламино)пропанамид (Соединение A21), или соединение, раскрытое в патенте США 8,552,003, вводят в дозе от 200 мг до 400 мг (например, в дозе 300 мг), например, один раз в неделю, например, перорально. В некоторых вариантах осуществления комбинация применяется для лечения рака, описанного в настоящей заявке, например, рака толстой и прямой кишки, рака легкого (например, немелкоклеточного рака легкого (НМРЛ)) или рака молочной железы (например, трижды негативного рака молочной железы (например, ТНРМЖ)).
В других вариантах осуществления комбинация включает ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекулу антитела против PD-1, описанного в настоящей заявке) и ингибитор mTOR, эверолимус (Соединение A36), или соединение, раскрытое в публикации PCT WO 2014/085318. В некоторых вариантах осуществления ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекулу антитела против PD-1), вводят в дозе от 200 мг до 600 мг (например, в дозе 400 мг), например, один раз в 4 недели, например, внутривенно. В некоторых вариантах осуществления, ингибитор mTOR, эверолимус (Соединение A36), или соединение, раскрытое в публикации PCT WO 2014/085318, вводят в дозе от 2 мг до 8 мг (например, в дозе 5 мг), например, один раз в неделю, например, перорально. В некоторых вариантах осуществления комбинация применяется для лечения рака, описанного в настоящей заявке, например, рака толстой и прямой кишки, рака легкого (например, немелкоклеточного рака легкого (НМРЛ)) или рака молочной железы (например, трижды негативного рака молочной железы (например, ТНРМЖ)).
В других вариантах осуществления комбинация включает ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекулу антитела против PD-1, описанного в настоящей заявке) и ингибитор DAC, панобиностат (Соединение A19), или соединение, раскрытое в публикации PCT WO 2014/072493. В некоторых вариантах осуществления ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекулу антитела против PD-1), вводят в дозе от 200 мг до 600 мг (например, в дозе 400 мг), например, один раз в 4 недели, например, внутривенно. В некоторых вариантах осуществления ингибитор DAC, панобиностат (Соединение A19), или соединение, раскрытое в публикации PCT WO 2014/072493, применен в дозе от 5 мг до 15 мг (например, в дозе 10 мг), например, три раза в неделю (например, по схеме введения неделя через неделю), например, перорально. В некоторых вариантах осуществления комбинация применяется для лечения рака, описанного в настоящей заявке, например, рака толстой и прямой кишки, рака легкого (например, немелкоклеточного рака легкого (НМРЛ)) или рак молочной железы (например, трижды негативного рака молочной железы (например, ТНРМЖ)).
В других вариантах осуществления комбинация включает ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекулу антитела против PD-1, описанного в настоящей заявке) и ингибитор IL-1β, канакинумаб, или соединение, раскрытое в публикации PCT WO 2002/16436. В некоторых вариантах осуществления ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекулу антитела против PD-1), вводят в дозе от 200 мг до 600 мг (например, в дозе 400 мг), например, один раз в 4 недели, например, внутривенно. В некоторых вариантах осуществления ингибитор IL-1β, канакинумаб, или соединение, раскрытое в публикации PCT WO 2002/16436, вводят в дозе от 50 мг до 150 мг (например, в дозе 100 мг), например, один раз в восемь недель, например, подкожно. В некоторых вариантах осуществления комбинация применяется для лечения рака, описанного в настоящей заявке, например, рака толстой и прямой кишки (например, микросателлитно стабильного рака толстой и прямой кишки (MSS CRC)), рака легкого (например, немелкоклеточного рака легкого (НМРЛ)) или рака молочной железы (например, трижды негативного рака молочной железы (например, ТНРМЖ)).
В других вариантах осуществления комбинация включает ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекулу антитела против PD-1, описанного в настоящей заявке) и ингибитор IL-17, CJM112, или соединение, раскрытое в публикации PCT WO 2014/122613. В некоторых вариантах осуществления ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекулу антитела против PD-1), вводят в дозе от 200 мг до 600 мг (например, в дозе 400 мг), например, один раз в 4 недели, например, внутривенно. В некоторых вариантах осуществления ингибитор IL-17, CJM112, или соединение, раскрытое в публикации PCT WO 2014/122613, вводят в дозе от 10 мг до 50 мг (например, в дозе 25 мг), например, один раз в четыре недели, например, внутривенно. В некоторых вариантах осуществления комбинация применяется для лечения рака, описанного в настоящей заявке, например, рака толстой и прямой кишки (например, MSS CRC), рака легкого (например, немелкоклеточного рака легкого (НМРЛ)) или рака молочной железы (например, трижды негативного рака молочной железы (например, ТНРМЖ)).
В других вариантах осуществления комбинация включает ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекулу антитела против PD-1, описанного в настоящей заявке) и ингибитор MEK или траметиниб. В некоторых вариантах осуществления ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекулу антитела против PD-1), вводят в дозе от 200 мг до 600 мг (например, в дозе 400 мг), например, один раз в 4 недели, например, внутривенно. В некоторых вариантах осуществления ингибитор MEK или траметиниб вводят в дозе от 0,2 мг до 1 мг (например, в дозе 0,5 мг), например, один раз в день, например, перорально. В некоторых вариантах осуществления комбинация применяется для лечения рака, описанного в настоящей заявке, например, рака толстой и прямой кишки, рака легкого (например, немелкоклеточного рака легкого (НМРЛ)) или рака молочной железы (например, трижды негативного рака молочной железы (например, ТНРМЖ)).
В некоторых вариантах осуществления комбинация включает ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекулу антитела против PD-1, описанного в настоящей заявке), ингибитор BRAF или дабрафениб и ингибитор MEK или траметиниб. В некоторых вариантах осуществления ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекулу антитела против PD-1), вводят в дозе от 200 мг до 600 мг (например, в дозе 400 мг), например, один раз в 4 недели, например, внутривенно. В некоторых вариантах осуществления ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекулу антитела против PD-1), вводят в дозе от 200 мг до 600 мг (например, в дозе 400 мг), например, один раз в 8 недель, например, внутривенно. В некоторых вариантах осуществления ингибитор BRAF или дабрафениб вводят в дозе от 50 мг до 250 мг (например, в дозе 150 мг) два раза в день, например, перорально. В некоторых вариантах осуществления ингибитор MEK или траметиниб вводят в дозе от 1 мг до 3 мг (например, в дозе 2 мг), например, один раз в день, например, перорально. В некоторых вариантах осуществления ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекула антитела против PD-1), вводят, например, в дозе от 200 мг до 600 мг (например, в дозе 400 мг), например, один раз в 4 недели, после введения ингибитора BRAF или дабрафениба, ингибитора MEK или траметиниба или обоих в течение, например, 2-8 недель, например, 4 недель. В некоторых вариантах осуществления комбинация применяется для лечения рака, описанного в настоящей заявке, например, рака кожи (например, меланомы, например, неоперабельной или метастатической меланомы). В некоторых вариантах осуществления комбинация применяется для лечения рака, который имеет мутацию BRAF, например, мутацию BRAF V600. В других вариантах осуществления комбинация применяется для лечения рака у субъекта, имеющего повышенный уровень лактатдегидрогеназы (ЛДГ) в сыворотке по сравнению с референсным уровным ЛДГ. В некоторых вариантах осуществления комбинация применяется для лечения субъекта, который имеет неоперабельную или метастатическую меланому, имеющую мутацию BRAF (например, мутацию BRAF V600), и имеет повышенный уровень ЛДГ в сыворотке по сравнению с референсным уровнем ЛДГ в сыворотке.
В других вариантах осуществления комбинация включает ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекулу антитела против PD-1, описанного в настоящей заявке) и ингибитор EGFR, (R,E)-N-(7-хлор-1-(1-(4-(диметиламино)бут-2-еноил)азепан-3-ил)-1H-бензо[d]имидазол-2-ил)-2-метилизоникотинамид (Соединение A40), или соединение, раскрытое в публикации PCT WO 2013/184757. В некоторых вариантах осуществления ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекулу антитела против PD-1), вводят в дозе от 200 мг до 600 мг (например, в дозе 400 мг), например, один раз в 4 недели, например, внутривенно. В некоторых вариантах осуществления ингибитор EGFR, (R,E)-N-(7-хлор-1-(1-(4-(диметиламино)бут-2-еноил)азепан-3-ил)-1H-бензо[d]имидазол-2-ил)-2-метилизоникотинамид (Соединение A40), или соединение, раскрытое в публикации PCT WO 2013/184757, вводят в дозе от 10 мг до 50 мг (например, в дозе 25 мг), например, один раз в день (например, в день 1 до дня 10 первого курса введения), например, перорально. В некоторых вариантах осуществления комбинация применяется для лечения рака, описанного в настоящей заявке, например, рака толстой и прямой кишки, рака легкого (например, немелкоклеточного рака легкого (НМРЛ)) или рака молочной железы (например, трижды негативного рака молочной железы (например, ТНРМЖ)).
В других вариантах осуществления комбинация включает ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекулу антитела против PD-1, описанного в настоящей заявке) и CSF-1/1R-связывающее средство (например, ингибитор тирозинкиназы CSF-1R), 4-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)окси)-N-метилпиколинамид (Соединение A15), или соединение, раскрытое в публикации PCT WO 2005/073224. В некоторых вариантах осуществления ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекулу антитела против PD-1), вводят в дозе от 200 мг до 600 мг (например, в дозе 400 мг), например, один раз в 4 недели, например, внутривенно. В некоторых вариантах осуществления CSF-1/1R-связывающее средство (например, ингибитор тирозинкиназы CSF-1R), 4-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)окси)-N-метилпиколинамид (Соединение A15), или соединение, раскрытое в публикации PCT WO 2005/073224, вводят в дозе от 50 мг до 1000 мг (например, в дозе 100 мг, 150 мг, 300 мг, 600 мг, 900 мг), например, ежедневно, согласно схеме 7 дней через 7 дней или один раз в неделю, например, перорально. В некоторых вариантах осуществления комбинация применяется для лечения рака, описанного в настоящей заявке, например, рака головного мозга (например, мультиформной глиобластомы (GBM)), рака молочной железы (например, трижды негативного рака молочной железы (например, ТНРМЖ)) или рака поджелудочной железы.
В других вариантах осуществления комбинация включает ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекулу антитела против PD-1, описанного в настоящей заявке) и ингибитор 6-фосфофрукто-2-киназы/фруктозо-2,6-бисфосфатазы 3 (PFKFB3), PFK-158, или соединение, раскрытое в публикации PCT WO 2013/148228. В некоторых вариантах осуществления ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекулу антитела против PD-1), вводят в дозе от 200 мг до 600 мг (например, в дозе 400 мг), например, один раз в 4 недели, например, внутривенно. В некоторых вариантах осуществления комбинация применяется для лечения рака, описанного в настоящей заявке, например, рака яичника, рака фаллопиевой трубы или рака толстой и прямой кишки (CRC).
В одном варианте осуществления комбинация включает ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекулу антитела против PD-1, описанного в настоящей заявке) и химиотерапевтическое средство, например, паклитаксел (например, паклитаксел-альбумин). В некоторых вариантах осуществления ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекулу антитела против PD-1), вводят в дозе от 200 мг до 600 мг (например, в дозе 400 мг), например, один раз в 4 недели, например, внутривенно. В некотором варианте осуществления химиотерапевтическое средство, например, паклитаксел (например, паклитаксел-альбумин), вводят в дозе от 50 мг/м2 до 200 мг/м2 (например, в дозе 100 мг/м2), например, еженедельно в День 1, День 8 и День 15 раз в четыре недели (qw3/4), например, внутривенно. В некоторых вариантах осуществления комбинация применяется для лечения рака, описанного в настоящей заявке, например, рака молочной железы (например, HER2-негативного рака молочной железы).
В других вариантах осуществления комбинация включает ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекулу антитела против PD-1, описанного в настоящей заявке) и ингибитор TGF-β, XOMA 089, или соединение, раскрытое в публикации PCT WO 2012/167143. В некоторых вариантах осуществления ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекула антитела против PD-1), вводят в дозе от 100 мг до 600 мг (например, в дозе 100 мг или 300 мг), например, один раз в 3 недели, например, внутривенно. В некоторых вариантах осуществления ингибитор TGF-β, XOMA 089, или соединение, раскрытое в публикации PCT WO 2012/167143, вводят в дозе от 0,1 мг/кг до 15 мг/кг, например, от 0,1 мг/кг до 6 мг/кг, или от 0,3 мг/кг до 3 мг/кг (например, в дозе 0,1 мг/кг, 0,3 мг/кг, 1 мг/кг, 3 мг/кг, 6 мг/кг, 10 мг/кг или 15 мг/кг), например, один раз в три недели, например, внутривенно. В некоторых вариантах осуществления комбинация применяется для лечения рака, описанного в настоящей заявке, например, рака поджелудочной железы, рака толстой и прямой кишки (например, микросателлитно стабильного рака толстой и прямой кишки (MSS-CRC)), рака легкого (например, немелкоклеточного рака легкого), рака молочной железы (например, трижды негативного рака молочной железы), рака печени (например, гепатоцеллюлярной карциномы), рака предстательной железы или рака почки (например, светлоклеточной почечно-клеточной карциномы).
В других вариантах осуществления комбинация включает ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекулу антитела против PD-1, описанного в настоящей заявке) и ингибитор PD-L1 или молекулу антитела против PD-L1, раскрытого в публикации заявки на патент США 2016/0108123. В некоторых вариантах осуществления ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекулу антитела против PD-1), вводят в дозе от 100 мг до 600 мг (например, в дозе 100 мг или 300 мг), например, один раз в 3 недели, например, внутривенно. В некоторых вариантах осуществления ингибитор PD-L1 или молекулу антитела против PD-L1, раскрытую в публикации заявки на патент США 2016/0108123, вводят в дозе от 10 мг до 2000 мг (например, от 20 мг до 1600 мг или от 80 мг до 1200 мг (например, в дозе 20 мг, 80 мг, 240 мг, 800 мг или 1200 мг), например, один раз в три недели или один раз в шесть недель, например, внутривенно. В некоторых вариантах осуществления комбинация применяется для лечения рака, описанного в настоящей заявке, например, солидной опухоли, например, рака легкого (например, немелкоклеточного рака легкого), рака молочной железы (например, трижды негативного рака молочной железы), рака матки (например, рака эндометрия) или рака щитовидной железы (например, анапластической карциномой щитовидной железы).
В других вариантах осуществления комбинация включает ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекулу антитела против PD-1, описанного в настоящей заявке) и химиотерапевтическое средство (например, гипометилирующее средство, например, децитабин). В некоторых вариантах осуществления ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекулу антитела против PD-1), вводят в дозе от 200 мг до 600 мг (например, от 300 мг до 500 мг, например, в дозе 400 мг), например, один раз в 4 недели, например, внутривенно. В некоторых вариантах осуществления химиотерапевтическое средство (например, гипометилирующее средство, например, децитабин) вводят в дозе от 5 мг/м2 до 50 мг/м2 (например, от 10 мг/м2 до 30 мг/м2, например, в дозе 20 мг/м2), например, ежедневно, например, в течение 1, 2, 3, 4, 5, 6, 7, 8 или более дней, например, внутривенно. В некоторых вариантах осуществления ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекулу антитела против PD-1), вводят в день 8 28-дневного курса и химиотерапевтическое средство (например, гипометилирующее средство, например, децитабин) вводят в дни 1, 2, 3, 4 и 5 28-дневного курса. В некоторых вариантах осуществления комбинация применяется для лечения рака, описанного в настоящей заявке, например, гемобластоза, например, лейкоза (например, острого миелоидного лейкоза (ОМЛ), например, рецидивирующего или рефракторного ОМЛ или de novo ОМЛ), или миелодиспластического синдрома (МДС) (например, МДС с высоким риском).
В других вариантах осуществления комбинация включает ингибитор молекулы иммунной контрольной точки, например, ингибитор TIM-3 или молекулу антитела против TIM-3, раскрытого в публикации заявки на патент США 2015/0218274, и химиотерапевтическое средство (например, гипометилирующее средство, например, децитабин). В некоторых вариантах осуществления ингибитор молекулы иммунной контрольной точки, например, ингибитор TIM-3 или молекулу антитела против TIM-3, раскрытого в публикации заявки на патент США 2015/0218274, вводят в дозе от 50 мг до 500 мг (например, от 100 мг до 400 мг, например, в дозе 240 мг), например, один раз в 2 недели, например, внутривенно. В некоторых вариантах осуществления химиотерапевтическое средство (например, гипометилирующее средство, например, децитабин) вводят в дозе от 5 мг/м2 до 50 мг/м2 (например, от 10 мг/м2 до 30 мг/м2, например, в дозе 20 мг/м2), например, ежедневно, например, в течение 1, 2, 3, 4, 5, 6, 7, 8 или более дней, например, внутривенно. В некоторых вариантах осуществления ингибитор молекулы иммунной контрольной точки, например, ингибитор TIM-3 или молекулу антитела против TIM-3, раскрытого в публикации заявки на патент США 2015/0218274, вводят в дни 8 и 22 28-дневного курса и химиотерапевтическое средство (например, гипометилирующее средство, например, децитабин) вводят в дни 1, 2, 3, 4 и 5 28-дневного курса. В некоторых вариантах осуществления комбинация применяется для лечения рака, описанного в настоящей заявке, например, гемобластоза, например, лейкоза (например, острого миелоидного лейкоза (ОМЛ), например, рецидивирующего или рефракторного ОМЛ или de novo ОМЛ) или миелодиспластического синдрома (МДС) (например, МДС с высоким риском).
В других вариантах осуществления комбинация включает ингибитор PD-1 (например, молекулу антитела против PD-1, описанного в настоящей заявке), ингибитор TIM-3 (например, молекулу антитела против TIM-3, раскрытого в публикации заявки на патент США 2015/0218274) и химиотерапевтическое средство (например, гипометилирующее средство, например, децитабин). В некоторых вариантах осуществления ингибитор PD-1 (например, молекулу антитела против PD-1), вводят в дозе от 200 мг до 600 мг (например, от 300 мг до 500 мг, например, в дозе 400 мг), например, один раз в 4 недели, например, внутривенно. В некоторых вариантах осуществления ингибитор TIM-3 (например, молекулу антитела против TIM-3, раскрытого в публикации заявки на патент США 2015/0218274) вводят в дозе от 20 мг до 400 мг (например, от 40 мг до 200 мг или от 50 мг до 100 мг, например, в дозе 80 мг), например, один раз в 2 недели, например, внутривенно. В некоторых вариантах осуществления химиотерапевтическое средство (например, гипометилирующее средство, например, децитабин) вводят в дозе от 5 мг/м2 до 50 мг/м2 (например, от 10 мг/м2 до 30 мг/м2, например, в дозе 20 мг/м2), например, ежедневно, например, в течение 1, 2, 3, 4, 5, 6, 7, 8 или более дней, например, внутривенно. В некоторых вариантах осуществления ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в день 8 28-дневного курса, ингибитор TIM-3 (например, молекулу антитела против TIM-3, раскрытого в публикации заявки на патент США 2015/0218274) вводят в дни 8 и 22 28-дневного курса и химиотерапевтическое средство (например, децитабин) вводят в дни 1, 2, 3, 4 и 5 28-дневного курса. В некоторых вариантах осуществления комбинация применяется для лечения рака, описанного в настоящей заявке, например, гемобластоза, например, лейкоза (например, острого миелоидного лейкоза (ОМЛ), например, рецидивирующего или рефракторного ОМЛ или de novo ОМЛ), или миелодиспластического синдрома (МДС) (например, МДС с высоким риском).
Комбинации, раскрытые в настоящей заявке, могут вводить вместе в одной композиции или вводить отдельно в двух или более разных композициях, например, композициях или дозированных лекарственных формах, как описано в настоящей заявке. Введение терапевтических средств может осуществляться в любом порядке. Первое средство и дополнительные средства (например, второе, третье средства) могут вводить одним и тем же путем введения или разными путями введения. Например, первое терапевтическое средство могут вводить одновременно, до или после дополнительного средства. В некоторых вариантах осуществления первое средство вводят местно, например, терапевтическое средство любой из категорий (i)-(iii) может быть связано со средством, направленно взаимодействующим на опухоль, например, направленно взаимодействующим на опухоль антителом (например, с получением конъюгата антитела-лекарственного средства), или любым другим носителем (например, лекарственная форма, такая как лекарственная форма направленного действия) таким образом, что введение первого средства локализовано в нужной области, например, области локализации опухоли (например, обогащенной дендритными клетками области). В одном варианте осуществления терапевтическое средство является антигеном (например, вакциной, например, противоопухолевой вакциной in situ), который направленно взаимодействует с окружением опухоли, что приводит к активации дендритных клеток. Терапевтическое средство также можно вводить местно, например, вводить в область локализации опухоли (например, интратуморальное или перитуморальное введение). Локализованная доставка или введение терапевтического средства могут уменьшать один или более побочных эффектов или токсичность, которые в ином случае ассоциированы с системным введением терапевтического средства. В одном примере осуществления терапевтическое средство (например, STING или TLR) может быть конъюгировано с антителом, связывающим опухоль (например, антителом, которое связывается с HER2), что обеспечивает доставку терапевтического средства к HER-2-экспрессирующей клетке.
При введении в комбинации, первое средство, дополнительное средство (например, второе или третье средство) или все средства могут вводить в количестве или дозе, которая выше, ниже или такая же, как количество или доза каждого средства, применяемого индивидуально, например, в виде монотерапии. В некоторых вариантах осуществления вводимое количество или доза первого средства, дополнительного средства (например, второго или третьего средства) или всех средств ниже (например, по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 40% или по меньшей мере на 50%), чем количество или доза каждого средства, применяемого индивидуально, например, в виде монотерапии. В других вариантах осуществления количество или доза первого средства, дополнительного средства (например, второго или третьего средства) или всех средств, которая приводит к требуемому эффекту (например, лечению рака), является более низкой (например, по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 40% или по меньшей мере на 50% более низкой).
В некоторых вариантах осуществления комбинации могут быть представлены в форме молекулы антитела, например, би- или триспецифичной молекулы, против одного или более терапевтических средств, выбранных из антигенпрезентирующей комбинации, комбинации эффекторной клетки или комбинации против опухолевой иммуносупрессии или их любой комбинации. Например, биспецифичная молекула против двух или больше ингибиторов контрольной точки (например, молекула антитела против PD-1 и против LAG-3). В других вариантах осуществления комбинации могут быть представлены в форме молекулы антитела, например, би- или триспецифичной молекулы, против одного или более терапевтических средств, выбранных из двух или всех из антигенпрезентирующей комбинации, комбинации эффекторной клетки и/или комбинации против опухолевой иммуносупрессии. В одном варианте осуществления молекула антитела является полноразмерным антителом или его фрагментом (например, Fab, F(ab')2, Fv или одноцепочечным Fv-фрагментом (scFv)). В других вариантах осуществления молекула антитела имеет константную область тяжелой цепи (Fc), выбранную из, например, константных областей тяжелой цепи IgG1, IgG2, IgG3, IgG4, IgM, IgA1, IgA2, IgD и IgE; в частности, выбранную из, например, константных областей тяжелой цепи IgG1, IgG2, IgG3 и IgG4, более конкретно, константных областей тяжелой цепи IgG1 или IgG4 (например, IgG1 или IgG4 человека). В одном варианте осуществления константная область тяжелой цепи является человеческим IgG1 или человеческим IgG4. В одном варианте осуществления константная область изменена, например, мутирована, с целью изменения свойств молекулы антитела (например, с целью увеличения или уменьшения одного или более из: связывания Fc-рецептора, гликозилирования антитела, количества остатков цистеина, эффекторной функции или функции комплемента). В некоторых вариантах осуществления молекула антитела представлена в форме молекулы биспецифичного или мультиспецифичного антитела, например, молекулы биспецифичного, триспецифичного антитела, как описано в настоящей заявке.
Некоторые примеры терапевтических средств и их комбинаций представлены в настоящей заявке ниже. Более подробное описание терапевтических средств, применяемых в комбинациях, представлено в Подробном описании.
Иммуномодуляторы
В некоторых вариантах осуществления иммуномодулятор, применяемый в комбинациях, раскрытых в настоящей заявке (например, в комбинации с терапевтическим средством, выбранным из антигенпрезентирующей комбинации), является ингибитором молекулы иммунной контрольной точки. В одном варианте осуществления иммуномодулятор является ингибитором PD-1, PD-L1, PD-L2, CTLA-4, TIM-3, LAG-3, CEACAM (например, CEACAM-1, -3 и/или -5), VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4 и/или TGF-бета. В одном варианте осуществления ингибитор молекулы иммунной контрольной точки ингибирует PD-1, PD-L1, LAG-3, TIM-3, CEACAM (например, CEACAM-1, -3 и/или -5), CTLA-4 или их любую комбинацию.
Ингибирование ингибирующей молекулы может быть выполнено на уровне ДНК, РНК или белка. В вариантах осуществления ингибирующая нуклеиновая кислота (например, дцРНК, миРНК или мшРНК) может применяться для ингибирования экспрессии ингибирующей молекулы. В других вариантах осуществления ингибитор ингибирующего сигнала является полипептидом, например, растворимым лигандом (например, PD-1-Ig или CTLA-4 Ig) или антителом или его антигенсвязывающим фрагментом, которые связываются с ингибирующей молекулой; например, антителом или его фрагментом (также указанными в настоящей заявке как "молекула антитела"), которые связываются с PD-1, PD-L1, PD-L2, CEACAM (например, CEACAM-1, -3 и/или -5), CTLA-4, TIM-3, LAG-3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4 и/или TGF-бета или их комбинацией.
В некоторых вариантах осуществления молекула антитела представлена в форме молекулы биспецифичного или мультиспецифичного антитела. В одном варианте осуществления молекула биспецифичного антитела обладает первой специфичностью связывания к PD-1 или PD-L1 и второй специфичностью связывания, например, второй специфичностью связывания в отношении TIM-3, CEACAM (например, CEACAM-1, -3 и/или -5), LAG-3 или PD-L2. В одном варианте осуществления молекула биспецифичного антитела связывается с PD-1 или PD-L1 и TIM-3. В другом варианте осуществления молекула биспецифичного антитела связывается с PD-1 или PD-L1 и LAG-3. В другом варианте осуществления молекула биспецифичного антитела связывается с PD-1 или PD-L1 и CEACAM (например, CEACAM-1, -3 и/или -5). В другом варианте осуществления молекула биспецифичного антитела связывается с PD-1 или PD-L1 и CEACAM-1. В другом варианте осуществления молекула биспецифичного антитела связывается с PD-1 или PD-L1 и CEACAM-3. В еще одном варианте осуществления молекула биспецифичного антитела связывается с PD-1 или PD-L1 и CEACAM-5. В другом варианте осуществления молекула биспецифичного антитела связывается с PD-1 или PD-L1. В еще одном варианте осуществления молекула биспецифичного антитела связывается с PD-1 и PD-L2. В другом варианте осуществления молекула биспецифичного антитела связывается с TIM-3 и LAG-3. В другом варианте осуществления молекула биспецифичного антитела связывается с CEACAM (например, CEACAM-1, -3 и/или -5) и LAG-3. В другом варианте осуществления молекула биспецифичного антитела связывается с CEACAM (например, CEACAM-1, -3 и/или -5) и TIM-3. Любая комбинация вышеуказанных молекул может быть получена в молекуле мультиспецифичного антитела, например, триспецифичного антитела, которое включает первую специфичность связывания в отношении PD-1 или PD-1, и вторую и третью специфичности связывания в отношении двух или более из: TIM-3, CEACAM (например, CEACAM-1, -3 и/или -5), LAG-3 или PD-L2.
В некоторых вариантах осуществления иммуномодулятор является ингибитором PD-1, например, человеческого PD-1 (например, молекулой антитела, как описано в настоящей заявке). В другом варианте осуществления иммуномодулятор является ингибитором PD-L1, например, человеческого PD-L1. В одном варианте осуществления ингибитор PD-1 или PD-L1 является молекулой антитела к PD-1 или PD-L1. Ингибитор PD-1 или PD-L1 могут вводить отдельно или в комбинации с другими иммуномодуляторами, например, в комбинации с ингибитором LAG-3, TIM-3, CEACAM (например, CEACAM-1, -3 и/или -5) или CTLA-4. В примере осуществления ингибитор PD-1 или PD-L1, например, молекулу антитела против PD-1 или PD-L1, вводят в комбинации с ингибитором LAG-3, например, молекулой антитела против LAG-3. В другом варианте осуществления ингибитор PD-1 или PD-L1, например, молекулу антитела против PD-1 или PD-L1, вводят в комбинации с ингибитором TIM-3, например, молекулой антитела против TIM-3. В другом варианте осуществления ингибитор PD-1 или PD-L1, например, молекулу антитела против PD-1 или PD-L1, вводят в комбинации с ингибитором CEACAM (например, CEACAM-1, -3 и/или -5 ингибиторов), например, молекулой антитела против CEACAM. В другом варианте осуществления ингибитор PD-1 или PD-L1, например, молекулу антитела против PD-1 или PD-L1, вводят в комбинации с ингибитором CEACAM-1, например, молекулой антитела против CEACAM-1. В другом варианте осуществления ингибитор PD-1 или PD-L1, например, молекулу антитела против PD-1 или PD-L1, вводят в комбинации с ингибитором CEACAM-5, например, молекулой антитела против CEACAM-5. В других вариантах осуществления ингибитор PD-1 или PD-L1, например, молекулу антитела против PD-1, вводят в комбинации с ингибитором LAG-3, например, молекулой антитела против LAG-3, и ингибитором TIM-3, например, молекулой антитела против TIM-3. Другие комбинации иммуномодуляторов с ингибитором PD-1 (например, одного или более из PD-L2, CTLA-4, TIM-3, LAG-3, CEACAM (например, CEACAM-1, -3 и/или -5), VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4 и/или TGF-бета) также включены в объем настоящего изобретения. Любая из молекул антител, известных в уровне техники или раскрытых в настоящей заявке, может применяться в вышеуказанных комбинациях ингибиторов молекулы контрольной точки.
В других вариантах осуществления иммуномодулятор является ингибитором CEACAM (например, CEACAM-1, -3 и/или -5), например, человеческого CEACAM (например, CEACAM-1, -3 и/или -5). В одном варианте осуществления иммуномодулятор является ингибитором CEACAM-1, например, человеческого CEACAM-1. В другом варианте осуществления иммуномодулятор является ингибитором CEACAM-3, например, человеческого CEACAM-3. В другом варианте осуществления иммуномодулятор является ингибитором CEACAM-5, например, человеческого CEACAM-5. В одном варианте осуществления ингибитор CEACAM (например, CEACAM-1, -3 и/или -5) является молекулой антитела к CEACAM (например, CEACAM-1, -3 и/или -5). Ингибитор CEACAM (например, CEACAM-1, -3 и/или -5) могут вводить отдельно или в комбинации с другими иммуномодуляторами, например, в комбинации с ингибитором LAG-3, TIM-3, PD-1, PD-L1 или CTLA-4.
В других вариантах осуществления иммуномодулятор является ингибитором LAG-3, например, человеческого LAG-3. В одном варианте осуществления ингибитор LAG-3 является молекулой антитела к LAG-3. Ингибитор LAG-3 могут вводить отдельно или в комбинации с другими иммуномодуляторами, например, в комбинации с ингибитором CEACAM (например, CEACAM-1, -3 и/или -5), TIM-3, PD-1, PD-L1 или CTLA-4.
В других вариантах осуществления иммуномодулятор является ингибитором TIM-3, например, человеческого TIM-3. В одном варианте осуществления ингибитор TIM-3 является молекулой антитела к TIM-3. Ингибитор TIM-3 могут вводить отдельно или в комбинации с другими иммуномодуляторами, например, в комбинации с ингибитором CEACAM (например, CEACAM-1, -3 и/или -5), LAG-3, PD-1, PD-L1 или CTLA-4.
В некоторых вариантах осуществления иммуномодулятор, применяемый в комбинациях, раскрытых в настоящей заявке (например, в комбинации с терапевтическим средством, выбранным из антигенпрезентирующей комбинации), является активатором или агонистом костимулирующей молекулы. В одном варианте осуществления агонист костимулирующей молекулы выбран из агониста (например, агонистического антитела или его антигенсвязывающим фрагментом или растворимой слитой конструкцией) OX40, CD2, CD27, CD28, CD, ICAM-1, LFA-1 (CD11a/CD18), ICOS (CD278), 4-1BB (CD137), GITR, CD30, CD40, BAFFR, HVEM, CD7, СВЕТ, NKG2C, SLAMF7, NKp80, CD160, B7-H3 или лиганда CD83.
В других вариантах осуществления иммуномодулятор является агонистом GITR. В одном варианте осуществления агонист GITR является молекулой антитела к GITR. Агонист GITR могут вводить отдельно или в комбинации с другими иммуномодуляторами, например, в комбинации с ингибитором PD-1, PD-L1, CTLA-4, CEACAM (например, CEACAM-1, -3 и/или -5), TIM-3 или LAG-3. В некоторых вариантах осуществления молекула антитела против GITR является биспецифичным антителом, которое связывается с GITR и PD-1, PD-L1, CTLA-4, CEACAM (например, CEACAM-1, -3 и/или -5), TIM-3 или LAG-3. В одном примере осуществления молекулу антитела против GITR вводят в комбинации с молекулой антитела против PD-1 (например, молекулой против PD-1, как описано в настоящей заявке). Молекула антитела к GITR и молекула антитела против PD-1 могут быть представлены в форме композиции отдельных антител или в виде молекулы биспецифичного антитела. В других вариантах осуществления агонист GITR могут вводить в комбинации с другой костимулирующий молекулой, например, агонистом OX40, CD2, CD27, CD28, CD, ICAM-1, LFA-1 (CD11a/CD18), ICOS (CD278), 4-1BB (CD137), CD30, CD40, BAFFR, HVEM, CD7, СВЕТ, NKG2C, SLAMF7, NKp80, CD160, B7-H3 или лиганда CD83.
В других вариантах осуществления иммуномодулятор является активатором костимулирующей молекулы (например, агониста OX40). В одном варианте осуществления агонист OX40 является молекулой антитела к OX40. Агонист OX40 могут вводить отдельно или в комбинации с другими иммуномодуляторами, например, в комбинации с ингибитором PD-1, PD-L1, CTLA-4, CEACAM (например, CEACAM-1, -3 и/или -5), TIM-3 или LAG-3. В некоторых вариантах осуществления молекула антитела против OX40 является биспецифичным антителом, которое связывается с GITR и PD-1, PD-L1, CTLA-4, CEACAM (например, CEACAM-1, -3 и/или -5), TIM-3 или LAG-3. В одном примере осуществления молекулу антитела OX40 вводят в комбинации с молекулой антитела против PD-1 (например, молекулой против PD-1, как описано в настоящей заявке). Молекула антитела OX40 и молекула антитела против PD-1 могут быть представлены в форме композиции отдельных антител или в виде молекулы биспецифичного антитела. В других вариантах осуществления агонист OX40 могут вводить в комбинации с другой костимулирующий молекулой, например, агонистом GITR, CD2, CD27, CD28, CD, ICAM-1, LFA-1 (CD11a/CD18), ICOS (CD278), 4-1BB (CD137), CD30, CD40, BAFFR, HVEM, CD7, СВЕТ, NKG2C, SLAMF7, NKp80, CD160, B7-H3 или лиганда CD83.
Следует отметить, что в настоящей заявке предложены лишь примерные комбинации ингибиторов ингибиторов контрольной точки или агонистов костимулирующих молекул. Дополнительные комбинации таких средств включены в объем настоящего изобретения.
Молекулы антитела к PD-1
В одном варианте осуществления ингибитор PD-1 является молекулой антитела против PD-1, как описано в публикации заявки на патент США 2015/0210769 (USSN 14/604,415), озаглавленной "Молекулы антител к PD-1 и их применение" ("Antibody Molecules to PD-1 and Uses Thereof"), полностью включенной посредством отсылки. В одном варианте осуществления молекула антитела против PD-1 включает по меньшей мере одну антигенсвязывающую область, например, вариабельную область или соответствующий антигенсвязывающий фрагмент, из антитела, описанного в настоящей заявке, например, антитела, выбранного из любого из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E; или описанные в Таблице 1 или кодируемые нуклеотидной последовательностью в Таблице 1; или последовательностью, по существу идентичной (например, идентичной по меньшей мере на 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или выше) любой из вышеуказанных последовательностей.
В еще одном варианте осуществления молекула антитела против PD-1 включает по меньшей мере одну, две, три или четыре вариабельных области из антитела, описанного в настоящей заявке, например, антитела, выбранное из любого из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E; или описанные в Таблице 1 или кодируемые нуклеотидной последовательностью в Таблице 1; или последовательностью, по существу идентичной (например, идентичной по меньшей мере на 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или выше) любой из вышеуказанных последовательностей.
В еще одном варианте осуществления молекула антитела против PD-1 включает по меньшей мере одну или две вариабельных области тяжелой цепи из антитела, описанного в настоящей заявке, например, антитела, выбранного из любого из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E; или описанные в Таблице 1 или кодируемые нуклеотидной последовательностью в Таблице 1; или последовательностью, по существу идентичной (например, идентичной по меньшей мере на 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или выше) любой из вышеуказанных последовательностей.
В еще одном варианте осуществления молекула антитела против PD-1 включает по меньшей мере одну или две вариабельных области легкой цепи из антитела, описанного в настоящей заявке, например, антитела, выбранного из любого из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E; или описанные в Таблице 1 или кодируемые нуклеотидной последовательностью в Таблице 1; или последовательностью, по существу идентичной (например, идентичной по меньшей мере на 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или выше) любой из вышеуказанных последовательностей.
В еще одном варианте осуществления молекула антитела против PD-1 включает константную область тяжелой цепи IgG4, например, человеческого IgG4. В одном варианте осуществления человеческий IgG4 включает замену в положении 228 согласно нумерации EU (например, замену Ser на Pro). В другом варианте осуществления молекула антитела против PD-1 включает константную область тяжелой цепи IgG1, например, человеческого IgG1. В одном варианте осуществления человеческий IgG1 включает замену в положении 297 согласно нумерации EU (например, замену Asn на Ala). В одном варианте осуществления человеческий IgG1 включает замену в положении 265 согласно нумерации EU, замену в положении 329 согласно нумерации EU или обе таких замены (например, замену Asp на Ala в положении 265 и замену Pro на Ala в положении 329). В одном варианте осуществления человеческий IgG1 включает замену в положении 234 согласно нумерации EU, замену в положении 235 согласно нумерации EU или обе таких замены (например, замену Leu на Ala в положении 234 и замену Leu на Ala в положении 235). В одном варианте осуществления константная область тяжелой цепи включает аминокислотную последовательность, представленную в Таблице 3, или последовательность, по существу идентичную (например, идентичную по меньшей мере на 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или выше) ей.
В еще одном варианте осуществления молекула антитела против PD-1 включает константную область каппа легкой цепи, например, человеческую константную область каппа легкой цепи. В одном варианте осуществления константная область легкой цепи включает аминокислотную последовательность, представленную в Таблице 3, или последовательность, по существу идентичную (например, идентичную по меньшей мере на 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или выше) ей.
В другом варианте осуществления молекула антитела против PD-1 включает константную область тяжелой цепи IgG4, например, человеческого IgG4, и константную область каппа легкой цепи, например, человеческую константную область каппа легкой цепи, например, константную область тяжелой и легкой цепи, включающую аминокислотную последовательность, представленную в Таблице 3, или последовательность, по существу идентичную (например, идентичную по меньшей мере на 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или выше) ей. В одном варианте осуществления человеческий IgG4 включает замену в положении 228 согласно нумерации EU (например, замену Ser на Pro). В еще одном варианте осуществления молекула антитела против PD-1 включает константную область тяжелой цепи IgG1, например, человеческого IgG1, и константную область каппа легкой цепи, например, человеческую константную область каппа легкой цепи, например, константную область тяжелой и легкой цепи, включающую аминокислотную последовательность, представленную в Таблице 3, или последовательность, по существу идентичную (например, идентичную по меньшей мере на 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или выше) ей. В одном варианте осуществления человеческий IgG1 включает замену в положении 297 согласно нумерации EU (например, замену Asn на Ala). В одном варианте осуществления человеческий IgG1 включает замену в положении 265 согласно нумерации EU, замену в положении 329 согласно нумерации EU или обе таких замены (например, замену Asp на Ala в положении 265 и замену Pro на Ala в положении 329). В одном варианте осуществления человеческий IgG1 включает замену в положении 234 согласно нумерации EU, замену в положении 235 согласно нумерации EU или обе таких замены (например, замену Leu на Ala в положении 234 и замену Leu на Ala в положении 235).
В другом варианте осуществления молекула антитела против PD-1 включает вариабельный домен и константную область тяжелой цепи, вариабельный домен и константную область легкой цепи или и то, и другое, включающие аминокислотную последовательность BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E; или описанные в Таблице 1 или кодируемые нуклеотидной последовательностью в Таблице 1; или последовательность, по существу идентичную (например, идентичную по меньшей мере на 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или выше) любой из вышеуказанных последовательностей. Молекула антитела против PD-1 необязательно включает лидерную последовательность из тяжелой цепи, легкой цепи или обеих, как показано в Таблице 4; или последовательность, по существу идентичную им.
В еще одном варианте осуществления молекула антитела против PD-1 включает по меньшей мере одну, две или три определяющие комплементарность области (CDR-области) из вариабельной области тяжелой цепи антитела, описанного в настоящей заявке, например, антитела, выбранного из любого из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E; или описанные в Таблице 1 или кодируемые нуклеотидной последовательностью в Таблице 1; или последовательностью, по существу идентичной (например, идентичной по меньшей мере на 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или выше) любой из вышеуказанных последовательностей.
В еще одном варианте осуществления молекула антитела против PD-1 включает по меньшей мере одну, две или три CDR-области (или одновременно все CDR-области) из вариабельной области тяжелой цепи, включающей аминокислотную последовательность, показанную в Таблице 1 или кодируемую нуклеотидной последовательностью, показанной в Таблице 1. В одном варианте осуществления одна или более CDR-областей (или одновременно все CDR-области) имеют одно, два, три, четыре, пять, шесть или более изменений, например, аминокислотных замен или делеций, по сравнению с аминокислотной последовательностью, показанной в Таблице 1, или кодируемой нуклеотидной последовательностью, показанной в Таблице 1.
В еще одном варианте осуществления молекула антитела против PD-1 включает по меньшей мере одну, две или три CDR-области из вариабельной области легкой цепи антитела, описанного в настоящей заявке, например, антитела, выбранного из любого из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E; или описанные в Таблице 1 или кодируемые нуклеотидной последовательностью в Таблице 1; или последовательностью, по существу идентичной (например, идентичной по меньшей мере на 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или выше) любой из вышеуказанных последовательностей.
В еще одном варианте осуществления молекула антитела против PD-1 включает по меньшей мере одну, две или три CDR-области (или одновременно все CDR-области) из вариабельной области легкой цепи, включающей аминокислотную последовательность, показанную в Таблице 1 или кодируемую нуклеотидной последовательностью, показанной в Таблице 1. В одном варианте осуществления одна или более CDR-областей (или одновременно все CDR-области) имеют одно, два, три, четыре, пять, шесть или более изменений, например, аминокислотных замен или делеций, по сравнению с аминокислотной последовательностью, показанной в Таблице 1 или кодируемой нуклеотидной последовательностью, показанной в Таблице 1. В некоторых вариантах осуществления молекула антитела против PD-1 включает замену в CDR-области легкой цепи, например, одну или более замен в CDR1, CDR2 и/или CDR3 легкой цепи. В одном варианте осуществления молекула антитела против PD-1 включает замену в CDR3 легкой цепи в положении 102 вариабельной области легкой цепи, например, замену остатка цистеина на остаток тирозина или остатка цистеина на остаток серина, в положении 102 вариабельной области легкой цепи согласно Таблице 1 (например, SEQ ID NO: 16 или 24 в случае мышиной или химерной, немодифицированной; или любой из SEQ ID NO: 34, 42, 46, 54, 58, 62, 66, 70, 74 или 78 в случае модифицированной последовательности).
В другом варианте осуществления молекула антитела против PD-1 включает по меньшей мере одну, две, три, четыре, пять или шесть CDR-областей (или одновременно все CDR-области) из вариабельной области тяжелой и легкой цепи, включающей аминокислотную последовательность, показанную в Таблице 1 или кодируемую нуклеотидной последовательностью, показанной в Таблице 1. В одном варианте осуществления одна или более CDR-областей (или одновременно все CDR-области) имеют одно, два, три, четыре, пять, шесть или более изменений, например, аминокислотных замен или делеций, по сравнению с аминокислотной последовательностью, показанной в Таблице 1 или кодируемой нуклеотидной последовательностью, показанной в Таблице 1.
В одном варианте осуществления молекула антитела против PD-1 включает все шесть CDR-областей из антитела, описанного в настоящей заявке, например, антитела, выбранного из любого из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E; или описанные в Таблице 1 или кодируемые нуклеотидной последовательностью в Таблице 1, или близко родственные CDR-области, например, CDR-области, которые идентичны или которые имеют по меньшей мере одно аминокислотное изменение, но не больше двух, трех или четырех изменений (например, замен, делеций или вставок, например, консервативных замен). В одном варианте осуществления молекула антитела против PD-1 может включать любую CDR-область, описанную в настоящей заявке. В некоторых вариантах осуществления молекула антитела против PD-1 включает замену в CDR-области легкой цепи, например, одну или более замен в CDR1, CDR2 и/или CDR3 легкой цепи. В одном варианте осуществления молекула антитела против PD-1 включает замену в CDR3 легкой цепи в положении 102 вариабельной области легкой цепи, например, замену остатка цистеина на остаток тирозина или остатка цистеина на остаток серина, в положении 102 вариабельной области легкой цепи согласно Таблице 1 (например, SEQ ID NO: 16 или 24 в случае мышиной или химерной, немодифицированной; или любой из SEQ ID NO: 34, 42, 46, 54, 58, 62, 66, 70, 74 или 78 в случае модифицированной последовательности).
В другом варианте осуществления молекула антитела против PD-1 включает по меньшей мере одну, две или три CDR-области согласно Кэбату с соавт. (например, по меньшей мере одну, две или три CDR-области согласно определению Кэбата, как представлено в Таблице 1) из вариабельной области тяжелой цепи антитела, описанного в настоящей заявке, например, антитела, выбранного из любого из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E; или описанные в Таблице 1 или кодируемые нуклеотидной последовательностью в Таблице 1; или последовательностью, по существу идентичной (например, идентичной по меньшей мере на 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или выше) любой из вышеуказанных последовательностей; или которое имеет по меньшей мере одно аминокислотное изменение, но не больше двух, трех или четырех изменений (например, замен, делеций или вставок, например, консервативных замен) по сравнению с одной, двумя или тремя CDR-областями согласно Кэбату с соавт., показанными в Таблице 1.
В другом варианте осуществления молекула антитела против PD-1 включает по меньшей мере одну, две или три CDR-области согласно Кэбату с соавт. (например, по меньшей мере одну, две или три CDR-области согласно определению Кэбата, как представлено в Таблице 1) из вариабельной области легкой цепи антитела, описанного в настоящей заявке, например, антитела, выбранного из любого из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E; или описанные в Таблице 1 или кодируемые нуклеотидной последовательностью в Таблице 1; или последовательностью, по существу идентичной (например, идентичной по меньшей мере на 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или выше) любой из вышеуказанных последовательностей; или которое имеет по меньшей мере одно аминокислотное изменение, но не больше двух, трех или четырех изменений (например, замен, делеций или вставок, например, консервативных замен) по сравнению с одной, двумя или тремя CDR-областями согласно Кэбату с соавт., показанными в Таблице 1.
В еще одном варианте осуществления молекула антитела против PD-1 включает по меньшей мере одну, две, три, четыре, пять или шесть CDR-областей согласно Кэбату с соавт. (например, по меньшей мере одну, две, три, четыре, пять или шесть CDR-областей согласно определению Кэбата, как представлено в Таблице 1) из вариабельных областей тяжелой и легкой цепи антитела, описанного в настоящей заявке, например, антитела, выбранного из любого из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E; или описанные в Таблице 1 или кодируемые нуклеотидной последовательностью в Таблице 1; или последовательностью, по существу идентичной (например, идентичной по меньшей мере на 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или выше) любой из вышеуказанных последовательностей; или которое имеет по меньшей мере одно аминокислотное изменение, но не больше двух, трех или четырех изменений (например, замен, делеций или вставок, например, консервативных замен) по сравнению с одной, двумя, тремя, четырьмя, пятью или шестью CDR-областями согласно Кэбату с соавт., показанными в Таблице 1.
В еще одном варианте осуществления молекула антитела против PD-1 включает все шесть CDR-областей согласно Кэбату с соавт. (например, все шесть CDR-областей согласно определению Кэбата, как представлено в Таблице 1) из вариабельных областей тяжелой и легкой цепи антитела, описанного в настоящей заявке, например, антитела, выбранного из любого из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E; или описанные в Таблице 1 или кодируемые нуклеотидной последовательностью в Таблице 1; или последовательностью, по существу идентичной (например, идентичной по меньшей мере на 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или выше) любой из вышеуказанных последовательностей; или которое имеет по меньшей мере одно аминокислотное изменение, но не больше двух, трех или четырех изменений (например, замен, делеций или вставок, например, консервативных замен) по сравнению со всеми шестью CDR-областями согласно Кэбату с соавт., показанными в Таблице 1. В одном варианте осуществления молекула антитела против PD-1 может включать любую CDR-область, описанную в настоящей заявке.
В другом варианте осуществления молекула антитела против PD-1 включает по меньшей мере одну, две или три гипервариабельных петли Чотиа (например, по меньшей мере одну, две или три гипервариабельных петли согласно определению Чотиа, как представлено в Таблице 1) из вариабельной области тяжелой цепи антитела, описанного в настоящей заявке, например, антитела, выбранного из любого из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E; или описанные в Таблице 1 или кодируемые нуклеотидной последовательностью в Таблице 1; или, по меньшей мере, аминокислоты из тех гипервариабельных петель, которые контактируют с PD-1; или которое имеет по меньшей мере одно аминокислотное изменение, но не больше двух, трех или четырех изменений (например, замен, делеций или вставок, например, консервативных замен) по сравнению с одной, двумя или тремя гипервариабельными петлями согласно Чотиа с соавт., показанными в Таблице 1.
В другом варианте осуществления молекула антитела против PD-1 включает по меньшей мере одну, две или три гипервариабельных петли Чотиа (например, по меньшей мере одну, две или три гипервариабельных петли согласно определению Чотиа, как представлено в Таблице 1) вариабельной области легкой цепи антитела, описанного в настоящей заявке, например, антитела, выбранного из любого из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E; или описанные в Таблице 1 или кодируемые нуклеотидной последовательностью в Таблице 1; или, по меньшей мере, аминокислоты из тех гипервариабельных петель, которые контактируют с PD-1; или которое имеет по меньшей мере одно аминокислотное изменение, но не больше двух, трех или четырех изменений (например, замен, делеций или вставок, например, консервативных замен) по сравнению с одной, двумя или тремя гипервариабельными петлями согласно Чотиа с соавт., показанными в Таблице 1.
В еще одном варианте осуществления молекула антитела против PD-1 включает по меньшей мере одну, две, три, четыре, пять или шесть гипервариабельных петель (например, по меньшей мере одну, две, три, четыре, пять или шесть гипервариабельных петель согласно определению Чотиа, как представлено в Таблице 1) из вариабельных областей тяжелой и легкой цепи антитела, описанного в настоящей заявке, например, антитела, выбранного из любого из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E; или описанные в Таблице 1 или кодируемые нуклеотидной последовательностью в Таблице 1; или, по меньшей мере, аминокислоты из тех гипервариабельных петель, которые контактируют с PD-1; или которое имеет по меньшей мере одно аминокислотное изменение, но не больше двух, трех или четырех изменений (например, замен, делеций или вставок, например, консервативных замен) по сравнению с одной, двумя, тремя, четырьмя, пятью или шестью гипервариабельными петлями согласно Чотиа с соавт., показанными в Таблице 1.
В одном варианте осуществления молекула антитела против PD-1 включает все шесть гипервариабельных петель (например, все шесть гипервариабельных петель согласно определению Чотиа, как представлено в Таблице 1) антитела, описанного в настоящей заявке, например, антитела, выбранного из любого из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D, или BAP049-Clone-E, или близко родственных гипервариабельных петель, например, гипервариабельных петель, которые идентичны или которые имеют по меньшей мере одно аминокислотное изменение, но не больше двух, трех или четырех изменений (например, замен, делеций или вставок, например, консервативных замен); или которые имеют по меньшей мере одно аминокислотное изменение, но не больше двух, трех или четырех изменений (например, замен, делеций или вставок, например, консервативных замен) по сравнению со всеми шестью гипервариабельными петлями согласно Чотиа с соавт., показанными в Таблице 1. В одном варианте осуществления молекула антитела против PD-1 может включать любую гипервариабельную петлю, описанную в настоящей заявке.
В другом варианте осуществления молекула антитела против PD-1 включает по меньшей мере одну, две или три гипервариабельных петли, которые имеют такие же канонические структуры, как у соответствующей гипервариабельной петли антитела, описанного в настоящей заявке, например, антитела, выбранного из любого из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E, например, такие же канонические структуры как, по меньшей мере, петля 1, и/или петля 2 вариабельных доменов тяжелой и/или легкой цепи антитела, описанного в настоящей заявке. См., например, Chothia et al., (1992) J. Mol. Biol. 227:799-817; Tomlinson et al., (1992) J. Mol. Biol. 227:776-798 по поводу описаний канонических структур гипервариабельных петель. Эти структуры могут быть определены при просмотре таблиц, описанных в указанных источниках.
В некоторых вариантах осуществления молекула антитела против PD-1 включает комбинацию CDR-областей или гипервариабельных петель, определенных согласно Кэбату с соавт. и Чотиа с соавт.
В одном варианте осуществления молекула антитела против PD-1 включает по меньшей мере одну, две или три CDR-области или гипервариабельные петли из вариабельной области тяжелой цепи антитела, описанного в настоящей заявке, например, антитела, выбранного из любого из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E, согласно определению Кэбата и Чотиа (например, по меньшей мере одну, две или три CDR-области или гипервариабельные петли согласно определению Кэбата и Чотиа, как представлено в Таблице 1); или кодируемые нуклеотидной последовательностью в Таблице 1; или последовательностью, по существу идентичной (например, идентичной по меньшей мере на 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или выше) любой из вышеуказанных последовательностей; или которое имеет по меньшей мере одно аминокислотное изменение, но не больше двух, трех или четырех изменений (например, замен, делеций или вставок, например, консервативных замен) по сравнению с одной, двумя или тремя CDR-областями или гипервариабельными петлями согласно Кэбату и/или Чотиа, показанными в Таблице 1.
Например, молекула антитела против PD-1 может включать CDR1 VH согласно Кэбату с соавт. или гипервариабельную петлю 1 VH согласно Чотиа с соавт., или их комбинации, например, как показано в Таблице 1. В одном варианте осуществления комбинации CDR-области Kabat и Чотиа CDR1 VH включает аминокислотную последовательность GYTFTTYWMH (SEQ ID NO: 224) или по существу идентичную ей аминокислотную последовательность (например, имеющую по меньшей мере одно аминокислотное изменение, но не больше двух, трех или четырех изменений (например, замен, делеций или вставок, например, консервативных замен)). Молекула антитела против PD-1 может дополнительно включать, например, CDR-области 2-3 VH согласно Кэбату с соавт. и CDR-области 1-3 VL согласно Кэбату с соавт., например, как показано в Таблице 1. Таким образом, в некоторых вариантах осуществления каркасные области определены на основе комбинации CDR-областей, определенных согласно Кэбату с соавт., и гипервариабельных петель, определенных согласно Чотиа с соавт. Например, молекула антитела против PD-1 может включать FR1 VH, определенную на основе гипервариабельной петли 1 VH согласно Чотиа с соавт., и FR2 VH, определенную на основе CDR-областей 1-2 VH согласно Кэбату с соавт., например, как показано в Таблице 1. Молекула антитела против PD-1 может дополнительно включать, например, FR-области 3-4 VH, определенные на основе CDR-областей 2-3 VH согласно Кэбату с соавт., и FR-области 1-4 VL, определенные на основе CDR-областей 1-3 VL согласно Кэбату с соавт.
Молекула антитела против PD-1 может содержать любую комбинацию CDR-областей или гипервариабельных петель согласно определениям Кэбата и Чотиа. В одном варианте осуществления молекула антитела против PD-1 включает по меньшей мере одну, две или три CDR-области из вариабельной области легкой цепи антитела, описанного в настоящей заявке, например, антитела, выбранного из любого из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E, согласно определению Кэбата и Чотиа (например, по меньшей мере одну, две или три CDR-области согласно определению Кэбата и Чотиа, как представлено в Таблице 1).
В одном варианте осуществления молекула антитела против PD-1 включает:
(a) вариабельную область тяжелой цепи (VH), включающую аминокислотную последовательность VHCDR1 SEQ ID NO: 4, аминокислотную последовательность VHCDR2 SEQ ID NO: 5 и аминокислотную последовательность VHCDR3 SEQ ID NO: 3; и вариабельную область легкой цепи (VL), включающую аминокислотную последовательность VLCDR1 SEQ ID NO: 13, аминокислотную последовательность VLCDR2 SEQ ID NO: 14 и аминокислотную последовательность VLCDR3 SEQ ID NO: 33;
(b) VH, включающую аминокислотную последовательность VHCDR1, выбранную из SEQ ID NO: 1; аминокислотную последовательность VHCDR2 SEQ ID NO: 2; и аминокислотную последовательность VHCDR3 SEQ ID NO: 3; и VL, включающую аминокислотную последовательность VLCDR1 SEQ ID NO: 10, аминокислотную последовательность VLCDR2 SEQ ID NO: 11 и аминокислотную последовательность VLCDR3 SEQ ID NO: 32;
(c) VH, включающую аминокислотную последовательность VHCDR1 SEQ ID NO: 224, аминокислотную последовательность VHCDR2 SEQ ID NO: 5 и аминокислотную последовательность VHCDR3 SEQ ID NO: 3; и VL, включающую аминокислотную последовательность VLCDR1 SEQ ID NO: 13, аминокислотную последовательность VLCDR2 SEQ ID NO: 14 и аминокислотную последовательность VLCDR3 SEQ ID NO: 33; или
(d) VH, включающую аминокислотную последовательность VHCDR1 SEQ ID NO: 224; аминокислотную последовательность VHCDR2 SEQ ID NO: 2 и аминокислотную последовательность VHCDR3 SEQ ID NO: 3; и VL, включающую аминокислотную последовательность VLCDR1 SEQ ID NO: 10, аминокислотную последовательность VLCDR2 SEQ ID NO: 11 и аминокислотную последовательность VLCDR3 SEQ ID NO: 32.
В комбинациях в настоящей заявке, в другом варианте осуществления, молекула антитела против PD-1 включает: (i) вариабельную область тяжелой цепи (VH), включающую аминокислотную последовательность VHCDR1, выбранную из SEQ ID NO: 1, SEQ ID NO: 4 или SEQ ID NO: 224; аминокислотную последовательность VHCDR2 SEQ ID NO: 2 или SEQ ID NO: 5; и аминокислотную последовательность VHCDR3 SEQ ID NO: 3; и (ii) вариабельную область легкой цепи (VL), включающую аминокислотную последовательность VLCDR1 SEQ ID NO: 10 или SEQ ID NO: 13, аминокислотную последовательность VLCDR2 SEQ ID NO: 11 или SEQ ID NO: 14, и аминокислотную последовательность VLCDR3 SEQ ID NO: 32 или SEQ ID NO: 33.
В варианте осуществления, например, варианте осуществления, включающем вариабельную область, CDR-область (например, CDR-область Чотиа или CDR-область Кэбата) или другую последовательность, указанную в настоящей заявке, например, в Таблице 1, молекула антитела является молекулой моноспецифичного антитела, молекула биспецифичного антитела или является молекулой антитела, которая включает антигенсвязывающий фрагмент антитела, например, полуантитело или антигенсвязывающий фрагмент полуантитела. В некоторых вариантах осуществления молекула антитела является молекулой биспецифичного антитела, обладающего первой специфичностью связывания в отношении PD-1 и второй специфичностью связывания в отношении TIM-3, LAG-3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), PD-L1 или PD-L2. В одном варианте осуществления молекула биспецифичного антитела связывается с PD-1 и TIM-3. В другом варианте осуществления молекула биспецифичного антитела связывается с PD-1 и LAG-3. В другом варианте осуществления молекула биспецифичного антитела связывается с PD-1 и CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5). В другом варианте осуществления молекула биспецифичного антитела связывается с PD-1 и CEACAM-1. В еще одном варианте осуществления молекула биспецифичного антитела связывается с PD-1 и CEACAM-5. В другом варианте осуществления молекула биспецифичного антитела связывается с PD-1 и PD-L1. В еще одном варианте осуществления молекула биспецифичного антитела связывается с PD-1 и PD-L2. Любая комбинация вышеуказанных молекул может быть получена в молекуле мультиспецифичного антитела, например, триспецифичного антитела, которое включает первую специфичность связывания в отношении PD-1 и вторую и третью специфичность связывания в отношении одного или более: TIM-3, LAG-3, CEACAM (например, CEACAM-1, CEACAM-3 или CEACAM-5), PD-L1 или PD-L2.
В других вариантах осуществления молекула антитела против PD-1 применяется в комбинации с биспецифичный молекулой, включающей одно или более из: TIM-3, LAG-3, CEACAM (например, CEACAM-1, CEACAM-3 или CEACAM-5), PD-L1 или PD-L2. В одном варианте осуществления молекула биспецифичного антитела, применяемая в комбинации, связывается с CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5) и LAG-3. В другом варианте осуществления молекула биспецифичного антитела, применяемая в комбинации, связывается с CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5) и TIM-3. В другом варианте осуществления молекула биспецифичного антитела, применяемая в комбинации, связывается с LAG-3 и TIM-3.
Применения комбинированной терапии
Комбинации, раскрытые в настоящей заявке, могут приводить к одному или более из следующего: увеличение презентации антигена, увеличение функции эффекторной клетки (например, одного или более из пролиферации Т-клеток, секреции IFN-γ или цитолитической функции), ингибирование функции регуляторных Т-клеток, влияние на активность множества типов клеток, таких как регуляторная Т-клетка, эффекторные Т-клетки и NK-клетки), увеличение инфильтрирующих опухоль лимфоцитов, увеличение опосредованной Т-клеточным рецептором пролиферации и уменьшение иммунного ускользания раковых клеток. В одном варианте осуществления, применение ингибитора PD-1 в комбинациях ингибирует, уменьшает или нейтрализует одну или более активностей PD-1, что приводит к блокаде или снижению иммунной контрольной точки. Таким образом, такие комбинации могут применяться для лечения или предотвращения нарушений, при которых требуется усиление иммунного ответа у субъекта.
Таким образом, в другом аспекте предложен способ коррекции иммунного ответа у субъекта. Способ включает введение субъекту комбинации, раскрытой в настоящей заявке (например, комбинации, включающей терапевтически эффективное количество молекулы антитела против PD-1), отдельно или в комбинации с одним или более средствами или процедурами, в результате чего осуществляется модуляция иммунного ответа у субъекта. В одном варианте осуществления молекула антитела усиливает, стимулирует или увеличивает иммунный ответ у субъекта. Субъект может быть млекопитающим, например, приматом, предпочтительно высшим приматом, например, человеком (например, пациентом, имеющим или подвергающимся риску развития нарушения, описанного в настоящей заявке). В одном варианте осуществления субъект нуждается в усилении иммунного ответа. В одном варианте осуществления субъект имеет или подвергается риску развития нарушения, описанного в настоящей заявке, например, рака или инфекционного заболевания, как описано в настоящей заявке. В некоторых вариантах осуществления субъект имеет или подвергается риску ослабления иммунитета. Например, субъект проходит или прошел химиотерапевтическое лечение и/или лучевую терапию. В альтернативе, или в комбинации, субъект имеет или подвергается риску ослабления иммунитета в результате инфекции.
В одном аспекте предложен способ лечения (например, одно или более из уменьшения, ингибирования или задержки прогрессии) рака или опухоли у субъекта. Способ включает введение субъекту комбинации, раскрытой в настоящей заявке (например, комбинации, включающей терапевтически эффективное количество молекулы антитела против PD-1).
В некоторых вариантах осуществления рак, подвергаемый лечению комбинацией, включает, без ограничения перечисленным, солидную опухоль, гемобластоз (например, лейкоз, лимфому, миелому, например множественную миелому) и метастатическое поражение. В одном варианте осуществления рак является солидной опухолью. Примеры солидных опухолей включают злокачественные опухоли, например, саркомы и карциномы, например, аденокарциномы различных систем органов, таких как аденокарциномы, поражающие легкое, молочную железу, яичник, лимфоидную ткань, желудочно-кишечный тракт (например, толстую кишку), анальный канал, гениталии и мочеполовой тракт (например, почечку, уротелий, клетки мочевого пузыря, предстательную железу), глотку, ЦНС (например, головной мозг, нервные или глиальные клетки), голову и шею, кожу (например, меланому) и поджелудочную железу, а также аденокарциномы, которые включают такие злокачественные опухоли, как формы рака толстой кишки, рак прямой кишки, рак почки (например, почечно-клеточную карциному (светлоклеточную или несветлоклеточную почечно-клеточную карциному), рак печени, рак легкого (например, немелкоклеточный рак легкого (плоскоклеточный или неплоскоклеточный немелкоклеточный рак легкого)), рак тонкой кишки и рак пищевода. Рак может быть раком на ранней, промежуточной, поздней стадии или метастатическим раком.
В одном варианте осуществления рак выбран из рака легкого (например, немелкоклеточного рака легкого (НМРЛ) (например, НМРЛ с плоскоклеточной и/или неплоскоклеточной гистологией или НМРЛ аденокарциномы)), рака кожи (например, рака из клеток Меркеля или меланомы (например, распространенной меланомы)), рака почки (например, рака почки (например, почечно-клеточной карциномы)), рака печени, миеломы (например, множественной миеломы), рака предстательной железы, рака молочной железы (например, рака молочной железы, который не экспрессирует один, два или ни один эстрогеновый рецептор, прогестероновый рецептор или Her2/neu, например, трижды негативный рак молочной железы), рака толстой и прямой кишки, рака поджелудочной железы, рака головы и шеи (например, плоскоклеточной карциномы головы и шеи (HNSCC), рака прямой кишки, рака желудка и пищевода, рака щитовидной железы (например, анапластической карциномой щитовидной железы), рака шейки матки, нейроэндокринной опухоли (NET) (например, атипичной легочной карциноидной опухоли), лимфопролиферативного заболевания (например, посттрансплантационного лимфопролиферативного заболевания) или гемобластоза, Т-клеточной лимфомы, В-клеточной лимфомы, неходжкинской лимфомы или лейкоза (например, миелоидного лейкоза или лимфоидного лейкоза).
В другом варианте осуществления рак выбран из карциномы (например, распространенной или метастатической карциномы), меланомы или карциномы легкого, например, немелкоклеточной карциномы легкого.
В одном варианте осуществления рак является раком легкого, например, немелкоклеточным раком легкого или мелкоклеточным раком легкого. В некоторых вариантах осуществления немелкоклеточный рак легкого является немелкоклеточным раком легкого I стадии (например, стадии Ia или Ib), II стадии (например, стадии IIa или IIb), III стадии (например, стадии IIIa или IIIb) или IV стадии.
В одном варианте осуществления рак является меланомой, например, распространенной меланомой. В одном варианте осуществления рак является распространенной или неоперабельной меланомой, которая не реагирует на другие терапии. В других вариантах осуществления рак является меланомой с мутацией BRAF (например, мутацией BRAF V600). В других вариантах осуществления комбинацию, раскрытую в настоящей заявке (например, комбинацию, включающую молекулу антитела против PD-1), вводят после лечения антителом против CTLA-4 (например, ипилимумабом), с или без ингибитора BRAF (например, вемурафениба или дабрафениба).
В другом варианте осуществления рак является гепатокарциномой, например распространенной гепатокарциномой, с или без вирусной инфекции, например, хронического вирусного гепатита.
В другом варианте осуществления рак является раком предстательной железы, например, распространенным раком предстательной железы.
В еще одном варианте осуществления рак является миеломой, например, множественной миеломой.
В еще одном варианте осуществления рак является раком почки, например, почечно-клеточной карциномой (RCC) (например, метастатической RCC, несветлоклеточной почечно-клеточной карциномой (nccRCC) или светлоклеточной почечно-клеточной карциномой (CCRCC)).
В одном варианте осуществления микроокружение рака имеет повышенный уровень экспрессии PD-L1. В альтернативе, или в комбинации, микроокружение рака может иметь повышенную экспрессию IFNγ и/или CD8.
В некоторых вариантах осуществления субъект имеет, или у него обнаружили, опухоль, которая имеет одно или более из высокого уровня или экспрессии PD-L1 и/или является инфильтрирующий опухоль лимфоцит (TIL)+ (например, имеет повышенное количество TIL-лимфоцитов). В некоторых вариантах осуществления субъект имеет, или у него обнаружили, опухоль, которая имеет высокий уровень или экспрессию PD-L1 и которая является TIL+. В некоторых вариантах осуществления способы, описанные в настоящей заявке, дополнительно включают идентификацию субъекта на основе наличия опухоли, которая имеет одно или более из высокого уровня или экспрессии PD-L1 и/или является TIL+. В некоторых вариантах осуществления способы, описанные в настоящей заявке, дополнительно включают идентификацию субъекта на основе наличия опухоли, которая имеет высокий уровень или экспрессию PD-L1 и является TIL+. В некоторых вариантах осуществления опухоли, которые являются TIL+, являются CD8 и IFNγ положительными. В некоторых вариантах осуществления субъект имеет, или у него обнаружили, высокий процент клеток, которые являются положительными на один, два или более из PD-L1, CD8 и/или IFNγ. В некоторых вариантах осуществления субъект имеет, или у него обнаружили, высокий процент клеток, которые являются положительными на все из PD-L1, CD8 и IFNγ.
В некоторых вариантах осуществления способы, описанные в настоящей заявке, дополнительно включают идентификацию субъекта на основе наличия высокого процента клеток, которые являются положительными на один, два или более из PD-L1, CD8 и/или IFNγ. В некоторых вариантах осуществления способы, описанные в настоящей заявке, дополнительно включают идентификацию субъекта на основе наличия высокого процента клеток, которые являются положительными на все из PD-L1, CD8 и IFNγ. В некоторых вариантах осуществления субъект имеет, или у него обнаружили, один, два или более из PD-L1, CD8 и/или IFNγ, и одно или более из рака легкого, например, плоскоклеточного рака легкого или аденокарциномы легкого (например, НМРЛ); рака головы и шеи; плоскоклеточного рака шейки матки; рака желудка; рака пищевода; рака щитовидной железы (например, анапластической карциномы щитовидной железы); рака кожи (например, рака из клеток Меркеля или меланомы), рака молочной железы (например, ТНРМЖ) и/или рака носоглотки (NPC). В некоторых вариантах осуществления способы, описанные в настоящей заявке, дополнительно описывают идентификацию субъекта на основе наличия одного, двух или более из PD-L1, CD8 и/или IFNγ, и одного или более из рака легкого, например, плоскоклеточного рака легкого или аденокарциномы легкого (например, НМРЛ); рака головы и шеи; плоскоклеточного рака шейки матки; рака желудка; рака щитовидной железы (например, анапластической карциномы щитовидной железы); рака кожи (например, рака из клеток Меркеля или меланомы), нейроэндокринной опухоли, рака молочной железы (например, ТНРМЖ) и/или рака носоглотки.
Способы и композиции, раскрытые в настоящей заявке, могут применяться для лечения метастатических поражений, связанных с вышеуказанными формами рака.
В другом аспекте изобретения предложен способ лечения инфекционного заболевания у субъекта, включающий введение субъекту комбинации, как описано в настоящей заявке, например, комбинации, включающей терапевтически эффективное количество молекулы антитела против PD-1, описанной в настоящей заявке. В одном варианте осуществления инфекционное заболевание выбрано из гепатита (например, гепатита C) или сепсиса.
Кроме того, в изобретении предложен способ усиления иммунного ответа на антиген у субъекта, включающий введение субъекту: (i) антигена; и (ii) комбинации, как описано в настоящей заявке, например, комбинации, включающей терапевтически эффективное количество молекулы антитела против PD-1, описанной в настоящей заявке, в результате чего у субъекта усиливается иммунный ответ на антиген. Антиген может быть, например, опухолевым антигеном, вирусным антигеном, бактериальным антигеном или антигеном из патогена.
Комбинации, как описано в настоящей заявке, могут вводить субъекту системно (например, перорально, парентерально, подкожно, внутривенно, ректально, внутримышечно, внутрибрюшинно, интраназально, трансдермально или ингаляцией, или путем внутриполостной установки), наружно или путем нанесения на слизистые оболочки, такие как нос, горло и бронхиолы.
Дозы и схемы применения терапевтических средств, раскрытых в настоящей заявке, могут быть определены специалистом. В некоторых вариантах осуществления молекулу антитела против PD-1 вводят путем инъекции (например, подкожно или внутривенно) в дозе приблизительно 1-30 мг/кг, например, приблизительно 5-25 мг/кг, приблизительно 10-20 мг/кг, приблизительно 1-5 мг/кг или приблизительно 3 мг/кг. Схема применения может изменяться, например, от одного раза в неделю до одного раза в 2, 3 или 4 недели. В одном варианте осуществления молекулу антитела против PD-1 вводят в дозе приблизительно от 10-20 мг/кг раз в две недели.
В некоторых вариантах осуществления молекулу антитела против PD-1 вводят путем инъекции (например, подкожно или внутривенно) в дозе (например, постоянной дозе) приблизительно от 100 мг до 600 мг, например, приблизительно от 200 мг до 500 мг, например, приблизительно от 250 мг до 450 мг, приблизительно от 300 мг до 400 мг, приблизительно от 250 мг до 350 мг, приблизительно от 350 мг до 450 мг или приблизительно 100 мг, приблизительно 200 мг, приблизительно 300 мг или приблизительно 400 мг. Схема применения (например, схема введения постоянной дозы) может изменяться, например, от одного раза в неделю до одного раза в 2, 3, 4, 5 или 6 недель. В одном варианте осуществления молекулу антитела против PD-1 вводят в дозе приблизительно от 300 мг до 400 мг один раз в три недели или один раз в четыре недели. В одном варианте осуществления молекулу антитела против PD-1 вводят в дозе приблизительно от 300 мг один раз в три недели. В одном варианте осуществления молекулу антитела против PD-1 вводят в дозе приблизительно от 400 мг один раз в четыре недели. В одном варианте осуществления молекулу антитела против PD-1 вводят в дозе приблизительно от 300 мг один раз в четыре недели. В одном варианте осуществления молекулу антитела против PD-1 вводят в дозе приблизительно от 400 мг один раз в три недели.
В одном варианте осуществления молекулу антитела против PD-1 вводят отдельно или в комбинации (например, в комбинации с молекулой антитела против LAG-3), в дозе меньше или приблизительно 5 мг/кг; меньше или приблизительно 4 мг/кг; меньше или приблизительно 3 мг/кг; меньше или приблизительно 2 мг/кг; меньше или приблизительно 1 мг/кг, раз в две недели. В одном варианте осуществления молекулу антитела против PD-1 вводят в дозе 1-5 мг/кг раз в две недели; 1-4 мг/кг раз в две недели, 1-3 мг/кг раз в две недели или 1-2 мг/кг раз в две недели. В одном варианте осуществления молекулу антитела против LAG-3 вводят отдельно или в комбинации (например, в комбинации с молекулой антитела против PD-1) в дозе 1-5 мг/кг раз в две недели; 1-4 мг/кг раз в две недели, 1-3 мг/кг раз в две недели или 1-2 мг/кг раз в две недели.
Молекулы антитела, описанные в настоящей заявке, предпочтительны для применения в способах, описанных в настоящей заявке, хотя другие антитела против PD-1 могут применяться вместо них или в комбинации с молекулой антитела против PD-1 согласно изобретению.
Дополнительные комбинированные терапии
Способы и комбинации, описанные в настоящей заявке, могут включать или применяться в комбинации с другими средствами или терапевтическими методами. В одном варианте осуществления способы, описанные в настоящей заявке, включают введение субъекту комбинации, включающей молекулу антитела против PD-1, как описано в настоящей заявке, в комбинации со средством или терапевтической процедурой или методом, в количестве, эффективном для лечения или предотвращения нарушения. Молекула антитела против PD-1 и средство или терапевтическая процедура или метод могут применять одновременно или последовательно, в любом порядке. Может применяться любая комбинация и последовательность молекул антитела против PD-1 и других терапевтических средств, процедур или методов (например, как описано в настоящей заявке). Молекула антитела и/или другие терапевтические средства, процедуры или методы могут применять в периоды активного нарушения или в период ремиссии или менее активной болезни. Молекулу антитела могут применять перед другим лечением, одновременно с лечением, после лечения или во время ремиссии нарушения.
В некоторых вариантах осуществления способы и композиции, описанные в настоящей заявке, применяют в комбинации с одной или более другими молекулами антител, химиотерапией, другой противоопухолевой терапией (например, направленными противоопухолевыми терапиями, генотерапией, вирусной терапией, терапией РНК, пересадкой костного мозга, нанотерапией или онколитическими средствами), цитотоксическими средствами, иммунотерапией (например, иммунотерапией на основе цитокинов или клеток), хирургическими операциями (например, лампэктомией или мастэктомией) или процедурами лучевой терапии или комбинацией любого из предыдущих. Дополнительная терапия может применяться в форме адъювантной или неоадъювантной терапии. В некоторых вариантах осуществления дополнительная терапия является ферментным ингибитором (например, низкомолекулярным ферментным ингибитором) или метастатическим ингибитором. Примеры цитотоксических средств, которые могут применяться в комбинации, включают антимикротубулиновые средства, ингибиторы топоизомеразы, антиметаболиты, ингибиторы митоза, алкилирующие средства, антрациклины, алкалоиды барвинка, интеркалирующие средства, средства, способные блокировать путь передачи сигнала, средства, которые вызывают апоптоз, ингибиторы протеасом и ионизирующее излучение (например, локальное или тотальное облучение (например, облучение гамма-излучением)). В других вариантах осуществления дополнительной терапией является хирургия или лучевая терапия или их комбинация. В других вариантах осуществления дополнительной терапией является терапия, направленная на одно или более из пути PI3K/AKT/mTOR, ингибитора HSP90 или ингибитора тубулина.
В альтернативе или в комбинации с вышеуказанными комбинациями, способы и композиции, описанные в настоящей заявке, могут включать, применяться в комбинации с одним или более из: иммуномодулятора (например, активатора костимулирующей молекулы или ингибитора ингибирующей молекулы, например, молекулы иммунной контрольной точки); вакцины, например, терапевтической вакцины против рака; или других форм клеточной иммунотерапии.
Примерные неограничивающие комбинации и применение комбинаций, раскрытых в настоящей заявке, например, комбинации, включающей молекулу антитела против PD-1, включают следующее.
В некоторых вариантах осуществления комбинация, раскрытая в настоящей заявке, например, комбинация, включающая молекулу антитела против PD-1, включает или применяется в комбинации с модулятором костимулирующей молекулы или ингибирующей молекулы, например, коингибирующим лигандом или рецептором.
В одном варианте осуществления комбинация, раскрытая в настоящей заявке, например, комбинация, включающая молекулу антитела против PD-1, включает или применяется в комбинации с модулятором, например агонистом, костимулирующей молекулы. В одном варианте осуществления агонист костимулирующей молекулы выбран из агониста (например, агонистического антитела или его антигенсвязывающего фрагмента или растворимой слитой конструкции) OX40, CD2, CD27, CD, ICAM-1, LFA-1 (CD11a/CD18), ICOS (CD278), 4-1BB (CD137), GITR, CD30, CD40, BAFFR, HVEM, CD7, СВЕТ, NKG2C, SLAMF7, NKp80, CD160, B7-H3 или лиганда CD83.
В одном варианте осуществления комбинация, раскрытая в настоящей заявке, например, комбинация, включающая молекулу антитела против PD-1, включает или применяется в комбинации с ингибитором ингибирующей молекулы (или молекулы иммунной контрольной точки), выбранной из PD-L1, PD-L2, CTLA-4, TIM-3, LAG-3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4 и/или TGF-бета. В одном варианте осуществления ингибитором является растворимый лиганд (например, CTLA-4-Ig) или антитело или фрагмент антитела, которые связываются с PD-L1, PD-L2 или CTLA-4. Например, молекулу антитела против PD-1 могут вводить в комбинации с антителом против CTLA-4, например, ипилимумабом, например, для лечения рака (например, рака, выбранного из: меланомы, например, метастатической меланомы; рака легкого, например, немелкоклеточного рака легкого; или рака предстательной железы). В одном варианте осуществления молекулу антитела против PD-1 применяют после лечения антителом против CTLA-4 (например, ипилимумабом), с или без ингибитора BRAF (например, вемурафениба или дабрафениба).
В другом варианте осуществления комбинация, раскрытая в настоящей заявке, например, комбинация, включающая молекулу антитела против PD-1, включает или применяется в комбинации с антителом против LAG-3 или его антигенсвязывающим фрагментом.
В другом варианте осуществления комбинация, раскрытая в настоящей заявке, например, комбинация, включающая молекулу антитела против PD-1, включает или применяется в комбинации с антителом против TIM-3 или его антигенсвязывающим фрагментом.
В других вариантах осуществления комбинация, раскрытая в настоящей заявке, например, комбинация, включающая молекулу антитела против PD-1, включает или применяется в комбинации с антителом против LAG-3 и антителом против TIM-3 (или их антигенсвязывающими фрагментами).
В другом варианте осуществления комбинация, раскрытая в настоящей заявке, например, комбинация, включающая молекулу антитела против PD-1, включает или применяется в комбинации с ингибитором CEACAM (например, ингибитором CEACAM-1 и/или CEACAM-5), например, молекулой антитела против CEACAM. В другом варианте осуществления молекулу антитела против PD-1 вводят в комбинации с ингибитором CEACAM-1, например, молекулой антитела против CEACAM-1. В другом варианте осуществления молекулу антитела против PD-1 вводят в комбинации с ингибитором CEACAM-5, например, молекулой антитела против CEACAM-5.
Комбинацию антител, перечисленных в настоящей заявке, можно вводить отдельно, например, в виде отдельных антител или их антигенсвязывающих фрагментов, или связанными, например, в виде молекулы биспецифичного или триспецифичного антитела. В одном варианте осуществления вводят биспецифичное антитело, которое включает молекулу антитела против PD-1 и антитела против TIM-3, против CEACAM (например, против CEACAM-1, CEACAM-3 и/или против CEACAM-5) или против LAG-3, или его антигенсвязывающий фрагмент. В некоторых вариантах осуществления комбинация антител, перечисленных в настоящей заявке, применяется для лечения рака, например, рака, описанного в настоящей заявке (например, солидной опухоли или гемобластоза).
В других вариантах осуществления комбинация, раскрытая в настоящей заявке, например, комбинация, включающая молекулу антитела против PD-1, включает или применяется в комбинации с цитокином. Цитокин можно вводить в виде молекулы, слитой с молекулой антитела против PD-1, или в виде отдельных композиций. В одном варианте осуществления антитело против PD-1 вводят в комбинации с одним, двумя, тремя или более цитокинами, например, в виде слитой молекулы или в виде отдельных композиций. В одном варианте осуществления цитокин является интерлейкином (IL), выбранным из одного, двух, трех или более из IL-1, IL-2, IL-12, IL-15 или IL-21. В одном варианте осуществления молекула биспецифичного антитела обладает первой специфичностью связывания к первой мишени (например, к PD-1), второй специфичностью связывания ко второй мишени (например, LAG-3 или TIM-3) и, необязательно, связана с доменом интерлейкина (например, IL-12), например, полноразмерным IL-12 или его частью. В некоторых вариантах осуществления комбинация молекулы антитела против PD-1 и цитокина, описанного в настоящей заявке, применяется для лечения рака, например, рака, описанного в настоящей заявке (например, солидной опухоли).
В некоторых вариантах осуществления комбинация, раскрытая в настоящей заявке, например, комбинация, включающая молекулу антитела против PD-1, включает или применяется в комбинации с антителом, специфичным против HLA C, например, антителом, специфичным к иммуноглобулиноподобным рецепторам киллерных клеток (также указано в настоящей заявке как "антитело против KIR"). В некоторых вариантах осуществления комбинация молекулы антитела против PD-1 и антитела против KIR применяется для лечения рака, например, рака, описанного в настоящей заявке (например, солидной опухоли, например, распространенной солидной опухоли).
В одном варианте осуществления комбинация, раскрытая в настоящей заявке, например, комбинация, включающая молекулу антитела против PD-1, включает или применяется в комбинации с клеточной иммунотерапией (например, Provenge® (например, Sipuleucel-T)) и, необязательно, в комбинации с циклофосфамидом. В некоторых вариантах осуществления комбинация молекулы антитела против PD-1, Provenge® и/или циклофосфамида применяется для лечения рака, например, рака, описанного в настоящей заявке (например, рака предстательной железы, например, распространенного рака предстательной железы).
В другом варианте осуществления комбинация, раскрытая в настоящей заявке, например, комбинация, включающая молекулу антитела против PD-1, включает или применяется в комбинации с вакциной, например, противораковой вакциной (например, вакциной против почечноклеточной карциномы на основе дендритных клеток (DC-RCC)). В одном варианте осуществления вакцина является вакциной на основе пептида, на основе ДНК, на основе РНК или на основе антигена или их комбинации. В вариантах осуществления вакцина включает один или более пептидов, нуклеиновых кислот (например, ДНК или РНК), антигенов или их комбинацию. В некоторых вариантах осуществления комбинация молекулы антитела против PD-1 и вакцины DC-RCC применяется для лечения рака, например, рака, описанного в настоящей заявке (например, рака почки, например, метастатической почечно-клеточной карциномы (RCC) или светлоклеточной почечно-клеточной карциномы (CCRCC)).
В другом варианте осуществления комбинация, раскрытая в настоящей заявке, например, комбинация, включающая молекулу антитела против PD-1, включает или применяется в комбинации с адъювантом.
В еще одном варианте осуществления комбинация, раскрытая в настоящей заявке, например, комбинация, включающая молекулу антитела против PD-1, включает или применяется в комбинации с химиотерапией и/или иммунотерапией. Например, молекула антитела против PD-1 может применяться для лечения миеломы, отдельно или в комбинации с одним или более из: химиотерапии или других противоопухолевых средств (например, аналогов талидомида, например, леналидомида), антитела против TIM-3, детерминированных опухолевым антигеном дендритных клеток, опухолевых клеток, слитых (например, посредством электрослияния) с дендритными клетками, или вакцинации иммуноглобулином идиотипа, продуцируемого злокачественными плазматическими клетками. В одном варианте осуществления молекула антитела против PD-1 применяется в комбинации с антителом против TIM-3 для лечения миеломы, например, множественной миеломы.
В одном варианте осуществления комбинация, раскрытая в настоящей заявке, например, комбинация, включающая молекулу антитела против PD-1, включает или применяется в комбинации с химиотерапией для лечения рака легкого, например, немелкоклеточного рака легкого. В одном варианте осуществления молекула антитела против PD-1 применяется со стандартной при раке легкого, например НМРЛ, химиотерапией, например, двухкомпонентной терапией производными платины для лечения рака легкого. В других вариантах осуществления молекула антитела против PD-1 применяется в комбинации с ингибитором индоламин-пиррол-2,3-диоксигеназы (IDO) (например, (4E)-4-[(3-хлор-4-фторанилино)-нитрозометилиден]-1,2,5-оксадиазол-3-амином (также известным как INCB24360), индоксимодом (1-метил-D-триптофаном), α-циклогексил-5H-имидазо[5,1-a]изоиндол-5-этанолом (также известным как NLG919) и т.д.) у субъекта с распространенным или метастатическим раком (например, пациента с метастатическим и рецидивирующим НМРЛ).
В других вариантах осуществления комбинация, раскрытая в настоящей заявке, например, комбинация, включающая молекулу антитела против PD-1, включает или применяется в комбинации с одним или более следующего: иммунная стратегия (например, интерлейкин-2 или интерферон-α), средство направленного действия (например, ингибитор VEGF, такой как моноклональное антитело к VEGF); ингибитор VEGF тирозинкиназы, такой как сунитиниб, сорафениб, акситиниб и пазопаниб; ингибитор РНКи; или ингибитор медиатора передачи сигнала VEGF, например, ингибитор мишени рапамицина у млекопитающих (mTOR), например, эверолимус и темсиролимус. Любая из таких комбинаций может применяться для лечения рака почки, например, почечно-клеточной карциномы (RCC) (например, светлоклеточной почечно-клеточной карциномы (CCRCC) или несветлоклеточной почечно-клеточной карциномы (nccRCC), или метастатической RCC, или рака печени (например, гепатоцеллюлярной карциномы).
В некоторых вариантах осуществления комбинация, раскрытая в настоящей заявке, например, комбинация, включающая молекулу антитела против PD-1, включает или применяется в комбинации с ингибитором MEK (например, ингибитором MEK, как описано в настоящей заявке). В некоторых вариантах осуществления комбинация антитела против PD-1 и ингибитора MEK применяется для лечения рака (например, рака, описанного в настоящей заявке). В некоторых вариантах осуществления рак, подвергаемый лечению комбинацией, выбран из меланомы, рака толстой и прямой кишки, немелкоклеточного рака легкого, рака яичника, рака молочной железы, рака предстательной железы, рака поджелудочной железы, гемобластоза или почечно-клеточной карциномы. В некоторых вариантах осуществления рак включает мутацию BRAF (например, мутацию BRAF V600E), BRAF дикого типа, KRAS дикого типа или активирующую мутацию KRAS. Рак может быть на ранней, промежуточной или поздней стадии.
В другом варианте осуществления комбинация, раскрытая в настоящей заявке, например, комбинация, включающая молекулу антитела против PD-1, включает или применяется в комбинации с одним, двумя или всеми из оксалиплатина, лейковорина или 5-ФУ (например, комбинированная терапия FOLFOX). В альтернативе, или в комбинации, комбинация дополнительно включает ингибитор VEGF (например, ингибитор VEGF, как раскрыто в настоящей заявке). В некоторых вариантах осуществления комбинация антитела против PD-1, комбинированной терапии FOLFOX и ингибитора VEGF применяется для лечения рака (например, рака, описанного в настоящей заявке). В некоторых вариантах осуществления рак, подвергаемый лечению комбинацией, выбран из меланомы, рака толстой и прямой кишки, немелкоклеточного рака легкого, рака яичника, рака молочной железы, рака предстательной железы, рака поджелудочной железы, гемобластоза или почечно-клеточного рака. Рак может быть на ранней, промежуточной или поздней стадии.
В других вариантах осуществления комбинация, раскрытая в настоящей заявке, например, комбинация, включающая молекулу антитела против PD-1, включает или применяется с ингибитором тирозинкиназы (например, акситинибом) для лечения почечно-клеточной карциномы и других солидных опухолей.
В других вариантах осуществления комбинация, раскрытая в настоящей заявке, например, комбинация, включающая молекулу антитела против PD-1, включает или применяется со средством, направленным на рецептор 4-1BB (например, антителом, которое стимулирует передачу сигналов через 4-1BB (CD-137), например, PF-2566). В одном варианте осуществления молекулу антитела против PD-1 вводят в комбинации с ингибитором тирозинкиназы (например, акситинибом) и средством, направленным на рецептор 4-1BB.
Молекула антитела против PD-1 может быть связана с веществом, например, цитотоксическим средством или молекулой (например, терапевтическим лекарственным средством; соединением, испускающим излучение; молекулами растительного, грибкового или бактериального происхождения; или биологическим белком (например, белковым токсином), или частицей (например, рекомбинантной вирусной частицей, например, через белок вирусной оболочки). Например, антитело может быть соединено с радиоактивным изотопом, таким как α-, β- или γ-излучатель или β- и γ-излучатель.
Может применяться любая комбинация и последовательность молекул антитела против PD-1 и других терапевтических средств, процедур или методик (например, как описано в настоящей заявке). Молекула антитела и/или другие терапевтические средства, процедуры или методики могут применяться в периоды активного нарушения или в период ремиссии или менее активного заболевания. Молекулу антитела можно применять перед другим лечением, одновременно с лечением, после лечения или во время ремиссии нарушения.
Дополнительные комбинированные терапии
В некоторых вариантах осуществления любая из комбинаций, раскрытых в настоящей заявке, альтернативно или в комбинации, дополнительно включает одно или более средств, описанных в Таблице 7.
В некоторых вариантах осуществления дополнительное терапевтическое средство выбрано из одного или более следующего: 1) ингибитор протеинкиназы C (PKC); 2) ингибитор белка теплового шока 90 (HSP90); 3) ингибитор фосфоинозитид-3-киназы (PI3K) и/или мишени рапамицина (mTOR); 4) ингибитор цитохрома P450 (например, ингибитор CYP17 или ингибитор 17-альфа-гидроксилазы/C17-20 лиазы); 5) вещество, образующее комплексные соединения с железом; 6) ингибитор ароматазы; 7) ингибитор p53, например, ингибитор взаимодействия p53/Mdm2; 8) индуктор апоптоза; 9) ингибитор ангиогенеза; 10) ингибитор альдостеронсинтазы; 11) ингибитор рецептора smoothened (SMO); 12) ингибитор рецептора пролактина (PRLR); 13) ингибитор сигнала Wnt; 14) ингибитор CDK4/6; 15) ингибитора рецептора фактора роста фибробластов 2 (FGFR2)/рецептора фактора роста фибробластов 4 (FGFR4); 16) ингибитор макрофагального колониестимулирующего фактора (М-КСФ); 17) ингибитор одного или более из c-KIT, выброса гистамина, Flt3 (например, FLK2/STK1) или PKC; 18) ингибитор одного или более из VEGFR-2 (например, FLK-1/KDR), PDGFR-бета, c-KIT или Raf-киназы C; 19) ингибитор агониста соматостатина и/или высвобождения гормона роста; 20) ингибитор киназы анапластической лимфомы (ALK); 21) ингибитор рецептора инсулиноподобного фактора роста 1 (IGF-1R); 22) ингибитор P-гликопротеина 1; 23) ингибитор рецептора фактора роста эндотелия сосудов (VEGFR); 24) ингибитор киназы BCR-ABL; 25) ингибитор FGFR; 26) ингибитор CYP11B2; 27) ингибитор HDM2, например, ингибитор взаимодействия HDM2-p53; 28) ингибитор тирозинкиназы; 29) ингибитор c-MET; 30) ингибитор JAK; 31) ингибитор DAC; 32) ингибитор 11β-гидроксилазы; 33) ингибитор IAP; 34) ингибитор киназы PIM; 35) ингибитор поркупина; 36) ингибитор BRAF, например, BRAF V600E или BRAF дикого типа; 37) ингибитор HER3; 38) ингибитор MEK; или 39) ингибитор липидкиназы, например, как описано в настоящей заявке и в Таблице 7.
В одном варианте осуществления дополнительное терапевтическое средство выбрано из одного или более следующего: Соединение A8, Соединение A17, Соединение A23, Соединение A24, Соединение A27, Соединение A29, Соединение A33 и Соединение A13.
В других вариантах осуществления дополнительное терапевтическое средство выбрано из одного или более следующего: Соединение A5, Соединение A8, Соединение A17, Соединение A23, Соединение A24, Соединение A29 и Соединение A40.
В других вариантах осуществления дополнительное терапевтическое средство выбрано из одного или более следующего: Соединение A9, Соединение A16, Соединение A17, Соединение A21, Соединение A22, Соединение A25, Соединение A28, Соединение A48 и Составные 49.
В одном варианте осуществления рак выбран из рака легкого (например, немелкоклеточного рака легкого (НМРЛ) (например, НМРЛ с плоскоклеточной и/или неплоскоклеточной гистологией или НМРЛ аденокарциномы), или раскрыт в публикации, перечисленной в Таблице 7.
Биомаркеры
В другом аспекте, в настоящей заявке предложен способ оценки или мониторинга эффективности терапии (например, комбинированной терапии), описанной в настоящей заявке, у субъекта (например, субъекта, имеющего рак, например, рак, описанный в настоящей заявке). Способ включает регистрацию значения эффективности терапии, где указанное значение указывает на эффективность терапии.
В вариантах осуществления значение эффективности терапии включает количественный показатель одного, двух, трех, четырех, пяти, шести, семи, восьми, девяти или более (например, всех) из следующего:
(i) параметр фенотипа инфильтрирующего опухоль лимфоцита (TIL);
(ii) параметр популяции миелоидных клеток;
(iii) параметр экспрессии поверхностного маркера;
(iv) параметр биомаркера иммунологического ответа;
(v) параметр модуляции системного цитокина;
(vi) параметр свободно циркулирующей ДНК (сцДНК);
(vii) параметр системной иммунномодуляции;
(viii) параметр микробиома;
(ix) параметр маркера активации в циркулирующей иммунной клетке; или
(x) параметр циркулирующего цитокина.
В некоторых вариантах осуществления параметр фенотипа TIL включает уровень или активность одного, двух, трех, четырех или более (например, всех) из окрашивания гематоксилином и эозином (ГЭ) на количество TIL, CD8, FOXP3, CD4 или CD3, у субъекта, например, в образце субъекта (например, образце опухоли).
В некоторых вариантах осуществления параметр популяции миелоидных клеток включает уровень или активность одного или обоих из CD68 или CD163 у субъекта, например, в образце субъекта (например, образце опухоли).
В некоторых вариантах осуществления параметр экспрессии поверхностного маркера включает уровень или активность одного, двух или более (например, всех) из PD-L1, LAG-3 или TIM-3 у субъекта, например, в образце субъекта (например, образце опухоли).
В некоторых вариантах осуществления параметр биомаркера иммунологического ответа включает уровень или последовательность одного или более маркеров на основе нуклеиновой кислоты у субъекта, например, в образце субъекта (например, образце опухоли).
В некоторых вариантах осуществления параметр модуляции системного цитокина включает уровень или активность одного, двух, трех, четырех, пяти, шести, семи, восьми или более (например, всех) из IL-18, IFN-γ, ITAC (CXCL11), IL-6, IL-10, IL-4, IL-17, IL-15 или TGF-бета у субъекта, например, в образце субъекта (например, образце крови, например, образце плазмы крови).
В некоторых вариантах осуществления параметр сцДНК включает последовательность или уровень одной или более молекул циркулирующей опухолевой ДНК (сцДНК) у субъекта, например, в образце субъекта (например, образце крови, например, образце плазмы крови).
В некоторых вариантах осуществления параметр системной иммуномодуляции включает фенотипическую характеристику активированной иммунной клетки, например, CD3-экспрессирующей клетки, CD8-экспрессирующей клетки или обеих у субъекта, например, в образце субъекта (например, образце крови, например, образце МКПК).
В некоторых вариантах осуществления параметр микробиома включает последовательность или уровень экспрессии одного или более генов в микробиоме у субъекта, например, в образце субъекта (например, образце стула).
В некоторых вариантах осуществления параметр маркера активации в циркулирующей иммунной клетке включает уровень или активность одного, двух, трех, четырех, пяти или более (например, всех) из циркулирующих CD8+, HLA-DR+Ki67+, Т-клеток, IFN-γ, IL-18 или CXCL11 (IFN-γ индуцированных CCK) экспрессирующих клеток в образце (например, образце крови, например, образце плазмы крови).
В некоторых вариантах осуществления параметр циркулирующего цитокина включает уровень или активность IL-6 у субъекта, например, в образце субъекта (например, образце крови, например, образце плазмы крови).
В некоторых вариантах осуществления любого из способов, раскрытых в настоящей заявке, терапия включает комбинацию:
(a) ингибитора молекулы иммунной контрольной точки, например, ингибитора PD-1 (например, молекулы антитела против PD-1); и
(b) одного или более (например, двух, трех, четырех или более) из следующего:
(i) ингибитор IAP, (S)-N-(S)-1-циклогексил-2-(S)-2-(4-(4-фторбензоил)тиазол-2-ил)пирролидин-1-ил)-2-оксоэтил)-2-(метиламино)пропанамид (Соединение A21) или соединение, раскрытое в патенте США 8,552,003;
(ii) ингибитор mTOR, эверолимус (Соединение A36), или соединение, раскрытое в публикации PCT WO 2014/085318;
(iii) ингибитор DAC, панобиностат (Соединение A19), или соединение, раскрытое в публикации PCT WO 2014/072493;
(iv) ингибитор IL-1β, канакинумаб, или соединение, раскрытое в публикации PCT WO 2002/16436;
(v) ингибитор IL-17, CJM112, или соединение, раскрытое в публикации PCT WO 2014/122613;
(vi) ингибитор MEK или траметиниб; или
(vii) ингибитор EGFR, (R,E)-N-(7-хлор-1-(1-(4-(диметиламино)бут-2-еноил)азепан-3-ил)-1H-бензо[d]имидазол-2-ил)-2-метилизоникотинамид (Соединение A40), или соединение, раскрытое в публикации PCT WO 2013/184757.
В некоторых вариантах осуществления любого из способов, раскрытых в настоящей заявке, количественный показатель одного или более из (i)-(x) получают из образца, полученого от субъекта. В некоторых вариантах осуществления образец выбран из образца опухоли, образца крови (например, образца плазмы крови или образца МКПК) или образца стула.
В некоторых вариантах осуществления любого из способов, раскрытых в настоящей заявке, субъекта оценивают до получения, во время или после получения терапии, например, комбинированной терапии.
В некоторых вариантах осуществления любого из способов, раскрытых в настоящей заявке, количественный показатель одного или более из (i)-(x) оценивает профиль на одного или более из экспрессии гена, проточной цитометрии или экспрессии белка.
В некоторых вариантах осуществления любого из способов, раскрытых в настоящей заявке, присутствие повышенного уровня или активности одного, двух, трех, четырех, пяти или более (например, всех) из циркулирующих CD8+, HLA-DR+Ki67+, Т-клеток, IFN-γ, IL-18 или CXCL11 (IFN-γ индуцированных CCK) экспрессирующих клеток и/или присутствие пониженного уровня или активности IL-6 у субъекта или в образце является положительным прогностическим показателем эффективности терапии.
В альтернативе, или в комбинации со способами, раскрытыми в настоящей заявке, чувствительными к указанному значению, выполняют одно, два, три, четыре или более (например, все) из следующего:
(i) назначение субъекту терапии (например, комбинированной терапии);
(ii) введение изменяемой дозы терапии (например, комбинированной терапии);
(iii) изменение схемы или временного периода терапии (например, комбинированной терапии);
(iv) введение субъекту дополнительного средства (например, терапевтического средства, описанного в настоящей заявке) в комбинации с терапией (например, комбинированной терапией); или
(v) назначение субъекту альтернативной терапии (например, терапии, описанной в настоящей заявке).
Дополнительные варианты осуществления
В дополнительных вариантах осуществления предложен способ лечения рака, включающий: определение у субъекта или в образце (например, образце субъекта, включающем раковые клетки и, необязательно, иммуноциты, такие как TIL) присутствие одного, двух или всех из PD-L1, CD8 или IFN-γ, с получением значения для одного, двух или всех из PD-L1, CD8 и IFN-γ. Способ может дополнительно включать сравнение значений PD-L1, CD8 и/или IFN-γ с референсным значением, например, контрольным значением. Если значение PD-L1, CD8 и/или IFN-γ превышает референсное значение, например, контрольное значение, субъекту вводят терапевтически эффективное количество комбинации, описанной в настоящей заявке (например, комбинации, которая включает антитело против PD-1, описанное в настоящей заявке), необязательно в комбинации с одним или более другими средствами, в результате чего осуществляют лечение рака. Рак может быть, например, раком, описанным в настоящей заявке, таким как рак легкого (плоскоклеточный), рак легкого (аденокарцинома), рак головы и шеи, рак шейки матки (плоскоклеточный), рак желудка, рак щитовидной железы (например, анапластическая карцинома щитовидной железы), рак кожи (например, рак из клеток Меркеля или меланома), рак носоглотки, нейроэндокринная опухоль (например, атипичная легочная карциноидная опухоль) или рак молочной железы, например, ТН рак молочной железы, например, ИМ-ТН рак молочной железы. В некоторых вариантах осуществления рак является ЭР+ раком молочной железы или раком поджелудочной железы.
Также предложен способ лечения рака, включающий: исследование субъекта или образца (например, образца субъекта, включающего раковые клетки) на присутствие PD-L1, с определением значения PD-L1, сравнение значения PD-L1 с контрольным значением, и, если значение PD-L1 превышает контрольное значение, введение субъекту терапевтически эффективного количества комбинации, описанной в настоящей заявке (например, комбинации, которая включает антитело против PD-1, описанное в настоящей заявке), необязательно в комбинации с одним или более другими средствами, в результате чего осуществляют лечение рака. Рак может быть, например, раком, описанным в настоящей заявке, таким как немелкоклеточная (НМРЛ) аденокарцинома (АКА), НМРЛ плоскоклеточная карцинома (ПКК) или гепатоцеллюлярная карцинома (ГЦК).
В другом аспекте изобретения представлены диагностические или терапевтические наборы, которые включают молекулы антитела, описанные в настоящей заявке, и инструкции по применению.
Все публикации, заявки на патент, патенты и другие источники, указанные в настоящей заявке, полностью включены посредством отсылки.
Другие признаки, цели и преимущества изобретения будут ясны из описания и чертежей, а также из формулы изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На Фигуре 1 показаны аминокислотные последовательности вариабельных областей легкой и тяжелой цепи мышиного мАт против PD-1, BAP049. Верхние и нижние последовательности приведены из двух независимых анализов. Последовательности CDR-областей легкой и тяжелой цепи на основе нумерации Кэбата подчеркнуты. Последовательности CDR-областей легкой и тяжелой цепи на основе нумерации Чотиа выделены полужирным курсивом. Неспаренный остаток Cys в положении 102 последовательности легкой цепи заключен в рамку. Последовательности раскрыты в SEQ ID NO: 8, 228, 16 и 229, соответственно, в порядке появления.
На Фигуре 2A показаны аминокислотные последовательности вариабельных областей легкой и тяжелой цепи мышиного (Mu) мАт против PD-1, BAP049, выравненного с последовательностями зародышевой линии. Верхние и нижние последовательности являются последовательностями зародышевой линии (GL) и BAP049 (Mu мАт), соответственно. Последовательности CDR-областей легкой и тяжелой цепи на основе нумерации Кэбата подчеркнуты. Последовательности CDR-областей легкой и тяжелой цепи на основе нумерации Чотиа выделены полужирным курсивом. "-" означает идентичный аминокислотный остаток. Последовательности раскрыты в SEQ ID NO: 230, 8, 231 и 16, соответственно, в порядке появления.
На Фигуре 2B показана последовательность мышиного гена κ J2 и соответствующая мутация в мышином мАт против PD-1, BAP049. "-" означает идентичный нуклеотидный остаток. Последовательности раскрыты в SEQ ID NO: 233, 232, 234 и 235, соответственно, в порядке появления.
На Фигурах 3A-3B показано конкурентное связывание между флуоресцентно меченым мышиным мАт против PD-1, BAP049 (Mu мАт), и тремя химерными вариантами BAP049 (Chi мАт). Эксперимент проводили дважды, и результаты показаны на Фигурах 3A и 3B, соответственно. Три химерных антитела BAP049 (Chi мАт (Cys), Chi мАт (Tyr) и Chi мАт (Ser)) имеют остаток Cys, Tyr и Ser в положении 102 вариабельной области легкой цепи, соответственно. Chi мАт (Cys), Chi мАт (Tyr) и Chi мАт (Сер) также известны как BAP049-chi, BAP049-chi-Y и BAP049-chi-S, соответственно.
Фигура 4 является гистограммой, на которой показаны результаты анализ связывания FACS для шестнадцати гуманизированных клонов BAP049 (BAP049-hum01 - BAP049-hum16). Концентрации антител составляют 200, 100, 50, 25 и 12,5 нг/мл с левого столбца до правого столбца для каждого тестируемого мАт.
На Фигуре 5 показан структурный анализ гуманизированных клонов BAP049 (a, b, c, d и e обозначают различные типы последовательностей каркасной области). Также показаны концентрации мАт в образцах.
На Фигурах 6A-6B показана аффинность и специфичность связывания гуманизированных мАт BAP049, измеренные в анализе конкурентного связывания при использовании постоянной концентрации Alexa 488-меченого мышиного мАт BAP049, серийных разведений тестируемых антител и PD-1-экспрессирующих клеток 300.19. Эксперимент проводили дважды, и результаты показаны на Фигурах 6A и 6B, соответственно.
На Фигуре 7 показано ранжирование гуманизированных клонов BAP049 по данным FACS, анализа конкурентного связывания и структурного анализа. Также показаны концентрации мАт в образцах.
На Фигурах 8A-8B показано блокирование связывания лиганда с PD-1 в присутствии выбранных клонов гуманизированного BAP049. Блокирование связывания PD-L1-Ig и PD-L2-Ig с PD-1 показано на Фигуре 8A. Блокирование связывания PD-L2-Ig с PD-1 показано в Фигуре 8B. Оценивали BAP049-hum01, BAP049-hum05, BAP049-hum08, BAP049-hum09, BAP049-hum10 и BAP049-hum11. Также в анализы включали мышиное мАт BAP049 и химерное мАт, содержащее Tyr в положении 102 вариабельной области легкой цепи.
На Фигурах 9A-9B показано выравнивание последовательностей вариабельного домена тяжелой цепи для шестнадцати клонов гуманизированного BAP049 и химерного BAP049 (BAP049-chi). На Фигуре 9A показаны все последовательности (SEQ ID NO: 22, 38, 38, 38, 38, 38, 38, 38, 38, 38, 50, 50, 50, 50, 82, 82 и 86, соответственно, в порядке появления). На Фигуре 9B показаны только те аминокислотные последовательности, которые отличаются от мышиной последовательности (SEQ ID NO: 22, 38, 38, 38, 38, 38, 38, 38, 38, 38, 50, 50, 50, 50, 82, 82 и 86, соответственно, в порядке появления).
На Фигурах 10A-10B показано выравнивание последовательностей вариабельного домена легкой цепи для шестнадцати клонов гуманизированного BAP049 и химерного BAP049 (BAP049-chi). На Фигуре 10A показаны все последовательности (SEQ ID NO: 24, 66, 66, 66, 66, 70, 70, 70, 58, 62, 78, 74, 46, 46, 42, 54 и 54, соответственно, в порядке появления). На Фигуре 10B показаны только те аминокислотные последовательности, которые отличаются от мышиной последовательности (SEQ ID NO: 24, 66, 66, 66, 66, 70, 70, 70, 58, 62, 78, 74, 46, 46, 42, 54 и 54, соответственно, в порядке появления).
Фигура 11 является схематической диаграммой, на которой описан процессинг и презентация антигена, ответы эффекторных клеток и пути иммуносупрессии, являющиеся мишенью комбинированной терапии, раскрытой в настоящей заявке.
На Фигуре 12 показаны расчетные концентрации Ctrough (Cmin) для пациентов разного веса, получающих одну и ту же дозу примерной молекулы антитела против PD-1. Показано сравнение расчетной средней стационарной остаточной концентрации Ctrough после введения постоянной/фиксированной дозы в зависимости от массы тела в двух схемах введения молекулы антитела против PD-1.
На Фигуре 13 показаны наблюдаемые и прогнозируемые на основе модели (в совокупности или у отдельных пациентов) концентрации Cmin.
На Фигурах 14A-14B показаны накопление данных, временная динамика и внутрисубъектная вариабельность модели, использованной для исследования фармакокинетики. Заштрихованные области соответствуют 90% прогнозируемому интервалу; сплошные линии соответствуют медиане прогнозирования в каждой точке; черные точки соответствуют наблюдаемым фармакокинетическим данным.
На Фигуре 15 показан процент выживших мышей после имплантации клеток MC38 и введения антитела против PD-1, Соединения A21 или комбинации антитела против PD-1 и Соединения A21.
На Фигуре 16A показана масса тела десяти животных в группе, получавших растворитель, антитело против мышиного PD-1 (четыре дозы 10 мг/кг, в/в, раз в неделю), панобиностат (Соединение A19, пяти доз 10 мг/кг, раз в два дня) или комбинацию панобиностата и антитела против мышиного PD-1.
На Фигуре 16B показаны реакции отдельных опухолей на лечение контрольным растворителем, антителом против мышиного PD-1, панобиностатом (Соединением A19) или комбинацией панобиностата и антитела против мышиного PD-1.
На Фигуре 17 показан процент выживших мышей-носителей аллотрансплантатов лимфомы A20 после введения Соединения A40, ибрутиниба, антитела против PD-L1, комбинации Соединения A40 и антитела против PD-L1 или комбинации ибрутиниба и антитела против PD-L1 (антитело против PD-L1 обозначено как aPD-L1).
На Фигуре 18 показан средний объем опухолей у мышей-носителей аллотрансплантатов лимфомы A20 после введения Соединения A40, ибрутиниба, антитела против PD-L1, комбинации Соединения A40 и антитела против PD-L1 или комбинации ибрутиниба и антитела против PD-L1 (антитело против PD-L1 обозначено как aPD-L1).
На Фигуре 19 показана схема I/II фазы исследований первого применения у человека примерной молекулы антитела против PD-1 у больных с распространенными солидными опухолями. *Для определения МПД потребовался по меньшей мере 21 пациент. Оценки опухоли проводили при скрининге, затем каждые 2 курса (1 курс=28 дней) ±1 неделя, начиная с Курса 3 Дня 1 до Курса 11 Дня 1, и после этого каждые 3 курса до прегрессирования заболевания за irRC или исключения пациента. irRC, иммунозависимые критерии ответа при лечении солидных опухолей; МПД, максимальная переносимая доза; НМРЛ, немелкоклеточный рак легкого; RP2D, рекомендованная доза во II фазе; ТНРМЖ, трижды негативный рак молочной железы.
На Фигуре 20 показано процентное изменение целевых очагов в динамике для каждого из подлежащих рентгенографической оценке пациентов, получавших молекулу антитела против PD-1 в I/II фазе исследований. Лечение пациентов проводили согласно следующим схемам: 1 мг/кг раз в две недели, 3 мг/кг раз в две недели, 10 мг/кг раз в две недели, 3 мг/кг раз в четыре недели или 5 мг/кг раз в четыре недели (примерные линии на фигуре обозначены схемами применения).
На Фигурах 21A-21C показаны оценки опухолей и иммуногистохимическое обнаружение CD8+ Т-лимфоцитов у пациента, имеющего метастатическую атипичную карциноидную опухоль легкого с клиническим ответом на молекулу антитела против PD-1 в I/II фазе исследований.
На Фигуре 21A показаны изображения КТ-сканирования, демонстрирующие реакцию у пациента. На левой панели показан метастаз печени до лечения антителами. На средней панели показана псевдопрогрессия в печени (сопровождаемая значительным уменьшением очагов поражений в легком, не показано) при первом повторном определении стадии. На правой панели показан ответ во всех очагах при втором повторном определении стадии.
На Фигуре 21B показано уменьшение нагрузки метастатической атипичной карциноидной опухоли легкого (% изменение относительно исходного значения) и отдельных очагов (размер очага (нм)) у пациента.
На Фигуре 21C показаны изображения иммуногистохимической окраски, на которых показаны высокие уровни CD8+ Т-лимфоцитов в образце опухоли, полученном от пациента во время Курса 2, в День 1. BL, исходные значения; C2D1, Курс 2, День 1.
На Фигуре 22A показан процент выживших мышей после имплантации клеток MC38 и введения антитела против PD-1, Соединения A15 (один раз в неделю или ежедневно) или комбинации антитела против PD-1 и Соединения A15 (один раз в неделю или ежедневно).
На Фигуре 22B показан средний объем опухоли у мышей после имплантации клеток MC38 и введения антитела против PD-1, Соединения A15 (ежедневно) или комбинации антитела против PD-1 и Соединения A15 (ежедневно).
На Фигуре 22C показан средний объем опухоли у мышей после имплантации клеток MC38 и введения антитела против PD-1, Соединения A15 (один раз в неделю) или комбинации антитела против PD-1 и Соединения A15 (один раз в неделю).
На Фигуре 23 показано улучшение в динамике до конечного результата, наблюдаемого у животных, получавших молекулу антитела против PD-L1 в комбинации с антителом против PD-1.
КРАТКОЕ ОПИСАНИЕ ТАБЛИЦ
Таблица 1 - таблица аминокислотных и нуклеотидных последовательностей молекул мышиных, химерных и гуманизированных антител против PD-1. Молекулы антител включают мышиное мАт BAP049, химерные мАт BAP049-chi и BAP049-chi-Y, а также гуманизированные мАт BAP049-hum01 - BAP049-hum16 и BAP049-Clone-A - BAP049-Clone-E. В данной таблице показаны аминокислотные и нуклеотидные последовательности CDR-областей тяжелой и легкой цепи, аминокислотные и нуклеотидные последовательности вариабельных областей тяжелой и легкой цепи, и аминокислотные и нуклеотидные последовательности тяжелых и легких цепей.
В Таблице 2 показаны аминокислотные и нуклеотидные последовательности каркасных областей тяжелой и легкой цепи гуманизированных мАт BAP049-hum01 - BAP049-hum16 и BAP049-Clone-A - BAP049-Clone-E.
В Таблице 3 показаны аминокислотные последовательности константной области тяжелых цепей IgG человека и каппа легкой цепи человека.
В Таблице 4 показаны аминокислотные последовательности лидерных последовательностей тяжелой и легкой цепи гуманизированных мАт BAP049-Clone-A - BAP049-Clone-E.
В Таблице 5 показаны примерные ФК параметры на основе схем введения постоянной дозы.
В Таблице 6 предоставлен примерный список терапевтических средств из Антигенпрезентирующих комбинаций (Категория A), Комбинаций эффекторной клетки (Категория B) и Комбинаций против опухолевой иммуносупрессии (Категория C).
Таблица 7 - таблица выбранных терапевтических средств, которые можно вводить в комбинации с молекулами антитела против PD-1 и другими иммуномодуляторами (например, одним или более следующих: активатор костимулирующей молекулы и/или ингибитор молекулы иммунной контрольной точки), описанными в настоящей заявке. В Таблице 7 представлено следующее, слева направо: Обозначение соединения второго терапевтического средства, Структура соединения и Патентная публикация(и), в которой раскрыто Соединение.
Таблица 8 - таблица примерных биомаркеров и набора образцов, например, для оценки эффективности способов лечения (например, комбинированных терапий), описанных в настоящей заявке.
Таблица 9 - таблица целей и ожидаемых показателей в I/II фазе исследований.
Таблица 10 - таблица демографических данных и характеристик пациентов в I/II фазе исследований.
В Таблице 11 показано распределение пациентов в I/II фазе исследований.
Таблица 12 показаны нежелательные явления независимо от отношения к исследуемому лекарственному средству в I/II фазе исследований (любой градиент, наблюдаемый у≥20% пациентов - выборка для оценки безопасности).
В Таблице 13 показан наилучший общий ответ (на основе оценки статуса болезни, проводимой исследователем при использовании критерия RECIST v1.1).
ПОДРОБНОЕ ОПИСАНИЕ
В настоящей заявке раскрыты, по меньшей мере частично, молекулы антитела (например, молекулы гуманизированного антитела), которые связываются с белком программируемой смерти 1 (PD-1) с высокой аффинностью и специфичностью. Также предложены молекулы нуклеиновых кислот, кодирующие молекулы антитела, векторы экспрессии, клетки-хозяева и способы получения молекул антитела. Также предложены фармацевтические композиции и дозированные лекарственные формы, включающие молекулы антитела. Молекулы антитела против PD-1, раскрытые в настоящей заявке, могут применяться (отдельно или в комбинации с другими средствами или терапевтическими методами) для лечения, предотвращения и/или диагностики таких нарушений, как онкологические заболевания (например, солидные опухоли и опухоли мягких тканей), а также инфекционные заболевания (например, хронические инфекционные заболевания или сепсис). Таким образом, в настоящей заявке раскрыты композиции и способы обнаружения PD-1, а также способы лечения различных нарушений, в том числе рака и/или инфекционных заболеваний, с применением молекул антитела против PD-1. В некоторых вариантах осуществления молекулу антитела против PD-1 вводят или применяют в постоянной или фиксированной дозе.
Также в настоящей заявке раскрыты способы и композиции, включающие комбинацию двух, трех или более терапевтических средств, выбранных из одного, двух или всех следующих категорий (i)-(iii): (i) средство, которое увеличивает презентацию антигена (например, презентацию опухолевого антигена) (например, посредством увеличения одного или более из активности или созревания дендритных клеток, захвата антигена или процессинга антигена); (ii) средство, которое усиливает ответ эффекторных клеток (например, ответ иммунных эффекторных клеток, например, активацию и/или мобилизацию В-клеток и/или Т-клеток, например, в лимфатическом узле); или (iii) средство, которое уменьшает опухолевую иммуносупрессию (например, посредством увеличения инфильтрации Т-клеток и уничтожения опухолевых клеток). В некоторых вариантах осуществления комбинация включает ингибитор PD-1 (например, молекулу антитела против PD-1, как описано в настоящей заявке). Без ограничения теорией, считается, что терапевтические методы, которые усиливают противоопухолевый иммунитет, более эффективны, когда иммунный ответ оптимизирован через различные мишени на разных стадиях иммунного ответа. Каждая из этих стадий показана в схематической форме на Фигуре 21. Например, методы, которые приводят к активации дендритных клеток, комбинированные с методами, которые усиливают клеточный и гуморальный иммунитет, могут приводить к более эффективному и/или длительному терапевтическому ответу.
Дополнительные термины определены ниже и по всему тексту заявки.
При использовании в настоящей заявке формы единственного числа (артикли "a" и "an" в оригинальном тексте описания) относятся к одному или больше чем одному (например, по меньшей мере к одному) грамматическому объекту артикля.
Термин "или" используется в настоящей заявке для обозначения термина "и/или" и используется попеременно с ним, если из контекста прямо не следует иное.
"Приблизительно" и "около" обычно означают допустимую степень погрешности для измеряемой величины с учетом характера или точности измерений. Примерная степень ошибки находится в пределах 20 процентов (%), как правило, в пределах 10%, и более типично в пределах 5% от заданного значения или диапазона значений.
Под "комбинацией" или "в комбинации с" не подразумевается, что терапия или терапевтические средства нужно вводить в одно и то же время и/или включать для доставки в одну лекарственную форму, хотя такие способы доставки включены в объем настоящего описания. Терапевтические средства в комбинации можно применять одновременно, до или после одного или более других дополнительных терапий или терапевтических средств. Терапевтические средства или терапевтический протокол могут применять в любом порядке. Как правило, каждое средство вводят в дозе и/или по графику, определенному для данного средства. Также следует понимать, что дополнительное терапевтическое средство, применяемое в данной комбинации, можно вводить вместе в одной композиции или вводить отдельно в разных композициях. В целом предполагается, что дополнительные терапевтические средства, применяемые в комбинации, будут применяться на уровнях, которые не превышают уровни, на которых они применяются отдельно. В некоторых вариантах осуществления уровни, применяемые в комбинации, будут ниже, чем применяемые отдельно.
В вариантах осуществления дополнительное терапевтическое средство применяют в терапевтической или более низкой дозе, чем терапевтическая доза. В некоторых вариантах осуществления концентрация второго терапевтического средства, которая требуется для ингибирования, например ингибирования роста, ниже в том случае, когда второе терапевтическое средство применяют в комбинации с первым терапевтическим средством, например, молекулой антитела против PD-1, чем в том случае, когда второе терапевтическое средство вводят отдельно. В некоторых вариантах осуществления концентрация первого терапевтического средства, которая требуется для ингибирования, например ингибирования роста, ниже в том случае, когда первое терапевтическое средство вводят в комбинации со вторым терапевтическим средством, чем в том случае, когда первое терапевтическое средство вводят отдельно. В некоторых вариантах осуществления, в комбинированной терапии, концентрация второго терапевтического средства, которая требуется для ингибирования, например ингибирования роста, ниже, чем терапевтическая доза второго терапевтического средства при монотерапии, например, ниже на 10-20%, 20-30%, 30-40%, 40-50%, 50-60%, 60-70%, 70-80% или на 80-90%. В некоторых вариантах осуществления, в комбинированной терапии, концентрация первого терапевтического средства, которая требуется для ингибирования, например ингибирования роста, ниже, чем терапевтическая доза первого терапевтического средства при монотерапии, например, ниже на 10-20%, 20-30%, 30-40%, 40-50%, 50-60%, 60-70%, 70-80% или на 80-90%.
Термин "ингибирование", "ингибитор" или "антагонист" включает уменьшение некоторого параметра, например активности, данной молекулы, например, ингибитора иммунной контрольной точки. Например, данный термин включает ингибирование активности, например активности PD-1 или PD-L1, по меньшей мере на 5%, 10%, 20%, 30%, 40% или больше. Таким образом ингибирование не должно составлять 100%.
Термин "активация", "активатор" или "агонист" включает увеличение некоторого параметра, например активности, данной молекулы, например, костимулирующей молекулы. Например, данный термин включает увеличение активности, например костимулирующей активности, по меньшей мере на 5%, 10%, 25%, 50%, 75% или больше.
Термин "противораковое действие" относится к биологическому действию, которое может проявляться разными способами, в том числе, без ограничения, например, уменьшением объема опухоли, уменьшением количества раковых клеток, уменьшением количества метастазов, увеличением продолжительности жизни, уменьшением пролиферации раковых клеток, уменьшением выживания раковых клеток или уменьшением тяжести различных физиологических симптомов, связанных с онкологическим заболеванием. "Противораковое действие" может также проявляться в способности пептидов, полинуклеотидов, клеток и антител предотвращать первичное возникновение рака.
Термин "противоопухолевое действие" относится к биологическому действию, которое может проявляться разными способами, в том числе, без ограничения, например, уменьшением объема опухоли, уменьшением количества опухолевых клеток, уменьшением пролиферации опухолевых клеток или уменьшением выживания опухолевых клеток.
Термин "рак" относится к заболеванию, характеризуемому быстрым и безконтрольным ростом аберрантных клеток. Раковые клетки могут распространяться локально или, через кровоток и лимфатическую систему, в другие части тела. Примеры различных форм рака описаны в настоящей заявке и включают, без ограничения перечисленными, рак молочной железы, рак предстательной железы, рак яичника, рак шейки матки, рак кожи, рак поджелудочной железы, рак толстой и прямой кишки, рак почки, рак печени, рак головного мозга, лимфому, лейкоз, рак легкого и т.п. Термины "опухоль" и "рак" используются в настоящей заявке попеременно, например, оба термина охватывают солидные и гемобластные, например, диффузные или циркулирующие опухоли. При использовании в настоящей заявке термин "рак" или "опухоль" включает предраковые опухоли, а также рак и злокачественные опухоли.
Термин "антигенпрезентирующая клетка" или "АПК" относится к клетке иммунной системы, такой как вспомогательная клетка (например, В-клетка, дендритная клетка и т.п.), которая презентирует чужеродный антиген, связанный с молекулами главного комплекса гистосовместимости (MHC), на своей поверхности. Т-клетки могут распознавать такие комплексы при использовании своих T-клеточных рецепторов (TCR). АПК процессируют антигены и презентируют их Т-клеткам.
Термин "костимулирующая молекула" относится к когнатному партнеру по связыванию на Т-клетке, который специфично связывается с костимулирующим лигандом, опосредуя таким образом костимулирующий ответ Т-клетки, такой как, без ограничения перечисленным, пролиферацию. Костимулирующие молекулы являются молекулами клеточной поверхности, отличными от антигенных рецепторов или их лигандов, которые требуются для эффективного иммунного ответа. Костимулирующие молекулы включают, без ограничения перечисленными, молекулу MHC I класса, ФНО-рецепторные белки, иммуноглобулиноподобные белки, рецепторы цитокинов, интегрины, сигнальные лимфоцит-активирующие молекулы (белки SLAM), активирующие NK-клеточные рецепторы, BTLA, рецептор Толл-лиганда, OX40, CD2, CD7, CD27, CD28, CD30, CD40, CD, ICAM-1, LFA-1 (CD11a/CD18), 4-1BB (CD137), B7-H3, CD, ICAM-1, ICOS (CD278), GITR, BAFFR, СВЕТ, HVEM (LIGHTR), KIRDS2, SLAMF7, NKp80 (KLRF1), NKp44, NKp30, NKp46, CD19, CD4, CD8 альфа, CD8 бета, IL2R бета, IL2R гамма, IL7R альфа, ITGA4, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA-6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA-1, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, LFA-1, ITGB7, NKG2D, NKG2C, TNFR2, TRANCE/RANKL, DNAM1 (CD226), SLAMF4 (CD244, 2B4), CD84, CD96 (Tactile), CEACAM1, CRTAM, Ly9 (CD229), CD160 (BY55), PSGL1, CD100 (SEMA4D), CD69, SLAMF6 (NTB-A, Ly108), SLAM (SLAMF1, CD150, IPO-3), BLAME (SLAMF8), SELPLG (CD162), LTBR, LAT, GADS, SLP-76, PAG/Cbp, CD19a и лиганд, который специфично связывается с CD83.
"Иммунная эффекторная клетка" или "эффекторная клетка", при использовании данного термина в настоящей заявке, относится к клетке, которая задействована в иммунном ответе, например, в стимуляции иммунного эффекторного ответа. Примеры иммунных эффекторных клеток включают Т-клетки, например, альфа/бета Т-клетки и гамма/дельта Т-клетки, В-клетки, естественные киллерные (NK) клетки, естественные киллерные Т-клетки (NKT), тучные клетки и фагоциты миелоидного происхождения.
"Иммунная эффекторная" или "эффекторная" "функция" или "ответ", при использовании данного термина в настоящей заявке, относится к функции или ответу, например, иммунной эффекторной клетки, которые усиливают или стимулируют иммунную атаку клетки-мишени. Например, иммунная эффекторная функция или ответ относятся к свойству T или NK-клетки, которое вызывает уничтожение или ингибирование роста или пролиферации клетки-мишени. В случае Т-клетки первичная стимуляция и костимуляция являются примерами иммунной эффекторной функции или ответа.
Термин "эффекторная функция" относится к специализированной функции клетки. Эффекторная функция Т-клетки, например, может быть цитолитической активностью или хелперной активностью, включающей секрецию цитокинов.
При использовании в настоящей заявке термины "лечить" и "лечение" относятся к уменьшению или ослаблению прогрессии, тяжести и/или длительности нарушения, например, пролиферативного нарушения, или к улучшению одного или более симптомов (предпочтительно, одного или более явных симптомов) нарушения, вызванному применением одной или более терапий. В некоторых вариантах осуществления термины "лечить" и "лечение" относятся к ослаблению по меньшей мере одного измеримого физического параметра пролиферативного нарушения, такого как рост опухоли, не являющегося обязательно явным для пациента. В других вариантах осуществления термины "лечить" и "лечение" относятся к ингибированию прогрессирования пролиферативного нарушения, либо физическому, например, посредством стабилизации явного симптома, либо физиологическому, например, посредством стабилизации физического параметра, или и к тому, и к другому. В других вариантах осуществления термины "лечить" и "лечение" относятся к уменьшению или стабилизации размера опухоли или количества раковых клеток.
Композиции и способы настоящего изобретения охватывают полипептиды и нуклеиновые кислоты, имеющие определенные последовательности, или последовательности, по существу идентичные или подобные им, например, последовательности по меньшей мере на 85%, 90%, 95% или более идентичные определенной последовательности. В случае аминокислотной последовательности термин "по существу идентичный" используется в настоящей заявке для обозначения первой аминокислоты, которая содержит достаточное или минимальное количество аминокислотных остатков, которые: i) идентичны или ii) являются консервативными заменами выравненных аминокислотных остатков во второй аминокислотной последовательности, в результате чего первая и вторая аминокислотные последовательности могут иметь общий структурный домен и/или общую функциональную активность. Например, аминокислотные последовательности, которые содержат общий структурный домен, обладающий по меньшей мере приблизительно 85%, 90%. 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью с референсной последовательностью, например, последовательностью, представленной в настоящей заявке.
В случае нуклеотидной последовательности термин "по существу идентичный" используется в настоящей заявке для обозначения первой последовательности нуклеиновой кислоты, которая содержит достаточное или минимальное количество нуклеотидов, которые идентичны выравненным нуклеотидам во второй последовательности нуклеиновой кислоты, в результате чего первая и вторая нуклеотидные последовательности кодируют полипептид, обладающий общей функциональной активностью, или кодируют общий структурный домен полипептида или общую функциональную активность полипептида. Например, нуклеотидные последовательности, обладающие по меньшей мере приблизительно 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичностью с референсной последовательностью, например, последовательностью, представленной в настоящей заявке.
Термин "функциональный вариант" относится к полипептидам, которые имеют аминокислотную последовательность, по существу идентичную природной последовательности или кодируемую по существу идентичной нуклеотидной последовательностью, и могут обладать одной или более активностями природной последовательности.
Вычисления гомологии или идентичности последовательностей (термины используются в настоящей заявке попеременно) выполняют следующим образом.
Для определения процента идентичности двух аминокислотных последовательностей или двух последовательностей нуклеиновых кислот, последовательности выравнивают с целью оптимального сравнения (например, пропуски могут быть введены в одну или обе из первой и второй аминокислотной последовательности или последовательности нуклеиновых кислот для оптимального выравнивания, при этом негомологичные последовательности можно не учитывать в целях сравнения). В предпочтительном варианте осуществления длина референсной последовательности, выравненной в целях сравнения, составляет по меньшей мере 30%, предпочтительно по меньшей мере 40%, более предпочтительно по меньшей мере 50%, 60% и еще более предпочтительно по меньшей мере 70%, 80%, 90%, 100% от длины референсной последовательности. Затем сравнивают аминокислотные остатки или нуклеотиды в соответствующих аминокислотных положениях или нуклеотидных положениях. Если положение в первой последовательности занимает такой же аминокислотный остаток или нуклеотид, как и в соответствующем положении во второй последовательности, то тогда молекулы в данном положении являются идентичными (при использовании в настоящем описании "идентичность" аминокислоты или нуклеиновой кислоты эквивалентна "гомологии" аминокислоты или нуклеиновой кислоты).
Процент идентичности между двумя последовательностями зависит от числа идентичных положений в этих последовательностях, с учетом количества пропусков и длины каждого пропуска, которые требуется ввести для оптимального выравнивания двух последовательностей.
Сравнение последовательностей и определение процента идентичности между двумя последовательностями может быть выполнено при использовании математического алгоритма. В предпочтительном варианте осуществления процент идентичности между двумя аминокислотными последовательностями определяют с помощью алгоритма Нидлмана и Вунша (Needleman and Wunsch (1970) J. Mol. Biol. 48:444-453), который входит в программу GAP в пакете программ GCG (доступного по адресу www.gcg.com), при использовании матрицы Blossum 62 или матрицы РАМ250, а также штрафа за введение пропуска 16, 14, 12, 10, 8, 6 или 4, и штраф за продолжение пропуска 1, 2, 3, 4, 5 или 6. В другом предпочтительном варианте осуществления процент идентичности между двумя нуклеотидными последовательностями определяют при использовании программы GAP в пакете программ GCG (доступного по адресу www.gcg.com), с использованием матрицы NWSgapdna.CMP, штрафа за введение пропуска 40, 50, 60, 70 или 80 и штрафа за продолжение пропуска 1, 2, 3, 4, 5 или 6. Особенно предпочтительный набор параметров (и набор, который следует использовать, если не указано иное) представляет собой матрицу замен Blossum 62 со штрафом за введение пропуска 12, штрафом за продление пропуска 4 и штраф за пропуск со сдвигом рамки 5.
Процент идентичности между двумя аминокислотными или нуклеотидными последовательностями может быть определен при использовании алгоритма Ю. Майерса и У. Миллера (Е. Meyers и W. Miller (1989) CABIOS, 4: 1117), который входит в программу ALIGN (версии 2.0), с использованием таблицы весов замен остатков РАМ120, штраф за продление пропуска 12 и штрафа за введение пропуска 4.
Последовательности нуклеиновых кислот и белков, описанные в настоящей заявке, могут применяться в качестве "запрашиваемой последовательности" для выполнения поиска в общедоступных базах данных, например, для идентификации других членов семейства или родственных последовательностей. Такие поиски могут быть выполнены с помощью программы NBLAST и XBLAST (версии 2.0), согласно публикации Altschul et al. (1990), J. Mol. Biol. 215:403-10. Поиски нуклеотидов в BLAST могут быть выполнены с помощью программы NBLAST, score=100, wordlength=12, с получением нуклеотидных последовательностей, гомологичных молекулам нуклеиновой кислоты (SEQ ID NO: 1) согласно изобретению. Поиск белков в BLAST может быть выполнен с помощью программы XBLAST, score=50, wordlength=3, с получением аминокислотных последовательностей, гомологичных белковым молекулам согласно изобретению. Для получения выравниваний с пропусками, в целях сравнения, можно использовать программу Gapped BLAST, описанную в Altschul et al., (1997) Nucleic Acids Res. 25:3389-3402. При использовании программ BLAST и Gapped BLAST можно применять параметры по умолчанию соответствующих программ (например, XBLAST и NBLAST). См. www.ncbi.nlm.nih.gov.
При использовании в настоящем описании термин "гибридизуется в условиях низкой строгости, средней строгости, высокой строгости или в условиях очень высокой строгости" описывает условия гибридизации и промывки. Руководство по проведению реакций гибридизации можно найти в справочнике Current Protocols in Molecular Biology, John Wiley & Sons, N.Y. (1989), 6.3.1-6.3.6, который включен в настоящее описание посредством отсылки. В указанном справочнике описаны водные и неводные способы, при этом можно использовать любой из них. Конкретные условия гибридизации, указанные в настоящем описании, являются следующими: 1) условия гибридизации низкой строгости в 6× хлориде натрия/цитрате натрия (SSC) приблизительно при 45°C, с двумя последующими промывками в 0,2× SSC, 0,1% SDS, по меньшей мере при 50°C (в условиях низкой строгости температуру при промывках можно повышать до 55°C); 2) условия гибридизации средней строгости в 6× SSC приблизительно при 45°C, с последующей одной или более промывками в 0,2× SSC, 0,1% SDS при 60°C; 3) условия гибридизации высокой строгости в 6× SSC приблизительно при 45°C, с последующей одной или более промывками в 0,2× SSC, 0,1% SDS при 65°C; и, предпочтительно, 4) условия гибридизации очень высокой строгости: 0,5М фосфат натрия, 7% SDS при 65°C, с последующей одной или более промывками в 0,2× SSC, 1% SDS при 65°C. Условия очень высокой строгости (4) являются предпочтительными условиями и условиями, которые следует использовать, если не указано иное.
Следует понимать, что молекулы согласно настоящему изобретению могут иметь дополнительные консервативные или несущественные аминокислотные замены, которые не оказывают существенного влияния на их функции.
Предполагается, что термин "аминокислота" охватывает все молекулы, как природные, так и синтетические, которые одновременно включают функциональную аминогруппу и функциональную кислотную группу, и могут входить в состав полимера из природных аминокислот. Примеры аминокислот включают природные аминокислоты, их аналоги, производные и родственные соединения; аналоги аминокислот, имеющие модифицированные боковые цепи; и все их стереоизомеры любого из предыдущего. При использовании в изобретении термин "аминокислота" включает D- и L- оптические изомеры и пептидомиметики.
"Консервативная аминокислотная замена" является заменой, при которой аминокислотный остаток заменяется аминокислотным остатком, имеющим подобную боковую цепь. В уровне техники были определены семейства аминокислотных остатков, имеющих подобные боковые цепи. Такие семейства включают аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин), кислотными боковыми цепями (например, аспарагиновую кислоту, глутаминовую кислоту), незаряженными полярными боковыми цепями (например, глицин, аспарагин, глутамин, серии, треонин, тирозин, цистеин), неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан), бета-разветвленными боковыми цепями (например, треонин, валин, изолейцин) и ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан, гистидин).
Термины "полипептид", "пептид" и "белок" (в случае одной цепи) используются в настоящей заявке попеременно для обозначения аминокислотных полимеров любой длины. Такой полимер может быть линейным или разветвленным, он может включать модифицированные аминокислоты, и он может прерываться неаминокислотами. Данные термины также охватывают аминокислотный полимер, который был модифицирован; например, посредством образования дисульфидной связи, гликозилирования, липидирования, ацетилирования, фосфорилирования или любой другой манипуляции, такой как конъюгирование с метящим компонентом. Полипептид может быть выделен из природных источников, может быть получен с помощью рекомбинантных методов из эукариотического или прокариотического организма-хозяина, или может быть продуктом методик синтеза.
Термины "нуклеиновая кислота", "последовательность нуклеиновой кислоты", "нуклеотидная последовательность" или "полинуклеотидная последовательность" и "полинуклеотид" используются попеременно. Данные термины относятся к полимерной форме нуклеотидов любой длины, дезоксирибонуклеотидов или рибонуклеотидов, или их аналогов. Полинуклеотид может быть одноцепочечным или двухцепочечным, причем в том случае, если он является одноцепочечным, он может являться кодирующей цепью или некодирующей (антисмысловой) цепью. Полинуклеотид может содержать модифицированные нуклеотиды, такие как метилированные нуклеотиды и аналоги нуклеотидов. Последовательность нуклеотидов может прерываться ненуклеотидными компонентами. Полинуклеотид может быть дополнительно модифицирован после полимеризации, например, путем конъюгирования с метящим компонентом. Нуклеиновая кислота может быть рекомбинантным полинуклеотидом или полинуклеотидом геномного, кДНК, полусинтетического или синтетического происхождения, который либо не встречается в природе, либо связан с другим полинуклеотидом в неприродной конфигурации.
Термин "выделенный" при использовании в настоящей заявке относится к материалу, который был удален из исходного или нативного окружения (например, из природной среды, если такой материал является природным). Например, природный полинуклеотид или полипептид, присутствующий в живом животном, не является выделенным, однако тот же полинуклеотид или полипептид, отделенный при вмешательстве человека от некоторых или всех сопутствующих материалов в природной системе, является выделенным. Такие полинуклеотиды могут быть частью вектора, и/или такие полинуклеотиды или полипептиды могут быть частью композиции, и при этом будут являться выделенными в таком векторе или композиции, поскольку не будут являться частью среды, в которой они находятся в природе.
Различные аспекты настоящего изобретения более подробно описаны ниже. Дополнительные определения приведены в тексте описания.
Примерные комбинации антигенпрезентирующих комбинаций, комбинаций эффекторной клетки и комбинаций против опухолевой иммуносупрессии
В настоящей заявке представлены примерные комбинации терапевтических средств из двух или более категорий из антигенпрезентирующей категории (A), категории эффекторной клетки (B) и категории против опухолевой иммуносупрессии (C).
Таблица 6: Список терапевтических средств в категориях (A)-(C)
В некоторых вариантах осуществления комбинации настоящего изобретения включают одно или более следующего:
A1B1, A1B2, A1B3, A1B4, A1B5, A1B6, A1B7, A1B8, A1B9, A1B10, A1B11, A1B12, A2B1, A2B2, A2B3, A2B4, A2B5, A2B6, A2B7, A2B8, A2B9, A2B10, A2B11, A2B12, A3B1, A3B2, A3B3, A3B4, A3B5, A3B6, A3B7, A3B8, A3B9, A3B10, A3B11, A3B12, A4B1, A4B2, A4B3, A4B4, A4B5, A4B6, A4B7, A4B8, A4B9, A4B10, A4B11, A4B12, A5B1, A5B2, A5B3, A5B4, A5B5, A5B6, A5B7, A5B8, A5B9, A5B10, A5B11, A5B12, A6B1, A6B2, A6B3, A6B4, A6B5, A6B6, A6B7, A6B8, A6B9, A6B10, A6B11, A6B12, A7B1, A7B2, A7B3, A7B4, A7B5, A7B6, A7B7, A7B8, A7B9, A7B10, A7B11, A7B12, A8B1, A8B2, A8B3, A8B4, A8B5, A8B6, A8B7, A8B8, A8B9, A8B10, A8B11, A8B12, A9B1, A9B2, A9B3, A9B4, A9B5, A9B6, A9B7, A9B8, A9B9, A9B10, A9B11, A9B12, A10B1, A10B2, A10B3, A10B4, A10B5, A10B6, A10B7, A10B8, A10B9, A10B10, A10B11, A10B12, A11B1, A11B2, A11B3, A11B4, A11B5, A11B6, A11B7, A11B8, A11B9, A11B10, A11B11, A11B12, A1C1, A1C2, A1C3, A1C4, A1C5, A1C6, A1C7, A1C8, A1C9, A1C10, A1C11, A1C12, A1C13, A1C14, A1C15, A1C16, A1C17, A1C18, A1C19, A1C20, A1C21, A2C1, A2C2, A2C3, A2C4, A2C5, A2C6, A2C7, A2C8, A2C9, A2C10, A2C11, A2C12, A2C13, A2C14, A2C15, A2C16, A2C17, A2C18, A2C19, A2C20, A2C21, A3C1, A3C2, A3C3, A3C4, A3C5, A3C6, A3C7, A3C8, A3C9, A3C10, A3C11, A3C12, A3C13, A3C14, A3C15, A3C16, A3C17, A3C18, A3C19, A3C20, A3C21, A4C1, A4C2, A4C3, A4C4, A4C5, A4C6, A4C7, A4C8, A4C9, A4C10, A4C11, A4C12, A4C13, A4C14, A4C15, A4C16, A4C17, A4C18, A4C19, A4C20, A4C21, A5C1, A5C2, A5C3, A5C4, A5C5, A5C6, A5C7, A5C8, A5C9, A5C10, A5C11, A5C12, A5C13, A5C14, A5C15, A5C16, A5C17, A5C18, A5C19, A5C20, A5C21, A6C1, A6C2, A6C3, A6C4, A6C5, A6C6, A6C7, A6C8, A6C9, A6C10, A6C11, A6C12, A6C13, A6C14, A6C15, A6C16, A6C17, A6C18, A6C19, A6C20, A6C21, A7C1, A7C2, A7C3, A7C4, A7C5, A7C6, A7C7, A7C8, A7C9, A7C10, A7C11, A7C12, A7C13, A7C14, A7C15, A7C16, A7C17, A7C18, A7C19, A7C20, A7C21, A8C1, A8C2, A8C3, A8C4, A8C5, A8C6, A8C7, A8C8, A8C9, A8C10, A8C11, A8C12, A8C13, A8C14, A8C15, A8C16, A8C17, A8C18, A8C19, A8C20, A8C21, A9C1, A9C2, A9C3, A9C4, A9C5, A9C6, A9C7, A9C8, A9C9, A9C10, A9C11, A9C12, A9C13, A9C14, A9C15, A9C16, A9C17, A9C18, A9C19, A9C20, A9C21, A10C1, A10C2, A10C3, A10C4, A10C5, A10C6, A10C7, A10C8, A10C9, A10C10, A10C11, A10C12, A10C13, A10C14, A10C15, A10C16, A10C17, A10C18, A10C19, A10C20, A10C21, A11C1, A11C2, A11C3, A11C4, A11C5, A11C6, A11C7, A11C8, A11C9, A11C10, A11C11, A11C12, A11C13, A11C14, A11C15, A11C16, A11C17, A11C18, A11C19, A11C20, A11C21, B1C1, B1C2, B1C3, B1C4, B1C5, B1C6, B1C7, B1C8, B1C9, B1C10, B1C11, B1C12, B1C13, B1C14, B1C15, B1C16, B1C17, B1C18, B1C19, B1C20, B1C21, B2C1, B2C2, B2C3, B2C4, B2C5, B2C6, B2C7, B2C8, B2C9, B2C10, B2C11, B2C12, B2C13, B2C14, B2C15, B2C16, B2C17, B2C18, B2C19, B2C20, B2C21, B3C1, B3C2, B3C3, B3C4, B3C5, B3C6, B3C7, B3C8, B3C9, B3C10, B3C11, B3C12, B3C13, B3C14, B3C15, B3C16, B3C17, B3C18, B3C19, B3C20, B3C21, B4C1, B4C2, B4C3, B4C4, B4C5, B4C6, B4C7, B4C8, B4C9, B4C10, B4C11, B4C12, B4C13, B4C14, B4C15, B4C16, B4C17, B4C18, B4C19, B4C20, B4C21, B5C1, B5C2, B5C3, B5C4, B5C5, B5C6, B5C7, B5C8, B5C9, B5C10, B5C11, B5C12, B5C13, B5C14, B5C15, B5C16, B5C17, B5C18, B5C19, B5C20, B5C21, B6C1, B6C2, B6C3, B6C4, B6C5, B6C6, B6C7, B6C8, B6C9, B6C10, B6C11, B6C12, B6C13, B6C14, B6C15, B6C16, B6C17, B6C18, B6C19, B6C20, B6C21, B7C1, B7C2, B7C3, B7C4, B7C5, B7C6, B7C7, B7C8, B7C9, B7C10, B7C11, B7C12, B7C13, B7C14, B7C15, B7C16, B7C17, B7C18, B7C19, B7C20, B7C21, B8C1, B8C2, B8C3, B8C4, B8C5, B8C6, B8C7, B8C8, B8C9, B8C10, B8C11, B8C12, B8C13, B8C14, B8C15, B8C16, B8C17, B8C18, B8C19, B8C20, B8C21, B9C1, B9C2, B9C3, B9C4, B9C5, B9C6, B9C7, B9C8, B9C9, B9C10, B9C11, B9C12, B9C13, B9C14, B9C15, B9C16, B9C17, B9C18, B9C19, B9C20, B9C21, B10C1, B10C2, B10C3, B10C4, B10C5, B10C6, B10C7, B10C8, B10C9, B10C10, B10C11, B10C12, B10C13, B10C14, B10C15, B10C16, B10C17, B10C18, B10C19, B10C20, B10C21, B11C1, B11C2, B11C3, B11C4, B11C5, B11C6, B11C7, B11C8, B11C9, B11C10, B11C11, B11C12, B11C13, B11C14, B11C15, B11C16, B11C17, B11C18, B11C19, B11C20, B11C21, B12C1, B12C2, B12C3, B12C4, B12C5, B12C6, B12C7, B12C8, B12C9, B12C10, B12C11, B12C12, B12C13, B12C14, B12C15, B12C16, B12C17, B12C18, B12C19, B12C20, B12C21, A1B1C1, A1B1C2, A1B1C3, A1B1C4, A1B1C5, A1B1C6, A1B1C7, A1B1C8, A1B1C9, A1B1C10, A1B1C11, A1B1C12, A1B1C13, A1B1C14, A1B1C15, A1B1C16, A1B1C17, A1B1C18, A1B1C19, A1B1C20, A1B1C21, A1B2C1, A1B2C2, A1B2C3, A1B2C4, A1B2C5, A1B2C6, A1B2C7, A1B2C8, A1B2C9, A1B2C10, A1B2C11, A1B2C12, A1B2C13, A1B2C14, A1B2C15, A1B2C16, A1B2C17, A1B2C18, A1B2C19, A1B2C20, A1B2C21, A1B3C1, A1B3C2, A1B3C3, A1B3C4, A1B3C5, A1B3C6, A1B3C7, A1B3C8, A1B3C9, A1B3C10, A1B3C11, A1B3C12, A1B3C13, A1B3C14, A1B3C15, A1B3C16, A1B3C17, A1B3C18, A1B3C19, A1B3C20, A1B3C21, A1B4C1, A1B4C2, A1B4C3, A1B4C4, A1B4C5, A1B4C6, A1B4C7, A1B4C8, A1B4C9, A1B4C10, A1B4C11, A1B4C12, A1B4C13, A1B4C14, A1B4C15, A1B4C16, A1B4C17, A1B4C18, A1B4C19, A1B4C20, A1B4C21, A1B5C1, A1B5C2, A1B5C3, A1B5C4, A1B5C5, A1B5C6, A1B5C7, A1B5C8, A1B5C9, A1B5C10, A1B5C11, A1B5C12, A1B5C13, A1B5C14, A1B5C15, A1B5C16, A1B5C17, A1B5C18, A1B5C19, A1B5C20, A1B5C21, A1B6C1, A1B6C2, A1B6C3, A1B6C4, A1B6C5, A1B6C6, A1B6C7, A1B6C8, A1B6C9, A1B6C10, A1B6C11, A1B6C12, A1B6C13, A1B6C14, A1B6C15, A1B6C16, A1B6C17, A1B6C18, A1B6C19, A1B6C20, A1B6C21, A1B7C1, A1B7C2, A1B7C3, A1B7C4, A1B7C5, A1B7C6, A1B7C7, A1B7C8, A1B7C9, A1B7C10, A1B7C11, A1B7C12, A1B7C13, A1B7C14, A1B7C15, A1B7C16, A1B7C17, A1B7C18, A1B7C19, A1B7C20, A1B7C21, A1B8C1, A1B8C2, A1B8C3, A1B8C4, A1B8C5, A1B8C6, A1B8C7, A1B8C8, A1B8C9, A1B8C10, A1B8C11, A1B8C12, A1B8C13, A1B8C14, A1B8C15, A1B8C16, A1B8C17, A1B8C18, A1B8C19, A1B8C20, A1B8C21, A1B9C1, A1B9C2, A1B9C3, A1B9C4, A1B9C5, A1B9C6, A1B9C7, A1B9C8, A1B9C9, A1B9C10, A1B9C11, A1B9C12, A1B9C13, A1B9C14, A1B9C15, A1B9C16, A1B9C17, A1B9C18, A1B9C19, A1B9C20, A1B9C21, A1B10C1, A1B10C2, A1B10C3, A1B10C4, A1B10C5, A1B10C6, A1B10C7, A1B10C8, A1B10C9, A1B10C10, A1B10C11, A1B10C12, A1B10C13, A1B10C14, A1B10C15, A1B10C16, A1B10C17, A1B10C18, A1B10C19, A1B10C20, A1B10C21, A1B11C1, A1B11C2, A1B11C3, A1B11C4, A1B11C5, A1B11C6, A1B11C7, A1B11C8, A1B11C9, A1B11C10, A1B11C11, A1B11C12, A1B11C13, A1B11C14, A1B11C15, A1B11C16, A1B11C17, A1B11C18, A1B11C19, A1B11C20, A1B11C21, A1B12C1, A1B12C2, A1B12C3, A1B12C4, A1B12C5, A1B12C6, A1B12C7, A1B12C8, A1B12C9, A1B12C10, A1B12C11, A1B12C12, A1B12C13, A1B12C14, A1B12C15, A1B12C16, A1B12C17, A1B12C18, A1B12C19, A1B12C20, A1B12C21, A2B1C1, A2B1C2, A2B1C3, A2B1C4, A2B1C5, A2B1C6, A2B1C7, A2B1C8, A2B1C9, A2B1C10, A2B1C11, A2B1C12, A2B1C13, A2B1C14, A2B1C15, A2B1C16, A2B1C17, A2B1C18, A2B1C19, A2B1C20, A2B1C21, A2B2C1, A2B2C2, A2B2C3, A2B2C4, A2B2C5, A2B2C6, A2B2C7, A2B2C8, A2B2C9, A2B2C10, A2B2C11, A2B2C12, A2B2C13, A2B2C14, A2B2C15, A2B2C16, A2B2C17, A2B2C18, A2B2C19, A2B2C20, A2B2C21, A2B3C1, A2B3C2, A2B3C3, A2B3C4, A2B3C5, A2B3C6, A2B3C7, A2B3C8, A2B3C9, A2B3C10, A2B3C11, A2B3C12, A2B3C13, A2B3C14, A2B3C15, A2B3C16, A2B3C17, A2B3C18, A2B3C19, A2B3C20, A2B3C21, A2B4C1, A2B4C2, A2B4C3, A2B4C4, A2B4C5, A2B4C6, A2B4C7, A2B4C8, A2B4C9, A2B4C10, A2B4C11, A2B4C12, A2B4C13, A2B4C14, A2B4C15, A2B4C16, A2B4C17, A2B4C18, A2B4C19, A2B4C20, A2B4C21, A2B5C1, A2B5C2, A2B5C3, A2B5C4, A2B5C5, A2B5C6, A2B5C7, A2B5C8, A2B5C9, A2B5C10, A2B5C11, A2B5C12, A2B5C13, A2B5C14, A2B5C15, A2B5C16, A2B5C17, A2B5C18, A2B5C19, A2B5C20, A2B5C21, A2B6C1, A2B6C2, A2B6C3, A2B6C4, A2B6C5, A2B6C6, A2B6C7, A2B6C8, A2B6C9, A2B6C10, A2B6C11, A2B6C12, A2B6C13, A2B6C14, A2B6C15, A2B6C16, A2B6C17, A2B6C18, A2B6C19, A2B6C20, A2B6C21, A2B7C1, A2B7C2, A2B7C3, A2B7C4, A2B7C5, A2B7C6, A2B7C7, A2B7C8, A2B7C9, A2B7C10, A2B7C11, A2B7C12, A2B7C13, A2B7C14, A2B7C15, A2B7C16, A2B7C17, A2B7C18, A2B7C19, A2B7C20, A2B7C21, A2B8C1, A2B8C2, A2B8C3, A2B8C4, A2B8C5, A2B8C6, A2B8C7, A2B8C8, A2B8C9, A2B8C10, A2B8C11, A2B8C12, A2B8C13, A2B8C14, A2B8C15, A2B8C16, A2B8C17, A2B8C18, A2B8C19, A2B8C20, A2B8C21, A2B9C1, A2B9C2, A2B9C3, A2B9C4, A2B9C5, A2B9C6, A2B9C7, A2B9C8, A2B9C9, A2B9C10, A2B9C11, A2B9C12, A2B9C13, A2B9C14, A2B9C15, A2B9C16, A2B9C17, A2B9C18, A2B9C19, A2B9C20, A2B9C21, A2B10C1, A2B10C2, A2B10C3, A2B10C4, A2B10C5, A2B10C6, A2B10C7, A2B10C8, A2B10C9, A2B10C10, A2B10C11, A2B10C12, A2B10C13, A2B10C14, A2B10C15, A2B10C16, A2B10C17, A2B10C18, A2B10C19, A2B10C20, A2B10C21, A2B11C1, A2B11C2, A2B11C3, A2B11C4, A2B11C5, A2B11C6, A2B11C7, A2B11C8, A2B11C9, A2B11C10, A2B11C11, A2B11C12, A2B11C13, A2B11C14, A2B11C15, A2B11C16, A2B11C17, A2B11C18, A2B11C19, A2B11C20, A2B11C21, A2B12C1, A2B12C2, A2B12C3, A2B12C4, A2B12C5, A2B12C6, A2B12C7, A2B12C8, A2B12C9, A2B12C10, A2B12C11, A2B12C12, A2B12C13, A2B12C14, A2B12C15, A2B12C16, A2B12C17, A2B12C18, A2B12C19, A2B12C20, A2B12C21, A3B1C1, A3B1C2, A3B1C3, A3B1C4, A3B1C5, A3B1C6, A3B1C7, A3B1C8, A3B1C9, A3B1C10, A3B1C11, A3B1C12, A3B1C13, A3B1C14, A3B1C15, A3B1C16, A3B1C17, A3B1C18, A3B1C19, A3B1C20, A3B1C21, A3B2C1, A3B2C2, A3B2C3, A3B2C4, A3B2C5, A3B2C6, A3B2C7, A3B2C8, A3B2C9, A3B2C10, A3B2C11, A3B2C12, A3B2C13, A3B2C14, A3B2C15, A3B2C16, A3B2C17, A3B2C18, A3B2C19, A3B2C20, A3B2C21, A3B3C1, A3B3C2, A3B3C3, A3B3C4, A3B3C5, A3B3C6, A3B3C7, A3B3C8, A3B3C9, A3B3C10, A3B3C11, A3B3C12, A3B3C13, A3B3C14, A3B3C15, A3B3C16, A3B3C17, A3B3C18, A3B3C19, A3B3C20, A3B3C21, A3B4C1, A3B4C2, A3B4C3, A3B4C4, A3B4C5, A3B4C6, A3B4C7, A3B4C8, A3B4C9, A3B4C10, A3B4C11, A3B4C12, A3B4C13, A3B4C14, A3B4C15, A3B4C16, A3B4C17, A3B4C18, A3B4C19, A3B4C20, A3B4C21, A3B5C1, A3B5C2, A3B5C3, A3B5C4, A3B5C5, A3B5C6, A3B5C7, A3B5C8, A3B5C9, A3B5C10, A3B5C11, A3B5C12, A3B5C13, A3B5C14, A3B5C15, A3B5C16, A3B5C17, A3B5C18, A3B5C19, A3B5C20, A3B5C21, A3B6C1, A3B6C2, A3B6C3, A3B6C4, A3B6C5, A3B6C6, A3B6C7, A3B6C8, A3B6C9, A3B6C10, A3B6C11, A3B6C12, A3B6C13, A3B6C14, A3B6C15, A3B6C16, A3B6C17, A3B6C18, A3B6C19, A3B6C20, A3B6C21, A3B7C1, A3B7C2, A3B7C3, A3B7C4, A3B7C5, A3B7C6, A3B7C7, A3B7C8, A3B7C9, A3B7C10, A3B7C11, A3B7C12, A3B7C13, A3B7C14, A3B7C15, A3B7C16, A3B7C17, A3B7C18, A3B7C19, A3B7C20, A3B7C21, A3B8C1, A3B8C2, A3B8C3, A3B8C4, A3B8C5, A3B8C6, A3B8C7, A3B8C8, A3B8C9, A3B8C10, A3B8C11, A3B8C12, A3B8C13, A3B8C14, A3B8C15, A3B8C16, A3B8C17, A3B8C18, A3B8C19, A3B8C20, A3B8C21, A3B9C1, A3B9C2, A3B9C3, A3B9C4, A3B9C5, A3B9C6, A3B9C7, A3B9C8, A3B9C9, A3B9C10, A3B9C11, A3B9C12, A3B9C13, A3B9C14, A3B9C15, A3B9C16, A3B9C17, A3B9C18, A3B9C19, A3B9C20, A3B9C21, A3B10C1, A3B10C2, A3B10C3, A3B10C4, A3B10C5, A3B10C6, A3B10C7, A3B10C8, A3B10C9, A3B10C10, A3B10C11, A3B10C12, A3B10C13, A3B10C14, A3B10C15, A3B10C16, A3B10C17, A3B10C18, A3B10C19, A3B10C20, A3B10C21, A3B11C1, A3B11C2, A3B11C3, A3B11C4, A3B11C5, A3B11C6, A3B11C7, A3B11C8, A3B11C9, A3B11C10, A3B11C11, A3B11C12, A3B11C13, A3B11C14, A3B11C15, A3B11C16, A3B11C17, A3B11C18, A3B11C19, A3B11C20, A3B11C21, A3B12C1, A3B12C2, A3B12C3, A3B12C4, A3B12C5, A3B12C6, A3B12C7, A3B12C8, A3B12C9, A3B12C10, A3B12C11, A3B12C12, A3B12C13, A3B12C14, A3B12C15, A3B12C16, A3B12C17, A3B12C18, A3B12C19, A3B12C20, A3B12C21, A4B1C1, A4B1C2, A4B1C3, A4B1C4, A4B1C5, A4B1C6, A4B1C7, A4B1C8, A4B1C9, A4B1C10, A4B1C11, A4B1C12, A4B1C13, A4B1C14, A4B1C15, A4B1C16, A4B1C17, A4B1C18, A4B1C19, A4B1C20, A4B1C21, A4B2C1, A4B2C2, A4B2C3, A4B2C4, A4B2C5, A4B2C6, A4B2C7, A4B2C8, A4B2C9, A4B2C10, A4B2C11, A4B2C12, A4B2C13, A4B2C14, A4B2C15, A4B2C16, A4B2C17, A4B2C18, A4B2C19, A4B2C20, A4B2C21, A4B3C1, A4B3C2, A4B3C3, A4B3C4, A4B3C5, A4B3C6, A4B3C7, A4B3C8, A4B3C9, A4B3C10, A4B3C11, A4B3C12, A4B3C13, A4B3C14, A4B3C15, A4B3C16, A4B3C17, A4B3C18, A4B3C19, A4B3C20, A4B3C21, A4B4C1, A4B4C2, A4B4C3, A4B4C4, A4B4C5, A4B4C6, A4B4C7, A4B4C8, A4B4C9, A4B4C10, A4B4C11, A4B4C12, A4B4C13, A4B4C14, A4B4C15, A4B4C16, A4B4C17, A4B4C18, A4B4C19, A4B4C20, A4B4C21, A4B5C1, A4B5C2, A4B5C3, A4B5C4, A4B5C5, A4B5C6, A4B5C7, A4B5C8, A4B5C9, A4B5C10, A4B5C11, A4B5C12, A4B5C13, A4B5C14, A4B5C15, A4B5C16, A4B5C17, A4B5C18, A4B5C19, A4B5C20, A4B5C21, A4B6C1, A4B6C2, A4B6C3, A4B6C4, A4B6C5, A4B6C6, A4B6C7, A4B6C8, A4B6C9, A4B6C10, A4B6C11, A4B6C12, A4B6C13, A4B6C14, A4B6C15, A4B6C16, A4B6C17, A4B6C18, A4B6C19, A4B6C20, A4B6C21, A4B7C1, A4B7C2, A4B7C3, A4B7C4, A4B7C5, A4B7C6, A4B7C7, A4B7C8, A4B7C9, A4B7C10, A4B7C11, A4B7C12, A4B7C13, A4B7C14, A4B7C15, A4B7C16, A4B7C17, A4B7C18, A4B7C19, A4B7C20, A4B7C21, A4B8C1, A4B8C2, A4B8C3, A4B8C4, A4B8C5, A4B8C6, A4B8C7, A4B8C8, A4B8C9, A4B8C10, A4B8C11, A4B8C12, A4B8C13, A4B8C14, A4B8C15, A4B8C16, A4B8C17, A4B8C18, A4B8C19, A4B8C20, A4B8C21, A4B9C1, A4B9C2, A4B9C3, A4B9C4, A4B9C5, A4B9C6, A4B9C7, A4B9C8, A4B9C9, A4B9C10, A4B9C11, A4B9C12, A4B9C13, A4B9C14, A4B9C15, A4B9C16, A4B9C17, A4B9C18, A4B9C19, A4B9C20, A4B9C21, A4B10C1, A4B10C2, A4B10C3, A4B10C4, A4B10C5, A4B10C6, A4B10C7, A4B10C8, A4B10C9, A4B10C10, A4B10C11, A4B10C12, A4B10C13, A4B10C14, A4B10C15, A4B10C16, A4B10C17, A4B10C18, A4B10C19, A4B10C20, A4B10C21, A4B11C1, A4B11C2, A4B11C3, A4B11C4, A4B11C5, A4B11C6, A4B11C7, A4B11C8, A4B11C9, A4B11C10, A4B11C11, A4B11C12, A4B11C13, A4B11C14, A4B11C15, A4B11C16, A4B11C17, A4B11C18, A4B11C19, A4B11C20, A4B11C21, A4B12C1, A4B12C2, A4B12C3, A4B12C4, A4B12C5, A4B12C6, A4B12C7, A4B12C8, A4B12C9, A4B12C10, A4B12C11, A4B12C12, A4B12C13, A4B12C14, A4B12C15, A4B12C16, A4B12C17, A4B12C18, A4B12C19, A4B12C20, A4B12C21, A5B1C1, A5B1C2, A5B1C3, A5B1C4, A5B1C5, A5B1C6, A5B1C7, A5B1C8, A5B1C9, A5B1C10, A5B1C11, A5B1C12, A5B1C13, A5B1C14, A5B1C15, A5B1C16, A5B1C17, A5B1C18, A5B1C19, A5B1C20, A5B1C21, A5B2C1, A5B2C2, A5B2C3, A5B2C4, A5B2C5, A5B2C6, A5B2C7, A5B2C8, A5B2C9, A5B2C10, A5B2C11, A5B2C12, A5B2C13, A5B2C14, A5B2C15, A5B2C16, A5B2C17, A5B2C18, A5B2C19, A5B2C20, A5B2C21, A5B3C1, A5B3C2, A5B3C3, A5B3C4, A5B3C5, A5B3C6, A5B3C7, A5B3C8, A5B3C9, A5B3C10, A5B3C11, A5B3C12, A5B3C13, A5B3C14, A5B3C15, A5B3C16, A5B3C17, A5B3C18, A5B3C19, A5B3C20, A5B3C21, A5B4C1, A5B4C2, A5B4C3, A5B4C4, A5B4C5, A5B4C6, A5B4C7, A5B4C8, A5B4C9, A5B4C10, A5B4C11, A5B4C12, A5B4C13, A5B4C14, A5B4C15, A5B4C16, A5B4C17, A5B4C18, A5B4C19, A5B4C20, A5B4C21, A5B5C1, A5B5C2, A5B5C3, A5B5C4, A5B5C5, A5B5C6, A5B5C7, A5B5C8, A5B5C9, A5B5C10, A5B5C11, A5B5C12, A5B5C13, A5B5C14, A5B5C15, A5B5C16, A5B5C17, A5B5C18, A5B5C19, A5B5C20, A5B5C21, A5B6C1, A5B6C2, A5B6C3, A5B6C4, A5B6C5, A5B6C6, A5B6C7, A5B6C8, A5B6C9, A5B6C10, A5B6C11, A5B6C12, A5B6C13, A5B6C14, A5B6C15, A5B6C16, A5B6C17, A5B6C18, A5B6C19, A5B6C20, A5B6C21, A5B7C1, A5B7C2, A5B7C3, A5B7C4, A5B7C5, A5B7C6, A5B7C7, A5B7C8, A5B7C9, A5B7C10, A5B7C11, A5B7C12, A5B7C13, A5B7C14, A5B7C15, A5B7C16, A5B7C17, A5B7C18, A5B7C19, A5B7C20, A5B7C21, A5B8C1, A5B8C2, A5B8C3, A5B8C4, A5B8C5, A5B8C6, A5B8C7, A5B8C8, A5B8C9, A5B8C10, A5B8C11, A5B8C12, A5B8C13, A5B8C14, A5B8C15, A5B8C16, A5B8C17, A5B8C18, A5B8C19, A5B8C20, A5B8C21, A5B9C1, A5B9C2, A5B9C3, A5B9C4, A5B9C5, A5B9C6, A5B9C7, A5B9C8, A5B9C9, A5B9C10, A5B9C11, A5B9C12, A5B9C13, A5B9C14, A5B9C15, A5B9C16, A5B9C17, A5B9C18, A5B9C19, A5B9C20, A5B9C21, A5B10C1, A5B10C2, A5B10C3, A5B10C4, A5B10C5, A5B10C6, A5B10C7, A5B10C8, A5B10C9, A5B10C10, A5B10C11, A5B10C12, A5B10C13, A5B10C14, A5B10C15, A5B10C16, A5B10C17, A5B10C18, A5B10C19, A5B10C20, A5B10C21, A5B11C1, A5B11C2, A5B11C3, A5B11C4, A5B11C5, A5B11C6, A5B11C7, A5B11C8, A5B11C9, A5B11C10, A5B11C11, A5B11C12, A5B11C13, A5B11C14, A5B11C15, A5B11C16, A5B11C17, A5B11C18, A5B11C19, A5B11C20, A5B11C21, A5B12C1, A5B12C2, A5B12C3, A5B12C4, A5B12C5, A5B12C6, A5B12C7, A5B12C8, A5B12C9, A5B12C10, A5B12C11, A5B12C12, A5B12C13, A5B12C14, A5B12C15, A5B12C16, A5B12C17, A5B12C18, A5B12C19, A5B12C20, A5B12C21, A6B1C1, A6B1C2, A6B1C3, A6B1C4, A6B1C5, A6B1C6, A6B1C7, A6B1C8, A6B1C9, A6B1C10, A6B1C11, A6B1C12, A6B1C13, A6B1C14, A6B1C15, A6B1C16, A6B1C17, A6B1C18, A6B1C19, A6B1C20, A6B1C21, A6B2C1, A6B2C2, A6B2C3, A6B2C4, A6B2C5, A6B2C6, A6B2C7, A6B2C8, A6B2C9, A6B2C10, A6B2C11, A6B2C12, A6B2C13, A6B2C14, A6B2C15, A6B2C16, A6B2C17, A6B2C18, A6B2C19, A6B2C20, A6B2C21, A6B3C1, A6B3C2, A6B3C3, A6B3C4, A6B3C5, A6B3C6, A6B3C7, A6B3C8, A6B3C9, A6B3C10, A6B3C11, A6B3C12, A6B3C13, A6B3C14, A6B3C15, A6B3C16, A6B3C17, A6B3C18, A6B3C19, A6B3C20, A6B3C21, A6B4C1, A6B4C2, A6B4C3, A6B4C4, A6B4C5, A6B4C6, A6B4C7, A6B4C8, A6B4C9, A6B4C10, A6B4C11, A6B4C12, A6B4C13, A6B4C14, A6B4C15, A6B4C16, A6B4C17, A6B4C18, A6B4C19, A6B4C20, A6B4C21, A6B5C1, A6B5C2, A6B5C3, A6B5C4, A6B5C5, A6B5C6, A6B5C7, A6B5C8, A6B5C9, A6B5C10, A6B5C11, A6B5C12, A6B5C13, A6B5C14, A6B5C15, A6B5C16, A6B5C17, A6B5C18, A6B5C19, A6B5C20, A6B5C21, A6B6C1, A6B6C2, A6B6C3, A6B6C4, A6B6C5, A6B6C6, A6B6C7, A6B6C8, A6B6C9, A6B6C10, A6B6C11, A6B6C12, A6B6C13, A6B6C14, A6B6C15, A6B6C16, A6B6C17, A6B6C18, A6B6C19, A6B6C20, A6B6C21, A6B7C1, A6B7C2, A6B7C3, A6B7C4, A6B7C5, A6B7C6, A6B7C7, A6B7C8, A6B7C9, A6B7C10, A6B7C11, A6B7C12, A6B7C13, A6B7C14, A6B7C15, A6B7C16, A6B7C17, A6B7C18, A6B7C19, A6B7C20, A6B7C21, A6B8C1, A6B8C2, A6B8C3, A6B8C4, A6B8C5, A6B8C6, A6B8C7, A6B8C8, A6B8C9, A6B8C10, A6B8C11, A6B8C12, A6B8C13, A6B8C14, A6B8C15, A6B8C16, A6B8C17, A6B8C18, A6B8C19, A6B8C20, A6B8C21, A6B9C1, A6B9C2, A6B9C3, A6B9C4, A6B9C5, A6B9C6, A6B9C7, A6B9C8, A6B9C9, A6B9C10, A6B9C11, A6B9C12, A6B9C13, A6B9C14, A6B9C15, A6B9C16, A6B9C17, A6B9C18, A6B9C19, A6B9C20, A6B9C21, A6B10C1, A6B10C2, A6B10C3, A6B10C4, A6B10C5, A6B10C6, A6B10C7, A6B10C8, A6B10C9, A6B10C10, A6B10C11, A6B10C12, A6B10C13, A6B10C14, A6B10C15, A6B10C16, A6B10C17, A6B10C18, A6B10C19, A6B10C20, A6B10C21, A6B11C1, A6B11C2, A6B11C3, A6B11C4, A6B11C5, A6B11C6, A6B11C7, A6B11C8, A6B11C9, A6B11C10, A6B11C11, A6B11C12, A6B11C13, A6B11C14, A6B11C15, A6B11C16, A6B11C17, A6B11C18, A6B11C19, A6B11C20, A6B11C21, A6B12C1, A6B12C2, A6B12C3, A6B12C4, A6B12C5, A6B12C6, A6B12C7, A6B12C8, A6B12C9, A6B12C10, A6B12C11, A6B12C12, A6B12C13, A6B12C14, A6B12C15, A6B12C16, A6B12C17, A6B12C18, A6B12C19, A6B12C20, A6B12C21, A7B1C1, A7B1C2, A7B1C3, A7B1C4, A7B1C5, A7B1C6, A7B1C7, A7B1C8, A7B1C9, A7B1C10, A7B1C11, A7B1C12, A7B1C13, A7B1C14, A7B1C15, A7B1C16, A7B1C17, A7B1C18, A7B1C19, A7B1C20, A7B1C21, A7B2C1, A7B2C2, A7B2C3, A7B2C4, A7B2C5, A7B2C6, A7B2C7, A7B2C8, A7B2C9, A7B2C10, A7B2C11, A7B2C12, A7B2C13, A7B2C14, A7B2C15, A7B2C16, A7B2C17, A7B2C18, A7B2C19, A7B2C20, A7B2C21, A7B3C1, A7B3C2, A7B3C3, A7B3C4, A7B3C5, A7B3C6, A7B3C7, A7B3C8, A7B3C9, A7B3C10, A7B3C11, A7B3C12, A7B3C13, A7B3C14, A7B3C15, A7B3C16, A7B3C17, A7B3C18, A7B3C19, A7B3C20, A7B3C21, A7B4C1, A7B4C2, A7B4C3, A7B4C4, A7B4C5, A7B4C6, A7B4C7, A7B4C8, A7B4C9, A7B4C10, A7B4C11, A7B4C12, A7B4C13, A7B4C14, A7B4C15, A7B4C16, A7B4C17, A7B4C18, A7B4C19, A7B4C20, A7B4C21, A7B5C1, A7B5C2, A7B5C3, A7B5C4, A7B5C5, A7B5C6, A7B5C7, A7B5C8, A7B5C9, A7B5C10, A7B5C11, A7B5C12, A7B5C13, A7B5C14, A7B5C15, A7B5C16, A7B5C17, A7B5C18, A7B5C19, A7B5C20, A7B5C21, A7B6C1, A7B6C2, A7B6C3, A7B6C4, A7B6C5, A7B6C6, A7B6C7, A7B6C8, A7B6C9, A7B6C10, A7B6C11, A7B6C12, A7B6C13, A7B6C14, A7B6C15, A7B6C16, A7B6C17, A7B6C18, A7B6C19, A7B6C20, A7B6C21, A7B7C1, A7B7C2, A7B7C3, A7B7C4, A7B7C5, A7B7C6, A7B7C7, A7B7C8, A7B7C9, A7B7C10, A7B7C11, A7B7C12, A7B7C13, A7B7C14, A7B7C15, A7B7C16, A7B7C17, A7B7C18, A7B7C19, A7B7C20, A7B7C21, A7B8C1, A7B8C2, A7B8C3, A7B8C4, A7B8C5, A7B8C6, A7B8C7, A7B8C8, A7B8C9, A7B8C10, A7B8C11, A7B8C12, A7B8C13, A7B8C14, A7B8C15, A7B8C16, A7B8C17, A7B8C18, A7B8C19, A7B8C20, A7B8C21, A7B9C1, A7B9C2, A7B9C3, A7B9C4, A7B9C5, A7B9C6, A7B9C7, A7B9C8, A7B9C9, A7B9C10, A7B9C11, A7B9C12, A7B9C13, A7B9C14, A7B9C15, A7B9C16, A7B9C17, A7B9C18, A7B9C19, A7B9C20, A7B9C21, A7B10C1, A7B10C2, A7B10C3, A7B10C4, A7B10C5, A7B10C6, A7B10C7, A7B10C8, A7B10C9, A7B10C10, A7B10C11, A7B10C12, A7B10C13, A7B10C14, A7B10C15, A7B10C16, A7B10C17, A7B10C18, A7B10C19, A7B10C20, A7B10C21, A7B11C1, A7B11C2, A7B11C3, A7B11C4, A7B11C5, A7B11C6, A7B11C7, A7B11C8, A7B11C9, A7B11C10, A7B11C11, A7B11C12, A7B11C13, A7B11C14, A7B11C15, A7B11C16, A7B11C17, A7B11C18, A7B11C19, A7B11C20, A7B11C21, A7B12C1, A7B12C2, A7B12C3, A7B12C4, A7B12C5, A7B12C6, A7B12C7, A7B12C8, A7B12C9, A7B12C10, A7B12C11, A7B12C12, A7B12C13, A7B12C14, A7B12C15, A7B12C16, A7B12C17, A7B12C18, A7B12C19, A7B12C20, A7B12C21, A8B1C1, A8B1C2, A8B1C3, A8B1C4, A8B1C5, A8B1C6, A8B1C7, A8B1C8, A8B1C9, A8B1C10, A8B1C11, A8B1C12, A8B1C13, A8B1C14, A8B1C15, A8B1C16, A8B1C17, A8B1C18, A8B1C19, A8B1C20, A8B1C21, A8B2C1, A8B2C2, A8B2C3, A8B2C4, A8B2C5, A8B2C6, A8B2C7, A8B2C8, A8B2C9, A8B2C10, A8B2C11, A8B2C12, A8B2C13, A8B2C14, A8B2C15, A8B2C16, A8B2C17, A8B2C18, A8B2C19, A8B2C20, A8B2C21, A8B3C1, A8B3C2, A8B3C3, A8B3C4, A8B3C5, A8B3C6, A8B3C7, A8B3C8, A8B3C9, A8B3C10, A8B3C11, A8B3C12, A8B3C13, A8B3C14, A8B3C15, A8B3C16, A8B3C17, A8B3C18, A8B3C19, A8B3C20, A8B3C21, A8B4C1, A8B4C2, A8B4C3, A8B4C4, A8B4C5, A8B4C6, A8B4C7, A8B4C8, A8B4C9, A8B4C10, A8B4C11, A8B4C12, A8B4C13, A8B4C14, A8B4C15, A8B4C16, A8B4C17, A8B4C18, A8B4C19, A8B4C20, A8B4C21, A8B5C1, A8B5C2, A8B5C3, A8B5C4, A8B5C5, A8B5C6, A8B5C7, A8B5C8, A8B5C9, A8B5C10, A8B5C11, A8B5C12, A8B5C13, A8B5C14, A8B5C15, A8B5C16, A8B5C17, A8B5C18, A8B5C19, A8B5C20, A8B5C21, A8B6C1, A8B6C2, A8B6C3, A8B6C4, A8B6C5, A8B6C6, A8B6C7, A8B6C8, A8B6C9, A8B6C10, A8B6C11, A8B6C12, A8B6C13, A8B6C14, A8B6C15, A8B6C16, A8B6C17, A8B6C18, A8B6C19, A8B6C20, A8B6C21, A8B7C1, A8B7C2, A8B7C3, A8B7C4, A8B7C5, A8B7C6, A8B7C7, A8B7C8, A8B7C9, A8B7C10, A8B7C11, A8B7C12, A8B7C13, A8B7C14, A8B7C15, A8B7C16, A8B7C17, A8B7C18, A8B7C19, A8B7C20, A8B7C21, A8B8C1, A8B8C2, A8B8C3, A8B8C4, A8B8C5, A8B8C6, A8B8C7, A8B8C8, A8B8C9, A8B8C10, A8B8C11, A8B8C12, A8B8C13, A8B8C14, A8B8C15, A8B8C16, A8B8C17, A8B8C18, A8B8C19, A8B8C20, A8B8C21, A8B9C1, A8B9C2, A8B9C3, A8B9C4, A8B9C5, A8B9C6, A8B9C7, A8B9C8, A8B9C9, A8B9C10, A8B9C11, A8B9C12, A8B9C13, A8B9C14, A8B9C15, A8B9C16, A8B9C17, A8B9C18, A8B9C19, A8B9C20, A8B9C21, A8B10C1, A8B10C2, A8B10C3, A8B10C4, A8B10C5, A8B10C6, A8B10C7, A8B10C8, A8B10C9, A8B10C10, A8B10C11, A8B10C12, A8B10C13, A8B10C14, A8B10C15, A8B10C16, A8B10C17, A8B10C18, A8B10C19, A8B10C20, A8B10C21, A8B11C1, A8B11C2, A8B11C3, A8B11C4, A8B11C5, A8B11C6, A8B11C7, A8B11C8, A8B11C9, A8B11C10, A8B11C11, A8B11C12, A8B11C13, A8B11C14, A8B11C15, A8B11C16, A8B11C17, A8B11C18, A8B11C19, A8B11C20, A8B11C21, A8B12C1, A8B12C2, A8B12C3, A8B12C4, A8B12C5, A8B12C6, A8B12C7, A8B12C8, A8B12C9, A8B12C10, A8B12C11, A8B12C12, A8B12C13, A8B12C14, A8B12C15, A8B12C16, A8B12C17, A8B12C18, A8B12C19, A8B12C20, A8B12C21, A9B1C1, A9B1C2, A9B1C3, A9B1C4, A9B1C5, A9B1C6, A9B1C7, A9B1C8, A9B1C9, A9B1C10, A9B1C11, A9B1C12, A9B1C13, A9B1C14, A9B1C15, A9B1C16, A9B1C17, A9B1C18, A9B1C19, A9B1C20, A9B1C21, A9B2C1, A9B2C2, A9B2C3, A9B2C4, A9B2C5, A9B2C6, A9B2C7, A9B2C8, A9B2C9, A9B2C10, A9B2C11, A9B2C12, A9B2C13, A9B2C14, A9B2C15, A9B2C16, A9B2C17, A9B2C18, A9B2C19, A9B2C20, A9B2C21, A9B3C1, A9B3C2, A9B3C3, A9B3C4, A9B3C5, A9B3C6, A9B3C7, A9B3C8, A9B3C9, A9B3C10, A9B3C11, A9B3C12, A9B3C13, A9B3C14, A9B3C15, A9B3C16, A9B3C17, A9B3C18, A9B3C19, A9B3C20, A9B3C21, A9B4C1, A9B4C2, A9B4C3, A9B4C4, A9B4C5, A9B4C6, A9B4C7, A9B4C8, A9B4C9, A9B4C10, A9B4C11, A9B4C12, A9B4C13, A9B4C14, A9B4C15, A9B4C16, A9B4C17, A9B4C18, A9B4C19, A9B4C20, A9B4C21, A9B5C1, A9B5C2, A9B5C3, A9B5C4, A9B5C5, A9B5C6, A9B5C7, A9B5C8, A9B5C9, A9B5C10, A9B5C11, A9B5C12, A9B5C13, A9B5C14, A9B5C15, A9B5C16, A9B5C17, A9B5C18, A9B5C19, A9B5C20, A9B5C21, A9B6C1, A9B6C2, A9B6C3, A9B6C4, A9B6C5, A9B6C6, A9B6C7, A9B6C8, A9B6C9, A9B6C10, A9B6C11, A9B6C12, A9B6C13, A9B6C14, A9B6C15, A9B6C16, A9B6C17, A9B6C18, A9B6C19, A9B6C20, A9B6C21, A9B7C1, A9B7C2, A9B7C3, A9B7C4, A9B7C5, A9B7C6, A9B7C7, A9B7C8, A9B7C9, A9B7C10, A9B7C11, A9B7C12, A9B7C13, A9B7C14, A9B7C15, A9B7C16, A9B7C17, A9B7C18, A9B7C19, A9B7C20, A9B7C21, A9B8C1, A9B8C2, A9B8C3, A9B8C4, A9B8C5, A9B8C6, A9B8C7, A9B8C8, A9B8C9, A9B8C10, A9B8C11, A9B8C12, A9B8C13, A9B8C14, A9B8C15, A9B8C16, A9B8C17, A9B8C18, A9B8C19, A9B8C20, A9B8C21, A9B9C1, A9B9C2, A9B9C3, A9B9C4, A9B9C5, A9B9C6, A9B9C7, A9B9C8, A9B9C9, A9B9C10, A9B9C11, A9B9C12, A9B9C13, A9B9C14, A9B9C15, A9B9C16, A9B9C17, A9B9C18, A9B9C19, A9B9C20, A9B9C21, A9B10C1, A9B10C2, A9B10C3, A9B10C4, A9B10C5, A9B10C6, A9B10C7, A9B10C8, A9B10C9, A9B10C10, A9B10C11, A9B10C12, A9B10C13, A9B10C14, A9B10C15, A9B10C16, A9B10C17, A9B10C18, A9B10C19, A9B10C20, A9B10C21, A9B11C1, A9B11C2, A9B11C3, A9B11C4, A9B11C5, A9B11C6, A9B11C7, A9B11C8, A9B11C9, A9B11C10, A9B11C11, A9B11C12, A9B11C13, A9B11C14, A9B11C15, A9B11C16, A9B11C17, A9B11C18, A9B11C19, A9B11C20, A9B11C21, A9B12C1, A9B12C2, A9B12C3, A9B12C4, A9B12C5, A9B12C6, A9B12C7, A9B12C8, A9B12C9, A9B12C10, A9B12C11, A9B12C12, A9B12C13, A9B12C14, A9B12C15, A9B12C16, A9B12C17, A9B12C18, A9B12C19, A9B12C20, A9B12C21, A10B1C1, A10B1C2, A10B1C3, A10B1C4, A10B1C5, A10B1C6, A10B1C7, A10B1C8, A10B1C9, A10B1C10, A10B1C11, A10B1C12, A10B1C13, A10B1C14, A10B1C15, A10B1C16, A10B1C17, A10B1C18, A10B1C19, A10B1C20, A10B1C21, A10B2C1, A10B2C2, A10B2C3, A10B2C4, A10B2C5, A10B2C6, A10B2C7, A10B2C8, A10B2C9, A10B2C10, A10B2C11, A10B2C12, A10B2C13, A10B2C14, A10B2C15, A10B2C16, A10B2C17, A10B2C18, A10B2C19, A10B2C20, A10B2C21, A10B3C1, A10B3C2, A10B3C3, A10B3C4, A10B3C5, A10B3C6, A10B3C7, A10B3C8, A10B3C9, A10B3C10, A10B3C11, A10B3C12, A10B3C13, A10B3C14, A10B3C15, A10B3C16, A10B3C17, A10B3C18, A10B3C19, A10B3C20, A10B3C21, A10B4C1, A10B4C2, A10B4C3, A10B4C4, A10B4C5, A10B4C6, A10B4C7, A10B4C8, A10B4C9, A10B4C10, A10B4C11, A10B4C12, A10B4C13, A10B4C14, A10B4C15, A10B4C16, A10B4C17, A10B4C18, A10B4C19, A10B4C20, A10B4C21, A10B5C1, A10B5C2, A10B5C3, A10B5C4, A10B5C5, A10B5C6, A10B5C7, A10B5C8, A10B5C9, A10B5C10, A10B5C11, A10B5C12, A10B5C13, A10B5C14, A10B5C15, A10B5C16, A10B5C17, A10B5C18, A10B5C19, A10B5C20, A10B5C21, A10B6C1, A10B6C2, A10B6C3, A10B6C4, A10B6C5, A10B6C6, A10B6C7, A10B6C8, A10B6C9, A10B6C10, A10B6C11, A10B6C12, A10B6C13, A10B6C14, A10B6C15, A10B6C16, A10B6C17, A10B6C18, A10B6C19, A10B6C20, A10B6C21, A10B7C1, A10B7C2, A10B7C3, A10B7C4, A10B7C5, A10B7C6, A10B7C7, A10B7C8, A10B7C9, A10B7C10, A10B7C11, A10B7C12, A10B7C13, A10B7C14, A10B7C15, A10B7C16, A10B7C17, A10B7C18, A10B7C19, A10B7C20, A10B7C21, A10B8C1, A10B8C2, A10B8C3, A10B8C4, A10B8C5, A10B8C6, A10B8C7, A10B8C8, A10B8C9, A10B8C10, A10B8C11, A10B8C12, A10B8C13, A10B8C14, A10B8C15, A10B8C16, A10B8C17, A10B8C18, A10B8C19, A10B8C20, A10B8C21, A10B9C1, A10B9C2, A10B9C3, A10B9C4, A10B9C5, A10B9C6, A10B9C7, A10B9C8, A10B9C9, A10B9C10, A10B9C11, A10B9C12, A10B9C13, A10B9C14, A10B9C15, A10B9C16, A10B9C17, A10B9C18, A10B9C19, A10B9C20, A10B9C21, A10B10C1, A10B10C2, A10B10C3, A10B10C4, A10B10C5, A10B10C6, A10B10C7, A10B10C8, A10B10C9, A10B10C10, A10B10C11, A10B10C12, A10B10C13, A10B10C14, A10B10C15, A10B10C16, A10B10C17, A10B10C18, A10B10C19, A10B10C20, A10B10C21, A10B11C1, A10B11C2, A10B11C3, A10B11C4, A10B11C5, A10B11C6, A10B11C7, A10B11C8, A10B11C9, A10B11C10, A10B11C11, A10B11C12, A10B11C13, A10B11C14, A10B11C15, A10B11C16, A10B11C17, A10B11C18, A10B11C19, A10B11C20, A10B11C21, A10B12C1, A10B12C2, A10B12C3, A10B12C4, A10B12C5, A10B12C6, A10B12C7, A10B12C8, A10B12C9, A10B12C10, A10B12C11, A10B12C12, A10B12C13, A10B12C14, A10B12C15, A10B12C16, A10B12C17, A10B12C18, A10B12C19, A10B12C20, A10B12C21, A11B1C1, A11B1C2, A11B1C3, A11B1C4, A11B1C5, A11B1C6, A11B1C7, A11B1C8, A11B1C9, A11B1C10, A11B1C11, A11B1C12, A11B1C13, A11B1C14, A11B1C15, A11B1C16, A11B1C17, A11B1C18, A11B1C19, A11B1C20, A11B1C21, A11B2C1, A11B2C2, A11B2C3, A11B2C4, A11B2C5, A11B2C6, A11B2C7, A11B2C8, A11B2C9, A11B2C10, A11B2C11, A11B2C12, A11B2C13, A11B2C14, A11B2C15, A11B2C16, A11B2C17, A11B2C18, A11B2C19, A11B2C20, A11B2C21, A11B3C1, A11B3C2, A11B3C3, A11B3C4, A11B3C5, A11B3C6, A11B3C7, A11B3C8, A11B3C9, A11B3C10, A11B3C11, A11B3C12, A11B3C13, A11B3C14, A11B3C15, A11B3C16, A11B3C17, A11B3C18, A11B3C19, A11B3C20, A11B3C21, A11B4C1, A11B4C2, A11B4C3, A11B4C4, A11B4C5, A11B4C6, A11B4C7, A11B4C8, A11B4C9, A11B4C10, A11B4C11, A11B4C12, A11B4C13, A11B4C14, A11B4C15, A11B4C16, A11B4C17, A11B4C18, A11B4C19, A11B4C20, A11B4C21, A11B5C1, A11B5C2, A11B5C3, A11B5C4, A11B5C5, A11B5C6, A11B5C7, A11B5C8, A11B5C9, A11B5C10, A11B5C11, A11B5C12, A11B5C13, A11B5C14, A11B5C15, A11B5C16, A11B5C17, A11B5C18, A11B5C19, A11B5C20, A11B5C21, A11B6C1, A11B6C2, A11B6C3, A11B6C4, A11B6C5, A11B6C6, A11B6C7, A11B6C8, A11B6C9, A11B6C10, A11B6C11, A11B6C12, A11B6C13, A11B6C14, A11B6C15, A11B6C16, A11B6C17, A11B6C18, A11B6C19, A11B6C20, A11B6C21, A11B7C1, A11B7C2, A11B7C3, A11B7C4, A11B7C5, A11B7C6, A11B7C7, A11B7C8, A11B7C9, A11B7C10, A11B7C11, A11B7C12, A11B7C13, A11B7C14, A11B7C15, A11B7C16, A11B7C17, A11B7C18, A11B7C19, A11B7C20, A11B7C21, A11B8C1, A11B8C2, A11B8C3, A11B8C4, A11B8C5, A11B8C6, A11B8C7, A11B8C8, A11B8C9, A11B8C10, A11B8C11, A11B8C12, A11B8C13, A11B8C14, A11B8C15, A11B8C16, A11B8C17, A11B8C18, A11B8C19, A11B8C20, A11B8C21, A11B9C1, A11B9C2, A11B9C3, A11B9C4, A11B9C5, A11B9C6, A11B9C7, A11B9C8, A11B9C9, A11B9C10, A11B9C11, A11B9C12, A11B9C13, A11B9C14, A11B9C15, A11B9C16, A11B9C17, A11B9C18, A11B9C19, A11B9C20, A11B9C21, A11B10C1, A11B10C2, A11B10C3, A11B10C4, A11B10C5, A11B10C6, A11B10C7, A11B10C8, A11B10C9, A11B10C10, A11B10C11, A11B10C12, A11B10C13, A11B10C14, A11B10C15, A11B10C16, A11B10C17, A11B10C18, A11B10C19, A11B10C20, A11B10C21, A11B11C1, A11B11C2, A11B11C3, A11B11C4, A11B11C5, A11B11C6, A11B11C7, A11B11C8, A11B11C9, A11B11C10, A11B11C11, A11B11C12, A11B11C13, A11B11C14, A11B11C15, A11B11C16, A11B11C17, A11B11C18, A11B11C19, A11B11C20, A11B11C21, A11B12C1, A11B12C2, A11B12C3, A11B12C4, A11B12C5, A11B12C6, A11B12C7, A11B12C8, A11B12C9, A11B12C10, A11B12C11, A11B12C12, A11B12C13, A11B12C14, A11B12C15, A11B12C16, A11B12C17, A11B12C18, A11B12C19, A11B12C20 или A11B12C21.
Молекулы антител
В одном варианте осуществления молекула антитела связывается с PD-1 млекопитающего, например, человека. Например, молекула антитела специфично связывается с эпитопом, например, линейным или конформационным эпитопом (например, эпитопом, описанным в настоящей заявке) на PD-1.
При использовании в настоящей заявке термин "молекула антитела" относится к белку, например, к иммуноглобулиновой цепи или ее фрагменту, содержащим по меньшей мере одну последовательность вариабельного домена иммуноглобулина. Термин "молекула антитела" включает, например, моноклональное антитело (в том числе полноразмерное антитело, которое имеет Fc-область иммуноглобулина). В одном варианте осуществления молекула антитела включает полноразмерное антитело или полноразмерную иммуноглобулиновую цепь. В одном варианте осуществления молекула антитела содержит антигенсвязывающий или функциональный фрагмент полноразмерного антитела или полноразмерную иммуноглобулиновую цепь. В одном варианте осуществления молекула антитела является молекулой мультиспецифичного антитела, например, она содержит множество последовательностей вариабельных доменов иммуноглобулина, где первая последовательность вариабельного домена иммуноглобулина из такого множества обладает специфичностью связывания в отношении первого эпитопа, а вторая последовательность вариабельного домена иммуноглобулина из такого множества обладает специфичностью связывания в отношении второго эпитопа. В одном варианте осуществления молекула мультиспецифичного антитела является молекулой биспецифичного антитела. Биспецифичное антитело обладает специфичностью не больше чем к двум антигенам. Молекула биспецифичного антитела характеризуется первой последовательностью вариабельного домена иммуноглобулина, которая обладает специфичностью связывания в отношении первого эпитопа, и второй последовательностью вариабельного домена иммуноглобулина, которая обладает специфичностью связывания в отношении второго эпитопа.
В варианте осуществления молекула антитела является молекулой моноспецифичного антитела и связывает один эпитоп. Например, молекула моноспецифичного антитела, имеющая множество последовательностей вариабельных доменов иммуноглобулина, каждая из которых связывает один и тот же эпитоп.
В варианте осуществления молекула антитела является молекула мультиспецифичного антитела, например, она включает множество последовательностей вариабельных доменов иммуноглобулина, где первая последовательность вариабельного домена иммуноглобулина из множества обладает специфичностью связывания в отношении первого эпитопа, а вторая последовательность вариабельного домена иммуноглобулина из множества обладает специфичностью связывания в отношении второго эпитопа. В варианте осуществления первый и второй эпитопы находятся на одном и том же антигене, например, одном и том же белке (или субъединице мультимерного белка). В варианте осуществления первый и второй эпитопы перекрываются. В варианте осуществления первый и второй эпитопы не перекрываются. В варианте осуществления первый и второй эпитопы находятся на разных антигенах, например, разных белках (или разных субъединицах мультимерного белка). В варианте осуществления молекула мультиспецифичного антитела включает третий, четвертый или пятый вариабельный домен иммуноглобулина. В варианте осуществления молекула мультиспецифичного антитела является молекулой биспецифичного антитела, молекулой триспецифичного антитела или молекулой тетраспецифичного антитела.
В варианте осуществления молекула мультиспецифичного антитела является молекулой биспецифичного антитела. Биспецифичное антитело обладает специфичностью не больше чем к двум антигенам. Молекула биспецифичного антитела характеризуется первой последовательностью вариабельного домена иммуноглобулина, которая обладает специфичностью связывания в отношении первого эпитопа, и второй последовательностью вариабельного домена иммуноглобулина, которая обладает специфичностью связывания в отношении второго эпитопа. В варианте осуществления первый и второй эпитопы находятся на одном и том же антигене, например, одном и том же белке (или субъединице мультимерного белка). В варианте осуществления первый и второй эпитопы перекрываются. В варианте осуществления первый и второй эпитопы не перекрываются. В варианте осуществления первый и второй эпитопы находятся на разных антигенах, например, разных белках (или разных субъединицах мультимерного белка). В варианте осуществления молекула биспецифичного антитела включает последовательность вариабельного домена тяжелой цепи и последовательность вариабельного домена легкой цепи, которые обладают специфичностью связывания в отношении первого эпитопа, и последовательность вариабельного домена тяжелой цепи и последовательность вариабельного домена легкой цепи, которые обладают специфичностью связывания в отношении второго эпитопа. В варианте осуществления молекула биспецифичного антитела включает полуантитело, обладающее специфичностью связывания в отношении первого эпитопа, и полуантитело, обладающее специфичностью связывания в отношении второго эпитопа. В варианте осуществления молекула биспецифичного антитела включает полуантитело или его фрагмент, обладающие специфичностью связывания в отношении первого эпитопа, и полуантитело или его фрагмент, обладающие специфичностью связывания в отношении второго эпитопа. В варианте осуществления молекула биспецифичного антитела включает scFv или его фрагмент, обладающие специфичностью связывания в отношении первого эпитопа, и scFv или его фрагмент, обладающие специфичностью связывания в отношении второго эпитопа. В варианте осуществления первый эпитоп расположен на PD-1Е, а второй эпитоп расположен на TIM-3, LAG-3, CEACAM (например, CEACAM-1 и/или CEACAM-5), PD-L1 или PD-L2.
В одном варианте осуществления молекула антитела включает диатело и одноцепочечную молекулу, а также антигенсвязывающий фрагмент антитела (например, Fab, F(ab')2 и Fv). Например, молекула антитела может включать последовательность вариабельного домена тяжелой (Н) цепи (сокращенно обозначенного в настоящей заявке как VH) и последовательность вариабельного домена легкой (L) цепи (сокращенно обозначенного в изобретении как VL). В одном варианте осуществления молекула антитела включает или состоит из тяжелой цепи и легкой цепи (называемой в настоящей заявке полуантителом). В другом примере молекула антитела включает две последовательности вариабельных доменов тяжелой (Н) цепи и две последовательности вариабельных доменов легкой (L) цепи, образуя таким образом два антигенсвязывающих участка, такие как Fab, Fab', F(ab')2, Fc, Fd, Fd', Fv, одноцепочечные антитела (например, ScFv), антитела с одним вариабельным доменом, диатела (Dab) (бивалентные и биспецифичные) и химерные (например, гуманизированные) антитела, которые могут быть получены путем модификации целых антител, или антитела, синтезированные dе novo с помощью технологий рекомбинантных ДНК. Такие функциональные фрагменты антител сохраняют способность селективно связываться со своим соответствующим антигеном или рецептором. Антитела и фрагменты антител могут относиться к любому классу антител, в том числе, без ограничения, IgG, IgA, IgM, IgD и IgE, и к любому субклассу антител (например, IgG1, IgG2, IgG3 и IgG4). Препарат молекул антител может быть моноклональным или поликлональным. Молекула антитела также может быть человеческим, гуманизированным, CDR-перевитым или полученным in vitro антителом. Антитело может иметь константную область тяжелой цепи, выбранную, например, из IgG1, IgG2, IgG3 или IgG4. Антитело также может иметь легкую цепь, выбранную, например, из каппа или лямбда цепи. Термин "иммуноглобулин" (Ig) в настоящем описании используется попеременно с термином "антитело".
Примеры антигенсвязывающих фрагментов молекулы антитела включают: (i) Fab-фрагмент, моновалентный фрагмент, состоящий из VL, VH, CL и CH1 доменов; (ii) F(ab')2-фрагмент, бивалентный фрагмент, содержащий два Fab-фрагмента, связанных дисульфидным мостиком в шарнирной области; (iii) Fd-фрагмент, состоящий из VH и CH1 доменов; (iv) Fv-фрагмент, состоящий из доменов VL и VH одного плеча антитела; (v) фрагмент диатела (dAb), который состоит из VH домена; (vi) вариабельный домен верблюдовых или камелизированный вариабельный домен; (vii) одноцепочечный Fv (ScFv), см., например, Bird et al. (1988) Science 242:423-426; и Huston et al. (1988), Proc. Natl. Acad. Sci. USA 85:58795883); (viii) однодоменное антитело. Указанные фрагменты антител получены с помощью стандартных методик, известных специалистам в данной области, и эти фрагменты подвергают скринингу на пригодность таким же образом, как и интактные антитела.
Термин "антитело" включает интактные молекулы, а также их функциональные фрагменты. Константные области антител могут быть изменены, например подвергнуты мутации, с целью изменения свойств антитела (например, для увеличения или уменьшения одного или более из следующего: связывание с Fc-рецептором, гликозилирование антитела, число цистеиновых остатков, функция эффекторных клеток или функция комплемента).
Молекулы антитела также могут быть однодоменными антителами. Однодоменные антитела могут включать антитела, гипервариабельные области которых являются частью однодоменного полипептида. Примеры включают, без ограничения, антитела с тяжелой цепью, природные антитела, изначально не имеющие легких цепей, однодоменные антитела, полученные из обычных 4-цепочечных антител, сконструированные антитела и однодоменные каркасы, отличные от каркасов, полученных из антител. Однодоменные антитела могут быть любыми известными из уровня техники антителами или любыми однодоменными антителами, которые могут быть получены в будущем. Однодоменные антитела могут быть получены из любых биологических видов, в том числе, без ограничения, мыши, человека, верблюда, ламы, рыбы, акулы, козы, кролика и быков. В соответствии с другим аспектом настоящего изобретения однодоменное антитело является природным однодоменным антителом, известным как антитело из тяжелой цепи, не имеющее легких цепей. Такие однодоменные антитела раскрыты, например, в WO 9404678. Для ясности, такой вариабельный домен, полученный из антитела из тяжелой цепи, которое в природе не имеет легкой цепи, указано в настоящей заявке как VHH или нанотело, чтобы его можно было отличить от обычной VH четырехцепочечных иммуноглобулинов. Такая молекула VHH может быть получена из антител, индуцируемых у видов Верблюдовых (Camelidae), например, у верблюдов, лам, одногорбых верблюдов, альпак и гуанако. Другие виды, помимо верблюдовых, могут вырабатывать антитела, состоящие из тяжелых цепей, изначально не имеющие легкой цепи; такие VHH включены в объем настоящего изобретения.
Области VH и VL подразделяются на области гипервариабельности, называемые "определяющими комплементарность областями" (CDR), чередующиеся с областями, которые являются более консервативными и называются "каркасными областями" (FR или FW).
Протяженность каркасной области и CDR-областей была точно определена с помощью ряда способов (см. Kabat, E. A., et al. (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242; Chothia, C. et al. (1987) J. Mol. Biol. 196:901-917; и определение AbM, используемое в программе АbМ Oxford Molecular для моделирования антител. См. в общем, например, Protein Sequence and Structure Analysis of Antibody Variable Domains, в: Antibody Engineering Lab Manual (Ed.: Duebel, S. and Kontermann, R., Springer-Verlag, Heidelberg).
Термины "определяющая комплементарность область" и "CDR" при использовании в настоящей заявке относятся к аминокислотным последовательностям в пределах вариабельных участков антитела, которые придают антигенную специфичность и аффинность связывания. Как правило, в каждой вариабельной области тяжелой цепи присутствуют три CDR-области (HCDR1, HCDR2, HCDR3), и три CDR-области присутствуют в каждой вариабельной области легкой цепи (LCDR1, LCDR2, LCDR3).
Точные границы аминокислотной последовательности каждой CDR-области могут быть определены при использовании любой из ряда общеизвестных схем, в том числе описанных в Kabat et al. (1991), "Sequences of Proteins of Immunological Interest", 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD ("схема нумерации Кэбата"), Al-Lazikani et al., (1997) JMB 273,927-948 ("схема нумерации Чотиа"). При использовании в настоящей заявке, CDR-области, определенные согласно системе нумерации Чотиа также иногда называют "гипервариабельными петлями".
Например, согласно Кэбату, аминокислотные остатки CDR в вариабельной области тяжелой цепи (VH) имеют нумерацию 31-35 (HCDR1), 50-65 (HCDR2) и 95-102 (HCDR3); и аминокислотные остатки CDR в вариабельной области легкой цепи (VL) имеют нумерацию 24-34 (LCDR1), 50-56 (LCDR2) и 89-97 (LCDR3). Согласно Чотиа, аминокислотные остатки CDR в VH имеют нумерацию 26-32 (HCDR1), 52-56 (HCDR2) и 95-102 (HCDR3); и аминокислотные остатки в VL имеют нумерацию 26-32 (LCDR1), 50-52 (LCDR2) и 91-96 (LCDR3). При объединении определений CDR Кэбата и Чотиа, CDR-области состоят из аминокислотных остатков 26-35 (HCDR1), 50-65 (HCDR2) и 95-102 (HCDR3) в человеческой VH и аминокислотных остатков 24-34 (LCDR1), 50-56 (LCDR2) и 89-97 (LCDR3) в человеческой VL.
Как правило, если специально не указано, молекулы антитела против PD-1 могут включать любую комбинацию одной или более CDR-согласно Кэбату и/или гипервариабельных петель согласно Чотиа, например, описанных в Таблице 1. В одном варианте осуществления используются следующие определения для молекул антитела против PD-1, описанных в Таблице 1: HCDR1 согласно объединенным определениям CDR Кэбата и Чотиа, и области HCCDR 2-3 и LCCDR 1-3 согласно определению CDR Кэбата. Согласно всем определениям, каждая из VH и VL обычно включает три CDR-области и четыре FR-области, расположенные от N-конца к C-концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4.
При использовании в настоящей заявке "последовательность вариабельного домена иммуноглобулина" относится к аминокислотной последовательности, которая может образовывать структуру вариабельного домена иммуноглобулина. Например, последовательность может включать всю или часть аминокислотной последовательности природного вариабельного домена. Например, последовательность может включать или не включать одну, две или более N- или С-концевых аминокислот, или может включать другие изменения, которые совместимы с образованием структуры белка.
Термин "антигенсвязывающий сайт" относится к части молекулы антитела, содержащей детерминанты, которые образуют контактную поверхность, которая связывается с PD-1 полипептидом или его эпитопом. В отношении белков (или миметиков белков), антигенсвязывающий сайт обычно включает одну или более петель (по меньшей мере четыре аминокислоты или миметика аминокислот), образующих контактную поверхность, которая связывается с полипептидом PD-1. Обычно антигенсвязывающий участок молекулы антитела включает по меньшей мере одну или две CDR-области и/или гипервариабельные петли или, более типично, по меньшей мере три, четыре, пять или шесть CDR-областей и/или гипервариабельных петель.
Термины "конкурирует" или "перекрестно конкурирует" используются в настоящем описании попеременно для обозначения способности молекулы антитела блокировать связывание молекулы антитела против PD-1, например молекулы антитела против PD-1 согласно изобретению, с мишенью, например, с человеческим PD-1. Блокирование связывания может быть прямым или непрямым (например, посредством аллостерической модуляции молекулы антитела или мишени). Степень, в которой молекула антитела может блокировать связывание другой молекулы антитела с мишенью, и, следовательно, как можно было бы говорить, конкурировать, может быть определена с помощью анализа конкурентного связывания, например, FACS анализа, анализов ELISA или BIACORE. В некоторых вариантах осуществления анализ конкурентного связывания является количественным конкурентным анализом. В некоторых вариантах осуществления первая молекула антитела против PD-1, как говорят, конкурирует за связывание мишени со второй молекулой антитела против PD-1, если связывание первой молекулы антитела с мишенью уменьшено на 10% или больше, например, на 20% или больше, на 30% или больше, на 40% или больше, на 50% или больше, на 55% или больше, на 60% или больше, на 65% или больше, на 70% или больше, на 75% или больше, на 80% или больше, на 85% или больше, на 90% или больше, на 95% или больше, на 98% или больше, на 99% или больше в анализе конкурентного связывания (например, в конкурентном анализе, описанном в настоящей заявке).
Термины "моноклональное антитело" или "композиция моноклонального антитела" при использовании в настоящей заявке относятся к препарату молекул антител одного молекулярного состава. Композиция моноклонального антитела проявляет одиночную специфичность связывания и аффинность к конкретному эпитопу. Моноклональные антитела могут быть получены с помощью технологии гибридом или способов, в которых технология гибридом не применяется (например, с помощью рекомбинантных способов).
"Эффективно человеческий" белок представляет собой белок, который не вызывает ответ нейтрализующих антител, например, ответ человеческих анти-мышиных антител (HAMA). В ряде случаев HAMA может представлять проблему, например, при повторном введении молекулы антитела, например, при лечении хронического или рецидивирующего заболевания. Ответ HAMA может сделать повторное введение антител потенциально неэффективным вследствие повышенного клиренса антител из сыворотки (см., например, Saleh et al., Cancer Immunol. Immunother., 32:180-190 (1990)), а также вследствие потенциальных аллергических реакций (см., например, LoBuglio et al., Hybridoma, 5:5117-5123 (1986)).
Молекула антитела может быть поликлональным или моноклональным антителом. В других вариантах осуществления антитело может быть получено рекомбинантным способом, например, получено с помощью фагового дисплея или комбинаторными способами.
Способы фагового дисплея и комбинаторные способы получения антител известны в уровне техники (и описаны, например, в патенте США 5,223,409 (Ladner et al.); публикации международной заявки WO 92/18619 (Kang et al.); публикации международной заявки WO 91/17271 (Dower et al.); публикации международной заявки WO 92/20791 (Winter et al.); публикации международной заявки WO 92/15679 (Markland et al.); публикации международной заявки WO 93/01288 (Breitling et al.); публикации международной заявки WO 92/01047 (McCafferty et al.); публикации международной заявки WO 92/09690 (Garrard et al.); публикации международной заявки WO 90/02809 (Ladner et al.); Fuchs et al. (1991) Bio/Technology 9:1370-1372; Hay et al. (1992) Hum Antibody Hybridomas 3:81-85; Huse et al. (1989) Science 246:1275-1281; Griffths et al. (1993) EMBO J 12:725-734; Hawkins et al. (1992) J Mol Biol 226:889-896; Clackson et al. (1991) Nature 352:624-628; Gram et al. (1992) PNAS 89:3576-3580; Garrad et al. (1991) Bio/Technology 9:1373-1377; Hoogenboom et al. (1991) Nuc Acid Res 19:4133-4137; и Barbas et al. (1991) PNAS 88:7978-7982, при этом содержание всех указанных публикаций включено в настоящую заявку посредством отсылки).
В одном варианте осуществления антитело является полностью человеческим антителом (например, антителом, полученным в мышах, которые были генетически модифицированы с целью получения антитела из человеческой иммуноглобулиновой последовательности) или нечеловеческим антителом, например, антителом грызунов (мышиным или крысиным), коз, приматов (например, обезьян), верблюдов. Предпочтительно нечеловеческое антитело представляет собой антитело грызунов (мышиное или крысиное антитело). Способы получения антител грызунов известны в уровне техники.
Человеческие моноклональные антитела могут быть получены с использованием трансгенных мышей, несущих человеческие иммуноглобулиновые гены, а не мышиной системы. Спленоциты таких трансгенных мышей, иммунизированных представляющим интерес антигеном, используют для получения гибридом, которые секретируют человеческие мАт со специфической аффинностью к эпитопам из человеческого белка (см., например, публикацию международной заявки WO 91/00906 (Wood et al.), публикацию PCT WO 91/10741 (Kucherlapati et al.); публикацию международной заявки WO 92/03918 (Lonberg et al.); публикацию международной заявки 92/03917 (Kay et al.); Lonberg, N. et al. 1994 Nature 368:856-859; Green, L.L. et al. 1994 Nature Genet. 7:13-21; Morrison, S.L. et al. 1994 Proc. Natl. Acad. Sci. USA 81:6851-6855; Bruggeman et al. 1993 Year Immunol 7:33-40; Tuaillon et al. 1993 PNAS 90:3720-3724; Bruggeman et al. 1991 Eur J Immunol 21:1323-1326).
Антитело может быть антителом, в котором вариабельная область или ее часть, например, CDR-области, созданы не в человеческом организме, например, в организме крысы или мыши. В объем настоящего изобретения включены химерные, CDR-перевитые и гуманизированные антитела. В объем настоящего изобретения входят антитела, полученные не в человеческом организме, например, в организме крысы или мыши, а затем модифицированные, например, в вариабельной каркасной области или константной области, с целью снижения антигенности в организме человека.
Химерные антитела могут быть получены с помощью технологий рекомбинантных ДНК, известных в уровне техники (см. публикацию международной заявки PCT/US86/02269 (Robinson et al.); европейскую заявку на патент 184,187 (Akira, et al.); европейскую заявку на патент 171,496 (Taniguchi, M.); европейскую заявку на патент 173,494 (Morrison et al.); международную заявку WO 86/01533 (Neuberger et al.); патент США 4,816,567 (Cabilly et al.); европейскую заявку на патент 125,023 (Cabilly et al.); Better et al. (1988 Science 240:1041-1043); Liu et al. (1987) PNAS 84:3439-3443; Liu et al., 1987, J. Immunol. 139:3521-3526; Sun et al. (1987) PNAS 84:214-218; Nishimura et al., 1987, Canc. Res. 47:999-1005; Wood et al. (1985) Nature 314:446-449; и Shaw et al., 1988, J. Natl Cancer Inst. 80:1553-1559).
В гуманизированном или CDR-перевитом антителе по меньшей мере одна или две, но обычно все три реципиентных CDR-области (тяжелых и/или легких цепей иммуноглобулина) будут заменены донорными CDR-областями. Антитело можно заменить по меньшей мере частью нечеловеческой CDR-области или только некоторые из CDR-областей можно заменить нечеловеческими CDR. Требуется только заменить некоторые CDR-области, необходимые для связывания гуманизированного антитела с PD-1. Предпочтительно, чтобы донором являлось антитело грызуна, например, крысиное или мышиное антитело, а реципиентом являлся человеческий каркас или человеческий консенсусный каркас. Обычно иммуноглобулин, предоставляющий CDR-области, называют "донором", а иммуноглобулин, предоставляющий каркас, называют "акцептором". В одном варианте осуществления донорный иммуноглобулин не является человеческим (например, является иммуноглобулином грызуна). Акцепторный каркас является природным (например, человеческим) каркасом или консенсусным каркасом, или имеет последовательность, которая идентична им приблизительно на 85% или более, предпочтительно на 90%, 95%, 99% или более.
При использовании в настоящей заявке термин "консенсусная последовательность" относится к последовательности, созданной из наиболее часто встречающихся аминокислот (или нуклеотидов) в семействе родственных последовательностей (см., например, Winnaker, From Genes to Clones (Verlagsgesellschaft, Weinheim, Germany 1987). В семействе белков каждое положение в консенсусной последовательности занимает аминокислота, наиболее часто встречающаяся в этом положении в данном семействе. Если две аминокислоты встречаются одинаково часто, каждая из них может быть включена в консенсусную последовательность. Термин "консенсусный каркас" относится к каркасной области в консенсусной последовательности иммуноглобулина.
Антитело можно гуманизировать способами, известными в уровне техники (см., например, Morrison, S. L., 1985, Science 229:1202-1207, Oi et al., 1986, BioTechniques 4:214, и патенты США US 5,585,089, US 5,693,761 и US 5,693,762 (Queen et al.), при этом содержание всех указанных публикаций включено в настоящую заявку посредством отсылки).
Гуманизированные или CDR-перевитые антитела могут быть получены путем CDR-графтинга или замены CDR-областей, где одна, две или все CDR-области цепи иммуноглобулина могут быть заменены. См., например, патент США 5,225,539; Jones et al. 1986 Nature 321:552-525; Verhoeyan et al. 1988 Science 239:1534; Beidler et al. 1988 J. Immunol. 141:4053-4060; Winter US 5,225,539, и содержание всех указанных публикаций включено в настоящее описание посредством отсылки. Винтер описывает способ CDR-графтинга, который может применяться для получения гуманизированных антител согласно настоящему изобретению (заявка на патент Великобритании GB 2188638А, поданная 26 марта 1987 года, Winter US 5225539), содержание которых включено в настоящее описание посредством отсылки.
Также в объем настоящего изобретения включены гуманизированные антитела, в которых были заменены, удалены или добавлены определенные аминокислоты. Критерии отбора аминокислот из донора описаны в US 5,585,089, например, в разделах 12-16 US 5,585,089, например, в разделах 12-16 US 5,585,089, содержание которого включено в настоящее описание посредством отсылки. Другие способы гуманизации антител описаны в заявке Padlan et al., ЕР 519596 A1, опубликованной 23 декабря 1992 года.
Молекула антитела может быть одноцепочечным антителом. Одноцепочечное антитело (ScFv) может быть сконструированным (см., например, Colcher, D. et al. (1999) Алл. N. Y. Acad. Sci. 880:263-80; и Reiter, Y. (1996) Clin. Cancer Res. 2:245-52). Одноцепочечное антитело может быть димеризовано или мультимеризовано с получением поливалентных антител, обладающих специфичностями в отношении разных эпитопов одного и того же белка-мишени.
В других вариантах осуществления молекула антитела имеет константную область тяжелой цепи, которая выбрана, например, из константных областей тяжелой цепи IgG1, IgG2, IgG3, IgG4, IgM, IgA1, IgA2, IgD и IgE; в частности, выбрана, например, из (например, человеческих) константных областей тяжелой цепи IgG1, IgG2, IgG3 и IgG4. В другом варианте осуществления молекула антитела имеет константную область легкой цепи, которая выбрана, например, из (например, человеческих) константных областей легкой цепи каппа или лямбда. Константная область может быть изменена, например, подвергнута мутации, с целью модификации свойств антитела (например, для увеличения или уменьшения одного или более следующих свойств: связывание с Fc-рецептором, гликозилирование антитела, число остатков цистеина, функция эффекторных клеток и/или функция комплемента). В одном варианте осуществления антитело обладает эффекторной функцией и может связывать комплемент. В других вариантах осуществления антитело не рекрутирует эффекторные клетки или не связывает комплемент. В другом варианте осуществления у антитела понижена или отсутствует способность связываться с Fc-рецептором. Например, оно относится к такому изотипу или субтипу, фрагменту или другому мутанту, которые не способны связываться с Fc-рецептором, например, его область связывания с Fc-рецептором подвергнута мутации или удалена.
Способы изменения константной области антитела известны в уровне техники. Антитела с измененной функцией, например, с измененной аффинностью к эффекторному лиганду, такому как FcR на клетке, или компонент C1 комплемента, могут быть получены путем замены по меньшей мере одного аминокислотного остатка в константной части антитела другим остатком (см., например, ЕР 388151 A1, патент США 5,624,821 и патент США 5,648,260, содержание которых включено в настоящее описание посредством отсылки). Можно описать аналогичный тип изменений, применение которых в мышином иммуноглобулине или иммуноглобулине других биологических видов может приводить к снижению или устранению указанных функций.
Молекула антитела может быть дериватизирована или присоединена к другой функциональной молекуле (например, к другому пептиду или белку). При использовании в настоящей заявке термин "дериватизированная" молекула антитела относится к молекуле антитела, которая была модифицирована. Способы дериватизации включают, без ограничения перечисленным, присоединение флуоресцентной молекулы, радионуклида, токсина, фермента или аффинного лиганда, такого как биотин. Таким образом, предполагается, что молекулы антитела согласно изобретению включают дериватизированные и иным образом модифицированные формы антител, описанных в настоящей заявке, в том числе молекулы иммуноадгезии. Например, молекула антитела может быть функционально связана (посредством химического сшивания, генетического слияния, нековалентной ассоциации или другим способом) с одним или более другими молекулярными единицами, такими как другое антитело (например, биспецифичное антитело или диатело), детектируемое вещество, цитотоксическое средство, фармацевтическое средство и/или белок или пептид, который может опосредовать ассоциацию антитела или части антитела с другой молекулой (например, с коровой областью стрептавидина или полигистидиновой меткой).
Один из типов дериватизированной молекулы антитела получают при сшивании двух или более антител (одинакового типа или разных типов, например, с получением биспецифичных антител). Подходящие сшивающие агенты включают гетеробифункциональные соединения, которые имеют две различные реакционноспособные группы, разделенные подходящим спейсером (например, сложным эфиром м-малеимидобензоил-N-гидроксисукцинимида), или гомобифункциональные соединения (например, дисукцинимидилсуберат). Такие линкеры могут быть получены в Pierce Chemical Company, Rockford, Ill.
Подходящие детектируемые вещества, которыми можно дериватизировать (или пометить) молекулу антитела согласно изобретению, включают флуоресцентные соединения, различные ферменты, простетические группы, люминесцентные материалы, биолюминесцентные материалы, испускающие флуоресценцию атомы металлов, например, европий (Eu) и другие лантаноиды, и радиоактивные вещества (описанные ниже). Примеры флуоресцентных детектируемых веществ включают флуоресцеин, флуоресцеин изотиоцианат, родамин, 5-диметиламин-1-хлорид-нафталинсульфонил-хлорид, фикоэритрин и т.п. Антитело также может быть дериватизировано детектируемыми ферментами, такими как щелочная фосфатаза, пероксидаза хрена (β-галактозидаза, ацетилхолинэстераза, глюкозооксидаза и т.п. При дериватизации антитела детектируемым ферментом, его детектируют путем добавления дополнительных реагентов, которые используются ферментом для получения детектируемого продукта реакции. Например, если детектируемым веществом является пероксидаза хрена, добавление перекиси водорода и диаминобензидина приводит к образованию окрашенного продукта реакции, который можно обнаружить. Молекула антитела также может быть дериватизирована простетической группой (например, стрептавидином/биотином и авидином/биотином). Например, антитело может быть дериватизировано биотином и детектировано путем непрямого измерения связывания авидина или стрептавидина. Примеры подходящих флуоресцентных материалов включают умбеллиферон, флуоресцеин, флуоресцеин изотиоцианат, родамин, дихлортриазиниламин флуоресцеин, дансилхлорид или фикоэритрин; пример люминесцентного материала включает люминол; и примеры биолюминисцентных материалов включают люциферазу, люциферин и экворин.
Меченая молекула антитела может применяться, например, в диагностических и/или экспериментальных целях в ряде случаев, включающих: (i) выделение заданного антигена с помощью стандартных методов, таких как аффинная хроматография или иммунопреципитация; (ii) обнаружение заданного антигена (например, в клеточном лизате или супернатанте клеток) с целью оценки относительного содержания и профиля экспрессии белка; (iii) контроль уровней белка в тканях в качестве части методики клинического анализа, например, для определения эффективности данной схемы лечения.
Молекулы антитела могут быть конъюгированы с другой молекулой, как правило, меткой или терапевтическим (например, цитотоксическим или цитостатическим) средством или частицей. Радиоактивные изотопы могут использоваться в диагностических или терапевтических применениях.
В изобретении предложены меченные радиоактивным изотопом молекулы антитела и способы их мечения. В одном варианте осуществления раскрыт способ мечения молекулы антитела. Способ включает контакт молекулы антитела с комплексообразующим веществом, с получением в результате конъюгированного антитела.
Как обсуждается выше, молекула антитела может быть конъюгирована с терапевтическим средством. Терапевтически активные радиоизотопы уже были указаны. Примеры других терапевтических средств включают таксол, цитохалазин B, грамицидин D, бромид этидия, эметин, митомицин, этопозид, тенопозид, винкристин, винбластин, колхицин, доксорубицин, даунорубицин, дигидроксиантрациндион, митоксантрон, митрамицин, актиномицин D, 1-дегидротестостерон, глюкокортикоиды, прокаин, тетракаин, лидокаин, пропранолол, пуромицин, майтанзиноиды, например, майтанзинол (см. патент США 5,208,020), СС-1065 (см. патенты США 5,475,092, 5,585,499, 5,846,545) и их аналоги или гомологи. Терапевтические средства включают, без ограничения перечисленными, антиметаболиты (например, метотрексат, 6-меркаптопурин, 6-тиогуанин, цитарабин, 5-фторурацил, дакарбазин), алкилирующие средства (например, мехлорэтамин, тиотепу, хлорамбуцил, СС-1065, мелфалан, кармустин (BSNU) и ломустин (CCNU), циклофосфамид, бусульфан, дибромманнит, стрептозотоцин, митомицин C и цис-дихлордиаминплатину (II) (DDP) цисплатин), антрациклины (например, даунорубицин (ранее дауномицин) и доксорубицин), антибиотики (например, дактиномицин (ранее актиномицин), блеомицин, митрамицин и антрамицин (АМС)), и антимитотические средства (например, винкристин, винбластин, таксол и майтанзиноиды).
В одном из аспектов настоящее изобретение относится к способу получения связывающей мишень молекулы, которая специфично связывается с мишенью, раскрытой в настоящей заявке, например, с рецептором PD-1. Например, связывающая мишень молекула является молекулой антитела. Способ включает: получение белка-мишени, который включает, по меньшей мере, часть нечеловеческого белка, которая гомологична (по меньшей мере идентична на 70%, 75, 80, 85, 87, 90, 92, 94, 95, 96, 97, 98%) соответствующей части человеческого белка-мишени, но отличается по меньшей мере одной аминокислотой (например, по меньшей мере на одной, двумя, тремя, четырьмя, пятью, шестью, семью, восемью или девятью аминокислотами); получение молекулы антитела, которое специфично связывается с антигеном; и оценку эффективности связывающего средства при модулировании активности белка-мишени. Способ может дополнительно включать введение связывающего средства (например, молекулы антитела) или его производного (например, молекулы гуманизированного антитела) человеку.
Молекулы мультиспецифичных антител
В некоторых вариантах осуществления молекула антитела является молекулой мультиспецифичного (например, биспецифичного или триспецифичного) антитела. Методики получения молекул биспецифичных или гетеродимерных антител известны в уровне техники и включают, без ограничения, например, метод "выступ во впадину", описанный, например, в US5731168; спаривание Fc с применением электростатического направления, как описано, например, в WO 09/089004, WO 06/106905 и WO 2010/129304; образование гетеродимера методом SEED (англ. Strand Exchange Engineered Domains - домены, сконструированные путем обмена цепей), как описано, например, в WO 07/110205; замену плеча Fab, как описано, например, в WO 08/119353, WO 2011/131746 и WO 2013/060867; двойной конъюгат антитела, например, сшивание антитела с получением биспецифичной структуры при использовании гетеробифункционального реагента, имеющего реакционноспособную аминогруппу и реакционноспособную сульфгидрильную группу, как описано, например, в US4433059; детерминанты биспецифичного антитела, созданные в результате рекомбинации полуантител (пар тяжелых-легких цепей или Fab-фрагментов) от разных антител через цикл восстановления и окисления дисульфидных связей между двумя тяжелыми цепями, как описано, например, в US4444878; трифункциональные антитела, например, три Fab'-фрагмента, сшитые через реакционноспособные сульфгидрильные группы, как описано, например, в US5273743; биосинтетические связывающие белки, например, пара scFv-фрагментов, сшитых через С-концевые хвосты, предпочтительно путем химического сшивания дисульфида или реакционноспособной аминогруппы, как описано, например, в US5534254; бифункциональные антитела, например, Fab-фрагменты с разными специфичностями связывания, димеризованные посредством лейциновых молний (например, c-fos и c-jun), которые заменяют константный домен, как описано, например, в US5582996; биспецифичные и олигоспецифичные моно- и олиговалентные рецепторы, например, VH-CH1 области двух антител (два Fab-фрагмента), соединенные через полипептидный спейсер между СН1 областью одного антитела и VH областью другого антитела, как правило, с ассоциированными легкими цепям, как описано, например, в US5591828; биспецифичные конъюгаты ДНК-антител, например, сшивание антител или Fab-фрагментов посредством двухцепочечного фрагмента ДНК, как описано, например, в US5635602; биспецифичные слитые белки, например, экспрессионную конструкцию, содержащую два scFv с гидрофильным спиральным пептидным линкером между ними и полноразмерной константной областью, как описано, например, в US5637481; мультивалентные и мультиспецифичные связывающие белки, например, димер из полипептидов, имеющих первый домен со связывающей областью вариабельной области тяжелой цепи Ig, и второй домен со связывающей областью вариабельной области легкой цепи Ig, которые обычно называют диателами (также раскрыты структуры более высокого порядка, образующие биспецифичные, триспецифичные или тетраспецифичные молекулы, как описано, например, в US5837242); конструкции минител со связанными VL и VH цепями, дополнительно соединенные пептидными спейсерами с шарнирной областью антитела и СН3 областью, которые могут димеризоваться с образованием биспецифичных/поливалентных молекул, как описано, например, в US5837821; VH и VL домены, связанные через короткий пептидный линкер (например, из 5 или 10 аминокислот) или вообще без линкера, в любой ориентации, которые могут образовывать димеры с образованием биспецифичных диател; тримеры и тетрамеры, как описано, например, в US5844094; цепь VH доменов (или VL доменов, членов семейства), соединенных пептидными связями со сшиваемыми группами на С-конце, дополнительно связанных с VL доменами, с образованием серии из FV-фрагментов (или из scFv-фрагментов), как описано, например, в US5864019; и одноцепочечные связывающие полипептиды с VH доменом и VL доменом, связанными через пептидный линкер, которые объединены в поливалентные структуры посредством нековалентного или химического сшивания с образованием, например, гомобивалентных, гетеробивалентных, тривалентных и тетравалентных структур с применением формата ScFv или формата диател, как описано, например, в US5869620. Дополнительные примеры мультиспецифичных и биспецифичных молекул и способы их получения можно найти, например, в US5910573, US5932448, US5959083, US5989830, US6005079, US6239259, US6294353, US6333396, US6476198, US6511663, US6670453, US6743896, US6809185, US6833441, US7129330, US7183076, US7521056, US7527787, US7534866, US7612181, US2002/004587A1, US2002/076406A1, US2002/103345A1, US2003/207346A1, US2003/211078A1, US2004/219643A1, US2004/220388A1, US2004/242847A1, US2005/003403A1, US2005/004352A1, US2005/069552A1, US2005/079170A1, US2005/100543A1, US2005/136049A1, US2005/136051A1, US2005/163782A1, US2005/266425A1, US2006/083747A1, US2006/120960A1, US2006/204493A1, US2006/263367A1, US2007/004909A1, US2007/087381A1, US2007/128150A1, US2007/141049A1, US2007/154901A1, US2007/274985A1, US2008/050370A1, US2008/069820A1, US2008/152645A1, US2008/171855A1, US2008/241884A1, US2008/254512A1, US2008/260738A1, US2009/130106A1, US2009/148905A1, US2009/155275A1, US2009/162359A1, US2009/162360A1, US2009/175851A1, US2009/175867A1, US2009/232811A1, US2009/234105A1, US2009/263392A1, US2009/274649A1, EP346087A2, WO00/06605A2, WO02/072635A2, WO04/081051A1, WO06/020258A2, WO2007/044887A2, WO2007/095338A2, WO2007/137760A2, WO2008/119353A1, WO2009/021754A2, WO2009/068630A1, WO91/03493A1, WO93/23537A1, WO94/09131A1, WO94/12625A2, WO95/09917A1, WO96/37621A2, WO99/64460A1. Содержание указанных выше заявок полностью включено в настоящее описание посредством отсылки.
В других вариантах осуществления молекула антитела против PD-1 (например, молекула моноспецифичного, биспецифичного или мультиспецифичного антитела) ковалентно связана, например слита, с другим партнером, например, с белком, например, с одним, двумя или более цитокинами, например, в виде слитой молекулы, например слитого белка. В других вариантах осуществления слитая молекула содержит один или более белков, например, один, два или более цитокинов. В одном варианте осуществления цитокин является интерлейкином (IL), выбранным из одного, двух, трех или более из IL-1, IL-2, IL-12, IL-15 или IL-21. В одном варианте осуществления молекула биспецифичного антитела обладает первой специфичностью связывания в отношении первой мишени (например, PD-1), второй специфичностью связывания в отношении второй мишени (например, LAG-3 или TIM-3) и, необязательно, связана с доменом интерлейкина (например, IL-12), например, полноразмерным IL-12 или его частью.
"Слитый белок" и "слитый полипептид" относятся к полипептиду, имеющему по меньшей мере две ковалентно связанных друг с другом части, где каждая из частей является полипептидом, обладающим разными свойствами. Свойство может быть биологическим свойством, таким как активность в in vitro или in vivo. Свойство также может быть простым химическим или физическим свойством, например, связыванием с молекулой-мишенью, катализом реакции и т.д. Эти две части могут быть соединены напрямую одной пептидной связью или через пептидный линкер, но при этом находиться в рамке считывания друг с другом.
В настоящем изобретении предложена выделенная молекула нуклеиновой кислоты, кодирующая вышеуказанную молекулу антитела, векторы и их клетки-хозяева. Молекула нуклеиновой кислоты включает, без ограничения, РНК, геномную ДНК и кДНК.
Примеры средств, применяемых в комбинациях
В настоящей заявке описаны способы и композиции, которые включают комбинацию одного или более следующего: (i) средство, которое увеличивает презентацию антигена (например, опухолевого антигена); (ii) средство, которое усиливает ответ эффекторных клеток (например, активацию и/или мобилизацию В-клеток и/или Т-клеток); или (iii) средство, которое уменьшает опухолевую иммуносупрессию, в результате чего осуществляется лечение нарушения, например, гиперпролиферативного состояния или нарушения (например, рака). В некоторых вариантах осуществления комбинация включает ингибитор PD-1 (например, молекулу антитела против PD-1, как описано в настоящей заявке). Примеры средств, которые могут применяться в этих комбинациях, предложены в настоящей заявке.
Примеры агонистов STING
В варианте осуществления комбинация включает агонист STING. В некоторых вариантах осуществления комбинация применяется для лечения рака, например, рака, описанного в настоящей заявке, например, солидной опухоли (например, рака молочной железы, плоскоклеточной карциномы, меланомы, рака яичника, карциномы фаллопиевой трубы, перитонеальной карциномы, саркомы мягких тканей, рака пищевода, рака головы и шеи, рака эндометрия, рака шейки матки или базально-клеточной карциномы), например, гемобластоза (например, лейкоза (например, хронического лимфоцитарного лейкоза (ХЛЛ)) или лимфомы (например, В-клеточной лимфомы из клеток краевой зоны, мелкоклеточной лимфоцитарной лимфомы, фолликулярной лимфомы, лимфомы Ходжкина, неходжкинской лимфомы)). В некоторых вариантах осуществления рак выбран из рака головы и шеи (например, плоскоклеточной карциномы головы и шеи (HNSCC), рака кожи (например, меланомы), рака легкого (например, немелкоклеточного рака легкого (НМРЛ)) или рак молочной железы (например, трижды негативного рака молочной железы (ТНРМЖ)).
В некоторых вариантах осуществления агонист STING является циклическим динуклеотидом, например, циклическим динуклеотидом, включающим пуриновые или пиримидиновые нуклеотидные основания (например, нуклеотидные основания аденозин, гуанин, урацил, тимин или цитозин). В некоторых вариантах осуществления нуклеотидные основания циклического динуклеотида включают одно и то же нуклеотидное основание или разные нуклеотидные основания.
В некоторых вариантах осуществления агонист STING включает нуклеотидное основание аденозин или гуанозин. В некоторых вариантах осуществления агонист STING включает одно нуклеотидное основание аденозин и одно нуклеотидное основание гуанозин. В некоторых вариантах осуществления агонист STING включает два нуклеотидных основания аденозина или два нуклеотидных основания гуанозина.
В некоторых вариантах осуществления агонист STING включает модифицированный циклический динуклеотид, например, включающий модифицированное нуклеотидное основание, модифицированную рибозу или модифицированную фосфатную связь. В некоторых вариантах осуществления модифицированный циклический динуклеотид включает модифицированную фосфатную связь, например, тиофосфат.
В некоторых вариантах осуществления агонист STING включает циклический динуклеотид (например, модифицированный циклический динуклеотид) с 2', 5' или 3', 5' фосфатными связями. В некоторых вариантах осуществления агонист STING включает циклический динуклеотид (например, модифицированный циклический динуклеотид) с Rp или Sp стереохимией вокруг фосфатных связей.
В некоторых вариантах осуществления агонистом STING является Rp,Rp-дитио-2',3'-c-ди-АМФ (например, Rp,Rp-дитио-c-[A(2',5')pA(3',5')p]) или его циклический динуклеотидный аналог. В некоторых вариантах осуществления агонистом STING является соединение, представленной в патентной публикации US2015/0056224 (например, соединение на Фигуре 2c, например, соединение 21 или соединение 22). В некоторых вариантах осуществления агонистом STING является c-[G(2',5')pG(3',5')p], его O-замещенное дитиорибозой производное или соединение, показанное на Фиг. 4 публикаций PCT WO 2014/189805 и WO 2014/189806. В некоторых вариантах осуществления агонистом STING является c-[(2',5')pA(3',5')p] или его O-замещенное дитиорибозой производной, или соединение, показанное на Фиг. 5 публикаций PCT WO 2014/189805 и WO 2014/189806. В некоторых вариантах осуществления агонистом STING является c-[G(2',5')pA(3',5')p] или его O-замещенное дитиорибозой производное, или соединение, показанное на Фиг. 5 публикаций PCT WO 2014/189805 и WO 2014/189806. В некоторых вариантах осуществления агонистом STING является 2'-O-пропаргил-циклический-[A(2',5')pA(3',5')p] (2'-O-пропаргил-ML-CDA) или соединение, показанное на Фиг. 7 публикации PCT WO 2014/189806.
Другие примеры агонистов STING раскрыты, например, в публикациях PCT WO 2014/189805 и WO 2014/189806, и публикации U.S. 2015/0056225.
Примеры агонистов TLR
В варианте осуществления комбинация, описанная в настоящей заявке, включает агонист Толл-подобного рецептора (TLR). В некоторых вариантах осуществления комбинация применяется для лечения рака, например, рака, описанного в настоящей заявке, например, солидной опухоли (например, рака молочной железы, плоскоклеточной карциномы, меланомы, рака яичника, карциномы фаллопиевой трубы, перитонеальной карциномы, саркомы мягких тканей, рака пищевода, рака головы и шеи, рака эндометрия, рака шейки матки или базально-клеточной карциномы), например, гемобластоза (например, лейкоза (например, хронического лимфоцитарного лейкоза (ХЛЛ)) или лимфомы (например, В-клеточной лимфомы из клеток краевой зоны, мелкоклеточной лимфоцитарной лимфомы, фолликулярной лимфомы, лимфомы Ходжкина, неходжкинской лимфомы)).
Рецепторы TLR представляют собой семейство паттерн-распознающих рецепторов, которые первоначально были идентифицированы как сенсоры врожденной иммунной системы, которые распознают микробные патогены. У людей TLR-рецепторы включают TLR-1, TLR-2, TLR-3, TLR-4, TLR-5, TLR-6, TLR-7, TLR-8, TLR-9 и TLR-10. TLR-1, -2, -4, -5 и -6 экспрессируются на поверхности клеток, а TLR-3, -7/8 и -9 экспрессируются в ЭР компартементе. Субпопуляции человеческих дендритных клеток можно идентифицировать по определенным профилям экспрессии TLR. Миелоидная или "обычная" субпопуляция человеческих дендритных клеток экспрессирует TLR-рецепторы 1-8, а плазмоцитоидная субпопуляция дендритных клеток экспрессирует только TLR-7 и TLR-9. Связывание лиганда с TLR-рецепторами активирует каскад внутриклеточных сигнальных путей, которые вызывают продукцию факторов, участвующих в воспалении и иммунитете. Стимуляция миелоидной субпопуляции и плазмоцитоидной субпопуляции человеческих дендритных клеток приводит к примированию антигенспецифичных CD4+ и CD8+ Т-клеток и активации NK-клеток и Т-клеток, соответственно.
В некоторых вариантах осуществления агонист TLR выбран из одного или более из агониста TLR-1, агониста TLR-2, агониста TLR-3, агониста TLR-4, агониста TLR-5, агониста TLR-6, агониста TLR-7, агониста TLR-8, агониста TLR-9, агониста TLR-10, агониста TLR-1/2, агониста TLR-2/6 или агониста TLR-7/8. В одном варианте осуществления агонист TLR является агонистом TLR7.
В некоторых вариантах осуществления агонистом TLR является имиквимод или 3-(2-метилпропил)-3,5,8-триазатрицикло[7.4.0.02,6]тридека-1(9),2(6),4,7,10,12-гексаен-7-амин. Имиквимод или 3-(2-метилпропил)-3,5,8-триазатрицикло[7.4.0.02,6]тридека-1(9),2(6),4,7,10,12-гексаен-7-амин может связываться и активировать TLR-7 и/или TLR-8.
В некоторых вариантах осуществления агонистом TLR является 852A. 852A раскрыт, например, в Inglefield et al. J Interferon Cytokine Res. 2008; 28(4):253-63. 852A может связываться и активировать TLR-7 и/или TLR-8.
В некоторых вариантах осуществления агонистом TLR является бацилла Кальмета-Герена (БЦЖ). БЦЖ может связываться и активировать TLR-9.
В некоторых вариантах осуществления агонистом TLR является EMD 120108. EMD 120108 представляет собой синтетический олигонуклеотид, содержащий фосфоротиоат-олигодезоксинуклеотид. EMD 1201081 может связываться и активировать TLR-9, например, в моноцитах/макрофагах, плазмоцитоидных дендритных клетках (ДК) и В-клетках, инициируя иммунные сигнальные пути, активируя В-клетки и индуцируя продукцию цитокинов T-хелперными клетками.
В некоторых вариантах осуществления агонистом TLR является IMO-2055. IMO-2055 представляет собой синтетический олигонуклеотид, содержащий неметилированные CpG динуклеотиды. Имитируя неметилированные CpG последовательности в бактериальной ДНК, IMO-2055 может связываться и активировать TLR-9, например, в моноцитах/макрофагах, плазмоцитоидных дендритных клетках (ДК) и В-клетках, инициируя иммунные сигнальные пути и активируя В-клетки и ДК, и индуцируя продукцию цитокинов T-хелперными клетками.
Другие примеры агонистов TLR, которые могут применяться в комбинации, включают, например, агонистов TLR-1/2 (например, Pam3Cys), агонистов TLR-2 (например, CFA, MALP2, Pam2Cys, FSL-1 или Hib-OMPC), агонистов TLR-3 (например, полирибоинозиновую:полирибоцитидиловую кислоту (поли-I:C), полиаденозин-полиуридиловую кислоту (поли-AU), полиинозиновую-полицитидиловую кислоту, стабилизированную поли-L-лизином и карбоксиметилцеллюлозой (Hiltonol®)), агонистов TLR-4 (например, монофосфориллипид (MPL), ЛПС, сиалил-Tn (STn)), агонистов TLR-5 (например, бактериальный флагеллин), агонистов TLR-7 (например, имиквимод), агонистов TLR-7/8 (например, резиквимод или локсорибин) и агонистов TLR-9 (например, неметилированный CpG динуклеотид (CpG-ODN)).
В другом варианте осуществления агонист TLR применяется в комбинации с агонистом GITR, например, как описано в WO2004060319 и публикации международной заявки WO2014012479.
Примеры ингибиторов VEGFR
В одном варианте осуществления комбинация, описанная в настоящей заявке, включает ингибитор рецептора фактора роста эндотелия сосудов (VEGF) (например, ингибитор одного или более из VEGFR (например, VEGFR-1, VEGFR-2, VEGFR-3) или VEGF). В некоторых вариантах осуществления комбинация применяется для лечения рака, например, рака, описанного в настоящей заявке, например, солидной опухоли (например, меланомы, рака молочной железы, рака толстой кишки, рака пищевода, стромальной опухоли желудочно-кишечного тракта (GIST), рака почки (например, почечно-клеточного рака), рака печени, немелкоклеточного рака легкого (НМРЛ), рака яичника, рака поджелудочной железы, рака предстательной железы или рака желудка), например, гемобластоза (например, лимфомы).
В некоторых вариантах осуществления ингибитором VEGFR является ваталаниба сукцинат (Соединение A47) или соединение, раскрытое в EP 296122.
В некотором варианте осуществления ингибитором VEGFR является ингибитор одного или более из VEGFR-2, PDGFR бета, KIT или Raf-киназы C, 1-метил-5-((2-(5-(трифторметил)-1H-имидазол-2-ил)пиридин-4-ил)окси)-N-(4-(трифторметил)фенил)-1H-бензо[d]имидазол-2-амин (Соединение A37) или соединение, раскрытое в публикации PCT WO 2007/030377.
Другие образцовые ингибиторы пути VEGFR, которые могут использоваться в комбинациях, раскрытых в настоящей заявке, включают, например, бевацизумаб (Авастин®), акситиниб (Инлита®); бриваниб аланинат (BMS-582664, (S)-((R)-1-(4-(4-фтор-2-метил-1H-индол-5-илокси)-5-метилпирроло[2,1-f][1,2,4]триазин-6-илокси)пропан-2-ил)2-аминопропаноат); сорафениб (Нексавар®); пазопаниб (Вотриент®); сунитиниба малат (Сутент®); цедираниб (AZD2171, CAS 288383-20-1); варгатеф (BIBF1120, CAS 928326-83-4); форетиниб (GSK1363089); телатиниб (BAY57-9352, CAS 332012-40-5); апатиниб (YN968D1, CAS 811803-05-1); иматиниб (Гливек®); понатиниб (AP24534, CAS 943319-70-8); тивозаниб (AV951, CAS 475108-18-0); регорафениб (BAY73-4506, CAS 755037-03-7); ваталаниба дигидрохлорид (PTK787, CAS 212141-51-0); бриваниб (BMS-540215, CAS 649735-46-6); вандетаниб (Капрелса® или AZD6474); мотесаниба дифосфат (AMG706, CAS 857876-30-3, N-(2,3-дигидро-3,3-диметил-1H-индол-6-ил)-2-[(4-пиридинилметил)амино]-3-пиридинкарбоксамид, описанный в публикации PCT WO 02/066470); довитиниб лактилмолочную кислоту (TKI258, CAS 852433-84-2); линфаниб (ABT869, CAS 796967-16-3); кабозантиниб (XL184, CAS 849217-68-1); лестауртиниб (CAS 111358-88-4); N-[5-[[[5-(1,1-диметилэтил)-2-оксазолил]метил]тио]-2-тиазолил]-4-пиперидинкарбоксамид (BMS38703, CAS 345627-80-7); (3R,4R)-4-амино-1-((4-(3-метоксифенил)амино)пирроло[2,1-f][1,2,4]триазин-5-ил)метил)пиперидин-3-ол (BMS690514); N-(3,4-дихлор-2-фторфенил)-6-метокси-7-[[(3aα,5β,6aα)-октагидро-2-метилцикло-пента[c]пиррол-5-ил]метокси]-4-хиназолинамин (XL647, CAS 781613-23-8); 4-метил-3-[[1-метил-6-(3-пиридинил)-1H-пиразоло[3,4-d]пиримидин-4-ил]амино]-N-[3-(трифторметил)фенил]-бензамид (BHG712, CAS 940310-85-0); афлиберцепт (Эйлеа®) и эндостатин (ENDOSTAR®).
Примеры антител против VEGF, которые могут применяться в комбинациях, раскрытых в настоящей заявке, включают, например, моноклональное антитело, которое связывается с таким же эпитопом, что и моноклональное антитело против VEGF A4.6.1, продуцируемое гибридомой ATCC HB 10709; рекомбинантное гуманизированное моноклональное антитело против VEGF, созданное согласно Presta et al. (1997) Cancer Res. 57:4593-4599. В одном варианте осуществления антителом против VEGF является бевацизумаб (BV), также известный как rhuMAb VEGF или Авастин®. Он включает мутантные каркасные области человеческого IgG1 и антигенсвязывающие определяющие комплементарность области из мышиного моноклонального антитела против hVEGF A.4.6.1, которое блокирует связывание человеческого VEGF с его рецепторами. Бевацизумаб и другие гуманизированные антитела против VEGF также описаны в патенте США 6,884,879, опубликованном 26 февраля 2005 года. Дополнительные антитела включают антитела серий G6 или B20 (например, G6-31, B20-4.1), как описано в публикации PCT WO2005/012359, публикации PCT WO2005/044853, содержание указанных заявок на патент прямо включено в настоящую заявку посредством отсылки. По поводу дополнительных антител, см. патенты США 7,060,269, 6,582,959, 6,703,020, 6,054,297, WO98/45332, WO 96/30046, WO94/10202, EP 0666868B1, публикации заявок на патент США 2006/009360, 2005/0186208, 2003/0206899, 2003/0190317, 2003/0203409 и 2005/0112126; а также Popkov et al, Journal of Immunological Methods 288: 149-164 (2004). Другие антитела включают антитела, которые связываются с функциональным эпитопом на человеческом VEGF, включающим остатки F17, M18, D19, Y21, Y25, Q89, 191, K101, E103 и C104 или, в альтернативе, включающим остатки F17, Y21, Q22, Y25, D63, 183 и Q89.
Примеры ингибиторов c-MET
В одном варианте осуществления комбинация, описанная в настоящей заявке, включает ингибитор c-MET. В некоторых вариантах осуществления комбинация применяется для лечения рака, например, рака, описанного в настоящей заявке, например, солидной опухоли (например, немелкоклеточного рака легкого, рака поджелудочной железы, рака печени, рака щитовидной железы (например, анапластической карциномы щитовидной железы), опухоли головного мозга (например, глиобластомы), рака почки (например, почечно-клеточной карциномы) или рака головы и шеи (например, плоскоклеточной карциномы головы и шеи). В некоторых вариантах осуществления рак является раком печени, например, гепатоцеллюлярной карциномой (ГЦК) (например, c-MET-экспрессирующей ГЦК).
В некоторых вариантах осуществления ингибитором c-MET является Соединение A17 или соединение, описанное в патентах США 7,767,675 и 8,420,645). c-MET, рецепторная тирозинкиназа, повышенно экспрессирующаяся или мутировавшая во многих типах опухолевых клеток, играет важную роль в пролиферации, выживании, инвазии, метастазе опухолевых клеток и опухолевом ангиогенезе. Ингибирование c-MET может вызывать апоптоз опухолевых клеток, повышенно экспрессирующих белок c-MET или экспрессирующих конститутивно активированный белок c-MET.
В некоторых вариантах осуществления ингибитором c-MET является JNJ-38877605. JNJ-38877605 представляет собой обладающий биодоступностью при приеме внутрь низкомолекулярный ингибитор c-Met. JNJ-38877605 селективно связывается с c-MET, вызывая ингибирование фосфорилирования c-MET и прерывание путей передачи сигнала c-Met.
В некоторых вариантах осуществления ингибитором c-MET является AMG 208. AMG 208 представляет собой селективный низкомолекулярный ингибитор c-MET. AMG 208 ингибирует лиганд-зависимую и лиганд-независимую активацию c-MET, ингибируя его тирозинкиназную активность, что может вызывать ингибирование роста клеток в опухолях, которые повышенно экспрессируют c-Met.
В некоторых вариантах осуществления ингибитором c-MET является AMG 337. AMG 337 представляет собой биодоступный при приеме внутрь ингибитор c-Met. AMG 337 селективно связывается с c-MET, вызывая прерывание путей передачи сигнала c-MET.
В некоторых вариантах осуществления ингибитором c-MET является LY2801653. LY2801653 представляет собой биодоступный при приеме внутрь низкомолекулярный ингибитор c-Met. LY2801653 селективно связывается с c-MET, вызывая ингибирование фосфорилирования c-MET и прерывание путей передачи сигнала c-Met.
В некоторых вариантах осуществления ингибитором c-Met является MSC2156119J. MSC2156119J представляет собой биодоступный при приеме внутрь ингибитор c-Met. MSC2156119J селективно связывается с c-MET, что приводит к ингибированию фосфорилирования c-MET и прерыванию путей c-Met-опосредованной передачи сигнала.
В некоторых вариантах осуществления ингибитором c-MET является капматиниб. Капматиниб также известен как INCB028060. Капматиниб представляет собой биодоступный при приеме внутрь ингибитор c-MET. Капматиниб селективно связывается с c-Met, вызывая ингибирование фосфорилирования c-Met и прерывание путей передачи сигнала c-Met.
В некоторых вариантах осуществления ингибитором c-MET является кризотиниб. Кризотиниб также известен как PF-02341066. Кризотиниб представляет собой биодоступный при приеме внутрь ингибитор киназы рецепторной тирозинкиназы анапластической лимфомы (ALK) и c-Met/рецептора фактора роста гепатоцитов (HGFR) на основе аминопиридина. Кризотиниб АТФ-конкурентно связывается и ингибирует ALK киназу и слитые белки ALK. Кроме того, кризотиниб ингибирует c-Met киназу и прерывает сигнальный путь c-Met. В целом данное средство ингибирует рост опухолевых клеток.
В некоторых вариантах осуществления ингибитором c-MET является голватиниб. Голватиниб представляет собой биодоступный при приеме внутрь двойной ингибитор c-MET киназы и VEGFR-2 с потенциальной противоопухолевой активностью. Голватиниб связывается и ингибирует активность c-MET и VEGFR-2, что может ингибировать рост опухолевых клеток и выживание опухолевых клеток, которые повышенно экспрессируют такие рецепторные тирозинкиназы.
В некоторых вариантах осуществления ингибитором c-MET является тивантиниб. Тивантиниб также известен как ARQ 197. Тивантиниб представляет собой биодоступный при приеме внутрь низкомолекулярный ингибитор c-MET. Тивантиниб связывается с белком c-MET и блокирует пути передачи сигнала c-Met, что может вызвать апоптоз опухолевых клеток, повышенно экспрессирующих белок c-MET или экспрессирующих конститутивно активированый белок c-Met.
Примеры ингибиторов TGFb
В одном варианте осуществления комбинация, описанная в настоящей заявке, включает ингибитор трансформирующего фактора роста бета (TGF-β). В некоторых вариантах осуществления комбинация применяется для лечения рака, например, рака, описанного в настоящей заявке, например, солидной опухоли (например, рака головного мозга (например, глиомы), меланомы, рака почки (например, почечно-клеточной карциномы), плевральной злокачественной мезотелиомы (например, рецидивирующей плевральной злокачественной мезотелиомы) или рака молочной железы (например, метастатического рака молочной железы)). В некоторых вариантах осуществления рак выбран из рака толстой и прямой кишки (например, микросателлитно стабильного рака толстой и прямой кишки (MSS CRC), рака печени (например, гепатоцеллюлярной карциномы), рака легкого (например, немелкоклеточного рака легкого (НМРЛ)), рака молочной железы (например, трижды негативного рака молочной железы (ТНРМЖ)), TGFb-экспрессирующего рака, рака поджелудочной железы, рака предстательной железы или рака почки (например, почечно-клеточной карциномы).
TGF-β относится к большому семейству структурно подобных цитокинов, включающих, например, костные морфогенетические белки (BMP), факторы роста и индукторы дифференцировки, активины и ингибины. В некоторых вариантах осуществления ингибиторы TGF-β, описанные в настоящей заявке, могут связывать и/или ингибировать одну или более изоформ TGF-β (например, одни, два или все из TGF-β1, TGF-β2 или TGF-β3).
В нормальных условиях TGF-β поддерживает гомеостаз и ограничивает рост эпителиальных, эндотелиальных, нейронных и гемопоэтических линий клеток, например, путем индукции антипролиферативных и апоптотических ответов. Канонические и неканонические сигнальные пути участвуют в клеточных ответах на TGF-β. Активация канонического пути TGF-β/Smad может опосредовать антипролиферативные эффекты TGF-β. Неканонический путь TGF-β может активировать дополнительные внутриклеточные пути, например, митоген-активируемые протеинкиназы (MAPK), фосфатидилинозитол-3-киназы/протеинкиназы B, Rho-подобные ГТФ-азы (Tian et al. Cell Signal. 2011; 23(6):951-62; Blobe et al. N Engl J Med. 2000; 342(18):1350-8), модулируя, таким образом, эпителиально-мезенхимальный переход (EMT) и/или подвижность клеток.
Изменения сигнального пути TGF-β связаны с заболеваниями человека, например, онкологическими заболеваниями, сердечно-сосудистыми заболеваниями, фиброзом, репродуктивными нарушениями и заживлением ран. Без ограничения теорией, считается, что в некоторых вариантах осуществления, роль TGF-β при раке зависит от некоторых показателей при заболевании (например, стадии опухоли и генетического изменения) и/или клеточного контекста. Например, на поздних стадиях рака, TGF-β может модулировать опухолевый процесс, например, ускоряя рост опухоли (например, путем индукции EMT), блокируя противоопухолевые иммунные ответы, увеличивая связанный с опухолью фиброз или усиливая ангиогенез (Wakefield and Hill Nat Rev Cancer. 2013; 13(5):328-41). В некоторых вариантах осуществления комбинация, включающая ингибитор TGF-β, описанный в настоящей заявке, применяется для лечения рака на поздней стадии, метастатического рака или прогрессирующего рака.
Доклинические результаты указывают, что TGF-β играет важную роль в иммунной регуляции (Wojtowicz-Praga Invest New Drugs. 2003; 21(1):21-32; Yang et al. Trends Immunol. 2010; 31(6):220-7). TGF-β может понижать иммунный ответ хозяина посредством нескольких механизмов, например, изменения баланса T-хелперов к иммунному фенотипу Th2; ингибирование противоопухолевого ответа Th1 типа и макрофагов M1-типа; супрессии функций цитотоксических CD8+ Т-лимфоцитов (CTL), NK-лимфоцитов и дендритных клеток, образования CD4+CD25+ T-регуляторных клеток; или активации макрофагов M2-типа с проопухолевой активностью, опосредованной секрецией иммуносупрессорных цитокинов (например, IL10 или VEGF), провоспалительных цитокинов (например, IL6, ФНОα или IL1) и образования активных форм кислорода (ROS) с генотоксической активностью (Yang et al. Trends Immunol. 2010; 31(6):220-7; Truty and Urrutia Pancreatology. 2007; 7(5-6):423-35; Achyut et al Gastroenterology. 2011; 141(4):1167-78).
В некоторых вариантах осуществления ингибитором TGF-β является фрезолимумаб (Номер CAS: 948564-73-6). Фрезолимумаб также известен как GC1008. Фрезолимумаб представляет собой человеческое моноклональное антитело, которое связывается и ингибирует изоформы TGF-бета 1, 2 и 3.
Тяжелая цепь фрезолимумаба имеет следующую аминокислотную последовательность: QVQLVQSGAEVKKPGSSVKVSCKASGYTFSSNVISWVRQAPGQGLEWMGGVIPIVDIANYAQRFKGRVTITADESTSTTYMELSSLRSEDTAVYYCASTLGLVLDAMDYWGQGTLVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVESKYGPPCPSCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK (SEQ ID NO: 238). Легкая цепь фрезолимумаба имеет следующую аминокислотную последовательность:
ETVLTQSPGTLSLSPGERATLSCRASQSLGSSYLAWYQQKPGQAPRLLIYGASSRAPGIPDRFSGSGSGTDFTLTISRLEPEDFAVYYCQQYADSPITFGQGTRLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO: 239).
Фрезолимумаб раскрыт, например, в WO 2006/086469, US 8,383,780 и US 8,591,901.
В некоторых вариантах осуществления ингибитором TGF-β является XOMA 089. XOMA 089 также известен как XPA.42.089. XOMA 089 представляет собой полностью человеческое моноклональное антитело, которое специфично связывает и нейтрализует лиганды TGF-бета 1 и 2.
Вариабельная область тяжелой цепи XOMA 089 имеет следующую аминокислотную последовательность:
QVQLVQSGAEVKKPGSSVKVSCKASGGTFSSYAISWVRQAPGQGLEWMGGIIPIFGTANYAQKFQGRVTITADESTSTAYMELSSLRSEDTAVYYCARGLWEVRALPSVYWGQGTLVTVSS (SEQ ID NO: 240) (раскрыта как SEQ ID NO: 6 в WO 2012/167143). Вариабельная область легкой цепи XOMA 089 имеет следующую аминокислотную последовательность:
SYELTQPPSVSVAPGQTARITCGANDIGSKSVHWYQQKAGQAPVLVVSEDIIRPSGIPERISGSNSGNTATLTISRVEAGDEADYYCQVWDRDSDQYVFGTGTKVTVLG (SEQ ID NO: 241) (раскрыта как SEQ ID NO: 8 в WO 2012/167143).
XOMA 089 с высокой аффинностью связывается с изоформами человеческого TGF-β. Обычно XOMA 089 связывается с высокой аффинностью с TGF-β1 и TGF-β2, и, в меньшей степени, с TGF-β3. В анализах BiaCore, KD XOMA 089 на человеческом TGF-β составляет 14,6 пМ для TGF-β1, 67,3 пМ для TGF-β2 и 948 пМ для TGF-β3. Принимая во внимание высокую аффинность связывания со всеми тремя изоформами TGF-β, в некоторых вариантах осуществления XOMA 089, как ожидают, будет связываться с TGF-β1, 2 и 3 в дозе XOMA 089, описанной в настоящей заявке. XOMA 089 перекрестно реагирует с TGF-β грызунов и яванского макака и демонстрирует функциональную активность in vitro и in vivo, что делает грызунов и яванского макака подходящими видами для токсикологических исследований.
В некоторых вариантах осуществления комбинация включает ингибитор PD-1 (например, молекулу антитела против PD-1, описанного в настоящей заявке) и ингибитор TGF-β (например, ингибитор TGF-β, описанный в настоящей заявке).
Без ограничения теорией, считается, что в некоторых вариантах осуществления устойчивость к PD-1 иммунотерапии связана с присутствием транскрипционной сигнатуры, которая включает, например, гены, связанные с сигнализацией TGF-β и TGF-β-зависимыми процессами, например, заживлением ран или ангиогенезом (Hugo et al. Cell. 2016; 165(1):35-44). В некоторых вариантах осуществления блокада TGF-β расширяет терапевтическое окно терапии, которая ингибирует ось PD-1/PD-L1. Ингибиторы TGF-β могут влиять на клиническую эффективность PD-1 иммунотерапии, например, путем модулирования микроокружения опухоли, например, васкулогенеза, фиброза, или факторов, которые влияют на рекрутинг эффекторных Т-клеток (Yang et al. Trends Immunol. 2010; 31(6):220-7; Wakefield and Hill Nat Rev Cancer. 2013; 13(5):328-41; Truty and Urrutia Pancreatology. 2007; 7(5-6):423-35).
Без ограничения теорией, также считается, что в некоторых вариантах осуществления ряд элементов цикла противоопухолевого иммунитета экспрессируют и PD-1, и рецепторы TGF-β, при этом PD-1 и рецепторы TGF-β, вероятно, усиливают слабо представленные клеточные сигналы. Например, в моделях аутохтонного рака предстательной железы на мышах использование доминантно-негативной формы TGFBRII или блокирование продукции TGF-β в Т-клетах задерживает рост опухоли (Donkor et al. Immunity. 2011; 35(1):123-34; Diener et al. Lab Invest. 2009; 89(2):142-51). Исследования трансгенной аденокарциномы предстательной железы мыши (TRAMP) на мышах показали, что блокирование сигнализации TGF-β в адоптивно перенесенных Т-клетках увеличивает их персистирование и противоопухолевую активность (Chou et al. J Immunol. 2012; 189(8):3936-46). Противоопухолевая активность перенесенных Т-клеток может постепенно уменьшаться, частично из-за апрегуляции PD-1 в инфильтрирующих опухоль лимфоцитах, что подтверждает эффективность комбинации ингибирования PD-1 и TGF-β, как описано в настоящей заявке. Применение нейтрализирующих антител против PD-1 или против TGF-β также может влиять на Treg-клетки, с учетом их высокого уровня экспрессии PD-1 и их чувствительности к стимуляции TGF-β (Riella et al. Am J Transplant. 2012; 12 (10):2575-87), что подтверждает эффективность комбинации ингибирования PD-1 и TGF-β для лечения рака, например, посредством увеличения модуляции дифференцировки и функции Treg-клеток.
Без ограничения теорией, считается, что раковые опухоли могут использовать TGF-β, чтобы уклоняться от иммунного надзора, что способствует росту опухоли и метастатическому прогрессированию. Например, в некоторых прогрессирующих раковых опухолях высокий уровень TGF-β связан с агрессивностью опухоли и неблагоприятным прогнозом, при этом путь TGF-β может способствовать одному или более из подвижности раковых клеток, инвазии, EMT или фенотипа стволовых клеток. Иммунная регуляция, опосредованная раковыми клетками и популяциями лейкоцитов (например, посредством множества экспрессированных на клетках или секретируемых молекул, например, IL-10 или TGF-β), может ограничивать ответ на ингибиторы контрольных точек в качестве монотерапии у некоторых пациентов. В некоторых вариантах осуществления комбинированное ингибирование TGF-β с ингибитором контрольной точки (например, ингибитором PD-1, описанным в настоящей заявке) применяется для лечения рака, который не отвечает или плохо отвечает на монотерапию ингибитором контрольной точки (например, антителом против PD-1), например, рака поджелудочной железы или рака толстой и прямой кишки (например, микросателлитно стабильного рака толстой и прямой кишки (MSS-CRC)). В других вариантах осуществления комбинированное ингибирование TGF-β с ингибитором контрольной точки (например, ингибитором PD-1, описанным в настоящей заявке) применяется для лечения рака, который демонстрирует высокий уровень инфильтрации эффекторных Т-клеток, например, рака легкого (например, немелкоклеточного рака легкого), рака молочной железы (например, трижды негативного рака молочной железы), рака печени (например, гепатоцеллюлярной карциномы), рака предстательной железы или рака почки (например, светлоклеточной почечно-клеточной карциномы). В некоторых вариантах осуществления комбинация ингибитора TGF-β и ингибитора PD-1 приводит к синергическому действию.
В одном варианте осуществления ингибитор TGF-β, XOMA 089, или соединение, раскрытое в публикации PCT WO 2012/167143, вводят в дозе от 0,1 мг/кг до 20 мг/кг, например, от 0,1 мг/кг до 15 мг/кг, от 0,1 мг/кг до 12 мг/кг, от 0,3 мг/кг до 6 мг/кг, между 1 мг/кг и 3 мг/кг, от 0,1 мг/кг до 1 мг/кг, от 0,1 мг/кг до 0,5 мг/кг, от 0,1 мг/кг до 0,3 мг/кг, от 0,3 мг/кг до 3 мг/кг, от 0,3 мг/кг до 1 мг/кг, от 3 мг/кг до 6 мг/кг или от 6 мг/кг до 12 мг/кг, например, в дозе приблизительно 0,1 мг/кг, 0,3 мг/кг, 0,5 мг/кг, 1 мг/кг, 3 мг/кг, 6 мг/кг, 12 мг/кг или 15 мг/кг, например, один раз в неделю, один раз в две недели, один раз в три недели, один раз в четыре недели или один раз в шесть недель.
В одном варианте осуществления ингибитор TGF-β, XOMA 089, или соединение, раскрытое в публикации PCT WO 2012/167143, вводят в дозе от 0,1 мг/кг до 15 мг/кг (например, от 0,3 мг/кг до 12 мг/кг или от 1 мг/кг до 6 мг, например, приблизительно 0,1 мг/кг, 0,3 мг/кг, 1 мг/кг, 3 мг/кг, 6 мг/кг, 12 мг/кг или 15 мг/кг), например, один раз в три недели. Например, ингибитор TGF-β, XOMA 089, или соединение, раскрытое в публикации PCT WO 2012/167143, могут вводить в дозе от 0,1 мг/кг до 1 мг/кг (например, от 0,1 мг/кг до 1 мг/кг, например, 0,3 мг/кг), например, один раз в три недели. В одном варианте осуществления, ингибитор TGF-β, XOMA 089 или соединение, раскрытое в публикации PCT WO 2012/167143, вводят внутривенно.
В одном варианте осуществления комбинация включает ингибитор TGF-β, XOMA 089, или соединение, раскрытое в публикации PCT WO 2012/167143, и ингибитор PD-1 (например, антитело против PD-1, описанное в настоящей заявке).
В одном варианте осуществления ингибитор TGF-β, XOMA 089, или соединение, раскрытое в публикации PCT WO 2012/167143, вводят в дозе от 0,1 мг/кг до 15 мг/кг (например, от 0,3 мг/кг до 12 мг/кг или от 1 мг/кг до 6 мг, например, приблизительно 0,1 мг/кг, 0,3 мг/кг, 1 мг/кг, 3 мг/кг, 6 мг/кг, 12 мг/кг или 15 мг/кг), например, один раз в три недели, например, внутривенно, и ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе от 50 мг до 500 мг (например, от 100 мг до 400 мг, например, в дозе приблизительно 100 мг, 200 мг, 300 мг или 400 мг), например, один раз в 3 недели или один раз в 4 недели, например, путем внутривенной инфузии. В некоторых вариантах осуществления ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе от 100 мг до 300 мг (например, в дозе приблизительно 100 мг, 200 мг или 300 мг), например, один раз в 3 недели, например, путем внутривенной инфузии.
В некоторых вариантах осуществления ингибитор TGF-β, XOMA 089, или соединение, раскрытое в публикации PCT WO 2012/167143, вводят в дозе приблизительно 0,1 мг/кг или 0,3 мг/кг, например, один раз в 3 недели, например, путем внутривенной инфузии, и ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе приблизительно 100 мг, например, один раз в 3 недели, например, путем внутривенной инфузии. В некоторых вариантах осуществления ингибитор TGF-β, XOMA 089, или соединение, раскрытое в публикации PCT WO 2012/167143, вводят в дозе приблизительно 0,3 мг/кг, например, один раз в 3 недели, например, путем внутривенной инфузии, и ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе приблизительно 100 мг или 300 мг, например, один раз в 3 недели, например, путем внутривенной инфузии. В некоторых вариантах осуществления ингибитор TGF-β, XOMA 089, или соединение, раскрытое в Публикации PCT WO 2012/167143, вводят в дозе приблизительно 1 мг/кг, 3 мг/кг, 6 мг/кг, 12 мг/кг или 15 мг/кг, например, один раз в 3 недели, например, путем внутривенной инфузии, и ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе приблизительно 300 мг, например, один раз в 3 недели, например, путем внутривенной инфузии.
В некоторых вариантах осуществления ингибитор TGF-β, XOMA 089, или соединение, раскрытое в публикации PCT WO 2012/167143, вводят в дозе между 0,1 мг и 0,2 мг (например, приблизительно 0,1 мг/кг), например, один раз в три недели, например, путем внутривенной инфузии, и ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе от 50 мг до 200 мг (например, приблизительно 100 мг), например, один раз в три недели, например, путем внутривенной инфузии.
В некоторых вариантах осуществления ингибитор TGF-β, XOMA 089, или соединение, раскрытое в публикации PCT WO 2012/167143, вводят в дозе между 0,2 мг и 0,5 мг (например, приблизительно 0,3 мг/кг), например, один раз в три недели, например, путем внутривенной инфузии, и ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе от 50 мг до 200 мг (например, приблизительно 100 мг), например, один раз в три недели, например, путем внутривенной инфузии.
В некоторых вариантах осуществления ингибитор TGF-β, XOMA 089, или соединение, раскрытое в публикации PCT WO 2012/167143, вводят в дозе между 0,2 мг и 0,5 мг (например, приблизительно 0,3 мг/кг), например, один раз в три недели, например, путем внутривенной инфузии, и ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе от 200 мг до 400 мг (например, приблизительно 300 мг), например, один раз в три недели, например, путем внутривенной инфузии.
В некоторых вариантах осуществления ингибитор TGF-β, XOMA 089, или соединение, раскрытое в публикации PCT WO 2012/167143, вводят в дозе от 0,5 мг до 2 мг (например, приблизительно 1 мг/кг), например, один раз в три недели, например, путем внутривенной инфузии, и ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе от 200 мг и 400 мг (например, приблизительно 300 мг), например, один раз в три недели, например, путем внутривенной инфузии.
В некоторых вариантах осуществления ингибитор TGF-β, XOMA 089, или соединение, раскрытое в публикации PCT WO 2012/167143, вводят в дозе от 2 мг до 5 мг (например, приблизительно 3 мг/кг), например, один раз в три недели, например, путем внутривенной инфузии, и ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе от 200 мг и 400 мг (например, приблизительно 300 мг), например, один раз в три недели, например, путем внутривенной инфузии.
В некоторых вариантах осуществления ингибитор TGF-β, XOMA 089, или соединение, раскрытое в публикации PCT WO 2012/167143, вводят в дозе между 5 мг и 10 мг (например, приблизительно 6 мг/кг), например, один раз в три недели, например, путем внутривенной инфузии, и ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе от 200 мг и 400 мг (например, приблизительно 300 мг), например, один раз в три недели, например, путем внутривенной инфузии.
В некоторых вариантах осуществления ингибитор TGF-β, XOMA 089, или соединение, раскрытое в публикации PCT WO 2012/167143, вводят в дозе от 10 мг до 15 мг (например, приблизительно 12 мг/кг), например, один раз в три недели, например, путем внутривенной инфузии, и ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе от 200 мг и 400 мг (например, приблизительно 300 мг), например, один раз в три недели, например, путем внутривенной инфузии.
В некоторых вариантах осуществления ингибитор TGF-β, XOMA 089, или соединение, раскрытое в публикации PCT WO 2012/167143, вводят в дозе от 10 мг до 20 мг (например, приблизительно 15 мг/кг), например, один раз в три недели, например, путем внутривенной инфузии, и ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе от 200 мг и 400 мг (например, приблизительно 300 мг), например, один раз в три недели, например, путем внутривенной инфузии.
В некоторых вариантах осуществления, ингибитор TGF-β, XOMA 089, или соединение, раскрытое в публикации PCT WO 2012/167143, вводят до введения ингибитора PD-1 (например, молекулы антитела против PD-1). В других вариантах осуществления ингибитор TGF-β, XOMA 089, или соединение, раскрытое в публикации PCT WO 2012/167143, вводят после введения ингибитора PD-1 (например, молекулы антитела против PD-1). В некоторых вариантах осуществления ингибитор TGF-β, XOMA 089, или соединение, раскрытое в публикации PCT WO 2012/167143, и ингибитор PD-1 (например, молекулу антитела против PD-1) вводят отдельно, по меньшей мере с 30-минутным (например, по меньшей мере 1, 1,5 или 2 часа) перерывом между двумя указанными введениями.
В одном варианте осуществления ингибитор TGF-β, XOMA 089, или соединение, раскрытое в публикации PCT WO 2012/167143, применяют в комбинации с ингибитором PD-1 (например, молекулой антитела против PD-1) для лечения рака поджелудочной железы, рака толстой и прямой кишки (например, микросателлитно стабильного рака толстой и прямой кишки (MSS-CRC)), рака легкого (например, немелкоклеточного рака легкого), рака молочной железы (например, трижды негативного рака молочной железы), рака печени (например, гепатоцеллюлярной карциномы), рака предстательной железы или рака почки (например, светлоклеточной почечно-клеточной карциномы).
Примеры ингибиторов IDO/TDO
В одном варианте осуществления комбинация, описанная в настоящей заявке, включает ингибитор индоламин-2,3-диоксигеназы (IDO) и/или триптофан-2,3-диоксигеназы (TDO). В некоторых вариантах осуществления комбинация применяется для лечения рака, например, рака, описанного в настоящей заявке, например, солидной опухоли (например, меланомы, немелкоклеточного рака легкого, рака толстой кишки, плоскоклеточной карциномы головы и шеи, рака яичника, перитонеального рака, рака фаллопиевой трубы, рака молочной железы (например, метастатического или HER2-негативного рака молочной железы)), например, гемобластоза (например, лимфомы, например, неходжкинской лимфомы или лимфомы Ходжкина (например, диффузной В-крупноклеточной лимфомы (ДВККЛ))).
В некоторых вариантах осуществления ингибитор IDO/TDO выбран из (4E)-4-[(3-хлор-4-фторанилино)-нитрозометилиден]-1,2,5-оксадиазол-3-амина (также известного как INCB24360), индоксимода (1-метил-D-триптофана) или α-циклогексил-5H-имидазо[5,1-a]изоиндол-5-этанола (также известного как NLG919).
В некоторых вариантах осуществления ингибитором IDO/TDO является эпакадостат (Номер CAS: 1204669-58-8). Эпакадостат также известен как INCB24360 или INCB024360 (Incyte). Эпакадостат является мощным и селективным ингибитором индоламин-2,3-диоксигеназы (IDO1) с IC50 10 нМ, высокоселективным в отношении других родственных ферментов, таких как IDO2 или триптофан-2,3-диоксигеназа (TDO).
В некоторых вариантах осуществления ингибитором IDO/TDO является индоксимод (New Link Genetics). Индоксимод, D-изомер 1-метил-триптофана, является низкомолекулярным ингибитором пути индоламин-2,3-диоксигеназы (IDO), вводимым перорально, который блокирует механизмы, с помощью которых опухоли уклоняются от иммунно-опосредованного разрушения.
В некоторых вариантах осуществления ингибитором IDO/TDO является NLG919 (New Link Genetics). NLG919 является мощным ингибитором пути IDO (индоламин-(2,3)-диоксигеназы) с Ki/EC50 7 нМ/75 нМ в бесклеточных анализах.
В некоторых вариантах осуществления ингибитором IDO/TDO является F001287 (Flexus/BMS). F001287 является низкомолекулярным ингибитором индоламин-2,3-диоксигеназы 1 (IDO1).
Примеры антагонистов A2AR
В одном варианте осуществления комбинация, описанная в настоящей заявке, включает антагонист аденозиновых A2a-рецепторов (A2aR) (например, ингибитор пути A2aR, например, ингибитор аденозина, например, ингибитор A2aR или CD-73). В некоторых вариантах осуществления комбинация применяется для лечения рака, например, рака, описанного в настоящей заявке. В некоторых вариантах осуществления рак является раком легкого, например, немелкоклеточным раком легкого (НМРЛ).
В некоторых вариантах осуществления антагонистом A2aR является истрадефиллин (Номер CAS: 155270-99-8). Истрадефиллин также известен как KW-6002 или 8-[(E)-2-(3,4-диметоксифенил)винил]-1,3-диэтил-7-метил-3,7-дигидро-1H-пурин-2,6-дион. Истрадефиллин раскрыт, например, в LeWitt et al. (2008) Annals of Neurology 63 (3): 295-302.
В некоторых вариантах осуществления антагонистом A2aR является тозаденант (Biotie). Тозаденант также известен как SYN115 или 4-гидрокси-N-(4-метокси-7-морфолин-4-ил-1,3-бензотиазол-2-ил)-4-метилпиперидин-1-карбоксамид. Тозаденант блокирует водействие эндогенного аденозина на A2a-рецепторы, что приводит к потенцированию водействия допамина на D2-рецептор и ингибированию водействия глутамата на mGluR5-рецептор. В некоторых вариантах осуществления антагонистом A2aR является преладенант (Номер CAS: 377727-87-2). Преладенант также известен как SCH 420814 или 2-(2-фуранил)-7-[2-[4-[4-(2-метоксиэтокси)-фенил]-1-пиперазинил]этил]7H-пиразоло[4,3-e][1,2,4]триазоло[1,5-c]пиримидин-5-амин. Преладенант был разработан в качестве лекарственного средства, которое действовало как мощный и селективный антагонист аденозинового A2A-рецептора.
В некоторых вариантах осуществления антагонистом A2aR является випаденан. Випаденан также известен как BIIB014, V2006 или 3-[(4-амино-3-метилфенил)метил]-7-(фуран-2-ил)триазоло[4,5-d]пиримидин-5-амин. В некоторых вариантах осуществления антагонистом A2aR является PBF-509 (Palobiofarma). В некоторых вариантах осуществления антагонист A2aR, например PBF-509, вводят в суточной дозе приблизительно 80 мг, 160 мг или 240 мг.
Другие примеры антагонистов A2aR включают, например, ATL-444, MSX-3, SCH-58261, SCH-412,348, SCH-442,416, VER-6623, VER-6947, VER-7835, CGS-15943 или ZM-241,385.
В некоторых вариантах осуществления антагонистом A2aR является антагонист пути A2aR (например, ингибитор CD-73, например, антитело против CD73), MEDI9447. MEDI9447 представляет собой моноклональное антитело, специфичное к CD73. Направленное воздействие CD73 на внеклеточную продукцию аденозина может уменьшать иммуносупрессивное действие аденозина. MEDI9447, как сообщали, обладал рядом активностей, например, ингибировал эктонуклеотидазную активность CD73, устранял АМФ-опосредованную супрессию лимфоцитов и ингибировал рост сингенной опухоли. MEDI9447 может вызывать изменения в популяциях миелоидных и лимфоидных инфильтрирующих лейкоцитов в микроокружении опухоли. Такие изменения включают, например, увеличение количества CD8 эффекторных клеток и активированных макрофагов, а также уменьшение пропорций миелоидных супрессорных клеток (МСК) и регуляторных Т-лимфоцитов.
Примеры онколитических вирусов
В некоторых вариантах осуществления комбинация, как описано в настоящей заявке, включает онколитический вирус. В вариантах осуществления онколитические вирусы способны к селективной репликации и индукции апоптоза или замедлению роста раковой клетки. В некоторых случаях онколитические вирусы не оказывают никакого воздействия или оказывают минимальное воздействие на нераковые клетки. В некоторых вариантах осуществления комбинация применяется для лечения рака, например, рака, описанного в настоящей заявке. В некоторых вариантах осуществления рак является раком головного мозга, например, глиобластомой (GBM). Онколитический вирус включает, без ограничения перечисленным, онколитический аденовирус, онколитические вирусы простого герпеса, онколитический ретровирус, онколитический парвовирус, онколитический вирус коровьей оспы, онколитический вирус Синдбис, онколитический вирус гриппа или онколитический РНК-вирус (например, онколитический реовирус, онколитический вирус болезни Ньюкасла (NDV), онколитический вирус кори или онколитический вирус везикулярного стоматита (VSV)).
В некоторых вариантах осуществления онколитический вирус является рекомбинантным вирусом герпеса, например, вирусом простого герпеса (HSV), который включает ген, кодирующий ГМ-КСФ. Без ограничения теорией, считается, что в некоторых вариантах осуществления вставка гена ГМ-КСФ может усиливать противоопухолевый иммунный ответ, например, в результате рекрутинга и стимуляции дендритных клеток в области опухоли. Другие модификации могут быть введены в вирус, например, с целью ослабления вируса и/или увеличения селективности в отношении раковых клеток. В некоторых вариантах осуществления рекомбинантный вирус герпеса не имеет функционального гена ICP34.5, функционального гена ICP47 или не имеет обоих указанных генов. В некоторых вариантах осуществления делеция гена ICP34.5 предотвращает заражение вирусом HSV неопухолевых клеток или обеспечивает опухолеселективную репликацию. В некоторых вариантах осуществления делеция гена ICP47 обеспечивает или увеличивает презентацию антигена. Делеция ICP47 может вызывать повышение экспрессии гена HSV US11 и позволяет US11 экспрессироваться как предраннего и непозднего гена. Это может дополнительно увеличить степень вирусной репликации и онколизис опухолевых клеток. В некоторых вариантах осуществления HSV-1 штамма JS1 применяется, например, для улучшения способности киллинга опухолевых клеток по сравнению с другими штаммами HSV-1. В некоторых вариантах осуществления рекомбинантным вирусом герпеса является талимоген лагерпарепвек (T-VEC). T-VEC основан на вирусе простого герпеса 1 типа (HSV-1), модифицированном путем включения гена, который кодирует человеческий ГМ-КСФ. Талимоген лагерпарепвек описан, например, в публикации международной заявки WO 2014/036412. В некоторых вариантах осуществления комбинация применяется для лечения меланомы, рака головы и шеи, рака поджелудочной железы, рака молочной железы, рака толстой и прямой кишки или рака почки (например, почечно-клеточной карциномы). В некоторых вариантах осуществления, онколитическим вирусом является рекомбинантный вирус герпеса, например, нейроаттенуированный, репликационно ограниченный вирус простого герпеса 1 типа (HSV-1). В некоторых вариантах осуществления рекомбинантный вирус герпеса включает делецию гена ICP34.5. В некоторых вариантах осуществления рекомбинантный вирус герпеса не способен к репликации в неделящихся клетках. В некоторых вариантах осуществления рекомбинантный вирус герпеса сконструирован из штамма дикого типа 17. В некоторых вариантах осуществления рекомбинантным вирусом герпеса является HSV1716 (SEPREHVIR®). Без ограничения теорией, считается, что в некоторых вариантах осуществления при внутриопухолевой инъекции онколитический HSV1716 реплицируется и вызывает лизис делящихся клеток, таких как опухолевые клетки. HSV1716 описан, например, в публикации международной заявки WO 2003/068809. В некоторых вариантах осуществления комбинация применяется для лечения глиомы (например, низкодифференцированной глиомы), рака головы и шеи (например, плоскоклеточной карциномы головы и шеи), меланомы, рака печени (например, гепатоцеллюлярной карциномы), плевральной мезотелиомы или педиатрического рака не-ЦНС.
В некоторых вариантах осуществления онколитическим вирусом является вирус коровьей оспы. В некоторых вариантах осуществления вирус коровьей оспы включает ген, который активирует продукцию цитотоксических Т-клеток (например, ген TIR-домен-содержащего, адаптер-индуцирующего интерферона-β (TRIF)), ген, который уменьшает иммунную блокаду (например, ген гидроксипростагландин-дегидрогеназы 15-(NAD) (HPGD)) или оба указанных гена. В некоторых вариантах осуществления поверхность вируса коровьей оспы дегликозилирована. В некоторых вариантах осуществления вирус коровьей оспы обладает одним или более (например, двумя, тремя или всеми) свойствами, выбранных из лизиса раковой опухоли, иммунной адаптации, стимуляции Т-клеток или снятия иммунного ингибирования. В некоторых вариантах осуществления вирус коровьей оспы сконструирован из штамма Western Reserve. В некоторых вариантах осуществления онколитическим вирусом является WO-12 (Western Oncolytics Ltd., USA). В некоторых вариантах осуществления комбинация применяется для лечения солидной опухоли.
В некоторых вариантах осуществления онколитическим вирусом является рекомбинантный вирус полиомиелита, например, живой аттенуированный, непатогенный онколитический вирус, в котором участок внутренней посадки рибосомы (IRES) заменен гетерологичным IRES, например, для уменьшения или устранения нейровирулентности. В некоторых вариантах осуществления гетерологичный IRES представляет собой IRES из риновируса человека 2 типа (HRV2). В некоторых вариантах осуществления рекомбинантным вирусом полиомиелита является онколитический вирус полиомиелита PVS-RIPO (также известный как PVSRIPO). PVS-RIPO представляет собой генетически модифицированный непатогенный вариант перорального полиовируса Sabin 1 типа, в котором участок внутренней посадки рибосомы (IRES) заменен IRES из риновируса человека 2 типа (HRV2). Без ограничения теорией, считается, что в некоторых вариантах осуществления PVS-RIPO избирательно размножается в восприимчивых, ненейронных клетках (например, клетках мультиформной глиобластомы (GBM)) из-за присутствия гетерологичного HRV2 в этом рекомбинантном вирусе. При внутриопухолевом введении PVS-RIPO, полиовирус может селективно захватываться опухолевыми клетками и реплицироваться в них, экспрессируя CD155 (рецептор полиовируса, PVR или NECL5), что, в конечном счете, приводит к лизису опухолевой клетки. CD155, онкофетальная молекула клеточной адгезии и опухолевый антиген, эктопически экспрессируется в некоторых раковых опухолях, таких как GMB, и играет роль в миграции, инвазии и метастазе опухолевой клетки. PVS-RIPO описан, например, в публикации международной заявки WO 2014/081937. В некоторых вариантах осуществления комбинация применяется для лечения солидной опухоли, например, солидной опухоли, экспрессирующей CD155. В других вариантах осуществления комбинация применяется для лечения рака головного мозга, например, глиобластомы.
В некоторых вариантах осуществления онколитическим вирусом является вирус, например, рекомбинантный онколитический вирус, описанный в заявке US2010/0178684 A1, которая полностью включена в настоящую заявку посредством отсылки. В некоторых вариантах осуществления рекомбинантный онколитический вирус включает, или включает последовательность нуклеиновой кислоты (например, гетерологичную последовательность нуклеиновой кислоты), кодирующую, ингибитор иммунного или воспалительного ответа, например, как описано в US2010/0178684 A1, полностью включенной в настоящую заявку посредством отсылки. В вариантах осуществления рекомбинантный онколитический вирус, например, онколитический NDV, включает, или включает последовательность нуклеиновой кислоты, кодирующую, проапоптотический белок (например, апоптин), цитокин (например, ГМ-КСФ, КСФ, интерферон, интерлейкин-2 (IL-2), фактор некроза опухоли альфа), иммуноглобулин (например, антитело против ED-B фибронектина), опухолеассоциированный антиген, биспецифичный адапторный белок (например, биспецифичное антитело или фрагмент антитела, направленного против белка HN NDV и Т-клеточный костимулирующий рецептор, такой как CD3 или CD28; или слитый белок человеческого IL-2 и одноцепочечного антитела, направленного против белка HN NDV). См., например, публикацию Zamarin et al. Future Microbiol. 7.3(2012):347-67, полностью включенную в настоящую заявку посредством отсылки. В некоторых вариантах осуществления онколитическим вирусом является химерный онколитический NDV, описанный в US 8591881 B2, US 2012/0122185 A1 или US 2014/0271677 A1, которые полностью включены в настоящую заявку посредством отсылки.
В некоторых вариантах осуществления онколитический вирус включает условно репликативный аденовирус (CRAd), который создан для репликации исключительно в раковых клетках. См., например, Alemany et al. Nature Biotechnol. 18 (2000):723-27. В некоторых вариантах осуществления онколитический аденовирус включает аденовирус, описанный в Таблице 1 на странице 725 в публикации Alemany et al., полностью включенной в настоящую заявку посредством отсылки.
Примеры онколитических вирусов включают, без ограничения перечисленными, следующие:
Онколитический аденовирус группы B (ColoAd1) (PsiOxus Therapeutics Ltd.) (см., например, клиническое исследование NCT02053220);
ONCOS-102 (ранее называемый CGTG-102), который является аденовирусом, включающим гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ) (Oncos Therapeutics) (см., например, клиническое исследование NCT01598129);
VCN-01, который является генетически модифицированным онколитическим аденовирусом человека, кодирующим человеческую PH20 гиалуронидазу (VCN Biosciences, S.L.) (см., например, клинические исследования NCT02045602 и NCT02045589);
Условно репликативный аденовирус ICOVIR-5, который является вирусом, полученным из аденовируса человека дикого типа серотипа 5 (Had5), который был модифицирован для селективной репликации в раковых клетках с дерегулированным путем ретинобластомы/E2F (Institut Catala d'Oncologia) (см., например, клиническое исследование NCT01864759);
Celyvir, который включает костномозговые аутологичные мезенхимальные стволовые клетки (MSC), инфицированные онколитическим аденовирусом ICOVIR5 (Hospital Infantil Universitario Nino Jesus, Madrid, Spain/Ramon Alemany) (см., например, клиническое исследование NCT01844661);
CG0070, который является условно репликативным онколитическим аденовирусом серотипа 5 (Ad5), в котором человеческий промотор E2F-1 регулирует экспрессию существенных вирусных генов E1a, ограничивая, таким образом, вирусную репликацию и цитотоксичность дефектными по пути Rb опухолевыми клетками (Cold Genesys, Inc.) (см., например, клиническое исследование NCT02143804); или
DNX-2401 (ранее называемый Delta-24-RGD), который является аденовирусом, сконструированным для селективной репликации в клетках с дефицитом пути ретинобластомы (Rb) и более эффективного заражения клеток, которые экспрессируют некоторые RGD-связывающие интегрины (Clinica Universidad de Navarra, Universidad de Navarra/DNAtrix, Inc.) (см., например, клиническое исследование NCT01956734).
В некоторых вариантах осуществления онколитический вирус, описанный в настоящей заявке, вводят путем инъекции, например, подкожной, внутриартериальной, внутривенной, внутримышечной, интратекальной или внутрибрюшинной инъекции. В вариантах осуществления онколитический вирус, описанный в настоящей заявке, вводят интратуморально, трансдермально, трансмукозально, перорально, интраназально или путем пульмонального введения.
Примеры вакцин, например, скаффолд-вакцин
В одном варианте осуществления комбинация, описанная в настоящей заявке, включает вакцину, например, скаффолд-вакцину. В некоторых вариантах осуществления комбинация применяется для лечения рака, например, рака, описанного в настоящей заявке.
Вакцины против рака раскрыты, например, в публикациях PCT WO 2007/070660 и WO 2012/167230, EP 1960009 B1, патентах США US 8,067,237 и US 8,932,583, и публикации US 2011/0020216. Компоненты, которые могут применяться в вакцинах против рака (например, имплантируемые скаффолд-материалы) раскрыты, например, в публикациях PCT WO 2009/102465 и WO 2013/106852. Способы, которые могут применяться для введения вакцин против рака, раскрыты, например, в публикациях PCT WO 2013/158673, WO 2012/048165 и WO 2012/149358.
В некоторых вариантах осуществления вакцина против рака включает макропористый скаффолд,, включающий: (i) клетки или рекрутирующую клетки композицию, и (ii) активирующий сигнал, способный индуцировать или стимулировать миграцию клеток, и (iii) биоактивную композицию, нанесенную или включенную на/в скаффолд, которая вызывает модификацию клеток, рекрутируемых в скаффолд. Миграцию модифицированных клеток могут обеспечивать открытые, соединенные между собой, макропоры и активирующий сигнал.
В некоторых вариантах осуществления вакцина против рака вызывает эндогенный иммунный ответ против раковой мишени при введении пористых скаффолдов, несущих рекрутирующую композицию и композицию антигена-мишени, где эндогенная антигенпрезентирующая клетка рекрутируется в скаффолд с последующим контактом с антигеном, и где указанная клетка остается, пока активирующий сигнал не вызывает выход клетки в ткань лимфатического узла вне скаффолда, стимулируя, таким образом, эндогенный иммунный ответ против указанной раковой мишени.
В некоторых вариантах осуществления вакцина против рака используется, чтобы удаления клетки-мишени из организма млекопитающего с применением скаффолд-композиции.
В некоторых вариантах осуществления вакцина против рака in situ получена посредством рекрутинга раковых клеток к имплантированным скаффолдам и разрушения клеток с применением цитотоксического средства.
В некоторых вариантах осуществления цитозин-гуанозиновый олигонуклеотид (CpG-ODN) применяется в качестве компонента скаффолда, который может эффективно перепрограммировать и активировать дендритные клетки, рекрутированные к скаффолду, и вызывать эффективный противоопухолевый ответ.
В некоторых вариантах осуществления полиинозин-полицитидиловая кислота (поли-I:C) и/или CpG ODN применяются для синергического воздействия на ингибирование опухоли.
В некоторых вариантах осуществления пористые палочки, включающие соединение, рекрутирующее иммунные клетки (например, ГМ-КСФ), и соединение, активирующее иммунные клетки (например, CpG ODN), и, необязательно, включающие антиген, такой как лизат опухоли, применяются, например, для индукции иммунного ответа против вакцинного антигена. В некоторых вариантах осуществления поры, которые способствуют рекрутингу или выходу клеток, формируются in situ в гидрогелях после инъекции гидрогеля. В некоторых вариантах осуществления для введения применяют инъекционный пористый гидрогелевый полимер с памятью формы.
В других вариантах осуществления комбинации, раскрытые в настоящей заявке, включают вакцину против рака или против опухоли. Неограничивающие примеры вакцин против опухоли, которые могут применяться, включает пептиды антигенов меланомы, такие как пептиды gp100, антигены MAGE, Trp-2, MART1 и/или тирозиназы, опухолевые клетки, трансфицированные для экспрессии цитокина ГМ-КСФ, вакцины на основе ДНК, вакцины на основе РНК и вакцины на основе вирусной трансдукции. Вакцина против рака может быть профилактической или терапевтической.
Было разработано множество экспериментальных стратегий вакцинации против опухолей (см. Rosenberg, S., 2000, Development of Cancer Vaccines, ASCO Educational Book Spring: 60-62; Logothetis, C., 2000, ASCO Educational Book Spring: 300-302; Khayat, D. 2000, ASCO Educational Book Spring: 414-428; Foon, K. 2000, ASCO Educational Book Spring: 730-738; также см. Restifo, N. and Sznol, M., Cancer Vaccines, гл. 61, стр. 3023-3043, в DeVita, V. et al. (eds.), 1997, Cancer: Principles and Practice of Oncology. Fifth Edition). Согласно одной из этих стратегий вакцину получают при использовании аутологичных или аллогенных опухолевых клеток. Эти клеточные вакцины, как было показано, являлись наиболее эффективными при трансдукции опухолевых клеток с экспрессией ГМ-КСФ. ГМ-КСФ, как было показано, являлся мощным активатором презентации антигена для противоопухолевой вакцинации (Dranoff et al. (1993) Proc. Natl. Acad. Sci. U.S.A. 90: 3539-43).
Комбинации, раскрытые в настоящей заявке, например, блокада PD-1, могут применяться в сочетании с набором рекомбинантных белков и/или пептидов, экспрессируемых в опухоли, с целью получения иммунного ответа против этих белов. Такие белки обычно рассматриваются иммунной системой как свои антигены, и поэтому она толерантна по отношению к ним. Опухолевый антиген может также включать белок теломеразу, которая требуется для синтеза теломер хромосом и которая экспрессируется более чем в 85% человеческих раковых опухолей и лишь в ограниченном числе соматических тканей (Kim, N et al. (1994) Science 266: 2011-2013). (Эти соматические ткани могут быть защищены от иммунной атаки различными способами). Опухолевый антиген также может быть "неоантигенами", экспрессируемыми в раковых клетках в результате соматических мутаций, которые изменяют последовательность белка или приводят к образованию слитых белков из двух неродственных последовательностей (например, bcr-abl в филадельфийской хромосоме), или идиотипом из В-клеточных опухолей.
Другие вакцины против опухолей могут включать белки из вирусов, ассоциированных с различными формами рака у человека, таких как вирусы папилломы человека (ВПЧ), вирусы гепатита (HBV и HCV), герпесвирус саркомы Капоши (KHSV) и вирус Эпштейна-Барр (EBV). Другой формой опухолеспецифического антигена, который может применяться в сочетании с блокадой PD-1, являются очищенные белки теплового шока (HSP), выделенные непосредственно из опухолевой ткани. Такие белки теплового шока содержат фрагменты белков из опухолевых клеток, при этом HSP обладают высокой эффективностью при доставке антигенпрезентирующих клеток для индукции противоопухолевого иммунитета (Suot, R & Srivastava, P (1995) Science 269:1585-1588; Tamura, Y. et al. (1997) Science 278:117-120).
Дендритные клетки (ДК) являются мощными антигенпрезентирующими клетками, которые могут применяться для примирования антигенспецифичных ответов. Дендритные клетки могут быть получены ex vivo и нагружены различными белковыми и пептидными антигенами, а также экстрактами опухолевых клеток (Nestle, F. et al. (1998) Nature Medicine 4:328-332). ДК также могут быть трансдуцированы генетическими способами с целью экспрессии, в том числе, и таких опухолевых антигенов. ДК также подвергали слиянию непосредственно с опухолевыми клетками в целях иммунизации (Kugler, A. Et al. (2000) Nature Medicine 6:332-336). В качестве способа вакцинации иммунизация ДК может быть эффективной в комбинации с другим средством, например, блокадой PD-1, для активации более мощных противоопухолевых ответов.
Примеры биспецифичных активаторов Т-клеток
В одном варианте осуществления комбинация, описанная в настоящей заявке, включает биспецифичный активатор Т-клеток. В некоторых вариантах осуществления комбинация применяется для лечения рака, например, рака, описанного в настоящей заявке, например, солидной опухоли (например, рака желудочно-кишечного тракта, меланомы или рака легкого) или гемобластоза (например, лимфомы (например, неходжкинской лимфомы) или лейкоза (например, острого лимфообластного лейкоза)).
Биспецифичные активаторы Т-клеток (BiTE®) представляют собой класс искусственных биспецифичных моноклональных антител, которые могут направлять иммунную систему хозяина, например, цитотоксическую активность Т-клеток, против раковых клеток. Биспецифичные активаторы Т-клеток могут формировать связь между Т-клетками и опухолевыми клетками, что заставляет Т-клетки проявлять цитотоксическую активность в отношении опухолевых клеток, продуцируя такие белки как перфорин и гранзимы, независимо от присутствия молекул MHC I или костимулирующих молекул. Такие белки проникают в опухолевые клетки и инициируют апоптоз клеток. Эта активность воспроизводит физиологические процессы, наблюдаемые во время атак опухолевых клеток Т-клетками.
В некоторых вариантах осуществления биспецифичным активатором Т-клеток является слитый белок, включающий два одноцепочечных вариабельных фрагмента (scFv) разных антител. В некоторых вариантах осуществления один из scFv-фрагментов связывается с Т-клетками, например, через рецептор CD3, а другой связывается с опухолевой клеткой, например, через опухолеспецифичную молекулу.
В некоторых вариантах осуществления биспецифичным активатором Т-клеток является молекула биспецифичного антитела NKG2A и CD138 или молекула биспецифичного антитела CD3 и TCR. В некоторых вариантах осуществления биспецифичным активатором Т-клеток является молекула биспецифичного антитела, которая связывается с CD3 и опухолевым антигеном (например, EGFR, PSCA, PSMA, EpCAM, HER2, помимо прочего).
В некоторых вариантах осуществления биспецифичным активатором Т-клеток является блинатумомаб (Номер CAS: 853426-35-4). Блинатумомаб также известен как MT103. Блинатумомаб специфично воздействует на сайт CD3 в случае Т-клеток и сайт CD19 в случае В-клеток.
В некоторых вариантах осуществления биспецифичным активатором Т-клеток является MT110. MT110 представляет собой одноцепочечное антитело, которое направленно взаимодействует с EpCAM и CD3. MT110 раскрыт, например, в Amann et al. J Immunother. 2009;32(5):452-64.
В некоторых вариантах осуществления биспецифичный активатор Т-клеток направленно воздействует на меланома-ассоциированный хондроитинсульфат протеогликан (MCSP). В некоторых вариантах осуществления биспецифичный активатор Т-клеток направленно воздействует на CD33. В некоторых вариантах осуществления биспецифичный активатор Т-клеток включает трастузумаб (направленно взаимодействующий с HER2/neu), цетуксимаб или панитумумаб (оба направленно взаимодействуют с рецептором EGF), их функциональный фрагмент. В некоторых вариантах осуществления биспецифичный активатор Т-клеток направленно воздействует на CD66e и EphA2.
Пример агониста GITR
В одном варианте осуществления комбинация, описанная в настоящей заявке, включает агонист GITR. В некоторых вариантах осуществления комбинация применяется для лечения рака, например, рака, описанного в настоящей заявке, например, солидной опухоли или гемобластоза. В некоторых вариантах осуществления рак выбран из forkhead box P3 (FoxP3)-экспрессирующего рака, рака головы и шеи (например, плоскоклеточной карциномы головы и шеи (HNSCC)), или рака легкого (например, немелкоклеточного рака легкого (НМРЛ)).
В некоторых вариантах осуществления агонистом GITR является молекула антитела против GITR. Примеры молекулы антител против GITR описаны, например, в публикации международной заявки WO 2016/057846 (например, Mab7). В некоторых вариантах осуществления молекула антитела против GITR включает последовательность HCDR1 GFSLSSY (SEQ ID NO: 301) (раскрытую как SEQ ID NO: 84 в WO 2016/057846), последовательность HCDR2 WGGGG (SEQ ID NO: 302) (раскрытую как SEQ ID NO: 80 в WO 2016/057846), последовательность HCDR3 HAYGHDGGFAMDY (SEQ ID NO: 303) (раскрытую как SEQ ID NO: 29 в WO 2016/057846), LCDR1 SESVSSN (SEQ ID NO: 304) (раскрытую как SEQ ID NO: 85 в WO 2016/057846), LCDR2 GAS (SEQ ID NO: 305) (раскрытую как SEQ ID NO: 82 в WO 2016/057846) и LCDR3 SYSYPF (SEQ ID NO: 306) (раскрытую как SEQ ID NO: 83 в WO 2016/057846), все согласно определению CDR-областей Чотиа. В других вариантах осуществления молекула антитела против GITR включает последовательность HCDR1 SYGVD (SEQ ID NO: 307) (раскрытую как SEQ ID NO: 22 в WO 2016/057846), последовательность HCDR2 VIWGGGGTYYASSLMG (SEQ ID NO: 308) (раскрытую как SEQ ID NO: 25 в WO 2016/057846), последовательность HCDR3 HAYGHDGGFAMDY (SEQ ID NO: 303) (раскрытую как SEQ ID NO: 29 в WO 2016/057846), LCDR1 RASESVSSNVA (SEQ ID NO: 309) (раскрытую как SEQ ID NO: 30 в WO 2016/057846), LCDR2 GASNRAT (SEQ ID NO: 310) (раскрытую как SEQ ID NO: 33 в WO 2016/057846) и LCDR3 GQSYSYPFT (SEQ ID NO: 311) (раскрытую как SEQ ID NO: 34 в WO 2016/057846), все согласно определению CDR-областей Кэбата.
В некоторых вариантах осуществления молекула антитела против GITR включает аминокислотную последовательность вариабельной области тяжелой цепи (VH) EVQLVESGGGLVQSGGSLRLSCAASGFSLSSYGVDWVRQAPGKGLEWVGVIWGGGGTYYASSLMGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARHAYGHDGGFAMDYWGQGTLVTVSS (SEQ ID NO: 312) (раскрытую как SEQ ID NO: 99 в WO 2016/057846). В некоторых вариантах осуществления молекула антитела против GITR включает аминокислотную последовательность вариабельной области легкой цепи (VL) EIVMTQSPATLSVSPGERATLSCRASESVSSNVAWYQQRPGQAPRLLIYGASNRATGIPARFSGSGSGTDFTLTISRLEPEDFAVYYCGQSYSYPFTFGQGTKLEIK (SEQ ID NO: 313) (раскрытую как SEQ ID NO: 7 в WO 2016/057846).
В некоторых вариантах осуществления молекула антитела против GITR включает аминокислотную последовательность тяжелой цепи (HC): EVQLVESGGGLVQSGGSLRLSCAASGFSLSSYGVDWVRQAPGKGLEWVGVIWGGGGTYYASSLMGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARHAYGHDGGFAMDYWGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK (SEQ ID NO: 314) (раскрытую как SEQ ID NO: 100 в WO 2016/057846). В некоторых вариантах осуществления молекула антитела против GITR включает аминокислотную последовательность легкой цепи (LC) EIVMTQSPATLSVSPGERATLSCRASESVSSNVAWYQQRPGQAPRLLIYGASNRATGIPARFSGSGSGTDFTLTISRLEPEDFAVYYCGQSYSYPFTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO: 315) (раскрытую как SEQ ID NO: 66 в WO 2016/057846).
Примеры агонистов GITR включают, например, слитые белки GITR и антител против GITR (например, бивалентных антител против GITR), такие как слитый белок GITR, описанный в патенте США: 6,111,090, европейском патенте: 0920505B1, патенте США: 8,586,023, публикациях PCT: WO 2010/003118 и 2011/090754, или антитело против GITR, описанное, например, в патенте США: 7,025,962, европейском патенте: 1947183B1, патенте США: 7,812,135, патенте США: 8,388,967, патенте США: 8,591,886, европейском патенте: EP 1866339, публикации PCT: WO 2011/028683, патенте США: 8,709,424, публикации PCT: WO 2013/039954, публикации международной заявки: WO2013/039954, публикации U.S.: US2014/0072566, публикации международной заявки: WO2015/026684, публикации PCT: WO2005/007190, публикации PCT: WO 2007/133822, публикации PCT: WO2005/055808, публикации PCT: WO 99/40196, публикации PCT: WO 2001/03720, публикации PCT: WO99/20758, патенте США: 6,689,607, публикации PCT: WO2006/083289, публикации PCT: WO 2005/115451, патенте США: 7,618,632, публикации PCT: WO 2011/051726, публикации международной заявки: WO2004/060319 и публикации международной заявки: WO2014/012479.
В одном варианте осуществления агонист GITR применяется в комбинации с ингибитором PD-1, например, как описано в WO2015/026684.
В другом варианте осуществления агонист GITR применяется в комбинации с агонистом TLR, например, как описано в WO2004/060319 и публикации международной заявки: WO2014/012479.
Примеры ингибиторов PD-1
PD-1 - представитель семейства CD28/CTLA-4, экспрессируемый, например, на активированных CD4+ и CD8+ Т-клетках, Treg-клетках и В-клетках. Он отрицательно регулирует сигнализацию и функцию эффекторных Т-клеток. PD-1 индуцируется на инфильтрирующих опухоль Т-клетках и может приводить к функциональному истощению или дисфункции (Keir et al. (2008) Annu. Rev. Immunol. 26:677-704; Pardoll et al. (2012) Nat Rev Cancer 12(4):252-64). PD-1 доставляет коингибирующий сигнал при связывании с любым из двух его лигандов, лигандом 1 белка программируемой смерти (PD-L1) или лигандом 2 белка программируемой смерти (PD-L2). PD-L1 экспрессируется на клетках разных типов, в том числе Т-клетках, естественных киллерных (NK) клетках, макрофагах, дендритных клетках (ДК), В-клетках, эпителиальных клетках, эндотелиальных клетках сосудов, а также на многих типах опухолей. Высокая экспрессия PD-L1 на мышиных и человеческих опухолях связана с неблагоприятными клиническими прогнозами при различных формах рака ((Keir et al. (2008) Annu. Rev. Immunol. 26:677704; Pardoll et al. (2012) Nat. Rev. Cancer 12(4):252-64). PD-L2 экспрессируется на дендритных клетках, макрофагах и некоторых опухолях.
Для противоопухолевой иммунотерапии проводили предварительную доклиническую и клиническую оценку блокады пути PD-1. Как в доклинических, так и в клинических исследованиях было показано, что блокада пути PD-1 восстанавливает активность эффекторных Т-клеток и вызывает эффективный противоопухолевый ответ. Например, блокада пути PD-1 может восстанавливать истощенную/нарушенную функцию эффекторных Т-клеток (например, пролиферацию, секрецию IFN-γ или цитолитическую функцию) и ингибирует функции Treg-клеток (Keir et al. (2008) Annu. Rev. Immunol. 26:677-704; Pardoll et al. (2012) Nat. Rev. Cancer 12(4):252-64). Блокада пути PD-1 может быть выполнена антителом, его антигенсвязывающим фрагментом, иммуноадгезином, слитым белком или олигопептидом PD-1, PD-L1 и/или PD-L2.
При использовании в настоящей заявке термин "белок программируемой смерти 1" или "PD-1" включает изоформы PD-1 млекопитающих, например, человека, видовые гомологи человеческого PD-1, а также аналоги, включающие по меньшей мере один общий эпитоп с PD-1. Аминокислотная последовательность PD-1, например человеческого PD-1, известна в уровне техники, например, Shinohara T et al. (1994) Genomics 23(3):704-6; Finger LR, et al. Gene (1997) 197(1-2):177-87.
Молекулы антитела против PD-1, описанные в настоящей заявке, могут применяться отдельно или в комбинации с одним или более дополнительными средствами, описанными в настоящей заявке, в соответствии со способом, описанным в настоящей заявке. В некоторых вариантах осуществления комбинации, описанные в настоящей заявке, включают ингибитор PD-1, например, молекулу антитела против PD-1 (например, молекулы гуманизированного антитела), как описано в настоящей заявке.
В некоторых вариантах осуществления молекула антитела против PD-1 (например, выделенная или рекомбинантная молекула антитела) обладают одним или более следующими свойствами:
(i) связывается с PD-1, например человеческим PD-1, с высокой аффинностью, например, с константой аффинности по меньшей мере приблизительно 107 M-1, как правило, приблизительно 108 M-1 и, более типично, приблизительно от 109 M-1 до 1010 M-1, или более высокой;
(ii) по существу не связывается с CD28, CTLA-4, ICOS или BTLA;
(iii) ингибирует или уменьшает связывание PD-1 с лигандом PD-1, например, PD-L1 или PD-L2, или обоими;
(iv) специфично связывается с эпитопом на PD-1Е, например, тем же или подобным эпитопом, как эпитоп, распознаваемый мышиным моноклональным антителом BAP049 или химерным антителом BAP049, например, BAP049-chi или BAP049-chi-Y;
(v) демонстрирует такую же или подобную аффинность связывания или специфичность, или и то, и другое, как любое из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E;
(vi) демонстрирует такую же или подобную аффинность связывания или специфичность, или и то, и другое, как молекула антитела (например, вариабельная область тяжелой цепи и вариабельная область легкой цепи), описанная в Таблице 1;
(vii) демонстрирует такую же или подобную аффинность связывания или специфичность, или и то, и другое, как молекула антитела (например, вариабельная область тяжелой цепи и вариабельная область легкой цепи), имеющего аминокислотную последовательность, показанную в Таблице 1;
(viii) демонстрирует такую же или подобную аффинность связывания или специфичность, или и то, и другое, как молекула антитела (например, вариабельная область тяжелой цепи и вариабельная область легкой цепи), кодируемого нуклеотидной последовательностью, показанной в Таблице 1;
(ix) ингибирует, например конкурентно ингибирует, связывание второй молекулы антитела с PD-1, где вторая молекула антитела является молекулой антитела, описанной в настоящей заявке, например, молекулой антитела, выбранной из, например, любого из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E;
(x) связывается с тем же или перекрывающимся эпитопом со второй молекулой антитела к PD-1, где вторая молекула антитела является молекулой антитела, описанного в настоящей заявке, например, молекулой антитела, выбранного из, например, любого из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E;
(xi) конкурирует за связывание, и/или связывает тот же эпитоп, со второй молекулой антитела к PD-1, где вторая молекула антитела является молекулой антитела, описанного в настоящей заявке, например, молекулой антитела, выбранного из, например, любого из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E;
(xii) обладает одним или более биологическими свойствами молекулы антитела, описанного в настоящей заявке, например, молекула антитела, выбранного из, например, любого из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E;
(xiii) обладает одним или более фармакокинетическими свойствами молекулы антитела, описанного в настоящей заявке, например, молекулы антитела, выбранного из, например, любого из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E;
(xiv) ингибирует одну или более активностей PD-1, например, приводит к одному или больше из: увеличения количества инфильтрирующих опухоль лимфоцитов, увеличения опосредованной T-клеточным рецептором пролиферации или уменьшения иммунного ускользания раковых клеток;
(xv) связывает человеческий PD-1 и обладает перекрестной реактивностью в отношении PD-1 яванского макака;
(xvi) связывается с одним или более остатками в цепи C, петле CC', цепи C' или петле FG PD-1 или комбинации двух, трех или всех из цепи C, петли CC', цепи C' или петли FG PD-1, например, при анализе связывания с помощью ELISA или BiaCore; или
(xvii) имеет область VL, которая в большей степени способствует связыванию с PD-1, чем область VH.
В некоторых вариантах осуществления молекула антитела связывается с PD-1 с высокой аффинностью, например, с KD, которая является приблизительно такой же или по меньшей мере приблизительно на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% или 90% выше или ниже, чем KD молекулы мышиного или химерного антитела против PD-1, например, молекулы мышиного или химерного антитела против PD-1, описанного в настоящей заявке. В некоторых вариантах осуществления KD молекулы мышиного или химерного антитела против PD-1 составляет меньше чем приблизительно 0,4, 0,3, 0,2, 0,1 или 0,05 нМ, например, при измерении с помощью метода BiaCore. В некоторых вариантах осуществления KD молекулы мышиного или химерного антитела против PD-1 составляет меньше чем приблизительно 0,2 нМ, например, приблизительно 0,135 нМ. В других вариантах осуществления KD молекулы мышиного или химерного антитела против PD-1 составляет меньше чем приблизительно 10, 5, 3, 2 или 1 нМ, например, при измерении связывания на клетках, экспрессирующих PD-1 (например, клетках 300.19). В некоторых вариантах осуществления KD молекулы мышиного или химерного антитела против PD-1 составляет меньше чем приблизительно 5 нМ, например, приблизительно 4,60 нМ (или приблизительно 0,69 мкг/мл).
В некоторых вариантах осуществления молекула антитела против PD-1 связывается с PD-1 с Koff меньше 1×10-4, 5×10-5 или 1×10-5 с-1, например, приблизительно 1,65×10-5 с-1. В некоторых вариантах осуществления молекула антитела против PD-1 связывается с PD-1 с Kon выше 1×104, 5×104, 1×105 или 5×105 М-1с-1, например, приблизительно 1,23×105 М-1с-1.
В некоторых вариантах осуществления уровень экспрессии молекулы антитела выше, например по меньшей мере приблизительно в 0,5, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 раз выше, чем уровень экспрессии молекулы мышиного или химерного антитела, например, молекулы мышиного или химерного антитела против PD-1, описанного в настоящей заявке. В некоторых вариантах осуществления молекула антитела экспрессируется в клетках CHO.
В некоторых вариантах осуществления молекула антитела против PD-1 уменьшает одну или более PD-1-ассоциированных активностей с IC50 (концентрация при 50% ингибировании), которая является приблизительно такой же или ниже, например, по меньшей мере приблизительно на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% или 90% ниже, чем IC50 молекулы мышиного или химерного антитела против PD-1, например, молекулы мышиного или химерного антитела против PD-1, описанного в настоящей заявке. В некоторых вариантах осуществления IC50 молекулы мышиного или химерного антитела против PD-1 составляет меньше чем приблизительно 6, 5, 4, 3, 2 или 1 нМ, например, при измерении связывания на клетках, экспрессирующих PD-1 (например, клетках 300.19). В некоторых вариантах осуществления IC50 молекулы мышиного или химерного антитела против PD-1 составляет меньше чем приблизительно 4 нМ, например, приблизительно 3,40 нМ (или приблизительно 0,51 мкг/мл). В некоторых вариантах осуществления уменьшаемой PD-1-ассоциированной активностью является связывание PD-L1 и/или PD-L2 с PD-1. В некоторых вариантах осуществления молекула антитела против PD-1 связывается с мононуклеарными клетками периферической крови (МКПК), активированными стафилококковым энтеротоксином B (SEB). В других вариантах осуществления молекула антитела против PD-1 повышает экспрессию IL-2 в цельной крови, активированной SEB. Например, антитело против PD-1 повышает экспрессию IL-2 по меньшей мере приблизительно в 2, 3, 4 или 5 раз по сравнению с экспрессией IL-2 при использовании изотипического контроля (например, IgG4).
В некоторых вариантах осуществления молекула антитела против PD-1 обладает повышенной стабильностью, например, является по меньшей мере приблизительно в 0,5, 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 раз более стабильной in vivo или in vitro, чем молекула мышиного или химерного антитела против PD-1, например, молекула мышиного или химерного антитела против PD-1, описанного в настоящей заявке.
В одном варианте осуществления молекула антитела против PD-1 является молекулой гуманизированного антитела и имеет оценку риска на основе анализа эпитопов Т-клеток 300-700, 400-650, 450-600 или оценку риска, как описано в настоящей заявке.
В другом варианте осуществления молекула антитела против PD-1 включает по меньшей мере одну антигенсвязывающую область, например, вариабельную область или ее антигенсвязывающий фрагмент, из антитела, описанного в настоящей заявке, например, антитела, выбранного из любого из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E; или описанные в Таблице 1 или кодируемые нуклеотидной последовательностью в Таблице 1; или последовательностью, по существу идентичной (например, идентичной по меньшей мере на 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или выше) любой из вышеуказанных последовательностей.
В еще одном варианте осуществления молекула антитела против PD-1 включает по меньшей мере одну, две, три или четыре вариабельных области из антитела, описанного в настоящей заявке, например, антитела, выбранного из любого из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E; или описанные в Таблице 1 или кодируемые нуклеотидной последовательностью в Таблице 1; или последовательностью, по существу идентичной (например, идентичной по меньшей мере на 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или выше) любой из вышеуказанных последовательностей.
В еще одном варианте осуществления молекула антитела против PD-1 включает по меньшей мере одну или две вариабельных области тяжелой цепи из антитела, описанного в настоящей заявке, например, антитела, выбранного из любого из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E; или описанные в Таблице 1 или кодируемые нуклеотидной последовательностью в Таблице 1; или последовательностью, по существу идентичной (например, идентичной по меньшей мере на 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или выше) любой из вышеуказанных последовательностей.
В еще одном варианте осуществления молекула антитела против PD-1 включает по меньшей мере одну или две вариабельных области легкой цепи из антитела, описанного в настоящей заявке, например, антитела, выбранного из любого из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E; или описанные в Таблице 1 или кодируемые нуклеотидной последовательностью в Таблице 1; или последовательностью, по существу идентичной (например, идентичной по меньшей мере на 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или выше) любой из вышеуказанных последовательностей.
В еще одном варианте осуществления молекула антитела против PD-1 включает константную область тяжелой цепи IgG4, например, человеческого IgG4. В одном варианте осуществления человеческий IgG4 включает замену в положении 228 согласно нумерации EU (например, замену Ser на Pro). В другом варианте осуществления молекула антитела против PD-1 включает константную область тяжелой цепи IgG1, например, человеческого IgG1. В одном варианте осуществления человеческий IgG1 включает замену в положении 297 согласно нумерации EU (например, замену Asn на Ala). В одном варианте осуществления человеческий IgG1 включает замену в положении 265 согласно нумерации EU, замену в положении 329 согласно нумерации EU или обе таких замены (например, замену Asp на Ala в положении 265 и замену Pro на Ala в положении 329). В одном варианте осуществления человеческий IgG1 включает замену в положении 234 согласно нумерации EU, замену в положении 235 согласно нумерации EU или обе таких замены (например, замену Leu на Ala в положении 234 и замену Leu на Ala в положении 235). В одном варианте осуществления константная область тяжелой цепи включает аминокислотную последовательность, представленную в Таблице 3, или последовательность, по существу идентичную (например, идентичную по меньшей мере на 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или выше) ей.
В еще одном варианте осуществления молекула антитела против PD-1 включает константную область каппа легкой цепи, например, человеческую константную область каппа легкой цепи. В одном варианте осуществления константная область легкой цепи включает аминокислотную последовательность, представленную в Таблице 3, или последовательность, по существу идентичную (например, идентичную по меньшей мере на 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или выше) ей.
В другом варианте осуществления молекула антитела против PD-1 включает константную область тяжелой цепи IgG4, например, человеческого IgG4, и константную область каппа легкой цепи, например, человеческую константную область каппа легкой цепи, например, константную область тяжелой и легкой цепи, включающую аминокислотную последовательность, представленную в Таблице 3, или последовательность, по существу идентичную (например, идентичную по меньшей мере на 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или выше) ей. В одном варианте осуществления человеческий IgG4 включает замену в положении 228 согласно нумерации EU (например, замену Ser на Pro). В еще одном варианте осуществления молекула антитела против PD-1 включает константную область тяжелой цепи IgG1, например, человеческого IgG1, и константную область каппа легкой цепи, например, человеческую константную область каппа легкой цепи, например, константную область тяжелой и легкой цепи, включающую аминокислотную последовательность, представленную в Таблице 3, или последовательность, по существу идентичную (например, идентичную по меньшей мере на 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или выше) ей. В одном варианте осуществления человеческий IgG1 включает замену в положении 297 согласно нумерации EU (например, замену Asn на Ala). В одном варианте осуществления человеческий IgG1 включает замену в положении 265 согласно нумерации EU, замену в положении 329 согласно нумерации EU или обе таких замены (например, замену Asp на Ala в положении 265 и замену Pro на Ala в положении 329). В одном варианте осуществления человеческий IgG1 включает замену в положении 234 согласно нумерации EU, замену в положении 235 согласно нумерации EU или обе таких замены (например, замену Leu на Ala в положении 234 и замену Leu на Ala в положении 235).
В другом варианте осуществления молекула антитела против PD-1 включает вариабельный домен и константную область тяжелой цепи, вариабельный домен и константную область легкой цепи или и то, и другое, включающие аминокислотную последовательность BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E; или описанные в Таблице 1 или кодируемые нуклеотидной последовательностью в Таблице 1; или последовательностью, по существу идентичной (например, идентичной по меньшей мере на 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или выше) любой из вышеуказанных последовательностей. Молекула антитела против PD-1 необязательно включает лидерную последовательность из тяжелой цепи, легкой цепи или обеих, как показано в Таблице 4; или последовательность, по существу идентичную им.
В еще одном варианте осуществления молекула антитела против PD-1 включает по меньшей мере одну, две или три определяющих комплементарность областей (CDR-областей) из вариабельной области тяжелой цепи антитела, описанного в настоящей заявке, например, антитела, выбранного из любого из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E; или описанные в Таблице 1 или кодируемые нуклеотидной последовательностью в Таблице 1; или последовательностью, по существу идентичной (например, идентичной по меньшей мере на 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или выше) любой из вышеуказанных последовательностей.
В еще одном варианте осуществления молекула антитела против PD-1 включает по меньшей мере одну, две или три CDR-области (или одновременно все CDR-области) из вариабельной области тяжелой цепи, включающей аминокислотную последовательность, показанную в Таблице 1 или кодируемую нуклеотидной последовательностью, показанной в Таблице 1. В одном варианте осуществления одна или более CDR-областей (или одновременно все CDR-области) имеют одно, два, три, четыре, пять, шесть или более изменений, например, аминокислотных замен или делеций, по сравнению с аминокислотной последовательностью, показанной в Таблице 1 или кодируемой нуклеотидной последовательностью, показанной в Таблице 1.
В еще одном варианте осуществления молекула антитела против PD-1 включает по меньшей мере одну, две или три CDR-области из вариабельной области легкой цепи антитела, описанного в настоящей заявке, например, антитела, выбранного из любого из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E; или описанные в Таблице 1 или кодируемые нуклеотидной последовательностью в Таблице 1; или последовательностью, по существу идентичной (например, идентичной по меньшей мере на 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или выше) любой из вышеуказанных последовательностей.
В еще одном варианте осуществления молекула антитела против PD-1 включает по меньшей мере одну, две или три CDR-области (или одновременно все CDR-области) из вариабельной области легкой цепи, включающей аминокислотную последовательность, показанную в Таблице 1 или кодируемую нуклеотидной последовательностью, показанной в Таблице 1. В одном варианте осуществления одна или более CDR-областей (или одновременно все CDR-области) имеют одно, два, три, четыре, пять, шесть или более изменений, например, аминокислотных замен или делеций, по сравнению с аминокислотной последовательностью, показанной в Таблице 1 или кодируемой нуклеотидной последовательностью, показанной в Таблице 1. В некоторых вариантах осуществления молекула антитела против PD-1 включает замену в CDR-области легкой цепи, например, одну или более замен в CDR1, CDR2 и/или CDR3 легкой цепи. В одном варианте осуществления молекула антитела против PD-1 включает замену в CDR3 легкой цепи в положении 102 вариабельной области легкой цепи, например, замену остатка цистеина на остаток тирозина или остатка цистеина на остаток серина, в положении 102 вариабельной области легкой цепи согласно Таблице 1 (например, SEQ ID NO: 16 или 24 в случае мышиной или химерной, немодифицированной; или любой из SEQ ID NO: 34, 42, 46, 54, 58, 62, 66, 70, 74 или 78 в случае модифицированной последовательности).
В другом варианте осуществления молекула антитела против PD-1 включает по меньшей мере одну, две, три, четыре, пять или шесть CDR-областей (или одновременно все CDR-области) из вариабельной области тяжелой и легкой цепи, включающей аминокислотную последовательность, показанную в Таблице 1 или кодируемую нуклеотидной последовательностью, показанной в Таблице 1. В одном варианте осуществления одна или более CDR-областей (или одновременно все CDR-области) имеют одно, два, три, четыре, пять, шесть или более изменений, например, аминокислотных замен или делеций, по сравнению с аминокислотной последовательностью, показанной в Таблице 1 или кодируемой нуклеотидной последовательностью, показанной в Таблице 1.
В одном варианте осуществления молекула антитела против PD-1 включает все шесть CDR-областей из антитела, описанного в настоящей заявке, например, антитела, выбранного из любого из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E; или описанные в Таблице 1 или кодируемые нуклеотидной последовательностью в Таблице 1 или близко родственные CDR-области, например, CDR-области, которые идентичны или которые имеют по меньшей мере одно аминокислотное изменение, но не больше двух, трех или четырех изменений (например, замен, делеций или вставок, например, консервативных замен). В одном варианте осуществления молекула антитела против PD-1 может включать любую CDR-область, описанную в настоящей заявке. В некоторых вариантах осуществления молекула антитела против PD-1 включает замену в CDR-области легкой цепи, например, одну или более замен в CDR1, CDR2 и/или CDR3 легкой цепи. В одном варианте осуществления молекула антитела против PD-1 включает замену в CDR3 легкой цепи в положении 102 вариабельной области легкой цепи, например, замену остатка цистеина на остаток тирозина или остатка цистеина на остаток серина, в положении 102 вариабельной области легкой цепи согласно Таблице 1 (например, SEQ ID NO: 16 или 24 в случае мышиной или химерной, немодифицированной; или любой из SEQ ID NO: 34, 42, 46, 54, 58, 62, 66, 70, 74 или 78 в случае модифицированной последовательности).
В другом варианте осуществления молекула антитела против PD-1 включает по меньшей мере одну, две или три CDR-области согласно Кэбату с соавт. (например, по меньшей мере одну, две или три CDR-области согласно определению Кэбата, как представлено в Таблице 1) из вариабельной области тяжелой цепи антитела, описанного в настоящей заявке, например, антитела, выбранного из любого из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E; или описанные в Таблице 1 или кодируемые нуклеотидной последовательностью в Таблице 1; или последовательностью, по существу идентичной (например, идентичной по меньшей мере на 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или выше) любой из вышеуказанных последовательностей; или которые имеют по меньшей мере одно аминокислотное изменение, но не больше двух, трех или четырех изменений (например, замен, делеций или вставок, например, консервативных замен) по сравнению с одной, двумя или тремя CDR-областями согласно Кэбату с соавт., показанными в Таблице 1.
В другом варианте осуществления молекула антитела против PD-1 включает по меньшей мере одну, две или три CDR-области согласно Кэбату с соавт. (например, по меньшей мере одну, две или три CDR-области согласно определению Кэбата, как представлено в Таблице 1) из вариабельной области легкой цепи антитела, описанного в настоящей заявке, например, антитела, выбранного из любого из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E; или описанные в Таблице 1 или кодируемые нуклеотидной последовательностью в Таблице 1; или последовательностью, по существу идентичной (например, идентичной по меньшей мере на 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или выше) любой из вышеуказанных последовательностей; или которые имеют по меньшей мере одно аминокислотное изменение, но не больше двух, трех или четырех изменений (например, замен, делеций или вставок, например, консервативных замен) по сравнению с одной, двумя или тремя CDR-областями согласно Кэбату с соавт., показанными в Таблице 1.
В еще одном варианте осуществления молекула антитела против PD-1 включает по меньшей мере одну, две, три, четыре, пять или шесть CDR-областей согласно Кэбату с соавт. (например, по меньшей мере одну, две, три, четыре, пять или шесть CDR-областей согласно определению Кэбата, как представлено в Таблице 1) из вариабельных областей тяжелой и легкой цепи антитела, описанного в настоящей заявке, например, антитела, выбранного из любого из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E; или описанные в Таблице 1 или кодируемые нуклеотидной последовательностью в Таблице 1; или последовательностью, по существу идентичной (например, идентичной по меньшей мере на 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или выше) любой из вышеуказанных последовательностей; или которые имеют по меньшей мере одно аминокислотное изменение, но не больше двух, трех или четырех изменений (например, замен, делеций или вставок, например, консервативных замен) по сравнению с одной, двумя, тремя, четырьмя, пятью или шестью CDR-областями согласно Кэбату с соавт., показанными в Таблице 1.
В еще одном варианте осуществления молекула антитела против PD-1 включает все шесть CDR-областей согласно Кэбату с соавт. (например, все шесть CDR-областей согласно определению Кэбата, как представлено в Таблице 1) из вариабельных областей тяжелой и легкой цепи антитела, описанного в настоящей заявке, например, антитела, выбранного из любого из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E; или описанные в Таблице 1 или кодируемые нуклеотидной последовательностью в Таблице 1; или последовательностью, по существу идентичной (например, идентичной по меньшей мере на 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или выше) любой из вышеуказанных последовательностей; или которые имеют по меньшей мере одно аминокислотное изменение, но не больше двух, трех или четырех изменений (например, например, замен, делеций или вставок, например, консервативных замен), по сравнению со всеми шестью CDR-областями согласно Кэбату с соавт., показанными в Таблице 1. В одном варианте осуществления молекула антитела против PD-1 может включать любую CDR-область, описанную в настоящей заявке.
В другом варианте осуществления молекула антитела против PD-1 включает по меньшей мере одну, две или три гипервариабельных петли Чотиа (например, по меньшей мере одну, две или три гипервариабельных петли согласно определению Чотиа, как представлено в Таблице 1) из вариабельной области тяжелой цепи антитела, описанного в настоящей заявке, например, антитела, выбранного из любого из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E; или описанные в Таблице 1 или кодируемые нуклеотидной последовательностью в Таблице 1; или, по меньшей мере, аминокислоты из таких гипервариабельных петель, которые контактируют с PD-1; или которые имеют по меньшей мере одно аминокислотное изменение, но не больше двух, трех или четырех изменений (например, замен, делеций или вставок, например, консервативных замен) по сравнению с одной, двумя или тремя гипервариабельными петлями согласно Чотиа с соавт., показанными в Таблице 1.
В другом варианте осуществления молекула антитела против PD-1 включает по меньшей мере одну, две или три гипервариабельных петли Чотиа (например, по меньшей мере одну, две или три гипервариабельных петли согласно определению Чотиа, как представлено в Таблице 1) вариабельной области легкой цепи антитела, описанного в настоящей заявке, например, антитела, выбранного из любого из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E; или описанные в Таблице 1 или кодируемые нуклеотидной последовательностью в Таблице 1; или, по меньшей мере, аминокислоты из таких гипервариабельных петель, которые контактируют с PD-1; или которые имеют по меньшей мере одно аминокислотное изменение, но не больше двух, трех или четырех изменений (например, замен, делеций или вставок, например, консервативных замен) по сравнению с одной, двумя или тремя гипервариабельными петлями согласно Чотиа с соавт., показанными в Таблице 1.
В еще одном варианте осуществления молекула антитела против PD-1 включает по меньшей мере одну, две, три, четыре, пять или шесть гипервариабельных петель (например, по меньшей мере одну, две, три, четыре, пять или шесть гипервариабельных петель согласно определению Чотиа, как представлено в Таблице 1) из вариабельных областей тяжелой и легкой цепи антитела, описанного в настоящей заявке, например, антитела, выбранного из любого из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E; или описанные в Таблице 1 или кодируемые нуклеотидной последовательностью в Таблице 1; или, по меньшей мере, аминокислоты из таких гипервариабельных петель, которые контактируют с PD-1; или которые имеют по меньшей мере одно аминокислотное изменение, но не больше двух, трех или четырех изменений (например, замен, делеций или вставок, например, консервативных замен) по сравнению с одной, двумя, тремя, четырьмя, пятью или шестью гипервариабельными петлями согласно Чотиа с соавт., показанными в Таблице 1.
В одном варианте осуществления молекула антитела против PD-1 включает все шесть гипервариабельных петель (например, все шесть гипервариабельных петель согласно определению Чотиа, как представлено в Таблице 1) антитела, описанного в настоящей заявке, например, антитела, выбранного из любого из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D, или BAP049-Clone-E, или близко родственные гипервариабельные петли, например, гипервариабельные петли, которые идентичны или которые имеют по меньшей мере одно аминокислотное изменение, но не больше двух, трех или четырех изменений (например, замен, делеций или вставок, например, консервативных замен); или которые имеют по меньшей мере одно аминокислотное изменение, но не больше двух, трех или четырех изменений (например, замен, делеций или вставок, например, консервативных замен) по сравнению со всеми шестью гипервариабельными петлями согласно Чотиа с соавт., показанными в Таблице 1. В одном варианте осуществления молекула антитела против PD-1 может включать любую гипервариабельную петлю, описанную в настоящей заявке.
В другом варианте осуществления молекула антитела против PD-1 включает по меньшей мере одну, две или три гипервариабельных петли, которые имеют такие же канонические структуры, как и соответствующая гипервариабельная петля антитела, описанного в настоящей заявке, например, антитела, выбранного из любого из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E, например, такие же канонические структуры как, по меньшей мере, петля 1 и/или петля 2 из вариабельных доменов тяжелой и/или легкой цепи антитела, описанного в настоящей заявке. См., например, Chothia et al., (1992) J. Mol. Biol. 227:799-817; Tomlinson et al., (1992) J. Mol. Biol. 227:776-798 по поводу описаний канонических структур гипервариабельных петель. Эти структуры могут быть определены при просмотре таблиц, описанных в указанных источниках.
В некоторых вариантах осуществления молекула антитела против PD-1 включает комбинацию CDR-областей или гипервариабельных петель, определенных согласно Кэбату с соавт. и Чотиа с соавт.
В одном варианте осуществления молекула антитела против PD-1 включает по меньшей мере одну, две или три CDR-области или гипервариабельные петли из вариабельной области тяжелой цепи антитела, описанного в настоящей заявке, например, антитела, выбранного из любого из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E, согласно определению Кэбата и Чотиа (например, по меньшей мере одну, две или три CDR-области или гипервариабельные петли согласно определению Кэбата и Чотиа, как представлено в Таблице 1); или кодируемые нуклеотидной последовательностью в Таблице 1; или последовательностью, по существу идентичной (например, идентичной по меньшей мере на 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или выше) любой из вышеуказанных последовательностей; или которые имеют по меньшей мере одно аминокислотное изменение, но не больше двух, трех или четырех изменений (например, замен, делеций или вставок, например, консервативных замен) по сравнению с одной, двумя или тремя CDR-областями или гипервариабельными петлями согласно Кэбату и/или Чотиа, показанными в Таблице 1.
Например, молекула антитела против PD-1 может включать CDR1 VH согласно Кэбату с соавт. или гипервариабельную петлю 1 VH согласно Чотиа с соавт., или их комбинации, например, как показано в Таблице 1. В одном варианте осуществления комбинация CDR-областей согласно Кэбату и Чотиа CDR1 VH включает аминокислотную последовательность GYTFTTYWMH (SEQ ID NO: 224) или аминокислотную последовательность, по существу идентичную ей (например, имеющую по меньшей мере одно аминокислотное изменение, но не больше двух, трех или четырех изменений (например, замен, делеций или вставок, например, консервативных замен)). Молекула антитела против PD-1 может дополнительно включать, например, CDR-области 2-3 VH согласно Кэбату с соавт. и CDR-области 1-3 VL согласно Кэбату с соавт., например, как показано в Таблице 1. Таким образом, в некоторых вариантах осуществления каркасные области определены на основе комбинации CDR-областей, определенных согласно Кэбату с соавт., и гипервариабельных петель, определенных согласно Чотиа с соавт. Например, молекула антитела против PD-1 может включать FR1 VH, определенную на основе гипервариабельной петли 1 VH согласно Чотиа с соавт. и FR2 VH, определенную на основе CDR-областей 1-2 VH согласно Кэбату с соавт., например, как показано в Таблице 1. Молекула антитела против PD-1 может дополнительно включать, например, FR-области 3-4 VH, определенные на основе CDR-областей 2-3 VH согласно Кэбату с соавт. и FR-области 1-4 VL, определенные на основе CDR-областей 1-3 VL согласно Кэбату с соавт.
Молекула антитела против PD-1 может содержать любую комбинацию CDR-областей или гипервариабельных петель согласно определениям Кэбата и Чотиа. В одном варианте осуществления молекула антитела против PD-1 включает по меньшей мере одну, две или три CDR-области из вариабельной области легкой цепи антитела, описанного в настоящей заявке, например, антитела, выбранного из любого из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E, согласно определению Кэбата и Чотиа (например, по меньшей мере одну, две или три CDR-области согласно определению Кэбата и Чотиа, как представлено в Таблице 1).
В варианте осуществления, например, варианте осуществления, включающем вариабельную область, CDR (например, CDR согласно Чотиа или CDR согласно Кэбату) или другая последовательность, указанная в настоящей заявке, например, в Таблице 1, молекула антитела является молекулой моноспецифичного антитела, молекулой биспецифичного антитела, или является молекулой антитела, которая включает антигенсвязывающий фрагмент антитела, например, полуантитело или антигенсвязывающий фрагмент полуантитела. В некоторых вариантах осуществления молекула антитела является молекулой биспецифичного антитела, обладающего первой специфичностью связывания в отношении PD-1 и второй специфичностью связывания в отношении TIM-3, LAG-3, CEACAM (например, CEACAM-1 и/или CEACAM-5), PD-L1 или PD-L2.
В одном варианте осуществления молекула антитела против PD-1 включает:
(a) вариабельную область тяжелой цепи (VH), включающую аминокислотную последовательность VHCDR1 SEQ ID NO: 4, аминокислотную последовательность VHCDR2 SEQ ID NO: 5 и аминокислотную последовательность VHCDR3 SEQ ID NO: 3; и вариабельную область легкой цепи (VL), включающую аминокислотную последовательность VLCDR1 SEQ ID NO: 13, аминокислотную последовательность VLCDR2 SEQ ID NO: 14 и аминокислотную последовательность VLCDR3 SEQ ID NO: 33;
(b) VH, включающую аминокислотную последовательность VHCDR1, выбранную из SEQ ID NO: 1; аминокислотную последовательность VHCDR2 SEQ ID NO: 2 и аминокислотную последовательность VHCDR3 SEQ ID NO: 3; и VL, включающую аминокислотную последовательность VLCDR1 SEQ ID NO: 10, аминокислотную последовательность VLCDR2 SEQ ID NO: 11 и аминокислотную последовательность VLCDR3 SEQ ID NO: 32;
(c) VH, включающую аминокислотную последовательность VHCDR1 SEQ ID NO: 224, аминокислотную последовательность VHCDR2 SEQ ID NO: 5 и аминокислотную последовательность VHCDR3 SEQ ID NO: 3; и VL, включающую аминокислотную последовательность VLCDR1 SEQ ID NO: 13, аминокислотную последовательность VLCDR2 SEQ ID NO: 14 и аминокислотную последовательность VLCDR3 SEQ ID NO: 33; или
(d) VH, включающую аминокислотную последовательность VHCDR1 SEQ ID NO: 224; аминокислотную последовательность VHCDR2 SEQ ID NO: 2 и аминокислотную последовательность VHCDR3 SEQ ID NO: 3; и VL, включающую аминокислотную последовательность VLCDR1 SEQ ID NO: 10, аминокислотную последовательность VLCDR2 SEQ ID NO: 11 и аминокислотную последовательность VLCDR3 SEQ ID NO: 32.
В одном варианте осуществления молекула антитела против PD-1 включает VH, включающую аминокислотную последовательность VHCDR1 SEQ ID NO: 4, аминокислотную последовательность VHCDR2 SEQ ID NO: 5 и аминокислотную последовательность VHCDR3 SEQ ID NO: 3; и VL, включающую аминокислотную последовательность VLCDR1 SEQ ID NO: 13, аминокислотную последовательность VLCDR2 SEQ ID NO: 14 и аминокислотную последовательность VLCDR3 SEQ ID NO: 33.
В одном варианте осуществления молекула антитела против PD-1 включает VH, включающую аминокислотную последовательность VHCDR1 SEQ ID NO: 1; аминокислотную последовательность VHCDR2 SEQ ID NO: 2 и аминокислотную последовательность VHCDR3 SEQ ID NO: 3; и VL, включающую аминокислотную последовательность VLCDR1 SEQ ID NO: 10, аминокислотную последовательность VLCDR2 SEQ ID NO: 11 и аминокислотную последовательность VLCDR3 SEQ ID NO: 32.
В одном варианте осуществления молекула антитела против PD-1 включает VH, включающую аминокислотную последовательность VHCDR1 SEQ ID NO: 224, аминокислотную последовательность VHCDR2 SEQ ID NO: 5 и аминокислотную последовательность VHCDR3 SEQ ID NO: 3; и VL, включающую аминокислотную последовательность VLCDR1 SEQ ID NO: 13, аминокислотную последовательность VLCDR2 SEQ ID NO: 14 и аминокислотную последовательность VLCDR3 SEQ ID NO: 33.
В одном варианте осуществления молекула антитела против PD-1 включает VH, включающую аминокислотную последовательность VHCDR1 SEQ ID NO: 224; аминокислотную последовательность VHCDR2 SEQ ID NO: 2 и аминокислотную последовательность VHCDR3 SEQ ID NO: 3; и VL, включающую аминокислотную последовательность VLCDR1 SEQ ID NO: 10, аминокислотную последовательность VLCDR2 SEQ ID NO: 11 и аминокислотную последовательность VLCDR3 SEQ ID NO: 32.
В одном варианте осуществления молекула антитела является молекулой гуманизированного антитела. В другом варианте осуществления молекула антитела является молекулой моноспецифичного антитела. В еще одном варианте осуществления молекула антитела является молекулой биспецифичного антитела.
В одном варианте осуществления молекула антитела против PD-1 включает:
(i) вариабельную область тяжелой цепи (VH), включающую аминокислотную последовательность VHCDR1, выбранную из SEQ ID NO: 1, SEQ ID NO: 4 или SEQ ID NO: 224; аминокислотную последовательность VHCDR2 SEQ ID NO: 2 и аминокислотную последовательность VHCDR3 SEQ ID NO: 3; и
(ii) вариабельную область легкой цепи (VL), включающую аминокислотную последовательность VLCDR1 SEQ ID NO: 10, аминокислотную последовательность VLCDR2 SEQ ID NO: 11 и аминокислотную последовательность VLCDR3 SEQ ID NO: 32.
В другом варианте осуществления молекула антитела против PD-1 включает:
(i) вариабельную область тяжелой цепи (VH), включающую аминокислотную последовательность VHCDR1, выбранную из SEQ ID NO: 1, SEQ ID NO: 4 или SEQ ID NO: 224; аминокислотную последовательность VHCDR2 SEQ ID NO: 5 и аминокислотную последовательность VHCDR3 SEQ ID NO: 3; и
(ii) вариабельную область легкой цепи (VL), включающую аминокислотную последовательность VLCDR1 SEQ ID NO: 13, аминокислотную последовательность VLCDR2 SEQ ID NO: 14 и аминокислотную последовательность VLCDR3 SEQ ID NO: 33.
В одном варианте осуществления молекула антитела против PD-1 включает аминокислотную последовательность VHCDR1 SEQ ID NO:1. В другом варианте осуществления молекула антитела против PD-1 включает аминокислотную последовательность VHCDR1 SEQ ID NO:4. В еще одном варианте осуществления молекула антитела против PD-1 включает аминокислотную последовательность VHCDR1 SEQ ID NO: 224.
В одном варианте осуществления каркасная область вариабельной области легкой или тяжелой цепи (например, область, включающая, по меньшей мере, FR1, FR2, FR3 и, необязательно, FR4) молекулы антитела против PD-1, может быть выбрана из: (a) каркасной области вариабельной области легкой или тяжелой цепи, включающей по меньшей мере 80%, 85%, 87% 90%, 92%, 93%, 95%, 97%, 98% или предпочтительно 100% аминокислотных остатков из человеческой каркасной области вариабельной области легкой или тяжелой цепи, например, остаток каркасной области вариабельной области легкой или тяжелой цепи из зрелого человеческого антитела, человеческой последовательности зародышевой линии или человеческой консенсусной последовательности; (b) каркасной области вариабельной области легкой или тяжелой цепи, включающей от 20% до 80%, от 40% до 60%, от 60% до 90% или от 70% до 95% аминокислотных остатков из человеческой каркасной области вариабельной области легкой или тяжелой цепи, например, остаток каркасной области вариабельной области легкой или тяжелой цепи из зрелого человеческого антитела, человеческой последовательности зародышевой линии или человеческой консенсусной последовательности; (c) нечеловеческой каркасной области (например, каркасной области грызуна); или (d) нечеловеческой каркасной области, которая была изменена, например, с удалением антигенных или цитотоксических детерминант, например, деиммунизирована или частично гуманизирована. В одном варианте осуществления каркасная область вариабельной области легкой или тяжелой цепи (в частности, FR1, FR2 и/или FR3) включает последовательность каркасной области вариабельной области легкой или тяжелой цепи, которая по меньшей мере на 70, 75, 80, 85, 87, 88, 90, 92, 94, 95, 96, 97, 98, 99% идентична каркасным областям VL или VH сегмента человеческого гена зародышевой линии.
В некоторых вариантах осуществления молекула антитела против PD-1 включает вариабельный домен тяжелой цепи, имеющий по меньшей мере одно, два, три, четыре, пять, шесть, семь, десять, пятнадцать, двадцать или больше изменений, например, аминокислотных замен или делеций, из аминокислотной последовательности BAP049-chi-HC, например, аминокислотной последовательности FR-области во всей вариабельной области, например, показанной на ФИГ. 9A-9B или SEQ ID NO: 18, 20, 22 или 30. В одном варианте осуществления молекула антитела против PD-1 включает вариабельный домен тяжелой цепи, имеющий одно или более следующего: E в положении 1, V в положении 5, A в положении 9, V в положении 11, K в положении 12, K в положении 13, E в положении 16, L в положении 18, R в положении 19, I или V в положении 20, G в положении 24, I в положении 37, A или S в положении 40, T в положении 41, S в положении 42, R в положении 43, M или L в положении 48, V или F в положении 68, T в положении 69, I в положении 70, S в положении 71, A или R в положении 72, K или N в положении 74, T или K в положении 76, S или N в положении 77, L в положении 79, L в положении 81, E или Q в положении 82, M в положении 83, S или N в положении 84, R в положении 87, A в положении 88 или T в положении 91 аминокислотной последовательности BAP049-chi-HC, например, аминокислотной последовательности FR во всей вариабельной области, например, показанной на ФИГ. 9A-9B или SEQ ID NO: 18, 20, 22 или 30.
В альтернативе или в комбинации с заменами тяжелой цепи BAP049-chi-HC, описанного в настоящей заявке, молекула антитела против PD-1 включает вариабельный домен легкой цепи, имеющий по меньшей мере одно, два, три, четыре, пять, шесть, семь, десять, пятнадцать, двадцать или больше аминокислотных изменений, например, аминокислотных замен или делеций, из аминокислотной последовательности BAP049-chi-LC, например, аминокислотной последовательности, показанной на ФИГ. 10A-10B или SEQ ID NO: 24 или 26. В одном варианте осуществления молекула антитела против PD-1 включает вариабельный домен тяжелой цепи, имеющий одно или более следующего: E в положении 1, V в положении 2, Q в положении 3, L в положении 4, T в положении 7, D или L или в положении 9, F или T в положении 10, Q в положении 11, S или P в положении 12, L или в положении 13, S в положении 14, P или L или V в положении 15, K в положении 16, Q или D в положении 17, R в положении 18, в положении 19, S в положении 20, I или L в положении 21, T в положении 22, L в положении 43, K в положении 48, A или S в положении 49, R или Q в положении 51, Y в положении 55, I в положении 64, S или P в положении 66, S в положении 69, Y в положении 73, G в положении 74, E в положении 76, F в положении 79, N в положении 82, N в положении 83, L или I в положении 84, E в положении 85, S или P в положении 86, D в положении 87, A или F или I в положении 89, T или Y в положении 91, F в положении 93 или Y в положении 102 аминокислотной последовательности BAP049-chi-LC, например, аминокислотной последовательности, показанной на ФИГ. 10A-10B или SEQ ID NO: 24 или 26.
В других вариантах осуществления молекула антитела против PD-1 включает одну, две, три или четыре каркасных области тяжелой цепи (например, аминокислотную последовательность VHFW, показанную в Таблице 2 или кодируемую нуклеотидной последовательностью, показанной в Таблице 2) или последовательность, по существу идентичную им.
В других вариантах осуществления молекула антитела против PD-1 включает одну, две, три или четыре каркасных области легкой цепи (например, аминокислотную последовательность VLFW, показанную в Таблице 2 или кодируемую нуклеотидной последовательностью, показанной в Таблице 2) или последовательность, по существу идентичную им.
В других вариантах осуществления молекула антитела против PD-1 включает одну, две, три или четыре каркасных области тяжелой цепи (например, аминокислотную последовательность VHFW, показанную в Таблице 2 или кодируемую нуклеотидной последовательностью, показанной в Таблице 2) или последовательность, по существу идентичную им; и одну, две, три или четыре каркасных области легкой цепи (например, аминокислотную последовательность VLFW, показанную в Таблице 2 или кодируемую нуклеотидной последовательностью, показанной в Таблице 2) или последовательность, по существу идентичную им.
В некоторых вариантах осуществления молекула антитела против PD-1 включает каркасную область 1 тяжелой цепи (VHFW1) из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E (например, SEQ ID NO: 147). В некоторых вариантах осуществления молекула антитела включает каркасную область 1 тяжелой цепи (VHFW1) из BAP049-hum14 или BAP049-hum15 (например, SEQ ID NO: 151).
В некоторых вариантах осуществления молекула антитела против PD-1 включает каркасную область 2 тяжелой цепи (VHFW2) из BAP049-hum01, BAP049-hum02, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum09, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C или BAP049-Clone-E (например, SEQ ID NO: 153). В некоторых вариантах осуществления молекула антитела включает каркасную область 2 тяжелой цепи (VHFW2) из BAP049-hum03, BAP049-hum04, BAP049-hum08, BAP049-hum10, BAP049-hum14, BAP049-hum15 или BAP049-Clone-D (например, SEQ ID NO: 157). В некоторых вариантах осуществления молекула антитела включает каркасную область 2 тяжелой цепи (VHFW2) из BAP049-hum16 (например, SEQ ID NO: 160).
В некоторых вариантах осуществления молекула антитела против PD-1 включает каркасную область 3 тяжелой цепи (VHFW3) из BAP049-hum01, BAP049-hum02, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum09, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C или BAP049-Clone-E (например, SEQ ID NO: 162). В некоторых вариантах осуществления молекула антитела включает каркасную область 3 тяжелой цепи (VHFW3) из BAP049-hum03, BAP049-hum04, BAP049-hum08, BAP049-hum10, BAP049-hum14, BAP049-hum15, BAP049-hum16 или BAP049-Clone-D (например, SEQ ID NO: 166).
В некоторых вариантах осуществления молекула антитела против PD-1 включает каркасную область 4 тяжелой цепи (VHFW4) из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E (например, SEQ ID NO: 169).
В некоторых вариантах осуществления молекула антитела против PD-1 включает каркасную область 1 легкой цепи (VLFW1) из BAP049-hum08, BAP049-hum09, BAP049-hum15, BAP049-hum16 или BAP049-Clone-C (например, SEQ ID NO: 174). В некоторых вариантах осуществления молекула антитела включает каркасную область 1 легкой цепи (VLFW1) из BAP049-hum01, BAP049-hum04, BAP049-hum05, BAP049-hum07, BAP049-hum10, BAP049-hum11, BAP049-hum14, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-D или BAP049-Clone-E (например, SEQ ID NO: 177). В некоторых вариантах осуществления молекула антитела включает каркасную область 1 легкой цепи (VLFW1) из BAP049-hum06 (например, SEQ ID NO: 181). В некоторых вариантах осуществления молекула антитела включает каркасную область 1 легкой цепи (VLFW1) из BAP049-hum13 (например, SEQ ID NO: 183). В некоторых вариантах осуществления молекула антитела включает каркасную область 1 легкой цепи (VLFW1) из BAP049-hum02, BAP049-hum03 или BAP049-hum12 (например, SEQ ID NO: 185).
В некоторых вариантах осуществления молекула антитела против PD-1 включает каркасную область 2 легкой цепи (VLFW2) из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum06, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-D или BAP049-Clone-E (например, SEQ ID NO: 187). В некоторых вариантах осуществления молекула антитела включает каркасную область 2 легкой цепи (VLFW2) из BAP049-hum04, BAP049-hum05, BAP049-hum07, BAP049-hum13 или BAP049-Clone-C (например, SEQ ID NO: 191). В некоторых вариантах осуществления молекула антитела включает каркасную область 2 легкой цепи (VLFW2) из BAP049-hum12 (например, SEQ ID NO: 194).
В некоторых вариантах осуществления молекула антитела против PD-1 включает каркасную область 3 легкой цепи (VLFW3) из BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E (например, SEQ ID NO: 196). В некоторых вариантах осуществления молекула антитела включает каркасную область 3 легкой цепи (VLFW3) из BAP049-hum02 или BAP049-hum03 (например, SEQ ID NO: 200). В некоторых вариантах осуществления молекула антитела включает каркасную область 3 легкой цепи (VLFW3) из BAP049-hum01 или BAP049-Clone-A (например, SEQ ID NO: 202). В некоторых вариантах осуществления молекула антитела включает каркасную область 3 легкой цепи (VLFW3) из BAP049-hum04, BAP049-hum05 или BAP049-Clone-B (например, SEQ ID NO: 205).
В некоторых вариантах осуществления молекула антитела против PD-1 включает каркасную область 4 легкой цепи (VLFW4) из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E (например, SEQ ID NO: 208).
В некоторых вариантах осуществления молекула антитела против PD-1 включает каркасные области 1-3 тяжелой цепи из BAP049-hum01, BAP049-hum02, BAP049-hum05, BAP049-hum06, BAP-hum07, BAP049-hum09, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C или BAP049-Clone-E (например, SEQ ID NO: 147 (VHFW1), SEQ ID NO: 153 (VHFW2) и SEQ ID NO: 162 (VHFW3)). В некоторых вариантах осуществления молекула антитела включает каркасные области 1-3 тяжелой цепи из BAP049-hum03, BAP049-hum04, BAP049-hum08, BAP049-hum10 или BAP049-Clone-D (например, SEQ ID NO: 147 (VHFW1), SEQ ID NO: 157 (VHFW2) и SEQ ID NO: 166 (VHFW3)). В некоторых вариантах осуществления молекула антитела включает каркасные области 1-3 тяжелой цепи из BAP049-hum14 или BAP049-hum15 (например, SEQ ID NO: 151 (VHFW1), SEQ ID NO: 157 (VHFW2) и SEQ ID NO: 166 (VHFW3)). В некоторых вариантах осуществления молекула антитела включает каркасные области 1-3 тяжелой цепи из BAP049-hum16 (например, SEQ ID NO: 147 (VHFW1), SEQ ID NO: 160 (VHFW2) и SEQ ID NO: 166 (VHFW3)). В некоторых вариантах осуществления молекула антитела дополнительно включает каркасную область 4 тяжелой цепи (VHFW4) из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E (например, SEQ ID NO: 169).
В некоторых вариантах осуществления молекула антитела против PD-1 включает каркасные области 1-3 легкой цепи из BAP049-hum01 или BAP049-Clone-A (например, SEQ ID NO: 177 (VLFW1), SEQ ID NO: 187 (VLFW2) и SEQ ID NO: 202 (VLFW3)). В некоторых вариантах осуществления молекула антитела включает каркасные области 1-3 легкой цепи из BAP049-hum02 или BAP049-hum03 (например, SEQ ID NO: 185 (VLFW1), SEQ ID NO: 187 (VLFW2) и SEQ ID NO: 200 (VLFW3)). В некоторых вариантах осуществления молекула антитела включает каркасные области 1-3 легкой цепи из BAP049-hum04, BAP049-hum05 или BAP049-Clone-B (например, SEQ ID NO: 177 (VLFW1), SEQ ID NO: 191 (VLFW2) и SEQ ID NO: 205 (VLFW3)). В некоторых вариантах осуществления молекула антитела включает каркасные области 1-3 легкой цепи из BAP049-hum06 (например, SEQ ID NO: 181 (VLFW1), SEQ ID NO: 187 (VLFW2) и SEQ ID NO: 196 (VLFW3)). В некоторых вариантах осуществления молекула антитела включает каркасные области 1-3 легкой цепи из BAP049-hum07 (например, SEQ ID NO: 177 (VLFW1), SEQ ID NO: 191 (VLFW2) и SEQ ID NO: 196 (VLFW3)). В некоторых вариантах осуществления молекула антитела включает каркасные области 1-3 легкой цепи из BAP049-hum08, BAP049-hum09, BAP049-hum15, BAP049-hum16 или BAP049-Clone-C (например, SEQ ID NO: 174 (VLFW1), SEQ ID NO: 187 (VLFW2) и SEQ ID NO: 196 (VLFW3)). В некоторых вариантах осуществления молекула антитела включает каркасные области 1-3 легкой цепи из BAP049-hum10, BAP049-hum11, BAP049-hum14, BAP049-Clone-D или BAP049-Clone-E (например, SEQ ID NO: 177 (VLFW1), SEQ ID NO: 187 (VLFW2) и SEQ ID NO: 196 (VLFW3)). В некоторых вариантах осуществления молекула антитела включает каркасные области 1-3 легкой цепи из BAP049-hum12 (например, SEQ ID NO: 185 (VLFW1), SEQ ID NO: 194 (VLFW2) и SEQ ID NO: 196 (VLFW3)). В некоторых вариантах осуществления молекула антитела включает каркасные области 1-3 легкой цепи из BAP049-hum13 (например, SEQ ID NO: 183 (VLFW1), SEQ ID NO: 191 (VLFW2) и SEQ ID NO: 196 (VLFW3)). В некоторых вариантах осуществления молекула антитела дополнительно включает каркасную область 4 легкой цепи (VLFW4) из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E (например, SEQ ID NO: 208).
В некоторых вариантах осуществления молекула антитела против PD-1 включает каркасные области 1-3 тяжелой цепи из BAP049-hum01 или BAP049-Clone-A (например, SEQ ID NO: 147 (VHFW1), SEQ ID NO: 153 (VHFW2) и SEQ ID NO: 162 (VHFW3)) и каркасные области 1-3 легкой цепи из BAP049-hum01 или BAP049-Clone-A (например, SEQ ID NO: 177 (VLFW1), SEQ ID NO: 187 (VLFW2) и SEQ ID NO: 202 (VLFW3)).
В некоторых вариантах осуществления молекула антитела против PD-1 включает каркасные области 1-3 тяжелой цепи из BAP049-hum02 (например, SEQ ID NO: 147 (VHFW1), SEQ ID NO: 153 (VHFW2) и SEQ ID NO: 162 (VHFW3)) и каркасные области 1-3 легкой цепи из BAP049-hum02 (например, SEQ ID NO: 185 (VLFW1), SEQ ID NO: 187 (VLFW2) и SEQ ID NO: 200 (VLFW3)).
В некоторых вариантах осуществления молекула антитела против PD-1 включает каркасные области 1-3 тяжелой цепи из BAP049-hum03 (например, SEQ ID NO: 147 (VHFW1), SEQ ID NO: 157 (VHFW2) и SEQ ID NO: 166 (VHFW3)) и каркасные области 1-3 легкой цепи из BAP049-hum03 (например, SEQ ID NO: 185 (VLFW1), SEQ ID NO: 187 (VLFW2) и SEQ ID NO: 200 (VLFW3)).
В некоторых вариантах осуществления молекула антитела против PD-1 включает каркасные области 1-3 тяжелой цепи из BAP049-hum04 (например, SEQ ID NO: 147 (VHFW1), SEQ ID NO: 157 (VHFW2) и SEQ ID NO: 166 (VHFW3)) и каркасные области 1-3 легкой цепи из BAP049-hum04 (например, SEQ ID NO: 177 (VLFW1), SEQ ID NO: 191 (VLFW2) и SEQ ID NO: 205 (VLFW3)).
В некоторых вариантах осуществления молекула антитела против PD-1 включает каркасные области 1-3 тяжелой цепи из BAP049-hum05 или BAP049-Clone-B (например, SEQ ID NO: 147 (VHFW1), SEQ ID NO: 153 (VHFW2) и SEQ ID NO: 162 (VHFW3)) и каркасные области 1-3 легкой цепи из BAP049-hum05 или BAP049-Clone-B (например, SEQ ID NO: 177 (VLFW1), SEQ ID NO: 191 (VLFW2) и SEQ ID NO: 205 (VLFW3)).
В некоторых вариантах осуществления молекула антитела против PD-1 включает каркасные области 1-3 тяжелой цепи из BAP049-hum06 (например, SEQ ID NO: 147 (VHFW1), SEQ ID NO: 153 (VHFW2) и SEQ ID NO: 162 (VHFW3)) и каркасные области 1-3 легкой цепи из BAP049-hum06 (например, SEQ ID NO: 181 (VLFW1), SEQ ID NO: 187 (VLFW2) и SEQ ID NO: 196 (VLFW3)).
В некоторых вариантах осуществления молекула антитела против PD-1 включает каркасные области 1-3 тяжелой цепи из BAP049-hum07 (например, SEQ ID NO: 147 (VHFW1), SEQ ID NO: 153 (VHFW2) и SEQ ID NO: 162 (VHFW3)) и каркасные области 1-3 легкой цепи из BAP049-hum07 (например, SEQ ID NO: 177 (VLFW1), SEQ ID NO: 191 (VLFW2) и SEQ ID NO: 196 (VLFW3)).
В некоторых вариантах осуществления молекула антитела против PD-1 включает каркасные области 1-3 тяжелой цепи из BAP049-hum08 (например, SEQ ID NO: 147 (VHFW1), SEQ ID NO: 157 (VHFW2) и SEQ ID NO: 166 (VHFW3)) и каркасные области 1-3 легкой цепи из BAP049-hum08 (например, SEQ ID NO: 174 (VLFW1), SEQ ID NO: 187 (VLFW2) и SEQ ID NO: 196 (VLFW3)).
В некоторых вариантах осуществления молекула антитела против PD-1 включает каркасные области 1-3 тяжелой цепи из BAP049-hum09 или BAP049-Clone-C (например, SEQ ID NO: 147 (VHFW1), SEQ ID NO: 153 (VHFW2) и SEQ ID NO: 162 (VHFW3)) и каркасные области 1-3 легкой цепи из BAP049-hum09 или BAP049-Clone-C (например, SEQ ID NO: 174 (VLFW1), SEQ ID NO: 187 (VLFW2) и SEQ ID NO: 196 (VLFW3)).
В некоторых вариантах осуществления молекула антитела против PD-1 включает каркасные области 1-3 тяжелой цепи из BAP049-hum10 или BAP049-Clone-D (например, SEQ ID NO: 147 (VHFW1), SEQ ID NO: 157 (VHFW2) и SEQ ID NO: 166 (VHFW3)) и каркасные области 1-3 легкой цепи из BAP049-hum10 или BAP049-Clone-D (например, SEQ ID NO: 177 (VLFW1), SEQ ID NO: 187 (VLFW2) и SEQ ID NO: 196 (VLFW3)).
В некоторых вариантах осуществления молекула антитела против PD-1 включает каркасные области 1-3 тяжелой цепи из BAP049-hum11 или BAP049-Clone-E (например, SEQ ID NO: 147 (VHFW1), SEQ ID NO: 153 (VHFW2) и SEQ ID NO: 162 (VHFW3)) и каркасные области 1-3 легкой цепи из BAP049-hum11 или BAP049-Clone-E (например, SEQ ID NO: 177 (VLFW1), SEQ ID NO: 187 (VLFW2) и SEQ ID NO: 196 (VLFW3)).
В некоторых вариантах осуществления молекула антитела против PD-1 включает каркасные области 1-3 тяжелой цепи из BAP049-hum12 (например, SEQ ID NO: 147 (VHFW1), SEQ ID NO: 153 (VHFW2) и SEQ ID NO: 162 (VHFW3)) и каркасные области 1-3 легкой цепи из BAP049-hum12 (например, SEQ ID NO: 185 (VLFW1), SEQ ID NO: 194 (VLFW2) и SEQ ID NO: 196 (VLFW3)).
В некоторых вариантах осуществления молекула антитела против PD-1 включает каркасные области 1-3 тяжелой цепи из BAP049-hum13 (например, SEQ ID NO: 147 (VHFW1), SEQ ID NO: 153 (VHFW2) и SEQ ID NO: 162 (VHFW3)) и каркасные области 1-3 легкой цепи из BAP049-hum13 (например, SEQ ID NO: 183 (VLFW1), SEQ ID NO: 191 (VLFW2) и SEQ ID NO: 196 (VLFW3)).
В некоторых вариантах осуществления молекула антитела против PD-1 включает каркасные области 1-3 тяжелой цепи из BAP049-hum14 (например, SEQ ID NO: 151 (VHFW1), SEQ ID NO: 157 (VHFW2) и SEQ ID NO: 166 (VHFW3)) и каркасные области 1-3 легкой цепи из BAP049-hum14 (например, SEQ ID NO: 177 (VLFW1), SEQ ID NO: 187 (VLFW2) и SEQ ID NO: 196 (VLFW3)).
В некоторых вариантах осуществления молекула антитела против PD-1 включает каркасные области 1-3 тяжелой цепи из BAP049-hum15 (например, SEQ ID NO: 151 (VHFW1), SEQ ID NO: 157 (VHFW2) и SEQ ID NO: 166 (VHFW3)) и каркасные области 1-3 легкой цепи из BAP049-hum15 (например, SEQ ID NO: 174 (VLFW1), SEQ ID NO: 187 (VLFW2) и SEQ ID NO: 196 (VLFW3)).
В некоторых вариантах осуществления молекула антитела против PD-1 включает каркасные области 1-3 тяжелой цепи из BAP049-hum16 (например, SEQ ID NO: 147 (VHFW1), SEQ ID NO: 160 (VHFW2) и SEQ ID NO: 166 (VHFW3)) и каркасные области 1-3 легкой цепи из BAP049-hum16 (например, SEQ ID NO: 174 (VLFW1), SEQ ID NO: 187 (VLFW2) и SEQ ID NO: 196 (VLFW3)).
В некоторых вариантах осуществления молекула антитела против PD-1 дополнительно включает каркасную область 4 тяжелой цепи (VHFW4) из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E (например, SEQ ID NO: 169) и каркасную область 4 легкой цепи (VLFW4) из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E (например, SEQ ID NO: 208).
В некоторых вариантах осуществления молекула антитела против PD-1 включает каркасную область тяжелой цепи, содержащую комбинацию каркасных областей FW1, FW2 и FW3, как показано на ФИГ. 5 или 7. В другом варианте осуществления молекула антитела включает каркасную область легкой цепи, содержащую комбинацию каркасных областей FW1, FW2 и FW3, как показано на ФИГ. 5 или 7. В других вариантах осуществления молекула антитела включает каркасную область тяжелой цепи, содержащую комбинацию каркасных областей FW1, FW2 и FW3, как показано на ФИГ. 5 или 7, и каркасную область легкой цепи, содержащую комбинацию каркасных областей FW1, FW2 и FW3, как показано на ФИГ. 5 или 7.
В одном варианте осуществления вариабельный домен тяжелой или легкой цепи, или оба, молекулы антитела против PD-1 включает аминокислотную последовательность, которая по существу идентична аминокислотной последовательности, раскрытой в настоящей заявке, например, по меньшей мере на 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или выше идентична вариабельной области антитела, описанного в настоящей заявке, например, антитела, выбранного из любого из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E; или описанную в Таблице 1 или кодируемую нуклеотидной последовательностью в Таблице 1; или которая отличается по меньшей мере 1 или 5 остатками, но меньше чем 40, 30, 20 или 10 остатками из вариабельной области антитела, описанного в настоящей заявке.
В одном варианте осуществления вариабельная область тяжелой или легкой цепи, или обе, молекулы антитела против PD-1 включает аминокислотную последовательность, кодируемую последовательностью нуклеиновой кислоты, описанной в настоящей заявке или нуклеиновой кислоты, которая гибридизуется с последовательностью нуклеиновой кислоты, описанной в настоящей заявке (например, последовательностью нуклеиновой кислоты, как показано в Таблицах 1 и 2), или ее комплементом, например, при условиях низкой строгости, средней строгости или высокой строгости или других условиях гибридизации, описанных в настоящей заявке.
В другом варианте осуществления молекула антитела против PD-1 включает по меньшей мере одну, две, три или четыре антигенсвязывающих области, например, вариабельных области, имеющих аминокислотную последовательность, представленную в Таблице 1, или последовательность, по существу идентичную ей (например, последовательность, идентичную ей по меньшей мере приблизительно на 85%, 90%, 95%, 99% или более, или которая отличается не больше чем 1, 2, 5, 10 или 15 аминокислотными остатками от последовательностей, показанных в Таблице 1). В другом варианте осуществления молекула антитела против PD-1 включает VH и/или VL домен, кодируемый нуклеиновой кислотой, имеющей нуклеотидную последовательность, представленную в Таблице 1, или последовательность, по существу идентичную ей (например, последовательность, идентичную ей по меньшей мере приблизительно на 85%, 90%, 95%, 99% или более, или которая отличается не больше чем 3, 6, 15, 30 или 45 нуклеотидами от последовательностей, показанных в Таблице 1).
В еще одном варианте осуществления молекула антитела против PD-1 включает по меньшей мере одну, две или три CDR-области из вариабельной области тяжелой цепи, имеющей аминокислотную последовательность, представленную в Таблице 1, или последовательность, по существу гомологичную ей (например, последовательность, идентичную ей по меньшей мере приблизительно на 85%, 90%, 95%, 99% или более, и/или имеющую одну, две, три или больше замен, вставок или делеций, например, косервативных замен). В еще одном варианте осуществления молекула антитела против PD-1 включает по меньшей мере одну, две или три CDR-области из вариабельной области легкой цепи, имеющей аминокислотную последовательность, представленную в Таблице 1, или последовательность, по существу гомологичную ей (например, последовательность, идентичную ей по меньшей мере приблизительно на 85%, 90%, 95%, 99% или более, и/или имеющую одну, две, три или больше замен, вставок или делеций, например, косервативных замен). В еще одном варианте осуществления молекула антитела против PD-1 включает по меньшей мере одну, две, три, четыре, пять или шесть CDR-областей из вариабельных областей тяжелой и легкой цепи, имеющих аминокислотную последовательность, представленную в Таблице 1), или последовательность, по существу гомологичную ей (например, последовательность, идентичную ей по меньшей мере приблизительно на 85%, 90%, 95%, 99% или более, и/или имеющую одну, две, три или больше замен, вставок или делеций, например, косервативных замен).
В одном варианте осуществления молекула антитела против PD-1 включает по меньшей мере одну, две или три CDR-области и/или гипервариабельные петли из вариабельной области тяжелой цепи, имеющей аминокислотную последовательность антитела, описанного в настоящей заявке, например, антитела, выбранного из любого из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E, как представлено в Таблице 1, или последовательность, по существу идентичную ей (например, последовательность, идентичную ей по меньшей мере приблизительно на 85%, 90%, 95%, 99% или более, и/или имеющую одну, две, три или больше замен, вставок или делеций, например, косервативных замен). В другом варианте осуществления молекула антитела против PD-1 включает по меньшей мере одну, две или три CDR-области и/или гипервариабельные петли из вариабельной области легкой цепи, имеющей аминокислотную последовательность антитела, описанного в настоящей заявке, например, антитела, выбранного из любого из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E, как представлено в Таблице 1, или последовательность, по существу идентичную ей (например, последовательность, идентичную ей по меньшей мере приблизительно на 85%, 90%, 95%, 99% или более, и/или имеющую одну, две, три или больше замен, вставок или делеций, например, косервативных замен). В одном варианте осуществления молекула антитела против PD-1 включает все шесть CDR-областей и/или гипервариабельных петель, описанных в настоящей заявке, например, описанных в Таблице 1.
В одном варианте осуществления молекула антитела против PD-1 имеет вариабельную область, которая идентична по последовательности или которая отличается на 1, 2, 3 или 4 аминокислоты от вариабельной области, описанной в настоящей заявке (например, FR-области, раскрытой в настоящей заявке).
В одном варианте осуществления молекула антитела против PD-1 представляет собой полноразмерное антитело или его фрагмент (например, Fab, F(ab')2, Fv или одноцепочечный Fv-фрагмент (scFv)). В некоторых вариантах осуществления молекула антитела против PD-1 представляет собой моноклональное антитело или антитело с одиночной специфичностью. Молекула антитела против PD-1 также может быть молекулой гуманизированного, химерного, верблюжьего, акульего или полученного in vitro антитела. В одном варианте осуществления такая молекула антитела против PD-1 является молекулой гуманизированного антитела. Тяжелые и легкие цепи молекулы антитела против PD-1 могут быть полноразмерными (например, антитело может включать по меньшей мере одну, а предпочтительно две, полноразмерных тяжелых цепи и по меньшей мере одну, а предпочтительно две, полноразмерных легких цепи), или может включать антигенсвязывающий фрагмент (например, Fab, F(ab')2, Fv, одноцепочечный Fv-фрагмент, однодоменное антитело, диатело (dAb), двухвалентное антитело или биспецифичное антитело или его фрагмент, их однодоменный вариант или верблюжье антитело).
В других вариантах осуществления молекула антитела против PD-1 имеет константную область тяжелой цепи (Fc), выбранную из, например, константных областей тяжелой цепи IgG1, IgG2, IgG3, IgG4, IgM, IgA1, IgA2, IgD и IgE; в частности, выбранную из, например, константных областей тяжелой цепи IgG1, IgG2, IgG3 и IgG4, более конкретно, константной области тяжелой цепи IgG1 или IgG2 (например, человеческого IgG1, IgG2 или IgG4). В одном варианте осуществления константная область тяжелой цепи происходит из человеческого IgG1. В другом варианте осуществления молекула антитела против PD-1 имеет константную область легкой цепи, выбранную из, например, константных областей каппа или лямбда легкой цепи, предпочтительно каппа (например, каппа человека). В одном варианте осуществления константная область изменена, например подвергнута мутации, с целью изменения свойств молекулы антитела против PD-1 (например, для увеличения или уменьшения одного или более следующего: связывание Fc-рецептора, гликозилирование антитела, количество остатков цистеина, функция эффекторных клеток или функция комплемента). Например, константная область содержит мутацию в положениях 296 (M→Y), 298 (S→T), 300 (T→E), 477 (H→K) и 478 (N→F) для изменения связывания Fc-рецептора (например, мутантные положения соответствуют положениям 132 (M→Y), 134 (S→T), 136 (T→E), 313 (H→K) и 314 (N→F) SEQ ID NO: 212 или 214; или положениям 135 (M→Y), 137 (S→T), 139 (T→E), 316 (H→K) и 317 (N→F) SEQ ID NO: 215, 216, 217 или 218). В другом варианте осуществления константная область тяжелой цепи IgG4, например, человеческого IgG4, содержит мутацию в положении 228 согласно нумерации EU (например, S→P), например, как показано в Таблице 3. В некоторых вариантах осуществления молекулы антитела против PD-1 включают человеческий IgG4, содержащий мутацию в положении 228 согласно нумерации EU (например, S→P), например, как показано в Таблице 3; и константную область каппа легкой цепи, например, как показано в Таблице 3. В другом варианте осуществления константная область тяжелой цепи IgG1, например, человеческого IgG1, содержит мутацию в одном или более из положения 297 согласно нумерации EU (например, N→A), положения 265 согласно нумерации EU (например, D→A), положения 329 согласно нумерации EU (например, P→A), положения 234 согласно нумерации EU (например, L→A) или положения 235 согласно нумерации EU (например, L→A), например, как показано в Таблице 3. В некоторых вариантах осуществления молекулы антитела против PD-1 включают человеческий IgG1, содержащий мутацию в одном или более из вышеуказанных положений, например, как показано в Таблице 3; и константную область каппа легкой цепи, например, как показано в Таблице 3.
В одном варианте осуществления молекула антитела против PD-1 является выделенной или рекомбинантной.
В одном варианте осуществления молекула антитела против PD-1 является молекулой гуманизированного антитела.
В одном варианте осуществления молекула антитела против PD-1 имеет оценку риска на основе анализа эпитопов Т-клеток меньше 700, 600, 500, 400 или меньше.
В одном варианте осуществления молекула антитела против PD-1 является молекулой гуманизированного антитела и имеет оценку риска на основе анализа эпитопов Т-клеток 300-700, 400-650, 450-600 или оценку риска, как описано в настоящей заявке.
В одном варианте осуществления молекула антитела против PD-1 включает:
(a) вариабельную область тяжелой цепи (VH), включающую аминокислотную последовательность VHCDR1 SEQ ID NO: 4, аминокислотную последовательность VHCDR2 SEQ ID NO: 5 и аминокислотную последовательность VHCDR3 SEQ ID NO: 3; и вариабельную область легкой цепи (VL), включающую аминокислотную последовательность VLCDR1 SEQ ID NO: 13, аминокислотную последовательность VLCDR2 SEQ ID NO: 14 и аминокислотную последовательность VLCDR3 SEQ ID NO: 33;
(b) VH, включающую аминокислотную последовательность VHCDR1, выбранную из SEQ ID NO: 1; аминокислотную последовательность VHCDR2 SEQ ID NO: 2 и аминокислотную последовательность VHCDR3 SEQ ID NO: 3; и VL, включающую аминокислотную последовательность VLCDR1 SEQ ID NO: 10, аминокислотную последовательность VLCDR2 SEQ ID NO: 11 и аминокислотную последовательность VLCDR3 SEQ ID NO: 32;
(c) VH, включающую аминокислотную последовательность VHCDR1 SEQ ID NO: 224, аминокислотную последовательность VHCDR2 SEQ ID NO: 5 и аминокислотную последовательность VHCDR3 SEQ ID NO: 3; и VL, включающую аминокислотную последовательность VLCDR1 SEQ ID NO: 13, аминокислотную последовательность VLCDR2 SEQ ID NO: 14 и аминокислотную последовательность VLCDR3 SEQ ID NO: 33; или
(d) VH, включающую аминокислотную последовательность VHCDR1 SEQ ID NO: 224; аминокислотную последовательность VHCDR2 SEQ ID NO: 2 и аминокислотную последовательность VHCDR3 SEQ ID NO: 3; и VL, включающую аминокислотную последовательность VLCDR1 SEQ ID NO: 10, аминокислотную последовательность VLCDR2 SEQ ID NO: 11 и аминокислотную последовательность VLCDR3 SEQ ID NO: 32.
В некоторых вариантах осуществления молекула антитела против PD-1 включает:
(i) вариабельную область тяжелой цепи (VH), включающую аминокислотную последовательность VHCDR1, выбранную из SEQ ID NO: 1, SEQ ID NO: 4 или SEQ ID NO: 224; аминокислотную последовательность VHCDR2 SEQ ID NO: 2 и аминокислотную последовательность VHCDR3 SEQ ID NO: 3; и
(ii) вариабельную область легкой цепи (VL), включающую аминокислотную последовательность VLCDR1 SEQ ID NO: 10, аминокислотную последовательность VLCDR2 SEQ ID NO: 11 и аминокислотную последовательность VLCDR3 SEQ ID NO: 32.
В других вариантах осуществления молекула антитела против PD-1 включает:
(i) вариабельную область тяжелой цепи (VH), включающую аминокислотную последовательность VHCDR1, выбранную из SEQ ID NO: 1, SEQ ID NO: 4 или SEQ ID NO: 224; аминокислотную последовательность VHCDR2 SEQ ID NO: 5 и аминокислотную последовательность VHCDR3 SEQ ID NO: 3; и
(ii) вариабельную область легкой цепи (VL), включающую аминокислотную последовательность VLCDR1 SEQ ID NO: 13, аминокислотную последовательность VLCDR2 SEQ ID NO: 14 и аминокислотную последовательность VLCDR3 SEQ ID NO: 33.
В вариантах осуществления вышеуказанных молекул антитела, VHCDR1 включает аминокислотную последовательность SEQ ID NO:1. В других вариантах осуществления VHCDR1 включает аминокислотную последовательность SEQ ID NO:4. В других вариантах осуществления VHCDR1 включает аминокислотную последовательность SEQ ID NO: 224.
В вариантах осуществления вышеуказанные молекулы антитела имеют вариабельную область тяжелой цепи, включающую по меньшей мере одну каркасную (FW) область, включающую аминокислотную последовательность любого из SEQ ID NO: 147, 151, 153, 157, 160, 162, 166 или 169, или аминокислотную последовательность, по меньшей мере на 90% идентичную ей, или содержащую не больше двух аминокислотных замен, вставок или делеций по сравнению с аминокислотной последовательностью любого из SEQ ID NO: 147, 151, 153, 157, 160, 162, 166 или 169.
В других вариантах осуществления вышеуказанные молекулы антитела имеют вариабельную область тяжелой цепи, включающую по меньшей мере одну каркасную область, включающую аминокислотную последовательность любого из SEQ ID NO: 147, 151, 153, 157, 160, 162, 166 или 169.
В других вариантах осуществления вышеуказанные молекулы антитела имеют вариабельную область тяжелой цепи, включающую по меньшей мере две, три или четыре каркасных области, включающие аминокислотные последовательности любого из SEQ ID NO: 147, 151, 153, 157, 160, 162, 166 или 169.
В других вариантах осуществления вышеуказанные молекулы антитела включают аминокислотную последовательность VHFW1 SEQ ID NO: 147 или 151, аминокислотную последовательность VHFW2 SEQ ID NO: 153, 157 или 160 и аминокислотную последовательность VHFW3 SEQ ID NO: 162 или 166, и, необязательно, дополнительно включают аминокислотную последовательность VHFW4 SEQ ID NO: 169.
В других вариантах осуществления вышеуказанные молекулы антитела имеют вариабельную область легкой цепи, включающую по меньшей мере одну каркасную область, включающую аминокислотную последовательность любого из SEQ ID NO: 174, 177, 181, 183, 185, 187, 191, 194, 196, 200, 202, 205 или 208, или аминокислотную последовательность, идентичную ей по меньшей мере на 90%, или содержащую не больше двух аминокислотных замен, вставок или делеций по сравнению с аминокислотной последовательностью любого из 174, 177, 181, 183, 185, 187, 191, 194, 196, 200, 202, 205 или 208.
В других вариантах осуществления вышеуказанные молекулы антитела имеют вариабельную область легкой цепи, включающую по меньшей мере одну каркасную область, включающую аминокислотную последовательность любого из SEQ ID NO: 174, 177, 181, 183, 185, 187, 191, 194, 196, 200, 202, 205 или 208.
В других вариантах осуществления вышеуказанные молекулы антитела имеют вариабельную область легкой цепи, включающую по меньшей мере две, три или четыре каркасных области, включающие аминокислотные последовательности любого из SEQ ID NO: 174, 177, 181, 183, 185, 187, 191, 194, 196, 200, 202, 205 или 208.
В других вариантах осуществления вышеуказанные молекулы антитела включают аминокислотную последовательность VLFW1 SEQ ID NO: 174, 177, 181, 183 или 185, аминокислотную последовательность VLFW2 SEQ ID NO: 187, 191 или 194 и аминокислотную последовательность VLFW3 SEQ ID NO: 196, 200, 202 или 205, и, необязательно, дополнительно включают аминокислотную последовательность VLFW4 SEQ ID NO: 208.
В других вариантах осуществления вышеуказанные антитела включают вариабельный домен тяжелой цепи, включающий аминокислотную последовательность, по меньшей мере на 85% идентичную любому из SEQ ID NO: 38, 50, 82 или 86.
В других вариантах осуществления вышеуказанные молекулы антитела включают вариабельный домен тяжелой цепи, включающий аминокислотную последовательность SEQ ID NO: 38, 50, 82 или 86.
В других вариантах осуществления вышеуказанные молекулы антитела включают вариабельный домен легкой цепи, включающий аминокислотную последовательность, по меньшей мере на 85% идентичную любому из SEQ ID NO: 42, 46, 54, 58, 62, 66, 70, 74 или 78.
В других вариантах осуществления вышеуказанные молекулы антитела включают вариабельный домен легкой цепи, включающий аминокислотную последовательность SEQ ID NO: 42, 46, 54, 58, 62, 66, 70, 74 или 78.
В других вариантах осуществления вышеуказанные молекулы антитела включают вариабельный домен тяжелой цепи, включающий аминокислотную последовательность SEQ ID NO: 38.
В других вариантах осуществления вышеуказанные молекулы антитела включают тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 40.
В других вариантах осуществления вышеуказанные молекулы антитела включают тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 91.
В других вариантах осуществления вышеуказанные молекулы антитела включают вариабельный домен тяжелой цепи, включающий аминокислотную последовательность SEQ ID NO: 50.
В других вариантах осуществления вышеуказанные молекулы антитела включают тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 52 или SEQ ID NO: 102.
В других вариантах осуществления вышеуказанные молекулы антитела включают вариабельный домен тяжелой цепи, включающий аминокислотную последовательность SEQ ID NO: 82.
В других вариантах осуществления вышеуказанные молекулы антитела включают тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 84.
В других вариантах осуществления вышеуказанные молекулы антитела включают вариабельный домен тяжелой цепи, включающий аминокислотную последовательность SEQ ID NO: 86.
В других вариантах осуществления вышеуказанные молекулы антитела включают тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 88.
В других вариантах осуществления вышеуказанные молекулы антитела включают вариабельный домен легкой цепи, включающий аминокислотную последовательность SEQ ID NO: 42.
В других вариантах осуществления вышеуказанные молекулы антитела включают легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 44.
В других вариантах осуществления вышеуказанные молекулы антитела включают вариабельный домен легкой цепи, включающий аминокислотную последовательность SEQ ID NO: 46.
В других вариантах осуществления вышеуказанные молекулы антитела включают легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 48.
В других вариантах осуществления вышеуказанные молекулы антитела включают вариабельный домен легкой цепи, включающий аминокислотную последовательность SEQ ID NO: 54.
В других вариантах осуществления вышеуказанные молекулы антитела включают легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 56.
В других вариантах осуществления вышеуказанные молекулы антитела включают вариабельный домен легкой цепи, включающий аминокислотную последовательность SEQ ID NO: 58.
В других вариантах осуществления вышеуказанные молекулы антитела включают легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 60.
В других вариантах осуществления вышеуказанные молекулы антитела включают вариабельный домен легкой цепи, включающий аминокислотную последовательность SEQ ID NO: 62.
В других вариантах осуществления вышеуказанные антитела включают легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 64.
В других вариантах осуществления вышеуказанные молекулы антитела включают вариабельный домен легкой цепи, включающий аминокислотную последовательность SEQ ID NO: 66.
В других вариантах осуществления вышеуказанные молекулы антитела включают легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 68.
В других вариантах осуществления вышеуказанные молекулы антитела включают вариабельный домен легкой цепи, включающий аминокислотную последовательность SEQ ID NO: 70.
В других вариантах осуществления вышеуказанные молекулы антитела включают легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 72.
В других вариантах осуществления вышеуказанные молекулы антитела включают вариабельный домен легкой цепи, включающий аминокислотную последовательность SEQ ID NO: 74.
В других вариантах осуществления вышеуказанные молекулы антитела включают легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 76.
В других вариантах осуществления вышеуказанные молекулы антитела включают вариабельный домен легкой цепи, включающий аминокислотную последовательность SEQ ID NO: 78.
В других вариантах осуществления вышеуказанные молекулы антитела включают легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 80.
В других вариантах осуществления вышеуказанные молекулы антитела включают вариабельный домен тяжелой цепи, включающий аминокислотную последовательность SEQ ID NO: 38, и вариабельный домен легкой цепи, включающий аминокислотную последовательность SEQ ID NO: 42.
В других вариантах осуществления вышеуказанные молекулы антитела включают вариабельный домен тяжелой цепи, включающий аминокислотную последовательность SEQ ID NO: 38, и вариабельный домен легкой цепи, включающий аминокислотную последовательность SEQ ID NO: 66.
В других вариантах осуществления вышеуказанные молекулы антитела включают вариабельный домен тяжелой цепи, включающий аминокислотную последовательность SEQ ID NO: 38, и вариабельный домен легкой цепи, включающий аминокислотную последовательность SEQ ID NO: 70.
В других вариантах осуществления вышеуказанные молекулы антитела включают вариабельный домен тяжелой цепи, включающий аминокислотную последовательность SEQ ID NO: 50, и вариабельный домен легкой цепи, включающий аминокислотную последовательность SEQ ID NO: 70.
В других вариантах осуществления вышеуказанные молекулы антитела включают вариабельный домен тяжелой цепи, включающий аминокислотную последовательность SEQ ID NO: 38, и вариабельный домен легкой цепи, включающий аминокислотную последовательность SEQ ID NO: 46.
В других вариантах осуществления вышеуказанные молекулы антитела включают вариабельный домен тяжелой цепи, включающий аминокислотную последовательность SEQ ID NO: 50, и вариабельный домен легкой цепи, включающий аминокислотную последовательность SEQ ID NO: 46.
В других вариантах осуществления вышеуказанные молекулы антитела включают вариабельный домен тяжелой цепи, включающий аминокислотную последовательность SEQ ID NO: 50, и вариабельный домен легкой цепи, включающий аминокислотную последовательность SEQ ID NO: 54.
В других вариантах осуществления вышеуказанные молекулы антитела включают вариабельный домен тяжелой цепи, включающий аминокислотную последовательность SEQ ID NO: 38, и вариабельный домен легкой цепи, включающий аминокислотную последовательность SEQ ID NO: 54.
В других вариантах осуществления вышеуказанные молекулы антитела включают вариабельный домен тяжелой цепи, включающий аминокислотную последовательность SEQ ID NO: 38, и вариабельный домен легкой цепи, включающий аминокислотную последовательность SEQ ID NO: 58.
В других вариантах осуществления вышеуказанные молекулы антитела включают вариабельный домен тяжелой цепи, включающий аминокислотную последовательность SEQ ID NO: 38, и вариабельный домен легкой цепи, включающий аминокислотную последовательность SEQ ID NO: 62.
В других вариантах осуществления вышеуказанные молекулы антитела включают вариабельный домен тяжелой цепи, включающий аминокислотную последовательность SEQ ID NO: 50, и вариабельный домен легкой цепи, включающий аминокислотную последовательность SEQ ID NO: 66.
В других вариантах осуществления вышеуказанные молекулы антитела включают вариабельный домен тяжелой цепи, включающий аминокислотную последовательность SEQ ID NO: 38, и вариабельный домен легкой цепи, включающий аминокислотную последовательность SEQ ID NO: 74.
В других вариантах осуществления вышеуказанные молекулы антитела включают вариабельный домен тяжелой цепи, включающий аминокислотную последовательность SEQ ID NO: 38, и вариабельный домен легкой цепи, включающий аминокислотную последовательность SEQ ID NO: 78.
В других вариантах осуществления вышеуказанные молекулы антитела включают вариабельный домен тяжелой цепи, включающий аминокислотную последовательность SEQ ID NO: 82, и вариабельный домен легкой цепи, включающий аминокислотную последовательность SEQ ID NO: 70.
В других вариантах осуществления вышеуказанные молекулы антитела включают вариабельный домен тяжелой цепи, включающий аминокислотную последовательность SEQ ID NO: 82, и вариабельный домен легкой цепи, включающий аминокислотную последовательность SEQ ID NO: 66.
В других вариантах осуществления вышеуказанные молекулы антитела включают вариабельный домен тяжелой цепи, включающий аминокислотную последовательность SEQ ID NO: 86, и вариабельный домен легкой цепи, включающий аминокислотную последовательность SEQ ID NO: 66.
В других вариантах осуществления вышеуказанные молекулы антитела включают тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 91, и легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 44.
В других вариантах осуществления вышеуказанные молекулы антитела включают тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 91, и легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 56.
В других вариантах осуществления вышеуказанные молекулы антитела включают тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 91, и легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 68.
В других вариантах осуществления вышеуказанные молекулы антитела включают тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 91, и легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 72.
В других вариантах осуществления вышеуказанные молекулы антитела включают тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 102, и легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 72.
В других вариантах осуществления вышеуказанные молекулы антитела включают тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 40, и легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 44.
В других вариантах осуществления вышеуказанные молекулы антитела включают тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 40, и легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 48.
В других вариантах осуществления вышеуказанные молекулы антитела включают тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 52, и легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 48.
В других вариантах осуществления вышеуказанные молекулы антитела включают тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 52, и легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 56.
В других вариантах осуществления вышеуказанные молекулы антитела включают тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 40, и легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 56.
В других вариантах осуществления вышеуказанные антитела включают тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 40, и легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 60.
В других вариантах осуществления вышеуказанные молекулы антитела включают тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 40, и легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 64.
В других вариантах осуществления вышеуказанные молекулы антитела включают тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 52, и легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 68.
В других вариантах осуществления вышеуказанные молекулы антитела включают тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 40, и легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 68.
В других вариантах осуществления вышеуказанные молекулы антитела включают тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 52, и легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 72.
В других вариантах осуществления вышеуказанные молекулы антитела включают тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 40, и легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 72.
В других вариантах осуществления вышеуказанные молекулы антитела включают тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 40, и легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 76.
В других вариантах осуществления вышеуказанные молекулы антитела включают тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 40, и легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 80.
В других вариантах осуществления вышеуказанные молекулы антитела включают тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 84, и легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 72.
В других вариантах осуществления вышеуказанные антитела включают тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 84, и легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 68.
В других вариантах осуществления вышеуказанные молекулы антитела включают тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 88, и легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 68.
В других вариантах осуществления вышеуказанные молекулы антитела выбраны из Fab, F(ab')2, Fv или одноцепочечного Fv-фрагмента (scFv).
В других вариантах осуществления вышеуказанные молекулы антитела включают константную область тяжелой цепи, выбранную из IgG1, IgG2, IgG3 и IgG4.
В других вариантах осуществления вышеуказанные молекулы антитела включают константную область легкой цепи, выбранную из константных областей каппа или лямбда легкой цепи.
В других вариантах осуществления вышеуказанные молекулы антитела включают человеческую константную область тяжелой цепи IgG4 с мутацией в положении 228 согласно нумерации EU или положении 108 SEQ ID NO: 212 или 214 и константную область каппа легкой цепи.
В других вариантах осуществления вышеуказанные молекулы антитела включают человеческую константную область тяжелой цепи IgG4, содержащую мутацию с заменой серина на пролин в положении 228 согласно нумерации EU или положении 108 SEQ ID NO: 212 или 214, и константную область каппа легкой цепи.
В других вариантах осуществления вышеуказанные молекулы антитела включают человеческую константную область тяжелой цепи IgG1, содержащую мутацию с заменой аспарагина на аланин в положении 297 согласно нумерации EU или положении 180 SEQ ID NO: 216, и константную область каппа легкой цепи.
В других вариантах осуществления вышеуказанные молекулы антитела включают человеческую константную область тяжелой цепи IgG1, содержащую мутацию с заменой аспартата на аланин в положении 265 согласно нумерации EU или положении 148 SEQ ID NO: 217 и мутацию с заменой пролина на аланин в положении 329 согласно нумерации EU или положении 212 SEQ ID NO: 217, и константную область каппа легкой цепи.
В других вариантах осуществления вышеуказанные молекулы антитела включают человеческую константную область тяжелой цепи IgG1, содержащую мутацию с заменой лейцина на аланин в положении 234 согласно нумерации EU или положении 117 SEQ ID NO: 218 и мутацию с заменой лейцина на аланин в положении 235 согласно нумерации EU или положении 118 SEQ ID NO: 218, и константную область каппа легкой цепи.
В других вариантах осуществления вышеуказанные молекулы антитела способны к связыванию с человеческим PD-1 с константой диссоциации (KD) меньше чем приблизительно 0,2 нМ.
В некоторых вариантах осуществления вышеуказанные молекулы антитела связываются с человеческим PD-1 с KD меньше чем приблизительно 0,2 нМ, 0,15 нМ, 0,1 нМ, 0,05 нМ или 0,02 нМ, например, приблизительно от 0,13 нМ до 0,03 нМ, например, приблизительно от 0,077 нМ до 0,088 нМ, например, приблизительно 0,083 нМ, например, при измерении с помощью метода BiaCore.
В других вариантах осуществления вышеуказанные молекулы антитела связываются с PD-1 яванского макака с KD меньше чем приблизительно 0,2 нМ, 0,15 нМ, 0,1 нМ, 0,05 нМ или 0,02 нМ, например, приблизительно от 0,11 нМ до 0,08 нМ, например, приблизительно 0,093 нМ, например, при измерении с помощью метода BiaCore.
В некоторых вариантах осуществления вышеуказанные молекулы антитела связываются с человеческим PD-1 и с PD-1 яванского макака с аналогичной KD, например, в нМ диапазоне, например, при измерении с помощью метода BiaCore. В некоторых вариантах осуществления вышеуказанные молекулы антитела связываются со слитым белком человеческого PD-1-Ig с KD меньше чем приблизительно 0,1 нМ, 0,075 нМ, 0,05 нМ, 0,025 нМ или 0,01 нМ, например, приблизительно 0,04 нМ, например, при измерении с помощью ELISA.
В некоторых вариантах осуществления вышеуказанные молекулы антитела связываются с клетками Jurkat, которые экспрессируют человеческий PD-1 (например, трансфицированными человеческим PD-1 клетками Jurkat) с KD меньше чем приблизительно 0,1 нМ, 0,075 нМ, 0,05 нМ, 0,025 нМ или 0,01 нМ, например, приблизительно 0,06 нМ, например, при измерении с помощью FACS анализа.
В некоторых вариантах осуществления вышеуказанные молекулы антитела связываются с Т-клетками яванского макака с KD меньше чем приблизительно 1 нМ, 0,75 нМ, 0,5 нМ, 0,25 нМ или 0,1 нМ, например, приблизительно 0,4 нМ, например, при измерении с помощью FACS анализа.
В некоторых вариантах осуществления вышеуказанные молекулы антитела связываются с клетками, которые экспрессируют PD-1 яванского макака (например, клетками, трансфицированными PD-1 яванского макака) с KD меньше чем приблизительно 1 нМ, 0,75 нМ, 0,5 нМ, 0,25 нМ или 0,01 нМ, например, приблизительно 0,6 нМ, например, при измерении с помощью FACS анализа.
В некоторых вариантах осуществления вышеуказанные молекулы антитела не обладают перекрестной реактивностью с мышиным или крысиным PD-1. В других вариантах осуществления вышеуказанные антитела обладают перекрестной реактивностью с PD-1 макака-резуса. Например, перекрестная реактивность может быть измерена с помощью метода BiaCore или анализа связывания с использованием клеток, которые экспрессируют PD-1 (например, клеток 300.19, экспрессирующих человеческий PD-1). В других вариантах осуществления вышеуказанные молекулы антитела связывают внеклеточный Ig-подобный домен PD-1.
В других вариантах осуществления вышеуказанные молекулы антитела способны уменьшать связывание PD-1 с PD-L1, PD-L2 или обоими, или с клеткой, которая экспрессирует PD-L1, PD-L2 или оба. В некоторых вариантах осуществления вышеуказанные молекулы антитела уменьшают (например, блокируют) связывание PD-L1 с клеткой, которая экспрессирует PD-1 (например, клетками 300.19, экспрессирующими человеческий PD-1) с IC50 меньше чем приблизительно 1,5 нМ, 1 нМ, 0,8 нМ, 0,6 нМ, 0,4 нМ, 0,2 нМ или 0,1 нМ, например, от приблизительно 0,79 нМ до приблизительно 1,09 нм, например, приблизительно 0,94 нМ или приблизительно 0,78 нМ или меньше, например, приблизительно 0,3 нМ. В некоторых вариантах осуществления вышеуказанные антитела уменьшают (например, блокируют) связывание PD-L2 с клеткой, которая экспрессирует PD-1 (например, клетками 300.19, экспрессирующими человеческий PD-1) с IC50 меньше чем приблизительно 2 нМ, 1,5 нМ, 1 нМ, 0,5 нМ или 0,2 нМ, например, от приблизительно 1,05 нМ до приблизительно 1,55 нМ, или приблизительно 1,3 нМ или меньше, например, приблизительно 0,9 нМ.
В других вариантах осуществления вышеуказанные молекулы антитела способны усиливать антигенспецифичный Т-клеточный ответ.
В вариантах осуществления молекула антитела является молекулой моноспецифичного антитела или молекулой биспецифичного антитела. В вариантах осуществления молекула антитела обладает первой специфичностью связывания в отношении PD-1 и второй специфичностью связывания в отношении TIM-3, LAG-3, CEACAM (например, CEACAM-1, CEACAM-3 и/или CEACAM-5), PD-L1 или PD-L2. В вариантах осуществления молекула антитела включает антигенсвязывающий фрагмент антитела, например, полуантитело или антигенсвязывающий фрагмент полуантитела.
В некоторых вариантах осуществления вышеуказанные молекулы антитела увеличивают экспрессию IL-2 из клеток, активированных стафилококковым энтеротоксином B (SEB) (например, в концентрации 25 мкг/мл), по меньшей мере приблизительно в 2, 3, 4, 5 раз, например, приблизительно в 2-3 раза, например, приблизительно в 2-2,6 раза, например, приблизительно в 2,3 раза, по сравнению с экспрессией IL-2 в случае использования изотипического контроля (например, IgG4), например, при измерении в анализе с SEB активацией Т-клеток или анализе человеческой цельной крови ex vivo.
В некоторых вариантах осуществления вышеуказанные молекулы антитела увеличивают экспрессию IFN-γ из Т-клеток, стимулированных антителом против CD3 (например, в концентрации 0,1 мкг/мл), по меньшей мере приблизительно в 2, 3, 4, 5 раз, например, приблизительно в 1,2-3,4 раза, например, приблизительно в 2,3 раза, по сравнению с экспрессией IFN-γ в случае использования изотипического контроля (например, IgG4), например, при измерении в анализе активности IFN-γ.
В некоторых вариантах осуществления вышеуказанные молекулы антитела увеличивают экспрессию IFN-γ из Т-клеток, активированных SEB (например, в концентрации 3 пг/мл), по меньшей мере приблизительно в 2, 3, 4, 5 раз, например, приблизительно в 0,5-4,5 раза, например, приблизительно в 2,5 раза, по сравнению с экспрессией IFN-γ в случае использования изотипического контроля (например, IgG4), например, при измерении в анализе активности IFN-γ.
В некоторых вариантах осуществления вышеуказанные молекулы антитела увеличивают экспрессию IFN-γ из Т-клеток, активированных пептидом ЦМВ, по меньшей мере приблизительно в 2, 3, 4, 5 раз, например, приблизительно в 2-3,6 раза, например, приблизительно в 2,8 раза, по сравнению с экспрессией IFN-γ в случае использования изотипического контроля (например, IgG4), например, при измерении в анализе активности IFN-γ.
В некоторых вариантах осуществления вышеуказанные молекулы антитела увеличивают пролиферацию CD8+ Т-клеток, активированных пептидом ЦМВ, по меньшей мере приблизительно в 1, 2, 3, 4, 5 раз, например, приблизительно в 1,5 раза, по сравнению с пролиферацией CD8+ Т-клеток в случае использования изотипического контроля (например, IgG4), например, при измерении процента CD8+ Т-клеток, которые прошли по меньшей мере n (например, n=2 или 4) клеточных делений.
В некоторых вариантах осуществления вышеуказанные молекулы антитела имеют Cmax от приблизительно 100 мкг/мл до приблизительно 500 мкг/мл, от приблизительно 150 мкг/мл до приблизительно 450 мкг/мл, от приблизительно 250 мкг/мл до приблизительно 350 мкг/мл или от приблизительно 200 мкг/мл до и приблизительно 400 мкг/мл, например, приблизительно 292,5 мкг/мл, например, при измерении у обезьяны.
В некоторых вариантах осуществления вышеуказанные молекулы антитела имеют T1/2 от приблизительно 250 часов до приблизительно 650 часов, от приблизительно 300 часов до приблизительно 600 часов, от приблизительно 350 часов до приблизительно 550 часов или от приблизительно 400 часов до приблизительно 500 часов, например, приблизительно 465,5 часа, например, при измерении у обезьяны.
В некоторых вариантах осуществления вышеуказанные молекулы антитела связываются с PD-1 с Kd медленее 5×10-4, 1×10-4, 5×10-5 или 1×10-5 с-1, например, приблизительно 2,13×10-4 с-1, например, при измерении с помощью метода BiaCore. В некоторых вариантах осуществления вышеуказанные молекулы антитела связываются с PD-1 с Ka быстрее 1×104, 5×104, 1×105 или 5×105 М-1с-1, например, приблизительно 2,78×105 М-1с-1, например, при измерении с помощью метода BiaCore.
В некоторых вариантах осуществления вышеуказанные молекулы антитела против PD-1 связываются с одним или более остатками в цепи C, петле CC', цепи C' и петле FG PD-1. Доменная структура PD-1 описана, например, в Cheng et al., "Structure and Interactions of the Human Programmed Cell Death 1 Receptor", J. Biol. Chem. 2013, 288:11771-11785. Как описано в публикации Cheng et al., цепь C содержит остатки F43-M50, петля СС' содержит остатки S51-N54, цепь C' содержит остатки Q55-F62, и петля FG содержит остатки L108-I114 (нумерация аминокислот приведена в соответствии с Cheng et al., выше). Таким образом, в некоторых вариантах осуществления антитело против PD-1, как описано в настоящей заявке, связывается по меньшей мере с одним остатком в одном или более фрагментах F43-M50, S51-N54, Q55-F62 и L108-I114 в PD-1. В некоторых вариантах осуществления антитело против PD-1, как описано в настоящей заявке, связывается по меньшей мере с одним остатком в двух, трех или всех четырех фрагментах F43-M50, S51-N54, Q55-F62 и L108-I114 в PD-1. В некоторых вариантах осуществления антитело против PD-1 связывается с остатком в PD-1, который также является частью сайта связывания для одного или обоих из PD-L1 и PD-L2.
В другом аспекте изобретения предложена выделенная молекула нуклеиновой кислоты, кодирующая любую из вышеуказанных молекул антител, а также соответствующие векторы и клетки-хозяева.
Также предложена выделенная нуклеиновая кислота, кодирующая вариабельную область тяжелой цепи антитела или вариабельную область легкой цепи, или обе, любой из вышеуказанных молекул антител.
В одном варианте осуществления выделенная нуклеиновая кислота кодирует CDR-области 1-3 тяжелой цепи, где указанная нуклеиновая кислота включает нуклеотидную последовательность SEQ ID NO: 108-112, 223, 122-126, 133-137 или 144-146.
В другом варианте осуществления выделенная нуклеиновая кислота кодирует CDR-области 1-3 легкой цепи, где указанная нуклеиновая кислота включает нуклеотидную последовательность SEQ ID NO: 113-120, 127-132 или 138-143.
В других вариантах осуществления вышеуказанная нуклеиновая кислота дополнительно включает нуклеотидную последовательность, кодирующую вариабельный домен тяжелой цепи, где указанная нуклеотидная последовательность по меньшей мере на 85% идентична любому из SEQ ID NO: 39, 51, 83, 87, 90, 95 или 101.
В других вариантах осуществления вышеуказанная нуклеиновая кислота дополнительно включает нуклеотидную последовательность, кодирующую вариабельный домен тяжелой цепи, где указанная нуклеотидная последовательность включает любой из SEQ ID NO: 39, 51, 83, 87, 90, 95 или 101.
В других вариантах осуществления вышеуказанная нуклеиновая кислота дополнительно включает нуклеотидную последовательность, кодирующую тяжелую цепь, где указанная нуклеотидная последовательность по меньшей мере на 85% идентична любому из SEQ ID NO: 41, 53, 85, 89, 92, 96 или 103.
В других вариантах осуществления вышеуказанная нуклеиновая кислота дополнительно включает нуклеотидную последовательность, кодирующую тяжелую цепь, где указанная нуклеотидная последовательность включает любой из SEQ ID NO: 41, 53, 85, 89, 92, 96 или 103.
В других вариантах осуществления вышеуказанная нуклеиновая кислота дополнительно включает нуклеотидную последовательность, кодирующую вариабельный домен легкой цепи, где указанная нуклеотидная последовательность по меньшей мере на 85% идентична любому из SEQ ID NO: 43, 47, 55, 59, 63, 67, 71, 75, 79, 93, 97, 99, 104 или 106.
В других вариантах осуществления вышеуказанная нуклеиновая кислота дополнительно включает нуклеотидную последовательность, кодирующую вариабельный домен легкой цепи, где указанная нуклеотидная последовательность включает любой из SEQ ID NO: 43, 47, 55, 59, 63, 67, 71, 75, 79, 93, 97, 99, 104 или 106.
В других вариантах осуществления вышеуказанная нуклеиновая кислота дополнительно включает нуклеотидную последовательность, кодирующую легкую цепь, где указанная нуклеотидная последовательность по меньшей мере на 85% идентична любому из SEQ ID NO: 45, 49, 57, 61, 65, 69, 73, 77, 81, 94, 98, 100, 105 или 107.
В других вариантах осуществления вышеуказанная нуклеиновая кислота дополнительно включает нуклеотидную последовательность, кодирующую легкую цепь, где указанная нуклеотидная последовательность включает любой из SEQ ID NO: 45, 49, 57, 61, 65, 69, 73, 77, 81, 94, 98, 100, 105 или 107.
В некоторых вариантах осуществления предложены один или более векторов экспрессии и клеток-хозяев, включающих вышеуказанные нуклеиновые кислоты.
Также предложен способ получения молекулы антитела или его фрагмента, включающий культивирование клетки-хозяина, как описано в настоящей заявке, в условиях, подходящих для экспрессии гена.
В одном аспекте изобретения предложен способ получения молекулы антитела, описанного в настоящей заявке. Способ включает: предоставление антигена PD-1 (например, антигена, включающего, по меньшей мере, часть эпитопа PD-1); получение молекулы антитела, которое специфично связывается с полипептидом PD-1; и оценку, связывается ли молекула антитела специфично с полипептидом PD-1, или оценку эффективности молекулы антитела при модуляции, например ингибировании, активности PD-1. Способ может дополнительно включать введение молекулы антитела субъекту, например, человеку или не относящемуся к человеку животному.
В другом аспекте изобретения предложены композиции, например фармацевтические композиции, которые включают фармацевтически приемлемый носитель, вспомогательное вещество или стабилизатор и по меньшей мере одно из терапевтических средств, например, молекул антител против PD-1, описанных в настоящей заявке. В одном варианте осуществления композиция, например фармацевтическая композиция, включает комбинацию молекулы антитела и одного или более средств, например, терапевтического средства или другой молекулы антитела, как описано в настоящей заявке. В одном варианте осуществления молекула антитела конъюгирована с меткой или терапевтическим средством.
Дополнительные ингибиторы PD-1 и других молекул иммунных контрольных точек
В некоторых вариантах осуществления ингибитор PD-1 является ингибитором, например, молекулой антитела против PD-1, отличающейся от молекулы антитела против PD-1 из Таблицы 1. В некоторых вариантах осуществления ингибитор PD-1 включает молекулу антитела против PD-1 из Таблицы 1 и молекулу антитела против PD-1, отличающуюся от молекулы антитела из Таблицы 1. В других вариантах осуществления ингибитор PD-1 является антителом против PD-1, выбранным из ниволумаба, пембролизумаба или пидилизумаба.
В некоторых вариантах осуществления антителом против PD-1 является ниволумаб. Альтернативные названия ниволумаба включают MDX-1106, MDX-1106-04, ONO-4538 или BMS-936558. В некоторых вариантах осуществления антителом против PD-1 является ниволумаб (Номер CAS: 946414-94-4). Ниволумаб представляет собой полностью человеческое моноклональное IgG4 антитело, которое специфично блокирует PD-1. Ниволумаб (клон 5C4) и другие человеческие моноклональные антитела, которые специфично связываются с PD-1, раскрыты в US 8,008,449 и WO2006/121168. В одном варианте осуществления ингибитором PD-1 является ниволумаб и имеет последовательность, раскрытую в настоящей заявке (или последовательность, по существу идентичную или подобную ей, например, последовательность, по меньшей мере на 85%, 90%, 95% или выше идентичную указанной последовательности).
Аминокислотные последовательности тяжелой и легкой цепи ниволумаба являются следующими:
Тяжелая цепь
QVQLVESGGGVVQPGRSLRLDCKASGITFSNSGMHWVRQAPGKGLEWVAVIWYDGSKRYYADSVKGRFTISRDNSKNTLFLQMNSLRAEDTAVYYCATNDDYWGQGTLVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVESKYGPPCPPCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK (SEQ ID NO: 242)
Легкая цепь
EIVLTQSPATLSLSPGERATLSCRASQSVSSYLAWYQQKPGQAPRLLIYDASNRATGIPARFSGSGSGTDFTLTISSLEPEDFAVYYCQQSSNWPRTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO: 243)
В некоторых вариантах осуществления антителом против PD-1 является пембролизумаб. Пембролизумаб (также называемый ламбролизумаб, MK-3475, MK03475, SCH-900475 или Китруда®; Merck) представляет собой гуманизированное моноклональное IgG4 антитело, которое связывается с PD-1. Пембролизумаб и другие гуманизированные антитела против PD-1 раскрыты в Hamid, O. et al. (2013) New England Journal of Medicine 369 (2): 134-44, US 8,354,509 и WO2009/114335. Аминокислотные последовательности тяжелой и легкой цепи пембролизумаба являются следующими:
Тяжелая цепь (SEQ ID NO: 244)
Легкая цепь (SEQ ID NO: 245)
В одном варианте осуществления ингибитором PD-1 является пембролизумаб, раскрытый, например, в US 8,354,509 и WO 2009/114335, и имеющий последовательность, раскрытую в настоящей заявке (или последовательность, по существу идентичную или подобную ей, например, последовательность, по меньшей мере на 85%, 90%, 95% или выше идентичную указанной последовательности).
В некоторых вариантах осуществления антителом против PD-1 является пидилизумаб. Пидилизумаб (CT-011; Cure Tech) представляет собой гуманизированное моноклональное IgG1k антитело, которое связывается с PD-1. Пидилизумаб и другие гуманизированные моноклональные антитела против PD-1 раскрыты в WO2009/101611.
Другие антитела против PD-1 включают AMP 514 (Amplimmune), помимо прочих, например, антитела против PD-1, раскрытые в US 8,609,089, US 2010028330 и/или US 20120114649. Дополнительные примеры антител против PD-1 также включают, например, REGN2810, BGB-108 и BGB-A317.
В некоторых вариантах осуществления ингибитором PD-1 является иммуноадгезин (например, иммуноадгезин, который включает внеклеточную или PD-1-связывающую часть PD-L1 или PD-L2, слитую с константной областью (например, Fc-областью иммуноглобулиновой последовательности). В некоторых вариантах осуществления ингибитором PD-1 является AMP-224 (B7-DCIg; Amplimmune; например, раскрытый в WO2010/027827 и WO2011/066342), Fc-слитый PD-L2 растворимый рецептор, который блокирует взаимодействие между PD-1 и B7-H1.
Примеры ингибиторов PD-L1 или PD-L2
В одном варианте осуществления комбинация, описанная в настоящей заявке, включает ингибитор PD-L1 или PD-L2. В некоторых вариантах осуществления комбинация применяется для лечения рака, например, рака, описанного в настоящей заявке, например, солидной опухоли или гемобластоза. В некоторых вариантах осуществления рак является раком щитовидной железы (например, анапластической карциномой щитовидной железы), раком эндометрия, лимфомой, раком легкого (например, немелкоклеточным раком легкого), раком молочной железы (например, трижды негативным раком молочной железы) или MSI-H раком. В некоторых вариантах осуществления ингибитор PD-L1 является антителом против PD-L1 или его фрагментом.
В варианте осуществления антитело против PD-L1 или его фрагмент являются молекулой антитела против PD-L1, раскрытой в публикации заявки на патент US 2016/0108123 (USSN 14/881,888), озаглавленной "Antibody Molecules to PD-L1 and Uses Thereof", полностью включенной посредством отсылки.
В одном варианте осуществления молекула антитела против PD-L1 включает по меньшей мере один или два вариабельных домена тяжелой цепи (необязательно включающих константную область), по меньшей мере один или два вариабельных домена легкой цепи (необязательно включающих константную область), или и то, и другое, включающие аминокислотную последовательность любого из BAP058-hum01, BAP058-hum02, BAP058-hum03, BAP058-hum04, BAP058-hum05, BAP058-hum06, BAP058-hum07, BAP058-hum08, BAP058-hum09, BAP058-hum10, BAP058-hum11, BAP058-hum12, BAP058-hum13, BAP058-hum14, BAP058-hum15, BAP058-hum16, BAP058-hum17, BAP058-Clone-K, BAP058-Clone-L, BAP058-Clone-M, BAP058-Clone-N или BAP058-Clone-O; или как описано в Таблице 1 US 2016/0108123, или кодируемые нуклеотидной последовательностью в Таблице 1; или последовательностью, по существу идентичной (например, идентичной по меньшей мере на 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или выше) любой из вышеуказанных последовательностей.
В еще одном варианте осуществления молекула антитела против PD-L1 включает по меньшей мере одну, две или три определяющие комплементарность области (CDR-области) из вариабельной области тяжелой цепи и/или вариабельной области легкой цепи антитела, описанного в настоящей заявке, например, антитела, выбранного из любого из BAP058-hum01, BAP058-hum02, BAP058-hum03, BAP058-hum04, BAP058-hum05, BAP058-hum06, BAP058-hum07, BAP058-hum08, BAP058-hum09, BAP058-hum10, BAP058-hum11, BAP058-hum12, BAP058-hum13, BAP058-hum14, BAP058-hum15, BAP058-hum16, BAP058-hum17, BAP058-Clone-K, BAP058-Clone-L, BAP058-Clone-M, BAP058-Clone-N или BAP058-Clone-O; или как описано в Таблице 1 US 2016/0108123, или кодируемые нуклеотидной последовательностью в Таблице 1; или последовательностью, по существу идентичной (например, идентичной по меньшей мере на 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или выше) любой из вышеуказанных последовательностей.
В еще одном варианте осуществления молекула антитела против PD-L1 включает по меньшей мере одну, две или три CDR-области (или одновременно все CDR-области) из вариабельной области тяжелой цепи, включающей аминокислотную последовательность, показанную в Таблице 1 US 2016/0108123 или кодируемую нуклеотидной последовательностью, показанной в Таблице 1. В одном варианте осуществления одна или более CDR-областей (или одновременно все CDR-области) имеют одно, два, три, четыре, пять, шесть или более изменений, например, аминокислотных замен или делеций, по сравнению с аминокислотной последовательностью, показанной в Таблице 1 или кодируемой нуклеотидной последовательностью, показанной в Таблице 1.
В еще одном варианте осуществления молекула антитела против PD-L1 включает по меньшей мере одну, две или три CDR-области (или одновременно все CDR-области) из вариабельной области легкой цепи, включающей аминокислотную последовательность, показанную в Таблице 1 US 2016/0108123 или кодируемую нуклеотидной последовательностью, показанной в Таблице 1. В одном варианте осуществления одна или более CDR-областей (или одновременно все CDR-области) имеют одно, два, три, четыре, пять, шесть или более изменений, например, аминокислотных замен или делеций, по сравнению с аминокислотной последовательностью, показанной в Таблице 1 или кодируемой нуклеотидной последовательностью, показанной в Таблице 1. В некоторых вариантах осуществления молекула антитела против PD-L1 включает замену в CDR-области легкой цепи, например, одну или более замен в CDR1, CDR2 и/или CDR3 легкой цепи.
В другом варианте осуществления молекула антитела против PD-L1 включает по меньшей мере одну, две, три, четыре, пять или шесть CDR-областей (или одновременно все CDR-области) из вариабельной области тяжелой и легкой цепи, включающей аминокислотную последовательность, показанную в Таблице 1 или кодируемую нуклеотидной последовательностью, показанной в Таблице 1 US 2016/0108123. В одном варианте осуществления одна или более CDR-областей (или одновременно все CDR-области) имеют одно, два, три, четыре, пять, шесть или более изменений, например, аминокислотных замен или делеций, по сравнению с аминокислотной последовательностью, показанной в Таблице 1 или кодируемой нуклеотидной последовательностью, показанной в Таблице 1.
В одном варианте осуществления молекула антитела против PD-L1 включает:
(i) вариабельную область тяжелой цепи (VH), включающую аминокислотную последовательность VHCDR1, выбранную из SEQ ID NO: 1, SEQ ID NO: 4 или SEQ ID NO: 195; аминокислотную последовательность VHCDR2 SEQ ID NO: 2 и аминокислотную последовательность VHCDR3 SEQ ID NO: 3, каждая из которых раскрыта в Таблице 1 US 2016/0108123; и
(ii) вариабельную область легкой цепи (VL), включающую аминокислотную последовательность VLCDR1 SEQ ID NO: 9, аминокислотную последовательность VLCDR2 SEQ ID NO: 10 и аминокислотную последовательность VLCDR3 SEQ ID NO: 11, каждая из которых раскрыта в Таблице 1 US 2016/0108123.
В другом варианте осуществления молекула антитела против PD-L1 включает:
(i) вариабельную область тяжелой цепи (VH), включающую аминокислотную последовательность VHCDR1, выбранную из SEQ ID NO: 1, SEQ ID NO: 4 или SEQ ID NO: 195; аминокислотную последовательность VHCDR2 SEQ ID NO: 5 и аминокислотную последовательность VHCDR3 SEQ ID NO: 3, каждая из которых раскрыта в Таблице 1 US 2016/0108123; и
(ii) вариабельную область легкой цепи (VL), включающую аминокислотную последовательность VLCDR1 SEQ ID NO: 12, аминокислотную последовательность VLCDR2 SEQ ID NO: 13 и аминокислотную последовательность VLCDR3 SEQ ID NO: 14, каждая из которых раскрыта в Таблице 1 US 2016/0108123.
В одном варианте осуществления молекула антитела против PD-L1 включает аминокислотную последовательность VHCDR1 SEQ ID NO: 1, раскрытую в Таблице 1 US 2016/0108123. В другом варианте осуществления молекула антитела против PD-L1 включает аминокислотную последовательность VHCDR1 SEQ ID NO: 4, раскрытую в Таблице 1 US 2016/0108123. В еще одном варианте осуществления молекула антитела против PD-L1 включает аминокислотную последовательность VHCDR1 SEQ ID NO: 195, каждая из которых раскрыта в Таблице 1 US 2016/0108123.
В одном варианте осуществления молекула антитела против PD-L1 включает аминокислотную последовательность VH EVQLVQSGAEVKKPGATVKISCKVSGYTFTSYWMYWVRQARGQRLEWIGRIDPNSGSTKYNEKFKNRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARDYRKGLYAMDYWGQGTTVTVSS (SEQ ID NO: 316) или SEQ ID NO: 78 из US 2016/0108123 и аминокислотную последовательность VL AIQLTQSPSSLSASVGDRVTITCKASQDVGTAVAWYLQKPGQSPQLLIYWASTRHTGVPSRFSGSGSGTDFTFTISSLEAEDAATYYCQQYNSYPLTFGQGTKVEIK (SEQ ID NO: 317) или SEQ ID NO: 82 из US 2016/0108123, каждая из которых раскрыта в Таблице 1 US 2016/0108123. В одном варианте осуществления молекула антитела против PD-L1 включает аминокислотную последовательность VH EVQLVQSGAEVKKPGATVKISCKVSGYTFTSYWMYWVRQATGQGLEWMGRIDPNSGSTKYNEKFKNRVTITADKSTSTAYMELSSLRSEDTAVYYCARDYRKGLYAMDYWGQGTTVTVSS (SEQ ID NO: 318) или SEQ ID NO: 30 из US 2016/0108123 и аминокислотную последовательность VL DVVMTQSPLSLPVTLGQPASISCKASQDVGTAVAWYQQKPGQAPRLLIYWASTRHTGVPSRFSGSGSGTEFTLTISSLQPDDFATYYCQQYNSYPLTFGQGTKVEIK (SEQ ID NO: 319) или SEQ ID NO: 66 из US 2016/0108123, каждая из которых раскрыта в Таблице 1 US 2016/0108123.
В одном варианте осуществления молекула антитела против PD-L1 включает аминокислотную последовательность тяжелой цепи SEQ ID NO: 80 из US 2016/0108123 и аминокислотную последовательность легкой цепи SEQ ID NO: 84 из US 2016/0108123, каждая из которых раскрыта в Таблице 1 US 2016/0108123. В одном варианте осуществления молекула антитела против PD-L1 включает аминокислотную последовательность тяжелой цепи SEQ ID NO: 96 из US 2016/0108123 и аминокислотную последовательность легкой цепи SEQ ID NO: 68 из US 2016/0108123, каждая из которых раскрыта в Таблице 1 US 2016/0108123.
Ингибитор PD-L1 (например, молекула антитела против PD-L1, описанного в настоящей заявке) или композиция, описанная в настоящей заявке, могут быть включены в лекарственную форму (например, дозированный состав или дозированную лекарственную форму), подходящую для введения (например, внутривенного введения) субъекту, как описано в настоящей заявке.
В некоторых вариантах осуществления лекарственная форма является жидкой лекарственной формой. В других вариантах осуществления лекарственная форма является лиофилизированной лекарственной формой, например, лиофилизированной или высушенной из жидкой лекарственной формы. В других вариантах осуществления лекарственная форма является восстановленной лекарственной формой, например, восстановленной из лиофилизированной лекарственной формы.
В некоторых вариантах осуществления лекарственная форма включает ингибитор PD-L1 (например, молекулу антитела против PD-L1) и буферное вещество.
В некоторых вариантах осуществления лекарственная форма включает ингибитор PD-L1 (например, молекулу антитела против PD-L1), присутствующий в концентрации 10-500 мг/мл, например, 25-250 мг/мл, 50-150 мг/мл, 50-100 мг/мл, или 100-200 мг/мл, например, 50 мг/мл, 100 мг/мл, 150 мг/мл или 200 мг/мл. В некоторых вариантах осуществления ингибитор PD-1 (например, молекула антитела против PD-1) присутствует в концентрации 50-150 мг/мл, например, 100 мг/мл. В некоторых вариантах осуществления лекарственная форма имеет pH 5-6 (например, 5,5). В некоторых вариантах осуществления лекарственная форма предназначена для внутривенной инфузии, например, после разведения. В некоторых вариантах осуществления лекарственная форма включает одно или более фармацевтически приемлемых вспомогательных веществ.
В некоторых вариантах осуществления лекарственная форма включает буферное вещество, включающее гистидин (например, гистидиновый буфер). В некоторых вариантах осуществления лекарственная форма включает L-гистидин, L-гистидина гидрохлорида моногидрат или оба. В некоторых вариантах осуществления буферное вещество (например, гистидиновый буфер) присутствует в концентрации от 1 мМ до 20 мМ, например, от 2 мМ до 15 мМ, от 3 мМ до 10 мМ, от 4 мМ до 9 мМ, от 5 мМ до 8 мМ или от 6 мМ до 7 мМ, например, 1 мМ, 2 мМ, 3 мМ, 4 мМ, 5 мМ, 6 мМ, 6,7 мМ, 7 мМ, 8 мМ, 9 мМ, 10 мМ, 11 мМ, 12 мМ, 13 мМ, 14 мМ, 15 мМ, 16 мМ, 17 мМ, 18 мМ, 19 мМ или 20 мМ.
В некоторых вариантах осуществления лекарственная форма дополнительно включает углевод. В некоторых вариантах осуществления углеводом является сахароза. В некоторых вариантах осуществления углевод (например, сахароза) присутствует в концентрации от 50 мМ до 150 мМ, например, от 25 мМ до 150 мМ, от 50 мМ до 100 мМ, от 60 мМ до 90 мМ, от 70 мМ до 80 мМ или от 70 мМ до 75 мМ, например, 25 мМ, 50 мМ, 60 мМ, 70 мМ, 73,3 мМ, 80 мМ, 90 мМ, 100 мМ или 150 мМ.
В некоторых вариантах осуществления лекарственная форма дополнительно включает поверхностно-активное вещество. В некоторых вариантах осуществления поверхностно-активным веществом является полисорбат 20. В некоторых вариантах осуществления поверхностно-активное вещество или полисорбат 20, присутствует в концентрации 0,005-0,025% (в/в), например, 0,0075-0,02% или 0,01-0,015% (в/в), например, 0,005%, 0,0075%, 0,01%, 0,013%, 0,015% или 0,02% (в/в).
В некоторых вариантах осуществления лекарственная форма включает ингибитор PD-L1 (например, молекулу антитела против PD-L1), гистидиновый буфер, углевод и поверхностно-активное вещество. В некоторых вариантах осуществления лекарственная форма включает ингибитор PD-L1 (например, молекулу антитела против PD-L1) и одно или более (например, два, три или все) из L-гистидина, L-гистидина гидрохлорида моногидрата, сахарозы или полисорбата 20, например, при pH 5-6. В некоторых вариантах осуществления лекарственная форма включает ингибитор PD-L1 (например, молекулу антитела против PD-L1), L-гистидин, L-гистидина гидрохлорида моногидрат, сахарозу и полисорбат 20, например, при pH 5-6.
Лекарственная форма, описанная в настоящей заявке, может храниться в контейнере. В некоторых вариантах осуществления в контейнере (например, флаконе) присутствует от 50 мг до 150 мг, например, от 80 мг до 120 мг, от 90 мг до 110 мг, от 100 мг до 120 мг, от 100 мг до 110 мг, от 110 мг до 120 мг или от 110 мг до 130 мг ингибитора PD-L1 (например, молекулы антитела против PD-L1).
Другие примеры буферных веществ, которые могут использоваться в лекарственной форме, описанной в настоящей заявке, включают, без ограничения перечисленными, аргининовый буфер, цитратный буфер или фосфатный буфер. Другие примеры углеводов, которые могут использоваться в лекарственной форме, описанной в настоящей заявке, включают, без ограничения перечисленными, трегалозу, маннит, сорбит или их комбинацию. Лекарственная форма, описанная в настоящей заявке, также может содержать вещество, регулирующее тоничность, например, хлорид натрия, и/или стабилизирующее вещество, например, аминокислоту (например, глицин, аргинин, метионин или их комбинацию).
В одном варианте осуществления комбинация включает ингибитор PD-L1 или молекулу антитела, раскрытого в US 2016/0108123, и ингибитор PD-1 (например, антитело против PD-1, описанное в настоящей заявке).
Комбинацию ингибитора PD-1 (например, молекулы антитела против PD-1, описанного в настоящей заявке) и ингибитора PD-L1 (например, молекулы антитела против PD-L1, описанного в настоящей заявке), тестировали в модели MC38 аденокарциномы толстой кишки на мышах. В исследовании использовали суррогатное антитело против мышиного PD-1, RMP1-14. Совместное введение RMP1-14 и молекулы антитела против PD-L1 привело к повышенной противоопухолевой активности по сравнению с отдельными средствами в данной модели. Например, молекула антитела против PD-L1 и RMP1-14 в комбинации приводили к 4/10 животных с полными ответами, а также 3/10 животных, демонстрирующих частичные ответы. Комбинированная терапия приводила к незначимому улучшению медианного времени до конечного результата до 46 дней, что было на 21 день больше, чем животные, получавшие изотип, и более чем на 20 дней больше, чем при отдельном введении одного из антител.
В некоторых вариантах осуществления ингибитор PD-1 (например, молекула антитела против PD-1) связывает PD-1 и ингибирует его взаимодействие с PD-L1, PD-L2 или обоими. В некоторых вариантах осуществления ингибитор PD-L1 (например, молекула антитела против PD-L1) связывает PD-L1 и ингибирует его взаимодействие с PD-1, B7.1 или обоими. PD-1 и PD-L1 опосредуют перекрывающиеся, но при этом также различные функции в отношении Т-клетки. Оба рецептора могут передавать отрицательные сигналы Т-клетке при связывании. PD-L1 может опосредовать иммуносупрессивную функцию при взаимодействии с B7.1, например, блокировать способность B7.1 активировать Т-клетки посредством связывания с CD28 и дополнительно останавливать генерацию иммунного ответа (Butte et al. Immunity. 2007; 27(1):111-22). Без ограничения теорией, считается, что в некоторых вариантах осуществления комбинированное ингибирование PD-L1 и PD-1 может приводить к безызбыточному и/или дополнительному противоопухолевому иммунитету (Dong et al. Nat Med. 2002; 8(8):793-800; Yamazaki et al J Immunol. 2002; 169(10):5538-45; Taube et al. Sci Transl Med. 2012; 4(127):127ra37). В некоторых вариантах осуществления комбинация ингибитора PD-1 (например, молекулы антитела против PD-1, описанного в настоящей заявке) и ингибитора PD-L1 (например, молекулы антитела против PD-L1, описанного в настоящей заявке), увеличивает активацию Т-клеток по сравнению с ингибитором PD-1 или ингибитором PD-L1 по отдельности. В некоторых вариантах осуществления комбинация ингибитора PD-1 (например, молекулы антитела против PD-1, описанного в настоящей заявке) и ингибитора PD-L1 (например, молекулы антитела против PD-L1, описанного в настоящей заявке) обладает синергической противоопухолевой активностью.
В одном варианте осуществления ингибитор PD-L1 или молекулу антитела против PD-L1, раскрытого в US 2016/0108123, вводят в дозе (например, постоянной дозе) от 10 мг до 2000 мг, например, от 20 мг до 1600 мг, от 40 мг до 1200 мг, от 80 мг до 800 мг, от 100 мг до 600 мг, от 200 мг до 300 мг, от 20 мг до 100 мг, от 40 мг до 200 мг, от 100 мг до 400 мг, от 200 мг до 600 мг, от 800 мг до 1200 мг или от 1200 мг до 1600 мг, например, в дозе (например, постоянной дозе) приблизительно 10 мг, 20 мг, 40 мг, 80 мг, 100 мг, 150 мг, 200 мг, 240 мг, 300 мг, 400 мг, 500 мг, 600 мг, 800 мг, 1000 мг, 1200 мг, 1600 мг или 2000 мг, например, один раз в три недели, один раз в четыре недели или один раз в шесть недель.
В одном варианте осуществления ингибитор PD-L1 или молекулу антитела против PD-L1, раскрытого в US 2016/0108123, вводят в дозе от 20 мг до 1200 мг (например, от 80 мг до 800 мг, например, приблизительно 20 мг, 80 мг, 240 мг, 800 мг или 1200 мг), например, один раз в три недели или один раз в шесть недель. Например, ингибитор PD-L1 или молекулу антитела против PD-L1, раскрытого в US 2016/0108123, могут вводить в дозе от 10 мг до 100 мг (например, от 20 мг до 80 мг, например, 20 мг, 40 мг или 80 мг), например, один раз в три недели или один раз в шесть недель. В одном варианте осуществления ингибитор PD-L1 или молекулу антитела против PD-L1, раскрытого в US 2016/0108123, вводят путем внутривенной инфузии.
В одном варианте осуществления ингибитор PD-L1 или молекулу антитела против PD-L1, раскрытого в US 2016/0108123, вводят в дозе от 10 мг до 100 мг (например, от 20 мг до 80 мг, например, 20 мг, 40 мг или 80 мг), например, один раз в три недели или один раз в шесть недель, например, путем внутривенной инфузии, и ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе от 50 мг до 500 мг (например, от 100 мг до 400 мг, например, в дозе приблизительно 100 мг, 200 мг, 300 мг или 400 мг), например, один раз в 3 недели или один раз в 4 недели, например, путем внутривенной инфузии. В некоторых вариантах осуществления ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе от 100 мг до 300 мг (например, в дозе приблизительно 100 мг, 200 мг или 300 мг), например, один раз в 3 недели, например, путем внутривенной инфузии. В некоторых вариантах осуществления ингибитор PD-L1 или молекулу антитела против PD-L1, раскрытого в US 2016/0108123, вводят в дозе приблизительно 20 мг, например, один раз в три недели, и ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе приблизительно 100 мг или 300 мг, например, один раз в три недели. В некоторых вариантах осуществления ингибитор PD-L1 или молекулу антитела против PD-L1, раскрытого в US 2016/0108123, вводят в дозе приблизительно 20 мг, 80 мг, 240 мг, 800 мг или 1200 мг, например, один раз в три недели, и ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе приблизительно 300 мг, например, один раз в три недели.
В одном варианте осуществления ингибитор PD-L1 или молекулу антитела против PD-L1, раскрытого в US 2016/0108123, вводят в дозе от 10 мг до 50 мг (например, приблизительно 20 мг), например, один раз в три недели или один раз в шесть недель, например, путем внутривенной инфузии, и ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе от 50 мг до 200 мг (например, приблизительно 100 мг), например, один раз в 3 недели, например, путем внутривенной инфузии.
В одном варианте осуществления ингибитор PD-L1 или молекулу антитела против PD-L1, раскрытого в US 2016/0108123, вводят в дозе от 10 мг до 50 мг (например, приблизительно 20 мг), например, один раз в три недели или один раз в шесть недель, например, путем внутривенной инфузии, и ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе от 200 мг до 400 мг (например, приблизительно 300 мг), например, один раз в 3 недели, например, путем внутривенной инфузии.
В одном варианте осуществления ингибитор PD-L1 или молекулу антитела против PD-L1, раскрытого в US 2016/0108123, вводят в дозе от 50 мг до 100 мг (например, приблизительно 80 мг), например, один раз в три недели или один раз в шесть недель, например, путем внутривенной инфузии, и ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе от 200 мг до 400 мг (например, приблизительно 300 мг), например, один раз в 3 недели, например, путем внутривенной инфузии.
В одном варианте осуществления ингибитор PD-L1 или молекулу антитела против PD-L1, раскрытого в US 2016/0108123, вводят в дозе от 200 мг до 300 мг (например, приблизительно 240 мг), например, один раз в три недели или один раз в шесть недель, например, путем внутривенной инфузии, и ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе от 200 мг до 400 мг (например, приблизительно 300 мг), например, один раз в 3 недели, например, путем внутривенной инфузии.
В одном варианте осуществления ингибитор PD-L1 или молекулу антитела против PD-L1, раскрытого в US 2016/0108123, вводят в дозе от 500 мг до 1000 мг (например, приблизительно 800 мг), например, один раз в три недели или один раз в шесть недель, например, путем внутривенной инфузии, и ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе от 200 мг до 400 мг (например, приблизительно 300 мг), например, один раз в 3 недели, например, путем внутривенной инфузии.
В одном варианте осуществления ингибитор PD-L1 или молекулу антитела против PD-L1, раскрытого в US 2016/0108123, вводят в дозе от 1000 мг до 1500 мг (например, приблизительно 1200 мг), например, один раз в три недели или один раз в шесть недель, например, путем внутривенной инфузии, и ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе от 200 мг до 400 мг (например, приблизительно 300 мг), например, один раз в 3 недели, например, путем внутривенной инфузии.
В некоторых вариантах осуществления ингибитор PD-L1 или молекулу антитела против PD-L1, раскрытого в US 2016/0108123, вводят до введения ингибитора PD-1 (например, молекулы антитела против PD-1). Например, ингибитор PD-L1 или молекулу антитела против PD-L1, раскрытого в US 2016/0108123, могут вводить первым, с последующим вливанием раствора декстрозы в течение приблизительно 1 часа перед началом введения ингибитора PD-1 (например, молекулы антитела против PD-1). В некоторых вариантах осуществления ингибитор PD-L1 или молекулу антитела против PD-L1, раскрытого в US 2016/0108123, вводят после введения ингибитора PD-1 (например, молекулы антитела против PD-1).
В одном варианте осуществления ингибитор PD-L1 или молекулу антитела против PD-L1, раскрытого в US 2016/0108123, вводят в комбинации с ингибитором PD-1 (например, молекулой антитела против PD-1) для лечения солидной опухоли, например, рака легкого (например, немелкоклеточного рака легкого), рака молочной железы (например, трижды негативного рака молочной железы), рака матки (например, карциномы эндометрия) или рака щитовидной железы (например, анапластической карциномы щитовидной железы).
В некоторых вариантах осуществления ингибитором PD-L1 является молекула антитела. В некоторых вариантах осуществления ингибитор против PD-L1 выбран из YW243.55.S70, MPDL3280A, MEDI-4736, MSB-0010718C или MDX-1105.
В некоторых вариантах осуществления антителом против PD-L1 является MSB0010718C. MSB0010718C (также называемый A09-246-2; Merck Serono) представляет собой моноклональное антитело, которое связывается с PD-L1. Пембролизумаб и другие гуманизированные антитела против PD-L1 раскрыты в WO2013/079174 и имеют последовательность, раскрытую в настоящей заявке (или последовательность, по существу идентичную или подобную ей, например, последовательность, по меньшей мере на 85%, 90%, 95% или выше идентичную указанной последовательности). Аминокислотные последовательности тяжелой и легкой цепи MSB0010718C включают, по меньшей мере, следующее:
Тяжелая цепь (SEQ ID NO: 24, как раскрыто в WO2013/079174)
EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYIMMWVRQAPGKGLEWVSSIYPSGGITFYADKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARIKLGTVTTVDYWGQGTLVTVSS (SEQ ID NO: 246)
Легкая цепь (SEQ ID NO: 25, как раскрыто в WO2013/079174)
QSALTQPASVSGSPGQSITISCTGTSSDVGGYNYVSWYQQHPGKAPKLMIYDVSNRPSGVSNRFSGSKSGNTASLTISGLQAEDEADYYCSSYTSSSTRVFGTGTKVTVL (SEQ ID NO: 247)
В одном варианте осуществления ингибитором PD-L1 является YW243.55.S70. Антитело YW243.55.S70 представляет собой антитело против PD-L1, описанное в WO 2010/077634 (последовательности вариабельной области тяжелой и легкой цепи показаны в SEQ ID NO. 20 и 21, соответственно), и имеет последовательность, раскрытую в указанной заявке (или последовательность, по существу идентичную или подобную ей, например, последовательность, по меньшей мере на 85%, 90%, 95% или выше идентичную указанной последовательности).
В одном варианте осуществления ингибитором PD-L1 является MDX-1105. MDX-1105, также известный как BMS-936559, является антителом против PD-Ll, описанным в WO2007/005874, и имеет последовательность, раскрытую в указанной заявке (или последовательность, по существу идентичную или подобную ей, например, последовательность, по меньшей мере на 85%, 90%, 95% или выше идентичную указанной последовательности).
В одном варианте осуществления ингибитором PD-L1 является MDPL3280A (Genentech/Roche). MDPL3280A представляет собой человеческое Fc-оптимизированное IgG1 моноклональное антитело, которое связывается с PD-L1. MDPL3280A и другие человеческие моноклональные антитела к PD-L1 раскрыты в патенте США 7,943,743, публикации PCT WO 2013/019906 и публикации U.S. 2012/0039906. Например, MDPL3280A (также известный как атезолизумаб или RO5541267) может включать вариабельную область тяжелой цепи, включающую аминокислотную последовательность SEQ ID NO: 24, как раскрыто в WO 2013/019906, и вариабельную область легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 21, как раскрыто в WO 2013/019906 (или последовательность, по существу идентичную или подобную ей, например, последовательность, по меньшей мере на 85%, 90%, 95% или выше идентичную указанной последовательности).
В одном варианте осуществления ингибитором PD-L1 является MEDI-4736 (также известный как дурвалумаб). MEDI-4736 описан в WO 2011/066389 и WO 2015/036499. Например, MEDI-4736 может включать вариабельную область легкой цепи, включающую аминокислотную последовательность SEQ ID NO: 1, как раскрыто в WO 2015/036499, и вариабельную область тяжелой цепи, включающую аминокислотную последовательность SEQ ID NO: 2, как раскрыто в WO 2015/036499 (или последовательность, по существу идентичную или подобную ей, например, последовательность, по меньшей мере на 85%, 90%, 95% или выше идентичную указанной последовательности).
В других вариантах осуществления ингибитором PD-L2 является AMP-224. AMP-224 является PD-L2 Fc слитым растворимым рецептором, который блокирует взаимодействие между PD-1 и B7-H1 (B7-DCIg; Amplimmune; например, раскрыт в WO2010/027827 и WO2011/066342).
Примеры ингибиторов LAG-3
В одном варианте осуществления комбинация, описанная в настоящей заявке, включает ингибитор LAG-3. В некоторых вариантах осуществления комбинация применяется для лечения рака, например, рака, описанного в настоящей заявке, например, солидной опухоли или гемобластоза. В некоторых вариантах осуществления рак является раком легкого (например, немелкоклеточным раком легкого), раком кожи (например, меланомой) или раком почки (например, почечно-клеточной карциномой). В некоторых вариантах осуществления ингибитором LAG-3 является антитело против LAG-3 или его фрагмент.
В одном варианте осуществления антитело против LAG-3 или его фрагмент являются молекулой антитела против LAG-3, как описано в заявке US 2015/0259420, озаглавленной "Antibody Molecules to LAG-3 and Uses Thereof", полностью включенной посредством отсылки.
В одном варианте осуществления молекула антитела против LAG-3 включает по меньшей мере одну, две, три, четыре, пять или шесть CDR-областей (или одновременно все CDR-области) из вариабельной области тяжелой и легкой цепи (например, по меньшей мере одну, две или три CDR-области из вариабельной области тяжелой цепи, по меньшей мере одну, две или три CDR-области из вариабельной области легкой цепи или и то, и другое) из антитела, выбранного из любого из BAP050-hum01, BAP050-hum02, BAP050-hum03, BAP050-hum04, BAP050-hum05, BAP050-hum06, BAP050-hum07, BAP050-hum08, BAP050-hum09, BAP050-hum10, BAP050-hum11, BAP050-hum12, BAP050-hum13, BAP050-hum14, BAP050-hum15, BAP050-hum16, BAP050-hum17, BAP050-hum18, BAP050-hum19, BAP050-hum20, huBAP050(Ser) (например, BAP050-hum01-Ser, BAP050-hum02-Ser, BAP050-hum03-Ser, BAP050-hum04-Ser, BAP050-hum05-Ser, BAP050-hum06-Ser, BAP050-hum07-Ser, BAP050-hum08-Ser, BAP050-hum09-Ser, BAP050-hum10-Ser, BAP050-hum11-Ser, BAP050-hum12-Ser, BAP050-hum13-Ser, BAP050-hum14-Ser, BAP050-hum15-Ser, BAP050-hum18-Ser, BAP050-hum19-Ser или BAP050-hum20-Ser), BAP050-Clone-F, BAP050-Clone-G, BAP050-Clone-H, BAP050-Clone-I или BAP050-Clone-J; или, как описано в Таблице 1 US 2015/0259420; или кодируемые нуклеотидной последовательностью в Таблице 1; или последовательностью, по существу идентичной (например, идентичной по меньшей мере на 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или выше) любой из вышеуказанных последовательностей, или близко родственные CDR-области, например, CDR-области, которые идентичны или которые имеют по меньшей мере одно аминокислотное изменение, но не больше двух, трех или четырех изменений (например, замен, делеций или вставок, например, консервативных замен).
В еще одном варианте осуществления молекула антитела против LAG-3 включает по меньшей мере одну, две, три или четыре вариабельных области (например, по меньшей мере одну или две вариабельных области тяжелой цепи (необязательно включающих константную область), по меньшей мере одну или две вариабельных области легкой цепи (необязательно включающих константную область), или и то, и другое) из антитела, описанного в настоящей заявке, например, антитела, выбранного из любого из BAP050-hum01, BAP050-hum02, BAP050-hum03, BAP050-hum04, BAP050-hum05, BAP050-hum06, BAP050-hum07, BAP050-hum08, BAP050-hum09, BAP050-hum10, BAP050-hum11, BAP050-hum12, BAP050-hum13, BAP050-hum14, BAP050-hum15, BAP050-hum16, BAP050-hum17, BAP050-hum18, BAP050-hum19, BAP050-hum20, huBAP050(Ser) (например, BAP050-hum01-Ser, BAP050-hum02-Ser, BAP050-hum03-Ser, BAP050-hum04-Ser, BAP050-hum05-Ser, BAP050-hum06-Ser, BAP050-hum07-Ser, BAP050-hum08-Ser, BAP050-hum09-Ser, BAP050-hum10-Ser, BAP050-hum11-Ser, BAP050-hum12-Ser, BAP050-hum13-Ser, BAP050-hum14-Ser, BAP050-hum15-Ser, BAP050-hum18-Ser, BAP050-hum19-Ser или BAP050-hum20-Ser), BAP050-Clone-F, BAP050-Clone-G, BAP050-Clone-H, BAP050-Clone-I или BAP050-Clone-J; или, как описано в Таблице 1 US 2015/0259420; или кодируемые нуклеотидной последовательностью в Таблице 1; или последовательностью, по существу идентичной (например, идентичной по меньшей мере на 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или выше) любой из вышеуказанных последовательностей.
В еще одном варианте осуществления молекула антитела против LAG-3 включает по меньшей мере одну, две или три CDR-области (или одновременно все CDR-области) из вариабельной области тяжелой цепи, включающей аминокислотную последовательность, показанную в Таблице 1 US 2015/0259420 или кодируемую нуклеотидной последовательностью, показанной в Таблице 1. В одном варианте осуществления одна или более CDR-областей (или одновременно все CDR-области) имеют одно, два, три, четыре, пять, шесть или более изменений, например, аминокислотных замен или делеций, по сравнению с аминокислотной последовательностью, показанной в Таблице 1 или кодируемой нуклеотидной последовательностью, показанной в Таблице 1.
В еще одном варианте осуществления молекула антитела против LAG-3 включает по меньшей мере одну, две или три CDR-области (или одновременно все CDR-области) из вариабельной области легкой цепи, включающей аминокислотную последовательность, показанную в Таблице 1 US 2015/0259420 или кодируемую нуклеотидной последовательностью, показанной в Таблице 1. В одном варианте осуществления одна или более CDR-областей (или одновременно все CDR-области) имеют одно, два, три, четыре, пять, шесть или более изменений, например, аминокислотных замен или делеций, по сравнению с аминокислотной последовательностью, показанной в Таблице 1 или кодируемой нуклеотидной последовательностью, показанной в Таблице 1. В некоторых вариантах осуществления молекула антитела против PD-L1 включает замену в CDR-области легкой цепи, например, одну или более замен в CDR1, CDR2 и/или CDR3 легкой цепи.
В другом варианте осуществления молекула антитела против LAG-3 включает по меньшей мере одну, две, три, четыре, пять или шесть CDR-областей (или одновременно все CDR-области) из вариабельной области тяжелой и легкой цепи, включающей аминокислотную последовательность, показанную в Таблице 1 или кодируемую нуклеотидной последовательностью, показанной в Таблице 1 US 2015/0259420. В одном варианте осуществления одна или более CDR-областей (или одновременно все CDR-области) имеют одно, два, три, четыре, пять, шесть или более изменений, например, аминокислотных замен или делеций, по сравнению с аминокислотной последовательностью, показанной в Таблице 1 или кодируемой нуклеотидной последовательностью, показанной в Таблице 1.
В одном варианте осуществления молекула антитела против LAG-3 включает:
(i) вариабельную область тяжелой цепи (VH), включающую аминокислотную последовательность VHCDR1, выбранную из SEQ ID NO: 1, SEQ ID NO: 4 или SEQ ID NO: 286; аминокислотную последовательность VHCDR2 SEQ ID NO: 2 и аминокислотную последовательность VHCDR3 SEQ ID NO: 3, каждая из которых раскрыта в Таблице 1 US 2015/0259420; и
(ii) вариабельную область легкой цепи (VL), включающую аминокислотную последовательность VLCDR1 SEQ ID NO: 10, аминокислотную последовательность VLCDR2 SEQ ID NO: 11 и аминокислотную последовательность VLCDR3 SEQ ID NO: 12, каждая из которых раскрыта в Таблице 1 US 2015/0259420.
В другом варианте осуществления молекула антитела против LAG-3 включает:
(i) вариабельную область тяжелой цепи (VH), включающую аминокислотную последовательность VHCDR1, выбранную из SEQ ID NO: 1, SEQ ID NO: 4 или SEQ ID NO: 286; аминокислотную последовательность VHCDR2 SEQ ID NO: 5 и аминокислотную последовательность VHCDR3 SEQ ID NO: 3, каждая из которых раскрыта в Таблице 1 US 2015/0259420; и
(ii) вариабельную область легкой цепи (VL), включающую аминокислотную последовательность VLCDR1 SEQ ID NO: 13, аминокислотную последовательность VLCDR2 SEQ ID NO: 14 и аминокислотную последовательность VLCDR3 SEQ ID NO: 15, каждая из которых раскрыта в Таблице 1 US 2015/0259420.
В одном варианте осуществления молекула антитела против LAG-3 включает аминокислотную последовательность VHCDR1 SEQ ID NO:1. В другом варианте осуществления молекула антитела против LAG-3 включает аминокислотную последовательность VHCDR1 SEQ ID NO:4. В еще одном варианте осуществления молекула антитела против LAG-3 включает аминокислотную последовательность VHCDR1 SEQ ID NO: 286, каждая из которых раскрыта в Таблице 1 US 2015/0259420.
В некоторых вариантах осуществления молекула антитела против LAG-3 включает VH, включающую аминокислотную последовательность QVQLVQSGAEVKKPGASVKVSCKASGFTLTNYGMNWVRQARGQRLEWIGWINTDTGEPTYADDFKGRFVFSLDTSVSTAYLQISSLKAEDTAVYYCARNPPYYYGTNNAEAMDYWGQGTTVTVSS (SEQ ID NO: 320) или SEQ ID NO: 104 из US 2015/0259420, и VL, включающую аминокислотную последовательность DIQMTQSPSSLSASVGDRVTITCSSSQDISNYLNWYLQKPGQSPQLLIYYTSTLHLGVPSRFSGSGSGTEFTLTISSLQPDDFATYYCQQYYNLPWTFGQGTKVEIK (SEQ ID NO: 321) или SEQ ID NO: 56 из US 2015/0259420, каждая из которых раскрыта в Таблице 1 US 2015/0259420. В некоторых вариантах осуществления молекула антитела против LAG-3 включает VH, включающую аминокислотную последовательность QVQLVQSGAEVKKPGASVKVSCKASGFTLTNYGMNWVRQAPGQGLEWMGWINTDTGEPTYADDFKGRFVFSLDTSVSTAYLQISSLKAEDTAVYYCARNPPYYYGTNNAEAMDYWGQGTTVTVSS (SEQ ID NO: 322) или SEQ ID NO: 108 из US 2015/0259420, и VL, включающую аминокислотную последовательность DIQMTQSPSSLSASVGDRVTITCSSSQDISNYLNWYQQKPGKAPKLLIYYTSTLHLGIPPRFSGSGYGTDFTLTINNIESEDAAYYFCQQYYNLPWTFGQGTKVEIK (SEQ ID NO: 323) или SEQ ID NO: 36 из US 2015/0259420, каждая из которых раскрыта в Таблице 1 US 2015/0259420.
В некоторых вариантах осуществления молекула антитела против LAG-3 включает тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 122 из US 2015/0259420, и легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 58 из US 2015/0259420, каждая из которых раскрыта в Таблице 1 US 2015/0259420. В некоторых вариантах осуществления молекула антитела против LAG-3 включает тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 134 из US 2015/0259420, и легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 38 из US 2015/0259420, каждая из которых раскрыта в Таблице 1 US 2015/0259420.
В некоторых вариантах осуществления антителом против LAG-3 является BMS-986016. BMS-986016 (также называемое BMS986016; Bristol-Myers Squibb) представляет собой моноклональное антитело, которое связывается с LAG-3. BMS-986016 и другие гуманизированные антитела против LAG-3 раскрыты в US 2011/0150892, WO2010/019570 и WO2014/008218.
Примеры ингибиторов TIM-3
В одном варианте осуществления комбинация, описанная в настоящей заявке, включает ингибитор TIM-3. В некоторых вариантах осуществления комбинация применяется для лечения рака, например, рака, описанного в настоящей заявке, например, солидной опухоли или гемобластоза. В некоторых вариантах осуществления рак является раком легкого (например, немелкоклеточным раком легкого), раком кожи (например, меланомой) или раком почки (например, почечно-клеточной карциномой). В других вариантах осуществления рак не является немелкоклеточным раком легкого, меланомой и почечно-клеточной карциномой. В некоторых вариантах осуществления ингибитором TIM-3 является антитело против TIM-3 или его фрагмент.
В одном варианте осуществления антитело против TIM-3 или его фрагмент являются молекулой антитела против TIM-3, как описано в заявке US 2015/0218274, озаглавленной "Antibody Molecules to TIM-3 and Uses Thereof", полностью включенной посредством отсылки.
В одном варианте осуществления молекула антитела против TIM-3 включает по меньшей мере одну, две, три, четыре, пять или шесть CDR-областей (или одновременно все CDR-области) из вариабельной области тяжелой и легкой цепи (например, по меньшей мере одну, две или три CDR-области из вариабельной области тяжелой цепи, по меньшей мере одну, две или три CDR-области из вариабельной области легкой цепи, или и то, и другое) из антитела, выбранного из любого из ABTIM3, ABTIM3-hum01, ABTIM3-hum02, ABTIM3-hum03, ABTIM3-hum04, ABTIM3-hum05, ABTIM3-hum06, ABTIM3-hum07, ABTIM3-hum08, ABTIM3-hum09, ABTIM3-hum10, ABTIM3-hum11, ABTIM3-hum12, ABTIM3-hum13, ABTIM3-hum14, ABTIM3-hum15, ABTIM3-hum16, ABTIM3-hum17, ABTIM3-hum18, ABTIM3-hum19, ABTIM3-hum20, ABTIM3-hum21, ABTIM3-hum22, ABTIM3-hum23; или как описано в Таблицах 1-4 US 2015/0218274; или кодируемых нуклеотидной последовательностью в Таблицах 1-4; или последовательностью, по существу идентичной (например, идентичной по меньшей мере на 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или выше) любой из вышеуказанных последовательностей, или близко родственные CDR-области, например, CDR-области, которые идентичны или которые имеют по меньшей мере одно аминокислотное изменение, но не больше двух, трех или четырех изменений (например, замен, делеций или вставок, например, консервативных замен).
В еще одном варианте осуществления молекула антитела против TIM-3 включает по меньшей мере одну, две, три или четыре вариабельных области (например, по меньшей мере одну или две вариабельных области тяжелой цепи (необязательно включающих константную область), по меньшей мере одну или две вариабельных области легкой цепи (необязательно включающих константную область) или и то, и другое) из антитела, описанного в настоящей заявке, например, антитела, выбранного из любого из ABTIM3, ABTIM3-hum01, ABTIM3-hum02, ABTIM3-hum03, ABTIM3-hum04, ABTIM3-hum05, ABTIM3-hum06, ABTIM3-hum07, ABTIM3-hum08, ABTIM3-hum09, ABTIM3-hum10, ABTIM3-hum11, ABTIM3-hum12, ABTIM3-hum13, ABTIM3-hum14, ABTIM3-hum15, ABTIM3-hum16, ABTIM3-hum17, ABTIM3-hum18, ABTIM3-hum19, ABTIM3-hum20, ABTIM3-hum21, ABTIM3-hum22, ABTIM3-hum23; или как описано в Таблицах 1-4 US 2015/0218274; или кодируемые нуклеотидной последовательностью в Таблицах 1-4; или последовательностью, по существу идентичной (например, идентичной по меньшей мере на 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или выше) любой из вышеуказанных последовательностей.
В еще одном варианте осуществления молекула антитела против TIM-3 включает по меньшей мере одну, две или три CDR-области (или одновременно все CDR-области) из вариабельной области тяжелой цепи, включающей аминокислотную последовательность, показанную в Таблицах 1-4 US 2015/0218274 или кодируемую нуклеотидной последовательностью, показанной в Таблицах 1-4. В одном варианте осуществления одна или более CDR-областей (или одновременно все CDR-области) имеют одно, два, три, четыре, пять, шесть или более изменений, например, аминокислотных замен или делеций, по сравнению с аминокислотной последовательностью, показанной в Таблицах 1-4 или кодируемой нуклеотидной последовательностью, показанной в Таблице 1-4.
В еще одном варианте осуществления молекула антитела против TIM-3 включает по меньшей мере одну, две или три CDR-области (или одновременно все CDR-области) из вариабельной области легкой цепи, включающей аминокислотную последовательность, показанную в Таблицах 1-4 US 2015/0218274 или кодируемую нуклеотидной последовательностью, показанной в Таблицах 1-4. В одном варианте осуществления одна или более CDR-областей (или одновременно все CDR-области) имеют одно, два, три, четыре, пять, шесть или более изменений, например, аминокислотных замен или делеций, по сравнению с аминокислотной последовательностью, показанной в Таблицах 1-4 или кодируемой нуклеотидной последовательностью, показанной в Таблицах 1-4. В некоторых вариантах осуществления молекула антитела против TIM-3 включает замену в CDR-области легкой цепи, например, одну или более замен в CDR1, CDR2 и/или CDR3 легкой цепи.
В другом варианте осуществления молекула антитела против TIM-3 включает по меньшей мере одну, две, три, четыре, пять или шесть CDR-областей (или одновременно все CDR-области) из вариабельной области тяжелой и легкой цепи, включающей аминокислотную последовательность, показанную в Таблицах 1-4 US 2015/0218274 или кодируемую нуклеотидной последовательностью, показанной в Таблицах 1-4. В одном варианте осуществления, одна или более CDR-областей (или одновременно все CDR-области) имеют одно, два, три, четыре, пять, шесть или более изменений, например, аминокислотных замен или делеций, по сравнению с аминокислотной последовательностью, показанной в Таблицах 1-4 или кодируемой нуклеотидной последовательностью, показанной в Таблицах 1-4.
В одном варианте осуществления молекула антитела против TIM-3 включает:
(a) вариабельную область тяжелой цепи (VH), включающую аминокислотную последовательность VHCDR1, выбранную из SEQ ID NO: 9; аминокислотную последовательность VHCDR2 SEQ ID NO: 10 и аминокислотную последовательность VHCDR3 SEQ ID NO: 5; и вариабельную область легкой цепи (VL), включающую аминокислотную последовательность VLCDR1 SEQ ID NO: 12, аминокислотную последовательность VLCDR2 SEQ ID NO: 13 и аминокислотную последовательность VLCDR3 SEQ ID NO: 14, каждая из которых раскрыта в Таблицах 1-4 US 2015/0218274;
(b) VH, включающую аминокислотную последовательность VHCDR1, выбранную из SEQ ID NO: 3; аминокислотную последовательность VHCDR2 SEQ ID NO: 4 и аминокислотную последовательность VHCDR3 SEQ ID NO: 5; и VL, включающую аминокислотную последовательность VLCDR1 SEQ ID NO: 6, аминокислотную последовательность VLCDR2 SEQ ID NO: 7 и аминокислотную последовательность VLCDR3 SEQ ID NO: 8, каждая из которых раскрыта в Таблицах 1-4 US 2015/0218274;
(c) VH, включающую аминокислотную последовательность VHCDR1, выбранную из SEQ ID NO: 9; аминокислотную последовательность VHCDR2 SEQ ID NO: 25 и аминокислотную последовательность VHCDR3 SEQ ID NO: 5; и VL, включающую аминокислотную последовательность VLCDR1 SEQ ID NO: 12, аминокислотную последовательность VLCDR2 SEQ ID NO: 13, и аминокислотную последовательность VLCDR3 SEQ ID NO: 14, каждая из которых раскрыта в Таблицах 1-4 US 2015/0218274;
(d) VH, включающую аминокислотную последовательность VHCDR1, выбранную из SEQ ID NO: 3; аминокислотную последовательность VHCDR2 SEQ ID NO: 24 и аминокислотную последовательность VHCDR3 SEQ ID NO: 5; и VL, включающую аминокислотную последовательность VLCDR1 SEQ ID NO: 6, аминокислотную последовательность VLCDR2 SEQ ID NO: 7 и аминокислотную последовательность VLCDR3 SEQ ID NO: 8, каждая из которых раскрыта в Таблицах 1-4 US 2015/0218274;
(e) VH, включающую аминокислотную последовательность VHCDR1, выбранную из SEQ ID NO: 9; аминокислотную последовательность VHCDR2 SEQ ID NO: 31 и аминокислотную последовательность VHCDR3 SEQ ID NO: 5; и VL, включающую аминокислотную последовательность VLCDR1 SEQ ID NO: 12, аминокислотную последовательность VLCDR2 SEQ ID NO: 13 и аминокислотную последовательность VLCDR3 SEQ ID NO: 14, каждая из которых раскрыта в Таблицах 1-4 US 2015/0218274; или
(f) VH, включающую аминокислотную последовательность VHCDR1, выбранную из SEQ ID NO: 3; аминокислотную последовательность VHCDR2 SEQ ID NO: 30 и аминокислотную последовательность VHCDR3 SEQ ID NO: 5; и VL, включающую аминокислотную последовательность VLCDR1 SEQ ID NO: 6, аминокислотную последовательность VLCDR2 SEQ ID NO: 7 и аминокислотную последовательность VLCDR3 SEQ ID NO: 8, каждая из которых раскрыта в Таблицах 1-4 US 2015/0218274.
В некоторых вариантах осуществления молекула антитела против TIM-3 включает VH, включающую аминокислотную последовательность QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYNMHWVRQAPGQGLEWIGDIYPGQGDTSYNQKFKGRATMTADKSTSTVYMELSSLRSEDTAVYYCARVGGAFPMDYWGQGTLVTVSS (SEQ ID NO: 324) или SEQ ID NO: 32 из US 2015/0218274, и VL, включающую аминокислотную последовательность DIVLTQSPDSLAVSLGERATINCRASESVEYYGTSLMQWYQQKPGQPPKLLIYAASNVESGVPDRFSGSGSGTDFTLTISSLQAEDVAVYYCQQSRKDPSTFGGGTKVEIK (SEQ ID NO: 325) или SEQ ID NO: 20 из US 2015/0218274, каждая из которых раскрыта в Таблице 1 US 2015/0218274. В некоторых вариантах осуществления молекула антитела против TIM-3 включает VH, включающую аминокислотную последовательность QVQLVQSGAEVKKPGSSVKVSCKASGYTFTSYNMHWVRQAPGQGLEWMGDIYPGNGDTSYNQKFKGRVTITADKSTSTVYMELSSLRSEDTAVYYCARVGGAFPMDYWGQGTTVTVSS (SEQ ID NO: 326) или SEQ ID NO: 52 из US 2015/0218274, и VL, включающую аминокислотную последовательность AIQLTQSPSSLSASVGDRVTITCRASESVEYYGTSLMQWYQQKPGKAPKLLIYAASNVESGVPSRFSGSGSGTDFTLTISSLQPEDFATYFCQQSRKDPSTFGGGTKVEIK (SEQ ID NO: 327) или SEQ ID NO: 64 из US 2015/0218274, каждая из которых раскрыта в Таблице 1 US 2015/0218274.
В некоторых вариантах осуществления молекула антитела против TIM-3 включает тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 34 из US 2015/0218274, и легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 22 из US 2015/0218274, каждая из которых раскрыта в Таблице 1 US 2015/0218274. В некоторых вариантах осуществления молекула антитела против TIM-3 включает тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 54 из US 2015/0218274, и легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 66 из US 2015/0218274, каждая из которых раскрыта в Таблице 1 US 2015/0218274.
Примеры антител против TIM-3 также раскрыты в патенте США 8,552,156, WO 2011/155607, EP 2581113 и публикации U.S. 2014/044728.
В одном варианте осуществления комбинация, описанная в настоящей заявке, включает ингибитор TIM-3 (например, молекулу антитела против TIM-3, описанного в настоящей заявке) и химиотерапевтическое средство (например, гипометилирующее средство, например, децитабин). В некоторых вариантах осуществления ингибитор TIM-3 (например, молекулу антитела против TIM-3, раскрытого в публикации заявки на патент США 2015/0218274) вводят в дозе от 10 мг до 1000 мг (например, от 20 мг до 800 мг, от 80 мг до 400 мг, например, в дозе 240 мг), например, один раз в 2 недели, например, внутривенно. В некоторых вариантах осуществления ингибитор TIM-3 (например, молекулу антитела против TIM-3, раскрытого в публикации заявки на патент США 2015/0218274) хранят в форме жидкости (например, во флаконе) для внутривенной инфузии. В некоторых вариантах осуществления химиотерапевтическое средство (например, гипометилирующее средство, например, децитабин) вводят в дозе от 5 мг/м2 до 50 мг/м2 (например, от 10 мг/м2 до 30 мг/м2 (например, в дозе 20 мг/м2), например, ежедневно, например, в течение 1, 2, 3, 4, 5, 6, 7, 8 или более дней, например, внутривенно. Например, ингибитор TIM-3 (например, молекулу антитела против TIM-3, раскрытого в публикации заявки на патент США 2015/0218274) могут вводить в Дни 8 и 22 28-дневного курса, и химиотерапевтическое средство (например, гипометилирующее средство, например, децитабин) могут вводить в Дни 1, 2, 3, 4 и 5 28-дневного курса. В некоторых вариантах осуществления химиотерапевтическое средство (например, гипометилирующее средство, например, децитабин) вводят путем внутривенной инфузии в течение от 30 минут до 2 часов, например, 1 часа.
В одном варианте осуществления комбинация дополнительно включает ингибитор PD-1 (например, молекулу антитела против PD-1, описанного в настоящей заявке). В некоторых вариантах осуществления ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе от 200 мг до 600 мг (например, от 300 мг до 500 мг, например, в дозе 400 мг), например, один раз в 4 недели, например, внутривенно. Например, ингибитор PD-1 (например, молекулу антитела против PD-1, описанного в настоящей заявке) могут вводить в День 8 28-дневного курса. В некоторых вариантах осуществления ингибитор PD-1 (например, молекулу антитела против PD-1) хранят в форме лиофилизата (например, во флаконе) для внутривенной инфузии. В некоторых вариантах осуществления, в случае введения в комбинации с ингибитором PD-1 (например, молекулой антитела против PD-1, описанного в настоящей заявке), ингибитор TIM-3 (например, молекулу антитела против TIM-3, раскрытого в публикации заявки на патент США 2015/0218274) вводят в дозе от 20 мг до 400 мг (например, от 40 мг до 200 мг или от 50 мг до 100 мг, например, в дозе 80 мг), например, один раз в 2 недели, например, внутривенно.
В некоторых вариантах осуществления ингибитор PD-1 (например, молекулу антитела против PD-1, описанного в настоящей заявке) и ингибитор TIM-3 (например, молекулу антитела против TIM-3, раскрытого в публикации заявки на патент США 2015/0218274) вводят в один день. В некоторых вариантах осуществления ингибитор TIM-3 (например, молекулу антитела против TIM-3, раскрытого в публикации заявки на патент США 2015/0218274) вводят до введения ингибитора PD-1 (например, молекулы антитела против PD-1, описанного в настоящей заявке). В некоторых вариантах осуществления ингибитор TIM-3 (например, молекулу антитела против TIM-3, раскрытого в публикации заявки на патент США 2015/0218274) вводят первым, с последующим вливанием солевого раствора или раствора декстрозы, например, в течение приблизительно 1 часа, до начала введения ингибитора PD-1 (например, молекулы антитела против PD-1, описанного в настоящей заявке). В других вариантах осуществления ингибитор TIM-3 (например, молекулу антитела против TIM-3, раскрытого в публикации заявки на патент США 2015/0218274) вводят после введения ингибитора PD-1 (например, молекулы антитела против PD-1, описанного в настоящей заявке). В некоторых вариантах осуществления ингибитор PD-1 (например, молекулу антитела против PD-1, описанного в настоящей заявке) и ингибитор TIM-3 (например, молекулу антитела против TIM-3, раскрытого в публикации заявки на патент США 2015/0218274) вводят в разные дни.
В некоторых вариантах осуществления ингибитор PD-1 (например, молекулу антитела против PD-1, описанного в настоящей заявке), ингибитор TIM-3 (например, молекулу антитела против TIM-3, раскрытого в публикации заявки на патент США 2015/0218274) или оба вводят путем внутривенной инфузии в течение от 30 минут до 2 часов, например, приблизительно 1 часа.
В некоторых вариантах осуществления комбинация применяется для лечения рака, например, рака, описанного в настоящей заявке, например, гемобластоза, например, лейкоза (например, острого миелоидного лейкоза (ОМЛ)), или миелодиспластического синдрома (МДС). В некоторых вариантах осуществления рак является лейкозом, например, рецидивирующим или рефракторным ОМЛ, или de novo ОМЛ (например, ОМЛ, не соответствующего стандарту лечения). В других вариантах осуществления рак представляет собой МДС, например, МДС с высоким риском.
Примеры ингибиторов CTLA-4
В одном варианте осуществления комбинация, описанная в настоящей заявке, включает ингибитор CTLA-4. В некоторых вариантах осуществления комбинация применяется для лечения рака, например, рака, описанного в настоящей заявке, например, солидной опухоли или гемобластоза.
Примеры антител против CTLA-4 включают тремелимумаб (IgG2 моноклональное антитело, выпускаемое Pfizer, раньше известное как тицилимумаб, CP-675,206); и ипилимумаб (антитело к CTLA-4, также известное как MDX-010, CAS 477202-00-9).
В одном варианте осуществления комбинация включает молекулу антитела против PD-1, например, как описано в настоящей заявке, и антитела против CTLA-4, например, ипилимумаба. Примерные дозы, которые могут использоваться, включают дозу молекулы антитела против PD-1 приблизительно 1-10 мг/кг, например, 3 мг/кг, и дозу антитела против CTLA-4, например, ипилимумаба, приблизительно 3 мг/кг.
Другие примеры антител против CTLA-4 раскрыты, например, в патенте США 5,811,097.
Примеры ингибиторов IAP
В одном варианте осуществления комбинация, описанная в настоящей заявке, включает ингибитор ингибитора белка апоптоза (IAP). В некоторых вариантах осуществления комбинация применяется для лечения рака, например, рака, описанного в настоящей заявке, например, солидной опухоли (например, рака толстой и прямой кишки (CRC), рака легкого (например, немелкоклеточного рака легкого (НМРЛ)), рака молочной железы (например, трижды негативного рака молочной железы (ТНРМЖ)), рака яичника или рака поджелудочной железы), например, гемобластоза (например, множественной миеломы).
В некоторых вариантах осуществления ингибитором IAP является (S)-N-(S)-1-циклогексил-2-(S)-2-(4-(4-фторбензоил)тиа-зол-2-ил)пирролидин-1-ил)-2-оксоэтил)-2-(метиламино)пропанамид (Соединение A21) или соединение, раскрытое в патенте США 8,552,003.
В некоторых вариантах осуществления ингибитор IAP, (S)-N-(S)-1-циклогексил-2-(S)-2-(4-(4-фторбензоил)тиа-зол-2-ил)пирролидин-1-ил)-2-оксоэтил)-2-(метиламино)пропанамид (Соединение A21), или соединение, раскрытое в патенте США 8,552,003, представляет собой низкомолекулярный SMAC-миметик для перорального применения, который связывается с доменом BIR3 CIAP1, XIAP и, необязательно, CIAP2. Белки CIAP1 и CIAP2 являются компонентами белковых комплексов семейства ФНО рецепторов смерти. Без ограничения теорией, считается, что в некоторых вариантах осуществления связывание ингибитора IAP, (S)-N-(S)-1-циклогексил-2-(S)-2-(4-(4-фторбензоил)тиазол-2-ил)пирролидин-1-ил)-2-оксоэтил)-2-(метиламино)пропанамида (Соединения A21), или соединения, раскрытого в патенте США 8,552,003, может активировать E3 лигазную функцию CIAP1, вызывать убиквитинилирование и протеосомную деградацию CIAP1, и/или активировать сигнализацию NF-κB после активации рецепторов (Gyrd-Hansen M, Meier P (2010) Nat. Rev. Cancer p. 561-74). В некоторых вариантах осуществления ингибитор IAP, (S)-N-(S)-1-циклогексил-2-(S)-2-(4-(4-фторбензоил)тиазол-2-ил)пирролидин-1-ил)-2-оксоэтил)-2-(метиламино)пропанамид (Соединение A21), или соединение, раскрытое в патенте США 8,552,003, применяется для повышения противоопухолевого иммунитета у субъекта. Например, ингибитор IAP, (S)-N-(S)-1-циклогексил-2-(S)-2-(4-(4-фторбензоил)тиазол-2-ил)пирролидин-1-ил)-2-оксоэтил)-2-(метиламино)пропанамид (Соединение A21), или соединение, раскрытое в патенте США 8,552,003, может повышать пролиферацию и функцию человеческих и мышиных Т-клеток in vitro после костимуляции, и/или усиливать ответ на профилактические и терапевтические противоопухолевые вакцины in vivo, например, в результате активации NF-κB (Dougan et al. (2010) J. Exp. Med. p. 2195-206). Активность NF-κB вовлечена в перекрестное примирование Т-клеток во время иммуногенного апоптоза в ответ на выброс воспалительных молекул, ассоциированных с угрозой (Yatim et al. (2015) Science p. 328-34), указывая на механизм для повышения функции Т-клеток и противоопухолевого иммунитета. В качестве другого примера, ингибитор IAP, (S)-N-(S)-1-циклогексил-2-(S)-2-(4-(4-фторбензоил)тиазол-2-ил)пирролидин-1-ил)-2-оксоэтил)-2-(метиламино)пропанамид (Соединение A21), или соединение, раскрытое в патенте США 8,552,003, может защищать дендритные клетки моноцитарного происхождения от апоптоза, например, подобно лигированию CD40 (Knights et al. (2013) Cancer Immunol. Immunother. p. 321-35).
В некоторых вариантах осуществления комбинация, описанная в настоящей заявке, включает ингибитор IAP, (S)-N-(S)-1-циклогексил-2-(S)-2-(4-(4-фторбензоил)тиазол-2-ил)пирролидин-1-ил)-2-оксоэтил)-2-(метиламино)пропанамид (Соединение A21), или соединение, раскрытое в патенте США 8,552,003, и ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекулу антитела против PD-1).
Без ограничения теорией, считается, что в некоторых вариантах осуществления ингибитор IAP, (S)-N-(S)-1-циклогексил-2-(S)-2-(4-(4-фторбензоил)тиазол-2-ил)пирролидин-1-ил)-2-оксоэтил)-2-(метиламино)пропанамид (Соединение A21), или соединение, раскрытое в патенте США 8,552,003, представляет собой перорально доступную малую молекулу, которая активирует сигнализацию NF-kB после активации членов семейства ФНО рецепторов. NF-κB является главным регулятором транскрипции в иммунных клетках и также функционирует в опухолевых клетках непосредственно (Perkins (2012) Nat. Rev. Cancer p. 121-32). Доклинические данные позволяют предполагать, что активность NF-κB требуется для перекрестного примирования CD8+ Т-лимфоцитов, подвергающихся иммуногенному апоптозу (Yatim et al. (2015) Science p. 328-34). Соединение A21 стимулировало пролиферацию Т-лимфоцитов, индуцировало IFN гамма и подавляло продукцию IL-10 in vitro. Клинические исследования с Соединением A21 продемонстрировали индукцию циркулирующих цитокинов, включая ФНО альфа, IL-8, IL-10 и CCL2 (Infante et al. (2014) J. Clin. Oncol. p. 3103-10). Клинические данные указывают, что Соединение A21 повышало уровень полного ответа ТНРМЖ на лечение паклитакселом согласно лабораторным исследованиям. В некоторых вариантах осуществления ингибитор IAP, (S)-N-(S)-1-циклогексил-2-(S)-2-(4-(4-фторбензоил)тиазол-2-ил)пирролидин-1-ил)-2-оксоэтил)-2-(метиламино)пропанамид (Соединение A21), или соединение, раскрытое в патенте США 8,552,003, увеличивает, или применяется для увеличения, противоопухолевой активности ингибитора молекулы иммунной контрольной точки, например, ингибитора PD-1 (например, молекулы антитела против PD-1).
В некоторых вариантах осуществления ингибитор IAP, (S)-N-(S)-1-циклогексил-2-(S)-2-(4-(4-фторбензоил)тиазол-2-ил)пирролидин-1-ил)-2-оксоэтил)-2-(метиламино)пропанамид (Соединение A21), или соединение, раскрытое в патенте США 8,552,003, и ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекулу антитела против PD-1), вводят в дозе и/или по временной схеме, что в комбинации они позволяют получить требуемую противоопухолевую активность.
Без ограничения теорией, считается, что дозы ингибитора IAP, (S)-N-(S)-1-циклогексил-2-(S)-2-(4-(4-фторбензоил)тиазол-2-ил)пирролидин-1-ил)-2-оксоэтил)-2-(метиламино)пропанамид (Соединения A21), или соединения, раскрытого в патенте США 8,552,003, ниже или равные 1800 мг, являются активными, например, согласно фармакодинамическим данным. Например, в парных биопсиях кожи двух пациентов, получавших дозу 320 мг, обнаружили деградацию CIAP1, белка, являющегося мишенью Соединения A21; образцы кожи, полученные при биопсии от пациентов, получавших более низкие дозы (160 мг и ниже), показали менее стабильную фармакодинамическую активность (Infante et al. (2014) J. Clin. Oncol. p. 3103-10). В некоторых вариантах осуществления дозы выше 900 мг не требуются для клинической эффективности. В некоторых ситуациях дозу Соединения A21 1800 мг плохо переносили при введении в комбинации с паклитакселом. Таким образом, в одном варианте осуществления ингибитор IAP, (S)-N-(S)-1-циклогексил-2-(S)-2-(4-(4-фторбензоил)тиазол-2-ил)пирролидин-1-ил)-2-оксоэтил)-2-(метиламино)пропанамид (Соединение A21), или соединение, раскрытое в патенте США 8,552,003, вводят в дозе от 300 мг до 900 мг, например, один раз в неделю. В некоторых вариантах осуществления ингибитор IAP, (S)-N-(S)-1-циклогексил-2-(S)-2-(4-(4-фторбензоил)тиазол-2-ил)пирролидин-1-ил)-2-оксоэтил)-2-(метиламино)пропанамид (Соединение A21), или соединение, раскрытое в патенте США 8,552,003, вводят менее часто, чем один раз в неделю, например, вводят один раз в две недели, один раз в три недели или один раз в четыре недели.
В некоторых вариантах осуществления ингибитор IAP, например, (S)-N-(S)-1-циклогексил-2-(S)-2-(4-(4-фторбензоил)тиа-зол-2-ил)пирролидин-1-ил)-2-оксоэтил)-2-(метиламино)пропанамид (Соединение A21) или соединение, раскрытое в патенте США 8,552,003, вводят в дозе приблизительно 1800 мг или меньше, например, один раз в неделю.
В некоторых вариантах осуществления ингибитор IAP, (S)-N-(S)-1-циклогексил-2-(S)-2-(4-(4-фторбензоил)тиазол-2-ил)пирролидин-1-ил)-2-оксоэтил)-2-(метиламино)пропанамид (Соединение A21), или соединение, раскрытое в патенте США 8,552,003, вводят в дозе от 160 мг до 1800 мг, от 200 мг до 1200 мг, от 300 мг до 900 мг, от 400 мг до 800 мг или от 500 мг до 700 мг, например, в дозе 300 мг, 400 мг, 500 мг, 600 мг, 700 мг, 800 мг или 900 мг, например, один раз в неделю, один раз в две недели, один раз в три недели или один раз в четыре недели.
В некоторых вариантах осуществления ингибитор IAP, (S)-N-(S)-1-циклогексил-2-(S)-2-(4-(4-фторбензоил)тиазол-2-ил)пирролидин-1-ил)-2-оксоэтил)-2-(метиламино)пропанамид (Соединение A21), или соединение, раскрытое в патенте США 8,552,003, вводят в дозе от приблизительно 200 мг до приблизительно 400 мг, например, приблизительно 300 мг, один раз в неделю. В других вариантах осуществления ингибитор IAP, (S)-N-(S)-1-циклогексил-2-(S)-2-(4-(4-фторбензоил)тиазол-2-ил)пирролидин-1-ил)-2-оксоэтил)-2-(метиламино)пропанамид (Соединение A21), или соединение, раскрытое в патенте США 8,552,003, вводят в дозе от приблизительно 800 мг до приблизительно 1000 мг, например, приблизительно 900 мг, один раз в неделю. В некоторых вариантах осуществления ингибитор IAP, (S)-N-(S)-1-циклогексил-2-(S)-2-(4-(4-фторбензоил)тиазол-2-ил)пирролидин-1-ил)-2-оксоэтил)-2-(метиламино)пропанамид (Соединение A21), или соединение, раскрытое в патенте США 8,552,003, вводят в дозе от приблизительно 200 мг до приблизительно 400 мг, например, приблизительно 300 мг, один раз в четыре недели.
В некоторых вариантах осуществления ингибитор IAP, (S)-N-(S)-1-циклогексил-2-(S)-2-(4-(4-фторбензоил)тиазол-2-ил)пирролидин-1-ил)-2-оксоэтил)-2-(метиламино)пропанамид (Соединение A21), или соединение, раскрытое в патенте США 8,552,003, вводят перорально.
В некоторых вариантах осуществления ингибитор IAP, (S)-N-(S)-1-циклогексил-2-(S)-2-(4-(4-фторбензоил)тиазол-2-ил)пирролидин-1-ил)-2-оксоэтил)-2-(метиламино)пропанамид (Соединение A21), или соединение, раскрытое в патенте США 8,552,003, применяют в комбинации с ингибитором PD-1 (например, молекулой антитела против PD-1). В одном варианте осуществления ингибитор IAP, (S)-N-(S)-1-циклогексил-2-(S)-2-(4-(4-фторбензоил)тиазол-2-ил)пирролидин-1-ил)-2-оксоэтил)-2-(метиламино)пропанамид (Соединение A21), или соединение, раскрытое в патенте США 8,552,003, вводят в дозе от 200 мг до 400 мг (например, в дозе 300 мг), например, один раз в неделю, например, перорально, и ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе от 300 мг до 500 мг (например, в дозе 400 мг), например, один раз в 4 недели, например, путем внутривенной инфузии.
В некоторых вариантах осуществления ингибитор IAP, (S)-N-(S)-1-циклогексил-2-(S)-2-(4-(4-фторбензоил)тиазол-2-ил)пирролидин-1-ил)-2-оксоэтил)-2-(метиламино)пропанамид (Соединение A21), или соединение, раскрытое в патенте США 8,552,003, применяют в комбинации с ингибитором PD-1 (например, молекулой антитела против PD-1) для лечения рака толстой и прямой кишки, рака легкого (например, немелкоклеточного рака легкого (НМРЛ)) или рака молочной железы (например, трижды негативного рака молочной железы (например, ТНРМЖ)).
Примеры ингибиторов EGFR
В одном варианте осуществления комбинация, описанная в настоящей заявке, включает ингибитор рецептора эпидермального фактора роста (EGFR). В некоторых вариантах осуществления комбинация применяется для лечения рака, например, рака, описанного в настоящей заявке, например, солидной опухоли (например, рака легкого (например, немелкоклеточного рака легкого), рака поджелудочной железы, рака молочной железы (например, трижды негативного рака молочной железы (ТНРМЖ)) или рака толстой кишки). В некоторых вариантах осуществления рак выбран из рака толстой и прямой кишки (например, микросателлитно стабильного рака толстой и прямой кишки (MSS CRC)), рака легкого (например, немелкоклеточного рака легкого) или рака молочной железы (например, трижды негативного рака легкого (ТНРМЖ)).
В некоторых вариантах осуществления ингибитором EGFR является (R,E)-N-(7-хлор-1-(1-(4-(диметиламино)бут-2-еноил)азе-пан-3-ил)-1H-бензо[d]имидазол-2-ил)-2-метилизоникотинамид (Соединение A40), или соединение, раскрытое в публикации PCT WO 2013/184757.
В некоторых вариантах осуществления ингибитор EGFR, например, (R,E)-N-(7-хлор-1-(1-(4-(диметиламино)бут-2-еноил)азе-пан-3-ил)-1H-бензо[d]имидазол-2-ил)-2-метилизоникотинамид (Соединение A40), или соединение, раскрытое в публикации PCT WO 2013/184757, вводят в дозе 150-250 мг, например, в день. В некоторых вариантах осуществления ингибитор EGFR, например, (R,E)-N-(7-хлор-1-(1-(4-(диметиламино)бут-2-еноил)азепан-3-ил)-1H-бензо[d]имидазол-2-ил)-2-метилизоникотинамид (Соединение A40), или соединение, раскрытое в публикации PCT WO 2013/184757, вводят в дозе приблизительно 150, 200 или 250 мг, или приблизительно 150-200 или 200-250 мг.
В некоторых вариантах осуществления ингибитор EGFR, (R,E)-N-(7-хлор-1-(1-(4-(диметиламино)бут-2-еноил)азепан-3-ил)-1H-бензо[d]имидазол-2-ил)-2-метилизоникотинамид (Соединение A40), или соединение, раскрытое в публикации PCT WO 2013/184757, является ковалентным, необратимым ингибитором тирозинкиназы. В некоторых вариантах осуществления ингибитор EGFR, (R,E)-N-(7-хлор-1-(1-(4-(диметиламино)бут-2-еноил)азепан-3-ил)-1H-бензо[d]имидазол-2-ил)-2-метилизоникотинамид (Соединение A40), или соединение, раскрытое в публикации PCT WO 2013/184757, ингибирует активирующие мутации EGFR (L858R, ex19del). В других вариантах осуществления ингибитор EGFR, (R,E)-N-(7-хлор-1-(1-(4-(диметиламино)бут-2-еноил)азепан-3-ил)-1H-бензо[d]имидазол-2-ил)-2-метилизоникотинамид (Соединение A40), или соединение, раскрытое в публикации PCT WO 2013/184757, не ингибирует или по существу не ингибирует EGFR дикого типа (wt). Соединение A40 показало эффективность у пациентов с EGFR мутантным НМРЛ. В некоторых вариантах осуществления ингибитор EGFR, (R,E)-N-(7-хлор-1-(1-(4-(диметиламино)бут-2-еноил)азепан-3-ил)-1H-бензо[d]имидазол-2-ил)-2-метилизоникотинамид (Соединение A40), или соединение, раскрытое в публикации PCT WO 2013/184757, также ингибирует одну или более киназ из семейства TEC-киназ. Киназы семейства Tec включают, например, ITK, BMX, TEC, RLK и BTK, и являются основными в размножении Т-клеточного рецептора и сигнализации рецепторов хемокинов (Schwartzberg et al. (2005) Nat. Rev. Immunol. p. 284-95). Например, Соединение A40 может ингибировать ITK с биохимической IC50 1,3 нМ. ITK является важным ферментом для выживания Th2 клеток, и его ингибирование приводит к смещению баланса между Th2 и Th1 клетками. Комбинированное лечение in vivo ингибитором ITK ибрутинибом или Соединением A40 и антителом против PD-L1 приводит к превосходной эффективности по сравнению с любым отдельно применяемым средством в нескольких моделях.
В некоторых вариантах осуществления комбинация, описанная в настоящей заявке, включает ингибитор EGFR, (R,E)-N-(7-хлор-1-(1-(4-(диметиламино)бут-2-еноил)азепан-3-ил)-1H-бензо[d]имидазол-2-ил)-2-метилизоникотинамид (Соединение A40), или соединение, раскрытое в публикации PCT WO 2013/184757, и ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекулу антитела против PD-1).
Комбинация ингибирования ITK (ибрутинибом) и ингибирования контрольной точки более эффективна, чем отдельное применение любого средства в различных сингенных моделях на мышах, например, таких, которые экспрессируют ITK, но не экспрессируют BTK. В некоторых вариантах осуществления ингибитор EGFR, (R,E)-N-(7-хлор-1-(1-(4-(диметиламино)бут-2-еноил)азепан-3-ил)-1H-бензо[d]имидазол-2-ил)-2-метилизоникотинамид (Соединение A40), или соединение, раскрытое в публикации PCT WO 2013/184757, ингибирует ITK. Синергический эффект ингибирования ITK и блокады контрольной точки исследовали на мышиных аллотрансплантатах при использовании линий мышиных раковых клеток (A20, CT26 и 4T1) (Sagiv-Barfi et al. (2015) Blood, стр. 2079-86). Комбинация антитела против PD-L1 и ибрутиниба (ингибитора ITK), как было показано, являлась значительно более эффективной, чем любое отдельное средство во всех трех моделях. В этих экспериментах эффект лечения был длителным несмотря на введение ибрутиниба только в течение 8 дней и введение в общей сложности 5 доз антитела против PD-L1. Приблизительно половина мышей с опухолями CT26, получавших эту комбинацию, были полностью вылечены (ни одна из мышей, получавших любое отдельное средство, не была вылечена). Повторное введение этим мышам инокулята опухоли CT26 продемонстрировало долговременную противоопухолевую память, специфичную к этой клеточной линии (Sagiv-Barfi et al. (2015) Blood, стр. 2079-86). Кроме того, опухолеспецифичные Т-клетки были обнаружены в крови и селезенке мышей, получавших ибрутиниб и антитело против PD-L1. Подобный эксперимент проводили при использовании Соединения A40 в модели лимфомы A20 (см., например, Пример 4). Комбинация Соединения A40 и антитела против PD-L1 или ибрутиниба и антитела против PD-L1 была более эффективной, чем отдельное средство. Соединение A40 и ибрутиниб вводили лишь в течение десяти дней и вводили в общей сложности 5 доз антитела против PD-L1. Соединение A40 и ибрутиниб вводили лишь кратковременно, при этом действие Соединения A40 плюс антитело против PD-L1 и ибрутиниба плюс антитело против PD-L1 на выживаемость продолжалось дольше 60 дней. Комбинация антитела против PD-L1 и Соединения A40 приводила к регрессии опухолей у мышей-носителей аллотрансплантата лимфомы A20. Таким образом, в некоторых вариантах осуществления ингибитор EGFR, (R,E)-N-(7-хлор-1-(1-(4-(диметиламино)бут-2-еноил)азепан-3-ил)-1H-бензо[d]имидазол-2-ил)-2-метилизоникотинамид (Соединение A40), или соединение, раскрытое в публикации PCT WO 2013/184757, увеличивает или применяется для увеличения противоопухолевого действия ингибитора PD-1 (например, молекулы антитела против PD-1).
В некоторых вариантах осуществления ингибитор EGFR, (R,E)-N-(7-хлор-1-(1-(4-(диметиламино)бут-2-еноил)азепан-3-ил)-1H-бензо[d]имидазол-2-ил)-2-метилизоникотинамид (Соединение A40), или соединение, раскрытое в публикации PCT WO 2013/184757, и ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекулу антитела против PD-1), вводят в дозе и/или по времененной схеме, которые в комбинации обеспечивают требуемую противоопухолевую активность.
В одном варианте осуществления ингибитор EGFR, (R,E)-N-(7-хлор-1-(1-(4-(диметиламино)бут-2-еноил)азепан-3-ил)-1H-бензо[d]имидазол-2-ил)-2-метилизоникотинамид (Соединение A40), или соединение, раскрытое в публикации PCT WO 2013/184757, вводят в дозе от 5 мг до 100 мг, например, от 10 мг до 75 мг, от 15 мг до 50 мг, от 20 мг до 30 мг, от 10 мг до 40 мг, от 10 мг до 25 мг или от 25 мг до 40 мг, например, в дозе 5 мг, 10 мг, 15 мг, 20 мг, 25 мг, 30 мг, 35 мг, 40 мг, 45 мг, 50 мг, 60 мг, 70 мг, 80 мг, 90 мг или 100 мг, например, два раза в день, один раз в день, один раз в два дня, один раз в три дня или один раз в неделю.
В одном варианте осуществления ингибитор EGFR, (R,E)-N-(7-хлор-1-(1-(4-(диметиламино)бут-2-еноил)азепан-3-ил)-1H-бензо[d]имидазол-2-ил)-2-метилизоникотинамид (Соединение A40), или соединение, раскрытое в публикации PCT WO 2013/184757, вводят в дозе от 10 мг до 50 мг (например, 25 мг), например, один раз в день. В некоторых вариантах осуществления ингибитор EGFR, (R,E)-N-(7-хлор-1-(1-(4-(диметиламино)бут-2-еноил)азепан-3-ил)-1H-бензо[d]имидазол-2-ил)-2-метилизоникотинамид (Соединение A40), или соединение, раскрытое в публикации PCT WO 2013/184757, вводят перорально. В одном варианте осуществления ингибитор EGFR, (R,E)-N-(7-хлор-1-(1-(4-(диметиламино)бут-2-еноил)азепан-3-ил)-1H-бензо[d]имидазол-2-ил)-2-метилизоникотинамид (Соединение A40), или соединение, раскрытое в Публикации PCT WO 2013/184757, вводят в дозе от 10 мг до 50 мг (например, 25 мг), например, один раз в день, например, перорально, и ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе от 300 мг до 500 мг (например, в дозе 400 мг), например, один раз в 4 недели, например, путем внутривенной инфузии. В некоторых вариантах осуществления комбинацию вводят в одном или более курсах применения, например, одном или более 28-дневных курсах применения. В некоторых вариантах осуществления ингибитор EGFR, (R,E)-N-(7-хлор-1-(1-(4-(диметиламино)бут-2-еноил)азепан-3-ил)-1H-бензо[d]имидазол-2-ил)-2-метилизоникотинамид (Соединение A40), или соединение, раскрытое в публикации PCT WO 2013/184757, вводят в день 1 до дня 10 первого курса применения. В некоторых вариантах осуществления ингибитор EGFR, (R,E)-N-(7-хлор-1-(1-(4-(диметиламино)бут-2-еноил)азепан-3-ил)-1H-бензо[d]имидазол-2-ил)-2-метилизоникотинамид (Соединение A40), или соединение, раскрытое в публикации PCT WO 2013/184757, не вводят в день 11 до дня 28 первого курса применения, или не вводят ни в одном из последующих курсов применения.
В некоторых вариантах осуществления ингибитор EGFR, (R,E)-N-(7-хлор-1-(1-(4-(диметиламино)бут-2-еноил)азепан-3-ил)-1H-бензо[d]имидазол-2-ил)-2-метилизоникотинамид (Соединение A40), или соединение, раскрытое в публикации PCT WO 2013/184757, применяют в комбинации с ингибитором PD-1 (например, молекулой антитела против PD-1) для лечения рака толстой и прямой кишки (CRC) (например, MSS-CRC), рака легкого (например, немелкоклеточного рака легкого (НМРЛ)) или рака молочной железы (например, трижды негативного рака молочной железы (ТНРМЖ)).
В некоторых вариантах осуществления ингибитор EGFR выбран из одного из более из эрлотиниба, гефитиниба, цетуксимаба, панитумумаба, нецитумумаба, PF-00299804, нимотузумаб или RO5083945.
Примеры ингибиторов mTOR
В одном варианте осуществления комбинация, описанная в настоящей заявке, включает ингибитор мишени рапамицина (mTOR). В некоторых вариантах осуществления комбинация применяется для лечения рака, например, рака, описанного в настоящей заявке, например, солидной опухоли (например, рака предстательной железы, рака молочной железы, рака головного мозга, рака мочевого пузыря, рака поджелудочной железы, рака почки или рака печени, рака легкого (например, мелкоклеточного рака легкого или немелкоклеточного рака легкого), рака дыхательных путей/грудины, саркомы, рака костей, немелкоклеточного рака легкого, эндокринного рака, астроцитомы, рака шейки матки, неврологического рака, рака желудка или меланомы), например, гемобластоза (например, лейкоза (например, лимфоцитарного лейкоза), например, лимфомы, или например, множественной миеломы). В некоторых вариантах осуществления рак выбран из рака толстой и прямой кишки (например, микросателлитно стабильного рака толстой и прямой кишки (MSS CRC)), рака легкого (например, немелкоклеточного рака легкого) или рака молочной железы (например, трижды негативного рака легкого (ТНРМЖ)).
В некоторых вариантах осуществления ингибитором mTOR является дактолизиб (Соединение A4) или 8-(6-метокси-пиридин-3-ил)-3-метил-1-(4-пиперазин-1-ил-3-трифторметил-фенил)-1,3-дигидро-имидазо[4,5-c]хинолин-2-он (Соединение A41), или соединение, раскрытое в публикации PCT WO 2006/122806.
В некоторых вариантах осуществления ингибитором mTOR является эверолимус (также известный как Афинитор®; Соединение A36) или соединение, раскрытое в публикации PCT WO 2014/085318.
В некоторых вариантах осуществления ингибитор mTOR, эверолимус (Соединение A36), или соединение, раскрытое в публикации PCT WO 2014/085318, ингибирует мишень рапамицина у млекопитающих (mTOR), серин-треонинкиназу, после пути PI3K/AKT. Путь mTOR дерегулирован при нескольких формах рака у человека. Без ограничения теорией, считается, что в некоторых вариантах осуществления ингибитор mTOR, эверолимус (Соединение A36), или соединение, раскрытое в публикации PCT WO 2014/085318, связывается с внутриклеточным белком, FKBP-12, что приводит к образованию ингибирующего комплекса с mTOR комплексом 1 (mTORC1) и, таким образом, ингибированию активности mTOR киназы. Эверолимус (Соединение A36) может снижать активность рибосомной протеинкиназы S6 (S6K1) и/или связывающего эукариотический фактор инициации 4E белка (4E-BP1), нижестоящих эффекторов mTOR, участвующих в синтезе белка. S6K1 является субстратом mTORC1 и фосфорилирует домен активации 1 эстрогенового рецептора, что приводит к лиганднезависимой активации рецептора. Кроме того, эверолимус (Соединение A36) может ингибировать экспрессию гипоксия-индуцируемого фактора (например, HIF-1) и/или снижать экспрессию фактора роста эндотелия сосудов (VEGF). Ингибирование mTOR эверолимусом (Соединение A36), как было показано, уменьшало пролиферацию клеток, ангиогенез и захват глюкозы в исследованиях in vitro и/или in vivo. Конститутивная активация пути PI3K/Akt/mTOR может способствовать эндокринной устойчивости при раке молочной железы. Исследования in vitro показывают, что эстрогензависимые и HER2+ клетки рака молочной железы чувствительны к ингибирующим эффектам эверолимуса (Соединения A36), и что комбинированное лечение эверолимусом и ингибиторами Akt, HER2 или ароматазы увеличивает противоопухолевую активность эверолимуса (Соединения A36) синергическим образом. Двумя регуляторами сигнализации mTORC1 являются супрессоры онкогенов, комплексы туберин-склероза 1 и 2 (TSC1, TSC2). Потеря или деактивация TSC1 или TSC2 приводит к активации нижестоящей сигнализации. При туберозном склерозе (TSC), генетическом нарушении, инактивирующие мутации в гене TSC1 или TSC2 приводят к образованию гамартом по всему телу.
В некоторых вариантах осуществления комбинация, описанная в настоящей заявке, включает ингибитор mTOR, эверолимус (Соединение A36), или соединение, раскрытое в публикации PCT WO 2014/085318, и ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекулу антитела против PD-1).
Эверолимус (Соединение A36) применяли в клиниках в качестве прямого противоопухолевого средства в дозе 10 мг ежедневно для подавления активности mTOR в опухолевых клетках, а также в качестве иммунодепрессанта у больных, требующих пересадки паренхиматозных органов, в дозе 1,5-2,0 мг ежедневно для подавления функции Т-лимфоцитов. Без ограничения теорией, считается, что в некоторых вариантах осуществления, при таких дозах и схемах применения, эверолимус (Соединение A36), как ожидается, будет ослаблять эффективный противоопухолевый ответ. Иммуностарение представляет собой снижение иммунной функции, которое наблюдается у пожилых людей и включает пониженный ответ на вакцинацию, в том числе вакцинацию против гриппа. Снижение иммунной функции с возрастом включает увеличение PD-1-положительных "истощенных" Т-лимфоцитов, которые демонстрируют пониженный ответ при стимуляции антигеном (Lages et al. (2010) Aging Cell 9, 785-798). Клинические данные указывают, что доза 5 мг в неделю может быть иммуностимулирующей, уменьшая процент PD-1-положительных CD4+ и CD8+ лимфоцитов по сравнению с лечением плацебо и усиливая ответ на вакцину против гриппа у пожилых субъектов (Mannick et al. (2014) Sci. Transl. Med. Vol. 6, Issue 268, pp. 268ra179). В некоторых вариантах осуществления иммуностимулирующая доза ингибитора mTOR, эверолимуса (Соединения A36), или соединения, раскрытого в публикации PCT WO 2014/085318, увеличивает или используется для увеличения противоопухолевой активности ингибитора PD-1 (например, молекулы антитела против PD-1).
В некоторых вариантах осуществления ингибитор mTOR, эверолимус (Соединение A36), или соединение, раскрытое в публикации PCT WO 2014/085318, и ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекулу антитела против PD-1), вводят в дозе и/или по временной схеме, которые в комбинации обеспечивают требуемую противоопухолевую активность.
В некоторых вариантах осуществления доза эверолимуса (Соединения A36), одобренная при показаниях рака у взрослых (например, рака молочной железы (например, ТНРМЖ), почечно-клеточной карциномы и нейроэндокринных опухолей (например, атипичной легочной карциноидной опухоли) составляет 10 мг ежедневно. Без ограничения теорией, считается, что в некоторых вариантах осуществления моделирование и симуляция на основе mTOR-опосредованного фосфорилирования ее нижестоящей S6 киназы (S6K) указывает, что схема применения с введением 20 мг раз в неделю ингибирует mTOR-опосредованное фосфорилирование S6K почти полностью, схема применения с введением 5 мг раз в неделю ингибирует фосфорилирование S6K больше чем на 50% и схема применения с введением 0,5 мг раз в день ингибирует фосфорилирование S6K приблизительно на 38% в интервале между введениями (Mannick et al. (2014) Sci. Transl. Med. Vol. 6, Issue 268, pp. 268ra179; Tanaka (2008) J. Clin. Oncol. p. 1596-602). Таким образом, в некоторых вариантах осуществления ингибитор mTOR, эверолимус (Соединение A36), или соединение, раскрытое в публикации PCT WO 2014/085318, вводят в дозе 5 мг раз в неделю (QW), например, в комбинации с ингибитором PD-1 (например, молекулой антитела против PD-1). В других вариантах осуществления также может использоваться доза 0,5 мг раз в день (QD), например, если доза 5 мг раз в неделю (QW) плохо переносится. В некоторых вариантах осуществления ингибитор mTOR, эверолимус (Соединение A36), или соединение, раскрытое в публикации PCT WO 2014/085318, вводят в дозе 5 мг или меньше, один раз в неделю.
В некоторых вариантах осуществления ингибитор mTOR, например, эверолимус (Соединение A36), или соединение, раскрытое в публикации PCT WO 2014/085318, вводят в дозе приблизительно 2,5-20 мг/день. В одном варианте осуществления ингибитор TOR, например, эверолимус (Соединение A36), или соединение, раскрытое в публикации PCT WO 2014/085318, вводят в дозе приблизительно 2,5, 5, 10 или 20 мг/день, например, приблизительно 2,5-5, 5-10 или 10-20 мг/день.
В одном варианте осуществления ингибитор mTOR, эверолимус (Соединение A36), или соединение, раскрытое в публикации PCT WO 2014/085318, вводят в дозе от 1 мг до 10 мг, от 2 мг до 8 мг, от 3 мг до 7 мг или от 4 мг до 6 мг, например, в дозе 1 мг, 2 мг, 3 мг, 4 мг, 5 мг, 6 мг, 7 мг, 8 мг, 9 мг или 10 мг, например, один раз в неделю, один раз в две недели, один раз в три недели или один раз в четыре недели. В одном варианте осуществления ингибитор mTOR, эверолимус (Соединение A36), или соединение, раскрытое в публикации PCT WO 2014/085318, вводят в дозе от 4 мг до 6 мг, например, 5 мг, например, один раз в неделю.
В другом варианте осуществления ингибитор mTOR, эверолимус (Соединение A36), или соединение, раскрытое в публикации PCT WO 2014/085318, вводят в дозе от 0,1 мг до 1 мг, от 0,2 мг до 0,8 мг, от 0,3 мг до 0,7 мг, или от 0,4 мг до 0,6 мг, например, 0,1 мг, 0,2 мг, 0,3 мг, 0,4 мг, 0,5 мг, 0,6 мг, 0,7 мг, 0,8 мг, 0,9 мг или 1 мг, например, один раз в день или один раз в неделю.
В некоторых вариантах осуществления ингибитор mTOR, эверолимус (Соединение A36), или соединение, раскрытое в публикации PCT WO 2014/085318, вводят перорально.
В некоторых вариантах осуществления ингибитор mTOR, эверолимус (Соединение A36), или соединение, раскрытое в публикации PCT WO 2014/085318, вводят в дозе от 2 мг до 8 мг (например, в дозе 5 мг), например, один раз в неделю, например, перорально, и ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе от 300 мг до 500 мг (например, в дозе 400 мг), например, один раз в 4 недели, например, путем внутривенной инфузии.
В некоторых вариантах осуществления ингибитор mTOR, эверолимус (Соединение A36), или соединение, раскрытое в публикации PCT WO 2014/085318, применяют в комбинации с ингибитором PD-1 (например, молекулой антитела против PD-1) для лечения рака толстой и прямой кишки, рака легкого (например, немелкоклеточного рака легкого (НМРЛ)) или рака молочной железы (например, трижды негативного рака молочной железы (ТНРМЖ)).
В некоторых вариантах осуществления mTOR ингибитор выбран из одного или более из рапамицина, темсиролимуса (Торизела®), AZD8055, BEZ235, BGT226, XL765, PF-4691502, GDC0980, SF1126, OSI-027, GSK1059615, KU-0063794, WYE-354, Palomid 529 (P529), PF-04691502 или PKI-587, ридафоролимуса (официально известного как деферолимус, (1R,2R,4S)-4-[(2R)-2[(1R,9S,12S,15R,16E,18R,19R,21R,23S,24E,26E,28Z,30S,32S,35R)-1,18-дигидрокси-19,30-диметокси-15,17,21,23,29,35-гексаметил-2,3,10,14,20-пентаоксо-11,36-диокса-4-азатрицикло[30.3.1.04,9]гексатриаконта-16,24,26,28-тетраен-12-ил]пропил]-2-метоксициклогексил-диметилфосфинат, также известный как AP23573 и MK8669, и описанный в публикации PCT WO 03/064383); эверолимуса (Афинитора® или RAD001); рапамицина (AY22989, Сиролимуса®); симапимода (Номер CAS: 164301-51-3); (5-{2,4-бис[(3S)-3-метилморфолин-4-ил]пиридо[2,3-d]пиримидин-7-ил}-2-метоксифенил)метанола (AZD8055); 2-амино-8-[транс-4-(2-гидроксиэтокси)циклогексил]-6-(6-метокси-3-пиридинил)-4-метил-пиридо[2,3-d]пиримидин-7(8H)-она (PF04691502, Номер CAS: 1013101-36-4); N2-[1,4-диоксо-4-[[4-(4-оксо-8-фенил-4H-1-бензопиран-2-ил)морфолиний-4-ил]метокси]бутил]-L-аргинилглицил-L-α-аспартил-L-серина (SEQ ID NO: 237) внутренняя соль (SF1126, Номер CAS: 936487-67-1) или XL765 (SAR245409).
Другие примеры ингибиторов mTOR включают, без ограничения перечисленными, темсиролимус; ридафоролимус (1R,2R,4S)-4-[(2R)-2[(1R,9S,12S,15R,16E,18R,19R,21R,23S,24E,26E,28Z,30S,32S,35R)-1,18-дигидрокси-19,30-диметокси-15,17,21,23,29,35-гексаметил-2,3,10,14,20-пентаоксо-11,36-диокса-4-азатрицикло[30.3.1.04,9]гексатриаконта-16,24,26,28-тетраен-12-ил]пропил]-2-метоксициклогексил-диметилфосфинат, также известный как AP23573 и MK8669; эверолимус (RAD001); рапамицин (AY22989); симапимод; (5-{2,4-бис[(3S)-3-метилморфолин-4-ил]пиридо[2,3-d]пиримидин-7-ил}-2-метоксифенил)метанол (AZD8055); 2-амино-8-[транс-4-(2-гидроксиэтокси)циклогексил]-6-(6-метокси-3-пиридинил)-4-метил-пиридо[2,3-d]пиримидин-7(8H)-он (PF04691502); и N2-[1,4-диоксо-4-[[4-(4-оксо-8-фенил-4H-1-бензопиран-2-ил)морфолиний-4-ил]метокси]бутил]-L-аргинилглицил-L-α-аспартил-L-серина (SEQ ID NO: 237) внутренняя соль (SF1126); и XL765.
Примеры агонистов IL-15
В одном варианте осуществления комбинация, описанная в настоящей заявке, включает агонист интерлейкина-15 (IL-15). В некоторых вариантах осуществления комбинация применяется для лечения рака, например, рака, описанного в настоящей заявке, например, солидной опухоли (например, рефракторной солидной опухоли), (например, меланомы (например, метастатической или распространенной меланомы), рака почки (например, почечно-клеточного рака), немелкоклеточного рака легкого, плоскоклеточного рака головы и шеи или рака мочевого пузыря (например, не инвазирующего мышечную ткань рака мочевого пузыря)), например, гемобластоза (например, лейкоза, например, острого миелогенного лейкоза (например, рефракторного или рецидивирующего острого миелогенного лейкоза), например, лимфомы, например, неходжкинской лимфомы (например, рецидивирующей/рефракторной медленно прогрессирующей В-клеточной неходжкинской лимфомы), например, или множественной миеломы (например, рецидивирующей или рефракторной множественной миеломы)). В некоторых вариантах осуществления рак является солидной опухолью.
IL-15, секретированный мононуклеарными фагоцитами (и некоторыми другими типами клеток) после вирусной инфекции, регулирует активацию и пролиферацию T и NK-клеток. Этот цитокин вызывает активацию активаторов транскрипции STAT3, STAT5 и STAT6 через пути передачи сигнала JAK киназы в тучных клетках, Т-клетках и дендритных эпидермальных Т-клетках. IL-15 и интерлейкин-2 (IL-2) структурно подобны и обладают многими общими биологическими активностями; оба могут связываться с одними и теми же субъединицами рецептора эритропоэтина, негативно регулируя активность друг друга. Количество CD8+ Т-клеток памяти может регулироваться балансом между IL-15 и IL-2.
В некоторых вариантах осуществления агонистом IL-15 является рекомбинантный человеческий IL-15 (rhIL-15), например, CYP0150 (Cytune). CYP0150 представляет собой рекомбинантный белок, состоящий из человеческого IL-15, связанного с доменом Sushi+ человеческого рецептора альфа-цепи (транспрезентация).
CYP0150 раскрыт, например, в публикации PCT WO 2007/046006. CYP0150 имеет следующую аминокислотную последовательность: MAPRRARGCRTLGLPALLLLLLLRPPATRGDYKDDDDKIEGRITCPPPMSVEHADIWVKSYSLYSRERYICNSGFKRKAGTSSLTECVLNKATNVAHWTTPSLKCIRDPALVHQRPAPPSGGSGGGGSGGGSGGGGSLQNWVNVISDLKKIEDLIQSMHIDATLYTESDVHPSCKVTAMKCFLLELQVISLESGDASIHDTVENLIILANNSLSSNGNVTESGCKECEELEEKNIKEFLQSFVHIVQMFINTS (SEQ ID NO: 248) (раскрытую как SEQ ID NO: 60 в WO 2007/046006) или MDSKGSSQKAGSRLLLLLVVSNLLLCQGVVSTTRDYKDDDDKIEGRNWVNVISDLKKIEDLIQSMHIDATLYTESDVHPSCKVTAMKCFLLELQVISLESGDASIHDTVENLIILANNSLSSNGNVTESGCKECEELEEKNIKEFLQSFVHIVQMFINTSSGGGSGGGGSGGGGSGGGGSGGGSLQITCPPPMSVEHADIWVKSYSLYSRERYICNSGFKRKAGTSSLTECVLNKATNVAHWTTPSLKCIRDPALVHQRPAPP (SEQ ID NO: 249) (раскрытую как SEQ ID NO: 62 в WO 2007/046006).
В некоторых вариантах осуществления агонистом IL-15 является ALT-803 (Altor BioScience). ALT-803 представляет собой растворимый комплекс IL-15N72D:IL-15RαSu/Fc, полученный из высокопродуктивной рекомбинантной линии клеток млекопитающего, которая коэкспрессирует IL-15N72D и слитый белок IL-15RαSu/Fc. Мутантный IL-15 (N72D) обладает повышенной биологической активностью IL-15 (Zhu et al. 2009, J Immunol. 183:3598). Мутантный IL-15N72D и растворимый домен IL-15Rα могут образовывать стабильные гетеродимерные комплексы в растворе, при этом такой комплекс демонстрирует повышенную биологическую активность (приблизительно в 25 раз более активный) по сравнению с не связанным в комплекс IL-15. ALT-803 раскрыт, например, в публикации PCT WO 2012/040323 и патенте США 8,507,222.
В некоторых вариантах осуществления агонистом IL-15 является hetIL-15 (Admune). HetIL-15 представляет собой гетеродимерный человеческий IL-15 (IL-15/sIL-15Ra). HetIL-15 раскрыт, например, в публикации PCT WO 2009/002562 и WO 2014/066527.
Примеры агонистов CD40
В одном варианте осуществления комбинация включает агонист CD40. В некоторых вариантах осуществления комбинация применяется для лечения рака, например, рака, описанного в настоящей заявке, например, солидной опухоли (например, рака легкого, рака пищевода, меланомы или почечно-клеточной карциномы), например, гемобластоза (например, лейкоза (например, хронического лимфоцитарного лейкоза (ХЛЛ)), например, лимфомы (например, неходжкинской лимфомы), или множественной миеломы).
В одном варианте осуществления агонистом CD40 является ADC-1013 (Alligator/BioInvent). ADC-1013 представляет собой полностью человеческое IgG агонистическое моноклональное антитело против человеческого CD40. CD40, интегральный мембранный белок, присутствующий на поверхности B-лимфоцитов, является членом суперсемейства рецепторов фактора некроза опухоли и экспрессируется на высоком уровне во многих раковых опухолях, таких как В-клеточные злокачественные новообразования. Агонисты CD40, например, антитела против CD40, способны эффективно заменять активность хелперных Т-клеток (Ridge, J. et al. (1998) Nature 393: 474-478).
ADC-1013 раскрыт, например, в публикации PCT WO 2015/091853. Клоны ADC-1013 включают, например, 1136/1137, 1132/1133, 1148/1149, 1140/1135, 1134/1135, 1107/1108, 1142/1135, 1146/1147 и 1150/1151.
Вариабельная область тяжелой цепи 1132/1133 имеет следующую аминокислотную последовательность: EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYAMSWVRQAPGKGLEWVSGIGSYGGGTYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARYVNFGMDYWGQGTLVTVSS (SEQ ID NO: 250) (раскрытую как SEQ ID NO: 65 в WO 2015/091853). Вариабельная область легкой цепи 1132/1133 имеет следующую аминокислотную последовательность: DIQMTQSPSSLSASVGDRVTITCRASQSISSYLNWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQYGRNPPTFGQGTKLEIK (SEQ ID NO: 251) (раскрытую как SEQ ID NO: 66 в WO 2015/091853). CDR1 тяжелой цепи 1132/1133 имеет следующую аминокислотную последовательность: GFTFSSYA (SEQ ID NO: 252) (раскрытую как SEQ ID NO: 13 в WO 2015/091853). CDR2 тяжелой цепи 1132/1133 имеет следующую аминокислотную последовательность: IGSYGGGT (SEQ ID NO: 253) (раскрытую как SEQ ID NO: 14 в WO 2015/091853). CDR3 тяжелой цепи 1132/1133 имеет следующую аминокислотную последовательность: ARYVNFGMDY (SEQ ID NO: 254) (раскрытую как SEQ ID NO: 15 в WO 2015/091853). CDR1 легкой цепи 1132/1133 имеет следующую аминокислотную последовательность: QSISSY (SEQ ID NO: 255) (раскрытую как SEQ ID NO: 16 в WO 2015/091853). CDR2 легкой цепи 1132/1133 имеет следующую аминокислотную последовательность: AAS (SEQ ID NO: 256) (раскрытую как SEQ ID NO: 17 в WO 2015/091853). CDR3 легкой цепи 1132/1133 имеет следующую аминокислотную последовательность: QQYGRNPPT (SEQ ID NO: 257) (раскрытую как SEQ ID NO: 18 в WO 2015/091853).
Вариабельная область тяжелой цепи 1107/1108 имеет следующую аминокислотную последовательность: EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYAMSWVRQAPGKGLEWVSAISGSGGSTYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARRVWGFDYWGQGTLVTVSS (SEQ ID NO: 258) (раскрытую как SEQ ID NO: 79 в WO 2015/091853). Вариабельная область легкой цепи 1107/1108 имеет следующую аминокислотную последовательность: DIQMTQSPSSLSASVGDRVTITCRASQSISSYLNWYQQKPGKAPKLLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQYGVYPFTFGQGTKLEIK (SEQ ID NO: 259) (раскрытую как SEQ ID NO: 80 в WO 2015/091853).
CDR1 тяжелой цепи 1107/1108 имеет следующую аминокислотную последовательность: GFTFSSYA (SEQ ID NO: 252) (раскрытую как SEQ ID NO: 55 в WO 2015/091853). CDR2 тяжелой цепи 1107/1108 имеет следующую аминокислотную последовательность: ISGSGGST (SEQ ID NO: 260) (раскрытую как SEQ ID NO: 56 в WO 2015/091853). CDR3 тяжелой цепи 1107/1108 имеет следующую аминокислотную последовательность: ARRVWGFDY (SEQ ID NO: 261) (раскрытую как SEQ ID NO: 57 в WO 2015/091853). CDR1 легкой цепи 1107/1108 имеет следующую аминокислотную последовательность: QSISSY (SEQ ID NO: 255) (раскрытую как SEQ ID NO: 58 в WO 2015/091853). CDR2 легкой цепи 1107/1108 имеет следующую аминокислотную последовательность: AAS (SEQ ID NO: 256) (раскрытую как SEQ ID NO: 59 в WO 2015/091853). CDR3 легкой цепи 1107/1108 имеет следующую аминокислотную последовательность: QQYGVYPFT (SEQ ID NO: 262) (раскрытую как SEQ ID NO: 60 в WO 2015/091853).
В некоторых вариантах осуществления агонистом CD40 является ISF35. ISF35 представляет собой химерный CD154. ISF раскрыт в публикации PCT WO 2003/099340 и WO 2008/070743.
В некоторых вариантах осуществления агонистом CD40 является дацетузумаб. Дацетузумаб также известен как SGN-40 или huS2C6. Дацетузумаб представляет собой гуманизированное моноклональное антитело, специфичное к CD40. Дацетузумаб раскрыт, например, в Advani et al. J Clin Oncol. 2009; 27(26):4371-7; и Khubchandani et al. Curr Opin Investig Drugs. 2009; 10(6):579-87.
В некоторых вариантах осуществления агонистом CD40 является лукатумумаб (Номер CAS: 903512-50-5). Лукатумумаб также известен как CHIR-12.12 или HCD-122. Лукатумумаб связывается с и ингибирует CD40, ингибируя, таким образом, вызываемую лигандом CD40 пролиферацию клеток и индуцируя лизис клеток посредством антителозависимой клеточной цитотоксичности (ADCC) в клетках, повышенно экспресирующих CD40. Лукатумумаб раскрыт, например, в Tai et al. Cancer Res. 2005; 65(13):5898-906.
Антитела против CD40 способны эффективно заменять активность хелперных Т-клеток (Ridge, J. et al. (1998) Nature 393: 474-478) и могут применяться вместе с антителами к PD-1 (Ito, N. et al. (2000) Immunobiology 201 (5) 527-40).
Примеры агонистов OX40
В одном варианте осуществления комбинация, описанная в настоящей заявке, включает агонист OX40. В некоторых вариантах осуществления комбинация применяется для лечения рака, например, рака, описанного в настоящей заявке, например, солидной опухоли (например, рака молочной железы, меланомы, рака головы и шеи или рака предстательной железы), например, гемобластоза (например, лимфомы (например, В-клеточной лимфомы)).
OX40, также известный как CD134, является гликопротеином клеточной поверхности и членом суперсемейства рецепторов фактора некроза опухоли (ФНО), экспрессируется на Т-лимфоцитах и обеспечивает костимулирующий сигнал для пролиферации и выживания активированных Т-клеток. Активация OX40 может вызывать пролиферацию эффекторных Т-лимфоцитов, которые вызывают иммунный ответ против опухолевых клеток, которые экспрессируют опухолеассоциированные антигены (TAA).
В некоторых вариантах осуществления агонист OX40 выбран из мАт 106-222, гуманизированного 106-222 (Hu106), мАт 119-122 или гуманизированного 119-122 (Hu119).
МАт 106-222, гуманизированное 106-222 (Hu106), мАт 119-122 и гуманизированное 119-122 (Hu119) раскрыты, например, в публикации PCT WO 2012/027328 и патенте США 9,006,399. Аминокислотная последовательность вариабельной области тяжелой цепи мАт 106-222 раскрыта как SEQ ID NO: 4 в WO 2012/027328. Аминокислотная последовательность вариабельной области легкой цепи мАт 106-222 раскрыта как SEQ ID NO: 10 в WO 2012/027328. Аминокислотная последовательность вариабельной области тяжелой цепи гуманизированного 106-222 (Hu106) раскрыта как SEQ ID NO: 5 в WO 2012/027328. Аминокислотная последовательность вариабельной области легкой цепи гуманизированного 106-222 (Hu106) раскрыта как SEQ ID NO: 11 в WO 2012/027328. Аминокислотная последовательность вариабельной области тяжелой цепи мАт 119-122 раскрыта как SEQ ID NO: 16 в WO 2012/027328. Аминокислотная последовательность вариабельной области легкой цепи мАт 119-122 раскрыта как SEQ ID NO: 22 в WO 2012/027328. Аминокислотная последовательность вариабельной области тяжелой цепи гуманизированного 119-122 (Hu119) раскрыта как SEQ ID NO: 17 в WO 2012/027328. Аминокислотная последовательность вариабельной области легкой цепи гуманизированного 119-122 (Hu119) раскрыта как SEQ ID NO: 23 в WO 2012/027328.
В некоторых вариантах осуществления агонистом OX40 является гуманизированное моноклональное антитело, раскрытое в патенте США 7,959,925 и публикации PCT WO 2006/121810.
В некоторых вариантах осуществления агонист OX40 выбран из MEDI6469, MEDI0562 или MEDI6383. MEDI6469 представляет собой мышиное моноклональное антитело против OX40. MEDI0562 представляет собой гуманизированное моноклональное антитело против OX40. MEDI6383 представляет собой моноклональное антитело против OX40.
В некоторых вариантах осуществления агонист OX40, например MEDI6469, вводят внутривенно в дозе приблизительно 0,4 мг/кг, например, раз в два дня.
Другие примеры антител против OX-40 раскрыты, например, в Weinberg, A. et al. (2000) Immunol 164: 2160-2169.
Примеры агонистов CD27
В одном варианте осуществления комбинация, описанная в настоящей заявке, включает агонист CD27. В некоторых вариантах осуществления комбинация применяется для лечения рака, например, рака, описанного в настоящей заявке, например, солидной опухоли (например, меланомы, почечно-клеточной карциномы, гормонорефракторной аденокарциномы предстательной железы, рака яичника, рака молочной железы, аденокарциномы толстой и прямой кишки или немелкоклеточного рака легкого), например, гемобластоза (например, лимфомы (например, лимфомы Ходжкина, лимфомы Беркетта, мантийноклеточной лимфомы, первичной лимфомы центральной нервной системы или В-клеточной лимфомы из клеток краевой зоны) или лейкоза (например, хронического лимфоцитарного лейкоза (ХЛЛ)).
В одном варианте осуществления агонистом CD27 является варлилумаб (Номер CAS: 1393344-72-3). Варлилумаб также известен как CDX-1127 (Celldex) или 1F5. Варлилумаб представляет собой полностью человеческое моноклональное антитело (мАт), специфичное к CD27, молекуле в пути активации лимфоцитов. CDX-1127 является агонистическим мАт против CD27, которое может активировать человеческие Т-клетки в рамках стимуляции Т-клеточного рецептора и, таким образом, опосредовать противоопухолевые эффекты. CDX-1127 также может обеспечивать прямое терапевтическое действие против опухолей с экспрессией CD27.
Варлилумаб раскрыт, например, в Vitale et al., Clin Cancer Res. 2012;18(14):3812-21, WO 2008/051424 и US 8,481,029.
В одном варианте осуществления агонистом CD27 является BION-1402 (BioNovion). BION-1402 также известен как hCD27.15. BION-1402 представляет собой моноклональное антитело против человеческого CD27. BION-1402 может стимулировать пролиферацию и/или выживание CD27+ клеток. BION-1402 может активировать человеческий CD27 эффективнее, чем его лиганд CD70, что приводит к значительно более усиленному воздействию на пролиферацию CD8+ и CD4+ Т-клеток.
BION-1402 раскрыт, например, как hCD27.15 в WO 2012/004367. Это антитело продуцируется гибридомой hCD27.15, которая была депонирована в ATCC 2 июня 2010 года под номером PTA 11008. Вариабельная область тяжелой цепи hCD27.15 имеет аминокислотную последовательность: EVRLQQSGADLVKPGASVKLSCASGFIIKATYMHWVRQRPEQGLEWIGRIDPANGEKYDPKFQVKAITADTSSSTAYLQLNSLTSDDTAVYYCARYAWYFDVWGAGTTVTVSSAKTTPPXVYPXXPGS (SEQ ID NO: 263) (раскрытую как SEQ ID NO: 3 в WO 2012/004367). Вариабельная область легкой цепи hCD27.15 имеет аминокислотную последовательность: DIQMTQSPASLSASVGDTVTITCRASENIYSFLAWYHQKQGRSPQLLVYHAKTLAEGVPSRFSGSGSGTQFSLKINSLQAEDFGSYYCQHYYGSPLTFGAGTKLEVKRADAAPTVSIFPPSSEELSL (SEQ ID NO: 264) (раскрытую как SEQ ID NO: 4 в WO 2012/004367). CDR1 тяжелой цепи hCD27.15 имеет аминокислотную последовательность: GFIIKATYMH (SEQ ID NO: 265) (раскрытую как SEQ ID NO: 5 в WO 2012/004367). CDR2 тяжелой цепи hCD27.15 имеет аминокислотную последовательность: RIDPANGETKYDPKFQV (SEQ ID NO: 266) (раскрытую как SEQ ID NO: 6 в WO 2012/004367). CDR3 тяжелой цепи hCD27.15 имеет аминокислотную последовательность: YAWYFDV (SEQ ID NO: 267) (раскрытую как SEQ ID NO: 7 в WO 2012/004367). CDR1 легкой цепи hCD27.15 имеет аминокислотную последовательность: RASENIYSFLA (SEQ ID NO: 268) (раскрытую как SEQ ID NO: 8 в WO 2012/004367). CDR2 легкой цепи hCD27.15 имеет аминокислотную последовательность: HAKTLAE (SEQ ID NO: 269) (раскрытую как SEQ ID NO: 9 в WO 2012/004367). CDR3 легкой цепи hCD27.15 имеет аминокислотную последовательность: QHYYGSPLT (SEQ ID NO: 270) (раскрытую как SEQ ID NO: 10 в WO 2012/004367).
Примеры CSF-1/1R-связывающих средств
В одном варианте осуществления комбинация, описанная в настоящей заявке, включает CSF-1/1R-связывающее средство. В некоторых вариантах осуществления комбинация применяется для лечения рака, например, рака, описанного в настоящей заявке, например, солидной опухоли (например, рака предстательной железы, рака молочной железы или пигментного виллонодулярного синовита (PVNS)).
В некоторых вариантах осуществления CSF-1/1R-связывающим средством является ингибитор макрофагального колониестимулирующего фактора (М-КСФ). М-КСФ также иногда известен как CSF-1.
В другом варианте осуществления CSF-1/1R-связывающим средством является ингибитор CSF-1R тирозинкиназы, 4-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)окси)-N-метилпиколинамид (Соединение A15), или соединение, раскрытое в публикации PCT WO 2005/073224. В некоторых вариантах осуществления рак выбран из рака головного мозга (например, мультиформной глиобластомы (GBM)), рака поджелудочной железы или рака молочной железы (например, трижды негативного рака молочной железы (ТНРМЖ)).
В некоторых вариантах осуществления CSF-1/1R-связывающее средство (например, ингибитор тирозинкиназы CSF-1R), 4-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)окси)-N-метилпиколинамид (Соединение A15), или соединение, раскрытое в Публикации PCT WO 2005/073224, вводят в дозе от 50 мг до 1500 мг, например, от 75 мг до 1000 мг, от 100 мг до 900 мг, от 200 мг до 800 мг, от 300 мг до 700 мг, от 400 мг до 600 мг, от 100 мг до 700 мг, от 100 мг до 500 мг, от 100 мг до 300 мг, от 700 мг до 900 мг, от 500 мг до 900 мг, от 300 мг до 900 мг, от 75 мг до 150 мг, от 100 мг до 200 мг, от 200 мг до 400 мг, от 500 мг до 700 мг, или от 800 мг до 1000 мг, например, в дозе 50 мг, 100 мг, 150 мг, 200 мг, 250 мг, 300 мг, 350 мг, 400 мг, 450 мг, 500 мг, 550 мг, 600 мг, 650 мг, 700 мг, 750 мг, 800 мг, 850 мг, 900 мг, 950 мг или 1000 мг. В некоторых вариантах осуществления, CSF-1/1R-связывающее средство (например, ингибитор тирозинкиназы CSF-1R), 4-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]ти-азол-6-ил)окси)-N-метилпиколинамид (Соединение A15), или соединение, раскрытое в публикации PCT WO 2005/073224, вводят ежедневно, например, согласно схеме введения 7 дней/7 дней перерыв. В других вариантах осуществления CSF-1/1R-связывающее средство (например, ингибитор тирозинкиназы CSF-1R), 4-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)окси)-N-метилпиколинамид (Соединение A15), или соединение, раскрытое в публикации PCT WO 2005/073224, вводят два раза в неделю, один раз в неделю, один раз в две недели, один раз в три недели или один раз в четыре недели.
В некоторых вариантах осуществления CSF-1/1R-связывающее средство (например, ингибитор тирозинкиназы CSF-1R), 4-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)окси)-N-метилпиколинамид (Соединение A15), или соединение, раскрытое в публикации PCT WO 2005/073224, вводят в дозе от 50 мг до 150 мг, например, приблизительно 100 мг, например, ежедневно, например, согласно схеме введения 7 дней/7 дней перерыв. В других вариантах осуществления CSF-1/1R-связывающее средство (например, ингибитор тирозинкиназы CSF-1R), 4-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)окси)-N-метилпиколинамид (Соединение A15), или соединение, раскрытое в публикации PCT WO 2005/073224, вводят в дозе от 100 мг до 200 мг, например, приблизительно 150 мг, например, ежедневно, например, согласно схеме введения 7 дней/7 дней перерыв. В других вариантах осуществления CSF-1/1R-связывающее средство (например, ингибитор тирозинкиназы CSF-1R), 4-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)окси)-N-метилпиколинамид (Соединение A15), или соединение, раскрытое в публикации PCT WO 2005/073224, вводят в дозе от 200 мг до 400 мг, например, приблизительно 300 мг, например, ежедневно, например, согласно схеме введения 7 дней/7 дней перерыв. В других вариантах осуществления CSF-1/1R-связывающее средство (например, ингибитор тирозинкиназы CSF-1R), 4-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)окси)-N-метилпиколинамид (Соединение A15), или соединение, раскрытое в публикации PCT WO 2005/073224, вводят в дозе от 500 мг до 700 мг, например, приблизительно 600 мг, например, ежедневно, например, согласно схеме введения 7 дней/7 дней перерыв. В других вариантах осуществления CSF-1/1R-связывающее средство (например, ингибитор тирозинкиназы CSF-1R), 4-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)окси)-N-метилпиколинамид (Соединение A15), или соединение, раскрытое в публикации PCT WO 2005/073224, вводят в дозе от 800 мг до 1000 мг, например, приблизительно 900 мг, например, ежедневно, например, согласно схеме введения 7 дней/7 дней перерыв.
В некоторых вариантах осуществления CSF-1/1R-связывающее средство (например, ингибитор тирозинкиназы CSF-1R), 4-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)окси)-N-метилпиколинамид (Соединение A15), или соединение, раскрытое в публикации PCT WO 2005/073224, вводят в дозе от 50 мг до 150 мг, например, приблизительно 100 мг, один раз в неделю. В других вариантах осуществления CSF-1/1R-связывающее средство (например, ингибитор тирозинкиназы CSF-1R), 4-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)окси)-N-метилпиколинамид (Соединение A15), или соединение, раскрытое в публикации PCT WO 2005/073224, вводят в дозе от 100 мг до 200 мг, например, приблизительно 150 мг, один раз в неделю. В других вариантах осуществления CSF-1/1R-связывающее средство (например, ингибитор тирозинкиназы CSF-1R), 4-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)окси)-N-метилпиколинамид (Соединение A15), или соединение, раскрытое в публикации PCT WO 2005/073224, вводят в дозе от 200 мг до 400 мг, например, приблизительно 300 мг, один раз в неделю. В других вариантах осуществления CSF-1/1R-связывающее средство (например, ингибитор тирозинкиназы CSF-1R), 4-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)окси)-N-метилпиколинамид (Соединение A15), или соединение, раскрытое в публикации PCT WO 2005/073224, вводят в дозе от 500 мг до 700 мг, например, приблизительно 600 мг, один раз в неделю. В других вариантах осуществления CSF-1/1R-связывающее средство (например, ингибитор тирозинкиназы CSF-1R), 4-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)окси)-N-метилпиколинамид (Соединение A15), или соединение, раскрытое в публикации PCT WO 2005/073224, вводят в дозе от 800 мг до 1000 мг, например, приблизительно 900 мг, один раз в неделю.
В некоторых вариантах осуществления CSF-1/1R-связывающее средство (например, ингибитор тирозинкиназы CSF-1R), 4-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)окси)-N-метилпиколинамид (Соединение A15), или соединение, раскрытое в публикации PCT WO 2005/073224, вводят перорально.
В некоторых вариантах осуществления CSF-1/1R-связывающее средство (например, ингибитор тирозинкиназы CSF-1R), 4-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)окси)-N-метилпиколинамид (Соединение A15), или соединение, раскрытое в публикации PCT WO 2005/073224, вводят в комбинации с ингибитором PD-1 (например, молекулой антитела против PD-1). В одном варианте осуществления CSF-1/1R-связывающее средство (например, ингибитор тирозинкиназы CSF-1R), 4-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)окси)-N-метилпиколинамид (Соединение A15), или соединение, раскрытое в публикации PCT WO 2005/073224, вводят в дозе от 50 мг до 150 мг (например, приблизительно 100 мг), например, ежедневно (например, согласно схеме введения 7 дней/7 дней перерыв) или один раз в неделю, например, перорально, и ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе от 300 мг до 500 мг (например, в дозе 400 мг), например, один раз в 4 недели, или в дозе от 200 мг до 400 мг (например, в дозе 300 мг), например, один раз в 3 недели, например, путем внутривенной инфузии. В другом варианте осуществления CSF-1/1R-связывающее средство (например, ингибитор тирозинкиназы CSF-1R), 4-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)окси)-N-метилпиколинамид (Соединение A15), или соединение, раскрытое в публикации PCT WO 2005/073224, вводят в дозе от 100 мг до 200 мг (например, приблизительно 150 мг), например, ежедневно (например, согласно схеме введения 7 дней/7 дней перерыв) или один раз в неделю, например, перорально, и ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе от 300 мг до 500 мг (например, в дозе 400 мг), например, один раз в 4 недели, или в дозе от 200 мг до 400 мг (например, в дозе 300 мг), например, один раз в 3 недели, например, путем внутривенной инфузии. В другом варианте осуществления CSF-1/1R-связывающее средство (например, ингибитор тирозинкиназы CSF-1R), 4-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)окси)-N-метилпиколинамид (Соединение A15), или соединение, раскрытое в публикации PCT WO 2005/073224, вводят в дозе от 200 мг до 400 мг (например, приблизительно 300 мг), например, ежедневно (например, согласно схеме введения 7 дней/7 дней перерыв) или один раз в неделю, например, перорально, и ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе от 300 мг до 500 мг (например, в дозе 400 мг), например, один раз в 4 недели, или в дозе от 200 мг до 400 мг (например, в дозе 300 мг), например, один раз в 3 недели, например, путем внутривенной инфузии. В другом варианте осуществления CSF-1/1R-связывающее средство (например, ингибитор тирозинкиназы CSF-1R), 4-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)окси)-N-метилпиколинамид (Соединение A15), или соединение, раскрытое в публикации PCT WO 2005/073224, вводят в дозе от 500 мг до 700 мг (например, приблизительно 600 мг), например, ежедневно (например, согласно схеме введения 7 дней/7 дней перерыв) или один раз в неделю, например, перорально, и ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе от 300 мг до 500 мг (например, в дозе 400 мг), например, один раз в 4 недели, или в дозе от 200 мг до 400 мг (например, в дозе 300 мг), например, один раз в 3 недели, например, путем внутривенной инфузии. В другом варианте осуществления CSF-1/1R-связывающее средство (например, ингибитор тирозинкиназы CSF-1R), 4-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)окси)-N-метилпиколинамид (Соединение A15), или соединение, раскрытое в публикации PCT WO 2005/073224, вводят в дозе от 800 мг до 1000 мг (например, приблизительно 900 мг), например, ежедневно (например, согласно схеме введения 7 дней/7 дней перерыв) или один раз в неделю, например, перорально, и ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе от 300 мг до 500 мг (например, в дозе 400 мг), например, один раз в 4 недели, или в дозе от 200 мг до 400 мг (например, в дозе 300 мг), например, один раз в 3 недели, например, путем внутривенной инфузии.
В некоторых вариантах осуществления CSF-1/1R-связывающее средство (например, ингибитор тирозинкиназы CSF-1R), 4-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)окси)-N-метилпиколинамид (Соединение A15), или соединение, раскрытое в публикации PCT WO 2005/073224, вводят в комбинации с ингибитором PD-1 (например, молекулой антитела против PD-1) для лечения рака, например, солидной опухоли (например, распространенной солидной опухоли), например, рака головного мозга (например, мультиформной глиобластомы (GBM), например, рецидивирующей глиобластомы), рака молочной железы (например, трижды негативного рака молочной железы (например, ТНРМЖ)) или рака поджелудочной железы (например, распространенного рака поджелудочной железы).
В некоторых вариантах осуществления CSF-1/1R-связывающим средством является ингибитор М-КСФ, Соединение A33, или связывающее средство к CSF-1, раскрытое в публикации PCT WO 2004/045532 или публикации PCT WO 2005/068503, включающее RX1 или 5H4 (например, молекулу антитела или Fab-фрагмент против М-КСФ). В некоторых вариантах осуществления рак выбран из рака эндометрия, рака кожи (например, меланомы), рака поджелудочной железы или рака молочной железы (например, трижды негативного рака молочной железы (ТНРМЖ)).
В некоторых вариантах осуществления CSF-1/1R-связывающее средство, например, ингибитор М-КСФ, Соединение A33, или соединение, раскрытое в публикации PCT WO 2004/045532 (например, молекулу антитела или Fab-фрагмент против М-КСФ), вводят в средней дозе приблизительно 10 мг/кг. В некоторых вариантах осуществления CSF-1/1R-связывающим средством является ингибитор CSF1R или 4-(2-((1R,2R)-2-гидроксициклогексиламино)бензотиазол-6-илокси)-N-метилпиколинамид. 4-(2-((1R,2R)-2-гидроксициклогек-силамино)бензотиазол-6-илокси)-N-метилпиколинамид раскрыт как Пример 157 на странице 117 публикации PCT WO 2007/121484.
В некоторых вариантах осуществления CSF-1/1R-связывающим средством является пексидартиниб (Регистрационный номер CAS 1029044-16-3). Пексидартиниб также известен как PLX3397 или 5-((5-хлор-1H-пирроло[2,3-b]пиридин-3-ил)метил)-N-((6-(трифтор-метил)пиридин-3-ил)метил)пиридин-2-амин. Пексидартиниб представляет собой низкомолекулярный ингибитор рецепторной тирозинкиназы (RTK) KIT, CSF1R и FLT3. FLT3, CSF1R и FLT3 повышенно экспрессируются или мутированы во многих типах раковых клеток и играют важные роли в пролиферации и метастазе опухолевых клеток. PLX3397 может связываться и ингибировать фосфорилирование рецептора фактора стволовых клеток (KIT), рецептора колониестимулирующего фактора 1 (CSF1R) и FMS-подобной тирозинкиназы 3 (FLT3), что может приводить к ингибированию пролиферации опухолевых клеток и даунмодуляции макрофагов, остеокластов и тучных клеток, участвующих в остеолитической метастатической болезни. В некоторых вариантах осуществления CSF-1/1R-связывающее средство, например, пексидартиниб, применяется в комбинации с ингибитором PD-1, например, молекулой антитела против PD-1, описанного в настоящей заявке.
В некоторых вариантах осуществления CSF-1/1R-связывающим средством является эмактузумаб. Эмактузумаб также известен как RG7155 или RO5509554. Эмактузумаб представляет собой гуманизированное IgG1 мАт, специфичное к CSF1R. В некоторых вариантах осуществления CSF-1/1R-связывающее средство, например, пексидартиниб, применяется в комбинации с ингибитором PD-L1, например, молекулой антитела против PD-L1, описанного в настоящей заявке.
В некоторых вариантах осуществления CSF-1/1R-связывающим средством является FPA008. FPA008 представляет собой гуманизированное мАт, которое ингибирует CSF1R. В некоторых вариантах осуществления CSF-1/1R-связывающее средство, например, FPA008, применяется в комбинации с ингибитором PD-1, например, молекулой антитела против PD-1, описанного в настоящей заявке.
Примеры ингибиторов IL-17
В одном варианте осуществления комбинация, описанная в настоящей заявке, включает ингибитор интерлейкина-17 (IL-17). В некоторых вариантах осуществления комбинация применяется для лечения рака, например, рака, описанного в настоящей заявке, например, солидной опухоли, например, рака молочной железы (например, трижды негативного рака молочной железы (ТНРМЖ), рака легкого (например, немелкоклеточного рака легкого (НМРЛ)) или рака толстой кишки. В некоторых вариантах осуществления рак выбран из рака толстой и прямой кишки (например, микросателлитно стабильного рака толстой и прямой кишки (MSS CRC)), рака легкого (например, немелкоклеточного рака легкого) или рака молочной железы (например, трижды негативного рака легкого (ТНРМЖ)).
В некоторых вариантах осуществления ингибитором IL-17 является секукинумаб (регистрационный номер CAS: 875356-43-7 (тяжелая цепь) и 875356-44-8 (легкая цепь)). Секукинумаб также известен как AIN457 и Козэнтикс®. Секукинумаб представляет собой рекомбинантное человеческое моноклональное IgG1/κ антитело, которое специфично связывается с IL-17A. Оно экспрессируется в рекомбинантной линии клеток яичников китайского хомячка (CHO).
Секукинумаб описан, например, в WO 2006/013107, US 7,807,155, US 8,119,131, US 8,617,552 и EP 1776142. Вариабельная область тяжелой цепи секукинумаба имеет следующую аминокислотную последовательность: EVQLVESGGGLVQPGGSLRLSCAASGFTFSNYWMNWVRQAPGKGLEWVAAINQDGSEKYYVGSVKGRFTISRDNAKNSLYLQMNSLRVEDTAVYYCVRDYYDILTDYYIHYWYFDLWGRGTLVTVSS (SEQ ID NO: 271) (раскрытую как SEQ ID NO: 8 в WO 2006/013107). Вариабельная область легкой цепи секукинумаба имеет следующую аминокислотную последовательность: EIVLTQSPGTLSLSPGERATLSCRASQSVSSSYLAWYQQKPGQAPRLLIYGASSRATGIPDRFSGSGSGTDFTLTISRLEPEDFAVYYCQQYGSSPCTFGQGTRLEIKR (SEQ ID NO: 298) (раскрытую как SEQ ID NO: 10 в WO 2006/013107). CDR1 тяжелой цепи секукинумаба имеет аминокислотную последовательность NYWMN (SEQ ID NO: 272) (раскрытую как SEQ ID NO: 1 в WO 2006/013107). CDR2 тяжелой цепи секукинумаба имеет аминокислотную последовательность AINQDGSEKYYVGSVKG (SEQ ID NO: 273) (раскрытую как SEQ ID NO: 2 в WO 2006/013107). CDR3 тяжелой цепи секукинумаба имеет аминокислотную последовательность DYYDILTDYYIHYWYFDL (SEQ ID NO: 274) (раскрытую как SEQ ID NO: 3 в WO 2006/013107). CDR1 легкой цепи секукинумаба имеет аминокислотную последовательность RASQSVSSSYLA (SEQ ID NO: 275) (раскрытую как SEQ ID NO: 4 в WO 2006/013107). CDR2 легкой цепи секукинумаба имеет аминокислотную последовательность GASSRAT (SEQ ID NO: 276) (раскрытую как SEQ ID NO: 5 в WO 2006/013107). CDR3 легкой цепи секукинумаба имеет аминокислотную последовательность GASSRAT (SEQ ID NO: 299) (раскрытую как SEQ ID NO: 6 в WO 2006/013107).
В некоторых вариантах осуществления ингибитором IL-17 является CJM112. CJM112 также известен как XAB4. CJM112 представляет собой полностью человеческое моноклональное антитело (например, изотипа IgG1/κ), специфичное к IL-17A.
CJM112 раскрыт, например, в WO 2014/122613. Тяжелая цепь CJM112 имеет следующую аминокислотную последовательность: EVQLVESGGDLVQPGGSLRLSCAASGFTFSSYWMSWVRQAPGKGLEWVANIKQDGSEKYYVDSVKGRFTISRDNAKNSLYLQMNSLRAEDTAVYYCARDRGSLYYWGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK (SEQ ID NO: 277) (раскрытую как SEQ ID NO: 14 в WO 2014/122613). Легкая цепь CJM112 имеет следующую аминокислотную последовательность: AIQLTQSPSSLSASVGDRVTITCRPSQGINWELAWYQQKPGKAPKLLIYDASSLEQGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQFNSYPLTFGGGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO: 278) (раскрытую как SEQ ID NO: 44 в WO 2014/122613).
CJM112 может связываться с IL-17A человека, яванского макака, мыши и крысы и нейтрализовать биоактивность этих цитокинов in vitro и in vivo. IL-17A, представитель семейства IL-17, является главным провоспалительным цитокином, который, как было показано, играет важные роли во многих иммуноопосредованных состояниях, таких как псориаз и онкологические заболевания (Witowski et al. (2004) Cell Mol. Life Sci. p. 567-79; Miossec and Kolls (2012) Nat. Rev. Drug Discov. p. 763-76). Без ограничения теорией, считается, что в некоторых вариантах осуществления ингибитор IL-17, например, антитело против IL17, может усиливать PD-1-опосредованный ответ, например, блокируя опосредованное IL-17 размножение супрессирующих Т-клетки нейтрофилов и/или уменьшая метастаз (Coffelt et al. (2015) Nature p. 345-8).
В некоторых вариантах осуществления комбинация, описанная в настоящей заявке, включает ингибитор IL-17, CJM112, или соединение, раскрытое в WO 2006/013107, и ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекулу антитела против PD-1).
IL-17 является важным медиатором врожденного иммунитета и хронической воспалительной реакции. Например, вызывая повышенную продукцию хемокинов в различных тканях, IL-17 является важным в патофизиологии аутоиммунного заболевания (Isailovic et al. (2015) J. Autoimmun. p. 1-11). IL-17 секретируют, прежде всего, CD4+ Th17, а также γδ Т-клетки, CD8+ Т-клетки, нейтрофилы и эозинофилы, а он рекрутирует моноциты и нейтрофилы в область воспаления (Alshaker and Matalka (2011) Cancer Cell Int. p. 11-33). Роль инфильтрата Th17 клеток в опухолях исследовали в различных типах раковых опухолей и во многих условиях это коррелировало с неблагоприятным прогнозом (Zeng et al. (2015) Int. J. Clin. Exp. Med. p. 10515-36). Клетки Th17 и, в частности IL-17, выполняют как противоопухолевые, так проопухолевые функции. В некоторых условиях IL-17 вызывает васкуляризацию опухолей, пролиферацию клеток, туморогенез, метастаз и/или рекрутирование супрессорных клеток макрофагального происхождения в микроокружение опухоли (Yang et al. (2014) Mediators Inflamm. p. 014:623759). Существует метод направленного воздействия на IL-17 при лечении злокачественного новообразования (Zou and Restifo (2010) Nat. Rev. Immunol. p. 246-56). В некоторых вариантах осуществления ингибитор IL-17, CJM112, или соединение, раскрытое в WO 2006/013107, увеличивают или применяются для увеличения опосредованной PD-1 реакции, например, блокирования опосредованного IL-17 размножения супрессирующих Т-клетки нейтрофилов и/или уменьшения метастаза.
В некоторых вариантах осуществления ингибитор IL-17, CJM112, или соединение, раскрытое в WO 2006/013107, и ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекулу антитела против PD-1), вводят в дозе и/или согласно временной схеме, которые в комбинации обеспечивают требуемую противоопухолевую активность.
В одном варианте осуществления ингибитор IL-17, CJM112, или соединение, раскрытое в WO 2006/013107, вводят в дозе от 5 мг до 100 мг, например, от 10 мг до 75 мг, от 15 мг до 50 мг, от 20 мг до 30 мг, от 10 мг до 25 мг, или от 25 мг до 40 мг, например, в дозе 5 мг, 10 мг, 15 мг, 20 мг, 25 мг, 30 мг, 35 мг, 40 мг, 45 мг, 50 мг, 60 мг, 70 мг, 80 мг, 90 мг или 100 мг, например, один раз в две недели, каждые четыре недели, один раз в шесть недель или один раз в восемь недель, например, внутривенно.
В одном варианте осуществления ингибитор IL-17, CJM112, или соединение, раскрытое в WO 2006/013107, вводят в дозе от 20 мг до 30 мг (например, 25 мг), например, один раз в четыре недели. В некоторых вариантах осуществления ингибитор IL-17, CJM112, или соединение, раскрытое в WO 2006/013107, вводят внутривенно. В одном варианте осуществления ингибитор IL-17, CJM112, или соединение, раскрытое в WO 2006/013107, вводят в дозе от 20 мг до 30 мг (например, 25 мг), например, один раз в четыре недели, например, путем внутривенной инфузии, и ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе от 300 мг до 500 мг (например, в дозе 400 мг), например, один раз в 4 недели, например, путем внутривенной инфузии.
В одном варианте осуществления ингибитор IL-17, CJM112, или соединение, раскрытое в WO 2006/013107, вводят в дозе от 5 мг до 750 мг, например, от 10 мг до 500 мг, от 15 мг до 450 мг, от 20 мг до 400 мг, от 25 до 350 мг, от 50 мг до 300 мг, от 75 мг до 250 мг, от 100 мг до 200 мг, от 25 мг до 75 мг, или от 40 мг до 60 мг, например, в дозе 5 мг, 10 мг, 15 мг, 20 мг, 30 мг, 40 мг, 50 мг, 70 мг, 80 мг, 90 мг, 100 мг, 150 мг, 200 мг, 250 мг, 300 мг, 350 мг, 400 мг, 450 мг или 500 мг, например, один раз в две недели, один раз в четыре недели, один раз в шесть недель или один раз в восемь недель, например, подкожно.
В одном варианте осуществления ингибитор IL-17, CJM112, или соединение, раскрытое в WO 2006/013107, вводят в дозе от 40 мг до 60 мг (например, 50 мг), например, один раз в четыре недели. В некоторых вариантах осуществления ингибитор IL-17, CJM112, или соединение, раскрытое в WO 2006/013107, вводят подкожно. В одном варианте осуществления ингибитор IL-17, CJM112, или соединение, раскрытое в WO 2006/013107, вводят в дозе от 40 мг до 60 мг (например, 50 мг), например, один раз в четыре недели, например, путем подкожной инъекции, и ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе от 300 мг до 500 мг (например, в дозе 400 мг), например, один раз в 4 недели, например, путем внутривенной инфузии.
В одном варианте осуществления ингибитор IL-17, CJM112, или соединение, раскрытое в WO 2006/013107, применяют в комбинации с ингибитором PD-1 (например, молекулой антитела против PD-1) для лечения рака толстой и прямой кишки (CRC), рака легкого (например, немелкоклеточного рака легкого (НМРЛ)) или рака молочной железы (например, трижды негативного рака молочной железы (ТНРМЖ)).
В некоторых вариантах осуществления ингибитором IL-17 является иксекизумаб (Номер CAS: 1143503-69-8). Иксекизумаб также известен как LY2439821. Иксекизумаб представляет собой гуманизированное моноклональное IgG4 антитело, специфичное к IL-17A.
Иксекизумаб описан, например, в WO 2007/070750, US 7,838,638 и US 8,110,191. Вариабельная область тяжелой цепи иксекизумаба имеет следующую аминокислотную последовательность: QVQLVQSGAEVKKPGSSVKVSCKASGYSFTDYHIHWVRQAPGQGLEWMGVINPMYGTTDYNQRFKGRVTITADESTSTAYMELSSLRSEDTAVYYCARYDYFTGTGVYWGQGTLVTVSS (SEQ ID NO: 279) (раскрытую как SEQ ID NO: 118 в WO 2007/070750). Вариабельная область легкой цепи иксекизумаба имеет следующую аминокислотную последовательность: DIVMTQTPLSLSVTPGQPASISCRSSRSLVHSRGNTYLHWYLQKPGQSPQLLIYKVSNRFIGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCSQSTHLPFTFGQGTKLEIK (SEQ ID NO: 280) (раскрытую как SEQ ID NO: 241 в WO 2007/070750).
В некоторых вариантах осуществления ингибитором IL-17 является бродалумаб (Номер CAS: 1174395-19-7). Бродалумаб также известен как AMG 827 или AM-14. Бродалумаб связывается с рецептором интерлейкина-17 (IL-17RA) и блокирует активацию рецептора IL-17.
Бродалумаб раскрыт, например, в WO 2008/054603, US 7,767,206, US 7,786,284, US 7,833,527, US 7,939,070, US 8,435,518, US 8,545,842, US 8,790,648 и US 9,073,999. CDR1 тяжелой цепи бродалумаба имеет аминокислотную последовательность RYGIS (SEQ ID NO: 281) (раскрытую как SEQ ID NO: 146 в WO 2008/054603). CDR2 тяжелой цепи бродалумаба имеет аминокислотную последовательность WISTYSGNTNYAQKLQG (SEQ ID NO: 282) (раскрытую как SEQ ID NO: 147 в WO 2008/054603). CDR3 тяжелой цепи бродалумаба имеет аминокислотную последовательность RQLYFDY (SEQ ID NO: 283) (раскрытую как SEQ ID NO: 148 в WO 2008/054603). CDR1 легкой цепи бродалумаба имеет аминокислотную последовательность RASQSVSSNLA (SEQ ID NO: 284) (раскрытую как SEQ ID NO: 224 в WO 2008/054603). CDR2 тяжелой цепи бродалумаба имеет аминокислотную последовательность DASTRAT (SEQ ID NO: 285) (раскрытую как SEQ ID NO: 225 в WO 2008/054603). CDR3 тяжелой цепи бродалумаба имеет аминокислотную последовательность QQYDNWPLT (SEQ ID NO: 286) (раскрытую как SEQ ID NO: 226 в WO 2008/054603).
Примеры ингибиторов IL-1β
В одном варианте осуществления комбинация, описанная в настоящей заявке, включает ингибитор интерлейкина-1 бета (IL-1β). В некоторых вариантах осуществления комбинация применяется для лечения рака, например, рака, описанного в настоящей заявке, например, гемобластоза (например, лимфомы (например, лимфомы Ходжкина), лейкоза (например, острого или хронического лейкоза), или множественной миеломы) или солидной опухоли (например, рака толстой и прямой кишки (CLC), рака легкого (например, немелкоклеточного рака легкого (НМРЛ)) или рака молочной железы (например, трижды негативного рака молочной железы (ТНРМЖ)). В некоторых вариантах осуществления рак выбран из рака толстой и прямой кишки (например, микросателлитно стабильного рака толстой и прямой кишки (MSS CRC), рака легкого (например, немелкоклеточного рака легкого) или рака молочной железы (например, трижды негативного рака легкого (ТНРМЖ)).
В некоторых вариантах осуществления ингибитором IL-1β является канакинумаб. Канакинумаб также известен как ACZ885 или Иларис®. Канакинумаб представляет собой человеческое моноклональное IgG1/κ антитело, которое нейтрализует биоактивность человеческого IL-1β.
Канакинумаб раскрыт, например, в WO 2002/16436, US 7,446,175, и EP 1313769. Вариабельная область тяжелой цепи канакинумаба имеет следующую аминокислотную последовательность: MEFGLSWVFLVALLRGVQCQVQLVESGGGVVQPGRSLRLSCAASGFTFSVYGMNWVRQAPGKGLEWVAIIWYDGDNQYYADSVKGRFTISRDNSKNTLYLQMNGLRAEDTAVYYCARDLRTGPFDYWGQGTLVTVSS (SEQ ID NO: 287) (раскрытую как SEQ ID NO: 1 в US 7,446,175). Вариабельная область легкой цепи канакинумаба имеет следующую аминокислотную последовательность: MLPSQLIGFLLLWVPASRGEIVLTQSPDFQSVTPKEKVTITCRASQSIGSSLHWYQQKPDQSPKLLIKYASQSFSGVPSRFSGSGSGTDFTLTINSLEAEDAAAYYCHQSSSLPFTFGPGTKVDIK (SEQ ID NO: 288) (раскрытую как SEQ ID NO: 2 в US 7,446,175).
Канакинумаб применяли, например, для лечения криопирин-ассоциированных периодических синдромов (КАПС) у взрослых и детей, для лечения системного ювенильного идиопатического артрита (SJIA), для симптоматического лечения приступов острого подагрического артрита у взрослых и для лечения других опосредуемых IL-1β воспалительных заболеваний. Без ограничения теорией, считается, что в некоторых вариантах осуществления ингибиторы IL-1β, например, канакинумаб, могут усиливать противоопухолевый иммунный ответ, например, блокируя одну или более функций IL-1β, в том числе, например, рекрутирование иммуносупрессивных нейтрофилов в микроокружение опухоли, стимуляцию опухолевого ангиогенеза и/или стимуляцию метастаза (Dinarello (2010) Eur. J. Immunol. p. 599-606). В некоторых вариантах осуществления комбинация, описанная в настоящей заявке, включает ингибитор IL-1β, канакинумаб, или соединение, раскрытое в WO 2002/16436, и ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекулу антитела против PD-1).
IL-1 является секретируемым плейотропным цитокином с основной ролью в воспалении и иммунном ответе. Повышение IL-1 наблюдается в различных клинических условиях, включая рак (Apte et al. (2006) Cancer Metastasis Rev. p. 387-408; Dinarello (2010) Eur. J. Immunol. p. 599-606). IL-1β повышен при раке легкого, молочной железы и толстой и прямой кишки (Voronov et al. (2014) Front Physiol. p. 114), и ассоциирован с неблагоприятным прогнозом (Apte et al. (2000) Adv. Exp. Med. Biol. p. 277-88). Без ограничения теорией, считается, что в некоторых вариантах осуществления IL-1β, происходящий из микроокружения опухоли и секретируемый злокачественными клетками, вызывает пролиферацию опухолевых клеток, увеличивает инвазивность и ослабляет противоопухолевый иммунный ответ, частично в результате рекрутирования ингибиторных нейтрофилов (Apte et al. (2006) Cancer Metastasis Rev. p. 387-408; Miller et al. (2007) J. Immunol. p. 6933-42). Экспериментальные данные указывают, что ингибирование IL-1β приводит к уменьшению опухолевой нагрузки и метастаза (Voronov et al. (2003) Proc. Natl. Acad. Sci. U.S.A. p. 2645-50). Канакинумаб может связывать IL-1β и ингибировать опосредованную IL-1 сигнализацию. Таким образом, в некоторых вариантах осуществления ингибитор IL-1β, например, канакинумаб, увеличивает или применяется для увеличения иммуноопосредованного противоопухолевого действия ингибитора PD-1 (например, молекулы антитела против PD-1).
В некоторых вариантах осуществления ингибитор IL-1β, канакинумаб, или соединение, раскрытое в WO 2002/16436, и ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекулу антитела против PD-1), вводят в дозе и/или согласно временной схеме, которые в комбинации обеспечивают требуемую противоопухолевую активность.
В одном варианте осуществления ингибитор IL-1β, канакинумаб, или соединение, раскрытое в WO 2002/16436, вводят в дозе от 25 мг до 200 мг, например, от 50 мг до 150 мг, от 80 мг до 120 мг, между 140 мг и 160 мг, от 40 мг до 60 мг, от 80 мг до 100 мг, от 50 мг до 100 мг, или от 100 мг до 150 мг, например, в дозе 30 мг, 40 мг, 50 мг, 60 мг, 70 мг, 80 мг, 90 мг, 100 мг, 110 мг, 120 мг, 130 мг, 140 мг, 150 мг, 160 мг, 170 мг, 180 мг, 190 мг или 200 мг, например, один раз в четыре недели, один раз в шесть недель, один раз в восемь недель, один раз в десять недель или один раз в двенадцать недель.
В одном варианте осуществления ингибитор IL-1β, канакинумаб, или соединение, раскрытое в WO 2002/16436, вводят в дозе от 80 мг до 120 мг (например, в дозе 100 мг), например, один раз в восемь недель. В некоторых вариантах осуществления ингибитор IL-1β, канакинумаб, или соединение, раскрытое в WO 2002/16436, вводят подкожно, например, в область живота или бедра. В одном варианте осуществления ингибитор IL-1β, например, канакинумаб, вводят в дозе от 80 мг до 120 мг (например, в дозе 100 мг), например, один раз в восемь недель, например, путем подкожной инъекции, и ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе от 300 мг до 500 мг (например, в дозе 400 мг), например, один раз в 4 недели, например, путем внутривенной инфузии.
В некоторых вариантах осуществления ингибитор IL-1β, канакинумаб, или соединение, раскрытое в WO 2002/16436, применяют в комбинации с ингибитором PD-1 (например, молекулой антитела против PD-1) для лечения рака толстой и прямой кишки (например, MSS CRC), рака легкого (например, немелкоклеточного рака легкого (НМРЛ) или рака молочной железы (например, трижды негативного рака молочной железы (ТНРМЖ)).
Примеры ингибиторов CXCR2
В одном варианте осуществления комбинация, описанная в настоящей заявке, включает ингибитор ингибитора рецептора (C-X-C мотив) хемокина 2 (CXCR2). В некоторых вариантах осуществления комбинация применяется для лечения рака, например, рака, описанного в настоящей заявке, например, солидной опухоли, например, рака молочной железы, метастатической саркомы, рака поджелудочной железы, меланомы, почечно-клеточной карциномы (RCC), немелкоклеточного рака легкого (НМРЛ) или педиатрической опухоли (например, рабдомиосаркомы).
В некоторых вариантах осуществления ингибитором CXCR2 является данириксин (Номер CAS: 954126-98-8). Данириксин также известен как GSK1325756 или 1-(4-хлор-2-гидрокси-3-пиперидин-3-илсульфонилфенил)-3-(3-фтор-2-метилфенил)мочевина. Данириксин раскрыт, например, в Miller et al. Eur J Drug Metab Pharmacokinet (2014) 39:173-181; и Miller et al. BMC Pharmacology and Toxicology (2015), 16:18.
В некоторых вариантах осуществления ингибитором CXCR2 является репариксин (Номер CAS: 266359-83-5). Репариксин также известен как репертаксин или (2R)-2-[4-(2-метилпропил)фенил]-N-метилсульфонилпропанамид. Репариксин является неконкурентным аллостерическим ингибитором CXCR1/2. Репариксин раскрыт, например, в Zarbock et al. British Journal of Pharmacology (2008), 1-8.
В некоторых вариантах осуществления ингибитором CXCR2 является навариксин. Навариксин также известен как MK-7123, SCH 527123, PS291822 или 2-гидрокси-N,N-диметил-3-[[2-[[(1R)-1-(5-метилфуран-2-ил)пропил]амино]-3,4-диоксоциклобутен-1-ил]амино]бензамид. Навариксин раскрыт, например, в Ning et al. Mol Cancer Ther. 2012;11(6):1353-64.
Примеры ингибиторов PI3K-γ, -δ
В одном варианте осуществления комбинация, описанная в настоящей заявке, включает ингибитор фосфатидилинозитол-4,5-бисфосфат-3-киназы (PI3K), например, фосфатидилинозитол-4,5-бисфосфат-3-киназы гамма и/или дельта (PI3K-γ,δ). В некоторых вариантах осуществления комбинация применяется для лечения рака, например, рака, описанного в настоящей заявке, например, солидной опухоли (например, рака предстательной железы, рака молочной железы, рака головного мозга, рака мочевого пузыря, рака поджелудочной железы, рака почки, солидной опухоли, рака печени, немелкоклеточного рака легкого, эндокринного рака, рака яичника, меланомы, рака женской репродуктивной системы, рака пищеварительной системы/желудочно-кишечного тракта, мультиформной глиобластомы, рака головы и шеи или рака толстой кишки), например, гемобластоза (например, лейкоза (например, лимфоцитарного лейкоза, например, хронического лимфоцитарного лейкоза (ХЛЛ) (например, рецидивирующего ХЛЛ)), например, лимфомы (например, неходжкинской лимфомы (например, рецидивирующей фолликулярной В-клеточной неходжкинской лимфомы (FL) или рецидивирующей мелкоклеточной лимфоцитарной лимфомы (SLL)), или например, множественной миеломы).
В некоторых вариантах осуществления ингибитором PI3K является ингибитор дельта и гамма изоформ PI3K. Примеры ингибиторов PI3K, которые могут применяться в комбинации, описаны, например, в WO 2010/036380, WO 2010/006086, WO 09/114870, WO 05/113556, GSK 2126458, GDC-0980, GDC-0941, Sanofi XL147, XL756, XL147, PF-46915032, BKM 120, CAL-101, CAL 263, SF1126, PX-886 и двойной ингибитор PI3K (например, Novartis BEZ235).
В некоторых вариантах осуществления ингибитором PI3K-γ,δ является иделалисиб (Номер CAS: 870281-82-6). Иделалисиб также известен как ZYDELIG®, GS-1101, CAL-101 или 5-фтор-3-фенил-2-[(1S)-1-(7H-пурин-6-иламино)пропил]-4(3H)-хиназолинон. Иделалисиб блокирует P110δ, дельта изоформу PI3K. Иделалисиб раскрыт, например, в Wu et al. Journal of Hematology & Oncology (2013) 6:36.
В некоторых вариантах осуществления ингибитором PI3K-γ,δ является дактолизиб (Соединение A4) или 8-(6-метокси-пиридин-3-ил)-3-метил-1-(4-пиперазин-1-ил-3-трифторметил-фенил)-1,3-дигидро-имидазо[4,5-c]хинолин-2-он (Соединение A41), или соединение, раскрытое в публикации PCT WO 2006/122806.
В некоторых вариантах осуществления ингибитором PI3K-γ,δ является бупарлисиб (Соединение A6) или соединение, раскрытое в публикации PCT WO 2007/084786.
В одном варианте осуществления ингибитор PI3K-γ,δ, например, бупарлисиб (Соединение A6) или соединение, раскрытое в публикации PCT WO 2007/084786, вводят в дозе приблизительно 100 мг (например, в день).
Другие примеры ингибиторов PI3K-γ,δ, которые могут применяться в комбинации, включают, например, пиктилисиб (GDC-0941), LY294002, пиларалисиб (XL147), PI-3065, PI-103, VS-5584 (SB2343), CZC24832, дувелисиб (IPI-145, INK1197), TG100-115, CAY10505, GSK1059615, PF-04691502, AS-605240, воксталисиб (SAR245409, XL765), IC-87114, омипалисиб (GSK2126458, GSK458), TG100713, гедатолисиб (PF-05212384, PKI-587), PKI-402, аналог XL147, PIK-90, PIK-293, PIK-294, 3-метиладенин (3-МА), AS-252424, AS-604850 или апитолисиб (GDC-0980, RG7422).
В некоторых вариантах осуществления ингибитором PI3K является Соединение A8 или соединение, описанное в Публикации PCT WO2010/029082.
В некоторых вариантах осуществления ингибитором PI3K является пан-ингибитор PI3K, (4S, 5R)-3-(2'-амино-2-морфолино-4'-(трифторметил)-[4,5'-бипиримидин]-6-ил)-4-(гидроксиметил)-5-метилоксазолидин -2-он (Соединение A13) или соединение, раскрытое в Публикации PCT WO2013/124826.
Примеры ингибиторов PI3K-γ,-δ включают, без ограничения перечисленными, дувелисиб и иделалисиб. Иделалисиб (также называемый GS-1101 или CAL-101; Gilead) представляет собой малую молекулу, которая блокирует дельта изоформу PI3K. Структура иделалисиба (5-фтор-3-фенил-2-[(1S)-1-(7H-пурин-6-иламино)про-пил]-4(3H)-хиназолинона) показана ниже.
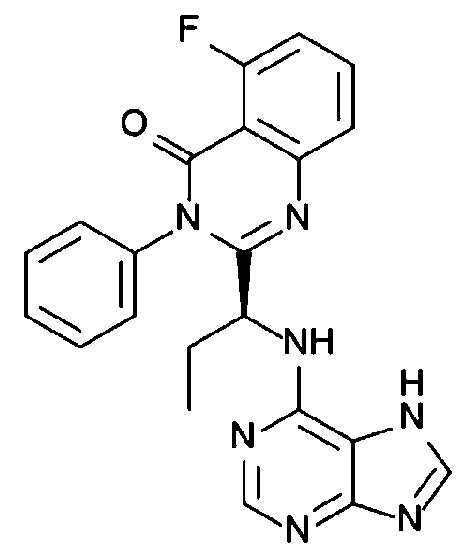
Дувелисиб (также называемый IPI-145; Infinity Pharmaceuticals и Abbvie) представляет собой малую молекулу, которая блокирует PI3K-δ,γ. Структура дувелисиба (8-хлор-2-фенил-3-[(1S)-1-(9H-пурин-6-иламино)этил]-1(2H)-изохинолинона) показана ниже.

В одном варианте осуществления ингибитор является двойным ингибитором фосфатидилинозитол-3-киназы (PI3K) и mTOR, выбранным из 2-амино-8-[транс-4-(2-гидроксиэтокси)циклогексил]-6-(6-метокси-3-пиридинил)-4-метил-пиридо[2,3-d]пиримидин-7(8H)-она (PF-04691502); N-[4-[[4-(диметиламино)-1-пиперидинил]карбо-нил]фенил]-N'-[4-(4,6-ди-4-морфолинил-1,3,5-триазин-2-ил)фенил]мочевины (PF-05212384, PKI-587); 2-метил-2-{4-[3-метил-2-оксо-8-(хинолин-3-ил)-2,3-дигидро-1H-имидазо[4,5-c]хинолин-1-ил]фенил}пропаннитрила (BEZ-235); апитолисиба (GDC-0980, RG7422); 2,4-дифтор-N-{2-(метилокси)-5-[4-(4-пиридазинил)-6-хинолинил]-3-пиридинил}бензолсульфонамида (GSK2126458); 8-(6 метоксипиридин-3-ил)-3-метил-1-(4-(пиперазин-1-ил)-3-(трифторме-тил)фенил)-1H-имидазо[4,5-c]хинолин-2(3H)-он малеиновой кислоты (NVP-BGT226); 3-[4-(4-морфолинил-пиридо[3',2':4,5]фуро[3,2-d]пиримидин-2-ил]фенола (PI-103); 5-(9-изопропил-8-метил-2-морфолино-9H-пурин-6-ил)пиримидин-2-амина (VS-5584, SB2343); или N-[2-[(3,5-диметоксифенил)амино]хиноксалин-3-ил]-4-[(4-метил-3-метоксифенил)карбонил]аминофенилсульфонамида (XL765).
Примеры ингибиторов BAFF-R
В одном варианте осуществления комбинация, описанная в настоящей заявке, включает ингибитор рецептора фактора, активирующего В-клетки (BAFF-R). В некоторых вариантах осуществления комбинация применяется для лечения рака, например, рака, описанного в настоящей заявке, например, гемобластоза, например, лейкоза (например, хронического лимфоцитарного лейкоза (ХЛЛ), например, рецидивирующего или рефракторного хронического лимфоцитарного лейкоза).
В одном варианте осуществления ингибитором BAFF-R является VAY736. VAY736 представляет собой полностью человеческое моноклональное антитело к BAFF-R, полученной из комбинаторной библиотеки антител (HuCAL). BAFF-R, также известный как представитель суперсемейства рецептора фактора некроза опухоли 13C, повышенно экспрессируется в некоторых типах опухолевых клеток и при некоторых аутоиммунных заболеваниях. VAY736 обладает противовоспалительной и противоопухолевой активностью. В раковых клетках BAFF-R играет важную роль в пролиферации и выживании В-клеток. VAY736 направленно взаимодействует и связывается с BAFF-R, что приводит к ингибированию взаимодействия BAFF/BAFF-R и BAFF-R-опосредованной сигнализациив. Это может уменьшить рост опухолевых клеток, экспрессирующих BAFF-R.
VAY736 раскрыт, например, в US 8,106,163. CDR1 тяжелой цепи VAY736 имеет аминокислотную последовательность GDSVSSNSAAWG (SEQ ID NO: 289) (раскрытую как SEQ ID NO: 3 в US 8,106,163). CDR2 тяжелой цепи VAY736 имеет аминокислотную последовательность RIYYRSKWYNSYAVSVKS (SEQ ID NO: 290) (раскрытую как SEQ ID NO: 10 в US 8,106,163). CDR3 тяжелой цепи VAY736 имеет аминокислотную последовательность YDWVPKIGVFDS (SEQ ID NO: 300) (раскрытую как SEQ ID NO: 17 в US 8,106,163). CDR1 легкой цепи VAY736 имеет аминокислотную последовательность RASQFISSSYLS (SEQ ID NO: 291) (раскрытую как SEQ ID NO: 24 в US 8,106,163). CDR2 легкой цепи VAY736 имеет аминокислотную последовательность LLIYGSSSRAT (SEQ ID NO: 292) (раскрытую как SEQ ID NO: 31 в US 8,106,163). CDR3 легкой цепи VAY736 имеет аминокислотную последовательность QQLYSSPM (SEQ ID NO: 293) (раскрытую как SEQ ID NO: 38 в US 8,106,163). Вариабельная область тяжелой цепи VAY736 имеет следующую аминокислотную последовательность: QVQLQQSGPGLVKPSQTLSLTCAISGDSVSSNSAAWGWIRQSPGRGLEWLGRIYYRSKWYNSYAVSVKSRITINPDTSKNQFSLQLNSVTPEDTAVYYCARYDWVPKIGVFDSWGQGTLVTVSS (SEQ ID NO: 294) (раскрытую как SEQ ID NO: 52 в US 8,106,163). Вариабельная область легкой цепи VAY736 имеет следующую аминокислотную последовательность: DIVLTQSPATLSLSPGERATLSCRASQFISSSYLSWYQQKPGQAPRLLIYGSSSRATGVPARFSGSGSGTDFTLTISSLEPEDFAVYYCQQLYSSPMTFGQGTKVEIKRT (SEQ ID NO: 295) (раскрытую как SEQ ID NO: 45 в US 8,106,163). Тяжелая цепь VAY736 имеет следующую аминокислотную последовательность: QVQLQQSGPGLVKPSQTLSLTCAISGDSVSSNSAAWGWIRQSPGRGLEWLGRIYYRSKWYNSYAVSVKSRITINPDTSKNQFSLQLNSVTPEDTAVYYCARYDWVPKIGVFDSWGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK (SEQ ID NO: 296) (раскрытую как SEQ ID NO: 75 в US 8,106,163). Вариабельная область легкой цепи VAY736 имеет следующую аминокислотную последовательность: DIVLTQSPATLSLSPGERATLSCRASQFISSSYLSWYQQKPGQAPRLLIYGSSSRATGVPARFSGSGSGTDFTLTISSLEPEDFAVYYCQQLYSSPMTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (SEQ ID NO: 297) (раскрытую как SEQ ID NO: 71 в US 8,106,163).
Примеры ингибиторов MALT-1/BTK
В одном варианте осуществления комбинация, описанная в настоящей заявке, включает ингибитор MALT-1 и/или BTK. В некоторых вариантах осуществления комбинация применяется для лечения рака, например, рака, описанного в настоящей заявке.
Примеры ингибиторов MALT-1/BTK включают, без ограничения перечисленными, (S)-1-(6-(2H-1,2,3-триазол-2-ил)-5-(трифторметил)пиридин-3-ил)-3-(2-хлор-7-(1-метоксиэтил)пиразоло[1,5-a]пиримидин-6-ил)мочевину, (S)-1-(2-хлор-7-(1-метоксиэтил)пиразоло[1,5-a]пиримидин-6-ил)-3-(2-(трифторметил)пиридин-4-ил)мочевину, (S)-1-(2-хлор-7-(1-метоксиэтил)пиразоло[1,5-a]пиримидин-6-ил)-3-(1-метил-2-оксо-5-(трифторметил)-1,2-дигидропиридин-3-ил)мочевину, (R)-1-(6-(2H-1,2,3-триазол-2-ил)-5-(трифторметил)пиридин-3-ил)-3-(2-хлор-7-(1 метокси-2-метилпропил)пиразоло[1,5-a]пиримидин-6-ил)мочевину, (R)-1-(5-хлор-6-(2H-1,2,3-триазол-2-ил)пиридин-3-ил)-3-(2-хлор-7-(1-метокси-2-метилпропил)пиразоло[1,5-a]пиримидин-6-ил)мочевину, (S)-1-(7-(1-метоксиэтил)-2-метилпиразоло[1,5-a]пиримидин-6-ил)-3-(2-(трифторметил)пиридин-4-ил)мочевину, (S)-1-(2-фтор-7-(1-метоксиэтил)пиразоло[1,5-a]пиримидин-6-ил)-3-(2-(трифторметил)пиридин-4-ил)мочевину и (S)-1-(2-хлор-7-(1-метоксиэтил)пиразоло[1,5-a]пиримидин-6-ил)-3-(5-цианопиридин-3-ил)мочевину.
Примеры ингибиторов BTK включают, без ограничения перечисленными, ибрутиниб (PCI-32765); GDC-0834; RN-486; CGI-560; CGI-1764; HM-71224; CC-292; ONO-4059; CNX-774 или LFM-A13. В одном варианте осуществления ингибитор BTK не уменьшает или ингибирует киназную активность интерлейкин-2-индуцируемой киназы (ITK), например, выбран из GDC-0834; RN-486; CGI-560; CGI-1764; HM-71224; CC-292; ONO-4059; CNX-774 или LFM-A13.
В одном варианте осуществления ингибитором киназы является ингибитор BTK, например, ибрутиниб (PCI-32765). Структура ибрутиниба (1-[(3R)-3-[4-амино-3-(4-феноксифенил)-1H-пиразоло[3,4-d]пиримидин-1-ил]пиперидин-1-ил]проп-2-ен-1-она) показана ниже.

В других вариантах осуществления ингибитором BTK является ингибитор BTK, описанный в международной заявке WO/2015/079417, которая полностью включена в настоящую заявку посредством отсылки. Например, в некоторых вариантах осуществления, ингибитором BTK является соединение формулы (I) или его фармацевтически приемлемая соль;
в которой
R1 является водородом, C1-C6 алкилом, который необязательно заменен гидрокси;
R2 является водородом или галогеном;
R3 является водородом или галогеном;
R4 является водородом;
R5 является водородом или галогеном;
или R4 и R5 присоединены друг к другу и обозначают связь, -CH2-, -CH2-CH2-, -CH=CH-, -CH=CH-CH2-; -CH2-CH=CH-; или -CH2-CH2-CH2-;
R6 и R7 независимо друг от друга обозначают H, C1-C6, алкил, который необязательно замещен гидроксилом, C3-C6 циклоалкил, который необязательно замещен галогеном или гидрокси, или галоген;
R8, R9, R, R', R10 и R11 независимо друг от друга обозначают H или C1-C6 алкил, который необязательно замещен C1-C6 алкокси; или любые два из R8, R9, R, R', R10 и R11 вместе с атомом углерода, с которым они связаны, могут образовывать 3-6-членное насыщенное карбоциклическое кольцо;
R12 является водородом или C1-C6 алкилом, который необязательно замещен галогеном или C1-C6 алкокси;
или R12 и любой из R8, R9, R, R', R10 или R11 вместе с атомами, с которыми они связаны, могут образовывать 4, 5, 6 или 7-членное азациклическое кольцо, которое необязательно может быть замещено галогеном, циано, гидроксилом, C1-C6 алкилом или C1-C6 алкокси;
n является 0 или 1; и
R13 является C2-C6 алкенилом, который необязательно замещен C1-C6 алкилом, C1-C6 алкокси или N,N-ди-C1-C6 алкиламино; C2-C6 алкинилом, который необязательно замещен C1-C6 алкилом или C1-C6 алкокси; или C2-C6 алкиленилоксидом, которой необязательно замещен C1-C6 алкилом.
В некоторых вариантах осуществления ингибитор BTK Формулы I выбран из следующего: N-(3-(5-((1-акрилоилазетидин-3-ил)окси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамид; (E)-N-(3-(6-амино-5-((1-(бут-2-еноил)азетидин-3-ил)окси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамид; N-(3-(6-амино-5-((1-пропиолоилазетидин-3-ил)окси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамид; N-(3-(6-амино-5-((1-(бут-2-иноил)азетидин-3-ил)окси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамид; N-(3-(5-((1-акрилоилпиперидин-4-ил)окси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамид; N-(3-(6-амино-5-(2-(N-метилакриламидо)этокси)пири-мидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамид; (E)-N-(3-(6-амино-5-(2-(N-метилбут-2-енамидо)этокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамид; N-(3-(6-амино-5-(2-(N-метилпропиоламидо)этокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамид; (E)-N-(3-(6-амино-5-(2-(4-метокси-N-метилбут-2-енамидо)этокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамид; N-(3-(6-амино-5-(2-(N-метилбут-2-инамидо)этокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамид; N-(2-((4-амино-6-(3-(4-циклопропил-2-фторбензамидо)-5-фтор-2-метилфенил)пиримидин-5-ил)окси)этил)-N-метилоксиран-2-карбоксамид; N-(2-((4-амино-6-(3-(6-циклопропил-8-фтор-1-оксоизохинолин-2-(1H)-ил)фенил)пирими-дин-5-ил)окси)этил)-N-метилакриламид; N-(3-(5-(2-акриламидо-этокси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамид; N-(3-(6-амино-5-(2-(N-этилакрил-амидо)этокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамид; N-(3-(6-амино-5-(2-(N-(2-фторэтил)акриламидо)-этокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамид; N-(3-(5-(1-акриламидоциклопропил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамид; (S)-N-(3-(5-(2-акриламидопропокси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамид; (S)-N-(3-(6-амино-5-(2-(бут-2-инамидо)пропокси)-пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамид; (S)-N-(3-(6-амино-5-(2-(N-метилакриламидо)-пропокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамид; (S)-N-(3-(6-амино-5-(2-(N-метилбут-2-инамидо)-пропокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамид; N-(3-(6-амино-5-(3-(N-метилакриламидо)пропокси) пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамид; (S)-N-(3-(5-((1-акрилоилпирролидин-2-ил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамид; (S)-N-(3-(6-амино-5-((1-(бут-2-иноил)пирролидин-2-ил)метокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамид; (S)-2-(3-(5-((1-акрилоилпирролидин-2-ил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-(гидроксиметил)фенил)-6-циклопропил-3,4-дигидроизохинолин-1(2H)-он; N-(2-((4-амино-6-(3-(6-циклопропил-1-оксо-3,4-дигидроизохинолин-2(1H)-ил)-5-фтор-2-(гидроксиметил)фенил)пиримидин-5-ил)окси)этил)-N-метилакриламид; N-(3-(5-(((2S,4R)-1-акрилоил-4-метоксипирролидин-2-ил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамид; N-(3-(6-амино-5-(((2S,4R)-1-(бут-2-иноил)-4-метоксипирролидин-2-ил)метокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамид; 2-(3-(5-(((2S,4R)-1-акрилоил-4-метоксипирролидин-2-ил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-(гидроксиметил)фенил)-6-циклопропил-3,4-дигидроизохинолин-1(2H)-он; N-(3-(5-(((2S,4S)-1-акрилоил-4-метоксипирролидин-2-ил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамид; N-(3-(6-амино-5-(((2S,4S)-1-(бут-2-иноил)-4-метоксипирролидин-2-ил)метокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамид; N-(3-(5-(((2S,4R)-1-акрилоил-4-фторпирролидин-2-ил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамид; N-(3-(6-амино-5-(((2S,4R)-1-(бут-2-иноил)-4-фторпирролидин-2-ил)метокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамид; (S)-N-(3-(5-((1-акрилоилазетидин-2-ил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамид; (S)-N-(3-(6-амино-5-((1-пропиолоилазетидин-2-ил)метокси)пиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамид; (S)-2-(3-(5-((1-акрилоилазетидин-2-ил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-(гидроксиметил)фенил)-6-циклопропил-3,4-дигидроизохинолин-1(2H)- он; (R)-N-(3-(5-((1-акрилоилазетидин-2-ил)метокси)-6-аминопири-мидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамид; (R)-N-(3-(5-((1-акрилоилпиперидин-3-ил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамид; N-(3-(5-(((2R,3S)-1-акрилоил-3-метоксипирролидин-2-ил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамид; N-(3-(5-(((2S,4R)-1-акрилоил-4-цианопирролидин-2-ил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамид; или N-(3-(5-(((2S,4S)-1-акрилоил-4-цианопирролидин-2-ил)метокси)-6-аминопиримидин-4-ил)-5-фтор-2-метилфенил)-4-циклопропил-2-фторбензамид.
Если не представлено иное, химические термины, используемые выше при описании ингибитора BTK Формулы I, используются согласно их значениям, приведенным в международной заявке WO/2015/079417, которая полностью включена в настоящую заявку посредством отсылки.
Примеры ингибиторов JAK
В одном варианте осуществления комбинация, описанная в настоящей заявке, включает ингибитор Янус-киназы (JAK). В некоторых вариантах осуществления комбинация применяется для лечения рака, например, рака, описанного в настоящей заявке, например, солидной опухоли (например, рака толстой кишки, рака предстательной железы, рака легкого, рака молочной железы или рака поджелудочной железы), например, гемобластоза (например, лейкоза (например, миелоидного лейкоз или лимфоцитарного лейкоза), например, лимфомы (например, неходжкинской лимфомы), или множественной миеломы.
В некоторых вариантах осуществления ингибитором JAK является 2-фтор-N-метил-4-(7-(хинолин-6-илметил)имидазо[1,2-b][1,2,4]триазин-2-ил)бензамид (Соединение A17) или его дигидрохлорид, или соединение, раскрытое в публикации PCT WO 2007/070514.
В некоторых вариантах осуществления ингибитор JAK, например, 2-фтор-N-метил-4-(7-(хинолин-6-илметил)имидазо[1,2-b][1,2,4]триазин-2-ил)бензамид (Соединение A17) или его дигидрохлорид, или соединение, раскрытое в публикации PCT WO 2007/070514, вводят в дозе приблизительно 400-600 мг (например, в день), например, приблизительно 400, 500 или 600 мг или приблизительно 400-500 или 500-600 мг.
В некотором варианте осуществления ингибитором JAK является руксолитиниба фосфат (также известный как Джакави®; Соединение A18) или соединение, раскрытое в публикации PCT WO 2007/070514.
В одном варианте осуществления ингибитор JAK, например, руксолитиниба фосфат (также известный как Джакави; Соединение A18) или соединение, раскрытое в публикации PCT WO 2007/070514, вводят в дозе приблизительно 15-25 мг, например, два раза в день. В некоторых вариантах осуществления доза составляет приблизительно 15, 20 или 25 мг или приблизительно 15-20 или 20-25 мг.
Примеры ингибиторов CRTH2
В одном варианте осуществления комбинация, описанная в настоящей заявке, включает ингибитор рецептора хемоаттрактанта, гомологичного T-хелперной клетке 2 (CRTH2). В некоторых вариантах осуществления комбинация применяется для лечения рака, например, рака, описанного в настоящей заявке.
В некоторых вариантах осуществления ингибитором CRTH2 является QAV680 (Номер CAS: 872365-16-7). QAV680 также известен как февипипрант и 2-[2-метил-1-[(4-метилсульфонилфенил)-метил]пирроло[2,3-b]пиридин-3-ил]уксусная кислота. QAV680 раскрыт, например, в Sandham et al. Bioorg Med Chem. 2013; 21(21):6582-91. QAW039 также известен как [1-(4-метансульфонил-2-трифторметил-бензил)-2-метил-1H-пирроло[2,3-b]пиридин-3-ил]-уксусная кислота. QAW039 раскрыт, например, в Sykes et al. European Respiratory Journal September 1, 2014 vol. 44 no. Suppl 58 P4074.
В некоторых вариантах осуществления ингибитором CRTH2 является QAW039 (Номер CAS: 872365-14-5).
Другие ингибиторы CRTH2, которые могут применяться в комбинации, включают, например, AZD1981, ARRY-502, сетипипрант (ACT-453859) и ACT-129968.
Примеры ингибиторов PFKFB3
В одном варианте осуществления комбинация, описанная в настоящей заявке, включает ингибитор 6-фосфофрукто-2-киназы/фруктозо-2,6-бисфосфатазы 3 (PFKFB3). В некоторых вариантах осуществления комбинация применяется для лечения рака, например, рака, описанного в настоящей заявке, например, солидной опухоли (например, распространенной солидной опухоли), например, рака яичника, рака фаллопиевой трубы, рака толстой и прямой кишки (CRC), лейкоза, рака легкого, рака предстательной железы, рака молочной железы или рак поджелудочной железы. В некоторых вариантах осуществления рак является раком яичника (например, рецидивирующим раком яичника), раком фаллопиевой трубы или раком толстой и прямой кишки (например, метастатическим раком толстой и прямой кишки). Без ограничения теорией, считается, что в некоторых вариантах осуществления направляемый PFKFB3 гликолиз может регулировать ветвление сосудов в раковой опухоли, при этом эндотелиальные клетки могут использовать гликолиз для синтеза АТФ и метастатического потенциала. В некоторых вариантах осуществления комбинация применяется для лечения рака с высокой ангиогенной активностью. В других вариантах осуществления комбинация применяется для лечения рака, обогащенного Th17 клетками. В других вариантах осуществления комбинация применяется для лечения рака, не отвечающего или умеренно отвечающего на монотерапию антителом против PD-1 или против PD-L1.
В некоторых вариантах осуществления ингибитором PFKFB3 является PFK-158. PFK-158 также известен как ACT-PFK-158 или (E)-1-(пиридин-4-ил)-3-(7-(трифторметил)хинолин-2-ил)-проп-2-ен-1-он (Авария Номер 1462249-75-7). PFK-158 - производная 3-(3-пиридинил)-1-[4-пиридинил]-2-пропен-1-он (3PO). PFKFB3, который катализирует превращение фруктоза-6-фосфата в фруктозо-2,6-бисфосфат, экспрессируется и активен на высоком уровне в человеческих раковых клетках, а также играет важную роль в увеличении гликолитического потока и пролиферации раковых клеток. В некоторых вариантах осуществления PFKFB3 экспрессируется (например, повышенно экспрессируется по сравнению с нормальной тканью) при раке, выбранном из лейкоза, рака толстой кишки, рака легкого, рака предстательной железы, рака яичника, рака фаллопиевой трубы, рака молочной железы или рака поджелудочной железы. Ингибиторы PFKFB3, например, PFK-158, могут связываться и ингибировать активность PFKFB3, что приводит к ингибированию гликолитического пути и захвата глюкозы раковыми клетками. Это предотвращает синтез макромолекул и продукцию энергии, которые вызывают повышенную клеточную пролиферацию в раковых клетках по сравнению с нормальными, здоровыми клетками. Лишение раковых клеток питательных веществ и энергии приводит к ингибированию роста раковых клеток. В некоторых вариантах осуществления ингибитор PFKFB3, например, PFK-158, ингибирует захват глюкозы раковой клеткой. В других вариантах осуществления ингибитор PFKFB3, например, PFK-158, уменьшает патологический ангиогенез. Например, PFK-158 может уменьшать захват 18FDG в ксенотрансплантатах опухолей и демонстрирует противоопухолевую активность у мышей с пониженным количеством лейкоцитов (LLC). PFK-158 раскрыт, например, на странице 5 в WO 2013/148228.
В некоторых вариантах осуществления ингибитор PFKFB3 имеет следующую структуру:
 .
.
В некоторых вариантах осуществления комбинация, описанная в настоящей заявке, применяется для лечения рака яичника. Рак яичника общеизвестен как иммунореактивное заболевание (Zhang et al., N Engl J Med. 2003; 348(3):203-13). Например, улучшение общей выживаемости наблюдали у пациентов с более высоким количеством внутриэпителиальных CD8+ Т-клеток по сравнению с пациентами с более низким количеством CD8+ частоты Т-клеток (средняя выживаемость 55 месяцев против 26 месяцев; отношение рисков=0,33; P<0,001) (Sato et al. Proc Natl Acad Sci U S A. 2005; 102(51):18538-43). В некоторых вариантах осуществления увеличенное количество Treg может использоваться в качестве показателей низкой выживаемости (Curiel et al. Nat Med. 2004; 10(9):942-9). Без ограничения теорией, считается, что в некоторых вариантах осуществления высокая нагрузка опухолевого антигена может приводить к прогрессирующей потере одной или более эффекторных функций антигенспецифичных Т-клеток, например, приводя к истощению Т-клеток. Больные раком яичника, например, прогрессирующим раком яичника, могут быть выбраны для иммунотерапии, например, комбинированной терапии, описанной в настоящей заявке, по меньшей мере, частично, из-за малого бремени болезни после первичной терапии, а также высокого риска рецидива.
В некоторых вариантах осуществления комбинация дополнительно включает ингибитор IDO (например, ингибитор IDO, описанный в настоящей заявке). В других вариантах осуществления комбинация дополнительно включает агонист CD-27 (например, агонист CD-27, описанный в настоящей заявке). В других вариантах осуществления комбинация дополнительно включает антитело против CTLA-4 (например, антитело против CTLA-4, описанное в настоящей заявке, например, ипилимумаб). В других вариантах осуществления комбинация дополнительно включает ингибитор PARP (например, PARP, описанный в настоящей заявке, например, ипилимумаб). В других вариантах осуществления комбинация дополнительно включает химиотерапию (например, химиотерапию, описанную в настоящей заявке, например, паклитаксел). В других вариантах осуществления комбинация дополнительно включает ингибитор CSF-1R (например, ингибитор CSF-1R, описанный в настоящей заявке).
В некоторых вариантах осуществления комбинация, описанная в настоящей заявке, применяется для лечения рака толстой и прямой кишки. Рак толстой и прямой кишки (CRC) обычно рассматривают как вызванный воспалением рак. Метастатические, или IV стадии, раковые опухоли толстой кишки имеют 5-летнюю относительную выживаемость приблизительно 11%. Без ограничения теорией, считается, что в некоторых вариантах осуществления развитие CRC у человека связано с путем интерлейкина-23 (IL-23)-IL-17 (Grivennikov et al., Nature. 2012; 491(7423):254-8). IL-17 связан с неблагоприятным прогнозом и вызывает ангиогенез посредством стимуляции продукции VEGF раковых клеток при CRC. Активированные gdT17 клетки также секретируют другие цитокины, включая IL-8, ФНО-альфа и ГМ-КСФ, которые вызывают хемоаттрактацию МСК в опухоль и поддерживают их иммуносупрессорную активность. Профили экспрессии клетки Th17 в CRC, как показывали, были связаны с плохим выживанием (Grivennikov et al., Nature. 2012; 491 (7423):254-8; Zou and Restifo, Nat Rev Immunol. 2010; 10(4):248-56). CRC часто чувствителен к ингибированию VEGF, однако было показано, что IL-17-опосредованная паракринная сеть способствует развитию резистентности опухоли к антиангиогенной терапии (Chung et al. Nat Med. 2013; 19(9):1114-23). Вызываемое IL-17 рекрутирование CD11b+Gr1+ миелоидных клеток в микроокружение опухоли может вызывать VEGF-независимый рост опухоли.
В некоторых вариантах осуществления комбинация применяется для лечения субъекта, имеющего микросателлитно стабильный (MSS) рак толстой и прямой кишки. В некоторых вариантах осуществления субъект не отвечает или плохо отвечает на монотерапию ингибитором контрольной точки. В других вариантах осуществления комбинация применяется для лечения субъекта, имеющего микросателлитно нестабильный рак толстой и прямой кишки (MSI). В некоторых вариантах осуществления субъект имеет рак толстой и прямой кишки MSI или рак толстой и прямой кишки IV стадии. В некоторых вариантах осуществления субъект отвечает на терапию ингибитором контрольной точки.
В некоторых вариантах осуществления комбинация дополнительно включает химиотерапию, например, химиотерапию, описанную в настоящей заявке. В некоторых вариантах осуществления комбинация дополнительно включает 5-ФУ, фолиновую кислоту или и то, и другое. В альтернативе, или в комбинации, комбинация дополнительно включает оксалиплатин. Альтернативно, или в комбинации, в других вариантах осуществления комбинация дополнительно включает иринотекан. В некоторых вариантах осуществления комбинация дополнительно включает FOLFOX или FOLFIRI. В некоторых вариантах осуществления комбинация дополнительно включает ингибитор ангиогенеза (например, бевацизумаб).
В некоторых вариантах осуществления ингибитор PFKFB3, PFK-158 или соединение, раскрытое в публикации PCT WO 2013/148228, применяют в комбинации с ингибитором PD-1 (например, молекулой антитела против PD-1). В некоторых вариантах осуществления ингибитор PFKFB3, PFK-158 или соединение, раскрытое в публикации PCT WO 2013/148228, вводят внутривенно. В некоторых вариантах осуществления ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе от 300 мг до 500 мг (например, в дозе 400 мг), например, один раз в 4 недели, например, путем внутривенной инфузии. В других вариантах осуществления ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе от 200 мг до 400 мг (например, в дозе 300 мг), например, один раз в 3 недели, например, путем внутривенной инфузии. В некоторых вариантах осуществления комбинация применяется для лечения рака, описанного в настоящей заявке, например, рака яичника, рака фаллопиевой трубы (например, папиллярной серозной аденокарциномы) или рака толстой и прямой кишки. В некоторых вариантах осуществления комбинация применяется для лечения субъекта, который плохо отвечает или не отвечал на химиотерапию (например, химиотерапию на основе производных платины или химиотерапию 5-ФУ).
Примеры химиотерапии
В одном варианте осуществления комбинация, описанная в настоящей заявке, включает химиотерапевтическое средство. В некоторых вариантах осуществления комбинация применяется для лечения рака, например, рака, описанного в настоящей заявке, например, рака молочной железы, рака легкого (например, немелкоклеточного рака легкого (НМРЛ)), рака носоглотки или рака поджелудочной железы. В некоторых вариантах осуществления рак является раком молочной железы, например, метастатическим раком молочной железы, например, HER2-негативным раком молочной железы (например, трижды негативным раком молочной железы (ТНРМЖ) или HR+ раком молочной железы, резистентным к эндокринной терапии). В некоторых вариантах осуществления рак легкого (например, немелкоклеточный рак легкого) является плоскоклеточным НМРЛ или неплоскоклеточным НМРЛ. В некоторых вариантах осуществления комбинация применяется для лечения рака носоглотки.
В некоторых вариантах осуществления химиотерапевтическим средством является паклитаксел, например, паклитаксел, связанный с наночастицами альбумина, также известный как альбумин-связанный паклитаксел или паклитаксел-альбумин (Абраксан®). В некоторых вариантах осуществления паклитаксел имеет следующую структуру:
Паклитаксел также известен как (2α,4α,5β,7β,10β,13α)-4,10-бис(ацетилокси)-13-{[(2R,3S)-3-(бензоиламино)-2-гидрокси-3-фенилпропаноил]окси}-1,7-дигидрокси-9-оксо-5,20-эпокситакс-11-ен-2-ила бензоат.
Паклитаксел-альбумин представляет собой паклитаксел, связанный с наночастицами альбумина, который отличается от обычного паклитаксела, в лекарственную форму которого включают Kolliphor EL (ранее Cremophor EL). Эта не содержащая растворителя лекарственная форма была разработана для улучшения терапевтического индекса паклитаксела, в особенности для уменьшения токсических явлений, таких как аллергические реакции (что позволяет исключить премедикацию антигистаминными и стероидными препаратами), с потенциальным увеличением захвата паклитаксела в раковых клетках (Ibrahim et al. Clin Cancer Res. 2002; 8(5):1038-44). Растворитель, используемый для обычного паклитаксела, также может влиять на доставку лекарственных средств в опухоль, ограничивая его клиническую эффективность (ten Tije et al. Clin Pharmacokinet. 2003; 42(7):665-85) и приводя к превышению дозозависимого увеличения системной экспозиции лекарственного средства в узком диапазоне доз, что, скорее всего, объясняется захватом паклитаксела в мицеллах растворителя (Gianni et al. J Clin Oncol. 1995; 13(1):180-90; van Tellingen et al. Br J Cancer. 1999; 81(2):330-5; Sparreboom et al. Cancer Res. 1999; 59(7):1454-7). По сравнению с обычным паклитакселом паклитаксел-альбумин создает в 10 раз более высокую среднюю максимальную концентрацию свободного паклитаксела, и, кроме того, паклитаксел-альбумин быстрее переходит через слои эндотелиальных клеток и демонстрирует более высокое проникновение в ткани и более медленную элиминацию паклитаксела. Согласно доклиническим моделям, увеличение интратуморальной доставки и удерживания приводит к получению на 33% более высоких концентраций лекарственного средства в опухоли (Desai et al. Clin Cancer Res. 2006; 12(4):1317-24. Ошибка исправлена в: Clin Cancer Res. 2006; 12(12):3869).
Без ограничения теорией, считается, что в некоторых вариантах осуществления паклитаксел-альбумин является ингибитором микротрубочек, который вызывает сборку микротрубочек из димеров тубулина и стабилизирует микротрубочки в результате блокирования деполимеризации. Такая стабильность приводит к ингибированию нормальной динамической реорганизации сети микротрубочек, которая необходима для жизненно важной интерфазы и митотических клеточных функций.
В некоторых вариантах осуществления паклитаксел-альбумин может применяться в качестве монотерапии, с рекомендуемой дозой 260 мг/м2 каждые 3 недели, для лечения больных метастатическим раком молочной железы, например, после неэффективности химиотерапии первой линии вследствие метастазирования или рецидива в течение 6 месяцев после вспомогательной химиотерапии (предыдущая терапия должна была включать антрациклин, если нет клинических противопоказаний). Результаты исследования III фазы продемонстрировали значительно улучшенный общий процент пациентов с ответом (ORR) (33 и 19%; P=0,001) и время до прогрессирования заболевания (TTP) (23,0 и 16,9 недель; HR=0,75; P=0,006) у больных, получавших на первой и второй линии или далее паклитаксел-альбумин, в сравнении с пациентами, которые получали обычный паклитаксел, 175 мг/м2 каждые 3 недели (Gradishar et al. J Clin Oncol. 2005; 23(31):7794-803).
В некоторых вариантах осуществления может использоваться схема с еженедельным введением (День 1, 8, 15 каждые 4 недели) паклитаксел-альбумина. Две различных еженедельных дозы (100 мг/м2 и 150 мг/м2 qw3/4) сравнивали в рандомизированном исследовании II фазы с 300 мг/м2 паклитаксел-альбумином раз в 3 недели (q3w) и 100 мг/м2 доцетаксела q3w в условиях применения терапии первой линии (Gradishar et al. J Clin Oncol. 2009; 27(22):3611-9. Erratum in: J Clin Oncol. 2011; 29(19):2739; Gradishar et al. Clin Breast Cancer. 2012; 12(5):313-21). В некоторых вариантах осуществления доза 150 мг/м2 qw3/4 используется, например, для пациентов, которым нужен быстрый эффект противоопухолевой терапии. В других вариантах осуществления доза 100 мг/м2 qw3/4 используется, например, из-за более контролируемого профиля безопасности.
Фармакокинетику суммарного паклитаксела после 30 и 180-минутных инфузий паклитаксел-альбумина в дозах 80-375 мг/м2 определяли в клинических исследованиях. Уровни дозы в мг/м2 относятся к мг паклитаксела в паклитаксел-альбумине. После внутривенного введения паклитаксел-альбумина, концентрации паклитаксела в плазме уменьшались в двухфазном процессе, с первоначальным быстрым распределением в периферическом компартементе и более медленной второй фазой, представляющей элиминацию лекарственного средства. Экспозиция лекарственного средства (AUC) была дозозависимой в диапазоне 80-300 мг/м2, при этом фармакокинетика паклитаксела в случае паклитаксел-альбумина не зависела от продолжительности внутривенного введения. Средний общий клиренс изменялся в пределах от 13 до 30 л/ч/м2 и средний период полувыведения в конечной фазе изменялся с 13 до 27 часов.
В некоторых вариантах осуществления комбинация, описанная в настоящей заявке, применяется для лечения рака молочной железы, например, метастатического рака молочной железы или HER2-негативного рака молочной железы (например, трижды негативного рака молочной железы). Без ограничения теорией, считается, что в некоторых вариантах осуществления применение стероидов в комбинации с соединениями против PD-1 может быть антагонистическим, при этом паклитаксел-альбумин обладает преимуществом по сравнению с другими таксанами, по меньшей мере отчасти, поскольку не требуется премедикация кортикостероидами.
В некоторых вариантах осуществления комбинация применяется для лечения субъекта, имеющего трижды негативный рак молочной железы или HR+ рак молочной железы, после неэффективного применения эндокринной терапии. В других вариантах осуществления комбинация применяется для лечения таксан-наивного пациента или пациента, имеющего по меньшей мере 1 год безрецидивной выживаемости, после их применения в схеме вспомогательной терапии. В некоторых вариантах осуществления комбинация применяется для лечения субъекта, который соответствует критериям применения химиотерапии первой линии.
При раке молочной железы взаимодействие иммунной системы с опухолевыми клетками и микроокружением опухоли может играть важную роль, например, в случае ТНРМЖ и HER2+ подтипов. Рак молочной железы в целом, и в частности подтипы ТНРМЖ, часто содержит инфильтрирующие опухоль лимфоциты (TIL) в строме и ассоциирован с высокой экспрессией PD-L1 (до 50% опухолей). Без ограничения теорией, считается, что в некоторых вариантах осуществления цитотоксические химиотерапевтические средства могут увеличивать иммунное примирование, миграцию Т-клеток и/или иммуноэффекторные фазы цикла противоопухолевого иммунитета, с одновременным увеличением антигенности, иммуногенности и чувствительности к иммунному киллингу раковых клеток, что увеличивает потенциал для ответа на ингибиторы контрольной точки.
В некоторых вариантах осуществления комбинация применяется для лечения субъекта с развитием или риском развития резистентности к терапии против PD-1 или против PD-L1. Например, доклинические и клинические результаты указывают, что несколько цитотоксических и противораковых терапий могут помочь преодолеть некоторые потенциальные механизмы резистентности к ингибированию PD-L1/PD-1 (например, нарушение в активации Т-клеток, специфичных к раковому антигену, или отсутствие инфильтрации иммуноцитов в опухолях) посредством увеличения миграции Т-клеток и инфильтрации в ложе опухоли (Zitvogel et al. 2013). Несколько цитотоксических средств (включая паклитаксел) также могут непосредственно воздействовать на фенотип и функцию дендритных клеток (ДК), вызывая их созревание и секрецию провоспалительных цитокинов и повышение их функции презентации антигена (например, экспрессии молекул MHC II класса на своей поверхности), что приводит к усилению примирования CD8+ Т-клеток и повышению цитотоксической активности (Pfannenstiel et al. Cell Immunol. 2010; 263(1):79-87). Также было сделано предположение, что химиотерапия могла стимулировать в опухолевых клетках их антигенность (вызывая соматические мутации и повышая экспонирование различных молекул на поверхности опухолевых клеток, действующих в качестве новых антигенов), иммуногенность (в результате секреции молекул, ассоциированных с апоптозом (CDAM)) и чувствительность к иммунной атаке (при экспрессии костимулирующих молекул, таких как B7-1, на поверхности злокачественных клеток или даунрегуляции иммуносупрессорных молекул, таких как PD-L1 и PD-L2) (Hodge et al. Int J Cancer. 2013; 133(3):624-36). В доклинических моделях in vivo, химиотерапия препаратами платины или таксанами демонстрирует синергический эффект в сочетании с антителами против PD-L1 и вызывает длительные противоопухолевые ответы, связанные с увеличенным количеством инфильтрирующих опухоль CD8+ Т-клеток (Giaccone et al. 2015, Adams et al. 2015, Liu et al. 2015). В клинических условиях увеличенная экспрессия PD-L1 и инфильтрация CD8+ Т-клеток в опухоли наблюдали у больных, подвергавшихся серийной биопсии в исследовании фазы 1b с тестированием комбинации ингибитора PD-L1 (атезолизумаба) и химиотерапии при НМРЛ (Camidge et al. 2015). Развитие новых интратуморальных инфильтратов иммунных клеток также наблюдали после неоадъювантной терапии паклитакселом при раке молочной железы на ранней стадии с клиническим ответом и ответом по результатам лабораторных исследований, непосредственно коррелирующими с инфильтрацией иммунных клеток в опухоли (Demaria et al. Clin Cancer Res. 2001; 7(10):3025-30).
В некоторых вариантах осуществления комбинация применяется, для лечения субъекта, демонстрировавшего иммунную инфильтрацию, например, содержащую инфильтрирующие опухоль лимфоциты (TIL), при раке. В других вариантах осуществления субъект выбран для лечения в результате, по меньшей мере частично, присутствия TIL-лимфоцитов в раковой опухоли. Например, более 70% раковых опухолей молочной железы содержат инфильтрирующие опухоль лимфоциты в строме, при этом доклинические данные указывают, что в большинстве случаев рака молочной железы локальное иммунное микроокружение играет роль в контроле прогрессирования рака. Несколько исследований показали, что иммунная инфильтрация при раке молочной железы коррелирует с лучшим прогнозом и с более эффективным ответом на химиотерапию (Denkert et al. J Clin Oncol. 2010; 28(1):105-13; Loi et al. Oncoimmunology. 2013; 2(7):e24720). В случае ТНРМЖ приблизительно 15% опухолей демонстрируют высокую степень лимфоцитарной инфильтрации при диагностике, при этом большинство (65-80%) содержит низкие или средние уровни иммунных клеток (Ruffell et al. Proc Natl Acad Sci U S A. 2012; 109(8):2796-801; Garcia-Teijido et al. Clin Med Insights Oncol. 2016; 10(Suppl 1):31-9). Анализ профилей экспрессии генов также продемонстрировал связь между экспрессией иммуномодуляторных генов и лучшим результатом лечения при ТНРМЖ (Desmedt et al. J Clin Oncol. 2016; 34(16):1872-81). В 2 различных исследованиях, в одном на образцах ТНРМЖ и другом во всех типах рака молочной железы, экспрессия PD-L1 была высокой (19% в образцах ТНРМЖ, и 44% в образцах всех типов РМЖ) и ассоциированной с более интенсивным инфильтратом CD8+ Т-клеток, чем PD-L1- опухоли в образцах ТНРМЖ (Mittendorf et al. Cancer Immunol Res. 2014; 2(4):361-70., Ghebeh et al. Neoplasia. 2006; 8(3):190-8). Кроме того, ТНРМЖ, по-видимому, демонстрирует генетическую нестабильность с высокой частотой мутаций, что также могло привести к повышению иммуногенных неоантигенов и инфильтрации противоопухолевых Т-клеток (Wang et al. Ann Oncol. 2015; 26(3):523-8). При HER2-положительном раке молочной железы, TIL и иммунные сигнатуры также связаны с лучшим прогнозом (Salgado et al. JAMA Oncol. 2015; 1(4):448-54). HER2-положительный рак молочной железы также является высоко пролиферирующим подтипом рака молочной железы с повышенным уровнем геномной нестабильности. Оверэкспрессия самого HER2 может действовать в качестве опухолеассоциированного антигена, индуцируя иммунную систему. В случае высокопролиферативных HR+ формах рака (люминальный B подтип), иммунные клетки позволяют предсказывать лучший прогноз (Bianchini et al. J Clin Oncol. 2010; 28(28):4316-23. Erratum in: J Clin Oncol. 2010; 28(32):4868. J Clin Oncol. 2012; 30(6):679). При HR+ раке молочной железы взаимодействие между опухолевыми клетками и иммунной средой может быть основано на иных механизмах, нежели при других подтипах рака молочной железы, включая модуляцию микроокружения опухоли взаимными влияниями эндокринных факторов, провоспалительного статуса и иммуноцитов (Dieci et al. Cancer Treat Rev. 2016; 46:9-19).
В некоторых вариантах осуществления химиотерапевтическое средство, например, паклитаксел-альбумин, и ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекулу антитела против PD-1), вводят в дозе и/или согласно временной схеме, которые в комбинации обеспечивают требуемую противоопухолевую активность.
В одном варианте осуществления химиотерапевтическое средство, например, паклитаксел-альбумин, вводят в дозе от 25 мг/м2 до 300 мг/м2, например, от 25 мг/м2 до 250 мг/м2, от 50 мг/м2 до 200 мг/м2, от 100 мг/м2 до 150 мг/м2, от 75 мг/м2 до 125 мг/м2, от 125 мг/м2 до 175 мг/м2, от 50 мг/м2 до 100 мг/м2, от 100 мг/м2 до 200 мг/м2 или от 200 мг/м2 до 250 мг/м2, например, в дозе 50 мг/м2, 75 мг/м2, 100 мг/м2, 125 мг/м2, 150 мг/м2, 175 мг/м2, 200 мг/м2, 220 мг/м2 или 260 мг/м2, например, три раза (например, еженедельно) в течение периода продолжительностью четыре недели, например, еженедельно в День 1, День 8 и День 15 каждые четыре недели (qw3/4), например, внутривенно.
В одном варианте осуществления химиотерапевтическое средство, например, паклитаксел-альбумин, вводят в дозе от 50 мг/м2 до 150 мг/м2 (например, 100 мг/м2), например, еженедельно в День 1, День 8 и День 15 каждые четыре недели (qw3/4). В некоторых вариантах осуществления химиотерапевтическое средство, например, паклитаксел-альбумин, вводят внутривенно. В одном варианте осуществления химиотерапевтическое средство, например, паклитаксел-альбумин, вводят в дозе от 50 мг/м2 до 150 мг/м2 (например, 100 мг/м2), например, еженедельно в День 1, День 8 и День 15 каждые четыре недели (qw3/4), например, путем внутривенной инфузии, и ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе от 300 мг до 500 мг (например, в дозе 400 мг), например, один раз в 4 недели или один раз в 8 недель, например, путем внутривенной инфузии. В некоторых вариантах осуществления инфузию химиотерапевтического средства, например, паклитаксел-альбумина, начинают после (например, по меньшей мере через 30 минут, 45 минут, 60 минут, 75 минут, 90 минут или 120 минут после) завершения инфузии ингибитора PD-1 (например, молекулы антитела против PD-1). Например, химиотерапевтическое средство, например, паклитаксел-альбумин и/или ингибитор PD-1 (например, молекулу антитела против PD-1), могут вводить путем 30-120 минутной (например, 30 минутной) внутривенной инфузии. В варианте осуществления курс лечения составляет 28 дней или 56 дней (например, 28 дней).
В некоторых вариантах осуществления химиотерапевтическое средство включает цисплатин, пеметрексед или оба. Цисплатин также известен как цисплатин, платамин, неоплатин, цисмаплат, или цис-диамминдихлорплатина (II) (CDDP). Пеметрексед также известен как (S)-2-(4-(2-(2-амино-4-оксо-4,7-дигидро-3H-пирроло[2,3-d]пиримидин-5-ил)этил)бензамидо)пентандиовая кислота. В некоторых вариантах осуществления комбинация применяется для лечения рака, например, рака, описанного в настоящей заявке. В некоторых вариантах осуществления рак является раком легкого, например, немелкоклеточным раком легкого (НМРЛ). В некоторых вариантах осуществления НМРЛ является неплоскоклеточным НМРЛ. В некоторых вариантах осуществления рак является раком носоглотки.
В некоторых вариантах осуществления химиотерапевтическое средство включает паклитаксел, карбоплатин или оба. Карбоплатин также известен как цис-диаммин(циклобутан-1,1-дикарбоксилат-O,O')платина (II). В некоторых вариантах осуществления комбинация применяется для лечения рака, например, рака, описанного в настоящей заявке. В некоторых вариантах осуществления рак является раком легкого, например, немелкоклеточным раком легкого (НМРЛ). В некоторых вариантах осуществления НМРЛ является плоскоклеточным НМРЛ. В некоторых вариантах осуществления рак является раком носоглотки.
Другие примеры химиотерапевтических средств, которые могут применяться в комбинации, включают, без ограничения перечисленными, алкилирующее средство (например, бифункциональное алкилирующее средство (например, циклофосфамид, мехлорэтамин, хлорамбуцил или мелфалан), монофункциональное алкилирующее средство (дакарбазин (DTIC), нитрозомочевины, темозоломид (пероральный дакарбазин)), антрациклин (например, даунорубицин, доксорубицин, эпирубицин, идарубицин, митоксантрон или валрубицин), средства, разрушающие цитоскелет (таксан) (например, паклитаксел, доцетаксел, Абраксан или Таксотер), эпотилон, ингибитор гистондеацетилазы (например, вориностат или ромидепсин), ингибитор топоизомеразы I (например, иринотекан или топотекан), ингибитор топоизомеразы II (например, этопозид, тенипозид или тафлупозид) или ингибиторы киназ (например, бортезомиб, эрлотиниб, гефитиниб, иматиниб, вемурафениб, висмодегиб), аналог нуклеотидов или предшественников (например, азацитидин, имуран, капецитабин, цитарабин, доксифлуридин, фторурацил, гемцитабин, гидроксимочевину, меркаптопурин, метотрексат, тиогуанин), пептидный антибиотик (например, блеомицин или актиномицин), средство на основе платины (например, карбоплатин, цисплатин или оксалиплатин), ретиноид (например, третиноин, алитретиноин, бексаротен) или алкалоид барвинка или производное (например, винбластин, винкристин, виндезин или винорелбин).
В некоторых вариантах осуществления комбинация дополнительно включает ингибитор ангиогенеза, ингибитор EGFR, ингибитор PARP (например, BSI-201), конъюгат антитела-лекарственного средства (например, специфичный к GPNMB (например, глембатумумаб ведотин (CDX-011)), сацитузумаб говитекан (IMMU-132)), ингибитор рецептора Frizzled (например, вантиктумаб), ингибитор PD-L1 (например, атезолизумаб), хирургию, лучевую терапию или их комбинацию.
В одном варианте осуществления комбинация, описанная в настоящей заявке, включает химиотерапевтическое средство (например, гипометилирующее средство, например, децитабин). В одном варианте осуществления комбинация, описанная в настоящей заявке, дополнительно включает ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекулу антитела против PD-1, описанного в настоящей заявке), ингибитор TIM-3 (например, молекулу антитела против TIM-3, описанного в настоящей заявке) или оба. В некоторых вариантах осуществления комбинация применяется для лечения рака, например, рака, описанного в настоящей заявке, например, гемобластоза, например, лейкоза (например, острого миелоидного лейкоза (ОМЛ)), или миелодиспластического синдрома (МДС). В некоторых вариантах осуществления рак является лейкозом, например, рецидивирующим или рефракторным ОМЛ, или de novo ОМЛ (например, ОМЛ, не соответствующим стандарту лечения). В других вариантах осуществления раком является МДС, например, МДС с высоким риском.
В некоторых вариантах осуществления химиотерапевтическим средством является гипометилирующее средство. Гипометилирующее средство (или деметилирующее средство) является средством, которое ингибирует метилирование ДНК. В некоторых вариантах осуществления гипометилирующее средство блокирует активность ДНК метилтрансферазы (т.е., ингибитор ДНК метилтрансферазы/ингибитор DNMT). Примеры гипометилирующих средств, которые могут применяться в комбинации, описанной в настоящей заявке, включают децитабин и азацитидин.
В некоторых вариантах осуществления химиотерапевтическим средством является децитабин. Децитабин (также известный как 5-аза-2'-дезоксицитидин или Дакоген®) является аналогом дезоксинуклеозида цитидина. Он может селективно ингибировать ДНК метилтрансферазы в низких дозах. Ингибирование ДНК метилтрансферазы децитабином может привести к гипометилированию промоторов генов, что может привести к реактивации генов-супрессоров опухоли или индукции клеточной дифференцировки или клеточного старения с последующим апоптозом. Децитабин показан для лечения взрослых в возрасте 65 лет и старше с недавно диагностированным de novo или вторичным ОМЛ, согласно классификации ВОЗ, которые не подлежат применению стандартной индукционной химиотерапии. Применение децитабина исследовали у больных с недавно диагностированным de novo или вторичным ОМЛ согласно классификации ВОЗ (Малик Malik and Cashen. Cancer Manag Res. 2014; 6: 53-61). Медианная общая выживаемость (OS) в совокупности всех пациентов с назначенным лечением составляла 7,7 месяцев у больных, получавших децитабин. Процент пациентов с полной ремиссией (CR+ полная ремиссия с неполным восстановлением количества тромбоцитов (CRp)) составляла 17,8% (Lubbert et al. J Clin Oncol. 2011; 29(15):1987-96). Децитабин показан для лечения пациентов с МДС, например, ранее проходивших лечение и не проходивших лечение, de novo и вторичным МДС всех подтипов франко-американо-британской классификации, а также групп среднего-1, среднего-2 и высокого риска согласно Международной прогностической оценочной системе, в США.
В некоторых вариантах осуществления комбинация применяется для лечения острого миелоидного лейкоза (ОМЛ). ОМЛ представляет собой клональную неоплазию гемопоэтической системы, которая характеризуется, например, пролиферацией патологических миелоидных бластных клеток в костном мозге. Пролиферация патологических миелоидных бластных клеток может нарушать нормальный гемопоэз, что приводит к накоплению дисфункциональных, незрелых миелоидных клеток в костном мозге и периферической крови. В некоторых вариантах осуществления диагноз ОМЛ ставят, когда миелоидные бластные клетки составляют≥20% ядросодержащих клеток в пунктате костного мозга. Эти лейкозные бластные клетки могут ингибировать нормальные гемопоэтические стволовые клетки и клетки-предшественники и влиять на появление зрелых, дифференцированных гемопоэтических клеток в периферической крови. Клинические симптомы могут включать, например, анемию, нейтропению или тромбоцитопению, что может привести к угрожающей жизни инфекции и кровотечению. ОМЛ может возникать на фоне предшествующего миелодиспластического синдрома ("вторичный ОМЛ") или предшествующей цитотоксической химиотерапии ("связанный с терапией ОМЛ").
Долговременный контроль заболевания может быть достигнут у больных с хорошими прогностическими показателями, например, молодой возраст и благоприятная цитогенетика. Пациенты до 60 без значительных сопутствующих патологий могут первоначально проходить лечение с применением интенсивной миелоаблативной индукционной химиотерапии, которая, как правило, включает антрациклин и цитарабин. Цель этой терапии состоит в том, чтобы достигнуть, например, полной ремиссии (CR) меньше чем с 5% бластными клетками в условиях нормального гемопоэза, что может достигаться более чем в 65% случаев в данной группе пациентов. Послеремиссионная консолидирующая терапия с применением химиотерапии или либо аутологичная или аллогенная пересадка гемопоэтических стволовых клеток могут впоследствии применять для увеличения длительности ремиссии. Существуют довольно высокие показатели рецидива ОМЛ, в случае которых доступны ограниченные варианты эффективного лечения. Пожилые пациенты обычно страдают еще хуже, достигая значительно более низких и менее продолжительных ответов, и испытывают больше осложнений при лечении. Для этого группы пожилых больных, которые не могут переносить интенсивную терапию, варианты крайне ограничены, и эффективного стандартного подхода не существует. Варианты лечения включают, например, низкую дозу цитарабина или гипометилирующих средств, таких как 5-азацитидин или децитабин. Существует потребность в более эффективных методах лечения для повышения выживаемости больных ОМЛ, например, пожилых больных ОМЛ и больных с рецидивирующим или рефракторным заболеванием.
Миелодиспластический синдром (МДС) является гетерогенной группой хронических миелоидных нарушений, которые включают персистирующие цитопении периферической крови и повышенную частоту лейкозной трансформации. Клинические показатели являются переменными, и диагноз, как правило, ставят на основе морфологических и цитогенетических патологий гемопоэтических клеток в костном мозге и периферической крови. Прогноз по МДС может быть определен согласно пересмотренной Международной прогностической оценочной системе (rIPSS), которая основана на клинических данных цитогенетики, процентах бластных клеток костного мозга и цитопении. Пациентов подразделяют на пять категорий риска в соответствии с общими баллами на основе этих прогностических факторов (Greenberg et al. J Natl Compr Canc Netw. 2013; 11(7):838-74). Пациенты с диагнозом МДС высокого и очень высокого риска согласно rIPSS имеют высокий процент трансформации в ОМЛ и неблагоприятный прогноз. Гипометилирующие средства считаются стандартом лечения при МДС (NCCN Guidelines for Patients®, Myelodysplastic Syndromes, Version 1.2016, National Comprehensive Cancer Network).
Без ограничения теорией, считается, что в некоторых вариантах осуществления противоопухолевый иммунитет может использоваться для лечения ОМЛ и улучшения результатов лечения больных, например, на основе противолейкозной активности, наблюдаемой при аллогенной трансплантации гемопоэтических стволовых клеток и инфузий донорских лимфоцитов. Имеются подтверждения супресивного иммунного микроокружения при ОМЛ с повышенной экспрессией PD-L1 в лейкозных бластных клетках. Доклинические данные в модели ОМЛ на мышах указывают, что развитие заболевания связано с повышенной экспрессией PD-1 на CD8-положительных Т-клетках, и что лечение антителами против PD-1 или против PD-L1 уменьшает бремя ОМЛ и улучшает выживаемость в этих моделях данного заболевания. У больных имеется подтверждение повышенной экспрессии PD-L1 в подгруппе больных ОМЛ/МДС, которая продолжает повышаться при прогрессировании.
В дополнение к активации пути PD-1/PD-L1, имеется подтверждение, что стволовые клетки ОМЛ коэкспрессируют иммунную контрольную точку TIM-3. TIM-3 может совместно с путем PD-1/PD-L1 подавлять распознавание опухоли цитотоксическими Т-клетками. TIM-3 является уникальным антигеном стволовых клеток ОМЛ, который присутствует в лейкозных бластных клетках, но отсутствует в нормальных гемопоэтических стволовых клетках, при этом лечение антителами против TIM3 показало эффективность при снижении лейкозной нагрузки в модели ОМЛ на мышах (Kikushige et al. Cell Stem Cell. 2010; 7(6):708-17). Также имеются подтверждения при МДС, что лечение гипометилирующим средством стандарта лечения, децитабином, увеличивает экспрессия PD-1 в Т-клетках, что подчеркивает его роль в иммуномодуляции.
Без ограничения теорией, считается, что в некоторых вариантах осуществления, химиотерапевтические средства (например, гипометилирующее средства, например, децитабин) могут вызвать увеличение экспрессии иммунных контрольных точек (например, PD-1 и/или TIM-3), которые могут обеспечивать иммунное ускользание и приводить к терапевтической резистентности. Без ограничения теорией, также считается, что в некоторых вариантах осуществления при ОМЛ и МДС наблюдается повышенная коэкспрессия рецепторов иммунных контрольных точек PD-1 и TIM-3, которые совместно ингибируют иммунное распознавание цитотоксическими Т-клетками. Доклинические данные указывают, что параллельная блокада PD-1 и TIM-3 вызывают более сильную активацию Т-клеток, чем при отдельной терапии (Sakuishi et al. J Exp Med. 2010; 207(10):2187-94, Ngiow et al. Cancer Res. 2011; 71(10):3540-51), и синергически ингибирует рост опухоли в экспериментальных моделях рака (Anderson et al. Cancer Immunol Res. 2014; 2(5):393-8, Ngiow et al. Cancer Res. 2011; 71(10):3540-51). В некоторых вариантах осуществления комбинация, описанная в настоящей заявке, оптимизирует подход к ингибированию контрольной точки при ОМЛ и МДС, например, предусматривая индуцируемую лечением иммуномодуляцию и коингибирующие пути.
В других вариантах осуществления комбинация включает ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекулу антитела против PD-1, описанного в настоящей заявке), и химиотерапевтическое средство (например, гипометилирующее средство, например, децитабин). В некоторых вариантах осуществления ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекулу антитела против PD-1), вводят в дозе от 200 мг до 600 мг (например, от 300 мг до 500 мг, например, в дозе 400 мг), например, один раз в 4 недели, например, внутривенно. В некоторых вариантах осуществления химиотерапевтическое средство (например, гипометилирующее средство, например, децитабин) вводят в дозе от 5 мг/м2 до 50 мг/м2 (например, от 10 мг/м2 до 30 мг/м2, например, в дозе 20 мг/м2), например, ежедневно, например, в течение 1, 2, 3, 4, 5, 6, 7, 8 или более дней, например, внутривенно. В варианте осуществления ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекулу антитела против PD-1), вводят в день 8 из 28-дневного курса, и химиотерапевтическое средство (например, гипометилирующее средство, например, децитабин) вводят в дни 1, 2, 3, 4 и 5 из 28-дневного курса.
В других вариантах осуществления комбинация включает ингибитор молекулы иммунной контрольной точки, например, ингибитор TIM-3 или молекулу антитела против TIM-3, раскрытого в публикации заявки на патент США 2015/0218274, и химиотерапевтическое средство (например, гипометилирующее средство, например, децитабин). В некоторых вариантах осуществления ингибитор молекулы иммунной контрольной точки, например, ингибитор TIM-3 или молекулу антитела против TIM-3, раскрытого в публикации заявки на патент США 2015/0218274, вводят в дозе от 10 мг до 1000 мг (например, от 20 мг до 800 мг, от 80 мг до 400 мг, например, в дозе 240 мг), например, один раз в 2 недели, например, внутривенно. В некоторых вариантах осуществления химиотерапевтическое средство (например, гипометилирующее средство, например, децитабин) вводят в дозе от 5 мг/м2 до 50 мг/м2 (например, от 10 мг/м2 до 30 мг/м2 (например, в дозе 20 мг/м2), например, ежедневно, например, в течение 1, 2, 3, 4, 5, 6, 7, 8 или более дней, например, внутривенно. В варианте осуществления ингибитор молекулы иммунной контрольной точки, например, ингибитор TIM-3 или молекулу антитела против TIM-3, раскрытого в публикации заявки на патент США 2015/0218274, вводят в дни 8 и 22 28-дневного курса, и химиотерапевтическое средство (например, гипометилирующее средство, например, децитабин) вводят в дни 1, 2, 3, 4 и 5 28-дневного курса.
В других вариантах осуществления комбинация включает ингибитор PD-1 (например, молекулу антитела против PD-1, описанного в настоящей заявке), ингибитор TIM-3 (например, молекулу антитела против TIM-3, раскрытого в публикации заявки на патент США 2015/0218274) и химиотерапевтическое средство (например, гипометилирующее средство, например, децитабин). В некоторых вариантах осуществления ингибитор PD-1 (например, молекулу антитела против PD-1), вводят в дозе от 200 мг до 600 мг (например, в дозе 400 мг), например, один раз в 4 недели, например, внутривенно. В некоторых вариантах осуществления ингибитор TIM-3 (например, молекулу антитела против TIM-3, раскрытого в публикации заявки на патент США 2015/0218274), вводят в дозе от 10 мг до 800 мг (например, от 20 мг до 400 мг, от 40 мг до 200 мг или от 50 мг до 100 мг, например, в дозе 80 мг), например, один раз в 2 недели, например, внутривенно. В некоторых вариантах осуществления химиотерапевтическое средство (например, гипометилирующее средство, например, децитабин) вводят в дозе от 5 мг/м2 до 50 мг/м2 (например, от 10 мг/м2 до 30 мг/м2 (например, в дозе 20 мг/м2), например, ежедневно, например, в течение 1, 2, 3, 4, 5, 6, 7, 8 или более дней, например, внутривенно. В варианте осуществления ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в день 8 28-дневного курса, ингибитор TIM-3 (например, молекулу антитела против TIM-3, раскрытого в публикации заявки на патент США 2015/0218274), вводят в дни 8 и 22 28-дневного курса и химиотерапевтическое средство (например, гипометилирующее средство, например, децитабин) вводят в дни 1, 2, 3, 4 и 5 28-дневного курса.
В некоторых вариантах осуществления ингибитор PD-1 (например, молекулу антитела против PD-1, описанного в настоящей заявке) и ингибитор TIM-3 (например, молекулу антитела против TIM-3, раскрытого в публикации заявки на патент США 2015/0218274), вводят в один день. В некоторых вариантах осуществления ингибитор PD-1 (например, молекулу антитела против PD-1, описанного в настоящей заявке) и ингибитор TIM-3 (например, молекулу антитела против TIM-3, раскрытого в публикации заявки на патент США 2015/0218274), вводят в разные дни. В некоторых вариантах осуществления ингибитор TIM-3 (например, молекулу антитела против TIM-3, раскрытого в публикации заявки на патент США 2015/0218274), вводят, например, в тот же день, перед введением ингибитора PD-1 (например, молекулы антитела против PD-1, описанного в настоящей заявке). В других вариантах осуществления ингибитор TIM-3 (например, молекулу антитела против TIM-3, раскрытого в публикации заявки на патент США 2015/0218274), вводят, например, в тот же день, после введения ингибитора PD-1 (например, молекулы антитела против PD-1, описанного в настоящей заявке). В некоторых вариантах осуществления вливание солевого раствора или раствора декстрозы, например, в течение приблизительно 1 часа, могут выполнять между введением ингибитора PD-1 (например, молекулы антитела против PD-1, описанного в настоящей заявке) и введением ингибитора TIM-3 (например, молекулы антитела против TIM-3, раскрытого в публикации заявки на патент США 2015/0218274). В некоторых вариантах осуществления ингибитор PD-1 (например, молекулу антитела против PD-1, описанного в настоящей заявке), ингибитор TIM-3 (например, молекулу антитела против TIM-3, раскрытого в публикации заявки на патент США 2015/0218274) или оба вводят путем внутривенной инфузии в течение от 30 минут до 2 часов, например, приблизительно 1 часа. Ингибитор PD-1 (например, молекулу антитела против PD-1, описанного в настоящей заявке) и ингибитор TIM-3 (например, молекулу антитела против TIM-3, раскрытого в публикации заявки на патент США 2015/0218274), могут хранить в форме жидкости или лиофилизата. В некоторых вариантах осуществления ингибитор PD-1 (например, молекулу антитела против PD-1, описанного в настоящей заявке) хранят в форме лиофилизата, а ингибитор TIM-3 (например, молекулу антитела против TIM-3, раскрытого в публикации заявки на патент США 2015/0218274) хранят в форме жидкости.
Комбинация, включающая химиотерапевтическое средство (например, гипометилирующее средство (также иногда известное как деметилирующее средство), например, децитабин) и один или оба из ингибитора PD-1 (например, молекулы антитела против PD-1, описанного в настоящей заявке) или ингибитора TIM-3 (например, молекулы антитела против TIM-3, раскрытого в публикации заявки на патент США 2015/0218274), может применяться в комбинации с дополнительной терапией, например, для лечения рака, например, противораковой терапией, описанной в настоящей заявке. Примеры дополнительных терапий включают, без ограничения перечисленными, триоксид мышьяка (трисенокс), полностью транс-ретиноевую кислоту (ATRA), пересадку стволовых клеток или костного мозга, второе химиотерапевтическое средство (например, азацитидин, цитарабин, даунорубицин, идарубицин или леналидомид) или лучевую терапию.
Примеры ингибиторов BRAF и MEK
В одном варианте осуществления комбинация, описанная в настоящей заявке, включает ингибитор BRAF. В некоторых вариантах осуществления комбинация применяется для лечения рака, например, рака, описанного в настоящей заявке, например, рака кожи (например, меланомы). Без ограничения теорией, считается, что в некоторых вариантах осуществления путь митоген-активируемой протеинкиназы (MAPK) аберрантно активирован в различных формах рака человека, например, в результате мутации BRAF киназы, которая была обнаружена почти в 50% метастатических меланом. В некоторых вариантах осуществления комбинация применяется для лечения рака, имеющего мутацию BRAF, например, мутацию BRAF, описанную в настоящей заявке. В некоторых вариантах осуществления комбинация применяется для лечения меланомы, например, неоперабельной или метастатической меланомы. В некоторых вариантах осуществления комбинация применяется для лечения меланомы у субъекта, где меланома имеет мутацию BRAF (например, мутацию BRAF V600), и при этом субъект имеет повышенный уровень лактатдегидрогеназы (ЛДГ) по сравнению с референсным уровнем ЛДГ.
В некоторых вариантах осуществления ингибитором BRAF является дабрафениб. Дабрафениб также известен как GSK2118436, N-{3-[5-(2-аминопиримидин-4-ил)-2-трет-бутил-1,3-тиазол-4-ил]-2-фторфенил}-2,6-дифторбензолсульфонамид или Тафинлар® (Номер CAS 1195765-45-7). Дабрафениб представляет собой перорально биодоступный мощный и селективный ингибитор RAF киназы человеческих ферментов BRAF и CRAF дикого типа, а также мутантных форм фермента BRAF, например, BRAF V600E, BRAF V600K и BRAF V600D. Механизм действия дабрафениба согласуется с конкурентным ингибированием связывания АТФ. В некоторых вариантах осуществления комбинация применяется для лечения субъекта, у которого определили наличие рака (например, меланомы), имеющей мутацию BRAF, например, мутацию BRAF, описанную в настоящей заявке (например, мутацию BRAF V600). В других вариантах осуществления комбинация применяется для лечения рака (например, меланомы), отличающегося от рака с BRAF дикого типа (например, меланомы с BRAF дикого тип).
В некоторых вариантах осуществления ингибитор BRAF или дабрафениб вводят в дозе от 50 мг до 300 мг (например, от 100 мг до 200 мг), например, два раза в день. В некоторых вариантах осуществления ингибитор BRAF или дабрафениб вводят в дозе от 100 мг до 200 мг (например, в дозе приблизительно 150 мг), например, два раза в день. Например, вторую дозу ингибитора BRAF или дабрафениба могут вводить приблизительно через 12 часов после введения первой дозы. В некоторых вариантах осуществления ингибитор BRAF или дабрафениб вводят в общей суточной дозе от 100 мг до 600 мг (например, от 200 мг до 400 мг). В некоторых вариантах осуществления ингибитор BRAF или дабрафениб вводят в общей суточной дозе от 200 мг до 400 мг (например, в общей суточной дозе приблизительно 300 мг). В некоторых вариантах осуществления ингибитор BRAF дабрафениб вводят перорально.
В одном варианте осуществления комбинация, описанная в настоящей заявке, включает ингибитор MEK. В некоторых вариантах осуществления комбинация применяется для лечения рака, например, рака, описанного в настоящей заявке, например, рака кожи (например, меланомы). Без ограничения теорией, считается, что при ингибировании MEK, члена сигнального каскада MAPK, может быть заблокирована пролиферация клеток и индуцирован апоптоз. В некоторых вариантах осуществления комбинация применяется для лечения меланомы, например, неоперабельной или метастатической меланомы. В некоторых вариантах осуществления комбинация применяется для лечения меланомы у субъекта, где меланома имеет мутацию BRAF (например, мутацию BRAF V600), а субъект имеет повышенный уровень лактатдегидрогеназы (ЛДГ) по сравнению с референсным уровнем ЛДГ.
В некоторых вариантах осуществления ингибитором MEK является траметиниб. Траметиниб также известен как GSK1120212, JTP-74057, TMT212, N-(3-{3-циклопропил-5-[(2-фтор-4-иодфенил)-амино]-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидропиридо[4,3-d]пиримидин-1(2H)-ил}фенил)ацетамид или Мекинист® (Номер CAS 871700-17-3). Без ограничения теорией, считается, что в некоторых вариантах осуществления траметиниб является обратимым и высокоселективным аллостерическим ингибитором MEK1 и MEK2. Белки MEK являются важными компонентами пути MAPK, который обычно гиперактивирован в опухолевых клетках, таких как клетки меланомы. Онкогенные мутации в BRAF и RAS могут передавать сигнал через MEK1 или MEK2.
В некоторых вариантах осуществления ингибитор MEK или траметиниб вводят в дозе от 0,5 мг до 4 мг (например, от 1 мг до 3 мг), например, один раз в день. В некоторых вариантах осуществления ингибитор MEK или траметиниб вводят в дозе от 1 мг до 3 мг (например, в дозе приблизительно 2 мг), например, один раз в день. В некоторых вариантах осуществления ингибитор MEK или траметиниб вводят перорально.
В одном варианте осуществления комбинация, описанная в настоящей заявке, включает ингибитор BRAF и ингибитор MEK.
Доклинические данные in vitro и in vivo указывали на повышенную противоопухолевую активность комбинации ингибитора BRAF (например, дабрафениба) и ингибитора MEK (например, траметиниба). Например, комбинация дабрафениба и траметиниба продемонстрировала увеличенную антипролиферативную активность против группы BRAF-мутантных клеточных линий in vitro, что позволяет предположить синергический эффект дабрафениба и траметиниба при решении проблемы первичной устойчивости к каждому отдельному средству. Комбинация была эффективной при ингибировании роста дабрафениб-резистентных BRAF-мутантных клонов клеток меланомы, что указывет на потенциальную способность комбинированной терапии преодолевать приобретенную резистентность. Эти данные, полученные с линиями клеток, сопоставимы с результатами in vitro других экспериментальных комбинаций ингибиторов BRAF и MEK (Corcoran et al. Sci Signal. 2010; 3(149):ra84; Emery et al. Proc Natl Acad Sci U S A. 2009; 106(48):20411-6).
В качестве другого примера, комбинация дабрафениба и траметиниба продемонстрировала повышенную активность в ксенотрансплантатных моделях BRAF-мутантной меланомы на мышах по сравнению с любым отдельным средством. В исследованиях кожной токсичности, проведенных на крысах, добавление траметиниба к дабрафенибу предотвращало развитие пролиферативных поражений кожи, наблюдаемых после лечения одним дабрафенибом. Эти результаты дают основание предполагать, что добавление ингибитора MEK к ингибитору BRAF может подавлять пролиферативные сигналы в нормальных клетках кожи, которые могут приводить к развитию гиперпролиферативных поражений кожи, в том числе, например, кератоакантом и кожных плоскоклеточных карцином, часто наблюдаемых в клинических исследованиях, включающих ингибиторы BRAF (Flaherty et al. Curr Opin Oncol. 2010; 22(3):178-83; Chapman et al. Expert Opin Investig Drugs. 2011; 20(2):209-20; Robert et al. Curr Opin Oncol. 2011; 23(2):177-82). Аналогичные результаты наблюдали с другой комбинацией ингибиторов BRAF и MEK (Carnahan et al. Mol Cancer Ther. 2010; 9(8):2399-410).
В некоторых вариантах осуществления ингибитор BRAF или дабрафениб вводят в дозе от 50 мг до 300 мг (например, от 100 мг до 200 мг), например, два раза в день, например, перорально, и ингибитор MEK или траметиниб вводят в дозе от 0,5 мг до 4 мг (например, от 1 мг до 3 мг), например, один раз в день, например, перорально. В некоторых вариантах осуществления ингибитор BRAF или дабрафениб вводят в дозе от 100 мг до 200 мг (например, в дозе приблизительно 150 мг), два раза в день, перорально, и ингибитор MEK или траметиниб вводят в дозе от 1 мг до 3 мг (например, в дозе приблизительно 2 мг), один раз в день, перорально. Например, первую дозу ингибитора BRAF или дабрафениба могут вводить в то же время, что и ингибитор MEK или траметиниб, и вторую дозу ингибитора BRAF или дабрафениба могут вводить приблизительно через 12 часов после введения первой дозы. В некоторых вариантах осуществления ингибитор BRAF или дабрафениб вводят в общей суточной дозе от 100 мг до 600 мг (например, от 200 мг до 400 мг), например, перорально, и ингибитор MEK или траметиниб вводят в дозе от 0,5 мг до 4 мг (например, от 1 мг до 3 мг), например, один раз в день, например, перорально. В некоторых вариантах осуществления ингибитор BRAF или дабрафениб вводят в общей суточной дозе от 200 мг до 400 мг (например, в общей суточной дозе приблизительно 300 мг), например, перорально, и ингибитор MEK или траметиниб вводят в дозе от 1 мг до 3 мг (например, в дозе приблизительно 2 мг), например, один раз в день, например, перорально.
В некоторых вариантах осуществления комбинация включает ингибитор PD-1 (например, молекулу антитела против PD-1 и: (i) ингибитор BRAF или дабрафениб, (ii) ингибитор MEK или траметиниб, или (iii) - (i) и (ii). Без ограничения теорией, считается, что применение ингибитора молекулы иммунной контрольной точки, например, ингибитора PD-1 или PD-L1, в комбинации с ингибитором BRAF (например, дабрафенибом), ингибитором MEK (например, траметинибом) или обоими может улучшить ответ (например, более быстрый ответ, более длительный ответ, более высокий процент ответа или более полный ответ), вызванный ингибированием BRAF и/или MEK.
Следующие наблюдения, по меньшей мере частично, подтверждают комбинаторный или синергический эффект направленной терапии (например, BRAF-направленной терапии, MEK-направленной терапии или обеих) с ингибитором иммунной контрольной точки (например, ингибитором PD-1, например, молекулой антитела против PD-1). Например, онкогенный BRAF может приводить к иммунному ускользанию меланомы (Sumimoto et al. J Exp Med. 2006; 203(7):1651-6). Блокирование активности BRAF приводит к увеличенной экспрессии антигенов дифференцировки меланомы in vitro (Kono et al. Mol Cancer Res. 2006; 4(10):779-92), например, посредством выброса транскрипционной репрессии и последующей экспрессии мишеней MITF, например, MART-1, gp100, TRP-1 и TRP-2 (Boni et al. Cancer Res. 2010; 70(13):5213-9). Влияние ингибирования пути MAPK на активацию Т-клеток и сигнализацию также исследовали in vitro. Хотя ингибиторы BRAF не проявляли нежелательных явлений в отношении функции Т-клеток и могут даже усиливать их функцию посредством парадоксальной сигнализации через RAS-GTP (Callahan et al. Cancer Immunol Res. 2014; 2(1):70-9), ингибиторы MEK показали дозозависимое ингибирование функции Т-клеток in vitro (Boni et al. Cancer Res. 2010; 70(13):5213-9; Vella et al. Cancer Immunol Res. 2014; 2(4):351-60). Противоопухолевое действие траметиниба in vivo также исследовали в сингенной модели опухоли CT26 на иммунокомпетентных мышах BALB/C. В этом исследовании монотерапия траметинибом повышала инфильтрирующие опухоль CD4+ лимфоциты (TIL) и не оказывала негативного влияния на распространение CD8+ TIL. Комбинация траметиниба с антителом против мышиного PD-1 приводила к эффективному противоопухолевому ответу в сингенной модели KRAS-мутантной колоректальной опухоли CT26 на мышах (Liu et al. Clin Cancer Res. 2015; 21(7):1639-51).
В качестве другого примера, анализ иммунных биомаркеров проводили на образцах опухолей 16 пациентов с метастатической меланомой, получавших вемурафениб или дабрафениб плюс траметиниб. В этом анализе ингибирование BRAF связывали с повышенной экспрессией антигенов меланомы (например, MART, TYRP-1, TYRP-2, gp100), значительно повышенными CD8+ TIL, пониженной экспрессией иммуносупрессорных цитокинов в микроокружении опухоли и повышенными маркерами Т-клеточной токсичности, но также повышенным маркером истощения Т-клеток (например, TIM-3, PD-1). Также отмечали, что экспрессия антигенов и CD8+ TIL были понижены в ходе прогрессирования меланомы, но могли быть восстановлены при совместном ингибировании BRAF и MEK (Frederick et al. Clin Cancer Res. 2013; 19(5):1225-31; Wilmott et al. Clin Cancer Res. 2012; 18(5):1386-94).
Без ограничения теорией, считается, что в некоторых вариантах осуществления применение ингибитора BRAF (например, дабрафениба) или ингибитора MEK (например, траметиниба), отдельно или в комбинации, может улучшать ответ на иммунотерапевтическое средство, например, в результате изменения иммунного микроокружения (Schilling et al. Ann Oncol. 2014; 25(3):747-53; Liu et al. Clin Cancer Res. 2015; 1;21(7):1639-51; Kakavand et al. Clin Cancer Res. 2015; 21(14):3140-8).
В некоторых вариантах осуществления ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе от 200 мг до 600 мг, например, от 300 мг до 500 мг (например, в дозе 400 мг) один раз в четыре недели или один раз в восемь недель. Анализ популяционной фармакокинетики (ФК) молекулы антитела против PD-1, описанной в настоящей заявке, показал, что изменения экспозиции, обусловленные разной массой тела пациентов, минимальны в предполагаемом диапазоне массы тела 30-150 кг для группы пациентов, что подтверждает выбор схемы введения постоянной дозы. Постоянная доза приблизительно 400 мг один раз в четыре недели или приблизительно 300 мг один раз в три недели, как ожидают, будет обеспечивать более высокое среднее значение Ctrough в равновесном состоянии, чем EC50 ex vivo для антигенстимулируемой продукции IL-2, трансляционного биомаркера блокады PD-1 (Patnaik et al. Clin Cancer Res. 2015; 21(19):4286-93). Основанная, по меньшей мере частично, на наблюдаемом профиле безопасности и ожидаемых значениях Ctrough, доза приблизительно 400 мг один раз в четыре недели, как ожидают, будет безопасной и эффективной дозой. Без ограничения теорией, считается, что в некоторых вариантах осуществления увеличение интервала между введениями молекулы антитела против PD-1 (например, до восьми недель или более) может сделать комбинацию более переносимой. С учетом длительного периода полувыведения молекулы антитела против PD-1, описанной в настоящей заявке, значения Ctrough в неделю 8, как ожидают, будут превышать EC50 ex vivo для антигенстимулируемой продукции IL-2.
В некоторых вариантах осуществления ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе от 300 мг до 500 мг (например, в дозе 400 мг) один раз в четыре недели, например, внутривенно, например, в течение 15-120 минут (например, приблизительно 30 минут). В других вариантах осуществления ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе от 300 мг до 500 мг (например, в дозе 400 мг) один раз в восемь недель, например, внутривенно, например, в течение 15-120 минут (например, приблизительно 30 минут). В некоторых вариантах осуществления введение доз могут прервать до 12 недель, например, до 8 недель или до 4 недель.
В некоторых вариантах осуществления ингибитор PD-1 (например, молекулу антитела против PD-1) вводят субъекту в виде лекарственной формы, описанной в настоящей заявке. В некоторых вариантах осуществления лекарственная форма является лиофилизированной лекарственной формой. В других вариантах осуществления лекарственная форма является восстановленной лекарственной формой, например, восстановленной из лиофилизированной лекарственной формы. В других вариантах осуществления лекарственная форма является жидкой лекарственной формой. В некоторых вариантах осуществления ингибитор PD-1 (например, молекулу антитела против PD-1) восстанавливают при использвании стерильной воды для инъекций.
В некоторых вариантах осуществления ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе от 300 мг до 500 мг (например, в дозе 400 мг), например, один раз в четыре недели, например, внутривенно, и: (i) ингибитор BRAF или дабрафениб вводят в дозе от 50 мг до 300 мг (например, от 100 мг до 200 мг, например, в дозе 150 мг), например, два раза в день, например, перорально, или в общей суточной дозе от 100 мг до 600 мг (например, от 200 мг до 400 мг, например, в общей суточной дозе 300 мг), например, перорально, (ii) ингибитор MEK или траметиниб вводят в дозе от 0,5 мг до 4 мг (например, от 1 мг до 3 мг, например, в дозе 2 мг), например, один раз в день, например, перорально; или (iii) - (i) и (ii).
В некоторых вариантах осуществления комбинация включает ингибитор PD-1 (например, молекулу антитела против PD-1, ингибитор BRAF или дабрафениб и ингибитор MEK или траметиниб. В некоторых вариантах осуществления ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе от 300 мг до 500 мг (например, в дозе 400 мг), например, один раз в четыре недели, например, внутривенно; ингибитор BRAF или дабрафениб вводят в дозе от 50 мг до 300 мг (например, от 100 мг до 200 мг, например, в дозе 150 мг), например, два раза в день, например, перорально, или в общей суточной дозе от 100 мг до 600 мг (например, от 200 мг до 400 мг, например, в общей суточной дозе 300 мг), например, перорально; и ингибитор MEK или траметиниб вводят в дозе от 0,5 мг до 4 мг (например, от 1 мг до 3 мг, например, в дозе 2 мг), например, один раз в день, например, перорально.
В некоторых вариантах осуществления введение ингибитора PD-1 (например, молекулы антитела против PD-1) начинают в тот же день, как и введение ингибитора BRAF или дабрафениба, ингибитора MEK или траметиниба, или обоих. В других вариантах осуществления ингибитор PD-1 (например, молекулу антитела против PD-1) вводят после введения ингибитора BRAF или дабрафениба, ингибитора MEK или траметиниба, или обоих, в течение приблизительно четырех недель или больше. Например, введение ингибитора PD-1 (например, молекулы антитела против PD-1) могут начинать в День 29, когда введение ингибитора BRAF или дабрафениба, ингибитора MEK или траметиниба, или обоих, начинают в День 1. В качестве примера, ингибитор BRAF или дабрафениб могут вводить два раза в день в схеме введения в течение Дней 1-28 28-дневного курса, и ингибитор MEK или траметиниб могут быть вводить в схеме введения в течение Дней 1-28 28-дневного курса.
В некоторых вариантах осуществления ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе от 300 мг до 500 мг (например, в дозе 400 мг), например, один раз в восемь недель, например, внутривенно, и: (i) ингибитор BRAF или дабрафениб вводят в дозе от 50 мг до 300 мг (например, от 100 мг до 200 мг, например, в дозе 150 мг), например, два раза в день, например, перорально, или в общей суточной дозе от 100 мг до 600 мг (например, от 200 мг до 400 мг, например, в общей суточной дозе 300 мг), например, перорально, (ii) ингибитор MEK или траметиниб вводят в дозе от 0,5 мг до 4 мг (например, от 1 мг до 3 мг, например, в дозе 2 мг), например, один раз в день, например, перорально; или (iii) - (i) и (ii).
В некоторых вариантах осуществления комбинация включает ингибитор PD-1 (например, молекулу антитела против PD-1, ингибитор BRAF или дабрафениб и ингибитор MEK или траметиниб. В некоторых вариантах осуществления ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе от 300 мг до 500 мг (например, в дозе 400 мг), например, один раз в восемь недель, например, внутривенно; ингибитор BRAF или дабрафениб вводят в дозе от 50 мг до 300 мг (например, от 100 мг до 200 мг, например, в дозе 150 мг), например, два раза в день, например, перорально, или в общей суточной дозе от 100 мг до 600 мг (например, от 200 мг до 400 мг, например, в общей суточной дозе 300 мг), например, перорально; и ингибитор MEK или траметиниб вводят в дозе от 0,5 мг до 4 мг (например, от 1 мг до 3 мг, например, в дозе 2 мг), например, один раз в день, например, перорально.
В некоторых вариантах осуществления комбинация применяется для лечения рака, например, меланомы, с повышенным уровнем (например, уровнем в сыворотке) ЛДГ, например, по сравнению с референсным уровнем ЛДГ, например, уровнем ЛДГ у здорового субъекта. Хотя, без ограничения теорией, считается, что в некоторых вариантах осуществления ЛДГ сыворотки является независимым прогностическим фактором при меланоме и коррелирует с неблагоприятным прогнозом, что подтверждается низкой выживаемостью больных с распростаненной меланомой по сравнению с пациентами с уровнями ЛДГ в диапазоне нормальных значений. Исследования также показали, что повышенная ЛДГ была негативным предиктором ответа на терапию и других показателей эффективности (Sirott et al. Cancer. 1993; 72(10):3091-8; Eton et al. J Clin Oncol. 1998; 16(3):1103-11; Balch et al. J Clin Oncol. 2001; 19(16):3622-34). Совокупность пациентов с повышенным уровнем ЛДГ представляет область неудовлетворенной медицинской потребности, которая гарантирует применение варианта лечения (например, комбинированной терапии), описанного в настоящей заявке. В некоторых вариантах осуществления рак, например меланома, также имеет мутацию BRAF V600.
В некоторых вариантах осуществления уровень ЛДГ у субъекта по меньшей мере в 2, 3, 4 или 5 раз выше, чем референсный уровень, например, референсный уровень, описанный в настоящей заявке. В некоторых вариантах осуществления исходный уровень ЛДГ находится между 1× верхней границей нормы (ULN) и 2× ULN. В других вариантах осуществления исходный уровень ЛДГ превышает 2× ULN, например, превышает 3× ULN, 4× ULN или 5× ULN. В некоторых вариантах осуществления уровень ЛДГ превышает приблизительно 100-350 (например, приблизительно 105-333) МЕ/л (международные единицы на литр). В некоторых вариантах осуществления уровень ЛДГ определяют в сыворотке. Анализы по определению уровня ЛДГ описаны, например, в Ferri FF, ed. Ferri's Clinical Advisor 2014. Philadelphia: Pa: Elsevier Mosby; 2014: Раздел IV - Лабораторные исследования и интерпретация результатов. В некоторых вариантах осуществления субъект имеет оценку состояния по шкале ECOG, выбранную из 0, 1 или 2. Способы определения оценки состояния по шкале ECOG описаны, например, в Oken et al. Am J Clin Oncol. 1982; 5:649-655.
В некоторых вариантах осуществления комбинация применяется для лечения рака (например, меланомы) с мутацией BRAF, например, мутацией BRAF, описанной в настоящей заявке. В некоторых вариантах осуществления мутацией BRAF является мутация V600. В некоторых вариантах осуществления мутация BRAF расположена в активирующем сегменте киназного домена. В других вариантах осуществления мутация BRAF приводит к повышению киназной активности и, необязательно, является трансформирующей in vitro. В некоторых вариантах осуществления мутация BRAF выбрана из мутации V600E, мутации V600K или мутации V600D. В некоторых вариантах осуществления мутацией BRAF является мутация V600E. В других вариантах осуществления комбинация применяется для лечения рака (например, меланомы), отличающегося от рака с BRAF дикого типа (например, меланома с BRAF дикого типа). В некоторых вариантах осуществления мутацией BRAF является мутация, которая чувствительна к или реагирует на ингибитор BRAF, ингибитору MEK или обоих.
Примеры мутаций BRAF включают, без ограничения перечисленными, BRAF c.1779_1780delTGinsGA (D594N), BRAF c.1780G>C (D594H), BRAF c.1780G>A (D594N), BRAF c.1781A>G (D594G), BRAF c.1781A>T (D594V), BRAF c.1782T>A (D594E), BRAF c.1782T>G (D594E), BRAF c.1789C>G (L597V), BRAF c.1789_1790delCTinsTC (L597S), BRAF c.1790T>A (L597Q), BRAF c.1790T>G (L597R), BRAF c.1798G>A (V600M), BRAF c.1798_1799delGTinsAA (V600K), BRAF c.1798_1799delGTinsAG (V600R), BRAF c.1799T>A (V600E), BRAF c.1799T>G (V600G), BRAF c.1799_1800delTGinsAT (V600D), BRAF c.1799_1800delTGinsAA (V600E) или BRAF c.1801A>G (K601E). Другие примеры мутаций BRAF также включают слияние BRAF, например, как описано в Botton et al. Pigment Cell Melanoma Res. 2013; 26(6):845-51; Hutchinson et al. Clin Cancer Res. 2013; 19(24):6696-702).
В некоторых вариантах осуществления ингибитором PD-1 является молекула антитела против PD-L1.
Другие примеры ингибиторов BRAF, которые могут применяться в комбинации, описанной в настоящей заявке, включают, без ограничения перечисленными, вемурафениб (также известный как RG7204 или PLX4032), GDC-0879, PLX-4720, сорафениб или LGX818.
Другие примеры ингибиторов MEK, которые могут применяться в комбинации, описанной в настоящей заявке, включают, без ограничения перечисленными, кобиметиниб (также известный как XL518), биниметиниб (также известный как MEK162), селуметиниб, 32590PD-1, CI-1040, 03590PD-1 или TAK-733.
В некоторых вариантах осуществления комбинация, описанная в настоящей заявке, применяется также в комбинации с хирургией, химиотерапевтическим средством, лучевой терапией, иммунотерапией (например, терапией молекулой антитела против CTLA-4, молекулой антитела против PD-L1, интерфероном, интерлейкином (например, IL-2) или ФНО) или направленной терапией (например, онколитическим вирусом или ингибитором ангиогенеза).
Фармацевтические композиции и наборы
В другом аспекте настоящего изобретения предложены композиции, например, фармацевтически приемлемые композиции, которые включают молекулу антитела, описанную в настоящей заявке, в лекарственной форме с фармацевтически приемлемым носителем. При использовании в настоящей заявке "фармацевтически приемлемый носитель" включает любые возможные растворители, дисперсионные среды, изотонические и задерживающие абсорбцию вещества и т.п., которые являются физиологически совместимыми. Носитель может подходить для внутривенного, внутримышечного, подкожного, парентерального, ректального, спинального или эпидермального введения (например, путем инъекции или инфузии).
Композиции согласно настоящему изобретению могут находиться в различных формах. Они включают, например, жидкие, полутвердые и твердые лекарственные формы, такие как жидкие растворы (например, растворы для инъекций или инфузий), дисперсии или суспензии, липосомы и суппозитории. Предпочтительная форма зависит от предполагаемого способа введения и терапевтического применения. Типичные предпочтительные композиции находятся в форме растворов для инъекций или инфузий. Предпочтительным способом введения является парентеральный (например, внутривенный, подкожный, внутрибрюшинный, внутримышечный). В предпочтительном варианте осуществления антитело вводят путем внутривенной инфузии или инъекции. В другом предпочтительном варианте осуществления антитело вводят путем внутримышечной или подкожной инъекции.
Фразы "парентеральное введение" и "вводимый парентерально", используемые в настоящем описании, означают способы введения, отличные от энтерального и наружного применения, обычно осуществляемые путем инъекции, и включают, без ограничения, внутривенную, внутримышечную, внутриартериальную, интратекальную, интракапсулярную, интраорбитальную, внутрисердечную, внутрикожную, внутрибрюшинную, транстрахеальную, подкожную, субкутикулярную, внутрисуставную, субкапсулярную, субарахноидальную, интраспинальную, эпидуральную и внутригрудинную инъекцию и инфузию.
Терапевтические композиции обычно должны быть стерильными и стабильными в условиях производства и хранения. Композиция может быть изготовлена в виде раствора, микроэмульсии, дисперсии, липосомы или другой упорядоченной структуры, подходящей для высокой концентрации антител. Стерильные растворы для инъекций могут быть изготовлены путем введения активного соединения (т.е. антитела или части антитела) в требуемом количестве в подходящий растворитель с одним или с комбинацией перечисленных выше ингредиентов, с последующей стерилизацией фильтрованием, при необходимости. Как правило, дисперсии изготавливают путем введения активного соединения в стерильный носитель, который содержит основную дисперсионную среду и другие необходимые компоненты из перечисленных выше. В случае стерильных порошков для приготовления стерильных растворов для инъекций, предпочтительными способами изготовления являются вакуумная сушка и лиофильная сушка, которые дают порошок действующего вещества плюс любой дополнительный требуемый ингредиент из раствора, предварительно подвергнутого стерилизации фильтрованием. Нужную текучесть раствора можно поддерживать, например, при использовании покрытия, такого как лецитин, путем поддержания требуемого размера частиц в случае дисперсии и при использовании поверхностно-активных веществ. Пролонгированная абсорбция композиций для инъекций может быть достигнута при включении в композицию вещества, которое задерживает абсорбцию, например, моностеаратных солей и желатина.
Ингибитор PD-1 (например, молекула антитела против PD-1) или композиция, описанная в настоящей заявке, могут быть включены в лекарственную форму (например, дозированный состав или дозированную лекарственную форму), подходящую для введения (например, внутривенного введения) субъекту, как описано в настоящей заявке.
В некоторых вариантах осуществления лекарственная форма является композицией лекарственной субстанции. В других вариантах осуществления лекарственная форма является лиофилизированной лекарственной формой, например, лиофилизированной или высушеной из композиции лекарственной субстанции. В других вариантах осуществления лекарственная форма является восстановленной лекарственной формой, например, восстановленной из лиофилизированной лекарственной формы. В других вариантах осуществления лекарственная форма является жидкой лекарственной формой.
В некоторых вариантах осуществления лекарственная форма является композицией лекарственной субстанции. В некоторых вариантах осуществления лекарственная форма (например, композиция лекарственной субстанции) включает ингибитор PD-1 (например, молекулу антитела против PD-1) и буферное вещество.
В некоторых вариантах осуществления лекарственная форма (например, композиция лекарственной субстанции) включает ингибитор PD-1 (например, молекулу антитела против PD-1), присутствующий в концентрации 10-50 мг/мл, например, 15-50 мг/мл, 20-45 мг/мл, 25-40 мг/мл, 30-35 мг/мл, 25-35 мг/мл, или 30-40 мг/мл, например, 15 мг/мл, 20 мг/мл, 25 мг/мл, 30 мг/мл, 33,3 мг/мл, 35 мг/мл, 40 мг/мл, 45 мг/мл или 50 мг/мл. В некоторых вариантах осуществления ингибитор PD-1 (например, молекула антитела против PD-1) присутствует в концентрации 30-35 мг/мл, например, 33,3 мг/мл.
В некоторых вариантах осуществления лекарственная форма (например, композиция лекарственной субстанции) включает буферное вещество, включающее гистидин (например, гистидиновый буфер). В некоторых вариантах осуществления буферное вещество (например, гистидиновый буфер) присутствует в концентрации от 1 мМ до 20 мМ, например, от 2 мМ до 15 мМ, от 3 мМ до 10 мМ, от 4 мМ до 9 мМ, от 5 мМ до 8 мМ или от 6 мМ до 7 мМ, например, 1 мМ, 2 мМ, 3 мМ, 4 мМ, 5 мМ, 6 мМ, 6,7 мМ, 7 мМ, 8 мМ, 9 мМ, 10 мМ, 11 мМ, 12 мМ, 13 мМ, 14 мМ, 15 мМ, 16 мМ, 17 мМ, 18 мМ, 19 мМ или 20 мМ. В некоторых вариантах осуществления буферное вещество (например, гистидиновый буфер) присутствует в концентрации от 6 мМ до 7 мМ, например, 6,7 мМ. В других вариантах осуществления буферное вещество (например, гистидиновый буфер) имеет pH 4-7, например 5-6, например, 5, 5,5 или 6. В некоторых вариантах осуществления буферное вещество (например, гистидиновый буфер) имеет pH 5-6, например 5,5. В некоторых вариантах осуществления буферное вещество включает гистидин в концентрации от 6 мМ до 7 мМ (например, 6,7 мМ) и имеет pH 5-6 (например, 5,5).
В некоторых вариантах осуществления лекарственная форма (например, композиция лекарственной субстанции) включает ингибитор PD-1 (например, молекулу антитела против PD-1), присутствующий в концентрации 30-35 мг/мл, например, 33,3 мг/мл; и буферное вещество, которое включает гистидин в концентрации от 6 мМ до 7 мМ (например, 6,7 мМ) и имеет pH 5-6 (например, 5,5).
В некоторых вариантах осуществления лекарственная форма (например, композиция лекарственной субстанции) дополнительно включают углевод. В некоторых вариантах осуществления углеводом является сахароза. В некоторых вариантах осуществления углевод (например, сахароза) присутствует в концентрации от 50 мМ до 150 мМ, например, от 25 мМ до 150 мМ, от 50 мМ до 100 мМ, от 60 мМ до 90 мМ, от 70 мМ до 80 мМ или от 70 мМ до 75 мМ, например, 25 мМ, 50 мМ, 60 мМ, 70 мМ, 73,3 мМ, 80 мМ, 90 мМ, 100 мМ или 150 мМ. В некоторых вариантах осуществления лекарственная форма включает углевод или сахарозу, присуствующие в концентрации от 70 мМ до 75 мМ, например, 73,3 мМ.
В некоторых вариантах осуществления лекарственная форма (например, композиция лекарственной субстанции) включает ингибитор PD-1 (например, молекулу антитела против PD-1), присутствующий в концентрации 30-35 мг/мл, например, 33,3 мг/мл; буферное вещество, которое включает гистидин в концентрации от 6 мМ до 7 мМ (например, 6,7 мМ) и имеет pH 5-6 (например, 5,5); и углевод или сахарозу, присутствующие в концентрации от 70 мМ до 75 мМ, например, 73,3 мМ.
В некоторых вариантах осуществления лекарственная форма (например, композиция лекарственной субстанции) дополнительно включают поверхностно-активное вещество. В некоторых вариантах осуществления поверхностно-активным веществом является полисорбат 20. В некоторых вариантах осуществления поверхностно-активное вещество или полисорбат 20 присутствуют в концентрации 0,005-0,025% (в/в), например, 0,0075-0,02% или 0,01-0,015% (в/в), например, 0,005%, 0,0075%, 0,01%, 0,013%, 0,015% или 0,02% (в/в). В некоторых вариантах осуществления лекарственная форма включает поверхностно-активное вещество или полисорбат 20, присутствующие в концентрации 0,01-0,015%, например, 0,013% (в/в).
В некоторых вариантах осуществления лекарственная форма (например, композиция лекарственной субстанции) включает ингибитор PD-1 (например, молекулу антитела против PD-1), присутствующий в концентрации 30-35 мг/мл, например, 33,3 мг/мл; буферное вещество, которое включает гистидин в концентрации от 6 мМ до 7 мМ (например, 6,7 мМ) и имеет pH 5-6 (например, 5,5); и поверхностно-активное вещество или полисорбат 20, присутствующие в концентрации 0,01-0,015%, например, 0,013% (в/в).
В некоторых вариантах осуществления лекарственная форма (например, композиция лекарственной субстанции) включает ингибитор PD-1 (например, молекулу антитела против PD-1), присутствующий в концентрации 30-35 мг/мл, например, 33,3 мг/мл; буферное вещество, которое включает гистидин в концентрации от 6 мМ до 7 мМ (например, 6,7 мМ) и имеет pH 5-6 (например, 5,5); углевод или сахарозу, присутствующие в концентрации от 70 мМ до 75 мМ, например, 73,3 мМ; и поверхностно-активное вещество или полисорбат 20, присутствующие в концентрации 0,01-0,015%, например, 0,013% (в/в).
В некоторых вариантах осуществления лекарственная форма (например, композиция лекарственной субстанции) включает ингибитор PD-1 (например, молекулу антитела против PD-1), присутствующий в концентрации 33,3 мг/мл; буферное вещество, которое включает гистидин в концентрации 6,7 мМ и имеет pH 5,5; сахарозу, присутствующую в концентрации 73,3 мМ; и полисорбат 20, присутствующий в концентрации 0,013% (в/в).
В некоторых вариантах осуществления лекарственная форма является лиофилизированной лекарственной формой. В некоторых вариантах осуществления лиофилизированная лекарственная форма лиофилизирована из композиции лекарственной субстанции, описанной в настоящей заявке. Например, 2-5 мл, например, 3-4 мл, например, 3,6 мл, композиции лекарственной субстанции, описанной в настоящей заявке, могут наполнять контейнер (например, флакон) и лиофилизировать.
В некоторых вариантах осуществления лекарственная форма является восстановленной лекарственной формой. Например, восстановленная лекарственная форма может быть приготовлена при растворении лиофилизированной лекарственной формы в разбавителе, при этом белок диспергирован в восстановленной лекарственной форме. В некоторых вариантах осуществления лиофилизированную лекарственную форму восстанавливают в 0,5-2 мл, например 1 мл, воды или буфера для инъекций. В некоторых вариантах осуществления лиофилизированную лекарственную форму восстанавливают 1 мл воды для инъекций, например, в клиническом центре.
В некоторых вариантах осуществления лекарственная форма (например, восстановленная лекарственная форма) включает ингибитор PD-1 (например, молекулу антитела против PD-1) и буферное вещество.
В некоторых вариантах осуществления лекарственная форма (например, восстановленная лекарственная форма) включает ингибитор PD-1 (например, молекулу антитела против PD-1), присутствующий в концентрации от 20 мг/мл до 200 мг/мл, например, от 50 мг/мл до 150 мг/мл, от 80 мг/мл до 120 мг/мл или от 90 мг/мл до 110 мг/мл, например, 50 мг/мл, 60 мг/мл, 70 мг/мл, 80 мг/мл, 90 мг/мл, 100 мг/мл, 110 мг/мл, 120 мг/мл, 130 мг/мл, 140 мг/мл, 150 мг/мл, 160 мг/мл, 170 мг/мл, 180 мг/мл, 190 мг/мл или 200 мг/мл. В некоторых вариантах осуществления ингибитор PD-1 (например, молекула антитела против PD-1) присутствует в концентрации 80-120 мг/мл, например, 100 мг/мл.
В некоторых вариантах осуществления лекарственная форма (например, восстановленная лекарственная форма) включает буферное вещество, включающее гистидин (например, гистидиновый буфер). В некоторых вариантах осуществления буферное вещество (например, гистидиновый буфер) присутствует в концентрации от 5 мМ до 100 мМ, например, от 10 мМ до 50 мМ, от 15 мМ до 25 мМ, например, 5 мМ, 10 мМ, 20 мМ, 30 мМ, 40 мМ, 50 мМ, 60 мМ, 70 мМ, 80 мМ, 90 мМ или 100 мМ. В некоторых вариантах осуществления буферное вещество (например, гистидиновый буфер) присутствует в концентрации от 15 мМ до 25 мМ, например, 20 мМ. В других вариантах осуществления буферное вещество (например, гистидиновый буфер) имеет pH 4-7, например 5-6, например 5, 5,5 или 6. В некоторых вариантах осуществления буферное вещество (например, гистидиновый буфер) имеет pH 5-6, например 5,5. В некоторых вариантах осуществления буферное вещество включает гистидин в концентрации от 15 мМ до 25 мМ (например, 20 мМ) и имеет pH 5-6 (например, 5,5).
В некоторых вариантах осуществления лекарственная форма (например, восстановленная лекарственная форма) включает ингибитор PD-1 (например, молекулу антитела против PD-1), присутствующий в концентрации 80-120 мг/мл, например, 100 мг/мл; и буферное вещество, которое включает гистидин в концентрации от 6 мМ до 7 мМ (например, 6,7 мМ) и имеет pH 5-6 (например, 5,5).
В некоторых вариантах осуществления лекарственная форма (например, восстановленная лекарственная форма) дополнительно включает углевод. В некоторых вариантах осуществления углеводом является сахароза. В некоторых вариантах осуществления углевод (например, сахароза) присутствует в концентрации от 100 мМ до 500 мМ, например, от 150 мМ до 400 мМ, от 175 мМ до 300 мМ или от 200 мМ до 250 мМ, например, 150 мМ, 160 мМ, 170 мМ, 180 мМ, 190 мМ, 200 мМ, 210 мМ, 220 мМ, 230 мМ, 240 мМ, 250 мМ, 260 мМ, 270 мМ, 280 мМ, 290 мМ или 300 мМ. В некоторых вариантах осуществления лекарственная форма включает углевод или сахарозу, присутствующие в концентрации от 200 мМ до 250 мМ, например, 220 мМ.
В некоторых вариантах осуществления лекарственная форма (например, восстановленная лекарственная форма) включает ингибитор PD-1 (например, молекулу антитела против PD-1), присутствующий в концентрации 80-120 мг/мл, например, 100 мг/мл; и буферное вещество, которое включает гистидин в концентрации от 6 мМ до 7 мМ (например, 6,7 мМ) и имеет pH 5-6 (например, 5,5); и углевод или сахарозу, которые присутствуют в концентрации от 200 мМ до 250 мМ, например, 220 мМ.
В некоторых вариантах осуществления лекарственная форма (например, восстановленная лекарственная форма) дополнительно включает поверхностно-активное вещество. В некоторых вариантах осуществления поверхностно-активным веществом является полисорбат 20. В некоторых вариантах осуществления поверхностно-активное вещество или полисорбат 20 присутствуют в концентрации 0,01-0,1% (в/в), например, 0,02-0,08%, 0,025-0,06% или 0,03-0,05% (в/в), например, 0,01%, 0,025%, 0,03%, 0,04%, 0,05%, 0,06%, 0,07%, 0,08%, 0,09% или 0,1% (в/в). В некоторых вариантах осуществления лекарственная форма включает поверхностно-активное вещество или полисорбат 20, присутствующие в концентрации 0,03-0,05%, например, 0,04% (в/в).
В некоторых вариантах осуществления лекарственная форма (например, восстановленная лекарственная форма) включает ингибитор PD-1 (например, молекулу антитела против PD-1), присутствующий в концентрации 80-120 мг/мл, например, 100 мг/мл; и буферное вещество, которое включает гистидин в концентрации от 6 мМ до 7 мМ (например, 6,7 мМ) и имеет pH 5-6 (например, 5,5); и поверхностно-активное вещество или полисорбат 20, присутствующие в концентрации 0,03-0,05%, например, 0,04% (в/в).
В некоторых вариантах осуществления лекарственная форма (например, восстановленная лекарственная форма) включает ингибитор PD-1 (например, молекулу антитела против PD-1), присутствующий в концентрации 80-120 мг/мл, например, 100 мг/мл; и буферное вещество, которое включает гистидин в концентрации от 6 мМ до 7 мМ (например, 6,7 мМ) и имеет pH 5-6 (например, 5,5); углевод или сахарозу, присутствующие в концентрации от 200 мМ до 250 мМ, например, 220 мМ; и поверхностно-активное вещество или полисорбат 20, присутствующие в концентрации 0,03-0,05%, например, 0,04% (в/в).
В некоторых вариантах осуществления лекарственная форма (например, восстановленная лекарственная форма) включает ингибитор PD-1 (например, молекулу антитела против PD-1), присутствующий в концентрации 100 мг/мл; и буферное вещество, которое включает гистидин в концентрации 6,7 мМ и имеет pH 5,5; сахарозу, присутствующую в концентрации 220 мМ; и полисорбат 20, присутствующий в концентрации 0,04% (в/в).
В некоторых вариантах осуществления лекарственную форму восстанавливают таким образом, что отбираемый объем по меньшей мере 1 мл (например, по меньшей мере 1,5 мл, 2 мл, 2,5 мл или 3 мл) восстановленной лекарственной формы может быть отобран из контейнера (например, флакона), содержащего восстановленную лекарственную форму. В некоторых вариантах осуществления лекарственную форму восстанавливают и/или отбирают из контейнера (например, флакона) в клиническом центре. В некоторых вариантах осуществления лекарственную форму (например, восстановленную лекарственную форму) вводят в инфузионный пакет, например, в пределах 1 часа (например, в пределах 45 минут, 30 минут или 15 минут), до начала инфузии пациенту.
В некоторых вариантах осуществления лекарственная форма является жидкой лекарственной формой. В некоторых вариантах осуществления жидкую лекарственную форму изготавливают путем разведения композиции лекарственной субстанции, описанной в настоящей заявке. Например, композиция лекарственной субстанции может быть разведена, например, 10-30 мг/мл (например, 25 мг/мл) раствора, включающего одно или более вспомогательных веществ (например, концентрированных вспомогательных веществ). В некоторых вариантах осуществления раствор включает один, два или все из гистидина, сахарозы или полисорбата 20. В некоторых вариантах осуществления раствор включает такое же вспомогательное вещество(а), как и композиция лекарственной субстанции. Примеры вспомогательных веществ включают, без ограничения перечисленными, аминокислоту (например, гистидин), углевод (например, сахарозу) или поверхностно-активное вещество (например, полисорбат 20). В некоторых вариантах осуществления жидкая лекарственная форма не является восстановленной лиофилизированной лекарственной формой. В других вариантах осуществления жидкая лекарственная форма является восстановленной лиофилизированной лекарственной формой. В некоторых вариантах осуществления лекарственную форму хранят в виде жидкости. В других вариантах осуществления лекарственную форму изготавливают в виде жидкости, а затем сушат, например путем лиофилизации или сушки распылением, перед хранением.
В некоторых вариантах осуществления лекарственная форма (например, жидкая лекарственная форма) включает ингибитор PD-1 (например, молекулу антитела против PD-1), присутствующий в концентрации от 5 мг/мл до 50 мг/мл, например, от 10 мг/мл до 40 мг/мл, от 15 мг/мл до 35 мг/мл или от 20 мг/мл до 30 мг/мл, например, 5 мг/мл, 10 мг/мл, 15 мг/мл, 20 мг/мл, 25 мг/мл, 30 мг/мл, 35 мг/мл, 40 мг/мл, 45 мг/мл или 50 мг/мл. В некоторых вариантах осуществления ингибитор PD-1 (например, молекула антитела против PD-1) присутствует в концентрации 20-30 мг/мл, например 25 мг/мл.
В некоторых вариантах осуществления лекарственная форма (например, жидкая лекарственная форма) включает буферное вещество, включающее гистидин (например, гистидиновый буфер). В некоторых вариантах осуществления буферное вещество (например, гистидиновый буфер) присутствует в концентрации от 5 мМ до 100 мМ, например, от 10 мМ до 50 мМ, от 15 мМ до 25 мМ, например, 5 мМ, 10 мМ, 20 мМ, 30 мМ, 40 мМ, 50 мМ, 60 мМ, 70 мМ, 80 мМ, 90 мМ или 100 мМ. В некоторых вариантах осуществления буферное вещество (например, гистидиновый буфер) присутствует в концентрации от 15 мМ до 25 мМ, например 20 мМ. В других вариантах осуществления буферное вещество (например, гистидиновый буфер) имеет pH 4-7, например 5-6, например 5, 5,5 или 6. В некоторых вариантах осуществления буферное вещество (например, гистидиновый буфер) имеет pH 5-6, например 5,5. В некоторых вариантах осуществления буферное вещество включает гистидин в концентрации от 15 мМ до 25 мМ (например, 20 мМ) и имеет pH 5-6 (например, 5,5).
В некоторых вариантах осуществления лекарственная форма (например, жидкая лекарственная форма) включает ингибитор PD-1 (например, молекулу антитела против PD-1), присутствующий в концентрации 20-30 мг/мл, например 25 мг/мл; и буферное вещество, которое включает гистидин в концентрации от 6 мМ до 7 мМ (например, 6,7 мМ) и имеет pH 5-6 (например, 5,5).
В некоторых вариантах осуществления лекарственная форма (например, жидкая лекарственная форма) дополнительно включает углевод. В некоторых вариантах осуществления углеводом является сахароза. В некоторых вариантах осуществления углевод (например, сахароза) присутствует в концентрации от 100 мМ до 500 мМ, например, от 150 мМ до 400 мМ, от 175 мМ до 300 мМ или от 200 мМ до 250 мМ, например, 150 мМ, 160 мМ, 170 мМ, 180 мМ, 190 мМ, 200 мМ, 210 мМ, 220 мМ, 230 мМ, 240 мМ, 250 мМ, 260 мМ, 270 мМ, 280 мМ, 290 мМ или 300 мМ. В некоторых вариантах осуществления лекарственная форма включает углевод или сахарозу, присутствующие в концентрации от 200 мМ до 250 мМ, например, 220 мМ.
В некоторых вариантах осуществления лекарственная форма (например, жидкая лекарственная форма) включает ингибитор PD-1 (например, молекулу антитела против PD-1), присутствующий в концентрации 20-30 мг/мл, например 25 мг/мл; и буферное вещество, которое включает гистидин в концентрации от 6 мМ до 7 мМ (например, 6,7 мМ) и имеет pH 5-6 (например, 5,5); и углевод или сахарозу, присутствующие в концентрации от 200 мМ до 250 мМ, например, 220 мМ.
В некоторых вариантах осуществления лекарственная форма (например, жидкая лекарственная форма) дополнительно включает поверхностно-активное вещество. В некоторых вариантах осуществления поверхностно-активным веществом является полисорбат 20. В некоторых вариантах осуществления, поверхностно-активное вещество или полисорбат 20 присутствуют в концентрации 0,01-0,1% (в/в), например, 0,02-0,08%, 0,025-0,06% или 0,03-0,05% (в/в), например, 0,01%, 0,025%, 0,03%, 0,04%, 0,05%, 0,06%, 0,07%, 0,08%, 0,09% или 0,1% (в/в). В некоторых вариантах осуществления лекарственная форма включает поверхностно-активное вещество или полисорбат 20, присутствующие в концентрации 0,03-0,05%, например 0,04% (в/в).
В некоторых вариантах осуществления лекарственная форма (например, жидкая лекарственная форма) включает ингибитор PD-1 (например, молекулу антитела против PD-1), присутствующий в концентрации 20-30 мг/мл, например 25 мг/мл; и буферное вещество, которое включает гистидин в концентрации от 6 мМ до 7 мМ (например, 6,7 мМ) и имеет pH 5-6 (например, 5,5); и поверхностно-активное вещество или полисорбат 20, присутствующие в концентрации 0,03-0,05%, например 0,04% (в/в).
В некоторых вариантах осуществления лекарственная форма (например, жидкая лекарственная форма) включает ингибитор PD-1 (например, молекулу антитела против PD-1), присутствующий в концентрации 20-30 мг/мл, например 25 мг/мл; и буферное вещество, которое включает гистидин в концентрации от 6 мМ до 7 мМ (например, 6,7 мМ) и имеет pH 5-6 (например, 5,5); углевод или сахарозу, присутствующие в концентрации от 200 мМ до 250 мМ, например 220 мМ; и поверхностно-активное вещество или полисорбат 20, присутствующие в концентрации 0,03-0,05%, например 0,04% (в/в).
В некоторых вариантах осуществления лекарственная форма (например, жидкая лекарственная форма) включает ингибитор PD-1 (например, молекулу антитела против PD-1), присутствующий в концентрации 25 мг/мл; и буферное вещество, которое включает гистидин в концентрации 6,7 мМ и имеет pH 5,5; сахарозу, присутствующую в концентрации 220 мМ; и полисорбат 20, присутствующий в концентрации 0,04% (в/в).
В некоторых вариантах осуществления от 1 мл до 10 мл (например, от 2 мл до 8 мл, от 3 мл до 7 мл или от 4 мл до 5 мл, например, 3 мл, 4 мл, 4,3 мл, 4,5 мл, 5 мл или 6 мл) жидкой лекарственной формы наполняют контейнер (например, флакон). В других вариантах осуществления жидкой лекарственной формой наполняют контейнер (например, флакон) таким образом, что отбираемый объем по меньшей мере 2 мл (например, по меньшей мере 3 мл, по меньшей мере 4 мл или по меньшей мере 5 мл) жидкой лекарственной формы можно отобрать из каждого контейнера (например, флакона). В некоторых вариантах осуществления жидкую лекарственную форму разводят из композиции лекарственной субстанции и/или отбирают из контейнера (например, флакона) в клиническом центре. В некоторых вариантах осуществления лекарственную форму (например, жидкую лекарственную форму) вводят в инфузионный пакет, например, в пределах 1 часа (например, в пределах 45 минут, 30 минут или 15 минут) до начала инфузии пациенту.
Лекарственная форма, описанная в настоящей заявке, может храниться в контейнере. Контейнер, используемый для любой из лекарственных форм, описанных в настоящей заявке, может включать, например, флакон и, необязательно, пробку, колпачок или оба. В некоторых вариантах осуществления флакон является стеклянным флаконом, например, флаконом 6R из прозрачного стекла. В других вариантах осуществления пробка является резиновой пробкой, например, серой резиновой пробкой. В других вариантах осуществления колпачок является отгибаемым колпачком, например, алюминиевым отгибаемым колпачком. В некоторых вариантах осуществления контейнер включает флакон 6R из прозрачного стекла, серую резиновую пробку и алюминиевый отгибаемый колпачок. В некоторых вариантах осуществления контейнер (например, флакон) является контейнером для одноразового применения. В некоторых вариантах осуществления в контейнере (например, флаконе) присутствует от 50 мг до 150 мг, например, от 80 мг до 120 мг, от 90 мг до 110 мг, от 100 мг до 120 мг, от 100 мг до 110 мг, от 110 мг до 120 мг или от 110 мг до 130 мг, ингибитора PD-1 (например, молекулы антитела против PD-1).
Другие примеры буферных веществ, которые могут использоваться в лекарственной форме, описанной в настоящей заявке, включают, без ограничения перечисленными, аргининовый буфер, цитратный буфер или фосфатный буфер. Другие примеры углеводов, которые могут использоваться в лекарственной форме, описанной в настоящей заявке, включают, без ограничения перечисленными, трегалозу, маннит, сорбит или их комбинацию. Лекарственная форма, описанная в настоящей заявке, также может содержать вещество, регулирующее тоничность, например, хлорид натрия, и/или стабилизирующее вещество, например, аминокислоту (например, глицин, аргинин, метионин или их комбинацию).
Молекулы антитела могут вводить различными способами, известными в уровне техники, хотя для многих терапевтических применений предпочтительным путем/способом введения является внутривенная инъекция или инфузия. Например, молекулы антитела могут вводить путем внутривенной инфузии со скоростью более 20 мг/мин, например, 20-40 мг/мин, и, как правило, большей или равной 40 мг/мин, с получением дозы приблизительно 35-440 мг/м2, как правило, приблизительно 70-310 мг/м2, и более типично приблизительно 110-130 мг/м2. В вариантах осуществления молекулы антитела могут вводить путем внутривенной инфузии со скоростью меньше 10 мг/мин; предпочтительно меньше или равной 5 мг/мин, с получением дозы приблизительно 1-100 мг/м 2, предпочтительно приблизительно 5-50 мг/м2, приблизительно 7-25 мг/м2 и более предпочтительно приблизительно 10 мг/м2. Специалисту в данной области будет очевидно, что путь и/или способ введения будет изменяться в зависимости от требуемых результатов. В некоторых вариантах осуществления активное соединение может быть приготовлено с носителем, который будет предохранять соединение от быстрого высвобождения, например, в виде лекарственной формы с регулируемым высвобождением, включая имплантаты, трансдермальные пластыри и микроинкапсулированные системы доставки. Могут использоваться биоразлагаемые, биосовместимые полимеры, такие как этилен-винилацетат, полиангидриды, полигликолевая кислота, коллаген, полиортоэфиры и полимолочная кислота. Многие способы изготовления таких композиций запатентованы или в целом известны специалистам в данной области. См., например, Sustained and Controlled Release Drug Delivery Systems, J. R. Robinson, ed., Marcel Dekker, Inc., New York, 1978.
В некоторых вариантах осуществления молекулу антитела могут вводить перорально, например, с инертным разбавителем или усваиваемым съедобным носителем. Соединение (и другие компоненты, при необходимости) также могут быть заключены в желатиновую капсулу с твердой или мягкой оболочкой, спрессованы в таблетки или включены непосредственно в рацион субъекта. Для перорального терапевтического введения, соединения могут объединять со вспомогательными веществами и применять в форме таблеток для приема внутрь, буккальных таблеток, пастилок, капсул, настоек, суспензий, сиропов, облаток и т.п. Для введения соединения согласно изобретению иными способами, нежели парентеральное введение, может требоваться нанести покрытие на соединение или вводить соединение с материалом для предотвращения его инактивации. Терапевтические композиции также можно вводить с помощью медицинских устройств, известных в уровне техники.
Схемы применения подбирают таким образом, чтобы обеспечить оптимальный требуемый ответ (например, терапевтический ответ). Например, можно вводить один болюс, можно вводить несколько разделенных доз в течение некоторого времени, или дозу могут пропорционально уменьшать или увеличивать, в соответствии с требованиями клинической ситуации. Особенно предпочтительным является изготовление парентеральных композиций в виде стандартной лекарственной формы из-за простоты введения и однородности дозы. Стандартная лекарственная форма, при использовании в настоящем описании, относится к физически дискретным единицам, подходящим в качестве единичных доз для субъектов, подлежащих лечению, при этом каждая единица содержит заданное количество активного соединения, рассчитанное на получение требуемого терапевтического эффекта, в сочетании с необходимым фармацевтическим носителем. Спецификация для стандарных лекарственных форм согласо изобретению определяется и напрямую зависит от: (a) уникальных свойств активного соединения и предполагаемого терапевтического эффекта, и (b) ограничений, храктерных в области изготовления смесей такого активнго соединения для лечения чувствительности у пациентов.
Примерный неограничивающий диапазон для терапевтически или профилактически эффективного количества молекулы антитела составляет 0,1-30 мг/кг, более предпочтительно 1-25 мг/кг. Дозы и терапевтические схемы применения молекулы антитела против PD-1 могут быть определены специалистом. В некоторых вариантах осуществления молекулу антитела против PD-1 вводят путем инъекции (например, подкожно или внутривенно), в дозе приблизительно 1-40 мг/кг, например 1-30 мг/кг, например, приблизительно 5-25 мг/кг, приблизительно 10-20 мг/кг, приблизительно 1-5 мг/кг, 1-10 мг/кг, 5-15 мг/кг, 10-20 мг/кг, 15-25 мг/кг или приблизительно 3 мг/кг. Схема введения может изменяться, например, от одного раза в неделю до одного раза в 2, 3 или 4 недели. В одном варианте осуществления молекулу антитела против PD-1 вводят в дозе от приблизительно 10-20 мг/кг раз в две недели.
В качестве другого примера, неограничивающий диапазон для терапевтически или профилактически эффективного количества молекулы антитела составляет 200-500 мг, более предпочтительно 300-400 мг/кг. Дозы и терапевтические схемы молекулы антитела против PD-1 могут быть определены специалистом. В некоторых вариантах осуществления молекулу антитела против PD-1 вводят путем инъекции (например, подкожно или внутривенно), в дозе (например, постоянной дозе) приблизительно от 200 мг до 500 мг, например, приблизительно от 250 мг до 450 мг, приблизительно от 300 мг до 400 мг, приблизительно от 250 мг до 350 мг, приблизительно от 350 мг до 450 мг или приблизительно 300 мг, или приблизительно 400 мг. Схема введения (например, схема введения постоянной дозы) может изменяться, например, от одного раза в неделю до одного раза в 2, 3, 4, 5 или 6 недель. В одном варианте осуществления молекулу антитела против PD-1 вводят в дозе приблизительно от 300 мг до 400 мг один раз в три или один раз в четыре недели. В одном варианте осуществления молекулу антитела против PD-1 вводят в дозе приблизительно от 300 мг один раз в три недели. В одном варианте осуществления молекулу антитела против PD-1 вводят в дозе приблизительно от 400 мг один раз в четыре недели. В одном варианте осуществления молекулу антитела против PD-1 вводят в дозе приблизительно от 300 мг один раз в четыре недели. В одном варианте осуществления молекулу антитела против PD-1 вводят в дозе приблизительно от 400 мг один раз в три недели. Без ограничения теорией, в некоторых вариантах осуществления введение постоянной или фиксированной дозы может быть выгодным для пациентов, например, для упрощения снабжения лекарственными препаратами и для уменьшения фармацевтических ошибок.
В некоторых вариантах осуществления клиренс (CL) молекулы антитела против PD-1 составляет от приблизительно 6-16 мл/ч, например, приблизительно 7-15 мл/ч, приблизительно 8-14 мл/ч, приблизительно 9-12 мл/ч или приблизительно 10-11 мл/ч, например, приблизительно 8,9 мл/ч, 10,9 мл/ч или 13,2 мл/ч.
В некоторых вариантах осуществления коэффициент влияния веса на CL молекулы антитела против PD-1 составляет от приблизительно 0,4 до 0,7, приблизительно 0,5-0,6 или 0,7, или меньше, например, 0,6 или меньше, или приблизительно 0,54.
В некоторых вариантах осуществления объем распределения в равновесном состоянии (Vss) молекулы антитела против PD-1 составляет от приблизительно 5-10 V, например, приблизительно 6-9 V, приблизительно 7-8 V или приблизительно 6,5-7,5 V, например, приблизительно 7,2 V.
В некоторых вариантах осуществления период полувыведения молекулы антитела против PD-1 составляет приблизительно 10-30 дней, например, приблизительно 15-25 дней, приблизительно 17-22 дней, приблизительно 19-24 дней или приблизительно 18-22 дней, например, приблизительно 20 дней.
В некоторых вариантах осуществления Cmin (например, для пациента весом 80 кг) молекулы антитела против PD-1 составляет по меньшей мере приблизительно 0,4 мкг/мл, например, по меньшей мере приблизительно 3,6 мкг/мл, например, от приблизительно 20-50 мкг/мл, например, приблизительно 22-42 мкг/мл, приблизительно 26-47 мкг/мл, приблизительно 22-26 мкг/мл, приблизительно 42-47 мкг/мл, приблизительно 25-35 мкг/мл, приблизительно 32-38 мкг/мл, например, приблизительно 31 мкг/мл или приблизительно 35 мкг/мл. В одном варианте осуществления Cmin определяют у пациента, получающего молекулу антитела против PD-1 в дозе приблизительно 400 мг один раз в четыре недели. В другом варианте осуществления Cmin определяют у пациента, получающего молекулу антитела против PD-1 в дозе приблизительно 300 мг один раз в три недели. В некоторых вариантах осуществления Cmin по меньшей мере приблизительно в 50 раз выше, например, по меньшей мере приблизительно в 60 раз, 65 раз, 70 раз, 75 раз, 80 раз, 85 раз, 90 раз, 95 раз или 100 раз, например, по меньшей мере приблизительно в 77 раз, выше, чем EC50 молекулы антитела против PD-1, например, как определено на основе изменения IL-2 в анализе с SEB ex vivo. В других вариантах осуществления Cmin по меньшей мере в 5 раз выше, например, по меньшей мере 6 раз, 7 раз, 8 раз, 9 раз или 10 раз, например, по меньшей мере приблизительно в 8,6 раз, выше, чем EC90 молекулы антитела против PD-1, например, как определено на основе изменения IL-2 в анализе с SEB ex vivo.
Молекулу антитела могут вводить путем внутривенной инфузии со скоростью более 20 мг/мин, например, 20-40 мг/мин, и, как правило, больше или равной 40 мг/мин, с получением дозы приблизительно 35-440 мг/м2, как правило, приблизительно 70-310 мг/м2 и, более типично, приблизительно 110-130 мг/м2. В вариантах осуществления скорость введения лекарственного средства приблизительно 110-130 мг/м2 обеспечивает уровень приблизительно 3 мг/кг. В других вариантах осуществления молекулу антитела могут вводить путем внутривенной инфузии со скоростью меньше 10 мг/мин, например, меньше или равной 5 мг/мин, с получением дозы приблизительно 1-100 мг/м2, например, приблизительно 5-50 мг/м2, приблизительно 7-25 мг/м2 или, приблизительно 10 мг/м2. В некоторых вариантах осуществления антитело вводят путем инфузии в течение приблизительно 30 минут. Нужно отметить, что значения дозировки могут меняться в зависимости от типа и серьезности условия, которое будет облегчено. Следует также понимать, что для любого конкретного субъекта конкретные схемы введения нужно корректировать по времени в соответствии с индивидуальной потребностью и профессиональным решением лица, осуществляющего или контролирующего введение композиций, и что диапазоны доз, указанные в настоящем описании, являются лишь примерными и не должны рассматриваться как ограничение объема или практического применения заявленной композиции.
Фармацевтические композиции согласно изобретению могут включать "терапевтически эффективное количество" или "профилактически эффективное количество" антитела или части антитела согласно изобретению. "Терапевтически эффективное количество" относится к количеству, которое в необходимых дозах и в течение требуемых периодов времени, эффективно обеспечивает нужный терапевтический результат. Терапевтически эффективное количество модифицированного антитела или фрагмента антитела может изменяться в зависимости от таких факторов, как патологическое состояние, возраст, пол и вес пациента, а также от способности антитела или части антитела вызывать требуемый ответ у пациента. Терапевтически эффективное количество также является количеством, при котором терапевтически полезные эффекты модифицированного антитела или фрагмента антитела перевешивают их любые токсические или вредные эффекты. "Терапевтически эффективная доза" предпочтительно ингибирует измеряемый параметр, например, скорость роста опухоли, по меньшей мере приблизительно на 20%, более предпочтительно по меньшей мере приблизительно на 40%, еще более предпочтительно по меньшей мере приблизительно на 60% и еще более предпочтительно по меньшей мере приблизительно на 80% по сравнению с субъектами, не проходившими лечение. Способность соединения ингибировать измеряемый параметр, например рак, может быть оценена с помощью системы модели на животных, позволяющей прогнозировать эффективность в отношении человеческих опухолей. В альтернативе это свойство композиции может быть оценено с помощью исследования способности соединения к ингибированию, причем такое ингибирование исследуют с помощью ализов in vitro, известных специалисту в данной области.
"Профилактически эффективное количество" относится к количеству, в необходимых дозах и в течение требуемых периодов времени, которое эффективно обеспечивает требуемый профилактический результат. Обычно, поскольку профилактическую дозу применяют у субъектов до заболевания или на ранней стадии заболевания, профилактически эффективное количество будет меньше, чем терапевтически эффективное количество.
Также в объем настоящего изобретения входит набор, включающий молекулу антитела, описанного в настоящей заявке. Набор может включать один или более других элементов, включающих: инструкции по применению, другие реагенты, например, метку, терапевтическое средство или вещество, применяемое для комплексообразования или другого сшивания антитела с меткой или терапевтическим средством, или радиопротекторную композицию; устройства или другие материалы для получения антитела для введения; фармацевтически приемлемые носители; и устройства или другие материалы для введения субъекту.
Применения комбинированной терапии
Комбинации, например, молекулы антитела против PD-1, раскрытые в настоящей заявке, имеют диагностические, а также терапевтические и профилактические применения in vitro и in vivo. Например, эти молекулы можно вводить в клетки в культуре, in vitro или ex vivo, или субъекту, например, человеку, для лечения, предотвращения и/или диагностики различных нарушений, таких как различные формы рака и инфекционные заболевания.
Таким образом, в одном аспекте изобретения предложен способ модификации иммунного ответа у субъекта, включающий введение субъекту комбинации, описанной в настоящей заявке, в результате чего осуществляется модификация иммунного ответа у субъекта. В одном варианте осуществления происходит усиление, стимуляция или повышающая регуляция иммунного ответа.
При использовании в настоящей заявке термин "субъект" включает человека и не относящихся к человеку животных. В одном варианте осуществления субъектом является человек, например, пациент, имеющий нарушение или состояние, характеризуемое патологической функцией PD-1. Термин "не относящиеся к человеку животные" включает млекопитающих и немлекопитающих, например, не относящихся к человеку приматов. В одном варианте осуществления субъектом является человек. В одном варианте осуществления субъектом является пациент, нуждающийся в усилении иммунного ответа. В одном варианте осуществления субъект имеет иммунодефицитное состояние, например, субъект проходит химиотерапию или лучевую терапию, или ранее подвергался такому лечению. В альтернативе, или в комбинации, субъект имеет или подвергается риску развития иммунодефицита в результате инфекции. Способы и композиции, описанные в настоящей заявке, подходят для лечения пациентов, страдающих заболеванием, которое можно лечить путем усиления опосредуемого Т-клетками иммунного ответа. Например, способы и композиции, описанные в настоящей заявке, могут усиливать различные иммунные активности. В одном варианте осуществления субъект имеет повышенное количество и/или активность инфильтрирующих опухоль Т-лимфоцитов (TIL). В другом варианте осуществления субъект имеет повышенную экспрессию или активность интерферона гамма (IFN-γ). В еще одном варианте осуществления субъект имеет пониженную экспрессию или активность PD-L1.
Терапевтические применения
Блокада PD-1 может усиливать иммунный ответ против раковых клеток у субъекта. Лиганд PD-1, PD-L1, не экспрессируется в нормальных клетках человека, но широко представлен в различных формах раковых опухолей человека (Dong et al. (2002) Nat Med 8:787-9). Взаимодействие между PD-1 и PD-L1 может вызывать снижение инфильтрирующих опухоли лимфоцитов, снижение опосредуемой Т-клеточным рецептором пролиферации и/или иммунное ускользание раковых клеток (Dong et al. (2003) J Mol Med 81:281-7; Blank et al. (2005) Cancer Immunol. Immunother. 54:307-314; Konishi et al. (2004) Clin. Cancer Res. 10:5094-100). Иммунная супрессия может быть снята путем ингибирования локального взаимодействия PD-1 с PD-L1; данный эффект является аддитивным в том случае, если также блокируют взаимодействие PD-1 с PD-L2 (Iwai et al. (2002) PNAS 99:12293-7; Brown et al. (2003) J. Immunol. 170:1257-66). Таким образом, ингибирование PD-1 может приводить к усилению иммунного ответа.
В одном аспекте настоящее изобретение относится к лечению субъекта in vivo с применением молекулы антитела против PD-1, в результате чего ингибируется или уменьшается рост раковых опухолей. Антитело против PD-1 можно применять отдельно для ингибирования роста раковых опухолей. В альтернативе антитело против PD-1 можно применять в комбинации с одним или более из: терапии стандарта лечения (например, в случае рака или инфекционных заболеваний), другого антитела или его антигенсвязывающего фрагмента, иммуномодулятора (например, активатора костимулирующей молекулы или ингибитора ингибирующей молекулы), вакцины, например, терапевтической противоопухолевой вакцины, или других форм клеточной иммунотерапии, как описано ниже.
Таким образом, в одном варианте осуществления изобретения предложен способ ингибирования роста опухолевых клеток у субъекта, включающий введение субъекту терапевтически эффективного количества молекулы антитела против PD-1, описанной в настоящей заявке.
В одном варианте осуществления способы подходят для лечения рака in vivo. Для достижения антигенспецифичного улучшения иммунитета молекулу антитела против PD-1 можно вводить вместе с целевым антигеном. При введении антител к PD-1 в комбинации с одним или более средствами, комбинацию можно вводить в любом порядке или одновременно.
В другом аспекте предложен способ лечения субъекта, например, уменьшения или облечения гиперпролиферативного состояния или нарушения (например, рака), например, солидной опухоли, гемобластоза, опухоли мягких тканей или метастатического поражения у субъекта. Способ включает введение субъекту одной или более комбинаций, раскрытых в настоящей заявке.
При использовании в настоящей заявке термин "рак" включает все виды злокачественных новообразований или онкогенных процессов, метастатические ткани или клетки, ткани или органы со злокачественной трансформацией, независимо от гистологического типа или стадии инвазивности. Примеры онкологических заболеваний включают, без ограничения перечисленными, солидные опухоли, гемобластозы, опухоли мягких тканей и метастатические поражения. Примеры солидных опухолей включают злокачественные новообразования, например, саркомы и карциномы (в том числе аденокарциномы и плоскоклеточные карциномы), различных систем органов, например, поражающие печень, легкое, молочную железу, лимфоидную ткань, желудочно-кишечный тракт (например, толстую кишку), мочеполовой тракт (например, почки, уротелиальные клетки), предстательную железу и глотку. Аденокарциномы включают злокачественные новообразования, такие как большинство форм рака толстой кишки, рак прямой кишки, почечно-клеточную карциному, рак печени, немелкоклеточную карциному легкого, рак тонкой кишки и рак пищевода. Плоскоклеточные карциномы включают злокачественные новообразования, например, в легком, пищеводе, коже, голове и шеи, полости рта, анусе и шейке матки. В одном варианте осуществления рак является меланомой, например, меланомой в поздней стадии. Метастатические поражения при вышеуказанных формах рака также можно лечить или предотвращать с помощью способов и композиций согласно изобретению.
Примеры раковых опухолей, рост которых можно ингибировать с помощью молекул антител, раскрытых в настоящей заявке, включают формы рака, обычно чувствительные к иммунотерапии. Неограничивающие примеры предпочтительных для лечения форм рака включают меланому (например, метастатическую злокачественную меланому), рак почки (например, светлоклеточную карциному), рак предстательной железы (например, гормонорефракторную аденокарциному предстательной железы), рак молочной железы, рак толстой кишки и рак легкого (например, немелкоклеточный рак легкого). Кроме того, рефракторные или рецидивирующие злокачественные опухоли можно лечить с помощью молекул антитела, описанных в настоящей заявке.
Примеры других форм рака, которые можно лечить, включают рак кости, рак поджелудочной железы, рак кожи, рак головы или шеи, кожную или внутриглазную злокачественную меланому, рак матки, рак яичника, рак прямой кишки, анальный рак, гастро-эзофагальный рак, рак желудка, липосаркому, рак яичка, рак матки, карциному фаллопиевых труб, карциному эндометрия, карциному шейки матки, карциному влагалища, карциному вульвы, рак из клеток Меркеля, лимфому Ходжкина, неходжкинскую лимфому, рак пищевода, рак тонкой кишки, рак эндокринной системы, рак щитовидной железы, рак паращитовидной железы, рак надпочечника, саркому мягких тканей, рак уретры, рак пениса, хронические или острые лейкозы, в том числе острый миелоидный лейкоз, хронический миелоидный лейкоз, острый лимфобластный лейкоз, хронический лимфоцитарный лейкоз, солидные опухоли детского возраста, лимфоцитарную лимфому, рак мочевого пузыря, множественную миелому, миелодиспластический синдром, рак почки или мочеточника, карциному почечной лоханки, новообразования центральной нервной системы (ЦНС), первичную лимфому ЦНС, опухолевый ангиогенез, опухоль позвоночного канала, глиому ствола головного мозга, аденому гипофиза, саркому Капоши, эпидермоидный рак, плоскоклеточный рак, Т-клеточную лимфому, формы рака, обусловленные факторами внешней среды, в том числе рак, вызванный асбестом (например, мезотелиому), и комбинации указанных форм рака. В некоторых вариантах осуществления рак является раком кожи, например, раком из клеток Меркеля или меланомой. В одном варианте осуществления рак является раком из клеток Меркеля. В других вариантах осуществления рак является меланомой. В других вариантах осуществления рак является раком молочной железы, например, трижды негативным раком молочной железы (ТНРМЖ) или HER2-негативным раком молочной железы. В других вариантах осуществления рак является раком почки, например, почечно-клеточной карциномой (например, светлоклеточной почечно-клеточной карциномой (CCRCC) или несветлоклеточной почечно-клеточной карциномой (nccRCC)). В других вариантах осуществления рак является раком щитовидной железы, например, анапластической карциномой щитовидной железы (ATC). В других вариантах осуществления рак является нейроэндокринной опухолью (NET), например, атипичной легочной карциноидной опухолью или NET в поджелудочной железе, желудочно-кишечном (ЖКТ) тракте или легком. В некоторых вариантах осуществления рак является раком легкого, например, немелкоклеточным раком легкого (НМРЛ) (например, плоскоклеточным НМРЛ или неплоскоклеточным НМРЛ). В некоторых вариантах осуществления рак является лейкозом (например, острым миелоидным лейкозом (ОМЛ), например, рецидивирующим или рефракторным ОМЛ, или de novo ОМЛ). В некоторых вариантах осуществления рак является миелодиспластическим синдромом (МДС) (например, МДС с высоким риском).
В некоторых вариантах осуществления рак выбран из рака легкого, плоскоклеточного рака легкого, меланомы, рака почки, рака печени, миеломы, рака предстательной железы, рака молочной железы, ЭР+ рака молочной железы, ИМ-ТН рака молочной железы, рака толстой и прямой кишки, рака толстой и прямой кишки с высокой микросателлитной нестабильностью, EBV+ рака желудка, рака поджелудочной железы, рака щитовидной железы, гемобластоза, неходжкинской лимфомы или лейкоза, или метастатического поражения при раке. В некоторых вариантах осуществления рак выбран из немелкоклеточного рака легкого (НМРЛ), аденокарциномы НМРЛ, плоскоклеточной карциномы НМРЛ, гепатоцеллюлярной карциномы.
Лечение метастатических раковых опухолей, например, метастатических раковых опухолей, которые экспрессируют PD-L1 (Iwai et al. (2005) Int. Immunol. 17:133-144), могут проводить с применением молекул антител, описанных в настоящей заявке. В одном варианте осуществления рак экспрессирует повышенный уровень PD-L1, IFNγ и/или CD8.
Без ограничения теорией, в некоторых вариантах осуществления пациент с большей вероятностью будет отвечать на лечение иммуномодулятором (необязательно в комбинации с одним или более средствами, как описано в настоящей заявке), если пациент будет иметь рак с высокой экспрессией PD-L1, и/или если раковая опухоль инфильтрирована противоопухолевыми иммунными клетками, например, TIL-клетками. Противоопухолевые иммунные клетки могут быть положительными на CD8, PD-L1 и/или IFN-γ; таким образом, уровни CD8, PD-L1 и/или IFN-γ могут служить в качестве показателей уровней TIL в микроокружении. В некоторых вариантах осуществления микроокружение раковой опухоли указано как тройной положительный фенотип по PD-L1/CD8/IFN-γ.
Таким образом, в некоторых аспектах в настоящей заявке предложены способы определения, является ли образец опухоли положительным на один или более из PD-L1, CD8 и IFN-γ, и в том случае, если образец опухоли является положительным на один или более, например, два или все три указанных маркера, то пациенту вводят терапевтически эффективное количество молекулы антитела против PD-1, необязательно в комбинации с одним или более другими иммуномодуляторами или противоопухолевыми средствами.
В следующих показаниях большая часть пациентов являются трижды положительными на PD-L1/CD8/IFN-γ: рак легкого (плоскоклеточный), рак легкого (аденокарцинома), рак головы и шеи, рак желудка, НМРЛ, HNSCC, рак желудка (например, MSIhi и/или EBV+); CRC (например, MSIhi), назофарингеальный рак (NPC), рак шейки матки (например, плоскоклеточный), рак щитовидной железы, например, папиллярный рак щитовидной железы, например, анапластическая карцинома щитовидной железы; рак кожи (например, рак из клеток Меркеля или меланома); рак молочной железы (например, рак молочной железы TN); и ДВККЛ (диффузная В-крупноклеточная лимфома). Как правило, при раке молочной железы и обычно при раке толстой кишки, умеренная часть пациентов являются трижды положительными на PD-L1/CD8/IFN-γ. При следующих показаниях небольшая часть пациентов являются трижды положительными на PD-L1/CD8/IFN-γ: ЭР+ рак молочной железы и рак поджелудочной железы. Эти результаты обсуждаются ниже в Примере 4. Независимо от того, большая или малая часть пациентов являются трижды положительными на указанные маркеры, скрининг пациентов на такие маркеры позволяет определять часть пациентов, которые имеет особенно высокую вероятность эффективного ответа на терапию антителом PD-1 (например, блокирующим антителом PD-1), необязательно в комбинации с одним или более другими иммуномодуляторами (например, молекулой антитела против TIM-3, молекулой антитела против LAG-3 или молекулой антитела против PD-L1) и/или противоопухолевыми средствами, например, перечисленными в Таблице 7 и раскрытыми в публикациях, перечисленных в Таблице 7.
В некоторых вариантах осуществления образец рака классифицируют как трижды положительный на PD-Ll/CD8/IFN-γ. Такое определение можно приближенно разделить на два пороговых условия: когда отдельная клетка классифицирована как положительная, и когда образец в целом классифицирован как положительный. Во-первых, можно измерять, в отдельной клетке, уровень PD-L1, CD8 и/или IFN-γ. В некоторых вариантах осуществления клетка, которая является положительной по одному или более из указанных маркеров, является клеткой, которая имеет более высокий уровень маркера по сравнению с контрольной клеткой или референсным значением. Например, в некоторых вариантах осуществления высокий уровень PD-L1 в данной клетке является более высоким уровнем, чем уровень PD-L1 в соответствующей нераковой ткани у пациента. В качестве другого примера, в некоторых вариантах осуществления высокий уровень CD8 или IFN-γ в данной клетке является уровнем данного белка, обычно наблюдаемым в TIL. Во-вторых, также в образце можно измерить процент клеток, которые являются положительными на PD-L1, CD8 и/или IFN-γ. (Одна клетка не должна обязательно экспрессировать все три маркера). В некоторых вариантах осуществления трижды положительный образец является образцом, который содержит высокий процент клеток, например, более высокий, чем референсное значение, или более высокий, чем в контрольном образце, которые являются положительными на указанные маркеры.
В других вариантах осуществления можно измерять общие уровни PD-L1, CD8 и/или IFN-γ в образце. В этом случае высокий уровень CD8 или IFN-γ в образце может быть уровнем такого белка, как правило, наблюдаемым в опухоли, инфильтрированной TIL. Аналогичным образом, высокий уровень PD-L1 может быть уровнем такого белка, как правило, наблюдаемым в образце опухоли, например, микроокружении опухоли.
Определение подгрупп пациентов, которые являются трижды положительными на PD-Ll/CD8/IFN-γ, как показано в Примере 4 ниже, позволило выявить некоторые подсовокупности пациентов с возможным ответом на лечение антителом против PD-1. Например, многие больные ИМ-ТН раком молочной железы (иммуномодулирующим, трижды негативным раком) являются трижды положительными на PD-Ll/CD8/IFN-γ. ИМ-ТН рак молочной железы описан, например, в публикации Brian D. Lehmann et al., "Identification of human triple-negative breast cancer subtypes and preclinical models for selection of targeted therapies", J Clin Invest. Jul 1, 2011; 121(7):2750-2767. Трижды негативный рак молочной железы относится к таким формам рака, которые не экспрессируют эстрогеновый рецептор (ЭР), прогестероновый рецептор (ПР) и HER2/Neu. Эти формы рака плохо поддаются лечению, поскольку они обычно не отвечают на средства, которые направленно воздействуют на ЭР, ПР и HER2/Neu. Трижды негативный рак молочной железы можно дополнительно подразделить на разные классы, к одному из которых относится иммуномодулирующий рак. Как описано в Lehmann et al., ИМ-ТН рак молочной железы обогащен факторами, вовлеченными в процессы иммунных клеток, такие как одно или более из сигнализации иммунных клеток (например, пути Th1/Th2, пути NK-клеток, сигнального пути В-клеточного рецептора, пути ДК и сигнализации T-клеточного рецептора), цитокиновой сигнализации (например, цитокинового пути, пути IL-12 и пути IL-7), процессинга и презентации антигена, сигнализации через центральные пути передачи иммунного сигнала (например, сигнализации NFKB, ФНО и JAK/STAT), генов, участвующих в функции Т-клеток, иммунной транскрипции, выброса интерферона (IFN) и процессинга антигена. Таким образом, в некоторых вариантах осуществления рак, подвергаемый лечению, представляет собой рак, который является положительным или определен как положительный на один или более маркеров ИМ-ТН рака молочной железы, например, фактор, который стимулирует одно или более из сигнализации иммунных клеток (например, пути Th1/Th2, пути NK-клеток, сигнального пути В-клеточного рецептора, пути ДК и сигнализации T-клеточного рецептора), цитокиновой сигнализации (например, цитокинового пути, пути IL-12 и пути IL-7), процессинга и презентации антигена, сигнализации через центральные пути передачи иммунного сигнала (например, сигнализации NFKB, ФНО и JAK/STAT), генов, участвующих в функции Т-клеток, иммунной транскрипции, выброса интерферона (IFN) и процессинга антигена.
В качестве другого примера, в настоящей заявке показано, что подгруппа больных раком толстой кишки с высокой MSI (микросателлитной нестабильностью) также являются трижды положительными по PD-Ll/CD8/IFN-γ. Таким образом, в некоторых вариантах осуществления антитело к PD-1, например, антитело к PD-1 согласно изобретению (необязательно в комбинации с одним или более иммуномодуляторами, такими как антитело к LAG-3, антитело к TIM-3 или антитело к PD-L1, и одним или более противоопухолевыми средствами, например, противоопухолевым средством, описанным в Таблице 7 или в публикации из Таблицы 7), вводят больному, который имеет или у которого определен рак толстой кишки с высокой MSI, в результате чего осуществляется лечение рака. В некоторых вариантах осуществления клетка с высокой MSI является клеткой, которая имеет более высокий уровень MSI по сравнению с референсным значением или значением в контрольной клетке, например, нераковой клетке из ткани такого же типа, что и рак.
В качестве другого примера, в настоящей заявке показано, что подгруппа больных раком желудка с высокой MSI и/или которые являются EBV+, также являются трижды положительными по PD-Ll/CD8/IFN-γ. Таким образом, в некоторых вариантах осуществления антитело к PD-1, например, антитело к PD-1 согласно изобретению (необязательно в комбинации с одним или более иммуномодуляторами, такими как антитело к LAG-3, антитело к TIM-3 или антитело к PD-L1, и одним или более противоопухолевыми средствами, например, противоопухолевым средством, указанным в Таблице 7 или в публикации из Таблицы 7) вводят больному, который имеет или у которого определен рак желудка с высоким MSI и/или EBV+, в результате чего осуществляется лечение рака. В некоторых вариантах осуществления клетка с высокой MSI является клеткой, которая имеет более высокий уровень MSI по сравнению с референсным значением или значением в контрольной клетке, например, нераковой клетке из ткани такого же типа, что и рак.
Кроме того, в настоящей заявке раскрыты способы исследования рака на PD-L1 с последующим лечением рака с применением антитела к PD-1. Как описано в Примере 5 ниже, образец рака можно исследовать на уровни белка PD-L1 или уровни мРНК. Образец, содержащий более высокий уровень PD-L1 (белка или мРНК) по сравнению с референсным значением или значением в контрольной клетке (например, в нераковой клетке), может быть классифицирован как PD-L1-положительный. Таким образом, в некоторых вариантах осуществления антитело к PD-1, например, антитело к PD-1, как описано в настоящей заявке (необязательно в комбинации с одним или более противоопухолевыми средствами) вводят больному, который имеет или у которого определен PD-L1 положительный рак. Рак может являться, например, немелкоклеточной аденокарциномой (АСА) легкого (НМРЛ), НМРЛ плоскоклеточной карциномой (SCC) или гепатоцеллюлярной карциномой (НСС).
В некоторых вариантах осуществления настоящие способы включают применение антитела против PD-1, например, антитела против PD-1, как описано в настоящей заявке, например, в виде монотерапии, для лечения рака, который является (или определен как являющийся) PD-L1 положительным. В некоторых вариантах осуществления рак является раком толстой кишки и прямой кишки (например, MSI-H), раком желудка (например, MSI-H и/или EBV+), NPC, раком шейки матки, раком молочной железы (например, ТН раком молочной железы) и раком яичника. В некоторых вариантах осуществления рак представляет собой НМРЛ, меланому или HNSCC. В некоторых вариантах осуществления антитело против PD-1 вводят в дозе, например, 1, 3, 10 или 20 мг/кг. В других вариантах осуществления молекулу антитела против PD-1 вводят в дозе, например, 200, 250, 300, 350, 400, 450 или 500 мг. В одном варианте осуществления молекулу антитела против PD-1 вводят в дозе от 250 мг до 450 мг, например, 250 мг, 300 мг, 350 мг, 400 мг или 450 мг.
На основе, например, Примера 4 в настоящей заявке, было обнаружено, что некоторые раковые опухоли желудка, которые являются трижды положительными на PD-Ll/CD8/IFN-γ, также являются положительными на PIK3CA. Таким образом, в некоторых вариантах осуществления рак можно лечить молекулой антитела против PD-1 (необязательно в комбинации с одним или более иммуномодуляторами, например, молекулой антитела против LAG-3, молекулой антитела против TIM-3 или молекулой антитела против PD-L1) и средством, которое ингибирует PIK3CA. Примеры средств в данной категории описаны в Stein RC (September 2001). "Prospects for phosphoinositide 3-kinase inhibition as a cancer treatment". Endocrine-related Cancer 8(3):237-48 и Marone R, Cmiljanovic V, Giese B, Wymann MP (January 2008). "Targeting phosphoinositide 3-kinase: moving towards therapy". Biochimica et Biophysica Acta 1784(1):159-85.
На основе, например, Примера 4 в настоящей заявке, CRC, например, пациента, который имеет (или идентифицирован как имеющий) MSI-H CRC, можно лечить антителом к PD-1, необязательно в комбинации с терапевтическим средством, которое направленно воздействует на один или более из LAG-3, RNF43 и BRAF. В качестве примера, указанные типы рака можно лечить антителом к PD-1, необязательно в комбинации с одним или более терапевтическими средствами, которые направленно воздействует на один или более из LAG-3, PD-1, RNF43 и BRAF. В некоторых вариантах осуществления одно или более терапевтических средств включают иммуномодуляторы, такие как молекулу антитела против LAG-3, и противоопухолевое средство, описанное в Таблице 7 или в публикации, перечисленной в Таблице 7. Ингибиторы LAG-3, например, антитела, описаны в настоящей заявке. RNF43 можно ингибировать, например, антителом, малой молекулой (например, 2-(2',3-диметил-[2,4'-бипиридин]-5-ил)-N-(5-(пиразин-2-ил)пиридин-2-ил)ацетамидом (Соединением A28)), миРНК или лигандом Rspo или их производным. Ингибиторы BRAF (например, вемурафениб или дабрафениб) описаны в настоящей заявке.
На основе, например, Примера 4 в настоящей заявке, пациента, который имеет (или идентифицирован как имеющий) плоскоклеточный рак легкого, можно лечить молекулой антитела к PD-1 в комбинации с терапевтическим средством, которое направленно воздействует на LAG-3, например, молекулой антитела к LAG-3, и, необязательно, одним или более противоопухолевыми средствами, такими как противоопухолевое средство, описанное в Таблице 7 или в публикации в Таблице 7.
В некоторых вариантах осуществления субъекта, который имеет (или идентифицирован как имеющий) плоскоклеточный рак легкого, можно лечить антителом к PD-1, необязательно в комбинации с терапевтическим средством, которое направленно воздействует на TIM-3, например, антителом к TIM-3. Ингибиторы TIM-3, например, антитела, описаны в настоящей заявке.
На основе, например, Примера 4 в настоящей заявке, пациента, который имеет (или идентифицирован как имеющий) рак щитовидной железы (например, анапластическую карциному щитовидной железы), можно лечить молекулой антитела к PD-1, необязательно в комбинации с терапевтическим средством, которое направленно воздействует на BRAF, необязательно в комбинации с одним или более иммуномодуляторами, например, молекулой антитела против LAG-3, молекулой антитела против TIM-3 и молекулой антитела против PD-L1. Ингибиторы BRAF (например, вемурафениб или дабрафениб) описаны в настоящей заявке, например, в Таблице 7 и публикациях, перечисленных в Таблице 7.
В некоторых вариантах осуществления способы лечения в настоящей заявке могут применяться для лечения пациента, который имеет (или идентифицирован как имеющий) рак, ассоциированный с инфекцией, например, вирусной или бактериальной инфекцией. Примеры типов рака включают рак шейки матки, рак прямой кишки, ВПЧ-ассоциированный плоскоклеточный рак головы и шеи, ВПЧ-ассоциированные папилломы пищевода, HHV6-ассоциированные лимфомы, EBV-ассоциированные лимфомы (включая лимфому Беркитта), MALT-лимфому желудка, другие ассоциированные с инфекцией MALT-лимфомы, HCC и саркому Капоши.
В других вариантах осуществления рак является гемобластозом или раком, включающим, без ограничения перечисленными, лейкоз или лимфому. Например, молекула антитела против PD-1 может применяться для лечения типов рака и злокачественных новообразований, включающих, без ограничения перечисленными, например, острые лейкозы, в том числе, без ограничения, например, В-клеточный острый лимфолейкоз ("В-ОЛЛ"), Т-клеточный острый лимфолейкоз ("Т-ОЛЛ"), острый лимфолейкоз (ОЛЛ); один или более хронических лейкозов, включающих, без ограничения, например, хронический миелоидный лейкоз (ХМЛ), хронический лимфоцитарный лейкоз (ХЛЛ); дополнительные гемобластозы или гематологические заболевания, включающие, без ограничения, например, В-клеточный пролимфоцитарный лейкоз, бластную опухоль из плазмоцитоидных дендритных клеток, лимфому Беркитта, диффузную В-крупноклеточную лимфому, фолликулярную лимфому, волосатоклеточный лейкоз, мелкоклеточную или крупноклеточную фолликулярную лимфому, злокачественные лимфопролиферативные состояния, MALT-лимфому, мантийноклеточную лимфому, лимфому из клеток краевой зоны, множественную миелому, миелодисплазию и миелодиспластический синдром, неходжкинскую лимфому, плазмабластную лимфому, неоплазию из плазмоцитоидных дендритных клеток, макроглобулинемию Вальденстрема и "предлейкозы", которые представляют собой разнородную группу гематологических состояний, объединенных неэффективной продукцией (или дисплазией) миелоидных клеток крови, и т.п.
В одном варианте осуществления рак выбран из рака легкого (например, немелкоклеточного рака легкого (НМРЛ) (например, НМРЛ плоскоклеточной и/или неплоскоклеточной гистологии, или НМРЛ аденокарциномы)), меланомы (например, распространенной меланомы), рака почки (например, почечно-клеточной карциномы, например, светлоклеточной почечно-клеточной карциномы), рака печени, миеломы (например, множественной миеломы), рака предстательной железы, рака молочной железы (например, рака молочной железы, который не экспрессирует один, два или все из эстрогенового рецептора, прогестеронового рецептора или HER2/Neu, например, трижды негативного рака молочной железы), рак толстой и прямой кишки, рака поджелудочной железы, рака головы и шеи (например, плоскоклеточной карциномы головы и шеи (HNSCC), анального рака, гастроэзофагального рака, рака щитовидной железы, рака шейки матки, лимфопролиферативной болезни (например, посттрансплантационной лимфопролиферативной болезни) или гемобластоза, Т-клеточной лимфомы, неходжкинской лимфомы или лейкоза (например, миелоидного лейкоза).
В другом варианте осуществления рак выбран из карциномы (например, распространенной или метастатической карциномы), меланомы или карциномы легкого, например, немелкоклеточной карциномы легкого.
В одном варианте осуществления рак является раком легкого, например, немелкоклеточным раком легкого.
В другом варианте осуществления рак является гепатокарциномой, например, распространенной гепатокарциномой, с или без вирусной инфекции, например, хронического вирусного гепатита.
В другом варианте осуществления рак является раком предстательной железы, например, распространенным раком предстательной железы.
В еще одном варианте осуществления рак является миеломой, например, множественной миеломой.
В еще одном варианте осуществления рак является раком почки, например, почечно-клеточной карциномой (RCC) (например, метастатической RCC, несветлоклеточной почечно-клеточной карциномо (nccRCC) или светлоклеточной почечно-клеточной карциномой).
В одном варианте осуществления рак является меланомой, например, распространенной меланомой. В одном варианте осуществления рак является распространенной или неоперабельной меланомой, которая не отвечает на другие терапии. В других вариантах осуществления рак является меланомой с мутацией BRAF (например, мутацией BRAF V600). В некоторых вариантах осуществления рак (например, меланома) присутствует у субъекта, имеющего повышенный уровень ЛДГ в сыворотке, по сравнению с референсным уровнем ЛДГ в сыворотке. В других вариантах осуществления молекулу антитела против PD-1 применяют после лечения антителом против CTLA-4 (например, ипилимумабом), с или без ингибитора BRAF (например, вемурафениба или дабрафениба). В одном варианте осуществления молекулу антитела против PD-1 вводят с ингибитором BRAF. Например, молекулу антитела против PD-1 могут вводить в дозе от 200 мг до 600 мг (например, в дозе 400 мг), например, один раз в 4 недели или один раз в 8 недель, например, внутривенно, и ингибитор BRAF или дабрафениб могут вводить в дозе от 50 мг до 250 мг (например, в дозе 150 мг), два раза в день, например, перорально. В одном варианте осуществления комбинация дополнительно включает ингибитор MEK или траметиниб.
В одном варианте осуществления рак является раком толстой и прямой кишки (CRC). Рак толстой и прямой кишки - третий по распространенности рак в мире, приблизительно с 1,4 миллионами человек, диагностированных в 2012 году, и четвертая наиболее распространенная причина смерти от рака, с 694000 смертельных случаев (World Cancer Report 2014). Результаты лечения больных CRC связаны с иммунным инфильтратом в опухолях, что указывает на возможность эффективного применения при CRC таких терапий, которые стимулируют иммунный ответ (Fridman et al. 2011 Cancer Res. p. 5601-5). Без ограничения теорией, считается, что в некоторых вариантах осуществления комбинированная терапия может быть более эффективной при лечении рака толстой и прямой кишки, например, кроме подгруппы с дефицитной репарацией ошибочно спаренных нуклеотидов, когда монотерапии являются менее эффективными (Kroemer et al. (2015) OncoImmunology 4:7, e1058597-1-3). Например, комбинация ингибитора PD-1 (например, молекулы антитела против PD-1) и второго терапевтического средства, описанного в настоящей заявке, может увеличивать процент пациентов с ответом и/или продолжительность ответа по сравнению с монотерапией (например, только ингибитором PD-1 или только вторым терапевтическим средством по отдельности).
В другом варианте осуществления рак является раком легкого, например, немелкоклеточным раком легкого (НМРЛ). Рак легкого - наиболее распространенный рак в мире, приблизительно с 1,8 миллионами новых случаев в 2012 году, и наиболее распространенная причина смерти от рака, с 1,6 миллионами смертельных случаев (World Cancer Report 2014). Из этих случаев приблизительно 85% составляет немелкоклеточный рак легкого (НМРЛ). Для лечения НМРЛ применяют ингибиторы взаимодействия PD-1/PD-L1. Процент пациентов с ответом к указанным средствам в сплошной выборке составляет приблизительно 20% после неэффективности терапии первой линии (Gettinger and Herbst (2014) Cancer J. p. 281-9; Brahmer et al. (2012) N. Engl. J. Med. p. 123-35; Topalian et al. (2012) N. Engl. J. Med. p. 2443-54; Herbst et al. (2014) Nature p. 563-7; Borghaei et al. (2015) N. Engl. J. Med. p. 1627-39). В некоторых вариантах осуществления подбор по экспрессии PD-L1 в опухолях может повышать ответ к ингибиторам PD-1/PD-L1. Без ограничения теорией, считается, что в некоторых вариантах осуществления комбинированная терапия может быть более эффективной при лечении рака легкого (например, НМРЛ) по сравнению с монотерапиями. Например, комбинация ингибитора PD-1 (например, молекулы антитела против PD-1) и второго терапевтического средства, описанного в настоящей заявке, может увеличить процент пациентов с ответом и/или продолжительность ответа (например, с расширением активности, углублением ответа и/или получением более продолжительных ответов) по сравнению с монотерапией (например, только ингибитором PD-1 или только вторым терапевтическим средством по отдельности).
Рак молочной железы является вторым по распространенности раком в мире, приблизительно с 1,7 миллионами новых случаев в 2012 году и пятой наиболее частой причиной смерти от рака, приблизительно с 521000 смертельных случаев (World Cancer Report). Из этих случаев приблизительно 15% составляют трижды негативные опухоли, которые не экспрессируют эстрогеновый рецептор (ЭР), прогестероновый рецептор (ПР) или HER2. В результате у таких пациентов обычно не удается эффективно применять направленные терапии, доступные для пациентов с другими подтипами рака молочной железы. Трижды негативный рак молочной железы (ТНРМЖ) - агрессивная болезнь, и исходы болезни после лечения плохие (Foulkes et al. (2010) N. Engl. J. Med. p. 1938-48). Недавно полученные данные указывают, что ингибиторы PD-1 активны у некоторых пациентов, с ответом, отмеченным у пяти из 27 пациентов, получавших пембролизумаб, с метастатическим ТНРМЖ в исследовании Keynote-012 (Buisseret et al. (2015) Annals of Oncology 26(suppl_3): p. 6-9). Без ограничения теорией, считается, что в некоторых вариантах осуществления комбинированная терапия может быть более эффективной при лечении рака молочной железы (например, ТНРМЖ) по сравнению с монотерапиями. Например, комбинация ингибитора PD-1 (например, молекулы антитела против PD-1) и второго терапевтического средства, описанного в настоящей заявке, может увеличить процент пациентов с ответом и/или продолжительность ответа (например, с увеличением процента пациентов, которые отвечают на лечение) по сравнению с монотерапией (например, только ингибитором PD-1 или только вторым терапевтическим средством по отдельности).
Способы и композиции, раскрытые в настоящей заявке, могут применяться для лечения метастатических поражений, ассоциируемых с вышеуказанными формами рака.
Комбинированная терапия
Неограничивающие примеры комбинаций и применения молекул антител против PD-1 раскрыты в публикации заявки на патент США 2015/0210769 (USSN 14/604,415), озаглавленной "Antibody Molecules to PD-1 and Uses Thereof", полностью включенной посредством отсылки.
В некоторых вариантах осуществления комбинация включает молекулу антитела против PD-1 в комбинации с модулятором костимулирующей молекулы или ингибирующей молекулы, например, коингибирующего лиганда или рецептора.
В одном варианте осуществления молекулу антитела против PD-1 вводят в комбинации с модулятором, например агонистом, костимулирующей молекулы. В одном варианте осуществления агонист костимулирующей молекулы выбран из агониста (например, агонистического антитела или его антигенсвязывающего фрагмента, или растворимой слитой конструкции) OX40, CD2, CD27, CD, ICAM-1, LFA-1 (CD11a/CD18), ICOS (CD278), 4-1BB (CD137), GITR, CD30, CD40, BAFFR, HVEM, CD7, СВЕТ, NKG2C, SLAMF7, NKp80, CD160, B7-H3 или лиганда CD83.
В другом варианте осуществления молекула антитела против PD-1 применяется в комбинации с костимулирующий молекулой, например, агонистом, ассоциированным с положительным сигналом, который включает костимулирующий домен CD28, CD27, ICOS и GITR.
В одном варианте осуществления молекулу антитела против PD-1 вводят в комбинации с ингибитором молекулы, ингибирующей молекулу иммунной контрольной точки. Специалистам в данной области будет известно, что термин "иммунные контрольные точки" означает группу молекул на клеточной поверхности CD4 и CD8 Т-клеток. Эти молекулы могут эффективно служить в качестве "тормоза" для даунмодуляции или ингибирования противоопухолевого иммунного ответа. Молекулы иммунных контрольных точек включают, без ограничения перечисленными, белок программируемой смерти 1 (PD-1), антиген цитотоксических Т-лимфоцитов 4 (CTLA-4), B7H1, B7H4, OX-40, CD137, CD40, LAG-3 и TIM-3, которые непосредственно ингибируют иммунные клетки. Иммунотерапевтические средства, которые могут действовать в качестве ингибиторов иммунных контрольных точек, применимых в способах настоящего изобретения, включают, без ограничения перечисленными, ингибиторы PD-L1, PD-L2, CTLA-4, TIM-3, LAG-3, VISTA, BTLA, TIGIT, LAIR1, CD160, 2B4, CEACAM (например, CEACAM-1 и/или CEACAM-5) и/или TGF-бета.
В одном варианте осуществления ингибитором является растворимый лиганд (например, CTLA-4-Ig или TIM-3-Ig) или антитело, или фрагмент антитела, которые связываются с PD-L1, PD-L2 или CTLA-4. Например, молекулу антитела против PD-1 могут вводить в комбинации с антителом против CTLA-4, например, ипилимумабом, например, для лечения рака (например, рака, выбранного из: меланомы, например, метастатической меланомы; рака легкого, например, немелкоклеточной карциномы легкого; или рака предстательной железы). Примеры антител против CTLA-4 включают тремелимумаб (моноклональное IgG2 антитело, выпускаемое Pfizer, раньше известное как тицилимумаб, CP-675,206); и ипилимумаб (антитело к CTLA-4, также известное как MDX-010, номер CAS 477202-00-9). В одном варианте осуществления молекулу антитела против PD-1 вводят после лечения, например после лечения меланомы, антителом против CTLA-4 (например, ипилимумабом), с или без ингибитора BRAF (например, вемурафениба или дабрафениба). Примерные дозы, которые могут применяться, включают дозу молекулы антитела против PD-1 приблизительно 1-10 мг/кг, например 3 мг/кг, или 200-500 мг, например 300 мг или 400 мг), и дозу антитела против CTLA-4, например, ипилимумаба, приблизительно 3 мг/кг.
Иммунные ингибирующие молекулы, например, PD-1 и LAG-3, могут регулировать, например синергически регулировать, функцию Т-клеток, вызывая иммунное ускользание опухолей. В другом варианте осуществления молекулу антитела против PD-1 вводят в комбинации с антителом против LAG-3 или его антигенсвязывающим фрагментом. В другом варианте осуществления молекулу антитела против PD-1 вводят в комбинации с антителом против TIM-3 или его антигенсвязывающим фрагментом. В других вариантах осуществления молекулу антитела против PD-1 вводят в комбинации с антителом против LAG-3 и антителом против TIM-3 или их антигенсвязывающими фрагментами. Комбинацию антител, указанных в настоящей заявке, могут вводить раздельно, например, в виде отдельных антител, или в виде связанной молекулы, например, молекулы биспецифичных или триспецифичных антител. В другом варианте осуществления молекулу антитела против PD-1 вводят в комбинации с ингибитором CEACAM (например, ингибитором CEACAM-1, CEACAM-3 и/или CEACAM-5), например, молекулой антитела против CEACAM. В другом варианте осуществления молекулу антитела против PD-1 вводят в комбинации с ингибитором CEACAM-1, например, молекулой антитела против CEACAM-1. В другом варианте осуществления молекулу антитела против PD-1 вводят в комбинации с ингибитором CEACAM-5, например, молекулой антитела против CEACAM-5. В одном варианте осуществления вводят биспецифичное антитело, которое включает молекулу антитела против PD-1 и антитела против TIM-3 или против LAG-3, или их антигенсвязывающий фрагмент. В некоторых вариантах осуществления комбинацию антител, указанных в настоящей заявке, применяют для лечения рака, например, рака, описанного в настоящей заявке (например, солидной опухоли). Эффективность вышеуказанных комбинаций может быть протестирована в моделях на животных, известных в уровне техники. Например, модели на животных для тестирования синергического эффекта против PD-1 и против LAG-3 описаны, например, в Woo et al. (2012) Cancer Res. 72(4):917-27.
В одном варианте осуществления ингибитором СЕАСАМ (например, СЕАСАМ-1 и/или СЕАСАМ-5) является молекула антитела против СЕАСАМ. Без ограничения теорией, СЕАСАМ-1 был описан в качестве лиганда и партнера TIM-3 (см., например, WO 2014/022332). Синергический эффект in vivo комбинации антител против TIM-3 и против СЕАСАМ-1 был обнаружен в ксенотрансплантатных моделях опухолей (см., например, WO 2014/022332). Считается, что опухоли используют СЕАСАМ-1 или СЕАСАМ-5 для ингибирования иммунной системы, как описано, например, в Markel et al. J Immunol. 2002 Mar 15; 168(6):2803-10; Markel et al. J Immunol. 2006 Nov 1; 177(9):6062-71; Markel et al. Immunology. 2009 Feb; 126(2):186-200; Markel et al. Cancer Immunol Immunother. 2010 Feb; 59(2):215-30; Ortenberg et al. Mol Cancer Ther. 2012 Jun; 11(6):1300-10; Stern et al. J Immunol. 2005 Jun 1; 174(11):6692-701; Zheng et al. PLoS One. 2010 Sep 2; 5(9). pii: e12529. Таким образом, ингибиторы СЕАСАМ могут применяться с другими иммуномодуляторами, описанными в настоящей заявке (например, с ингибиторами против PD-1 или против TIM-3) для усиления иммунного ответа против рака, например, меланомы, рака легкого (например, НМРЛ), рака мочевого пузыря, толстой кишки или яичника, или других типов рака, описанных в настоящей заявке. В одном варианте осуществления ингибитором СЕАСАМ является антитело против СЕАСАМ-1, как описано в WO 2010/125571, WO 2013/82366 и WO 2014/022332, например, моноклональное антитело 34В1, 26Н7 и 5F4 или их рекомбинантная форму, как описано, например, в US 2004/0047858, US 7,132,255 и WO 99/52552. В других вариантах осуществления антитело против СЕАСАМ является молекулой антитела против СЕАСАМ-1 и/или молекулой антитела против СЕАСАМ-5, как описано, например, в WO 2010/125571, WO 2013/054331 и US 2014/0271618.
В некоторых вариантах осуществления PD-1 и LAG-3 иммунные ингибирующие молекулы (например, молекулы антител) вводят в комбинации друг с другом, например, для лечения рака. В некоторых вариантах осуществления пациент является пациентом, у которого наблюдали прогрессию (например, заметный рост опухоли) в ходе терапии ингибитором PD-1 (например, молекулой антитела, описанного в настоящей заявке) и/или ингибитором PD-L1 (например, молекулой антитела). В некоторых вариантах осуществления терапию молекулой антитела PD-1 и/или молекулой антитела PD-L1 продолжают и дополнительно включают в терапию LAG-3 иммунную ингибирующую молекулу (например, антитело).
В некоторых вариантах осуществления PD-1 и TIM-3 иммунные ингибирующие молекулы (например, молекулы антител) вводят в комбинации друг с другом, например, для лечения рака. В некоторых вариантах осуществления пациент является пациентом, у которого наблюдали прогрессию (например, заметный рост опухоли) в ходе терапии с ингибитором PD-1 (например, молекулой антитела, описанного в настоящей заявке) и/или ингибитором PD-L1 (например, молекулой антитела). В некоторых вариантах осуществления терапию молекулой антитела PD-1 и/или молекулой антитела PD-L1 продолжают и дополнительно включают в терапию TIM-3 иммунную ингибирующую молекулу (например, антитело).
В других вариантах осуществления молекулу антитела против PD-1 вводят в комбинации с цитокином, например, интерлейкином-21, интерлейкином-2, интерлейкином-12 или интерлейкином-15. В некоторых вариантах осуществления комбинация молекулы антитела против PD-1 и цитокина, описанного в настоящей заявке, применяется для лечения рака, например, рака, описанного в настоящей заявке (например, солидной опухоли или меланомы).
Примеры иммуномодуляторов, которые могут применяться в комбинации с молекулами антитела против PD-1, включают, без ограничения перечисленными, например, афутузумаб (выпускаемый Roche®); пэгфилграстим (Неуластим®); леналидомид (CC-5013, Ревлимид®); талидомид (Thalomid®), актимид (CC4047); и цитокины, например, IL-21 или IRX-2 (смесь человеческих цитокинов, включающая интерлейкин 1, интерлейкин 2 и интерферон γ, CAS 951209-71-5, производства IRX Therapeutics).
В других вариантах осуществления молекула антитела против PD-1 применяется в комбинации с ингибитором индоламин-пиррол-2,3-диоксигеназы (IDO) (например, INCB24360) у субъекта с распространенным или метастатическим раком (например, у пациента с метастатическим и рецидивирующим НМЛР раком).
В других вариантах осуществления комбинации, раскрытые в настоящей заявке, например, комбинацию, включающую молекулу антитела против PD-1, вводят субъекту в сочетании (например, до, одновременно или после) с одним или более из следующего: трансплантация костного мозга, абляционная терапия против Т-клеток с использованием химиотерапевтических средств, таких как флударабин, дистанционная лучевая терапия (XRT), циклофосфамид и/или антитела, такие как OKT3 или Кэмпас. В одном варианте осуществления комбинации, например, комбинации, включающие молекулу антитела против PD-1, вводят после абляционной терапии против В-клеток с использованием таких средств, которые взаимодействуют с CD20, например, Ритуксан. Например, в одном варианте осуществления субъекты могут проходить стандартное лечение химиотерапией с высокими дозами, с последующей трансплантацией стволовых клеток периферической крови. В некоторых вариантах осуществления после трансплантации субъекты получают комбинации. В дополнительном варианте осуществления комбинации вводят до или после хирургического вмешательства.
Другим примером комбинации является антитело против PD-1 в комбинации с дакарбазином для лечения меланомы. Другая комбинированная терапия, которая может привести к синергии с блокадой PD-1 посредством апоптоза клеток, включает радиацию, хирургию и гормональную депривацию. Каждый из указанных протоколов создает источник опухолевого антигена в организме хозяина. Ингибиторы ангиогенеза также можно комбинировать с блокадой PD-1. Ингибирование ангиогенеза приводит к гибели опухолевой клетки, что может доставлять опухолевый антиген в пути презентации антигенов в организме хозяина.
Комбинации, которые включают блокирующие антитела PD-1, также могут применяться в комбинации с биспецифичными антителами. Биспецифичные антитела могут применяться для направленного взаимодействия с двумя отдельными антигенами. Например, биспецифичные антитела против Fc-рецептора/опухолевого антигена (например, Her-2/Neu) применялись для направления макрофагов в области локализации опухоли. Такое направление может более эффективно активировать опухолеспецифичные ответы. Плечо Т-клетки из таких ответов будет усилено путем применения блокады PD-1. В альтернативе антиген может быть доставлен непосредственно в ДК с помощью биспецифичных антител, которые связываются с опухолевым антигеном и специфичным маркером клеточной поверхности дендритных клеток.
Опухоли уклоняются от иммунного надзора с помощью различных механизмов. Многие из этих механизмов могут быть преодолены путем деактивации белков, которые экспрессируются опухолями и которые являются иммуносупрессивными. Они включают, среди прочих, TGF-бета (Kehrl, J. et al. (1986) J. Exp. Med. 163: 1037-1050), IL-10 (Howard, M. & O'Garra, A. (1992) Immunology Today 13: 198-200) и лиганд Fas (Hahne, M. et al. (1996) Science 274: 1363-1365). Композиции, раскрытые в настоящей заявке, которые включают антитела против PD-1, могут противодействовать действию иммуносупрессора и способствовать индукции иммунных ответов против опухоли у хозяина.
Другие антитела, которые можно использовать для активации иммунного ответа у хозяина, могут применяться в комбинации с молекулой антителом против PD-1, как описано в настоящей заявке. Они включают молекулы на поверхности дендритных клеток (ДК), которые активируют функцию ДК и презентацию антигена. Антитела против CD40 способны эффективно заменять активность T-хелперных клеток (Ridge, J. et al. (1998) Nature 393:474-478) и могут применяться в комбинации с антителами к PD-1 (Ito, N. et al. (2000) Immunobiology 201(5)527-40). Антитела против костимулирующих молекул T-клеток, такие как CTLA-4 (например, патент США 5,811,097), ОХ-40 (Weinberg, A. et al. (2000) Immunol 164:2160-2169), 4-1BB (Melero, I. et al. (1997) Nature Medicine 3:682-685 (1997) и ICOS (Hutloff, A. et al. (1999) Nature 397:262-266) также могут обеспечивать повышенные уровни активации Т-клеток.
Дополнительные примеры стандартной терапии описаны в разделе под названием "Combination Therapies" в публикации заявки на патент США 2015/0210769 (USSN 14/604,415), озаглавленной "Antibody Molecules to PD-1 and Uses Thereof", полностью включенной посредством отсылки, и ниже.
Во всех способах, описанных в настоящей заявке, блокада PD-1 может быть объединена с другими формами иммунотерапии, такими как лечение цитокинами (например, интерферонами, ГМ-КСФ, Г-КСФ, IL-2, IL-21) или терапия биспецифичным антителом, которая предусматривает повышенную презентацию опухолевых антигенов (см., например, Holliger (1993) Proc. Natl. Acad. Sci. USA 90:6444-6448; Poljak (1994) Structure 2:1121-1123).
Способы введения молекул антител известны в уровне техники и описаны ниже. Подходящие дозы применяемых молекул будут зависеть от возраста и массы тела субъекта, а также конкретного применяемого лекарственного средства. Дозы и схемы лечения с применением молекулы антитела против PD-1 могут быть определены специалистом. В некоторых вариантах осуществления молекулу антитела против PD-1 вводят путем инъекции (например, подкожно или внутривенно) в дозе приблизительно 1-30 мг/кг, например, приблизительно 5-25 мг/кг, приблизительно 10-20 мг/кг, приблизительно 1-5 мг/кг или приблизительно 3 мг/кг. В некоторых вариантах осуществления молекулу антитела против PD-1 вводят в дозе приблизительно 1 мг/кг, приблизительно 3 мг/кг, приблизительно 5 мг/кг, приблизительно 10 мг/кг, приблизительно 20 мг/кг, приблизительно 30 мг/кг или приблизительно 40 мг/кг. В некоторых вариантах осуществления молекулу антитела против PD-1 вводят в дозе приблизительно 1-3 мг/кг или приблизительно 3-10 мг/кг. В некоторых вариантах осуществления молекулу антитела против PD-1 вводят в дозе приблизительно 0,5-2, 2-4, 2-5, 5-15 или 5-20 мг/кг. Схема введения может изменяться, например, от одного раза в неделю до одного раза в 2, 3 или 4 недели. В одном варианте осуществления молекулу антитела против PD-1 вводят в дозе приблизительно от 10-20 мг/кг раз в две недели. В другом варианте осуществления молекулу антитела против PD-1 вводят в дозе приблизительно 1 мг/кг один раз в две недели, приблизительно 3 мг/кг один раз в две недели, 10 мг/кг один раз в две недели, 3 мг/кг один раз в четыре недели или 5 мг/кг один раз в четыре недели.
В других вариантах осуществления молекулу антитела против PD-1 вводят путем инъекции (например, подкожно или внутривенно) в дозе (например, постоянной дозе) приблизительно от 200 мг до 500 мг, например, приблизительно от 250 мг до 450 мг, приблизительно от 300 мг до 400 мг, приблизительно от 250 мг до 350 мг, приблизительно от 350 мг до 450 мг или приблизительно 300 мг или приблизительно 400 мг. В некоторых вариантах осуществления молекулу антитела против PD-1 вводят в дозе приблизительно 200 мг, 250 мг, 300 мг, 350 мг, 400 мг, 450 мг или 500 мг. В некоторых вариантах осуществления молекулу антитела против PD-1 вводят в дозе приблизительно 250-450 мг или приблизительно 300-400 мг. В некоторых вариантах осуществления молекулу антитела против PD-1 вводят в дозе приблизительно 200-300 мг, 250-350 мг, 300-400 мг, 350-450 мг или 400-500 мг. Схема введения может изменяться, например, от одного раза в неделю до одного раза в 2, 3, 4, 5 или 6 недель. В одном варианте осуществления молекулу антитела против PD-1 вводят в дозе приблизительно от 300 мг до 400 мг один раз в три или один раз в четыре недели. В одном варианте осуществления молекулу антитела против PD-1 вводят в дозе приблизительно от 300 мг один раз в три недели. В одном варианте осуществления молекулу антитела против PD-1 вводят в дозе приблизительно от 400 мг один раз в четыре недели. В одном варианте осуществления молекулу антитела против PD-1 вводят в дозе приблизительно от 300 мг один раз в четыре недели. В одном варианте осуществления молекулу антитела против PD-1 вводят в дозе приблизительно от 400 мг один раз в три недели.
Молекулы антитела могут применяться в неконъюгированных формах или в виде конъюгата со вторым средством, например, цитотоксическим средством, радиоизотопом или белком, например, белковым токсином или вирусным белком. Этот способ включает: введение молекулы антитела, отдельно или в виде конъюгата с цитотоксическим средством, субъекту, которому требуется такое лечение. Молекулы антитела могут применяться для доставки различных терапевтических средств, например, цитотоксической молекулы, например, терапевтического лекарственного средства, радиоизотопа, молекулы растительного, грибкового или бактериального происхождения или биологических белков (например, белковых токсинов) или частиц (например, рекомбинантных вирусных частиц, например, посредством вирусного белка оболочки), или их смесей.
Дополнительные комбинированные терапии
Комбинации, раскрытые в настоящей заявке, например, комбинация, включающая блокирующие PD-1 средства, также можно комбинировать со стандартным лечением рака, например, химиотерапевтическими схемами. В таких случаях можно уменьшать вводимую дозу химиотерапевтического реагента (Mokyr, М. et al. (1998) Cancer Research 58:5301-5304). В некоторых вариантах осуществления способы и композиции, описанные в настоящей заявке, применяют в комбинации с одной или более из молекул других антител, химиотерапии, другой противоопухолевой терапии (например, противоопухолевых средств направленного действия или онколитических средств), цитотоксических средств, иммунотерапевтических средств (например, цитокинов), хирургического вмешательства и/или процедур лучевой терапии. Примеры цитотоксических веществ, которые можно вводить в комбинации, включают антимикротубулиновые средства, ингибиторы топоизомеразы, антиметаболиты, ингибиторы митоза, алкилирующие средства, антрациклины, алкалоиды барвинка, интеркалирующие средства, средства, способные нарушать пути передачи сигнала, средства, вызывающие апоптоз, ингибиторы протеосомы и лучевую терапию (например, локальное или тотальное облучение тела).
В альтернативе, или в комбинации с вышеуказанными комбинациями, способы и композиции, описанные в настоящей заявке, можно применять в комбинации с одним или более из следующего: иммуномодулятор (например, активатор костимулирующей молекулы или ингибитор ингибирующей молекулы), вакцина, например, терапевтическая противораковая вакцина, или другие формы клеточной иммунотерапии.
Примеры комбинаций, например, комбинаций, включающих молекулы антитела против PD-1 и стандартный способ лечения рака, раскрыты в публикации заявки на патент США 2015/0210769 (USSN 14/604,415), озаглавленной "Antibody Molecules to PD-1 and Uses Thereof", полностью включенной посредством отсылки, в том числе, без ограничения, алкилирующие средства, антрациклины, алкалоиды барвинка, ингибиторы протеасомы и ингибиторы тирозинкиназы (например, ингибитор рецепторной тирозинкиназы (RTK)).
Пример ингибитора тирозинкиназы включает, без ограничения перечисленным, ингибитор пути эпидермального фактора роста (EGF) (например, ингибитор рецептора эпидермального фактора роста (EGFR)), ингибитор пути фактора роста эндотелия сосудов (VEGF) (например, ингибитор рецептора фактора роста эндотелия сосудов (VEGFR) (например, ингибитор VEGFR-1, ингибитор VEGFR-2, ингибитор VEGFR-3)), ингибитор пути фактора роста тромбоцитов (PDGF) (например, ингибитор рецептора фактора роста тромбоцитов (PDGFR) (например, ингибитор PDGFR-β)), ингибитор RAF-1, ингибитор KIT и ингибитор RET. Выбранные ингибиторы тирозинкиназы выбраны из сунитиниба, эрлотиниба, гефитиниба или сорафениба. Сорафениб также известен как 4-[4-[[4-хлор-3-(трифторметил)фенил]карбамоиламино]фенокси]-N-метил-пиридин-2-карбоксамид. В некоторых вариантах осуществления комбинация включает сорафениб, например, для лечения рака, описанного в настоящей заявке, например, рака печени (например, гепатоцеллюлярной карциномы).
В некоторых вариантах осуществления комбинации включают ингибиторы рецептора фактора роста эндотелия сосудов (VEGF), например, ингибитор VEGFR, как описано в настоящей заявке.
В некоторых вариантах осуществления комбинация включает ингибитор PI3K, например, ингибитор PI3K, как описано в настоящей заявке.
В некоторых вариантах осуществления комбинация включает ингибитор mTOR, например, ингибитор mTOR, как описано в настоящей заявке.
В некоторых вариантах осуществления комбинация включает ингибитор BRAF, например, GSK2118436, RG7204, PLX4032, GDC-0879, PLX4720 и сорафениба тозилат (Bay 43-9006). В некоторых вариантах осуществления комбинация включает ингибитор RAF, например, дебрафениб или N-{3-[5-(2-аминопиримидин-4-ил)-2-трет-бутил-1,3-тиазол-4-ил]-2-фторфенил}-2,6-дифторбензолсульфонамид.
В некоторых вариантах осуществления комбинация включает ингибитор MEK. В некоторых вариантах осуществления рак, подвергаемый лечению комбинацией, выбран из меланомы, рака толстой и прямой кишки, немелкоклеточного рака легкого, рака яичника, рака молочной железы (например, трижды негативного рака молочной железы (ТНРМЖ)), рака предстательной железы, рака поджелудочной железы, гемобластоза или почечно-клеточной карциномы. В некоторых вариантах осуществления рак включает мутацию BRAF (например, мутацию BRAF V600E), BRAF дикого типа, KRAS дикого типа или активирующую мутацию KRAS. Рак может быть на ранней, промежуточной или поздней стадии. В одном варианте осуществления рак, подвергаемый лечению комбинацией, является неоперабельной или метастатической меланомой, например, имеющей мутацию BRAFV600. В некоторых вариантах осуществления рак выбран из рака толстой и прямой кишки (например, микросателлитно стабильного рака толстой и прямой кишки (MSS CRC), рака легкого (например, немелкоклеточного рака легкого) или рака молочной железы (например, трижды негативного рака легкого (ТНРМЖ)).
Любой ингибитор MEK может применяться в комбинации, включающей, без ограничения перечисленным, ARRY-142886, G02442104 (также известный как GSK1120212), RDEA436, RDEA119/BAY 869766, AS703026, G00039805 (также известный как AZD-6244 или селуметиниб), BIX 02188, BIX 02189, CI-1040 (PD-184352), 032590PD-1, PD98059, U0126, GDC-0973 ([3,4-дифтор-2-[(2-фтор-4-иодфенил)амино]фенил][3-гидрокси-3-(25)-2-пиперидинил-1-азетидинил]метанон), G-38963, G02443714 (также известный как AS703206) или их фармацевтически приемлемую соль или сольват. Дополнительные примеры ингибиторов MEK раскрыты в WO 2013/019906, WO 03/077914, WO 2005/121142, WO 2007/04415, WO 2008/024725 и WO 2009/085983, содержание которых включено в настоящую заявку посредством отсылки.
В некоторых вариантах осуществления ингибитором MEK является траметиниб или N-(3-{3-циклопропил-5-[(2-фтор-4-иодфенил)амино]-6,8-диметил-2,4,7-триоксо-3,4,6,7-тетрагидро-пиридо[4,3-d]пиримидин-1(2H)-ил}фенил)ацетамид.
В некоторых вариантах осуществления ингибитор MEK или траметиниб является обратимым и высокоселективным аллостерическим ингибитором MEK1 и MEK2. Белки MEK являются важными компонентами пути MAPK, который обычно гиперактивирован в опухолевых клетках. Онкогенные мутации в BRAF (представителе RAF киназ) и RAS сигнализируют через MEK1 или MEK2. Без ограничения теорией, считается, что в некоторых вариантах осуществления ингибитор MEK, например, траметиниб, может повышать CD4+ и CD8+ инфильтрирующие опухоль лимфоциты (TIL), и/или повышать эффективность ингибитора PD-1 (Liu et al. (2014) Clin. Cancer Res. p. 462-8).
В некоторых вариантах осуществления комбинация, описанная в настоящей заявке, включает ингибитор MEK или траметиниб, и ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекулу антитела против PD-1).
Сигнализация пути MAPK важна для роста опухоли (Downward (2003) Nat. Rev. Cancer. p. 11-22), и траметиниб эффективен в качестве монотерапии и в комбинации с дабрафенибом для лечения BRAFV600 мутантной меланомы. Траметиниб производит ингибирование MEK в опухолевых клетках при экспозициях, достигаемых в одобренной дозе 2 мг п/о, один раз в день (QD) (Infante et al. (2012) Lancet Oncol. p. 773-81). Доклинические данные, полученные в сингенной модели CT26 на мышах, демонстрируют, что комбинация траметиниба и антитела против PD-L1 приводит к повышению TIL, уменьшению роста опухоли и увеличению продолжительности выживания (Liu et al. (2015) Clin. Cancer Res. p. 1639-51). Иммуномодулирующие эффекты траметиниба в комбинации с антителами к ингибитору контрольной точки исследовали в сингенной модели CT26 на мышах in vivo. Например, траметиниб увеличивает количество инфильтрирующих опухоль лимфоцитов (TIL), и траметиниб потенцирует противоопухолевые эффекты при лечении антителом против PD-1, антителом против PD-L1 и антителом против CTLA-4. При использовании этой модели, мышам вводили контроль, траметиниб, антитело против PD-1 или комбинацию траметиниба и антитела против PD-1 в течение семи дней, после чего опухоли собирали. Лечение траметинибом или траметинибом и антителом против PD-1 в течение семи дней привело к значимым повышениям CD4+ Т-клеток в опухолевой ткани. Только лечение комбинацией траметиниба и антитела против PD-1 привело к значимым повышениям CD8+ Т-клеток. Кроме того, в модели CT26 на мышах комбинация траметиниба и антитела против PD-1 была более эффективной при ингибировании роста опухоли, чем любое отдельное средство. Лечение комбинацией также увеличивало длительность выживания. Схема введения лекарственного средства может быть важной. Рост опухоли был ингибирован при параллельном введении траметиниба и антитела против PD-1, или когда сначала траметиниб вводили как отдельное средство в течение 7 дней до лечения комбинацией. Рост опухоли не был ингибирован, если сначала вводили антитело, а затем применяли комбинированную терапию, что указывает на то, что схема введения лекарственного средства может быть важной. В некоторых вариантах осуществления ингибитор MEK или траметиниб повышает или применяется для повышения противоопухолевого эффекта ингибитора PD-1 (например, молекулы антитела против PD-1).
В некоторых вариантах осуществления ингибитор MEK или траметиниб и ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекулу антитела против PD-1), вводят в дозе и/или согласно временной схеме, которые в комбинации обеспечивают требуемую противоопухолевую активность.
В одном варианте осуществления ингибитор MEK или траметиниб вводят в дозе от 0,2 мг до 5 мг, например, от 0,3 мг до 4 мг, от 0,4 мг до 3 мг, от 0,5 мг до 2 мг, от 1 мг до 1,5 мг, от 1,5 мг до 2 мг или от 0,4 мг до 0,6 мг, например, в дозе 0,2 мг, 0,5 мг, 1 мг, 1,5 мг, 2 мг, 2,5 мг, 3 мг, 4 мг или 5 мг, например, два раза в день, один раз в день, один раз в два дня, один раз в три дня или один раз в неделю.
В одном варианте осуществления ингибитор MEK или траметиниб вводят в дозе от 0,4 мг до 0,6 мг (например, в дозе 0,5 мг) один раз в день. В другом варианте осуществления ингибитор MEK или траметиниб вводят в дозе от 1 мг до 3 мг (например, в дозе 2 мг) один раз в день. В некоторых вариантах осуществления ингибитор MEK или траметиниб вводят перорально. В одном варианте осуществления ингибитор MEK или траметиниб вводят в дозе от 0,4 мг до 0,6 мг (например, в дозе 0,5 мг), например, один раз в день, например, перорально, и ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе от 300 мг до 500 мг (например, дозе 400 мг), например, один раз в 4 недели, например, путем внутривенной инфузии. В одном варианте осуществления ингибитор MEK или траметиниб вводят в дозе от 1 мг до 3 мг (например, в дозе 2 мг), например, один раз в день, например, перорально, и ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе от 300 мг до 500 мг (например, дозе 400 мг), например, один раз в 4 недели или один раз в 8 недель, например, путем внутривенной инфузии.
В одном варианте осуществления ингибитор MEK или траметиниб применяют в комбинации с ингибитором PD-1 (например, молекулой антитела против PD-1) для лечения меланомы (например, метастатической или неоперабельной меланомы), рака толстой и прямой кишки (CRC), рака легкого (например, немелкоклеточного рака легкого (НМРЛ)) или рака молочной железы (например, трижды негативного рака молочной железы (ТНРМЖ)). В некоторых вариантах осуществления меланома имеет мутацию BRAF, например, мутацию BRAF V600. В некоторых вариантах осуществления комбинация дополнительно включает ингибитор BRAF, например, дабрафениб. В некоторых вариантах осуществления комбинация применяется для лечения субъекта, имеющего повышенный уровень ЛДГ в сыворотке по сравнению с референсным уровнем ЛДГ в сыворотке.
В некоторых вариантах осуществления комбинация включает ингибитор JAK2, например, CEP-701, INCB18424, CP-690550 (тазоцитиниб).
В некоторых вариантах осуществления комбинация включает паклитаксел или средство на основе паклитаксела, например, Таксол®, белок-связанный паклитаксел (например, Абраксан®).
Лучевую терапию могут применять с помощью одного из более способов или комбинации способов, включающих, без ограничения, дистанционную лучевую терапию, внутреннюю лучевую терапию, имплантационное облучение, стереотаксическую радиохирургию, системную лучевую терапию, радиотерапию и постоянную или временную интерстициальную брахитерапию.
Раскрытые комбинации могут применять в комбинации с одной или более существующих методов лечения онкологических заболеваний, включающих, без ограничения перечисленными: хирургическое вмешательство, лучевую терапию (например, дистанционную лучевую терапию, которая включает трехмерную, конформную лучевую терапию, в которой полем облучения обозначено, локальное облучение (например, облучение, направленное на предварительно выбранную мишень или орган) или фокусированное облучение). Фокусированное облучение может быть выбрано из группы, состоящей из стереотаксической радиохирургии, фракционированной стереотаксической радиохирургии и лучевой терапии с модулируемой интенсивностью. При фокусированном облучении источник излучения может быть выбран из группы, состоящей из пучка частиц (протонов), кобальта-60 (фотонов) и линейного ускорителя (рентгеновского излучения), например, как описано в WO 2012/177624.
В некоторых вариантах осуществления комбинации включают антитело против иммуноглобулин-подобных рецепторов киллерных клеток (также называемое в настоящей заявке "антителом против KIR"), пан-KIR антитело, антитело против NKG2D и антитело против MICA. В некоторых вариантах осуществления комбинация молекулы антитела против PD-1 и антитела против KIR, пан-KIR антитела или антитела против NKG2D, описанных в настоящей заявке, применяется для лечения рака, например, рака, описанного в настоящей заявке (например, солидной опухоли, например, распространенной солидной опухоли).
В одном варианте осуществления комбинация включает клеточную иммунотерапию (например, Provenge (например, Сипулейцел)) и, необязательно, в комбинации с циклофосфамидом. В некоторых вариантах осуществления комбинация молекулы антитела против PD-1, Provenge и/или циклофосфамида применяется для лечения рака, например, рака, описанного в настоящей заявке (например, рака предстательной железы, например, распространенного рака предстательной железы).
В другом варианте осуществления комбинация включает вакцину, например, вакцину на основе дендритных клеток против почечноклеточной карциномы (DC-RCC). В некоторых вариантах осуществления комбинация молекулы антитела против PD-1 и вакцины DC-RCC применяется для лечения рака, например, рака, описанного в настоящей заявке (например, рака почки, например, метастатической почечно-клеточной карциномы (RCC) или светлоклеточной почечно-клеточной карциномы (CCRCC)).
В еще одном варианте осуществления молекулу антитела против PD-1, отдельно или в комбинации с другим иммуномодулятором (например, молекулой антитела против LAG-3, против PD-L1 или против TIM-3), применяют в комбинации с химиотерапией и/или иммунотерапией. Например, молекула антитела против PD-1 может применяться для лечения миеломы, отдельно или в комбинации с одним или более из: химиотерапии или других противоопухолевых средств (например, аналогов талидомида, например, леналидомида), антитела против TIM-3, сенсибилизированных опухолевым антигеном дендритных клеток, слияний (например, электрослияний) опухолевых клеток и дендритных клеток, или вакцинации с использованием идиотипа иммуноглобулина, продуцируемого злокачественными плазматическими клетками. В одном варианте осуществления молекула антитела против PD-1 применяется в комбинации с антителом против TIM-3 для лечения миеломы, например, множественной миеломы.
В одном варианте осуществления молекулу антитела против PD-1, отдельно или в комбинации с другим иммуномодулятором (например, молекулой антитела против LAG-3, против PD-L1 или против TIM-3), применяют в комбинации с химиотерапией для лечения рака легкого, например, немелкоклеточного рака легкого. В одном варианте осуществления молекула антитела против PD-1 применяется с двойной терапией препаратами платины для лечения рака легкого.
В еще одном варианте осуществления молекула антитела против PD-1, отдельно или в комбинации с другим иммуномодулятором (например, молекулой антитела против LAG-3, против PD-L1 или против TIM-3), применяют для лечения рака почки, например, почечно-клеточной карциномы (RCC) (например, светлоклеточной почечно-клеточной карциномы (CCRCC), несветлоклеточной почечно-клеточной карциномы (nccRCC) или метастатической RCC). Молекулу антитела против PD-1 можно применять в комбинации с одним или более из: иммунной стратегии (например, интерлейкина-2 или интерферона-α), средства направленного действия (например, ингибитора VEGF, такого как моноклональное антитело против VEGF), ингибитора тирозинкиназы VEGF, такого как сунитиниб, сорафениб, акситиниб и пазопаниб, ингибитора РНКи) или ингибитора нижестоящего медиатора по пути сигнализации VEGF, например, ингибитора мишени рапамицина у млекопитающих (mTOR), например, эверолимуса и темсиролимуса. В некоторых вариантах осуществления комбинация включает сорафениб, например, для лечения рака, описанного в настоящей заявке, например, рака печени (например, гепатоцеллюлярной карциномы).
Пример подходящих терапевтических средств для применения в комбинации с молекулами антитела против PD-1, описанного в настоящей заявке, отдельно или в комбинации с другим иммуномодулятором (например, молекулой антитела против LAG-3, против PD-L1 или против TIM-3), для лечения рака поджелудочной железы включает, без ограничения перечисленным, химиотерапевтическое средство, например, паклитаксел или средство на основе паклитаксела (например, лекарственную форму паклитаксела, такую как Таксол, лекарственную форму паклитаксела в виде стабилизированных альбумином наночастиц (например, Абраксан) или липосомальную лекарственную форму паклитаксела), гемцитабин (например, гемцитабин отдельно или в комбинации с АХР107-11), другие химиотерапевтические средства, такие как оксалиплатин, 5-фторурацил, капецитабин, рубитекан, эпирубицина гидрохлорид, NC-6004, цисплатин, доцетаксел (например, Таксотер), митомицин C, ифосфамид; интерферон; ингибитор тирозинкиназы (например, ингибитор EGFR (например, эрлотиниб, панитумумаб, цетуксимаб, нимотузумаб); ингибитор рецептора HER2/Neu (например, трастузумаб); двойной ингибитор киназ (например, бозутиниб, саракатиниб, лапатиниб, вандетаниб); мультикиназный ингибитор (например, сорафениб, сунитиниб, XL184, пазопаниб); ингибитор VEGF (например, бевацизумаб, AV-951, бриваниб); радиоиммунотерапию (например, XR303), противоопухолевую вакцину (например, GVAX, пептид сурвивина); ингибитор ЦОГ-2 (например, целекоксиб); ингибитор рецептора IGF-1 (например, AMG 479, МК-0646); ингибитор mTOR (например, эверолимус, темсиролимус); ингибитор IL-6 (например, CNTO 328); ингибитор циклин-зависимой киназы (например, Р276-00, UCN-01); соединение, направленное на измененный энергетический метаболизм (AEMD) (например, CPI-613); ингибитор HDAC (например, вориностат); агонист TRAIL-рецептора 2 (TR-2) (например, конатумумаб); ингибитор МЕК (например, AS703026, селуметиниб, GSK1120212); двойной ингибитор киназы Raf/MEK (например, R05126766); ингибитор сигнального пути Notch (например, MK0752); слитый белок моноклонального антитела-антитела (например, L19IL2); куркумин; ингибитор HSP90 (например, танеспимицин, STA-9090); rIL-2, денилейкин дифтитокс; ингибитор топоизомеразы 1 (например, иринотекан, РЕР02); статин (например, симвастатин); ингибитор фактора VIIa (например, PCI-27483); ингибитор АКТ (например, RX-0201); активируемое гипоксией пролекарство (например, ТН-302); метформина гидрохлорид, ингибитор гамма-секретазы (например, RO4929097); ингибитор рибонуклеотидредуктазы (например, 3-АР); иммунотоксин (например, HuC242-DM4); ингибитор PARP (например, KU-0059436, велипариб); ингибитор CTLA-4 (например, СР-675206, ипилимумаб); AdV-tk терапия; ингибитор протеасом (например, бортезомиб (Велкейд), NPI-0052); тиазолидиндион (например, пиоглитазон); NPC-1C; ингибитор Aurora-киназы (например, R763/AS703569), ингибитор CTGF (например, FG-3019); siG12D-LODER; и лучевую терапию (например, томотерапию, стереотактическое облучение, протонную терапию), хирургическое вмешательство и их комбинацию. В некоторых вариантах осуществления может применяться комбинация паклитаксела или средства на основе паклитаксела и гемцитабина с молекулами антитела против PD-1, описанного в настоящей заявке.
Пример подходящих терапевтических средств для применения в комбинации с молекулами антитела против PD-1, отдельно или в комбинации с другим иммуномодулятором (например, молекулой антитела против LAG-3, против PD-L1 или против TIM-3), для лечения мелкоклеточного рака легкого включает, без ограничения перечисленным, химиотерапевтическое средство, например, этопозид, карбоплатин, цисплатин, оксалиплатин, иринотекан, топотекан, гемцитабин, липосомальный SN-38, бендамустин, темозоломид, белотекан, NK012, FR901228, флавопиридол); ингибитор тирозинкиназы (например, ингибитор EGFR (например, эрлотиниб, гефитиниб, цетуксимаб, панитумумаб); мультикиназный ингибитор (например, сорафениб, сунитиниб); ингибитор VEGF (например, бевацизумаб, вандетаниб); противоопухолевую вакцину (например, GVAX); ингибитор Всl-2 (например, облимерсен натрия, АВТ-263); ингибитор протеасом (например, бортезомиб (Велкейд), NPI-0052), паклитаксел или средство на основе паклитаксела; доцетаксел; ингибитор рецептора IGF-1 (например, AMG 479); ингибитор HGF/SF (например, AMG 102, MK-0646); хлорохин; ингибитор Aurora-киназы (например, MLN8237); радиоиммунотерапию (например, TF2); ингибитор HSP90 (например, танеспимицин, STA-9090); ингибитор mTOR (например, эверолимус); биспецифичное антитело к Ep-CAM/CD3 (например, МТ110); ингибитор CK-2 (например, СХ-4945); ингибитор HDAC (например, белиностат); антагонист SMO (например, BMS 833923); пептидную противоопухолевую вакцину и лучевую терапию (например, лучевую терапию с модулируемой интенсивностью (IMRT), гипофракционированную лучевую терапию, гипоксия-направляемую лучевую терапию), хирургическое вмешательство и их комбинации.
Пример подходящих терапевтических средств для применения в комбинации с молекулами антитела против PD-1, отдельно или в комбинации с другим иммуномодулятором (например, молекулой антитела против LAG-3, против PD-L1 или против TIM-3), для лечения немелкоклеточного рака легкого включает, без ограничения перечисленным, химиотерапевтическое средство, например, винорелбин, цисплатин, доцетаксел, пеметрексед динатрия, этопозид, гемцитабин, карбоплатин, липосомальный SN-38, TLK286, темозоломид, топотекан, пеметрексед динатрия, азацитидин, иринотекан, тегафур-гимерацил-отерацил калия, сапацитабин); ингибитор тирозинкиназы (например, ингибитор EGFR (например, эрлотиниб, гефитиниб, цетуксимаб, панитумумаб, нецитумумаб, PF-00299804, нимотузумаб, RO5083945), ингибитор МЕТ (например, PF-02341066, ARQ 197), ингибитор киназы PI3K (например, XL147, GDC-0941), двойной ингибитор киназы Raf/MEK (например, RO5126766), двойной ингибитор киназы PI3K/mT0R (например, XL765), ингибитор SRC (например, дазатиниб), двойной ингибитор (например, BIBW 2992, GSK1363089, ZD6474, AZD0530, AG-013736, лапатиниб, MEHD7945A, линифаниб), мультикиназный ингибитор (например, сорафениб, сунитиниб, пазопаниб, AMG 706, XL184, MGCD265, BMS-690514, R935788), ингибитор VEGF (например, эндостар, эндостатин, бевацизумаб, цедираниб, BIBF 1120, акситиниб, тивозаниб, AZD2171), противоопухолевую вакцину (например, липосомную вакцину BLP25, GVAX, рекомбинантную ДНК и аденовирус, экспрессирующий белок L523S), ингибитор Всl-2 (например, облимерсен натрия), ингибитор протеасом (например, бортезомиб, карфилзомиб, NPI-0052, MLN9708), паклитаксел или средство на основе паклитаксела, доцетаксел, ингибитор рецептора IGF-1 (например, циксутумумаб, MK-0646, OSI 906, СР-751,871, BIIB022), гидроксихлорохин, ингибитор HSP90 (например, танеспимицин, STA-9090, AUY922, XL888), ингибитор mTOR (например, эверолимус, темсиролимус, ридафоролимус), биспецифичное антитело к Ep-CAM/CD3 (например, МТ110), ингибитор CK-2 (например, СХ-4945), ингибитор HDAC (например, MS 275, LBH589, вориностат, вальпроевую кислоту, FR901228), ингибитор DHFR (например, пралатрексат), ретиноид (например, бексаротен, третиноин), конъюгат антитела-лекарственного средства (например, SGN-15), бисфосфонат (например, золедроновую кислоту), противоопухолевую вакцину (например, белагенпуматуцел-L), низкомолекулярный гепарин (НМГ) (например, тинзапарин, эноксапарин), GSK1572932A, мелатонин, талактоферрин, димесна, ингибитор топоизомеразы (например, амрубицин, этопозид, каренитецин), нелфинавир, циленгитид, ингибитор ErbB3 (например, ММ-121, U3-1287), ингибитор сурвивина (например, YM155, LY2181308), эрибулина мезилат, ингибитор ЦОГ-2 (например, целекоксиб), пэгфилграстим, ингибитор Polo-подобной киназы 1 (например, BI 6727), агонист TRAIL-рецептора 2 (TR-2) (например, CS-1008), конъюгат пептида CNGRC (SEQ ID NO:225) ФНО альфа, дихлорацетат (DCA), ингибитор HGF (например, SCH 900105), SAR240550, агонист PPAR-гамма (например, CS-7017), ингибитор гамма-секретазы (например, RO4929097), эпигенетическую терапию (например, 5-азацитидин), нитроглицерин, ингибитор MEK (например, AZD6244), ингибитор циклин-зависимой киназы (например, UCN-01), холестерин-Fus1, антимикротубулиновое средство (например, Е7389), ингибитор фарнезил-OH-трансферазы (например, лонафарниб), иммунотоксин (например, ВВ-10901, SS1 (dsFv) РЕ38), фондапаринукс, средство, разрушающие сосуды (например, AVE8062), ингибитор PD-L1 (например, MDX-1105, MDX-1106), бета-глюкан, NGR-hTNF, EMD 521873, ингибитор MEK (например, GSK1120212), аналог эпотилона (например, иксабепилон), ингибитор кинезинового веретена (например, 4SC-205), средство, направленно взаимодействующее с теломерами (например, KML-001), ингибитор пути Р70 (например, LY2584702), ингибитор AKT (например, MK-2206), ингибитор ангиогенеза (например, леналидомид), ингибитор сигнального пути Notch (например, OMP-21М18), лучевую терапию, хирургическое вмешательство и их комбинации.
Пример подходящих терапевтических средств для применения в комбинации с молекулами антитела против PD-1, отдельно или в комбинации с другим иммуномодулятором (например, молекулой антитела против LAG-3, против PD-L1 или против TIM-3), для лечения рака яичника включает, без ограничения перечисленным, химиотерапевтическое средство (например, паклитаксел или средство на основе паклитаксела; доцетаксел; карбоплатин; гемцитабин; доксорубицин; топотекан; цисплатин, иринотекан, TLK286, ифосфамид, олапариб, оксалиплатин, мелфалан, пеметрексед динатрия, SJG-136, циклофосфамид, этопозид, децитабин); антагонист грелина (например, AEZS-130), иммунотерапию (например, АРС8024, ореговомаб, ОРТ-821), ингибитор тирозинкиназы (например, ингибитор EGFR (например, эрлотиниб), двойной ингибитор (например, Е7080), мультикиназный ингибитор (например, AZD0530, JI-101, сорафениб, сунитиниб, пазопаниб), ON 01910.Na), ингибитор VEGF (например, бевацизумаб, BIBF 1120, цедираниб, AZD2171), ингибитор PDGFR (например, IMC-3G3), паклитаксел, ингибитор топоизомеразы (например, каренитецин, иринотекан), ингибитор HDAC (например, вальпроат, вориностат), ингибитор рецептора фолата (например, фарлетузумаб), ингибитор ангиопоэтина (например, AMG 386), аналог эпотилона (например, иксабепилон), ингибитор протеасом (например, карфлизомиб), ингибитор рецептора IGF-1 (например, OSI 906, AMG 479), ингибитор PARP (например, велипариб, AG014699, инипариб, MK-4827), ингибитор Aurora-киназы (например, MLN8237, ENMD-2076), ингибитор ангиогенеза (например, леналидомид), ингибитор DHFR (например, пралатрексат), радиоиммунотерапию (например, Hu3S193), статин (например, ловастатин), ингибитор топоизомеразы 1 (например, NKTR-102), противоопухолевую вакцину (например, вакцину на основе длинных синтетических пептидов р53, аутологичную OC-DC вакцину), ингибитор mTOR (например, темсиролимус, эверолимус), ингибитор BCR/ABL (например, иматиниб), антагонист рецепторов ET-A (например, ZD4054), агонист TRAIL-рецептора 2 (TR-2) (например, CS-1008), ингибитор HGF/SF (например, AMG 102), EGEN-001, ингибитор Polo-подобной киназы 1 (например, BI 6121), ингибитор гамма-секретазы (например, RO4929097), ингибитор Wee-1 (например, MK-1775), антимикротубулиновое средство (например, винорелбин, Е7389), иммунотоксин (например, денилейкин дифтитокс), SB-485232, средство, разрушающее сосуды (например, AVE8062), ингибитор интегрина (например, EMD 525797), ингибитор кинезинового веретена (например, 4SC-205), ревлимид, ингибитор HER2 (например, MGAH22), ингибитор ErrB3 (например, MM-121), лучевую терапию; и их комбинации.
В одном примере осуществления молекулу антитела против PD-1, отдельно или в комбинации с другим иммуномодулятором (например, молекулой антитела против LAG-3, против PD-L1 или против TIM-3), применяют для лечения миеломы, отдельно или в комбинации с одним или более из: химиотерапии или других противоопухолевых средств (например, аналогов талидомида, например, леналидомида), HSCT (Cook, R. (2008) J Manag Care Pharm. 14(7 Suppl):19-25), антитела против TIM-3 (Hallett, WHD et al. (2011) J of American Society for Blood and Marrow Transplantation 17(8):1133-145), сенсибилизированных опухолевым антигеном дендритных клеток, слияний (например, электрослияний) опухолевых клеток и дендритных клеток, или вакцинации идиотипом иммуноглобулина, продуцируемым злокачественными плазматическими клетками (см. обзор Yi, Q. (2009) Cancer J. 15(6):502-10).
В еще одном варианте осуществления молекулу антитела против PD-1, отдельно или в комбинации с другим иммуномодулятором (например, молекулой антитела против LAG-3, против PD-L1 или против TIM-3), применяют для лечения рака почки, например, почечно-клеточной карциномы (RCC), несветлоклеточной почечно-клеточной карциномы или метастатической RCC. Молекулу антитела против PD-1 могут применять в комбинации с одним или более из: иммунной стратегии (например, интерлейкина-2 или интерферона-α), средства направленного действия (например, ингибитора VEGF, такого как моноклональное антитело к VEGF, например, бевацизумаб (Rini, B.I. et al. (2010) J. Clin. Oncol. 28(13):2137-2143)); ингибитора тирозинкиназы VEGF, такого как сунитиниб, сорафениб, акситиниб и пазопаниб (см. обзор Pal. S.K. et al. (2014) Clin. Advances in Hematology & Oncology 12(2):90-99)); ингибитора РНКи) или ингибитора нижестоящего медиатора сигнализации VEGF, например, ингибитора мишени рапамицина у млекопитающих (mTOR), например, эверолимуса и темсиролимуса (Hudes, G. et al. (2007) N. Engl. J. Med. 356(22):2271-2281, Motzer, R.J. et al. (2008) Lancet 372: 449-456).
Пример подходящих терапевтических средств для применения в комбинациях, описанных в настоящей заявке, например, комбинациях с молекулами антитела против PD-1, описанного в настоящей заявке, отдельно или в комбинации с другим иммуномодулятором (например, молекулой антитела против LAG-3, против PD-L1 или против TIM-3), для лечения хронического миелогенного лейкоза (ОМЛ) согласно изобретению включает, без ограничения перечисленным, химиотерапевтическое средство (такое как цитарабин, гидроксимочевину, клофарабин, мелфалан, тиотепа, флударабин, бусульфан, этопозид, кордицепин, пентостатин, капецитабин, азацитидин, циклофосфамид, кладрибин, топотекан), ингибитор тирозинкиназы (например, ингибитор BCR/ABL (например, иматиниб, нилотиниб), ON 01910.Na, двойной ингибитор (например, дазатиниб, бозутиниб), мультикиназный ингибитор (например, DCC-2036, понатиниб, сорафениб, сунитиниб, RGB-286638)), интерферон-альфа, стероиды, апоптическое средство (например, омацетаксин мепесукцинат), иммунотерапию (например, аллогенные CD4+ Th1-подобные T-клетки памяти/связанные с микрочастицами антитела против CD3/против CD28, аутологичные цитокин-индуцированные клетки-киллеры (CIK), AHN-12), средство, направленно взаимодействующее с CD52 (например, алемтузумаб), ингибитор HSP90 (например, танеспимицин, STA-9090, AUY922, XL888), ингибитор mTOR (например, эверолимус), антагонист SMO (например, BMS 833923), ингибитор рибонуклеотидредуктазы (например, 3-АР), ингибитор JAK-2 (например, INCB018424), гидроксихлорохин, ретиноид (например, фенретинид), ингибитор циклин-зависимой киназы (например, UCN-01), ингибитор HDAC (например, белиностат, вориностат, JNJ-26481585), ингибитор PARP (например, велипариб), антагонист MDM2 (например, RO5045337), ингибитор Aurora-В киназы (например, ТАК-901), радиоиммунотерапию (например, меченое актинием-225 антитело против CD33, HuM195), ингибитор Hedgehog (например, PF-04449913), ингибитор STAT3 (например, ОРВ-31121), КВ004, противоопухолевую вакцину (например, AG858), трансплантацию костного мозга, трансплантацию стволовых клеток, лучевую терапию и их комбинации.
Пример подходящих терапевтических средств для применения в комбинациях, описанных в настоящей заявке, например, комбинациях с молекулами антитела против PD-1, описанного в настоящей заявке, отдельно или в комбинации с другим иммуномодулятором (например, молекулой антитела против LAG-3, против PD-L1 или против TIM-3), для лечения хронического лимфоцитарного лейкоза (ХЛЛ) включает, без ограничения перечисленным, химиотерапевтическое средство (например, флударабин, циклофосфамид, доксорубицин, винкристин, хлорамбуцил, бендамустин, хлорамбуцил, бусульфан, гемцитабин, мелфалан, пентостатин, митоксантрон, 5-азацитидин, пеметрексед динатрия), ингибитор тирозинкиназы (например, ингибитор EGFR (например, эрлотиниб), ингибитор BTK (например, PCI-32765), мультикиназный ингибитор (например, MGCD265, RGB-286638), средство, направленно взаимодействующее с CD-20 (например, ритуксимаб, офатумумаб, RO5072759, LFB-R603), средство, направленно взаимодействующее с CD52 (например, алемтузумаб), преднизолон, дарбэпоэтин альфа, леналидомид, ингибитор Всl-2 (например, АВТ-263), иммунотерапию (например, аллогенные CD4+ Th1-подобные T-клетки памяти/связанные с микрочастицами антитела против CD3/против CD28, аутологичные цитокин-индуцированные клетки-киллеры (CIK)), ингибитор HDAC (например, вориностат, вальпроевую кислоту, LBH589, JNJ-26481585, AR-42), ингибитор XIАР (например, AEG35156), средство, направленно взаимодействующее с CD-74 (например, милатузумаб), ингибитор mTOR (например, эверолимус), АТ-101, иммунотоксин (например, CAT-8015, антитело к Тас(Fv)-РЕ38 (LMB-2)), средство, направленно взаимодействующее с CD37 (например, TRU-016), радиоиммунотерапию (например, I131-тозитумомаб), гидроксихлорохин, перифозин, ингибитор SRC (например, дазатиниб), талидомид, ингибитор PI3K дельта (например, CAL-101), ретиноид (например, фенретинид), антагонист MDM2 (например, RO5045337), плериксафор, ингибитор Aurora-киназы (например, MLN8237, ТАК-901), ингибитор протеасом (например, бортезомиб), средство, направленно взаимодействующее с CD-19 (например, MEDI-551, MOR208), ингибитор MEK (например, ABT-348), ингибитор JAK-2 (например, INCB018424), активируемое гипоксией пролекарство (например, ТН-302), паклитаксел или средство на основе паклитаксела, ингибитор HSP90, ингибитор AKT (например, MK2206), ингибитор ГМГ-КоА-редуктазы (например, симвастатин), GNKG186, лучевую терапию, трансплантацию костного мозга, трансплантацию стволовых клеток и их комбинацию.
Пример подходящих терапевтических средств для применения в комбинациях, описанных в настоящей заявке, например, комбинациях с молекулами антитела против PD-1, описанного в настоящей заявке, отдельно или в комбинации с другим иммуномодулятором (например, молекулой антитела против LAG-3, против PD-L1 или против TIM-3), для лечения острого лимфоцитарного лейкоза (ОЛЛ) включает, без ограничения перечисленными, химиотерапевтическое средство (например, преднизолон, дексаметазон, винкристин, аспарагиназу, даунорубицин, циклофосфамид, цитарабин, этопозид, тиогуанин, меркаптопурин, клофарабин, липосомальный аннамицин, бусульфан, этопозид, капецитабин, децитабин, азацитидин, топотекан, темозоломид), ингибитор тирозинкиназы (например, ингибитор BCR/ABL (например, иматиниб, нилотиниб), ON 01910.Na, мультикиназный ингибитор (например, сорафениб)), средство, направленно взаимодействующее с CD-20 (например, ритуксимаб), средство, направленно взаимодействующее с CD52 (например, алемтузумаб), ингибитор HSP90 (например, STA-9090), ингибитор mTOR (например, эверолимус, рапамицин), ингибитор JAK-2 (например, INCB018424), ингибитор рецептора HER2/Neu (например, трастузумаб), ингибитор протеасом (например, бортезомиб), метотрексат, аспарагиназу, средство, направленно взаимодействующее с CD-22 (например, эпратузумаб, инотузомаб), иммунотерапию (аутологичные цитокин-индуцированные клетки-киллеры (CIK), AHN-12), блинатумомаб, ингибитор циклин-зависимой киназы (например, UCN-01), средство, направленно взаимодействующее с CD45, (например, BC8), антагонист MDM2 (например, RO5045337), иммунотоксин (например, CAT-8015, DT2219ARL), ингибитор HDAC (например, JNJ-26481585), JVRS-100, паклитаксел или средство на основе паклитаксела, ингибитор STAT3 (например, OPB-31121), ингибитор PARP (например, велипариб), EZN-2285, лучевую терапию, стероид, трансплантацию костного мозга, трансплантацию стволовых клеток или их комбинацию.
Пример подходящих терапевтических средств для применения в комбинациях, описанных в настоящей заявке, например, комбинациях с молекулами антитела против PD-1, описанного в настоящей заявке, отдельно или в комбинации с другим иммуномодулятором (например, молекулой антитела против LAG-3, против PD-L1 или против TIM-3), для лечения острого миелоидного лейкоза (ОМЛ), включает, без ограничения перечисленным, химиотерапевтическое средство (например, цитарабин, даунорубицин, идарубицин, клофарабин, децитабин, возароксин, азацитидин, клофарабин, рибавирин, СРХ-351, треосульфан, элацитарабин, азацитидин), ингибитор тирозинкиназы (например, ингибитор BCR/ABL (например, иматиниб, нилотиниб), ON 01910.Na, мультикиназный ингибитор (например, мидостаурин, SU 11248, квизартиниб, сорафиниб)), иммунотоксин (например, гемтузумаб озогамицин), слитый белок DT388IL3, ингибитор HDAC (например, вориностат, LBH589), плериксафор, ингибитор mTOR (например, эверолимус), ингибитор SRC (например, дазатиниб), ингибитор HSP90 (например, STA-9090), ретиноид (например, бексаротен, ингибитор Aurora-киназы (например, BI 811283), ингибитор JAK-2 (например, INCB018424), ингибитор Polo-подобной киназы (например, BI 6727), ценерсен, средство, направленно взаимодействующее с CD45 (например, BC8), ингибитор циклин-зависимой киназы (например, UCN-01), антагонист MDM2 (например, RO5045337), ингибитор mTOR (например, эверолимус), LY573636-натрий, ZRx-101, MLN4924, леналидомид, иммунотерапию (например, AHN-12), гистамина дигидрохлорид, лучевую терапию, трансплантацию костного мозга, трансплантацию стволовых клеток и их комбинацию.
Пример подходящих терапевтических средств для применения в комбинациях, описанных в настоящей заявке, например, комбинациях с молекулами антитела против PD-1, описанного в настоящей заявке, отдельно или в комбинации с другим иммуномодулятором (например, молекулой антитела против LAG-3, против PD-L1 или против TIM-3), для лечения множественной миеломы (MM) включает, без ограничения перечисленным, химиотерапевтическое средство (например, мелфалан, амифостин, циклофосфамид, доксорубицин, клофарабин, бендамустин, флударабин, адриамицин, SyB L-0501), талидомид, леналидомид, дексаметазон, преднизон, помалидомид, ингибитор протеасом (например, бортезомиб, карфилзомиб, MLN9708), противоопухолевую вакцину (например, GVAX), средство, направленно взаимодействующее с CD-40 (например, SGN-40, CHIR-12.12), перифозин, золедроновую кислоту, иммунотерапию (например, MAGE-A3, NY-ESO-1, HuMax-CD38), ингибитор HDAC (например, вориностат, LBH589, AR-42), аплидин, ингибитор циклин-зависимой киназы (например, PD-0332991, динациклиб), триоксид мышьяка, СВ3304, ингибитор HSP90 (например, KW-2478), ингибитор тирозинкиназы (например, ингибитор EGFR (например, цетуксимаб), мультикиназный ингибитор (например, АТ9283)), ингибитор VEGF (например, бевацизумаб), плериксафор, ингибитор MEK (например, AZD6244), IPH2101, аторвастатин, иммунотоксин (например, ВВ-10901), NPI-0052, радиоиммунотерапевтическое средство (например, иттрий Y90 ибритумомаб тиуксетан), ингибитор STAT3 (например, OPB-31121), MLN4924, ингибитор Aurora-киназы (например, ENMD-2076), IMGN901, ACE-041, ингибитор CK-2 (например, CX-4945), лучевую терапию, трансплантацию костного мозга, трансплантацию стволовых клеток и их комбинацию.
Пример подходящих терапевтических средств для применения в комбинациях, описанных в настоящей заявке, например, комбинациях с молекулами антитела против PD-1, описанного в настоящей заявке, отдельно или в комбинации с другим иммуномодулятором (например, молекулой антитела против LAG-3, против PD-L1 или против TIM-3), для лечения рака предстательной железы включает, без ограничения перечисленными, химиотерапевтическое средство (например, доцетаксел, карбоплатин, флударабин), абиратерон, гормональную терапию (например, флутамид, бикалутамид, нилутамид, ципротерона ацетат, кетоконазол, аминоглутетимид, абареликс, дегареликс, лейпролид, гозерелин, трипторелин, бусерелин), ингибитор тирозинкиназы (например, двойной ингибитор киназы (например, лапатаниб), мультикиназный ингибитор (например, сорафениб, сунитиниб)), ингибитор VEGF (например, бевацизумаб), TAK-700, противоопухолевую вакцину (например, BPX-101, PEP223), леналидомид, TOK-001, ингибитор рецептора IGF-1 (например, циксутумумаб), TRC105, ингибитор Aurora-киназы (например, MLN8237), ингибитор протеасом (например, бортезомиб), OGX-011, радиоиммунотерапию (например, HuJ591-GS), ингибитор HDAC (например, вальпроевую кислоту, SB939, LBH589), гидроксихлорохин, ингибитор mTOR (например, эверолимус), довитиниба лактат, дииндолилметан, эфавиренц, OGX-427, генистеин, IMC-3G3, бафетиниб, СР-675,206, лучевую терапию, хирургическое вмешательство или их комбинацию.
Пример подходящих терапевтических средств для применения в комбинациях, описанных в настоящей заявке, например, комбинациях с молекулами антитела против PD-1, описанного в настоящей заявке, отдельно или в комбинации с другим иммуномодулятором (например, молекулой антитела против LAG-3, против PD-L1 или против TIM-3), для лечения HNSCC включает, без ограничения перечисленным, одно или оба из Соединения A8, описанного в настоящей заявке (или соединения, описанного в публикации PCT WO2010/029082) и цетуксимаба (например, Эрбитукса, выпускаемого BMS). В некоторых вариантах осуществления терапевтическое средство (например, Соединение A8 или соединение, родственное A8) является модулятором PI3K, например, ингибитором PI3K. В некоторых вариантах осуществления терапевтическое средство (например, цетуксимаб) модулирует, например ингибирует, EGFR. В некоторых вариантах осуществления рак имеет, или идентифицирован как имеющий, повышенные уровни или активность PI3K или EGFR по сравнению с контрольной клеткой или референсным значением.
Пример подходящих терапевтических средств для применения в комбинациях, описанных в настоящей заявке, например, комбинациях с молекулами антитела против PD-1, описанного в настоящей заявке, отдельно или в комбинации с другим иммуномодулятором (например, молекулой антитела против LAG-3, против PD-L1 или против TIM-3), для лечения рака желудка, например, MSI-H и/или EBV+ рака желудка, включает, без ограничения перечисленным, Соединение A8, описанное в настоящей заявке (или соединение, описанное в публикации PCT WO2010/029082). В некоторых вариантах осуществления терапевтическое средство (например, Соединение A8 или соединение, родственное A8) является модулятором PI3K, например, ингибитором PI3K. В некоторых вариантах осуществления, рак имеет, или идентифицирован как имеющий, повышенные уровни или активность PI3K по сравнению с контрольной клеткой или референсным значением.
Пример подходящих терапевтических средств для применения в комбинациях, описанных в настоящей заявке, например, комбинациях с молекулами антитела против PD-1, описанного в настоящей заявке, отдельно или в комбинации с другим иммуномодулятором (например, молекулой антитела против LAG-3, против PD-L1 или против TIM-3), для лечения рака желудка, например, MSI-H и/или RNF43-инактивированного рака желудка, включает, без ограничения перечисленным, Соединение A28, описанное в настоящей заявке (или соединение, описанное в публикации PCT WO2010/101849). В некоторых вариантах осуществления терапевтическое средство (например, Соединение A28 или соединение, родственное A28), является модулятором, например ингибитором, поркупина. В некоторых вариантах осуществления рак имеет, или идентифицирован как имеющий, повышенные уровни или активность поркупина по сравнению с контрольной клеткой или референсным значением.
Пример подходящих терапевтических средств для применения в комбинациях, описанных в настоящей заявке, например, комбинациях с молекулами антитела против PD-1, описанного в настоящей заявке, отдельно или в комбинации с другим иммуномодулятором (например, молекулой антитела против LAG-3, против PD-L1 или против TIM-3), для лечения стромальной опухоли ЖКТ (GIST), включает, без ограничения перечисленным, Соединение A16, описанное в настоящей заявке (или соединение, описанное в публикации PCT WO1999/003854). В некоторых вариантах осуществления терапевтическое средство (например, Соединение A16 или соединение, родственное A16) является модулятором, например ингибитором, тирозинкиназы. В некоторых вариантах осуществления рак имеет, или определен как имеющий, повышенные уровни или активность тирозинкиназы по сравнению с контрольной клеткой или референсным значением.
Пример подходящих терапевтических средств для применения в комбинациях, описанных в настоящей заявке, например, комбинациях с молекулами антитела против PD-1, описанного в настоящей заявке, отдельно или в комбинации с другим иммуномодулятором (например, молекулой антитела против LAG-3, против PD-L1 или против TIM-3), для лечения НМРЛ, например, плоскоклеточного или аденокарциномы, включает, без ограничения перечисленным, одно или оба из Соединения A17, описанного в настоящей заявке (или соединения, описанного в патенте США 7,767,675 и 8,420,645) и Соединения A23, описанного в настоящей заявке (или соединения, описанного в публикации PCT WO2003/077914). В некоторых вариантах осуществления соединение (например, Соединение A17 или соединение, родственное A17) модулирует, например ингибирует, c-MET. В некоторых вариантах осуществления соединение (например, Соединение A23 или соединение, родственное A23) модулирует, например ингибирует, Alk. В некоторых вариантах осуществления, рак имеет, или определен как имеющий, повышенные уровни или активность одного или оба из c-MET или Alk по сравнению с контрольной клеткой или референсным значением. В некоторых вариантах осуществления рак имеет, или идентифицирован как имеющий, мутацию в EGFR.
Пример подходящих терапевтических средств для применения в комбинациях, описанных в настоящей заявке, например, комбинациях с молекулами антитела против PD-1, описанного в настоящей заявке, отдельно или в комбинации с другим иммуномодулятором (например, молекулой антитела против LAG-3, против PD-L1 или против TIM-3), для лечения меланомы (например, меланомы NRAS), включает, без ограничения перечисленным, одно или оба из Соединения A24, описанного в настоящей заявке (или соединения, описанного в патентах США 8,415,355 и 8,685,980) и Соединения A34, описанного в настоящей заявке (или соединения, описанного в публикации PCT WO2003/077914). В некоторых вариантах осуществления соединение (например, Соединение A24 или соединение, связанное с A24) модулирует, например ингибирует, одно или более из JAK и CDK4/6. В некоторых вариантах осуществления соединение (например, Соединение A34 или соединение, родственное A34) модулирует, например ингибирует, MEK. В некоторых вариантах осуществления рак имеет, или идентифицирован как имеющий, повышенные уровни или активность одного или более из JAK, CDK4/6 и MEK по сравнению с контрольной клеткой или референсным значением.
Пример подходящих терапевтических средств для применения в комбинациях, описанных в настоящей заявке, например, комбинациях с молекулами антитела против PD-1, описанного в настоящей заявке, отдельно или в комбинации с другим иммуномодулятором (например, молекулой антитела против LAG-3, против PD-L1 или против TIM-3), для лечения меланомы (например, меланомы NRAS), включает, без ограничения перечисленным, одно или оба из Соединения A29, описанного в настоящей заявке (или соединения, описанного в публикации PCT WO2011/025927) и Соединения A34, описанного в настоящей заявке (или соединения, описанного в публикации PCT WO2003/077914). В некоторых вариантах осуществления соединение (например, Соединение A29 или соединение, родственное A29) модулирует, например ингибирует, BRAF. В некоторых вариантах осуществления соединение (например, Соединение A34 или соединение, родственное A34) модулирует, например ингибирует, MEK. В некоторых вариантах осуществления, рак имеет, или идентифицирован как имеющий, повышенные уровни или активность одного или обоих из BRAF и MEK по сравнению с контрольной клеткой или референсным значением.
Пример подходящих терапевтических средств для применения в комбинациях, описанных в настоящей заявке, например, комбинациях с молекулами антитела против PD-1, описанного в настоящей заявке, отдельно или в комбинации с другим иммуномодулятором (например, молекулой антитела против LAG-3, против PD-L1 или против TIM-3), для лечения плоскоклеточного НМРЛ включает, без ограничения перечисленным, Соединение A5, описанное в настоящей заявке (или соединение, описанное в патенте США 8,552,002). В некоторых вариантах осуществления соединение (например, Соединение A5 или соединение, родственное A5) модулирует, например ингибирует, FGFR. В некоторых вариантах осуществления, рак имеет, или идентифицирован как имеющий, повышенные уровни или активность FGFR по сравнению с контрольной клеткой или референсным значением.
Пример подходящих терапевтических средств для применения в комбинациях, описанных в настоящей заявке, например, комбинациях с молекулами антитела против PD-1, описанного в настоящей заявке, отдельно или в комбинации с другим иммуномодулятором (например, молекулой антитела против LAG-3, против PD-L1 или против TIM-3) для лечения рака толстой и прямой кишки включает, без ограничения перечисленным, одно или оба из Соединения A29, описанного в настоящей заявке (или соединения в публикации PCT WO2011/025927) и цетуксимаба (например, Эрбитукса, выпускаемого BMS). В некоторых вариантах осуществления терапевтическое средство (например, Соединение A29 или соединение, родственное A29) модулирует, например ингибирует, BRAF. В некоторых вариантах осуществления терапевтическое средство (например, цетуксимаб) модулирует, например ингибирует, EGFR. В некоторых вариантах осуществления рак имеет, или идентифицирован как имеющий, повышенные уровни или активность BRAF или EGFR по сравнению с контрольной клеткой или референсным значением.
В настоящем описании также предложен способ лечения рака Соединением A8, цетуксимабом и комбинацией, описанной в настоящей заявке, например, комбинаций с молекулами антитела против PD-1, описанного в настоящей заявке, (необязательно в комбинации с молекулой антитела к TIM-3 или молекулой антитела к LAG-3). В некоторых вариантах осуществления пациент сначала проходит лечение Соединением A8 и цетуксимабом. Это лечение продолжают в течение некоторого периода времени, например, установленного периода времени, например, приблизительно 1, 2, 4, 6, 8, 10 или 12 месяцев. Затем вводят молекулу антитела к PD-1 (необязательно в комбинации с молекулой антитела к TIM-3 или молекулой антитела к LAG-3). Антитело к PD-1 необязательно может применяться в комбинации с цетуксимабом.
В некоторых вариантах осуществления пациент сначала проходит лечение всеми тремя из Соединения A8, цетуксимаба и молекулы антитела к PD-1 (необязательно в комбинации с молекулой антитела к TIM-3 или молекулы антитела к LAG-3). Это лечение продолжают в течение некоторого периода времени, например, установленного периода времени, например, приблизительно 6, 8, 10 или 12 месяцев. Затем введение Соединения A8 и/или цетуксимаба могут снижать таким образом, что поддерживающая фаза включает лечение молекулой антитела PD-1 (например, в виде монотерапии или в комбинации с молекулой антитела к TIM-3 или молекулой антитела к LAG-3), но не включает лечение Соединением A8 или цетуксимабом.
В других вариантах осуществления три соединения (Соединение A8, цетуксимаб и молекулу антитела к PD-1, необязательно в комбинации с молекулой антитела к TIM-3 или молекулой антитела к LAG-3) применяют последовательно в начале лечения. Например, Соединение A8 и цетуксимаб могут применять сначала, как описано выше. Затем в схему применения включают молекулу антитела к PD-1 (необязательно в комбинации с молекулой антитела к TIM-3 или молекулой антитела к LAG-3). Затем введение Соединения A8 и/или цетуксимаба могут снижать, как описано выше.
Примерные дозы для схем применения трех (или более) средств являются следующими. Молекулу антитела против PD-1 могут вводить, например, в дозе приблизительно 1-40 мг/кг, например, 1-30 мг/кг, например, приблизительно 5-25 мг/кг, приблизительно 10-20 мг/кг, приблизительно 1-5 мг/кг или приблизительно 3 мг/кг. В альтернативе молекулу антитела против PD-1 могут вводить, например, в дозе приблизительно 200-500 мг, например, приблизительно 300-500 мг, приблизительно 200-400 мг, приблизительно 250-350 мг или приблизительно 300-400 мг, или приблизительно 300 мг, или приблизительно 400 мг. В одном варианте осуществления молекулу антитела к PD-1 вводят один раз в три недели, например, в дозе 300 мг один раз в три недели. В другом варианте осуществления молекулу антитела против PD-1 вводят один раз в четыре недели, например, в дозе 400 мг один раз в четыре недели. В некоторых вариантах осуществления Соединение A8 вводят в дозе приблизительно 200-300, 300-400 или 200-400 мг. В некоторых вариантах осуществления цетуксимаб вводят в начальной дозе 400 мг/м2, в виде 120-минутной внутривенной инфузии, с последующей инфузией 250 мг/м2 еженедельно, в течение 60 минут. В вариантах осуществления одно или более из Соединения A8, цетуксимаба и молекулы антитела PD-1 вводят в дозе, которая ниже, чем доза, в которой такое средство обычно применяют в монотерапии, например, приблизительно на 0-10%, 10-20%, 20-30%, 30-40%, 40-50%, 50-60%, 60-70%, 70-80% или 80-90% ниже, чем доза, в которой такое средство обычно применяют в монотерапии. В вариантах осуществления одно или более из Соединения A8, цетуксимаба и молекулы антитела PD-1 вводят в дозе, которая ниже, чем доза такого средства, указанного в этом параграфе, например, приблизительно на 0-10%, 10-20%, 20-30%, 30-40%, 40-50%, 50-60%, 60-70%, 70-80% или 80-90% ниже, чем доза такого средства, указанного в этом параграфе. В некоторых вариантах осуществления концентрация Соединения A8, которая требуется для ингибирования, например ингибирования роста, ниже тогда, когда Соединение A8 применяют в комбинации с одним или обоими из цетуксимаба и молекулы антитела PD-1, чем тогда, когда Соединение A8 применяют отдельно. В некоторых вариантах осуществления концентрация цетуксимаба, которая требуется для ингибирования, например ингибирования роста, ниже тогда, когда цетуксимаб применяют в комбинации с одним или обоими из Соединения A8 и молекулы антитела PD-1, чем тогда, когда цетуксимаб применяют отдельно. В некоторых вариантах осуществления концентрация молекулы антитела PD-1, которая требуется для ингибирования, например ингибирования роста, ниже тогда, когда молекулу антитела PD-1 применяют в комбинации с одним или обоими из цетуксимаба и Соединения A8, чем тогда, когда молекулу антитела PD-1 применяют отдельно.
В настоящей заявке дополнительно раскрыт способ лечения рака молекулами антитела против PD-1, отдельно или в комбинации с другим иммуномодулятором (например, молекулой антитела против LAG-3, против PD-L1 или против TIM-3) и противоопухолевым средством направленного действия, например, средством, которое направленно воздействует на один или более белков. В некоторых вариантах осуществления молекулу антитела против PD-1 (и необязательно другой иммуномодулятор(ы)) вводят первой, а противоопухолевое средство направленного действия вводят вторым. Период времени между введением молекулы антитела против PD-1 и противоопухолевым средством направленного действия может составлять, например, 10, 20 или 30 минут, 1, 2, 4, 6 или 12 часов или 1, 2, 3, 4, 5, 6 или 7 дней, или любой промежуток времени в указанном диапазоне. В некоторых вариантах осуществления молекулу антитела против PD-1 вводят многократно в течение некоторого периода времени (например, 1, 2, 3, 4, 5 или 6 дней или 1, 2, 4, 8, 12, 16 или 20 недель, или любого промежутка времени в указанном диапазоне) перед введением противоопухолевого средства направленного действия. В других вариантах осуществления молекулу антитела против PD-1 и противоопухолевое средство направленного действия вводят по существу в одно и то же время.
Инфекционные заболевания
Другие способы согласно изобретению применяются для лечения пациентов, которые подверглись воздействию определенных токсинов или патогенов. Таким образом, в другом аспекте настоящего изобретения предложен способ лечения инфекционного заболевания у субъекта, включающий введение субъекту комбинации, раскрытой в настоящей заявке, например, комбинации, включающей молекулу антитела против PD-1, в результате чего осуществляют лечение инфекционного заболевания у субъекта.
При лечении инфекции (например, острой и/или хронической) введение молекул антител против PD-1 можно комбинировать со стандартными методами лечения в дополнение к или вместо стимуляции естественной иммунной защиты организма-хозяина от инфекции. Естественные механизмы иммунной защиты организма-хозяина от инфекции включают, без ограничения, воспаление, лихорадку, антитело-опосредуемую защиту организма-хозяина, Т-лимфоцит-опосредуемые механизмы защиты организма, включающие секрецию лимфокинов и цитотоксические Т-клетки (в особенности во время вирусной инфекции), комплемент-опосредуемый лизис и опсонизацию (облегчающую фагоцитоз) и фагоцитоз. Способность молекул антитела против PD-1 к реактивации дисфункциональных Т-клеток может быть полезной для лечения хронических инфекций, в частности, таких, при которых клеточный иммунитет важен для полного выздоровления.
Аналогично применению в отношении опухолей, как обсуждается выше, антитело-опосредуемая блокада PD-1 может применяться отдельно или в качестве адъюванта, в комбинации с вакцинами, для стимуляции иммунного ответа на патогены, токсины и аутоантигены. Примеры патогенов, в отношении которых такой терапевтический подход может быть особенно полезным, включают патогены, для которых в настоящее время не существует эффективной вакцины, или патогены, в отношении которых обычные вакцины не обладают полной эффективностью. Такие патогены включают, без ограничения перечисленными, ВИЧ, гепатит (А, В и С), грипп, герпес, лямблии, малярийные плазмодии, лейшмании, Staphylococcus aureus, Pseudomonas Aeruginosa. Блокада PD-1 особенно полезна против инфекций, вызываемых такими возбудителями, как ВИЧ, которые представляют измененные антигены в течение инфекций. Эти новые эпитопы распознаются как чужеродные в момент введения антитела против человеческого PD-1, что вызывает сильный Т-клеточный ответ, который не подавляется негативными сигналами через PD-1.
Дополнительные и другие комбинированные терапии
Молекулы антитела против PD-1 могут применяться в любой из комбинаций, раскрытых в настоящей заявке. В некоторых вариантах осуществления в настоящей заявке предложены комбинации с одной или более дополнительными терапиями. Многие комбинации в этом разделе могут применяться при лечении рака, однако также описаны другие показания. В некоторых вариантах осуществления молекулу антитела против PD-1 вводят путем инъекции (например, подкожно или внутривенно) в дозе (например, постоянной дозе) приблизительно от 200 мг до 500 мг, например, приблизительно от 300 мг до 400 мг или приблизительно 300 мг, или приблизительно 400 мг. Схема введения (например, схема введения постоянной дозы) может изменяться, например, от одного раза в неделю до одного раза в 2, 3, 4, 5 или 6 недель. В одном варианте осуществления молекулу антитела против PD-1 вводят в дозе приблизительно от 300 мг один раз в три недели. В одном варианте осуществления молекулу антитела против PD-1 вводят в дозе приблизительно от 400 мг один раз в четыре недели. В данном разделе особое внимание уделяется комбинациям молекул антитела против PD-1, необязательно в комбинации с одним или более иммуномодуляторами (например, молекулой антитела против TIM-3, молекулой антитела против LAG-3 или молекулой антитела против PD-L1), с одним или более средствами, описанными в Таблице 7. В комбинациях ниже, в одном варианте осуществления, молекула антитела против PD-1 включает:
(a) вариабельную область тяжелой цепи (VH), включающую аминокислотную последовательность VHCDR1 SEQ ID NO: 4, аминокислотную последовательность VHCDR2 SEQ ID NO: 5 и аминокислотную последовательность VHCDR3 SEQ ID NO: 3; и вариабельную область легкой цепи (VL), включающую аминокислотную последовательность VLCDR1 SEQ ID NO: 13, аминокислотную последовательность VLCDR2 SEQ ID NO: 14 и аминокислотную последовательность VLCDR3 SEQ ID NO: 33;
(b) VH, включающую аминокислотную последовательность VHCDR1, выбранную из SEQ ID NO: 1; аминокислотную последовательность VHCDR2 SEQ ID NO: 2 и аминокислотную последовательность VHCDR3 SEQ ID NO: 3; и VL, включающую аминокислотную последовательность VLCDR1 SEQ ID NO: 10, аминокислотную последовательность VLCDR2 SEQ ID NO: 11 и аминокислотную последовательность VLCDR3 SEQ ID NO: 32;
(c) VH, включающую аминокислотную последовательность VHCDR1 SEQ ID NO: 224, аминокислотную последовательность VHCDR2 SEQ ID NO: 5 и аминокислотную последовательность VHCDR3 SEQ ID NO: 3; и VL, включающую аминокислотную последовательность VLCDR1 SEQ ID NO: 13, аминокислотную последовательность VLCDR2 SEQ ID NO: 14 и аминокислотную последовательность VLCDR3 SEQ ID NO: 33; или
(d) VH, включающую аминокислотную последовательность VHCDR1 SEQ ID NO: 224; аминокислотную последовательность VHCDR2 SEQ ID NO: 2 и аминокислотную последовательность VHCDR3 SEQ ID NO: 3; и VL, включающую аминокислотную последовательность VLCDR1 SEQ ID NO: 10, аминокислотную последовательность VLCDR2 SEQ ID NO: 11 и аминокислотную последовательность VLCDR3 SEQ ID NO: 32.
В комбинациях ниже, в другом варианте осуществления, молекула антитела против PD-1 включает: (i) вариабельную область тяжелой цепи (VH), включающую аминокислотную последовательность VHCDR1, выбранную из SEQ ID NO: 1, SEQ ID NO: 4 или SEQ ID NO: 224; аминокислотную последовательность VHCDR2 SEQ ID NO: 2 или SEQ ID NO: 5; и аминокислотную последовательность VHCDR3 SEQ ID NO: 3; и (ii) вариабельную область легкой цепи (VL), включающую аминокислотную последовательность VLCDR1 SEQ ID NO: 10 или SEQ ID NO: 13, аминокислотную последовательность VLCDR2 SEQ ID NO: 11 или SEQ ID NO: 14 и аминокислотную последовательность VLCDR3 SEQ ID NO: 32 или SEQ ID NO: 33.
В одном варианте осуществления комбинация, например, комбинация, включающая молекулу антитела против PD-1, как описано в настоящей заявке, включает или применяется в комбинации с ингибитором PKC, сотрастаурином (Соединением A1), или соединением, раскрытым в публикации PCT WO 2005/039549, для лечения нарушения, например, нарушения, описанного в настоящей заявке. В одном варианте осуществления ингибитором PKC является сотрастаурин (Соединение A1) или соединение, раскрытое в публикации PCT WO 2005/039549. В одном варианте осуществления молекула антитела PD-1 применяется в комбинации с сотрастаурином (Соединением A1) или соединением, описанным в публикации PCT WO 2005/039549, для лечения нарушения, такого как рак, меланома, неходжкинская лимфома, воспалительное заболевание кишечника, отторжение трансплантата, глазное нарушение или псориаз.
В некоторых вариантах осуществления сотрастаурин (Соединение A1) вводят в дозе приблизительно 20-600 мг, например, от приблизительно 200 до приблизительно 600 мг, от приблизительно 50 мг до приблизительно 450 мг, приблизительно от 100 мг до 400 мг, приблизительно от 150 мг до 350 мг или приблизительно от 200 мг до 300 мг, например, приблизительно 50 мг, 100 мг, 150 мг, 200 мг, 300 мг, 400 мг, 500 мг или 600 мг. Схема введения может изменяться, например, от одного раза в два дня до одного раза в день, двух или трех раз в день.
В одном варианте осуществления комбинация, например, комбинация, включающая молекулу антитела против PD-1, как описано в настоящей заявке, включает или применяется в комбинации с ингибитором BCR-ABL, Тасигной® (Соединение A2), или соединением, раскрытым в публикации PCT WO 2004/005281, для лечения нарушения, например, нарушения, описанного в настоящей заявке. В одном варианте осуществления ингибитором BCR-ABL является Тасигна или соединение, раскрытое в публикации PCT WO 2004/005281. В одном варианте осуществления молекула антитела PD-1 применяется в комбинации с Тасигной (Соединением A2) или соединением, описанным в публикации PCT WO 2004/005281, для лечения нарушения, такого как лимфоцитарный лейкоз, болезнь Паркинсона, неврологический рак, меланома, рак пищеварительного/желудочно-кишечного тракта, рак толстой и прямой кишки, миелоидный лейкоз, рак головы и шеи или легочная гипертензия.
В одном варианте осуществления ингибитор BCR-ABL или Тасигну вводят в дозе приблизительно 300 мг (например, два раза в день, например, в случае недавно диагностированного Ph+ CML-CP) или приблизительно 400 мг, например, два раза в день, например, в случае резистентного или интолерантного Ph+ CML-CP и CML-AP). Ингибитор BCR-ABL или Соединение A2 вводят в дозе приблизительно 300-400 мг.
В другом варианте осуществления комбинация, например, комбинация, включающая молекулу антитела против PD-1, как описано в настоящей заявке, включает или применяется в комбинации с ингибитором HSP90, таким как 5-(2,4-дигидрокси-5-изопропилфенил)-N-этил-4-(4-(морфолинометил)фенил)изоксазол-3-карбоксамид (Соединение A3), или соединением, раскрытым в публикации PCT WO 2010/060937 или WO 2004/072051, для лечения нарушения, например, нарушения, описанного в настоящей заявке. В одном варианте осуществления ингибитором HSP90 является 5-(2,4-дигидрокси-5-изопропилфенил)-N-этил-4-(4-(морфолинометил)фенил)-изоксазол-3-карбоксамид (Соединение A3) или соединение, раскрытое в публикации PCT WO 2010/060937 или WO 2004/072051. В одном варианте осуществления молекула антитела PD-1 применяется в комбинации с 5-(2,4-дигидрокси-5-изопропилфенил)-N-этил-4-(4-(морфолинометил)фенил)изоксазол-3-карбоксамидом (Соединение A3) или соединением, описанным в Публикации PCT WO 2010/060937 или WO 2004/072051, для лечения нарушения, такого как рак, множественная миелома, немелкоклеточный рак легкого, лимфома, рак желудка, рак молочной железы, рак пищеварительного/желудочно-кишечного тракта, рак поджелудочной железы, рак толстой и прямой кишки, солидная опухоль или нарушение гемопоэза.
В другом варианте осуществления комбинация, например, комбинация, включающая молекулу антитела против PD-1, как описано в настоящей заявке, применяется в комбинации с ингибитором PI3K и/или mTOR, дактолизибом (Соединением A4), или 8-(6-метокси-пиридин-3-ил)-3-метил-1-(4-пиперазин-1-ил-3-трифторметил-фенил)-1,3-дигидро-имидазо[4,5-c]хинолин-2-оном (Соединением A41), или соединением, раскрытым в публикации PCT WO 2006/122806, для лечения нарушения, например, нарушения, описанного в настоящей заявке. В одном варианте осуществления, ингибитором PI3K и/или mTOR является дактолизиб (Соединение A4), 8-(6-метокси-пиридин-3-ил)-3-метил-1-(4-пиперазин-1-ил-3-трифторметил-фенил)-1,3-дигидро-имидазо[4,5-c]хинолин-2-он (Соединение A41), или соединение, раскрытое в публикации PCT WO 2006/122806. В одном варианте осуществления молекула антитела PD-1 применяется в комбинации с дактолизибом (Соединением A4), 8-(6-метокси-пиридин-3-ил)-3-метил-1-(4-пиперазин-1-ил-3-трифторметил-фенил)-1,3-дигидро-имидазо[4,5-c]хинолин-2-оном (Соединением A41), или соединением, описанным в публикации PCT WO 2006/122806, для лечения нарушения, такого как рак, рак предстательной железы, лейкоз (например, лимфоцитарный лейкоз), рак молочной железы, рак головного мозга, рак мочевого пузыря, рак поджелудочной железы, рак почки, солидная опухоль или рак печени.
В другом варианте осуществления комбинация, например, комбинация, включающая молекулу антитела против PD-1, как описано в настоящей заявке, включает или применяется в комбинации с ингибитором FGFR, 3-(2,6-дихлор-3,5-диметоксифенил)-1-(6-((4-(4-этилпиперазин-1-ил)фенил)амино)-пиримидин-4-ил)-1-метилмочевиной (Соединением A5), или соединением, раскрытым в патенте США 8,552,002, для лечения нарушения, например, нарушения, описанного в настоящей заявке. В одном варианте осуществления ингибитором FGFR является 3-(2,6-дихлор-3,5-диметоксифенил)-1-(6-((4-(4-этилпиперазин-1-ил)фенил)амино)пиримидин-4-ил)-1-метилмочевина (Соединение A5) или соединение, раскрытое в патенте США 8,552,002. В одном варианте осуществления молекула антитела PD-1 применяется в комбинации с Соединением A5 или соединением, описанным в US 8,552,002, для лечения нарушения, такого как рак пищеварительного/желудочно-кишечного тракта, гемобластоз или солидная опухоль.
В одном варианте осуществления ингибитор FGFR или 3-(2,6-дихлор-3,5-диметоксифенил)-1-(6-((4-(4-этилпиперазин-1-ил)фенил)амино)пиримидин-4-ил)-1-метилмочевину (Соединение A5) вводят в дозе приблизительно 100-125 мг (например, в день), например, приблизительно 100 мг или приблизительно 125 мг.
В другом варианте осуществления комбинация, например, комбинация, включающая молекулу антитела против PD-1, как описано в настоящей заявке, включает или применяется в комбинации с ингибитором PI3K, бупарлисибом (Соединением A6), или соединением, раскрытым в публикации PCT WO 2007/084786, для лечения нарушения, например, нарушения, описанного в настоящей заявке. В одном варианте осуществления ингибитором PI3K является бупарлисиб (Соединение A6) или соединение, раскрытое в публикации PCT WO 2007/084786. В одном варианте осуществления молекула антитела PD-1 применяется в комбинации с бупарлисибом (Соединением A6) или соединением, раскрытым в Публикации PCT WO 2007/084786, для лечения нарушения, такого как рак предстательной железы, немелкоклеточный рак легкого, эндокринный рак, лейкоз, рак яичника, меланома, рак мочевого пузыря, рак молочной железы, рак женской репродуктивной системы, рак пищеварительного/желудочно-кишечного тракта, рак толстой и прямой кишки, мультиформная глиобластома, солидная опухоль, неходжкинская лимфома, нарушение гемопоэза или рак головы и шеи.
В одном варианте осуществления ингибитор PI3K или бупарлисиб (Соединение A6) вводят в дозе приблизительно 100 мг (например, в день).
В другом варианте осуществления комбинация, например, комбинация, включающая молекулу антитела против PD-1, как описано в настоящей заявке, включает или применяется в комбинации с ингибитором FGFR, 8-(2,6-дифтор-3,5-диметоксифенил)-N-(4-(диметиламино)метил)-1H-имидазол-2-ил)хиноксалин-5-карбоксамидом (Соединением A7), или соединением, раскрытым в публикации PCT WO 2009/141386, для лечения нарушения, например, нарушения, описанного в настоящей заявке. В одном варианте осуществления ингибитором FGFR является 8-(2,6-дифтор-3,5-диметоксифенил)-N-(4-(диметиламино)метил)-1H-имидазол-2-ил)хиноксалин-5-карбоксамид (Соединение A7) или соединение, раскрытое в публикации PCT WO 2009/141386. В одном варианте осуществления ингибитором FGFR является 8-(2,6-дифтор-3,5-диметоксифенил)-N-(4-(диметиламино)метил)-1H-имидазол-2-ил)хиноксалин-5-карбоксамид (Соединение A7). В одном варианте осуществления молекула антитела PD-1 применяется в комбинации с 8-(2,6-дифтор-3,5-диметоксифенил)-N-(4-(диметиламино)метил)-1H-имидазол-2-ил)хиноксалин-5-карбоксамидом (Соединением A7) или соединением, раскрытым в публикации PCT WO 2009/141386, для лечения нарушения, такого как рак, характеризуемый ангиогенезом.
В одном варианте осуществления ингибитор FGFR или 8-(2,6-дифтор-3,5-диметоксифенил)-N-(4-(диметиламино)метил)-1H-имидазол-2-ил)хиноксалин-5-карбоксамид (Соединение A7) вводят в дозе, например, от приблизительно 3 мг до приблизительно 5 г, более предпочтительно от приблизительно 10 мг до приблизительно 1,5 г на человека в день, необязательно разделенной на 1-3 отдельных дозы, которые могут, например, иметь такую же величину.
В другом варианте осуществления комбинация, например, комбинация, включающая молекулу антитела против PD-1, как описано в настоящей заявке, включает или применяется в комбинации с ингибитором PI3K, (S)-N1-(4-метил-5-(2-(1,1,1-трифтор-2-метилпропан-2-ил)пиридин-4-ил)тиазол-2-ил)пирролидин-1,2-дикарбоксамидом (Соединением A8), или соединением, раскрытым в публикации PCT WO 2010/029082, для лечения нарушения, например, нарушения, описанного в настоящей заявке. В одном варианте осуществления ингибитором PI3K является (S)-N1-(4-метил-5-(2-(1,1,1-трифтор-2-метилпропан-2-ил)пиридин-4-ил)тиазол-2-ил)пирролидин-1,2-дикарбоксамид (Соединение A8) или соединение, раскрытое в публикации PCT WO 2010/029082. В одном варианте осуществления молекула антитела PD-1 применяется в комбинации с (S)-N1-(4-метил-5-(2-(1,1,1-трифтор-2-метилпропан-2-ил)пиридин-4-ил)тиазол-2-ил)пирролидин-1,2-дикарбоксамидом (Соединением A8) или соединением, раскрытым в публикации PCT WO 2010/029082, для лечения нарушения, такого как рак желудка, рак молочной железы, рак поджелудочной железы, рак пищеварительного/желудочно-кишечного тракта, солидная опухоль и рак головы и шеи.
В одном варианте осуществления ингибитор PI3K или (S)-N1-(4-метил-5-(2-(1,1,1-трифтор-2-метилпропан-2-ил)пиридин-4-ил)тиазол-2-ил)пирролидин-1,2-дикарбоксамид (Соединение A8) вводят в дозе приблизительно 150-300, 200-300, 200-400 или 300-400 мг (например, в день), например, приблизительно 200, 300 или 400 мг.
В другом варианте осуществления комбинация, например, комбинация, включающая молекулу антитела против PD-1, как описано в настоящей заявке, включает или применяется в комбинации с ингибитором цитохрома P450 (например, ингибитором CYP17) или соединением, раскрытым в публикации PCT WO 2010/149755, для лечения нарушения, например, нарушения, описанного в настоящей заявке. В одном варианте осуществления ингибитором цитохрома P450 (например, ингибитором CYP17) является соединение, раскрытое в публикации PCT WO 2010/149755. В одном варианте осуществления молекула антитела PD-1 применяется в комбинации с соединением, раскрытым в публикации PCT WO 2010/149755, для лечения рака предстательной железы.
В другом варианте осуществления комбинация, например, комбинация, включающая молекулу антитела против PD-1, как описано в настоящей заявке, включает или применяется в комбинации с ингибитором HDM2, (S)-1-(4-хлорфенил)-7-изопропокси-6-метокси-2-(4-(метил(((1r,4S)-4-(4-метил-3-оксопиперазин-1-ил)циклогексил)метил)амино)фенил)-1,2-дигидроизохинолин-3(4H)-оном (Соединением A10), или соединением, раскрытым в публикации PCT WO 2011/076786, для лечения нарушения, например, нарушения, описанного в настоящей заявке). В одном варианте осуществления ингибитором HDM2 является (S)-1-(4-хлорфенил)-7-изопропокси-6-метокси-2-(4-(метил(((1r,4S)-4-(4-метил-3-оксопиперазин-1-ил)циклогексил)метил)амино)фенил)-1,2-дигидроизохинолин-3(4H)-он (Соединение A10) или соединение, раскрытое в публикации PCT WO 2011/076786. В одном варианте осуществления молекула антитела PD-1 применяется в комбинации с (S)-1-(4-хлорфенил)-7-изопропокси-6-метокси-2-(4-(метил(((1r,4S)-4-(4-метил-3-оксопиперазин-1-ил)циклогексил)-метил)амино)фенил)-1,2-дигидроизохинолин-3(4H)-оном (Соединением A10) или соединением, раскрытым в публикации PCT WO 2011/076786, для лечения нарушения, такого как солидная опухоль.
В одном варианте осуществления ингибитор HDM2 или (S)-1-(4-хлорфенил)-7-изопропокси-6-метокси-2-(4-(метил(((1r,4S)-4-(4-метил-3-оксопиперазин-1-ил)циклогексил)метил)амино)фенил)-1,2-дигидроизохинолин-3(4H)-он (Соединение A10) вводят в дозе приблизительно 400-700 мг, например, вводят три раза в неделю, в течение 2 недель и перерывом на одну неделю. В некоторых вариантах осуществления доза составляет приблизительно 400, 500, 600 или 700 мг; приблизительно 400-500, 500-600 или 600-700 мг, например, с введением три раза в неделю.
В другом варианте осуществления комбинация, например, комбинация, включающая молекулу антитела против PD-1, как описано в настоящей заявке, включает или применяется в комбинации с железосвязывающим комплексообразующим средством, деферазироксом (также известным как Эксиджад; Соединение A11), или соединением, раскрытым в публикации PCT WO 1997/049395, для лечения нарушения, например, нарушения, описанного в настоящей заявке. В одном варианте осуществления железосвязывающим комплексообразующим средством является деферазирокс или соединение, раскрытое в публикации PCT WO 1997/049395. В одном варианте осуществления железосвязывающим комплексообразующим средством является деферазирокс (Соединение A11). В одном варианте осуществления молекула антитела PD-1 применяется в комбинации с деферазироксом (Соединением A11) или соединением, раскрытым в публикации PCT WO 1997/049395, для лечения перегрузки железом, гемохроматоза или миелодисплазии.
В другом варианте осуществления комбинация, например, комбинация, включающая молекулу антитела против PD-1, как описано в настоящей заявке, включает или применяется в комбинации с ингибитором ароматазы летрозолом (также известным как Фемара; Соединение A12) или соединением, раскрытым в US 4,978,672, для лечения нарушения, например, нарушения, описанного в настоящей заявке. В одном варианте осуществления ингибитором ароматазы является летрозол (Соединение A12) или соединение, раскрытое в патенте США 4,978,672. В одном варианте осуществления молекула антитела PD-1 применяется в комбинации с летрозолом (Соединением A12) или соединением, раскрытым в патенте США 4,978,672, для лечения нарушения, такого как рак, лейомиосаркома, рак эндометрия, рак молочной железы, рак женской репродуктивной системы или гормональный дефицит.
В другом варианте осуществления комбинация, например, комбинация, включающая молекулу антитела против PD-1, как описано в настоящей заявке, включает или применяется в комбинации с ингибитором PI3K, например, пан-PI3K ингибитором, (4S,5R)-3-(2'-амино-2-морфолино-4'-(трифторметил)-[4,5'-бипиримидин]-6-ил)-4-(гидроксиметил)-5-метилоксазолидин-2-оном (Соединением A13), или соединением, раскрытым в публикации PCT WO2013/124826, для лечения нарушения, например, нарушения, описанного в настоящей заявке. В одном варианте осуществления ингибитором PI3K является (4S,5R)-3-(2'-амино-2-морфолино-4'-(трифторметил)-[4,5'-бипиримидин]-6-ил)-4-(гидроксиметил)-5-метилоксазолидин-2-он (Соединение A13) или соединение, раскрытое в публикации PCT WO2013/124826. В одном варианте осуществления молекула антитела PD-1 применяется в комбинации с (4S,5R)-3-(2'-амино-2-морфолино-4'-(трифторметил)-[4,5'-бипиримидин]-6-ил)-4-(гидроксиметил)-5-метилоксазолидин-2-оном (Соединением A13) или соединением, раскрытым в публикации PCT WO2013/124826, для лечения нарушения, такого как рак или распространенная солидная опухоль.
В другом варианте осуществления комбинация, например, комбинация, включающая молекулу антитела против PD-1, как описано в настоящей заявке, включает или применяется в комбинации с ингибитором p53 и/или ингибитором взаимодействия p53/Mdm2, (S)-5-(5-хлор-1-метил-2-оксо-1,2-дигидропиридин-3-ил)-6-(4-хлорфенил)-2-(2,4-диметоксипиримидин-5-ил)-1-изопропил-5,6-дигидропирроло[3,4-d]имидазол-4(1H)-оном (Соединением A14), или соединением, раскрытым в публикации PCT WO2013/111105, для лечения нарушения, например, нарушения, описанного в настоящей заявке. В одном варианте осуществления ингибитором p53 и/или ингибитором взаимодействия p53/Mdm2 является (S)-5-(5-хлор-1-метил-2-оксо-1,2-дигидропиридин-3-ил)-6-(4-хлорфенил)-2-(2,4-диметоксипиримидин-5-ил)-1-изопропил-5,6-дигидропирроло[3,4-d]имидазол-4(1H)-он (Соединение A14) или соединение, раскрытое в публикации PCT WO2013/111105. В одном варианте осуществления молекула антитела PD-1 применяется в комбинации с (S)-5-(5-хлор-1-метил-2-оксо-1,2-дигидропиридин-3-ил)-6-(4-хлорфенил)-2-(2,4-диметоксипиримидин-5-ил)-1-изопропил-5,6-дигидропирроло[3,4-d]имидазол-4(1H)-оном (Соединением A14) или соединением, раскрытым в публикации PCT WO2013/111105, для лечения нарушения, такого как рак или саркома мягких тканей.
В другом варианте осуществления комбинация, например, комбинация, включающая молекулу антитела против PD-1, как описано в настоящей заявке, включает или применяется в комбинации с ингибитором тирозинкиназы CSF-1R, 4-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)окси)-N-метилпиколинамидом (Соединением A15), или соединением, раскрытым в публикации PCT WO 2005/073224, для лечения нарушения, например, нарушения, описанного в настоящей заявке. В одном варианте осуществления ингибитором тирозинкиназы CSF-1R является 4-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)окси)-N-метилпиколинамид (Соединение A15) или соединение, раскрытое в публикации PCT WO 2005/073224. В одном варианте осуществления молекула антитела PD-1 применяется в комбинации с 4-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)окси)-N-метилпиколинамидом (Соединением A15) или соединением, раскрытым в Публикации PCT WO 2005/073224, для лечения нарушения, такого как рак.
CSF-1-дифференцированные макрофаги, иногда называемые в настоящей заявке как макрофаги M2 или опухолеассоциированные макрофаги (TAM), в случае присутствия в злокачественных тканях, обычно являются протуморогенными и могут характеризоваться, например, экспрессией CSF-1R и CD163. В раковой опухоли, CSF-1-дифференцированные макрофаги часто отражают нарушенную целостность ткани и/или адаптивный процесс, инициированный опухолями для поддержания роста (Noy and Pollard (2014) Immunity; 41(1):49-61). Чтобы проявлять свою протуморогенную активность, макрофаги M2 секретируют множество молекул, например, цитокинов, хемокинов, факторов роста, гормонов, матрикс-ремоделирующих протеаз и метаболитов, таких как CSF-1 и CCL2, простагландин E2 и ассоциированные с повреждением молекулярные структуры, такие как белок группы высокой подвижности бокс 1, внеклеточный аденозинтрифосфат и компоненты деградированного внеклеточного матрикса (Ruffell et al. (2012) Trends Immunol; 33(3):119-26; Zelenay et al. (2013) Trends Immunol; 34(7):329-35). Исследования in vivo показали, что M2-макрофаги также опосредуют устойчивость к химиотерапии, предоставляя факторы выживания и/или активируя антиапоптотические программы в злокачественных клетках. Например, нейтрализация CSF-1 повышает ответ на химиотерапию в карциномах молочной железы (DeNardo et al. (2011) Cancer Discov. 1, 54-67). Макрофаги TAM ассоциированы с сигнализацией фактора роста эндотелия сосудов и являются регуляторами опухолевого ангиогенеза (Murdoch et al. (2008) Nat Rev Cancer; 8(8):618-31; Ruffell et al. (2012) Trends Immunol; 33(3):119-26). Макрофаги M2 также могут непосредственно подавлять пролиферацию CD8+ Т-клеток в моделях опухолей на мышах (DeNardo et al. (2011) Cancer Discov. 1, 54-67; Doedens et al. (2010) Cancer Res; 70 (19):7465-75; Movahedi et al. (2010) Cancer Res; 70(14):5728-39; Ruffell et al. (2014) Cancer Cell; 26, 623-637). Например, макрофаги непосредственно подавляют Т-клеточные ответы посредством экспрессии PD-L1 в гепатоцеллюлярных и овариальных карциномах (Kuang et al. (2009) J Exp Med; 206(6):1327-37; Kryczek et al. (2006) J Exp Med; 203(4):871-81).
Доклинические данные указывают, что TAM-макрофаги могут служить терапевтической мишенью, по меньшей мере частично, поскольку они представляют собой важных руководителей различных процессов, способствующих развитию опухоли, например, ускользания от иммунного надзора. Например, дифференцировка, миграция и выживание TAM могут регулироваться CSF-1R при связывании с растворимым КСФ. CSF-1R является представителем семейства рецепторных протеинтирозинкиназ рецепторов фактора роста, которое включает несколько известных протоонкогенов (Ries et al. (2014) Cancer Cell 25(6):846-59). При нарушении пути CSF-1R, Соединение A15 вызывало снижение и перепрограммирование макрофагов M2-типа в моделях глиомы на животных, обеспечивая противоопухолевую эффективность в результате удаления/перепрограммирования иммуносупрессорных TAM. В качестве монотерапии, отдельное ингибирование CSF-1R препятствует росту ортотопически имплантированных клеточных линий PDAC (Mitchem et al. (2013) Cancer Res; 73 (3): 1128-41) и вызывает регрессию мультиформной глиобластомы (GBM) (Pyontech et al. (2013) Nat Med; 19 (10):1264-72).
Противоопухолевый иммунитет в микроокружении опухоли может подавляться различными инфильтрирующими опухоль лейкоцитами, в том числе Treg, МСК и TAM. TAM и МСК могут присутствовать в опухолях в больших количествах, при этом их иммуномодулирующая активность часто проявляется локально в микроокружении опухоли. Без ограничения теорией, считается, что механизмы, используемые этими типами клеток для супрессии эффективного иммунитета, включают, например, секрецию цитокинов, таких как IL-10 и TGF-β, и экспрессию ингибиторных рецепторов, например, CTLA-4 и PD-L1. Удаление TAM и МСК, которые важны в генеративной иммуносупрессии, обеспечивает, по меньшей мере частично, основу для комбинационных стратегий с применением ингибиторов контрольных точек, таких как терапия против PD-1, в таких злокачественных новообразованиях, в которых TAM способствуют патогенезу опухоли. Таким образом, ингибитор CSF-1R может увеличивать клиническую эффективность ингибитора контрольной точки, такого как молекула антитела против PD-1, и/или обеспечивать клиническую эффективность, например, у пациентов с опухолями, демонстрирующими высокую экспрессию TAM (например, такими как рак головного мозга (например, глиобластома), рак молочной железы (например, ТНРМЖ) или рак поджелудочной железы), и у пациентов, которые не отвечают эффективно на молекулу антитела против PD-1 в качестве единственного средства.
Без ограничения теорией, считается, что в некоторых вариантах осуществления ингибитор тирозинкиназы CSF-1R, 4-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)окси)-N-метилпиколинамид (Соединение A15), или соединение, раскрытое в публикации PCT WO 2005/073224, селективно ингибирует активность киназы CSF-1R. Соединение A15 мощно ингибирует CSF-1R (IC50 1,2 нМ), согласно определению в анализе киназной активности in vitro с рекомбинантным доменом киназы CSF-1R. Клеточная активность Соединения A15 была продемонстрирована в снижении тирозин-фосфорилированных уровней CSF-1R в клетках (EC50 pCSF-1R 58 нМ) и значительном антипролиферативном действии на зависимую от макрофагального колониестимулирующего фактора (М-КСФ) клеточную линию MNFS-60 (EC50 71 нМ). Биохимическая и клеточная киназная селективность Соединения A15 была показана на группе более чем из 200 киназ, а также на клеточном уровне, при помощи твердофазных иммуноферментных анализов аутофосфорилирования (ELISA) и анализов пролиферации киназа-трансфицированных BaF3. Значения IC50 для соответствующей подгруппы киназ, включающей родственный класс III RTK-киназ cKit и PDGFRβ, составляли по меньшей мере >3 мкМ. Киназную селективность Соединения A15 подтверждали на клеточном уровне, как оценивали с помощью анализов аутофосфорилирования (анализов ELISA с ECL) и анализов пролиферации BaF3. Клеточные EC50 в отношении pPDGFRβ, BAF3-PDGFRβ и pcKit составляли≥2 мкМ, все остальные клеточные линии BaF3 показывали >10 мкМ, тогда как клеточные EC50 для pCSF-1R и MCSF-зависимой пролиферации составляли <71 нМ.
Биологические эффекты сигнализации CSF-1R включают, например, дифференцировку, пролиферацию, миграцию и/или выживание макрофагов-предшественников и остеокластов моноцитарной линии дифференцировки. Без ограничения теорией, считается, что в некоторых вариантах осуществления механизм, с помощью которого Соединение A15 опосредует противоопухолевую активность через сигнализацию CSF-1R, заключается в снижении или перепрограммировании опухолеассоциированных макрофагов (TAM) в классически активированные фагоцитирующие макрофаги (Pyonteck et al. (2013) Nat Med; 19(10):1264-72; Mao et al. (2016) Clin Cancer Res. Mar 8, DOI: 10.1158/1078-0432.CCR-15-1912, Epub ahead of print). Было показано, что Соединение A15 (200 мг/кг ежедневно) вызывало регрессию развившихся опухолей и повышало выживаемость в генетической модели глиобластомы на мышах, и замедляло рост ксенотрансплантатов, полученных из проневральной глиобластомы (Pyonteck et al. (2013) Nat Med; 19(10):1264-72). В генетической модели (регулируемой тромбоцитарным фактором роста B или PDG мышей) эффективность Соединения A15 сопровождалась заметным перепрограммированием из фенотипа M2 в M1. Клинический потенциал Соединения A15 (200 мг/кг ежедневно, в течение 10 дней) также был показан в модели нейробластомы на животных (Mao et al. (2016) Clin Cancer Res. Mar 8, DOI: 10.1158/1078-0432.CCR-15-1912). Это исследование показало, что инфильтрирующие CSF-1R+ миелоидные клетки являются супрессорными и указывают на вероятность неблагоприятного исхода болезни у больных нейробластомой. Добавление Соединения A15 восстанавливало потенциал миелоидных клеток к стимуляции пролиферации человеческих Т-клеток (Mao et al. (2016) Clin Cancer Res. Mar 8, DOI: 10.1158/1078-0432.CCR-15-1912). Аналогичным образом, первичные человеческие моноциты совместно культивировали с линиями клеток нейробластомы, и затем, как было показано, они приобретали сильную супрессорную активность против аутологичных Т-клеток. Добавление Соединения A15 обеспечивало ингибирование супрессорной функции стимулированных в опухоли моноцитов по отношению к CD8+ и CD4+ Т-клеткам (Mao et al. (2016) Clin Cancer Res. Mar 8, DOI: 10.1158/1078-0432.CCR-15-1912).
Как описано в Примере 6, Соединение A15 также тестировали в комбинации с примерной молекулой антитела против PD-1 в сингенной модели рака толстой и прямой кишки MC38, выбранной из-за присутствия TAM-макрофагов и ответа на антитело против PD-1, при этом было показано, что оно ингибирует рост опухоли и повышает выживаемость по сравнению с одной молекулой антитела против PD-1.
В некоторых вариантах осуществления ингибитор тирозинкиназы CSF-1R, 4-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиа-зол-6-ил)окси)-N-метилпиколинамид (Соединение A15), или соединение, раскрытое в публикации PCT WO 2005/073224, вводят согласно периодической схеме применения. Доклинические данные указывают, что сопоставимая противоопухолевая активность может быть достигнута с некоторыми периодическими схемами. Эксперименты на крысах и обезьянах показали повышение трансаминаз при непрерывном ежедневном применении. Такие повышения трансаминаз обычно временные, и может быть выбрана схема 7 дней введения/7 дней перерыв для получения переносимого профиля и истощения TAM. В других вариантах осуществления ингибитор тирозинкиназы CSF-1R, 4-((2-(((1R,2R)-2-гидроксицикло-гексил)амино)бензо[d]тиазол-6-ил)окси)-N-метилпиколинамид (Соединение A15), или соединение, раскрытое в публикации PCT WO 2005/073224, вводят один раз в неделю. Доклинические данные указывают, что введение Соединения A15 один раз в неделю (Q1W) обеспечивает, по меньшей мере, такую же эффективность, как ежедневная доза, в отношении истощения TAM и противоопухолевой активности. В некоторых вариантах осуществления доза ингибитора тирозинкиназы CSF-1R, 4-((2-(((1R,2R)-2-гидроксициклогексил)-амино)бензо[d]тиазол-6-ил)окси)-N-метилпиколинамида (Соединения A15), или соединения, раскрытого в публикации PCT WO, 2005/073224, при использовании в комбинации по меньшей мере в два (например, по меньшей мере 3, 4 или 5) раза ниже уровня наибольшей исследованной дозы одного средства для ингибитора тирозинкиназы CSF-1R, 4-((2-(((1R,2R)-2-гидроксициклогексил)-амино)бензо[d]тиазол-6-ил)окси)-N-метилпиколинамида (Соединение A15), или соединения, раскрытого в публикации PCT WO 2005/073224. В некоторых вариантах осуществления ингибитор тирозинкиназы CSF-1R, 4-((2-(((1R,2R)-2-гидроксициклогексил)-амино)бензо[d]тиазол-6-ил)окси)-N-метилпиколинамид (Соединение A15), или соединение, раскрытое в публикации PCT WO 2005/073224, вводят в дозе от 50 мг до 1500 мг, например, от 75 мг до 1000 мг, от 100 мг до 900 мг, от 200 мг до 800 мг, от 300 мг до 700 мг, от 400 мг до 600 мг, от 100 мг до 700 мг, от 100 мг до 500 мг, от 100 мг до 300 мг, от 700 мг до 900 мг, от 500 мг до 900 мг, от 300 мг до 900 мг, от 75 мг до 150 мг, от 100 мг до 200 мг, от 200 мг до 400 мг, от 500 мг до 700 мг или от 800 мг до 1000 мг, например, в дозе 50 мг, 100 мг, 150 мг, 200 мг, 250 мг, 300 мг, 350 мг, 400 мг, 450 мг, 500 мг, 550 мг, 600 мг, 650 мг, 700 мг, 750 мг, 800 мг, 850 мг, 900 мг, 950 мг или 1000 мг, например, ежедневно (например, согласно схеме введения 7 дней/7 дней перерыв) или два раза в неделю, один раз в неделю, один раз в две недели, один раз в три недели или один раз в четыре недели. В некоторых вариантах осуществления ингибитор тирозинкиназы CSF-1R, 4-((2-(((1R,2R)-2-гидроксициклогексил)-амино)бензо[d]тиазол-6-ил)окси)-N-метилпиколинамид (Соединение A15), или соединение, раскрытое в публикации PCT WO 2005/073224, вводят в дозе 100 мг, 150 мг, 300 мг, 600 мг или 900 мг. В других вариантах осуществления ингибитор тирозинкиназы CSF-1R, 4-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)окси)-N-метилпиколинамид (Соединение A15), или соединение, раскрытое в публикации PCT WO 2005/073224, введят ежедневно, например, согласно схеме введения 7 дней/7 дней перерыв, или один раз в неделю. В некоторых вариантах осуществления ингибитор тирозинкиназы CSF-1R, 4-((2-(((1R,2R)-2-гидроксициклогексил)-амино)бензо[d]тиазол-6-ил)окси)-N-метилпиколинамид (Соединение A15), или соединение, раскрытое в Публикации PCT WO 2005/073224, вводят в дозе от 50 мг до 150 мг, например, приблизительно 100 мг, например, ежедневно (например, согласно схеме введения 7 дней/7 дней перерыв). В других вариантах осуществления ингибитор тирозинкиназы CSF-1R, 4-((2-(((1R,2R)-2-гидроксициклогексил)-амино)бензо[d]тиазол-6-ил)окси)-N-метилпиколинамид (Соединение A15), или соединение, раскрытое в публикации PCT WO 2005/073224, вводят в дозе от 100 мг до 200 мг, например, приблизительно 150 мг, например, ежедневно (например, согласно схеме введения 7 дней/7 дней перерыв). В других вариантах осуществления ингибитор тирозинкиназы CSF-1R, 4-((2-(((1R,2R)-2-гидроксициклогексил)-амино)бензо[d]тиазол-6-ил)окси)-N-метилпиколинамид (Соединение A15), или соединение, раскрытое в публикации PCT WO 2005/073224, вводят в дозе от 200 мг до 400 мг, например, приблизительно 300 мг, например, ежедневно (согласно схеме введения 7 дней/7 дней перерыв). В других вариантах осуществления ингибитор тирозинкиназы CSF-1R, 4-((2-(((1R,2R)-2-гидроксициклогексил)-амино)бензо[d]тиазол-6-ил)окси)-N-метилпиколинамид (Соединение A15), или соединение, раскрытое в публикации PCT WO 2005/073224, вводят в дозе от 500 мг до 700 мг, например, приблизительно 600 мг, например, ежедневно (например, согласно схеме введения 7 дней/7 дней перерыв). В других вариантах осуществления ингибитор тирозинкиназы CSF-1R, 4-((2-(((1R,2R)-2-гидроксициклогексил)-амино)бензо[d]тиазол-6-ил)окси)-N-метилпиколинамид (Соединение A15), или соединение, раскрытое в публикации PCT WO 2005/073224, вводят в дозе от 800 мг до 1000 мг, например, приблизительно 900 мг, например, ежедневно (например, согласно схеме введения 7 дней/7 дней перерыв).
В некоторых вариантах осуществления ингибитор тирозинкиназы CSF-1R, 4-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиа-зол-6-ил)окси)-N-метилпиколинамид (Соединение A15), или соединение, раскрытое в публикации PCT WO 2005/073224, вводят в дозе от 50 мг до 150 мг, например, приблизительно 100 мг, один раз в неделю. В других вариантах осуществления ингибитор тирозинкиназы CSF-1R, 4-((2-(((1R,2R)-2-гидроксициклогексил)-амино)бензо[d]тиазол-6-ил)окси)-N-метилпиколинамид (Соединение A15), или соединение, раскрытое в публикации PCT WO 2005/073224, вводят в дозе от 100 мг до 200 мг, например, приблизительно 150 мг, один раз в неделю. В других вариантах осуществления ингибитор тирозинкиназы CSF-1R, 4-((2-(((1R,2R)-2-гидроксицикло-гексил)амино)бензо[d]тиазол-6-ил)окси)-N-метилпиколинамид (Соединение A15), или соединение, раскрытое в публикации PCT WO 2005/073224, вводят в дозе от 200 мг до 400 мг, например, приблизительно 300 мг, один раз в неделю. В других вариантах осуществления ингибитор тирозинкиназы CSF-1R, 4-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)окси)-N-метилпиколинамид (Соединение A15), или соединение, раскрытое в публикации PCT WO 2005/073224, вводят в дозе от 500 мг до 700 мг, например, приблизительно 600 мг, один раз в неделю. В других вариантах осуществления ингибитор тирозинкиназы CSF-1R, 4-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)окси)-N-метилпиколинамид (Соединение A15), или соединение, раскрытое в публикации PCT WO 2005/073224, вводят в дозе от 800 мг до 1000 мг, например, приблизительно 900 мг, один раз в неделю.
В некоторых вариантах осуществления ингибитор тирозинкиназы CSF-1R, 4-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиа-зол-6-ил)окси)-N-метилпиколинамид (Соединение A15), или соединение, раскрытое в публикации PCT WO 2005/073224, вводят в комбинации с ингибитором PD-1 (например, молекулой антитела против PD-1). В некоторых вариантах осуществления ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе от 300 мг до 500 мг (например, в дозе 400 мг), например, один раз в 4 недели. В других вариантах осуществления ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе от 200 мг до 400 мг (например, в дозе 300 мг), например, один раз в 3 недели. В одном варианте осуществления ингибитор тирозинкиназы CSF-1R, 4-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиа-зол-6-ил)окси)-N-метилпиколинамид (Соединение A15), или соединение, раскрытое в публикации PCT WO 2005/073224, вводят в дозе от 50 мг до 150 мг (например, приблизительно 100 мг), например, ежедневно (например, согласно схеме введения 7 дней/7 дней перерыв) или один раз в неделю, например, перорально, и ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе от 300 мг до 500 мг (например, в дозе 400 мг), например, один раз в 4 недели, или в дозе от 200 мг до 400 мг (например, в дозе 300 мг), например, один раз в 3 недели, например, путем внутривенной инфузии. В другом варианте осуществления ингибитор тирозинкиназы CSF-1R, 4-((2-(((1R,2R)-2-гидроксициклогексил)-амино)бензо[d]тиазол-6-ил)окси)-N-метилпиколинамид (Соединение A15), или соединение, раскрытое в публикации PCT WO 2005/073224, вводят в дозе от 100 мг до 200 мг (например, приблизительно 150 мг), например, ежедневно (например, согласно схеме введения 7 дней/7 дней перерыв) или один раз в неделю, например, перорально, и ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе от 300 мг до 500 мг (например, в дозе 400 мг), например, один раз в 4 недели, или в дозе от 200 мг до 400 мг (например, в дозе 300 мг), например, один раз в 3 недели, например, путем внутривенной инфузии. В другом варианте осуществления ингибитор тирозинкиназы CSF-1R, 4-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)окси)-N-метилпиколинамид (Соединение A15), или соединение, раскрытое в публикации PCT WO 2005/073224, вводят в дозе от 200 мг до 400 мг (например, приблизительно 300 мг), например, ежедневно (например, согласно схеме введения 7 дней/7 дней перерыв) или один раз в неделю, например, перорально, и ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе от 300 мг до 500 мг (например, в дозе 400 мг), например, один раз в 4 недели, или в дозе от 200 мг до 400 мг (например, в дозе 300 мг), например, один раз в 3 недели, например, путем внутривенной инфузии. В другом варианте осуществления ингибитор тирозинкиназы CSF-1R, 4-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиа-зол-6-ил)окси)-N-метилпиколинамид (Соединение A15), или соединение, раскрытое в публикации PCT WO 2005/073224, вводят в дозе от 500 мг до 700 мг (например, приблизительно 600 мг), например, ежедневно (например, согласно схеме введения 7 дней/7 дней перерыв) или один раз в неделю, например, перорально, и ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе от 300 мг до 500 мг (например, в дозе 400 мг), например, один раз в 4 недели, или в дозе от 200 мг до 400 мг (например, в дозе 300 мг), например, один раз в 3 недели, например, путем внутривенной инфузии. В другом варианте осуществления ингибитор тирозинкиназы CSF-1R, 4-((2-(((1R,2R)-2-гидроксициклогексил)-амино)бензо[d]тиазол-6-ил)окси)-N-метилпиколинамид (Соединение A15), или соединение, раскрытое в публикации PCT WO 2005/073224, вводят в дозе от 800 мг и 1000 мг (например, приблизительно 900 мг), например, ежедневно (например, согласно схеме введения 7 дней/7 дней перерыв) или один раз в неделю, например, перорально, и ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе от 300 мг до 500 мг (например, в дозе 400 мг), например, один раз в 4 недели, или в дозе от 200 мг до 400 мг (например, в дозе 300 мг), например, один раз в 3 недели, например, путем внутривенной инфузии.
В некоторых вариантах осуществления ингибитор тирозинкиназы CSF-1R, 4-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиа-зол-6-ил)окси)-N-метилпиколинамид (Соединение A15), или соединение, раскрытое в публикации PCT WO 2005/073224, вводят перорально. В некоторых вариантах осуществления молекулу антитела против PD-1 вводят внутривенно. В некоторых вариантах осуществления молекулу антитела против PD-1 вводят путем внутривенной инфузии, например, в течение от 15 минут до 3 часов, например, в течение от 30 минут до 2 часов, например, в течение 30 минут, 1 часа, 1,5 часов или 2 часов. В некоторых вариантах осуществления ингибитор тирозинкиназы CSF-1R, 4-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)окси)-N-метилпиколинамид (Соединение A15), или соединение, раскрытое в публикации PCT WO 2005/073224, вводят до введения молекулы антитела против PD-1, например, натощак. Например, введение молекулы антитела против PD-1 могут начинать в любое время после введения ингибитора тирозинкиназы CSF-1R, 4-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиазол-6-ил)окси)-N-метилпиколинамида (Соединения A15), или соединения, раскрытого в публикации PCT WO 2005/073224.
В некоторых вариантах осуществления ингибитор тирозинкиназы CSF-1R, 4-((2-(((1R,2R)-2-гидроксициклогексил)амино)бензо[d]тиа-зол-6-ил)окси)-N-метилпиколинамид (Соединение A15), или соединение, раскрытое в публикации PCT WO 2005/073224, вводят в комбинации с ингибитором PD-1 (например, молекулой антитела против PD-1) для лечения рака, например, солидной опухоли (например, распространенной солидной опухоли). Примеры форм рака, которые можно лечить комбинацией, включают, без ограничения перечисленными, рак головного мозга (например, мультиформную глиобластому (GBM), например, рецидивирующую глиобластому), рак молочной железы (например, трижды негативный рак молочной железы (например, ТНРМЖ)) или рак поджелудочной железы (например, распространенный рак поджелудочной железы). Общие признаки этих форм рака включают, например, биологию опухоли, характеризуемую высоким уровнем TAM в микроокружении опухоли, что может способствовать иммунному уклонению и иммунной супрессии. В некоторых вариантах осуществления блокада CSF-1R в сочетании с терапией против PD-1 может, например, вызывать перепрограммирование TAM и/или снятие иммунной супрессии инфильтрирующих опухоль лимфоцитов (TIL).
В другом варианте осуществления комбинация, например, комбинация, включающая молекулу антитела против PD-1, как описано в настоящей заявке, включает или применяется в комбинации с индуктором апоптоза и/или ингибитором ангиогенеза, таким как иматиниба мезилат (также известным как Гливек®; Соединение A16), или соединением, раскрытым в публикации PCT WO1999/003854, для лечения нарушения, например, описанного нарушения. В одном варианте осуществления индуктором апоптоза и/или ингибитором ангиогенеза является иматиниба мезилат (Соединение A16) или соединение, раскрытое в публикации PCT WO1999/003854. В одном варианте осуществления молекула антитела PD-1 применяется в комбинации с иматиниба мезилатом (Соединением A16) или соединением, раскрытым в публикации PCT WO1999/003854, для лечения нарушения, такого как рак, множественная миелома, рак предстательной железы, немелкоклеточный рак легкого, лимфома, рак желудка, меланома, рак молочной железы, рак поджелудочной железы, рак пищеварительного/желудочно-кишечного тракта, рак толстой и прямой кишки, мультиформная глиобластома, рак печени, рак головы и шеи, астма, рассеянный склероз, аллергия, деменция при болезни Альцгеймера, боковой амиотрофический склероз или ревматоидный артрит.
В некоторых вариантах осуществления иматиниба мезилат (Соединение A16) вводят в дозе приблизительно 100-1000 мг, например, приблизительно от 200 мг до 800 мг, приблизительно от 300 мг до 700 мг или приблизительно от 400 мг до 600 мг, например, приблизительно 200 мг, 300 мг, 400 мг, 500 мг, 600 мг или 700 мг. Схема введения может изменяться, например, от одного раза в два дня до одного раза в день, двух или трех раз в день. В одном варианте осуществления иматиниба мезилат вводят ежедневно в дозе для приема внутрь приблизительно от 100 мг до 600 мг, например, приблизительно 100 мг, 200 мг, 260 мг, 300 мг, 400 мг или 600 мг ежедневно.
В другом варианте осуществления комбинация, например, комбинация, включающая молекулу антитела против PD-1, как описано в настоящей заявке, включает или применяется в комбинации с ингибитором JAK, 2-фтор-N-метил-4-(7-(хинолин-6-илметил)имидазо[1,2-b][1,2,4]триазин-2-ил)бензамидом (Соединением A17), или его дигидрохлоридом, или соединением, раскрытым в публикации PCT WO 2007/070514, для лечения нарушения, например, нарушения, описанного в настоящей заявке. В одном варианте осуществления ингибитором JAK является 2-фтор-N-метил-4-(7-(хинолин-6-илметил)имидазо[1,2-b][1,2,4]триазин-2-ил)бензамид (Соединение A17) или его дигидрохлорид, или соединение, раскрытое в публикации PCT WO 2007/070514. В одном варианте осуществления молекула антитела PD-1 применяется в комбинации с 2-фтор-N-метил-4-(7-(хинолин-6-илметил)имидазо[1,2-b][1,2,4]триазин-2-ил)бензамидом (Соединением A17) или его дигидрохлоридом, или соединением, раскрытым в публикации PCT WO 2007/070514, для лечения нарушения, такого как рак толстой и прямой кишки, миелоидный лейкоз, гемобластоз, аутоиммунное заболевание, неходжкинская лимфома или тромбоцитемия.
В одном варианте осуществления ингибитор JAK или 2-фтор-N-метил-4-(7-(хинолин-6-илметил)имидазо[1,2-b][1,2,4]триазин-2-ил)бензамид (Соединение A17), или его дигидрохлорид вводят в дозе приблизительно 400-600 мг (например, в день), например, приблизительно 400, 500 или 600 мг, или приблизительно 400-500 или 500-600 мг.
В другом варианте осуществления комбинация, например, комбинация, включающая молекулу антитела против PD-1, как описано в настоящей заявке, включает или применяется в комбинации с ингибитором JAK, руксолитиниба фосфатом (также известным как Джакави; Соединение A18), или соединением, раскрытым в публикации PCT WO 2007/070514, для лечения нарушения, например, нарушения, описанного в настоящей заявке. В одном варианте осуществления ингибитором JAK является руксолитиниба фосфат (Соединение A18) или соединение, раскрытое в публикации PCT WO 2007/070514. В одном варианте осуществления молекула антитела PD-1 применяется в комбинации с руксолитиниба фосфатом (Соединение A18) или соединением, раскрытым в публикации PCT WO 2007/070514, для лечения нарушения, такого как рак предстательной железы, лимфоцитарный лейкоз, множественная миелома, лимфома, рак легкого, лейкоз, кахексия, рак молочной железы, рак поджелудочной железы, ревматоидный артрит, псориаз, рак толстой и прямой кишки, миелоидный лейкоз, гемобластоз, аутоиммунное заболевание, неходжкинская лимфома или тромбоцитемия.
В одном варианте осуществления ингибитор JAK или руксолитиниба фосфат (Соединение A18) вводят в дозе приблизительно 15-25 мг, например, два раза в день. В некоторых вариантах осуществления доза составляет приблизительно 15, 20 или 25 мг, или приблизительно 15-20 или 20-25 мг.
В другом варианте осуществления комбинация, например, комбинация, включающая молекулу антитела против PD-1, как описано в настоящей заявке, включает или применяется в комбинации с ингибитором деацетилазы (DAC) панобиностатом (Соединением A19) или соединением, раскрытым в публикации PCT WO 2014/072493, для лечения нарушения, например, нарушения, описанного в настоящей заявке. В одном варианте осуществления ингибитором DAC является панобиностат (Соединение A19) или соединение, раскрытое в публикации PCT WO 2014/072493. В одном варианте осуществления молекула антитела PD-1 применяется в комбинации с панобиностатом (Соединение A19), соединением, раскрытым в публикации PCT WO 2014/072493, для лечения нарушения, такого как рак толстой и прямой кишки, мелкоклеточный рак легкого, рак дыхательных путей/грудины, рак предстательной железы, множественная миелома, миелодиспластический синдром, рак костей, немелкоклеточный рак легкого, эндокринный рак, лимфома, неврологический рак, лейкоз, ВИЧ/СПИД, иммунологическое нарушение, отторжение трансплантата, рак желудка, меланома, рак молочной железы (например, трижды негативный рак молочной железы (ТНРМЖ)), рак поджелудочной железы, рак толстой и прямой кишки, мультиформная глиобластома, миелоидный лейкоз, гемобластоз, рак почки, неходжкинская лимфома, рак головы и шеи, нарушение гемопоэза или рак печени. В некоторых вариантах осуществления рак выбран из рака толстой и прямой кишки (например, микросателлитно стабильного рака толстой и прямой кишки (MSS CRC), рака легкого (например, немелкоклеточного рака легкого) или рака молочной железы (например, трижды негативного рака легкого (ТНРМЖ)).
В некоторых вариантах осуществления, ингибитор деацетилазы (DAC), панобиностат (Соединение A19), или соединение, раскрытое в публикации PCT WO 2014/072493, является ингибитором гистондеацетилаз (HDAC). Без ограничения теорией, считается, что в некоторых вариантах осуществления ингибитор деацетилазы (DAC), панобиностат (Соединение A19), или соединение, раскрытое в публикации PCT WO 2014/072493, относится к классу соединений производных коричной-гидроксамовой кислоты и является пан-ингибитором гистонных (и негистонных) DAC (HDAC) I, II и IV класса. Такие HDAC представляют собой эпигенетические модуляторы и важные мишени рака из-за дисрегуляции указанных ферментов во многих типах опухолей. Ферменты DAC также специфично взаимодействуют с лизиновыми группами на различных негистонных белках, таких как p53, α-тубулин, Hsp90 и HIF1-α. Таким образом, в некоторых вариантах осуществления ингибитор деацетилазы (DAC), панобиностат (Соединение A19), или соединение, раскрытое в публикации PCT WO 2014/072493, является пан-ингибитором DAC. Ингибитор деацетилазы (DAC), панобиностат (Соединение A19), или соединение, раскрытое в публикации PCT WO 2014/072493, может обеспечить многогранный подход к ингибированию пролиферации и/или выживания раковых клеток, например, посредством своего воздействия на ацетилирование гистонов, экспрессию генов и/или онкогенную функцию негистонных белков, таких как Hsp90. Панобиностат (Соединение A19), например, как пан-ингибитор HDAC, очень эффективен при ингибировании активности HDAC большинства изоформ I, IIa, IIb и IV класса в низких наномолярных концентрациях.
В некоторых вариантах осуществления комбинация, описанная в настоящей заявке, включает ингибитор деацетилазы (DAC), панобиностат (Соединение A19), или соединение, раскрытое в публикации PCT WO 2014/072493, и ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекулу антитела против PD-1).
Без ограничения теорией, считается, что в некоторых вариантах осуществления эпигенетические модификаторы, такие как ингибиторы HDAC, могут применяться для усиления иммунотерапии. Панобиностат (Соединение A19) повышал экспрессию гена PD-L1 в линиях клеток меланомы, культивируемом биопсийном материале меланомы и у мышей опухоленосителей. Панобиностат (Соединение A19) также умеренно улучшал ответы на лечение ингибитором PD-1 у мышей (Woods et al. (2015) Cancer Immunol. Res. p. 1375-85). Клинические данные указывают, что эпигенетические модификаторы, включающие комбинацию ингибитора HDAC с ингибитором DNMT, активны у некоторых пациентов с НМРЛ (Juergens et al. (2011) Cancer Discov. p. 598-607). Доклинические данные указывают, что такие иммунотерапии, как ингибиторы PD-1 или CTLA-4, могут усиливать такую активность (Kim et al. (2014) Proc. Natl. Acad. Sci. U.S.A. p. 11774-9). В некоторых вариантах осуществления ингибитор деацетилазы (DAC) панобиностат (Соединение A19) или соединение, раскрытое в публикации PCT WO 2014/072493, усиливает или применяется для усиления иммунотерапии, например, иммунотерапии, включающей ингибитор PD-1 (например, молекулу антитела против PD-1). В некоторых вариантах осуществления ингибитор деацетилазы (DAC) панобиностат (Соединение A19) или соединение, раскрытое в публикации PCT WO 2014/072493, и ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекулу антитела против PD-1), вводят в дозе и/или согласно временной схеме, которые в комбинации обеспечивают требуемую противоопухолевую активность.
В некоторых вариантах осуществления одобренная доза панобиностата (Соединение A19) при множественной миеломе составляет 20 мг раз в два дня, три раза в неделю (TIW), с введением панобиностата (Соединение A19) две недели и перерывом на неделю в течение 21-дневного курса. В других вариантах осуществления схема с менее частым введением в течение одной недели/перерывом на одну неделю, в течение 28-дневного курса, также тестировали у больных миеломной болезнью при использовании дозы TIW 30-60 мг. В некоторых вариантах осуществления ингибитор деацетилазы (DAC) панобиностат (Соединение A19) или соединение, раскрытое в публикации PCT WO 2014/072493, вводят в дозе TIW 10 мг по схеме введения в течение одной недели/перерывом на одну неделю, например, в комбинации с ингибитором PD-1 (например, молекулой антитела против PD-1). Доза и схема применения могут быть увеличены до схемы TIW 20 мг, с введением две недели/перерывом на неделю, при возможности, в зависимости от показателей безопасности и переносимости более низкой дозы и схемы с менее частым введением. Если доза TIW 10 мг по схеме с введением в течение одной недели/перерывом на одну неделю является неприемлемо токсичной, может использоваться более низкая доза или схема с менее частым введением.
В одном варианте осуществления ингибитор DAC, панобиностат (Соединение A19), или соединение, раскрытое в публикации PCT WO, 2014/072493, вводят в дозе приблизительно 20 мг (например, в день).
В одном варианте осуществления ингибитор DAC, панобиностат (Соединение A19), или соединение, раскрытое в публикации PCT WO 2014/072493, вводят в дозе от 2 мг до 30 мг, от 5 мг до 20 мг или от 10 мг до 15 мг, например, 2 мг, 5 мг, 10 мг, 15 мг, 20 мг, 25 мг или 30 мг, например, один раз в день, три раза в неделю или один раз в неделю, например, по схеме введения в течение одной недели/перерывом на одну неделю, в течение одной недели/перерывом на три недели или в течение двух недель/перерывом на одну неделю. В одном варианте осуществления ингибитор DAC или панобиностат (Соединение A19) вводят в дозе от 5 мг до 15 мг, например, приблизительно 10 мг, например, три раза в неделю, например, по схеме введения в течение одной недели/перерывом на три недели или в течение одной недели/перерывом на одну неделю. В другом варианте осуществления ингибитор DAC или панобиностат (Соединение A19) вводят в дозе от 15 мг до 25 мг, например, 20 мг, например, три раза в неделю, например, по схеме введения в течение двух недель/перерывом на три недели.
В некоторых вариантах осуществления ингибитор DAC, панобиностат (Соединение A19), или соединение, раскрытое в публикации PCT WO 2014/072493, вводят перорально.
В одном варианте осуществления ингибитор DAC, панобиностат (Соединение A19), или соединение, раскрытое в публикации PCT WO 2014/072493, вводят в дозе от 5 мг до 15 мг (например, в дозе 10 мг), например, три раза в неделю (например, по схеме введения в течение одной недели/перерывом на три недели или в течение двух недель/перерывом на одну неделю), например, перорально, и ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе от 300 мг до 500 мг (например, в дозе 400 мг), например, один раз в 4 недели, например, путем внутривенной инфузии.
В одном варианте осуществления ингибитор DAC, панобиностат (Соединение A19), или соединение, раскрытое в публикации PCT WO 2014/072493, вводят в комбинации с ингибитором PD-1 (например, молекулой антитела против PD-1), для лечения рака толстой и прямой кишки (например, MSS CRC), рака легкого (например, немелкоклеточного рака легкого (НМРЛ) или рака молочной железы (например, трижды негативного рака молочной железы (ТНРМЖ)).
В другом варианте осуществления комбинация, например, комбинация, включающая молекулу антитела против PD-1, как описано в настоящей заявке, включает или применяется в комбинации с ингибитором одного или более из цитохрома P450 (например, 11B2), альдостерона или ангиогенеза, озилодростатом (Соединением A20), или соединением, раскрытым в публикации PCT WO2007/024945, для лечения нарушения, например, нарушения, описанного в настоящей заявке. В одном варианте осуществления ингибитором одного или более из цитохрома P450 (например, 11B2), альдостерона или ангиогенеза является озилодростат (Соединение A20) или соединение, раскрытое в публикации PCT WO2007/024945. В одном варианте осуществления молекула антитела PD-1 применяется в комбинации с озилодростатом (Соединением A20) или соединением, раскрытым в публикации PCT WO2007/024945, для лечения нарушения, такого как синдром Кушинга, артериальная гипертензия или терапия сердечной недостаточности.
В другом варианте осуществления комбинация, например, комбинация, включающая молекулу антитела против PD-1, как описано в настоящей заявке, включает или применяется в комбинации с ингибитором IAP, (S)-N-(S)-1-циклогексил-2-(S)-2-(4-(4-фторбензоил)тиазол-2-ил)пирролидин-1-ил)-2-оксоэтил)-2-(метиламино)пропанамидом (Соединением A21) или соединением, раскрытым в US 8,552,003, для лечения нарушения, например, нарушения, описанного в настоящей заявке. В одном варианте осуществления ингибитором IAP является (S)-N-(S)-1-циклогексил-2-(S)-2-(4-(4-фторбензоил)тиазол-2-ил)пирролидин-1-ил)-2-оксоэтил)-2-(метиламино)пропанамид (Соединение A21) или соединение, раскрытое в патенте США 8,552,003. В одном варианте осуществления молекула антитела PD-1 применяется в комбинации с (S)-N-(S)-1-циклогексил-2-(S)-2-(4-(4-фторбензоил)тиазол-2-ил)пирролидин-1-ил)-2-оксоэтил)-2-(метиламино)пропанамидом (Соединением A21) или соединением, раскрытым в патенте США 8,552,003, для лечения нарушения, такого как множественная миелома, рак толстой и прямой кишки (CLC), рак легкого (например, немелкоклеточный рак легкого (НМРЛ), рак молочной железы (например, трижды негативный рак молочной железы (ТНРМЖ)), рак яичника, рак поджелудочной железы или нарушение гемопоэза. В некоторых вариантах осуществления рак выбран из рака толстой и прямой кишки (например, микросателлитно стабильного рака толстой и прямой кишки (MSS CRC), рака легкого (например, немелкоклеточного рака легкого) или рака молочной железы (например, трижды негативного рака легкого (ТНРМЖ)).
В некоторых вариантах осуществления ингибитор IAP, (S)-N-(S)-1-циклогексил-2-(S)-2-(4-(4-фторбензоил)тиазол-2-ил)пирролидин-1-ил)-2-оксоэтил)-2-(метиламино)пропанамид (Соединение A21) или соединение, раскрытое в патенте США 8,552,003, представляет собой низкомолекулярный перорально доступный SMAC-миметик, который связывается с доменом BIR3 CIAP1, XIAP и, необязательно, CIAP2. Белки CIAP1 и CIAP2 являются компонентами белковых комплексов семейства рецептора ФНО, содержащих домены смерти. Без ограничения теорией, считается, что в некоторых вариантах осуществления связывание ингибитора IAP, (S)-N-(S)-1-циклогексил-2-(S)-2-(4-(4-фторбензоил)тиазол-2-ил)пирролидин-1-ил)-2-оксоэтил)-2-(метиламино)пропанамида (Соединения A21), или соединения, раскрытого в патенте США 8,552,003, может активировать E3 лигазную функцию CIAP1, вызывать убиквитинилирование и протеосомную деградацию CIAP1 и/или активировать нижестоящую сигнализацию NF-κB после рецепторов (Gyrd-Hansen M, Meier P (2010) Nat. Rev. Cancer p. 561-74). В некоторых вариантах осуществления ингибитор IAP, (S)-N-(S)-1-циклогексил-2-(S)-2-(4-(4-фторбензоил)тиазол-2-ил)пирролидин-1-ил)-2-оксоэтил)-2-(метиламино)пропанамид (Соединение A21), или соединение, раскрытое в патенте США 8,552,003, применяется для повышения противоопухолевого иммунитета у субъекта. Например, ингибитор IAP, (S)-N-(S)-1-циклогексил-2-(S)-2-(4-(4-фторбензоил)тиазол-2-ил)пирролидин-1-ил)-2-оксоэтил)-2-(метиламино)пропанамид (Соединение A21), или соединение, раскрытое в патенте США 8,552,003, может повышать пролиферацию и функцию человеческих и мышиных Т-клеток in vitro после костимуляции и/или ответа на профилактические и терапевтические противоопухолевые вакцины in vivo, например, посредством активации NF-κB (Dougan et al. (2010) J. Exp. Med. p. 2195-206). Активность NF-κB вовлечена в перекрестное примирование Т-клеток в ходе иммуногенного апоптоза клеток в ответ на выброс ассоциированных с опасностью воспалительных молекул (Yatim et al. (2015) Science p. 328-34), указывая на механизм для усиления функции Т-клеток и противоопухолевого иммунитета. В качестве другого примера, ингибитор IAP, (S)-N-(S)-1-циклогексил-2-(S)-2-(4-(4-фторбензоил)тиазол-2-ил)пирролидин-1-ил)-2-оксоэтил)-2-(метиламино)пропанамид (Соединение A21), или соединение, раскрытое в патенте США 8,552,003, может защищать моноцитарные дендритные клетки от апоптоза подобно лигированию CD40 (Knights et al. (2013) Cancer Immunol. Immunother. p. 321-35).
В некоторых вариантах осуществления комбинация, описанная в настоящей заявке, включает ингибитор IAP, (S)-N-(S)-1-циклогексил-2-(S)-2-(4-(4-фторбензоил)тиазол-2-ил)пирролидин-1-ил)-2-оксоэтил)-2-(метиламино)пропанамид (Соединение A21), или соединение, раскрытое в патенте США 8,552,003, и ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекулу антитела против PD-1).
Без ограничения теорией, считается, что в некоторых вариантах осуществления ингибитор IAP, (S)-N-(S)-1-циклогексил-2-(S)-2-(4-(4-фторбензоил)тиазол-2-ил)пирролидин-1-ил)-2-оксоэтил)-2-(метиламино)пропанамид (Соединение A21), или соединение, раскрытое в патенте США 8,552,003, представляет собой перорально доступную малую молекулу, которая активирует сигнализацию NF-kB после членов семейства рецептора ФНО. NF-κB является главным регулятором транскрипции в иммунных клетках, а также действует непосредственно в опухолевых клетках (Perkins (2012) Nat. Rev. Cancer p. 121-32). Доклинические данные указывают, что активность NF-κB требуется для перекрестного примирования CD8+ Т-лимфоцитов, подвергающихся иммуногенному апоптозу (Yatim et al. (2015) Science p. 328-34). Соединение A21 стимулировало пролиферацию Т-лимфоцитов, индуцировало IFN гамма и подавляло продукцию IL-10 in vitro. Клинические исследования с Соединением A21 продемонстрировали индукцию циркулирующих цитокинов, включая ФНО альфа, IL-8, IL-10 и CCL2 (Infante et al. (2014) J. Clin. Oncol. p. 3103-10). Клинические данные указывают, что Соединение A21 повышало процент больных ТНРМЖ с полным ответом по результатам лабораторного исследования при лечении паклитакселом. В некоторых вариантах осуществления ингибитор IAP, (S)-N-(S)-1-циклогексил-2-(S)-2-(4-(4-фторбензоил)тиазол-2-ил)пирролидин-1-ил)-2-оксоэтил)-2-(метиламино)пропанамид (Соединение A21), или соединение, раскрытое в патенте США 8,552,003, увеличивает или применяется для увеличения противоопухолевой активности ингибитора PD-1 (например, молекулы антитела против PD-1).
В некоторых вариантах осуществления ингибитор IAP, (S)-N-(S)-1-циклогексил-2-(S)-2-(4-(4-фторбензоил)тиазол-2-ил)пирролидин-1-ил)-2-оксоэтил)-2-(метиламино)пропанамид (Соединение A21), или соединение, раскрытое в патенте США 8,552,003, и ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекулу антитела против PD-1), вводят в дозе и/или согласно временной схеме, которые в комбинации обеспечивают требуемую противоопухолевую активность.
Без ограничения теорией, считается, что дозы ингибитора IAP, (S)-N-(S)-1-циклогексил-2-(S)-2-(4-(4-фторбензоил)тиазол-2-ил)пирролидин-1-ил)-2-оксоэтил)-2-(метиламино)пропанамида (Соединения A21), или соединения, раскрытого в патенте США 8,552,003, ниже или равные 1800 мг, являются активными, например, согласно фармакодинамическим данным. Например, в парных биопсиях кожи двух пациентов, получавших дозу 320 мг, оба показали деградацию CIAP1, белка, являющегося мишенью Соединения A21; биопсии кожи, собранные у пациентов, получавших более низкие дозы (160 мг и ниже), показали менее выраженную фармакодинамическую активность (Infante et al. (2014) J. Clin. Oncol. p. 3103-10). В некоторых вариантах осуществления дозы выше 900 мг не требуются для клинической эффективности. В некоторых ситуациях дозу Соединения A21 1800 мг плохо переносили в случае применения в комбинации с паклитакселом. Таким образом, в одном варианте осуществления ингибитор IAP, (S)-N-(S)-1-циклогексил-2-(S)-2-(4-(4-фторбензоил)тиазол-2-ил)пирролидин-1-ил)-2-оксоэтил)-2-(метиламино)пропанамид (Соединение A21), или соединение, раскрытое в патенте США 8,552,003, вводят в дозе от 300 мг до 900 мг, например, один раз в неделю. В некоторых вариантах осуществления ингибитор IAP, (S)-N-(S)-1-циклогексил-2-(S)-2-(4-(4-фторбензоил)тиазол-2-ил)пирролидин-1-ил)-2-оксоэтил)-2-(метиламино)пропанамид (Соединение A21), или соединение, раскрытое в патенте США 8,552,003, вводят реже чем один раз в неделю, например, вводят один раз в две недели, один раз в три недели или один раз в четыре недели.
В одном варианте осуществления ингибитор IAP или (S)-N-(S)-1-циклогексил-2-(S)-2-(4-(4-фторбензоил)тиазол-2-ил)пирролидин-1-ил)-2-оксоэтил)-2-(метиламино)пропанамид (Соединение A21) или соединение, раскрытое в US 8,552,003, вводят в дозе приблизительно 1800 мг или меньше, например, один раз в неделю.
В некоторых вариантах осуществления ингибитор IAP, (S)-N-(S)-1-циклогексил-2-(S)-2-(4-(4-фторбензоил)тиазол-2-ил)пирролидин-1-ил)-2-оксоэтил)-2-(метиламино)пропанамид (Соединение A21), или соединение, раскрытое в патенте США 8,552,003, вводят в дозе от приблизительно 160 мг до приблизительно 1800 мг, от приблизительно 200 мг до приблизительно 1200 мг, от приблизительно 300 мг до приблизительно 900 мг, от 400 мг до приблизительно 800 мг или от приблизительно 500 мг до приблизительно 700 мг, например, в дозе приблизительно 300 мг, приблизительно 400 мг, приблизительно 500 мг, приблизительно 600 мг, приблизительно 700 мг, приблизительно 800 мг или приблизительно 900 мг, например, один раз в неделю, один раз в две недели, один раз в три недели или один раз в четыре недели.
В некоторых вариантах осуществления ингибитор IAP, (S)-N-(S)-1-циклогексил-2-(S)-2-(4-(4-фторбензоил)тиазол-2-ил)пирролидин-1-ил)-2-оксоэтил)-2-(метиламино)пропанамид (Соединение A21), или соединение, раскрытое в патенте США 8,552,003, вводят в дозе от приблизительно 200 мг до приблизительно 400 мг, например, приблизительно 300 мг, один раз в неделю. В других вариантах осуществления ингибитор IAP, (S)-N-(S)-1-циклогексил-2-(S)-2-(4-(4-фторбензоил)тиазол-2-ил)пирролидин-1-ил)-2-оксоэтил)-2-(метиламино)пропанамид (Соединение A21), или соединение, раскрытое в патенте США 8,552,003, вводят в дозе от приблизительно 800 мг до приблизительно 1000 мг, например, приблизительно 900 мг, один раз в неделю. В некоторых вариантах осуществления ингибитор IAP, (S)-N-(S)-1-циклогексил-2-(S)-2-(4-(4-фторбензоил)тиазол-2-ил)пирролидин-1-ил)-2-оксоэтил)-2-(метиламино)пропанамид (Соединение A21), или соединение, раскрытое в патенте США 8,552,003, вводят в дозе от приблизительно 200 мг до приблизительно 400 мг, например, приблизительно 300 мг, один раз в четыре недели.
В некоторых вариантах осуществления ингибитор IAP, (S)-N-(S)-1-циклогексил-2-(S)-2-(4-(4-фторбензоил)тиазол-2-ил)пирролидин-1-ил)-2-оксоэтил)-2-(метиламино)пропанамид (Соединение A21), или соединение, раскрытое в патенте США 8,552,003, вводят перорально.
В некоторых вариантах осуществления ингибитор IAP, (S)-N-(S)-1-циклогексил-2-(S)-2-(4-(4-фторбензоил)тиазол-2-ил)пирролидин-1-ил)-2-оксоэтил)-2-(метиламино)пропанамид (Соединение A21), или соединение, раскрытое в патенте США 8,552,003, вводят в комбинации с ингибитором PD-1 (например, молекулой антитела против PD-1). В одном варианте осуществления ингибитор IAP, (S)-N-(S)-1-циклогексил-2-(S)-2-(4-(4-фторбензоил)тиазол-2-ил)пирролидин-1-ил)-2-оксоэтил)-2-(метиламино)пропанамид (Соединение A21), или соединение, раскрытое в патенте США 8,552,003, вводят в дозе от 200 мг до 400 мг (например, в дозе 300 мг), например, один раз в неделю, например, перорально, и ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе от 300 мг до 500 мг (например, в дозе 400 мг), например, один раз в 4 недели, например, путем внутривенной инфузии.
В некоторых вариантах осуществления ингибитор IAP, например, (S)-N-(S)-1-циклогексил-2-(S)-2-(4-(4-фторбензоил)-тиазол-2-ил)пирролидин-1-ил)-2-оксоэтил)-2-(метиламино)пропан-амид (Соединение A21) или соединение, раскрытое в патенте США 8,552,003, вводят в комбинации с ингибитором PD-1 (например, молекулой антитела против PD-1), для лечения рака толстой и прямой кишки (например, MSS CRC), рака легкого (например, немелкоклеточного рака легкого (НМРЛ)) или рака молочной железы (например, трижды негативного рака молочной железы (например, ТНРМЖ)).
В другом варианте осуществления комбинация, например, комбинация, включающая молекулу антитела против PD-1, как описано в настоящей заявке, включает или применяется в комбинации с ингибитором Smoothened (SMO), сонидегиба фосфатом (Соединением A22), (R)-2-(5-(4-(6-бензил-4,5 диметилпиридазин-3-ил)-2-метилпиперазин-1-ил)пиразин-2-ил)пропан-2-олом (Соединением A25) или соединением, раскрытым в публикации PCT WO 2007/131201 или WO 2010/007120, для лечения нарушения, например, нарушения, описанного в настоящей заявке. В одном варианте осуществления ингибитором SMO является сонидегиба фосфат (Соединение A22), (R)-2-(5-(4-(6-бензил-4,5-диметилпиридазин-3-ил)-2-метилпиперазин-1-ил)пиразин-2-ил)пропан-2-ол (Соединение A25) или соединение, раскрытое в публикации PCT WO 2007/131201 или WO 2010/007120. В одном варианте осуществления молекула антитела PD-1 применяется в комбинации с сонидегиба фосфатом (Соединением A22), (R)-2-(5-(4-(6-бензил-4,5-диметилпиридазин-3-ил)-2-метилпиперазин-1-ил)пиразин-2-ил)пропан-2-олом (Соединением A25) или соединением, раскрытым в публикации PCT WO 2007/131201 или WO 2010/007120, для лечения нарушения, такого как рак, медуллобластома, мелкоклеточный рак легкого, рак предстательной железы, базально-клеточная карцинома, рак поджелудочной железы или воспаление.
В некоторых вариантах осуществления сонидегиба фосфат (Соединение A22) вводят в дозе приблизительно 20-500 мг, например, приблизительно от 40 мг до 400 мг, приблизительно от 50 мг до 300 мг или приблизительно от 100 мг до 200 мг, например, приблизительно 50 мг, 100 мг, 150 мг, 200 мг, 250 мг или 300 мг. Схема введения может изменяться, например, от одного раза в два дня до одного раза в день, двух или трех раз в день.
В другом варианте осуществления комбинация, например, комбинация, включающая молекулу антитела против PD-1, как описано в настоящей заявке, включает или применяется в комбинации с ингибитором Alk, церитинибом (также известным как Зикадия; Соединение A23), или соединением, раскрытым в публикации PCT WO 2007/131201, для лечения нарушения, например, нарушения, описанного в настоящей заявке. В одном варианте осуществления ингибитором Alk является церитиниб (Соединение A23) или соединение, раскрытое в публикации PCT WO 2007/131201. В одном варианте осуществления молекула антитела PD-1 применяется в комбинации с церитинибом (Соединением A23) или соединением, раскрытым в публикации PCT WO 2007/131201, для лечения нарушения, такого как немелкоклеточный рак легкого или солидные опухоли.
В одном варианте осуществления ингибитор Alk или церитиниб (Соединение A23) вводят в дозе приблизительно 750 мг, например, один раз в день.
В другом варианте осуществления комбинация, например, комбинация, включающая молекулу антитела против PD-1, как описано в настоящей заявке, включает или применяется в комбинации с ингибитором JAK и/или CDK4/6, 7-циклопентил-N,N-диметил-2-((5-(пиперазин-1-ил)пиридин-2-ил)амино)-7H-пирроло[2,3-d]пиримидин-6-карбоксамидом (Соединением A24), или соединением, раскрытым в патенте США 8,415,355 или патенте США 8,685,980, для лечения нарушения, например, нарушения, описанного в настоящей заявке. В одном варианте осуществления, ингибитором JAK и/или CDK4/6 является 7-циклопентил-N,N-диметил-2-((5-(пиперазин-1-ил)пиридин-2-ил)амино)-7H-пирроло[2,3-d]пиримидин-6-карбоксамидом (Соединением A24) или соединением, раскрытым в патенте США 8,415,355 или патенте США 8,685,980. В одном варианте осуществления молекула антитела PD-1 применяется в комбинации с 7-циклопентил-N,N-диметил-2-((5-(пиперазин-1-ил)пиридин-2-ил)амино)-7H-пирроло[2,3-d]пиримидин-6-карбоксамидом (Соединением A24) или соединением, раскрытым в US 8,415,355 или US 8,685,980, для лечения нарушения, такого как лимфома, неврологический рак, меланома, рак молочной железы или солидная опухоль.
В одном варианте осуществления ингибитор JAK и/или CDK4/6 или 7-циклопентил-N,N-диметил-2-((5-(пиперазин-1-ил)пиридин-2-ил)амино)-7H-пирроло[2,3-d]пиримидин-6-карбоксамид (Соединение A24) вводят в дозе приблизительно 200-600 мг, например, в день. В одном варианте осуществления соединение вводят в дозе приблизительно 200, 300, 400, 500 или 600 мг, или приблизительно 200-300, 300-400, 400-500 или 500-600 мг.
В другом варианте осуществления комбинация, например, комбинация, включающая молекулу антитела против PD-1, как описано в настоящей заявке, включает или применяется в комбинации с ингибитором рецептора пролактина (PRLR), молекулой человеческого моноклонального антитела (Соединением A26), раскрытого в патенте США 7,867,493, для лечения нарушения, например, нарушения, описанного в настоящей заявке. В одном варианте осуществления ингибитором PRLR является человеческое моноклональное антитело (Соединение A26), раскрытое в US 7,867,493. В одном варианте осуществления молекула антитела PD-1 применяется в комбинации с молекулой человеческого моноклонального антитела (Соединением A26), описанного в патенте США 7,867,493, для лечения нарушения, такого как рак, рак предстательной железы или рак молочной железы.
В другом варианте осуществления комбинация, например, комбинация, включающая молекулу антитела против PD-1, как описано в настоящей заявке, включает или применяется в комбинации с ингибитором киназы PIM, N-(4-((1R, 3S, 5S)-3-амино-5-метилциклогексил)пиридин-3-ил)-6-(2,6-дифторфенил)-5-фторпиколинамидом (Соединением A27), или соединением, раскрытым в публикации PCT WO 2010/026124, для лечения нарушения, например, нарушения, описанного в настоящей заявке. В одном варианте осуществления ингибитором киназы PIM является N-(4-((1R,3S,5S)-3-амино-5-метилциклогексил)пиридин-3-ил)-6-(2,6-дифторфенил)-5-фторпиколинамид (Соединение A27) или соединение, раскрытое в публикации PCT WO 2010/026124. В одном варианте осуществления молекула антитела PD-1 применяется в комбинации с N-(4-((1R,3S,5S)-3-амино-5-метилциклогексил)пиридин-3-ил)-6-(2,6-дифторфенил)-5-фторпиколинамидом (Соединением A27) или соединением, раскрытым в публикации PCT WO 2010/026124, для лечения нарушения, такого как множественная миелома, миелодиспластический синдром, миелоидный лейкоз или неходжкинская лимфома.
В другом варианте осуществления комбинация, например, комбинация, включающая молекулу антитела против PD-1, как описано в настоящей заявке, включает или применяется в комбинации с ингибитором сигнализации Wnt, 2-(2',3-диметил-[2,4'-бипиридин]-5-ил)-N-(5-(пиразин-2-ил)пиридин-2-ил)ацетамидом (Соединением A28), или соединением, раскрытым в публикации PCT WO 2010/101849, для лечения нарушения, например, нарушения, описанного в настоящей заявке. В одном варианте осуществления ингибитором сигнализации Wnt является 2-(2',3-диметил-[2,4'-бипиридин]-5-ил)-N-(5-(пиразин-2-ил)пиридин-2-ил)ацетамид (Соединение A28) или соединение, раскрытое в публикации PCT WO 2010/101849. В одном варианте осуществления ингибитором сигнализации Wnt является 2-(2',3-диметил-[2,4'-бипиридин]-5-ил)-N-(5-(пиразин-2-ил)пиридин-2-ил)ацетамид (Соединение A28). В одном варианте осуществления молекула антитела PD-1 применяется в комбинации с 2-(2',3-диметил-[2,4'-бипиридин]-5-ил)-N-(5-(пиразин-2-ил)пиридин-2-ил)ацетамидом (Соединением A28) или соединением, раскрытым в публикации PCT WO 2010/101849, для лечения нарушения, такого как солидная опухоль (например, рак головы и шеи, плоскоклеточная карцинома, рак молочной железы, рак поджелудочной железы или рак толстой кишки). В некоторых вариантах осуществления рак выбран из рака кожи (например, меланомы), солидной опухоли с высокой микросателлитной нестабильностью (MSI-H), рака поджелудочной железы или рака молочной железы (например, трижды негативного рака молочной железы (ТНРМЖ)).
В некоторых вариантах осуществления 2-(2',3-диметил-[2,4'-бипиридин]-5-ил)-N-(5-(пиразин-2-ил)пиридин-2-ил)ацетамид (Соединение A28) вводят в дозе приблизительно 1-50 мг, например, приблизительно от 2 мг до 45 мг, приблизительно от 3 мг до 40 мг, приблизительно от 5 мг до 35 мг, от 5 мг до 10 мг или приблизительно от 10 мг до 30 мг, например, приблизительно 2 мг, 5 мг, 10 мг, 20 мг, 30 мг или 40 мг. Схема введения может изменяться, например, от одного раза в два дня до одного раза в день, два или три раза в день.
В другом варианте осуществления комбинация, например, комбинация, включающая молекулу антитела против PD-1, как описано в настоящей заявке, включает или применяется в комбинации с ингибитором BRAF, энкорафенибом (Соединением A29), или соединением, раскрытым в публикации PCT WO 2011/025927, для лечения нарушения, например, нарушения, описанного в настоящей заявке. В одном варианте осуществления ингибитором BRAF является энкорафениб (Соединение A29) или соединение, раскрытое в публикации PCT WO 2011/025927. В одном варианте осуществления молекула антитела PD-1 применяется в комбинации с энкорафенибом (Соединением A29) или соединением, раскрытым в публикации PCT WO 2011/025927, для лечения нарушения, такого как немелкоклеточный рак легкого, меланома или рак толстой и прямой кишки.
В одном варианте осуществления ингибитор BRAF или энкорафениб (Соединение A29) вводят в дозе приблизительно 200-300, 200-400 или 300-400 мг, например, в день. В одном варианте осуществления соединение вводят в дозе приблизительно 200, приблизительно 300 или приблизительно 400 мг.
В другом варианте осуществления комбинация, например, комбинация, включающая молекулу антитела против PD-1, как описано в настоящей заявке, включает или применяется в комбинации с ингибитором CDK4/6, 7-циклопентил-N,N-диметил-2-((5-((1R,6S)-9-метил-4-оксо-3,9-диазабицикло[4.2.1]нонан-3-ил)пиридин-2-ил)амино)-7H-пирроло[2,3-d]пиримидин-6-карбоксамидом (Соединением A30), или соединением, раскрытым в публикации PCT WO 2011/101409, для лечения нарушения, например, нарушения, описанного в настоящей заявке. В одном варианте осуществления ингибитором CDK4/6 является 7-циклопентил-N,N-диметил-2-((5-((1R,6S)-9-метил-4-оксо-3,9-диазабицикло[4.2.1]но-нан-3-ил)пиридин-2-ил)амино)-7H-пирроло[2,3-d]пиримидин-6-карбоксамид (Соединение A30) или соединение, раскрытое в публикации PCT WO 2011/101409. В одном варианте осуществления молекула антитела PD-1 применяется в комбинации с 7-циклопентил-N,N-диметил-2-((5-((1R,6S)-9-метил-4-оксо-3,9-диазабицикло[4.2.1]нонан-3-ил)пиридин-2-ил)амино)-7H-пирроло[2,3-d]пиримидин-6-карбоксамидом (Соединением A30) или соединением, раскрытым в публикации PCT WO 2011/101409, для лечения нарушения, такого как рак, мантийноклеточная лимфома, липосаркома, немелкоклеточный рак легкого, меланома, плоскоклеточный рак пищевода или рак молочной железы.
В другом варианте осуществления комбинация, например, комбинация, включающая молекулу антитела против PD-1, как описано в настоящей заявке, включает или применяется в комбинации с ингибитором HER3, Соединением A31, или соединением, раскрытым в публикации PCT WO 2012/022814, для лечения нарушения, например, нарушения, описанного в настоящей заявке. В одном варианте осуществления ингибитором HER3 является Соединение A31 или соединение, раскрытое в публикации PCT WO 2012/022814. В одном варианте осуществления молекула антитела PD-1 применяется в комбинации с Соединением A31 или соединением, раскрытым в публикации PCT WO 2012/022814, для лечения нарушения, такого как рак желудка, рак пищевода, рак головы и шеи, плоскоклеточная карцинома, рак желудка, рак молочной железы (например, метастатический рак молочной железы) или рак пищеварительного/желудочно-кишечного тракта.
В некоторых вариантах осуществления Соединением A31 является молекула человеческого моноклонального антитела.
В одном варианте осуществления ингибитор HER3 или Соединение A31 вводят в дозе приблизительно 3, 10, 20 или 40 мг/кг, например, один раз в неделю (QW). В одном варианте осуществления соединение вводят в дозе приблизительно 3-10, 10-20 или 20-40 мг/кг.
В другом варианте осуществления комбинация, например, комбинация, включающая молекулу антитела против PD-1, как описано в настоящей заявке, включает или применяется в комбинации с ингибитором FGFR2 и/или FGFR4, Соединением A32, или соединением, раскрытым в публикации PCT WO 2014/160160 (например, конъюгатом молекулы антитела-лекарственного средства против FGFR2 и/или FGFR4, например, мАт 12425), для лечения нарушения, например, нарушения, описанного в настоящей заявке. В одном варианте осуществления ингибитором FGFR2 и/или FGFR4 является Соединение A32 или соединение, раскрытое в публикации PCT WO 2014/160160. В одном варианте осуществления молекула антитела PD-1 применяется в комбинации с Соединением A32 или соединением, описанным в Таблице 7, для лечения нарушения, такого как рак, рак желудка, рак молочной железы, рабдомиосаркома, рак печени, рак надпочечника, рак легкого, рак пищевода, рак толстой кишки или рак эндометрия.
В некоторых вариантах осуществления Соединение A32 является конъюгатом молекулы антитела-лекарственного средства против FGFR2 и/или FGFR4, например, мАт 12425.
В другом варианте осуществления комбинация, например, комбинация, включающая молекулу антитела против PD-1, как описано в настоящей заявке, включает или применяется в комбинации с ингибитором М-КСФ, Соединением A33, или соединением, раскрытым в публикации PCT WO 2004/045532 (например, молекулой антитела или Fab-фрагментом против М-КСФ), для лечения нарушения, например, нарушения, описанного в настоящей заявке. В одном варианте осуществления ингибитором М-КСФ является Соединение A33 или соединение, раскрытое в публикации PCT WO 2004/045532. В одном варианте осуществления молекула антитела PD-1 применяется в комбинации с Соединением A33 или соединением, описанным в публикации PCT WO 2004/045532, для лечения нарушения, такого как рак, рак предстательной железы, рак молочной железы или пигментный виллонодулярный синовит (PVNS).
В вариантах осуществления Соединение A33 является молекулой моноклонального антитела против М-КСФ или его фрагментом (например, Fab-фрагментом). В вариантах осуществления ингибитор М-КСФ или Соединение A33 вводят в средней дозе приблизительно 10 мг/кг.
В другом варианте осуществления комбинация, например, комбинация, включающая молекулу антитела против PD-1, как описано в настоящей заявке, включает или применяется в комбинации с ингибитором MEK, биниметинибом (Соединением A34), или соединением, раскрытым в публикации PCT WO 2003/077914, для лечения нарушения, например, нарушения, описанного в настоящей заявке. В одном варианте осуществления ингибитором MEK является биниметиниб (Соединение A34) или соединение, раскрытое в публикации PCT WO 2003/077914. В одном варианте осуществления молекула антитела PD-1 применяется в комбинации с биниметинибом (Соединением A34) или соединением, раскрытым в публикации PCT WO 2003/077914, для лечения нарушения, такого как немелкоклеточный рак легкого, мультисистемное генетическое нарушение, меланома, рак яичника, рак пищеварительного/желудочно-кишечного тракта, ревматоидный артрит или рак толстой и прямой кишки.
В одном варианте осуществления ингибитор MEK или биниметиниб (Соединение A34) вводят в дозе приблизительно 45 мг, например, два раза в день.
В другом варианте осуществления комбинация, например, комбинация, включающая молекулу антитела против PD-1, как описано в настоящей заявке, включает или применяется в комбинации с ингибитором одного или более из c-KIT, выброса гистамина, Flt3 (например, FLK2/STK1) или PKC, мидостаурином (Соединением A35), или соединением, раскрытым в публикации PCT WO 2003/037347, для лечения нарушения, например, нарушения, описанного в настоящей заявке. В одном варианте осуществления ингибитором является мидостаурин (Соединение A35) или соединение, раскрытое в публикации PCT WO 2003/037347. В одном варианте осуществления ингибитором одного или более из c-KIT, выброса гистамина, Flt3 (например, FLK2/STK1) или PKC является мидостаурин. В одном варианте осуществления молекула антитела PD-1 применяется в комбинации с мидостаурином (Соединением A35) или соединением, раскрытым в публикации PCT WO 2003/037347, для лечения нарушения, такого как рак, рак толстой и прямой кишки, миелоидный лейкоз, миелодиспластический синдром, возрастная макулодистрофия, осложнение диабета или дерматологическое нарушение.
В другом варианте осуществления комбинация, например, комбинация, включающая молекулу антитела против PD-1, как описано в настоящей заявке, включает или применяется в комбинации с ингибитором TOR (например, ингибитором mTOR), эверолимусом (также известным как Афинитор; Соединение A36), или Соединением, раскрытым в публикации PCT WO 2014/085318, для лечения нарушения, например, нарушения, описанного в настоящей заявке). В одном варианте осуществления ингибитором TOR является эверолимус (Соединение A36) или Соединение, раскрытое в публикации PCT WO 2014/085318. В одном варианте осуществления молекула антитела PD-1 применяется в комбинации с эверолимусом (Соединением A36) для лечения нарушения, такого как рак толстой и прямой кишки, интерстициальная легочная болезнь, мелкоклеточный рак легкого, рак дыхательных путей/грудины, рак предстательной железы, множественная миелома, саркома, возрастная макулодистрофия, рак костей, туберозный склероз, немелкоклеточный рак легкого, эндокринный рак, лимфома, неврологические нарушения, астроцитома, рак шейки матки, неврологический рак, лейкоз, иммунные нарушения, отторжение трансплантата, рак желудка, меланома, эпилепсия, рак молочной железы (например, трижды негативный рак молочной железы (ТНРМЖ)) или рак мочевого пузыря. В некоторых вариантах осуществления рак выбран из рака толстой и прямой кишки (например, микросателлитно стабильного рака толстой и прямой кишки (MSS CRC), рака легкого (например, немелкоклеточного рака легкого) или рака молочной железы (например, трижды негативного рака молочной железы (ТНРМЖ)).
В некоторых вариантах осуществления ингибитор mTOR, эверолимус (Соединение A36), или соединение, раскрытое в публикации PCT WO 2014/085318, ингибирует мишень рапамицина у млекопитающих (mTOR), серин/треонин-киназу, нижестоящую по пути PI3K/AKT. Путь mTOR дерегулирован при нескольких формах рака у человека. Без ограничения теорией, считается, что в некоторых вариантах осуществления ингибитор mTOR, эверолимус (Соединение A36), или соединение, раскрытое в публикации PCT WO 2014/085318, связывается с внутриклеточным белком FKBP-12, что приводит к образованию ингибирующего комплекса с mTOR комплексом 1 (mTORC1) и, таким образом, ингибированию активности mTOR киназы. Эверолимус (Соединение A36) может уменьшать активность S6 рибосомной протеинкиназы (S6K1) и/или связывающего эукариотический фактор инициации 4E белка (4E-BP1), нижестоящих эффекторов mTOR, участвующих в синтезе белка. S6K1 является субстратом mTORC1 и фосфорилирует домен активации 1 эстрогенового рецептора, что приводит к лиганднезависимой активации рецептора. Кроме того, эверолимус (Соединение A36) может ингибировать экспрессию индуцируемого гипоксией фактора (например, HIF-1) и/или уменьшать экспрессию фактора роста эндотелия сосудов (VEGF). Ингибирование mTOR эверолимусом (Соединение A36), как было показано, уменьшало пролиферацию клеток, ангиогенез и захват глюкозы в исследованиях in vitro и/или in vivo. Конститутивная активация пути PI3K/Akt/mTOR может способствовать эндокринной устойчивости рака молочной железы. Исследования in vitro показывают, что эстрогензависимые и HER2+ клетки рака молочной железы чувствительны к ингибирующим эффектам эверолимуса (Соединение A36), и что комбинированное лечение эверолимусом и ингибиторами Akt, HER2 или ароматазы повышает противоопухолевую активность эверолимуса (Соединения A36) синергическим образом. Двумя регуляторами сигнализации mTORC1 являются супрессоры онкогенов, комплексы туберин-склероза 1 и 2 (TSC1, TSC2). Потеря или инактивация TSC1 или TSC2 приводит к активации нижестоящей сигнализации. При TSC, генетическом нарушении, инактивирующие мутации в гене TSC1 или TSC2 приводят к образованию гамартом по всему телу.
В некоторых вариантах осуществления комбинация, описанная в настоящей заявке, включает ингибитор mTOR, эверолимус (Соединение A36), или соединение, раскрытое в публикации PCT WO 2014/085318, и ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекулу антитела против PD-1).
Эверолимус (Соединение A36) применяли в клиниках в качестве прямого противоопухолевого средства в дозе 10 мг ежедневно для подавления активности mTOR в опухолевых клетках, а также в качестве иммунодепрессанта у больных, требующих пересадки паренхиматозных органов, в дозе 1,5-2,0 мг ежедневно для подавления функции Т-лимфоцитов. Без ограничения теорией, считается, что в некоторых вариантах осуществления, при таких дозах и схемах применения, эверолимус (Соединение A36), как ожидается, будет ослаблять эффективный противоопухолевый ответ. Иммуностарение представляет собой снижение иммунной функции, которое наблюдается у пожилых людей и включает пониженный ответ на вакцинацию, в том числе вакцинацию против гриппа. Снижение иммунной функции с возрастом включает увеличение PD-1-положительных "истощенных" Т-лимфоцитов, которые демонстрируют пониженный ответ при стимуляции антигеном (Lages et al. (2010) Aging Cell 9, 785-798). Клинические данные указывают, что доза 5 мг в неделю может быть иммуностимулирующей, уменьшая процент PD-1-положительных CD4+ и CD8+ лимфоцитов по сравнению с лечением плацебо и усиливая ответ на вакцину против гриппа у пожилых субъектов (Mannick et al. (2014) Sci. Transl. Med. Vol. 6, Issue 268, pp. 268ra179). В некоторых вариантах осуществления иммуностимулирующая доза ингибитора mTOR, эверолимуса (Соединения A36), или соединения, раскрытого в публикации PCT WO 2014/085318, увеличивает или используется для увеличения противоопухолевой активности ингибитора PD-1 (например, молекулы антитела против PD-1).
В некоторых вариантах осуществления ингибитор mTOR, эверолимус (Соединение A36), или соединение, раскрытое в публикации PCT WO 2014/085318, и ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекулу антитела против PD-1), вводят в дозе и/или по временной схеме, которые в комбинации обеспечивают требуемую противоопухолевую активность.
В некоторых вариантах осуществления доза эверолимуса (Соединения A36), одобренная при показаниях рака у взрослых (например, рака молочной железы (например, ТНРМЖ), почечно-клеточной карциномы и нейроэндокринных опухолей (например, атипичной легочной карциноидной опухоли) составляет 10 мг ежедневно. Без ограничения теорией, считается, что в некоторых вариантах осуществления моделирование и симуляция на основе mTOR-опосредованного фосфорилирования ее нижестоящей S6 киназы (S6K) указывает, что схема применения с введением 20 мг раз в неделю ингибирует mTOR-опосредованное фосфорилирование S6K почти полностью, схема применения с введением 5 мг раз в неделю ингибирует фосфорилирование S6K больше чем на 50% и схема применения с введением 0,5 мг раз в день ингибирует фосфорилирование S6K приблизительно на 38% в интервале между введениями (Mannick et al. (2014) Sci. Transl. Med. Vol. 6, Issue 268, pp. 268ra179; Tanaka (2008) J. Clin. Oncol. p. 1596-602). Таким образом, в некоторых вариантах осуществления ингибитор mTOR, эверолимус (Соединение A36), или соединение, раскрытое в публикации PCT WO 2014/085318, вводят в дозе 5 мг раз в неделю (QW), например, в комбинации с ингибитором PD-1 (например, молекулой антитела против PD-1). В других вариантах осуществления также может использоваться доза 0,5 мг раз в день (QD), например, если доза 5 мг раз в неделю (QW) плохо переносится. В некоторых вариантах осуществления ингибитор mTOR, эверолимус (Соединение A36), или соединение, раскрытое в публикации PCT WO 2014/085318, вводят в дозе 5 мг или меньше, один раз в неделю.
В одном варианте осуществления ингибитор TOR или эверолимус (Соединение A36) вводят в дозе приблизительно 2,5-20 мг/день. В одном варианте осуществления соединение вводят в дозе приблизительно 2,5, 5, 10, или 20 мг/день, например, приблизительно 2,5-5, 5-10 или 10-20 мг/день.
В одном варианте осуществления ингибитор mTOR, эверолимус (Соединение A36), или соединение, раскрытое в публикации PCT WO 2014/085318, вводят в дозе от 1 мг до 10 мг, от 2 мг до 8 мг, от 3 мг до 7 мг или от 4 мг до 6 мг, например, в дозе 1 мг, 2 мг, 3 мг, 4 мг, 5 мг, 6 мг, 7 мг, 8 мг, 9 мг или 10 мг, например, один раз в неделю, один раз в две недели, один раз в три недели или один раз в четыре недели. В одном варианте осуществления ингибитор mTOR, эверолимус (Соединение A36), или соединение, раскрытое в публикации PCT WO 2014/085318, вводят в дозе от 4 мг до 6 мг, например 5 мг, например, один раз в неделю.
В другом варианте осуществления ингибитор mTOR, эверолимус (Соединение A36), или соединение, раскрытое в публикации PCT WO 2014/085318, вводят в дозе от 0,1 мг до 1 мг, от 0,2 мг до 0,8 мг, от 0,3 мг до 0,7 мг или от 0,4 мг до 0,6 мг, например, 0,1 мг, 0,2 мг, 0,3 мг, 0,4 мг, 0,5 мг, 0,6 мг, 0,7 мг, 0,8 мг, 0,9 мг или 1 мг, например, один раз в день или один раз в неделю.
В некоторых вариантах осуществления ингибитор mTOR, эверолимус (Соединение A36), или соединение, раскрытое в публикации PCT WO 2014/085318, вводят перорально.
В некоторых вариантах осуществления ингибитор mTOR, эверолимус (Соединение A36), или соединение, раскрытое в публикации PCT WO 2014/085318, вводят в дозе от 2 мг до 8 мг (например, в дозе 5 мг), например, один раз в неделю, например, перорально, и ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе от 300 мг до 500 мг (например, в дозе 400 мг), например, один раз в 4 недели, например, путем внутривенной инфузии.
В некоторых вариантах осуществления ингибитор mTOR, эверолимус (Соединение A36), или соединение, раскрытое в публикации PCT WO 2014/085318, вводят в комбинации с ингибитором PD-1 (например, молекулой антитела против PD-1) для лечения рака толстой и прямой кишки (например, MSS CRC), рака легкого (например, немелкоклеточного рака легкого (НМРЛ)) или рака молочной железы (например, трижды негативного рака молочной железы (ТНРМЖ)).
В другом варианте осуществления комбинация, например, комбинация, включающая молекулу антитела против PD-1, как описано в настоящей заявке, включает или применяется в комбинации с ингибитором одного или более из VEGFR-2, PDGFR бета, KIT или RAF-киназы C, 1-метил-5-((2-(5-(трифторметил)-1H-имидазол-2-ил)пиридин-4-ил)окси)-N-(4-(трифторметил)фенил)-1H-бензо[d]имидазол-2-амином (Соединением A37), или соединением, раскрытым в публикации PCT WO 2007/030377, для лечения нарушения, например, нарушения, описанного в настоящей заявке. В одном варианте осуществления ингибитором одного или более из VEGFR-2, PDGFR бета, KIT или RAF-киназы C является 1-метил-5-((2-(5-(трифторметил)-1H-имидазол-2-ил)пиридин-4-ил)окси)-N-(4-(трифторметил)фенил)-1H-бензо[d]имидазол-2-амин (Соединение A37) или соединение, раскрытое в публикации PCT WO 2007/030377. В одном варианте осуществления молекула антитела PD-1 применяется в комбинации с 1-метил-5-((2-(5-(трифторметил)-1H-имидазол-2-ил)пиридин-4-ил)окси)-N-(4-(трифторметил)фенил)-1H-бензо[d]имидазол-2-амином (Соединением A37) или соединением, раскрытым в публикации PCT WO 2007/030377, для лечения нарушения, такого как рак, меланома или солидная опухоль.
В другом варианте осуществления комбинация, например, комбинация, включающая молекулу антитела против PD-1, как описано в настоящей заявке, включает или применяется в комбинации с ингибитором агонистов соматостатина и/или высвобождения гормона роста, пасиреотида диаспартатом (также известным как Сигнифор; Соединение A38), или соединением, раскрытым в публикации PCT WO2002/010192 или патенте США 7,473,761, для лечения нарушения, например, нарушения, описанного в настоящей заявке. В одном варианте осуществления, ингибитором агонистов соматостатина и/или высвобождения гормона роста является пасиреотида диаспартат (Соединение A38) или соединение, раскрытое в публикации PCT WO2002/010192 или патенте США 7,473,761. В одном варианте осуществления молекула антитела PD-1 применяется в комбинации с пасиреотида диаспартатом (Соединением A38) или соединением, раскрытым в публикации PCT WO2002/010192 или патенте США 7,473,761, для лечения нарушения, такого как рак предстательной железы, эндокринный рак, нейрологический рак, нейроэндокринная опухоль (NET) (например, атипичная легочная карциноидная опухоль), рак кожи (например, меланома или рак из клеток Меркеля), рак поджелудочной железы, рак печени, синдром Кушинга, желудочно-кишечное нарушение, акромегалия, заболевание печени и желчных протоков или цирроз печени.
В другом варианте осуществления комбинация, например, комбинация, включающая молекулу антитела против PD-1, как описано в настоящей заявке, включает или применяется в комбинации с модулятором передечи сигнала и/или ингибитором ангиогенеза, довитинибом (Соединением A39), или соединением, раскрытым в публикации PCT WO 2009/115562, для лечения нарушения, например, нарушения, описанного в настоящей заявке. В одном варианте осуществления, модулятором передечи сигнала и/или ингибитором ангиогенеза является довитиниб (Соединение A39) или соединение, раскрытое в публикации PCT WO 2009/115562. В одном варианте осуществления молекула антитела PD-1 применяется в комбинации с довитинибом (Соединением A39) или соединением, раскрытым в публикации PCT WO 2009/115562, для лечения нарушения, такого как рак, рак дыхательных путей/грудины, множественная миелома, рак предстательной железы, немелкоклеточный рак легкого, эндокринный рак или неврологическое генетическое нарушение.
В другом варианте осуществления комбинация, например, комбинация, включающая молекулу антитела против PD-1, как описано в настоящей заявке, включает или применяется в комбинации с ингибитором EGFR, (R,E)-N-(7-хлор-1-(1-(4-(диметиламино)бут-2-еноил)азепан-3-ил)-1H-бензо[d]имидазол-2-ил)-2-метилизоникотинамидом (Соединением A40), или соединением, раскрытым в публикации PCT WO 2013/184757, для лечения нарушения, например, нарушения, описанного в настоящей заявке. В одном варианте осуществления ингибитором EGFR является (R,E)-N-(7-хлор-1-(1-(4-(диметиламино)бут-2-еноил)азепан-3-ил)-1H-бензо[d]имидазол-2-ил)-2-метилизоникотинамид (Соединение A40) или соединение, раскрытое в публикации PCT WO 2013/184757. В одном варианте осуществления молекула антитела PD-1 применяется в комбинации с (R,E)-N-(7-хлор-1-(1-(4-(диметиламино)бут-2-еноил)азепан-3-ил)-1H-бензо[d]имидазол-2-ил)-2-метилизоникотин-амидом (Соединением A40) или соединением, раскрытым в публикации PCT WO 2013/184757, для лечения нарушения, такого как рак, например, солидная опухоль.
В некоторых вариантах осуществления ингибитор EGFR, (R,E)-N-(7-хлор-1-(1-(4-(диметиламино)бут-2-еноил)азепан-3-ил)-1H-бензо[d]имидазол-2-ил)-2-метилизоникотинамид (Соединение A40), или соединение, раскрытое в публикации PCT WO 2013/184757, является ковалентным, необратимым ингибитором тирозинкиназы. В некоторых вариантах осуществления ингибитор EGFR, (R,E)-N-(7-хлор-1-(1-(4-(диметиламино)бут-2-еноил)азепан-3-ил)-1H-бензо[d]имидазол-2-ил)-2-метилизоникотинамид (Соединение A40), или соединение, раскрытое в публикации PCT WO 2013/184757, ингибирует активирующие мутации EGFR (L858R, ex19del). В других вариантах осуществления ингибитор EGFR, (R,E)-N-(7-хлор-1-(1-(4-(диметиламино)бут-2-еноил)азепан-3-ил)-1H-бензо[d]имидазол-2-ил)-2-метилизоникотинамид (Соединение A40), или соединение, раскрытое в публикации PCT WO 2013/184757, не ингибирует или по существу не ингибирует EGFR дикого типа (wt). Соединение A40 показало эффективность у пациентов с EGFR мутантным НМРЛ. В некоторых вариантах осуществления ингибитор EGFR, (R,E)-N-(7-хлор-1-(1-(4-(диметиламино)бут-2-еноил)азепан-3-ил)-1H-бензо[d]имидазол-2-ил)-2-метилизоникотинамид (Соединение A40), или соединение, раскрытое в публикации PCT WO 2013/184757, также ингибирует одну или более киназ из семейства TEC-киназ. Киназы семейства Tec включают, например, ITK, BMX, TEC, RLK и BTK, и являются основными в размножении Т-клеточного рецептора и сигнализации рецепторов хемокинов (Schwartzberg et al. (2005) Nat. Rev. Immunol. p. 284-95). Например, Соединение A40 может ингибировать ITK с биохимической IC50 1,3 нМ. ITK является важным ферментом для выживания Th2 клеток, и его ингибирование приводит к смещению баланса между Th2 и Th1 клетками. Комбинированное лечение in vivo ингибитором ITK ибрутинибом или Соединением A40 и антителом против PD-L1 приводит к превосходной эффективности по сравнению с любым отдельно применяемым средством в нескольких моделях.
В некоторых вариантах осуществления комбинация, описанная в настоящей заявке, включает ингибитор EGFR, (R,E)-N-(7-хлор-1-(1-(4-(диметиламино)бут-2-еноил)азепан-3-ил)-1H-бензо[d]имидазол-2-ил)-2-метилизоникотинамид (Соединение A40), или соединение, раскрытое в публикации PCT WO 2013/184757, и ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекулу антитела против PD-1).
Комбинация ингибирования ITK (ибрутинибом) и ингибирования контрольной точки более эффективна, чем отдельное применение любого средства в различных сингенных моделях на мышах, например, таких, которые экспрессируют ITK, но не экспрессируют BTK. В некоторых вариантах осуществления ингибитор EGFR, (R,E)-N-(7-хлор-1-(1-(4-(диметиламино)бут-2-еноил)азепан-3-ил)-1H-бензо[d]имидазол-2-ил)-2-метилизоникотинамид (Соединение A40), или соединение, раскрытое в публикации PCT WO 2013/184757, ингибирует ITK. Синергический эффект ингибирования ITK и блокады контрольной точки исследовали на мышиных аллотрансплантатах при использовании линий мышиных раковых клеток (A20, CT26 и 4T1) (Sagiv-Barfi et al. (2015) Blood, стр. 2079-86). Комбинация антитела против PD-L1 и ибрутиниба (ингибитора ITK), как было показано, являлась значительно более эффективной, чем любое отдельное средство во всех трех моделях. В этих экспериментах эффект лечения был длителным несмотря на введение ибрутиниба только в течение 8 дней и введение в общей сложности 5 доз антитела против PD-L1. Приблизительно половина мышей с опухолями CT26, получавших эту комбинацию, были полностью вылечены (ни одна из мышей, получавших любое отдельное средство, не была вылечена). Повторное введение этим мышам инокулята опухоли CT26 продемонстрировало долговременную противоопухолевую память, специфичную к этой клеточной линии (Sagiv-Barfi et al. (2015) Blood, стр. 2079-86). Кроме того, опухолеспецифичные Т-клетки были обнаружены в крови и селезенке мышей, получавших ибрутиниб и антитело против PD-L1. Для более глубокого изучения данного наблюдения в отношении Соединения A40, подобный эксперимент проводили при использовании модели лимфомы A20. В данном исследовании комбинация Соединения A40 и антитела против PD-L1 или ибрутиниба и антитела против PD-L1 была более эффективной, чем любое отдельное средство. Соединение A40 и ибрутиниб вводили лишь в течение десяти дней и вводили в общей сложности 5 доз антитела против PD-L1. Действие Соединения A40 плюс антитело против PD-L1 и ибрутиниба плюс антитело против PD-L1 на выживаемость продолжалось дольше 60 дней, даже если Соединение A40 и ибрутиниб вводили лишь кратковременно. Комбинация антитела против PD-L1 и Соединения A40 приводила к регрессии опухолей у мышей-носителей аллотрансплантата лимфомы A20. Таким образом, в некоторых вариантах осуществления ингибитор EGFR, (R,E)-N-(7-хлор-1-(1-(4-(диметиламино)бут-2-еноил)азепан-3-ил)-1H-бензо[d]имидазол-2-ил)-2-метилизоникотинамид (Соединение A40), или соединение, раскрытое в публикации PCT WO 2013/184757, увеличивает или применяется для увеличения противоопухолевого действия ингибитора PD-1 (например, молекулы антитела против PD-1).
В некоторых вариантах осуществления ингибитор EGFR, (R,E)-N-(7-хлор-1-(1-(4-(диметиламино)бут-2-еноил)азепан-3-ил)-1H-бензо[d]имидазол-2-ил)-2-метилизоникотинамид (Соединение A40), или соединение, раскрытое в публикации PCT WO 2013/184757, и ингибитор молекулы иммунной контрольной точки, например, ингибитор PD-1 (например, молекулу антитела против PD-1), вводят в дозе и/или по времененной схеме, которые в комбинации обеспечивают требуемую противоопухолевую активность.
В одном варианте осуществления ингибитор EGFR или (R,E)-N-(7-хлор-1-(1-(4-(диметиламино)бут-2-еноил)азепан-3-ил)-1H-бензо[d]имидазол-2-ил)-2-метилизоникотинамид (Соединение A40) вводят в дозе 150-250 мг, например, в день. В одном варианте осуществления соединение вводят в дозе приблизительно 150, 200 или 250 мг, или приблизительно 150-200 или 200-250 мг.
В одном варианте осуществления ингибитор EGFR, (R,E)-N-(7-хлор-1-(1-(4-(диметиламино)бут-2-еноил)азепан-3-ил)-1H-бензо[d]имидазол-2-ил)-2-метилизоникотинамид (Соединение A40), или соединение, раскрытое в публикации PCT WO 2013/184757, вводят в дозе от 5 мг до 100 мг, например, от 10 мг до 75 мг, от 15 мг до 50 мг, от 20 мг до 30 мг, от 10 мг до 40 мг, от 10 мг до 25 мг или от 25 мг до 40 мг, например, в дозе 5 мг, 10 мг, 15 мг, 20 мг, 25 мг, 30 мг, 35 мг, 40 мг, 45 мг, 50 мг, 60 мг, 70 мг, 80 мг, 90 мг или 100 мг, например, два раза в день, один раз в день, один раз в два дня, один раз в три дня или один раз в неделю.
В одном варианте осуществления ингибитор EGFR, (R,E)-N-(7-хлор-1-(1-(4-(диметиламино)бут-2-еноил)азепан-3-ил)-1H-бензо[d]имидазол-2-ил)-2-метилизоникотинамид (Соединение A40), или соединение, раскрытое в публикации PCT WO 2013/184757, вводят в дозе от 10 мг до 50 мг (например, 25 мг) один раз в день. В некоторых вариантах осуществления ингибитор EGFR, (R,E)-N-(7-хлор-1-(1-(4-(диметиламино)бут-2-еноил)азепан-3-ил)-1H-бензо[d]имидазол-2-ил)-2-метилизоникотинамид (Соединение A40), или соединение, раскрытое в публикации PCT WO 2013/184757, вводят перорально. В одном варианте осуществления ингибитор EGFR, (R,E)-N-(7-хлор-1-(1-(4-(диметиламино)бут-2-еноил)азепан-3-ил)-1H-бензо[d]имидазол-2-ил)-2-метилизоникотинамид (Соединение A40), или соединение, раскрытое в Публикации PCT WO 2013/184757, вводят в дозе от 10 мг до 50 мг (например, 25 мг), например, один раз в день, например, перорально, и ингибитор PD-1 (например, молекулу антитела против PD-1) вводят в дозе от 300 мг до 500 мг (например, в дозе 400 мг), например, один раз в 4 недели, например, путем внутривенной инфузии. В некоторых вариантах осуществления комбинацию вводят в одном или более курсах применения, например, одном или более 28-дневных курсах применения. В некоторых вариантах осуществления ингибитор EGFR, (R,E)-N-(7-хлор-1-(1-(4-(диметиламино)бут-2-еноил)азепан-3-ил)-1H-бензо[d]имидазол-2-ил)-2-метилизоникотинамид (Соединение A40), или соединение, раскрытое в публикации PCT WO 2013/184757, вводят в день 1 до дня 10 первого курса применения. В некоторых вариантах осуществления ингибитор EGFR, (R,E)-N-(7-хлор-1-(1-(4-(диметиламино)бут-2-еноил)азепан-3-ил)-1H-бензо[d]имидазол-2-ил)-2-метилизоникотинамид (Соединение A40), или соединение, раскрытое в публикации PCT WO 2013/184757, не вводят в день 11 до дня 28 первого курса применения, или не вводят ни в одном из последующих курсов применения.
В некоторых вариантах осуществления ингибитор EGFR, (R,E)-N-(7-хлор-1-(1-(4-(диметиламино)бут-2-еноил)азепан-3-ил)-1H-бензо[d]имидазол-2-ил)-2-метилизоникотинамид (Соединение A40), или соединение, раскрытое в публикации PCT WO 2013/184757, вводят в комбинации с ингибитором PD-1 (например, молекулой антитела против PD-1) для лечения рака толстой и прямой кишки (CRC), рака легкого (например, немелкоклеточного рака легкого (НМРЛ)) или рака молочной железы (например, трижды негативного рака молочной железы (ТНРМЖ)).
В другом варианте осуществления комбинация, например, комбинация, включающая молекулу антитела против PD-1, как описано в настоящей заявке, включает или применяется в комбинации с ингибитором ALK, N6-(2-изопропокси-5-метил-4-(1-метилпиперидин-4-ил)фенил)-N4-(2-(изопропилсульфонил)фенил)-1H-пиразоло[3,4-d]пиримидин-4,6-диамином (Соединением A42), или соединением, раскрытым в публикации PCT WO 2008/073687, для лечения нарушения, например, нарушения, описанного в настоящей заявке. В одном варианте осуществления ингибитором ALK является N6-(2-изопропокси-5-метил-4-(1-метилпиперидин-4-ил)фенил)-N4-(2-(изопропилсульфонил)фенил)-1H-пиразоло[3,4-d]пиримидин-4,6-диамин (Соединение A42) или соединение, раскрытое в публикации PCT WO 2008/073687. В одном варианте осуществления молекула антитела PD-1 применяется в комбинации с N6-(2-изопропокси-5-метил-4-(1-метилпиперидин-4-ил)фенил)-N4-(2-(изопропилсульфонил)-фенил)-1H-пиразоло[3,4-d]пиримидин-4,6-диамином (Соединением A42) или соединением, раскрытым в публикации PCT WO 2008/073687, для лечения нарушения, такого как рак, анапластическая крупноклеточная лимфома (ALCL), немелкоклеточная карцинома легкого (НМРЛ) или нейробластома.
В другом варианте осуществления комбинация, например, комбинация, включающая молекулу антитела против PD-1, как описано в настоящей заявке, включает или применяется в комбинации с ингибитором IGF-1R, 3-(4-(4-((5-хлор-4-((5-метил-1H-пиразол-3-ил)амино)пиримидин-2-ил)амино)-5-фтор-2-метилфенил)пиперидин-1-ил)тиетан-1,1-диоксидом (Соединением A43), 5-хлор-N2-(2-фтор-5-метил-4-(1-(тетрагидро-2H-пиран-4-ил)пиперидин-4-ил)фенил)-N4-(5-метил-1H-пиразол-3-ил)пиримидин-2,4-диамином (Соединением A44) или 5-хлор-N2-(4-(1-этилпиперидин-4-ил)-2-фтор-5-метилфенил)-N4-(5-метил-1H-пиразол-3-ил)пиримидин-2,4-диамином (Соединением A45), или соединением, раскрытым в публикации PCT WO 2010/002655, для лечения нарушения, например, описанного нарушения. В одном варианте осуществления ингибитором IGF-1R является 3-(4-(4-((5-хлор-4-((5-метил-1H-пиразол-3-ил)амино)пиримидин-2-ил)амино)-5-фтор-2-метилфенил)пиперидин-1-ил)тиетан-1,1-диоксид (Соединение A43), 5-хлор-N2-(2-фтор-5-метил-4-(1-(тетрагидро-2H-пиран-4-ил)пиперидин-4-ил)фенил)-N4-(5-метил-1H-пиразол-3-ил)пиримидин-2,4-диамин (Соединение A44), 5-хлор-N2-(4-(1-этилпиперидин-4-ил)-2-фтор-5-метилфенил)-N4-(5-метил-1H-пиразол-3-ил)пиримидин-2,4-диамин (Соединение A45) или соединение, раскрытое в публикации PCT WO 2010/002655. В одном варианте осуществления молекула антитела PD-1 применяется в комбинации с 3-(4-(4-((5-хлор-4-((5-метил-1H-пиразол-3-ил)амино)пиримидин-2-ил)амино)-5-фтор-2-метилфенил)пиперидин-1-ил)тиетан-1,1-диоксидом (Соединением A43), 5-хлор-N2-(2-фтор-5-метил-4-(1-(тетрагидро-2H-пиран-4-ил)-пиперидин-4-ил)фенил)-N4-(5-метил-1H-пиразол-3-ил)пиримидин-2,4-диамином (Соединением A44), 5-хлор-N2-(4-(1-этилпиперидин-4-ил)-2-фтор-5-метилфенил)-N4-(5-метил-1H-пиразол-3-ил)пиримидин-2,4-диамином (Соединением A45) или соединением, раскрытым в публикации PCT WO 2010/002655, для лечения нарушения, такого как рак или саркома.
В другом варианте осуществления комбинация, например, комбинация, включающая молекулу антитела против PD-1, как описано в настоящей заявке, включает или применяется в комбинации с ингибитором P-гликопротеина 1, вальсподаром (также известным как AMDRAY; Соединение A46), или соединением, раскрытым в EP 296122, для лечения нарушения, например, нарушения, описанного в настоящей заявке. В одном варианте осуществления ингибитором P-гликопротеина 1 является вальсподар (Соединение A46) или соединение, раскрытое в EP 296122. В одном варианте осуществления молекула антитела PD-1 применяется в комбинации с вальсподаром (Соединением A46) или соединением, раскрытым в EP 296122, для лечения нарушения, такого как рак или опухоль, резистентная к лекарственному средству.
В другом варианте осуществления комбинация, например, комбинация, включающая молекулу антитела против PD-1, как описано в настоящей заявке, включает или применяется в комбинации с одним или более из ингибитора VEGFR, ваталаниба сукцината (Соединение A47) или соединения, раскрытого в EP 296122, для лечения нарушения, например, нарушения, описанного в настоящей заявке. В одном варианте осуществления ингибитором VEGFR является ваталаниба сукцинат (Соединение A47) или соединение, раскрытое в EP 296122. В одном варианте осуществления молекула антитела PD-1 применяется в комбинации с ваталаниба сукцинатом (Соединение A47) или соединением, раскрытым в EP 296122, для лечения рака.
В другом варианте осуществления комбинация, например, комбинация, включающая молекулу антитела против PD-1, как описано в настоящей заявке, включает или применяется в комбинации с ингибитором IDH или соединением, раскрытым в WO2014/141104, для лечения нарушения, например, нарушения, описанного в настоящей заявке. В одном варианте осуществления ингибитором IDH являетс соединение, раскрытое в публикации PCT WO2014/141104. В одном варианте осуществления молекула антитела PD-1 применяется в комбинации с соединением, раскрытым в WO2014/141104, для лечения нарушения, такого как рак.
В другом варианте осуществления комбинация, например, комбинация, включающая молекулу антитела против PD-1, как описано в настоящей заявке, включает или применяется в комбинации с ингибитором BCL-ABL или соединением, раскрытым в публикации PCT WO2013/171639, WO2013/171640, WO2013/171641 или WO2013/171642, для лечения нарушения, например, нарушения, описанного в настоящей заявке. В одном варианте осуществления ингибитором BCL-ABL является соединение, раскрытое в публикации PCT WO2013/171639, WO2013/171640, WO2013/171641 или WO2013/171642. В одном варианте осуществления молекула антитела PD-1 применяется в комбинации с соединением, раскрытым в публикации PCT WO2013/171639, WO2013/171640, WO2013/171641 или WO2013/171642, для лечения нарушения, такого как рак.
В другом варианте осуществления комбинация, например, комбинация, включающая молекулу антитела против PD-1, как описано в настоящей заявке, включает или применяется в комбинации с ингибитором c-RAF или соединением, раскрытым в публикации PCT WO2014/151616, для лечения нарушения, например, нарушения, описанного в настоящей заявке. В одном варианте осуществления ингибитором c-RAF является Соединение A50 или соединение, раскрытое в публикации PCT WO2014/151616. В некоторых вариантах осуществления ингибитор c-RAF или Соединение A50 является соединением формулы (I):

или его фармацевтически приемлемой солью, где:
Z1 является O, S, S(=O) или SO2;
Z2 является N, S или CRa, где Ra является H, галогеном, C1-4 алкилом или C1-4 галогеналкилом;
R1 является CN, галогеном, OH, C1-4 алкокси или C1-4 алкилом, который необязательно замещен одной - тремя группами, выбранными из галогена, C1-4 алкокси, CN и гидроксила;
Кольцо B выбрано из фенила, пиридина, пиримидина, пиразина, пиридазина, пиридона, пиримидона, пиразинона, пиридазинона и тиазола, каждый из которых необязательно замещен не более чем двумя группами, выбранными из галогена, OH, CN, C1-4 алкила, C2-4 алкенила, -O-(C1-4 алкила), NH2, NH-(C1-4 алкила), -N(C1-4 алкила)2, -SO2R2, NHSO2R2, NHC(O)R2, NHCO2R2, C3-6 циклоалкила, 5-6-членного гетероарила, -O-C3-6 циклоалкила, -O-(5-6-членного гетероарила), C4-8 гетероциклоалкила и -O-(4-8-членного гетероциклоалкила), где каждый гетероциклоалкил и гетероарил содержат до трех гетероатомов, выбранных из N, O и S, в качестве членов кольца,
где каждый C1-4 алкил, C2-4 алкенил, C3-6 циклоалкил, 5-6-членный гетероарил и 4-8-членный гетероциклоалкил необязательно замещен не более чем тремя группами, выбранными из оксо, гидроксила, галогена, C1-4 алкила, C1-4 галогеналкила, C1-4 алкокси и -(CH2)1-2Q, где Q является OH, C1-4 алкокси, -CN, NH2, -NHR3, -N(R3)2, -SO2R3, NHSO2R3, NHC(O)OR3 или NHC(O)R3; каждый R2 и R3 независимо является C1-4 алкилом; и
Кольцо B необязательно сконденсировано с 5-6-членным ароматическим или неароматическим кольцом, содержащим до двух гетероатомов, выбранных из N, O и S, где 5-6-членное кольцо может быть замещено галогеном, C1-4 алкилом, C1-4 галогеналкилом или C1-4 алкокси, и, если конденсированное кольцо является неароматическим, варианты заместителей могут дополнительно включать оксо;
каждый Y независимо выбран из C1-4 алкила, C1-4 алкокси, CN, галогена, оксо, -(CH2)pOR4, -(CH2)pN(R4)2, -(CH2)pNHC(O)R4, -(CH2)pNHCOO(C1-4 алкила) и имидазола,
или две группы Y на Кольце A необязательно объединены с образованием кольца, конденсированного с или содержащего мостик Кольца A, где указанное конденсированное или содержащее мостик кольцо необязательно содержит гетероатом, выбранный из N, O и S, в качестве члена кольца, и необязательно замещено не более чем двумя группами, выбранными из C1-4 алкила, C1-4 алкокси, CN, галогена, оксо, -(CH2)pOR4, -(CH2)pN(R4)2, -(CH2)pNHC(O)R4 и -(CH2)pNHCOO(C1-4 алкила);
каждый R4 независимо является H или C1-4 алкилом;
каждое p независимо является 0, 1 или 2;
q является 0, 1 или 2;
Z3, Z4 и Z5 независимо выбраны из CH и N и, необязательно, NO;
L является -C(=O)-NR4-[CY] или -NR4-C(=O)-[CY], где [CY] указывает, какой атом L присоединен к CY; и
CY является ароматическим кольцом, выбранным из фенила, пиридина, пиримидина, пиразина, пиридазина, пиридона, тиазола, изотиазола, оксазола, пиразола и изоксазола, где кольцо необязательно сконденсировано с тиофеновым, имидазольным, оксазолоновым или пиррольным кольцом;
и CY замещен не более чем двумя группами, выбранными из галогена, CN, R5, OR5, SO2R5, -S(=NH)(=O)R5, OH, NH2, NHR5 и -N(R5)2,
где каждый R5 независимо является C1-4 алкилом, C2-4 алкенилом, C2-6 гетероциклилом, 5-членным гетероарилом, содержащим до трех гетероатомов, выбранных из N, O и S, в качестве членов кольца, или C3-8 циклоалкилом, и R5 необязательно замещен не более чем четырьмя группами, выбранными из оксо, галогена, CN, R6, OH, OR6, SO2R6, NH2, NHR6, N(R6)2, NHSO2R6, NHCOOR6, NHC(=O)R6, -CH2OR7, -CH2N(R7)2, где каждый
R6 независимо является C1-4 алкилом, и каждый R7 независимо является H или C1-4 алкилом;
и два R4, R5, R6 или R7 на одном атоме азота могут быть объединены с образованием 5-6-членного гетероциклического кольца, необязательно содержащего дополнительный N, O или S в качестве члена кольца, и необязательно замещенного не более чем двумя группами, выбранными из C1-4 алкила, оксо, галогена, OH и C1-4 алкокси.
В одном варианте осуществления молекула антитела PD-1 применяется в комбинации с соединением, раскрытым в публикации PCT WO2014/151616, для лечения нарушения, такого как рак, например, рак, описанный в настоящей заявке. В некоторых вариантах осуществления рак является раком легкого (например, немелкоклеточным раком легкого).
В другом варианте осуществления комбинация, например, комбинация, включающая молекулу антитела против PD-1, как описано в настоящей заявке, включает или применяется в комбинации с конкурентным ингибитором ERK1/2 АТФ, или соединением, раскрытым в Публикации PCT WO2015/066188, для лечения нарушения, например, нарушения, описанного в настоящей заявке. В одном варианте осуществления конкурентным ингибитором ERK1/2 АТФ является соединение, раскрытое в публикации PCT WO2015/066188. В одном варианте осуществления молекула антитела PD-1 применяется в комбинации с Соединением A51 или соединением, раскрытым в публикации PCT WO2015/066188, для лечения нарушения, такого как рак.
В некоторых вариантах осуществления комбинацию, например, комбинацию, включающую молекулу антитела против PD-1, как описано в настоящей заявке, вводят в комбинации с одним или более средствами, выбранными из Соединения A8, Соединения A17, Соединения A23, Соединения A24, Соединения A27, Соединения A29 и Соединения A33.
В некоторых вариантах осуществления комбинацию, например, комбинацию, включающую молекулу антитела против PD-1, как описано в настоящей заявке, вводят в комбинации с противоопухолевым средством, имеющим известную активность в анализе на иммунных клетках, например, в одном или более из анализа huMLR, анализа пролиферации Т-клеток и анализа пролиферации В-клеток. Примеры анализов описаны ниже. На основе анализа может быть вычислено значение IC50 для каждого тестируемого средства. В вариантах осуществления противоопухолевое средство имеет IC50, например, 0-1 мкМ, 1-4 мкМ или больше 4 мкМ, например, 4-10 мкМ или 4-20 мкМ. В вариантах осуществления второе терапевтическое средство выбрано из одного или более из: Соединения A9, Соединения A16, Соединения A17, Соединения A21, Соединения A22, Соединения A25, Соединения A28, Соединения A48 и Соединения 49.
В некоторых вариантах осуществления Соединение A28 (или соединение, родственное Соединению A28) вводят в дозе приблизительно 5-10 или 10-30 мг. В некоторых вариантах осуществления Соединение A22 (или соединение, родственное Соединению A22) вводят в дозе приблизительно 200 мг. В некоторых вариантах осуществления Соединение A17 (или соединение, родственное Соединению A17) вводят в дозе приблизительно 400-600 мг. В некоторых вариантах осуществления Соединение A16 (или соединение, родственное Соединению A16) вводят внутрь в дозе приблизительно 400-600 мг в день. В некоторых вариантах осуществления Соединение A29 (или соединение, родственное Соединению A29) вводят в дозе приблизительно 200-400 или 300-400 мг. В некоторых вариантах осуществления Соединение A24 (или соединение, родственное Соединению A24) вводят в дозе приблизительно 200-600 мг. В некоторых вариантах осуществления Соединение A23 (церитиниб) (или соединение, родственное церитинибу) вводят в дозе приблизительно 750 мг один раз в день. В некоторых вариантах осуществления Соединение A8 (или соединение, родственное Соединению A8) вводят в дозе приблизительно 200-400 или 300-400 мг. В некоторых вариантах осуществления Соединение A5 (или соединение, родственное Соединению A5) вводят в дозе приблизительно 100-125 мг. В некоторых вариантах осуществления Соединение A6 (или соединение, родственное Соединению A6) вводят в дозе приблизительно 100 мг. В некоторых вариантах осуществления Соединение A1 (или соединение, родственное Соединению A1) вводят в дозе приблизительно 200-300 или 200-600 мг. В некоторых вариантах осуществления Соединение A40 (или соединение, родственное Соединению A40) вводят в дозе приблизительно 150-250 мг. В вариантах осуществления Соединение A10 (или соединение, родственное Соединению A10) вводят в дозе приблизительно 400-700 мг, например, вводят три раза в неделю, в течение 2 недель и с перерывом на одну неделю. В вариантах осуществления ингибитор BCR-ABL вводят в дозе приблизительно 20 мг два раза в день - 80 мг два раза в день.
Примеры анализов huMLR и анализа пролиферации B или Т-клеток приведены ниже.
Реакция смешанной культуры человеческих лимфоцитов
Реакция смешанной культуры лимфоцитов (СКЛ) является функциональным тестом, с помощью которого измеряют пролиферативный ответ лимфоцитов одного человека (респондера) на лимфоциты другого человека (стимулятора). Для выполнения аллогенной СКЛ, мононуклеарные клетки периферической крови (МКПК) от трех доноров выделяли из лейкоцитарного слоя с HLA неизвестного типа (Kantonspital Blutspendezentrum from Bern and Aarau, Switzerland). Клетки подготавливали при концентрации 2×105 в 0,2 мл культуральной среды, содержащей RPMI 1640 GlutaMAXTM с 10% фетальной телячьей сыворотки (FCS), 100 Ед пенициллина/100 мкг стрептомицина, 50 мкМ 2-меркаптоэтанола. Реакции двунаправленных СКЛ доноров проводили путем смешивания МКПК двух разных доноров в соотношении 1:1 и совместного культивирования в трех повторностях в плоскодонных 96-луночных планшетах для культур тканей в течение 6 дней при 37°C, 5% CO2, в присутствии тестируемых соединений в диапазоне из 8 концентраций или в их отсутствии. Клетки импульсно метили 3H-TdR (1 мкКи/0,2 мл) в течение последних 16 часов культивирования, и включение радиоактивной метки использовали для измерения пролиферации клеток. Концентрация, при которой происходит 50% ингибирование максимального ответа huMLR (IC50), вычисляли для каждого соединения. Циклоспорин использовали в качестве положительного контроля ингибирования huMLR.
Анализ пролиферации человеческих B-клеток
МКПК выделяли в градиенте плотности Ficoll-Paque из свежей человеческой крови и подвергали отрицательному выделению B-клеток. B-клетки ресуспендировали в культуральной среде (RPMI 1640, HEPES, 10% FCS, 50 мкг/мл гентамицина, 50 мкМ 2-меркаптоэтанола, 1×ITS (инсулин, трансферрин и селенит натрия), 1× заменимые аминокислоты) в концентрации 9×104 на лунку в плоскодонных 96-луночных планшетах для культивирования. Стимуляцию В-клеток проводили с использованием молекулы человеческого антитела против IgM (30 мкг/мл) и IL-4 (75 нг/мл) или лигандом CD40 (3 мкг/мл) и IL-4 (75 нг/мл) в присутствии тестируемых соединений в диапазоне из 7 концентраций или в их отсутствии. Через 72 часа культивирования при 37°C, 10% CO2, клетки импульсно метили 3H-TdR (1 мкКи/лунка) в течение последних 6 часов культивирования. Затем B-клетки собирали и измеряли включение тимидина с помощью сцинтилляционного счетчика. Для каждой повторности обработок вычисляли средние значения, и полученные данные вводили в программу XLfit 4 для определения соответствующих значений IC50.
Анализ пролиферации человеческих Т-клеток
МКПК выделяли в градиенте плотности Ficoll-Paque из свежей человеческой крови и подвергали отрицательному выделению Т-клеток. T-клетки подготавливали в культуральной среде (RPMI 1640, HEPES, 10% FCS, 50 мкг/мл гентамицина, 50 мкМ 2-меркаптоэтанола, 1×ITS (инсулин, трансферрин и селенит натрия), 1× заменимые аминокислоты) в концентрации 8×104 на лунку в плоскодонных 96-луночных культуральных планшетах. Стимуляцию T-клеток проводили с использованием молекулы человеческого антитела против CD3 (10 мкг/мл) или молекулы человеческого антитела против CD3 (5 мкг/мл) и молекулы антитела против CD28 (1 мкг/мл) в присутствии тестируемых соединений в диапазоне из 7 концентраций или в их отсутствии. Через 72 часа культивирования при 37°C, 10% CO2, клетки импульсно метили 3H-TdR (1 мкКи/лунка) в течение последних 6 часов культивирования. Пролиферацию клеток измеряли по включению тимидина, что позволяло выполнить определение IC50 для каждого тестируемого соединения.
Контрацепция
В некоторых вариантах осуществления любого из способов, раскрытых в настоящей заявке, субъект использует контрацепцию (например, контрацептивное средство) до применения, во время или после применения терапии (например, комбинированной терапии), включающей молекулу антитела против PD-1, описанную в настоящей заявке. Без ограничения теорией, считается, что в некоторых вариантах осуществления использование контрацепции в течение некоторого периода до применения, во время или после применения терапии (например, комбинированной терапии) может уменьшить или предотвратить риск эмбриофетальной токсичности, например, повышенный риск прерывания беременности или смерть недоношенного ребенка.
В некоторых вариантах осуществления способ, описанный в настоящей заявке, включает введение контрацептивного средства субъекту (например, женского пола), который применяет или применял терапию (например, комбинированную терапию), включающую молекулу антитела против PD-1, описанную в настоящей заявке. В других вариантах осуществления контрацептивное средство используется в комбинации с терапией (например, комбинированной терапией), включающей молекулу антитела против PD-1, описанную в настоящей заявке, для лечения описанного в настоящей заявке нарушения, например рака, описанного в настоящей заявке. В других вариантах осуществления контрацептивное средство применяется в комбинации с терапией (например, комбинированной терапией), включающей молекулу антитела против PD-1, описанную в настоящей заявке, для уменьшения или предотвращения риска эмбриофетальной токсичности, например, повышенного риска прерывания беременности или смерти недоношенного ребенка.
В некоторых вариантах осуществления субъект получает рекомендацию, например, от лица, предоставляющего медицинские услуги, прекратить терапию (например, комбинированную терапию), включающую молекулу антитела против PD-1, если субъект является беременным или известно, что субъект беременный, или существует высокая вероятность того, что субъект беременный. В других вариантах осуществления субъект прекращает терапию (например, комбинированную терапию), включающую молекулу антитела против PD-1, если субъект является беременным, или известно, что субъект беременный, или существует высокая вероятность того, что субъект беременный.
В некоторых вариантах осуществления продолжительность периода, когда субъект (например, женского пола) использует эффективную контрацепцию (иногда называемого в настоящем описании как период контрацепции), может быть определена, по меньшей мере частично, по полупериоду существования (T1/2) молекулы антитела против PD-1 в сыворотке. В течение периода контрацепции субъект может завершить терапию или продолжать терапию. В некоторых вариантах осуществления период контрацепции включает период, следующий после получения последней дозы терапии (например, последней дозы молекулы антитела против PD-1). В других вариантах осуществления период контрацепции дополнительно включает период, в течение которого субъект получает терапию (например, молекулу антитела против PD-1).
В некоторых вариантах осуществления период контрацепции включает период продолжительностью 50 дней или больше, например, 60 дней или больше, 80 дней или больше, 90 дней или больше, 100 дней или больше, 110 дней или больше, 120 дней или больше, 130 дней или больше, 140 дней или больше, 150 дней или больше, 160 дней или больше, 170 дней или больше, 180 дней или больше, 190 дней или больше, 200 дней или больше, 220 дней или больше, 240 дней или больше, 260 дней или больше, 280 дней или больше, или 300 дней или больше, например, после введения последней дозы молекулы антитела против PD-1. В некоторых вариантах осуществления период контрацепции включает период продолжительностью 150 дней или больше, например, после введения последней дозы молекулы антитела против PD-1. В некоторых вариантах осуществления период контрацепции включает период, когда субъект получает молекулу антитела против PD-1, и период продолжительностью 150 дней или больше после введения последней дозы молекулы антитела против PD-1.
В некоторых вариантах осуществления продолжительность периода контрацепции по меньшей мере в 2, 3, 4, 5, 6, 7, 8, 9 или 10 раз больше полупериода существования молекулы антитела против PD-1 в сыворотке. В некоторых вариантах осуществления продолжительность периода контрацепции по меньшей мере в 5 раз больше полупериода существования молекулы антитела против PD-1 в сыворотке. В некоторых вариантах осуществления полупериод существования молекулы антитела против PD-1 в сыворотке составляет от 10 дней до 30 дней, например, от 15 дней до 25 дней, от 17 дней до 23 дней или от 19 дней до 21 дней, например, 15 дней или больше, 16 дней или больше, 17 дней или больше, 18 дней или больше, 19 дней или больше, 20 дней или больше, 21 дней или больше, 22 дней или больше или 23 дней или больше. В некоторых вариантах осуществления полупериод существования молекулы антитела против PD-1 в сыворотке составляет от 17 дней до 23 дней, например, приблизительно 19 дней, 20 дней, 21 дней, 22 дней или 23 дней.
В некоторых вариантах осуществления субъект использует контрацепцию до получения терапии (например, комбинированной терапии), включающей молекулу антитела против PD-1. В других вариантах осуществления субъект использует контрацепцию во время терапии (например, комбинированной терапии), включающей молекулу антитела против PD-1. В других вариантах осуществления субъект использует контрацепцию после получения терапии (например, комбинированной терапии), включающей молекулу антитела против PD-1.
В некоторых вариантах осуществления субъект использует контрацепцию во время и после получения терапии (например, комбинированной терапии), включающей молекулу антитела против PD-1. В других вариантах осуществления субъект использует контрацепцию до и во время получения терапии (например, комбинированной терапии), включающей молекулу антитела против PD-1. В других вариантах осуществления субъект использует контрацепцию до и после получения терапии (например, комбинированной терапии), включающей молекулу антитела против PD-1. В других вариантах осуществления субъект использует контрацепцию до получения, во время и после получения терапии (например, комбинированной терапии), включающей молекулу антитела против PD-1.
В некоторых вариантах осуществления субъект использует контрацепцию по меньшей мере за 1, 3, 7, 14 или 28 дней или по меньшей мере 1, 2 или 3 месяца до введения субъекту молекулы антитела против PD-1, например, до введения первой дозы молекулы антитела против PD-1.
В других вариантах осуществления субъект использует контрацепцию во время терапии (например, комбинированной терапии), по меньшей мере один, два, 3 раза, 4 раза, 5 раз, 6 раз, 7 раз, 8 раз, 9 раз или 10 раз, в течение периода, когда субъекту вводят молекулу антитела против PD-1, например, между введением первой и последней доз молекулы антитела против PD-1.
В других вариантах осуществления субъект использует контрацепцию в течение по меньшей мере 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 200, 210, 220, 230, 240, 250, 260, 270, 280, 290 или 300 дней или по меньшей мере 3, 4, 5, 6, 7, 9, или 10 месяцев после введения субъекту молекулы антитела против PD-1, например, после введения последней дозы молекулы антитела против PD-1.
Субъект может использовать различные типы контрацепции (например, контрацептивных средств). Например, контрацепция может осуществляться с помощью устройства, лекарственного средства, способа или их любой комбинации. Примеры типов контрацепции (например, контрацептивных средств), которые могут использоваться субъектом, включают, без ограничения перечисленными, контрацептивный имплантат (например, этоногестрел), контрацептивный трансдермальный пластырь, пероральное контрацептивное средство (например, прогестин и/или эстроген), контрацептивную губку (например, медроксипрогестерон), контрацептивную губку, контрацептивное вагинальное кольцо, кормление грудью в качестве контроля рождаемости, цервикальный колпачок, презерватив, диафрагму, женский презерватив, способы на основе определения периода фертильности, внутриматочное устройство (ВМУ или спираль), посткоитальное пероральное контрацептивное средство (экстренную контрацепцию), экстравагинальный половой акт, спермицид, стерилизацию для женщин (стерилизацию путем перевязки маточных труб), вазэктомию, прерванный половой акт (метод прерывания полового акта до эякуляции) или их комбинацию.
В некоторых вариантах осуществления субъект является женщиной, например, женщиной со способностью к деторождению потенциалом. Способность женщины к деторождению может находиться под воздействием различных факторов, например, возраста, состояния здоровья, генетики, патологических состояний или факторов внешней среды. В некоторых вариантах осуществления субъект имеет возраст 15-50 лет, например, 18-45 лет, 20-40 лет или 25-35 лет. В некоторых вариантах осуществления возраст субъекта составляет по меньшей мере 20, 25, 30, 35, 40 или 45 лет.
Биомаркеры
В изобретении также предложены способы оценки или мониторинга эффективности терапии (например, комбинированной терапии), описанной в настоящей заявке, у субъекта (например, субъекта, имеющего рак, например, рак, описанный в настоящей заявке). Способ включает получение значения эффективности для терапии, где указанное значение указывает на эффективность терапии.
В вариантах осуществления значение эффективности терапии включает один, два, три, четыре, пять, шесть, семь, восемь, девять или более (например, все) следующих показателей:
(i) параметр фенотипа инфильтрирующих опухоль лимфоцитов (TIL);
(ii) параметр популяции миелоидных клеток;
(iii) параметр поверхностного маркера экспрессии;
(iv) параметр биомаркера иммунологического ответа;
(v) параметр модуляции системных цитокинов;
(vi) параметр свободной циркулирующей ДНК (сцДНК);
(vii) параметр системной иммуномодуляции;
(viii) параметр микробиома;
(ix) параметр маркера активации в циркулирующей иммунной клетке; или
(x) параметр циркулирующего цитокина.
В некоторых вариантах осуществления параметр фенотипа TIL включает уровень или активность одного, двух, трех, четырех или более (например, всех) из окрашивания гематоксилином и эозином (ГЭ) для подсчета TIL, на CD8, FOXP3, CD4 или CD3 у субъекта, например, в образце субъекта (например, образце опухоли). В некоторых вариантах осуществления параметр популяции миелоидных клеток включает уровень или активность одного или обоих из CD68 или CD163 у субъекта, например, в образце субъекта (например, образце опухоли). В некоторых вариантах осуществления параметр поверхностного маркера экспрессии включает уровень или активность одного, двух или более (например, всех) из PD-L1, LAG-3 или TIM-3 у субъекта, например, в образце субъекта (например, образце опухоли). В некоторых вариантах осуществления параметр биомаркера иммунологического ответа включает уровень или последовательность одного или более маркеров на основе нуклеиновой кислоты у субъекта, например, в образце субъекта (например, образце опухоли). В некоторых вариантах осуществления параметр модуляции системных цитокинов включает уровень или активность одного, двух, трех, четырех, пяти, шести, семи, восьми и более (например, всех) из IL-18, IFN-γ, ITAC (CXCL11), IL-6, IL-10, IL-4, IL-17, IL-15 или TGF-бета у субъекта, например, в образце субъекта (например, образце крови, например, образце плазмы крови). В некоторых вариантах осуществления параметр сцДНК включает последовательность или уровень одной или более молекул циркулирующей опухолевой ДНК (сцДНК) у субъекта, например, в образце субъекта (например, образце крови, например образце плазмы крови), В некоторых вариантах осуществления параметр системной иммуномодуляции включает фенотипический анализ активированной иммунной клетки, например CD3-экспрессирующей клетки, CD8-экспрессирующей клетки или обеих, у субъекта, например, в образце субъекта (например, например, образце крови, например, образце МКПК). В некоторых вариантах осуществления параметр микробиома включает последовательность или уровень экспрессии одного или более генов в микробиоме субъекта, например, в образце субъекта (например, образце стула). В некоторых вариантах осуществления параметр маркера активации в циркулирующей иммунной клетке включает уровень или активность одного, двух, трех, четырех, пяти или более (например, всех) из циркулирующих CD8+, HLA-DR+Ki67+, Т-клеток, IFN-γ, IL-18 или CXCL11 (IFN-γ индуцированных CCK) экспрессирующих клеток, в образце (например, образце крови, например, образце плазмы крови). В некоторых вариантах осуществления параметр циркулирующего цитокина включает уровень или активность IL-6 у субъекта, например, в образце субъекта (например, образце крови, например образце плазмы крови).
В некоторых вариантах осуществления оценка или мониторинг включают анализ биомаркеров. Например, оценку или мониторинг эффективности терапии можно производить на молекулярном уровне и/или клеточном уровне по одному или более биомаркерам, описанным в настоящей заявке. В некоторых вариантах осуществления изменение маркера может относиться к исходу болезни. Примеры биомаркеров и набор образцов описаны в Таблице 8.
Таблица 8. Примеры биомаркеров и набор образцов
(дни -28 до -1)
CD68, экспрессия CD163
PD-L1, LAG-3, TIM-3
На онове нуклеиновой кислоты (количественный анализ или секвенирование ДНК или РНК)
Оценка других биомаркеров иммуного ответа
(В любое время между днем 1 и 15; при этом забор биопсии происходит после введении дозы)
(незапланированный)**
(до введения дозы)
(до введения дозы)
(в любое время)
**Образцы биопсии для оценки прогрессирования заболевания требуется собирать в момент прогрессирования, даже если это не было сделано в начальный период лечения.
В некоторых вариантах осуществления исследуемый парный образец опухоли получают для оценки фармакодинамического эффекта на микроокружение опухоли. В некоторых вариантах осуществления образцы опухоли получают при скрининге и приблизительно после двух курсов терапии. В других вариантах осуществления образец опухоли получают в момент прогрессирования заболевания, которое происходит во время лечения.
В некоторых вариантах осуществления первичную оценку окрашенного гематоксилином и эозином (ГЭ) препарата на количество инфильтрирующих опухоль лимфоцитов (TIL) используют для проведения последующего ИГХ анализа микроокружения опухоли, например, исследования с помощью ИГХ одного или больше из TIL-лимфоцитов (например, CD8, CD3, CD4 или FOXP3), популяции миелоидных клеток (например, CD163 или CD68), поверхностного маркера, например, LAG-3, TIM-3 или PD-L1. Другие методики оценки биомаркеров иммунологического ответа, таких как методы на основе нуклеиновых кислот (секвенирование или количественный анализ ДНК или РНК) или другие методы, могут применяться в этой быстро развивающейся области науки.
Степень инфильтрации опухоли иммунными клетками, в том числе лимфоцитами и макрофагами, изменения показателей регуляторных Т-клеток и/или изменения экспрессии гена в образцах биопсии опухолей могут определять эффективность для данной комбинации.
В некоторых вариантах осуществления образец крови забирают, как указано в Таблице 8, для исследования уровней циркулирующих цитокинов в плазме крови и маркера активации в циркулирующих иммунных клетках. Без ограничения теорией, считается, что в некоторых вариантах осуществления увеличение количества одного или более из циркулирующих CD8+, HLA-DR+Ki67+, Т-клеток, IFN-γ, IL-18 или CXCL11 (IFN-γ индуцированного CCK) экспрессирующих клеток указывает на расширение ранее существующего примированного иммунного ответа, тогда как уменьшение IL-6 указывает на пониженные миелоидные супрессорные клетки (МСК) (Herbst et al. (2016) Lancet 387(10027):1540-50; Tumeh et al. (2014) Nature p. 568-71; Powles et al. (2014) Nature p. 558-62). В некоторых вариантах осуществления образец крови получают при скрининге и/или в конце лечения для анализа свободной циркулирующей ДНК (сцДНК), например, для оценки какой-либо корреляции с исходом болезни. Также могут использоваться любые дополнительные маркеры или способы, известные в уровне техники. В некоторых вариантах осуществления комбинацию специфических для соединений маркеров применяют для определения фармакодинамической активности при более низких дозах, используемых в терапии, которые являются или могут быть более низкими, чем ранее установленные дозы.
Нуклеиновые кислоты
В изобретении также представлены нуклеиновые кислоты, включающие нуклеотидные последовательности, которые кодируют вариабельные области тяжелой и легкой цепи и CDR-области или гипервариабельные петли молекул антитела против PD-1, как описано в настоящей заявке. Например, в изобретении представлена первая и вторая нуклеиновая кислота, кодирующая вариабельные области тяжелой и легкой цепи, соответственно, молекулы антитела против PD-1, выбранной из одной или более молекул антитела, раскрытого в настоящей заявке. Нуклеиновая кислота может включать нуклеотидную последовательность, представленную в таблицах в настоящей заявке, или последовательность, по существу идентичную ей (например, последовательность, идентичную ей по меньшей мере приблизительно на 85%, 90%, 95%, 99% или более, или которая отличается не более чем на 3, 6, 15, 30 или 45 нуклеотидов от последовательностей, показанных в таблицах в настоящей заявке.
В некоторых вариантах осуществления нуклеиновая кислота может включать нуклеотидную последовательность, кодирующую по меньшей мере одну, две или три CDR-области или гипервариабельные петли из вариабельной области тяжелой цепи, имеющей аминокислотную последовательность, представленную в таблицах в настоящей заявке, или последовательность, по существу гомологичную ей (например, последовательность, идентичную ей по меньшей мере приблизительно на 85%, 90%, 95%, 99% или более, и/или имеющую одну или более замен, например консервативных замен). В других вариантах осуществления нуклеиновая кислота может включать нуклеотидную последовательность, кодирующую по меньшей мере одну, две или три CDR-области или гипервариабельные петли из вариабельной области легкой цепи, имеющей аминокислотную последовательность, представленную в таблицах в настоящей заявке, или последовательность, по существу гомологичную ей (например, последовательность, идентичную ей по меньшей мере приблизительно на 85%, 90%, 95%, 99% или более, и/или имеющую одну или более замен, например консервативных замен). В еще одном варианте осуществления нуклеиновая кислота может включать нуклеотидную последовательность, кодирующую по меньшей мере одну, две, три, четыре, пять или шесть CDR-областей или гипервариабельных петель из вариабельных областей тяжелой и легкой цепи, имеющих аминокислотную последовательность, представленную в таблицах в настоящей заявке, или последовательность, по существу гомологичную ей (например, последовательность, идентичную ей по меньшей мере приблизительно на 85%, 90%, 95%, 99% или более, и/или имеющую одну или более замен, например консервативных замен).
В некоторых вариантах осуществления нуклеиновая кислота может включать нуклеотидную последовательность, кодирующую по меньшей мере одну, две или три CDR-области или гипервариабельные петли из вариабельной области тяжелой цепи, имеющей нуклеотидную последовательность, представленную в таблицах в настоящей заявке, последовательность, по существу гомологичную ей (например, последовательность, идентичную ей по меньшей мере приблизительно на 85%, 90%, 95%, 99% или более, и/или способную к гибридизации в условиях строгости, описанных в настоящей заявке). В другом варианте осуществления нуклеиновая кислота может включать нуклеотидную последовательность, кодирующую по меньшей мере одну, две или три CDR-области или гипервариабельные петли из вариабельной области легкой цепи, имеющей нуклеотидную последовательность, представленную в таблицах в настоящей заявке, или последовательность, по существу гомологичную ей (например, последовательность, идентичную ей по меньшей мере приблизительно на 85%, 90%, 95%, 99% или более, и/или способную к гибридизации в условиях строгости, описанных в настоящей заявке). В еще одном варианте осуществления нуклеиновая кислота может включать нуклеотидную последовательность, кодирующую по меньшей мере одну, две, три, четыре, пять или шесть CDR-областей или гипервариабельных петель из вариабельных областей тяжелой и легкой цепи, имеющих нуклеотидную последовательность, представленную в таблицах в настоящей заявке, или последовательность, по существу гомологичную ей (например, последовательность, идентичную ей по меньшей мере приблизительно на 85%, 90%, 95%, 99% или более, и/или способную к гибридизации в условиях строгости, описанных в настоящей заявке).
В другом аспекте в настоящей заявке представлены клетки-хозяева и векторы, содержащие нуклеиновые кислоты, описанные в настоящей заявке. Нуклеиновые кислоты могут присутствовать в одном векторе или отдельных векторах, присутствующих в одной клетке-хозяине или отдельных клетках-хозяевах, как описано более подробно ниже.
В некоторых вариантах осуществления предложены одна или более молекул нуклеиновых кислот, которые включают одну или обе нуклеотидных последовательности, которые кодируют вариабельные области тяжелой и легкой цепи, CDR-области, гипервариабельные петли, каркасные области молекул антитела против PD-1. В некоторых вариантах осуществления нуклеотидная последовательность, которая кодирует молекулу антитела против PD-1, является кодон-оптимизированной. Например, в изобретении представлена первая и вторая нуклеиновая кислота, кодирующая вариабельные области тяжелой и легкой цепи, соответственно, молекулы антитела против PD-1, выбранной из одного или более, например, любого из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E, как представлено в Таблице 1, или последовательность, по существу идентичная им. Например, нуклеиновая кислота может включать нуклеотидную последовательность, представленную в Таблицах 1 и 2, или последовательность, по существу идентичную ей (например, последовательность, идентичную ей по меньшей мере приблизительно на 85%, 90%, 95%, 99% или более, или которая отличается не более чем на 3, 6, 15, 30 или 45 нуклеотидов от последовательностей, показанных в Таблицах 1 и 2).
В других вариантах осуществления молекула нуклеиновой кислоты включает нуклеотидную последовательность, которая кодирует вариабельный домен тяжелой цепи и/или константную область тяжелой цепи, включающую аминокислотную последовательность BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E; или как описано в Таблице 1; или нуклеотидную последовательность в Таблице 1; или последовательность, по существу идентичную (например, последовательность, идентичную по меньшей мере приблизительно на 85%, 90%, 95%, 99% или более) любой из вышеуказанных последовательностей.
В других вариантах осуществления молекула нуклеиновой кислоты включает нуклеотидную последовательность, которая кодирует вариабельный домен легкой цепи и/или константную область легкой цепи, включающую аминокислотную последовательность BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E; или как описано в Таблице 1; или нуклеотидную последовательность в Таблице 1; или последовательность, по существу идентичную (например, последовательность, идентичную по меньшей мере приблизительно на 85%, 90%, 95%, 99% или более) любой из вышеуказанных последовательностей.
Вышеуказанные нуклеотидные последовательности, кодирующие вариабельный домен тяжелой и легкой цепи и константные области антитела против PD-1, могут присутствовать в отдельной молекуле нуклеиновой кислоты, или в одной молекуле нуклеиновой кислоты. В некоторых вариантах осуществления молекулы нуклеиновых кислот включают нуклеотидную последовательность, кодирующую лидерную последовательность, например, лидерную последовательность, показанную в Таблице 4, или последовательность, по существу идентичную ей.
В некоторых вариантах осуществления молекула нуклеиновой кислоты включает нуклеотидную последовательность, кодирующую по меньшей мере одну, две или три CDR-области или гипервариабельные петли из вариабельной области тяжелой цепи, имеющей аминокислотную последовательность, представленную в Таблице 1, или последовательность, по существу гомологичную ей (например, последовательность, идентичную ей по меньшей мере приблизительно на 85%, 90%, 95%, 99% или более, и/или имеющую одну, две, три или больше замен, вставок или делеций, например, косервативных замен).
В другом варианте осуществления молекула нуклеиновой кислоты включает нуклеотидную последовательность, кодирующую по меньшей мере одну, две или три CDR-области или гипервариабельные петли из вариабельной области легкой цепи, имеющей аминокислотную последовательность, представленную в Таблице 1, или последовательность, по существу гомологичную ей (например, последовательность, идентичную ей по меньшей мере приблизительно на 85%, 90%, 95%, 99% или более, и/или имеющую одну, две, три или больше замен, вставок или делеций, например, косервативных замен).
В еще одном варианте осуществления молекула нуклеиновой кислоты включает нуклеотидную последовательность, кодирующую по меньшей мере одну, две, три, четыре, пять или шесть CDR-областей или гипервариабельных петель из вариабельных областей тяжелой и легкой цепи, имеющих аминокислотную последовательность, представленную в Таблице 1, или последовательность, по существу гомологичную ей (например, последовательность, идентичную ей по меньшей мере приблизительно на 85%, 90%, 95%, 99% или более, и/или имеющую одну, две, три или более замен, вставок или делеций, например, косервативных замен).
В одном варианте осуществления молекула нуклеиновой кислоты включает нуклеотидную последовательность, кодирующую молекулу антитела против PD-1, которая включает замену в CDR3 легкой цепи в положении 102 вариабельной области легкой цепи, например, замену остатка цистеина на остаток тирозина или остатка цистеина на остаток серина, в положении 102 вариабельной области легкой цепи согласно Таблице 1 (например, SEQ ID NO: 16 или 24 в случае мышиной или химерной, немодифицированной; или любой из SEQ ID NO: 34, 42, 46, 54, 58, 62, 66, 70, 74 или 78 в случае модифицированной последовательности).
В другом варианте осуществления молекула нуклеиновой кислоты включает одну или более каркасных областей тяжелой цепи (например, любую из VHFW1 (тип a), VHFW1 (тип b), VHFW2 (тип a), VHFW2 (тип b), VHFW2 (тип c), VHFW3 (тип a), VHFW3 (тип b) или VHFW4, или их любую комбинацию, например, комбинацию каркасных областей, как описано в настоящей заявке) для любого из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E, как представлено в Таблице 1 и 2, или последовательность, по существу идентичную ей. Например, молекула нуклеиновой кислоты может включать нуклеотидную последовательность, представленную в Таблицах 1 и 2, или последовательность, по существу идентичную ей (например, последовательность, идентичную ей по меньшей мере приблизительно на 85%, 90%, 95%, 99% или более, или которая отличается не более чем на 3, 6, 15, 30 или 45 нуклеотидов от последовательностей, показанных в Таблицах 1 и 2).
В другом варианте осуществления молекула нуклеиновой кислоты включает одну или более каркасных областей легкой цепи (например, любую из VLFW1 (тип a), VLFW1 (тип b), VLFW1 (тип c), VLFW1 (тип d), VLFW1 (тип e), VLFW2 (тип a), VLFW2 (тип b), VLFW2 (тип c), VLFW3 (тип a), VLFW3 (тип b), VLFW3 (тип c), VLFW3 (тип d) или VLFW4, или их любую комбинацию, например, комбинацию каркасных областей, как описано в настоящей заявке) для любого из BAP049-hum01, BAP049-hum02, BAP049-hum03, BAP049-hum04, BAP049-hum05, BAP049-hum06, BAP049-hum07, BAP049-hum08, BAP049-hum09, BAP049-hum10, BAP049-hum11, BAP049-hum12, BAP049-hum13, BAP049-hum14, BAP049-hum15, BAP049-hum16, BAP049-Clone-A, BAP049-Clone-B, BAP049-Clone-C, BAP049-Clone-D или BAP049-Clone-E, как представлено в Таблице 1 и 2, или последовательность, по существу идентичную ей. Например, молекула нуклеиновой кислоты может включать нуклеотидную последовательность, представленную в Таблицах 1 и 2, или последовательность, по существу идентичную ей (например, последовательность, идентичную ей по меньшей мере приблизительно на 85%, 90%, 95%, 99% или более, или которая отличается не более чем на 3, 6, 15, 30 или 45 нуклеотидов от последовательностей, показанных в Таблицах 1 и 2).
В другом варианте осуществления молекула нуклеиновой кислоты включает одну или более каркасных областей тяжелой цепи и одну или более каркасных областей легкой цепи, как описано в настоящей заявке. Каркасные области тяжелой и легкой цепи могут присутствовать в одном векторе или отдельных векторах.
Векторы и клетки-хозяева
В другом аспекте настоящей заявки представлены клетки-хозяева и векторы, содержащие нуклеиновые кислоты, описанные в настоящей заявке. Нуклеиновые кислоты могут присутствовать в одном векторе или отдельных векторах, присутствующих в одной клетке-хозяине или отдельных клетках-хозяевах.
В одном варианте осуществления векторы включают нуклеотиды, кодирующие молекулу антитела, описанную в настоящей заявке. В одном варианте осуществления векторы включают нуклеотидные последовательности, описанные в настоящей заявке. Векторы включают, без ограничения перечисленным, вирус, плазмиду, космиду, фаг лямбда или искусственную дрожжевую хромосому (YAC).
Могут применяться различные векторные системы. Например, в одном из классов векторов используются элементы ДНК, которые получены из вирусов животных, таких как, например, вирус папилломы коров, вирус полиомы, аденовирус, вирус коровьей оспы, бакуловирус, ретровирусы (вирус саркомы Рауса, MMTV или MOMLV) или вирус SV40. В другом классе векторов используют элементы РНК, полученные из РНК-вирусов, таких как вирус леса Семлики, вирус восточного энцефалита лошадей и Флавивирусы.
Кроме того, клетки, которые несут стабильно интегрированную ДНК в своих хромосомах, могут быть отобраны при введении одного или более маркеров, которые позволяют производить отбор трансфицированных клеток-хозяев. Маркер может обеспечивать, например, прототрофность ауксотрофного хозяина, устойчивость к биоциду (например, антибиотикам) или устойчивость к тяжелым металлам, таким как медь, и т.п. Селективный маркерный ген может быть непосредственно соединен с экспрессируемыми последовательностями ДНК или введен в такую клетку с помощью котрансформации. Дополнительные элементы также могут быть необходимы для оптимального синтеза мРНК. Эти элементы могут включать сигналы сплайсинга, а также промоторы транскрипции, энхансеры и сигналы терминации.
После подготовки экспрессионного вектора или последовательности ДНК, содержащих конструкции, к экспрессии, векторы экспрессии можно трансфицировать или вводить в соответствующую клетку-хозяина. Для выполнения этого могут использоваться различные методы, такие как, например, слияние протопластов, осаждение фосфатом кальция, электропорация, ретровирусная трансдукция, вирусная трансфекция, генная пушка, трансфекция на основе липидов или другие стандартные методики. В случае слияния протопластов, клетки выращивают в средах и подвергают скринингу на наличие нужной активности. Способы и условия культивирования полученных трансфицированных клеток и выделения продуцируемой молекулы антитела известны специалистам в данной области и могут быть изменены или оптимизированы в зависимости от конкретного используемого вектора экспрессии и клетки-хозяина млекопитающего на основе настоящего описания.
В изобретении также предложены клетки-хозяева, включающие нуклеиновую кислоту, кодирующую молекулу антитела, как описано в настоящей заявке.
В одном варианте осуществления клетки-хозяева генетически модифицированы с включением нуклеиновых кислот, кодирующих молекулу антитела.
В одном варианте осуществления клетки-хозяева генетически модифицированы с применением кассеты экспрессии. Фраза "кассета экспрессии" относится к нуклеотидным последовательностям, которые способны вызывать экспрессию гена в организмах-хозяевах, совместимых с такими последовательностями. Такие кассеты могут включать промотор, открытую рамку считывания с интронами или без интронов и сигнал терминации. Могут также использоваться дополнительные факторы, необходимые или полезные при осуществлении экспрессии, такие как, например, индуцируемый промотор.
В изобретении также предложены клетки-хозяева, включающие векторы, описанные в настоящей заявке.
Клетка может быть, без ограничения перечисленным, эукариотической клеткой, бактериальной клеткой, клеткой насекомого или клеткой человека. Подходящие эукариотические клетки включают, без ограничения перечисленными, клетки Vero, клетки HeLa, клетки COS, клетки CHO, клетки HEK293, клетки BHK и клетки MDCKII. Подходящие клетки насекомого включают, без ограничения перечисленным, клетки Sf9.
В некоторых вариантах осуществления клетка-хозяин является эукариотической клеткой, например, клеткой млекопитающего, клеткой насекомого, дрожжевой клеткой, или прокариотической клеткой, например, E. coli. Например, клетка млекопитающего может быть культивируемой клеткой или клеточной линией. Примеры клеток млекопитающих включают лимфоцитарные клеточные линии (например, NSO), клетки яичников китайского хомячка (CHO), клетки COS, ооциты и клетки трансгенного животного, например, эпителиоцит молочной железы.
Таблица 1. Аминокислотные и нуклеотидные последовательности молекул мышиных, химерных и гуманизированных антител. Молекулы антител включают мышиное мАт BAP049, химерные мАт BAP049-chi и BAP049-chi-Y, и гуманизированные мАт BAP049-hum01 - BAP049-hum16 и BAP049-Clone-A - BAP049-Clone-E. Показаны аминокислотные и нуклеотидные последовательности CDR-областей тяжелой и легкой цепи, вариабельных областей тяжелой и легкой цепи и тяжелых и легких цепей.
Таблица 2. Аминокислотные и нуклеотидные последовательности каркасных областей тяжелой и легкой цепи гуманизированных мАт BAP049-hum01 - BAP049-hum16 и BAP049-Clone-A - BAP049-Clone-E
(тип a)
GAAGTGCAGCTGGTGCAGTCTGGCGCCGAAGTGAAGAAGCCTGGCGAGTCCCTGCGGATCTCCTGCAAGGGCTCT (SEQ ID NO: 149)
GAGGTGCAGCTGGTGCAGTCAGGCGCCGAAGTGAAGAAGCCCGGCGAGTCACTGAGAATTAGCTGTAAAGGTTCA (SEQ ID NO: 150)
(тип b)
(тип a)
(SEQ ID NO: 153)
TGGGTGCGACAGGCTACCGGCCAGGGCCTGGAATGGATGGGC (SEQ ID NO: 155)
TGGGTCCGCCAGGCTACCGGTCAAGGCCTCGAGTGGATGGGT (SEQ ID NO: 156)
(тип b)
(SEQ ID NO: 157)
TGGATCCGGCAGTCCCCCTCTAGGGGCCTGGAATGGCTGGGC (SEQ ID NO: 159)
(тип c)
(SEQ ID NO: 160)
(тип a)
AGAGTGACCATCACCGCCGACAAGTCCACCTCCACCGCCTACATGGAACTGTCCTCCCTGAGATCCGAGGACACCGCCGTGTACTACTGCACCCGG (SEQ ID NO: 164)
AGAGTGACTATCACCGCCGATAAGTCTACTAGCACCGCCTATATGGAACTGTCTAGCCTGAGATCAGAGGACACCGCCGTCTACTACTGCACTAGG (SEQ ID NO: 165)
(тип b)
AGGTTCACCATCTCCCGGGACAACTCCAAGAACACCCTGTACCTGCAGATGAACTCCCTGCGGGCCGAGGACACCGCCGTGTACTACTGTACCAGA (SEQ ID NO: 168)
(SEQ ID NO: 169)
TGGGGCCAGGGCACCACAGTGACCGTGTCCTCT (SEQ ID NO: 171)
TGGGGTCAAGGCACTACCGTGACCGTGTCTAGC (SEQ ID NO: 172)
TGGGGCCAGGGCACAACAGTGACCGTGTCCTCC (SEQ ID NO: 173)
(тип a)
(SEQ ID NO: 174)
GAGATCGTGCTGACCCAGTCCCCCGACTTCCAGTCCGTGACCCCCAAAGAAAAAGTGACCATCACATGC (SEQ ID NO: 176)
(тип b)
(SEQ ID NO: 177)
GAGATCGTGCTGACCCAGTCCCCTGCCACCCTGTCACTGTCTCCAGGCGAGAGAGCTACCCTGTCCTGC (SEQ ID NO: 179)
GAGATCGTCCTGACTCAGTCACCCGCTACCCTGAGCCTGAGCCCTGGCGAGCGGGCTACACTGAGCTGT (SEQ ID NO: 180)
(тип c)
(SEQ ID NO: 181)
(тип d)
(SEQ ID NO: 183)
(тип e)
(тип a)
(SEQ ID NO: 187)
TGGTATCAGCAGAAGCCCGGCCAGGCCCCCAGACTGCTGATCTAC (SEQ ID NO: 189)
TGGTATCAGCAGAAGCCCGGTCAAGCCCCTAGACTGCTGATCTAC (SEQ ID NO: 190)
(тип b)
(SEQ ID NO: 191)
TGGTATCAGCAGAAGCCCGGTAAAGCCCCTAAGCTGCTGATCTAC (SEQ ID NO: 193)
(тип c)
(SEQ ID NO: 194)
(тип a)
(SEQ ID NO: 196)
GGCGTGCCCTCTAGATTCTCCGGCTCCGGCTCTGGCACCGACTTTACCTTCACCATCTCCAGCCTGGAAGCCGAGGACGCCGCCACCTACTACTGC (SEQ ID NO: 198)
GGCGTGCCCTCTAGGTTTAGCGGTAGCGGTAGTGGCACCGACTTCACCTTCACTATCTCTAGCCTGGAAGCCGAGGACGCCGCTACCTACTACTGT (SEQ ID NO: 199)
(тип b)
(SEQ ID NO: 200)
(тип c)
(SEQ ID NO: 202)
GGCGTGCCCTCTAGATTCTCCGGCTCCGGCTCTGGCACCGAGTTTACCCTGACCATCTCCAGCCTGCAGCCCGACGACTTCGCCACCTACTACTGC (SEQ ID NO: 204)
(тип d)
(SEQ ID NO: 205)
GGCGTGCCCTCTAGGTTTAGCGGTAGCGGTAGTGGCACCGACTTCACCTTCACTATCTCTAGCCTGCAGCCCGAGGATATCGCTACCTACTACTGT (SEQ ID NO: 207)
(SEQ ID NO: 208)
TTCGGCCAGGGCACCAAGGTGGAAATCAAG (SEQ ID NO: 210)
TTCGGTCAAGGCACTAAGGTCGAGATTAAG (SEQ ID NO: 211)
Таблица 3. Аминокислотные последовательности константной области человеческих тяжелых цепей IgG и человеческой каппа легкой цепи
ASTKGPSVFP LAPCSRSTSE STAALGCLVK DYFPEPVTVS WNSGALTSGV HTFPAVLQSS GLYSLSSVVT VPSSSLGTKT YTCNVDHKPS NTKVDKRVES KYGPPCPPCP APEFLGGPSV FLFPPKPKDT LMISRTPEVT CVVVDVSQED PEVQFNWYVD GVEVHNAKTK PREEQFNSTY RVVSVLTVLH QDWLNGKEYK CKVSNKGLPS SIEKTISKAK GQPREPQVYT LPPSQEEMTK NQVSLTCLVK GFYPSDIAVE WESNGQPENN YKTTPPVLDS DGSFFLYSRL TVDKSRWQEG NVFSCSVMHE ALHNHYTQKS LSLSLGK (SEQ ID NO: 212)
RTVAAPSVFI FPPSDEQLKS GTASVVCLLN NFYPREAKVQ WKVDNALQSG NSQESVTEQD SKDSTYSLSS TLTLSKADYE KHKVYACEVT HQGLSSPVTK
SFNRGEC (SEQ ID NO: 213)
ASTKGPSVFP LAPCSRSTSE STAALGCLVK DYFPEPVTVS WNSGALTSGV HTFPAVLQSS GLYSLSSVVT VPSSSLGTKT YTCNVDHKPS NTKVDKRVES KYGPPCPPCP APEFLGGPSV FLFPPKPKDT LMISRTPEVT CVVVDVSQED PEVQFNWYVD GVEVHNAKTK PREEQFNSTY RVVSVLTVLH QDWLNGKEYK CKVSNKGLPS SIEKTISKAK GQPREPQVYT LPPSQEEMTK NQVSLTCLVK GFYPSDIAVE WESNGQPENN YKTTPPVLDS DGSFFLYSRL TVDKSRWQEG NVFSCSVMHE ALHNHYTQKS LSLSLG (SEQ ID NO: 214)
ASTKGPSVFP LAPSSKSTSG GTAALGCLVK DYFPEPVTVS WNSGALTSGV HTFPAVLQSS GLYSLSSVVT VPSSSLGTQT YICNVNHKPS NTKVDKRVEP KSCDKTHTCP PCPAPELLGG PSVFLFPPKP KDTLMISRTP EVTCVVVDVS HEDPEVKFNW YVDGVEVHNA KTKPREEQYN STYRVVSVLT VLHQDWLNGK EYKCKVSNKA LPAPIEKTIS KAKGQPREPQ VYTLPPSREE MTKNQVSLTC LVKGFYPSDI AVEWESNGQP ENNYKTTPPV LDSDGSFFLY SKLTVDKSRW QQGNVFSCSV MHEALHNHYT QKSLSLSPGK (SEQ ID NO: 215)
ASTKGPSVFP LAPSSKSTSG GTAALGCLVK DYFPEPVTVS WNSGALTSGV HTFPAVLQSS GLYSLSSVVT VPSSSLGTQT YICNVNHKPS NTKVDKRVEP KSCDKTHTCP PCPAPELLGG PSVFLFPPKP KDTLMISRTP EVTCVVVDVS HEDPEVKFNW YVDGVEVHNA KTKPREEQYA STYRVVSVLT VLHQDWLNGK EYKCKVSNKA LPAPIEKTIS KAKGQPREPQ VYTLPPSREE MTKNQVSLTC LVKGFYPSDI AVEWESNGQP ENNYKTTPPV LDSDGSFFLY SKLTVDKSRW
QQGNVFSCSV MHEALHNHYT QKSLSLSPGK (SEQ ID NO: 216)
ASTKGPSVFP LAPSSKSTSG GTAALGCLVK DYFPEPVTVS WNSGALTSGV HTFPAVLQSS GLYSLSSVVT VPSSSLGTQT YICNVNHKPS NTKVDKRVEP KSCDKTHTCP PCPAPELLGG PSVFLFPPKP KDTLMISRTP EVTCVVVAVS HEDPEVKFNW YVDGVEVHNA KTKPREEQYN STYRVVSVLT VLHQDWLNGK EYKCKVSNKA LAAPIEKTIS KAKGQPREPQ VYTLPPSREE MTKNQVSLTC LVKGFYPSDI AVEWESNGQP ENNYKTTPPV LDSDGSFFLY SKLTVDKSRW QQGNVFSCSV MHEALHNHYT QKSLSLSPGK (SEQ ID NO: 217)
ASTKGPSVFP LAPSSKSTSG GTAALGCLVK DYFPEPVTVS WNSGALTSGV HTFPAVLQSS GLYSLSSVVT VPSSSLGTQT YICNVNHKPS NTKVDKRVEP KSCDKTHTCP PCPAPEAAGG PSVFLFPPKP KDTLMISRTP EVTCVVVDVS HEDPEVKFNW YVDGVEVHNA KTKPREEQYN STYRVVSVLT VLHQDWLNGK EYKCKVSNKA LPAPIEKTIS KAKGQPREPQ VYTLPPSREE MTKNQVSLTC LVKGFYPSDI AVEWESNGQP ENNYKTTPPV LDSDGSFFLY SKLTVDKSRW QQGNVFSCSV MHEALHNHYT QKSLSLSPGK (SEQ ID NO: 218)
Таблица 4. Аминокислотные последовательности лидерных последовательностей тяжелой и легкой цепи для гуманизированных мАт BAP049-Clone-A - BAP049-Clone-E
Таблица 7. Выбранные терапевтические средства, которые могут вводить в комбинации с молекулами антитела против PD-1, например, в качестве отдельного средства или в комбинации с другими иммуномодуляторами, описанными в настоящей заявке. Каждая публикация, перечисленная в данной Таблице, полностью включена в настоящую заявку посредством отсылки, включая все структурные формулы в указанной публикации.
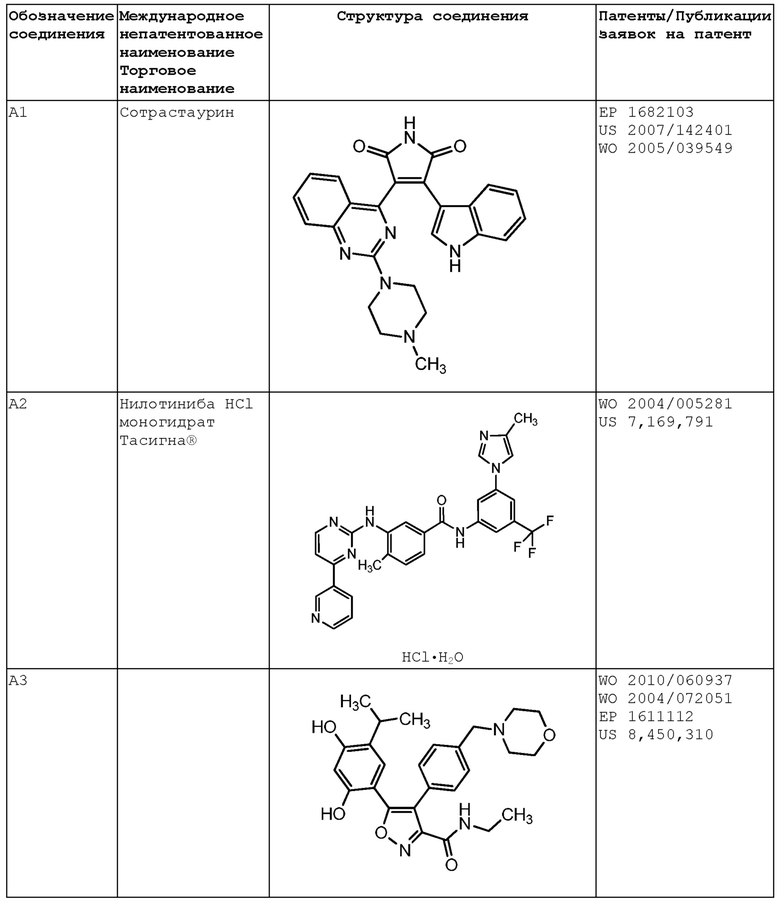

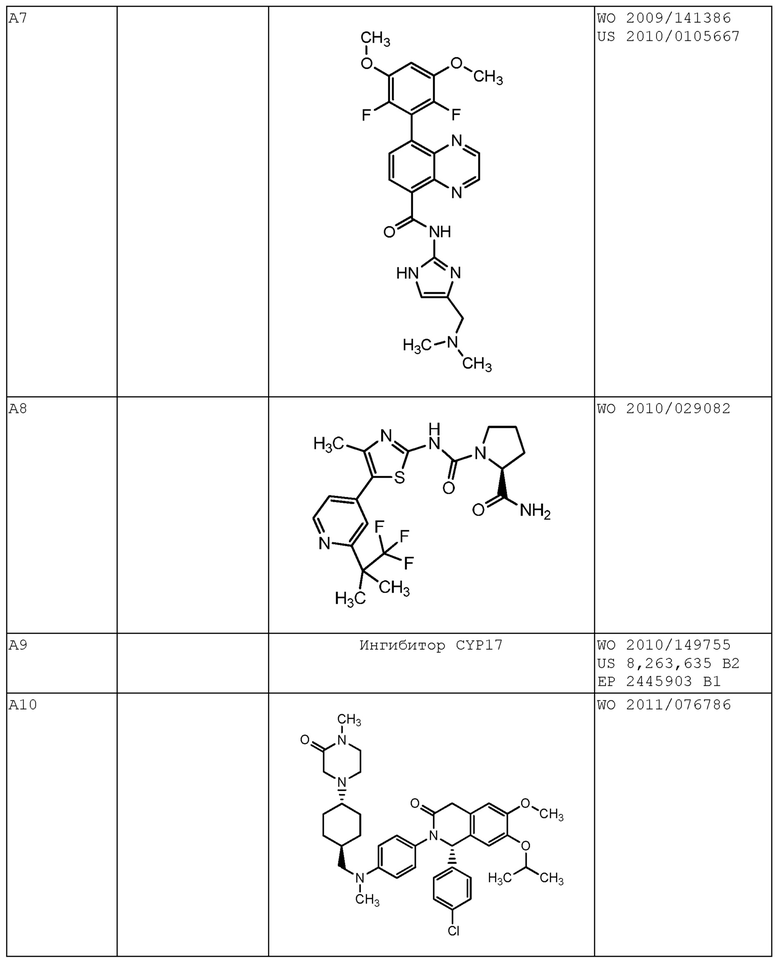


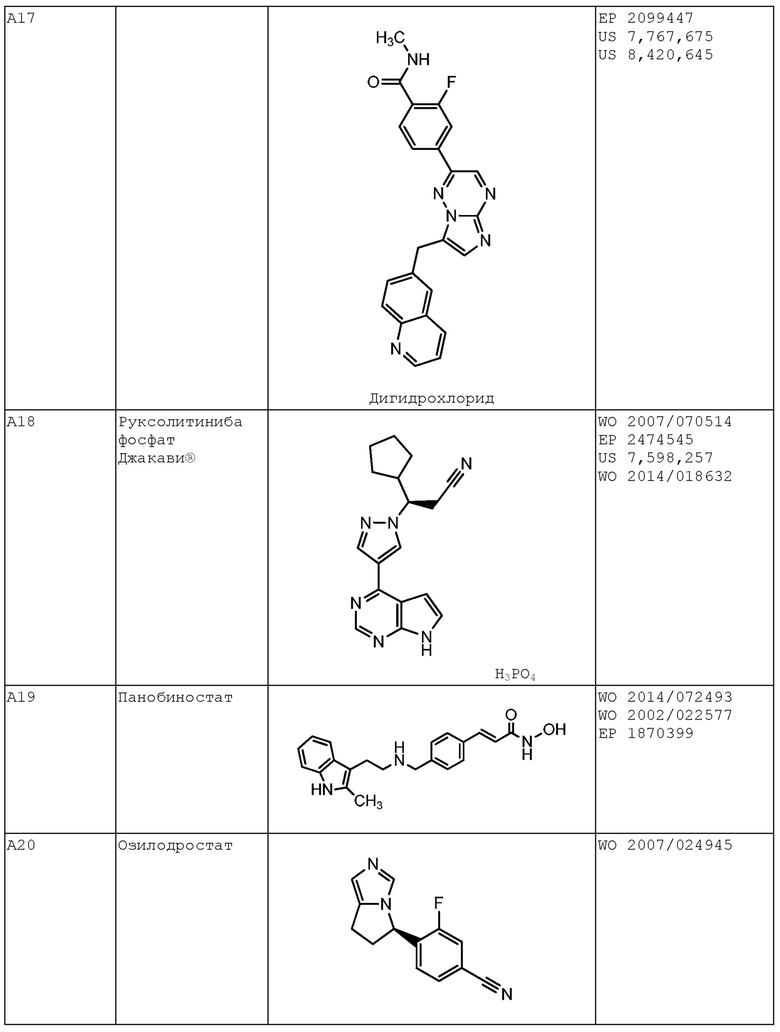






ПРИМЕРЫ
Примеры ниже представлены для помощи в понимании изобретения, но не предназначены, и не должны рассматриваться, в качестве ограничения его объема каким-либо образом.
Пример 1: Анализ фармакокинетики схем введения постоянной дозы
На основе фармакокинетического (ФК) моделирования, применение постоянной дозы, как ожидают, обеспечивает экспозицию у пациентов при надлежащих концентрациях Cmin. Более 99,5% пациентов будут иметь концентрации выше EC50, и более 93% пациентов будут иметь концентрации выше EC90. Расчетное среднее значение Cmin в равновесном состоянии для примерной молекулы антитела против PD-1 при использовании дозы 300 мг один раз в три недели (Q3W) или 400 мг один раз в четыре недели (Q4W), как ожидают, будет в среднем превышать 20 мкг/мл (при максимальном весе 150 кг).
Таблица 5. Примерные параметры ФК на основе схем введения постоянной дозы
35 [26, 47] (300 мг q3w)
Ожидаемые средние концентрации Cmin в равновесном состоянии для примерной молекулы антитела против PD-1, наблюдаемые с любыми дозами/схемами (300 мг q3w или с 400 мг q4w), будут по меньшей мере в 77 раз выше EC50 (0,42 мкг/мл) и приблизительно в 8,6 раз выше EC90. Активность ex vivo основана на изменении IL-2 в анализе SEB ex vivo.
Меньше 10% пациентов, как ожидают, достигнут концентраций Cmin ниже 3,6 мкг/мл с дозой 300 мг Q3W или 400 мг Q4W. Меньше 0,5% пациентов, как ожидают, достигнут концентраций Cmin ниже 0,4 мкг/мл с дозой 300 мг Q3W или 400 мг Q4W.
Расчетные концентрации Ctrough (Cmin) для пациентов с различным весом, получающих такую же дозу примерной молекулы антитела против PD-1, показаны на Фигуре 12. Введение доз в зависимости от массы тела сравнивается с фиксированной дозой (3,75 мг/кг Q3W против 300 мг Q3W и 5 мг/кг Q4W против 400 мг Q4W). Фигура 12 подтверждает эффективность введения постоянной дозы примерной молекулы антитела против PD-1.
Модель ФК далее валидировали. Как показано на Фигуре 13, наблюдаемые и предсказанные с помощью модели концентрации лежат на одной линии. На Фигурах 14A-14B показано, что модель фиксирует накопление, временную динамику и внутрисубъектную вариабельность.
Пример 2: Фармакология in vivo для комбинации антитела против PD-1 и Соединения A21
Соединение А21 комбинировали in vivo с примерной молекулой антитела против PD-1 в модели сингенной опухоли MC38 на мышах. Мышам C57Bl/6 имплантировали по 1×106 клеток MC38/мышь. Вводили растворитель и соединение A21 (50 мг/кг перорально, два раза в день, QW), всего четыре дозы, начиная с дня 4 после имплантации опухоли. Изотип и антитело к PD-1 мыши вводили в дозе 10 мг/кг в/в, QW.
Как показано на Фигуре 15, синергическую активность наблюдали с комбинацией Соединения A21 (100 мг/кг перорально, один раз в неделю, вводили раздельно, 50 мг/кг, два раза в день) и антитела против PD-1 (10 мг/кг в/в, один раз в неделю), независимо от эффективности отдельного средства LCL161. Когорта комбинации показала 4 полных ответа (CR), тогда как ни одного CR не зафиксировали при введении одного средства.
Пример 3: Фармакология in vivo для комбинации антитела против PD-1 и панобиностата (Соединения A19)
Панобиностат (Соединение A19) комбинировали in vivo с примерной молекулой антитела против PD-1 в сингенной модели опухоли MC38 на мышах. Панобиностат (Соединение A19) вводили раз в два дня в дозе 12 мг/кг, которая приводит к экспозиции лекарственного средства, сопоставимой с наблюдаемой у пациентов, проходивших лечение с утвержденной дозой и схемой. Некоторое снижение массы тела наблюдали при введении одного панобиностата и комбинации, с восстановлением после завершения введения панобиностата. Как показано на Фигурах 16A-16B, существенную синергическую активность наблюдали с комбинацией панобиностата (Соединения A19) и молекулы антитела против PD1 (10 мг/кг в/в, один раз в неделю): все десять животных, получавших комбинацию, показали CR, по сравнению с тремя из десяти животных, получавших один ингибитор PD-1, или двумя из десяти, получавших один панобиностат.
Пример 4: Фармакология in vivo для комбинации антитела против PD-L1 и Соединения A40
Соединение A40 комбинировали in vivo с примерной молекулой антитела против PD-L1 в модели лимфомы A20. Как показано на Фигуре 17, комбинация антитела против PD-L1 и Соединения A40, или антитела против PD-L1 и ибрутиниба, была более эффективной, чем какое-либо отдельное средство. Соединение A40 и ибрутиниб вводили в течение только десяти дней, при этом ввели в общей сложности 5 доз антитела против PD L1. Даже несмотря на то, что Соединение A40 и ибрутиниб вводили недолго, эффекты Соединения A40 плюс антитело против PD-L1 и ибрутиниба плюс антитело против PD-L1 на выживание продолжались после 60 дней. Как показано на Фигуре 18, комбинация антитела против PD-L1 и Соединения A40 также привела к регрессии опухоли у мышей, несущих аллотрансплантаты лимфомы A20.
Пример 5: Исследование фазы I/II первого применения на людях примерной молекулы антитела против PD-1 у больных с распространенными солидными опухолями
Молекулы антител
Примерной молекулой антитела (BAP049-Clone-E), тестируемой в данном исследовании, является гуманизированное моноклональное IgG4 антитело (мАт) против белка программируемой смерти 1 (PD-1), которое блокирует связывание лиганда программируемой смерти 1 (PD-L1) и лиганда программируемой смерти 2 (PD-L2) с PD-1. Оно связывается с PD-1 с высокой аффинностью и ингибирует свою биологическую активность. Аминокислотная последовательности этой молекулы антитела описана в Таблице 1 в настоящей заявке (VH: SEQ ID NO: 38; VL: SEQ ID NO: 70). Результаты доклинических исследований токсикологии показали, что оно имеет благоприятный профиль безопасности. Его фармакодинамическая активность была также продемонстрирована in vivo. В данном Примере представлены данные из первого исследования введения человеку этой молекулы антитела, фазы I/II, на взрослых с прогрессирующими солидными опухолями.
Методы
Схема исследования и лечение
На Фигуре 19 показана схема многоцентрового открытого исследования для Фазы I/II с повышением дозы и расширением групп введения дозы для исследования безопасности и эффективности примерной молекулы антитела, вводимой пациентам с распространенными солидными опухолями.
Пациентов лечили молекулой антитела, пока они не испытывали неприемлемую токсичность, прогрессирующее заболевание в соответствии с модифицированным иммуноопосредованным критерием ответа в солидных опухолях ([irRC], определяли как увеличение на 20% суммы диаметров всех измеренных целевых поражений. Прогрессирование должно быть подтверждено во второй оценке через≥4 недели, принимая в качестве референсного значения наименьшую сумму диаметров всех целевых поражений, зарегистрированных на момент включения в исследование или после. Сумма также должна демонстрировать абсолютное увеличение≥5 мм) и/или прекращали лечение по решению исследователя или по собственному решению.
В фазе исследования с повышением дозы молекулу антитела вводили внутривенно (в/в) раз в 2 недели (Q2W) или раз в 4 недели (Q4W). Оценивали пять схем введения молекулы антитела: 1 мг/кг Q2W, 3 мг/кг Q2W, 10 мг/кг Q2W, 3 мг/кг Q4W и 5 мг/кг Q4W. Пациенты должны были получать молекулу антитела, пока не была достигнута максимальная переносимая доза (МПД) или пока не была установлена более низкая рекомендуемая доза Фазы II (RP2D). Байесовскую линейную модель отношения дозы-экспозиции для молекулы антитела и адаптивную байесовскую модель логистической регрессии после повышения дозы с методом контроля передозировки использовали для выполнения повышения дозы.
Цели исследования и конечные показатели
Цели и конечные показатели исследования показаны в Таблице 9.
Таблица 9. Цели исследования и конечные показатели
Переносимость: временные прекращения введения, снижения и интенсивность дозы
Основные критерии включения
В исследование включали пациентов с распространенными/метастатическими солидными опухолями, с измеряемыми или неизмеряемыми проявлениями болезни согласно определению с помощью критерия оценки ответа при солидных опухолях (RECIST) версии 1.1, опухоли которых прогрессировали, несмотря на стандартную терапию, или которые не переносили стандартную терапию, или для которых не существует стандартной терапии. Оценка общего состояния по шкале Восточной объединенной онкологической группы составляла≤2. Опухоль можно было подвергнуть биопсии, при этом пациент соглашался на проведение биопсии опухоли в начале исследования и во время терапии исследуемым препаратом.
Основные критерии исключения
Из исследования исключали пациентов с симптоматическими метастазами центральной нервной системы (ЦНС) или метастазами центральной нервной системы, которые требуют локальной ЦНС-направленной терапии (такой как лучевая терапия или хирургическое вмешательство) или повышаемых доз кортикостероидов в течение 2 предшествующих недель. Пациентов исключали, если они получали системную противоопухолевую терапию в течение 2 недель после введения первой дозы исследуемого препарата или ранее получали PD-1 или PD-L1-направленную терапию. Также исключали пациентов, требующих постоянной терапии системными стероидами, кроме заместительных доз стероидов в случае недостаточности коры надпочечников, или ранее имевших случаи тяжелых аллергических реакций против других мАт.
Оценки
Нежелательные явления (AE) классифицировали при использовании общих терминологических критериев нежелательных явлений Национального института рака США (NCI CTCAE) версии 4.03. Тщательный забор образцов для исследования фармакокинетики (ФК) во множестве точек времени (до 336 часов после введения дозы Q2W и 672 часов после введения дозы Q4W) производили у всех пациентов в Фазе I. Предварительный анализ популяционной ФК проводили для оценки параметров ФК и оценки влияния веса в качестве ковариаты на клиренс и объем распределения. Ответ по результатам рентгенологического исследования оценивали с помощью компьютерной томографией (КТ) согласно RECIST версии 1.1. Сканирование проводили каждые 2 курса, начиная со дня 1 курса 3 до дня 1 курса 11, затем каждые 3 курса до прогрессирования болезни по irRC или выбывания пациента из исследования. Для исследований биомаркеров архивный образец опухоли и вновь полученный образец биопсии опухоли до лечения собирали при скрининге. Дополнительную биопсию опухоли получали в ходе лечения.
Результаты
Демографические показатели и характеристики пациентов
Как показано в Таблице 10, 58 пациентов были зарегистрированы в Фазе I исследования. Пациенты имели широкий диапазон распространенных солидных опухолей. 4/58 (7%) пациентов ранее получали 0 схем противоопухолевой терапии, 7/58 (12%) ранее получали 1 схему противоопухолевой терапии, 13/58 (22%) ранее получали 2 схемы противоопухолевой терапии, и 34/58 (59%) ранее получал≥3 схем противоопухолевой терапии.
Таблица 10. Демографические показатели и характеристики пациентов
Фазы I
N=58
Диагноз, n (%)
Анальный рак
Рак молочной железы
Холангиокарцинома
Меланома кожи
Рак пищевода
Рак желудка
Рак головы и шеи
Гепатоцеллюлярная карцинома
Липосаркома
Метастатический RCC
НМРЛ
Рак предстательной железы
МРЛ
ТНРМЖ
Прочие
2 (3)
2 (3)
2 (3)
1 (2)
1 (2)
1 (2)
3 (5)
2 (3)
3 (5)
6 (10)
1 (2)
1 (2)
2 (3)
1 (2)
30 (52)
≥3
34 (59)
Распределение пациентов и экспозиция
Как показано в Таблице 11, 11/58 (19%) пациентов получали исследуемое лекарственное средство. Из 58 пациентов, на момент окончания сбора данных 46 пациентов участвовали в исследовании в течение >8 недель; 34 пациента - в течение >12 недель; 20 пациентов - в течение >20 недель; 6 пациентов - в течение >36 недель. В Таблице 11 также указано, что основной причиной окончания лечения являлось прогрессирующее заболевание, наблюдавшееся у 39/58 (67%) пациентов. У пациентов Фазы I медианная продолжительность экспозиции составляла 14 недель (диапазон 2-46); у пациентов Фазы II средняя продолжительность экспозиции составляла 2,86 недели (диапазон 0,6-9,9).
Таблица 11. Распределение пациентов
Дозолимитирующие токсические явления (ДЛТ), клиническая ФК и RP2D
Никаких дозолимитирующих токсических явлений не отмечали. Предсказанные на основе модели профили зависимости концентрации от времени (Курс 1/Курс 3, при наличии; полулогарифмическое представление) для молекулы антитела в зависимости от дозы и схемы введения показаны на Фигуре 14. Максимальные концентрации в сыворотке (Cmax) наблюдались обычно через 1 час после окончания инфузии. Приблизительно дозопропорциональные повышения экспозиции наблюдали с 1-10 мг/кг. Молекула антитела достигает AUC0-336ч приблизительно 1000 мкг*день/мл в Курсе 3 при введении дозы 3 мг/кг Q2W или 5 мг/кг Q4W.
Приблизительно 2,1~3,4-кратное накопление наблюдали при введении дозы Q2W и 1,6~2,2-кратное при введении дозы Q4W. Вариабельность ФК была низкой или средней; межсубъектная вариабельность (геометрическое среднее CV%) изменялась от 0,5 до 39,2% для Cmax и от 3,6 до 47,7% для AUC0-336ч (Курс 1). Расчетный период полувыведения из предварительного анализа популяционной ФК у пациентов составлял 20 (95% CI:17-23) дней.
На основе анализа популяционной фармакокинетики (ФК), постоянная доза 400 мг Q4W согласно расчету должна достигать средних концентраций Ctrough в равновесном состоянии приблизительно 31 мкг/мл (90% CI: 22-42), что превышает EC50 ex vivo для блокады PD-1 0,42 мкг/мл (Фигура 12). Поэтому в качестве рекомендуемой дозы фазы II (RP2D) для молекулы антитела выбрали 400 мг Q4W. Альтернативная схема применения 300 мг Q3W, как ожидают, будет достигать аналогичной экспозиции дозы 400 мг Q4W и может использоваться в комбинированных схемах в тех случаях, когда график Q3W более удобен.
Безопасность и переносимость
У пациентов Фазы I наиболее распространенными (встречающимися у≥20% пациентов) из всех классов нежелательных явлений (АЕ), независимо от отношения к исследуемому препарату, являлись тошнота, усталость, анемия, диарея, одышка, рвота, боль в животе, снижение аппетита и запор (Таблица 12). Наиболее распространенным AE (встречающимися у≥10% пациентов) классов 3/4, независимо от отношения к исследуемому препарату, являлась анемия. Наиболее распространенным AE (встречающимся у≥20% пациентов) всех классов, подозреваемым на связь с исследуемым препаратом, являлась усталость. AE классов 3/4, подозреваемые на связь с исследуемым препаратом, были редкими, наблюдаемыми у 3,4% пациентов. Никаких тенденций не наблюдали в профиле неблагоприятных явлений в когортах введения доз.
Таблица 12. Нежелательные явления независимо от взаимосвязи с исследуемым лекарственным средством (любого класса, наблюдаемые у≥20% пациентов - выборка оценки безопасности)
У пациентов Фазы II наиболее распространенными (наблюдаемыми у≥10% пациентов) из всех классов AE, независимо от связи с исследуемым лекарственным средством, являлись боль в животе, запор, кашель, сниженный аппетит, одышка, усталость и повышенная гамма-глутамилтрансфераза. Наиболее распространенными AE (наблюдаемым у≥5% пациентов) класса 3/4, независимо от связи с исследуемым лекарственным средством, являлись боль в животе и повышенная гамма-глутамилтрансфераза. Наиболее распространенными AE (наблюдаемым у≥5% пациентов) всех классов, подозреваемыми на связь с исследуемым лекарственным средством, являлись усталость, тошнота и зуд. Ни регистрировали никаких AE 3/4, подозреваемых на связь с исследуемым лекарственным средством.
Ни отмечали никаких инфузионных реакций или снижений дозы. Один пациент прекращал лечение из-за нежелательного явления (Класс 3, одышка), не подозреваемого на связь с исследуемым лекарственным средством.
Эффективность
Общий процент пациентов с ответом и показатель контроля заболевания для опухолей различных типов составляли 2% и 41%, соответственно (Таблица 13). Изменения опухолевой массы в динамике для каждого из подлежащих рентгенологическому исследованию пациентов можно заметить на Фигуре 20. Диагнозы пациентов, остающихся в исследовании на момент прекращения сбора данных фазы I, включают: липосаркому (два пациента), рак яичка, атипичную карциноидную опухоль легкого, анапластическую карциному щитовидной железы, рак из клеток Меркеля, светлоклеточную почечно-клеточную карциному, меланому и трижды негативный рак молочной железы (ТНРМЖ). Как показано на Фигурах 21A-21B, частичный ответ после псевдопрогрессии наблюдали у одного пациента с метастатическим атипичным легочным карциноидом. Как показано на Фигуре 21C, высокие уровни CD8+ Т-лимфоцитов были обнаружены при иммуногистохимическом окрашивании в образце опухоли, полученном от этого пациента в День 1 Курса 2.
Таблица 13. Наилучший общий ответ (на основе оценки статуса болезни исследователем при использовании критериев RECIST v1.1)
(N=16)
n (%)
(N=15)
n (%)
(N=11)
n (%)
(N=42)
n (%)
(N=6)
n (%)
(N=10)
n (%)
(N=16)
n (%)
(N=58)
n (%)
*Подлежащие оценке пациенты определены как пациенты по меньшей мере с одной оценкой после лечения или прекратившие лечение до первой оценки после включения в исследовние.
Выводы
Примерная молекула антитела являлась хорошо переносимой и имела контролируемый профиль безопасности. Выбрали RP2D 400 мг Q4W. Ожидается, что альтернативная схема введения дозы 300 мг Q3W будет достигать аналогичной экспозиции и может быть более удобной альтернативой для оценки некоторых схем комбинированной терапии, включающих молекулу антитела. Предварительные данные эффективности у одного пациента свидетельствуют о противоопухолевом ответе, направляемом повышенной активностью CD8+ Т-лимфоцитов, как и ожидалось для клинически активного ингибитора PD-1.
Пример 6: Фармакология in vivo для комбинации антитела против PD-1 и Соединения A15
Соединение A15 тестировали в комбинации с примерной молекулой антитела против PD-1 в сингенной модели рака толстой и прямой кишки MC38, выбранной из-за присутствия TAM и ответа на антитело против PD-1. Как показано на Фигурах 22A-22C, комбинация антитела против PD-1 и Соединения A15 ингибировала рост опухоли и увеличивала выживаемость по сравнению с одним антителом против PD-1. В этом исследовании еженедельное введение Соединения A15 (200 мг/кг) в комбинации с молекулой антитела против PD-1 было более эффективным (8 из 11 полных респондеров), чем ежедневное введение Соединения A15 (200 мг/кг) в комбинации с еженедельным введением дозы молекулы антитела против PD-1 (4 из 11 полных респондеров) и одной молекулы антитела против PD-1 (5 из 11 полных респондеров, еженедельное введение дозы). Умеренное снижение TAM отмечали через 2 дня после введения второй дозы в схеме с еженедельным введением Соединения A15. Наблюдаемая кинетика TAM в схеме с еженедельным введением комбинации Соединения A15 и антитела против PD-1 была транзиторной, поскольку количество TAM возвращалось к нормальным значениям через 7 дней после введения второй дозы. Снижение опухолевых Treg наблюдали при анализе во всех точках времени (через 2 и 7 дней после введения дозы) при введении Соединения A15 плюс молекула антитела против PD-1 в схеме с еженедельным введением.
Пример 7: Активность антитела против PD-L1 в модели рака толстой кишки MC38 в комбинации с антителом против PD-1
Комбинацию примерной молекулы антитела против PD-1 и примерной молекулы антитела против PD-L1 тестировали в мышиной модели аденокарциномы толстой кишки. Использовали суррогатное антитело против мышиного PD-1, RMP1-14. Как показано на Фигуре 23, совместное введение RMP1-14 и молекулы антитела против PD-L1 приводило к усилению противоопухолевой активности по сравнению с обоими средствами в этой модели по отдельности. В частности, молекула антитела против PD-L1 и RMP1-14 в комбинации приводили к 4/10 животным с полным ответом, а также 3/10 животных демонстрировали частичные ответы. Кроме того, комбинированная терапия привела к незначительному увеличению медианного времени до конечного показателя до 46 дней, что на 21 день больше, чем у животных, получавших изотип, и на 20 дней дольше, чем только одно антитело.
Другие варианты осуществления и примеры, включая фигуры и таблицы, раскрыты в Публикации международной заявки на патент WO 2015/112900 и публикации заявки на патент США 2015/0210769, озаглавленной "Antibody Molecules to PD-1 and Uses Thereof", которые полностью включены посредством отсылки.
ВКЛЮЧЕНИЕ ПОСРЕДСТВОМ ОТСЫЛКИ
Все публикации, патенты и регистрационные номера, указанные в настоящем документе, полностью включены посредством отсылок, как если бы каждая отдельная публикация или патент были прямо и индивидуально указаны как включенные посредством отсылок.
ЭКВИВАЛЕНТЫ
Хотя обсуждались определенные варианты осуществления настоящего изобретения, представленное выше описание является иллюстративным и неограничивающим. Различные вариации изобретения будут очевидными для специалистов в данной области при ознакомлении с настоящим описанием и формулой изобретения ниже. Полный объем изобретения должен определяться при отсылке к формуле изобретения, наряду с ее полным объемом эквивалентов, а также описанием, наряду с такими вариациями.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> NOVARTIS AG
<120> МОЛЕКУЛЫ АНТИТЕЛ К PD-1 И ИХ ПРИМЕНЕНИЯ
<130> C2160-7015WO
<140>
<141>
<150> 62/431,846
<151> 2016-12-09
<150> 62/414,128
<151> 2016-10-28
<150> 62/400,787
<151> 2016-09-28
<150> 62/381,384
<151> 2016-08-30
<150> 62/359,781
<151> 2016-07-08
<150> 62/347,331
<151> 2016-06-08
<150> 62/344,784
<151> 2016-06-02
<150> 62/331,371
<151> 2016-05-03
<150> 62/269,044
<151> 2015-12-17
<160> 327
<170> PatentIn version 3.5
<210> 1
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 1
Thr Tyr Trp Met His
1 5
<210> 2
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 2
Asn Ile Tyr Pro Gly Thr Gly Gly Ser Asn Phe Asp Glu Lys Phe Lys
1 5 10 15
Asn
<210> 3
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 3
Trp Thr Thr Gly Thr Gly Ala Tyr
1 5
<210> 4
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 4
Gly Tyr Thr Phe Thr Thr Tyr
1 5
<210> 5
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 5
Tyr Pro Gly Thr Gly Gly
1 5
<210> 6
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 6
Gln Val Gln Leu Gln Gln Pro Gly Ser Glu Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Met His Trp Val Arg Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Tyr Pro Gly Thr Gly Gly Ser Asn Phe Asp Glu Lys Phe
50 55 60
Lys Asn Arg Thr Ser Leu Thr Val Asp Thr Ser Ser Thr Thr Ala Tyr
65 70 75 80
Met His Leu Ala Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Trp Thr Thr Gly Thr Gly Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ala
115
<210> 7
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 7
caggtccagc tgcagcaacc tgggtctgag ctggtgaggc ctggagcttc agtgaagctg 60
tcctgcaagg cgtctggcta cacattcacc acttactgga tgcactgggt gaggcagagg 120
cctggacaag gccttgagtg gattggaaat atttatcctg gtactggtgg ttctaacttc 180
gatgagaagt tcaaaaacag gacctcactg actgtagaca catcctccac cacagcctac 240
atgcacctcg ccagcctgac atctgaggac tctgcggtct attactgtac aagatggact 300
actgggacgg gagcttattg gggccaaggg actctggtca ctgtctctgc a 351
<210> 8
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 8
Gln Val Gln Leu Gln Gln Ser Gly Ser Glu Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Met His Trp Val Arg Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Tyr Pro Gly Thr Gly Gly Ser Asn Phe Asp Glu Lys Phe
50 55 60
Lys Asn Arg Thr Ser Leu Thr Val Asp Thr Ser Ser Thr Thr Ala Tyr
65 70 75 80
Met His Leu Ala Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Trp Thr Thr Gly Thr Gly Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ala
115
<210> 9
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 9
caggtccagc tgcagcagtc tgggtctgag ctggtgaggc ctggagcttc agtgaagctg 60
tcctgcaagg cgtctggcta cacattcacc acttactgga tgcactgggt gaggcagagg 120
cctggacaag gccttgagtg gattggaaat atttatcctg gtactggtgg ttctaacttc 180
gatgagaagt tcaaaaacag gacctcactg actgtagaca catcctccac cacagcctac 240
atgcacctcg ccagcctgac atctgaggac tctgcggtct attactgtac aagatggact 300
actgggacgg gagcttattg gggccaaggg actctggtca ctgtctctgc a 351
<210> 10
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 10
Lys Ser Ser Gln Ser Leu Leu Asp Ser Gly Asn Gln Lys Asn Phe Leu
1 5 10 15
Thr
<210> 11
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 11
Trp Ala Ser Thr Arg Glu Ser
1 5
<210> 12
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 12
Gln Asn Asp Tyr Ser Tyr Pro Cys Thr
1 5
<210> 13
<211> 13
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 13
Ser Gln Ser Leu Leu Asp Ser Gly Asn Gln Lys Asn Phe
1 5 10
<210> 14
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 14
Trp Ala Ser
1
<210> 15
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 15
Asp Tyr Ser Tyr Pro Cys
1 5
<210> 16
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 16
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Ala Gly
1 5 10 15
Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Gly Asn Gln Lys Asn Phe Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Phe Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Val Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Cys Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile
100 105 110
Lys
<210> 17
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 17
gacattgtga tgacccagtc tccatcctcc ctgactgtga cagcaggaga gaaggtcact 60
atgagctgca agtccagtca gagtctgtta gacagtggaa atcaaaagaa cttcttgacc 120
tggtaccagc agaaaccagg gcagcctcct aaactgttga tcttctgggc atccactagg 180
gaatctgggg tccctgatcg cttcacaggc agtggatctg taacagattt cactctcacc 240
atcagcagtg tgcaggctga agacctggca gtttattact gtcagaatga ttatagttat 300
ccgtgcacgt tcggaggggg gaccaagctg gaaataaaa 339
<210> 18
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 18
Gln Val Gln Leu Gln Gln Pro Gly Ser Glu Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Met His Trp Val Arg Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Tyr Pro Gly Thr Gly Gly Ser Asn Phe Asp Glu Lys Phe
50 55 60
Lys Asn Arg Thr Ser Leu Thr Val Asp Thr Ser Ser Thr Thr Ala Tyr
65 70 75 80
Met His Leu Ala Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Trp Thr Thr Gly Thr Gly Ala Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser
115
<210> 19
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 19
caggtccagc tgcagcagcc tgggtctgag ctggtgaggc ctggagcttc agtgaagctg 60
tcctgcaagg cgtctggcta cacattcacc acttactgga tgcactgggt gaggcagagg 120
cctggacaag gccttgagtg gattggaaat atttatcctg gtactggtgg ttctaacttc 180
gatgagaagt tcaaaaacag gacctcactg actgtagaca catcctccac cacagcctac 240
atgcacctcg ccagcctgac atctgaggac tctgcggtct attactgtac aagatggact 300
actgggacgg gagcttattg gggccagggc accaccgtga ccgtgtcctc c 351
<210> 20
<211> 444
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 20
Gln Val Gln Leu Gln Gln Pro Gly Ser Glu Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Met His Trp Val Arg Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Tyr Pro Gly Thr Gly Gly Ser Asn Phe Asp Glu Lys Phe
50 55 60
Lys Asn Arg Thr Ser Leu Thr Val Asp Thr Ser Ser Thr Thr Ala Tyr
65 70 75 80
Met His Leu Ala Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Trp Thr Thr Gly Thr Gly Ala Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro
210 215 220
Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
290 295 300
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln
340 345 350
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440
<210> 21
<211> 1332
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 21
caggtccagc tgcagcagcc tgggtctgag ctggtgaggc ctggagcttc agtgaagctg 60
tcctgcaagg cgtctggcta cacattcacc acttactgga tgcactgggt gaggcagagg 120
cctggacaag gccttgagtg gattggaaat atttatcctg gtactggtgg ttctaacttc 180
gatgagaagt tcaaaaacag gacctcactg actgtagaca catcctccac cacagcctac 240
atgcacctcg ccagcctgac atctgaggac tctgcggtct attactgtac aagatggact 300
actgggacgg gagcttattg gggccagggc accaccgtga ccgtgtcctc cgcttccacc 360
aagggcccat ccgtcttccc cctggcgccc tgctccagga gcacctccga gagcacagcc 420
gccctgggct gcctggtcaa ggactacttc cccgaaccgg tgacggtgtc gtggaactca 480
ggcgccctga ccagcggcgt gcacaccttc ccggctgtcc tacagtcctc aggactctac 540
tccctcagca gcgtggtgac cgtgccctcc agcagcttgg gcacgaagac ctacacctgc 600
aacgtagatc acaagcccag caacaccaag gtggacaaga gagttgagtc caaatatggt 660
cccccatgcc caccgtgccc agcacctgag ttcctggggg gaccatcagt cttcctgttc 720
cccccaaaac ccaaggacac tctcatgatc tcccggaccc ctgaggtcac gtgcgtggtg 780
gtggacgtga gccaggaaga ccccgaggtc cagttcaact ggtacgtgga tggcgtggag 840
gtgcataatg ccaagacaaa gccgcgggag gagcagttca acagcacgta ccgtgtggtc 900
agcgtcctca ccgtcctgca ccaggactgg ctgaacggca aggagtacaa gtgcaaggtg 960
tccaacaaag gcctcccgtc ctccatcgag aaaaccatct ccaaagccaa agggcagccc 1020
cgagagccac aggtgtacac cctgccccca tcccaggagg agatgaccaa gaaccaggtc 1080
agcctgacct gcctggtcaa aggcttctac cccagcgaca tcgccgtgga gtgggagagc 1140
aatgggcagc cggagaacaa ctacaagacc acgcctcccg tgctggactc cgacggctcc 1200
ttcttcctct acagcaggct aaccgtggac aagagcaggt ggcaggaggg gaatgtcttc 1260
tcatgctccg tgatgcatga ggctctgcac aaccactaca cacagaagag cctctccctg 1320
tctctgggta aa 1332
<210> 22
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 22
Gln Val Gln Leu Gln Gln Ser Gly Ser Glu Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Met His Trp Val Arg Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Tyr Pro Gly Thr Gly Gly Ser Asn Phe Asp Glu Lys Phe
50 55 60
Lys Asn Arg Thr Ser Leu Thr Val Asp Thr Ser Ser Thr Thr Ala Tyr
65 70 75 80
Met His Leu Ala Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Trp Thr Thr Gly Thr Gly Ala Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser
115
<210> 23
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 23
caggtccagc tgcagcagtc tgggtctgag ctggtgaggc ctggagcttc agtgaagctg 60
tcctgcaagg cgtctggcta cacattcacc acttactgga tgcactgggt gaggcagagg 120
cctggacaag gccttgagtg gattggaaat atttatcctg gtactggtgg ttctaacttc 180
gatgagaagt tcaaaaacag gacctcactg actgtagaca catcctccac cacagcctac 240
atgcacctcg ccagcctgac atctgaggac tctgcggtct attactgtac aagatggact 300
actgggacgg gagcttattg gggccagggc accaccgtga ccgtgtcctc c 351
<210> 24
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 24
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Ala Gly
1 5 10 15
Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Gly Asn Gln Lys Asn Phe Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Phe Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Val Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Cys Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 25
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 25
gacattgtga tgacccagtc tccatcctcc ctgactgtga cagcaggaga gaaggtcact 60
atgagctgca agtccagtca gagtctgtta gacagtggaa atcaaaagaa cttcttgacc 120
tggtaccagc agaaaccagg gcagcctcct aaactgttga tcttctgggc atccactagg 180
gaatctgggg tccctgatcg cttcacaggc agtggatctg taacagattt cactctcacc 240
atcagcagtg tgcaggctga agacctggca gtttattact gtcagaatga ttatagttat 300
ccgtgcacgt tcggccaagg gaccaaggtg gaaatcaaa 339
<210> 26
<211> 220
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 26
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Ala Gly
1 5 10 15
Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Gly Asn Gln Lys Asn Phe Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Phe Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Val Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Cys Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
115 120 125
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
130 135 140
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
145 150 155 160
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
165 170 175
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
180 185 190
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
195 200 205
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215 220
<210> 27
<211> 660
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 27
gacattgtga tgacccagtc tccatcctcc ctgactgtga cagcaggaga gaaggtcact 60
atgagctgca agtccagtca gagtctgtta gacagtggaa atcaaaagaa cttcttgacc 120
tggtaccagc agaaaccagg gcagcctcct aaactgttga tcttctgggc atccactagg 180
gaatctgggg tccctgatcg cttcacaggc agtggatctg taacagattt cactctcacc 240
atcagcagtg tgcaggctga agacctggca gtttattact gtcagaatga ttatagttat 300
ccgtgcacgt tcggccaagg gaccaaggtg gaaatcaaac gtacggtggc tgcaccatct 360
gtcttcatct tcccgccatc tgatgagcag ttgaaatctg gaactgcctc tgttgtgtgc 420
ctgctgaata acttctatcc cagagaggcc aaagtacagt ggaaggtgga taacgccctc 480
caatcgggta actcccagga gagtgtcaca gagcaggaca gcaaggacag cacctacagc 540
ctcagcagca ccctgacgct gagcaaagca gactacgaga aacacaaagt ctacgcctgc 600
gaagtcaccc atcagggcct gagctcgccc gtcacaaaga gcttcaacag gggagagtgt 660
<210> 28
<400> 28
000
<210> 29
<400> 29
000
<210> 30
<211> 444
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 30
Gln Val Gln Leu Gln Gln Ser Gly Ser Glu Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Met His Trp Val Arg Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Tyr Pro Gly Thr Gly Gly Ser Asn Phe Asp Glu Lys Phe
50 55 60
Lys Asn Arg Thr Ser Leu Thr Val Asp Thr Ser Ser Thr Thr Ala Tyr
65 70 75 80
Met His Leu Ala Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Trp Thr Thr Gly Thr Gly Ala Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro
210 215 220
Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
290 295 300
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln
340 345 350
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440
<210> 31
<211> 1332
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 31
caggtccagc tgcagcagtc tgggtctgag ctggtgaggc ctggagcttc agtgaagctg 60
tcctgcaagg cgtctggcta cacattcacc acttactgga tgcactgggt gaggcagagg 120
cctggacaag gccttgagtg gattggaaat atttatcctg gtactggtgg ttctaacttc 180
gatgagaagt tcaaaaacag gacctcactg actgtagaca catcctccac cacagcctac 240
atgcacctcg ccagcctgac atctgaggac tctgcggtct attactgtac aagatggact 300
actgggacgg gagcttattg gggccagggc accaccgtga ccgtgtcctc cgcttccacc 360
aagggcccat ccgtcttccc cctggcgccc tgctccagga gcacctccga gagcacagcc 420
gccctgggct gcctggtcaa ggactacttc cccgaaccgg tgacggtgtc gtggaactca 480
ggcgccctga ccagcggcgt gcacaccttc ccggctgtcc tacagtcctc aggactctac 540
tccctcagca gcgtggtgac cgtgccctcc agcagcttgg gcacgaagac ctacacctgc 600
aacgtagatc acaagcccag caacaccaag gtggacaaga gagttgagtc caaatatggt 660
cccccatgcc caccgtgccc agcacctgag ttcctggggg gaccatcagt cttcctgttc 720
cccccaaaac ccaaggacac tctcatgatc tcccggaccc ctgaggtcac gtgcgtggtg 780
gtggacgtga gccaggaaga ccccgaggtc cagttcaact ggtacgtgga tggcgtggag 840
gtgcataatg ccaagacaaa gccgcgggag gagcagttca acagcacgta ccgtgtggtc 900
agcgtcctca ccgtcctgca ccaggactgg ctgaacggca aggagtacaa gtgcaaggtg 960
tccaacaaag gcctcccgtc ctccatcgag aaaaccatct ccaaagccaa agggcagccc 1020
cgagagccac aggtgtacac cctgccccca tcccaggagg agatgaccaa gaaccaggtc 1080
agcctgacct gcctggtcaa aggcttctac cccagcgaca tcgccgtgga gtgggagagc 1140
aatgggcagc cggagaacaa ctacaagacc acgcctcccg tgctggactc cgacggctcc 1200
ttcttcctct acagcaggct aaccgtggac aagagcaggt ggcaggaggg gaatgtcttc 1260
tcatgctccg tgatgcatga ggctctgcac aaccactaca cacagaagag cctctccctg 1320
tctctgggta aa 1332
<210> 32
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 32
Gln Asn Asp Tyr Ser Tyr Pro Tyr Thr
1 5
<210> 33
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 33
Asp Tyr Ser Tyr Pro Tyr
1 5
<210> 34
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 34
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Ala Gly
1 5 10 15
Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Gly Asn Gln Lys Asn Phe Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Phe Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Val Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 35
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 35
gacattgtga tgacccagtc tccatcctcc ctgactgtga cagcaggaga gaaggtcact 60
atgagctgca agtccagtca gagtctgtta gacagtggaa atcaaaagaa cttcttgacc 120
tggtaccagc agaaaccagg gcagcctcct aaactgttga tcttctgggc atccactagg 180
gaatctgggg tccctgatcg cttcacaggc agtggatctg taacagattt cactctcacc 240
atcagcagtg tgcaggctga agacctggca gtttattact gtcagaatga ttatagttat 300
ccgtacacgt tcggccaagg gaccaaggtg gaaatcaaa 339
<210> 36
<211> 220
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 36
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Ala Gly
1 5 10 15
Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Gly Asn Gln Lys Asn Phe Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Phe Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Val Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
115 120 125
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
130 135 140
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
145 150 155 160
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
165 170 175
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
180 185 190
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
195 200 205
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215 220
<210> 37
<211> 660
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 37
gacattgtga tgacccagtc tccatcctcc ctgactgtga cagcaggaga gaaggtcact 60
atgagctgca agtccagtca gagtctgtta gacagtggaa atcaaaagaa cttcttgacc 120
tggtaccagc agaaaccagg gcagcctcct aaactgttga tcttctgggc atccactagg 180
gaatctgggg tccctgatcg cttcacaggc agtggatctg taacagattt cactctcacc 240
atcagcagtg tgcaggctga agacctggca gtttattact gtcagaatga ttatagttat 300
ccgtacacgt tcggccaagg gaccaaggtg gaaatcaaac gtacggtggc tgcaccatct 360
gtcttcatct tcccgccatc tgatgagcag ttgaaatctg gaactgcctc tgttgtgtgc 420
ctgctgaata acttctatcc cagagaggcc aaagtacagt ggaaggtgga taacgccctc 480
caatcgggta actcccagga gagtgtcaca gagcaggaca gcaaggacag cacctacagc 540
ctcagcagca ccctgacgct gagcaaagca gactacgaga aacacaaagt ctacgcctgc 600
gaagtcaccc atcagggcct gagctcgccc gtcacaaaga gcttcaacag gggagagtgt 660
<210> 38
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 38
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Thr Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Asn Ile Tyr Pro Gly Thr Gly Gly Ser Asn Phe Asp Glu Lys Phe
50 55 60
Lys Asn Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Trp Thr Thr Gly Thr Gly Ala Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser
115
<210> 39
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 39
gaagtgcagc tggtgcagtc tggagcagag gtgaaaaagc ccggggagtc tctgaggatc 60
tcctgtaagg gttctggcta cacattcacc acttactgga tgcactgggt gcgacaggcc 120
actggacaag ggcttgagtg gatgggtaat atttatcctg gtactggtgg ttctaacttc 180
gatgagaagt tcaagaacag agtcacgatt accgcggaca aatccacgag cacagcctac 240
atggagctga gcagcctgag atctgaggac acggccgtgt attactgtac aagatggact 300
actgggacgg gagcttattg gggccagggc accaccgtga ccgtgtcctc c 351
<210> 40
<211> 444
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 40
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Thr Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Asn Ile Tyr Pro Gly Thr Gly Gly Ser Asn Phe Asp Glu Lys Phe
50 55 60
Lys Asn Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Trp Thr Thr Gly Thr Gly Ala Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro
210 215 220
Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
290 295 300
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln
340 345 350
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440
<210> 41
<211> 1332
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 41
gaagtgcagc tggtgcagtc tggagcagag gtgaaaaagc ccggggagtc tctgaggatc 60
tcctgtaagg gttctggcta cacattcacc acttactgga tgcactgggt gcgacaggcc 120
actggacaag ggcttgagtg gatgggtaat atttatcctg gtactggtgg ttctaacttc 180
gatgagaagt tcaagaacag agtcacgatt accgcggaca aatccacgag cacagcctac 240
atggagctga gcagcctgag atctgaggac acggccgtgt attactgtac aagatggact 300
actgggacgg gagcttattg gggccagggc accaccgtga ccgtgtcctc cgcttccacc 360
aagggcccat ccgtcttccc cctggcgccc tgctccagga gcacctccga gagcacagcc 420
gccctgggct gcctggtcaa ggactacttc cccgaaccgg tgacggtgtc gtggaactca 480
ggcgccctga ccagcggcgt gcacaccttc ccggctgtcc tacagtcctc aggactctac 540
tccctcagca gcgtggtgac cgtgccctcc agcagcttgg gcacgaagac ctacacctgc 600
aacgtagatc acaagcccag caacaccaag gtggacaaga gagttgagtc caaatatggt 660
cccccatgcc caccgtgccc agcacctgag ttcctggggg gaccatcagt cttcctgttc 720
cccccaaaac ccaaggacac tctcatgatc tcccggaccc ctgaggtcac gtgcgtggtg 780
gtggacgtga gccaggaaga ccccgaggtc cagttcaact ggtacgtgga tggcgtggag 840
gtgcataatg ccaagacaaa gccgcgggag gagcagttca acagcacgta ccgtgtggtc 900
agcgtcctca ccgtcctgca ccaggactgg ctgaacggca aggagtacaa gtgcaaggtg 960
tccaacaaag gcctcccgtc ctccatcgag aaaaccatct ccaaagccaa agggcagccc 1020
cgagagccac aggtgtacac cctgccccca tcccaggagg agatgaccaa gaaccaggtc 1080
agcctgacct gcctggtcaa aggcttctac cccagcgaca tcgccgtgga gtgggagagc 1140
aatgggcagc cggagaacaa ctacaagacc acgcctcccg tgctggactc cgacggctcc 1200
ttcttcctct acagcaggct aaccgtggac aagagcaggt ggcaggaggg gaatgtcttc 1260
tcatgctccg tgatgcatga ggctctgcac aaccactaca cacagaagag cctctccctg 1320
tctctgggta aa 1332
<210> 42
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 42
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Gly Asn Gln Lys Asn Phe Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Ala Pro Arg Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Pro Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 43
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 43
gaaattgtgt tgacacagtc tccagccacc ctgtctttgt ctccagggga aagagccacc 60
ctctcctgca agtccagtca gagtctgtta gacagtggaa atcaaaagaa cttcttgacc 120
tggtaccagc agaaacctgg ccaggctccc aggctcctca tctattgggc atccactagg 180
gaatctgggg tcccatcaag gttcagcggc agtggatctg ggacagaatt cactctcacc 240
atcagcagcc tgcagcctga tgattttgca acttattact gtcagaatga ttatagttat 300
ccgtacacgt tcggccaagg gaccaaggtg gaaatcaaa 339
<210> 44
<211> 220
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 44
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Gly Asn Gln Lys Asn Phe Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Ala Pro Arg Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Leu Gln Pro Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
115 120 125
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
130 135 140
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
145 150 155 160
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
165 170 175
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
180 185 190
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
195 200 205
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215 220
<210> 45
<211> 660
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 45
gaaattgtgt tgacacagtc tccagccacc ctgtctttgt ctccagggga aagagccacc 60
ctctcctgca agtccagtca gagtctgtta gacagtggaa atcaaaagaa cttcttgacc 120
tggtaccagc agaaacctgg ccaggctccc aggctcctca tctattgggc atccactagg 180
gaatctgggg tcccatcaag gttcagcggc agtggatctg ggacagaatt cactctcacc 240
atcagcagcc tgcagcctga tgattttgca acttattact gtcagaatga ttatagttat 300
ccgtacacgt tcggccaagg gaccaaggtg gaaatcaaac gtacggtggc tgcaccatct 360
gtcttcatct tcccgccatc tgatgagcag ttgaaatctg gaactgcctc tgttgtgtgc 420
ctgctgaata acttctatcc cagagaggcc aaagtacagt ggaaggtgga taacgccctc 480
caatcgggta actcccagga gagtgtcaca gagcaggaca gcaaggacag cacctacagc 540
ctcagcagca ccctgacgct gagcaaagca gactacgaga aacacaaagt ctacgcctgc 600
gaagtcaccc atcagggcct gagctcgccc gtcacaaaga gcttcaacag gggagagtgt 660
<210> 46
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 46
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Gly Asn Gln Lys Asn Phe Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Ala Pro Arg Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Ile
50 55 60
Pro Pro Arg Phe Ser Gly Ser Gly Tyr Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Asn Asn Ile Glu Ser Glu Asp Ala Ala Tyr Tyr Phe Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 47
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 47
gacatccaga tgacccagtc tccatcctcc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgca agtccagtca gagtctgtta gacagtggaa atcaaaagaa cttcttgacc 120
tggtaccagc agaaacctgg ccaggctccc aggctcctca tctattgggc atccactagg 180
gaatctggga tcccacctcg attcagtggc agcgggtatg gaacagattt taccctcaca 240
attaataaca tagaatctga ggatgctgca tattacttct gtcagaatga ttatagttat 300
ccgtacacgt tcggccaagg gaccaaggtg gaaatcaaa 339
<210> 48
<211> 220
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 48
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Gly Asn Gln Lys Asn Phe Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Ala Pro Arg Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Ile
50 55 60
Pro Pro Arg Phe Ser Gly Ser Gly Tyr Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Asn Asn Ile Glu Ser Glu Asp Ala Ala Tyr Tyr Phe Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
115 120 125
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
130 135 140
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
145 150 155 160
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
165 170 175
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
180 185 190
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
195 200 205
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215 220
<210> 49
<211> 660
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 49
gacatccaga tgacccagtc tccatcctcc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgca agtccagtca gagtctgtta gacagtggaa atcaaaagaa cttcttgacc 120
tggtaccagc agaaacctgg ccaggctccc aggctcctca tctattgggc atccactagg 180
gaatctggga tcccacctcg attcagtggc agcgggtatg gaacagattt taccctcaca 240
attaataaca tagaatctga ggatgctgca tattacttct gtcagaatga ttatagttat 300
ccgtacacgt tcggccaagg gaccaaggtg gaaatcaaac gtacggtggc tgcaccatct 360
gtcttcatct tcccgccatc tgatgagcag ttgaaatctg gaactgcctc tgttgtgtgc 420
ctgctgaata acttctatcc cagagaggcc aaagtacagt ggaaggtgga taacgccctc 480
caatcgggta actcccagga gagtgtcaca gagcaggaca gcaaggacag cacctacagc 540
ctcagcagca ccctgacgct gagcaaagca gactacgaga aacacaaagt ctacgcctgc 600
gaagtcaccc atcagggcct gagctcgccc gtcacaaaga gcttcaacag gggagagtgt 660
<210> 50
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 50
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Met His Trp Ile Arg Gln Ser Pro Ser Arg Gly Leu Glu Trp Leu
35 40 45
Gly Asn Ile Tyr Pro Gly Thr Gly Gly Ser Asn Phe Asp Glu Lys Phe
50 55 60
Lys Asn Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Trp Thr Thr Gly Thr Gly Ala Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser
115
<210> 51
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 51
gaagtgcagc tggtgcagtc tggagcagag gtgaaaaagc ccggggagtc tctgaggatc 60
tcctgtaagg gttctggcta cacattcacc acttactgga tgcactggat caggcagtcc 120
ccatcgagag gccttgagtg gctgggtaat atttatcctg gtactggtgg ttctaacttc 180
gatgagaagt tcaagaacag attcaccatc tccagagaca attccaagaa cacgctgtat 240
cttcaaatga acagcctgag agccgaggac acggccgtgt attactgtac aagatggact 300
actgggacgg gagcttattg gggccagggc accaccgtga ccgtgtcctc c 351
<210> 52
<211> 444
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 52
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Met His Trp Ile Arg Gln Ser Pro Ser Arg Gly Leu Glu Trp Leu
35 40 45
Gly Asn Ile Tyr Pro Gly Thr Gly Gly Ser Asn Phe Asp Glu Lys Phe
50 55 60
Lys Asn Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Trp Thr Thr Gly Thr Gly Ala Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro
210 215 220
Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
290 295 300
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln
340 345 350
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440
<210> 53
<211> 1332
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 53
gaagtgcagc tggtgcagtc tggagcagag gtgaaaaagc ccggggagtc tctgaggatc 60
tcctgtaagg gttctggcta cacattcacc acttactgga tgcactggat caggcagtcc 120
ccatcgagag gccttgagtg gctgggtaat atttatcctg gtactggtgg ttctaacttc 180
gatgagaagt tcaagaacag attcaccatc tccagagaca attccaagaa cacgctgtat 240
cttcaaatga acagcctgag agccgaggac acggccgtgt attactgtac aagatggact 300
actgggacgg gagcttattg gggccagggc accaccgtga ccgtgtcctc cgcttccacc 360
aagggcccat ccgtcttccc cctggcgccc tgctccagga gcacctccga gagcacagcc 420
gccctgggct gcctggtcaa ggactacttc cccgaaccgg tgacggtgtc gtggaactca 480
ggcgccctga ccagcggcgt gcacaccttc ccggctgtcc tacagtcctc aggactctac 540
tccctcagca gcgtggtgac cgtgccctcc agcagcttgg gcacgaagac ctacacctgc 600
aacgtagatc acaagcccag caacaccaag gtggacaaga gagttgagtc caaatatggt 660
cccccatgcc caccgtgccc agcacctgag ttcctggggg gaccatcagt cttcctgttc 720
cccccaaaac ccaaggacac tctcatgatc tcccggaccc ctgaggtcac gtgcgtggtg 780
gtggacgtga gccaggaaga ccccgaggtc cagttcaact ggtacgtgga tggcgtggag 840
gtgcataatg ccaagacaaa gccgcgggag gagcagttca acagcacgta ccgtgtggtc 900
agcgtcctca ccgtcctgca ccaggactgg ctgaacggca aggagtacaa gtgcaaggtg 960
tccaacaaag gcctcccgtc ctccatcgag aaaaccatct ccaaagccaa agggcagccc 1020
cgagagccac aggtgtacac cctgccccca tcccaggagg agatgaccaa gaaccaggtc 1080
agcctgacct gcctggtcaa aggcttctac cccagcgaca tcgccgtgga gtgggagagc 1140
aatgggcagc cggagaacaa ctacaagacc acgcctcccg tgctggactc cgacggctcc 1200
ttcttcctct acagcaggct aaccgtggac aagagcaggt ggcaggaggg gaatgtcttc 1260
tcatgctccg tgatgcatga ggctctgcac aaccactaca cacagaagag cctctccctg 1320
tctctgggta aa 1332
<210> 54
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 54
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Gly Asn Gln Lys Asn Phe Leu Thr Trp Tyr Gln Gln Lys Pro Gly Lys
35 40 45
Ala Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr
65 70 75 80
Ile Ser Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 55
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 55
gaaattgtgt tgacacagtc tccagccacc ctgtctttgt ctccagggga aagagccacc 60
ctctcctgca agtccagtca gagtctgtta gacagtggaa atcaaaagaa cttcttgacc 120
tggtatcagc agaaaccagg gaaagctcct aagctcctga tctattgggc atccactagg 180
gaatctgggg tcccatcaag gttcagtgga agtggatctg ggacagattt tactttcacc 240
atcagcagcc tgcagcctga agatattgca acatattact gtcagaatga ttatagttat 300
ccgtacacgt tcggccaagg gaccaaggtg gaaatcaaa 339
<210> 56
<211> 220
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 56
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Gly Asn Gln Lys Asn Phe Leu Thr Trp Tyr Gln Gln Lys Pro Gly Lys
35 40 45
Ala Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr
65 70 75 80
Ile Ser Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
115 120 125
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
130 135 140
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
145 150 155 160
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
165 170 175
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
180 185 190
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
195 200 205
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215 220
<210> 57
<211> 660
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 57
gaaattgtgt tgacacagtc tccagccacc ctgtctttgt ctccagggga aagagccacc 60
ctctcctgca agtccagtca gagtctgtta gacagtggaa atcaaaagaa cttcttgacc 120
tggtatcagc agaaaccagg gaaagctcct aagctcctga tctattgggc atccactagg 180
gaatctgggg tcccatcaag gttcagtgga agtggatctg ggacagattt tactttcacc 240
atcagcagcc tgcagcctga agatattgca acatattact gtcagaatga ttatagttat 300
ccgtacacgt tcggccaagg gaccaaggtg gaaatcaaac gtacggtggc tgcaccatct 360
gtcttcatct tcccgccatc tgatgagcag ttgaaatctg gaactgcctc tgttgtgtgc 420
ctgctgaata acttctatcc cagagaggcc aaagtacagt ggaaggtgga taacgccctc 480
caatcgggta actcccagga gagtgtcaca gagcaggaca gcaaggacag cacctacagc 540
ctcagcagca ccctgacgct gagcaaagca gactacgaga aacacaaagt ctacgcctgc 600
gaagtcaccc atcagggcct gagctcgccc gtcacaaaga gcttcaacag gggagagtgt 660
<210> 58
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 58
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Gly Asn Gln Lys Asn Phe Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Ala Pro Arg Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr
65 70 75 80
Ile Ser Ser Leu Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 59
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 59
gatattgtga tgacccagac tccactctcc ctgcccgtca cccctggaga gccggcctcc 60
atctcctgca agtccagtca gagtctgtta gacagtggaa atcaaaagaa cttcttgacc 120
tggtaccagc agaaacctgg ccaggctccc aggctcctca tctattgggc atccactagg 180
gaatctgggg tcccctcgag gttcagtggc agtggatctg ggacagattt cacctttacc 240
atcagtagcc tggaagctga agatgctgca acatattact gtcagaatga ttatagttat 300
ccgtacacgt tcggccaagg gaccaaggtg gaaatcaaa 339
<210> 60
<211> 220
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 60
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Gly Asn Gln Lys Asn Phe Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Ala Pro Arg Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr
65 70 75 80
Ile Ser Ser Leu Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
115 120 125
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
130 135 140
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
145 150 155 160
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
165 170 175
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
180 185 190
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
195 200 205
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215 220
<210> 61
<211> 660
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 61
gatattgtga tgacccagac tccactctcc ctgcccgtca cccctggaga gccggcctcc 60
atctcctgca agtccagtca gagtctgtta gacagtggaa atcaaaagaa cttcttgacc 120
tggtaccagc agaaacctgg ccaggctccc aggctcctca tctattgggc atccactagg 180
gaatctgggg tcccctcgag gttcagtggc agtggatctg ggacagattt cacctttacc 240
atcagtagcc tggaagctga agatgctgca acatattact gtcagaatga ttatagttat 300
ccgtacacgt tcggccaagg gaccaaggtg gaaatcaaac gtacggtggc tgcaccatct 360
gtcttcatct tcccgccatc tgatgagcag ttgaaatctg gaactgcctc tgttgtgtgc 420
ctgctgaata acttctatcc cagagaggcc aaagtacagt ggaaggtgga taacgccctc 480
caatcgggta actcccagga gagtgtcaca gagcaggaca gcaaggacag cacctacagc 540
ctcagcagca ccctgacgct gagcaaagca gactacgaga aacacaaagt ctacgcctgc 600
gaagtcaccc atcagggcct gagctcgccc gtcacaaaga gcttcaacag gggagagtgt 660
<210> 62
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 62
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Gly Asn Gln Lys Asn Phe Leu Thr Trp Tyr Gln Gln Lys Pro Gly Lys
35 40 45
Ala Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr
65 70 75 80
Ile Ser Ser Leu Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 63
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 63
gaaattgtgt tgacacagtc tccagccacc ctgtctttgt ctccagggga aagagccacc 60
ctctcctgca agtccagtca gagtctgtta gacagtggaa atcaaaagaa cttcttgacc 120
tggtatcagc agaaaccagg gaaagctcct aagctcctga tctattgggc atccactagg 180
gaatctgggg tcccctcgag gttcagtggc agtggatctg ggacagattt cacctttacc 240
atcagtagcc tggaagctga agatgctgca acatattact gtcagaatga ttatagttat 300
ccgtacacgt tcggccaagg gaccaaggtg gaaatcaaa 339
<210> 64
<211> 220
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 64
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Gly Asn Gln Lys Asn Phe Leu Thr Trp Tyr Gln Gln Lys Pro Gly Lys
35 40 45
Ala Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr
65 70 75 80
Ile Ser Ser Leu Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
115 120 125
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
130 135 140
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
145 150 155 160
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
165 170 175
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
180 185 190
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
195 200 205
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215 220
<210> 65
<211> 660
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 65
gaaattgtgt tgacacagtc tccagccacc ctgtctttgt ctccagggga aagagccacc 60
ctctcctgca agtccagtca gagtctgtta gacagtggaa atcaaaagaa cttcttgacc 120
tggtatcagc agaaaccagg gaaagctcct aagctcctga tctattgggc atccactagg 180
gaatctgggg tcccctcgag gttcagtggc agtggatctg ggacagattt cacctttacc 240
atcagtagcc tggaagctga agatgctgca acatattact gtcagaatga ttatagttat 300
ccgtacacgt tcggccaagg gaccaaggtg gaaatcaaac gtacggtggc tgcaccatct 360
gtcttcatct tcccgccatc tgatgagcag ttgaaatctg gaactgcctc tgttgtgtgc 420
ctgctgaata acttctatcc cagagaggcc aaagtacagt ggaaggtgga taacgccctc 480
caatcgggta actcccagga gagtgtcaca gagcaggaca gcaaggacag cacctacagc 540
ctcagcagca ccctgacgct gagcaaagca gactacgaga aacacaaagt ctacgcctgc 600
gaagtcaccc atcagggcct gagctcgccc gtcacaaaga gcttcaacag gggagagtgt 660
<210> 66
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 66
Glu Ile Val Leu Thr Gln Ser Pro Asp Phe Gln Ser Val Thr Pro Lys
1 5 10 15
Glu Lys Val Thr Ile Thr Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Gly Asn Gln Lys Asn Phe Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Ala Pro Arg Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr
65 70 75 80
Ile Ser Ser Leu Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 67
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 67
gaaattgtgc tgactcagtc tccagacttt cagtctgtga ctccaaagga gaaagtcacc 60
atcacctgca agtccagtca gagtctgtta gacagtggaa atcaaaagaa cttcttgacc 120
tggtaccagc agaaacctgg ccaggctccc aggctcctca tctattgggc atccactagg 180
gaatctgggg tcccctcgag gttcagtggc agtggatctg ggacagattt cacctttacc 240
atcagtagcc tggaagctga agatgctgca acatattact gtcagaatga ttatagttat 300
ccgtacacgt tcggccaagg gaccaaggtg gaaatcaaa 339
<210> 68
<211> 220
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 68
Glu Ile Val Leu Thr Gln Ser Pro Asp Phe Gln Ser Val Thr Pro Lys
1 5 10 15
Glu Lys Val Thr Ile Thr Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Gly Asn Gln Lys Asn Phe Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Ala Pro Arg Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr
65 70 75 80
Ile Ser Ser Leu Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
115 120 125
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
130 135 140
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
145 150 155 160
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
165 170 175
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
180 185 190
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
195 200 205
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215 220
<210> 69
<211> 660
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 69
gaaattgtgc tgactcagtc tccagacttt cagtctgtga ctccaaagga gaaagtcacc 60
atcacctgca agtccagtca gagtctgtta gacagtggaa atcaaaagaa cttcttgacc 120
tggtaccagc agaaacctgg ccaggctccc aggctcctca tctattgggc atccactagg 180
gaatctgggg tcccctcgag gttcagtggc agtggatctg ggacagattt cacctttacc 240
atcagtagcc tggaagctga agatgctgca acatattact gtcagaatga ttatagttat 300
ccgtacacgt tcggccaagg gaccaaggtg gaaatcaaac gtacggtggc tgcaccatct 360
gtcttcatct tcccgccatc tgatgagcag ttgaaatctg gaactgcctc tgttgtgtgc 420
ctgctgaata acttctatcc cagagaggcc aaagtacagt ggaaggtgga taacgccctc 480
caatcgggta actcccagga gagtgtcaca gagcaggaca gcaaggacag cacctacagc 540
ctcagcagca ccctgacgct gagcaaagca gactacgaga aacacaaagt ctacgcctgc 600
gaagtcaccc atcagggcct gagctcgccc gtcacaaaga gcttcaacag gggagagtgt 660
<210> 70
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 70
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Gly Asn Gln Lys Asn Phe Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Ala Pro Arg Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr
65 70 75 80
Ile Ser Ser Leu Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 71
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 71
gaaattgtgt tgacacagtc tccagccacc ctgtctttgt ctccagggga aagagccacc 60
ctctcctgca agtccagtca gagtctgtta gacagtggaa atcaaaagaa cttcttgacc 120
tggtaccagc agaaacctgg ccaggctccc aggctcctca tctattgggc atccactagg 180
gaatctgggg tcccctcgag gttcagtggc agtggatctg ggacagattt cacctttacc 240
atcagtagcc tggaagctga agatgctgca acatattact gtcagaatga ttatagttat 300
ccgtacacgt tcggccaagg gaccaaggtg gaaatcaaa 339
<210> 72
<211> 220
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 72
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Gly Asn Gln Lys Asn Phe Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Ala Pro Arg Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr
65 70 75 80
Ile Ser Ser Leu Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
115 120 125
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
130 135 140
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
145 150 155 160
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
165 170 175
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
180 185 190
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
195 200 205
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215 220
<210> 73
<211> 660
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 73
gaaattgtgt tgacacagtc tccagccacc ctgtctttgt ctccagggga aagagccacc 60
ctctcctgca agtccagtca gagtctgtta gacagtggaa atcaaaagaa cttcttgacc 120
tggtaccagc agaaacctgg ccaggctccc aggctcctca tctattgggc atccactagg 180
gaatctgggg tcccctcgag gttcagtggc agtggatctg ggacagattt cacctttacc 240
atcagtagcc tggaagctga agatgctgca acatattact gtcagaatga ttatagttat 300
ccgtacacgt tcggccaagg gaccaaggtg gaaatcaaac gtacggtggc tgcaccatct 360
gtcttcatct tcccgccatc tgatgagcag ttgaaatctg gaactgcctc tgttgtgtgc 420
ctgctgaata acttctatcc cagagaggcc aaagtacagt ggaaggtgga taacgccctc 480
caatcgggta actcccagga gagtgtcaca gagcaggaca gcaaggacag cacctacagc 540
ctcagcagca ccctgacgct gagcaaagca gactacgaga aacacaaagt ctacgcctgc 600
gaagtcaccc atcagggcct gagctcgccc gtcacaaaga gcttcaacag gggagagtgt 660
<210> 74
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 74
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Gly Asn Gln Lys Asn Phe Leu Thr Trp Tyr Leu Gln Lys Pro Gly Gln
35 40 45
Ser Pro Gln Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr
65 70 75 80
Ile Ser Ser Leu Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 75
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 75
gacatccaga tgacccagtc tccatcctcc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgca agtccagtca gagtctgtta gacagtggaa atcaaaagaa cttcttgacc 120
tggtacctgc agaagccagg gcagtctcca cagctcctga tctattgggc atccactagg 180
gaatctgggg tcccctcgag gttcagtggc agtggatctg ggacagattt cacctttacc 240
atcagtagcc tggaagctga agatgctgca acatattact gtcagaatga ttatagttat 300
ccgtacacgt tcggccaagg gaccaaggtg gaaatcaaa 339
<210> 76
<211> 220
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 76
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Gly Asn Gln Lys Asn Phe Leu Thr Trp Tyr Leu Gln Lys Pro Gly Gln
35 40 45
Ser Pro Gln Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr
65 70 75 80
Ile Ser Ser Leu Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
115 120 125
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
130 135 140
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
145 150 155 160
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
165 170 175
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
180 185 190
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
195 200 205
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215 220
<210> 77
<211> 660
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 77
gacatccaga tgacccagtc tccatcctcc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgca agtccagtca gagtctgtta gacagtggaa atcaaaagaa cttcttgacc 120
tggtacctgc agaagccagg gcagtctcca cagctcctga tctattgggc atccactagg 180
gaatctgggg tcccctcgag gttcagtggc agtggatctg ggacagattt cacctttacc 240
atcagtagcc tggaagctga agatgctgca acatattact gtcagaatga ttatagttat 300
ccgtacacgt tcggccaagg gaccaaggtg gaaatcaaac gtacggtggc tgcaccatct 360
gtcttcatct tcccgccatc tgatgagcag ttgaaatctg gaactgcctc tgttgtgtgc 420
ctgctgaata acttctatcc cagagaggcc aaagtacagt ggaaggtgga taacgccctc 480
caatcgggta actcccagga gagtgtcaca gagcaggaca gcaaggacag cacctacagc 540
ctcagcagca ccctgacgct gagcaaagca gactacgaga aacacaaagt ctacgcctgc 600
gaagtcaccc atcagggcct gagctcgccc gtcacaaaga gcttcaacag gggagagtgt 660
<210> 78
<211> 113
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 78
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Gly Asn Gln Lys Asn Phe Leu Thr Trp Tyr Gln Gln Lys Pro Gly Lys
35 40 45
Ala Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr
65 70 75 80
Ile Ser Ser Leu Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 79
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 79
gatgttgtga tgactcagtc tccactctcc ctgcccgtca cccttggaca gccggcctcc 60
atctcctgca agtccagtca gagtctgtta gacagtggaa atcaaaagaa cttcttaacc 120
tggtatcagc agaaaccagg gaaagctcct aagctcctga tctattgggc atccactagg 180
gaatctgggg tcccctcgag gttcagtggc agtggatctg ggacagattt cacctttacc 240
atcagtagcc tggaagctga agatgctgca acatattact gtcagaatga ttatagttat 300
ccgtacacgt tcggccaagg gaccaaggtg gaaatcaaa 339
<210> 80
<211> 220
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 80
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Gly Asn Gln Lys Asn Phe Leu Thr Trp Tyr Gln Gln Lys Pro Gly Lys
35 40 45
Ala Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr
65 70 75 80
Ile Ser Ser Leu Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
115 120 125
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
130 135 140
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
145 150 155 160
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
165 170 175
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
180 185 190
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
195 200 205
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215 220
<210> 81
<211> 660
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 81
gatgttgtga tgactcagtc tccactctcc ctgcccgtca cccttggaca gccggcctcc 60
atctcctgca agtccagtca gagtctgtta gacagtggaa atcaaaagaa cttcttaacc 120
tggtatcagc agaaaccagg gaaagctcct aagctcctga tctattgggc atccactagg 180
gaatctgggg tcccctcgag gttcagtggc agtggatctg ggacagattt cacctttacc 240
atcagtagcc tggaagctga agatgctgca acatattact gtcagaatga ttatagttat 300
ccgtacacgt tcggccaagg gaccaaggtg gaaatcaaac gtacggtggc tgcaccatct 360
gtcttcatct tcccgccatc tgatgagcag ttgaaatctg gaactgcctc tgttgtgtgc 420
ctgctgaata acttctatcc cagagaggcc aaagtacagt ggaaggtgga taacgccctc 480
caatcgggta actcccagga gagtgtcaca gagcaggaca gcaaggacag cacctacagc 540
ctcagcagca ccctgacgct gagcaaagca gactacgaga aacacaaagt ctacgcctgc 600
gaagtcaccc atcagggcct gagctcgccc gtcacaaaga gcttcaacag gggagagtgt 660
<210> 82
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 82
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Met His Trp Ile Arg Gln Ser Pro Ser Arg Gly Leu Glu Trp Leu
35 40 45
Gly Asn Ile Tyr Pro Gly Thr Gly Gly Ser Asn Phe Asp Glu Lys Phe
50 55 60
Lys Asn Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Trp Thr Thr Gly Thr Gly Ala Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser
115
<210> 83
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 83
caggttcagc tggtgcagtc tggagctgag gtgaagaagc ctggggcctc agtgaaggtc 60
tcctgcaagg cttctggcta cacattcacc acttactgga tgcactggat caggcagtcc 120
ccatcgagag gccttgagtg gctgggtaat atttatcctg gtactggtgg ttctaacttc 180
gatgagaagt tcaagaacag attcaccatc tccagagaca attccaagaa cacgctgtat 240
cttcaaatga acagcctgag agccgaggac acggccgtgt attactgtac aagatggact 300
actgggacgg gagcttactg gggccagggc accaccgtga ccgtgtcctc c 351
<210> 84
<211> 444
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 84
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Met His Trp Ile Arg Gln Ser Pro Ser Arg Gly Leu Glu Trp Leu
35 40 45
Gly Asn Ile Tyr Pro Gly Thr Gly Gly Ser Asn Phe Asp Glu Lys Phe
50 55 60
Lys Asn Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Trp Thr Thr Gly Thr Gly Ala Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro
210 215 220
Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
290 295 300
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln
340 345 350
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440
<210> 85
<211> 1332
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 85
caggttcagc tggtgcagtc tggagctgag gtgaagaagc ctggggcctc agtgaaggtc 60
tcctgcaagg cttctggcta cacattcacc acttactgga tgcactggat caggcagtcc 120
ccatcgagag gccttgagtg gctgggtaat atttatcctg gtactggtgg ttctaacttc 180
gatgagaagt tcaagaacag attcaccatc tccagagaca attccaagaa cacgctgtat 240
cttcaaatga acagcctgag agccgaggac acggccgtgt attactgtac aagatggact 300
actgggacgg gagcttactg gggccagggc accaccgtga ccgtgtcctc cgcttccacc 360
aagggcccat ccgtcttccc cctggcgccc tgctccagga gcacctccga gagcacagcc 420
gccctgggct gcctggtcaa ggactacttc cccgaaccgg tgacggtgtc gtggaactca 480
ggcgccctga ccagcggcgt gcacaccttc ccggctgtcc tacagtcctc aggactctac 540
tccctcagca gcgtggtgac cgtgccctcc agcagcttgg gcacgaagac ctacacctgc 600
aacgtagatc acaagcccag caacaccaag gtggacaaga gagttgagtc caaatatggt 660
cccccatgcc caccgtgccc agcacctgag ttcctggggg gaccatcagt cttcctgttc 720
cccccaaaac ccaaggacac tctcatgatc tcccggaccc ctgaggtcac gtgcgtggtg 780
gtggacgtga gccaggaaga ccccgaggtc cagttcaact ggtacgtgga tggcgtggag 840
gtgcataatg ccaagacaaa gccgcgggag gagcagttca acagcacgta ccgtgtggtc 900
agcgtcctca ccgtcctgca ccaggactgg ctgaacggca aggagtacaa gtgcaaggtg 960
tccaacaaag gcctcccgtc ctccatcgag aaaaccatct ccaaagccaa agggcagccc 1020
cgagagccac aggtgtacac cctgccccca tcccaggagg agatgaccaa gaaccaggtc 1080
agcctgacct gcctggtcaa aggcttctac cccagcgaca tcgccgtgga gtgggagagc 1140
aatgggcagc cggagaacaa ctacaagacc acgcctcccg tgctggactc cgacggctcc 1200
ttcttcctct acagcaggct aaccgtggac aagagcaggt ggcaggaggg gaatgtcttc 1260
tcatgctccg tgatgcatga ggctctgcac aaccactaca cacagaagag cctctccctg 1320
tctctgggta aa 1332
<210> 86
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 86
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Asn Ile Tyr Pro Gly Thr Gly Gly Ser Asn Phe Asp Glu Lys Phe
50 55 60
Lys Asn Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Trp Thr Thr Gly Thr Gly Ala Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser
115
<210> 87
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 87
gaagtgcagc tggtgcagtc tggagcagag gtgaaaaagc ccggggagtc tctgaggatc 60
tcctgtaagg gttctggcta cacattcacc acttactgga tgcactgggt gcgacaggcc 120
cctggacaag ggcttgagtg gatgggtaat atttatcctg gtactggtgg ttctaacttc 180
gatgagaagt tcaagaacag attcaccatc tccagagaca attccaagaa cacgctgtat 240
cttcaaatga acagcctgag agccgaggac acggccgtgt attactgtac aagatggact 300
actgggacgg gagcttattg gggccagggc accaccgtga ccgtgtcctc c 351
<210> 88
<211> 444
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 88
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Asn Ile Tyr Pro Gly Thr Gly Gly Ser Asn Phe Asp Glu Lys Phe
50 55 60
Lys Asn Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Trp Thr Thr Gly Thr Gly Ala Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro
210 215 220
Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
290 295 300
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln
340 345 350
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440
<210> 89
<211> 1332
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 89
gaagtgcagc tggtgcagtc tggagcagag gtgaaaaagc ccggggagtc tctgaggatc 60
tcctgtaagg gttctggcta cacattcacc acttactgga tgcactgggt gcgacaggcc 120
cctggacaag ggcttgagtg gatgggtaat atttatcctg gtactggtgg ttctaacttc 180
gatgagaagt tcaagaacag attcaccatc tccagagaca attccaagaa cacgctgtat 240
cttcaaatga acagcctgag agccgaggac acggccgtgt attactgtac aagatggact 300
actgggacgg gagcttattg gggccagggc accaccgtga ccgtgtcctc cgcttccacc 360
aagggcccat ccgtcttccc cctggcgccc tgctccagga gcacctccga gagcacagcc 420
gccctgggct gcctggtcaa ggactacttc cccgaaccgg tgacggtgtc gtggaactca 480
ggcgccctga ccagcggcgt gcacaccttc ccggctgtcc tacagtcctc aggactctac 540
tccctcagca gcgtggtgac cgtgccctcc agcagcttgg gcacgaagac ctacacctgc 600
aacgtagatc acaagcccag caacaccaag gtggacaaga gagttgagtc caaatatggt 660
cccccatgcc caccgtgccc agcacctgag ttcctggggg gaccatcagt cttcctgttc 720
cccccaaaac ccaaggacac tctcatgatc tcccggaccc ctgaggtcac gtgcgtggtg 780
gtggacgtga gccaggaaga ccccgaggtc cagttcaact ggtacgtgga tggcgtggag 840
gtgcataatg ccaagacaaa gccgcgggag gagcagttca acagcacgta ccgtgtggtc 900
agcgtcctca ccgtcctgca ccaggactgg ctgaacggca aggagtacaa gtgcaaggtg 960
tccaacaaag gcctcccgtc ctccatcgag aaaaccatct ccaaagccaa agggcagccc 1020
cgagagccac aggtgtacac cctgccccca tcccaggagg agatgaccaa gaaccaggtc 1080
agcctgacct gcctggtcaa aggcttctac cccagcgaca tcgccgtgga gtgggagagc 1140
aatgggcagc cggagaacaa ctacaagacc acgcctcccg tgctggactc cgacggctcc 1200
ttcttcctct acagcaggct aaccgtggac aagagcaggt ggcaggaggg gaatgtcttc 1260
tcatgctccg tgatgcatga ggctctgcac aaccactaca cacagaagag cctctccctg 1320
tctctgggta aa 1332
<210> 90
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 90
gaagtgcagc tggtgcagtc tggcgccgaa gtgaagaagc ctggcgagtc cctgcggatc 60
tcctgcaagg gctctggcta caccttcacc acctactgga tgcactgggt gcgacaggct 120
accggccagg gcctggaatg gatgggcaac atctatcctg gcaccggcgg ctccaacttc 180
gacgagaagt tcaagaacag agtgaccatc accgccgaca agtccacctc caccgcctac 240
atggaactgt cctccctgag atccgaggac accgccgtgt actactgcac ccggtggaca 300
accggcacag gcgcttattg gggccagggc accacagtga ccgtgtcctc t 351
<210> 91
<211> 443
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 91
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Thr Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Asn Ile Tyr Pro Gly Thr Gly Gly Ser Asn Phe Asp Glu Lys Phe
50 55 60
Lys Asn Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Trp Thr Thr Gly Thr Gly Ala Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro
210 215 220
Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
290 295 300
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln
340 345 350
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly
435 440
<210> 92
<211> 1329
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 92
gaagtgcagc tggtgcagtc tggcgccgaa gtgaagaagc ctggcgagtc cctgcggatc 60
tcctgcaagg gctctggcta caccttcacc acctactgga tgcactgggt gcgacaggct 120
accggccagg gcctggaatg gatgggcaac atctatcctg gcaccggcgg ctccaacttc 180
gacgagaagt tcaagaacag agtgaccatc accgccgaca agtccacctc caccgcctac 240
atggaactgt cctccctgag atccgaggac accgccgtgt actactgcac ccggtggaca 300
accggcacag gcgcttattg gggccagggc accacagtga ccgtgtcctc tgcttctacc 360
aaggggccca gcgtgttccc cctggccccc tgctccagaa gcaccagcga gagcacagcc 420
gccctgggct gcctggtgaa ggactacttc cccgagcccg tgaccgtgtc ctggaacagc 480
ggagccctga ccagcggcgt gcacaccttc cccgccgtgc tgcagagcag cggcctgtac 540
agcctgagca gcgtggtgac cgtgcccagc agcagcctgg gcaccaagac ctacacctgt 600
aacgtggacc acaagcccag caacaccaag gtggacaaga gggtggagag caagtacggc 660
ccaccctgcc ccccctgccc agcccccgag ttcctgggcg gacccagcgt gttcctgttc 720
ccccccaagc ccaaggacac cctgatgatc agcagaaccc ccgaggtgac ctgtgtggtg 780
gtggacgtgt cccaggagga ccccgaggtc cagttcaact ggtacgtgga cggcgtggag 840
gtgcacaacg ccaagaccaa gcccagagag gagcagttta acagcaccta ccgggtggtg 900
tccgtgctga ccgtgctgca ccaggactgg ctgaacggca aagagtacaa gtgtaaggtc 960
tccaacaagg gcctgccaag cagcatcgaa aagaccatca gcaaggccaa gggccagcct 1020
agagagcccc aggtctacac cctgccaccc agccaagagg agatgaccaa gaaccaggtg 1080
tccctgacct gtctggtgaa gggcttctac ccaagcgaca tcgccgtgga gtgggagagc 1140
aacggccagc ccgagaacaa ctacaagacc acccccccag tgctggacag cgacggcagc 1200
ttcttcctgt acagcaggct gaccgtggac aagtccagat ggcaggaggg caacgtcttt 1260
agctgctccg tgatgcacga ggccctgcac aaccactaca cccagaagag cctgagcctg 1320
tccctgggc 1329
<210> 93
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 93
gagatcgtgc tgacccagtc ccctgccacc ctgtcactgt ctccaggcga gagagctacc 60
ctgtcctgca agtcctccca gtccctgctg gactccggca accagaagaa cttcctgacc 120
tggtatcagc agaagcccgg ccaggccccc agactgctga tctactgggc ctccacccgg 180
gaatctggcg tgccctctag attctccggc tccggctctg gcaccgagtt taccctgacc 240
atctccagcc tgcagcccga cgacttcgcc acctactact gccagaacga ctactcctac 300
ccctacacct tcggccaggg caccaaggtg gaaatcaag 339
<210> 94
<211> 660
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 94
gagatcgtgc tgacccagtc ccctgccacc ctgtcactgt ctccaggcga gagagctacc 60
ctgtcctgca agtcctccca gtccctgctg gactccggca accagaagaa cttcctgacc 120
tggtatcagc agaagcccgg ccaggccccc agactgctga tctactgggc ctccacccgg 180
gaatctggcg tgccctctag attctccggc tccggctctg gcaccgagtt taccctgacc 240
atctccagcc tgcagcccga cgacttcgcc acctactact gccagaacga ctactcctac 300
ccctacacct tcggccaggg caccaaggtg gaaatcaagc gtacggtggc cgctcccagc 360
gtgttcatct tccccccaag cgacgagcag ctgaagagcg gcaccgccag cgtggtgtgt 420
ctgctgaaca acttctaccc cagggaggcc aaggtgcagt ggaaggtgga caacgccctg 480
cagagcggca acagccagga gagcgtcacc gagcaggaca gcaaggactc cacctacagc 540
ctgagcagca ccctgaccct gagcaaggcc gactacgaga agcacaaggt gtacgcctgt 600
gaggtgaccc accagggcct gtccagcccc gtgaccaaga gcttcaacag gggcgagtgc 660
<210> 95
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 95
gaggtgcagc tggtgcagtc aggcgccgaa gtgaagaagc ccggcgagtc actgagaatt 60
agctgtaaag gttcaggcta caccttcact acctactgga tgcactgggt ccgccaggct 120
accggtcaag gcctcgagtg gatgggtaat atctaccccg gcaccggcgg ctctaacttc 180
gacgagaagt ttaagaatag agtgactatc accgccgata agtctactag caccgcctat 240
atggaactgt ctagcctgag atcagaggac accgccgtct actactgcac taggtggact 300
accggcacag gcgcctactg gggtcaaggc actaccgtga ccgtgtctag c 351
<210> 96
<211> 1329
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 96
gaggtgcagc tggtgcagtc aggcgccgaa gtgaagaagc ccggcgagtc actgagaatt 60
agctgtaaag gttcaggcta caccttcact acctactgga tgcactgggt ccgccaggct 120
accggtcaag gcctcgagtg gatgggtaat atctaccccg gcaccggcgg ctctaacttc 180
gacgagaagt ttaagaatag agtgactatc accgccgata agtctactag caccgcctat 240
atggaactgt ctagcctgag atcagaggac accgccgtct actactgcac taggtggact 300
accggcacag gcgcctactg gggtcaaggc actaccgtga ccgtgtctag cgctagcact 360
aagggcccgt ccgtgttccc cctggcacct tgtagccgga gcactagcga atccaccgct 420
gccctcggct gcctggtcaa ggattacttc ccggagcccg tgaccgtgtc ctggaacagc 480
ggagccctga cctccggagt gcacaccttc cccgctgtgc tgcagagctc cgggctgtac 540
tcgctgtcgt cggtggtcac ggtgccttca tctagcctgg gtaccaagac ctacacttgc 600
aacgtggacc acaagccttc caacactaag gtggacaagc gcgtcgaatc gaagtacggc 660
ccaccgtgcc cgccttgtcc cgcgccggag ttcctcggcg gtccctcggt ctttctgttc 720
ccaccgaagc ccaaggacac tttgatgatt tcccgcaccc ctgaagtgac atgcgtggtc 780
gtggacgtgt cacaggaaga tccggaggtg cagttcaatt ggtacgtgga tggcgtcgag 840
gtgcacaacg ccaaaaccaa gccgagggag gagcagttca actccactta ccgcgtcgtg 900
tccgtgctga cggtgctgca tcaggactgg ctgaacggga aggagtacaa gtgcaaagtg 960
tccaacaagg gacttcctag ctcaatcgaa aagaccatct cgaaagccaa gggacagccc 1020
cgggaacccc aagtgtatac cctgccaccg agccaggaag aaatgactaa gaaccaagtc 1080
tcattgactt gccttgtgaa gggcttctac ccatcggata tcgccgtgga atgggagtcc 1140
aacggccagc cggaaaacaa ctacaagacc acccctccgg tgctggactc agacggatcc 1200
ttcttcctct actcgcggct gaccgtggat aagagcagat ggcaggaggg aaatgtgttc 1260
agctgttctg tgatgcatga agccctgcac aaccactaca ctcagaagtc cctgtccctc 1320
tccctggga 1329
<210> 97
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 97
gagatcgtcc tgactcagtc acccgctacc ctgagcctga gccctggcga gcgggctaca 60
ctgagctgta aatctagtca gtcactgctg gatagcggta atcagaagaa cttcctgacc 120
tggtatcagc agaagcccgg taaagcccct aagctgctga tctactgggc ctctactaga 180
gaatcaggcg tgccctctag gtttagcggt agcggtagtg gcaccgactt caccttcact 240
atctctagcc tgcagcccga ggatatcgct acctactact gtcagaacga ctatagctac 300
ccctacacct tcggtcaagg cactaaggtc gagattaag 339
<210> 98
<211> 660
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 98
gagatcgtcc tgactcagtc acccgctacc ctgagcctga gccctggcga gcgggctaca 60
ctgagctgta aatctagtca gtcactgctg gatagcggta atcagaagaa cttcctgacc 120
tggtatcagc agaagcccgg taaagcccct aagctgctga tctactgggc ctctactaga 180
gaatcaggcg tgccctctag gtttagcggt agcggtagtg gcaccgactt caccttcact 240
atctctagcc tgcagcccga ggatatcgct acctactact gtcagaacga ctatagctac 300
ccctacacct tcggtcaagg cactaaggtc gagattaagc gtacggtggc cgctcccagc 360
gtgttcatct tcccccccag cgacgagcag ctgaagagcg gcaccgccag cgtggtgtgc 420
ctgctgaaca acttctaccc ccgggaggcc aaggtgcagt ggaaggtgga caacgccctg 480
cagagcggca acagccagga gagcgtcacc gagcaggaca gcaaggactc cacctacagc 540
ctgagcagca ccctgaccct gagcaaggcc gactacgaga agcataaggt gtacgcctgc 600
gaggtgaccc accagggcct gtccagcccc gtgaccaaga gcttcaacag gggcgagtgc 660
<210> 99
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 99
gagatcgtgc tgacccagtc ccccgacttc cagtccgtga cccccaaaga aaaagtgacc 60
atcacatgca agtcctccca gtccctgctg gactccggca accagaagaa cttcctgacc 120
tggtatcagc agaagcccgg ccaggccccc agactgctga tctactgggc ctccacccgg 180
gaatctggcg tgccctctag attctccggc tccggctctg gcaccgactt taccttcacc 240
atctccagcc tggaagccga ggacgccgcc acctactact gccagaacga ctactcctac 300
ccctacacct tcggccaggg caccaaggtg gaaatcaag 339
<210> 100
<211> 660
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 100
gagatcgtgc tgacccagtc ccccgacttc cagtccgtga cccccaaaga aaaagtgacc 60
atcacatgca agtcctccca gtccctgctg gactccggca accagaagaa cttcctgacc 120
tggtatcagc agaagcccgg ccaggccccc agactgctga tctactgggc ctccacccgg 180
gaatctggcg tgccctctag attctccggc tccggctctg gcaccgactt taccttcacc 240
atctccagcc tggaagccga ggacgccgcc acctactact gccagaacga ctactcctac 300
ccctacacct tcggccaggg caccaaggtg gaaatcaagc gtacggtggc cgctcccagc 360
gtgttcatct tccccccaag cgacgagcag ctgaagagcg gcaccgccag cgtggtgtgt 420
ctgctgaaca acttctaccc cagggaggcc aaggtgcagt ggaaggtgga caacgccctg 480
cagagcggca acagccagga gagcgtcacc gagcaggaca gcaaggactc cacctacagc 540
ctgagcagca ccctgaccct gagcaaggcc gactacgaga agcacaaggt gtacgcctgt 600
gaggtgaccc accagggcct gtccagcccc gtgaccaaga gcttcaacag gggcgagtgc 660
<210> 101
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 101
gaagtgcagc tggtgcagtc tggcgccgaa gtgaagaagc ctggcgagtc cctgcggatc 60
tcctgcaagg gctctggcta caccttcacc acctactgga tgcactggat ccggcagtcc 120
ccctctaggg gcctggaatg gctgggcaac atctaccctg gcaccggcgg ctccaacttc 180
gacgagaagt tcaagaacag gttcaccatc tcccgggaca actccaagaa caccctgtac 240
ctgcagatga actccctgcg ggccgaggac accgccgtgt actactgtac cagatggacc 300
accggaaccg gcgcctattg gggccagggc acaacagtga ccgtgtcctc c 351
<210> 102
<211> 443
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 102
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Met His Trp Ile Arg Gln Ser Pro Ser Arg Gly Leu Glu Trp Leu
35 40 45
Gly Asn Ile Tyr Pro Gly Thr Gly Gly Ser Asn Phe Asp Glu Lys Phe
50 55 60
Lys Asn Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Trp Thr Thr Gly Thr Gly Ala Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro
210 215 220
Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
290 295 300
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln
340 345 350
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly
435 440
<210> 103
<211> 1329
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 103
gaagtgcagc tggtgcagtc tggcgccgaa gtgaagaagc ctggcgagtc cctgcggatc 60
tcctgcaagg gctctggcta caccttcacc acctactgga tgcactggat ccggcagtcc 120
ccctctaggg gcctggaatg gctgggcaac atctaccctg gcaccggcgg ctccaacttc 180
gacgagaagt tcaagaacag gttcaccatc tcccgggaca actccaagaa caccctgtac 240
ctgcagatga actccctgcg ggccgaggac accgccgtgt actactgtac cagatggacc 300
accggaaccg gcgcctattg gggccagggc acaacagtga ccgtgtcctc cgcttctacc 360
aaggggccca gcgtgttccc cctggccccc tgctccagaa gcaccagcga gagcacagcc 420
gccctgggct gcctggtgaa ggactacttc cccgagcccg tgaccgtgtc ctggaacagc 480
ggagccctga ccagcggcgt gcacaccttc cccgccgtgc tgcagagcag cggcctgtac 540
agcctgagca gcgtggtgac cgtgcccagc agcagcctgg gcaccaagac ctacacctgt 600
aacgtggacc acaagcccag caacaccaag gtggacaaga gggtggagag caagtacggc 660
ccaccctgcc ccccctgccc agcccccgag ttcctgggcg gacccagcgt gttcctgttc 720
ccccccaagc ccaaggacac cctgatgatc agcagaaccc ccgaggtgac ctgtgtggtg 780
gtggacgtgt cccaggagga ccccgaggtc cagttcaact ggtacgtgga cggcgtggag 840
gtgcacaacg ccaagaccaa gcccagagag gagcagttta acagcaccta ccgggtggtg 900
tccgtgctga ccgtgctgca ccaggactgg ctgaacggca aagagtacaa gtgtaaggtc 960
tccaacaagg gcctgccaag cagcatcgaa aagaccatca gcaaggccaa gggccagcct 1020
agagagcccc aggtctacac cctgccaccc agccaagagg agatgaccaa gaaccaggtg 1080
tccctgacct gtctggtgaa gggcttctac ccaagcgaca tcgccgtgga gtgggagagc 1140
aacggccagc ccgagaacaa ctacaagacc acccccccag tgctggacag cgacggcagc 1200
ttcttcctgt acagcaggct gaccgtggac aagtccagat ggcaggaggg caacgtcttt 1260
agctgctccg tgatgcacga ggccctgcac aaccactaca cccagaagag cctgagcctg 1320
tccctgggc 1329
<210> 104
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 104
gagatcgtgc tgacccagtc ccctgccacc ctgtcactgt ctccaggcga gagagctacc 60
ctgtcctgca agtcctccca gtccctgctg gactccggca accagaagaa cttcctgacc 120
tggtatcagc agaagcccgg ccaggccccc agactgctga tctactgggc ctccacccgg 180
gaatctggcg tgccctctag attctccggc tccggctctg gcaccgactt taccttcacc 240
atctccagcc tggaagccga ggacgccgcc acctactact gccagaacga ctactcctac 300
ccctacacct tcggccaggg caccaaggtg gaaatcaag 339
<210> 105
<211> 660
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 105
gagatcgtgc tgacccagtc ccctgccacc ctgtcactgt ctccaggcga gagagctacc 60
ctgtcctgca agtcctccca gtccctgctg gactccggca accagaagaa cttcctgacc 120
tggtatcagc agaagcccgg ccaggccccc agactgctga tctactgggc ctccacccgg 180
gaatctggcg tgccctctag attctccggc tccggctctg gcaccgactt taccttcacc 240
atctccagcc tggaagccga ggacgccgcc acctactact gccagaacga ctactcctac 300
ccctacacct tcggccaggg caccaaggtg gaaatcaagc gtacggtggc cgctcccagc 360
gtgttcatct tccccccaag cgacgagcag ctgaagagcg gcaccgccag cgtggtgtgt 420
ctgctgaaca acttctaccc cagggaggcc aaggtgcagt ggaaggtgga caacgccctg 480
cagagcggca acagccagga gagcgtcacc gagcaggaca gcaaggactc cacctacagc 540
ctgagcagca ccctgaccct gagcaaggcc gactacgaga agcacaaggt gtacgcctgt 600
gaggtgaccc accagggcct gtccagcccc gtgaccaaga gcttcaacag gggcgagtgc 660
<210> 106
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 106
gagatcgtcc tgactcagtc acccgctacc ctgagcctga gccctggcga gcgggctaca 60
ctgagctgta aatctagtca gtcactgctg gatagcggta atcagaagaa cttcctgacc 120
tggtatcagc agaagcccgg tcaagcccct agactgctga tctactgggc ctctactaga 180
gaatcaggcg tgccctctag gtttagcggt agcggtagtg gcaccgactt caccttcact 240
atctctagcc tggaagccga ggacgccgct acctactact gtcagaacga ctatagctac 300
ccctacacct tcggtcaagg cactaaggtc gagattaag 339
<210> 107
<211> 660
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 107
gagatcgtcc tgactcagtc acccgctacc ctgagcctga gccctggcga gcgggctaca 60
ctgagctgta aatctagtca gtcactgctg gatagcggta atcagaagaa cttcctgacc 120
tggtatcagc agaagcccgg tcaagcccct agactgctga tctactgggc ctctactaga 180
gaatcaggcg tgccctctag gtttagcggt agcggtagtg gcaccgactt caccttcact 240
atctctagcc tggaagccga ggacgccgct acctactact gtcagaacga ctatagctac 300
ccctacacct tcggtcaagg cactaaggtc gagattaagc gtacggtggc cgctcccagc 360
gtgttcatct tcccccccag cgacgagcag ctgaagagcg gcaccgccag cgtggtgtgc 420
ctgctgaaca acttctaccc ccgggaggcc aaggtgcagt ggaaggtgga caacgccctg 480
cagagcggca acagccagga gagcgtcacc gagcaggaca gcaaggactc cacctacagc 540
ctgagcagca ccctgaccct gagcaaggcc gactacgaga agcataaggt gtacgcctgc 600
gaggtgaccc accagggcct gtccagcccc gtgaccaaga gcttcaacag gggcgagtgc 660
<210> 108
<211> 15
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 108
acttactgga tgcac 15
<210> 109
<211> 51
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 109
aatatttatc ctggtactgg tggttctaac ttcgatgaga agttcaagaa c 51
<210> 110
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 110
tggactactg ggacgggagc ttat 24
<210> 111
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 111
ggctacacat tcaccactta c 21
<210> 112
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 112
tatcctggta ctggtggt 18
<210> 113
<211> 51
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 113
aagtccagtc agagtctgtt agacagtgga aatcaaaaga acttcttgac c 51
<210> 114
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 114
tgggcatcca ctagggaatc t 21
<210> 115
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 115
cagaatgatt atagttatcc gtgcacg 27
<210> 116
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 116
agtcagagtc tgttagacag tggaaatcaa aagaacttc 39
<210> 117
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 117
tgggcatcc 9
<210> 118
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 118
gattatagtt atccgtgc 18
<210> 119
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 119
cagaatgatt atagttatcc gtacacg 27
<210> 120
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 120
gattatagtt atccgtac 18
<210> 121
<211> 51
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 121
aagtccagtc agagtctgtt agacagtgga aatcaaaaga acttcttaac c 51
<210> 122
<211> 15
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 122
acctactgga tgcac 15
<210> 123
<211> 51
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 123
aacatctatc ctggcaccgg cggctccaac ttcgacgaga agttcaagaa c 51
<210> 124
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 124
tggacaaccg gcacaggcgc ttat 24
<210> 125
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 125
ggctacacct tcaccaccta c 21
<210> 126
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 126
tatcctggca ccggcggc 18
<210> 127
<211> 51
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 127
aagtcctccc agtccctgct ggactccggc aaccagaaga acttcctgac c 51
<210> 128
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 128
tgggcctcca cccgggaatc t 21
<210> 129
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 129
cagaacgact actcctaccc ctacacc 27
<210> 130
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 130
tcccagtccc tgctggactc cggcaaccag aagaacttc 39
<210> 131
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 131
tgggcctcc 9
<210> 132
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 132
gactactcct acccctac 18
<210> 133
<211> 15
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 133
acctactgga tgcac 15
<210> 134
<211> 51
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 134
aatatctacc ccggcaccgg cggctctaac ttcgacgaga agtttaagaa t 51
<210> 135
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 135
tggactaccg gcacaggcgc ctac 24
<210> 136
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 136
ggctacacct tcactaccta c 21
<210> 137
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 137
taccccggca ccggcggc 18
<210> 138
<211> 51
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 138
aaatctagtc agtcactgct ggatagcggt aatcagaaga acttcctgac c 51
<210> 139
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 139
tgggcctcta ctagagaatc a 21
<210> 140
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 140
cagaacgact atagctaccc ctacacc 27
<210> 141
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 141
agtcagtcac tgctggatag cggtaatcag aagaacttc 39
<210> 142
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 142
tgggcctct 9
<210> 143
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 143
gactatagct acccctac 18
<210> 144
<211> 51
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 144
aacatctacc ctggcaccgg cggctccaac ttcgacgaga agttcaagaa c 51
<210> 145
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 145
tggaccaccg gaaccggcgc ctat 24
<210> 146
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 146
taccctggca ccggcggc 18
<210> 147
<211> 25
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 147
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser
20 25
<210> 148
<211> 75
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 148
gaagtgcagc tggtgcagtc tggagcagag gtgaaaaagc ccggggagtc tctgaggatc 60
tcctgtaagg gttct 75
<210> 149
<211> 75
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 149
gaagtgcagc tggtgcagtc tggcgccgaa gtgaagaagc ctggcgagtc cctgcggatc 60
tcctgcaagg gctct 75
<210> 150
<211> 75
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 150
gaggtgcagc tggtgcagtc aggcgccgaa gtgaagaagc ccggcgagtc actgagaatt 60
agctgtaaag gttca 75
<210> 151
<211> 25
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 151
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser
20 25
<210> 152
<211> 75
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 152
caggttcagc tggtgcagtc tggagctgag gtgaagaagc ctggggcctc agtgaaggtc 60
tcctgcaagg cttct 75
<210> 153
<211> 14
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 153
Trp Val Arg Gln Ala Thr Gly Gln Gly Leu Glu Trp Met Gly
1 5 10
<210> 154
<211> 42
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 154
tgggtgcgac aggccactgg acaagggctt gagtggatgg gt 42
<210> 155
<211> 42
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 155
tgggtgcgac aggctaccgg ccagggcctg gaatggatgg gc 42
<210> 156
<211> 42
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 156
tgggtccgcc aggctaccgg tcaaggcctc gagtggatgg gt 42
<210> 157
<211> 14
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 157
Trp Ile Arg Gln Ser Pro Ser Arg Gly Leu Glu Trp Leu Gly
1 5 10
<210> 158
<211> 42
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 158
tggatcaggc agtccccatc gagaggcctt gagtggctgg gt 42
<210> 159
<211> 42
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 159
tggatccggc agtccccctc taggggcctg gaatggctgg gc 42
<210> 160
<211> 14
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 160
Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met Gly
1 5 10
<210> 161
<211> 42
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 161
tgggtgcgac aggcccctgg acaagggctt gagtggatgg gt 42
<210> 162
<211> 32
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 162
Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr Met Glu
1 5 10 15
Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys Thr Arg
20 25 30
<210> 163
<211> 96
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 163
agagtcacga ttaccgcgga caaatccacg agcacagcct acatggagct gagcagcctg 60
agatctgagg acacggccgt gtattactgt acaaga 96
<210> 164
<211> 96
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 164
agagtgacca tcaccgccga caagtccacc tccaccgcct acatggaact gtcctccctg 60
agatccgagg acaccgccgt gtactactgc acccgg 96
<210> 165
<211> 96
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 165
agagtgacta tcaccgccga taagtctact agcaccgcct atatggaact gtctagcctg 60
agatcagagg acaccgccgt ctactactgc actagg 96
<210> 166
<211> 32
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 166
Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln
1 5 10 15
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Thr Arg
20 25 30
<210> 167
<211> 96
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 167
agattcacca tctccagaga caattccaag aacacgctgt atcttcaaat gaacagcctg 60
agagccgagg acacggccgt gtattactgt acaaga 96
<210> 168
<211> 96
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 168
aggttcacca tctcccggga caactccaag aacaccctgt acctgcagat gaactccctg 60
cgggccgagg acaccgccgt gtactactgt accaga 96
<210> 169
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 169
Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
1 5 10
<210> 170
<211> 33
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 170
tggggccagg gcaccaccgt gaccgtgtcc tcc 33
<210> 171
<211> 33
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 171
tggggccagg gcaccacagt gaccgtgtcc tct 33
<210> 172
<211> 33
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 172
tggggtcaag gcactaccgt gaccgtgtct agc 33
<210> 173
<211> 33
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 173
tggggccagg gcacaacagt gaccgtgtcc tcc 33
<210> 174
<211> 23
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 174
Glu Ile Val Leu Thr Gln Ser Pro Asp Phe Gln Ser Val Thr Pro Lys
1 5 10 15
Glu Lys Val Thr Ile Thr Cys
20
<210> 175
<211> 69
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 175
gaaattgtgc tgactcagtc tccagacttt cagtctgtga ctccaaagga gaaagtcacc 60
atcacctgc 69
<210> 176
<211> 69
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 176
gagatcgtgc tgacccagtc ccccgacttc cagtccgtga cccccaaaga aaaagtgacc 60
atcacatgc 69
<210> 177
<211> 23
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 177
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys
20
<210> 178
<211> 69
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 178
gaaattgtgt tgacacagtc tccagccacc ctgtctttgt ctccagggga aagagccacc 60
ctctcctgc 69
<210> 179
<211> 69
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 179
gagatcgtgc tgacccagtc ccctgccacc ctgtcactgt ctccaggcga gagagctacc 60
ctgtcctgc 69
<210> 180
<211> 69
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 180
gagatcgtcc tgactcagtc acccgctacc ctgagcctga gccctggcga gcgggctaca 60
ctgagctgt 69
<210> 181
<211> 23
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 181
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys
20
<210> 182
<211> 69
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 182
gatattgtga tgacccagac tccactctcc ctgcccgtca cccctggaga gccggcctcc 60
atctcctgc 69
<210> 183
<211> 23
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 183
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys
20
<210> 184
<211> 69
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 184
gatgttgtga tgactcagtc tccactctcc ctgcccgtca cccttggaca gccggcctcc 60
atctcctgc 69
<210> 185
<211> 23
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 185
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys
20
<210> 186
<211> 69
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 186
gacatccaga tgacccagtc tccatcctcc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgc 69
<210> 187
<211> 15
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 187
Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr
1 5 10 15
<210> 188
<211> 45
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 188
tggtaccagc agaaacctgg ccaggctccc aggctcctca tctat 45
<210> 189
<211> 45
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 189
tggtatcagc agaagcccgg ccaggccccc agactgctga tctac 45
<210> 190
<211> 45
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 190
tggtatcagc agaagcccgg tcaagcccct agactgctga tctac 45
<210> 191
<211> 15
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 191
Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr
1 5 10 15
<210> 192
<211> 45
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 192
tggtatcagc agaaaccagg gaaagctcct aagctcctga tctat 45
<210> 193
<211> 45
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 193
tggtatcagc agaagcccgg taaagcccct aagctgctga tctac 45
<210> 194
<211> 15
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 194
Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile Tyr
1 5 10 15
<210> 195
<211> 45
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 195
tggtacctgc agaagccagg gcagtctcca cagctcctga tctat 45
<210> 196
<211> 32
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 196
Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr
1 5 10 15
Phe Thr Ile Ser Ser Leu Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys
20 25 30
<210> 197
<211> 96
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 197
ggggtcccct cgaggttcag tggcagtgga tctgggacag atttcacctt taccatcagt 60
agcctggaag ctgaagatgc tgcaacatat tactgt 96
<210> 198
<211> 96
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 198
ggcgtgccct ctagattctc cggctccggc tctggcaccg actttacctt caccatctcc 60
agcctggaag ccgaggacgc cgccacctac tactgc 96
<210> 199
<211> 96
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 199
ggcgtgccct ctaggtttag cggtagcggt agtggcaccg acttcacctt cactatctct 60
agcctggaag ccgaggacgc cgctacctac tactgt 96
<210> 200
<211> 32
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 200
Gly Ile Pro Pro Arg Phe Ser Gly Ser Gly Tyr Gly Thr Asp Phe Thr
1 5 10 15
Leu Thr Ile Asn Asn Ile Glu Ser Glu Asp Ala Ala Tyr Tyr Phe Cys
20 25 30
<210> 201
<211> 96
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 201
gggatcccac ctcgattcag tggcagcggg tatggaacag attttaccct cacaattaat 60
aacatagaat ctgaggatgc tgcatattac ttctgt 96
<210> 202
<211> 32
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 202
Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Glu Phe Thr
1 5 10 15
Leu Thr Ile Ser Ser Leu Gln Pro Asp Asp Phe Ala Thr Tyr Tyr Cys
20 25 30
<210> 203
<211> 96
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 203
ggggtcccat caaggttcag cggcagtgga tctgggacag aattcactct caccatcagc 60
agcctgcagc ctgatgattt tgcaacttat tactgt 96
<210> 204
<211> 96
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 204
ggcgtgccct ctagattctc cggctccggc tctggcaccg agtttaccct gaccatctcc 60
agcctgcagc ccgacgactt cgccacctac tactgc 96
<210> 205
<211> 32
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 205
Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr
1 5 10 15
Phe Thr Ile Ser Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Tyr Cys
20 25 30
<210> 206
<211> 96
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 206
ggggtcccat caaggttcag tggaagtgga tctgggacag attttacttt caccatcagc 60
agcctgcagc ctgaagatat tgcaacatat tactgt 96
<210> 207
<211> 96
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 207
ggcgtgccct ctaggtttag cggtagcggt agtggcaccg acttcacctt cactatctct 60
agcctgcagc ccgaggatat cgctacctac tactgt 96
<210> 208
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 208
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
1 5 10
<210> 209
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 209
ttcggccaag ggaccaaggt ggaaatcaaa 30
<210> 210
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 210
ttcggccagg gcaccaaggt ggaaatcaag 30
<210> 211
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 211
ttcggtcaag gcactaaggt cgagattaag 30
<210> 212
<211> 327
<212> Белок
<213> Homo sapiens
<400> 212
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
100 105 110
Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
165 170 175
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
305 310 315 320
Leu Ser Leu Ser Leu Gly Lys
325
<210> 213
<211> 107
<212> Белок
<213> Homo sapiens
<400> 213
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
1 5 10 15
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
20 25 30
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
35 40 45
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
50 55 60
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
65 70 75 80
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
85 90 95
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 214
<211> 326
<212> Белок
<213> Homo sapiens
<400> 214
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
100 105 110
Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
165 170 175
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
305 310 315 320
Leu Ser Leu Ser Leu Gly
325
<210> 215
<211> 330
<212> Белок
<213> Homo sapiens
<400> 215
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu
225 230 235 240
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330
<210> 216
<211> 330
<212> Белок
<213> Homo sapiens
<400> 216
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Ala Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu
225 230 235 240
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330
<210> 217
<211> 330
<212> Белок
<213> Homo sapiens
<400> 217
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Ala Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Ala Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu
225 230 235 240
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330
<210> 218
<211> 330
<212> Белок
<213> Homo sapiens
<400> 218
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Ala Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu
225 230 235 240
Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330
<210> 219
<211> 19
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 219
Met Glu Trp Ser Trp Val Phe Leu Phe Phe Leu Ser Val Thr Thr Gly
1 5 10 15
Val His Ser
<210> 220
<211> 20
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 220
Met Ser Val Pro Thr Gln Val Leu Gly Leu Leu Leu Leu Trp Leu Thr
1 5 10 15
Asp Ala Arg Cys
20
<210> 221
<211> 19
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 221
Met Ala Trp Val Trp Thr Leu Pro Phe Leu Met Ala Ala Ala Gln Ser
1 5 10 15
Val Gln Ala
<210> 222
<211> 20
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 222
Met Ser Val Leu Thr Gln Val Leu Ala Leu Leu Leu Leu Trp Leu Thr
1 5 10 15
Gly Thr Arg Cys
20
<210> 223
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 223
tggactactg ggacgggagc ttac 24
<210> 224
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 224
Gly Tyr Thr Phe Thr Thr Tyr Trp Met His
1 5 10
<210> 225
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 225
Cys Asn Gly Arg Cys
1 5
<210> 226
<400> 226
000
<210> 227
<400> 227
000
<210> 228
<211> 134
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 228
Gln Val Gln Leu Gln Gln Pro Gly Ser Glu Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Met His Trp Val Arg Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Tyr Pro Gly Thr Gly Gly Ser Asn Phe Asp Glu Lys Phe
50 55 60
Lys Asn Arg Thr Ser Leu Thr Val Asp Thr Ser Ser Thr Thr Ala Tyr
65 70 75 80
Met His Leu Ala Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Trp Thr Thr Gly Thr Gly Ala Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ala Ala Lys Thr Thr Pro Pro Ser Val Tyr Pro Leu
115 120 125
Ala Pro Gly Ser Ala Ala
130
<210> 229
<211> 116
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 229
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Ala Gly
1 5 10 15
Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Gly Asn Gln Lys Asn Phe Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Phe Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Val Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Cys Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile
100 105 110
Lys Arg Ala Asp
115
<210> 230
<211> 98
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 230
Gln Val Gln Leu Gln Gln Pro Gly Ser Glu Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met His Trp Val Lys Gln Arg His Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asn Ile Tyr Pro Gly Ser Gly Ser Thr Asn Tyr Asp Glu Lys Phe
50 55 60
Lys Ser Lys Gly Thr Leu Thr Val Asp Thr Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met His Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg
<210> 231
<211> 101
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 231
Asp Ile Val Met Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Ala Gly
1 5 10 15
Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
20 25 30
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
65 70 75 80
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro
100
<210> 232
<211> 37
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<220>
<221> CDS
<222> (2)..(37)
<400> 232
g tgc acg ttc gga ggg ggg acc aag ctg gaa ata aaa 37
Cys Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
1 5 10
<210> 233
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 233
Cys Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
1 5 10
<210> 234
<211> 38
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<220>
<221> CDS
<222> (2)..(37)
<400> 234
g tac acg ttc gga ggg ggg acc aag ctg gaa ata aaa c 38
Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
1 5 10
<210> 235
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 235
Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
1 5 10
<210> 236
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 236
Met Tyr Pro Pro Tyr
1 5
<210> 237
<211> 4
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 237
Arg Gly Asp Ser
1
<210> 238
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 238
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Ser Ser Asn
20 25 30
Val Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Val Ile Pro Ile Val Asp Ile Ala Asn Tyr Ala Gln Arg Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Thr Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ser Thr Leu Gly Leu Val Leu Asp Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro
210 215 220
Pro Cys Pro Ser Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
260 265 270
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440 445
<210> 239
<211> 215
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 239
Glu Thr Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Leu Gly Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Pro Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Ala Asp Ser Pro
85 90 95
Ile Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys Arg Thr Val Ala
100 105 110
Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser
115 120 125
Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu
130 135 140
Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser
145 150 155 160
Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu
165 170 175
Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val
180 185 190
Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys
195 200 205
Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 240
<211> 121
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 240
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Ile Pro Ile Phe Gly Thr Ala Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Leu Trp Glu Val Arg Ala Leu Pro Ser Val Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 241
<211> 109
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 241
Ser Tyr Glu Leu Thr Gln Pro Pro Ser Val Ser Val Ala Pro Gly Gln
1 5 10 15
Thr Ala Arg Ile Thr Cys Gly Ala Asn Asp Ile Gly Ser Lys Ser Val
20 25 30
His Trp Tyr Gln Gln Lys Ala Gly Gln Ala Pro Val Leu Val Val Ser
35 40 45
Glu Asp Ile Ile Arg Pro Ser Gly Ile Pro Glu Arg Ile Ser Gly Ser
50 55 60
Asn Ser Gly Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Ala Gly
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Gln Val Trp Asp Arg Asp Ser Asp Gln
85 90 95
Tyr Val Phe Gly Thr Gly Thr Lys Val Thr Val Leu Gly
100 105
<210> 242
<211> 440
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 242
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Asp Cys Lys Ala Ser Gly Ile Thr Phe Ser Asn Ser
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Asn Asp Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser
115 120 125
Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr
165 170 175
Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys
180 185 190
Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp
195 200 205
Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala
210 215 220
Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
225 230 235 240
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
245 250 255
Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val
260 265 270
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
275 280 285
Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
290 295 300
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly
305 310 315 320
Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
325 330 335
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr
340 345 350
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
355 360 365
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
370 375 380
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
385 390 395 400
Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe
405 410 415
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
420 425 430
Ser Leu Ser Leu Ser Leu Gly Lys
435 440
<210> 243
<211> 214
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 243
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ser Ser Asn Trp Pro Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 244
<211> 447
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 244
Gln Val Gln Leu Val Gln Ser Gly Val Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Met Tyr Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Asn Pro Ser Asn Gly Gly Thr Asn Phe Asn Glu Lys Phe
50 55 60
Lys Asn Arg Val Thr Leu Thr Thr Asp Ser Ser Thr Thr Thr Ala Tyr
65 70 75 80
Met Glu Leu Lys Ser Leu Gln Phe Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Asp Tyr Arg Phe Asp Met Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro
210 215 220
Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
260 265 270
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440 445
<210> 245
<211> 218
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 245
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Lys Gly Val Ser Thr Ser
20 25 30
Gly Tyr Ser Tyr Leu His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro
35 40 45
Arg Leu Leu Ile Tyr Leu Ala Ser Tyr Leu Glu Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln His Ser Arg
85 90 95
Asp Leu Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 246
<211> 118
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 246
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ile Met Met Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Tyr Pro Ser Gly Gly Ile Thr Phe Tyr Ala Asp Lys Gly
50 55 60
Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln
65 70 75 80
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg
85 90 95
Ile Lys Leu Gly Thr Val Thr Thr Val Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 247
<211> 110
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 247
Gln Ser Ala Leu Thr Gln Pro Ala Ser Val Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Ile Thr Ile Ser Cys Thr Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Gly Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Asp Val Ser Asn Arg Pro Ser Gly Val Ser Asn Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Ile Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Thr Ser Ser
85 90 95
Ser Thr Arg Val Phe Gly Thr Gly Thr Lys Val Thr Val Leu
100 105 110
<210> 248
<211> 253
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 248
Met Ala Pro Arg Arg Ala Arg Gly Cys Arg Thr Leu Gly Leu Pro Ala
1 5 10 15
Leu Leu Leu Leu Leu Leu Leu Arg Pro Pro Ala Thr Arg Gly Asp Tyr
20 25 30
Lys Asp Asp Asp Asp Lys Ile Glu Gly Arg Ile Thr Cys Pro Pro Pro
35 40 45
Met Ser Val Glu His Ala Asp Ile Trp Val Lys Ser Tyr Ser Leu Tyr
50 55 60
Ser Arg Glu Arg Tyr Ile Cys Asn Ser Gly Phe Lys Arg Lys Ala Gly
65 70 75 80
Thr Ser Ser Leu Thr Glu Cys Val Leu Asn Lys Ala Thr Asn Val Ala
85 90 95
His Trp Thr Thr Pro Ser Leu Lys Cys Ile Arg Asp Pro Ala Leu Val
100 105 110
His Gln Arg Pro Ala Pro Pro Ser Gly Gly Ser Gly Gly Gly Gly Ser
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Leu Gln Asn Trp Val Asn Val
130 135 140
Ile Ser Asp Leu Lys Lys Ile Glu Asp Leu Ile Gln Ser Met His Ile
145 150 155 160
Asp Ala Thr Leu Tyr Thr Glu Ser Asp Val His Pro Ser Cys Lys Val
165 170 175
Thr Ala Met Lys Cys Phe Leu Leu Glu Leu Gln Val Ile Ser Leu Glu
180 185 190
Ser Gly Asp Ala Ser Ile His Asp Thr Val Glu Asn Leu Ile Ile Leu
195 200 205
Ala Asn Asn Ser Leu Ser Ser Asn Gly Asn Val Thr Glu Ser Gly Cys
210 215 220
Lys Glu Cys Glu Glu Leu Glu Glu Lys Asn Ile Lys Glu Phe Leu Gln
225 230 235 240
Ser Phe Val His Ile Val Gln Met Phe Ile Asn Thr Ser
245 250
<210> 249
<211> 263
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 249
Met Asp Ser Lys Gly Ser Ser Gln Lys Ala Gly Ser Arg Leu Leu Leu
1 5 10 15
Leu Leu Val Val Ser Asn Leu Leu Leu Cys Gln Gly Val Val Ser Thr
20 25 30
Thr Arg Asp Tyr Lys Asp Asp Asp Asp Lys Ile Glu Gly Arg Asn Trp
35 40 45
Val Asn Val Ile Ser Asp Leu Lys Lys Ile Glu Asp Leu Ile Gln Ser
50 55 60
Met His Ile Asp Ala Thr Leu Tyr Thr Glu Ser Asp Val His Pro Ser
65 70 75 80
Cys Lys Val Thr Ala Met Lys Cys Phe Leu Leu Glu Leu Gln Val Ile
85 90 95
Ser Leu Glu Ser Gly Asp Ala Ser Ile His Asp Thr Val Glu Asn Leu
100 105 110
Ile Ile Leu Ala Asn Asn Ser Leu Ser Ser Asn Gly Asn Val Thr Glu
115 120 125
Ser Gly Cys Lys Glu Cys Glu Glu Leu Glu Glu Lys Asn Ile Lys Glu
130 135 140
Phe Leu Gln Ser Phe Val His Ile Val Gln Met Phe Ile Asn Thr Ser
145 150 155 160
Ser Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
165 170 175
Gly Gly Gly Ser Gly Gly Gly Ser Leu Gln Ile Thr Cys Pro Pro Pro
180 185 190
Met Ser Val Glu His Ala Asp Ile Trp Val Lys Ser Tyr Ser Leu Tyr
195 200 205
Ser Arg Glu Arg Tyr Ile Cys Asn Ser Gly Phe Lys Arg Lys Ala Gly
210 215 220
Thr Ser Ser Leu Thr Glu Cys Val Leu Asn Lys Ala Thr Asn Val Ala
225 230 235 240
His Trp Thr Thr Pro Ser Leu Lys Cys Ile Arg Asp Pro Ala Leu Val
245 250 255
His Gln Arg Pro Ala Pro Pro
260
<210> 250
<211> 117
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 250
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Gly Ser Tyr Gly Gly Gly Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Tyr Val Asn Phe Gly Met Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 251
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 251
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Gly Arg Asn Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 252
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 252
Gly Phe Thr Phe Ser Ser Tyr Ala
1 5
<210> 253
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 253
Ile Gly Ser Tyr Gly Gly Gly Thr
1 5
<210> 254
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 254
Ala Arg Tyr Val Asn Phe Gly Met Asp Tyr
1 5 10
<210> 255
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 255
Gln Ser Ile Ser Ser Tyr
1 5
<210> 256
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 256
Ala Ala Ser
1
<210> 257
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 257
Gln Gln Tyr Gly Arg Asn Pro Pro Thr
1 5
<210> 258
<211> 116
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 258
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Val Trp Gly Phe Asp Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser
115
<210> 259
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 259
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile Ser Ser Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Gly Val Tyr Pro Phe
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 260
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 260
Ile Ser Gly Ser Gly Gly Ser Thr
1 5
<210> 261
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 261
Ala Arg Arg Val Trp Gly Phe Asp Tyr
1 5
<210> 262
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 262
Gln Gln Tyr Gly Val Tyr Pro Phe Thr
1 5
<210> 263
<211> 128
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<220>
<221> МОД_ОСТ
<222> (120)..(120)
<223> Любая аминокислота
<220>
<221> МОД_ОСТ
<222> (124)..(125)
<223> Любая аминокислота
<400> 263
Glu Val Arg Leu Gln Gln Ser Gly Ala Asp Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Ala Ser Gly Phe Ile Ile Lys Ala Thr Tyr
20 25 30
Met His Trp Val Arg Gln Arg Pro Glu Gln Gly Leu Glu Trp Ile Gly
35 40 45
Arg Ile Asp Pro Ala Asn Gly Glu Lys Tyr Asp Pro Lys Phe Gln Val
50 55 60
Lys Ala Ile Thr Ala Asp Thr Ser Ser Ser Thr Ala Tyr Leu Gln Leu
65 70 75 80
Asn Ser Leu Thr Ser Asp Asp Thr Ala Val Tyr Tyr Cys Ala Arg Tyr
85 90 95
Ala Trp Tyr Phe Asp Val Trp Gly Ala Gly Thr Thr Val Thr Val Ser
100 105 110
Ser Ala Lys Thr Thr Pro Pro Xaa Val Tyr Pro Xaa Xaa Pro Gly Ser
115 120 125
<210> 264
<211> 127
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 264
Asp Ile Gln Met Thr Gln Ser Pro Ala Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Thr Val Thr Ile Thr Cys Arg Ala Ser Glu Asn Ile Tyr Ser Phe
20 25 30
Leu Ala Trp Tyr His Gln Lys Gln Gly Arg Ser Pro Gln Leu Leu Val
35 40 45
Tyr His Ala Lys Thr Leu Ala Glu Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Gln Phe Ser Leu Lys Ile Asn Ser Leu Gln Ala
65 70 75 80
Glu Asp Phe Gly Ser Tyr Tyr Cys Gln His Tyr Tyr Gly Ser Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Val Lys Arg Ala Asp Ala Ala
100 105 110
Pro Thr Val Ser Ile Phe Pro Pro Ser Ser Glu Glu Leu Ser Leu
115 120 125
<210> 265
<211> 10
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 265
Gly Phe Ile Ile Lys Ala Thr Tyr Met His
1 5 10
<210> 266
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 266
Arg Ile Asp Pro Ala Asn Gly Glu Thr Lys Tyr Asp Pro Lys Phe Gln
1 5 10 15
Val
<210> 267
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 267
Tyr Ala Trp Tyr Phe Asp Val
1 5
<210> 268
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 268
Arg Ala Ser Glu Asn Ile Tyr Ser Phe Leu Ala
1 5 10
<210> 269
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 269
His Ala Lys Thr Leu Ala Glu
1 5
<210> 270
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 270
Gln His Tyr Tyr Gly Ser Pro Leu Thr
1 5
<210> 271
<211> 127
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 271
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Ala Ile Asn Gln Asp Gly Ser Glu Lys Tyr Tyr Val Gly Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Val Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Arg Asp Tyr Tyr Asp Ile Leu Thr Asp Tyr Tyr Ile His Tyr Trp
100 105 110
Tyr Phe Asp Leu Trp Gly Arg Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 272
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 272
Asn Tyr Trp Met Asn
1 5
<210> 273
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 273
Ala Ile Asn Gln Asp Gly Ser Glu Lys Tyr Tyr Val Gly Ser Val Lys
1 5 10 15
Gly
<210> 274
<211> 18
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 274
Asp Tyr Tyr Asp Ile Leu Thr Asp Tyr Tyr Ile His Tyr Trp Tyr Phe
1 5 10 15
Asp Leu
<210> 275
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 275
Arg Ala Ser Gln Ser Val Ser Ser Ser Tyr Leu Ala
1 5 10
<210> 276
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 276
Gly Ala Ser Ser Arg Ala Thr
1 5
<210> 277
<211> 446
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 277
Glu Val Gln Leu Val Glu Ser Gly Gly Asp Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Asn Ile Lys Gln Asp Gly Ser Glu Lys Tyr Tyr Val Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Arg Gly Ser Leu Tyr Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu
130 135 140
Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
145 150 155 160
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
165 170 175
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu
180 185 190
Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr
195 200 205
Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr
210 215 220
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
225 230 235 240
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
245 250 255
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
260 265 270
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
275 280 285
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
305 310 315 320
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
325 330 335
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
340 345 350
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
355 360 365
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
370 375 380
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
385 390 395 400
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
405 410 415
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
420 425 430
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 278
<211> 214
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 278
Ala Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Pro Ser Gln Gly Ile Asn Trp Glu
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Ser Leu Glu Gln Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Phe Asn Ser Tyr Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 279
<211> 119
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 279
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ser Phe Thr Asp Tyr
20 25 30
His Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Val Ile Asn Pro Met Tyr Gly Thr Thr Asp Tyr Asn Gln Arg Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Tyr Asp Tyr Phe Thr Gly Thr Gly Val Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 280
<211> 112
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 280
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Arg Ser Leu Val His Ser
20 25 30
Arg Gly Asn Thr Tyr Leu His Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ile Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Ser Gln Ser
85 90 95
Thr His Leu Pro Phe Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 281
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 281
Arg Tyr Gly Ile Ser
1 5
<210> 282
<211> 17
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 282
Trp Ile Ser Thr Tyr Ser Gly Asn Thr Asn Tyr Ala Gln Lys Leu Gln
1 5 10 15
Gly
<210> 283
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 283
Arg Gln Leu Tyr Phe Asp Tyr
1 5
<210> 284
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 284
Arg Ala Ser Gln Ser Val Ser Ser Asn Leu Ala
1 5 10
<210> 285
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 285
Asp Ala Ser Thr Arg Ala Thr
1 5
<210> 286
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 286
Gln Gln Tyr Asp Asn Trp Pro Leu Thr
1 5
<210> 287
<211> 137
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 287
Met Glu Phe Gly Leu Ser Trp Val Phe Leu Val Ala Leu Leu Arg Gly
1 5 10 15
Val Gln Cys Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln
20 25 30
Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe
35 40 45
Ser Val Tyr Gly Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
50 55 60
Glu Trp Val Ala Ile Ile Trp Tyr Asp Gly Asp Asn Gln Tyr Tyr Ala
65 70 75 80
Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn
85 90 95
Thr Leu Tyr Leu Gln Met Asn Gly Leu Arg Ala Glu Asp Thr Ala Val
100 105 110
Tyr Tyr Cys Ala Arg Asp Leu Arg Thr Gly Pro Phe Asp Tyr Trp Gly
115 120 125
Gln Gly Thr Leu Val Thr Val Ser Ser
130 135
<210> 288
<211> 126
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 288
Met Leu Pro Ser Gln Leu Ile Gly Phe Leu Leu Leu Trp Val Pro Ala
1 5 10 15
Ser Arg Gly Glu Ile Val Leu Thr Gln Ser Pro Asp Phe Gln Ser Val
20 25 30
Thr Pro Lys Glu Lys Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Ile
35 40 45
Gly Ser Ser Leu His Trp Tyr Gln Gln Lys Pro Asp Gln Ser Pro Lys
50 55 60
Leu Leu Ile Lys Tyr Ala Ser Gln Ser Phe Ser Gly Val Pro Ser Arg
65 70 75 80
Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Asn Ser
85 90 95
Leu Glu Ala Glu Asp Ala Ala Ala Tyr Tyr Cys His Gln Ser Ser Ser
100 105 110
Leu Pro Phe Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys
115 120 125
<210> 289
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 289
Gly Asp Ser Val Ser Ser Asn Ser Ala Ala Trp Gly
1 5 10
<210> 290
<211> 18
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 290
Arg Ile Tyr Tyr Arg Ser Lys Trp Tyr Asn Ser Tyr Ala Val Ser Val
1 5 10 15
Lys Ser
<210> 291
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 291
Arg Ala Ser Gln Phe Ile Ser Ser Ser Tyr Leu Ser
1 5 10
<210> 292
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 292
Leu Leu Ile Tyr Gly Ser Ser Ser Arg Ala Thr
1 5 10
<210> 293
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 293
Gln Gln Leu Tyr Ser Ser Pro Met
1 5
<210> 294
<211> 124
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 294
Gln Val Gln Leu Gln Gln Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Ser Gly Asp Ser Val Ser Ser Asn
20 25 30
Ser Ala Ala Trp Gly Trp Ile Arg Gln Ser Pro Gly Arg Gly Leu Glu
35 40 45
Trp Leu Gly Arg Ile Tyr Tyr Arg Ser Lys Trp Tyr Asn Ser Tyr Ala
50 55 60
Val Ser Val Lys Ser Arg Ile Thr Ile Asn Pro Asp Thr Ser Lys Asn
65 70 75 80
Gln Phe Ser Leu Gln Leu Asn Ser Val Thr Pro Glu Asp Thr Ala Val
85 90 95
Tyr Tyr Cys Ala Arg Tyr Asp Trp Val Pro Lys Ile Gly Val Phe Asp
100 105 110
Ser Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 295
<211> 110
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 295
Asp Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Phe Ile Ser Ser Ser
20 25 30
Tyr Leu Ser Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ser Ser Ser Arg Ala Thr Gly Val Pro Ala Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Leu Tyr Ser Ser Pro
85 90 95
Met Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr
100 105 110
<210> 296
<211> 454
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 296
Gln Val Gln Leu Gln Gln Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Ser Gly Asp Ser Val Ser Ser Asn
20 25 30
Ser Ala Ala Trp Gly Trp Ile Arg Gln Ser Pro Gly Arg Gly Leu Glu
35 40 45
Trp Leu Gly Arg Ile Tyr Tyr Arg Ser Lys Trp Tyr Asn Ser Tyr Ala
50 55 60
Val Ser Val Lys Ser Arg Ile Thr Ile Asn Pro Asp Thr Ser Lys Asn
65 70 75 80
Gln Phe Ser Leu Gln Leu Asn Ser Val Thr Pro Glu Asp Thr Ala Val
85 90 95
Tyr Tyr Cys Ala Arg Tyr Asp Trp Val Pro Lys Ile Gly Val Phe Asp
100 105 110
Ser Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys
115 120 125
Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly
130 135 140
Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro
145 150 155 160
Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr
165 170 175
Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val
180 185 190
Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn
195 200 205
Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro
210 215 220
Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
225 230 235 240
Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
245 250 255
Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
260 265 270
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
275 280 285
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn
290 295 300
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
305 310 315 320
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
325 330 335
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
340 345 350
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn
355 360 365
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
370 375 380
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
385 390 395 400
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
405 410 415
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
420 425 430
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
435 440 445
Ser Leu Ser Pro Gly Lys
450
<210> 297
<211> 215
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 297
Asp Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Phe Ile Ser Ser Ser
20 25 30
Tyr Leu Ser Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ser Ser Ser Arg Ala Thr Gly Val Pro Ala Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Leu Tyr Ser Ser Pro
85 90 95
Met Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala
100 105 110
Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser
115 120 125
Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu
130 135 140
Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser
145 150 155 160
Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu
165 170 175
Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val
180 185 190
Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys
195 200 205
Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 298
<211> 109
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 298
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Ser Ser Pro
85 90 95
Cys Thr Phe Gly Gln Gly Thr Arg Leu Glu Ile Lys Arg
100 105
<210> 299
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 299
Gln Gln Tyr Gly Ser Ser Pro Cys Thr
1 5
<210> 300
<211> 12
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 300
Tyr Asp Trp Val Pro Lys Ile Gly Val Phe Asp Ser
1 5 10
<210> 301
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 301
Gly Phe Ser Leu Ser Ser Tyr
1 5
<210> 302
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 302
Trp Gly Gly Gly Gly
1 5
<210> 303
<211> 13
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 303
His Ala Tyr Gly His Asp Gly Gly Phe Ala Met Asp Tyr
1 5 10
<210> 304
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 304
Ser Glu Ser Val Ser Ser Asn
1 5
<210> 305
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 305
Gly Ala Ser
1
<210> 306
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 306
Ser Tyr Ser Tyr Pro Phe
1 5
<210> 307
<211> 5
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 307
Ser Tyr Gly Val Asp
1 5
<210> 308
<211> 16
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 308
Val Ile Trp Gly Gly Gly Gly Thr Tyr Tyr Ala Ser Ser Leu Met Gly
1 5 10 15
<210> 309
<211> 11
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 309
Arg Ala Ser Glu Ser Val Ser Ser Asn Val Ala
1 5 10
<210> 310
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 310
Gly Ala Ser Asn Arg Ala Thr
1 5
<210> 311
<211> 9
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 311
Gly Gln Ser Tyr Ser Tyr Pro Phe Thr
1 5
<210> 312
<211> 121
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 312
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Ser Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Leu Ser Ser Tyr
20 25 30
Gly Val Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Val Ile Trp Gly Gly Gly Gly Thr Tyr Tyr Ala Ser Ser Leu Met
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg His Ala Tyr Gly His Asp Gly Gly Phe Ala Met Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 313
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 313
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Glu Ser Val Ser Ser Asn
20 25 30
Val Ala Trp Tyr Gln Gln Arg Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gly Gln Ser Tyr Ser Tyr Pro Phe
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 314
<211> 451
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 314
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Ser Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Leu Ser Ser Tyr
20 25 30
Gly Val Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Val Ile Trp Gly Gly Gly Gly Thr Tyr Tyr Ala Ser Ser Leu Met
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg His Ala Tyr Gly His Asp Gly Gly Phe Ala Met Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
355 360 365
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly Lys
450
<210> 315
<211> 214
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 315
Glu Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Glu Ser Val Ser Ser Asn
20 25 30
Val Ala Trp Tyr Gln Gln Arg Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Gly Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gly Gln Ser Tyr Ser Tyr Pro Phe
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 316
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 316
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Val Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Tyr Trp Val Arg Gln Ala Arg Gly Gln Arg Leu Glu Trp Ile
35 40 45
Gly Arg Ile Asp Pro Asn Ser Gly Ser Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Asn Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Tyr Arg Lys Gly Leu Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 317
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 317
Ala Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Gly Thr Ala
20 25 30
Val Ala Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile
35 40 45
Tyr Trp Ala Ser Thr Arg His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Glu Ala
65 70 75 80
Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Ser Tyr Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 318
<211> 120
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 318
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Val Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Tyr Trp Val Arg Gln Ala Thr Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Asp Pro Asn Ser Gly Ser Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Asn Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Tyr Arg Lys Gly Leu Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 319
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 319
Asp Val Val Met Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Lys Ala Ser Gln Asp Val Gly Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Trp Ala Ser Thr Arg His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Ser Tyr Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 320
<211> 125
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 320
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Phe Thr Leu Thr Asn Tyr
20 25 30
Gly Met Asn Trp Val Arg Gln Ala Arg Gly Gln Arg Leu Glu Trp Ile
35 40 45
Gly Trp Ile Asn Thr Asp Thr Gly Glu Pro Thr Tyr Ala Asp Asp Phe
50 55 60
Lys Gly Arg Phe Val Phe Ser Leu Asp Thr Ser Val Ser Thr Ala Tyr
65 70 75 80
Leu Gln Ile Ser Ser Leu Lys Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Pro Pro Tyr Tyr Tyr Gly Thr Asn Asn Ala Glu Ala Met
100 105 110
Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 321
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 321
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Ser Ser Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Thr Leu His Leu Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Tyr Asn Leu Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 322
<211> 125
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 322
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Phe Thr Leu Thr Asn Tyr
20 25 30
Gly Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Thr Asp Thr Gly Glu Pro Thr Tyr Ala Asp Asp Phe
50 55 60
Lys Gly Arg Phe Val Phe Ser Leu Asp Thr Ser Val Ser Thr Ala Tyr
65 70 75 80
Leu Gln Ile Ser Ser Leu Lys Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asn Pro Pro Tyr Tyr Tyr Gly Thr Asn Asn Ala Glu Ala Met
100 105 110
Asp Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 323
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 323
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Ser Ser Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Thr Leu His Leu Gly Ile Pro Pro Arg Phe Ser Gly
50 55 60
Ser Gly Tyr Gly Thr Asp Phe Thr Leu Thr Ile Asn Asn Ile Glu Ser
65 70 75 80
Glu Asp Ala Ala Tyr Tyr Phe Cys Gln Gln Tyr Tyr Asn Leu Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 324
<211> 118
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 324
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Asn Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Ile Tyr Pro Gly Gln Gly Asp Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Ala Thr Met Thr Ala Asp Lys Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Val Gly Gly Ala Phe Pro Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 325
<211> 111
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 325
Asp Ile Val Leu Thr Gln Ser Pro Asp Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Glu Arg Ala Thr Ile Asn Cys Arg Ala Ser Glu Ser Val Glu Tyr Tyr
20 25 30
Gly Thr Ser Leu Met Gln Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Ala Ala Ser Asn Val Glu Ser Gly Val Pro Asp
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Ala Glu Asp Val Ala Val Tyr Tyr Cys Gln Gln Ser Arg
85 90 95
Lys Asp Pro Ser Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 326
<211> 118
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 326
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Asn Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Asp Ile Tyr Pro Gly Asn Gly Asp Thr Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Val Gly Gly Ala Phe Pro Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser
115
<210> 327
<211> 111
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 327
Ala Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Glu Ser Val Glu Tyr Tyr
20 25 30
Gly Thr Ser Leu Met Gln Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro
35 40 45
Lys Leu Leu Ile Tyr Ala Ala Ser Asn Val Glu Ser Gly Val Pro Ser
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Phe Cys Gln Gln Ser Arg
85 90 95
Lys Asp Pro Ser Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ВИДЫ КОМБИНИРОВАННОЙ ТЕРАПИИ С ИСПОЛЬЗОВАНИЕМ ХИМЕРНЫХ АНТИГЕННЫХ РЕЦЕПТОРОВ И ИНГИБИТОРОВ PD-1 | 2017 |
|
RU2809160C2 |
| 5-БРОМ-2,6-ДИ-(1Н-ПИРАЗОЛ-1-ИЛ)ПИРИМИДИН-4-АМИН ДЛЯ ПРИМЕНЕНИЯ В ЛЕЧЕНИИ РАКА | 2016 |
|
RU2745560C2 |
| РЕЖИМ ВВЕДЕНИЯ ДОЗ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЯ, МОДУЛИРУЕМОГО CSF-1R | 2021 |
|
RU2835316C1 |
| НОВАЯ КОМБИНАЦИЯ ДЛЯ ПРИМЕНЕНИЯ ПРИ ЛЕЧЕНИИ ЗЛОКАЧЕСТВЕННОГО НОВООБРАЗОВАНИЯ | 2016 |
|
RU2742494C2 |
| РЕЖИМ ДОЗИРОВАНИЯ ИНГИБИТОРА WNT И МОЛЕКУЛЫ АНТИТЕЛА К PD-1 В КОМБИНАЦИИ | 2018 |
|
RU2767533C2 |
| МОЛЕКУЛЫ АНТИТЕЛ К CD73 И ПУТИ ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2791192C2 |
| РЕЖИМЫ ДОЗИРОВАНИЯ АНТИТЕЛ АНТИ-LAG-3 И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2801208C2 |
| 1-(4-АМИНО-5-БРОМ-6-(1H-ПИРАЗОЛ-1-ИЛ)ПИРИМИДИН-2-ИЛ)-1H-ПИРАЗОЛ-4-ОЛ И ЕГО ПРИМЕНЕНИЕ В ЛЕЧЕНИИ РАКА | 2018 |
|
RU2791531C2 |
| ИНГИБИТОРЫ FGFR2 ОТДЕЛЬНО ИЛИ В КОМБИНАЦИИ С ИММУНОСТИМУЛИРУЮЩИМИ АГЕНТАМИ В ЛЕЧЕНИИ РАКА | 2016 |
|
RU2745707C2 |
| ИНГИБИТОРЫ FGFR2 ОТДЕЛЬНО ИЛИ В КОМБИНАЦИИ С ИММУНОСТИМУЛИРУЮЩИМИ АГЕНТАМИ В ЛЕЧЕНИИ РАКА | 2016 |
|
RU2834309C2 |


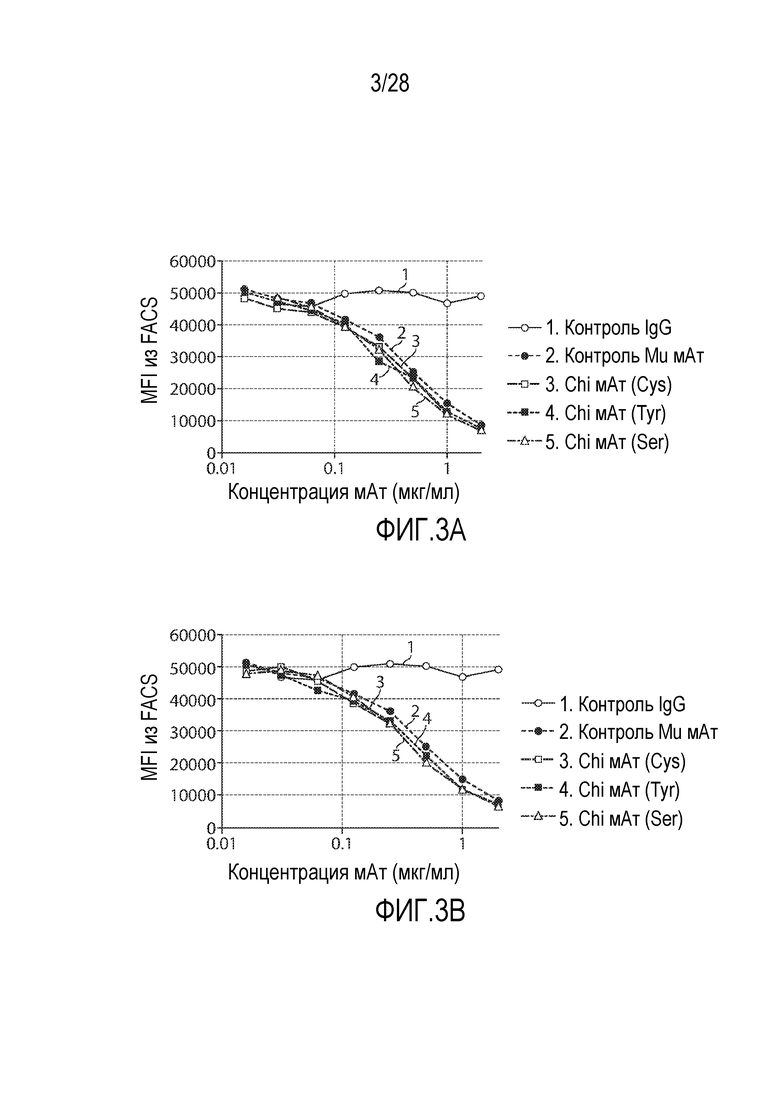

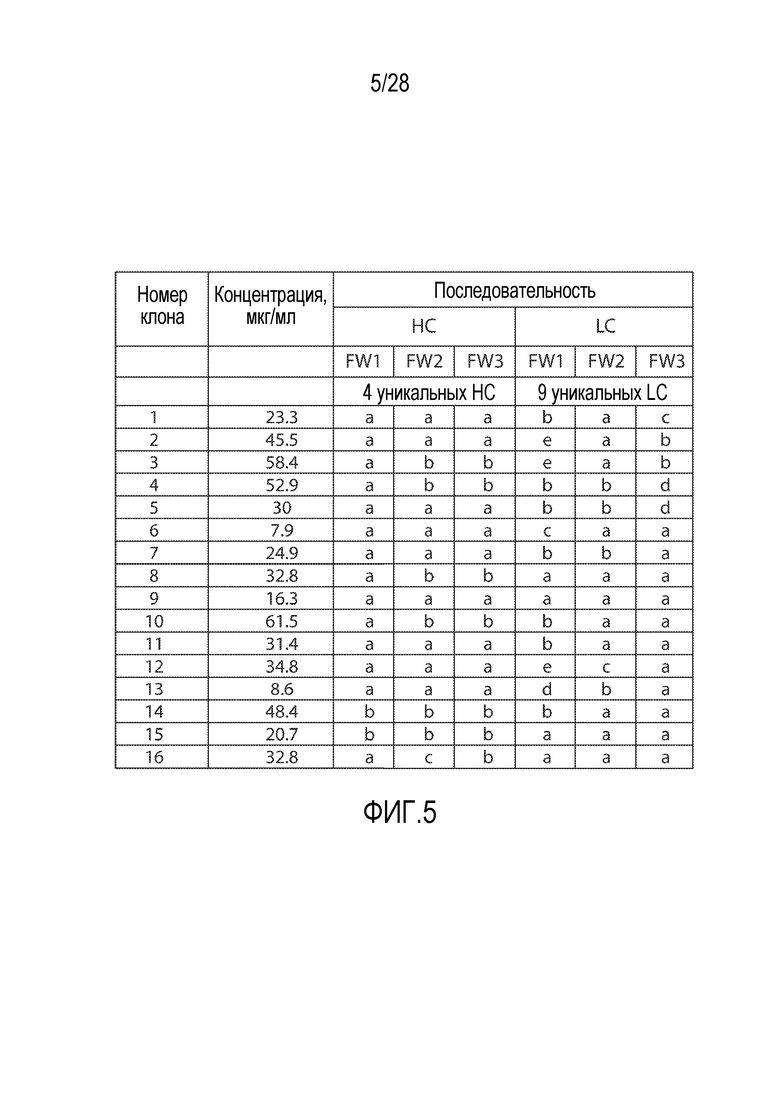


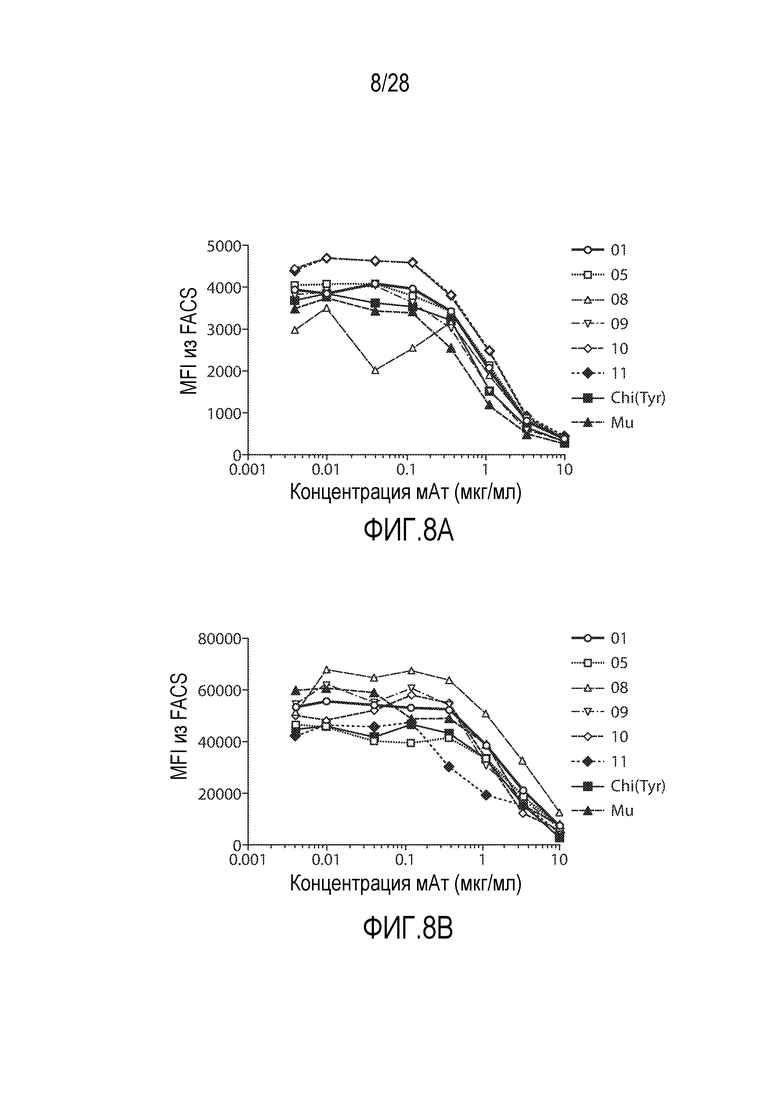





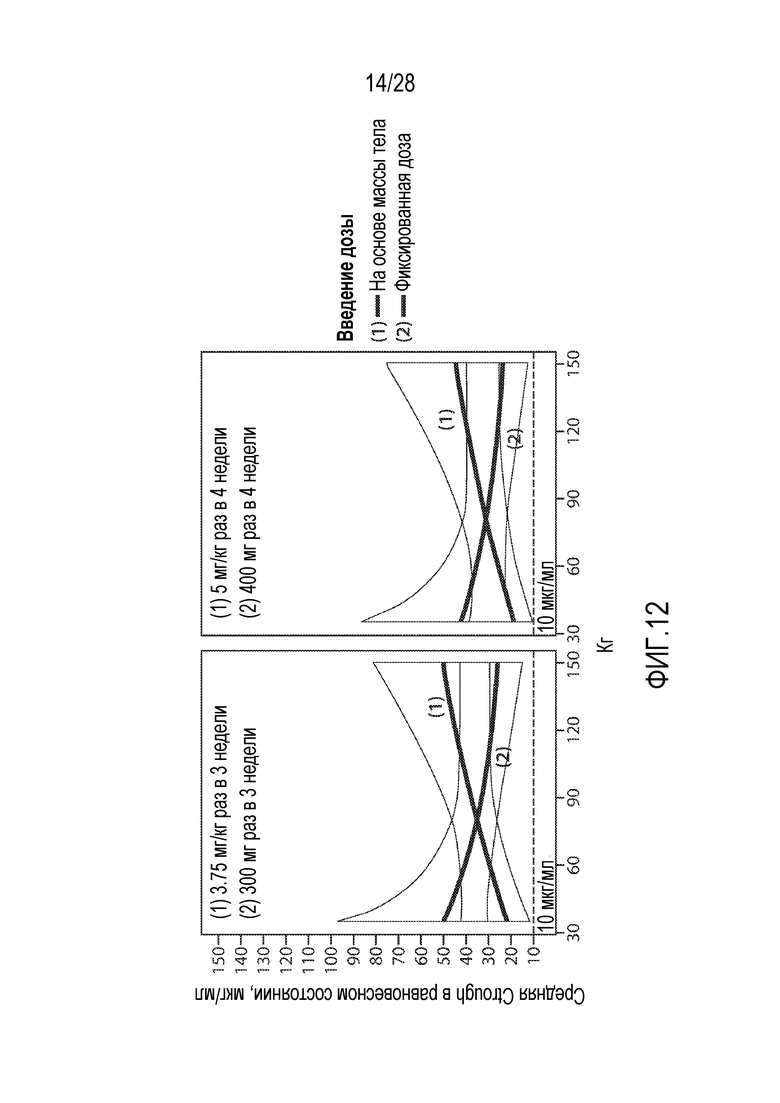
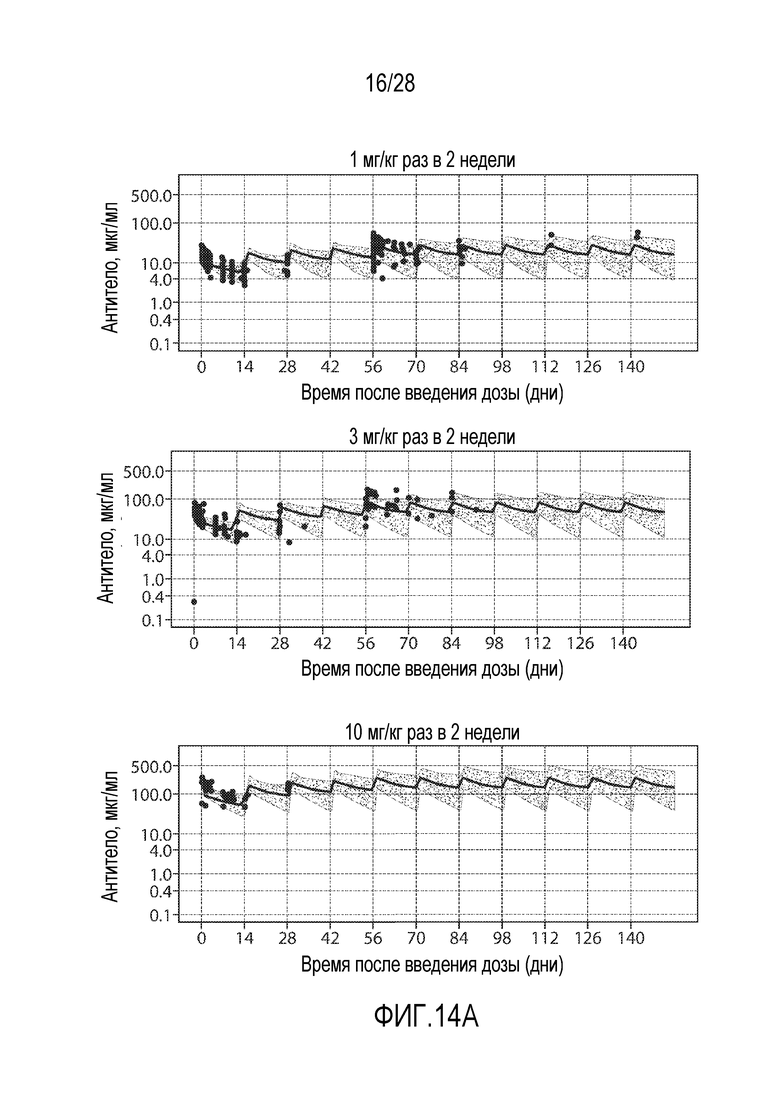
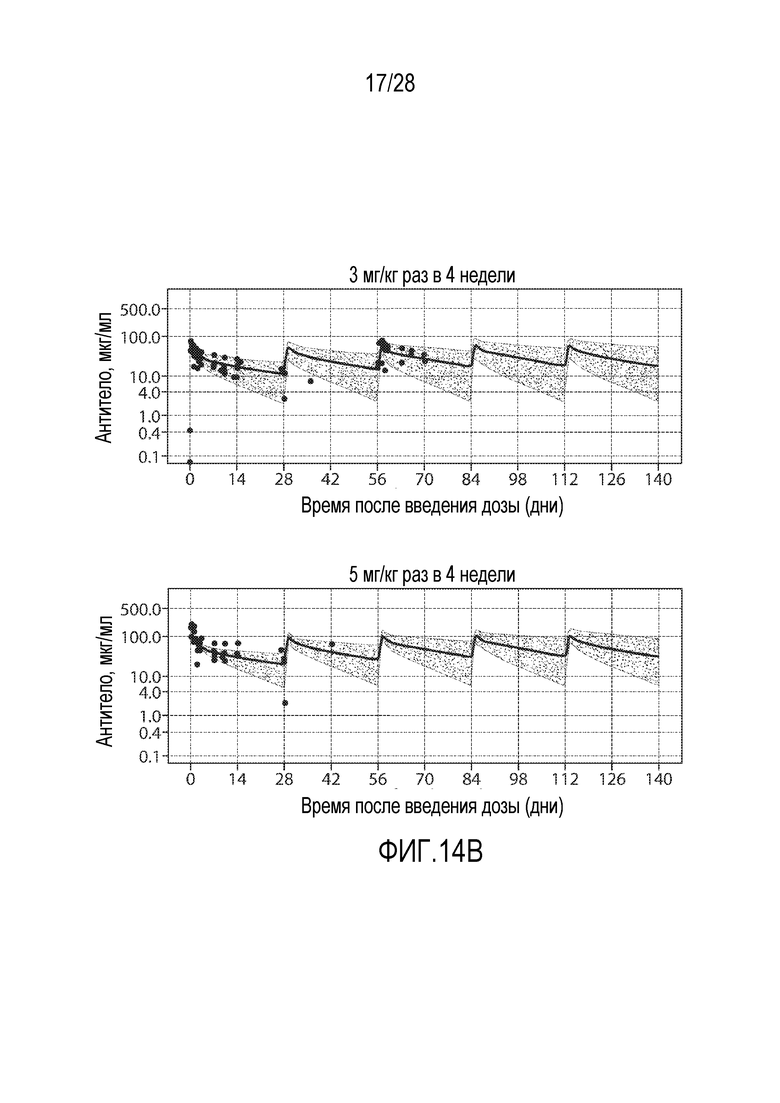
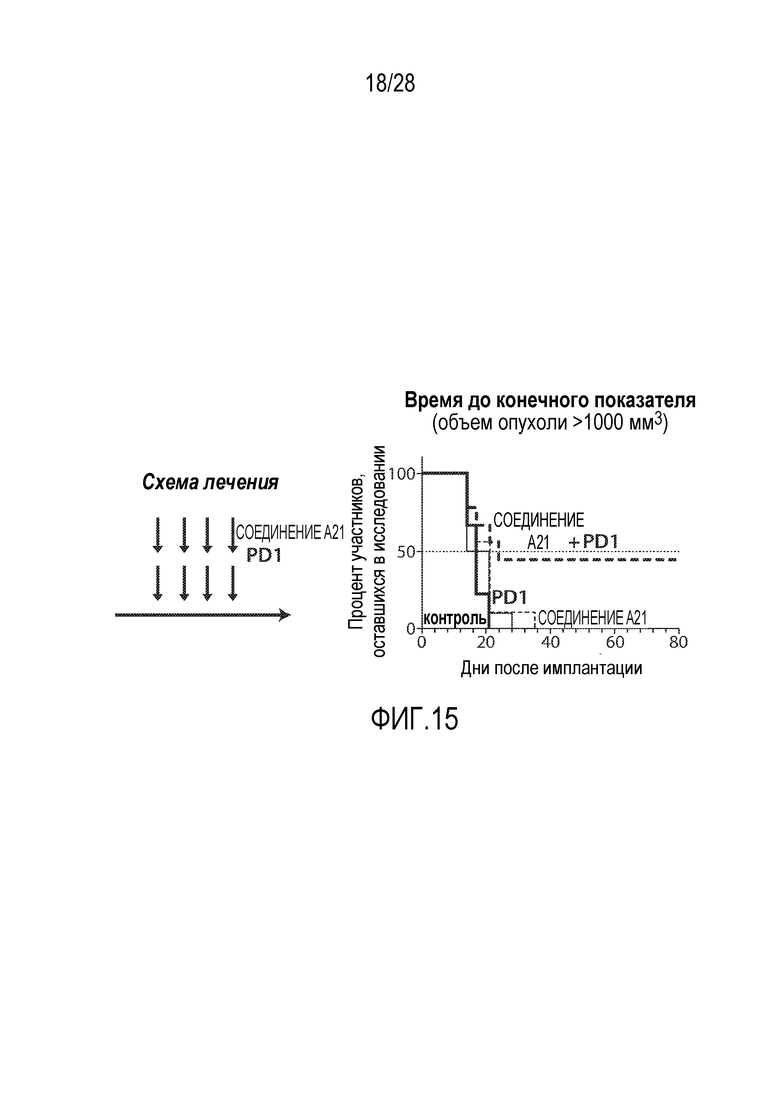
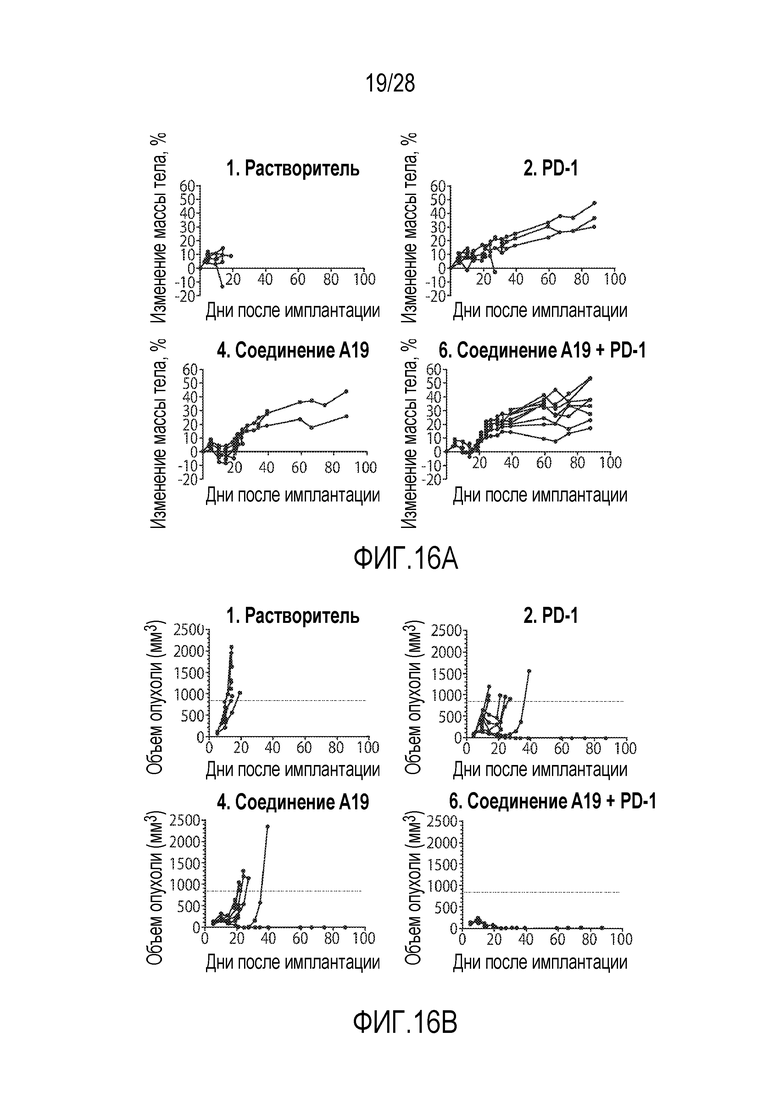
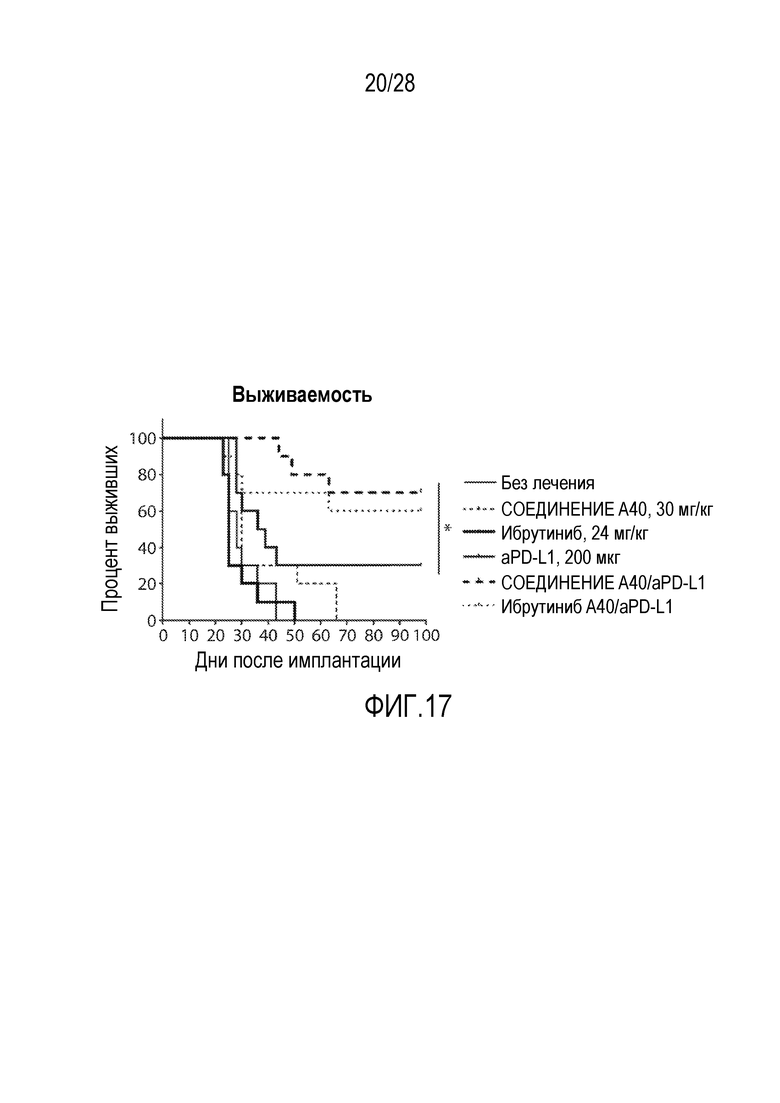

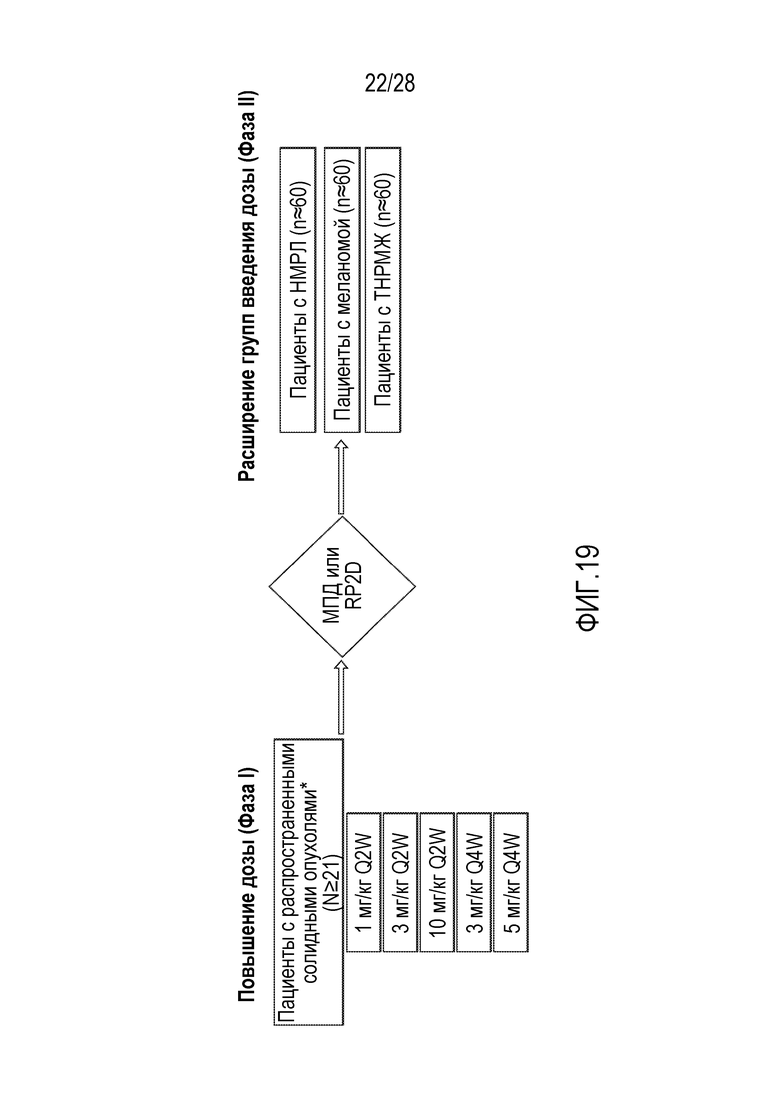
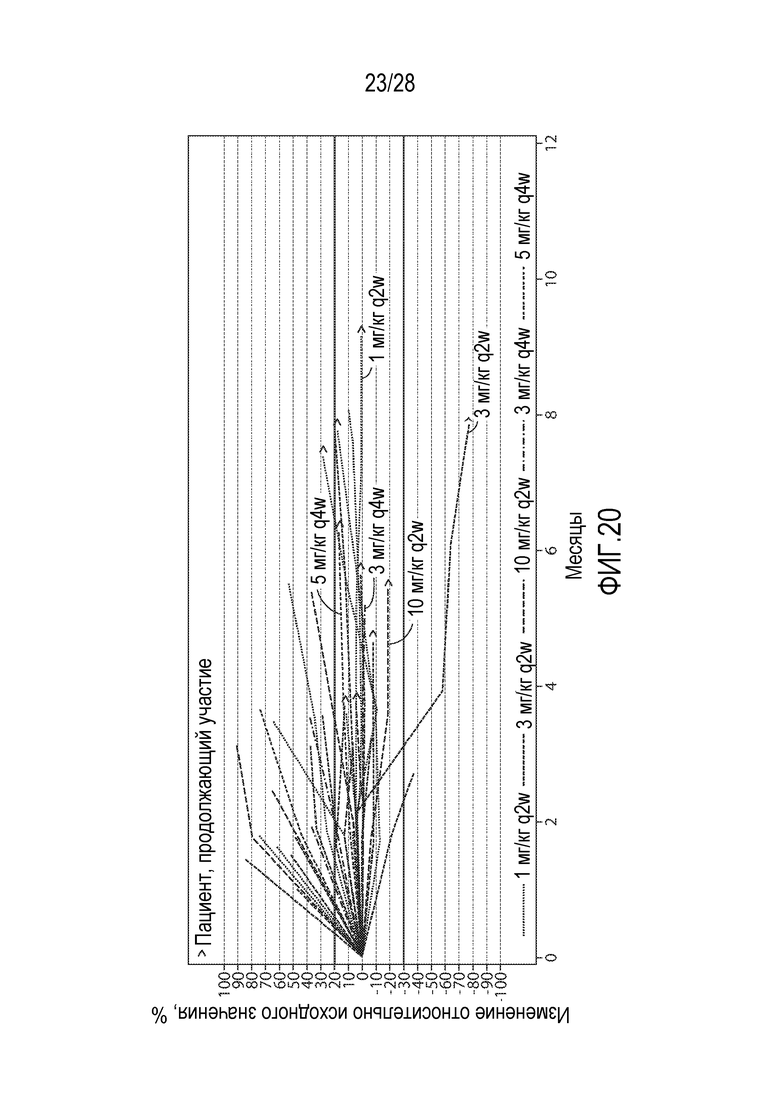

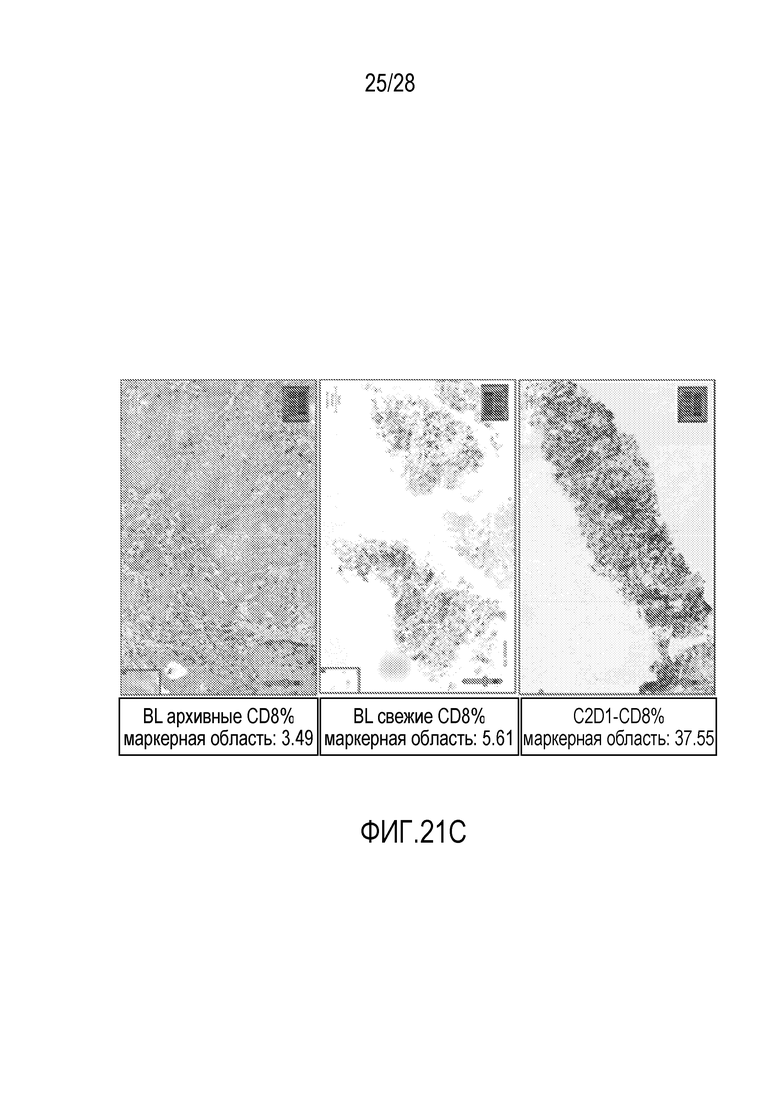
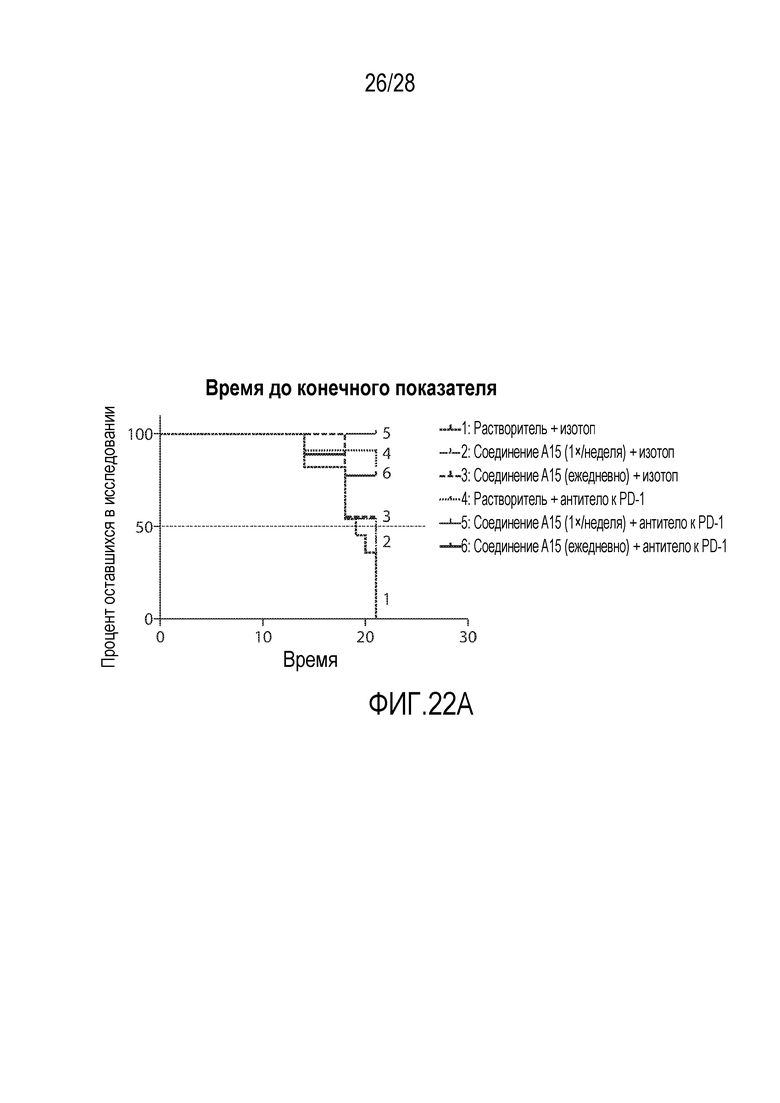
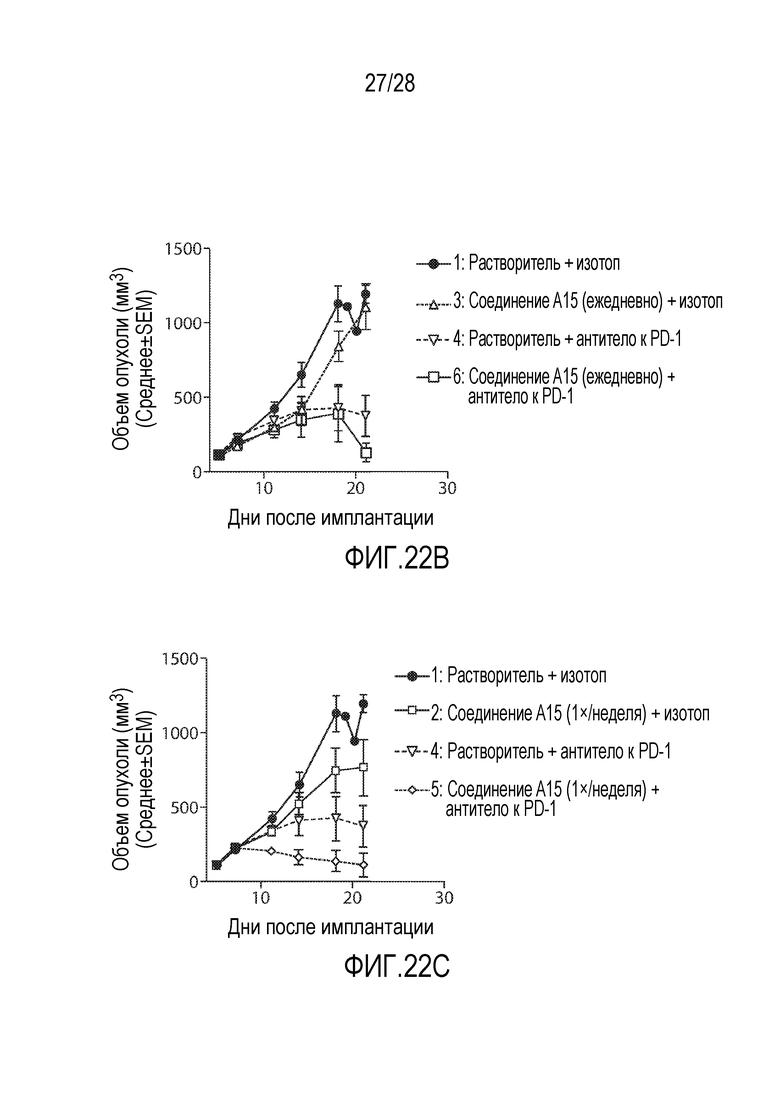
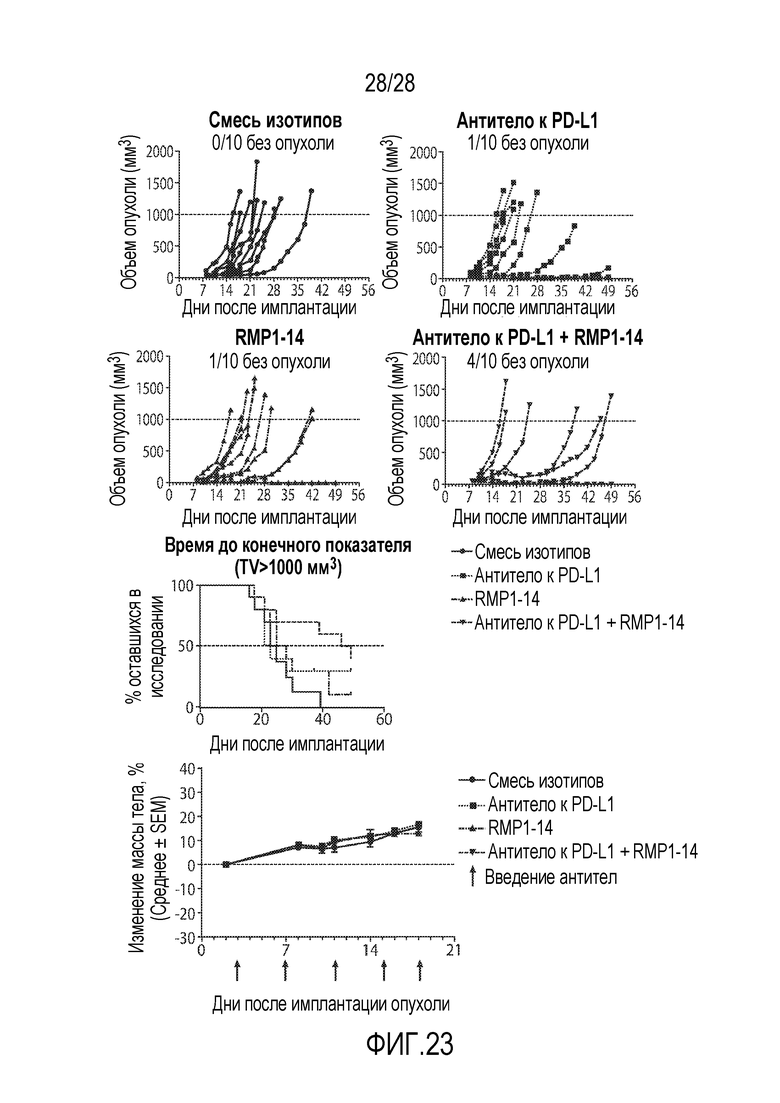
Изобретение относится к области биотехнологии. Описана группа изобретений, включающая применение молекулы антитела против PD-1 при лечении рака у субъекта (варианты), способ лечения рака у субъекта (варианты), применение фармацевтической композиции, включающей молекулу антитела против PD-1 в дозе приблизительно от 300 мг до 400 мг один раз в три недели или один раз в четыре недели, для лечения рака. В одном из вариантов реализации молекулы антитела против PD-1 при лечении рака применяется в дозе приблизительно от 300 мг до 400 мг один раз в три недели или один раз в четыре недели. Изобретение расширяет арсенал способов лечения рака с использованием молекулы антитела против PD-1. 15 н. и 88 з.п. ф-лы, 35 ил., 13 табл., 7 пр.
1. Применение молекулы антитела против PD-1 в дозе приблизительно от 300 мг до 400 мг один раз в три недели или один раз в четыре недели при лечении рака у субъекта,
где молекула антитела против PD-1 включает:
(a) вариабельную область тяжелой цепи (VH), включающую аминокислотную последовательность VHCDR1 SEQ ID NO: 4, аминокислотную последовательность VHCDR2 SEQ ID NO: 5 и аминокислотную последовательность VHCDR3 SEQ ID NO: 3; и вариабельную область легкой цепи (VL), включающую аминокислотную последовательность VLCDR1 SEQ ID NO: 13, аминокислотную последовательность VLCDR2 SEQ ID NO: 14 и аминокислотную последовательность VLCDR3 SEQ ID NO: 33;
(b) VH, включающую аминокислотную последовательность VHCDR1 SEQ ID NO: 1; аминокислотную последовательность VHCDR2 SEQ ID NO: 2 и аминокислотную последовательность VHCDR3 SEQ ID NO: 3; и VL, включающую аминокислотную последовательность VLCDR1 SEQ ID NO: 10, аминокислотную последовательность VLCDR2 SEQ ID NO: 11 и аминокислотную последовательность VLCDR3 SEQ ID NO: 32;
(c) VH, включающую аминокислотную последовательность VHCDR1 SEQ ID NO: 224, аминокислотную последовательность VHCDR2 SEQ ID NO: 5 и аминокислотную последовательность VHCDR3 SEQ ID NO: 3; и VL, включающую аминокислотную последовательность VLCDR1 SEQ ID NO: 13, аминокислотную последовательность VLCDR2 SEQ ID NO: 14 и аминокислотную последовательность VLCDR3 SEQ ID NO: 33; или
(d) VH, включающую аминокислотную последовательность VHCDR1 SEQ ID NO: 224; аминокислотную последовательность VHCDR2 SEQ ID NO: 2 и аминокислотную последовательность VHCDR3 SEQ ID NO: 3; и VL, включающую аминокислотную последовательность VLCDR1 SEQ ID NO: 10, аминокислотную последовательность VLCDR2 SEQ ID NO: 11 и аминокислотную последовательность VLCDR3 SEQ ID NO: 32.
2. Способ лечения рака у субъекта, включающий введение субъекту молекулы антитела против PD-1 в дозе приблизительно от 300 мг до 400 мг один раз в три недели или один раз в четыре недели,
где молекула антитела против PD-1 включает:
(a) вариабельную область тяжелой цепи (VH), включающую аминокислотную последовательность VHCDR1 SEQ ID NO: 4, аминокислотную последовательность VHCDR2 SEQ ID NO: 5 и аминокислотную последовательность VHCDR3 SEQ ID NO: 3; и вариабельную область легкой цепи (VL), включающую аминокислотную последовательность VLCDR1 SEQ ID NO: 13, аминокислотную последовательность VLCDR2 SEQ ID NO: 14 и аминокислотную последовательность VLCDR3 SEQ ID NO: 33;
(b) VH, включающую аминокислотную последовательность VHCDR1 SEQ ID NO: 1; аминокислотную последовательность VHCDR2 SEQ ID NO: 2 и аминокислотную последовательность VHCDR3 SEQ ID NO: 3; и VL, включающую аминокислотную последовательность VLCDR1 SEQ ID NO: 10, аминокислотную последовательность VLCDR2 SEQ ID NO: 11 и аминокислотную последовательность VLCDR3 SEQ ID NO: 32;
(c) VH, включающую аминокислотную последовательность VHCDR1 SEQ ID NO: 224, аминокислотную последовательность VHCDR2 SEQ ID NO: 5 и аминокислотную последовательность VHCDR3 SEQ ID NO: 3; и VL, включающую аминокислотную последовательность VLCDR1 SEQ ID NO: 13, аминокислотную последовательность VLCDR2 SEQ ID NO: 14 и аминокислотную последовательность VLCDR3 SEQ ID NO: 33; или
(d) VH, включающую аминокислотную последовательность VHCDR1 SEQ ID NO: 224; аминокислотную последовательность VHCDR2 SEQ ID NO: 2 и аминокислотную последовательность VHCDR3 SEQ ID NO: 3; и VL, включающую аминокислотную последовательность VLCDR1 SEQ ID NO: 10, аминокислотную последовательность VLCDR2 SEQ ID NO: 11 и аминокислотную последовательность VLCDR3 SEQ ID NO: 32.
3. Применение по п. 1 или способ по п. 2, где молекула антитела против PD-1 применяется в комбинации с одним или более терапевтическими средствами, выбранными из одной, двух или всех следующих категорий (i)-(iii):
(i) средство, которое увеличивает презентацию опухолевого антигена, выбранное из одного или более следующих: агонист STING (стимулятора интерферонового ответа cGAMP интерактор 1), агонист TLR (Толл-подобного рецептора), антагонист A2AR (аденозинового A2a-рецептора), онколитический вирус, модулятор TIM-3 (Т-клеточный иммуноглобулин и домен муцина-3 Т-клеточный иммуноглобулин и содержащий муцин домен-3), ингибитор рецептора фактора роста эндотелия сосудов (VEGFR), ингибитор c-Met (тирозин-протеинкиназы Met), ингибитор TGFb (трансформирующего фактора роста бета), ингибитор IDO/TDO (индоламин-2,3-диоксигеназы/триптофан-2,3-диоксигеназы), вакцина или би- или триспецифичный активатор клеток;
(ii) средство, которое усиливает ответ эффекторных клеток, выбранное из одного или более следующих: агонист GITR (глюкокортикоид-индуцированного TNFR-связанного белка), ингибитор PD-L1 (лиганда 1 белка программируемой смерти), ингибитор IAP (ингибитор белка апоптоза), ингибитор EGFR (рецептора эпидермального фактора роста), ингибитор мишени рапамицина (mTOR), IL-15 (интерлейкина-15) или его вариант, ингибитор CTLA-4 (цитотоксического Т-лимфоцит-ассоциированного белка 4), молекула биспецифичного антитела, которая связывается с CD3 (кластером дифференцировки 3) и опухолевым антигеном, агонист CD40 (кластера дифференцировки 40), агонист OX40 (члена суперсемейства рецепторов фактора некроза опухоли 4) или агонист CD27 (кластера дифференцировки 27); или
(iii) средство, которое уменьшает опухолевую иммуносупрессию, выбранное из одного или более следующих: агонист GITR, ингибитор молекулы иммунной контрольной точки, выбранной из одного или более из PD-L1, LAG-3 (ген активации лимфоцитов 3), TIM-3 или CTLA-4, ингибитор CSF-1/1R (колониестимулирующего фактора-1/рецептора колониестимулирующего фактора-1), ингибитор IL-17 (интерлейкина-17), ингибитор IL-1β (интерлейкина-1 бета), ингибитор CXCR2 (хемокинового рецептора мотива C-X-C 2), ингибитор PI3Kγ (фосфоинозитид-3-киназы гамма) или PI3Kδ (фосфоинозитид-3-киназа дельта), ингибитор BAFF-R (рецептора фактора активации В-клеток), ингибитор MALT-1/BTK (транслокационного белка 1 лимфоидной ткани, ассоциированной со слизистыми оболочками/ тирозинкиназы Брутона), ингибитор JAK (Янус киназы), ингибитор CRTH2 (рецептора 2 простагландина D2), ингибитор VEGFR (рецептора сосудистого эндотелиального фактора роста), IL-15 или его вариант, ингибитор CTLA-4, ингибитор IDO/TDO, антагонист A2AR, ингибитор TGFb или ингибитор PFKFB3 (6-фосфофрукто-2-киназы/фруктозо-2,6-бисфосфатазы 3).
4. Применение по п. 1 или 3 или способ по п. 2 или 3, где молекула антитела против PD-1 применяется в дозе приблизительно 300 мг один раз в три недели.
5. Применение по п. 1 или 3 или способ по п. 2 или 3, где молекула антитела против PD-1 применяется в дозе приблизительно 400 мг один раз в четыре недели.
6. Применение по любому из пп. 1 или 3-5 или способ по любому из пп. 2-5, где молекула антитела против PD-1 включает:
(a) VH, включающий аминокислотную последовательность SEQ ID NO: 38, и VL, включающий аминокислотную последовательность SEQ ID NO: 42;
(b) VH, включающий аминокислотную последовательность SEQ ID NO: 38, и VL, включающий аминокислотную последовательность SEQ ID NO: 66;
(d) VH, включающий аминокислотную последовательность SEQ ID NO: 38, и VL, включающий аминокислотную последовательность SEQ ID NO: 70;
(d) VH, включающий аминокислотную последовательность SEQ ID NO: 50, и VL, включающий аминокислотную последовательность SEQ ID NO: 70;
(e) VH, включающий аминокислотную последовательность SEQ ID NO: 38, и VL, включающий аминокислотную последовательность SEQ ID NO: 46;
(f) VH, включающий аминокислотную последовательность SEQ ID NO: 50, и VL, включающий аминокислотную последовательность SEQ ID NO: 46;
(g) VH, включающий аминокислотную последовательность SEQ ID NO: 50, и VL, включающий аминокислотную последовательность SEQ ID NO: 54;
(h) VH, включающий аминокислотную последовательность SEQ ID NO: 38, и VL, включающий аминокислотную последовательность SEQ ID NO: 54;
(i) VH, включающий аминокислотную последовательность SEQ ID NO: 38, и VL, включающий аминокислотную последовательность SEQ ID NO: 58;
(j) VH, включающий аминокислотную последовательность SEQ ID NO: 38, и VL, включающий аминокислотную последовательность SEQ ID NO: 62;
(k) VH, включающий аминокислотную последовательность SEQ ID NO: 50, и VL, включающий аминокислотную последовательность SEQ ID NO: 66;
(l) VH, включающий аминокислотную последовательность SEQ ID NO: 38, и VL, включающий аминокислотную последовательность SEQ ID NO: 74;
(m) VH, включающий аминокислотную последовательность SEQ ID NO: 38, и VL, включающий аминокислотную последовательность SEQ ID NO: 78;
(n) VH, включающий аминокислотную последовательность SEQ ID NO: 82, и VL, включающий аминокислотную последовательность SEQ ID NO: 70;
(o) VH, включающий аминокислотную последовательность SEQ ID NO: 82, и VL, включающий аминокислотную последовательность SEQ ID NO: 66; или
(p) VH, включающий аминокислотную последовательность SEQ ID NO: 86, и VL, включающий аминокислотную последовательность SEQ ID NO: 66.
7. Применение по любому из пп. 1 или 3-6 или способ по любому из пп. 2-6, где рак является солидной опухолью или гемобластозом.
8. Применение по любому из пп. 1 или 3-7 или способ по любому из пп. 2-7, где рак выбран из рака легкого, рака почки, рака печени, миеломы, рака предстательной железы, рака молочной железы, рака толстой и прямой кишки (CRC), рака желудка, рака поджелудочной железы, рака щитовидной железы, нейроэндокринной опухоли (NET), рак яичника, рак фаллопиевой трубы, лимфомы, лейкоза, миелодиспластического синдрома (МДС) или метастатического поражения рака.
9. Применение по п. 8 или способ по п. 8, где рак кожи является раком из клеток Меркеля или меланомой.
10. Применение по п. 8 или способ по п. 8, где рак молочной железы является трижды негативным раком молочной железы (ТНРМЖ), HER2-негативным раком молочной железы или ЭР+ раком молочной железы.
11. Применение по п. 8 или способ по п. 8, где рак почки является почечно-клеточной карциномой.
12. Применение по п. 11 или способ по п. 11, где почечно-клеточная карцинома является светлоклеточной почечно-клеточной карциномой (CCRCC) или несветлоклеточной почечно-клеточной карциномой (nccRCC).
13. Применение по п. 8 или способ по п. 8, где рак щитовидной железы является анапластическим раком щитовидной железы (ATC).
14. Применение по п. 8 или способ по п. 8, где нейроэндокринная опухоль (NET) является атипичной легочной карциноидной опухолью или NET в поджелудочной железе, желудочно-кишечном тракте (ЖКТ) или легком.
15. Применение по п. 8 или способ по п. 8, где рак легкого является немелкоклеточным раком легкого (НМРЛ).
16. Применение по п. 15 или способ по п. 15, где НМРЛ является плоскоклеточным НМРЛ, неплоскоклеточным НМРЛ или НМРЛ аденокарциномой.
17. Применение по п. 8 или способ по п. 8, где рак толстой и прямой кишки (CRC) является раком толстой и прямой кишки с высокой микросателлитной нестабильностью (MSI-H CRC) или микросателлитно стабильным раком толстой и прямой кишки (MSS CRC).
18. Применение по п. 8 или способ по п. 8, где лейкоз является острым миелоидным лейкозом (ОМЛ).
19. Применение по п. 18 или способ по п. 18, где острый миелоидный лейкоз (ОМЛ) является рецидивирующим или рефракторным ОМЛ, или de novo ОМЛ.
20. Применение по п. 8 или способ по п. 8, где миелодиспластический синдром (МДС) является МДС с высоким риском.
21. Применение по п. 8 или способ по п. 8, где рак печени является гепатоцеллюлярной карциномой.
22. Применение по п. 8 или способ по п. 8, где рак желудка является EBV+ раком желудка.
23. Применение по п. 8 или способ по п. 8, где лимфома является неходжкинской лимфомой.
24. Применение по любому из пп. 1 или 3-23 или способ по любому из пп. 2-23, где молекула антитела против PD-1 применяется в комбинации с ингибитором IAP.
25. Применение по любому из пп. 1 или 3-23 или способ по любому из пп. 2-23, где молекула антитела против PD-1 применяется в комбинации с ингибитором mTOR.
26. Применение по любому из пп. 1 или 3-23 или способ по любому из пп. 2-23, где молекула антитела против PD-1 применяется в комбинации с ингибитором DAC.
27. Применение по любому из пп. 1 или 3-23 или способ по любому из пп. 2-23, где молекула антитела против PD-1 применяется в комбинации с ингибитором IL-1β.
28. Применение по любому из пп. 1 или 3-23 или способ по любому из пп. 2-23, где молекула антитела против PD-1 применяется в комбинации с ингибитором IL-17.
29. Применение по любому из пп. 1 или 3-23 или способ по любому из пп. 2-23, где молекула антитела против PD-1 применяется в комбинации с ингибитором MEK.
30. Применение по любому из пп. 1 или 3-23 или способ по любому из пп. 2-23, где молекула антитела против PD-1 применяется в комбинации с ингибитором EGFR.
31. Применение по любому из пп. 24-30 или способ по любому из пп. 24-30, где комбинация применяется для лечения рака толстой и прямой кишки, рака легкого или рака молочной железы.
32. Применение по п. 31 или способ по п. 31, где раком легкого является НМРЛ.
33. Применение по п. 31 или способ по п. 31, где раком молочной железы является ТНРМЖ.
34. Применение по любому из пп. 1 или 3-23 или способ по любому из пп. 2-23, где молекула антитела против PD-1 применяется в комбинации с CSF-1/1R-связывающим средством.
35. Применение по п. 34 или способ по п. 34, где комбинация применяется для лечения рака головного мозга, рака молочной железы или рака поджелудочной железы.
36. Применение по п. 35 или способ по п. 35, где рак мозга является мультиформной глиобластомой (GBM).
37. Применение по п. 35 или способ по п. 35, где раком молочной железы является ТНРМЖ.
38. Применение по любому из пп. 1 или 3-23 или способ по любому из пп. 2-23, где молекула антитела против PD-1 применяется в комбинации с ингибитором 6-фосфофрукто-2-киназы/фруктозо-2,6-бисфосфатазы 3 (PFKFB3).
39. Применение по п. 38 или способ по п. 38, где комбинация применяется для лечения рака яичника, рака фаллопиевой трубы или рака толстой и прямой кишки (CRC).
40. Применение по любому из пп. 1 или 3-23 или способ по любому из пп. 2-23, где молекула антитела против PD-1 применяется в комбинации с химиотерапевтическим средством, где, необязательно, химиотерапевтическим средством является паклитаксел.
41. Применение по п. 40 или способ по п. 40, где комбинация применяется для лечения рака молочной железы.
42. Применение по п. 41 или способ по п. 41, где рак молочной железы является HER2-негативным раком молочной железы.
43. Применение по любому из пп. 1 или 3-23 или способ по любому из пп. 2-23, где молекулу антитела против PD-1 вводят в комбинации с ингибитором BRAF и ингибитором MEK.
44. Применение по п. 43 или способ по п. 43,
где антитело против PD-1 применяют в дозе приблизительно 400 мг один раз в четыре недели,
где ингибитор BRAF применяют в дозе от 50 мг до 250 мг два раза в день, и
где ингибитор MEK применяют в дозе от 1 мг до 3 мг один раз в день.
45. Применение по п. 44 или способ по п. 44, где ингибитор BRAF применяют в дозе приблизительно 150 мг два раза в день и/или ингибитор MEK применяют в дозе приблизительно 2 мг один раз в день.
46. Применение по п. 44 или 45 или способ по п. 44 или 45, где молекулу антитела против PD-1 применяют внутривенно и/или где ингибитор BRAF и/или ингибитор MEK применяют перорально.
47. Применение по любому из пп. 44-46 или способ по любому из пп. 44-46, где ингибитор BRAF представляет собой дабрафениб и/или где ингибитор MEK представляет собой траметиниб.
48. Применение по любому из пп. 44-47 или способ по любому из пп. 44-47, который предназначен для лечения меланомы, необязательно, где меланома имеет мутацию BRAF, необязательно, где мутация BRAF представляет собой мутацию BRAF V600.
49. Применение по любому из пп. 43-47 или способ по любому из пп. 43-47, где комбинация применяется для лечения рака кожи, рака легкого, рака толстой и прямой кишки или рака поджелудочной железы.
50. Применение по п. 49 или способ по п. 49, где рак кожи является меланомой или где рак легкого является немелкоклеточным раком легкого.
51. Применение по любому из пп. 1 или 3-23 или способ по любому из пп. 2-23, где молекулу антитела против PD-1 вводят в комбинации с ингибитором TGF-β.
52. Применение по п. 51 или способ по п. 51, где комбинация применяется для лечения рака поджелудочной железы, рака толстой и прямой кишки, рака легкого, рака молочной железы, рака печени, рака предстательной железы или рака почки.
53. Применение по п. 52 или способ по п. 52, где рак толстой и прямой кишки является микросателлитно стабильным раком толстой и прямой кишки (MSS-CRC).
54. Применение по п. 52 или способ по п. 52, где раком легкого является НМРЛ.
55. Применение по п. 52 или способ по п. 52, где раком молочной железы является ТНРМЖ.
56. Применение по п. 52 или способ по п. 52, где рак печени является гепатоцеллюлярной карциномой.
57. Применение по п. 52 или способ по п. 52, где рак почки является светлоклеточной почечно-клеточной карциномой.
58. Применение по любому из пп. 1 или 3-23 или способ по любому из пп. 2-23, где молекулу антитела против PD-1 вводят в комбинации с ингибитором PD-L1.
59. Применение по п. 58 или способ по п. 58, где комбинация применяется для лечения рака легкого, рака молочной железы, рака матки или рака щитовидной железы.
60. Применение по п. 59 или способ по п. 59, где раком легкого является НМРЛ.
61. Применение по п. 59 или способ по п. 59, где раком молочной железы является ТНРМЖ.
62. Применение по п. 59 или способ по п. 59, где рак матки является карциномой эндометрия.
63. Применение по п. 59 или способ по п. 59, где рак щитовидной железы является анапластической карциномой щитовидной железы.
64. Применение по любому из пп. 1 или 3-23 или способ по любому из пп. 2-23, где молекулу антитела против PD-1 вводят в комбинации с гипометилирующим средством.
65. Применение по п. 64 или способ по п. 64, где комбинация дополнительно включает ингибитор TIM-3.
66. Применение по п. 64 или 65 или способ по п. 64 или 65, где комбинация применяется для лечения лейкоза или миелодиспластического синдрома (МДС).
67. Применение по п. 66 или способ по п. 66, где лейкоз является острым миелоидным лейкозом (ОМЛ).
68. Применение по п. 66 или способ по п. 66, где МДС является МДС с высоким риском.
69. Применение по любому из пп. 1 или 3-68 или способ по любому из пп. 2-68, где молекула антитела против PD-1 применяется в комбинации со вторым ингибитором PD-1.
70. Применение фармацевтической композиции, включающей молекулу антитела против PD-1 в дозе приблизительно от 300 мг до 400 мг один раз в три недели или один раз в четыре недели, для лечения рака,
где молекула антитела против PD-1 включает:
(a) вариабельную область тяжелой цепи (VH), включающую аминокислотную последовательность VHCDR1 SEQ ID NO: 4, аминокислотную последовательность VHCDR2 SEQ ID NO: 5 и аминокислотную последовательность VHCDR3 SEQ ID NO: 3; и вариабельную область легкой цепи (VL), включающую аминокислотную последовательность VLCDR1 SEQ ID NO: 13, аминокислотную последовательность VLCDR2 SEQ ID NO: 14 и аминокислотную последовательность VLCDR3 SEQ ID NO: 33;
(b) VH, включающую аминокислотную последовательность VHCDR1 SEQ ID NO: 1; аминокислотную последовательность VHCDR2 SEQ ID NO: 2 и аминокислотную последовательность VHCDR3 SEQ ID NO: 3; и VL, включающую аминокислотную последовательность VLCDR1 SEQ ID NO: 10, аминокислотную последовательность VLCDR2 SEQ ID NO: 11 и аминокислотную последовательность VLCDR3 SEQ ID NO: 32;
(c) VH, включающую аминокислотную последовательность VHCDR1 SEQ ID NO: 224, аминокислотную последовательность VHCDR2 SEQ ID NO: 5 и аминокислотную последовательность VHCDR3 SEQ ID NO: 3; и VL, включающую аминокислотную последовательность VLCDR1 SEQ ID NO: 13, аминокислотную последовательность VLCDR2 SEQ ID NO: 14 и аминокислотную последовательность VLCDR3 SEQ ID NO: 33; или
(d) VH, включающую аминокислотную последовательность VHCDR1 SEQ ID NO: 224; аминокислотную последовательность VHCDR2 SEQ ID NO: 2 и аминокислотную последовательность VHCDR3 SEQ ID NO: 3; и VL, включающую аминокислотную последовательность VLCDR1 SEQ ID NO: 10, аминокислотную последовательность VLCDR2 SEQ ID NO: 11 и аминокислотную последовательность VLCDR3 SEQ ID NO: 32.
71. Применение по п. 70, где доза составляет приблизительно 300 мг один раз в три недели.
72. Применение по п. 70, где доза составляет приблизительно 400 мг один раз в четыре недели.
73. Применение по любому из пп. 70-72, где молекула антитела против PD-1 включает:
(a) VH, включающий аминокислотную последовательность SEQ ID NO: 38, и VL, включающий аминокислотную последовательность SEQ ID NO: 42;
(b) VH, включающий аминокислотную последовательность SEQ ID NO: 38, и VL, включающий аминокислотную последовательность SEQ ID NO: 66;
(d) VH, включающий аминокислотную последовательность SEQ ID NO: 38, и VL, включающий аминокислотную последовательность SEQ ID NO: 70;
(d) VH, включающий аминокислотную последовательность SEQ ID NO: 50, и VL, включающий аминокислотную последовательность SEQ ID NO: 70;
(e) VH, включающий аминокислотную последовательность SEQ ID NO: 38, и VL, включающий аминокислотную последовательность SEQ ID NO: 46;
(f) VH, включающий аминокислотную последовательность SEQ ID NO: 50, и VL, включающий аминокислотную последовательность SEQ ID NO: 46;
(g) VH, включающий аминокислотную последовательность SEQ ID NO: 50, и VL, включающий аминокислотную последовательность SEQ ID NO: 54;
(h) VH, включающий аминокислотную последовательность SEQ ID NO: 38, и VL, включающий аминокислотную последовательность SEQ ID NO: 54;
(i) VH, включающий аминокислотную последовательность SEQ ID NO: 38, и VL, включающий аминокислотную последовательность SEQ ID NO: 58;
(j) VH, включающий аминокислотную последовательность SEQ ID NO: 38, и VL, включающий аминокислотную последовательность SEQ ID NO: 62;
(k) VH, включающий аминокислотную последовательность SEQ ID NO: 50, и VL, включающий аминокислотную последовательность SEQ ID NO: 66;
(l) VH, включающий аминокислотную последовательность SEQ ID NO: 38, и VL, включающий аминокислотную последовательность SEQ ID NO: 74;
(m) VH, включающий аминокислотную последовательность SEQ ID NO: 38, и VL, включающий аминокислотную последовательность SEQ ID NO: 78;
(n) VH, включающий аминокислотную последовательность SEQ ID NO: 82, и VL, включающий аминокислотную последовательность SEQ ID NO: 70;
(o) VH, включающий аминокислотную последовательность SEQ ID NO: 82, и VL, включающий аминокислотную последовательность SEQ ID NO: 66; или
(p) VH, включающий аминокислотную последовательность SEQ ID NO: 86, и VL, включающий аминокислотную последовательность SEQ ID NO: 66.
74. Применение по любому из пп. 70-73, где рак выбран из рака легкого, рака почки, рака печени, миеломы, рака предстательной железы, рака молочной железы, рака толстой и прямой кишки, рака желудка, рака поджелудочной железы, рака щитовидной железы, нейроэндокринной опухоли (NET), рака яичника, рака фаллопиевой трубы, лимфомы, лейкоза, миелодиспластического синдрома (МДС) или метастатического поражения рака.
75. Применение по любому из пп. 70-73, где рак кожи является раком из клеток Меркеля или меланомой.
76. Применение по п. 74, где рак молочной железы является трижды негативным раком молочной железы (ТНРМЖ), HER2-негативным раком молочной железы, ЭР+ раком молочной железы.
77. Применение по п. 74, где рак почки является почечно-клеточной карциномой.
78. Применение по п. 77, где почечно-клеточная карцинома является светлоклеточной почечно-клеточной карциномой (CCRCC) или несветлоклеточной почечно-клеточной карциномой (nccRCC).
79. Применение по п. 74, где рак щитовидной железы является анапластической карциномой щитовидной железы (ATC).
80. Применение по п. 74, где нейроэндокринная опухоль (NET) является атипичной легочной карциноидной опухолью или NET в поджелудочной железе, желудочно-кишечном тракте (ЖКТ) или легком.
81. Применение по п. 74, где рак легкого является немелкоклеточным раком легкого (НМРЛ).
82. Применение по п. 81, где НМРЛ является плоскоклеточным НМРЛ, неплоскоклеточным НМРЛ или НМРЛ аденокарциномой.
83. Применение по п. 74, где рак толстой и прямой кишки (CRC) является раком толстой и прямой кишки с высокой микросателлитной нестабильностью (MSI-H CRC) или микросателлитно стабильным раком толстой и прямой кишки (MSS CRC).
84. Применение по п. 74, где лейкоз является острым миелоидным лейкозом (ОМЛ).
85. Применение по п. 84, где острый миелоидный лейкоз (ОМЛ) является рецидивирующим или рефракторным ОМЛ, или de novo ОМЛ.
86. Применение по п. 74, где миелодиспластический синдром (МДС) является МДС с высоким риском.
87. Применение молекулы антитела против PD-1 в дозе приблизительно 300 мг один раз в три недели или приблизительно 400 мг один раз в четыре недели при лечении рака у субъекта,
где молекула антитела против PD-1 включает VH, включающую аминокислотную последовательность SEQ ID NO: 38, и VL, включающую аминокислотную последовательность SEQ ID NO: 54.
88. Применение молекулы антитела против PD-1 в дозе приблизительно 300 мг один раз в три недели или приблизительно 400 мг один раз в четыре недели при лечении рака у субъекта,
где молекула антитела против PD-1 включает VH, включающую аминокислотную последовательность SEQ ID NO: 38, и VL, включающую аминокислотную последовательность SEQ ID NO: 70.
89. Применение молекулы антитела против PD-1 в дозе приблизительно 300 мг один раз в три недели или приблизительно 400 мг один раз в четыре недели при лечении рака у субъекта,
где молекула антитела против PD-1 включает тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 91, и легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 56.
90. Применение молекулы антитела против PD-1 в дозе приблизительно 300 мг один раз в три недели или приблизительно 400 мг один раз в четыре недели при лечении рака у субъекта,
где молекула антитела против PD-1 включает тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 91, и легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 72.
91. Способ лечения рака у субъекта, включающий введение субъекту молекулы антитела против PD-1 в дозе приблизительно 300 мг один раз в три недели или приблизительно 400 мг один раз в четыре недели,
где молекула антитела против PD-1 включает VH, включающую аминокислотную последовательность SEQ ID NO: 38, и VL, включающую аминокислотную последовательность SEQ ID NO: 54.
92. Способ лечения рака у субъекта, включающий введение субъекту молекулы антитела против PD-1 в дозе приблизительно 300 мг один раз в три недели или приблизительно 400 мг один раз в четыре недели,
где молекула антитела против PD-1 включает VH, включающую аминокислотную последовательность SEQ ID NO: 38, и VL, включающую аминокислотную последовательность SEQ ID NO: 70.
93. Способ лечения рака у субъекта, включающий введение субъекту молекулы антитела против PD-1 в дозе приблизительно 300 мг один раз в три недели или приблизительно 400 мг один раз в четыре недели,
где молекула антитела против PD-1 включает тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 91, и легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 56.
94. Способ лечения рака у субъекта, включающий введение субъекту молекулы антитела против PD-1 в дозе приблизительно 300 мг один раз в три недели или приблизительно 400 мг один раз в четыре недели,
где молекула антитела против PD-1 включает тяжелую цепь, включающую аминокислотную последовательность SEQ ID NO: 91, и легкую цепь, включающую аминокислотную последовательность SEQ ID NO: 72.
95. Применение молекулы антитела против PD-1 в дозе 300 мг один раз в три недели или 400 мг один раз в четыре недели при лечении рака у субъекта, где:
молекула антитела против PD-1 включает тяжелую цепь (HC), включающую аминокислотную последовательность SEQ ID NO: 91, и легкую цепь (LC), включающую аминокислотную последовательность SEQ ID NO: 72;
и где молекулу антитела против PD-1 применяют в комбинации с дабрафенибом и траметинибом.
96. Применение молекулы антитела против PD-1 в дозе 300 мг один раз в три недели или 400 мг один раз в четыре недели при лечении рака у субъекта, где:
молекула антитела против PD-1 включает тяжелую цепь (HC), включающую аминокислотную последовательность SEQ ID NO: 91, и легкую цепь (LC), включающую аминокислотную последовательность SEQ ID NO: 72;
и где молекулу антитела против PD-1 применяют в комбинации с дабрафенибом, где дабрафениб применяют в дозе 150 мг два раза в день, и в комбинации с траметинибом, где траметиниб применяют в дозе 2 мг один раз в день.
97. Способ лечения рака у субъекта, включающий введение субъекту молекулы антитела против PD-1 в дозе 300 мг один раз в три недели или 400 мг один раз в четыре недели, где:
молекула антитела против PD-1 включает тяжелую цепь (HC), включающую аминокислотную последовательность SEQ ID NO: 91, и легкую цепь (LC), включающую аминокислотную последовательность SEQ ID NO: 72;
и где молекулу антитела против PD-1 применяют в комбинации с дабрафенибом и траметинибом.
98. Способ лечения рака у субъекта, включающий введение субъекту молекулы антитела против PD-1 в дозе 300 мг один раз в три недели или 400 мг один раз в четыре недели, где:
молекула антитела против PD-1 включает тяжелую цепь (HC), включающую аминокислотную последовательность SEQ ID NO: 91, и легкую цепь (LC), включающую аминокислотную последовательность SEQ ID NO: 72;
и где молекулу антитела против PD-1 применяют в комбинации с дабрафенибом, где дабрафениб применяют в дозе 150 мг два раза в день, и в комбинации с траметинибом, где траметиниб применяют в дозе 2 мг один раз в день.
99. Применение по любому из пп. 85-90, 95 или 96 или способ по любому из пп. 91-94, 97 или 98, где рак включает мутацию BRAF.
100. Применение по п. 99 или способ по п. 99, где рак представляет собой мутантную меланому BRAF V600E.
101. Применение по п. 99 или способ по п. 99, где рак представляет собой мутантный немелкоклеточный рак легкого BRAF V600E.
102. Применение по п. 99 или способ по п. 99, где рак представляет собой рак толстой и прямой кишки BRAF V600E.
103. Применение по п. 99 или способ по п. 99, где рак представляет собой рак поджелудочной железы BRAF V600E.
| WO 2015112900 A1 30.07.2015 | |||
| WO 2006133396 A2 14.12.2006 | |||
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА ЧЕЛОВЕКА К БЕЛКУ ПРОГРАММИРУЕМОЙ СМЕРТИ 1 (PD-1) И СПОСОБЫ ЛЕЧЕНИЯ РАКА С ИСПОЛЬЗОВАНИЕМ АНТИ-PD-1-АНТИТЕЛ САМОСТОЯТЕЛЬНО ИЛИ В КОМБИНАЦИИ С ДРУГИМИ ИММУНОТЕРАПЕВТИЧЕСКИМИ СРЕДСТВАМИ | 2006 |
|
RU2494107C2 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2023-01-16—Публикация
2016-12-16—Подача