Область техники, к которой относится изобретение
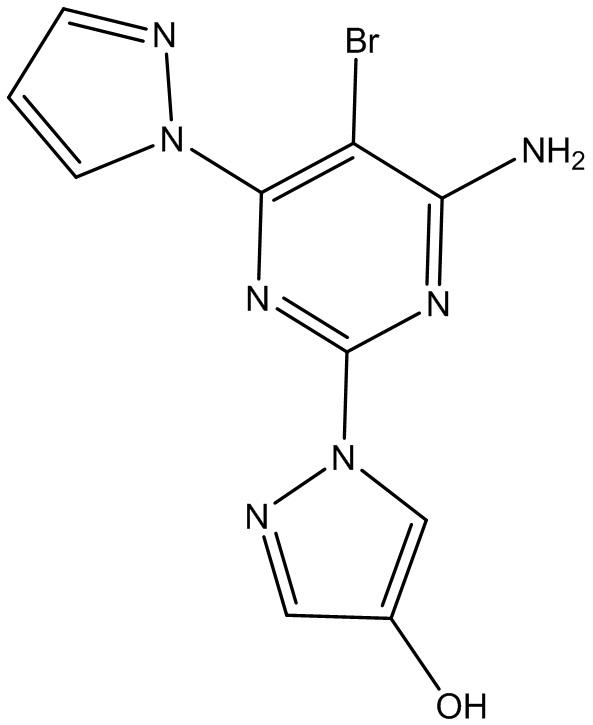
Настоящее изобретение относится к активному метаболиту 5-бром-2,6-ди(1H-пиразол-1-ил)пиримидин-4-амина, а именно 1-(4-амино-5-бром-6-(1H-пиразол-1-ил)пиримидин-2-ил)-1H-пиразол-4-олу, который модулирует аденозиновый рецептор A2a. В частности, настоящее изобретение относится к фармацевтическим композициям, содержащим 1-(4-амино-5-бром-6-(1H-пиразол-1-ил)пиримидин-2-ил)-1H-пиразол-4-ол, а также способам их получения и их применения в лечении рака.
Предпосылки изобретения
Рак является существенной проблемой в сфере общественного здравоохранения во всем мире. В настоящее время он является второй ведущей причиной смертности в Соединенных Штатах и ряде развитых стран, и ожидается, что он превзойдет заболевания сердца в качестве ведущей причины смертности в следующие несколько лет. (Siegel R L, et al, Cancer Statistics, 2015, CA Cancer J Clin 2015; 65:5-29. VC 2015 American Cancer Society и ссылки, приведенные в нем).
Рак считается сложным заболеванием, которое обусловлено как внутренними, так и внешними клеточными процессами, связанными с развитием рака. В ходе ряда исследований, проведенных на различных in vitro и животных моделях, включая, например, легочные метастазы, клетки аденокарциномы легких человека, мышиные клетки меланомы, мышиные клетки рака яичников, мышиные клетки рака молочной железы, было подтверждено, что целенаправленное воздействие на аденозинэргическую систему обладает огромным потенциалом для разработки различных средств для лечения. Целый ряд данных подчеркивает значение аденозина в качестве критически важного регуляторного аутокринного и паракринного фактора, который накапливается в неопластическом микроокружении. Внеклеточный аденозин, который обычно присутствует в высоких концентрациях в раковых тканях, является крайне важным медиатором изменения функций иммунных клеток при раке. Возможно, это объясняется тем, что жестко регулируемые сигнальные пути аденозиновых рецепторов иммунных клеток подвергаются значительным изменениям в опухолях, тем самым изменяя функции этих клеток с иммунного надзора и защиты организма хозяина на способствование перерождению клеток в раковые и их росту. (Antonioli L et al., Immunity, inflammation and cancer: a leading role for adenosine, Nature, 842, December 2013, Volume 13 и ссылки, приведенные в нем).
Как известно, опухоли используют многочисленные механизмы иммуносупрессии для способствования опухолевому росту (Koebel CM. et al, Adaptive immunity maintains occult cancer in an equilibrium state, Nature. 2007, 450, 7171:903-907 и Schreiber RD. et al., Cancer immunoediting: Integrating immunity's roles in cancer suppression and promotion, Science. 2011, 331, 6024:1565-1570). Существуют исследования, свидетельствующие о том, что один такой механизм опосредован катаболизмом внеклеточного AMP в иммуносупрессивный аденозин (Ohta A. et al, A2A adenosine receptor protects tumors from antitumor T cells. Proc Natl Acad Sci U S A. 2006; 103: 13132-13137 и Ohta A. et al., A2A adenosine receptor may allow expansion of T cells lacking effector functions in extracellular adenosine-rich microenvironments. J Immunol. 2009, 183, 9:5487-5493). Сначала внеклеточный ATP подвергается превращению в AMP посредством экзофермента CD39. Дополнительное дефосфорилирование AMP посредством экзофермента CD73 приводит к продуцированию внеклеточного аденозина.
Во время данного процесса активность аденозинкиназы также подавляется, обуславливая подавление реутилизационной активности данного фермента и повышение уровней аденозина. Например, в условиях гипоксии при воспалении или в пределах микроокружения опухоли ингибирование аденозинкиназы вызывает повышение в 15-20 раз как внеклеточного, так и внутриклеточного уровней аденозина (Decking UK. Et al, Hypoxia-induced inhibition of adenosine kinase potentiates cardiac adenosine release. Circ. Res. 1997; 81(2):154-164. doi: 10.1161/01.RES.81.2.154). Образованный внеклеточный аденозин связывается с четырьмя известными рецепторами клеточной поверхности (A1, A2A, A2B и A3), которые экспрессируются на множестве субпопуляций иммунных клеток, включая T-клетки, естественные клетки-киллеры (NK), T-клеточные естественные киллеры, макрофаги, дендритные клетки и супрессорные клетки миелоидного происхождения (MDSC). Подтипы рецепторов A2A и A2B главным образом ответственны за иммуносупрессивные эффекты аденозина. Они участвуют в общем сигнальном пути, причем оба из них вызывают активацию аденилатциклазы и накопление внутриклеточного cAMP. Был дополнительно предоставлен ряд свидетельств, демонстрирующих, что внутриклеточный cAMP является сигнальной молекулой, которая ингибирует сигнальный путь T-клеточного рецептора на ранней и поздней стадиях инициируемого T-клеточным рецептором сигнального пути активации T-клетки. (Ohta A, Sitkovsky M, Role of G-protein-coupled adenosine receptors in downregulation of inflammation and protection from tissue damage, Nature, 2001, 414: 916-920).
Было высказано предположение, что элиминация рецептора A2a способами генетической инженерии или ингибирование сигнального пути рецептора A2a с применением антагонистов рецептора A2a обеспечит предупреждение ингибирования противоопухолевых T-клеток и улучшит отторжение опухоли (Ohta A. et al., A2a adenosine receptor protects tumors from antitumor T cells. Proc Natl Acad Sci U S A. 2006; 103: 13132-13137).
Рецептор A2a функционирует в качестве неизбыточного отрицательного регулятора активированных T-клеток для защиты нормальных тканей от чрезмерного коллатерального повреждения при воспалении. Было высказано предположение, что рецептор A2a может также 'ошибочно' защищать раковые ткани. Был сделан вывод, что если это действительно так, то генетическая инактивация или фармакологический антагонизм рецептора A2a будет обеспечивать предупреждение ингибирования противоопухолевых T-клеток и тем самым улучшать отторжение опухоли посредством таких деингибированных T-клеток (Sitkovsky M. et al, Adenosine A2a receptor antagonists: blockade of adenosinergic effects and T regulatory cells, British Journal of Pharmacology, 2008, 153, S457-S464).
Рак легкого является ведущей причиной смертности от рака по всему миру, и с 1985 г. он является наиболее распространенной формой рака в мире как с точки зрения частоты возникновения, так и смертности. В глобальном масштабе рак легкого вносит наибольший вклад в новые случаи диагностирования рака (12,4% от общего количества новых случаев рака) и случаи смертей от рака (17,6% от общего количества смертей от рака).
Рак легкого развивается из клеток респираторного эпителия, и его можно подразделить на две широкие категории. Мелкоклеточный рак легкого (SCLC) является опухолью с высокой степенью злокачественности, происходящей из клеток, демонстрирующих нейроэндокринные характеристики, и на его долю приходится 15% случаев рака легкого. Немелкоклеточный рак легкого (NSCLC), на долю которого приходятся оставшиеся 85% случаев, дополнительно подразделяют на 3 главных патологических подтипа: аденокарциному, плоскоклеточную карциному и крупноклеточную карциному. На долю только аденокарциномы приходится 38,5% всех случаев рака легкого, при этом на долю плоскоклеточной карциномы приходится 20%, а на долю крупноклеточной карциномы приходится 2,9%. За последние несколько десятилетий частота возникновения аденокарциномы сильно увеличилась, и аденокарцинома заняла позицию плоскоклеточной карциномы в качестве наиболее распространенного типа NSCLC. (De la Cruz, C et al., Lung Cancer: Epidemiology, Etiology, and Prevention, Clin Chest Med. 2011 December; 32(4)).
В частности, в случае NSCLC стадия заболевания определяет способ лечения, который включает хирургическое вмешательство, лучевую терапию, двухкомпонентную химиотерапию на основе препаратов платины и с недавних пор целевые виды терапии, предусматривающие прерывание сигнальных путей, ответственных за пролиферацию и выживание клеток. На ранних стадиях заболевания эффективной является системная химиотерапия (двухкомпонентная на основе препаратов платины, таксановая, гемцитабиновая, пеметрекседовая) (Azzoli CG. et al., 2011 Focused Update of 2009 American Society of Clinical Oncology Clinical Practice Guideline Update on Chemotherapy for Stage IV Non-Small-Cell Lung Cancer, J Oncol Pract. 2012; 8:63-6 doi:10.1200/JOP.2011.000374), которая в результате обеспечивает невысокую эффективность, поэтому мультимодальная терапевтическая стратегия стала важным вариантом лечения пациентов с NSCLC. В нескольких исследованиях было доказано, что комбинации двух или более лекарственных средств обладают более высокой эффективностью, но за счет дополнительной токсичности (Yoshida T. et al., Comparison of adverse events and efficacy between gefitinib and erlotinib in patients with non-small-cell lung cancer: a retrospective analysis, Med Oncol. 2013; 30:349).
В последнее время осуществляется разработка нескольких подходов для усиления противораковых ответов Т-клеток и восстановления их способности выявлять и атаковать раковые клетки, среди которых были разработаны mAb, блокирующие ассоциированный с цитотоксическими лимфоцитами антиген 4 (CTLA4) и опосредованные белком 1 программируемой смерти клеток (PD-1) T-клеточные события.
Ипилимумаб, представляющий собой полностью человеческое mAb к CTLA4, показал тенденцию к обеспечению более высокой клинической пользы среди пациентов с SQCLC (Lynch TJ. et al., Ipilimumab in combination with paclitaxel and carboplatin as first-line treatment in stage IIIB/IV non-small-cell lung cancer: Results from a randomized, double-blind, multicenter phase II study, J Clin Oncol.2012; 30: 2046-54). mAb к PD-1 (MEDI4735, BMS-936558, BMS-936559) продемонстрировали способность обеспечивать существенную длительную регрессию опухолей у проходивших интенсивное предварительное лечение пациентов с NSCLC на поздней стадии (Brahmer JR. et al., Safety and activity of anti-PD-L1 antibody in patients with advanced cancer, N Engl J Med. 2012; 366: 2455-65).
Существуют исследования, показывающие наличие изменений, вызывающих изменения во внеклеточном микроокружении опухоли. Одним из таких внеклеточных изменений является повышение концентраций аденозина, что нарушает опосредованное T-клетками отторжение и способствует ангиогенезу. Исследование показало, что значительное количество аденокарцином легкого экспрессируют аденозиновый рецептор A2a, поддерживая проведение тестирования антагонистов аденозинового рецептора A2a в качестве противораковых терапевтических средств. (Mediavilla-Varela, M et al., Antagonism of adenosine A2a receptor expressed by lung adenocarcinoma tumor cells and cancer associated fibroblasts inhibits their growth, Cancer Biology & Therapy, September 2013, 14:9, 860-868).
Несмотря на разработку новых терапевтических средств NSCLC все еще характеризуется 5-летней выживаемостью у только 14%, что предполагает необходимость продолжения исследований, направленных на новые средства для лечения (Spira A. et al., Multidisciplinary management of lung cancer, N Engl J Med. 2004; 350:379-92 doi: 10.1056/NEJMra035536).
В WO 2011/121418, соответствующее раскрытие которого включено в данный документ посредством ссылки, раскрыт ряд аминопиримидиновых производных в качестве антагонистов аденозинового рецептора A2a для применения в лечении нейродегенеративных заболеваний, таких как болезнь Паркинсона. Кроме того, эффективность соединений, описанных в WO 2011/121418, в лечении рака была исследована впоследствии. Конкретное соединение в данном классе представляет собой 5-бром-2,6-ди(1H-пиразол-1-ил)пиримидин-4-амин, которое, как было установлено, является эффективным в лечении рака. Структура 5-бром-2,6-ди(1H-пиразол-1-ил)пиримидин-4-амина показана ниже.
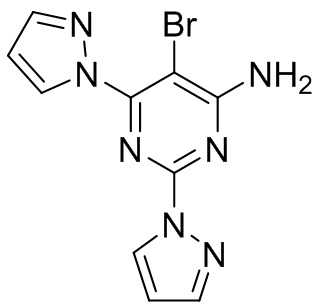
В PCT/IB2016/054834 раскрывается применение такого соединения отдельно или в комбинации с одним или несколькими иммунотерапевтическими средствами в лечении рака.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к активному метаболиту 5-бром-2,6-ди(1H-пиразол-1-ил)пиримидин-4-амина, а именно 1-(4-амино-5-бром-6-(1H-пиразол-1-ил)пиримидин-2-ил)-1H-пиразол-4-олу или его фармацевтически приемлемой соли. Настоящее изобретение дополнительно предусматривает вышеуказанное соединение, находящееся в по сути выделенном виде. Настоящее изобретение дополнительно предусматривает композиции, содержащие 1-(4-амино-5-бром-6-(1H-пиразол-1-ил)пиримидин-2-ил)-1H-пиразол-4-ол или его фармацевтически приемлемую соль и по меньшей мере один фармацевтически приемлемый носитель.
Настоящее изобретение дополнительно предусматривает способ ингибирования аденозинового рецептора A2a, включающий введение 1-(4-амино-5-бром-6-(1H-пиразол-1-ил)пиримидин-2-ил)-1H-пиразол-4-ола или его фармацевтически приемлемой соли.
Настоящее изобретение дополнительно предусматривает способ лечения рака у субъекта, нуждающегося в таком лечении, включающий введение 1-(4-амино-5-бром-6-(1H-пиразол-1-ил)пиримидин-2-ил)-1H-пиразол-4-ола или его фармацевтически приемлемой соли отдельно или в комбинации с одним или несколькими иммунотерапевтическими средствами.
Краткое описание графических материалов
Фиг. 1. Иллюстрирует XIC-хроматограмму, спектры Q1 и MS/MS 5-бром-2,6-ди(1H-пиразол-1-ил)пиримидин-4-амина в водном стандарте (MH+: 308).
Фиг. 2. Иллюстрирует XIC-хроматограмму, спектры Q1 и MS/MS 5-бром-2,6-ди(1H-пиразол-1-ил)пиримидин-4-амина в микросомах печени человека через 120 минут (MH+: 308).
Фиг. 3. Иллюстрирует XIC-хроматограмму, спектры Q1 и MS/MS продукта монооксигенации 5-бром-2,6-ди(1H-пиразол-1-ил)пиримидин-4-амина в микросомах печени человека через 120 минут (MH+: 324).
Фиг. 4. Иллюстрирует Q1-спектр водных стандартов 5-бром-2,6-ди(1H-пиразол-1-ил)пиримидин-4-амина (1 мкМ; MH+: 308) и его продуктов монооксигенации: 1-(6-амино-5-бром-2-(1H-пиразол-1-ил)пиримидин-4-ил)-1H-пиразол-4-ола (1 мкМ; MH+: 324) и 1-(4-амино-5-бром-6-(1H-пиразол-1-ил)пиримидин-2-ил)-1H-пиразол-4-ола (1 мкМ; MH+: 324) и идентификацию 1-(4-амино-5-бром-6-(1H-пиразол-1-ил)пиримидин-2-ил)-1H-пиразол-4-ола в микросомах печени человека через 120 минут (MH+: 324).
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Таким образом, в варианте осуществления 1 настоящее изобретение относится к следующему соединению, представляющему собой 1-(4-амино-5-бром-6-(1H-пиразол-1-ил)пиримидин-2-ил)-1H-пиразол-4-ол:
 ;
;
которое образуется посредством метаболизма 5-бром-2,6-ди(1H-пиразол-1-ил)пиримидин-4-амина у животных, человека и/или в клеточных анализах in-vitro.
В варианте осуществления 2 настоящее изобретение относится к находящемуся в выделенном виде 1-(4-амино-5-бром-6-(1H-пиразол-1-ил)пиримидин-2-ил)-1H-пиразол-4-олу или его фармацевтически приемлемой соли.
В варианте осуществления 3 настоящее изобретение предусматривает фармацевтическую композицию, содержащую 1-(4-амино-5-бром-6-(1H-пиразол-1-ил)пиримидин-2-ил)-1H-пиразол-4-ол или его фармацевтически приемлемую соль и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество.
В варианте осуществления 4 настоящее изобретение предусматривает комбинацию, в частности фармацевтическую комбинацию, содержащую терапевтически эффективное количество 1-(4-амино-5-бром-6-(1H-пиразол-1-ил)пиримидин-2-ил)-1H-пиразол-4-ола или его фармацевтически приемлемой соли и одно или несколько иммунотерапевтических средств.
В варианте осуществления 5 настоящее изобретение предусматривает способ лечения рака у субъекта, нуждающегося в таком лечении, при этом способ включает введение субъекту, нуждающемуся в этом, терапевтически эффективного количества 1-(4-амино-5-бром-6-(1H-пиразол-1-ил)пиримидин-2-ил)-1H-пиразол-4-ола или его фармацевтически приемлемой соли отдельно или в комбинации с одним или несколькими иммунотерапевтическими средствами.
В варианте осуществления 6 настоящее изобретение относится к применению 1-(4-амино-5-бром-6-(1H-пиразол-1-ил)пиримидин-2-ил)-1H-пиразол-4-ола или его фармацевтически приемлемой соли отдельно или в комбинации с одним или несколькими иммунотерапевтическими средствами для лечения рака.
В варианте осуществления 7 настоящее изобретение относится к соединению 1-(4-амино-5-бром-6-(1H-пиразол-1-ил)пиримидин-2-ил)-1H-пиразол-4-ол в соответствии с вариантом осуществления 2 или фармацевтической композиции в соответствии с вариантом осуществления 3 для применения в лечении рака.
В варианте осуществления 8 настоящее изобретение относится к комбинации 1-(4-амино-5-бром-6-(1H-пиразол-1-ил)пиримидин-2-ил)-1H-пиразол-4-ола и одного или нескольких иммунотерапевтических средств для применения в лечении рака.
В варианте осуществления 9 настоящее изобретение предусматривает способ ингибирования аденозинового рецептора A2a у субъекта, где способ включает введение субъекту терапевтически эффективного количества 1-(4-амино-5-бром-6-(1H-пиразол-1-ил)пиримидин-2-ил)-1H-пиразол-4-ола в соответствии с вариантом осуществления 2 или введение фармацевтической композиции в соответствии с вариантом осуществления 3 субъекту.
В варианте осуществления 10 настоящее изобретение относится к способу согласно варианту осуществления 5, применению в соответствии с вариантом осуществления 6, или соединению для применения в соответствии с вариантом осуществления 7, или комбинации для применения в соответствии с вариантом осуществления 8, где рак выбран из рака легкого, меланомы, рака почки, рака печени, миеломы, рака предстательной железы, рака молочной железы, колоректального рака, рака поджелудочной железы, рака головы и шеи, рака анального канала, рака желудка и пищевода, рака щитовидной железы, рака шейки матки, лимфопролиферативного заболевания или гемобластоза, T-клеточной лимфомы, B-клеточной лимфомы, неходжкинской лимфомы или лейкоза.
В варианте осуществления 11 настоящее изобретение относится к способу согласно варианту осуществления 5, применению в соответствии с вариантом осуществления 6, или соединению для применения в соответствии с вариантом осуществления 7, или комбинации для применения в соответствии с вариантом осуществления 8, где рак представляет собой виды карциномы, конкретно рак легкого и более конкретно немелкоклеточный рак легкого.
В варианте осуществления 12 настоящее изобретение относится к способу согласно варианту осуществления 5, 10 или 11, применению в соответствии с вариантом осуществления 6, 10 или 11 или комбинации для применения в соответствии с вариантами осуществления 9, 10 или 11, где одно или несколько иммунотерапевтических средств выбраны из группы, состоящей из антител к CTLA4, антител к PD-1 и антител к PD-L1.
В варианте осуществления 13 настоящее изобретение относится к способу согласно варианту осуществления 5, 10 или 11, применению в соответствии с вариантом осуществления 6, 10 или 11 или комбинации для применения в соответствии с вариантами осуществления 9, 10 или 11, где иммунотерапевтическое средство выбрано из группы, состоящей из ипилимумаба, тремелимумаба, ниволумаба, пембролизумаба, пидилизумаба (CT-011), AMP-224, AMP-514 (MEDI0680-Medimmune), MPDL3280A (Genentech Roche), MEDI4736, MSB0010718C (Merck Serono), YW243.55.S70 и MDX-1105.
В варианте осуществления 14 настоящее изобретение относится к способу согласно варианту осуществления 5, 10 или 11, применению в соответствии с вариантом осуществления 6, 10 или 11 или комбинации для применения в соответствии с вариантами осуществления 9, 10 или 11, где иммунотерапевтические средства представляют собой антитело к PD-1.
В варианте осуществления 14A настоящее изобретение относится к способу согласно варианту осуществления 5, 10 или 11, применению в соответствии с вариантом осуществления 6, 10 или 11 или комбинации для применения в соответствии с вариантами осуществления 9, 10 или 11, где иммунотерапевтические средства представляют собой антитело к PD-1, выбранное из ниволумаба, пембролизумаба, пидилизумаба, MEDI0680 (AMP514 Medimmune), AMP224 (Medimmune) и антител, описанных в US 2015/0210769).
В варианте осуществления 15 настоящее изобретение относится к способу, применению или комбинации для применения в соответствии с вариантом осуществления 14, где антитело к PD-1 содержит
(a) вариабельную область тяжелой цепи (VH), содержащую аминокислотную последовательность VHCDR1 под SEQ ID NO: 4, аминокислотную последовательность VHCDR2 под SEQ ID NO: 5 и аминокислотную последовательность VHCDR3 под SEQ ID NO: 3; и вариабельную область легкой цепи (VL), содержащую аминокислотную последовательность VLCDR1 под SEQ ID NO: 13, аминокислотную последовательность VLCDR2 под SEQ ID NO: 14 и аминокислотную последовательность VLCDR3 под SEQ ID NO: 15;
(b) VH, содержащую аминокислотную последовательность VHCDR1 под SEQ ID NO: 1; аминокислотную последовательность VHCDR2 под SEQ ID NO: 2 и аминокислотную последовательность VHCDR3 под SEQ ID NO: 3; и VL, содержащую аминокислотную последовательность VLCDR1 под SEQ ID NO: 10, аминокислотную последовательность VLCDR2 под SEQ ID NO: 11 и аминокислотную последовательность VLCDR3 под SEQ ID NO: 12;
(c) VH, содержащую аминокислотную последовательность VHCDR1 под SEQ ID NO: 41, аминокислотную последовательность VHCDR2 под SEQ ID NO: 5 и аминокислотную последовательность VHCDR3 под SEQ ID NO: 3; и VL, содержащую аминокислотную последовательность VLCDR1 под SEQ ID NO: 13, аминокислотную последовательность VLCDR2 под SEQ ID NO: 14 и аминокислотную последовательность VLCDR3 под SEQ ID NO: 15; или
(d) VH, содержащую аминокислотную последовательность VHCDR1 под SEQ ID NO: 41; аминокислотную последовательность VHCDR2 под SEQ ID NO: 2 и аминокислотную последовательность VHCDR3 под SEQ ID NO: 3; и VL, содержащую аминокислотную последовательность VLCDR1 под SEQ ID NO: 10, аминокислотную последовательность VLCDR2 под SEQ ID NO: 11 и аминокислотную последовательность VLCDR3 под SEQ ID NO: 12.
В варианте осуществления 16 настоящее изобретение относится к способу, применению или комбинации для применения в соответствии с вариантом осуществления 14, где антитело к PD-1 содержит VH, содержащую аминокислотную последовательность под SEQ ID NO: 6, и VL, содержащую аминокислотную последовательность под SEQ ID NO: 20.
В варианте осуществления 17 настоящее изобретение относится к способу, применению или комбинации для применения в соответствии с вариантом осуществления 14, где антитело к PD-1 содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 8, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 22.
В варианте осуществления 18 настоящее изобретение относится к способу, применению или комбинации для применения в соответствии с вариантом осуществления 14, где антитело к PD-1 содержит VH, содержащую аминокислотную последовательность под SEQ ID NO: 6, и VL, содержащую аминокислотную последовательность под SEQ ID NO: 16.
В варианте осуществления 19 настоящее изобретение относится к способу, применению или комбинации для применения в соответствии с вариантом осуществления 14, где антитело к PD-1 содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 8, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 18.
В варианте осуществления 20 настоящее изобретение относится к способу, применению или комбинации для применения в соответствии с любым из вариантов осуществления 14-19, где молекула антитела к PD-1 вводится в дозе, составляющей приблизительно 300 мг, один раз каждые три недели.
В варианте осуществления 21 настоящее изобретение относится к способу, применению или комбинации для применения в соответствии с любым из вариантов осуществления 14-19, где молекула антитела к PD-1 вводится в дозе, составляющей приблизительно 400 мг, один раз каждые четыре недели.
В варианте осуществления 22 настоящее изобретение относится к способу согласно варианту осуществления 5, 10 или 11, применению в соответствии с вариантом осуществления 6, 10 или 11 или комбинации для применения в соответствии с вариантами осуществления 9, 10 или 11, где иммунотерапевтические средства представляют собой антитело к PD-L1.
В варианте осуществления 22A настоящее изобретение относится к способу, применению или комбинации для применения в соответствии с вариантом осуществления 22, где молекула антитела к PD-L1 выбрана из YW243.55.S70, MPDL3280A, MEDI-4736, MSB-0010718C, MDX-1105 и антитела к PD-L1, описанного в US 2016/0108123.
В варианте осуществления 23 настоящее изобретение относится к способу, применению или комбинации для применения в соответствии с вариантом осуществления 22, где молекула антитела к PD-L1 содержит
(a) вариабельную область тяжелой цепи (VH), содержащую аминокислотную последовательность VHCDR1 под SEQ ID NO: 47, аминокислотную последовательность VHCDR2 под SEQ ID NO: 48 и аминокислотную последовательность VHCDR3 под SEQ ID NO: 46; и вариабельную область легкой цепи (VL), содержащую аминокислотную последовательность VLCDR1 под SEQ ID NO: 52, аминокислотную последовательность VLCDR2 под SEQ ID NO: 53 и аминокислотную последовательность VLCDR3 под SEQ ID NO: 54;
(b) VH, содержащую аминокислотную последовательность VHCDR1 под SEQ ID NO: 44; аминокислотную последовательность VHCDR2 под SEQ ID NO: 45 и аминокислотную последовательность VHCDR3 под SEQ ID NO: 46; и VL, содержащую аминокислотную последовательность VLCDR1 под SEQ ID NO: 49, аминокислотную последовательность VLCDR2 под SEQ ID NO: 50 и аминокислотную последовательность VLCDR3 под SEQ ID NO: 51;
(c) VH, содержащую аминокислотную последовательность VHCDR1 под SEQ ID NO: 63, аминокислотную последовательность VHCDR2 под SEQ ID NO: 48 и аминокислотную последовательность VHCDR3 под SEQ ID NO: 46; и VL, содержащую аминокислотную последовательность VLCDR1 под SEQ ID NO: 52, аминокислотную последовательность VLCDR2 под SEQ ID NO: 53 и аминокислотную последовательность VLCDR3 под SEQ ID NO: 54; или
(d) VH, содержащую аминокислотную последовательность VHCDR1 под SEQ ID NO: 63; аминокислотную последовательность VHCDR2 под SEQ ID NO: 45 и аминокислотную последовательность VHCDR3 под SEQ ID NO: 46; и VL, содержащую аминокислотную последовательность VLCDR1 под SEQ ID NO: 49, аминокислотную последовательность VLCDR2 под SEQ ID NO: 50 и аминокислотную последовательность VLCDR3 под SEQ ID NO: 51.
В варианте осуществления 24 настоящее изобретение относится к способу, применению или комбинации для применения в соответствии с вариантом осуществления 22, где молекула антитела к PD-L1 содержит вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 55, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 58.
В варианте осуществления 25 настоящее изобретение относится к способу, применению или комбинации для применения в соответствии с любым из вариантов осуществления 12-24, где иммунотерапевтическое средство вводится совместно в одной композиции или вводится раздельно в двух или более различных формах композиций.
В варианте осуществления 26 настоящее изобретение относится к способу, применению или комбинации для применения в соответствии с любым из вариантов осуществления 12-24, где иммунотерапевтическое средство вводится одновременно с соединением -(4-амино-5-бром-6-(1H-пиразол-1-ил)пиримидин-2-ил)-1H-пиразол-4-ол, до или после него.
В варианте осуществления 27 настоящее изобретение предусматривает способ получения 1-(4-амино-5-бром-6-(1H-пиразол-1-ил)пиримидин-2-ил)-1H-пиразол-4-ола в соответствии с примером 1.
Определение
Применяемый в данном документе термин рак используют для обозначения группы заболеваний, характеризующихся аномальным ростом клеток со способностью проникать или распространяться в другие части организма. Виды рака классифицируют на основе типа клеток, с которым опухолевые клетки имеют сходство, и который, таким образом, считается источником происхождения опухоли. Такие типы включают карциному, саркому, лимфому и лейкоз, герминогенную опухоль и бластому.
Применяемый в данном документе термин карцинома используют для обозначения видов рака, происходящих из эпителиальных клеток. Данная группа включает множество наиболее распространенных видов рака, в частности у людей старшего возраста, и включает практически все виды, развивающиеся в молочной железе, предстательной железе, легком, поджелудочной железе и толстой кишке.
Например, термин "рак" включает без ограничения солидную опухоль, гемобластоз (например, лейкоз, лимфому, миелому, например множественную миелому) и метастатическое поражение. В одном варианте осуществления рак представляет собой солидную опухоль. Примеры солидных опухолей включают злокачественные новообразования, например виды саркомы и карциномы, например виды аденокарциномы различных систем органов, такие как поражающие легкое, молочную железу, яичник, лимфоидную ткань, желудочно-кишечный тракт (например, толстую кишку), анальный канал, половые органы и мочеполовой тракт (например, клетки почки, уротелия, мочевого пузыря, предстательную железу), глотку, ЦНС (например, головной мозг, нервные или глиальные клетки), голову и шею, кожу (например, меланома) и поджелудочную железу, а также виды аденокарциномы, которые включают злокачественные новообразования, такие как виды рака толстой кишки, рак прямой кишки, почечно-клеточная карцинома, рак печени, немелкоклеточный рак легкого, рак тонкой кишки и рак пищевода. Рак может быть на ранней, промежуточной, поздней стадии или представлять собой метастатический рак.
В одном варианте осуществления рак выбран из рака легкого (например, немелкоклеточного рака легкого (NSCLC) (например, NSCLC с плоскоклеточной и/или неплоскоклеточной гистологией или аденокарциномы NSCLC)), меланомы (например, меланомы на поздней стадии), рака почки (например, почечно-клеточной карциномы), рака печени, миеломы (например, множественной миеломы), рака предстательной железы, рака молочной железы (например, рака молочной железы, при котором не экспрессируются один, два или все из рецептора эстрогена, рецептора прогестерона или Her2/neu, например трижды негативного рака молочной железы), колоректального рака, рака поджелудочной железы, рака головы и шеи (например, плоскоклеточной карциномы головы и шеи (HNSCC), рака анального канала, рака желудка и пищевода, рака щитовидной железы, рака шейки матки, лимфопролиферативного заболевания (например, посттрансплантационного лимфопролиферативного заболевания) или гемобластоза, T-клеточной лимфомы, B-клеточной лимфомы, неходжкинской лимфомы или лейкоза (например, миелоидного лейкоза или лимфоидного лейкоза).
В другом варианте осуществления рак может представлять собой, например, рак, описанный в данном документе, такой как рак легкого (плоскоклеточный), рак легкого (аденокарцинома), рак головы и шеи, рак шейки матки (плоскоклеточный), рак желудка, рак щитовидной железы, меланому, рак носоглотки (например, дифференцированная или недифференцированная метастатическая или местно-рецидивирующая носоглоточная карцинома) или рак молочной железы.
В другом варианте осуществления рак выбран из карциномы (например, карциномы на поздней стадии или метастатической карциномы), меланомы или карциномы легкого, например немелкоклеточной карциномы легкого.
В одном варианте осуществления рак представляет собой рак легкого, например немелкоклеточный рак легкого или мелкоклеточный рак легкого.
Применяемый в данном документе термин рак легкого (также известный как карцинома легкого или легочная карцинома) используют для обозначения злокачественных опухолей легкого, характеризующихся неконтролируемым ростом клеток в тканях легкого.
Применяемый в данном документе термин немелкоклеточная карцинома легкого (NSCLC) используют для обозначения любого типа рака легкого, отличного от мелкоклеточной карциномы легкого (SCLC).
Применяемый в данном документе термин иммунотерапевтическое лечение относится к широкому классу видов терапии, предназначенных для стимулирования иммуно-опосредованного уничтожения опухолевых клеток. В указанных видах терапии применяют иммунотерапевтические средства.
Применяемый в данном документе термин иммунотерапевтические средства относится к соединениям, пригодным для осуществления иммунотерапевтического лечения рака, как например средство, выбранное из группы, состоящей из антител к CTLA4, таких как ипилимумаб и тремелимумаб, антител к PD-1, таких как MDX-1106, MK3475, CT-011, AMP-224 или молекула антитела к PD-1, описанная в WO 2015/112900; и антител к PD-L1, таких как MEDI4736, MDX-1105 или антитело к PD-L1, описанное в US 2016/0108123.
Используемый в данном документе термин "белок 1 программируемой смерти клеток" или "PD-1" охватывает изоформы PD-1 млекопитающих, например PD-1 человека, видовые гомологи PD-1 человека и аналоги, содержащие по меньшей мере один общий с PD-1 эпитоп. Аминокислотная последовательность PD-1, например PD-1 человека, известна из уровня техники, например Shinohara T et al., (1994) Genomics 23(3):704-6; Finger LR, et al., Gene (1997) 197(1-2):177-87.
Применяемый в данном документе термин "лиганд 1 программируемой смерти клеток" или "PD-L1" охватывает изоформы PD-L1 млекопитающих, например PD-1 человека, видовые гомологи PD-L1 человека и аналоги, содержащие по меньшей мере один общий с PD-1 эпитоп. Аминокислотная последовательность PD-L1, например PD-1 человека, известна из уровня техники, например Dong et al., (1999) Nat Med. 5(12):1365-9; Freeman et al., (2000) J Exp Med. 192(7):1027-34).
Под "находящийся в выделенном виде" авторы настоящего изобретения подразумевают, что соединение не содержит каких-либо компонентов, которые бы, как правило, сопутствовали ему при его образовании в процессе метаболизма in vivo. Например, оно не содержит какого-либо биологического материала, такого как компоненты сыворотки крови, а также других метаболитов 5-бром-2,6-ди(1H-пиразол-1-ил)пиримидин-4-амина, образующихся in vivo. Соответствующим образом, соединение находится в очищенном и выделенном виде. Под "очищенный" авторы настоящего изобретения подразумевают, что соединение является в подходящем случае более чем на 75% чистым, в более подходящем случае более чем на 90% чистым, и предпочтительно более чем на 95% чистым, и наиболее предпочтительно более чем на 98% чистым.
Применяемый в данном документе термин "комбинация" относится либо к фиксированной комбинации в одной единичной дозированной форме, либо к комбинированному применению, где соединение формулы I и партнер по комбинации (т.е. иммунотерапевтическое средство) могут быть введены независимо в одно и то же время или по отдельности через промежутки времени, в частности когда данные промежутки времени дают возможность партнерам по комбинации демонстрировать кооперативный, например синергетический, эффект. Отдельные компоненты могут быть упакованы в набор или находиться по отдельности. Один или оба компонента (например, порошки или жидкости) могут быть восстановлены или разбавлены до требуемой дозы перед введением.
Термины "совместное введение" или "комбинированное введение" или им подобные, используемые в данном документе, понимаются как охватывающие введение выбранного партнера по комбинации одному субъекту, нуждающемуся в этом (например, пациенту), и предполагают включение схем лечения, в которых средства необязательно вводят тем же путем введения или в то же время.
Используемые в данном документе термины "фармацевтическая комбинация" и "комбинированный продукт" используются взаимозаменяемо и относятся либо к фиксированной комбинации в одной единичной дозированной форме, либо к нефиксированной комбинации или набору из частей для комбинированного введения, где два или более терапевтических средств могут вводиться независимо в одно и то же время или по отдельности в пределах временных интервалов, в частности, когда такие временные интервалы обеспечивают возможность демонстрации кооперативного, например синергетического, эффекта партнеров по комбинации. Термин "фиксированная комбинация" означает, что как соединение формулы I, так и партнер по комбинации (т.е. иммунотерапевтическое средство) вводятся пациенту одновременно в форме единого объекта или дозы. Термин "нефиксированная комбинация" означает, что как соединение формулы I, так и партнер по комбинации (т.е. иммунотерапевтическое средство) вводятся пациенту в виде отдельных объектов либо одновременно, параллельно, либо последовательно без конкретных ограничений по времени, при этом такое введение обеспечивает эффективные терапевтические уровни двух соединений в организме пациента. Последнее также применяется в отношении "коктейльной терапии", например введение трех или более терапевтических средств. В предпочтительном варианте осуществления фармацевтическая комбинация представляет собой нефиксированную комбинацию.
Термин "комбинированная терапия" относится к введению двух или более терапевтических средств для лечения рака, описанных в настоящем изобретении. Такое введение охватывает совместное введение этих терапевтических средств по сути одновременно, например, в одной капсуле, имеющей фиксированное соотношение активных ингредиентов. В качестве альтернативы, такое введение охватывает совместное введение в нескольких или в отдельных контейнерах (например, в таблетках, капсулах, порошках и жидкостях) для каждого активного ингредиента. Порошки и/или жидкости могут быть восстановлены или разбавлены до требуемой дозы перед введением. Кроме того, такое введение также охватывает применение каждого типа терапевтического средства последовательным образом, либо приблизительно в одно и то же время, либо в различное время. В любом случае схема лечения будет обеспечивать полезные эффекты комбинации лекарственных средств при лечении состояний или нарушений, описанных в данном документе.
Применяемый в данном документе термин "фармацевтически приемлемые соли" относится к солям, которые сохраняют биологическую эффективность и свойства соединений по настоящему изобретению и которые не являются нежелательными с биологической или иной точки зрения. Во многих случаях соединения по настоящему изобретению способны к образованию кислотных и/или основных солей вследствие присутствия амино- и/или карбоксильных групп или подобных им групп. Фармацевтически приемлемые соли присоединения кислоты могут быть образованы с использованием неорганических кислот и органических кислот, например ацетатные, аспартатные, бензоатные, безилатные, бикарбонатные/карбонатные, бисульфатные/сульфатные, боратные, камфорсульфонатные, цитратные, эдисилатные, эсилатные, формиатные, фумаратные, глюцептатные, глюконатные, глюкуронатные, гексафторфосфатные, гибензатные, гидрохлоридные/хлоридные, гидробромидные/бромидные, гидройодидные/йодидные, изетионатные, лактатные, малатные, малеатные, малонатные, мезилатные, метилсульфатные, нафтилатные, 2-напсилатные, никотинатные, нитратные, оротатные, оксалатные, пальмитатные, памоатные, фосфатные/гидрофосфатные/дигидрофосфатные, сахаратные, стеаратные, сукцинатные, тартратные, тозилатные и трифторацетатные соли. Неорганические кислоты, из которых могут быть получены соли, включают, например, хлористоводородную кислоту, бромистоводородную кислоту, серную кислоту, азотную кислоту и фосфорную кислоту. Органические кислоты, из которых могут быть получены соли, включают, например, уксусную кислоту, пропионовую кислоту, гликолевую кислоту, пировиноградную кислоту, щавелевую кислоту, малеиновую кислоту, малоновую кислоту, янтарную кислоту, фумаровую кислоту, винную кислоту, лимонную кислоту, бензойную кислоту, коричную кислоту, миндальную кислоту, метансульфоновую кислоту, этансульфоновую кислоту, п-толуолсульфоновую кислоту и салициловую кислоту. Фармацевтически приемлемые соли присоединения основания могут быть образованы с помощью неорганических и органических оснований. Неорганические основания, из которых могут быть получены соли, включают, например, соли натрия, калия, лития, аммония, кальция, магния, железа, цинка, меди, марганца и алюминия; в частности, предпочтительными являются соли аммония, калия, натрия, кальция и магния. Органические основания, из которых могут быть получены соли, включают, например, первичные, вторичные и третичные амины, замещенные амины, в том числе встречающиеся в природе замещенные амины, циклические амины и основные ионообменные смолы, в частности, такие как изопропиламин, триметиламин, диэтиламин, триэтиламин, трипропиламин и этаноламин. Фармацевтически приемлемые соли по настоящему изобретению можно синтезировать из исходного соединения, основного или кислотного фрагмента, с помощью традиционных химических способов. Как правило, такие соли можно получать путем проведения реакции форм свободной кислоты таких соединений со стехиометрическим количеством подходящего основания (такого как гидроксид, карбонат, бикарбонат Na, Ca, Mg или K или подобных), или путем проведения реакции форм свободного основания таких соединений со стехиометрическим количеством подходящей кислоты. Такие реакции, как правило, проводят в воде, или в органическом растворителе, или в их смеси. Как правило, желательным является применение неводных сред, таких как эфир, этилацетат, этанол, изопропанол или ацетонитрил, где это применимо. Перечни дополнительных подходящих солей можно найти, например, в "Remington's Pharmaceutical Sciences", 20th ed., Mack Publishing Company, Easton, Pa., (1985); и в "Handbook of Pharmaceutical Salts: Properties, Selection, and Use" by Stahl and Wermuth (Wiley-VCH, Вайнхайм, Германия, 2002).
Настоящее изобретение включает все фармацевтически приемлемые изотопно-меченые соединения по настоящему изобретению, т.е. соединения согласно вариантам осуществления с первого по семидесятый, где (1) один или несколько атомов заменены на атомы, характеризующиеся одинаковым атомным числом, но отличающимися атомной массой или массовым числом от атомной массы или массового числа, которые обычно встречаются в природе, и/или (2) изотопное соотношение одного или нескольких атомов отличается от встречающегося в природе соотношения.
Примеры изотопов, подходящих для включения в соединения по настоящему изобретению, включают изотопы водорода, такие как 2H и 3H, углерода, такие как 11C, 13C и 14C, хлора, такой как 36Cl, фтора, такой как 18F, йода, такие как 123I и 125I, азота, такие как 13N и 15N, кислорода, такие как 15O, 17O и 18O, фосфора, такой как 32P, и серы, такой как 35S.
Некоторый изотопно-меченые соединения согласно вариантам осуществления с первого по семидесятый, например соединения, содержащие радиоактивный изотоп, пригодны в исследованиях распределения лекарственного средства и/или субстрата в тканях. Радиоактивные изотопы тритий, т.е. 3H, и углерод-14, т.е. 14C, являются особенно пригодными для данной цели ввиду простоты их включения и доступности средств обнаружения.
Замещение более тяжелыми изотопами, как например дейтерием, т.е. 2H, может обеспечивать определенные терапевтические преимущества, что обусловлено более высокой устойчивостью к инактивации в процессе метаболизма, например увеличение периода полувыведения in vivo или снижение требований в отношении дозировки, и, следовательно, может быть предпочтительным в некоторых случаях. В некоторых соединениях согласно вариантам осуществления с первого по семидесятый остатки R9 или кольцо, образованное комбинацией R8 и R9, могут содержать один или несколько атомов дейтерия для улучшения устойчивости к инактивации в процессе метаболизма соединения in vivo.
Замещение позитронно-активными изотопами, такими как 11C, 18F, 15O и 13N, может быть пригодно в исследованиях с использованием позитронно-эмиссионной томографии (PET) для оценки степени занятости рецепторов субстратом.
Изотопно-меченые соединения согласно вариантам осуществления с первого по семидесятый, как правило, можно получать с помощью традиционных методик, известных специалистам в данной области техники, или посредством способов, аналогичных описанным в сопутствующих примерах и способах получения, с использованием подходящего изотопно-меченого реагента вместо немеченого реагента, используемого ранее.
Фармацевтически приемлемые сольваты в соответствии с настоящим изобретением включают таковые, где растворитель для кристаллизации может быть замещен изотопом, например, D2O, d6-ацетон, d6-DMSO.
Применяемый в данном документе термин "фармацевтически приемлемый носитель" включает любые и все растворители, дисперсионные среды, покрытия, поверхностно-активные вещества, антиоксиданты, консерванты (например, антибактериальные средства, противогрибковые средства), средства для обеспечения изотоничности, замедляющие абсорбцию средства, соли, консерванты, лекарственные средства, стабилизаторы лекарственных средств, связующие средства, вспомогательные вещества, разрыхляющие средства, смазывающие вещества, подслащивающие средства, ароматизирующие средства, красители и подобные материалы и их комбинации, которые будут известны специалисту обычной квалификации в данной области техники (см., например, Remington's Pharmaceutical Sciences, 18th Ed. Mack Printing Company, 1990, pp. 1289-1329). За исключением случаев, когда любой традиционный носитель является несовместимым с активным ингредиентом, предполагается его применение в терапевтических или фармацевтических композициях.
Термин "терапевтически эффективное количество" соединения по настоящему изобретению относится к количеству соединения по настоящему изобретению, которое будет вызывать биологический или медицинский ответ у субъекта, например снижение или подавление активности фермента или белка, или уменьшать тяжесть симптомов, облегчать состояния, замедлять или сдерживать прогрессирование заболевания, или предупреждать развитие заболевания и т.д. В одном неограничивающем варианте осуществления термин "терапевтически эффективное количество" относится к количеству соединения по настоящему изобретению, которое при введении субъекту является эффективным в отношении (1) по меньшей мере частичного облегчения, подавления, предупреждения и/или снижения тяжести состояния, или нарушения, или заболевания, (i) опосредованного его аденозиновым рецептором A2a, или (ii) ассоциированного с аденозином или активностью аденозинового рецептора A2a, или (iii) характеризующегося аномальной активностью аденозинового рецептора A2a; или (2) снижения или подавления активности его аденозинового рецептора A2a. В другом неограничивающем варианте осуществления термин "терапевтически эффективное количество" означает количество соединения формулы I, которое при введении в клетку, или в ткань, или в неклеточный биологический материал, или в среду является эффективным в отношении по меньшей мере частичного снижения или подавления активности рецептора A2a; или по меньшей мере частичного снижения или подавления экспрессии рецептора A2a.
Используемый в данном документе термин "субъект" относится к животному. Предпочтительно, животное является млекопитающим. Субъект также относится, например, к приматам (например, людям), коровам, овцам, козам, лошадям, собакам, кошкам, кроликам, крысам, мышам, рыбам, птицам и т.п. В предпочтительном варианте осуществления субъектом является человек.
Используемые в данном документе термины "ингибирование" или "ингибирующий" относятся к снижению или ослаблению данного состояния, симптома, или нарушения, или заболевания или значительному снижению исходной активности в отношении биологической активности или процесса.
Используемый в данном документе термин "осуществление лечение" или "лечение" любого заболевания или нарушения относится в одном варианте осуществления к снижению тяжести заболевания или нарушения (т.е. замедлению, или остановке, или снижению развития заболевания или по меньшей мере одного из его клинических симптомов). В другом варианте осуществления "осуществление лечения" или "лечение" относятся к облегчению или снижению тяжести по меньшей мере одного физического параметра, в том числе таких, которые могут быть неявными для пациента. В еще одном варианте осуществления "осуществление лечения" или "лечение" означают модулирование заболевания или нарушения либо физически (например, стабилизацию явного симптома), либо физиологически (например, стабилизацию физического параметра), либо включая и то, и другое. В еще одном варианте осуществления "осуществление лечения" или "лечение" относится к предупреждению или задержке возникновения, или развития, или прогрессирования заболевания или нарушения.
Используемые в данном документе термины в форме единственного числа и подобные термины, применяемые в контексте настоящего изобретения (в частности, в контексте формулы изобретения), следует истолковывать как охватывающие как формы единственного числа, так и формы множественного числа, если в данном документе не указано иное или нет явного противоречия по контексту.
Все способы, описанные в данном документе, можно осуществлять в любом подходящем порядке, если в данном документе не указано иное или нет иного явного противоречия по контексту. Использование всех возможных примеров или иллюстративного стиля изложения (например, "такой как"), предоставленных в данном документе, предназначено только для лучшего освещения настоящего изобретения и не предполагает ограничения объема настоящего изобретения, заявленного иным образом.
Соединение по настоящему изобретению получают либо в свободной форме, в виде его соли, либо в виде его пролекарственных производных.
В настоящем изобретении также предусмотрены пролекарства на основе соединений по настоящему изобретению, которые превращаются in vivo в соединения по настоящему изобретению. Пролекарство представляет собой активное или неактивное соединение, которое химически модифицировано посредством физиологического действия in vivo, такого как гидролиз, метаболизм и т.п., в соединение по настоящему изобретению после введения пролекарства субъекту. Пригодность и методики, используемые для изготовления и применения пролекарств, хорошо известны специалистам в данной области техники. Пролекарства можно по существу разделить на две неисключительные категории: пролекарства-биопредшественники и пролекарства-носители. См. The Practice of Medicinal Chemistry, Ch. 31-32 (Ed. Wermuth, Academic Press, San Diego, Calif., 2001). Как правило, пролекарства-биопредшественники представляют собой соединения, которые являются неактивными или обладают низкой активностью по сравнению с соответствующим активным лекарственным соединением, которые содержат одну или несколько защитных групп и превращаются в активную форму посредством метаболизма или сольволиза. Как форма активного лекарственного средства, так и любые высвобожденные продукты метаболизма должны обладать приемлемо низкой токсичностью.
Пролекарства-носители представляют собой лекарственные соединения, которые содержат транспортный фрагмент, например, который улучшает поглощение и/или локализированную доставку к месту(местам) действия. Желательно, чтобы для такого пролекарства-носителя связь между фрагментом лекарственного средства и транспортным фрагментом представляла собой ковалентную связь, пролекарство являлось неактивным или менее активным, чем лекарственное соединение, и любой высвобожденный транспортный фрагмент являлся приемлемо нетоксичным. Для пролекарств, где транспортный фрагмент предназначен для увеличения поглощения, как правило, высвобождение транспортного фрагмента должно быть быстрым. В других случаях желательно использовать фрагмент, который обеспечивает медленное высвобождение, например определенные полимеры или другие фрагменты, такие как циклодекстрины. Пролекарства-носители, например, можно применять для улучшения одного или нескольких из следующих свойств: увеличенная липофильность, увеличенная продолжительность фармакологических эффектов, увеличенная сайт-специфичность, сниженные токсичность и нежелательные реакции и/или улучшение состава на основе лекарственного средства (например, устойчивость, растворимость в воде, подавление нежелательного органолептического или физико-химического свойства). Например, липофильность может быть увеличена путем эстерификации (a) гидроксильных групп липофильными карбоновыми кислотами (например, карбоновой кислотой, содержащей по меньшей мере один липофильный фрагмент).
Иллюстративные пролекарства представляют собой, например, O-ацилпроизводные спиртов или арилспиртов. Предпочтительными являются фармацевтически приемлемые сложноэфирные производные, подвергающиеся превращению путем сольволиза при физиологических условиях. Кроме того, было осуществлено маскирование аминов в виде арилкарбонилоксиметилзамещенных производных, которые расщепляются эстеразами in vivo с высвобождением свободного лекарственного средства и формальдегида (Bundgaard, J. Med. Chem. 2503 (1989)). Более того, было осуществлено маскирование лекарственных средств, содержащих кислотную NH-группу, как например имидазол, имид, индол и т.п., с помощью N-ацилоксиметильных групп (Bundgaard, Design of Prodrugs, Elsevier (1985)). Было осуществлено маскирование гидроксигрупп в виде сложных эфиров и эфиров. В EP 039051 (Sloan и Little) раскрыты пролекарства на основе основания Манниха гидроксамовой кислоты, их получение и применение.
Кроме того, соединения по настоящему изобретению, в том числе их соли, также могут быть получены в форме их гидратов или включают другие растворители, применяемые для их кристаллизации.
Фармацевтическая композиция, комбинация, доза и введение
В другом аспекте в настоящем изобретении предусмотрена фармацевтическая композиция, содержащая соединение по настоящему изобретению и носитель, например фармацевтически приемлемый носитель. Фармацевтическая композиция может быть составлена для конкретных путей введения, таких как пероральное введение, офтальмическое введение (например, местное введение, интравитреальная инъекция, имплантат (в том числе интравитреальный, транссклеральный, субтеноновый и т.п., депо и т.д.) и парентеральное введение и т.д. Кроме того, фармацевтические композиции по настоящему изобретению могут быть изготовлены в твердой форме, в том числе капсулах, таблетках, пилюлях, гранулах, порошках или суппозиториях, или в жидкой форме, в том числе растворах, суспензиях или эмульсиях. Фармацевтические композиции можно подвергать традиционным фармацевтическим технологическим операциям, таким как стерилизация, и/или они могут содержать традиционные инертные разбавители, смазывающие средства или буферные средства, а также вспомогательные средства, такие как консерванты, стабилизаторы, смачивающие средства, эмульгаторы и буферы и т.д.
Как правило, фармацевтические композиции представляют собой таблетки и желатиновые капсулы, содержащие активный ингредиент вместе с
a) разбавителями, например лактозой, декстрозой, сахарозой, маннитом, сорбитом, целлюлозой и/или глицином;
b) смазывающими веществами, например диоксидом кремния, тальком, стеариновой кислотой, ее магниевой или кальциевой солью и/или полиэтиленгликолем; в случае таблеток также со
c) связующими средствами, например алюмосиликатом магния, крахмальной пастой, желатином, трагакантом, метилцеллюлозой, натрий-карбоксиметилцеллюлозой и/или поливинилпирролидоном; при необходимости,
d) разрыхлителями, например видами крахмала, агаром, альгиновой кислотой или ее натриевой солью или шипучими смесями; и/или
e) абсорбентами, красящими веществами, ароматизаторами и подсластителями.
Таблетки могут быть либо покрыты оболочкой, либо покрыты энтеросолюбильным покрытием в соответствии со способами, известными из уровня техники.
Подходящие композиции для перорального введения включают эффективное количество соединения по настоящему изобретению в форме таблеток, пастилок для рассасывания, водных или масляных суспензий, диспергируемых порошков или гранул, эмульсий, твердых или мягких капсул, или сиропов, или настоек. Композиции, предназначенные для перорального применения, получают в соответствии с любым способом, известным из уровня техники, для изготовления фармацевтических композиций, и такие композиции могут содержать одно или несколько средств, выбранных из группы, состоящей из подслащивающих веществ, ароматизирующих средств, красящих средств и консервирующих средств, с целью обеспечения препаратов, которые являются фармацевтически приемлемыми и имеют привлекательный вкус. Таблетки содержат активный ингредиент в смеси с нетоксичными, фармацевтически приемлемыми вспомогательными веществами, которые являются подходящими для изготовления таблеток. Такие вспомогательные вещества представляют собой, например, инертные разбавители, такие как карбонат кальция, карбонат натрия, лактоза, фосфат кальция или фосфат натрия; гранулирующие и разрыхляющие средства, например кукурузный крахмал или альгиновая кислота; связующие средства, например крахмал, желатин или аравийская камедь; и смазывающие средства, например стеарат магния, стеариновая кислота или тальк. Таблетки являются непокрытыми или покрытыми посредством известных методик для замедления распада и абсорбции в желудочно-кишечном тракте и тем самым обеспечения устойчивого действия в течение более длительного периода. Например, можно применять материал для обеспечения замедленного действия, такой как глицерилмоностеарат или глицерилдистеарат. Составы для перорального применения могут быть представлены в виде твердых желатиновых капсул, где активный ингредиент смешивают с инертным твердым разбавителем, например карбонатом кальция, фосфатом кальция или каолином, или в виде мягких желатиновых капсул, где активный ингредиент смешивают с водой или масляной средой, например с арахисовым маслом, жидким парафином или оливковым маслом.
Некоторые композиции для инъекции представляют собой водные изотонические растворы или суспензии, и суппозитории преимущественно получают из жировых эмульсий или суспензий. Указанные композиции могут быть стерилизованы и/или могут содержать вспомогательные средства, такие как консерванты, стабилизирующие, смачивающие или эмульгирующие средства, ускорители растворения, соли для регуляции осмотического давления и/или буферы. Кроме того, они также могут содержать другие терапевтически полезные вещества. Указанные композиции получают в соответствии с традиционными способами смешивания, гранулирования или нанесения покрытия соответственно, и они содержат приблизительно 0,1-75% или содержат приблизительно 1-50% активного ингредиента.
Некоторые композиции для инъекции включают составы в форме глазных имплантатов и глазного депо, которые являются подходящими для внутриглазного, окологлазного, субконъюнктивального и/или субтенонового введения. Как правило, композиции для инъекции содержат соединение согласно вариантам осуществления с первого по семидесятый в комбинации с биологически совместимым или биоразлагаемым полимерным материалом.
В настоящем изобретении дополнительно предусмотрены безводные фармацевтические композиции и лекарственные формы, содержащие соединения по настоящему изобретению в качестве активных ингредиентов, поскольку вода может содействовать разрушению некоторых соединений.
Безводные фармацевтические композиции и лекарственные формы по настоящему изобретению можно получать с применением безводных ингредиентов или ингредиентов с низким содержанием влаги и условий с низким содержанием влаги или низкой влажностью. Безводную фармацевтическую композицию можно получать и хранить таким образом, чтобы сохранялась ее безводная природа. Соответственно, безводные композиции предпочтительно упаковывают с применением материалов, которые, как известно, предотвращают воздействие воды, так чтобы их можно было включать в подходящие рецептурные наборы. Примеры подходящей упаковки включают без ограничения герметично закрытые виды фольги, пластиковые материалы, контейнеры с однократной дозой (например флаконы), блистерные упаковки и контурные безъячейковые упаковки.
В настоящем изобретении дополнительно предусмотрены фармацевтические композиции и лекарственные формы, которые содержат одно или несколько средств, которые снижают скорость, с которой соединение по настоящему изобретению в качестве активного ингредиента будет распадаться. Такие средства, которые упоминаются в данном документе как "стабилизаторы", включают без ограничения антиоксиданты, такие как аскорбиновая кислота, буферы для регулирования pH или солевые буферы и т.д.
В предпочтительном варианте осуществления 1-(4-амино-5-бром-6-(1H-пиразол-1-ил)пиримидин-2-ил)-1H-пиразол-4-ол или фармацевтически приемлемая соль для применения в лечении рака предназначены для введения парентеральным или пероральным путем, предпочтительно пероральным путем.
Фармацевтическая композиция или комбинация по настоящему изобретению может быть представлена в однократной дозировке, составляющей приблизительно 1-1000 мг активного(активных) ингредиента(ингредиентов) для субъекта весом приблизительно 50-70 кг, или приблизительно 1-500 мг, или приблизительно 1-250 мг, или приблизительно 1-150 мг, или приблизительно 0,5-100 мг, или приблизительно 1-50 мг активных ингредиентов. Терапевтически эффективная доза соединения, фармацевтической композиции или их комбинаций зависит от вида субъекта, веса тела, возраста и индивидуального состояния, нарушения или заболевания, лечение которых осуществляют, или их тяжести. Лечащий врач, клиницист или ветеринар обычной квалификации может легко определить эффективное количество каждого из активных ингредиентов, необходимое для предупреждения, лечения или ингибирования прогрессирования нарушения или заболевания.
Вышеупомянутые параметры дозировки являются очевидными в тестах in vitro и in vivo с применением преимущественно млекопитающих, например мышей, крыс, собак, нечеловекообразных обезьян или выделенных органов, тканей и их препаратов. Соединения по настоящему изобретению можно применять in vitro в виде растворов, например, предпочтительно водных растворов, и in vivo либо энтерально, либо парентерально, преимущественно внутривенно, например в виде суспензии или водного раствора. Доза in vitro может находиться в диапазоне молярной концентрации от приблизительно 10-3 моль/л до 10-9 моль/л. Терапевтически эффективное количество in vivo в зависимости от пути введения может находиться в диапазоне приблизительно 0,1-500 мг/кг или приблизительно 1-100 мг/кг.
В других вариантах осуществления предусматривается фармацевтическая композиция, которая содержит по меньшей мере одно соединение в соответствии с вариантами осуществления от первого по семидесятый и по меньшей мере один носитель.
Терапевтические наборы
В одном варианте осуществления в настоящем изобретении предусматривается набор, содержащий две или более отдельных фармацевтических композиций, по меньшей мере одна из которых содержит соединение формулы (I). В одном варианте осуществления набор содержит средства для раздельного содержания указанных композиций, такие как контейнер, разделенная бутылка или разделенный пакет из фольги. Примером такого набора является блистерная упаковка, как правило, применяемая для упаковки таблеток, капсул и т.п.
Набор по настоящему изобретению можно применять для введения различных лекарственных форм, например для перорального и парентерального применения, для введения отдельных композиций с различными интервалами между введениями доз или для титрования отдельных композиций одна относительно другой. В целях содействия соблюдению режима лечения набор по настоящему изобретению, как правило, содержит инструкции по введению.
В видах комбинированной терапии по настоящему изобретению соединение формулы I и другое иммунотерапевтическое средство могут быть изготовлены и/или составлены одними и теми же или различными производителями. Более того, соединение по настоящему изобретению и другое терапевтическое средство можно объединять в комбинированной терапии (i) до того, как комбинированный продукт попадает к лечащим врачам (например, в случае набора, содержащего соединение по настоящему изобретению и другое терапевтическое средство); (ii) самими лечащими врачами (или под наблюдением лечащего врача) незадолго до введения; (iii) в самих пациентах, например, в ходе последовательного введения соединения по настоящему изобретению и другого терапевтического средства.
Соответственно, в настоящем изобретении предусматривается применение 1-(4-амино-5-бром-6-(1H-пиразол-1-ил)пиримидин-2-ил)-1H-пиразол-4-ола или его фармацевтически приемлемой соли для лечения рака, где лекарственный препарат получают для осуществления введения с другим иммунотерапевтическим средством. В настоящем изобретении также предусматривается применение иммунотерапевтического средства для лечения рака, где лекарственный препарат вводят с 1-(4-амино-5-бром-6-(1H-пиразол-1-ил)пиримидин-2-ил)-1H-пиразол-4-олом или его фармацевтически приемлемой солью.
В настоящем изобретении также предусматривается 1-(4-амино-5-бром-6-(1H-пиразол-1-ил)пиримидин-2-ил)-1H-пиразол-4-ол или его фармацевтически приемлемая соль для применения в способе лечения рака, где 1-(4-амино-5-бром-6-(1H-пиразол-1-ил)пиримидин-2-ил)-1H-пиразол-4-ол получают для осуществления введения с другим иммунотерапевтическим средством. В настоящем изобретении также предусматривается другое иммунотерапевтическое средство для применения в способе лечения рака, где другое иммунотерапевтическое средство получают для осуществления введения с 1-(4-амино-5-бром-6-(1H-пиразол-1-ил)пиримидин-2-ил)-1H-пиразол-4-олом. В настоящем изобретении также предусматривается 1-(4-амино-5-бром-6-(1H-пиразол-1-ил)пиримидин-2-ил)-1H-пиразол-4-ол для применения в способе лечения рака, где 1-(4-амино-5-бром-6-(1H-пиразол-1-ил)пиримидин-2-ил)-1H-пиразол-4-ол вводится с другим иммунотерапевтическим средством. В настоящем изобретении также предусматривается другое иммунотерапевтическое средство для применения в способе лечения рака, где другое терапевтическое средство вводится с 1-(4-амино-5-бром-6-(1H-пиразол-1-ил)пиримидин-2-ил)-1H-пиразол-4-олом.
В настоящем изобретении также предусматривается применение 1-(4-амино-5-бром-6-(1H-пиразол-1-ил)пиримидин-2-ил)-1H-пиразол-4-ола для лечения рака, где пациент ранее (например в течение 24 часов) получал лечение с помощью другого иммунотерапевтического средства. В настоящем изобретении также предусматривается применение другого иммунотерапевтического средства для лечения рака, где пациент ранее (например в течение 24 часов) получал лечение с помощью 1-(4-амино-5-бром-6-(1H-пиразол-1-ил)пиримидин-2-ил)-1H-пиразол-4-ола или его фармацевтически приемлемой соли.
Комбинированная терапия
В одном варианте осуществления фармацевтическая комбинация (или комбинированный продукт) содержит соединение формулы (I) или его фармацевтически приемлемую соль или сокристалл и одно или несколько иммунотерапевтических средств, выбранных из группы, состоящей из антител к CTLA4, таких как ипилимумаб и тремелимумаб, антител к PD-1, таких как MDX-1106 (ниволумаб), MK3475 (пембролизумаб), CT-011 (пидилизумаб), AMP-224, AMP-514 (MEDI0680 Medimmune) или молекула антитела к PD-1, описанная в WO 2015/112900 (US 2015/0210769); и антител к PD-L1, таких как MPDL3280A, MEDI4736, MSB0010718C (Merch Sorono), YW243.55.S70, MDX-1105 или молекулы антитела к PD-L1, раскрытого в US 2016/0108123, поданной 13 октября 2015 г. под названием "Молекулы антител к PD-L1 и варианты их применения".
Компоненты комбинированного продукта находятся в одном и том же составе или в отдельных составах.
В предпочтительном варианте осуществления комбинированный продукт содержит соединение формулы (I) или его фармацевтически приемлемую соль или сокристалл и одно или несколько иммунотерапевтических средств, пригодных в лечении рака, конкретно в иммунотерапевтическом лечении рака, при этом такое средство выбрано из группы, состоящей из антител к PD-1, таких как MDX-1106, MK3475, CT-011, AMP-224 или молекула антитела к PD-1, описанная в WO 2015/112900 (US 2015/0210769); и антител к PD-L1, таких как MPDL3280A, MEDI4736, MDX-1105 или молекулы антитела к PD-L1, раскрытого в US 2016/0108123.
Примеры молекулы антитела к PD-1
В предпочтительном варианте осуществления комбинированный продукт содержит соединение формулы (I) или его фармацевтически приемлемую соль или сокристалл и молекулу антитела к PD-1, как например антител, описанных в данном документе.
PD-1 является представителем семейства CD28/CTLA-4, который экспрессируется, например, на активированных Т-клетках CD4+ и CD8+, Treg и В-клетках. Он осуществляет отрицательную регуляцию передачи сигнала в эффекторных Т-клетках и их функционирования. PD-1 индуцируется на Т-клетках, инфильтрирующих опухоль, и может приводить к их функциональному истощению или дисфункции (Keir et al. (2008) Annu. Rev. Immunol. 26:677-704; Pardoll et al., (2012) Nat Rev Cancer 12(4):252-64). PD-1 подает коингибирующий сигнал при связывании с любым из двух своих лигандов, представляющих собой лиганд 1 программируемой смерти клеток (PD-L1) или лиганд 2 программируемой смерти клеток (PD-L2). PD-L1 экспрессируется на клетках ряда типов, в том числе на Т-клетках, естественных клетках-киллерах (NK), макрофагах, дендритных клетках (DC), В-клетках, эпителиальных клетках, клетках эндотелия сосудов, а также во многих типах опухолей. Высокий уровень экспрессии PD-L1 в опухолях мыши и человека был связан с неблагоприятными клиническими исходами при различных видах рака (Keir et al., (2008) Annu. Rev. Immunol. 26:677-704; Pardoll et al., (2012) Nat Rev Cancer 12(4):252-64). PD-L2 экспрессируется на дендритных клетках, макрофагах и в некоторых опухолях. Блокировка сигнального пути PD-1 была утверждена в доклинических и клинических исследованиях в качестве иммунотерапии рака. Как доклинические, так и клинические исследования продемонстрировали, что блокировка PD-1 может обеспечивать восстановление активности эффекторных Т-клеток и приводит к устойчивому противоопухолевому ответу. Например, блокировка сигнального пути PD-1 может обеспечивать восстановление функции истощенных/дисфункциональных эффекторных Т-клеток (например, пролиферации, секреции IFN-γ или цитолитической функции) и/или ингибирование функции Treg-клеток (Keir et al., (2008) Annu. Rev. Immunol. 26:677-704; Pardoll et al., (2012) Nat Rev Cancer 12(4):252-64). Блокада сигнального пути PD-1 может быть осуществлена с помощью антитела, его антигенсвязывающего фрагмента, иммуноадгезина, слитого белка или олигопептида PD-1, PD-L1 и/или PD-L2.
В одном варианте осуществления ингибитор PD-1 представляет собой молекулу антитела к PD-1. В одном варианте осуществления ингибитор PD-1 представляет собой молекулу антитела к PD-1, как описано в US 2015/0210769, опубликованном 30 июля 2015 г. под названием "Молекулы антител к PD-1 и варианты их применения", включенном посредством ссылки во всей своей полноте.
В одном варианте осуществления молекула антитела к PD-1 содержит по меньшей мере одну, две, три, четыре, пять или шесть определяющих комплементарность областей (CDR) (или в совокупности все CDR) из вариабельной области тяжелой и легкой цепи, содержащих аминокислотную последовательность, показанную в таблице A (например, из последовательностей вариабельной области тяжелой и легкой цепи BAP049-Клон-E или BAP049-Клон-B, раскрытых в таблице A), или кодируемую нуклеотидной последовательностью, показанной в таблице A. В некоторых вариантах осуществления CDR находятся в соответствии с определением по Kabat (например, как указано в таблице A). В некоторых вариантах осуществления CDR находятся в соответствии с определением по Chothia (например, как указано в таблице A). В некоторых вариантах осуществления CDR находятся в соответствии с комбинированными определениями CDR как по Kabat, так и по Chothia (например, как указано в таблице A). В одном варианте осуществления CDR1 VH согласно комбинации определений CDR по Kabat и Chothia содержит аминокислотную последовательность GYTFTTYWMH (SEQ ID NO: 41). В одном варианте осуществления одна или несколько CDR (или в совокупности все CDR) имеют одно, два, три, четыре, пять, шесть или больше изменений, например, аминокислотных замен (например, консервативных аминокислотных замен) или делеций, по сравнению с аминокислотной последовательностью, показанной в таблице A, или кодируемой нуклеотидной последовательностью, показанной в таблице A.
В одном варианте осуществления молекула антитела к PD-1 содержит вариабельную область тяжелой цепи (VH), содержащую аминокислотную последовательность VHCDR1 под SEQ ID NO: 1, аминокислотную последовательность VHCDR2 под SEQ ID NO: 2 и аминокислотную последовательность VHCDR3 под SEQ ID NO: 3; и вариабельную область легкой цепи (VL), содержащую аминокислотную последовательность VLCDR1 под SEQ ID NO: 10, аминокислотную последовательность VLCDR2 под SEQ ID NO: 11 и аминокислотную последовательность VLCDR3 под SEQ ID NO: 12, каждая из которых раскрыта в таблице A.
В одном варианте осуществления молекула антитела содержит VH, содержащую VHCDR1, кодируемую нуклеотидной последовательностью под SEQ ID NO: 24, VHCDR2, кодируемую нуклеотидной последовательностью под SEQ ID NO: 25, и VHCDR3, кодируемую нуклеотидной последовательностью под SEQ ID NO: 26; и VL, содержащую VLCDR1, кодируемую нуклеотидной последовательностью под SEQ ID NO: 29, VLCDR2, кодируемую нуклеотидной последовательностью под SEQ ID NO: 30, и VLCDR3, кодируемую нуклеотидной последовательностью под SEQ ID NO: 31, каждая из которых раскрыта в таблице A.
В одном варианте осуществления молекула антитела к PD-1 содержит VH, содержащую аминокислотную последовательность под SEQ ID NO: 6 или аминокислотную последовательность, идентичную на по меньшей мере 85%, 90%, 95% или 99% или больше SEQ ID NO: 6. В одном варианте осуществления молекула антитела к PD-1 содержит VL, содержащую аминокислотную последовательность под SEQ ID NO: 20 или аминокислотную последовательность, идентичную на по меньшей мере 85%, 90%, 95% или 99% или больше SEQ ID NO: 20. В одном варианте осуществления молекула антитела к PD-1 содержит VL, содержащую аминокислотную последовательность под SEQ ID NO: 16 или аминокислотную последовательность, идентичную на по меньшей мере 85%, 90%, 95% или 99% или больше SEQ ID NO: 16. В одном варианте осуществления молекула антитела к PD-1 содержит VH, содержащую аминокислотную последовательность под SEQ ID NO: 6, и VL, содержащую аминокислотную последовательность под SEQ ID NO: 20. В одном варианте осуществления молекула антитела к PD-1 содержит VH, содержащую аминокислотную последовательность под SEQ ID NO: 6, и VL, содержащую аминокислотную последовательность под SEQ ID NO: 16.
В одном варианте осуществления молекула антитела содержит VH, кодируемую нуклеотидной последовательностью под SEQ ID NO: 7 или нуклеотидной последовательностью, идентичной на по меньшей мере 85%, 90%, 95% или 99% или больше SEQ ID NO: 7. В одном варианте осуществления молекула антитела содержит VL, кодируемую нуклеотидной последовательностью под SEQ ID NO: 21 или 17 или нуклеотидной последовательностью, идентичной на по меньшей мере 85%, 90%, 95% или 99% или больше SEQ ID NO: 21 или 17. В одном варианте осуществления молекула антитела содержит VH, кодируемую нуклеотидной последовательностью под SEQ ID NO: 7, и VL, кодируемую нуклеотидной последовательностью под SEQ ID NO: 21 или 17.
В одном варианте осуществления молекула антитела к PD-1 содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 8 или аминокислотную последовательность, идентичную на по меньшей мере 85%, 90%, 95% или 99% или больше SEQ ID NO: 8. В одном варианте осуществления молекула антитела к PD-1 содержит легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 22 или аминокислотную последовательность, идентичную на по меньшей мере 85%, 90%, 95% или 99% или больше SEQ ID NO: 22. В одном варианте осуществления молекула антитела к PD-1 содержит легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 18 или аминокислотную последовательность, идентичную на по меньшей мере 85%, 90%, 95% или 99% или больше SEQ ID NO: 18. В одном варианте осуществления молекула антитела к PD-1 содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 8, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 22. В одном варианте осуществления молекула антитела к PD-1 содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 8, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 18.
В одном варианте осуществления молекула антитела содержит тяжелую цепь, кодируемую нуклеотидной последовательностью под SEQ ID NO: 9 или нуклеотидной последовательностью, идентичной на по меньшей мере 85%, 90%, 95% или 99% или больше SEQ ID NO: 9. В одном варианте осуществления молекула антитела содержит легкую цепь, кодируемую нуклеотидной последовательностью под SEQ ID NO: 23 или 19 или нуклеотидной последовательностью, идентичной на по меньшей мере 85%, 90%, 95% или 99% или больше SEQ ID NO: 23 или 19. В одном варианте осуществления молекула антитела содержит тяжелую цепь, кодируемую нуклеотидной последовательностью под SEQ ID NO: 9, и легкую цепь, кодируемую нуклеотидной последовательностью под SEQ ID NO: 23 или 19.
Молекулы антител, описанные в данном документе, можно получать с использованием векторов, клеток-хозяев и способов, описанных в US 2015/0210769, включенном посредством ссылки во всей своей полноте.
Определения
Области VH и VL можно подразделить на области гипервариабельности, называемые "определяющими комплементарность областями" (CDR), которые чередуются с областями, являющимися более консервативными, называемыми "каркасными областями" (FR или FW).
Размеры каркасной области и CDR были точно определены с помощью ряда способов (см. Kabat, E. A., et al., (1991) Sequences of Proteins of Immunological Interest, Fifth Edition, U.S. Department of Health and Human Services, NIH Publication No. 91-3242; Chothia, C. et al., (1987) J. Mol. Biol. 196:901-917; и определения AbM, используемого в программном обеспечении Oxford Molecular's AbM для моделирования антител. См. в целом, например, Protein Sequence and Structure Analysis of Antibody Variable Domains. В Antibody Engineering Lab Manual (Ed.: Duebel, S. and Kontermann, R., Springer-Verlag, Heidelberg).
Термины "определяющая комплементарность область" и "CDR", используемые в данном документе, относятся к последовательностям аминокислот в вариабельных областях антитела, которые придают антигенную специфичность и аффинность связывания. Как правило, в каждой вариабельной области тяжелой цепи присутствуют три CDR (HCDR1, HCDR2, HCDR3), и в каждой вариабельной области легкой цепи присутствуют три CDR (LCDR1, LCDR2, LCDR3).
Точные границы аминокислотной последовательности данной CDR могут быть определены с использованием любой из ряда хорошо известных схем, в том числе описанных в Kabat et al., (1991), "Sequences of Proteins of Immunological Interest," 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (схема нумерации в соответствии с "Kabat"), Al-Lazikani et al., (1997) JMB 273,927-948 (схема нумерации в соответствии с "Chothia"). Как используется в данном документе, CDR, определенные согласно схеме нумерации "Chothia", также иногда называют "гипервариабельными петлями".
Например, согласно Kabat аминокислотные остатки CDR в вариабельном домене тяжелой цепи (VH) нумеруются 31-35 (HCDR1), 50-65 (HCDR2) и 95-102 (HCDR3); а аминокислотные остатки CDR в вариабельном домене легкой цепи (VL) нумеруются 24-34 (LCDR1), 50-56 (LCDR2) и 89-97 (LCDR3). Согласно Chothia аминокислоты CDR в VH нумеруются 26-32 (HCDR1), 52-56 (HCDR2) и 95-102 (HCDR3); а аминокислотные остатки в VL нумеруются 26-32 (LCDR1), 50-52 (LCDR2) и 91-96 (LCDR3). Объединяя определения CDR по Kabat и по Chothia, CDR состоят из аминокислотных остатков 26-35 (HCDR1), 50-65 (HCDR2) и 95-102 (HCDR3) в VH человека и аминокислотных остатков 24-34 (LCDR1), 50-56 (LCDR2) и 89-97 (LCDR3) в VL человека.
Как правило, если конкретно не указано иное, молекулы антитела к PD-1 могут содержать любую комбинацию одной или нескольких CDR по Kabat и/или CDR по Chothia, например, описанных в таблице A. В одном варианте осуществления для молекул антитела к PD-1, описанных в таблице A, используются следующие определения: HCDR1 в соответствии с комбинированными определениями CDR как по Kabat, так и по Chothia, и HCCDR 2-3 и LCCDR 1-3 в соответствии с определением CDR по Kabat. Согласно всем определениям, каждая из VH и VL, как правило, содержит три CDR и четыре FR, расположенные от аминоконца к карбоксиконцу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4.
Расчеты гомологии или идентичности последовательностей между последовательностями (термины используются в данном документе взаимозаменяемо) выполняют следующим образом.
Чтобы определить процентную идентичность двух аминокислотных последовательностей или двух последовательностей нуклеиновых кислот, последовательности выравнивают в целях оптимального сравнения (например, для оптимального выравнивания можно вводить гэпы в одну или обе из первой и второй аминокислотной последовательности или последовательности нуклеиновых кислот, и негомологичные последовательности могут не учитываться в целях сравнения). В предпочтительном варианте осуществления длина эталонной последовательности, выровненной в целях сравнения, составляет по меньшей мере 30%, предпочтительно по меньшей мере 40%, более предпочтительно по меньшей мере 50%, 60% и еще более предпочтительно по меньшей мере 70%, 80%, 90%, 100% длины эталонной последовательности. Затем сравнивают аминокислотные остатки или нуклеотиды в соответствующих аминокислотных положениях или нуклеотидных положениях. Когда положение в первой последовательности занято тем же аминокислотным остатком или нуклеотидом, что и соответствующее положение во второй последовательности, тогда молекулы являются идентичными в данном положении (как используется в данном документе, "идентичность" аминокислоты или нуклеиновой кислоты эквивалентна "гомологии" аминокислоты или нуклеиновой кислоты).
Процентная идентичность двух последовательностей зависит от числа идентичных положений, общих для последовательностей, при этом учитывается число гэпов и длина каждого гэпа, которые необходимо ввести для оптимального выравнивания двух последовательностей.
Сравнение последовательностей и определение процентной идентичности двух последовательностей можно осуществлять с применением математического алгоритма. В предпочтительном варианте осуществления процентную идентичность двух аминокислотных последовательностей определяют с помощью алгоритма Нидлмана-Вунша ((1970) J. Mol. Biol. 48:444-453), который был включен в программу GAP в составе пакета программного обеспечения GCG (доступного на www.gcg.com), с применением либо матрицы Blossom 62, либо матрицы PAM250, а также штрафа за открытие гэпа, составляющего 16, 14, 12, 10, 8, 6 или 4, и штрафа за продление гэпа, составляющего 1, 2, 3, 4, 5 или 6. В еще одном предпочтительном варианте осуществления процентную идентичность между двумя нуклеотидными последовательностями определяют с применением программы GAP в пакете программного обеспечения GCG (доступного на www.gcg.com) с применением матрицы NWSgapdna.CMP и штрафа за открытие гэпа, составляющего 40, 50, 60, 70 или 80, и штрафа за продление гэпа, составляющего 1, 2, 3, 4, 5 или 6. Особенно предпочтительным набором параметров (и тем, который следует применять, если не указано иное) является матрица весов Blossum 62 со штрафом за открытие гэпа 12, штрафом за продление гэпа 4 и штрафом за сдвиг рамки гэпа 5.
Процентную идентичность двух аминокислотных или нуклеотидных последовательностей можно определить с помощью алгоритма E. Meyers и W. Miller ((1989) CABIOS, 4:11-17), который был включен в программу ALIGN (версия 2.0), с применением таблицы весов замен остатков PAM120, штрафа за продление гэпа 12 и штрафа за открытие гэпа 4.
Последовательности нуклеиновой кислоты и белка, описанные в данном документе, можно применять в качестве "запрашиваемой последовательности" для проведения поиска в общедоступных базах данных, например, для идентификации других представителей семейства или родственных последовательностей. Такие поиски можно выполнять с применением программ NBLAST и XBLAST (версия 2.0) Altschul, et al., (1990) J. Mol. Biol. 215:403-10. Поиски нуклеотидов посредством BLAST можно выполнять с помощью программы NBLAST, оценка=100, длина слова=12, чтобы получить нуклеотидные последовательности, гомологичные молекулам нуклеиновой кислоты по настоящему изобретению. Поиски белка посредством BLAST можно выполнять с помощью программы XBLAST, оценка=50, длина слова=3, чтобы получить аминокислотные последовательности, гомологичные молекулам белка по настоящему изобретению. Для получения выравниваний с гэпами в целях сравнения можно использовать Gapped BLAST, как описано в Altschul et al., (1997) Nucleic Acids Res. 25:3389-3402. При использовании программ BLAST и Gapped BLAST можно применять параметры по умолчанию из соответствующих программ (например, XBLAST и NBLAST). См. www.ncbi.nlm.nih.gov.
"Консервативная аминокислотная замена" представляет собой замену, при которой аминокислотный остаток замещается аминокислотным остатком, имеющим сходную боковую цепь. Семейства аминокислотных остатков, имеющих сходные боковые цепи, были определены в уровне техники. Эти семейства включают аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин), кислыми боковыми цепями (например, аспарагиновая кислота, глутаминовая кислота), незаряженными полярными боковыми цепями (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин), неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан), бета-разветвленными боковыми цепями (например, треонин, валин, изолейцин) и ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан, гистидин).
Таблица A. Аминокислотные и нуклеотидные последовательности иллюстративных молекул антител к PD-1
Другие иллюстративные ингибиторы PD-1
В одном варианте осуществления молекула антитела к PD-1 представляет собой ниволумаб (Bristol-Myers Squibb), также известный как MDX-1106, MDX-1106-04, ONO-4538, BMS-936558 или OPDIVO®. Ниволумаб (клон 5C4) и другие антитела к PD-1 раскрыты в US 8008449 и WO 2006/121168, включенных посредством ссылки во всей своей полноте. В одном варианте осуществления молекула антитела к PD-1 содержит одну или несколько из последовательностей CDR (или в совокупности все из последовательностей CDR), последовательность вариабельной области тяжелой цепи или легкой цепи или последовательность тяжелой цепи или легкой цепи ниволумаба, например, как раскрыто в таблице B.
В одном варианте осуществления молекула антитела к PD-1 представляет собой пембролизумаб (Merck & Co), также известный как ламбролизумаб, MK-3475, MK03475, SCH-900475 или KEYTRUDA®. Пембролизумаб и другие антитела к PD-1 раскрыты в Hamid, O. et al., (2013) New England Journal of Medicine 369 (2): 134-44, US 8354509 и WO 2009/114335, включенных посредством ссылки во всей своей полноте. В одном варианте осуществления молекула антитела к PD-1 содержит одну или несколько из последовательностей CDR (или в совокупности все из последовательностей CDR), последовательность вариабельной области тяжелой цепи или легкой цепи или последовательность тяжелой цепи или легкой цепи пембролизумаба, например, как раскрыто в таблице B.
В одном варианте осуществления молекула антитела к PD-1 представляет собой пидилизумаб (CureTech), также известный как CT-011. Пидилизумаб и другие антитела к PD-1 раскрыты в Rosenblatt, J. et al., (2011) J Immunotherapy 34(5): 409-18, US 7695715, US 7332582 и US 8686119, включенных посредством ссылки во всей своей полноте. В одном варианте осуществления молекула антитела к PD-1 содержит одну или несколько из последовательностей CDR (или в совокупности все из последовательностей CDR), последовательность вариабельной области тяжелой цепи или легкой цепи или последовательность тяжелой цепи или легкой цепи пидилизумаба, например, как раскрыто в таблице B.
В одном варианте осуществления молекула антитела к PD-1 представляет собой MEDI0680 (Medimmune), также известное как AMP-514. MEDI0680 и другие антитела к PD-1 раскрыты в US 9205148 и WO 2012/145493, включенных посредством ссылки во всей своей полноте. В одном варианте осуществления молекула антитела к PD-1 содержит одну или несколько из последовательностей CDR (или в совокупности все из последовательностей CDR), последовательность вариабельной области тяжелой цепи или легкой цепи или последовательность тяжелой цепи или легкой цепи MEDI0680.
Дополнительные известные антитела к PD-1 включают таковые, описанные, например, в WO 2015/112800, WO 2016/092419, WO 2015/085847, WO 2014/179664, WO 2014/194302, WO 2014/209804, WO 2015/200119, US 8735553, US 7488802, US 8927697, US 8993731 и US 9102727, включенных посредством ссылки во всей своей полноте.
В одном варианте осуществления антитело к PD-1 представляет собой антитело, которое конкурирует за связывание и/или связывает тот же эпитоп на PD-1, как и одно из антител к PD-1, описанных в данном документе.
В одном варианте осуществления ингибитор PD-1 представляет собой пептид, который ингибирует сигнальный путь с участием PD-1, например, как описано в US 8907053, включенном посредством ссылки во всей своей полноте. В одном варианте осуществления ингибитор PD-1 представляет собой иммуноадгезин (например, иммуноадгезин, который содержит внеклеточную или PD-1-связывающую часть PD-L1 или PD-L2, слитую с константной областью (например, Fc-область последовательности иммуноглобулина)). В одном варианте осуществления ингибитор PD-1 представляет собой AMP-224 (B7-DCIg (Amplimmune), например, раскрытый в WO 2010/027827 и WO 2011/066342, включенных посредством ссылки во всей своей полноте).
Таблица B. Аминокислотные последовательности других иллюстративных молекул антител к PD-1
Пример молекулы антитела к PD-L1
В одном варианте осуществления комбинированный продукт содержит соединение формулы (I) или его фармацевтически приемлемую соль или сокристалл и молекулу антитела к PD-L1, как например антител, описанных в данном документе.
Лиганд 1 программируемой смерти клеток (PD-L1) был описан как лиганд иммуноингибирующего рецептора 1 программируемой смерти клеток (PD-1). Связывание PD-L1 с PD-1 приводит к подавлению опосредованной T-клеточным рецептором пролиферации лимфоцитов и секреции цитокинов (Freeman et al., (2000) J Exp Med 192:1027-34). Таким образом, блокирование PD-L1 может привести к усилению противоопухолевого иммунитета.
Несколько типов клеток экспрессируют PD-L1. Например, PD-L1 экспрессируется на активированных T-клетках, дендритных клетках (DC), естественных клетках-киллерах (NK), макрофагах, B-клетках, моноцитах и клетках эндотелия сосудов. PD-L1 экспрессируется при множестве видов рака, включая карциному легкого, яичника и толстой кишки человека и различные виды миеломы (Iwai et al., (2002) PNAS 99:12293-7; Ohigashi et al., (2005) Clin Cancer Res 11:2947-53; Okazaki et al. (2007) Intern. Immun. 19:813-24; Thompson et al., (2006) Cancer Res. 66:3381-5). Экспрессия PD-L1 сильно коррелирует с неблагоприятным прогнозом для различных типов рака, в том числе рака почки, яичника, мочевого пузыря, молочной железы, желудка и поджелудочной железы.
Множество инфильтрирующих опухоль T-лимфоцитов преимущественно экспрессируют PD-1 по сравнению с T-лимфоцитами в нормальных тканях и T-лимфоцитами периферической крови. Это указывает на то, что активация PD-1 на опухолереактивных T-клетках может содействовать нарушению противоопухолевых иммунных ответов (Ahmadzadeh et al., (2009) Blood 114:1537-44). Таким образом, передача сигнала с участием PD-L1, опосредуемая экспрессирующими PD-L1 опухолевыми клетками, взаимодействующими с экспрессирующими PD-1 T-клетками, может приводить к аттенуации активации T-клеток и ускользанию от иммунного надзора (Sharpe et al., (2002) Nat Rev Immunol. 2:116-26; Keir et al., (2008) Annu Rev Immunol. 26:677-704). Блокирование PD-1 может подавлять распространение в крови недостаточно иммуногенных опухолевых клеток путем усиления рекрутирования эффекторных Т-клеток (Iwai et al., (2005) Int. Immunol. 17:133-144).
Антитело к PD-L1 может усиливать T-клеточный иммунитет, например, посредством блокирования его ингибирующих взаимодействий как с PD-1, так и B7-1. Антитело к PD-1 также может обеспечивать осуществление иммунной регуляции посредством PD-L2/PD-1. Как PD-1, так и B7-1 экспрессируются на T-клетках, B-клетках, DC и макрофагах, что обеспечивает возможность двусторонних взаимодействий между B7-1 и PD-L1 на таких типах клеток. PD-L1 на клетках, не являющихся гемопоэтическими, может взаимодействовать с B7-1, а также PD-1 на T-клетках.
В некоторых вариантах осуществления молекула антитела к PD-L1 выбрана из YW243.55.S70, MPDL3280A, MEDI-4736, MSB-0010718C или MDX-1105.
В некоторых вариантах осуществления антитело к PD-L1 представляет собой MSB0010718C. MSB0010718C (также обозначаемое как A09-246-2; Merck Serono) представляет собой моноклональное антитело, которое связывается с PD-L1. MSB0010718C и другие гуманизированные антитела к PD-L1 раскрыты в WO 2013/079174 и характеризуются последовательностью, раскрытой в данном документе (или последовательностью, по сути идентичной или подобной ей, например, последовательностью, на по меньшей мере 85%, 90%, 95% или больше идентичной указанной последовательности). Аминокислотные последовательности тяжелой и легкой цепей MSB0010718C включают по меньшей мере следующие:
тяжелая цепь (SEQ ID NO: 24, раскрытая в WO 2013/079174)
EVQLLESGGGLVQPGGSLRLSCAASGFTFSSYIMMWVRQAPGKGLEWVSSIYPSGGITFYADKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARIKLGTVTTVDYWGQGTLVTVSS (SEQ ID NO: 42)
легкая цепь (SEQ ID NO: 25, раскрытая в WO 2013/079174)
QSALTQPASVSGSPGQSITISCTGTSSDVGGYNYVSWYQQHPGKAPKLMIYDVSN RPSGVSNRFSGSKSGNTASLTISGLQAEDEADYYCSSYTSSSTRVFGTGTKVTVL (SEQ ID NO: 43)
В одном варианте осуществления ингибитор PD-L1 представляет собой YW243.55.S70. Антитело YW243.55.S70 представляет собой антитело к PD-L1, описанное в WO 2010/077634 (последовательности вариабельных областей тяжелой и легкой цепей показаны под SEQ ID NO: 20 и 21 соответственно), и характеризуется последовательностью, раскрытой в нем (или последовательностью, по сути идентичной или подобной ей, например, последовательностью, на по меньшей мере 85%, 90%, 95% или больше идентичной указанной последовательности).
В одном варианте осуществления ингибитор PD-L1 представляет собой MDX-1105. MDX-1105, также известное как BMS-936559, представляет собой антитело к PD-L1, описанное в WO 2007/005874, и характеризуется последовательностью, раскрытой в нем (или последовательностью, по сути идентичной или подобной ей, например, последовательностью, на по меньшей мере 85%, 90%, 95% или больше идентичной указанной последовательности).
В одном варианте осуществления ингибитор PD-L1 представляет собой MDPL3280A (Genentech/Roche). MDPL3280A представляет собой моноклональное антитело IgG1 человека с оптимизированной Fc, которое связывается с PD-L1. MDPL3280A и другие моноклональные антитела к PD-L1 человека раскрыты в патенте США № 7943743 и публикации заявки на патент США № 20120039906.
В другом варианте осуществления ингибитор PD-L1 представляет собой молекулу антитела к PD-L1, раскрытую в US 2016/0108123, поданном 13 октября 2015 г. под названием "Молекулы антител к PD-1 и варианты их применения", включенном посредством ссылки во всей своей полноте.
В одном варианте осуществления молекула антитела к PD-L1 содержит по меньшей мере один или два вариабельных домена тяжелой цепи (необязательно включающих константную область), по меньшей мере один или два вариабельных домена легкой цепи (необязательно включающих константную область) или оба из них, содержащих аминокислотную последовательность любого из BAP058-hum01, BAP058-hum02, BAP058-hum03, BAP058-hum04, BAP058-hum05, BAP058-hum06, BAP058-hum07, BAP058-hum08, BAP058-hum09, BAP058-hum10, BAP058-hum11, BAP058-hum12, BAP058-hum13, BAP058-hum14, BAP058-hum15, BAP058-hum16, BAP058-hum17, BAP058-Клон-K, BAP058-Клон-L, BAP058-Клон-M, BAP058-Клон-N или BAP058-Клон-O; или приведенную в таблице 1 US 2016/0108123, или кодируемую нуклеотидной последовательностью из таблицы 1; или последовательность, по сути идентичную (например, идентичную на по меньшей мере 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или больше) любой из вышеуказанных последовательностей.
В еще одном варианте осуществления молекула антитела к PD-L1 содержит по меньшей мере одну, две или три определяющих комплементарность области (CDR) из вариабельной области тяжелой цепи и/или вариабельной области легкой цепи антитела, описанного в данном документе, например, любого антитела, выбранного из BAP058-hum01, BAP058-hum02, BAP058-hum03, BAP058-hum04, BAP058-hum05, BAP058-hum06, BAP058-hum07, BAP058-hum08, BAP058-hum09, BAP058-hum10, BAP058-hum11, BAP058-hum12, BAP058-hum13, BAP058-hum14, BAP058-hum15, BAP058-hum16, BAP058-hum17, BAP058-Клон-K, BAP058-Клон-L, BAP058-Клон-M, BAP058-Клон-N или BAP058-Клон-O; или описанного в таблице 1 US 2016/0108123, или кодируемого нуклеотидной последовательностью из таблицы 1 US 2016/0108123; или с последовательностью, по сути идентичной (например, на по меньшей мере 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или больше идентичной) любой из вышеуказанных последовательностей.
В еще одном варианте осуществления молекула антитела к PD-L1 содержит по меньшей мере одну, две или три CDR (или в совокупности все CDR) из вариабельной области тяжелой цепи, содержащую аминокислотную последовательность, показанную в таблице 1 US 2016/0108123, или кодируемую нуклеотидной последовательностью, показанной в таблице 1 US 2016/0108123. В одном варианте осуществления одна или несколько CDR (или в совокупности все CDR) имеют одно, два, три, четыре, пять, шесть или больше изменений, например, аминокислотных замен или делеций, по сравнению с аминокислотной последовательностью, показанной в таблице 1 US 2016/0108123, или кодируемой нуклеотидной последовательностью, показанной в таблице 1 US 2016/0108123.
В еще одном варианте осуществления молекула антитела к PD-L1 содержит по меньшей мере одну, две или три CDR (или в совокупности все CDR) из вариабельной области легкой цепи, содержащей аминокислотную последовательность, показанную в таблице 1 US 2016/0108123, или кодируемую нуклеотидной последовательностью, показанной в таблице 1. В одном варианте осуществления одна или несколько CDR (или в совокупности все CDR) имеют одно, два, три, четыре, пять, шесть или больше изменений, например, аминокислотных замен или делеций, по сравнению с аминокислотной последовательностью, показанной в таблице 1 US 2016/0108123, или кодируемой нуклеотидной последовательностью, показанной в таблице 1 US 2016/0108123. В некоторых вариантах осуществления молекула антитела к PD-L1 содержит замену в CDR легкой цепи, например одну или несколько замен в CDR1, CDR2 и/или CDR3 легкой цепи.
В другом варианте осуществления молекула антитела к PD-L1 содержит по меньшей мере одну, две, три, четыре, пять или шесть CDR (или в совокупности все CDR) из вариабельной области тяжелой и легкой цепи, содержащей аминокислотную последовательность, показанную в таблице 1, или кодируемую нуклеотидной последовательностью, показанной в таблице 1 US 2016/0108123. В одном варианте осуществления одна или несколько CDR (или в совокупности все CDR) имеют одно, два, три, четыре, пять, шесть или больше изменений, например, аминокислотных замен или делеций, по сравнению с аминокислотной последовательностью, показанной в таблице 1 US 2016/0108123, или кодируемой нуклеотидной последовательностью, показанной в таблице 1 US 2016/0108123.
В одном варианте осуществления молекула антитела к PD-L1 содержит по меньшей мере одну, две или три CDR или гипервариабельные петли из вариабельной области тяжелой цепи антитела, описанного в данном документе, например любого антитела, выбранного из BAP058-hum01, BAP058-hum02, BAP058-hum03, BAP058-hum04, BAP058-hum05, BAP058-hum06, BAP058-hum07, BAP058-hum08, BAP058-hum09, BAP058-hum10, BAP058-hum11, BAP058-hum12, BAP058-hum13, BAP058-hum14, BAP058-hum15, BAP058-hum16, BAP058-hum17, BAP058-Клон-K, BAP058-Клон-L, BAP058-Клон-M, BAP058-Клон-N или BAP058-Клон-O, в соответствии с определениями по Kabat и Chothia (например, по меньшей мере одну, две или три CDR или гипервариабельные петли в соответствии с определениями по Kabat и Chothia, как указано в таблице 1 US 2016/0108123); или кодируемых нуклеотидной последовательностью из таблицы 1 US 2016/0108123; или с последовательностью, по сути идентичной (например, идентичной на по меньшей мере 80%, 85%, 90%, 92%, 95%, 97%, 98%, 99% или больше) любой из вышеуказанных последовательностей; или которые имеют по меньшей мере одно изменение аминокислоты, но не более двух, трех или четырех измерений (например, замен, делеций или вставок, например, консервативных замен), по сравнению с одной, двумя или тремя CDR или гипервариабельными петлями в соответствии с Kabat и/или Chothia, показанными в таблице 1 US 2016/0108123.
В одном варианте осуществления молекула антитела к PD-L1 может содержать CDR1 VH в соответствии с Kabat et al., ((1991), "Sequences of Proteins of Immunological Interest," 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD), или гипервариабельную петлю 1 VH в соответствии с Chothia et al., (1992) J. Mol. Biol. 227:799-817, или их комбинацию, например, как показано в таблице 1 US 2016/0108123. В одном варианте осуществления CDR1 VH согласно комбинации определений CDR по Kabat и Chothia содержит аминокислотную последовательность GYTFTSYWMY (SEQ ID NO: 63) или аминокислотную последовательность, по сути идентичную ей (например, имеющую по меньшей мере одно аминокислотное изменение, но не более двух, трех или четырех изменений (например, замен, делеций или вставок, например, консервативных замен)). Молекула антитела к PD-L1 может дополнительно содержать, например, CDR 2-3 VH в соответствии с Kabat et al., и CDR 1-3 VL в соответствии с Kabat et al., например, показанные в таблице 1 US 2016/0108123.
В предпочтительном варианте осуществления молекула антитела к PD-L1 для применения в настоящем изобретении содержит
(a) вариабельную область тяжелой цепи (VH), содержащую аминокислотную последовательность VHCDR1 под SEQ ID NO: 47, аминокислотную последовательность VHCDR2 под SEQ ID NO: 48 и аминокислотную последовательность VHCDR3 под SEQ ID NO: 46; и вариабельную область легкой цепи (VL), содержащую аминокислотную последовательность VLCDR1 под SEQ ID NO: 52, аминокислотную последовательность VLCDR2 под SEQ ID NO: 53 и аминокислотную последовательность VLCDR3 под SEQ ID NO: 54;
(b) VH, содержащую аминокислотную последовательность VHCDR1 под SEQ ID NO: 44; аминокислотную последовательность VHCDR2 под SEQ ID NO: 45 и аминокислотную последовательность VHCDR3 под SEQ ID NO: 46; и VL, содержащую аминокислотную последовательность VLCDR1 под SEQ ID NO: 49, аминокислотную последовательность VLCDR2 под SEQ ID NO: 50 и аминокислотную последовательность VLCDR3 под SEQ ID NO: 51;
(c) VH, содержащую аминокислотную последовательность VHCDR1 под SEQ ID NO: 63, аминокислотную последовательность VHCDR2 под SEQ ID NO: 48 и аминокислотную последовательность VHCDR3 под SEQ ID NO: 46; и VL, содержащую аминокислотную последовательность VLCDR1 под SEQ ID NO: 52, аминокислотную последовательность VLCDR2 под SEQ ID NO: 53 и аминокислотную последовательность VLCDR3 под SEQ ID NO: 54; или
(d) VH, содержащую аминокислотную последовательность VHCDR1 под SEQ ID NO: 63; аминокислотную последовательность VHCDR2 под SEQ ID NO: 45 и аминокислотную последовательность VHCDR3 под SEQ ID NO: 46; и VL, содержащую аминокислотную последовательность VLCDR1 под SEQ ID NO: 52, аминокислотную последовательность VLCDR2 под SEQ ID NO: 53 и аминокислотную последовательность VLCDR3 под SEQ ID NO: 54.
В одном аспекте предыдущего варианта осуществления молекула антитела к PD-L1 для применения в настоящем изобретении содержит вариабельный домен тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 55, и вариабельный домен легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 58.
В одном аспекте предыдущего варианта осуществления молекула антитела к PD-L1 для применения в настоящем изобретении содержит тяжелую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 62, и легкую цепь, содержащую аминокислотную последовательность под SEQ ID NO: 60.
Таблица C. Аминокислотные и нуклеотидные последовательности гуманизированного mAb к PD-L1 BAP058-hum013. Показаны аминокислотные и нуклеотидные последовательности CDR тяжелых и легких цепей, вариабельных областей тяжелых и легких цепей, а также тяжелых и легких цепей.
Доза и введение иммунотерапевтического средства
Иммунотерапевтическое средство (такое как молекула антитела к PD-1 или молекула антитела к PD-L1) можно вводить субъекту системно (например, перорально, парентерально, подкожно, внутривенно, ректально, внутримышечно, внутрибрюшинно, интраназально, трансдермально или путем ингаляции или внутриполостной установки), местно или путем применения в отношении слизистых оболочек, как например носа, горла и бронхов.
Дозы и терапевтические схемы приема иммунотерапевтического средства (например, молекулы антитела к PD-1 или молекулы антитела к PD-L1) могут быть определены специалистом в данной области техники. В определенных вариантах осуществления иммунотерапевтическое средство (например, молекулу антитела к PD-1) вводят путем инъекции (например, подкожно или внутривенно) в дозе от приблизительно 1 до 30 мг/кг, например от приблизительно 5 до 25 мг/кг, от приблизительно 10 до 20 мг/кг, от приблизительно 1 до 5 мг/кг или приблизительно 3 мг/кг. Схема введения доз может варьировать от, например, одного раза в неделю до одного раза в 2, 3 или 4 недели. В одном варианте осуществления молекулу антитела к PD-1 вводят в дозе от приблизительно 10 до 20 мг/кг раз в две недели. В другом варианте осуществления молекулу антитела к PD-1 вводят в дозе от приблизительно 1 до 10 мг/кг, или от приблизительно 1 до 5 мг/кг, или приблизительно 3 мг/кг каждые 4 недели.
Например, молекулу антитела к PD-1 вводят или применяют в постоянной или фиксированной дозе. В некоторых вариантах осуществления молекулу антитела к PD-1 вводят путем инъекции (например, подкожно или внутривенно) в дозе (например, в постоянной дозе) от приблизительно 200 мг до 500 мг, например от приблизительно 250 мг до 450 мг, от приблизительно 300 мг до 400 мг, от приблизительно 250 мг до 350 мг, от приблизительно 350 мг до 450 мг, или приблизительно 300 мг, или приблизительно 400 мг. Схема введения доз (например, схема введения постоянных доз) может варьировать, например, от одного раза в неделю до одного раза каждые 2, 3, 4, 5 или 6 недель. В одном варианте осуществления молекулу антитела к PD-1 вводят в дозе от приблизительно 300 мг до 400 мг один раз в три недели или один раз в четыре недели. В одном варианте осуществления молекулу антитела к PD-1 вводят в дозе от приблизительно 300 мг один раз в три недели. В одном варианте осуществления молекулу антитела к PD-1 вводят в дозе от приблизительно 400 мг один раз в четыре недели. В одном варианте осуществления молекулу антитела к PD-1 вводят в дозе от приблизительно 300 мг один раз в четыре недели. В одном варианте осуществления молекулу антитела к PD-1 вводят в дозе от приблизительно 400 мг один раз в три недели.
В другом варианте осуществления молекулу антитела к PD-1 вводят в постоянной дозе от приблизительно 300 мг до 400 мг один раз в три недели или один раз в четыре недели. В подварианте данного варианта осуществления молекулу антитела к PD-1 вводят в постоянной дозе, составляющей приблизительно 400 мг, каждые четыре недели. В еще одном подварианте данного варианта осуществления молекулу антитела к PD-1 вводят в постоянной дозе, составляющей приблизительно 300 мг, каждые три недели.
Примеры
Следующие примеры предназначены для иллюстрации настоящего изобретения, и их не следует истолковывать как ограничивающие его. Значения температуры приведены в градусах Цельсия. Если не указано иное, то все операции выпаривания осуществляли при пониженном давлении предпочтительно от приблизительно 15 мм рт.ст. до 100 мм рт.ст. (= 20-133 мбар). Структура конечных продуктов, промежуточных соединений и исходных материалов подтверждена с помощью стандартных аналитических способов, например микроанализа и спектроскопических характеристик, например MS, IR, ЯМР. Используемые сокращения представляют собой стандартные сокращения в данной области техники.
Все исходные вещества, структурные элементы, реагенты, кислоты, основания, дегидрирующие средства, растворители и катализаторы, используемые для синтеза соединений по настоящему изобретению, являются либо коммерчески доступными, либо их можно получить посредством способов органического синтеза, известных специалисту обычной квалификации в данной области техники (Houben-Weyl 4th Ed. 1952, Methods of Organic Synthesis, Thieme, Volume 21). Также соединения по настоящему изобретению могут быть получены посредством способов органического синтеза, известных специалисту обычной квалификации в данной области техники, как показано в следующих примерах.
Следующие примеры иллюстрируют, но никоим образом не ограничивают настоящее изобретение.
Сокращения
ACN ацетонитрил
водн. водный
br широкий
BSA бычий сывороточный альбумин
CPBA: 3-хлорпероксибензойная кислота
d дублет
dd дублет дублетов
DCM дихлорметан
DMF N,N-диметилформамид
DMSO диметилсульфоксид
EtOAc этилацетат
г граммы
ч час(-ы)
HPLC высокоэффективная жидкостная хроматография
IS внутренний стандарт
LCMS жидкостная хроматография и тандемная масс-спектрометрия
М моль/л
m мультиплет
MeOH метанол
мин. минуты
мл миллилитр(-ы)
ммоль миллимоли
MS масс-спектрометрия
масса/заряд соотношение массы и заряда
NADPH бета-никотинамиддинуклеотидфосфат, восстановленная форма
ЯМР ядерный магнитный резонанс
ppm частей на миллион
к.т. комнатная температура
Rt время удерживания
s синглет
насыщ. насыщенный
t триплет
THF тетрагидрофуран.
Способы UPLC
2 мин. UPLC: Waters UPLC Acquity; колонка: Acquity HSS T3, 1,8 мм, 2,1*50 мм, при 60°C, элюент A: вода+0,05% HCOOH+3,75 мМ ацетат аммония, B: ACN+0,04% HCOOH, градиент: от 5 до 98% B за 1,4 мин, скорость потока: 1,0 мл/мин.
10 мин. UPLC: Waters UPLC Acquity; колонка: Acquity HSS T3, 1,8 мм, 2,1*50 мм, при 60°C, элюент A: вода+0,05% HCOOH+3,75 мМ ацетат аммония, B: ACN+0,04% HCOOH, градиент: от 5 до 98% B за 9,4 мин, время удержания 0,4 мин, скорость потока: 1 мл/мин.
Пример 1. Получение 1-(4-амино-5-бром-6-(1 H -пиразол-1-ил)пиримидин-2-ил)-1 H -пиразол-4-ола
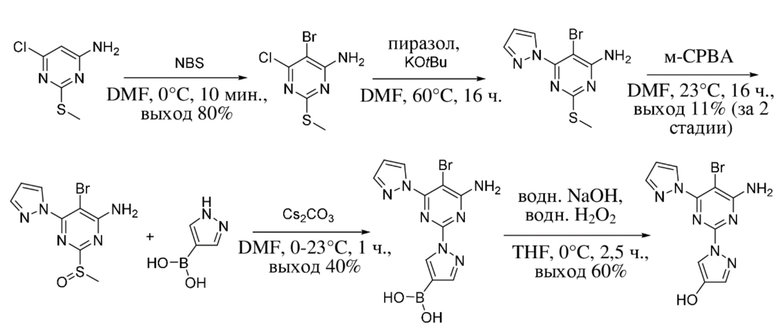
5-Бром-6-хлор-2-(метилтио)пиримидин-4-амин
К охлажденному раствору 6-хлор-2-(метилтио)пиримидин-4-амина (15,0 г, 85 ммоль) в DMF (150 мл) порциями добавляли N-бромсукцинимид (16,7 г, 94 ммоль) при перемешивании при 0°C. Через 10 мин реакцию гасили путем добавления воды при 0°C. Реакционную смесь разбавляли солевым раствором и экстрагировали 3 раза с помощью EtOAc. Объединенные органические фазы промывали дважды с помощью насыщенного водного раствора NaHCO3, затем солевого раствора, разделяли и фильтровали через разделитель фаз с Na2SO4 для обеспечения высушивания. Фильтрат концентрировали in vacuo с получением указанного в заголовке соединения (18,8 г, 74 ммоль, выход 80%, чистота 92%) в виде бесцветного твердого вещества, которое использовали на следующей стадии без дополнительный очистки. Масса/заряд=254/256/258 [M+H]+, Rt=0,95 мин. (UPLC 2 мин.), 1H ЯМР (600 МГц, DMSO-d6) δ 8,03 (br s, 1H), 7,25 (br s, 1H), 2,42 (s, 3H).
5-Бром-2-(метилтио)-6-(1H-пиразол-1-ил)пиримидин-4-амин
Смесь 5-бром-6-хлор-2-(метилтио)пиримидин-4-амина (17,8 г, 70 ммоль), 1H-пиразола (4,7 г, 69 ммоль) и KOtBu (7,9 г, 70 ммоль) в DMF (250 мл) перемешивали при 60°C в течение 16 часов. Растворитель устраняли in vacuo, и остаток разбавляли с помощью насыщенного водного раствора NaHCO3 и экстрагировали 3 раза с помощью EtOAc. Объединенные органические фазы промывали солевым раствором, разделяли и фильтровали через разделитель фаз с Na2SO4 для обеспечения высушивания. Фильтрат концентрировали in vacuo с получением указанного в заголовке соединения (20 г, чистота 64%), которое использовали на следующей стадии без дополнительный очистки. Масса/заряд=286/288/290 [M+H]+, Rt=0,85 мин. (UPLC 2 мин), 1H ЯМР (600 МГц, DMSO-d6) δ 8,35 (d, J=2,5 Гц, 1H), 8,03 (br s, 1H), 7,81 (br s, 1H), 7,26 (br s, 1H), 6,55 (s, 1H), 2,46 (s, 3H).
5-Бром-2-(метилсульфинил)-6-(1H-пиразол-1-ил)пиримидин-4-амин
К суспензии 5-бром-2-(метилтио)-6-(1H-пиразол-1-ил)пиримидин-4-амина (20 г, чистота 64%) в DCM (100 мл) по каплям добавляли раствор 3-хлорпероксибензойной кислоты (9,3 г, 53,7 ммоль) в DCM (100 мл) при перемешивании на протяжении 20 мин. при 0°C, и полученную смесь перемешивали при 23°C в течение 16 часов. Осадок собирали путем фильтрования реакционной смеси и промывали с помощью DCM. Твердое вещество высушивали in vacuo с получением указанного в заголовке соединения (2,4 г, 7,6 ммоль, выход для двух стадий 11%) в виде бесцветного твердого вещества. Масса/заряд=302/304 [M+H]+, Rt=0,53 мин. (UPLC 2 мин.), 1H ЯМР (600 МГц, DMSO-d6) δ 8,63 (br s, 1H), 8,38 (d, J=2,3 Гц, 1H), 7,87 (s, 1H), 7,72 (s, 1H), 6,60-6,61 (m, 1H), 2,86 (s, 3H).
(1-(4-Амино-5-бром-6-(1H-пиразол-1-ил)пиримидин-2-ил)-1H-пиразол-4-ил)бороновая кислота
К смеси 5-бром-2-(метилсульфинил)-6-(1H-пиразол-1-ил)пиримидин-4-амина (50 мг, 0,17 ммоль) и (1H-пиразол-4-ил)бороновой кислоты (18 мг, 0,17 ммоль) в DMF (1 мл) добавляли Cs2CO3 (54 мг, 0,17 ммоль) при 0°C. Полученную смесь перемешивали в течение 1 часа при 23°C. Реакционную смесь разбавляли водой и экстрагировали 3 раза с помощью EtOAc. Объединенные органические фазы промывали водой, затем солевым раствором, разделяли и фильтровали через разделитель фаз с Na2SO4 для обеспечения высушивания. Фильтрат концентрировали in vacuo с получением указанного в заголовке соединения (30 мг, 0,066 ммоль, выход 40%), которое использовали на следующей стадии без дополнительный очистки. Масса/заряд=350/352 [M+H]+, Rt=0,55 мин. (UPLC 2 мин).
1-(4-Амино-5-бром-6-(1H-пиразол-1-ил)пиримидин-2-ил)-1H-пиразол-4-ол
К энергично перемешиваемому раствору (1-(4-амино-5-бром-6-(1H-пиразол-1-ил)пиримидин-2-ил)-1H-пиразол-4-ил)бороновой кислоты (30 мг, 0,066 ммоль) в THF (1 мл) добавляли 25 вес. % водного раствора NaOH (0,021 мл, 0,13 ммоль) и 30% водный раствор H2O2 (0,020 мл, 0,20 ммоль) при 0°C. Через 30 минут добавляли другую порцию 30% водного раствора H2O2 (0,020 мл, 0,20 ммоль), и смесь перемешивали при той же температуре в течение в общей сложности 2,5 часов. Реакцию гасили с помощью насыщенного водного раствора NH4Cl, затем разбавляли водой и экстрагировали 4 раза с помощью DCM и 3 раза с помощью смеси 4/1 DCM/MeOH. Объединенные органические фазы фильтровали через разделитель фаз для обеспечения высушивания, и фильтрат концентрировали in vacuo. Неочищенный продукт абсорбировали на Isolute и очищали с помощью колоночной хроматографии (ISCO, 12 г колонка с диоксидом кремния RediSep, скорость потока: 30 мл/мин, растворитель: CH2Cl2:MeOH, начиная от 1:0, время удержания 3 мин, затем до 96:4 на протяжении 25 мин). Фракции продукта объединяли и концентрировали in vacuo с получением указанного в заголовке соединения (14 мг, 0,040 ммоль, выход 60%) в виде бесцветного твердого вещества. Масса/заряд=322/324 [M+H]+, Rt=0,58 мин. (UPLC 2 мин); Rt=2,27 мин; чистота при 254 нм: >95% (UPLC 10 мин), 1H ЯМР (600 МГц, DMSO-d6) δ 9,23 (br s, 1H), 8,44 (d, J=2,5 Гц, 1H), 8,32 (br s, 1H), 7,94 (s, 1H), 7,90-7,81 (m, 1H), 7,46 (br s, 2H), 6,63-6,50 (m, 1H).
В качестве альтернативы 6-хлор-2-(метилтио)пиримидин-4-амин можно вводить в реакцию сначала с пиразолом в присутствии основания с получением 2-(метилтио)-6-(1H-пиразол-1-ил)пиримидин-4-амина с последующей обработкой с помощью NBS с получением 5-бром-2-(метилтио)-6-(1H-пиразол-1-ил)пиримидин-4-амина.
Пример 1A. Получение 1-(6-амино-5-бром-2-(1H-пиразол-1-ил)пиримидин-4-ил)-1H-пиразол-4-ола
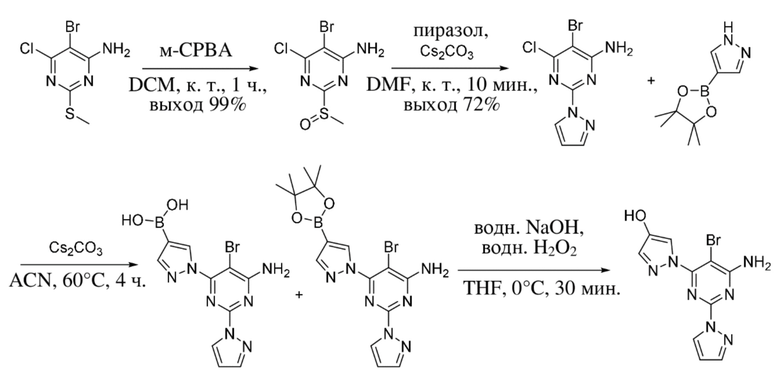
5-Бром-6-хлор-2-(метилсульфинил)пиримидин-4-амин
К раствору 13 г 5-бром-6-хлор-2-(метилтио)пиримидин-4-амина (52 ммоль) в 450 мл DCM медленно по каплям добавляли 13 г (57 ммоль) м-хлорпербензойной кислоты (77%) (Sigma-Aldrich), растворенной в 100 мл DCM. Раствор перемешивали при комнатной температуре в течение 1 часа. Образованный белый осадок фильтровали, промывали несколько раза с помощью DCM и высушивали. На данной стадии получали 14 г (99%) указанного в заголовке соединения. Масса/заряд=270/272 [M+H]+, Rt=0,56 мин. (UPLC 2 мин), 1H-ЯМР (400 МГц, DMSO-d6) δ 8,17 (d, 2H), 2,78 (s, 3H).
5-Бром-6-хлор-2-(1H-пиразол-1-ил)пиримидин-4-амин
2 г (7,4 ммоль) 5-бром-6-хлор-2-(метилсульфинил)пиримидин-4-амина суспендировали в 30 мл DMF. К данной суспензии добавляли 0,5 г (7,4 ммоль) 1H-пиразола и 1,5 г (4,4 ммоль) карбоната цезия. Реакционную смесь энергично перемешивали при комнатной температуре в течение 10 мин. Раствор выливали на 200 мл холодной воды. Образованный осадок фильтровали, промывали с помощью холодной воды и высушивали. Требуемый продукт получали в виде белого твердого вещества (1,5 г, 72%). Масса/заряд=274/276 [M+H]+, Rt=0,80 мин. (UPLC 2 мин), 1H-ЯМР (400 МГц, DMSO-d6) δ 8,44 (d, 1H), 8,15 (d, 2H), 7,81 (d, 1H), 6,56 (dd, 1H).
(1-(6-Амино-5-бром-2-(1H-пиразол-1-ил)пиримидин-4-ил)-1H-пиразол-4-ил)бороновая кислота
Смесь 0,10 г (0,36 ммоль) 5-бром-6-хлор-2-(1H-пиразол-1-ил)пиримидин-4-амина, 0,14 г (0,73 ммоль) 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразола и 0,12 г (0,36 ммоль) карбоната цезия в 10 мл ацетонитрила перемешивали в течение 4 ч при 60°C в герметично закрытой стеклянной пробирке. Затем растворитель удаляли с использованием пониженного давления. Полученное твердое вещество промывали эфиром/пентаном и высушивали. Смесь бороновой кислоты и сложного эфира бороновой кислоты применяли на следующей стадии без дополнительной очистки.
1-(6-Амино-5-бром-2-(1H-пиразол-1-ил)пиримидин-4-ил)-1H-пиразол-4-ол
К раствору (1-(6-амино-5-бром-2-(1H-пиразол-1-ил)пиримидин-4-ил)-1H-пиразол-4-ил)бороновой кислоты или 5-бром-2-(1H-пиразол-1-ил)-6-(4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пиразол-1-ил)пиримидин-4-амина в THF (2,5 мл), охлажденному до 0°C, добавляли 2 мл 1 н. NaOH и H2O2 (30%) (0,23 мл, 2,32 ммоль). Смесь перемешивали при комнатной температуре в течение 30 мин. Реакционную смесь подкисляли до pH 3-4 путем добавления 1 н. HCl, экстрагировали с помощью этилацетата, и высушивали над безводным Na2SO4, и концентрировали в вакууме. Неочищенный продукт очищали посредством колоночной хроматографии на силикагеле с применением DCM-MeOH (2-5%). Масса/заряд=322/324 [M+H]+, Rt=0,58 мин. (UPLC 2 мин); 1H ЯМР (600 МГц, DMSO-d6) δ 9,18 (br s, 1H), 8,57-8,78 (m, 1H), 8,29 (br s, 1H), 7,97 (s, 1H), 7,79 (s, 1H), 7,54 (s, 1H), 7,40 (br s, 1H), 6,55 (s, 1H).
Пример 2. Выделение/характеристика метаболита 5-бром-2,6-ди(1H-пиразол-1-ил)пиримидин-4-амина. Идентификация метаболитов в микросомах крысы, собаки и человека in vitro с применением жидкостной хроматографии и масс-спектрометрии
Сокращения
ACN: ацетонитрил
CC: калибровочная кривая
IS: внутренний стандарт
DMSO: диметилсульфоксид
MRM: мониторинг множественных реакций
NADH: никотинамидадениндинуклеотидфосфат (восстановленный)
об/мин: оборотов в минуту.
Микросомы печени
Микросомы печени крысы (самец, объединенные, Sprague Dawley)
Источник: XenoTech, LLC (Канзас, США)
Содержание белка: 20 мг/мл
Номер по каталогу: R I 000, номер партии: 0710623
Микросомы печени собаки (самец, объединенные, бигль)
Источник: XenoTech, LLC (Канзас, США)
Содержание белка: 20 мг/мл
Номер по каталогу: D I 000, номер партии: 0810143
Микросомы печени человека (смесь полов, объединенные)
Источник: XenoTech, LLC (Канзас, США)
Содержание белка: 20 мг/мл
Номер по каталогу: H061 0, номер партии: 101042
Исходные растворы и реагенты
Тестируемое соединение
Получали 2 мМ и 0,2 мМ исходные растворы 5-бром-2,6-ди(1H-пиразол-1-ил)пиримидин-4-амина в DMSO для инкубаций in vitro. Конечное содержание органического вещества при инкубациях микросом печени составляло 0,5%.
Раздельно получали 2,5 мМ исходный раствор 1-(6-амино-5-бром-2-(1H-пиразол-1-ил)пиримидин-4-ил)-1H-пиразол-4-ола и 1-(4-амино-5-бром-6-(1H-пиразол-1-ил)пиримидин-4-ил)-1H-пиразол-6-ола в DMSO. Исходные растворы дополнительно разбавляли в ацетонитриле с получением концентрации 1 мкМ 1-(6-амино-2-бром-6-(1H-пиразол-1-ил)пиримидин-4-ил)-1H-пиразол-4-ола и 1-(4-амино-5-бром-6-(1H-пиразол-1-ил)пиримидин-4-ил)-1H-пиразол-6-ола для проведения хроматографических анализов.
Получали 0,1 мМ исходный раствор диклофенака и верапамила в DMSO для инкубаций in vitro. Конечное содержание органического вещества при инкубациях микросом печени составляло 0,5%.
Инкубации микросом in vitro
Микросомальный белок печени (25 мкл для 0,5 мг/мл; 15 мкл для 0,3 мг/мл), NADPH (100 мкл, в конечной концентрации 2 мМ) и фосфатный буфер (870 мкл для 0,5 мг/мл; 880 мкл для 0,3 мг/мл) инкубировали в микроцентрифужной пробирке в орбитальном шейкере-инкубаторе в течение 10 мин, поддерживая температуру на уровне 37°C. Реакции инициировали путем добавления 5 мкл 2 мМ и 0,2 мМ 5-бром-2,6-ди(1H-пиразол-1-ил)пиримидин-4-амина (в конечной концентрации 10 мкМ для 0,5 мг/мл белка; в конечной концентрации 1 мкМ для 0,3 мг/мл белка; с конечной концентрацией DMSO 0,5%) и образцы инкубировали при 37°C. Аликвоты (200 мкл) отбирали из реакционной пробирки через 0, 60 и 120 минут, и реакцию гасили путем добавления 100 мкл ацетонитрила. Реакции проводили в двух повторностях. Подвергнутые гашению образцы центрифугировали при 14000 об/мин (примерно 21000g) в течение 10 минут (Eppendorf Centrifuge 5810 R), и супернатант анализировали с помощью LCMS/MS.
Контрольные инкубации (без добавления NADPH) и холостые инкубации (без добавления тестируемого соединения) проводили в одной повторности для каждого вида. Данные образцы отбирали через 0 и 120 мин и гасили с применением ацетонитрила. Супернатант анализировали на предмет наличия какой-либо не связанной с микросомами деградации и матричного влияния. В качестве положительного контроля применяли диклофенак в микросомах печени крысы и человека и верапамил в микросомах печени собаки. Эксперименты в отношении реакции и контроля проводили в одной повторности. Данные в отношении метаболического обмена диклофенака и верапамила совпадали с полученными в лаборатории ретроспективными данными.
Аналитические способы и параметры оборудования
Образцы обрабатывали с применением способа осаждения белков и затем анализировали с использованием линейного градиента с временем анализа 28 мин. посредством HPLC с тандемной масс-спектрометрией (масс-спектрометр API 4000). Каждый образец вводили и сканировали по отдельности в отношении спектров Q1 (MH+/MH-) и MS/MS.
Пики различных возможных метаболитов идентифицировали по сканограмме Q1 после оценивания матричного влияния с применением холостых образцов без тестируемого соединения, и подтверждение осуществляли исходя из спектра фрагментации (по сканограмме MSIMS). Краткое описание аналитического способа представлено в таблице 9.
Таблица 9. Условия проведения хроматографии и масс-спектрометрии
Время анализа
(мин)
0,01
5
23
24
28
95
95
5
95
95
5
5
95
5
5
Модифицированный аналитический способ
Также разрабатывали альтернативный вариант аналитического способа для увеличения времени удержания и проведения оценки других метаболитов, наряду с идентифицированным метаболитом M-1. Проводили совместную хроматографию водных растворов 1-(6-амино-5-бром-2-(1H-пиразол-1-ил)пиримидин-4-ил)-1H-пиразол-4-ола и 1-(4-амино-5-бром-6-(1H-пиразол-1-ил)пиримидин-2-ил)-1H-пиразол-4-ола (1 мкМ) с инкубированными in vitro образцами, применяя модифицированный аналитический способ для подтверждения идентичности. Краткое описание модифицированного способа представлено в таблице 10.
Таблица 10. Модифицированные условия проведения хроматографии и масс-спектрометрии
Время анализа
(мин.)
0,01
5
23
24
28
95
95
5
95
95
5
5
95
5
5
Определение массового баланса в микросомах печени человека
Исходный раствор 5-бром-2,6-ди(1H-пиразол-1-ил)пиримидин-4-амина и 1-(4-амино-5-бром-6-(1H-пиразол-1-ил)пиримидин-2-ил)-1H-пиразол-4-ола подвергали серийному разбавлению в DMSO с получением растворов добавок в концентрациях 1, 0,5 и 0,25 мМ и 0,5, 0,25 и 0,125 мМ соответственно.
Калибровочные стандарты 5-бром-2,6-ди(1H-пиразол-1-ил)пиримидин-4-амина и 1-(4-амино-5-бром-6-(1H-пиразол-1-ил)пиримидин-2-ил)-1H-пиразол-4-ола получали путем добавления 5 мкл соответствующих растворов добавок в 995 мкл инкубационного буфера с получением 10, 5, 2,5 и 1,25 мкМ образцов для 5-бром-2,6-ди(1H-пиразол-1-ил)пиримидин-4-амина и 5, 2,5, 1,25 и 0,625 мкМ образцов для 1-(4-амино-5-бром-6-(1H-пиразол-1-ил)пиримидин-2-ил)-1H-пиразол-4-ола.
200 мкл аликвоту таких образцов с добавкой 5-бром-2,6-ди(1H-пиразол-1-ил)пиримидин-4-амина и 1-(6-амино-5-бром-2-(1H-пиразол-1-ил)пиримидин-4-ил)-1H-пиразол-4-ола разбавляли с помощью 100 мкл ацетонитрила. Аликвоту (25 мкл) данных образцов дополнительно разбавляли с помощью 100 мкл внутреннего стандарта (галоперидол, 1 мкг/мл в ацетонитриле).
Инкубационные образцы также получали аналогично получению калибровочных стандартов путем добавления 25 мкл подвергнутого гашению образца с 100 мкл внутреннего стандарта.
Затем проводили количественное определение инкубационных образцов отдельно для 5-бром-2,6-ди(1H-пиразол-1-ил)пиримидин-4-амина и
1-(4-амино-5-бром-6-(1H-пиразол-1-ил)пиримидин-2-ил)-1H-пиразол-4-ола в MRM-режиме, а подробное описание способа представлено в таблице 11.
Таблица 11. Условия проведения хроматографии и масс-спектрометрии при MRM-анализе
Время анализа
Результаты
Образцы in vitro оценивали в отношении наличия метаболитов. Показатели в отношении MH+ (Q I) и дочерних ионов (MS/MS) при различном времени удерживания для возможных метаболитов 5-бром-2,6-ди(1H-пиразол-1-ил)пиримидин-4-амина со спектром фрагментации представлены в таблице 1 и ниже.
Таблица 1. Спектр фрагментации для исходного соединения (5-бром-2,6-ди(1H-пиразол-1-ил)пиримидин-4-амина) и его метаболитов
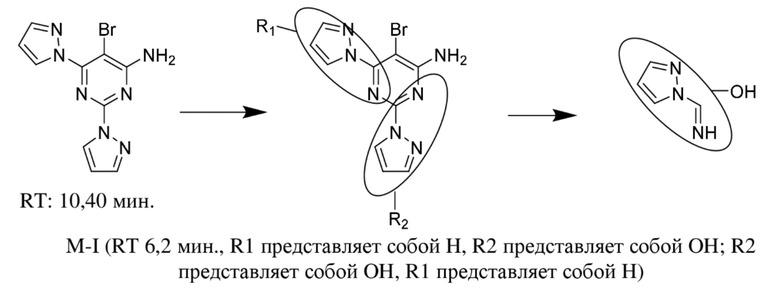
Обобщенные данные в отношении предполагаемых метаболитов 5-бром-2,6-ди(1H-пиразол-1-ил)пиримидин-4-амина, обнаруженных у различных видов, представлены в таблице 2.
Таблица 2. Обобщенные данные в отношении обнаруженных метаболитов 5-бром-2,6-ди(1H-пиразол-1-ил)пиримидин-4-амина
(M)
Микросомы печени собаки
Микросомы печени человека
X
X
X
X
X обозначает наличие.
Относительное содержание исходного соединения и его метаболита в образцах микросом представлено в таблице 3.
Таблица 3. Относительное содержание 5-бром-2,6-ди(1H-пиразол-1-ил)пиримидин-4-амина (10 мкМ) и его метаболитов, обнаруженных в микросомах печени с применением MRM-анализа
M-I
Н. о.
Н. о.
0,0g
0,06
0,13
0,14
M-I
0,01
0,01
0,56
0,67
0,95
1,52
M-I
0,01
0,02
0,97
0,93
1,84
1,78
Исходное соединение представляет собой 5-бром-2,6-ди(1H-пиразол-1-ил)пиримидин-4-амин
Н.о.: не обнаружено; относительное содержание исходного соединения и его метаболитов являются количественными показателями; расчеты производились с учетом того, что эффективность ионизации для исходного соединения и его метаболитов является сходной; * значения % оставшегося количества, составляющие более 100%, принимались за 100 в расчетах.
Экстракционные ионные хроматограммы (XIC), Q1- и MS/MS-спектры водного стандарта и отдельных образцов микросом представлены на фигурах 1-3.
Метаболит монооксигенации (M-I, 6,22 мин) образовывался в микросомах печени крысы, собаки и человека. Процентная доля метаболита по отношению к исходному соединению (5-бром-2,6-ди(1H-пиразол-1-ил)пиримидин-4-амину) являлась равномерно низкой. Однако данный анализ предполагает одинаковую эффективность ионизации как для метаболита, так и для исходного соединения (таблица 3).
Независимо исследовали зависимую от времени убыль 5-бром-2,6-ди(1H-пиразол-1-ил)пиримидин-4-амина (1 мкМ), диклофенака (положительный контроль для человека и крысы, 0,5 мкМ), верапамила (положительный контроль для собаки, 0,5 мкМ) в микросомах печени (концентрация белка 0,3 мг/мл). Результаты представлены в таблице 4 и таблице 5.
Таблица 4. Зависимая от времени убыль 5-бром-2,6-ди(1H-пиразол-1-ил)пиримидин-4-амина (1 мкМ) при инкубации в микросомах печени человека, собаки и крысы (0,3 мг/мл)
условия
(минуты)
печени человека
% оставшегося количества
% оставшегося количества
% оставшегося количества
60
120
40
24
48
22
50
17
52
17
78
65
76
52
120
97
100
100
(холостой)
120
Исходное соединение представляет собой 5-бром-2,6-ди(1H-пиразол-1-ил)пиримидин-4-амин.
Значения % оставшегося количества, составляющие более 100%, принимались за 100 в расчетах.
Таблица 5. Зависимая от времени убыль положительных контролей (0,5 мкМ) при инкубации в микросомах печени (0,3 мг/мл)
Положительный контроль ->
(диклофенак)
(диклофенак)
(верапамил)
60
120
100
6
12
1
9
1
120
98
100
94
Было обнаружено, что при инкубации контрольные образцы 5-бром-2,6-ди(1H-пиразол-1-ил)пиримидин-4-амина (без добавления NADPH) сохраняли стабильность вплоть до 120 мин., указывая на отсутствие метаболизма, не опосредованного CYP. Холостые образцы при инкубации (без добавления тестируемого соединения) не продемонстрировали какого-либо матричного влияния (таблица 4).
Относительный уровень метаболизма 5-бром-2,6-ди(1H-пиразол-1-ил)пиримидин-4-амина при концентрациях 1 мкМ и концентрациях микросомального белка 0,3 мг/мл у тестированных видов составлял DLM>HLM>RLM. Результаты представлены в таблице 6.
Таблица 6. Относительный уровень метаболизма 5-бром-2,6-ди(1H-пиразол-1-ил)пиримидин-4-амина у различных видов
(мг/мл)
Собака
Человек
12 6
16 26
1,2 0,6
1,6 2,6
Собака
Человек
83 83
76 78
0,83 0,83
0,76 0,78
* Концентрацию метаболизированного анализируемого соединения (мкМ) рассчитывали с применением следующей формулы:
концентрация метаболизированного анализируемого соединения=(% метаболизированного количества через 120 мин X конечная концентрация исходного соединения)/100.
Исходное соединения представляет собой 5-бром-2,6-ди(1H-пиразол-1-ил)пиримидин-4-амин
Синтезировали 1-(6-амино-5-бром-2-(1H-пиразол-1-ил)пиримидин-4-ил)-1H-пиразол-4-ол и 1-(4-амино-5-бром-6-(1H-пиразол-1-ил)пиримидин-2-ил)-1H-пиразол-4-ол. Структуры данных соединений представлены ниже.
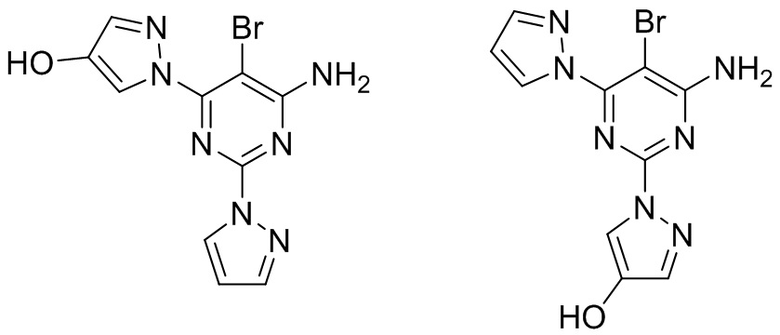
Затем проводили идентификацию метаболита, обнаруженного в инкубированных образцах микросом человека, посредством совместной хроматографии с соединениями, представляющими собой 1-(6-амино-5-бром-2-(1H-пиразол-1-ил)пиримидин-4-ил)-1H-пиразол-4-ол и 1-(4-амино-5-бром-6-(1H-пиразол-1-ил)пиримидин-2-ил)-1H-пиразол-4-ол, при мониторинге в Q1-режиме. Результаты совместной хроматографии подтвердили, что идентифицированный метаболит (M-I), обнаруженный в образцах микросом, представляет собой 1-(4-амино-5-бром-6-(1H-пиразол-1-ил)пиримидин-2-ил)-1H-пиразол-4-ол. Хроматограмма представлена на фигуре 4.
5-Бром-2,6-ди(1H-пиразол-1-ил)пиримидин-4-амин и его метаболит (M-I, 1-(4-амино-5-бром-6-(1H-пиразол-1-ил)пиримидин-2-ил)-1H-пиразол-4-ол) количественно определяли в инкубированных образцах микросом печени человека в MRM-режиме с применением стандарта в виде 4-точечной калибровочной кривой. Процентная доля метаболита M-I в микросомах печени человека составила приблизительно 15-20% после 60 минут инкубации с исходным соединением. Массовый баланс, составляющий приблизительно 95-107%, был достигнут для уровня метаболизма в микросомах печени человека. Результаты представлены в таблице 7. Обобщенные данные в отношении калибровочной кривой для 5-бром-2,6-ди(1H-пиразол-1-ил)пиримидин-4-амина и 1-(4-амино-5-бром-6-(1H-пиразол-1-ил)пиримидин-2-ил)-1H-пиразол-4-ола представлены в таблице 8.
Таблица 7. Массовый баланс для метаболизма 5-бром-2,6-ди(1H-пиразол-1-ил)пиримидин-4-амина в микросомах печени человека с применением MRM-анализа
(мин.)
Концентрация
(мкМ)
Концентрация (мкМ)
соединения
M-I
30
60
11,34a
10,47a
1,29
2,23
96,26
88
10,95
18,93
107,22
107,81
30
60
10,09a
9,18
0,92
1,74
87,44
79,55
7,97
15,08
95,41
94,63
Значения находятся в пределах +/- 20% от ULOQ (верхнего предела количественного определения).
Таблица 8. Обобщенные данные в отношении калибровочной кривой для 5-бром-2,6-ди(1H-пиразол-1-ил)пиримидин-4-амина и 1-(4-амино-5-бром-6-(1H-пиразол-1-ил)пиримидин-2-ил)-1H-пиразол-4-ола в микросомах печени человека
A
B
C
D
(мкМ)
конц. (мкМ)
(мкМ)
На долю метаболита M-I, образованного в микросомах печени человека, приходится 15-20% количества исходного соединения. Метаболит M-I, образованный у крысы и собаки, количественно не определяли, и, таким образом, уровень образования данного метаболита может быть выше или ниже, чем в микросомах печени человека.
В заключение, 5-бром-2,6-ди(1H-пиразол-1-ил)пиримидин-4-амин подвергается метаболизму по окислительному пути в микросомах протестированных доклинических видов и человека in vitro, и обнаруженный метаболит являлся идентичным 1-(4-амино-5-бром-6-(1H-пиразол-1-ил)пиримидин-2-ил)-1H-пиразол-4-олу, что было подтверждено посредством хроматографии.
Пример 3. Анализ связывания радиолиганда с hA2A in vitro
Аффинность связывания соединения определяли путем радиолигандного анализа конкурентного связывания (RLB) с использованием [3H]-ZM241385 (ARC, кат. № ART0884) в качестве радиолиганда и мембран, полученных из клеток HEK-293, стабильно экспрессирующих аденозиновый рецептор A2a человека (Perkin Elmer RBHA2AM400UA), применяя 50 мМ Tris с pH 7,5, 1 мМ MgCl2, 0,1 мг/мл BSA, 0,2 Ед./мл аденозиндеаминазы в качестве буфера для анализа. Мембраны предварительно связывали с покрытыми агглютинином из проростков пшеницы (WGA) SPA-гранулами на основе силиката иттрия (YSI) (Perkin Elmer RPNQ0023) перед уравновешением с радиолигандом (2 нМ 3H-ZM241385, 0,5 мкг/лунка мембран с hA2A, 50 мкг/лунка YSI WGA, конечная концентрация) и диапазоном концентраций тестируемого соединения (конечная концентрация DMSO 0,3%) в конечном объеме 100 мкл. Неспецифическое связывание (NSB) определяли посредством 10 мкМ XAC. Применяли белые 384-луночные аналитические планшеты (Greiner № 781207). Аналитические планшеты инкубировали при комнатной температуре до установления равновесия (1,5 часа) перед осуществлением центрифугирования и подсчета в бета-сцинтилляционном счетчике (TopCount NXT) с регистрацией измерений в виде числа импульсов в минуту (имп./мин). Имп./мин преобразовывали в процент ингибирования с применением уравнения:
где общее связывание (TB) представляет собой связывание в отсутствие конкурирующего соединения.
Значение IC50, полученное исходя из кривой концентрация-эффект, преобразовывали в константу ингибирования (Ki) с применением уравнения Ченга-Прусова.
Таблица 11. Значения Ki A2A человека для примера 1
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> NOVARTIS AG
PALOBIOFARMA S.L.
<120> 1-(4-АМИНО-5-БРОМ-6-(1H-ПИРАЗОЛ-1-ИЛ)ПИРИМИДИН-2-ИЛ)-1H-ПИРАЗОЛ-4-ОЛ
И ЕГО ПРИМЕНЕНИЕ В ЛЕЧЕНИИ РАКА
<130> PAT057566-WO-PCT
<140> PCT/IB2018/050783
<141> 2018-02-08
<150> 62/457,219
<151> 2017-02-10
<160> 63
<170> PatentIn версия 3.5
<210> 1
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 1
Thr Tyr Trp Met His
1 5
<210> 2
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 2
Asn Ile Tyr Pro Gly Thr Gly Gly Ser Asn Phe Asp Glu Lys Phe Lys
1 5 10 15
Asn
<210> 3
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 3
Trp Thr Thr Gly Thr Gly Ala Tyr
1 5
<210> 4
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 4
Gly Tyr Thr Phe Thr Thr Tyr
1 5
<210> 5
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 5
Tyr Pro Gly Thr Gly Gly
1 5
<210> 6
<211> 117
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 6
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Thr Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Asn Ile Tyr Pro Gly Thr Gly Gly Ser Asn Phe Asp Glu Lys Phe
50 55 60
Lys Asn Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Trp Thr Thr Gly Thr Gly Ala Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser
115
<210> 7
<211> 351
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 7
gaggtgcagc tggtgcagtc aggcgccgaa gtgaagaagc ccggcgagtc actgagaatt 60
agctgtaaag gttcaggcta caccttcact acctactgga tgcactgggt ccgccaggct 120
accggtcaag gcctcgagtg gatgggtaat atctaccccg gcaccggcgg ctctaacttc 180
gacgagaagt ttaagaatag agtgactatc accgccgata agtctactag caccgcctat 240
atggaactgt ctagcctgag atcagaggac accgccgtct actactgcac taggtggact 300
accggcacag gcgcctactg gggtcaaggc actaccgtga ccgtgtctag c 351
<210> 8
<211> 443
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 8
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Arg Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Thr Tyr
20 25 30
Trp Met His Trp Val Arg Gln Ala Thr Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Asn Ile Tyr Pro Gly Thr Gly Gly Ser Asn Phe Asp Glu Lys Phe
50 55 60
Lys Asn Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Trp Thr Thr Gly Thr Gly Ala Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro
210 215 220
Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
290 295 300
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln
340 345 350
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly
435 440
<210> 9
<211> 1329
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 9
gaggtgcagc tggtgcagtc aggcgccgaa gtgaagaagc ccggcgagtc actgagaatt 60
agctgtaaag gttcaggcta caccttcact acctactgga tgcactgggt ccgccaggct 120
accggtcaag gcctcgagtg gatgggtaat atctaccccg gcaccggcgg ctctaacttc 180
gacgagaagt ttaagaatag agtgactatc accgccgata agtctactag caccgcctat 240
atggaactgt ctagcctgag atcagaggac accgccgtct actactgcac taggtggact 300
accggcacag gcgcctactg gggtcaaggc actaccgtga ccgtgtctag cgctagcact 360
aagggcccgt ccgtgttccc cctggcacct tgtagccgga gcactagcga atccaccgct 420
gccctcggct gcctggtcaa ggattacttc ccggagcccg tgaccgtgtc ctggaacagc 480
ggagccctga cctccggagt gcacaccttc cccgctgtgc tgcagagctc cgggctgtac 540
tcgctgtcgt cggtggtcac ggtgccttca tctagcctgg gtaccaagac ctacacttgc 600
aacgtggacc acaagccttc caacactaag gtggacaagc gcgtcgaatc gaagtacggc 660
ccaccgtgcc cgccttgtcc cgcgccggag ttcctcggcg gtccctcggt ctttctgttc 720
ccaccgaagc ccaaggacac tttgatgatt tcccgcaccc ctgaagtgac atgcgtggtc 780
gtggacgtgt cacaggaaga tccggaggtg cagttcaatt ggtacgtgga tggcgtcgag 840
gtgcacaacg ccaaaaccaa gccgagggag gagcagttca actccactta ccgcgtcgtg 900
tccgtgctga cggtgctgca tcaggactgg ctgaacggga aggagtacaa gtgcaaagtg 960
tccaacaagg gacttcctag ctcaatcgaa aagaccatct cgaaagccaa gggacagccc 1020
cgggaacccc aagtgtatac cctgccaccg agccaggaag aaatgactaa gaaccaagtc 1080
tcattgactt gccttgtgaa gggcttctac ccatcggata tcgccgtgga atgggagtcc 1140
aacggccagc cggaaaacaa ctacaagacc acccctccgg tgctggactc agacggatcc 1200
ttcttcctct actcgcggct gaccgtggat aagagcagat ggcaggaggg aaatgtgttc 1260
agctgttctg tgatgcatga agccctgcac aaccactaca ctcagaagtc cctgtccctc 1320
tccctggga 1329
<210> 10
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 10
Lys Ser Ser Gln Ser Leu Leu Asp Ser Gly Asn Gln Lys Asn Phe Leu
1 5 10 15
Thr
<210> 11
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 11
Trp Ala Ser Thr Arg Glu Ser
1 5
<210> 12
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 12
Gln Asn Asp Tyr Ser Tyr Pro Tyr Thr
1 5
<210> 13
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 13
Ser Gln Ser Leu Leu Asp Ser Gly Asn Gln Lys Asn Phe
1 5 10
<210> 14
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 14
Trp Ala Ser
1
<210> 15
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 15
Asp Tyr Ser Tyr Pro Tyr
1 5
<210> 16
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 16
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Gly Asn Gln Lys Asn Phe Leu Thr Trp Tyr Gln Gln Lys Pro Gly Lys
35 40 45
Ala Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr
65 70 75 80
Ile Ser Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 17
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 17
gagatcgtcc tgactcagtc acccgctacc ctgagcctga gccctggcga gcgggctaca 60
ctgagctgta aatctagtca gtcactgctg gatagcggta atcagaagaa cttcctgacc 120
tggtatcagc agaagcccgg taaagcccct aagctgctga tctactgggc ctctactaga 180
gaatcaggcg tgccctctag gtttagcggt agcggtagtg gcaccgactt caccttcact 240
atctctagcc tgcagcccga ggatatcgct acctactact gtcagaacga ctatagctac 300
ccctacacct tcggtcaagg cactaaggtc gagattaag 339
<210> 18
<211> 220
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 18
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Gly Asn Gln Lys Asn Phe Leu Thr Trp Tyr Gln Gln Lys Pro Gly Lys
35 40 45
Ala Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr
65 70 75 80
Ile Ser Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
115 120 125
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
130 135 140
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
145 150 155 160
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
165 170 175
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
180 185 190
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
195 200 205
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215 220
<210> 19
<211> 660
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 19
gagatcgtcc tgactcagtc acccgctacc ctgagcctga gccctggcga gcgggctaca 60
ctgagctgta aatctagtca gtcactgctg gatagcggta atcagaagaa cttcctgacc 120
tggtatcagc agaagcccgg taaagcccct aagctgctga tctactgggc ctctactaga 180
gaatcaggcg tgccctctag gtttagcggt agcggtagtg gcaccgactt caccttcact 240
atctctagcc tgcagcccga ggatatcgct acctactact gtcagaacga ctatagctac 300
ccctacacct tcggtcaagg cactaaggtc gagattaagc gtacggtggc cgctcccagc 360
gtgttcatct tcccccccag cgacgagcag ctgaagagcg gcaccgccag cgtggtgtgc 420
ctgctgaaca acttctaccc ccgggaggcc aaggtgcagt ggaaggtgga caacgccctg 480
cagagcggca acagccagga gagcgtcacc gagcaggaca gcaaggactc cacctacagc 540
ctgagcagca ccctgaccct gagcaaggcc gactacgaga agcataaggt gtacgcctgc 600
gaggtgaccc accagggcct gtccagcccc gtgaccaaga gcttcaacag gggcgagtgc 660
<210> 20
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 20
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Gly Asn Gln Lys Asn Phe Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Ala Pro Arg Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr
65 70 75 80
Ile Ser Ser Leu Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 21
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 21
gagatcgtcc tgactcagtc acccgctacc ctgagcctga gccctggcga gcgggctaca 60
ctgagctgta aatctagtca gtcactgctg gatagcggta atcagaagaa cttcctgacc 120
tggtatcagc agaagcccgg tcaagcccct agactgctga tctactgggc ctctactaga 180
gaatcaggcg tgccctctag gtttagcggt agcggtagtg gcaccgactt caccttcact 240
atctctagcc tggaagccga ggacgccgct acctactact gtcagaacga ctatagctac 300
ccctacacct tcggtcaagg cactaaggtc gagattaag 339
<210> 22
<211> 220
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 22
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Lys Ser Ser Gln Ser Leu Leu Asp Ser
20 25 30
Gly Asn Gln Lys Asn Phe Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Ala Pro Arg Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr
65 70 75 80
Ile Ser Ser Leu Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Asn
85 90 95
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile
100 105 110
Lys Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp
115 120 125
Glu Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn
130 135 140
Phe Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu
145 150 155 160
Gln Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp
165 170 175
Ser Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr
180 185 190
Glu Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser
195 200 205
Ser Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215 220
<210> 23
<211> 660
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 23
gagatcgtcc tgactcagtc acccgctacc ctgagcctga gccctggcga gcgggctaca 60
ctgagctgta aatctagtca gtcactgctg gatagcggta atcagaagaa cttcctgacc 120
tggtatcagc agaagcccgg tcaagcccct agactgctga tctactgggc ctctactaga 180
gaatcaggcg tgccctctag gtttagcggt agcggtagtg gcaccgactt caccttcact 240
atctctagcc tggaagccga ggacgccgct acctactact gtcagaacga ctatagctac 300
ccctacacct tcggtcaagg cactaaggtc gagattaagc gtacggtggc cgctcccagc 360
gtgttcatct tcccccccag cgacgagcag ctgaagagcg gcaccgccag cgtggtgtgc 420
ctgctgaaca acttctaccc ccgggaggcc aaggtgcagt ggaaggtgga caacgccctg 480
cagagcggca acagccagga gagcgtcacc gagcaggaca gcaaggactc cacctacagc 540
ctgagcagca ccctgaccct gagcaaggcc gactacgaga agcataaggt gtacgcctgc 600
gaggtgaccc accagggcct gtccagcccc gtgaccaaga gcttcaacag gggcgagtgc 660
<210> 24
<211> 15
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 24
acctactgga tgcac 15
<210> 25
<211> 51
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 25
aatatctacc ccggcaccgg cggctctaac ttcgacgaga agtttaagaa t 51
<210> 26
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 26
tggactaccg gcacaggcgc ctac 24
<210> 27
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 27
ggctacacct tcactaccta c 21
<210> 28
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 28
taccccggca ccggcggc 18
<210> 29
<211> 51
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 29
aaatctagtc agtcactgct ggatagcggt aatcagaaga acttcctgac c 51
<210> 30
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 30
tgggcctcta ctagagaatc a 21
<210> 31
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 31
cagaacgact atagctaccc ctacacc 27
<210> 32
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 32
agtcagtcac tgctggatag cggtaatcag aagaacttc 39
<210> 33
<211> 9
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 33
tgggcctct 9
<210> 34
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 34
gactatagct acccctac 18
<210> 35
<211> 440
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 35
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Asp Cys Lys Ala Ser Gly Ile Thr Phe Ser Asn Ser
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Trp Tyr Asp Gly Ser Lys Arg Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Phe
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Asn Asp Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser
115 120 125
Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp
130 135 140
Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr
145 150 155 160
Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr
165 170 175
Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys
180 185 190
Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp
195 200 205
Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala
210 215 220
Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
225 230 235 240
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
245 250 255
Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val
260 265 270
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
275 280 285
Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
290 295 300
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly
305 310 315 320
Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
325 330 335
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr
340 345 350
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
355 360 365
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
370 375 380
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
385 390 395 400
Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe
405 410 415
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
420 425 430
Ser Leu Ser Leu Ser Leu Gly Lys
435 440
<210> 36
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 36
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Ser Ser Asn Trp Pro Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 37
<211> 447
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 37
Gln Val Gln Leu Val Gln Ser Gly Val Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Met Tyr Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Asn Pro Ser Asn Gly Gly Thr Asn Phe Asn Glu Lys Phe
50 55 60
Lys Asn Arg Val Thr Leu Thr Thr Asp Ser Ser Thr Thr Thr Ala Tyr
65 70 75 80
Met Glu Leu Lys Ser Leu Gln Phe Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Asp Tyr Arg Phe Asp Met Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro
210 215 220
Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
260 265 270
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440 445
<210> 38
<211> 218
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 38
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Lys Gly Val Ser Thr Ser
20 25 30
Gly Tyr Ser Tyr Leu His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro
35 40 45
Arg Leu Leu Ile Tyr Leu Ala Ser Tyr Leu Glu Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln His Ser Arg
85 90 95
Asp Leu Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 39
<211> 447
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 39
Gln Val Gln Leu Val Gln Ser Gly Ser Glu Leu Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Gly Met Asn Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Gln Trp Met
35 40 45
Gly Trp Ile Asn Thr Asp Ser Gly Glu Ser Thr Tyr Ala Glu Glu Phe
50 55 60
Lys Gly Arg Phe Val Phe Ser Leu Asp Thr Ser Val Asn Thr Ala Tyr
65 70 75 80
Leu Gln Ile Thr Ser Leu Thr Ala Glu Asp Thr Gly Met Tyr Phe Cys
85 90 95
Val Arg Val Gly Tyr Asp Ala Leu Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp Lys Thr His
210 215 220
Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
260 265 270
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 40
<211> 213
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 40
Glu Ile Val Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Ser Ala Arg Ser Ser Val Ser Tyr Met
20 25 30
His Trp Phe Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Trp Ile Tyr
35 40 45
Arg Thr Ser Asn Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Cys Leu Thr Ile Asn Ser Leu Gln Pro Glu
65 70 75 80
Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Arg Ser Ser Phe Pro Leu Thr
85 90 95
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Ala Ala Pro
100 105 110
Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly Thr
115 120 125
Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala Lys
130 135 140
Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln Glu
145 150 155 160
Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser Ser
165 170 175
Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr Ala
180 185 190
Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser Phe
195 200 205
Asn Arg Gly Glu Cys
210
<210> 41
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 41
Gly Tyr Thr Phe Thr Thr Tyr Trp Met His
1 5 10
<210> 42
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 42
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ile Met Met Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Tyr Pro Ser Gly Gly Ile Thr Phe Tyr Ala Asp Lys Gly
50 55 60
Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln
65 70 75 80
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg
85 90 95
Ile Lys Leu Gly Thr Val Thr Thr Val Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 43
<211> 110
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 43
Gln Ser Ala Leu Thr Gln Pro Ala Ser Val Ser Gly Ser Pro Gly Gln
1 5 10 15
Ser Ile Thr Ile Ser Cys Thr Gly Thr Ser Ser Asp Val Gly Gly Tyr
20 25 30
Asn Tyr Val Ser Trp Tyr Gln Gln His Pro Gly Lys Ala Pro Lys Leu
35 40 45
Met Ile Tyr Asp Val Ser Asn Arg Pro Ser Gly Val Ser Asn Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Asn Thr Ala Ser Leu Thr Ile Ser Gly Leu
65 70 75 80
Gln Ala Glu Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Thr Ser Ser
85 90 95
Ser Thr Arg Val Phe Gly Thr Gly Thr Lys Val Thr Val Leu
100 105 110
<210> 44
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 44
Ser Tyr Trp Met Tyr
1 5
<210> 45
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 45
Arg Ile Asp Pro Asn Ser Gly Ser Thr Lys Tyr Asn Glu Lys Phe Lys
1 5 10 15
Asn
<210> 46
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 46
Asp Tyr Arg Lys Gly Leu Tyr Ala Met Asp Tyr
1 5 10
<210> 47
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 47
Gly Tyr Thr Phe Thr Ser Tyr
1 5
<210> 48
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 48
Asp Pro Asn Ser Gly Ser
1 5
<210> 49
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 49
Lys Ala Ser Gln Asp Val Gly Thr Ala Val Ala
1 5 10
<210> 50
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 50
Trp Ala Ser Thr Arg His Thr
1 5
<210> 51
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 51
Gln Gln Tyr Asn Ser Tyr Pro Leu Thr
1 5
<210> 52
<211> 7
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 52
Ser Gln Asp Val Gly Thr Ala
1 5
<210> 53
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 53
Trp Ala Ser
1
<210> 54
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 54
Tyr Asn Ser Tyr Pro Leu
1 5
<210> 55
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 55
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Val Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Tyr Trp Val Arg Gln Ala Arg Gly Gln Arg Leu Glu Trp Ile
35 40 45
Gly Arg Ile Asp Pro Asn Ser Gly Ser Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Asn Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Tyr Arg Lys Gly Leu Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 56
<211> 360
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 56
gaggtccagc tggtacagtc tggggctgag gtgaagaagc ctggggctac agtgaaaatc 60
tcctgcaagg tttctggcta caccttcacc agttactgga tgtactgggt gcgacaggct 120
cgtggacaac gccttgagtg gataggtagg attgatccta atagtgggag tactaagtac 180
aatgagaagt tcaagaacag attcaccatc tccagagaca attccaagaa cacgctgtat 240
cttcaaatga acagcctgag agccgaggac acggccgtgt attactgtgc aagggactat 300
agaaaggggc tctatgctat ggactactgg ggccagggca ccaccgtgac cgtgtcctcc 360
<210> 57
<211> 1341
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 57
gaggtccagc tggtacagtc tggggctgag gtgaagaagc ctggggctac agtgaaaatc 60
tcctgcaagg tttctggcta caccttcacc agttactgga tgtactgggt gcgacaggct 120
cgtggacaac gccttgagtg gataggtagg attgatccta atagtgggag tactaagtac 180
aatgagaagt tcaagaacag attcaccatc tccagagaca attccaagaa cacgctgtat 240
cttcaaatga acagcctgag agccgaggac acggccgtgt attactgtgc aagggactat 300
agaaaggggc tctatgctat ggactactgg ggccagggca ccaccgtgac cgtgtcctcc 360
gcttccacca agggcccatc cgtcttcccc ctggcgccct gctccaggag cacctccgag 420
agcacagccg ccctgggctg cctggtcaag gactacttcc ccgaaccggt gacggtgtcg 480
tggaactcag gcgccctgac cagcggcgtg cacaccttcc cggctgtcct acagtcctca 540
ggactctact ccctcagcag cgtggtgacc gtgccctcca gcagcttggg cacgaagacc 600
tacacctgca acgtagatca caagcccagc aacaccaagg tggacaagag agttgagtcc 660
aaatatggtc ccccatgccc accgtgccca gcacctgagt tcctgggggg accatcagtc 720
ttcctgttcc ccccaaaacc caaggacact ctcatgatct cccggacccc tgaggtcacg 780
tgcgtggtgg tggacgtgag ccaggaagac cccgaggtcc agttcaactg gtacgtggat 840
ggcgtggagg tgcataatgc caagacaaag ccgcgggagg agcagttcaa cagcacgtac 900
cgtgtggtca gcgtcctcac cgtcctgcac caggactggc tgaacggcaa ggagtacaag 960
tgcaaggtgt ccaacaaagg cctcccgtcc tccatcgaga aaaccatctc caaagccaaa 1020
gggcagcccc gagagccaca ggtgtacacc ctgcccccat cccaggagga gatgaccaag 1080
aaccaggtca gcctgacctg cctggtcaaa ggcttctacc ccagcgacat cgccgtggag 1140
tgggagagca atgggcagcc ggagaacaac tacaagacca cgcctcccgt gctggactcc 1200
gacggctcct tcttcctcta cagcaggcta accgtggaca agagcaggtg gcaggagggg 1260
aatgtcttct catgctccgt gatgcatgag gctctgcaca accactacac acagaagagc 1320
ctctccctgt ctctgggtaa a 1341
<210> 58
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 58
Ala Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Gly Thr Ala
20 25 30
Val Ala Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile
35 40 45
Tyr Trp Ala Ser Thr Arg His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Glu Ala
65 70 75 80
Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Ser Tyr Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 59
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 59
gccatccagt tgacccagtc tccatcctcc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgca aggccagtca ggatgtgggt actgctgtag cctggtacct gcagaagcca 120
gggcagtctc cacagctcct gatctattgg gcatccaccc ggcacactgg ggtcccctcg 180
aggttcagtg gcagtggatc tgggacagat ttcaccttta ccatcagtag cctggaagct 240
gaagatgctg caacatatta ctgtcagcag tataacagct atcctctcac gttcggccaa 300
gggaccaagg tggaaatcaa a 321
<210> 60
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 60
Ala Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Gly Thr Ala
20 25 30
Val Ala Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile
35 40 45
Tyr Trp Ala Ser Thr Arg His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Glu Ala
65 70 75 80
Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Ser Tyr Pro Leu
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 61
<211> 642
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полинуклеотид"
<400> 61
gccatccagt tgacccagtc tccatcctcc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgca aggccagtca ggatgtgggt actgctgtag cctggtacct gcagaagcca 120
gggcagtctc cacagctcct gatctattgg gcatccaccc ggcacactgg ggtcccctcg 180
aggttcagtg gcagtggatc tgggacagat ttcaccttta ccatcagtag cctggaagct 240
gaagatgctg caacatatta ctgtcagcag tataacagct atcctctcac gttcggccaa 300
gggaccaagg tggaaatcaa acgtacggtg gctgcaccat ctgtcttcat cttcccgcca 360
tctgatgagc agttgaaatc tggaactgcc tctgttgtgt gcctgctgaa taacttctat 420
cccagagagg ccaaagtaca gtggaaggtg gataacgccc tccaatcggg taactcccag 480
gagagtgtca cagagcagga cagcaaggac agcacctaca gcctcagcag caccctgacg 540
ctgagcaaag cagactacga gaaacacaaa gtctacgcct gcgaagtcac ccatcagggc 600
ctgagctcgc ccgtcacaaa gagcttcaac aggggagagt gt 642
<210> 62
<211> 447
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
полипептид"
<400> 62
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Val Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Tyr Trp Val Arg Gln Ala Arg Gly Gln Arg Leu Glu Trp Ile
35 40 45
Gly Arg Ile Asp Pro Asn Ser Gly Ser Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Asn Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Tyr Arg Lys Gly Leu Tyr Ala Met Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro
210 215 220
Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
260 265 270
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440 445
<210> 63
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: синтетический
пептид"
<400> 63
Gly Tyr Thr Phe Thr Ser Tyr Trp Met Tyr
1 5 10
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| 5-БРОМ-2,6-ДИ-(1Н-ПИРАЗОЛ-1-ИЛ)ПИРИМИДИН-4-АМИН ДЛЯ ПРИМЕНЕНИЯ В ЛЕЧЕНИИ РАКА | 2016 |
|
RU2745560C2 |
| МОЛЕКУЛЫ АНТИТЕЛ К PD-1 И ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2788092C2 |
| ПРОИЗВОДНЫЕ 3-(5-АМИНО-1-ОКСОИЗОИНДОЛИН-2-ИЛ)ПИПЕРИДИН-2,6-ДИОНА И ИХ ПРИМЕНЕНИЕ В ЛЕЧЕНИИ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С БЕЛКОМ С "ЦИНКОВЫМИ ПАЛЬЦАМИ" 2 СЕМЕЙСТВА IKAROS (IKZF2) | 2019 |
|
RU2815714C2 |
| СПОСОБЫ КОМБИНИРОВАННОГО ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ, ВКЛЮЧАЮЩИЕ СРЕДСТВА, БЛОКИРУЮЩИЕ CTLA-4 И PD-1 | 2020 |
|
RU2833523C2 |
| АНТИТЕЛА К PD-1 И ИХ ПРИМЕНЕНИЕ | 2017 |
|
RU2761640C2 |
| АНТИ-PD-1 АНТИТЕЛА | 2019 |
|
RU2788095C2 |
| АНТИТЕЛА К PD-1 СОБАК | 2014 |
|
RU2732604C2 |
| ВИДЫ КОМБИНИРОВАННОЙ ТЕРАПИИ С ИСПОЛЬЗОВАНИЕМ ХИМЕРНЫХ АНТИГЕННЫХ РЕЦЕПТОРОВ И ИНГИБИТОРОВ PD-1 | 2017 |
|
RU2809160C2 |
| Гетеродимерные слитые белки ИЛ-15/ИЛ-15Рα - Fc и их применение | 2019 |
|
RU2827796C2 |
| ГИБРИДНЫЕ БЕЛКИ ВАРИАНТА sPD-1—FC | 2019 |
|
RU2785993C2 |
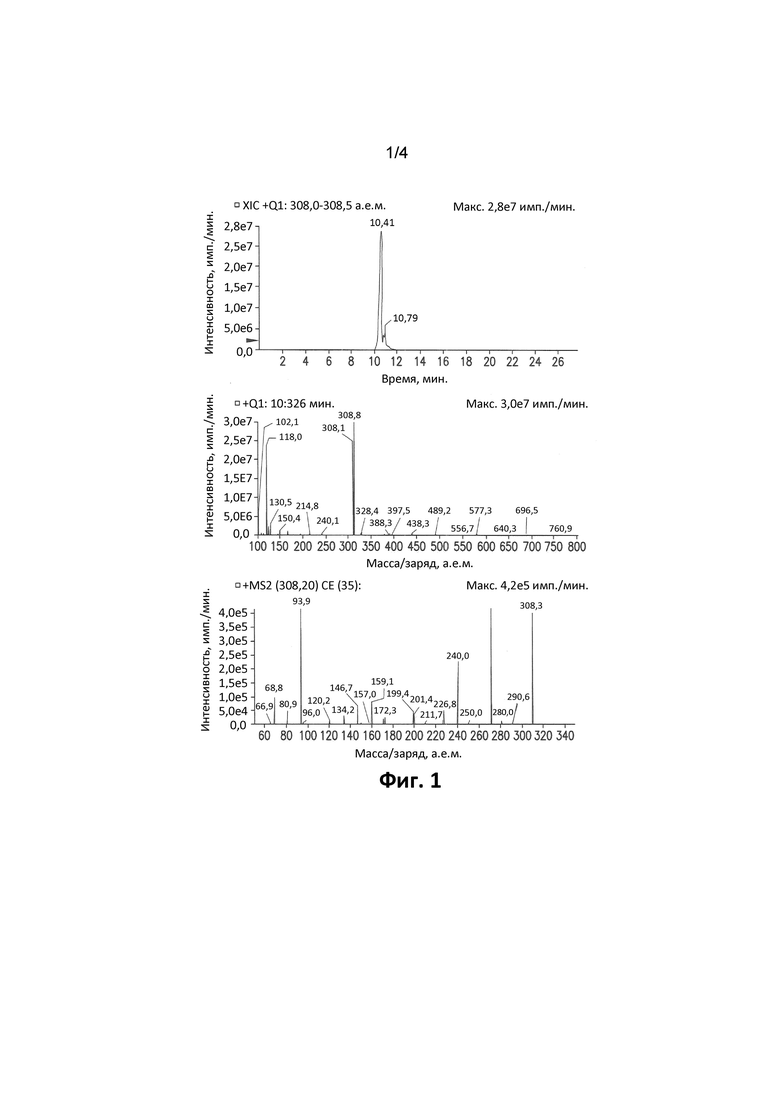
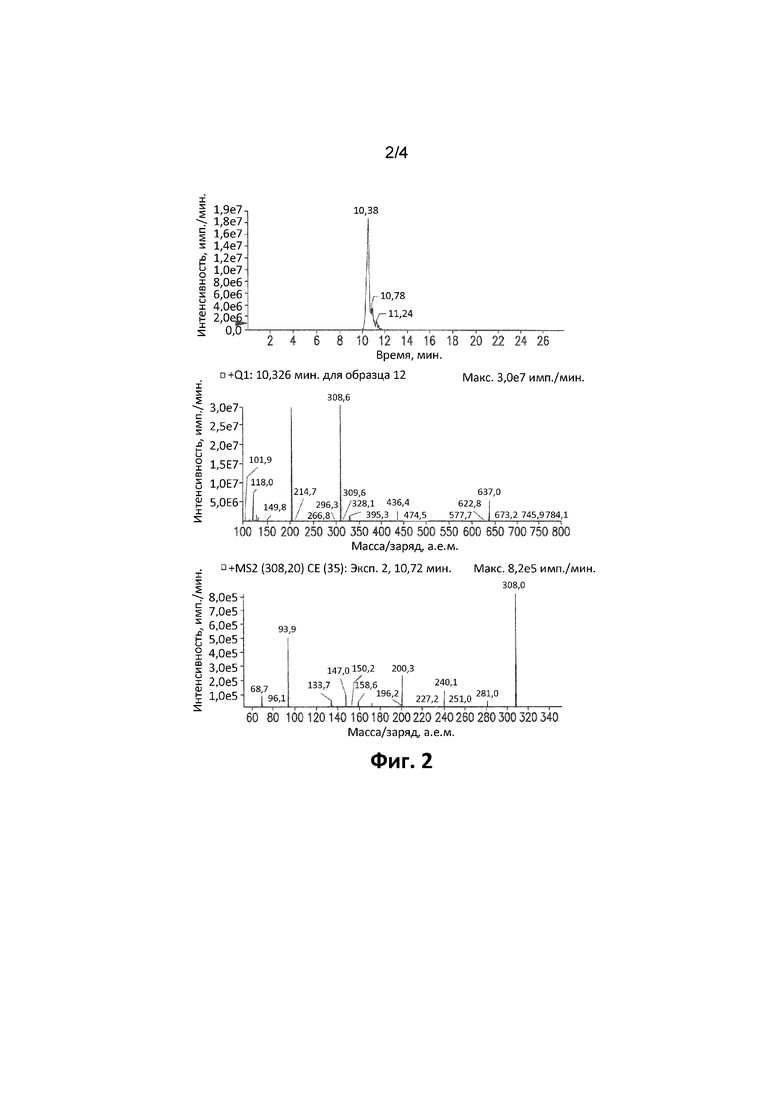
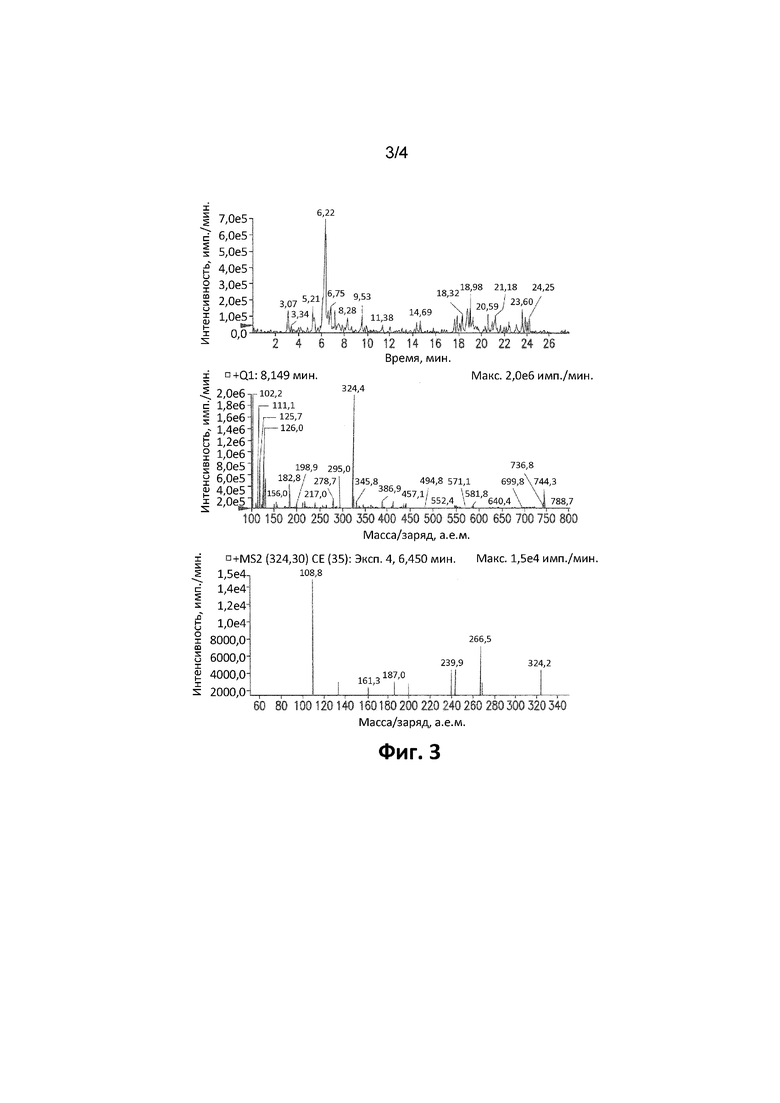
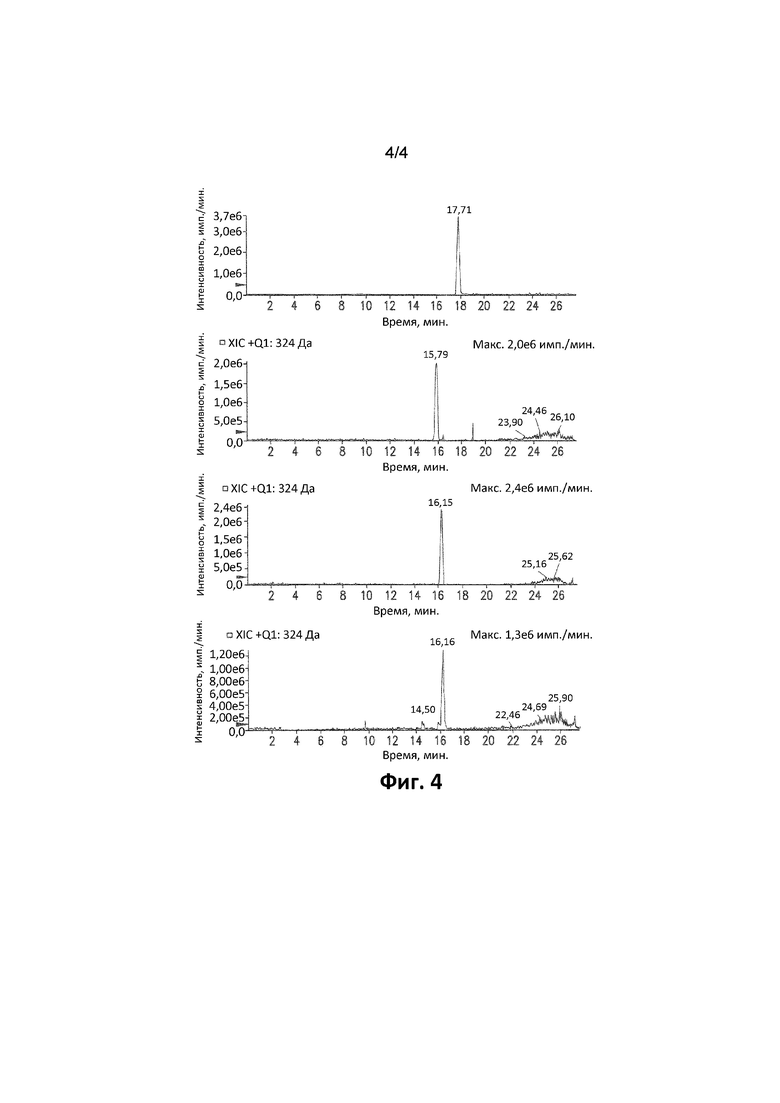
Настоящее изобретение относится к активному метаболиту 5-бром-2,6-ди(1H-пиразол-1-ил)пиримидин-4-амина, который представляет собой соединение 1-(4-амино-5-бром-6-(1H-пиразол-1-ил)пиримидин-2-ил)-1H-пиразол-4-ол указанной ниже формулы. Также предложены фармацевтическая композиция и комбинация, содержащие 1-(4-амино-5-бром-6-(1H-пиразол-1-ил)пиримидин-2-ил)-1H-пиразол-4-ол, и способ ингибирования аденозинового рецептора A2a у субъекта. Предложенное соединение модулирует аденозиновый рецептор A2a и может применяться для лечении рака отдельно или в комбинации с одним или несколькими иммунотерапевтическими средствами. 5 н.п. ф-лы, 4 ил., 15 табл., 4 пр.
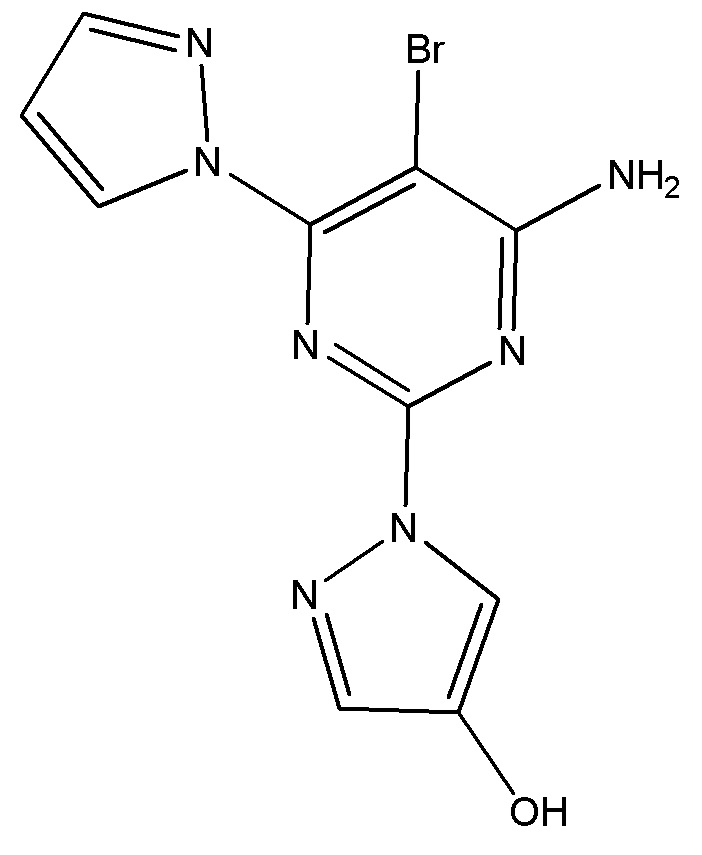
1. Метаболит 5-бром-2,6-ди(1H-пиразол-1-ил)пиримидин-4-амина, который представляет собой соединение
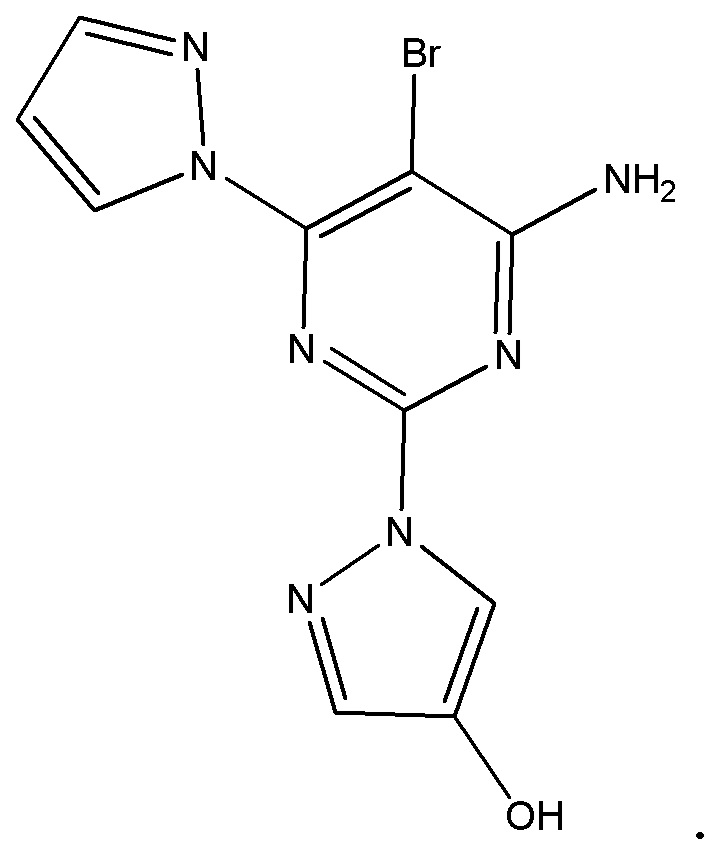
2. Соединение 1-(4-амино-5-бром-6-(1H-пиразол-1-ил)пиримидин-2-ил)-1H-пиразол-4-ол, находящееся в выделенном виде.
3. Фармацевтическая композиция, ингибирующая аденозиновый рецептор A2a человека, содержащая терапевтически эффективное количество 1-(4-амино-5-бром-6-(1H-пиразол-1-ил)пиримидин-2-ил)-1H-пиразол-4-ола и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество.
4. Комбинация, ингибирующая аденозиновый рецептор A2a человека, содержащая терапевтически эффективное количество 1-(4-амино-5-бром-6-(1H-пиразол-1-ил)пиримидин-2-ил)-1H-пиразол-4-ола и одно или нескольких иммунотерапевтических средств.
5. Способ ингибирования аденозинового рецептора A2a у субъекта, где способ включает введение субъекту терапевтически эффективного количества 1-(4-амино-5-бром-6-(1H-пиразол-1-ил)пиримидин-2-ил)-1H-пиразол-4-ола по п. 1 или 2.
| WO 2011121418 A1, 06.10.2011 | |||
| WO 2009114335 A2, 17.09.2009 | |||
| WO 2014209804 A1, 31.12.2014 | |||
| EA 200800229 A1, 30.06.2008. |
Авторы
Даты
2023-03-09—Публикация
2018-02-08—Подача