ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДТВЕННЫЕ ЗАЯВКИ
Настоящая заявка притязает на приоритет предварительной заявки на патент США с №62/428871, поданной 1 декабря 2016 г.; предварительной заявки на патент США с №62/450895, поданной 26 января 2017 г. предварительной заявки на патент США с №62/466198, поданной 2 марта 2017 г.; предварительной заявки на патент США с №62/500807, поданной 3 мая 2017 г.; и предварительной заявки на патент США с №62/584342, поданной 10 ноября 2017 г., описание которых таким образом включено посредством ссылки во всей их полноте.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к области диагностики и терапии таупатий, таких как болезнь Альцгеймера.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Многие, возможно, большинство физиологических и патофизиологических процессов могут сопровождаться аберрантным повышением или понижением регуляции экспрессии генов. Примеры включают несоответствующую экспрессию провоспалительных цитокинов при ревматоидном артрите, недостаточную экспрессию рецептора LDL в печени при гиперхолестеринемии, сверхэкспрессию проангиогенных факторов и недостаточную экспрессию антиангиогенных факторов при росте солидных опухолей, и это лишь некоторые из них. Кроме того, патогенные организмы, такие как вирусы, бактерии, грибы и простейшие, можно контролировать путем изменения экспрессии генов.
Промоторные области генов, как правило, содержат проксимальные, центральные и нижележащие (3') элементы, и транскрипция может регулироваться множеством энхансеров. Эти последовательности содержат множество сайтов связывания для множества факторов транскрипции и могут активировать транскрипцию независимо от местоположения, расстояния или ориентации относительно последовательности промотора. Для достижения регуляции экспрессии генов связанные с энхансерами факторы транскрипции выгибают в петлю промежуточные последовательности и контактируют с промоторной областью. Кроме того, для активации эукариотических генов может потребоваться декомпактизация структуры хроматина, что может быть осуществлено путем привлечения модифицирующих гистоны ферментов или АТФ-зависимых ремоделирующих хроматин комплексов, так что структура хроматина изменяется, и увеличивается доступность ДНК для других белков, вовлеченных в экспрессии генов, (Ong and Corces (2011) Nat Rev Genetics 12:283).
Нарушение структуры хроматина может происходить по нескольким механизмам, некоторые из которых относятся к конкретному гену, а другие распространены повсюду в геноме и имеют место во время клеточных процессов, таких как митоз, в которых требуется конденсация хроматина. Остатки лизина в гистонах могут стать ацетилированными, эффективно нейтрализуя взаимодействие зарядов между белками гистонов и хромосомной ДНК. Это наблюдалось в гиперацетилированном и сильно транскрибируемом локусе β-глобина, который, как было показано, также чувствителен к ДНКазе, что является признаком широкой доступности. Другие типы модификаций гистонов, которые наблюдались, включают метилирование, фосфорилирование, дезаминирование, АДФ-рибозилирование, добавление сахаров - β-N-ацетилглюкозаминов, убиквитинирование и сумоилирование (смотрите Bannister and Kouzarides (2011) Cell Res 21: 381).
Репрессия или активация связанных с заболеванием генов была достигнута благодаря использованию сконструированных факторов транскрипции. Методы конструирования и использования сконструированных факторов транскрипции с доменами типа «цинковые пальцы» (ZFP-TF) полностью описаны (смотрите, например, патент США с №6534261), а в последнее время также были описаны как подобные активаторам транскрипции эффекторы (TALE)-факторы транскрипции (TF) (TALE-TF), так и факторы транскрипции на основе CRISPR(коротких палиндромных повторов, регулярно расположенных группами)-Cas (CRISPR-Cas-TF) (смотрите обзор Kabadi and Gersbach (2014) Methods 69 (2): 188-197). Неограничивающие примеры целевых генов включают фосфоламбан (Zhang et al., (2012) Mol Ther 20(8):1508-1515), GDNF (Langaniere et al., (2010) J. Neurosci 39(49):16469) и VEGF (Liu et al., (2001) J Biol Chem 276:11323-11334). Кроме того, активация генов была достигнута путем использования слияния CRIPSR/Cas-ацетилтрансфераза (Hilton et al., (2015) Nat Biotechnol 33 (5):510-517). Было также показано, что сконструированные факторы транскрипции (TF), которые подавляют экспрессию генов (являются репрессорами), эффективны при лечении тринуклеотидных заболеваний, таких как болезнь Хантингтона (HD). Смотрите, например, патент США с №89568282 и публикацию заявки на патент США с №2015/0335708.
Болезнь Альцгеймера (AD) представляет собой сложное многофакторное заболевание, характеризующееся несколькими различными механизмами заболевания, которые не полностью поняты и могут взаимодействовать друг с другом еще недостаточно изученным образом. По оценкам, 5,3 миллиона американцев всех возрастов страдают AD, что делает ее одной из десяти основных причин смерти в Америке, и, по оценкам, к 2050 году во всем мире будет 106,2 миллиона человек с этой болезнью (van Dijk et al., (2015) Front Neurosci 9, art. 173). Эта болезнь чаще встречается у женщин (две трети случаев), а также люди африканского или латиноамериканского происхождения имеют более высокую вероятность развития AD, чем люди белой европеоидной расы. Причины AD, по-видимому, связаны с генетикой (особенно в случае раннего начала, 5% случаев), а также с факторами окружающей среды и образа жизни. Как правило, болезнь диагностируется в середине седьмого десятка лет человека, хотя к моменту установления диагноза болезнь прогрессировала годами или даже десятилетиями. Болезнь продолжает прогрессировать с течением времени, и до настоящего времени не было идентифицировано никаких терапевтических вмешательств, которые бы ограничивали или обращали вспять последствия болезни.
Признаком болезни является утрата синапсов в головном мозге, что приводит к снижению когнитивных способностей. Считается, что в здоровом головном мозге синаптическая пластичность - это то, что позволяет учиться и формировать память. В ходе AD синаптическая пластичность изменяется, и многие механизмы, участвующие в поддержании этой пластичности, являются разрегулированными, что приводит к дисфункции синапса и его разрушению (Spiers-Jones and Hyman (2014) Neuron 82:756).
Хотя, по-видимому, существует множество молекулярных факторов, которые оказывают влияние на возникновение и прогрессирование AD, большая часть научных исследований была сосредоточена на двух основных участниках болезни. Первым участником является фрагмент из 40-42 аминокислот белка-предшественника амилоида (APP), называемый амилоидом β (Aβ), который образуется путем протеолитического расщепления бета-секретазой и гамма-секретазой (Olsson et al., (2014) J Biol Chem 289 (3):1540-1550). Нерастворимые фрагменты Aβ накапливаются в «сенильных» бляшках в головном мозге, хотя, по-видимому, нет строгой корреляции между наличием этих бляшек и нейродегенерацией.
Другой участник, Тау (Tau), также получил большое внимание. Тау представляет собой ассоциированный с микротрубочками белок, который изначально считался стабилизирующим микротрубочки. У пациентов с AD и у пожилых людей вообще, но в меньшей степени, тау может накапливаться в нейрофибриллярных клубках (NFT). В ходе болезни тау становится гиперфосфорилированным и отделяется от микротрубочек и накапливается в филаментах. В отличие от Aβ бляшек, существует прямая корреляция между наличием NFT и снижением познавательной способности (Spiers-Jones and Hyman, там же).
Интересно, что как тау, так и Аβ, по-видимому, играют важную роль в нормальной синаптической функции. Тау, по-видимому, играет важную роль в транспортировке митохондрий в клетке к синапсу, и было показано, что сверхэкспрессия тау ингибирует эту транспортировку. Считается, что нарушение транспортировки митохондрий вызывает утрату синапса из-за важной роли, которую митохондрии играют в продукции АТФ и кальциевом буферном действии. Aβ, по-видимому, играет роль в пластичности синапсов в здоровой клетке. Однако накопление этих двух белков в бляшках и клубках связано с прогрессированием AD. В действительности, представляется, что появление амилоидных бляшек важно на самых ранних стадиях AD, и это приводит к появлению NFT, и что эти два белка фактически действуют синергетически друг с другом с ускорением прогрессирования болезни (Pooler et al. al., (2015) Acta Neuropath Comm 3 (14):1). Впрочем, становится все более очевидным, что растворимые формы этих белков вносят вклад в токсичность (Spiers-Jones and Hyman, там же).
В действительности, аномальные уровни и/или агрегация тау, как было показано, вовлечены в ряд состояний, которые в совокупности называются таупатиями. Они включают болезнь Альцгеймера (AD), лобно-височную деменцию (FTD, смотрите Benussi et al., (2015) Front Ag Neuro 7, art. 171)), прогрессирующий супрануклеарный парез (PSP), трудноизлечимые генетические эпилепсии (например, синдром Драве, смотрите Gheyara et al., (2014) Ann Neurol 76:443-456) и кортикобазальную дегенерацию (CBD, смотрите Scholz and Bras 2015, Int J. Mol. Sci 16 (10):24629-24655). Снижение экспрессии тау у взрослых мышей, используя введение антисмысловых олигонуклеотидов непосредственно в спинномозговую жидкость (CSF), вызывало полное или частичное снижение уровней тау, а также защищало подвергнутых лечению мышей от эпилептических припадков, вызванных химическими веществами, по показателю тяжести припадка (DeVos et al., (2013) J of NeuroSci 33 (31):12887).
Было установлено, что AD протекает в головном мозге иерархическим образом, начиная с энторинальной коры, а затем распространяясь через гиппокампальную формацию, лимбические и ассоциативные коры и, наконец, поражая большинство областей головного мозга на поздних стадиях болезни. Интересно, что прогрессирование AD отмечается появлением NFT, что указывает на вовлеченность тау на более поздних стадиях болезни. Было даже высказано предположение, что тау может обладать прионоподобными свойствами, поскольку научное исследование показывает, что неправильно свернутый высокофосфорилированный тау-белок легче поглощается нейронами и может распространять болезнь по головному мозгу, и что этот неправильно свернутый тау, выделенный из головного мозга пациентов с AD, может легко поглощаться нейронами мыши (Takeda et al., (2015) Nat Comm doi: 10.1038/ncomms9490; Hyman (2014) Neuron 82:1189). Кроме того, научное исследование, проведенное с использованием модели на трансгенной мыши, показало, что экспрессия мутанта тау человека, который связан с образованием клубочков только в энторинальной коре головного мозга мыши, приводила к неправильному свертыванию тау-белка мыши и агрегации этого тау в нейронах без какой-либо обнаруживаемой экспрессия тау человека (de Calignon et al., (2012) Neuron 73:685-697), что позволяет предположить, что неправильно свернутый белок человека способен «ронять семена» неправильного свертывания и вызывать агрегацию белков мыши. Кроме того, генетическое уменьшение или утрата эндогенного тау мыши защищает от нейропатологической токсичности, вызванной сверхэкспрессией мутантного трансгена тау человека (Wegmann et al., (2015) EMBO J. 34 (24):3028-41).
Таким образом, остается потребность в способах предотвращения и/или лечения таупатий, включая AD, FTD, PSP CBD и эпилептические припадки; в том числе в способах воздействия, которые показывают практически повсеместную доставку в головной мозг.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Здесь раскрыты способы и композиции для диагностики, предотвращения и/или лечения одной или более таупатий, таких как болезнь Альцгеймера (AD). В частности, здесь предложены способы и композиции для модификации (например, модулирования экспрессии) аллели тау для лечения по крайней мере одной таупатии, такой как AD, включающие сконструированные репрессоры факторов транскрипции (которые подавляют экспрессию тау). Кроме того, эти способы и композиции могут использоваться для модификации аллели тау для лечения и/или предотвращения других таупатий, в том числе AD, FTD, PSP CBD и/или эпилептических припадков. В частности, здесь предложены способы и композиции выявления, уменьшения и/или устранения агрегатов тау у субъекта с таупатией.
Таким образом, здесь описаны генетические модуляторы гена ассоциированного с микротрубочками белка тау (MAPT), при этом модулятор включает: ДНК-связывающий домен, который связывается с сайтом-мишенью из по крайней мере 12 нуклеотидов в гене MAPT; и функциональный домен (например, регулирующий транскрипцию домен (такой как подавляющий домен или активирующий домен) или нуклеазный домен). Может использоваться любой ДНК-связывающий домен, включая, но без ограничения этим, белок с цинковыми пальцами (ZFP), белок с TAL-эффекторным доменом (TALE), химерная руководящая РНК (из систем CRISPR), белок Argonaute и т.п. Также предложены один или более полинуклеотидов, включая вирусные и невирусные средства доставки генов (например, как мРНК, плазмиды, AAV векторы, лентивирусные векторы, Ad векторы), кодирующие генетические модуляторы, описанные здесь (или один или более их компонентов на одних и тех же или разных полинуклеотидах). В некоторых вариантах осуществления средство доставки гена включает AAV вектор, включая, но без ограничения этим, AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV8, AAV 8.2, AAV9, AAV rh10, псевдотипы этих векторов (например, как AAV2/8, AAV2/5, AAV2/6, AAV2/9 и т.д.), включая варианты AAV векторов, известные в данной области техники (например, из патента США с №9585971 и предварительной заявки на патент США с №62/503121). Также предложены фармацевтические композиции и выделенные клетки, содержащие один или более генетических модуляторов, один или более полинуклеотидов и/или одно или более средств доставки генов. В настоящем изобретении также предложены способы и применения для модуляции экспрессии MAPT у субъекта, нуждающегося в этом, в том числе путем предоставления субъекту одного или более полинуклеотидов, одного или более средств доставки генов и/или фармацевтической композиции, как здесь описано. В некоторых вариантах осуществления описанные здесь композиции используются для подавления экспрессии MAPT у субъекта, в том числе для лечения и/или предотвращения таупатии (например, путем уменьшения количества тау у субъекта). Описанные здесь композиции снижают уровни тау в течение продолжительных периодов времени (от 6 месяцев до года и более) в головном мозге (включая, но без ограничения этим, лобную кору (долю), переднюю кору, заднюю кору, гиппокамп, ствол мозга, полосатое тело, таламус, средний мозг, мозжечок) и спинном мозге (включая, но без ограничения этим, поясничную, грудную и шейную области). Описанные здесь композиции могут быть предоставлены субъекту любым способом введения, включая, но без ограничения этим, интрацеребровентрикулярное, интратекальное, интракраниальное, внутривенное, орбитальное (ретроорбитальное (RO)) и/или внутрицистернальное введение. Также предложены наборы, включающие одну или более композиций (например, генетических модуляторов, полинуклеотидов, фармацевтических композиций и/или клеток), описанных здесь, а также инструкции по применению этих композиций.
Таким образом, в одном аспекте предложены сконструированные (не встречающиеся в природе) генетические модуляторы (например, репрессоры) одного или более генов тау. Генетические модуляторы тау могут включать системы (например, белки с цинковыми пальцами, белки TAL-эффекторы (TALE) или CRISPR/dCas-TF), которые модулируют (например, подавляют) экспрессию аллели тау. Сконструированные белки с цинковыми пальцами или TALE представляют собой не встречающиеся в природе белки с цинковыми пальцами или TALE, ДНК-связывающие домены (например, распознающие спирали или RVD) которых были изменены (например, путем отбора и/или конструктивного расчета) для связывания с предварительно выбранным сайтом-мишенью. Любой из белков с цинковыми пальцами, описанных здесь, может включать 1, 2, 3, 4, 5, 6 или более цинковых пальцев, при этом каждый цинковый палец имеет распознающую спираль, которая связывается с субсайтом-мишенью в выбранной последовательности(ях) (например, гене(ах)). Аналогично, любой из описанных здесь белков TALE может включать любое количество RVD TALE. В некоторых вариантах осуществления по крайней мере один RVD обладает характеристиками неспецифического ДНК-связывания. В некоторых вариантах осуществления по крайней мере одна распознающая спираль (или RVD) не встречается в природе. CRISPR/Cas-TF включает химерную руководящую РНК, которая связывается с последовательностью-мишенью. В некоторых вариантах осуществления сконструированный фактор транскрипции связывается (например, через ДНК-связывающий домен ZFP, TALE или sgRNA) с сайтом-мишенью из по крайней мере 12 пар оснований в гене, кодирующем тау, например, сайтом-мишенью, включающим по крайней мере 12 пар оснований (например, 12, 13, 14, 15, 16, 17, 18 или более), из таблиц 1-3 (SEQ ID NO:1-6, 33 и 44-46), включая смежные или несмежные последовательности в этих сайтах-мишенях. В некоторых вариантах осуществления ДНК-связывающие домены белков с цинковыми пальцами имеют распознающие спирали в белках, представленных в любой из таблиц 1-3, включая ZFP, обозначенные 52288, 52322, 52366, 57890, 57880, 65888, 52364, 52389, 65894, 57930, 65918, 65920, 65887, 57947, 65968, 65976 или 65860 из таблиц 1, 2 и 3. В некоторых вариантах осуществления генетический модулятор представляет собой генетический репрессор, который включает ДНК-связывающий домен (ZFP, TALE, химерную руководящую РНК), описанный здесь, функционально связанный с подавляющим транскрипцию доменом. В других вариантах осуществления генетический модулятор представляет собой генетический репрессор, включающий ДНК-связывающий домен (ZFP, TALE, химерную руководящую РНК), описанный здесь, функционально связанный с по крайней мере одним нуклеазным доменом (например, одним, двумя или более нуклеазными доменами). Результирующая нуклеаза способна к генетической модификации (путем вставок и/или делеций) гена-мишени, например, в последовательности(ях)-мишени ДНК-связывающего домена; в сайте(ах) расщепления; вблизи (1-50 или более пар оснований) от последовательности(ей)-мишени и/или сайта(ов) расщепления; и/или между парными сайтами-мишенями, когда для расщепления используется пара нуклеаз.
В некоторых вариантах осуществления белки с цинковыми пальцами (ZFP), белок Cas системы CRISPR/Cas или белки TALE, описанные здесь, могут быть помещены в функциональную связь с регуляторным доменом (или функциональным доменом) как часть слитого белка. Функциональным доменом может быть, например, активирующий транскрипцию домен, подавляющий транскрипцию домен и/или нуклеазный (расщепляющий) домен. Выбирая либо активирующий домен, либо подавляющий домен для использования с ДНК-связывающим доменом, такие молекулы можно использовать либо для активации, либо для подавления экспрессии тау. В некоторых вариантах осуществления функциональные или регуляторные домены могут играть роль в посттрансляционных модификациях гистонов. В некоторых случаях домен представляет собой гистон-ацетилтрансферазу (HAT), гистон-деацетилазу (HDAC), гистон-метилазу или фермент, который сумолирует или биотинилирует гистон, или другой ферментативный домен, который делает возможной регулируемую посттрансляционными модификациями гистонов репрессию генов (Kousarides (2007) Cell 128:693-705). В некоторых вариантах осуществления предложена молекула, включающая ZFP, dCas или TALE, нацеленный на ген тау (например, MAPT), как здесь описано, слитый с подавляющим транскрипцию доменом, которая может использоваться для подавления экспрессии тау. В некоторых вариантах осуществления способы и композиции настоящего изобретения применимы для лечения эукариот. В некоторых вариантах осуществления активность регуляторного домена регулируется экзогенной небольшой молекулой или лигандом, так что взаимодействие с транскрипционным аппаратом клетки не будет происходить в отсутствие экзогенного лиганда. Такие внешние лиганды контролируют степень взаимодействия ZFP-TF, CRISPR/Cas-TF или TALE-TF с транскрипционным аппаратом. Регуляторный домен(ы) может быть функционально связан с любой частью(ями) одного или более из ZFP, dCas или TALE, в том числе между одним или более ZFP, dCas или TALE, вне одного или более ZFP, dCas или TALE, и любой их комбинацией. В предпочтительных вариантах регуляторный домен приводит к подавлению экспрессии гена целевого гена тау. Любой из слитых белков, описанных здесь, может быть составлен в фармацевтическую композицию.
В некоторых вариантах осуществления способы и композиции настоящего изобретения включают использование двух или более слитых белков, описанных здесь, например двух или более модуляторов тау (например, репрессоров тау). Два или более слитых белка могут связываться с разными сайтами-мишенями и включать одинаковые или разные функциональные домены. Альтернативно, два или более слитых белка, описанных здесь, могут связываться с одним и тем же сайтом-мишенью, но включать разные функциональные домены. В некоторых случаях используются три или более слитых белка, в других - четыре или более слитых белка, тогда как в других - 5 или более слитых белков. В предпочтительных вариантах осуществления два или более, три или более, четыре или более или пять или более слитых белков доставляются в клетку в виде нуклеиновых кислот. В предпочтительных вариантах осуществления слитые белки вызывают подавление экспрессии целевого гена. В некоторых вариантах осуществления два слитых белка вводят в дозах, в которых каждый белок активен сам по себе, но в комбинации подавляющая активность является аддитивной. В предпочтительных вариантах осуществления два слитых белка вводят в дозах, в которых ни один не является активным сам по себе, но в комбинации подавляющая активность является синергетической.
В некоторых вариантах осуществления сконструированные ДНК-связывающие домены, описанные здесь, могут быть помещены в функциональную связь с нуклеазными (расщепляющими) доменами как часть слитого белка. В некоторых вариантах осуществления нуклеаза включает нуклеазу Ttago. В других вариантах осуществления нуклеазные системы, такие как система CRISPR/Cas, могут использоваться со специфической химерной руководящей РНК для нацеливания нуклеазы на сайт-мишень в ДНК. В некоторых вариантах осуществления такие нуклеазы и слияния с нуклеазой(ами) могут использоваться для нацеливания на аллель тау в стволовых клетках, таких как индуцированные плюрипотентные стволовые клетки (iPSC), эмбриональные стволовые клетки человека (hESC), мезенхимные стволовые клетки (MSC) или нервные стволовые клетки, в которых активность слияния с нуклеазой приведет к снижению экспрессии аллели тау. В некоторых вариантах осуществления предложены фармацевтические композиции, содержащие модифицированные стволовые клетки.
В еще одном аспекте предложен полинуклеотид, кодирующий любой из ДНК-связывающих белков, нуклеаз и/или факторов транскрипции, описанных здесь. В некоторых вариантах осуществления полинуклеотид включает по крайней мере один AAV вектор (или его псевдотип или вариант), включая, но без ограничения этим, один или более AAV2, AAV2/9, AAV6 или AAV9 векторов, в том числе, но без ограничения этим, один или более AAV векторов, описанных в патенте США с №9585971 или патенте США с №7198951) и/или один или более AAV векторов, описанных в предварительной заявке на патент США с №62/503121.
В других аспектах настоящее изобретение включает доставку донорной нуклеиновой кислоты в клетку-мишень. Донор может быть доставлен до, после или вместе с нуклеиновой кислотой, кодирующей нуклеазу(ы). Донорная нуклеиновая кислота может включать экзогенную последовательность (трансген) для интеграции в геном клетки, например эндогенный локус. В некоторых вариантах осуществления донор может включать полноразмерный ген или его фрагмент, фланкированный участками гомологии с целевым сайтом расщепления. В некоторых вариантах осуществления у донора отсутствуют гомологичные участки, и он интегрируется в локус-мишень посредством независимого от гомологии механизма (т.е. NHEJ). Донор может включать любую последовательность нуклеиновой кислоты, например нуклеиновую кислоту, которая при использовании в качестве субстрата для направляемой гомологией репарации индуцированного нуклеазой двухцепочечного разрыва приводит к специфической для донора делеции, которая будет создана в эндогенном хромосомной локусе, или, альтернативно (или дополнительно), новым аллельным формам (например, точечным мутациям, которые удаляют сайт связывания фактора транскрипции) эндогенного локуса, которые будут созданы. В некоторых аспектах донорная нуклеиновая кислота представляет собой олигонуклеотид, причем интеграция приводит к событию редактирования гена или к целенаправленной делеции. В некоторых вариантах осуществления донор кодирует фактор транскрипции, способный подавлять экспрессию Tau. В других вариантах осуществления донор кодирует молекулу РНК, которая ингибирует экспрессию тау-белка.
В некоторых вариантах осуществления полинуклеотид, кодирующий ДНК-связывающий белок, представляет собой мРНК. В некоторых аспектах мРНК может быть химически модифицирована (смотрите, например, Kormann et al., (2011) Nature Biotechnology 29 (2):154-157). В других аспектах мРНК может включать кэп-группировку ARCA (смотрите патенты США с №7074596 и 8153773). В других вариантах осуществления мРНК может включать смесь немодифицированных и модифицированных нуклеотидов (смотрите публикацию заявки на патент США с №2012/0195936).
В еще одном аспекте предложен вектор для доставки гена, включающий любой из полинуклеотидов (например, кодирующих генетические модуляторы (репрессоры)), описанных здесь. В некоторых вариантах осуществления вектор представляет собой аденовирусный вектор (например, Ad5/F35 вектор), лентивирусный вектор (LV), включающий компетентные по интеграции или дефектные по интеграции лентивирусные векторы, или аденоассоциированный вирусный вектор (AAV). В некоторых вариантах осуществления AAV вектор представляет собой AAV2, AAV6 или AAV9 вектор. В некоторых вариантах осуществления AAV вектор представляет собой вариант AAV, способный пересекать гематоэнцефалический барьер (например, патент США с №9585971 и предварительная заявка на патент США с №62/503121). Также здесь предложены аденовирусные (Ad) векторы, LV векторы или векторы на основе аденоассоциированных вирусов (AAV), включающие последовательность, кодирующую по крайней мере одну нуклеазу (ZFN или TALEN), и/или донорную последовательность для целенаправленной интеграции в ген-мишень. В некоторых вариантах осуществления Ad вектор представляет собой химерный Ad вектор, например Ad5/F35 вектор. В некоторых вариантах осуществления лентивирусный вектор представляет собой дефектный по интегразе лентивирусный вектор (IDLV) или компетентный по интеграции лентивирусный вектор. В некоторых вариантах осуществления вектор псевдотипируется с помощью белка оболочки VSV-G или других белков оболочки.
Кроме того, также предложены фармацевтические композиции, содержащие нуклеиновые кислоты (например, векторы (например, AAV) для доставки, включающие последовательности, кодирующие искусственные факторы транскрипции (репрессоры тау), описанные здесь, и/или белки (например, ZFP, Cas или TALE или слитые белки включающие ZFP, Cas или TALE). Например, некоторые композиции включают нуклеиновую кислоту, включающую последовательность, которая кодирует один из ZFP, Cas или TALE, описанных здесь, функционально связанную с регуляторной последовательностью, в сочетании с фармацевтически приемлемым носителем или разбавителем, причем регуляторная последовательность обеспечивает экспрессию нуклеиновой кислоты в клетке. В некоторых вариантах осуществления кодируемые ZFP, CRISPR/Cas или TALE являются специфическими для мутантной аллели тау. В некоторых вариантах осуществления фармацевтические композиции содержат ZFP, CRISPR/Cas или TALE, которые модулируют мутантную аллель тау, и ZFP, CRISPR/Cas или TALE, которые модулируют нейротрофический фактор. Композиции на основе белка включают один из нескольких ZFP, CRISPR/Cas или TALE, описанных здесь, и фармацевтически приемлемый носитель или разбавитель.
В еще одном аспекте также предложена выделенная клетка, содержащая любой из белков, полинуклеотидов и/или композиций, описанных здесь.
В другом аспекте здесь предложены способы лечения и/или предотвращения таупатии, такой как болезнь Альцгеймера или эпилептический припадок, используя описанные здесь способы и композиции. В некоторых вариантах осуществления способы включают композиции, в случае которых полинуклеотиды и/или белки могут доставляться с использованием вирусного вектора, невирусного вектора (например, плазмиды) и/или их комбинаций. В некоторых вариантах осуществления способы включают композиции, содержащие популяции стволовых клеток, содержащие ZFP или TALE или измененные с помощью ZFN, TALEN, Ttago или нуклеазной системы CRISPR/Cas настоящего изобретения. Введение описанных здесь композиций (белков, полинуклеотидов, клеток и/или фармацевтических композиций, содержащих эти белки, полинуклеотиды и/или клетки), приводит к терапевтическому (клиническому) эффекту, в том числе, но без ограничения этим, уменьшению интенсивности или устранение любого из клинических симптомов, связанных с AD, таупатиями или эпилептическим припадком, а также увеличению функционирования и/или количества клеток ЦНС (например, нейронов, астроцитов, миелина и т.д.). В некоторых вариантах осуществления описанные здесь композиции и способы снижают экспрессию тау (по сравнению с контролями, не получающими искусственные репрессоры, описанные здесь), на по крайней мере 30% или 40%, предпочтительно на по крайней мере 50%, еще более предпочтительно на по крайней мере 70%. В некоторых вариантах осуществления достигается снижение на по крайней мере 50%.
В еще одном аспекте здесь описан способ доставки репрессора тау в головной мозг субъекта (например, являющегося млекопитающим субъекта, такого как мышь, человек или не являющийся человеком примат) (NHP), с использованием вирусного или невирусного вектора. В некоторых вариантах осуществления вирусный вектор представляет собой AAV вектор, например AAV9 вектор, или вариант AAV вектора, описанный в патенте США с №9585971 или предварительной заявке на патент США с №62/503121. Доставка может осуществляться в любую область головного мозга, например, в гиппокамп или энторинальную кору, любым подходящим способом, включая использование канюли или любой другой технологии доставки. Любой AAV вектор, который обеспечивает практически повсеместную доставку репрессора в головной мозг субъекта, в том числе посредством антерградного и ретроградного аксонного транспорта в области головного мозга, без непосредственного введения вектора (например, доставка в скорлупу приводит к доставке в другие структуры, такие как кора головного мозга, черная субстанция, таламус и т.д.). В некоторых вариантах осуществления субъектом является человек, а в других вариантах осуществления субъектом является не являющийся человеком примат. Введение может быть в однократной дозе или в нескольких приемах (в любое время между введениями).
Таким образом, в других аспектах здесь описан способ предотвращения и/или лечения таупатии (например, AD) у субъекта, при этом способ включает введение репрессора аллели тау субъекту с использованием одного или более AAV векторов. В некоторых вариантах осуществления AAV, кодирующий репрессор, вводят в ЦНС (головной мозг и/или CSF) любым способом доставки, включая, но без ограничения этим, интрацеребровентрикулярную, интратекальную или интрацистернальную доставку. В других вариантах осуществления AAV, кодирующий репрессор, вводят непосредственно в паренхиму (например, гиппокамп и/или энторинальную кору) субъекта. В других вариантах осуществления AAV, кодирующий репрессор, вводят внутривенно (IV). В любом из способов, описанных здесь, введение может быть выполнено один раз (однократное введение) или может быть выполнено многократно (с любым временем между введениями). При многократном введении могут использоваться одинаковые или разные дозы и/или средства доставки для способов введения (например, разные AAV векторы, вводимые IV и/или ICV). Способы включают способы уменьшения агрегации тау у субъекта (например, уменьшения NFT, характерных для агрегации тау), например, в нейронах субъекта с AD; способы уменьшения апоптоза в нейроне или популяции нейронов (например, нейроне AD или популяция нейронов AD); способы снижения чрезмерной возбудимости нейронов; способы снижения индуцированной амилоидом бета токсичности (например, утраты синапса и/или дистрофии аксонов); и/или способы уменьшения потери одной или более когнитивных функций у субъектов с AD, все по сравнению с субъектом, не подвергаемым способу, или по сравнению с самим субъектом до подвергания способам. Таким образом, описанные здесь способы приводят к снижению биомаркеров и/или симптомов таупатий, в том числе одного или более из следующих: нейротоксичности, глиоза, дистрофических аксонов, утраты отростков, эксайтотоксичности, истончения коры головного мозга и гиппокампа, накопления тау в аксонах, когнитивной недостаточности (например, в лабиринте с радиальными рукавами и водном лабиринте Морриса в моделях на грызунах, формирования страха и т.д.) и/или двигательной недостаточности.
В некоторых аспектах предложены способы и композиции настоящего изобретения для уменьшения количества патогенных видов тау в клетке. В некоторых вариантах осуществления способы приводят к снижению гиперфосфорилированного тау. В некоторых случаях снижение гиперфосфорилированного тау приводит к уменьшению растворимого или гранулярного тау. В других вариантах осуществления уменьшение патогенных видов тау уменьшает агрегацию тау и вызывает уменьшение нейрофибриллярных клубков (NFT) по сравнению с клеткой или субъектом, который не был подвергнут лечению в соответствии со способами и/или композициями настоящего изобретения. В дальнейших вариантах осуществления предложены способы возвращения в прежнее состояние количества NFT, наблюдаемых в клетке. В еще одних вариантах осуществления способы и композиции настоящего изобретения вызывают замедление распространения патогенных видов тау (NFT, гиперфосфорилированных тау) в головном мозге субъекта. В некоторых вариантах осуществления распространение патогенных тау по головному мозгу останавливается, а в других вариантах осуществления распространение патогенных тау по головному мозгу прекращается. В других вариантах осуществления уменьшается количество дистрофических аксонов, связанных с амилоидными β-бляшками в головном мозге. В некоторых вариантах осуществления количество дистрофических аксонов уменьшается до уровней, обнаруживаемых в соответствующем по возрасту головном мозге дикого типа. В дальнейших вариантах осуществления здесь предложены способы и композиции для уменьшения гиперфосфорилированного тау, связанного с амилоидными β-бляшками в головном мозге субъекта.
В любом из описанных здесь способов репрессор аллели тау может представлять собой ZFP-TF, например, слитый белок, включающий ZFP, который специфически связывается с аллелью тау, и подавляющий транскрипцию домен (например, KOX, KRAB и т.д.). В других вариантах осуществления репрессором аллели тау может быть TALE-TF, например слитый белок, включающий полипептид TALE, который специфически связывается с аллелью тау, и подавляющий транскрипцию домен (например, KOX, KRAB и т.д.). В некоторых вариантах осуществления репрессор аллели тау представляет собой CRISPR/Cas-TF, причем нуклеазные домены в белке Cas были инактивированы, так что белок больше не расщепляет ДНК. Результирующий РНК-руководимый ДНК-связывающий домен Cas сливают с репрессором транскрипции (например, KOX, KRAB и т.д.) для репрессии аллели тау.
В некоторых вариантах осуществления последовательность, кодирующая описанный здесь генетический модулятор (генетический репрессор) (например, ZFP-TF, TALE-TF или CRISPR/Cas-TF), встраивается (интегрируется) в геном, тогда как в других вариантах осуществления последовательность, кодирующая репрессор, поддерживается эписомно. В некоторых случаях нуклеиновая кислота, кодирующая слияние с TF, встраивается (например, посредством опосредованной нуклеазой(ами) интеграции) в безопасный сайт-гавань, включающий промотор, так что эндогенный промотор управляет экспрессией. В других вариантах осуществления донорная последовательность репрессора (TF) встраивается (посредством опосредованной нуклеазой(ами) интеграции) в безопасный сайт-гавань, и донорная последовательность включает промотор, который управляет экспрессией репрессора. В некоторых вариантах осуществления последовательность, кодирующая генетический модулятор, сохраняется внехромосомно (эписомно) после доставки и может включать гетерологичный промотор. Промотор может быть конститутивным или индуцибельным промотором. В некоторых вариантах осуществления последовательность промотора широко экспрессируется, тогда как в других вариантах осуществления этот промотор является тканеспецифическим или специфическим для клетки/типа. В предпочтительных вариантах осуществления промоторная последовательность является специфической для нервных клеток. В особенно предпочтительных вариантах осуществления выбранный промотор характеризуется тем, что он имеет низкую экспрессию. Неограничивающие примеры предпочтительных промоторов включают специфические для нервных клеток промоторы NSE, Synapsin, CAMKiia и MECP. Неограничивающие примеры повсеместных промоторов включают CAS и Ubc. Дальнейшие варианты осуществления включают использование саморегулирующихся промоторов, описанных в публикации заявки на патент США с №2015/0267205.
В еще одних вариантах осуществления репрессор может включать нуклеазу (например, ZFN, TALEN и/или систему CRISPR/Cas), которая подавляет аллель тау путем расщепления и, таким образом, инактивации аллели тау. В некоторых вариантах осуществления нуклеаза вводит вставку и/или делецию («Indel») посредством негомологичного соединения концов (NHEJ) после расщепления нуклеазой. В других вариантах осуществления нуклеаза вводит донорную последовательность (с помощью направляемых и не направляемых гомологией способов), при этом интеграция донора инактивирует аллель тау.
В любом из описанных здесь способов репрессор может быть доставлен субъекту (например, в головной мозг) в виде белка, полинуклеотида или любой комбинации из белка и полинуклеотида. В некоторых вариантах осуществления репрессор(ы) доставляется с использованием AAV вектора. В других вариантах осуществления по крайней мере один компонент репрессора (например, sgRNA системы CRISPR/Cas) доставляется в форме РНК. В других вариантах осуществления репрессор(ы) доставляется с использованием комбинации любой из экспрессионных конструкций, описанных здесь, например одного репрессора (или его части) на одной экспрессионной конструкции (AAV9) и одного репрессора (или его части) на отдельной экспрессионной конструкции (AAV или другой вирусной или невирусной конструкции).
Кроме того, в любом из описанных здесь способов репрессоры могут доставляться в любой концентрации (дозе), которая обеспечивает желаемый эффект. В предпочтительных вариантах осуществления репрессор доставляется с использованием вектора на основе аденоассоциированного вируса (AAV) при MOI (множественности заражения), составляющей 10000-50000 векторных геномов/клетку (или любое значение между ними). В некоторых вариантах осуществления репрессор доставляется с использованием лентивирусного вектора при MOI от 250 до 1000 (или любое значения между ними). В других вариантах осуществления репрессор доставляется с использованием плазмидного вектора в количестве, составляющем 0,01-1000 нг/100000 клеток (или любое значения между ними). В других вариантах осуществления репрессор доставляется в виде мРНК в количестве 150-1500 нг/100000 клеток (или любое значения между ними).
В любом из описанных здесь способов способ может приводить к репрессии аллелей тау в одном или более нейронах субъекта с AD на приблизительно 50% или более, 55% или более, 60% или более, 65% или более, приблизительно 70% или более, приблизительно 75% или более, приблизительно 85% или более, приблизительно 90% или более, приблизительно 92% или более или приблизительно 95% или более.
В дальнейших аспектах модулирующие тау факторы транскрипции, описанные здесь, такие как модулирующие тау факторы транскрипции, включающие один или более из белка с цинковыми пальцами (ZFP-TF), TALE (TALE-TF) и CRISPR/Cas-TF, например, ZFP-TF, TALE-TF или CRISPR/Cas-TF, используются для подавления экспрессии мутантной аллели тау или аллели тау дикого типа в головном мозге (например, нейроне) субъекта. Подавление может представлять собой репрессию на приблизительно 50% или более, 55% или более, 60% или более, 65% или более, 70% или более, приблизительно 75% или более, приблизительно 85% или более, приблизительно 90% или более, приблизительно 92% или более или приблизительно 95% или более аллелей тау в одном или более нейронах субъекта по сравнению с не подвергнутыми воздействию нейронами (дикого типа) субъекта. В некоторых вариантах осуществления модулирующий тау фактор транскрипции может использоваться для достижения одного или более описанных здесь способов.
Также предложен набор, включающий один или более AAV модуляторов (например, репрессоров) тау и/или полинуклеотидов, включающих компоненты модуляторов тау, и/или кодирующих модуляторы тау (или их компоненты), описанные здесь. Наборы могут, кроме того, включать клетки (например, нейроны), реагенты (например, для обнаружения и/или количественного определения тау-белка, например, в CSF) и/или инструкции по применению, включающие описанные здесь способы.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг. 1А-1D отображена экспрессия MAPT после введения сконструированных генетических модуляторов MAPT, описанных здесь. Фиг. 1А представляет собой схему, демонстрирующую сайты-мишени в гене MAPT для ДНК-связывающей молекулы генетического модулятора. Модулятором для этих экспериментов был репрессор. На фиг. 1B представлены диаграммы, показывающие экспрессию MAPT через 24 часа после введения указанных количеств репрессора MAPT (52322, 52364, 52366, 52389, 57880, 57890 и 52288) или GFP или ложных контролей в форме мРНК (в указанных дозах 1000 нг, 300 нг, 100 нг, 30 нг, 10 нг или 3 нг, слева направо, соответственно) в клетки Neuro 2A. На фиг. 1C представлены диаграммы, показывающие экспрессию MAPT через 7 дней после введения репрессора MAPT (52322, 52364, 52366, 52389, 57880, 57890 и 52288) или GFP или ложных контролей с использованием AAV9 вектора (с промотором CMV) в указанных дозах 3×105 векторных генов/клетку, 1×105 векторных генов/клетку, 3×104 векторных генов/клетку, 1×104 векторных генов/клетку в первичные нейроны коры головного мозга мыши (MCN). На фиг. 1D представлены диаграммы, отображающие репрессию тау (MAPT) и репрессию вне мишени с помощью 57880 и двух типичных производных (65887 и 65888), содержащих мутации в контактах с фосфатными остатками в остове ZFP.
На фиг. 2А-2С отображены уровни белков (тау, GAPDH и ZFP) в MCN, обработанных указанным репрессором (52389), переносимых AAV9 вектором. Фиг. 2А представляет собой Вестерн-блоттинг, демонстрирующий уровни указанных белков в указанных дозах AAV9. Фиг. 2В и фиг. 2С представляют собой диаграммы, демонстрирующие соотношение белков тау/GAPDH (верхние панели) и ZFP/GAPDH (нижние панели) в указанных дозах AAV9-52389 или ложного контроля (M).
На фиг. 3 представлены результаты анализа с использованием микрочипов, показывающие специфичность указанных репрессоров (52322, 52364, 52366, 52389, 57880, 57890 или 52288) для гена МАРТ. Анализ проводили через 24 часа после введения в клетки Neuro2A репрессоров в форме мРНК в количестве 300 нг. Результаты обсуждаются в примере 3. Числа над каждым графиком представляют собой количество генов, экспрессия которых была увеличена (стрелка вверх) или уменьшена (репрессия) (стрелка вниз).
На фиг. 4 представлены результаты анализа с использованием микрочипов указанных репрессоров (52322, 52364, 52366, 52389, 57880, 57890, 52288) через 24 часа после введения в первичные фибробласты человека репрессоров в форме мРНК в количестве 300 нг. Результаты обсуждаются в примере 3. Числа над каждым графиком представляют собой количество генов, экспрессия которых увеличилась (стрелка вверх) или уменьшилась (репрессия) (стрелка вниз).
На фиг. 5А и 5В представлены результаты анализа с использованием микрочипов указанных репрессоров (52322, 52364, 52366, 52389, 57880, 57890). На фиг. 5А представлены результаты через 7 дней после введения в нейроны коры головного мозга мыши репрессоров, переносимых AAV вектором (AAV), в дозе 1×105 вирусных геномов/клетку. Результаты обсуждаются в примере 3. Числа над каждым графиком представляют собой количество генов, экспрессия которых увеличилась (стрелка вверх) или уменьшилась (репрессия) (стрелка вниз). На фиг. 5В представлены результаты анализа с использованием микрочипов, сравнивая два репрессора 57880 и 65888 с одинаковыми спиралями. Данные для белка 57880 показаны в верхнем ряду, в то время как данные для белка 65888 показаны в нижнем ряду. У 65888 некоторые потенциальные контакты с фосфатными остатками были удалены из остова цинкового пальца (смотрите таблицу 2), и данные демонстрируют значительное увеличение специфичности белка 65888 (57880 активировал 75 генов и подавлял 110 генов в этих экспериментальных условиях, в то время как 65888 активировал 3 гена и подавлял 4 гена, в том числе тау) при сохранении сходной подавляющей тау активности в нейронах коры головного мозга мыши.
Фиг. 6А и 6В представляют собой диаграммы, отображающие экспрессию мРНК в клетках с использованием генетических репрессоров, переносимых AAV вектором (AAV9), причем экспрессией репрессора управляет указанные промотор (CMV, Synapsin (SYN1), промотор альфа-кальций/кальмодулин-зависимой протеинкиназы (CamKII) и фрагмент размером 229 п.н. промотора метил-CpG-связывающего белка 2 (MeCP2). На фиг. 6А продемонстрирована экспрессия в MCN. Фиг. 6В демонстрирует экспрессию в первичных нейронах гиппокампа.
На фиг. 7А-7D представлены уровни мРНК (для тау человека и ZFP) в нейронах, происходящих из iPSC человека. Фиг. 7А представляет собой схему, показывающую частичную последовательность сайтов-мишеней в MAPT человека и мыши (SEQ ID NO:31, 32 и 48-51, соответственно, слева направо). На фиг. 7В представлены диаграммы, показывающие экспрессию мРНК в iPSC через 18 дней после введения указанных репрессоров, переносимых AAV вектором, в указанных дозах. На фиг. 7C представлены диаграммы, показывающие экспрессию мРНК в iPSC через 18 дней после введения указанного репрессора (52366), переносимого AAV вектором с указанными промоторами. Фиг. 7D представляет собой ряд графиков, полученных на микрочипах с использованием типичных ZFP-TF в нейронах, происходящих из iPSC человека, и показывает, что ZFP-TF являются высокоспецифичными. Клетки подвергали воздействию 1E5 AAV6, включающего донор ZFP-TF, в течение 19 дней до анализа.
На фиг. 8А-8Н представлена эффективная трансдукция ZFP-TF нервных клеток и эффекты in vivo на экспрессию мРНК (для тау и ZFP) у являющихся мышами субъектов с использованием различных AAV векторов для доставки репрессоров тау. Смотрите пример 6. На фиг. 8А показана эффективная трансдукция двигательной зоны коры головного мозга (верхние панели), гиппокампа (средние панели) и мозжечка (нижние панели) после введения AAV либо IV (правые панели), либо ICV (левые панели). На фиг. 8В показано сильное снижение тау (снижение на ~50-70%) при и ICV, и IV введении в основных областей таупатии, включая двигательную зону коры головного мозга (левая панель, верхний ряд), ствол мозга (правая панель, верхний ряд) и гиппокамп (нижняя левая панель)). На фиг. 8C показано снижение мРНК для тау (снижение на ~40-70%) по всему головному мозгу и спинному мозгу после IV или ICV введения векторов AAV-ZFP-TF. На фиг. 8D представлены уровни мРНК для тау (MAPT), а на фиг. 8E представлены уровни мРНК для репрессора (ZFP) для каждого среза гиппокампа. Фиг. 8F представляет собой графики, отображающие устойчивую репрессию тау во всей ЦНС и спинном мозге после введения репрессоров тау, описанных здесь (левая панель показывает репрессор 52389, а правая панель показывает репрессор 57890), с использованием AAV векторов. На фиг. 8G представлены графики, отображающие быструю и продолжительную репрессию тау в течение нескольких месяцев в коре головного мозга (левые панели) и гиппокампе (правые панели) животных, которым вводили указанные композиции («GFP» относится к GFP в качестве контроля; «172» относится к нерелевантному ZFP-TF в качестве контроля, который не связывается с MAPT; «52389» относится к репрессору 52389, переносимому на AAV конструкции, «57890» относится к репрессору 57890, описанному здесь, переносимому на AAV конструкции, а «PBS» относится к контролю животных, получающих только PBS). Верхний ряд на фиг. 8G отображает экспрессию мРНК для тау, а нижний ряд показывает приведенные уровни тау-белка. Фиг. 8H представляет собой графики, показывающие уровни общего тау-белка мыши в CSF (верхний ряд, левая панель), коре головного мозга (верхний ряд, правая панель) и гиппокампе (верхний ряд, крайний правый график) животных, получающих указанные композиции («VEH» относится к контрольным животным, которым вводили только носитель: «172V» относится к животным, получающим нерелевантный ZFP-TF в качестве контроля, который не связывается с MAPT, переносимым AAV вектором, «389V» относится к репрессору 52389, переносимому на AAV конструкции, и «890V» относится к репрессору 57890, описанному здесь, переносимому на AAV конструкции). Также представлен (нижний ряд) статистический анализ, показывающий корреляцию между CSF и уровнями в коре головного мозга (правая панель) и гиппокампе (левая панель).
На 9A-9D отображен дальнейший анализ модуляции (репрессии) MAPT in vivo с использованием статистического анализа, как описано в примере 6. На фиг. 9A представлен дисперсионный анализ (ANOVA) с последующим апостериорным тестом Сидака (Sidak) для всех срезов (верхняя панель демонстрирует тау, нижняя панель демонстрирует ZFP). На фиг. 9В показано среднее максимальное снижение тау (верхняя панель демонстрирует тау, нижняя панель демонстрирует ZFP). На фиг. 9C показана высокая корреляция между уровнями MAPT и ZFP-TF у животных, получавших репрессор MAPT 52322. На фиг. 9D показана высокая корреляция между уровнями MAPT и ZFP-TF у животных, получавших репрессор MAPT 52389.
Фиг. 10А-10D представляют собой графики, отображающие репрессию мРНК для MAPT (тау) после лечения тау-специфическим ZFP-TF in vivo после инъекции в гиппокамп. В этом эксперименте четыре различных промотора (CMV, SNY1, CAMKII или MeCP2) были использованы для управления экспрессией конструкции ZFP-TF-venus. На фиг. 10А показана экспрессия тау через 6 недель после инъекции и продемонстрировано снижение у всех животных, которые получали ZFP-TF, независимо от выбранного промотора. Звездочки указывают на значимость сигнала по сравнению с контролем в виде PBS (р<0,0001 для всех промоторов). На фиг. 10B показана экспрессия ZFP-TF с различных промоторов, причем самая высокая экспрессия ZFP-TF была обнаружена у животных, подвергнутых лечению CAMKII-управляемым вектором. Присутствие активированных астроцитов определяли для каждой группы лечения (фиг. 10C) посредством обнаружения GFAP. В этом эксперименте промотор MeCP2 не приводил к повышению GFAP по сравнению с животными, которым инъецировали PBS, SYN1 приводил к повышению уровней GFAP в 4,0 раза (P<0,0001), CMV приводил к повышению уровней в 3,2 раза (P<0,01), и CAMKII приводил к повышению уровней в 2,4 раза (P<0,05). Точно так же присутствие микроглии также было определено (фиг. 10D) в группах лечения, причем промотор MeCP2 не приводил к значительным изменениям уровней IBA1 по сравнению с животными, которым инъецировали PBS, SYN1 приводил к 4,7-кратному повышению уровней IBA1 (P<0,0001), CMV приводил к повышению уровней в 3,0 раза (Р<0,05), а CAMKII приводил к повышению уровней в 3,2 раза (Р<0,001).
Фиг. 11 представляет собой график, показывающий снижение экспрессии тау-белка в группах, описанных на фиг. 10. По сравнению с контрольными уровнями после инъекции PBS (269 нг/мл), конструкция rAAV9-SYN1-52389V давала 23% от контрольных уровней (61 нг/мл, P<0,0001), конструкция rAAV9-CAMKII-52389V давала 18% от контрольных уровней (49 нг/мл, P<0,0001), конструкция rAAV9-SYN1-52389V давала 12% от контрольных уровней (32 нг/мл, P<0,0001). Таким образом, промоторы нервных клеток способны вызывать снижение на >80% мРНК для тау и тау-белка по всему гиппокампу мыши.
На фиг. 12А-12F представлены гистологические доказательства снижения тау в гиппокампе и соединенных областях головного мозга. AAV, включающие тау-специфичный ZFP-TF, управляемый промотором CMV, доставляли в гиппокамп для оценки снижения эндогенного тау-белка с помощью иммунофлуоресцентного окрашивания. Для обнаружения ZFP-TF связывали с флуоресцентным белком Venus, и животных умерщвляли через 6 недель после инъекции. Фиг. 12А представляет собой поперечный срез гиппокампа и показывает 4 области в рамках для более тщательного изучения. Фиг. 12В представляет собой крупный план рамки 1 на фиг. 12А и показывает окрашивание GFP/DAPI (левая панель); GFP/тау/DAPI (средняя панель) и тау (правая панель). Фиг. 12C представляет собой график интенсивности флуоресценции в рамке 1, демонстрирующий уменьшение тау на ипсилатеральной стороне среза (правая панель). Фиг. 12D показывает крупный план рамки 2, в то время как фиг. 12E представляет собой крупный план рамки 3, демонстрируя уменьшение окрашивания тау на ипсилатеральной стороне (правая панель). На фиг. 12F показана рамка 4, причем на верхней панели показан сигнал GFP (указание на ZFP-TF) на ипсилатеральной стороне от инъекции с сопутствующим уменьшением окрашивания тау (нижняя панель). Нижняя средняя панель также показывает графическое представление уменьшения окрашивания тау. Нижняя левая и правая панели показывают окрашивание на ипсилатеральном (слева) и контралатеральном (справа) срезах. Данные обсуждаются подробнее в примерах.
Фиг. 13А-13J демонстрируют безопасность и устойчивую экспрессию ZFP-TF в течение шести месяцев в гиппокампе in vivo. На фиг. 13А отображен сигнал для трансдуцированных клеток в гиппокампе в целом в 6-недельный момент времени, указывая на то, что экспрессия векторов, кодирующих ZFP-TF и только GFP, практически одинакова. Фиг. 13В показывает схожие результаты конкретно для астроцитов, тогда как фиг. 13С показывает результаты для микроглии. На фиг. 13D показаны данные по трансдукции, подобные фиг. 13А, за исключением 6-месячного момента времени. Точно так же на фиг. 13E показаны данные по астроцитам для 6-месячного момента времени, а на фиг. 13F показаны данные по микроглии для 6-месячного момента времени. Фиг. 13G демонстрирует, что средняя толщина области гиппокампа сохраняется в различных группах лечения, демонстрируя отсутствие явной нейротоксичности от длительной экспрессии ZFP-TF. На фиг. 13H показана зона действия инъекций в переднем (левая панель) и заднем (правая панель) гиппокампе. Данные обсуждаются более подробно в примерах. Фиг. 13I представляет собой диаграммы, показывающие приведенные уровни экспрессии у субъектов, получавших указанные ZF (тау на верхней левой диаграмме, ZF на верхней средней диаграмме, VG/клетку на верхней правой диаграмме, GFPA (глиальной фибриллярный кислый белок, маркер для астроцитов) на левой нижней диаграмме, IBA1 (ионизированный кальций-связывающая молекула-адаптер 1, маркер микроглии) на средней нижней диаграмме, и NeuN (хорошо узнаваемый маркер постмитотических нейронов, который является высококонсервативным среди разных видов, (Wang et al., (2015) Sci Reports 5: 17383, doi 10.1038/spre17383)) на нижней правой диаграмме). На фиг. 13J представлены графики, показывающие приведенные уровни экспрессии указанных белков у субъектов, получавших указанные композиции («PBS» означает отсутствие модулятора тау; «89V 6 недель» относится к мышам, которых лечили с помощью конструкции 52389 Venus», с отбором через 6 недель, и «89V 11m» относится к конструкции 52389 Venus, с отбором через 11 месяцев (тау, ZFP, GFAP, IBA1 слева направо на верхних панелях; NeuN, MAP1, MAP1A, MAP2 слева направо на нижних панелях).
Фиг. 14А-14F представляют собой микрофотографии срезов головного мозга мышей APP/PS1, получавших ZFP-TF. На этих изображениях GFP зеленого цвета, RFP красного цвета, а антитела, специфические для Aβ, помечены вторым антителом (синим цветом). Фиг. 14А и 14С представляют собой изображения корковых слоев головного мозга дикого типа (CTX), причем левый CTX был подвергнут воздействию нерелевантного ZFP-TF (фиг. 14A), а правый CTX был подвергнут воздействию AAV, кодирующего флуоресцентный белок tRFP (фиг. 14C). На фиг. 14B и 14D представлены изображения корковых слоев головного мозга мышей APP/PS1, причем левый CTX был подвергнут воздействию AAV, кодирующего тау-специфический ZFP-TF («389dV», фиг. 14B), или AAV, кодирующего tRFP (фиг. 14D). Изображения иллюстрируют уменьшение дистрофических аксонов (идентифицируемых как крапчатое окрашивание вокруг Aβ бляшек и указанных стрелками) в CTX, подвергнутом лечению тау-специфическим ZFP-TF. Фиг. 14E и 14F представляют собой изображения с большим увеличением двух примеров срезов СЕХ от APP/PS1, подвергнутых лечению либо тау-специфическим ZFP-TF (фиг. 14E), либо tRFP (фиг. 14F), причем присутствуют больше дистрофические аксонов (указанных стрелками) на срезе с воздействием tRFP, чем на срезе с воздействием ZFP-TF389.
Фиг. 15 представляет собой диаграмму, демонстрирующую количественное представление числа дистрофических аксонов на Aβ бляшку у мышей APP/PS1. Каждая точка представляет среднее количество дистрофических аксонов на бляшку для всех бляшек на одном кортикальном срезе; 3-5 срезов анализировали на каждое полушарие на каждую мышь. Как можно видеть, наблюдалось статистически значимое уменьшение дистрофических аксонов в CTX, подвергнутом воздействию 389dV ZFP-TF, по сравнению с CTX, подвергнутом воздействию tRFP (крайний левый (серый) столбец - с воздействием 389dV, второй слева (белый) столбец - с воздействием tRFP). Также показано сравнение CTX у мышей, которым вводили нерелевантный ZFP-TF («172dV», серый столбец с полосками, 2-ой от правого столбца) или tRFP (белый столбец с полосками, крайний справа столбец). Как можно видеть, между этими образцами не было различий в количестве дистрофических аксонов/бляшек.
Фиг. 16 представляет собой диаграмму, отображающую количественное сравнение данных, представленных на фиг. 15, с учетом вариаций среди животных дистрофических аксонов на бляшку на исходном уровне. Количество дистрофий на Aβ бляшку усредняли для каждого полушария, подвергнутого воздействию ZFP-TF, или для контралатерального полушария, подвергнутого воздействию tRFP, и сравнивали с использованием парного двустороннего T-критерия. Значения для каждой группы были приведены к среднему значению для стороны, подвергнутой воздействию tRFP (установленному на 100%). Используя этот парный анализ, было установлено, что количество дистрофических аксонов было значительно уменьшено (среднее снижение на 34%) в случае группы, подвергнутой лечению 52389V (самый левый (серый) столбец - с лечением 389dV, второй слева (белый) столбец - с лечением tRFP), но не в случае группы, подвергнутой лечению нерелевантным ZFP-TF (172dV, второй справа (серый с полосами) столбец; tRFP, крайний справа (с полосами, белого цвета) столбец).
На фиг. 17 отображены показательные результаты анализа с использованием микрочипов на ткани гиппокампа, полученной от мышей, получавших ZFP-TF. ZFP-TF доставляли животным, используя описанные здесь AAV (2,5е12 вирусных геномов/животное), посредством ретроорбитальной доставки. Мышей лечили и умерщвляли через десять недель, и отображенные результаты представляют собой данные по сравнению с нерелевантным ZFP-TF в качестве контроля.
ПОДРОБНОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Здесь раскрыты композиции и способы для предотвращения и/или лечения таупатий. В частности, описанные здесь композиции и способы используются для подавления экспрессии белка MAPT (тау) для предотвращения или лечения таупатий, таких как болезнь Альцгеймера (AD), лобно-височная деменция, прогрессирующий супрануклеарный парез, эпилепсии и/или кортикобазальная дегенерация. Репрессоры MAPT (например, MAPT-модулирующие факторы транскрипции, такие как MAPT-модулирующие факторы транскрипции, включающие белки с цинковыми пальцами (ZFP-TF), TALE (TALE-TF) и/или CRISPR/Cas-TF, модифицируют ЦНС так, что последствия и/или симптомы таупатии уменьшаются или устраняются, например, в результате уменьшения агрегации тау в головном мозге субъекта с таупатией (например, AD) и уменьшения возникновения нейрофибриллярных клубков. В предпочтительных вариантах осуществления MAPT-модулирующие факторы транскрипции доставляются в головной мозг с помощью вирусного вектора, такого как AAV. Было показано, что AAV хорошо подходит для доставки в головной мозг, поэтому использование этих вирусных векторов для доставки MAPT-модулирующих факторов транскрипции особенно применимо для лечения таких заболеваний, как болезнь Альцгеймера, связанная с несоответствующей экспрессией и, следовательно, агрегацией тау-белка.
Общие сведения
При осуществлении на практике способов, а также приготовлении и применении композиций, раскрытых здесь, используются, если не указано иное, методы, общепринятые в молекулярной биологии, биохимии, структуре и анализе хроматина, вычислительной химии, культуре клеток, рекомбинантной ДНК и смежных областях, которые находятся в пределах компетентности в определенной области техники. Эти методы полностью объяснены в литературе. Смотрите, например, Sambrook et al., MOLECULAR CLONING: A LABORATORY MANUAL, второе издание, Cold Spring Harbor Laboratory Press, 1989 и третье издание, 2001; Ausubel et al., CURRENT PROTOCOLS IN MOLECULAR BIOLOGY, John Wiley & Sons, New York, 1987 и периодические обновления; серию METHODS IN ENZYMOLOGY, Academic Press, San Diego; Wolffe, CHROMATIN STRUCTURE AND FUNCTION, третье издание, Academic Press, San Diego, 1998; METHODS IN ENZYMOLOGY, Vol. 304, ʺChromatinʺ (P.M. Wassarman and A.P. Wolffe, eds.), Academic Press, San Diego, 1999; и METHODS IN MOLECULAR BIOLOGY, Vol. 119, ʺChromatin Protocolsʺ (P.B. Becker, ed.) Humana Press, Totowa, 1999.
Определения
Термины «нуклеиновая кислота», «полинуклеотид» и «олигонуклеотид» используются взаимозаменяемо и относятся к полимеру из дезоксирибонуклеотидов или рибонуклеотидов с линейной или кольцевой структурой и в одноцепочечной или двухцепочечной форме. Для целей настоящего раскрытия эти термины не должны рассматриваться как ограничивающие длину полимера. Термины могут охватывать известные аналоги природных нуклеотидов, а также нуклеотиды, которые модифицированы в основании, сахарной и/или фосфатной составляющих (например, фосфоротиоатные остовы). Как правило, аналог конкретного нуклеотида обладает той же специфичностью в отношении спаривания оснований; т.е. аналог A будет парой оснований с T.
Термины «полипептид», «пептид» и «белок» используются взаимозаменяемо для обозначения полимера из аминокислотных остатков. Термин также применяется к полимерам из аминокислот, в которых одна или более аминокислот являются химическими аналогами или модифицированными производными соответствующей встречающейся в природе аминокислоты.
Термин «связывание» относится к специфическому для последовательности нековалентному взаимодействию между макромолекулами (например, между белком и нуклеиновой кислотой). Не все компоненты взаимодействия в виде связывании должны быть специфическими для последовательности (например, в случае контактов с фосфатными остатками в остове ДНК), если взаимодействие в целом является специфическим для последовательности. Такие взаимодействия обычно характеризуются константой диссоциации (Kd), составляющей 10-6 М-1 или ниже. «Сродство» относится к силе связывания: повышенное сродство коррелирует с более низкой Kd.
«Связывающий белок» представляет собой белок, который способен к нековалентному связыванию с другой молекулой. Связывающий белок может связываться, например, с молекулой ДНК (ДНК-связывающий белок), молекулой РНК (РНК-связывающий белок) и/или молекулой белка (белок-связывающий белок). В случае белок-связывающего белка он может связываться с самим собой (с образованием гомодимеров, гомотримеров и т.д.), и/или он может связываться с одной или более молекул другого белка или белков. Связывающий белок может обладать более одним типом активности связывания. Например, белки с цинковыми пальцами обладают ДНК-связывающей, РНК-связывающей и белок-связывающей активностью.
«ДНК-связывающий белок с цинковыми пальцами» (или связывающий домен) представляет собой белок, или домен внутри более крупного белка, который связывает ДНК специфическим для последовательности образом через один или более цинковых пальцев, которые являются участками аминокислотной последовательности внутри связывающего домена, структура которого стабилизируется благодаря координации иона цинка. Термин ДНК-связывающий белок с цинковыми пальцами часто сокращенно называют белком с цинковыми пальцами или ZFP.
Термин «ДНК-связывающий домен TALE» или «TALE» представляет собой полипептид, включающий один или более повторяющихся доменов/единиц TALE. Повторяющиеся домены участвуют в связывании TALE с соответствующей ему ДНК-последовательностью-мишенью. Одна «повторяющаяся единица» (также называемая «повтор») обычно имеет длину 33-35 аминокислот и демонстрирует, по крайней мере, некоторую степень гомологии последовательности с другими повторяющимися последовательностями TALE внутри встречающегося в природе белка TALE. Смотрите, например, патент США с № 8586 526.
«TtAgo» представляет собой прокариотический белок Argonaute, предположительно участвующий в сайленсинге генов. TtAgo происходит из бактерий Thermus thermophilus. Смотрите, например, Swarts et al., (2014) Nature 507(7491):258-261, G. Sheng et al., (2013) Proc. Natl. Acad. Sci. U.S.A. 111, 652). «Система TtAgo» представляет собой все необходимые компоненты, включая, например, руководящие ДНК для расщепления ферментом TtAgo.
«Рекомбинация» относится к процессу обмена генетической информацией между двумя полинуклеотидами, включая, но без ограничения этим, захват донора посредством негомологичного соединения концов (NHEJ) и гомологичную рекомбинацию. Для целей этого раскрытия термин «гомологичная рекомбинация (HR)» относится к специализированной форме такого обмена, которая имеет место, например, во время репарации двухцепочечных разрывов в клетках с помощью направляемых гомологией механизмов репарации. Этот процесс требует гомологии нуклеотидных последовательностей, использует «донорную» молекулу для репарации матрицы молекулы «мишени» (т.е. той, которая подверглась двухцепочечному разрыву) и известен под разными названиями как «возникающая не в результате кроссинговера генная конверсия» или «генная конверсия на коротком участке», поскольку он приводит к передаче генетической информации от донора к мишени. Не желая быть ограниченными какой-либо конкретной теорией, такой перенос может включать редактирование несоответствия в гетеродуплексной ДНК, которое образуется между поврежденной мишенью и донором, и/или «синтез-зависимый отжиг цепей», при котором донор используется для повторного синтеза генетической информации, которая станет частью мишени, и/или связанные процессы. Такая специализированная HR часто приводит к изменению последовательности молекулы мишени, так что часть или вся последовательность донорного полинуклеотида включается в полинуклеотид-мишень.
ДНК-связывающие домены, такие как sgRNAs, связывающие домены «цинковые пальцы» или ДНК-связывающие домены TALE могут быть «сконструированы» для связывания с заранее определенной нуклеотидной последовательностью, например, посредством конструирования sgRNA, которая связывается с выбранным сайтом-мишенью, или путем конструирования (изменения одной или более аминокислот) распознающей спиральной области встречающегося в природе белка с цинковыми пальцами или путем конструирования RVD белка TALE. Следовательно, сконструированные белки с цинковыми пальцами или TALE представляют собой белки, которые не встречаются в природе. Неограничивающими примерами способов создания ДНК-связывающих доменов являются конструирование и отбор. «Сконструированный» белок с цинковыми пальцами или TALE представляет собой не встречающийся в природе белок, конструкция/построение которого преимущественно вытекает из рациональных критериев. Рациональные критерии для конструирования включают применение правил замещения и компьютерных алгоритмов для обработки информации в базе данных, хранящей информацию о существующих конструкциях ZFP и данных о связывании. «Отобранный» белок с цинковыми пальцами или TALE представляет собой не встречающийся в природе белок, который получен в основном в результате эмпирического процесса, такого как фаговый дисплей, ловушка взаимодействия или отбор гибридов. Смотрите, например, патенты США с №8586526; 6140081; 6453242; 6746838; 7241573; 6866997; 7241574; и 6534261; смотрите также публикацию международной заявки на патент с № WO 03/016496.
Термин «последовательность» относится к нуклеотидной последовательности любой длины, которая может представлять собой ДНК или РНК; может быть линейной, кольцевой или разветвленной и может быть или одноцепочечной, или двухцепочечной. Термин «донорная последовательность» относится к нуклеотидной последовательности, которая встраивается в геном. Донорная последовательность может иметь любую длину, например, от 2 до 10000 нуклеотидов в длину (или любое целое число между ними или больше), предпочтительно, от приблизительно 100 до 1000 нуклеотидов в длину (или любое целое число между ними), более предпочтительно, от приблизительно 200 до 500 нуклеотидов в длину.
«Сайт-мишень» или «последовательность-мишень» представляет собой последовательность нуклеиновой кислоты, которая определяет часть нуклеиновой кислоты, с которой будет связываться связывающая молекула, при условии существования достаточных условий для связывания.
«Экзогенная» молекула представляет собой молекулу, которая обычно не присутствует в клетке, но может быть введена в клетку одним или более генетическими, биохимическими или другими способами. «Обычное присутствие в клетке» определяется с учетом конкретной стадии развития и условий окружающей среды клетки. Так, например, молекула, которая присутствует только во время эмбрионального развития мышц, является экзогенной молекулой по отношению к мышечной клетке взрослого человека. Аналогично, молекула, индуцированная тепловым шоком, является экзогенной молекулой по отношению к клетке, не подвергшейся тепловому шоку. Экзогенная молекула может включать, например, функционирующий вариант неправильно функционирующей эндогенной молекулы или неправильно функционирующий вариант обычно функционирующей эндогенной молекулы.
Экзогенная молекула может представлять собой, помимо прочего, небольшую молекулу, такую, которая образуется с помощью процесса комбинаторной химии, или макромолекулу, такую как белок, нуклеиновая кислота, углевод, липид, гликопротеин, липопротеин, полисахарид, любое модифицированное производное вышеуказанных молекул или любой комплекс, включающий одну или более вышеуказанных молекул. Нуклеиновые кислоты включают ДНК и РНК, могут быть одно- или двухцепочечными; могут быть линейными, разветвленными или кольцевыми; и могут быть любой длины. Нуклеиновые кислоты включают те, которые способны образовывать дуплексы, а также образующие триплексы нуклеиновые кислоты. Смотрите, например, патенты США с №5176996 и 5422251. Белки включают, но без ограничения ими, ДНК-связывающие белки, факторы транскрипции, ремоделирующие хроматин факторы, метилированные ДНК-связывающие белки, полимеразы, метилазы, деметилазы, ацетилазы, деацетилазы, киназы, фосфатазы, интегразы, рекомбиназы, лигазы, топоизомеразы, гиразы и геликазы.
Экзогенная молекула может представлять собой молекулу того же типа, что и эндогенная молекула, например экзогенный белок или нуклеиновая кислота. Например, экзогенная нуклеиновая кислота может включать геном инфицирующего вируса, плазмиду или эписому, введенную в клетку, или хромосому, которая обычно не присутствует в клетке. Способы введения экзогенных молекул в клетки известны специалистам в данной области техники и включают, но без ограничения ими, липид-опосредованный перенос (т.е. липосомы, включающие нейтральные и катионные липиды), электропорацию, прямую инъекцию, слияние клеток, бомбардировку частицами, копреципитацию фосфатом кальция, DEAE-декстран-опосредованный перенос и опосредованный вирусным вектором перенос. Экзогенная молекула также может представлять собой молекулу того же типа, что и эндогенная молекула, но полученную от вида, отличного от вида, от которого получена клетка. Например, последовательность нуклеиновой кислоты человека может быть введена в линию клеток, первоначально полученную от мыши или хомяка.
Напротив, «эндогенная» молекула представляет собой молекулу, которая обычно присутствует в конкретной клетке на определенной стадии развития в определенных условиях окружающей среды. Например, эндогенная нуклеиновая кислота может включать хромосому, геном митохондрии, хлоропласт или другую органеллу или встречающуюся в природе эписомную нуклеиновую кислоту. Дополнительные эндогенные молекулы могут включать белки, например, факторы транскрипции и ферменты.
«Слитая» молекула представляет собой молекулу, в которой две или более субъединичных молекул связаны, предпочтительно ковалентно. Субъединичные молекулы могут представлять собой молекулы одного и того же химического типа или могут представлять собой молекулы разных химических типов. Примеры первого типа слитой молекулы включают, но без ограничения ими, слитые белки (например, слияние между ДНК-связывающим доменом ZFP или TALE и одним или более активирующих доменов) и слитые нуклеиновые кислоты (например, нуклеиновую кислоту, кодирующую слитый белок, описанный выше). Примеры слитой молекулы второго типа включают, но без ограничения ими, слияние между образующей триплекс нуклеиновой кислотой и полипептидом и слияние между связующим с малой бороздкой и нуклеиновой кислотой. Термин также включает системы, в которых полинуклеотидный компонент связывается с полипептидным компонентом с образованием функциональной молекулы (например, системы CRISPR/Cas, в которой химерная руководящая РНК связывается с функциональным доменом для модуляции экспрессии генов).
Экспрессия слитого белка в клетке может быть результатом доставки слитого белка в клетку или доставки полинуклеотида, кодирующего слитый белок, в клетку, где полинуклеотид транскрибируется, а транскрипт транслируется с образованием слитого белка. Транс-сплайсинг, расщепление полипептида и лигирование полипептидов также могут участвовать в экспрессии белка в клетке. Способы доставки полинуклеотидов и полипептидов в клетки представлены в другом месте этого описания.
«Домен мультимеризации» (также называемый «доменом димеризации» или «доменом взаимодействия белков») представляет собой домен, включенный в N-, C- или N- и C-концевые области ZFP-TF или TALE-TF. Эти домены допускают мультимеризацию множества единиц ZFP-TF или TALE-TF, так что более крупные участки тринуклеотидных повторяющихся доменов становятся предпочтительно связанными мультимеризованными ZFP-TF или TALE-TF по сравнению с более короткими участками с числовыми показателями длин дикого типа. Примеры доменов мультимеризации включают лейциновые молнии. Домены мультимеризации также могут регулироваться небольшими молекулами, причем домен мультимеризации принимает надлежащую конформацию, чтобы обеспечить взаимодействие с другим доменом мультимеризации только в присутствии небольшой молекулы или внешнего лиганда. Таким образом, экзогенные лиганды могут быть использованы для регуляции активности этих доменов.
Для целей настоящего изобретения «ген» включает область ДНК, кодирующую продукт гена (смотрите ниже), а также все области ДНК, которые регулируют продукцию продукта гена, независимо от того, являются ли такие регуляторные последовательности смежными с кодирующими и/или транскрибируемыми последовательностями. Соответственно, ген включает, но необязательно ограничивается этим, промоторные последовательности, терминаторы, регулирующие трансляцию последовательности, такие как сайты связывания рибосом и участки внутренней посадки рибосом, энхансеры, сайленсеры, инсуляторы, граничные элементы, начала репликации, сайты прикрепления к матриксу и локус-контролирующие области.
«Экспрессия гена» относится к преобразованию информации, содержащейся в гене, в продукт гена. Продукт гена может быть непосредственным продуктом транскрипции гена (например, мРНК, тРНК, рРНК, антисмысловой РНК, рибозимом, структурной РНК или любым другим типом РНК) или белком, полученным в результате трансляции мРНК. Продукты генов также включают РНК, которые модифицированы с помощью таких процессов, как кэппирование, полиаденилирование, метилирование и редактирование, и белки, модифицированные, например, метилированием, ацетилированием, фосфорилированием, убиквитинированием, АДФ-рибозилированием, миристилированием и гликозилированием.
«Модуляция» экспрессии гена относится к изменению активности гена. Модуляция экспрессии может включать, но без ограничения, активацию гена и репрессию гена. Редактирование генома (например, расщепление, изменение, инактивация, случайная мутация) может использоваться для модуляции экспрессии. Инактивация гена относится к любому снижению экспрессии гена по сравнению с клеткой, которая не включает белок ZFP или TALE, как здесь описано. Таким образом, инактивация гена может быть частичной или полной.
Термин «генетический модулятор» относится к любой молекуле, которая изменяет экспрессию и/или последовательность одного или более генов. Неограничивающие примеры генетических модуляторов включают факторы транскрипции (такие как искусственные факторы транскрипции, описанные здесь), которые связываются с геном-мишенью и изменяют его экспрессию, и нуклеазы, которые модифицируют последовательность гена-мишени, которая, в свою очередь, изменяет свою экспрессию (например, инактивация мишени с помощью вставок и/или делеций). Таким образом, генетический модулятор может быть генетическим репрессором (который подавляет и/или инактивирует экспрессию генов) или генетическим активатором.
«Представляющая интерес область» представляет собой любую область клеточного хроматина, такую как, например, ген или некодирующая последовательность внутри или рядом с геном, с которой желательно связать экзогенную молекулу. Связывание может осуществляться с целью целенаправленного расщепления ДНК и/или целенаправленной рекомбинации. Представляющая интерес область может присутствовать, например, в хромосоме, эписоме, геноме органеллы (например, митохондрии, хлоропласта) или в геноме инфицирующего вируса. Представляющая интерес область может находиться в кодирующей области гена, в транскрибируемых некодирующих областях, таких как, например, лидерные последовательности, трейлерные последовательности или интроны, или в нетранскрибируемых областях, либо выше (5'), либо ниже (3') кодирующей области. Представляющая интерес область может быть настолько мала, как одна нуклеотидная пара или до 2000 нуклеотидных пар в длину, или равна любому целому числу нуклеотидных пар.
«Эукариотические» клетки включают, но без ограничения ими, клетки грибов (такие как дрожжи), клетки растений, клетки животных, клетки млекопитающих и клетки человека (например, Т-клетки).
Термины «функциональная связь» и «функционально связаны» (или «функционально связанные») используются взаимозаменяемо применительно к соположению двух или более компонентов (таких как элементы последовательности), в котором компоненты расположены так, что оба компоненты функционируют нормально и допускают возможность того, что по крайней мере один из компонентов может опосредовать функцию, которая влияет на по крайней мере один из других компонентов. В качестве иллюстрации регулирующая транскрипцию последовательность, такая как промотор, функционально связана с кодирующей последовательностью, если регулирующая транскрипцию последовательность контролирует уровень транскрипции кодирующей последовательности в ответ на присутствие или отсутствие одного или более регулирующих транскрипцию факторов. Регулирующая транскрипцию последовательность, как правило, функционально связана в цис-положении с кодирующей последовательностью, но не обязательно должна быть непосредственно смежной с ней. Например, энхансер представляет собой регулирующую транскрипцию последовательность, которая функционально связана с кодирующей последовательностью, даже если они не являются смежными.
Что касается слитых полипептидов, термин «функционально связанные» может относиться к тому факту, что каждый из компонентов в связи с другим компонентом выполняет ту же функцию, как и если бы он не был связан таким образом. Например, что касается слитой молекулы, в которой ДНК-связывающий домен ZFP или TALE слит с активирующим доменом, ДНК-связывающий домен ZFP или TALE и активирующий домен находятся в функциональной связи, если в слитом полипептиде часть ДНК-связывающего домена ZFP или TALE способна связываться со своим сайтом-мишенью и/или сайтом связывания, в то время как активирующий домен способен усиливать экспрессию гена. ZFP, слитые с доменами, способными регулировать экспрессию генов, в совокупности называются «ZFP-TF» или «факторами транскрипции с цинковыми пальцами», тогда как TALE, слитые с доменами, способными регулировать экспрессию генов, в совокупности называются «TALE-TF» или «факторы транскрипции TALE». Когда слитый полипептид, в котором ДНК-связывающий домен ZFP слит с расщепляющим доменом («ZFN» или «нуклеазой с цинковыми пальцами»), ДНК-связывающий домен ZFP и расщепляющий домен находятся в функциональной связи, если в слитом полипептиде часть ДНК-связывающего домена ZFP способна связываться со своим сайтом-мишенью и/или сайтом связывания, в то время как расщепляющий домен способен расщеплять ДНК в непосредственной близости от сайта-мишени. Когда слитый полипептид, в котором ДНК-связывающий домен TALE слит с расщепляющим доменом («TALEN» или «нуклеазой с TALE»), ДНК-связывающий домен TALE и расщепляющий домен находятся в функциональной связи, если в слитом полипептиде часть ДНК-связывающего домена TALE способна связываться со своим сайтом-мишенью и/или сайтом связывания, в то время как расщепляющий домен способен расщеплять ДНК в непосредственной близости от сайта-мишени. Что касается слитой молекулы, в которой ДНК-связывающий домен Cas (например, химерная руководящая РНК) слит с активирующим доменом, ДНК-связывающий домен Cas и активирующий домен находятся в функциональной связи, если в слитом полипептиде часть ДНК-связывающего домена Cas способна связываться со своим сайтом-мишенью и/или сайтом связывания, в то время как активирующий домен способен усиливать экспрессию гена. Когда слитый полипептид, в котором ДНК-связывающий домен Cas слит с расщепляющим доменом, ДНК-связывающий домен Cas и расщепляющий домен находятся в функциональной связи, если в слитом полипептиде часть ДНК-связывающего домена Cas способна связываться со своим сайтом-мишенью и/или сайтом связывания, в то время как расщепляющий домен способен расщеплять ДНК в непосредственной близости от сайта-мишени.
«Функциональный фрагмент» белка, полипептида или нуклеиновой кислоты представляет собой белок, полипептид или нуклеиновую кислоту, последовательность которого не идентична полноразмерному белку, полипептиду или нуклеиновой кислоте, но сохраняет ту же функцию, что и полноразмерный белок, полипептид или нуклеиновая кислота. Функциональный фрагмент может содержать больше, меньше или такое же количество остатков, что и соответствующая нативная молекула, и/или может содержать одну или более аминокислотных или нуклеотидных замен. Способы определения функции нуклеиновой кислоты (например, кодирующей функции, способности гибридизоваться с другой нуклеиновой кислотой) хорошо известны в данной области техники. Точно так же способы определения функции белка хорошо известны. Например, ДНК-связывающая функция полипептида может быть определена, например, с помощью анализа на связывание с фильтром, электрофоретического сдвига подвижности или иммунопреципитации. Расщепление ДНК может быть проанализировано с помощью гель-электрофореза. Смотрите Ausubel et al., выше. Способность белка взаимодействовать с другим белком может быть определена, например, с помощью коиммунопреципитации, двухгибридных анализов или комплементации, как генетической, так и биохимической. Смотрите, например, Fields et al., (1989) Nature 340: 245-246; патент США с №5585245 и публикацию международной заявки на патент с № WO 98/44350.
«Вектор» способен переносить последовательности генов в клетки-мишени. Как правило, «векторная конструкция», «экспрессионный вектор» и «вектор для переноса генов» означают любую конструкцию нуклеиновой кислоты, способную управлять экспрессией представляющего интерес гена, и которая может переносить последовательности гена в клетки-мишени. Таким образом, этот термин включает средства для клонирования и экспрессии, а также интегрирующиеся векторы.
«Ген-репортер» или «репортерная последовательность» относится к любой последовательности, которая продуцирует белковый продукт, который легко измеряется, предпочтительно, хотя и не обязательно, в обычном анализе. Подходящие гены-репортеры включают, но без ограничения ими, последовательности, кодирующие белки, которые опосредуют устойчивость к антибиотикам (например, устойчивость к ампициллину, устойчивость к неомицину, устойчивость к G418, устойчивость к пуромицину), последовательности, кодирующие окрашенные или флуоресцентные или люминесцентные белки (например, зеленый флуоресцентный белок, усиленный зеленый флуоресцентный белок, красный флуоресцентный белок, люциферазу) и белки, которые опосредуют усиление роста клеток и/или амплификацию генов (например, дигидрофолатредуктазу). Эпитопные метки включают, например, одну или более копий FLAG, His, myc, Tap, HA или любую обнаруживаемую аминокислотную последовательность. «Метки экспрессии» включают последовательности, которые кодируют репортеры, которые могут быть функционально связаны с желаемой последовательностью гена, чтобы контролировать экспрессию представляющего интерес гена.
Тау и болезнь Альцгеймера
Тау-белок кодируется геном MAPT, который включает 16 экзонов. Интересно, что экзоны 1, 4, 5, 7, 9, 11 и 12 экспрессируются конститутивно, тогда как экзоны 2, 3 и 10 могут присутствовать в видах тау-белков, полученных из альтернативно сплайсированных вариантов, что приводит к присутствию шести различных изоформ тау-белка в головном мозге взрослого человека. Тау связывается с микротрубочками с помощью 3 или 4 повторяющихся тубулинсвязывающих мотивов в С-концевой половине белка, и считается, что он стабилизирует трубочки, причем tau4R (4 тубулинсвязывающих мотива), как полагают, взаимодействует сильнее с микротрубочками, чем tau3R. Отношение 3R к 4R является обычно неизменным, но может быть нарушено при патологических состояниях. Форма тау, которая взаимодействует с микротрубочками, фосфорилируется, и, по-видимому, гиперфосфорилирование заставляет тау отделяться от микротрубочек. Гиперфосфорилированный тау может секвестрироваться в клетке, что затем приводит к конформационным изменениям белка и к агрегации. Эти агрегаты могут представлять собой начальную стадию образования патогенных нейрофибриллярных клубков (NFT), однако гиперфосфорилированный тау может быть патогенным как в растворимой форме, так и при присутствии в клубках (Bodea et al., (2016) J of Neurochem 138 (Suppl 1):71-94). На ранних стадиях AD NFT ограничиваются присутствием в энторинальной коре и срединных участках височной доли, а к моменту появления тяжелых клинических симптомов заболевания NFT широко распространены по всему головному мозгу. В связи с наличием большого количества NFT также происходит широкое распространение амилоидных бляшек. Фактически, оказывается, что отложение амилоида в коре головного мозга приводит к увеличению скорости распространения тау и распространению NFT на дистальные области головного мозга. По мере распространения клубков с тау наблюдается сопутствующее увеличение потери нейронов (Pooler et al., (2015) Acta Neuropathol Commun 3:14, doi: 10.1186/s40478-015-0199-x).
Тау содержит 95 аминокислотных остатков, которые способны фосфорилироваться, и было идентифицировано несколько киназ, которые могут отвечать за фосфорилирование тау, которые могут быть возможными мишенями-кандидатами для новых терапевтических средств, включая гликогенсинтазу-3, циклин-зависимую киназу 5, члены семейства MAPK, внеклеточно регулируемую киназу, N-концевую киназу c-Jun и киназу, регулирующую сродство к микротрубочкам (Bodea (2016), там же).
Белок амилоид β (Aβ) является основным компонентом сенильных бляшек, которые вместе с NFT являются отличительными признаками невропатологического подтверждения болезни Альцгеймера. Аβ является пептидом, который содержит цепи из 39-42 аминокислот; 42 аминокислотная форма агрегирует более активно и, как полагают, вовлечена в патогенез заболевания и является основой амилоидной гипотезы (предположения о том, что накопление Aβ в головном мозге является основной причиной AD, смотрите обзор Hardy and Selkoe (2002) Science 297:353). Aβ являются продуктами протеолитического расщепления белка-предшественника амилоида (APP), повсеместного, гликозилированного, сульфатированного и фосфорилированного интегрального мембранного белка (Sorrentino et al., (2014) FEBS Lett 588:641-652). Однако становится ясно, что патогенез, приводящий к AD, является чрезвычайно сложным, и что патогенез накопления Aβ может играть роль в аномальном поведении тау (Ando et al., (2016) PLoS Genet 12 (3):e1005917.
Было показано, что снижение тау в головном мозге ослабляет патологию AD. Регулируемое подавление экспрессии трансгена тау в модели AD на мыши продемонстрировало снижение агрегатов тау, ассоциированного с трансгеном, и снижение концентрации гиперфосфорилированного тау и NFT. Фактически, это научное исследование также продемонстрировало полную утрату NFT, что указывает на то, что накопление NFT может быть обратимым (Polydoro et al., (2013) J of Neurosci 33 (33):13300-13311). Кроме того, исследования, проведенные с внутриклеточным антителом против тау, доставляемым с помощью AAV непосредственно посредством введения внутрь гиппокампа, продемонстрировали снижение нерастворимых видов тау, NFT и спасение от атрофии гиппокампа, которая наблюдается в не подвергнутой лечению модели на мыши (Liu et al., (2016) J Neurosci 36 (49): 12425-12435).
ДНК-связывающие домены
В описанных здесь способах используются композиции, например, тау-модулирующие факторы транскрипции, включающие ДНК-связывающий домен, который специфически связывается с последовательностью-мишенью в гене тау (MATP). Любой полинуклеотидный или полипептидный ДНК-связывающий домен может использоваться в композициях и способах, раскрытых здесь, например, ДНК-связывающие белки (например, ZFP или TALE) или ДНК-связывающие полинуклеотиды (например, химерные руководящие РНК). Таким образом, описаны генетические модуляторы (репрессоры) генов тау.
В некоторых вариантах осуществления репрессор тау или ДНК-связывающий домен в нем включает белок с цинковыми пальцами. Выбор сайтов-мишеней; ZFP и способы проектирования и конструирования слитых белков (и кодирующих их полинуклеотидов) известны специалистам в данной области техники и подробно описаны в патентах США с №6140081; 5789538; 6453242; 6534261; 5925523; 6007988; 6013453; 6200759; и публикации международной заявки на патент с № WO 95/19431; WO 96/06166; WO 98/53057; WO 98/54311; WO 00/27878; WO 01/60970; WO 01/88197; WO 02/099084; WO 98/53058; WO 98/53059; WO 98/53060; WO 02/016536 и WO 03/016496.
Сайты-мишени в тау, как правило, вовлекают по крайней мере один цинковый палец, но могут вовлекать множество цинковых пальцев (например, 2, 3, 4, 5, 6 или более пальцев). Обычно ZFP включают как минимум три пальца. Некоторые из ZFP включают четыре, пять или шесть пальцев, в то время как некоторые ZFP включают 8, 9, 10, 11 или 12 пальцев. ZFP, которые включают три пальца, обычно распознают сайт-мишень, который включает 9 или 10 нуклеотидов; ZFP, которые включают четыре пальца, обычно распознают сайт-мишень, который включает от 12 до 14 нуклеотидов; в то время как ZFP с шестью пальцами могут распознавать сайты-мишени, которые включают от 18 до 21 нуклеотида. ZFP также могут представлять собой слитые белки, которые включают один или более регуляторных доменов, причем эти домены могут быть активирующими или подавляющими транскрипцию доменами. В некоторых вариантах осуществления слитый белок включает два ДНК-связывающих домена ZFP, связанных вместе. Эти белки с цинковыми пальцами могут, таким образом, включать 8, 9, 10, 11, 12 или более пальцев. В некоторых вариантах осуществления два ДНК-связывающих домена связаны через удлиняющийся гибкий линкер, так что один ДНК-связывающий домен включает 4, 5 или 6 цинковых пальцев, а второй ДНК-связывающий домен включает дополнительные 4, 5 или 5 цинковых пальцев. В некоторых вариантах осуществления линкер представляет собой стандартный линкер между пальцами, так что массив пальцев включает один ДНК-связывающий домен, включающий 8, 9, 10, 11 или 12 или более пальцев. В других вариантах осуществления линкер представляет собой нетипичный линкер, такой как гибкий линкер. ДНК-связывающие домены слиты с по крайней мере одним регуляторным доменом и могут рассматриваться как структура «ZFP-ZFP-TF». Конкретные примеры этих вариантов осуществления могут называться «ZFP-ZFP-KOX», который включает два ДНК-связывающих домена, связанных гибким линкером и слитых с репрессором KOX, и «ZFP-KOX-ZFP-KOX», в котором два слитых белка ZFP-KOX слиты вместе с помощью линкера.
Сконструированный связывающий домен «цинковый палец» может иметь новую специфичность связывания по сравнению со встречающимся в природе белком с цинковыми пальцами. Методы конструирования включают, но без ограничения ими, конструктивный расчет и различные типы отбора. Конструктивный расчет включает, например, использование баз данных, включающих триплетные (или квадруплетные) нуклеотидные последовательности и отдельные аминокислотные последовательности цинкового пальца, в которых каждая триплетная или квадруплетная нуклеотидная последовательность связана с одной или более аминокислотными последовательностями цинковых пальцев, которые связывают конкретную триплетную или квадруплетную последовательность. Смотрите, например, находящиеся в совместной собственности патенты США с №6452442 и 6534261, которые включены сюда посредством ссылки во всей их полноте.
Кроме того, как раскрыто в этих и других ссылках, домены «цинковые пальцы» и/или белки с множеством цинковых пальцев могут быть связаны вместе с использованием любых подходящих линкерных последовательностей, включая, например, линкеры длиной 5 или более аминокислот. Смотрите также патенты США с №6479626, 6903185 и 7153949 для показательных линкерных последовательностей длиной 6 или более аминокислот. Описанные здесь белки могут включать любую комбинацию подходящих линкеров между отдельными цинковыми пальцами белка.
ZFP может быть функционально связан (ассоциирован) с одним или более регулирующих транскрипцию доменов (например, подавляющих доменов) с образованием ZF-TF (например, репрессора). Способы и композиции также могут использоваться для увеличения специфичности ZFP для предусмотренной для него мишени по сравнению с другими непредусмотренными сайтами расщепления, известными как сайты вне мишени, например, путем мутаций в остове ZFP, как описано в заявке на патент США с №15/685580. Таким образом, описанные здесь репрессоры тау могут содержать мутации в одной или более из остовных областей ДНК-связывающих доменов и/или одну или более мутаций в их регулирующих транскрипцию доменах. Эти ZFP могут включать мутации в аминокислоты внутри ДНК-связывающего домена ZFP (в «остове ZFP»), которые могут неспецифически взаимодействовать с фосфатами в остове ДНК, но они не содержат изменений в распознающих спиралях ДНК. Таким образом, настоящее изобретение включает мутации катионных аминокислотных остатков в остове ZFP, которые не требуются для специфичности в отношении нуклеотидной мишени. В некоторых вариантах осуществления эти мутации в остове ZFP включают мутацию катионного аминокислотного остатка в нейтральный или анионный аминокислотный остаток. В некоторых вариантах осуществления эти мутации в остове ZFP включают мутацию полярного аминокислотного остатка в нейтральный или неполярный аминокислотный остаток. В предпочтительных вариантах осуществления мутации осуществляются в положении (-5), (-9) и/или положении (-14) относительно ДНК-связывающей спирали. В некоторых вариантах осуществления цинковый палец может содержать одну или более мутаций в положении (-5), (-9) и/или (-14). В дальнейших вариантах осуществления один или более цинковых пальцев в белке с множеством цинковых пальцев может содержать мутации в положении (-5), (-9) и/или (-14). В некоторых вариантах осуществления аминокислоты в (-5), (-9) и/или (-14) (например, аргинин (R) или лизин (K)) мутированы в аланин (A), лейцин (L), Ser (S), Asp (N), Glu (E), Tyr (Y) и/или глютамин (Q).
Альтернативно, ДНК-связывающий домен может быть получен из нуклеазы. Например, известны последовательности распознавания хоминг-эндонуклеаз и мегануклеаз, таких как I-SceI, I-CeuI, PI-PspI, PI-Sce, I-SceIV, I-CsmI, I-PanI, I-SceII, I-PpoI, I-SceIII, I-CreI, I-TevI, I-TevII и I-TevIII. Смотрите также патент США с № 5420032; патент США с № 6833252; Belfort et al., (1997) Nucleic Acids Res. 25:3379-3388; Dujon et al., (1989) Gene 82:115-118; Perler et al., (1994) Nucleic Acids Res. 22, 1125-1127; Jasin (1996) Trends Genet. 12:224-228; Gimble et al., (1996) J. Mol. Biol. 263:163-180; Argast et al., (1998) J. Mol. Biol. 280:345-353 и каталог New England Biolabs. Кроме того, ДНК-связывающая специфичность хоминг-эндонуклеаз и мегануклеаз может быть создана для связывания неприродных сайтов-мишеней. Смотрите, например, Chevalier et al., (2002) Molec. Cell 10:895-905; Epinat et al., (2003) Nucleic Acids Res. 31:2952-2962; Ashworth et al., (2006) Nature 441:656-659; Paques et al., (2007) Current Gene Therapy 7:49-66; публикацию заявки на патент США с №2007/0117128.
Белками с «двуручными» цинковыми пальцами являются те белки, в которых два кластера ДНК-связывающих доменов «цинковые пальцы» разделены промежуточными аминокислотами, так что два домена «цинковые пальцы» связываются с двумя дискретными сайтами-мишенями. Примером двуручного типа белка, связывающего цинковыми пальцами, является SIP1, в котором кластер из четырех цинковых пальцев расположен на N-конце белка, а кластер из трех пальцев расположен на C-конце (смотрите Remacle et al., (1999) EMBO Journal 18 (18):5073-5084). Каждый кластер цинковых пальцев в этих белках способен связываться с уникальной последовательностью-мишенью, и расстояние между двумя последовательностями-мишенями может включать множество нуклеотидов. Двуручные ZFP могут включать функциональный домен, например, слитый с одним или обоими из ZFP. Таким образом, будет очевидно, что функциональный домен может быть присоединен к внешней стороне одного или обоих ZFP или может быть расположен между ZFP (прикрепленным к обоим ZFP).
В некоторых вариантах осуществления ДНК-связывающий домен включает встречающийся в природе или сконструированный (не встречающийся в природе) ДНК-связывающий домен TAL-эффектора (TALE). Смотрите, например, патент США с №8586526, полностью включенный сюда посредством ссылки. В некоторых вариантах осуществления ДНК-связывающий белок TALE связывается с 12, 13, 14, 15, 16, 17, 18, 19, 20 или более следующих друг за другом нуклеотидов сайта-мишени в тау, как показано в таблице 1 или 2 (SEQ ID NO:1-6 или 33). RVD ДНК-связывающего белка TALE, который связывается с сайтом-мишенью в тау, могут быть встречающимися в природе или не встречающимися в природе RVD. Смотрите патенты США с №8586526 и 9458205.
Известно, что патогенные для растений бактерии рода Xanthomonas вызывают множество заболеваний у важных сельскохозяйственных культур. Патогенность Xanthomonas зависит от консервативной системы секреции III типа (T3S), которая добавляет более 25 различных эффекторных белков в клетку растения. Среди этих добавляемых белков находятся подобные активаторам транскрипции эффекторы (TALE), которые имитируют активаторы транскрипции у растений и манипулируют транскриптомом растений (смотрите Kay et al., (2007) Science 318:648-651). Эти белки содержат ДНК-связывающий домен и активирующий транскрипцию домен. Одним из наиболее хорошо охарактеризованных TALE является AvrBs3 из Xanthomonas campestgris pv. Vesicatoria (смотрите Bonas et al., (1989) Mol Gen Genet 218:127-136 и WO2010079430). TALE содержат центрированный домен из тандемных повторов, каждый из которых содержит приблизительно 34 аминокислоты, которые являются ключом к специфичности связывания ДНК этих белков. Кроме того, они содержат последовательность ядерной локализации и кислый активирующий транскрипцию домен (ради обзора смотрите Schornack S, et al., (2006) J Plant Physiol 163 (3):256-272). Кроме того, в фитопатогенных бактериях Ralstonia solanacearum были обнаружены два гена, обозначенных brg11 и hpx17, которые гомологичны семейству AvrBs3 Xanthomonas в штамме GMI1000 биовара 1 R. solanacearum и штамме RS1000 биовара 4 (смотрите Heuer et al. (2007) Appl и Envir Micro 73 (13):4379-4384). Эти гены идентичны по нуклеотидной последовательности друг другу на 98,9%, но отличаются делецией 1575 п.н. в повторяющемся домене hpx17. Однако оба продукта генов идентичны по последовательности белкам семейства AvrBs3 Xanthomonas на менее 40%.
Специфичность этих TALE зависит от последовательностей, обнаруживаемых в тандемных повторах. Повторяющаяся последовательность составляет приблизительно 102 п.н., и повторы, как правило, на 91-100% гомологичны друг другу (Bonas et al., там же). Полиморфизм повторов обычно находится в положениях 12 и 13, и, по-видимому, существует взаимно-однозначное соответствие между идентичностью двух гипервариабельных остатков (HD) в положениях 12 и 13 и идентичностью следующих друг за другом нуклеотидов в последовательности-мишени TALE (смотрите Moscou and Bogdanove (2009) Science 326:1501 и Boch et al., (2009) Science 326:1509-1512). Экспериментально, код для распознавания ДНК этими TALE был определен так, что последовательность HD в положениях 12 и 13 приводит к связыванию с цитозином (C), NG связывается с T, NI с A, C, G или T, NN связывается с A или G, и NG связывается с T. Эти ДНК-связывающие повторы были собраны в белки с новыми комбинациями и количеством повторов, чтобы создать искусственные факторы транскрипции, способные взаимодействовать с новыми последовательностями. Кроме того, в патенте США с №8586526 и публикации заявки на патент США №2013/0196373, полностью включенных сюда посредством ссылки, описаны TALE с N-кэппированными полипептидами, С-кэппированными полипептидами (например, +63, +231 или +278) и/или новыми (нетипичными) RVD.
Примеры TALE описаны в патентах США c №8586526 и 9458205, которые включены посредством ссылки во всей их полноте.
В некоторых вариантах осуществления ДНК-связывающие домены включают домен димеризации и/или мультимеризации, например, биспираль (CC) и димеризующийся цинковый палец (DZ). Смотрите публикацию заявки на патент США с №2013/0253040.
В еще одних вариантах осуществления ДНК-связывающий домен включает химерную руководящую РНК системы CRISPR/Cas, например sgRNA, как описано в 20150056705.
Недавно были получены убедительные доказательства существования у архей и многих бактерий РНК-опосредованного пути защиты генома, предположительно параллельного пути РНК-интерференции у эукариот (ради обзоров смотрите Godde and Bickerton, 2006. J. Mol. Evol. 62:718-729; Lillestol et al., 2006. Archaea 2:59-72; Makarova et al., 2006. Biol. Direct 1:7; Sorek et al., 2008. Nat. Rev. Microbiol. 6:181-186). Предполагается, что этот путь, известный как система CRISPR-Cas или прокариотическая РНК-интерференции (pRNAi), возникает из двух эволюционно и часто физически связанных генных локусов: локуса CRISPR (коротких палиндромных повторов, регулярно расположенных группами), который кодирует РНК-компоненты системы, и локуса cas (CRISPR-ассоциированного), который кодирует белки (Jansen et al., 2002. Mol. Microbiol. 43:1565-1575; Makarova et al., 2002. Nucleic Acids Res. 30:482-496; Makarova et al. al., 2006. Biol. Direct 1:7; Haft et al., 2005. PLoS Comput. Biol. 1:e60). Локусы CRISPR в микробных хозяевах содержат комбинацию CRISPR-ассоциированных (Cas) генов, а также некодирующие РНК-элементы, способные программировать специфичность CRISPR-опосредованного расщепления нуклеиновой кислоты. Отдельные белки Cas не имеют значительного сходства последовательностей с белковыми компонентами механизма РНК-интерференции у эукариот, но обладают аналогичными предсказанными функциями (например, связыванием РНК, нуклеазной, геликазной и т.д.) (Makarova et al., 2006. Biol. Direct 1:7). CRISPR-ассоциированные (cas) гены часто связаны с массивами повтор-спейсер CRISPR. Было описано более сорока различных семейств белков Cas. Из этих семейств белков Cas1, по-видимому, является повсеместным среди различных систем CRISPR/Cas. Конкретные комбинации генов cas и повторяющихся структур были использованы для определения 8 подтипов CRISPR (Ecoli, Ypest, Nmeni, Dvulg, Tneap, Hmari, Apern и Mtube), некоторые из которых связаны с дополнительным генным модулем, кодирующим ассоциированные с повторами загадочные белки (RAMP). В одном геноме может встречаться более одного подтипа CRISPR. Случайное распределение подтипов CRISPR/Cas предполагает, что система подвергается горизонтальному переносу генов во время эволюции микроорганизмов.
CRISPR типа II, первоначально описанная в S. pyogenes, является одной из наиболее хорошо охарактеризованных систем и осуществляет целенаправленный разрыв двухцепочечной ДНК в четыре последовательных этапа. Во-первых, две некодирующие РНК, массив pre-crRNA (crRNA-предшественников) и tracrRNA, транскрибируются из локуса CRISPR. Во-вторых, tracrRNA гибридизуется с повторяющимися участками pre-crRNA и опосредует процессинг pre-crRNA в зрелые crRNA, содержащие отдельные спейсерные последовательности, причем процессинг происходит с помощью специфической для двухцепочечной РНК РНКазы III в присутствии белка Cas9. В-третьих, комплекс зрелая crRNA:tracrRNA направляет Cas9 к ДНК-мишени посредством спаривания оснований по Уотсону-Крику между спейсером в crRNA и протоспейсером в ДНК-мишени рядом с прилегающим к протоспейсеру мотивом (PAM), что является дополнительным требованием для распознавания мишени. Кроме того, tracrRNA также должна присутствовать, поскольку она подвергается спариванию оснований с crRNA на ее 3'-конце, и эта ассоциация запускает активность Cas9. Наконец, Cas9 опосредует расщепление ДНК-мишени с созданием двухцепочечного разрыва внутри протоспейсера. Активность системы CRISPR/Cas состоит из трех этапов: (i) вставки чужеродных последовательностей ДНК в массив CRISPR для предотвращения будущих атак, в процессе, называемом «адаптация», (ii) экспрессии соответствующих белков, а также экспрессии и процессинга массива с последующей (iii) РНК-опосредованной интерференцией с использованием чужеродной нуклеиновой кислоты. Таким образом, в бактериальной клетке некоторые из так называемых белков «Cas» участвуют в природной функции системы CRISPR/Cas.
Системы CRISPR типа II были обнаружены у многих различных бактерий. Поиски BLAST по общедоступным геномам, проведенные Fonfara et al. ((2013) Nuc Acid Res 42 (4):2377-2590), позволили обнаружить ортологи Cas9 у 347 видов бактерий. Кроме того, эта группа продемонстрировала in vitro расщепление с помощью CRISPR/Cas ДНК-мишени с использованием ортологов Cas9 из S. pyogenes, S. mutans, S. therophilus, C. jejuni, N. meningitides, P. multocida и F. novicida. Таким образом, термин «Cas9» относится к руководимой РНК ДНК-нуклеазе, включающей ДНК-связывающий домен и два нуклеазных домена, причем ген, кодирующий Cas9, может быть получен из любых подходящих бактерий.
Белок Cas9 имеет по крайней мере два нуклеазных домена: один нуклеазный домен подобен эндонуклеазе HNH, а другой напоминает эндонуклеазный домен Ruv. Домен HNH-типа, по-видимому, ответственен за расщепление цепи ДНК, которая комплементарна crRNA, в то время как домен Ruv-типа расщепляет некомплементарную цепь. Можно сконструировать нуклеазу Cas 9 так, чтобы только один из нуклеазных доменов был функциональным, создавая никазу Cas (смотрите Jinek et al., (2012) Science 337:816). Никазы могут быть созданы путем специфической мутации аминокислот в каталитическом домене фермента или путем усечения части или всего домена таким образом, что он больше не функционирует. Поскольку Cas9 содержит два нуклеазных домена, этот подход может быть использован для любого из двух доменов. Двухцепочечный разрыв в ДНК-мишени может быть достигнут с использованием двух таких никаз Cas9. Каждая из никаз будет расщеплять одну цепь ДНК, а использование двух будет создавать двухцепочечный разрыв.
Потребность в комплексе crRNA-tracrRNA можно избежать путем использования сконструированной «химерной руководящей РНК» (sgRNA), которая включает шпильку, обычно образуемую с помощью отжига crRNA и tracrRNA (смотрите Jinek et al., там же, и Cong et al., (2013) Sciencexpress/10.1126/science.1231143). В S. pyrogenes сконструированное слияние tracrRNA:crRNA, или sgRNA, направляет Cas9 на расщепление ДНК-мишени, когда образуется двухцепочечный РНК:ДНК гетеродимер между Cas-ассоциированными РНК и ДНК-мишенью. Эта система, включающая белок Cas9 и сконструированную sgRNA, содержащую последовательность PAM, использовалась для руководимого РНК редактирования генома (смотрите Ramalingam et al., Stem Cells and Development 22 (4):595-610 (2013)) и была применима для редактирования генома эмбрионов рыбок данио in vivo (смотрите Hwang et al., (2013) Nature Biotechnology 31 (3):227) с эффективностью редактирования, схожей с ZFN и TALEN.
Первичные продукты локусов CRISPR, по-видимому, представляют собой короткие РНК, которые содержат внедряющиеся нацеливающие последовательности и называются руководящими РНК или прокариотическими, вызывающими сайлинсинг РНК (psiRNA) с учетом их предполагаемой роли в пути (Makarova et al., 2006. Biol. Direct 1:7; Hale et al., 2008. RNA, 14:2572-2579). Анализ РНК показывает, что транскрипты с локуса CRISPR расщепляются в пределах повторяющихся последовательностей с высвобождением промежуточных РНК-продуктов размером ~60-70 нуклеотидов, которые содержат отдельные внедряющиеся нацеливающие последовательности и фланкирующие повторяющиеся фрагменты (Tang et al., 2002. Proc. Natl. Acad. Sci. 99:7536-7541; Tang et al., 2005. Mol. Microbiol. 55:469-481; Lillestol et al., 2006. Archaea 2:59-72; Brouns et al., 2008. Science 321:960-964; Hale et al., 2008. RNA, 14:2572-2579). У архей Pyrococcus furiosus эти промежуточные РНК далее процессируются в присутствующие в большом количестве, стабильные зрелые psiРНК размером ~35-45 нуклеотидов (Hale et al., 2008. RNA, 14:2572-2579).
Потребность в комплексе crRNA-tracrRNA можно избежать путем использования сконструированной «химерной руководящей РНК» (sgRNA), которая включает шпильку, обычно образуемую с помощью отжига crRNA и tracrRNA (смотрите Jinek et al., (2012) Science 337:816 и Cong et al., (2013) Sciencexpress/10.1126/science.1231143). В S. pyrogenes сконструированное слияние tracrRNA:crRNA, или sgRNA, направляет Cas9 на расщепление ДНК-мишени, когда образуется двухцепочечный РНК:ДНК гетеродимер между Cas-ассоциированными РНК и ДНК-мишенью. Эта система, включающая белок Cas9 и сконструированную sgRNA, содержащую последовательность PAM, использовалась для руководимого РНК редактирования генома (смотрите Ramalingam там же) и была применима для редактирования генома эмбрионов рыбок данио in vivo (смотрите Hwang et al., (2013) Nature Biotechnology 31 (3):227) с эффективностью редактирования, схожей с ZFN и TALEN.
Химерные или sgRNA могут быть сконструированы так, чтобы они включали последовательность, комплементарную любой желаемой мишени. В некоторых вариантах осуществления длина руководящей последовательности составляет приблизительно или более чем приблизительно 5, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 75 или более нуклеотидов. В некоторых вариантах осуществления длина руководящей последовательности составляет менее чем приблизительно 75, 50, 45, 40, 35, 30, 25, 20, 15, 12 или менее нуклеотидов. В некоторых вариантах осуществления sgRNA включает последовательность, которая связывается с 12, 13, 14, 15, 16, 17, 18, 19, 20 или более следующих друг за другом нуклеотидов сайта-мишени в тау, как показано в таблице 1 или 2 (SEQ ID NO:1-6 или 33). В некоторых вариантах осуществления РНК включают 22 основания комплементарности мишени и в форме G[n19], за которыми следует прилегающий к протоспейсеру мотив (PAM) формы NGG или NAG для использования с системой CRISPR/Cas S. pyogenes. Таким образом, в одном способе sgRNA могут быть сконструированы путем использования известной мишени для ZFN в представляющем интерес гене путем (i) совмещения последовательности распознавания гетеродимером ZFN с эталонной последовательностью соответствующего генома (человека, мыши или конкретного вида растений); (ii) определения спейсерной области между половинными сайтами для ZFN; (iii) определения местоположения мотива G[N20]GG, который находится ближе всего к спейсерной области (когда более чем один такой мотив перекрывает спейсер, выбирается мотив, который центрирован относительно спейсера); (iv) использования этого мотива в качестве ядра sgRNA. Этот способ преимущественно основывается на проверенных мишенях для нуклеаз. Альтернативно, sgRNA могут быть разработаны для нацеливания на любую представляющую интерес область, просто идентифицируя подходящую последовательность-мишень, соответствующую формуле G[n20]GG. Наряду с областью комплементарности sgRNA может включать дополнительные нуклеотиды для удлинения до хвостовой области tracrRNA-части sgRNA (смотрите Hsu et al., (2013) Nature Biotech doi: 10.1038/nbt.2647). Длина хвостовых областей может составлять от +67 до +85 нуклеотидов или любое число между ними, при этом предпочтительная длина составляет +85 нуклеотидов. Можно также использовать усеченные sgRNA, «tru-gRNA» (смотрите Fu et al., (2014) Nature Biotech 32 (3):279). В tru-gRNA длина области комплементарности уменьшена до 17 или 18 нуклеотидов.
Кроме того, могут также использоваться альтернативные последовательности PAM, причем последовательность PAM может представлять собой NAG в качестве альтернативы NGG (Hsu 2013, там же) с использованием Cas9 S. pyogenes. Дополнительные последовательности PAM также могут включать последовательности, в которых отсутствует начальный G (Sander and Joung (2014) Nature Biotech 32 (4):347). Помимо кодируемых S. pyogenes последовательностей PAM для Cas9 могут использоваться другие последовательности PAM, которые являются специфическими для белков Cas9, из других бактериальных источников. Например, последовательности PAM, приведенные ниже (адаптированные из Sander and Joung, там же, и Esvelt et al., (2013) Nat Meth 10 (11):1116), являются специфическими для этих белков Cas9:
Таким образом, подходящую последовательность-мишень для использования с системой CRISPR/Cas S. pyogenes можно выбрать в соответствии со следующим принципом: [n17, n18, n19 или n20](G/A)G. В качестве альтернативы последовательность PAM может следовать принципу G[n17, n18, n19, n20](G/A)G. Для белков Cas9, полученных из не являющихся S. pyogenes бактерий, те же руководящие принципы могут быть использованы, когда альтернативными PAM заменяются последовательности PAM S. pyogenes.
Наиболее предпочтительным является выбор последовательности-мишени с наибольшей вероятностью специфичности, которая позволяет избежать потенциальных последовательностей вне мишени. Эти нежелательные последовательности вне мишени могут быть идентифицированы путем рассмотрения следующих атрибутов: i) сходства по последовательности-мишени, за которой следует последовательность PAM, о которой известно, что она функционирует с используемым белком Cas9; ii) сходной последовательности-мишени с менее чем тремя несовпадениями по сравнению с желаемой последовательностью-мишенью; iii) последовательности-мишени, сходной с таковой в ii), в которой все несоответствия расположены в дистальной области PAM, а не в проксимальной области PAM (есть данные, что нуклеотиды 1-5, непосредственно примыкающие или проксимальные относительно PAM, иногда называемые областью «затравки» (Wu et al., (2014) Nature Biotech doi: 10.1038/nbt2889), являются наиболее важными для распознавания, поэтому предполагаемые сайты вне мишени с несоответствиями, расположенные в области затравки, могут быть наименее вероятно распознаны sgRNA); и iv) сходной последовательности-мишени, в которой несоответствия не последовательно разнесены или разнесены более чем на четыре нуклеотида друг от друга (Hsu 2014, там же). Таким образом, выполняя анализ числа потенциальных сайтов вне мишени в геноме для любой используемой системы CRIPSR/Cas, используя вышеуказанные критерии, можно определить подходящую последовательность-мишень для sgRNA.
В некоторых вариантах осуществления белок Cas может быть «функциональным производным» встречающегося в природе белка Cas. «Функциональное производное» полипептида с нативной последовательностью представляет собой соединение, обладающее качественными биологическими свойствами, общими с полипептидом с нативной последовательностью. «Функциональные производные» включают, но без ограничения ими, фрагменты нативной последовательности и производные полипептида с нативной последовательностью и его фрагментов, при условии, что они обладают биологической активностью, общей с соответствующим полипептидом с нативной последовательностью. Рассматриваемая здесь биологическая активность представляет собой способность функционального производного к гидролизу ДНК-субстратом на фрагменты. Термин «производное» охватывает как варианты аминокислотной последовательности полипептида, ковалентные модификации, так и их слияния. В некоторых аспектах функциональное производное может заключать в себе единственное биологическое свойство встречающегося в природе белка Cas. В других аспектах функциональное производное может заключать в себе подмножество биологических свойств встречающегося в природе белка Cas. Подходящие производные полипептида Cas или его фрагмента включают, но без ограничения ими, мутанты, слияния, ковалентные модификации белка Cas или его фрагмента. Белок Cas, который включает белок Cas или его фрагмент, а также производные белка Cas или его фрагмента, может быть получен из клетки или синтезирован химически или путем комбинирования этих двух процедур. Клетка может представлять собой клетку, которая от природы продуцирует белок Cas, или клетку, которая от природы продуцирует белок Cas и генетически сконструирована для продуцирования эндогенного белка Cas на более высоком уровне экспрессии или для продуцирования белка Cas с экзогенно введенной нуклеиновой кислоты, которая кодирует Cas, который является одинаковым или отличным от эндогенного Cas. В некоторых случаях клетка не продуцирует белок Cas от природы и генетически сконструирована для продукции белка Cas.
Приводимые в качестве примера нуклеазные системы CRISPR/Cas, нацеленные на конкретные гены (в том числе гены безопасных гавань), раскрыты, например, в публикации США №2015/0056705.
Таким образом, нуклеаза включает ДНК-связывающий домен, который специфически связывается с сайтом-мишенью в любом гене, в который желательно вставить донор (трансген), в комбинации с нуклеазным доменом, который расщепляет ДНК.
Модуляторы гена тау
Связывающие ДНК для тау домены могут быть слиты или иным образом связаны с любыми дополнительными молекулами (например, полипептидами) для использования в описанных здесь способах. В некоторых вариантах осуществления в способах используются слитые молекулы, включающие по крайней мере одну ДНК-связывающую молекулу (например, ZFP, TALE или химерную руководящую РНК) и гетерологичный регуляторный (функциональный) домен (или его функциональный фрагмент).
В некоторых вариантах осуществления функциональный домен модулятора тау включает регулирующий транскрипцию домен. Обычные домены включают, например, домены факторов транскрипции (активаторы, репрессоры, коактиваторы, корепрессоры), сайленсеры, онкогены (например, myc, jun, fos, myb, max, mad, rel, ets, bcl, myb, члены семьи mos и т.д.); осуществляющие репарацию ДНК ферменты и связанные с ними факторы и модификаторы; осуществляющие реаранжировку ДНК ферменты и связанные с ними факторы и модификаторы; связанные с хроматином белки и их модификаторы (например, киназы, ацетилазы и деацетилазы); и модифицирующие ДНК ферменты (например, метилтрансферазы, топоизомеразы, геликазы, лигазы, киназы, фосфатазы, полимеразы, эндонуклеазы) и связанные с ними факторы и модификаторы. Смотрите, например, публикацию заявки на патент США с №2013/0253040, полностью включенную сюда посредством ссылки.
Подходящие домены для достижения активации включают активирующий домен VP16 HSV (смотрите, например, Hagmann et al., J. Virol. 71, 5952-5962 (1997)), ядерные рецепторы гормонов (смотрите, например, Torchia et al., Curr. Opin. Cell. Biol. 10:373-383 (1998)); субъединицу p65 ядерного фактора каппа B (Bitko & Barik, J. Virol. 72:5610-5618 (1998) и Doyle & Hunt, Neuroreport 8:2937-2942 (1997)); Liu et al., Cancer Gene Ther. 5:3-28 (1998)), или искусственные химерные функциональные домены, такие как VP64 (Beerli et al., (1998) Proc. Natl. Acad. Sci. USA 95:14623-33), и дегрон (Molinari et al. (1999) EMBO J. 18, 6439-6447). Дополнительные, приводимые в качестве примера активирующие домены включают Oct 1, Oct-2A, Sp1, AP-2 и CTF1 (Seipel et al., EMBO J. 11, 4961-4968 (1992), а также p300, CBP, PCAF, SRC1 PvALF, AtHD2A и ERF-2. Смотрите, например, Robyr et al., (2000) Mol. Endocrinol. 14:329-347; Collingwood et al., (1999) J. Mol. Endocrinol. 23:255-275; Leo et al., (2000) Gene 245:1-11; Manteuffel-Cymborowska (1999) Acta Biochim. Pol. 46:77-89; McKenna et al., (1999) J. Steroid Biochem. Mol. Biol. 69:3-12; Malik et al., (2000) Trends Biochem. Sci. 25:277-283 и Lemon et al., (1999) Curr. Opin. Genet. Dev. 9:499-504. Дополнительные, приводимые в качестве примера активирующие домены включают, но без ограничения ими, OsGAI, HALF-1, C1, AP1, ARF-5, -6, -7 и -8, CPRF1, CPRF4, MYC-RP/GP и TRAB1. Смотрите, например, Ogawa et al., (2000) Gene 245:21-29; Okanami et al., (1996) Genes Cells 1:87-99; Goff et al., (1991) Genes Dev. 5:298-309; Cho et al. al., (1999) Plant Mol. Biol. 40:419-429; Ulmason et al., (1999) Proc. Natl. Acad. Sci. USA 96:5844-5849; Sprenger-Haussels et al., (2000) Plant J. 22:1-8; Gong et al., (1999) Plant Mol. Biol. 41:33-44; и Hobo et al., (1999) Proc. Natl. Acad. Sci. USA 96:15348-15353.
Приводимые в качестве примера подавляющие домены, которые могут использоваться для получения репрессоров тау, включают, но без ограничения ими, KRAB A/B, KOX, TGF-бета-индуцибельный ранний ген (TIEG), v-erbA, SID, MBD2, MBD3, члены семейства DNMT (например, DNMT1, DNMT3A, DNMT3B), Rb и MeCP2. Смотрите, например, Bird et al., (1999) Cell 99:451-454; Tyler et al., (1999) Cell 99:443-446; Knoepfler et al., (1999) Cell 99:447-450; и Robertson et al., (2000) Nature Genet. 25:338-342. Дополнительные, приводимые в качестве примера подавляющие домены включают, но без ограничения ими, ROM2 и AtHD2A. Смотрите, например, Chem et al., (1996) Plant Cell 8:305-321; и Wu et al., (2000) Plant J. 22:19-27.
В некоторых случаях домен участвует в эпигенетической регуляции хромосомы. В некоторых вариантах осуществления домен представляет собой гистон-ацетилтрансферазу (HAT), например, тип A, ядернолокализованный, такой как члены семейства MYST MOZ, Ybf2/Sas3, MOF и Tip60, члены семейства GNAT Gcn5 или pCAF, члены семейства p300 CBP, p300 или Rtt109 (Berndsen and Denu (2008) Curr Opin Struct Biol 18 (6): 682-689). В других случаях домен представляет собой гистон-деацетилазу (HDAC), такую как класс I (HDAC-1, 2, 3 и 8), класс II (HDAC IIA (HDAC-4, 5, 7 и 9), HDAC IIB (HDAC 6 и 10)), класс IV (HDAC-11), класс III (также известный как сиртуины (SIRT); SIRT1-7) (смотрите Mottamal et al., (2015) Molecules 20 (3):3898-3941). Другим доменом, который используется в некоторых вариантах осуществления, является гистон-фосфорилаза или -киназа, примеры которых включают MSK1, MSK2, ATR, ATM, DNA-PK, Bub1, VprBP, IKK-α, PKCβ1, Dik/Zip, JAK2, PKC5, WSTF и СК2. В некоторых вариантах осуществления осуществляющий метилирование домен используется и может быть выбран из групп, таких как Ezh2, PRMT1/6, PRMT5/7, PRMT 2/6, CARM1, set7/9, MLL, ALL-1, Suv 39h, G9a, SETDB1, Ezh2, Set2, Dot1, PRMT 1/6, PRMT 5/7, PR-Set7 и Suv4-20h. Домены, участвующие в сумоилировании и биотинилировании (Lys9, 13, 4, 18 и 12), также могут использоваться в некоторых вариантах осуществления (ради обзора смотрите Kousarides (2007) Cell 128:693-705).
Слитые молекулы конструируют способами клонирования и биохимической конъюгации, которые хорошо известны специалистам в данной области техники. Слитые молекулы включают ДНК-связывающий домен и функциональный домен (например, активирующий или подавляющий транскрипцию домен). Слитые молекулы также необязательно включают сигналы ядерной локализации (такие как, например, сигнал от среднего Т-антигена SV40) и эпитопные метки (такие как, например, FLAG и гемагглютинин). Слитые белки (и кодирующие их нуклеиновые кислоты) конструируют так, чтобы трансляционная рамка считывания сохранялась среди компонентов слияния.
Слияния между полипептидным компонентом функционального домена (или его функциональным фрагментом), с одной стороны, и небелковым ДНК-связывающим доменом (например, антибиотиком, интеркалятором, связующим с малой бороздкой, нуклеиновой кислотой), с другой стороны, конструируют способами биохимической конъюгации, известными специалистам в данной области техники. Смотрите, например, каталог Pierce Chemical Company (Rockford, IL). Были описаны способы и композиции для слияний связующего с малой бороздкой и полипептида. Mapp et al., (2000) Proc. Natl. Acad. Sci. USA 97:3930-3935. Аналогично, CRISPR/Cas-TF и нуклеазы, включающие представляющий собой нуклеиновую кислоту компонент в виде sgRNA в ассоциации с полипептидным компонентом в качестве функционального домена, также известны специалистам в данной области техники и подробно здесь описаны.
Слитая молекула может быть составлена в композицию с фармацевтически приемлемым носителем, как известно специалистам в данной области техники. Смотрите, например, Remington's Pharmaceutical Sciences, 17-е издание, 1985, и публикацию находящейся в совместной собственности международной заявки на патент с № WO 00/42219.
Функциональный компонент/домен слитой молекулы может быть выбран из любого множества различных компонентов, способных влиять на транскрипцию гена, когда слитая молекула связывается с последовательностью-мишенью с помощью свого ДНК-связывающего домена. Следовательно, функциональный компонент может включать, но без ограничения ими, различные домены факторов транскрипции, такие как активаторы, репрессоры, коактиваторы, корепрессоры и сайленсеры.
В некоторых вариантах осуществления слитая молекула включает ДНК-связывающий домен и нуклеазный домен с созданием функциональных молекул, которые способны распознавать намеченную нуклеиновую кислоту-мишень через свои сконструированные (ZFP или TALE или sgRNA) ДНК-связывающие домены, и с созданием нуклеаз (например, нуклеазы с цинковыми пальцами или нуклеаз TALE или нуклеаз CRISPR/Cas), которые вызывают расщепление ДНК вблизи сайта связывания ДНК посредством нуклеазной активности. Это расщепление приводит к инактивации (репрессии) гена тау. Таким образом, репрессоры тау также включают нуклеазы для тау.
Таким образом, описанные здесь способы и композиции являются широко применимыми и могут включать любую представляющую интерес нуклеазу. Неограничивающие примеры нуклеаз включают мегануклеазы, TALEN и нуклеазы с цинковыми пальцами. Нуклеаза может включать гетерологичные ДНК-связывающие и расщепляющие домены (например, нуклеазы с цинковыми пальцами; TALEN; мегануклеазные ДНК-связывающие домены с гетерологичными расщепляющими доменами, sgRNA в ассоциации с нуклеазными доменами), или, альтернативно, ДНК-связывающий домен встречающейся в природе нуклеазы может быть изменен для связывания с выбранным сайтом-мишенью (например, мегануклеаза, которая была сконструирована так, чтобы связываться с сайтом, отличным от соответствующего ей сайта связывания).
Нуклеазный домен может быть получен из любой нуклеазы, например любой эндонуклеазы или экзонуклеазы. Неограничивающие примеры подходящих нуклеазных (расщепляющих) доменов, которые могут быть слиты с связывающими ДНК для тау доменами, описанными здесь, включают домены из любого рестрикционного фермента, например, рестрикционного фермента IIS типа (например, FokI). В некоторых вариантах осуществления расщепляющие домены представляют собой половинные домены (полудомены) для расщепления, которые требуют димеризации для расщепляющей активности. Смотрите, например, патенты США с №8586526, 8409861 и 7888121, полностью включенные сюда посредством ссылки. Как правило, два слитых белка необходимы для расщепления, если слитые белки включают половинный домен для расщепления. Альтернативно, можно использовать один белок, включающий два половинных домена для расщепления. Два половинных домена для расщепления могут быть получены из одной и той же эндонуклеазы (или ее функциональных фрагментов), или каждый половинный домен для расщепления может быть получен из разных эндонуклеаз (или ее функциональных фрагментов). Кроме того, сайты-мишени для двух слитых белков предпочтительно расположены по отношению друг к другу так, что связывание двух слитых белков с их соответствующими сайтами-мишенями помещает половинные домены в такую пространственную ориентацию друг к другу, которая позволяет половинным доменам для расщепления образовывать функциональный расщепляющий домен, например, в результате димеризации.
Нуклеазный домен также может быть получен из любой мегануклеазы (хоминг-эндонуклеазы), также может быть использован домен с расщепляющей активностью от описанных здесь нуклеаз, в том числе, но без ограничения ими, I-SceI, I-CeuI, PI-PspI, PI-Sce, I-SceIV, I-CsmI, I-PanI, I-SceII, I-PpoI, I-SceIII, I-CreI, I-TevI, I-TevII и I-TevIII.
В некоторых вариантах осуществления нуклеаза включает компактную TALE-нуклеазу (cTALEN). Это одноцепочечные слитые белки, связывающие ДНК-связывающий домен TALE с нуклеазным доменом TevI. Слитый белок может или действовать как никаза, ограниченная областью TALE, или создавать двухцепочечный разрыв, в зависимости от того, где расположен ДНК-связывающий домен TALE относительно нуклеазного домена мегануклеазы (например, TevI) (смотрите Beurdeley et al., (2013) Nat Comm: 1-8 DOI: 10.1038/ncomms2782).
В других вариантах осуществления TALE-нуклеаза представляет собой мега-TAL. Эти мега-TAL-нуклеазы представляют собой слитые белки, включающие ДНК-связывающий домен TALE и мегануклеазный расщепляющий домен. Расщепляющий домен мегануклеазы активен в виде мономера и не требует димеризации для активности. (Смотрите Boissel et al., (2013) Nucl Acid Res: 1-13, doi: 10.1093/nar/gkt1224).
Кроме того, нуклеазный домен мегануклеазы также может проявлять ДНК-связывающую функциональность. Любые TALEN могут использоваться в сочетании с дополнительными TALEN (например, одной или более TALEN (cTALEN или FokI-TALEN) с одной или более мега-TAL и/или ZFN.
Кроме того, расщепляющие домены могут включать одно или более изменений по сравнению с диким типом, например, для образования облигатных гетеродимеров, которые уменьшают или устраняют эффекты расщепления вне мишени. Смотрите, например, патенты США №7914796, 8034598 и 8623618, полностью включенные сюда посредством ссылки.
Описанные здесь нуклеазы могут создавать двухцепочечные или одноцепочечные разрывы в двухцепочечной мишени (например, гене). Создание одноцепочечных разрывов («ников») описано, например, в патентах США с №8703489 и 9200266, включенных сюда посредством ссылки, в которых описано, как мутация каталитического домена одного из нуклеазных доменов приводит к появлению никазы.
Таким образом, нуклеазный (расщепляющий) домен или половинный домен для расщепления может представлять собой любую часть белка, которая сохраняет расщепляющую активность или которая сохраняет способность к мультимеризации (например, димеризации) с образованием функционального расщепляющего домена.
Альтернативно, нуклеазы могут быть собраны in vivo в сайте-мишени нуклеиновой кислоты с использованием так называемой технологии «сплит-ферментов» (разделенных ферментов) (смотрите, например, публикацию заявки на патент США №2009/0068164). Компоненты таких сплит-ферментов могут быть экспрессированы либо на отдельных экспрессионных конструкциях, либо могут быть связаны в одну открытую рамку считывания, в которой отдельные компоненты разделены, например, саморасщепляющимся пептидом 2А или последовательностью IRES. Компоненты могут быть отдельными связывающими доменами «цинковые пальцы» или доменами связывающего нуклеиновую кислоту домена мегануклеазы.
Нуклеазы могут быть подвергнуты скринингу на активность перед использованием, например, в хромосомной системе на основе дрожжей, как описано в публикации заявки на патент США №2009/0111119. Экспрессирующие нуклеазы конструкции могут быть легко созданы с использованием методов, известных в данной области техники.
Экспрессия слитых белков (или их компонентов) может контролироваться конститутивным промотором или индуцибельным промотором, например промотором галактокиназы, который активируется (дерепрессируется) в присутствии рафинозы и/или галактозы, и подавляется в присутствии глюкозы. Неограничивающие примеры предпочтительных промоторов включают специфические для нервных клеток промоторы NSE, Synapsin, CAMKiia и MECP. Неограничивающие примеры повсеместных промоторов включают CAS и Ubc. Дальнейшие варианты осуществления включают использование саморегулирующихся промоторов (посредством включения сайтов связывания с высоким сродством для связывающего ДНК для тау домена), как описано в публикации заявки на патент США №2015/0267205).
Доставка
Белки и/или полинуклеотиды (например, модуляторы тау) и композиции, содержащие описанные здесь белки и/или полинуклеотиды, могут доставляться в клетку-мишень любым подходящим способом, включая, например, инъекцию белков, с использованием мРНК и/или экспрессионной конструкции (например, плазмиды, лентивирусного вектора, AAV вектора, Ad вектора и т.д.). В предпочтительных вариантах осуществления репрессор доставляется с использованием AAV вектора, включая, но без ограничения этим, AAV9 (смотрите патент США с №7198951), AAV вектор, описанный в патенте США с №9585971, и/или вектор AAV, описанный в предварительной заявке на патент США с №62/503121.
Способы доставки белков, включающих белки с цинковыми пальцами, описанные здесь, описаны, например, в патентах США с №6452442; 6503717; 6534261; 6599692; 6607882; 6689558; 6824978; 6933113; 6979539; 7013219; и 7163824, раскрытие всех из которых включено сюда посредством ссылки во всей их полноте.
Могут использоваться любые векторные системы, включая, но без ограничения этим, плазмидные векторы, ретровирусные векторы, лентивирусные векторы, аденовирусные векторы, поксвирусные векторы; векторы на основе вируса герпеса и аденоассоциированного вируса и т.д. Смотрите также патенты США с №8586526; 6534261; 6607882; 6824978; 6933113; 6979539; 7013219 и 7163824, полностью включенные сюда посредством ссылки. Кроме того, будет очевидно, что любой из этих векторов может включать одну или более последовательностей, кодирующих ДНК-связывающий белок. Таким образом, когда в клетку вводится один или более модуляторов (например, репрессоров) тау, последовательности, кодирующие белковые компоненты и/или полинуклеотидные компоненты, могут переноситься в одном и том же векторе или в разных векторах. Когда используется множество векторов, каждый вектор может включать последовательность, кодирующую один или более модуляторов (например, репрессоров) тау или их компоненты. В предпочтительных вариантах осуществления векторной системой является AAV вектор, например, AAV9 или вариант AAV, описанный в патенте США с №9585971 и/или предварительной заявке на патент США с №62/503121.
Обычные способы переноса генов на вирусной и невирусной основе могут использоваться для введения нуклеиновых кислот, кодирующих сконструированные модуляторы тау, в клетки (например, клетки млекопитающих) и ткани-мишени. Такие способы также могут использоваться для введения нуклеиновых кислот, кодирующих такие репрессоры (или их компоненты) в клетки in vitro. В некоторых вариантах осуществления нуклеиновые кислоты, кодирующие репрессоры, вводят для применения в генной терапии in vivo или ex vivo. Системы доставки на основе невирусного вектора включают ДНК-плазмиды, «голую» нуклеиновую кислоту и нуклеиновую кислоту в комплексе со средством доставки, таким как липосома или полоксамер. Системы доставки на основе вирусных векторов включают содержащие ДНК и РНК вирусы, которые имеют или эписомный, или интегрированный геном после доставки в клетку. Ради обзора процедур генной терапии смотрите Anderson, Science 256:808-813 (1992); Nabel & Felgner, TIBTECH 11:211-217 (1993); Mitani & Caskey, TIBTECH 11:162-166 (1993); Dillon, TIBTECH 11:167-175 (1993); Miller, Nature 357:455-460 (1992); Van Brunt, Biotechnology 6(10):1149-1154 (1988); Vigne, Restorative Neurology and Neuroscience 8:35-36 (1995); Kremer & Perricaudet, British Medical Bulletin 51(1):31-44 (1995); Haddada et al., in Current Topics in Microbiology and Immunology Doerfler and Böhm (eds.) (1995); и Yu et al., Gene Therapy 1:13-26 (1994).
Способы невирусной доставки нуклеиновых кислот включают электропорацию, липофекцию, микроинъекцию, баллистическую трансформацию, виросомы, липосомы, иммунолипосомы, поликатион или конъюгаты липид:нуклеиновая кислота, голую ДНК, голую РНК, искусственные вирионы и усиленное агентами поглощение ДНК. Сонопорация с использованием, например, системы Sonitron 2000 (Rich-Mar) также может использоваться для доставки нуклеиновых кислот. В предпочтительном варианте осуществления одна или более нуклеиновых кислот доставляются в виде мРНК. Также предпочтительным является использование кэппированных мРНК для повышения эффективности трансляции и/или стабильности мРНК. Особенно предпочтительными являются кэп-группировки ARCA (anti-reverse cap analog) или их варианты. Смотрите патенты США с №7074596 и 8153773, включенные сюда посредством ссылки.
Дополнительные, приводимые в качестве примера системы доставки нуклеиновых кислот включают системы, предоставляемые Amaxa Biosystems (Cologne, Германия), Maxcyte, Inc. (Rockville, Maryland), BTX Molecular Delivery Systems (Holliston, MA) и Copernicus Therapeutics Inc (смотрите, например, патент США с №6008336). Липофекция описана, например, в патентах США с №5049386; 4946787; и 4897355), а реагенты для липофекции доступны коммерчески (например, Transfectam™ и Lipofectin™ и Lipofectamine™ RNAiMAX). Катионные и нейтральные липиды, которые подходят для эффективной липофекции полинуклеотидов через распознавание рецепторов, включают липиды Felgner, публикация международной заявки на патент с № WO 91/17424 и WO 91/16024. Доставка может осуществляться в клетки (введение ex vivo) или в ткани-мишени (введение in vivo).
Приготовление комплексов липид:нуклеиновая кислота, включая целенаправленные липосомы, такие как иммунолипидные комплексы, хорошо известно специалистам в данной области техники (смотрите, например, Crystal, Science 270:404-410 (1995); Blaese et al., Cancer Gene Ther. 2:291-297 (1995); Behr et al., Bioconjugate Chem. 5:382-389 (1994); Remy et al., Bioconjugate Chem. 5:647-654 (1994); Gao. et al., Gene Therapy 2:710-722 (1995); Ahmad et al., Cancer Res. 52:4817-4820 (1992); патенты США с №4186183; 4217344; 4235871; 4261975; 4485054; 4501728; 4774085; 4837028 и 4946787).
Дополнительные способы доставки включают использование упаковки доставляемых нуклеиновых кислот в средства доставки EnGeneIC (EDV). Эти EDV специфически доставляются в ткани-мишени с использованием биспецифических антител, причем одно плечо антитела обладает специфичностью для ткани-мишени, а другое специфично для EDV. Антитело переносит EDV на поверхность клетки-мишени, а затем EDV вводится в клетку путем эндоцитоза. Попадая в клетку, содержимое высвобождается (смотрите MacDiarmid et al., (2009) Nature Biotechnology 27 (7):643).
При применении систем на основе РНК- или ДНК-содержащих вирусов для доставки нуклеиновых кислот, кодирующих сконструированные ZFP, TALE или системы CRISPR/Cas, используются преимущества весьма сформировавшихся в процессе эволюции процессов для нацеливания вируса на конкретные клетки в организме и передачи полезного груза в ядро. Вирусные векторы можно вводить непосредственно пациентам (in vivo), или их можно использовать для обработки клеток in vitro, и модифицированные клетки вводятся пациентам (ex vivo). Обычные основанные на вирусах системы для доставки ZFP, TALE или систем CRISPR/Cas включают, но без ограничения ими, ретровирусные, лентивирусные, аденовирусные векторы, векторы на основе аденоассоциированных вирусов, вируса коровьей оспы и вируса простого герпеса для переноса генов. При использовании способов переноса генов ретровирусом, лентивирусом и аденоассоциированным вирусом возможна интеграция в геном хозяина, что часто приводит к длительной экспрессии вставленного трансгена. Кроме того, высокие эффективности трансдукции наблюдались во многих различных типах клеток и тканях-мишенях.
Тропизм ретровируса может быть изменен путем включения чужеродных белков оболочки, расширяя потенциальную целевую популяцию клеток-мишеней. Лентивирусные векторы представляют собой ретровирусные векторы, которые способны трансдуцировать или инфицировать неделящиеся клетки и, как правило, дают высокие титры вирусов. Выбор ретровирусной системы для переноса генов зависит от ткани-мишени. Ретровирусные векторы состоят из цис-действиющих длинных концевых повторов с пакующей емкостью до 6-10 т.п.н. чужеродной последовательности. Минимальные цис-действующие LTR достаточны для репликации и упаковки векторов, которые затем используются для интеграции терапевтического гена в клетку-мишень для обеспечения постоянной экспрессии трансгена. Широко используемые ретровирусные векторы включают векторы, основанные на вирусе лейкоза мышей (MuLV), вирусе лейкоза гиббонов (GaLV), вирусе иммунодефицита обезьян (SIV), вирусе иммунодефицита человека (ВИЧ) и их комбинациях (смотрите, например, Buchscher et al., J. Virol. 66:2731-2739 (1992); Johann et al., J. Virol. 66:1635-1640 (1992); Sommerfelt et al., Virol. 176:58-59 (1990); Wilson et al., J. Virol. 63:2374-2378 (1989); Miller et al., J. Virol. 65:2220-2224 (1991); публикацию международной заявки на патент с № WO 1994/026877).
В применениях, в которых предпочтительна транзиторная экспрессия, могут использоваться системы на основе аденовируса. Векторы на основе аденовируса способны к очень высокой эффективности трансдукции во многих типах клеток и не требуют деления клеток. При использовании таких векторов были получены высокий титр и высокий уровень экспрессии. Этот вектор может быть продуцирован в больших количествах в относительно простой системе. Векторы на основе аденоассоциированного вируса («AAV») также используются для трансдукции клеток целевыми нуклеиновыми кислотами, например, при получении нуклеиновых кислот и пептидов in vitro и в случае процедур генной терапии in vivo и ex vivo (смотрите, например, West et al., Virology 160:38-47 (1987); патент США с №4797368; публикацию международной заявки на патент с № WO 93/24641; Kotin Human Human Therapy 5:793-801 (1994); Muzyczka, J. Clin. Invest. 94:1351 (1994). Конструирование рекомбинантных AAV векторов описано в ряде публикаций, в том числе в патенте США с №5173414; Tratschin et al., Mol. Cell. Biol. 5:3251-3260 (1985); Tratschin et al., Mol. Cell. Biol. 4:2072-2081 (1984); Hermonat & Muzyczka, PNAS 81:6466-6470 (1984); и Samulski et al., J. Virol. 63:03822-3828 (1989).
В настоящее время доступны по крайней мере шесть подходов на основе вирусных векторов для переноса генов в клинических испытаниях, в которых используются подходы, которые включают комплементацию дефектных векторов генами, вставленными в линии клеток-хелперов, для создания агента для трансдукции.
PLASN и MFG-S являются примерами ретровирусных векторов, которые использовались в клинических испытаниях (Dunbar et al., Blood 85:3048-305 (1995); Kohn et al., Nat. Med. 1:1017-102 (1995); Malech et al., PNAS 94:22 12133-12138 (1997)). PA317/pLASN был первым терапевтическим вектором, использованным при испытании генной терапии. (Blaese et al., Science 270:475-480 (1995)). Эффективность трансдукции, составляющая 50% или более, наблюдалась для упакованных MFG-S векторов. (Ellem et al., Immunol Immunother. 44 (1):10-20 (1997); Dranoff et al., Hum. Gene Ther. 1:111-2 (1997)).
Рекомбинантные векторы на основе аденоассоциированных вирусов (rAAV) представляют собой многообещающие альтернативные системы доставки генов, основанные на дефектном и непатогенном аденоассоциированном вирусе типа 2 семейства Parvoviridae. Все векторы получают из плазмиды, в которой сохраняются только инвертированные концевые повторы длиной 145 п.н. AAV, фланкирующие кассету для экспрессии трансгенов. Эффективный перенос генов и стабильная доставка трансгенов благодаря интеграции в геномы трансдуцированной клетки являются ключевыми характеристиками этой векторной системы. (Wagner et al., Lancet 351:9117 1702-3 (1998), Kearns et al., Gene Ther. 9:748-55 (1996)). Другие серотипы AAV, включая AAV1, AAV3, AAV4, AAV5, AAV6, AAV8, AAV 8.2, AAV9 и AAV rh10 и псевдотипированный AAV, такой как AAV2/8, AAV2/5, AAV2/9 и AAV2/6, также могут использоваться в соответствии с настоящим изобретением. Новые серотипы AAV, способные пересекать гематоэнцефалический барьер, также могут использоваться в соответствии с настоящим изобретением (смотрите, например, патент США с №9585971). В предпочтительных вариантах осуществления используется вектор на основе AAV9 (включая варианты и псевдотипы AAV9).
Рекомбинантные аденовирусные векторы (Ad), дефектные по репликации, могут быть получены с высоким титром и легко инфицировать ряд различных типов клеток. Большинство аденовирусных векторов сконструированы таким образом, что трансген заменяет гены E1a, E1b и/или E3 Ad; впоследствии дефектный по репликации вектор размножают в клетках человека 293, которые обеспечивают функцию делетированного гена транзиторно. Аденовирусные векторы могут трансдуцировать множество типов тканей in vivo, включая неделящиеся, дифференцированные клетки, такие как клетки, встречающиеся в печени, почке и мышце. Обычные аденовирусные векторы имеют большую емкость. Пример использования аденовирусного вектора в клинических испытаниях включал полинуклеотидную терапию для противоопухолевой иммунизации с помощью внутримышечной инъекции (Sterman et al., Hum. Gene Ther. 7: 1083-9 (1998)). Дополнительные примеры использования аденовирусных векторов для переноса генов в клинических испытаниях включают Rosenecker et al., Infection 24:1 5-10 (1996); Sterman et al., Hum. Gene Ther. 9:7 1083-1089 (1998); Welsh et al., Hum. Gene Ther. 2:205-18 (1995); Alvarez et al., Hum. Gene Ther. 5:597-613 (1997); Topf et al., Gene Ther. 5:507-513 (1998); Sterman et al., Hum. Gene Ther. 7:1083-1089 (1998).
Упаковывающие клетки используются для образования вирусных частиц, способных к инфицированию клетки-хозяина. Такие клетки включают клетки 293, которые упаковывают аденовирус, и клетки ψ2 или клетки PA317, которые упаковывают ретровирус. Вирусные векторы, используемые в генной терапии, обычно получают с помощью линии клеток-продуцентов, которая упаковывает НК-вектор в вирусную частицу. Векторы, как правило, содержат минимальные вирусные последовательности, необходимые для упаковки и последующей интеграции в хозяина (если применимо), при этом другие вирусные последовательности заменяются экспрессионной кассетой, кодирующей белок, который должен быть экспрессирован. Недостающие вирусные функции поставляются транзиторно с помощью упаковывающей линии клеток. Например, AAV векторы, используемые в генной терапии, содержат, как правило, только последовательности инвертированных концевых повторов (ITR) из генома AAV, которые необходимы для упаковки и интеграции в геном хозяина. Вирусная ДНК упаковывается в линии клеток, которая содержит плазмиду-помощника, кодирующую другие гены AAV, а именно rep и cap, но без последовательностей ITR. Линия клеток также может быть инфицирована аденовирусом в качестве помощника. Вирус-помощник способствует репликации AAV вектора и экспрессии генов AAV с плазмиды-помощника. Плазмида-помощник не упаковывается в значительных количествах из-за отсутствия последовательностей ITR. Загрязнение аденовирусом может быть уменьшено, например, путем тепловой обработки, к которой аденовирус является более чувствительным, чем AAV.
Во многих применениях генной терапии желательно, чтобы применяемый в генной терапии вектор доставлялся с высокой степенью специфичности в конкретный тип ткани. Соответственно, вирусный вектор может быть модифицирован для придания специфичности для данного типа клеток путем экспрессии лиганда в виде белка слияния с белком оболочки вируса на внешней поверхности вируса. Выбранный лиганд обладает сродством к рецептору, о котором известно, что он присутствует в представляющем интерес типе клеток. Например, Han et al., Proc. Natl. Acad. Sci. USA 92:9747-9751 (1995), сообщили, что вирус лейкоза мыши Молони может быть модифицирован для экспрессии герегулина человека, слитого с gp70, и рекомбинантный вирус инфицирует некоторые клетки рака молочной железы человека, экспрессирующие рецептор эпидермального фактора роста человека. Этот принцип может быть распространен на другие пары вирус-клетка-мишень, в которых клетка-мишень экспрессирует рецептор, а вирус экспрессирует слитый белок, включающий лиганд для рецептора на поверхности клетки. Например, нитевидный фаг может быть сконструирован для экспонирования фрагментов антител (например, FAB или Fv), обладающим специфическим сродством практически к любому выбранному клеточному рецептору. Хотя приведенное выше описание относится, главным образом, к вирусным векторам, те же принципы могут быть применены к невирусным векторам. Такие векторы могут быть сконструированы так, чтобы они содержали специфические последовательности для поглощения, которые способствуют поглощению конкретными клетками-мишенями.
Применимые в генной терапии векторы могут доставляться in vivo путем введения отдельному пациенту, обычно путем системного введения (например, внутривенной, внутрибрюшинной, внутримышечной, подкожной, интратекальной, интрацистернальной, интрацеребровентрикулярной или интракраниальной инфузии, включая прямую инъекцию в головной мозг, в том числе в любую область головного мозга, такую как гиппокамп, кора головного мозга, полосатое тело и т.д.), или местного применения, как описано ниже. Альтернативно, векторы могут доставляться в клетки ex vivo, такие как клетки, эксплантированные из отдельного пациента (например, лимфоциты, аспираты костного мозга, биопсия тканей) или универсальные гематопоэтические стволовые клетки донора, с последующей реимплантацией клеток пациенту, обычно после отбора клеток, которые включили вектор.
В некоторых вариантах осуществления описанные здесь композиции (например, полинуклеотиды и/или белки) доставляются непосредственно in vivo. Композиции (клетки, полинуклеотиды и/или белки) могут вводиться непосредственно в центральную нервную систему (ЦНС), включая, но без ограничения, прямую инъекцию в головной или спинной мозг. Мишенью может быть одна или более областей головного мозга, включая, но без ограничения этим, гиппокамп, черную субстанцию, базальное ядро Мейнерта (NBM), полосатое тело и/или кору головного мозга. Альтернативно или в дополнение к доставке в ЦНС, композиции могут вводиться системно (например, с помощью внутривенной, внутрибрюшинной, внутрисердечной, внутримышечной, подкожной, интратекальной, интрацистернальной, интрацеребровентрикулярной и/или интракраниальной инфузии). Способы и композиции для доставки описанных здесь композиций непосредственно субъекту (в том числе непосредственно в ЦНС) включают, но без ограничения этим, прямую инъекцию (например, стереотаксическую инъекцию) с помощью игл в сборах. Такие способы описаны, например, в патентах США с №7837668 и 8092429, относящихся к доставке композиций (включая экспрессионные векторы) в головной мозг, и публикации заявки на патент США с №2006/0239966, которые полностью включены сюда посредством ссылки.
Эффективное количество для введения будет меняться от пациента к пациенту и в соответствии со способом введения и местом введения. Соответственно, эффективные количества лучше всего определяются врачом, вводящим композиции, и подходящие дозы могут быть легко определены специалистом со средним уровнем компетентности в данной области техники. После предоставления достаточного времени для интеграции и экспрессии (как правило, например, 4-15 дней), анализ уровней терапевтического полипептида в сыворотке или других тканях и сравнение с начальным уровнем до введения позволит определять, является ли вводимое количество слишком низким, в правильном диапазоне или слишком высоким. Подходящие схемы для начального и последующего введений также являются вариабельными, но они характеризуются начальным введением, за которым следуют последующие введения, если необходимо. Последующие введения могут осуществляться через различные интервалы, начиная от ежедневного до ежегодного и каждые несколько лет.
Для доставки ZFP с использованием векторов на основе аденоассоциированных вирусов (AAV) непосредственно в головной мозг человека можно применять диапазон доз 1×1010-5×1015 (или любое другое значение между ними) векторных геномов на полосатое тело. Как уже отмечалось, дозы могут меняться для других структур головного мозга и для разных протоколов доставки. Способы доставки AAV векторов непосредственно в головной мозг известны в данной области техники. Смотрите, например, патенты США с №9089667; 9050299; 8337458; 8309355; 7182944; 6953575 и 6309344.
Трансфекция клеток ex vivo для диагностики, исследования или генной терапии (например, путем реинфузии трансфицированных клеток в организм хозяина) хорошо известна специалистам в данной области техники. В предпочтительном варианте осуществления клетки выделяют из организма субъекта, трансфицируют по крайней мере одним модулятором (например, репрессором) тау или его компонентом и повторно вводят обратно в организм субъекта (например, пациента). В предпочтительном варианте осуществления одну или более нуклеиновых кислот, кодирующих модулятор (например, репрессор) тау, доставляют с использованием AAV9. В других вариантах осуществления одну или более нуклеиновых кислот, кодирующих модулятор (например, репрессор) тау, доставляют в виде мРНК. Также предпочтительным является использование кэппированных мРНК для повышения эффективности трансляции и/или стабильности мРНК. Особенно предпочтительными являются кэп-группировки ARCA (anti-reverse cap analog) или их варианты. Смотрите патенты США с №7074596 и 8153773, полностью включенные сюда посредством ссылки. Различные типы клеток, подходящие для трансфекции ex vivo, хорошо известны специалистам в данной области техники (смотрите, например, Freshney et al., Culture of Animal Cells, A Manual of Basic Technique (3rd ed. 1994)) и ссылки, приведенные в них, для изучения вопроса, как выделить и культивировать клетки от пациентов).
В одном варианте осуществления стволовые клетки используются в процедурах ex vivo для трансфекции клеток и генной терапии. Преимущество использования стволовых клеток заключается в том, что они могут дифференцироваться в клетки другого типа in vitro или могут быть введены млекопитающему (например, донору клеток), где они будут приживаться в костном мозге. Известны способы дифференцировки клеток CD34+ in vitro в клинически важные типы иммунных клеток с использованием цитокинов, таких как GM-CSF, IFN-γ и TNF-α (смотрите Inaba et al., J. Exp. Med. 176:1693-1702 (1992)).
Стволовые клетки выделяют для трансдукции и дифференцировки с использованием известных способов. Например, стволовые клетки выделяют из клеток костного мозга путем пэннинга клеток костного мозга с использованием антител, которые связывают нежелательные клетки, такие как CD4+ и CD8+ (T-клетки), CD45+ (panB-клетки), GR-1 (гранулоциты) и Iad (дифференцированные антигенпрезентирующие клетки) (смотрите Inaba et al., J. Exp. Med. 176:1693-1702 (1992)).
Стволовые клетки, которые были модифицированы, также могут использоваться в некоторых вариантах осуществления. Например, нервные стволовые клетки, которые были сделаны устойчивыми к апоптозу, могут использоваться в качестве терапевтических композиций, причем стволовые клетки также содержат TF-ZFP настоящего изобретения. Устойчивость к апоптозу может возникнуть, например, в результате нокаута BAX и/или BAK, используя BAX- или BAK-специфические TALEN или ZFN (смотрите патент США с №8599912), в стволовых клетках или в клетках, в которых имеются нарушения в каспазе, снова используя, например, специфические для каспазы-6 ZFN. Эти клетки могут быть трансфицированы ZFP-TF или TALE-TF, которые, как известно, регулируют ген тау.
Векторы (например, ретровирусы, аденовирусы, липосомы и т.д.), содержащие терапевтические нуклеиновые кислоты, кодирующие ZFP, также можно вводить непосредственно в организм для трансдукции клеток in vivo. Альтернативно, можно вводить голую ДНК. Введение осуществляется любым путем, обычно используемым для введения молекулы в максимальный контакт с клетками крови или ткани, включая, но без ограничения, инъекцию, инфузию, местное применение и электропорацию. Подходящие способы введения таких нуклеиновых кислот доступны и хорошо известны специалистам в данной области техники, и, хотя для введения конкретной композиции можно использовать более одного пути, особый путь часто может обеспечить более прямую и более эффективную реакцию, чем другой путь.
Способы введения ДНК в гематопоэтические стволовые клетки раскрыты, например, в патенте США с №5928638. Векторы, применимые для введения трансгенов в гемопоэтические стволовые клетки, например, CD34+ клетки, включают аденовирус типа 35.
Векторы, подходящие для введения трансгенов в иммунные клетки (например, Т-клетки), включают не интегрирующиеся лентивирусные векторы. Смотрите, например, Ory et al., (1996) Proc. Natl. Acad. Sci. USA 93:11382-11388; Dull et al., (1998) J. Virol. 72:8463-8471; Zuffery et al., (1998) J. Virol. 72:9873-9880; Follenzi et al., (2000) Nature Genetics 25:217-222.
Фармацевтически приемлемые носители частично определяются конкретной вводимой композицией, а также конкретным способом, применяемым для введения композиции. Соответственно, существует широкий ряд подходящих составов фармацевтических композиций, доступных, как описано ниже (смотрите, например, Remington's Pharmaceutical Sciences, 17-е издание, 1989).
Как отмечено выше, раскрытые способы и композиции можно использовать в клетках любого типа, включая, но без ограничения этим, прокариотические клетки, клетки грибов, клетки архей, клетки растений, клетки насекомых, клетки животных, клетки позвоночных, клетки млекопитающих и клетки человека. Подходящие линии клеток для экспрессии белка известны специалистам в данной области техники и включают, но без ограничения ими, COS, CHO (например, CHO-S, CHO-K1, CHO-DG44, CHO-DUXB11), VERO, MDCK, WI38, V79, B14AF28-G3, BHK, HaK, NS0, SP2/0-Ag14, HeLa, HEK293 (например, HEK293-F, HEK293-H, HEK293-T), perC6, клетки насекомых, такие как Spodoptera fugiperda (Sf) и клетки грибов, такие как Saccharomyces, Pischia и Schizosaccharomyces. Потомство, варианты и производные этих линий клеток также могут использоваться. В предпочтительном варианте осуществления способы и композиции доставляются непосредственно в клетку головного мозга, например в полосатое тело.
Модели расстройств ЦНС
Исследования расстройств ЦНС могут проводиться на модельных системах на животных, таких как отличные от человека приматы (например, для болезни Паркинсона (Johnston and Fox (2015) Curr Top Behav Neurosci 22: 221-35); бокового амиотрофического склероза (Jackson et al., (2015) J. Med Primatol: 44(2):66-75), болезни Хантингтона (Yang et al., (2008) Nature 453(7197):921-4); болезни Альцгеймера (Park et al., (2015) Int J Mol Sci 16(2):2386-402); эпилептического припадка (Hsiao et al., (2016) E Bio Med 9:257-77), представители собачьих (например, MPS VII (Gurda et al., (2016) Mol Ther 24(2):206-216); болезни Альцгеймера (Schutt et al., (2016) J Alzheimers Dis 52(2):433-49); эпилептического припадка (Varatharajah et al., (2017) Int J Neural Syst 27(1):1650046) и мыши (например, для эпилептического припадка (Kadiyala et al., (2015) Epilepsy Res 109:183-96); болезни Альцгеймера (Li et al., (2015) J Alzheimers Dis Parkin 5(3) doi 10:4172/2161-0460), (обзор Webster et al., (2014) Front Genet 5 art 88, doi:10.3389f/gene.2014.00088). Эти модели могут использоваться даже в случае отсутствия модели на животном, которая полностью повторяет заболевание ЦНС, поскольку они могут применяться для исследования совокупностей определенных симптомов заболевания. Модели могут быть полезны при определении профилей эффективности и безопасности терапевтических способов и композиций (генетических репрессоров), описанных здесь.
Применения
Описанные здесь модуляторы тау (например, репрессоры тау), включающие MAPT-связывающие молекулы (например, ZFP, TALE, системы CRISPR/Cas, Ttago и т.д.), описанные здесь, и нуклеиновые кислоты, кодирующие их, могут использоваться для различных применений. Эти применения включают терапевтические способы, в которых MAPT-связывающую молекулу (в том числе нуклеиновую кислоту, кодирующую ДНК-связывающий белок) вводят субъекту с использованием вирусного (например, AAV) или невирусного вектора и используют для модуляции экспрессии гена-мишени внутри субъекта. Модуляция может быть в форме репрессии, например, подавления экспрессии тау, которая вносит вклад в течение болезни AD. Альтернативно, модуляция может быть в форме активации, когда активация экспрессии или повышенная экспрессия эндогенного клеточного гена может уменьшить болезненное состояние. В еще одних вариантах осуществления модуляция может представлять собой репрессию посредством расщепления (например, одной или более нуклеазами), например, для инактивации гена MAPT. Как отмечено выше, для таких применений MAPT-связывающие молекулы или, что более типично, нуклеиновые кислоты, кодирующие их, составляются с фармацевтически приемлемым носителем в фармацевтическую композицию.
MAPT-связывающие молекулы или векторы, кодирующие их, по отдельности или в сочетании с другими подходящими компонентами (например, липосомами, наночастицами или другими компонентами, известными в данной области техники), могут быть превращены в аэрозольные препараты (т.е. они могут быть «распылены») для введения путем ингаляции. Аэрозольные препараты могут быть помещены в приемлемые газы-вытеснители под давлением, такие как дихлордифторметан, пропан, азот и т.п. Препараты, подходящие для парентерального введения, такого как, например, внутривенным, внутримышечным, внутрикожным и подкожным путями, включают водные и неводные, изотонические стерильные инъекционные растворы, которые могут содержать антиоксиданты, буферы, бактериостатики и растворенные вещества, которые делают препарат изотоническим с кровью предполагаемого реципиента, а также водные и неводные стерильные суспензии, которые могут включать суспендирующие агенты, солюбилизаторы, загустители, стабилизаторы и консерванты. Композиции можно вводить, например, с помощью внутривенной инфузии, перорально, местно, внутрибрюшинно, внутрипузырно, ретроорбитально (RO), интракраниально (например, в любую область головного мозга, включая, но без ограничения этим, гиппокамп и/или кору головного мозга) или интратекально. Композиции соединений могут быть представлены в герметичных контейнерах с единичной дозой или множеством доз, таких как ампулы и флаконы. Инъекционные растворы и суспензии могут быть приготовлены из стерильных порошков, гранул и таблеток ранее описанного типа.
Доза, вводимая пациенту, должна быть достаточной для обеспечения положительного терапевтического ответа у пациента с течением времени. Доза определяется эффективностью и Kd конкретной используемой MAPT-связывающей молекулы, клетки-мишени и состояния пациента, а также весом тела или площадью поверхности пациента, подвергаемого лечению. Размер дозы также определяется наличием, природой и степенью любых неблагоприятных побочных эффектов, которые сопровождают введение конкретного соединения или вектора конкретному пациенту.
Следующие примеры относятся к примерным вариантам осуществления настоящего изобретения, в которых МАРТ-модулятор включает белок с цинковыми пальцами. Понятно, что это сделано только с целью пояснения примером, и что могут использоваться другие модуляторы (например, репрессоры) MAPT, в том числе, но без ограничения, TALE-TF, система CRISPR/Cas, дополнительные ZFP, ZFN, TALEN, дополнительные системы CRISPR/Cas, хоминг-эндонуклеазы (мегануклеазы) со сконструированными ДНК-связывающими доменами. Будет очевидно, что эти модуляторы могут быть легко получены с использованием способов, известных специалисту в данной области техники, для связывания с сайтами-мишенями, как проиллюстрировано ниже. Аналогично, следующие примеры относятся к примерным вариантам осуществления, в которых средством доставки является любой AAV вектор, но будет очевидно, что для доставки репрессоров тау, описанных здесь, можно использовать любой вирусный (Ad, LV и т.д.) или невирусный (плазмиду, мРНК и т.д.) вектор.
ПРИМЕРЫ
Пример 1: Репрессоры MAPT
Скрининг приблизительно 185 белков с цинковыми пальцами, сконструированных по существу, как описано в патенте США с №6534261; публикации заявки на патент США с №2015/0056705; 2011/0082093; 2013/0253040; и 2015/0335708, был выполнен, и ZFP привязаны к их сайтам-мишеням в MAPT. Белки с цинковыми пальцами 52288, 52322, 52364, 52366, 52389, 57880, 57890 и 65888 (смотрите таблицы 1-3 ниже), нацеленные на MAPT мыши, были отобраны для дальнейшего исследования. Мутанты по контактированию с фосфатными остатками, перечисленные для 65888, являются такими, как описано ранее (смотрите, например, заявку на патент США с №15/685580). В таблице 1 представлены распознающие спирали ДНК-связывающего домена этих ZFP и последовательности-мишени этих ZFP. Была также создана совокупность ZFP, которые нацелены на последовательности MAPT-мишени, общие для генов мыши и человека. Они представлены в таблице 2. В таблице 3 представлены исходные (родительские) и производные ZFP-TF, в которых остов ZFP был мутирован в указанных местах для удаления потенциальных неспецифических контактов с фосфатными остатками. ZFP были оценены с помощью стандартного анализа SELEX и продемонстрировали связывание с их сайтами-мишенями.
Таблица 1: Конструкции специфических для MAPT мыши репрессоров
(SEQ ID NO:1)
(SEQ ID NO:8)
(SEQ ID NO:10)
ccGTTGCGCCTGAT
tGATGCCcagctcc
(SEQ ID NO:2)
(SEQ ID NO:12)
(SEQ ID NO:13)
(SEQ ID NO:14)
(SEQ ID NO:15)
gtGGCGGAGACTGA GAGcgcgcgcggcc (SEQ ID NO:3)
(SEQ ID NO:19)
(SEQ ID NO:20)
(SEQ ID NO:8)
(SEQ ID NO:20)
(SEQ ID NO:37)
(SEQ ID NO:25)
(SEQ ID NO:26)
(SEQ ID NO:9)
(SEQ ID NO:26)
(SEQ ID NO:9)
(SEQ ID NO:35)
Таблица 2: Конструкции специфических для MAPT человека/мыши репрессоров
(SEQ ID NO:22)
(SEQ ID NO:13)
(SEQ ID NO:23)
(SEQ ID NO:18)
(SEQ ID NO:19)
(SEQ ID NO:8)
(SEQ ID NO:25)
(SEQ ID NO:26)
(SEQ ID NO:27)
(SEQ ID NO:28)
(SEQ ID NO:29)
(SEQ ID NO:30)
(SEQ ID NO:29)
(SEQ ID NO:47)
(SEQ ID NO:35)
(SEQ ID NO:36)
(SEQ ID NO:25)
(SEQ ID NO:40)
(SEQ ID NO:41)
(SEQ ID NO:42)
(SEQ ID NO:9)
(SEQ ID NO:43)
ZFP, включающие одну или более мутаций в остовных областях, как описано в заявке на патент США № 15/685580, (например, мутации в положении (-5), (-9) и/или положении (-14) относительно ДНК-связывающей спирали, например, R или K в A, L, S, N, E, Y или Q) также были получены (смотрите, например, 65888, 57930, 65918, 65920, 65894, 57947, 65,968, 65887, 65860 и 65976 в таблицах 1-3). Все ZFP, описанные здесь, были функционально связаны с подавляющим доменом KRAB с образованием ZFP-TF, и все подавляли экспрессию MAPT.
Типичные ZFP-TF трансфицировали в клетки Neuro2a мыши или первичные нейроны коры головного мозга мыши. Через 24 часа экстрагировали тотальную РНК, и осуществляли мониторинг экспрессии MAPT и двух контрольных генов (ATP5b, RPL38) с использованием ОТ-кПЦР в режиме реального времени. Как показано на фиг. 1, было обнаружено, что ZFP-TF эффективны в подавлении экспрессии MAPT с разнообразием зависимости доза-ответ и подавляющей MAPT активностью (смотрите фиг. 1B).
Были сконструированы репрессоры тау ZFP-TF, которые включали мутации в остовной области. В таблице 3 представлены типичные репрессоры ZFP-TF (и исходные для них соединения). Результаты с этими оптимизированными ZFP-TF (например, показанные в качестве примера результаты сравнения 65888 с 57880) продемонстрировали резко увеличенную специфичность (более чем в 10 раз) без влияния на активность в первичных нейронах (репрессии тау, смотрите фиг. 1B). Кроме того, два производных исходного 57880, 65887 и 65888, были проверены в клетках Neuro2A на подавляющую активность для областей вне мишени BOD1 и MOSPD1 (смотрите фиг. 1D), при этом репрессия вне мишени белками, включающими мутации по контактированию с фосфатными остатками в остове ZFP, была уменьшена. Смотрите также заявку на патент США c №15/685580.
Таблица 3: Оптимизированные конструкции ZFP-TF
[Исходный]
(SEQ ID NO:37)
(SEQ ID NO:25)
(SEQ ID NO:26)
(SEQ ID NO:9)
(SEQ ID NO:35)
cgGCAGAAGGTGG
GcGGTGGCggcggcg
(SEQ ID NO:44)
(SEQ ID NO:37)
(SEQ ID NO:25)
(SEQ ID NO:26)
(SEQ ID NO:9)
(SEQ ID NO:35)
cgGCAGAAGGTGG GcGGTGGCggcggcg
(SEQ ID NO:44)
(SEQ ID NO:20)
(SEQ ID NO:37)
(SEQ ID NO:25)
(SEQ ID NO:26)
(SEQ ID NO:9)
(SEQ ID NO:35)
tgGTGCTGGAGCT
GGTGGGTggcggaga
(SEQ ID NO:6)
[Исходный]
(SEQ ID NO:27)
(SEQ ID NO:28)
(SEQ ID NO:29)
(SEQ ID NO:30)
(SEQ ID NO:29)
(SEQ ID NO:30)
tgGTGCTGGAGCT
GGTGGGTggcggaga
(SEQ ID NO:6)
(SEQ ID NO:27)
(SEQ ID NO:28)
(SEQ ID NO:29)
(SEQ ID NO:30)
(SEQ ID NO:29)
(SEQ ID NO:47)
gcGGCGGCgGCAG
AAGGTGGGcggtggc (SEQ ID NO:45)
[Исходный]
(SEQ ID NO:25)
(SEQ ID NO:26)
(SEQ ID NO:9)
(SEQ ID NO:35)
(SEQ ID NO:38)
(SEQ ID NO:8)
gcGGCGGCgGCAG
AAGGTGGGcggtggc (SEQ ID NO:45)
(SEQ ID NO:25)
(SEQ ID NO:26)
(SEQ ID NO:9)
(SEQ ID NO:35)
(SEQ ID NO:38)
(SEQ ID NO:8)
ctGGTGGGtGGCGG AGACTGAgagcgcg (SEQ ID NO:5)
[Исходный]
(SEQ ID NO:18)
(SEQ ID NO:19)
(SEQ ID NO:20)
(SEQ ID NO:8)
(SEQ ID NO:25)
(SEQ ID NO:26)
ctGGTGGGtGGCGG
AGACTGAgagcgcg
(SEQ ID NO:5)
(SEQ ID NO:18)
(SEQ ID NO:19)
(SEQ ID NO:20)
(SEQ ID NO:8)
(SEQ ID NO:25)
(SEQ ID NO:26)
(SEQ ID NO:18)
(SEQ ID NO:19)
(SEQ ID NO:20)
(SEQ ID NO:8)
(SEQ ID NO:25)
(SEQ ID NO:26)
ccGTTGCGCCTGAT tGATGCCcagctcc
(SEQ ID NO:2)
[Исходный]
(SEQ ID NO:11)
(SEQ ID NO:13)
(SEQ ID NO:14)
(SEQ ID NO:15)
(SEQ ID NO:16)
(SEQ ID NO:11)
(SEQ ID NO:12)
(SEQ ID NO:13)
(SEQ ID NO:14)
(SEQ ID NO:15)
(SEQ ID NO:16)
Пример 2. Репрессия тау в нейронах мыши
Все репрессоры ZFP клонировали в векторы rAAV2/9 с использованием промотора CMV для управления экспрессией. Вирус продуцировали в клетках HEK293T, очищали с использованием градиента плотности CsCl и титровали с помощью кПЦР в режиме реального времени в соответствии со способами, известными в данной области техники. Очищенный вирус использовали для инфицирования культивируемых первичных нейронов коры головного мозга мыши в дозе 3E5, 1E5, 3E4 и 1E4 вирусных генов (VG)/клетку. Через 7 дней экстрагировали тотальную РНК, и осуществляли мониторинг экспрессии MAPT и двух контрольных генов (ATP5b, EIF4a2) с использованием ОТ-кПЦР в режиме реального времени.
Было установлено, как показано на фиг. 1С, что все AAV векторы, кодирующие ZFP-TF, эффективно подавляют MAPT мыши в широком диапазоне инфицирующих доз, при этом некоторые ZFP снижают экспрессию мишени более чем на 95% в многократных дозах. Напротив, репрессия MAPT не наблюдалась для rAAV2/9 вируса, кодирующего CMA-GFP, проверенного в эквивалентных дозах, или для подвергнутых ложной обработке нейронов (смотрите фиг. 1).
rAAV2/9, кодирующий CMV-52389-KRAB, использовали для инфицирования нейронов коры головного мозга мыши в дозе 3E5, 1E5 и 3E4 VG/клетку. Через 10 дней выделяли общий белок из одного набора повторов; параллельную группу инфицирований использовали для экстракции тотальной РНК. Равные количества общего клеточного лизата исследовали с помощью Вестерн-блоттинга на общий белок тау (анти-тау-5), 52389-KRAB (анти-ZNF10) и GAPDH (анти-GAPDH) (смотрите фиг. 2А). Количественную флуоресценцию определяли с использованием системы LiCOR Odyssey, обнаруживая снижение на 98% белка тау в дозе 3E5 VG/клетку по сравнению с подвергнутыми ложной обработке нейронами (смотрите фиг. 2). Экспрессию MAPT, 52389-KRAB и двух контрольных генов (ATP5b, EIF4a2) контролировали с использованием ОТ-кПЦР в режиме реального времени. Уровни транскрипта MAPT были снижены на 98% в группе 3E5 VG/клетку по сравнению с подвергнутыми ложной обработке нейронами (смотрите фиг. 2).
Таким образом, описанные здесь генетические модуляторы (например, репрессоры), в том числе те, которые связываются с сайтами-мишенями, как показано в таблицах 1 и 2, были функциональными репрессорами, когда их разрабатывали в виде плазмид, в форме мРНК, в Ad векторах и/или в AAV векторах.
Пример 3: Специфичность репрессии MAPT
Общая специфичность ZFP-TF, продемонстрированная в таблицах 1 и 2, была оценена с помощью анализа с использованием микрочипов в клетках Neuro2A мыши. Вкратце, 300 нг мРНК, кодирующей ZFP-TF, трансфицировали в 150000 клеток Neuro2A при биологическом четырехкратном повторении. Через 24 часа тотальную РНК экстрагировали и обрабатывали по протоколу производителя (Affymetrix Genechip MTA1.0). Робастное среднее значение по множеству чипов (RMA) использовали для приведения необработанных сигналов от каждого набора зондов. Анализ проводили с использованием Transcriptome Analysis Console 3.0 (Affymetrix) с опцией «Gene Level Differential Expression Analysis». Образцы, трансфицированные ZFP, сравнивали с образцами, которые были обработаны нерелевантным ZFP-TF (который не связывается с сайтом-мишенью в MAPT). Переходы к изменениям сообщались для транскриптов (наборов зондов) с >2-кратной разницей в среднем сигнале относительно контроля и значением P<0,05 (односторонний дисперсионный анализ (ANOVA), непарный T-критерий для каждого набора зондов).
Как показано на фиг. 3, SBS#52322 подавлял 5 генов в дополнение к MAPT и вызывал увеличение в 3 других генах. SBS#52364 и #52366 подавляли 4 гена в дополнение к MAPT, тогда как SBS#52389 вызывал репрессию только гена MAPT и увеличение экспрессии 1 гена. SBS#57880 уменьшал экспрессию 2 генов в дополнение к MAPT и увеличивал экспрессию 1 гена. SBS#57890 подавлял 4 гена в дополнение к MAPT и увеличивал экспрессию 1 гена. SBS#52288 подавлял 124 гена в дополнение к MAPT и увеличивал экспрессию 25 генов.
Специфичность ZFP-TF также оценивали в первичных фибробластах человека, которые более чувствительны к трансфекции и позволяют оценивать специфичность даже при более высоких эффективных уровнях ZFP-TF. Использовали четыре биологических повтора каждой обработки, состоящей из 300 нг мРНК, кодирующей ZFP-TF, трансфицированной в 150000 фибробластов человека. Через 24 часа тотальную РНК экстрагировали и обрабатывали по протоколу производителя (Affymetrix Human Primeview). Обработка и анализ были такими же, как описано для клеток Neuro2A. Важно отметить, что фибробласты человека не экспрессируют MAPT, поэтому никаких изменений в уровнях MAPT обнаружено не было. Исходя из ранее описанного критерия кратного изменения, SBS#52322 подавлял 58 генов и вызывал увеличение в 53 других генах. SBS#52364 подавлял 43 гена и увеличивал экспрессию 25 генов. SBS#52366 подавлял 63 гена и вызывал увеличение экспрессии 63 других генов. SBS#52389 не подавлял никаких генов и увеличивал экспрессию 13 других генов. SBS#57880 уменьшал экспрессию 7 генов и увеличивал экспрессию 2 генов. SBS#57890 уменьшал экспрессию 1 гена и увеличивал экспрессию 2 генов, тогда как SBS#52288 подавлял 594 гена, увеличивая экспрессию 302 генов (смотрите фиг. 4).
Специфичность ZFP-TF, кроме того, оценивали в первичных нейронах коры головного мозга мыши после доставки ZFP-TF с помощью AAV. Использовали шесть биологических повторов каждой обработки, состоящей из rAAV2/9, кодирующего CMV-ZFP-TF, инфицированного в дозе 1E5 VG/клетку, в 160 тыс. первичных нейронов коры головного мозга мыши. Через 7 дней тотальную РНК экстрагировали и обрабатывали по протоколу производителя (Affymetrix Human Primeview). Обработка и анализ были такими же, как описано для клеток Neuro2A и фибробластов.
На основании ранее описанного критерия кратного изменения SBS#52322 подавлял 80 генов в дополнение к MAPT и вызывал увеличение экспрессии 19 других генов. SBS#52364 подавлял 29 генов в дополнение к MAPT и увеличивал экспрессию 2 генов. SBS#52389 подавлял 1 ген в дополнение к MAPT. SBS#57880 уменьшал экспрессию 60 генов в дополнение к MAPT и увеличивал экспрессию 3 генов. SBS#57890 только подавлял MAPT и увеличивал экспрессию 1 гена (смотрите фиг. 5).
Эксперименты также проводились для изучения влияния на специфичность модификации(й) (описанных здесь в заявке на патент США №15/685 580) потенциальных контактов остова цинкового пальца с фосфатными остатками. Были сравнены два типичных подавляющих тау белка с ZFP (57880 и 65888), которые имеют идентичные спиральные домены (смотрите таблицу 3), но 65888 имеет мутации в остове цинкового пальца для удаления потенциальных контактирующих с фосфатными группами аминокислотных остатков.
Как показано на фиг. 5В, количество генов, экспрессия которых была либо повышена, либо понижена с помощью 57800 (75 и 110 соответственно), было заметно уменьшено (3 с повышенной и 4 с пониженной экспрессией, включая тау) с помощью белка 65888, демонстрируя увеличение специфичности путем модификаций в остовной области.
Пример 4. Промоторы нервных клеток для ограниченной ЦНС экспрессии ZFP-TF
Три промотора нервных клеток оценивали на их способность экспрессировать ZFP-TF в первичных нейронах мыши: фрагмент размером 469 п.н. промотора Synapsin1 человека (SYN1; Kügler et al., (2001) Methods Mol Med 53:139-50), фрагмент размером 375 п.н. промотора альфа-кальций/кальмодулин-зависимой протеинкиназы (CamKII; Dittgen et al., (2004) Proc Natl Acad Sci USA 101 (52):18206-11), и фрагмент размером 229 п.н. промотора метил-CpG-связывающего белка 2 (MeCP2; Adachi et al., (2005) Hum Mol Genet 14 (23): 3709-22). Каждый фрагмент клонировали вместо промотора CMV, использованного в примере 2, и для каждой промоторной конструкции, управляющей 52389-KRAB, связанными пептидной последовательностью 2А, был получен rAAV2/9 для обеспечения коэкспрессии обоих белков (Nagai et al., (2002) Nat Biotechnol 20 (1):87-90 и MD Ryan et al., (1991) J. Gen. Virol. 72 p. 2727).
Очищенный вирус использовали для инфицирования культивируемых первичных нейронов коры головного мозга мыши в дозе 3E5, 1E5, 3E4 и 1E4 вирусных геномов/клетку. Через 7 дней тотальную РНК экстрагировали, и контролировали экспрессию MAPT и двух контрольных генов (ATP5b, EIF4a2) с использованием ОТ-кПЦР в режиме реального времени.
Все промоторы приводили к экспрессии ZFP, при этом как SYN1, так и CamKII достигали уровней транскрипции, сходных с CMV. Напротив, экспрессия с MeCP2 была на уровнях, которые были в приблизительно 10 раз ниже. MAPT также подавлялся в широком диапазоне инфицирующих доз, при этом самый сильный ответ продемонстрировал SYN1, затем CAMKII, затем CMV и, наконец, MeCP2 с самыми низкими уровнями репрессии MAPT. В максимальной дозе, составляющей 3E5 вирусных геномов/клетку, все промоторы были способны подавлять MAPT на >90%, при этом SYN1 продемонстрировал самое сильное снижение MAPT на 99,4% (в ~175 раз ниже) по сравнению с подвергнутыми ложной обработке нейронами (смотрите фиг. 6A).
Очищенный вирус также использовали для инфицирования культивируемых первичных нейронов гиппокампа, и образцы анализировали и обрабатывали, как описано для нейронов коры головного мозга. Все промоторы нервных клеток приводили к экспрессии ZFP и репрессии MAPT с одинаковым ранговым порядком активности, схожей степенью репрессии и профилями зависимости доза-ответ, наблюдаемыми в первичных нейронах коры головного мозга (смотрите фиг. 6B).
В совокупности эти результаты наводят на мысль, что любого из промоторов нервных клеток было бы достаточно для достижения экспрессии ZFP и репрессии MAPT в основных областях, представляющих интерес для связанного с MAPT показания, а именно в гиппокампе и коре головного мозга.
Кроме того, применение сильного промотора нервных клеток (такого как SYN1 или CAMKII) может использоваться для снижения уровня высокоэкспрессируемого транскрипта-мишени, когда соответствующая доставка ZFP-TF является ограничением (например, посредством внутривенной или интратекальной доставки) и/или в случае, когда ZFP-TF с низким сродством может быть выбран для минимизации регуляции гена вне мишени. И наоборот, более слабый промотор нервных клеток (такой как MeCP2) может быть выбран, когда представляющий интерес ген-мишень экспрессируется на умеренных или низких уровнях, когда достаточная доставка в целевые области не ограничена (например, прямая интракраниальная доставка), и/или для минимизации активности вне мишени ZFP-TF с высоким сродством.
Пример 5: Репрессия MAPT человека в нейронах, полученных из iPS
На основе стандартного анализа специфичности SELEX для всех ZFP, описанных здесь, было предсказано, что ZFP, перечисленные в таблицах 2 и 3, будут проявлять толерантность к несовпадениям по одному (в случае SBS#57890 и SBS#52366) или двум (в случай SBS#57880) неконсервативным положениям в последовательности MAPT человека (смотрите фиг. 7A, SEQ ID NO:31, 32 и 48-51, соответственно, слева направо).
Типичные ZFP-TF в таблицах 2 и 3 клонировали в AAV вектор (AAV6, AAV9 AAV2/9 или их варианты) с фрагментом размером 469 п.н. промотора SYN1, описанным в примере 4. Вирус rAAV продуцировали в клетках HEK293T, очищали с использованием градиента плотности CsCl и титровали с помощью кПЦР. Очищенный вирус использовали для инфицирования полученных из iPS человека нейронов в дозе 3E5, 1E5, 3E4 и 1E4 вирусных геномов/клетку (iCell Neurons, Cellular Dynamics International Inc.). Через 18 или 19 дней тотальную РНК экстрагировали, и оценивали экспрессию MAPT человека, ZFP-KRAB, и трех контрольных генов (ATP5b, EIF4a2, GAPDH) с использованием ОТ-кПЦР в режиме реального времени. Экспрессии ZFP на схожих уровнях были установлены для каждого вируса в диапазоне проверенных доз.
Показательные результаты представлены на фиг. 7. В максимальной дозе, составляющей 3E5 вирусных геномов/клетку, 57880-KRAB подавлял MAPT человека на 95%, 52366-KRAB приводил к снижению экспрессии MAPT на 87%, а 57890-KRAB понижал экспрессию MAPT на 45% по сравнению с ложно-инфицированными клетками (смотрите фиг. 7В). Схожие результаты были получены для других факторов транскрипции, описанных здесь, (например, ZFP-TF, как показано в таблицах 1-3). Одним из объяснений сниженной подавляющей MAPT человека активности SBS#57890 по сравнению с поведением, наблюдаемым для MAPT мыши, является его исключительная степень специфичности по всему геному, что согласуется с плохой толерантностью к несоответствиям в его сайте-мишени (смотрите пример 3).
Промоторы CMV, SYN1 и CAMKII оценивали на экспрессию ZFP-TF и репрессию MAPT человека с использованием ZFP-TF 52366. Для каждой промоторной конструкции, управляющей 52366-KRAB, получали rAAV2/9, и использовали его для инфицирования полученных из iPS человека нейронов, как описано. Промотор SYN1 приводил к наибольшим уровням экспрессии ZFP и снижению MAPT (5% от подвергнутых ложной обработке нейронов) по сравнению с CAMKII (40% от ложного контроля) и CMV (71% ложного контроля) (смотрите фиг. 7C).
Нейроны, полученные из iPS человека, также подвергали анализу с использованием микрочипов, как описано выше, для анализа степени репрессии вне мишени в популяции 19959 кодирующих транскриптов. В каждом случае ZFP-TF сравнивали с белком 65976 на основе ранее описанного критерия кратного изменения, и графики показывают изменение профиля для исследуемого ZFP-TF (смотрите фиг. 7D). Результаты показывают, что некоторые из ZFP-TF в качестве репрессоров тау человека являются высокоспецифичными в нейронах человека.
Пример 6: Репрессия MAPT in vivo, управляемая AAV-доставленными ZFP-TF
Различные ZFP-TF, описанные здесь, доставляли с использованием различных AAV векторов в гиппокамп мыши для оценки репрессии MAPT in vivo. AAV, кодирующие репрессоры тау, вводили либо внутривенно (IV), либо интрацеребровентрикулярно (ICV) с 57890.T2A.Venus, либо интракраниально (IC) с помощью стереотаксической инъекции.
Вкратце, в случае AAV 2/9 суммарную дозу, составляющую 8E9 векторных геномов rAAV2/9-CMV-ZFP-TF на полушарие, вводили с помощью стереотаксической инъекции с использованием двойных двусторонних инъекций по 2 мкл. В случае AAV векторов, описанных в патенте США с №9585971, AAV вводили вводили интрацеребровентрикулярно (ICV) или внутривенно (IV) в суммарных дозах, составляющих 1E12. Векторы AAV, описанные в предварительной заявке на патент США с №62/503121, вводили ICV в дозе, составляющей 1E12 векторных геномов/животное, или в дозе 2E12 векторных геномов/животное в случае IV.
Животных умерщвляли через четыре (IV и ICV) или пять недель (IC) после инъекции. У животных, подвергнутых лечению IV и ICV, правое полушарие рассекали на различные области головного мозга для анализа ОТ-кПЦР, а левое полушарие использовалось для гистологии. Для животных, подвергнутых лечению IC, каждый гиппокамп был разделен на три части для анализа ОТ-кПЦР (A, передний; B, середина; C, задний гиппокамп). Экспрессию MAPT и ZFP-TF также анализировали с помощью ОТ-кПЦР в режиме реального времени и приводили к среднему геометрическому значению трех генов домашнего хозяйства (ATP5b, EIF4a2 и GAPDH).
Данные показали, что AAV векторы эффективно трансдуцировали нервные клетки-мишени при интрацеребровентрикулярном или внутривенном введении, и что ZFP-TF приводили к сильному и устойчивому снижению тау во всей ЦНС (головном и спинном мозге, в том числе в лобной коре, передней коре, задней коре, гиппокампе, стволе мозга, полосатом теле, таламусе, среднем мозге, мозжечке, поясничном отделе спинного мозга, грудном отделе спинного мозга и шейном отделе спинного мозга). На фиг. 8A-8C показаны показательные результаты с использованием ZFP-TF SBS#52322, SBS#52389 и SBS#57890 после введения AAV векторов, описанных в 62/503121 («SGMO» на фиг. 8B), по сравнению с AAV9 («9» на фиг. 8В). Микрофотография, представленная на фиг. 8А, была сделана через 4 недели после доставки вектора SGMO, с использованием доз, составляющих 1e11 векторных геномов/мышь в случае ICV доставки и 2e12 векторных геномов/мышь в случае внутривенной доставки. На фиг. 8С представлены изменения уровней мРНК для тау после однократного введения посредством ICV или IV введения доз из того же эксперимента. Такие же результаты были обнаружены для всех дополнительных исследованных ZFP-TF.
Фиг. 8D и 8E представляют показательные результаты с использованием вектора AAV2/9 и продемонстрировали, что в случае интракраниальной доставки в гиппокамп как 52389-KRAB, так и 52322-KRAB были способны эффективно подавлять MAPT (смотрите фиг. 8D). Зону действия оценивали по относительным уровням экспрессии ZFP на трех срезах для каждого полушария. Этот анализ показал, что, хотя многие срезы имели превосходную зону действия, в некоторых была небольшая или нулевая экспрессия ZFP-TF, что свидетельствует о неоднородной зоне действия по всему гиппокампу у нескольких животных после интракраниальной стереотаксической доставки (смотрите фиг. 8E). Схожие результаты были получены с другими ZFP-TF, как здесь описано.
Кроме того, описанные здесь репрессоры тау, доставляемые с использованием AAV вектора, описанного в патенте США с № 9585971, также значительно подавляли тау в ЦНС (в том числе спинном мозге). Показательные результаты представлены на фиг. 8F-8H. Для всех ZFP-TF, описанных здесь, репрессия в ЦНС была быстрой и поддерживалась с течением времени как на уровне белка, так и на уровне мРНК. Кроме того, уровни тау в CSF коррелируют с уровнями в головном мозге и, таким образом, могут использоваться в качестве показателя функции репрессора тау (смотрите показательную фиг. 8H).
В целом, любой описанный здесь репрессор тау, доставляемый с помощью любого AAV вектора любым путем, эффективно модулирует (подавляет) тау в течение длительных периодов.
Для дальнейшего понимания степени индуцированной ZFP-TF репрессии MAPT в гиппокампе использовали три метода анализа. Во-первых, значения экспрессии ZFP-TF и MAPT из всех шести срезов от каждого животного в группе лечения были усреднены и сравнены с группой PBS с помощью дисперсионного анализа (ANOVA) с последующим апостериорным тестом Сидака (Sidak). Очень значимая (P<0,0001) репрессия MAPT наблюдалась как для 52322 (среднее снижение MAPT на 66%), так и для 52389 (среднее снижение MAPT на 55%) (смотрите фиг. 9A).
Во-вторых, срез от каждого животного с наибольшим уровнем экспрессии ZFP-TF был идентифицирован и использован для расчета среднего максимального снижения тау при идеальном сценарии зоны действия. Опять же, очень значимая (P<0,0001) репрессия MAPT наблюдалась для всех протестированных ZFP-TF. Показательные результаты, представленные на фиг. 9B, показывают снижение более чем на 70% с использованием 52322 (среднее снижение MAPT на 73%) и 52389 (среднее снижение MAPT на 89%).
В-третьих, была оценена корреляция между уровнями MAPT и ZFP-TF (представленными здесь как абсолютное значение копий ZFP/нг РНК, введенных в реакцию ОТ-кПЦР). Очень значимая взаимосвязь наблюдалась как для 52322 (P<0,0001, R2=0,53), так и для 52389 (P<0,0001, R2=0,82) (смотрите фиг. 9C и 9D).
Снижение тау в модели таупатии на мыши, трансгенной по мутантному (P301L) тау человека, (rTg4510, Jackson Labs) также оценивают после введения генетических репрессоров, описанных здесь. Кроме того, клиническая и терапевтическая эффективность репрессоров оценивается в этой и других моделях AD на мыши (например, APPswe/PS1d9, Jackson Labs) с целью определения, наблюдается ли снижение биомаркеров и симптомов таупатий, в том числе одного или более из следующих: нейротоксичности, глиоза, дистрофических аксонов, утраты отростков, эксайтотоксичности, истончения коры головного мозга и гиппокампа, накопления тау в аксонах, когнитивной (например, в лабиринте с радиальными рукавами и водном лабиринте Морриса, формирования страха и т.д.) и/или двигательной недостаточности. Смотрите, например, Bryan et al., (2009) Chapter 1: Transgenic Mouse Models of Alzheimer's Disease: Behavioral Testing and Considerations in Methods of Behavior Analysis in Neuroscience. 2nd edition, ed. Buccafusco, Boca Raton (FL): CRC Press/Taylor & Francis. Кроме того, модели химически индуцированных эпилептических припадков, например, у мышей дикого типа, получавших эксайтотоксические соединения, такие как пентилентетразол (PTZ, смотрите, например, Meyers et al., (1975) Epilepsia 16 (2):257-67) или каинат (Ferraro et al.., (1997) Mamm Genome 8: 200-208, также оценивают через 4-8 недель после введения генетических репрессоров, описанных здесь, чтобы определить, оказывает ли снижение тау защитный эффект от приступа, включая летальный исход, связанный с приступом, пролонгированную задержку приступа и/или снижение тяжести приступа.
Модуляторы (например, репрессоры) тау, описанные здесь, доставлялись с использованием невирусных или вирусных (например, AAV) векторов, описанных здесь, непосредственно в головной мозг, например, с помощью интракраниальной инъекции в гиппокамп или кору головного мозга, интрацеребровентрикулярной или внутривенной доставки. После определенного периода времени после введения репрессоров (1-11 месяцев после введения репрессора) головной мозг собирали, рассекали и подвергали иммуногистохимическому анализу и/или анализу изображений (например, 2-фотонной визуализации) для оценки жизнеспособности нервных клеток, глиоза, дистрофических аксонов, плотности позвонков, толщины коры головного мозга и гиппокампа, экспрессия мРНК для тау и уровней белка тау.
Через 8 недель после введения репрессоров ZFP у мышей, получавших репрессоры, наблюдалась репрессия тау (мРНК и белка) на 80-90% или более в нейронах, экспрессирующих ZFP. После длительного (6 месяцев) нокдауна тау не наблюдалось значительной потери нейронов или увеличенного глиоза. Репрессия тау у мышей также защищает от дистрофий аксонов. Таким образом, модуляторы тау (например, репрессоры), описанные здесь, обеспечивают in vivo клинические и терапевтические преимущества для субъектов с таупатиями.
Пример 7. Репрессия MAPT in vivo и снижение белка, вызванные AAV-доставленными ZFP-TF, экспрессируемыми с промоторов нервных клеток.
Рекомбинантные AAV векторы, кодирующие конструкции ZFP-TF 2A-Venus, описанные здесь, управляемые промоторами CMV, SYN1, CAMKII или MeCP2, описанными в примере 5, доставляли в гиппокамп мыши для оценки мРНК для MAPT и снижения белка in vivo. Вкратце, суммарную дозу, составляющую 2,4E10 векторных геномов на полушарие, вводили с помощью стереотаксической инъекции взрослым мышам дикого типа с использованием двойных двусторонних инъекций по 1,5 мкл. Животных умерщвляли через шесть недель после инъекции, и каждый гиппокамп хорошо гомогенизировали лезвием бритвы, и полученную ткань распределяли на два равных количества. Одна половина была взята для анализа мРНК, причем экспрессию MAPT, ZFP-TF, GFAP и IBA1 анализировали с помощью ОТ-кПЦР в режиме реального времени и приведена к среднему геометрическому значению трех генов домашнего хозяйства (ATP5b, EIF4a2 и GAPDH). Другая половина была взята для количественного анализа тау-белка с помощью ELISA, и показательные результаты представлены на фиг. 10. По сравнению с контрольными животными, мРНК для тау была снижена на по крайней мере 85% после введения AAV, кодирующего ZFP-TF. Показательные результаты после введения rAAV9-CMV-52389V были следующими: снижение экспрессии тау на 63% с помощью rAAV9-SYN1-52389V; снижение экспрессии тау на 74% с помощью rAAV9-CAMKII-52389V; и снижение на 83% с помощью конструкции rAAV9-MeCP2-52389V (P<0,0001 для всех промоторов). Было обнаружено, что средняя экспрессия ZFP является самой высокой для вектора, кодирующего промотор CAMKII (установленная на значении 1), самой низкой для промотора MeCP2 (15% от уровней CAMKII) и промежуточной для промоторов CMV (59% от уровней CAMKII) и SYN1 (90% от уровней CAMKII).
Присутствие микроглии и активированных астроцитов также оценивали с использованием реагентов ОТ-кПЦР для IBA1 и GFAP, соответственно. Промотор MeCP2 не приводил к значительным изменениям уровней IBA1 по сравнению с животными, которым вводили PBS, SYN1 приводил к повышению уровней IBA1 в 4,7 раза (P<0,0001), CMV приводил к повышению уровней в 3,0 раза (P<0,05), и CAMKII приводил к повышению уровней в 3,2 раза (P<0,001). Также, промотор MeCP2 не приводил к повышению GFAP по сравнению с животными, которым вводили PBS, SYN1 приводил к повышению уровней GFAP в 4,0 раза (P<0,0001), CMV приводил к повышению уровней в 3,2 раза (P<0,01), а CAMKII приводил к повышению уровней в 2,4 раза (р<0,05).
Устойчивое снижение общего тау-белка также наблюдалось для всех трех конструкций с промоторами нервных клеток (показательные результаты с использованием SBS 52389 представлены на фиг. 11). По сравнению с контрольными уровнями после инъеции PBS (269 нг/мл), конструкция rAAV9-SYN1-52389V давала 23% от контрольных уровней (61 нг/мл, P<0,0001), конструкция rAAV9-CAMKII-52389V давала 18% от контрольных уровней (49 нг/мл, P<0,0001), конструкция rAAV9-SYN1-52389V привела к 12% от контрольных уровней (32 нг/мл, P<0,0001). Схожие или высокие уровни снижения достигаются с другими ZFP-TF, описанными здесь (например, 57890, 65894, 57930, 65918, 65920, 57880, 65887, 65888, 57947, 65968, 52322, 52364, 52366, 52288, 52389 и/или 65860).
Таким образом, промоторы нервных клеток способны вызывать снижение на >80% мРНК для тау и тау-белка по всему гиппокампу мыши.
Пример 8: Гистологическое подтверждение снижения тау по всему гиппокампу и в связанных областях головного мозга
Искусственные факторы транскрипции, описанные здесь, доставляли в гиппокамп мыши для оценки репрессии тау in vivo путем иммунофлуоресцентного окрашивания. Суммарная доза, составляющая 2,4E10 векторных геномов rAAV-CMV-ZFP-TF (rAAV2/9, rAAV6 и т.д.), вводилась с помощью стереотаксической инъекции с использованием двойных односторонних инъекций по 1,5 мкл взрослым мышам дикого типа. ZFP-TF были связаны с флуоресцентным белком Venus для определения места экспрессии TF. Животных умерщвляли через шесть недель после инъекции, и весь головной мозг собирали, и делали его срезы для гистологического окрашивания ядер (DAPI), тау и GFP, используя стандартные методы. Также был проведен анализ сортировки клеток с возбуждением флуоресценции (FACS). Вкратце, для оценки эффективности нокдауна тау в клетках, трансдуцированных AAV ZFP-dVenus, авторы настоящего изобретения подвергали диссоциации гиппокампы, в которые инъецировали AAV CMV ZFP-dVenus, с использованием набора для диссоциации клеток с помощью папаина (Worthington Biochem. Corp.) в соответствии с руководством производителя, а затем проанализировали суспензию клеток с использованием проточной цитометрии (проточного цитометра Miltenyi MACSQuant VYB). Затем клетки, экспрессирующие dVenus или GFP, в тех же образцах разделяли с помощью FACS с использованием зеленого лазера с длиной волны 488 нм (клеточного сортера BioRadS3; 30-50 тыс. GFP-позитивных клеток в каждом образце). После сортировки клетки осаждали путем центрифугирования в течение 10 минут при 1000×g и ресуспендировали в 100 мкл реагента (ThermoFisher) для анализа РНК.
Показательные результаты представлены на фиг. 12 (животным инъецировали rAAV2/9-CMV-ZFP-TF SBS#52389). На фиг. 12А представлен поперечный срез головного мозга мыши через передний гиппокамп и определены четыре области, представленные в рамке и пронумерованные 1-4. Инъекцию осуществляли в левое полушарие (ипсилатеральная сторона), что приводит к увеличению флуоресценции в левой части поперечного среза. Последующие панели представляют собой изображения крупным планом каждой из этих рамок. Рамки описаны ниже:
В рамке 1 (фиг. 12В) показан количественный анализ интенсивности флуоресценции в ретросплениальной коре, причем экспрессия ZFP-TF четко разграничена между ипсилатеральным и контралатеральным полушариями. На левой панели фиг. 12В флуоресцентный сигнал был выше на ипсилатеральной стороне срединной линии («ipsi»), чем на контралатеральной стороне («contra»). Экспрессия ZFP здесь, вероятно, возникает из аксональных отростков гиппокампа. Большая часть сигнала на правой стороне панели была обусловлена окрашиванием ядер DAPI. На среднем изображении представлена общая флуоресценция с использованием меченных антител против тау, причем сигнал на ипсилатеральной (левой) стороне панели был почти весь обусловлен сигналом GFP, в то время как сигнал на противоположной (правой) стороне панели был в основном обусловлен присутствием тау и основным окрашиванием DAPI. На правой панели фиг. 12В показана рамка с поперечным срезом, которая была проанализирована для количественного определения сигнала тау (изображенного на фиг. 12С). На фигуре показана сниженная тау-специфическая флуоресценция с подвергнутой инъекции (подвергнутой лечению) стороны («ipsi» по сравнению с «contra»).
Рамка 2, фиг. 12D (ипсилатеральная) и рамка 3, фигура 12E (контралатеральная) представляют собой изображения гиппокампа, показывающие снижение тау на ипсилатеральной (подвергнутой лечению) стороне по сравнению с контралатеральной стороной, нокдаун тау был особенно отчетливым в зубчатой извилине на контралатеральной сторона по сравнению с ипсилатеральной стороной (обозначенной стрелкой).
Рамка 4 представляет собой область гипоталамуса, в которой имелась очаговая экспрессия ZFP на ипсилатеральной стороне (верхняя панель показывает флуоресценцию GFP, левый овал), а общая флуоресценция тау (нижняя панель) показывает снижение общего сигнала тау на ~50% (смотрите график, демонстрирующий сравнение между ипсилатеральной стороной и контралатеральной стороной). Схожие результаты получают с использованием конструкций на основе AAV, включающих ZFP-TF, как описано в таблицах 1, 2 и 3.
Таким образом, описанные здесь ZFP-TF подавляют экспрессию тау in vivo.
Пример 9. Безопасность in vivo, снижение тау и устойчивая экспрессия ZFP-TF в гиппокампе мыши.
Для оценки безопасности как кратковременной, так и длительной экспрессии в гиппокампе описанных здесь, нацеленных на тау искусственных факторов транскрипции, описанные здесь ZFP-TF доставляли in vivo в гиппокамп мыши для мониторинга экспрессии ZFP, а также реакции астроцитов и микроглии и макроскопической анатомии гиппокампа. В одном эксперименте суммарную дозу, составляющую 2,4E10 векторных геномов rAAV2/9-CMV-52389-2A-Venus («389dV»), rAAV2/9-CMV-ZFP-TF («389»), rAAV2/9-CMV GFP («GFP») или PBS («PBS»), вводили с помощью стереотаксической инъекции с использованием двойных односторонних инъекции по 1,5 мкл взрослым мышам дикого типа. Две группы были умерщвлены либо через шесть недель, либо через шесть месяцев после инъекции, и весь головной мозг собирали, и делали его срезы для гистологического окрашивания ядер (DAPI), GFP, GFAP (для обнаружения активированных астроцитов) и IBA1 (для обнаружения микроглии), используя стандартные методы, и результаты представлены на фиг. 13. На фиг. 13H представлены изображения, отображающие флуоресценцию двух областей гиппокампа, демонстрируя, что после инъекций тау был подавлен как в передней, так и в задней областях гиппокампа.
Для момента времени, составляющего 6 недель, (фиг. 13А), отображающего сигнал для трансдуцированных клеток в гиппокампе, сигнал для ZFP-TF почти такой же, как для вектора, кодирующего GFP. На фиг. 13B показаны результаты для астроцитов, а также показаны почти такие же результаты для трех видов лечения, которые также наблюдались в микроглии гиппокампа (фиг. 13С).
Для момента времени, составляющего 6 недель, данные на фиг. 13D демонстрируют очень схожие уровни флуоресценции для векторов, кодирующих GFP и ZFP-TF, как видно в составляющий 6 недель момент времени, предполагая, что не было большого изменения количества трансдуцированных клеток в гиппокампе с течением времени. Фиг. 13E также показывает, что сигнал между различными лечения был очень схожим и не претерпевал значительных изменений между 6-недельным и 6-месячным моментами времени (фиг. 13B по сравнению с 13E - обратите внимание на разницу по оси Y между двумя фигурами). Микроглия в составляющий 6 месяцев момент времени после лечения AAV векторами является практически одинаковой, с небольшим уменьшением в образцах, подвергнутых лечению PBS.
Измерение средней толщины СА1 (одной из областей гиппокампа) не показало значительных изменений после 6 месяцев экспрессии ZFP (фиг. 13G), демонстрируя отсутствие явной нейротоксичности от длительной экспрессии ZFP.
Был проведен дополнительный анализ, в котором ZFP-TF вводили, как указано выше, за исключением того, что сравнивали только PBS и конструкции 52288, 52364 и 52389, связанные с 2a-Venus. Введение доз было таким же, как описано в примере 6. После введения доз животных умерщвляли через 4 недели, и данные представлены на фиг. 13I. Представленные данные показывают, что лечение конструкцией 52288 приводило к существенно аттенуированным векторным геномам и ослаблению экспрессии ZFP по сравнению с другими конструкциями и не подавляло экспрессию тау каким-либо существенным образом. Однако это приводило к повышению уровня GFAP и IBA1. ZFP 52364 давала более высокие уровни векторного генома и экспрессии ZFP, чем конструкция 52288, но приводила к высоким в равной степени уровням GFAP и IBA1 и не значительно подавлял экспрессию тау. Напротив, конструкция 52389 была способна вызывать значительное снижение экспрессии тау, не влияя на экспрессию GFAP или IBA1.
Отсутствие снижения тау in vivo и повышение нейровоспалительных биомаркеров для ZFP 52288 и 52364 коррелируют с профилями специфичности ZFP, оцененными в клетках Neuro2A, фибробластах человека и первичных нейронах (фиг. 3, 4, 5), показывая, что высокоспецифичные ZFP значительно снижали экспрессию тау и были допустимы in vivo.
Исследование части групп дозирования, получавших PBS или 52389-2a-Venus, было продлено на 11 месяцев. В дополнение к анализу степени репрессии тау, образцы также анализировали на уровни экспрессии мРНК от количества экспрессированного ZFP и любые изменения количества транскриптов, кодирующих GFAP, IBA1, NeuN, MAP1A, MAP1B и MAP2. Вкратце, каждый гиппокамп хорошо гомогенизировали лезвием бритвы, и полученную ткань распределяли на два равных количества. Одна половина была взята для анализа мРНК, причем экспрессию MAPT, ZFP-TF, GFAP и IBA1 анализировали с помощью ОТ-кПЦР в режиме реального времени и приводили к среднему геометрическому значению трех генов домашнего хозяйства (ATP5b, EIF4a2 и GAPDH). Показательные результаты представлены на фиг. 13J, которая также включает полученные в составляющий 6-недель момент времени данные для сравнения. Данные демонстрируют, что в целом не было большого изменения большинства проанализированных наборов данных между 6-недельными и 11-месячными временными рамками. Однако было обнаружено снижение количества детектируемой экспрессии ZFP. Никаких значительных компенсирующих изменений не наблюдалось для трех других ассоциированных с микротрубочками белков (MAP1A, MAP1B и MAP2), а также не наблюдалось какого-либо снижения уровней NeuN, что согласуется с сохранением объема гиппокампа в подвергнутых воздействию ZFP полушариях, оцененных через шесть месяцев после доставки ZFP. Дополнительные эксперименты были выполнены с использованием ZFP-TF, как описано здесь, и дали схожие результаты.
Таким образом, результаты демонстрируют, что после однократного введения экспрессия ZFP сохраняется со временем in vivo и не приводит к токсичности для ЦНС субъекта, и что опосредованное ZFP снижение тау в гиппокампе взрослых мышей является устойчивым и хорошо переносилось в течение по крайней мере 11 месяцев.
Используя мышей C57BL/6 дикого типа (самок 8-недельного возраста), было проведено другое исследование, в котором ZFP-TF доставляли с использованием AAV, описанных здесь, посредством ретроорбитальной доставки. Использовали 2,5e12 вирусных геномов (vg) на животное, и животных умерщвляли через десять недель. Анализ с использованием микрочипов был выполнен на ткани гиппокампа от подвергнутых лечению мышей, причем представленные данные сравниваются с нерелевантным ZFP-TF, доставленным таким же способом. На фиг. 17 показано, что тау был специфически подавлен белками 57890V и 52389V по сравнению с лечением кодирующим GFP AAV. Эти данные демонстрируют, что специфичность этих белков, наблюдаемая in vitro, также выявляется in vivo.
Пример 10. Снижение тау в модели AD на мыши.
Исследования проводили на модели AD на мыши в дополнение к тем, которые были выполнены выше на мышах дикого типа. Мышей APP/PS1 (обзор в Li et al., там же) лечили ZFP-TF, как здесь описано, для анализа эффективности в этой модели.
Вкратце, в одном эксперименте 4 мыши APP/PS1 и 2 контрольных дикого типа были подвергнуты лечению в возрасте 4,5 месяцев. Осуществляли однократные инъекции, вводя 3 мкл композиции AAV в противоположные корковые слои (CTX) головного мозга. Левый CTX каждой мыши получил 3 мкл AAV9, включающего ZFP-TF, связанный с GFP, под управлением промотора Synapsin1, (или нерелевантный ZFP-TF в качестве контроля («172»; AAV9 syn1-172v)) или 52389 ZFP-TF («389»; AAV9 syn1-389v). Правый CTX каждой мыши получил 3 мкл AAV9, включающего конструкцию для экспрессии RFP, под управлением промотора Synapsin1 («AAV9 syn1-tRFP»).
Через одиннадцать (11) недель после лечения мышей 7-месячного возраста перфузировали 4% PFA/PBS. Затем весь головной мозг удаляли и после фиксировали в течение 2 дней с использованием 4% PFA/PBS при 4°C. Затем ткань подвергали криопротекции в 30% растворе сахарозы/PBS. Коронарные срезы толщиной 50 мкм анализировали на иммунофлуоресцентное мечение для tRFP, GFP и бета-амилоид («Aβ»). Анализировали 3 среза головного мозга на каждую мышь, и получали 3-5 изображений каждого среза. Дистрофические аксоны подсчитывали в богатых Aβ бляшках так, чтобы от 121 до 256 бляшек было проанализировано на каждое животное. 708 бляшек было подсчитано для CTX, подвергнутого воздействию AAV9 syn1-389v, и 287 бляшек было подсчитано для CTX, подвергнутого воздействию AAV9 syn1-tRFP. Показательные данные представлены на фиг. 14A-D, и они показывают статистически значимое различие в количестве дистрофических аксонов на количество Aβ бляшек в корковых слоях, подвергнутых лечению ZFP-TF52389, по сравнению с корковыми слоями, подвергнутыми лечению tRFP (фиг. 15 и 16). Напротив, не было различий в дистрофиях на бляшку у животных, получавших нерелевантный ZFP-TF. Кроме того, количество и объем бляшек не изменялись как у подвергнутых лечению, так и не подвергнутых лечению животных. Дальнейшие эксперименты, выполненные с использованием других AAV векторов, способов введения и/или ZFP-TF, описанных здесь, дали схожие результаты.
Таким образом, описанные здесь генетические репрессоры тау обеспечивают клиническое и терапевтическое преимущество для таких таупатий, как AD, как показали исследования на известных моделях AD на мыши.
Пример 11. Снижение тау in vivo в головном мозге приматов.
Тау-специфические ZFP-TF приматов исследуют на яванских макаках (M.ascicularis) для наблюдения за репрессией экспрессии тау у приматов (модели на не являющемся человеком примате (NHP)). Яванские макаки помещаются в клетки из нержавеющей стали, снабженные сетчатым полом из нержавеющей стали и автоматической поилкой. Исследование соответствует всем применимым разделам положений Заключительных правил Закона о защите животных (Свод федеральных правил, раздел 9).
Начальные эксперименты проводятся с целью определения того, может ли гиппокамп обезьян быть соответственно нацеленным. Контрольный продукт (рецептурный буфер, PBS и 0,001% Pluronic F 68, pH 7,1) и исследуемый продукт размораживают и распределяют в день 1 исследований, при этом исследуемый и контрольный продукты вводят с помощью МРТ-контролируемой доставки AAV9-GFP или AAV9-ZFP-TF в гиппокамп.
В первом эксперименте AAV9, включающий управляемый hSYN1 ген GFP, доставляется в дозе=3,84е11 векторных геномов/полушарие в левое полушарие и 7,68е11 векторных геномов/полушарие в правое полушарие. Одно животное получает однократную дозу исследуемого продукта в объеме = 40 мкл в левое полушарие и однократную дозу = 80 мкл в правое полушарие. Второе животное получает две дозы по 20 мкл в левое полушарие и две дозы по 40 мкл в правое полушарие. Для обоих исследуемых продуктов концентрация дозы составляет 9,6е12 векторных геномов/мл. Через 14 дней животных умерщвляют, и головной мозг разделяют пополам и делят примерно на 17 срезов (3 мм каждый). Срезы, включающие области гиппокампа/энторинальной коры, используют для анализа собственной флуоресценции GFP и иммуногистохимического анализа GFP. Другие срезы используются для сбора тканевых штампов для анализа мРНК с помощью ОТ-кПЦР, причем анализируются уровни экспрессии генов тау и домашнего хозяйства. Кроме того, некоторые штампы собираются и сохраняются для предварительного анализа белка тау. Результаты показывают, что промотор hSYN1 способен управлять экспрессией GFP, которая обнаруживается в области гиппокампа после доставки.
Второй эксперимент проводят для оценки влияния пути введения на экспрессию GFP и местоположение в головном мозге. В этом исследовании трансген GFP переносится частицей SB3 AAV (смотрите предварительную заявку на патент США с №62/503121), а концентрация дозы исследуемого продукта составляет 2,5e13 векторных геномов/мл. Дозу вводят интрацеребровентрикулярным, интратекальным или внутривенным путем, причем объем дозы (мл/животное) составляет приблизительно 1, 1,5 и 10-16 соответственно. Через 14 дней после введения доз животных умерщвляют, а головной мозг делят пополам, как описано выше. В дополнение к анализу уровней экспрессии генов тау и домашнего хозяйства с помощью ОТ-кПЦР, также анализируются гены, связанные с воспалением (GFAP и Iba1). Испытательные исследования также проводятся для анализа уровней тау-белка в образцах тканей головного мозга и в спинномозговой жидкости. Эти исследования показывают, что все пути введения доз хорошо переносятся и способны доставлять трансген GFP в область гиппокампа.
Затем проводят исследование для анализа подавления экспрессии тау искусственными факторами транскрипции, описанными здесь, в головном мозге яванских макак. Исследуются три или более ZFP-TF, описанных здесь (таблицы 1-3), причем три ZFP были охарактеризованы как белки, которые обладают высокой специфичностью (0 вне мишени) и высокой (репрессией на ≥90%) эффективностью in vitro (ZFP-TF1); умеренной специфичностью (5-10 вне мишени) и высокой эффективностью in vitro (ZFP-TF2); и высокой специфичностью и умеренной (50-60%) эффективностью in vitro (ZFP-TF3). Животных умерщвляют через 1, 3 и 6 месяцев и анализируют, как описано выше. Значительная репрессия тау по всему головному мозгу и CSF наблюдается без значительной потери нейронов.
Исследования показывают, что тау-специфические реагенты ZFP-TF подавляют экспрессию тау (в том числе на терапевтическом уровне) в головном мозге приматов.
Все патенты, заявки на патенты и публикации, упомянутые здесь, тем самым включены посредством ссылки для всех целей во всей их полноте.
Хотя изобретение было предоставлено в некоторых деталях в качестве иллюстрации и примера с целью ясности понимания, для специалистов в данной области техники будет очевидно, что различные изменения и модификации могут быть осуществлены на практике, не отступая от сущности или объема настоящего изобретения. Соответственно, вышеприведенные описания и примеры не должны рассматриваться как ограничение.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> SANGAMO THERAPEUTICS, INC.
<120> МОДУЛЯТОРЫ ТАУ И СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ИХ ДОСТАВКИ
<130> 8325-0140.40
<140> PCT/US2017/064181
<141> 2017-12-01
<150> 62/584,342
<151> 2017-11-10
<150> 62/500,807
<151> 2017-05-03
<150> 62/466,198
<151> 2017-03-02
<150> 62/450,895
<151> 2017-01-26
<150> 62/428,871
<151> 2016-12-01
<160> 51
<170> Патент в версии 3.5
<210> 1
<211> 28
<212> ДНК
<213> Mouse sp.
<400> 1
cgacagaagg cgaggacaga agaggaca 28
<210> 2
<211> 28
<212> ДНК
<213> Mouse sp.
<400> 2
ccgttgcgcc tgattgatgc ccagctcc 28
<210> 3
<211> 28
<212> ДНК
<213> Mouse sp.
<400> 3
gtggcggaga ctgagagcgc gcgcggcc 28
<210> 4
<211> 28
<212> ДНК
<213> Неизвестная
<220>
<223> Описание неизвестной последовательности:
человеческий или мышиный олигонуклеотид
<400> 4
cttctgtcga ttatcaggta agcgccgc 28
<210> 5
<211> 28
<212> ДНК
<213> Неизвестная
<220>
<223> Описание неизвестной последовательности:
человеческий или мышиный олигонуклеотид
<400> 5
ctggtgggtg gcggagactg agagcgcg 28
<210> 6
<211> 28
<212> ДНК
<213> Неизвестная
<220>
<223> Описание неизвестной последовательности:
человеческий или мышиный олигонуклеотид
<400> 6
tggtgctgga gctggtgggt ggcggaga 28
<210> 7
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 7
Arg Ser Asp Asn Leu Ala Arg
1 5
<210> 8
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 8
Asp Arg Ser His Leu Ala Arg
1 5
<210> 9
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 9
Gln Ser Gly Asn Leu Ala Arg
1 5
<210> 10
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 10
Gln Ser Asn Thr Arg Ile Met
1 5
<210> 11
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 11
Glu Arg Gly Thr Leu Ala Arg
1 5
<210> 12
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 12
Thr Ser Ala Asn Leu Ser Arg
1 5
<210> 13
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 13
Thr Ser Gly Asn Leu Thr Arg
1 5
<210> 14
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 14
His Arg Thr Ser Leu Thr Asp
1 5
<210> 15
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 15
Arg Ser His Ser Leu Leu Arg
1 5
<210> 16
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 16
His Pro Ser Ala Arg Lys Arg
1 5
<210> 17
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 17
Arg Ser Ala Asn Leu Thr Arg
1 5
<210> 18
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 18
Asp Ser Ser His Leu Glu Leu
1 5
<210> 19
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 19
Asp Arg Ser Asn Leu Thr Arg
1 5
<210> 20
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 20
Asp Arg Ser His Leu Thr Arg
1 5
<210> 21
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 21
Arg Ser Asp Asn Leu Ser Glu
1 5
<210> 22
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 22
Thr Ser Ser Asn Arg Lys Thr
1 5
<210> 23
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 23
Asp Arg Ser Ala Leu Ala Arg
1 5
<210> 24
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 24
Arg Asn Ser Asp Arg Thr Lys
1 5
<210> 25
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 25
Arg Ser Ala His Leu Ser Arg
1 5
<210> 26
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 26
Thr Ser Gly His Leu Ser Arg
1 5
<210> 27
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 27
Leu Arg His His Leu Thr Arg
1 5
<210> 28
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 28
Arg Arg Phe Thr Leu Ser Lys
1 5
<210> 29
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 29
Arg Ser Asp Val Leu Ser Glu
1 5
<210> 30
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 30
Lys His Ser Thr Arg Arg Val
1 5
<210> 31
<211> 19
<212> ДНК
<213> Homo sapiens
<400> 31
gcagtcaccg ccacccacc 19
<210> 32
<211> 19
<212> ДНК
<213> Mus sp.
<400> 32
tcagtctccg ccacccacc 19
<210> 33
<211> 28
<212> ДНК
<213> Неизвестная
<220>
<223> Описание неизвестной последовательности:
человеческий или мышиный олигонуклеотид
<400> 33
aggggcgggc agcgaggcct gggcgggc 28
<210> 34
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 34
Arg Ser Ala Asp Leu Thr Arg
1 5
<210> 35
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 35
Gln Ser Gly Asp Leu Thr Arg
1 5
<210> 36
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 36
Arg Ser Asp His Leu Ser Glu
1 5
<210> 37
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 37
Leu Lys Gln His Leu Thr Arg
1 5
<210> 38
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 38
Asp Arg Ser His Leu Ser Arg
1 5
<210> 39
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 39
Asp Arg Ser Asn Leu Ser Arg
1 5
<210> 40
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 40
Leu Arg Gln Asn Leu Ile Met
1 5
<210> 41
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 41
Thr Ser Ala Asn Leu Thr Val
1 5
<210> 42
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 42
Arg Ser Asp His Leu Ser Arg
1 5
<210> 43
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 43
Gln Arg Asn Asp Arg Lys Ser
1 5
<210> 44
<211> 28
<212> ДНК
<213> Mouse sp.
<400> 44
cggcagaagg tgggcggtgg cggcggcg 28
<210> 45
<211> 28
<212> ДНК
<213> Mouse sp.
<400> 45
gcggcggcgg cagaaggtgg gcggtggc 28
<210> 46
<211> 28
<212> ДНК
<213> Неизвестная
<220>
<223> Описание неизвестной последовательности:
человеческий или мышиный олигонуклеотид
<400> 46
ctccagaagg ggatcatgac ctcctcac 28
<210> 47
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: синтетический пептид
<400> 47
Arg Leu Tyr Thr Leu His Lys
1 5
<210> 48
<211> 18
<212> ДНК
<213> Homo sapiens
<400> 48
acccaccagc tccggcac 18
<210> 49
<211> 18
<212> ДНК
<213> Mus sp.
<400> 49
acccaccagc tccagcac 18
<210> 50
<211> 15
<212> ДНК
<213> Homo sapiens
<400> 50
tctgtcgact atcag 15
<210> 51
<211> 15
<212> ДНК
<213> Mus sp.
<400> 51
tctgtcgatt atcag 15
<---
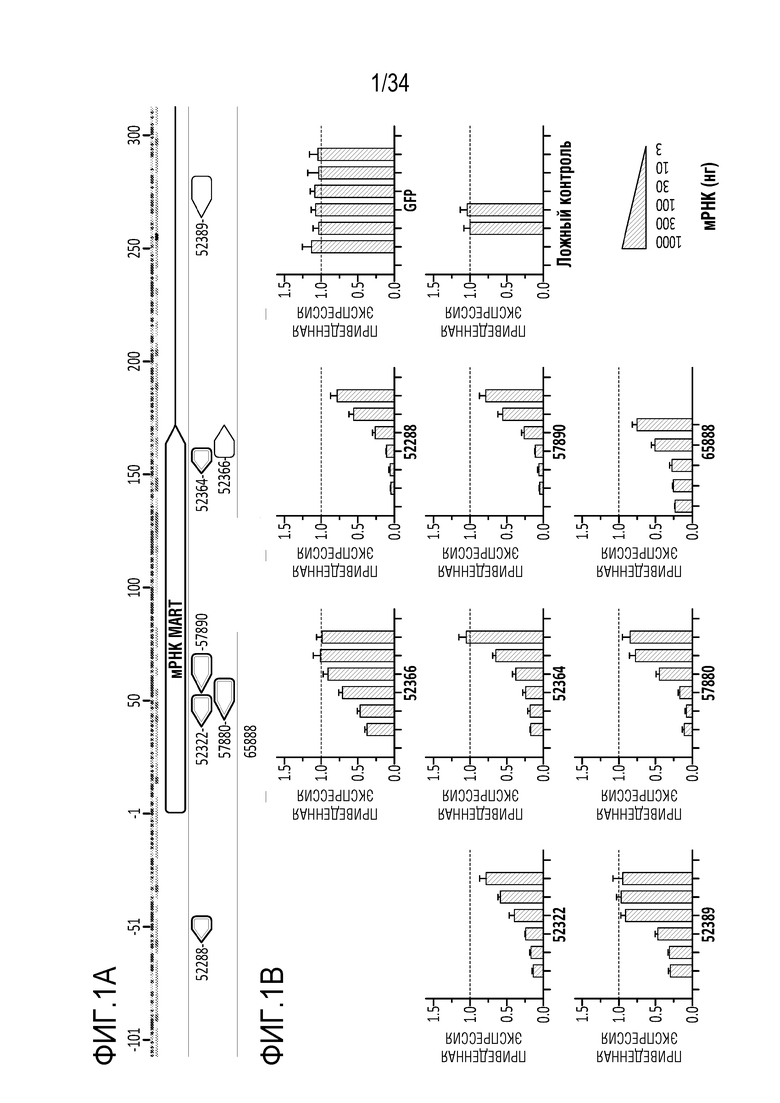
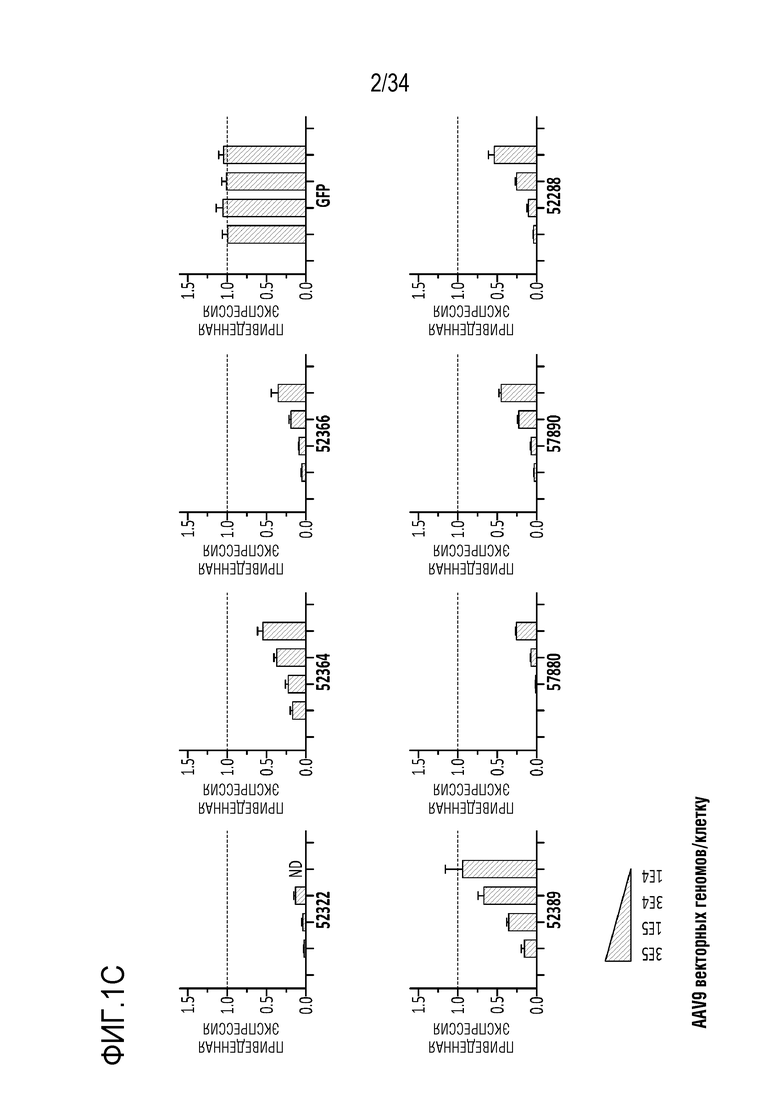
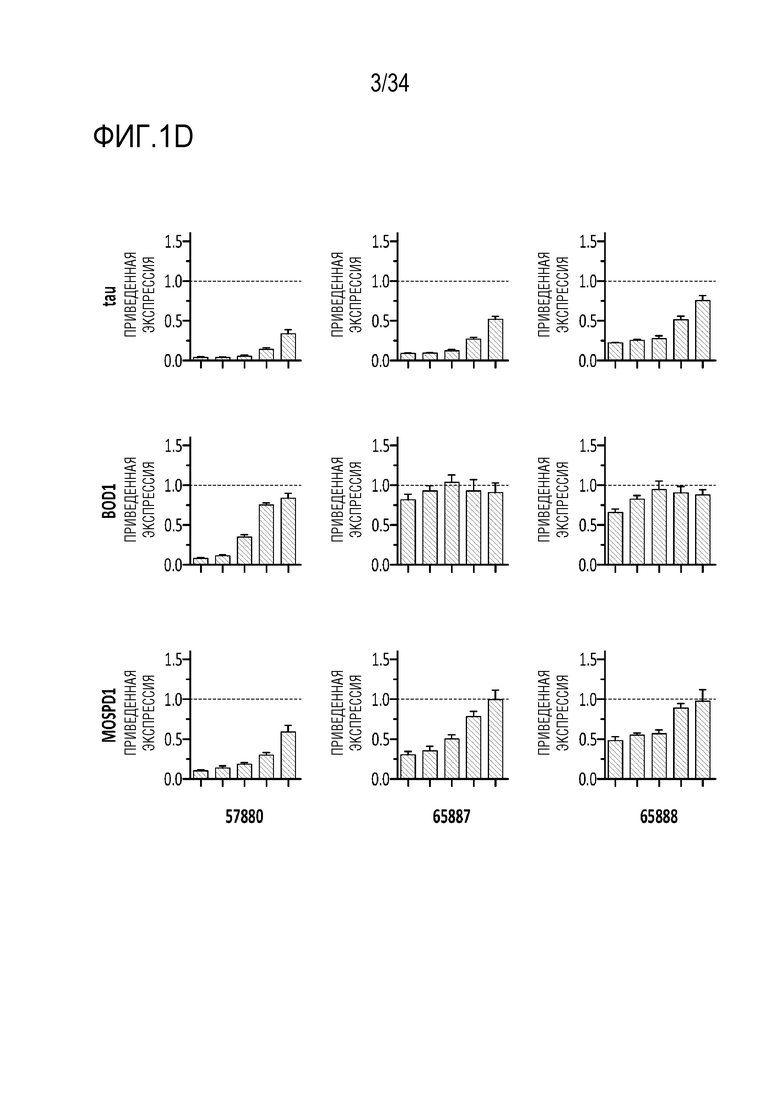
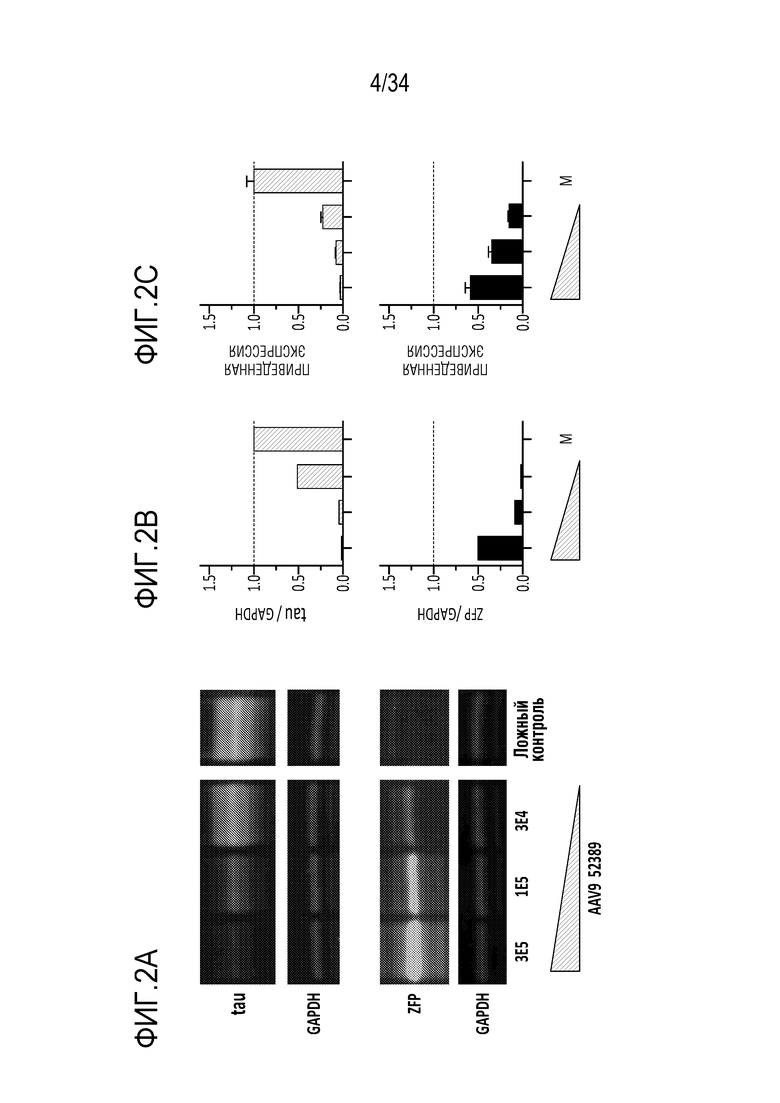
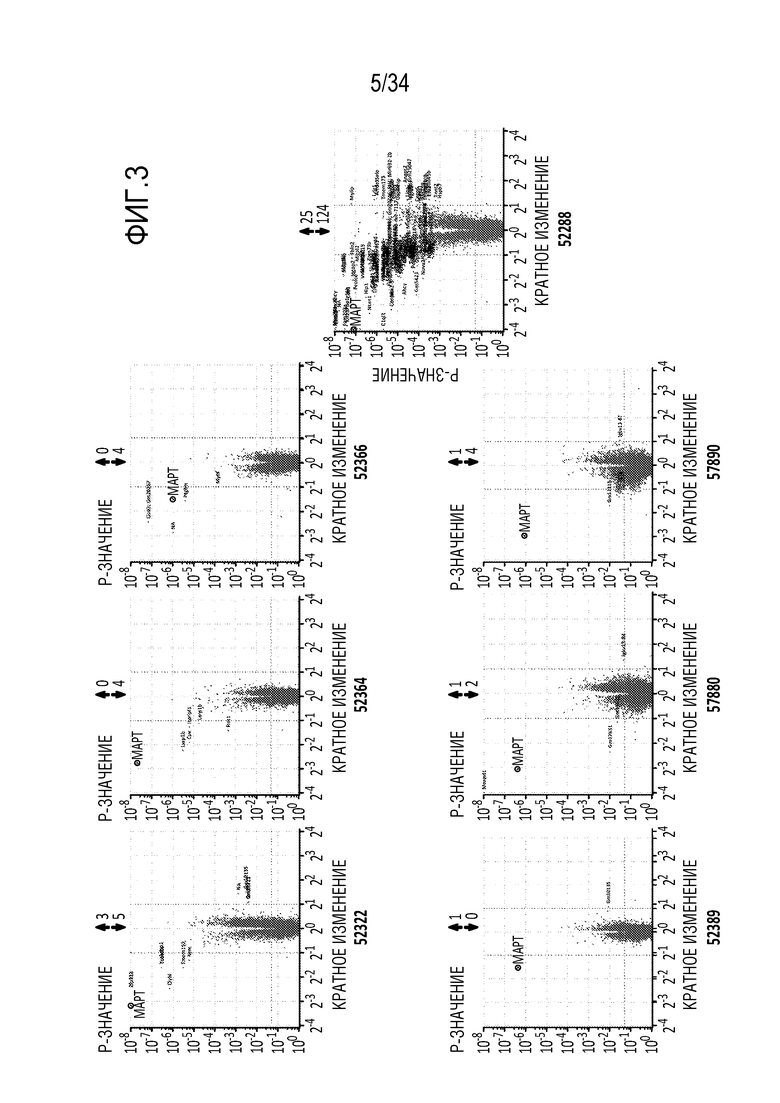
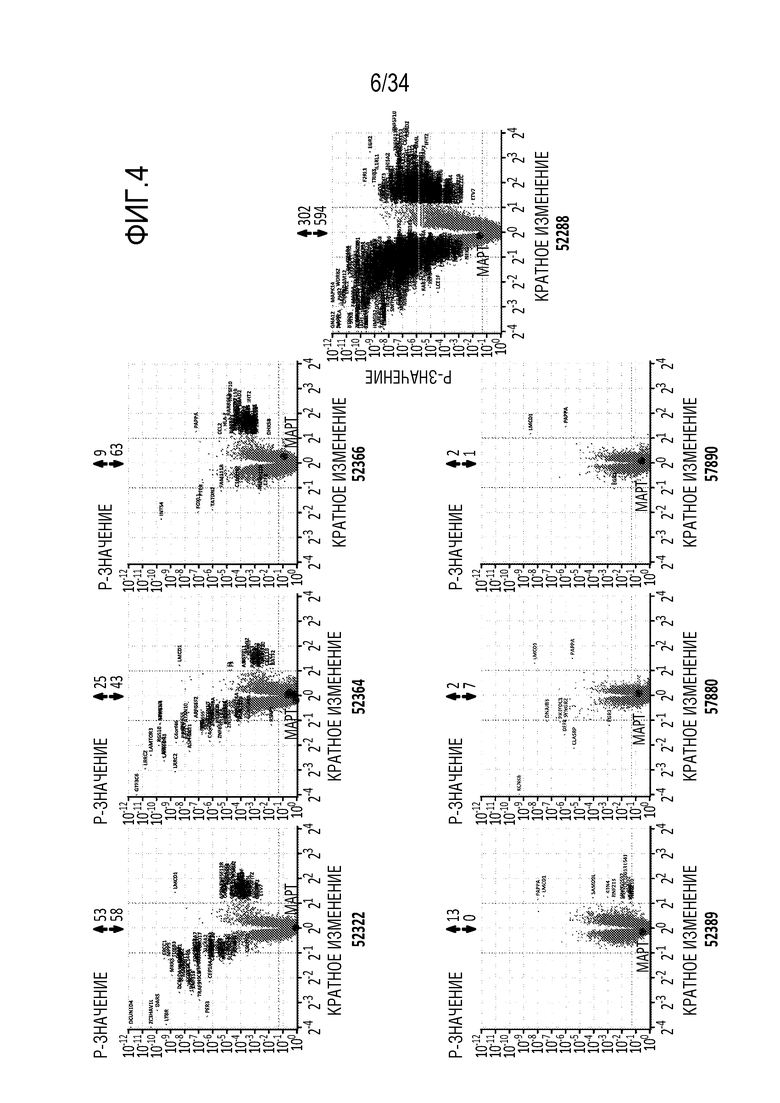
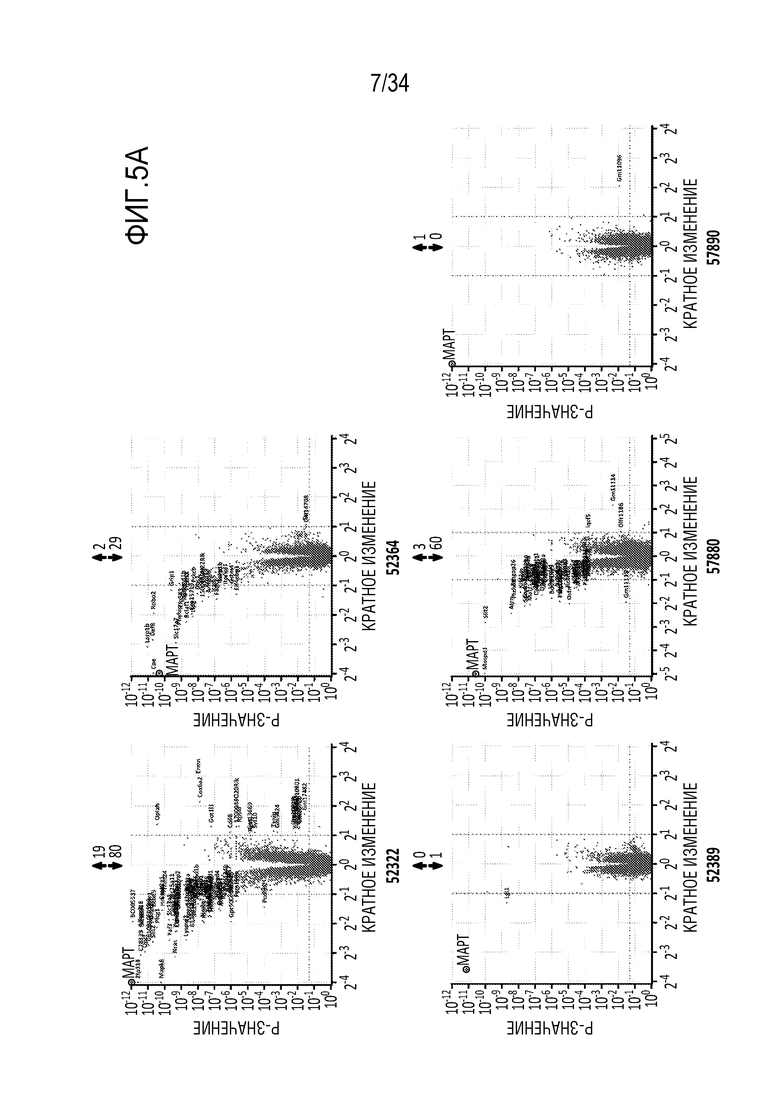
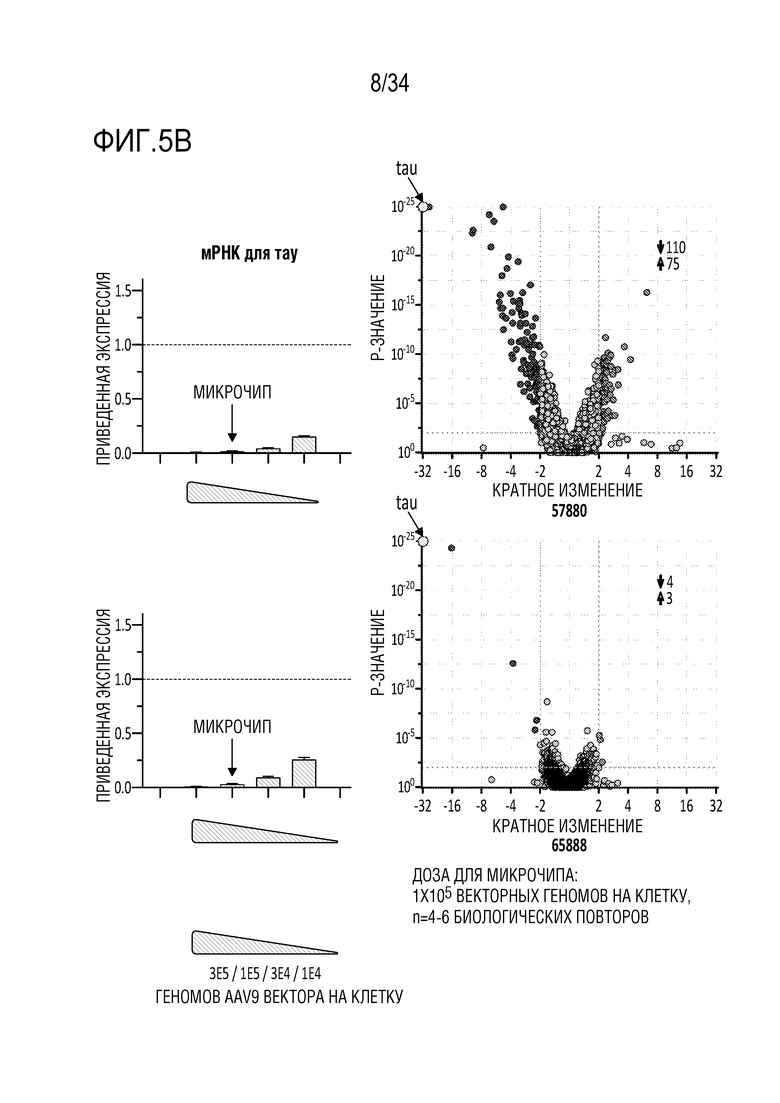

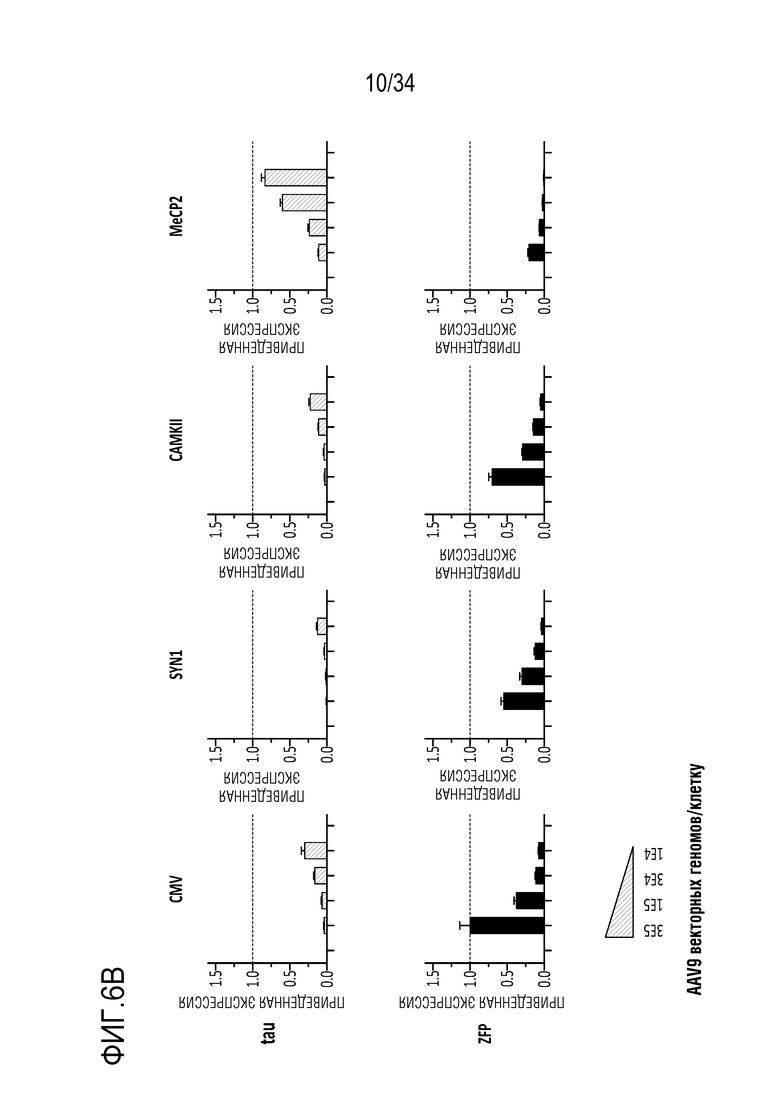
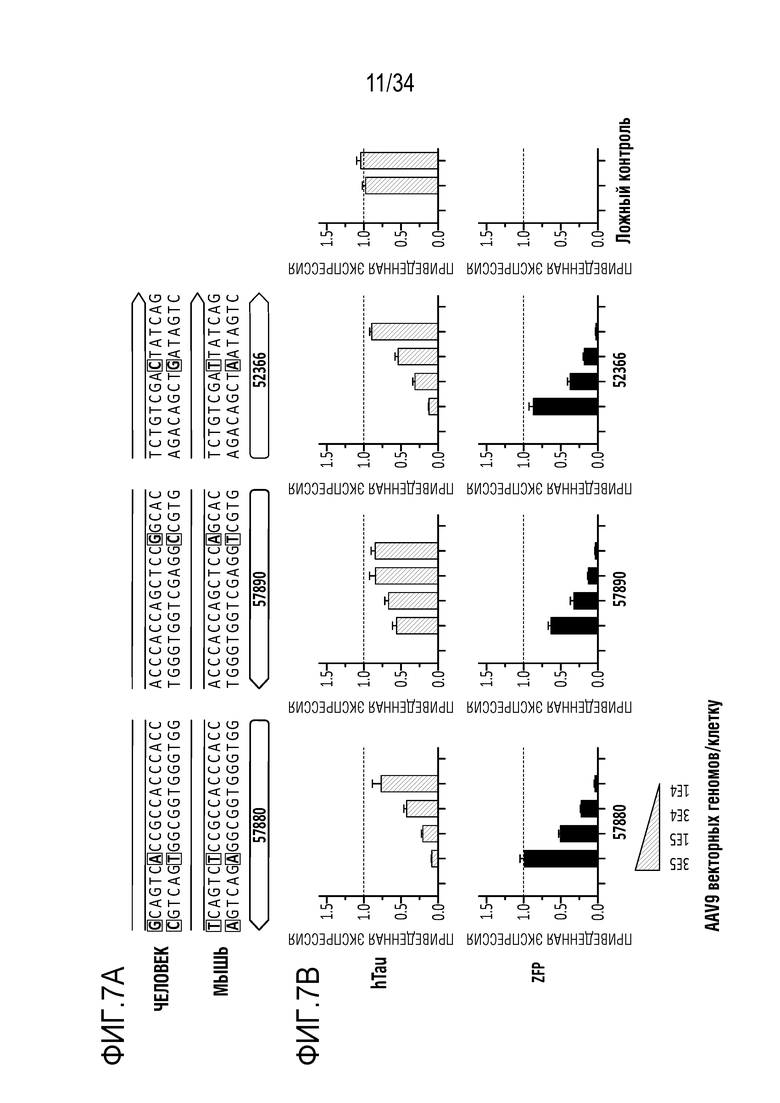
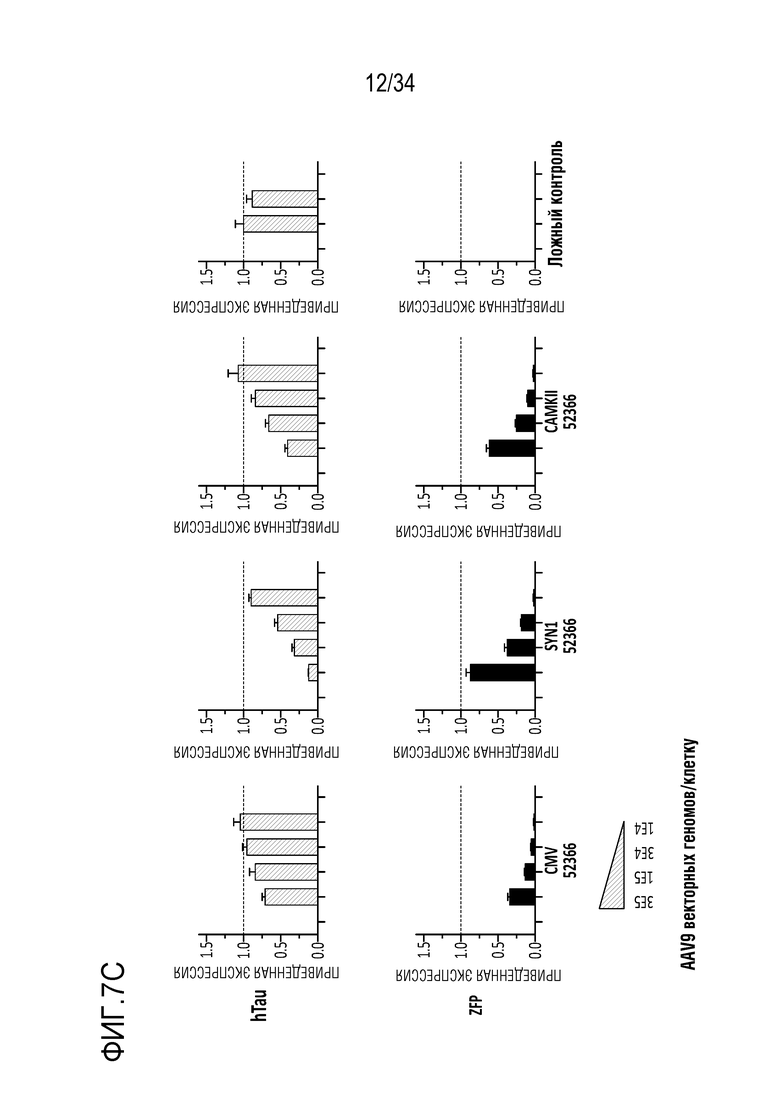
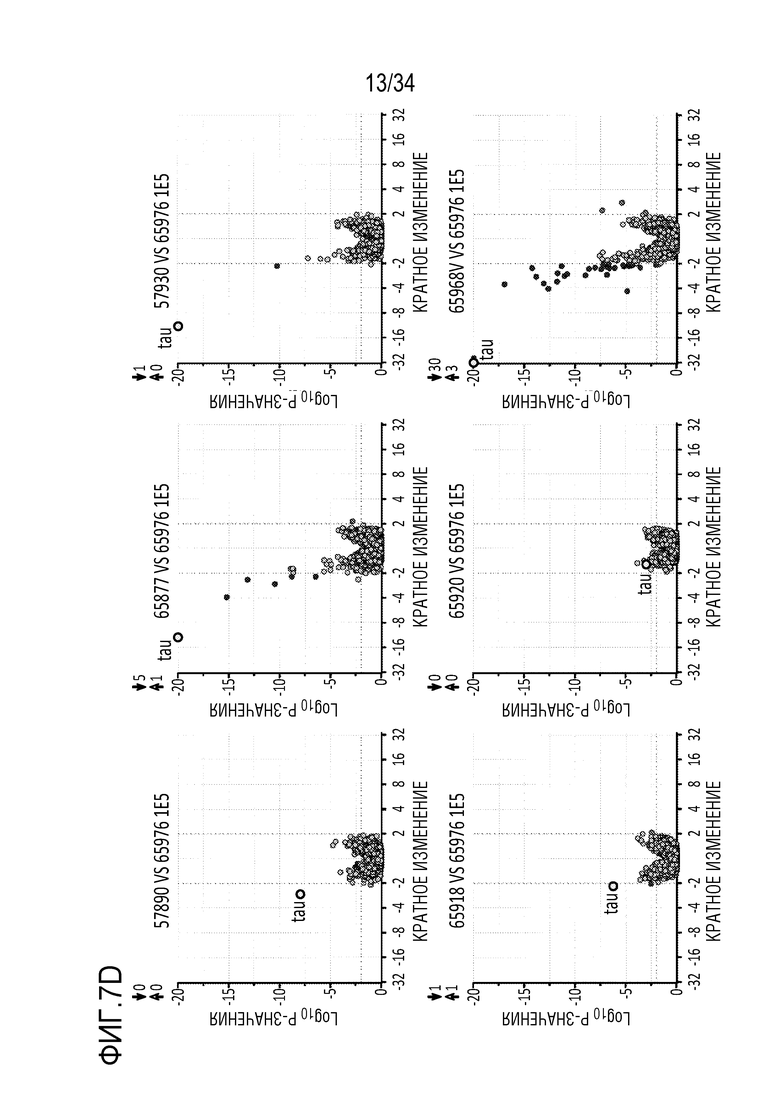
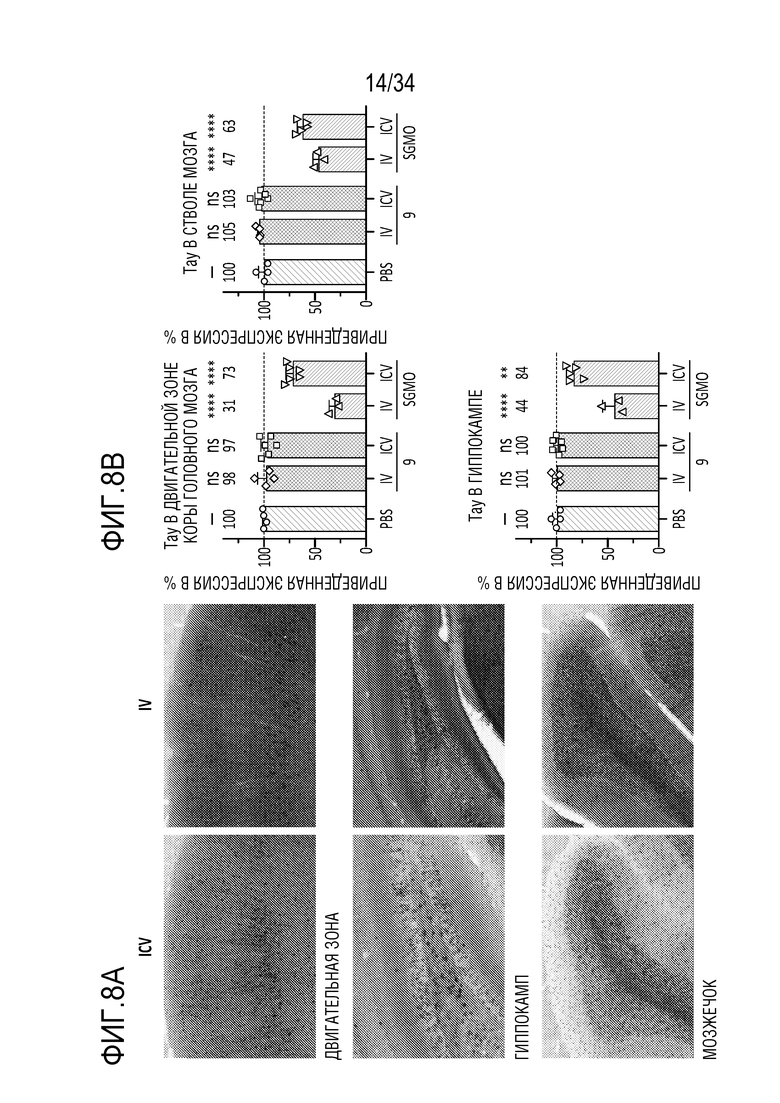
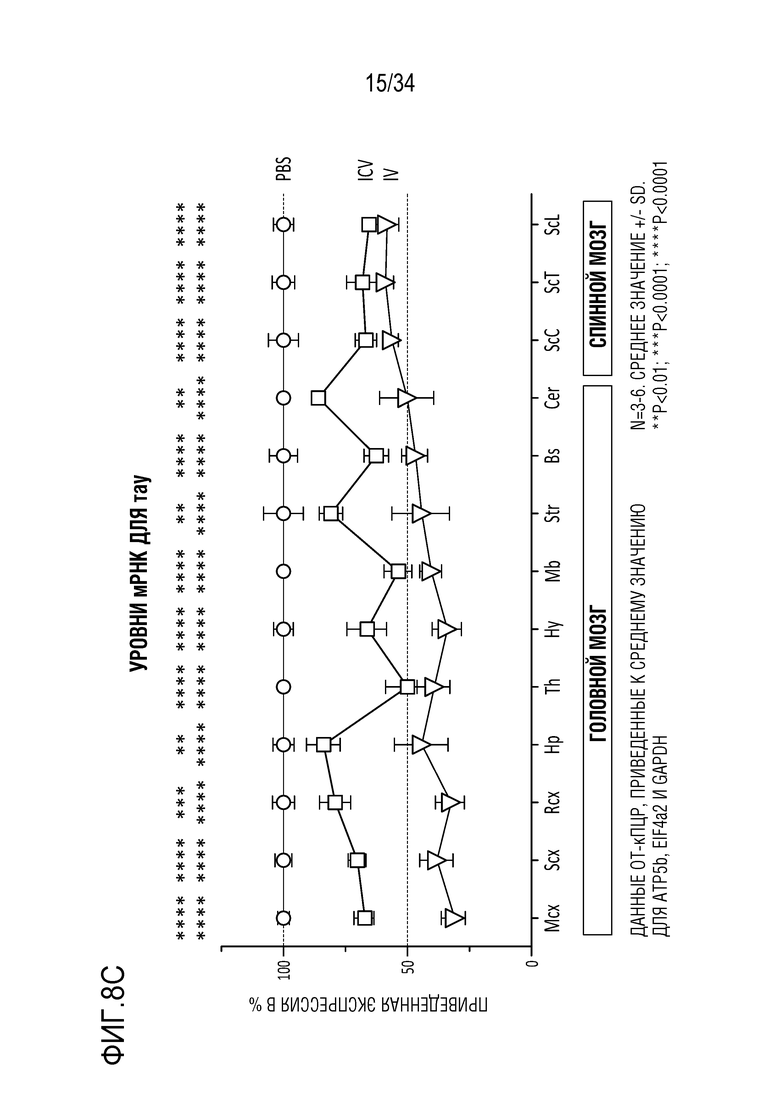
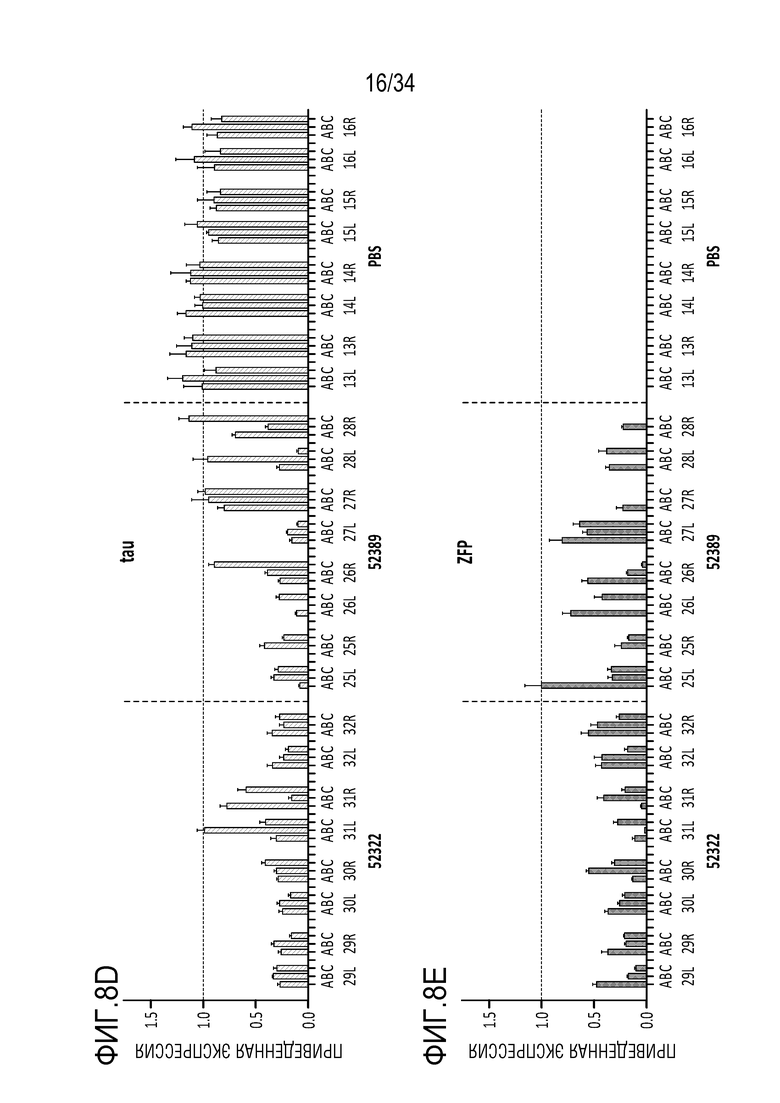
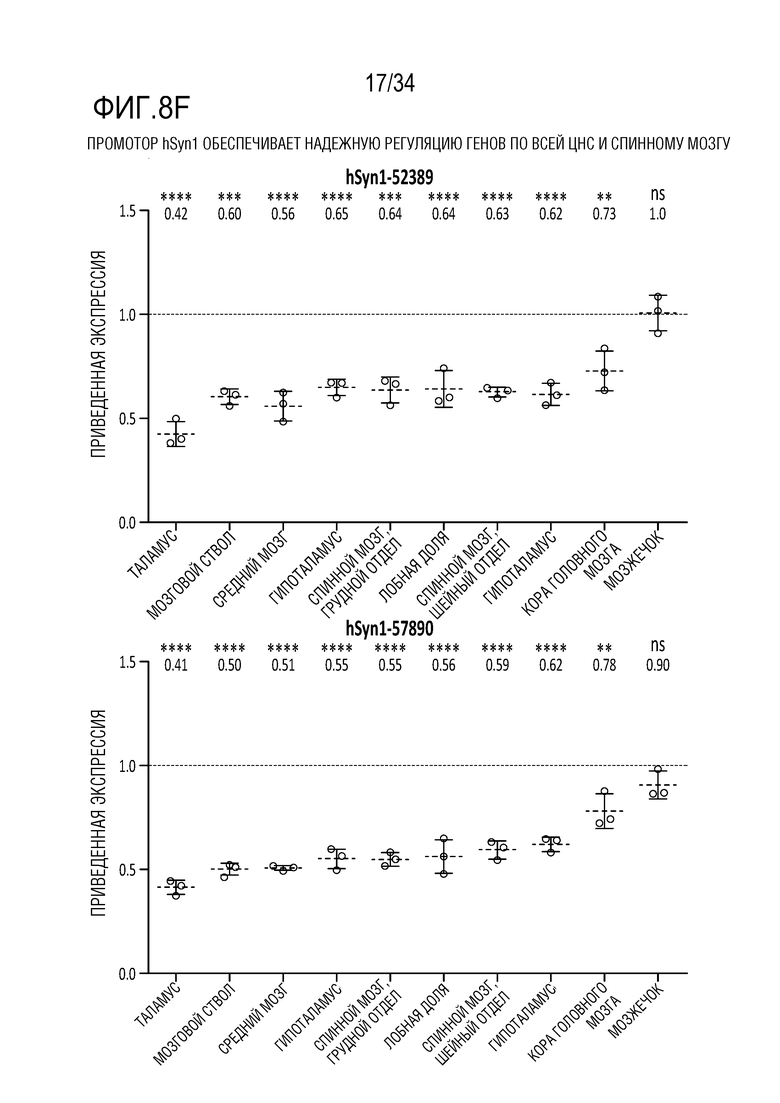
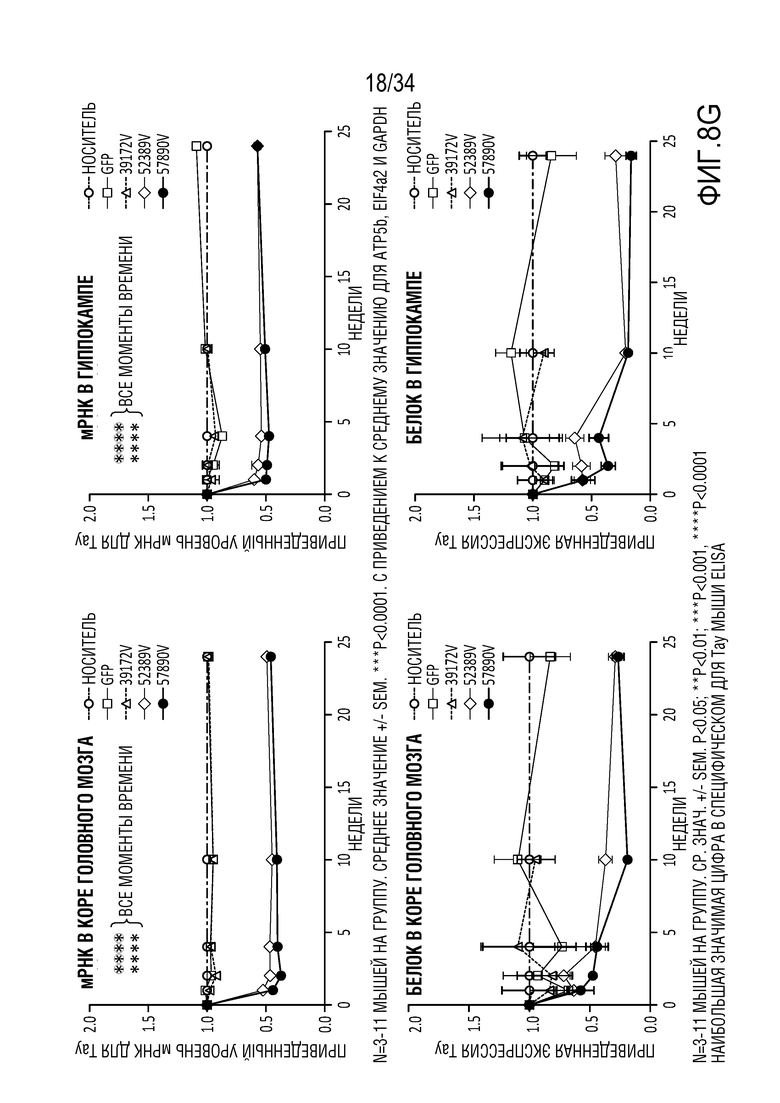
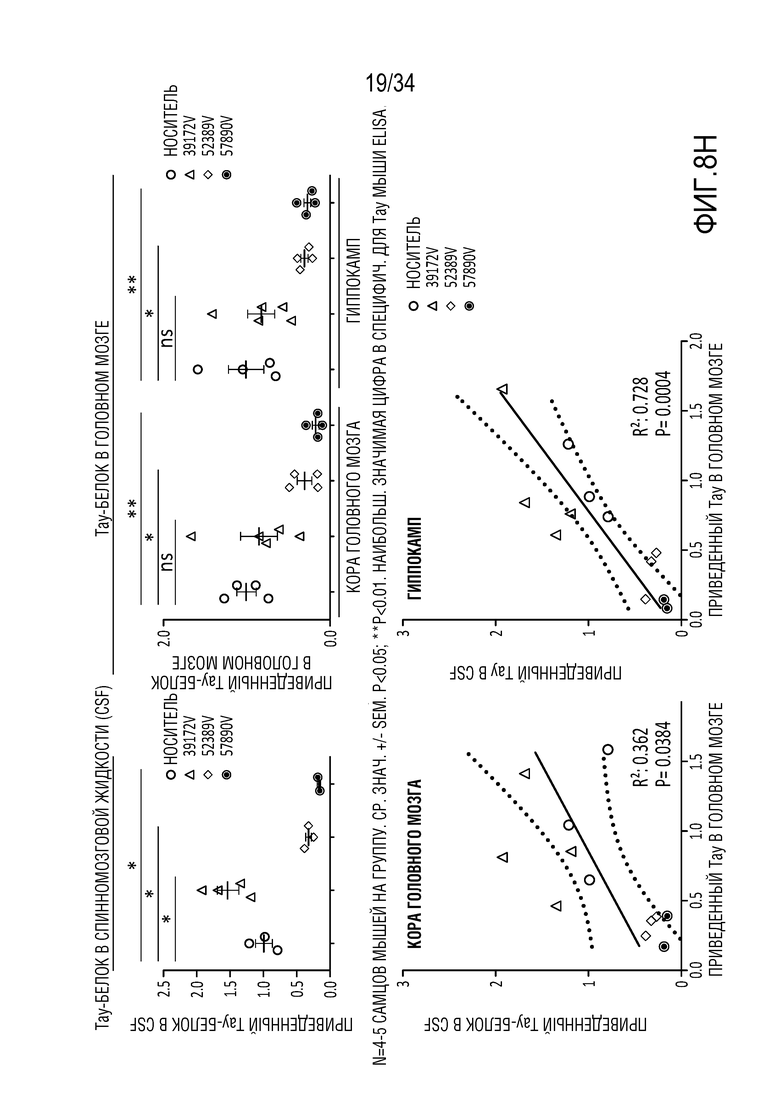
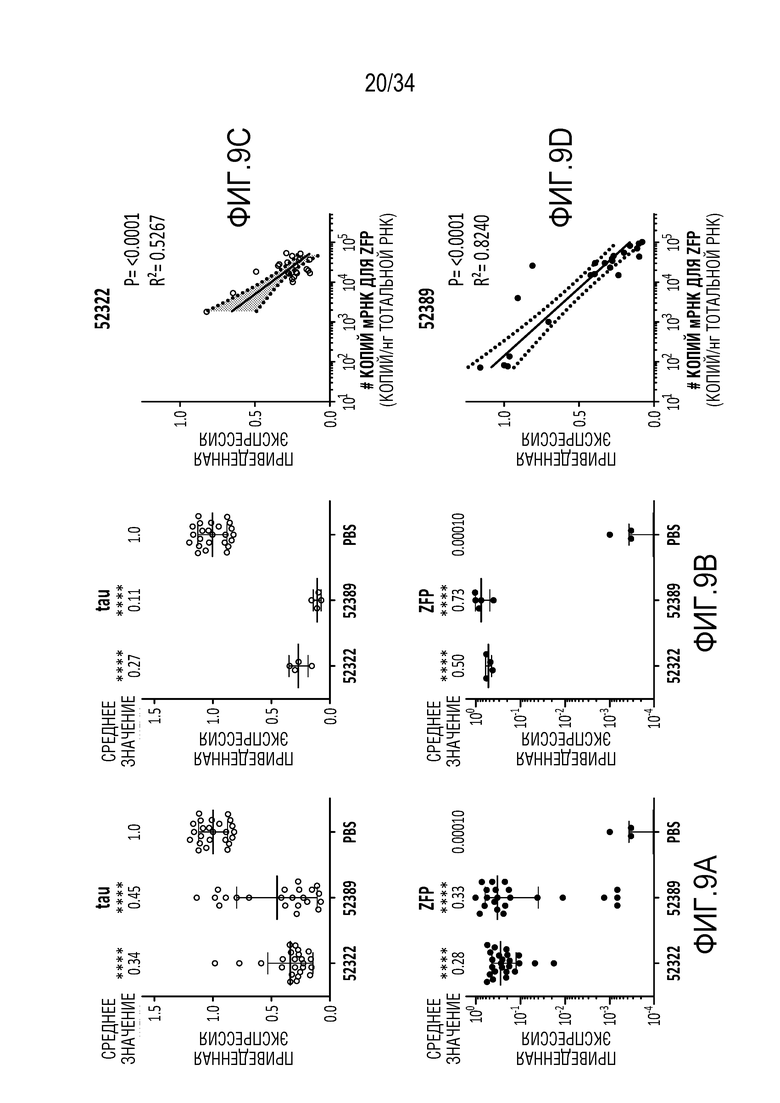
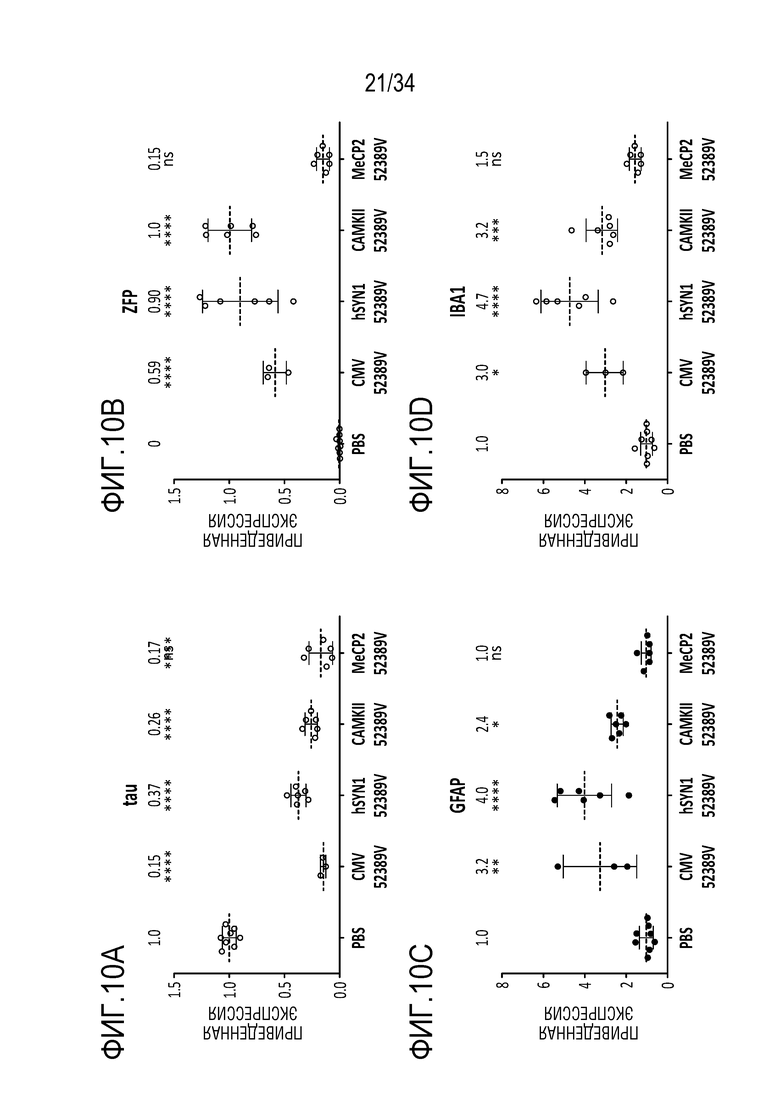
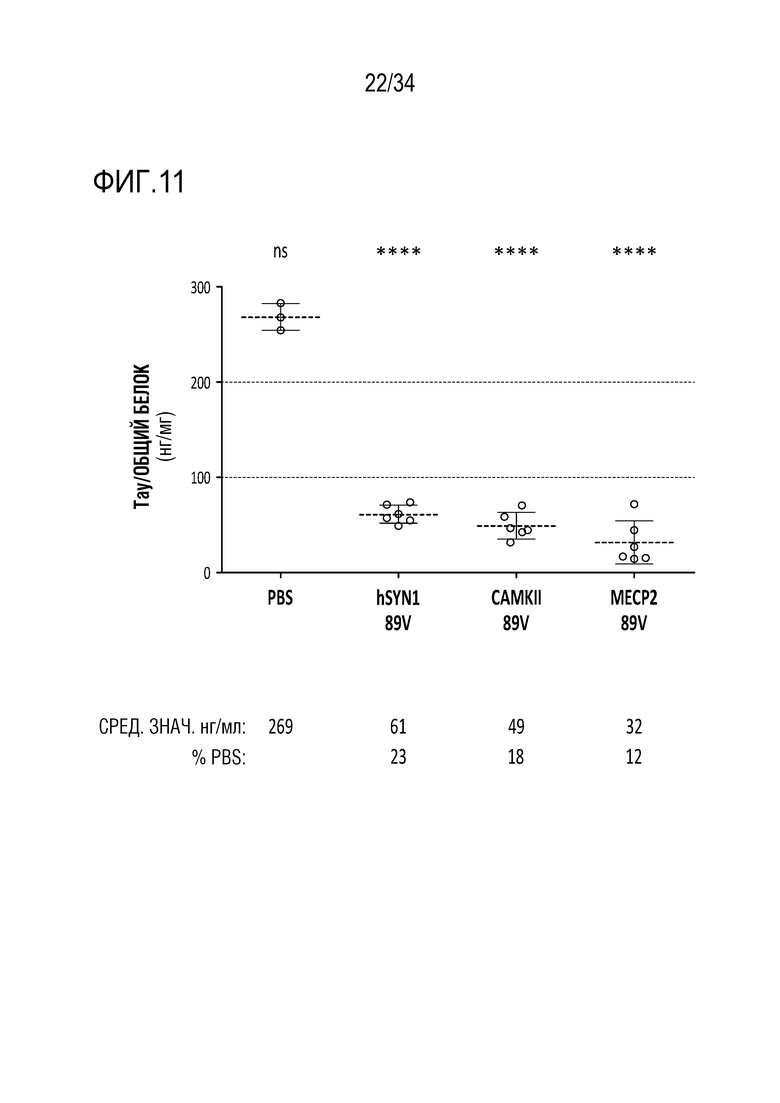
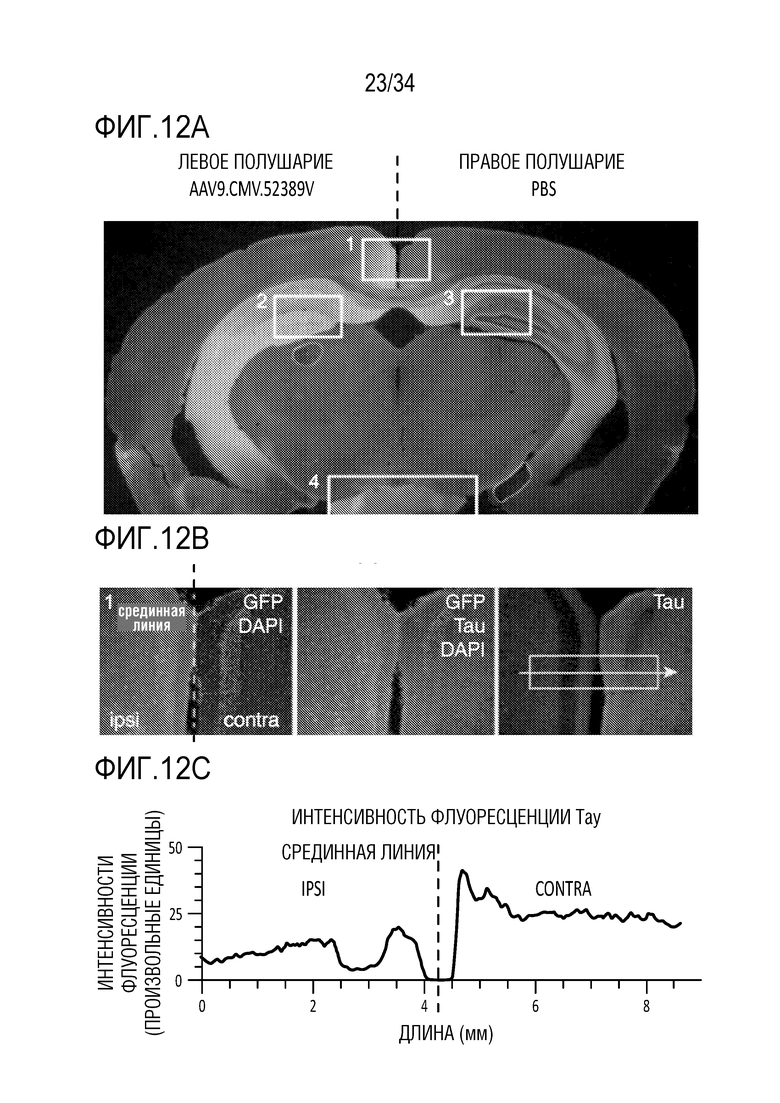
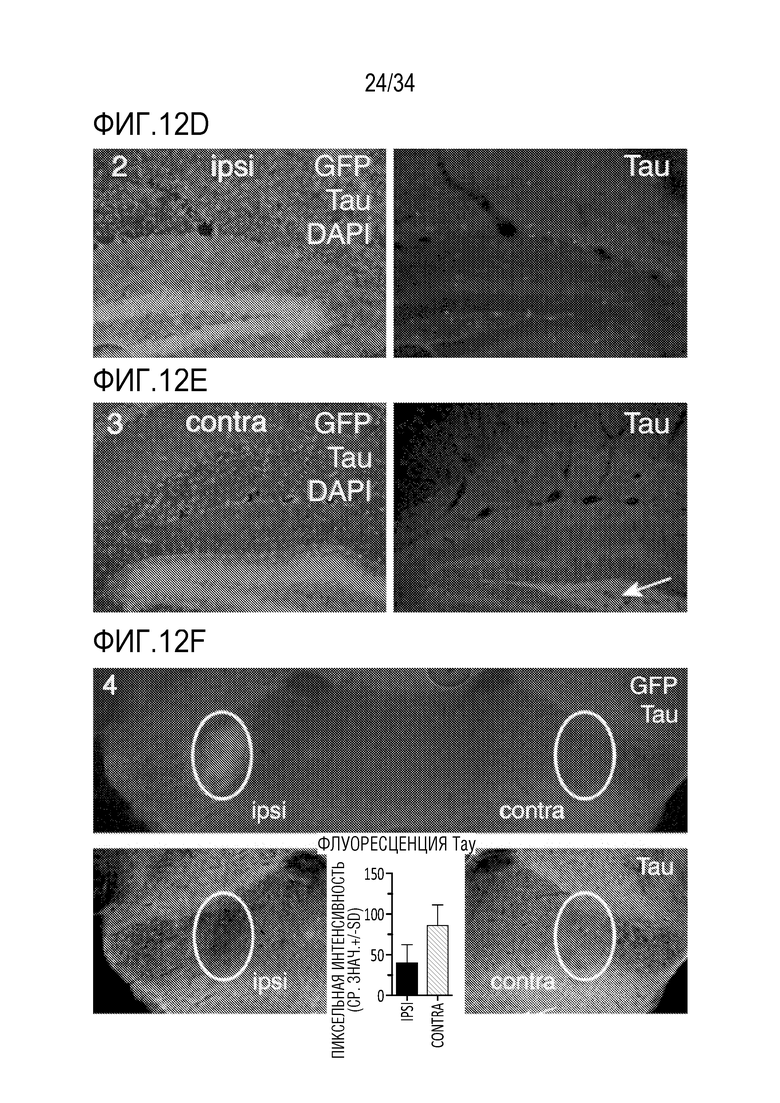
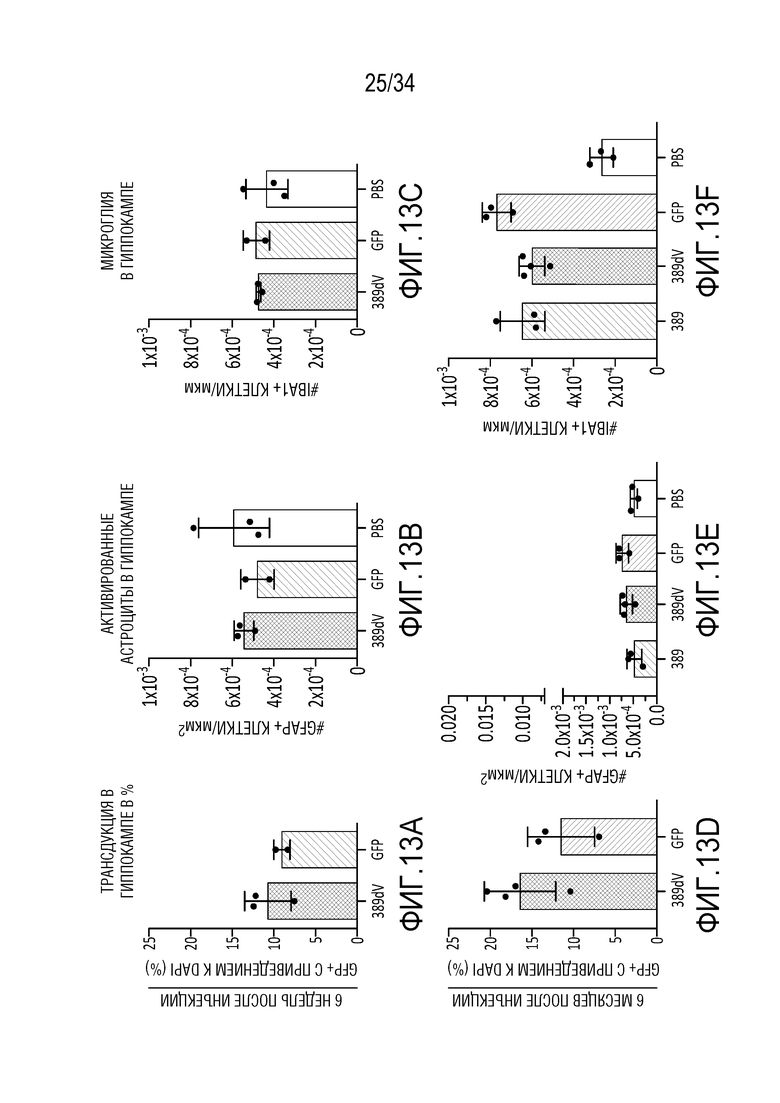
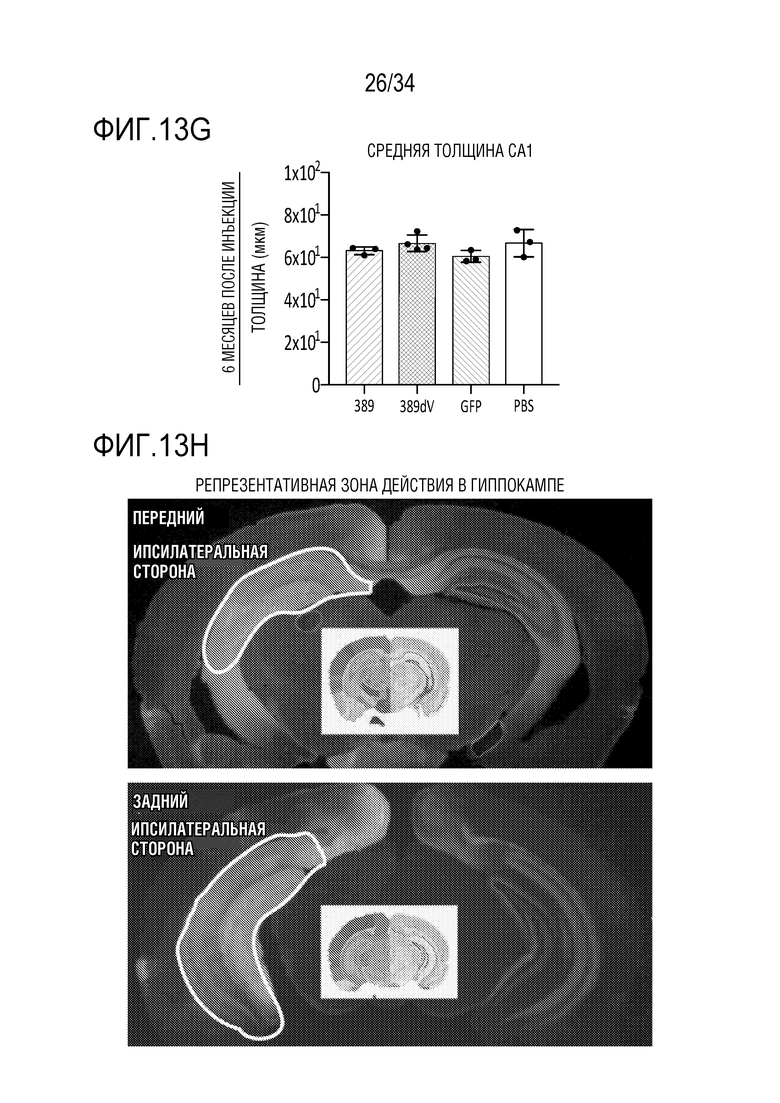
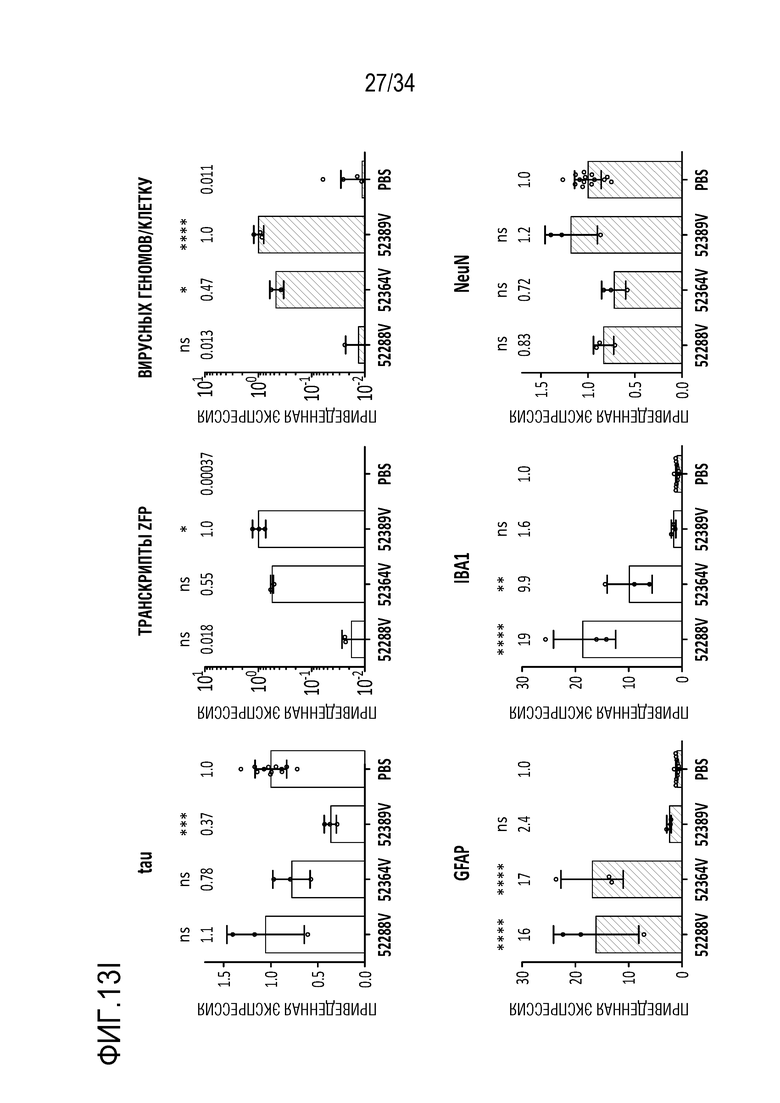
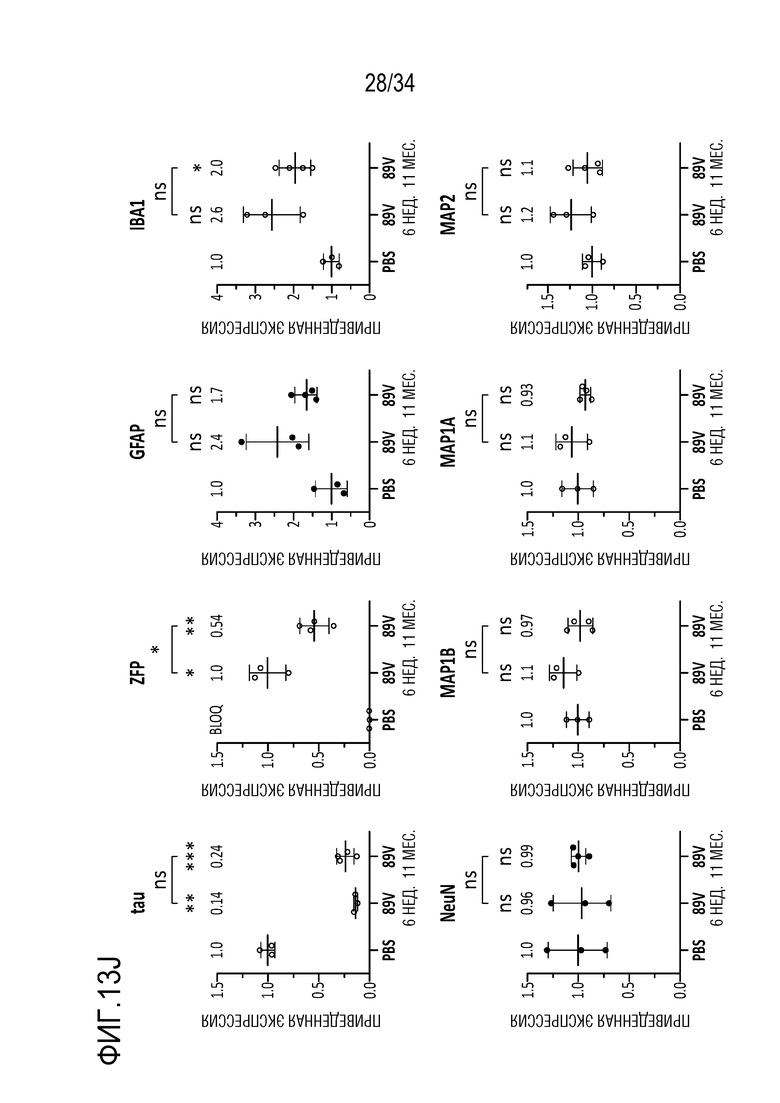
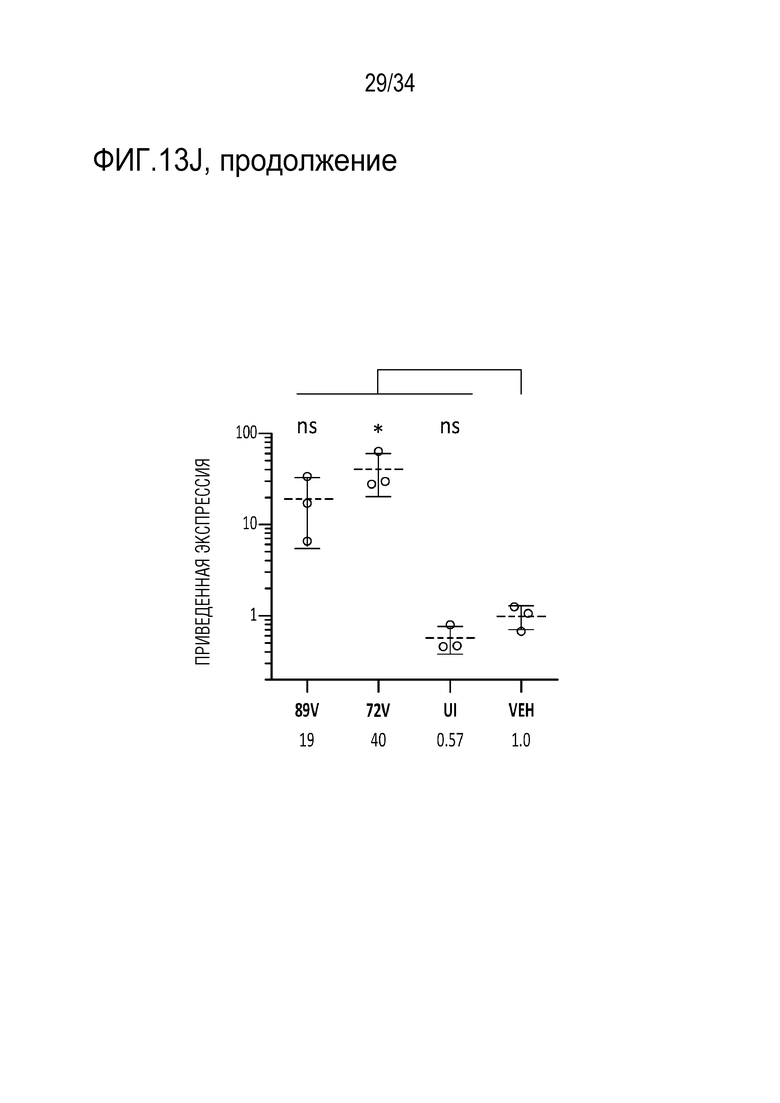
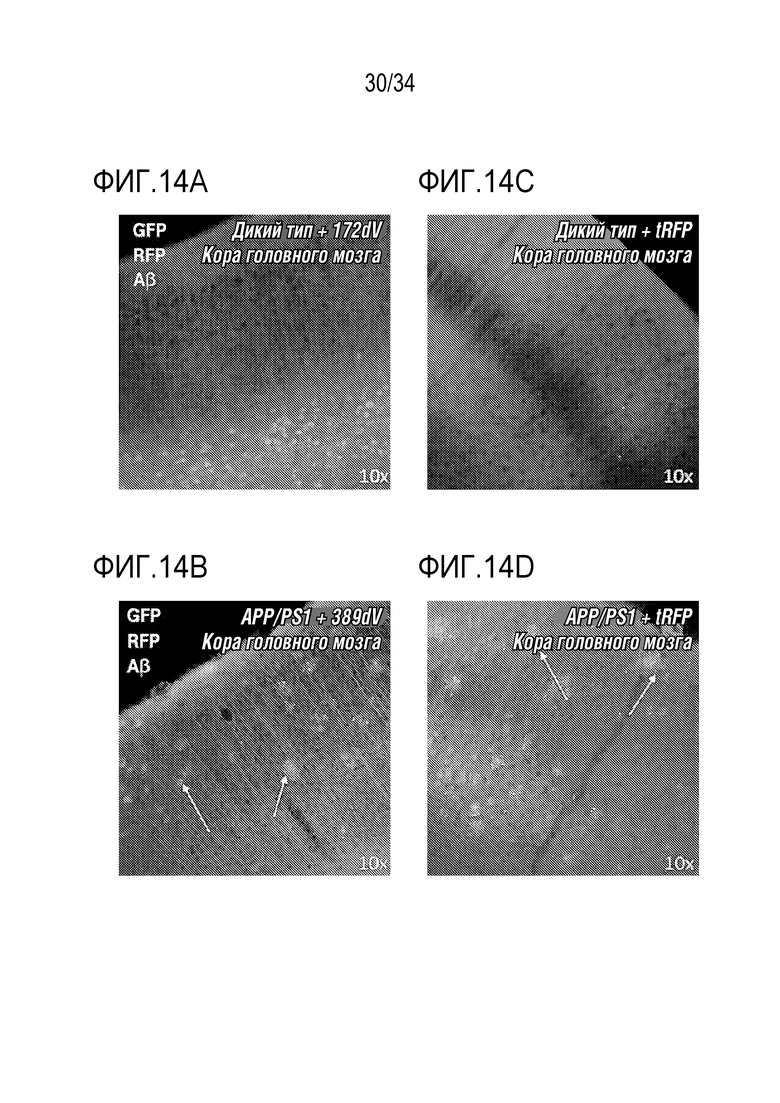
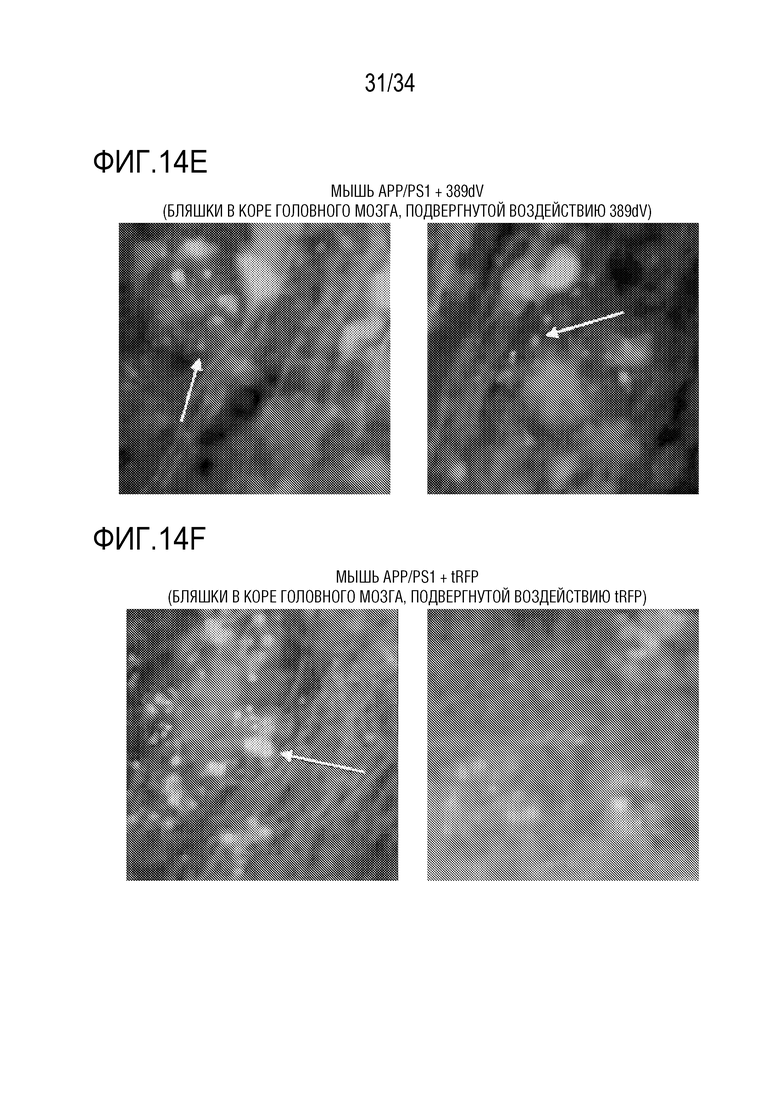
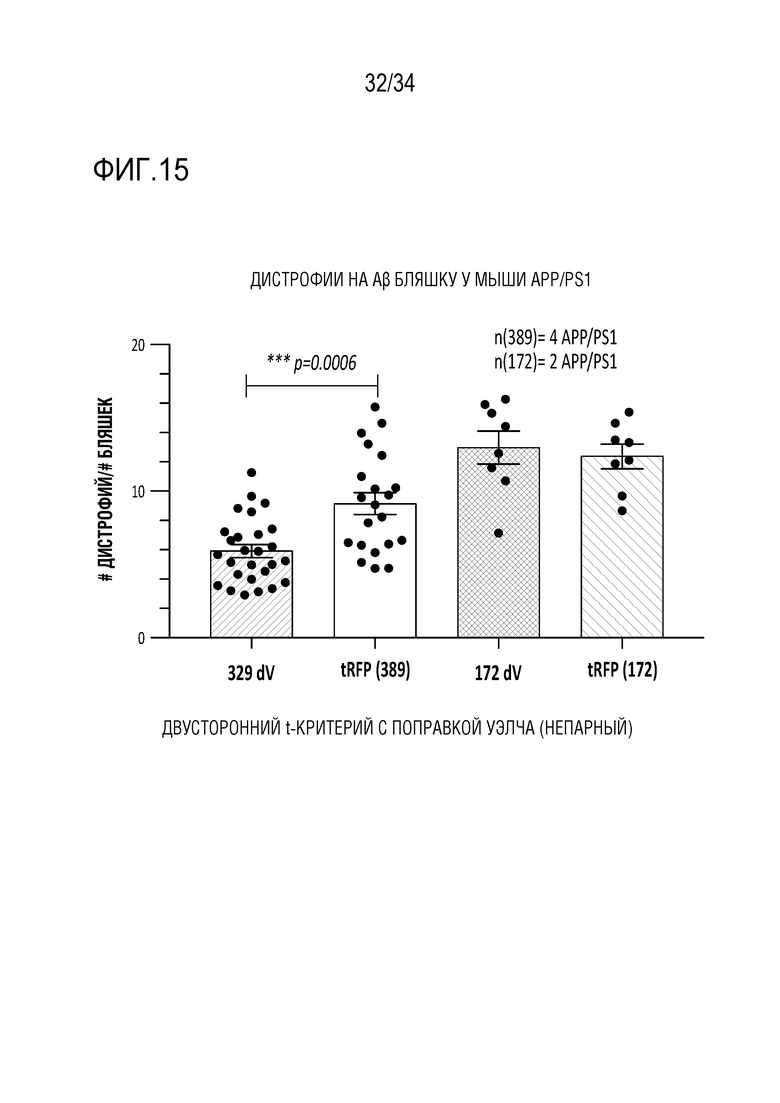
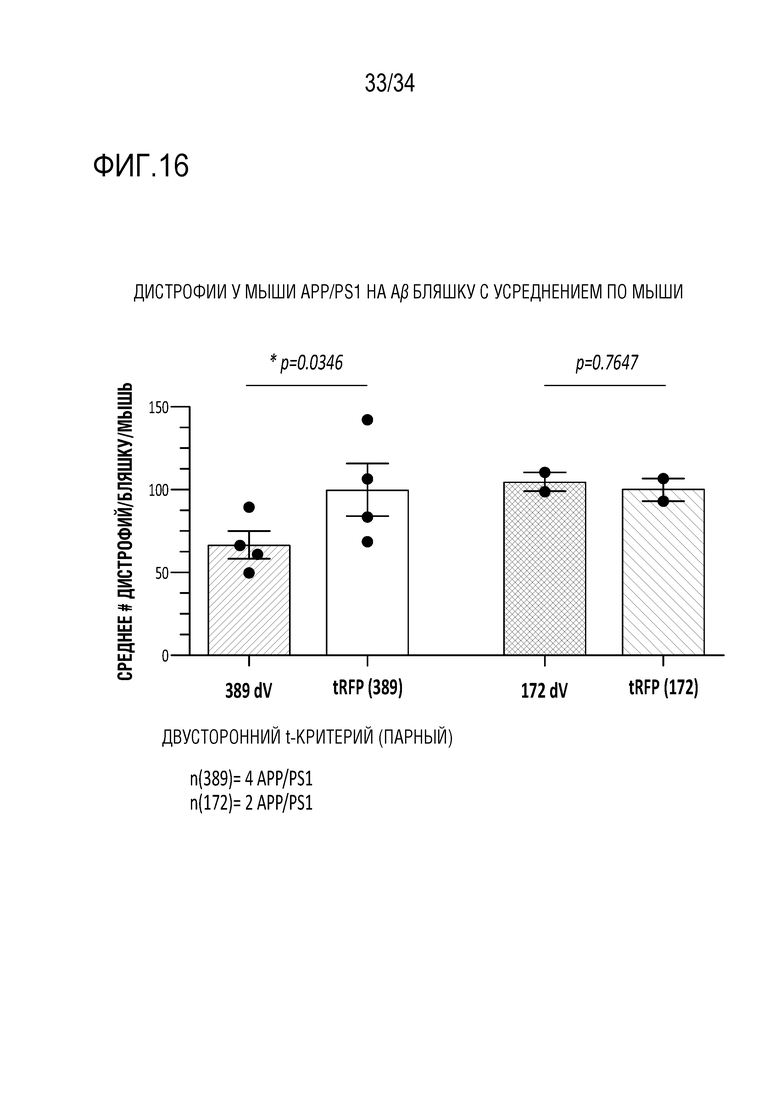
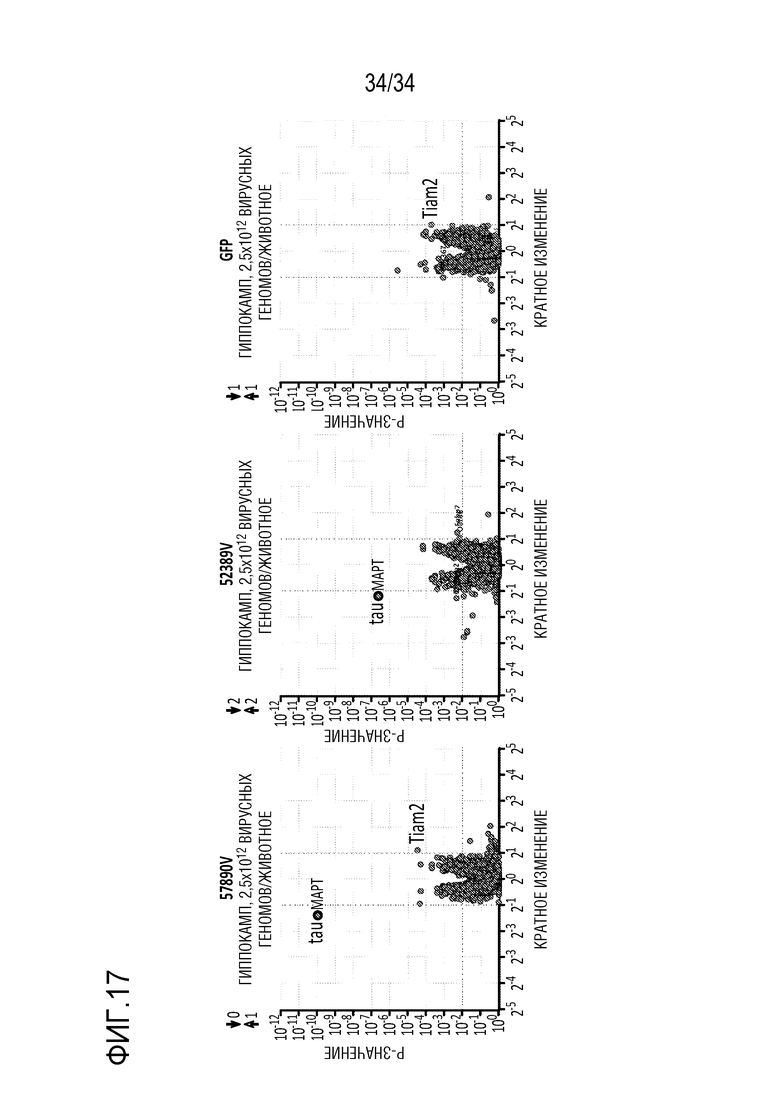
Изобретение относится к области биотехнологии. Описана группа изобретений, включающая репрессор транскрипции гена ассоциированного с микротрубочками белка тау (MAPT), полинуклеотид, кодирующий репрессор транскрипции, средство доставки генов, фармацевтическую композицию для подавления экспрессии MAPT, применение репрессора транскрипции, полинуклеотида, средства доставки генов и/или фармацевтической композиции для подавления экспрессии MAPT у субъекта и набор для подавления экспрессии MAPT. Изобретение расширяет арсенал средств для подавления экспрессии MAPT. 6 н. и 24 з.п. ф-лы, 17 ил., 3 табл., 11 пр.
1. Репрессор транскрипции гена ассоциированного с микротрубочками белка тау (MAPT), где указанный репрессор включает
ДНК-связывающий домен на основе белка с цинковыми пальцами (ZFP), который связывается с сайтом-мишенью из по крайней мере 12 нуклеотидов в гене MAPT, где указанный ДНК-связывающий домен на основе ZFP содержит четыре, пять или шесть доменов «цинковые пальцы», где каждый домен «цинковые пальцы» содержит область распознающей спирали, и где ДНК-связывающий домен на основе ZFP содержит области распознающей спирали, в следующем порядке:
(i) RSDNLAR (SEQ ID NO:7), DRSHLAR (SEQ ID NO:8), QSGNLAR (SEQ ID NO:9), QSNTRIM (SEQ ID NO:10);
(ii) ERGTLAR (SEQ ID NO:11), TSANLSR (SEQ ID NO:12), TSGNLTR (SEQ ID NO:13), HRTSLTD (SEQ ID NO:14), RSHSLLR (SEQ ID NO:15), HPSARKR (SEQ ID NO:16);
(iii) RSANLTR (SEQ ID NO:17), DSSHLEL (SEQ ID NO:18), DRSNLTR (SEQ ID NO:19), DRSHLTR (SEQ ID NO:20), DRSHLAR (SEQ ID NO:8);
(iv) DRSHLTR (SEQ ID NO:20), LKQHLTR (SEQ ID NO:37), RSAHLSR (SEQ ID NO:25), TSGHLSR (SEQ ID NO:26), QSGNLAR (SEQ ID NO:9), QSGDLTR (SEQ ID NO:35);
(v) RSAHLSR (SEQ ID NO:25), TSGHLSR (SEQ ID NO:26), QSGNLAR (SEQ ID NO:9), QSGDLTR (SEQ ID NO:35), DRSHLSR (SEQ ID NO:38), DRSHLAR (SEQ ID NO:8);
(vi) RSDNLSE (SEQ ID NO:21), TSSNRKT (SEQ ID NO:22), TSGNLTR (SEQ ID NO:13), DRSALAR (SEQ ID NO:23), RNSDRTK (SEQ ID NO:24);
(vii) DSSHLEL (SEQ ID NO:18), DRSNLTR (SEQ ID NO:19), DRSHLTR (SEQ ID NO:20), DRSHLAR (SEQ ID NO:8), RSAHLSR (SEQ ID NO:25), TSGHLSR (SEQ ID NO:26);
(viii) LRHHLTR (SEQ ID NO:27), RRFTLSK (SEQ ID NO:28), RSDVLSE (SEQ ID NO:29), KHSTRRV (SEQ ID NO:30), RSDVLSE (SEQ ID NO:29), RLYTLHK (SEQ ID NO:47); или
(ix) RSADLTR (SEQ ID NO:34), QSGDLTR (SEQ ID NO:35), RSDHLSE (SEQ ID NO:36), RSAHLSR (SEQ ID NO:25); и
регулирующий транскрипцию домен или нуклеазный домен,
где указанный репрессор транскрипции подавляет экспрессию гена MAPT.
2. Репрессор транскрипции по п. 1, где указанный ДНК-связывающий домен на основе ZFP содержит RSADLTR (SEQ ID NO:34), QSGDLTR (SEQ ID NO:35), RSDHLSE (SEQ ID NO:36) и RSAHLSR (SEQ ID NO:25) для F1-F4 соответственно.
3. Репрессор транскрипции по п. 1, где указанный ДНК-связывающий домен на основе ZFP содержит RSANLTR (SEQ ID NO:17), DSSHLEL (SEQ ID NO:18), DRSNLTR (SEQ ID NO:19), DRSHLTR (SEQ ID NO:20) и DRSHLAR (SEQ ID NO:8) для F1-F5 соответственно.
4. Репрессор транскрипции по п. 1, где указанный ДНК-связывающий домен на основе ZFP содержит RSDNLSE (SEQ ID NO:21), TSSNRKT (SEQ ID NO:22), TSGNLTR (SEQ ID NO:13), DRSALAR (SEQ ID NO:23) и RNSDRTK (SEQ ID NO:24) для F1-F5 соответственно.
5. Репрессор транскрипции по п. 1, где указанный ДНК-связывающий домен на основе ZFP содержит LRHHLTR (SEQ ID NO:27), RRFTLSK (SEQ ID NO:28), RSDVLSE (SEQ ID NO:29), KHSTRRV (SEQ ID NO:30), RSDVLSE (SEQ ID NO:29) и RLYTLHK (SEQ ID NO:47) для F1-F6 соответственно.
6. Репрессор транскрипции по п. 1, где указанный ДНК-связывающий домен на основе ZFP содержит DSSHLEL (SEQ ID NO:18), DRSNLTR (SEQ ID NO:19), DRSHLTR (SEQ ID NO:20), DRSHLAR (SEQ ID NO:8), RSAHLSR (SEQ ID NO:25) и TSGHLSR (SEQ ID NO:26) для F1-F6 соответственно.
7. Репрессор транскрипции по п. 1, где указанный ДНК-связывающий домен на основе ZFP содержит DSSHLEL (SEQ ID NO:18), DRSNLTR (SEQ ID NO:19), DRSHLTR (SEQ ID NO:20), DRSHLAR (SEQ ID NO:8), RSAHLSR (SEQ ID NO:25) и TSGHLSR (SEQ ID NO:26) для F1-F6 соответственно и мутацию Qm5 в области остова F1, F3 и F5.
8. Репрессор транскрипции по п. 1, где указанный ДНК-связывающий домен на основе ZFP содержит RSDNLAR (SEQ ID NO:7), DRSHLAR (SEQ ID NO:8), QSGNLAR (SEQ ID NO:9) и QSNTRIM (SEQ ID NO:10) для F1-F4 соответственно.
9. Репрессор транскрипции по п. 1, где указанный ДНК-связывающий домен на основе ZFP содержит ERGTLAR (SEQ ID NO:11), TSANLSR (SEQ ID NO:12), TSGNLTR (SEQ ID NO:13), HRTSLTD (SEQ ID NO:14), RSHSLLR (SEQ ID NO:15) и HPSARKR (SEQ ID NO:16) для F1-F6 соответственно.
10. Репрессор транскрипции по п. 1, где указанный ДНК-связывающий домен на основе ZFP содержит LRHHLTR (SEQ ID NO:27), RRFTLSK (SEQ ID NO:28), RSDVLSE (SEQ ID NO:29), KHSTRRV (SEQ ID NO:30), RSDVLSE (SEQ ID NO:29) и RLYTLHK (SEQ ID NO:47) для F1-F6 соответственно и мутацию Qm5 в области остова F1 и F5.
11. Репрессор транскрипции по п. 1, где указанный ДНК-связывающий домен на основе ZFP содержит DRSHLTR (SEQ ID NO:20), LKQHLTR (SEQ ID NO:37), RSAHLSR (SEQ ID NO:25), TSGHLSR (SEQ ID NO:26), QSGNLAR (SEQ ID NO:9) и QSGDLTR (SEQ ID NO:35) для F1-F6 соответственно.
12. Репрессор транскрипции по п. 1, где указанный ДНК-связывающий домен на основе ZFP содержит DRSHLTR (SEQ ID NO:20), LKQHLTR (SEQ ID NO:37), RSAHLSR (SEQ ID NO:25), TSGHLSR (SEQ ID NO:26), QSGNLAR (SEQ ID NO:9) и QSGDLTR (SEQ ID NO:35) для F1-F6 соответственно и мутацию Qm5 в области остова F1 и F5.
13. Репрессор транскрипции по п. 1, где указанный ДНК-связывающий домен на основе ZFP содержит DRSHLTR (SEQ ID NO:20), LKQHLTR (SEQ ID NO:37), RSAHLSR (SEQ ID NO:25), TSGHLSR (SEQ ID NO:26), QSGNLAR (SEQ ID NO:9) и QSGDLTR (SEQ ID NO:35) для F1-F6 соответственно и мутацию Qm5 в области остова F1, F3 и F5.
14. Репрессор транскрипции по п. 1, где указанный ДНК-связывающий домен на основе ZFP содержит DSSHLEL (SEQ ID NO:18), DRSNLTR (SEQ ID NO:19), DRSHLTR (SEQ ID NO:20), DRSHLAR (SEQ ID NO:8), RSAHLSR (SEQ ID NO:25) и TSGHLSR (SEQ ID NO:26) для F1-F6 соответственно и мутацию Qm5 в области остова F3 и F5.
15. Репрессор транскрипции по п. 1, где указанный ДНК-связывающий домен на основе ZFP содержит RSAHLSR (SEQ ID NO:25), TSGHLSR (SEQ ID NO:26), QSGNLAR (SEQ ID NO:9), QSGDLTR (SEQ ID NO:35), DRSHLSR (SEQ ID NO:38) и DRSHLAR (SEQ ID NO:8) для F1-F6 соответственно.
16. Репрессор транскрипции по п. 1, где указанный ДНК-связывающий домен на основе ZFP содержит RSAHLSR (SEQ ID NO:25), TSGHLSR (SEQ ID NO:26), QSGNLAR (SEQ ID NO:9), QSGDLTR (SEQ ID NO:35), DRSHLSR (SEQ ID NO:38) и DRSHLAR (SEQ ID NO:8) для F1-F6 соответственно и мутацию Qm5 в области остова F1, F3 и F5.
17. Репрессор транскрипции по п. 1, где указанный ДНК-связывающий домен на основе ZFP содержит ERGTLAR (SEQ ID NO:11), TSANLSR (SEQ ID NO:12), TSGNLTR (SEQ ID NO:13), HRTSLTD (SEQ ID NO:14), RSHSLLR (SEQ ID NO:15) и HPSARKR (SEQ ID NO:16) для F1-F6 соответственно и мутацию Qm5 в области остова F5.
18. Репрессор транскрипции по любому из пп. 1-17, где указанный регулирующий транскрипцию домен содержит домен KRAB.
19. Репрессор транскрипции по любому из пп. 1-18, где указанный ДНК-связывающий домен на основе ZFP связывается с сайтом-мишенью в гене MAPT человека.
20. Полинуклеотид, кодирующий репрессор транскрипции по любому из пп. 1-19.
21. Средство доставки генов, включающее аденоассоциированный вирусный (AAV) вектор, где указанный AAV вектор содержит полинуклеотид по п. 20 между нуклеотидными последовательностями инвертированных концевых повторов указанного AAV вектора, где указанное средство доставки гена позволяет осуществить экспрессию указанного полинуклеотида в клетке, трансдуцированной указанным вектором.
22. Средство доставки генов по п. 21, где указанный AAV вектор представляет собой AAV6, AAV9 или AAV2/9 вектор.
23. Фармацевтическая композиция для подавления экспрессии MAPT, содержащая один или более различных репрессоров транскрипции по любому из пп. 1-19, один или более различных полинуклеотидов по п. 20 и/или одно или более различных средств доставки генов по п. 21 или 22.
24. Фармацевтическая композиция по п. 23, где указанный репрессор транскрипции включает нуклеазный домен, расщепляющий ген MAPT.
25. Фармацевтическая композиция по п. 24, дополнительно содержащая донорную молекулу нуклеиновой кислоты для интеграции в расщепленный ген MAPT.
26. Применение одного или более различных репрессоров транскрипции по любому из пп. 1-19, одного или более различных полинуклеотидов по п. 20, одного или более различных средств доставки генов по п. 21 или 22 и/или фармацевтической композиции по любому из пп. 23-25 для подавления экспрессии MAPT у субъекта.
27. Применение по п. 26, где введение субъекту является интрацеребровентрикулярным, интратекальным, интракраниальным, внутривенным, ретроорбитальным или интрацистернальным.
28. Применение по п. 26 или 27, где подавление экспрессии MAPT у субъекта лечит и/или предотвращает таупатию.
29. Применение по любому из пп. 26-28, где количество тау у субъекта снижается.
30. Набор для подавления экспрессии MAPT, включающий один или более различных репрессоров транскрипции по любому из пп. 1-19, один или более различных полинуклеотидов по п. 20, одно или более различных средств доставки генов по п. 21 или 22, фармацевтическую композицию по любому из пп. 23-25 и инструкции по применению.
| US 20150353917 A1, 10.12.2015 | |||
| US 20030021776 A1, 30.01.2003 | |||
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2010 |
|
RU2582916C2 |
| Aravind Asokan et al | |||
| "The AAV Vector Toolkit: Poised at the Clinical Crossroads", Molecular Therapy, Vol | |||
| Прибор для промывания газов | 1922 |
|
SU20A1 |
| Приспособление для укладки спичечных или т.п. коробок рядами | 1925 |
|
SU699A1 |
Авторы
Даты
2023-02-03—Публикация
2017-12-01—Подача