Область техники, к которой относится настоящее изобретение
Настоящее раскрытие относится к специфичному связыванию антитела к ICAM-1 с ICAM-1 или его антигенсвязывающего фрагмента, и их применению, более конкретно, к антителу к ICAM-1 или его антигенсвязывающему фрагменту, и фармацевтической композиции для предупреждения и/или лечения заболевания, опосредованного иммунными клетками, и фармацевтической композиции для регулирования функции и/или дифференцировки дендритных клеток, содержащей антитело или антигенсвязывающий фрагмент.
Предшествующий уровень техники настоящего изобретения
Дендритные клетки (DC) представляют собой хорошо охарактеризованные антигенпрезентирующие клетки, которые интегрируют множество иммунных ответов и включают гетерогенное семейство антигенпрезентирующих клеток, которые участвуют в инициации иммунитета и иммунной толерантности. В настоящее время известно, что незрелые дендритные клетки индуцируют переход Т-клеток в состоянии анергии, а дендритные клетки, трансформированные в зрелые дендритные клетки активными стимуляторами, такими как липополисахарид (LPS), индуцируют ответы первичных Т-клеток. Кроме того, полузрелые дендритные клетки с уникальными профилями продуцирования цитокинов могут выполнять иммунотолерантные функции.
ICAM-1 (молекула межклеточной адгезии 1) обозначает домен 1 - домен 5, а также гликопротеин клеточной поверхности I типа размером 90 кДа, состоящий из пяти внеклеточных доменов суперсемейства иммуноглобулинов, пронумерованных от N-конца к C-концу, трансмембранной области и внутриклеточной области.
ICAM-1 опосредует лейкоцитарно-лейкоцитарные взаимодействия, такие как взаимодействия между Т-клетками и антигенпрезентирующими клетками. Также он опосредует отток лейкоцитов в ткани во время воспалительного процесса. В соответствии с исследованием in vitro, было высказано предположение, что антитела, которые нарушают взаимодействие ICAM-1 и антигена-1, связанного с функцией лейкоцитов (LFA-1), могут нарушать адгезию Т-клеток к эндотелиальным клеткам, и было высказано предположение, что активация Т-клеток этими антителами также может быть значительно снижена в смешанных лимфоцитах (Proc Natl Acad Sci USA. 1988, 85:3095-3099). В исследовании на обезьянах с использованием R6-5-D6 (энлимомаба), мышиного моноклонального антитела, которое связывается с доменом человеческого ICAM-1, выживаемость почечных аллотрансплантатов повысилось, а проникновение Т-клеток в трансплантат снизилось по сравнению с контрольной группой (J Immunol. 1990, 144:4604-4612). Кроме того, было продемонстрировано, что энлимомаб оказывает ингибирующее действие в отношении активности заболевания у пациентов с ревматоидным артритом (Arthritis Rheum. 1994, 37:992-999; J Rheumatol. 1996, 23:1338-1344). Однако лечение энлимомабом после трансплантации почки не очень эффективно для снижения частоты острого отторжения или риска задержки функционирования трансплантата. Кроме того, энримомаб блокирует адгезию нейтрофилов, а также Т-клеток к эндотелиальным клеткам сосудов, и, таким образом, сообщалось, что нарушение миграции нейтрофилов потенциально повышает восприимчивость к инфекции (J. Immunol. 1999, 162:2352-2357). Существует необходимость в разработке вещества, которое специфически связывается с ICAM-1 для регулирования дифференцировки и функции дендритных клеток, тем самым более эффективно контролируя иммунный ответ.
Подробное описание сущности изобретения
Техническая проблема
В одном примере предусмотрено антитело к ICAM-1 или его антигенсвязывающий фрагмент, который специфически распознает ICAM-1.
Антитело к ICAM-1 или его антигенсвязывающий фрагмент может содержать области, определяющие комплементарность, тяжелой цепи (CDR), содержащие полипептид (CDR-H1), содержащий аминокислотную последовательность под SEQ ID NO: 1 (GYTFTDYA), полипептид (CDR-H2), содержащий аминокислотную последовательность под SEQ ID NO: 2 (ISTYSGNT), и полипептид (CDR-H3), содержащий аминокислотную последовательность под SEQ ID NO: 3 (ARSLYFGSSGFDY), или вариабельную область тяжелой цепи, содержащую область, определяющую комплементарность, тяжелой цепи, описанную выше; и области, определяющие комплементарность, легкой цепи, содержащие полипептид (CDR-L1), содержащий аминокислотную последовательность под SEQ ID NO: 4 (QTLVYRNGNTY), полипептид (CDR-L2), содержащий аминокислотную последовательность под SEQ ID NO: 5 (KVS), и полипептид (CDR-L3), содержащий аминокислотную последовательность под SEQ ID NO: 6 (SQNTHFPYT), или вариабельную область легкой цепи, содержащую область, определяющую комплементарность, легкой цепи, описанную выше.
В соответствии с одним вариантом осуществления вариабельная область тяжелой цепи может содержать аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 7 и 11-34, и вариабельная область легкой цепи может содержать аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 8 и 35-38.
В другом примере предусмотрена молекула нуклеиновой кислоты, кодирующая область, определяющую комплементарность, тяжелой цепи, вариабельную область тяжелой цепи или тяжелую цепь антитела к ICAM-1.
В другом примере предусмотрена молекула нуклеиновой кислоты, кодирующая область, определяющую комплементарность, легкой цепи, вариабельную область легкой цепи или легкую цепь антитела к ICAM-1.
В другом примере предусмотрен рекомбинантный вектор, содержащий молекулу нуклеиновой кислоты, кодирующую область, определяющую комплементарность, тяжелой цепи, вариабельную область тяжелой цепи или тяжелую цепь антитела к ICAM-1, и молекулу нуклеиновой кислоты, кодирующую область, определяющую комплементарность, легкой цепи, вариабельную область легкой цепи или легкую цепь антитела к ICAM-1, в одном векторе или каждое в отдельных векторах.
В другом примере может быть предусмотрена рекомбинантная клетка, содержащая рекомбинантный вектор.
В другом примере может быть предусмотрена фармацевтическая композиция для предупреждения и/или лечения заболевания, содержащая антитело к ICAM-1 или его антигенсвязывающий фрагмент в качестве активного ингредиента. Заболевание может представлять собой заболевание, опосредованное иммунными клетками. В другом примере предусмотрен способ предупреждения и/или лечения заболевания, опосредованного иммунными клетками, при этом способ включает стадию введения фармацевтически эффективного количества антитела к ICAM-1 и/или антигенсвязывающего фрагмента субъекту, нуждающемуся в предупреждении и/или лечении заболевания, опосредованного иммунными клетками. Способ может дополнительно включать стадию идентификации субъекта, нуждающегося в предупреждении и/или лечении заболевания, опосредованного иммунными клетками, перед стадией введения. В другом примере предусмотрено применение антитела к ICAM-1 или его антигенсвязывающего фрагмента для предупреждения и/или лечения заболевания, опосредованного иммунными клетками, или применение антитела к ICAM-1 или его антигенсвязывающего фрагмента в изготовлении лекарственного препарата для предупреждения или лечения заболевания, опосредованного иммунными клетками. В фармацевтической композиции, способе и применении заболевание, опосредованное иммунными клетками, может быть выбрано из отторжения трансплантата, реакции «трансплантат против хозяина», астмы, аутоиммунного заболевания и т.п.
В другом примере предусмотрена фармацевтическая композиция для регулирования функции и/или дифференцировки дендритной клетки, содержащая антитело к ICAM-1 или его антигенсвязывающий фрагмент в качестве активного ингредиента. В другом примере предусмотрен способ регулирования функции и/или дифференцировки дендритной клетки, включающий стадию введения фармацевтически эффективного количества антитела к ICAM-1 или его антигенсвязывающего фрагмента субъекту, нуждающемуся в регуляции функции и/или дифференцировки дендритной клетки. В другом примере предусмотрено применение антитела к ICAM-1 или его антигенсвязывающего фрагмента в изготовлении лекарственного препарата для регуляции функции и/или дифференцировки заболевания, опосредованного иммунными клетками.
Техническое решение
В настоящем описании предусмотрено антитело к ICAM-1 или его антигенсвязывающий фрагмент, который специфично распознает ICAM-1, и их применение.
Антитело к ICAM-1 или его антигенсвязывающий фрагмент характеризуется тем, что он специфично распознает домен 2 среди доменов ICAM-1 и/или связывается с ним. Антитело к ICAM-1 или его антигенсвязывающий фрагмент может представлять собой антагонист, обладающий ингибирующей активностью в отношении ICAM-1. Однако антитело не ингибирует само связывание ICAM-1 и LFA-1 путем связывания с доменом 2, а не с доменом 1 ICAM-1, который представляет собой сайт связывания для LFA-1, лиганда ICAM-1, который представляет собой антиген. Это может быть подтверждено тем фактом, что антитело не ингибирует трансмиграцию Т-клеток. Антитело может потенциально влиять на активацию пространственной функции иммунных синапсов для передачи Т-клеточной активности и связывания и реорганизации между родственными белками, поскольку оно подавляет иммунную активность Т-клеток при кокультивировании с дендритными клетками и Т-клетками и функционально индуцирует иммунную супрессию, индуцируя дифференцировку в толерогенные дендритные клетки. В этом отношении антитело может представлять собой антагонист, который функционально ингибирует активность ICAM-1, а не физически ингибирует связывание рецептора и лиганда. Кроме того, антитело может индуцировать результат подавления иммунной активности Т-клеток, содержащих лиганд, в результате вышеописанной активности. Другими словами, антитело к ICAM-1 или его антигенсвязывающий фрагмент, предусмотренные в настоящем документе, могут ингибировать функцию и/или дифференцировку дендритной клетки и могут оказывать профилактический и/или терапевтический эффект на заболевание, опосредованное иммунными клетками. путем связывания с доменом 2 ICAM-1 (например, человеческого ICAM-1) и индукции антигенспецифичной Т-клеточной толерантности.
ICAM-1 (молекула межклеточной адгезии 1), также называемый CD54 (кластер дифференцировки 54), представляет собой гликопротеин клеточной поверхности, экспрессируемый на эндотелиальной клетке или клетке иммунной системы.
ICAM-1, выступающий в качестве антигена антитела, предусмотренного в настоящем документе, может происходить от млекопитающих, например, представлять собой человеческий ICAM-1 (например, номера доступа в NCBI NP_000192.2 и т.д.), обезьяний ICAM-1 (например, номера доступа в NCBI NP_001266532 и т.д.). В одном примере антитело может проявлять перекрестную реактивность с человеческим ICAM-1 и обезьяньим ICAM-1.
В настоящем описании термин «антитело» относится к веществу, продуцируемому с помощью стимуляции антигена в иммунной системе, или белка, который специфично связывается с конкретным антигеном, и используется в качестве концепции для включения белка, полученного рекомбинантно или синтетически на основе вещества или белка. Антитело может быть получено не естественным путем, например, рекомбинантным или синтетическим путем. Антитело может представлять собой животное антитело (например, мышиное антитело и т.д.), химерное антитело (например, химерное антитело мышь-человек), гуманизированное антитело или человеческое антитело. Антитело может представлять собой моноклональное антитело или поликлональное антитело.
Кроме того, в настоящем описании можно понять, что антитело включает в себя все фрагменты антитела, обладающие антигенсвязывающей способностью, если не указано иное. В настоящем описании термин «области, определяющие комплементарность (CDR)» относится к области, которая придает антигенсвязывающую специфичность среди вариабельных областей антитела. Антигенсвязывающий фрагмент антитела, описанного выше, может представлять собой фрагмент антитела, содержащий одну или несколько областей, определяющих комплементарность.
В одном примере предусмотрено антитело к ICAM-1 или его антигенсвязывающий фрагмент, который специфично распознает ICAM-1 или специфично связывается с ICAM-1.
Антитело к ICAM-1 или его антигенсвязывающий фрагмент может содержать области, определяющие комплементарность, тяжелой цепи (CDR), содержащие полипептид (CDR-H1), содержащий аминокислотную последовательность под SEQ ID NO: 1 (GYTFTDYA), полипептид (CDR-H2), содержащий аминокислотную последовательность под SEQ ID NO: 2 (ISTYSGNT), и полипептид (CDR-H3), содержащий аминокислотную последовательность под SEQ ID NO: 3 (ARSLYFGSSGFDY), или вариабельную область тяжелой цепи, содержащую область, определяющую комплементарность, тяжелой цепи, описанную выше; и области, определяющие комплементарность, легкой цепи, содержащие полипептид (CDR-L1), содержащий аминокислотную последовательность под SEQ ID NO: 4 (QTLVYRNGNTY), полипептид (CDR-L2), содержащий аминокислотную последовательность под SEQ ID NO: 5 (KVS), и полипептид (CDR-L3), содержащий аминокислотную последовательность под SEQ ID NO: 6 (SQNTHFPYT), или вариабельную область легкой цепи, содержащую область, определяющую комплементарность, легкой цепи, описанную выше.
В вариабельной области тяжелой цепи каркас 1 тяжелой цепи (VH-FR1; N-концевая прилегающая область CDRH1) может содержать аминокислотную последовательность под SEQ ID NO: 97 (QVQLX1QSGAEX2X3X4PGX5SVKX6SCKX7S; X1 представляет собой Q или V, X2 представляет собой L или V, X3 представляет собой V или K, X4 представляет собой R или K, X5 представляет собой V или A, X6 представляет собой I или V, X7 представляет собой G или A) или под SEQ ID NO: 98 (QVQLX8QSGAEVX9KPGASVKX10SCKX11S; X8 представляет собой V или Q, X9 представляет собой K или V, X10 представляет собой I или V, X11 представляет собой G или A), например, аминокислотную последовательность, выбранную из SEQ ID NO: 39, 40, 41, 42, 43, 44, 45, 46, 47 и 48, каркас 2 тяжелой цепи (VH-FR2; область между C-концом CDRH1 и N-концом CDRH2) может содержать аминокислотную последовательность под SEQ ID NO: 99 (LHWVX12QX13X14X15X16X17LEWX18GV; X12 представляет собой K или R, X13 представляет собой S или A, X14 представляет собой H или P, X15 представляет собой A или G, X16 представляет собой K или Q, X17 представляет собой S или R, X18 представляет собой I или M) или под SEQ ID NO: 100 (LHWVX19QAPGQX20LEWX21GV; X19 представляет собой R или K, X20 представляет собой R или S, X21 представляет собой I или M), например, аминокислотную последовательность, выбранную из SEQ ID NO: 49, 50, 51, 52, 53, 54 и 55, каркас 3 тяжелой цепи (VH-FR3; область между C-концом CDRH2 и N-концом CDRH3) может содержать аминокислотную последовательность под SEQ ID NO: 101 (X22YX23QKFX24GX25X26TX27TX28DX29SX30X31TAYX32ELX33X34LX35SEDX36AX37X38YC; X22 представляет собой D или K, X23 представляет собой N или S, X24 представляет собой R или Q, X25 представляет собой K или R, X26 представляет собой A или V, X27 представляет собой M или I, X28 представляет собой V или R, X29 представляет собой K или T, X30 представляет собой S или A, X31 представляет собой T или S, X32 представляет собой L или M, X33 представляет собой A или S, X34 представляет собой R или S, X35 представляет собой T или R, X36 представляет собой S или T, X37 представляет собой I или V, X38 представляет собой H или Y) или под SEQ ID NO: 102 (X39YX40QKFX41GX42X43TX44TX45RX46SAX47TAYX48ELSSLRSEDTAX49X50YC; X39 представляет собой D или K, X40 представляет собой N или S, X41 представляет собой R или Q, X42 представляет собой R или K, X43 представляет собой A или V, X44 представляет собой I или M, X45 представляет собой R или V, X46 представляет собой T или K, X47 представляет собой S или T, X48 представляет собой M или L, X49 представляет собой V или I, X50 представляет собой Y или H), например, аминокислотную последовательность, выбранную из SEQ ID NO: 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79 и 80, и/или каркас 4 тяжелой цепи (VH-FR4; область, прилегающая к С-концу CDRH3) может содержать аминокислотную последовательность под SEQ ID NO: 81.
В вариабельной области легкой цепи каркас 1 легкой цепи (VL-FR1; N-концевая прилегающая область CDRL1) может содержать аминокислотную последовательность под SEQ ID NO: 103 (DVVLTQX51PLSX52PVX53LGX54X55ASISCRSS; X51 представляет собой T или S, X52 представляет собой L или S, X53 представляет собой N или T, X54 представляет собой D или Q, X55 представляет собой Q или P) или под SEQ ID NO: 104 (DVVLTQX56PLSX57PVTLGQPASISCRSS; X56 представляет собой S или T, X57 представляет собой L или S), например, аминокислотную последовательность, выбранную из SEQ ID NO: 82, 83 и 84, каркас 2 легкой цепи (VL-FR2; область между C-концом CDRL1 и N-концом CDRL2) может содержать аминокислотную последовательность под SEQ ID NO: 105 (LHWYX58QX59X60GQX61PX62LLIX63; X58 представляет собой L или Q, X59 представляет собой K или R, X60 представляет собой A или P, X61 представляет собой S или P, X62 представляет собой K или R, X63 представляет собой Y или отсутствует), например, аминокислотную последовательность, выбранную из SEQ ID NO: 85, 86, 87, 88 и 89, каркас 3 легкой цепи (VL-FR3; область между C-концом CDRL2 и N-концом CDRL3) может содержать аминокислотную последовательность под SEQ ID NO: 106 (NRFSGVPDRFSGSGX64GTDFTLKISRVEAEDX65GVYFC; X64 представляет собой S или А, X65 представляет собой L или V), например, аминокислотную последовательность, выбранную из SEQ ID NO: 90, 91 и 93, и/или каркас 4 легкой цепи (VL-FR4; область, прилегающая к С-концу CDRL3) может содержать аминокислотную последовательность под SEQ ID NO: 107 (FGGGTKX66X67X68X69X70; X66 представляет собой I или L, X67 представляет собой K или E, X68 представляет собой R или I, X69 представляет собой Q или K, X70 представляет собой R или отсутствует), например, аминокислотную последовательность под SEQ ID NO: 93 или 94.
В антителе к ICAM-1 или его антигенсвязывающем фрагменте вариабельная область тяжелой цепи может содержать VH-FR1, содержащую аминокислотную последовательность под SEQ ID NO: 97 или 98 (например, SEQ ID NO: 39, 40, 41, 42, 43, 44, 45, 46, 47 или 48), CDRH1, содержащую аминокислотную последовательность под SEQ ID NO: 1, VH-FR2, содержащую аминокислотную последовательность под SEQ ID NO: 99 или 100 (например, SEQ ID NO: 49, 50, 51, 52, 53, 54 или 55), CDRH2, содержащую аминокислотную последовательность под SEQ ID NO: 2, VH-FR3, содержащую аминокислотную последовательность под SEQ ID NO: 101 или 102 (например, SEQ ID NO: 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, or 80), CDRH3, содержащую аминокислотную последовательность под SEQ ID NO: 3, и VH-FR4, содержащую аминокислотную последовательность под SEQ ID NO: 81; и вариабельная область легкой цепи может содержать VL-FR1, содержащую аминокислотную последовательность под SEQ ID NO: 103 или 104 (например, SEQ ID NO: 82, 83 или 84), CDRL1, содержащую аминокислотную последовательность под SEQ ID NO: 4, VL-FR2, содержащую аминокислотную последовательность под SEQ ID NO: 105 (например, SEQ ID NO: 85, 86, 87, 88 или 89), CDRL2, содержащую аминокислотную последовательность под SEQ ID NO: 5, VL-FR3, содержащую аминокислотную последовательность под SEQ ID NO: 106 (например, SEQ ID NO: 90, 91 или 93), CDRL3, содержащую аминокислотную последовательность под SEQ ID NO: 6, и VL-FR4, содержащую аминокислотную последовательность под SEQ ID NO: 107 (например, SEQ ID NO: 93 или 94).
В соответствии с одним вариантом осуществления вариабельная область тяжелой цепи может содержать аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 7 и 11-34, и вариабельная область легкой цепи может содержать аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 8 и 35-38.
Антитела животного происхождения, полученные путем иммунизации необходимым антигеном иммунизированного животного, обычно могут вызывать реакцию иммунного отторжения при введении людям с терапевтической целью, и было разработано химерное антитело для подавления этой реакции иммунного отторжения. Химерные антитела представляют собой антитела, полученные путем замены константной области антитела животного происхождения, которая вызывает антиизотипический ответ, константной областью человеческого антитела с применением методов генной инженерии. Химерные антитела значительно улучшили антиизотипический ответ по сравнению с антителами животного происхождения, но аминокислоты животного происхождения все еще присутствуют в вариабельной области, что имеет побочные эффекты для потенциального антиидиотипического ответа. Для уменьшения этих побочных эффектов было разработано гуманизированное антитело. Его получают путем привития области CDR (областей, определяющих комплементарность), которая играет важную роль в связывании антигена среди вариабельных областей химерного антитела, в каркас человеческого антитела.
Самым важным в технологии прививания CDR для получения гуманизированного антитела является выбор оптимизированного человеческого антитела, которое может лучше всего принимать области CDR антитела животного происхождения, с этой целью можно использовать применение баз данных антител, анализ кристаллической структуры, технологию молекулярного моделирования и т.п.
В соответствии с одним вариантом осуществления антитело может представлять собой животное антитело (например, мышиное антитело), химерное антитело (например, химерное антитело мышь-человек) или гуманизированное антитело.
В антителе или антигенсвязывающем фрагменте каркас тяжелой цепи и/или константная область тяжелой цепи, за исключением CDR тяжелой цепи под SEQ ID NO: 1-3 могут представлять собой каркас тяжелой цепи и/или константную область тяжелой цепи, полученную из иммуноглобулина (IgG (IgG1, IgG2, IgG3, IgG4 и т.д.), IgM, IgA, IgD или IgE), например, человеческого иммуноглобулина (IgG (IgG1, IgG2, IgG3, IgG4 и т.д.), IgM, IgA, IgD или IgE) и каркас легкой цепи и/или константная область легкой цепи, за исключением CDR легкой цепи под SEQ ID NO: 4-6 могут представлять собой каркас легкой цепи и/или константную область легкой цепи типа каппа (κ) или лямбда (λ).
Полное антитело имеет две полноразмерные легкие цепи и две полноразмерные тяжелые цепи, в которых каждая легкая цепь связана с тяжелой цепью посредством дисульфидной связи. Константная область антитела делится на константную область тяжелой цепи и константную область легкой цепи, и константная область тяжелой цепи имеет тип гамма (γ), мю (μ), альфа (α), дельта (δ) и эпсилон (ε) и имеет подклассы гамма 1 (γ1), гамма 2 (γ2), гамма 3 (γ3), гамма 4 (γ4), альфа 1 (α1) и альфа 2 (α2). Константная область легкой цепи имеет тип каппа (κ) и лямбда (λ).
Термин «тяжелая цепь» предназначен для охвата полноразмерных тяжелых цепей и их фрагментов, при этом полноразмерная тяжелая цепь содержит домен VH вариабельной области, включая аминокислотные последовательности, достаточные для обеспечения специфичности к антигенам, три константные области, CH1, CH2 и CH3, и шарнир. Кроме того, термин «легкая цепь» предназначен для охвата полноразмерных легких цепей и их фрагментов, полноразмерных легких цепей, содержащих домен VL вариабельной области, включая аминокислотные последовательности, достаточные для обеспечения специфичности к антигенам, и константную область CL.
Термин «область, определяющая комплементарность (CDR)» относится к аминокислотной последовательности, встречающейся в гипервариабельной области тяжелой цепи или легкой цепи иммуноглобулина. Тяжелая и легкая цепи могут соответственно содержать три CDR (CDRH1, CDRH2 и CDRH3; и CDRL1, CDRL2 и CDRL3). CDR может обеспечивать контактный остаток, который играет важную роль в связывании антител с антигенами или эпитопами. С другой стороны, в настоящем описании термины «специфически связывание» и «специфическое распознавание» имеют то же общее значение, которое известно специалисту в данной области техники, и указывают на то, что антитело и антиген специфически взаимодействуют друг с другом, вызывая иммунологическую реакцию.
Термин «антигенсвязывающий фрагмент» относится к фрагментам интактного иммуноглобулина, содержащим часть полипептида, составляющую антигенсвязывающий сайт, например, часть антитела, содержащую CDR. Например, антигенсвязывающий фрагмент может представлять собой scFv, (scFv)2, scFvFc, Fab, Fab′ или F(ab′)2.
Fab представляет собой структуру, имеющую вариабельную область легкой цепи и тяжелой цепи, константную область легкой цепи и первую константную область (CH1) тяжелой цепи, и имеет один антигенсвязывающий сайт. Fab' отличается от Fab тем, что Fab' содержит шарнирную область по меньшей мере с одним остатком цистеина на С-конце CH1. Антитело F(ab')2 образуется за счет дисульфидного связывания остатков цистеина в шарнирной области Fab'. Fv представляет собой минимальный фрагмент антитела, состоящий только из вариабельной области тяжелой цепи и вариабельной области легкой цепи. Методики рекомбинации для генерации фрагмента Fv широко известны из уровня техники. Двухцепочечный Fv содержит вариабельную область тяжелой цепи и область легкой цепи, которые связаны друг с другом с помощью нековалентной связи. Одноцепочечный Fv обычно содержит вариабельную область тяжелой цепи и вариабельную область легкой цепи, которые связаны друг с другом с помощью ковалентной связи посредством пептидного линкера или связаны на С-концах с образованием димерной структуры, подобной двухцепочечному Fv.
Антигенсвязывающие фрагменты могут быть получены с помощью протеазы (например, Fab может быть получен с помощью рестриктивного расщепления целого антитела папаином, а фрагмент F (ab')2 может быть получен с помощью расщепления пепсином) или может быть получен путем с использованием методики генетической рекомбинации.
Термин «шарнирная область», используемый в настоящем документе, относится к области между доменами CH1 и CH2 в тяжелой цепи антитела, которая обеспечивает гибкость антигенсвязывающего сайта.
Антитело к ICAM-1 может представлять собой моноклональное антитело. Моноклональное антитело можно получить с помощью метода, широко известного в данной области техники, например, с помощью метода фагового дисплея. В качестве альтернативы антитело к ICAM-1 может быть сконструировано в форме моноклонального антитела животного происхождения (например, мышиного) с помощью обычного способа.
Между тем, отдельные моноклональные антитела можно подвергать скринингу на основе способности связывания с ICAM-1 с использованием типичного формата ELISA (иммуноферментного анализа). Ингибирующая активность может быть определена с помощью функциональных анализов, таких как клеточный анализ, или функциональных анализов, таких как конкурентный ELISA (конкурентный ELISA) для анализа молекулярных взаимодействий в случае конъюгатов. Соответствующую аффинность (значения Kd) в отношении ICAM-1 затем можно проанализировать для выбранных представителей моноклональных антител на основании сильной ингибирующей активности.
В другом примере предусмотрена фармацевтическая композиция для предупреждения и/или лечения заболевания, содержащая антитело к ICAM-1 или его антигенсвязывающий фрагмент в качестве активного ингредиента. Заболевание может представлять собой заболевание, опосредованное иммунными клетками. В другом примере предусмотрен способ предупреждения и/или лечения заболевания, опосредованного иммунными клетками, при этом способ включает стадию введения фармацевтически эффективного количества антитела к ICAM-1 или его антигенсвязывающего фрагмента субъекту, нуждающемуся в предупреждении и/или лечении заболевания, опосредованного иммунными клетками. Способ может дополнительно включать стадию идентификации пациента, нуждающегося в предупреждении и/или лечении заболевания, опосредованного иммунными клетками, перед стадией введения. В другом примере предусмотрено применение антитела к ICAM-1 или его антигенсвязывающего фрагмента для предупреждения и/или лечения заболевания, опосредованного иммунными клетками, или применение антитела к ICAM-1 или его антигенсвязывающего фрагмента в изготовлении лекарственного препарата для предупреждения или лечения заболевания, опосредованного иммунными клетками.
В случае фармацевтической композиции, способа и применения заболевание, опосредованное иммунными клетками, может быть выбрано из всех заболеваний, связанных с иммунными клетками. Иммунная клетка может представлять собой по меньшей мере клетку, выбранную из группы, состоящей из Т-клетки, В-клетки, дендритной клетки, макрофага, моноцита и т.п. В одном примере заболевание, опосредованное иммунными клетками, может быть выбрано из отторжения трансплантата (например, отторжения, которое происходит во время трансплантации аллогенных клеток, трансплантации аллогенных органов, трансплантации ксеногенных клеток, трансплантации ксеногенных органов), реакции «трансплантат против хозяина» (например, реакции «трансплантат против хозяина», которая возникает во время аллогенной трансплантации костного мозга), астмы, ожирения, сахарного диабета 2 типа, аутоиммунного заболевания (например, энцефаломиелита (например, аллергического энцефаломиелита), ревматоидного артрита, системной красной волчанки (волчанки), атопического дерматита, рассеянного склероза, сахарного диабета 1 типа, хронического воспалительного заболевания (например, воспалительного заболевания кишечника (например, болезни Крона, язвенного колита)), болезни Бехчета, синдрома Шегрена, миастении гравис, склеродермии, узелкового полиартериити, болезни Кикучи, коллагеноза, тиреоидита Хашимото, псориаза, витилиго, гипертиреоза, фибромиалгии, очаговой алопеции, аллергии и т.д.), воспаления, опосредованного иммунными клетками (например, Т-клетками, В-клетками, дендритными клетками, макрофагами, моноцитами и т.д.) (например, воспаления, опосредованного макрофагами и т.д.), воспалительного заболевания, вызванного воспалением, опосредованным иммунными клетками, и т.п.
В другом примере предусмотрена фармацевтическая композиция для регулирования дифференцировки и/или функции дендритных клеток, при этом композиция содержит антитело к ICAM-1 или его антигенсвязывающий фрагмент в качестве активного ингредиента. В другом примере предусмотрен способ регулирования дифференцировки и/или функции дендритной клетки, при этом способ включает стадию введения фармацевтически эффективного количества антитела к ICAM-1 или его антигенсвязывающего фрагмента субъекту, нуждающемуся в регуляции дифференцировки и функция дендритных клеток. В другом примере предусмотрено применение антитела к ICAM-1 или его антигенсвязывающего фрагмента в регуляции дифференцировки и/или функции дендритных клеток или применение антитела к ICAM-1 или его антигенсвязывающего фрагмента в изготовлении лекарственного препарата для регулирования дифференцировки и/или функции дендритных клеток.
Фармацевтическая композиция может дополнительно содержать фармацевтически приемлемый носитель.
Фармацевтически приемлемый носитель может обычно применяться в составе лекарственных средств, и один или несколько из них выбраны из группы, состоящей из лактозы, декстрозы, сахарозы, трегалозы, аргинина, гистидина, сорбита, маннита, крахмала, аравийской камеди, фосфата кальция, альгината, желатина, силиката кальция, микрокристаллической целлюлозы, поливинилпирролидона, целлюлозы, воды, сиропа, метилцеллюлозы, метилгидроксибензоата, пропилгидроксибензоата, талька, стеарата магния, минерального масла и т.д., но без ограничения ими. Фармацевтическая композиция может дополнительно содержать один или несколько компонентов, выбранных из группы, состоящей из разбавителя, наполнителей, смазывающего вещества, смачивающего вещества, подсластителя, ароматизатора, эмульгатора, суспендирующего вещества, консерванта и т.п., которые обычно применяются при изготовлении фармацевтической композиции.
Фармацевтическую композицию или эффективное количество антитела или его антигенсвязывающего фрагмента можно вводить перорально или парентерально. В случае парентерального введения можно вводить внутривенную инъекцию, подкожную инъекцию, внутримышечную инъекцию, внутрибрюшинную инъекцию, эндотелиальное введение, интраназальное введение, внутрилегочное введение, интраректальное введение или местное введение в область поражения. Поскольку пероральное введение приводит к перевариванию белков или пептидов, активный ингредиент в композициях для перорального введения может быть покрыт оболочкой или составлен для предупреждения переваривания в желудке. Кроме того, композицию можно вводить с использованием необязательного устройства, которое позволяет доставлять активный ингредиент к целевой клетке.
Описанное в настоящем документе «фармацевтически эффективное количество» может означать количество или дозировку активного ингредиента (т.е. антитела к ICAM-1 или его антигенсвязывающего фрагмента) и может определяться различными способами с помощью таких факторов, как способ составления, способ введения, возраст пациента, масса, пол, патологическое состояние, питание, время введения, интервал введения, путь введения, скорость выведения и чувствительность ответа.
Содержание антитела к ICAM-1 или его антигенсвязывающего фрагмента или дозировка антитела к ICAM-1 или его антигенсвязывающего фрагмента в фармацевтической композиции может быть назначена различными способами, в зависимости от таких факторов, как способ составления, способ введения, возраст пациента, масса, пол, патологическое состояние, питание, время введения, интервал введения, путь введения, скорость выведения и чувствительность ответа. Например, суточная доза антитела к ICAM-1 или его антигенсвязывающего фрагмента может находиться в диапазоне от 0,001 до 1000 мг/кг, особенно от 0,01 до 100 мг/кг, более конкретно от 0,1 до 50 мг/кг и даже более конкретно от 0,1 до 20 мг/кг, но без ограничения этим. Суточная доза может быть составлена в в одном составе в стандартной лекарственной форме или составлена в соответственно разделенных лекарственных формах, или она может быть изготовлена так, что содержится в контейнере для нескольких доз.
Фармацевтическую композицию можно вводить в комбинации с другими лекарственными препаратами, такими как другие противораковые средства, и могут быть назначены соответствующие назначения в отношении дозы, способа введения и видов других лекарственных препаратов, в зависимости от состояния пациента.
Фармацевтическая композиция может быть составлена в виде раствора в масле или водной среде, суспензии, сиропа, эмульсии, экстракта, порошка, гранул, таблетки или капсулы и может дополнительно содержать для составления диспергирующее или стабилизирующее средство.
Пациент, которому вводят фармацевтическую композицию, может представлять собой млекопитающее, включая примата, включая человека и обезьяну.
Между тем, поскольку антитело к ICAM-1 или его антигенсвязывающий фрагмент специфически связывается с ICAM-1, ICAM-1 может быть обнаружен или подтвержден с их помощью. Соответственно, в другом примере настоящего изобретения предусмотрена композиция для обнаружения ICAM-1, при этом композиция содержит антитело к ICAM-1 или его антигенсвязывающий фрагмент. В другом примере предусмотрен способ обнаружения ICAM-1, при этом способ включает стадию обработки биологического образца антителом к ICAM-1 или его антигенсвязывающим фрагментом; и стадию идентификации наличия реакции антигена и антитела. Если обнаружена реакция антигена и антитела, можно определить (сделать заключение о том), что ICAM-1 присутствует в биологическом образце. Следовательно, способ обнаружения может дополнительно включать стадию определения того, что ICAM-1 присутствует в биологическом образце, когда реакция антигена и антитела обнаруживается после стадии определения наличия реакции антигена и антитела. Биологический образец может быть выбран из группы, состоящей из клеток, тканей и биологических жидкостей, полученных (выделенных) от млекопитающих, таких как люди (например, пациенты, которым предстоит трансплантация или получившие трансплантат, пациенты с аутоиммунными заболеваниями и т.д.), и их культур.
Стадию идентификации наличия реакции антигена и антитела можно осуществлять с помощью различных способов, известных из уровня техники. Например, ее можно определить с помощью обычной ферментативной реакции, флуоресценции, люминесценции и/или обнаружения излучения и, в частности, можно измерить с помощью способа, выбранного из группы, состоящей из иммунохроматографии, иммуногистохимии, иммуноферментного анализа (ELISA), радиоиммуноанализа. (RIA), ферментно-иммуного анализа (EIA), флуоресцентного иммуноанализа (FIA), люминесцентного иммуноанализа (LIA), вестерн-блоттинга, микроматричного анализа и т.д., но без ограничения ими.
В другом примере предусмотрена молекула полипептида, при этом молекула полипептида содержит область, определяющую комплементарность, тяжелой цепи, область, определяющую комплементарность, легкой цепи, или их комбинацию антитела к ICAM-1, описанного выше; или вариабельную область тяжелой цепи, вариабельную область легкой цепи или их комбинацию. Молекула полипептида может использоваться для получения антител в качестве предшественника антитела и может входить в состав белкового каркаса (например, пептитела), биспецифического антитела или мультиспецифического антитела, имеющего структуру, аналогичную структуре антитела.
В другом примере предусмотрена молекула нуклеиновой кислоты, кодирующая область, определяющую комплементарность, тяжелой цепи, вариабельную область тяжелой цепи или тяжелую цепь антитела к ICAM-1.
В другом примере предусмотрена молекула нуклеиновой кислоты, кодирующая область, определяющую комплементарность, легкой цепи, вариабельную область легкой цепи или легкую цепь антитела к ICAM-1.
В другом примере предусмотрен рекомбинантный вектор, содержащий молекулу нуклеиновой кислоты, кодирующую область, определяющую комплементарность, тяжелой цепи, вариабельную область тяжелой цепи или тяжелую цепь антитела к ICAM-1, и молекулу нуклеиновой кислоты, кодирующую область, определяющую комплементарность, легкой цепи, вариабельную область легкой цепи или легкую цепь антитела к ICAM-1, в одном векторе или в отдельных векторах, несущих каждый из полинуклеотидов.
Термин «вектор» относится к способу экспрессии целевого гена в клетке-хозяине, например, плазмидным вектором, космидным вектором и вирусным вектором, таким как вектор бактериофага, аденовирусный вектор, ретровирусный вектор и аденоассоциированный вирусный вектор. Рекомбинантный вектор может быть сконструирован из плазмид, часто применяемых в данной области техники (например, pSC101, pGV1106, pACYC177, ColE1, pKT230, pME290, pBR322, pUC8/9, pUC6, pBD9, pHC79, pIJ61, pLAFR1 pEX, pHV14, серий pET и pUC19), фагов (например, λgt4λB, λ-Charon, λδz1 и M13), или с помощью манипуляций с вирусами (например, SV40 и т.д.).
В рекомбинантном векторе полинуклеотид может быть функционально связан с промотором. Термин «функционально связанный» предназначен для обозначения функциональной связи между нуклеотидной последовательностью, представляющей интерес, и последовательностью, регулирующей экспрессию (например, промоторной последовательностью). Будучи «функционально связанным», регуляторный элемент может контролировать транскрипцию и/или трансляцию других нуклеотидных последовательностей.
Рекомбинантный вектор может быть сконструирован обычно как вектор клонирования или вектор экспрессии. В случае рекомбинантных векторов экспрессии можно использовать вектор, обычно доступный в данной области техники, для экспрессии чужеродного белка в растительных, животных или микробных клетках. Для конструирования рекомбинантных векторов можно применять различные способы, хорошо известные из уровня техники.
Для применения в хозяевах, таких как прокариотические или эукариотические клетки, рекомбинантный вектор может быть сконструирован соответствующим образом. Например, когда вектор конструируется как вектор экспрессии для применения в прокариотическом хозяине, вектор обычно содержит сильный промотор для транскрипции (например, промотор pLκλ, промотор CMV, промотор trp, промотор lac, промотор tac, промотор Т7 и т.д.), сайт связывания рибосомы для инициации трансляции и последовательности терминации транскрипции/трансляции. С другой стороны, вектор экспрессии для применения в эукариотическом хозяине содержит точку инициации репликации, функциональную в эукариотической клетке, такую как точку инициации репликации f1, точку инициации репликации SV40, точку инициации репликации pMB1, точку инициации репликации аденовируса, точку инициации репликации AAV и точку инициации репликации BBV, но без ограничения ими. Кроме того, вектор экспрессии обычно содержит промотор, полученный из геномов клеток млекопитающих (например, промотор металлотионеина) или из вирусов млекопитающих (например, поздний промотор аденовируса, промотор 7.5K вируса осповакцины, промотор SV40, промотор цитомегаловируса и промотор tk HSV), и последовательность полиаденилирования в качестве последовательности терминации транскрипции.
В другом примере предусмотрена рекомбинантная клетка, содержащая рекомбинантный вектор.
Рекомбинантная клетка может быть получена путем введения рекомбинантного вектора в подходящую клетку-хозяина. До тех пор, пока она обеспечивает стабильное последовательное клонирование и экспрессию рекомбинантного вектора, в настоящем раскрытии можно применять любую клетку-хозяина, известную из уровня техники. Примеры прокариотической клетки-хозяина, доступные для настоящего раскрытия, включают E. coli, E. coli JM109, E. coli BL21, E. coli RR1, E. coli LE392, E. coli B, E. coli X 1776, E. coli W3110, Bacillus spp., такую как Bacillus subtilis и Bacillus thuringiensis, и штаммы энтеробактерий, такие как Salmonella typhimurium, Serratia marcescens и различные виды Pseudomonas. Эукариотические клетки-хозяева, которые можно применять для трансформации, могут включать без ограничения Saccharomyces cerevisiae, клетки насекомых и клетки животных, такие как линия клеток Sp2/0, CHO (яичника китайского хомячка) K1, CHO DG44, CHO-S, PER.C6, W138, BHK, COS-7, 293, HepG2, Huh7, 3T3, RIN, MDCK, HEK293 и т.д., но без ограничения ими.
Молекула нуклеиновой кислоты или рекомбинантный вектор, несущий ее, могут быть введены (трансфицированы) в клетку-хозяина с помощью способа, хорошо известного из уровня техники. Эту трансфекцию можно проводить с использованием CaCl2 или метода электропорации, если клетка-хозяин является прокариотической. В случае эукариотических клеток-хозяев генетическое введение может быть достигнуто с помощью, но без ограничения ими, микроинъекцией, преципитации фосфатом кальция, электропорации, опосредованной липосомами трансфекции и бомбардировкой частицами и т.д.
Способ селекции трансформированной клетки-хозяина может быть легко осуществлен в соответствии со способом, хорошо известным из уровня техники, с использованием фенотипа, экспрессируемого селективным маркером. Например, когда селективный маркер представляет собой ген, придающий устойчивость к определенному антибиотику, трансформант можно легко выбрать путем культивирования трансформанта в среде, содержащей антибиотик.
В другом примере предусмотрен способ получения антитела к ICAM-1 или его антигенсвязывающего фрагмента, при этом способ включает стадию экспрессии полинуклеотида или рекомбинантного вектора, содержащего его, в клетке-хозяине. Способ получения может включать стадию культивирования рекомбинантной клетки, содержащей рекомбинантный вектор, и необязательно может дополнительно включать стадию выделения и/или очистки антитела из среды для культивирования.
Положительные эффекты
Антитело к ICAM-1 или его антигенсвязывающий фрагмент, предусмотренные в настоящем документе, связываются с доменом 2 человеческого ICAM-1 и обладают свойством индуцирования антигенспецифической устойчивости Т-клеток, поэтому его можно эффективно применять для регуляции дифференцировки и/или функции дендритных клеток и/или для предупреждения и/или лечения заболевания, опосредованного иммунными клетками.
Краткое описание чертежей
На Фиг. 1 представлен результат подтверждения связывания химерного антитела SI9, полученного в одном примере, с клетками Du145, линией клеток, экспрессирующей ICAM-1, с помощью проточной цитометрии.
На Фиг. 2a-2d представлены графики, показывающие результаты количественного определения очищенных антител путем измерения OD (оптической плотности) при 280 нм в одном примере.
На Фиг. 3a-3d представлены графики, показывающие результаты измерения фактора симметрии пика путем выполнения анализа с помощью эксклюзионной HPLC (далее SE-HPLC) в отношении антитела к ICAM-1, полученного в соответствии с одним примером.
На Фиг. 4a-4d представлены графики, показывающие результаты измерения изменения флуоресценции с помощью реагента ANS при выдерживании антитела к ICAM-1, полученного в соответствии с одним примером, при 61 °C в течение 1 часа.
На Фиг. 5 представлен график, показывающий результаты измерения реактивности ANS после выдерживания антитела к ICAM-1, полученного в соответствии с одним примером, при 67 °C в течение 1 часа.
На Фиг. 6 представлен график сравнения связывающей способности антитела к ICAM-1 с антигеном ICAM-1, полученного в соответствии с одним примером с помощью теста ELISA (ось y: значение OD 450 нм; ось х: концентрация антител (нг/мл)).
На Фиг. 7a-7c представлены графики, показывающие температуру плавления антитела к ICAM-1, полученного в соответствии с одним примером (7a: химерное антитело, 7b: H17L1, 7c: H17L4).
На Фиг. 8 представлен график, показывающий аффинность (KD) при измерении константы связывания (Kon) и константы диссоциации (Koff) антитела к ICAM-1, полученного в соответствии с одним примером.
На Фиг. 9 представлен график тепловой карты, показывающий изменения профилей экспрессии генов при введении гуманизированного антитела, полученного в соответствии с одним примером, при различных состояниях периферической крови.
На Фиг. 10 представлен график, показывающий изменения профиля экспрессии генов, полученного при введении гуманизированного антитела DNP007, полученного в соответствии с одним примером, при различных состояниях периферической крови путем анализа пути KEGG (-10log (скорректированное p-значение)).
На Фиг. 11 представлен график, показывающий изменения профиля экспрессии генов, полученного при введении гуманизированного антитела DNP007, полученного в соответствии с одним примером, при различных состояниях периферической крови путем анализа биологического процесса GО (-10log (скорректированное p-значение)).
На Фиг. 12a и 12b представлены графики, показывающие изменения в профиле экспрессии генов, полученные при введении гуманизированного антитела DNP007, полученного в соответствии с одним примером, при различных состояниях периферической крови путем анализа увеличения и уменьшения экспрессии генов цитокинов.
На Фиг. 13 представлен график, показывающий изменения уровня цитокинов, полученные при введении гуманизированного антитела DNP007, полученного в соответствии с одним примером, при различных состояниях периферической крови, путем анализа изменения увеличения и уменьшения уровня белка.
На Фиг. 14 представлен график, показывающий изменения уровня цитокинов, полученные при введении гуманизированного антитела DNP007, полученного в соответствии с одним примером, в условиях кокультивирования с дендритными клетками и их собственными Т-клетками путем анализа изменения увеличения и уменьшения уровня белка.
На Фиг. 15 представлен график, показывающий уровень экспрессии кофакторов созревания в дендритных клетках, обработанных гуманизированным антителом DNP007, полученным в соответствии с одним примером.
На Фиг. 16 представлен график, показывающий степень секреции воспалительных цитокинов дендритными клетками, обработанными гуманизированным антителом DNP007, полученным в соответствии с одним примером.
На Фиг. 17 представлен график, показывающий степень апоптоза дендритных клеток, обработанных гуманизированным антителом DNP007, полученным в соответствии с одним примером.
На Фиг. 18a и 18b представлены графики, показывающие уровни экспрессии факторов поверхности дендритных клеток, обработанных гуманизированным антителом DNP007, полученным в соответствии с одним примером, и показывающие, индуцируются ли толерогенные дендритные клетки.
На Фиг. 19а и 19b представлены графики, показывающие уровень экспрессии IDO (индолеамин-2,3-диоксигеназы) в дендритных клетках, обработанных гуманизированным антителом DNP007, полученным в соответствии с одним примером, на Фиг. 19а представлен результат канонического пути, на Фиг. 19b представлен результат неканонического пути. Показано на каждой фигуре.
На Фиг. 20 представлен график, показывающий уровень продуцирования интерферона гамма (IFN-r), воспалительного цитокина и степень пролиферации Т-клеток, культивированных с дендритными клетками, обработанными гуманизированным антителом DNP007, полученным в соответствии с одним примером.
На Фиг. 21 показана степень пролиферации Т-клеток в соответствии с различными путями созревания дендритных клеток (стимуляция LPS, стимуляция TNF-a и стимуляция CD40L) и степень продуцирования интерферона гамма (IFN-r), воспалительного цитокина, Т-клетками, культивируемыми с дендритными клетками, обработанными гуманизированным антителом DNP007, полученным в соответствии с одним примером.
На Фиг. 22a-22c представлены результаты подтверждения терапевтического эффекта в отношении ревматоидного артрита гуманизированного антитела DNP007, полученного в соответствии с одним примером на животной модели ревматоидного артрита. На Фиг. 22a и 22b показаны баллы тяжести артрита до и после введения антитела, а на Фиг. 22c показаны уровни антител к коллагену, соответственно.
На Фиг. 23a и 23b представлены результаты подтверждения ингибирующего эффекта гуманизированного антитела DNP007 в отношении к реакции «трансплантат против хозяина», полученного в соответствии с одним примером на животной модели реакции «трансплантат против хозяина». На Фиг. 22a показана выживаемость, а на Фиг. 22b показана степень восстановления Т-клеток соответственно.
Пути осуществления настоящего изобретения
Далее в настоящем документе настоящее изобретение будет описано более подробно с помощью примеров, однако они носят лишь иллюстративный характер и не предназначены для ограничения объема настоящего изобретения.
Пример 1. Получение мышиного моноклонального антитела к ICAM-1
Для разработки антитела, специфичного к ICAM-1, проводили следующий эксперимент.
1-1: Иммунитет мышей
Рекомбинантный человеческий белок ICAM-1 (0,5 мг/мл; номер доступа в NCBI NP_000192.2) смешивали с равным объемом адъюванта (Invivogen, № vac-adx-10) для получения иммунной субстанции. Во внутрибрюшинную полость (IP) 6-недельной самки мыши Balb/c вводили 200 мкл приготовленной иммунной субстанции трижды с интервалом в 3 недели.
1-2: Получение мышиного моноклонального антитела к ICAM-1
Селезенку иммунизированной мыши, описанной выше, вырезали с получением суспензии отдельных клеток. Полученные клетки дважды промывали RPMI (GIBCO, № 21875034), а затем смешивали с 0,4% (масс./об.) трипанового синего (Sigma) в соотношении 1:1 (об./об.), а затем подсчитывали количество клеток. окрашиванием трипановым синим (Sigma-Аldrich, № T8154). Клеточную линию миеломы мыши X63 (ATCC CRL-1580) промывали, подсчитывали и использовали в качестве партнера по слиянию клеток.
Клетки миеломы и спленоциты смешивали в соотношении 1:5, и супернатант удаляли после центрифугирования. 1 мл 50% (масс./об.) PEG (полиэтиленгликоля) 1500, предварительно нагретого до 37 °C, медленно добавляли в течение 1 минуты. После выдержки в течение приблизительно 1 минуты медленно добавляли среду RPMI и постепенно разводили. После центрифугирования его суспендировали в RPMI (20% FBS, гипоксантин-аминоптерин-тимидин; Gibco), содержащем 1× HAT (гипоксантин, аминоптерин, тимидин), разливали в 96-луночный планшет по 150 мкл/лунка, а затем культивировали в инкубаторе при 37 °C и 5% CO2. После слияния в течение определенного периода времени выполняли подачу HAT, и когда наблюдали хорошо сформированную колонию, добавляли 150 мкл среды HT (гипоксантин, тимидин) и культивировали в инкубаторе при 37 °C и 5% CO2 в течение 48 часов.
100 мкл среды для культивирования извлекали из 96-луночного планшета для культивирования гибридом для подтверждения того, был ли ICAM-1 реактивным. ICAM-1 (R&D system, № ADP4-050) разводили в PBS в концентрации 1,0 мкг (микрограмм)/мл, затем разливали в иммунопланшет Nunc (Thermo, № 439454) по 100 мкл/лунка, хранили в инкубаторе при 37 °C и 5% CO2 в течение 1 часа и покрывали. После полного удаления покрывающего раствора 1× раствор для блокирования казеина (Sigma-Aldrich, № B6429) распределяли по 200 мкл/лунка и хранили в инкубаторе при 37 °С в течение 1 часа для выполнения блокирования. После полного удаления блокирующего раствора раствор для культивирования гибридомы распределяли по 100 мкл/лунка и хранили в инкубаторе при 37 °С в течение 1 часа для индукции реакции антигена и антитела. После полного удаления раствора для культивирования его трижды промывали промывочным раствором (0,02% Tween 20 в PBS). Вторичное меченое HRP козье антитело к мышиному IgG (Jackson) разводили в блокирующем растворе в соотношении 1:10000 (об./об.), распределяли по 100 мкл/лунка и хранили в инкубаторе при 37 °C в течение 30 минут для индукции реакции вторичных антител. После трехкратной промывки TMB (Thermo) распределяли по 80 мкл/лунку для индукции появления окраски, а затем добавляли 1,0 н. серную кислоту (H2SO4) для завершения реакции. Дополнительно выполняли проточную цитометрию, чтобы подтвердить, распознает ли полученное антитело к ICAM-1 ICAM-1, экспрессируемый на поверхности клетки. К клеточной линии рака предстательной железы Du145 (АТСС, № HTB-81), 1 × 106 клеткам, экспрессирующим ICAM-1, добавляли 100 мкл раствора для культивирования и оставляли настояться при комнатной температуре в течение 15 минут для индукции связывания антител. После промывания путем добавления PBS добавляли 100 мкл вторичного меченого FITC козьего антитела к мышиному IgG (Jackson), разведенного в PBS в соотношении 1:100 (об./об.), и реакцию проводили при комнатной температуре в течение 10 минут. После промывания для удаления непрореагировавшего вторичного антитела реактивность подтверждали с помощью проточной цитометрии. Как и в описанном выше способе тестирования, сначала выбирали положительное антитело, которое связывается с антигеном ICAM-1, и дополнительно выбирали моноклональное антитело, способное к флуоресцентному окрашиванию в клеточной линии Du145. Выбранное моноклональное антитело (обозначаемое SI9) проявляло высокую реактивность в отношении белкового антигена ICAM-1 и свойство эффективного связывания с поверхностью клеточной линии Du145.
Пример 2. Получение химерного моноклонального антитела к ICAM-1
2-1. Клонирование генной последовательности антитела к ICAM-1
Ген мышиного моноклонального антитела SI9, выбранный в Примере 1, клонировали с использованием набора Mouse Ig-Primer Set (Millipore, № в кат. 69831). Гибридому, продуцирующую моноклональное антитело SI9, разработанную в Примере 1, культивировали, и суммарную РНК экстрагировали из линии слитых клеток. ПЦР выполняли с использованием РНК, экстрагированной с помощью набора Mouse Ig-Primer Set в качестве матрицы, и после ее вставки в вектор pGem-T (Promega, № в кат. A3600), последовательность ДНК подтверждали секвенированием, а ген мышиного антитела идентифицировали через сайт IMGT (www.imgt.org). Аминокислотные последовательности вариабельных областей тяжелой и легкой цепей и кодирующие последовательности нуклеиновых кислот анализируемого антитела SI9 представлены в Табл. 1:
Таблица 1
2-2. Получение химерного антитела
На основании аминокислотной последовательности полученного мышиного антитела SI9 к ICAM-1, приведенного выше, получали химерное антитело к ICAM-1.
2-2-1. Конструкция плазмиды
Для экспрессии химерного антитела к ICAM-1 получали плазмиду для экспрессии тяжелой цепи и плазмиду для экспрессии легкой цепи соответственно. Плазмиду для экспрессии легкой цепи получали с использованием вектора pOptiVEC (Invitrogen), а плазмиду для экспрессии тяжелой цепи получали с использованием вектора pcDNA3.3 (Invitrogen).
Для экспрессии каждой cDNA, кодирующей вариабельную область, и cDNA, кодирующей константную область антитела в виде непрерывной аминокислотной последовательности без дополнительной аминокислотной вставки, каждый из генов, полученных путем связывания клонированной последовательности нуклеиновой кислоты, кодирующей вариабельную область (см. Табл. 1), синтезировали с известной последовательностью нуклеиновой кислоты, кодирующей константную область человеческого IgG4 (тяжелая цепь; GenBank_AIC59040.1), или последовательностью нуклеиновой кислоты, кодирующей константную область каппа (легкая цепь; GenBank_ AAA58989.1) (Bioneer). Последовательность «CPSCP» средней шарнирной области константной области легкой цепи дополнительно модифицировали до «CPPCP», аналогично изотипу IgG1, для предупреждения шаффлинга антител. Гены экспрессии тяжелой и легкой цепей, синтезированные, как описано выше, разрезали рестрикционными ферментами Xho I и Sal I, а затем ген экспрессии легкой цепи лигировали с вектором pOptiVec, и ген экспрессии тяжелой цепи лигировали с вектором pcDNA3.3 соответственно, при этом конструировали плазмиду для экспрессии полного антитела (плазмида экспрессии pcDNA3.3-тяжелая цепь антитела к ICAM-1 и плазмида экспрессии pOptiVEC-легкая цепь антитела к ICAM-1).
2-2-2. Трансформация
Полученную плазмиду экспрессии pcDNA3.3-тяжелая цепь антитела к ICAM-1 и плазмиду экспрессии pOptiVEC-легкая цепь антитела к ICAM-1 трансфицировали в клетки DG44 (Invitrogen), полученные из клеток СНО, для осуществления процесса трансформации.
Сначала, за 3 дня до трансфекции, суспендированные клетки DG44 культивировали в среде MEMa, содержащей 5% FBS, для индукции адгезивных клеток. Трансформацию проводили в 6-луночном планшете с использованием регента для трансфекции ViaFect (Promega, № в кат.: E4981). За день до трансформации клетки DG44, адаптированные к адгезивному состоянию, получали путем субкультивирования при концентрации 1 × 105 клеток/лунка. Количество ДНК, применяемое для трансформации, использовали в комбинации соотношения 1: 2 плазмиды экспрессии pcDNA3.3-тяжелая цепь антитела к ICAM-1 и плазмиды экспрессии pOptiVEC-легкая цепь антитела к ICAM-1 соответственно, 1,0 мкг и 2,0 мкг. Трансформацию проводили в течение 48 часов. Популяцию трансформированных клеток анализировали с использованием проточного цитометра, и результаты показаны на Фиг. 1. Как показано на Фиг. 1, можно подтвердить феномен связывания химерного антитела, полученного путем вставки гена, кодирующего вариабельную область мышиного антитела SI9, в ген, кодирующий константную область человеческого антитела, с линией клеток, экспрессирующей ICAM-1.
Пример 3. Получение гуманизированного антитела к ICAM-1
3.1. Выбор последовательности рекомбинантных антител с помощью гуманизации in silico
Последовательность гуманизированного антитела, полученную путем рекомбинации каркасной области зародышевой линии, кодирующей ген человеческого антитела, при сохранении аминокислотной последовательности каждой из CDR тяжелой и легкой цепи (CDRH1: GYTFTDYA (SEQ ID NO: 1), CDRH2: ISTYSGNT (SEQ ID NO: 2), CDRH3: ARSLYFGSSGFDY (SEQ ID NO: 3), CDRL1: QTLVYRNGNTY (SEQ ID NO: 4), CDRL2: KVS (SEQ ID NO: 5), CDRL3: SQNTHFPYT (SEQ ID NO: 6) химерного антитела к ICAM-1 (SI9) отбирали с помощью способа in silico.
В результате в качестве последовательностей гуманизированного антитела DNP007 отбирали 24 вида вариабельных областей тяжелой цепи и 4 вида вариабельных областей легкой цепи соответственно. Аминокислотные последовательности вариабельной области тяжелой цепи, вариабельной области легкой цепи, CDR и каркаса выбранного гуманизированного антитела показаны в Табл. 2, 3, 4 и 5 ниже. В Табл. 2 и 3 ниже подчеркнутые жирным шрифтом области представляют собой аминокислотные последовательности CDR (CDR1, CDR2 и CDR3 по порядку).
Таблица 2
Последовательность вариабельной области тяжелой цепи гуманизированного антитела DNP007
Таблица 3
Последовательность вариабельной области легкой цепи гуманизированного антитела DNP007
Таблица 4
Каркасная последовательность вариабельной области тяжелой цепи гуманизированного антитела DNP007
Таблица 5
Каркасная последовательность вариабельной области легкой цепи гуманизированного антитела DNP007
3.2. Экспрессия и анализ гуманизированного рекомбинантного антитела
Выбранные последовательности антител лигировали с константной областью тяжелой цепи человеческого IgG4 и константной областью легкой цепи каппа соответственно, и экспрессировали в клетках HEK293 (ATCC CRL-1573) в форме человеческого IgG4.
Таблица 6
Последовательность константной области гуманизированного антитела DNP007
Через 7 дней после трансфекции гуманизированное рекомбинантное антитело очищали от раствора для культивирования с использованием смолы KanCap A (Kaneca).
Очищенное антитело количественно определяли путем измерения OD (оптической плотности) при 280 нм, и результаты показаны на Фиг. 2a-2d. Как показано на Фиг. 2a-2d, большинство антител, продуцируемых независимо от типа комбинируемых тяжелых и легких цепей, показали относительно высокую продуктивность.
Для анализа чистоты очищенного антитела проводили анализ с помощью экслюзионной HPLC (далее SE-HPLC) с использованием эксклюзионной колонки Sepax Zenix-C SEC-300 (Sepax technologies) для измерения коэффициента симметрии пика. Полученные результаты показаны на Фиг. 3a-3d. Когда антитело высокой степени очистки анализировали с помощью SE-HPLC, наблюдали один симметричный пик, но когда включали гетерогенные вещества, такие как макромолекула/малая молекула, наблюдали два или более пика или наблюдали низкий фактор симметрии пика. Как показано на Фиг. 3a-3d, в большинстве случаев гуманизированное антитело к ICAM-1 демонстрировало относительно высокий фактор симметрии пика.
3-3. Отбор гуманизированных антител в соответствии с физико-химическими/биологическими свойствами
3-3-1. Скрининг высокостабильных гуманизированных антител
3-3-1-1. Первичный скрининг высокостабильных гуманизированных антител
Для предпочтительного выбора антител с с высокой стабильностью, отбирали гуманизированные антитела, демонстрирующие устойчивость к тепловой денатурации, оставляя антитела в жестких условиях высокой температуры и наблюдая за изменениями их физических свойств.
Измерение тепловой денатурации подтверждали с помощью эксперимента по связыванию с использованием 8-анилино-1-нафталинсульфоновой кислоты (далее ANS; Sigma). ANS представляет собой соединение, которое может подтвердить наличие или отсутствие денатурации белка, поскольку оно связывается с гидрофобным участком, открытым во время денатурации белка, и испускает свет с длиной волны 470 нм.
96 видов гуманизированных рекомбинантных антител, полученных в Примере 2-1, постоянно разводили до концентрации 0,2 мг/мл, используя PBS (фосфатно-солевой буфер), и оставляли при высокой температуре (61 °C) в течение подходящего времени (1 часа). 20 мкл раствора ANS 0,2 мг/мл добавляли к 200 мкл образца антитела, смешивали, проводили реакцию в течение 15 минут и анализировали в условиях возбуждения при 360 нм и испускания при 460 нм. Длину волны 460 нм, испускаемой в результате реакции ANS, измеряли с помощью флуорометра (BioTek, SynergyHT), и относительную оценку на основе антитела H1L1 (100%) показывали на Фиг. 4a-4d. В случае тяжелых цепей VH7 и VH22, независимо от легкой цепи, подлежащей комбинированию, испускание флуоресценции при 470 нм ANS, по-видимому, быстро увеличивалось, и было подтверждено, что оно было слегка денатурировано в результате нагревания, однако другие антитела показали относительную устойчивость к нагреванию.
3-3-1-2. Вторичный скрининг высокостабильных гуманизированных антител
Всего изначально отбирали 47 видов гуманизированных антител, демонстрирующих относительно высокую продуктивность антител, относительно высокий фактор симметрии пика и/или относительно высокую термическую стабильность в условиях высокой температуры (61 °C) на Фиг. 2a-2d, 3a-3d и 4a-4d (см. Фиг. 5).
Для более строгой оценки стабильности 47 видов гуманизированных антител постоянно разводили до концентрации 0,2 мг/мл, оставляли при 67 °C в течение 1 часа, измеряли реактивность ANS и показывали относительную реактивность на основе антитела H1L1 на Фиг. 5. По сравнению с реактивностью ANS при 61 °C (4a-4d) реактивность ANS при 67 °C имела тенденцию быть немного выше, однако 6 типов гуманизированных антител комбинации H17L1, H4L3, H5L3, H11L3, H17L3 и H17L4 (см. Табл. 7) демонстрировали относительно низкую реактивность ANS и были оценены как антитела, обладающие высокой устойчивостью к тепловой денатурации.
Таблица 7
3-3-2. Анализ связывания антигена
В качестве оценки теста стабильности, как показано в Табл. 7, отбирали гуманизированные антитела 6 ведущих антител, и связывающую способность 5 антител, за исключением H11L3, сравнивали с родительским антителом (химерным антителом; см. Пример 1.3).
Антиген ICAM-1 (ICAM-1; R&D System) наносили на 96-луночный планшет из расчета 100 нг на лунку с последующим блокированием. Количество первичного антитела последовательно разводили дважды от 80 нг/мл и его связывали в течение 1 часа при 37 °C, а вторичное антитело, разведенное 1:10000 конъюгатом меченого HRP козьего антитела к человеческому Ig (Jackson ImmunoResearch), объединяли при 37 °C C в течение 30 минут. Каждую стадию промывали трижды и вводили в реакцию с TMB (3,3', 5,5'-тетраметилбензидином). После остановки реакции обработкой 1 н. раствором H2SO4 в том же количестве (100 мкл), что и раствор TMB, значение OD измеряли при 450 нм.
Связывающая способность родительского антитела и пяти гуманизированных рекомбинантных антител, полученных, как описано выше, с антигеном ICAM-1 показана на Фиг. 6 и в Табл. 8.
Таблица 8
(нг/мл)
Все 5 типов оцениваемых гуманизированных антител обычно проявляли более высокую реактивность, чем химерное родительское антитело, и среди них антитело из комбинации H17L4 демонстрировало самую высокую реактивность.
3-3-3. Анализ температуры плавления
В частности, температуры плавления гуманизированных антител H17L1 и H17L4, проявляющих стабильные физические свойства, сравнивали с родительским антителом (химерным антителом; см. Пример 1.3) для оценки стабильности.
Краситель для определения термического сдвига белка (Lifetechnologies, № 4466038) добавляли к образцу антитела для приготовления образца для реакции, и температуру непрерывно повышали с 25 °C до 95 °C для индукции денатурации образца антитела. Денатурацию антител подтверждали облучением реакционного раствора длиной волны 580 нм и измерением длины волны 623 нм, испускаемой красителем для определения термического сдвига белка, а температуру плавления анализировали с помощью программного обеспечения ViiATM 7. Полученные результаты показаны в Табл. 9 ниже и на Фиг. 7a (химерное родительское антитело), 7b (H17L1) и 7c (H17L4):
Таблица 9
Как показано в Табл. 9 и на Фиг. 7a-7c, в каждом образце антитела идентифицировали две температуры плавления. Температуру плавления 1 аналогичным образом измеряли при приблизительно 67 °C для всех трех антител, включая химерное родительское антитело, однако температура плавления 2 составляла 10 °C или больше в двух гуманизированных антителах по сравнению с химерным родительским антителом. Это означает, что 2 типа гуманизированных антител обладают значительной устойчивостью к тепловой денатурации по сравнению с химерными родительскими антителами.
3-3-4. Измерение аффинности
Систему Octet (ForteBio) применяли для сравнения аффинности гуманизированных антител H17L1 и H17L4 в отношении антигена с родительским антителом. Каждое из трех антител присоединяли к реакционному в отношении амина биосенсору AR2G (ForteBio) и добавляли 5 различных концентраций раствора антигена ICAM-1 для индукции реакции антигена и антитела. Используя результаты реакции антигена и антитела, измеряли константу связывания (Kon) и константу диссоциации (Koff) и рассчитывали аффинность (KD), результаты показаны в Табл. 10 и на Фиг. 8:
Таблица 10
Как показано в Табл. 10 и на Фиг. 8, аффинность (KD) химерного родительского антитела составляла 1,03 × 10-8 М, а гуманизированных антител H17L1 и H17L4 составляла 3,43 × 10-9 и 3,62 × 10-9 М соответственно. Было возможным подтвердить повышенную аффинность гуманизированного антитела.
Пример 4. Тест иммуномодулирующей эффективности в периферической крови (in vitro)
4-1. Выделение мононуклеарных клеток периферической крови и измерение изменений IFNg
Для подтверждения иммуномодулирующей эффективности антител, предусмотренных в настоящем документе, мононуклеарные клетки периферической крови обрабатывали антителом DNP007 (антителом H17L4), полученным в Примере 3, и измеряли уровень секреции IFN-гамма, типичного провоспалительного цитокина. Кровь собирали у здоровых добровольцев, и мононуклеарные клетки периферической крови выделяли с помощью Ficoll-Paque Plus (GE healthcare, № 17144002). Выделенные мононуклеарные клетки периферической крови суспендировали в среде RPMI с добавлением 10% FBS, и добавляли GM-CSF (Creagene) и IL-4 (Creagene) в концентрации 100 нг/мл соответственно таким образом, чтобы дендритные клетки могли дифференцироваться из моноцитов. Антитело DNP007 добавляли к мононуклеарным клеткам периферической крови в концентрации 10,0 мкг/мл.
Для подтверждения эффективности антитела DNP007 в отношении дендритных клеток-предшественников моноцитов, выделенные мононуклеарные клетки периферической крови культивировали в чашке для культивирования в течение 2 часов для индукции адгезии к чашке для культивирования, а затем адгезивные клетки и суспендированные клетки разделяли соответственно, добавляли GM-CSF и IL-4 в концентрации 100 нг/мл соответственно, и наряду с этим добавляли антитело DNP007 (10,0 мкг/мл).
В день 6 культивирования мононуклеарные клетки периферической крови, адгезивные клетки и суспензионные клетки промывали соответственно, добавляли липополисахариды (LPS, Sigma-Aldrich, № L2630) в концентрации 5,0 мкг/мл и культивировали. На следующий день отбирали раствор для культивирования и измеряли концентрацию секретируемого IFN-гамма с помощью набора Human IFN gamma Uncoated ELISA (Invitrogen, № 88-7316-77).
В группе образцов, обработанных антителом DNP007, при всех условиях мононуклеарных клеток периферической крови, адгезивных клеток и суспендированных клеток, уровень секреции INF-гамма был заметно снижен (Табл. 11). Эти результаты воспринимали как явление, которое возникает, когда антитело DNP007 подавляет механизм активации иммунных клеток с помощью LPS.
Таблица 11
4-2. Анализ эффекта антитела DNP007 в отношении мононуклеарных клеток периферической крови - анализ профиля экспрессии генов (анализ транскриптома путем секвенирования РНК)
Для определения того, происходит ли регуляция иммунного ответа DNP007 только за счет дендритных клеток или контакта с иммунными клетками, включая дендритные клетки и Т-клетки, мононуклеарные клетки периферической крови человека выделяли и разделяли на 5 типов групп периферической крови и добавляли 100 нг/мл GM-CSF и 100 нг/мл IL-4. Клетки получали с помощью культивирования в течение 6 дней в условиях с добавлением или без добавления 10 мкг/мл антитела DNP007. Для индукции перехода в зрелые дендритные клетки клетки промывали в день 6 культивирования и обрабатывали 5 мкг/мл LPS (Sigma-Aldrich) в течение одного дня для получения клеток для каждой группы, выделяли суммарную РНК и определяли профили экспрессии анализируемых генов.
(1) Все PBMC: мононуклеарные клетки периферической крови человека выделяли из крови здоровых добровольцев путем центрифугирования в градиенте концентрации с Ficoll-Paque (GE Healthcare).
(2) Дендритные клетки, полученные из CD14+ моноцитов: CD14+ моноциты выделяли из мононуклеарных клеток периферической крови человека, разделенных с помощью центрифугирования крови здоровых добровольцев в градиенте концентрации с Ficoll-Paque (GE Healthcare), с помощью магнитного разделения (с использованием магнитных гранул).
(3) CD14-истощенные PBMC: CD14+ моноциты из (2) разделяли с помощью магнитного разделения (с использованием магнитных гранул) и использовали оставшуюся популяцию периферической крови.
(4) Прикрепленные PBMC: Мононуклеарные клетки периферической крови человека, выделенные путем центрифугирования в градиенте концентрации с Ficoll-Paque (GE Healthcare) от здоровых добровольцев, прикрепляли к клеткам в инкубаторе при 37 °C, 5% CO2 в течение 2 часов в среде RPMI с добавлением 10% FBS и затем супернатант (включая суспензионные клетки) удаляли и отделяли только прикрепленные клетки.
(5) Использовали верхний слой суспензионных клеток, удаленных из эксперимента в (4).
Результаты показаны на фиг. 9. Как показано на Фиг. 9, дендритные клетки, дифференцированные только из CD14+ моноцитов (A), и популяций периферической крови без CD14+ моноцитов (B) показали профиль экспрессии генов, аналогичный профилю экспрессии генов контрольной группы, не обработанной DNP007. С другой стороны, в состоянии (C, D, E), в котором несколько других иммунных клеток присутствуют вместе, а не в состоянии, в котором дендритные клетки, полученные из CD14+, существуют по отдельности, при добавлении DNP007 профиль экспрессии генов значительно отличался от профиля экспрессии генов контрольной группы, не получавшей DNP007.
Кроме того, в результате анализа пути KEGG и биологического процесса GO путем разделения расположенных выше и ниже генов вдвое или больше по сравнению с контрольной группой, не обработанной DNP007, на группы генов с аналогичными функциями в этих профилях общей экспрессии генов, профили экспрессии генов, измененные DNP007, в основном включали гены, участвующие в регуляции иммунных ответов, включая воспалительные ответы (Фиг. 10 и 11). Схематическая диаграмма части цитокинов среди генов, имеющих четкий паттерн изменения, показана на Фиг. 12a и 12b. В результате анализа экспрессии генов верхнего слоя суспензионных клеток и образцов мононуклеарных клеток цельной периферической крови (цельных PBMC), за исключением прикрепленных клеток в периферической крови, как показано на фиг. 12a и 12b, было обнаружено, что экспрессия генов цитокинов, которые являются мишенями типичных аутоиммунных заболеваний, таких как IL6, IL17, IL23 и IL36, подавлялась обработкой антителом DNP007.
Благодаря этим результатам, антитело к ICAM-1 DNP007, предусмотренное в настоящем описании, влияет не только на дендритные клетки, но действует на процесс контакта или перекрестную реакцию между дендритными клетками и другими иммунными клетками, благодаря чему можно заметить, что экспрессия различных генов иммунного ответа регулируется, приводя к иммуносупрессивному ответу.
4-3. Анализ эффекта антитела DNP007 в отношении мононуклеарных клеток периферической крови - анализ цитокинов
При подготовке эксперимента 4-2, изложенного выше, для подтверждения того, показало ли изменение экспрессии гена корреляцию с фактическим изменением экспрессии белка, в эксперименте 4-2 супернатант отделяли и фактические цитокины анализировали количественно.
IFN-гамма, IL1-бета, IL-6, IL-10, IL-12(p70), IL-17, IL-27 анализировали с использованием набора Human Luminex Screening assay (LXSAH, R&D), а TGF-бета анализировали с использованием набора для анализа с предварительным смешиванием TGF-бета (TGTBMAG-64K-03; Merck Millipore).
Все цитокины, проанализированные, как показано на Фиг. 13, продемонстрировали снижение фактического уровня экспрессии белка от 40 до 80% при введении антитела DNP007. Это результат согласуется с результатом профиля экспрессии генов в Примере 4-2, и можно отметить, что иммуносупрессивный ответ антитела DNP007 был подтвержден повторно.
Кроме того, даже когда активацию иммунной системы индуцировали обработкой LPS в условиях кокультивирования с Т-клетками того же человека после разделения на периферическую кровь нормальных людей и дифференцирование в дендритные клетки, образец, введенный с антителом DNP007, продемонстрировал заметное ингибирование экспрессии иммунных цитокинов на уровне белка, как показано на Фиг. 14.
Пример 5. Тест определения эффекта антитела в отношении дендритных клеток
5-1. Тест индукции активности полузрелых дендритных клеток в мононуклеарных клетках периферической крови
В этом примере подтверждали эффект антитела, предусмотренного в настоящем документе, в отношении дифференцировки и созревания дендритных клеток. Более конкретно, после прикрепления микрогранул CD14 (Miltenyi Biotec, 130-050-201) к периферической крови, полученной путем сбора крови у здоровых добровольцев, мононуклеарные клетки периферической крови человека отделяли с использованием устройства для сбора клеток (Miltenyi Biotec., № в кат. 000403).
К ним добавляли раствор для культивирования RPMI, содержащий 10% FBS, обработанный GM-CSF (Creagene) и IL-4 (Creagene) в концентрации 100 нг/мл соответственно для индукции дифференцировки в незрелые дендритные клетки (незрелые DC) в течение 5 дней. В день 5 культивирования добавляли 5 мкг/мл LPS (липополисахариды, Sigma-Aldrich, № L2630), и дендритные клетки стимулировали в течение 24 часов для дифференцировки в зрелые дендритные клетки (зрелые DC). Антитело DNP007 (антитело к H17L4) и контрольное антитело (hIgG), предусмотренные в настоящем документе, добавляли в концентрации 5,0 мкг/мл в дни 0 и 3 процесса индукции дифференцировки дендритных клеток. В день 6 дифференцировки уровень экспрессии CD80 (Invitrogen, № в каталоге 11-0809-42), CD86 (BD, № в каталоге 555657), CD40 (BD, № в каталоге 555588), CD54 (BD, № в каталоге 347977) и HLA-DR (BioLegend, № в каталоге 307616) (вверху в скобках указаны антитела к фактору), поверхностного фактора созревания дендритных клеток, подтверждали и сравнивали с использованием проточного цитометра.
Полученный уровень экспрессии (среднее значение интенсивности флуоресценции, MFI) каждого фактора преобразовывали в относительное значение для группы, получавшей только LPS, и он показан на Фиг. 15.
Как показано на Фиг. 15, в случае дендритных клеток, обработанных контрольным антителом (hIgG), экспрессия всех кофакторов, таких как CD80, CD54, CD40 и HLA-DR, увеличивалась путем стимуляции LPS, было подтверждено, что экспрессия этих кофакторов значительно снижалась в группе, обработанной тестируемым антителом DNP007 и LPS. Эти результаты показывают, что указанные выше антитела ограничивают созревание дендритных клеток в результате стимуляции антигеном и индуцируют иммуносупрессивное окружение.
5-2. Тест секреции провоспалительных цитокинов в дендритных клетках
Для подтверждения того, влияет ли антитело, предусмотренное в настоящем документе, на стадии дифференцировки и созревания дендритных клеток, мононуклеарные клетки периферической крови человека, выделенные из периферической крови, культивировали с GM-CSF и IL-4 в течение 5 дней для дифференцировки в дендритные клетки, а затем стимулирующие факторы, такие как LPS, добавляли и культивировали в течение 24 часов для индукции созревания, количество провоспалительных цитокинов в растворе для культивирования анализировали с измерением зрелости дендритных клеток.
Более конкретно, после прикрепления микрогранул CD14 (Miltenyi Biotec, 130-050-201) к периферической крови человека мононуклеарные клетки периферической крови человека выделяли с использованием устройства для сбора клеток (Miltenyi Biotec., № в кат. 000403). К ним добавляли раствор для культивирования RPMI, содержащий 10% FBS, обработанный GM-CSF и IL-4 в концентрации 100 нг/мл для индукции дифференцировки в незрелые DC в течение 5 дней. В день 5 культивирования добавляли 5 мкг/мл LPS, и дендритные клетки стимулировали в течение 24 часов для индукции дифференцировки в зрелые дендритные клетки (зрелые DC). Антитело DNP007 (антитело к H17L4) и контрольное антитело (hIgG), предусмотренные в настоящем документе, добавляли в концентрациях от 0,1 до 10,0 мкг/мл соответственно в дни 0 и 3 процесса индукции дифференцировки дендритных клеток. В день 6 дифференцировки количество провоспалительных цитокинов (IL-6 и TNF-a) в растворе для культивирования анализировали с помощью методики ELISA.
На Фиг. 16 показаны результаты, полученные выше. Как показано на Фиг. 16, в зрелых дендритных клетках, обработанных контрольным антителом, секреция IL-6 и TNF-α, которые являются типичными провоспалительными цитокинами, значительно увеличивалась в результате стимуляции LPS, тогда как в дендритных клетках, обработанных тестируемым антителом DNP007, способность к секреция провоспалительных цитокинов была значительно снижена. Созревание дендритных клеток относится к процессу, посредством которого дендритные клетки приобретают способность в качестве антигенпрезентирующих клеток, а функции зрелых дендритных клеток индуцируют активность антигенспецифичных Т-клеток. В результате обработки антителами, предусмотренными в настоящем документе, секреция провоспалительных цитокинов IL-6 и TNF-α, которые являются важным показателем зрелости дендритных клеток, была значительно ингибирована, и в результате этого было подтверждено, что антитела, предусмотренные в настоящем документе, характеризуются функцией ингибирования созревания дендритных клеток.
5-3. Тест на апоптоз дендритных клеток
Для определения того, влияет ли антитело, предусмотренное в настоящем документе, на апоптоз на стадии дифференцировки дендритных клеток, измеряли степень гибели дендритных клеток, дифференцированных и созревших в течение 6 дней в соответствии с обработкой антителом. Степень апоптоза подтверждали с помощью проточной цитометрии после окрашивания 7AAD.
Более конкретно, после прикрепления микрогранул CD14 (Miltenyi Biotec, 130-050-201) к периферической крови человека мононуклеарные клетки периферической крови человека выделяли с использованием устройства для сбора клеток (Miltenyi Biotec., № в кат. 000403). Раствор для культивирования RPMI, содержащий 10% FBS, обработанный GM-CSF и IL-4 в концентрации 100 нг/мл соответственно добавляли для индукции дифференцировки в незрелые DC в течение 5 дней. В день 5 культивирования добавляли 5 мкг/мл LPS, и дендритные клетки стимулировали в течение 24 часов для дифференцировки зрелых дендритных клеток. Антитело DNP007 (антитело к H17L4), предусмотренное в настоящем документе, и контрольное антитело (hIgG), добавляли дважды в концентрации 5,0 мкг/мл в дни 0 и 3 процесса индукции дифференцировки дендритных клеток. В день 6 после индукции дифференцировки зрелые дендритные клетки (зрелые DC) окрашивали 7AAD (7-амино-актиномицин D, BD, 51-68981E 5 мкл/тест) и анализировали с помощью проточного цитометра.
Результаты, полученные выше, показаны на Фиг. 17. Как показано на Фиг. 17, в результате подтверждения степени апоптоза дендритных клеток, которые подверглись дифференцировке и созреванию, контрольная группа, обработанная антителами, продемонстрировала апоптоз 2,33%, в то время как скорость апоптоза дендритных клеток, обработанных тестируемым антителом DNP007, составила 36,3%, что указывало на более высокий эффект апоптоза, чем в контрольной группе.
Цитотоксический эффект тестируемого антитела в отношении дендритных клеток можно оценить в виде апоптоза.
5-4. Тест индукции иммунных толерогенных дендритных клеток (толерогенных DC)
Для подтверждения того, индуцирует ли антитело, предусмотренное в настоящем документе, толерогенные дендритные клетки, экспрессию маркеров толерогенных дендритных клеток подтверждали с помощью проточной цитометрии в полузрелых дендритных клетках, которые подвергались дифференцировке и созреванию в течение 6 дней.
Более конкретно, антитело DNP007 (антитело к H17L4), предусмотренное в настоящем документе, и контрольное антитело (hIgG) добавляли к полузрелым дендритным клеткам, которые подверглись дифференцировке и созреванию из мононуклеарных клеток периферической крови человека в течение 6 дней таким же образом, как в Примерах 5-2 или 5-3 дважды при концентрации 5,0 мкг/мл в дни 0 и 3 процесса индукции дифференцировки дендритных клеток, и экспрессию маркеров толерогенных дендритных клеток подтверждали с помощью проточной цитометрии в день 6 после индукции дифференцировки.
Факторы экспрессии клеточной поверхности PDL1 (Invitrogen, № в каталоге 17-5983-42), PDL2 (Miltenyi biotec, № в каталоге 130-098-528) и аденозиновый рецептор A2b (Novus, № в каталоге NBP2-41312PE) (выше в скобках указаны антитела к фактору) окрашивали с помощью обработки антителом в соответствующей концентрации и проводили реакцию в течение 20 минут в холодильнике. Добавляли 2 мл буфера для проточной цитометрии (0,5% BSA, 0,01% NaN3 в 1× PBS), центрифугировали при 2200 об./мин. в течение 3 минут, супернатант удаляли, промывали и анализировали.
Вещества клеточной жидкости, IDO (индолеамин-2,3-диоксигеназа; Invitrogen, № в каталоге 12-9477-42), TGF-β (R&D systems, № в каталоге IC240P), IL-10 (Miltenyi biotec, № в каталоге 130-112-729) (выше в скобках укаазны антитела к фактору) окрашивали в соответствии с инструкциями производителя набора для способа внутриклеточного окрашивания антигенов. К осадку клеток добавляли 100 мкл буфера для фиксации IC (Invitrogen, № в каталоге 00-8222-49), свет блокировали при комнатной температуре и проводили реакцию в течение 30 минут для фиксации клеток. Добавляли 2 мл 1× буфера для пермеабилизации (Invitrogen, № в каталоге 00-8333-56), центрифугировали при 600 g в течение 5 минут и супернатант удаляли. Соответствующую концентрацию каждого антитела добавляли к 100 мкл 1× буфера для пермеабилизации, обрабатывали оставшимся осадком клеток и проводили реакцию в течение 30 минут после блокирования света при комнатной температуре. Добавляли 2 мл 1× буфера для пермеабилизации, центрифугировали при 600 g в течение 5 минут, промывали и добавляли 2 мл буфера для проточной цитометрии с последующим центрифугированием для осуществления дополнительной промывки. Клетки фиксировали добавлением 1% параформальдегида, и уровни экспрессии каждого антигена анализировали с использованием проточного цитометра.
Полученные результаты показаны на Фиг. 18a и 18b. Как показано на Фиг. 18a и 18b, дендритные клетки, обработанные тестируемым антителом DNP007, демонстрировали значительное увеличение экспрессии IDO, типичного фактора иммунной толерантности, по сравнению с дендритными клетками, обработанными контрольным антителом (контроль), а также увеличение уровней экспрессии PDL1, PDL2 и аденозин R A2b, известных в качестве других иммуносупрессивных факторов, по сравнению с контрольной группой.
Таким образом, было подтверждено, что экспрессия некоторых факторов, связанных с IDO и иммунной толерантностью, увеличивалась, на основе анализа дендритных клеток, обработанных антителами, предусмотренными в настоящем документе. В частности, известно, что IDO, экспрессируемая на дендритных клетках, ингибирует пролиферацию Т-клеток и играет важную роль в иммунной толерантности. Таким образом, увеличение экспрессии IDO с помощью антител, предусмотренных в настоящем документе, предполагает высокую вероятность индукции иммунной толерантности.
5-5. Тест экспрессии IDO в дендритных клетках
Для определения того, каким из двух известных путей созревания ингибируется созревание дендритных клеток антителами, предусмотренными в настоящем документе, LPS и CD40L использовали для индукции созревания дендритных клеток. Экспрессию IDO, маркера толерогенных дендритных клеток, подтверждали с помощью проточной цитометрии в полузрелых дендритных клетках, которые подвергались дифференцировке и созреванию в течение 6 дней.
Более конкретно, стимуляцию с помощью LPS, известную как канонический путь, исследовали в тех же условиях, что и в Примерах 5-2 или 5-3, путем получения полузрелых дендритных клеток, которые подвергались дифференцировке и созреванию в течение 6 дней.
В тесте стимуляции с помощью CD40L, известном как неканонический путь, использовали незрелые дендритные клетки дифференцировались в течение 5 дней путем добавления раствора для культивирования RPMI, содержащего 10% FBS, обработанного GM-CSF и IL-4 в концентрации 100 нг/мл, соответственно. В день 5 культивирования 1 мкг/мл CD40L (Enzo, ALX-522-110) добавляли к RPMI, содержащей 10% FBS, обработанной GM-CSF и IL-4 в концентрации 100 нг/мл, и стимулировали в течение 48 часов для индукции зрелых дендритных клеток (зрелых DC). Антитело DNP007 (антитело к H17L4), предусмотренное в настоящем документе, и контрольное антитело (hIgG) обрабатывали дважды в концентрации 5,0 мкг/мл в дни 0 и 3 во время процесса индукции дифференцировки дендритных клеток, а CD40L обрабатывали в количестве 5,0 мкг/мл в день 5.
В день 7 индукции дифференцировки зрелые дендритные клетки (зрелые DC) окрашивали вышеупомянутыми окрашивающими внутриклеточными антигенами и анализировали с использованием проточного цитометра.
Полученные результаты показаны на Фиг. 19a (канонический путь) и 19b (неканонический путь). Как показано на Фиг. 19a и 19b, тестируемое антитело DNP007 вызывало снижение экспрессии IDO в клетках во время процесса созревания дендритных клеток при использовании CD40L, тогда как созревание дендритных клеток при использовании LPS показало значительную разницу в экспрессии IDO между индивидуумами. В качестве пути созревания дендритных клеток существуют канонические пути, индуцируемые стимуляцией LPS и TNF-α, и неканонические пути, индуцируемые CD40L. Приведенные выше результаты показывают, что антитела, предусмотренные в настоящем документе, влияют на оба пути созревания дендритных клеток, специфично ограничивая созревание с помощью CD40L и индуцируя дифференцировку в толерогенные дендритные клетки.
5-6. Тест иммуносупрессии Т-клеток водорастворимыми веществами
Для подтверждения того, обусловлен ли фактор, влияющий на Т-клетки дендритных клеток, созревание которых ингибируется обработкой антител, предусмотренных в настоящем документе, межклеточной конъюгацией или медиаторами, секретируемыми клетками, дендритные клетки и Т-клетки культивировали в различных условиях, а также подтверждали способность к ингибированию активности Т-клеток.
Более конкретно, человеческие Т-клетки, выделенные с использованием устройства для сбора клеток после прикрепления микрогранул CD3 (Miltenyi, 130-050-201) к периферической крови человека, и зрелые дендритные клетки (зрелые DC), полученные в тех же условиях, что и в Примерах 5-1, для 5-5, культивировали в раздельных условиях для подтверждения способности ингибировать активность Т-клеток. В нижней камере планшета, предназначенной для пропускания среды для культивирования, наносили покрытие из 1 мкг/мл антитела к CD3 (BD, 557052) и 1 мкг/мл антитела к CD28 (BD, 555725), и помещали аутологичные T-клетки, выделенные из периферической крови. В это время аутологичные Т-клетки подвергали мечению CFSE в качестве условия для подтверждения пролиферации. Дендритные клетки, дифференцированные обработкой антителом DNP007 (антитело к H17L4), предусмотренным в настоящем документе, помещали в верхнюю камеру. Два типа клеток культивировали в течение 4 дней, делая общей среду для культивирования в каждой камере. Количество дендритных клеток и аутологичных Т-клеток обрабатывали в соотношении 1:10.
Полученные результаты показаны на Фиг. 20. Как показано на Фиг. 20, в отсутствие прямого контакта между двумя типами клеток пролиферацию Т-клеток ингибировали дендритными клетками, обработанными тестируемым антителом, и продуцирование интерферона гамма (IFN-r), провоспалительного цитокина, снижалось. Приведенные выше результаты показывают, что обработанные антителами дендритные клетки, предусмотренные в настоящем документе, могут ингибировать активность и пролиферацию Т-клеток посредством обмена материалом с Т-клетками, и указывают на то, что вещество, секретируемое дендритными клетками, выступает в качестве медиатора для ингибирования активности Т-клеток, и индуцирует иммунную толерантность.
5-7. Тест иммуносупрессии Т-клеток дендритными клетками, обработанными антителами
Для оценки способности ингибировать Т-клеточную активность дендритных клеток, созревание которых ингибировали обработкой антителами, предусмотренными в настоящем документе, активность и пролиферацию Т-клеток подтверждали в условиях, в которых дендритные клетки и Т-клетки культивировали вместе. Сначала созревание дендритных клеток индуцировали с использованием LPS, TNF-a и CD40L, которые являются стимуляторами двух известных путей созревания, и измеряли пролиферацию Т-клеток и уровень экспрессии внутриклеточных провоспалительных цитокинов. Более конкретно, созревание дендритных клеток индуцировали с использованием двух известных путей созревания (канонический путь: LPS, и TNF-альфа/неканонический путь: CD40L). Стимуляцию с помощью LPS и CD40L проводили так же, как в Примере 5-5. Стимуляцию TNF-альфа выполняли обработкой RPMI, содержащей 10% FBS, обработанной GM-CSF и IL-4 в концентрации 100 нг/мл соответственно, 13 нг/мл TNF-a, 10 нг/мл IL-1β и 350 нг/мл PGE2 в день 5 в состоянии индуцирования незрелых дендритных клеток и стимулирования в течение 48 часов дифференцировки в зрелые DC. Антитело DNP007 (антитело к H17L4), предусмотренное в настоящем документе, и контрольное антитело (hIgG), обрабатывали дважды в концентрации 5,0 мкг/мл в дни 0 и 3 процесса индукции дифференцировки дендритных клеток.
Для индукции активности Т-клеток, аутологичные Т-клетки и зрелые дендритные клетки, дифференцированные таким же образом, как указано выше, добавляли в планшет, покрытый 1 мкг/мл антитела к CD3 в соотношении 1:10. Через 3 дня измеряли уровень экспрессии внутриклеточных воспалительных цитокинов и пролиферацию Т-клеток. В это время аналогичным образом выполняли мечение CFSE для подтверждения пролиферации Т-клеток.
Полученные результаты показаны на Фиг. 21. Как показано на Фиг. 21, Т-клетки, культивированные с дендритными клетками, обработанными контрольным антителом, демонстрировали активную пролиферацию клеток и высокую экспрессию IFN-γ и IL-10, которые являются типичными для провоспалительных цитокинов. В отличие от этого, Т-клетки, обработанные дендритными клетками с ограниченным созреванием путем обработки тестируемым антителом DNP007, ингибировали пролиферацию, несмотря на стимуляцию антителом к CD3, и заметно снижали секрецию провоспалительных цитокинов.
Эти результаты указывают на то, что антитела, предусмотренные в настоящем документе, влияют как на пути созревания дендритных клеток (канонический путь, индуцированный стимуляцией LPS и TNF-α, и неканонический путь, индуцированный CD40L), так и Т-клеток, сенсибилизированных дендритными клетками, созревание которых ингибируется, ограничивая пролиферацию и экспрессию провоспалительных цитокинов. Иными словами, полузрелые дендритные клетки, индуцированные антителами, предусмотренными в настоящем документе, ингибируют активность и пролиферацию Т-клеток.
Пример 6. Эффект антител в отношении лечения заболеваний, связанных с иммунитетом (in vivo)
6-1. Тест эффективности лечения ревматоидного артрита
Для подтверждения того, эффективно ли антитело, предусмотренное в настоящем документе, при ревматоидном артрите, готовили модель легкого и умеренного ревматоидного артрита, следующим образом: в первый день 4 мг бычьего коллагена II типа (Chodrex inc, № в кат. 20021) готовили с использованием CFA (Sigma, № в кат. F5881) в количестве 0,5 мл + 0,5 мл в соотношении объемов 1:1, разделенных на 10 частей по 0,1 мл каждая, и вводимых в эпидермис животных-приматов (яванский макак (Мacaca fascicularis), пол: самка, возраст: 2,5-5 лет, масса тела: 2-6 кг, источник: PrimGen). В дни 21 и 45 инъекцию проводили таким же образом, за исключением того, что вторую и третью инъекцию заменяли IFA (Sigma, № в кат. F5506) вместо CFA. Контрольной группе вводили PBS таким же образом. Балл RA, который измеряет появление артрита, оценивали полуколичественно по степени отека или изменения красного цвета в каждом суставе животного (Фиг. 22a). Антитело DNP007 (антитело к H17L4), предусмотренное в настоящем документе, вводили в дозе 8 мг/кг два раза в неделю, начиная с 70-го дня после первой обработки коллагеном, и оценивали артрит 64 суставов в соответствии с критериями оценки. Кроме того, на основе плазмы крови животных, которым осуществляли введение, тестировали бычьи коллаген-специфичные антитела. Изменение бычьего коллаген-специфичного антитела измеряли с помощью набора для ELISA (№ в кат. 2052T) Chondrex.
Полученные результаты показаны на Фиг. 22b и 22c. В результате балл артрита снизился в группе (n = 3), которой вводили тестируемое антитело DNP007 по сравнению с группой, которой не осуществляли введение (n = 2) (Фиг. 22b), и антитело к коллагену, прямой иммунологический фактор заболевания, также значимо снижался (Фиг. 22c). Эти результаты показывают, что антитела, предусмотренные в настоящем документе, эффективны при лечении ревматоидного артрита.
6-2. Тест эффективности лечения реакции «трансплантат против хозяина»
Реакция «трансплантат против хозяина» (GVHD) является одним из побочных эффектов у пациентов (реципиентов) с трансплантацией при трансплантации аллогенных органов (например, костного мозга) и явлением, которое возникает, когда NK-клетки или Т-клетки донора атакуют органы реципиента. Для подтверждения того, эффективно ли антитело, предусмотренное в настоящем документе, в ингибировании реакции «трансплантат против хозяина» во время аллогенной трансплантации костного мозга, мононуклеарные клетки периферической крови (PBMC) добавляли в организм мышей NOD-SCID, а восстановление и выживаемость Т-клеток сравнивали с таковыми контрольной группы.
Более конкретно, модель реакции «трансплантат против хозяина» (GVHD) получали путем облучения самок мышей NSG (NOD.Cg-Prkdcscid Il2rgtm1Wjl/SzJ) 1,6 Гр с последующим введением PBMC человека. РВМС человека получали с помощью центрифугирования в пробирке Leuosisp™ (Greiner bio-one, 227290) с использованием Ficoll (GE Healthcare, 17544202) и разделения среднего лейкоцитарного слоя. Выделенные PBMC человека вводили внутрибрюшинно в количестве 1 × 107 клеток/200 мкл на мышь.
Тестируемую группу готовили путем введения антитела DNP007 (антитело к H17L4), предусмотренного в настоящем документе, в дозе 10 мг/кг два раза в неделю, в общей сложности 12 раз в течение 6 недель, а положительный контроль готовили путем введения CTLA-4-Ig (Bio X cell, BE0099) в дозе 10 мг/кг два раза в неделю, в общей сложности 12 раз в течение 6 недель. G1 (n = 3) представляет собой группу отрицательного контроля без введения PBMC, а G2 (n = 7) представляет собой группу отрицательного контроля, в которой индуцируется GVHD и в качестве носителя вводят PBS. Кроме того, G3 (n = 7) представляет собой группу положительного контроля, которой вводят CTLA-4-Ig, а G4 (n = 7) представляет собой тестовую группу, которой вводят тестируемое антитело DNP007. Измерение индукции GVHD и эффекта лечения регистрировали с помощью оценивания пяти клинических критериев (потеря массы тела, поза, активность, шерсть, кожа).
Полученные результаты показаны на Фиг. 23a и 23b. В результате было подтверждено, что тестовая группа (G4), которой вводили антитело, предусмотренное в настоящем документе, имела значимо повышенный уровень выживаемости, чем группа отрицательного контроля G2 (Фиг. 23a), и было подтверждено, что восстановление человеческих Т-клеток обычно осуществлялось эффективно (Фиг. 23b). Эти результаты показывают, что антитело, предусмотренное в настоящем документе, оказывает эффект предупреждения реакции «трансплантат против хозяина», которая возникает во время аллогенной трансплантации костного мозга, и позволяет восстановить нормальные донорские Т-клетки.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ДИНОНА
<120> АНТИТЕЛО, СПЕЦИФИЧНО СВЯЗЫВАЮЩЕЕСЯ С ICAM-1, И ЕГО ПРИМЕНЕНИЕ
<130> OPP20195065KR
<150> KR 10-2018-0173725
<151> 31 декабря 2018 г.
<160> 107
<170> KopatentIn 3.0
<210> 1
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH-CDR1)
<400> 1
Gly Tyr Thr Phe Thr Asp Tyr Ala
1 5
<210> 2
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH-CDR2)
<400> 2
Ile Ser Thr Tyr Ser Gly Asn Thr
1 5
<210> 3
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH-CDR3)
<400> 3
Ala Arg Ser Leu Tyr Phe Gly Ser Ser Gly Phe Asp Tyr
1 5 10
<210> 4
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VL-CDR1)
<400> 4
Gln Thr Leu Val Tyr Arg Asn Gly Asn Thr Tyr
1 5 10
<210> 5
<211> 3
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VL-CDR2)
<400> 5
Lys Val Ser
1
<210> 6
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VL-CDR3)
<400> 6
Ser Gln Asn Thr His Phe Pro Tyr Thr
1 5
<210> 7
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (химерная VH)
<400> 7
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Arg Pro Gly Val
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Ala Leu His Trp Val Lys Gln Ser His Ala Lys Ser Leu Glu Trp Ile
35 40 45
Gly Val Ile Ser Thr Tyr Ser Gly Asn Thr Asp Tyr Asn Gln Lys Phe
50 55 60
Arg Gly Lys Ala Thr Met Thr Val Asp Lys Ser Ser Thr Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ala Arg Leu Thr Ser Glu Asp Ser Ala Ile His Tyr Cys
85 90 95
Ala Arg Ser Leu Tyr Phe Gly Ser Ser Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Ala Leu Thr Val Ser Ser
115 120
<210> 8
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (химерная VL)
<400> 8
Asp Val Val Leu Thr Gln Thr Pro Leu Ser Leu Pro Val Asn Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Thr Leu Val Tyr Arg
20 25 30
Asn Gly Asn Thr Tyr Leu His Trp Tyr Leu Gln Lys Ala Gly Gln Ser
35 40 45
Pro Lys Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Phe Cys Ser Gln Asn
85 90 95
Thr His Phe Pro Tyr Thr Phe Gly Gly Gly Thr Lys Ile Lys Arg
100 105 110
<210> 9
<211> 363
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая (последовательность нуклеиновой кислоты,
кодирующая химерную VH)
<400> 9
caggtgcagc tgcagcagag cggcgcggaa ctggtgcgcc cgggcgtgag cgtgaaaatt 60
agctgcaaag gcagcggcta tacctttacc gattatgcgc tgcattgggt gaaacagagc 120
catgcgaaaa gcctggaatg gattggcgtg attagcacct atagcggcaa caccgattat 180
aaccagaaat ttcgcggcaa agcgaccatg accgtggata aaagcagcac caccgcgtat 240
ctggaactgg cgcgcctgac cagcgaagat agcgcgattc attattgcgc gcgcagcctg 300
tattttggca gcagcggctt tgattattgg ggccagggca ccgcgctgac cgtgagcagc 360
taa 363
<210> 10
<211> 333
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая (последовательность нуклеиновой кислоты, кодирующая химерную VL)
<400> 10
gatgtggtgc tgacccagac cccgctgagc ctgccggtga acctgggcga tcaggcgagc 60
attagctgcc gcagcagcca gaccctggtg tatcgcaacg gcaacaccta tctgcattgg 120
tatctgcaga aagcgggcca gagcccgaaa ctgctgattt ataaagtgag caaccgcttt 180
agcggcgtgc cggatcgctt tagcggcagc ggcagcggca ccgattttac cctgaaaatt 240
agccgcgtgg aagcggaaga tctgggcgtg tatttttgca gccagaacac ccattttccg 300
tatacctttg gcggcggcac caaaattaaa cgc 333
<210> 11
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH1)
<400> 11
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Ala Leu His Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Ile
35 40 45
Gly Val Ile Ser Thr Tyr Ser Gly Asn Thr Asp Tyr Asn Gln Lys Phe
50 55 60
Arg Gly Arg Ala Thr Ile Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Tyr Phe Gly Ser Ser Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Ala Leu Thr Val Ser Ser
115 120
<210> 12
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH2)
<400> 12
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Ala Leu His Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Val Ile Ser Thr Tyr Ser Gly Asn Thr Asp Tyr Asn Gln Lys Phe
50 55 60
Arg Gly Arg Val Thr Met Thr Val Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val His Tyr Cys
85 90 95
Ala Arg Ser Leu Tyr Phe Gly Ser Ser Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Ala Leu Thr Val Ser Ser
115 120
<210> 13
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH3)
<400> 13
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Ala Leu His Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Val Ile Ser Thr Tyr Ser Gly Asn Thr Asp Tyr Asn Gln Lys Phe
50 55 60
Arg Gly Arg Ala Thr Ile Thr Arg Asp Lys Ser Ala Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val His Tyr Cys
85 90 95
Ala Arg Ser Leu Tyr Phe Gly Ser Ser Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Ala Leu Thr Val Ser Ser
115 120
<210> 14
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH4)
<400> 14
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Ala Leu His Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Ile
35 40 45
Gly Val Ile Ser Thr Tyr Ser Gly Asn Thr Asp Tyr Asn Gln Lys Phe
50 55 60
Arg Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ala Thr Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Tyr Phe Gly Ser Ser Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Ala Leu Thr Val Ser Ser
115 120
<210> 15
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH5)
<400> 15
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Ala Leu His Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Val Ile Ser Thr Tyr Ser Gly Asn Thr Asp Tyr Asn Gln Lys Phe
50 55 60
Arg Gly Arg Val Thr Ile Thr Val Asp Lys Ser Ala Thr Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Tyr Phe Gly Ser Ser Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Ala Leu Thr Val Ser Ser
115 120
<210> 16
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH6)
<400> 16
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Ala Leu His Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Ile
35 40 45
Gly Val Ile Ser Thr Tyr Ser Gly Asn Thr Lys Tyr Ser Gln Lys Phe
50 55 60
Gln Gly Lys Ala Thr Ile Thr Arg Asp Lys Ser Ala Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Tyr Phe Gly Ser Ser Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Ala Leu Thr Val Ser Ser
115 120
<210> 17
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH7)
<400> 17
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Ala Leu His Trp Val Lys Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Val Ile Ser Thr Tyr Ser Gly Asn Thr Lys Tyr Ser Gln Lys Phe
50 55 60
Gln Gly Arg Ala Thr Met Thr Arg Asp Thr Ser Ala Thr Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Ile His Tyr Cys
85 90 95
Ala Arg Ser Leu Tyr Phe Gly Ser Ser Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Ala Leu Thr Val Ser Ser
115 120
<210> 18
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH8)
<400> 18
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Ala Leu His Trp Val Arg Gln Ala Pro Gly Gln Ser Leu Glu Trp Met
35 40 45
Gly Val Ile Ser Thr Tyr Ser Gly Asn Thr Lys Tyr Ser Gln Lys Phe
50 55 60
Gln Gly Arg Ala Thr Met Thr Arg Asp Lys Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Tyr Phe Gly Ser Ser Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Ala Leu Thr Val Ser Ser
115 120
<210> 19
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH9)
<400> 19
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Val Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Ala Leu His Trp Val Arg Gln Ala Pro Gly Gln Ser Leu Glu Trp Met
35 40 45
Gly Val Ile Ser Thr Tyr Ser Gly Asn Thr Lys Tyr Ser Gln Lys Phe
50 55 60
Gln Gly Lys Val Thr Ile Thr Val Asp Thr Ser Ala Thr Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val His Tyr Cys
85 90 95
Ala Arg Ser Leu Tyr Phe Gly Ser Ser Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Ala Leu Thr Val Ser Ser
115 120
<210> 20
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH10)
<400> 20
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Ala Leu His Trp Val Lys Gln Ala Pro Gly Gln Ser Leu Glu Trp Met
35 40 45
Gly Val Ile Ser Thr Tyr Ser Gly Asn Thr Lys Tyr Ser Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Val Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Ile Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Tyr Phe Gly Ser Ser Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Ala Leu Thr Val Ser Ser
115 120
<210> 21
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH11)
<400> 21
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Ala Leu His Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Ile
35 40 45
Gly Val Ile Ser Thr Tyr Ser Gly Asn Thr Lys Tyr Ser Gln Lys Phe
50 55 60
Gln Gly Lys Val Thr Ile Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Ile His Tyr Cys
85 90 95
Ala Arg Ser Leu Tyr Phe Gly Ser Ser Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Ala Leu Thr Val Ser Ser
115 120
<210> 22
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH12)
<400> 22
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Ala Leu His Trp Val Lys Gln Ala Pro Gly Gln Arg Leu Glu Trp Ile
35 40 45
Gly Val Ile Ser Thr Tyr Ser Gly Asn Thr Lys Tyr Ser Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Val Asp Lys Ser Ala Thr Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Tyr Phe Gly Ser Ser Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Ala Leu Thr Val Ser Ser
115 120
<210> 23
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH13)
<400> 23
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Ala Leu His Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Val Ile Ser Thr Tyr Ser Gly Asn Thr Asp Tyr Asn Gln Lys Phe
50 55 60
Arg Gly Arg Val Thr Ile Thr Arg Asp Lys Ser Ala Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Tyr Phe Gly Ser Ser Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Ala Leu Thr Val Ser Ser
115 120
<210> 24
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH14)
<400> 24
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Ala Leu His Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Val Ile Ser Thr Tyr Ser Gly Asn Thr Asp Tyr Asn Gln Lys Phe
50 55 60
Arg Gly Arg Val Thr Ile Thr Val Asp Thr Ser Ala Thr Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val His Tyr Cys
85 90 95
Ala Arg Ser Leu Tyr Phe Gly Ser Ser Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Ala Leu Thr Val Ser Ser
115 120
<210> 25
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH15)
<400> 25
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Ala Leu His Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Ile
35 40 45
Gly Val Ile Ser Thr Tyr Ser Gly Asn Thr Asp Tyr Asn Gln Lys Phe
50 55 60
Arg Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val His Tyr Cys
85 90 95
Ala Arg Ser Leu Tyr Phe Gly Ser Ser Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Ala Leu Thr Val Ser Ser
115 120
<210> 26
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH16)
<400> 26
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Ala Leu His Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Val Ile Ser Thr Tyr Ser Gly Asn Thr Asp Tyr Asn Gln Lys Phe
50 55 60
Arg Gly Arg Ala Thr Met Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Tyr Phe Gly Ser Ser Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Ala Leu Thr Val Ser Ser
115 120
<210> 27
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH17)
<400> 27
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Ala Leu His Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Val Ile Ser Thr Tyr Ser Gly Asn Thr Asp Tyr Asn Gln Lys Phe
50 55 60
Arg Gly Arg Ala Thr Ile Thr Val Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Tyr Phe Gly Ser Ser Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Ala Leu Thr Val Ser Ser
115 120
<210> 28
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH18)
<400> 28
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Ala Leu His Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Ile
35 40 45
Gly Val Ile Ser Thr Tyr Ser Gly Asn Thr Asp Tyr Asn Gln Lys Phe
50 55 60
Arg Gly Arg Val Thr Ile Thr Arg Asp Lys Ser Ala Thr Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Tyr Phe Gly Ser Ser Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Ala Leu Thr Val Ser Ser
115 120
<210> 29
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH19)
<400> 29
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Ala Leu His Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Ile
35 40 45
Gly Val Ile Ser Thr Tyr Ser Gly Asn Thr Lys Tyr Ser Gln Lys Phe
50 55 60
Gln Gly Arg Ala Thr Ile Thr Val Asp Thr Ser Ala Thr Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Tyr Phe Gly Ser Ser Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Ala Leu Thr Val Ser Ser
115 120
<210> 30
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH20)
<400> 30
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Ala Leu His Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Ile
35 40 45
Gly Val Ile Ser Thr Tyr Ser Gly Asn Thr Lys Tyr Ser Gln Lys Phe
50 55 60
Gln Gly Arg Ala Thr Met Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val His Tyr Cys
85 90 95
Ala Arg Ser Leu Tyr Phe Gly Ser Ser Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Ala Leu Thr Val Ser Ser
115 120
<210> 31
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH21)
<400> 31
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Ala Leu His Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Ile
35 40 45
Gly Val Ile Ser Thr Tyr Ser Gly Asn Thr Lys Tyr Ser Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Met Thr Val Asp Lys Ser Ala Thr Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ser Leu Tyr Phe Gly Ser Ser Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Ala Leu Thr Val Ser Ser
115 120
<210> 32
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH22)
<400> 32
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Ala Leu His Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Val Ile Ser Thr Tyr Ser Gly Asn Thr Lys Tyr Ser Gln Lys Phe
50 55 60
Gln Gly Arg Ala Thr Met Thr Arg Asp Lys Ser Ala Thr Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val His Tyr Cys
85 90 95
Ala Arg Ser Leu Tyr Phe Gly Ser Ser Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Ala Leu Thr Val Ser Ser
115 120
<210> 33
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH23)
<400> 33
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Ala Leu His Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Val Ile Ser Thr Tyr Ser Gly Asn Thr Lys Tyr Ser Gln Lys Phe
50 55 60
Gln Gly Arg Ala Thr Met Thr Val Asp Lys Ser Ala Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val His Tyr Cys
85 90 95
Ala Arg Ser Leu Tyr Phe Gly Ser Ser Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Ala Leu Thr Val Ser Ser
115 120
<210> 34
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH24)
<400> 34
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Gly Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Ala Leu His Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Ile
35 40 45
Gly Val Ile Ser Thr Tyr Ser Gly Asn Thr Lys Tyr Ser Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Val Asp Lys Ser Ala Thr Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val His Tyr Cys
85 90 95
Ala Arg Ser Leu Tyr Phe Gly Ser Ser Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Ala Leu Thr Val Ser Ser
115 120
<210> 35
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VL1)
<400> 35
Asp Val Val Leu Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Thr Leu Val Tyr Arg
20 25 30
Asn Gly Asn Thr Tyr Leu His Trp Tyr Gln Gln Arg Pro Gly Gln Ser
35 40 45
Pro Arg Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Phe Cys Ser Gln Asn
85 90 95
Thr His Phe Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 36
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VL2)
<400> 36
Asp Val Val Leu Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Thr Leu Val Tyr Arg
20 25 30
Asn Gly Asn Thr Tyr Leu His Trp Tyr Gln Gln Arg Ala Gly Gln Ser
35 40 45
Pro Arg Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Phe Cys Ser Gln Asn
85 90 95
Thr His Phe Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 37
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VL3)
<400> 37
Asp Val Val Leu Thr Gln Thr Pro Leu Ser Ser Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Thr Leu Val Tyr Arg
20 25 30
Asn Gly Asn Thr Tyr Leu His Trp Tyr Leu Gln Arg Ala Gly Gln Pro
35 40 45
Pro Arg Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ala Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Phe Cys Ser Gln Asn
85 90 95
Thr His Phe Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 38
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VL4)
<400> 38
Asp Val Val Leu Thr Gln Thr Pro Leu Ser Ser Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Thr Leu Val Tyr Arg
20 25 30
Asn Gly Asn Thr Tyr Leu His Trp Tyr Gln Gln Arg Pro Gly Gln Pro
35 40 45
Pro Arg Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ala Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Phe Cys Ser Gln Asn
85 90 95
Thr His Phe Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 39
<211> 25
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH-FR1)
<400> 39
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Arg Pro Gly Val
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Gly Ser
20 25
<210> 40
<211> 25
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH-FR1)
<400> 40
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Gly Ser
20 25
<210> 41
<211> 25
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH-FR1)
<400> 41
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser
20 25
<210> 42
<211> 25
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH-FR1)
<400> 42
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser
20 25
<210> 43
<211> 25
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH-FR1)
<400> 43
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Gly Ser
20 25
<210> 44
<211> 25
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH-FR1)
<400> 44
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Gly Ser
20 25
<210> 45
<211> 25
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH-FR1)
<400> 45
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Val Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser
20 25
<210> 46
<211> 25
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH-FR1)
<400> 46
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser
20 25
<210> 47
<211> 25
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH-FR1)
<400> 47
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser
20 25
<210> 48
<211> 25
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH-FR1)
<400> 48
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser
20 25
<210> 49
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH-FR2)
<400> 49
Leu His Trp Val Lys Gln Ser His Ala Lys Ser Leu Glu Trp Ile Gly
1 5 10 15
Val
<210> 50
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH-FR2)
<400> 50
Leu His Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Ile Gly
1 5 10 15
Val
<210> 51
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH-FR2)
<400> 51
Leu His Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met Gly
1 5 10 15
Val
<210> 52
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH-FR2)
<400> 52
Leu His Trp Val Lys Gln Ala Pro Gly Gln Arg Leu Glu Trp Met Gly
1 5 10 15
Val
<210> 53
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH-FR2)
<400> 53
Leu His Trp Val Arg Gln Ala Pro Gly Gln Ser Leu Glu Trp Met Gly
1 5 10 15
Val
<210> 54
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH-FR2)
<400> 54
Leu His Trp Val Lys Gln Ala Pro Gly Gln Ser Leu Glu Trp Met Gly
1 5 10 15
Val
<210> 55
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH-FR2)
<400> 55
Leu His Trp Val Lys Gln Ala Pro Gly Gln Arg Leu Glu Trp Ile Gly
1 5 10 15
Val
<210> 56
<211> 38
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH-FR3)
<400> 56
Asp Tyr Asn Gln Lys Phe Arg Gly Lys Ala Thr Met Thr Val Asp Lys
1 5 10 15
Ser Ser Thr Thr Ala Tyr Leu Glu Leu Ala Arg Leu Thr Ser Glu Asp
20 25 30
Ser Ala Ile His Tyr Cys
35
<210> 57
<211> 38
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH-FR3)
<400> 57
Asp Tyr Asn Gln Lys Phe Arg Gly Arg Ala Thr Ile Thr Arg Asp Thr
1 5 10 15
Ser Ala Ser Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp
20 25 30
Thr Ala Val Tyr Tyr Cys
35
<210> 58
<211> 38
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH-FR3)
<400> 58
Asp Tyr Asn Gln Lys Phe Arg Gly Arg Val Thr Met Thr Val Asp Thr
1 5 10 15
Ser Ala Ser Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp
20 25 30
Thr Ala Val His Tyr Cys
35
<210> 59
<211> 38
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH-FR3)
<400> 59
Asp Tyr Asn Gln Lys Phe Arg Gly Arg Ala Thr Ile Thr Arg Asp Lys
1 5 10 15
Ser Ala Ser Thr Ala Tyr Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp
20 25 30
Thr Ala Val His Tyr Cys
35
<210> 60
<211> 38
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH-FR3)
<400> 60
Asp Tyr Asn Gln Lys Phe Arg Gly Arg Val Thr Met Thr Arg Asp Thr
1 5 10 15
Ser Ala Thr Thr Ala Tyr Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp
20 25 30
Thr Ala Val Tyr Tyr Cys
35
<210> 61
<211> 38
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH-FR3)
<400> 61
Asp Tyr Asn Gln Lys Phe Arg Gly Arg Val Thr Ile Thr Val Asp Lys
1 5 10 15
Ser Ala Thr Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp
20 25 30
Thr Ala Val Tyr Tyr Cys
35
<210> 62
<211> 38
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH-FR3)
<400> 62
Lys Tyr Ser Gln Lys Phe Gln Gly Lys Ala Thr Ile Thr Arg Asp Lys
1 5 10 15
Ser Ala Ser Thr Ala Tyr Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp
20 25 30
Thr Ala Val Tyr Tyr Cys
35
<210> 63
<211> 38
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH-FR3)
<400> 63
Lys Tyr Ser Gln Lys Phe Gln Gly Arg Ala Thr Met Thr Arg Asp Thr
1 5 10 15
Ser Ala Thr Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp
20 25 30
Thr Ala Ile His Tyr Cys
35
<210> 64
<211> 38
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH-FR3)
<400> 64
Lys Tyr Ser Gln Lys Phe Gln Gly Arg Ala Thr Met Thr Arg Asp Lys
1 5 10 15
Ser Ala Ser Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp
20 25 30
Thr Ala Val Tyr Tyr Cys
35
<210> 65
<211> 38
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH-FR3)
<400> 65
Lys Tyr Ser Gln Lys Phe Gln Gly Lys Val Thr Ile Thr Val Asp Thr
1 5 10 15
Ser Ala Thr Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp
20 25 30
Thr Ala Val His Tyr Cys
35
<210> 66
<211> 38
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH-FR3)
<400> 66
Lys Tyr Ser Gln Lys Phe Gln Gly Arg Val Thr Ile Thr Val Asp Thr
1 5 10 15
Ser Ala Ser Thr Ala Tyr Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp
20 25 30
Thr Ala Ile Tyr Tyr Cys
35
<210> 67
<211> 38
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH-FR3)
<400> 67
Lys Tyr Ser Gln Lys Phe Gln Gly Lys Val Thr Ile Thr Arg Asp Thr
1 5 10 15
Ser Ala Ser Thr Ala Tyr Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp
20 25 30
Thr Ala Ile His Tyr Cys
35
<210> 68
<211> 38
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH-FR3)
<400> 68
Lys Tyr Ser Gln Lys Phe Gln Gly Lys Val Thr Ile Thr Arg Asp Thr
1 5 10 15
Ser Ala Ser Thr Ala Tyr Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp
20 25 30
Thr Ala Ile His Tyr Cys
35
<210> 69
<211> 38
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH-FR3)
<400> 69
Asp Tyr Asn Gln Lys Phe Arg Gly Arg Val Thr Ile Thr Arg Asp Lys
1 5 10 15
Ser Ala Ser Thr Ala Tyr Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp
20 25 30
Thr Ala Val Tyr Tyr Cys
35
<210> 70
<211> 38
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH-FR3)
<400> 70
Asp Tyr Asn Gln Lys Phe Arg Gly Arg Val Thr Ile Thr Val Asp Thr
1 5 10 15
Ser Ala Thr Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp
20 25 30
Thr Ala Val His Tyr Cys
35
<210> 71
<211> 38
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH-FR3)
<400> 71
Asp Tyr Asn Gln Lys Phe Arg Gly Arg Val Thr Met Thr Arg Asp Thr
1 5 10 15
Ser Ala Ser Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp
20 25 30
Thr Ala Val His Tyr Cys
35
<210> 72
<211> 38
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH-FR3)
<400> 72
Asp Tyr Asn Gln Lys Phe Arg Gly Arg Ala Thr Met Thr Arg Asp Thr
1 5 10 15
Ser Ala Ser Thr Ala Tyr Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp
20 25 30
Thr Ala Val Tyr Tyr Cys
35
<210> 73
<211> 38
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH-FR3)
<400> 73
Asp Tyr Asn Gln Lys Phe Arg Gly Arg Ala Thr Ile Thr Val Asp Thr
1 5 10 15
Ser Ala Ser Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp
20 25 30
Thr Ala Val Tyr Tyr Cys
35
<210> 74
<211> 38
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH-FR3)
<400> 74
Asp Tyr Asn Gln Lys Phe Arg Gly Arg Val Thr Ile Thr Arg Asp Lys
1 5 10 15
Ser Ala Thr Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp
20 25 30
Thr Ala Val Tyr Tyr Cys
35
<210> 75
<211> 38
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH-FR3)
<400> 75
Lys Tyr Ser Gln Lys Phe Gln Gly Arg Ala Thr Ile Thr Val Asp Thr
1 5 10 15
Ser Ala Thr Thr Ala Tyr Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp
20 25 30
Thr Ala Val Tyr Tyr Cys
35
<210> 76
<211> 38
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH-FR3)
<400> 76
Lys Tyr Ser Gln Lys Phe Gln Gly Arg Ala Thr Met Thr Arg Asp Thr
1 5 10 15
Ser Ala Ser Thr Ala Tyr Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp
20 25 30
Thr Ala Val His Tyr Cys
35
<210> 77
<211> 38
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH-FR3)
<400> 77
Lys Tyr Ser Gln Lys Phe Gln Gly Arg Val Thr Met Thr Val Asp Lys
1 5 10 15
Ser Ala Thr Thr Ala Tyr Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp
20 25 30
Thr Ala Val Tyr Tyr Cys
35
<210> 78
<211> 38
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH-FR3)
<400> 78
Lys Tyr Ser Gln Lys Phe Gln Gly Arg Ala Thr Met Thr Arg Asp Lys
1 5 10 15
Ser Ala Thr Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp
20 25 30
Thr Ala Val His Tyr Cys
35
<210> 79
<211> 38
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH-FR3)
<400> 79
Lys Tyr Ser Gln Lys Phe Gln Gly Arg Ala Thr Met Thr Val Asp Lys
1 5 10 15
Ser Ala Ser Thr Ala Tyr Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp
20 25 30
Thr Ala Val His Tyr Cys
35
<210> 80
<211> 38
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH-FR3)
<400> 80
Lys Tyr Ser Gln Lys Phe Gln Gly Arg Val Thr Ile Thr Val Asp Lys
1 5 10 15
Ser Ala Thr Thr Ala Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp
20 25 30
Thr Ala Val His Tyr Cys
35
<210> 81
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH-FR4)
<400> 81
Trp Gly Gln Gly Thr Ala Leu Thr Val Ser Ser
1 5 10
<210> 82
<211> 26
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VL-FR1)
<400> 82
Asp Val Val Leu Thr Gln Thr Pro Leu Ser Leu Pro Val Asn Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser
20 25
<210> 83
<211> 26
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VL-FR1)
<400> 83
Asp Val Val Leu Thr Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser
20 25
<210> 84
<211> 26
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VL-FR1)
<400> 84
Asp Val Val Leu Thr Gln Thr Pro Leu Ser Ser Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser
20 25
<210> 85
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VL-FR2)
<400> 85
Leu His Trp Tyr Leu Gln Lys Ala Gly Gln Ser Pro Lys Leu Leu Ile
1 5 10 15
Tyr
<210> 86
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VL-FR2)
<400> 86
Leu His Trp Tyr Leu Gln Lys Ala Gly Gln Ser Pro Lys Leu Leu Ile
1 5 10 15
<210> 87
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VL-FR2)
<400> 87
Leu His Trp Tyr Gln Gln Arg Ala Gly Gln Ser Pro Arg Leu Leu Ile
1 5 10 15
Tyr
<210> 88
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VL-FR2)
<400> 88
Leu His Trp Tyr Leu Gln Arg Ala Gly Gln Pro Pro Arg Leu Leu Ile
1 5 10 15
Tyr
<210> 89
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VL-FR2)
<400> 89
Leu His Trp Tyr Gln Gln Arg Pro Gly Gln Pro Pro Arg Leu Leu Ile
1 5 10 15
Tyr
<210> 90
<211> 36
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VL-FR3)
<400> 90
Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly
1 5 10 15
Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Leu Gly
20 25 30
Val Tyr Phe Cys
35
<210> 91
<211> 36
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VL-FR3)
<400> 91
Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly
1 5 10 15
Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly
20 25 30
Val Tyr Phe Cys
35
<210> 92
<211> 36
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VL-FR3)
<400> 92
Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ala Gly
1 5 10 15
Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Val Gly
20 25 30
Val Tyr Phe Cys
35
<210> 93
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VL-FR4)
<400> 93
Phe Gly Gly Gly Thr Lys Ile Lys Arg Gln
1 5 10
<210> 94
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VL-FR4)
<400> 94
Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
1 5 10
<210> 95
<211> 327
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (тяжелая цепь)
<400> 95
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
100 105 110
Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
165 170 175
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
305 310 315 320
Leu Ser Leu Ser Leu Gly Lys
325
<210> 96
<211> 106
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (легкая цепь)
<400> 96
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
1 5 10 15
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
20 25 30
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
35 40 45
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
50 55 60
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
65 70 75 80
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
85 90 95
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 97
<211> 25
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH-FR1)
<220>
<221> MOD_RES
<222> (5)
<223> Xaa представляет собой Gln или Val
<220>
<221> MOD_RES
<222> (11)
<223> Xaa представляет собой Leu или Val
<220>
<221> MOD_RES
<222> (12)
<223> Xaa представляет собой Val или Lys
<220>
<221> MOD_RES
<222> (13)
<223> Xaa представляет собой Arg или Lys
<220>
<221> MOD_RES
<222> (16)
<223> Xaa представляет собой Val или Ala
<220>
<221> MOD_RES
<222> (20)
<223> Xaa представляет собой Ile или Val
<220>
<221> MOD_RES
<222> (24)
<223> Xaa представляет собой Gly или Ala
<400> 97
Gln Val Gln Leu Xaa Gln Ser Gly Ala Glu Xaa Xaa Xaa Pro Gly Xaa
1 5 10 15
Ser Val Lys Xaa Ser Cys Lys Xaa Ser
20 25
<210> 98
<211> 25
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH-FR1)
<220>
<221> MOD_RES
<222> (5)
<223> Xaa представляет собой Val или Gln
<220>
<221> MOD_RES
<222> (12)
<223> Xaa представляет собой Lys или Val
<220>
<221> MOD_RES
<222> (20)
<223> Xaa представляет собой Ile или Val
<220>
<221> MOD_RES
<222> (24)
<223> Xaa представляет собой Gly или Ala
<400> 98
Gln Val Gln Leu Xaa Gln Ser Gly Ala Glu Val Xaa Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Xaa Ser Cys Lys Xaa Ser
20 25
<210> 99
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH-FR2)
<220>
<221> MOD_RES
<222> (5)
<223> Xaa представляет собой Lys или Arg
<220>
<221> MOD_RES
<222> (7)
<223> Xaa представляет собой Ser или Ala
<220>
<221> MOD_RES
<222> (8)
<223> Xaa представляет собой His или Pro
<220>
<221> MOD_RES
<222> (9)
<223> Xaa представляет собой Ala или Gly
<220>
<221> MOD_RES
<222> (10)
<223> Xaa представляет собой Lys или Gln
<220>
<221> MOD_RES
<222> (11)
<223> Xaa представляет собой Ser или Arg
<220>
<221> MOD_RES
<222> (15)
<223> Xaa представляет собой Ile или Met
<400> 99
Leu His Trp Val Xaa Gln Xaa Xaa Xaa Xaa Xaa Leu Glu Trp Xaa Gly
1 5 10 15
Val
<210> 100
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH-FR2)
<220>
<221> MOD_RES
<222> (5)
<223> Xaa представляет собой Arg или Lys
<220>
<221> MOD_RES
<222> (11)
<223> Xaa представляет собой Arg или Ser
<220>
<221> MOD_RES
<222> (15)
<223> Xaa представляет собой Ile или Met
<400> 100
Leu His Trp Val Xaa Gln Ala Pro Gly Gln Xaa Leu Glu Trp Xaa Gly
1 5 10 15
Val
<210> 101
<211> 38
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH-FR3)
<220>
<221> MOD_RES
<222> (1)
<223> Xaa представляет собой Asp или Lys
<220>
<221> MOD_RES
<222> (3)
<223> Xaa представляет собой Asn или Ser
<220>
<221> MOD_RES
<222> (7)
<223> Xaa представляет собой Arg или Gln
<220>
<221> MOD_RES
<222> (9)
<223> Xaa представляет собой Lys или Arg
<220>
<221> MOD_RES
<222> (10)
<223> Xaa представляет собой Ala или Val
<220>
<221> MOD_RES
<222> (12)
<223> Xaa представляет собой Met или Ile
<220>
<221> MOD_RES
<222> (14)
<223> Xaa представляет собой Val или Arg
<220>
<221> MOD_RES
<222> (16)
<223> Xaa представляет собой Lys или Thr
<220>
<221> MOD_RES
<222> (18)
<223> Xaa представляет собой Ser или Ala
<220>
<221> MOD_RES
<222> (19)
<223> Xaa представляет собой Thr или Ser
<220>
<221> MOD_RES
<222> (23)
<223> Xaa представляет собой Leu или Met
<220>
<221> MOD_RES
<222> (26)
<223> Xaa представляет собой Ala или Ser
<220>
<221> MOD_RES
<222> (27)
<223> Xaa представляет собой Arg или Ser
<220>
<221> MOD_RES
<222> (29)
<223> Xaa представляет собой Thr или Arg
<220>
<221> MOD_RES
<222> (33)
<223> Xaa представляет собой Ser или Thr
<220>
<221> MOD_RES
<222> (35)
<223> Xaa представляет собой Ile или Val
<220>
<221> MOD_RES
<222> (36)
<223> Xaa представляет собой His или Tyr
<400> 101
Xaa Tyr Xaa Gln Lys Phe Xaa Gly Xaa Xaa Thr Xaa Thr Xaa Asp Xaa
1 5 10 15
Ser Xaa Xaa Thr Ala Tyr Xaa Glu Leu Xaa Xaa Leu Xaa Ser Glu Asp
20 25 30
Xaa Ala Xaa Xaa Tyr Cys
35
<210> 102
<211> 38
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VH-FR3)
<220>
<221> MOD_RES
<222> (1)
<223> Xaa представляет собой Asp или Lys
<220>
<221> MOD_RES
<222> (3)
<223> Xaa представляет собой Asn или Ser
<220>
<221> MOD_RES
<222> (7)
<223> Xaa представляет собой Arg или Gln
<220>
<221> MOD_RES
<222> (9)
<223> Xaa представляет собой Arg или Lys
<220>
<221> MOD_RES
<222> (10)
<223> Xaa представляет собой Ala или Val
<220>
<221> MOD_RES
<222> (12)
<223> Xaa представляет собой Ile или Met
<220>
<221> MOD_RES
<222> (14)
<223> Xaa представляет собой Arg или Val
<220>
<221> MOD_RES
<222> (16)
<223> Xaa представляет собой Thr или Lys
<220>
<221> MOD_RES
<222> (19)
<223> Xaa представляет собой Ser или Thr
<220>
<221> MOD_RES
<222> (23)
<223> Xaa представляет собой Met или Leu
<220>
<221> MOD_RES
<222> (35)
<223> Xaa представляет собой Val или Ile
<220>
<221> MOD_RES
<222> (36)
<223> Xaa представляет собой Tyr или His
<400> 102
Xaa Tyr Xaa Gln Lys Phe Xaa Gly Xaa Xaa Thr Xaa Thr Xaa Arg Xaa
1 5 10 15
Ser Ala Xaa Thr Ala Tyr Xaa Glu Leu Ser Ser Leu Arg Ser Glu Asp
20 25 30
Thr Ala Xaa Xaa Tyr Cys
35
<210> 103
<211> 26
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VL-FR1)
<220>
<221> MOD_RES
<222> (7)
<223> Xaa представляет собой Thr или Ser
<220>
<221> MOD_RES
<222> (11)
<223> Xaa представляет собой Leu или Ser
<220>
<221> MOD_RES
<222> (14)
<223> Xaa представляет собой Asn или Thr
<220>
<221> MOD_RES
<222> (17)
<223> Xaa представляет собой Asp или Gln
<220>
<221> MOD_RES
<222> (18)
<223> Xaa представляет собой Gln или Pro
<400> 103
Asp Val Val Leu Thr Gln Xaa Pro Leu Ser Xaa Pro Val Xaa Leu Gly
1 5 10 15
Xaa Xaa Ala Ser Ile Ser Cys Arg Ser Ser
20 25
<210> 104
<211> 26
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VL-FR1)
<220>
<221> MOD_RES
<222> (7)
<223> Xaa представляет собой Ser или Thr
<220>
<221> MOD_RES
<222> (11)
<223> Xaa представляет собой Leu или Ser
<400> 104
Asp Val Val Leu Thr Gln Xaa Pro Leu Ser Xaa Pro Val Thr Leu Gly
1 5 10 15
Gln Pro Ala Ser Ile Ser Cys Arg Ser Ser
20 25
<210> 105
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VL-FR2)
<220>
<221> MOD_RES
<222> (5)
<223> Xaa представляет собой Leu или Gln
<220>
<221> MOD_RES
<222> (7)
<223> Xaa представляет собой Lys или Arg
<220>
<221> MOD_RES
<222> (8)
<223> Xaa представляет собой Ala или Pro
<220>
<221> MOD_RES
<222> (11)
<223> Xaa представляет собой Ser или Pro
<220>
<221> MOD_RES
<222> (13)
<223> Xaa представляет собой Lys или Arg
<220>
<221> MOD_RES
<222> (17)
<223> Xaa представляет собой Tyr или отсутствует
<400> 105
Leu His Trp Tyr Xaa Gln Xaa Xaa Gly Gln Xaa Pro Xaa Leu Leu Ile
1 5 10 15
Xaa
<210> 106
<211> 36
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VL-FR3)
<220>
<221> MOD_RES
<222> (15)
<223> Xaa представляет собой Ser или Ala
<220>
<221> MOD_RES
<222> (31)
<223> Xaa представляет собой Leu или Val
<400> 106
Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Xaa Gly
1 5 10 15
Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Xaa Gly
20 25 30
Val Tyr Phe Cys
35
<210> 107
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетическая (VL-FR4)
<220>
<221> MOD_RES
<222> (7)
<223> Xaa представляет собой Ile или Leu
<220>
<221> MOD_RES
<222> (8)
<223> Xaa представляет собой Lys или Glu
<220>
<221> MOD_RES
<222> (9)
<223> Xaa представляет собой Arg или Ile
<220>
<221> MOD_RES
<222> (10)
<223> Xaa представляет собой Gln или Lys
<220>
<221> MOD_RES
<222> (11)
<223> Xaa представляет собой Arg или отсутствует
<400> 107
Phe Gly Gly Gly Thr Lys Xaa Xaa Xaa Xaa Xaa
1 5 10
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| КОНСТРУКЦИИ, ИМЕЮЩИЕ SIRP-АЛЬФА ДОМЕН ИЛИ ЕГО ВАРИАНТ | 2016 |
|
RU2740672C2 |
| АНТИ-TIGIT АНТИТЕЛА И СПОСОБЫ ПРИМЕНЕНИЯ | 2016 |
|
RU2732591C2 |
| АНТИ-TIGIT АНТИТЕЛА И СПОСОБЫ ПРИМЕНЕНИЯ | 2016 |
|
RU2817838C2 |
| АНТИ-PVRIG АНТИТЕЛА И СПОСОБЫ ПРИМЕНЕНИЯ | 2016 |
|
RU2732042C2 |
| АНТИ-PVRIG АНТИТЕЛА И СПОСОБЫ ПРИМЕНЕНИЯ | 2016 |
|
RU2827926C2 |
| ВАРИАНТНЫЕ МОЛЕКУЛЫ IL-10 И СПОСОБ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛИ | 2020 |
|
RU2836849C2 |
| АНТИ-ApoC3 АНТИТЕЛА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2781074C2 |
| АНТИ-PD-1 АНТИТЕЛА | 2019 |
|
RU2788095C2 |
| ИММУНОЦИТОКИНЫ НА ОСНОВЕ IL-15 И IL-15Rα ДОМЕНА SUSHI | 2012 |
|
RU2763298C2 |
| АНТИ-DR5-АНТИТЕЛО И ЕГО ПРИМЕНЕНИЕ | 2018 |
|
RU2735956C1 |
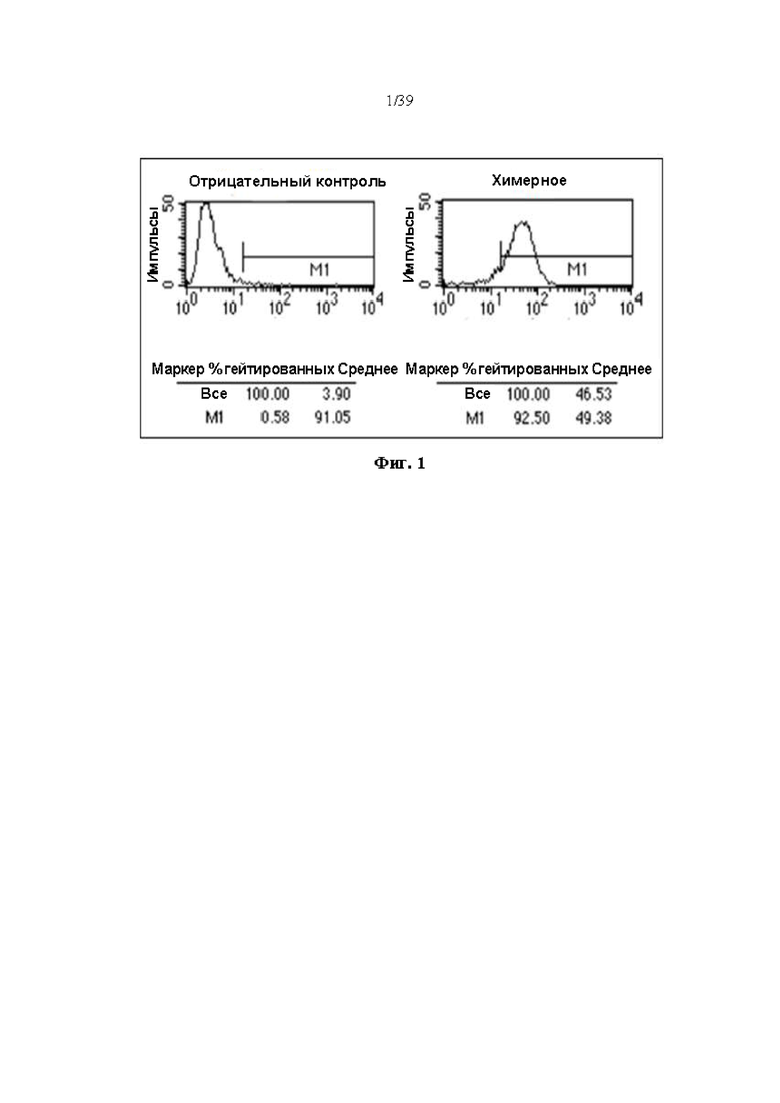
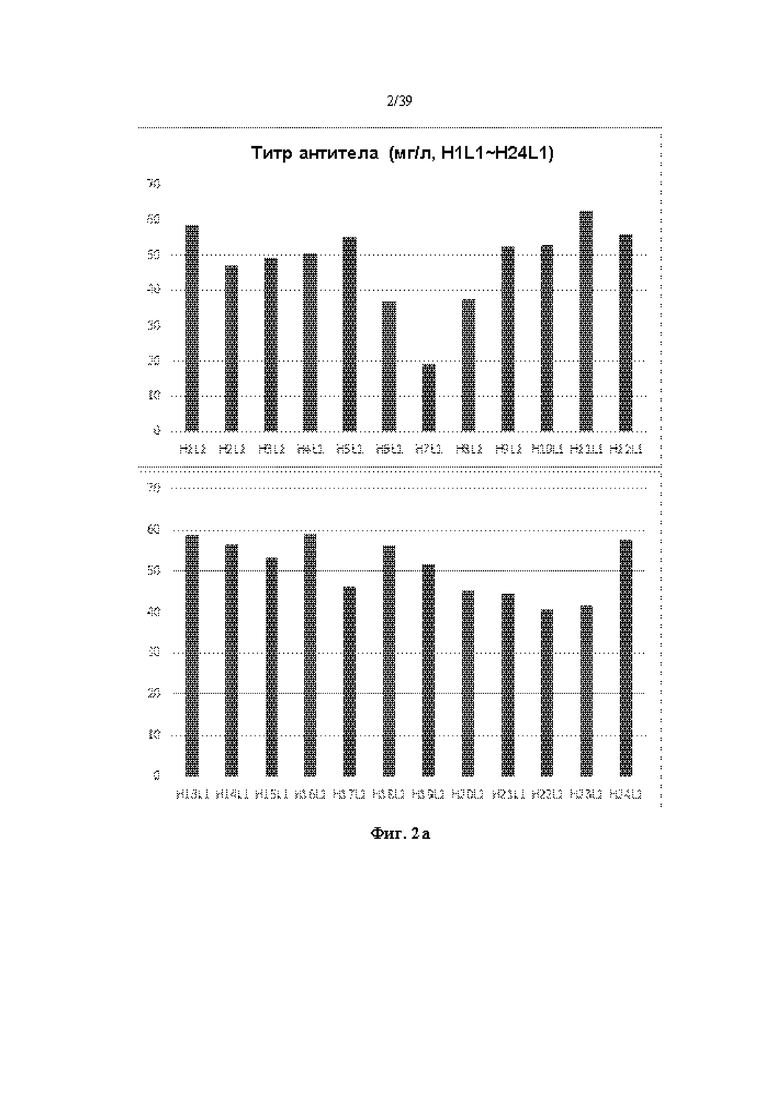
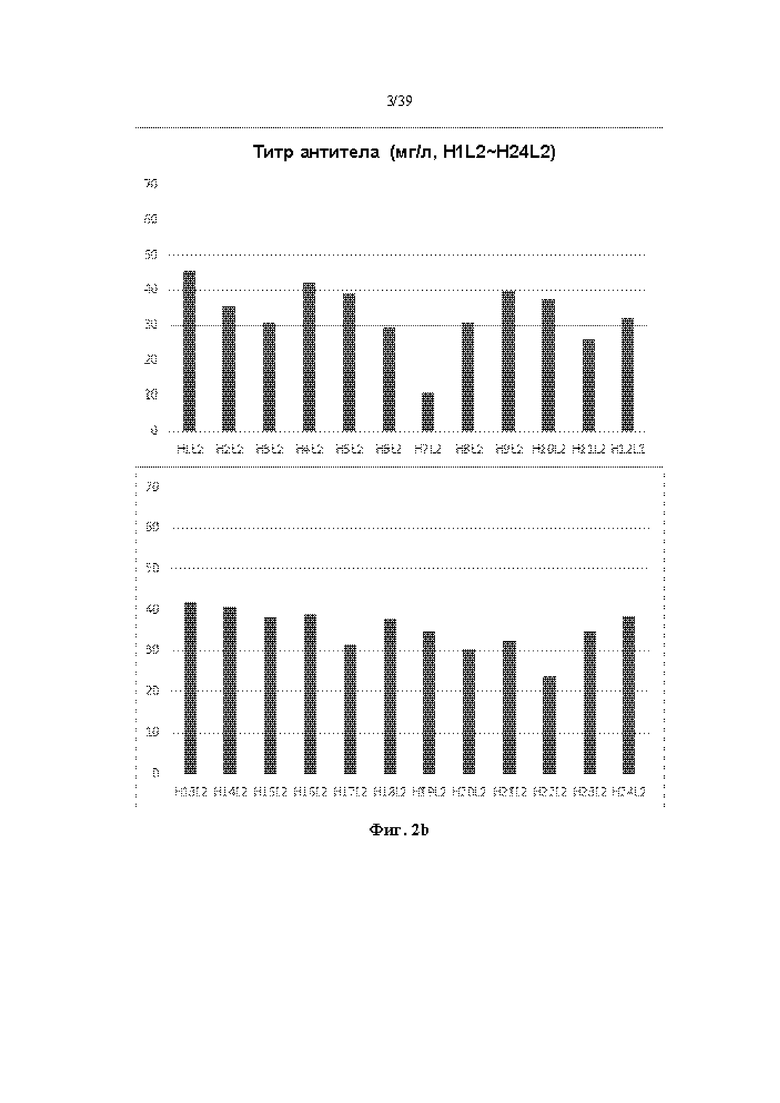
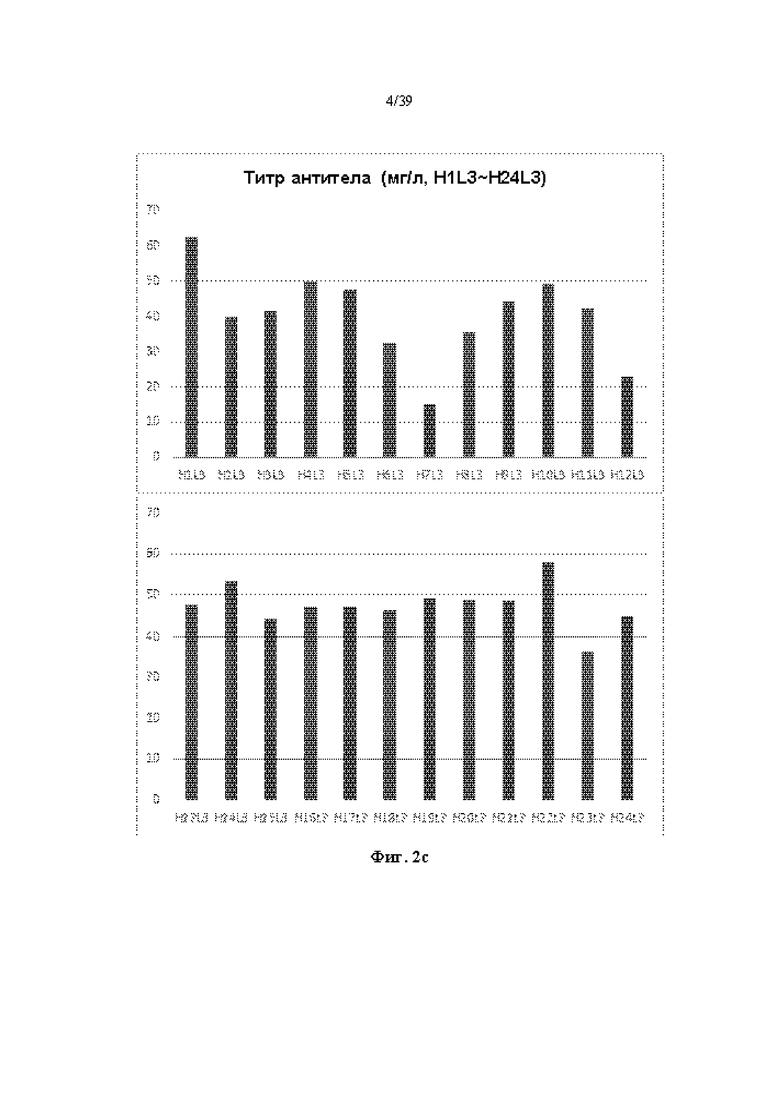
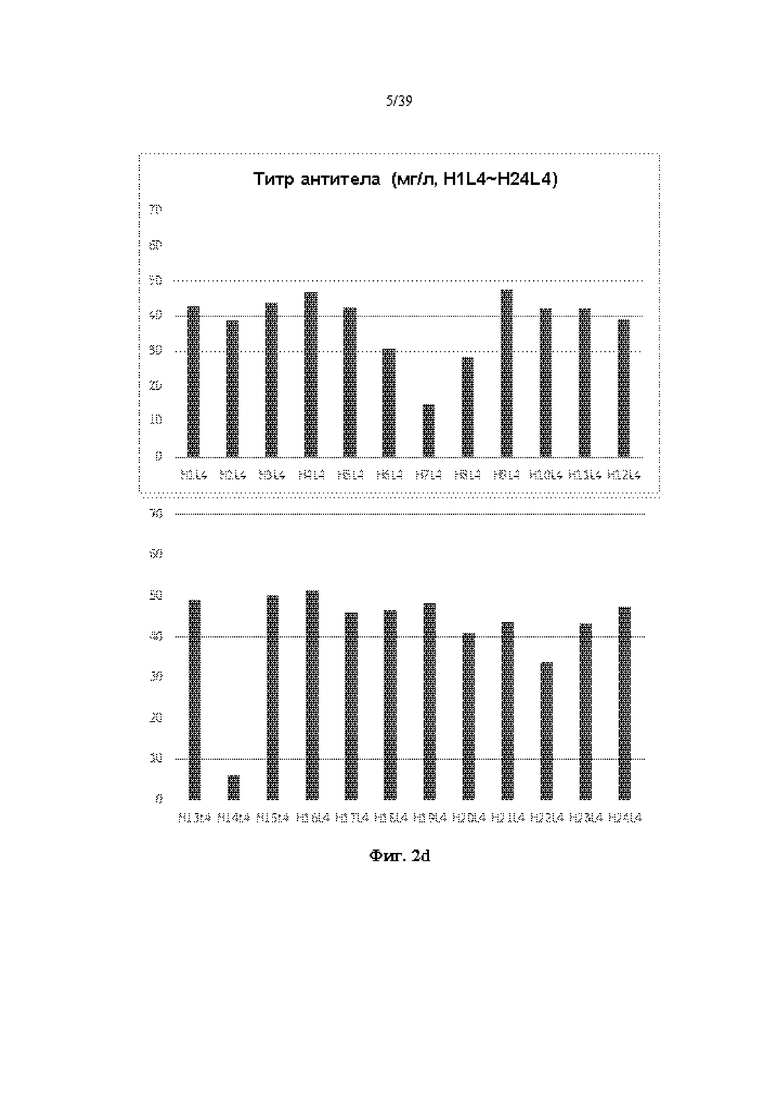
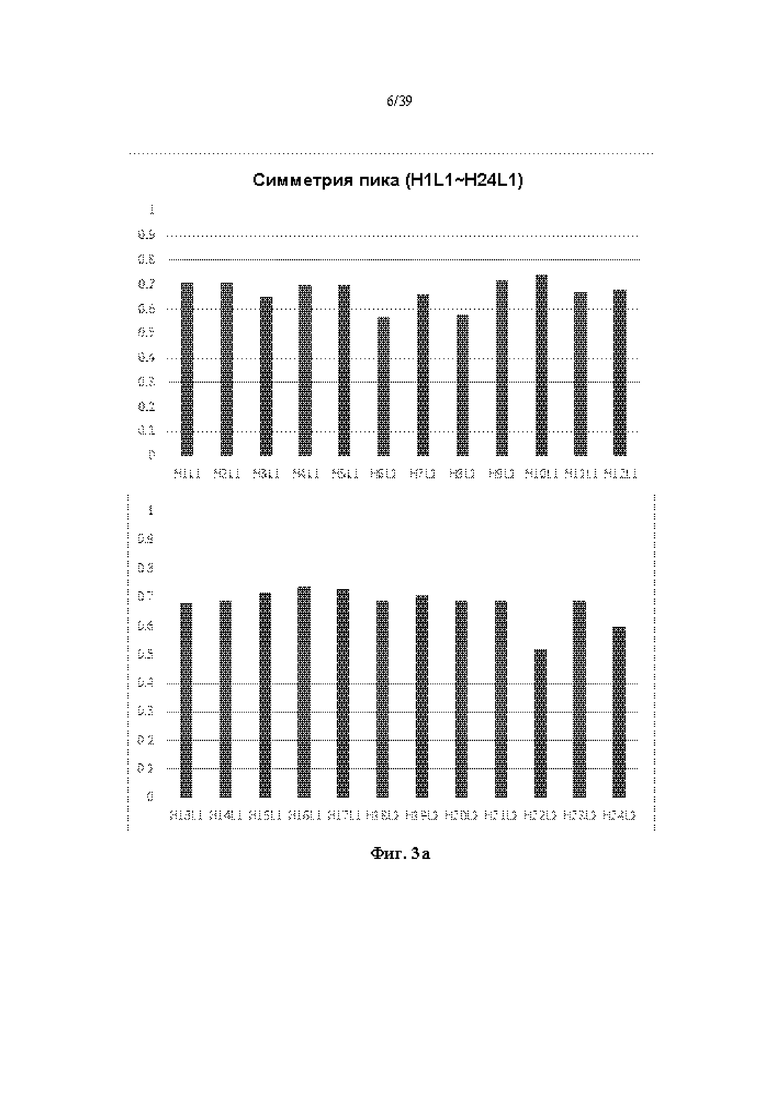
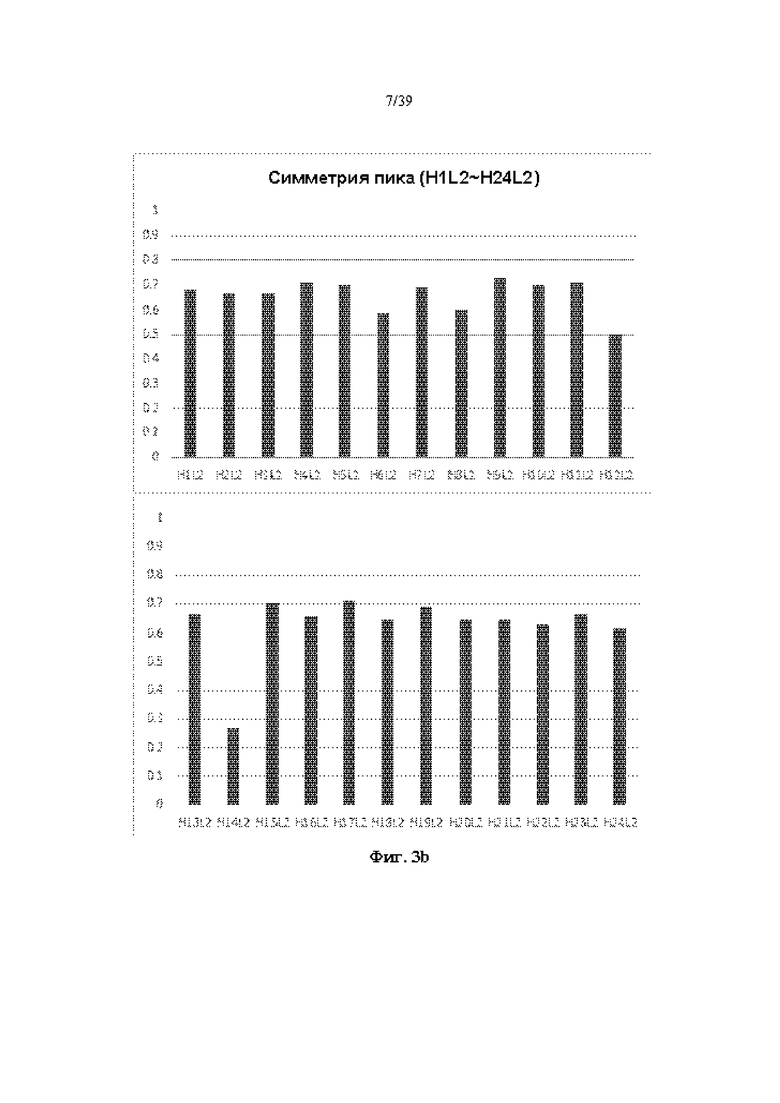
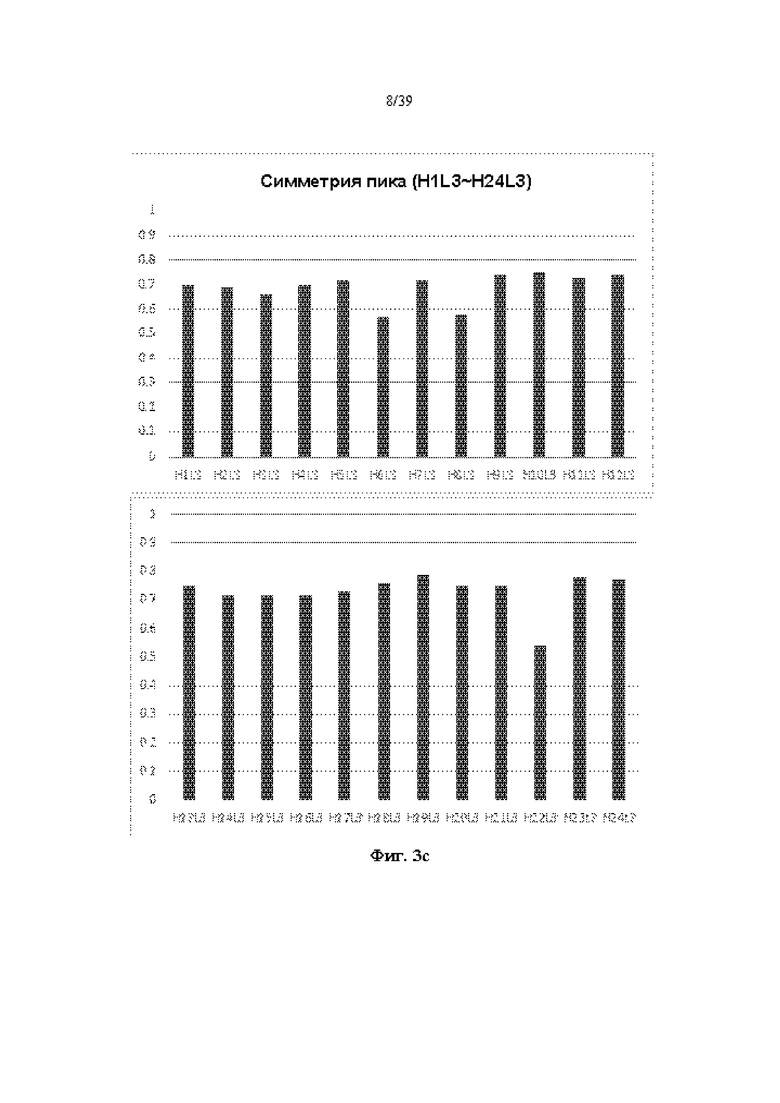



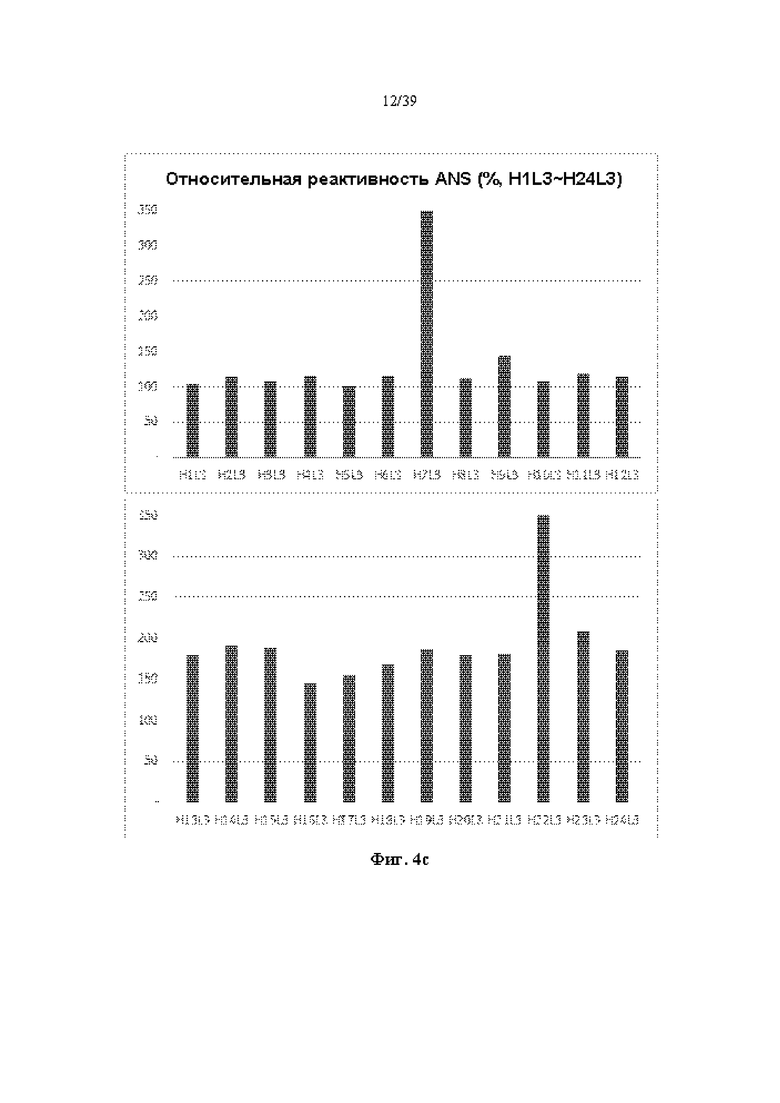
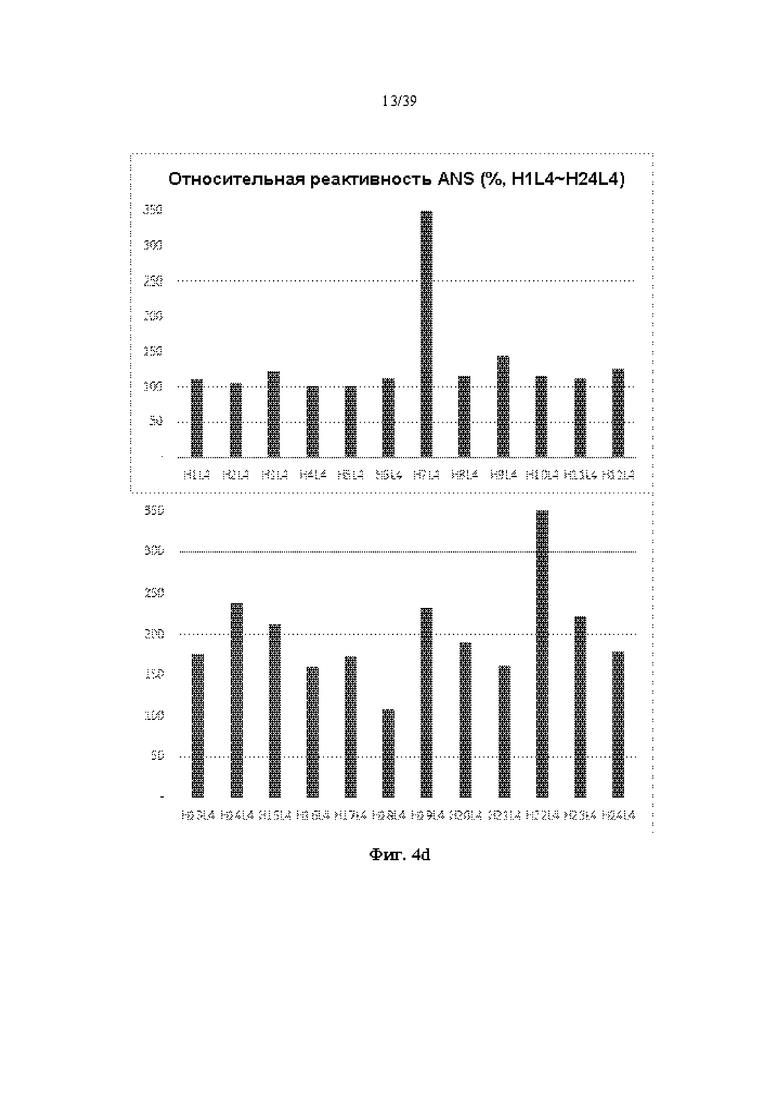
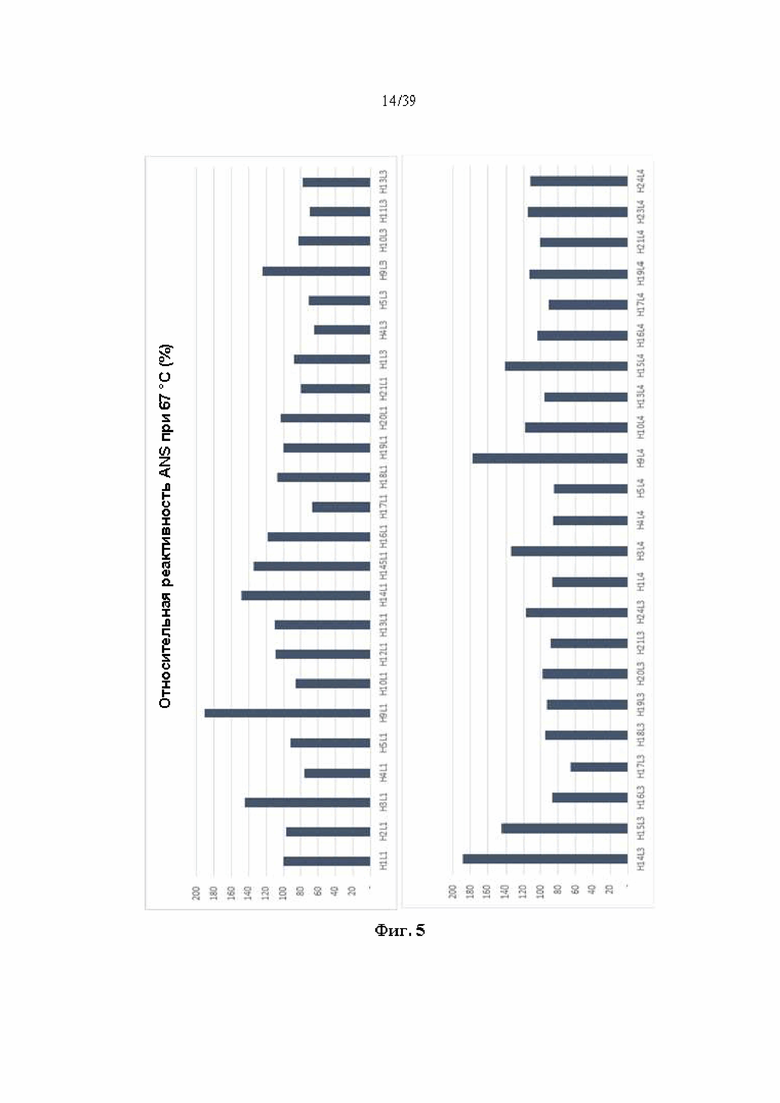
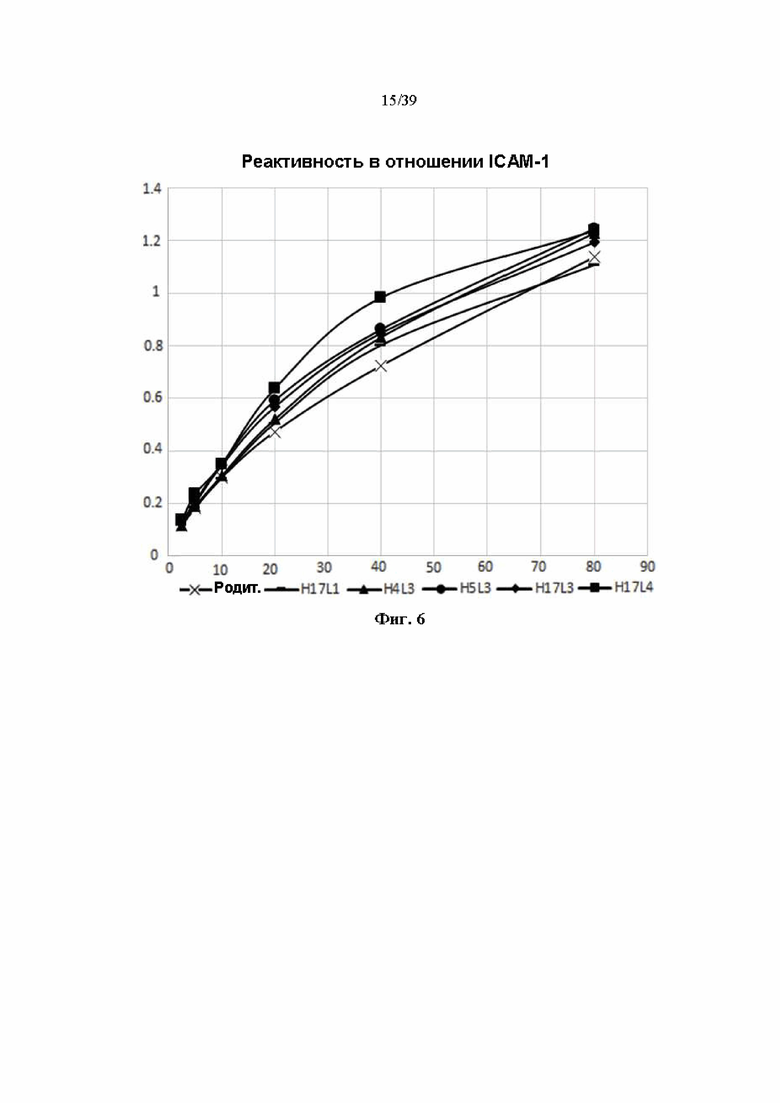
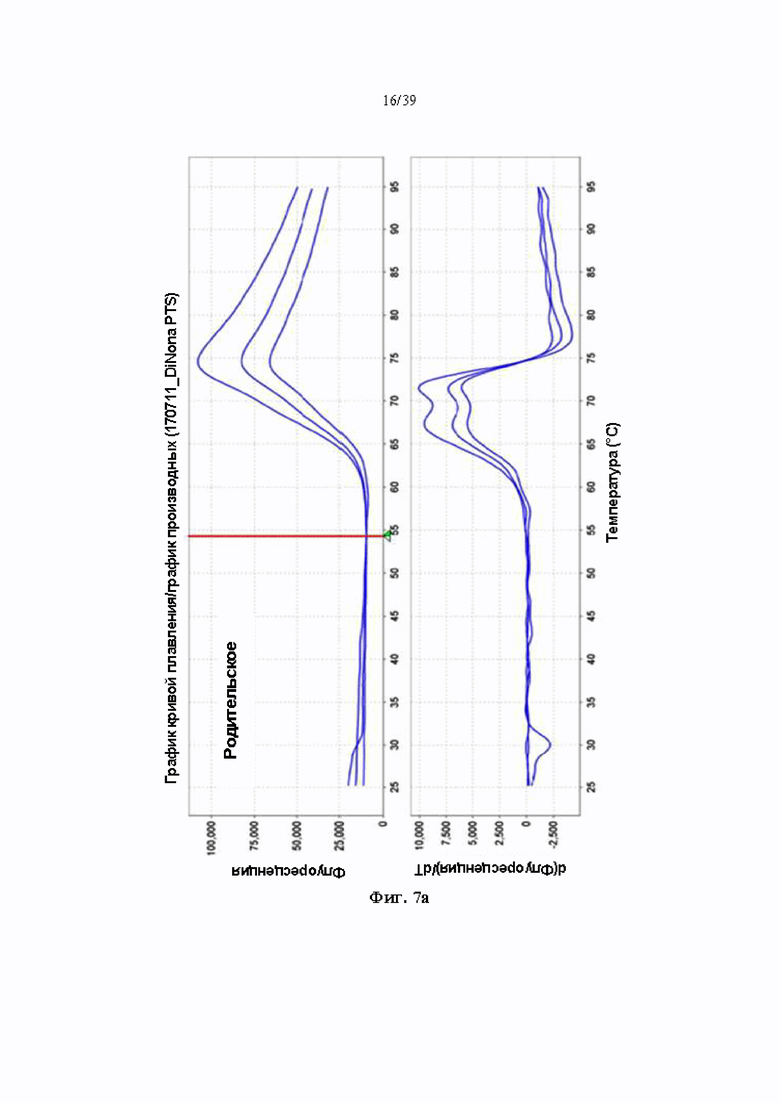

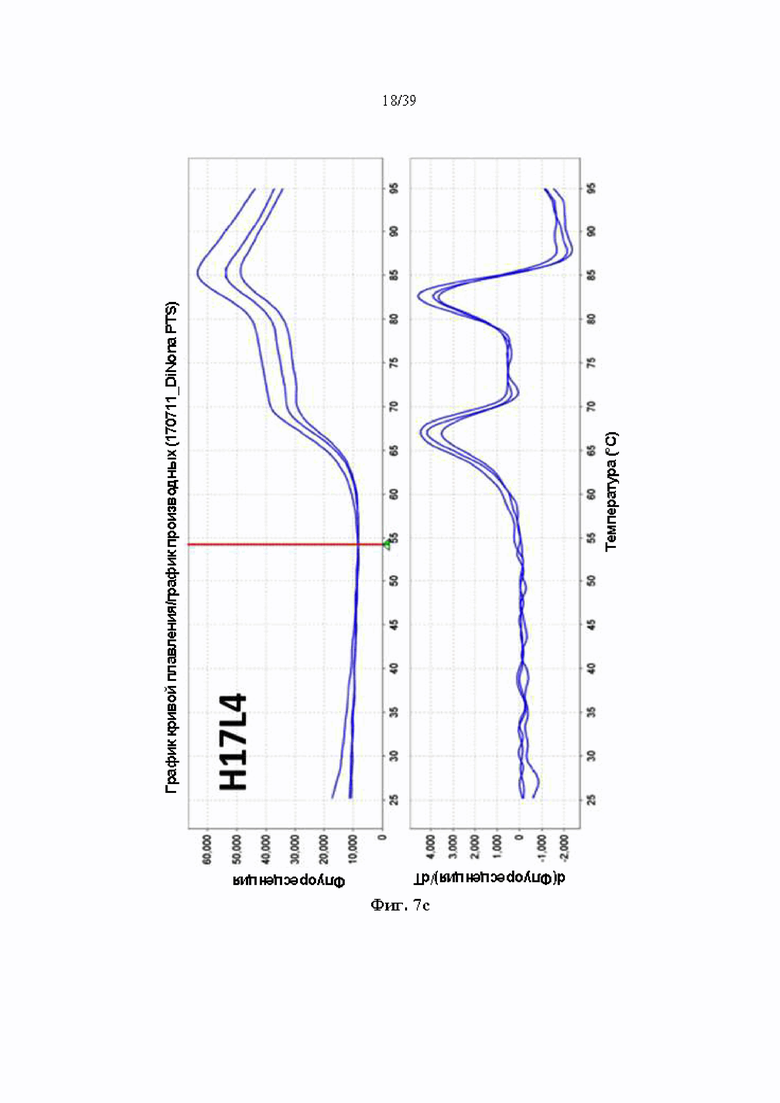

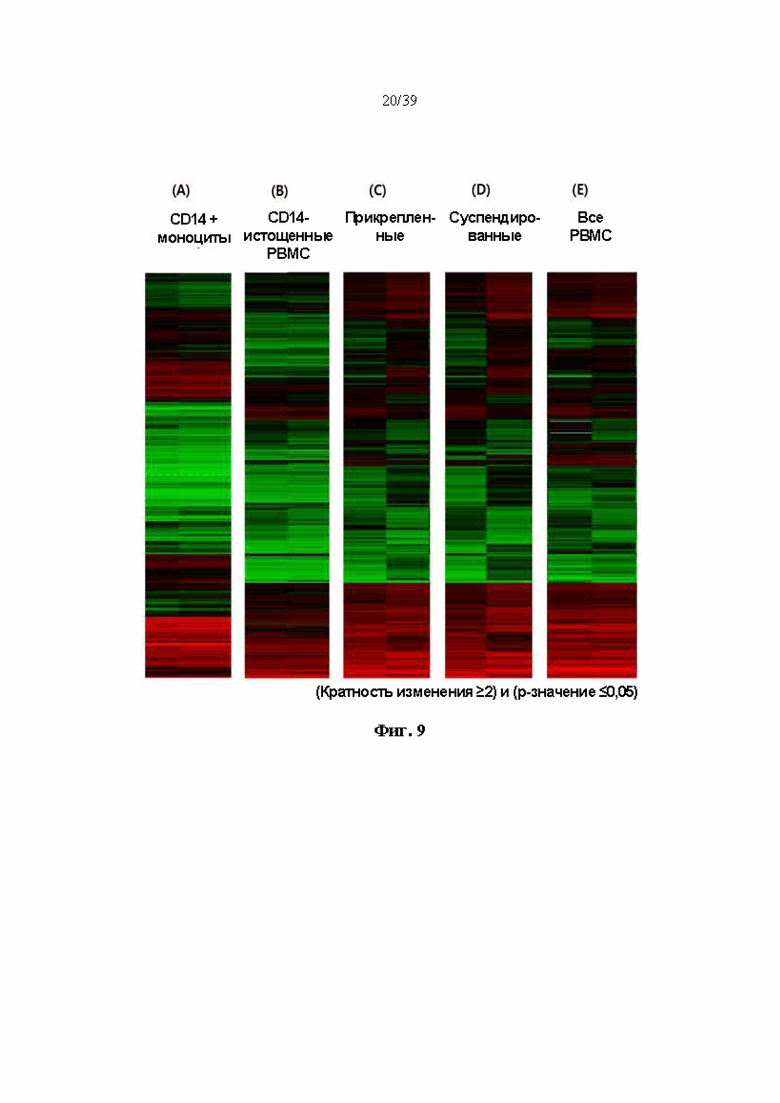
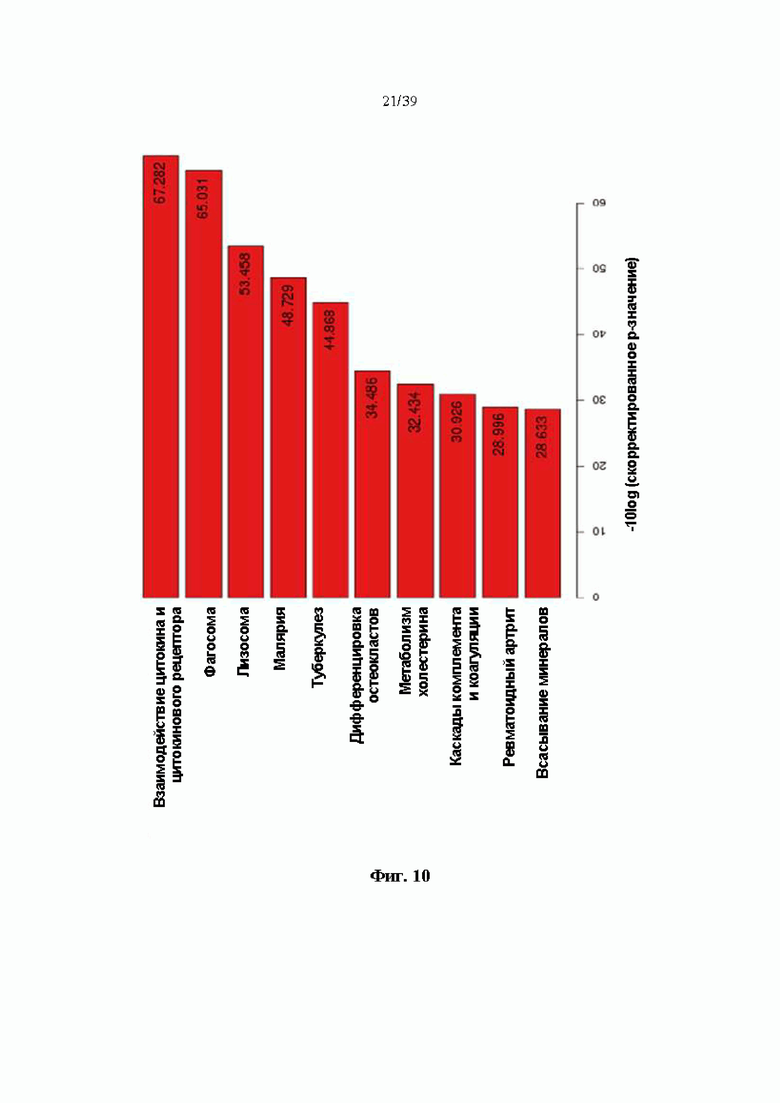
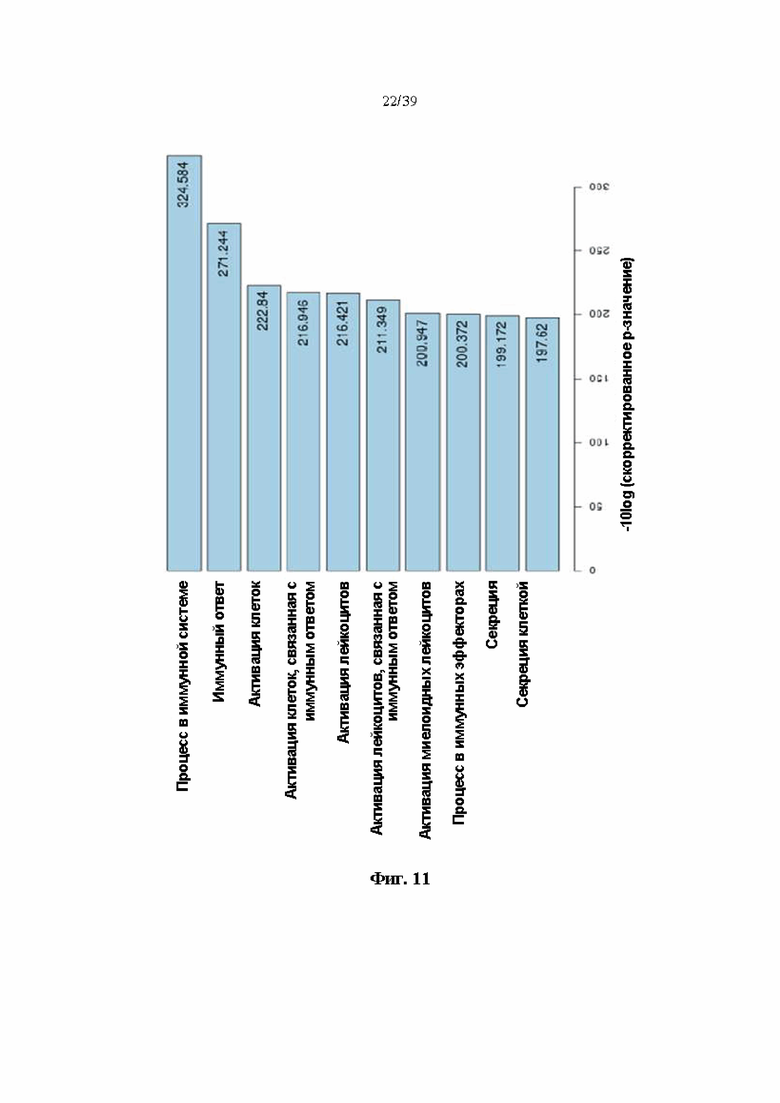

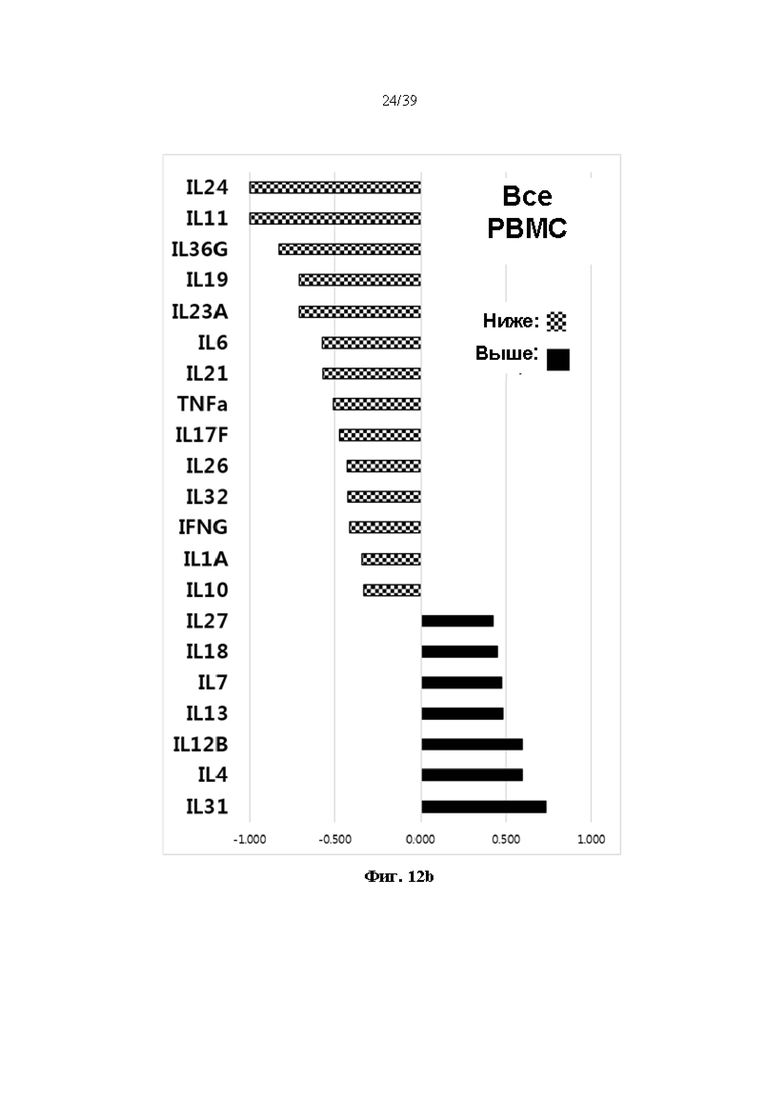

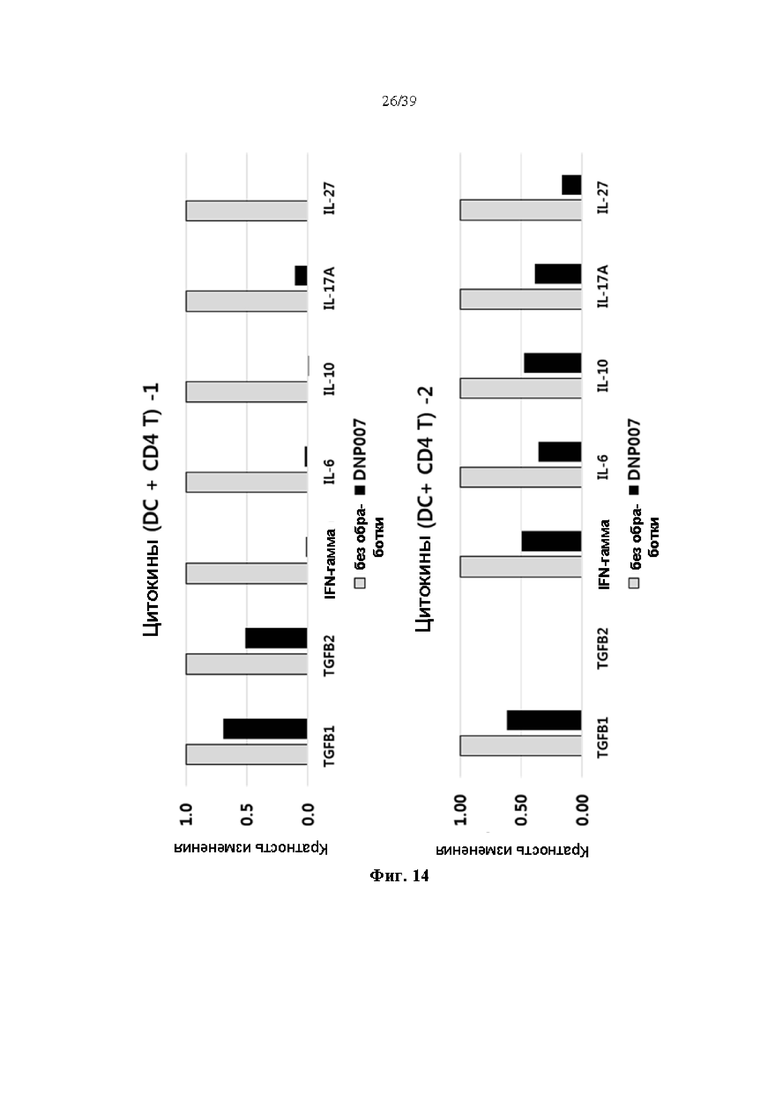

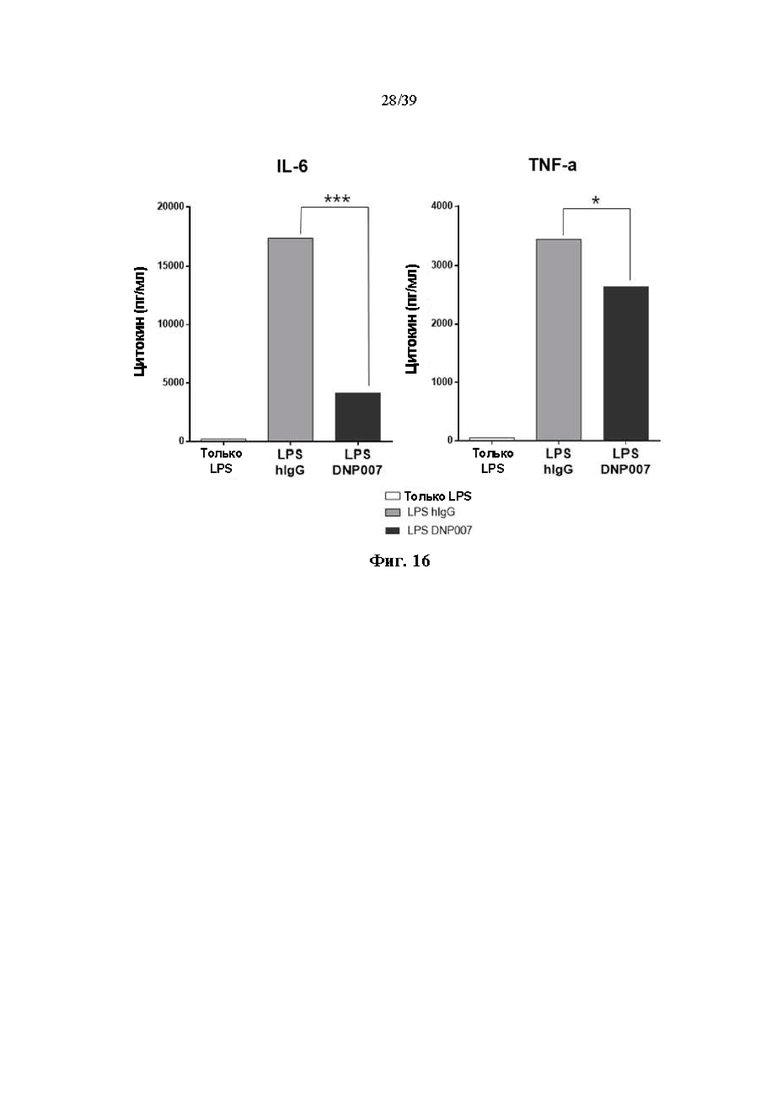
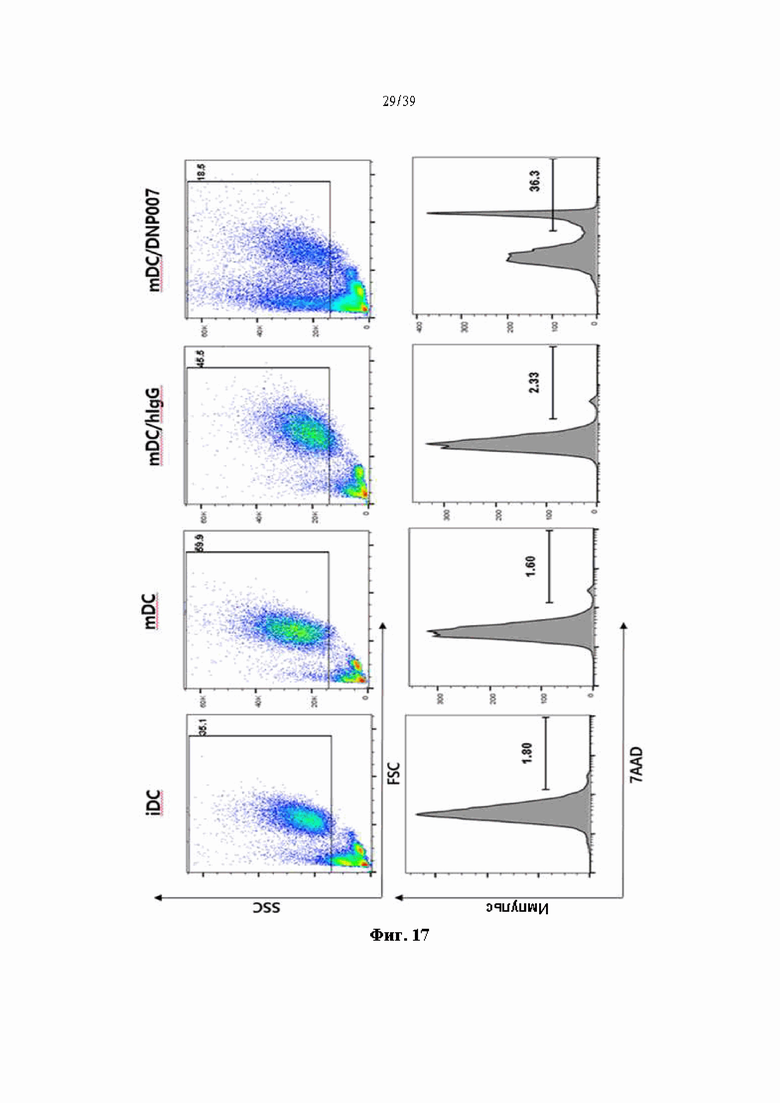

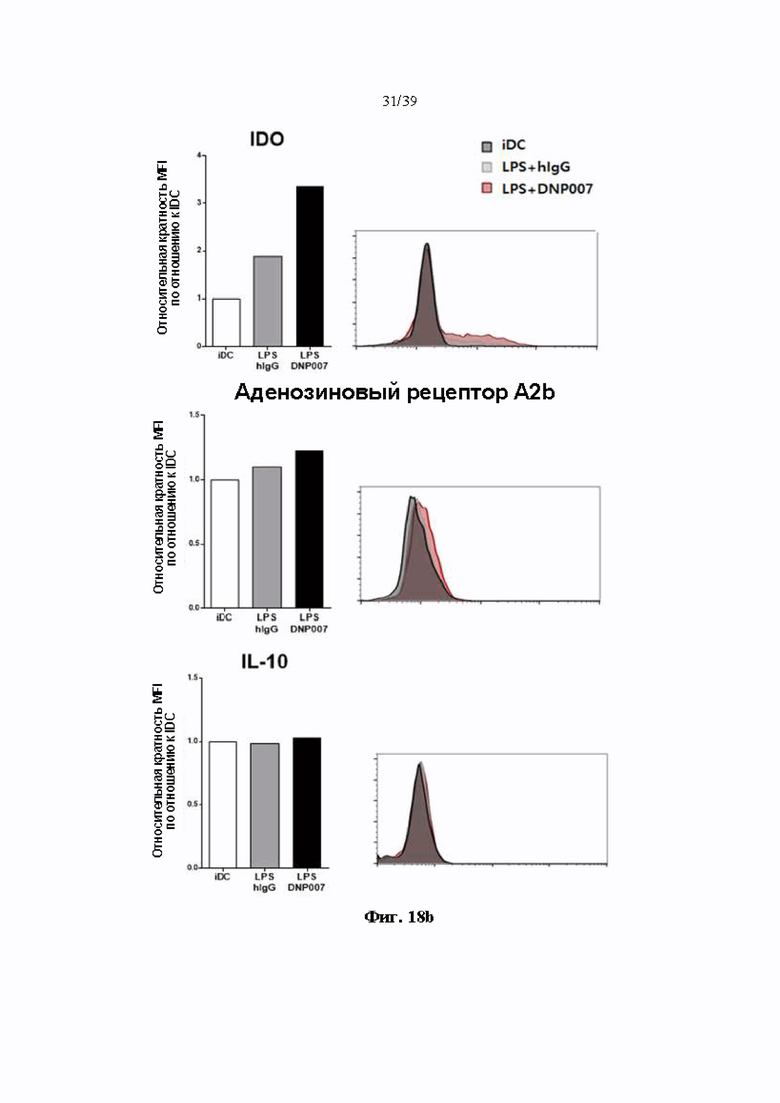

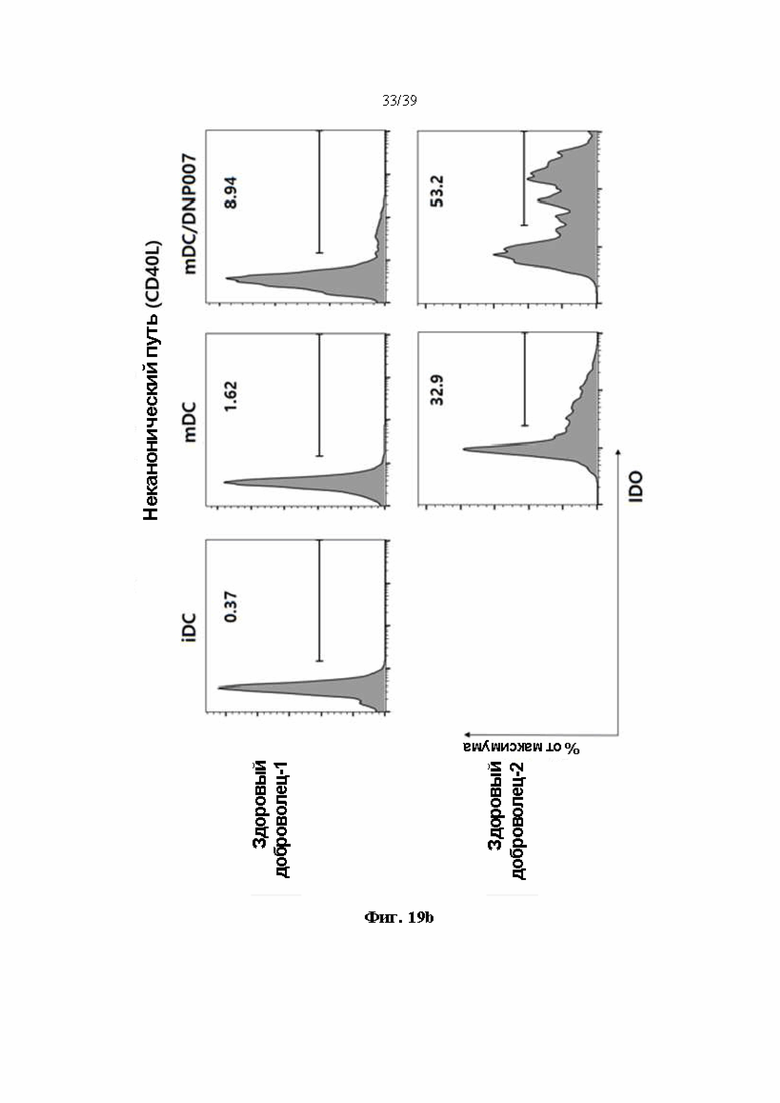
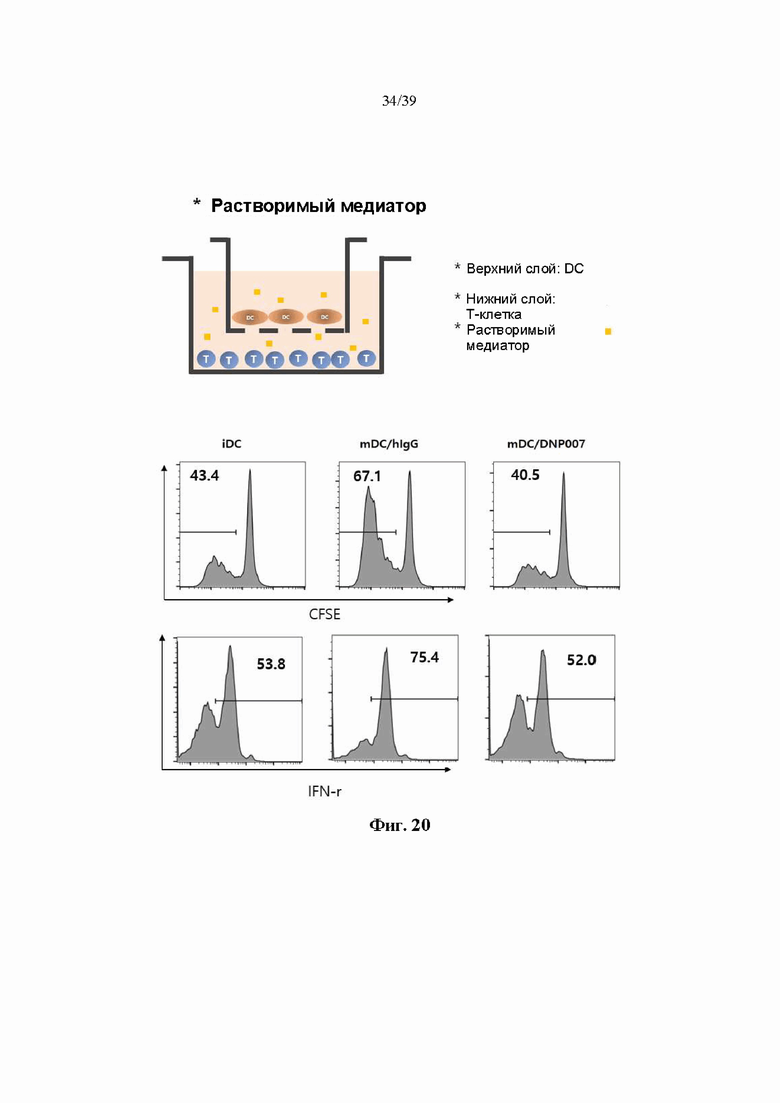



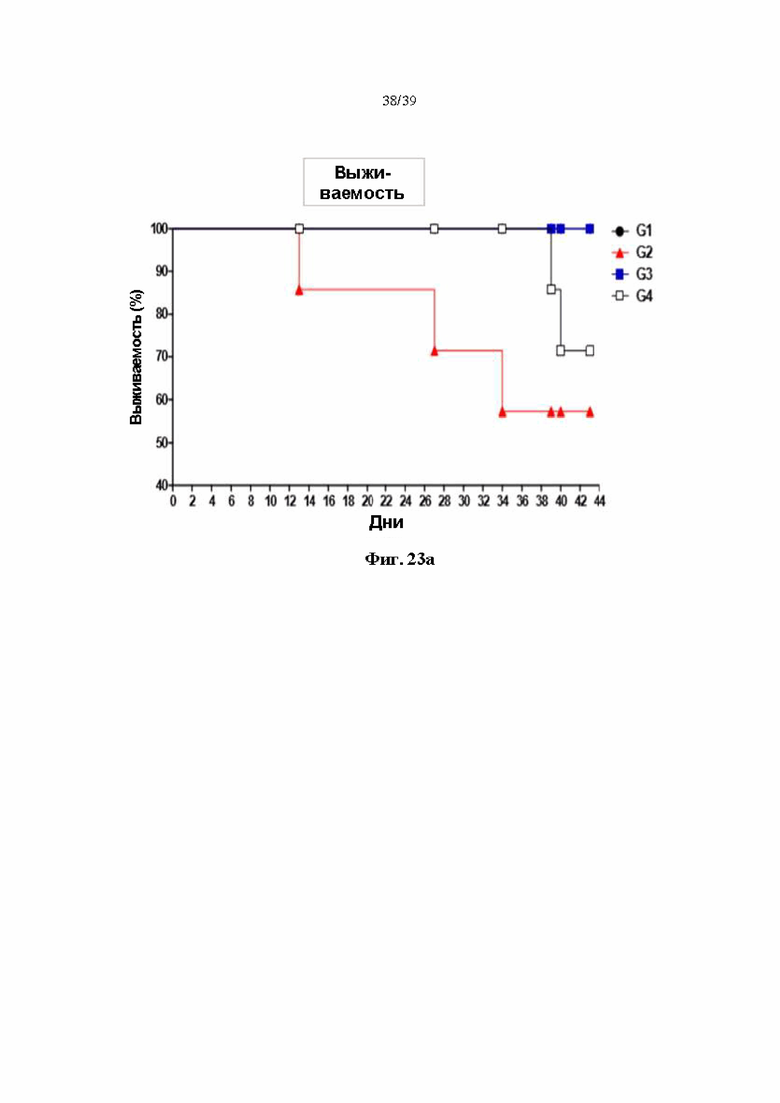
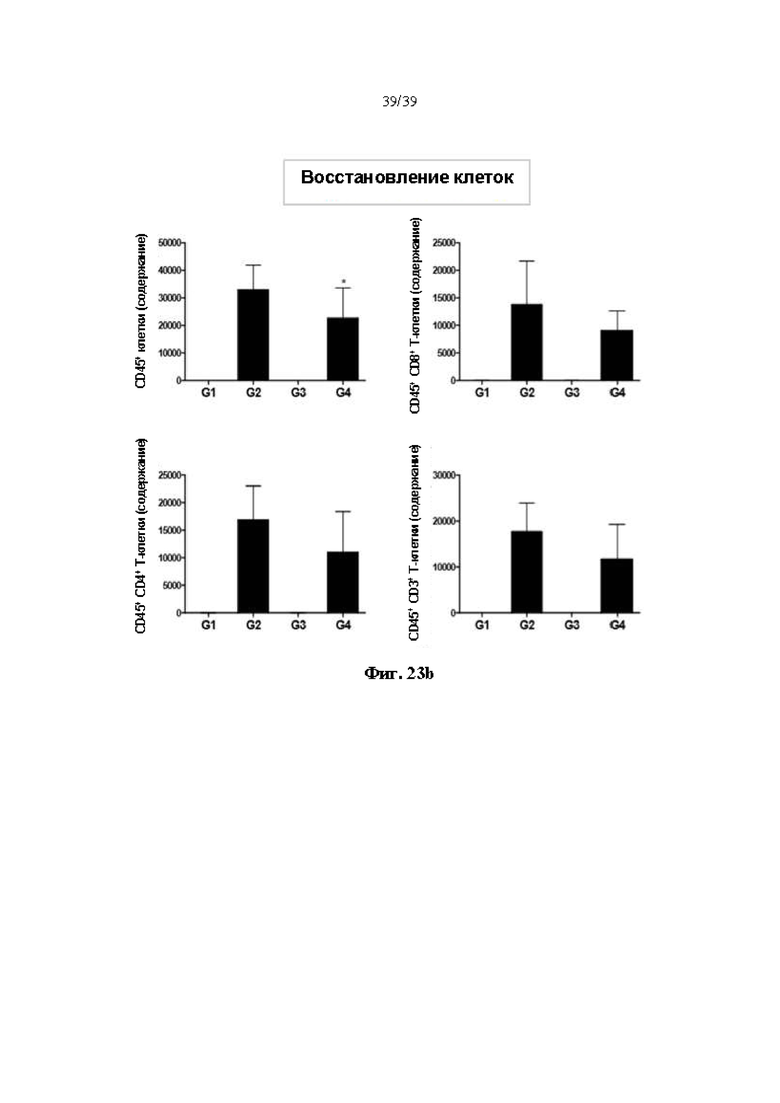
Изобретение относится к области биотехнологии. Предложено антитело к ICAM-1 или его антигенсвязывающий фрагмент. Также предложены молекулы нуклеиновой кислоты, кодирующие указанное антитело, рекомбинантный вектор экспрессии, рекомбинантная клетка для получения антитела по изобретению. Кроме того, предусмотрена фармацевтическая композиция для предупреждения или лечения заболевания, опосредованного иммунными клетками, а также композиция для обнаружения ICAM-1. Композиции содержат антитело к ICAM-1 или его антигенсвязывающий фрагмент в качестве активного ингредиента. Изобретение обеспечивает регулирование дифференцировки и функции дендритных клеток для более эффективного контроля иммунного ответа. 8 н. и 6 з.п. ф-лы, 39 ил., 11 табл., 6 пр.
1. Антитело к ICAM-1 или его антигенсвязывающий фрагмент, содержащий следующие области, определяющие комплементарность (CDR):
CDR-H1, содержащую аминокислотную последовательность под SEQ ID NO: 1,
CDR-H2, содержащую аминокислотную последовательность под SEQ ID NO: 2,
CDR-H3, содержащую аминокислотную последовательность под SEQ ID NO: 3,
CDR-L1, содержащую аминокислотную последовательность под SEQ ID NO: 4,
CDR-L2, содержащую аминокислотную последовательность под SEQ ID NO: 5 и
CDR-L3, содержащую аминокислотную последовательность под SEQ ID NO: 6.
2. Антитело к ICAM-1 или его антигенсвязывающий фрагмент по п. 1, содержащий в качестве каркаса:
каркас 1 тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 97 или SEQ ID NO: 98;
каркас 2 тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 99 или SEQ ID NO: 100;
каркас 3 тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 101 или SEQ ID NO: 102;
каркас 4 тяжелой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 81;
каркас 1 легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 103 или SEQ ID NO: 104;
каркас 2 легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 105;
каркас 3 легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 106; и
каркас 4 легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 107.
3. Антитело к ICAM-1 или его антигенсвязывающий фрагмент по п. 1, содержащий в качестве каркаса:
каркас 1 тяжелой цепи, содержащий аминокислотную последовательность, выбранную из SEQ ID NO: 39, 40, 41, 42, 43, 44, 45, 46, 47 и 48;
каркас 2 тяжелой цепи, содержащий аминокислотную последовательность, выбранную из SEQ ID NO: 49, 50, 51, 52, 53, 54 и 55;
каркас 3 тяжелой цепи, содержащий аминокислотную последовательность, выбранную из SEQ ID NO: 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79 и 80;
каркас 4 тяжелой цепи, содержащий аминокислотную последовательность под SEQID NO: 81;
каркас 1 легкой цепи, содержащий аминокислотную последовательность, выбранную из SEQ ID NO: 82, 83 и 84;
каркас 2 легкой цепи, содержащий аминокислотную последовательность, выбранную из SEQ ID NO: 85, 86, 87, 88 и 89;
каркас 3 легкой цепи, содержащий аминокислотную последовательность, выбранную из SEQ ID NO: 90, 91 и 92; и
каркас 4 легкой цепи, содержащий аминокислотную последовательность под SEQ ID NO: 93 или SEQ ID NO: 94.
4. Антитело к ICAM-1 или его антигенсвязывающий фрагмент по п. 1, содержащий
вариабельную область тяжелой цепи, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 7 и 11-34; и
вариабельную область легкой цепи, содержащую аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 8 и 35-38.
5. Антитело к ICAM-1 или его антигенсвязывающий фрагмент по любому из пп. 1-4, где антитело к ICAM-1 представляет собой животное антитело, химерное антитело или гуманизированное антитело.
6. Антитело к ICAM-1 или его антигенсвязывающий фрагмент по любому из пп. 1-4, где фрагмент представляет собой scFv, (scFv)2, Fab, Fab' или F(ab')2 антитела к ICAM-1.
7. Фармацевтическая композиция для предупреждения или лечения заболевания, опосредованного иммунными клетками, содержащая антитело к ICAM-1 или его антигенсвязывающий фрагмент по любому из пп. 1-4, где заболевание, опосредованное иммунными клетками, представляет собой отторжение трансплантата, реакцию «трансплантат против хозяина», астму, ожирение, сахарный диабет 2 типа, воспаление, опосредованное иммунными клетками, или аутоиммунное заболевание.
8. Фармацевтическая композиция по п. 7, где аутоиммунное заболевание представляет собой энцефаломиелит, ревматоидный артрит, системную красную волчанку, атопический дерматит, рассеянный склероз, сахарный диабет 1 типа, болезнь Крона, язвенный колит, болезнь Бехчета, синдром Шегрена, миастению гравис, склеродермию, узелковый полиартериит, болезнь Кикучи, коллагеноз, тиреоидит Хашимото, псориаз, витилиго, гипертиреоз, фибромиалгию, очаговую алопецию или аллергию.
9. Молекула нуклеиновой кислоты, кодирующая вариабельную область тяжелой цепи, содержащую CDR-H1, содержащую аминокислотную последовательность под SEQ ID NO: 1, CDR-H2, содержащую аминокислотную последовательность под SEQ ID NO: 2, и CDR-H3, содержащую аминокислотную последовательность под SEQ ID NO: 3;
вариабельную область легкой цепи, содержащую CDR-L1, содержащую аминокислотную последовательность под SEQ ID NO: 4, CDR-L2, содержащую аминокислотную последовательность под SEQ ID NO: 5, и CDR-L3, содержащую аминокислотную последовательность под SEQ ID NO: 6; или
обе из них.
10. Молекула нуклеиновой кислоты, кодирующая
аминокислотную последовательность, выбранную из SEQ ID NO: 7 и 11-34;
аминокислотную последовательность, выбранную из SEQ ID NO: 8 и 35-38;
или обе из них.
11. Рекомбинантный вектор, содержащий молекулу нуклеиновой кислоты по п. 9 или 10 для экспрессии антитела к ICAM-1 или его антигенсвязывающего фрагмента по п. 1.
12. Рекомбинантная клетка, содержащая рекомбинантный вектор по п. 11 для получения антитела к ICAM-1 или его антигенсвязывающего фрагмента по п. 1.
13. Способ получения антитела к ICAM-1 или его антигенсвязывающего фрагмента, включающий
стадию культивирования рекомбинантной клетки по п. 12, содержащей рекомбинантный вектор, содержащий молекулу нуклеиновой кислоты, кодирующую аминокислотные последовательности под SEQ ID NO: 1-6; и стадию выделения и очистки указанного антитела из среды для культивирования, в которой находится указанная рекомбинантная клетка.
14. Композиция для обнаружения ICAM-1, содержащая антитело к ICAM-1 или его антигенсвязывающий фрагмент по любому из пп. 1-4.
| WO 2010016652 A1, 11.02.2010 | |||
| WO 2005086568 A2, 22.09.2005 | |||
| US 8900586 B2, 02.12.2014 | |||
| VUORTE J | |||
| et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| ФРЕЙДЛИН И.С | |||
| Иммунная система и ее дефекты: Руководство для врачей | |||
| СПб., 1998 | |||
| Способ обработки грубых шерстей на различных аппаратах для мериносовой шерсти | 1920 |
|
SU113A1 |
Авторы
Даты
2023-02-09—Публикация
2019-12-31—Подача