Предложенное изобретение относится к биотехнологии, а именно, к получению противовоспалительного средства на основе биологически активной пептидной фракции из селезенки млекопитающих. Препарат в форме водно-спиртового лосьона может быть использован в медицине и ветеринарии в качестве противовоспалительного средства для предупреждения развития воспаления при аутоиммунных и воспалительных заболеваниях.
Разработан способ получения уникального состава противовоспалительного препарата, обладающего следующими характеристиками:
Лекарственная форма: водно-спиртовой раствор очищенных пептидов селезенки млекопитающих в диапазоне молекулярных масс до 12 кДа с концентрацией не менее 1% (лосьон) для накожного применения. Лечебный лосьон получают по оригинальной технологии, допускающей неограниченное масштабирование за счет исключения критических процессно-аппаратных приемов, а именно: ацетона, хроматографии, диализа, лиофилизации и ультрафильтрации. Эффективность поглощения пептидов интактной кожи человека около 60% в присутствии 40%-ного этанола впервые продемонстрирована in vivo с помощью хроматографического анализа остаточного материала на коже.
Физиологическое действие: очищенные пептиды не более 12 кДа из селезенки млекопитающих в присутствии этанола проникают сквозь кератиновый слой кожи 10-15 мкм, достигают следующего базального слоя с расположенными в нем клетками Лангерганса (первичная биологическая мишень) и направляют дифференцировку клеток Лангерганса по толерогенному способу, которые далее мигрируют в лимфоузлы и инициируют специфическую толерантность Т-регуляторных клеток к собственным антигенам организма, что обеспечивает проявление противовоспалительного эффекта.
Физиологическое действие пептидов селезенки впервые расшифровано с помощью генно-модифицированной модели мышей in vivo с принудительной экспрессией фактора некроза опухолей (ФНО-альфа) и в опытах со смешанными культурами дендритных клеток, Т-лимфоцитов и незрелых (naïve) моноцитов in vitro.
При накожной аппликации предложенного препарата пептиды селезенки запускают системный терапевтический процесс с достижением толерогенного противовоспалительного действия, что продемонстрировано in vivo на млекопитающих с ревматоидным артритом (собаки) и псориатическим артритом (мыши).
Предшествующий уровень техники
Известные противовоспалительные средства
Противовоспалительные и иммуносупрессивные средства, такие как глюкокортикостероиды, НПВП, цитостатики и специфические противовоспалительные моноклональные антитела являются симптоматическими средствами, т.е. они не излечивают заболевание, но только смягчают его проявление.
Длительное применение всех описанных лекарственных средств сопровождается побочными явлениями, которые со временем становятся часто более угрожающими, чем сами заболевания. В последнее время надежду подают противовоспалительные моноклональные антитела, но и они имеют серьезные побочные явления, нарастающие со временем - аллергические реакции, гриппоподобный синдром (повышение температуры, недомогание, боли в мышцах), тошнота, диарея и другие диспептические нарушения, уменьшение количества клеток крови - тромбоцитов, лейкоцитов, эритроцитов, а также кардиотоксическое действие. К тому же высокая стоимость препаратов моноклональных антител делает их практически недоступными для массового использования.
Негормональные противовоспалительные препараты - НПВП, такие как аспирин, ибупрофен, парацетамол и другие обладают умеренными побочными явлениями, в основном поражают ЖКТ (НПВС-гастропатия), но слабой эффективностью. При наружном применении могут вызывать раздражение кожных покровов в виде покраснения, отека, высыпаний или зуда; при длительном применении - системные побочные реакции.
Глюкокортикостероидные препараты - природные гормоны надпочечников или синтетические аналоги противовоспалительных гормонов, такие как кортизол, гидрокортизон, преднизолон, дексаметазон и другие имеют сильное противовоспалительное действие, но подавляют иммунитет и обладают тяжелыми, зачастую необратимыми побочными явлениями при длительном приеме. Системные побочные эффекты при приеме глюкокортикостероидов проявляются со стороны центральной нервной системы (психозы, депрессия, повышенная нервная возбудимость и другие), со стороны сердечно-сосудистой системы (тромбоэмболии, повышение артериального давления, миокардиодистрофия и другие), со стороны репродуктивной системы (гирсутизм, задержка полового развития и другие), со стороны пищеварительной системы (жировая дистрофия печени, панкреатит, кровотечения из ЖКТ, стероидные язвы кишечника и желудка), со стороны эндокринной системы (сахарный диабет, синдром Кушинга, ожирение, атрофия коры надпочечников вследствие угнетения ее функции) и других систем организма. Также во время терапии глюкокортикостероидными препаратами наблюдаются обострения инфекционно-воспалительных процессов хронической формы.
Цитостатики, например, метотрексат и другие, также обладают сильным специфическим действием и тяжелыми необратимыми побочными явлениями при длительном приеме.
Моноклональные антитела к противовоспалительным цитокинам и/или к их рецепторам, как уже было отмечено выше, обладают сильным специфическим действием, но чрезвычайно дороги и со временем теряют эффективность из-за появления вторичных антител в организме пациента.
Наиболее перспективным источником действующего начала для лечения аутоиммунных и воспалительных заболеваний ранее была определена селезенка млекопитающих. Известен инъекционный препарат "Спленопид", разработанный А.Б.Цыпиным и соавторами в 1998 году [1], получаемый в виде ультрафильтрата экстракта селезенки свиньи на мембране с отсечкой 50 кДа, с помощью которого удавалось излечивать ряд аутоиммунных и воспалительных заболеваний. Известен также более ранний патент В.А.Чернова и соавторов 1993 г. [2], где белково-пептидный компаунд селезенки КРС в диапазоне 10-140 кДа использовали для лечения чумы плотоядных.
Однако, оба препарата имеют 4 критических недостатка:
(1) В диапазоне до 50 кДа и, тем более, до 140 кДа присутствуют практически все известные эффекторы (цитокины, хемокины, интерфероны) как провоспалительной, так и противовоспалительной природы. По этой причине такие препараты в принципе не могут быть однозначно охарактеризованы и не могут быть причислены к категории лекарственных средств, несмотря на заявленный положительный физиологический эффект.
(2) Оба препарата являются чрезвычайно грязными по своему составу и, кроме потенциальных эффекторных молекул, содержат более 80% балластных компонентов белковой, полинуклеотидной, полисахаридной и иной природы.
(3) Их инъекционное использование недопустимо не только из-за превалирования балласта, но также по той причине, что биополимеры из ксенобиотических органов и тканей свыше 20-30 кДа обладают иммуногенностью для человека, что чревато выработкой аутоиммунных антител (например, для минимизации появления вторичных аутоиммунных антител терапевтические моноклональные антитела специально "гуманизируют"). Авторы обоих патентов не испытывали трансдермальную форму, но с описанным составом трансдермальная форма также опасна возникновением аутоиммунного дерматита после многократного применения.
(4) Оба препарата никоим образом не изучены на молекулярно-клеточном уровне, до сих пор не были известны их биологические мишени.
Более того, в патентной и научно-медицинской литературе авторами не обнаружено ни одного примера, где была бы определена первичная биологическая мишень и расшифрован механизм действия селезеночных и других природных низкомолекулярных пептидов с молекулярным весом меньше 10-12 кДа. Это касается всех известных коммерческих пептидных препаратов из природных источников (Кортексин, Polyerga, Спленопид, Сампрост, Тималин, Тактивин, Пиналекс и др.).
Также не обнаружено противовоспалительных средств на основе пептидов селезенки системного противовоспалительного действия в трансдермальной (накожной) лекарственной форме.
Трансдермальная доставка лекарственных веществ
Казалось бы, трансдермальная доставка лекарств теоретически позволяет вводить препарат доступным неинвазивным путем. Благодаря простоте применения и самостоятельному введению, трансдермальная доставка должна характеризоваться контролируемым по скорости высвобождением препарата, уникальным для такого желательного способа [3, 4].
Однако, несмотря на впечатляющую широту исследований в данной области [5], рынок терапевтических средств системного действия с использованием пассивного неинвазивного трансдермального переноса до сих пор является минорным.
Вещества, которые могут быть доставлены трансдермально, а именно: никотин, кортикостероиды, скополамин и другие вещества, представляют собой небольшие и гидрофобные молекулы. Обход естественных препятствий для того, чтобы обеспечить проникновение лекарства, является заветным шагом к успешной трансдермальной доставке [6]. Поэтому попытки продвинуться в этом направлении продолжаются постоянно, а именно, разрабатываются технологии трансдермальной доставки: с использованием наноэмульсии [7], с использованием трансферосом [8], [9], с использованием наночастиц [10], с использованием глипизидного матрикса этилцеллюлозы/поливинилпирролидона и Эудрагита RL-100/Эудрагита RS-100 [11]), с использованием ионофореза [12], с использованием электропорации [13]). Существует способ [14], где в составе накожных средств указан этанол в концентрации от 0.01 до 60%, но в данной заявке рассматриваются только низкомолекулярные вещества до 0.5-0.6 кДа и нет упоминания о пептидах. В целом, несмотря на многочисленные попытки, до настоящего времени в реальной практике не существует способов пассивной глубокой доставки пептидов до слоя васкуляризации.
Единственным эффективным методом чрезкожного введения белковых гормонов и пептидов обладает техника с использованием пластырей с растворимыми микроиглами [15, 16, 17, 18, 19]. Технология нацелена на внебольничное применение, но она выходит за рамки темы неинвазивного пассивного трансдермального введения и является высокотехнологичным развитием инъекционных методов.
Биодоступность и биологическая мишень
Представляется не совсем логичным, что изобретатели трансдермальных способов доставки активных белков и пептидов не ставили перед собой задачу выявления первичной биологической мишени, т.е. эффекторной клетки. Вероятной причиной является тот факт, что под понятием "биодоступность", как правило, понимается способность трансдермального лекарственного препарата достигать капилляров системного кровотока, хотя в некоторых случаях это не является необходимым и достаточным требованием.
Анатомически кожа состоит из трех основных слоев. Самой внешней частью и первой линией защиты от проникновения чужеродных веществ является роговой слой. Этот слой, в основном, состоит из мертвых клеток (кератиноцитов), имеет толщину примерно 10-15 мкм и окружен липидным внеклеточным матриксом [20]. Под роговым слоем находится жизнеспособный эпидермис (суммарно базальный и шиповатый слой), толщина которого составляет примерно 50-100 мкм. Вместе взятые эти три слоя называют полным эпидермисом. Под полным эпидермисом находится первый слой васкуляризации, присутствующий в слое, известном как дерма. Это волокнистый слой, толщиной приблизительно 1-2 мм, состоящий из капиллярных слоев, которые являются местом введения препарата в циркуляцию [21], если препарат способен их достичь. Однако, многократно экспериментально доказано, что кожа не пропускает глубже базального слоя молекулы, превышающие 500 Да [22], особенно это касается молекул гидрофильной природы [23].
Авторы предложенного изобретения поставили задачу выяснить - существуют ли в верхних слоях кожи эффекторные клетки, на которые можно воздействовать в терапевтическом смысле. В коже непосредственно под кератиновым слоем, т.е. в базальном и шиповатом слоях, находятся дендритные клетки (клетки Лангерганса). Важнейшим моментом является то, что клетки Лангерганса не существуют как постоянный эпидермальный класс дендритных клеток. Они мигрируют в эпидермис и обратно в лимфатические узлы, куда транспортируют «захваченные» чужеродные агенты, например, антигены, и представляют их лимфоцитам. Данное положение продемонстрировано в серии фундаментальных работ G.F.Murphy и соавт., выполненных с 1986 года [24], где была показана трансформация дермальных активно фагоцитирующих макрофагов в эпидермальные клетки Лангерганса через промежуточные формы, которые совмещали в себе как свойства моноцитов-макрофагов, так и типичных дендритных клеток.
Именно клетки Лангерганса принимают участие в индукции иммунной толерантности к собственным антигенам кожи, которые высвобождаются при травмах и воспалительных процессах, связывая в единую функциональную систему два органа - кожу и лимфоузлы [25].
На основании анализа указанных данных авторы настоящего изобретения сделали вывод о том, что, если под термином "биодоступность" понимать способность лекарственного вещества достигать биологической мишени, т.е. эффекторной клетки, то среди всех пептидных кандидатов на роль трансдермального противовоспалительного средства с пассивным переносом логично заранее выбирать те, которые напрямую взаимодействуют с клетками Лангерганса.
Методы оценки поглощения пептидов интактной кожей in vivo
Известные методы оценки эффективности трансдермальной доставки in vitro (более корректно - оценки эффективности кожной абсорбции) позволяют контролировать экспериментальные переменные с помощью простейших протоколов. Предполагается, что оценки in vitro являются важными инструментами для разработки и скрининга рецептур, предсказывающих кожную абсорбцию in vivo [26, 27, 28, 29, 30, 31]. Однако, распространение результатов данного подхода, в т.ч. с использованием модификаций ячейки Франца [32], на эффективность переноса пептидов через нетравмированную кожу in vivo является спорным.
Для лучшей количественной оценки проникновения веществ внутрь кожи in vivo используются методы, практически недоступные для рутинного анализа, а именно: ослабленная инфракрасная спектроскопия полного отражения с Фурье-преобразованием [33, 34] и конфокальная лазерная сканирующая микроскопия (CLSM) как модификация флуоресцентной микроскопии [35, 36, 37].
Обзор методов оценки поглощения лекарств кожей in vivo показывает, что это самая методически сложная проблема [38, 39, 40, 41, 42]. При этом используются неоправданно экзотические, в т.ч. микротравмирующие процедуры типа кожного микродиализа, зачищающей липкой ленты, термического воздействия и др., подробно описанные в обзоре [43]. В итоге возникла необходимость разработки собственного оригинального корректного способа оценки.
Получение пептидных препаратов из природных источников
Известны способы получения пептидных лекарственных препаратов, косметических средств и биологически активных добавок из органов и тканей млекопитающих, например: Патент SU 1077089 [44], Патент SU 1112606 [45], Патент SU 1218521 [46], Патент SU 1522485 [47], Патент SU 944191 [48], Патент RU 2104702 [49], Патент CN 1557465A [50]. Общими признаками известных способов получения пептидных препаратов является использование значительного объема ацетона и/или ультрафильтрации и/или хроматографии и/или лиофилизации, что неприемлемо для массового производства в необходимом диапазоне терапевтических курсов, миллионы и более доз препарата.
В качестве ближайшего аналога предлагается противовоспалительный препарат «Спленопид» [1]. Препарат предназначен для в/м введения и представляет собой пептидную фракцию из селезенки КРС или свиней с молекулярной массой 0,4-50 кДа в форме лиофилизата с желатинолем и гентамицином, терапевтический эффект которого показан на грызунах и человеке. «Спленопид» обладает выраженным иммунокоррегирующим действием при различных патологиях, связанных с нарушением функций иммунной системы, стимулирует метаболическую и функциональную активность лейкоцитов периферической крови, способствует выведению аутоиммунных комплексов из организма при системной красной волчанке, что связано с повышением активности фагоцитирующих клеток и снижением воспалительной реакции.
Как уже было отмечено выше, «Спленопид» обладает рядом недостатков, из которых выделяются по меньшей мере два наиболее существенных:
- из-за наличия в составе препарата неопределенной смеси биополимеров в диапазоне до 50 кДа, включающей эффекторы как провоспалительной, так и противовоспалительной природы, такой препарат в принципе не может быть однозначно охарактеризован, что не позволяет причислить его к категории лекарственных средств;
- из-за наличия в составе препарата, помимо потенциальных эффекторных молекул, более 80% балластных компонентов белковой, полинуклеотидной, полисахаридной и иной природы из ксенобиотических органов и тканей свыше 20 кДа, многократное инъекционное использование недопустимо, поскольку чревато выработкой аутоиммунных антител.
Предложенное изобретение решает техническую проблему отсутствия эффективного пептидного противовоспалительного средства в форме трансдермального препарата, который может быть получен простым способом, пригодным для массового производства.
Техническая задача состоит в разработке состава терапевтически эффективного пептидного противовоспалительного средства с минимизацией побочных эффектов, пригодного для внебольничного применения, а также способа его получения.
Раскрытие сущности изобретения
Авторы предложенного изобретения поставили задачу найти биологически активное вещество или молекулярный компаунд, пригодный к стабильному излечению аутоиммунных и воспалительных состояний без побочных явлений, свойственных глюкокортикостероидам, НПВП, цитостатикам и специфическим противовоспалительным моноклональным антителам.
При этом заранее руководствовались следующими 4-мя ограничениями:
1. Активное вещество или молекулярный компаунд должны быть природного происхождения. Это наиболее дешевый и неограниченный источник сырья, что важно для массового производства. Кроме того, синтетические соединения, например пептиды, не учитывают необходимые природные требования, такие как гликозилирование, фосфорилирование, ветвление, образование кольцевых форм, синергидное действие в комплексе (компаунде). Последнее утверждение оправдано тем фактом, что до сих пор не созданы синтетические вещества, стабильно излечивающие аутоиммунные и воспалительные заболевания.
2. В случае пептидов, их молекулярная масса не должна превышать 20 кДа во избежание аутоиммунизации.
3. Лекарственная форма должна быть неинвазивной для возможности внебольничного индивидуального применения. Пероральная форма была исключена из-за неизбежной деградации биомолекул в ЖКТ. Учитывая необходимость доклинических исследований, кандидатную лекарственную форму свели исключительно к трансдермальной (накожной), т.к. ректальную и сублингвальную формы весьма проблематично испытывать на животных.
4. Способ получения вещества или молекулярного компаунда должен быть стандартизуемым, экономным, экологически приемлемым и неограниченно масштабируемым ввиду чрезвычайно широкой потребности в желаемом препарате.
В процессе реализации данных задач получен продукт с заданными целевыми свойствами, а также разработана эффективная технология способа его получения и применения.
Технический результат предложенного изобретения состоит в:
- достижении противовоспалительного терапевтического эффекта на фоне перманентной принудительной суперэкспрессии наиболее мощного провоспалительного цитокина - фактора некроза опухолей (ФНО-альфа - TNFα), т.е. препарат по изобретению обеспечивает не только противовоспалительный эффект, но и проявляет толерогенное действие - инициирует специфическую толерантность Т-регуляторных клеток к собственным антигенам организма, что обуславливает его эффективность в терапии аутоиммунных воспалительных заболеваний;
- более эффективной стимуляции незрелых (naïve) моноцитов к выработке Treg, по сравнению с цитокинами GM-CSF + M-CSF, которые используются в классической методике индуцирования Treg и могут присутствовать в пептидных фракциях из селезенки с молекулярной массой более 12 кДа, а именно около 30 кДа для GM-CSF и около 60 кДа для M-CSF, но отсутствуют в предложенном препарате на основе фракции пептидов из селезенки с молекулярной массой не более 12 кДа;
- достижении системного противовоспалительного терапевтического действия при использовании препарата в форме водно-спиртового лосьона при нанесении его на кожу, что вызывает снижение концентрации провоспалительных цитокинов TNFa, IL-1b и IL-2 в крови;
- предупреждении развития псориатического и ревматоидного артрита с эффективностью около 70% за счет системного толерогенного противовоспалительного терапевтического действия;
- возможности достижения толерогенного противовоспалительного терапевтического эффекта в пригодной для возможности внебольничного индивидуального применения форме;
- возможности достижения системного толерогенного противовоспалительного терапевтического действия без проявления нежелательных побочных эффектов - аллергических реакций и подавления адаптивного иммунитета.
Указанный технический результат достигается за счет разработки авторами настоящего изобретения уникального состава и лечебной формы противовоспалительного препарата.
Предложен противовоспалительный препарат на основе пептидов селезенки млекопитающих, представленный в форме композиции накожного водно-спиртового лосьона системного противовоспалительного действия, содержащий фракцию очищенных пептидов селезенки млекопитающих с молекулярной массой не более 12 кДа. При этом рабочий диапазон представлен фракцией пептидов с молекулярной массой в диапазоне от приблизительно 0,4 кДа до 12 кДа.
Фракция очищенных пептидов селезенки млекопитающих с молекулярной массой не более 12 кДа представлена в препарате с концентрацией не менее 1%, что обеспечивает эффективное количество активного начала, а именно, 1÷5% мас. к общей массе композиции.
В состав предложенного препарата также входит 96% этанол в количестве 40% мас. и вода - остальное, при рН 7.4±0.2.
Кроме этого, в составе предложенного препарата могут присутствовать хлористый натрий в количестве 0 - 0,5% мас., хлористый цинк в количестве 0 - 0,05% мас. и сульфат кальция в количестве 0 - 0,2% мас.
В наиболее предпочтительном воплощении предложен противовоспалительный препарат на основе пептидов селезенки млекопитающих, представленный в форме композиции накожного водно-спиртового лосьона системного противовоспалительного действия, содержащий фракцию очищенных пептидов селезенки млекопитающих с молекулярной массой не более 12 кДа в количестве 1÷5% мас. к общей массе композиции, 96% этанол в количестве 40% мас., хлористый натрий в количестве до 0,5% мас, хлористый цинк в количестве до 0,05% мас., сульфат кальция в количестве до 0,2% мас., вода - остальное, при рН 7.4±0.2.
Предложенный препарат нормализует баланс воспалительных и противовоспалительных реакций, который определяют по нормализации in vivo уровня цитокинов ФНО-альфа, IL-1-бета и IL-2, в том числе при воспалительной ЛПС-провокации.
Кроме этого, предложенный препарат предупреждает развитие аутоиммунных или воспалительных заболеваний, включая псориатический и ревматоидный артрит, что позволяет его использовать в профилактике, терапии или для уменьшения тяжести симптомов указанных заболеваний как у человека, так и у животных.
Соответственно, предложенный водно-спиртовой лосьон может быть представлен в виде препарата, композиции или средства для фармацевтического или ветеринарного применения.
Указанный технический результат достигается за счет разработки авторами настоящего изобретения эффективной технологии получения противовоспалительного препарата.
Предложенный способ получения противовоспалительного препарата предусматривает последовательное проведение следующих этапов:
смешивания измельченной до состояния фарша селезенки млекопитающего с 0,1% раствором хлористого цинка в соотношении 2 массовых частей раствора на 1 массовую часть фарша,
фиксации крупномолекулярной фракции путем закисления полученного гомогената при интенсивном перемешивании до значения рН 3,0±0,2 с помощью 5 М раствора соляной кислоты,
экстракции пептидов доведением рН гомогената до значения рН 8,0±0,2 с помощью 5 М раствора гидроксида натрия,
получения осветленного экстракта с помощью замораживания-экссудации или проточного центрифугирования,
преципитации крупномолекулярного балласта путем добавления в экстракт 5 М раствора серной кислоты до значения рН 2,5±0,2 с отсечкой балласта при помощи нутч-фильтра и получения кислого фильтрата,
преципитации сульфата путем нейтрализации фильтрата 30%-й водной взвесью гидроксида кальция до значения рН 7,4±0,2 с отсечкой преципитата при помощи нутч-фильтра и получения нейтрального фильтрата,
преципитации остаточного балласта и частичного обессоливания путем внесения в фильтрат расчетного объема 96%-ного этанола до содержания 40 мас. % с отсечкой остаточного белково-солевого осадка при помощи нутч-фильтра и получения композиции накожного водно-спиртового лосьона системного противовоспалительного действия, содержащего фракцию очищенных пептидов селезенки млекопитающих с молекулярной массой не более 12 кДа в количестве 1÷5% мас. к общей массе композиции, 96% этанол в количестве 40% мас., хлористый натрий в количестве до 0,5% мас., хлористый цинк в количестве до 0,05% мас., сульфат кальция в количестве до 0,2% мас., вода - остальное, при рН 7.4±0.2.
При этом определение границы отсечки молекулярной массы пептидов осуществляют с помощью вытеснительной хроматографии и с помощью SDS-электрофореза в градиентном полиакриламидном геле.
Для получения препарата используют селезенку млекопитающих, предпочтительно КРС или свиньи.
Указанный технический результат достигается за счет разработки авторами настоящего изобретения эффективной технологии применения противовоспалительного препарата.
Предложенный способ подавления воспалительной реакции включает нанесение на кожу пациента эффективного количества противовоспалительного пептидного препарата.
Эффективное количество предложенного препарата обеспечивается, например, введением в дозе не менее 2 мг/кг веса при ежедневном, еженедельном применении, а также раз в 2 недели и ежемесячно. Курс лечения составляет от одного до нескольких месяцев, предпочтительно, три, шесть или девять месяцев. Наиболее предпочтительным является доза 2 мг/кг веса при ежедневном применении.
При этом пептиды в составе предложенного препарата без проникновения в системный кровоток воздействуют на внутрикожные дендритные клетки, направляя их на толерогенный путь дифференцировки с последующей передачей толерогенного сигнала Т-регуляторным лимфоцитам (Treg).
При этом воспалительная реакция может быть ассоциирована с псориатическим артритом, в том числе, вызванным искусственным конститутивным синтезом фактора некроза опухоли альфа (ФНО-альфа), или активацией провоспалительных цитокинов, в том числе, вызванной бактериальным эндотоксином (ЛПС), или ревматоидным артритом, в том числе, спонтанным ревматоидным артритом, или системной воспалительной реакцией.
Используемый в способе подавления воспалительной реакции противовоспалительный препарат может быть получен вышеописанным способом получения.
Также предложено применение противовоспалительного препарата в терапии воспалительного заболевания, выбранного из хронического воспалительного заболевания, синдрома системного воспалительного ответа (реакции) или аутоиммунного заболевания, а именно, из псориатического артрита или ревматоидного артрита.
Используемый в терапии воспалительного заболевания противовоспалительный препарат может быть получен вышеописанным способом получения.
Краткое описание чертежей:
Фиг.1. Эффективность поглощения пептидов селезенки свиньи интактной человеческой кожей (анализ смывов).
Колонка: HW-50 1×25 см
Подвижная фаза: Моноэтаноламин 2%, лимонная кислота 10 мМ, рН 10.3
Обозначения испытуемых образцов:
0 Исходный образец пептидов ≤12 кДа, 20 мкг
1 Остаток пептидов на коже после смыва с помощью физраствора
2 Остаток после смыва с помощью 15%-ного ДМСО
3 Остаток после смыва с помощью 3%-ного Tween-80
4 Остаток после смыва с помощью 40%-ного этанола
5 Остаток после смыва с помощью 40%-ного этанола + 5% ДМСО (диметилсульфоксид)
Фиг.2A. Развитие псориатического артрита у генно-модифицированных мышей ihTNFtg с геном фактора некроза опухолей - ФНОα (TNFα), синтез которого в организме мыши индуцируется доксициклином (Dox) при пероральном введении, где
PsA - псориатический артрит
ctr - контрольная мышь (здоровая)
Dox - результат активации TNFα с помощью Доксициклина.
Фиг.2B. Демонстрация аппликации накожной формы испытуемых пептидных образцов.
Фиг.2C. Восстановление физиологических параметров in vivo под действием испытуемых фракций пептидов.
Одновременно с индукцией ФНО-альфа (TNF-α), начиная с нулевого дня, мышам ежедневно вводят:
- • - физраствор (плацебо);
-  - испытуемые пептиды внутрибрюшинно в виде растворенного в физрастворе ацетонового преципитата в дозировке 2.0 мг/кг веса в день.
- испытуемые пептиды внутрибрюшинно в виде растворенного в физрастворе ацетонового преципитата в дозировке 2.0 мг/кг веса в день.
- Δ - испытуемые пептиды накожно в виде лосьона с 40% этанола в дозировке 2.0 мг/кг веса в день, как показано на Фиг.2B;
Каждые 7 дней до 21 дня наблюдают четыре стандартных параметра:
WG - Weight Gain - индекс прибавки веса.
PASI - Psoriasis Area and Severity Index - индекс тяжести поражения псориазом.
SFP - Swelling (Fore Paws) - индекс отека передних лап.
GS - Grip Strength - индекс силы хватания передними лапами.
Фиг.3A. Определение границы отсечки молекулярной массы пептидов ПТК (PTC) и суммарной концентрации пептидов образца ПТК с помощью аналитической вытеснительной хроматографии.
Колонка: HW-50 1x25 см
Подвижная фаза: Моноэтаноламин 2%, лимонная кислота 10 мМ, рН 10.3
Обозначения образцов и стандартных белков:
1 - BSA (бычий сывороточный альбумин) 69 кДа (40 мкл, 10 мг/мл)
2 - Цитохром С 12 кДа
3 - Образец серийного ПТК (40 мкл)
4 - Контрольный образец пептидного экстракта после ультрафильтрации на мембране 10 кДа
5 - Инсулин 5.7 кДа.
Фиг.3B. Определение границы отсечки молекулярной массы и контроль чистоты препарата ПТК (PTC) с помощью SDS-электрофореза в градиентном полиакриламидном геле 10-18% по методу Laemmli [52]. Показано полное отсутствие белковых компонентов с молекулярной массой свыше 12 кДа.
Фиг.4. Пептиды ПТК (PTC) не активируют CD4+ Т-клетки напрямую.
CD4+ Т-клетки, селективно выделенные из селезенки мышей C57Bl/6, стимулируют in vitro в течение 5 дней различными количествами пептидов ПТК (PTC).
После инкубации клетки анализируют методом проточной цитометрии на пролиферативную активность (левая панель) или экспрессию ядерных белков Foxp3 или Tbet, которые характерны для активированных супрессорных Treg или иммуногенных Th1-клеток.
Экспрессия Foxp3 и Tbet показана только для клеток, стимулированных 5000 мкг/мл пептидов ПТК (PTC).
Фиг.5 ПТК (PTC)-активированные DCs индуцируют дифференцировку клеток Foxp3+ Treg
(A) Клетки костного мозга мышей C57Bl/6 дифференцируют в DCs путем стимуляции с помощью GM-CSF + IL-6 в течение 6 дней. После удаления цитокинов, DCs активируют пептидами ПТК (PTC) или указанными цитокинами в течение дополнительных 24 ч. Затем DCs культивируют совместно с CD4+ клетками мышей C57Bl/6 в течение 5 дней. Т-клетки анализируют на пролиферацию и на часть клеток Foxp3+ и Tbet+.
(B) Репрезентативные изображения, иллюстрирующие стратегию стробирования, включая элементы FMO-контроля (flourescence minus one), для количественной оценки параметров, показанных в (A).
Показаны средние значения ± SEM пяти повторных экспериментов. Статистический анализ проводят с помощью двухфакторного дисперсионного анализа ANOVA с последующим множественным сравнением Tukey's для анализа значимости между формами кривых с течением времени. Показаны достоверные различия между кривыми для ПТК (PTC) и GM-CSF+IL-4 (*Р < 0,05 и **Р < 0,01).
Фиг.6. Класс дендритных клеток (DCs) является основной биологической мишенью пептидов ПТК (PTC).
(A) Клетки, полученные из костного мозга, дифференцируют в DCs с помощью GM-CSF + IL-4 (10 нг/мл обоих) в течение 6 дней. После удаления цитокинов, зрелые DCs активируют пептидами ПТК (PTC) или указанными цитокинами в течение дополнительных 24 ч и анализируют методом проточной цитометрии. Показаны средние значения ± SEM пяти повторных экспериментов. Статистический анализ проводят с помощью однофакторного дисперсного анализа ANOVA с последующим множественным Tukey-сравнением. Показаны только значения, относящиеся к DCs, обработанными пептидами ПТК (PTC) (*Р < 0,05, **Р < 0,01 и ***Р < 0,001).
(B) Репрезентативные изображения, иллюстрирующие стратегию стробирования, включая элементы FMO-контроля (flourescence minus one), для количественной оценки параметров, показанных в (A).
Фиг.7. ПТК (PTC)-опосредованная индукция Treg зависит от взаимодействия DCs с рецепторами PD-1 и CTLA4 CD4+ Т-клеток
(А) Клетки костного мозга мышей C57Bl/6 стимулируют с помощью GM-CSF + IL-4 (по 10 нг/мл каждого) в течение 6 дней для получения зрелых DCs. После удаления цитокинов DCs активируют с помощью ПТК (PTC) еще в течение 48 ч. Сенсибилизированные DCs дважды промывают безцитокиновой средой и инкубируют с сингенными CD4+-клетками селезенки в соотношении 1:5 и в присутствии специфических моноклональных антител (monAbs) (по 20 мкг/мл) в течение 5 дней. Клетки собирают и анализируют на указанные параметры методом проточной цитометрии.
Средним значениям анализируемых параметров в клетках, инкубированных с контролем IgG, присваивают значение 1. Показаны средние значения ± SEM из четырех повторных экспериментов.
Статистический анализ проводят с помощью однофакторного дисперсного анализа ANOVA с последующим множественным Tukey-сравнением. (*Р < 0,05, **Р < 0,01 и ***Р < 0,001).
(B) Репрезентативные изображения, подчеркивающие стратегию стробирования, включая элементы управления FMO, для количественной оценки параметров, показанных в (A).
Фиг.8. Воздействие ПТК (накожная аппликация) в дозировке 2.0 мг/кг веса в день на концентрацию in vivo провоспалительных цитокинов TNFα (ФНО-альфа), IL-1b, IL-2 после ЛПС-провокации.
Фиг.9. Воздействие ПТК (накожная аппликация) в дозировке 2.0 мг/кг веса в день в тесте на противовоспалительную активность in vivo. В качестве плацебо используют физраствор. Показано постмортальное микроскопическое исследование поперечного среза кожи в районах псориатической деформации. Контроль - здоровая мышь.
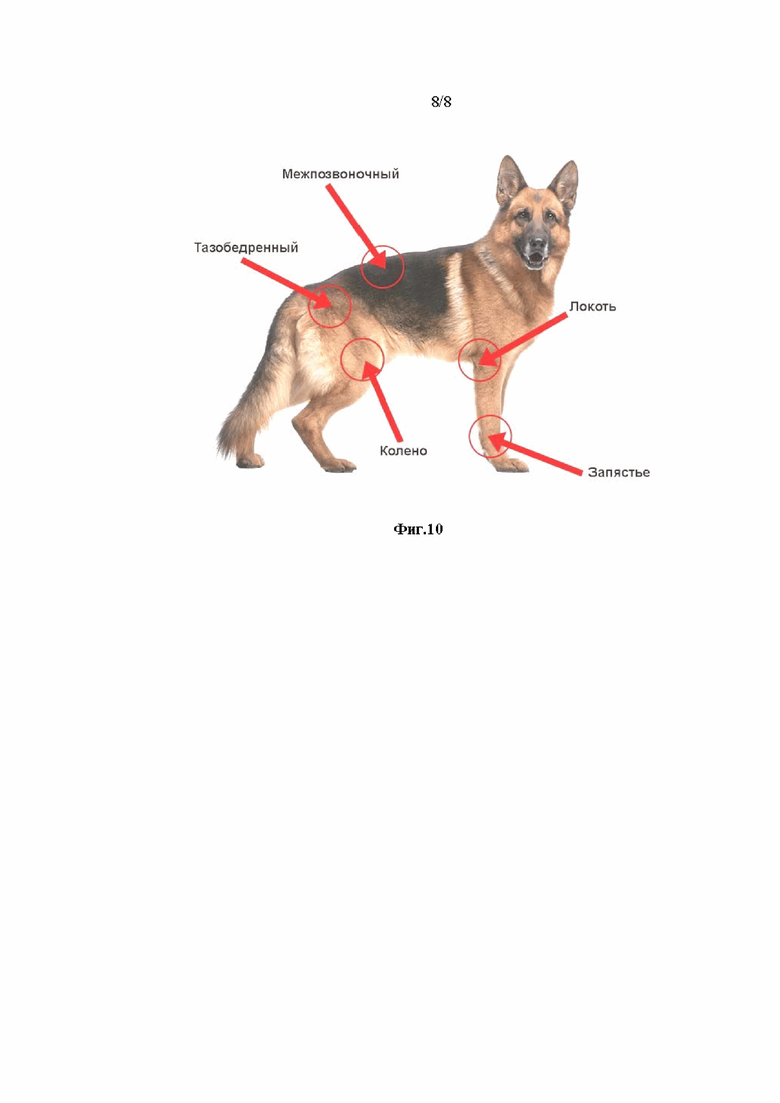
Фиг.10. Суставы собаки, подверженные артриту.
Примеры осуществления изобретения
Пример 1. Подбор состава накожной лекарственной формы
Биологическая мишень противовоспалительных пептидов была определена в несколько этапов, которой оказались дендритные клетки, представленные в коже клетками Лангерганса (см. далее Пример 4), что определило достаточность оценки кожной абсорбции (несмываемости образца с поверхности кожи). Для того, чтобы пептиды количественно достигали клеток Лангерганса, необходимо, чтобы они могли преодолеть, по крайней мере, тонкий кератиновый слой 10-15 мкм. Расчет на то, что пептиды, которые впитываются в кожу, способны проникнуть сквозь кератиновый слой и достигнуть клеток Лангерганса, в дальнейшем был подтвержден явным неожиданным физиологическим эффектом (см. далее Примеры 2, 6, 7, 8).
Для демонстрации эффекта готовят концентрированный образец пептидов селезенки свиньи или КРС, полученный микрометодом, который далее используют для определения источников действующего начала (см. далее Пример 2), а именно: гомогенизируют образец селезенки в 2-х объемах 0,1%-ного хлористого цинка, доводят рН гомогената с помощью 10%-ного раствора аммиака до значения 8.0±0.2, замораживают при температуре -20°С, оттаивают на сетке, в полученный экстракт (экссудат) вносят 1,5 объема ацетона (обессоливание и удаление крупномолекулярного балласта выше 12 кДа), фильтруют на бумажном фильтре, в фильтрат вносят 2 объема ацетона, осадок собирают на бумажном фильтре, промывают ацетоном, сушат и растворяют в 0,9%-м растворе хлористого натрии (физраствор), фильтруют через шприцевую насадку 0,2 мкм, разводят до необходимой концентрации.
Исходя из данной постановки задачи, был разработан состав раствора, который наилучшим образом способствует пассивному поглощению макромолекул нетравмированной кожей. Испытывали неионные детергенты, этанол, диметилсульфоксид и их комбинации. Эффективность абсорбции пептидов in vivo измеряли путем хроматографического определения остаточного количества и состава пептидов на интактной человеческой коже после пассивного впитывания образца. Неожиданным образом таким оптимальным растворителем оказался водный раствор, содержащий 40 мас. % этанола. Эффективность поглощения кожей пептидов менее 12 кДа составила около 60% без заметной дискриминации по молекулярным массам (Фиг.1).
В эксперименте в качестве исходного контрольного образца используют обессоленный образец пептидов в диапазоне до 12 кДа с концентрацией 40 мг/мл, полученный из суммарного экстракта по вышеописанной методике с дробной ацетоновой очисткой. Для составления испытуемых образцов исходный образец разводят в физрастворе с добавлением компонентов, указанных на диаграмме.
На чистую интактную человеческую кожу in vivo наносят по 10 мкл образцов с суммарным количеством пептидов по 20 мкг. После самопроизвольного впитывания и высыхания образца, остаток пептидов смывают с кожи дважды каждый раз по 30 мкл подвижной фазы (2% моноэтаноламин, 0,01 М цитрат, рН 10.3), отбирают микродозатором и собирают в микропробирку. Смывы анализируют с помощью вытеснительной аналитической хроматографии.
Выбор аналитической хроматографии определен двумя причинами, а именно:
(а) высокая чувствительность и воспроизводимость,
(б) возможность оценки дискриминации абсорбции в зависимости от молекулярной массы пептидов.
Результат: Наиболее эффективным оказался 40%-ный этанол (образец № 4), в т.ч. с добавлением ДМСО до 5% (образец № 5). При этом дискриминация по молекулярной массе неожиданным образом отсутствовала. Таким образом, лекарственная форма была выбрана как спиртсодержащая композиция, конкретно - водно-спиртовой лосьон.
Пример 2. Определение природного источника лекарственного начала для оптимизации технологии его получения
Первоначальным объектом исследования были выбраны именно пептиды. Для этого были известны косвенные данные. Впоследствии выбор оправдался.
Несмотря на то, что опытами А.Б.Цыпина и соавт. [1] ранее было показано, что противовоспалительными свойствами обладает ультрафильтрат селезенки до 50 кДа, исследование необходимо было провести заново, т.к. в силу опасности развития побочных эффектов, в первую очередь аутоиммунизации, отсечка в 50 кДа совершенно недостаточна, и необходимо было точно определить источник действующего начала, и он был выявлен в безопасном диапазоне до 12 кДа.
В первой серии опытов используют пептиды из плазмы крови и различных органов и тканей свиньи (всего 4 источника), полученные из суммарного экстракта по методике с дробной ацетоновой очисткой, описанной в Примере 1.
Из полученных фракций формировали образцы пептидов в двух вариантах:
(а) накожный вариант с суммарной концентрацией 6 мг/мл в 40%-ном этаноле,
(б) инъекционный внутрибрюшинный вариант с концентрацией 1 мг/мл в физиологическом растворе.
Для тестирования фракций, обладающих наилучшим лечебным действием против искусственного псориатического артрита, использовали генно-модифицированных мышей ihTNFtg [51], несущих дополнительный ген фактора некроза опухоли (ФНО-альфа - TNF-α), главного провоспалительного цитокина. Ген содержит промотор, активируемый доксициклином (Dox), который мыши получают с питьевой водой. При активации промотора TNF-α у мышей развивается тяжелый псориатический артрит (Фиг.2A). Данных мышей используют как специфическую чувствительную модель при выборе фракций, обладающих системным лечебным действием в трансдермальной лечебной форме.
Одновременно с индукцией ФНО-альфа (TNF-α), начиная с нулевого дня, мышам ежедневно вводят:
- • - физраствор (плацебо);
-  - испытуемые пептиды внутрибрюшинно в виде растворенного в физрастворе ацетонового преципитата в дозировке 2.0 мг/кг веса в день (на мышь 30 г инъекция 60 мкл в концентрации пептидов 1 мг/мл);
- испытуемые пептиды внутрибрюшинно в виде растворенного в физрастворе ацетонового преципитата в дозировке 2.0 мг/кг веса в день (на мышь 30 г инъекция 60 мкл в концентрации пептидов 1 мг/мл);
- Δ - испытуемые пептиды накожно в виде лосьона с 40% этанола с дозировкой 2.0 мг/кг веса в день, как показано на Фиг.2B (на мышь 30 г кожное нанесение 2×5 мкл в концентрации 6 мг/мл);
Каждые 7 дней до 21 дня наблюдают четыре стандартных параметра:
WG - Weight Gain - индекс прибавки веса.
PASI - Psoriasis Area and Severity Index - индекс тяжести поражения псориазом.
SFP - Swelling Fore Paws - индекс отека передних лап.
GS - Grip Strength - индекс силы хватания передними лапами.
На Фиг.2C показан результат для наиболее адекватного варианта пептидов из селезенки свиньи, который далее был принят за основу при разработке технологии получения противовоспалительного препарата (см. Пример 3). Аналогичные данные были получены при использовании селезенки КРС.
Результаты:
В данной серии опытов были определены наиболее богатые источники (органы и ткани), содержащие лечебное начало. Поскольку лечебной активностью обладали экстракты не единственного органа и ткани млекопитающих (КРС и свинья), был сделан вывод о вездесущности в организме противовоспалительных регуляторных пептидов, но для наилучшей стандартизации последующего промышленного получения пептидного компаунда была выбрана селезенка, наиболее богатая пептидным компаундом с противовоспалительным действием.
При накожном и внутрибрюшинном введении пептиды селезенки одинаково эффективно восстанавливают физиологические параметры, преодолевая псориатический артрит, вызываемый постоянным воздействием суперэкспресии ФНО-альфа (TNF-α). При этом важно отметить, что внутрибрюшинное введение принципиально отличается от внутривенного или внутримышечного, т.к. введенные пептиды не попадают непосредственно в системный кровоток, а воздействуют на клетки стенки кишечника.
Дополнительно выявлено системное общеорганизменное действие пептидов, когда нанесение пептидов на локальную область ушей или внутрибрюшинно заставляет нормализоваться дистальные области организма - суставы и кожу. Показан однозначный терапевтический эффект пептидов селезенки на фоне перманентной принудительной суперэкспрессии наиболее мощного провоспалительного цитокина - фактора некроза опухолей (ФНО-альфа - TNFα), что говорит о том, что пептидный компаунд имеет не только противовоспалительный эффект, но действует на уровне более глубокой нормализации иммунитета, т.е. имеет толерогенное действие. Это далее было подтверждено в опытах in vitro (см. Фиг.4-7). На этом основании он получил условное наименование "Пептидного Толерогенного Компаунда" - ПТК (Peptide Tolerogenic Compound - PTC).
С помощью тест-модели генетически модифицированных мышей, несущих дополнительный ген фактора некроза опухоли (ФНО-альфа - TNF-α) [51], отработана оптимальная технология получения ПТК (см. Пример 3).
Пример 3. Описание технологии получения ПТК (PTC)
Измельчают сырье (селезенку КРС или свиней) на мясорубке, смешивают с 0,1%-ным раствором хлористого цинка в соотношении 2 массовых частей раствора на 1 массовую часть фарша, полученный гомогенат при интенсивном перемешивании закисляют до значения 3.0±0.2 с помощью 5 М раствора соляной кислоты для фиксации крупномолекулярной фракции, экстрагируют пептиды доведением рН гомогената до значения 8.0±0.2 с помощью 5 М раствора гидроксида натрия, получают осветленный экстракт с помощью замораживания-экссудации или проточного центрифугирования (используются стандартные методики осветления пептидных экстрактов, известные, например, из [1], [2], [50]), добавляют 5 М раствор серной кислоты до значения рН 2.5±0.2 (вторая фиксация крупномолекулярного балласта), получают кислый фильтрат с помощью нутч-фильтра, нейтрализуют фильтрат 30%-й водной взвесью гидроксида кальция до значения рН 7.4±0.2 (осаждение сульфата), получают нейтральный фильтрат с помощью нутч-фильтра, вносят в фильтрат равный объем 96%-ного этанола (финишное осаждение крупномолекулярного балласта и обессоливание) с получением расчетного содержания этанола 40,1 мас. % (рассчитано с учетом плотности 96%-ного этанола 0.806 и уменьшения результирующего объема водно-спиртовой смеси с коэффициентом 0.964 [55]), получают фильтрат с помощью нутч-фильтра (готовый ПТК в форме лосьона).
Определение границы отсечки молекулярной массы пептидов ПТК (PTC) и суммарной концентрации образца пептидов осуществляют с помощью аналитической вытеснительной хроматографии (Фиг.3A).
Корректное определение суммарной концентрации пептидов в ПТК осуществляют путем сравнения интеграла кривой "1" (образцовый раствор BSA с концентрацией 10 мг/мл) и интеграла кривой "3" (образец ПТК равного объема с BSA). В представленном случае (Фиг.3A) суммарная концентрация пептидов в полученном образце ПТК составляет ≈ 15 мг/мл ≈ 1,5%.
Определение границы отсечки молекулярной массы и контроль чистоты препарата ПТК (PTC) осуществляют с помощью SDS- электрофореза в градиентном полиакриламидном геле 10-18% по методу Laemmli [52] (Фиг.3B). Показано полное отсутствие белковых компонентов с молекулярной массой свыше 12 кДа.
Предложенный способ получения препарата низкомолекулярных пептидов имеет следующие преимущества:
- Способ исключает критические аппаратные и процессные ограничения, а именно: ацетоновое осаждение, диализ, хроматографию, лиофилизацию, ультрафильтрацию. Благодаря этому он обеспечивает максимально экономичное и неограниченное промышленное масштабирование.
- С помощью эмпирически подобранного сочетания концентраций кислот, хлористого цинка, гидроксида кальция и этанола предложенный способ позволяет четко ограничивать сверху молекулярную массу целевых пептидов на уровне от 10 до 12 кДа, но не выше 12 кДа, без применения токсичного взрывоопасного ацетона и дорогостоящих низкопроизводительных методов ультрафильтрации и хроматографии, которые используются в предшествующих технологиях. Цинк в данном случае играет двойную роль - как дифференциальный осадитель и необходимый кофактор регуляторных пептидов.
- Благодаря сочетанию серной кислоты и гидроксида кальция в качестве осадителя сульфата, и этанола в качестве вторичного осадителя, содержание солей в конечном продукте не превышает 0,05% хлористого цинка, 0,2% сульфата кальция (максимальная растворимость [53]), 0,5% хлористого натрия при рН 7.4±0.2 без использования процедуры диализа и/или обессоливания на колонках. Это определяет физиологически комфортный состав готового лосьона для накожного применения.
Таблица 1. Состав предложенного водно-спиртового лосьона, полученного предложенным способом
% мас. к общей массе композиции
Все последующие эксперименты проводят с использованием стандартных серийных образцов ПТК (PCT) в качестве унифицированного источника пептидов для соблюдения воспроизводимости результатов.
Для экспериментов in vitro пептиды осаждают из ПТК с помощью двухступенчатой ацетоновой процедуры. Вначале к раствору ПТК добавляют 1 объем ацетона для осаждения остаточных солей и фильтруют. В фильтрат вносят 2 объема ацетона для получения пептидного преципитата, преципитат промывают ацетоном, собирают на бумажном фильтре и высушивают под стерильным ламинарным потоком воздуха. Высушенный преципитат растворяют в физиологическом растворе, приводят штоковый раствор к концентрации 10 мг/мл, стерилизуют с помощью шприцевой фильтровальной насадки с мембраной 0,2 мкм, расфасовывают и замораживают мелкими порциями.
Пример 4. Определение биологической мишени ПТК in vitro
Для определения влияния пептидов ПТК (РСТ) непосредственно на Т-клетки, CD4+клетки выделяют из селезенки мышей C57BL/6 с помощью технологии MACS (технология магнитного разделение клеточных популяций на основе поверхностных антигенов) и стимулируют in vitro в течение 5 дней различными количествами пептидов ПТК.
Поскольку дифференцировка и/или активация лимфоцитов обычно связана с интенсивной пролиферацией [56], CD4+клетки предварительно метят флуорохромом CFSE, а степень пролиферации клеток (количественно определяют как долю клеток CFSEl0), и количество Foxp3 - или Tbet-позитивных клеток анализируют методом проточной цитометрии. Foxp3 и Tbet являются основными транскрипционными факторами, которые инициируют и поддерживают развитие линий Treg и Th1 из незрелых (naive) клеток-предшественников Th, соответственно. Их обычно используют в качестве маркеров противовоспалительных Treg и воспалительных Th1-клеточных сублиний.
Результат (Фиг.4): Стимуляция CD4+ клеток с помощью ПТК не влияет на пролиферацию Т-клеток или их дифференцировку в подтипы Treg или Th1.
Для полной активации CD4+ Т-клеткам обычно требуется вовлечение Т-клеточного рецептора и ко-стимулирующих молекул, которые обычно обеспечиваются взаимодействием с антигенпрезентирующими клетками, такими как дендритные клетки (DCs). В этих условиях Т-клетки начинают пролиферировать и, в зависимости от цитокиновой среды, дифференцироваться в специфическое подмножество Т-хелперов.
Таким образом, на следующем этапе анализируют, могут ли пептиды ПТК стимулировать Т-клетки опосредованно через активацию DCs. Для этого клетки костного мозга, выделенные от мышей C57Bl/6/c, дифференцируют в зрелые DCs путем стимуляции GM-CSF+IL-4, как описано в работе Varga et al. [54], а затем активируют в течение 2 дней с помощью пептидов ПТК или IL-10, TGFβ и GM-CSF+IL-4, т.е. известными толерогенными и иммуногенными триггерами активации дендритных клеток (DCs). Затем DCs в течение 5 дней культивируют совместно с незрелыми (naïve) CD4+ клетками, выделенными из селезенки мышей C57Bl/6, в так называемом MLR- анализе (смешанная реакция лимфоцитов), а количество пролиферирующих и Foxp3 - и Tbet-позитивных клеток определяют методом проточной цитометрии.
Когда DCs активируют с помощью пептидов ПТК, они способствуют значительно более высокой пролиферации CD4+ Т-клеток, чем любые другие использованные стимулы. Более того, количество Foxp3+ толерогенных Treg-клеток, образованных ПТК-активированными дендритными клетками DCs, такое же высокое, как и у DCs, активированных IL-10 или TGFβ, и значительно выше, чем у DCs, активированных иммуногенной комбинацией GM-CSF + IL-4. Напротив, количество Tbet-позитивных иммуногенных клеток остается самым низким при совместном культивировании CD4+ клеток с ПТК-активированными DCs и значительно отличается от количества Tbet+ CD4+ клеток, индуцированных дендритными клетками DCs, активированными суммой цитокинов GM-CSF + IL-4.
Результат (Фиг.5): Пептиды ПТК стимулируют Т-клетки опосредованно, через активацию дендритных клеток (DCs). Пептиды ПТК непосредственно влияют на DCs и дифференцируют их в толерогенные клетки, которые, в свою очередь, способствуют поляризации незрелых (naïve) CD4+ Т-клеток в толерогенные Foxp3+ Treg-клетки.
Пример 5. Расшифровка каскада толерогенной активации in vitro
В данном примере исследуют, действительно ли пептиды ПТК непосредственно стимулируют DCs. Для этого клетки костного мозга инкубируют с цитокинами GM-CSF + IL-4 в течение 6 дней для получения зрелых DCs. После отмывания цитокинов клетки стимулируют с помощью ПТК (РСТ), толерогенными (IL-10, TGFβ) или иммуногенными (GM-CSF + IL-4) цитокинами еще в течение 24 ч, а CD11c+/MHCII+дендритные клетки DCs анализируют методом проточной цитометрии.
По сравнению с GM-CSF + IL-4, пептиды ПТК (PTC) оказываются только слабыми индукторами CD80 - лиганда, как правило, интенсивно экспрессируемого иммуногенными DCs, и, таким образом, фенотип Т-клеток, стимулированных ПТК, скорее напоминает фенотип, полученный после стимуляции толерогенным IL-10 и фактором роста TGFβ.
При индукции CD86 пептиды ПТК (PTC) столь же эффективны, как GM-CSF + IL-4, но несколько менее эффективны, чем TGFβ. Напротив, количество клеток, экспрессирующих типичные толерогенные маркеры, такие как поверхностные лиганды PD-L1 и CD205, но не внутриклеточные IDO, было значительно увеличено при стимуляции DCs пептидами ПТК (PTC) по сравнению со стимуляцией GM-CSF + IL-4. Из проанализированных толерогенных маркеров рецептор CD205 был наиболее сильно индуцирован пептидами ПТК (PTC). Ни IL-10, ни TGFβ не могут так сильно активировать этот маркер. По своей способности стимулировать внутриклеточный белок IDO или поверхностный рецептор CD86 пептиды ПТК (PTC) были промежуточными по сравнению с IL-10 и TGFβ.
Результат (Фиг.6): Пептиды ПТК (PTC) действительно стимулируют зрелые DCs к толерогенной дифференцировке и механизм активации DCs пептидами ПТК принципиально отличается от механизма активации IL-10 или TGFβ.
Остается вопрос, будет ли блокирование PD-1 - PD-L1/2 и/или CTLA4 - CD80/86 взаимодействий между DCs и Т-клетками, которые, как известно, важны для DCs-опосредованной дифференцировки Treg-клеток, предотвращать ПТК-опосредованную толерогенную активность DCs.
Для ответа на этот вопрос, полученные из костного мозга, созревшие под действием GM-CSF + IL-4 и DCs, активированные пептидами ПТК, совместно культивируют с сингенными незрелыми (naive) CD4+ Т-клетками в присутствии или отсутствии функционально блокирующих анти-PD-1 и/или анти-CTLA4 моноклональных антител (monAbs).
В то время как количество пролиферирующих Т-клеток несколько увеличено в присутствии антител по сравнению с контролем IgG, доля Foxp3+ Treg значительно снижена в присутствии анти-PD-1 monAb и, в меньшей степени, анти-CTLA4 monAb. Кроме того, наличие обоих функционально-блокирующих антител обеспечивает наиболее сильный эффект, предполагая аддитивное действие.
Этот эффект наблюдают как в пролиферирующих, так и в непролиферирующих клетках, но он более выражен в покоящихся CD4+ клетках. Экспрессия иммуногенного транскрипционного фактора Tbet показывает противоположный результат. Количество Тbet+клеток увеличивается в присутствии функционально блокирующих анти-PD-1 и анти-CTLA4 антител, причем эффект наблюдают только у пролиферирующих CD4+ Т-клеток.
Результат (Фиг.7): Пептиды ПТК (PTC) в первую очередь нацелены на DCs и индуцируют экспрессию лигандов, таких как PD-L1 или CD86. Активированные DCs, в свою очередь, преобразуют незрелые (naïve) CD4+ клетки в толерогенные Treg посредством прямых взаимодействий PD-1⇔ PD-L1/2 и/или CTLA4 ⇔ CD80/86.
Пример 6. Воздействие ПТК (накожная аппликация) на концентрацию in vivo провоспалительных цитокинов.
Используют беспородных белых мышей, которым вводят ЛПС (липополисахарид - пироген) в сочетании с накожным введением ПТК в дозировке 2.0 мг/кг веса (как на Фиг.2B). Измеряют концентрацию цитокинов в плазме крови.
Влияние пептидов ПТК на концентрацию цитокинов in vivo продемонстрировано на Фиг.8. Измеряют концентрацию в плазме крови следующих цитокинов: TNFα (ФНО-альфа), IL-1b, IL-2.
Результат: При ежедневных аппликациях ПТК в течение месяца в форме водно-спиртового лосьона в дозировке 2,0 мг/кг веса концентрация в крови провоспалительных цитокинов TNFa, IL-1b и IL-2 достоверно снижается по сравнению с плацебо. Ни у одного из животных не было зарегистрировано аллергии в месте нанесения препарата, а также развития системной аллергической реакции на препарат.
Пример 7. Проведение патологоанатомического исследования для демонстрации эффекта ПТК в тесте на противовоспалительную активность in vivo
Для данного эксперимента также используют генно-модифицированных мышей ihTNFtg [51] с принудительной суперпродукцией фактора некроза опухолей - ФНО (TNFα), вследствие чего у мышей развивается выраженный псориатический артрит (см. Фиг.2A).
Одновременно с индукцией ФНО-альфа (TNF-α), начиная с нулевого дня, мышам ежедневно наносят физраствор (в качестве плацебо) или пептиды ПТК накожно на безволосную часть ушей, как показано на Фиг.2B, в дозировке 2,0 мг/кг веса в день. Через 10 дней постмортально проводят микроскопическое исследование поперечного среза кожи в дистальных районах псориатической деформации (Фиг.9).
Результат: При воздействии ПТК в форме накожного лосьона в дозировке 2,0 мг/кг веса в день артритно-псориатическая деформация подавляется с эффективностью около 70%. В дополнительном контрольном опыте без индукции TNF-α ни у одного из 5 животных не было зарегистрировано аллергии в месте нанесения препарата, а также развития системной аллергической реакции на препарат.
Пример 8. Лечение ревматоидного артрита у крупных млекопитающих.
Девять испытуемых собак различных пород и беспородных в возрасте от 4 до 8 лет и весом от 12 до 25 кг были предоставлены для лечения их владельцами. Перед применением ПТК состояние животных было задокументировано ветеринарными врачами, у которых они находились на регулярном лечении. У всех животных артрит не был следствием травмирования. Также были исключены гнойный артрит и хламидийный артрит.
До применения пептидов все девять собак лечили от 1,5 до 3 лет либо безуспешно, либо с временным терапевтическим эффектом с помощью физиотерапии и известными противоартритными средствами (Стоп-артрит, Артрогликан, Лошадиная сила, Кетофен, Римадил, Хондартрон, Хондроитин Комплекс, Хондролон, Румалон). Кортикостероидные препараты испытуемым собакам ранее не назначали.
Для чистоты эксперимента все противоартритные препараты перед началом применения ПТК были отменены.
В силу специфики поведения животных, нанесение лосьона ПТК осуществляли только на тазобедренную область и в область позвоночника во избежание интенсивного слизывания (Фиг.10). Аппликацию осуществляли следующим образом: на суставы наносили лосьон ПТК в концентрации от 1% до 5% одноразовой полиэтиленовой пипеткой под шерсть непосредственно на кожу в объеме 0,5-1,5 мл в каждую точку (не менее 3 точек) и прижимали полиэтиленовой пленкой на 3 минуты. Этого времени по опыту достаточно для развития терапевтического эффекта. Благодаря наличию в лекарственной форме 40%-го этанола лосьон ПТК легко распространяется по коже под шерстью. При нанесении раствора ПТК каждый раз соблюдали дозировку не менее 2 мг/кг веса, исходя из концентрации пептидов и веса животного. Препарат применяли ежедневно, еженедельно, раз в 2 недели и ежемесячно.
Собакам №№ 1,2,3 (наиболее легкая группа) проведен 3-месячный курс с последующим наблюдением в течение 6-9 месяцев после завершения лечения (еженедельное применение).
Собакам №№ 4,5,6,7 проведен 6-месячный курс с последующим наблюдением в течение 3-6 месяцев после завершения лечения (№№4,5 с нанесением раз в 2 недели, №№6,7 - ежемесячно).
Собакам №№ 8,9 (первоначально слабо отвечающие на лечение) проведен 9-месячный курс с последующим наблюдением в течение 3 месяцев после завершения лечения (первый квартал - еженедельное применение, в середине курса (второй квартал) - ежедневно, в конце (третий квартал) - раз в неделю).
Результаты приведены в Таблице 2.
Таблица 2. Данные по терапевтическому эффекту ПТК на собаках
Обозначения:
«+» - недостаточный терапевтический эффект, сохранялись боли в суставах при прощупывании суставов;
«++» - удовлетворительный терапевтический эффект, при прощупывании суставов болевых реакций не наблюдалось, но при движении наблюдалось некоторое ограничение подвижности или нарушение координации;
«+++» - максимальный терапевтический эффект, не наблюдалось болевых реакций при прощупывании суставов и заметных ограничений подвижности или нарушений координации при движении;
«Н/Д» - нет данных.
Важно также, что в течение всего наблюдаемого периода в течение лечения и в последующий период побочные явления не наблюдались. Животные после излечивания проявляли здоровое активное поведение, температура и стул были в норме. Не было отмечено грибковых, вирусных и бактериальных инфекций, что свидетельствует в пользу того, что пептиды не проявляли иммуносупрессорного воздействия. Ни у одного из животных не было зарегистрировано аллергии в месте нанесения препарата, а также развития системной аллергической реакции на препарат.
Обращает на себя внимание то, что воздействие пептидов только на бедра и позвоночник приводит к явному терапевтическому эффекту и в остальных больных суставах, хотя в дистальных суставах лечебный эффект достигался с 1-1,5 месячной задержкой, что подтверждает факт системного общеорганизменного действия накожной лекарственной формы ПТК.
ЦИТИРУЕМЫЕ ИСТОЧНИКИ
1. Патент RU 2152219 С1, 10.07.2000.
2. Патент RU 2033796 С1, 30.04.1995.
3. Herwadkar A, Banga AK. Peptide and protein transdermal drug delivery. Drug Discov. Today Technol. 2012; 9(2):e147-e154.
4. Benjamin J Bruno, Geoffrey D Miller and Carol S Lim. Basics and recent advances in peptide and protein drug delivery. Ther Deliv. 2013 Nov; 4(11): 1443-1467.
5. Sharma A. Transdermal Drug Delivery System Market Size, Outlook Analysis Report to 2025. 2019; Res.Gate, Jul. https://www.marketresearch.com/OG-Analysis-v3922/Transdermal-Drug-Delivery-System-Size-12510535/
6. Sharma J.P.K., Bansal S, Banik A. Noninvasive routes of proteins and peptides drug delivery. Indian J. Pharm. Sci. 2011; 73(4):367-375.
7. Ahmed O.A.A. et al. Optimization of self- nanoemulsifying systems for the enhancement of in vivo hypogly- cemic efficacy of glimepiride transdermal patches. Expert Opin Drug Deliv. 2014 Jul; 11:1005-13.
8. Benson HA. Transfersomes for transdermal drug delivery. Expert Opin Drug Deliv 2006; 3:727-37.
9. Cevc G. Transdermal drug delivery of insulin with ultradeformable carriers. Clin Pharmacokinet. 2003; 42(5):461-74.
10. Desai P. et al. Interaction of nanoparticles and cell-penetrating peptides with skin for transdermal drug delivery. Mol Membr Biol. 2010; Oct; 27(7):247-59.
11. Mutalik S. et al. Glipizide matrix transdermal systems for diabetes mellitus: preparation, in vitro and preclinical studies. Life Sci. 2006; Sep 6; 79(16):1568-77.
12. Rastogi R. et al. Investigation on the synergistic effect of a combination of chemical enhancers and modulated iontophoresis for transdermal delivery of insulin. Drug Dev Ind Pharm 2010; Aug; 36(8):993-1004
13. Rastogi R. et al. Electroporation of polymeric nanoparticles: an alternative technique for transdermal delivery of insulin. Drug Dev Ind Pharm 2010; Nov; 36(11):1303-11
14. US Patent Application 20100040702, 2010. Chemical composition for skin care formulations
15. Waghule T. et al. Microneedles: A smart approach and increasing potential for transdermal drug delivery system. Biomed Pharmacother. 2019; Jan;109:1249-1258.
16. Arora A. et al. Micro-scale devices for transdermal drug delivery. Int. J. Pharm. 2008; 364(2):227-236.
17. Garland M.J. et al. Dissolving polymeric microneedle arrays for electrically assisted transdermal drug delivery. J. Control. Release. 2012; 159(1):52-59.
18. Wilson EJ. Three Generations: The Past, Present, and Future of Transdermal Drug Delivery Systems. 2011; Pharmcon; SC, USA, Google Scholar
19. Herwadkar A, Banga AK. Peptide and protein transdermal drug delivery. Drug Discov. Today Technol. 2012; 9(2):e147-e154
20. Pathan IB, Setty CM. Chemical penetration enhancers for transdermal drug delivery systems. Trop. J. Pharm. Res. 2009; 8(2):173-179.
21. Flynn G.L., Stewart B. Percutaneous Drug Penetration: Choosing Candidates for Transdermal Development. Drug Devel. Res. 1988; 13:169-185
22. Bos JD, Meinardi MM. The 500 Dalton rule for the skin penetration of chemical compounds and drugs. Exp. Dermatol. 2000; 9(3):165-169.
23. Ruan RQ, et al. Transdermal delivery of human epidermal growth factor facilitated by a peptide chaperon. Eur. J. Med. Chem. 2013; 62:405-409.
24. Сборник трудов G.F.Murphy https://www.researchgate.net/scientific-contributions/2050382893-G-F-Murphy
25 . Blauvelt A. Langerhans Cells. 1998; Encyclopedia of Immunology (Second Edition) https://www.sciencedirect.com/topics/medicine-and-dentistry/langerhans-cell
26. Патент RU 2462265 С1, 27.09.2012.
27. Thakker, K.; Chern, W. Development and validation of in vitro release tests for semisolid dosage forms - Case study. Dissol. Technol., 2003; May, p.10-15
28. Cardot, J-M.; Beyssac, E.; Alric, M. In vitro-in vivo correlation: Importance of dissolution in IVIVC. Dissol. Technol. 2007; Feb p.15-19
29. Frum, Y. et al. Towards a correlation between drug properties and in vitro transdermal flux variability. Int. J. Pharm., 2007; May v.336(1): 140-147
30. Godin, B.; Touitou, E. Transdermal skin delivery: Predictions for humans from in vivo, ex vivo and animal models. Adv. Drug Deliv. Rev., 2007; Sep 30; 59 (11):1152-61.
31. Yang, Y. et al. Development and validation of in vitro-in vivo correlation (IVIVC) for estradiol transdermal drug delivery systems. J. Control. Rel., 2015; Jul 13; 210:58-66
32. Franz T.J. The finite dose technique as a valid in vitro model for the study of percutaneous absorption in man. Comparative Study Curr Probl Dermatol. 1978; 7:58-68.
33. Gannu, R. et al. Development of nitrendipine transdermal patches: In vitro and ex vivo characterization. Curr. Drug Deliv., 2007; Jan; 4(1):69-76
34. Mcauley, W.J. et al. The effects of esterified solvents on the diffusion of a model compound across human skin: An ATR-FTIR spectroscopic study. Int. J. Pharm., 2013; Apr 15; 447(1-2):1-6
35. Caspers, P.J. et al. In vitro and in vivo Raman spectroscopy of human skin. Biospectroscopy, 1998; 4(5 Suppl):S31-9.
36. Ashtikar, M. et al. Non-invasive depth profile imaging of the stratum corneum using confocal Raman microscopy: First insights into the method. Eur. J. Pharm. Sci., 2013; 50(5), p.601-608
37. Franzen, L. et al. Quantitative detection of caffeine in human skin by confocal Raman spectroscopy - A systematic in vitro validation study. Eur. J. Pharm. Biopharm., 2015; Sep;95(Pt A):110-6
38. Nair, A. et al. Basic considerations in the dermatokinetics of topical formulations. Braz. J. Pharm. Sci., 2013; v.49, n.3, p.423-434
39. Zorin, S. et al. In vitro test of nicotine's permeability through human skin. Risk evaluation and safety aspects. Ann. Occup. Hyg., 1999; Aug 43(6):405-13.
40. Heard, C.M. et al. In vitro transdermal delivery of caffeine, theobromine, theophylline and catechin from extract of guarana, Paullinia Cupana. Int. J. Pharm., 2006; Jul 6;317(1):26-31.
41. Chen, L.; Han, L.; Lian, G. Recent advances in predicting skin permeability of hydrophilic solutes. Adv. Drug Deliv. Rev., 2013; Feb 9;65(2):295-305
42. Delgado-Charro, M.B.; Guy, R.H. Effective use of transdermal drug delivery in children. Adv. Drug Deliv. Rev., 2014; Jun;73:63-82
43. Ruela A.L.M. et al. Evaluation of skin absorption of drugs from topical and transdermal formulations. Braz. J. Pharm. Sci. 2016; Jul/Sep vol.52 no.3
44. Патент SU 1077089 С, 15.11.1994.
45. Патент SU 1112606 А1, 27.04.1982.
46. Патент SU 1218521 А1, 1980.
47. Патент SU 1522485 С, 15.11.1994.
48. Патент SU 944191С, 15.08.1994.
49. Патент RU 2104702 С1, 20.02.1998.
50. Патент CN 1557465A, 2004. https://patents.google.com/patent/CN1557465A/en
51. Retser E. et al. Doxycycline-Induced Expression of Transgenic Human Tumor Necrosis Factor α in Adult Mice Results in Psoriasis-like Arthritis, Arthritis & Rheumatism, 2013; Sep;65(9):2290-300
52. Laemmli, U.K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature, 1970; 227(5259), 680-685.
53. Рабинович В.А., Хавин З.Я. Краткий химический справочник. Ленинград, "Химия", 1991.
54. Varga, G. et al. Active MAC-1 (CD11b/CD18) on DCs inhibits full T-cell activation. Blood, 2007; 109:661-669.
55. Справочник по электротехническим материалам. Под ред. Ю.В. Корицкого и др. Том 1 (3-е изд., 1986) https://studizba.com/files/show/djvu/3147-1-spravochnik-po-elektrotehnicheskim.html
56. Bocharov, G. et al. Feedback regulation of proliferation vs. differentiation rates explains the dependence of CD4 T-cell expansion on precursor number. Proc Natl Acad Sci USA. 2011; Feb 22;108(8):3318-23.
| название | год | авторы | номер документа |
|---|---|---|---|
| Пептидный толерогенный компаунд | 2021 |
|
RU2766340C1 |
| Способ оценки эффективности терапии in vitro и in vivo в мышиной экспериментальной модели имиквимод-индуцированного псориазоподобного дерматита | 2023 |
|
RU2829630C1 |
| МОДИФИЦИРОВАННЫЕ УГЛЕВОДАМИ ЧАСТИЦЫ И ПОРОШКООБРАЗНЫЕ КОМПОЗИЦИИ ДЛЯ МОДУЛЯЦИИ ИММУННОГО ОТВЕТА | 2016 |
|
RU2752620C2 |
| ВНУТРИКЛЕТОЧНАЯ ДОСТАВКА БИОЛОГИЧЕСКИХ МОЛЕКУЛ ДЛЯ ИНДУЦИРОВАНИЯ ТОЛЕРАНТНОСТИ | 2017 |
|
RU2770492C2 |
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА ПРОТИВ IL-21 ЧЕЛОВЕКА | 2008 |
|
RU2504552C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЛЕКАРСТВЕННОГО ПРЕПАРАТА ИММУНОМОДУЛЯТОРА ДЛЯ ЛЕЧЕНИЯ ТЯЖЕЛЫХ ФОРМ ГНОЙНО-СЕПТИЧЕСКИХ И АУТОИММУННЫХ ЗАБОЛЕВАНИЙ | 2012 |
|
RU2491944C1 |
| ЧАСТИЦЫ, КОНЪЮГИРОВАННЫЕ С ПЕПТИДОМ | 2014 |
|
RU2685186C2 |
| КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ПРОБИОТИЧЕСКИЕ БАКТЕРИИ ИЛИ ИХ КОМПОНЕНТЫ, И СПОСОБ ЕЕ ПРИМЕНЕНИЯ В ЛЕЧЕНИИ ИММУННЫХ ЗАБОЛЕВАНИЙ КОЖИ | 2017 |
|
RU2699540C2 |
| ВНУТРИКЛЕТОЧНАЯ ДОСТАВКА БИОМОЛЕКУЛ ДЛЯ ИНДУКЦИИ ТОЛЕРАНТНОСТИ | 2017 |
|
RU2747878C2 |
| ПРОБИОТИЧЕСКИЙ ШТАММ Bifidobacterium longum, ПРОБИОТИЧЕСКАЯ КОМПОЗИЦИЯ И ПРИМЕНЕНИЯ ШТАММА Bifidobacterium longum | 2008 |
|
RU2466185C2 |






Группа изобретений относится к области биотехнологии и раскрывает способ получения противовоспалительного препарата на основе пептидов селезенки млекопитающих, предусматривающий последовательное проведение следующих этапов: смешивания измельченной до состояния фарша селезенки млекопитающего с 0,1%-ным раствором хлористого цинка в соотношении 2 массовых частей раствора на 1 массовую часть фарша, фиксации крупномолекулярной фракции путем закисления полученного гомогената при интенсивном перемешивании до значения рН 3,0±0,2 с помощью 5 М раствора соляной кислоты, экстракции пептидов доведением рН гомогената до значения рН 8,0±0,2 с помощью 5 М раствора гидроксида натрия, получения осветленного экстракта с помощью замораживания-экссудации или проточного центрифугирования, преципитации крупномолекулярного балласта путем добавления в экстракт 5 М раствора серной кислоты до значения рН 2,5±0,2 с отсечкой балласта при помощи нутч-фильтра и получения кислого фильтрата, преципитации сульфата путем нейтрализации фильтрата 30%-ной водной взвесью гидроксида кальция до значения рН 7,4±0,2 с отсечкой балласта при помощи нутч-фильтра и получением нейтрального фильтрата, преципитации остаточного балласта и частичного обессоливания путем внесения в фильтрат расчетного объема 96%-ного этанола до 40 мас.% с отсечкой остаточного белково-солевого осадка при помощи нутч-фильтра и получения композиции накожного водно-спиртового лосьона системного противовоспалительного действия, содержащего фракцию очищенных пептидов селезенки млекопитающих с молекулярной массой не более 12 кДа в концентрации 1÷5 мас.% к общей массе композиции, 96%-ный этанол в количестве 40 мас.%, хлористый натрий в количестве 0-0,5 мас.%, хлористый цинк в количестве 0-0,05 мас.%, сульфат кальция в количестве 0-0,2 мас.%, вода – остальное, при рН 7.4±0.2. Также группа изобретений относится к противовоспалительному препарату на основе пептидов селезенки млекопитающих в форме композиции накожного водно-спиртового лосьона системного противовоспалительного действия. Техническим результатом группы изобретений является достижение противовоспалительного терапевтического эффекта на фоне перманентной принудительной суперэкспрессии наиболее мощного провоспалительного цитокина; более эффективная стимуляция незрелых (naïve) моноцитов к выработке Treg; достижение системного противовоспалительного терапевтического действия при использовании препарата в форме водно-спиртового лосьона при нанесении его на кожу; предупреждение развития псориатического и ревматоидного артрита с эффективностью около 70%; возможность достижения толерогенного противовоспалительного терапевтического эффекта в пригодной для возможности внебольничного индивидуального применения форме; возможность достижения системного толерогенного противовоспалительного терапевтического действия без проявления нежелательных побочных эффектов. 2 н. и 4 з.п. ф-лы, 2 табл., 10 ил., 8 пр.
1. Способ получения противовоспалительного препарата на основе пептидов селезенки млекопитающих, предусматривающий последовательное проведение следующих этапов:
смешивания измельченной до состояния фарша селезенки млекопитающего с 0,1%-ным раствором хлористого цинка в соотношении 2 массовых частей раствора на 1 массовую часть фарша,
фиксации крупномолекулярной фракции путем закисления полученного гомогената при интенсивном перемешивании до значения рН 3,0±0,2 с помощью 5 М раствора соляной кислоты,
экстракции пептидов доведением рН гомогената до значения рН 8,0±0,2 с помощью 5 М раствора гидроксида натрия,
получения осветленного экстракта с помощью замораживания-экссудации или проточного центрифугирования,
преципитации крупномолекулярного балласта путем добавления в экстракт 5 М раствора серной кислоты до значения рН 2,5±0,2 с отсечкой балласта при помощи нутч-фильтра и получения кислого фильтрата,
преципитации сульфата путем нейтрализации фильтрата 30%-ной водной взвесью гидроксида кальция до значения рН 7,4±0,2 с отсечкой балласта при помощи нутч-фильтра и получением нейтрального фильтрата,
преципитации остаточного балласта и частичного обессоливания путем внесения в фильтрат расчетного объема 96%-ного этанола до 40 мас.% с отсечкой остаточного белково-солевого осадка при помощи нутч-фильтра и получения композиции накожного водно-спиртового лосьона системного противовоспалительного действия, содержащего фракцию очищенных пептидов селезенки млекопитающих с молекулярной массой не более 12 кДа в концентрации 1÷5 мас.% к общей массе композиции, 96%-ный этанол в количестве 40 мас.%, хлористый натрий в количестве 0-0,5 мас.%, хлористый цинк в количестве 0-0,05 мас.%, сульфат кальция в количестве 0-0,2 мас.%, вода – остальное, при рН 7,4±0,2.
2. Способ по п.1, отличающийся тем, что определение границы отсечки молекулярной массы пептидов осуществляют с помощью вытеснительной хроматографии и с помощью SDS-электрофореза в градиентном полиакриламидном геле.
3. Способ по любому из пп. 1, 2, отличающийся тем, что для получения препарата используют селезенку КРС или свиньи.
4. Противовоспалительный препарат на основе пептидов селезенки млекопитающих в форме композиции накожного водно-спиртового лосьона системного противовоспалительного действия, полученный способом по любому из пп. 1-3.
5. Противовоспалительный препарат по п. 4, отличающийся тем, что препарат нормализует баланс воспалительных и противовоспалительных реакций, который определяют по нормализации in vivo уровня цитокинов ФНО-альфа, IL-1-бета и IL-2.
6. Противовоспалительный препарат по любому из пп. 4, 5, отличающийся тем, что препарат предупреждает развитие псориатического артрита или ревматоидного артрита.
| ПЕПТИДСОДЕРЖАЩАЯ ФРАКЦИЯ ИЗ СЕЛЕЗЕНКИ МЛЕКОПИТАЮЩИХ, ОБЛАДАЮЩАЯ ИММУНОСТИМУЛИРУЮЩЕЙ АКТИВНОСТЬЮ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 1993 |
|
RU2033796C1 |
| Способ получения стимулятора из селезенки млекопитающих | 1983 |
|
SU1158201A1 |
| СПОСОБ КОМПЛЕКСНОГО ЛЕЧЕНИЯ МАСТИТА У ЛАКТИРУЮЩИХ КОРОВ | 2013 |
|
RU2519349C1 |
| CN 104352521 A, 18.02.2015. | |||
Авторы
Даты
2023-02-14—Публикация
2021-12-21—Подача