ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к области биотехнологии и, более конкретно, к набору праймеров, реагенту, коммерческому набору для выявления метилирования конкретных областей генов, связанных с колоректальным раком у человека, в кале, крови или ткани с применением специфической ПЦР, а также к применению коммерческого набора, которые подходят для осуществления выявления в геноме человека с целью выявления, происходит ли метилирование в конкретных областях генов, связанных с колоректальным раком и предраковой аденомой.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Колоректальный рак, также известный как распространенная аденома, является известной злокачественной опухолью пищеварительной системы. Текущие результаты исследований позволяют предположить, что частота возникновения колоректального рака связана не только с генетическими факторами, которые свидетельствуют об очевидной тенденции семейного наследования, но также связана с влиянием различных факторов внешней среды. Эпителиальные клетки колоректальной слизистой оболочки сначала претерпевают генетические и эпигенетические изменения под сочетанным действием ряда факторов, приобретая способность к злокачественной пролиферации, инвазии, инфильтрации и метастазированию, затем формируют локальные опухолевидные образования и, наконец, формируют метастазы в лимфатических узлах и других тканях и органах. В последние годы было показано, что в стране автора настоящего изобретения с повышением уровня жизни людей, изменениями в рационе питания и привычках, увеличением продолжительности жизни и тенденцией к старению населения заболеваемость колоректальным раком и смертность от него имеют линейную тенденцию к росту, а возраст начала заболевания имеет прогрессирующую тенденцию. Согласно "2015 China Cancer Statistics", опубликованной в "CA: A Cancer Journal for Clinicians", колоректальный рак занимает пятое место по заболеваемости раком у мужчин и четвертое у женщин, а также колоректальный рак занимает пятое место по смертности от рака как у мужчин, так и у женщин. Хотя современные хирургические способы и способы адъювантного лечения постоянно совершенствуются, послеоперационная выживаемость пациентов с колоректальным раком значительно улучшилась, все же уровень общей выживаемости пациентов в пределах пятилетнего периода времени все еще не является оптимальным, что в основном обусловлено тем, что уровень выживаемости тесно связан со стадией развития опухоли у пациентов с колоректальным раком, - выживаемость пациентов с ранней стадией колоректального рака после операции в пределах 5-летнего периода времени превышает 90%, однако у большинства пациентов появление симптомов или обнаружение заболевания происходит, когда опухоль уже развилась до средней или поздней стадии. Поскольку 93% случаев колоректального рака возникают на фоне аденом, большинство из них не имеют характерных симптомов на ранней стадии, а для перехода от аденом к раку требуется от 3 до 17 лет, что обеспечивает временную основу для раннего скрининга. Следовательно, для улучшения уровня общей выживаемости пациентов важными аспектами являются скрининг населения с высоким риском развития колоректального рака, раннее выявление и диагностика пациентов с колоректальным раком и раннее лечение пациентов с колоректальным раком.
Существующие способы скрининга колоректального рака и распространенной аденомы в основном делятся на две категории: анализ кала и структурное исследование толстой кишки. Анализ кала включает анализ кала на скрытую кровь (FOBT) и анализ ДНК в образцах стула (sDNA). Структурное исследование толстой кишки включает гибкую сигмоидоскопию (FSIG), колоноскопию (CS), двойную контрастную бариевую клизму (DCBE) и колоноскопию с помощью компьютерной томографии (CTC). FOBT представляет собой простой и быстрый способ скрининга колоректального рака и типов распространенной аденомы и используется для выявления следов гемоглобина в образцах кала. FOBT прост, недорог и неинвазивен, и его можно применять для крупномасштабных скрининговых исследований. Однако на результаты FOBT могут оказывать влияние многие факторы. Положительные результаты могут быть выявлены только при разрывах и кровотечениях опухоли, в то время как кровотечение полипов или раковой ткани зачастую бывает прерывистым и его следы могут не содержаться ни в одном образце кала. Следовательно, FOBT характеризуется низкой специфичностью и может привести к получению ошибочного медицинского заключения об отсутствии заболевания. FSIG представляет собой способ прямого исследования дистального отдела толстой кишки с применением эндоскопических методик. Операция относительно проста, требования к подготовке кишечника относительно низкие, и не требуется седация во время операции, а очаги поражения можно подвергать биопсии и лечению, что делает FSIG относительно недорогим, простым и безопасным способом скрининга. Тем не менее, участок обследования при FSIG ограничен дистальным отделом толстой кишки (ограниченным селезеночным изгибом), и если колоноскопию проводить после обнаружения с помощью FSIG опухолей в дистальных отделах ободочной и прямой кишки, можно пропустить 72,0% опухолей в проксимальных отделах ободочной и прямой кишки. Колоноскопия (CS) в настоящее время является золотым стандартом диагностики и лечения колоректального рака и типов распространенной аденомы и позволяет провести полное обследование всей толстой кишки, биопсию и удаление обнаруженных полипов. Хотя CS обладает преимуществами, состоящими в хорошем лечебном эффекте и высокой точности, она также обладает определенными недостатками: (1) CS является инвазивным способом исследования с более высоким риском возникновения осложнений, которые могут привести к перфорации толстой кишки (0,3%) или даже смерти (1/5000); (2) является времязатратной, требует надлежащей подготовки кишечника и седации перед исследованием; (3) является дорой, стоимость будет выше, если потребуется биопсия и удаление полипов; (4) при колоноскопии частота ошибочного медицинского заключения об отсутствии колоректального рака и распространенной аденомы составляет 5%. CTC представляет собой неинвазивную процедуру, при которой томографическое исследование проводят при толщине среза сканирования 1-2 мм, для выявления очагов поражения кишечника на 2-мерных и 3-мерных изображениях. CTC обладает преимуществами, состоящими в скорости, точности и низкой сложности, а обеспечиваемая ею эффективность скрининга больших полипов, колоректального рака и распространенной аденомы близка к эффективности CS. Тем не менее, в качестве стандартного способа скрининга CTC обладает очевидными слабыми местами: для получения удовлетворительного изображения при CTC все же необходимо выпустить 2-4 рад рентгеновских лучей в брюшную полость пациента во время обследования, что увеличивает риск развития рака; обычно введение в просвет кишки воздуха или углекислого газа для расширения кишечного тракта вызывает у пациента некоторый дискомфорт при обследовании; кроме того, высокая стоимость обследования накладывает тяжелое экономическое бремя как на отдельных лиц, так и на общество.
Генетическое тестирование отслоившихся клеток в образцах стула (sDNA) в настоящее время является наиболее передовой технологией для скрининга колоректального рака и распространенной аденомы. Это неинвазивный способ скрининга. По сравнению с нормальной слизистой оболочкой толстой кишки скорость метаболизма в клетках колоректального рака и распространенной аденомы была значительно увеличена, и соответственно увеличилось количество отслоившихся клеток. Посредством количественного анализа ДНК в отслоившихся клетках в кале можно эффективно осуществлять скрининг некоторых типов колоректального рака и распространенной аденомы. Такой способ обычно включает два типа тестов: первый тип представляет собой выявление отслоившихся клеток в кале с помощью цитологических исследований, то есть стандартное патологоанатомическое исследование отслоившихся эпителиальных клеток кишечника в кале с целью обнаружения опухолевых клеток с целью осуществления четкой диагностики опухолей кишечника. Второй тип представляет собой выявление ДНК отслоившихся клеток в кале, поскольку исследования показали, что мутировавшие гены в отслоившихся опухолевых клетках в кале пациента в значительной степени совпадают с мутировавшими генами в самой опухолевой ткани. Если ген данного типа может быть выявлен в опухолевых отслоившихся клетках из кала, также можно подтвердить диагноз кишечных опухолей. Такой способ обладает высокой специфичностью, и положительный результат, по сути, может подтвердить наличие очагов поражения. Для подвергаемой скринингу популяции нет необходимости менять пищевые привычки или ограничивать употребление лекарственных средств.
Ген PRDM12 (белок 12, содержащий домен гомологии PRDI-BF1 и RIZ) расположен в хромосоме 9 человека, 9q34.12 (chr9: 130664594-130682997, hg38), и принадлежит к семейству регуляторов транскрипции, содержащих белковые домены PR и SET (семейство доменов PR/SET). Белок, кодируемый PRDM12, содержит N-концевые домены гомологии (PR) PRDI-BF1 и RIZ, один домен SET и три ДНК-связывающих домена с цинковыми пальцами C2H2 на С-конце. Отечественные и зарубежные исследования показали, что PRDM12 является важным регулятором транскрипции, контролирующим дифференцировку и образование нейронов, и ассоциирован с частотой возникновения солидных опухолей и гемобластозов. В настоящее время стране авторов настоящего изобретения и в других странах нет публикаций результатов исследований связи между степенью метилирования конкретных областей гена PRDM12 и онкогенезом, а также нет публикаций результатов исследований коммерческого набора для количественного выявления, предназначенного для количественного выявления степени метилирования PRDM12.
Ген FOXE1 (Forkhead Box E1) расположен в хромосоме 9 человека, 9q22.33 (chr9: 97853254-97856715, hg38), является членом семейства факторов транскрипции forkhead (семейства Forkhead) и содержит домен forkhead, который характерен для всех генов данного семейства (домен Forkhead). Данный домен состоит из более чем 100 аминокислот, которые могут распознавать конкретные последовательности геномной ДНК и связываться с ними. Предыдущие исследования показали, что FOXE1 является важным транскрипционным фактором и транскрипционным фактором семейства forkhead, специфичным для щитовидной железы, который необходим для морфогенеза и дифференцировки щитовидной железы, а также участвует в индуцируемой гормонами щитовидной железы регуляции транскрипции. FOXE1 напрямую связан с частотой возникновения рака щитовидной железы, рака поджелудочной железы и плоскоклеточной карциномы кожи. Также сообщалось о гиперметилировании гена FOXE1 при плоскоклеточной карциноме кожи и раке молочной железы. Хотя роль FOXE1 при колоректальном раке до сих пор до конца не изучена, последние исследования показали, что аномально высокое метилирование гена FOXE1 обуславливает низкую экспрессию гена, что связано с метастазированием колоректального рака и прогнозом у пациента, и его используют в качестве потенциального биомаркера для выявления колоректального рака (биомаркер). Хотя в вышеуказанных исследованиях есть сообщения о выявлении метилирования в конкретных областях гена FOXE1, в стране авторов настоящего изобретения и в других странах нет публикаций о коммерческих наборах для количественного выявления метилирования в конкретных областях гена FOXE1.
Ген B3GAT2 (бета-1,3-глюкуронилтрансферазы 2) расположен в хромосоме 6 человека, 6q13 (chr6: 70856679-70957189, hg38), является членом семейства глюкуронилтрансфераз и кодирует трансмембранный белок. Основная функция гена B3GAT2 заключается в катализе переноса бета-1,3-связанной глюкуроновой кислоты на концевую галактозильную группу остатков Gal-Beta-1-4 GLcNAc или Gal-Beta-1-3 GLcNAc, содержащихся в различных гликопротеинах или гликолипидах. Предыдущие исследования показали, что B3GAT2 участвует в синтезе эпитопов углеводной цепи HNK-1, что связано с распознаванием, адгезией и миграцией клеток в нервной системе и оказывает регулирующее влияние на рост и развитие нервной системы, регенерацию нейронов и синаптическую пластичность. В настоящее время в стране авторов настоящего изобретения и в других странах нет публикаций результатов исследований взаимосвязи между геном B3GAT2 и онкогенезом. Лишь в одном исследовании было обнаружено, что метилирование конкретной области гена B3GAT2 связано с частотой возникновением пищевода Барретта, что применяют в качестве биомаркера для диагностики данного заболевания. Хотя пищевод Барретта может привести к развитию рака пищевода, риск перерождения в рак очень низок. В настоящее время в стране авторов настоящего изобретения и в других странах нет публикаций о коммерческом наборе для количественного выявления степени метилирования конкретных областей гена B3GAT2.
Ген виментина расположен на хромосоме 10, 10P13 (chr10: 17229548-17229607), и принадлежит к семейству генов волокнистых белков, представляющих собой промежуточные филаменты типа III. Ген виментина является членом семейства волокнистых белков, представляющих собой промежуточные филаменты, и во многих отношениях характеризуется сложными паттернами генной экспрессии, и в основном экспрессируется в эмбриональных тканях и зрелых клетках, происходящих из мезенхимальной ткани. Все больше и больше исследований свидетельствуют о том, что экспрессия виментина не является специфическим биомаркером для клеток мезенхимального происхождения и опухолевых клеток мезенхимальной дифференцировки. Было обнаружено, что кератин и виментин совместно экспрессируются при раке молочной железы, гепатоцеллюлярной карциноме, раке предстательной железы, раке эндометрия, раке желудка, раке пищевода, раке толстой кишки, раке легкого и других злокачественных опухолях эпителиального происхождения и тесно связаны с сильной инвазивностью и хорошей способностью раковых клеток к перемещению. Другое исследование подтвердило, что подавление виментина, которое ассоциировано с образованием опухолей и предраковых очагов поражения (таких как аденомы), может быть тесно связано с метилированием его промотора. Это свидетельствует о том, что метилирование ДНК может обеспечивать подавление экспрессии виментина на уровне транскрипции гена, что оказывает стимулирующее действие на миграцию опухолевых клеток. Chen и соавторы показали, что уровни метилирования виментина в тканях колоректального рака на ранней стадии и распространенной аденомы без метастазов и при колоректальном раке на поздней стадии и распространенной аденоме эквивалентны. Другие исследования показали, что метилирование конкретных областей гена виментина не ассоциировано с размером опухоли и стадией по системе Дьюка. Все это иллюстрирует важность выявления метилирования в конкретных областях гена виментина для ранней диагностики колоректального рака и распространенной аденомы.
Ген SFRP2 расположен на хромосоме 4q31.3 (chr4: 153789388-153789447), и кодируемый белок SFRP2 содержит характерную богатую цистеином область. Многие исследования показали, что гиперметилирование гена SFRP2 может привести к его сайленсингу в ряде опухолей. Ген SFRP2 содержит два интрона и три экзона. Вокруг первого экзона гена SFRP2 имеется высокая плотность островков CpG. Такой островок CpG тесно связан с гиперметилированием ДНК в опухолевых клетках. В последние годы многие исследования показали, что гиперметилирование гена SFRP2 связано с частотой возникновения колоректального рака. Многочисленные исследования продемонстрировали, что степень метилирования SFRP2 является наиболее чувствительным маркером для диагностики колоректального рака. Следовательно, в качестве одной из основ для скрининга колоректального рака можно применять выявление метилирования в конкретных областях гена SFRP2 из отслоившихся клеток в кале.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В свете вышеописанной проблемы в существующей технологии первой целью настоящего изобретения является создание набора праймеров для выявления метилирования конкретных областей генов, связанных с колоректальным раком у человека. Набор праймеров содержит набор праймеров для участков метилирования любого гена, выбранного из группы, состоящей из PRDM12, FOXE1, B3GAT2, виментина, SFRP2-1 и SFRP2-2 или любой комбинации таких генов.
Необязательно, набор праймеров для выявления для гена PRDM12 предусматривает набор из специфических праймеров и зонда, имеющих следующие последовательности:
прямой праймер: 5'-GTTAGATTAGAAGTATAAAATGTG-3'(SEQ ID NO: 1), называемый праймером 1;
обратный праймер: 5'-ATCCCATTCCTCTCCTCC-3' (SEQ ID NO: 2), называемый праймером 2; и
зонд для выявления: 5'-AGCGCGGTGGAGATTTG-3' (SEQ ID NO: 3), называемый зондом 1.
Необязательно, набор праймеров для выявления для гена FOXE1 предусматривает набор из специфических праймеров и зонда, имеющих следующие последовательности:
прямой праймер: 5'- CGAGTttAAGtttTTGGtAGAGG -3' (SEQ ID NO: 4), называемый праймером 3;
обратный праймер: 5'- CCGATCGACTaAaaCCCGa -3' (SEQ ID NO: 5), называемый праймером 4; и
зонд для выявления: 5'- tCGAGTTCGGGCGtTGAGG -3' (SEQ ID NO: 6), называемый зондом 2.
Необязательно, набор праймеров для выявления для гена B3GAT2 предусматривает набор из специфических праймеров и зонда, имеющих следующие последовательности:
прямой праймер: 5'- TtCGtCGGGTtTGGCG -3' (SEQ ID NO: 7), называемый праймером 5;
обратный праймер: 5'- CAaaAaaTCGTaCAaCCCCG -3' (SEQ ID NO: 8), называемый праймером 6; и
зонд для выявления: 5'- tCGCGAGtAAGtTCGGGAG -3' (SEQ ID NO: 9), называемый зондом 3.
Необязательно, набор праймеров для выявления для гена виментина предусматривает набор из специфических праймеров и зонда, имеющих следующие последовательности:
прямой праймер: 5'- GtCGtAGttTtTACGttTCGT -3' (SEQ ID NO: 10), называемый праймером 7;
обратный праймер: 5'- aaCGCACGaCAaAaaAaCG -3' (SEQ ID NO: 11), называемый праймером 8; и
зонд для выявления: 5'- ttCGGGCGGCGTGTATG -3' (SEQ ID NO: 12), называемый зондом 4.
Необязательно, набор праймеров для выявления для гена SFRP2-1 предусматривает набор из специфических праймеров и зонда, имеющих следующие последовательности:
прямой праймер: 5'- CGGAtTGGGGtAAAAtAAGttC -3' (SEQ ID NO: 13), называемый праймером 9;
обратный праймер: 5'- CTaaCGaaAACGCGCCTA -3' (SEQ ID NO: 14), называемый праймером 10; и
зонд для выявления: 5'- TAGGCGCGTTttCGttAGTAttTGG -3' (SEQ ID NO: 15), называемый зондом 5.
Необязательно, набор праймеров для выявления для гена SFRP2-2 предусматривает набор из специфических праймеров и зонда, имеющих следующие последовательности:
прямой праймер: 5'- AATGtAGtCGGCGCG -3' (SEQ ID NO: 16), называемый праймером 11;
обратный праймер: 5'- CCTTaTTaaaAaTTCAAaaAaCCCG -3' (SEQ ID NO: 17), называемый праймером 12; и
зонд для выявления: 5'- AGttAtTTtCGGGCGTGCGGt -3' (SEQ ID NO: 18), называемый зондом 6.
Необязательно, набор праймеров дополнительно содержит набор праймеров для гена внутреннего стандарта ACTB. Набор праймеров для гена внутреннего стандарта ACTB предусматривает набор из специфических праймеров и зонда, имеющих следующие последовательности:
прямой праймер: 5'- GTGATGGAGGAGGTTTAGTAAG -3' (SEQ ID NO: 19), называемый праймером 13;
обратный праймер: 5'- CAATAAAACCTACTCCTCCCTT -3' (SEQ ID NO: 20), называемый праймером 14; и
зонд для выявления: 5'- TGTGTTTGTTATTGTGTGTTGGGTGGT -3' (SEQ ID NO: 21), называемый зондом 7.
Необязательно, флуоресцентная репортерная группа на 5'-конце зонда для выявления предусматривает: ALEX-350, FAM, VIC, TET, CAL Fluor Gold 540, JOE, HEX, CAL Flour Orange 560, TAMRA, Cal Fluor Red 590, ROX, CAL Fluor 20 Red 610, TEXAS RED, CAL Flour Red 635, Quasar 670, Cy3, Cy5, Cy5.5 или Quasar 705. Группа для гашения на 3'-конце зонда для выявления предусматривает: TAMRA, BHQ1, BHQ2 и MGB.
Другой целью настоящего изобретения является обеспечение реагента для выявления метилирования конкретных областей генов, связанных с колоректальным раком у человека. Реагент содержит шесть систем для ПЦР, а именно: смесь-A для ПЦР для CRC, смесь-B для ПЦР для CRC, смесь-C для ПЦР для CRC, смесь-D для ПЦР для CRC, смесь-E для ПЦР для CRC и смесь-F для ПЦР для CRC соответственно. Каждая система для ПЦР предусматривает набор из специфических праймеров и зонда для метилирования конкретных областей соответствующего гена, как описано выше, и набор из специфических праймеров и зонда для описанного выше гена внутреннего стандарта. Система для ПЦР А содержит прямой праймер (праймер 1) для гена PRDM12, обратный праймер (праймер 2) для гена PRDM12 и зонд для выявления (зонд 1) для гена PRDM12. Система для ПЦР B содержит прямой праймер (праймер 3) для гена FOXE1, обратный праймер (праймер 4) для гена FOXE1 и зонд для выявления (зонд 2) для гена FOXE1. Система для ПЦР C содержит прямой праймер (праймер 5) для гена B3GAT2, обратный праймер (праймер 6) для гена B3GAT2 и зонд для выявления (зонд 3) для гена B3GAT2. Система для ПЦР D содержит прямой праймер (праймер 7) для гена виментина, обратный праймер (праймер 8) для гена виментина и зонд для выявления (зонд 4) для гена виментина. Система для ПЦР E содержит прямой праймер (праймер 9) для гена SFRP2-1, обратный праймер (праймер 10) для гена SFRP2-1 и зонд для выявления (зонд 5) для гена SFRP2-1. Система для ПЦР F содержит прямой праймер (праймер 11) для гена SFRP2-2, обратный праймер (праймер 12) для гена SFRP2-2 и зонд для выявления (зонд 6) для гена SFRP2-2.
Необязательно, каждая из шести систем для ПЦР, а именно смесь-A для ПЦР для CRC, смесь-B для ПЦР для CRC, смесь-C для ПЦР для CRC, смесь-D для ПЦР для CRC, смесь-E для ПЦР для CRC и смесь-F для ПЦР для CRC, дополнительно содержит универсальные ингредиенты, в том числе буфер для ПЦР, dNTP и MgCl2.
Необязательно, ген внутреннего стандарта представляет собой конститутивный ген человека, то есть ген ACTB. Праймеры и зонд гена внутреннего стандарта применяют для контроля качества каждого образца и его амплификации в каждой реакционной системе, что позволяет избежать ложноотрицательного результата или частично заглушенного результата.
Необязательно, в шести ПЦР-системах, а именно смеси-A для ПЦР для CRC, смеси-B для ПЦР для CRC, смеси-C для ПЦР для CRC, смеси-D для ПЦР для CRC, смеси-E для ПЦР для CRC и смеси-F для ПЦР для CRC, каждая реакционная система имеет конечный объем от 20 мкл до 40 мкл; концентрации праймеров в каждой реакционной системе являются следующими: прямой праймер имеет концентрацию от 0,3 мкМ до 0,8 мкМ, обратный праймер имеет концентрацию от 0,3 мкМ до 0,8 мкМ, и зонд имеет концентрацию от 0,1 мкМ до 0,3 мкМ; и конечные концентрации универсальных ингредиентов каждой из шести систем для ПЦР являются следующими: конечные концентрации dATP, dTTP, dCTP и dGTP в dNTP составляют от 0,1 мМ до 0,3 мМ, а конечная концентрация MgCl2 составляет от 1 мМ до 2 мМ.
Еще одной целью настоящего изобретения является создание коммерческого набора для выявления метилирования конкретных областей генов, связанных с колоректальным раком у человека. Коммерческий набор содержит любую из шести систем для ПЦР или любую их комбинацию; от 0,5 до 2 единиц taq-полимеразы для ПЦР с горячим стартом, положительный контроль, отрицательный контроль и холостой контроль. Положительный контроль представляет собой смесь гена внутреннего стандарта ACTB и фрагментов метилированной плазмидной ДНК PRDM12, FOXE1, B3GAT2, виментина, SFRP2-1 и SFRP2-2 или представляет собой положительный контроль в виде метилированной цельногеномной ДНК человека. Отрицательный контроль представляет собой смесь гена внутреннего стандарта ACTB и фрагментов неметилированной плазмидной ДНК PRDM12, FOXE1, B3GAT2, виментина, SFRP2-1 и SFRP2-2 или представляет собой отрицательный контроль в виде неметилированной цельногеномной ДНК человека. Холостой контроль представляет собой буфер на основе Tris-EDTA или воду без нуклеаз c рН, составляющим 8,5 ± 0,1.
Еще одной целью настоящего изобретения является создание способа применения коммерческого набора для выявления метилирования конкретных областей генов, связанных с колоректальным раком у человека. ДНК выделяют непосредственно из кала, крови или тканей человека и конвертируют ДНК путем обработки бисульфитом, полученную конвертированную ДНК применяют в качестве матрицы, которую амплифицируют с помощью ПЦР, а накопление сигналов с зонда для выявления применяют для осуществления выявления в режиме реального времени метилирования конкретных областей генов, связанных с колоректальным раком у человека, т. е. генов PRDM12, FOXE1, B3GAT2, виментина, SFRP2-1 и SFRP2-2. При этом в качестве гена внутреннего стандарта применяли ген ACTB. Способ предусматривает следующие конкретные экспериментальные стадии ПЦР:
стадия 1: сбор образцов кала, крови или тканей у определенного количества пациентов с колоректальным раком и пациентов с распространенной аденомой;
стадия 2: выделение геномной ДНК человека из образцов кала, крови или тканей подлежащих тестированию пациентов;
стадия 3: конвертирование полученной выделенной геномной ДНК человека с помощью бисульфита и применение полученной конвертированной ДНК в качестве матрицы для ПЦР;
стадия 4: объединение 29,7 мкл × (n+1) смеси для ПЦР и 0,3 мкл × (n+1) смешанного раствора taq-полимеразы для ПЦР с горячим стартом из коммерческого набора для выявления, равномерное перемешивание в течение 20 с и немедленное центрифугирование в течение 10 с; где n представляет собой количество подлежащих тестированию образцов;
стадия 5: распределение полученного центрифугированного раствора в пробирки для ПЦР, таким образом, чтобы каждая пробирка для ПЦР содержала 30 мкл полученного центрифугированного раствора, затем добавление 10 мкл конвертированной ДНК-матрицы, в отношении которой выполняют выявление, где общий объем составляет 40 мкл;
стадия 6: проведение реакции амплификации, где процедура реакции является следующей:
стадия 7: определение результатов ПЦР, при котором во время выявления в образце исходный уровень определяют путем получения сигналов флуоресценции циклов 3-15; порог устанавливают путем проведения линии порога, превышающей наиболее высокую точку кривой амплификации нормального отрицательного контроля, для которой значение Ct не поддается выявлению; решение о том, является результат для образца положительным или отрицательным принимают на основе зарегистрированных значений Ct, то есть на основе номера цикла, при осуществлении которого флуоресцентный сигнал в каждой реакционной пробирке достигает установленного порога.
При использовании вышеуказанных технических решений преимущества настоящего изобретения резюмируются следующим образом.
1. Настоящее изобретение позволяет идентифицировать метилирование конкретных областей новых генов в качестве онкомаркера для колоректального рака человека, который можно применять в качестве средства раннего скрининга и вспомогательного средства для выявления больных.
2. В коммерческом наборе по настоящему изобретению выбраны подходящие области целевых генов и сконструированы высокоспецифичные праймеры и зонд.
3. Коммерческий набор по настоящему изобретению может предусматривать непосредственное применение кала для выделения ДНК, такой способ отбора образцов является неинвазивным и обеспечивает значительное уменьшение болевых ощущений у пациента.
4. В настоящем изобретении впервые раскрыт коммерческий набор для выявления метилирования генов PRDM12, FOXE1, B3GAT2, виментина, SFRP2-1 и SFRP2-2, связанных с колоректальным раком и распространенной аденомой, и применение данного коммерческого набора. Коммерческий набор для выявления включает прямые праймеры, обратные праймеры и соответствующие флуоресцентные зонды для специфичной в отношении метилирования амплификации генов PRDM12, FOXE1, B3GAT2, виментина, SFRP2-1 и SFRP2-2. Уровни метилирования генов PRDM12, FOXE1, B3GAT2, виментина, SFRP2-1 и SFRP2-2 приводят к низкой экспрессии генов PRDM12, FOXE1, B3GAT2, виментина, SFRP2-1 и SFRP2-2 у пациентов с колоректальным раком и пациентов с распространенной аденомой, так что клетки колоректального рака и клетки распространенной аденомы обладают более сильной инвазивной способностью. Следовательно, статус метилирования генов PRDM12, FOXE1, B3GAT2, виментина, SFRP2-1 и SFRP2-2 можно применять в качестве молекулярных биомаркеров для оценки злокачественности и прогноза колоректального рака и распространенной аденомы. Диагностические коммерческие наборы, основанные на выявлении уровней метилирования генов PRDM12, FOXE1, B3GAT2, виментина, SFRP2-1 и SFRP2-2, связанных с колоректальным раком и распространенной аденомой, позволяют легко и быстро выявлять колоректальный рак и распространенную аденому на молекулярном уровне с тем, чтобы судить о злокачественности и прогнозе колоректального рака и распространенной аденомы. Диагностический коммерческий набор по настоящему изобретению обладает высокой эффективностью выявления, высокой специфичностью и преимуществами, состоящими в точности, надежности, гибкости, быстроте и низкой стоимости, что обеспечивает благоприятный эффект в отношении раннего выявления и своевременного лечения колоректального рака и распространенной аденомы.
5. В отличие от общепринятой для скрининга колоректального рака и распространенной аденомы колоноскопии, а также стандартного анализа кала на скрытую кровь, в коммерческом наборе, представленном в настоящем изобретении, для скрининга колоректального рака и распространенной аденомы применяется способ специфичной к метилированию ПЦР с выявлением в ДНК отслоившихся клеток в кале. Коммерческий набор, представленный в настоящем изобретении, обладает следующими преимуществами:
1) является полностью неинвазивным: необходимо всего 2-5 г образца кала, что вполне приемлемо для населения, у которого отсутствуют симптомы;
2) высокая точность: коммерческий набор позволяет выявлять колоректальный рак и распространенную аденому в абсолютном большинстве случаев, а также в большинстве случаев предраковую аденому в доклинических исследованиях, позволяет выявлять колоректальный рак на ранней стадии в 96,3% случаев и предраковые аденомы (≥1 см) в 85,8% случаев, при этом специфичность составляет 100%;
3) позволяет осуществлять одновременное выявление опухолей в левой и правой частях толстой кишки, что уменьшает слепую зону выявления и позволяет избежать ошибочного медицинского заключения об их отсутствии;
4) позволяет обнаружить не только колоректальный рак и распространенную аденому, но и предраковую аденому, что дает возможность предотвратить колоректальный рак и распространенную аденому путем удаления предраковой аденомы; и
5) простота в эксплуатации: после получения коммерческого тестового набора пользователь может осуществить сбор образцов дома, а затем отправить собранные образцы экспресс-почтой для тестирования специалистам.
6. В данном способе применяют метод флуоресцентной ПЦР в режиме реального времени (ПЦР в режиме реального времени), который разработан на основе стандартной технологии полимеразной цепной реакции. В процессе осуществления амплификации в стандартной полимеразной цепной реакции для количественного определения применяют флуоресцентные красители или выявление посредством электрофореза, тогда как применение способа с использованием зонда по настоящему изобретению обеспечивает более высокую точность, более высокую чувствительность и более высокую производительность данной технологии, и при этом отпадает необходимость в таких операциях, как электрофорез или гибридизация после ПЦР, обеспечивая таким образом уменьшение уровня загрязнения и количества ошибок при реализации.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Прилагаемые графические материалы, описанные в данном документе, используются для обеспечения дополнительного понимания настоящего изобретения и составляют часть настоящего изобретения. Иллюстративные варианты осуществления настоящего изобретения и их описания используются для пояснения настоящего изобретения и не представляют собой ограничение настоящего изобретения. На графических материалах:
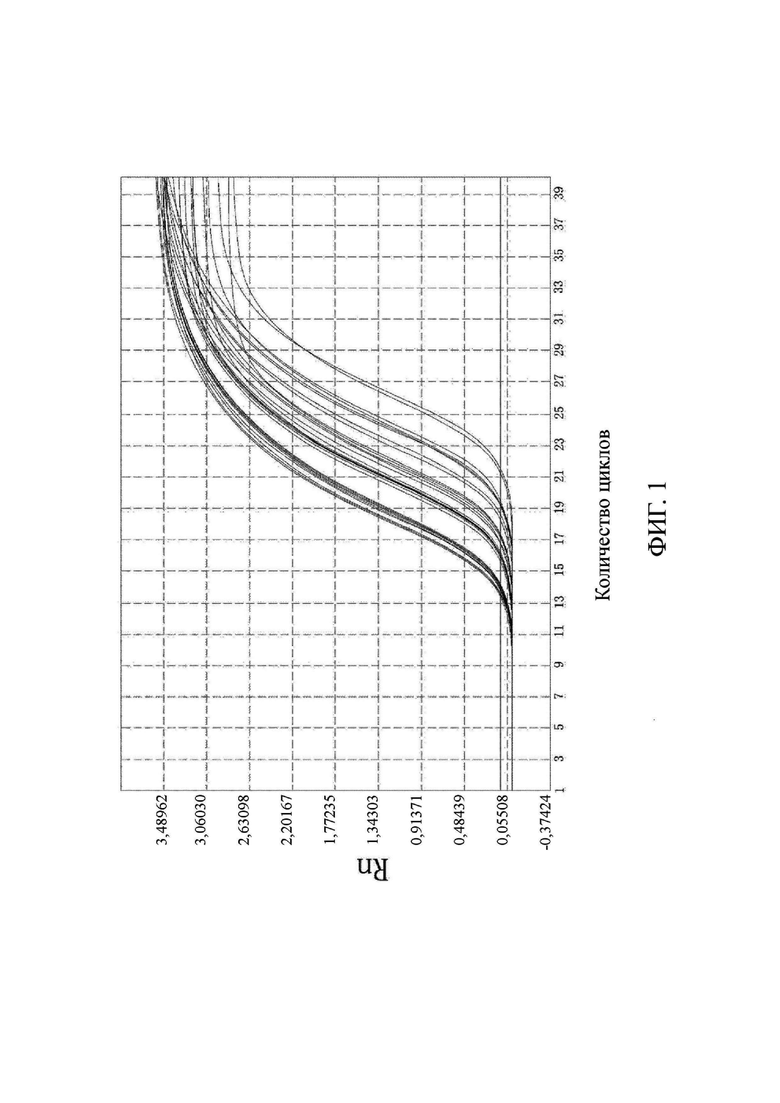
на фиг. 1 показаны результаты выявления метилирования гена PRDM12;
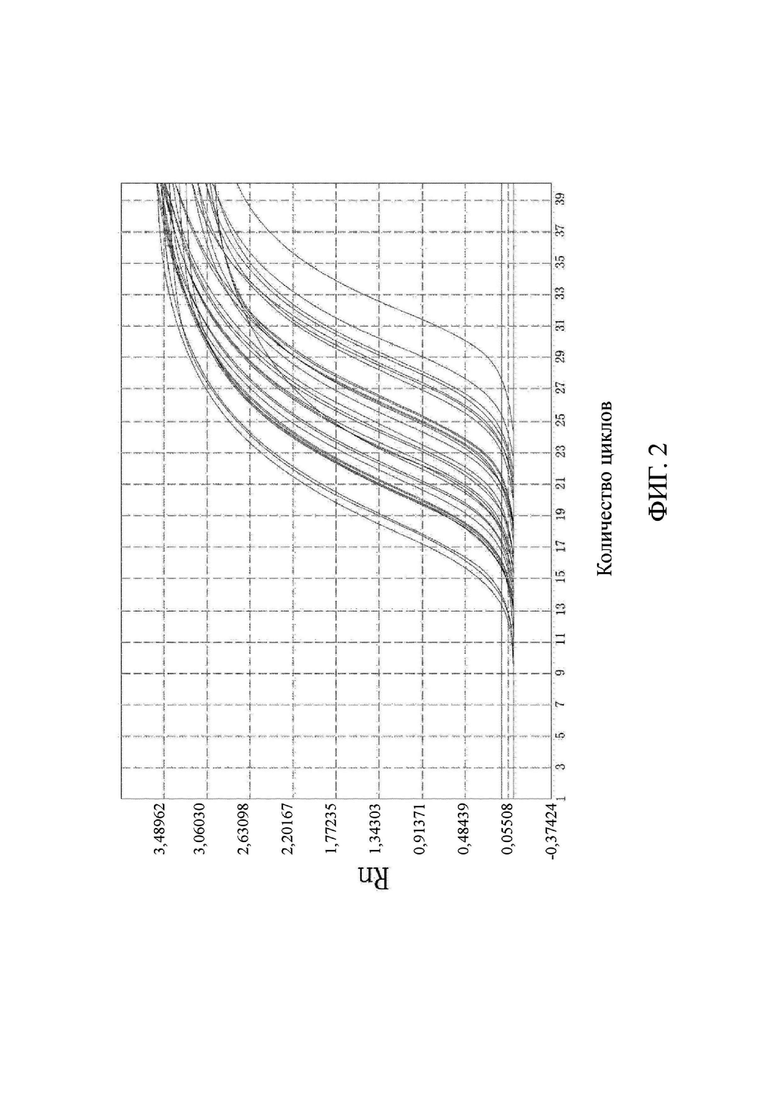
на фиг. 2 показаны результаты выявления метилирования гена FOXE1;
на фиг. 3 показаны результаты выявления метилирования гена B3GAT2;
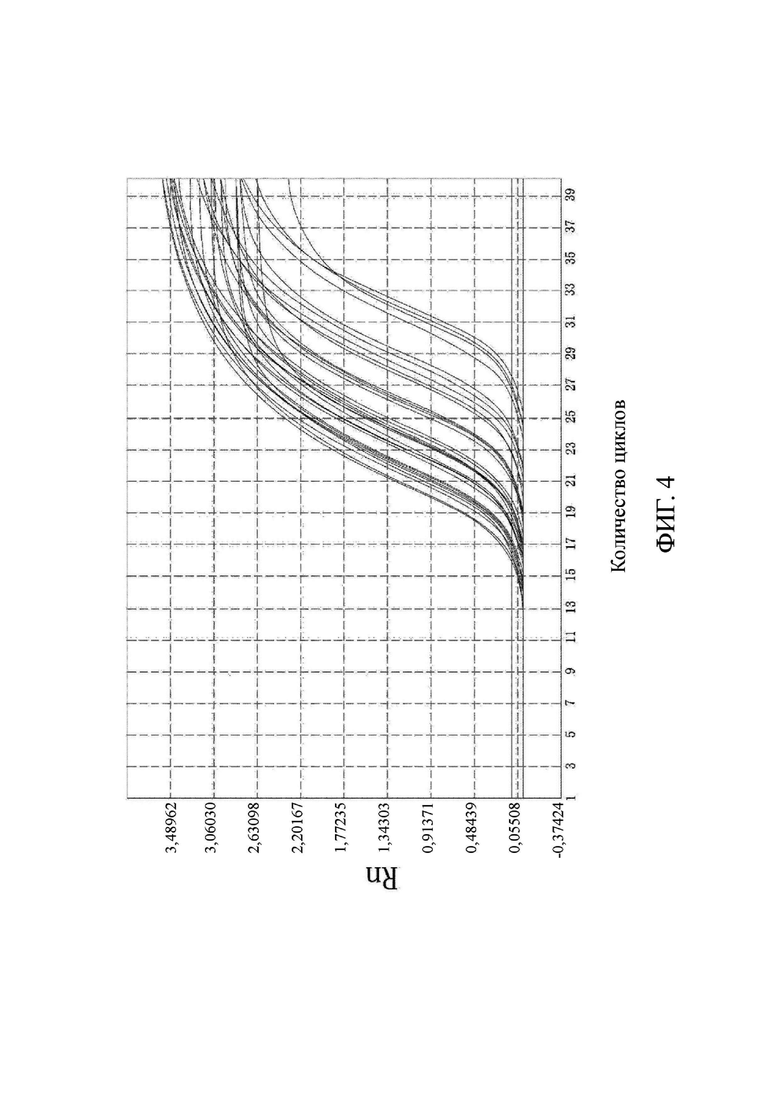
на фиг. 4 показаны результаты выявления метилирования гена виментина;
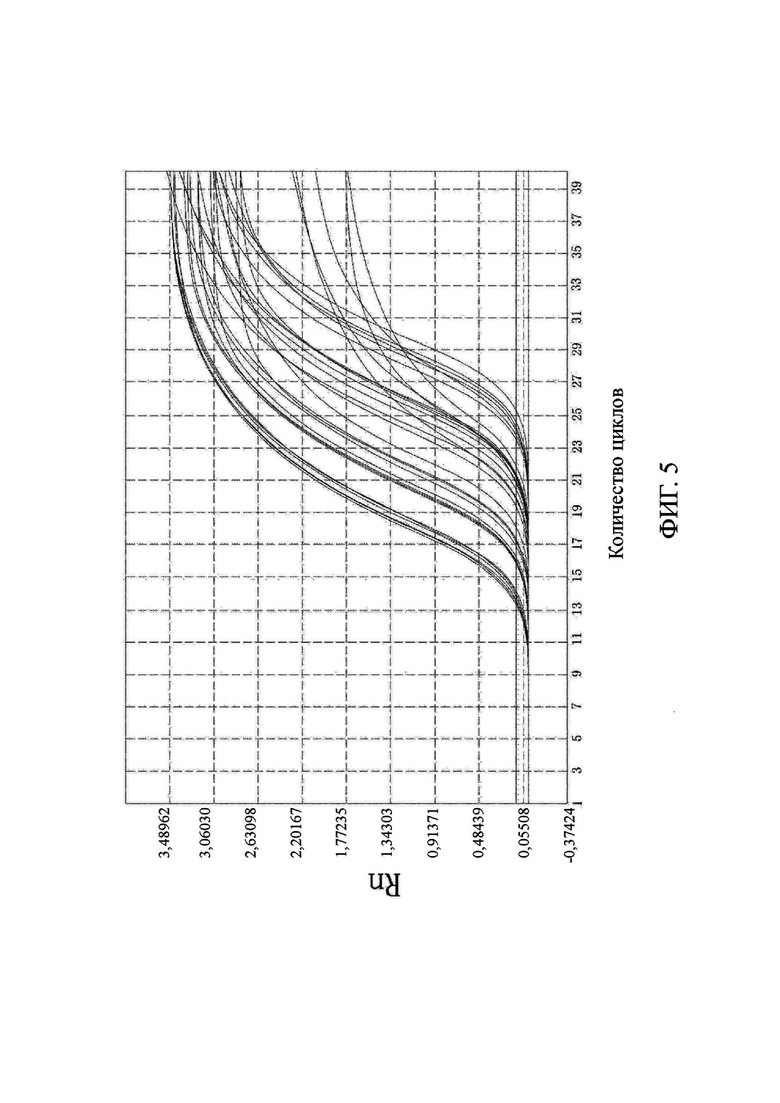
на фиг. 5 показаны результаты выявления метилирования гена SFRP2-1; и
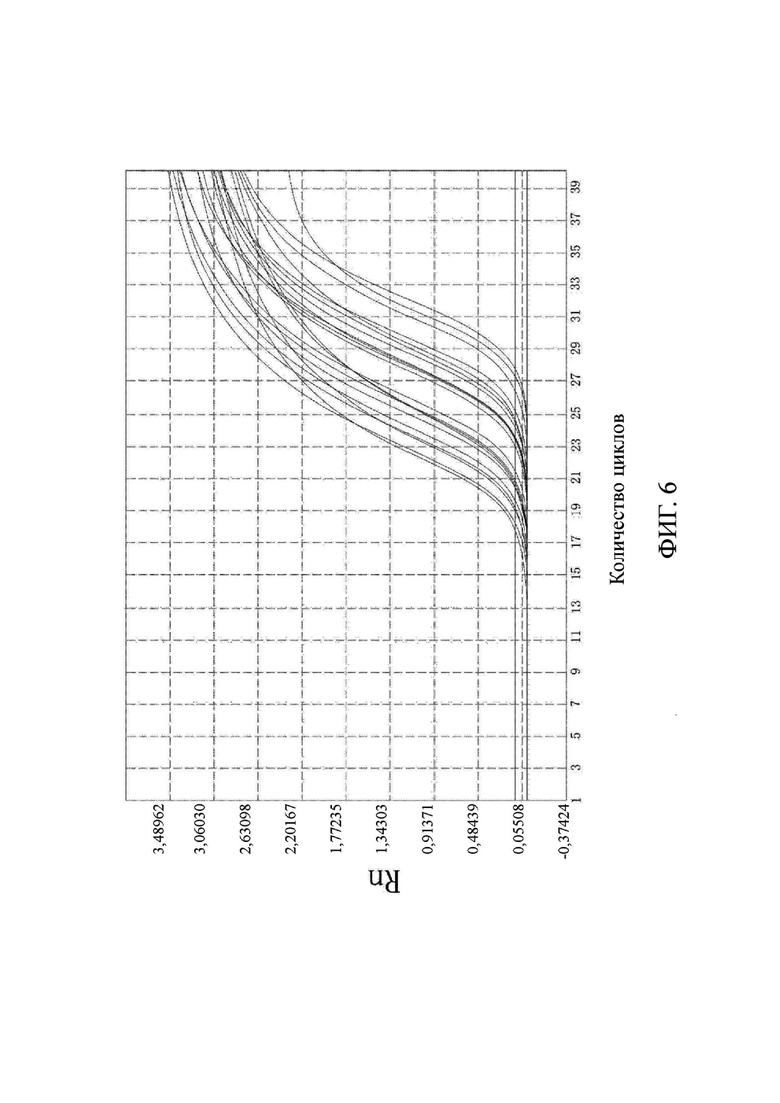
на фиг. 6 показаны результаты выявления метилирования гена SFRP2-2.
ПОДРОБНОЕ ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Для решения технической задачи, прояснения и понимания технических решений и полезных эффектов настоящего изобретения настоящее изобретения будет дополнительно подробно описано ниже со ссылкой на прилагаемые графические материалы и варианты осуществления. Следует понимать, что конкретные варианты осуществления, описанные в данном документе, используются лишь для пояснения настоящего изобретения, а не для ограничения настоящего изобретения.
Что касается фиг. 1-6, на них показаны результаты выявления метилирования соответствующих генов (канал FAM).
Ниже настоящее изобретение описано более подробно со ссылкой на варианты осуществления.
1. Сбор образцов у объектов исследования
В данном исследовании образцы были получены хирургическим путем от 31 пациента с колоректальным раком в Шанхайской больнице Чанхай, которые были выбраны в качестве объектов исследования. Во всех случаях диагноз был поставлен на основании полученных от пациентов клинических данных, результатов визуализации, колоноскопии и т. д. и подтвержден посредством диагностики с использованием морфологического анализа материала, полученного в результате хирургического вмешательства. Полученные хирургическим путем ткани колоректального рака и ткани, расположенные рядом с ними (нормальная ткань слизистой оболочки ободочной и прямой кишки на расстоянии ≥5 см от раковой ткани), подвергали мгновенной заморозке в жидком азоте и хранили в холодильнике при температуре -80 градусов. Собирали соответствующее количество раковой ткани и ткани, расположенной рядом с ней, и из них выделяли геномную ДНК.
В данном исследовании в качестве объектов исследования был выбран 31 пациент с колоректальным раком из Шанхайской больницы Чанхай и образцы кала соответствующих пациентов. В рассматриваемых случаях диагноз был поставлен на основании клинических данных, результатов визуализации, колоноскопии и морфологического анализа материала, полученного в результате хирургического вмешательства, у пациентов. Собранные образцы кала хранили в пробирке для сбора, содержащей раствор для сохранения ДНК в кале, и помещали в холодильник при температуре -20 градусов. Для выделения геномной ДНК собирали соответствующее количество каждого образца кала.
2. Выделение геномной ДНК
Образцы тканей выделяли из раковых тканей и тканей, расположенных рядом с ними, с применением набора QIAamp DNA Mini Kit Tissue, коммерческого набора для выделения цельногеномной ДНК (Qiagen, Германия). Образцы кала получали с применением набора QIAamp DNA feces Mini Kit, коммерческого набора для выделения геномной ДНК из кала. Для последующего выявления метилирования конкретных областей генов с помощью ПЦР определяли концентрацию и качество геномной ДНК на микроспектрофотометре NanoDrop2000 (Thermo Fisher Scientific, США). Конкретные стадии выделения проводили в соответствии с инструкциями по эксплуатации коммерческого набора для выделения.
3. Выбор контрольных групп
Положительный контроль представлял собой смесь гена внутреннего стандарта ACTB и фрагментов метилированной плазмидной ДНК PRDM12, FOXE1, B3GAT2, виментина, SFRP2-1 и SFRP2-2 или представлял собой положительный контроль в виде метилированной цельногеномной ДНК человека. Отрицательный контроль представлял собой смесь гена внутреннего стандарта ACTB и фрагментов неметилированной плазмидной ДНК PRDM12, FOXE1, B3GAT2, виментина, SFRP2-1 и SFRP2-2, или представлял собой отрицательный контроль в виде неметилированной цельногеномной ДНК человека, или представлял собой отрицательный контроль в виде неметилированной цельногеномной ДНК человека. Холостой контроль представлял собой буфер на основе Tris-EDTA или воду без нуклеаз.
4. Бисульфитная конверсия ДНК
Геномную ДНК, полученную из кала, крови или тканей, обрабатывали с помощью коммерческого набора для бисульфитной конверсии ДНК ZYMO EZ DNA Methylation Gold Kit (ZYMO Company, США) согласно инструкциям, при этом обработка по сути включала три стадии - сульфонирование, гидролиз и дезаминирование, обеспечивающие конверсию неметилированного цитозина (C) в урацил (U), тогда как метилированный цитозин (5mC) не подвергался конверсии. Геномную ДНК тестируемого образца после конвертирования с помощью бисульфита применяли в качестве матрицы для выявления метилирования посредством ПЦР. Положительный контроль и отрицательный контроль представляли собой генетически сконструированные плазмиды.
5. Разработка и синтез праймеров и зондов
Для разработки специфических праймеров и зондов к конкретным сайтам метилирования генов PRDM12, FOXE1, B3GAT2, виментина, SFRP2-1, SFRP2-2 в геноме человека и гена внутреннего стандарта ACTB (см. последовательность всего генома человека, опубликованную в базе данных NCBI) применяли программное обеспечение Premier 3.0 и BeaconDesigner. Праймеры и зонды были синтезированы компанией Sangon Bioengineering Co., Ltd. (Шанхай).
В рамках настоящего изобретения одновременно были разработаны и проверены несколько наборов комбинаций последовательностей праймеров и зондов для последовательностей метилированных нуклеиновых кислот фрагментов целевых генов PRDM12, FOXE1, B3GAT2, виментина, SFRP2-1 и SFRP2-2, связанных с колоректальным раком и распространенной аденомой. После повторных экспериментов по оптимизации были оптимизированы представленные далее последовательности (таблица 1) наборов праймеров и зондов для выявления метилирования фрагментов генов PRDM12, FOXE1, B3GAT2, виментина, SFRP2-1 и SFRP2-2. Последовательности наборов специфических праймеров и зондов представлены в таблице 1.
6. Компоненты системы для ПЦР-реакции
Система для ПЦР-реакции содержит вышеупомянутые специфические праймеры, которые можно разделить на 6 реакционных систем (A/B/C/D/E/F), среди которых:
система для ПЦР А содержит прямой праймер (праймер 1) для гена PRDM12, обратный праймер (праймер 2) для гена PRDM12 и зонд для выявления (зонд 1) для гена PRDM12. система для ПЦР B содержит прямой праймер (праймер 3) для гена FOXE1, обратный праймер (праймер 4) для гена FOXE1 и зонд для выявления (зонд 2) для гена FOXE1. система для ПЦР C содержит прямой праймер (праймер 5) для гена B3GAT2, обратный праймер (праймер 6) для гена B3GAT2 и зонд для выявления (зонд 3) для гена B3GAT2. система для ПЦР D содержит прямой праймер (праймер 7) для гена виментина, обратный праймер (праймер 8) для гена виментина и зонд для выявления (зонд 4) для гена виментина. система для ПЦР E содержит прямой праймер (праймер 9) для гена SFRP2-1, обратный праймер (праймер 10) для гена SFRP2-1 и зонд для выявления (зонд 5) для гена SFRP2-1. система для ПЦР F содержит прямой праймер (праймер 11) для гена SFRP2-2, обратный праймер (праймер 12) для гена SFRP2-2 и зонд для выявления (зонд 6) для гена SFRP2-2. Система для ПЦР-реакции дополнительно содержит прямой праймер (праймер 13) для гена внутреннего стандарта ACTB, обратный праймер (праймер 14) для гена внутреннего стандарта ACTB, зонд для выявления (зонд 7) для ACTB, буфер для ПЦР, dNTP, taq-полимеразу для ПЦР с горячим стартом и MgCl2.
Конвертированную ДНК вносили в каждую систему для ПЦР-реакции, и конечная концентрация каждого компонента показана в таблице 2.
7. Применение коммерческого набора, которое включало следующие стадии.
(1) Получали подлежащие тестированию образцы, при этом для настоящего изобретения были применимы все образцы - кала, крови или тканей. Из образцов кала, крови или тканей выделяли геномную ДНК и конвертировали с помощью бисульфита, а конвертированную ДНК применяли в качестве матрицы для ПЦР-реакций.
(2) Из коммерческого набора извлекали реагент для ПЦР-реакции, уравновешивали до комнатной температуры, 29,7 мкл × (n+1), раствор для ПЦР-реакции и смесь ферментов 0,3 мкл × (n+1) равномерно перемешивали в течение 20 с и немедленно центрифугировали; где n представляет собой количество протестированных образцов; выполняли немедленное центрифугирование.
(3) Полученный в результате центрифугирования раствор распределяли по пробиркам для ПЦР, по 30 мкл полученного в результате центрифугирования раствора на пробирку.
(4) С помощью микропипетки 10 мкл раствора матричной ДНК (подлежащей тестированию конвертированной ДНК или конвертированного отрицательного/положительного/холостого контроля) вносили в каждую пробирку для ПЦР до получения 40 мкл конечного объема каждой реакционной смеси. Пробирку немедленно закрывали крышкой, содержимое пробирки перемешивали до однородного состояния, подвергали кратковременному центрифугированию и переносили пробирку для ПЦР в амплификатор для флуоресцентной количественной ПЦР в режиме реального времени.
(5) В приборе для флуоресцентной количественной ПЦР в режиме реального времени программу амплификации устанавливали на непрерывное осуществление амплификации посредством ПЦР и получение и анализ флуоресцентного сигнала в режиме реального времени в процессе амплификации. Настройки программы реакции показаны в таблице 3.
(6) Определение результатов ПЦР
Во время выявления в образце исходный уровень определяли путем получения сигналов флуоресценции циклов 3-15; порог устанавливали путем проведения линии порога, превышающей наиболее высокую точку кривой амплификации нормального отрицательного контроля, для которой значение Ct не поддавалось выявлению; присвоение образцу положительного или отрицательного результата осуществляли на основе зарегистрированных значений Ct, то есть на основе номера цикла, при осуществлении которого флуоресцентный сигнал в каждой реакционной пробирке достигал установленного порога.
Выводы. (1) Для 31 положительного образа были получены кривые амплификации в соответствующих лунках выявления канала FAM, и результаты выявления являлись положительными, что согласовалось с результатами диагностики с использованием морфологического анализа. В 10 отрицательных образцах только канал ROX контроля для гена внутреннего стандарта имел кривую амплификации, а все результаты выявления целевого гена в канале FAM были отрицательными, что согласовалось с результатами диагностики с использованием морфологического анализа. Это свидетельствовало о том, что результаты выявления, полученные с помощью коммерческого набора, представленного в настоящем изобретении, характеризовались чрезвычайно высокой специфичностью и надежностью. Значения Ct показаны в подробном описании результатов выявления для каждого образца из настоящей заявки в таблице 3.
По результатам флуоресцентной количественной ПЦР в образцах видно, что гены PRDM12, FOXE1, B3GAT2, виментина, SFRP2-1 и SFRP2-2 характеризовались высоким уровнем амплификации в образцах колоректального рака и распространенной аденомы, в то время как уровень амплификации в нормальных образцах был чрезвычайно низким. Следовательно, было доказано, что коммерческий набор по настоящему изобретению позволяет быстро и точно выявлять мутантные гены и нормальные гены в отслоившихся клетках в кале пациента с колоректальным раком и пациента с распространенной аденомой. Можно видеть, что коммерческий набор по настоящему изобретению позволяет не только быстро и эффективно получить результаты, но и интерпретация результатов является очень ясной и интуитивно понятной, а сами результаты являются надежными и специфичными.
12
12
ний стандарт)
ний стандарт)
ний стандарт)
2
ний стандарт)
ний стандарт)
ин
ний стандарт)
ний стандарт)
2-1
ний стандарт)
2-1
ний стандарт)
2-2
2-2
ний стандарт)
2-2
В вышеприведенном описании проиллюстрированы и описаны предпочтительные варианты осуществления настоящего изобретения, и, как указано ранее, следует понимать, что настоящее изобретение не ограничено формой, раскрытой в данном документе, или не должно истолковываться как исключающее другие варианты осуществления, но может применяться в ряде других комбинаций, модификаций и условий. Можно понять, что настоящее изобретение можно подвергнуть модификации в пределах объема описанных в данном документе идей настоящего изобретения на основе вышеизложенного раскрытия и опыта или сведений в соответствующих областях техники. Тем не менее, модификации и изменения, производимые специалистами в данной области техники, не должны выходить за пределы сути и объема настоящего изобретения, и все они должны охватываться объемом охраны прилагаемой формулы настоящего изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ определения метилирования сайтов PuCGPy регуляторных областей генов-онкомаркеров колоректального рака методом GLAD-ПЦР-анализа и набор олигонуклеотидных праймеров и флуоресцентно-меченых зондов для осуществления указанного способа | 2016 |
|
RU2630669C1 |
| ОПУХОЛЕВЫЙ МАРКЕР, РЕАГЕНТ ДЛЯ ВЫЯВЛЕНИЯ МЕТИЛИРОВАНИЯ, НАБОР И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2770928C1 |
| ОПУХОЛЕВЫЙ МАРКЕР, РЕАГЕНТ ДЛЯ ВЫЯВЛЕНИЯ МЕТИЛИРОВАНИЯ, НАБОР И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2775177C1 |
| СОСТАВ, НАБОР И ПРИМЕНЕНИЕ ДЛЯ ВЫЯВЛЕНИЯ КОЛОРЕКТАЛЬНОГО РАКА | 2021 |
|
RU2836003C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ МЕТИЛИРОВАНИЯ САЙТОВ PuCGPy РЕГУЛЯТОРНЫХ ОБЛАСТЕЙ ГЕНОВ-ОНКОМАРКЕРОВ КОЛОРЕКТАЛЬНОГО РАКА МЕТОДОМ GLAD-ПЦР-АНАЛИЗА И ОЛИГОНУКЛЕОТИДНЫЕ ПРАЙМЕРЫ И ФЛУОРЕСЦЕНТНО-МЕЧЕНЫЕ ЗОНДЫ ДЛЯ ОСУЩЕСТВЛЕНИЯ УКАЗАННОГО СПОСОБА | 2015 |
|
RU2596404C1 |
| РЕАГЕНТ ДЛЯ ВЫЯВЛЕНИЯ, НАБОР ДЛЯ ВЫЯВЛЕНИЯ И СПОСОБ ВЫЯВЛЕНИЯ МЕТИЛИРОВАНИЯ ГЕНА ITGA4 | 2017 |
|
RU2739071C1 |
| НАБОР ДЛЯ СКРИНИНГА НА РАК ПРЯМОЙ И ОБОДОЧНОЙ КИШКИ И ПРОГРЕССИРУЮЩЕЙ АДЕНОМЫ И ЕГО ПРИМЕНЕНИЕ | 2019 |
|
RU2812023C2 |
| СПОСОБ IN VITRO ДИАГНОСТИКИ ИЛИ ПРОГНОЗИРОВАНИЯ КОЛОРЕКТАЛЬНОГО РАКА ИЛИ ЕГО ПРЕДРАКОВОЙ СТАДИИ | 2020 |
|
RU2831090C2 |
| РЕАГЕНТ ДЛЯ ОБНАРУЖЕНИЯ ОПУХОЛЕЙ | 2020 |
|
RU2818527C1 |
| Способ прогнозирования клинического течения нейроэндокринных новообразований толстой кишки | 2021 |
|
RU2771421C1 |

Изобретение относится к биотехнологии. Предложен набор праймеров. Набор содержит последовательности специфических праймеров и зондов для амплификации для метилированных областей конкретных областей генов-маркеров PRDM12, FOXE1 и B3GAT2, обнаруженных в данном исследовании. Группа праймеров и зондов также предусматривает последовательности специфических праймеров и зондов для амплификации метилированной области конкретной области генов виментина, SFRP2-1 и SFRP2-2. Группа специфических праймеров и зонда для амплификации гена внутреннего стандарта ACTBреагент. Предложен реагент для выявления метилирования конкретных областей генов, связанных с колоректальным раком у человека. Предложены набор для выявления метилирования конкретной области гена, связанного с колоректальным раком у человека, в кале, крови или ткани с применением специфической ПЦР и применение набора для выявления метилирования конкретных областей генов, связанных с колоректальным раком у человека. Набор праймеров характеризуется высокой эффективностью выявления и высокой точностью. 4 н. и 3 з.п. ф-лы, 3 табл., 6 ил.
1. Набор праймеров для выявления метилирования конкретных областей генов, связанных с колоректальным раком у человека, где набор праймеров предусматривает
набор праймеров для участков метилирования любого гена, выбранного из группы, состоящей из PRDM12, FOXE1, B3GAT2, виментина, SFRP2-1 и SFRP2-2 или любой комбинации этих генов, где
набор из специфических праймеров и зонда для метилирования гена PRDM12 предусматривает следующие последовательности:
прямой праймер: 5'-GTTAGATTAGAAGTATAAAATGTG-3', называемый праймером 1;
обратный праймер: 5'-ATCCCATTCCTCTCCTCC-3', называемый праймером 2; и
зонд для выявления: 5'-AGCGCGGTGGAGATTTG-3', называемый зондом 1;
набор из специфических праймеров и зонда для метилирования гена FOXE1 предусматривает следующие последовательности:
прямой праймер: 5'-CGAGTttAAGtttTTGGtAGAGG-3', называемый праймером 3;
обратный праймер: 5'-CCGATCGACTaAaaCCCGa-3', называемый праймером 4; и
зонд для выявления: 5'-tCGAGTTCGGGCGtTGAGG-3', называемый зондом 2;
набор из специфических праймеров и зонда для метилирования гена B3GAT2 предусматривает следующие последовательности:
прямой праймер: 5'-TtCGtCGGGTtTGGCG-3', называемый праймером 5;
обратный праймер: 5'-CAaaAaaTCGTaCAaCCCCG-3', называемый праймером 6; и
зонд для выявления: 5'-tCGCGAGtAAGtTCGGGAG-3', называемый зондом 3;
набор из специфических праймеров и зонда для метилирования гена виментина предусматривает следующие последовательности:
прямой праймер: 5'-GtCGtAGttTtTACGttTCGT-3', называемый праймером 7;
обратный праймер: 5'-aaCGCACGaCAaAaaAaCG-3', называемый праймером 8; и
зонд для выявления: 5'-ttCGGGCGGCGTGTATG-3', называемый зондом 4;
набор из специфических праймеров и зонда для метилирования гена SFRP2-1 предусматривает следующие последовательности:
прямой праймер: 5'-CGGAtTGGGGtAAAAtAAGttC-3', называемый праймером 9;
обратный праймер: 5'-CTaaCGaaAACGCGCCTA-3', называемый праймером 10; и
зонд для выявления: 5'-TAGGCGCGTTttCGttAGTAttTGG-3', называемый зондом 5;
набор из специфических праймеров и зонда для метилирования гена SFRP2-2 предусматривает следующие последовательности:
прямой праймер: 5'-AATGtAGtCGGCGCG-3', называемый праймером 11;
обратный праймер: 5'-CCTTaTTaaaAaTTCAAaaAaCCCG-3', называемый праймером 12; и
зонд для выявления: 5'-AGttAtTTtCGGGCGTGCGGt-3', называемый зондом 6.
2. Набор по п. 1, дополнительно содержащий набор праймеров для гена внутреннего стандарта ACTB, где
набор праймеров для гена внутреннего стандарта ACTB предусматривает набор из специфических праймеров и зонда, имеющих следующие последовательности:
прямой праймер: 5'-GTGATGGAGGAGGTTTAGTAAG-3', называемый праймером 13;
обратный праймер: 5'-CAATAAAACCTACTCCTCCCTT-3', называемый праймером 14; и
зонд для выявления: 5'-TGTGTTTGTTATTGTGTGTTGGGTGGT-3', называемый зондом 7.
3. Набор по любому из пп. 1, 2, где
флуоресцентная репортерная группа на 5'-конце зонда для выявления предусматривает: ALEX-350, FAM, VIC, TET, CAL Fluor Gold 540, JOE, HEX, CAL Flour Orange 560, TAMRA, Cal Fluor Red 590, ROX, CAL Fluor 20 Red 610, TEXAS RED, CAL Flour Red 635, Quasar 670, Cy3, Cy5, Cy5.5 или Quasar 705; и
группа для гашения на 3'-конце зонда для выявления предусматривает: TAMRA, BHQ1, BHQ2 и MGB.
4. Реагент для выявления метилирования конкретных областей генов, связанных с колоректальным раком у человека, предусматривающий шесть систем для ПЦР:
смесь-A для ПЦР для CRC, смесь-B для ПЦР для CRC, смесь-C для ПЦР для CRC, смесь-D для ПЦР для CRC, смесь-E для ПЦР для CRC и смесь-F для ПЦР для CRC соответственно, где
каждая система для ПЦР содержит:
набор из специфических праймеров и зонда для метилирования конкретных областей любого из генов PRDM12, FOXE1, B3GAT2, виментина, SFRP2-1 и SFRP2-2;
набор из специфических праймеров и зонда для гена внутреннего стандарта ACTB; и
универсальные ингредиенты, включающие буфер для ПЦР, dNTP и MgCl2;
где
набор из специфических праймеров и зонда для метилирования гена PRDM12 предусматривает следующие последовательности:
прямой праймер: 5'-GTTAGATTAGAAGTATAAAATGTG-3', называемый праймером 1;
обратный праймер: 5'-ATCCCATTCCTCTCCTCC-3', называемый праймером 2; и
зонд для выявления: 5'-AGCGCGGTGGAGATTTG-3', называемый зондом 1;
набор из специфических праймеров и зонда для метилирования гена FOXE1 предусматривает следующие последовательности:
прямой праймер: 5'-CGAGTttAAGtttTTGGtAGAGG-3', называемый праймером 3;
обратный праймер: 5'-CCGATCGACTaAaaCCCGa-3', называемый праймером 4; и
зонд для выявления: 5'-tCGAGTTCGGGCGtTGAGG-3', называемый зондом 2;
набор из специфических праймеров и зонда для метилирования гена B3GAT2 предусматривает следующие последовательности:
прямой праймер: 5'-TtCGtCGGGTtTGGCG-3', называемый праймером 5;
обратный праймер: 5'-CAaaAaaTCGTaCAaCCCCG-3', называемый праймером 6; и
зонд для выявления: 5'-tCGCGAGtAAGtTCGGGAG-3', называемый зондом 3;
набор из специфических праймеров и зонда для метилирования гена виментина предусматривает следующие последовательности:
прямой праймер: 5'-GtCGtAGttTtTACGttTCGT-3', называемый праймером 7;
обратный праймер: 5'-aaCGCACGaCAaAaaAaCG-3', называемый праймером 8; и
зонд для выявления: 5'-ttCGGGCGGCGTGTATG-3', называемый зондом 4;
набор из специфических праймеров и зонда для метилирования гена SFRP2-1 предусматривает следующие последовательности:
прямой праймер: 5'-CGGAtTGGGGtAAAAtAAGttC-3', называемый праймером 9;
обратный праймер: 5'-CTaaCGaaAACGCGCCTA-3', называемый праймером 10; и
зонд для выявления: 5'-TAGGCGCGTTttCGttAGTAttTGG-3', называемый зондом 5;
набор из специфических праймеров и зонда для метилирования гена SFRP2-2 предусматривает следующие последовательности:
прямой праймер: 5'-AATGtAGtCGGCGCG-3', называемый праймером 11;
обратный праймер: 5'-CCTTaTTaaaAaTTCAAaaAaCCCG-3', называемый праймером 12; и
зонд для выявления: 5'-AGttAtTTtCGGGCGTGCGGt-3', называемый зондом 6; и
набор из специфических праймеров и зонда для гена внутреннего стандарта ACTB предусматривает следующие последовательности:
прямой праймер: 5'-GTGATGGAGGAGGTTTAGTAAG-3', называемый праймером 13;
обратный праймер: 5'-CAATAAAACCTACTCCTCCCTT-3', называемый праймером 14; и
зонд для выявления: 5'-TGTGTTTGTTATTGTGTGTTGGGTGGT-3', называемый зондом 7.
5. Реагент по п. 4, где
в шести системах для ПЦР, а именно смеси-A для ПЦР для CRC, смеси-B для ПЦР для CRC, смеси-C для ПЦР для CRC, смеси-D для ПЦР для CRC, смеси-E для ПЦР для CRC и смеси-F для ПЦР для CRC,
каждая реакционная система имеет конечный объем от 20 мкл до 40 мкл;
концентрации праймеров для каждой реакционной системы являются следующими:
прямой праймер имеет концентрацию от 0,3 мкМ до 0,8 мкМ, обратный праймер имеет концентрацию от 0,3 мкМ до 0,8 мкМ, и зонд имеет концентрацию от 0,1 мкМ до 0,3 мкМ; и
конечные концентрации универсальных ингредиентов каждой из шести систем для ПЦР являются следующими:
конечные концентрации dATP, dTTP, dCTP и dGTP в dNTP составляют от 0,1 мМ до 0,3 мМ, а конечная концентрация MgCl2 составляет от 1 мМ до 2 мМ.
6. Набор для выявления метилирования конкретных областей генов, связанных с колоректальным раком у человека, где набор содержит:
любую из шести систем для ПЦР или любую их комбинацию,
от 0,5 ед. до 2 ед. taq-полимеразы для ПЦР с горячим стартом,
положительный контроль,
отрицательный контроль и
холостой контроль,
где
положительный контроль представляет собой смесь гена внутреннего стандарта ACTB и фрагментов метилированной плазмидной ДНК PRDM12, FOXE1, B3GAT2, виментина, SFRP2-1 и SFRP2-2 или представляет собой положительный контроль в виде метилированной цельногеномной ДНК человека;
отрицательный контроль представляет собой смесь гена внутреннего стандарта ACTB и фрагментов неметилированной плазмидной ДНК PRDM12, FOXE1, B3GAT2, виментина, SFRP2-1 и SFRP2-2 или представляет собой отрицательный контроль в виде неметилированной цельногеномной ДНК человека;
холостой контроль представляет собой буфер на основе Tris-EDTA или воду без нуклеаз c рН, составляющим 8,5 ± 0,1;
каждая из шести систем для ПЦР содержит:
набор из специфических праймеров и зонда для метилирования конкретных областей любого из генов PRDM12, FOXE1, B3GAT2, виментина, SFRP2-1 и SFRP2-2;
набор из специфических праймеров и зонда для гена внутреннего стандарта ACTB; и
универсальные ингредиенты, включающие буфер для ПЦР, dNTP и MgCl2;
где
набор из специфических праймеров и зонда для метилирования гена PRDM12 предусматривает следующие последовательности:
прямой праймер: 5'-GTTAGATTAGAAGTATAAAATGTG-3', называемый праймером 1;
обратный праймер: 5'-ATCCCATTCCTCTCCTCC-3', называемый праймером 2; и
зонд для выявления: 5'-AGCGCGGTGGAGATTTG-3', называемый зондом 1;
набор из специфических праймеров и зонда для метилирования гена FOXE1 предусматривает следующие последовательности:
прямой праймер: 5'-CGAGTttAAGtttTTGGtAGAGG-3', называемый праймером 3;
обратный праймер: 5'-CCGATCGACTaAaaCCCGa-3', называемый праймером 4; и
зонд для выявления: 5'-tCGAGTTCGGGCGtTGAGG-3', называемый зондом 2;
набор из специфических праймеров и зонда для метилирования гена B3GAT2 предусматривает следующие последовательности:
прямой праймер: 5'-TtCGtCGGGTtTGGCG-3', называемый праймером 5;
обратный праймер: 5'-CAaaAaaTCGTaCAaCCCCG-3', называемый праймером 6; и
зонд для выявления: 5'-tCGCGAGtAAGtTCGGGAG-3', называемый зондом 3;
набор из специфических праймеров и зонда для метилирования гена виментина предусматривает следующие последовательности:
прямой праймер: 5'-GtCGtAGttTtTACGttTCGT-3', называемый праймером 7;
обратный праймер: 5'-aaCGCACGaCAaAaaAaCG-3', называемый праймером 8; и
зонд для выявления: 5'-ttCGGGCGGCGTGTATG-3', называемый зондом 4;
набор из специфических праймеров и зонда для метилирования гена SFRP2-1 предусматривает следующие последовательности:
прямой праймер: 5'-CGGAtTGGGGtAAAAtAAGttC-3', называемый праймером 9;
обратный праймер: 5'-CTaaCGaaAACGCGCCTA-3', называемый праймером 10; и
зонд для выявления: 5'-TAGGCGCGTTttCGttAGTAttTGG-3', называемый зондом 5;
набор из специфических праймеров и зонда для метилирования гена SFRP2-2 предусматривает следующие последовательности:
прямой праймер: 5'-AATGtAGtCGGCGCG-3', называемый праймером 11;
обратный праймер: 5'-CCTTaTTaaaAaTTCAAaaAaCCCG-3', называемый праймером 12; и
зонд для выявления: 5'-AGttAtTTtCGGGCGTGCGGt-3', называемый зондом 6; и
набор из специфических праймеров и зонда для гена внутреннего стандарта ACTB предусматривает следующие последовательности:
прямой праймер: 5'-GTGATGGAGGAGGTTTAGTAAG-3', называемый праймером 13;
обратный праймер: 5'-CAATAAAACCTACTCCTCCCTT-3', называемый праймером 14; и
зонд для выявления: 5'-TGTGTTTGTTATTGTGTGTTGGGTGGT-3', называемый зондом 7.
7. Способ применения набора для выявления метилирования конкретных областей генов, связанных с колоректальным раком у человека, по п. 6, где
ДНК выделяют непосредственно из кала, крови или тканей человека и конвертируют ДНК путем обработки бисульфитом, полученную конвертированную ДНК применяют в качестве матрицы, которую амплифицируют с помощью ПЦР, а накопление сигналов с зонда для выявления применяют для осуществления выявления в режиме реального времени метилирования конкретных областей генов, связанных с колоректальным раком у человека, т. е. генов PRDM12, FOXE1, B3GAT2, виментина, SFRP2-1 и SFRP2-2,
в то же время в качестве гена внутреннего стандарта применяют ген ACTB; и
способ предусматривает следующие конкретные экспериментальные стадии ПЦР:
стадия 1: сбор образцов кала, крови или тканей у определенного количества пациентов с колоректальным раком и пациентов с распространенной аденомой;
стадия 2: выделение геномной ДНК человека из образцов кала, крови или тканей подлежащих тестированию пациентов;
стадия 3: конвертирование полученной выделенной геномной ДНК человека с помощью бисульфита и применение полученной конвертированной ДНК в качестве матрицы для ПЦР;
стадия 4: объединение 29,7 мкл × (n+1) смеси для ПЦР и 0,3 мкл × (n+1) смешанного раствора taq-полимеразы для ПЦР с горячим стартом из набора для выявления, равномерное перемешивание в течение 20 с и немедленное центрифугирование в течение 10 с; где n представляет собой количество подлежащих тестированию образцов;
стадия 5: распределение полученного центрифугированного раствора в пробирки для ПЦР таким образом, чтобы каждая пробирка для ПЦР содержала 30 мкл полученного центрифугированного раствора, затем добавление 10 мкл конвертированной ДНК-матрицы, в отношении которой выполняют выявление, где общий объем составляет 40 мкл;
стадия 6: проведение реакции амплификации, где процедура реакции является следующей:
стадия 7: определение результатов ПЦР, при котором во время выявления в образце исходный уровень определяют путем получения сигналов флуоресценции циклов 3-15; порог устанавливают путем проведения линии порога, превышающей наиболее высокую точку кривой амплификации нормального отрицательного контроля, для которой значение Ct не поддается выявлению; присвоение образцу положительного или отрицательного результата осуществляют на основе зарегистрированных значений Ct, то есть на основе номера цикла, при осуществлении которого флуоресцентный сигнал в каждой реакционной пробирке достигает установленного порога.
| WO 2011126768 A2, 13.10.2011 | |||
| CN 109486955 A, 19.03.2019 | |||
| WO 2012167145 A2, 06.12.2012 | |||
| CN 109811056 A, 28.05.2019 | |||
| Д | |||
| В | |||
| РЕБРИКОВ и др | |||
| ПЦР в реальном времени, 6-е издание, БИНОМ, лаборатория знаний, Москва, 2015, стр | |||
| Устройство для выпрямления опрокинувшихся на бок и затонувших у берега судов | 1922 |
|
SU85A1 |
| Основы полимеразной цепной реакции, методическое пособие, Москва, 2 января 2019, стр | |||
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
Авторы
Даты
2023-03-03—Публикация
2019-10-22—Подача