Изобретение относится к области медицины, а именно к регенеративной медицине. Оно описывает возможность использования внеклеточных везикул опухолевого происхождения в лечении органной недостаточности, в частности, почечной недостаточности.
Фосфолипидные внеклеточные везикулы (экзовезикулы, ЭВ) секретируются всеми типами клеток. Они присутствуют в супернатантах клеточных культур, а также во всех биологических жидкостях (кровь, лимфа, слюна, грудное молоко, спинномозговая жидкость и т.д.). ЭВ подразделяют на две группы в зависимости от их биогенеза и размера: экзосомы и микровезикулы. Экзосомы образуются в результате почкования эндосомальной мембраны с образованием мультивезикулярных телец. Затем эти тельца сливаются с плазматической мембраной и в виде экзосом высвобождаются во внеклеточное пространство. В отличие от экзосом, микровезикулы возникают в результате прямого выпячивания плазматической мембраны наружу и их последующего отделения от клетки. Размер экзосом составляет от 50 до 150 нм, тогда как размер микровезикул может быть намного больше (50–1000 нм в диаметре). Различить экзосомы и микровезикулы технически сложно из-за перекрывающихся размеров, общих поверхностных белков и отсутствия специфических маркеров (Elsharkasy et al. 2020). Поэтому, в этом изобретении различные типы везикул будут именоваться экзовезикулами.
Твердо установлено, что активация клетки, также как и апоптоз клетки, стимулируют образование и секрецию ЭВ, в которых находятся белки, липиды, ДНК и множество видов РНК. Концентрирование некоторых биомолекул в ЭВ предполагает, что формирование молекулярного груза в ЭВ происходит не случайным образом, а представляет собой организованный процесс (Elsharkasy et al., 2020). Биомолекулы в ЭВ защищены двойным слоем фосфолипидов от быстрой деградации внеклеточными ферментами. Поэтому, ЭВ могут проявлять свою функциональную активность не только в месте своего высвобождения, но и в отдаленных местах. Отрицательно заряженная поверхность ЭВ препятствует их неспецифическому сливанию с клеточными мембранами. Экспрессия иммуноглобулиновой молекулы CD47 на ЭВ позволяет им уклоняться от поглощения фагоцитарными клетками (обзор de Jong et al., 2019). В сравнении с липосомами или полимерными наночастицами ЭВ обладают намного более длительным периодом полужизни в крови. Поверхностные рецепторы, экспрессируемые на ЭВ, определяют направленность и характер их миграции в организме. Например, ЭВ, секретируемые воспалительными иммунными клетками, экспрессируют интегрины и другие адгезивные молекулы, которые обеспечивают их преимущественную миграцию в очаги воспаления (Tang et al., 2019).
В нескольких исследованиях показана способность ЭВ эффективно преодолевать различные биологические барьеры. Например, было показано, что ЭВ способны преодолевать гематоэнцефалический барьер, который является основным препятствием для доставки лекарств в мозг (Chen et. al., 2016).
В силу своего естественного происхождения ЭВ могут вызывать лишь минимальную реактивность со стороны иммунной системы. Ежедневно выполняются тысячи переливаний крови и плазмы, в результате чего пациентам передается большое количество ЭВ без видимых побочных эффектов. ЭВ не способны самостоятельно размножаться, они не обладают мутагенной активностью. В целом, ЭВ характеризуются низкой токсичностью. Имеющиеся данные показывают, что даже применение ксеногенных ЭВ не вызывает серьезных побочных эффектов (Elsharkasy et al., 2020). С практической точки зрения также важно то, что ЭВ могут храниться в течение длительного времени при –80°C или в лиофилизированной форме без потери своей биологической активности (Frank et al., 2018).
Мезенхимальные стволовые клетки (МСК) широко изучаются и применяются для лечения широкого спектра заболеваний (обзор Bruno et al., 2013). В различных экспериментальных моделях, иллюстрирующих респираторные, почечные, печеночные, нервные, скелетно-мышечные и сердечно-сосудистые заболевания, было показано, что ЭВ, продуцируемые МСК (МСК-ЭВ), способны практически в полной мере воспроизводить регенеративные эффекты МСК. Согласно опубликованным данным, МСК-ЭВ обладают выраженными противовоспалительными, антиапоптотическими, проангиогенными и иммуномодулирующими свойствами, аналогичными тем, которые демонстрируют MСК (обзор Zhang et al., 2020).
Ряд исследований были посвящены применению МСК в лечении почечной недостаточности. Вызванная разными причинами острая почечная недостаточность (ОПН) часто приводит к хронической почечной недостаточности (ХПН). Этим заболеванием страдают в разной мере около 10-15% населения. ХПН часто связана с сердечно-сосудистыми заболеваниями и/или диабетом. В экспериментах на крысах показано, что МСК-ЭВ способны улучшать функцию поврежденной почки и ингибировать пролиферацию Т-клеток in vitro. Они улучшали функцию и стимулировали морфологическое восстановление почки в экспериментальных моделях ХПН, диабетической нефропатии и почечного фиброза. Предполагается, что терапевтическое действие МСК-ЭВ опосредуется, по крайней мере частично, содержащейся в них микроРНК. Благоприятные клинические эффекты МСК-ЭВ на поврежденную почку могут быть связаны также с экзовезикулярным β, который стимулирует функциональную активность регуляторных Т-клеток (Zhang et al., 2020). MСК-ЭВ могут также значительно снижать уровень сывороточных маркеров почечной недостаточности (мочевина, креатинин и трансаминазы) (Kilpinen et al., 2013).
Известно, что митохондрии нежизнеспособны во внеклеточном пространстве. ЭВ способны транспортировать митохондрии и поддерживать их жизнеспособность за счет сохранения внутри себя внутриклеточной среды. Убедительно доказана возможность трансфекции экзовезикулярных митохондрий в клетку-мишень. Установлено, что трансфецированные митохондрии могут усиливать производство энергии в клетках и, возможно, за счет этого способствовать восстановлению поврежденного органа (Ikeda et al., 2021). Экзовезикулярный перенос функционально полноценных митохондрий в стареющие клетки, направленный на замену дефектных митохондрий, формирует новый подход к профилактике и лечению возрастных заболеваний.
Известен способ лечения пациента, страдающего заболеванием или состоянием, вызванным дисфункцией стволовых клеток или ускоренным старением, включающий введение пациенту композиции, содержащей внеклеточные везикулы, полученные из мезенхимальных стволовых клеток более здорового или более молодого субъекта, чем пациент (патент WO2017189842 A1, МПК А61К35/28, опубл. 02.11.2017 г.). Здесь показано, что МСК-ЭВ могут “омолаживать” клетки на биохимическом и генетическом уровнях. Этот эффект, по крайней мере частично, может быть обусловлен переносом функционально активных митохондрий в клетки-мишени. Такой перенос мог бы обеспечить «энергетическое омоложение» клеток-мишеней.
Известен способ лечения с использованием композиции на основе микровезикул, содержащих специфические микроРНК, которые могут функционировать как межклеточные регуляторы репрограммирования или трансдифференцировки клеток, а также как стимуляторы регенерации, ремоделирования и реконструкции тканей (WO2012020307 A2, МПК А61К35/22, опубл. 16.02.2012г.).
МСК-ЭВ могут использоваться в качестве переносчиков лекарственных препаратов в клетки-мишени (WО2016123556 A1, МПК С12Р21/00, опубл. 04.08.2016г.). Например, МСК-ЭВ, обработанные эритропоэтином (т.е. нагруженные эритропоэтином), оказались более эффективными в защите почек от повреждений, связанных с фиброзом, по сравнению с необработанными МСК-ЭВ (Wang et al., 2015).
Ксеногенные МСК-ЭВ также способны оказывать влияние на рост и функциональную активность клеток-мишеней (Saleh et al., 2019). Отсюда можно предполагать то, что терапевтические ЭВ могут быть получены не только из клеток человека, но и из клеток животных.
Задачей изобретения является создание на основе ЭВ доступного и недорогого лекарственного препарата, обеспечивающего эффективное восстановление поврежденных органов и тканей организма.
Техническим результатом изобретения является повышение эффективности лечения почечной недостаточности вследствие применения ЭВ, полученных из опухолевых клеток.
Задача решается и технический результат достигается посредством применения лечебной композиции, содержащей внеклеточные везикулы, полученные из гомологичных или ксеногенных опухолевых клеток, суспендированные в солевом растворе, для лечения почечной недостаточности.
Согласно изобретению внеклеточные везикулы можно получать из различных типов опухолей.
Согласно изобретению лечебная композиция может применяться для лечения почечной недостаточности.
Согласно изобретению лечебная композиция может применяться для переноса биомолекул к клеткам-мишеням.
Согласно изобретению лечебная композиция может применяться для переноса митохондрий к клеткам-мишеням.
На основе проведенных авторами экспериментальных исследований было установлено, что опухолевые экзовезикулы (О-ЭВ) обладают регенеративными свойствами, сопоставимыми с аналогичными свойства МСК и MСК-ЭВ. Это означает, что полученные из опухоли ЭВ способны концентрировать в себе биомолекулы, которые могут стимулировать регенеративную активность различных типов нормальных клеток. Таким образом, эти О-ЭВ могут стать универсальным средством для лечения органной недостаточности, вызванной заболеванием или травмой.
Посредством конфокальной микроскопии в О-ЭВ были обнаружены жизнеспособные митохондрии. Следовательно, подобно MCК-ЭВ О-ЭВ могут переносить митохондрии в клетки мишени и, таким образом, осуществлять их “энергетическое омоложение”. Это свойство О-ЭВ, вероятно, может быть использовано для лечения возрастных митохондриальных заболеваний таких, например, как болезнь Альцгеймера и болезнь Паркинсона, а также первичных митохондриальных заболеваний таких как синдром Кернса – Сайра и синдром Меласа, которые в настоящее время считаются неизлечимыми.
О-ЭВ можно получать не только из клеток человека, но и из клеток животных. По аналогии с MСК-ЭВ, О-ЭВ могут использоваться в качестве универсальных транспортных средств для доставки биомолекул экзогенных факторов, в клетки-мишени.
В отличие от трудоемкого протокола генерации МСК, требующего наличие донора, опухолевые клетки могут быть легко размножены вне организма. Процесс получения лекарственных композиций на основе О-ЭВ может быть адаптирован для крупномасштабного производства. Экзовезикулярные препараты можно хранить в замороженном или лиофилизированном виде в течение длительного времени. Эти препараты можно стандартизовать на основе физических, химических и биологических свойств. Таким образом, относительно недорогие препараты на основе О-ЭВ могут быть широко использованы для лечения распространенных, социально значимых, тяжелых заболеваний, в том числе тех, которые характеризуются высоким уровнем смертности.
Ниже приведены описания экспериментов, которые проводились на мышах-самцах CBA в возрасте от 4 до 6 месяцев.
Острую почечную недостаточность (ОПН) индуцировали однократным внутримышечным введением мышам 50% глицерола в дозе 8.6 мг/кг. Хроническую почечную недостаточность (ХПН) индуцировали трехкратным внутримышечным введением глицерола.
Для генерации МСК костный мозг забирали из бедренной и большеберцовой костей интактных мышей CBA и суспендировали с помощью стеклянного гомогенизатора. Полученные клетки культивировали в среде RPMI 1640, содержащей 10% фетальной телячьей сыворотки, 2 мМ L-глутамина и антибиотики. Неприкрепленные к пластиковой поверхности клетки удаляли во время запланированной смены среды, начиная с 3-го дня. Прикрепившиеся к пластику МСК имели веретенообразную фибробластоподобную форму. Они формировали сплошной монослой к 4-й неделе культивирования. МСК собирали с использованием 0,25% раствора версена-трипсина. Перед дальнейшем использованием клетки дважды промывали холодной бессывороточной средой.
Мышиные опухолевые клеточные линии (саркома L929, карцинома легких Льюиса (LLC) и меланома B16) сохраняли и размножали in vitro в среде RPMI 1640 с добавлением 10% фетальной телячьей сыворотки, 2 мМ L-глутамина и антибиотиков.
Для получения ЭВ МСК, клетки L929, LLC или B16 (1 × 10 6/мл) подвергали апоптозу путем культивирования их в бессывороточной среде в течение 48 часов. После культивирования клеточный дебрис удаляли центрифугированием при 2000 g в течение 15 мин., а полученную надосадочную жидкость подвергали центрифугированию для осаждения ЭВ при 14000 g в течение 60 мин при 4°С. Осадок ресуспендировали в физиологическом растворе. Размер ЭВ, экспрессирующих аннексин V, определяли методом проточной цитометрии на цитометре CytoFlex (Beckman Coulter Life Sciences, Индианаполис, Индиана) с использованием калибровочных наночастиц TruCOUNT (TC), согласно инструкции производителя. Концентрацию ЭВ определяли по количеству белка, измеряеого методом Брэдфорда.
В модели ОПН МСК (2 × 106 / мышь) или ЭВ (30-50 мкг / мышь) вводили мышам внутривенно (в ретроорбитальный синус) через сутки после введения им глицерола. Четыре группы животных с ОПН (по 10 мышей в группе) было сформировано:
1. Контрольная группа не получала лечения.
2. Группа получала МСК.
3. Группа получала MСК-ЭВ.
4. Группа получала О-ЭВ, секретированные клетками L929 (L929-ЭВ).
В модели ХПН МСК (2 × 106 / мышь) или ЭВ (30-50 мкг / мышь) вводили внутривенно мышам через 3 недели после последнего введения им глицерина. Шесть групп мышей с ХПН было сформировано:
1. Контрольная группа не получала лечения.
2. Группа получала МСК.
3. Группа получала MСК-ЭВ.
4. Группа получала L929-ЭВ.
5. Группа получала LLC-ЭВ.
6. Группа получала B16-ЭВ.
Эксперименты завершали через 11 дней после введения МСК или ЭВ.
Для гистологического исследования почки мышей фиксировали в 4% растворе формалина, затем их обезвоживали и заливали парафином. Срезы толщиной 4-5 мкм делали с помощью ротационного микротома (Microm HM 340E; Carl Zeiss, Германия) и окрашивали их гематоксилином/эозином, красным сириусом или трихромом Мэллори. Световую микроскопию и микрофотографию выполняли на световом микроскопе Axioskop 40 (Carl Zeiss, Германия). Морфометрический анализ гистологического строения почек проводили на парафиновых срезах путем определения следующих параметров: диаметры поверхностных почечных клубочков; диаметры собирающих канальцев почек и размер клеток в средней трети медуллярной области. Измерения осуществляли в одном поле зрения (линза окуляра 10 × 25; линза объектива 63×). Статистический анализ морфометрических данных проводили с использованием однофакторного дисперсионного анализа.
Уровни креатинина в крови измеряли с использованием тест-системы BioVision, Creatinine (Mouse) ELISA Kit rev 03/18, Catalog Number E4369-100 (Abcam). Определение FABP1 (fatty acid binding protein-1) в крови осуществляли с использованием тест системы Mouse/Rat FABP1/L-FABP Immunoassay Quantikine® ELISA, RnDSystems Catalog Number RFBP10.
Статистический анализ данных выполняли с использованием программы Graph Prism 8. Значимость различий оценивали с помощью t-критерия Стьюдента. Различия считались значимыми при p <0.05.
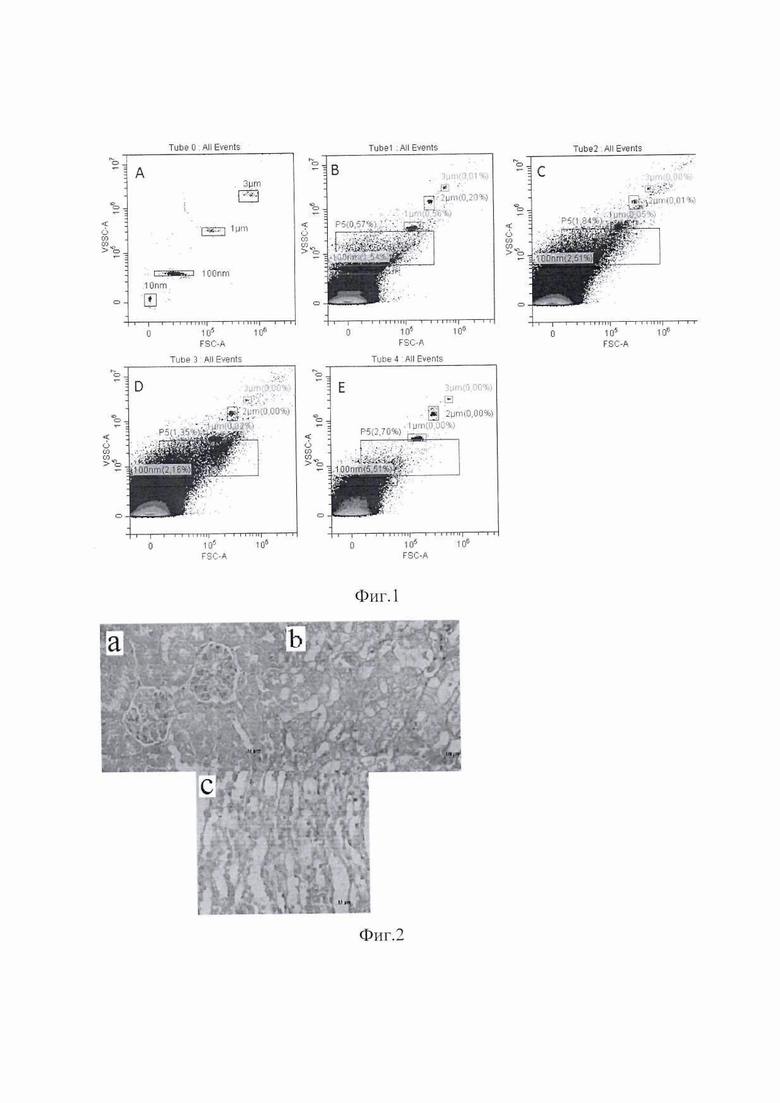
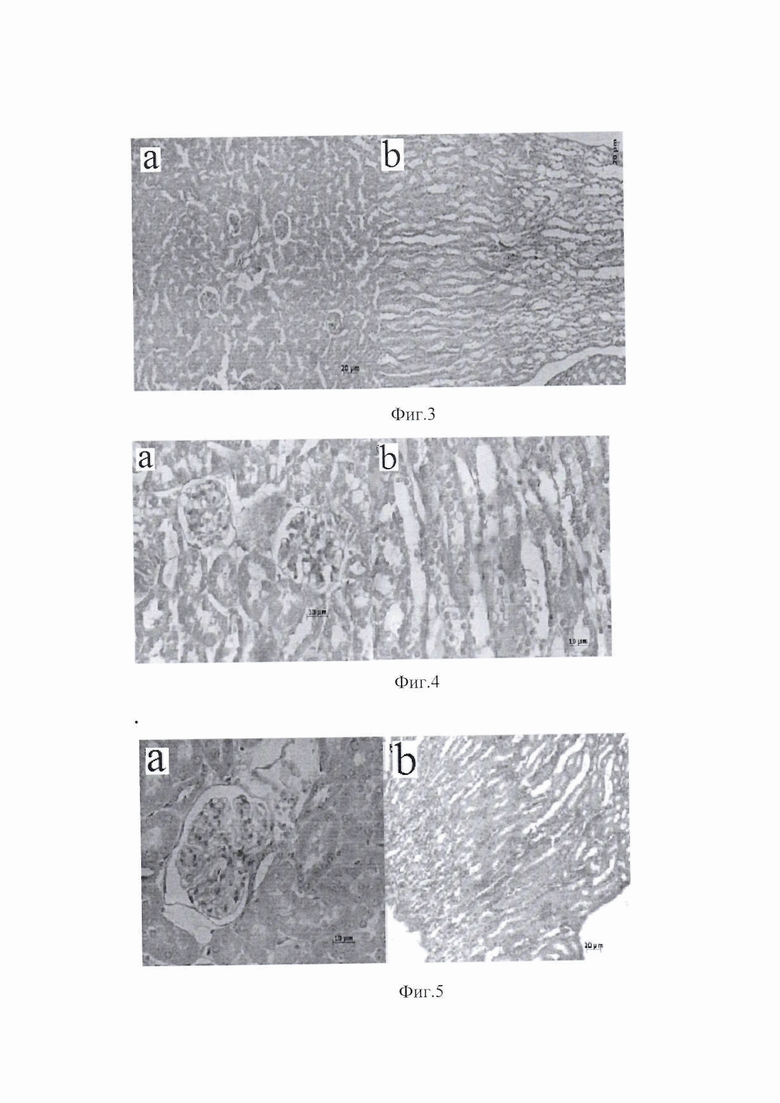
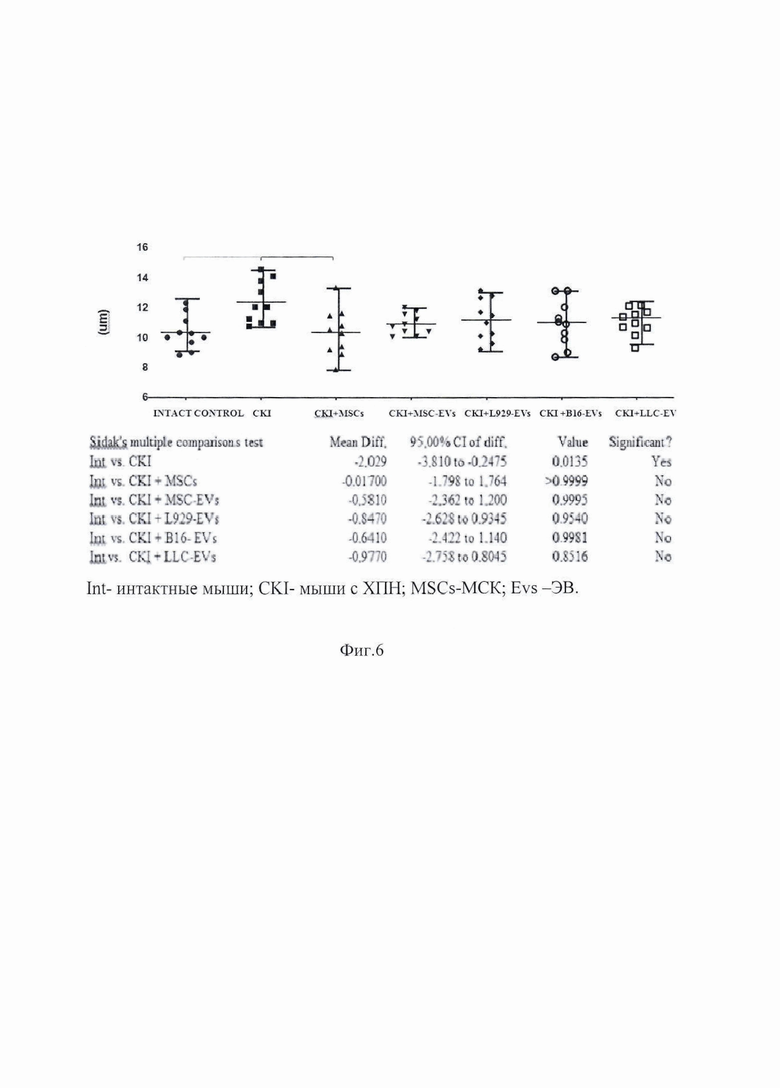
Результаты проведенных экспериментов представлены на изображениях фиг.1-6, где на фиг.1 показан размер ЭВ (А - стандартные частицы, меченные аннексином V-FITC без ЭВ; B - MCК-ЭВ; C-B16-ЭВ; D-LLC-ЭВ; и E-L929 ЭВ); на фиг.2 показана морфологическая структура почечной ткани у контрольных мышей с ХПН (клубочки, проксимальные и дистальные канальцы а, собирательные канальцы и петли Хени в мозговом веществе b, c); на фиг.3 показана морфологическая структура почечной ткани у мышей c ХПН, получавших MCК (клубочки, проксимальные и дистальные канальцы а, собирательные канальцы и структуры петли Хени на границе между корой и медуллярной областью b); на фиг.4 показана морфологическая структура ткани почки у мышей с ХПН, получавших B16-ЭВ (клубочки, проксимальные и дистальные канальцы а, собирательные канальцы и петлевые структуры Хени в средней части мозгового вещества b); на фиг.5 показана морфологическая структура ткани почки у мышей с ХПН, получавших LLC-ЭВ (клубочки и проксимальные канальцы а, собирательные (Беллини) протоки сосочка б); на фиг.6 показан диаметр (мкм) собирательных почечных канальцев у мышей с ХПН.
Как показано на фиг.1, размер подавляющего большинства ЭВ превышал 100 нм. Таким образом, большинство ЭВ, используемых в описанных экспериментах можно квалифицировать как микровезикулы.
Пример 1. Опухолевые ЭВ улучшают функцию почек в модели ОПН.
В экспериментах в качестве маркера повреждения почек был использован сывороточный креатинин, определение которого рутинно применяется для подсчета скорости клубочковой фильтрации. У мышей с ОПН уровень креатинина возрастал с 2.244 до 3.114 нг/мл. В таблице 1 приведена концентрация креатинина (нг/мл) в сыворотке крови мышей с ОПН. Было установлено, что введение мышам с ОПН МСК или МСК-ЭВ заметно снижало уровень креатинина в их крови, указывая, тем самым, на улучшение выделительной функции почек. Вместе с тем, наибольшее снижение уровня креатина было отмечено у мышей, получивших L929-ЭВ
Таблица 1.
Примечание: * P< 0.05 в сравнении с контролем.
Улучшение функции почек, вызванное лечебными воздействиями, сопровождалось соответствующими изменениями в морфологической структуре почек. Однако, большинство этих изменений в модели ОПН были не очевидны. Поэтому были проведены сравнительные исследования эффектов опухолевых ЭВ на функциональные и морфологические характеристики почки в модели ХПН, в которой регенеративным процессам дается больше времени.
Пример 2. Опухолевые ЭВ улучшают функциональные и морфологические характеристики почек в модели ХПН.
Два функциональных количественных параметра были исследованы в модели ХПН: креатинин и FABP1 (fatty acid binding protein-1). Считается, что повышение продукции жиросвязывающего FABP1 является ранним маркером повреждения почек. В наших экспериментах развитие ХПН приводило к достоверному повышению сывороточного уровня FABP1 с 0.8 до 1.085 нг/мл. В таблице 2 приведена концентрация креатинина и FABP1 (нг/мл) в сыворотке крови мышей с XПН. Как показано в таблице 2, введение мышам МСК или МСК-ЭВ приводило к снижению в крови как креатинина, так и FABP1 практически к нормальным значениям. Аналогичный эффект был также отмечен в случаях применения опухолевых (L929, LLC или В16) ЭВ
Таблица 2.
Примечание: * P< 0.05 в сравнении с контролем.
На гистологических срезах развитие ХПН приводило к расширению собирательных канальцев почки (фиг.2а), гипертрофии клеток собирательного протока (протока Беллини) (фиг.2b), дистрофии клеток петли Хентле в средней и нижней частях медуллярной области (фиг.2с). Вместе с тем, выраженных дистрофических изменений в почечных клубочках у мышей, получивших MCК или МСК-ЭВ, отмечено не было. Этих изменений также не наблюдалось у мышей, получивших О-ЭВ. Париентальный и висцеральный слои почечного тельца (капсула Шумлански-Боумена) выглядели хорошо сохранившимся, а мочевое (боуменское) пространство было ясно видимым (фиг. 3-5). В целом лечение мышей с ХПН с применением О-ЭВ нормализовало морфологическую структуру поврежденной почки (фиг. 6).
Представленные данные однозначно свидетельствуют о высокой способности опухолевых ЭВ стимулировать регенеративные процессы в нормальных тканях. Это способность, по-видимому, присуща разным опухолям независимо от их происхождения.
Возникают опасения по поводу возможных онкогенных свойств О-ЭВ. Известно, что О-ЭВ могут усиливать рост опухоли (Gregory et al., 2018). Однако, О-ЭВ не обладают мутагенной активностью, которая способна прямо индуцировать канцерогенез. О-ЭВ, по-видимому, могут ускорять рост клеток, которые стали опухолевыми в результате предшествующего канцерогенеза. Наши наблюдения в течение 6 месяцев за мышами, получившими О-ЭВ, не выявили у них повышенной раковой заболеваемости. Тем не менее, безопасность многократного длительного введения О-ЭВ при лечении хронических заболеваний, включая возрастные расстройства, требует дальнейшего тщательного изучения. С другой стороны, опасения по поводу применения О-ЭВ для лечения жизнеугрожающих состояний должны отойти на второй план, поскольку терапевтическая польза в таких случаях перевешивает риски потенциальных осложнений. Это относится не только к пациентам с почечной недостаточностью, но и к пациентам с тяжелым поражением других органов.
Таким образом, изобретение описывает универсальный подход к лечению заболеваний, связанных с повреждением внутренних органов, например, с ОПН или ХПН. Этот подход основан на использовании ЭВ опухолевого происхождения. В сравнении с ЭВ, полученным из МСК, опухолевые ЭВ намного проще и дешевле получать в промышленных количествах и легче стандартизовать их биологическую активность. В качестве лекарственных препаратов ЭВ опухолевого происхождения могут быть применимы для лечения различных дегенеративных заболеваний человека и животных.
Литература
1. Elsharkasy OM, Nordin JZ, Hagey DW, de Jong OG, Schiffelers RM, Andaloussi SE, Vader P. Extracellular vesicles as drug delivery systems: Why and how? Adv Drug Deliv Rev. 2020;159:332-343. doi: 10.1016/j.addr.2020.04.004. Epub 2020 Apr 16. PMID: 32305351.
2. de Jong OG, Kooijmans SAA, Murphy DE, Jiang L, Evers MJW, Sluijter JPG, Vader P, Schiffelers RM. Drug delivery with extracellular vesicles: from imagination to innovation. Acc Chem Res. 2019 Jul 16;52(7):1761-1770. doi: 10.1021/acs.accounts.9b00109. Epub 2019 Jun 5. PMID: 31181910; PMCID: PMC6639984.
3. Tang TT, Lv LL, Lan HY, Liu BC. Extracellular vesicles: opportunities and challenges for the treatment of renal diseases. Front Physiol. 2019 Mar 19;10:226. doi: 10.3389/fphys.2019.00226. PMID: 30941051; PMCID: PMC6433711.
4. Chen CC, Liu L, Ma F, Wong CW, Guo XE, Chacko JV, Farhoodi HP, Zhang SX, Zimak J, Ségaliny A, Riazifar M, Pham V, Digman MA, Pone EJ, Zhao W. Elucidation of exosome migration across the blood-brain barrier model in vitro. Cell Mol Bioeng. 2016 Dec;9(4):509-529. doi: 10.1007/s12195-016-0458-3. Epub 2016 Jul 7. PMID: 28392840; PMCID: PMC5382965.
5. Milasan A, Farhat M, Martel C. Extracellular vesicles as potential prognostic markers of lymphatic dysfunction. Front Physiol. 2020 May 25;11:476. doi: 10.3389/fphys.2020.00476. PMID: 32523544; PMCID: PMC7261898.
6. Frank J, Richter M, de Rossi C, Lehr CM, Fuhrmann K, Fuhrmann G. Extracellular vesicles protect glucuronidase model enzymes during freeze-drying. Sci Rep. 2018 Aug 17;8(1):12377. doi: 10.1038/s41598-018-30786-y. Erratum in: Sci Rep. 2019 Oct 25;9(1):15702. PMID: 30120298; PMCID: PMC6098026.
7. Bruno S, Collino F, Tetta C, Camussi G. Dissecting paracrine effectors for mesenchymal stem cells. Adv Biochem Eng Biotechnol. 2013;129:137-52. doi: 10.1007/10_2012_149. PMID: 22968371.
8. Zhang B, Tian X, Hao J, Xu G, Zhang W. Mesenchymal stem cell-derived extracellular vesicles in tissue regeneration. Cell Transplant. 2020 Jan-Dec;29:963689720908500. doi: 10.1177/0963689720908500. PMID: 32207341; PMCID: PMC7444208.
9. Kilpinen L, Impola U, Sankkila L, Ritamo I, Aatonen M, Kilpinen S, Tuimala J, Valmu L, Levijoki J, Finckenberg P, Siljander P, Kankuri E, Mervaala E, Laitinen S. Extracellular membrane vesicles from umbilical cord blood-derived MSC protect against ischemic acute kidney injury, a feature that is lost after inflammatory conditioning. J Extracell Vesicles. 2013 Dec 10;2. doi: 10.3402/jev.v2i0.21927. PMID: 24349659; PMCID: PMC3860334.
10. Ikeda G, Santoso MR, Tada Y, Li AM, Vaskova E, Jung JH, O'Brien C, Egan E, Ye J, Yang PC. Mitochondria-rich Extracellular vesicles from autologous stem cell-derived cardiomyocytes restore energetics of ischemic myocardium. J Am Coll Cardiol. 2021 Mar 2;77(8):1073-1088. doi: 10.1016/j.jacc.2020.12.060. PMID: 33632482.
11. Wang Y, Lu X, He J, Zhao W. Influence of erythropoietin on microvesicles derived from mesenchymal stem cells protecting renal function of chronic kidney disease. Stem Cell Res Ther. 2015 May 22;6(1):100. doi: 10.1186/s13287-015-0095-0. PMID: 25998259; PMCID: PMC4469245.
12. Saleh AF , Lázaro-Ibáñez E , Forsgard MA , Shatnyeva O , Osteikoetxea X , Karlsson F , Heath N , Ingelsten M , Rose J , Harris J , Mairesse M , Bates SM , Clausen M , Etal D , Leonard E , Fellows MD , Dekker N , Edmunds N . Extracellular vesicles induce minimal hepatotoxicity and immunogenicity. Nanoscale. 2019 Apr 4;11(14):6990-7001. doi: 10.1039/c8nr08720b. PMID: 30916672.
13. Gregory CD, Dransfield I. Apoptotic tumor cell-derived extracellular vesicles as important regulators of the onco-regenerative niche. Front Immunol. 2018 May 23;9:1111. doi: 10.3389/fimmu.2018.01111. PMID: 29875772; PMCID: PMC5974173.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ увеличения частоты оплодотворения при использовании сперматозоидов, полученных при биопсии яичка, с помощью внеклеточных везикул семенной плазмы | 2024 |
|
RU2841174C1 |
| ТЕХНОЛОГИЯ ДОЗРЕВАНИЯ ООЦИТОВ ЧЕЛОВЕКА НА СТАДИИ GV С ПОМОЩЬЮ ВНЕКЛЕТОЧНЫХ ВЕЗИКУЛ ФОЛЛИКУЛЯРНОЙ ЖИДКОСТИ В ПРОГРАММАХ ЭКСТРАКОРПОРАЛЬНОГО ОПЛОДОТВОРЕНИЯ: EV-IVM (EXTRACELLULAR VESICLES IN VITRO MATURATION) | 2023 |
|
RU2807492C1 |
| Способ образования опухолевых узлов меланомы в организме экспериментальных животных | 2022 |
|
RU2796892C1 |
| Способ прогнозирования присутствия сперматозоидов в ткани яичек человека при биопсии у пациентов с азооспермией с помощью спектроскопии комбинационного рассеяния семенной плазмы | 2024 |
|
RU2829263C1 |
| Применение мембранных везикул мультипотентных стромальных клеток, индуцированных цитохалазином В, для восстановления и повышения митохондриальной функции | 2019 |
|
RU2727540C1 |
| Способ увеличения пролиферативного потенциала трехмерных опухолевых клеточных культур | 2021 |
|
RU2782600C1 |
| СПОСОБ ЛЕЧЕНИЯ ХРОНИЧЕСКОЙ И ОСТРОЙ ПОЧЕЧНОЙ НЕДОСТАТОЧНОСТИ С ПОМОЩЬЮ ФЕТАЛЬНЫХ СТВОЛОВЫХ И ПРОГЕНИТОРНЫХ КЛЕТОК | 2007 |
|
RU2373942C2 |
| СПОСОБ СЕЛЕКЦИИ МУЖСКИХ ГАМЕТ С ПОМОЩЬЮ ВНЕКЛЕТОЧНЫХ ВЕЗИКУЛ ФОЛЛИКУЛЯРНОЙ ЖИДКОСТИ ПРИ ОПЛОДОТВОРЕНИИ МЕТОДОМ ИНТРАЦИТОПЛАЗМАТИЧЕСКОЙ ИНЪЕКЦИИ СПЕРМАТОЗОИДОВ В ООЦИТ | 2022 |
|
RU2801117C1 |
| СПОСОБ ИСПОЛЬЗОВАНИЯ ВНЕКЛЕТОЧНЫХ ВЕЗИКУЛ ФОЛЛИКУЛЯРНОЙ ЖИДКОСТИ ДЛЯ УВЕЛИЧЕНИЯ ПОДВИЖНОСТИ СПЕРМАТОЗОИДОВ ЧЕЛОВЕКА В ПРОГРАММАХ ЭКСТРАКОРПОРАЛЬНОГО ОПЛОДОТВОРЕНИЯ | 2022 |
|
RU2801339C1 |
| Способ лечения повторяющихся неудач имплантации эмбриона при вспомогательных репродуктивных технологиях | 2024 |
|
RU2838873C1 |
Настоящее изобретение относится к области медицины, а именно к применению лечебной композиции, содержащей внеклеточные везикулы, полученные из гомологичных или ксеногенных опухолевых клеток, суспендированные в изоосмотическом солевом растворе, для лечения почечной недостаточности. Настоящее изобретение обеспечивает повышение эффективности лечения почечной недостаточности вследствие применения внеклеточных везикул, полученных из опухолевых клеток. 4 з.п. ф-лы, 6 ил., 2 табл., 2 пр.
1. Применение лечебной композиции, содержащей внеклеточные везикулы, полученные из гомологичных или ксеногенных опухолевых клеток, суспендированные в изоосмотическом солевом растворе, для лечения почечной недостаточности.
2. Применение лечебной композиции по п.1, отличающееся тем, что внеклеточные везикулы получают из различных опухолей.
3. Применение лечебной композиции по п.1, 2, отличающееся тем, что предназначено для лечения острой или хронической недостаточности.
4. Применение лечебной композиции по п.1, 2, отличающееся тем, что предназначено для переноса биомолекул в клетки-мишени.
5. Применение лечебной композиции по п.1, 2, отличающееся тем, что предназначено для переноса митохондрий в клетки-мишени.
| WO 2018085275 A1, 11.05.2018 | |||
| Yifei Ren et al., Human amniotic epithelial cells ameliorate kidney damage in ischemia-reperfusion mouse model of acute kidney injury / Stem Cell Research & Therapy, 2020, Vol.11, pp.1-16 | |||
| Chao Liu et al., Extracellular vesicles for acute kidney injury in preclinical rodent models: a metaanalysis / Stem Cell Research |
Авторы
Даты
2023-03-07—Публикация
2022-01-28—Подача