Ссылка на родственную заявку
[0001] Согласно настоящей заявке испрашивается приоритет в соответствии с предварительной заявкой на выдачу патента США №62/550983, поданной 28 августа 2017 года, и предварительной заявкой на выдачу патента США №62/621730, поданной 25 января 2018 года, каждая из которых включена в настоящий документ посредством ссылки во всей своей полноте.
Область техники, к которой относится настоящее изобретение
Область настоящего изобретения
[0002] Настоящее изобретение относится к системе доставки лекарственного средства для доставки анестетической композиции с замедленным высвобождением. Настоящее изобретение относится к способу получения системы доставки лекарственного средства. Настоящее изобретение также относится к фармацевтической композиции с замедленным высвобождением, адаптированной для системы доставки лекарственного средства, которая обладает пролонгированной длительностью действия.
Сведения об уровне техники
[0003] Было описано несколько подходов по разработке местных анестетиков с замедленным высвобождением, включая: 1) получение местных анестетиков в форме многослойных липосом с использованием способа дегидратации-регидратации (патент США №6926905), 2) получение местных анестетиков в форме гигантских мультивезикулярных (GMV) липосом с использованием метода загрузки с помощью градиента сульфата аммония (патент США №7357944) и 3) получение местных анестетиков в форме мультивезикулярных липосом (MVL) с использованием метода «вода-в-масле» (патент США №8182835).
[0004] Для получения местных анестетиков в форме многослойных липосом посредством способа дегидратации-регидратации фосфолипид и холестерин, растворенные в трет-бутаноле, лиофилизировали и затем гидратировали с получением многослойных везикул (MLV) и везикулы MLV гомогенизировали с получением малых моноламеллярных везикул (SUV). Местный анестетик, например, бупивакаин, затем растворяли в растворе SUV с последующей лиофилизацией, гидратацией и промывкой гиперосмотическим солевым раствором для того, чтобы удалить свободный бупивакаин.
[0005] Для получения местных анестетиков в форме GMV липосом тонкую липидную пленку получали посредством растворения липида в растворителе, удаления растворителя и гидратации с применением раствора сульфата аммония с получением везикул MLV. Везикулы MLV затем гомогенизировали с получением везикул SUV, которые подвергали замораживанию-оттаиванию с получением липосом GMV. Внешнюю липосомальную среду замещали для того, чтобы создать градиент, анестетик, например, бупивакаин, активно загружался в липосомы GMV, и неинкапсулированный бупивакаин удаляли.
[0006] Для получения местных анестетиков в форме MVL бупивакаин, например, превращали в подходящую солевую форму, так чтобы он мог быть легко растворен в водном растворе, и затем водный раствор бупивакаина смешивали с липидным компонентом в органическом растворителе посредством механической турбулентности с получением эмульсии типа вода-в-масле. Эмульсию типа вода-в-масле затем диспергировали во второй водной фазе с получением сферул в растворителе. Наконец, после удаления органического растворителя получали местный анестетик в форме MVL.
[0007] В 1991 г. Legros et al. (патент США №5244678) раскрыли получение липосомального бупивакаина в форме MLV, содержащего L-a-фосфатидилхолин (ЕРС) и холестерин в молярном соотношении, равном 4:3. Затем эта группа раскрыла получение анестетиков в липосомальной форме посредством получения липидной пленки, состоящей из ЕРС и неполярного анестетика, с последующей гидратацией липидной пленки с использованием буфера с регулируемым значением рН, в котором неполярный анестетик остается в незагруженной форме (патент США №6149937). Например, при получении липосомального бупивакаина липидную пленку предпочтительно гидратировали с использованием буфера с рН 8,1 (значение pKa для бупивакаина составляет 8,1), в котором 50% бупивакаина оставалось в незагруженной форме. Legros et al. также раскрыли способ получения лиофилизированных композиций амфифильного лекарственного средства, инкапсулированного в липосомы (WO1997042936), которые получали посредством приготовления тонкой пленки, содержащей липидные компоненты и композицию амфифильного лекарственного средства, в частности бупивакаина, гидратации тонкой пленки с использованием буферного раствора с рН 8,1 с получением бупивакаина, инкапсулированного в липосомы, лиофилизации бупивакаина, инкапсулированного в липосомы, вместе с сорбитом в качестве стабилизатора мембран, и затем регидратации перед применением с получением липосомального бупивакаина в форме MLV.
[0008] Некоторые из вышеупомянутых примеров предшествующего уровня техники не позволяют достичь высокой степени захвата лекарственного средства, т.е. высокого соотношения лекарственного средства и липида. Несмотря на то, что в некоторых примерах предшествующего уровня техники проиллюстрирован состав с предполагаемым высоким соотношением лекарственного средства и липида, производство этих составов требует трудоемких процедур и высоких производственных затрат. Поэтому существует неудовлетворенная потребность в улучшенных и упрощенных производственных способах получения липосомальных местных анестетиков с замедленным высвобождением.
Краткое раскрытие настоящего изобретения
[0009] Настоящее изобретение относится к способу получения анестетической композиции с замедленным высвобождением, предусматривающему одностадийную лиофилизацию с получением липидной структуры с высокой степенью захвата (HELS), содержащей местный анестетик и липидную смесь, содержащую один или несколько фосфолипидов и/или холестерин, и затем гидратацию HELS с применением буферного раствора с регулируемым значением рН с получением многослойных везикул (MLV) с захваченным местным анестетиком и необязательно незахвачеиного местного анестетика. Эта анестетическая композиция с замедленным высвобождением обеспечивает быстрое наступление анестезии и пролонгированную длительность действия местной анестезии с минимальной токсичностью. Согласно некоторым вариантам осуществления местный анестетик представляет собой анестетик амидного типа.
[0010] Иллюстративным местным анестетиком согласно настоящему изобретению является анестетик амидного типа, как, например, ропивакаин. Другие местные анестетики, которые можно применять, включают лидокаин, бупивакаин и левобупивакаин. Согласно некоторым вариантам осуществления HELS согласно настоящему изобретению получают посредством растворения неполярного ропивакаина, фосфолипида и холестерина в системе растворителя, например, только трет-бутшол или трет-бутанол/вода в качестве сорастворителя, с последующим удалением системы растворителя с применением метода лиофилизации. Согласно некоторым вариантам осуществления композицию ропивакаина получают посредством гидратации HELS с применением фармацевтически приемлемого буферного раствора при значении рН выше 5,5. Теоретически, незагруженный ропивакаин составляет 0,8% от доступного ропивакаина при рН 6,0, исходя из вычисления на основе pKa (значение pKa ропивакаина составляет 8,1). Однако при выборе буфера с рН 6,0 в качестве раствора для гидратации эффективность связывания (АЕ) полученной анестетической композиции составляет более 64%, что демонстрирует, что процент незагруженного анестетика амидного типа не вносит существенный вклад в АЕ.
[0011] Тем не менее, для корректировки соотношения захваченного анестетика и незахваченного анестетика в везикулах MLV анестетической композиции можно подобрать значение рН фармацевтически приемлемого буферного раствора. Согласно определенным вариантам осуществления молярное соотношение анестетика амидного типа и фосфолипида (мольлекарственнога средства:мольфосфолипида) в MLV с захваченным анестетиком амидного типа анестетической композиции составляет по меньшей мере 0,5:1 и может обеспечить субъекта, нуждающегося в этом, достаточным количеством анестетика амидного типа для того, чтобы пролонгировать длительность действия анестезии после местного введения in vivo. Кроме того, ограничение количества незахваченного анестетика амидного типа может привести к достижению быстрого наступления анестезии с минимизированным воздействием на максимальную концентрацию в плазме (Cmax).
[0012] Другие задачи, преимущества и новые признаки настоящего изобретения станут более очевидными из последующего подробного описания вместе с приложенными чертежами.
Краткое описание чертежей
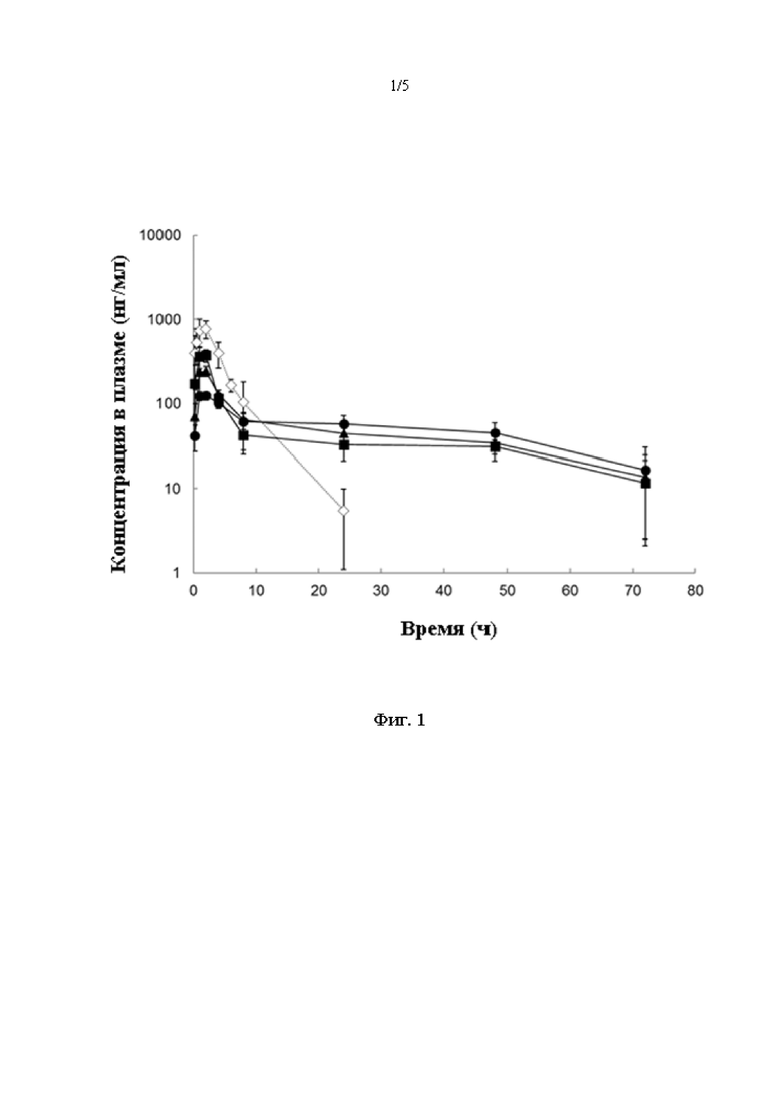
[0013] На фиг. 1 представлен график, на котором изображена концентрация ропивакаина в плазме у крыс после подкожной (SC) инъекции композиции ропивакаина (гидратированной с применением раствора гистидина с рН 5,5, закрашенный квадрат; гидратированной с применением раствора гистидина с рН 6,0, закрашенный треугольник; и гидратированной с применением раствора гистидина с рН 6,5, закрашенный круг) или после SC инъекции ропивакаина не в форме композиции (незакрашенный ромб) (все данные представлены как среднее значение ± стандартное отклонение (SD));
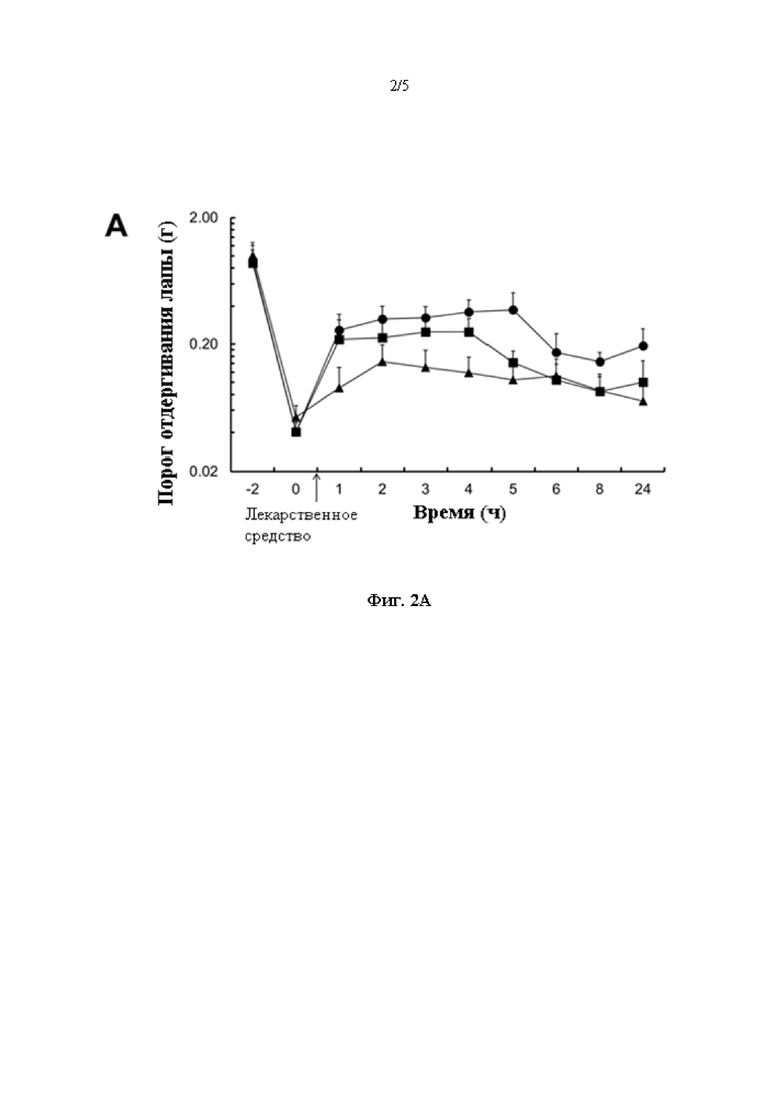
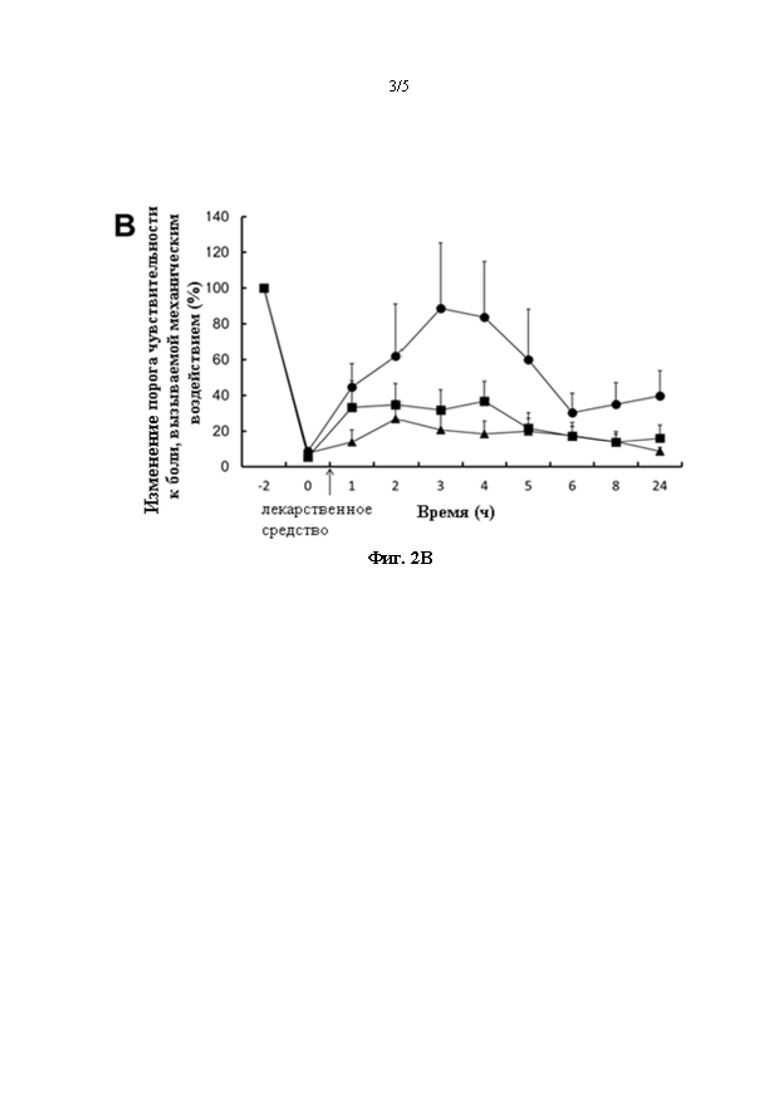
[0014] на фиг. 2А и 2В представлен ряд графиков, на которых показан эффект после SC введения композиции ропивакаина (круг), отдельно ропивакаина (квадрат) и наполнителя (треугольник) на пороги отдергивания лапы мышей при воздействии механических раздражителей (все данные показаны как среднее значение ± стандартная средняя ошибка (SEM)); на фиг. 2А представлен график порога отдергивания лапы относительно времени (g); на фиг. 2В представлен график изменения порога чувствительности к боли, вызываемой механическим воздействием, (%) относительно времени; и
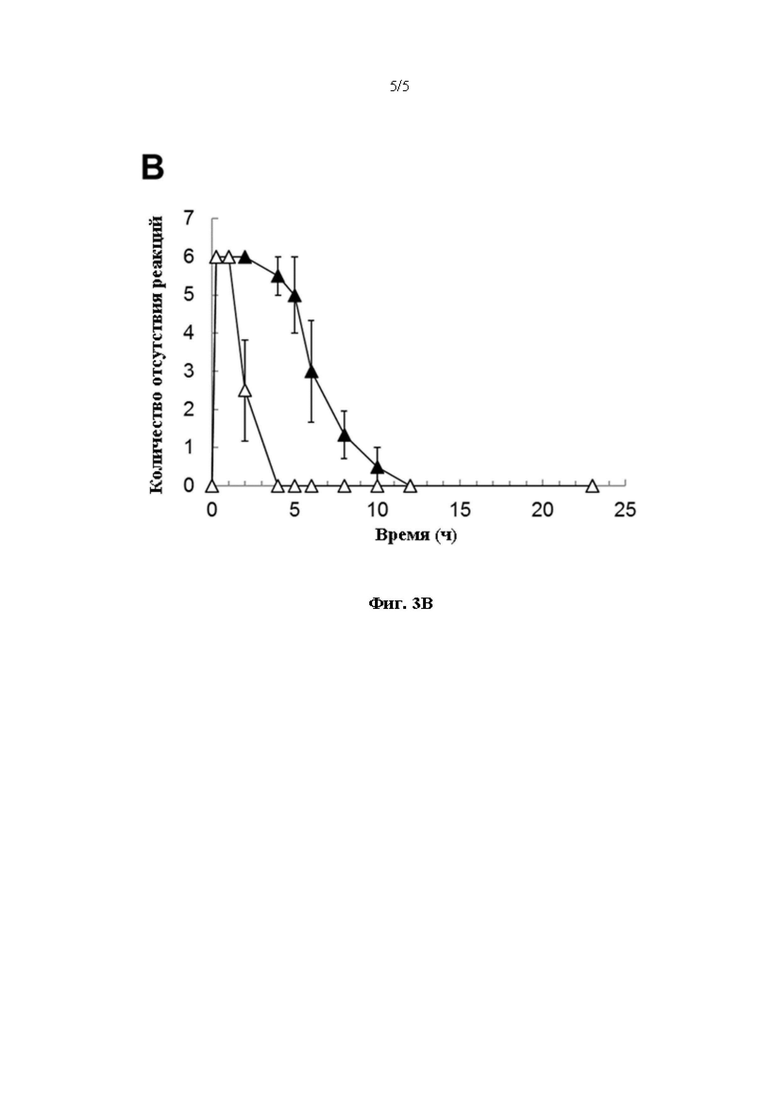
[0015] на фиг. 3А и 3В представлен ряд графиков, на которых показан анестезирующий эффект с течением времени после однократной внутрикожной (1С) инъекции композиции ропивакаина по сравнению с такой же дозой ропивакаина (все данные представлены как среднее значение ± SEM); на фиг. 3А анестезирующий эффект проиллюстрирован на когорте морских свинок, которым была введена доза 3,0 мг на папулу 1С инъекции композиции ропивакаина (закрашенный квадрат) или отдельно ропивакаина (незакрашенный квадрат); на фиг. 3В анестезирующий эффект проиллюстрирован на когорте морских свинок, которым была введена доза 1,5 мг на папулу 1С инъекции композиции ропивакаина (закрашенный треугольник) или отдельно ропивакаина (незакрашенный треугольник).
Подробное раскрытие настоящего изобретения
[0016] Следующие термины, используемые выше и во всем настоящем раскрытии, если не указано иное, следует понимать как имеющие указанные далее значения.
[0017] В контексте настоящего изобретения форма единственного числа охватывает форму множественного числа, если из контекста ясно не следует иное.
[0018] Все числа в настоящем документе можно понимать как модифицированные признаком «приблизительно», который, при ссылке на измеряемое значение, такое как количество, продолжительность времени и тому подобное, подразумевают как охватывающий отклонения ± 10%, предпочтительно ± 5%, более предпочтительно ± 1% и еще более предпочтительно ± 0,1% от указанного значения, поскольку такие отклонения являются подходящими для получения желаемого количества лекарственного средства, если не указано иное.
[0019] «Эффективность связывания» (АЕ) представляет собой количество лекарственного вещества, захваченного многослойными везикулами (MLV), в анестетической композиции, и его вычисляют по соотношению количества лекарственного вещества, захваченного в MLV, и количества лекарственного вещества в исходной анестетической композиции. MLV с захваченным лекарственным средством можно получить известными в данной области техники способами в соответствии с физическими свойствами MLV и общими знаниями в данной области техники. Предпочтительно, MLV с захваченным лекарственным веществом можно получить путем отделения незахвачеиного лекарственного средства от анестетической композиции с использованием способов центрифугирования, например, обычного центрифугирования, центрифугирования в градиенте плотности, дифференциального центрифугирования, или с использованием способов фильтрации, например, диафильтрации, гель-фильтрации, мембранной фильтрации.
Многослойная везикула
[0020] В контексте настоящего изобретения термин «многослойная везикула (MLV)» или «многослойные везикулы (MLV)» относится к частице, характеризующейся тем, что она имеет внутреннее водное пространство, отделенное от внешней среды мембраной из одного или нескольких бислоев, образующих везикулу. Бислойные мембраны многослойных везикул, как правило, образованы липидами, т.е. амфифильными молекулами синтетического или природного происхождения, которые содержат пространственно разделенные гидрофобные и гидрофильные домены. Согласно определенным вариантам осуществления настоящего изобретения многослойная везикула образована более чем одним слоем липидной бислойной мембраны.
[0021] В общем, бислойные мембраны MLV содержат липидную смесь, как правило, содержащую липиды с диалифатической цепью, такие как фосфолипиды, диглицериды, диалифатические гликолипиды, отдельные липиды, такие как сфингомиелин и гликосфинголипид, стероиды, такие как холестерин и его производные, и их комбинации. Примеры фосфолипидов согласно настоящему изобретению включают без ограничения 1,2-дилауроил-от-глицеро-3-фосфохолин (DLPC), 1,2-димиристоил-от-глицеро-3-фосфохолин (DMPC), 1,2-дипальмитоил-sn-глицеро-3-фосфохолин (DPPC), 1-пальмитоил-2-стеароил-sn-глицеро-3-фосфохолин (PSPC), 1-пальмитоил-2-олеоил-sn-глицеро-3-фосфатидилхолин (РОРС), 1,2-дистеароил-sn-глицеро-3-фосфохолин (DSPC), 1,2-диолеоил-sn-глицеро-3-фосфохолин (DOPC), гидрогенизированный соевый фосфатидилхолин (HSPC), 1,2-димиристоил-sn-глицеро-3-фосфо-(1’-rac-глицерин) (натриевая соль) (DMPG), 1,2-дипальмитоил-sn-глицеро-3-фосфо-(1’-rac-глицерин) (натриевая соль) (DPPG), 1-пальмитоил-2-стеароил-sn-глицеро-3-фосфо-(1’-rac-глицерин) (натриевая соль) (PSPG), 1,2-дистеароил-sn-глицеро-3-фосфо-(1’-rac-глицерин) (натриевая соль) (DSPG), 1,2-диолеоил-sn-глицеро-3-фосфо-(1’-rac-глицерин) (DOPG), 1,2-димиристоил-sn-глицеро-3-фосфо-L-серин (натриевая соль) (DMPS), 1,2-дипальмитоил-sn-глицеро-3-фосфо-L-серин (натриевая соль) (DPPS), 1,2-дистеароил-sn-глицеро-3-фосфо-L-серин (натриевая соль) (DSPS), 1,2-диолеоил-sn-глицеро-3-фосфо-L-серин (DOPS), 1,2-димиристоил-sn-глицеро-3-фосфат (натриевая соль) (DMPA), 1,2-дипальмитоил-sn-глицеро-3-фосфат (натриевая соль) (DPPA), 1,2-дистеароил-sn-глицеро-3-фосфат (натриевая соль) (DSPA), 1,2-диолеоил-sn-глицеро-3-фосфат (натриевая соль) (DOPA), 1,2-дипальмитоил-sn-глицеро-3-фосфоэтаноламин (DPPE), 1-пальмитоил-2-олеоил-sn-глицеро-3-фосфоэтаноламин (POPE), 1,2-дистеароил-sn-глицеро-3-фосфоэтаноламин (DSPE), 1,2-диолеоил-sn-глицеро-3-фосфоэтаноламин (DOPE), 1,2-дипальмитоил-sn-глицеро-3-фосфо-(1’-миоинозит) (аммониевая соль) (DPPI), 1,2-дистеароил-sn-глицеро-3-фосфоинозит (аммониевая соль) (DSPI), 1,2-диолеоил-sn-глицеро-3-фосфо-(1’-миоинозит) (аммониевая соль) (DOPI), кардиолипин, L-α-фосфатидилхолин (ЕРС) и L-α-фосфатидилэтаноламин (ЕРЕ).
Местные анестетики
[0022] Термин «местные анестетики» относится к одной или нескольким группам веществ, вызывающих потерю чувствительности в ограниченной области у субъекта, вызванную снижением возбуждения в нервных окончаниях или ингибированием процесса передачи нервного возбуждения в периферических нервах. Согласно некоторым вариантам осуществления местные анестетики являются анестетиками амидного типа. Типичная структура анестетика амидного типа содержит липофильную часть и гидрофильную часть, которые соединяются с помощью связи -NHCO- вблизи центра молекулы. Подходящие анестетики амидного типа включают без ограничения лидокаин, бупивакаин, левобупивакаин, ропивакаин, мепивакаин, пиррокаин, артикаин и прилокаин. Согласно определенным вариантам осуществления анестетик амидного типа представляет собой основание ропивакаина.
Липидная структура с высокой степенью захвата
[0023] Термин «липидная структура с высокой степенью захвата» (HELS) относится к твердофазной лиофилизированной лепешке, твердой массе не в форме пленки или высушенному порошку, содержащим липидную смесь и один или несколько анестетиков амидного типа, которые можно изготовить, хранить в течение длительного времени с продлением срока годности композиции и гидратировать непосредственно перед клиническим применением. Липидная смесь, описанная выше, может содержать один или несколько фосфолипидов без холестерина или может содержать один или несколько фосфолипидов с содержанием холестерина в мольных процентах не более 50% относительно количества всей липидной смеси. Альтернативно, содержание холестерина в мольных процентах из расчета на липидную смесь составляет от приблизительно 0% до приблизительно 50% и, необязательно, от приблизительно 33% до приблизительно 40%. Согласно некоторым вариантам осуществления настоящего изобретения фосфолипид(ы) и холестерин содержатся в молярном соотношении от 1:1 до 3:1.
[0024] HELS может быть получена путем 1) растворения липидной смеси и одного или нескольких анестетиков амидного типа в системе растворителя с получением жидкой структуры, содержащей один или несколько растворителей, с получением гомогенного раствора и 2) удаления растворителя(растворителей) с отверждением состава липидной смеси и анестетика(анестетиков) амидного типа. Удаление растворителя может быть осуществлено известными методами, такими как сублимационная сушка (лиофилизация) или распылительная сушка. Примеры систем растворителя, подходящих для сублимационной сушки, включают без ограничения системы трет-бутанол и трет-бутанол/вода в качестве сорастворителя с другими неводными растворителями, такими как ацетон, ацетонитрил, этанол, н-пропанол, изопропанол, н-бутанол, метанол, дихлорметан, диметилсульфоксид и четыреххлористый углерод, или без них. Примеры систем растворителя, подходящих для распылительной сушки, включают без ограничения воду, этанол, метанол, хлороформ, дихлорметан, простой диэтиловый эфир, четыреххлористый углерод, этилацетат и диоксан.
Анестетическая композиция
[0025] Термин «анестетическая композиция» относится к продукту в форме многослойной везикулы (MLV), подходящему для местного введения. Согласно определенным вариантам осуществления анестетическая композиция содержит анестетик амидного типа, захваченный MLV, а также незахваченный анестетик амидного типа. Термин «захватывать» или «захват» относится к бислойной мембране MLV, инкапсулирующей целевое лекарственное вещество, заключающей целевое лекарственное вещество или связывающейся с ним. Везикулы MLV с захваченным анестетиком амидного типа могут быть получены известными в данной области техники способами, предпочтительно путем отделения незахваченного анестетика амидного типа от анестетической композиции, применяя способы центрифугирования, например, обычное центрифугирование, центрифугирование в градиенте плотности, дифференциальное центрифугирование, или посредством способов фильтрации, например, диафильтрации, гель-фильтрации, мембранной фильтрации. Распределение по размеру везикул MLV с захваченным анестетиком амидного типа согласно настоящему изобретению может быть определено известными в данной области техники способами. Иллюстративный размер частиц MLV с захваченным анестетиком амидного типа составляет не менее 1 мкм и, необязательно, составляет более 5 мкм, как, например, в интервале от 5 мкм до 50 мкм или от 10 мкм до 25 мкм. Альтернативно, медианный диаметр (D50) везикул MLV с захваченным анестетиком амидного типа анестетической композиции составляет не менее 1 мкм и, необязательно, составляет более 5 мкм, как, например, в интервале от 5 до 50 мкм или от 10 до 25 мкм.
[0026] Для того, чтобы получить анестетическую композицию для применения структуру HELS гидратируют водным буферным раствором при значении рН выше 5,5. Согласно некоторым вариантам осуществления водный буферный раствор имеет значение рН в интервале от 5,5 до 8,0 и, необязательно, от 6,0 до 7,5.
[0027] Подходящие водные буферные растворы согласно настоящему изобретению включают без ограничения цитрат, ацетат, малат, пиперазин, сукцинат, 2-(N-морфолино)этансульфоновую кислоту (MES), гистидин, бис-трис, фосфат, этаноламин, N-(2-ацетамидо)иминодиуксусную кислоту (ADA), карбонат, N-(2-ацетамидо)-2-аминоэтансульфоновую кислоту (ACES), 1,4-пиперазиндиэтансульфоновую кислоту (PIPES), 3-морфолино-2-гидроксипропансульфоновую кислоту (MOPSO), имидазол, Ν,Ν-бис(2-гидроксиэтил)-2-аминоэтансульфоновую кислоту (BES), 4-(2-гидроксиэтил)пиперазин-1-этансульфоновую кислоту (HEPES), триэтаноламин, лизин, трис и глицилглицин. Количество незахваченного анестетика амидного типа в композиции можно регулировать на основе коэффициента распределения анестетика путем выбора подходящего значения рН для водного буферного раствора на основании клинического показания и общей дозы инъекции.
[0028] Согласно некоторым вариантам осуществления водный буферный раствор содержит гистидин в концентрации в интервале от 1 мМ до 200 мМ, от 10 мМ до 150 мМ или от 40 мМ до 120 мМ.
[0029] Количество незахваченного анестетика амидного типа зависит от эффективности связывания (АЕ) анестетической композиции, которую определяют посредством способа центрифугирования. Математически количество незахваченного анестетика амидного типа выражается следующим образом:
[0030] 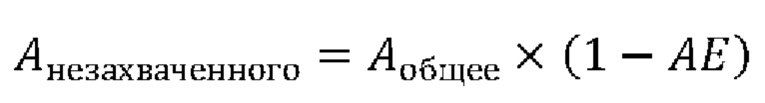
[0031] где Анезахваченного представляет собой количество незахваченного анестетика амидного типа; Аобщее представляет собой общее количество анестетика амидного типа в анестетической композиции; и АЕ получают посредством деления количества анестетика амидного типа, захваченного в везикулы MLV, на общее количество анестетика амидного типа в анестетической композиции. АЕ согласно настоящему изобретению составляет по меньшей мере 60% и, необязательно, от 70% до 95%.
[0032] Молярное соотношение анестетика амидного типа и фосфолипида (мольдекарственного средства:мольфосфолипида, D:PL) везикул MLV с захваченным анестетиком амидного типа предпочтительно составляет по меньшей мере 0,5:1, включая без ограничения 0,7:1, 0,9:1, 1,2:1 или 1,4:1, и медианный диаметр (D50) везикул MLV с захваченным анестетиком амидного типа предпочтительно составляет не менее 1 мкм, например, не менее 5 мкм и, необязательно, находится в интервале от 5 мкм до 20 мкм или от 5 мкм до 15 мкм.
[0033] Концентрация анестетика амидного типа в анестетической композиции должна быть выше 2 мг/мл для достижения клинического терапевтического эффекта. Подходящие концентрации анестетика амидного типа включают без ограничения от 2 мг/мл до 30 мг/мл и от 10 мг/мл до 20 мг/мл. Ограниченное количество незахваченного анестетика в анестетических композициях согласно настоящему изобретению может обеспечивать преимущество, состоящее в достижении более высокой максимальной переносимой дозы (в зависимости от концентрации анестетика в плазме, которая вызывает токсичность в отношении центральной нервной системы и сердечно-сосудистой системы), и его можно использовать для обеспечения быстрого наступления действия. Согласно некоторым вариантам осуществления Cmax после введения композиции ропивакаина составляет 16,7% от Cmax после введения ропивакаина не в форме композиции, что указывает на то, что в пределах окна безопасности этого анестетика может быть использована 6-кратная разрешенная клиническая доза.
[0034] Для клинического применения АЕ согласно определенным вариантам осуществления согласно настоящему изобретению находится в интервале от 70% до 95%. Оставшиеся везикулы MLV с захваченным анестетиком амидного типа действуют в качестве депо для постепенного высвобождения анестетика амидного типа в местную среду таким образом, чтобы поддерживать терапевтически эффективную дозу в локальном месте. Согласно некоторым вариантам осуществления период полувыведения ропивакаина, полученного при однократном SC введении композиции ропивакаина согласно настоящему изобретению, продлевается по меньшей мере в 10 раз по сравнению с периодом полувыведения ропивакаина не в форме композиции. Длительность анестезирующего действия после введения композиции ропивакаина согласно настоящему изобретению значительно превышает длительность анестезирующего действия ропивакаина не в форме композиции.
[0035] Настоящее раскрытие далее будет описано на основании последующих конкретных неограничивающих примеров.
Примеры
[0036] В последующих примерах проиллюстрировано получение и свойства определенных вариантов осуществления настоящего изобретения.
Пример 1
Получение композиций ропивакаина
[0037] HSPC и DMPC приобретали у NOF Corporation. Холестерин приобретали у Sigma-Aldrich, а ропивакаин приобретали у Apollo Scientific или Dishman. Все остальные химические вещества приобретали у Sigma-Aldrich.
[0038] Для получения нескольких HELS применяли различные липидные смеси с ропивакаином в следующих молярных соотношениях: HSPC:холестерин:ропивакаин = 1,5:1:2,2, HSPC:холестерин:ропивакаин = 2:1:2,9, ОМРС:холестерин:ропивакаин = 2:1:2,9 и ОМРС:ОРРО:холестерин:ропивакаин = 1,85:0,15:1:2,9. Липиды и ропивакаин смешивали и затем растворяли в системе трет-бутанол или mpem-бутанол/вода в качестве сорастворителя (1/1, об./об.) с получением жидких структур. Каждый образец жидких структур замораживали в течение от 30 до 60 минут и затем лиофилизировали всю ночь с получением HELS в форме лиофилизированной лепешки.
[0039] Для получения липидных структур для применения в качестве наполнителя-контроля липидную смесь в молярном соотношении ОМРС:холестерин = 2:1 взвешивали и затем растворяли в трет-бутаноле. Полученный образец замораживали в течение 60 минут и затем лиофилизировали всю ночь с получением наполнителя в виде лиофилизированной лепешки.
[0040] Лиофилизированные лепешки гидратировали различными буферами при различных значениях рН при подходящих температурах (например, выше 25°С/температура окружающей среды (AT) для DMPC и выше 60°С для HSPC) в течение от 2 до 10 минут с получением соответственно композиций ропивакаина и композиций наполнителя.
Пример 2
Исследование характеристик композиций ропивакаина
[0041] Эффективность связывания (АЕ) каждого вышеописанного препарата определяли следующим образом. Двести микролитров каждой композиции ропивакаина переносили в центрифугу и крутили в течение 5 мин при 3000×g при 4°С. После отделения супернатанта получали везикулы MLV с захваченным ропивакаином и ресуспендировали их до конечного объема 200 мкл. Эталонный стандарт оптической плотности устанавливали для каждого лекарственного вещества (например, ропивакаина) на основе растворов тестируемого лекарственного вещества с известной концентрацией. Количества лекарственного средства как исходной композиции ропивакаина, так и везикул MLV с захваченным ропивакаином измеряли с использованием спектрофотометра в ультрафиолетовой/видимой области спектра (УФ/видимая область). АЕ представляет собой соотношение количества лекарственного средства в MLV с захваченным ропивакаином и количества лекарственного средства в композиции ропивакаина. D:PL везикул MLV с захваченным ропивакаином рассчитывали посредством умножения D:PL структуры HELS на АЕ. Краткое изложение результатов приведено в Таблице 1.
[0042] Размер частиц каждой композиции ропивакаина измеряли с использованием анализатора лазерной дифракции (LA-950V2, Horiba). Медианный диаметр (D50) везикул MLV с захваченным ропивакаином, образованных гидратированием HELS (ОМРС:холестерин = 2:1) с применением 50 мМ гистидинового буфера (рН 6,5), составлял 11,1±0,3 мкм(n=3).
[0043]

Пример 3
Фармакокинетическое исследование композиций ропивакаина
[0044] Для фармакокинетического (PK) исследования применяли самок крыс линии Спрег-Доули с канюлированной яремной веной (JVC). Крыс держали в камере для содержания, которая работала в режиме суточного цикла 12 часов света/12 часов темноты и которая обеспечивала свободный доступ к воде и пище. Композиции ропивакаина получали в соответствии с Примером 1, где структуры HELS с соотношением ОМРС:холестерин:ропивакаин = 2:1:2,9 гидратировали с применением 50 мМ гистидиновых буферов при рН 5,5, 6,0 и 6,5 соответственно. Ропивакаин не в форме композиции получали посредством растворения моногидрата гидрохлорида ропивакаина в 0,9% NaCl до 24,0 мг/мл. In vivo PK профили соответствующих липосомальных композиций ропивакаина и ропивакаина не в форме композиции, введенных группам крыс (n=3 или 4 на группу), сравнивали после подкожной (SC) инъекции при дозе 20,0 мг/кг ропивакаина. Образцы крови собирали через 15 минут, 1 час, 2 часа, 4 часа, 8 часов, 24 часа, 48 часов и 72 часа после инъекции. Образцы плазмы получали центрифугированием и хранили замороженными при - 80°С до анализа. РК данные, полученные для образцов, анализировали с использованием некомпартментной модели (программное обеспечение WinNonlin®). РК параметры, полученные из этой модели, показаны в Таблице 2.
[0045]

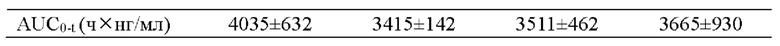
[0046] Cmax композиции ропивакаина была ниже, когда значение рН раствора для гидратации было более щелочным. По сравнению с группой, получавшей ропивакаин не в форме композиции, Cmax составляла 55,5% для композиции ропивакаина, гидратированной с применением раствора гистидина с рН 5,5, 35,5% для композиции ропивакаина, гидратированной с применением раствора гистидина с рН 6,0, и 16,7% для композиции ропивакаина, гидратированной с применением раствора гистидина с рН 6,5. Период полувыведения (Т1/2) для всех трех композиций ропивакаина был значительно пролонгирован по сравнению с Т1/2 ропивакаина не в форме композиции. Исходя из площади под кривой (AUC0-t), от 84,6% до 90,8% ропивакаина высвобождалось в течение 72 часов после инъекции композиции ропивакаина. Результаты РК исследования показаны на фиг. 1. После введения одной и той же дозы ропивакаин в плазме можно было обнаружить до истечения 72 часов во всех группах, получавших композицию ропивакаина, однако ропивакаин нельзя было обнаружить в плазме через 24 часа в группе, получавшей ропивакаин не в форме композиции.
Пример 4
Анестезирующий эффект на мышиной модели рассечения лапы
[0047] Для оценки анестезирующей эффективности после рассечения лапы применяли самцов мышей C57/BL6 дикого типа (возраст 8 недель, Envigo) так, как описано в Anesthesiology. 2003 Oct; 99(4): 1023-7 и J Nemo sci Methods. 1994 Jul; 53(1): 55-63. Камера для содержания мышей работала в режиме суточного цикла 12 часов света/12 часов темноты, обеспечивая выключение источников света и запрещая исследователям и техническим работникам проникать в камеру с мышами во время цикла темноты. Композицию ропивакаина и наполнитель получали согласно Примеру 1, где как структуру HELS с соотношением ОМРС:холестерин:ропивакаин = 2:1:2,9, так и липидную структуру наполнителя с соотношением DMPC:холестерин = 2:1 гидратировали с применением 50 мМ гистидинового буфера при рН 6,0. Ропивакаин не в форме композиции получали посредством растворения ропивакаина в 9,4%-ом растворе сахарозы, содержащем 0,1 Η HCl, в количестве 18,3 мг/мл. In vivo исследование эффективности композиции ропивакаина, ропивакаина не в форме композиции и наполнителя (n=8 на группу) сравнивали после SC инъекции после рассечения лапы при дозе 0,18 мг ропивакаина на рану.
[0048] Перед операцией устанавливали исходные (Т=-2 часа) пороги чувствительности к боли, вызываемой механическим воздействием (фон Фрея), для 32 мышей; исходные пороги чувствительности измеряли на левой задней лапе мышей. Всем 32 мышам делали разрез стопы (длиной 5 мм и глубиной 5 мм) на их левой задней лапе. Через два часа после операции (Т=0 часов) порог чувствительности к боли, вызываемой механическим воздействием, у каждой мыши оценивали снова и подтверждали наличие механической аллодинии у каждой мыши. Тридцать двух мышей рандомизировали на 4 группы (по 8 мышей на группу). При анестезировании с применением анестезии 2,5% изофлурана каждой мыши делали SC инъекцию наполнителя (10 мкл), композиции ропивакаина (10 мкл при концентрации 18,3 мг/мл) или ропивакаина не в форме композиции (10 мкл при концентрации 18,3 мг/мл). 50%-ный порог отдергивания лапы каждой мыши получали с использованием способа «вверх и вниз» в исходный момент времени (-2) и в заданные моменты времени (0, 1, 2, 3, 4, 5, 6, 8 и 24 часа) после обработки посредством SC инъекции.
[0049] Анестезирующая эффективность композиции ропивакаина (круг), ропивакаина не в форме композиции (квадрат) и наполнителя (треугольник) после рассечения лапы показана на фиг. 2А и 2В. Средний 50%-ый порог отдергивания лапы для каждой группы обработки наносили на график; данные, представленные в виде порога отдергивания лапы (g), наносили на график относительно времени (фиг. 2А). Для того, чтобы учесть исходные пороги чувствительности к боли, вызываемой механическим воздействием, у отдельных мышей, 50%-ые пороги отдергивания лапы каждой мыши после операции и обработки нормировали к ее исходному 50%-ому порогу отдергивания лапы (Т=-2 часа). Средний нормализованный 50%-ый порог отдергивания лапы для каждой группы обработки наносили на график; данные, представленные в виде % изменения порога чувствительности к боли, вызываемой механическим воздействием, относительно исходных порогов, наносили на график относительно времени (фиг. 2В). Момент наступления анестезирующего действия композиции ропивакаина и ропивакаина не в форме композиции после введения был схожим, причем порог отдергивания увеличивался от 0,04 г до 0,26 г и 0,22 г соответственно в первый момент времени (Т=1 час). У группы, получавшей композицию ропивакаина, наблюдали наибольшее (~88%) и самое продолжительное (по меньшей мере 5 часов) анестезирующее действие, а у группы, получавшей ропивакаин не в форме композиции, также наблюдали некоторую степень обезболивания по сравнению с группой, получавшей наполнитель.
Пример 5
Анестезирующий эффект на морских свинках с применением модифицированной модели булавочного укола в папулу от 1С инъекции
[0050] Для оценки анестезирующей эффективности применяли самцов морских свинок (возраст 8 недель, около 500 г, Charles River Laboratories) так, как описано в J Pharmacol Exp Ther. 1945; 85: 78-84. Всех морских свинок содержали в групповых клетках в количестве 2 животных на клетку с неограниченным доступом к корму для морских свинок (Healthy Pet®) и воде для того, чтобы обеспечить надлежащий уход и питание. Условия содержания поддерживали на уровне 65-75°F (~18-23°С) с суточным циклом 12 часов света/12 часов темноты. После начального периода акклиматизации к лабораторным условиям в течение 12 дней морские свинки были случайным образом обозначены как №1 - №8. Композицию ропивакаина получали согласно Примеру 1, где HELS с соотношением ОМРС:холестерин:ропивакаин = 2:1:2,9 гидратировали с применением 50 мМ гистидинового буфера при рН 6,0. Ропивакаин не в форме композиции получали посредством растворения моногидрата гидрохлорида ропивакаина в воде высшей степени очистки до 20,5 мг/мл.
[0051] Результаты in vivo исследования эффективности на морских свинках (n=4 или 6 на группу) сравнивали для композиции ропивакаина и ропивакаина не в форме композиции после внутрикожной (1С) инъекции при дозе 3,0 мг ропивакаина на папулу от 1С инъекции и 1,5 мг ропивакаина на папулу от 1С инъекции соответственно. Спины морских свинок выбривали за один день до эксперимента. В день эксперимента на спине перед введением лекарственного средства рисовали четыре области и чувствительность этих областей определяли посредством булавочного укола. Каждое животное получало четыре обозначенных состава в спину, что создавало 4 папулы соответственно. Реакцию на булавочные уколы в месте инъекции проверяли в момент времени 0 мин, 15 мин, 1 час, 2 часа, 4 часа, 5 часов, 6 часов, 8 часов, 10 часов, 12 часов и 23 часа после инъекции состава. Булавочные уколы делали сначала в контрольной области вне папулы в каждый момент времени. После наблюдения нормальной реакции животного на булавочный укол вне папулы делали шесть уколов внутри папулы, и уколы, на которые у морской свинки не было реакции, регистрировали как отсутствие реакции. Животных, у которых наблюдали 100% реакцию на все уколы, не отслеживали в остальные моменты времени.
[0052] Определяли анестезирующие эффекты для группы, получавшей композицию ропивакаина, по сравнению с группой, получавшей ропивакаин не в форме композиции при той же дозе, а результаты представлены на фиг. 3А и 3В. Наступление анестезии как для композиции ропивакаина, так и для ропивакаина не в форме композиции, при дозах как 3,0 мг (фиг. 3А), так и 1,5 мг ропивакаина (фиг. 3В) наблюдали в первый момент времени, в течение 15 мин. У группы, получавшей композицию ропивакаина, наблюдали продолжительные анестезирующие эффекты по сравнению с тем, что наблюдали для группы, получавшей ропивакаин не в форме композиции, для обеих доз. Для дозы 3 мг ропивакаина на папулу от 1С инъекции значительно пролонгированный анестезирующий эффект наблюдали в момент времени 10 часов и 12 часов после инъекции (р<0,05) для группы, получавшей композицию ропивакаина, по сравнению с группой, получавшей ропивакаин не в форме композиции. Для дозы 1,5 мг ропивакаина на папулу от 1С инъекции анестезирующий эффект был также более пролонгированным для группы, получавшей композицию ропивакаина, по сравнению с группой, получавшей ропивакаин не в форме композиции, и значимые различия (р<0,05) наблюдали в момент времени 2 часа, 4 часа и 5 часов после инъекции.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНЕСТЕТИЧЕСКИЕ КОМПОЗИЦИИ С ЗАМЕДЛЕННЫМ ВЫСВОБОЖДЕНИЕМ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2019 |
|
RU2820649C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ДЛЯ ПРИМЕНЕНИЯ ПРИ ЛЕЧЕНИИ БОЛИ | 2020 |
|
RU2812902C2 |
| ЛИПОСОМАЛЬНАЯ КОМПОЗИЦИЯ ДЛЯ ИСПОЛЬЗОВАНИЯ В ПЕРИТОНЕАЛЬНОМ ДИАЛИЗЕ | 2013 |
|
RU2609860C2 |
| ДЕПО-СОСТАВЫ МЕСТНОГО АНЕСТЕТИКА И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2013 |
|
RU2664700C2 |
| СИСТЕМА КОНТРОЛИРУЕМОЙ ДОСТАВКИ | 2005 |
|
RU2429882C2 |
| СПОСОБЫ УМЕНЬШЕНИЯ ОСЛОЖНЕНИЙ ОТ ВНУТРИСУСТАВНОГО СТЕРОИДА | 2019 |
|
RU2806023C2 |
| ЖИРОВЫЕ ЭМУЛЬСИИ, СОДЕРЖАЩИЕ ПРОПОФОЛ | 2003 |
|
RU2335279C2 |
| ДЕПО-СОСТАВЫ ГИДРОФОБНОГО АКТИВНОГО ИНГРЕДИЕНТА И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2013 |
|
RU2678433C2 |
| ЛИПОСОМАЛЬНЫЙ ПРЕПАРАТ ДЛЯ ПРИМЕНЕНИЯ ДЛЯ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННОГО НОВООБРАЗОВАНИЯ | 2017 |
|
RU2756755C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, ПОДХОДЯЩИЕ ДЛЯ СУСТАВНОЙ ДОСТАВКИ, И ИХ ПРИМЕНЕНИЕ ПРИ ЛЕЧЕНИИ СУСТАВНОЙ БОЛИ | 2019 |
|
RU2810788C2 |

Группа изобретений относится к способу получения анестетической композиции с замедленным высвобождением и к композиции для местного введения анестетика субъекту, нуждающемуся в этом, полученной указанным способом. Способ получения анестетической композиции с замедленным высвобождением предусматривает: растворение липидной смеси и по меньшей мере одного анестетика амидного типа в системе растворителя с получением жидкой структуры; удаление системы растворителя из жидкой структуры, где система растворителя содержит трет-бутанол или трет-бутанол/воду в качестве сорастворителя, для получения липидной структуры с высокой степенью захвата (HELS); гидратацию HELS с применением водного буферного раствора при pH от 5,5 до 8,0. Причем в результате гидратации HELS образуются многослойные везикулы (MLV) с захваченным анестетиком амидного типа; причем медианный диаметр везикул MLV с захваченным анестетиком амидного типа составляет по меньшей мере 1 мкм; и молярное соотношение анестетика амидного типа и фосфолипида в везикулах MLV с захваченным анестетиком амидного типа составляет по меньшей мере 0,5:1. Анестетическая композиция, полученная указанным выше способом, содержит многослойные везикулы с захваченным анестетиком амидного тип, медианный диаметр которых составляет не менее 1 мкм, и молярное соотношение анестетика амидного типа и фосфолипида в указанных везикулах составляет не менее 0,5:1. Использование композиции, полученной указанным выше способом, обеспечивает быстрое наступление анестезии и пролонгированную длительность действия местной анестезии с минимальной токсичностью. 2 н. и 10 з.п. ф-лы, 5 ил., 2 табл., 5 пр.
1. Способ получения анестетической композиции с замедленным высвобождением, предусматривающий:
растворение липидной смеси и по меньшей мере одного анестетика амидного типа в системе растворителя с получением жидкой структуры; и
удаление системы растворителя из жидкой структуры, где система растворителя содержит трет-бутанол или трет-бутанол/воду в качестве сорастворителя, для получения липидной структуры с высокой степенью захвата (HELS); и
гидратацию HELS с применением водного буферного раствора при рН от 5,5 до 8,0; причем в результате гидратации HELS образуются многослойные везикулы (MLV) с захваченным анестетиком амидного типа; причем медианный диаметр везикул MLV с захваченным анестетиком амидного типа составляет по меньшей мере 1 мкм; и молярное соотношение анестетика амидного типа и фосфолипида в везикулах MLV с захваченным анестетиком амидного типа составляет по меньшей мере 0,5:1.
2. Способ по п. 1, причем HELS находится в форме лепешки, порошка, твердой массы не в форме пленки или их комбинации.
3. Способ по п. 1, причем стадия удаления системы растворителя предусматривает лиофилизацию или распылительную сушку жидкой структуры.
4. Способ по п. 1, причем липидная смесь содержит холестерин.
5. Способ по п. 4, причем содержание холестерина в мольных процентах в липидной смеси составляет не более 50%.
6. Способ по п. 4, причем по меньшей мере один фосфолипид и холестерин представлены в молярном соотношении от 1:0,01 до 1:1.
7. Способ по любому из пп. 1-6, причем по меньшей мере один анестетик амидного типа представляет собой лидокаин, бупивакаин, левобупивакаин, ропивакаин, мепивакаин, пиррокаин, артикаин или прилокаин.
8. Способ по любому из пп. 1-6, причем по меньшей мере один анестетик амидного типа представляет собой основание ропивакаина.
9. Способ по любому из пп. 1-6, причем водный буферный раствор содержит гистидин в концентрации в интервале от 1 до 200 мМ.
10. Анестетическая композиция с замедленным высвобождением для местного введения местного анестетика субъекту, нуждающемуся в этом, причем композиция получена способом по любому из пп. 1-6, причем медианный диаметр везикул MLV с захваченным анестетиком амидного типа в анестетической композиции составляет не менее 1 мкм; и молярное соотношение анестетика амидного типа и фосфолипида в везикулах MLV с захваченным анестетиком амидного типа составляет не менее 0,5:1.
11. Анестетическая композиция с замедленным высвобождением по п. 10, причем по меньшей мере один анестетик амидного типа представляет собой основание ропивакаина.
12. Анестетическая композиция с замедленным высвобождением по п. 10, причем водный буферный раствор содержит гистидин в концентрации в интервале от 1 до 200 мМ.
| WO 9734582 A1, 25.09.1997 | |||
| US 5244678 A, 14.09.1993 | |||
| US 2015250724 A1, 10.09.2015 | |||
| WO 2008040556 A1, 10.04.2008 | |||
| US 2017035777 A1, 09.02.2017 | |||
| ЛИПОСОМАЛЬНАЯ КОМПОЗИЦИЯ ДЛИТЕЛЬНОГО ДЕЙСТВИЯ С КОНТРОЛИРУЕМЫМ ВЫСВОБОЖДЕНИЕМ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2012 |
|
RU2571077C2 |
Авторы
Даты
2023-03-09—Публикация
2018-08-28—Подача