Изобретение относится к области биотехнологии и регенеративной медицины, связано с получением линий первичных макрофагов с провоспалительными свойствами. Изобретение может быть использовано для проведения экспериментальных исследований для исследования воспалительных процессов и методов управляемой регенерации.
Макрофаги - это клетки врожденного иммунитета, которые первыми обеспечивают защиту организма. Предшественниками макрофагов могут быть три основные субпопуляции моноцитов периферической крови - классическая (CD14++), неклассическая (CD16++) и промежуточная (CD14+CD16+) [Ziegler-Heitbrock и др., 2010]. В ответ на различные факторы моноциты мигрируют из кровяного русла в ткань, где под влиянием микроокружения становятся макрофагами, приобретающими определенный функциональный фенотип - про- или противовоспалительный, M1 и М2 соответственно [Mills и др., 2000]. Провоспалительные макрофаги играют важную роль в борьбе с инфекциями, обладают активной фагоцитарной активностью, а также выделяют спектр цитокиновых и хемокиновых факторов для привлечения клеток адаптивного иммунного ответа. Макрофаги противовоспалительного фенотипа также играют важную роль -способствуют регенерации ткани, а также стимулируют ангиогенез [Martinez и др., 2008].
По многочисленным данным при опухолевых образованиях баланс поляризации макрофагов смещается в сторону М2 и большинство опухолеассоциированных макрофагов (ОАМ) обладают противовоспалительными функциями, что способствует дальнейшему развитию опухоли и стимулирует метастазирование [Mantovani и др.,]. Противоопухолевая активность Ml макрофагов была подтверждена во многих работах, в том числе на животных моделях [Poltavets и др., 2020]. Использование молекулярных методов для активации или подавления экспрессии генов является успешной стратегией для получения линий клеток моноцит-макрофагальной системы со стабильной поляризацией в сторону Ml, которая будет проявлять противоопухолевые свойства. Одним из наиболее используемых методов снижения экспрессии генов является метод нокдауна. Данный подход позволят снизить экспрессию одного или нескольких генов при помощи короткого олигонуклеотида (малые интерферирующие РНК), комплементарного соответствующей молекуле матричной РНК [Gerrick и др., 2018]. Для проведения нокдауна, то есть введения коротких последовательностей в клетки, используются липофильные агенты (трансфекция), а также метод электропорации.
Индолеамин-2,3-диоксигеназа 1 (IDO1) - это внутриклеточный фермент, который катализирует расщепление триптофана [Liu и др., 2018]. Экспрессируемая антигенпрезентирующими клетками IDO играет важную роль в подавлении врожденного иммунитета, также участвует в адаптивном иммунном ответе. Раковые клетки используют данный путь для подавления иммунного ответа хозяина, чтобы облегчить выживание, рост, инвазию и метастазирование. Ингибирование пути индолеамин-2,3-диоксигеназы было использовано при разработке методов лечения рака посредством различных химических ингибиторов IDO1 [Liu и др., 2018]. Природным ингибитором ID01 является BIN1: было показано, что он регулирует экспрессию IDO1 в клетках [Muller и др., 2005].
Ранее в наших работах было доказано, что первичная культура макрофагов, полученных классических моноцитов (CD14++) является наиболее чувствительной к провоспалительным индукторам [Vishnyakova и др., 2021] по сравнению с макрофагами, полученными из неклассической и промежуточной популяций.
Актуальность изучения макрофагов для дальнейшего использования их как в качестве основной мишени, так и в качестве агента для клеточной терапии неоспорима. Ключевой проблемой использования макрофагов в качестве терапевтического инструмента является отсутствие безопасных и эффективных методов модификации (репрограммирования) этих клеток. Решение этой проблемы требует дальнейшего изучения функций генов макрофагов и разработки способов генетической модификаций клеток, подавления и усиления экспрессии тех или иных генов, для получения стабильно активированных в M1 или М2 направлении популяций.
Для получения стабильной первичной культуры макрофагов с провоспалительными свойствами предложен способ проведения нокдауна макрофагов, полученных из CD14+ моноцитов.
Техническим результатом изобретения является клеточная культура макрофагов со стабильным провоспалительным фенотипом, пригодная для проведения исследований in vivo и in vitro.
Для достижения указанного результата, способ получения линии макрофагов с провоспалительными свойствами характеризуется тем, что производят забор крови в пробирки с ЭДТА, кровь разводится раствором фосфатного буфера, содержащего ЭДТА 1:1, азведенная кровь наслаивается на раствор фикола и центрифугируется при комнатной температуру 800 g в течение 20 минут, отбирается лейкоцитарная пленка, промывается дважды раствором фосфатного буфера, содержащего ЭДТА, после единожды раствором фосфатного буфера, содержащего ЭДТА и бычий сывороточный альбумин БСА (1%), полученный осадок клеток инкубируется с магнитными частицами, содержащими антитела к рецептору CD14, фракция клеток проводится через магнитную колонку и смывается раствором фосфатного буфера, содержащего ЭДТА и БСА и получают CD14++ моноциты, которые культивируются в среде RPMI с добавлением бычей сыворотки 10%, 2 мМ L-глутамина, 25 Ед /мл пенициллина, 25 мкг/мл стрептомицина); 20 нг/мл фактора, клетки дифференцируются в макрофаги в течение 7 дней при 5% CO2 и 37°С, после чего проводят нокдаун генов, при этом олигонуклеотиды, использованные для нокдауна, разводятся в фосфатном буфере, пары олигонуклеотидов отжигаются при температуре 95°С 2 минуты, далее инкубируются при комнатной температуре 1 час, для трансфекции клеток используют липофильный агент Lipofectamine 3000 (Thermo Fisher Scientific), после добавления липофильных комплексов к клеткам проводят инкубацию 24 часа, далее производят смену среды на RPMI с добавлением бычей сыворотки 10%, 2 мМ L-глутамина, 25 Ед /мл пенициллина, 25 мкг/мл стрептомицина, через 24 часа после смены среды проводят анализ фенотипа, а также анализ экспрессии провоспалительных генов и получают культуру макрофагов с провоспалительными свойствами.
Способ осуществляют в три этапа:
1. Проводят выделение моноцитов периферической крови
2. Дифференцируют моноциты в макрофаги
3. Проводят нокдаун генов для получения макрофагов с провоспалительными свойствами
Выделение CD14++ моноцитов методом магнитного сортинга
Для выделения моноцитов используют магнитный сортинг с использованием антител к белку CD14. Кровь собирают в пробирки для сбора S-Monovette® EDTA (SARSTEDT, Германия), смешивают в пропорции 1:1 с промывочным раствором autoMACS® (PBS, EDTA) (Miltenyi Biotec BV & Co. KG, Германия). Градиентное центрифугирование проводят с использованием Lympholyte-H (Cedarline), 800 g при комнатной температуре в течение 20 мин. Фракцию мононуклеарных клеток собирают и дважды промывают промывочным раствором при центрифугировании (300 g при 11°С в течение 10 мин). Количество и жизнеспособность оценивают на анализаторе ТС20 (Bio-Rad, США). Клетки подвергают иммуномагнитному сортингу на сепараторе MidiMACS ™ с использованием LS Columns (Miltenyi Biotec, Германия) и магнитных частиц anti-CD 14 MicroBeadsUltraPure (Miltenyi Biotec, Германия) в соответствии с протоколами производителя.
Дифференцирование моноцитов в макрофаги.
CD14++ моноциты культивируют в полной питательной среде RPMI с добавлением 2 мМ L-глутамина, 10% инактивированной нагреванием бычей сыворотки (FBS), 25 Ед /мл пенициллина, 25 мкг/мл стрептомицина с добавлением 20 нг / мл макрофагального колониестимулирующего фактора (M-CSF). В таких условия CD 14++моноциты дифференцируют в макрофаги в течение 7 дней в условиях 5% СО2 при 37°С.
Нокдаун генов макрофагов
Перед трансфекцией олигонуклеотиды отжигают для образования дуплекса: в пробирке смешивают по 30 мкл каждого олигонуклеотида из пары и 15 мкл буфера для отжига. Конечная концентрация дуплекса олигонуклеотида составляет 20 мкМ. Пробирку инкубируют в течение 2 минуты при 95°С, а затем медленно охлаждают до комнатной температуры (в течение 60 минут).
Используют следующие последовательности олигонуклеотидов:
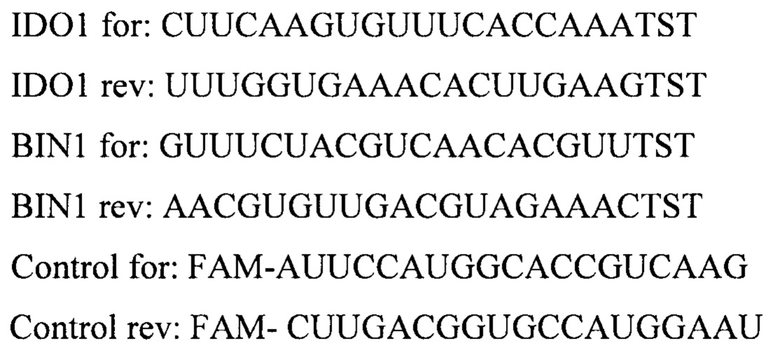
Для проведения нокдауна проводили трансфекцию клеток олигонуклеотидами. Использовали липофильный агент Lipofectamine 3000 (Thermo Fisher Scientific) согласно протоколу производителя. Используемая конечная концентрация олигонуклеотидов составляла 5 нМ.
Пример 1. Получение макрофагов с провоспалительными свойствами
1. Забор крови производится в специализированные пробирки с ЭДТА в объеме 15 мл.
2. Кровь разводится раствором фосфатного буфера, содержащего ЭДТА, в соотношении 1:1.
3. Разведенная кровь наслаивается на раствор фикола (Lympolite Н) и центрифугируется при комнатной температуре 800 g в течение 20 минут.
4. Далее отбирается лейкоцитарная пленка (представляющая собой слой над осадком эритроцитов, состоящий из лейкоцитов и тромбоцитов).
5. Лейкоцитарная пленка промывается дважды раствором фосфатного буфера, содержащего ЭДТА, после единожды раствором фосфатного буфера, содержащего ЭДТА и бычий сывороточный альбумин БСА (1%). Центрифугирование проводится при 300 g и температуре 11°С.
6. Полученный осадок клеток инкубируется с магнитными частицами, содержащими антитела к рецептору CD14 согласно протоколу производителя.
7. Далее фракция клеток проводится через магнитную колонку и смывается раствором фосфатного буфера, содержащего ЭДТА и БСА.
8. Полученные CD14++ моноциты культивируются в среде RPMI с добавлением бычей сыворотки 10%, 2 мМ L-глутамина, 25 Ед /мл пенициллина, 25 мкг/мл стрептомицина (ПанЭко, Россия); 20 нг/мл фактора, стимулирующего дифференцировку моноцитов в макрофаги (M-CSF) (78057.1, STEMCELL Technologies, Канада) в 6-луночных планшетах для культивирования клеток (Costar, США) при плотности 0,5×106 клеток на лунку. Клетки дифференцируются в макрофаги в течение 7 дней при 5% СО2 и 37°С.
9. На 8 день дифференцировки проводится смена среды на Opti-MEM I Reduced Serum Media (Thermo Fisher Scientific).
10. Олигонуклеотиды, использованные для нокдауна, разводятся в фосфатном буфере.
11. Пары олигонуклеотидов отжигаются при температуре 95°С 2 минуты, далее инкубируются при комнатной температуре 1 час.
12. Для трансфекции клеток используется липофильный агент Lipofectamine 3000 (Thermo Fisher Scientific) согласно протоколу производителя. Используемая конечная концентрация олигонуклеотидов составляет 5 нМ.
После добавления липофильных комплексов к клеткам инкубация составила 24 часа, далее производилась смена среды на RPMI с добавлением бычей сыворотки 10%, 2 мМ L-глутамина, 25 Ед /мл пенициллина, 25 мкг/мл стрептомицина (ПанЭко, Россия). Через 24 часа после смены среды проводился анализ фенотипа, а также анализ экспрессии провоспалительных генов.
Пример 2. Оценка эффективности получения макрофагов с провоспалительными свойствами
Для оценки эффективности трансфекции нами была использована контрольная пара олигонуклеотидов с флуорофором FAM. Методом цитофлуориметрического анализа было показано, что эффективность трансфекции при концентрации миРНК 5 нМ составила от 30 до 50%. Несмотря на сложность трансфекции первичной культуры иммунных клеток, нами было продемонстрировано, что это принципиально возможно. В связи с чувствительностью клеток была выбрана наименьшая концентрация олигонуклеотидов (5 нМ), так как при повышении концентрации дуплекса (40 нМ, 80 нМ) наблюдалось неспецифическая активации Ml поляризации.
Чтобы удостоверится в эффективности проведенного нокдауна был проведен ПЦР в реальном времени для оценки экспрессии генов IDO1 и BIN1, на чьи мРНК были исходно подобраны олигонуклеотиды. Согласно данным ПЦР-РВ, что при выбранной последовательности олигонуклеотидов и при их концентрации 5 нМ экспрессия генов IDO1 и BIN1 значимо снижалась по сравнению с контрольной пробой (р≤0.05).
После оценки эффективности трансфекции проводился анализ маркеров M1 поляризации. Проведенный нокдаун по обоим маркерам приводил к активации M1 макрофагального фенотипа. Этот вывод был сделан на основании анализа экспрессии ряда провоспалительных генов, вовлеченные как в рецептор-сигнальные каскады, так и в цитокиновый репертуар макрофагов. В качестве таких M1 маркеров были выбраны гены CCR7 и TNFa. Хемокиновый рецептор CCR7 является членом семейства рецепторов, связанных с G-белком (синоним CD197) и вовлечен в Ml поляризацию макрофагов (Kwiecien, 2019). Фактор некроза опухоли (TNFa) - это провоспалительный цитокин, который в основном продуцируется активированными макрофагами, Т-лимфоцитами и естественными клетками-киллерами. Снижение экспрессии генов IDO1 и BIN1 после проведенного нокдауна приводило к смещению поляризации в сторону M1, так как было показано значимое (р≤0.05) повышение уровня относительной экспрессии маркеров CCR7 и TNFa, которые демонстрируют активацию провоспалительных функций CD14++ макрофагов. Таким образом, нами было показано, что снижение экспрессии генов IDO1 и BIN1 путем таргентного сайленсинга соответствующим мРНК способствует активации провоспалительного фенотипа макрофагов человека моноцитарного происхождения.
Список литературы
1. Gerrick К. Y. и др. Transcriptional profiling identifies novel regulators of macrophage polarization // PLoS One. 2018. T. 13. №12.
2. Liu M. и др. Targeting the IDOl pathway in cancer: From bench to bedside // J. Hematol. Oncol. 2018. T. 11. №1. C. 1-12.
3. Mantovani А. и др. Tumor-associated macrophages and dendritic cells as prototypic type II polarized myeloid populations. // Tumori. T. 89. №5. C. 459-68.
4. Martinez F.O. и др. Macrophage activation and polarization. // Front. Biosci. 2008. T. 13. C. 453-461.
5. Mills CD. и др. M-1/M-2 Macrophages and the Th1/Th2 Paradigm // J. Immunol. 2000. T. 164. №12. C. 6166-6173.
6. Muller A.J. и др. Inhibition of indoleamine 2,3-dioxygenase, an immunoregulatory target of the cancer suppression gene Bin 1, potentiates cancer chemotherapy // Nat. Med. 2005. T. 11. №3. C. 312-319.
7. Poltavets A.S. и др. Macrophage Modification Strategies for Efficient Cell Therapy // Cells 2020, Vol.9, Page 1535. 2020. T. 9. №6. C. 1535.
8. Vishnyakova P. и др. The response of two polar monocyte subsets to inflammation // Biomed. Pharmacother. 2021. T. 139. C. 111614.
9. Ziegler-Heitbrock L. и др. Nomenclature of monocytes and dendritic cells in blood // Blood. 2010. T. 116. №16. C. e74-e80.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ подбора лекарственных средств для реализации фармакологической индукции митохондриальной дисфункции в макрофагах для противоопухолевой терапии | 2023 |
|
RU2810558C1 |
| ПРИМЕНЕНИЕ ЛИПОПОЛИСАХАРИДА ФОТОТРОФНОЙ БАКТЕРИИ RHODOBACTER CAPSULATUS PG В КАЧЕСТВЕ ФАКТОРА, УСИЛИВАЮЩЕГО ДИФФЕРЕНЦИРУЮЩУЮ АКТИВНОСТЬ 1α,25-ДИГИДРОКСИВИТАМИНА D | 2016 |
|
RU2642309C1 |
| СРЕДСТВО ДЛЯ ДИФФЕРЕНЦИРОВКИ МОНОЦИТОПОДОБНЫХ КЛЕТОК | 2014 |
|
RU2590696C2 |
| СОВМЕСТНАЯ ДИФФЕРЕНЦИРОВКА МОНОЦИТОВ ОТ АЛЛОГЕННЫХ ДОНОРОВ | 2013 |
|
RU2668816C2 |
| СПОСОБ ОЦЕНКИ ИММУНОСУПРЕССИВНЫХ СВОЙСТВ МЕЗЕНХИМАЛЬНЫХ СТРОМАЛЬНЫХ КЛЕТОК ЧЕЛОВЕКА | 2013 |
|
RU2539750C2 |
| КЛЕТКИ-ПРЕДШЕСТВЕННИКИ ПЕЧЕНИ ЧЕЛОВЕКА | 2000 |
|
RU2247565C2 |
| РЕКОМБИНАНТНЫЕ ОДНОДОМЕННЫЕ АНТИТЕЛА, СПЕЦИФИЧЕСКИ СВЯЗЫВАЮЩИЕ БЕЛОК F4/80, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИСПОЛЬЗОВАНИЯ ДЛЯ ДЕТЕКЦИИ ЭТОГО БЕЛКА | 2015 |
|
RU2599423C1 |
| СПОСОБЫ ПОЛУЧЕНИЯ ГИБРИДНЫХ/ХИМЕРНЫХ КЛЕТОК И ИХ ПРИМЕНЕНИЕ | 2010 |
|
RU2536978C2 |
| Способ подавления воспалительной реакции в тканях пародонта в эксперименте | 2017 |
|
RU2677642C1 |
| АНТИТЕЛА, СПЕЦИФИЧНЫЕ К BTN2, И ИХ ПРИМЕНЕНИЕ | 2020 |
|
RU2821703C2 |
Изобретение относится к области биотехнологии и регенеративной медицины, а именно к способу получения линии макрофагов с провоспалительными свойствами. Способ получения линии макрофагов с провоспалительными свойствами характеризуется тем, что производят забор крови в пробирки с ЭДТА, кровь разводится раствором фосфатного буфера, содержащего ЭДТА, разведенная кровь наслаивается на раствор фикола и центрифугируется при комнатной температуре, далее отбирается лейкоцитарная пленка, промывается дважды раствором фосфатного буфера, содержащего ЭДТА, после единожды раствором фосфатного буфера, содержащего ЭДТА и бычий сывороточный альбумин БСА (1%), полученный осадок клеток инкубируется с магнитными частицами, содержащими антитела к рецептору CD14, фракция клеток проводится через магнитную колонку и смывается раствором фосфатного буфера, содержащего ЭДТА и БСА, и получают CD14++ моноциты, которые культивируются в среде RPMI с добавлением бычьей сыворотки, L-глутамина, пенициллина, стрептомицина, макрофагального колониестимулирующего фактора, клетки дифференцируются в макрофаги в течение 7 дней, после чего проводят нокдаун генов, при этом олигонуклеотиды, использованные для нокдауна, разводятся в фосфатном буфере, пары олигонуклеотидов отжигаются, далее инкубируются при комнатной температуре, для трансфекции клеток используют липофильный агент Lipofectamine 3000, после добавления липофильных комплексов к клеткам проводят инкубацию 24 часа, далее производят смену среды на RPMI с добавлением бычьей сыворотки, L-глутамина, пенициллина, стрептомицина, через 24 часа после смены среды проводят анализ фенотипа, а также анализ экспрессии провоспалительных генов и получают культуру макрофагов с провоспалительными свойствами, при определенных условиях. Вышеописанный способ позволяет получить клеточную культуру макрофагов со стабильным провоспалительным фенотипом, пригодную для проведения исследований in vivo и in vitro. 2 пр.
Способ получения линии макрофагов с провоспалительными свойствами, характеризующийся тем, что производят забор крови в пробирки с ЭДТА, кровь разводится раствором фосфатного буфера, содержащего ЭДТА 1:1, разведенная кровь наслаивается на раствор фикола и центрифугируется при комнатной температуру 800 g в течение 20 минут, отбирается лейкоцитарная пленка, промывается дважды раствором фосфатного буфера, содержащего ЭДТА, после единожды раствором фосфатного буфера, содержащего ЭДТА и 1% бычий сывороточный альбумин (БСА), полученный осадок клеток инкубируется с магнитными частицами, содержащими антитела к рецептору CD14, фракция клеток проводится через магнитную колонку и смывается раствором фосфатного буфера, содержащего ЭДТА и БСА, и получают CD14++ моноциты, которые культивируются в среде RPMI с добавлением бычьей сыворотки 10%, 2 мМ L-глутамина, 25 Ед /мл пенициллина, 25 мкг/мл стрептомицина, 20 нг/мл макрофагального колониестимулирующего фактора, клетки дифференцируются в макрофаги в течение 7 дней при 5% СО2 и 37°С, после чего проводят нокдаун генов, при этом олигонуклеотиды, использованные для нокдауна, разводятся в фосфатном буфере, пары олигонуклеотидов отжигаются при температуре 95°С 2 мин, далее инкубируются при комнатной температуре 1 ч, для трансфекции клеток используют липофильный агент Lipofectamine 3000 производителя Thermo Fisher Scientific, после добавления липофильных комплексов к клеткам проводят инкубацию 24 ч, далее производят смену среды на RPMI с добавлением бычьей сыворотки 10%, 2 мМ L-глутамина, 25 Ед/мл пенициллина, 25 мкг/мл стрептомицина, через 24 часа после смены среды проводят анализ фенотипа, а также анализ экспрессии провоспалительных генов и получают культуру макрофагов с провоспалительными свойствами.
| ПОЛТАВЕЦ А.С., ВИШНЯКОВА П.А., ЗАЦЕПИН Т.С., ЕЛЬЧАНИНОВ А.В., ФАТХУДИНОВ Т.Х | |||
| Транзиентная модификация макрофагов для активации их провоспалительных функций//Вестник трансплантологии и искусственных органов | |||
| Способ регенерирования сульфо-кислот, употребленных при гидролизе жиров | 1924 |
|
SU2021A1 |
| Т | |||
| Прибор для равномерного смешения зерна и одновременного отбирания нескольких одинаковых по объему проб | 1921 |
|
SU23A1 |
| No S | |||
| С | |||
| Способ подпочвенного орошения с применением труб | 1921 |
|
SU139A1 |
| СПОСОБ ОЦЕНКИ СУММАРНОЙ СЕКРЕТНОЙ АКТИВНОСТИ МАКРОФАГОВ РАЗЛИЧНЫХ КОМПАРТМЕНТОВ В УСЛОВИЯХ ДЛИТЕЛЬНОГО КУЛЬТИВИРОВАНИЯ | 2011 |
|
RU2460783C1 |
| Способ идентификации функционального М1 и М2 фенотипа макрофагов человека, генерированных in vitro из моноцитов крови | 2019 |
|
RU2717024C1 |
| MIA S | |||
| et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
Авторы
Даты
2023-03-22—Публикация
2022-04-22—Подача