ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке по 35 U.S.C. 119(e) испрашивается приоритет Предварительной патентной заявки США серийный No. 62/320183, поданной 8 апреля 2016 г., и Предварительной заявки США серийный No. 62/323971, поданной 18 апреля 2016 г., полное содержание обеих из которых приведено в настоящем документе в качестве ссылки.
ОБЛАСТЬ ТЕХНИКИ
Настоящее описание относится к способам лечения пациента с злокачественной опухолью посредством введения пациенту композиции, содержащей CAR-T-клетки, и введения пациенту малой молекулы, связанной с нацеливающей группой посредством линкера. Описание относится также к композициям для использования в таких способах.
УРОВЕНЬ ТЕХНИКИ
Иммунотерапия, основанная на адоптивном переносе лимфоцитов (например, T-клеток) пациенту, является очень полезной терапией для лечения злокачественных опухолей и других заболеваний. Множество важных усовершенствований сделано в развитии способов иммунотерапии на основе адоптивного переноса лимфоцитов. Среди множества различных типов иммунотерапевтических средств, одним из наиболее многообещающих разработанных иммунотерапевтических средств являются T-клетки, экспрессирующие химерные рецепторы антигенов (CAR-T-клетки). Химерный рецептор антигена (CAR) представляет собой полученный с использованием генной инженерии рецептор, разработанный для нацеливания на специфический антиген, например, антиген опухоли. Это нацеливание может приводить к цитотоксичности против опухоли, например, таким образом, что CAR-T-клетки, экспрессирующие CAR, могут нацеливаться на опухоли и уничтожать опухоли посредством специфических для опухоли антигенов. CAR первого поколения состоят из узнающей области, например, одноцепочечного фрагмента вариабельной области (scFv), происходящей из антитела, для узнавания и связывания антигена, экспрессированного опухолью, и передающий сигналы активации домен, например, цепь CD3ζ T-клеток, может служить сигналом активации T-клетки в CAR. Хотя для CAR-T-клеток показаны положительные результаты in vitro, они имели ограниченный успех в уничтожении заболевания (например, злокачественной опухоли) в клинических исследованиях. Одной из проблем являлась неспособность продлевать активацию и размножение популяции CAR-T-клеток in vivo. Для решения этой проблемы, костимулирующий домен (например, CD137, CD28 или CD134) включен в CAR второго поколения для достижения продленной активации T-клеток in vivo. Добавление костимулирующего домена увеличивает пролиферацию и выживаемость in vivo T-клеток, содержащих CAR, и первоначальные клинические данные показали, что такие конструкции являются многообещающими лекарственными средствами для лечения заболеваний, таких как злокачественная опухоль. Хотя внесены улучшения в виды CAR-T-клеточной терапии, остается несколько проблем. Во-первых, может возникать «нецелевая» токсичность из-за нормальных клеток, экспрессирующих антиген, на который нацелены CAR-T-клетки (например, опухолеассоциированный антиген). Во-вторых, можно обнаружить нерегулируемую активацию CAR-T-клетки, когда быстрое и неконтролируемое уничтожение пораженных заболеванием клеток (например, клеток злокачественных опухолей) CAR-T-клетками индуцирует совокупность метаболических нарушений, называемую синдромом лизиса опухоли, в случае лечения опухоли, или синдром высвобождения цитокинов (CRS), которые могут являться летальными для пациентов. Синдром лизиса опухоли и CRS могут возникать в результате введения CAR-T-клеток, которые невозможно легко регулировать, и которые неконтролируемо активируются. Соответственно, хотя показано, что CAR-T-клетки являются многообещающими в качестве инструмента для лечения заболеваний, таких как злокачественная опухоль, необходимы дополнительные способы CAR-T-клеточной терапии, которые обеспечивают уменьшенную нецелевую токсичность и более точный контроль активации CAR-T-клетки.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Авторы настоящего изобретения открыли способы уменьшения нецелевой токсичности и более точного контроля активации CAR-T-клетки, обеспечивающие важные преимущества для CAR-T-клеточной терапии. В различных вариантах осуществления, описанных в настоящем документе, низкомолекулярный лиганд, связанный с нацеливающей группой посредством линкера, используют в качестве мостика между злокачественной опухолью и CAR-T-клетками, направляющего CAR-T-клетки на злокачественную опухоль для облегчения состояния при злокачественной опухоли. В одном варианте осуществления, «низкомолекулярный лиганд» может представлять собой, например, фолат, DUPA, лиганд NK-1R, лиганд CAIX, лиганд гамма-глутамилтранспептидазы или лиганд CCK2R, каждый из колторых представляет собой низкомолекулярный лиганд, который специфически связывается с клетками злокачественных опухолей (т.е. рецептор для этих лигандов является сверхэкспрессированным на злокачественных опухолях по сравнению с нормальными тканями).
В одном варианте осуществления, «низкомолекулярный лиганд» связан с «нацеливающей группой», которая связывается с CAR, экспрессированным CAR-T-клетками. В различных вариантах осуществления, «нацеливающая группа» может быть выбрана, например, из 2,4-динитрофенола (DNP), 2,4,6-тринитрофенола (TNP), биотина, дигоксигенина, флуоресцеина, изотиоцианата флуоресцеина (FITC), NHS-флуоресцеина, пентафторфенильного сложного эфира (PFP), тетрафторфенильного сложного эфира (TFP), ноттина, центирина и дарпина. «Нацеливающая группа» связывается с узнающей областью полученного с использованием генной инженерии CAR, экспрессированного CAR-T-клетками. Соответственно, узнающая область CAR (например, одноцепочечный фрагмент вариабельной области (scFv) антитела) направлена на «группу-мишень». Таким образом, низкомолекулярный лиганд, связанный с нацеливающей группой посредством линкера, действует в качестве «мостика» между злокачественной опухолью и CAR-T-клетками, направляющего CAR-T-клетки на злокачественную опухоль для облегчения состояния при злокачественной опухоли.
В одном иллюстративном варианте осуществления, авторы изобретения открыли, что изменение дозы низкомолекулекулярного лиганда, связанного с нацеливающей группой посредством линкера (т.е. мостика), может приводить к возможности контроля CRS in vivo. В другом варианте осуществления, авторы изобретения открыли, что изменение линкера в низкомолекулекулярном лиганде, связанном с нацеливающей группой (мостиком), может обеспечивать контроль CRS in vivo после активации CAR-T-клеток. В другом варианте осуществления, комбинации этих способов можно использовать для точного контроля активации CAR-T-клеток и высвобождения цитокинов in vivo. В другом варианте осуществления, аффинность низкомолекулекулярного лиганда для его рецептора на злокачественной опухоли можно изменять для контроля активации CAR-T-клетки, или для достижения специфичности для злокачественной опухоли, избегая токсичности по отношению к нормальным тканям.
В одном варианте осуществления, изобретение относится к способу лечения злокачественной опухоли. Способ включает i) введение пациенту первой дозы соединения или его фармацевтически приемлемой соли, где соединение содержит низкомолекулярный лиганд, связанный с нацеливающей группой посредством линкера, ii) введение пациенту композиции CAR-T-клетки, где CAR-T-клетка содержит CAR, направленный на нацеливающую группу, ii) введение пациенту второй дозы соединения или его фармацевтически приемлемой соли, где вторая доза отличается от первой дозы, и лечение пациента для облегчения состояния при злокачественной опухоли.
В другом варианте осуществления, изобретение относится к способу лечения злокачественной опухоли. Способ включает i) введение пациенту первого конъюгата или его фармацевтически приемлемой соли, ii) введение пациенту композиции CAR-T-клетки, где CAR-T-клетка содержит CAR, направленный на нацеливающую группу, iii) введение пациенту второго конъюгата или его фармацевтически приемлемой соли, где каждый из первого и второго конъюгата содержит низкомолекулярный лиганд, связанный с нацеливающей группой посредством линкера, и где первый конъюгат и второй конъюгат являются различными, и iv) лечение пациента для облегчения состояния при злокачественной опухоли.
В другом варианте осуществления, изобретение относится к способу лечения злокачественной опухоли. Способ включает i) введение пациенту первой дозы первого конъюгата или его фармацевтически приемлемой соли, ii) введение пациенту композиции CAR-T-клетки, где CAR-T-клетка содержит CAR, направленный на нацеливающую группу, ii) введение пациенту второй дозы второго конъюгата или его фармацевтически приемлемой соли, где каждый из первого конъюгата и второго конъюгата содержит низкомолекулярный лиганд, связанный с нацеливающей группой, где первый конъюгат и второй конъюгат являются различными, и где первая доза и вторая доза являются различными, и iv) лечение пациента для облегчения состояния при злокачественной опухоли.
В другом иллюстративном варианте осуществления, изобретение относится к CAR-T-клетке, содержащей нуклеиновую кислоту, содержащую SEQ ID NO: 1. В другом аспекте изобретение относится к CAR-T-клетке, содержащей полипептид, содержащий SEQ ID NO: 2. В другом варианте осуществления, изобретение относится к выделенной нуклеиновой кислоте, содержащей SEQ ID NO: 1 и кодирующей химерный рецептор антигена. В другом варианте осуществления, изобретение относится к полипептиду химерного рецептора антигена, содержащему SEQ ID NO: 2. В другом аспекте изобретение относится к вектору, содержащему SEQ ID NO: 1. В другом иллюстративном варианте осуществления, изобретение относится к вектору, содержащему SEQ ID NO: 1, где вектор представляет собой лентивирусный вектор.
Несколько вариантов осуществления описаны также посредством следующих пронумерованных пунктов:
1. Способ лечения злокачественной опухоли, включающий
i) введение пациенту первой дозы соединения или его фармацевтически приемлемой соли, где соединение содержит низкомолекулярный лиганд, связанный с нацеливающей группой посредством линкера;
ii) введение пациенту композиции CAR-T-клетки, где CAR-T-клетка содержит CAR, направленный на нацеливающую группу;
ii) введение пациенту второй дозы соединения или его фармацевтически приемлемой соли, где вторая доза отличается от первой дозы; и
iv) лечение пациента для облегчения состояния при злокачественной опухоли.
2. Способ лечения злокачественной опухоли, включающий
i) введение пациенту первого конъюгата или его фармацевтически приемлемой соли;
ii) введение пациенту композиции CAR-T-клетки, где CAR-T-клетка содержит CAR, направленный на нацеливающую группу;
iii) введение пациенту второго конъюгата или его фармацевтически приемлемой соли,
где каждый из первого и второго конъюгата содержит низкомолекулярный лиганд, связанный с нацеливающей группой посредством линкера, и где первый конъюгат и второй конъюгат являются различными; и
iv) лечение пациента для облегчения состояния при злокачественной опухоли.
3. Способ лечения злокачественной опухоли, включающий
i) введение пациенту первой дозы первого конъюгата или его фармацевтически приемлемой соли;
ii) введение пациенту композиции CAR-T-клетки где CAR-T-клетка содержит CAR, направленный на нацеливающую группу;
ii) введение пациенту второй дозы второго конъюгата или его фармацевтически приемлемой соли,
где каждый из первого конъюгата и второго конъюгата содержит низкомолекулярный лиганд, связанный с нацеливающей группой, где первый конъюгат и второй конъюгат являются различными, и где первая доза и вторая доза являются различными; и
iv) лечение пациента для облегчения состояния при злокачественной опухоли.
4. Способ по пункту 2 или 3, где линкер в первом конъюгате или его фармацевтически приемлемой соли, и линкер во втором конъюгате или его фармацевтически приемлемой соли являются различными.
5. Способ по пункту 2 или 3, где линкер в первом конъюгате или его фармацевтически приемлемой соли и линкер во втором конъюгате или его фармацевтически приемлемой соли являются одинаковыми.
6. Способ по любому из пунктов 2-5, где лиганд в первом конъюгате или его фармацевтически приемлемой соли и лиганд во втором конъюгате или его фармацевтически приемлемой соли являются различными.
7. Способ по любому из пунктов 2-5, где лиганд в первом конъюгате или его фармацевтически приемлемой соли и лиганд во втором конъюгате или его фармацевтически приемлемой соли являются одинаковыми.
8. Способ по любому из пунктов 2-7, где нацеливающая группа в первом конъюгате или его фармацевтически приемлемой соли и нацеливающая группа во втором конъюгате или его фармацевтически приемлемой соли, являются различными.
9. Способ по любому из пунктов 2-7, где нацеливающая группа в первом конъюгате или его фармацевтически приемлемой соли и нацеливающая группа во втором конъюгате или его фармацевтически приемлемой соли, являются одинаковыми.
10. Способ по любому из пунктов 1-9, где лиганд выбран из фолата, DUPA, лиганда NK-1R, лиганда CAIX, лиганда гамма-глутамилтранспептидазы и лиганда CCK2R.
11. Способ по пункту 10, где лиганд представляет собой фолат.
12. Способ по пункту 10, где лиганд представляет собой лиганд NK-1R.
13. Способ по пункту 10, где лиганд представляет собой DUPA.
14. Способ по пункту 10, где лиганд представляет собой лиганд CCK2R.
15. Способ по пункту 10, где лиганд представляет собой лиганд гамма-глутамилтранспептидазы.
16. Способ по любому из пунктов 1-15, где нацеливающая группа выбрана из 2,4-динитрофенола (DNP), 2,4,6-тринитрофенола (TNP), биотина, дигоксигенина, флуоресцеина, изотиоцианата флуоресцеина (FITC), NHS-флуоресцеина, пентафторфенильного сложного эфира (PFP), тетрафторфенильного сложного эфира (TFP), ноттина, центирина и дарпина.
17. Способ по пункту 16, где нацеливающая группа представляет собой FITC.
18. Способ по пункту 16, где нацеливающая группа представляет собой DNP.
19. Способ по пункту 16, где нацеливающая группа представляет собой TNP.
20. Способ по любому из пунктов 1-19, где линкер содержит полиэтиленгликоль (PEG), полипролин, гидрофильную аминокислоту, сахар, неприродный пептидогликан, поливинилпирролидон и/или плюроник F-127.
21. Способ по пункту 20, где линкер содержит PEG.
22. Способ по любому из пунктов 1-21, где соединение или его фармацевтически приемлемая соль, первый конъюгат или его фармацевтически приемлемая соль, или второй конъюгат или его фармацевтически приемлемая соль имеет формулу
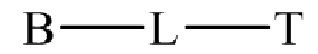 ,
,
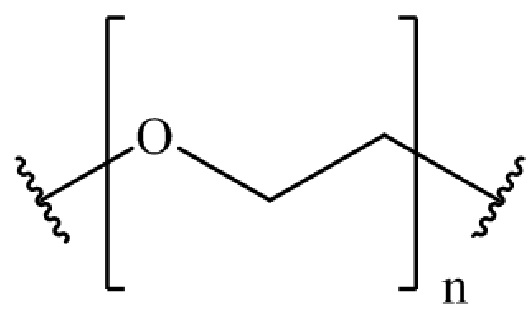
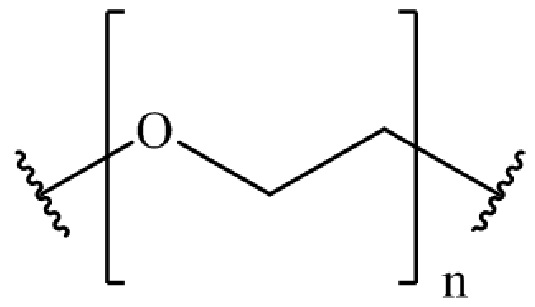
где B представляет собой низкомолекулярный лиганд, L представляет собой линкер, и T представляет собой нацеливающую группу, и где L содержит структуру, имеющую формулу
 ,
,
где n представляет собой целое число от 0 до 200.
23. Способ по пункту 22, где n представляет собой целое число от 0 до 150.
24. Способ по пункту 22, где n представляет собой целое число от 0 до 110.
25. Способ по пункту 22, где n представляет собой целое число от 0 до 20.
26. Способ по пункту 22, где n представляет собой целое число от 15 до 20.
27. Способ по пункту 22, где n представляет собой целое число от 15 до 110.
28. Способ по любому из пунктов 1-27, где линкер содержит PEG, и нацеливающая группа представляет собой FITC или его фармацевтически приемлемую соль.
29. Способ по любому из пунктов 1-28, где доза соединения или его фармацевтически приемлемой соли, первого конъюгата или его фармацевтически приемлемой соли, или второго конъюгата или его фармацевтически приемлемой соли, составляет от приблизительно 10 нмоль/кг до приблизительно 3000 нмоль/кг массы тела пациента.
30. Способ по любому из пунктов 1-29, где доза соединения или его фармацевтически приемлемой соли, первого конъюгата или его фармацевтически приемлемой соли, или второго конъюгата или его фармацевтически приемлемой соли, составляет от приблизительно 50 нмоль/кг до приблизительно 2000 нмоль/кг массы тела пациента.
31. Способ по любому из пунктов 1-30, где доза соединения или его фармацевтически приемлемой соли, первого конъюгата или его фармацевтически приемлемой соли, или второго конъюгата или его фармацевтически приемлемой соли, составляет от приблизительно 100 нмоль/кг до приблизительно 1000 нмоль/кг массы тела пациента.
32. Способ по любому из пунктов 1-31, где доза соединения или его фармацевтически приемлемой соли, первого конъюгата или его фармацевтически приемлемой соли, или второго конъюгата или его фармацевтически приемлемой соли, составляет от приблизительно 100 нмоль/кг до приблизительно 600 нмоль/кг массы тела пациента.
33. Способ по любому из пунктов 1-32, где доза соединения или его фармацевтически приемлемой соли, первого конъюгата или его фармацевтически приемлемой соли, или второго конъюгата или его фармацевтически приемлемой соли, составляет от приблизительно 200 нмоль/кг до приблизительно 500 нмоль/кг массы тела пациента.
34. Способ по любому из пунктов 1-33, где доза соединения или его фармацевтически приемлемой соли, первого конъюгата или его фармацевтически приемлемой соли, или второго конъюгата или его фармацевтически приемлемой соли, составляет от приблизительно 250 нмоль/кг до приблизительно 500 нмоль/кг массы тела пациента.
35. Способ по любому из пунктов 1-34, где злокачественная опухоль выбрана из рака легкого, рака кости, рака поджелудочной железы, рака кожи, рака головы, рака шеи, меланомы кожи, внутриглазной меланомы, рака тела матки, рака яичника, рака эндометрия, рака прямой кишки, рака желудка, рака толстого кишечника, рака молочной железы, трижды отрицательного рака молочной железы, карцинома фаллопиевых труб, карциномы эндометрия, карциномы шейки матки, карциномы влагалища, карцинома вульвы, болезни Ходжкина, рака пищевода, рака тонкого кишечника, злокачественной опухоли эндокринной системы, злокачественной опухоли щитовидной железы, злокачественной опухоли паращитовидной железы, немелкоклеточного рака легкого, злокачественной опухоли надпочечника, саркомы мягких тканей, злокачественной опухоли мочеиспускательного канала, рака предстательной железы, хронического лейкоза, острого лейкоза, лимфоцитарной лимфомы, мезотелиомы плевры, рака мочевого пузыря, лимфомы Беркитта, злокачественной опухоли мочеточника, рака почки, почечноклеточного рака, карциномы почечной лоханки, неоплазий центральной нервной системы (ЦНС), первичной лимфомы ЦНС, опухолей спинного мозга, глиомы ствола головного мозга, аденомы гипофиза и аденокарциномы желудочно-пищеводного соединения.
36. Способ по любому из пунктов 1-11 или 16-35, где злокачественная опухоль представляет собой экспрессирующую рецептор фолата злокачественную опухоль.
37. Способ по пункту 35, где злокачественная опухоль представляет собой рак эндометрия.
38. Способ по пункту 35, где злокачественная опухоль представляет собой немелкоклеточный рак легкого.
39. Способ по пункту 35, где злокачественная опухоль представляет собой рак яичника.
40. Способ по пункту 35, где злокачественная опухоль представляет собой трижды отрицательный рак молочной железы.
41. Способ по любому из пунктов 1-40, где CAR имеет узнающую область, и узнающая область представляет собой одноцепочечный фрагмент вариабельной области (scFv) антитела.
42. Способ по любому из пунктов 1-11, 16-17, или 20-41, где CAR имеет узнающую область, и узнающая область CAR представляет собой одноцепочечный фрагмент вариабельной области (scFv) антитела против FITC.
43. Способ по любому из пунктов 1-42, где CAR имеет костимулирующий домен, и костимулирующий домен выбран из CD28, CD137 (4-1BB), CD134 (OX40) и CD278 (ICOS).
44. Способ по любому из пунктов 1-43, где CAR имеет передающий сигналы активации домен, и передающий сигналы активации домен представляет собой цепь CD3ζ T-клетки или рецептор Fc γ.
45. Способ по любому из пунктов 1-11, 16-17, или 20-41, где CAR имеет узнающую область, и узнающая область представляет собой одноцепочечный фрагмент вариабельной области (scFv) антитела против FITC, где CAR имеет костимулирующий домен, и костимулирующий домен представляет собой CD137 (4-1BB), и где CAR имеет передающий сигналы активации домен, и передающий сигналы активации домен представляет собой цепь CD3ζ T-клетки.
46. Способ по любому из пунктов 1-45, где вводят множество доз соединения или его фармацевтически приемлемой соли, первого конъюгата или его фармацевтически приемлемой соли, или второго конъюгата или его фармацевтически приемлемой соли, и композиции CAR-T-клетки.
47. Способ по любому из пунктов 1-46, где пациента подвергают визуализации перед введением соединения или его фармацевтически приемлемой соли, первого конъюгата или его фармацевтически приемлемой соли, или второго конъюгата или его фармацевтически приемлемой соли, или перед введением композиции CAR-T-клетки.
48. Способ по любому из пунктов 1-47, где соединение или его фармацевтически приемлемая соль, первый конъюгат или его фармацевтически приемлемая соль, или второй конъюгат или его фармацевтически приемлемая соль, не является антителом и не содержит фрагмент антитела.
49. Способ по любому из пунктов 1-48, где нацеливающая группа не представляет собой пептидный эпитоп.
50. Способ по любому из пунктов 1-49, где высвобождения цитокинов, приводящего к «нецелевой» токсичности у пациента, не возникает, и где возникает токсичность CAR-T-клетки по отношению к злокачественной опухоли.
51. Способ по любому из пунктов 1-50, где «нецелевой» токсичности для тканей не возникает у пациента, и где возникает токсичность CAR-T-клетки по отношению к злокачественной опухоли.
52. Способ по любому из пунктов 1-51, где злокачественная опухоль содержит опухоль, где размер опухоли уменьшают у пациента, и где «нецелевой» токсичности не возникает.
53. CAR-T-клетка, содержащая нуклеиновую кислоту, содержащую SEQ ID NO: 1.
54. CAR-T-клетка, содержащая полипептид, содержащий SEQ ID NO: 2.
55. Выделенная нуклеиновая кислота, содержащая SEQ ID NO: 1 и кодирующая химерный рецептор антигена.
56. Полипептид химерного рецептора антигена, содержащий SEQ ID NO: 2.
57. Вектор, содержащий SEQ ID NO: 1.
58. Вектор по пункту 57, где вектор представляет собой лентивирусный вектор.
59. Способ, CAR-T-клетка, выделенная нуклеиновая кислота, кодирующая химерный рецептор антигена (CAR), или полипептид химерного рецептора антигена по любому из пунктов 1-56, где CAR содержит человеческие аминокислотные последовательности.
60. Способ, CAR-T-клетка, выделенная нуклеиновая кислота, кодирующая химерный рецептор антигена (CAR), или полипептид химерного рецептора антигена по любому из пунктов 1-56, где CAR состоит из человеческих аминокислотных последовательностей.
61. Набор, содержащий по меньшей мере два различных типа мостиков, содержащих низкомолекулярный лиганд, связанный с нацеливающей группой, где лиганды по меньшей мере в двух различных типах мостиков являются различными, и где лиганд выбран из фолата, DUPA, лиганда CAIX, лиганда NK-1R, лиганда гамма-глутамилтранспептидазы и лиганда CCK2R.
62. Набор по пункту 61, где лиганд по меньшей мере в одном из мостиков представляет собой лиганд NK-1R.
63. Набор по пункту 61, где лиганд по меньшей мере в одном из мостиков представляет собой лиганд гамма-глутамилтранспептидазы.
64. Набор по пункту 61, где лиганд по меньшей мере в одном из мостиков представляет собой фолат.
65. Набор по любому из пунктов 61-64, где мостик имеет формулу
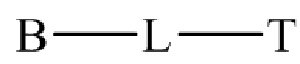 ,
,
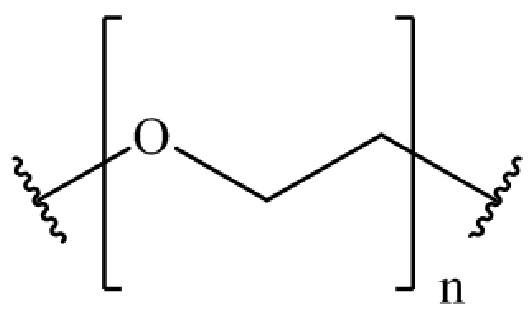
где B представляет собой низкомолекулярный лиганд, L представляет собой линкер, и T представляет собой нацеливающую группу, и где L содержит структуру, имеющую формулу
 ,
,
где n представляет собой целое число от 0 до 200.
66. Набор по пункту 65, где n представляет собой целое число от 0 до 150.
67. Набор по пункту 65, где n представляет собой целое число от 0 до 110.
68. Набор по пункту 65, где n представляет собой целое число от 0 до 20.
69. Набор по пункту 65, где n представляет собой целое число от 15 до 20.
70. Набор по пункту 65, где n представляет собой целое число от 15 до 110.
71. Способ по любому из пунктов 1-10, 16-52 или 59-60, или набор по любому из пунктов 61-70, где лиганд представляет собой лиганд CAIX.
72. Конъюгат формулы
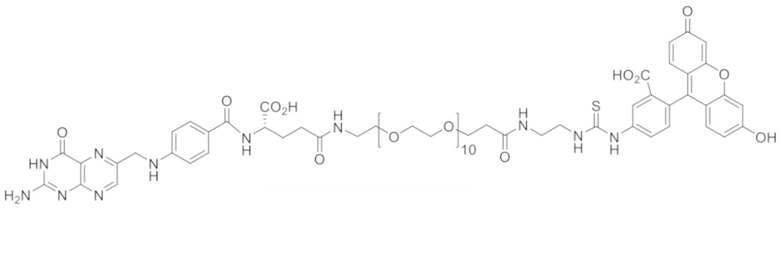 ,
,
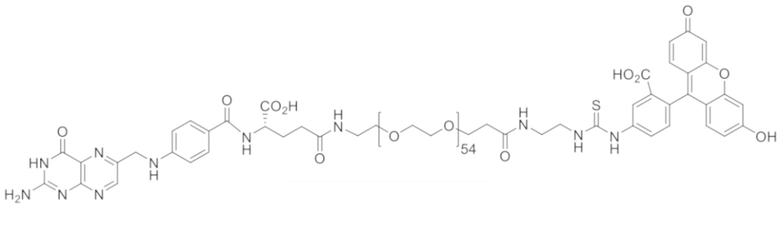 ,
, 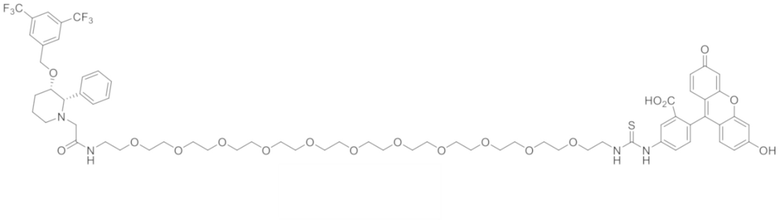 или
или
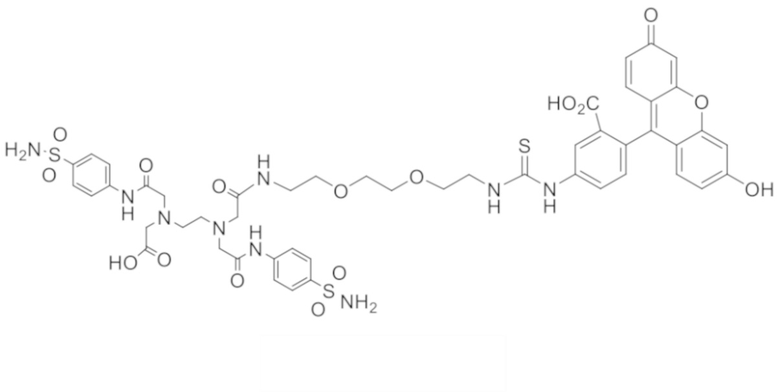 .
.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На ФИГУРАХ 1A-B показана пролиферация CAR-T-клеток с использованием конъюгатов FITC-малая молекула в различных типах клеток с соотношением (CAR-T-клетки):клетки-мишени (клетки злокачественных опухолей) 5:1. На фигуре 1A показана пролиферация CAR-T-клеток в клетках KB (FR+). На фигуре 1B показана пролиферация CAR-T-клеток в клетках HEK293 (NK1R+).
На ФИГУРАХ 2A-F показана продукция провоспалительного цитокина IFN-γ CAR-T-клетками с использованием конъюгатов FITC-малая молекула в различных типах клеток. На фигуре 2A показана продукция провоспалительного цитокина IFN-γ в клетках KB (FR+). На фигуре 2B показана продукция провоспалительного цитокина IFN-γ в клетках LNCaP (PSMA+). На фигуре 2C показана продукция провоспалительного цитокина IFN-γ в клетках HEK293 (NK1R+). На фигуре 2D показана продукция провоспалительного цитокина IFN-γ в клетках KB (FR+) с использованием различных концентраций FITC-фолата. На фигуре 2E показана продукция провоспалительного цитокина IFN-γ в клетках KB (FR+) с использованием различных конъюгатов. На фигуре 2F показана продукция провоспалительного цитокина IFN-γ в клетках KB (FR+) с использованием различных конъюгатов.
На ФИГУРАХ 3A-F показана токсичность in vitro для клеток опухолей, обработанных конъюгатами FITC-малая молекула, в различных типах клеток. На фигуре 3A показана токсичность in vitro для клеток KB (FR+). На фигуре 3B показана токсичность in vitro для клеток LNCaP (PSMA+). На фигуре 3C показана токсичность in vitro для клеток HEK293 (NK1R+). На фигуре 3D показана токсичность in vitro для клеток KB (FR+) как функция различных соотношений E:T (эффекторные клетки:клетки-мишени). На фигуре 3E показана токсичность in vitro для клеток KB (FR+) как функция концентрации FITC-фолата. На фигуре 3F показана токсичность in vitro для клеток KB (FR+) с использованием различных конъюгатов.
На ФИГУРАХ 4A-B показано, что активация CAR-T-клеток коррелирует с уровнем экспрессии антигена опухоли на клетках злокачественных опухолей. На фигуре 4A показан уровень антигена опухоли FRα. Наивысший пик присутствует для клеток KB (FR+). На фигуре 4B показана активация CAR-T-клеток с использованием конъюгатов FITC-малая молекула, как измерено по продукции IFN-γ в клетках MDA-MB-231 и KB.
На ФИГУРАХ 5A-C показаны ксенотрансплантаты опухолей HEK293 (NK1R+) и CAR-T-клеточная терапия, включающая обработку CAR-T-клетками либо с конъюгатом FITC-PEG11-NK1, либо без конъюгата. На фигуре 5A показан объем опухоли, измеренный в течение 24 суток. На фигуре 5B показана масса тела, измеренная в течение 22 суток терапии. На фигуре 5C показан процент CAR-T-клеток в CD3+ T-клетках человека после инъекции CAR-T-клеток вместе с FITC-PEG11-NK1.
На ФИГУРАХ 6A-B показаны органы, собранные от иллюстративных мышей из моделей, использованных на фигурах 5A-C. На фигуре 6A показаны органы, собранные из группы без обработки. На фигуре 6B показаны органы, собранные после двух недель CAR-T-клеточной терапии.
На ФИГУРАХ 7A-C показаны ксенотрансплантаты MDA-MB-231 (FR+) под воздействием CAR-T-клеточной терапии, включающей обработку клеток CAR-T-клетками с конъюгатом FITC-PEG12-фолат, с конъюгатом FITC-фолат или без конъюгата. На фигуре 7A показан объем опухоли, измеренный в течение 23 суток. На фигуре 7B показана масса тела, измеренная в течение 21 суток терапии. На фигуре 7C показан процент CAR-T-клеток в CD3+ T-клетках человека после инъекции CAR-T-клеток.
На ФИГУРАХ 8A-B показаны органы, собранные от иллюстративных мышей из моделей, использованных на фигурах 7A-C. На фигуре 8A показаны органы, собранные из группы без обработки. На фигуре 8B показаны органы, собранные после трех недель CAR-T-клеточной терапии, включающей CAR-T-клетки и конъюгат FITC-PEG12-фолат при 500 нмоль/кг массы тела.
На ФИГУРЕ 9 показаны показатели крови для модели ксенотрансплантата HEK293 (NK1R+) из фигур 5-6 и для модели ксенотрансплантата MDA-MB-231 (FR+) из фигур 7-8.
На ФИГУРЕ 10 показаны различия в цитотоксичности по отношению к клеткам опухолей KB (FR+), обработанным CAR-T-клетками, в зависимости от использованного конъюгата FITC-малая молекула.
На ФИГУРЕ 11 показано изменение в процентах массы тела в модели ксенотрансплантата опухоли KB с использованием CAR-T-клеток с различными концентрациями конъюгата FITC-PEG-12-фолат.
На ФИГУРАХ 12A-C показаны органы, собранные от иллюстративных мышей из моделей ксенотрансплантата KB, показанных на фигуре 11. На фигуре 12A показаны органы, собранные из группы без обработки. На фигуре 12B показаны органы, собранные из группы CAR-T-клеточной терапии, обработанной с использованием 250 нмоль/кг FITC-PEG-12-фолата. На фигуре 12C показаны органы, собранные из группы CAR-T-клеточной терапии, обработанной с использованием CAR-T-клеток и 500 нмоль/кг FITC-PEG-12-фолата.
На ФИГУРЕ 13 показаны показатели крови мышей из модели ксенотрансплантата KB из фигур 11-12.
На ФИГУРАХ 14A-B показаны конструкции, использованные для трансдукции CAR-T. На фигуре 14A показана конструкция CAR4-1BBZ. На фигуре 14B показан лентивирусный вектор.
На ФИГУРАХ 15A-B показан анализ проточной цитометрии трансдуцированных T-клеток. На фигуре 15A показаны нетрансдуцированные клетки. На фигуре 15B показаны трансдуцированные клетки.
На ФИГУРАХ 16A-B показана флуоресцентная микроскопия трансдуцированных CAR-T-клеток. На фигуре 16A показана визуализация GFP, показывающая трансдукцию. На фигуре 16B показан FITC-фолат, локализованный на положительно трансдуцированных клетках.
На ФИГУРЕ 17 показана активация CAR-T-клеток, как измерено по относительной экспрессии CD69 как функция использованного конъюгата.
На ФИГУРЕ 18 показана гетерогенность опухолей для KB, LNCaP и CAR-T-клеток как функция использованного конъюгата.
На ФИГУРАХ 19A-C показана противоопухолевая эффективность, когда одинаковые T-клетки с CAR против FITC (107 клеток) вводили мышам, несущим две различные опухоли, возникшие из двух различных линий клеток (т.е. MDA-MB-231(FR+) и HEK (NK1R+)) на разных боках, после чего только PBS (Фигура 19A), FITC-PEG11-NK1R (500 нмоль/кг) (Фигура 19B), или FITC-PEG11-NK1R (500 нмоль/кг) плюс FITC-PEG12-фолат (500 нмоль/кг) (Фигура 19C) инъецировали каждые вторые сутки. Фигура 19A: (•) FR+ (MDA-MB-231): CAR-T-клетки+PBS, ( ) NK1R+(HEK): CAR-T-клетки+PBS; Фигура 19B: (•) FR+ (MDA-MB-231): CAR-T-клетки+PBS, (
) NK1R+(HEK): CAR-T-клетки+PBS; Фигура 19B: (•) FR+ (MDA-MB-231): CAR-T-клетки+PBS, ( ) NK1R+(HEK): CAR-T-клетки+FITC-PEG11-NK1R (500 нмоль/кг); Фигура 19C: (•) FR+ (MDA-MB-231): CAR-T-клетки+FITC-PEG12-FA (500 нмоль/кг), (
) NK1R+(HEK): CAR-T-клетки+FITC-PEG11-NK1R (500 нмоль/кг); Фигура 19C: (•) FR+ (MDA-MB-231): CAR-T-клетки+FITC-PEG12-FA (500 нмоль/кг), ( ) NK1R+(HEK): CAR-T-клетки+PBS.
) NK1R+(HEK): CAR-T-клетки+PBS.
ОПРЕДЕЛЕНИЯ
Как применяют в настоящем документе, формы единственного числа могут обозначать один или несколько. Как применяют в настоящем документе, «приблизительно» применительно к числовому значению, включающему, например, целые числа, дроби и проценты, как правило, относится к диапазону числовых значений (например, +/- 5% - 10% указанного значения), который специалист в данной области считает эквивалентным указанному значению (например, имеющим такую же функцию или результат). Как применяют в настоящем документе, термины «лечить», «лечение», «обработанный» или «обработка» относятся как к терапевтическому лечению, так и к профилактическому или предупреждающему лечению.
Как применяют в настоящем документе, термины «облегчать», «получение облегчения», «облегчение» или «облегченный» применительно к злокачественной опухоли, могут обозначать уменьшение симптомов злокачественной опухоли, уменьшение размера опухоли, полное или частичное удаление опухоли (например, полный или частичный ответ), получение стабильного заболевания, предотвращение прогрессирования злокачественной опухоли (например, выживаемость без прогрессирования), или любой другой эффект на злокачественную опухоль, который терапевт может рассматривать как терапевтическое или профилактическое лечение злокачественной опухоли.
Как применяют в настоящем документе, термины «вводить», «введение» или «введенный» обозначают все способы введения соединения или его фармацевтически приемлемой соли, первого конъюгата или его фармацевтически приемлемой соли, второго конъюгата или его фармацевтически приемлемой соли, или композиции CAR-T-клетки, описанных в настоящем документе, пациенту, включая, но без ограничения, пероральный (po), внутривенный (iv), внутримышечный (im), подкожный (sc) и чрескожный.
Как применяют в настоящем документе, термин «нецелевая токсичность» обозначает повреждение органа или уменьшение массы пациента, которые являются неприемлемыми для терапевта, лечащего пациента, или любой другой эффект, который является неприемлемым для терапевта, лечащего пациента, такой как B-клеточная аплазия.
Как применяют в настоящем документе, термины «трансдукция» и «трансфекция» используют эквивалентно, и эти термины обозначают введение нуклеиновой кислоты в клетку любым искусственным способом, включая вирусные и невирусные способы.
ПОДРОБНОЕ ОПИСАНИЕ ИЛЛЮСТРАТИВНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
В различных вариантах осуществления, описанных в настоящем документе, низкомолекулярный лиганд, связанный с нацеливающей группой посредством линкера, используют в качестве мостика между злокачественной опухолью и CAR-T-клетками (т.е. цитотоксическими T-клетками, экспрессирующими химерный рецептор антигена). Мостик направляет CAR-T-клетки на злокачественную опухоль для облегчения состояния при злокачественной опухоли. В одном варианте осуществления, «низкомолекулярный лиганд» может представлять собой фолат, лиганд CAIX, DUPA, лиганд NK-1R, лиганд гамма-глутамилтранспептидазы или лиганд CCK2R, каждый из которых представляет собой низкомолекулярный лиганд, который специфически связывается с типом клеток злокачественной опухоли (т.е. рецептор для каждого из этих лигандов является сверхэкспрессированным на злокачественных опухолях по сравнению с нормальными тканями). «Нацеливающая группа», связанная с низкомолекулекулярным лигандом, связывается с узнающей областью полученного с использованием генной инженерии CAR, экспрессированного CAR-T-клетками. Соответственно, узнающая область CAR (например, одноцепочечный фрагмент вариабельной области (scFv) антитела) направлена на «группу-мишень». Таким образом, низкомолекулярный лиганд связанный с нацеливающей группой посредством линкера, действует в качестве мостика между злокачественной опухолью и CAR-T-клетками, направляющего CAR-T-клетки на злокачественную опухоль для облегчения состояния при злокачественной опухоли. В различных вариантах осуществления, мостиком между злокачественной опухолью и CAR-T-клетками может являться любой из конъюгатов, показанных в примерах 5-12.
Мостик представляет собой малую органическую молекулу, так что выведения из кровотока можно быстро достигать (например, за приблизительно 20 минут или менее). В одном аспекте ответ CAR-T-клетки может быть нацелен только на те клетки злокачественных опухолей, которые экспрессируют рецептор для части низкомолекулекулярного лиганда из «мостика», таким образом, уменьшая нецелевую токсичность для нормальных тканей. В другом аспекте активацию CAR-T-клетки можно контролировать благодаря быстрому выведению мостика из кровотока и возможности менять дозу и структуру мостика для регуляции активации CAR-T-клетки. Кроме того, эта система может являться «универсальной», поскольку один тип конструкции CAR-T-клетки можно использовать для нацеливания на широкое множество злокачественных опухолей. В качестве иллюстрации, нацеливающая группа, узнаваемая CAR-T-клеткой, может оставаться постоянной, так что можно использовать один тип конструкции CAR-T-клетки, в то время как низкомолекулярный лиганд, который связывается с злокачественной опухолью, изменяют, чтобы позволять нацеливание на широкое множество злокачественных опухолей. В одном варианте осуществления, авторы изобретения открыли, что изменение дозы низкомолекулекулярного лиганда, связанного с нацеливающей группой посредством линкера (т.е. мостика), может приводить к возможности контролировать CRS in vivo после активации CAR-T-клетки. В другом варианте осуществления, авторы изобретения открыли, что посредством изменения линкера в низкомолекулекулярном лиганде, связанном с нацеливающей группой (мостика), можно контролировать CRS in vivo после активации CAR-T-клетки. В другом варианте осуществления, комбинации этих способов можно использовать для точного контроля активации CAR-T-клетки и высвобождения цитокинов in vivo. В различных вариантах осуществления, описанных в списке пунктов ниже и в формуле изобретения, низкомолекулярный лиганд, связанный с нацеливающей группой посредством линкера, обозначают как «соединение», «первый конъюгат» или «второй конъюгат». Термин «соединение» используют в варианте осуществления, где дозу низкомолекулекулярного лиганда, связанного с нацеливающей группой посредством линкера, меняют для контроля высвобождения цитокинов in vivo. Термины «первый конъюгат» и «второй конъюгат» используют в вариантах осуществления, где два различных конъюгата вводят пациенту. Например, линкер в низкомолекулекулярном лиганде, связанном с нацеливающей группой, можно менять для контроля высвобождения цитокинов in vivo, или конъюгаты можно модифицировать для содержания различных низкомолекулекулярных лигандов или различных нацеливающих групп.
Несколько вариантов осуществления описаны в следующих пронумерованных пунктах:
1. Способ лечения злокачественной опухоли, включающий
i) введение пациенту первой дозы соединения или его фармацевтически приемлемой соли, где соединение содержит низкомолекулярный лиганд, связанный с нацеливающей группой посредством линкера;
ii) введение пациенту композиции CAR-T-клетки где CAR-T-клетка содержит CAR, направленный на нацеливающую группу;
ii) введение пациенту второй дозы соединения или его фармацевтически приемлемой соли, где вторая доза отличается от первой дозы; и
iv) лечение пациента для облегчения состояния при злокачественной опухоли.
2. Способ лечения злокачественной опухоли, включающий
i) введение пациенту первого конъюгата или его фармацевтически приемлемой соли;
ii) введение пациенту композиции CAR-T-клетки где CAR-T-клетка содержит CAR, направленный на нацеливающую группу;
iii) введение пациенту второго конъюгата или его фармацевтически приемлемой соли,
где каждый из первого и второго конъюгата содержит низкомолекулярный лиганд, связанный с нацеливающей группой посредством линкера, и где первый конъюгат и второй конъюгат являются различными; и
iv) лечение пациента для облегчения состояния при злокачественной опухоли.
3. Способ лечения злокачественной опухоли, включающий
i) введение пациенту первой дозы первого конъюгата или его фармацевтически приемлемой соли;
ii) введение пациенту композиции CAR-T-клетки где CAR-T-клетка содержит CAR, направленный на нацеливающую группу;
ii) введение пациенту второй дозы второго конъюгата или его фармацевтически приемлемой соли,
где каждый из первого конъюгата и второго конъюгата содержит низкомолекулярный лиганд, связанный с нацеливающей группой, где первый конъюгат и второй конъюгат являются различными, и где первая доза и вторая доза являются различными; и
iv) лечение пациента для облегчения состояния при злокачественной опухоли.
4. Способ по пункту 2 или 3, где линкер в первом конъюгате или его фармацевтически приемлемой соли и линкер во втором конъюгате или его фармацевтически приемлемой соли являются различными.
5. Способ по пункту 2 или 3, где линкер в первом конъюгате или его фармацевтически приемлемой соли и линкер во втором конъюгате или его фармацевтически приемлемой соли являются одинаковыми.
6. Способ по любому из пунктов 2-5, где лиганд в первом конъюгате или его фармацевтически приемлемой соли и лиганд во втором конъюгате или его фармацевтически приемлемой соли, являются различными.
7. Способ по любому из пунктов 2-5, где лиганд в первом конъюгате или его фармацевтически приемлемой соли и лиганд во втором конъюгате или его фармацевтически приемлемой соли, являются одинаковыми.
8. Способ по любому из пунктов 2-7, где нацеливающая группа в первом конъюгате или его фармацевтически приемлемой соли и нацеливающая группа во втором конъюгате или его фармацевтически приемлемой соли, являются различными.
9. Способ по любому из пунктов 2-7, где нацеливающая группа в первом конъюгате или его фармацевтически приемлемой соли и нацеливающая группа во втором конъюгате или его фармацевтически приемлемой соли, являются одинаковыми.
10. Способ по любому из пунктов 1-9, где лиганд выбран из фолата, DUPA, лиганда CAIX, лиганда NK-1R, лиганда гамма-глутамилтранспептидазы и лиганда CCK2R.
11. Способ по пункту 10, где лиганд представляет собой фолат.
12. Способ по пункту 10, где лиганд представляет собой лиганд NK-1R.
13. Способ по пункту 10, где лиганд представляет собой DUPA.
14. Способ по пункту 10, где лиганд представляет собой лиганд CCK2R.
15. Способ по пункту 10, где лиганд представляет собой лиганд гамма-глутамилтранспептидазы.
16. Способ по любому из пунктов 1-15, где нацеливающая группа выбрана из 2,4-динитрофенола (DNP), 2,4,6-тринитрофенола (TNP), биотина, дигоксигенина, флуоресцеина, изотиоцианата флуоресцеина (FITC), NHS-флуоресцеина, пентафторфенильного сложного эфира (PFP), тетрафторфенильного сложного эфира (TFP), ноттина, центирина и дарпина.
17. Способ по пункту 16, где нацеливающая группа представляет собой FITC.
18. Способ по пункту 16, где нацеливающая группа представляет собой DNP.
19. Способ по пункту 16, где нацеливающая группа представляет собой TNP.
20. Способ по любому из пунктов 1-19, где линкер содержит полиэтиленгликоль (PEG), полипролин, гидрофильную аминокислоту, сахар, неприродный пептидогликан, поливинилпирролидон и/или плюроник F-127.
21. Способ по пункту 20, где линкер содержит PEG.
22. Способ по любому из пунктов 1-21, где соединение или его фармацевтически приемлемая соль, первый конъюгат или его фармацевтически приемлемая соль, или второй конъюгат или его фармацевтически приемлемая соль, имеет формулу
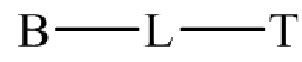 ,
,
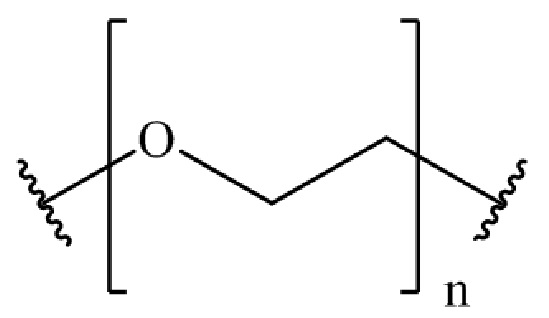
где B представляет собой низкомолекулярный лиганд, L представляет собой линкер, и T представляет собой нацеливающую группу, и где L содержит структуру, имеющую формулу
 ,
,
где n представляет собой целое число от 0 до 200.
23. Способ по пункту 22, где n представляет собой целое число от 0 до 150.
24. Способ по пункту 22, где n представляет собой целое число от 0 до 110.
25. Способ по пункту 22, где n представляет собой целое число от 0 до 20.
26. Способ по пункту 22, где n представляет собой целое число от 15 до 20.
27. Способ по пункту 22, где n представляет собой целое число от 15 до 110.
28. Способ по любому из пунктов 1-27, где линкер содержит PEG, и нацеливающая группа представляет собой FITC или его фармацевтически приемлемую соль.
29. Способ по любому из пунктов 1-28, где доза соединения или его фармацевтически приемлемой соли, первого конъюгата или его фармацевтически приемлемой соли, или второго конъюгата или его фармацевтически приемлемой соли составляет от приблизительно 10 нмоль/кг до приблизительно 3000 нмоль/кг массы тела пациента.
30. Способ по любому из пунктов 1-29, где доза соединения или его фармацевтически приемлемой соли, первого конъюгата или его фармацевтически приемлемой соли, или второго конъюгата или его фармацевтически приемлемой соли составляет от приблизительно 50 нмоль/кг до приблизительно 2000 нмоль/кг массы тела пациента.
31. Способ по любому из пунктов 1-30, где доза соединения или его фармацевтически приемлемой соли, первого конъюгата или его фармацевтически приемлемой соли, или второго конъюгата или его фармацевтически приемлемой соли составляет от приблизительно 100 нмоль/кг до приблизительно 1000 нмоль/кг массы тела пациента.
32. Способ по любому из пунктов 1-31, где доза соединения или его фармацевтически приемлемой соли, первого конъюгата или его фармацевтически приемлемой соли, или второго конъюгата или его фармацевтически приемлемой соли, составляет от приблизительно 100 нмоль/кг до приблизительно 600 нмоль/кг массы тела пациента.
33. Способ по любому из пунктов 1-32, где доза соединения или его фармацевтически приемлемой соли, первого конъюгата или его фармацевтически приемлемой соли, или второго конъюгата или его фармацевтически приемлемой соли составляет от приблизительно 200 нмоль/кг до приблизительно 500 нмоль/кг массы тела пациента.
34. Способ по любому из пунктов 1-33, где доза соединения или его фармацевтически приемлемой соли, первого конъюгата или его фармацевтически приемлемой соли, или второго конъюгата или его фармацевтически приемлемой соли составляет от приблизительно 250 нмоль/кг до приблизительно 500 нмоль/кг массы тела пациента.
35. Способ по любому из пунктов 1-34, где злокачественная опухоль выбрана из рака легкого, рака кости, рака поджелудочной железы, рака кожи, рака головы, рака шеи, меланомы кожи, внутриглазной меланомы, рака тела матки, рака яичника, рака эндометрия, рака прямой кишки, рака желудка, рака толстого кишечника, рака молочной железы, трижды отрицательного рака молочной железы, карциномы фаллопиевых труб, карциномы эндометрия, карциномы шейки матки, карциномы влагалища, карциномы вульвы, болезни Ходжкина, рака пищевода, рака тонкого кишечника, злокачественной опухоли эндокринной системы, злокачественной опухоли щитовидной железы, злокачественной опухоли паращитовидной железы, немелкоклеточного рака легкого, злокачественной опухоли надпочечника, саркомы мягких тканей, злокачественной опухоли мочеиспускательного канала, рака предстательной железы, хронического лейкоза, острого лейкоза, лимфоцитарной лимфомы, мезотелиомы плевры, рака мочевого пузыря, лимфомы Беркитта, злокачественной опухоли мочеточника, рака почки, почечноклеточного рака, карциномы почечной лоханки, неоплазий центральной нервной системы (ЦНС), первичной лимфомы ЦНС, опухолей спинного мозга, глиомы ствола головного мозга, аденомы гипофиза и аденокарциномы желудочно-пищеводного соединения.
36. Способ по любому из пунктов 1-11 или 16-35, где злокачественная опухоль представляет собой экспрессирующую рецептор фолата злокачественную опухоль.
37. Способ по пункту 35, где злокачественная опухоль представляет собой рак эндометрия.
38. Способ по пункту 35, где злокачественная опухоль представляет собой немелкоклеточный рак легкого.
39. Способ по пункту 35, где злокачественная опухоль представляет собой рак яичника.
40. Способ по пункту 35, где злокачественная опухоль представляет собой трижды отрицательный рак молочной железы.
41. Способ по любому из пунктов 1-40, где CAR имеет узнающую область, и узнающая область представляет собой одноцепочечный фрагмент вариабельной области (scFv) антитела.
42. Способ по любому из пунктов 1-11, 16-17 или 20-41, где CAR имеет узнающую область, и узнающая область CAR представляет собой одноцепочечный фрагмент вариабельной области (scFv) антитела против FITC.
43. Способ по любому из пунктов 1-42, где CAR имеет костимулирующий домен, и костимулирующий домен выбран из CD28, CD137 (4-1BB), CD134 (OX40) и CD278 (ICOS).
44. Способ по любому из пунктов 1-43, где CAR имеет передающий сигналы активации домен, и передающий сигналы активации домен представляет собой цепь CD3ζ T-клетки или рецептор Fc γ.
45. Способ по любому из пунктов 1-11, 16-17 или 20-41, где CAR имеет узнающую область, и узнающая область представляет собой одноцепочечный фрагмент вариабельной области (scFv) антитела против FITC, где CAR имеет a костимулирующий домен, и костимулирующий домен представляет собой CD137 (4-1BB), и где CAR имеет передающий сигналы активации домен, и передающий сигналы активации домен представляет собой цепь CD3ζ T-клетки.
46. Способ по любому из пунктов 1-45, где вводят множество доз соединения или его фармацевтически приемлемой соли, первого конъюгата или его фармацевтически приемлемой соли, или второго конъюгата или его фармацевтически приемлемой соли, и композиции CAR-T-клетки.
47. Способ по любому из пунктов 1-46, где пациента подвергают визуализации перед введением соединения или его фармацевтически приемлемой соли, первого конъюгата или его фармацевтически приемлемой соли, или второго конъюгата или его фармацевтически приемлемой соли, или перед введением композиции CAR-T-клетки.
48. Способ по любому из пунктов 1-47, где соединение или его фармацевтически приемлемая соль, первый конъюгат, или его фармацевтически приемлемая соль, или второй конъюгат, или его фармацевтически приемлемая соль, не является антителом и не содержит фрагмент антитела.
49. Способ по любому из пунктов 1-48, где нацеливающая группа не представляет собой пептидный эпитоп.
50. Способ по любому из пунктов 1-49, где высвобождения цитокинов приводящего к «нецелевой» токсичности у пациента, не возникает, и где возникает токсичность CAR-T-клетки по отношению к злокачественной опухоли.
51. Способ по любому из пунктов 1-50, где «нецелевой» токсичности для тканей не возникает у пациента и, где возникает токсичность CAR-T-клетки по отношению к злокачественной опухоли.
52. Способ по любому из пунктов 1-51, где злокачественная опухоль содержит опухоль, где размер опухоли уменьшают у пациента, и где «нецелевой» токсичности не возникает.
53. CAR-T-клетка, содержащая нуклеиновую кислоту, содержащую SEQ ID NO: 1.
54. CAR-T-клетка, содержащая полипептид, содержащий SEQ ID NO: 2.
55. Выделенная нуклеиновая кислота, содержащая SEQ ID NO: 1 и кодирующая химерный рецептор антигена.
56. Полипептид химерного рецептора антигена, содержащий SEQ ID NO: 2.
57. Вектор, содержащий SEQ ID NO: 1.
58. Вектор по пункту 57, где вектор представляет собой лентивирусный вектор.
59. Способ, CAR-T-клетка, выделенная нуклеиновая кислота, кодирующая химерный рецептор антигена (CAR), или полипептид химерного рецептора антигена по любому из пунктов 1-56, где CAR содержит человеческие аминокислотные последовательности.
60. Способ, CAR-T-клетка, выделенная нуклеиновая кислота, кодирующая химерный рецептор антигена (CAR), или полипептид химерного рецептора антигена по любому из пунктов 1-56, где CAR состоит из человеческих аминокислотных последовательностей.
61. Набор, содержащий по меньшей мере два различных типа мостиков, содержащих низкомолекулярный лиганд, связанный с нацеливающей группой, где лиганды по меньшей мере в двух различных типах мостиков являются различными, и где лиганд выбран из фолата, DUPA, лиганда CAIX, лиганда NK-1R, лиганда гамма-глутамилтранспептидазы и лиганда CCK2R.
62. Набор по пункту 61, где лиганд по меньшей мере в одном из мостиков представляет собой лиганд NK-1R.
63. Набор по пункту 61, где лиганд по меньшей мере в одном из мостиков представляет собой лиганд гамма-глутамилтранспептидазы.
64. Набор по пункту 61, где лиганд по меньшей мере в одном из мостиков представляет собой фолат.
65. Набор по любому из пунктов 61-64, где мостик имеет формулу
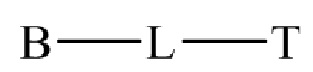 ,
,
где B представляет собой низкомолекулярный лиганд, L представляет собой линкер, и T представляет собой нацеливающую группу, и где L содержит структуру, имеющую формулу
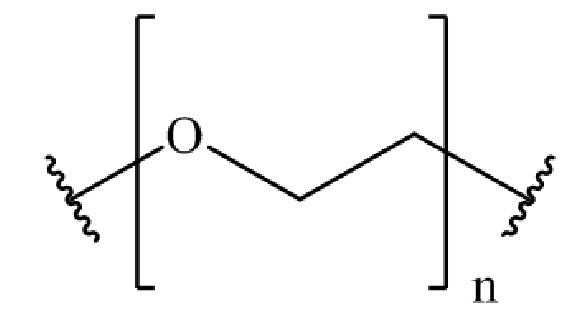 ,
,
где n представляет собой целое число от 0 до 200.
66. Набор по пункту 65, где n представляет собой целое число от 0 до 150.
67. Набор по пункту 65, где n представляет собой целое число от 0 до 110.
68. Набор по пункту 65, где n представляет собой целое число от 0 до 20.
69. Набор по пункту 65, где n представляет собой целое число от 15 до 20.
70. Набор по пункту 65, где n представляет собой целое число от 15 до 110.
71. Способ по любому из пунктов 1-10, 16-52 или 59-60, или набор по любому из пунктов 61-70, где лиганд представляет собой лиганд CAIX.
72. Конъюгат формулы
 ,
,
 ,
,  или
или
 .
.
Как описано в настоящем документе, «пациент» может представлять собой человека или, в случае ветеринарных применений, пациент может представлять собой лабораторное, сельскохозяйственное, домашнее или дикое животное. В одном аспекте пациент может представлять собой лабораторное животное, такое как грызун (например, мышь, крысу, хомяка и т.д.), кролик, обезьяна, шимпанзе, домашнее животное, такое как собака, кошка или кролик, сельскохозяйственное животное, такое как корова, лошадь, свинья, овца, коза, или дикое животное в неволе, такое как медведь, панда, лев, тигр, леопард, слон, зебра, жираф, горилла, дельфин или кит. В способах, описанных в настоящем документе, стадия «лечения пациента для облегчения состояния при злокачественной опухоли» может содержать стадии введения в способе или состоять из них.
В одном иллюстративном варианте осуществления, низкомолекулярный лиганд, связанный с нацеливающей группой посредством линкера (мостика), содержит изотиоцианат флуоресцеина (FITC), связанный с низкомолекулекулярным лигандом. Злокачественная опухоль сверхэкспрессирует рецептор для низкомолекулекулярного лиганда. В качестве второго компонента, например, цитотоксические T-клетки трансформируют для экспрессии CAR, содержащего scFv против FITC. В этом аспекте, CAR нацеливают на FITC, покрывая поверхность злокачественной опухоли молекулами FITC в результате связывания низкомолекулекулярного лиганда с злокачественной опухолью. Таким образом, можно избегать токсичности для нормальных, не являющихся мишенью клеток. Когда экспрессирующие CAR против FITC T-клетки связывают FITC, CAR-T-клетки активируются, и состояние при злокачественной опухоли облегчается (например, посредством уничтожения клеток злокачественных опухолей). В одном варианте осуществления, «низкомолекулярный лиганд» может представлять собой фолат, DUPA (лиганд, связанный положительными по PSMA клетками злокачественной опухоли предстательной железы человека и другими типами клеток злокачественных опухолей), лиганд NK-1R (рецепторы для лиганда NK-1R обнаружены, например, на злокачественных опухолях ободочной кишки и поджелудочной железы), лиганд CAIX (рецепторы для лиганда CAIX обнаружены, например, на злокачественных опухолях почки, яичника, вульвы и молочной железы), лиганд гамма-глутамилтранспептидазы (транспептидаза сверхэкспрессирована, например, в злокачественных опухолях яичника, злокачественных опухолях толстого кишечника, злокачественных опухолях печени, астроцитарных глиомах, меланомах и лейкозах) или лиганд CCK2R (рецепторы для лиганда CCK2R обнаружены на злокачественных опухолях щитовидной железы, легкого, поджелудочной железы, яичника, головного мозга, желудка, стромы желудочно-кишечного тракта и ободочной кишки, среди прочих), каждый из которых представляет собой низкомолекулярный лиганд, который специфически связывается с типом клеток злокачественной опухоли (т.е. рецептор для каждого из этих лигандов может являться сверхэкспрессированным в злокачественных опухолях по сравнению с нормальными тканями). В одном варианте осуществления, производное DUPA может представлять собой лиганд из низкомолекулекулярных лигандов, связанных с нацеливающей группой, и производные DUPA описаны в WO 2015/057852, содержание которой приведено в настоящем документе в качестве ссылки.
В одном варианте осуществления, низкомолекулярный лиганд представляет собой фолат. Фолат может представлять собой фолиевую кислоту, аналог фолиевой кислоты или другую молекулу, связывающую рецептор фолата. В различных вариантах осуществления, аналоги фолата, которые можно использовать, включают фолиновую кислоту, птерополиглутаминовую кислоту и связывающие рецептор фолата птеридины, такие как тетрагидроптерины, дигидрофолаты, тетрагидрофолаты и их деаза- и дидеаза- аналоги. Термины «деаза-» и «дидеаза-»аналоги относится к известным в данной области аналогам, имеющим замену на атомы углерода одного или двух атомов азота в природной структуре фолиевой кислоты. Например, деаза-аналоги включают 1-деаза-, 3-деаза-, 5-деаза-, 8-деаза- и 10-деаза-аналоги. Дидеаза-аналоги включают, например, 1,5 дидеаза-, 5,10-дидеаза-, 8,10-дидеаза- и 5,8-дидеаза-аналоги. Вышеуказанные аналоги фолиевой кислоты общепринятым образом называют «фолаты», что отражает их способность связываться с рецепторами фолата. Другие связывающие рецептор фолата аналоги включают аминоптерин, аметоптерин (метотрексат), N10-метилфолат, 2-деаминогидроксифолат, деаза-аналоги, такие как 1-деазаметоптерин или 3-деазаметоптерин, и 3',5'-дихлор-4-амино-4-дезокси-N10-метилптероилглутаминовую кислоту (дихлорметотрексат).
В одном варианте осуществления, низкомолекулярный лиганд может иметь массу менее, чем приблизительно 10000 Дальтон, менее, чем приблизительно 9000 Дальтон, менее, чем приблизительно 8000 Дальтон, менее, чем приблизительно 7000 Дальтон, менее, чем приблизительно 6000 Дальтон, менее, чем приблизительно 5000 Дальтон, менее, чем приблизительно 4500 Дальтон, менее, чем приблизительно 4000 Дальтон, менее, чем приблизительно 3500 Дальтон, менее, чем приблизительно 3000 Дальтон, менее, чем приблизительно 2500 Дальтон, менее, чем приблизительно 2000 Дальтон, менее, чем приблизительно 1500 Дальтон, менее, чем приблизительно 1000 Дальтон, или менее, чем приблизительно 500 Дальтон. В другом варианте осуществления, низкомолекулярный лиганд может иметь массу от приблизительно 1 до приблизительно 10000 Дальтон, от приблизительно 1 до приблизительно 9000 Дальтон, от приблизительно 1 до приблизительно 8000 Дальтон, от приблизительно 1 до приблизительно 7000 Дальтон, от приблизительно 1 до приблизительно 6000 Дальтон, от приблизительно 1 до приблизительно 5000 Дальтон, от приблизительно 1 до приблизительно 4500 Дальтон, от приблизительно 1 до приблизительно 4000 Дальтон, от приблизительно 1 до приблизительно 3500 Дальтон, от приблизительно 1 до приблизительно 3000 Дальтон, от приблизительно 1 до приблизительно 2500 Дальтон, от приблизительно 1 до приблизительно 2000 Дальтон, от приблизительно 1 до приблизительно 1500 Дальтон, от приблизительно 1 до приблизительно 1000 Дальтон, или от приблизительно 1 до приблизительно 500 Дальтон.
В одном аспекте «нацеливающая группа», которая связывается с CAR, экспрессированным CAR-T-клетками, может быть выбрана, например, из 2,4-динитрофенола (DNP), 2,4,6-тринитрофенола (TNP), биотина, дигоксигенина, флуоресцеина, изотиоцианата флуоресцеина (FITC), NHS-флуоресцеина, пентафторфенильного сложного эфира (PFP), тетрафторфенильного сложного эфира (TFP), ноттина, центирина и дарпина. Идентичность нацеливающей группы ограничена только тем, что ее должен узнавать и связывать CAR, предпочтительно, специфически, и тем, что она имеет относительно низкую молекулярную массу. В различных аспектах, иллюстративные нацеливающие группы представляют собой гаптены, включающие низкомолекулярные органические молекулы.
В одном иллюстративном варианте осуществления, нацеливающая группа может иметь следующую иллюстративную структуру:
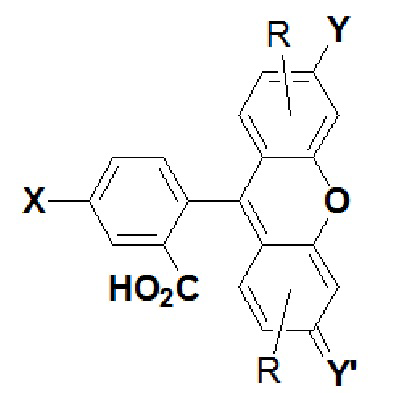 ,
,
где X представляет собой кислород, азот или серу, и где X присоединен к линкеру L; Y представляет собой ORa, NRa2 или NRa3+; и Y' представляет собой O, NRa или NRa2+; где каждый R независимо выбран в каждом случает из H, фтора, сульфоновой кислоты, сульфоната и их солей, и т.п.; и Ra представляет собой водород или алкил.
В одном иллюстративном аспекте, линкер в соединении или его фармацевтически приемлемой соли, первом конъюгате или его фармацевтически приемлемой соли, втором конъюгате или его его фармацевтически приемлемой соли, описанных в настоящем документе, может представлять собой прямую связь (например, в результате реакции группы изотиоцианата FITC и свободной аминогруппы низкомолекулекулярного лиганда), или связь можно осуществлять через промежуточный линкер. В одном варианте осуществления, промежуточный линкер, если он присутствует, может представлять собой любой биосовместимый линкер, известный в данной области, такой как двухвалентный линкер. В одном иллюстративном варианте осуществления, двухвалентный линкер может содержать от приблизительно 1 до приблизительно 30 атомов углерода. В другом иллюстративном варианте осуществления, двухвалентный линкер может содержать от приблизительно 2 до приблизительно 20 атомов углерода. В других вариантах осуществления, используют двухвалентные линкеры с более низкой молекулярная масса (т.е. линкеры, имеющие приблизительную молекулярную массу от приблизительно 30 до приблизительно 300). В другом варианте осуществления, длины линкеров, являющихся пригодными, включают, но без ограничения, линкеры, имеющие 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39 или 40, или более атомов.
В различных вариантах осуществления, низкомолекулярный лиганд, связанный с нацеливающей группой, может иметь формулу
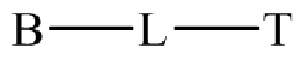 ,
,
где B представляет собой низкомолекулярный лиганд, L представляет собой линкер, и T представляет собой нацеливающую группу, и где L содержит структуру, имеющую формулу
 ,
,
где n представляет собой целое число от 0 до 200. В другом варианте осуществления, n может представлять собой целое число от 0 до 150, от 0 до 110, от 0 до 100, от 0 до 90, от 0 до 80, от 0 до 70, от 0 до 60, от 0 до 50, от 0 до 40, от 0 до 30, от 0 до 20, от 0 до 15, от 0 до 14, от 0 до 13, от 0 до 12, от 0 до 11, от 0 до 10, от 0 до 9, от 0 до 8, от 0 до 7, от 0 до 6, от 0 до 5, от 0 до 4, от 0 до 3, от 0 до 2, от 0 до 1, от 15 до 16, от 15 до 17, от 15 до 18, от 15 до 19, от 15 до 20, от 15 до 21, от 15 до 22, от 15 до 23, от 15 до 24, от 15 до 25, от 15 до 26, от 15 до 27, от 15 до 28, от 15 до 29, от 15 до 30, от 15 до 31, от 15 до 32, от 15 до 33, от 15 до 34, от 15 до 35, от 15 до 36, от 15 до 37, от 15 до 38, от 15 до 39, от 15 до 40, от 15 до 50, от 15 до 60, от 15 до 70, от 15 до 80, от 15 до 90, от 15 до 100, от 15 до 110, от 15 до 120, от 15 до 130, от 15 до 140, от 15 до 150, или n может представлять собой 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 50, 60, 70, 80, 90, 100, 108, 110, 120, 130, 140 или 150.
В другом варианте осуществления, линкер может представлять собой двухвалентный линкер, который может включать один или несколько спейсеров. Иллюстративные спейсеры показаны в следующей таблице. Описаны следующие неограничивающие, иллюстративные спейсеры, где * обозначает точку присоединения к низкомолекулекулярному лиганду или нацеливающей группе.
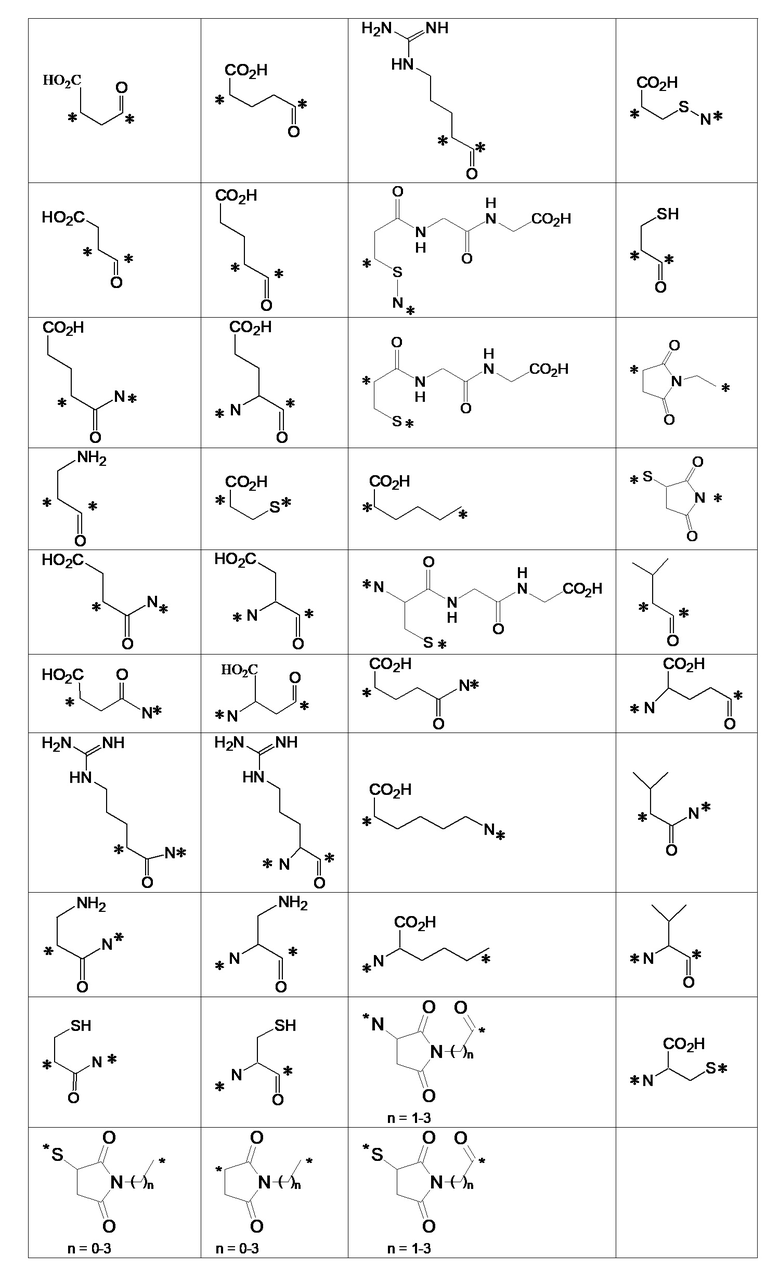
В других вариантах осуществления, низкомолекулярный лиганд, связанный с нацеливающей группой (мостиком), может иметь любую из следующих структур.
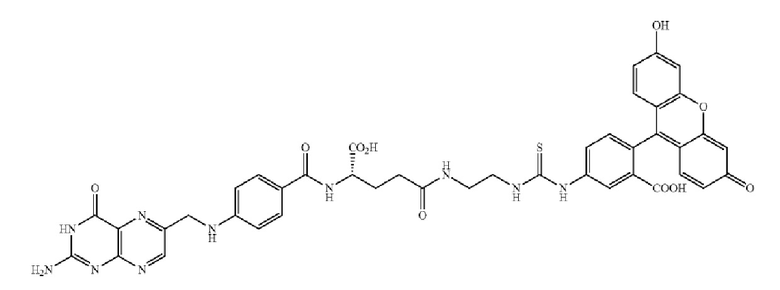
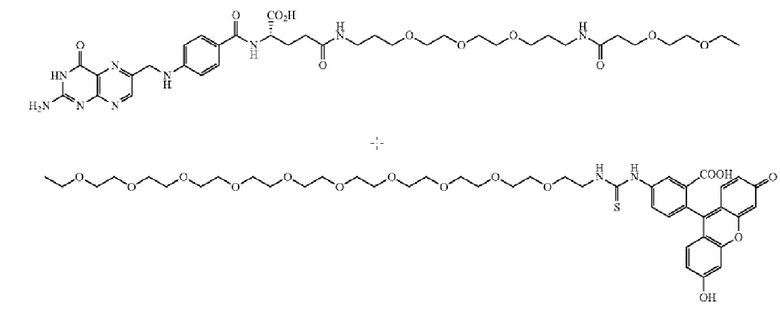
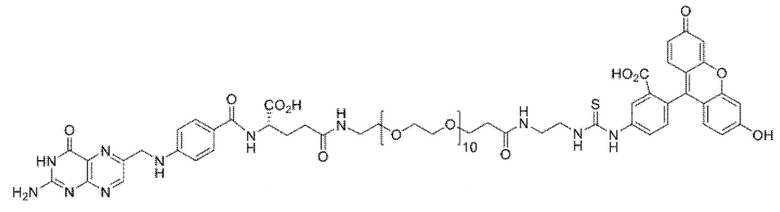
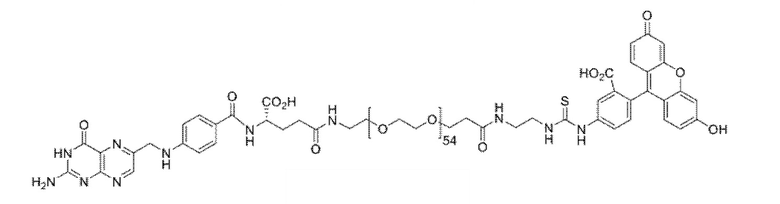
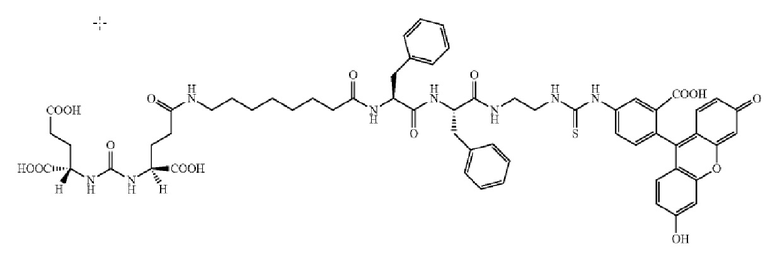
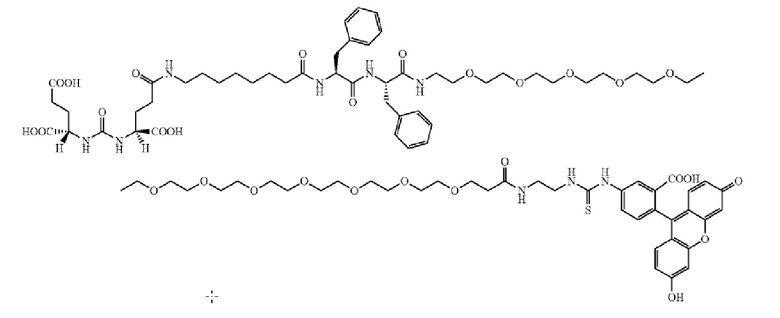
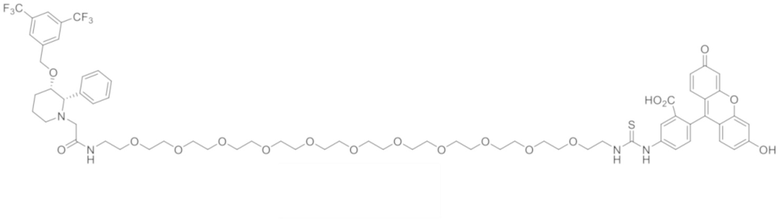
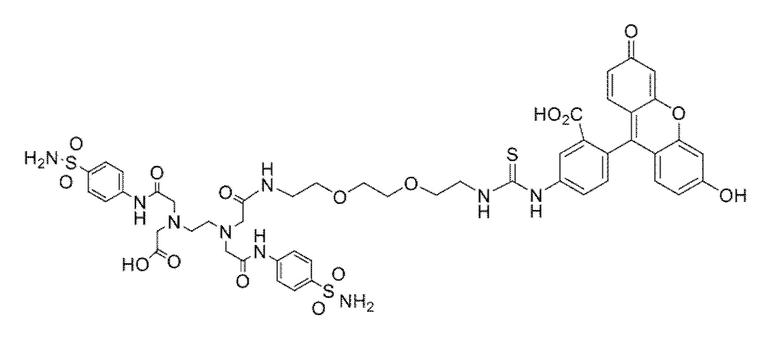
В других вариантах осуществления, соединение или его фармацевтически приемлемая соль, первый конъюгат или его фармацевтически приемлемая соль, или второй конъюгат или его фармацевтически приемлемая соль, не является антителом и не содержит фрагмент антитела. В другом варианте осуществления, нацеливающая группа не представляет собой пептидный эпитоп.
В одном иллюстративном аспекте, различные типы конъюгатов (например, первый конъюгат и второй конъюгат) можно вводить пациенту. Например, линкер в первом конъюгате или его фармацевтически приемлемой соли, и линкер во втором конъюгате или его фармацевтически приемлемой соли могут являться одинаковыми или различными. В другом аспекте лиганд в первом конъюгате или его фармацевтически приемлемой соли, и лиганд во втором конъюгате или его фармацевтически приемлемой соли могут являться одинаковыми или различными. В другом иллюстративном варианте осуществления, нацеливающая группа в первом конъюгате или его фармацевтически приемлемой соли, и нацеливающая группа во втором конъюгате или его фармацевтически приемлемой соли, могут являться одинаковыми или различными. Любые комбинации этих вариантов осуществления также предусматривают вместе с любыми комбинациями доз, описанными ниже.
В другом варианте осуществления, настоящее изобретение относится к набору, содержащему по меньшей мере два различных типа мостиков, где мостики содержат низкомолекулярный лиганд, связанный с нацеливающей группой, где лиганды по меньшей мере в двух различных типах мостиков являются различными, и где лиганд выбран из фолата, DUPA, лиганда CAIX, лиганда NK-1R, лиганда гамма-глутамилтранспептидазы и лиганда CCK2R. В этом варианте осуществления, лиганд по меньшей мере в одном из мостиков может представлять собой лиганд NK-1R, лиганд гамма-глутамилтранспептидазы, фолат, лиганд CAIX, лиганд CCK2R или DUPA.
В другом аспекте мостик в наборе может иметь формулу
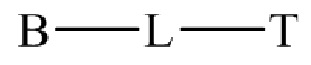 ,
,
где B представляет собой низкомолекулярный лиганд, L представляет собой линкер, и T представляет собой нацеливающую группу, и где L содержит структуру, имеющую формулу
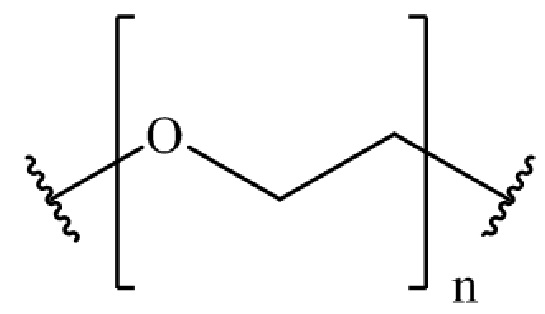 ,
,
где n представляет собой целое число от 0 до 200. В других вариантах осуществления, n может представлять собой целое число от 0 до 150, целое число от 0 до 110, целое число от 0 до 20, целое число от 15 до 20, целое число от 15 до 110, или любое другое значение или диапазон целых чисел, описанные в настоящем документе для n.
Предусматривают «фармацевтически приемлемую соль» низкомолекулекулярного лиганда, связанного с нацеливающей группой посредством линкера. Как применяют в настоящем документе, термин «фармацевтически приемлемая соль» относится к солям, противоионы которых можно использовать в качестве лекарственных средств. Такие соли включают 1) кислотно-аддитивные соли, которые можно получать посредством реакции свободного основания исходного соединения с неорганическими кислотами, такими как соляная кислота, бромистоводородная кислота, азотная кислота, фосфорная кислота, серная кислота и перхлорная кислота и т.п., или с органическими кислотами, такими как уксусная кислота, щавелевая кислота, (D) или (L) яблочная кислота, малеиновая кислота, метансульфоновая кислота, этансульфоновая кислота, п-толуолсульфоновая кислота, салициловая кислота, виннокаменная кислота, лимонная кислота, янтарная кислота или малоновая кислота и т.п.; или 2) соли, сформированные, когда протон кислоты, присутствующий в исходном соединении, либо заменяют на ион металла, например, ион щелочного металла, щелочноземельный ион или ион алюминия; либо координируют с органическим основанием, таким как этаноламин, диэтаноламин, триэтаноламин, триметамин, N-метилглюкамин и т.п. Фармацевтически приемлемые соли хорошо известны специалистам в данной области, и любую такую фармацевтически приемлемую соль можно предусматривать в связи с вариантами осуществления, описанными в настоящем документе.
В различных вариантах осуществления, пригодные кислотно-аддитивные соли формируют из кислот, формирующих нетоксичные соли. Иллюстративные примеры включают соли ацетат, аспартат, бензоат, безилат, бикарбонат/карбонат, бисульфат/сульфат, борат, камсилат, цитрат, эдизилат, эзилат, формат, фумарат, глуцептат, глюконат, глюкуронат, гексафторфосфат, гибензат, гидрохлорид/хлорид, гидробромид/бромид, гидроиодид/иодид, изетионат, лактат, малат, малеат, малонат, мезилат, метилсульфат, нафтилат, 2-напсилат, никотинат, нитрат, оротат, оксалат, пальмитат, памоат, фосфат/гидрофосфат/дигидрофосфат, сахарат, стеарат, сукцинат, тартрат, тозилат и трифторацетат.
В различных вариантах осуществления, пригодные основные соли формируют из оснований, формирующих нетоксичные соли. Иллюстративные примеры включают соли аргинина, бензатина, кальция, холина, диэтиламина, диоламина, глицина, лизина, магния, меглумина, оламина, калия, натрия, трометамина и цинка. Можно формировать также полусоли кислот и оснований, например, соль гемисульфат и соли гемикальция.
В одном иллюстративном аспекте, соединение или его фармацевтически приемлемая соль, первый конъюгат или его фармацевтически приемлемая соль, или второй конъюгат или его фармацевтически приемлемая соль, описанные в настоящем документе, могут содержать один или несколько хиральных центров, или могут иным образом являться способными существовать в форме множества стереоизомеров. Соответственно, различные варианты осуществления могут включать чистые стереоизомеры, так же как смеси стереоизомеров, такие как энантиомеры, диастереомеры и энантиомерно или диастереомерно обогащенные смеси. В одном аспекте соединение или его фармацевтически приемлемая соль, первый конъюгат или его фармацевтически приемлемая соль, второй конъюгат или его фармацевтически приемлемая соль, описанные в настоящем документе, могут являться способными существовать в форме геометрических изомеров. Соответственно, различные варианты осуществления могут включать чистые геометрические изомеры или смеси геометрических изомеров.
В некоторых аспектах, соединение или его фармацевтически приемлемая соль, первый конъюгат или его фармацевтически приемлемая соль, второй конъюгат или его фармацевтически приемлемая соль, описанные в настоящем документе, могут существовать в несольватированных формах, так же как в сольватированных формах, включая гидратированные формы. Как правило, сольватированные формы являются эквивалентными несольватированным формам и включены в объем настоящего изобретения.
В способах, описанных в настоящем документе, используют также цитотоксические T-лимфоциты, сконструированные для экспрессии химерного рецептора антигена (CAR), который узнает и связывает нацеливающую группу (например, FITC, DNP или TNP) из мостика. В одном варианте осуществления, CAR, описанные в настоящем документе, содержат три домена, включая 1) узнающую область (например, одноцепочечный фрагмент вариабельной области (scFv) антитела), которая специфически узнает и связывает нацеливающую группу, 2) костимулирующий домен, который увеличивает пролиферацию и выживаемость T-лимфоцитов, и 3) передающий сигналы активации домен, образующий сигнал активации цитотоксических T-лимфоцитов. В различных аспектах, в качестве неограничивающих примеров, можно использовать области scFv антител, связывающих фолат, DUPA, лиганд CAIX, лиганд NK-1R, лиганд гамма-глутамилтранспептидазы или лиганд CCK2R. В иллюстративных вариантах осуществления, области scFv могут быть получены из (i) антитела, известного в данной области, которое связывает нацеливающую группу, (ii) антитела, впервые полученного с использованием выбранной нацеливающей группы, такой как гаптен, и (iii) вариантов последовательности, происходящих из областей scFv таких антител, например, областей scFv, имеющих по меньшей мере приблизительно 80%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98%, по меньшей мере приблизительно 99%, или по меньшей мере приблизительно 99,5% идентичность последовательности с аминокислотной последовательностью области scFv, из которых они происходят.
В любых вариантах осуществления, описанных в настоящем документе, связывающая часть CAR может представлять собой, например, одноцепочечный фрагмент вариабельной области (scFv) антитела, фрагмент Fab, Fv, Fc или (Fab')2, и т.п.
В одном аспекте костимулирующий домен служит для увеличения пролиферации и выживаемости цитотоксических T-лимфоцитов после связывания CAR с нацеливающей группой. Пригодные костимулирующие домены включают: 1) CD28, 2) CD137 (4-1BB), член семейства рецептора фактора некроза опухоли (TNF), 3) CD134 (OX40), член суперсемейства рецепторов TNFR и 4) CD278 (ICOS), суперсемейство костимулирующих молекул CD28, экспрессированных на активированных T-клетках, или их комбинации. Пригодные костимулирующие домены включают также, но без ограничения, CD27, CD30, CD150, DAP10 и NKG2D или их комбинации. Специалисту в данной области понятно, что варианты последовательностей этих костимулирующих доменов можно использовать без неблагоприятного влияния на изобретение, где варианты имеют такую же или сходную активность, как и домен, на основе которого они смоделированы. В различных вариантах осуществления, такие варианты имеют по меньшей мере приблизительно 80%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98%, по меньшей мере приблизительно 99%, или по меньшей мере приблизительно 99,5% идентичность последовательности с аминокислотной последовательностью домена, из которого они происходят. В иллюстративном варианте осуществления, передающий сигналы активации домен служит для активации цитотоксических T-лимфоцитов после связывания CAR с нацеливающей группой. Пригодные передающие сигналы активации домены включают цепь CD3ζ T-клетки и рецептор Fc γ. Специалисту в данной области понятно, что можно использовать варианты последовательности этих отмеченных передающих сигналы активации доменов, где варианты имеют такую же или сходную активность, как и домен, на основе которого они смоделированы. В различных вариантах осуществления, варианты имеют по меньшей мере приблизительно 80%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98%, по меньшей мере приблизительно 99%, или по меньшей мере приблизительно 99,5% идентичность последовательности с аминокислотной последовательностью домена, из которого они происходят. В одном аспекте конструкции, кодирующие CAR, получают с использованием способов генной инженерии. Такие способы подробно описаны в Sambrook et al., «Molecular Cloning: A Laboratory Manual», 3rd Edition, Cold Spring Harbor Laboratory Press, (2001), содержание которого приведено в настоящем документе в качестве ссылки. В качестве примера, можно получать плазмидный или вирусный экспрессирующий вектор (например, лентивирусный вектор, ретровирусный вектор, sleeping beauty и piggyback (системы транспозона/транспозазы, включающие не опосредованную вирусами систему доставки гена CAR)), который кодирует слитый белок, содержащий узнающую область, один или несколько костимулирующих доменов и передающий сигналы активации домен, находящиеся в рамке считывания и связанные в направлении от 5' до 3'. В других вариантах осуществления, другие расположения являются приемлемыми и включают узнающую область, передающий сигналы активации домен, и один или несколько костимулирующих доменов. Расположение узнающей области в слитом белке в общем является таким, чтобы обеспечивать экспонирование этой области на внешней поверхности клетки. В одном варианте осуществления, CAR могут включать дополнительные элементы, такие как сигнальный пептид, для обеспечения надлежащего экспорта слитого белка к поверхности клетки, трансмембранный домен для обеспечения поддержания слитого белка как интегрированного в мембрану белка, и шарнирный домен, придающий гибкость узнающей области и позволяющий сильное связывание с нацеливающей группой. Схемы иллюстративного CAR показаны на фигурах 14A и B, где слитая белковая последовательность вставлена в лентивирусный экспрессирующий вектор, и где «SP» представляет собой сигнальный пептид, CAR представляет собой CAR против FITC, присутствует шарнир CD8α и трансмембранная (TM) область, костимулирующий домен представляет собой 4-1BB, и передающий сигналы активации домен представляет собой CD3ζ. В одном аспекте последовательность нуклеиновой кислоты вставки CAR представлена как SEQ ID NO:1, и аминокислотная последовательность вставки представлена как SEQ ID NO:2.
В одном варианте осуществления, CAR имеет узнающую область, и узнающая область представляет собой одноцепочечный фрагмент вариабельной области (scFv) антитела против FITC, костимулирующий домен, и костимулирующий домен представляет собой CD137 (4-1BB), и передающий сигналы активации домен, и передающий сигналы активации домен представляет собой цепь CD3ζ T-клетки. Специалисту в данной области хорошо известно, что scFv против FITC и scFv против флуоресцеина являются эквивалентными терминами.
В одном варианте осуществления, цитотоксические T-лимфоциты можно получать с использованием генной инженерии для экспрессии конструкций CAR посредством трансфекции популяции цитотоксических T-лимфоцитов экспрессирующим вектором, кодирующим конструкцию CAR. Подходящие способы получения трансдуцированной популяции T-лимфоцитов, экспрессирующих выбранную конструкцию CAR, хорошо известны специалисту в данной области, и описаны в Sambrook et al., «Molecular Cloning: A Laboratory Manual», 3rd Edition, Cold Spring Harbor Laboratory Press, (2001), содержание которого приведено в настоящем документе в качестве ссылки.
В различных вариантах осуществления, настоящее изобретение относится к CAR-T-клеткам, содержащим нуклеиновую кислоту из SEQ ID NO: 1 или 3. В другом варианте осуществления, настоящее изобретение относится к CAR-T-клеткам, содержащим полипептид из SEQ ID NO: 2. В другом иллюстративном аспекте, настоящее изобретение относится к выделенной нуклеиновой кислоте, содержащей SEQ ID NO: 1 или 3 и кодирующей химерный рецептор антигена. В другом варианте осуществления, настоящее изобретение относится к полипептиду химерного рецептора антигена, содержащему SEQ ID NO: 2. В другом варианте осуществления, настоящее изобретение относится к вектору, содержащему SEQ ID NO: 1 или 3. В другом аспекте настоящее изобретение относится к лентивирусному вектору, содержащему SEQ ID NO: 1 или 3. В другом варианте осуществления, SEQ ID NO: 2 может содержать человеческие или гуманизированные аминокислотные последовательности, или состоять из них. В каждом из этих вариантов осуществления, предусмотрен вариант последовательностей нуклеиновой кислоты или аминокислотных последовательностей, имеющих по меньшей мере приблизительно 80%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98%, по меньшей мере приблизительно 99%, или по меньшей мере приблизительно 99,5% идентичность последовательности с SEQ ID NO: 1, SEQ ID NO: 2, или SEQ ID NO: 3. В другом варианте осуществления, последовательность нуклеиновой кислоты может представлять собой вариант последовательности нуклеиновой кислоты, имеющий по меньшей мере приблизительно 80%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98%, по меньшей мере приблизительно 99%, или по меньшей мере приблизительно 99,5% идентичность последовательности с SEQ ID NO: 1 или 3, при условии, что вариант последовательности кодирует полипептид из SEQ ID NO: 2. В другом варианте осуществления, последовательность нуклеиновой кислоты или аминокислотная последовательность может представлять собой вариант последовательности нуклеиновой кислоты или аминокислотной последовательности, имеющий по меньшей мере приблизительно 80%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98%, по меньшей мере приблизительно 99%, или по меньшей мере приблизительно 99,5% идентичность последовательности с SEQ ID NO: 1 или SEQ ID NO: 2, или SEQ ID NO: 3, вместе с фрагментом из 200 нуклеиновых кислот или 200 аминокислот из SEQ ID NO: 1 или SEQ ID NO: 2, или SEQ ID NO: 3. Определение процента идентичности или сходства между последовательностями можно выполнять, например, с использованием программы GAP (программное обеспечение Genetics Computer Group,; в настоящее время доступно через Accelrys на http://www.accelrys.com), и выравнивания можно выполнять с использованием, например, алгоритма ClustalW (программное обеспечение VNTI, InforMax Inc.). Можно проводить поиск в базе данных последовательностей с использованием представляющей интерес последовательности нуклеиновой кислоты или аминокислотной последовательности. Алгоритмы для поиска в базе данных, как правило, основаны на программном обеспечении BLAST (Altschul et al., 1990). В некоторых вариантах осуществления, процент идентичности можно определять на протяжении всей последовательности нуклеиновой кислоты или аминокислотной последовательности.
В объем изобретения включены также нуклеиновые кислоты, комплементарные нуклеиновой кислоте, представленной SEQ ID NO: 1 или 3, и нуклеиновые кислоты, которые гибридизуются с нуклеиновой кислотой, представленной SEQ ID NO: 1 или 3, или нуклеиновые кислоты, которые гибридизуются с комплементарной ей нуклеиновой кислотой в условиях высокой строгости. В соответствии с изобретением, «условия высокой строгости» обозначают гибридизацию при 65°C в 5X SSPE и 50% формамиде, и отмывку при 65°C в 0,5X SSPE. Условия высокой строгости, низкой строгости и умеренной строгости гибридизации описаны в Sambrook et al., «Molecular Cloning: A Laboratory Manual», 3rd Edition, Cold Spring Harbor Laboratory Press, (2001), содержание которого приведено в настоящем документе в качестве ссылки. В некоторых иллюстративных аспектах, гибридизация происходит на протяжении всей нуклеиновой кислоты. В одном варианте осуществления, цитотоксические T-лимфоциты, используемые для получения CAR-T-клеток, используемых в способах, описанных в настоящем документе, могут представлять собой аутологичные клетки, хотя гетерологичные клетки тоже можно использовать, например, когда пациента, подвергаемого лечению, подвергали высокой дозе химиотерапии или радиационной терапии для повреждения иммунной системы пациента. В одном варианте осуществления, можно использовать аллогенные клетки.
В одном аспекте цитотоксические T-лимфоциты можно получать от пациента способами, хорошо известными в данной области. Например, цитотоксические T-клетки можно получать посредством сбора периферической крови от пациента, подвергания крови центрифугированию в градиенте плотности фиколла, и затем использования набора для отрицательного выделения T-клеток (такого как EasySep™ T Cell Isolation Kit) для выделения популяции цитотоксических T-клеток из периферической крови. В одном иллюстративном варианте осуществления, популяция цитотоксических T-лимфоцитов не обязательно должна являться чистой и может содержать другие клетки, такие как другие T-клетки, моноциты, макрофаги, клетки естественные киллеры и B-клетки. В одном аспекте собираемая популяция может содержать по меньшей мере приблизительно 90% выбранного типа клеток, по меньшей мере приблизительно 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% выбранного типа клеток. В одном варианте осуществления, после получения цитотоксических T лимфоцитов, клетки культивируют в условиях активации клеток. В этом варианте осуществления, условия культивирования могут являться такими, что клетки можно вводить пациенту без опасений относительно реакционной способности против компонентов культуральной среды. Например, условия культивирования могут не включать продукты бычьей сыворотки, такие как бычий сывороточный альбумин. В одном иллюстративном аспекте, активацию можно осуществлять посредством введения в культуральную среду известных активаторов, таких как антитела против CD3 в случае цитотоксических T-клеток. Другие пригодные активаторы включают антитела против CD28. В одном аспекте популяцию лимфоцитов можно культивировать в условиях, стимулирующих активацию, в течение от приблизительно 1 до приблизительно 4 суток. В одном варианте осуществления, подходящий уровень активации можно определять по размеру клеток, скорости пролиферации или маркерам активации, определенным посредством проточной цитометрии. В одном иллюстративном варианте осуществления, после культивирования популяции цитотоксических T-лимфоцитов в условиях, стимулирующих активацию, клетки можно трансфицировать экспрессирующим вектором, кодирующим CAR. Пригодные векторы и способы трансфекции описаны выше. В одном аспекте, после трансфекции клетки можно немедленно вводить пациенту, или клетки можно культивировать в течение по меньшей мере приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18 или более суток, или между приблизительно 5 и приблизительно 12 суток, между приблизительно 6 и приблизительно 13 суток, между приблизительно 7 и приблизительно 14 суток, или между приблизительно 8 и приблизительно 15 суток, например, чтобы обеспечить время для восстановления клеток от трансфекции. Подходящие условия культивирования могут являться сходными с условиями, при которых клетки культивировали для активации, либо в присутствии, либо в отсутствие средства, которое использовали для стимуляции активации.
Таким образом, как описано выше, в одном иллюстративном аспекте, способы лечения, описанные в настоящем документе, могут дополнительно включать 1) получение популяции аутологичных или гетерологичных цитотоксических T-лимфоцитов, 2) культивирование T-лимфоцитов в условиях, стимулирующих активацию клеток, и 3) трансфекцию лимфоцитов экспрессирующим вектором, кодирующим CAR, для получения CAR-T-клеток. В одном иллюстративном варианте осуществления, когда клетки трансфицированы и активированы, композицию, содержащую CAR-T-клетки, можно получать и вводить пациенту. В одном варианте осуществления, можно использовать культуральные среды, в которых отсутствуют какие-либо продукты животного происхождения, такие как бычья сыворотка. В другом варианте осуществления, можно использовать условия культивирования клеток, которые, как правило, использует специалист в данной области, чтобы избегать загрязнения бактериями, грибами и микоплазмой. В иллюстративном варианте осуществления, перед введением пациенту, клетки осаждают, промывают и ресуспендируют в фармацевтически приемлемом носителе или разбавителе. Иллюстративные композиции, содержащие экспрессирующие CAR цитотоксические T-лимфоциты, включают композиции, содержащие клетки в стерильном солевом растворе 290 мОсм, в пригодной для инфузии криосреде (содержащей Plasma-Lyte A, декстрозу, хлорид натрия для инъекции, человеческий сывороточный альбумин и DMSO), в 0,9% NaCl с 2% человеческим сывороточным альбумином или в любых других стерильных в пригодных для инфузии материалах 290 мОсм. Альтернативно, в зависимости от идентичности культуральной среды, CAR-T-клетки можно вводить в культуральной среде в качестве композиции, или концентрировать и ресуспендировать в культуральной среде перед введением. Композицию CAR-T-клетки можно вводить пациенту любыми подходящими способами, такими как парентеральное введение, например, внутрикожно, подкожно, внутримышечно, внутрибрюшинно, внутривенно или интратекально. В одном аспекте общее количество CAR-T-клеток и концентрацию клеток в композиции, вводимой пациенту, можно менять в зависимости от ряда факторов, включая тип используемых цитотоксических T-лимфоцитов, специфичность связывания CAR, идентичность нацеливающей группы и низкомолекулекулярного лиганда, идентичность злокачественной опухоли, локализацию злокачественной опухоли у пациента, способы, используемые для введения композиций пациенту, и общее состояние здоровья, возраст и массу пациента, подвергаемого лечению. Однако, подходящие композиции, содержащие трансдуцированные CAR-T-клетки, включают композиции, имеющие объем между приблизительно 5 мл и приблизительно 200 мл, содержащие от приблизительно 1×105 до приблизительно 1×1015 трансдуцированных CAR-T-клеток. Типичные композиции имеют объем между приблизительно 10 мл и приблизительно 125 мл, содержащий от приблизительно 1×107 до приблизительно 1×1010 CAR-T-клеток. Иллюстративная композиция содержит приблизительно 1×109 CAR-T-клеток в объеме приблизительно 100 мл. В одном аспекте однократную дозу или множественные дозы CAR-T-клеток можно вводить пациенту. В различных вариантах осуществления, злокачественная опухоль, подлежащая лечению, представляет собой карциному, саркому, лимфому, меланому, мезотелиому, назофарингеальную карциному, лейкоз, аденокарциному или миелому. В других вариантах осуществления, злокачественная опухоль может представлять собой рак легкого, рак кости, рак поджелудочной железы, рак кожи, рак головы, рак шеи, меланому кожи, внутриглазную меланому, рак тела матки, рак яичника, рак эндометрия, рак прямой кишки, рак желудка, рак толстого кишечника, рак молочной железы, трижды отрицательный рак молочной железы, карциному фаллопиевых труб, карциному эндометрия, карциному шейки матки, карциному влагалища, карциному вульвы, болезнь Ходжкина, рак пищевода, рак тонкого кишечника, злокачественную опухоль эндокринной системы, злокачественную опухоль щитовидной железы, злокачественную опухоль паращитовидной железы, немелкоклеточный рак легкого, злокачественную опухоль надпочечника, саркому мягких тканей, злокачественную опухоль мочеиспускательного канала, рак предстательной железы, хронический лейкоз, острый лейкоз, лимфоцитарную лимфому, мезотелиому плевры, рак мочевого пузыря, лимфому Беркитта, злокачественную опухоль мочеточника, рак почки, почечноклеточный рак, карциному почечной лоханки, неоплазии центральной нервной системы (ЦНС), первичную лимфому ЦНС, опухоль спинного мозга, глиому ствола головного мозга, аденому гипофиза или аденокарциному желудочно-пищеводного соединения.
В некоторых аспектах этих вариантов осуществления, злокачественная опухоль представляет собой экспрессирующую рецептор фолата злокачественную опухоль. В некоторых аспектах этих вариантов осуществления, злокачественная опухоль представляет собой рак эндометрия, немелкоклеточный рак легкого, рак яичника или трижды отрицательный рак молочной железы. В другом варианте осуществления, злокачественная опухоль, подвергаемая визуализации, представляет собой опухоль. В другом варианте осуществления, рак представляет собой злокачественную опухоль.
Соединение или его фармацевтически приемлемую соль, первый конъюгат или его фармацевтически приемлемую соль, второй конъюгат или его фармацевтически приемлемую соль, или композицию CAR-T-клеток, описанных в настоящем документе, можно вводить пациенту с использованием любого подходящего способа, известного в данной области. Как описано в настоящем документе, термин «введение» или «введенный» включает все способы введения соединения или его фармацевтически приемлемой соли, первого конъюгата или его фармацевтически приемлемой соли, второго конъюгата или его фармацевтически приемлемой соли, или композиции CAR-T-клеток пациенту, включая, но без ограничения, пероральный (po), внутривенный (iv), внутримышечный (im), подкожный (sc), чрескожный и т.п. Соединение или его фармацевтически приемлемую соль, первый конъюгат или его фармацевтически приемлемую соль, второй конъюгат или его фармацевтически приемлемую соль, описанные в настоящем документе, можно вводить в единичных дозированных формах и/или составах, содержащих общепринятые нетоксичные фармацевтически приемлемые носители, адъюванты и связующие.
В одном аспекте соединение или его фармацевтически приемлемую соль, первый конъюгат или его фармацевтически приемлемую соль, второй конъюгат или его фармацевтически приемлемую соль, или композицию CAR-T-клеток, как описано в настоящем документе, можно вводить непосредственно в кровоток, в мышцу или во внутренний орган. Подходящие способы для такого парентерального введения включают внутривенную, внутриартериальную, внутрибрюшинную, интратекальную, эпидуральную, интрацеребровентрикулярную, интрауретральную, интрастернальную, интракраниальную, внутриопухолевую, внутримышечную и подкожную доставку. В одном варианте осуществления, средства для парентерального введения включают игольные (включая микроигольные) инъекторы, безыгольные инъекторы и способы инфузии.
В одном иллюстративном аспекте, парентеральные составы представляют собой, как правило, водные растворы, которые могут содержать носители или наполнители, такие как соли, углеводы и забуферивающие средства (предпочтительно, при pH от 3 до 9), но их можно более подходящим образом составлять в форме стерильного неводного раствора или в высушенной форме для использования в сочетании с подходящим носителем, таким как стерильная апирогенная вода или стерильный солевой раствор. В других вариантах осуществления, любой из жидких составов, описанных в настоящем документе, можно адаптировать для парентерального введения, как описано в настоящем документе. Получение в стерильных условиях, посредством лиофилизации для получения стерильного лиофилизированного порошка для парентерального состава, можно легко осуществлять с использованием стандартных фармацевтических способов, хорошо известных специалистам в данной области. В одном варианте осуществления, растворимость соединения или его фармацевтически приемлемой соли, первого конъюгата или его фармацевтически приемлемой соли, второго конъюгата или его фармацевтически приемлемой соли, используемых для получения парентерального состава, можно увеличивать посредством использования подходящих способов получения составов, таких как включение увеличивающих растворимость средств.
В некоторых вариантах осуществления, скорость лизиса опухоли можно регулировать посредством корректировки концентрации первого конъюгата или его фармацевтически приемлемой соли, второго конъюгата или его фармацевтически приемлемой соли, или как первого, так и второго конъюгата, или их фармацевтически приемлемых солей. Соответственно, посредством изменения концентрации первого конъюгата или его фармацевтически приемлемой соли, второго конъюгата или его фармацевтически приемлемой соли, или как первого, так и второго конъюгата, или их фармацевтически приемлемых солей, цитотоксичность композиции CAR-T-клеток можно регулировать. В некоторых вариантах осуществления, можно поддерживать баланс цитотоксичности композиции CAR-T-клеток и риска синдрома лизиса опухоли или синдрома высвобождения цитокинов (CRS), как описано в настоящем документе, посредством корректировки концентрации первого конъюгата или его фармацевтически приемлемой соли, второго конъюгата или его фармацевтически приемлемой соли, или как первого, так и второго конъюгата, или их фармацевтически приемлемых солей. Понятно, что концентрация первого конъюгата или его фармацевтически приемлемой соли, второго конъюгата или его фармацевтически приемлемой соли, или как первого, так и второго конъюгата, или их фармацевтически приемлемых солей, могут являться функцией количества или дозы первого конъюгата или его фармацевтически приемлемой соли, второго конъюгата или его фармацевтически приемлемой соли, или как первого, так и второго конъюгата, или их фармацевтически приемлемых солей, которые вводят пациенту.
Количество соединения или его фармацевтически приемлемой соли, первого конъюгата или его фармацевтически приемлемой соли, второго конъюгата или его фармацевтически приемлемой соли, подлежащее введению пациенту, можно значительно менять в зависимости от злокачественной опухоли, подлежащей лечению, способа введения соединения или его фармацевтически приемлемой соли, первого конъюгата или его фармацевтически приемлемой соли, второго конъюгата или его фармацевтически приемлемой соли, и распределения в тканях. Количество, подлежащее введению пациенту, может быть основано на площади поверхности тела, массе и физической оценке. В различных вариантах осуществления, количества, подлежащие введению, могут лежать в диапазоне, например, от приблизительно 0,05 мг до приблизительно 30 мг, от 0,05 мг до приблизительно 25,0 мг, от приблизительно 0,05 мг до приблизительно 20,0 мг, от приблизительно 0,05 мг до приблизительно 15,0 мг, от приблизительно 0,05 мг до приблизительно 10,0 мг, от приблизительно 0,05 мг до приблизительно 9,0 мг, от приблизительно 0,05 мг до приблизительно 8,0 мг, от приблизительно 0,05 мг до приблизительно 7,0 мг, от приблизительно 0,05 мг до приблизительно 6,0 мг, от приблизительно 0,05 мг до приблизительно 5,0 мг, от приблизительно 0,05 мг до приблизительно 4,0 мг, от приблизительно 0,05 мг до приблизительно 3,0 мг, от приблизительно 0,05 мг до приблизительно 2,0 мг, от приблизительно 0,05 мг до приблизительно 1,0 мг, от приблизительно 0,05 мг до приблизительно 0,5 мг, от приблизительно 0,05 мг до приблизительно 0,4 мг, от приблизительно 0,05 мг до приблизительно 0,3 мг, от приблизительно 0,05 мг до приблизительно 0,2 мг, от приблизительно 0,05 мг до приблизительно 0,1 мг, от приблизительно 0,01 мг до приблизительно 2 мг, от приблизительно 0,3 мг до приблизительно 10 мг, от приблизительно 0,1 мг до приблизительно 20 мг или от приблизительно 0,8 до приблизительно 3 мг. Специалисту в данной области понятно, что дозу можно менять в пределах различных диапазонов, представленных выше, на основании факторов, отмеченных выше, и это можно осуществлять по решению терапевта.
В других вариантах осуществления, доза соединения или его фармацевтически приемлемой соли, первого конъюгата или его фармацевтически приемлемой соли, второго конъюгата или его фармацевтически приемлемой соли, может лежать в диапазоне, например, от приблизительно 50 нмоль/кг до приблизительно 3000 нмоль/кг массы тела пациента, от приблизительно 50 нмоль/кг до приблизительно 2000 нмоль/кг, от приблизительно 50 нмоль/кг до приблизительно 1000 нмоль/кг, от приблизительно 50 нмоль/кг до приблизительно 900 нмоль/кг, от приблизительно 50 нмоль/кг до приблизительно 800 нмоль/кг, от приблизительно 50 нмоль/кг до приблизительно 700 нмоль/кг, от приблизительно 50 нмоль/кг до приблизительно 600 нмоль/кг, от приблизительно 50 нмоль/кг до приблизительно 500 нмоль/кг, от приблизительно 50 нмоль/кг до приблизительно 400 нмоль/кг, от приблизительно 50 нмоль/кг до приблизительно 300 нмоль/кг, от приблизительно 50 нмоль/кг до приблизительно 200 нмоль/кг, от приблизительно 50 нмоль/кг до приблизительно 100 нмоль/кг, от приблизительно 100 нмоль/кг до приблизительно 300 нмоль/кг, от приблизительно 100 нмоль/кг до приблизительно 500 нмоль/кг, от приблизительно 100 нмоль/кг до приблизительно 1000 нмоль/кг, от приблизительно 100 нмоль/кг до приблизительно 2000 нмоль/кг массы тела пациента. В других вариантах осуществления, доза может составлять приблизительно 100 нмоль/кг, приблизительно 150 нмоль/кг, приблизительно 200 нмоль/кг, приблизительно 250 нмоль/кг, приблизительно 300 нмоль/кг, приблизительно 350 нмоль/кг, приблизительно 400 нмоль/кг, приблизительно 450 нмоль/кг, приблизительно 500 нмоль/кг, приблизительно 600 нмоль/кг, приблизительно 700 нмоль/кг, приблизительно 800 нмоль/кг, приблизительно 900 нмоль/кг, приблизительно 1000 нмоль/кг, приблизительно 2000 нмоль/кг или приблизительно 3000 нмоль/кг массы тела пациента. В этих вариантах осуществления, «кг» представляет собой килограммы массы тела пациента. В одном аспекте однократную дозу или множественные дозы соединения или его фармацевтически приемлемой соли, первого конъюгата или его фармацевтически приемлемой соли, второго конъюгата или его фармацевтически приемлемой соли, можно вводить пациенту. В другом варианте осуществления, между приблизительно 20 мкг/кг массы тела пациента и приблизительно 3 мг/кг массы тела пациента соединения или его фармацевтически приемлемой соли, первого конъюгата или его фармацевтически приемлемой соли, второго конъюгата или его фармацевтически приемлемой соли, вводят пациенту. В другом аспекте количества могут составлять между приблизительно 0,2 мг/кг массы тела пациента и приблизительно 0,4 мг/кг массы тела пациента, или могут составлять приблизительно 50 мкг/кг массы тела пациента. В одном аспекте однократную дозу или множественные дозы соединения или его фармацевтически приемлемой соли, первого конъюгата или его фармацевтически приемлемой соли, второго конъюгата или его фармацевтически приемлемой соли, можно вводить пациенту. В одном варианте осуществления, низкомолекулярный лиганд, связанный с нацеливающей группой, можно вводить пациенту до композиции CAR-T-клетки. В другом варианте осуществления, низкомолекулярный лиганд, связанный с нацеливающей группой, можно вводить пациенту одновременно с композицией CAR-T-клетки, но в различных составах. В другом варианте осуществления, низкомолекулярный лиганд, связанный с нацеливающей группой можно вводить пациенту после композиции CAR-T-клетки.
В одном иллюстративном аспекте, периоды времени между введением CAR-T-клеток и малой молекулы, связанной с нацеливающей группой, можно менять в широких пределах в зависимости от факторов, включающих тип используемых CAR-T-клеток, специфичность связывания CAR, идентичность нацеливающей группы и лиганда, идентичность злокачественной опухоли, локализацию злокачественной опухоли у пациента, способы, используемые для введения пациенту CAR-T-клеток и низкомолекулекулярного лиганда, связанного с нацеливающей группой, и общее состояние здоровья, возраст и массу пациента. В одном аспекте низкомолекулярный лиганд, связанный с нацеливающей группой, можно вводить до или после CAR-T-клеток, например, в пределах приблизительно 3, 6, 9, 12, 15, 18, 21 или 24 часов, или в пределах приблизительно 0,5, 1, 1,5, 2, 2,5, 3, 4 5, 6, 7, 8, 9, 10 или более суток.
В некоторых вариантах осуществления, скорость лизиса опухоли можно регулировать посредством корректировки частоты введения первого конъюгата или его фармацевтически приемлемой соли, второго конъюгата или его фармацевтически приемлемой соли, или как первого, так и второго конъюгата, или их фармацевтически приемлемых солей. Соответственно, посредством изменения частоты введения первого конъюгата или его фармацевтически приемлемой соли, второго конъюгата или его фармацевтически приемлемой соли, или как первого, так и второго конъюгата, или их фармацевтически приемлемых солей, цитотоксичность композиции CAR-T-клеток можно регулировать. В некоторых вариантах осуществления, можно поддерживать баланс цитотоксичности композиции CAR-T-клеток и риска синдрома лизиса опухоли или синдрома высвобождения цитокинов (CRS), как описано в настоящем документе, посредством корректировки частоты введения первого конъюгата или его фармацевтически приемлемой соли, второго конъюгата или его фармацевтически приемлемой соли, или как первого, так и второго конъюгата, или их фармацевтически приемлемых солей. Понятно, что частота введения первого конъюгата или его фармацевтически приемлемой соли, второго конъюгата или его фармацевтически приемлемой соли, или как первого, так и второго конъюгата, или их фармацевтически приемлемых солей, могут являться функцией любого применимого расписания дозирования, известного в данной области. Например, частота введения может являться функцией расписания дозирования, основанного на непрерывном дозировании, дозировании один раз в сутки (иначе называемом qd), дозировании два раза в сутки (иначе называемом bid), дозировании три раза в сутки (иначе называемом tid), дозировании два раза в неделю (иначе называемом BIW), дозировании три раза в неделю (иначе называемом. TIW), один раз в неделю и т.п. Понятно, что расписание дозирования, выбранное для первого конъюгата или его фармацевтически приемлемой соли, второго конъюгата или его фармацевтически приемлемой соли, или как первого, так и второго конъюгата, или их фармацевтически приемлемых солей, можно использовать в связи с концентрацией для регуляции цитотоксичности композиции CAR-T-клеток. В некоторых вариантах осуществления, можно поддерживать баланс цитотоксичности композиции CAR-T-клеток и риска синдрома лизиса опухоли или синдрома высвобождения цитокинов (CRS), как описано в настоящем документе, посредством корректировки расписания дозирования в связи с концентрацией первого конъюгата или его фармацевтически приемлемой соли, второго конъюгата или его фармацевтически приемлемой соли, или как первого, так и второго конъюгата, или их фармацевтически приемлемых солей.
В одном варианте осуществления способов, описанных в настоящем документе, злокачественную опухоль подвергают визуализации до введения пациенту соединения или его фармацевтически приемлемой соли, первого конъюгата или его фармацевтически приемлемой соли, второго конъюгата или его фармацевтически приемлемой соли, или до введения композиции CAR-T-клеток пациенту. В одном иллюстративном варианте осуществления, визуализацию проводят посредством визуализации PET. В других иллюстративных вариантах осуществления визуализацию проводят посредством визуализации MRI или визуализации SPECT/CT. Специалисту в данной области понятно, что способ визуализации может представлять собой любой подходящий способ визуализации, известный в данной области.
В любом из вариантов осуществления, описанных в настоящем документе, высвобождения цитокинов, приводящего к «нецелевой» токсичности у пациента, может не возникать, даже хотя возникает токсичность CAR-T-клетки по отношению к злокачественной опухоли. В любом варианте осуществления, описанном в настоящем документе, «нецелевой» токсичности для тканей может не возникать у пациента, даже хотя возникает токсичность CAR-T-клеток по отношению к злокачественной опухоли. В любом варианте осуществления, описанном в настоящем документе, злокачественная опухоль может содержать опухоль, и размер опухоли можно уменьшать у пациента, даже хотя «нецелевой» токсичности не возникает.
ПРИМЕРЫ
ПРИМЕР 1
Получение лентивирусного вектора, кодирующего ген CAR
Способ перекрывающейся ПЦР использовали для получения конструкций CAR, содержащих scFv против флуоресцеина. Синтезировали scFV против флуоресцеина, 4M5.3 (Kd=270 фМ, 762 п.о.), происходящий из антитела против флуоресцеина (4-4-20). Последовательность, кодирующую сигнальный пептид CD8α человека (SP, 63 п.о.), шарнир и трансмембранную область (249 п.о.), цитоплазматический домен 4-1BB (CD137, 141 п.о.) и цепь CD3ζ (336 п.о.), как показано на фигуре 14A, сливали с scFV против флуоресцеина посредством перекрывающейся ПЦР. Полученную конструкцию CAR (1551 п.о.) вставляли в расщепленный EcoRI/NotI лентивирусный экспрессирующий вектор pCDH-EF1-MCS-(PGK-GFP) (Фигура 14B, System Biosciences). Последовательность конструкции CAR в лентивирусном векторе подтверждали посредством секвенирования ДНК.
Иллюстративная последовательность нуклеиновой кислоты, кодирующей CAR, может содержать:
ATGGCCTTACCAGTGACCGCCTTGCTCCTGCCGCTGGCCTTGCTGCTCCACGCCGCCAGGCCGGATGTCGTGATGACCCAGACCCCCCTCAGCCTCCCAGTGTCCCTCGGTGACCAGGCTTCTATTAGTTGCAGATCCAGCCAGTCCCTCGTGCACTCTAACGGTAATACCTACCTGAGATGGTATCTCCAGAAGCCCGGACAGAGCCCTAAGGTGCTGATCTACAAAGTCTCCAACCGGGTGTCTGGAGTCCCTGACCGCTTCTCAGGGAGCGGTTCCGGCACCGACTTCACCCTGAAGATCAACCGGGTGGAGGCCGAAGACCTCGGCGTCTATTTCTGCTCTCAGAGTACACATGTGCCCTGGACCTTCGGCGGAGGGACCAAGCTGGAGATCAAAAGCTCCGCAGACGATGCCAAGAAAGATGCCGCTAAGAAAGACGATGCTAAGAAAGACGATGCAAAGAAAGACGGTGGCGTGAAGCTGGATGAAACCGGAGGAGGTCTCGTCCAGCCAGGAGGAGCCATGAAGCTGAGTTGCGTGACCAGCGGATTCACCTTTGGGCACTACTGGATGAACTGGGTGCGACAGTCCCCAGAGAAGGGGCTCGAATGGGTCGCTCAGTTCAGGAACAAACCCTACAATTATGAGACATACTATTCAGACAGCGTGAAGGGCAGGTTTACTATCAGTA
GAGACGATTCCAAATCTAGCGTGTACCTGCAGATGAACAATCTCAGGGTCGAAGATACAGGCATCTACTATTGCACAGGGGCATCCTATGGTATGGAGTATCTCGGTCAGGGGACAAGCGTCACAGTCAGTTTCGTGCCGGTCTTCCTGCCAGCGAAGCCCACCACGACGCCAGCGCCGCGACCACCAACACCGGCGCCCACCATCGCGTCGCAGCCCCTGTCCCTGCGCCCAGAGGCGTGCCGGCCAGCGGCGGGGGGCGCAGTGCACACGAGGGGGCTGGACTTCGCCTGTGATATCTACATCTGGGCGCCCTTGGCCGGGACTTGTGGGGTCCTTCTCCTGTCACTGGTTATCACCCTTTACTGCAACCACAGGAACCGTTTCTCTGTTGTTAAACGGGGCAGAAAGAAACTCCTGTATATATTCAAACAACCATTTATGAGACCAGTACAAACTACTCAAGAGGAAGATGGCTGTAGCTGCCGATTTCCAGAAGAAGAAGAAGGAGGATGTGAACTGAGAGTGAAGTTCAGCAGGAGCGCAGACGCCCCCGCGTACCAGCAGGGCCAGAACCAGCTCTATAACGAGCTCAATCTAGGACGAAGAGAGGAGTACGATGTTTTGGACAAGAGACGTGGCCGGGACCCTGAGATGGGGGGAAAGCCGAGAAGGAAGAACCCTCAGGAAGGCCTGTACAATGAACTGCAGAAAGATAAGATGGCGGAGGCCTACAGTGAGATTGGGATGAAAGGCGAGCGCCGGAGGGGCAAGGGGCACGATGGCCTTTACCAGGGTCTCAGTACAGCCACCAAGGACACCTACGACGCCCTTCACATGCAGGCCCTGCCCCCTCGCTAA (SEQ ID NO: 1).
В иллюстративной последовательности нуклеиновой кислоты, показанной выше, первый ATG представляет собой инициирующий кодон. Иллюстративная аминокислотная последовательность CAR может содержать:
MALPVTALLLPLALLLHAARPDVVMTQTPLSLPVSLGDQASISCRSSQSLVHSNGNTYLRWYLQKPGQSPKVLIYKVSNRVSGVPDRFSGSGSGTDFTLKINRVEAEDLGVYFCSQSTHVPWTFGGGTKLEIKSSADDAKKDAAKKDDAKKDDAKKDGGVKLDETGGGLVQPGGAMKLSCVTSGFTFGHYWMNWVRQSPEKGLEWVAQFRNKPYNYETYYSDSVKGRFTISRDDSKSSVYLQMNNLRVEDTGIYYCTGASYGMEYLGQGTSVTVSFVPVFLPAKPTTTPAPRPPTPAPTIASQPLSLRPEACRPAAGGAVHTRGLDFACDIYIWAPLAGTCGVLLLSLVITLYCNHRNRFSVVKRGRKKLLYIFKQPFMRPVQTTQEEDGCSCRFPEEEEGGCELRVKFSRSADAPAYQQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR (SEQ ID NO: 2)
Иллюстративная вставка может содержать:
GCCACCATGGCCTTACCAGTGACCGCCTTGCTCCTGCCGCTGGCCTTGCTGCTCCACGCCGCCAGGCCGGATGTCGTGATGACCCAGACCCCCCTCAGCCTCCCAGTGTCCCTCGGTGACCAGGCTTCTATTAGTTGCAGATCCAGCCAGTCCCTCGTGCACTCTAACGGTAATACCTACCTGAGATGGTATCTCCAGAAGCCCGGACAGAGCCCTAAGGTGCTGATCTACAAAGTCTCCAACCGGGTGTCTGGAGTCCCTGACCGCTTCTCAGGGAGCGGTTCCGGCACCGACTTCACCCTGAAGATCAACCGGGTGGAGGCCGAAGACCTCGGCGTCTATTTCTGCTCTCAGAGTACACATGTGCCCTGGACCTTCGGCGGAGGGACCAAGCTGGAGATCAAAAGCTCCGCAGACGATGCCAAGAAAGATGCCGCTAAGAAAGACGATGCTAAGAAAGACGATGCAAAGAAAGACGGTGGCGTGAAGCTGGATGAAACCGGAGGAGGTCTCGTCCAGCCAGGAGGAGCCATGAAGCTGAGTTGCGTGACCAGCGGATTCACCTTTGGGCACTACTGGATGAACTGGGTGCGACAGTCCCCAGAGAAGGGGCTCGAATGGGTCGCTCAGTTCAGGAACAAACCCTACAATTATGAGACATACTATTCAGACAGCGTGAAGGGCAGGTTTACTATCAGTA
GAGACGATTCCAAATCTAGCGTGTACCTGCAGATGAACAATCTCAGGGTCGAAGATACAGGCATCTACTATTGCACAGGGGCATCCTATGGTATGGAGTATCTCGGTCAGGGGACAAGCGTCACAGTCAGTTTCGTGCCGGTCTTCCTGCCAGCGAAGCCCACCACGACGCCAGCGCCGCGACCACCAACACCGGCGCCCACCATCGCGTCGCAGCCCCTGTCCCTGCGCCCAGAGGCGTGCCGGCCAGCGGCGGGGGGCGCAGTGCACACGAGGGGGCTGGACTTCGCCTGTGATATCTACATCTGGGCGCCCTTGGCCGGGACTTGTGGGGTCCTTCTCCTGTCACTGGTTATCACCCTTTACTGCAACCACAGGAACCGTTTCTCTGTTGTTAAACGGGGCAGAAAGAAACTCCTGTATATATTCAAACAACCATTTATGAGACCAGTACAAACTACTCAAGAGGAAGATGGCTGTAGCTGCCGATTTCCAGAAGAAGAAGAAGGAGGATGTGAACTGAGAGTGAAGTTCAGCAGGAGCGCAGACGCCCCCGCGTACCAGCAGGGCCAGAACCAGCTCTATAACGAGCTCAATCTAGGACGAAGAGAGGAGTACGATGTTTTGGACAAGAGACGTGGCCGGGACCCTGAGATGGGGGGAAAGCCGAGAAGGAAGAACCCTCAGGAAGGCCTGTACAATGAACTGCAGAAAGATAAGATGGCGGAGGCCTACAGTGAGATTGGGATGAAAGGCGAGCGCCGGAGGGGCAAGGGGCACGATGGCCTTTACCAGGGTCTCAGTACAGCCACCAAGGACACCTACGACGCCCTTCACATGCAGGCCCTGCCCCCTCGCTAA (SEQ ID NO: 3)
В иллюстративной вставке, показанной выше, первая последовательность GCCACC может представлять собой участок расщепления ферментом рестрикции, за которым следует инициирующий кодон ATG. Иллюстративная аминокислотная последовательность вставки может содержать:
ATMALPVTALLLPLALLLHAARPDVVMTQTPLSLPVSLGDQASISCRSSQSLVHSNGNTYLRWYLQKPGQSPKVLIYKVSNRVSGVPDRFSGSGSGTDFTLKINRVEAEDLGVYFCSQSTHVPWTFGGGTKLEIKSSADDAKKDAAKKDDAKKDDAKKDGGVKLDETGGGLVQPGGAMKLSCVTSGFTFGHYWMNWVRQSPEKGLEWVAQFRNKPYNYETYYSDSVKGRFTISRDDSKSSVYLQMNNLRVEDTGIYYCTGASYGMEYLGQGTSVTVSFVPVFLPAKPTTTPAPRPPTPAPTIASQPLSLRPEACRPAAGGAVHTRGLDFACDIYIWAPLAGTCGVLLLSLVITLYCNHRNRFSVVKRGRKKLLYIFKQPFMRPVQTTQEEDGCSCRFPEEEEGGCELRVKFSRSADAPAYQQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR (SEQ ID NO: 4)
ПРИМЕР 2
Получение лентивируса, содержащего ген CAR, для трансдукции T-клетки человека
Для получения лентивирусного вируса, содержащего одноцепочечный фрагмент вариабельной области (scFv) CAR против флуоресцеина, упаковывающую линию клеток 293TN трансфицировали совместно лентивирусным вектором, кодирующим scFv CAR против флуоресцеина, и смесью упаковывающих плазмид 2-го поколения (Cellecta). Через 24 и 48 часов после трансфекции, супернатанты, содержащие лентивирус с геном CAR, собирали, и вирусные частицы концентрировали посредством стандартного способа концентрирования вируса с полиэтиленгликолем (Clontech) для будущей трансдукции с использованием T-клеток человека.
ПРИМЕР 3
Выделение T-клеток человека из PBMC человека
T-клетки выделяли из мононуклеарных клеток периферической крови (PBMC) человека посредством центрифугирования в градиенте плотности фиколла (GE Healthcare Lifesciences). После отмывки оставшегося раствора фиколла, T-клетки выделяли с использованием набора для выделения T-клеток человека EasySep™ (STEM CELL technologies). Очищенные T-клетки культивировали в среде TexMACSTM (Miltenyi Biotech Inc) с 1% пенициллином и сульфатом стрептомицина в присутствии IL-2 человека (100 МЕ/мл, Miltenyi Biotech Inc). T-клетки культивировали при плотности 1×106 клеток/мл в многолуночных планшетах. T-клетки разделяли и повторно подпитывали каждые 2-3 суток.
ПРИМЕР 4
Трансдукция T-клеток человека
Выделенные T-клетки активировали с использованием Dynabeads в сочетании с антителами против CD3/CD28 (Life Technologies) в течение 12-24 часов в присутствии IL-2 человека (100 МЕ/мл), затем трансдуцировали лентивирусом, кодирующим ген CAR против флуоресцеина. Клетки собирали через 72 часа, и экспрессию CAR на трансдуцированных T-клетках идентифицировали посредством измерения клеток с флуоресцентным GFP с использованием проточной цитометрии. Как показано на фигуре 15A, для нетрансдуцированных T-клеток не показана экспрессия GFP. Как показано на фигуре 15B, трансдуцированные T-клетки экспрессируют GFP.
ПРИМЕР 5
Синтез FITC-фолата
Фолат-γ-этилендиамин присоединяли к изомеру I изотиоцианата флуоресцеина (FITC) (Sigma-Aldrich) в безводном диметилсульфоксиде (DMF) в присутствии тетраметилгуанидина и диизопропиламина. Неочищенный продукт наносили на колонку Xterra RP18 для препаративной HPLC (Waters) и элюировали с использованием условий градиента, начинающегося с 99% 5 мМ фосфата натрия (подвижная фаза A, pH 7,4) и 1% ацетонитрила (подвижная фаза B) и достигающего 90% A и 10% B за 10 мин при скорости потока 20 мл/мин. В этих условиях, главный пик FITC-фолата, как правило, элюируется через 27-50 мин. Качество фракции FITC-фолата мониторировали посредством аналитической обращеннофазовой HPLC с использованием УФ детектора. Фракции с более чем 98,0% чистотой (LCMS) лиофилизировали для получения конечного продукта FITC-фолата.
ПРИМЕР 6
Синтез FITC-PEG12-фолата
Универсальную смолу с полиэтиленгликолем (PEG) Nova Tag™ (0,2 г) загружали в сосуд для синтеза пептидов и промывали изопропиловым спиртом (i-PrOH) (3×10 мл) и диметилформамидом (DMF, 3×10 мл). Снятие защиты 9-флуоренилметоксикарбонила (Fmoc) проводили с использованием 20% пиперидина в DMF (3×10 мл). Тесты Кайзера проводили для оценки прогрессирования реакции. Затем в сосуд вводили раствор 5-трет-бутилового сложного эфира Fmoc-L-глутаминовой кислоты (Fmoc-Glu-(O-t-Bu)-OH) (23,5 мг) в DMF, N,N-диизопропилэтиламина (i-Pr2NEt) (4 эквив.) и гексафторфосфата бензотриазол-1-ил-окситрипирролидинoфосфония (PyBOP) (2 эквив.). Снятие защиты Fmoc проводили с использованием 20% пиперидина в DMF (3×10 мл). Затем в сосуд вводили раствор N10-TFA-Pte-OH (22,5 мг), DMF, i-Pr2NEt (4 эквив.) и PyBOP (2 эквив.). Аргон барботировали в течение 2 час, и смолу промывали с использованием DMF (3×3 мл) и i-PrOH (3×3 мл). После набухания смолы в дихлорметане (DCM), добавляли раствор 1M гидроксибензотриазола (HOBT) в DCM/трифторэтане (TFE) (1:1) (2×3 мл). Аргон барботировали в течение 1 час, растворитель удаляли, и смолу промывали с использованием DMF (3×3 мл) и i-PrOH (3×3 мл). После набухания смолы в DMF, добавляли раствор of Fmoc-NH-(PEG)12-COOH (46,3 мг) в DMF, i-Pr2NEt (4 эквив.), и PyBOP (2 эквив.). Аргон барботировали в течение 2 час, и смолу промывали с использованием DMF (3×3 мл) и i-PrOH (3×3 мл). Снятие защиты Fmoc проводили с использованием 20% пиперидина в DMF (3×10 мл). Тесты Кайзера проводили для оценки прогрессирования реакции. Затем в сосуд вводили раствор FITC (Life Technologies, 21,4 мг) в DMF и i-Pr2NEt (4 эквив.), затем аргон барботировали в течение 2 час, и смолу промывали с использованием DMF (3×3 мл) и i-PrOH (3×3 мл). Затем в сосуд добавляли 2% NH2NH2 в DMF (2×2 мл). Конечное соединение отщепляли от смолы с использованием TFA:H2O: триизопропилсилана (TIS) (95:2,5:2,5) (раствор для расщепления) и концентрировали в вакууме. Концентрированный продукт преципитировали в Et2O и высушивали в вакууме. Неочищенный продукт очищали с использованием препаративной RP-HPLC (подвижная фаза: A=10 мМ ацетат аммония pH=7, B=ACN; способ: 0% B - 30% B за 30 мин при 13 мл/мин). Очищенные фракции объединяли и лиофилизировали, получая FITC-PEG12-фолат.
ПРИМЕР 7
Синтез FITC-PEG20-фолата
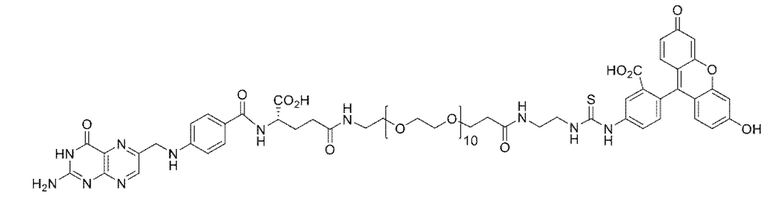
Связанную с полимером (200-400 меш) смолу с этилендиамином (50 мг) загружали в сосуд для синтеза пептидов и позволяли набухнуть в DCM (3 мл), затем в DMF (3 мл). Затем в сосуд вводили раствор Fmoc-PEG20-COOH (131 мг, 1,0 эквив.) в DMF, i-Pr2NEt (6,0 эквив.) и PyBOP (4,0 эквив.). Аргон барботировали в течение 6 час, раствор для связывания дренировали, и смолу промывали с использованием DMF (3×10 мл) и i-PrOH (3×10 мл). Тесты Кайзера проводили для оценки прогрессирования реакции. Снятие защиты Fmoc проводили с использованием 20% пиперидина в DMF (3×10 мл), перед присоединением каждой аминокислоты. Вышеуказанную последовательность повторяли до завершения реакции с использованием стадий связывания с Fmoc-Glu-OtBu (72 мг, 2,0 эквив.) и Tfa.птероевой кислотой (41 мг, 1,2 эквив.). Смолу промывали с использованием 2% гидразина в DMF 3×10 мл (5 мин) для отщепления защитной группы трифторацетила на птероевой кислоте и промывали с использованием i-PrOH (3×10 мл), затем посредством DMF (3×10 мл). Смолу сушили под аргоном в течение 30 мин. Фолат-пептид отщепляли от смолы с использованием раствора для расщепления. Вводили 10 мл смеси для расщепления, и аргон барботировали в течение 1,5 час. Смесь для расщепления дренировали в чистую колбу. Смолу промывали 3 раза с использованием большего количества смеси для расщепления. Объединенную смесь концентрировали под пониженным давлением до меньшего объема (~5 мл) и преципитировали в этиловом эфире.
Преципитат собирали посредством центрифугирования, промывали этиловым эфиром (3 раза) и высушивали под высоким вакуумом. Высушенный фолат-PEG20-EDA (1,0 эквив.) обрабатывали FITC (50 мг, 1,5 эквив.) в DMSO и DIPEA при комнатной температуре. Прогрессирование реакции мониторировали посредством LCMS. Через 8 час исходный материал был израсходован с получением продукта. Неочищенную реакционную смесь очищали посредством препаративной HPLC, (подвижная фаза A=10 мМ ацетат аммония, pH=7; органическая фаза B=ацетонитрил; Способ: 0% B - 30% B за 35 минут при 13 мл/мин) и получали FITC-PEG20-фолат с 60% выходом.
ПРИМЕР 8
Синтез FITC-PEG108-фолата
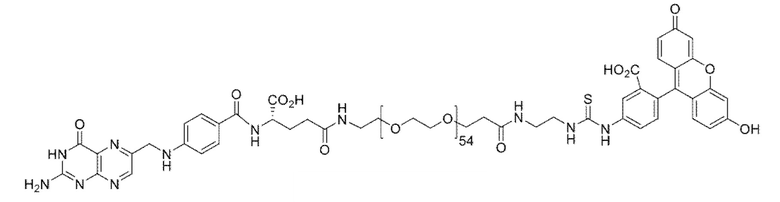
Связанную с полимером (200-400 меш) смолу с этилендиамином (50 мг) загружали в сосуд для синтеза пептидов и позволяли набухнуть в DCM (3 мл), затем в DMF (3 мл). Затем в сосуд вводили раствор Fmoc-PEG36-COOH (161 мг, 1,0 эквив.) в DMF, i-Pr2NEt (6,0 эквив.) и PyBOP (4,0 эквив.). Аргон барботировали в течение 6 час, раствор для связывания дренировали, и смолу промывали с использованием DMF (3×10 мл) и i-PrOH (3×10 мл). Тесты Кайзера проводили для оценки прогрессирования реакции. Снятие защиты Fmoc проводили с использованием 20% пиперидина в DMF (3×10 мл), перед присоединением каждой аминокислоты. Вышеуказанную последовательность повторяли до завершения реакции с использованием стадий связывания с 2X Fmoc-PEG36-COOH (161 мг, 1,0 эквив.), Fmoc-Glu-OtBu (72 мг, 2,0 эквив.) и Tfa.птероевой кислотой (41,0 мг, 1,2 эквив.). В конце смолу промывали с использованием 2% гидразина в DMF 3×10 мл (5 мин) для отщепления защитной группы трифторацетила на птероевой кислоте и промывали с использованием i-PrOH (3×10 мл), затем посредством DMF (3×10 мл). Смолу сушили под аргоном в течение 30 мин. Фолат-пептид отщепляли от смолы с использованием раствора для расщепления. Вводили 10 мл смеси для расщепления, и аргон барботировали в течение 1,5 час. Смесь для расщепления дренировали в чистую колбу. Смолу промывали 3X с использованием большего количества раствора для расщепления. Объединенную смесь концентрировали под пониженным давлением до меньшего объема (~5 мл) и преципитировали в этиловом эфире.
Преципитат собирали посредством центрифугирования, промывали этиловым эфиром (3X) и высушивали под высоким вакуумом. Высушенный Фолат-PEG108-EDA (1,0 эквив.) обрабатывали with FITC (50 мг, 1,5 эквив.) в DMSO и DIPEA при комнатной температуре. Прогрессирование реакции мониторировали посредством LCMS. Через 10 час исходный материал был израсходован с получением продукта. Неочищенную реакционную смесь очищали посредством препаративной HPLC, (подвижная фаза A=10 мМ ацетат аммония, pH=7; органическая фаза B=ацетонитрил; Способ: 0% B - 30% B за 35 минут при 13 мл/мин) и получали FITC-PEG108-фолат с 64% выходом.
ПРИМЕР 9
Синтез FITC-DUPA
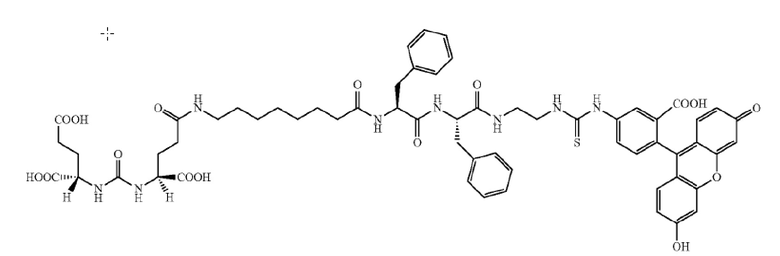
DUPA-FITC синтезировали твердофазным способом следующим образом. Универсальной смоле Nova Tag™ (50 мг, 0,53 мМ) позволяли набухнуть в DCM (3 мл), затем в DMF, 3 мл). Раствор 20% пиперидина в DMF (3×3 мл) добавляли к смоле, и аргон барботировали в течение 5 мин. Смолу промывали с использованием DMF (3×3 мл) и изопропилового спирта (i-PrOH, 3×3 мл). После набухания смолы в DMF, добавляли раствор DUPA-(OtBu)-OH (1,5 эквив.), HATU (2,5 эквив.) и i-Pr2NEt (4,0 эквив.) в DMF. Аргон барботировали в течение 2 час, и смолу промывали с использованием DMF (3×3 мл) и i-PrOH (3×3 мл). После набухания смолы в DCM, добавляли раствор 1 M HOBt в DCM/TFE (1:1) (2×3 мл). Аргон барботировали в течение 1 час, растворитель удаляли и смолу промывали с использованием DMF (3×3 мл) и i-PrOH (3×3 мл). После набухания смолы в DMF, добавляли раствор Fmoc-Phe-OH (2,5 эквив.), HATU (2,5 эквив.) и DIPEA (4,0 эквив.) в DMF. Аргон барботировали в течение 2 час, и смолу промывали с использованием DMF (3×3 мл) и i-PrOH (3×3 мл). Вышеуказанную последовательность повторяли в течение еще 2 стадий связывания для добавления 8-аминооктановой кислоты и изотиоцианата флуоресцеина или изотиоцианата родамина B. Конечное соединение отщепляли от смолы с использованием раствора для расщепления и концентрировали в вакууме. Концентрированный продукт преципитировали в диэтиловом эфире и высушивали в вакууме. Неочищенный продукт очищали с использованием препаративной RP-HPLC [λ=488 нм; градиент растворителя: 1% B - 80% B за 25 мин, промывка 80% B за 30 мин прогон; A=10 мМ NH4OAc, pH=7; B=ацетонитрил (ACN)]. ACN удаляли в вакууме, и очищенные фракции лиофилизировали с получением FITC-DUPA в форме оранжево-коричневого твердого вещества. RP-HPLC: tR=8,0 мин (A=10 мМ NH4OAc, pH=7,0; B=ACN, градиент растворителя: 1% B - 50% B за 10 мин, промывка 80% B за 15 мин прогон). 1H ЯМР (DMSO-d6/D2O): δ 0,98-1,27 (мс, 9H); 1,45 (ш, 3H); 1,68-1,85 (мс, 11H); 2,03 (м, 8H); 2,6-3,44 (мс, 12H); 3,82 (ш, 2H); 4,35 (м, 1H); 6,53 (д, J=8,1 Гц, 2H), 6,61 (дд, J=5,3, 3,5 Гц, 2H); 6,64 (с, 2H); 7,05 (д, J=8,2 Гц, 2H), 7,19 (м, 5H); 7,76 (д, J=8,0 Гц, 1H); 8,38 (с, 1H). HRMS (ESI) (m/z): (M+H)+ рассчитано для C51H59N7O15S, 1040,3712, обнаружено, 1040,3702. УФ/визуализация: λ макс.=491 нм.
ПРИМЕР 10
Синтез FITC-PEG12-DUPA
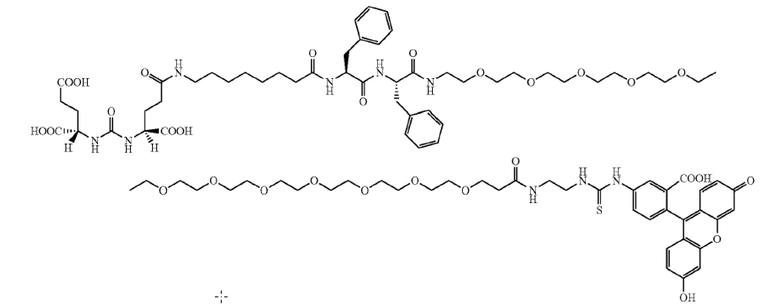
1,2-диаминоэтантритиловую смолу (0,025 г) загружали в сосуд для синтеза пептидов и промывали с использованием i-PrOH (3×10 мл), затем посредством DMF (3×10 мл). Затем в сосуд вводили раствор Fmoc-NH-(PEG)12-COOH (42,8 мг) в DMF, i-Pr2NEt (2,5 эквив.), и PyBOP (2,5 эквив.). Полученный раствор барботировали Ar в течение 1 час, раствор для связывания дренировали, и смолу промывали с использованием DMF (3×10 мл) и i-PrOH (3×10 мл). Тесты Кайзера проводили для оценки прогрессирования реакции. Снятие защиты Fmoc проводили с использованием 20% пиперидина в DMF (3×10 мл). Эту процедуру повторяли до завершения всех стадий связывания (2×1,5 эквив. Fmoc-Phe-OH и 1,5 эквив. 8-аминооктановой кислоты и 1,2 эквив. DUPA использовали на каждой из соответствующих им стадий связывания). После связывания DUPA, смолу промывали с использованием DMF (3×10 мл) и i-PrOH (3×10 мл) и высушивали под пониженным давлением. Пептид отщепляли от смолы в сосуде для синтеза пептидов с использованием раствора для расщепления. 15 мл раствора для расщепления добавляли в сосуд для синтеза пептидов, и реакционную смесь барботировали под Ar в течение 15 мин. Смолу обрабатывали с использованием двух дополнительных количеств по 10 мл раствора для расщепления по 5 мин каждым. Смесь для расщепления концентрировали до приблизительно 5 мл и преципитировали с использованием этилового эфира. Преципитат собирали посредством центрифугирования, промывали этиловым эфиром (3X) и высушивали под высоким вакуумом, что приводило к выделению неочищенного материала. К смешанному раствору неочищенного DUPA-(PEG)12-EDA (10 мг) и FITC (5,6 мг) в диметилсульфоксиде (DMSO, 1 мл) добавляли i-Pr2NEt (5 эквив.) при комнатной температуре и перемешивали в течение 6 час под аргоном. Реакцию мониторировали посредством LCMS и проводили очистку посредством препаративной HPLC (подвижная фаза: A=10 мМ ацетат аммония pH=7, B=ACN; способ: 0% B - 50% B за 30 мин при 13 мл/мин). Очищенные фракции объединяли и лиофилизировали, получая FITC-PEG12-DUPA.
ПРИМЕР 11
Синтез FITC-PEG11-NK1
К смешанному раствору NK-1 (0,02 г, 0,0433 ммоль, 1,0 экв.), O-(2-аминоэтил)-O'-[2-(Boc-амино)этил]декаэтиленгликоля (BocNH-PEG11-NH2) (Sigma, 0,0336 г, 0,0521 ммоль, 1,2 экв.), гексафторфосфата бензотриазол-1-ил-окситрипирролидинoфосфония (PyBOP) (0,027 г, 0,0521 ммоль, 1,2 экв.) в сухом CH2Cl2 добавляли N,N-диизопропилэтиламин (DIPEA) (0,076 мл, 0,4338 ммоль, 10 экв.) под аргоном при комнатной температуре. Прогрессирование реакции мониторировали посредством LCMS и проводили очистку посредством препаративной RP-HPLC (колонка Waters, XBridge™ Prep C18, 5 мкм; 19×100 мм, подвижная фаза A=20 мМ буфер ацетат аммония, pH 7, B=ацетонитрил, градиент 10-100% B за 30 мин, 13 мл/мин, λ=220 нм, 254 нм). Очищенные фракции собирали, все органические растворители выпаривали, и образец лиофилизировали в течение 48 час с получением NK1-PEG11-NHBoc. Выход: 40,13 мг (97%). К NK1-PEG11-NHBoc (0,0165 г, 0,015 ммоль) в сухом DCM добавляли трифторуксусную кислоту (TFA, 20 экв.), и реакционную смесь перемешивали в течение 4 час при комнатной температуре. Избыток TFA удаляли, и оставшийся раствор разводили водой и экстрагировали с использованием CH2Cl2 (3×5 мл). Объединенные органические слои промывали рассолом, высушивали (Na2SO4) и концентрировали. Полученный осадок сушили в вакууме и использовали для следующей стадии без дополнительной очистки. Смешанный раствор NK1-PEG11-NH2 (0,008 г, 0,0081 ммоль, 1,0 экв.), Изотиоцианат флуоресцеина (FITC) (Sigma, 0,0037 г, 0,0097 ммоль, 1,2 экв.) в сухом диметилсульфоксиде (DMSO, 0,3 мл) добавляли к диизопропилэтиламину (0,0028 мл, 0,0162 ммоль, 2,0 экв.) при комнатной температуре под аргоном. Прогрессирование реакции мониторировали посредством LCMS, и продукт очищали посредством препаративной RP-HPLC (колонка Waters, XBridge™ Prep C18, 5 мкм; 19×100 мм, подвижная фаза A=20 мМ буфер ацетат аммония, pH 7, B=ацетонитрил, градиент 10-100% B за 30 мин, 13 мл/мин, λ=280 нм). Очищенные фракции собирали, все органические растворители выпаривали, и образец лиофилизировали в течение 48 час с получением FITC-PEG11-NK1 с выходом 8,54 мг (77%).
*Примечание: соединение NK-1 синтезировали двухстадийным способом, начиная с основного лиганда, который получали с использованием способа из литературы. (ссылка: DESIGN AND DEVELOPMENT OF NEUROKININ-1 RECEPTOR-BINDING AGENT DELIVERY CONJUGATES, номер заявки: PCT/US2015/44229; содержание которой приведено в настоящем документе в качестве ссылки.
ПРИМЕР 12
Синтез FITC-PEG2-CA9
Лиганд CA9 (53,6 мг) растворяли в DMF (2-3 мл) в 50 мл круглодонной колбе с использованием тефлонового якоря магнитной мешалки. Циркулирующий воздух удаляли с использованием вакуума и заменяли газообразным азотом, это выполняли за три цикла. Круглодонную колбу постоянно поддерживали под газообразным азотом. В колбу добавляли 28,9 мг гидрохлорида N-(3-диметиламинопропил)-N'-этилкарбодиимида (EDC), затем 21,6 мг гидрата 1-гидроксибензотриазола (HOBt) и 18,9 мкл Boc-PEG2-NH2 (Sigma Aldrich). Добавляли 5,4 мкл триэтиламина (TEA), и реакционную смесь перемешивали в течение ночи. Реакционную смесь очищали с использованием HPLC и подтверждали с использованием UHPLC-MS (целевое m/z 831). Ацетонитрил удаляли с использованием ротационного выпаривания под высоким вакуумом, и продукт лиофилизировали. Соединение смешивали с 1:1 TFA:DCM в течение 30 минут. TFA/DCM удаляли с использованием ротационного выпаривания под высоким вакуумом с последующими 30 минутами под высоким вакуумом. Затем соединение растворяли в DMF и объединяли с 5 молярными эквивалентами i-Pr2NEt, 16 мг изотиоцианата флуоресцеина (Life Technologies) и перемешивали в течение 1 час. Реакционную смесь очищали посредством HPLC, и целевое соединение подтверждали с использованием UHPLC-MS (целевое m/z 1120). Образцы лиофилизировали и хранили при -20°C.
ПРИМЕР 13
Оценка экспрессии scFv против FITC на трансдуцированных CAR-T-клетках
Чтобы подтвердить, экспрессируется ли функциональный scFv против FITC на клеточной поверхности трансдуцированных CAR-T-клеток, CAR-T-клетки инкубировали с конъюгатом FITC-фолат в течение 30 мин на льду. После промывки клеток, добавляли антитело против фолата (Santa Cruz) и инкубировали в течение 30 мин на льду. Наконец, меченное Alexa Fluor 647 вторичное антитело (Jackson ImmunoResearch) использовали для визуализации CAR-T-клеток, экспрессирующих функциональный scFv против FITC. Как показано на фиг. 16A, для трансдуцированных CAR-T-клеток показана экспрессия GFP. Как показано на фиг. 16B, эти трансдуцированные CAR-T-клетки могут связывать конъюгат FITC-фолат, который визуализировали посредством иммунофлуоресцентного мечения.
ПРИМЕР 14
Анализ цитотоксичности CAR-T-клеток in vitro
Чтобы тестировать цитотоксичность CAR-T-клеток с использованием желательных FITC-лигандов, проводили стандартный анализ высвобождения лактатдегидрогеназы (LDH) с использованием набора для анализа цитотоксичности PierceTM LDH от ThermoFisher Scientific. Для получения образцов для анализа LDH, клетки злокачественных опухолей рассевали с плотностью 104 клеток/100 мкл среды в каждую лунку 96-луночного планшета и выращивали в течение ночи. CAR-T-клетки подготавливали на следующие сутки в различных количествах для получения различных соотношений эффекторные клетки (CAR-T-клетки):клетки-мишени (клетки злокачественных опухолей) (например, E:T=20:1, 10:1, 5:1 и 1:1). FITC-лиганды в различных концентрациях вводили в каждую лунку и совместно культивировали в течение 6-24 часов. После совместной инкубации, планшет, содержащий CAR-T-клетки и клетки злокачественных опухолей, центрифугировали при 350 × g при комнатной температуре в течение 10 мин для удаления клеточного дебриса или оставшихся клеток. Затем 50 мкл супернатантов из каждого образца переносили в новый 96-луночный планшет. 50 мкл полученной реакционной смеси для LDH добавляли к перенесенным 50 мкл каждого образца и инкубировали при комнатной температуре в течение 30 мин. Добавляли 50 мкл останавливающего раствора, и поглощение каждого образца измеряли при 490 нм и 680 нм. Процент цитотоксичности рассчитывали для каждого образца с использованием уравнения ниже:
% цитотоксичности=(экспериментальное значение - спонтанное для эффекторных клеток - спонтанное для клеток-мишеней)/(максимальный контроль для клеток-мишеней - спонтанный контроль для клеток-мишеней) × 100
Как показано на фигурах 3A-C, CAR-T-клетки активируются только при спаривании с совпадающими конъюгатами с антигенами опухолей. На фигуре 3A показана цитотоксичность CAR-T-клеток в модели KB (FR+) с E:T 10:1 с использованием 100 нМ каждого конъюгата. Активация с использованием FITC-фолата, FITC-PEG20-фолата и FITC-PEG108-фолата больше, чем активация с использованием FITC-DUPA или в отстутствие конъюгата. На фигуре 3B показана цитотоксичность CAR-T-клеток в модели LNCaP (PSMA+) с E:T 10:1 с использованием 100 нМ FITC-DUPA или FITC-PEG12-DUPA. Для конъюгатов FITC-DUPA показана большая активация, чем с использованием FITC-фолата или в отстутствие конъюгата. На фигуре 3C показана цитотоксичность CAR-T-клеток в модели HEK293 (NK1R+) с E:T 10:1 с использованием 100 нМ FITC-PEG11-NK1. Для FITC-PEG11-NK1 показана большая активация, чем активация с использованием FITC-фолата или в отстутствие конъюгата.
Как показано на фигуре 3D, цитотоксичность CAR-T-клеток по отношении к клеткам опухолей в модели KB (FR+) является функцией соотношения E:T, использованного в ходе анализа с использованием 100нМ FITC-фолата и FITC-DUPA. Как показано на фигуре 3E, цитотоксичность CAR-T-клеток по отношению к клеткам опухолей в модели KB (FR+) является функцией концентрации FITC-фолата, использованного во время совместной инкубации (соотношение E:T 10:1).
Как показано на фигуре 10, цитотоксичность CAR-T в модели KB (FR+) можно контролировать посредством корректировки концентрации конъюгата мостика, или с использованием линкеров с различной длиной PEG с E:T 10:1.
ПРИМЕР 15
Идентификация пролиферации CAR-T-клетки и активации CAR-T-клетки
Пролиферацию CAR-T-клетки в основном измеряли посредством проточной цитометрии. Сначала, клетки злокачественных опухолей (KB (FR+) или HEK (NK1R+)) рассевали при плотности 104 клеток/100 мкл среды в каждую лунку 96-луночного планшета и выращивали в течение ночи. На следующие сутки, CAR-T-клетки вводили в каждую лунку либо в присутствии, либо в отсутствие желательных FITC-лигандов, и клетки совместно культивировали в течение 5 суток (120 часов). После совместной инкубации, CAR-T-клетки окрашивали с использованием APC антител против CD3 человека (Biolegend) посредством стандартных способов иммуноокрашивания (20 мин на льду). Клетки, положительные как по окрашиванию против CD3 человека, так и по GFP, подсчитывали для пролиферации CAR-T-клеток.
Как показано на фигуре 1A-B, CAR-T-клетки пролиферировали в результате нацеливания на клетки опухолей (E:T=5:1) с использованием конъюгата FITC-малой молекулы (100 нМ) с использованием клеток KB (FR+) и клеток HEK293 (NK1R+). На фигуре 1A показана пролиферация CAR-T-клетки в присутствии клеток KB (FR+) с использованием различных конъюгатов. На фигуре 1B показана пролиферация CAR-T-клетки в присутствии клеток HEK (NK1R+) с использованием различных конъюгатов. Как можно кроме того видеть на фигуре 1, присутствие линкеров с различной длиной PEG влияет на уровни пролиферации CAR-T-клетки.
Для измерения активации CAR-T-клетки, клетки злокачественных опухолей получали таким же способом, описанным выше. Клетки злокачественных опухолей и CAR-T-клетки совместно культивировали в присутствии или в отсутствие 100 нМ FITC-лигандов с соотношением E:T 10:1 в течение 24 часов и собирали. После промывки, клетки из каждого образца окрашивали с использованием антитела против CD69 человека с Alexa Fluor 647 (Biolegend). Данные анализировали с отбором по положительным по GFP T-клеткам для количественной оценки активации CAR-T-клетки. Как показано на фигуре 17, экспрессия CD69 является связанной с совместно культивируемым конъюгатом.
ПРИМЕР 16
Анализ продукции IFN-γ
Для тестирования продукции IFN-γ CAR-T-клетками, проводили стандартный анализ ELISA с использованием набора ELISA для IFN-γ человека от Biolegend. Кратко, клетки злокачественных опухолей рассевали при плотности 104 клеток/100 мкл среды в каждую лунку 96-луночного планшета и выращивали в течение ночи. CAR-T-клетки вводили в каждый образец злокачественной опухоли с желательными FITC-лигандами и совместно культивировали в течение 24 часов. После совместной инкубации, супернатанты каждого образца собирали и центрифугировали при 1000 × g и 4°C в течение 10 мин для удаления клеточного дебриса. Затем осветленные супернатанты из каждого образца либо использовали для детекции IFN-γ посредством ELISA, либо хранили при -80°C для будущего использования. После завершения получения каждого образца, проводили стандартный ELISA на основании инструкций производителя.
Как показано на фигурах 2A-C, при использовании соотношения E:T 5:1 в клетках KB (FR+) (Фигура 2A), LNCaP (PSMA+) (Фигура 2B) или HEK (NK1R+) (Фигура 2C), CAR-T-клетки продуцируют значительное количество провоспалительного цитокина в присутствии 100 нМ конъюгата FITC-малая молекула. Как можно, кроме того, видеть, количество цитокина зависит от использованного конъюгата. Как показано на фигуре 2D, количество провоспалительного цитокина связано с концентрацией FITC-фолата, использованного с клетками KB (FR+). Как показано на фигуре 2E и 2F, для различных конъюгатов (100 нМ) получены различные ответы IFN-γ с использованием клеток KB (FR+).
Как показано на фигурах 4A-B, активация CAR-T-клеток коррелирует с уровнем антигена опухоли в клетках KB (FR+) и клетках MDA-MB-231. Измерение продукции IFN-γ в результате инкубации клеток с одинаковой дозой конъюгата показывает, что активация T-клеток с CAR против FITC коррелирует с уровнем экспрессии антигена опухоли на клетках злокачественных опухолей.
ПРИМЕР 17
Оценка корреляции между уровнем антигена опухоли и активацией CAR-T
Клетки KB (FR+) и клетки MDA-MB-231 инкубировали с 100 нМ FITC-фолата в течение 30 мин на льду. После промывки, связывание FITC-фолата с антигеном опухоли FRα не клетках измеряли посредством проточной цитометрии. Как показано на фигуре 4A, клетки KB (FR+) имеют более высокий уровень экспрессии FR и соответствующего связывания FITC, чем клетки MDA-MB-231.
Эти две линии клеток совместно культивировали с CAR-T-клетками в присутствии 100 нМ FITC-фолата, FITC-PEG20-фолата и FITC-PEG108-фолата с использованием соотношения E:T 10:1 в течение 24 часов. Активацию CAR-T-клеток детектировали посредством измерения их продукции INF-γ. Супернатант культивированных клеток собирали, и продукцию IFN-γ измеряли с использованием набора для ELISA. Как показано на фигуре 4B, с использованием более высокого уровня FRα, клетки KB (FR+) активировали CAR-T-клетки намного больше, чем клетки MDA-MB-231.
ПРИМЕР 18
Противоопухолевая эффективность CAR-T-клеток in vivo
Мышей NSG с иммунодефицитом (Jackson Laboratory) использовали для идентификации эффективности противоопухолевой активности CAR-T-клетки in vivo. Каждую экспрессирующую специфический для опухоли антиген линию клеток злокачественной опухоли подкожно инъецировали в плечо мышей NSG для развития ксенотрансплантатов солидной опухоли. Когда объем опухоли достигал приблизительно 50-100 мм3, CAR-T-клетки вводили мышам, несущим опухоли, и желательные FITC-лиганды также вводили (i.v.) каждые вторые сутки. Контрольным мышам вводили PBS вместо FITC-лигандов. Измеряли объем опухоли и уровни цитокинов в крови (IL2, IL6, IL10, IFNγ и TNFα). Общую токсичность терапии мониторировали посредством измерения потери массы. В конце каждой обработки, кровь мышей собирали для тестирования анемии, количества лейкоцитов и пролиферации CAR-T-клеток. Оценивали также органы мышей.
Модель ксенотрансплантации с использованием клеток HEK293 (NK1R+) показана на фигурах 5A-C и 6A-B. Как показано на фигуре 5A, размер опухолей уменьшался у мышей, подвергнутых обработке с использованием FITC-PEG11-NK1 (500 нмоль/кг), но они продолжали расти у контрольных мышей. Как показано на фигуре 5B, масса тела мышей, подвергнутых обработке с использованием FITC-PEG11-NK1, не изменялась по сравнению с контрольной мышью. Как показано на фигуре 5C, процент CAR-T-клеток в T-клетках человека увеличивался после инъекции CAR-T-клеток. Как показано на фигурах 6A-B, собранные органы из группы лечения (6B) выглядели нормальными по размеру без признаков синдрома высвобождения цитокинов после двух недель терапии по сравнению с собранными органами мышей из контрольной группы (6A).
Модель ксенотрансплантации с использованием клеток MDA-MB-231 (FR+) показана на Фигурах 7A-C и 8A-B. Как показано на фигуре 7A, размер опухолей уменьшался у мышей, подвергнутых обработке с использованием FITC-PEG12-фолата (500 нмоль/кг) или FITC-фолата (500 нмоль/кг), но опухоли продолжали расти у контрольных мышей. Как показано на фигуре 7B, масса тела мышей, подвергнутых обработке с использованием FITC-PEG11-NK1, не изменялась на протяжении обработки. Как показано на фигуре 7C, процент CAR-T-клеток в T-клетках человека увеличивался после терапии с использованием CAR-T-клеток и конъюгата. Как показано на фигурах 8A-B, собранные органы от мышей, подвергнутых обработке с использованием FITC-PEG12-фолата (8B), выглядели нормальными по размеру, и признаков синдрома высвобождения цитокинов не наблюдали после 3 недель терапии по сравнению с собранными органами мышей из контрольной группы (8A). Как использовали в любом из вариантов осуществления в этой патентной заявке, «нмоль/кг» и «нмолей/кг» являются эквивалентными.
Как показано на фигуре 9, показатели крови для модели HEK-NK1R с использованием FITC-PEG11-NK1 (500 нмоль/кг) и модели MDA-MB-231 с использованием FITC-PEG12-фолата (500 нмоль/кг) также показывают, что цитокиновый шторм не возникал в ходе обработки.
Как показано на фигурах 11, 12A-C и 13, ксенотрансплантаты опухолей KB (FR+) подвергали обработке с использованием двух различных концентраций FITC-PEG12-фолата. Как показано на фигуре 11, мыши, подвергнутые обработке с использованием более низкой дозы (250 нмоль/кг), имели более мягкую потерю массы тела по сравнению с мышами, подвергнутыми обработке с использованием более высокой дозы (500 нмоль/кг). Как показано на фигурах 12A-C, для собранных органов от мышей без обработки (Фигура 12A) и мышей, которым вводили более низкую дозу (Фигура 12B), показали более мягкий синдром высвобождения цитокинов по сравнению с более высокой дозой (Фигура 12C). Как показано на фигуре 13, для мышей с ксенотрансплантатом KB, которым вводили более низкие дозы, показали лучшие показатели крови, указывающие на более мягкое высвобождение цитокинов.
ПРИМЕР 19
Противоопухолевая эффективность CAR-T-клеток in vivo
Для исследования того, могут ли одинаковые T-клетки с CAR против FITC уничтожать смесь гетерогенных клеток злокачественных опухолей с использованием коктейля FITC-лигандов, мышей NSG с иммунодефицитом (Jackson laboratory) использовали для исследования in vivo. Две различные линии клеток (например, MDA-MB-231(FR+) и HEK(NK1R+)) имплантировали в разные бока одной и той же мыши. Затем T-клетки с CAR против FITC (107 клеток) вводили посредством внутривенной инъекции, когда объемы опухолей достигали приблизительно 50-100 мм3. Кроме того, смесь FITC-лигандов (т.е. FITC-PEG12-фолат (500 нмоль/кг) и FITC-PEG11-NK1R (500 нмоль/кг)), один FITC-PEG11-NK-1R (500 нмоль/кг) или PBS вводили каждые вторые сутки посредством внутривенной инъекции. Противоопухолевую эффективность CAR-T-клеток с использованием FITC-лигандов анализировали посредством измерения объема опухоли на каждые вторые сутки.
Как показано на фигурах 19A-C, обе опухоли (т.е. MDA-MB-231 (MDA) и HEK (NK1R)) уничтожали посредством одинаковых T-клеток CAR против FITC, когда вводили как FITC-PEG11-NK1R, так и FITC-PEG12-фолат. Только опухоль HEK (NK1R) подвергалась уничтожению у мыши, которую подвергали обработке только FITC-PEG11-NK1R. Без связи с теорией, считают, что MDA-MB-231 продолжала расти у той же самой мыши, когда вводили только FITC-PEG11-NK1R, поскольку FITC-PEG12-фолат не вводили. Как ожидали, для обеих опухолей не показали никакого ответа, когда вводили PBS. Эти данные позволяют предполагать, что одинаковые T-клетки с CAR против FITC могут уничтожать антигенно гетерогамную смесь опухолей посредством коктейля FITC-лигандов.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> PURDUE RESEARCH FOUNDATION
ENDOCYTE, INC.
<120> СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ CAR-T-КЛЕТОЧНОЙ ТЕРАПИИ
<130> 3220-264637
<140> PCT/US2017/026618
<141> 2017-04-07
<150> 62/323,971
<151> 2016-04-18
<150> 62/320,183
<151> 2016-04-08
<160> 4
<170> PatentIn версии 3.5
<210> 1
<211> 1554
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полинуклеотид
<400> 1
atggccttac cagtgaccgc cttgctcctg ccgctggcct tgctgctcca cgccgccagg 60
ccggatgtcg tgatgaccca gacccccctc agcctcccag tgtccctcgg tgaccaggct 120
tctattagtt gcagatccag ccagtccctc gtgcactcta acggtaatac ctacctgaga 180
tggtatctcc agaagcccgg acagagccct aaggtgctga tctacaaagt ctccaaccgg 240
gtgtctggag tccctgaccg cttctcaggg agcggttccg gcaccgactt caccctgaag 300
atcaaccggg tggaggccga agacctcggc gtctatttct gctctcagag tacacatgtg 360
ccctggacct tcggcggagg gaccaagctg gagatcaaaa gctccgcaga cgatgccaag 420
aaagatgccg ctaagaaaga cgatgctaag aaagacgatg caaagaaaga cggtggcgtg 480
aagctggatg aaaccggagg aggtctcgtc cagccaggag gagccatgaa gctgagttgc 540
gtgaccagcg gattcacctt tgggcactac tggatgaact gggtgcgaca gtccccagag 600
aaggggctcg aatgggtcgc tcagttcagg aacaaaccct acaattatga gacatactat 660
tcagacagcg tgaagggcag gtttactatc agtagagacg attccaaatc tagcgtgtac 720
ctgcagatga acaatctcag ggtcgaagat acaggcatct actattgcac aggggcatcc 780
tatggtatgg agtatctcgg tcaggggaca agcgtcacag tcagtttcgt gccggtcttc 840
ctgccagcga agcccaccac gacgccagcg ccgcgaccac caacaccggc gcccaccatc 900
gcgtcgcagc ccctgtccct gcgcccagag gcgtgccggc cagcggcggg gggcgcagtg 960
cacacgaggg ggctggactt cgcctgtgat atctacatct gggcgccctt ggccgggact 1020
tgtggggtcc ttctcctgtc actggttatc accctttact gcaaccacag gaaccgtttc 1080
tctgttgtta aacggggcag aaagaaactc ctgtatatat tcaaacaacc atttatgaga 1140
ccagtacaaa ctactcaaga ggaagatggc tgtagctgcc gatttccaga agaagaagaa 1200
ggaggatgtg aactgagagt gaagttcagc aggagcgcag acgcccccgc gtaccagcag 1260
ggccagaacc agctctataa cgagctcaat ctaggacgaa gagaggagta cgatgttttg 1320
gacaagagac gtggccggga ccctgagatg gggggaaagc cgagaaggaa gaaccctcag 1380
gaaggcctgt acaatgaact gcagaaagat aagatggcgg aggcctacag tgagattggg 1440
atgaaaggcg agcgccggag gggcaagggg cacgatggcc tttaccaggg tctcagtaca 1500
gccaccaagg acacctacga cgcccttcac atgcaggccc tgccccctcg ctaa 1554
<210> 2
<211> 517
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 2
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Asp Val Val Met Thr Gln Thr Pro Leu Ser Leu
20 25 30
Pro Val Ser Leu Gly Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln
35 40 45
Ser Leu Val His Ser Asn Gly Asn Thr Tyr Leu Arg Trp Tyr Leu Gln
50 55 60
Lys Pro Gly Gln Ser Pro Lys Val Leu Ile Tyr Lys Val Ser Asn Arg
65 70 75 80
Val Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp
85 90 95
Phe Thr Leu Lys Ile Asn Arg Val Glu Ala Glu Asp Leu Gly Val Tyr
100 105 110
Phe Cys Ser Gln Ser Thr His Val Pro Trp Thr Phe Gly Gly Gly Thr
115 120 125
Lys Leu Glu Ile Lys Ser Ser Ala Asp Asp Ala Lys Lys Asp Ala Ala
130 135 140
Lys Lys Asp Asp Ala Lys Lys Asp Asp Ala Lys Lys Asp Gly Gly Val
145 150 155 160
Lys Leu Asp Glu Thr Gly Gly Gly Leu Val Gln Pro Gly Gly Ala Met
165 170 175
Lys Leu Ser Cys Val Thr Ser Gly Phe Thr Phe Gly His Tyr Trp Met
180 185 190
Asn Trp Val Arg Gln Ser Pro Glu Lys Gly Leu Glu Trp Val Ala Gln
195 200 205
Phe Arg Asn Lys Pro Tyr Asn Tyr Glu Thr Tyr Tyr Ser Asp Ser Val
210 215 220
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ser Val Tyr
225 230 235 240
Leu Gln Met Asn Asn Leu Arg Val Glu Asp Thr Gly Ile Tyr Tyr Cys
245 250 255
Thr Gly Ala Ser Tyr Gly Met Glu Tyr Leu Gly Gln Gly Thr Ser Val
260 265 270
Thr Val Ser Phe Val Pro Val Phe Leu Pro Ala Lys Pro Thr Thr Thr
275 280 285
Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro
290 295 300
Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val
305 310 315 320
His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro
325 330 335
Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu
340 345 350
Tyr Cys Asn His Arg Asn Arg Phe Ser Val Val Lys Arg Gly Arg Lys
355 360 365
Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr
370 375 380
Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu
385 390 395 400
Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro
405 410 415
Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly
420 425 430
Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro
435 440 445
Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr
450 455 460
Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly
465 470 475 480
Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln
485 490 495
Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln
500 505 510
Ala Leu Pro Pro Arg
515
<210> 3
<211> 1560
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полинуклеотид
<400> 3
gccaccatgg ccttaccagt gaccgccttg ctcctgccgc tggccttgct gctccacgcc 60
gccaggccgg atgtcgtgat gacccagacc cccctcagcc tcccagtgtc cctcggtgac 120
caggcttcta ttagttgcag atccagccag tccctcgtgc actctaacgg taatacctac 180
ctgagatggt atctccagaa gcccggacag agccctaagg tgctgatcta caaagtctcc 240
aaccgggtgt ctggagtccc tgaccgcttc tcagggagcg gttccggcac cgacttcacc 300
ctgaagatca accgggtgga ggccgaagac ctcggcgtct atttctgctc tcagagtaca 360
catgtgccct ggaccttcgg cggagggacc aagctggaga tcaaaagctc cgcagacgat 420
gccaagaaag atgccgctaa gaaagacgat gctaagaaag acgatgcaaa gaaagacggt 480
ggcgtgaagc tggatgaaac cggaggaggt ctcgtccagc caggaggagc catgaagctg 540
agttgcgtga ccagcggatt cacctttggg cactactgga tgaactgggt gcgacagtcc 600
ccagagaagg ggctcgaatg ggtcgctcag ttcaggaaca aaccctacaa ttatgagaca 660
tactattcag acagcgtgaa gggcaggttt actatcagta gagacgattc caaatctagc 720
gtgtacctgc agatgaacaa tctcagggtc gaagatacag gcatctacta ttgcacaggg 780
gcatcctatg gtatggagta tctcggtcag gggacaagcg tcacagtcag tttcgtgccg 840
gtcttcctgc cagcgaagcc caccacgacg ccagcgccgc gaccaccaac accggcgccc 900
accatcgcgt cgcagcccct gtccctgcgc ccagaggcgt gccggccagc ggcggggggc 960
gcagtgcaca cgagggggct ggacttcgcc tgtgatatct acatctgggc gcccttggcc 1020
gggacttgtg gggtccttct cctgtcactg gttatcaccc tttactgcaa ccacaggaac 1080
cgtttctctg ttgttaaacg gggcagaaag aaactcctgt atatattcaa acaaccattt 1140
atgagaccag tacaaactac tcaagaggaa gatggctgta gctgccgatt tccagaagaa 1200
gaagaaggag gatgtgaact gagagtgaag ttcagcagga gcgcagacgc ccccgcgtac 1260
cagcagggcc agaaccagct ctataacgag ctcaatctag gacgaagaga ggagtacgat 1320
gttttggaca agagacgtgg ccgggaccct gagatggggg gaaagccgag aaggaagaac 1380
cctcaggaag gcctgtacaa tgaactgcag aaagataaga tggcggaggc ctacagtgag 1440
attgggatga aaggcgagcg ccggaggggc aaggggcacg atggccttta ccagggtctc 1500
agtacagcca ccaaggacac ctacgacgcc cttcacatgc aggccctgcc ccctcgctaa 1560
<210> 4
<211> 519
<212> PRT
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический
полипептид
<400> 4
Ala Thr Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu
1 5 10 15
Leu Leu His Ala Ala Arg Pro Asp Val Val Met Thr Gln Thr Pro Leu
20 25 30
Ser Leu Pro Val Ser Leu Gly Asp Gln Ala Ser Ile Ser Cys Arg Ser
35 40 45
Ser Gln Ser Leu Val His Ser Asn Gly Asn Thr Tyr Leu Arg Trp Tyr
50 55 60
Leu Gln Lys Pro Gly Gln Ser Pro Lys Val Leu Ile Tyr Lys Val Ser
65 70 75 80
Asn Arg Val Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly
85 90 95
Thr Asp Phe Thr Leu Lys Ile Asn Arg Val Glu Ala Glu Asp Leu Gly
100 105 110
Val Tyr Phe Cys Ser Gln Ser Thr His Val Pro Trp Thr Phe Gly Gly
115 120 125
Gly Thr Lys Leu Glu Ile Lys Ser Ser Ala Asp Asp Ala Lys Lys Asp
130 135 140
Ala Ala Lys Lys Asp Asp Ala Lys Lys Asp Asp Ala Lys Lys Asp Gly
145 150 155 160
Gly Val Lys Leu Asp Glu Thr Gly Gly Gly Leu Val Gln Pro Gly Gly
165 170 175
Ala Met Lys Leu Ser Cys Val Thr Ser Gly Phe Thr Phe Gly His Tyr
180 185 190
Trp Met Asn Trp Val Arg Gln Ser Pro Glu Lys Gly Leu Glu Trp Val
195 200 205
Ala Gln Phe Arg Asn Lys Pro Tyr Asn Tyr Glu Thr Tyr Tyr Ser Asp
210 215 220
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ser
225 230 235 240
Val Tyr Leu Gln Met Asn Asn Leu Arg Val Glu Asp Thr Gly Ile Tyr
245 250 255
Tyr Cys Thr Gly Ala Ser Tyr Gly Met Glu Tyr Leu Gly Gln Gly Thr
260 265 270
Ser Val Thr Val Ser Phe Val Pro Val Phe Leu Pro Ala Lys Pro Thr
275 280 285
Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser
290 295 300
Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly
305 310 315 320
Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp
325 330 335
Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile
340 345 350
Thr Leu Tyr Cys Asn His Arg Asn Arg Phe Ser Val Val Lys Arg Gly
355 360 365
Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val
370 375 380
Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu
385 390 395 400
Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp
405 410 415
Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn
420 425 430
Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg
435 440 445
Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly
450 455 460
Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu
465 470 475 480
Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu
485 490 495
Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His
500 505 510
Met Gln Ala Leu Pro Pro Arg
515
<---
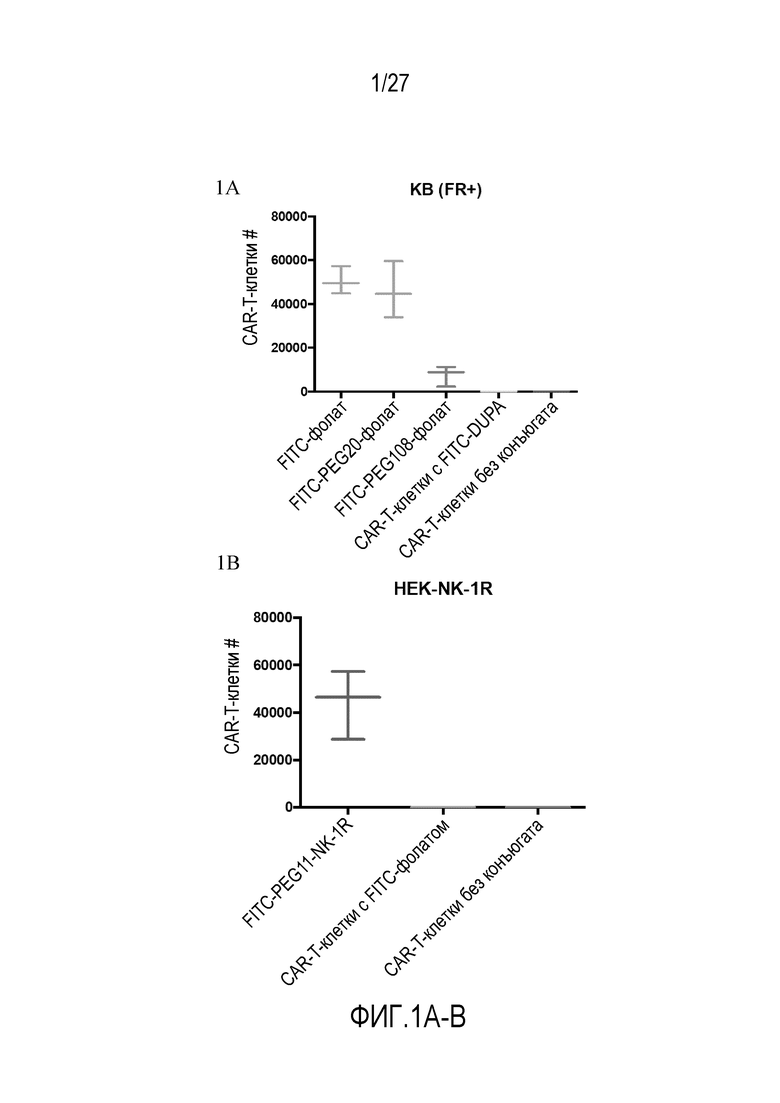
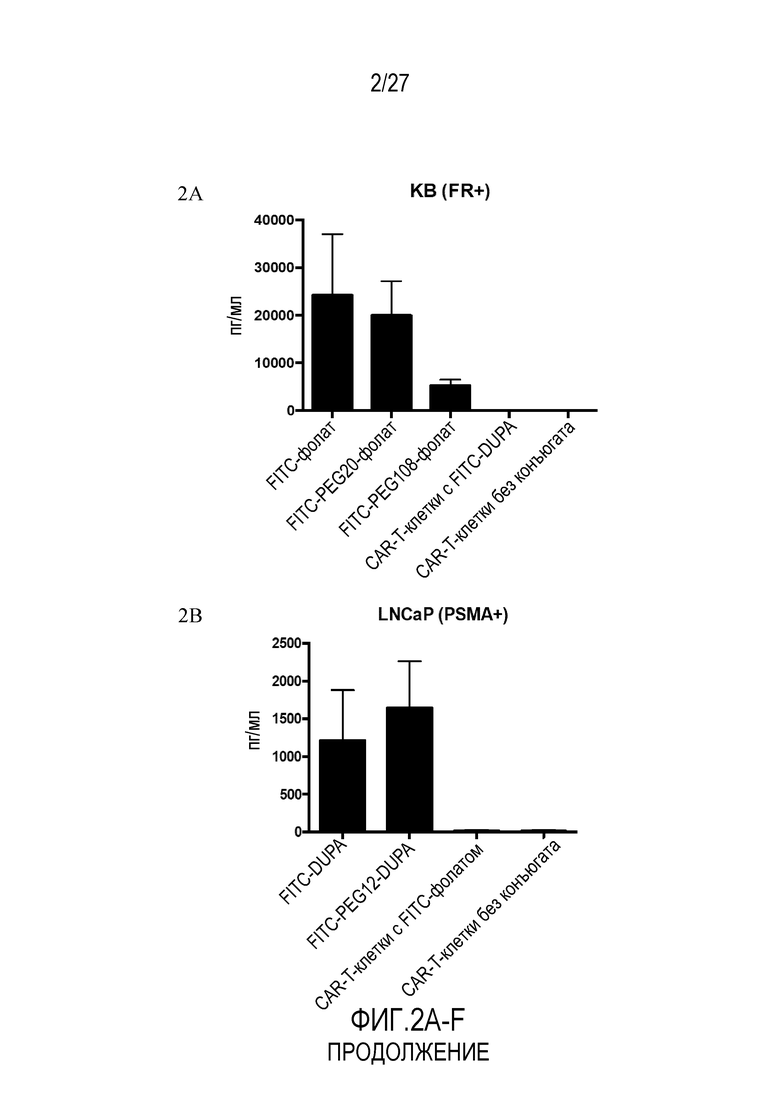
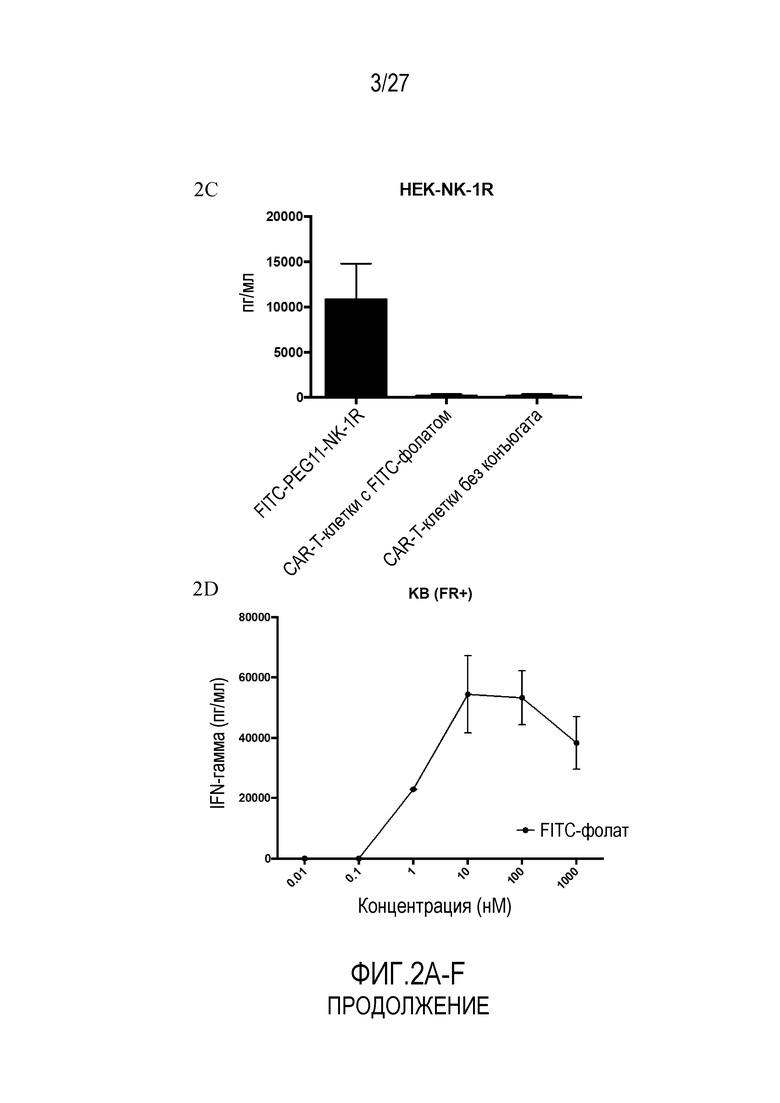
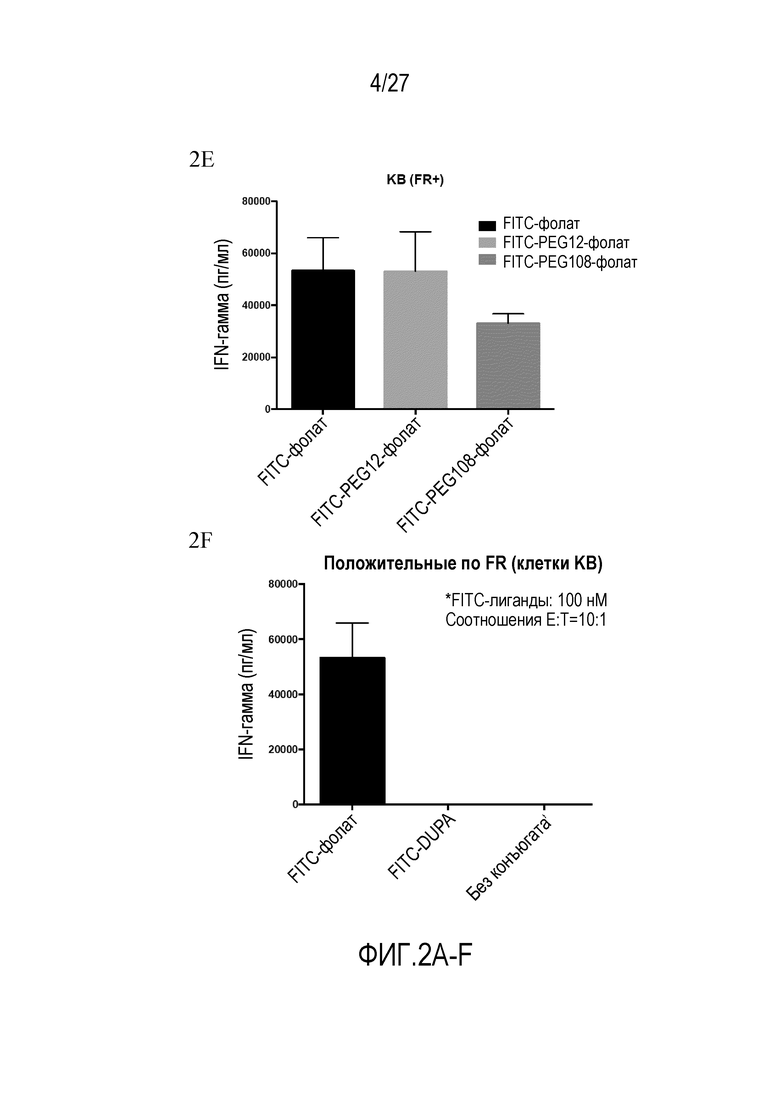
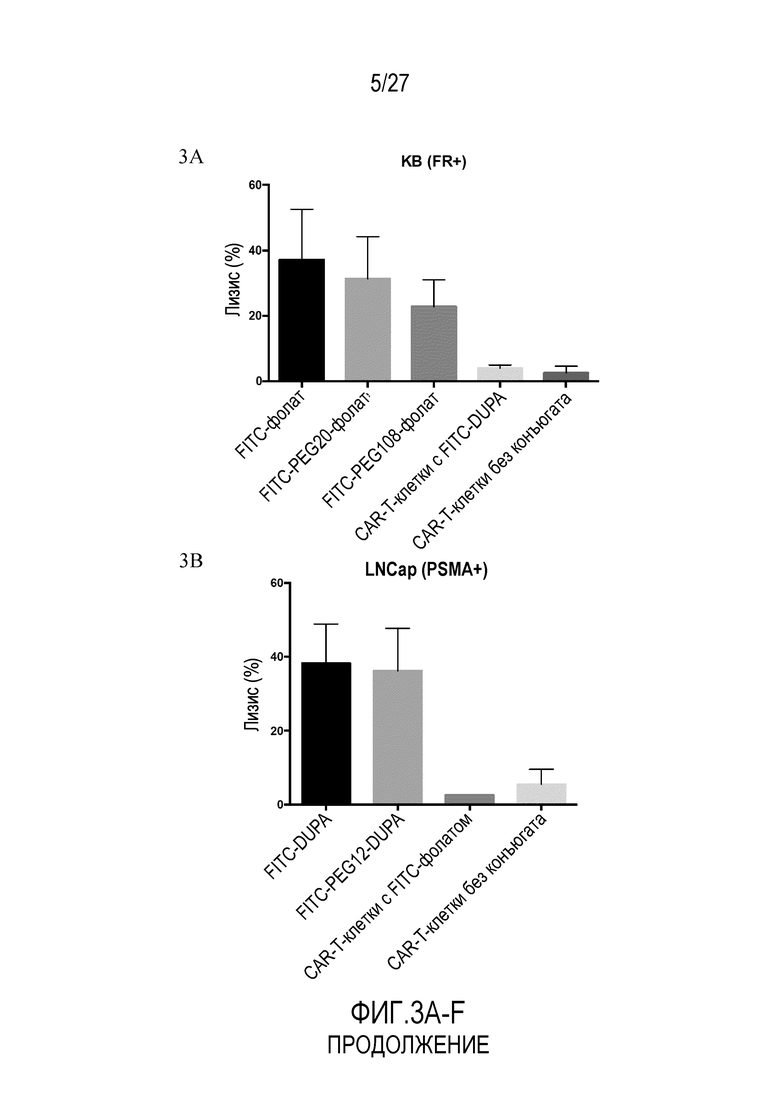
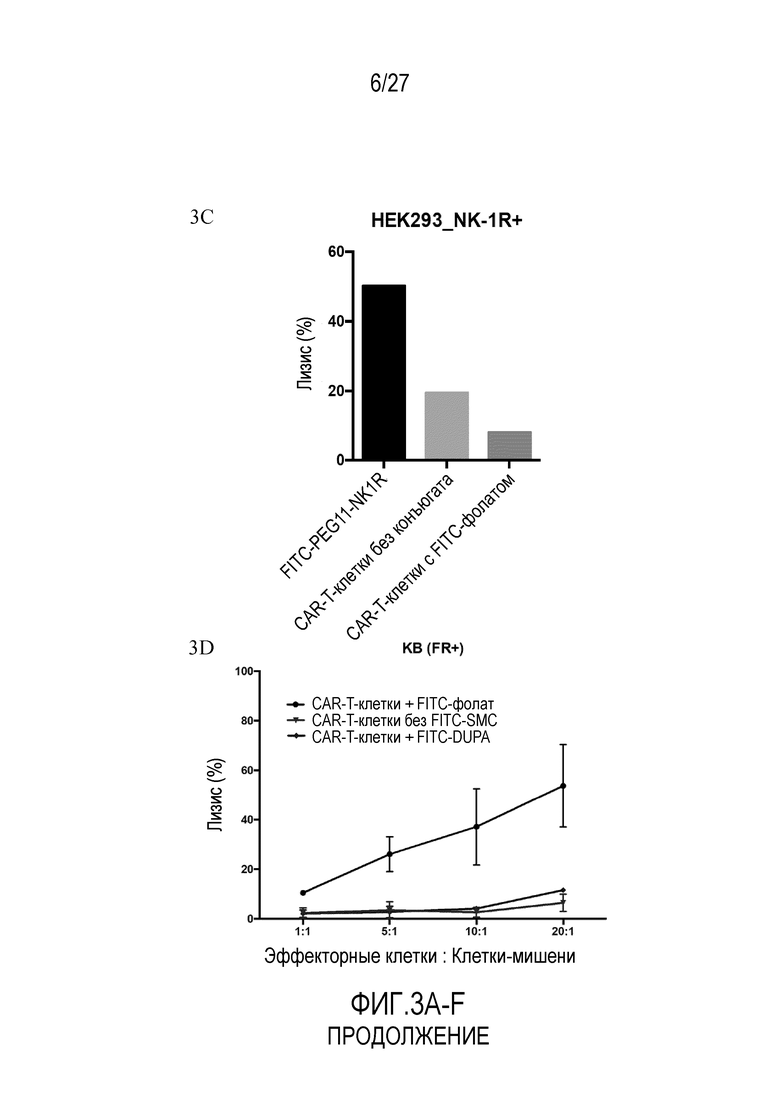
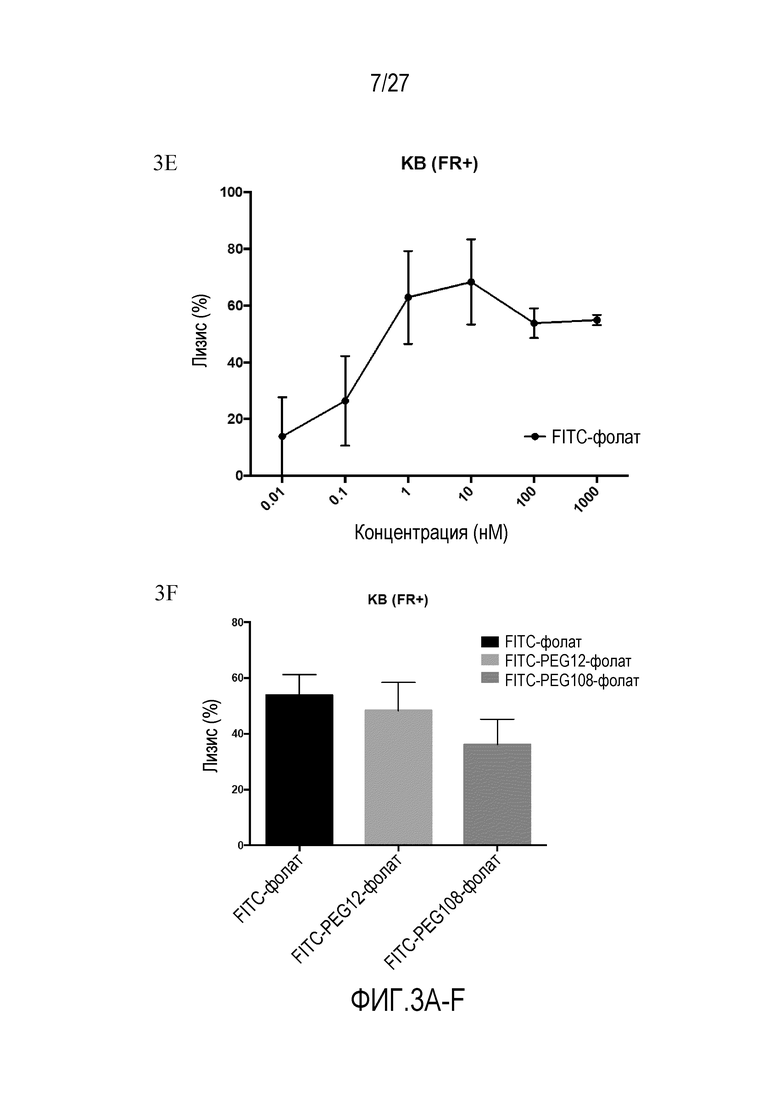
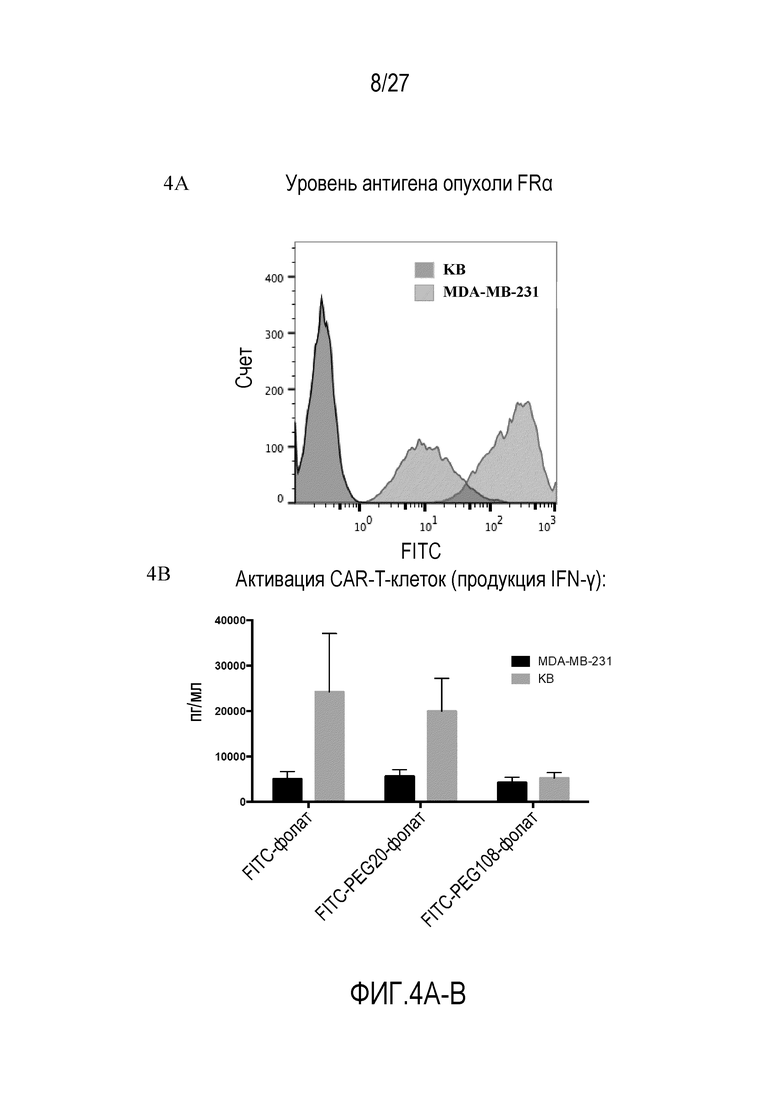
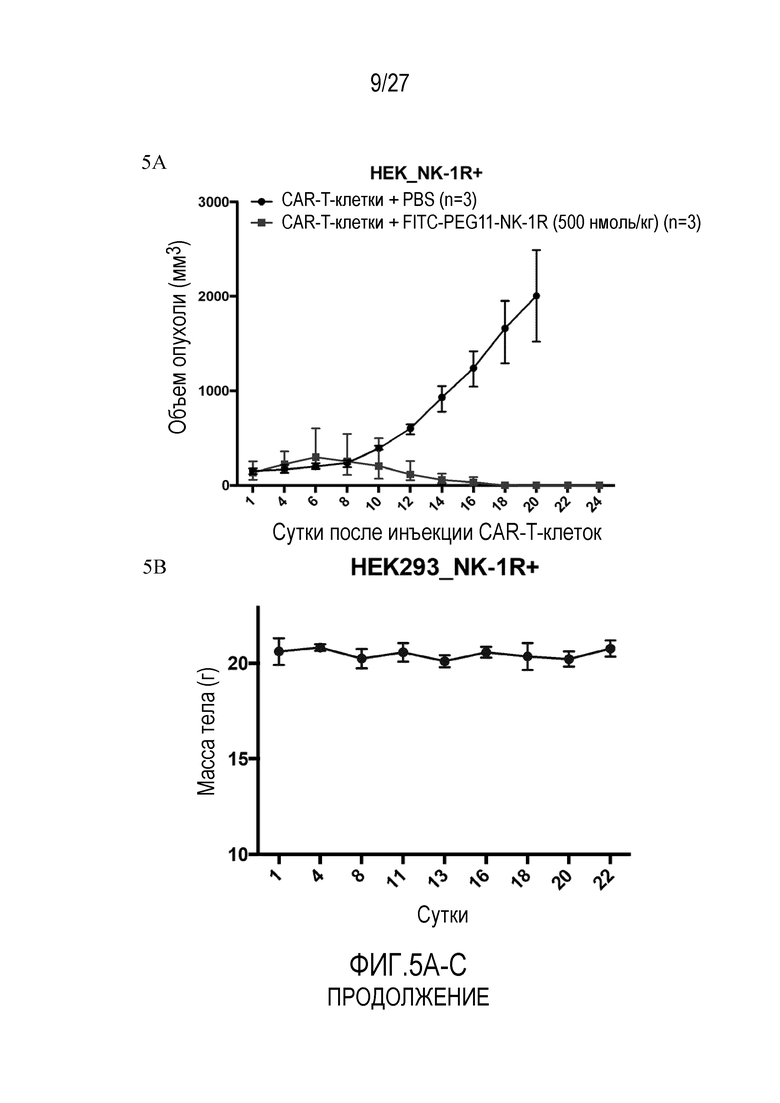
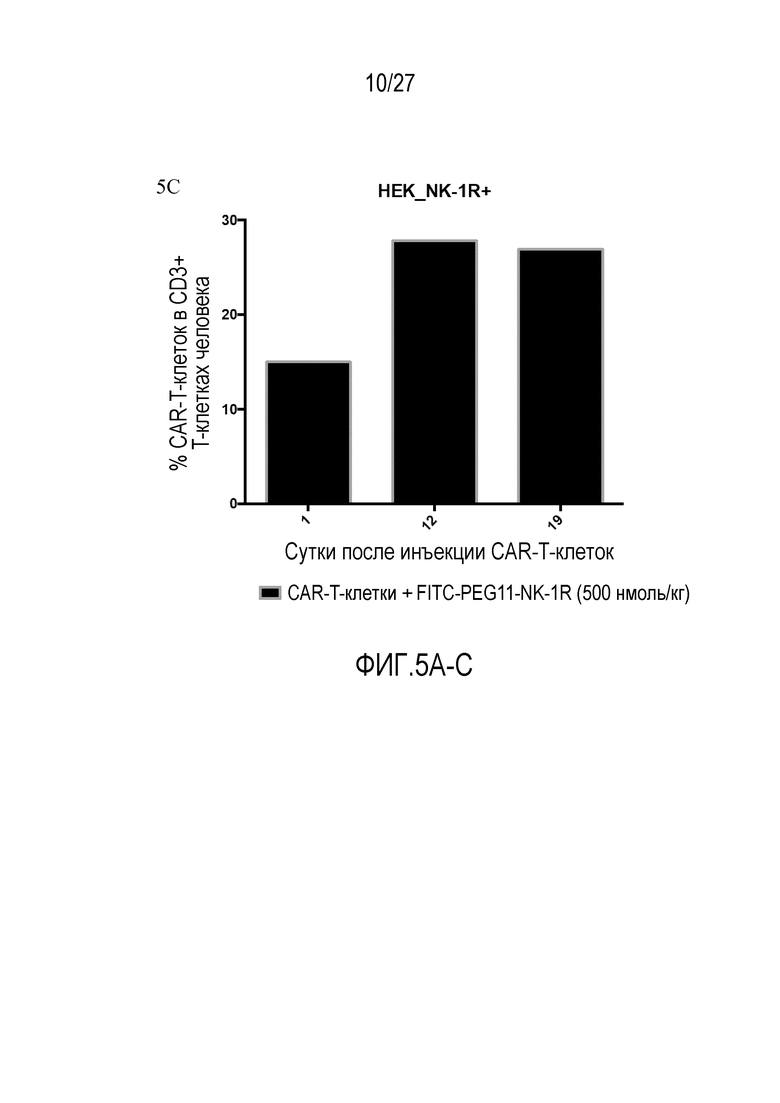
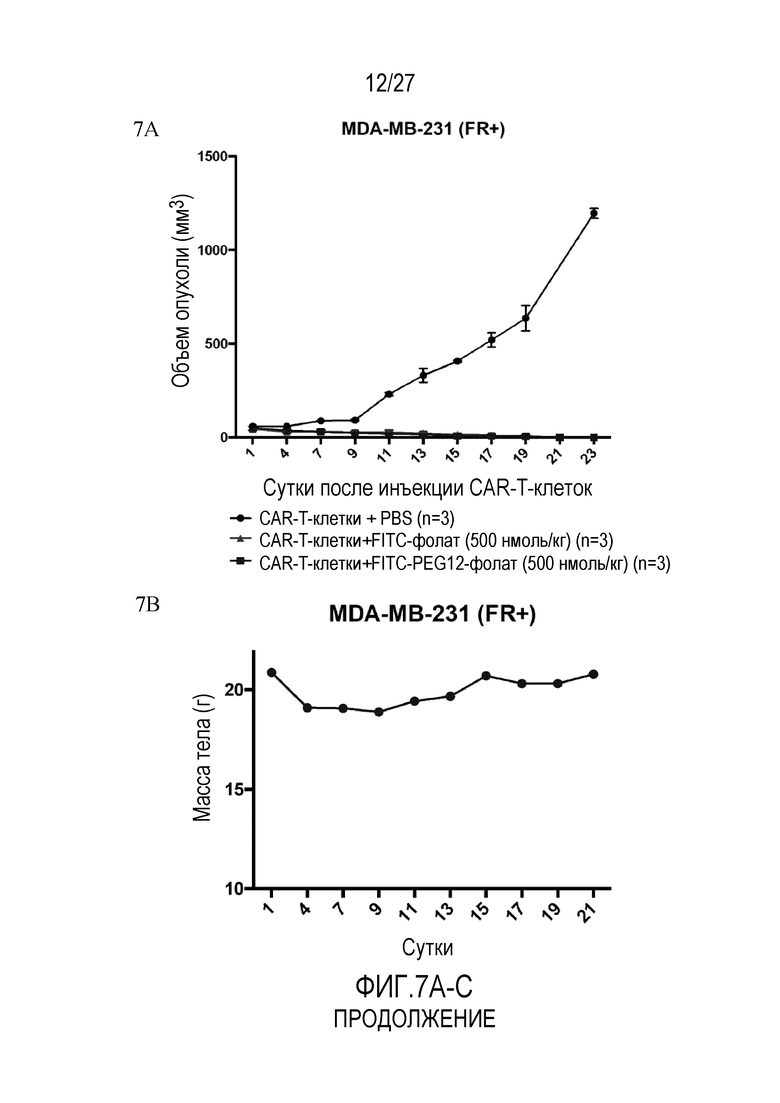
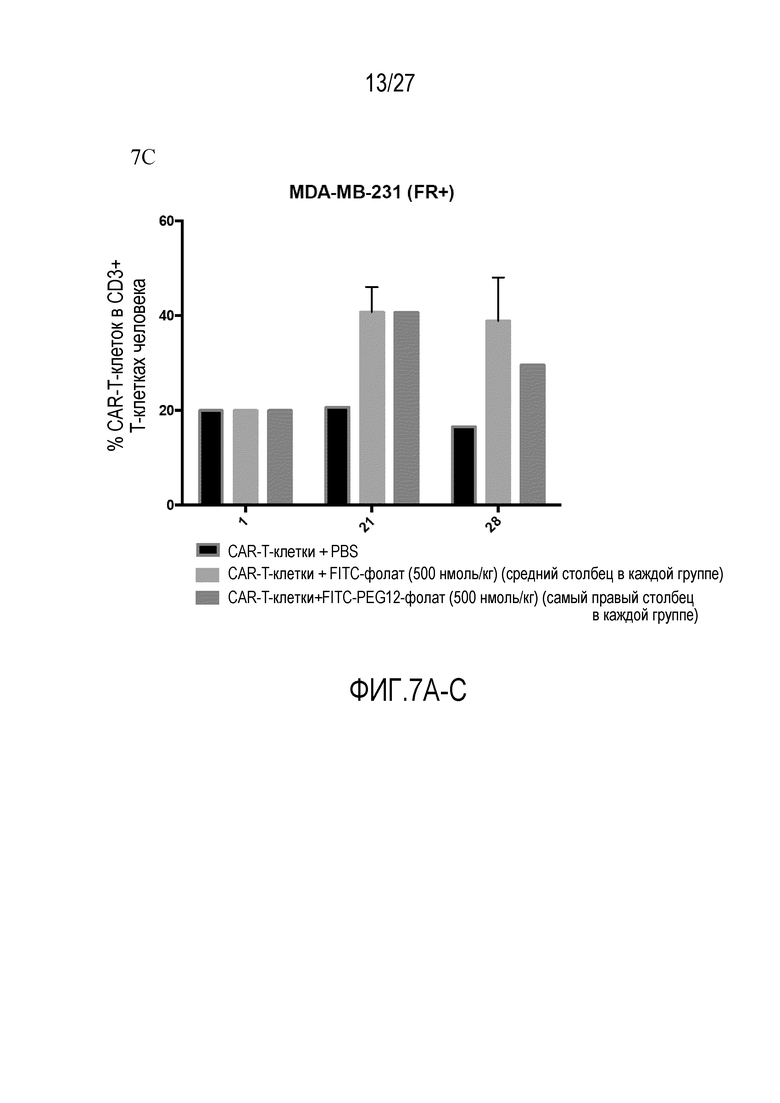
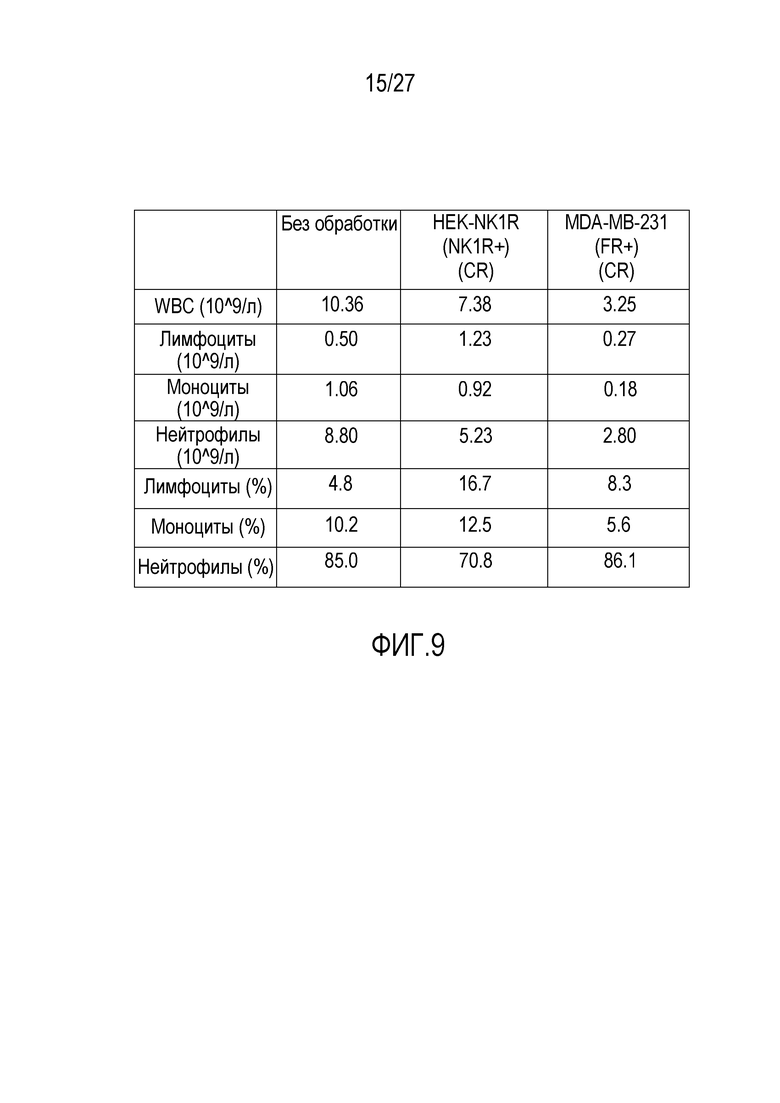
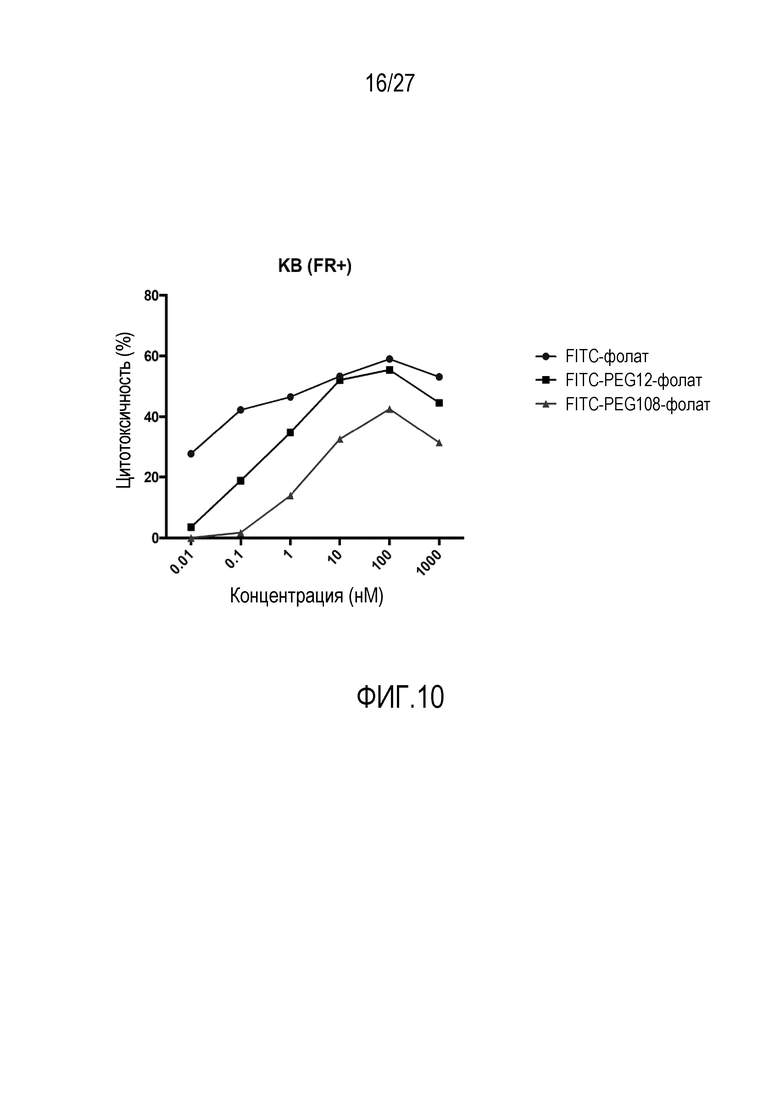
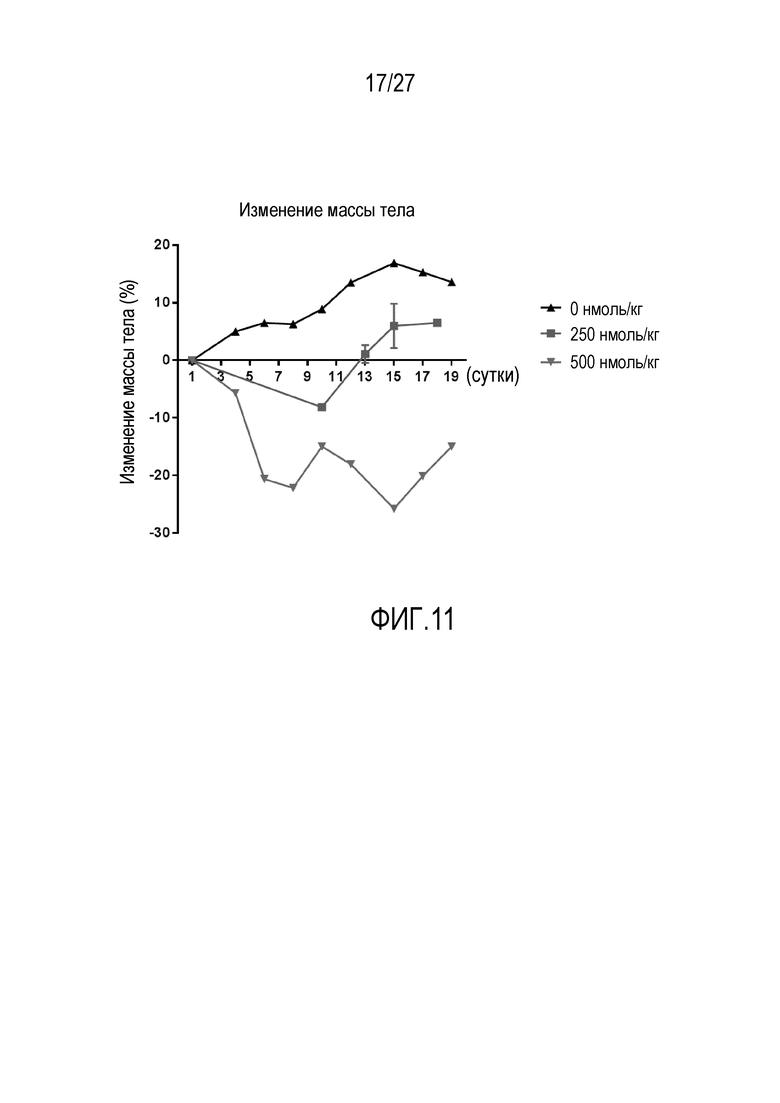
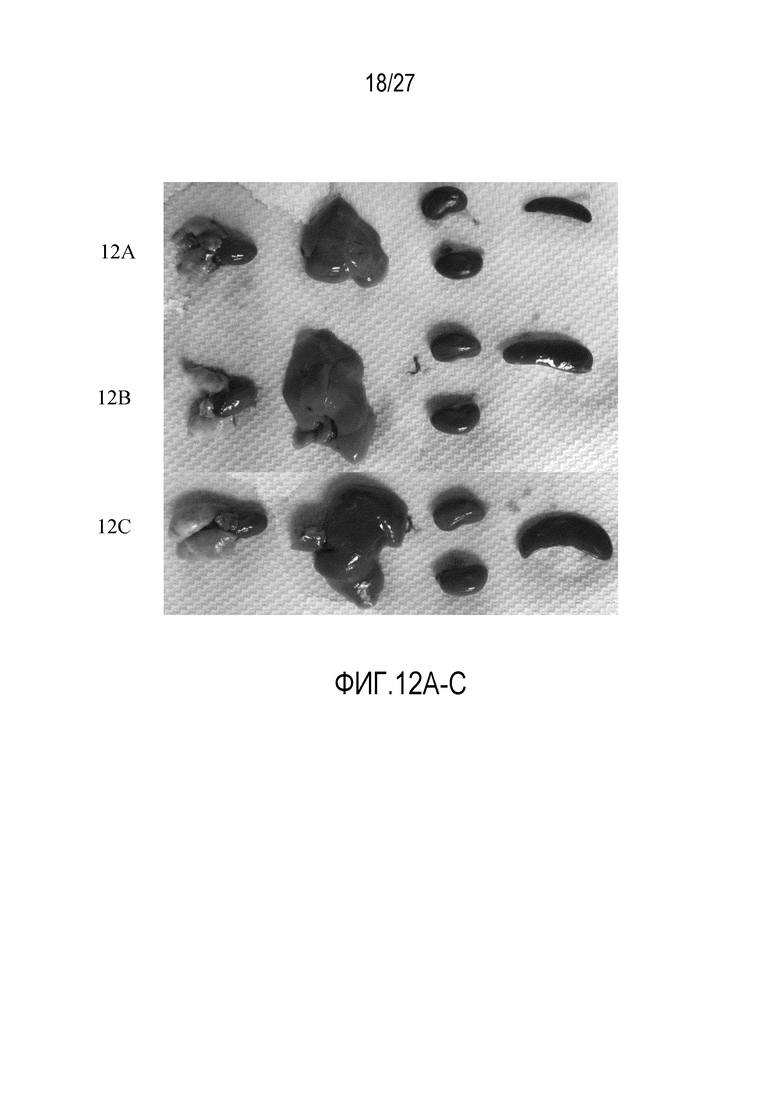
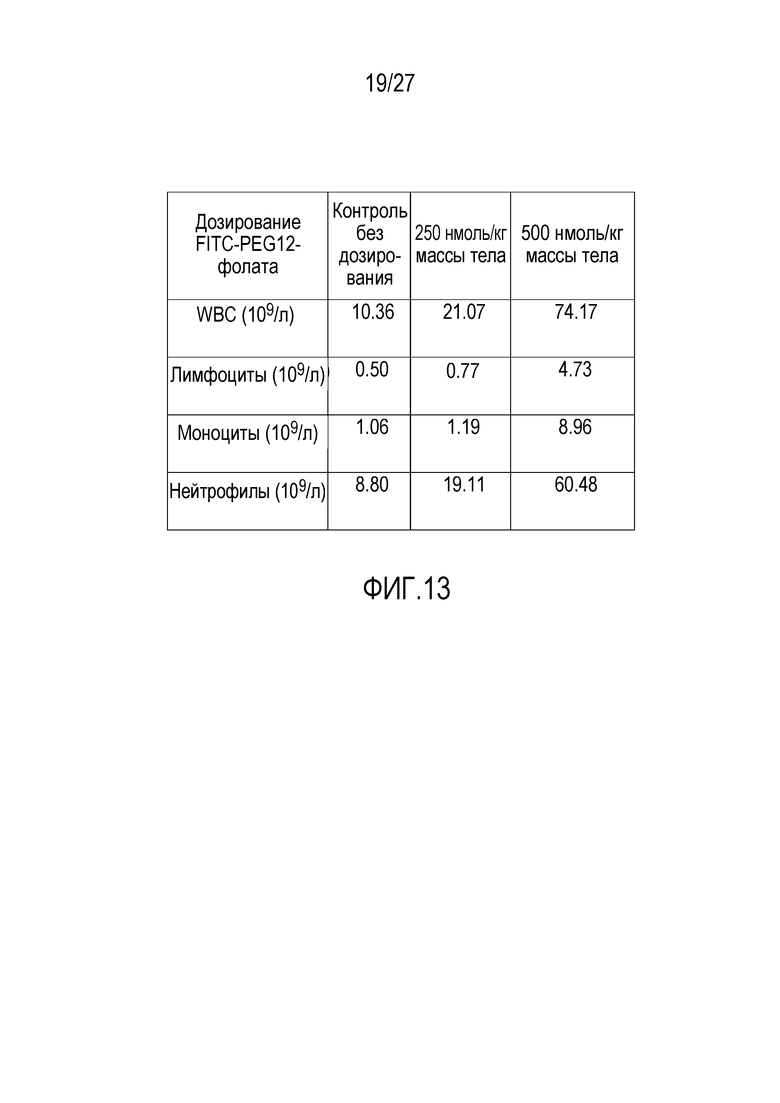
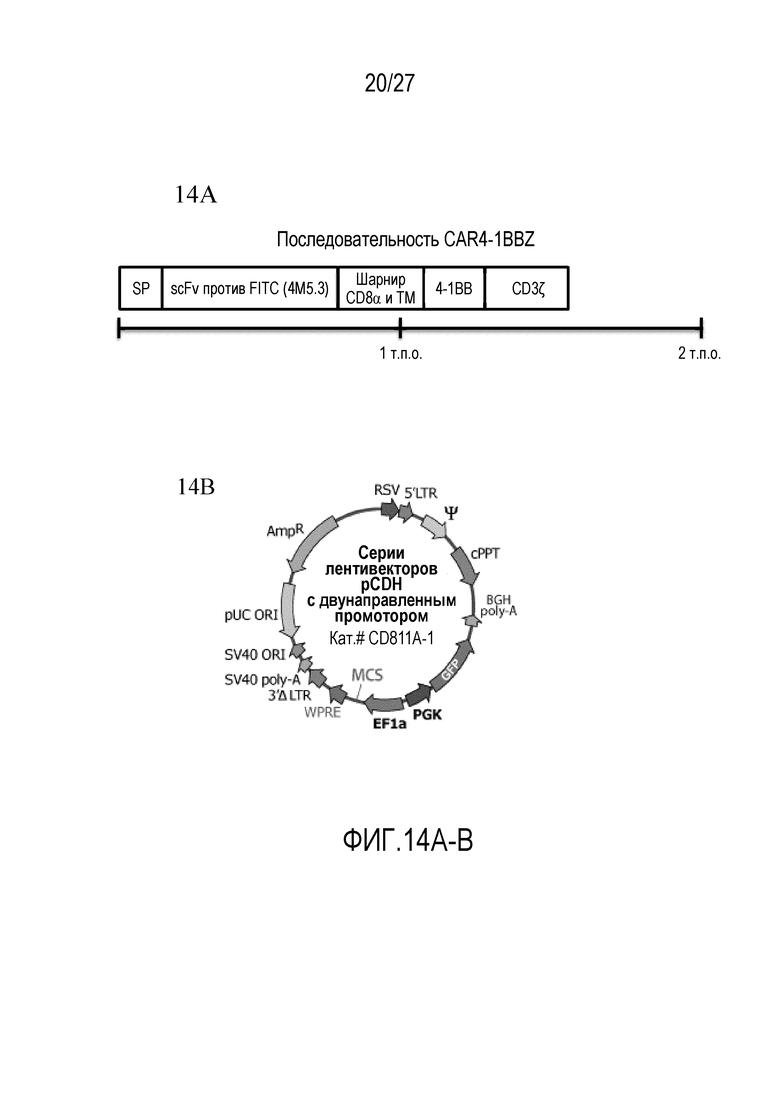
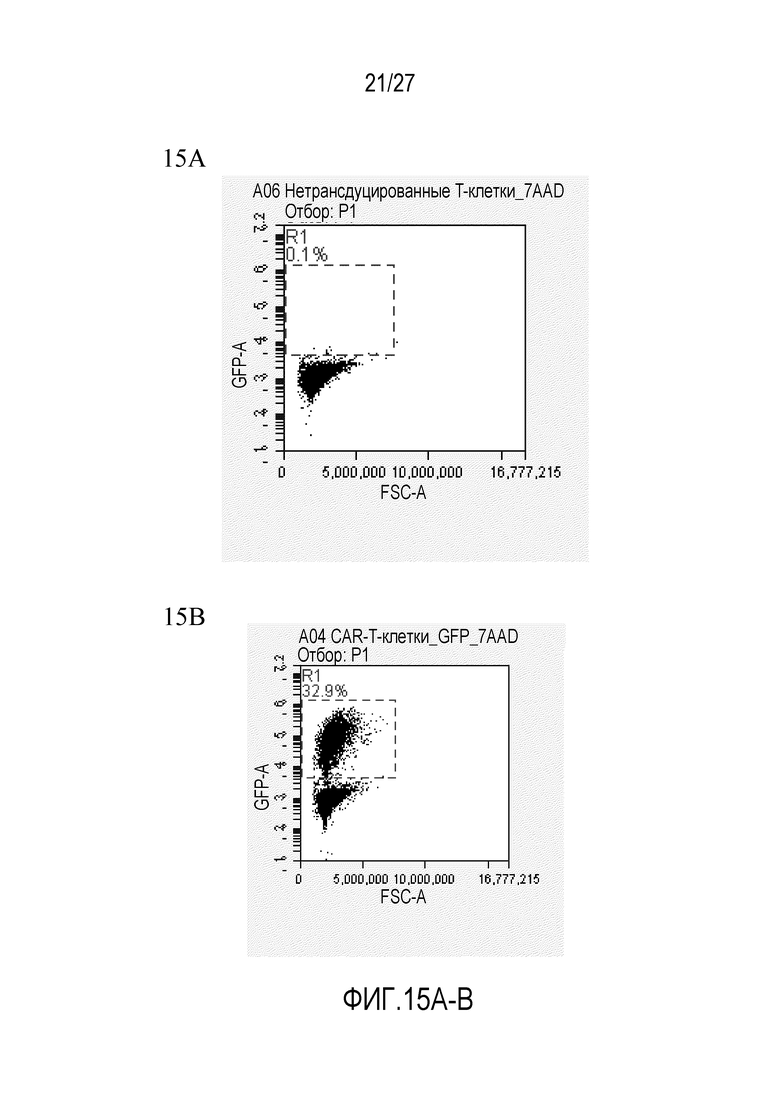

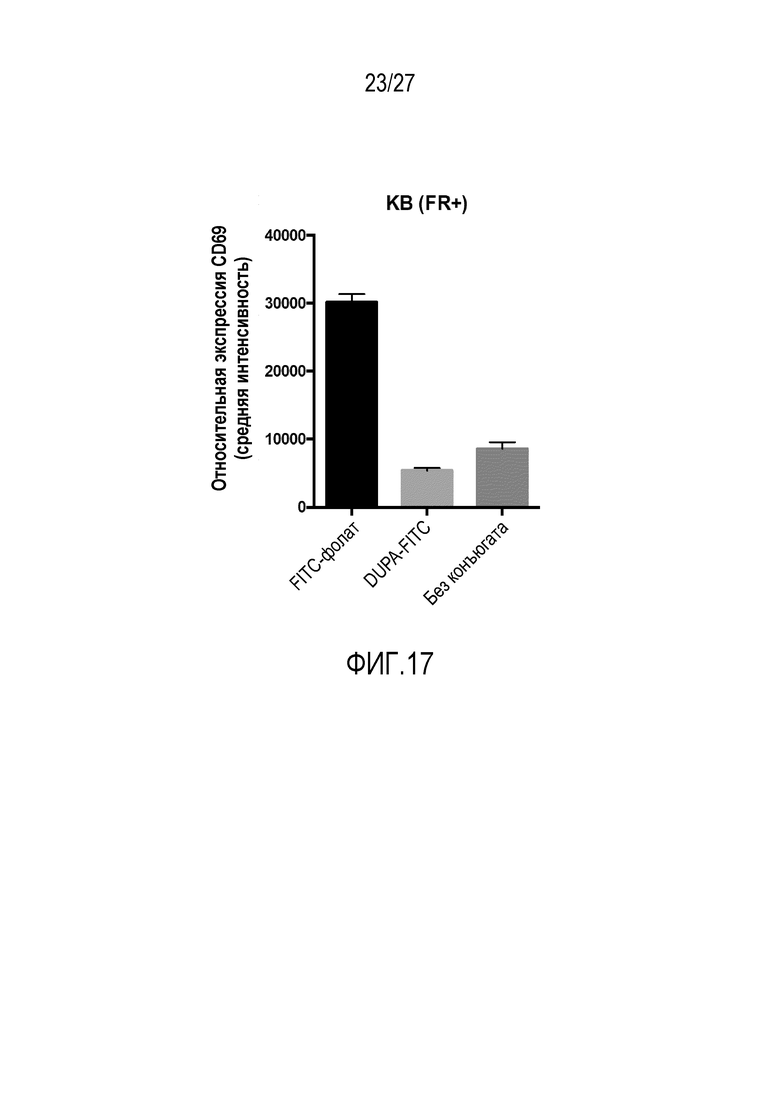
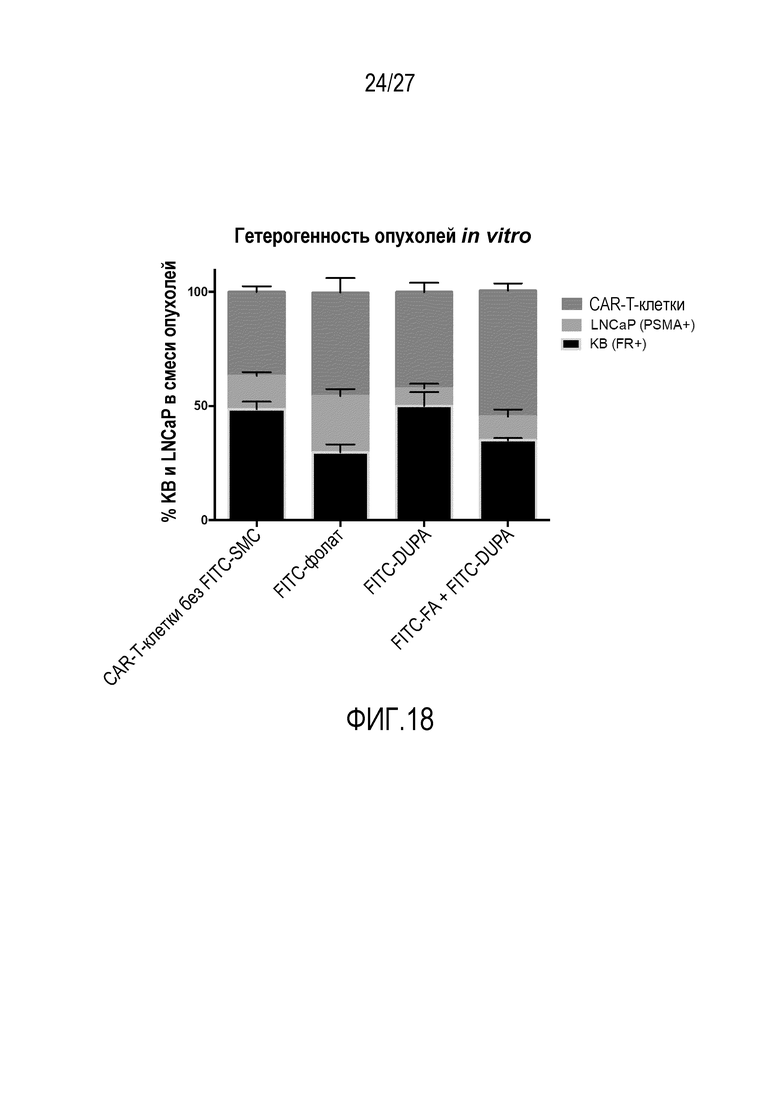
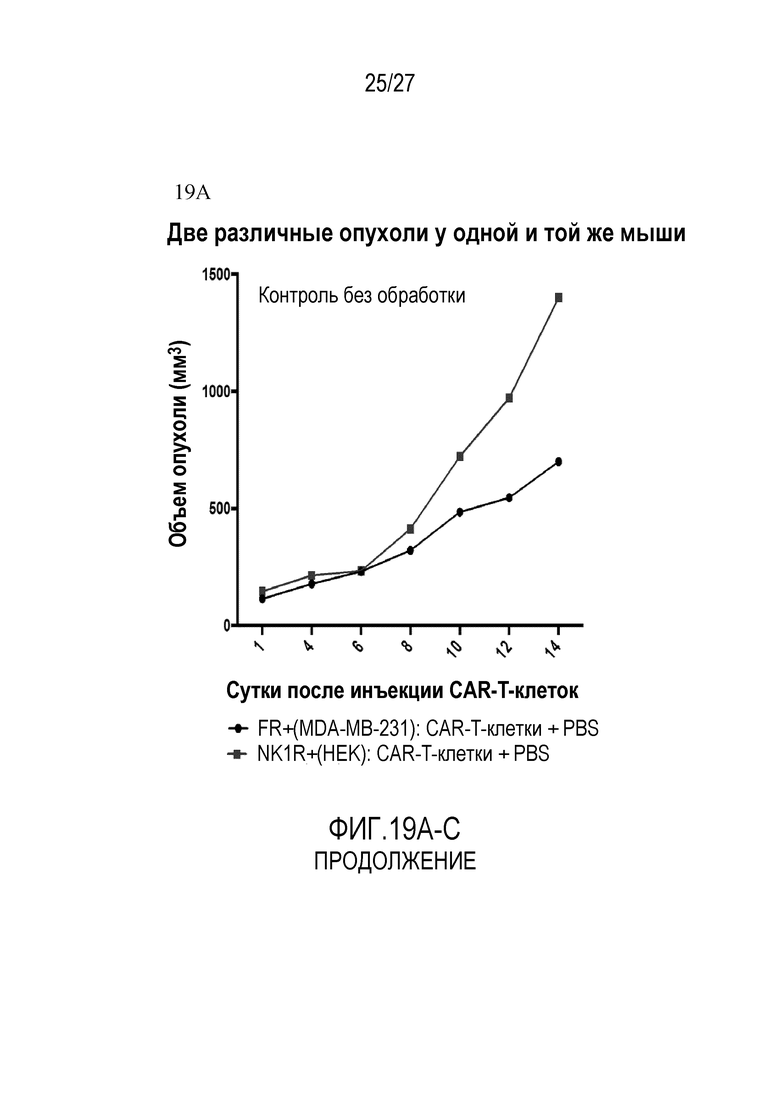
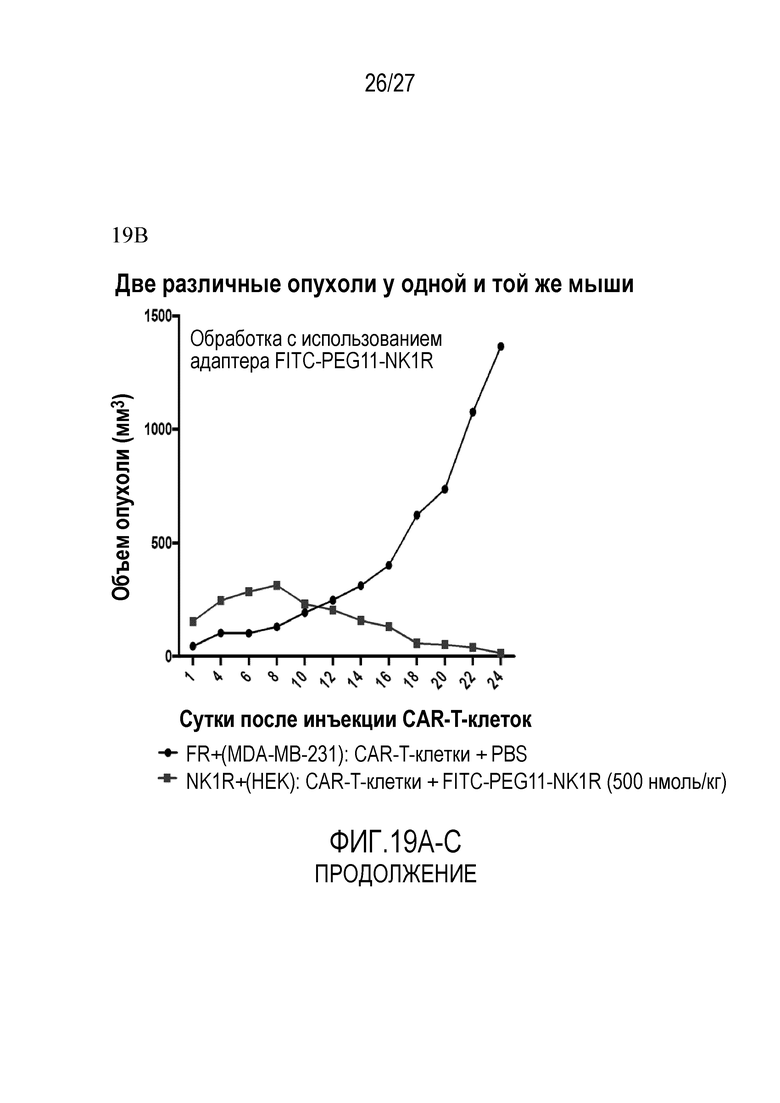
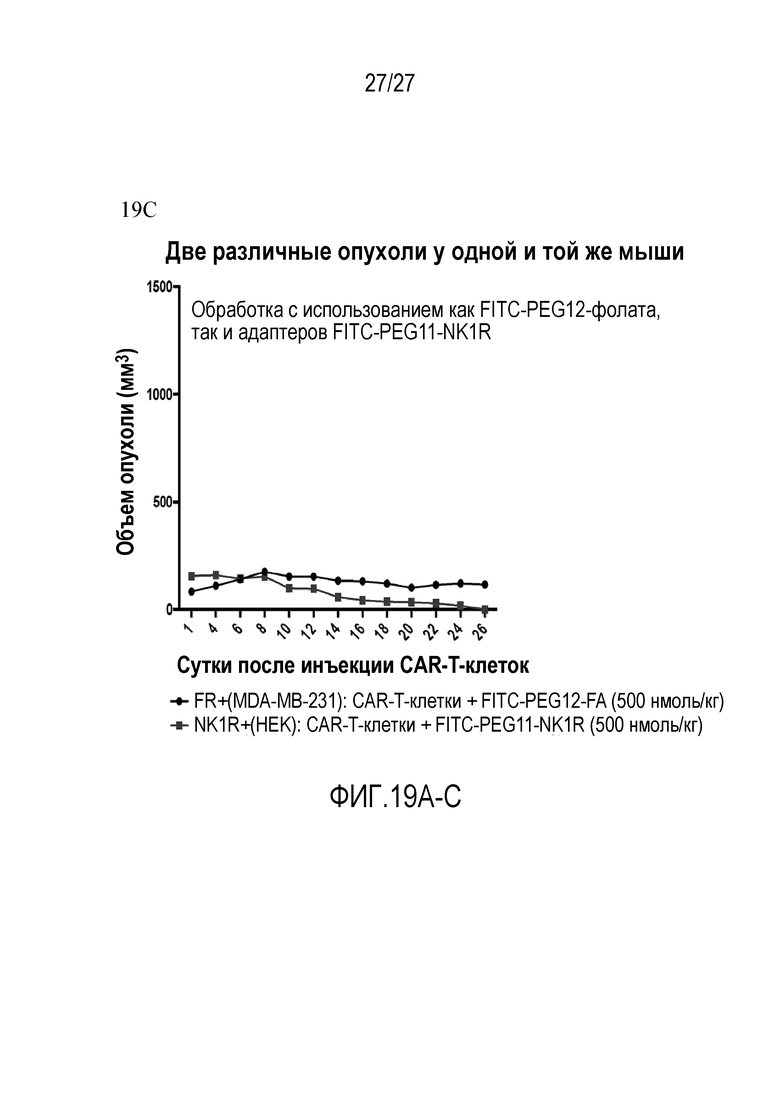
Настоящее изобретение относится к области биотехнологии, в частности к новому терапевтическому способу, и может быть использовано в медицине. Изобретение раскрывает способ лечения злокачественного новообразования, экспрессирующего рецептор NK-1, с применением композиции, содержащей CAR-T-клетки и конъюгат NK-1 рецептор-связывающего лиганда (NK1RL) с изотиоцианат флуоресцеином (FITC) в качестве активных терапевтических агентов. 39 з.п. ф-лы, 19 ил., 1 табл., 19 пр.
1. Способ лечения злокачественной опухоли, экспрессирующей рецептор NK-1, включающий
i) введение пациенту конъюгата или его фармацевтически приемлемой соли,
где конъюгат содержит NK-1 рецептор-связывающий лиганд (NK1RL) и изотиоцианат флуоресцеина (FITC); и
где конъюгат способен к связыванию со злокачественной опухолью, экспрессирующей рецептор NK-1; и
ii) введение пациенту композиции CAR-T-клетки, где CAR-T-клетка содержит CAR, направленный на FITC; и
где пациента подвергают лечению от злокачественной опухоли.
2. Способ по п. 1, где NK1RL связан с FITC посредством линкера, где линкер содержит полиэтиленгликоль (PEG), полипролин, гидрофильную аминокислоту, сахар, неприродный пептидогликан, поливинилпирролидон и/или плюроник F-127.
3. Способ по п. 2, где линкер содержит PEG.
4. Способ по п. 2 или 3, где конъюгат или его фармацевтически приемлемая соль имеют формулу
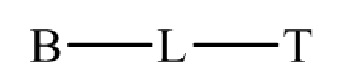 ,
,
где B представляет собой низкомолекулярный лиганд, L представляет собой линкер, и T представляет собой нацеливающую группу, и где L содержит структуру, имеющую формулу
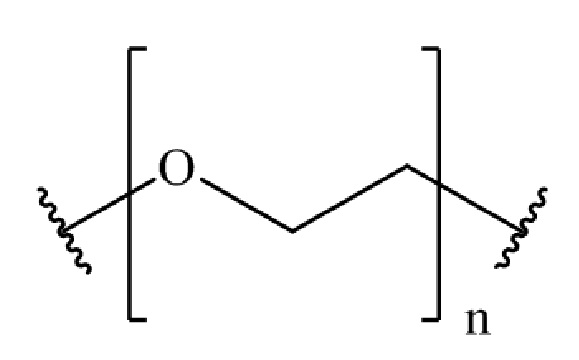 ,
,
где n представляет собой целое число от 0 до 200.
5. Способ по п. 4, где n представляет собой целое число от 0 до 150.
6. Способ по п. 4, где n представляет собой целое число от 0 до 110.
7. Способ по п. 4, где n представляет собой целое число от 0 до 20.
8. Способ по п. 4, где n представляет собой целое число от от 15 до 20.
9. Способ по п. 4, где n представляет собой целое число от от 15 до 110.
10. Способ по любому из пп. 1-9, где конъюгат или его фармацевтически приемлемую соль вводят в дозе от приблизительно 10 нмоль/кг до приблизительно 3000 нмоль/кг массы тела пациента.
11. Способ по любому из пп. 1-9, где конъюгат или его фармацевтически приемлемую соль вводят в дозе от приблизительно 50 нмоль/кг до приблизительно 2000 нмоль/кг массы тела пациента.
12. Способ по любому из пп. 1-9, где конъюгат или его фармацевтически приемлемую соль вводят в дозе от приблизительно 100 нмоль/кг до приблизительно 1000 нмоль/кг массы тела пациента.
13. Способ по любому из пп. 1-9, где конъюгат или его фармацевтически приемлемую соль вводят в дозе от приблизительно 100 нмоль/кг до приблизительно 600 нмоль/кг массы тела пациента.
14. Способ по любому из пп. 1-9, где конъюгат или его фармацевтически приемлемую соль вводят в дозе от приблизительно 200 нмоль/кг до приблизительно 500 нмоль/кг массы тела пациента.
15. Способ по любому из пп. 1-9, где конъюгат или его фармацевтически приемлемую соль вводят в дозе от приблизительно 250 нмоль/кг до приблизительно 500 нмоль/кг массы тела пациента.
16. Способ по любому из пп. 1-15, где злокачественная опухоль выбрана из рака легкого, рака кости, рака поджелудочной железы, рака кожи, рака головы, рака шеи, меланомы кожи, внутриглазной меланомы, рака тела матки, рака яичника, рака эндометрия, рака прямой кишки, рака желудка, рака толстого кишечника, рака молочной железы, трижды отрицательного рака молочной железы, карциномы фаллопиевых труб, карциномы эндометрия, карциномы шейки матки, карциномы влагалища, карциномы вульвы, болезни Ходжкина, рака пищевода, рака тонкого кишечника, злокачественной опухоли эндокринной системы, злокачественной опухоли щитовидной железы, злокачественной опухоли паращитовидной железы, немелкоклеточного рака легкого, злокачественной опухоли надпочечника, саркомы мягких тканей, злокачественной опухоли мочеиспускательного канала, рака предстательной железы, хронического лейкоза, острого лейкоза, лимфоцитарной лимфомы, мезотелиомы плевры, рака мочевого пузыря, лимфомы Беркитта, злокачественной опухоли мочеточника, рака почки, почечноклеточного рака, карциномы почечной лоханки, неоплазий центральной нервной системы (ЦНС), первичной лимфомы ЦНС, опухолей спинного мозга, глиомы ствола головного мозга, аденомы гипофиза и аденокарциномы желудочно-пищеводного соединения.
17. Способ по п. 16, где злокачественная опухоль представляет собой рак эндометрия.
18. Способ по п. 16, где злокачественная опухоль представляет собой немелкоклеточный рак легкого.
19. Способ по п. 16, где злокачественная опухоль представляет собой рак яичника.
20. Способ по п. 16, где злокачественная опухоль представляет собой трижды отрицательный рак молочной железы.
21. Способ по любому из пп. 1-20, где CAR имеет узнающую область, и узнающая область представляет собой одноцепочечный фрагмент вариабельной области (scFv) антитела.
22. Способ по любому из пп. 1-21, где CAR имеет узнающую область, и узнающая область CAR представляет собой одноцепочечный фрагмент вариабельной области (scFv) антитела против FITC.
23. Способ по любому из пп. 1-22, где CAR имеет костимулирующий домен, и костимулирующий домен выбран из CD28, CD137 (4-1BB), CD134 (OX40) и CD278 (ICOS).
24. Способ по любому из пп. 1-23, где CAR имеет передающий сигналы активации домен, и передающий сигналы активации домен представляет собой цепь CD3ζ T-клетки или рецептор Fc γ.
25. Способ по любому из пп. 1-24, где CAR имеет узнающую область, и узнающая область представляет собой одноцепочечный фрагмент вариабельной области (scFv) антитела против FITC, где CAR имеет костимулирующий домен, и костимулирующий домен представляет собой CD137 (4-1BB), и где CAR имеет передающий сигналы активации домен, и передающий сигналы активации домен представляет собой цепь CD3ζ T-клетки.
26. Способ по любому из пп. 1-25, где вводят множество доз конъюгата или его фармацевтически приемлемой соли и композиции CAR-T-клетки.
27. Способ по любому из пп. 1-26, где пациента подвергают визуализации перед введением конъюгата или его фармацевтически приемлемой соли или перед введением композиции CAR-T-клетки.
28. Способ по любому из пп. 1-27, где конъюгат или его фармацевтически приемлемая соль не является антителом и не содержит фрагмент антитела.
29. Способ по любому из пп. 1-28, где высвобождения цитокинов, приводящего к «нецелевой» токсичности у пациента, не возникает, и где возникает токсичность CAR-T-клетки по отношению к злокачественной опухоли.
30. Способ по любому из пп. 1-29, где «нецелевой» токсичности для тканей не возникает у пациента, и где возникает токсичность CAR-T-клетки по отношению к злокачественной опухоли.
31. Способ по любому из пп. 1-30, где злокачественная опухоль содержит опухоль, где размер опухоли уменьшают у пациента, и где «нецелевой» токсичности не возникает.
32. Способ по любому из пп. 1-31, где CAR-T-клетка содержит нуклеиновую кислоту, содержащую SEQ ID NO:1.
33. Способ по любому из пп. 1-32, где CAR-T-клетка содержит полипептид, содержащий SEQ ID NO:2.
34. Способ по любому из пп. 1-33, где CAR-T-клетка содержит выделенную нуклеиновую кислоту, содержащую SEQ ID NO:1 и кодирующую химерный рецептор антигена.
35. Способ по любому из пп. 1-34, где CAR-T-клетка содержит полипептид химерного рецептора антигена, содержащий SEQ ID NO:2.
36. Способ по любому из пп. 1-35, где CAR-T-клетка трансформирована вектором, содержащим SEQ ID NO:1.
37. Способ по п.36, где вектор представляет собой лентивирусный вектор.
38. Способ по любому из пп. 1-37, где CAR содержит человеческие аминокислотные последовательности.
39. Способ по любому из пп. 1-38, где CAR состоит из человеческих аминокислотных последовательностей.
40. Способ по любому из пп. 1-39, где конъюгат имеет формулы
 ,
,
 ,
, 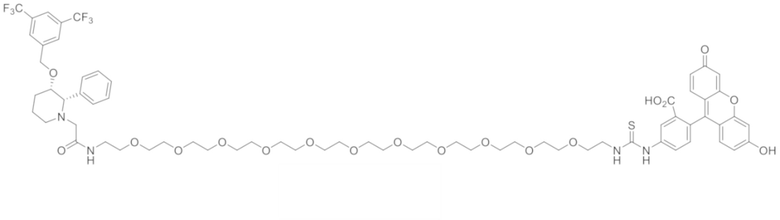 или
или
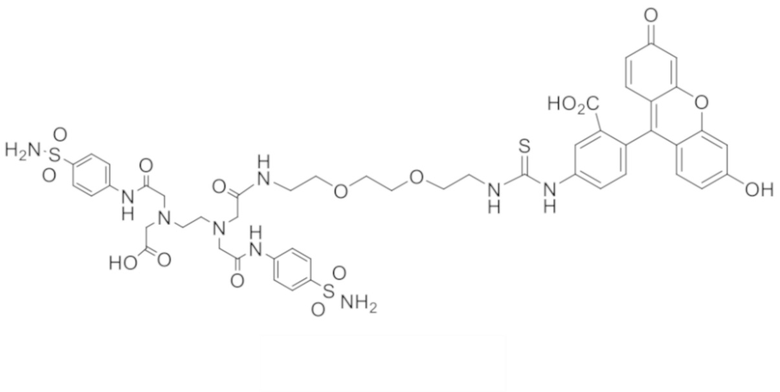 .
.
| RODGERS D | |||
| et al., Switch-mediated activation and retargeting of CAR-T cells for B-cell malignancies, PNAS, 2016, v | |||
| Способ обработки грубых шерстей на различных аппаратах для мериносовой шерсти | 1920 |
|
SU113A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Устройство для механических испытаний лубовых волокон | 1922 |
|
SU459A1 |
| US 20150320799 A1, 12.11.2015 | |||
| TAMADA K | |||
| Et al., Redirecting gene-modified T cells toward various cancer types using tagged antibodies, Clin | |||
| Cancer Res., 2012, v | |||
| Способ использования делительного аппарата ровничных (чесальных) машин, предназначенных для мериносовой шерсти, с целью переработки на них грубых шерстей | 1921 |
|
SU18A1 |
| Прибор для равномерного смешения зерна и одновременного отбирания нескольких одинаковых по объему проб | 1921 |
|
SU23A1 |
| Приспособление для предохранения от выталкивания ключа из дверного замка | 1926 |
|
SU6436A1 |
| WU C | |||
| et al., | |||
Авторы
Даты
2023-03-22—Публикация
2017-04-07—Подача