Изобретение относится к биотехнологии, в частности, к получению рекомбинантного белка, состоящего из аминокислотной последовательности флагеллина-С Pseudomonas aeruginosa штамма РА 103 (далее рекомбинантный белок FlicC) предназначенного для использования в качестве компонента рекомбинантной вакцины, а также к конструированию рекомбинантной плазмиды и созданию рекомбинантного штамма Escherichia coli (далее Ε. coli) предназначенных для синтеза рекомбинантного белка FlicC.
Pseudomonas aeruginosa (далее P. aeruginosa) до 15-20% всех внутрибольничных инфекций [1, 2]. Треть всех поражений мочеполовой системы у урологических больных, 20-25% гнойных хирургических инфекций и первичных грамотрицательных бактериемий обусловлены P. aeruginosa [3]. Синегнойная палочка является причиной инфекционных заболеваний у людей с ослабленным иммунитетом, в том числе при пневмонии и муковисцидозе. Инфекции, вызванные P. aeruginosa, плохо поддаются антибиотикотерапии в связи с частым выделением полирезистентных штаммов [4]. P. aeruginosa обладает множеством факторов патогенности, ряд из которых широко используются при разработке антисинегнойных вакцин. В настоящее время в технологии конструирования вакцин все большее внимание уделяется использованию генно-инженерных методов. В лаборатории протективных антигенов ФГБНУ НИИВС им. И.И. Мечникова, были получены рекомбинантные белки (OprF, OprI, OprL) наружной мембраны P. aeruginosa, делеционный вариант экзотоксина А и слитые рекомбинантные белки, включающие аминокислотные последовательности вышеперечисленных белков (OprF-Oprl, OprF-aTox, OprF-aTox-OprI) и изучены их иммунобиологические свойства [5].
В последнее время возрос интерес исследователей к семейству белков флагеллинов P. aeruginosa. Флагеллин - бактериальный белок, главный компонент жгутиков бактерий. Являясь важным фактором вирулентности P. aeruginosa, флагеллин участвует в формировании реакций организма хозяина на внедрение патогена, за счет активации факторов врожденного и адаптивного иммунного ответа [6]. В настоящее время известно, что флагеллин является лигандом для рецептора врожденной иммунной системы TLR5 (toll-like receptor 5) и/или рецепторов NAIPS (Nod-like receptor apoptosis-inhibitory protein 5), которые являются представителями семейства цитозольных рецепторов NLRs (nucleotide binding and oligomerization domain-like receptor). Образование комплекса флагеллин - TLR5 стимулирует развитие защитных реакций организма. Известно, что введение флагеллина мышам оказывало протективный эффект в отношении патогенных воздействий токсикантов, бактерий, вирусов и радиации [7, 8]. Особенно является интересным исследование адъювантных (иммуностимуляторующих) флагеллиновых белков свойств в сочетании с рекомбинантными протективными антигенами, что связывается со стимуляцией ими врожденных факторов иммунного ответа. Было показано, что включение флагеллина в состав рекомбинантных белков способствовало увеличению продукции цитокинов и активации антигенпрезентирующих клеток. Исследование in vivo подтвердили данный феномен: иммунизация мышей данным белком, содержащим флагеллин, вызывала специфический Т-клеточный ответ. При этом введение флагеллина потенцировало развитие адаптивного иммунитета не только у молодых, но и у старых животных [9, 10, 11].
Наиболее близким к заявляемому техническому решению (прототипом) является способ, описанный в работе Goudarzi et al. от 2009 года [10]. Синтез рекомбинантного белка осуществляли с использованием плазмиды pET-22b (Novagen). В указанном способе клонировали ген flicC, полученный из генома P. aeruginosa штамма 8821М. Недостатком способа является то, что очистка рекомбинантного белка, проведенная Goudarzi et al. осуществлялась с использованием аффинной хроматографии на никель-активированном сорбенте, что повышает стоимость получения данного белка.
Задачей изобретения является конструирование рекомбинантной плазмидной ДНК pPA-FlicC, кодирующей рекомбинантный белок FlicC P. aeruginosa; создание штамма-продуцента рекомбинантного белка FlicC P. aeruginosa с использованием Е. coli штамма К-12 и разработка способа очистки рекомбинантного белка FlicC P. aeruginosa.
Для решения этой задачи предлагается рекомбинантная плазмидная ДНК pPA-FlicC, кодирующая синтез рекомбинантного белка FlicC Pseudomonas aeruginosa, размером 4584 пар оснований, расщепляющаяся в результате гидролиза нуклеазами рестрикции BamHI и HindIII на фрагменты ДНК с размерами 1161 и 3423 пар оснований; содержащая последовательности модифицированного промотора бактериофага Т5 и двух лактозных оперонов; сайт посадки рибосомы; стартовый ATG-кодон; последовательность, кодирующую шесть гистидинов; лямбда t0 регион остановки транскрипции; регион остановки транскрипции; сайт инициации репликации плазмиды ColE1; ген, кодирующий устойчивость к ампициллину; при этом в результате экспрессии данной конструкции происходит синтез рекомбинантного продукта с массой около 40,7 кДа.
В другом аспекте изобретения предлагается штамм бактерий Escherichia coli PA-FlicC - продуцент рекомбинантного белка FlicC Р. aeruginosa с молекулярной массой 40,7 кДа, полученный путем трансформации родительского штамма бактерий Е. coli К-12 рекомбинантной плазмидной ДНК pPA-FlicC по п. 1.
В другом аспекте изобретения предлагается способ получения рекомбинантного белка FlicC P. aeruginosa с использованием штамма Е. coli PA-FlicC по п. 2, включающий его культивирование в питательной среде, разрушение клеток микроорганизма, выделение телец-включений, удаление примесей растворимых в 8 Μ мочевине, растворение рекомбинантного белка FlicC в буферном растворе с 6 Μ гуанидином хлорида и перевод рекомбинантного белка FlicC в нативные условиях при помощи диализа.
Технический результат заявляемого изобретения состоит в следующем. Как показали наши исследования, рекомбинантный белок FlicC является высокогидрофобным и труднорастворимым в буферах, содержащих 8 Μ мочевину. Такие свойства связаны с особенностями аминокислотной последовательности, формирующей этот белок. В наших исследованиях разработан способ очистки этого белка с учетом его свойств. Этот способ исключает использование хроматографии, при которой применяют дорогостоящие никель-активированные сорбенты, а сама предлагаемая процедура является более быстрой.
Краткое описание поясняющих материалов
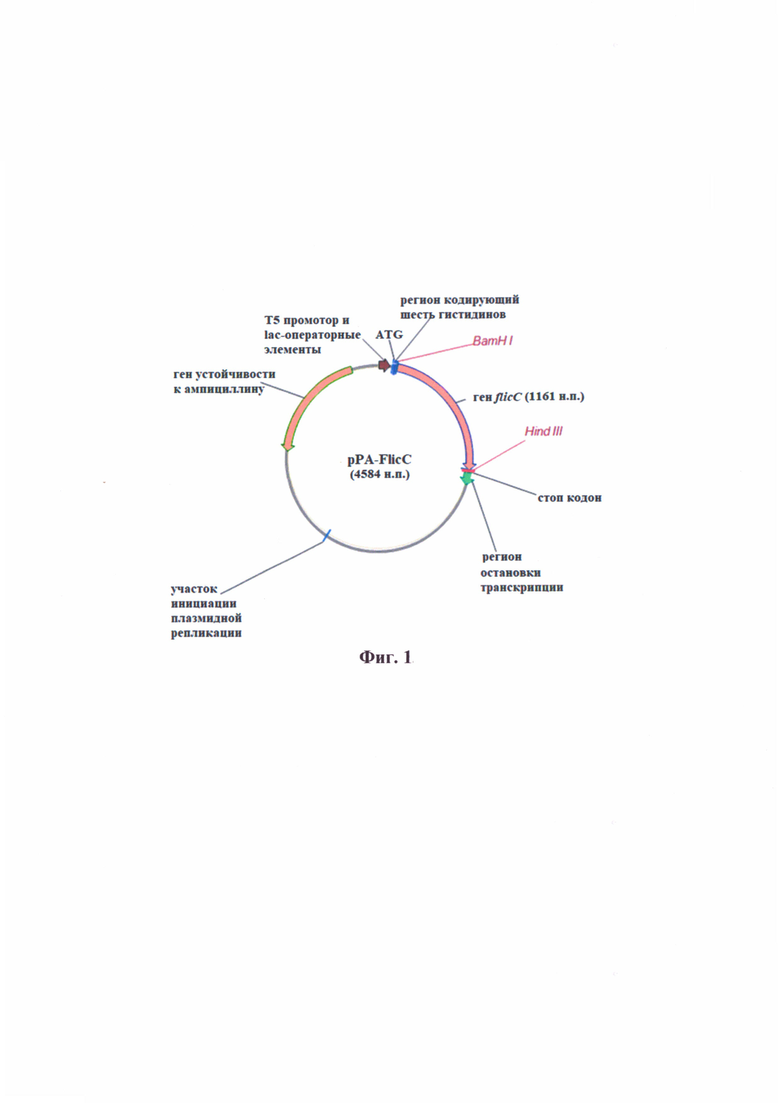
На фиг. 1 представлена схема плазмиды рРА- FlicC.
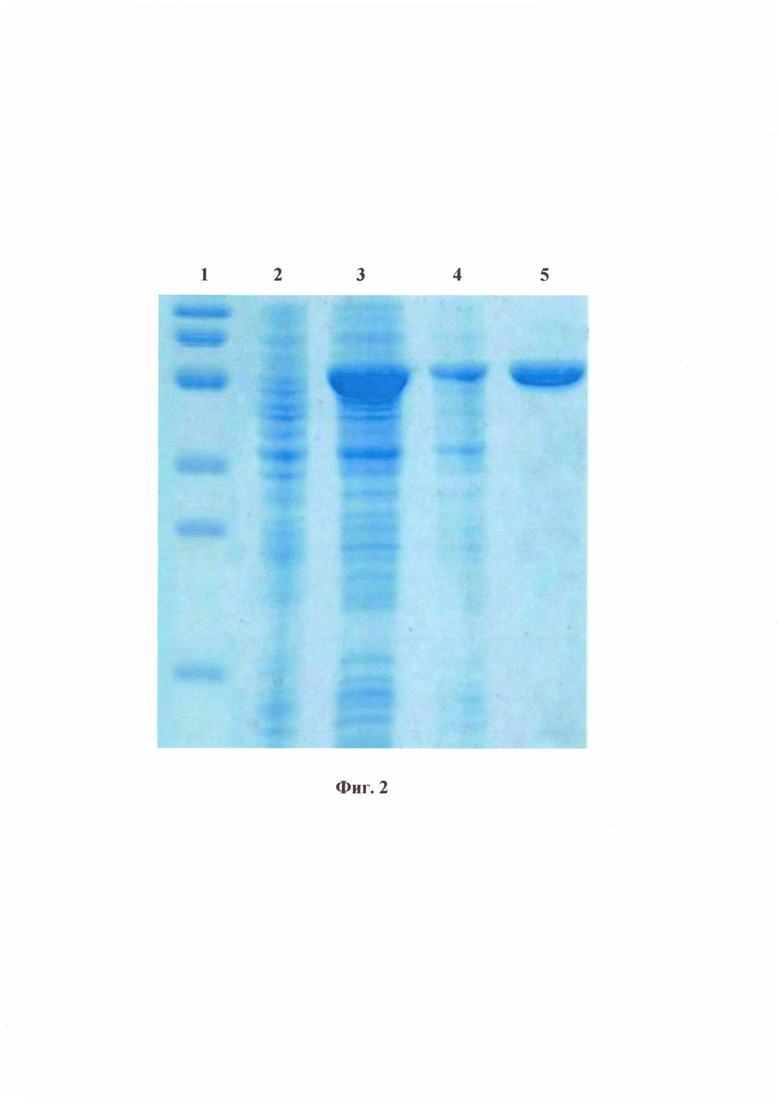
На фиг. 2 представлен анализ белковых продуктов в полиакриламидном геле (окраска Кумасси R-250), полученных в результате экспрессии в клетках Е. coli гена flicC, расположенных в плазмиде pPA-FlicC и очистки рекомбинантного белка FlicC.
Треки: 1 - белки неиндуцированного продуцента рекомбинантного белка; 2 - белки продуцента рекомбинантного белка, полученные после индукции экспрессии с помощью ИПТГ; 3 - тельца-включения, содержащие рекомбинантный белок FlicC; 4 - очищенный рекомбинантный белок FlicC; 5 - белковый маркер (молекулярные массы фрагментов маркера: 60, 50, 40, 30, 25 и 20).
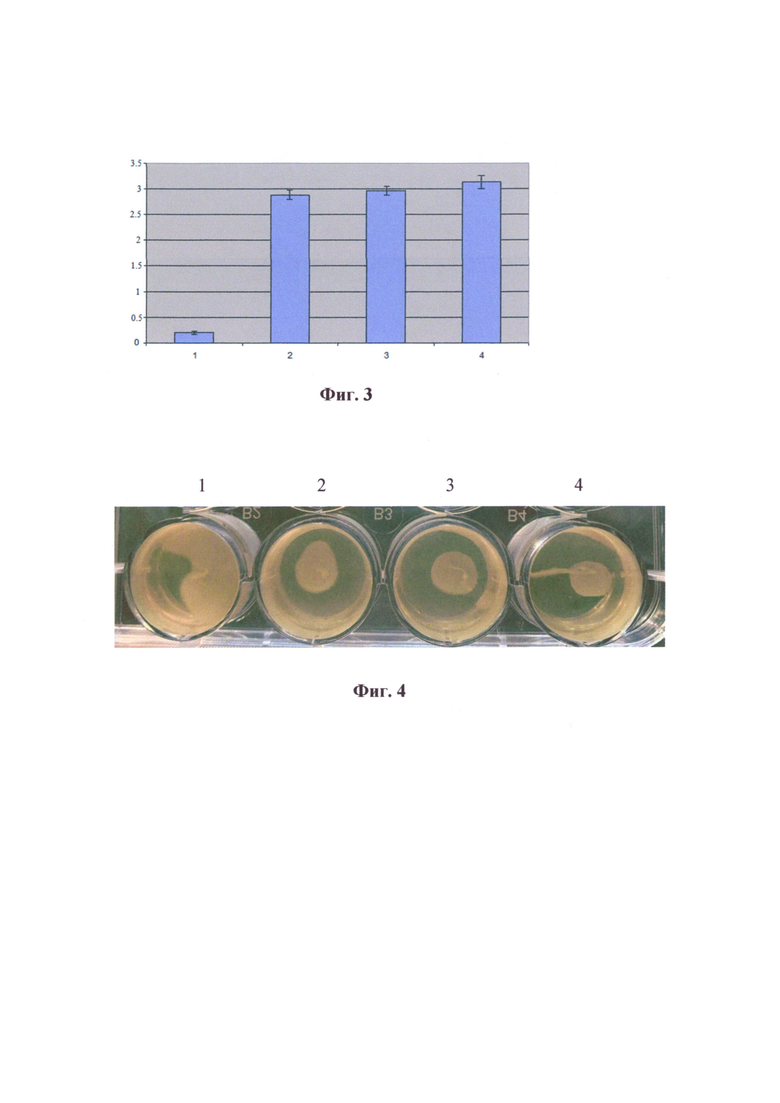
На фиг. 3 представлен анализ сывороток крови мышей иммунизированных рекомбинантным белком FlicC.
Столбики гистограммы: 1 - сыворотки неиммунизированных мышей (контроль); 2 - сыворотки мышей иммунизированных рекомбинантным белком FlicC, сорбированным на гидроокиси алюминия в соотношении 1:3; 3 - сыворотки мышей иммунизированных рекомбинантным белком FlicC, сорбированным на гидроокиси алюминия в соотношении 1:1; 4 - сыворотки мышей иммунизированных только рекомбинантным белком FlicC.
На фиг. 4 представлен анализ влияния антисывороток на подвижность бактерий P. aeruginosa, в полужидком агаре.
Лунки 12-ти луночного планшета заполненные полужидким агаром и засеянные культурой P. aeruginosa штамма РА-103 после культивирования.
Лунки: 1-е контрольной средой; 2 - со средой содержащей сыворотку мышей иммунизированных рекомбинантным белком FlicC, сорбированным на гидроокиси алюминия в соотношении 1:3; 3 - со средой содержащей сыворотку мышей иммунизированных рекомбинантным белком FlicC, сорбированным на гидроокиси алюминия в соотношении 1:1; 4 - со средой содержащей сыворотку мышей иммунизированных только рекомбинантным белком FlicC.
Осуществление изобретения
Плазмида pPA-FlicC имеет 4584 пар оснований и характеризуется наличием ДНК фрагмента, вырезаемого по сайтам рестрикции ВатHI и HindIII 1161 пар оснований, содержащий последовательность гена flicC P. aeruginosa. Плазмида содержит последовательности
модифицированного промотора бактериофага Т5 и двух лактозных оперонов; сайт посадки рибосомы; стартовый ATG-кодон; последовательность, кодирующую шесть гистидинов; лямбда t0 регион остановки транскрипции; регион остановки транскрипции; сайт инициации репликации плазмиды ColE1; ген устойчивости к ампициллину.
Плазмида pPA-FlicC имеет нуклеотидную последовательность SEQ IDNO: 1.
Заявленный рекомбинантный белок FlicC, закодированный в плазмиде pPA-FlicC имеет аминокислотную последовательность SEQ ID NO: 2.
Штамм Ε. coli PA-FlicC получен трансформацией клеток родительского штамма Е. coli K-12, содержащих плазмиду pREP4, с использованием традиционной генно-инженерной технологии.
Штамм Е. coli PA-FlicC - продуцент рекомбинантного белка FlicC.
Штамм Е. coli PA-FlicC характеризуется следующими признаками:
Культурально-морфологические признаки: Клетки мелкие, прямые, утолщенной палочковидной формы, грамотрицательные, неспороносные. Клетки хорошо растут на простых питательных средах. При росте на 1% агаризованной среде LB колонии круглые, гладкие, выпуклые, мутные, блестящие, серые, края ровные. При росте в жидких средах (на минимальной среде с глюкозой или LB-среде) образуют интенсивную ровную муть.
Физико-биологические признаки: Аэроб. Температурный диапазон роста 4-42°С при оптимуме рН 6,5-7,5. В качестве источника азота используют как минеральные соли в аммонийной и нитратной формах, так и органические соединения в виде аминокислот, пептона, триптона, дрожжевого экстракта и т.д. В качестве источника углерода используют аминокислоты, глицерин, углеводы.
Устойчивость к антибиотикам: Клетки проявляют устойчивость к ампициллину (до 200 мкг/мл) и к канамицину (до 100 мкг/мл).
Способ, условия и состав среды для хранения штамма: LB-среда с 10% глицерином и антибиотиками при -70°С в ампулах и в лиофилизированном состоянии в ампулах при 4 С.
Способ получения и очистки рекомбинантного белка FlicC включает следующие этапы: культивирование в питательной среде штамма Е. coli PA-FlicC; осаждение биомассы центрифугированием; выделение телец-включений; разрушение телец-включений при растворении их в денатурирующем буфере, содержащем 4 Μ мочевину, с последующим осаждением рекомбинантного белка FlicC P. aeruginosa и удалением растворимой в мочевине фракции; растворение рекомбинантного белка FlicC P. aeruginosa в буферном растворе, содержащем 6 Μ гуанидин гидрохлорид и диализ для перевода белкового препарата в нативные условия. После диализа и перевода в нативные условия препарат рекомбинантного белка FlicC выпадал в осадок и поэтому его разбивали на аликвоты с интенсивным перемешиванием. Полученный препарат оказался эффективным при иммунизации животных и стимулировал специфический иммунные реакции.
Изобретение иллюстрируется следующими примерами:
Пример 1. Получение рекомбинантной плазмиды ДНК pPA-FlicC.
Основой для получения плазмиды ДНК pPA-FlicC служил плазмидный вектор плазмидный вектор для экспрессии встроенных последовательностей в клетках Е. coli. QE-30 (Qiagen). Полноразмерную последовательность гена flicC синтезировали в результате ПЦР на основе матричной ДНК P. aeruginosa штамма РА 103. Дизайн праймеров осуществляли с использованием полноразмерной последовательности ДНК P. aeruginosa штамма РА 103, опубликованной в базе данных GenBank. Прямой праймер (5'-GGA ТСС GCC TTG АСС GTC ААС АСС ААС АТС G) имел дополнительный сайт рестрикции ВатHI, а обратный праймер (5'-AAG СТТ AGC GCA GCA GGC ТСА GAA CCG АС) - дополнительный сайт рестрикции HindIII. Ген FlicC встроили по сайтам рестрикции ВатHI и Hindill в плазмиду pQE-30. В результате была получена рекомбинантная плазмида pPA-FlicC (фиг. 1). Рассчитанная полноразмерная нуклеотидная последовательность плазмиды pPA-FlicC представлена на SEQ ID NO: 1. Аминокислотная последовательность рекомбинантного белка, полученная в результате трансляции встроенного гена FlicC (осуществлялась в компьютерной программе OMIGA), представлена на SEQ ID NO: 2.
Пример 2. Получение штамма Е. coli PA-FlicC - продуцента рекомбинантного белка FlicC.
Штамм-продуцент Е. coli PA-FlicC получали путем трансформации клеток родительского штамма Е. coli K-12 рекомбинантной плазмидой pPA-FlicC с последующим отбором рекомбинантных клонов на среде, содержащей ампициллин (100 мкг/мл) и канамицин (50 мкг/мл) при температуре 37°С. Первичный отбор рекомбинантных плазмид проводили с использованием рестриктного анализа и секвенирования.
Далее отбор продуцентов проводили по способности контролируемого синтеза рекомбинантного белка в клетках. Для этого инокулировали бактериальной колонией 3 мл LB-среды, содержащей ампициллин (в концентрации 100 мкг в мл) и канамицин (в концентрации 50 мкг в мл). Выращивали в термостатированном шейкере со скоростью орбитального вращения 170 об/мин в течение 12-16 часов и температуре 37°С. Затем в 5 мл свежей среды вносили 250 мкл выросшей культуры и инкубировали в прежних условиях в течение 1,5-2 часа до достижения культурой активной фазы роста (0,6-0,7 оптических единиц при длине волны 600 нм). Добавляли 5 мкл 1 Μ водного раствора химического индуктора изопропил~Р-с1-тиогалактопиранозид (далее ИПТГ). Инкубацию продолжали в прежних условиях 3-4 часа, после чего осаждали полученную биомассу в микроцентрифуге.
В качестве контроля использовали бактериальную культуру продуцента, инкубированную при тех же условиях, но без добавления ИПТГ. При анализе продуктов экспрессии в полиакриламидном геле по методу Лэммли идентифицировали рекомбинантный белок с размером около 40 кДа, что соответствовало расчетным данным (40,7 кДа) (фиг. 2).
Пример 3. Получение препарата очищенного рекомбинантного белка FlicC из штамма Е. coli PA-FlicC.
Инокулировали бактериальной колонией 50 мл LB-среды, содержащей ампициллин (в концентрации 100 мкг в мл) и канамицин (в концентрации 50 мкг в мл). Выращивали в термостатированном шейкере со скоростью орбитального вращения 170 об/мин в течение 12-16 часов и температуре 37°С. Затем полученную культуру вносили в 5 л колбу, содержащую 1 л свежей среды с теми же антибиотиками. Проводили культивирование в прежних условиях в течение 1,5-2 часа до достижения культурой активной фазы роста (0,6-0,7 оптических единиц при длине волны 600 нм). Добавляли 1 мл 1 Μ раствора ИПТГ. Инкубацию продолжали в прежних условиях 3-4 часа, после чего осаждали бактериальную биомассу в центрифуге Beckman Avanti J-E (ротор JA-14) со скоростью вращения 4000 об/мин в течение 10 мин.
Осадок биомассы ресуспендировали в 30 мл фосфатного буфера (рН 7,2), содержащего 5 mM EDTA, 7 mM β-меркаптоэтанола и обрабатывали ультразвуком (hight, 3 сек, 3 раза). Полученный лизат центрифугировали (использовали центрифугу Beckman Avanti J-E с ротором JA-20) при 10000 об/мин в течение 30 минут при температуре 4°С. Осадок собирали и растворяли в 30 мл следующего раствора: Tris-HCl (40 mM, рН 8,8), 10 mM NaCl, 6 mM MgCl2, 10 mM СаС12. К суспензии добавляли 1 мкл РНКазы А (10 мг/мл) и 2 мкл ДНКазы I. Повторно обрабатывали ультразвуком и инкубировали при температуре 37°С в течение 15 минут, а затем проводили центрифугирование со скоростью 10000 об/мин в течение 30 минут при температуре 4°С. Осадок растворяли в 20 мл фосфатного буфера, содержащего 5 mM EDTA, 20% сахарозы и 1% Triton Х-100 и инкубировали 10 минут при температуре 4°С. Затем центрифугировали со скоростью 10000 об/мин в течение 30 минут при температуре 4°С, собирая осадок, содержащий тельца-включения.
Полученный осадок телец-включений растворяли в 40 мл следующего лизирующего буфера: 4 Μ мочевина; 0,1 Μ NaH2PO4; 0,01 Μ Tris-HCl; рН - 8,0. Растворение биомассы проводили в орбитальном шейкере при вращении 70 об/мин в течение 12 часов при комнатной температуре. Затем, осаждали нерастворимую фракцию Beckman Avanti J-Е с ротором JA-20 при 10000 об/мин в течение 30 минут при комнатной температуре. Супернатант удаляли, а осадок, содержащий рекомбинантный белок FliC, растворяли в 10 мл следующего буферного раствора: 6 Μ гуанидин гидрохлорид; 0,1 M NaH2PO4; 0,01 Μ Tris-HCl; рН - 8,0.
Материал переносили в десять 1,5 мл микропробирок, которые устанавливали в мульти-вортекс V-32 (Биосан) и интенсивно встряхивали в течение часа при комнатной температуре. Затем осаждали нерастворимые компоненты в микроцентрифуге при скорости не менее 13000 об/мин и комнатной температуре.
Собирали раствор, содержащий рекомбинантный белок FliC, с которым проводили диализ против 0,05 Μ Tris-HCl; рН - 9,0. Препараты рекомбинантного белка FliC после диализа расфасовывали с интенсивным встряхиванием по аликвотам и хранили при - 20°С.
Анализ очищенного рекомбинантного белка проводили в полиакриламидном геле по методу Лэммли (фиг. 2).
Пример 4. Исследование антигенных свойств рекомбинантного белка FlicC.
Очищенный рекомбинантный белок FlicC использовали для иммунизации мышей линии Balb/c. При этом исследовали рекомбинантный белок FlicC в чистом виде и с адъювантом гидроокисью алюминия в соотношении белок: адъювант 1:1 и 1:3. Препараты вводили животным внутрибрюшинно двукратно с двухнедельным интервалом в дозе 50 мкг рекомбинантного белка FlicC на одно животное. В каждой группе присутствовало по десять животных. В качестве контроля использовали неиммунизированных мышей той же партии.
Через две недели после курса иммунизации у мешей тотально отбирали кровь и получали сыворотку. Препараты сывороток индивидуально анализировали в ИФА, а затем рассчитывали среднее значение и доверительный интервал. В результате в сыворотках всех иммунизированных животных выявили высокие титры специфических антител. При этом не выявили усиливающего действия гидроокиси алюминия на иммунизирующую дозу.
Пример 5. Изучение влияние антисывороток на подвижность бактерий P. aeruginosa.
Полученные иммунные мышиные сыворотки исследовали для анализа подавления подвижности бактерий P. aeruginosa в полужидкой питательной среде. В эксперименте использовали LB-среду с добавлением агара в концентрации 0,3%. Сыворотки добавляли в теплую агаризованную среду (с температурой не более 60°С) с различным разведением (1:100, 1:300, 1:1000 по отношению к среде). Затем среду разливали в 12-ти луночные планшеты с радиусом лунки 22,6 мм и рабочим объемом 2,0 мл.
Свежую культуру P. aeruginosa штамма РА-103 разводили до оптической плотности 0,2 при OD600 и добавляли в центр каждой лунки планшета в объеме 0,2 мл. В качестве контроля использовался фосфатно-солевой буфер. Далее проводили инкубацию при температуре 37°С в течение 18 часов. В результате эксперимента выявлено, что культура P. aeruginosa в полужидком агаре распространялась по всей поверхности в контрольных лунках. В тоже время в лунках с добавлением иммунных сывороток радиус распространения составлял 3-5 мм, что свидетельствовало об ингибировании органоидов (жгутиков) передвижения бактерий.
Источники научно-технической информации:
1. Колесова Т.С. Этиологическая роль синегнойной палочки при различных оппортунистических и внутрибольничных инфекциях // Современная медицина: актуальные вопросы. - 2017. - №3. - С. 134-140.
2. Карпунина Т.И., Кузнецова М.В., Николаева Н.В. и др. Эпидемиологические аспекты нозокомиальной синегнойной инфекции в многопрофильном хирургическом стационаре // Сибирский медицинский журнал. - 2009. - №4-1. - Т. 24. - С. 70-73.
3. Parkins D-M., Somayaji R., Waters J-V. Epidemiology, Biology, and impact of clonal Pseudomonas aeruginosa, infections in cystic fibrosis // Clin Microbiol. - 2018. - P. 29-31(4).
4. Pang Z., Paudonis R., Glick R-B., lin T-J., Cheng Z. Antibiotic resistanse in Pseudomonas aeruginosa: mechanisms and alternative therapeutic strategies // Biotechnology Advances. - 2019. - Vol. 37, №1. - p. 177-192.
5. Михайлова Η.Α., Зимина Е.М., Солдатенкова А.В., Калошин А.А. Разработка вакцины на основе рекомбинантного антигена синегнойной палочки // Журнал микробиологии, эпидемиологии и иммунобиологии. - 2019. - №1. - С. 78-80.
6. Hajam I.A., Lee J.H., Dar Р.А., Shahnawaz I., Jaume J.C. Bacterial flagellin-A potent immunomodulatory agent // Experimental and Molecular Medicine. - 2017. - Vol. 49, - №9.
7. Сафронов Г.А., Мурзина E.B., Болехан B.H. и др. Перспективные направления использования препаратов на основе рекомбинантного флагеллина // Медицинский академический журнал. - 2017. - №2. - Т. 17, - С. 7-20.
8. Духовлинов И.В., Богомолова Е.Г., Федорова Е.А. и др. Исследование протективной активности кандидатной вакцины против ротавирусной инфекции на основе рекомбинантного белка FLICVP6VP8 // Медицинская иммунология. - 2016. - Т. 18, №5. - С. 417-424.
9. Baofeng С., Xinsheng L., Yuzhen F., Peng Z., Yongguang Z., Yonglu W. Flagellin as a vaccine adjuvant // Expert review vaccines. - 2018. - Vol. 17, №4. - P. 335-349.
10. Goudarzi G., Sattari M., Roudkenar M.H., Montajabi-Niyat M., Zavaran-Hosseini Α., Mosavi-Hosseini K. Cloning, expression, purification, and characterization of recombinant flagellin isolated from Pseudomonas aeruginosa. Biotechnol Lett. - 2009. - Vol. 31, №1. 9. - P. 1353-1360.
11. Tanom Α., Farajnia S., Majidi J. Cloning, expression and characterization of recombinant exotoxin A-Flagellin fusion protein as a new vaccine candidate against Pseudomonas aeruginosa infections // Iran Biomed J. - 2013. - Vol. 17, №1. - P. 1-7.




Изобретение относится к биотехнологии, в частности, к получению рекомбинантного белка FlicC, состоящего из аминокислотной последовательности флагеллина-С P.aeruginosa, штамма РА 103, предназначенного для использования в качестве компонента рекомбинантной вакцины, а также к рекомбинантной плазмиде pPA-FlicC и рекомбинантному штамму E.coli PA-FlicC, предназначенным для синтеза рекомбинантного белка FlicC. Способ получения FlicC по данному изобретению, включающий культивирование E.coli PA-FlicC в питательной среде, разрушение клеток микроорганизма, выделение телец-включений, удаление примесей, растворимых в 8 Μ мочевине, растворение рекомбинантного белка FlicC в буферном растворе с 6 Μ гуанидина хлоридом и перевод рекомбинантного белка FlicC в нативные условия при помощи диализа, исключает использование хроматографии, при которой применяют дорогостоящие никель-активированные сорбенты, а сама предлагаемая процедура является более быстрой. 3 н.п. ф-лы, 4 ил., 5 пр.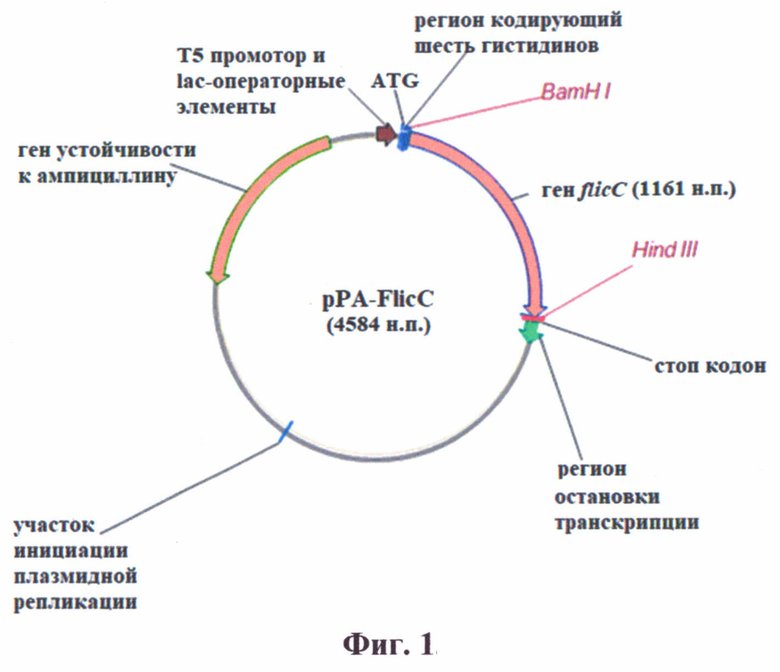
1. Рекомбинантная плазмидная ДНК pPA-FlicC, кодирующая синтез рекомбинантного белка FlicC Pseudomonas aeruginosa, размером 4584 пар оснований, расщепляющаяся в результате гидролиза нуклеазами рестрикции ВатHI и HindIII на фрагменты ДНК с размерами 1161 и 3423 пар оснований; содержащая последовательности модифицированного промотора бактериофага Т5 и двух лактозных оперонов; сайт посадки рибосомы; стартовый ATG-кодон; последовательность, кодирующую шесть гистидинов; лямбда t0 регион остановки транскрипции; регион остановки транскрипции; сайт инициации репликации плазмиды ColE1; ген, кодирующий устойчивость к ампициллину; при этом в результате экспрессии данной конструкции происходит синтез рекомбинантного продукта с массой около 40,7 кДа.
2. Штамм бактерий Escherichia coli PA-FlicC - продуцент рекомбинантного белка FlicC P. aeruginosa с молекулярной массой 40,7 кДа, полученный путем трансформации родительского штамма бактерий Е. coli K-12 рекомбинантной плазмидной ДНК рPA-FlicC по п. 1.
3. Способ получения рекомбинантного белка FlicC P. aeruginosa с использованием штамма Е. coli PA-FlicC по п. 2, включающий его культивирование в питательной среде, разрушение клеток микроорганизма, выделение телец-включений, удаление примесей, растворимых в 8 Μ мочевине, растворение рекомбинантного белка FlicC в буферном растворе с 6 Μ гуанидином хлорида и перевод рекомбинантного белка FlicC в нативные условия при помощи диализа.
| CAMPODONICO V.L | |||
| et al., Evaluation of flagella and flagellin of Pseudomonas aeruginosa as vaccines, Infect Immun., 2010, vol | |||
| Парный автоматический сцепной прибор для железнодорожных вагонов | 0 |
|
SU78A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| ГАЗОГЕНЕРАТОР ДЛЯ ДРОВ, ТОРФА И КИЗЯКА | 1923 |
|
SU746A1 |
| ШТАММ БАКТЕРИЙ Escherichia coli - ПРОДУЦЕНТ РЕКОМБИНАНТНОГО ФЛАГЕЛЛИНА | 2012 |
|
RU2524133C2 |
| СОФРОНОВ Г.А | |||
| и др., Перспективные направления использования препаратов на основе рекомбинантного флагеллина, Медицинский академический журнал, 2017, vol | |||
| Печь для сжигания твердых и жидких нечистот | 1920 |
|
SU17A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
2023-04-05—Публикация
2022-09-07—Подача