РОДСТВЕННЫЕ ЗАЯВКИ
Данная заявка испрашивает приоритет по предварительной заявке США № 62/459955, поданной 16 февраля 2017 года, и предварительной заявке США № 62/459953, поданной 16 февраля 2017 года. Идея изобретения, изложенная в выше указанной заявке, полностью включена в данный документ посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
Данное изобретение относится к способам и промежуточным веществам, подходящим для получения биологически активных молекул, особенно для синтеза ингибиторов респираторно-синцитиального вируса (РСВ).
УРОВЕНЬ ТЕХНИКИ
Респираторно-синцитиальный вирус человека (РСВЧ) представляет собой парамиксовирус, геном которого представлен негативно-полярной однонитевой РНК (KM. Empey, et al, Rev. Anti-Infective Agents, 2010, 50(1 May), 1258-1267). РСВ представляет собой основную причину острых инфекций нижних дыхательных путей (ОИНДП) и влияет на пациентов всех возрастов. Симптомы у взрослых людей, обычно, не тяжелые и, как правило, аналогичны простуде в легкой форме. Однако, у младенцев и детей предшкольного возраста вирус может вызвать инфекции нижних дыхательных путей, включая бронхиолит и пневмонию, причем многим из них требуется госпитализация. Практически все дети были инфицированы в возрасте до 3 лет. В известных группах высокого риска инфицирование РСВ с большей вероятностью переходит в ОИНДП. Недоношенные младенцы и/или младенцы, страдающие от болезней легких или сердца, имеют наибольший риск развития ОИНДП. Дополнительно, группы высокого риска включают людей пожилого возраста, взрослых с хроническими болезнями сердца и/или легких, пациентов с трансплантированными стволовыми клетками и
пациентов с ослабленным иммунитетом.
В настоящее время не существует доступной вакцины для предотвращения инфицирования РСВЧ. Паливизумаб представляет собой моноклональное антитело, которое применяется профилактически для предотвращения инфицирования РСВЧ у младенцев с высоким риском, например, у недоношенных младенцев и младенцев с заболеваниями сердца и/или легких. Высокая стоимость лечения паливизумабом ограничивает его применение для общих целей. Рибавирин также применяется для лечения инфекций РСВЧ, но его эффективность ограничена. Существует большая медицинская потребность в новых и эффективных способах лечения РСВЧ, которые, в общем, могут применяться популяциями всех типов и возрастов.
Несколько ингибиторов слияния РСВ раскрыты в следующих публикациях: WO2010/103306, WO2012/068622, WO2013/096681, WO2014/060411, WO2013/186995, WO2013/186334, WO2013/186332, WO2012/080451, WO2012/080450, WO2012/080449, WO2012/080447, WO2012/080446 и J. Med. Chem. 2015, 58, 1630-1643. Примеры других ингибиторов белка N для лечения СРВЧ раскрыты в следующих публикациях: WO2004/026843, J. Med. Chem. 2006, 49, 2311-2319 и J Med. Chem. 2007, 50, 1685-1692. Примеры ингибиторов белка L раскрыты в следующих публикациях: WO2011/005842, WO2005/0422530, Antiviral Res. 2005, 65, 125-131 и Bioorg. Med. Chem. Lett. 2013, 23, 6789-6793. Примеры ингибиторов нуклеозидов/полимеразы раскрыты в следующих публикациях: WO2013/242525 и J. Med. Chem. 2015, 58, 1862-1878.
Существует необходимость в разработке эффективных способов лечения СРВЧ. В данном изобретении определены соединения, которые представляют собой бензодиазепины, замещенные аминогетероарилом, и ингибируют РСВЧ. Изобретение охватывает способы получения соединений, а также способы применения этих соединений для лечения заболевания.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В данном изобретении предложены способы получения соединений формулы (I), или их фармацевтически приемлемой соли:
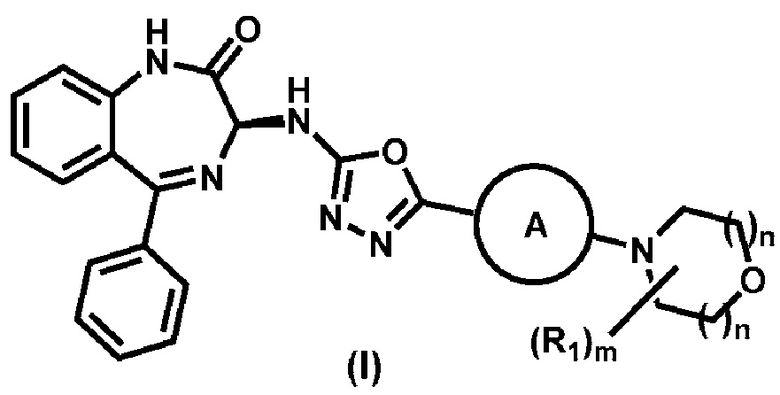 ,
,
где А представляет собой необязательно замещенный арил или необязательно замещенный гетероарил; предпочтительно, А представляет собой необязательно замещенный пиридил; каждый n выбирают независимо из 1 и 2; предпочтительно, каждый n представляет собой 1; m представляет собой 0, 1, 2, 3, или 4; предпочтительно, m представляет собой 0;
R1 выбирают из группы, состоящей из:
1) необязательно замещенного -C1-C8-алкила;
2) необязательно замещенного -C3-C8-циклоалкила; и
3) необязательно замещенного 3-12-членного гетероциклического фрагмента.
В альтернативном варианте, две смежные группы R1 вместе с атомами углерода, к которым они присоединены, образуют конденсированное кольцо; две геминальные группы R1 вместе с атомом углерода, к которому они присоединены, образуют спиро-кольцо; или две группы R1 на несмежных атомах углерода вместе образуют мостиковую группу, а именно -СН2- или -СН2СН2-.
Предпочтительно, если m представляет собой не 0, каждый R1 представляет собой метил.
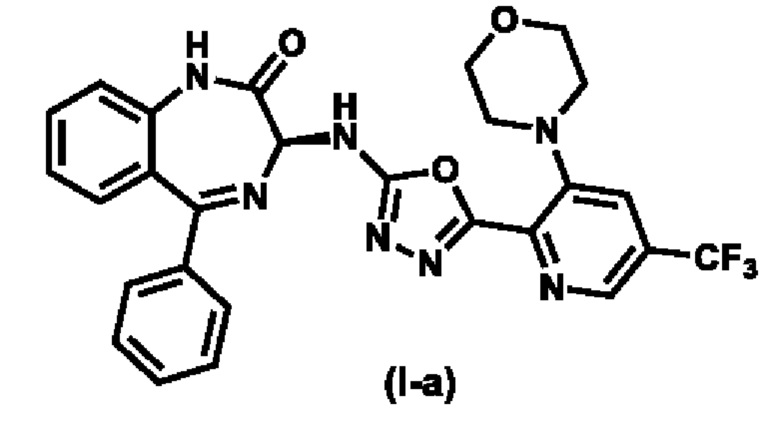
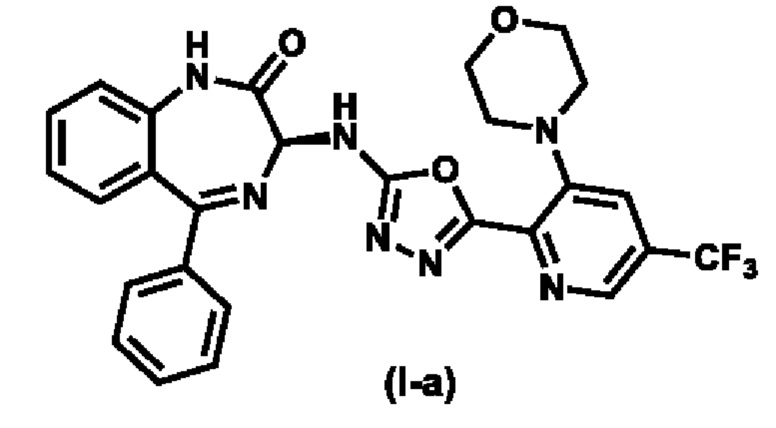
Предпочтительное соединение формулы (I) представляет собой соединение (I-a):
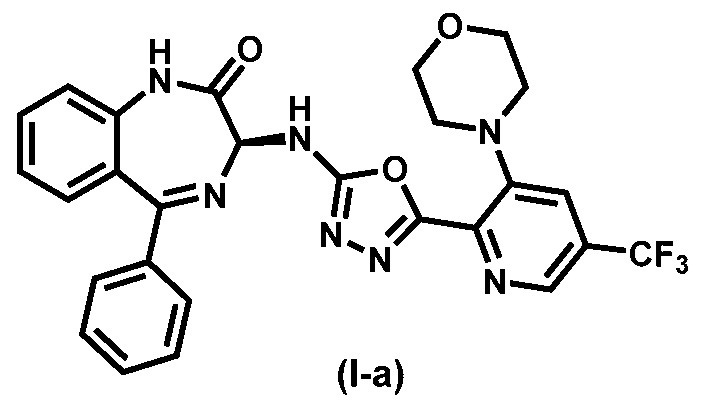 .
.
Изобретение дополнительно относится к способам увеличения выхода продукта и уменьшению количества этапов процесса для средне- и крупномасштабного производства соединений формулы (I), а именно соединения (I-a). Эти соединения полезны в качестве ингибиторов РСВ.
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В основном варианте реализации изобретения предложены способы получения соединения формулы (I), или его фармацевтически приемлемой соли:
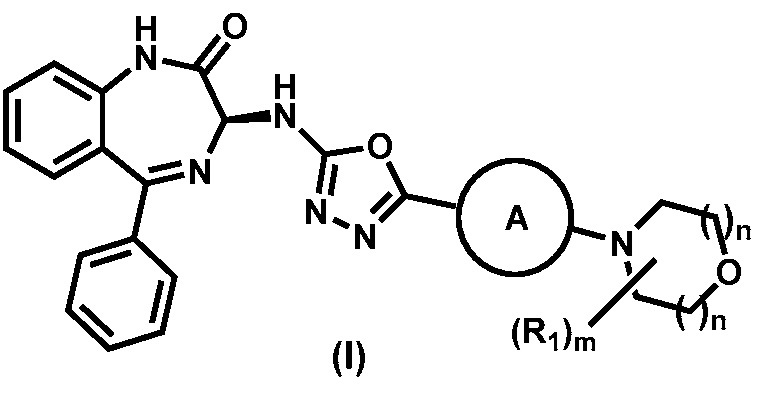 ,
,
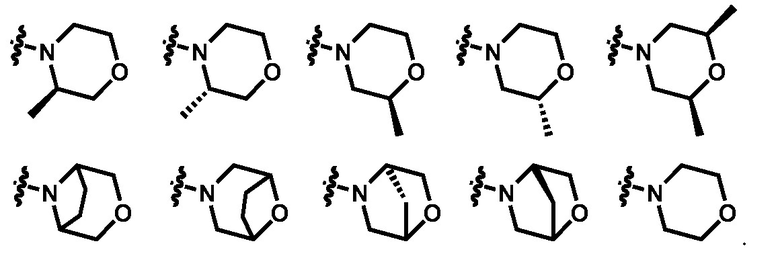
где А, R1, m и n описаны выше. В определенных вариантах реализации изобретения,
 выбирают из групп, перечисленных ниже:
выбирают из групп, перечисленных ниже:
Способ включает этапы
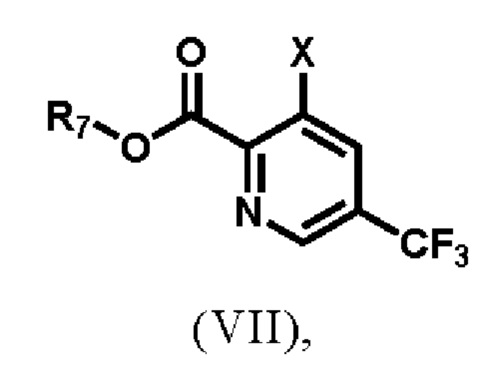
1) реакции соединения формулы (VII)
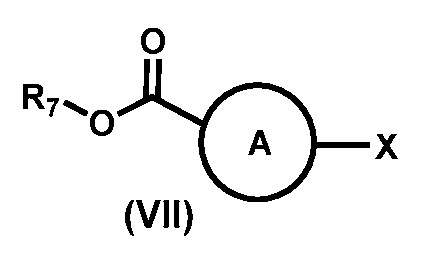 ,
,
где R7 выбирают из группы, состоящей из водорода, С1-С8-алкила, С2-С8-алкенила, С2-С8-алкинила, С3-С8-циклоалкила, С3-С8-циклоалкенила, 3-8-членного гетероциклического фрагмента, арила и гетероарила; и Х представляет собой замещаемую группу, а именно, но не ограничиваясь ими, галоген или -О-трифлат;
с соединением формулы (VII-X),
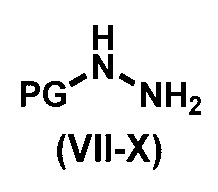 ,
,
где PG представляет собой водород или защитную группу амина, а именно, но не ограничиваясь ими, карбобензилокси (cbz), трет-бутоксикарбонил (Boc), метоксикарбонил или 9-флуоренилметоксикарбонил;
с образованием соединения формулы (VIII),
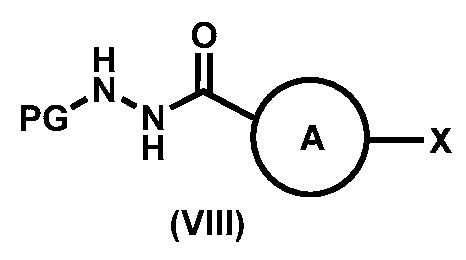 ;
;
2) реакции соединения формулы (VIII) с соединением формулы (IX):
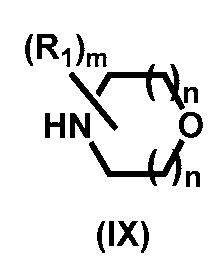 ,
,
где R1, m и n описаны выше;
с образованием соединения формулы (Х):
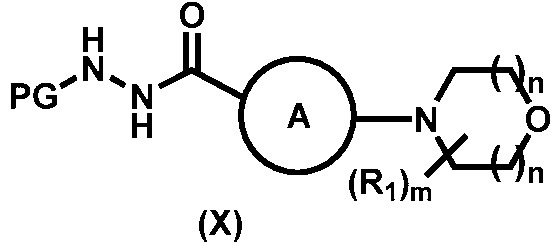 ;
;
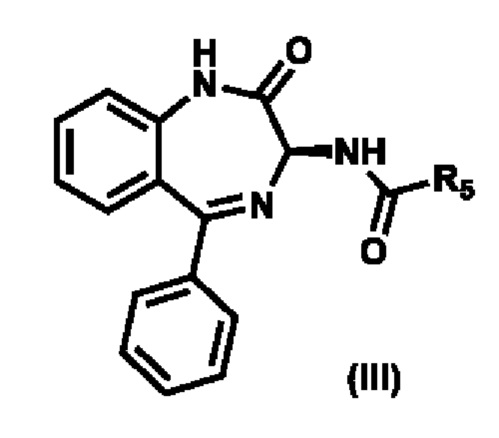
3) реакции соединения формулы (Х) с соединением формулы (III),
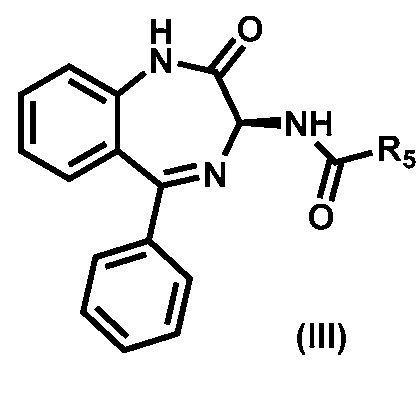 ,
,
где R5 выбирают из группы, состоящей из -О(CO)О-R6, необязательно замещенного арила и необязательно замещенного гетероарила; и R6 выбирают из группы, состоящей из необязательно замещенного C1-C8-алкила, необязательно замещенного C2-C8-алкенила, необязательно замещенного C2-C8-алкинила, необязательно замещенного C3-C8-циклоалкила, необязательно замещенного C3-C8-циклоалкенила, необязательно замещенного 3-8-членного гетероциклического фрагмента, необязательно замещенного арила и необязательно замещенного гетероарила;
с образованием соединения формулы (V),
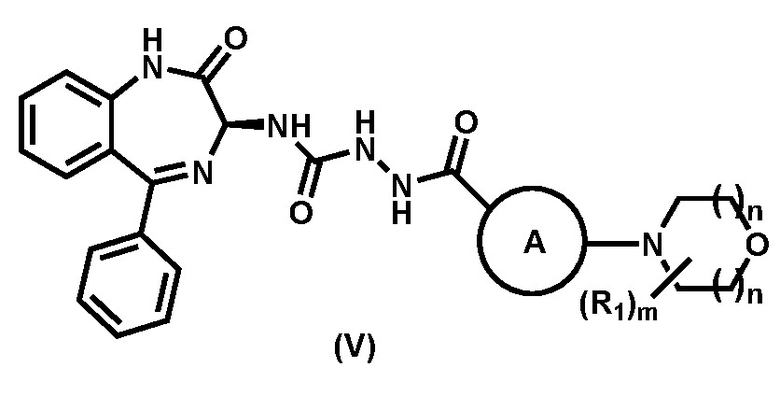 ; и
; и
4) реакции соединения формулы (V) с реагентом для циклизации с образованием соединения формулы (I).
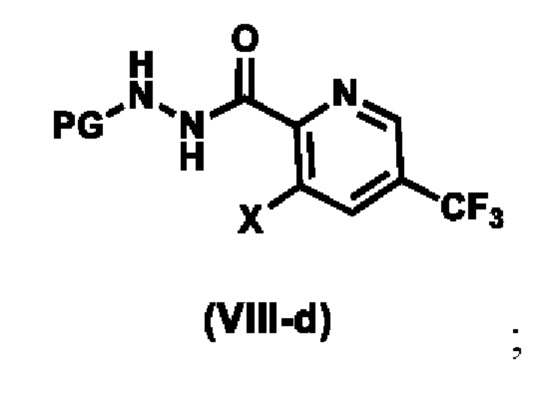
Предпочтительный вариант реализации соединения формулы (VIII) представляет собой соединения формулы (VIII-a), формулы (VIII-b) или формулы (VIII-c):
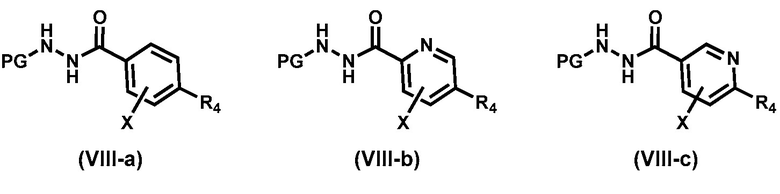 ,
,
где, R4 выбирают из галогена, метила, CF3 и CN. Более предпочтительный вариант реализации соединения формулы (VIII) представляет собой соединения формулы (Vlll -d),
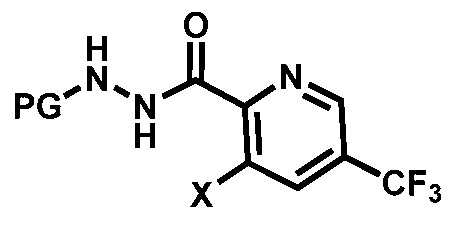 .
.
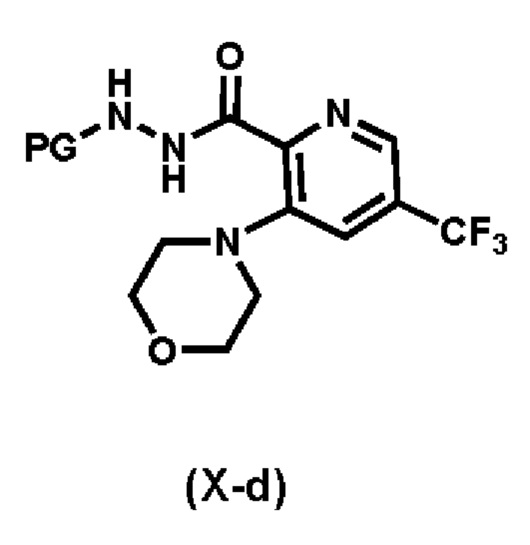
Предпочтительный вариант реализации соединения формулы (Х) представляет собой соединения формулы (Х-a), формулы (Х-b) или формулы (Х-c):
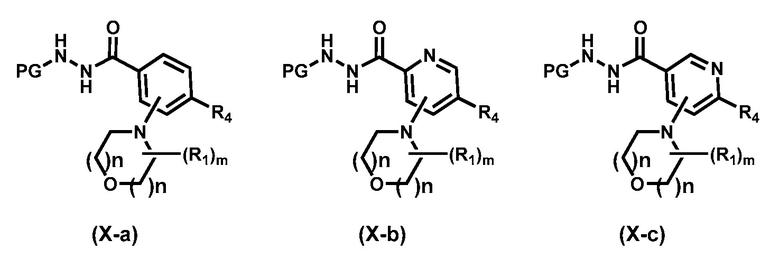 .
.
Более предпочтительный вариант реализации соединения формулы (Х) представляет собой соединения формулы (Х-d),
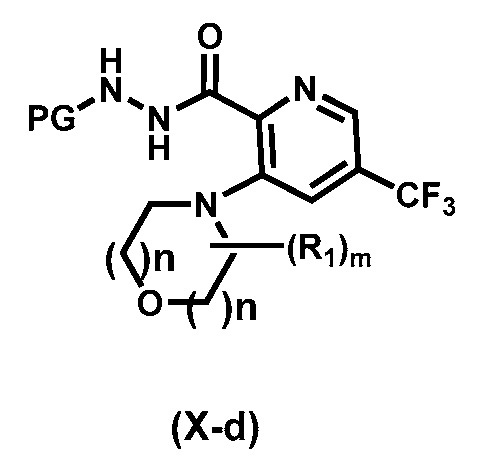 .
.
В предпочтительном варианте реализации соединения формулы (III) представляет собой соединение (III-a):
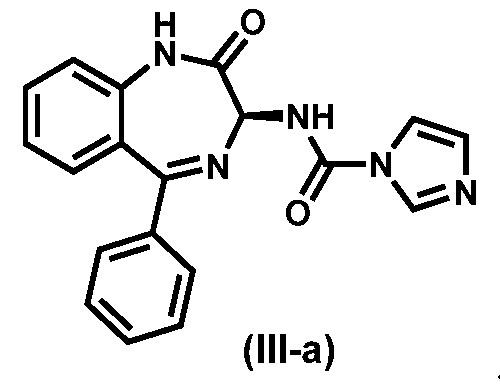
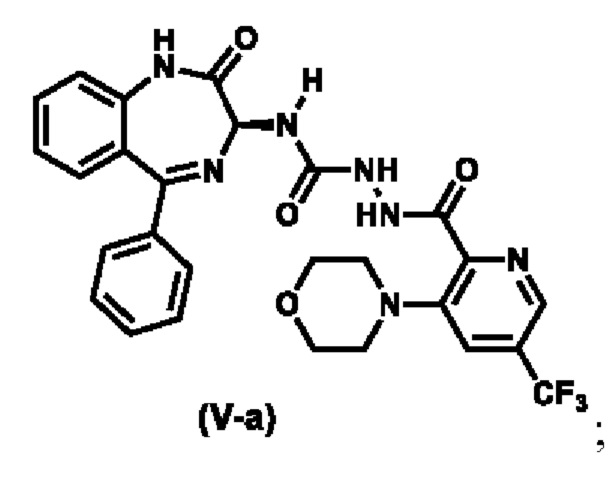
Предпочтительный вариант реализации соединения формулы (V) представляет собой соединение (V-a):
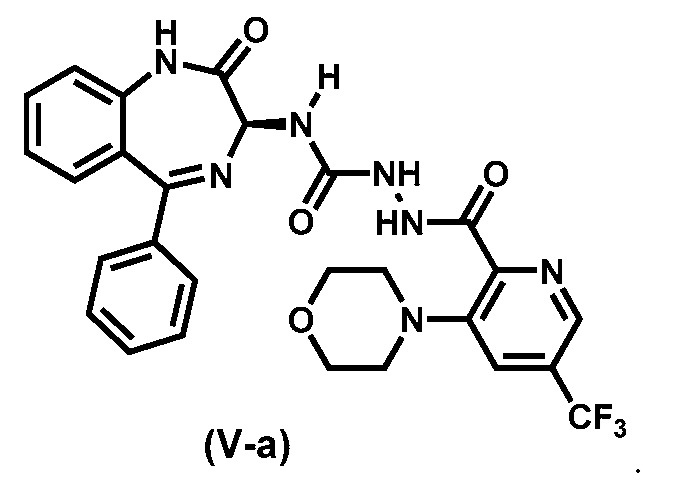
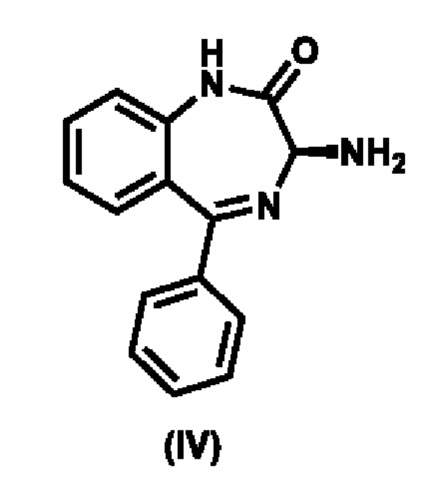
Соединение формулы (III) образуется в результате реакции соединения (IV),
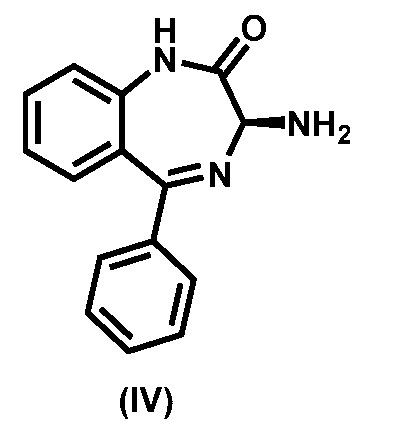 ,
,
с активирующим реагентом формулы Y-C(О)R5, где Y представляет собой замещаемую группу, а именно галоид или 1-имидазолил.
Соединение (IV) получают, например, разделением рацемической смеси соединения (IV) и его энантиомера.
В одном варианте реализации изобретения предложено соединение формулы (I), или его фармацевтически приемлемая соль, в твердом аморфном состоянии. В этом варианте реализации изобретения соединение формулы I представляет собой предпочтительно соединение (I-a) или его фармацевтически приемлемую соль, и предпочтительнее, соединение формулы (I) представляет собой свободное основание соединения (I-a).
В другом варианте реализации изобретения предложены композиции, содержащие соединение формулы (I), или его фармацевтически приемлемую соль в твердом аморфном состоянии, и фармацевтически приемлемый гидрофильный полимер для увеличения активности.
В одном варианте реализации этого аспекта изобретения гидрофильный полимер выбирают из гомополимера N-виниллактама, сополимеров N-виниллактама, сложных эфиров целлюлозы, простых эфиров целлюлозы, полиалкиленоксида, полиакрилата, полиметакрилата, полиакриламида, поливинилового спирта, полимера винилацетата, олигосахаридов и полисахаридов. Неограничивающие примеры подходящих гидрофильных полимеров включают гомополимер N-винилпирролидона, сополимеры N-винилпирролидона, сополимеры N-винилпирролидона и винилацетата, сополимеры N-винилпирролидона и винилпропионата, поливинилпирролидон, метилцеллюлозу, этилцеллюлозу, гидроксиалкилцеллюлозу, гидроксипропилцеллюлозу, гидроксиалкилалкилцеллюлозу, гидроксипропилметилцеллюлозу, фталат целлюлозы, сукцинат целлюлозы, ацетатфталат целлюлозы, фталат гидроксипропилметилцеллюлозы, сукцинат гидроксипропилметилцеллюлозы, ацетатсукцинат гидроксипропилметилцеллюлозы, полиэтиленоксид, полипропиленоксид, сополимер этиленоксида и пропиленоксида, сополимер метакриловой кислоты/этилакрилата, сополимер метакриловой кислоты/метилметакрилата, сополимер бутилметакрилата/2-диметиламиноэтилметакриалата, поли(гидроксиалкилакрилат), поли(гидроксиалкилметакрилат), сополимер винилацетата и кротоновой кислоты, частично гидролизованный поливинилацетат, каррагенан, галактоманнан или ксантановую камедь.
В еще одном варианте реализации этого аспекта изобретения гидрофильный полимер представляет собой гомополимер или сополимер N-винилпирролидона. Предпочтительно, гидрофильный полимер представляет собой коповидон.
Композиции, содержащие соединение формулы (I), или его фармацевтически приемлемую соль в твердом аморфном состоянии, и фармацевтически приемлемый гидрофильный полимер получают с помощью множества методик, а именно, без ограничений, экструзией из расплава, распылительной сушкой, совместным осаждением, сушкой вымораживанием или другими методиками испарения растворителя, причем экструзия из расплава и распылительная сушка являются предпочтительными. Способ экструзии из расплава, как правило, включает этапы получения расплава, которые включают активный(ые) ингредиент(ы), гидрофильный(ые) полимер(ы) и, предпочтительно, поверхностно-активное(ые) вещество(а), а затем охлаждение расплава пока он не затвердеет. «Плавление» подразумевает переход в жидкое или высокоэластичное состояние, в котором для одного компонента становится возможным внедриться, предпочтительно, внедриться гомогенно, в другой компонент или компоненты. Во многих случаях компонент(ы) полимера расплавляется и другие компоненты, включая активный(ые) ингредиент(ы), растворяются в расплаве, образуя таким образом раствор. Плавление, как правило, включает нагревание выше температуры размягчения полимера(ов). Получение расплава происходит множеством способов. Смешивание компонентов происходит до, во время или после образования расплава. Например, компоненты сначала смешивают, затем расплавляют, или одновременно смешивают и расплавляют. Расплав гомогенизируют для того, чтобы эффективно распределить активный(ые) ингредиент(ы). Дополнительно, удобно сначала расплавить полимер(ы), а затем добавить и гомогенизировать активный(е) ингредиент(ы). В одном примере, все материалы, кроме поверхностно-активного(ых) вещества(веществ), смешивают и подают в экструдер, а поверхностно-активное(ые) вещество(а) расплавляют вне экструдера и закачивают во время экструзии.
СХЕМЫ СИНТЕЗА
Данное изобретение будет лучше понятно вместе со схемами 1-2, где А, R1, PG, X, m, n и R5 описаны выше, если не указано иное.
Рядовому специалисту в данной области техники очевидно, что способ по данному изобретению может быть осуществлен и при замене соответствующих реагентов, а порядок самих этапов изменен.
Последовательность химических процессов синтеза гидразида, соединения формулы (Х) приведена на схеме (1).
Схема 1
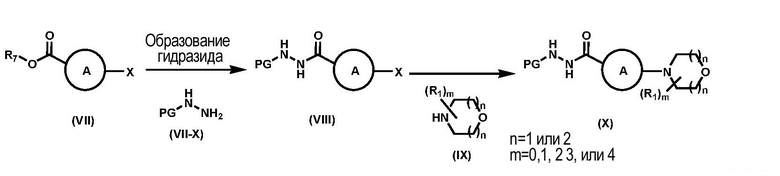
R7 выбирают из группы, состоящей из водорода, С1-С8-алкила, С2-С8-алкенила, С2-С8-алкинила, С3-С8-циклоалкила, С3-С8-циклоалкенила, 3-8-членного гетероциклического фрагмента, арила и гетероарила. Предпочтительно, соединение формулы (VII) представляет собой 3-гало-5-(трифторметил)-2-пиридинкарбоновую кислоту или алкил-3-гало-5-(трифторметил)пиколинат и, предпочтительнее, этил-3-хлор-5-(трифторметил)пиколинат, который является коммерчески доступным. Предпочтительные соединения формулы (VII-X) включают гидразина моногидрат, трет-бутоксикарбонилгидразин или карбобензоксигидразин.
В одном варианте реализации изобретения, R7 представляет собой C1-C8-алкил, предпочтительно, метил или этил. В этом варианте реализации изобретения реакция соединения формулы (VII) и гидразина моногидрата, как правило, происходит в протонном растворителе, а именно, но не ограничиваясь ими, метаноле, этаноле или изопропиловом спирте, или в смеси двух или более из них. Температура реакции, как правило, составляет от около 10 °C до около 70 °C, а длительность реакции, как правило, составляет от около 3 до 12 часов.
В другом варианте реализации изобретения R7 представляет собой водород, а соединение формулы (VII) превращают в соединение формулы (VIII) посредством реакции сочетания с соединением формулы (VII-X) в присутствии амидообразующего агента, а именно 1,1'-карбонилдиимидазола, бис(2-оксо-3-оксазолидинил)фосфинхлорида, 1-гидрокси-7-азабензотриазола, гидрата 1-гидроксибензотриазола, 3-гидрокси-1,2,3-бензотриазин-4(3Н)-она, гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида, 4-нитрофенола,
пентафторфенола, 2-гидроксипиридина, N-гидроксисукцинимида, N-гидроксифталамида, 2-меркаптобензоксазола, триметилацетилхлорида, изобутилхлорформиата, хлордиметокситриазола, оксалилхлорида, 2-гидроксипиридин-N-оксида, 5-нитро-2-гидроксипиридина, ангидрида трет-бутоксикарбонил-L-валина или их смеси. Примеры подходящих растворителей для этих реакций включают, но не ограничиваются ими, изопропилацетат, этилацетат, дихлорметан, ацетон, ТГФ, N-метилпирролидон, 2-метилтетрагидрофуран и ацетонитрил. Конкретные условия реакции варьируются в зависимости от природы агента реакции сочетания и являются известными рядовым специалистам в данной области техники.
Соединения формулы (VIII) превращают в соединение формулы (Х) посредством аминирования с соединением формулы (IX). Соединение формулы (IX) представляет собой, но не ограничивается ими, морфолин, 2-метилморфолин и его стереоизомеры, 3-метилморфолин и его стереоизомеры, 3,5-диметилморфолин и его стереоизомеры, 2,6-диметилморфолин и его стереоизомеры, 3-окса-8-азабицикло[3.2.1]октан, 2-окса-5-азабицикло[2.2.1]гептан, 8-окса-3-азабицикло[3.2.1]октан. Реакция, как правило, происходит в отсутствии растворителя или в апротонном растворителе, а именно, но не ограничиваясь ими, толуоле, ТГФ или дихлорметане. Температура реакции, как правило, составляет от около 10 °C до около 100 °C, а длительность реакции, как правило, составляет от 3 до 12 часов.
В одном варианте реализации изобретения, где PG представляет собой не водород, с соединения формулы (X) снята защита посредством удаления PG. Подходящие условия снятия защиты зависят от вида PG и известны специалистам в данной области техники, например, как это, в общем, описано в T.H. Greene and P.G. M. Wuts, Protective Groups in Organic Synthesis. 3rd edition, John Wiley & Sons, New York (1999).
На схеме 2 изображен синтез соединения формулы (I),
Схема 2
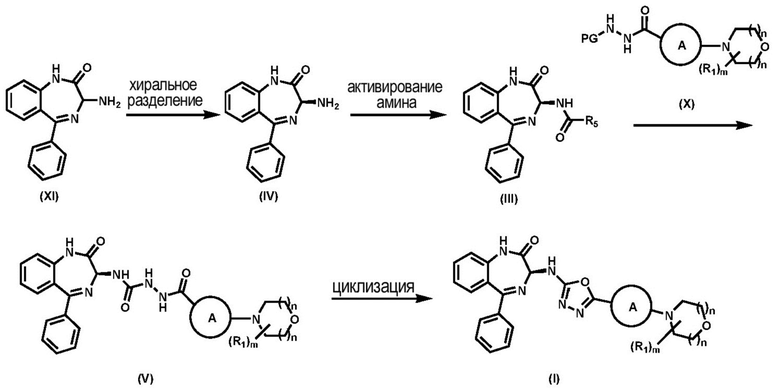
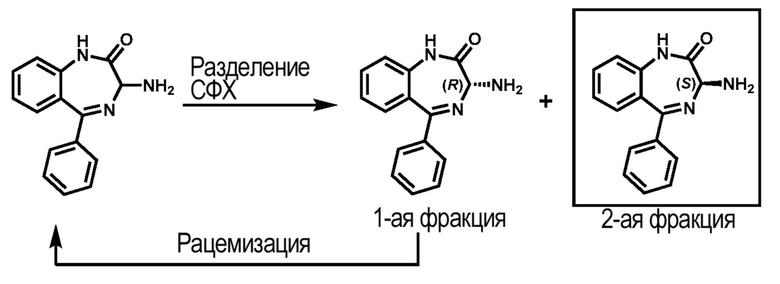
Соединение (XI) либо коммерчески доступно, либо может быть синтезировано способами, известными рядовым специалистам в данной области техники. Хиральное отделение рацемического соединения (XI) проводят такими способами, как, но не ограничиваясь ими, обработка хиральной кислотой и отделение диастереоизомерной соли посредством кристаллизации или хроматографии, капиллярного электрофореза (КЭ), сверхкритической флюидной хроматографии (СФХ), капиллярной электрохроматографии (КЭХ), газовой хроматографии (ГХ), высокоэффективной жидкостной хроматографии (ВЭЖХ) и кристаллизации с хиральной солью, с последующим разделением диастереомерных аналогов для получения S-изомера хирального соединения (IV). В одном варианте реализации изобретения соединение (IV) получают из рацемического соединения (XI) с помощью способов, раскрытых в предварительной заявке США №62/585192.
В одном варианте реализации изобретения СФХ применяется для получения хирального соединения (IV); подвижная фаза представляет собой диоксид углерода (СО2) или смесь диоксида углерода и полярного органического сорастворителя, а именно, но не ограничиваясь ими, метанола, этанола или 2-пропанола; температура ограничена диапазоном от 5 до 40-50 °C, предпочтительно, температура представляет собой температуру окружающей среды (около 25 °C). Методика и условия СФХ варьируются и зависимости от природы рацемических соединений и являются известными рядовым специалистам в данной области техники.
В одном аспекте хиральное соединение (IV) после разделения с помощью СФХ получают с энантиомерной чистотой (ee) более чем около 90 %. В одном аспекте хиральное соединение (IV) после разделения с помощью СФХ получают с энантиомерной чистотой (ee) более чем около 95 %. В одном аспекте хиральное соединение (IV) после разделения с помощью СФХ получают с энантиомерной чистотой (ee) более чем около 98 %.
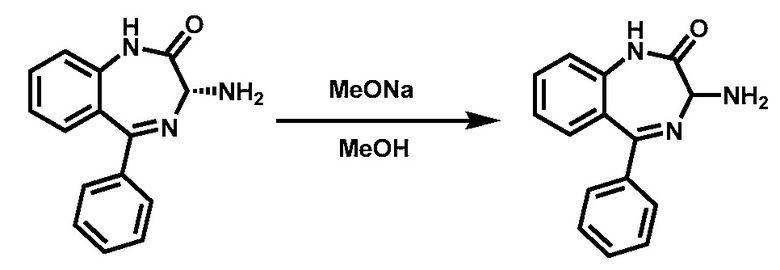
В одном варианте реализации изобретения, после хирального разделения кроме хирального соединения (IV) также получают другой эпимер - R-изомер хирального соединения (IV-А).
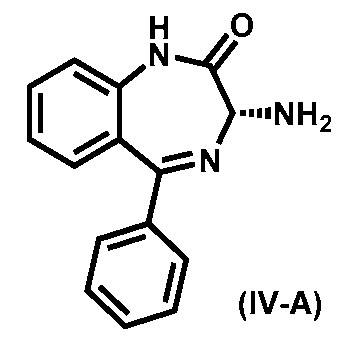
В одном варианте реализации изобретения хиральное соединение (IV-А) рацемизируют в основных условиях для получения рацемического соединения (XI). Рацемизирование происходит в протонном растворителе, а именно, но не ограничиваясь ими, метаноле, этаноле, трет-бутиловом спирте или изопропиловом спирте в присутствии основания, а именно, но не ограничиваясь ими, NaOMe или t-BuOK. Температура реакции, как правило, составляет от около 10 °C до около 70 °C, а длительность реакции, как правило, составляет от около 3 до 24 часов.
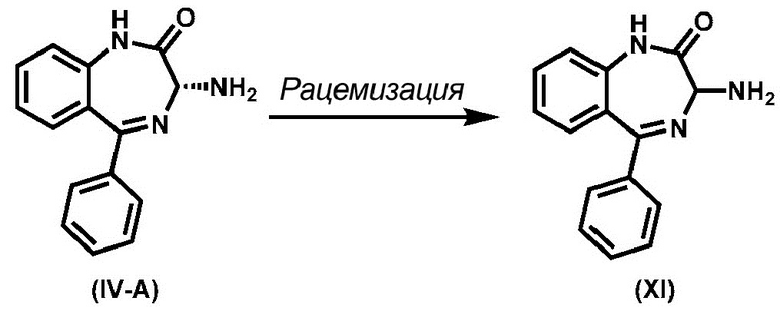
В одном варианте реализации изобретения хиральное соединение (IV) превращают в соединение формулы (III) с помощью агента активирования амина, а именно, но не ограничиваясь ими, 1,1’-карбонилдиимидазола, нитрофенилхлорформиата, трифосгена или фосгена. Этот процесс, как правило, проводят в протонном или апротонном растворителе, а именно, но не ограничиваясь ими, ацетонитриле, ТГФ, ДМСО или дихлорметане. Типичная температура реакции составляет от около 0 °C до около 30 °C, а длительность реакции, как правило, составляет от около 6 до 15 часов. В одном аспекте молярное отношение соединения (IV) к агенту активирования амина составляет около 1:1. В одном аспекте молярное отношение соединения (IV) к агенту активирования амина составляет около 1:2. В одном аспекте молярное отношение соединения (IV) к агенту активирования амина составляет около 1:3. Предпочтительно, молярное отношение соединения (IV) к агенту активирования амина составляет около 1:3.
В одном варианте реализации изобретения PG представляет собой водород; реакцию соединения формулы (III) с соединением формулы (X) проводят в протонном растворителе, а именно, но не ограничиваясь ими, ацетонитриле, ТГФ, ДМСО, ДМФ, сульфолане или 1-метил-2- пирролидоне. Типичная температура реакции составляет от около 10 °C до 50 °C, а длительность реакции, как правило, составляет от 6 до 48 часов. Реакцию, как правило, проводят при концентрации соединения формулы (III) от около 1 М до около 3 М, предпочтительно, концентрация соединения формулы (III) составляет 1,5 М. Молярное отношение соединения формулы (III) к соединению формулы (Х) составляет 1:1.
Соединение формулы (V) циклизируют в соединение формулы (I) с помощью реакции с агентом циклизации, а именно, но не ограничиваясь ими, р-толуолсульфонилхлоридом, тионилхлоридом, оксихлоридом фосфора или HATU в присутствии органического основания. Подходящие органические основания включают, но не ограничиваются ими, триэтиламин и диизопропилэтиламин. Этот процесс проводят в апротонном растворителе, а именно, но не ограничиваясь ими, ацетонитриле, ТГФ, ДМФ, ДМСО, N-метилпирролидоне, ацетоне, дихлорметане, этилацетате или изопропилацетате. Температура реакции составляет от около 0 °C до около 30 °C, а длительность реакции, как правило, составляет от 3 до 15 часов.
ОПРЕДЕЛЕНИЯ
Ниже перечислены определения различных терминов для описания изобретения. Эти определения применяются к терминам, используемым в данном описании и формуле изобретения, если это иным способом не ограничено в конкретных случаях, либо по отдельности, либо в составе большей группы.
Применяемый в данном документе термин «арил» относится к моно- или полициклическим карбоциклическим кольцевым системам, содержащим по меньшей мере одно ароматическое кольцо, включая, но не ограничиваясь ими, фенил, нафтил, тетрагидронафтил, инданил и инденил. Полициклический арил представляет собой полициклическую кольцевую систему, которая содержит по меньшей мере одно ароматическое кольцо. Полициклические арилы содержат сопряженные кольца, ковалентно связанные кольца или их комбинации.
Применяемый в данном документе термин «гетероарил» относится к моно- или полициклическому ароматическому радикалу, имеющему один циклообразующий атом или более, выбранный из S, O и N; а остальные циклообразующие атомы представляют собой углерод, причем любой N или S, содержащийся в кольце необязательно окислен. Гетероарил включает, но не ограничивается ими, пиридинил, пиразинил, пиримидинил, пирролил, пиразолил, имидазолил, тиазолил, оксазолил, изоксазолил, тиадиазолил, оксадиазолил, тиофенил, фуранил, хинолинил, изохинолинил, бензимидазолил, бензоксазолил, хиноксалинил. Полициклический гетероарил содержит сопряженные кольца, ковалентно связанные кольца или их комбинации.
В соответствии с изобретением, ароматические группы являются замещенными или незамещенными.
Термин «бициклический арил» или «бициклический гетероарил» относится к кольцевой системе, состоящей из двух колец, причем по меньшей мере одно кольцо является ароматическим; и два кольца являются сопряженными или ковалентно связанными.
Применяемый в данном документе термин «алкил» относится к насыщенному линейному или разветвленному углеводородному радикалу. «С1-С4-алкил», «С1-С6-алкил», «С1-С8-алкил», «С1-С12-алкил», «С2-С4-алкил» или «С3-С6-алкил» относятся к алкильной группе, содержащей от одного до четырех, от одного до шести, от одного до восьми, от одного до двенадцати, от 2 до 4 и от 3 до 6 атомов углерода, соответственно. Примеры С1-С8-углеводородных радикалов включают, но не ограничиваются ими, метильный, этильный, пропильный, изопропильный, н-бутильный, трет-бутильный, неопентильный, н-гексильный, гептильный и октильный радикалы.
Применяемый в данном документе термин «алкенил» относится к линейному или разветвленному углеводородному радикалу, имеющему по меньшей мере одну углерод-углеродную двойную связь в результате удаления одного атома водорода. «С2-С8-алкенил», «С2-С12-алкенил», «С2-С4-алкенил», «С3-С4-алкенил» или «С3-С6-алкенил» относятся к алкенильным группам, содержащим от двух до восьми, от двух до двенадцати, от двух до четырех, от трех до четырех или от трех до шести атомов углерода, соответственно. Алкенильные группы включают, например, но не ограничиваются ими, этенил, пропенил, бутенил, 1-метил-2-бутен-1-ил, гептенил, октенил и тому подобное.
Применяемый в данном документе термин «алкинил» относится к линейному или разветвленному углеводородному радикалу, имеющему по меньшей мере одну углерод-углеродную двойную связь в результате удаления одного атома водорода. «С2-С8-алкинил», «С2-С12-алкинил», «С2-С4-алкинил», «С3-С4-алкинил» или «С3-С6-алкинил» относятся к алкинильным группам, содержащим от двух до восьми, от двух до двенадцати, от двух до четырех, от трех до четырех или от трех до шести атомов углерода, соответственно. Типичные алкинильные группы включают, например, но не ограничиваются ими, этинил, 1-пропинил, 1-бутинил, гептинил, октинил и тому подобное.
Применяемый в данном документе термин «циклоалкил» относится к моноциклическому или полициклическому насыщенному карбоциклическому кольцу или би- или трициклической сопряженной, мостиковой или спиро-системе, а атомы углерода необязательно оксо-замещены или необязательно замещены экзоциклической олефиновой двойной связью. Предпочтительные циклоалкильные группы включают С3-С12-циклоалкил, С3-С6-циклоалкил, С3-С8-циклоалкил и С4-С7-циклоалкил. Примеры С3-С12-циклоалкила включают, но не ограничиваясь ими, циклопропил, циклобутил, циклопентил, циклогексил, циклооктил, 4-метиленциклогексил, бицикло[2.2.1]гептил, бицикло[3.1.0]гексил, спиро[2.5]октил, 3-метиленбицикло[3.2.1]октил, спиро[4,4]нонанил и тому подобное.
Применяемый в данном документе термин «циклоалкенил» относится к моноциклическому или полициклическому карбоциклическому кольцу или к би- или трициклической сопряженной, мостиковой или спиро-системе, имеющим по меньшей мере одну углерод-углеродную двойную связь, а атомы углерода необязательно оксо-замещены или необязательно замещены экзоциклической олефиновой двойной связью. Предпочтительные циклоаленильные группы включают С3-С12-циклоалкенильные, С3-С8-циклоалкенильные или С5-С7-циклоалкенильные группы. Примеры С3-С12-циклоалкенила включают, но не ограничиваясь ими, циклопропенил, циклобутенил, циклопентенил, циклогексенил, циклогептенил, циклооктенил, бицикло[2.2.1]гепт-2-енил, бицикло[3.1.0]гекс-2-енил, спиро[2.5]окт-4-енил, спиро[4.4]нон-1-енил, бицикло[4.2.1]нон-3-ен-9-ил и тому подобное.
Применяемый в данном документе термин «арилалкил» подразумевает функциональную группу, в которой алкенильная цепь присоединена к арильной группе, например, к -СН2СН2-фенилу. Термин «замещенный арилалкил» подразумевает арилалкильную функциональную группу, в которой арильная группа замещена. Аналогично, термин «гетероарилалкил» подразумевает функциональную группу, в которой алкенильная цепь присоединена к гетероарильной группе. Термин «замещенный гетероарилалкил» подразумевает гетероарилалкильную функциональную группу, в которой гетероарильная группа замещена.
Применяемый в данном документе термин «алкокси», используемый отдельно или в комбинации с другими терминами, если не указано иное, подразумевает алкильную группу, имеющую заданное количество атомов углерода, присоединенных к остальной молекуле через атом кислорода, а именно, например, метокси, этокси, 1-пропокси, 2-пропокси (изопропокси) и высшие гомологи или изомеры. Предпочтительными алкокси являются С1-С3-алкокси.
Понятно, что любой алкильный, алкенильный, алкинильный, циклоалкильный, гетероциклический и циклоалкенильный фрагмент молекулы, описанный в данном документе, также является алифатической или алициклической группой.
«Алифатическая группа» представляет собой неароматический фрагмент молекулы, состоящий из любой комбинации атомов углерода, атомов водорода, атомов галогена, кислорода, азота и других атомов, и необязательно содержит одну или более единиц ненасыщенности, например, двойные и/или тройные связи. Примеры алифатических групп представляют собой функциональные группы, а именно, алкил, алкенил, алкинил, O, OH, NH, NH2, C(O), S(О)2, C(О)О, C(О)NH, OC(О)О, OC(О)NH, OC(О)NH2, S(О)2NH, S(О)2NH2, NHC(О)NH2, NHC(О)C(О)NH, NHS(О)2NH, NHS(О)2NH2, C(О)NHS(О)2, C(О)NHS(О)2NH или C(О)NHS(О)2NH2 и тому подобное, группы, содержащие одну или более функциональных групп, неароматические углеводороды (необязательно замещенные) и группы, в которых один или более углеродов из неароматического углеводорода (необязательно замещенного) заменены функциональной группой. Атомы углерода в алифатической группе необязательно оксо-замещены. Алифатическая группа является линейной, разветвленной, циклической или их комбинацией, и, предпочтительно, содержит от 1 до около 24 атомов углерода, предпочтительнее, от около 1 до около 12 атомов углерода. Дополнительно к алифатическим углеводородным группам, применяемым в данном документе, алифатические группы намеренно включают, например, алкоксиалкилы, полиалкоксиалкилы, а именно, например, полиалкиленгликоли, полиамины и полиимины. Алифатические группы являются необязательно замещенными.
Термины «гетероциклический» или «гетероциклоалкил» применяются как синонимы и относятся к неароматическому кольцу или к би- или трициклической сопряженной, мостиковой или спиро-системе, причем (1) каждая кольцевая система содержит по меньшей мере один гетероатом, независимо выбранный из кислорода, серы и азота, (2) каждая кольцевая система является насыщенной или ненасыщенной, (3) гетероатомы азота и серы необязательно окислены, (4) гетероатом азота необязательно является четвертичным, (5) любое из выше указанных колец сопряжено с ароматическим кольцом и (6) оставшиеся циклообразующие атомы представляют собой атомы углерода, которые необязательно оксо-замещены или необязательно замещены экзоциклической олефиновой двойной связью. Типичные гетероциклоалкильные группы включают, но не ограничиваются ими, 1,3-диоксолан, пирролидинил, пиразолинил, пиразолидинил, имидазолинил, имидазолидинил, пиперидинил, пиперазинил, оксазолидинил, изоксазолидинил, морфолинил, тиазолидинил, изотиазолидинил, хиноксалинил, пиридазинолил, 2-азабицикло[2.2.1]гептил, 8-азабицикло[3.2.1]октил, 5-азаспиро[2.5]октил, 1-окса-7-азаспиро[4.4]нонанил, 7-оксооксепан-4-ил и тетрагидрофурил. Такие гетероциклические группы являются дополнительно замещенными. Гетероарил или гетероциклические группы присоединены к C или N (по возможности).
Понятно, что любой алкильный, алкенильный, алкинильный, алициклический, циклоалкильный, циклоалкенильный, арильный, гетероарильный, гетероциклический, алифатический фрагмент молекулы или подобные им, раскрытые в данном документе, также представляет собой одновалентную или многовалентную группу, когда применяется как мостик для связывания двух или более групп или заместителей, которое происходит у одного и того же атома или у разных атомов. Специалист в данной области техники легко определит валентность любой такой группы из контекста, в котором она используется.
Термин «замещенный» относится к замещению посредством независимой замены одного, двух, трех или более атомов водорода заместителями, которые включают, но не ограничиваются ими, -F, -CI, -Br, -I, -OH, C1-C12-алкил; C2-C12-алкенил, C2-C12-алкинил, -C3-C12-циклоалкил, защищенную гидрокси-группу, -NO2, -N3, -CN, -NH2, защищенную амино-группу, оксо-, тиоксо-, -NH-C1-C12-алкил, -NH-C2-C8-алкенил, -NH-C2-C8-алкинил, -NH-C3-C12-циклоалкил, -NH-арил, -NH-гетероарил, -NH-гетероциклоалкил, -диалкиламино, -диариламино, -дигетероариламино, -0-C1-C12-алкил, -0-C2-C8-алкенил, -0-C2-C8-алкинил, -O-C3-C12-циклоалкил, -O-арил, -O-гетероарил, -O-гетероциклоалкил, -C(О)-C1-C12-алкил, -C(О)-C2-C8-алкенил, -C(О)-C2-C8-алкинил, -C(О)-C3-C12-циклоалкил, -C(О)-арил, -C(O)-гетероарил, -C(О)-гетероциклоалкил, -CONH2, -CONH-C1-C12-алкил, -CONH-C2-C8-алкенил, -CONH-C2-C8-алкинил, -CONH-C3-C12-циклоалкил, -CONH-арил, -CONH-гетероарил, -CONH-гетероциклоалкил, -OCО2-C1-C12-алкил, -OCО2-C2-C8-алкенил, -OCО2-C2-C8-алкинил, -OCО2-C3-C12-циклоалкил, -OCО2-арил, -OCО2-гетероарил, -OCО2-гетероциклоалкил, -CO2-C1-C12–алкил, -CO2-C2-C8-алкенил, -CO2-C2-C8-алкинил, CО2-C3-C12-циклоалкил, -CO2-арил, CО2-гетероарил, CО2-гетероциклоалкил, -OCONH2, -OCONH-C1-C12-алкил, -OCONH-C2-C8-алкенил, -OCONH-C2-C8-алкинил, -OCONH-C3-C12-циклоалкил, -OCONH-арил, -OCONH-гетероарил, -OCONH-гетероциклоалкил, -NHC(О)H, -NHC(О)-C1-C12-алкил, -NHC(О)-C2-C8-алкенил, -NHC(О)-C2-C8-алкинил, -NHC(О)-C3-C12-циклоалкил, -NHC(О)-арил, -NHC(О)-гетероарил, -NHC(O)-гетероциклоалкил, -NHCО2-C1-C12-алкил, -NHCО2-C2-C8-алкенил, -NHCO2-C2-C8-алкинил, -NHCО2-C3-C12-циклоалкил, -NHCО2-арил, -NHCО2-гетероарил, -NHCO2-гетероциклоалкил, -NHC(О)NH2, -NHC(О)NH-C1-C12-алкил, -NHC(О)NH-C2-C8-алкенил, -NHC(О)NH-C2-C8-алкинил, -NHC(О)NH-C3-C12-циклоалкил, -NHC(О)NH-арил, -NHC(О)NH-гетероарил, -NHC(О)NH-гетероциклоалкил, NHC(S)NH2, -NHC(S)NH-C1-C12-алкил, -NHC(S)NH-C2-C8-алкенил, -NHC(S)NH-C2-C8-алкинил, -NHC(S)NH-C3-C12-циклоалкил, -NHC(S)NH-арил, -NHC(S)NH-гетероарил, -NHC(S)NH-гетероциклоалкил, -NHC(NH)NH2, -NHC(NH)NH-C1-C12-алкил, -NHC(NH)NH-C2-C8-алкенил, -NHC(NH)NH-C2-C8-алкинил, -NHC(NH)NH-C3-C12-циклоалкил, -NHC(NH)NH-арил, -NHC(NH)NH-гетероарил, -NHC(NH)NH-гетероциклоалкил, -NHC(NH)-C1-C12-алкил, -NHC(NH)-C2-C8-алкенил, -NHC(NH)-C2-C8-алкинил, -NHC(NH)-C3-C12-циклоалкил, -NHC(NH)-арил, -NHC(NH)-гетероарил, -NHC(NH)-гетероциклоалкил, -C(NH)NH-C1-C12-алкил, -C(NH)NH-C2-C8-алкенил, -C(NH)NH-C2-C8-алкинил, -C(NH)NH-C3-C12-циклоалкил, -C(NH)NH-арил, -C(NH)NH-гетероарил, -C(NH)NH-гетероциклоалкил, -S(О)-C1-C12-алкил, -S(О)-C2-C8-алкенил, -S(О)-C2-C8-алкинил, -S(О)-C3-C12-циклоалкил, -S(О)-арил, -S(О)-гетероарил, -S(O)-гетероциклоалкил, -SО2NH2, -SО2NH-C1-C12-алкил, -SО2NH-C2-C8-алкенил, -SО2NH-C2-C8-алкинил, -SО2NH-C3-C12-циклоалкил, -SО2NH-арил, -SC NH-гетероарил, -SО2NH-гетероциклоалкил, -NHSО2-C1-C12-алкил, -NHSО2-C2-C8-алкенил, -NHSО2-C2-C8-алкинил, -NHSО2-C3-C12-циклоалкил, -NHSО2-арил, -NHSО2-гетероарил, -NHSО2-гетероциклоалкил, -CH2NH2, -CH2SО2CH3-арил, -арилалкил, -гетероарил, -гетероарилалкил, -гетероциклоалкил, -C3-C12-циклоалкил, полиалкоксиалкил, полиалкокси, -метоксиметокси, -метоксиэтокси, -SH, -S-C1-C12-алкил, -S-C2-C8-алкенил, -S-C2-C8-алкинил, -S-C3-C12-циклоалкил, -S-арил, -S -гетероарил, -S-гетероциклоалкил или метилтиометил. Понятно, что арилы, гетероарилы, алкилы, циклоалкилы и тому подобное дополнительно замещены.
Термин «гало» или «галоген», применяемый в данном документе сам по себе или как часть другого заместителя, относится к атому фтора, хлора, брома или йода.
Применяемый в данном документе термин «необязательно замещенный» подразумевает, что указанная группа является замещенной или незамещенной. В одном варианте реализации изобретения указанная группа необязательно замещена нулем заместителей, т.е., указанная группа незамещена. В другом варианте реализации изобретения указанная группа необязательно замещена одной или более дополнительной(ыми) группой(ами), отдельно и независимо выбранной из групп, описанных в данном документе.
Термин «водород» включает водород и дейтерий. Дополнительно, список атомов включает другие изотопы этого атома, при условии, что полученное соединение является фармацевтически приемлемым.
Применяемый в данном документе термин «группа, активирующая гидрокси-группу» относится к активному химическому фрагменту молекулы, который известен в данной области техники как активирующий гидроксильную группу, таким образом он удаляется во время синтеза, а именно замещения или реакции отщепления. Примеры группы, активирующей гидрокси-группу, включают, но не ограничиваются ими, мезилат, тозилат, трифлат, п-нитробензоат, фосфонат и тому подобное.
Применяемый в данном документе термин «активированная гидроксильная группа» относится к гидроксильной группе, активированной группой, активирующей гидроксильную группу, как это определено выше, включая, например, мезилат, тозилат, трифлат, п-нитробензоат, фосфонат.
Применяемый в данном документе термин «группа, защищающая гидрокси-группу» относится к активному химическому фрагменту молекулы, который известен в данной области техники как защищающий гидроксильную группу от нежелательных реакций во время синтеза. После указанной(ых) методики(методик) синтеза группа, защищающая гидроксильную группу, как это описано в данном документе, избирательно удаляется. Группы, защищающие гидроксильную группу и известные в данной области техники, в общем описаны в T.H. Greene and P.G. M. Wuts, Protective Groups in Organic Synthesis. 3rd edition, John Wiley & Sons, New York (1999). Примеры групп, защищающих гидроксильную группу, включают бензилоксикарбонил, 4-метоксибензилоксикарбонил, трет-бутоксикарбонил, изопропоксикарбонил, дифенилметоксикарбонил, 2,2,2-трихлорэтоксикарбонил, аллилоксикарбонил, ацетил, формил, хлорацетил, трифторацетил, метоксиацетил, феноксиацетил, бензоил, метил, трет-бутил, 2,2,2-трихлорэтил, 2-триметилсилилэтил, аллил, бензил, трифенилметил (тритил), метоксиметил, метилтиометил, бензилоксиметил, 2-(триметилсилил)этоксиметил, метансульфонил, триметилсилил, триизопропилсилил и тому подобное.
Применяемый в данном документе термин «защищенная гидроксильная группа» относится к гидроксильной группе, защищенной группой, защищающей гидроксильную группу, как это определено выше, включая, например, бензоил, ацетил, триметилсилил, триэтилсилил, метоксиметил.
Применяемый в данном документе термин «неактивная гидроксильная группа» относится к неактивному фрагменту молекулы, известному в данной области техники как временно изменяющий физико-химические и, следовательно, биологические свойства исходного лекарственного средства путем экранирования или маскирования гидроксильной группы. После указанной(ых) методики(методик) синтеза неактивная гидроксильная группа, как это описано в данном документе, должна быть способной превращаться обратно в гидроксильную группу in vivo. Неактивные гидроксильные группы, известные в данной области техники, в общем описаны в Kenneth B. Sloan, Prodrugs. Topical and Ocular Drug Delivery. (Drugs and the Pharmaceutical Sciences; Volume 53), Marcel Dekker, Inc., New York (1992).
Применяемый в данном документе термин «группа, защищающая амино-группу» относится к активному химическому фрагменту молекулы, который известен в данной области техники как защищающий амино-группу от нежелательных реакций во время синтеза. После указанной(ых) методики(методик) синтеза группа, защищающая амино-группу, как это описано в данном документе, избирательно удаляется. Группы, защищающие амино-группу, известные в данной области техники, в общем описаны в T.H. Greene and P.G. M. Wuts, Protective Groups in Organic Synthesis. 3rd edition, John Wiley & Sons, New York (1999). Примеры групп, защищающих амино-группу, включают, например, но не ограничиваются ими, метоксикарбонил, трет-бутоксикарбонил, 9-флуоренилметоксикарбонил, бензилоксикарбонил и тому подобное.
Применяемый в данном документе термин «защищенная амино-группа» относится к амино-группе, защищенной группой, защищающей амино-группу, как это определено выше.
Термин «замещаемая группа» подразумевает функциональную группу или атом, которые могут быть заменены другой функциональной группой или атомом во время реакции замещения, а именно реакции нуклеофильного замещения. Для примера, типичные замещаемые группы включают хлор, бром и йод; группы сульфоновых эфиров, а именно мезилат, тозилат, брозилат, нозилат и тому подобное; и ацилокси-группы, а именно ацетокси, трифторацетокси и тому подобное.
Применяемый в данном документе термин «апротонный растворитель» относится к растворителю, который является относительно инертным к протонной активности, т.е., не выполняет роль донора протонов. Примеры включают, но не ограничиваются ими, углеводороды, а именно, например, гексан и толуол, галогенированные углеводороды, а именно, например, метиленхлорид, этиленхлорид, хлороформ и тому подобное, гетероциклические соединения, а именно, например, тетрагидрофуран и N-метилпирролидинон, и простые эфиры, а именно диэтиловый эфир, бис-метоксиметиловый эфир. Такие соединения хорошо известны специалистам в данной области техники, и специалистам в данной области техники очевидно, что для определенных соединений и условий реакции предпочтительными являются отдельные растворители или их смеси в зависимости от таких факторов, как, например, растворимость реагентов, реакционная способность реагентов и предпочтительные температурные диапазоны. Дополнительные пояснения касательно апротонных растворителей можно найти в учебниках по органической химии или в специализированных монографиях, например: Organic Solvents Physical Properties and Methods of Purification. 4th ed., изданной John A. Riddick et al , Vol. II, в Techniques of Chemistry Series. John Wiley & Sons, NY, 1986.
Применяемый в данном документе термин «протонный растворитель» относится к растворителю, который имеет свойство отдавать протон, а именно спирту, например, метанолу, этанолу, пропанолу, изопропанолу, бутанолу, трет-бутоналу и тому подобное. Такие соединения хорошо известны специалистам в данной области техники, и специалистам в данной области техники очевидно, что для определенных соединений и условий реакции предпочтительными являются отдельные растворители или их смеси в зависимости от таких факторов, как, например, растворимость реагентов, реакционная способность реагентов и предпочтительные температурные диапазоны. Дополнительные пояснения касательно протонных растворителей можно найти в учебниках по органической химии или в специализированных монографиях, например: Organic Solvents Physical Properties and Methods of Purification. 4th ed., изданной John A. Riddick et al , Vol. II, в Techniques of Chemistry Series. John Wiley & Sons, NY, 1986.
Комбинации заместителей и переменных, предусмотренные этим изобретением, являются только такими, которые приводят к образованию стабильных соединения. Применяемый в данном документе термин «стабильный» относится к соединению, которое обладает стабильностью, достаточной для производства и сохранения целостности соединения в течение достаточного периода времени, чтобы быть полезным для целей, детально описанных в данном документе (например, терапевтического или профилактического введения субъекту).
Синтезированные соединения отделяют от реакционной смеси и дополнительно очищают такими способами, как колоночная хроматография, жидкостная хроматография высокого давления или повторная кристаллизация. Специалисту в данной области техники понятно, что дополнительные способы синтеза соединений формул, описанных в данном документе, являются очевидными рядовым специалистам в данной области техники. Дополнительно, для получения целевых соединений различные этапы синтеза выполняют в альтернативной последовательности или порядке. Химические превращения во время синтеза и методологии защитных групп (защита и снятие защиты), подходящие для синтеза соединений, описанных в данном документе, известны в данной области техники и включают, например, описанные в R. Larock, Comprehensive Organic Transformations. 2nd Ed. Wiley-VCH (1999); T.W. Greene and P.G.M. Wuts, Protective Groups in Organic Synthesis. 3rd Ed., John Wiley and Sons (1999); L. Fieser and M. Fieser, Fieser and Fieser's Reagents for Organic Synthesis. John Wiley and Sons (1994); and L. Paquette, ed., Encyclopedia of Reagents for Organic Synthesis. John Wiley and Sons (1995) и в следующих их изданиях.
Применяемый в данном документе термин «субъект» относится к животному. Предпочтительно, животное представляет собой млекопитающее. Предпочтительнее, млекопитающее представляет собой человека. Субъект также относится, например, к собакам, котам, коням, коровам, свиньям, морским свинкам, рыбе, птицам и тому подобное.
Соединения по данному изобретению модифицируют с помощью присоединения подходящих функциональных групп для улучшения селективных биологических свойств. Такие модификации известны в данной области техники и включают, те, которые увеличивают биологическую проницаемость в данной биологической системе (например, крови, лимфатической системе, центральной нервной системе), увеличивают доступность при пероральном применении, увеличивают растворимость, чтобы способствовать введению с помощью инъекции, изменяют метаболизм, изменяют скорость выведения.
Соединения, описанные в данном документе, содержат один или более ассиметричных центров и, следовательно, образуют энантиомеры, диастереомеры и другие стереоизомерные формы, которые для аминокислот определены в терминах абсолютной стереохимии как (R)- или (S)-, или как (D)- или (L)-. Подразумевается, что данное изобретение включает все такие возможные изомеры, а также их рацемические и оптически чистые формы. Оптические изомеры получают из их соответствующих оптически активных исходных соединений с помощью методик, описанных выше, или путем разделения рацемических смесей. Разделение проводят в присутствии разделяющего агента с помощью хроматографии или повторной кристаллизации, или с помощью какой-либо комбинации данных методик, которые известны специалистам в данной области техники. Дополнительные детали, касающиеся разделения, можно найти в Jacques, et al, Enantiomers. Racemates. and Resolutions (John Wiley & Sons, 1981). Если соединения, описанные в данном документе, содержат олефиновую двойную связь, другие единицы ненасыщенности или другие центры геометрической ассиметрии, и если не указано иное, подразумевается, что соединения включают и E, и Z-геометрические изомеры или и цис-, и транс-изомеры. Аналогично, также предполагается, что включены все таутомерные формы. Таутомеры являются циклическими или ациклическими. Геометрия любой углерод-углеродной двойной связи, появляющаяся в данном документе, выбрана только для удобства и не предназначена для обозначения конкретной геометрии, если текст этого не указывает; следовательно, углерод-углеродная двойная связь или углерод-гетероатомная двойная связь, произвольно изображенная в данном документе как транс-, представляет собой цис-. транс- или смесь обоих в любой пропорции.
Определенные соединения по данному изобретению также существуют в разных стабильных конформационных формах, которые можно разделить. Поворотная изомерия в связи с ограниченным вращением вокруг ассиметричной одинарной связи, например, из-за пространственного затруднения или напряжения в кольце, способствует разделению разных конформеров. Данное изобретение включает каждый конформационный изомер этих соединений или их смесей.
Применяемый в данном документе термин «фармацевтически приемлемая соль» относится к тем солям, которые в пределах объема тщательной медицинской оценки подходят для применения в контакте с тканями человека и низших животных, что не сопровождается неспецифической токсичностью, раздражением, аллергической реакцией и тому подобное, и соответствуют рациональному соотношению преимуществ и рисков. Фармацевтически приемлемые соли хорошо известны в данной области техники. Например, S. M. Berge, et al. подробно описал фармацевтически приемлемые соли в J. Pharmaceutical Sciences, 66: 1-19 (1977). Соли получают in situ во время конечного выделения и очистки соединений по изобретению, или отдельно с помощью реакции между функциональной группой свободного основания и подходящей органической кислотой. Примеры фармацевтически приемлемых солей включают, но не ограничиваются ими, нетоксичные кислотно-аддитивные соли, которые представляют собой соли, состоящие из амино-группы на неорганической кислоте, а именно хлористоводородной кислоте, бромистоводородной кислоте, фосфорной кислоте, серной кислоте и перхлорной кислоте, или на органической кислоте, а именно уксусной кислоте, малеиновой кислоте, винной кислоте, лимонной кислоте, янтарной кислоте или малоновой кислоте, или полученные с помощью других способов, известных в данной области техники, а именно ионного обмена. Другие фармацевтически приемлемые соли включают, но не ограничиваются ими, адипат, альгинат, аскорбат, аспартат, бензолсульфонат, бензоат, бисульфат, борат, бутират, камфорат, камфорсульфонат, цитрат, циклопентанпропионат, диглуконат, додецилсульфат, этансульфонат, формиат, фумарат, глюкогептонат, глицерофосфат, глюконат, гемисульфат, гептаноат, гексаноат, гидройодид, 2-гидроксиэтансульфонат, лактобионат, лактат, лаурат, лаурилсульфат, малат, малеат, малонат, метансульфонат, 2-нафталинсульфонат, никотинат, нитрат, олеат, оксалат, пальмитат, памоат, пектинат, персульфат, 3-фенилпропионат, фосфат, пикрат, пивалат, пропионат, стеарат, сукцинат, сульфат, тартрат, тиоцианат, п-толуолсульфонат, ундеканоат, валерат и тому подобное. Типичные соли щелочных и щелочно-земельных металлов включают натрий, литий, калий, кальций, магний и тому подобное. Дополнительные фармацевтически приемлемые соли включают, по мере целесообразности, нетоксичные катионы аммония, четвертичного аммония и амина, связанные с противоионами, а именно галогенидом, гидроксидом, карбоксилатом, сульфатом, фосфатом, нитратом, алкилом, имеющим от 1 до 6 атомов углерода, сульфонатом и арилсульфонатом.
Применяемый в данном документе термин «фармацевтически примемлемый сложный эфир» относится к эфирам, которые гидролизуют in vivo, и включают те, которые легко распадаются в человеческом организме, оставляя исходное соединение или его соль. Подходящие эфирные группы включают, например, полученные из фармацевтически приемлемых алифатических карбоновых кислот, в частности, алкановых, алкеновых, циклоалкановых и двухосновных алкеновых кислот, в которых каждый алкильный или алкенильный фрагмент молекулы содержит преимущественно не более чем 6 атомов углерода. Примеры определенных сложных эфиров включают, но не ограничиваются ими, формиаты, ацетаты, пропионаты, бутираты, акрилаты и этилсукцинаты.
Подходящие концентрации реагентов, применяемые в способах синтеза по изобретению, составляют от 0,01 М до 10 М, как правило, от 0,1 М до 1 М. Подходящие температуры включают от -10 °C до 250 °C, предпочтительно, от -78 °C до 150 °C, предпочтительнее, от -78 °C до 100 °C, еще предпочтительнее, от 0 °C до 100 °C. Реакционный сосуд изготовляют предпочтительно из любого материала, который по существу не мешает прохождению реакции. Примеры включают стекло, пластик и металл. Давление реакции предпочтительно представляет собой атмосферное давление. Атмосфера включают, например, воздух (для реакций нечувствительных к кислороду и воде), или азот или аргон (для реакций чувствительных к кислороду и воде).
Термин «in situ», применяемый в данном документе, относится к применению промежуточного соединения в растворителе или растворителях, в которых промежуточное соединение получают без удаления растворителя.
СОКРАЩЕНИЯ
Сокращения, которые применяются в описании к следующим схемам и примерам:
Ас для ацетила;
AcOH для уксусной кислоты;
Bос2O для ди-трет-бутилдикарбоната;
Boc для трет-бутоксикарбонила;
Bz для бензоила;
Bn для бензила;
Рассол для раствора хлорида натрия в воде;
t-BuOH для трет-бутанола;
t-BuOK для трет-бутоксида калия;
Bu4NBr для бромида тетрабутиламмония;
Cbz для карбобензилокси;
CDI для 1,1-карбонилдиимидазола;
CH2CI2 для дихлорметана;
CH3 для метила;
CHsCN для ацетонитрила;
CS2CO3 для карбоната цезия;
DIBAL-H для гидрида диизобутилалюминия;
ДИПЭА или (i-Pr)2EtN для N,N-диизопропилэтиламина;
ДМАП для 4-диметиламинопиридина;
ДМЭ для 1,2-диметоксиэтана;
ДМФ для N,N-диметилформамида;
ДМСО для диметилсульфоксида;
EDC для N-(3-диметиламинопропил)-N'-этилкарбодиимида;
EDC-HCl для N-(3-диметиламинопропил)-N'-этилкарбодиимида;
EtOAc для этилацетата;
EtOH для этанола;
Et2О для диэтилового эфира;
HATU для гексафторфосфата О-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония;
HC1 для хлороводорода;
K2CO3 для карбоната калия;
MeOH для метанола;
МТБЭ для метил-трет-бутилового эфира;
NaCl для хлорида натрия;
NaH для гидрида натрия;
NaHCО3 для бикарбоната натрия или гидрокарбоната натрия;
Na2CО3 для карбоната натрия;
NaOH для гидроксида натрия;
NaOMe для метоксида натрия;
Na2SО4 для сульфата натрия;
Na2S2О3 для тиосульфата натрия;
NH4HCO3 для бикарбоната аммония;
NH4CI для хлорида аммония;
НМП для N-метил-2-пирролидона;
в/н для в течение ночи;
OH для гидроксила;
Pd для палладия;
ПДХ для дихромата пиридина;
z-PrOAc для изопропилацетата;
Ph для фенила;
ПМБ для п-метоксибензила;
кт для комнатной температуры;
ТБС для трет-бутилдиметилсилила;
ТЭА или Et3N для триэтиламина;
ТГФ для тетрагидрофурана;
ТФФ или PPh3 для трифенилфосфина;
Тs для тозила или -SO2-C6H4CH3;
TsOH для п-толилсульфоновой кислоты;
ТМС для трииметилсилила;
TMСC1 для триметилсилилхлорида.
Все другие сокращения, применяемые в данном документе, которые конкретно не определены выше, соответствуют значению, приписываемому им рядовым специалистом в данной области техники.
ПРИМЕРЫ
Соединения и способы по данному изобретению станут лучше понятны в связи со следующими примерами, которые предназначены только для иллюстрации и не ограничивают объем изобретения. Различные изменения и модификации раскрытых вариантов реализации изобретения станут очевидны специалистам в данной области техники, и такие изменения и модификации, включая, без ограничений, относящиеся к химическому строению, заместителям, производным, составам и/или способам по изобретению, могут быть сделаны без отклонения от сущности изобретения и объема прилагаемой формулы изобретения.
Пример 1. Получение 3-морфолино-5-(трифторметил)пиколиногидразида
Этап 1. Синтез 3-хлор-5-(трифторметил)пиколиногидразида

В 50-литровую 4-горлую круглодонную колбу, очищенную и наполненную инертной атмосферой азота, вводят раствор этил-3-хлор-5-(трифторметил)пиридин-2-карбоксилата (4,0 кг, 15,81 моль, 1,00 экв.) в этаноле (12 л) и обрабатывают моногидратом гидразина (1,98 кг, 2,00 экв.). Полученный раствор перемешивают в течение 2 ч при 20 °C на водяной бане. Полученный раствор гасят до 24 л водой, охлажденной до температуры замерзания, и перемешивают в течение 30 мин. Твердые вещества отфильтровывают. Полученный раствор экстрагируют 7x8,5 л МТБЭ (7 X 8,8 л), органические слои объединяют, сушат над сульфатом натрия, фильтруют и концентрируют в вакууме для получения указанного в заголовке соединения (3,65 кг) в виде твердого вещества желтого цвета. ЖХ-МС (ионизация электрораспылением, m/z): 240,0 [M+H]+.
Этап 2. Синтез 3-морфолино-5-(трифторметил)пиколиногидразида
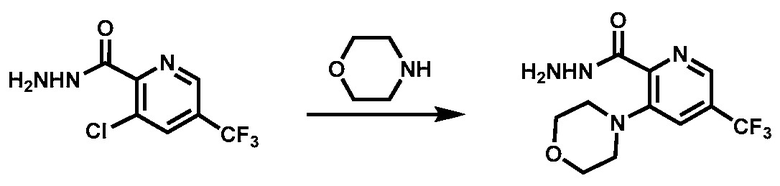
В 50-литровую 4-горлую круглодонную колбу, очищенную и наполненную инертной атмосферой азота, вводят раствор 3-хлор-5-(трифторметил)пиридин-2-карбогидразида (3,5 кг, 14,61 моль, 1,00 экв.) в толуоле (17,5 л), и морфолин (6,38 кг, 73,22 моль, 5,00 экв.). Полученный раствор перемешивают в течение 18 ч при 96 °C на масляной бане. Реакционную смесь охлаждают до 25 °C на водяной бане. Твердые вещества собирают фильтрованием. Полученную смесь концентрируют в вакууме. Объединенные твердые вещества промывают тетрагидрофураном (9 X 4,5 л). Твердые вещества отфильтровывают. Фильтрат концентрируют в вакууме. Остаток переводят в суспензию в МТБЭ (10 л) и перемешивают в течение 2 ч. Твердые вещества собирают фильтрованием. Реакцию повторяют с другим количеством исходного материала (3 кг) при тех же условиях и применяя ту же методику. Неочищенный продукт двух партий объединяют, промывают МТБЭ (4 л) и сушат в вакууме для получения указанного в заголовке соединения (6,1 кг) в виде твердого вещества светло-желтого цвета. ЖХ-МС (ионизация электрораспылением, m/z): 291,0 [MS+H+]. 1Н-ЯМР (300 МГц, ДМСО-d6): δ 9,63 (s, 1H), 8,49 (s, 1H), 7,71 (s, 1H), 4,54 (m, 2H), 3,77-3,68 (m, 4H), 3,18-3,06 (m, 4H).
Пример 2. Получение (S)-3-((5-(3-морфолинo-5-(трифторметил)пиридин-2-ил)-1,3,4-оксадиазол-2-ил)аминo-5-фенил-1,3-дигидро-2H-бензо[e][1,4]-диазепин-2-он (Соединение (I-a))
Этап 1: Хиральное разделение с помощью СФХ 3-амино-5-фенил-1,3-дигидро-2H-бензо[e][1,4]-диазепин-2-она
3-амино-5-фенил-1,3-дигидро-2H-бензо[e][1,4]-диазепин-2-он разделяют с помощью СФХ [Прибор: Waters 200 препаративная СФХ], колонна: Chiral Pak AD, 250 х 50 мм I.D., 10 мкм. Подвижная фаза: А для СО2 и В для 2-пропанола (0,1 % ΝΗ3Η2Ο), градиент: В 45 %, скорость потока: 180 мл/мин]. Первую часть ((R)-3-амино-5-фенил-1,3-дигидро-2H-бензо[e][1,4]-диазепин-2-он, 5,0 кг, выход 38,5 %) собирают в виде твердого вещества светло-желтого цвета. Вторую часть ((S)-3-амино-5-фенил-1,3-дигидро-2H-бензо[e][1,4]-диазепин-2-он) концентрируют при пониженном давлении и сушат в высоком вакууме для получения указанного в заголовке соединения (5,13 кг, выход 39,5 %) в виде твердого вещества светло-желтого цвета. 1Н-ЯМР: (ДСМО-d6 400 МГц): δ 10,68 (br, 1H), 7,60-7,56 (m, 1H), 7,48-7,40 (m, 5H), 7,27-7,24 (m, 2H), 7,21-7,17 (m, 1H), 4,24 (s, 1H). Чистота по ВЭЖХ: 100 %; хиральная чистота: 99,94 % ee.
ЖХ-МС (ионизация электрораспылением, m/z): 252,0 [M+H]+.
Этап 2: Рацемизация (R)-3-амино-5-фенил-1,3-дигидро-2H-бензо[e][1,4]-диазепин-2-она до 3-амино-5-фенил-1,3-дигидро-2H-бензо[e][1,4]-диазепин-2-она
Первая часть (R)-3-амино-5-фенил-1,3-дигидро-2H-бензо[e][1,4]-диазепин-2-она была рацемизирована и применялась для разделения с помощью СФХ следующим образом: (R)-3-амино-5-фенил-1,3-дигидро-2H-бензо[e][1,4]-диазепин-2-он (1,0 кг) в MeOH (10 л) обрабатывают NaOMe (171 г) и нагревают до 60 °C в течение 16 ч. После охлаждения до 25 °C реакционную смесь гасят путем добавления при 25 °C воды, охлажденной до температуры замерзания (10 л), и концентрируют при давлении для удаления большей части MeOH, получая при этом осадок. Остаток растирают с дополнительными 5 л воды, фильтруют и сушат в вакууме для получения рацемического 3-амино-5-фенил-1,3-дигидро-2H-бензо[e][1,4]-диазепин-2-она (0,9 кг) в виде твердого вещества бледно-желтого цвета. 1Н-ЯМР: (ДСМО-d6 400 МГц): δ 10,66 (br, 1H), 7,58-7,54 (m, 1H), 7,46-7,38 (m, 5H), 7,25-7,22 (m, 2H), 7,19-7,15 (m, 1H), 4,22 (s, 1H). Чистота по ВЭЖХ: 99,7 %; ЖХ-МС (ионизация электрораспылением, m/z): 252,2 [M+Н]+.
Рацемический амин, полученный выше, повторно разделяют с помощью препаративной СФХ.
Этап 3. Получение (S)-N-(2-оксо-5-фенил-2,3-гидидро-1Н-бензо[e][1,4]-диазепин-3-ил)-1Н-имидазол-1-карбоксамида
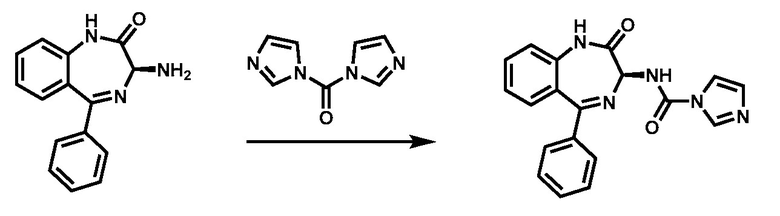
1,1'-карбонилдиимидазол (1,65 кг, 3,0 экв.) вводят в реактор, заполненный MeCN (12,7 л) при 20±5 °C, перемешивают в течение 15 мин и охлаждают до 0±3 °C. (S)-3-амино-5-фенил-1,3-дигидро-2H-бензо[e][1,4]-диазепин-2-он (0,85 кг, 1,0 экв.) добавляют партиями. поддерживая его при температуре ниже 5 °C. Реакционную смесь перемешивают при 2±3 °C в течение 2 ч, нагревают до 20±5 °C и перемешивают в течение 6 ч. Затем, реакционную смесь охлаждают до 0±3 °C, при температуре ниже 8 °C обрабатывают очищенной водой (365,5 г, 6,0 экв.) в растворе MeCN (4,25 л) и нагревают до 20 °C. Твердое вещество дважды фильтруют и промывают (1,7 л, 2 об.). Собранное твердое вещество сушат в вакуумном сушильном шкафу при < 25 °C для получения указанного в заголовке соединения (1,16 кг, чистота 98,6 % по ВЭЖХ) в виде твердого вещества белого цвета. ЖХ-МС (ионизация электрораспылением, m/z): 278,10, 346,13 [M+H]+.
Этап 4. (S)-2-(3-морфолино-5-(трифторметил)пиколиноил-N-2-оксо-5-фенил-2,3-дигидро-1H-бензо[e] [1.4]диазепин-3-ил)гидразин-1-карбоксамид
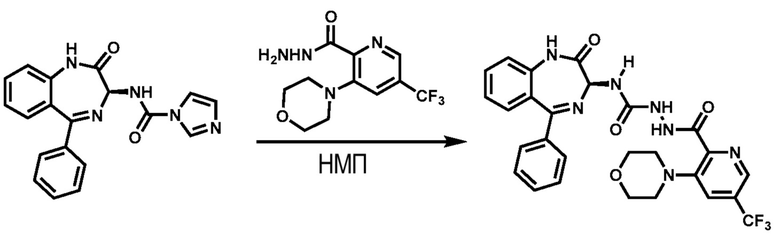
3-морфолино-5-(трифторметил)пиколиногидразид (0,84 кг, 1,0 экв.) при 25±5 °C вводят в 5-литровую колбу, наполненную НМП (2 л), и перемешивают в течение 10 мин.
(S)-N-(2-оксо-5-фенил-2,3-дигидро-1H-бензо[e][l,4]-диазепин-3-ил)-1H-имидазол-1-карбоксамид (1,0 кг, 1,0 экв.) при 25±5 °C партиями вводят в реакционную смесь и нагревают до 45 °C в течение 10 ч. Реакционную смесь охлаждают до 15 °C, выливают в воду, охлажденную до температуры замерзания (15 л, 3 °C), которая находится в 20-литровой колбе, перемешивают в течение 30 мин, фильтруют и промывают очищенной водой (2 X 3 л). Собранный отжатый осадок перемешивают с очищенной водой (10 л) при 25±5 °C в течение 1 ч, фильтруют и промывают очищенной водой (2 X 3 л). Собранный отжатый осадок сушат в вакуумном сушильном шкафу при 27 °C в течение 40 ч для получения неочищенного продукта (1,640 кг). Неочищенный продукт (1,64 кг) растворяют в ДХМ (10 л), перемешивают в течение 30 мин, засыпают активированным углем (0,15 кг) и перемешивают в течение 30 мин, фильтруют сквозь диатомит (1 мас./мас.) и промывают ДХМ (2 X 2,5 л). Фильтрат вместе с н-гептаном (30 л) загружают в 50-литровую круглодонную колбу при 25±5 °C и перемешивают в течение 1 ч. Твердое вещество фильтруют, отжатый осадок промывают н-гептаном (2 X 2 л), сушат в вакуумном сушильном шкафу при 27 °C в течение 30 ч для получения указанного в заголовке соединения (1,43 кг, чистота 95,3 % по ВЭЖХ) в виде твердого вещества светло-желтого цвета. ЖХ-МС (ионизация электрораспылением, m/z): 568,19 [M+H]+.
Этап 5: (S)-3-((5-(3-морфолино-5-(трифторметил)пиридин-2-ил)-1,3,4-оксадиазол-2-ил)амино-5-фенил-1,3-дигидро-2Н-бензо[e] [1.4]-диазепин-2-он
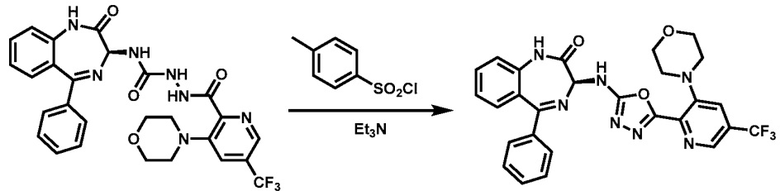
В смесь (S)-2-(3-морфолино-5-(трифторметил)пиколиноил)-N-2-оксо-5-фенил-2,3-дигидро-1H-бензо[e] [l,4]диазепин-3-ил)гидразин-1-карбоксамида (1,4 кг, 1 экв.) в ДХМ (11,2 л), которая находится в колбе, загружают 4A-MS (1,4 кг) и перемешивают при 20±5 °C в 2 ч. Затем, ее охлаждают до 0°C, загружают триэтиламин (0,62 кг, 2,5 экв.) и перемешивают в течение 10 мин. По каплям добавляют раствор п-толуолсульфонилхлорида (0,7 кг, 1,5 экв.) в ДХМ (1,4 л) в реакционную смесь, которую поддерживают при температуре ниже 5 °C, и перемешивают при 0±5 °C в течение 5 ч. Реакционную смесь фильтруют и промывают ДХМ (2 X 4,2 л). Фильтрат обрабатывают водой (4,2 л) при 0 °C и перемешивают при температуре от 0 до 10 °C в течение 5 мин. После разделения органическую фазу последовательно промывают 5%-ным водным раствором NaHCО3 (7 л), водой (7 л) и рассолом (7 л) и отделяют. Слой ДХМ концентрируют в вакууме при температуре ниже 30 °C, чтобы осталось ~7 л органического слоя. В органический слой добавляют МТБЭ (7 л) и концентрируют в вакууме, чтобы осталось ~7 л органического слоя (Этот этап повторяют один раз). В органический слой заливают воду (7 л) и перемешивают при 20±5 °C в течение 4 ч. Твердое вещество фильтруют и промывают ДХМ (3 X 2,1 л) и очищенной водой (2,8 л). Влажный отжатый осадок перемешивают с этилацетатом (7 л) в течение 12 ч, заливают н-гептаном (14 л) и перемешивают при 20±5 °C в течение 5 ч. Твердое вещество фильтруют, промывают н-гептаном (2 X 2,8 л) и сушат в вакуумном сушильном шкафу при температуре окружающей среды для получения указанного в заголовке соединения (0,776 кг, чистота 99,6 % по ВЭЖХ, хиральная чистота 97,8 % по хиральной ВЭЖХ) в виде твердого вещества желтоватого цвета. ЖХ-МС (ионизация электрораспылением, m/z): 550,17 [M+H]+;
1Н-ЯМР: (ДМСО-d6 400 МГц): δ 10,98 (br-s, 1H), 9,40 (d, J=8,0 Гц, 1H), 8,69 (br-d, J=4,0 Гц, 1H), 7,89 (d, J=4,0 Гц, 1H), 7,68 (dt, J=8,0 и 4,0 Гц, 1H), 7,56-7,51 (m, 3H), 7,49-7,45 (m, 2H), 7,38-7,35 (m, 2H), 7,29 (br-t, J=8,0 Гц, 1H), 5,22 (d, J=8,0 Гц, 1H), 3,75-3,72 (m, 4H), 3,09-3,07 (m, 4H); 13C (ДМСО-d6 100 МГц): δ 167,3, 167,0, 162,8, 156,4, 147,2, 139,2, 138,7, 138,4, 138,3, 138,0, 132,30, 130,7, 130,5, 129,5, 128,4, 126,2, 124,5, 123,4, 121,5, 71,8, 65,9, 51,0.
Пример 3. Получение аморфной формы (S)-3-((5-(3-морфолино-5- (трифторметил)пиридин-2-ил)-1,3,4-оксадиазол-2-ил)аминo-5-фенил-1,3-дигидро-2H-бензо[e] [1,4]-диазепин-2-она
(S)-3-((5-(3-морфолино-5- (трифторметил)пиридин-2-ил)-1,3,4-оксадиазол-2-ил)аминo-5-фенил-1,3-дигидро-2H-бензо[e][1,4]-диазепин-2-он (60,0 кг) растворяют в уксусной кислоте (170 мл), перемешивают в течение 10 мин, фильтруют сквозь керамическую воронку в 3-литровую колбу и лиофилизируют. Его дополнительно сушат с помощью вакуумного насоса при комнатной температуре в течение 3 дней. Его перемалывают в ступке и сушат в вакууме с потоком N2 в течение 3 дней для получения аморфной формы (S)-3-((5-(3-морфолино-5-(трифторметил)пиридин-2-ил)-1,3,4-оксадиазол-2-ил)аминo-5-фенил-1,3-дигидро-2H-бензо[e] [1,4]-диазепин-2-она в виде твердого вещества желтоватого цвета.
Пример 4. Получение комплекса аморфного соединения (I-a) (S)-3-((5-(3-морфолино-5- (трифторметил)пиридин-2-ил)-1,3,4-оксадиазол-2-ил)аминo-5-фенил-1,3-дигидро-2H-бензо[e] [1,4]-диазепин-2-она с коповидоном.
Смесь (S)-3-((5-(3-морфолино-5-(трифторметил)пиридин-2-ил)-1,3,4-оксадиазол-2-ил)аминo-5-фенил-1,3-дигидро-2H-бензо[e][1,4]-диазепин-2-она (6,4 г) и коповидона (поли(1-винилпирролидон-совинилацетат) (1,6 г) растворяют в ацетоне (160 мл). Раствор концентрируют в вакууме и дополнительно сушат с помощью высоковакуумного насоса в течение 2 дней. Полученное твердое вещество перемалывают в ступке с пестиком и дополнительно сушат в вакуумном сушильном шкафу при 45 °C в течение ночи для получения аморфной формы комплекса (S)-3-((5-(3-морфолино-5-(трифторметил)пиридин-2-ил)-1,3,4-оксадиазол-2-ил)аминo-5-фенил-1,3-дигидро-2H-бензо[e][1,4]-диазепин-2-она/коповидона в виде твердого вещества желтоватого цвета.
Хотя это изобретение было конкретно показано и описано со ссылками на его предпочтительные варианты реализации, специалистам в данной области техники должно быть понятно, что в его форму и детали могут быть внесены различные изменения, которые не выходят за рамки объема изобретения, охватываемого прилагаемой формулой изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| АНАЛОГИ ЦИКЛОСПОРИНА ДЛЯ ПРЕДУПРЕЖДЕНИЯ ИЛИ ЛЕЧЕНИЯ ИНФЕКЦИИ ГЕПАТИТА С | 2010 |
|
RU2492181C2 |
| ПРОИЗВОДНЫЕ ЖЕЛЧНОЙ КИСЛОТЫ В КАЧЕСТВЕ АГОНИСТОВ FXR/TGR5 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2707280C2 |
| ХИНОКСАЛИНСОДЕРЖАЩИЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ ВИРУСА ГЕПАТИТА С | 2008 |
|
RU2493160C2 |
| СПОСОБ ПОЛУЧЕНИЯ СУЛЬФОНИЛКАРБАМАТНЫХ ПРОИЗВОДНЫХ ЖЕЛЧНЫХ КИСЛОТ | 2018 |
|
RU2791682C2 |
| ПРОИЗВОДНЫЕ ЖЕЛЧНЫХ КИСЛОТ В КАЧЕСТВЕ АГОНИСТОВ FXR/TGR5 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2712099C2 |
| СОЕДИНЕНИЕ, НАЦЕЛЕННОЕ НА БЕЛОК И ЕГО ДЕГРАДАЦИЮ, И СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2021 |
|
RU2829459C1 |
| ИНГИБИТОРЫ ВИРУСА ГЕПАТИТА С | 2010 |
|
RU2544010C2 |
| КОМБИНАЦИОННАЯ ТЕРАПИЯ С ПРИМЕНЕНИЕМ ДИАРИЛЬНЫХ МАКРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ | 2018 |
|
RU2784853C2 |
| ТЕТРАЗОЛ-СОДЕРЖАЩИЕ ИНГИБИТОРЫ РЕГУЛИРУЮЩЕЙ АПОПТОТИЧЕСКИЕ СИГНАЛЫ КИНАЗЫ 1 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2807545C2 |
| ХИНОКСАЛИНИЛМАКРОЦИКЛИЧЕСКИЕ ИНГИБИТОРЫ СЕРИНПРОТЕАЗЫ ВИРУСА ГЕПАТИТА С | 2007 |
|
RU2475494C2 |
Изобретение относится к способу получения соединения формулы (Ia), где указанный способ включает (а) реакцию соединения формулы (VII), где R7 выбирают из группы, состоящей из водорода, C1-C8-алкила, С2-С8-алкенила, С2-С8-алкинила, С3-С8-циклоалкила, С3-С8-циклоалкенила, 3-8-членного гетероциклического фрагмента, арила и гетероарила; и X представляет собой хлор-; с соединением формулы (VII-X), где PG представляет собой водород; с образованием соединения формулы (VIII-d); (b) реакцию соединения формулы (VIII) с морфолином с образованием соединения формулы (X-d); c) реакцию соединения формулы (IV) с 1,1'-карбонилдиимидазолом или нитрофенилхлорформиатом с получением соединения формулы (III), где R5 представляет собой 1-имидазолил или нитрофенил-О-; d) выделение и очистку соединения формулы (III); (e) реакцию соединения формулы (III) с соединением формулы (X-d), причем указанную реакцию проводят при температуре примерно от 10 до 50°С в течение от 6 до 48 часов и при концентрации соединения формулы (III) примерно от 1 М до 3 М и молярном соотношении соединения формулы (III) и соединение формулы (X-d) 1:1, с получением соединения формулы (V-a), и (f) реакцию соединения формулы (V-a) с реагентом для циклизации с образованием соединения формулы (I-а). Технический результат - способ получения биологически активных молекул, ингибиторов респираторно-синцитиального вируса (РСВ). 13 з.п. ф-лы, 4 пр.
 ,
,  ,
, 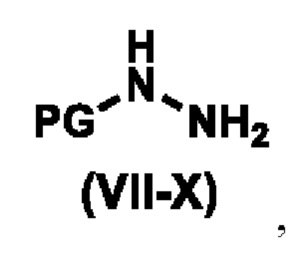
 ,
,  ,
,
 ,
, 
1. Способ получения соединения формулы (Ia),
где указанный способ включает следующие этапы:
(а) реакция соединения формулы (VII),
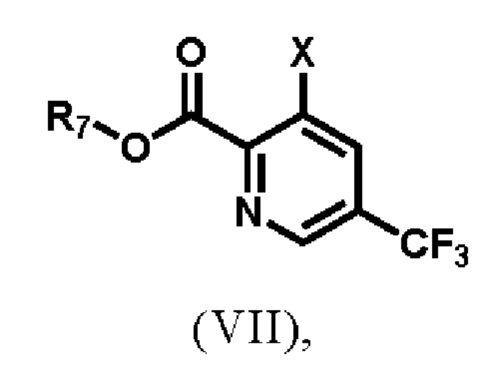
где R7 выбирают из группы, состоящей из водорода, C1-C8-алкила, С2-С8-алкенила, С2-С8-алкинила, С3-С8-циклоалкила, С3-С8-циклоалкенила, 3-8-членного гетероциклического фрагмента, арила и гетероарила; и X представляет собой хлор-;
с соединением формулы (VII-X),
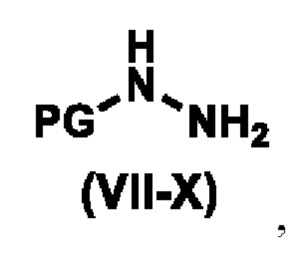
где, PG представляет собой водород;
с образованием соединения формулы (VIII-d):
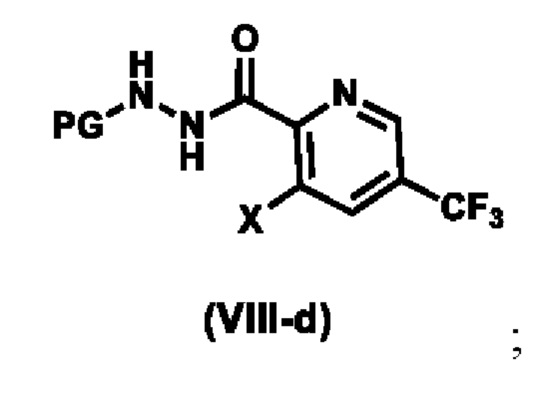
b) реакция соединения формулы (VIII) с морфолином с образованием соединения формулы (X-d):
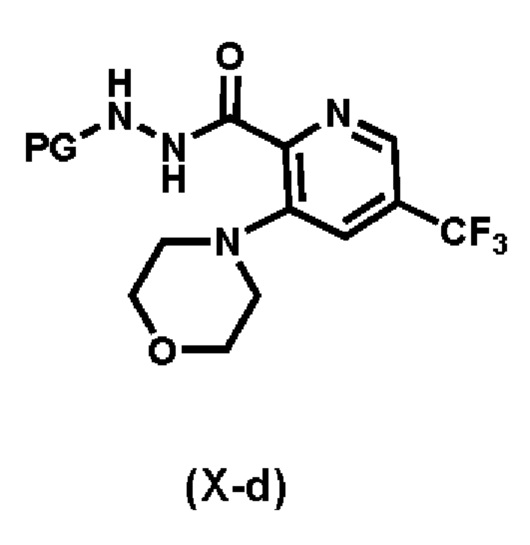
c) реакция соединения формулы (IV)
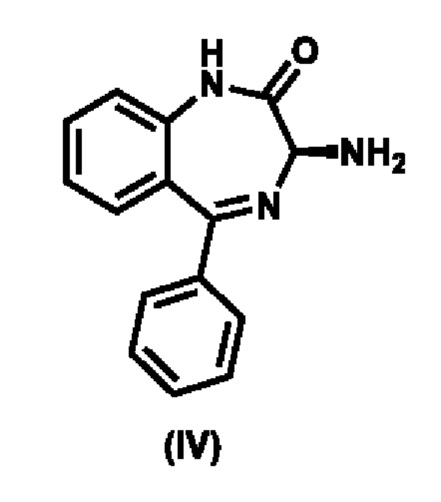
с 1,1'-карбонилдиимидазолом или нитрофенилхлорформиатом с получением соединения формулы (III)
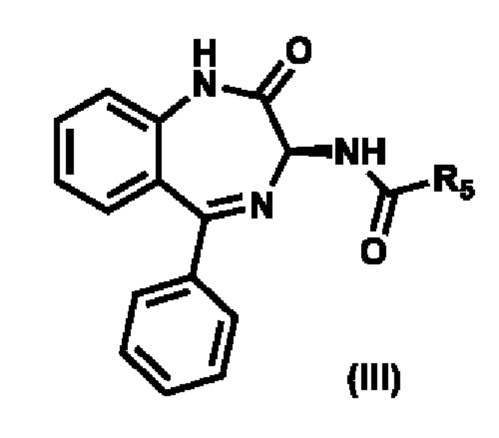
где R5 представляет собой 1-имидазолил или нитрофенил-О-;
d) выделение и очистка соединения формулы (III);
e) реакция соединения формулы (III) с соединением формулы (X-d), причем указанную реакцию проводят при температуре примерно от 10 до 50°С в течение от 6 до 48 часов и при концентрации соединения формулы (III) примерно от 1 М до 3 М и молярном соотношении соединения формулы (III) и соединение формулы (X-d) 1:1,
с получением соединения формулы (V-a),
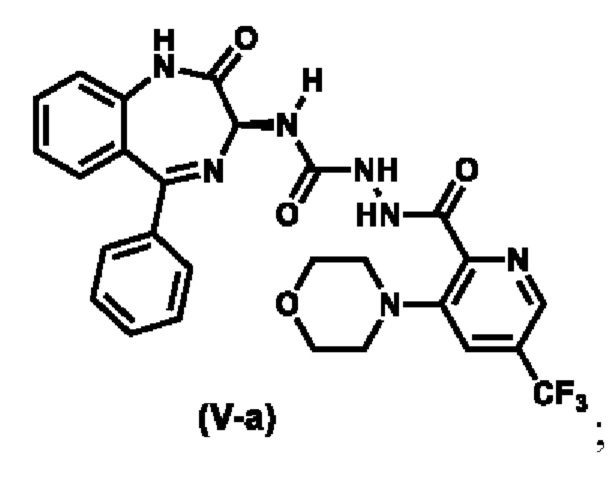 и
и
(f) реакция соединения формулы (V-a) с реагентом для циклизации с образованием соединения формулы (I-а).
2. Способ по п. 1, отличающийся тем, что этап (а) проводят в протонном растворителе при температуре от около 10°С до около 70°С.
3. Способ по любому из пп. 1, 2, отличающийся тем, что R7 представляет собой водород и этап (а) проводится в присутствии амидообразующего агента.
4. Способ по п. 3, где амидообразующий агент выбирают из группы, состоящей из 1,1'-карбонилдиимидазола, бис(2-оксо-3-оксазолидинил)фосфинхлорида, 1-гидрокси-7-азабензотриазола, 1-гидроксибензотриазолгидрата, 3-гидрокси-1,2,3-бензотриазин-4(3Н)-она, 1-(3-диметиламинопропил)-3-этилкарбодиинид гидрохлорида, 4-нитрофенола, пентафторфенола, 2-гидроксипиридина, N-гидроксисукцинимида, N-гидроксифталамида, 2-меркаптобензоксазола, триметилацетил хлорида, изобутилхлорформиата, хлордиметокситриазола, оксалилхлорида, 2-гидроксипиридин-N-оксида, 5-нитро-2-гидроксипиридина и Boc-L-валин ангидрида.
5. Способ по п. 1, отличающийся тем, что этап (а) проводят в растворителе, выбранном из группы, состоящей из изопропилацетата, этилацетата, дихлорметана, ацетона, тетрагидрофурана (ТГФ), 1-метил-2-пирролидона, 2-метилтетрагидрофурана и ацетонитрила.
6. Способ по любому из пп. 1-3, отличающийся тем, что R7 представляет собой C1-С8-алкил и этап (а) проводится в присутствии протонного растворителя.
7. Способ по п. 6, отличающийся тем, что протонный растворитель представляет собой метанол, этанол или изопропиловый спирт.
8. Способ по п. 6, отличающийся тем, что этап (а) проводят при температуре от около 10°С до около 70°С в течение от 3 часов до 12 часов.
9. Способ по любому из пп. 1-7, отличающийся тем, что этап (b) проводят (i) без растворителя или (ii) в апротонном растворителе при температуре от около 10°С до около 100°С.
10. Способ по любому из пп. 1-9, отличающийся тем, что этап (с) проводят в растворителе, выбранном из группы, состоящей из ацетонитрила, ТГФ, ДМСО и дихлорметана.
11. Способ по любому из пп. 1-10, отличающийся тем, что этап (с) проводят в ацетонитриле, ТГФ, диметилсудьфоксиде (ДМСО), N,N-диметилформамиде (ДМФ), сульфолане или 1-метил-2-пирролидоне.
12. Способ по п. 10, отличающийся тем, что на этап (е) концентрация соединения формулы (III) составляет 1,5 М.
13. Способ по любому из пп. 1-11, отличающийся тем, что агент циклизации на этапе (f) представляет собой пара-толуолсульфонилхлорид.
14. Способ по п. 12, отличающийся тем, что этап (f) проводят (i) в присутствии триэтиламина или диизопропилэтиламина; (ii) в растворителе, выбранном из группы, состоящей из ацетонитрила, ТГФ, ДМФ, ДМСО, НМП, ацетона, дихлорметана, этилацетата и изопропилацетата; (iii) при температуре от около 0°С до около 30°С и (iv) в течение от 3 часов до 15 часов.
| Автомобиль-сани, движущиеся на полозьях посредством устанавливающихся по высоте колес с шинами | 1924 |
|
SU2017A1 |
| US 20070185096 A1, 09.08.2007 | |||
| УПАКОВОЧНАЯ ТАРА-ЛЕДНИК | 1928 |
|
SU12387A1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ПРОИЗВОДНЫЕ БЕНЗОДИАЗЕПИНА И ИНГИБИТОР БЕЛКА СЛИЯНИЯ RSV | 2005 |
|
RU2388476C2 |
Авторы
Даты
2023-04-11—Публикация
2018-02-16—Подача