Настоящее изобретение относится к замещенным соединениям циклопентана и их фармацевтически приемлемым солям, которые ингибируют канонические каналы с транзиторным рецепторным потенциалом TRPC6 и TRPC3. Настоящее изобретение также относится к применению этих соединений и их фармацевтически приемлемых солей в медицине, например в лечении заболеваний, при которых ингибирование функции TRPC6 или TRPC3 имеет терапевтическое 3Начение. Настоящее изобретение также относится к способам лечения и способам изготовления лекарственных средств с использованием соединений согласно этому изобретению.
Каналы с транзиторным рецепторным потенциалом (TRP каналы) представляют собой группу ионных каналов, локализованных, главным образом, на плазматической мембране определенных клеток млекопитающих. TRP каналы обычно модулируют движущие силы входа ионов и механизм переноса Са2+ и Mg2+ в плазматической мембране. Семь канонических каналов с транзиторным рецепторным потенциалом (TRPC каналы) являются потенциал-зависимыми катионными каналами, которые активируются сопряженными с фосфолипазой С (PLC) рецепторами и могут быть подразделены на четыре подгруппы: группа 1 (TRPC1), группа 2 (TRPC2), группа 3 (TRPC3, TRPC6 и TRPC7) и группа 4 (TRPC4 и TRPC5). Из них TRPC группы 3, т.е. TRPC3, TRPC6 и TRPC7, взаимодействуют физически и сразу после коэкспрессии объединяются с образованием функциональных тетрамерных каналов. Гомология последовательностей между TRPC 3, 6 и 7 составляет около 75%.
TRPC6, член подсемейства канонических каналов с транзиторным рецепторным потенциалом (TRPC), является неселективным Са2+ каналом, экспрессируемым на подоцитах, которые играют важную роль в сохранении гломерулярной барьерной функции. Активация TRPC6 влечет за собой приток Са2+ и регулирует морфологию и подвижность подоцитов. Наблюдалось, что повышающая регуляция передачи сигнала TRPC6 вызывает повреждение подоцитов, приводящее к тяжелой протеинурии.
Фокально-сегментарный гломерулосклероз (FSGS) является самой распространенной причиной устойчивого к стероидам нефротического синдрома как у детей, так и у взрослых. Прогноз для пациентов с FSGS, не получавших лечения, плохой, причем у более чем 60% не получавших лечения пациентов имеет место прогрессирование до конечной стадии заболевания почек (ESRD), часто называемого также почечной недостаточностью, которая, в свою очередь, является последней стадией хронического заболевания почек. В типичных случаях время от постановки диагноза FSGS до ESRD составляет примерно 10 лет. Однако прогрессирование до ESRD может быть намного более быстрым, например за 6 месяцев. Литературные сведения подтверждают, что у порядка 20% пациентов с ESRD и3Начально имеется FSGS.
Мутации приобретения функции TRPC6 идентифицированы при FSGS семейного или спорадического типа с фенотипом протеинурии и устойчивостью к лечению стероидами, стандартному лечению FSGS. В свою очередь, развитие устойчивости к лечению стероидами в итоге может приводить к хроническому заболеванию почек (CKD). У 3Начительного количества пациентов с FSGS присутствует мутация канонического канала с транзиторным рецепторным потенциалом 6 (TRPC6), которая вызывает приобретение функции (Winn et al, Science. 2005, 308 (5729):1801-4). Поэтому присутствие мутаций приобретения функции TRPC6 при FSGS имеет прогностическое 3Начение. Соответственно, ингибирование TRPC6 потенциально предлагает новые возможности для терапевтического вмешательства для лечения FSGS, особенно для тех пациентов, у которых имеется мутация приобретения функции TRPC6.
Функция TRPC каналов также была связана с целым рядом других расстройств, причем повышающая регуляция TRPC3 наблюдалась при мышечной дистрофии и ассоциировалась с дегенерацией мышечного волокна (MilIay et al PNAS, 2009, 106(45): 19023-19028). Другие состояния, которые ассоциируются с TRPC3, включают гипертрофию сердца (Kiyonaka et al, PNAS 2009 106(13) 5400-5405). В дополнение к FSGS, TRPC6 ассоциируется с рядом состояний, таких как инфаркт миокарда (Varga-Szabo et al., J. Thromb. and Haemost. 2009, 7, 1057-1066), где потеря функции TRPC6 связана с замедлением прогрессирования сердечной дисфункции и сердечным ремоделированием после инфаркта миокарда в моделях в vivo (Gross et al, CircuIation Research 2016, 119: A296); легочная гипертензия (Yu et al, CircuIation 2009, 119, 2313-22); скелетно-мышечная дисфункция (MilIay et al, ibid); и пролиферация раковых клеток (Ding et al, J Natl Cancer Inst (2010) 102 (14): 1052-1068). Следовательно, ингибиторы TRPC6 и TRPC3 потенциально имеют широкое терапевтическое применение.
Насколько авторам изобретения известно, в настоящее время не существует ни ингибиторов TRPC6 или TRPC3, ни двойных ингибиторов TRPC6 и TRPC3, которые разрешены для клинического применения. Следовательно, существует потребность в новых ингибиторах TRPC6 и/или TRPC3 с фармакологическим и фармацевтическим профилем, подходящим для клинического применения. Задача настоящего изобретения заключается в предоставлении новых соединений, которые ингибируют TRPC6 и TRPC3 и которые пригодны для применения в качестве терапевтических агентов.
Теперь авторы изобретения неожиданно открыли, что производные циклопентана, описанные в данном документе, способны ингибировать TRPC6 и TRPC3 и, следовательно, могут быть поле3Ными для лечения состояний, при которых функция TRPC6 и TRPC3 имеет фармакологическую 3Начимость.
В одном аспекте предложено соединение формулы I

где:
X представляет собой а) О, и R1 представляет собой 6-членное ароматическое или гетероароматическое кольцо, выбранное из фенила, пиридила, пиримидила, пиразинила или пиридазила, где R1 возможно замещен одним или двумя заместителями Y, независимо выбранными из F, Cl, Br, CN, ОН, ОС1-3алкила, OCF3, C1-3алкила, C(O)NH2, CF3 или циклопропила; или б) NR2, и где N, R1 и R2 вместе образуют 5-членный ароматический гетероцикл, который возможно замещен одним или двумя заместителями Y, которые независимо выбраны из F, Cl, CN или Me;
R3 независимо выбран из F, Cl, CN, метила, метокси, гидрокси и этинила;
R4 независимо выбран из F или Cl, присоединенного к С2, С4 или С5 пиперидинового кольца; и
целые числа а и b независимо выбраны из 0, 1 или 2; или его фармацевтически приемлемая соль.
В еще одном аспекте предложена фармацевтическая композиция, содержащая терапевтически эффективное количество соединения формулы I или его фармацевтически приемлемой соли и по меньшей мере один фармацевтически приемлемый разбавитель, эксципиент или инертный носитель.
В еще одном аспекте предложено соединение формулы I или его фармацевтически приемлемая соль для применения в лечении или профилактике заболеваний и состояний, при которых TRPC6 и/или TRPC3 является поле3Ным. В воплощениях изобретения предложено соединение формулы I или его фармацевтически приемлемая соль для применения в лечении заболевания почек. В воплощениях заболевание почек представляет собой фокально-сегментарный гломерулосклероз (FSGS). В воплощениях заболевание почек представляет собой фокально-сегментарный гломерулосклероз (FSGS) с мутацией приобретения функции TRPC6.
В еще одном аспекте предложен способ лечения заболеваний или состояний, при которых ингибирование TRPC6 и/или TRPC3 является поле3Ным, включающий введение нуждающемуся в этом пациенту эффективного количества соединения формулы I или его фармацевтически приемлемой соли. В одном воплощении указанное заболевание или состояние представляет собой заболевание почек. В воплощениях заболевание почек представляет собой фокально-сегментарный гломерулосклероз (FSGS). В воплощениях заболевание почек представляет собой фокально-сегментарный гломерулосклероз (FSGS) с мутацией приобретения функции TRPC6.
В еще одном аспекте предложено соединение формулы I или его фармацевтически приемлемая соль для применения в изготовлении лекарственного средства для лечения заболеваний или состояний, при которых ингибирование TRPC6 и/или TRPC3 является поле3Ным. В одном воплощении указанное заболевание или состояние представляет собой заболевание почек. В другом воплощении заболевание почек представляет собой фокально-сегментарный гломерулосклероз (FSGS). В воплощениях заболевание почек представляет собой фокально-сегментарный гломерулосклероз (FSGS) с мутацией приобретения функции TRPC6.
В еще одном аспекте предложено соединение формулы I или его фармацевтически приемлемая соль для применения в медицине.
В еще одном аспекте предложен способ получения соединения формулы I и промежуточные соединения, используемые в его получении.
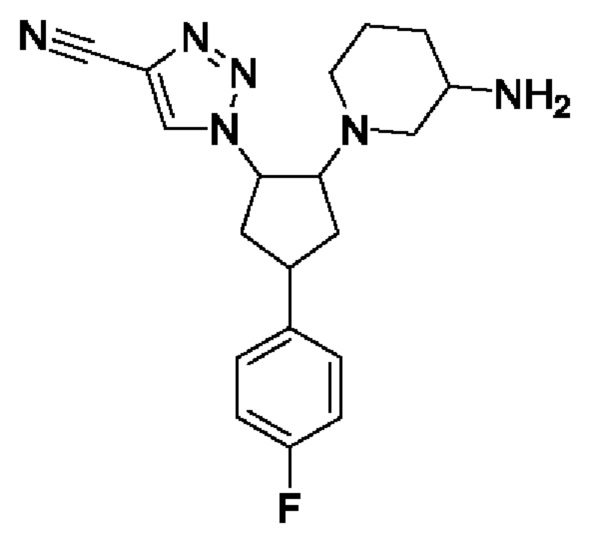
В еще одном аспекте соединение формулы I представляет собой (зи,5R)-5-фтор-1-((1R,2R,4S)-4-(4-фторфенил)-2-(1H-1,2,4-триазол-1-ил)циклопентил)пиперидин-3-амин. В воплощениях (зи,5R)-5-фтор-1-((1R,2R,4S)-4-(4-фторфенил)-2-(1H-1,2,4-триазол-1-ил)циклопентил)пиперидин-3-амин представлен в кристаллической форме, например монокристаллической полиморфной Форме А, которая дополнительно описана в данном документе.
Эти и другие аспекты настоящей заявки описаны более подробно ниже.
Соединения формулы I имеют несколько асимметрических атомов углерода; например, когда b=1, имеется два асимметрических атома углерода на пиперидиновом кольце по С3 и С5 и три на циклопентановом кольце по C1, С2 и С4. Настоящее описание охватывает все возможные энантиомеры и диастереоизомеры соединений формулы I.
Для целей этого описания изобретения термин "5-членный ароматический гетероцикл" о3Начает 5-членное ароматическое кольцо, содержащее 1-4 атома азота. Примеры подходящих 5-членных ароматических гетероциклов включают пирролил, имидазолил, пиразолил, триазолил и тетразолил.
Во избежание сомнений, когда в этом описании изобретения упоминаются положения С2-С5 на пиперидиновом кольце, имеются в виду положения на пиперидиновом кольце, которые отмечены ниже:
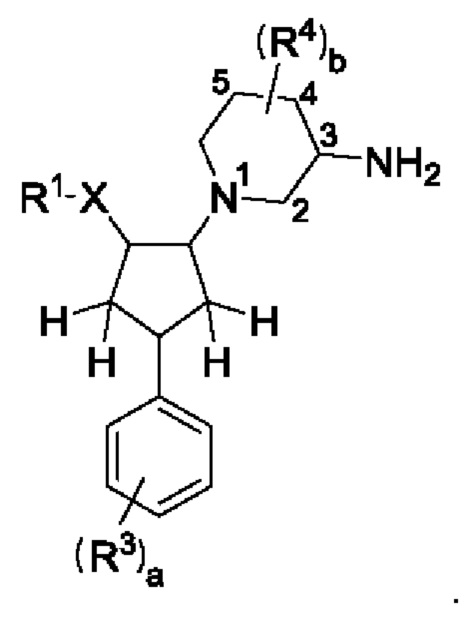
В воплощениях соединение формулы представляет собой соединение формулы Ia, где асимметрический атом углерода по С3 пиперидиновой группы находится в (R)-конфигурации.
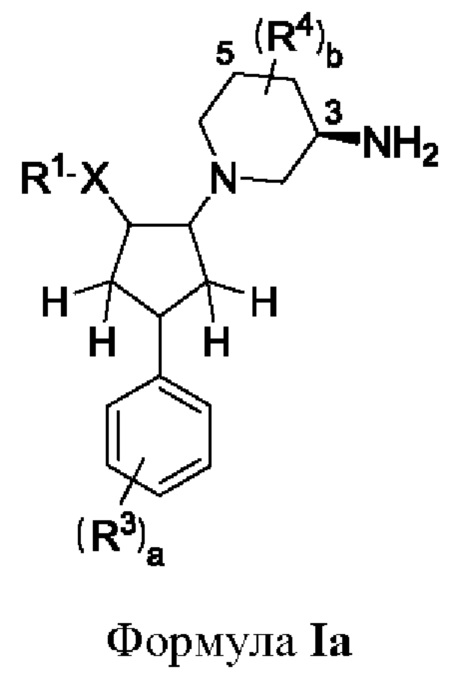
Например, соединение формулы Ia может представлять собой соединение формулы Iai, где асимметрические атомы углерода по С3 и С5 пиперидиновой группы находятся в (R)-конфигурации, т.е. соединение формулы Ia представляет собой (зи,5R)-5-фтор-1-[4-(4-фторфенил)-2-(1Н-1,2,4-триазол-1-ил)циклопентил]пиперидин-3-амин, который показан ниже.

Воплощения соединений формулы I и формулы Ia включают в себя соединения формулы Ib, где группа XR1 и пиперидиновая группа находятся в транс-положении по отношению друг к другу.
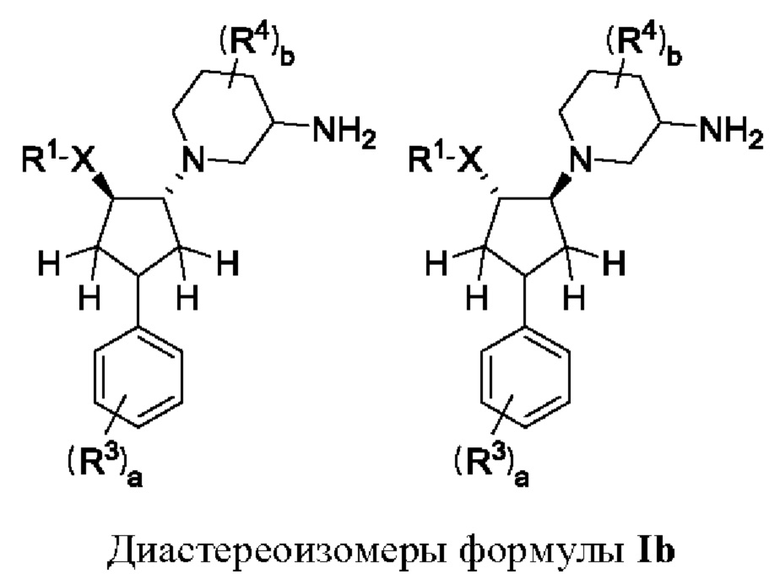
Таким образом, в случае, когда стереохимия групп на пиперидиновом кольце конкретно не указана, соединение может представлять собой соединение формулы Ibi, т.е. 5-фтор-1-[(1R,2R)-4-(4-фторфенил)-2-(1H-1,2,4-триазол-1-ил)циклопентил]-пиперидин-3-амин или 5-фтор-1-[(1S,2S)-4-(4-фторфенил)-2-(1Н-1,2,4-триазол-1-ил)циклопентил]пиперидин-3-амин, которые показаны ниже.
Воплощения соединений формулы I, Ia и Ib включают в себя соединения формулы Ic, где пиперидиновая группа и фенильная группа находятся в цис-положении по отношению друг к другу.

Таким образом, в случае, когда стереохимия групп на пиперидиновом кольце конкретно не указана, соединение формулы Ic может представлять собой соединение формулы Ici, т.е. 5-фтор-1-[(1R,4S)-4-(4-фторфенил)-2-(1Н-1,2,4-триазол-1-ил)циклопентил]пиперидин-3-амин или 5-фтор-1-[(1S,4R)-4-(4-фторфенил)-2-(1Н-1,2,4-триазол-1-ил)циклопентил]пиперидин-3-амин, которые показаны ниже.
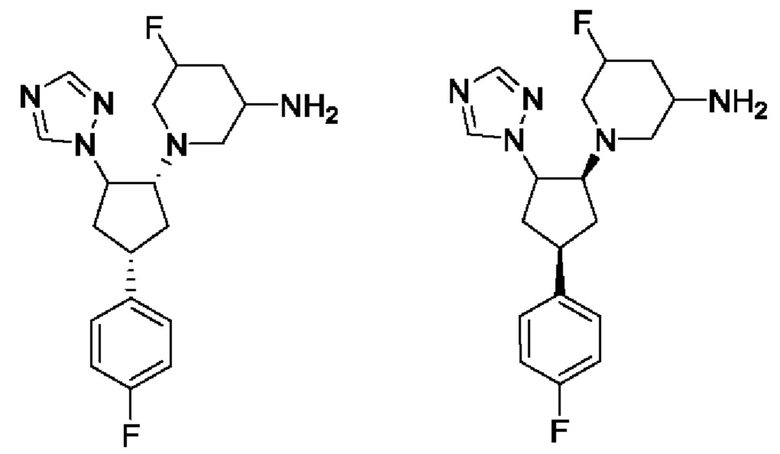
Диастереоизомеры формулы Ici
Воплощения соединений формулы I, Ia, Ib, и Ic включают в себя соединения формулы Id, где пиперидиновая группа и фенильная группа находятся в цис-положении по отношению друг к другу, а пиперидиновая группа и группа XR1 находятся в транс-положении по отношению друг к другу.
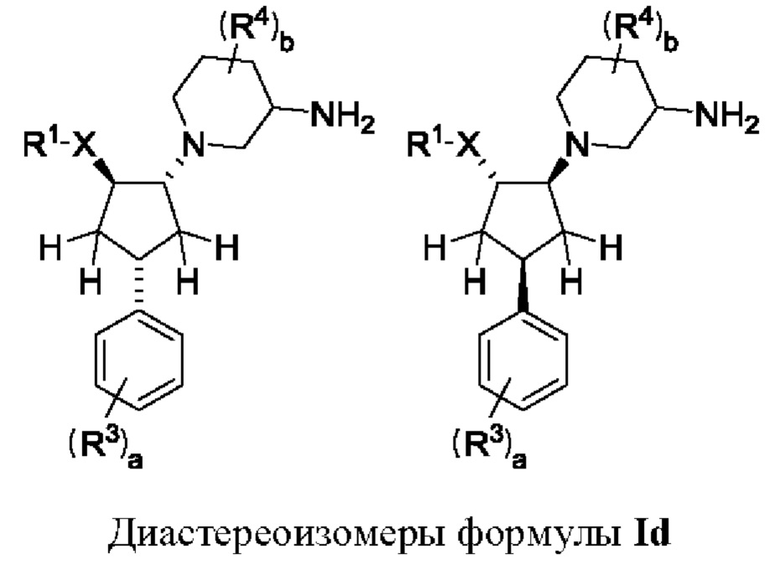
Таким образом, в случае, когда стереохимия групп на пиперидиновом кольце конкретно не указана, соединение формулы Id может представлять собой соединение формулы Idi, т.е. 5-фтор-1-[(1R,2R,4S)-4-(4-фторфенил)-2-(1Н-1,2,4-триазол-1-ил)циклопентил]пиперидин-3-амин или 5-фтор-1-[(1S,2S,4R)-4-(4-фторфенил)-2-(1Н-1,2,4-триазол-1-ил)циклопентил]пиперидин-3-амин.
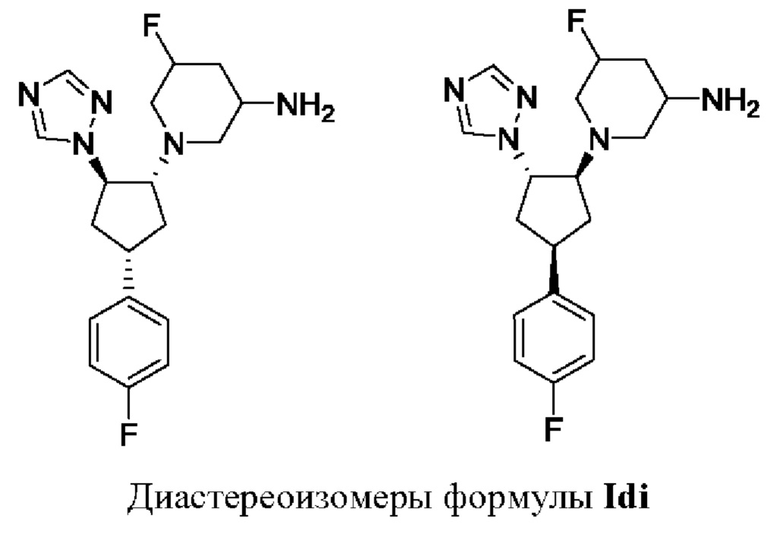
В воплощениях формулы Id, где пиперидиновая группа представляет собой 5-фтор-(зи,5R)-пиперидин-3-аминную группу, соединение формулы Id может представлять собой (зи,5R)-5-фтор-1-[(1R,2R,4S)-4-(4-фторфенил)-2-(1Н-1,2,4-триазол-1-ил)циклопентил]пиперидин-3-амин или (зи,5R)-5-фтор-1-[(1S,2S,4R)-4-(4-фторфенил)-2-(1Н-1,2,4-триазол-1-ил)циклопентил]пиперидин-3-амин, которые показаны ниже.
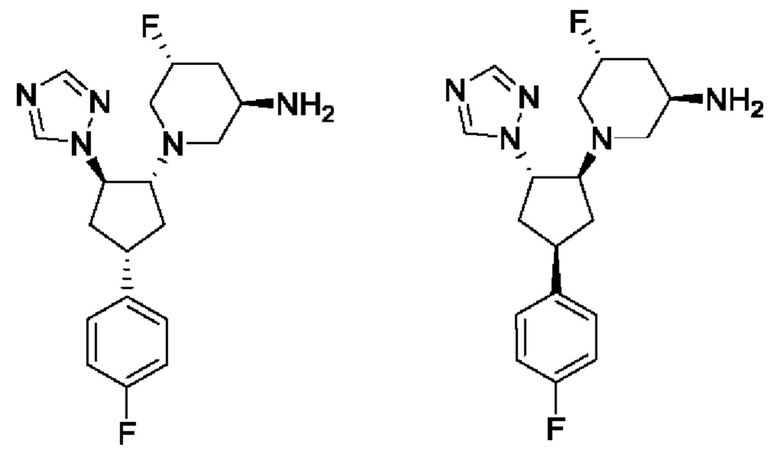
В одном воплощении соединение формулы I представляет собой (зи,5R)-5-фтор-1-[(1R,2R,4S)-4-(4-фторфенил)-2-(1Н-1,2,4-триазол-1-ил)циклопентил]пиперидин-3-амин

В воплощениях соединение формулы I, Ia, Ib, Ic или Id представляет собой соединение формулы Ie, где группа X представляет собой О, и R1 представляет собой 6-членное ароматическое или гетероароматическое кольцо, выбранное из фенила, пиридила, пиримидила, пиразинила или пиридазила, которое возможно замещено одним или двумя заместителями Y, независимо выбранными из F, Cl, Br, CN, ОН, ОС1-3алкила, OCF3, C1-3алкила, C(O)NH2, CF3 или циклопропила.
В воплощениях соединение формулы Ie представляет собой соединение формулы If, где по меньшей мере один заместитель на 6-членном ароматическом или гетероароматическом кольце R1 выбран из Me, Cl, F и CN.
В воплощениях соединение формулы I, Ia, Ib, Ic или Id представляет собой соединение формулы Ig, где группа XR1 представляет собой NR2, и где N, R1 и R2 вместе образуют 5-членный ароматический гетероцикл, который возможно замещен одним или двумя заместителями Y, независимо выбранными из F, Cl, CN или Me.
В воплощениях соединение формулы Ig представляет собой соединение формулы 1H, где по меньшей мере один заместитель на 5-членном ароматическом гетероцикле выбран из Me, Cl, F и CN.
В воплощениях соединение формулы Ig представляет собой соединение формулы Ii, где 5-членный ароматический гетероцикл является незамещенным.
В воплощениях соединение формулы I, Ia, Ib, Ic, Id, Ie, If, Ig, 1H или Ii представляет собой соединение формулы Ij, где по меньшей мере один заместитель R3 расположен в пара-положении по отношению к связи с циклопентановым кольцом.
В воплощениях соединение формулы Ij представляет собой соединение формулы Ik, где заместитель R3 представляет собой F, и а=1.
В воплощениях соединение формулы I, Ia, Ib, Ic, Id, Ie, If, Ig, 1H, Ii, Ij или Ik представляет собой соединение формулы Il, где по меньшей мере одна группа R4 представляет собой F.
В воплощениях соединение формулы Il представляет собой соединение формулы Im, где b=1.
В воплощениях соединение формулы I, Ia, Ib, Ic, Id, Ie, If, Ig, 1H, Ii, Ij, Ik, Il или Im представляет собой соединение формулы In, где R4 независимо выбран из F или Cl, присоединенного к С4 или С5 пиперидинового кольца.
В воплощениях соединение формулы I, Ia, Ib, Ic, Id, Ie, If, Ig, 1H, Ii, Ij, Ik, Il или Im представляет собой соединение формулы Io, где R4 представляет собой F, присоединенный к С4 или С5 пиперидинового кольца.
В воплощениях соединение формулы I, Ia, Ib, Ic или Id выбрано из
1-[4-(4-фторфенил)-2-(триазол-2-ил)циклопентил]пиперидин-3-амина;
1-[2-(3-амино-1-пиперидил)-4-(4-фторфенил)циклопентил]пиразол-4-карбонитрила;
1-[2-(3-амино-1-пиперидил)-4-(4-фторфенил)циклопентил]пиразол-3-карбонитрила;
1-[2-(3-амино-1-пиперидил)-4-(4-фторфенил)циклопентил]пиррол-3-карбонитрила;
1-[2-(3-амино-1-пиперидил)-4-(4-фторфенил)циклопентил]триазол-4-карбонитрила;
1-[2-(3-амино-5-фтор-1-пиперидил)-4-(4-фторфенил)циклопентил]пиразол-4-карбонитрила;
1-[2-(3-амино-4,4-дифтор-1-пиперидил)-4-(4-фторфенил)циклопентил]пиразол-4-карбонитрила;
1-[4-(4-фторфенил)-2-пиразол-1-ил-циклопентил]пиперидин-3-амина;
5-фтор-1-[4-(4-фторфенил)-2-пиразол-1-ил-циклопентил]пиперидин-3-амина;
5-фтор-1-[4-(4-фторфенил)-2-(1,2,4-триазол-1-ил)циклопентил]пиперидин-3-амина;
5-фтор-1-[4-(4-фторфенил)-2-(тетразол-2-ил)циклопентил]пиперидин-3-амина;
1-[4-(4-фторфенил)-2-(тетразол-2-ил)циклопентил]пиперидин-3-амина;
1-[2-(3-амино-1-пиперидил)-4-(4-фторфенил)циклопентил]-1,2,4-триазол-3-карбонитрила;
4-[2-(3-амино-1-пиперидил)-4-(4-фтор-3-гидрокси-фенил)циклопентокси]-бензонитрила;
4-[2-(3-амино-1-пиперидил)-4-(4-фтор-3-метокси-фенил)циклопентокси]-бензонитрила;
4-[2-(3-амино-1-пиперидил)-4-(3-фторфенил)циклопентокси]-3-хлор-бензонитрила;
4-[2-(3-амино-4,4-дифтор-1-пиперидил)-4-(4-фторфенил)циклопентокси]-бензонитрила;
4-[2-(5-амино-3,3-дифтор-1-пиперидил)-4-(4-фторфенил)циклопентокси]-бензонитрила;
4-[2-(3-амино-1-пиперидил)-4-(4-фторфенил)циклопентокси]-2-фтор-бензонитрила;
2-[2-(3-амино-1-пиперидил)-4-фенил-циклопентокси]бензонитрила;
4-[2-(3-амино-1-пиперидил)-4-фенил-циклопентокси]-3-хлор-бензонитрила;
6-[2-(3-амино-5-фтор-1-пиперидил)-4-(4-фторфенил)циклопентокси]-5-метил-пиридазин-3-карбонитрила;
1-[2-(4-хлорпиридазин-3-ил)окси-4-(4-фторфенил)циклопентил]пиперидин-3-амина;
6-[2-(3-амино-5-фтор-1-пиперидил)-4-(4-фторфенил)циклопентокси]пиридазин-3-карбонитрила;
1-[4-(4-фторфенил)-2-(5-фторпиридазин-3-ил)окси-циклопентил]пиперидин-3-амина;
6-(2-((R)-3-аминопиперидин-1-ил)-4-(4-фторфенил)циклопентилокси)-никотинонитрила;
6-[2-(3-амино-1-пиперидил)-4-(4-фторфенил)циклопентокси]пиридин-3-карбонитрила;
1-[4-(4-фторфенил)-2-пиридазин-3-илокси-циклопентил]пиперидин-3-амина;
5-фтор-1-[4-(4-фторфенил)-2-пиримидин-4-илокси-циклопентил]пиперидин-3-амина;
2-[2-(3-амино-1-пиперидил)-4-(4-фторфенил)циклопентокси]пиримидин-5-карбонитрила;
5-[2-(3-амино-1-пиперидил)-4-(4-фторфенил)циклопентокси]пиразин-2-карбонитрила; и
5-[2-(3-амино-1-пиперидил)-4-(4-фторфенил)циклопентокси]пиримидин-2-карбонитрила;
или их фармацевтически приемлемых солей.
В одном из воплощений предложена фармацевтическая композиция, содержащая терапевтически эффективное количество соединения формулы I или его фармацевтически приемлемой соли и по меньшей мере один фармацевтически приемлемый разбавитель, эксципиент или инертный носитель. В одном воплощении фармацевтическая композиция содержит соединение формулы I в форме свободного основания.
В одном из воплощений предложено соединение формулы I или его фармацевтически приемлемая соль для применения в лечении или профилактике заболеваний и состояний, при которых ингибирование TRPC6 и/или TRPC3 является поле3Ным. В одном воплощении применение предна3Начено для лечения заболевания почек. В одном воплощении заболевание почек представляет собой фокально-сегментарный гломерулосклероз (FSGS). В одном воплощении заболевание почек представляет собой фокально-сегментарный гломерулосклероз (FSGS) с мутацией приобретения функции TRPC6, как описано в Winn et al, Science. 2005, 308 (5729): 1801-4.
В одном из воплощений предложено соединение формулы I или его фармацевтически приемлемая соль для применения в получении лекарственного средства для лечения заболеваний или состояний, при которых ингибирование TRPC6 и/или TRPC3 является поле3Ным. В одном воплощении указанное заболевание или состояние представляет собой заболевание почек. В одном воплощении заболевание почек представляет собой фокально-сегментарный гломерулосклероз (FSGS), например FSGS с мутацией приобретения функции TRPC6.
В одном из воплощений предложен способ лечения заболевания или состояния, при котором ингибирование TRPC6 и/или TRPC3 является поле3Ным, включающий введение нуждающемуся в этом пациенту эффективного количества соединения формулы I или его фармацевтически приемлемой соли. В одном воплощении указанное заболевание или состояние представляет собой заболевание почек. В одном воплощении заболевание почек представляет собой фокально-сегментарный гломерулосклероз (FSGS), например FSGS с мутацией приобретения функции.
В одном из воплощений предложено соединение формулы I или его фармацевтически приемлемая соль для применения в качестве лекарственного средства.
В одном из воплощений предложен способ получения соединений формулы I и промежуточные соединения, используемые в их получении.
В одном воплощении способ получения соединения формулы I включает в себя стадию

где Р представляет собой подходящую защитную группу. Р может представлять собой карбаматную защитную группу, например трет-бутоксикарбонил или Boc группу. Аминопиперидиновая группа может быть представлена в единственной энантиомерной или диастереомерной форме. Аминопиперидиновая группа может быть представлена с е.е. (энантиомерный избыток) >95%, d.e. (диастереомерный избыток) >95% или с е.е. >95% и d.e. >95%.
Было обнаружено, что (зи,5R)-5-фтор-1-((1R,2R,4S)-4-(4-фторфенил)-2-(1Н-1,2,4-триазол-1-ил)циклопентил)пиперидин-3-амин, также упоминаемый здесь как Соединение 10, может существовать в кристаллической форме, "Форме А Соединения 10" или просто "Форме А". Одна кристаллическая форма (зи,5R)-5-фтор-1-((1R,2R,4S)-4-(4-фторфенил)-2-(1Н-1,2,4-триазол-1-ил)циклопентил)пиперидин-3-амина, т.е. Форма А Соединения 10, дает картину дифракции рентгеновских лучей на порошке, которая показана на Фиг. 1.
В одном аспекте предложена кристаллическая форма (зи,5R)-5-фтор-1-((1R,2R,4S)-4-(4-фторфенил)-2-(1Н-1,2,4-триазол-1-ил)циклопентил)пиперидин-3-амина.
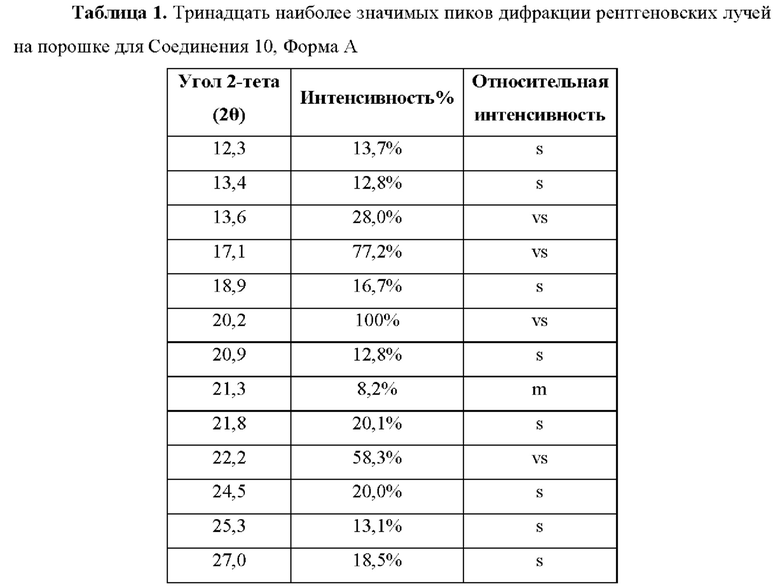
В другом аспекте предложен (зи,5R)-5-фтор-1-((1R,2R,4S)-4-(4-фторфенил)-2-(1Н-1,2,4-триазол-1-ил)циклопентил)пиперидин-3-амин, Форма А, который демонстрирует характеристические пики дифракции рентгеновских лучей на порошке (выраженные в градусах 2θ), которые показаны в Таблице 1 ниже, при использовании CuKα излучения.
(зи,5R)-5-Фтор-1-((1R,2R,4S)-4-(4-фторфенил)-2-(1Н-1,2,4-триазол-1-ил)циклопентил)пиперидин-3-амин, Форма А, характеризуется по меньшей мере одним из следующих 3Начений 2θ, измеренных с использованием CuKα излучения: 17,1° и 20,2°. (зи,5R)-5-Фтор-1-((1R,2R,4S)-4-(4-фторфенил)-2-(1Н-1,2,4-триазол-1-ил)-циклопентил)пиперидин-3-амин, Форма А, характеризуется картиной дифракции рентгеновских лучей на порошке, по существу такой, как показано на Фиг. А. Тринадцать наиболее 3Начимых пиков показаны в Таблице 1:
w = слабая, m = средняя, s = сильная, vs = очень сильная (смотри также Таблицу 3 ниже)
Согласно воплощению настоящего изобретения предложена кристаллическая форма (зи,5R)-5-фтор-1-((1R,2R,4S)-4-(4-фторфенил)-2-(1Н-1,2,4-триазол-1-ил)циклопентил)пиперидин-3-амина, Форма А, которая имеет картину дифракции рентгеновских лучей на порошке с по меньшей мере одним конкретным пиком примерно при 2-тета = 17,1°.
Согласно воплощению настоящего изобретения предложена кристаллическая форма (зи,5R)-5-фтор-1-((1R,2R,4S)-4-(4-фторфенил)-2-(1Н-1,2,4-триазол-1-ил)-циклопентил)пиперидин-3-амина, Форма А, которая имеет картину дифракции рентгеновских лучей на порошке с по меньшей мере одним конкретным пиком примерно при 2-тета = 20,2°.
Согласно воплощению настоящего изобретения предложена кристаллическая форма (зи,5R-5-фтор-1-((1R,2R,4S)-4-(4-фторфенил)-2-(1Н-1,2,4-триазол-1-ил)-циклопентил)пиперидин-3-амина, Форма А, которая имеет картину дифракции рентгеновских лучей на порошке с по меньшей мере двумя конкретными пиками примерно при 2-тета = 17,1° и 20,2°.
Согласно воплощению настоящего изобретения предложена кристаллическая форма (зи,5R)-5-фтор-1-((1R,2R,4S)-4-(4-фторфенил)-2-(1Н-1,2,4-триазол-1-ил)-циклопентил)пиперидин-3-амина, Форма А, которая имеет картину дифракции рентгеновских лучей на порошке с конкретными пиками примерно при 2-тета = 12,3; 13,4; 13,6; 17,1; 18,9; 20,2; 20,9; 21,3; 21,8; 22,2; 24,5; 25,3; и 27,0°.
Согласно воплощению настоящего изобретения предложена кристаллическая форма (зи,5R)-5-фтор-1-((1R,2R,4S)-4-(4-фторфенил)-2-(1Н-1,2,4-триазол-1-ил)-циклопентил)пиперидин-3-амина, Форма А, которая имеет картину дифракции рентгеновских лучей на порошке, по существу такую же, как картина дифракции рентгеновских лучей на порошке, показанная на Фиг. 1.
Согласно воплощению настоящего изобретения предложена кристаллическая форма (зи,5R)-5-фтор-1-((1R,2R,4S)-4-(4-фторфенил)-2-(1H-1,2,4-триазол-1-ил)-циклопентил)пиперидин-3-амина, Форма А, где указанная форма имеет картину дифракции рентгеновских лучей на порошке с по меньшей мере одним конкретным пиком при 2-тета = 17,1° плюс или минус 0,5° 2-тета.
Согласно воплощению настоящего изобретения предложена кристаллическая форма, Форма А, где указанная форма имеет картину дифракции рентгеновских лучей на порошке с по меньшей мере одним конкретным пиком при 2-тета = 20,2° плюс или минус 0,5° 2-тета.
Согласно воплощению настоящего изобретения предложена кристаллическая форма, Форма А, где указанная форма имеет картину дифракции рентгеновских лучей на порошке с по меньшей мере двумя конкретными пиками при 2-тета = 17,1° и 20,2°, где указанные 3Начения могут быть плюс или минус 0,5° 2-тета.
Согласно воплощению настоящего изобретения предложена кристаллическая форма, Форма А, где указанная форма имеет картину дифракции рентгеновских лучей на порошке с конкретными пиками при 2-тета = 12,3; 13,4; 13,6; 17,1; 18,9; 20,2; 20,9; 21,3; 21,8; 22,2; 24,5; 25,3; и 27,0°, где указанные 3Начения могут быть плюс или минус 0,5° 2-тета.
Когда говорится, что воплощения настоящего изобретения относятся к кристаллической форме (зи,5R)-5-фтор-1-((1R,2R,4S)-4-(4-фторфенил)-2-(1Н-1,2,4-триазол-1-ил)циклопентил)пиперидин-3-амина, степень кристалличности обычно составляет более примерно 60%, удобнее более примерно 80%, предпочтительно более примерно 90% и более предпочтительно более примерно 95%. Наиболее предпочтительно, степень кристалличности составляет более примерно 98%.
Кристаллическая форма (зи,5R)-5-фтор-1-((1R,2R,4S)-4-(4-фторфенил)-2-(1Н-1,2,4-триазол-1-ил)циклопентил)пиперидин-3-амина, Форма А, дает картину дифракции рентгеновских лучей на порошке, по существу такую же, как картина дифракции рентгеновских лучей на порошке, показанная на Фиг. 1, и имеет по существу тринадцать наиболее 3Начимых пиков (3Начения угла 2-тета), показанные в Таблице 1. Должно быть понятно, что 3Начения 2-тета на картине дифракции рентгеновских лучей на порошке может слегка варьировать от одного прибора к другому или от одного образца к другому, и поэтому приведенные 3Начения не должны рассматриваться как абсолютные.
В этом описании изобретения, если не указано иное, термин "фармацевтически приемлемый", использованный в данном документе, относится к тем соединениям, веществам, композициям и/или лекарственным формам, которые находятся в рамках обоснованного медицинского суждения, подходящим для применения в контакте с тканями людей и животных без излишних токсичности, раздражения, аллергической реакции или другой проблемы или осложнения, соизмеримых с разумным соотношением польза/риск.
В данном описании изобретения, если не указанное иное, фраза "эффективное количество" о3Начает количество соединения или композиции, которое является достаточным, чтобы 3Начительно и положительно модифицировать симптомы и/или состояния, которые лечат (например, обеспечивают положительный клинический ответ). Эффективное количество активного ингредиента для использования в фармацевтической композиции будет варьировать в зависимости от конкретного состояния, подлежащего лечению, тяжести этого состояния, продолжительности лечения, характера параллельной терапии, применяемого(ых) конкретного(ых) активного(ых) ингредиента(ов), используемого(ых) конкретного(ых) фармацевтически приемлемого(ых) эксципиента(ов)/носителя(ей) и подобных факторов в рамках 3Наний и опыта лечащего врача.
Термин "лечение", использованный в данном документе, если не указано иное, о3Начает реверсирование, облегчение, торможение прогрессирования, задержку прогрессирования, задержку начала или предупреждение расстройства или состояния, к которому такой термин применен, или одного или более симптомов такого расстройства или состояния. Термин "лечение", использованный в данном документе, если не указано иное, относится к акту лечения, которое определено непосредственно выше. Термин "лечение" также охватывает адъювантное и неоадъювантное лечение субъекта. Во избежание сомнений, упоминание в данном документе "лечения" охватывает куративное, паллиативное и профилактическое лечение и введение лекарственного средства для применения в таком лечении.
Соединения формулы I могут образовывать стабильные фармацевтически приемлемые соли с кислотами и основаниями, и в таких случаях введение соединения в виде соли может быть целесообра3Ным. Примеры солей присоединения кислоты включают ацетат, адипат, аскорбат, бензоат, бензолсульфонат, бикарбонат, бисульфат, бутират, камфорат, камфорсульфонат, холин, цитрат, циклогексилсульфамат, диэтилендиамин, этансульфонат, фумарат, глутамат, гликолят, гемисульфат, 2-гидроксиэтилсульфонат, гептаноат, гексаноат, гидрохлорид, гидробромид, гидройодид, гидроксималеат, лактат, малат, малеат, метансульфонат, меглумин, 2-нафталинсульфонат, нитрат, оксалат, памоат, персульфат, фенилацетат, фосфат, дифосфат, пикрат, пивалат, пропионат, хинат, салицилат, стеарат, сукцинат, сульфамат, сульфанилат, сульфат, тартрат, тозилат (пара-толуолсульфонат), трифторацетат и ундеканоат. Нетоксичные физиологически приемлемые соли являются предпочтительными, хотя другие соли могут быть поле3Ны, например, в выделении или очистке продукта.
Соли могут быть образованы обычными способами, такими как путем проведения реакции продукта в форме свободного основания с одним или более эквивалентами подходящей кислоты в растворителе или среде, в которой соль является нерастворимой, или в растворителе, таком как вода, который(ую) удаляют в вакууме, или посредством сублимационной сушки, или посредством обмена анионов существующей соли на другой анион на подходящей ионообменной смоле.
Соединения формулы I имеют более чем один хиральный центр, и следует иметь в виду, что данная заявка охватывает все индивидуальные стереоизомеры, энантиомеры и диастереоизомеры и их смеси. Таким образом, следует иметь в виду, что поскольку соединения формулы I могут существовать в оптически активных или рацемических формах благодаря наличию одного или более асимметрических атомов углерода, данная заявка охватывает в своем определении любую такую оптически активную или рацемическую форму, которая обладает вышеупомянутой активностью. Настоящая заявка охватывает все такие стереоизомеры, имеющие активность, которая определена в данном документе.
Синтез оптически активных форм может быть осуществлен стандартными методами органической химии, общеизвестными в данной области, например в результате синтеза из оптически активных исходных веществ или путем разделения рацемической формы. Рацематы могут быть разделены на индивидуальные энантиомеры с использованием известных методик (смотри, например, Advanced Organic Chemistry: 3rd Edition: author J. March, p 104-107). Подходящая методика включает в себя образование диастереомерных производных в результате реакции рацемического вещества с хиральным вспомогательным веществом с последующим разделением диастереомеров, например хроматографией, и затем отщеплением молекулы вспомогательного вещества. Аналогично, вышеупомянутая активность может быть оценена с использованием стандартных лабораторных методов, упомянутых в данном документе ниже.
Таким образом, везде в описании изобретения, где упоминается соединение формулы I, следует понимать, что термин "соединение" включает в себя диастереоизомеры, смеси диастереоизомеров и энантиомеры, которые являются ингибиторами TRPC6 и TRCP3.
Стереоизомеры могут быть разделены с использованием стандартных методов, например хроматографией или фракционной кристаллизацией. Энантиомеры могут быть выделены путем разделения рацемата, например фракционной кристаллизацией, разделением или ВЭЖХ (высокоэффективная жидкостная хроматография) или СФХ (сверхкритическая флюидная хроматография). Диастереоизомеры могут быть выделены разделением благодаря ра3Ным физическим свойствам диастереоизомеров, например фракционной кристаллизацией, ВЭЖХ или флэш-хроматографией. Альтернативно, конкретные стереоизомеры могут быть получены в результате хирального синтеза из хиральных исходных веществ в условиях, которые не будут вызывать рацемизацию или эпимеризацию, или в результате дериватизации с использованием хирального реагента.
Когда получают конкретный стереоизомер (посредством разделения, хирального синтеза или другими методами), его предпочтительно получают по существу изолированным от других стереоизомеров того же соединения. В одном аспекте смесь, содержащая конкретный стереоизомер соединения формулы I, может содержать менее 30%, в частности менее 20% и конкретнее менее 10% масс. других стереоизомеров того же соединения. В другом аспекте смесь, содержащая конкретный стереоизомер соединения формулы I, может содержать менее 6%, в частности менее 3% и конкретнее менее 2% масс. других стереоизомеров этого соединения. В другом аспекте смесь, содержащая конкретный стереоизомер соединения формулы I, может содержать менее 1%, в частности менее 0,5%, конкретнее менее 0,3% и еще конкретнее менее 0,1% масс. других стереоизомеров этого соединения.
Следует также иметь в виду, что некоторые соединения формулы I и их фармацевтически приемлемые соли могут существовать в сольватированных и несольватированных формах, таких как, например, гидратированные и безводные формы. Следует иметь в виду, что соединения в данном документе охватывают все такие сольватированные формы. Для ясности, охвачены сольватированные (например, гидратированные) формы свободной формы соединения, а также сольватированные (например, гидратированные) формы соли соединения.
Формула I, которая описана в данном документе, охватывает все изотопы составляющих ее атомов. Например, Н (или водород) включает любую изотопную форму водорода, в том числе 1Н, 2Н (D) и 3Н (m); С включает любую изотопную форму углерода, в том числе 12С, 13С и 14С; О включает любую изотопную форму кислорода, в том числе 16О, 17О и 18О; N включает любую изотопную форму азота, в том числе 13N, 14N и 15N; F включает любую изотопную форму фтора, в том числе 19F и 18F; и т.п. В одном аспекте соединения формулы I включают в себя изотопы атомов, охваченных в данном документе, в количествах, соответствующих их относительному количеству, встречающемуся в природе. Однако в некоторых случаях может быть желательным обогащение одного или более чем одного атома в конкретном изотопе, который обычно может присутствовать в более низком относительном количестве. Например, 1Н обычно присутствует в относительном количестве более 99,98%; однако в одном аспекте соединение любой формулы, представленной в данном документе, может быть обогащено 2Н или 3Н в одном или более положениях, где присутствует Н. В другом аспекте, когда соединение любой формулы, представленной в данном документе, обогащено радиоактивным изотопом, например 3Н и 14С, тогда соединение может быть использовано в анализах распределения лекарственного средства и/или субстрата в тканях. Следует иметь в виду, что настоящая заявка охватывает все такие изотопные формы.
Предложен способ лечения состояния, где требуется ингибирование TRPC6 и/или TRPC3, включающий введение терапевтически эффективного количества соединения формулы I или его фармацевтически приемлемой соли лицу, страдающему таким состоянием или восприимчивым к такому состоянию.
Соединения формулы I или их фармацевтически приемлемые соли обычно будут вводить пероральным путем в форме фармацевтических препаратов, содержащих активный ингредиент или его фармацевтически приемлемую соль или сольват, или сольват такой соли, в фармацевтически приемлемой лекарственной форме. В зависимости от расстройства и пациента, подлежащих лечению, композиции можно вводить в варьирующих дозах.
Фармацевтические композиции соединения формулы I, описанные выше, могут быть приготовлены для перорального введения, в частности в форме таблеток или капсул, и особенно с использованием технологий, обеспечивающих высвобождение лекарственного средства в ободочной кишке (Patel, М. М. Expert Opin. Drug Deliv. 2011, 8 (10), 1247-1258).
Фармацевтические композиции соединения формулы I, описанные выше, можно успешно вводить в стандартной лекарственной форме, и они могут быть приготовлены любыми способами, общеизвестными в фармацевтической области, например, как описано в Remington's Pharmaceutical Sciences, 17th ed., Mack Publishing Company, Easton, PA., (1985).
Фармацевтические композиции, подходящие для перорального введения, могут содержать один или более физиологически совместимых носителей и/или эксципиентов и могут находиться в твердой или жидкой форме. Таблетки и капсулы могут быть изготовлены с использованием связывающих агентов, наполнителей, смазывающих веществ и/или поверхностно-активных веществ, таких как лаурилсульфат натрия. Жидкие композиции могут содержать традиционные добавки, такие как суспендирующие агенты, эмульгаторы и/или консерванты. Жидкие композиции могут быть инкапсулированы, например в желатине, с получением стандартной лекарственной формы. Твердые пероральные лекарственные формы включают таблетки, состоящие из двух частей капсулы в твердой оболочке и мягкие эластичные желатиновые (SEG) капсулы. Такие состоящие из двух частей капсулы в твердой оболочке могут быть изготовлены, например, путем заключения соединения формулы (I) в желатиновую или гидроксипропилметилцеллюло3Ную (НРМС) оболочку.
Сухая композиция в оболочке обычно содержит желатин в концентрации примерно от 40% до 60% масс./масс., пластификатор (такой как глицерин, сорбит или пропиленгликоль) в концентрации от 20% до 30% и воду в концентрации примерно от 30% до 40%. Другие вещества, такие как консерванты, красители, вещества, придающие непрозрачность, и корригенты также могут присутствовать. Жидкое наполняемое вещество содержит твердое лекарственное средство, которое было растворено, солюбилизировано или диспергировано (с использованием суспендирующих агентов, таких как пчелиный воск, гидрогенизированное касторовое масло или полиэтиленгликоль 4000), или жидкое лекарственное средство в носителях или комбинациях носителей, таких как минеральное масло, растительные масла, триглицериды, гликоли и поверхностно-активные агенты.
Подходящие суточные дозы соединений формулы I или их фармацевтически приемлемых солей в терапевтическом лечении людей составляют примерно 0,0001-100 мг/кг массы тела.
Пероральные композиции являются предпочтительными, особенно таблетки или капсулы, которые могут быть изготовлены способами, известными специалистам в данной области, с получением доз активного соединения в диапазоне от 0,1 мг до 1000 мг.
Согласно дополнительному аспекту предложена также фармацевтическая композиция, содержащая соединение формулы I или его фармацевтически приемлемую соль в смеси с по меньшей мере одним фармацевтически приемлемым вспомогательным веществом, разбавителем и/или носителем.
Биологические анализы
Нижеследующие методики тестирования могут быть использованы для определения ингибирующих свойств соединений, описанных в данном документе.
Открытие каналов TRPC3 и TRPC6 вызывает приток преимущественно ионов кальция и натрия, что приводит к изменению электрического потенциала клеточной мембраны. Это изменение трансмембранного потенциала можно отслеживать с использованием красителей для определения трансмембранного потенциала в нижеследующих анализах с использованием FLIPR™ (флуоресцентный визуализирующий планшет-ридер).
Ингибирование TRPC6 - Анализ с использованием FLIPR™
TRPC6-HEK293 были приобретены у PerkinElmer (PerkinElmer, Product No.: AX-012-C). Клетки HEK293 были трансфицированы с использованием вектора экспрессии pcDNA3.1(+), содержащего кодирующую последовательность ионного канала TRPC6 человека. Использованная кодирующая последовательность идентична кодирующей последовательности GenBank NM_004621 за исключением 2 синонимичных вариантов (t1683c и c2529t). Клетки выращивали в DMEM + 10% фетальной бычьей сыворотки (FBS) + 0,5 мг/мл генетицина (селекция экспрессии ионных каналов) в качестве культуральной среды.
TRPC6-клетки высевали в количестве 10K (10 тысяч) клеток на лунку в 384-луночные полистирольные планшеты и затем выращивали в течение 24 ч при 37°С плюс 5% СО2. По истечении этого времени среду аспирировали с использованием устройства для отмывки планшетов Tecan и затем заменяли 40 мкл буфера для внесения красителя (130 мМ NaCl, 5 мМ KCl, 0,15 мМ CaCl2, 1 мМ MgCl2, 20 мМ HEPES ((4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота)), 5 мМ NaHCO3). Для TRPC6 использовали конечную концентрацию 0,5х. Клетки с красителем для определения трансмембранного потенциала затем инкубировали в течение 30 минут при комнатной температуре до начала экспериментов.
Для тестирования воздействий соединений на активность TRPC6 соединения сначала разводили в 100% DMSO до 3х конечной концентрации, которую использовали в экспериментах. Типичные эксперименты доза-ответ проводили в диапазоне от 10 мкМ (верхний предел концентрации) до 0,5 нМ (самая низкая концентрация). Десять микролитров 5х соединения в 0,5% DMSO добавляли к 40 мкл клеток, инкубированных с красителем для определения трансмембранного потенциала. Добавление соединений осуществляли на FLIPRTetra или FLIPR 384 (MDS Analytical Technologies, Molecular Devices, Sunnyvale, CA, 94089, USA). После инкубирования в течение 400 секунд с соединением добавляли 12,5 мкл OAG (1-олеоил-2-ацетил-sn-глицерин (OAG), Sigma, Gillingham, Dorset, SP8 4XT Cat# O6754-10MG) при 5x EC80 (типичная EC80 для TRPC6 = 3 мкМ конечная). OAG стимул разработан для измерения ингибирующей активности соединений в отношении рецептор-зависимой активации TRPC6.
Все данные нормализовали к низким контролям (только буфер) или высоким контролям (OAG ЕС100). Данные анализировали с использованием модуля выравнивания кривых ХС50 и регистрировали в виде 3Начений plC50 или IC50. Эти 3Начения усредняли для определения среднего 3Начения из минимум 2 экспериментов.
Ингибирование TRPC3 - Анализ с использованием FLIPR™
Клетки AD293 трансфицировали с использованием лентивирусного вектора PLVX-puro, содержащего кодирующую последовательность ионного канала TRPC3 человека. Устойчивые к пуромицину клетки отбирали путем обработки 2 мкг/мл пуромицина в течение двух недель. Моноклональные клетки получали путем предельного разведения и сравнивали их ответную реакцию на OAG в анализе трансмембранного потенциала. Клетки выращивали в DMEM + 10% фетальной бычьей сыворотки (FBS) + 1 мкг/мл пуромицина в качестве культуральной среды.
TRPC3-клетки высевали в количестве 9K (9 тысяч) на лунку в 384-луночные полистирольные планшеты. Клетки выращивали в течение 24 ч при 37°С плюс 5% СО2, после чего среду аспирировали с использованием устройства для отмывки планшетов Tecan и заменяли 40 мкл буфера для внесения красителя (130 мМ NaCl, 5 мМ KCl, 0,15 мМ CaCl2, 1 мМ MgCl2, 20 мМ HEPES ((4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота)), 5 мМ NaHCO3). Для TRPC3 использовали конечную концентрацию 0,5х красителя для определения трансмембранного потенциала (Molecular Devices Membrane Blue, FLIPR Membrane Potential Assay Kit (bulk) (набор для анализа трансмембранного потенциала с использованием FLIPR (большой объем)), Product#R8034(BLUE), Molecular Devices, Sunnyvale, CA, 94089, USA). Клетки с красителем для определения трансмембранного потенциала затем инкубировали в течение 30 минут при комнатной температуре до начала экспериментов.
Для тестирования воздействий соединений на активность TRPC3 соединения сначала разводили в 100% DMSO до 3х конечной концентрации, которую использовали в экспериментах. Типичные эксперименты доза-ответ проводили в диапазоне от 10 мкМ (верхний предел концентрации) до 0,5 нМ (самая низкая концентрация). Десять микролитров 5х соединения в 0,5% DMSO добавляли к 40 мкл клеток, инкубированных с красителем для определения трансмембранного потенциала. Добавление соединений осуществляли на FLIPRTetra или FLIPR 384 (MDS Analytical Technologies). После инкубирования в течение 400 секунд с соединением добавляли 12,5 мкл OAG при 5х EC80 (типичная EC80 для TRPC3 = 3 мкМ конечная). OAG стимул разработан для измерения ингибирующей активности соединений в отношении рецептор-зависимой активации TRPC3.
Все данные нормализовали к низким контролям (только буфер) или высоким контролям (OAG ЕС100). Данные анализировали с использованием модуля выравнивания кривых ХС50 и регистрировали в виде 3Начений plC50 или IC50. Эти 3Начения усредняли для определения среднего 3Начения из минимум 2 экспериментов.
Электрофизиологические анализы активации TRPC6 и TRPC3
Активация каналов TRPC6 и TRPC3 вызывает ионный ток, который может быть измерен с использованием метода фиксации потенциала (пэтч-кламп) в режиме "целая клетка" (смотри Estacion et al, J Physiol. 2006 Apr 15; 572(Pt 2): 359-377 и Washburn et al, Bioorg Med Chem Lett. 2013 Sep 1; 23(17):4979-84). 10 мкМ OAG (OAG является прямым активатором каналов TRPC6 и TRPC3) использовали для активации тока в TRPC6 или TRPC3 человека в TRPC6-трансдуцированных клетках HEK29 или TRPC3-трансдуцированных клетках AD293 соответственно. TRPC6- или TRPC3-трансдуцированные клетки инкубировали при 37°С и 5% СО2. Трансдуцированные клетки затем отцепляли от стенок колбы с использованием раствора трипсина (0,25% трипсина + 0,1% EDTA (этилендиаминтетрауксусная кислота)) и затем хранили в культуральной среде для пэтч-кламп экспериментов в пределах 5 ч. Клетки высевали в небольшой камере и непрерывно перфузировали внешним раствором (примерно 3 мл/мин), используя перфузионную систему RSC-200 (Science Instruments, BioLogic). Все регистрации тока проводили при комнатной температуре (примерно 22°С). Электроды сделаны из стеклянных капиллярных трубок и обеспечивают сопротивление 2-4 МОм, когда они заполнены соответствующими внутренними растворами.
Для регистрации тока TRPC6 внутриклеточный раствор содержал (в мМ): 120 CsOH, 120 аспартата, 20 CsCl, 2 MgCl, 0,4 CaCl2, 10 HEPES, 2 Na2ATP, 0,1 Na3GTP, 10 глюкозы, 1 EGTA (этиленгликольтетрауксусная кислота) (рН 7,2-7,25, скорректированный с использованием CsOH). Внеклеточный раствор содержал (в мМ): 145 NaCl, 5 KCl, 1 CaCl2, 1 MgCl2, 10 HEPES, 10 глюкозы (рН 7,4, скорректированный с использованием NaOH).
Для регистрации тока TRPC3 внутриклеточный раствор содержал (в мМ): 130 CsCl, 5 HEPES, 5 EGTA, 5 Na2ATP, 0,1 Na3GTP, 5,5 MgCl2 (рН 7,2-7,25, скорректированный с использованием CsOH). Внеклеточный раствор содержал (в мМ): 140 NaCl, 4 KCl, 1 MgCl2, 10 HEPES, 0,2 CaCl2, 10 глюкозы, 2 Na4EDTA (рН 7,4, скорректированный с использованием NaOH).
Между клеточной мембраной и электродом создавали изоляцию. После установления конфигурации "целая клетка" емкость клеточной мембраны отменяли электронно, и последовательное сопротивление компенсировали примерно на 70%. Ток в TRPC6 или TRPC3 вызывали в соответствии с протоколом 300-миллисекундного линейного изменения напряжения (от +100 мВ до -100 мВ) каждые 5 секунд при потенциале фиксации -60 мВ. Сразу после стабилизации контрольного тока регистрирующую камеру перфузировали внешним раствором, содержащим тестируемое соединение. При каждой концентрации лекарственного средства давали достаточно времени для воздействия лекарственного средства для достижения устойчивого состояния.
Ток в TRPC6 или TRPC3 измеряли как средний ток при +100 мВ. Зависимость тока от времени наносили на график для эксперимента в режиме "целая клетка". Процент ингибирования (%I) TRPC6 или TRPC3 вычисляли по формуле: %I=100×(1-lD/lc), где lD о3Начает амплитуда тока, измеренная в конце при конкретной концентрации лекарственного средства, и lc о3Начает амплитуда контрольного тока, измеренная до применения лекарственного средства. Уровень нулевого тока (фонового) устанавливают в самом начале до OAG-активации тока в TRPC6 или TRPC3. Амплификатор MultiClamp 700В с интерфейсом Digidata 1440 и программным обеспечением pCLaMP (AXON Instruments, Molecular Devices, Sunnyvale, CA, 94089, USA) используют для получения данных и анализа. Сначала вычисляют средний процент ингибирования при каждой концентрации лекарственного средства. Затем средние данные описывают логарифмической функцией с использованием программного обеспечения Prism 6 для расчета 3Начений IC50.
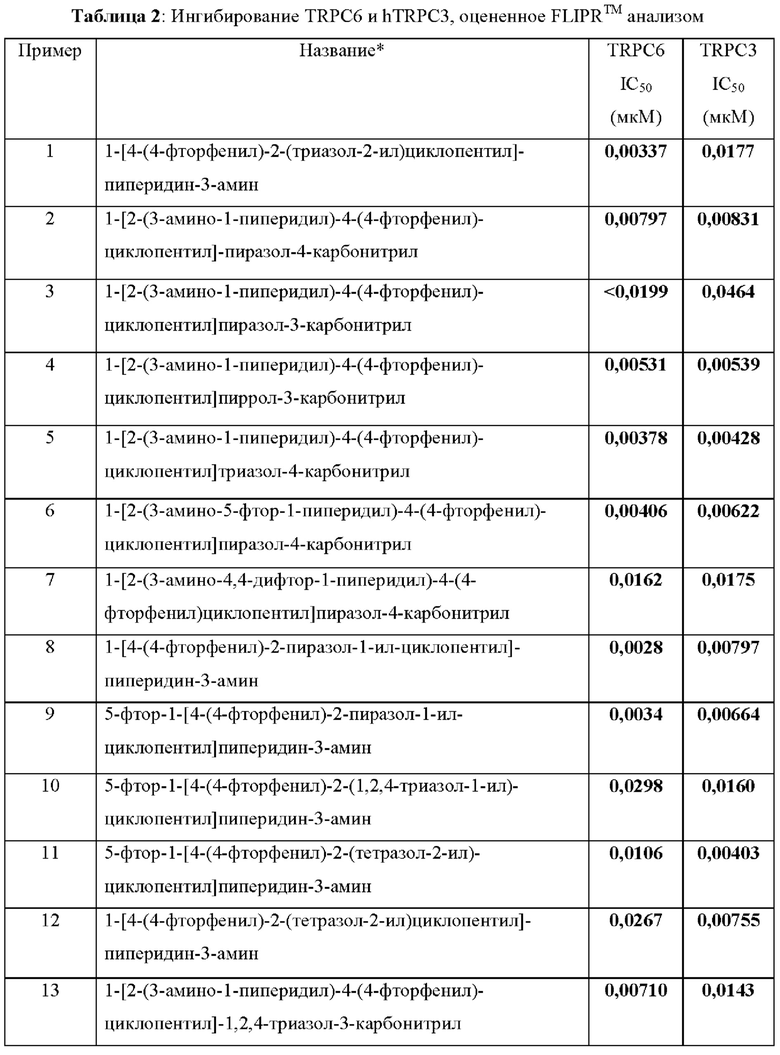


Как можно видеть из таблицы, приведенной выше, соединение по настоящему изобретению является высокоактивным ингибитором как TRPC6, так и TRPC3 с ингибирующей активностью в анализах, используемых в суб-30 нМ диапазоне. Эта способность ингибировать как TRPC6, так и TRPC3 может иметь терапевтическое 3Начение, так как степень селективности может обеспечивать повышенную терапевтическую эффективность по сравнению с селективным ингибитором любого из этих канонических каналов с транзиторным рецепторным потенциалом группы 3. Как отмечено выше, TRPC3 и TRPC6 имеют высокую гомологию последовательностей и принадлежат группе 3 канонических каналов с транзиторным рецепторным потенциалом. Таким образом, соединение по настоящему изобретению является перспективным в качестве терапевтического агента для лечения или профилактики заболеваний и состояний, при которых ингибирование TRPC6 и/или TRPC3 является поле3Ным, например заболевания почек и, в частности, фокально-сегментарного гломерулосклероза (FSGS).
Способ получения соединений
Соединения по изобретению могут быть получены так, как описано ниже. Например, Соединение 10 может быть получено из 1-(циклопент-3-енил)-4-фторбензола в качестве исходного вещества, который сам доступен в результате реакции метатезиса олефина 1-фтор-4-(гепта-1,6-диен-4-ил)бензола. Окисление циклопентена любым подходящим окислителем, таким как m-СРВА или перекись водорода в муравьиной кислоте, обеспечивает получение эпоксидного промежуточного соединения, которое может быть подвергнуто реакции нуклеофильного раскрытия кольца с использованием пиперидинового нуклеофила с получением производного циклопентанола. Производное циклопентанола затем может быть превращено путем проведения реакции Мицунобу в 1H-1,2,4-триазол-1-ильное производное. Конечные продукты затем получают путем удаления защитной группы Boc в кислотных условиях. Все подробности одного синтеза конечных соединений приведены ниже. Различные возможные изомерные продукты, полученные на каждой стадии синтеза, могут быть разделены хроматографией, например препаративной ВЭЖХ, такой как препаративная хиральная ВЭЖХ, или СФХ. Подходящие колонки для использования в этих стандартных методах и соответствующие системы элюентов приведены ниже.
Примеры
Заявленные соединения теперь будут дополнительно разъяснены со ссылкой на нижеследующие примеры, не являющиеся ограничивающими.
1H ЯМР измерения осуществляли на спектрометрах Bruker Avance, работающих при 1H частотах 300 и 400 МГц соответственно. Эксперименты, как правило, регистрировали при 25°С. Химические сдвиги даны в м.д. (миллионные доли) с растворителем в качестве внутреннего стандарта. ВЭЖХ обычно осуществляли на Shimadzu UHPLC, сопряженным с детектором DAD (детектор на диодной матрице), детектором ELSD (испарительный детектор светорассеяния) и 2020EV MS, или на Shimadzu UFLC, сопряженным с детектором DAD, детектором ELSD и 2020EV MS. Флэш-хроматографию осуществляли с использованием прямофа3Ной флэш-хроматографии на системе очистки SP1™ от Biotage™, в которой используется нормальнофа3Ный диоксид кремния FLASH+™ (40М, 25М или 12 М) или картриджи SNAP™ KP-Sil (340, 100, 50 или 10) с С18-флэш-колонками, или стандартной флэш-хроматографии. Как правило, все использованные растворители были коммерчески доступны и были аналитического сорта. Безводные растворители представляли собой растворители, рутинно используемые для реакций. Фазоразделители, использованные в примерах, представляли собой фазоразделительные колонки ISOLUTE®). Промежуточные соединения и соединения примеров, названия которых приведены ниже, были названы с использованием ACD/Name 12.01 от Advanced Chemistry Development, mc. (ACD/Labs). Исходные вещества были получены из коммерческих источников или изготовлены способами, описанными в литературе. Например, трет-бутил-((3R,5R)-5-фторпиперидин-3-ил)карбамат был приобретен у PharmaBlock Inc, 10 Xuefu Road, Nanjing Hi-Tech Zone, China.
Использованы следующие сокращения: AcOH = уксусная кислота; водн. = водный; BoC2O = ди-трет-бутилдикарбонат; Boc = трет-бутилоксикарбонил; br = уширенный; CDCl3 = дейтерированный хлороформ; CD3OD = дейтерированный метанол; CH3NO2 = нитрометан; d = дублет; δ = химический сдвиг в ЯМР относительно тетраметилсилана; DCE = 1,2-дихлорэтан; DCM = дихлорметан; DEA = диэтиламин; DEAD = диэтилазодикарбоксилат; DIPEA = N,N-диизопропилэтиламин; DMAP = 2,6-диметиламинопиридин; DMF = N,N-диметилформамид; DMSO = диметилсульфоксид; DMSO-d6 = дейтерированный диметилсульфоксид; DPPA = дифенилфосфоразидат; dppf = 1,1'-бис(дифенилфосфино)ферроцен; DIAD = диизопропил-(Е)-диазен-1,2-дикарбоксилат; ДСК = дифференциальная сканирующая колориметрия; DTAD = ди-трет-бутил-(Е)-диазен-1,2-дикарбоксилат; ее = энантиомерный избыток; экв. = эквивалент; ЭРИ = электрораспылительная ионизация; Et2O = диэтиловый эфир; EtOAc или ЕА = этилацетат; EtOH = этанол; FA = муравьиная кислота; катализатор Граббса (1,3-димезитилимидазолин-2-илиден)(трициклогексилфосфин)рутения дихлорид; ч = час(ы); HATU = (диметиламино)-N,N-диметил(3-оксидо-1H-[1,2,3]триазоло[4,5-b]пиридинил)метаниминия гексафторфосфат; HCl = соляная кислота; Н2О2 = перекись водорода; ВД = высокое давление; IPA = изопропиловый спирт; ЖХ = жидкостная хроматография; LiClO4 = перхлорат лития; m = мультиплет; моль = миллимоль; mCPBA = мета-хлорпероксибензойная кислота; МеОН = метанол; мин = минута(ы); MeCN = ацетонитрил; MeNO2 = нитрометан; МС = масс-спектрометрия; NMP = N-метил-2-пирролидон; ЯМР = ядерный магнитный резонанс; Pd2dba3 = трис(дибензилиденацетон)дипалладий(0); Pd(dppf)Cl2 = 1,1'-бис(ди-трет-бутилфосфино)ферроценпалладия дихлорид; РЕ = петролейный эфир; PPh3 = трифенилфосфин; q = квартет; к.т. = комнатная температура; Rt или RT = время удерживания; s = синглет; нас. = насыщенный; СФХ = сверхкритическая флюидная хроматография; t = триплет; ТЗР = 2,4,6-трипропил-1,3,5,2,4,6-триоксатрифосфинана 2,4,6-триоксид; TBTU = 2-(1Н-бензо[d][1,2,3]триазол-1-ил)-1,1,3,3-тетраметилизоурония тетрафторборат; TFA = трифторуксусная кислота; THF = тетрагидрофуран; ТСХ = тонкослойная хроматография; TMS = триметилсилил; Xantphos = 4,5-бис(дифенилфосфино)-9,9-диметилксантен.
Синтез исходных веществ и промежуточных соединений
Гепта-1,6-диен-4-илбензол D1

Раствор CH3NO2 (25,8 г) в DCM (400 мл) обрабатывали раствором TiCl4 (151 мл, 151 ммоль, 1,0 М в DCM) при -60°С, затем бензилальдегидом (10 г, 94,2 ммоль) в DCM (50 мл). Реакционную смесь перемешивали при -60°С в течение 0,5 ч, затем охлаждали до -78°С, после чего по каплям добавляли аллилтриметилсилан (32 г, 282 ммоль в DCM (50 мл). Реакционную смесь перемешивали при -78°С в течение 2 ч и при -60°С в течение 6 ч, затем вливали в насыщенный раствор NH4Cl (500 мл) и экстрагировали дихлорметаном (300 мл × 2). Объединенные органические слои промывали рассолом, сушили над безводным сульфатом натрия, фильтровали, концентрировали. Остаток очищали колоночной хроматографией (петролейный эфир) на силикагеле с получением гепта-1,6-диен-4-илбензола D1 (13,7 г, 84%-ный выход) в виде бесцветного масла.
1-Фтор-4-(гепта-1,6-диен-4-ил)бензол D2
TiCl4 (56,9 мл, 0,516 моль) добавляли к MeNO2 (69,5 мл, 1,29 моль) в DCM (1,5 л) при -78°С в течение периода времени 20 минут в атмосфере N2. Полученную смесь перемешивали в течение 20 мин и затем обрабатывали 4-фторбензилальдегидом (40 г, 0,322 моль) по каплям в течение периода времени 20 мин. Полученную смесь перемешивали при -70°С в течение 1 ч, затем обрабатывали аллилтриметилсиланом (110 г, 0,967 моль) в течение периода времени 0,5 ч. Полученную смесь перемешивали при -70°С в течение 3 ч и затем нагревали до 25°С. Реакционную смесь гасили смесью лед/вода (1 л), экстрагировали DCM (3×400 мл), и объединенные органические слои сушили (Na2SO4), фильтровали и выпаривали с получением бледно-желтого масла. После флэш-хроматографии на силикагеле (от 0 до 5% EtOAc в пентане) получили 1-фтор-4-(гепта-1,6-диен-4-ил)бензол (55,0 г, 90%) в виде бесцветного масла. 1Н ЯМР (300 МГц, CD3OD) δ 7.14 (2Н, m), 6.98 (2Н, m), 5.65 (2Н, ddt), 5.01-4.83 (4Н, m), 2.72 (1H, tt), 2.51-2.18 (4Н, m).
1-Фтор-3-(гепта-1,6-диен-4-ил)бензол D3
TiCl4 (56,9 мл, 515,65 ммоль), MeNO2 (69,5 мл, 1289,13 ммоль) в DCM (1500 мл) подвергали взаимодействию с 3-фторбензилальдегидом (40 г, 322,28 ммоль) и аллилтриметилсиланом (110 г, 966,85 ммоль) при -78°С, как описано для синтеза D1. После обработки и хроматографии (диоксид кремния, от 0 до 5% EtOAc в пентане) получили 1-фтор-3-(гепта-1,6-диен-4-ил)бензол D3 в виде бесцветного масла, которое использовали без дополнительной очистки.
1-Фтор-4-(гепта-1,6-диен-4-ил)-2-метоксибензол D4
Раствор нитрометана (5,7 г, 4,5 экв.) в DCM (80 мл) и TiCl4 (33,3 мл, 1,6 экв., 1М в DCM) подвергали взаимодействию с 4-фтор-3-метоксибензилальдегидом (3,5 г, 1,0 экв.) в 20 мл DCM, затем с аллилтриметилсиланом (7,2 г, 3,0 экв.), как описано для синтеза D1. После колоночной хроматографии (силикагель, петролейный эфир) получили 1-фтор-4-(гепта-1,6-диен-4-ил)-2-метоксибензол D4 (6,5 г, 98%-ный выход) в виде желтого масла. 1H ЯМР (CDCl3 400 МГц) 5 7.00 (1H, dd), 6.76 (1H, dd), 6.73-6.67 (1H, m), 5.71-5.65 (2Н, m), 5.02-4.95 (4Н, m), 3.91 (3Н, s), 2.72-2.67 (1Н, m), 2.44-2.33 (4Н, m).
Циклопент-3-енилбензол С1
В раствор D1 (13,7 г) в DCM (100 мл) добавляли катализатор Граббса (1,0 г, 0,015 экв). Эту смесь перемешивали при к.т.в атмосфере азота в течение ночи, и на этой стадии ТСХ показала, что исходного вещества не осталось. Реакционную смесь затем промывали водой (200 мл), рассолом (200 мл), затем сушили и выпаривали. После колоночной хроматографии (н-гептан) на силикагеле получили циклопент-3-енилбензол С1 (6,1 г, 55%-ный выход) в виде бесцветного масла.
1-(Циклопент-3-енил)-4-фторбензол С2
Катализатор Граббса (2,68 г, 3,15 ммоль) добавляли к 1-фтор-4-(гепта-1,6-диен-4-ил)бензолу (50 г, 0,263 моль) в DCM (500 мл) при 0°С в течение периода времени 20 мин в атмосфере азота. Полученную смесь перемешивали при 25°С в течение 15 ч. Растворитель удаляли при пониженном давлении, и остаток очищали колоночной хроматографией (от 0 до 5% EtOAc в петролейном эфире) с получением 1-(циклопент-3-ен-1-ил)-4-фторбензола С2 (30,0 г, 70,4%) в виде бесцветной жидкости. 1H ЯМР (300 МГц, CD3OD) δ 7.24 (2Н, m), 6.97 (2Н, m), 5.78 (2Н, d), 3.46 (1Н, tt), 2.81 (2Н, m), 2.40 (2Н, m).
1-(Циклопент-3-енил)-3-фторбензол С3
1-Фтор-3-(гепта-1,6-диен-4-ил)бензол (3,5 г) в DCM (40 мл) подвергали взаимодействию с катализатором Граббса (230 мг, 0,015 экв.), как описано для синтеза С1. После колоночной хроматографии (н-гептан) получили С3 (2,1 г, 70%) в виде бесцветного масла. 1H ЯМР (CDCl3, 400 МГц) δ 7.26-7.24 (1H, m), 7.04-6.88 (3Н, m), 5.80-5.75 (2Н, m), 3.49-3.45 (1Н, m), 2.87-2.81 (2Н, m), 2.48-2.41 (2Н, m).
4-(Циклопент-3-енил)-1-фтор-2-метоксибензол С4
1-Фтор-4-(гепта-1,6-диен-4-ил)-2-метоксибензол D4 (4,5 г, 1,0 экв.) в 50 мл DCM подвергали взаимодействию с добавленным катализатором Граббса (450 мг, 0,025 экв.), как описано для синтеза С1. После колоночной хроматографии на силикагеле (петролейный эфир) получили 4-(циклопент-3-енил)-1-фтор-2-метоксибензол (3,1 г, 79%-ный выход) в виде коричневого масла. 1H ЯМР (CDCl3, 400 МГц) δ 6.99-6.94 (1H, m), 6.85 (1H, dd), 6.76-6.62 (1H, m), 5.78 (2Н, s), 3.88 (3Н, s), 3.44-3.38 (1H, m), 2.82 (2Н, dd), 2.45-2.38 (2Н, m).
3-Фенил-6-оксабицикло[3.1.0]гексан Е1
В раствор циклопент-3-енилбензола С1 (6,1 г, 42,3 ммоль) в DCM (80 мл) порциями добавляли mCPBA (12,8 г, 1,5 экв., 85%) при 0°С. Эту смесь перемешивали при к.т. в течение ночи. Затем добавляли насыщенный раствор NaHSO3 (400 мл), и суспензию перемешивали при к.т. в течение 30 мин. Суспензию затем разбавляли водой (200 мл), экстрагировали дихлорметаном (200 мл), и органический слой промывали насыщенным раствором бикарбоната натрия и рассолом. Объединенные органические фазы сушили над безводным сульфатом натрия, фильтровали и выпаривали. Остаток очищали колоночной хроматографией (петролейный эфир/EtOAc 20:1) на силикагеле с получением 3-фенил-6-оксабицикло[3.1.0]гексана Е1 (4,9 г, 73%-ный выход) в виде бесцветного масла.
транс-3-(4-Фторфенил)-6-оксабицикло[3.1.0]гексан Е2

Муравьиную кислоту (88%) (392 мл, 9,15 моль) добавляли по каплям к Н2О2 (30%) (262 мл, 2,62 моль), охлажденной до 0°С, в течение периода времени 1 ч на воздухе. Затем добавляли 1-(циклопент-3-ен-1-ил)-4-фторбензол С2 (20 г, 0,123 моль) в DCM (250 мл) при 0°С в течение периода времени 3 ч на воздухе. Полученную смесь затем перемешивали при температуре окружающей среды в течение 12 ч, после чего растворитель удаляли при пониженном давлении. Неочищенный продукт очищали флэш-хроматографией на диоксиде кремния (от 0 до 10% EtOAc в петролейном эфире) с получением транс-3-(4-фторфенил)-6-оксабицикло[3.1.0]гексана Е2 (12,00 г, 54,6%) в виде бесцветного масла. 1Н ЯМР (300 МГц, CDCl3) δ 7.15 (2Н, m), 6.99 (2Н, m), 3.60 (2Н, s), 2.98 (1H, tt), 2.46 (2Н, dd), 1.71 (2Н, dd).
3-(3-Фторфенил)-6-оксабицикло[3.1.0]гексан Е3
1-(Циклопент-3-енил)-3-фторбензол С2 (2,1 г) в DCM (50 мл) и mCPBA (3,3 г, 1,5 экв., 85%) подвергали взаимодействию, как описано для синтеза Е1. После хроматографии на силикагеле (петролейный эфир/EtOAc = 20:1) получили Е3 (1,1 г, 47%) в виде бесцветного масла.
3-(4-Фтор-3-метоксифенил)-6-оксабицикло[3.1.0]гексан Е4
mCPBA (5,57 г, 2,0 экв.) и 4-(циклопент-3-енил)-1-фтор-2-метоксибензол С4 (3,1 г, 1,0 экв.) в 50 мл дихлорметана подвергали взаимодействию, как описано для синтеза Е1. После колоночной хроматографии получили Е4 в виде транс-изомера (1,3 г, 47%-ный выход) и цис-изомера (300 мг, 9%-ный выход) в виде бесцветных масел. Для транс-Е4 1Н ЯМР (CDCl3, 400 МГц) δ 7.00-6.95 (1H, m), 6.77 (1H, dd), 6.72-6.66 (1Н, m), 3.87 (3Н, s), 3.58 (2Н, s), 2.98-2.91 (1Н, m), 2.47-2.41 (2Н, m), 1.71 (2Н, dd). Для цис-Е4 1Н ЯМР (CDCl3, 400 МГц) δ 6.99 (1H, dd), 6.92 (1H, dd), 6.75-6.73 (1Н, m), 3.89 (3Н, s), 3.57 (2Н, s), 3.45-3.39 (1H, s), 2.33 (2Н, dd), 2.08 (2Н, dd).
трет-Бутил-(3R)-1-(2-гидрокси-4-фенилциклопентил)пиперидин-3-илкарбамат F1

В раствор 3-фенил-6-оксабицикло[3.1.0]гексана Е1 (1,5 г) в CH3CN (20 мл) добавляли (R)-трет-бутил-пиперидин-3-илкарбамат (2,2 г, 1,2 экв.) и LiClO4 (2,0 г, 2,0 экв.). Полученную суспензию кипятили с обратным холодильником в течение ночи, затем охлаждали и фильтровали. Фильтрат выпаривали, и остаток очищали колоночной хроматографией (петролейный эфир/EtOAc 1:1) на силикагеле с получением трет-бутил-(3R)-1-(2-гидрокси-4-фенилциклопентил)пиперидин-3-илкарбаматаЕ1 (1,97 г, 59%) в виде желтого твердого вещества, которое использовали без дополнительной очистки.
трет-Бутил-(3R)-1-(4-(4-фторфенил)-2-гидроксициклопентил)пиперидин-3-илкарбамат F2a
(R)-1,1'-Би-2-нафтол (1,607 г, 5,61 ммоль) в толуоле (50 мл) обрабатывали дибутилмагнием (7,29 мл, 1,0М, 7,29 ммоль в н-гептане) при 25°С. После перемешивания в течение 0,5 ч реакционную смесь охлаждали до 0°С и затем добавляли транс-3-(4-фторфенил)-6-оксабицикло[3.1.0]гексан Е2 (10 г, 56,11 ммоль) и трет-бутил-(R)-пиперидин-3-илкарбамат (11,24 г, 56,11 ммоль) в толуоле (150 мл). После перемешивания в течение ночи реакционную смесь вливали в дробленый лед, и смесь распределяли между DCM и водой. Водный слой экстрагировали снова DCM, и объединенные органические слои промывали насыщенным раствором NaHCO3 и рассолом, затем сушили (сульфат натрия) и выпаривали. После флэш-хроматографии на диоксиде кремния (от 0 до 10% МеОН в DCM) получили трет-бутил-(3R)-1-(4-(4-фторфенил)-2-гидроксициклопентил)пиперидин-3-илкарбамат F2b (12,00 г, 56,5%) в виде желтого масла. 1Н ЯМР (300 МГц, CDCl3) δ 7.20 (2Н, ddt), 6.94-7.07 (2Н, m), 4.94 (1H, s), 4.32 (1Н, t), 3.78 (1H, s), 3.31 (1H, dtd), 2.72 (2Н, dd), 2.53 (2Н, s), 2.24 (1H, dt), 1.96-2.10 (2Н, m), 1.52-1.86 (4Н, m), 1.47 (10Н, d). ЖХМС: m/z (ЭРИ), [M+H]+ = 379.
трет-Бутил-N-[(3R,5R)-5-фтор-1-[(1R,2R,4S)-4-(4-фторфенил)-2-гидрокси-циклопентил]-3-пиперидил]карбамат и трет-бутил-N-[(3R,5R)-5-фтор-1-[(1S,2S,4R)-4-(4-фторфенил)-2-гидрокси-циклопентил]-3-пиперидил]карбамат F2b

транс-3-(4-Фторфенил)-6-оксабицикло[3.1.0]гексан Е2 (1,225 г, 6,87 ммоль) добавляли к трет-бутил-((3R,5R)-5-фторпиперидин-3-ил)карбамату (1 г, 4,58 ммоль) и Na2CO3 (1,457 г, 13,74 ммоль) в EtOH (10 мл) при к.т. Полученную смесь перемешивали при 90°С в течение 12 ч. Растворитель затем удаляли при пониженном давлении, и неочищенный продукт очищали колоночной хроматографией на силикагеле (от 0 до 10% МеОН в DCM) с получением смеси вышеназванных стереоизомеров, F2b, (1,030 г, 56,7%) в виде желтого масла. ЖХМС (жидкостная хроматография/масс-спектрометрия): m/z (ЭРИ+ (электрораспылительная ионизация с регистрацией положительных ионов)), [М+Н]+=397.
трет-Бутил-4,4-дифтор-1-(4-(4-фторфенил)-2-гидроксициклопентил)-пиперидин-3-илкарбамат F2c
Смесь транс-3-(4-фторфенил)-6-оксабицикло[3.1.0]гексана Е2 (450 мг, 1,2 экв.), трет-бутил-4,4-дифторпиперидин-3-илкарбамата (500 мг, 1,0 экв.) и Na2CO3 (450 мг, 2,0 экв.) в этаноле (8 мл) перемешивали в условиях микроволнового излучения: 130°С, 16 ч. Смесь разбавляли дихлорметаном и фильтровали, фильтрат концентрировали, и остаток очищали колоночной флэш-хроматографией на силикагеле (петролейный эфир/EtOAc от 90:10 до 60:40) с получением трет-бутил-4,4-дифтор-1-(4-(4-фторфенил)-2-гидроксициклопентил)пиперидин-3-илкарбамата F2c (250 мг, 28%-ный выход) в виде светло-желтого густого масла.
трет-Бутил-(3R)-5,5-дифтор-1-(4-(4-фторфенил)-2-гидроксициклопентил)-пиперидин-3-илкарбамат F2d
В раствор (1R,3S,5S)-3-(4-фторфенил)-6-оксабицикло[3.1.0]гексана (транс-эпоксид) Е2 (300 мг, 1,0 экв.) в 10 мл безводного этанола добавляли (R)-трет-бутил-5,5-дифторпиперидин-3-илкарбамат (398 мг, 1,0 экв.) и карбонат натрия (357 мг, 2,0 экв.) в герметичной пробирке. Суспензию облучали в микроволновом реакторе при 130°С в течение 7 ч. Суспензию фильтровали и концентрировали. Остаток очищали на силикагелевой колонке (петролейный эфир/EtOAc, градиент от 0 до 10%, затем 20% EtOAc в DCM) с получением соединения трет-бутил-(3R)-5,5-дифтор-1-(4-(4-фторфенил)-2-гидроксициклопентил)пиперидин-3-илкарбамат F2d (290 мг, 42%-ный выход) в виде белого твердого вещества.
трет-Бутил-(3R)-1-(4-(3-фторфенил)-2-гидроксициклопентил)пиперидин-3-илкарбамат F3
В раствор 3-(3-фторфенил)-6-оксабицикло[3.1.0]гексана Е3 (300 мг) в CH3CN (10 мл) добавляли (R)-трет-бутил-пиперидин-3-илкарбамат (404 мг, 1,2 экв.) и LiCiO4 (358 мг, 2,0 экв). Реакционную смесь кипятили с обратным холодильником в течение ночи. ТСХ показала, что исходное вещество израсходовалось полностью. Смесь концентрировали, и к остатку добавляли этилацетат (50 мл) и воду (50 мл). Смесь экстрагировали этилацетатом. Органический слой сушили над Na2SO4, концентрировали и очищали колоночной хроматографией на силикагеле, элюируя этилацетатом, с получением трет-бутил-(3R)-1-(4-(3-фторфенил)-2-гидроксициклопентил)пиперидин-3-илкарбамата F3 (580 мг, 90%).
трет-Бутил-(3R)-1-(4-(4-фтор-3-метоксифенил)-2-гидроксициклопентил)-пиперидин-3-илкарбамат F4
В раствор 3-(4-фтор-3-метоксифенил)-6-оксабицикло[3.1.0]гексана Е4 (100 мг, 1,0 экв.) в 3 мл безводного этанола добавляли (R)-трет-бутил-пиперидин-3-илкарбамат (115 мг, 1,2 экв.) и карбонат натрия (101 мг, 2,0 экв.) в герметичной пробирке. Суспензию облучали в микроволновом реакторе при 130°С в течение 6 ч. Суспензию фильтровали и концентрировали. После колоночной хроматографии остатка (силикагель DCM/метанол, от 0 до 3% метанола) получили F4 (140 мл, 71%-ный выход) в виде бесцветного твердого вещества. 1H ЯМР (CDCl3 400 МГц) δ 6.99 (1H, dd), 6.86 (1H, dd), 6.75-6.71 (1H, m), 4.92 (1H, br s), 4.27-4.21 (1Н, m), 3.89 (3Н, s), 3.75 (1H, br s), 3.10-3.06 (2Н, m), 2.88-2.75 (2Н, m), 2.53 (2Н, m), 2.41-2.35 (2Н, m), 2.15-2.05 (1Н, m), 1.90-1.66 (6Н, m), 1.40 (9Н, d).
Соединение 1
Стадия 1. трет-Бутил-(3R)-1-(4-(4-фторфенил)-2-(2Н-1,2,3-триазол-2-ил)циклопентил)пиперидин-3-илкарбамат
Раствор транс-трет-бутил-(3R)-1-(4-(4-фторфенил)-2-гидроксициклопентил)-пиперидин-3-илкарбамата F2a (600 мг, 1,59 ммоль), 1Н-1,2,3-триазола (219 мг, 3,17 ммоль), DIAD (0,401 мл, 2,06 ммоль) и PPh3 (541 мг, 2,06 ммоль) в DCM (20 мл) перемешивали при к.т. в течение 2 часов. Растворитель удаляли при пониженном давлении, и остаток очищали колоночной флэш-хроматографией на силикагеле (от 10 до 50% MeCN в воде) с получением указанного в заголовке соединения (450 мг, 66,1%) в виде белого твердого вещества. Неочищенный продукт разделяли на препаративной системе Waters SFC 350 [колонка: CHIRAIaRT Amylose-SA, 2×25 см, 5 мкм; подвижная фаза А: СО2: 80; подвижная фаза В: МеОН (2 мМ NH3-MeOH): 20; скорость потока: 40 мл/мин; 220 нм]. Две фракции были получены в виде белых твердых веществ: фракция 1 (300 мг, 66,7%, RT1: 3,03) и фракция 2 (100 мг, 22,22%, RT2: 4,58).
Фракцию 1 дополнительно разделяли на препаративной системе Waters SFC 350, колонка: (R,R)-WHELK-O1-Kromasil, 5 см × 25 см (5 мкм); подвижная фаза А: СО2: 85, подвижная фаза В: МеОН (2 мМ NH3-МеОН): 15; скорость потока: 40 мл/мин; 220 нм; RT1: 2,31; RT2: 2,71. Фракции, содержащие целевое соединение, выпаривали досуха с получением изомера 1 (120 мг, 40%, 100% ее) и изомера 2 (120 мг, 40%, 98,4% ее) в виде белых твердых веществ. ЖХМС m/z (ЭРИ), [М+Н]+ = 430.
Стадия 2. 1-[4-(4-Фторфенил)-2-(триазол-2-ил)циклопентил]пиперидин-3-амин
Соединение 1

Раствор изомера 1 (120 мг, 0,28 ммоль), полученный на стадии 1, в TFA (1 мл) и DCM (5 мл) перемешивали при к.т.в течение 1 ч. Растворитель затем удаляли при пониженном давлении, и неочищенный продукт очищали препаративной ВЭЖХ [колонка: XBridge Prep OBD C18 колонка: 30×150 мм, 5 мкм; подвижная фаза А: вода (содержащая 10 ммоль/л NH4HCO3 + 0,1% водн. NH3), подвижная фаза В: MeCN; скорость потока: 60 мл/мин; градиент: от 25% В до 54% В за 8 мин; 254/220 нм; Rt: 6,87 мин] с получением Соединения 1 (70,0 мг, 76%) в виде белого твердого вещества. ЖХМС: m/z (ЭРИ), [M+H]+=330; 1Н ЯМР (300 МГц, CD3OD) δ 7.71 (2Н, s), 7.31 (2Н, ddd), 7.10-6.96 (m, 2Н), 5.23 (1H, ddd), 3.58 (2Н, ddt), 3.08-2.72 (3Н, m), 2.52-2.17 (3Н, m), 1.86 (4Н, ddd), 1.75-1.45 (2Н, m), 1.11 (1H, qd). 19F ЯМР (300 МГц, CD3OD, 24°С) δ -118.73 (s, 1F).
Соединение 2
Стадия 1. трет-Бутил-(3R)-1-(2-(4-циано-1Н-пиразол-1-ил)-4-(4-фторфенил)-циклопентил)пиперидин-3-илкарбамат
В смесь трет-бутил-(3R)-1-(4-(4-фторфенил)-2-гидроксициклопентил)-пиперидин-3-илкарбамата F2a (5 г, 13,21 ммоль), 1Н-пиразол-4-карбонитрила (1,230 г, 13,21 ммоль), PPh3 (5,20 г, 19,82 ммоль) в DCM (100 мл) добавляли DTAD (4,56 г, 19,82 ммоль). Эту реакционную смесь перемешивали при 25°С в течение 16 часов. Полученный раствор промывали нас. NaHCO3 и рассолом. Органический слой сушили над Na2SO4, фильтровали, затем концентрировали досуха. Остаток очищали С18 колоночной флэш-хроматографией (градиент элюирования от 40 до 55% MeCN в воде (с 0,2% аммиака)) с получением целевого продукта в виде желтого масла. ЖХМС: m/z (ЭРИ), [М+Н]+ = 454. После разделения препаративной хиральной ВЭЖХ [Chiralpak IA, 2×25 см, 5 мкм; подвижная фаза А: гексаны-ВЭЖХ, подвижная фаза В: IPA-ВЭЖХ; скорость потока: 20 мл/мин; градиент: А:В = 70:30, 17,5 мин] получили указанное в заголовке соединение (изомер 1, 2,60 г, 47,3%) в виде желтого масла.
Стадия 2. 1-[2-(3-Амино-1-пиперидил)-4-(4-фторфенил)циклопентил]пиразол-4-карбонитрил Соединение 2

К полученному на стадии 1 изомеру 1 (2,6 г, 5,73 ммоль) добавляли HCl в диоксане (50 мл, 200 ммоль). Полученную смесь перемешивали при 20°С в течение 4 часов, затем концентрировали досуха. Остаток обрабатывали смесью Et2O/MeOH (10/1), и полученное твердое вещество собирали, затем обрабатывали разбавленным нас. Na2CO3 и затем экстрагировали EtOAc. Органический слой сушили над Na2SO4 и концентрировали досуха с получением Соединения 2 (1,358 г, 67,0%) в виде светло-желтого твердого вещества. 1Н ЯМР (300 МГц, DMSO-d6) δ 8.74 (1Н, s), 8.11 (1Н, s), 7.30-7.43 (2Н, m), 7.05-7.20 (2Н, m), 4.87-5.00 (1Н, m), 3.26-3.41 (2Н, m), 2.79 (1Н, d), 2.50-2.72 (2Н, m), 2.09-2.32 (3Н, m), 1.96 (1H, dd), 1.50-1.79 (4H, m), 1.37 (3Н, d), 0.83-1.02 (1Н, m). ЖХМС: m/z (ЭРИ), [М+Н]+ = 354.
Соединение 3
Стадия 1. трет-Бутил-(3R)-1-(2-(3-циано-1Н-пиразол-1-ил)-4-(4-фторфенил)-циклопентил)пиперидин-3-илкарбамат
DTAD (243 мг, 1,06 ммоль) добавляли по каплям к F2a (200 мг, 0,53 ммоль), 1Н-пиразол-3-карбонитрилу (49,2 мг, 0,53 ммоль) и PPh3 (277 мг, 1,06 ммоль) в DCM (15 мл) при 0°С в атмосфере азота. Полученную смесь перемешивали при 25°С в течение 3 часов. Органический слой промывали водн. NaHCO3, и растворитель удаляли при пониженном давлении. Неочищенный продукт очищали обращенно-фазовой хроматографией (С18 колонка), используя убывающе полярные смеси воды (содержащей 0,1% NH3) и MeCN в качестве элюента. Фракции, содержащие целевое соединение, выпаривали досуха с получением трет-бутил-(3R)-1-(2-(3-циано-1Н-пиразол-1-ил)-4-(4-фторфенил)циклопентил)пиперидин-3-илкарбамата (240 мг, 100%) в виде белого твердого вещества. Это твердое вещество очищали препаративной ТСХ (DCM:MeOH = 40:1) с получением трет-бутил-((3R)-1-(2-(3-циано-1Н-пиразол-1-ил)-4-(4-фторфенил)циклопентил)пиперидин-3-ил)карбамата, фракция 1, (90 мг, 37,5%) в виде желтого твердого вещества и трет-бутил-((3R)-1-(2-(3-циано-1Н-пиразол-1-ил)-4-(4-фторфенил)циклопентил)пиперидин-3-ил)карбамата, фракция 2, (70,0 мг, 29,2%) в виде желтого твердого вещества. ЖХМС для обеих фракций: m/z (ЭРИ), [М+Н]+ = 454. Фракцию 1 (90 мг, 0,20 ммоль) очищали препаративной хиральной ВЭЖХ [колонка Chiralpak IE, изократическое элюирование 5% IPA в гексанах (модифицированных 0,1% DEA) в качестве элюента, с получением изомера 1 трет-бутил-((3R)-1-(2-(3-циано-1Н-пиразол-1-ил)-4-(4-фторфенил)циклопентил)пиперидин-3-ил)карбамата (35,0 мг, 38,9%, изомер 1, 99,3% ее) в виде желтого твердого вещества и изомера 2 (30,0 мг, 33,3%, изомер 2, 99% ее) в виде желтого твердого вещества. ЖХМС: (изомер 1) m/z (ЭРИ), [М+Н]+ = 454; (изомер 2) m/z (ЭРИ), [М+Н]+ = 454.
Стадия 2. 1-[2-(3-Амино-1-пиперидил)-4-(4-фторфенил)циклопентил]пиразол-3-карбонитрил Соединение 3

TFA (0,5 мл, 6,49 ммоль) добавляли к вышеуказанному изомеру 1 трет-бутил-((3R)-1-(2-(3-циано-1Н-пиразол-1-ил)-4-(4-фторфенил)циклопентил)пиперидин-3-ил)карбамата (20 мг, 0,04 ммоль) в DCM (3 мл). Полученную смесь перемешивали при 25°С в течение 2 часов. После препаративной колоночной ВЭЖХ [колонка X Select CSH Prep CI8 OBD, 5 мкм, 19×150 мм; подвижная фаза А: вода (0,05% TFA), подвижная фаза В: MeCN; скорость потока: 20 мл/мин; градиент: от 12% В до 32% В за 7 мин; 254; 220 нм] получили изомер 1 Соединения 3, (17,00 мг, 51,8%) в виде белого твердого вещества. 1Н ЯМР (300 МГц, CD3OD) δ 7.75 (dd, 1H), 7.28-7.42 (m, 2Н), 6.96-7.14 (m, 3Н), 5.17 (ddd, 1H), 3.81 (dt, 1Н), 3.60 (s, 1H), 3.41 (dt, 2Н), 3.14 (d, 1H), 2.67 (s, 1Н), 2.29-2.63 (m, 5Н), 1.90 (dt, 2Н), 1.44-1.74 (m, 2Н). 19F ЯМР (300 МГц, CD3OD) δ- 77.287 (m, 10F), -118.609 (s, 1F). ЖХМС: m/z (ЭРИ), [М+Н]+ = 354.
Соединение 4
Стадия 1. трет-Бутил-(3R)-1-(2-(3-циано-1Н-пиразол-1-ил)-4-(4-фторфенил)-циклопентил)пиперидин-3-илкарбамат
Раствор трет-бутил-(3R)-1-(4-(4-фторфенил)-2-гидроксициклопентил)-пиперидин-3-илкарбамата F2a (250 мг, 0,66 ммоль), 1Н-пиррол-3-карбонитрила (60,8 мг, 0,66 ммоль), PPh3 (346 мг, 1,32 ммоль) в DCM (15 мл) подвергали взаимодействию с DTAD (304 мг, 1,32 ммоль), как описано выше для синтеза соединения 3. После С18 колоночной хроматографии, градиент элюирования от 20 до 60% MeCN в воде (с 0,3% NH3H2O), получили трет-бутил-(3R)-1-(2-(3-циано-1Н-пиррол-1-ил)-4-(4-фторфенил)циклопентил)-пиперидин-3-илкарбамат (180 мг, 60,2%) в виде бесцветного масла. После препаративной хиральной ВЭЖХ [Phenomenex Lux 5u Cellulose-4, AXIA Packed, 250×21,2 мм, 5 мкм; подвижная фаза А: гексаны--ВЭЖХ, подвижная фаза В: IPA--ВЭЖХ; скорость потока: 20 мл/мин; градиент: А:В = 80:20 за 21 мин; 254/220 нм; RT1: 12,5; RT2: 17,2] получили изомер 1 трет-бутил-(3R)-1-(2-(3-циано-1H-пиррол-1-ил)-4-(4-фторфенил)циклопентил)пиперидин-3-илкарбамата (70,0 мг, 38,9%, изомер 1) в виде желтого масла и изомер 2 трет-бутил-(3R)-1-(2-(3-циано-1H-пиррол-1-ил)-4-(4-фторфенил)циклопентил)пиперидин-3-илкарбамата (70,0 мг, 38,9%, изомер 2) в виде желтого масла. ЖХМС для обоих изомеров: m/z (ЭРИ), [М+Н]+ = 453.
Стадия 2. 1-[2-(3-Амино-1-пиперидил)-4-(4-фторфенил)циклопентил]пиразол-3-карбонитрил Соединение 4

TFA (1 мл, 12,98 ммоль) добавляли к вышеуказанному изомеру 2 трет-бутил-(3R)-1-(2-(3-циано-1Н-пиррол-1-ил)-4-(4-фторфенил)циклопентил)пиперидин-3-илкарбамата (70 мг, 0,18 ммоль) в DCM (5 мл). Полученную смесь перемешивали при 25°С в течение 2 часов. После стандартной обработки, затем препаративной ВЭЖХ [колонка XBridge Prep OBD C18 30×150 мм, 5 мкм; подвижная фаза А: вода (10 ммоль/л NH4HCO3), подвижная фаза В: MeCN; скорость потока: 20 мл/мин; градиент: от 35% В до 39% В за 35 мин; 254/220 нм) получили изомер 2 Соединения 4 (20,00 мг, 24,25%) в виде белого твердого вещества. 1H ЯМР (300 МГц, CD3OD) δ 1.36 (dtd, 2Н), 1.50-1.93 (m, 3Н), 2.13-2.45 (m, 5Н), 2.63 (dt, 1Н), 2.86-2.97 (m, 1Н), 3.05 (dq, 1Н), 3.33-3.56 (m, 2Н), 4.71 (ddt, 1Н), 6.48 (dd, 1Н), 6.98-7.12 (m, 3Н), 7.27-7.40 (m, 2Н), 7.66 (t, 1H). 19F ЯМР (300 МГц, CD3OD) δ - 76.962 (m, 3F), -119.017 (s, 1F). ЖХМС: m/z (ЭРИ), [М+Н]+ = 353.
Соединение 5
Стадия 1. трет-Бутил-(3R)-1-(2-(4-циано-1Н-1,2,3-пиразол-1-ил)-4-(4-фторфенил)-циклопентил)пиперидин-3-илкарбамат
Реакцию Мицунобу F2a (350 мг, 0,92 ммоль), 1Н-1,2,3-триазол-4-карбонитрила (87 мг, 0,92 ммоль), PPh3 (485 мг, 1,85 ммоль) в DCM (15 мл) и DTAD (426 мг, 1,85 ммоль) осуществляли, как описано выше для синтеза соединения 3. После С18 колоночной флэш-хроматографии [градиент элюирования от 20 до 60% MeCN в воде (с 0,3% водн. NH3)] получили бесцветное масло (220 мг, 52,3%). После препаративной хиральной ВЭЖХ этого масла [Phenomenex Lux 5u Cellulose-4, AXIA Packed, 250×21,2 мм, 5 мкм; подвижная фаза А: гексаны-ВЭЖХ, подвижная фаза В: IPA--ВЭЖХ; скорость потока: 20 мл/мин; градиент: от 30 В до 30 В за 12 мин; 254/220 нм; RT1: 6,2; RT2: 8,4] получили трет-бутил-(3R)-1-(4-(4-фторфенил)-2-гидроксициклопентил)-пиперидин-3-илкарбамат (95 мг, 43,2%, фракция 1) в виде бесцветного масла и трет-бутил-(3R)-1-(4-(4-фторфенил)-2-гидроксициклопентил)пиперидин-3-илкарбамат (95 мг, 43,2%, фракция 2) в виде бесцветного масла. ЖХМС для обоих изомеров: m/z (ЭРИ), [М+Н]+ = 455.
Стадия 2. 1-[2-(3-Амино-1-пиперидил)-4-(4-фторфенил)циклопентил]тразол-4-карбонитрил Соединение 5
TFA (1 мл, 12,98 ммоль) добавляли к фракции 1 трет-бутил-(3R)-1-(4-(4-фторфенил)-2-гидроксициклопентил)пиперидин-3-илкарбамата (60 мг, 0,13 ммоль) в DCM (5 мл). Полученную смесь перемешивали при 25°С в течение 2 ч, и растворитель затем удаляли при пониженном давлении. После очистки препаративной ВЭЖХ (колонка: XBridge Shield RP18 OBD, 5 мкм, 19×150 мм; подвижная фаза А: вода (0,05% водн. NH3), подвижная фаза В: MeCN; скорость потока: 20 мл/мин; градиент: от 20% В до 47% В за 7 мин; 254/220 нм) получили изомер 1 Соединения 5 (73,0 мг, 56,4%) в виде белого твердого вещества. 1H ЯМР (300 МГц, CD3OD) δ 1.58-1.71 (m, 1Н), 1.75 (s, 1Н), 1.97 (s, 3Н), 2.50 (s, 3Н), 2.74 (br s, 2Н), 2.95 (m, 1Н), 3.22 (m, 1Н), 3.46 (m, 1H), 3.61-3.72 (m, 1Н), 3.92 (br.s, 1H), 5.53 (s, 1Н), 7.01-7.15 (m, 2Н), 7.31-7.42 (m, 2Н), 8.34 (dd, 1H). 19F ЯМР (300 МГц, CD3OD) δ -77.222 (m, 16F), -118.395 (s, 1F), ЖХМС: m/z (ЭРИ), [М+Н]+ = 355.
Соединение 6
Стадия 1. Синтез трет-бутил-(3R,5R)-1-(2-(4-циано-1Н-пиразол-1-ил)-4-(4-фторфенил)-циклопентил)-5-фторпиперидин-3-илкарбамата
Реакцию Мицунобу DIAD (235 мг, 1,16 ммоль), PPh3 (305 мг, 1,16 ммоль), 1Н-пиразол-4-карбонитрила (64,9 мг, 0,70 ммоль) и F2b (220 мг, 0,58 ммоль) в DCM (20 мл) проводили при к.т. Неочищенный продукт после обработки очищали С18 колоночной флэш-хроматографией, градиент элюирования от 0 до 48% MeCN в воде (содержит 0,3% NH4HCO3). Чистые фракции выпаривали досуха с получением бледно-желтого твердого вещества (220 мг, 80%). ЖХМС: m/z (ЭРИ), [М+Н]+ = 472. Неочищенный продукт дополнительно очищали препаративной хиральной ВЭЖХ [колонка Chiralpak IA, изократическое элюирование 30% EtOH в гексанах (модифицированных 0,1% DEA) в качестве элюента] с получением изомера 1 трет-бутил-(3R,5R)-1-(2-(4-циано-1H-пиразол-1-ил)-4-(4-фторфенил)циклопентил)-5-фторпиперидин-3-илкарбамата (100 мг, 45,5%, 100% ее) в виде бледно-желтого твердого вещества и изомера 2 трет-бутил-(3R,5R)-1-(2-(4-циано-1H-пиразол-1-ил)-4-(4-фторфенил)циклопентил)-5-фторпиперидин-3-илкарбамата (98 мг, 44,5%, изомер 2, 100% ее) в виде белого твердого вещества. ЖХМС для обоих изомеров: m/z (ЭРИ), [М+Н]+ = 472.
Стадия 2. 1-[2-(3-Амино-5-фтор-1-пиперидил)-4-(4-фторфенил)циклопентил]-пиразол-4-карбонитрил Соединение 6
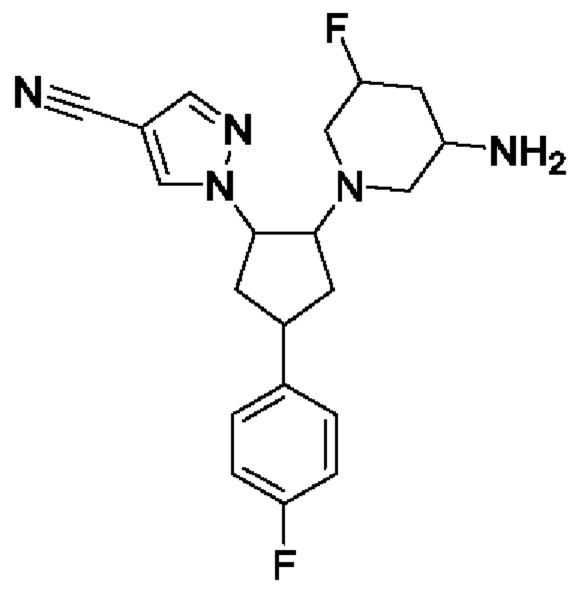
Удаление защитной группы Boc изомера 1 трет-бутил-(3R,5R)-1-(2-(4-циано-1Н-пиразол-1-ил)-4-(4-фторфенил)циклопентил)-5-фторпиперидин-3-илкарбамата (100 мг, 0,21 ммоль) проводили с использованием TFA (3 мл, 38,94 ммоль) в DCM (20 мл) при 0°С. После стандартной обработки неочищенный продукт очищали препаративной ВЭЖХ [(колонка XBridge Prep С18 OBD, 5 мкм диоксид кремния, диаметр 19 мм, длина 150 мм), используя убывающе полярные смеси воды (содержащей 0,05% TFA) и MeCN в качестве элюентов]. Фракции, содержащие целевое соединение, выпаривали досуха с получением изомера 1 Соединения 6 в форме TFA соли (68,0 мг, 37,1%) в виде белого твердого вещества. ЖХМС: m/z (ЭРИ), [М+Н]+ = 372. 1H ЯМР (400 МГц, CD3OD) 8.52-8.44 (1Н, d), 8.03-7.96 (1H, s), 7.41-7.29 (2Н, m), 7.13-7.00 (2Н, m), 5.06-4.95 (1.5H, m),4.81 (0.5Н, s) 3.79-3.64 (1Н, dt), 3.66-3.49 (2Н, m), 3.14-3.03 (1Н, d), 3.03-2.89 (1Н, q), 2.79-2.60 (1Н, dd), 2.49-2.29 (4Н, ddd), 2.26-2.15 (1Н, d), 1.97-1.74 (2Н, m). 19F ЯМР (282 МГц, CD3OD) δ -77.36, -118.84, -185.37.
Соединение 7
Стадия 1. трет-Бутил-1-(2-(4-циано-1Н-пиразол-1-ил)-4-(4-фторфенил)-циклопентил)-4,4-дифторпиперидин-3-илкарбамат
В результате реакции Мицунобу ди-трет-бутил-(Е)-диазен-1,2-дикарбоксилата (220 мг, 0,21 ммоль), F2c (220 мг, 0,53 ммоль), 1Н-пиразол-4-карбонитрила (10 мг, 0,11 ммоль) и PPh3 (56,4 мг, 0,21 ммоль) в DCM (10 мл) при 5°С в атмосфере азота получили, после стандартной обработки и флэш-хроматографии на оксиде алюминия (градиент элюирования от 0 до 60% MeCN в воде), трет-бутил-1-(2-(4-циано-1Н-пиразол-1-ил)-4-(4-фторфенил)циклопентил)-4,4-дифторпиперидин-3-илкарбамат (120 мг, 46%) в виде бесцветного масла. Этот неочищенный продукт дополнительно очищали препаративной хиральной ВЭЖХ [(колонка: Phenomenex Lux 5 мкм Cellulose-4, AXIA Packed, 2,12×25 см; подвижная фаза А: гексаны-ВЭЖХ, подвижная фаза В: EtOH-ВЭЖХ; скорость потока: 20 мл/мин; градиент: А:В = 80:20 за 40 мин; 254/220 нм; RT1: 10,664; RT2: 13,923)] получили 3 изомера (все в виде белого твердого вещества, и m/z (ЭРИ), [М+Н]+ = 490,4): изомер 1 (50,0 мг, 41,7%, 98% ее), изомер 2 (40,0 мг, 33,3%, 98% ее) и изомер 3 (30,0 мг, 25,00%, 100% ее; ЖХМС для всех изомеров: m/z (ЭРИ), [M+H]+ = 490.
ЕА
Стадия 2. 1-[2-(3-Амино-4,4-дифтор-1-пиперидил)-4-(4-фторфенил)циклопентил]-пиразол-4-карбонитрил Соединение 7

Удаление защитной группы Boc изомера 2 трет-бутил-1-(2-(4-циано-1Н-пиразол-1-ил)-4-(4-фторфенил)циклопентил)-4,4-дифторпиперидин-3-илкарбамата (40 мг, 0,08 ммоль) в DCM (3 мл) при 25°C с использованием TFA (47,5 мг, 0,49 ммоль) привело к получению, после препаративной ВЭЖХ (колонка: XBridge Prep С18 OBD 19×150 мм, 5 мкм; подвижная фаза А: вода (10 ммоль/л NH4HCO3), подвижная фаза В: MeCN; скорость потока: 20 мл/мин; градиент: от 46% В до 47% В за 7 мин; 254/220 нм; Rt: 6,05 мин), Соединения 7 (15,00 мг, 47,1%) в виде желтого твердого вещества. 1Н ЯМР (300 МГц, CD3OD) δ 1.70-2.03 (2Н, m), 2.05-2.24 (1Н, m), 2.25-2.45 (4Н, m), 2.61 (2Н, dddd), 2.80-3.11 (2H, m), 3.45-3.87 (2H, m), 4.94-5.03 (1H, m), 6.97-7.16 (2H, m), 7.26-7.45 (2H, m), 7.97 (1H, s), 8.46 (1H, s). 19F ЯМР (282 МГц, CD3OD) δ -119.11 -118.71 (m), -107.36, -106.52. ЖХМС: m/z (ЭРИ), [M+H]+ = 390.
Соединение 8
Стадия 1. трет-Бутил-(3R)-1-(4-(4-фторфенил)-2-(1H-пиразол-1-ил)-циклопентил)пиперидин-3-илкарбамат
Реакцию Мицунобу F2a (10 г, 26,42 ммоль), 1Н-пиразола (18 г, 264,40 ммоль), PPh3 (14 г, 53,38 ммоль) и DTAD (12 г, 52,11 ммоль) в DCM (1,5 л) проводили при 0°С в атмосфере азота. После стандартной обработки и после С18 колоночной флэш-хроматографии (от 0 до 100% MeCN в воде) получили неочищенный продукт (9,80 г, 87%) в виде желтого масла. ЖХМС: m/z (ЭРИ), [M+H]+ = 429; 1Н ЯМР (400 МГц, CDCl3) δ 1.47 (9Н, d), 1.52-1.82 (6Н, m), 2.20-2.55 (6Н, m), 2.66 (1Н, d), 3.53-3.81 (2Н, m), 4.75 (2Н, s), 6.27 (1Н, dt), 7.01 (2Н, t), 7.23 (2Н, td), 7.48-7.59 (2Н, m). Этот неочищенный продукт (4,5 г) очищали на препаративной системе Waters SFC 350 [Phenomenex Lux 5 мкм Cellulose-3, 5 см × 25 см, 5 мкм; подвижная фаза А: 80%, подвижная фаза В: МеОН (0,1% изопропиламина): 20%; скорость потока: 160 мл/мин; 220 нм; RT1: 3,93; RT2: 4,58] с получением трет-бутил-(3R)-1-(4-(4-фторфенил)-2-(1H-пиразол-1-ил)циклопентил)пиперидин-3-илкарбамата (2,000 г, 44,4%, 98.7% ее, изомер 1) в виде желтого твердого вещества.
Стадия 2. 1-[4-(4-Фторфенил)-2-пиразол-1-ил-циклопентил]-пиреридин-3-амин Соединение 8
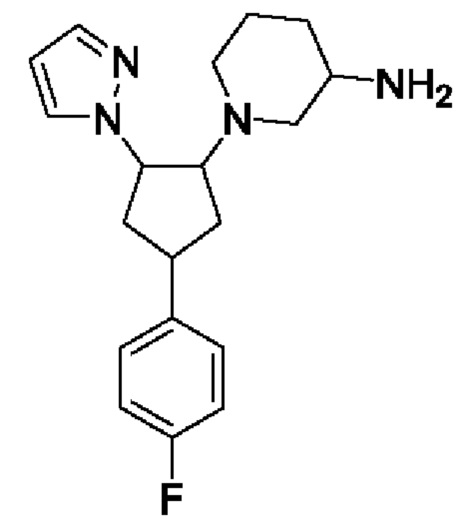
Удаление защитной группы Вос изомера 1 трет-бутил-((R)-1-((1S,2S,4R)-4-(4-фторфенил)-2-(1Н-пиразол-1-ил)циклопентил)пиперидин-3-ил)карбамата (2,0 г, 4,667 ммоль) в DCM (30,0 мл) с использованием TFA (6,0 мл) проводили, как описано выше. После флэш-хроматографии на диоксиде кремния (от 0 до 10% МеОН в DCM, 2%-ный гидроксид аммония в DCM использовали для подщелачивания колонки с диоксидом кремния) получили Соединение 8 (1,400 г, 91%) в виде белого твердого вещества. ЖХМС: m/z (ЭРИ), [М+Н]+ = 329; 1Н ЯМР (300 МГц, CD3OD) δ 1.10 (1Н, dtd), 1.48-2.08 (6Н, m), 2.13-2.49 (3Н, m), 2.77 (2Н, ddt), 2.89-3.02 (1Н, m), 3.54 (2Н, ddt), 4.91 (1Н, td), 6.31 (1Н, t), 7.03 (2Н, ddt), 7.28-7.39 (2Н, m), 7.53 (1Н, d), 7.79 (1Н, dd). 19F ЯМР (376 МГц, CD3OD) δ - 119.16.
Соединение 9
Стадия 1. трет-Бутил-(3R,5R)-5-фтор-1-(4-(4-фторфенил)-2-(1H-пиразол-1-ил)-циклопентил)пиперидин-3-илкарбамат
DTAD (1,742 г, 7,57 ммоль) добавляли к F2b (1,0 г, 2,52 ммоль), 1Н-пиразолу (0,859 г, 12,61 ммоль) и PPh3 (1,985 г, 7,57 ммоль) в DCM (50 мл), охлажденном до 0°С, в течение периода времени 5 минут в атмосфере азота. Полученную смесь перемешивали при к.т. в течение 3 часов. Неочищенный продукт очищали препаративной ВЭЖХ [колонка XBridge Prep OBD C18 19×250 мм, 5 мкм; подвижная фаза А: вода (0,05% водн. NH3), подвижная фаза В: MeCN; скорость потока: 60 мл/мин; градиент: от 40% В до 50% В за 7 мин; 220, 254 нм; RT: 6,48 мин] с получением трет-бутил-(3R,5R)-5-фтор-1-(4-(4-фторфенил)-2-(1Н-пиразол-1-ил)циклопентил)пиперидин-3-илкарбамата (0,700 г, 62,2%) в виде белого твердого вещества. ЖХМС: m/z (ЭРИ), [М+Н]+ = 447,3; 1Н ЯМР (CDCl3) δ 7.58 (d, 1Н), 7.51 (t, 1Н), 7.24 (ddd, 2Н), 7.11-6.94 (m, 2Н), 6.29 (q, 1Н), 4.73 (d, 2Н), 3.68-3.46 (m, 3Н), 2.83 (s, 1Н), 2.74-2.52 (m, 2Н), 2.39 (t, 3Н), 2.34-2.19 (m, 1Н), 2.00 (s, 1Н), 1.78 (dt, 2Н), 1.63 (s, 1Н), 1.48 (d, 9Н). После препаративной СФХ на препаративной системе Waters SFC 350 [Chiralpak AS-H, 5×25 см, 5 мкм; подвижная фаза А: СО2: 70%, подвижная фаза В: МеОН-препаративный: 30%; скорость потока: 150 мл/мин; 220 нм; RT1: 4,2; RT2: 5,31] получили целевой продукт, изомер 1, (330 мг, 47,1%) в виде белого твердого вещества и изомер 2 (335 мг, 47,9%) в виде желтой смолы.
Стадия 2. 5-Фтор-1-[4-(4-фторфенил)-2-пиразол-1-ил-циклопентил]-пиреридин-3-амин Соединение 9

TFA (2,0 мл) добавляли к изомеру 1 трет-бутил-((3R,5S)-5-фтор-1-((1S,2S,4R)-4-(4-фторфенил)-2-(1Н-пиразол-1-ил)циклопентил)пиперидин-3-ил)карбамата (328 мг, 0,73 ммоль) в DCM (8 мл). Полученную смесь перемешивали при к.т. в течение 2 часов. После препаративной ВЭЖХ [колонка XBridge Prep OBD С18 30×150 мм, 5 мкм; подвижная фаза А: вода (0,05% NH3H2O), подвижная фаза В: MeCN; скорость потока: 60 мл/мин; градиент: от 25% В до 50% В за 7 мин; 254/220 нм; Rt: 5,40 мин] получили Соединение 9 (120 мг, 47,2%, изомер 1) в виде белого твердого вещества, m/z (ЭРИ), [М+Н]+ = 347,1; 1Н ЯМР (300 МГц, CD3OD) δ 7.81 (d, 1H), 7.54 (d, 1H), 7.43-7.25 (m, 2Н), 7.12-6.97 (m, 2Н), 6.32 (t, 1Н), 5.01-4.88 (m, 1Н), 4.75-4.64 (m, 1Н), 3.67-3.45 (m, 2Н), 3.17-2.83 (m, 3Н), 2.49-2.15 (m, 4Н), 2.14-1.74 (m, 3Н), 1.43 (dddd, 1H). 19F ЯМР (282 МГц, CD3OD) δ -119.15, -183.33.
Соединение 10
Стадия 1. трет-Бутил-N-[(3R,5R)-5-фтор-1-[(1R,2R,4S)-4-(4-фторфенил)-2-(1,2,4-триазол-1-ил)циклопентил]-3-пиперидил]карбамат и трет-бутил-N-[(3R,5R)-5-фтор-1-[(1S,2S,4R)-4-(4-фторфенил)-2-(1,2,4-триазол-1-ил)циклопентил]-3-пиперидил]карбамат

При 0°С раствор смеси 1:1 трет-бутил-N-[(3R,5R)-5-фтор-1-[(1R,2R,4S)-4-(4-фторфенил)-2-гидрокси-циклопентил]-3-пиперидил]карбамата и трет-бутил-N-[(3R,5R)-5-фтор-1-[(1S,2S,4R)-4-(4-фторфенил)-2-гидрокси-циклопентил]-3-пиперидил]карбамата (F2b) (12 г, 30,27 ммоль), 1Н-1,2,4-триазола (3,14 г, 45,40 ммоль) и PPh3 (11,91 г, 45,40 ммоль) в THF (150 мл) обрабатывали диизопропилазодикарбоксилатом (9,18 г, 45,40 ммоль). После 3 ч при 25°С растворитель удаляли при пониженном давлении. После С18 колоночной флэш-хроматографии остатка (от 10 до 28% MeCN в воде (с 0,2% TFA)) получили целевые продукты реакции Мицунобу (12,00 г, 89%) в виде светло-желтого масла.

Смесь диастереомеров из серии реакций, описанных выше (т.е. трет-бутил-N-[(3R,5R)-5-фтор-1-[(1R,2R,4S)-4-(4-фторфенил)-2-(1,2,4-триазол-1-ил)циклопентил]-3-пиперидил]карбамата и трет-бутил-N-[(3R,5R)-5-фтор-1-[(1S,2S,4R)-4-(4-фторфенил)-2-(1,2,4-триазол-1-ил)циклопентил]-3-пиперидил]карбамата), (694 г, 1,55 моль) разделяли хиральной СФХ [колонка: CelluCoat, 50×250 мм, 10 мкм; подвижная фаза: 17% МеОН в СО2; скорость потока: 450 мл/мин; 260 нм; RT1: 2,25 мин; RT2: 2,88 мин] с получением трет-бутил-N-[(3R,5R)-5-фтор-1-[(1R,2R,4S)-4-(4-фторфенил)-2-(1,2,4-триазол-1-ил)циклопентил]-3-пиперидил]карбамата (изомера 1) (335,3 г, 48,3%, 99,8% ee/de) в виде белого твердого вещества; 1H ЯМР (400 МГц, CDCl3) δ 1.44 (9Н, s), 1.73-1.93 (3Н, m), 2.17-2.44 (4Н, m), 2.55 (1Н, s), 2.62-2.9 (2Н, m), 3.54 (2Н, dt), 3.94 (1Н, s), 4.79 (3Н, ddd), 6.9-7.07 (2Н, m), 7.20 (2Н, ddd), 7.97 (1Н, s), 8.19 (1Н, s); ЖХМС: m/z (ЭРИ+), [М+Н]+ = 448; и трет-бутил-N-[(3R,5R)-5-фтор-1-[(1S,2S,4R)-4-(4-фторфенил)-2-(1,2,4-триазол-1-ил)циклопентил]-3-пиперидил]карбамата (изомера 2) (343 г, 49,4%, 98,1% ee/de) в виде белого твердого вещества; 1Н ЯМР (400 МГц, CDCl3) δ 1.45 (9Н, s), 1.74 (3Н, q), 2.18-2.46 (4Н, m), 2.56-2.82 (3Н, m), 3.53 (2Н, dtd), 3.97 (1Н, s), 4.80 (3Н, ddd), 6.93-7.06 (2Н, m), 7.20 (2Н, ddd), 7.97 (1Н, s), 8.16 (1Н, s); ЖХМС: m/z (ЭРИ+), [М+Н]+ = 448.
Стадия 2. (3R,5R)-5-Фтор-1-[(1R,2R,4S)-4-(4-фторфенил)-2-(1,2,4-триазол-1-ил)циклопентил]-пиреридин-3-амин Соединение 10

Удаление защитной группы Boc изомера 1 трет-бутил-N-[(3R,5R)-5-фтор-1-[(1R,2R,4S)-4-(4-фторфенил)-2-(1,2,4-триазол-1-ил)циклопентил]-3-пиперидил]-карбамата (335 г, 0,75 моль) в изопропаноле (1,32 л) проводили в атмосфере азота путем добавления 3,8 М HCl (водн. 1,18 л, 4,5 моль, 6 экв.) при 20°С, затем перемешивания в течение 15 ч при 50°С. Растворители удаляли в вакууме, и остаток разбавляли DCM (2,5 л), охлаждали до приблизительно 10°С и подщелачивали до рН 10-11 1,5 М Na2CO3 (требовалось приблизительно 2,5 л). Органический слой отделяли, и водный слой реэкстрагировали DCM (1,5 л). Объединенные органические слои промывали водой (1 л) и сушили над Na2SO4. После осветляющего фильтрования и выпаривания растворителей 260 г (3R,5R)-5-фтор-1-[(1R,2R,4S)-4-(4-фторфенил)-2-(1,2,4-триазол-1-ил)циклопентил]пиперидин-3-амина было получено в виде белого аморфного твердого вещества (количественный выход).
Кристаллизацию в целевой полиморф, упоминаемый выше как Форма А Соединения 10 или Форма А, осуществляли путем добавления изопропилацетата (450 мл) к (3R,5R)-5-фтор-1-[(1R,2R,4S)-4-(4-фторфенил)-2-(1,2,4-триазол-1-ил)-циклопентил]пиперидин-3-амину (280 г, 804 ммоль) и нагревания при 70°С на протяжении 30 минут (до образования гомогенного раствора). Затем добавляли порциями гептан (450 мл) в течение 20-30 минут. После перемешивания в течение 30 минут при 70°С температуру постепенно снижали, и перемешивание продолжали при приблизительно 20°С в течение ночи (приблизительно 16 ч). Для анализа дифракции рентгеновских лучей на порошке полученную в результате твердую Форму А выделяли фильтрованием и затем промывали холодным гептаном (150-200 мл). После сушки в течение ночи при 40°С в вакууме получили 269 г (96,4%-ный выход, >99,9% ee/de) Формы А Соединения 10 в виде кристаллического твердого вещества. 1H ЯМР (500 МГц, DMSO-d6) δ 1.31 (1Н, m), 1.71 (1Н, q), 1.85 (2Н, m), 1.91 (1H, d), 2.20 (2Н, d), 2.24 (2Н, m), 2.33 (1Н, dd), 2.81 (1Н, d), 2.84 (1H, s), 2.89 (1Н, s), 3.38 (1Н, m), 3.49 (1Н, m), 4.78 (1Н, d), 5.01 (1Н, s), 7.12 (2Н, t), 7.37 (2Н, dd), 8.01 (1Н, s), 8.67 (1Н, s); ЖХМС: m/z (ЭРИ+), [М+Н]+ = 348. Кристаллографические данные приведены выше, например в Таблице 1 и на Фиг. 1.
Соединение 11
Стадия 1. трет-Бутил-(3R,5R)-5-фтор-1-(4-(4-фторфенил)-2-(2H-тетразол-2-ил)циклопентил)пиперидин-3-илкарбамат
Ди-трет-бутилазодикарбоксилат (437 мг, 1,90 ммоль) добавляли к F2b (376 мг, 0,95 ммоль), 2Н-тетразолу (100 мг, 1,42 ммоль) и Ph3P (497 мг, 1,90 ммоль) в DCM (30 мл) при 0°С в атмосфере азота. Полученную смесь перемешивали при 25°С в течение 8 часов, и затем растворитель удаляли при пониженном давлении. Неочищенный продукт очищали С18 флэш-хроматографией (от 0 до 40% MeCN в воде). Чистые фракции выпаривали досуха с получением транс-трет-бутил-(3R,5R)-5-фтор-1-(4-(4-фторфенил)-2-(2H-тетразол-2-ил)циклопентил)пиперидин-3-илкарбамата (253 мг, 59,5%) в виде белого твердого вещества. ЖХМС: m/z (ЭРИ), [М+Н]+ = 449,5. 1Н ЯМР (400 МГц, CD3OD) δ 8.78 (s, 1Н), 7.38 (dd, 2Н), 7.06 (t, 2Н), 5.68-5.55 (m, 1Н), 4.74 (s, 1Н), 3.85 (s, 1Н), 3.73-3.57 (m, 2Н), 3.10-2.92 (m, 2Н), 2.51-2.35 (m, 4Н), 2.12-1.86 (m, 4Н), 1.45 (d, 9Н). Неочищенный продукт очищали препаративной хиральной ВЭЖХ на колонке Chiralpak IA, изократическое элюирование 20% EtOH в гексанах (0,1% DEA) в качестве элюента. Фракции, содержащие целевое соединение, выпаривали досуха с получением изомера 1 (114 мг, 45,1%, изомер 1, 100% ее), фракции 2 (18,00 мг, 7,11%, смесь (изомера 2 и изомера 3) и изомера 4 (89 мг, 35,2%, 95,5% ее) в виде белого твердого вещества.
Стадия 2. 5-Фтор-1-[4-(4-фторфенил)-2-(тетразол-2-ил)циклопентил]-пиреридин-3-амин Соединение 11

TFA (1 мл, 12,98 ммоль) добавляли к вышеуказанному изомеру 1 (112 мг, 0,25 ммоль) в DCM (4 мл) при 25°С для удаления группы Boc. Полученную смесь перемешивали при 25°С в течение 2 часов, и затем растворитель удаляли при пониженном давлении. Неочищенный продукт очищали препаративной ВЭЖХ [(колонка XBridge Prep C18 OBD, диоксид кремния 5 мкм, диаметр 19 мм, длина 150 мм), используя в убывающе полярные смеси воды (содержащей 0,05% NH3H2O) и MeCN в качестве элюентов]. Фракции, содержащие целевое соединение, выпаривали досуха с получением Соединения 11 (40,0 мг, 46,0%, изомер 1) в виде белого твердого вещества. Это соединение оказалось наиболее эффективным изомером. ЖХМС: m/z (ЭРИ), [М+Н]+ = 349,5. ДСК: температура: 272,86°С; 1Н ЯМР (300 МГц, CD3OD) δ 8.79 (s, 1H), 7.52-7.31 (m, 2Н), 7.18-6.98 (m, 2Н), 5.59 (ddd, 1Н), 4.75 (s, 1Н), 3.66 (ddt, 2Н), 3.20-2.94 (m, 3Н), 2.59-2.26 (m, 4Н), 2.28-1.86 (m, 3Н), 1.62-1.23 (m, 1H). 19F ЯМР (300 МГц, CD3OD) δ -118.88-118.76 (1F, s), 184.37-183.48 (1F, s).
Соединение 12
Стадия 1. трет-Бутил-(3R)-1-(4-(4-фторфенил)-2-(2H-тетразол-2-ил)циклопентил)пиперидин-3-илкарбамат
Ди-трет-бутил-(Е)-диазен-1,2-дикарбоксилат (122 мг, 0,53 ммоль) добавляли к F2a (200 мг, 0,53 ммоль), 2Н-тетразолу (37,0 мг, 0,53 ммоль) и трифенилфосфину (139 мг, 0,53 ммоль) в DCM (10 мл) при 0°С в течение периода времени 5 минут в атмосфере азота. Полученную смесь перемешивали при к.т. в течение 15 часов. Растворитель удаляли при пониженном давлении. После колоночной флэш-хроматографии на диоксиде алюминия (от 0 до 70% MeCN в воде) получили белое твердое вещество (155 мг, 68%) (ЖХМС: m/z (ЭРИ), [M+H]+ = 431,15; TFA, ВЭЖХ Rt = 0,729 мин). После препаративной хиральной ВЭЖХ [(колонка: CHIRALART Cellulose-SB, 2×25 см, 5 мкм; подвижная фаза А: гексаны (0,1% TFA), подвижная фаза В: EtOH; скорость потока: 20 мл/мин; градиент: А:В = 85:15 за 15 мин; 254/220 нм; RT1: 11,2; RT2: 13,32] получили изомер 1 трет-бутил-(3R)-1-(4-(4-фторфенил)-2-(2Н-тетразол-2-ил)-циклопентил)пиперидин-3-илкарбамата (70,0 мг, 45,1%, 100% ее) в виде бесцветного масла и изомер 2 (70,0 мг, 45,1%, 100% ее) в виде бесцветного масла.
Стадия 2. 1-[4-(4-Фторфенил)-2-(тетразол-2-ил)циклопентил]пиреридин-3-амин Соединение 12
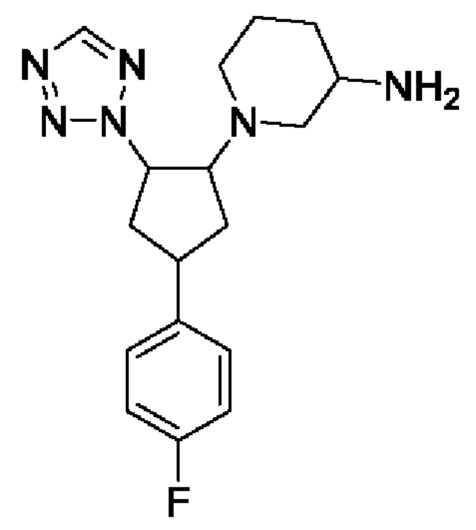
TFA (96 мг, 0,98 ммоль) добавляли к изомеру 1 трет-бутил-(3R)-1-(4-(4-фторфенил)-2-(2Н-тетразол-2-ил)циклопентил)пиперидин-3-илкарбамата (70 мг, 0,16 ммоль) в DCM (5 мл) при к.т. После перемешивания в течение 1 часа при к.т. растворитель удаляли при пониженном давлении. Неочищенный продукт очищали препаративной ВЭЖХ [(колонка: XBridge Prep OBD С18 19×250 мм, 5 мкм; подвижная фаза А: вода (0,05% водн. NH3), подвижная фаза В: MeCN; скорость потока: 20 мл/мин; градиент: от 36% В до 46% В за 7 мин; 220, 254 нм; Rt: 5,79 мин с получением Соединения 12 (25,00 мг, 46,5%) в виде белого твердого вещества. ЖХМС: m/z (ЭРИ), [M+H]+ = 331,5; TFA, ВЭЖХ Rt = 1,129 мин; 1Н ЯМР (300 МГц, CD3OD) δ 1.17 (1Н, dtd), 1.50-1.64 (1Н, m), 1.73 (1Н, ddd), 1.83-2.19 (4Н, m), 2.34-2.56 (3Н, m), 2.77-3.02 (3Н, m), 3.50-3.80 (2Н, m), 5.59 (1Н, ddd), 7.00-7.13 (2Н, m), 7.31-7.43 (2Н, m), 8.77 (1Н, s). 19F ЯМР (282 МГц, CD3OD) δ -118.65, -76.86. ДСК: температура: 281,89°С.
Соединение 13
Стадия 1. трет-Бутил-(3R)-1-(2-(3-циано-1H-1,2,4-триазол-1-ил)-4-(4-фторфенил)циклопентил)пиперидин-3-илкарбамат
Ди-трет-бутилазодикарбоксилат (426 мг, 1,85 ммоль) добавляли к F2a (350 мг, 0,92 ммоль), 1Н-1,2,4-триазол-3-карбонитрилу (104 мг, 1,11 ммоль) и Ph3P (485 мг, 1,85 ммоль) в DCM (10 мл) при 25°С в атмосфере азота, затем перемешивали при 25°С в течение 3 часов. После стандартной обработки и С18 колоночной флэш-хроматографии (от 0 до 40% MeCN в воде (содержащей 0,3% NH3OH)) получили белое твердое вещество (350 мг). После препаративной ТСХ (петролейный эфир:EtOAc = 2:1) получили фракцию 1 (110 мг, 26%) и фракцию 2 (230 мг, 55%) в виде белых твердых веществ. Фракцию 1 дополнительно разделяли препаративной хиральной ВЭЖХ на колонке Chiralpak IA, изократическое элюирование гексаном в EtOH в качестве элюента, с получением изомера 1 трет-бутил-(3R)-1-(2-(3-циано-1Н-1,2,4-триазол- 1-ил)-4-(4-фторфенил)циклопентил)пиперидин-3-илкарбамата (31,0 мг, 28%, 100% ее) и изомера 2 (37.0 мг, 34%, 100% ее) в виде белого твердого вещества.
Стадия 2. 1-[2-(3-Амино-1-пиперидил)-4-(4-фторфенил)циклопентил]-1,2,4-триазол-3-карбонитрил Соединение 13

TFA (1,0 мл) добавляли к полученному на стадии 1 изомеру 1 (31 мг, 0,07 ммоль) в DCM (5 мл) при 25°С.Полученную смесь перемешивали при 25°С в течение 2 ч, концентрировали и затем очищали препаративной ВЭЖХ (колонка XBridge Prep C18, 5 мкм диоксид кремния, диаметр 19 мм, длина 150 мм), используя убывающе полярные смеси воды (содержащей 0,05% TFA) и MeCN в качестве элюентов с получением Соединения 13 (24,3 мг, 46%), в виде белого твердого вещества; ЖХМС: m/z (ЭРИ) [M+H]+ = 355,5; 1Н ЯМР (300 МГц, CD3OD) δ 8.27 (s, 1Н), 7.35 (dd, 2Н), 7.06 (t, 2Н), 5.44 (q, 1H), 4.04 (dt, 1H), 3.72-3.37 (m, 3Н), 3.03-2.87 (m, 1Н), 2.82-2.67 (m, 2Н), 2.50 (ddd, 3Н), 2.13-1.87 (m, 3Н), 1.85-1.48 (m, 2Н).
Соединение 14 и Соединение 15
Стадия 1. трет-Бутил-(3R)-1-(4-(4-фтор-3-метоксифенил)-2-гидроксициклопентил)пиперидин-3-илкарбамат
В раствор F4 (100 мг, 1,0 экв.) в 3 мл безводного этанола добавляли (R)-трет-бутил-пиперидин-3-илкарбамат (115 мг, 1,2 экв.) и карбонат натрия (101 мг, 2,0 экв.) в герметичной пробирке. Суспензию облучали в микроволновом реакторе при 130°С в течение 6 ч, затем фильтровали и концентрировали. После колоночной хроматографии (силикагель от 0 до 3% метанола в DCM) получили трет-бутил-(3R)-1-(4-(4-фтор-3-метоксифенил)-2-гидроксициклопентил)пиперидин-3-илкарбамат (140 мг, 71%-ный выход) в виде бесцветного твердого вещества. 1Н ЯМР (CDCl3 400 МГц) δ 6.99 (dd, 1Н), 3.86 (dd, 1Н), 6.75-6.71 (m, 1Н), 4.92 (br. s, 1H), 4.27-4.21 (m, 1H), 3.89 (s, 3Н), 3.75 (br. s, 1H), 3.10-3.06 (m, 2H), 2.88-2.75 (m, 2H), 2.53 (br. s, 2H), 2.41-2.35 (m, 2H), 2.15-2.05 (m, 1H), 1.90-1.66 (m, 6H), 1.40 (d, 9H).
Стадия 2. трет-Бутил-(3R)-1-(2-(4-цианофенокси)-4-(4-фтор-3-метоксифенил)циклопентил)пиреридин-3-алкарбамат
Раствор трет-бутил-(3R)-1-(2-(4-цианофенокси)-4-(4-фтор-3-метоксифенил)-циклопентил)пиперидин-3-илкарбамата (140 мг, 1,0 экв.) в 3 мл безводного THF перемешивали и обрабатывали NaH (35 мг, 2,5 экв.). Через 0,5 ч 4-фторбензонитрил (50 мг, 1,2 экв.) добавляли в эту реакционную смесь, которую затем перемешивали в течение 18 ч при к.т. и затем при 45°С в течение 18 ч. Реакционную смесь затем вливали в 5 мл насыщенного раствора NH4Cl, экстрагировали EtOAc (5 мл × 3), сушили и очищали колоночной хроматографией на силикагеле (DCM/MeOH = 20/1) с получением целевого 4-цианофенокси-соединения (80 мг, 46%-ный выход). После очистки с использованием препаративной системы Waters SFC 350 [колонка: AS (250 мм × 30 мм 5 мкм); условия: 25% 1РА в водн. NH3 60 мл/мин] получили изомер 1 трет-бутил-(3R)-1-(2-(4-цианофенокси)-4-(4-фтор-3-метоксифенил)циклопентил)пиперидин-3-илкарбамата (30 мг, 37%-ный выход) и изомер 2 (35 мг, 43%-ный выход). Изомер 1 демонстрирует ЖХМС Rt = 0,892 мин в 5-95АВ_1,5 мин хроматографии, MS (ЭРИ) m/z=510,3 [M+H]+. 1H ЯМР (CDCl3 400 МГц) δ 7.84 (dd, 1Н), 7.60 (dd, 2Н) 7.16-7.11 (m, 1Н), 6.99-6.96 (m, 1Н), 6.84-6.82 (m, 1Н), 6.77-6.73 (m, 1Н), 4.79-4.77 (m, 2Н), 3.88 (s, 3Н), 3.73 (br. s, 1H), 3.25-3.19 (m, 2Н), 2.69-2.63 (m, 2Н), 2.47-2.19 (m, 4Н), 2.04-1.95 (m, 1Н), 1.88-1.82 (m, 2Н), 1.68-1.64 (m, 3Н), 1.43 (d, 9Н). ЖХМС: m/z (ЭРИ), [M+H]+ = 510.
Стоймя 3. 4-[2-(3-Амино-1-пмперидил)-4-(4-фтор-3-гидрокси-фенил)-циклопентокси]бензонитрил (Соединение 14) и 4-[2-(3-амино-1-пмперидил)-4-(4-фтор-3-метокси-фенил)циклопентокси]бензонитрил (Соединение 15)

В раствор изомера 1 описанного выше карбамата (30 мг) в DCM (2 мл) добавляли BBr3 (0,5 мл) при -78°С. Смесь перемешивали при -78°С в течение 1 ч. Смесь вливали в водн. NH4Cl (20 мл), доводили до рН = 10, используя водн. NaHCO3, затем экстрагировали DCM (2×20 мл). Органические слои сушили над сульфатом натрия, концентрировали и очищали препаративной ВЭЖХ [(метод: колонка: Durashell С18 150×25 мм х 5 мкм; градиент: 43-73% В (А = вода/0,05% аммиака, В = ацетонитрил), скорость потока: 25 мл/мин)] с получением Соединения 14 (1,3 мг, 5,6%-ный выход) и Соединения 15 (1,0 мг, 4,1%-ный выход).
Соединение 14: ЖХМС: m/z (ЭРИ), [М+Н]+ = 396. 1Н ЯМР (CD3OD 400 МГц) δ 7.65 (d, 2Н), 7.15 (d, 2Н), 6.93 (dd, 1Н), 6.82 (d, 1Н), 6.70-6.64 (m, 1Н), 5.00-4.98 (m, 1Н), 3.26-3.18 (m, 2Н), 3.05 -2.95 (m, 1Н), 2.93-2.63 (m, 3Н), 2.30-2.14 (m, 2Н), 2.10-1.95 (m, 2Н), 1.90-1.65 (m, 3Н), 1.63-1.49 (m, 1Н), 1.24-1.10 (m, 1Н).
Соединение 15: ЖХМС: m/z (ЭРИ), [M+H]+ = 410. 1Н ЯМР (CD3OD 400 МГц) δ 7.66 (d, 2Н), 7.15 (d, 2Н), 7.00-6.96 (m, 2Н), 6.83-6.75 (m, 1Н), 4.72-4.65 (m, 1Н), 3.84 (s, 3Н), 3.42-3.35 (m, 1H), 3.30-3.23 (m, 1H), 3.05-2.95 (m, 1Н), 2.90-2.65 (m, 3Н), 2.35-2.15 (m, 2Н), 2.14-1.95 (m, 2Н), 1.91-1.68 (m, 3Н), 1.62-1.49 (m, 1Н), 1.25-1.13 (m, 1H).
Соединение 16
Стадия 1. трет-Бутил-(3R)-1-(2-(2-хлор-4-цианофенокси)-4-(3-фторфенил)-циклопентил)пиперидин-3-илкарбамат
В раствор F3 (580 мг) в THF (8 мл) порциями добавляли NaH (184 мг, 3,0 экв.) при 0°С. После перемешивания при этой температуре в течение 30 мин порциями добавляли 3-хлор-4-фторбензонитрил (285 мг, 1,2 экв.), растворенный в THF (2 мл). Реакционную смесь перемешивали при к.т. в течение ночи, затем гасили водным NH4Cl (20 мл), разбавляли водой (50 мл), экстрагировали этилацетатом (50 мл × 3) и сушили над Na2SO4. Объединенный органический слой концентрировали с получением целевого эфира (920 мг) в виде желтого масла. ЖХМС: m/z (ЭРИ), [М+Н]+ = 514.
Стадия 2. 4-[2-(3-Амино-1-пиперидил)-4-(3-фторфенил)циклопентокси]-3-хлор-бензонитрил Соединение 16

Раствор вышеуказанного Вос-защищенного соединения (920 мг) в смеси HCl/диоксан (10 мл) перемешивали при к.т. в течение 2 ч, затем концентрировали с получением твердого вещества. Это твердое вещество промывали этилацетатом (3×20 мл), затем сушили с получением остатка (350 мг, 47%), который разделяли на препаративной системе Waters SFC 350 [колонка: AD (250×30 мм, 5 мкм), условия: 30% этанола/аммиак; скорость потока: 60 мл/мин] с получением изомера 1 Соединения 16 (95,7 мг) и второго изомера 2 того же соединения (125,1 мг).
Изомер 1 (Соединение 16): ЖХМС: m/z (ЭРИ) [M+H]+ = 414. Наиболее эффективный: 1Н ЯМР (CD3OD 400 МГц) δ 7.81-7.80 (1H, m), 7.68-7.65 (1H, m), 7.31-7.28 (2Н, m), 7.15-6.94 (3Н, m), 5.06-4.92 (1H, m), 3.40-3.25 (2Н, m), 3.05-2.95 (1Н, m), 2.92-2.72 (2Н, m), 2.45-2.36 (1Н, m), 2.32-2.00 (4Н, m), 1.90-1.51 (4Н, m), 1.24-1.19 (1Н, m).
Изомер 2: ЖХМС: m/z (ЭРИ), [М+Н]+ = 414. 1Н ЯМР (CD3OD 400 МГц) δ 7.83-7.82 (1H, m), 7.68-7.67 (1H, m), 7.32-7.27 (3Н, m), 7.05-7.01 (2Н, m), 5.05-4.97 (1H, m), 3.43-3.35 (2Н, m), 3.10-2.95 (1Н, m), 2.95-2.75 (2Н, m), 2.47-2.39 (1Н, m), 2.35-2.05 (4Н, m), 1.95-1.56 (4Н, m), 1.28-1.22 (1H, m).
Соединение 17
Стадия 1. трет-Бутил-1-(2-(4-цианофенокси)-4-(4-фторфенил)циклопентил)-4,4-дифторпиперидин-3-илкарбамат
В раствор трет-бутил-4,4-дифтор-1-(4-(4-фторфенил)-2-гидроксициклопентил)-пиперидин-3-илкарбамата F2c (250 мг, 1,0 экв.), 4-гидроксибензонитрила (86 мг, 1,2 экв.) и Ph3P (470 мг, 3,0 экв.) в безводном THF (10 мл) по каплям добавляли DIAD (485 мг, 4,0 экв.) при 0°С в атмосфере азота. Полученную смесь перемешивали при 14-22°С в течение 20 ч. После стандартной обработки и флэш-хроматографии (петролейный эфир/ЕА = от 90/10 до 80/20) получили смесь изомерных продуктов (220 мг, 71%-ный выход) в виде желтого густого масла. После разделения на препаративной системе Waters SFC 350 (колонка: OJ 250 мм × 30 мм × 5 мкм; условия: основание-метанол, скорость потока: 60 мл/мин) получили чистый 1 (20 мг, пик 1), и изомер 2 (15 мг, пик 2), и смесь двух изомеров (50 мг, пик 3+4), которую дополнительно разделяли на препаративной системе Waters SFC 350 (колонка: IC 250 мм × 30 мм, 10 мкм; условия: основание-метанол, скорость потока: 70 мл/мин) с получением изомера 3 (15 мг, пик 1 в втором разделении) и изомера 4 (10 мг, пик 2 в втором разделении). Все изомеры были получены в виде бесцветных масел. ЖХМС для изомера 1: m/z (ЭРИ) [М+Н]+ = 516.
Стадия 2. 4-[2-(3-Амино-4,4-дифтор-1-пиперидил)-4-(4-фторфенил)-циклопентокси]бензонитрил Соединение 17

В раствор вышеуказанного изомера 1 (20 мг, 1,0 экв.) в безводном дихлорметане (5 мл) добавляли TFA (1 мл). Полученную смесь перемешивали при 16-23°С в течение 1 ч. Смесь вливали в насыщенный раствор NaHCO3 (50 мл), экстрагировали DCM (30 мл × 3), сушили над безводным сульфатом натрия и концентрировали. Остаток очищали препаративной ВЭЖХ (колонка: Durashell 150×25 мм, 5 мкм; градиент: 70%-95% В (А = 0,05% аммиака/вода, В = метанол, скорость потока: 25 мл/мин)) с получением Соединения 17 (2,9 мг, 18%-ный выход) в виде белого твердого вещества после лиофилизации. ЖХМС: m/z (ЭРИ), [М+Н]+ = 416. 1H ЯМР (CD3OD 400 МГц) δ 7.68 (d, 2Н), 7.33-7.29 (dd, 2Н), 7.12 (d, 2Н), 7.03 (t, 2Н), 4.90-4.85 (m, 1Н), 3.35-3.32 (m, 1Н), 3.30-3.28 (m, 1H), 3.15-3.05 (m, 1H), 2.98-2.87 (m, 1H), 2.82-2.71 (m, 1Н), 2.66-2.55 (m, 1Н), 2.52-2.32 (m, 2Н), 2.27-2.08 (m, 3Н), 2.07-1.92 (m, 1Н), 1.81-1.75 (m, 1Н).
Соединение 18
Стадия 1. трет-Бутил-(3R)-1-(2-(4-цианофенокси)-4-(4-фторфенил)-циклопентил)-5,5-дифторпиперидин-3-илкарбамат
В смесь PPh3 (569 мг, 3,0 экв.) и 4-гидроксибензонитрила (129 мг, 1,5 экв.) добавляли раствор F2d (290 мг, 1,0 экв.) и DIAD (439 мг, 3,0 экв.) в 3 мл безводного THF в атмосфере азота. Этот желтый раствор перемешивали при 17-27°С в течение 18 ч. Раствор концентрировали и очищали на силикагелевой колонке (петролейный эфир/EtOAc, от 0 до 20% ЕА), промывали насыщенным раствором карбонат калия (3×10 мл) и концентрировали с получением трет-бутил-(3R)-1-(2-(4-цианофенокси)-4-(4-фторфенил)циклопентил)-5,5-дифторпиперидин-3-илкарбамата (328 мг, 88%-ный выход) в виде белого твердого вещества. ЖХМС: m/z (ЭРИ), [М+Н]+ = 516.
Стадия 2. 4-[2-(5-Амино-3,3-дифтор-1-пиперидил)-4-(4-фторфенил)-циклопентокси]бензонитрил Соединение 18

В раствор вышеуказанного Boc-защищенного соединения (328 мг, 1,0 экв.) в 5 мл DCM добавляли 2 мл TFA. Этот раствор перемешивали при к.т. в течение 1 ч, затем концентрировали. Остаток разбавляли водн. HCl и экстрагировали смесью петролейный эфир/EtOAc (1:1) (20 мл × 3) для удаления примесей. Водный слой подщелачивали бикарбонатом натрия и экстрагировали дихлорметаном (10 мл × 3). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали с получением желтого твердого вещества (50 мг, выход 19%), которое разделяли на препаративной системе Berger MG-II СФХ [Chiralpak AD 250×30 мм I D. (внутренний диаметр), 5 мкм; подвижная фаза: CO2/МеОН (0,1% водн. NH3) = 70/30 при 60 мл/мин)] с получением Соединения 18 (5,2 мг, 10%) в виде белого твердого вещества. Второй изомер также был выделен, данные здесь не сообщаются.
Соединение 18 показало: ЖХМС: m/z (ЭРИ), [M+H]+ = 416. 1Н ЯМР (CD3OD 400 МГц) δ 7.68 (d, 2Н), 7.32 (dd, 2Н), 7.15 (d, 2Н), 7.04 (t, 2Н), 4.89-4.84 (m, 1Н), 3.38-3.36 (m, 1Н), 3.18 (br. s, 1H), 2.96-2.92 (m, 2Н), 2.79-2.73 (m, 1H), 2.39-2.15 (m, 6Н), 1.84-1.78 (m, 2Н).
Соединение 19
Стадия 1. трет-Бутил-(3R)-1-(2-(4-циано-3-фторфенокси)-4-(4-фторфенил)-циклопентил)пиперидин-3-илкарбамат
В раствор F2a (200 мг), 2-фтор-4-гидроксибензонитрила (108 мг, 1,5 экв.) и Pph3 (272 мг, 2,0 экв.) в THF (4 мл) добавляли DIAD (180 мг, 2,0 экв.) в THF (1 мл) при 0°С. Эту смесь перемешивали при 25°С в течение 3 суток. Смесь разбавляли водой (20 мл) и экстрагировали ЕА (2×20 мл). Органические слои сушили над натрием, концентрировали и очищали колоночной хроматографией на силикагеле (петролейный эфир/ЕА = 5/1) с получением продукта (200 мг, 76%-ный выход), который разделяли на препаративной системе Waters SFC 350 [колонка: AD (300 мм × 50 мм, 10 мкм), условия: 35% IPA + водн. NH3 80 мл/мин] с получением изомера 1 (77 мг, 38%-ный выход, Rt = 8,21 мин) и изомера 2 (76 мг, 38%-ный выход, Rt = 9,64 мин). ЖХМС для обоих изомеров: m/z (ЭРИ), [M+Na]+ = 520.
Стадия 2. 4-[2-(3-Амино-1-пиперидил)-4-(4-фторфенил)циклопентокси]-2-фторбензонитрил Соединение 19
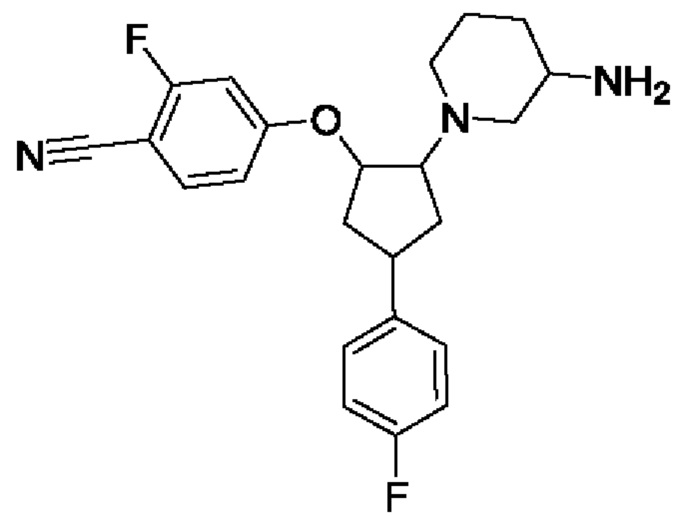
Раствор полученного непосредственно выше изомера 1 (77 мг) в DCM (2 мл) и TFA (1 мл) перемешивали при 27°С в течение 30 мин. Смесь концентрировали и очищали препаративной ВЭЖХ (метод: колонка: Waters Xbridge CIS 150×20 мм, 5 мкм; градиент: 65-95% В (А = вода/0,05% аммиака, В = метанол), скорость потока: 25 мл/мин) с получением Соединения 19 (13,5 мг, 20%-ный выход). ЖХМС: m/z (ЭРИ), [М+Н]+ = 398. 1Н ЯМР (CD3OD 400 МГц) δ 7.65 (t, 1Н), 7.32-7.25 (m, 2Н), 7.07-6.98 (m, 3Н), 6.94 (dd, 1Н), 4.84-4.80 (m, 1Н), 3.30-3.24 (m, 1Н), 3.20-3.14 (m, 1Н), 3.03-2.94 (m, 1Н), 2.89-2.73 (m, 2Н), 2.38-2.32 (m, 1H), 2.25-2.07 (m, 3Н), 1.99 (t, 1H), 1.92-1.84 (m, 1H), 1.81-1.66 (m, 2Н), 1.64-1.48 (m, 1Н), 1.21-1.11 (m, 1H).
Соединение 20
Стадия 1. трет-Бутил-(3R)-1-(2-(2-цианофенокси)-4-фенилциклопентил)-пиперидин-3-илкарбамат
В перемешиваемый раствор F1 (400 мг) в DMF (3 мл) порциями добавляли NaH (133 мг, 3,0 экв.) при 0°С, затем через 30 мин вводили по каплям 2-фторбензонитрил (148 мг, 1,1 экв.), растворенный в DMF (2 мл), и эту реакционную смесь перемешивали при к.т. в течение ночи. После стандартной обработки реакционную смесь очищали колоночной хроматографией (петролейный эфир/EtOAc 1:1) с получением неочищенного трет-бутил-(3R)-1-(2-(2-цианофенокси)-4-фенилциклопентил)-пиперидин-3-илкарбамата (210 мг, 41%-ный выход). ЖХМС: m/z (ЭРИ) [М+Н]+ = 462.
Стадия 2. 2-[2-(3-Амино-1-пиперидил)-4-фенил-циклопентокси]бензонитрил Соединение 20
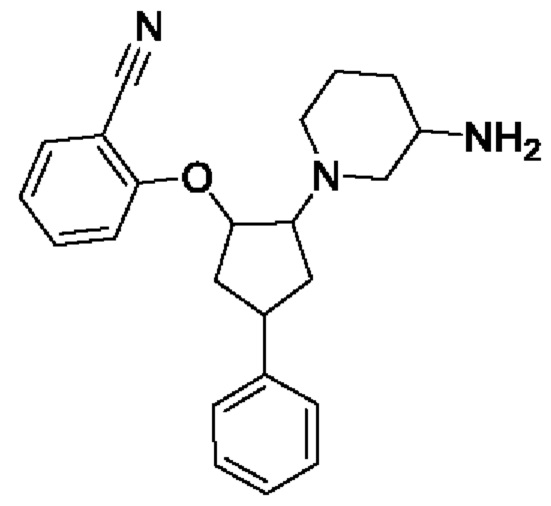
В перемешиваемый раствор продукта предыдущего эксперимента (210 мг) в дихлорметане (3 мл) добавляли смесь HCl/диоксан (2 мл, 4М) при к.т. Затем смесь перемешивали при к.т. в течение 2 ч, затем экстрагировали дихлорметаном (15 мл × 3), и затем водную фазу доводили до рН 8 добавлением насыщенного раствора NaHCO3. Водный слой экстрагировали дихлорметаном (20 мл × 3). Объединенные органические слои сушили над безводным сульфатом натрия и концентрировали с получением неочищенного 2-(2-((R)-3-аминопиперидин-1-ил)-4-фенилциклопентилокси)-бензонитрила (93 мг, 56%-ный выход). ЖХМС: m/z (ЭРИ), [М+Н]+ = 362. После очистки этого неочищенного продукта с использованием препаративной системы Waters SFC 350 [колонка: OJ (250 нм × 30 нм, 5 мкм), условия: 30% этанола/аммиак, скорость потока: 60 мл/мин] получили Соединение 20 (23,2 мг, изомер 1) и второй, менее эффективный, изомер (10,5 мг, изомер 2).
Соединение 20 (Изомер 1): ЖХМС: m/z (ЭРИ), [М+Н]+ = 361. 1Н ЯМР (CD3OD, 400 МГц) δ 7.64-7.60 (m, 2Н), 7.30-7.28 (m, 4Н), 7.20-7.18 (m, 2Н), 7.10-7.06 (m, 1Н), 3,38-3.35 (m, 1Н), 3.35-3.33 (m, 1H), 2.86-2.81 (m, 3Н), 2.40-1.60 (m, 9Н), 1.22-1.16 (m, 1H). Изомер 2 ЖХМС: m/z (ЭРИ), [M+H]+ = 362. 1Н ЯМР (CD3OD, 400 МГц) δ 7.64-7.60 (m, 2Н), 7.30-7.28 (m, 4Н), 7.21-7.17 (m, 2Н), 7.10-7.07 (m, 1Н), 3,37-3.34 (m, 1Н), 3.25-3.23 (m, 1Н), 3.01-2.81 (m, 3Н), 2.41-1.63 (m, 9Н), 1.21-1.13 (m, 1Н).
Соединение 21
1. трет-Бутил-(3R)-1-(2-(2-хлор-4-цианофенокси)-4-фенилциклопентил)-пиперидин-3-илкарбамат
В смесь NaH (1,1 г, 2,5 экв.) в безводном THF (20 мл) по каплям добавляли раствор F1 (4,0 г, 1,0 экв., 11,1 ммоль) в THF (30 мл) при 0°С в атмосфере азота. После перемешивания в течение 0,5 ч в реакционную смесь добавляли раствор 3-хлор-4-фторбензонитрила (2,0 г, 1,2 экв.) в THF (10 мл). После перемешивания при 17-21°С в течение еще 18 ч смесь вливали в воду (200 мл) и экстрагировали этилацетатом (3×100 мл). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали. После колоночной хроматографии на силикагеле (от 0 до 30% этилацетата в петролейном эфире) получили изомер 1 трет-бутил-(3R)-1-(2-(2-хлор-4-цианофенокси)-4-фенилциклопентил)пиперидин-3-илкарбамата (460 мг, 8,3%-ный выход) и смесь других продуктов. Изомер 1 представлял собой наименее полярный продукт, наблюдаемый методом ТСХ. 1Н ЯМР (CDCl3 400 МГц) δ 1.45 (9Н, s), 1.61-1.85 (4Н, m), 2.05-2.46 (4Н, m), 2.48 (2Н, br. s), 2.73 (1H, br. s), 3.15-3.25 (1H, m), 3.34-3.42 (1H, m), 3.75 (1H, br. s), 4.75 (1H, br. s), 4.85 (1H, br. s), 7.08-7.15 (1H, m), 7.23-7.26 (3H, m), 7.29-7.32 (2H, m), 7.52-7.55 (1H, m), 7.66-7.67 (1H, m).
Стадия 2. 4-[2-(3-Амино-1-пиперидил)-4-фенил-циклопентокси]-3-хлор-бензонитрил Соединение 21

В раствор изомера 1 (610 мг, 1,0 экв., 1,23 ммоль), полученного в предыдущем эксперименте, в дихлорметане (5 мл) добавляли TFA (3 мл). Полученный раствор перемешивали в течение 0,5 ч при 7-17°С. Раствор затем концентрировали, разбавляли водой (10 мл), подщелачивали аммиаком и экстрагировали DCM (15 мл × 3). Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали. Остаток разбавляли водой, затем сушили (лиофилизация) с получением конечного продукта, Соединения 21 (348,6 мг, 71%-ный выход), в виде белого твердого вещества. ЖХМС: Rt = 1,633 при 4,0 мин хроматографии, ЖХМС: m/z (ЭРИ), [М+Н]+ = 396. 1Н ЯМР (CD3OD 400 МГц) δ 1.13-1.26 (1H, m), 1.53-1.66 (1H, m), 1.70-1.77 (1Н, m), 1.77-1.85 (1Н, m), 1.86-1.94 (1Н, m), 2.01-2.07 (1H, m), 2.09-2.17 (1H, m), 2.18-2.29 (2Н, m), 2.36-2.45 (1Н, m), 2.76-2.83 (1Н, m), 2.84-2.92 (1H, m), 2.98-3.05 (1H, m), 3.22-3.39 (2Н, m), 4.91-4.95 (1Н, m), 7.16-7.22 (1Н, m), 7.24-7.33 (5Н, m), 7.66 (1H, dd), 7.80 (1H, d).
Соединение 22
Стадия 1. трет-Бутил-(3R,5R)-1-(2-(6-хлор-4-метилпиридазин-3-илокси)-4-(4-фторфенил)циклопентил)-5-фторпиперидин-3-илкарбамат
F2b (950 мг, 2,40 ммоль) добавляли к NaH (115 мг, 4,79 ммоль) и 3,6-дихлор-4-метилпиридазину (586 мг, 3,59 ммоль) в DMF (8 мл), охлажденном до 0°С, в течение периода времени 5 минут в атмосфере азота. Полученный раствор перемешивали при к.т. в течение 2 часов. Остаток очищали препаративной ТСХ (петролейный эфир:EtOAc = 2:1) с получением продукта в виде желтого масла (450 мг, 35,9%); ЖХМС: m/z (ЭРИ), [М+Н]+ = 523; 1Н ЯМР (400 МГц, DMSO-d6) δ 7.89-7.58 (m, 1H), 7.35 (t, 2H), 7.11 (td, 2H), 6.79 (dd, 1H), 5.48 (t, 1H), 4.85 (d, 1H), 3.67 (s, 1H), 3.34 (s, 2H), 3.17 (d, 1H), 2.51 (m, 4H), 2.36-2.08 (m, 4H), 2.13-1.79 (m, 2H), 1.76-1.47 (m, 2H), 1.43-1.26 (m, 21H).
Стадия 2. трет-Бутил-(3R,5R)-1-(2-(6-циано-4-метилпиридазин-3-илокси)-4-(4-фторфенил)циклопентил]-5-фторпиперидин-3-илкарбамат
6-Хлор-4-метилпиридазин-3-илокси-соединение (150 мг, 0,29 ммоль), полученное выше, добавляли к цианиду цинка (67,3 мг, 0,57 ммоль) и 2-ди-трет-бутилфосфино-2',4',6'-триизопропил-1,1'-бифенилу (18,27 мг, 0,04 ммоль) в THF (5 мл) в атмосфере азота. Полученную смесь перемешивали при 80°С в течение 1 часа, затем выпаривали. Остаток очищали препаративной ТСХ (петролейный эфир:EtOAc = 2:1) с получением неочищенного продукта (120 мг, 81%) в виде желтого масла. ЖХМС: m/z (ЭРИ) [М+Н]+ = 514; основной, ВЭЖХ Rt = 1,371 мин. После препаративной хиральной ВЭЖХ [CHIRALPAK IE, 2 см × 25 см, 5 мкм), подвижная фаза А: гексаны (0,1% DE)-ВЭЖХ, подвижная фаза В: EtOH-ВЭЖХ; скорость потока: 20 мл/мин; градиент: А:В = 70:30 за 31 мин; 220/254 нм] получили 8 фракций, каждая с ее >98%; Фракция 1 (RT1: 9,37 мин, 10,00 мг, 6,67%) в виде белого твердого вещества. Изомер 2 (RT2: 12,16 минут; 15,00 мг, 10,00%) в виде белого твердого вещества. Изомер 3 (RT3: 14,92 мин; 10,00 мг, 6,67%) в виде белого твердого вещества. Изомер 4 (RT4: 17,38 минут; 10,00 мг, 6,67%) в виде белого твердого вещества. Изомер 5 (RT5: 18,6 минут; 5,00 мг, 3,33%) в виде белого твердого вещества. Изомер 6 (RT6: 21,8 мин; 20,00 мг, 13,33%) в виде белого твердого вещества. Изомер 7 (RT7: 23,6 мин; 15,00 мг, 10,00%) в виде белого твердого вещества. Изомер 8 (RT8: 28 мин; 10,00 мг, 6,67%) в виде белого твердого вещества.
Стоймя 3. 6-[2-(3-Амино-5-фтор-1-пиперидил)-4-(4-фторфенил)-циклопентокси]-5-метил-пиридазин-3-карбонитрил Соединение 22

TFA (0,1 мл, 0,02 ммоль) добавляли к полученному выше изомеру 4 (8 мг, 0,02 ммоль) в DCM (1 мл). Полученный раствор перемешивали при к.т. в течение 30 минут. Растворитель удаляли при пониженном давлении. Смесь доводили до рН=8 водным NH3. Неочищенный продукт очищали препаративной ВЭЖХ [(колонка XBridge Prep OBD C18 30×150 мм, 5 мкм; подвижная фаза А: вода (0,05% водн. NH3), подвижная фаза В: MeCN; скорость потока: 55 мл/мин; градиент: от 35% В до 55% В за 7 мин; 254/220 нм; Rt: 6,15 мин)]. Фракции, содержащие целевое соединение, выпаривали досуха с получением Соединения 22 (4,40 мг, 68,3%) в виде белого твердого вещества, которое оказалось эффективным изомером. ЖХМС: m/z (ЭРИ), [М+Н]+ = 414; 1Н ЯМР (300 МГц, CD3OD) δ 7.89 (s, 1Н), 7.30-7.30 (m, 2Н), 7.07-7.0 (m, 2Н), 5.82 (br s, 1H), 5.02 (br s, 1H), 3.58 (br s, 2H), 3.34 (m, 1H), 3.18 (m, 2H), 2.90 (m, 2H), 2.47 (m, 1H), 2.38-2.13 (m, 6H), 1.85 (m, 2H). 19F ЯМР (282 МГц, CD3OD) δ - 118.834, -185.169.
Соединение 23
Стадия 1. ((3R)-1-(2-((4-Хлорпиридазин-3-ил)окси)-4-(4-фторфенил)-циклопентил)пиперидин-3-ил)карбамат
F2 (500 мг, 1,32 ммоль) добавляли к PPh3 (520 мг, 1,98 ммоль) и 4-хлорпиридазин-3(2Н)-ону (207 мг, 1,59 ммоль) в DCM (8 мл) при 0°С в течение периода времени 5 минут в атмосфере азота. Затем по каплям вводили DEAD (0,314 мл, 1,98 ммоль). Полученный раствор оставляли нагреваться до к.т. и перемешивали в течение 2 часов. Растворитель затем удаляли при пониженном давлении, и остаток очищали колоночной флэш-хроматографией на силикагеле с градиентом элюирования от 0 до 50% EtOAc в петролейном эфире с получением желтого масла (1000,0 мг, 154%). Неочищенный продукт очищали на препаративной системе Waters SFC 350 [(колонка: (R,R)WHELK-01 5/100 Kromasil, 2,11 см × 25 см (5 мкм); подвижная фаза А: СО2: 65%, подвижная фаза В: EtOH-ВЭЖХ: 35%; скорость потока: 45 мл/мин; 220 нм; RT1: 4,06; RT2: 4,85)] с получением изомера 1 трет-бутил-((3R)-1-(2-((4-хлорпиридазин-3-ил)окси)-4-(4-фторфенил)циклопентил)пиперидин-3-ил)карбамата (220 мг, 36,7%, 100% ее) в виде желтого твердого вещества и изомера 2 (240 мг, 40,0%, 96,1% ее) в виде желтого твердого вещества.
Изомер 1 ЖХМС: m/z (ЭРИ), [М+Н]+ = 491; 1Н ЯМР (400 МГц, DMSO-d6) δ 8.03 (d, 1H), 7.79 (d, 1H), 7.40-7.31 (m, 2H), 7.17-7.07 (m, 2H), 6.59 (d, 1H), 3.47 (dq, 1H), 3.33 (s, 3H), 3.17 (d, 1H), 2.75 (d, 1H), 2.62 (s, 1H), 2.25-2.14 (m, 2H), 2.03 (d, 2H), 1.94 (d, 2H), 1.82-1.71 (m, 1H), 1.62 (s, 1H), 1.53 (s, 1H), 1.37 (s, 9H).
Изомер 2 ЖХМС: m/z (ЭРИ), [M+H]+ = 491; 1H ЯМР (400 МГц, DMSO-d6) δ 8.04 (d, 1H), 7.80 (d, 1H), 7.40-7.32 (m, 1H), 7.11 (t, 2H), 6.60 (d, 1H), 3.44 (d3H), 3.17 (m, 1H), 2.52 (s, 5H), 2.36-2.14 (m, 2H), 2.00 (s, 1H), 1.89 (s, 1H), 1.84-1.70 (m, 2H), 1.67 (d, 1H), 1.55 (s, 1H), 1.36 (s, 9H).
Стадия 2. 1-[2-(4-Хлорпиридазин-3-ил)окси-4-(4-фторфенил)циклопентил]-пиперидин-3-амин Соединение 23
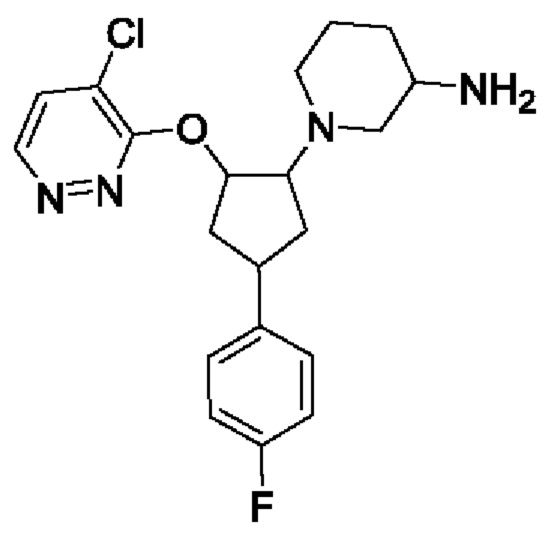
В раствор изомера 2 (240 мг, 0,49 ммоль) в DCM (10 мл) добавляли TFA (1 мл, 0,49 ммоль). Полученный раствор перемешивали при к.т. в течение 30 минут, и затем растворитель выпаривали. Смесь доводили до рН = 8 с использованием NH3.H2O. После препаративной ВЭЖХ [(колонка XBridge Prep OBD С18 30×150 мм, 5 мкм; подвижная фаза А: вода (0,05% водн. NH3), подвижная фаза В: MeCN; скорость потока: 55 мл/мин; градиент: от 35% В до 40% В за 7 мин; 254/220 нм; Rt: 5,53 мин) получили Соединение 23 (128 мг, 67,0%) в виде белого твердого вещества, которое оказалось более эффективным изомером. ЖХМС: m/z (ЭРИ), [М+Н]+ = 391; ЯМР (300 МГц, CD3OD) δ 8.00 (d, 1Н), 7.66 (d, 1Н), 7.38-7.24 (m, 2Н), 7.10-6.95 (m, 2Н), 5.71 (ddd, 1Н), 3.56 (dt, 2Н), 2.98 (d, 1Н), 2.81 (t, 2Н), 2.47-2.00 (m, 4Н), 1.94-1.34 (m, 5Н), 1.11 (d, 1H). ЯМР (282 МГц, CD3OD) δ -119.158.
Соединение 24
Стадия 1. трет-Бутил-(3R,5R)-1-(2-(6-цианопиридазин-3-илокси)-4-(4-фторфенил)-циклопентил)-5-фторпиперидин-3-илкарбамат
Раствор F2b (26 г, 65,58 ммоль) в THF (300 мл) охлаждали до 0°С, затем обрабатывали гидридом натрия (4,72 г, 196,73 ммоль) и через 10 минут 6-хлорпиридазин-3-карбонитрилом (10,98 г, 78,69 ммоль). Полученную смесь перемешивали при 0°С в течение 30 минут и при к.т.в течение 30 минут. После стандартной обработки неочищенный продукт очищали С18 флэш-хроматографией (от 0 до 40% MeCN в воде (0,5% TFA)). трет-Бутил-(3R,5R)-1-(2-(6-цианопиридазин-3-илокси)-4-(4-фторфенил)циклопентил)-5-фторпиперидин-3-илкарбамат (20,00 г, 61,1%) был получен в виде белого твердого вещества. Этот продукт дополнительно очищали на препаративной системе Waters SFC 350 [(колонка: Lux 5um Cellulose-4, 5×25 см, 5 мкм; подвижная фаза А: СО2: 60%, подвижная фаза В: МеОН: 40%; скорость потока: 150 мл/мин; 230 нм; RT1: 6,52; RT2: 7,27)] с получением изомера 1: (7,00 г, 96,8% ее) и изомера 2: (10,00 г, 95,5% ее) в виде белых твердых веществ. ЖХМС: m/z (ЭРИ), [М+Н]+ = 500.
Стадия 2. 6-[2-(3-Амино-5фтор-1-пиперидил)-4-(4-фторфенил)-циклопентокси]пиридазин-3-карбонитрил Соединение 24

Диметилсульфан (30 мл, 391,94 ммоль) и TFA (30 мл, 392,03 ммоль) добавляли по каплям к полученному в предыдущем эксперименте изомеру 2 (10 г, 20,02 ммоль) в DCM (100 мл) при 25°С. Полученную смесь перемешивали при 25°С в течение 2 ч, и затем растворитель удаляли при пониженном давлении. После С18 флэш-хроматографии (от 10 до 30% MeCN в воде (0,05% TFA)) получили Соединение 24 (9,00 г, 82%) в виде белого твердого вещества. ЖХМС: m/z (ЭРИ), [M+H]+ = 400; 1H ЯМР (300 МГц, CD3OD) δ 8.03 (d, 1H), 7.46-7.23 (m, 3Н), 7.14-6.97 (m, 2Н), 5.87 (d, 1Н), 5.07 (s, 1H), 3.65 (s, 2Н), 3.51-3.36 (m, 1Н), 3.31 (d, 2Н), 3.08-2.83 (m, 1Н), 2.73 (d, 1Н), 2.50 (s, 1Н), 2.29 (tt, 3Н), 1.93 (dq, 2Н). 19F ЯМР (376 МГц, CD3OD) δ -77.3, -118.76, -185.06.
Соединение 25
Стадия 1. трет-Бутил-(3R)-1-(2-(5-хлорпиридазин-3-илокси)-4-(4-фторфенил)-циклопентил)пиперидин-3-илкарбамат
DTAD (487 мг, 2,11 ммоль) добавляли к 5-хлорпиридазин-3(2Н)-ону (207 мг, 1,59 ммоль), F2a (400 мг, 1,06 ммоль) и PPh3 (554 мг, 2,11 ммоль) в DCM (20 мл). Полученную смесь перемешивали при 30°С в течение 2 часов, и затем растворитель удаляли при пониженном давлении. После С18 колоночной флэш-хроматографии (от 40 до 42% MeCN в воде (модифицированной 0,1% водн. NH3) получили целевой продукт (450 мг, 87%) в виде желтого твердого вещества. ЖХМС: m/z (ЭРИ), [М+Н]+ = 492; 1Н ЯМР (300 МГц, CD3OD) δ 1.20-1.32 (m, 1Н), 1.44 (d, 10Н), 1.49 (d, 1Н), 1.62-1.94 (m, 4Н), 1.95-2.17 (m, 3Н), 2.16-2.46 (m, 2Н), 2.68-2.98 (m, 2Н), 3.55 (dt, 3Н), 5.64 (tt, 1H), 6.97-7.15 (m, 3Н), 7.26-7.37 (m, 2Н), 8.12 (t, 1H).
Стадия 2. трет-Бутил-(3R)-1-(4-(4-фторфенил)-2-(5-фторпиридазин-3-илокси)циклопентил)пиперидин-3-илкарбамат
KF (237 мг, 4,07 ммоль) добавляли к вышеуказанному пиперидин-3-илкарбаматному соединению (400 мг, 0,81 ммоль) в DMSO (10 мл). Полученную смесь перемешивали при 100°С в течение 72 ч, затем разбавляли DCM (20 мл) и промывали водой (25 мл × 3). Органический слой сушили над Na2SO4, фильтровали и выпаривали с получением неочищенного продукта. После препаративной ВЭЖХ [колонка XBridge Prep OBD С18 19×250 мм, 5 мкм; подвижная фаза А: вода (0,05% водн. NH3), подвижная фаза В: MeCN; скорость потока: 20 мл/мин; градиент: от 66% В до 66% В за 8 мин; 220, 254 нм; Rt: 6,57-7,18 мин] получили трет-бутил-(3R)-l-(4-(4-фторфенил)-2-(5-фторпиридазин-3-илокси)циклопентил)пиперидин-3-илкарбамат (60,0 мг, 15,52%) в виде желтого твердого вещества. ЖХМС: m/z (ЭРИ), [М+Н]+ = 475.
Стадия 3. 1-[4-(4-Фторфенил)-2-(5-фторпиридазин-3-ил)окси-циклопентил]-пиперидин-3-амин Соединение 25
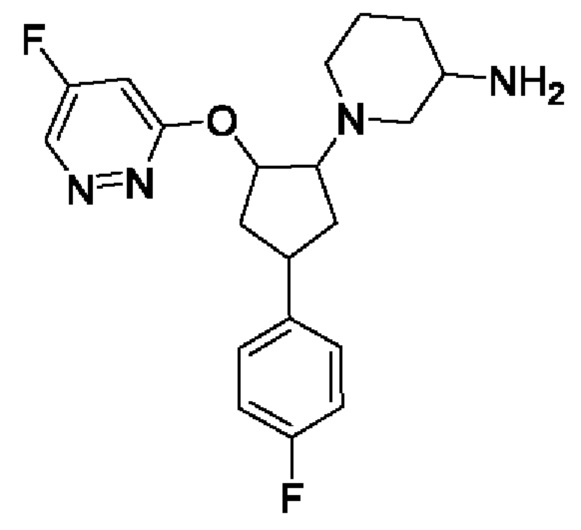
TFA (3 мл, 0,13 ммоль) добавляли к полученному выше карбамату (60 мг, 0,13 ммоль) в DCM (15 мл). Полученный раствор перемешивали при 25°С в течение 2 часов, и растворитель удаляли при пониженном давлении. После препаративной ВЭЖХ [колонка XSelect CSH Prep С18 OBD, 5 мкм, 19×150 мм; подвижная фаза А: вода (0,05% TFA), подвижная фаза В: MeCN; скорость потока: 25 мл/мин; градиент: от 15% В до 25% В за 7 мин; 254, 220 нм; Rt: 4,42 мин] получили Соединение 25, (R)-1-((1S,2S,4R)-4-(4-фторфенил)-2-(5-фторпиридазин-3-илокси)циклопентил)пиперидин-3-амин, (20,00 мг, 42,2%) в виде бесцветного масла. ЖХМС: m/z (ЭРИ), [М+Н]+ = 375; 1H ЯМР (300 МГц, CD3OD) δ 8.23 (d, 1H), 7.30-7.34 (m, 2Н), 7.01-7.07 (m, 2Н), 6.77 (d, 1Н), 5.86 (s, 1H), 4.11 (s, 1Н), 3.08-3.58 (m, 4Н), 2.89-2.91 (m, 2Н), 2.59 (s, 1Н), 2.32-2.36 (m, 1Н), 2.17-2.27 (m, 1Н), 1.85-2.03 (m, 3Н), 1.79-1.82 (m, 1Н), 1.63-1.66 (m, 1H). 19F ЯМР (300 МГц, CD3OD) δ -77.16, -111.97.
Соединение 26
Стадия 1. трет-Бутил-(3R)-1-(2-(5-цианопиридин-3-илокси)-4-(4-фторфенил)-циклопентил)пиперидин-3-илкарбамат
В смесь F2a (360 мг, 0,95 ммоль), 6-гидроксиникотинонитрила (114 мг, 0,95 ммоль), PPh3 (499 мг, 1,90 ммоль) в THF (25 мл) добавляли DTAD (438 мг, 1,90 ммоль). После перемешивания в течение 16 ч растворитель выпаривали. Остаток очищали препаративной ТСХ (EtOAc:петролейный эфир = 1:2) с получением трет-бутильного продукта (280 мг, 61,3%) в виде желтого масла. После препаративной ВЭЖХ получили фракцию 1 (120 мг, 33,8%) в виде белого твердого вещества и фракцию 2 (70,0 мг, 19,69%) в виде белого твердого вещества.
Фракция 1: 1H ЯМР (300 МГц, CDCl3) δ 8.67-8.76, 8.13 (1Н, s), 7.61-7.71 (1Н, m), 7.28-7.40 (2Н, m), 7.12 (2Н, t), 6.61 (1Н, s), 6.48 (1Н, dd), 5.33 (1Н, s), 3.54 (2Н, d), 3.26 (2Н, s), 2.77 (1Н, s), 2.15 (4Н, s), 1.61 (7Н, s), 1.35 (9Н, s), 1.20 (1Н, m). ЖХМС: m/z (ЭРИ), [М+Н]+ = 481.
Фракция 2: 1H ЯМР (300 МГц, CDCl3) δ 1.33 (9Н, d), 1.75 (4Н, s), 2.13 (3Н, s), 5.69 (1H, s), 6.99-7.19 (3H, m), 7.29-7.40 (2Н, m), 8.17 (2H, d), 8.72 (1Н, s); ЖХМС: m/z (ЭРИ), [М+Н]+ = 481.
Стадия 2. 6-(2-((R)-3-Аминопиперидин-1-ил)-4-(4-фторфенил)циклопентилокси)-никотинонитрил Соединение 26

В раствор вышеуказанной фракции 2 (70 мг, 0,15 ммоль) в DCM (15 мл) добавляли TFA (0,15 мл, 1,95 ммоль). Реакционную смесь перемешивали при 25°С в течение 1 часа и концентрировали досуха. Остаток очищали препаративной ВЭЖХ, [градиент воды (содержащей 0,05% NH3) и MeCN) с получением белого твердого вещества (50,0 мг, 90%), которое дополнительно очищали препаративной хиральной ВЭЖХ с получением изомера 1 6-(2-((R)-3-аминопиперидин-1-ил)-4-(4-фторфенил)-циклопентилокси)никотинонитрила, Соединения 26, (22,70 мг, 32,4%) в виде белого твердого вещества и изомера 2 (15,50 мг, 22,14%). Соединение 26 показало: 1Н ЯМР (300 МГц, CD3OD) δ 1.24 (1Н, t), 1.49-1.81 (3Н, m), 1.89 (1H, dq), 2.02-2.29 (4H, m), 2.34-2.49 (1H, m), 2.79-2.93 (2Н, m), 3.01 (1H, d), 3.11-3.41 (2Н, m), 5.60 (1Н, ddd), 6.88-7.09 (3Н, m), 7.22-7.36 (2Н, m), 7.98 (1Н, dd), 8.56 (1Н, dd). ЖХМС: m/z (ЭРИ), [М+Н]+ = 381.
Изомер 2: 1Н ЯМР (300 МГц, DMSO-d6) δ 1.17 (1H, td), 1.53-2.28 (9H, m), 2.32-2.47 (1H, m), 2.78-2.93 (2H, m), 3.01 (1H, d), 3.09-3.39 (1H, m), 5.58 (1H, d), 6.89-7.07 (3H, m), 7.28 (2Н, dd), 7.97 (1Н, dt), 8.55 (1Н, d). ЖХМС: m/z (ЭРИ), [M+H]+ = 381.
Соединение 27
Стадия 1. трет-Бутил-(3R)-1-(2-(6-цианопиридин-3-илокси)-4-(4-фторфенил)-циклопентил)пиперидин-3-илкарбамат
F2a (226,8 мг, 0,60 ммоль), 5-гидроксипиколинонитрил (86 мг, 0,72 ммоль) и Ph3P (393 мг, 1,50 ммоль) в DCM (10 мл) подвергали взаимодействию при 0°C с DTAD (276 мг, 1,20 ммоль). Реакционную смесь оставляли нагреваться до к.т. в течение 2 ч. После стандартной обработки и С18 колоночной флэш-хроматографии (от 0 до 45% MeCN в воде (0,1М водн. NH3)) получили трет-бутил-(3R)-1-(2-(6-цианопиридин-3-илокси)-4-(4-фторфенил)циклопентил)пиперидин-3-илкарбамат (160 мг, 55,6%) в виде светло-красного твердого вещества. ЖХМС: m/z (ЭРИ), [М+Н]+ = 481,30. После препаративной хиральной ВЭЖХ [(колонка: Chiralpak IA, 2×25 см, 5 мкм; подвижная фаза А: гексаны-ВЭЖХ, подвижная фаза В: EtOH-ВЭЖХ, градиент; скорость потока: 20 мл/мин; градиент: А:В = 90:10 за 12,5 мин; 254/220 нм; RT1: 11,13; RT2: 14,44)] получили две фракции, содержащие изомер 1 (30 мг, 0,06 ммоль) и изомер 2 (30 мг, 0,06 ммоль) в виде белых твердых веществ.
Стадия 2. 6-[2-(3-Амино-1-пиперидил)-4-(4-фторфенил)циклопентокси)-пиридин-3-карбонитрил Соединение 27
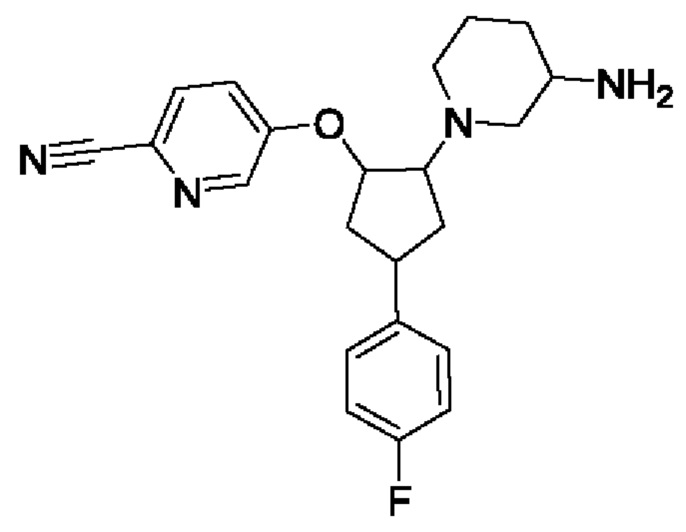
В перемешиваемый раствор изомера 1 (30 мг, 0,06 ммоль) в DCM (2 мл) добавляли TFA (0,66 мл) при к.т.в течение 16 ч. После очистки препаративной ВЭЖХ (колонка XBridge Prep С18 OBD, диоксид кремния 5 мкм, диаметр 19 мм, длина 150 мм, градиент воды (содержащей 0,05% TFA)/MeCN) получили Соединение 27 (24,00 мг, 90%) в виде белого твердого вещества, которое оказалось наиболее эффективным изомером. ЖХМС: m/z (ЭРИ), [М+Н]+ = 381; 1Н ЯМР (300 МГц, CD3OD) δ 8.43 (s, 1Н), 8.33 (s, 1Н), 7.85 (d, 1Н), 7.56 (d, 1Н), 7.32 (dd, 2Н), 7.16-6.97 (m, 2Н), 4.92 (s, 2Н), 3.38 (s, 2Н), 2.93 (d, 1Н), 2.61 (d, 3Н), 2.38 (dt, 1H), 2.21 (t, 2H), 2.05-1.76 (m, 3H), 1.77-1.48 (m, 2H). Соединение 28
Стадия 1. трет-Бутил-1-(1R)-4-(4-фторфенил)-2-пиридазин-3-илокси)-циклопентил)пиперидин-3-илкарбамат
DIAD (427 мг, 2,11 ммоль) PPh3 (554 мг, 2,11 ммоль), пиридазин-3(2Н)-он (152 мг, 1,59 ммоль) и F2a (400 мг, 1,06 ммоль) в DCM (10 мл) подвергали взаимодействию в стандартных условиях Мицунобу. После 2 ч при к.т. растворитель удаляли при пониженном давлении. После С18 колоночной флэш-хроматографии (от 45 до 50% MeCN в воде (модифицированной 0,1 водн. NH3) получили трет-бутил-((3R)-1-(4-(4-фторфенил)-2-(пиридазин-3-илокси)циклопентил)пиперидин-3-ил)карбамат (400 мг, 83%) в виде желтого твердого вещества. ЖХМС: m/z (ЭРИ), [М+Н]+ = 457; 1Н ЯМР (300 МГц, CD3OD) δ 1.17-1.33 (m, 1H), 1.45 (d, 9Н), 1.51-2.14 (m, 4Н), 2.18-2.50 (m, 2Н), 2.66-2.90 (m, 1Н), 2.94 (d, 1H), 3.38 (s, 2Н), 3.49-3.66 (m, 3Н), 5.64-5.79 (m, 1H), 6.93-7.12 (m, 3Н), 7.26-7.49 (m, 3Н), 8.09 (ddd, 1Н). После препаративной хиральной ВЭЖХ [Chiralpak IB, изократическое элюирование 40% IPA в гексанах (модифицированных 0,1% DEA) в качестве элюента] получили изомер 1 трет-бутил-1-((1R)-4-(4-фторфенил)-2-(пиридазин-3-илокси)циклопентил)пиперидин-3-илкарбамата (180 мг, 45,0%, 99,5% ее) в виде желтого твердого вещества и изомер 2 (180 мг, 45,0%, 99,5% ее) в виде желтого твердого вещества. ЖХМС (для обоих изомеров) m/z (ЭРИ), [М+Н]+ = 457.
Стадия 2. 1-[4-(4-Фторфенил)-2-пиридазин-3-илокси-циклопентил]пиперидин-3-амин Соединение 28
TFA (2 мл, 25,96 ммоль) добавляли к полученному выше изомеру 1 (180 мг, 0,39 ммоль) в DCM (10 мл). Полученную смесь перемешивали при 25°С в течение 2 часов. Растворитель затем удаляли при пониженном давлении, и неочищенный продукт очищали препаративной ВЭЖХ [колонка X select CSH OBD 30×150 мм, 5 мкм; подвижная фаза А: вода (0,05% TFA), подвижная фаза В: MeCN; скорость потока: 60 мл/мин; градиент: от 11% В до 21% В за 7 мин; 254; 220 нм; Rt: 5,57 мин] получили Соединение 28 (240 мг, 70.7%) в виде белого твердого вещества. ЖХМС: m/z (ЭРИ), [M+H]+ = 357; 1Н ЯМР (300 МГц, CD3OD) δ 1.56-1.75 (m, 1H), 1.82-2.31 (m, 5Н), 2.47 (ddd, 1H), 2.65-2.80 (m, 1H), 2.93 (t, 1Н), 3.08 (t, 1Н), 3.66 (dtd, 4Н), 4.32 (dt, 1Н), 5.99 (ddd, 1Н), 6.99-7.14 (m, 3Н), 7.29-7.42 (m, 2Н), 7.48 (dd, 1Н), 8.14 (dd, 1H). 19F ЯМР (300 МГц, CD3OD) δ -77.173 (m, 13F), -118.211 (s, 1F).
Соединение 29
Стадия 1. трет-Бутил-(3R,5R)-5-фтор-1-(4-(4-фторфенил)-2-(пиримидин-4-илокси)-циклопентил)пиперидин-3-илкарбамат
DTAD (581 мг, 2,52 ммоль) добавляли к F2b (500 мг, 1,26 ммоль), пиримидин-4-олу (145 мг, 1,51 ммоль) и PPh3 (827 мг, 3,15 ммоль) в DCM (15 мл) при 0°С в течение периода времени 5 минут. Полученный раствор перемешивали при 25°С в течение 2 часов. Растворитель удаляли при пониженном давлении. После С18 колоночной флэш-хроматографии (от 40 до 50% воды в MeCN) получили фракцию 1 (первый пик: 200 мг, 33,4%) в виде бесцветного масла и фракцию 2 (последний пик: 300 мг, 50,1%) в виде белого твердого вещества. Фракцию 2 дополнительно разделяли и очищали препаративной хиральной ВЭЖХ на колонке CHIRALPAK IA-3, изократическое элюирование 50% IPA в петролейном эфире (модифицированном диэтиламином) в качестве элюента. Фракции, содержащие целевое соединение, выпаривали досуха с получением изомера 1 трет-бутил((3S,5R)-5-фтор-1-((1S,2S,4R)-4-(4-фторфенил)-2-(пиримидин-4-илокси)циклопентил)пиперидин-3-ил)карбамата (160 мг, 41%, 100% ее) в виде белого твердого вещества и изомера 2 (110 мг, 28,2%, 99,6% ее) в виде белого твердого вещества. ЖХМС для обоих изомеров: m/z (ЭРИ), [М+Н]+ = 475.
Стадия 2. 5-Фтор-1-[4-(4-фторфенил)-2-пиримидин-4-илокси-циклопентил]-пиперидин-3-амин Соединение 29

TFA (3 мл, 0,34 ммоль) добавляли к вышеуказанному изомеру 1 (160 мг, 0,34 ммоль) в DCM (15 мл). Полученный раствор перемешивали при 25°С в течение 2 часов. После препаративной ВЭЖХ [колонка XBridge Prep OBD CI8 30×150 мм, 5 мкм; подвижная фаза А: вода (0,05% водн. NH3), подвижная фаза В: MeCN; скорость потока: 60 мл/мин; градиент: от 28% В до 40% В за 7 мин; 254/220 нм; Rt: 5,95 мин] получили Соединение 29 в виде белого твердого вещества (75,0 мг, 59,0%). ЖХМС: m/z (ЭРИ), [M+H]+ = 375; 1Н ЯМР (300 МГц, CD3OD) δ 8.75 (dd, 1Н), 8.46 (dd, 1Н), 7.38-7.24 (m, 2Н), 7.09-6.89 (m, 3Н), 5.62 (ddd, 1H), 4.90 (d, 0.5Н), 4.76 (s, 0.5Н), 3.35 (s, 1H), 3.30-3.01 (m, 4H), 2.51-1.96 (m, 6H), 1.77 (td, 1H), 1.44 (dt, 1H). 19F ЯМР (300 МГц, CD3OD) δ -183.07, -119.12
Соединение 30
Стадия 1. трет-Бутил-(3R)-1-(2-(5-бромпиримидин-2-илокси)-4-(4-фторфенил)-циклопентил)пиперидин-3-илкарбамат
В раствор F2a (900 мг, 2,38 ммоль) в DMF (6 мл) добавляли NaH (190 мг, 4,76 ммоль) при к.т. Эту смесь перемешивали в течение 3 мин, затем добавляли 5-бром-2-хлорпиримидин (690 мг, 3,57 ммоль). Через 8 ч реакционную смесь гасили насыщенным раствором NH4Cl (водн.) (30 мл) и экстрагировали DCM (2×20 мл). Органический слой сушили над Na2SO4, фильтровали и выпаривали с получением неочищенного продукта. После препаративной ТСХ (EtOAc:петролейный эфир = 1:2), получили продукт (500 мг, 39,3%) в виде белого твердого вещества. ЖХМС: m/z (ЭРИ), [М+Н]+ = 379.
Стадия 2. трет-Бутил-(3R)-1-(2-(5-цианопиримидин-2-илокси)-4-(4-фторфенил)-циклопентил)пиперидин-3-илкарбамат
В раствор вышеуказанного карбамата (330 мг, 0,62 ммоль) в DMF (5 мл) добавляли Zn(CN)2 (145 мг, 1,23 ммоль) и цинк (4,03 мг, 0.06 ммоль) при к.т., затем добавляли Pd2dba3 (106,8 мг, 0,12 ммоль) и dppf (137 мг, 0,25 ммоль), и эту реакционную смесь перемешивали в течение 3 ч при 120°С. После разбавления EtOAc (20 мл) и промывки (водой (10 мл × 2), насыщенным рассолом (10 мл)) объединенные органические фазы сушили над и выпаривали. Остаток очищали препаративной ТСХ (DCM:MeOH = 50:1) с получением неочищенного продукта (200 мг, 67,4%) в виде желтого твердого вещества. После препаративной хиральной ВЭЖХ (колонка: CHIRAL Cellulose-SB размеры: 0,46×15 см; 3 мкм; подвижная фаза: гексаны (0,1% DEA):IPA = 80:20; скорость потока: 1,0 мл/мин; детектор: УФ-254 нм; RT1: 7,353; RT2: 8,710) получили изомер 1 трет-бутил-(R)-1-((1S,2S,4R)-2-(5-цианопиримидин-2-илокси)-4-(4-фторфенил)циклопентил)пиперидин-3-илкарбамата (120 мг, 57,1%, 100% ее) и изомер 2 (50,0 мг, 23,81%, 98,7% ее) в виде белых твердых веществ. ЖХМС: m/z (ЭРИ), [M+H]+ = 482.
Стадия 3. 2-[2-(3-Амино-1-пиперидил)-4-(4фторфенил)циклопентокси]-пиримидин-5-карбонитрил Соединение 30

В раствор вышеуказанного изомера 1 (120 мг, 0,25 ммоль) в DCM (2 мл) добавляли TFA (0,66 мл) при к.т. После перемешивания в течение 16 ч и стандартной обработки неочищенный продукт очищали препаративной ВЭЖХ (колонка: XSelect CSH Prep С18 OBD, 5 мкм, 19×150 мм; подвижная фаза А: вода (0,1% FA), подвижная фаза В: MeCN; скорость потока: 20 мл/мин; градиент: от 2% В до 27% В за 7 мин; 220,254 нм) с получением Соединения 30 (100 мг, 93%) в виде белого твердого вещества, которое оказалось эффективным изомером. 1Н ЯМР (300 МГц, CD3OD) δ 8.98 (s, 2Н), 8.31 (s, 1Н), 7.32 (d, 2Н), 7.04 (t, 2Н), 5.59 (d, 1Н), 3.42 (br s, 1H), 3.26 (s, 1H), 2.96 (d, 1H), 2.85-2.67 (m, 1H), 2.67-2.51 (m, 2H), 2.43 (d, 1H), 2.23 (d, 2H), 2.05-1.46 (m, 5H). ЖХМС: m/z (ЭРИ), [M+H]+ = 382.
Соединение 31
Стадия 1. трет-Бутил-(3R)-1-(2-(5-бромпиримидин-2-илокси)-4-(4-фторфенил)-циклопентил)пиперидин-3-илкарбамат
В раствор F2a (900 мг, 2,38 ммоль) в DMF (6 мл) добавляли NaH (190 мг, 4,76 ммоль) при к.т.Эту смесь перемешивали в течение 3 мин, затем вводили 5-бром-2-хлорпиримидин (690 мг, 3,57 ммоль). После перемешивания в течение 8 ч реакционную смесь обрабатывали. После очистки препаративной ТСХ получили продукт (500 мг, 39,3%) в виде белого твердого вещества. Этот неочищенный продукт дополнительно очищали препаративной хиральной ВЭЖХ [(CHIRALPAK IC-3 размеры: 0,46×10 см; 3 мкм; подвижная фаза: гексаны (0,1% DEA):EtOH = 80:20; скорость потока: 1 мл/мин; детектор: 254 нм; RT1: 4,759; RT2: 5,595) получили изомер 1 трет-бутил-(3R)-1-(2-(5-цианопиразин-2-илокси)-4-(4-фторфенил)циклопентил)пиперидин-3-илкарбамата (100 мг, 55,6%, 99,9% ее) и изомер 2 (50,0 мг, 27,8%, 100% ее) в виде белого твердого вещества.
Стадия 2. 5-[2-(3-Аммно-1-пиперидил)-4-(4-фторфенил)циклопентокси]пиразин-2-карбонитрил Соединение 31

В раствор полученного выше изомера 2 (50 мг, 0,10 ммоль) в DCM (2 мл) добавляли TFA (0,5 мл, 6,5 ммоль) при к.т. Реакционную смесь перемешивали в течение 2 ч, затем подвергали стандартной обработке. Неочищенный продукт очищали препаративной ВЭЖХ [колонка XBridge Prep C18 OBD, 5 мкм; подвижная фаза А: вода (10 ммоль/л NH4HCO3), подвижная фаза В: MeCN; скорость потока: 20 мл/мин; градиент: от 20% В до 33% В за 20 мин; 254/220 нм] с получением Соединения 31 (30,0 мг, 76%) в виде белого твердого вещества. ЖХМС: m/z (ЭРИ), [M+H]+ = 382,4; 1Н ЯМР (400 МГц, CD3OD) δ 8.64 (s, 1H), 8.36 (s, 1H), 7.30 (dd, 2Н), 7.04 (t, 2Н), 5.65-5.53 (m, 1Н), 3.51-3.35 (m, 3Н), 2.93 (d, 1Н), 2.71 (d, 1Н), 2.57 (d, 2Н), 2.42 (s, 1Н), 2.20 (dd, 2Н), 2.02-1.89 (m, 1Н), 1.89-1.72 (m, 2Н), 1.65 (d, 2Н).
Соединение 32
Стадия 1. трет-Бутил-(3R)-1-(2-(2-цианопиримидин-2-илокси)-4-(4-фторфенил)-циклопентил)пиперидин-3-илкарбамат
В раствор F2a (260 мг, 0,69 ммоль), 5-гидроксипиримидин-2-карбонитрила (100 мг, 0,82 ммоль) и Ph3P (270 мг, 1,03 ммоль) в DCM (10 мл) при 0°С добавляли DTAD (237 мг, 1,03 ммоль). Эту смесь перемешивали в течение 2 ч при 25°С. Реакционную смесь гасили насыщенным раствором NaHCO3 (100 мл), экстрагировали DCM (2×50 мл), затем сушили и выпаривали с получением оранжевой смолы. После препаративной ВЭЖХ (колонка XBridge Prep С18 OBD, диоксид кремния 5 мкм, диаметр 19 мм, длина 150 мм, градиент воды (содержащей 0,05% NH3)/MeCN) получили продукт (190 мг, 57,4%) в виде белого твердого вещества. ЖХМС: m/z (ЭРИ), [М+Н]+ = 482. После препаративной хиральной ВЭЖХ [колонка: CHIRALPAK IC, внутренний диаметр 2,0 см × длина 25 см; подвижная фаза А: гексаны-ВЭЖХ, подвижная фаза В: EtOH-ВЭЖХ; скорость потока: 20 мл/мин; градиент: А:В = 85:15 за 24 мин; получили изомер 1 трет-бутил-(3R)-1-(2-(2-цианопиримидин-5-илокси)-4-(4-фторфенил)циклопентил)-пиперидин-3-илкарбамата (первая фракция: 5 мг, 50,0%, 100% ее) и изомер 2 (вторая фракция: 100 мг, 52,6%, 88,6% ее).
Стадия 2. 5-[2-(3-Аммно-1-пиперидил)-4-(4-фторфенил)циклопентокси]пиразин-2-карбонитрил Соединение 32

В раствор полученного выше изомера 2 (100 мг, 0,21 ммоль) в DCM (10 мл) добавляли TFA (0,66 мл) при 25°С. Реакционную смесь перемешивали в течение 16 ч, затем обрабатывали. Неочищенный продукт очищали препаративной ВЭЖХ (колонка: XSelect CSH Prep С18 OBD, 5 мкм, 19 мм × 150 мм; подвижная фаза А: вода (0,05% TFA), подвижная фаза В: MeCN; скорость потока: 20 мл/мин; градиент: от 10% В до 32% В за 7 мин; 254, 220 нм) получили Соединение 32 (80 мг, 51,6%) в виде белого твердого вещества. ЖХМС: m/z (ЭРИ), [M+H]+ = 382; 1Н ЯМР (300 МГц, CD3OD) δ 8.63 (s, 2Н), 7.42-7.26 (m, 2Н), 7.13-6.97 (m, 2Н), 5.57-5.40 (m, 1H), 4.08 (ddd, 1H), 3.76-3.36 (m, 5Н), 3.11 (q, 2Н), 2.63 (ddd, 1Н), 2.35 (dtd, 2Н), 2.23-2.01 (m, 3Н), 2.01-1.81 (m, 1Н), 1.70 (dd, 1H). 19F ЯМР (282 МГц, CD3OD) δ -77.14, -118.01.
Рентгенокристаллографические исследования Соединения 10, Форма А
Образец соединения 10, полученного, как описано выше, устанавливали на монокристаллическое кремниевое (SSC) предметное стекло, и дифракцию рентгеновских лучей на порошке регистрировали с использованием Theta-Theta PANalytical X'Pert PRO (длина волны рентгеновского излучения 1,5418Å, фильтрованное никелем Cu-излучение, напряжение 45 кВ, термоэлектронная эмиссия 40 мА). Использовали щель с автоматическим регулированием расходимости и антирассеивающую щель, и образцы вращали во время измерения. Образцы сканировали от 2 до 50° 2-тета с шагом 0,013° и 233-секундным шагом времени измерения с использованием детектора PLXCEL (активная область 3,35° 2-тета).
13 самых 3Начимых пиков дифракции рентгеновских лучей на порошке для Соединения 10, Форма А, указаны в Таблице 1, приведенной выше. 3Начения относительной интенсивности из Таблицы 1 отнесены к определениям, приведенным в Таблице 3 ниже.


| название | год | авторы | номер документа |
|---|---|---|---|
| КОНДЕНСИРОВАННЫЕ ТРИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ ИМИДАЗОЛА В КАЧЕСТВЕ МОДУЛЯТОРОВ АКТИВНОСТИ TNF | 2014 |
|
RU2679914C9 |
| КОНДЕНСИРОВАННЫЕ ТРИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ БЕНЗИМИДАЗОЛОВ В КАЧЕСТВЕ МОДУЛЯТОРОВ АКТИВНОСТИ TNF | 2014 |
|
RU2689777C1 |
| ТРИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ, ОБЕСПЕЧИВАЮЩИЕ РАЗРУШЕНИЕ БЕЛКА IKAROS И БЕЛКА AIOLOS | 2020 |
|
RU2833608C2 |
| ПИРАЗОЛ-4-ИЛ-ГЕТЕРОЦИКЛИЛ-КАРБОКСАМИДНЫЕ СОЕДИНЕНИЯ И СПОСОБЫ ПРИМЕНЕНИЯ | 2012 |
|
RU2638552C2 |
| ПИРАЗОЛО[3,4-С]ПИРИДИНЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2638116C2 |
| ИНГИБИТОРЫ ФУРИНА | 2019 |
|
RU2799824C2 |
| СОЕДИНЕНИЯ ПИРИДАЗИНАМИДА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ ТИРОЗИНКИНАЗЫ СЕЛЕЗЕНКИ (SYK) | 2013 |
|
RU2627661C2 |
| КОНДЕНСИРОВАННЫЕ ТРИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ ИМИДАЗОЛА В КАЧЕСТВЕ МОДУЛЯТОРОВ АКТИВНОСТИ TNF | 2014 |
|
RU2700004C1 |
| 3,6-ДИАМИНОПИРИДАЗИН-3-ИЛЬНЫЕ ПРОИЗВОДНЫЕ, СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ПРОАПОПТОТИЧЕСКИХ СРЕДСТВ | 2020 |
|
RU2830186C2 |
| ПОЛИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ И СПОСОБЫ ЦЕЛЕНАПРАВЛЕННОЙ ДЕГРАДАЦИИ ПОЛИПЕПТИДОВ БЫСТРО УСКОРЕННОЙ ФИБРОСАРКОМЫ | 2019 |
|
RU2830173C2 |
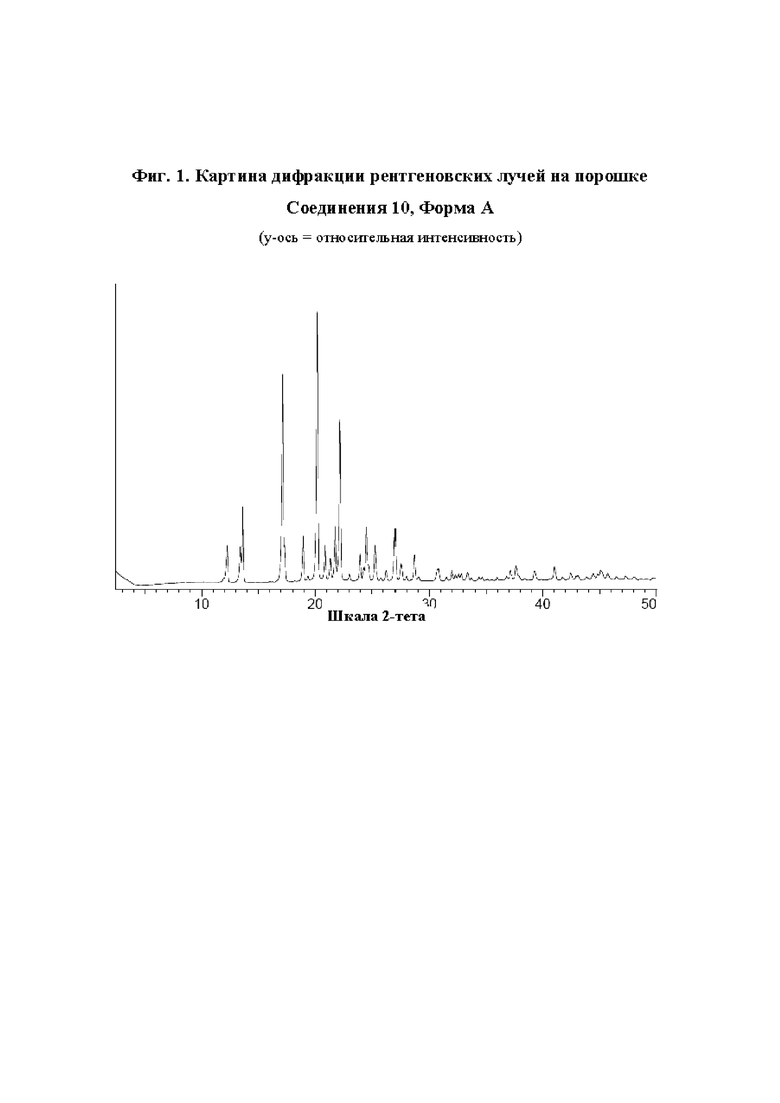
Группа изобретений относится к области органической химии и фармакологии, а именно к соединениям циклопентана, которые ингибируют канонические каналы с транзиторным рецепторным потенциалом TRPC6 и TRPC3. Раскрыто соединение формулы I где: X представляет собой а) О, и R1 представляет собой 6-членное ароматическое или гетероароматическое кольцо, выбранное из фенила, пиридила, пиримидила, пиразинила или пиридазила, где R1 возможно замещен одним или двумя заместителями Y, независимо выбранными из F, Cl, Br, CN, ОН, ОС1-3алкила, C1-3алкила или циклопропила; или б) NR2, и где N, R1 и R2 вместе образуют 5-членный ароматический гетероцикл, который возможно замещен одним или двумя заместителями Y, которые представляют собой CN; R3 независимо выбран из F, Cl, метила, метокси или гидрокси; R4 независимо выбран из F или Cl, присоединенного к С2, С4 или С5 пиперидинового кольца; и целые числа а и b независимо выбраны из 0, 1 или 2; или его фармацевтически приемлемая соль. Также раскрыто конкретное соединение (3R,5R)-5-фтор-1-((1R,2R,4S)-4-(4-фторфенил)-2-(1Н-1,2,4-триазол-1-ил)циклопентил)пиперидин-3-амин, кристаллическая форма (3R,5R)-5-фтор-1-((1R,2R,4S)-4-(4-фторфенил)-2-(1Н-1,2,4-триазол-1-ил)циклопентил)пиперидин-3-амина, фармацевтическая композиция, обладающая активностью ингибиторов TRPC6 (канал с транзиторным рецепторным потенциалом 6) и TRPC3 (канал с транзиторным рецепторным потенциалом 3), на основе раскрытого соединения. Кроме того описан способ ингибирования TRPC6 и/или TRPC3 у нуждающегося в этом субъекта и способ получения соединения формулы I. Группа изобретений обеспечивает эффективное ингибирование канонических каналов с транзиторным рецепторным потенциалом TRPC6 и TRPC3. 6 н. и 15 з.п. ф-лы, 1 ил., 3 табл., 32 пр.
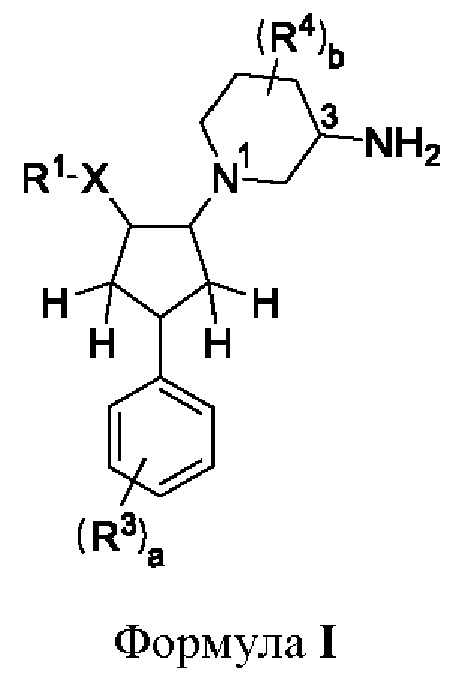
1. Соединение формулы I

где:
X представляет собой а) О, и R1 представляет собой 6-членное ароматическое или гетероароматическое кольцо, выбранное из фенила, пиридила, пиримидила, пиразинила или пиридазила, где R1 возможно замещен одним или двумя заместителями Y, независимо выбранными из F, Cl, Br, CN, ОН, ОС1-3алкила, C1-3алкила или циклопропила; или б) NR2, и где N, R1 и R2 вместе образуют 5-членный ароматический гетероцикл, который возможно замещен одним или двумя заместителями Y, которые представляют собой CN;
R3 независимо выбран из F, Cl, метила, метокси или гидрокси;
R4 независимо выбран из F или Cl, присоединенного к С2, С4 или С5 пиперидинового кольца; и
целые числа а и b независимо выбраны из 0, 1 или 2;
или его фармацевтически приемлемая соль.
2. Соединение по п. 1, в котором пиперидиновая группа и группа XR1 находятся в транс-конфигурации.
3. Соединение по п. 1 или 2, где пиперидин и фенильная группа находятся в цис-конфигурации.
4. Соединение по любому из пп. 1-3, где заместитель R3 расположен в пара-положении по отношению к связи с циклопентановым кольцом.
5. Соединение по п. 4, где заместитель R3 представляет собой F, и а=1.
6. Соединение по любому из пп. 1-5, где X представляет собой О.
7. Соединение по п. 6, где 6-членное ароматическое или гетероароматическое кольцо R1 выбрано из фенила, пиридила, пиримидила, пиразинила или пиридазила, и где R1 замещен по меньшей мере одним заместителем Y, выбранным из Me, Cl, F и CN.
8. Соединение по любому из пп. 1-5, где X представляет собой NR2.
9. Соединение по п. 8, где 5-членный ароматический гетероцикл, содержащий NR1R2, является незамещенным.
10. Соединение по п. 8 или 9, где 5-членный ароматический гетероцикл, содержащий NR1R2 выбран из пиррола, имидазола, пиразола и 1,2,4-триазола.
11. Соединение по п. 1, выбранное из
1-[4-(4-фторфенил)-2-(триазол-2-ил)циклопентил]пиперидин-3-амина;
1-[2-(3-амино-1-пиперидил)-4-(4-фторфенил)циклопентил]пиразол-4-карбонитрила;
1-[2-(3-амино-1-пиперидил)-4-(4-фторфенил)циклопентил]пиразол-3-карбонитрила;
1-[2-(3-амино-1-пиперидил)-4-(4-фторфенил)циклопентил]пиррол-3-карбонитрила;
1-[2-(3-амино-1-пиперидил)-4-(4-фторфенил)циклопентил]триазол-4-карбонитрила;
1-[2-(3-амино-5-фтор-1-пиперидил)-4-(4-фторфенил)циклопентил]пиразол-4-карбонитрила;
1-[2-(3-амино-4,4-дифтор-1-пиперидил)-4-(4-фторфенил)циклопентил]пиразол-4-карбонитрила;
1-[4-(4-фторфенил)-2-пиразол-1-ил-циклопентил]пиперидин-3-амина;
5-фтор-1-[4-(4-фторфенил)-2-пиразол-1-ил-циклопентил]пиперидин-3-амина;
5-фтор-1-[4-(4-фторфенил)-2-(1,2,4-триазол-1-ил)циклопентил]пиперидин-3-амина;
5-фтор-1-[4-(4-фторфенил)-2-(тетразол-2-ил)циклопентил]пиперидин-3-амина;
1-[4-(4-фторфенил)-2-(тетразол-2-ил)циклопентил]пиперидин-3-амина;
1-[2-(3-амино-1-пиперидил)-4-(4-фторфенил)циклопентил]-1,2,4-триазол-3-карбонитрила;
4-[2-(3-амино-1-пиперидил)-4-(4-фтор-3-гидрокси-фенил)циклоопентокси]-бензонитрила;
4-[2-(3-амино-1-пиперидил)-4-(4-фтор-3-метокси-фенил)циклопентокси]-бензонитрила;
4-[2-(3-амино-1-пиперидил)-4-(3-фторфенил)циклопентокси]-3-хлор-бензонитрила;
4-[2-(3-амино-4,4-дифтор-1-пиперидил)-4-(4-фторфенил)циклопентокси]-бензонитрила;
4-[2-(5-амино-3,3-дифтор-1-пиперидил)-4-(4-фторфенил)циклоопентокси]-бензонитрила;
4-[2-(3-амино-1-пиперидил)-4-(4-фторфенил)циклопентокси]-2-фтор-бензонитрила;
2-[2-(3-амино-1-пиперидил)-4-фенил-циклопентокси]бензонитрила;
4-[2-(3-амино-1-пиперидил)-4-фенил-циклопентокси]-3-хлор-бензонитрила;
6-[2-(3-амино-5-фтор-1-пиперидил)-4-(4-фторфенил)циклопентокси]-5-метил-пиридазин-3-карбонитрила;
1-[2-(4-хлорпиридазин-3-ил)окси-4-(4-фторфенил)циклопентил]пиперидин-3-амина;
6-[2-(3-амино-5-фтор-1-пиперидил)-4-(4-фторфенил)циклопентокси]пиридазин-3-карбонитрила;
1-[4-(4-фторфенил)-2-(5-фторпиридазин-3-ил)окси-циклопентил]пиперидин-3-амина;
6-(2-((R)-3-аминопиперидин-1-ил)-4-(4-фторфенил)циклопентилокси)-никотинонитрила;
6-[2-(3-амино-1-пиперидил)-4-(4-фторфенил)циклопентокси]пиридин-3-карбонитрила;
1-[4-(4-фторфенил)-2-пиридазин-3-илокси-циклопентил]пиперидин-3-амина;
5-фтор-1-[4-(4-фторфенил)-2-пиримидин-4-илокси-циклопентил]пиперидин-3-амина;
2-[2-(3-амино-1-пиперидил)-4-(4-фторфенил)циклопентокси]пиримидин-5-карбонитрила;
5-[2-(3-амино-1-пиперидил)-4-(4-фторфенил)циклопентокси]пиразин-2-карбонитрила и
5-[2-(3-амино-1-пиперидил)-4-(4-фторфенил)циклопентокси]пиримидин-2-карбонитрила;
или его фармацевтически приемлемая соль.
12. (3R,5R)-5-Фтор-1-((1R,2R,4S)-4-(4-фторфенил)-2-(1Н-1,2,4-триазол-1-ил)циклопентил)пиперидин-3-амин или его фармацевтически приемлемая соль.
13. Кристаллическая форма (3R,5R)-5-фтор-1-((1R,2R,4S)-4-(4-фторфенил)-2-(1Н-1,2,4-триазол-1-ил)циклопентил)пиперидин-3-амина, имеющая картину дифракции рентгеновских лучей на порошке с по меньшей мере тремя конкретными пиками при 2-тета = 17,1°, 20,2° и 22,2°, где указанные значения могут быть плюс или минус 0,5° 2-тета.
14. Фармацевтическая композиция, обладающая активностью ингибиторов TRPC6 (канал с транзиторным рецепторным потенциалом 6) и TRPC3 (канал с транзиторным рецепторным потенциалом 3), которая содержит эффективное количество соединения или его фармацевтически приемлемой соли или кристаллической формы по любому из пп. 1-13 и по меньшей мере один фармацевтически приемлемый разбавитель, эксципиент или инертный носитель.
15. Соединение или его фармацевтически приемлемая соль или кристаллическая форма по любому из пп. 1-13 для применения в изготовлении лекарственного средства, где лекарственное средство возможно предназначено для лечения заболевания почек.
16. Соединение или его фармацевтически приемлемая соль или кристаллическая форма по любому из пп. 1-13 для применения в качестве лекарственного средства.
17. Соединение или его фармацевтически приемлемая соль или кристаллическая форма по любому из пп. 1-13 для применения в лечении или профилактике заболеваний и состояний, при которых ингибирование TRPC6 и/или TRPC3 является полезным.
18. Соединение или его фармацевтически приемлемая соль или кристаллическая форма по любому из пп. 1-13 для применения в лечении заболевания почек, где это заболевание возможно представляет собой фокально-сегментарный гломерулосклероз (FSGS) с мутацией приобретения функции TRPC6.
19. Способ ингибирования TRPC6 и/или TRPC3 у нуждающегося в этом субъекта, включающий введение эффективного количества соединения или его фармацевтически приемлемой соли или кристаллической формы по любому из пп. 1-13.
20. Способ по п. 19, где нуждающийся субъект имеет заболевание почек, где заболевание почек возможно представляет собой фокально-сегментарный гломерулосклероз с мутацией приобретения функции TRPC6.
21. Способ получения соединения формулы I, включающий стадию
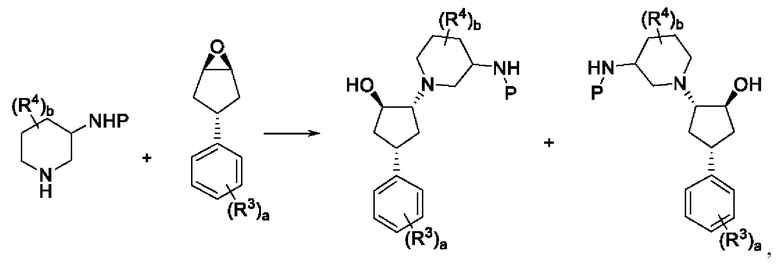
где Р представляет собой защитную группу, а остальные группы такие, как определено в п. 1.
| ЭЛЕКТРОННЫЙ ТЕРМОМЕТР С ПРОЗРАЧНЫМ ДИСПЛЕЕМ | 2008 |
|
RU2368876C1 |
| WO 1995004028 A1, 09.02.1995 | |||
| WO 2004013629 A2, 12.02.2004 | |||
| US 5134168 A1, 28.07.1992 | |||
| Движитель для судов | 1930 |
|
SU23141A1 |
Авторы
Даты
2023-04-27—Публикация
2019-05-09—Подача