Изобретение относится к медицине, в частности к акушерству, и может быть использовано для прогнозирования ранней преэклампсии по данным показателей коагуляционного гемостаза в сроки гестации 19-20 недель.
Преэклампсия (ПЭ) описывается как мультисистемное патологическое состояние, возникающее после 20-ти недель беременности с клиническими проявлениями в виде артериальной гипертензии в сочетании с протеинурией, а при тяжелом течении с явлениями полисистемной недостаточности. Также, на этапе клинической реализации, для ПЭ характерны специфические лабораторные изменения и морфологическая картина поражения кровеносных сосудов маточно-плацентарной площадки. В литературе описано и проанализировано более 15 специфических биомаркеров, дисбаланс которых рассматривается как предикция развития ПЭ (Liu N, Guo YN, Gong LK, Wang BS. Advances in biomarker development and potential application for preeclampsia based on pathogenesis. Eur J Obstet Gynecol Reprod Biol X. 2020 Oct 9;9:100119. doi: 10.1016/j.eurox.2020.100119. PMID: 33103113; PMCID: PMC7575783; Poon L.C., Shennan A., Hyett J.A. et al. The International Federation of Gynecology and Obstetrics (FIGO) initiative on pre-eclampsia: A pragmatic guide for first-trimester screening and prevention // Int J Gynaecol Obstet. 2019. Vol. 145, Suppl 1. P. 1-33. DOI: 10.1002/ijgo.12802.). При этом роль дисбаланса гемостатических реакций в формировании акушерской патологии, в том числе ПЭ, неоспорима и изучается на протяжении ни одного десятилетия. Согласно современным представлениям, вклад нарушений в системе гемостаза определяет 5-15% плацента ассоциированных осложнений. Ключевая роль в их в инициации принадлежит повышенному образованию тромбина, один из механизмов которого заключается в повышенном синтезе и высвобождение тканевого фактора (ТФ) моноцитами крови при усиленном системном воспалительном ответе матери (Schjetlein R, Abdelnoor М, Haugen G, Husby H, Sandset PM, Wisloff F. 1999. Hemostatic variables as independent predictors for fetal growth retardation in preeclampsia. ACTA Obstetricia et Gynecologica Scandinavica 78:191-197 DOI 10.1080/j.1600-0412.1999.780304.x.; Chaiworapongsa T, Yoshimatsu J, Espinoza J, Kim YM, Berman S, Edwin S, Yoon BH, Romero R. 2002. Evidence of in vivo generation of thrombin in patients with small-for-gestational-age fetuses and pre-eclampsia. Journal of Maternal-Fetal and Neonatal Medicine 11:362-367 DOI 10.1080/jmf.11.6.362.367).
Известно, что ПЭ с клиническими проявлениями до 34 недель относится к ранней преэклампсии, связана с задержкой роста плода, имеет тяжелое клиническое течение и неблагоприятный прогноз как для матери, так и для новорожденного (Magee L.A., Pels A., Helewa М., Rey Е., von Dadelszen P. Diagnosis, evaluation and management of the hypertensive disorders of pregnancy: execultive summary // J. Obstet. Gynaecol. Can. 2014. Vol. 36. N5. P. 416-441). Как правило, ранняя ПЭ манифестирует у пациенток группы низкого риска ее развития, в связи с чем предикция ранней ПЭ крайне затруднительна.
Известен способ прогнозирования тяжелой ПЭ (патент РФ, 2013 год: RU 2 481 578) посредством расчета и оценки лейкоцитарного индекса интоксикации по формуле Я.Я. Кальф-Калиф. Развитие тяжелой ПЭ прогнозируют при его значении выше 1,6. Способ технически прост в исполнение, но имеет ряд ограничений в использовании. Информативность предложенного способа доказана для пациенток с клиникой угрозы прерывания беременности во втором триместре беременности. Патогенез угрозы прерывания беременности многофакторен, зачастую инициирован воспалительными процессами, что, определенно, повлияет на лейкоцитарный индекс. Кроме того, реализация ранней ПЭ возможна в сроки гестации 21-28 недель, и прогнозирование будет запоздалым.
Предложен способ прогнозирования развития тяжелой ПЭ с полиорганной недостаточностью (ПОН) (Патент РФ, 2013 год: RU 2204833) путем комплексного исследования нескольких систем организма. Цель достигается тем, что исследуют системы организма: эндотелиальную, гемостаза, гематологическую, иммунную и гемодинамики, анализируют полученные данные с учетом теории функциональных систем на основании системного подхода, выявляют меж- и внутризвеньевые интеграционные межклеточные взаимодействия, ответственные за формирование полиорганной недостаточности. С помощью метода распознавания образов выявляют информативные показатели гомеостаза: число свободных эндотелиоцитов, уровень D-димеров, фибриногена, число тромбоцитов, количество лимфоцитов III типа, уровень интерлейкина 6, индекс активности лейкоцитов, общее периферическое сосудистое сопротивление и выводят решающее правило (F). При F>0 делают заключение о вероятной принадлежности беременной женщины к группе риска на развитие ПОН. При F<0 делают заключение о вероятной принадлежности беременной женщины к группе, где ПОН не будет развиваться в течение беременности.
Недостатком заявленного способа является трудоемкость постановки лабораторных тестов по заданным параметрам, необходимость выполнять сложные математические расчеты и высокая стоимость реактивов.
Имеется способ прогнозирования преэклампсии в поздние сроки беременности (патент РФ, 2019 год: RU 2 691 114), основанный на определении концентрации ADAM 12 и RBP 4 в сроке гестации 12 недель у женщин группы риска развития ПЭ. При увеличении концентрации данных маркеров: ADAM12 более 2,33 нг/мл и RBP 4 более 87,90 мкг/мл прогнозируют развитие преэклампсии, которая развивается после 34 недель беременности.
Недостатком заявленного способа является ограничение его использования только в группе пациенток высокого риска развития ПЭ, а также возможность прогнозировать развитие заболевания только после 34 недель беременности.
В патенте РФ RU 2 154 823 (2000) авторы предлагают способ прогноза развития гестоза с ранних сроков беременности. Способ основан на исследовании констант гомеостаза у беременных женщин в первой половине гестации. У беременной женщины исследуют систему эндотелиоцитов, подсчитывая в крови количество циркулирующих свободных эндотелиоцитов, выявляют показатель гемостаза - фактор Виллебранда и определяют диагностический показатель «Р» по формуле. При значении «Р» более 0 прогнозируют развитие гестоза, а при «Р» менее 0 прогнозируют физиологическое течение беременности.
Недостатком заявленного метода является необходимость наличия специально обученного сотрудника для подсчета количества эндотелиальных клеток в камере Горяева. Кроме того, в заявленном способе не представлен вариант лабораторного метода определения фактора Виллебранда. Не совсем понятно, что определялся антиген или ристомицин-кофакторная активность фактора Виллебранда. Также, необходимо отметить, что уровень антигена фактора Виллибранда очень чувствительный лабораторный тест и его показатель может повышаться при ряде заболеваний: вирусная инфекция, сахарный диабет и др.
Прототипом заявляемого способа выбран «Способ прогнозирования тяжести течения ранней преэклампсии» патент РФ RU 2 753 463 (2021), в котором авторы путем количественного определения в плазме крови матриксной металлопротеиназы 2 типа (ММП-2) у беременных с установленным диагнозом «умеренная преэклампсия» в сроке гестации 24-34 недели прогнозируют риск тяжелого течения ПЭ. При значении ММП-2 равном или превышающем 379 нг/мл прогнозируется высокий риск тяжелого течения преэклампсии, при чувствительности и специфичности метода 70% и 85%, соответственно.
Недостатком метода является его информативность только у пациенток с установленным диагнозом «умеренная преэклампсия» в сроке гестации 24-34 недели. Кроме того, как правило, ранняя ПЭ манифестирует сразу тяжелой степенью состояния пациентки, требующей неотложного принятия решения о досрочном родоразрешении. В связи с чем целевая когорта для использования заявленного метода малочисленна.
Авторы предлагают простой, доступный способ прогнозирования развития ранней ПЭ у пациенток группы низкого риска, позволяющий своевременно стратифицировать беременных в группу для проведения дополнительных методов обследования и профилактических мероприятий.
Технический результат заявляемого метода достигается путем определения уровня прокоагуляционной активности тканевого фактора (TF) в плазме крови в сроки гестации 19-21 неделя, во время проведения второго ультразвукового скрининга пациенткам низкого риска развития ПЭ.
Как известно, TF - это интегральный мембраносвязанный гликопротеин, который может быть обнаружен на поверхности активированных эндотелиальных клеток, лейкоцитов и тромбоцитов (Chu AJ. Tissue Factor, Blood Coagulation, and Beyond: An Overview. International Journal of Inflammation 2011;Article ID 367284, 30 pages, doi: 10.4061/2011/367284). Наибольшая экспрессия TF встречается в мозге (астроцитах), плаценте (клетках трофобласта) и легких (альвеолах) (Osterud В, Bjorklid Е. Sources of tissue factor. Seminars in Thrombosis and Hemostasis 2006;32(1):11-23. Flossel C, Luther T, Muller M, Albrecht S, Kasper M. Immuno histochemical detection of tissue factor (TF) in paraffin sections of routinely fixed human tissue. Histochemistry 1994;101:448-53). Большинство TF, циркулирующего в крови, экспрессируется на компонентах крови - тромбоцитах и их микрочастицах, гранулоцитах, моноцитах и макрофагах (Chu AJ. Tissue Factor, Blood Coagulation, and Beyond: An Overview. International Journal of Inflammation 2011;Article ID 367284, 30 pages, doi: 10.4061/2011/367284; Key NS, Mackman N. Tissue factor and its measurement in whole blood, plasma and microparticles. Seminars in Thrombosis and Hemostasis 2010 Nov;36(8):865-75. doi: 10.1055/s-0030-1267040). TF инициирует коагуляцию путем активации различными механизмами факторов VII, IX, X и II, что приводит к генерации тромбина, формированию фибрина и образованию фибриновых отложений (Mackman N. Role of Tissue Factor in Haemostasis, Thrombosis, and Vascular Development. Arterioscler Thromb Vase Biol 2004; 24:1015-22). Как известно, именно избыточное отложение фибрина в межворсинчатом пространстве является одной из причин недостаточной инвазии ворсин хориона в гравидарный эндометрий, что ведет к неадекватной перестройке спиральных артерий. Связывание TF с VII фактором на поверхности клеток инициирует синтез цитокинов, молекул адгезии и факторов роста, усиливая процессы воспаления, ангиогенеза и апоптоза (Belting М, Ahamed J, Ruf W. Signaling of the tissue factor coagulation pathway in angiogenesis and cancer. Arteiroscler Thromb Vase Biol 2005;25:1545-50). Продукты активации TF вызывают его дальнейшую гиперэкспрессию, которая замыкает порочный круг: тромбоз - воспаление-тромбоз (Chen D, Riesbeck K, McVey JH, Kemball-Cook G, Tuddenham EG, Lechler RI, Dorling A. Human thrombin and FXa mediate porcine endothelial cell activation; modulation by expression of TFPI-CD4 and hirudin-CD4 fusion proteins. Xenotransplantation 2001;8(4):258-65). Однако подчеркивается, что TF или апоформа TF могут не быть полностью активными. Это несоответствие подтверждается экспрессией TF в норме на поверхности трофобластических микроворсинок материнской части плаценты. Таким образом, тканевой фактор можно рассматривать как универсальный биомаркер прогнозирования плацента-ассоциированных осложнений беременности, включая преэклампсию.
Для количественного определения прокоагулянтной активности тканевого фактора авторами был использован набор «Actichrome TF Тканевой фактор» (кат. №846, версия 08.02.2019) производства ЗАО «БиоХимМак». Данный набор предназначен для измерения пептидной активности фактора человеческих тканей в лизатах клеток и человеческой плазме. Образцы смешиваются с человеческим фактором VIIa и человеческим фактором X. Реагенты инкубируются при 37°С, что ведет к образованию комплекса тканевого фактора с VIIa (TF/FVIIa), а также комплекса, необходимого для превращения человеческого фактора X в фактор Ха. Количество образующегося фактора-Ха измеряется его способностью расщеплять Spectrozyme-Xa, высокоспецифический хромогенный субстрат для фактора-Ха, который добавляется в реакционный раствор. Расщепление субстрата приводит к образованию паранитроанилина (пНА) хромофора в реакционной смеси. Оптическая плотность раствора считывается при 405 нм и сравнивается со значениями стандартной кривой, построенной с использованием известных значений уровня активного человеческого тканевого фактора.
Способ осуществляют следующим образом.
Для подтверждения эффективности заявляемого способа проведено проспективное наблюдательное исследование, с включением 81 пациентки. Основную группу составили 41 женщина, группы низкого риска развития ПЭ на период обследования в первом триместре, но с реализованной ранней тяжелой ПЭ, в сроки гестации 26-32 недели. Группа контроля представлена 40 беременными с физиологическим течением беременности, родами в сроки гестации больше 37 недель.
Критерием включения в исследование определено: первые предстоящие роды, возраст матери до 35 лет, отсутствие соматических заболеваний, таких как: артериальная гипертензия, сахарный диабет, повышение массы тела (индекс массы тела не более 25 до момента вступления в беременность), отсутствие семейной истории ПЭ.
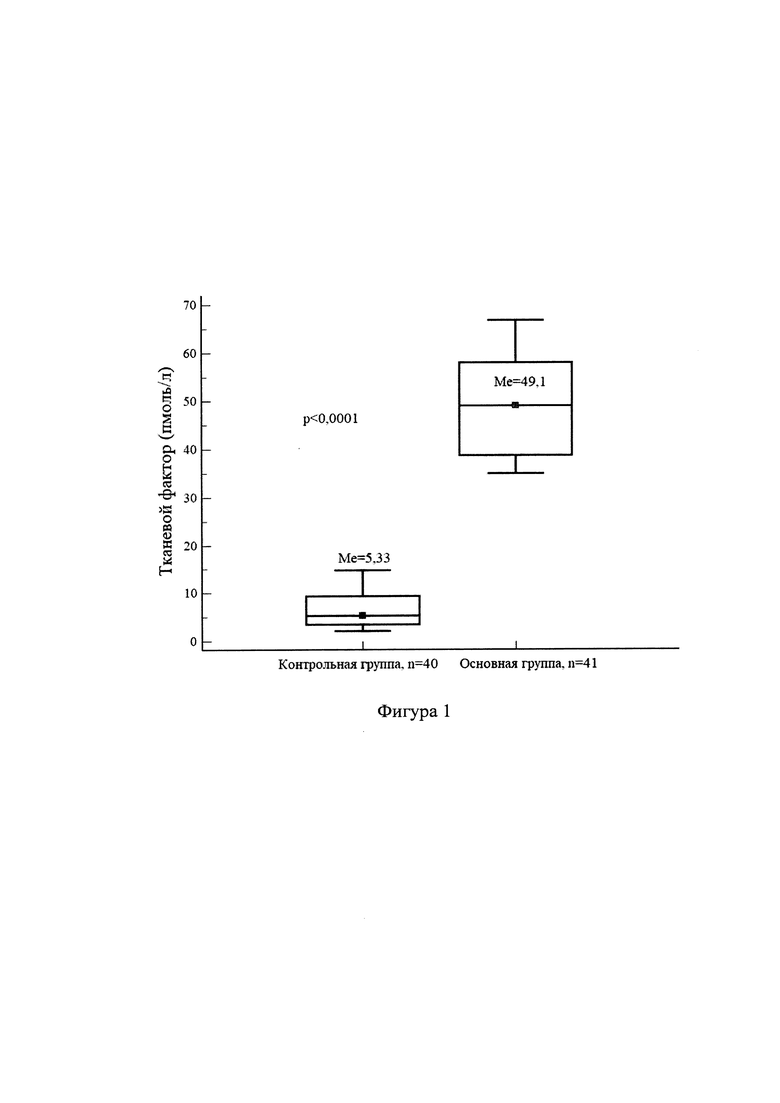
Медиана возраста пациенток контрольной группы составила 28 (95%CI 24,0-33,1) лет, основной - 27,1 (95%CI 22,8-34,3) лет. Группы были сопоставимы по клиническим характеристикам и социальному статусу. Медиана (Me) уровня прокоагулянтной активности TF в группе контроля составила 5,33 пмоль/л (95%CI:3,43-9,32), в основной 49,1 мм (95%CI:38,7-58,1), разница показателей статистически достоверна (р<0,0001) (Фиг. 1). Для определения критической величины показателя (порог отсечки) «уровень прокоагулянтной активности TF» и степени информативности теста проведен ROC-анализ. При проведении анализа определено, что при значении уровня прокоагулянтной активности TF≥14,74 пмоль/литр число верно классифицируемых положительных случаев составляет 100%, верно классифицируемых отрицательных случаев - 100% (Фиг. 2).
Клиническое наблюдение 1
К.И.А. - первобеременная, первородящая 26 лет. Менструальная функция не нарушена, гинекологический анамнез не отягощен. Соматические заболевания отрицает. Беременность желанная, запланированная, наступила во втором цикле при отсутствии использования методов контрацепции. При взятии на диспансерный учет рост пациентки 167, вес 60 кг, ИМТ=21,51. Консультацию посещала регулярно. При обследовании в первом триместре отклонений в лабораторных показателях не зарегистрировано.
Первый ультразвуковой скрининг в сроке гестации 11,5 недели. Ультразвуковых маркеров хромосомной патологии не обнаружено. Ультразвуковая анатомия плода без патологии. Рассчитан риск развития акушерских осложнений в программе Astraia как низкий (риск ПЭ до 37 недель беременности - 1 из 279, риск по задержке роста плода до 37 недель беременности - 1 из 573). Течение беременности благоприятное. При проведении второго ультразвукового скрининга в сроке гестации 19,5 недель: ультразвуковых маркеров хромосомной патологии не обнаружено. Ультразвуковая анатомия плода без патологии. Показатели фетометрии в пределах референсных значений. По данным доплерометрии патологические кровотоки в маточных артериях, сосудах пуповины не зарегистрированы. При исследовании уровня прокоагулянтной активности TF, получен показатель 38,1 пмоль/л.
В 30 недель на фоне полного благополучия появилась сильная головная боль, не купируемая приемом анальгетиков (принимала по совету родственников). При обращении в стационар АД 210/120; протеинурия в разовой порции мочи 6 граммов/литр. Переведена в отделение реанимации и интенсивной терапии (диагноз: беременность 30, 1 неделя; тяжелая преэклампсия), при стабилизации состояния (через 4 часа) экстренно родоразрешена абдоминальным путем. Родился недоношенный мальчик, весом 1750. Кровопотеря в родах составила 650 мл. Стабилизация пациентки на 3 сутки после родоразрешения. Переведена с ребенком на второй этап выхаживания новорожденных.
Клиническое наблюдение 2
З.Т.Г. - повторнобеременная, первородящая, 32 лет. Менструальная функция не нарушена, гинекологические заболевания отрицает. В анамнезе один артифициальный аборт 5 лет назад в сроке гестации 6-7 недель. Соматические заболевания отрицает. Беременность желанная, запланированная, наступила сразу после отмены контрацепции. После аборта в качестве контрацепции использовала комбинированные гормональные контрацептивы. При взятии на диспансерный учет рост пациентки 161, вес 64 кг, ИМТ=24,69. Консультацию посещала регулярно. При обследовании в первом триместре отклонений в лабораторных показателях не зарегистрировано.
Первый ультразвуковой скрининг в сроке гестации 11,5 недели: КТР 50,2 мм, соответствует сроку 11,5 недели. Ультразвуковых маркеров хромосомной патологии не обнаружено. Ультразвуковая анатомия плода без патологии. Допплерометрические характеристики маточно-плацентарного кровотока в норме. Рассчитан риск развития акушерских осложнений в программе Astraia как низкий (риск ПЭ до 37 недель беременности - 1 из 532, риск по задержке роста плода до 37 недель беременности - 1 из 579).
При проведении второго ультразвукового скрининга в сроке гестации 20,1 недель: фетометрически плод соответствует сроку 20,1 недель. Ультразвуковых маркеров хромосомной патологии не обнаружено. Ультразвуковая анатомия плода без патологии. Течение беременности благоприятное. Обследована на уровень прокоагулянтной активности TF, определен как 56,8 пмоль/л.
При осмотре врачом гинекологом в сроке гестации 26 недель диагностировано несоответствие высоты дна матки (ВДМ) сроку беременности - В ДМ=24 см, в связи с чем пациентка направлена на контрольное ультразвуковое исследование. По данным фетометрии плод соответствует 27 перцентилю. По данным допплерометрии регистрируется двустороннее нарушение маточно-плацентарного кровотока 1А типа - пульсационный индекс в маточных артериях - 2,2 - 2,8. Плодово-плацентарный кровоток не изменен. В 29 недель после ночного сна появилась сильная головная боль и пациентка направлена в краевой перинатальный центр. При обращении в стационар АД 180/110; протеинурия в разовой порции мочи 7 граммов/литр. Переведена в отделение реанимации и интенсивной терапии (диагноз: беременность 29,3 недели; тяжелая преэклампсия, задержка роста плода). При стабилизации состояния (через 3 часа) экстренно родоразрешена абдоминальным путем. Родился недоношенный мальчик, весом 1450. Кровопотеря в родах составила 600 мл.
Стабилизация пациентки на 2 сутки после родоразрешения. Переведена с ребенком на второй этап выхаживания новорожденных.
| название | год | авторы | номер документа |
|---|---|---|---|
| Прогнозирование плацентарной преэклампсии по данным плацентометрии в сроки гестации 19-21 неделя у пациентов группы низкого риска | 2021 |
|
RU2771762C1 |
| Способ прогнозирования рецидива ранней тяжелой преэклампсии по результатам исследования уровня плацентарных микровезикул в плазме крови у пациенток с тяжелой преэклампсией в личном анамнезе | 2022 |
|
RU2798715C1 |
| Способ прогнозирования рецидива ранней преэклампсии по маркерам эндотелиальной дисфункции | 2022 |
|
RU2795090C1 |
| Способ прогнозирования риска развития преэклампсии | 2023 |
|
RU2817206C1 |
| Способ прогнозирования эффективности лечения преэклампсии средней тяжести | 2020 |
|
RU2752715C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ТЯЖЕСТИ ТЕЧЕНИЯ РАННЕЙ ПРЕЭКЛАМПСИИ | 2021 |
|
RU2753463C1 |
| Способ прогнозирования эффективности лечения преэклампсии средней тяжести | 2019 |
|
RU2705374C1 |
| Способ прогнозирования развития гипертензивных расстройств при беременности в средней группе риска среди прошедших комбинированный скрининг 1 триместра | 2023 |
|
RU2803010C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ПРЕЖДЕВРЕМЕННЫХ РОДОВ У ЖЕНЩИН С УГРОЖАЮЩИМ ПОЗДНИМ ВЫКИДЫШЕМ И ПРИВЫЧНЫМ НЕВЫНАШИВАНИЕМ БЕРЕМЕННОСТИ | 2024 |
|
RU2826778C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА РАЗВИТИЯ ПРЕЭКЛАМПСИИ У БЕРЕМЕННЫХ С САХАРНЫМ ДИАБЕТОМ 1 И 2 ТИПОВ | 2020 |
|
RU2751139C1 |

Изобретение относится к медицине, а именно к акушерству, и может быть использовано для прогнозирования ранней преэклампсии по данным уровня прокоагулянтной активности тканевого фактора в плазме крови в сроки гестации 19-21 неделя у пациенток группы низкого риска. При уровне прокоагулянтной активности тканевого фактора (TF) более или равного 14,74 пмоль/литр прогнозируют высокий риск развития ранней преэклампсии. Способ обеспечивает возможность прогнозирования развития ранней преэклампсии у пациенток группы низкого риска, позволяющий своевременно стратифицировать беременных в группу для проведения дополнительных методов обследования и профилактических мероприятий, за счет определения уровня прокоагуляционной активности TF в плазме крови в сроки гестации 19-21 неделя, во время проведения второго ультразвукового скрининга пациенткам низкого риска развития преэклампсии. 2 ил., 2 пр.
Способ прогнозирования ранней преэклампсии по данным уровня прокоагулянтной активности тканевого фактора в плазме крови в сроки гестации 19-21 неделя у пациенток группы низкого риска, характеризующийся тем, что при уровне прокоагулянтной активности тканевого фактора (TF) более или равного 14,74 пмоль/литр прогнозируют высокий риск развития ранней преэклампсии.
| НИКОЛАЕВА М.Г | |||
| и др | |||
| Роль коагуляционного гемостаза в реализации ранней преэклампсии у пациенток низкого риска | |||
| Акушерство, Гинекология и Репродукция | |||
| Способ получения продуктов конденсации фенолов с формальдегидом | 1924 |
|
SU2022A1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РАННЕЙ ПРЕЭКЛАМПСИИ В СРОКЕ 11-13 НЕДЕЛЬ | 2018 |
|
RU2732489C2 |
| Способ прогнозирования тяжелой преэклампсии | 2020 |
|
RU2739694C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ПРЕЭКЛАМПСИИ ВО ВТОРОМ ТРИМЕСТРЕ БЕРЕМЕННОСТИ | 2014 |
|
RU2552931C1 |
| AU 2014236152 B2, 01.08.2019 | |||
| WO 2013087887 A2, 20.06.2013 | |||
| WO 2011116958 A1, 29.09.2011 | |||
Авторы
Даты
2023-04-28—Публикация
2022-06-27—Подача