1. Область техники, к которой относится изобретение
Изобретение относится к области люминесцентных соединений с поли(гетеро)ароматическим ядром - нафто[1,2-d]оксазолил-5-сульфокислотам. Изобретение проявляет собой фотосенсибилизатор, который выделяет при освещении ближним УФ/видимым светом радикальные формы кислорода, что приводит к гибели клеток, инкубированных совместно с изобретением. Изобретение может быть использовано в системах фотодинамической терапии инфекционных и неинфекционных заболеваний, включая новообразования и может найти применение в медицинской практике и в биохимических лабораториях.
2. Уровень техники
Одним из направлений создания новых биологически активных соединений является фотодинамическая терапия – активация селективной токсичности неактивного и нетоксичного вещества под воздействием квантов света. Данный подход находит применение при поиске противогрибковой, противобактериальной, противовирусной, противоопухолевой активности соединений, а также применим для ряда неинфекционных заболеваний. Среди нестандартных применений фотодинамической терапии встречаются использование для предотвращения гиперплазии интимы при установке стентов и баллонов при лечении атеросклероза [S. Houthoofd, M. Vuylsteke, S. Mordon, and I. Fourneau, “Photodynamic therapy for atherosclerosis. The potential of indocyanine green,” Photodiagnosis Photodyn. Ther., vol. 29, p. 101568, 2020, doi: https://doi.org/10.1016/j.pdpdt.2019.10.003.].
В литературе представлено достаточно много примеров фотосенсибилизаторов. Так, одним из первых и широко известных является кумарин, обладающий широки спектром фотодинамической активности, в том числе противогрибковой и антибактериальной [L. Sobotta, P. Skupin-Mrugalska, J. Piskorz, and J. Mielcarek, “Non-porphyrinoid photosensitizers mediated photodynamic inactivation against bacteria,” Dye. Pigment., vol. 163, pp. 337–355, 2019, doi: https://doi.org/10.1016/j.dyepig.2018.12.014.]. Для этого соединения описана IC50 для клеточной линии HeLa 54,2 мМ [J.-Y. CHUANG et al., “Coumarin Induces Cell Cycle Arrest and Apoptosis in Human Cervical Cancer HeLa Cells through a Mitochondria- and Caspase-3 Dependent Mechanism and NF-κB Down-regulation,” In Vivo (Brooklyn)., vol. 21, no. 6, pp. 1003 LP – 1009, Nov. 2007, [Online]. Available: http://iv.iiarjournals.org/content/21/6/1003.abstract.].
Среди полиароматических соединений можно выделить вещества природного происхождения, например гиперицин. Данное соединение охарактеризовано по механизму его действия и показана его высокая фотодинамическая активность – IC50 для клеток HeLa составляет 0,32 мМ [A. L. Vandenbogaerde, J. F. Cuveele, P. Proot, B. E. Himpens, W. J. Merlevede, and P. A. de Witte, “Differential cytotoxic effects induced after photosensitization by hypericin,” J. Photochem. Photobiol. B Biol., vol. 38, no. 2, pp. 136–142, 1997, doi: https://doi.org/10.1016/S1011-1344(96)07446-5.].
Среди гетероциклических соединений к фотосенсибилизаторам с высокой активностью можно отнести производные фенотиазинов. К данной группе относится фотосенсибилизатор, признаваемый эталоном – метиленовый синий. Для данного вещества описан и доказан механизм токсичности через формирование активных форм кислорода [P. Dharmaratne et al., “Contemporary approaches and future perspectives of antibacterial photodynamic therapy (aPDT) against methicillin-resistant Staphylococcus aureus (MRSA): A systematic review,” Eur. J. Med. Chem., vol. 200, p. 112341, 2020, doi: https://doi.org/10.1016/j.ejmech.2020.112341.].
В качестве примера для фотосенсибилизатора, способного вызывать гибель клеток при низкой концентрации и облучении УФ и/или близким к нему видимым светом можно привести рибофлавин. Для данного природного соединения описана токсичность для кератоцитов свиньи с визуальным подтверждением некроза среза ткани [Wollensak, G., Spoerl, E., Reber, F. et al. Keratocyte cytotoxicity of riboflavin/UVA-treatment in vitro. Eye 18, 718–722 (2004). https://doi.org/10.1038/sj.eye.6700751]
В публикациях [R. P. Zanocco, R. Bresoli-Obach, S. Nonell, E. Lemp, and A. L. Zanocco, “Structure-activity study of furyl aryloxazole fluorescent probes for the detection of singlet oxygen,” PLoS One, vol. 13, no. 7, p. e0200006, Jul. 2018, doi: 10.1371/journal.pone.0200006.; R. Ruiz-González, R. Zanocco, Y. Gidi, A. L. Zanocco, S. Nonell, and E. Lemp, “Naphthoxazole-based singlet oxygen fluorescent probes,” Photochem. Photobiol., vol. 89, no. 6, pp. 1427–1432, Nov. 2013, doi: 10.1111/php.12106.] описаны структуры с наиболее близким подобием, обладающие доказанной способностью генерировать активные формы кислорода. Для них показана способность как генерировать, так и поглощать активные формы кислорода. Однако при этом тесты на фотосенсибилизирующую способность для данных соединений не проводились, поэтому выступить прототипом они не могут.
Среди сульфокислот можно выделить природный фотосенсибилизатор тартразин. Для него описана геннотоксичность, связанная с облучением [L. Khayyat, A. Essawy, J. Sorour, and A. Soffar, “Tartrazine induces structural and functional aberrations and genotoxic effects in vivo,” PeerJ, vol. 2017, no. 2, pp. 1–14, Feb. 2017, doi: 10.7717/peerj.3041.]
Среди производных пирена не описано фотодинамически активных веществ. Среди произволных пирена близок к заявленному веществу краситель Alexa Fluor® 405, представляющий собой трисульфокислоту 1-замещенного пирена. Данное вещество применяется для окраски эндоплазматического ретикулума [C. van Zanten, D. Melnikau, and A. G. Ryder, “Effects of Viscosity and Refractive Index on the Emission and Diffusion Properties of Alexa Fluor 405 Using Fluorescence Correlation and Lifetime Spectroscopies,” J. Fluoresc., vol. 31, no. 3, pp. 835–845, May 2021, doi: 10.1007/s10895-021-02719-y.].
В связи с тем, что нами не было найдено в обозримой литературе близкого по структуре и свойствам подобия, нами предлагается 2-(пирен-1-ил)нафто[1,2-d]оксазолил-5-сульфокислота – мономолекулярный агент для фотодинамической терапии.
3. Сущность изобретения
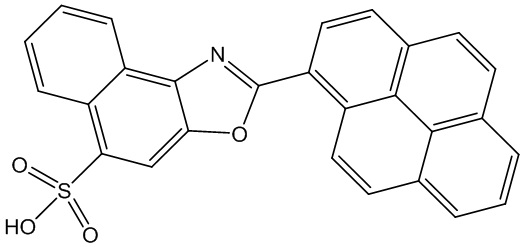
Сущность изобретения составляет растворимая в водной среде 2-(пирен-1-ил)нафто[1,2-d]оксазолил-5-сульфокислота, которая способна генерировать радикальные формы кислорода, что приводит к гибели живых клеток при совместном инкубировании, вызванную фотовозбуждением, что делает его фотодинамическим агентом (фотосенсибилизатором).
Представляемое изобретение демонстрирует хорошие результаты по направленной гибели живых клеток при совместном инкубировании с ним и одновременным облучением 405 нм лазером, при этом в отсутствии облучения никакого токсического эффекта, в аналогичных концентрациях, не наблюдается. При этом величина IC50 для 15 минутной экспозиции составляет порядка 7*10-5M, а для 30 минутной экспозиции, соответственно, 1.5*10-6M (или 1.5*10-3мМ), что существенно превосходит описанные в литературе вещества, обладающие фототоксическим эффектом в этом же диапазоне облучения.
4. Сведения, подтверждающие возможность осуществления изобретения
4.1. Описание способа получения сенсора 2-(пирен-1-ил)нафто[1,2-d]оксазолил-5-сульфокислоты 1
4-амино-3-гидроксинафталин-1-сульфокислоту (200 мг, 0,84 ммоль) и гидроксид натрия (34 мг, 0,84 ммоль) растворили в этаноле (25 мл). Затем при перемешивании добавляли пирен-1-карбаьдегид (232 мг, 1,01 ммоль). Интенсивно перемешивали 7 дней, растворитель упаривали, вещество выделяли флеш-хроматографией на силикагеле: избыток альдегида элюировали хлористым метиленом, затем непрореагировавший амин и продукты его окисления – этилацетатом, целевой продукт - подкисленным соляной кислотой спиртом.
Аммонийную соль приготавливали, растворяя сульфокислоту 1 в избытке водного раствора аммиака и упаривая полученный раствор досуха в вакууме.
2-(Пирен-1-ил)нафто[1,2-d]оксазолил-5-сульфокислота 1. Выход 189 мг (50,1%) 1H NMR (400 MHz, DMSO-d6); δ, ppm 7.65 (t, J= 7.0 Hz, 1H), 7.76 (t, J= 7.3 Hz, 1H), 8.14 (m, 1H), 8.27 (q, J=13.1 Hz, 2 H), 8.35-3.47 (m, 5 H), 8.71 (d, J=7.5 Hz, 1 H), 9.01(d, J=8.3 Hz 1 H), 9.07 (d, J=8.5 Hz, 1 H), 9.99 (d, J=9.5 Hz, 1 H). 13C NMR (100 MHz, DMSO-d6): δ, ppm: 110.4, 119.7, 122.2, 123.9, 124.6, 125.3, 125.5, 125.8, 126.6, 126.7, 127.0, 127.2, 127.5, 127.7, 127.8, 129.2, 129.4, 129.8, 130.1, 130.5, 131.2, 133.4, 136.4, 143.6, 146.1, 163.3, 172.5; EI – MS m/z (%):449 (100%). HRMS: Calc. for C27H15NO4S [M-H]- = 448.0649, found 448.0650. Found, %: C 72,13, H 3.37, N 3,10, S 7.11. C27H15NO4S Calc., %: C 72.15, H 3.36, N 3.12, O 14.24, S 7.13.
4.2. Определение цитотоксичности при облучении лазером 405 нм и в темноте
Для подтверждения возможности реализации изобретения приводим подтверждение фототоксического эффекта заявляемого изобретения.
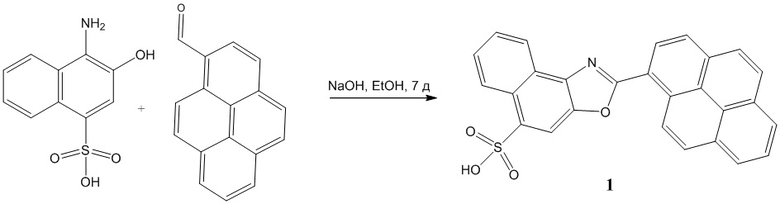
Фототоксический эффект соединения 1 проявляется при любом, сколько-нибудь долгом наблюдении окрашенных веществом клеток. Соединение 1 добавлялось к культуре HeLa в концентрации 1*10-3 М в виде водного раствора аммонийной соли, объемом 50 мкл. Инкубация с красителем осуществлялась в течение 30 минут. После инкубации клетки промывались дважды чистой питательной средой, в ней и осуществлялось последующее наблюдение на конфокальном микроскопе.
Для получения качественных данных было проведено исследование, использующее режим фотообесцвечивания, при котором на образец оказывается воздействие лазером с максимальной возможной интенсивности через программируемые промежутки времени. Клетки, для удобства наблюдения, были дополнительно окрашены ЭПР-селективным красителем.
Уже через 10 секунд обработки клеток, окрашенных сенсором, при помощи 405 нм лазера, на его максимальной мощности, наблюдается образование пузырей на клеточной мембране. Это явление связано с нарушением целостности клеточной мембраны (фиг.1). После чего, под действием осмотического давления, содержимое клетки начинает вытекать в окружающую среду, что часто свидетельствует о ранней стадии клеточной гибели [M. Mitsunaga, M. Ogawa, N. Kosaka, L. T. Rosenblum, P. L. Choyke, and H. Kobayashi, “Cancer cell-selective in vivo near infrared photoimmunotherapy targeting specific membrane molecules,” Nat. Med., vol. 17, no. 12, pp. 1685–1691, Nov. 2011, doi: 10.1038/nm.2554.; J. Icha, M. Weber, J. C. Waters, and C. Norden, “Phototoxicity in live fluorescence microscopy, and how to avoid it,” BioEssays, vol. 39, no. 8, p. 1700003, Aug. 2017, doi: 10.1002/bies.201700003.; [1] K. Nakajima and M. Ogawa, “Phototoxicity in near-infrared photoimmunotherapy is influenced by the subcellular localization of antibody-IR700,” Photodiagnosis Photodyn. Ther., vol. 31, p. 101926,
Для количественной оценки фототоксического эффекта исследуемого вещества был сконструирован бокс для ультрафиолетового воздействия на клетки. Ультрафиолетовый бокс представляет собой металлический контейнер, снабженный системой циркуляции воздуха из двух вентиляторов (приточного и вытяжного), ячейкой для фиксации культурального планшета и двумя лампами ультрафиолетового диапазона Camelion LH26-FS/BLB/E27 с диапазоном излучения от 320 до 380 нм и потребляемой мощностью 26 Вт каждая. Интенсивность освещения на уровне, где располагаются планшет с клетками, оценивалась при помощи люксметра RGK LM-20 с кремниевым фотоэлементом.
Клетки культуры HeLa рассаживались в культуральные 96 луночные планшеты (Eppendorf, Germany) в концентрации 104 клеток на мл и доращивались до 70-80% конфлюентности. В каждой лунке содержалось 200 мкл среды. Далее к клеткам добавлялся водный раствор соединения 1 в разных концентрациях, для контроля использовалось соответствующее количество дистиллированной воды. Инкубация с исследуемым веществом осуществлялась в течение 30 минут после чего осуществлялась обработка УФ излучением в течение разного времени (15, 30 и 45 минут). Аналогичные планшеты так же помещались на соответствующее время в темноту, для оценки не обусловленного фототоксичностью цитотоксического эффекта. После воздействия клетки помещались в инкубатор на 48 часов. Далее количество живых клеток оценивалось при помощи МТТ теста.
Для этого из каждой лунки удалялась среда и лунка дважды промывалась фосфатным буфером, для удаления следов исследуемого вещества, которое потенциально могло исказить результаты исследования, после чего в каждую лунку помещалась 100 мкл бессывороточной среды DMEM с растворенным в ней МТТ (3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide, Biolot, Russia) в концентрации 0.1 мг/мл. Инкубация с раствором МТТ осуществлялась в течение 2 часов, после чего жидкость из лунок удалялась. Далее в каждую лунку добавлялось 100 мкл DMSO. Через 15 минут, после появления насыщенной стабильной окраски, при помощи планшетного спектрофотометра Лазурит (Вектор-Бест, Россия) оценивалось светопропускание на длине волны 590 нм.
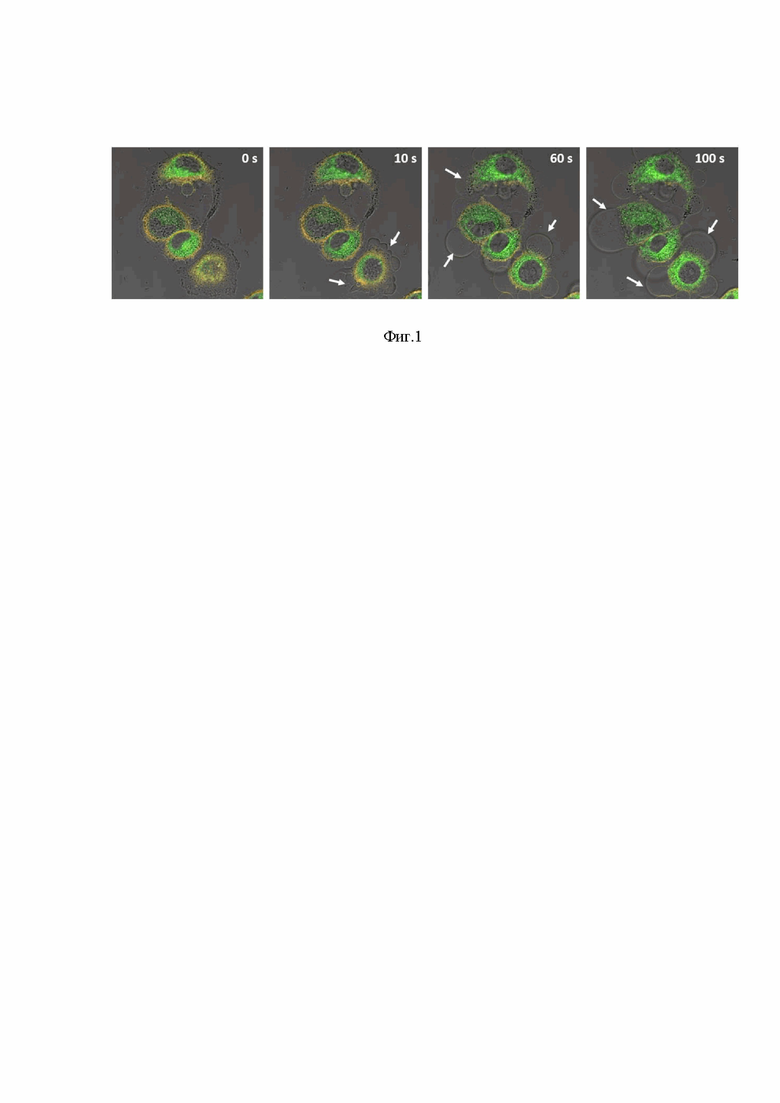
Фототоксический эффект исследуемого вещества был крайне ярко выражен и уже при концентрациях на уровне 1*10-4М наблюдалась 100% гибель клеток, даже при минимальном времени экспозиции, поэтому более подробно нами изучался диапазон концентраций от 5*10-7М до 3*10-5М, кривая выживаемости клеток представлена на фиг.2.
Даже при крайне малой концентрации исследуемого вещества наблюдается ярко выраженный фототоксический эффект, при этом в отсутствии УФ облучения никакого токсического эффекта, в аналогичных концентрациях, не наблюдается. При этом величина IC50 для 15 минутной экспозиции УФ/вид составляет порядка 7*10-5M, а для 30 минутной экспозиции, соответственно, 1.5*10-6M (или 1.5*10-3мМ), что существенно превосходит описанные в литературе вещества, обладающие фототоксическим эффектом в этом же диапазоне облучения [S. Jantová, M. Melušová, M. Pánik, V. Brezová, and Z. Barbieriková, “UVA-induced effects of 2,6-disubstituted 4-anilinoquinazolines on cancer cell lines,” J. Photochem. Photobiol. B Biol., vol. 154, pp. 77–88, 2016, doi: 10.1016/j.jphotobiol.2015.11.014.; V. Spanò et al., “Pyrazolo[3,4-h]quinolines promising photosensitizing agents in the treatment of cancer,” Eur. J. Med. Chem., vol. 102, pp. 334–351, 2015, doi: 10.1016/j.ejmech.2015.08.003.]
4.3. Подтверждение генерации активных форм кислорода соединением 1 при облучении УФ светом
Измерения ЭПР спектров выполнены на спектрометре Bruker “Elexsys E500”. Использовались спиновая ловушка DMPO (5,5-dimethyl-pyrroline N-oxide) и спиновый зонд ТМТН (N-(1-Hydroxy-2,2,6,6-tetramethylpiperidin-4-yl)-2-methylpropanamide).
При анализе водного раствора аммиачной соли 1 на ЭПР спектрометре парамагнитные центры не наблюдались как до, так и после УФ облучения. Следовательно вещество не образует стабильный радикал, в том числе и при облучении.
Спектры двух проб с 2мМ раствором метки ТМТН, одна из которых содержала 0.1мМ соединения 1, были зарегистрированы на ЭПР как до, так и после УФ-облучения. В спектрах обнаруживалось формирование и накопление радикальной формы метки. Что однозначно свидетельствует о прохождении радикального процесса.
Образцы подвергали облучению на УФ лампе и регистрировали ЭПР спектры через интервалы времени облучения. Установлено, что в отсутствии облучения количество парамагнитных центов возросло в обоих образцах незначительно. В это время как в процессе УФ облучения количество парамагнитных центров в образце с раствором аммиачной соли 1 линейно возрастало с увеличением времени экспозиции и значительно превысило соответствующее возрастание количества регистрируемых зондов в образце без фотокатализатора. В образце без сенсора зависимость количества парамагнитных центров от времени облучения описывается линейной регрессией с высоким коэффициентом достоверности, превышая при этом фототоксичность метиленового синего (фиг.3).
В один образец с водным раствором DMPO был добавлен 0.1 мл раствора аммиачного раствора сенсора. Второй образец содержал только водный раствор DMPO. Изучаемые образцы облучались УФ в течение 5 минут и потом регистрировались ЭПР спектры. В результате наблюдали спектр, являющийся компиляцией сигналов DMPO-OH аддукта и DMPO-OO- аддукта [B. Yang, J. Xu, and H. L. Zhu, “Recent progress in the small-molecule fluorescent probes for the detection of sulfur dioxide derivatives (HSO3−/SO32−),” Free Radic. Biol. Med., vol. 145, pp. 42–60, 2019, doi: 10.1016/j.freeradbiomed.2019.09.007.]. Результаты моделирования смешанных спектров позволяют говорить о вкладах аддуктов DMPO-OH и DMPO-OO- 20% и 80% соответственно. Форма спектров позволяет говорить о преобладании реакций типа II – переноса энергии и не более 20% реакций типа I – переноса заряда (фиг.4). Соответственно механизм генерирования активных форм кислорода для сенсора совпадает с описанным для большинства фотосенсибилизаторов.
| название | год | авторы | номер документа |
|---|---|---|---|
| ((2-(5,6-БИС(4-ФТОРФЕНИЛ)-1,2,4-ТРИАЗИН-3-ИЛ)ХИНОЛИН)БИС(2-ФЕНИЛПИРИДИН))ИРИДИЙ(III) ХЛОРИД - КЛЕТОЧНЫЙ ФЛУОРЕСЦЕНТНЫЙ КРАСИТЕЛЬ | 2024 |
|
RU2837462C1 |
| 2-(4-МЕТОКСИФЕНИЛ)-5-(4-(4-(ПИРЕН-1-ИЛ)-1H-1,2,3-ТРИАЗОЛ-1-ИЛ)ФЕНИЛ)-1,3,4-ОКСАДИАЗОЛ-МОНОМОЛЕКУЛЯРНЫЙ ХИМИЧЕСКИЙ СЕНСОР НА НИТРОАЛИФАТИЧЕСКОЕ ВЗРЫВЧАТОЕ ВЕЩЕСТВО ТЕТРАНИТРОПЕНТАЭРИТРИТ | 2023 |
|
RU2820003C1 |
| N-([1,1'-БИФЕНИЛ]-3-ИЛ)-4-ФЕНИЛ-1-(ПИРИДИН-2-ИЛ)-6,7-ДИГИДРО-5H-ЦИКЛОПЕНТА[C]ПИРИДИН-3-АМИН - МОНОМОЛЕКУЛЯРНЫЙ ОПТИЧЕСКИЙ СЕНСОР ДЛЯ ОБНАРУЖЕНИЯ НИТРОАРОМАТИЧЕСКИХ ВЗРЫВЧАТЫХ ВЕЩЕСТВ | 2022 |
|
RU2786741C1 |
| 5-ФЕНИЛ-5""-п-ТОЛИЛ-2,2":6",2""-ТЕРПИРИДИН - ХЕМОСЕНСОР ДЛЯ ФЛУОРЕСЦЕНТНОГО ОПРЕДЕЛЕНИЯ КАТИОНОВ Zn В ВОДНЫХ И ПИЩЕВЫХ ОБРАЗЦАХ | 2021 |
|
RU2773238C1 |
| Тетра(пирен-1-ил)тетрацианопорфиразин как мультифункциональный агент терапии злокачественных новообразований | 2019 |
|
RU2725641C1 |
| Модифицированный фотосенсибилизатор на основе наночастиц селена и гидрофильного полимера | 2024 |
|
RU2835425C1 |
| ВЕЩЕСТВО, ОБЛАДАЮЩЕЕ АНТИГЛИОМНОЙ АКТИВНОСТЬЮ, И СПОСОБ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ ГЛИОБЛАСТОМЫ | 2022 |
|
RU2794666C1 |
| (ЭТАН-1,2-ДИИЛБИС(ОКСИ))БИС(ЭТАН-2,1-ДИИЛ)БИС(ПИРЕН-1-КАРБОКСИЛАТ) - МОНОМОЛЕКУЛЯРНЫЙ ОПТИЧЕСКИЙ СЕНСОР ДЛЯ ОБНАРУЖЕНИЯ НИТРОАРОМАТИЧЕСКИХ ВЗРЫВЧАТЫХ ВЕЩЕСТВ | 2022 |
|
RU2812671C1 |
| ((ОКСИБИС(ЭТАН-2,1-ДИИЛ))БИС(ОКСИ))БИС(ЭТАН-2,1-ДИИЛ)БИС(ПИРЕН-1-КАРБОКСИЛАТ) - МОНОМОЛЕКУЛЯРНЫЙ ОПТИЧЕСКИЙ СЕНСОР ДЛЯ ОБНАРУЖЕНИЯ НИТРОАЛИФАТИЧЕСКИХ ВЗРЫВЧАТЫХ ВЕЩЕСТВ | 2022 |
|
RU2816695C1 |
| Способ комбинированного лечения пациентов с местно-распространенным раком желудка, осложненным субкомпенсированным опухолевым стенозом | 2023 |
|
RU2828409C1 |


Изобретение относится к области биологически активных соединений, а именно к применению 2-(пирен-1-ил)нафто[1,2-d]оксазолил-5-сульфокислоты. Технический результат: применение 2-(пирен-1-ил)нафто[1,2-d]оксазолил-5-сульфокислоты в качестве мономолекулярного агента для генерирования радикальных форм кислорода. 4 ил.

Применение 2-(Пирен-1-ил)нафто[1,2-d]оксазолил-5-сульфокислоты в качестве мономолекулярного агента для фотодинамической терапии
| Kanamori T | |||
| et al | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| The Journal of Organic Chemistry, 2018, Volume 83, No 22, p | |||
| Способ приготовления лака | 1929 |
|
SU13765A1 |
| О.С | |||
| Тания и др | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
Авторы
Даты
2023-05-02—Публикация
2022-07-28—Подача