Перекрестная ссылка на родственные заявки
Настоящая заявка заявляет приоритет предварительной заявки на патент США № 62524557, поданной 25 июня 2017 г., которая в полном объеме включена здесь посредством ссылки.
Область техники, к которой относится изобретение
Настоящее изобретение, в общем, относится к области биологических лекарственных средств и, более конкретно, относится к получению и применению мультиспецифических антител.
Уровень техники
У опухолевых клеток развиваются различные механизмы, чтобы уклониться от надзора иммунной системы. Одним из основных механизмов избегания надзора иммунной системы является снижение распознавания опухолевых клеток иммунной системой. Дефектная презентация опухолеспецифических антигенов или ее отсутствие приводит к иммунной толерантности и прогрессированию рака. Однако даже при наличии эффективного иммунологического распознавания в опухолях развиваются другие механизмы, позволяющие избежать элиминации под действием иммунной системы. Иммунокомпетентные опухоли создают супрессивную микросреду для подавления иммунного ответа. В формирование супрессивной опухолевой микросреды вовлекаются несколько «игроков», включая опухолевые клетки, регуляторные Т-клетки, миелоидные супрессорные клетки, стромальные клетки и клетки других типов. Подавление иммунного ответа может осуществляться в формате, зависимом от контактирования с клеткой, а также независимо от контактирования, посредством секреции иммуносупрессивных цитокинов или элиминации важных факторов выживаемости из локальной среды. Подавление, зависимое от контактирования с клеткой, основывается на молекулах, экспрессируемых на клеточной поверхности, например лиганда 1 белка запрограммированной гибели (PD-L1), T-лимфоцит-ассоциированного белка 4 (CTLA-4) и других [Dunn et al., 2004, Immunity, 21 (2): 137-48; Adachi & Tamada, 2015, Cancer Sci., 106 (8): 945-50].
Поскольку механизмы, с помощью которых опухоли избегают распознавания иммунной системой, продолжают лучше пониматься, недавно появились новые способы лечения, нацеленные на эти механизмы. 25 марта 2011 г. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило для применения инъекционный ипилимумаб (Ервой, Bristol-Myers Squibb) для лечения неоперабельной или метастатической меланомы. Ервой связывается с цитотоксическим Т-лимфоцит-ассоциированным белком 4 (CTLA-4), экспрессируемым на активированных T-клетках, и блокирует взаимодействие CTLA-4 с CD80/86 на антигенпрезентирующих клетках, блокируя тем самым негативный или ингибиторный сигнал, доставляемый в T-клетку через CTLA-4, приводя к реактивации антигенспецифических Т-клеток, что, в свою очередь, приводит к ликвидации опухоли у многих пациентов. Несколько лет спустя в 2014 г. FDA одобрило препарат Кейтруда (пембролизумаб, Merck) и препарат Опдиво (ниволумаб, Bristol-Myers Squibb) для лечения меланомы на поздних стадиях. Эти моноклональные антитела связываются с PD-1, который экспрессируется на активированных и/или истощенных Т-клетках, и блокируют взаимодействие PD-1 с PD-L1, который экспрессируется на опухолях, тем самым элиминируя ингибиторный сигнал через PD-1 в Т-клетку, что приводит к реактивации антигенспецифических Т-клеток, приводя, опять же, у многих пациентов к эрадикации опухоли. С тех пор были проведены дальнейшие клинические испытания, с целью сравнения эффективности одного моноклонального антитела Ервой с комбинацией моноклональных антител Ервой и Опдиво в лечении меланомы на поздних стадиях, которые показали повышение общей выживаемости и выживаемости без прогрессирования заболевания у пациентов, получавших комбинацию антител (Hodi et al., 2016, Lancet Oncol. 17 (11): 1558-1568, Hellman et al., 2018, Cancer Cell 33 (5): 853-861). Однако как показали результаты многих клинических испытаний, существенный положительный эффект лечения больных раком моноклональными антителами, которые специфичны для одной или более молекул иммунных контрольных точек, проявляется только у пациентов с высокой мутационной нагрузкой, в результате которой образуется новый эпитоп(ы) Т-клеток, который распознается антигенспецифическими Т-клетками, и в результате имеет место клинический ответ (Snyder et al., 2014, NEJM, 371: 2189-2199). Те пациенты, которые имеют низкую опухолевую мутационную нагрузку, в основном не демонстрируют объективный клинический ответ (Snyder et al., 2014, NEJM, 371: 2189-2199, Hellman et al., 2018, Cancer Cell, 33 (5): 853-861).
В последние годы другие группы исследователей разработали альтернативный подход, для которого не требуется наличия презентации неоэпитопа антигенпрезентирующими клетками для активации Т-клеток. Одним примером является разработка биспецифического антитела, в котором связывающий домен антитела, который специфичен для опухоль-ассоциированного антигена, например CD19, связан со связывающим доменом антитела, специфичным для CD3 на Т-клетках, создавая таким образом биспецифический активатор Т-клеток или молекулу BiTe. В 2014 г. FDA одобрило для применения биспецифическое антитело под названием блинатумомаб для лечения острого лимфобластного лейкоза из предшественников B-клеток. Блинатумомаб связывает scFv, специфичный для CD19, экспрессируемым на лейкозных клетках, с scFv, специфичный для CD3, экспрессируемым на Т-клетках (Bejnjamin and Stein 2016, Ther. Adv. Adv. Hematol., 7 (3): 142-146). Однако, несмотря на начальную частоту ответа у > 50% пациентов с рецидивирующим или рефрактерным ALL, многие пациенты резистентны к терапии блинатумомабом, или у них развиваются рецидивы после успешного лечения блинатумумабом. Появляются доказательства того, что резистентность к блинатумомабу или развитие рецидивов после лечения блинатумомабом обусловлены экспрессией молекул, ингибирующих иммунные контрольные точки, экспрессируемых на опухолевых клетках, таких как PD-L1, который регулирует ингибиторный сигнал через PD-1, экспрессируемый на активированных Т-клетках (Feucht et al. al., 2016, Oncotarget, 7 (47): 76902-76919). В случае пациента, участвующего в исследовании, с резистентностью к терапии блинатумомабом, был выполнен второй раунд терапии блинатумомабом, но с добавлением моноклонального антитела, пембролизумаба (Кейтруда, Merck), который специфичен для PD-1, и блокирует взаимодействие PD-1, экспрессируемого Т-клетками, с PD-L1, который экспрессируется опухолевыми клетками, что приводило к высокому ответу и снижению количества опухолевых клеток в костном мозге до уровня от 45% до менее чем 5% у этого одного пациента (Feucht et al., 2016, Oncotarget, 7 (47): 76902-76919). Эти результаты показывают, что объединение биспецифической молекулы BiTe с одним или более моноклональными антителами может существенно повысить клиническую активность по сравнению с каждым одним агентом.
Сущность изобретения
Настоящее изобретение обеспечивает, среди прочего, тетраспецифические мономеры антител, антитела, содержащие тетра-специфические мономеры, их антигенсвязывающие фрагменты, мультиспецифические антитела, иммуноконъюгаты, содержащие раскрытые антитела, способы получения раскрытых мономеров, антигенсвязывающих фрагментов и антител, и способы применения раскрытых молекул для лечения рака.
В одном аспекте заявка обеспечивает тетраспецифические мономеры антител. В одном варианте осуществления тетраспецифический мономер антитела имеет N-конец и С-конец, и включает последовательно расположенные от N-конца к С-концу первый домен scFv на N-конце, домен Fab, домен Fc, второй домен scFv и третий scFv на С-конце. Первый домен scFv, домен Fab, второй домен scFv и третий домен scFv каждый обладает специфичностью связывания с различным антигеном.
В одном варианте осуществления антиген включает опухолевый антиген, иммунный сигнальный антиген или их комбинацию. В одном варианте осуществления первый домен scFv, домен Fab, второй домен scFv и третий домен scFv каждый обладает специфичностью связывания с опухолевым антигеном или иммунным сигнальным антигеном. В одном варианте осуществления первый домен scFv обладает специфичностью связывания с опухолевым антигеном. В одном варианте осуществления первый домен scFv обладает специфичностью связывания с иммунным сигнальным антигеном. В одном варианте осуществления домен Fab обладает специфичностью связывания с опухолевым антигеном. В одном варианте осуществления домен Fab обладает специфичностью связывания с иммунным сигнальным антигеном. В одном варианте осуществления второй домен scFv обладает специфичностью связывания с опухолевым антигеном. В одном варианте осуществления второй домен scFv обладает специфичностью связывания с иммунным сигнальным антигеном. В одном варианте осуществления третий домен scFv обладает специфичностью связывания с опухолевым антигеном. В одном варианте осуществления третий домен scFv обладает специфичностью связывания с опухолевым антигеном.
В одном варианте осуществления тетраспецифический мономер включает домен scFv, домен Fab, второй домен scFv и третий домен scFv, каждый из которых независимо обладает специфичностью связывания с антигеном, выбранным из ROR1, PD-L1, CD3, CD28, 4-1BB, CEA, HER2, EGFR VIII, EGFR, LMP1, LMP2A, мезотелина, PSMA, EpCAM, глипикан-3, gpA33, GD2, TROP2, NKG2D, BCMA, CD19, CD20, CD33, CD123, CD22, CD30, PD-L1, PD1, OX40, 4-1BB, GITR, TIGIT, TIM-3, LAG-3, CTLA4, CD40, VISTA, ICOS, BTLA, LIGHT, HVEM, CSF1R, CD73 и CD39. В одном варианте осуществления домен scFv, домен Fab, второй домен scFv и третий домен scFv каждый независимо обладает специфичностью связывания с опухолеспецифическими антигенами, включая, не ограничиваясь этим, ROR1, CEA, HER2, EGFR, EGFR VIII, LMP1, LMP2A, мезотелин, PSMA, EpCAM, глипимай-3, gpA33, GD2, TROP2, BCMA, CD3, CD19, CD20, CD33, CD123, CD22, CD30, или модуляторами иммунных контрольных точек, включая, без ограничения, PD-L1, PD1, OX40, 4-1BB, GITR, TIGIT, TIM-3, LAG-3, CTLA4, CD40, VISTA, ICOS, BTLA, Light, HVEM, CD73, CD39 и т. д. В одном варианте осуществления один набор домена scFv может специфически связываться с модуляторами иммунных контрольных точек или опухолевым антигеном. В одном варианте осуществления scFv, специфический для CD3, может находиться на С-конце или N-конце тяжелой цепи или легкой цепей.
В одном варианте осуществления первый домен scFv, домен Fab, второй домен scFv и третий домен scFv каждый независимо обладает специфичностью связывания с антигеном, выбранным из CD3, EGRF VIII, PD-L1 и 4-1BB. В одном варианте осуществления первый домен scFv обладает специфичностью связывания с CD3. В одном варианте осуществления домен Fab обладает специфичностью связывания с EGRF VII. В одном варианте осуществления второй домен scFv обладает специфичностью связывания с PD-L1. В одном варианте осуществления второй домен scFv обладает специфичностью связывания с PD-L1. В одном варианте осуществления третий домен scFv обладает специфичностью связывания с 4-1BB. В одном варианте осуществления первый домен scFv обладает специфичностью связывания с CD3, домен Fab обладает специфичностью связывания с EGRF VII, второй домен scFv обладает специфичностью связывания с PD-L1, и третий домен scFv обладает специфичностью связывания с 4-1BB.
Fc-домен может быть гуманизированным. В одном варианте осуществления Fc-домен представляет Fc человеческого IgG1.
Домен scFv может включать линкер, связывающий домен scFv с тяжелой цепью или легкой цепью антитела. В одном варианте осуществления линкер может включать более 10 аминокислот. В одном варианте осуществления линкер может включать более 15 аминокислот. В одном варианте осуществления линкер может включать менее 20 аминокислот.
В одном варианте осуществления линкер может включать линкер gly-gly-gly-ser(G4S)n, и n может быть целым числом от 1 до 20. Например, n может быть равно 2, 4 или 6. В одном варианте осуществления первый домен scFv, второй домен scFv или третий домен scFv могут содержать gly-gly-gly-ser(G4S)n, где n равно 2 или 4.
В одном варианте осуществления заявка обеспечивает тетраспецифические мономеры антител, имеющие аминокислотную последовательность, имеющую процентную гомологию с SEQ ID NO: 02, 04, 06, 08, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58 и 60. Процентная гомология составляет не менее 70%, 80%, 90%, 95%, 98% или 99%.
Заявка также обеспечивает антигенсвязывающие фрагменты. В одном варианте осуществления заявка обеспечивает домены scFv. В одном варианте осуществления домен scFv имеет аминокислотную последовательность, имеющую процентную гомологию с SEQ ID NO: 02, 04, 06, 08, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58 и 60, где процентная гомология составляет не менее 70%, 80%, 90%, 95%, 98% или 99%. В одном варианте заявка обеспечивает домены Fab. В одном варианте осуществления домен Fab включает аминокислотную последовательность, имеющую процентную гомологию с SEQ ID NO: 02, 04, 06, 08, 10, 12, 14, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58 и 60, где процентная гомология составляет не менее 70%, 80%, 90%, 95%, 98% или 99%. Антигенсвязывающие фрагменты, раскрытые здесь, можно использовать для конструирования тетраспецифических мономеров антител или мультиспецифических антител.
В одном аспекте заявка обеспечивает мультиспецифические антитела. В одном варианте осуществления мультиспецифическое антитело включает тетраспецифические мономеры антитела. В одном варианте осуществления мультиспецифическое антитело включает два тетраспецифических мономера антитела, раскрытых здесь. Поскольку каждый тетраспецифический мономер антитела имеет четыре антигенсвязывающих домена, то раскрытое мультиспецифическое антитело может включать 8 антигенсвязывающих доменов. В одном варианте осуществления антигенсвязывающие домены в таком мультиспецифическом антителе каждый независимо обладает специфичностью связывания с разным антигеном, что обеспечивает получение октаспецифического антитела. В одном варианте осуществления мультиспецифическое антитело представляет собой пентаспецифическое антитело. В одном варианте осуществления мультиспецифическое антитело представляет пентаспецифическое антитело. В одном варианте осуществления мультиспецифическое антитело представляет пентаспецифическое антитело и гексаспецифическое антитело. В одном варианте осуществления мультиспецифическое антитело представляет пентаспецифическое антитело и гептаспецифическое антитело.
В одном варианте осуществления мультиспецифическое антитело включает димер тетраспецифического мономера антитела для обеспечения тетраспецифического антитела. В одном варианте осуществления заявка обеспечивает выделенные, очищенные или не существующие в природе мультиспецифичные антитела. В одном варианте осуществления заявка обеспечивает тетраспецифическое антитело, имеющее аминокислотную последовательность, имеющую процентную гомологию с SEQ ID NO: 66 и 68. Процентная гомология составляет не менее 70%, 80%, 90%, 95%, 98% или 99%.
Заявка также обеспечивает выделенную последовательность нуклеиновой кислоты, кодирующую тетраспецифические мономеры антител, мультиспецифические антитела или их антигенсвязывающие фрагменты. В одном варианте осуществления нуклеиновая кислота кодирует аминокислотную последовательность, имеющую процентную гомологию с тетраспецифическим мономером антитела, имеющим SEQ ID NO: 01, 03, 05, 07, 09, 11, 13, 15, 17, 19, 21, 23, 25, 27, 29, 31, 33, 35, 37, 39, 41, 43, 45, 47, 49, 51, 53, 55, 57 и 59. Процентная гомология составляет не менее 70%, 80%, 90%, 95%, 98% или 99%.
Кроме того, заявка обеспечивает векторы экспрессии и клетки-хозяева, содержащие последовательности нуклеиновой кислоты, раскрытые здесь. В одном варианте осуществления клетка-хозяин включает вектор экспрессии. Клетка-хозяин может представлять собой прокариотическую клетку или эукариотическую клетку.
Заявка дополнительно обеспечивает иммуноконъюгаты. В одном варианте осуществления иммуноконъюгат включает цитотоксический агент или визуализирующий агент, связанный с мультиспецифическим антителом, раскрытым здесь, через линкер.
Линкер может быть расщепляемым или нерасщепляемым. Линкер может включать ковалентную связь, такую как сложноэфирная связь, эфирная связь, амидная связь, дисульфидная связь, имидная связь, сульфоновая связь, фосфатная связь, фосфодиэфирная связь, пептидная связь или их комбинацию. В одном варианте осуществления линкер содержит гидрофобный поли(этиленгликолевый)линкер.
Цитотоксический агент может включать химиотерапевтический агент, ингибирующий рост агент, цитотоксический агент из класса калихеамицина, антимитотический агент, токсин, радиоактивный изотоп, терапевтический агент или их комбинацию. В одном варианте осуществления цитотоксический агент включает калихеамицин, озогамицин, монометилауристатин Е, эмтанзин, их производное или комбинацию.
Визуализирующий агент может представлять любое соединение, пригодное для целей визуализации. В одном варианте осуществления визуализирующий агент может представлять радионуклид, флуоресцентный агент, квантовые точки или их комбинацию.
Заявка дополнительно обеспечивает фармацевтическую композицию. В одном варианте осуществления фармацевтическая композиция содержит фармацевтически приемлемый носитель и тетраспецифический мономер антитела, раскрытый здесь. В одном варианте осуществления фармацевтическая композиция содержит фармацевтически приемлемый носитель и мультиспецифическое антитело, раскрытое здесь. В одном варианте осуществления фармацевтическая композиция содержит фармацевтически приемлемый носитель и антигенсвязывающий фрагмент, раскрытый здесь. В одном варианте осуществления фармацевтическая композиция содержит фармацевтически приемлемый носитель и иммуноконъюгат, раскрытый здесь.
В одном варианте осуществления фармацевтическая композиция дополнительно включает терапевтический агент. Примеры терапевтических агентов включают, без ограничения, радиоизотоп, радионуклид, токсин, химиотерапевтический агент или их комбинацию. В одном варианте осуществления терапевтический агент включает антитело, фермент или их комбинацию. В одном варианте осуществления терапевтический агент включает антиэстрогенный агент, ингибитор рецепторной тирозинкиназы, ингибитор киназ, ингибитор клеточного цикла, ингибитор синтеза ДНК, РНК или белка, ингибитор RAS или их комбинацию. В одном варианте осуществления терапевтический агент включает ингибитор иммунных контрольных точек. В одном варианте осуществления терапевтический агент включает ингибитор PD1, PDL1, CTLA4, 4-1BB, OX40, GITR, ICOS, LIGHT, TIM3, LAG3, TIGIT, CD40, CD27, HVEM, BTLA, VISTA, B7H4, CSF1R, NKG2D, CD73, их производное или комбинацию.
В дополнительном аспекте заявка обеспечивает способы получения тетраспецифических мономеров антител, мульти-специфических антител, их антигенсвязывающих фрагментов и их иммуноконъюгатов.
В одном варианте осуществления способ включает стадии культивирования клетки-хозяина, содержащей последовательности нуклеиновой кислоты, раскрытые здесь, так что последовательность ДНК, кодирующая антитело, экспрессируется, и выделения антитела. В одном варианте осуществления антитело представляет собой тетраспецифическое антитело.
В дополнительном аспекте заявка обеспечивает способы применения тетраспецифических мономеров антител, мульти-специфических антител, их антигенсвязывающих фрагментов и их иммуноконъюгатов для лечения рака. В одном варианте осуществления способ включает стадию введения тетраспецифических мономеров антител, мультиспецифических антител, их антигенсвязывающих фрагментов и их иммуноконъюгатов, или их фармацевтической композиции субъекту, нуждающемуся в таком лечении. В одном варианте осуществления способ включает стадию введения субъекту эффективного количества тетраспецифического антитела.
В одном варианте осуществления способ включает прямое введение в место опухоли эффективного количества мультиспецифических мономеров, мультиспецифических антител, иммуноконъюгатов, их антигенсвязывающих фрагментов.
Можно профилактировать или лечить различные типы рака. В одном варианте осуществления злокачественная опухоль может иметь клетки, экспрессирующие ROR1, CEA, HER2, EGFR, EGFR VIII, LMP1, LMP2A, мезотелин, PSMA, EpCAM, глипикан-3, gpA33, GD2, TROP2, NKG2D, BCMA, CD19, CD20, CD33 , CD123, CD22 или CD30. Примеры злокачественных заболеваний включают без ограничения рак молочной железы, колоректальный рак, рак анального канала, рак поджелудочной железы, рак желчного пузыря, рак желчных протоков, рак головы и шеи, рак носоглотки, рак кожи, меланому, рак яичника, рак предстательной железы, рак уретры, рак легкого, немелкоклеточный рак легкого, мелкоклеточный рак легкого, опухоль головного мозга, глиому, нейробластому, рак пищевода, рак желудка, рак печени, рак почки, рак мочевого пузыря, рак шейки матки, рак эндометрия, рак щитовидной железы, рак глаза, саркому, рак кости, лейкоз, миелому или лимфому.
В одном варианте осуществления способ может дополнительно включать совместное введение эффективного количества терапевтического агента. В одном варианте осуществления терапевтический агент может включать антитело, химиотерапевтический агент, фермент или их комбинацию. В одном варианте осуществления терапевтический агент может включать антиэстрогенный агент, ингибитор рецепторной тирозинкиназы, ингибитор киназ, ингибитор клеточного цикла, ингибитор синтеза ДНК, РНК или белка, ингибитор RAS или их комбинацию. В одном варианте осуществления терапевтический агент может включать ингибитор иммунных контрольных точек. В одном варианте осуществления терапевтический агент может включать ингибитор PD1, PD-L1, CTLA4, 4-1BB, OX40, GITR, ICOS, LIGHT, TIM3, LAG3, TIGIT, CD40, CD27, HVEM, BTLA, VISTA, B7H4, CSF1R, NKG2D, CD73, их производное или комбинацию.
В одном варианте осуществления терапевтический агент может включать капецитабин, цисплатин, циклофосфамид, метотрексат, 5-фторурацил, доксорубицин, циклофосфамид, мустин, винкристин, прокарбазин, преднизолон, блеомицин, винбластин, дакарбазин, этопозид, эпирубицин, пеметрексед, фолиновую кислоту, гемицитабин, оксалиплатин, иринотекан, топотекан, камптотецин, доцетаксел, паклитаксел, фулвестрант, тамоксифен, летрозол, эксеместан, анастрозол, аминоглутетимид, тестолактон, ворозол, форместан, фадрозол, эрлотиниб, лафатиниб, дазатиниб, гефитиниб, осимертиниб, вандетаниб, афатиниб, иматиниб, пазопаниб, лапатиниб, сунитиниб, нилотиниб, сорафениб, наб-палитаксел, эверолимус, темсиролимус, дабрафениб, вемурафениб, траметиниб, винтафолид, апатиниб, кризотиниб, перифорсин, олапариб, бортезомиб, тофацитиниб, трастузумаб, их производное или комбинацию.
Субъект может представлять человека. В одном варианте осуществления субъект может страдать раком. Заявка также обеспечивает растворы, содержащие эффективную концентрацию мультиспецифических антител, мономеров или иммуноконъюгатов, раскрытых здесь. В одном варианте осуществления раствор представляет плазму крови субъекта.
Цели и преимущества раскрытия могут стать очевидными из последующего подробного описания примерных вариантов его осуществления в сочетании с прилагаемыми фигурами. Другие варианты осуществления могут стать легко понятными специалистам в данной области техники из следующего подробного описания, в котором описаны варианты осуществления посредством описания наилучшего предполагаемого способа осуществления. Как можно понять, возможны другие и различные варианты осуществления, и некоторые детали вариантов осуществления могут быть изменены в различных очевидных отношениях, без отклонения от сущности и объема изобретения. Следовательно, фигуры и подробное описание следует рассматривать как иллюстративные по своей природе, а не как ограничивающие.
Краткое описание фигур
Вышеизложенные и другие признаки настоящего раскрытия могут стать более понятными из следующего описания и прилагаемой формулы изобретения, в сочетании с прилагаемыми фигурами. Очевидно, понятно, что эти фигуры иллюстрируют только несколько вариантов осуществления, расположенных в соответствии с раскрытием, и, следовательно, они не должны рассматриваться как ограничивающие его объем, раскрытие может быть описано с дополнительной специфичностью и подробностями посредством использования прилагаемых фигур, на которых:
На фиг. 1 представлена структура тетраспецифического антитела с доменами 1-4 в качестве антигенсвязывающих доменов. CD3×EGFRvIII×PD-L1×4-1BB тетраспецифическое антитело показано в качестве примера в соответствии с одним вариантом осуществления.
На фиг. 2 приведены результаты эксперимента, показывающие перенаправленную цитотоксичность РВМС (мононуклеарных клеток периферической крови) в отношении клеток линии астроцитомы U87, которые были трансфектированы EGFRvIII. Активность лизиса опухолей используемых тетраспецифических антител приведена в таблице 1.
На фиг. 3 приведены результаты эксперимента, показывающие перенаправленную цитотоксичность РВМС (мононуклеарных клеток периферической крови) в отношении клеток линии острого лимфобластного лейкоза Kasumi-2.
На фиг. 4 приведены результаты эксперимента, показывающие перенаправленную цитотоксичность РВМС (мононуклеарных клеток периферической крови) в отношении клеток линии астроцитомы U87, которые были трансфектированы EGFRvIII. Показана функциональная активность различных доменов 4-1BB и функциональное влияние доменов PD-L1 и 4-1BB.
На фиг. 5 приведены результаты эксперимента, показывающие анализ FACS тетраспецифических антител, связывающихся с клетками CHO, трансфектированными человеческим ROR1, в соответствии с некоторыми вариантами осуществления.
На фиг. 6 приведены результаты эксперимента, показывающие анализ FACS тетраспецифических антител, связывающихся с клетками СНО, трансфектированными человеческим 4-1BB, в соответствии с некоторыми вариантами осуществления.
На фиг. 7 приведены результаты эксперимента, показывающие анализ FACS тетраспецифических антител, связывающихся с клетками СНО, трансфектированными человеческим PD-L1, в соответствии с некоторыми вариантами осуществления.
На фиг. 8 приведены результаты эксперимента, показывающие анализ перенаправленной Т-клеточной цитотоксичности (RTCC), опосредованной тетраспецифическими антителами со связывающим доменом 323H7, который специфичен для Ig домена ROR1, с мононуклеарными клетками периферической крови в качестве эффекторов и клетками линии B-All Kasumi2 в качестве мишеней согласно некоторым вариантам осуществления.
На фиг. 8 показаны результаты эксперимента, показывающие анализ перенаправленной Т-клеточной цитотоксичности (RTCC), опосредованной тетраспецифическими антителами со связывающим доменом 323H7, который специфичен для Ig-домена ROR1, с мононуклеарными клетками периферической крови в качестве эффекторов и B-All клеточные линии Kasumi2 в качестве мишеней согласно некоторым вариантам осуществления.
На фиг. 9 приведены результаты эксперимента, показывающие анализ перенаправленной Т-клеточной цитотоксичности (RTCC), опосредованной тетраспецифическими антителами со связывающим доменом 323H7, который специфичен для Ig домена ROR1, с CD8+, CD45RO+ T-клетками памяти в качестве эффекторов и клетками линии B-ALL Kasumi2 в качестве мишеней согласно некоторым вариантам осуществления.
На фиг. 10 приведены результаты эксперимента, показывающие анализ перенаправленной Т-клеточной цитотоксичности (RTCC), опосредованной тетраспецифическими антителами со связывающим доменом 323H7, который специфичен для Ig домена ROR1, с CD8+, CD45RA+ наивными Т-клетками в качестве эффекторов и клетками линии B-ALL Kasumi2 в качестве мишеней согласно некоторым вариантам осуществления.
На фиг. 11 приведены результаты эксперимента, показывающие анализ перенаправленной Т-клеточной цитотоксичности (RTCC), опосредованной тетраспецифическими антителами со связывающим доменом 338H4, который специфичен для Frizzled домена ROR1, с мононуклеарными клетками периферической крови в качестве эффекторов и клетками линии B-All Kasumi2 в качестве мишеней согласно некоторым вариантам осуществления.
На фиг. 12 приведены результаты эксперимента, показывающие анализ перенаправленной Т-клеточной цитотоксичности (RTCC), опосредованной тетраспецифическими антителами со связывающим доменом 338H4, который специфичен для Frizzled домена ROR1, с CD8+, CD45RO+ T-клетками памяти в качестве эффекторов и клетками линии B-ALL Kasumi2 в качестве мишеней согласно некоторым вариантам осуществления.
На фиг. 13 приведены результаты эксперимента, показывающие анализ перенаправленной Т-клеточной цитотоксичности (RTCC), опосредованной тетраспецифическими антителами со связывающим доменом 338H4, который специфичен для Frizzled домена ROR1, с CD8+, CD45RA+ наивными Т-клетками в качестве эффекторов и клетками линии B-ALL Kasumi2 в качестве мишеней согласно некоторым вариантам осуществления.
Подробное описание изобретения
В последующем подробном описании делается ссылка на прилагаемые фигуры, которые составляют его часть. На фигурах аналогичные символы обычно идентифицируют аналогичные компоненты, если контекст не требует иного. Иллюстративные варианты осуществления, описанные в подробном описании, на фигурах и в формуле изобретения, не предназначены для ограничения. Могут быть использованы другие варианты осуществления и могут быть внесены другие изменения без отклонения от сущности или объема предмета изобретения, представленного в данном документе. Можно легко понять, что аспекты настоящего раскрытия, как, в общем, здесь описано и иллюстрировано на фигурах, могут быть расположены, заменены, объединены, разделены и выполнены в широком разнообразии различных конфигураций, которые все здесь явно предусмотрены.
Раскрытие, среди прочего, обеспечивает выделенные антитела, способы получения таких антител, тетраспецифические или мультиспецифические молекулы, конъюгаты антитело-лекарственное средство и/или иммуноконъюгаты, состоящие из таких антител или антигенсвязывающих фрагментов, фармацевтические композиции, содержащие антитела, тетраспецифические или мультиспецифические молекулы, конъюгаты антитело-лекарственное средство и/или иммуноконъюгаты, способ их получения и способ применения раскрытых молекул или композиции для лечения рака.
Термин «антитело» используется в самом широком смысле и конкретно охватывает отдельные моноклональные антитела (включая антитела-агонисты и антитела-антагонисты), композиции антител с полиэпитопной специфичностью, а также фрагменты антител (например, Fab, F(ab')2 и Fv), при условии, что они проявляют желаемую биологическую активность. В некоторых вариантах осуществления антитело может представлять моноклональное, поликлональное, химерное, одноцепочечное, тетраспецифическое или биэффективное, симианизированное, человеческое и гуманизированное антитело, а также их активные фрагменты. Примеры активных фрагментов молекул, которые связываются с известными антигенами, включают фрагменты Fab, F(ab')2, scFv и Fv, включая продукты экспрессии библиотеки Fab иммуноглобулина и фрагменты, связывающие эпитопы любого из антител и фрагментов, указанных выше. В некоторых вариантах осуществления антитело может включать молекулы иммуноглобулина и иммунологически активные участки молекул иммуноглобулина, т. е. молекулы, которые содержат сайт связывания, который иммуноспецифически связывает антиген. Иммуноглобулин может быть любого типа (IgG, IgM, IgD, IgE, IgA и IgY) или класса (IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) или подклассов молекул иммуноглобулина. В одном варианте осуществления антитело может представлять цельные антитела и любой антигенсвязывающий фрагмент, полученный из цельных антител. Типичное антитело относится к гетеротетрамерному белку, содержащему обычно две тяжелые (Н) цепи и две легкие (L) цепи. Каждая тяжелая цепь состоит из вариабельной области тяжелой цепи (сокращенно VH) и константной области тяжелой цепи. Каждая легкая цепь состоит из вариабельной области легкой цепи (сокращенно VL) и константной области легкой цепи. Области VH и VL могут дополнительно подразделяться на гипервариабельные области, определяющие комплементарность участки (CDR), и более консервативные области, называемые каркасными областями (FR). Каждая вариабельная область (VH или VL) обычно состоит из трех CDR и четырех FR, расположенных в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4 от аминоконца к карбоксиконцу. Внутри вариабельных областей легкой и тяжелой цепей имеются связывающие области, которые взаимодействуют с антигеном.
Как здесь используется, термин «моноклональное антитело» относится к антителу, полученному из популяции по существу гомогенных антител, т. е. отдельные антитела, составляющие популяцию, являются идентичными, за исключением возможных встречающихся в природе мутаций, которые могут присутствовать в незначительных количествах. Моноклональные антитела являются высокоспецифичными и направлены против одного антигенного сайта. Кроме того, в отличие от обычных (поликлональных) препаратов антител, которые обычно включают разные антитела, направленные против разных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты на антигене. Помимо их специфичности моноклональные антитела обладают тем преимуществом, что они синтезируются культурой гибридомных клеток, не содержащей примесей других иммуноглобулинов. Определение «моноклональный» указывает на характер антитела, как полученного по существу из гомогенной популяции антител, и его не следует истолковывать как требующее получения антитела каким-либо конкретным способом. Например, моноклональные антитела, которые должны использоваться в соответствии с настоящим изобретением, могут быть получены гибридомным методом, впервые описанным Kohler & Milstein, Nature, 256: 495 (1975), или могут быть получены методами рекомбинантной ДНК (см., например, патент США № 4816567).
Моноклональные антитела могут включать «химерные» антитела (иммуноглобулины), в которых часть тяжелой и/или легкой цепи идентична или гомологична соответствующим последовательностям в антителах, полученных из определенного вида или принадлежащих к определенному классу или подклассу антител, тогда как остальная часть цепи(ей) идентична или гомологична соответствующим последовательностям в антителах, полученных из другого вида или принадлежащих к другому классу или подклассу антител, а также фрагментам таких антител, при условии, что они проявляют желаемую биологическую активность (патент США № 4816567 и Morrison et al., Proc. Natl. Acad. Sci. USA, 81: 6851-6855 [1984]).
Моноклональные антитела могут быть получены с использованием различных способов, включая мышиную гибридому или фаговый дисплей (см. обзор Siegel. Transfus. Clin. Biol., 9: 15-22 (2002)), или посредством молекулярного клонирования антител непосредственно из первичных В-клеток (см. Tiller. New Biotechnol., 28: 453-7 (2011)). В настоящем расркытии антитела были получены иммунизацией кроликов человеческим белком PD-L1 и клетками, транзиентно экспрессирующими человеческий PD-L1, на поверхности клетки. Известно, что кролики продуцируют антитела высокой аффинности, разнообразия и специфичности (Weber et al. Exp. Mol. Med., 49: e305). В-клетки от иммунизированных животных культивировали in vitro и подвергали скринингу на продукцию анти-PD-L1-антител. Гены вариабельных областей антител выделяли с использованием методов рекомбинантной ДНК, и полученные антитела экспрессировали рекомбинантно, и затем подвергали скринингу на наличие желаемых признаков, таких как способность ингибировать связывание PD-L1 с PD-1, способность связываться с PD-L1 приматов, отличных от человека, и способность усиливать активацию Т-клеток человека. Данный общий метод создания антител аналогичен описанному в публикации Seeber et al., PLOS One, 9: e86184 (2014).
Термин «антиген- или эпитопсвязывающий участок или фрагмент» относится к фрагментам антитела, которые способны связываться с антигеном (в данном случае PD-L1). Эти фрагменты могут обладать антигенсвязывающей функцией и дополнительными функциями интактного антитела. Примеры связывающих фрагментов включают, не ограничиваясь этим, одноцепочечный фрагмент Fv (scFv), состоящий из областей VL и VH одного плеча антитела, соединенных в одну полипептидную цепь синтетическим линкером, или фрагмент Fab, который представляет собой моновалентный фрагмент, состоящий из области VL, константной области легко цепи (CL), VH и константной области 1 тяжелой цепи (CH1). Фрагменты антител могут быть даже еще меньшими субфрагментами и могут состоять из доменов, таких же небольших, как один домен CDR, в частности, домен CDR3 из областей VL и/или VH (например, см. Beiboer et al., J. Mol. Biol., 296: 833-49 (2000). Фрагменты антител получают с использованием обычных методов, известных специалистам в данной области. Фрагменты антител могут быть подвергнуты скринингу на применимость с использованием тех же методик, которые применяются для этих целей для интактных антител.
«Антиген- или эпитоп-связывающие фрагменты» можно получить из антитела по настоящему изобретению с помощью ряда методов, известных в данной области техники. Например, очищенные моноклональные антитела можно расщепить ферментом, таким как пепсин, и подвергнуть гель-фильтрации на основе ВЭЖХ. Соответствующую фракцию, содержащую фрагменты Fab, затем собирают и концентрируют мембранной фильтрацией и тому подобное. Дополнительное описание общих методик для выделения активных фрагментов антител см., например, Khaw, B.A. et al. J. Nucl. Med., 23: 1011-1019 (1982); Rousseaux et al. Methods Enzymology, 121:663-69, Academic Press, 1986.
При расщеплении антител папаином образуются два идентичных антигенсвязывающих фрагмента, называемых «Fab-фрагментами», каждый из которых имеет один антигенсвязывающий сайт, и остаточный «Fc-фрагмент», название которого отражает его способность легко кристаллизоваться. Обработка пепсином дает фрагмент F (ab')2, который имеет два антигенсвязывающих сайта и все еще способен к перекрестному связыванию антигена.
Фрагмент Fab может содержать константную область легкой цепи и первую константную область (CH1) тяжелой цепи. Fab'-фрагменты отличаются от Fab-фрагментов добавлением нескольких остатков на карбоксиконце области CH1 тяжелой цепи, включая один или более цистеинов из шарнирной области антитела. Fab'-SH является здесь обозначением Fab', в котором остаток(и) цистеина константных областей несет свободную тиоловую группу. Фрагменты F(ab')2 антитела первоначально были получены в виде пар Fab'-фрагментов, которые имеют цистеины шарнирной области между ними. Также известны другие химические соединения фрагментов антител.
«Fv» представляет собой минимальный фрагмент антитела, который содержит полный сайт распознавания и связывания антигена. Эта область состоит из димера вариабельной области одной тяжелой и одной легкой цепи в тесной нековалентной ассоциации. Именно в такой конфигурации три CDR каждой вариабельной области взаимодействуют с образованием антигенсвязывающего сайта на поверхности димера VH-VL. В совокупности шесть CDR придают антителу специфичность связывания антигена. Однако даже одна вариабельная область (или половина Fv, содержащего только три CDR, специфичных для антигена) обладает способностью распознавать и связывать антиген, хотя и с более низкой аффинностью, чем весь сайт связывания.
«Легкие цепи» антител (иммуноглобулинов) из любых видов позвоночных могут быть отнесены к одному из двух четко различимых типов, называемых каппа и лямбда (λ), на основе аминокислотных последовательностей их константных областей.
В зависимости от аминокислотной последовательности их константной области тяжелых цепей иммуноглобулины можно отнести к разным классам. Существует пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, и некоторые из них могут быть дополнительно разделены на подклассы (изотипы), например, IgG-1, IgG-2, IgG-3 и IgG-4; IgA-1 и IgA-2. Константные области тяжелой цепи, которые соответствуют различным классам иммуноглобулинов, называются альфа, дельта, эпсилон, гамма и мю соответственно. Структуры субъединиц и трехмерные конфигурации различных классов иммуноглобулинов хорошо известны.
«Гуманизированное антитело» относится к типу сконструированного антитела, чьи CDR получены из донорного иммуноглобулина, отличного от человеческого, а остальные части, молекулы, полученные из иммуноглобулина, получены из одного (или нескольких) иммуноглобулина(ов) человека. В некоторых вариантах осуществления каркасные поддерживающие остатки могут быть изменены для сохранения аффинности связывания. Способы получения «гуманизированных антител» хорошо известны специалистам в данной области (см., например, Queen et al., Proc. Natl Acad Sci USA, 86: 10029-10032 (1989), Hodgson et al., Bio/Technology, 9: 421 (1991)).
Термины «полипептид», «пептид» и «белок», используемые в данном документе, являются взаимозаменяемыми и определяются как обозначающие биологическую молекулу, состоящую из аминокислот, связанных пептидной связью.
Как здесь используется, термины «а», «an» и «the» означают «один или более» и включают множественное число, если по контексту не следует иное.
Под термином «выделенная» подразумевается биологическая молекула, не содержащая, по меньшей мере, некоторых компонентов, с которыми она встречается в природе. «Выделенный», когда используется для описания различных полипептидов, раскрытых здесь, означает полипептид, который был идентифицирован и отделен и/или выделен из клетки или клеточной культуры, в которой он был экспрессирован. Обычно выделенный полипептид может быть получен, по меньшей мере, одной стадией очистки. «Выделенное антитело» относится к антителу, которое по существу не содержит других антител, имеющих различные антигенные специфичности.
«Рекомбинантный» означает, что антитела получены с использованием методов рекомбинантных нуклеиновых кислот в экзогенных клетках-хозяевах.
Термин «антиген» относится к молекуле или ее фрагменту, которые могут индуцировать иммунный ответ в организме, в частности животного, более конкретно, млекопитающего, включая человека. Термин включает иммуногены и их области, ответственные за антигенность или антигенные детерминанты.
Также, как здесь используется, термин «иммуногенный» относится к веществам, которые вызывают или усиливают выработку антител, Т-клеток или других реактивных иммунных клеток, направленных против иммуногенного агента, и способствуют проявлению иммунного ответа у людей или животных. Иммунный ответ возникает, когда у субъекта продуцируется достаточное количество антител, Т-клеток и других реактивных иммунных клеток против введенных иммуногенных композиций по настоящему изобретению, для изменения течения или ослабления расстройства, которое нужно лечить.
«Специфическое связывание» или «специфически связывается с» или «специфично для» конкретного антигена или эпитопа означает связывание, которое заметно отличается от неспецифического взаимодействия. Специфическое связывание может быть измерено, например, определением связывания молекулы по сравнению со связыванием контрольной молекулы, которая обычно представляет собой молекулу сходной структуры, но которая не обладает активностью связывания. Например, специфическое связывание можно определить посредством конкуренции с контрольной молекулой, которая сходна с мишенью.
Специфическое связывание для конкретного антигена или эпитопа может проявляться, например, антителом, имеющим KD для антигена или эпитопа, по меньшей мере, примерно 10-4 М, по меньшей мере, примерно 10-5 М, по меньшей мере, примерно 10-6 М, по меньшей мере, примерно 10-7 М, по меньшей мере, примерно 10-8 М, по меньшей мере, примерно 10-9 М, альтернативно, по меньшей мере, примерно 10-10 М, по меньшей мере, примерно 10-11 М, по меньшей мере, примерно 10-12 М или более, где KD относится к скорости диссоциации конкретного взаимодействия антитело-антиген. Как правило, антитело, которое специфически связывается с антигеном, может иметь KD, значение которой в 20, 50, 100, 500, 1000, 5000, 10000 или более раз выше для контрольной молекулы относительно антигена или эпитопа.
Кроме того, специфическое связывание для конкретного антигена или эпитопа может проявляться, например, антителом, имеющим KA или Ka для антигена или эпитопа, по меньшей мере, в 20, 50, 100, 500, 1000, 5000, 10000 раз или более выше для эпитопа по сравнению с контролем, где KA или Ka относится к скорости ассоциации конкретного взаимодействия антитело-антиген.
«Гомология» между двумя последовательностями определяется идентичностью последовательности. Если две последовательности, которые подлежат сравнению друг с другом, отличаются по длине, то идентичность последовательности предпочтительно относится к проценту нуклеотидных остатков более короткой последовательности, которые идентичны нуклеотидным остаткам более длинной последовательности. Идентичность последовательности можно определить условно с использованием компьютерных программ. Отклонения, возникающие при сравнении между данной последовательностью и вышеописанными последовательностями по изобретению, могут быть вызваны, например, добавлением, делецией, заменой, вставкой или рекомбинацией.
В одном аспекте заявка обеспечивает тетраспецифические мономеры антител, антигенсвязывающие фрагменты и мультиспецифические антитела. В одном варианте осуществления заявка обеспечивает тетраспецифические антитела.
В одном варианте осуществления настоящее изобретение относится к тетраспецифическим антителам со специфичностью связывания в отношении четырех различных антигенов-мишеней. В одном варианте осуществления антигенами-мишенями являются опухолеспецифичные антигены, компонент CD3 рецептора Т-клеток или молекулы иммунных контрольных точек. Тетраспецифические антитела могут напрямую активировать эндогенные Т-клетки организма для уничтожения опухолевых клеток независимо от презентации опухолевого антигена МНС антигенспецифическим рецепторам Т-клеток. В некоторых вариантах осуществления компонент, модулирующий иммунные контрольные точки тетраспецифических антител, может преодолевать иммуносупрессивную микросреду опухоли, чтобы полностью активировать истощенные Т-клетки в микросреде опухоли.
Тетраспецифические антитела обладают уникальными свойствами прямой активации Т-клеток, в то же время, модулируя иммунные контрольные точки или ингибируя Treg или другие ингибиторные иммунные клетки или направляя в опухоль компонент против опухолевых антигенов. Это может принести положительный эффект для пациентов, когда лечение BiTE или CAR-T не подходит. В одном варианте осуществления тетраспецифические антитела могут проявлять клиническое преимущество при солидной опухоли, где BiTE-подобная технология или CAR-T лечение еще не продемонстрировали клиническую пользу за счет ограничений, вызванных ингибиторной микросредой опухоли.
В одном варианте осуществления заявка обеспечивает сконструированное антитело с 4 различными связывающими доменами или «тетраспецифическое антитело». Один связывающий домен специфичен для CD3 на Т-клетках, второй связывающий домен специфичен для опухоль-ассоциированного антигена, включая, не ограничиваясь этим, ROR1, CEA, HER2, EGFR, EGFRvIII, LMP1, LMP2A, мезотелин, PSMA, EpCAM, глипиман-3, gpA33, GD2, TROP2, BCMA, CD19, CD20, CD33, CD123, CD22, CD30, и третий и четвертый связывающие домены специфичны для двух различных модуляторов иммунных контрольных точек, таких как PD-L1, PD-1, OX40, 4-1BB, GITR, TIGIT, TIM-3, LAG-3, CTLA4, CD40, VISTA, ICOS, BTLA, Light, HVEM, CD73, CD39 и т. д.
Примерные тетраспецифические молекулы, раскрытые здесь (фиг.1), нацелены на ROR1 человека (SEQ ID NO: 33-48), CD19 человека (SEQ ID NO: 53-56) или EGFR vIII (SEQ ID NO: 49-52) в качестве опухоль-ассоциированных антигенов. Каждый из этих нацеленных тетраспецифических белков также несет античеловеческий PD-L1- (SEQ ID NO: 9-16), античеловеческий 4-1BB- (SEQ ID NO: 21-32) и античеловеческий CD3-связывающий домен (SEQ ID NO: 1-8). Эти связывающие домены были преобразованы в scFv, VLVH, для размещения в N-концевом домене 1 (D1) или scFv, VHVL, для размещения в C-концевых доменах 3 (D3) и 4 (D4) пептида (фиг. 1).
В некоторых вариантах осуществления молекулы scFv, описанные здесь, содержат гибкий линкер gly-gly-gly-ser(G4S)×4 из 20 аминокислот, который функционально связывает VH и VL, независимо от ориентации V-области (LH или HL). Оставшееся положение в тетраспецифическом белке, домен 2 (D2), состоит из тяжелой цепи IgG1, VH-CH1-шарнирная область-CH2-CH3, и соответствующей ему легкой цепи, VL-CL, которая может представлять каппа или лямбда цепь. D1 и D2 генетически связаны посредством (G4S) × 2 линкера из 10 аминокислот, так же как и D2, D3 и D4, что приводит к образованию непрерывного мономерного пептида с тяжелой цепью ~ 150 кДа. При котрансфекции с соответствующей легкой цепью конечный симметричный тетраспецифический пептид можно очистить с помощью Fc IgG1 (белок A/белок G) и анализировать для оценки функциональной активности. «Кассеты» генов тяжелой и легкой цепей были сконструированы ранее так, чтобы V-области можно было клонировать с использованием сайтов рестрикции (HindIII/NheI для тяжелой цепи и HindIII/BsiWI для легкой цепи) или «клонирования без рестрикции», такого как Gibson Assembly (SGI-DNA, La Jolla, CA), Infusion (Takara Bio USA) или NEBuilder (NEB, Ipswich, MA), последний из которых использовался здесь.
Тетраспецифические белки получают с помощью способа, который включает конструирование интактной молекулы, синтез и клонирование нуклеотидных последовательностей для каждого домена, экспрессию в клетках млекопитающих и очистку конечного продукта. Нуклеотидные последовательности собирали с использованием пакета программного обеспечения Geneious 10.2.3 (Biomatters, Auckland, NZ) и разбивали на составляющие их домены-компоненты для синтеза генов (Genewiz, South Plainsfield, NJ).
В одном варианте осуществления SI-35E18 (SEQ ID NO: 65 и 67) расщепляли на составляющие его домены, где анти-4-1BB scFv, VLVH, занимает D1, клон античеловеческий PD-L1 PL230C6 занимает D2 (положение Fab), клон антиспецифический Ig 323H7 для домена ROR1 VHVL scFv занимает положение D3, и античеловеческий CD3 scFv, VHVL, занимает С-концевой D4. Используя веб-инструменты NEBuilder, 5' и 3' нуклеотиды были добавлены к каждому из доменов в зависимости от их положения в более крупном белке, так что каждый домен перекрывает свои фланкирующие домены на 20-30 нуклеотидов, которые направляют сайт-специфическую рекомбинацию, тем самым генетически сливая каждый домен на одной стадии сборки гена. За счет большого количества гомологичных областей в тетраспецифической нуклеотидной последовательности N-концевые домены 1 и 2 собираются отдельно от С-концевых D3 и D4. Затем N- и С-концевые фрагменты собирают вместе во второй реакции NEBuilder.
Небольшую аликвоту трансформировали в E.coli DH10b (Invitrogen, Carlsbad, CA) и высевали в планшеты со средой TB+ карбенициллин из расчета 100 мкг/мл (Teknova, Hollister, CA) и инкубировали при 37°C в течение ночи. Полученные колонии селектировали и инокулировали 2 мл ночных культур в TB+ карбенициллин среду. ДНК получали (Thermo-Fisher, Carlsbad, CA) из ночных культур и затем секвенировали (Genewiz, South Plainsfield, NJ), используя праймеры для секвенирования (Sigma, St. Louis, MO), фланкирующие каждый домен. В некоторых вариантах осуществления последовательности ДНК собирали и анализировали в Geneious.
В еще одном аспекте заявка обеспечивает фармацевтические композиции, включающие мономеры мультиспецифических антител, мультиспецифические антитела, антигенсвязывающие фрагменты и их иммуноконъюгаты, и способы применения раскрытых антител или фармацевтических композиций для лечения рака.
Преимущества применения раскрытых тетраспецифических мономеров антител, мультиспецифических антител или композиций в целях лечения по сравнению с любыми существующими способами лечения включают, среди прочего, следующее: 1) включение домена Fc IgG может придавать характеристику более длительного периода полураспада в сыворотке крови по сравнению с биспецифической молекулой BiTe; 2) включение двух связывающих доменов, специфичных для модуляторов иммунных контрольных точек, которые могут ингибировать супрессорные пути и одновременно активировать костимуляторные пути; и 3) сшивание CD3 на Т-клетках с опухоль-ассоциированными антигенами, таким образом «перенаправляя» Т-клетки для индукции гибели опухоли без необходимости в удалении Т-клеток у пациента и их генетической модификации, чтобы они были специфичны для опухолевой клетки, прежде чем повторно введение их обратно пациенту, как это делается для Т-клеток химерного рецептора антигена (CAR-T).
Формуляцию фармацевтической композиции можно осуществить в соответствии со стандартной методологией, известной специалистам в данной области.
В одном варианте осуществления антитела и мономеры по настоящему изобретению можно приготовить в физиологически приемлемом составе, и он может содержать фармацевтически приемлемый носитель, разбавитель и/или эксципиент с использованием известных методик. Например, антитело по изобретению и как здесь описано, включая любое функционально эквивалентное антитело или его функциональные фрагменты, в частности, моноклональное антитело, включающее любое функционально эквивалентное антитело или его функциональные фрагменты, объединяют с фармацевтически приемлемым носителем, разбавителем и/или эксципиентом для формирования терапевтической композиции. Формуляцию фармацевтической композиции по настоящему изобретению можно осуществить в соответствии со стандартной методологией, известной специалистам в данной области.
В отношении формуляции подходящих композиций для введения субъекту, такому как человек-пациент, нуждающийся в лечении, антитела, раскрытые здесь, можно смешать или объединить с фармацевтически приемлемыми носителями, известными в данной области, в зависимости от выбранного пути введения. Отсутствуют конкретные ограничения в отношении способов применения антител, раскрытых здесь, и выбор подходящих путей введения и подходящих композиций известен в данной области без излишнего экспериментирования.
Подходящие фармацевтические носители, разбавители и/или эксципиенты хорошо известны в данной области и включают, например, забуференные фосфатом солевые растворы, воду, эмульсии, такие как эмульсии масло/вода.
«Фармацевтически приемлемый» относится к таким соединениям, материалам, композициям и лекарственным формам, которые в рамках здравого медицинского заключения пригодны для применения в контакте с тканями людей или животных без проявления чрезмерной токсичности, раздражения или других проблем или осложнений, соразмерных с разумным соотношением пользы/риска.
В одном варианте осуществления фармацевтическая композиция может включать белковые носители, например, такие как сывороточный альбумин или иммуноглобулин, в частности, человеческого происхождения. Дополнительные биологически активные агенты могут присутствовать в фармацевтической композиции по изобретению в зависимости от предполагаемого применения. В одном варианте осуществления белковое фармацевтически активное вещество может присутствовать в количествах от 1 нг до 10 мг на дозу. Обычно режим введения должен находиться в диапазоне от 0,1 мкг до 10 мг антитела по настоящему изобретению, в частности, в диапазоне от 1,0 мкг до 1,0 мг и, более конкретно, в диапазоне от 1,0 мкг до 100 мкг, где все отдельные числа, попадающие в эти диапазоны, также являются частью раскрытия. Если введение осуществляют посредством непрерывной инфузии, то более подходящая дозировка может находиться в диапазоне от 0,01 мкг до 10 мг единиц на килограмм массы тела в час, где все отдельные числа, попадающие в эти диапазоны, также являются частью раскрытия.
Композиции по настоящему изобретению можно вводить субъекту в форме твердого вещества, жидкости или аэрозоля в подходящей фармацевтически эффективной дозе. Примеры твердых композиций включают пилюли, кремы и имплантируемые дозированные единицы. Таблетки можно вводить перорально. Терапевтические кремы можно применять местно. Имплантируемые дозированные единицы могут вводиться локально, например, в место локализации опухоли, или могут быть имплантированы для системного высвобождения терапевтической композиции, например, подкожно. Примеры жидких композиций включают составы, адаптированные для инъекций внутримышечно, подкожно, внутривенно, внутриартериально, и составы для местного и внутриглазного введения. Примеры аэрозольных составов включают ингаляционные составы для введения в легкие.
Специалистам в данной области техники хорошо известно, что дозировка композиции может зависеть от различных факторов, таких как, например, патологическое состояние, которое лечат, конкретная используемая композиция и другие клинические факторы, такие как масса тела, размер, пол и общее состояние здоровья пациента, площадь поверхности тела, конкретное соединение или композиция, которые нужно вводить, другие лекарственные препараты, которые вводят одновременно, и путь введения.
Термин «терапевтически эффективное количество» или «эффективное количество» относится к количеству антитела, которое при введении человеку или животному вызывает ответ, достаточный для того, чтобы привести к терапевтическому эффекту у указанного человека или животного, например, для ослабления заболевания. Специалист с обычной квалификацией в данной области техники легко определит эффективное количество после рутинных процедур. Когда заболевание представляет собой рак, то эффективное количество лекарственного средства может ингибировать (например, замедлять до некоторой степени, подавлять или останавливать) один или более следующих примерных признаков, включая, без ограничения, рост опухолевых клеток, пролиферацию опухолевых клеток, подвижность опухолевых клеток, инфильтрацию опухолевых клеток в периферические органы, метастазирование опухоли и рост опухоли. Когда заболевание представляет болезнь Майера, то эффективное количество лекарственного средства может альтернативно обеспечивать одно или более из следующих действий при введении субъекту: замедлять или останавливать рост опухоли, уменьшать размер опухоли (например, объем или массу), ослаблять до некоторой степени один или более симптомов, связанных с раком, увеличивать выживаемость без прогрессирования заболевания, приводить к объективному ответу (включая, например, частичный ответ или полный ответ) и увеличивать общую выживаемость. В той степени, в которой лекарственное средство может предотвращать рост и/или приводить к гибели существующих опухолевых клеток, оно является цитостатическим и/или цитотоксическим.
Специалист в данной области способен определить эффективное количество или концентрацию антител, раскрытых здесь, для эффективного лечения такого патологического состояния, как рак. Специалист в данной области может определить другие параметры, такие как относительные количества различных компонентов в фармацевтической композиции, способы и частоту введения, без чрезмерного экспериментирования. Например, подходящий раствор для инъекций может содержать, без ограничения, примерно от 1 мг до примерно 20 мг, примерно от 1 мг до примерно 10 мг антител на мл. Примерная доза может составлять, без ограничения, примерно от 0,1 мг/кг до примерно 20 мг/кг, примерно от 1 мг/кг до примерно 5 мг/кг массы тела. Примерная частота введения может составлять, без ограничения, один раз в день или три раза в неделю.
Композиции можно вводить обычными путями введения. Как правило, композицию можно вводить местным, пероральным, ректальным, назальным, внутрикожным, внутрибрюшинным или парентеральным (например, внутривенным, подкожным или внутримышечным) путями. В некоторых вариантах осуществления композицию можно включить в матрицы с замедленным высвобождением, такие как биоразлагаемые полимеры, при этом полимеры имплантируют рядом с местом, в которое желательна доставка, например, в место локализации опухоли. Способ включает введение однократной дозы, введение повторных доз через заранее определенные интервалы времени и продолжительное введение в течение заранее определенного периода времени.
Несмотря на то, что возможны многие формы введения, примерной формой введения может быть раствор для инъекции, в частности для внутривенной или внутриартериальной инъекции. Обычно подходящая фармацевтическая композиция для инъекций может включать фармацевтически подходящие носители или эксципиенты, такие как, без ограничения, буфер, поверхностно-активное вещество или стабилизирующий агент. Примеры буферов могут включать, без ограничения, ацетатный, фосфатный или цитратный буфер. Примеры поверхностно-активных веществ могут включать, без ограничения, полисорбат. Пример стабилизатора может включать, без ограничения, человеческий альбумин.
В одном варианте осуществления введение может быть парентеральным, например, внутривенным. Препараты для парентерального введения включают стерильные водные или неводные растворы, суспензии и эмульсии. Неводные растворители включают, не ограничиваясь этим, пропиленгликоль, полиэтиленгликоль, растительное масло, такое как оливковое масло, и инъецируемые органические сложные эфиры, такие как этилолеат. Водные растворители могут быть выбраны из группы, состоящей из воды, спиртовых/водных растворов, эмульсий или суспензий, включая физиологический раствор и забуференные среды. Парентеральные носители включают раствор хлорида натрия, декстрозу Рингера, декстрозу и хлорид натрия, лактат Рингера или нелетучие масла. Носители для внутривенного введения включают пополнители жидкости и питательных веществ, пополнители электролитов (например, основанные на декстрозе Рингера) и другие. Также могут присутствовать консерванты, такие как, например, противомикробные препараты, антиоксиданты, хелатообразующие агенты, инертные газы и т. д.
Мономеры антител, антитела, антигенсвязывающие фрагменты и их иммуноконъюгаты можно использовать в комбинации с терапевтическим агентом или композицией, содержащей терапевтический агент, в целях лечения.
В некоторых вариантах осуществления молекула мультиспецифического антитела используется в комбинации с одним или более дополнительными терапевтическими агентами в их эффективном количестве. Дополнительный терапевтический агент включает антитело, химиотерапевтический агент, фермент или их комбинацию. В некоторых вариантах осуществления дополнительный терапевтический агент может представлять собой антиэстрогенный агент, ингибитор рецепторной тирозинкиназы, ингибитор киназ, ингибитор клеточного цикла, ингибитор синтеза ДНК, РНК или белка, ингибитор RAS или их комбинацию. В некоторых вариантах осуществления дополнительный терапевтический агент может представлять собой ингибитор иммунных контрольных точек. В некоторых вариантах осуществления терапевтический агент включает ингибиторы PD1, PDL1, CTLA4, 4-1BB, OX40, GITR, ICOS, LIGHT, TIM3, LAG3, TIGIT, CD40, CD27, HVEM, BTLA, VISTA, B7H4, CSF1R, NKG2D, CD73 , их производное или комбинацию.
В одном варианте осуществления терапевтический агент может включать капецитабин, цисплатин, трастузумаб, фулвестрант, тамоксифен, летрозол, эксеместан, анастрозол, аминоглутетимид, тестолактон, ворозол, форместан, фадрозол, летрозол, эрлотиниб, лафатиниб, дазатиниб, гефитиниб, иматиниб, пазопаниб, лапатиниб сунитиниб, нилотиниб, сорафениб, наб-палитаксел, их производное или комбинацию. В одном варианте осуществления терапевтический агент может включать капецитабин, цисплатин, циклофосфамид, метотрексат, 5-фторурацил, доксорубицин, циклофосфамид, мустин, винкристин, прокарбазин, преднизолон, блеомицин, винбластин, дакарбазин, этопозид, эпирубицин, пеметрексед, фолиновую кислоту, гемицитабин, оксалиплатин, иринотекан, топотекан, камптотецин, доцетаксел, паклитаксел, фулвестрант, тамоксифен, летрозол, эксеместан, анастрозол, аминоглутетимид, тестолактон, ворозол, форместан, фадрозол, эрлотиниб, лафатиниб, дазатиниб, гефитиниб, осимертиниб, вандетаниб, афатиниб, иматиниб, пазопаниб, лапатиниб, сунитиниб, нилотиниб, сорафениб, наб-палитаксел, эверолимус, темсиролимус, дабрафениб, вемурафениб, траметиниб, винтафолид, апатиниб, кризотиниб, перифорсин, олапариб, бортезомиб, тофацитиниб, трастузумаб, их производное или комбинацию.
Злокачественные опухоли, в том числе рак молочной железы, колоректальный рак, рак поджелудочной железы, рак головы и шеи, меланома, рак яичников, рак предстательной железы, немелкоклеточный рак легких, глиома, рак пищевода, рак носоглотки, рак анального канала, рак прямой кишки, рак желудка, мочевого пузыря рак, рак шейки матки или рак мозга, могут экспрессировать гены, связанные с опухолями. Ингибирование опухоль-ассоциированной активности с помощью специфических моноклональных антител или антигенсвязывающего фрагмента может оказывать терапевтическое действие на рак. Кроме того, введение терапевтически эффективного количества композиции, содержащей моноклональные антитела или антигенсвязывающий фрагмент, специфичные для опухоль-ассоциированного белка, можно излечивать, предотвращать, ослаблять и задерживать развитие или метастазирование злокачественных опухолей благодаря действию цитотоксического агента.
Настоящее раскрытие может быть более легко понятным посредством ссылки на следующее подробное описание конкретных вариантов осуществления и примеров, включенных в настоящий документ. Несмотря на то, что настоящее раскрытие было описано со ссылкой на специфические подробности некоторых его вариантов осуществления, не предполагается, что такие подробности следует рассматривать в качестве ограничений объема раскрытия.
Примеры
Пример 1: связывание тетраспецифических антител с антигеном EGFRvIII
Связывание тетраспецифических антител, приведенных в таблице 1, с антигеном EGFRvIII, экспрессируемым на поверхности клеток линии U87, оценивали с использованием метода FACS. Тетра-специфические антитела инкубировали с клетками линии U87, и затем детектировали с использованием вторичных античеловеческих антител, непосредственно конъюгированных с флуорохромом Alexa Fluor 647. Связывание тетраспецифических антител с клетками анализировали на проточном цитометре BD LSRFortessa. Все тестированные антитела связывались с антигеном с KD в однозначном и субнаномолярном диапазоне (таблица 2). Наблюдаемые различия в связывании находилисб в 3-х кратном диапазоне и могли быть обусловлены положением связывающего домена в молекуле, а также взаимодействиями со смежными доменами.
В таблице 1 приведены примерные тетраспецифические антитела с доменом, связывающимся с опухолевым антигеном EGFRvIII. В таблице 2 показано связывание с антигеном EGFRvIII, экспрессируемым на клетках линии U87. Связывание тетраспецифических антител, приведенных в таблице 1, с антигеном EGFRvIII оценивали с помощью проточной цитометрии.
Тетраспецифические антитела с доменом связывания с опухолевым антигеном EGFRvIII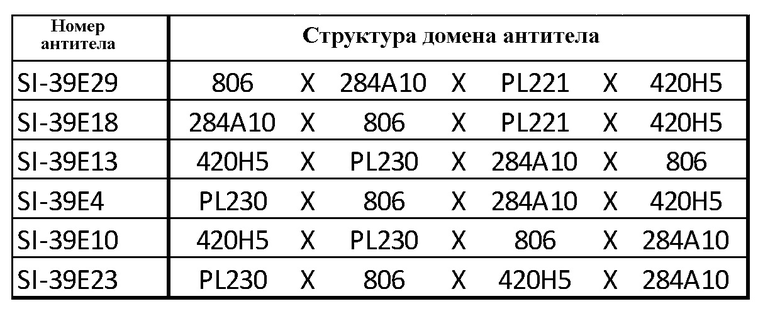
Связывание с антигеном EGFRvIII, экспрессируемым на клетках линии CHO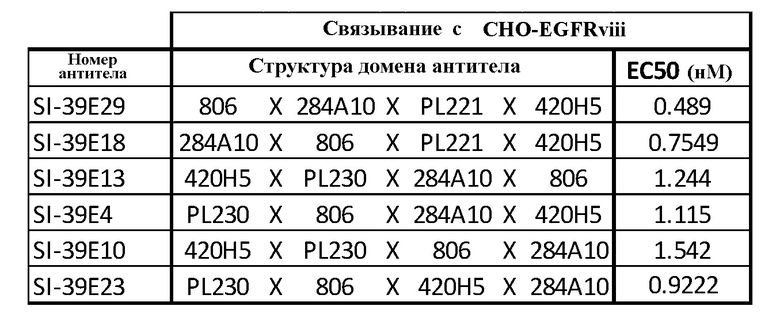
Пример 2: связывание тетраспецифических антител с белковыми антигенами EGFRvIII, 4-1BB, PD-L1 и CD3
Аффинность и кинетику связывания тетраспецифических антител, приведенных в таблице 1, с их соответствующим антигенам оценивали с помощью поверхностного плазмонного резонанса на приборе ForteBio Octet RED96. Антигены иммобилизовали на поверхности сенсорного чипа, и тестируемые антитела протекали над иммобилизованными антигенами. Все молекулы показали высокое связывание с антигенами (таблица 3). SI-39E29, SI-39E18 и SI-39E23 показали более низкое связывание с антигеном CD3 e/d, чем другие тестированные антитела. В таблице 3 показано связывание тетраспецифических антител, приведенных в таблице 1, с антигенами EGFRvIII, 4-1BB, PD-L1 и CD3.
Таблица 3. Связывание с антигенами EGFRvIII, 4-1BB, PD-L1 и CD3


Пример 3: перенаправленная цитотоксичность PBMC против клеток линии астроцитомы U87, которые были трансфектированы EGFRvIII
Тетраспецифические антитела, приведенные в таблице 1, оценивали по их способности перенаправлять РВМС на лизирование опухолевых клеток линии U87, трансфектированных EGFRvIII (U87vIII). PBMC выделяли в градиенте фиколла. Линия опухолевых клеток U87vIII стабильно экспрессировала локализованный в ядре красный флуоресцентный белок (RFP), доставленный посредством лентивирусной трансдукции (Sartorius). Опухолевые клетки U87vIII совместно культивировали с РВМС. Лизис опухолевых клеток оценивали подсчетом RFP-меченых ядер опухолевых клеток. Изображения получали на системе для визуализации живых клеток IncuCyte (Sartorius). Тетраспецифические антитела SI-39E18 и SI-39E13 показали наиболее высокую эффективность через 96 ч, за которыми следуют антитела SI-39E10, SI-39E4, SI-39E23 и SI-39E29, показавшие более низкую эффективность в этом исследовании, чем другие антитела, приведенные в таблице 1 (фиг. 2).
Пример 4: перенаправленная цитотоксичность PBMC против клеток линии острого лимфобластного лейкоза Kasumi-2
Тетраспецифические антитела, приведенные в таблице 4, оценивали по их способности лизировать лейкозные клетки линии Kasumi-2. PBMC выделяли в градиенте фиколла. Опухолевые клетки Kasumi-2 совместно культивировали с РВМС. Лизис опухолевых клеток оценивали на проточном цитометре BD LSRFortessa подсчетом количества живых опухолевых клеток, присутствующих через 96 ч совместного культивирования. Тетраспецифическое антитело SI-38E14 показало наиболее высокую активность в этом исследовании, за которым следует антитело SI-38E38 (фиг. 3). В таблице 4 показаны примерные тетраспецифические антитела с доменом распознавания опухолевого антигена CD19.
Тетраспецифические антитела с доменом распознавания опухолевого антигена CD19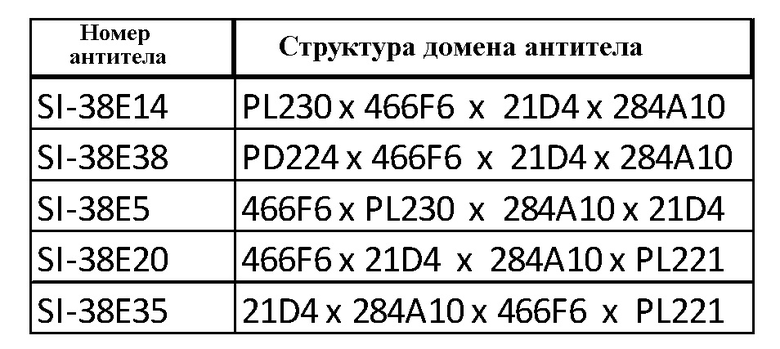
Пример 5: перенаправленная цитотоксичность PBMC против клеток линии астроцитомы U87, которые были трансфектированы EGFRvIII, функциональная активность различных доменов 4-1BB и функциональное влияние доменов PD-L1 и 4-1BB
Тетраспецифические антитела, приведенные в таблице 5, оценивали по их способности перенаправлять РВМС на лизирование опухолевых клеток линии U87, трансфектированных EGFRvIII (U87vIII). PBMC выделяли в градиенте фиколла. Линия опухолевых клеток U87vIII стабильно экспрессировала локализованный в ядре красный флуоресцентный белок (RFP), доставленный посредством лентивирусной трансдукции (Sartorius). Опухолевые клетки U87vIII совместно культивировали с РВМС. Лизис опухолевых клеток оценивали подсчетом RFP-меченных ядер опухолевых клеток. Изображения получали на системе для визуализации живых клеток IncuCyte (Sartorius). Активность антител оценивали через 96 ч инкубации. Антитела с различными доменами 4-1BB - SI-39E4, SI-39E2 и SI-39E3 проявили сходную активность (фиг. 4). Антитела с доменами PD-L1 и 4-1BB, замененными «молчащими» (не функциональными) доменами FITC, SI-39E1 и SI-39E5, показали снижение активности лизиса. Это наблюдение подтверждает функциональный вклад доменов 4-1BB и PD-L1. В таблице 5 показаны примерные тетраспецифические антитела с доменом, связывающимся с опухолевым антигеном EGFRvIII. FITC контрольные антитела.
Тетраспецифические антитела с доменом связывания с опухолевым антигеном EGFRvIII. FITC контрольные антитела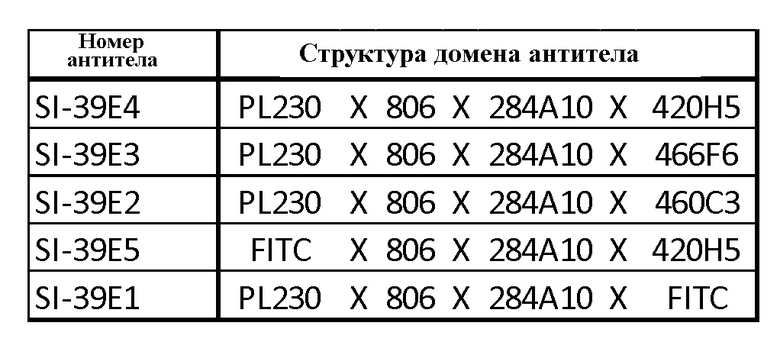
Пример 6: FACS-анализ связывания тетраспецифических антител с клетками СНО, трансфектированными ROR1 человека
Тетраспецифические антитела, приведенные в таблицах 1 и 2, тестировали на связывание с клетками яичника китайского хомячка (СНО), стабильно экспрессирующими полноразмерный ROR1 человека. Антитела готовили в конечной концентрации 2× и титровали 1:5 в 3 лунках 96-луночного планшета в 50 мкл PBS/2% FBS, и затем добавляли 5000 клеток ROR1-CHO в 50 мкл PBS/2% FBS. Эту смесь инкубировали в течение 30 мин на льду, промывали один раз 200 мкл PBS/2% FBS и затем добавляли вторичное антитело PE, козий античеловеческий IgG Fc, при разведении исходного раствора 1:1000, и эту смесь инкубировали в течение 30 мин на льду. Клетки промывали 2 × 200 мкл PBS/2% FBS, ресуспендировали в 50 мкл PBS/ 2% FBS и анализировали на BD LSRFORTESSA, и профиль связывания показан на фиг. 5. Тетраспецифические антитела SI-35E18, SI-35E19 и SI-35E20, со связывающим доменом 323H7, специфичным для Ig-домена ROR1, показали более высокое связывание, чем тетраспецифические антитела SI-3521, SI-35222 и SI-35223, со связывающим доменом 338H4, специфичным для frizzled домена ROR1, и тетраспецифические антитела SI-3524, SI-3525 и SI-3526 со связывающим доменом 330F11, специфичным для cringle домена ROR1, не связывались.
Пример 7: FACS-анализ связывания тетраспецифического антитела с клетками СНО, трансфектированными 41BB человека
Тетраспецифические антитела, приведенные в таблице 6, тестировали на связывание с клетками яичника китайского хомячка (СНО), стабильно экспрессирующими полноразмерный ROR1 человека. Антитела готовили в конечной концентрации 2× и титровали 1:5 в 3 лунках 96-луночного планшета в 50 мкл PBS/2% FBS, и затем добавляли 5000 клеток ROR1-CHO в 50 мкл PBS/2% FBS. Эту смесь инкубировали в течение 30 мин на льду, промывали один раз 200 мкл PBS/2% FBS и затем добавляли вторичное антитело, PE козий античеловеческий IgG Fc при разведении исходного раствора 1:1000, и эту смесь инкубировали в течение 30 мин на льду. Клетки промывали 2 × 200 мкл PBS/2% FBS, ресуспендировали в 50 мкл PBS/ 2% FBS и анализировали на BD LSRFortessa, и профиль связывания показан на фиг. 6. Все тетраспецифические антитела, за исключением контрольного SI-27E12 содержат домен связывания с 41BB, 460C3, 420H5 или 466F6 и связывались с клетками CHO, экспрессирующими 41BB, с различной интенсивностью. В таблице 6 приведен список примерных тетраспецифических антител.
Список примерных тетраспецифических антител
Пример 8: FACS-анализ связывания тетраспецифического антитела с клетками СНО, трансфектированными PD-L1 человека
Тетраспецифические антитела, приведенные в таблице 6, тестировали на связывание с клетками яичника китайского хомячка (СНО), стабильно экспрессирующими полноразмерный ROR1 человека. Антитела готовили в конечной концентрации 2× и титровали 1:5 в 3 лунках 96-луночного планшета в 50 мкл PBS/2% FBS, и затем добавляли 5000 клеток ROR1-CHO в 50 мкл PBS/2% FBS. Эту смесь инкубировали в течение 30 мин на льду, промывали один раз 200 мкл PBS/2% FBS и затем добавляли вторичное антитело, PE козий античеловеческий IgG Fc, при разведении исходного раствора 1:1000, и эту смесь инкубировали в течение 30 мин на льду. Клетки промывали 2×200 мкл PBS/2% FBS, ресуспендировали в 50 мкл PBS/2% FBS и анализировали на BD LSRFORTESSA, и профиль связывания показан на фиг. 7. Все тетраспецифические антитела, за исключением контрольного SI-27E15, содержат тот же домен связывания с PD-L1, PL230C6, и они показали очень похожую интенсивность связывания с клетками СНО, экспрессирующими PD-L1.
Пример 9: анализ перенаправленной Т-клеточной цитотоксичности (RTCC) с мононуклеарными клетками периферической крови в качестве эффекторов и клетками линии B-острого лимфобластного лейкоза (B-ALL) Kasumi-2 в качестве мишеней
Тетраспецифические антитела, приведенные в таблице 6, тестировали на активность RTCC против клеток линии B-ALL Kasumi 2 с использованием мононуклеарных клеток периферической крови человека (PBMC) в качестве эффекторов. Клетки-мишени Kasumi 2, 5×10e6, метили CFSE (Invitrogen, # C34554) при 0,5 мкМ в 10 мл культуральной среды в течение 20 мин при 37°С. Клетки промывали 3 раза по 50 мл культуральной среды, затем ресуспендировали в 10 мл, затем вновь подсчитывали. Антитела готовили в 2× конечной концентрации и титровали 1:3 в 10 лунках 96-луночного планшета в 200 мкл RPMI+10% FBS. РВМС человека выделяли в обычном градиенте плотности фиколла из «лейкопака», который представляет собой обогащенный продукт лейкафереза, собранный из нормальной периферической крови человека. В конечном 96-луночном планшете клетки-мишени, PBMC и серийные разведения антител объединяли добавлением 100 мкл клеток-мишеней (5000), 50 мкл PBMC (25000) и 100 мкл каждого разведения антитела в каждой лунке планшета для анализа. Планшет для анализа инкубировали при 37°С в течение примерно 72 ч и затем содержимое каждой лунки собирали и анализировали на количество оставшихся CFSE-меченных клеток-мишеней. Как показано на фиг. 8, все тетраспецифические антитела содержат одинаковый домен связывания с PD-L1 PL230C6, одинаковый домен связывания с ROR1 323H7 и одинаковый домен связывания с CD3 284A10, но содержат один из доменов связывания с 41BB, 460C3, 420H5 и 466F6, и они показали более высокую активность RTCC по сравнению с контролями, за исключением контрольного антитела SI-27E12, которое не имеет домена связывания с 41BB, но было также эффективно как тетраспецифические антитела SI-35E18, SI-35E19 и SI-35E20.
Пример 10: анализ перенаправленной Т-клеточной цитотоксичности (RTCC) с CD8+, CD45RO+ Т-клетками памяти в качестве эффекторов и клетками линии B-острого лимфобластного лейкоза (B-ALL) Kasumi-2 в качестве мишеней
Тетраспецифические антитела, приведенные в таблице 6, тестировали на активность RTCC против клеток линии B-ALL Kasumi 2 с использованием человеческих CD8+, CD45RO+ Т-клеток памяти в качестве эффекторов. Клетки-мишени Kasumi 2, 5×10e6, метили CFSE (Invitrogen, # C34554) при 0,5 мкМ в 10 мл культуральной среды в течение 20 мин при 37°С. Клетки промывали 3 раза по 50 мл культуральной среды, затем ресуспендировали в 10 мл, затем снова подсчитывали. Антитела готовили в 2× конечной концентрации и титровали 1:3 в 10 лунках 96-луночного планшета в 200 мкл RPMI+10% FBS. CD8+, CD45RO+ Т-клетки памяти человека обогащали из мононуклеарных клеток периферической крови нормального донора с использованием набора для обогащения CD8+ Т-клеток памяти человека EasySep™ (Stemcell Technologies, # 19159) в соответствии с протоколом изготовителя. Конечная популяция клеток была определена как содержащая 98% CD8+, CD45RO+ Т-клеток с помощью анализа FACS (данные не показаны). В конечном 96-луночном планшете клетки-мишени, Т-клетки и серийные разведения антител объединяли добавлением 100 мкл клеток-мишеней (5000), 50 мкл CD8+, CD45RO+ Т-клеток памяти (25000) и 100 мкл каждого разведения антитела в каждой лунке планшета для анализа. Планшет для анализа инкубировали при 37°С в течение примерно 72 ч и затем содержимое каждой лунки для анализа собирали и анализировали на количество оставшихся CFSE-меченных клеток-мишеней. Как показано на фиг. 9, все тетраспецифические антитела содержат одинаковый домен связывания с PD-L1 PL230C6, одинаковый домен связывания с ROR1 323H7 и одинаковый связывания с CD3 284A10, но имеют один из доменов связывания с 41BB, 460C3, 420H5 и 466F6, и они показали более высокую активность RTCC по сравнению с контролями, которые не содержат ни один из доменов связывания с 41BB, PD-L1, ROR1 или CD3.
Пример 11: анализ перенаправленной Т-клеточной цитотоксичности (RTCC) с CD8+, CD45RA+ наивными Т-клетками в качестве эффекторов и клетками линии B-острого лимфобластного лейкоза (B-ALL) Kasumi-2 в качестве мишеней
Тетраспецифические антитела, приведенные в таблице 6, тестировали на активность RTCC против клеток линии B-ALL Kasumi 2 с использованием человеческих CD8+, CD45RA+ Т-клеток памяти в качестве эффекторов. Клетки-мишени Kasumi 2, 5×10e6, метили CFSE (Invitrogen, # C34554) при 0,5 мкМ в 10 мл культуральной среды в течение 20 мин при 37°С. Клетки промывали 3 раза по 50 мл культуральной среды, затем ресуспендировали в 10 мл, затем снова подсчитывали. Антитела готовили в 2× конечной концентрации и титровали 1:3 в 10 лунках 96-луночного планшета в 200 мкл RPMI+10% FBS. CD8+, CD45RA+ Т-клетки памяти человека были обогащены из мононуклеарных клеток периферической крови нормального донора с использованием набора для выделения наивных CD8+ Т-клеток человека EasySep™ (Stemcell Technologies, # 19258) в соответствии с протоколом изготовителя. Конечная популяция клеток была определена как содержащая 98% CD8+, CD45RA+ T-клеток с помощью анализа FACS (данные не показаны). В конечном 96-луночном планшете клетки-мишени, Т-клетки и серийные разведения антител объединяли добавлением 100 мкл клеток-мишеней (5000), 50 мкл CD8+, CD45RO+Т-клеток (25000) и 100 мкл каждого разведения антитела в каждой лунке планшета для анализа. Планшет для анализа инкубировали при 37°С в течение примерно 72 ч и затем содержимое каждой лунки для анализа собирали и анализировали на количество оставшихся CFSE-меченных клеток-мишеней. Как показано на фиг.10, все тетраспецифические антитела содержат одинаковый домен связывания с PD-L1 PL230C6, одинаковый домен связывания с ROR1 323H7 и одинаковый домен связывания с CD3 284A10, но имеют один из доменов связывания с 41BB, 460C3, 420H5 и 466F6, и они показали более высокую активность RTCC по сравнению с контролями, которые не содержат ни один из доменов связывания с 41BB, PD-L1, ROR1 или CD3.
Пример 12: анализ перенаправленной Т-клеточной цитотоксичности (RTCC) с мононуклеарными клетками периферической крови в качестве эффекторов и клетками линии B-острого лимфобластного лейкоза (B-ALL) Kasumi-2 в качестве мишеней
Тетраспецифические антитела, приведенные в таблице 6, тестировали на активность RTCC против клеток линии B-ALL Kasumi 2 с использованием мононуклеарных клеток периферической крови человека (PBMC) в качестве эффекторов. Клетки-мишени Kasumi 2, 5×10e6, метили CFSE (Invitrogen, # C34554) при 0,5 мкМ в 10 мл культуральной среды в течение 20 мин при 37°С. Клетки промывали 3 раза по 50 мл культуральной среды, затем ресуспендировали в 10 мл, затем снова подсчитывали. Антитела готовили в 2× конечной концентрации и титровали 1:3 в 10 лунках 96-луночного планшета в 200 мкл RPMI+10% FBS. РВМС человека выделяли в обычном градиенте плотности фиколла из «лейкопака», который представляет собой обогащенный продукт лейкафереза, собранный из нормальной периферической крови человека. В конечном 96-луночном планшете клетки-мишени, PBMC и серийные разведения антител объединяли добавлением 100 мкл клеток-мишеней (5000), 50 мкл PBMC (25000) и 100 мкл каждого разведения антитела в каждой лунке планшета для анализа. Планшет для анализа инкубировали при 37°С в течение примерно 72 ч и затем содержимое каждой лунки для анализа собирали и анализировали на количество оставшихся CFSE-меченных клеток-мишеней. Как показано на фиг. 11, все тетраспецифические антитела содержат одинаковый домен связывания с PD-L1 PL230C6, одинаковый домен связывания с ROR1 338H4 и одинаковый домен связывания с CD3 284A10, но имеют один из доменов связывания с 41BB, 460C3, 420H5 и 466F6, и они показали более высокую активность RTCC по сравнению с контролями, за исключением контрольного SI-35E36, которое не имеет домена связывания с 41BB, но было примерно также эффективно как тетраспецифические антитела SI-35E18, 35E19 и 35E20.
Пример 13: анализ перенаправленной Т-клеточной цитотоксичности (RTCC) с CD8+, CD45RO+ Т-клетками памяти в качестве эффекторов и клетками линии B-острого лимфобластного лейкоза (B-ALL) Kasumi-2 в качестве мишеней
Тетраспецифические антитела, приведенные в таблице 6, тестировали на активность RTCC против клеток линии B-ALL Kasumi 2 с использованием человеческих CD8+, CD45RO+ Т-клеток памяти в качестве эффекторов. Клетки-мишени Kasumi 2, 5×10e6, метили CFSE (Invitrogen, # C34554) при 0,5 мкМ в 10 мл культуральной среды в течение 20 мин при 37°С. Клетки промывали 3 раза по 50 мл культуральной среды, затем ресуспендировали в 10 мл, затем снова подсчитывали. Антитела готовили в 2× конечной концентрации и титровали 1:3 в 10 лунках 96-луночного планшета в 200 мкл RPMI+10% FBS. CD8+, CD45RO+ Т-клетки памяти человека были обогащены из мононуклеарных клеток периферической крови нормального донора с использованием набора для обогащения CD8+ Т-клеток памяти человека EasySep™ (Stemcell Technologies, # 19159) в соответствии с протоколом изготовителя. Конечная популяция клеток была определена как содержащая 98% CD8+, CD45RO+ Т-клеток с помощью анализа FACS (данные не показаны). В конечном 96-луночном планшете клетки-мишени, Т-клетки и серийные разведения антител объединяли добавлением 100 мкл клеток-мишеней (5000), 50 мкл CD8+, CD45RO+ Т-клеток памяти (25000) и 100 мкл каждого разведения антитела в каждой лунке планшета для анализа. Планшет для анализа инкубировали при 37°С в течение примерно 72 ч и затем содержимое каждой лунки собирали и анализировали на количество оставшихся CFSE-меченных клеток-мишеней. Как показано на фиг. 12, все тетраспецифические антитела содержат одинаковый домен связывания с PD-L1 PL230C6, одинаковый домен связывания с ROR1 338H4 и одинаковый связывания с CD3 284A10, но имеют один из доменов связывания с 41BB, 460C3, 420H5 и 466F6, и они показали более высокую активность RTCC по сравнению с контролями, которые не содержат ни один из доменов связывания с 41BB, PD-L1, ROR1 или CD3.
Пример 14: анализ перенаправленной Т-клеточной цитотоксичности (RTCC) с CD8+, CD45RA+ наивными Т-клетками в качестве эффекторов и клетками линии B-острого лимфобластного лейкоза (B-ALL) Kasumi-2 в качестве мишеней
Тетраспецифические антитела, приведенные в таблице 6, тестировали на активность RTCC против клеток линии B-ALL Kasumi 2 с использованием человеческих CD8+, CD45RA+ Т-клеток памяти в качестве эффекторов. Клетки-мишени Kasumi 2, 5×10e6, метили CFSE (Invitrogen, # C34554) при 0,5 мкМ в 10 мл культуральной среды в течение 20 мин при 37°С. Клетки промывали 3 раза по 50 мл культуральной среды, затем ресуспендировали в 10 мл, затем снова подсчитывали. Антитела готовили в 2× конечной концентрации и титровали 1:3 в 10 лунках 96-луночного планшета в 200 мкл RPMI+10% FBS. CD8+, CD45RA+Т-клетки памяти человека были обогащены из мононуклеарных клеток периферической крови нормального донора с использованием набора для выделения наивных CD8+ Т-клеток человека EasySep™ (Stemcell Technologies, # 19258) в соответствии с протоколом изготовителя. Конечная популяция клеток была определена как содержащая 98% CD8+, CD45RA+ T-клеток с помощью анализа FACS (данные не показаны). В конечном 96-луночном планшете клетки-мишени, Т-клетки и серийные разведения антител объединяли добавлением 100 мкл клеток-мишеней (5000), 50 мкл CD8+, CD45RO+ Т-клеток (25000) и 100 мкл каждого разведения антитела в каждой лунке планшета для анализа. Планшет для анализа инкубировали при 37°С в течение примерно 72 ч и затем содержимое каждой лунки собирали и анализировали на количество оставшихся CFSE-меченных клеток-мишеней. Как показано на фиг. 13, все тетраспецифические антитела содержат одинаковый домен связывания с PD-L1 PL230C6, одинаковый домен связывания с ROR1 338H4 и одинаковый связывания с CD3 284A10, но имеют один из доменов связывания с 41BB, 460C3, 420H5 и 466F6, но они не показал большей активности RTCC по сравнению с контролями, которые не содержат ни один из связывающих доменов с 41BB, PD-L1, ROR1 или CD3. Это не согласуется с тетраспецифическими антителами, описанными в примере 6 и показанными на фиг.10, которые проявляют активность RTCC с CD8+, CD45RA+ наивными Т-клетками.
Несмотря на то, что настоящее раскрытие было описано со ссылкой на конкретные варианты осуществления или примеры, можно понять, что варианты осуществления являются иллюстративными и что объем раскрытия не ограничен таким образом. Альтернативные варианты осуществления настоящего раскрытия могут стать очевидными для специалистов в данной области техники, к которой относится настоящее раскрытие. Такие альтернативные варианты осуществления включаются в объем настоящего раскрытия. Следовательно, объем настоящего раскрытия определяется прилагаемой формулой изобретения и подтверждается вышеприведенным описанием. Все ссылки, цитированные или упомянутые в этом раскрытии, в полном объеме включены здесь посредством ссылки.
Список последовательностей
--->
CDR подчеркнуты в аминокислотных последовательностях
>SEQ ID:01 анти-CD3 284A10 VHv1 нуклеотидная последовательность
GAGGTGCAGCTGGTGGAGTCTGGGGGAGGCTTGGTCCAGCCTGGGGGGTCCCTGAGACTCTCCTGTGCAGCCTCTGGATTCACCATCAGTACCAATGCAATGAGCTGGGTCCGCCAGGCTCCAGGGAAGGGGCTGGAGTGGATCGGAGTCATTACTGGTCGTGATATCACATACTACGCGAGCTGGGCGAAAGGCAGATTCACCATCTCCAGAGACAATTCCAAGAACACGCTGTATCTTCAAATGAACAGCCTGAGAGCCGAGGACACGGCTGTGTATTACTGTGCGCGCGACGGTGGATCATCTGCTATTACTAGTAACAACATTTGGGGCCAAGGAACTCTGGTCACCGTTTCTTCA
>SEQ ID:02 анти-CD3 284A10 VHv1 аминокислотная последовательность
EVQLVESGGGLVQPGGSLRLSCAASGFTISTNAMSWVRQAPGKGLEWIGVITGRDITYYASWAKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARDGGSSAITSNNIWGQGTLVTVSS
>SEQ ID:03 анти-CD3 284A10 VLv1 нуклеотидная последовательность
GACGTCGTGATGACCCAGTCTCCTTCCACCCTGTCTGCATCTGTAGGAGACAGAGTCACCATCAATTGCCAAGCCAGTGAGAGCATTAGCAGTTGGTTAGCCTGGTATCAGCAGAAACCAGGGAAAGCCCCTAAGCTCCTGATCTATGAAGCATCCAAACTGGCATCTGGGGTCCCATCAAGGTTCAGCGGCAGTGGATCTGGGACAGAGTTCACTCTCACCATCAGCAGCCTGCAGCCTGATGATTTTGCAACTTATTACTGCCAAGGCTATTTTTATTTTATTAGTCGTACTTATGTAAATTCTTTCGGCGGAGGGACCAAGGTGGAGATCAAA
>SEQ ID:04 анти-CD3 284A10 VLv1 аминокислотная последовательность
DVVMTQSPSTLSASVGDRVTINCQASESISSWLAWYQQKPGKAPKLLIYEASKLASGVPSRFSGSGSGTEFTLTISSLQPDDFATYYCQGYFYFISRTYVNSFGGGTKVEIK
>SEQ ID:05 анти-CD3 480C8 VHv1 нуклеотидная последовательность
GAGGTGCAGCTGGTGGAGTCTGGGGGAGGCTTGGTCCAGCCTGGGGGGTCCCTGAGACTCTCCTGTGCAGCCTCTGGAATCGACCTCAGTAGCAATGCAATGAGCTGGGTCCGCCAGGCTCCAGGGAAGGGGCTGGAGTGGATCGGAGTCATTACTGGTCGTGATATCACATACTACGCGAGCTGGGCGAAAGGCAGATTCACCATCTCCAGAGACAATTCCAAGAACACGCTGTATCTTCAAATGAACAGCCTGAGAGCCGAGGACACGGCTGTGTATTACTGTGCGCGCGACGGTGGATCATCTGCTATTAATAGTAAGAACATTTGGGGCCAAGGAACTCTGGTCACCGTTTCTTCA
>SEQ ID:06 анти-CD3 480C8 VHv1 аминокислотная последовательность
EVQLVESGGGLVQPGGSLRLSCAASGIDLSSNAMSWVRQAPGKGLEWIGVITGRDITYYASWAKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARDGGSSAINSKNIWGQGTLVTVSS
>SEQ ID:07 анти-CD3 480C8 VLv1 нуклеотидная последовательность
GACATCCAGATGACCCAGTCTCCTTCCACCCTGTCTGCATCTGTAGGAGACAGAGTCACCATCACTTGCCAAGCCAGTGAGAGCATTAGCAGTTGGTTAGCCTGGTATCAGCAGAAACCAGGGAAAGCCCCTAAGCTCCTGATCTATGAAGCATCCAAACTGGCATCTGGGGTCCCATCAAGGTTCAGCGGCAGTGGATCTGGGACAGAGTTCACTCTCACCATCAGCAGCCTGCAGCCTGATGATTTTGCAACTTATTACTGCCAAGGCTATTTTTATTTTATTAGTCGTACTTATGTAAATGCTTTCGGCGGAGGGACCAAGGTGGAGATCAAA
>SEQ ID:08 анти-CD3 480C8 VLv1 аминокислотная последовательность
DIQMTQSPSTLSASVGDRVTITCQASESISSWLAWYQQKPGKAPKLLIYEASKLASGVPSRFSGSGSGTEFTLTISSLQPDDFATYYCQGYFYFISRTYVNAFGGGTKVEIK
>SEQ ID:09 анти-PD-L1 PL230C6 VHv3 нуклеотидная последовательность
CAGTCGGTGGAGGAGTCTGGGGGAGGCTTGGTCCAGCCTGGGGGGTCCCTGAGACTCTCCTGTACAGCCTCTGGAATCGACCTTAATACCTACGACATGATCTGGGTCCGCCAGGCTCCAGGCAAGGGGCTAGAGTGGGTTGGAATCATTACTTATAGTGGTAGTAGATACTACGCGAACTGGGCGAAAGGCCGATTCACCATCTCCAAAGACAATACCAAGAACACGGTGTATCTGCAAATGAACAGCCTGAGAGCTGAGGACACGGCTGTGTATTACTGTGCCAGAGATTATATGAGTGGTTCCCACTTGTGGGGCCAGGGAACCCTGGTCACCGTCTCTAGT
>SEQ ID:10 анти-PD-L1 PL230C6 VHv3 аминокислотная последовательность
QSVEESGGGLVQPGGSLRLSCTASGIDLNTYDMIWVRQAPGKGLEWVGIITYSGSRYYANWAKGRFTISKDNTKNTVYLQMNSLRAEDTAVYYCARDYMSGSHLWGQGTLVTVSS
>SEQ ID:11 анти-PD-L1 PL230C6 VLv2 нуклеотидная последовательность
GCCTATGATATGACCCAGTCTCCATCTTCCGTGTCTGCATCTGTAGGAGACAGAGTCACCATCAAGTGTCAGGCCAGTGAGGACATTTATAGCTTCTTGGCCTGGTATCAGCAGAAACCAGGGAAAGCCCCTAAGCTCCTGATCCATTCTGCATCCTCTCTGGCATCTGGGGTCCCATCAAGGTTCAGCGGCAGTGGATCTGGGACAGATTTCACTCTCACCATCAGCAGCCTGCAGCCTGAAGATTTTGCAACTTACTATTGTCAACAGGGTTATGGTAAAAATAATGTTGATAATGCTTTCGGCGGAGGGACCAAGGTGGAGATCAAA
>SEQ ID:12 анти-PD-L1 PL230C6 VLv2 аминокислотная последовательность
AYDMTQSPSSVSASVGDRVTIKCQASEDIYSFLAWYQQKPGKAPKLLIHSASSLASGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQGYGKNNVDNAFGGGTKVEIK
>SEQ ID:13 анти-PD-L1 PL221G5 VHv1 нуклеотидная последовательность
GAGGTGCAGCTGTTGGAGTCTGGGGGAGGCTTGGTACAGCCTGGGGGGTCCCTGAGACTCTCCTGTGCAGCCTCTGGATTCTCCTTCAGTAGCGGGTACGACATGTGCTGGGTCCGCCAGGCTCCAGGGAAGGGGCTGGAGTGGATCGCATGCATTGCTGCTGGTAGTGCTGGTATCACTTACGACGCGAACTGGGCGAAAGGCCGGTTCACCATCTCCAGAGACAATTCCAAGAACACGCTGTATCTGCAAATGAACAGCCTGAGAGCCGAGGACACGGCCGTATATTACTGTGCGAGATCGGCGTTTTCGTTCGACTACGCCATGGACCTCTGGGGCCAGGGAACCCTGGTCACCGTCTCGAGC
>SEQ ID:14 анти-PD-L1 PL221G5 VHv1 аминокислотная последовательность
EVQLLESGGGLVQPGGSLRLSCAASGFSFSSGYDMCWVRQAPGKGLEWIACIAAGSAGITYDANWAKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARSAFSFDYAMDLWGQGTLVTVSS
>SEQ ID:15 анти-PD-L1 PL221G5 VLv1 нуклеотидная последовательность
GACATCCAGATGACCCAGTCTCCTTCCACCCTGTCTGCATCTGTAGGAGACAGAGTCACCATCACTTGCCAGGCCAGTCAGAGCATTAGTTCCCACTTAAACTGGTATCAGCAGAAACCAGGGAAAGCCCCTAAGCTCCTGATCTATAAGGCATCCACTCTGGCATCTGGGGTCCCATCAAGGTTCAGCGGCAGTGGATCTGGGACAGAATTTACTCTCACCATCAGCAGCCTGCAGCCTGATGATTTTGCAACTTATTACTGCCAACAGGGTTATAGTTGGGGTAATGTTGATAATGTTTTCGGCGGAGGGACCAAGGTGGAGATCAAA
>SEQ ID:16 анти-PD-L1 PL221G5 VLv1 аминокислотная последовательность
DIQMTQSPSTLSASVGDRVTITCQASQSISSHLNWYQQKPGKAPKLLIYKASTLASGVPSRFSGSGSGTEFTLTISSLQPDDFATYYCQQGYSWGNVDNVFGGGTKVEIK
>SEQ ID:17 анти-PD-1 PD224D1 VHv2 нуклеотидная последовательность
GAGGTGCAGCTGGTGGAGTCTGGGGGAGGCTTGGTCCAGCCTGGGGGGTCCCTGAGACTCTCCTGTACAGCCTCTGGATTCTCCCTAAGTAGCTATGCAATGAGCTGGGTCCGCCAGGCTCCAGGGAAGGGGCTGGAGTACATCGGCTACATTGGTGATACTACTGGCATAGCCTACGCGAGCTGGGCGAATGGCAGATTCACCATCTCCAAAGACAATACCAAGAACACGGTGGATCTTCAAATGAACAGCCTGAGAGCCGAGGACACGGCTGTGTATTACTGTGCGAGAGGCTGGTCCTACTTAGACATCTGGGGCCAAGGGACCCTGGTCACCGTCTCGAGC
>SEQ ID:18 анти-PD-1 PD224D1 VHv2 аминокислотная последовательность
EVQLVESGGGLVQPGGSLRLSCTASGFSLSSYAMSWVRQAPGKGLEYIGYIGDTTGIAYASWANGRFTISKDNTKNTVDLQMNSLRAEDTAVYYCARGWSYLDIWGQGTLVTVSS
>SEQ ID:19 анти-PD-1 PD224D1 VLv2 нуклеотидная последовательность
GCCCTTGTGATGACCCAGTCTCCATCCTCCCTGTCTGCATCTGTAGGAGACAGAGTCACCATCACTTGCCAGGCCAGTCAGAACATTTACAGCAATTTAGCCTGGTATCAGCAGAAACCAGGGAAAGTTCCTAAGCTCCTGATCTATCAGGCCTCCACTCTGGCATCTGGGGTCCCATCTCGGTTCAGTGGCAGTGGATATGGGACAGATTTCACTCTCACCATCAGCAGCCTGCAGCCTGAAGATGTTGCAACTTATTACTGTCAAGGCGGTTATTATAGTGCTGCCCTTAATACTTTCGGCGGAGGGACCAAGGTGGAGATCAAA
>SEQ ID:20 анти-PD-1 PD224D1 VLv2 аминокислотная последовательность
ALVMTQSPSSLSASVGDRVTITCQASQNIYSNLAWYQQKPGKVPKLLIYQASTLASGVPSRFSGSGYGTDFTLTISSLQPEDVATYYCQGGYYSAALNTFGGGTKVEIK
>SEQ ID:21 анти-4-1BB 420H5 VHv3 нуклеотидная последовательность
CAGTCGCTGGTGGAGTCTGGGGGAGGCTTGGTACAGCCTGGGGGGTCCCTGAGACTCTCCTGTGCAGCCTCTGGATTCTCCTTCAGTAGCAACTACTGGATATGCTGGGTCCGCCAGGCTCCAGGGAAGGGGCTGGAGTGGATCGCATGCATTTATGTTGGTAGTAGTGGTGACACTTACTACGCGAGCTCCGCGAAAGGCCGGTTCACCATCTCCAGAGACAATTCCAAGAACACGCTGTATCTGCAAATGAACAGCCTGAGAGCCGAGGACACGGCCGTATATTACTGTGCGAGAGATAGTAGTAGTTATTATATGTTTAACTTGTGGGGCCAGGGAACCCTGGTCACCGTCTCGAGC
>SEQ ID:22 анти-4-1BB 420H5 VHv3 аминокислотная последовательность
QSLVESGGGLVQPGGSLRLSCAASGFSFSSNYWICWVRQAPGKGLEWIACIYVGSSGDTYYASSAKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARDSSSYYMFNLWGQGTLVTVSS
>SEQ ID:23 анти-4-1BB 420H5 VLv3 нуклеотидная последовательность
GCCCTTGTGATGACCCAGTCTCCTTCCACCCTGTCTGCATCTGTAGGAGACAGAGTCACCATCAATTGCCAGGCCAGTGAGGACATTGATACCTATTTAGCCTGGTATCAGCAGAAACCAGGGAAAGCCCCTAAGCTCCTGATCTTTTATGCATCCGATCTGGCATCTGGGGTCCCATCAAGGTTCAGCGGCAGTGGATCTGGGACAGAATTCACTCTCACCATCAGCAGCCTGCAGCCTGATGATTTTGCAACTTATTACTGCCAAGGCGGTTACTATACTAGTAGTGCTGATACGAGGGGTGCTTTCGGCGGAGGGACCAAGGTGGAGATCAAA
>SEQ ID:24 анти-4-1BB 420H5 VLv3 аминокислотная последовательность
ALVMTQSPSTLSASVGDRVTINCQASEDIDTYLAWYQQKPGKAPKLLIFYASDLASGVPSRFSGSGSGTEFTLTISSLQPDDFATYYCQGGYYTSSADTRGAFGGGTKVEIK
>SEQ ID:25 анти-4-1BB 466F6 VHv2 нуклеотидная последовательность
CGGTCGCTGGTGGAGTCTGGGGGAGGCTTGGTCCAGCCTGGGGGGTCCCTGAGACTCTCCTGTACAGCCTCTGGATTCACCATCAGTAGCTACCACATGCAGTGGGTCCGCCAGGCTCCAGGGAAGGGGCTGGAGTACATCGGAACCATTAGTAGTGGTGGTAATGTATACTACGCGAGCTCCGCGAGAGGCAGATTCACCATCTCCAGACCCTCGTCCAAGAACACGGTGGATCTTCAAATGAACAGCCTGAGAGCCGAGGACACGGCTGTGTATTACTGTGCGAGAGACTCTGGTTATAGTGATCCTATGTGGGGCCAGGGAACCCTGGTCACCGTCTCGAGC
>SEQ ID:26 анти-4-1BB 466F6 VHv2 аминокислотная последовательность
RSLVESGGGLVQPGGSLRLSCTASGFTISSYHMQWVRQAPGKGLEYIGTISSGGNVYYASSARGRFTISRPSSKNTVDLQMNSLRAEDTAVYYCARDSGYSDPMWGQGTLVTVSS
>SEQ ID:27 анти-4-1BB 466F6 VLv5 нуклеотидная последовательность
GACGTTGTGATGACCCAGTCTCCATCTTCCGTGTCTGCATCTGTAGGAGACAGAGTCACCATCACCTGTCAGGCCAGTCAGAACATTAGGACTTACTTATCCTGGTATCAGCAGAAACCAGGGAAAGCCCCTAAGCTCCTGATCTATGCTGCAGCCAATCTGGCATCTGGGGTCCCATCAAGGTTCAGCGGCAGTGGATCTGGGACAGATTTCACTCTCACCATCAGCGACCTGGAGCCTGGCGATGCTGCAACTTACTATTGTCAGTCTACCTATCTTGGTACTGATTATGTTGGCGGTGCTTTCGGCGGAGGGACCAAGGTGGAGATCAAA
>SEQ ID:28 анти-4-1BB 466F6 VLv5 аминокислотная последовательность
DVVMTQSPSSVSASVGDRVTITCQASQNIRTYLSWYQQKPGKAPKLLIYAAANLASGVPSRFSGSGSGTDFTLTISDLEPGDAATYYCQSTYLGTDYVGGAFGGGTKVEIK
>SEQ ID:29 анти-4-1BB 460C3 VHv1 нуклеотидная последовательность
GAGGTGCAGCTGTTGGAGTCTGGGGGAGGCTTGGTACAGCCTGGGGGGTCCCTGAGACTCTCCTGTGCAGCCTCTGGAATCGACTTCAGTAGGAGATACTACATGTGCTGGGTCCGCCAGGCTCCAGGGAAGGGGCTGGAGTGGATCGCATGCATATATACTGGTAGCCGCGATACTCCTCACTACGCGAGCTCCGCGAAAGGCCGGTTCACCATCTCCAGAGACAATTCCAAGAACACGCTGTATCTGCAAATGAACAGCCTGAGAGCCGAGGACACGGCCGTATATTACTGTGCGAGAGAAGGTAGCCTGTGGGGCCAGGGAACCCTGGTCACCGTCTCGAGC
>SEQ ID:30 анти-4-1BB 460C3 VHv1 аминокислотная последовательность
EVQLLESGGGLVQPGGSLRLSCAASGIDFSRRYYMCWVRQAPGKGLEWIACIYTGSRDTPHYASSAKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCAREGSLWGQGTLVTVSS
>SEQ ID:31 анти-4-1BB 460C3 VLv1 нуклеотидная последовательность
GACATCCAGATGACCCAGTCTCCTTCCACCCTGTCTGCATCTGTAGGAGACAGAGTCACCATCACTTGCCAGTCCAGTCAGAGTGTTTATAGTAACTGGTTCTCCTGGTATCAGCAGAAACCAGGGAAAGCCCCTAAGCTCCTGATCTATTCTGCATCCACTCTGGCATCTGGGGTCCCATCAAGGTTCAGCGGCAGTGGATCTGGGACAGAATTCACTCTCACCATCAGCAGCCTGCAGCCTGATGATTTTGCAACTTATTACTGCGCAGGCGGTTACAATACTGTTATTGATACTTTTGCTTTCGGCGGAGGGACCAAGGTGGAGATCAAA
>SEQ ID:32 анти-4-1BB 460C3 VLv1 аминокислотная последовательность
DIQMTQSPSTLSASVGDRVTITCQSSQSVYSNWFSWYQQKPGKAPKLLIYSASTLASGVPSRFSGSGSGTEFTLTISSLQPDDFATYYCAGGYNTVIDTFAFGGGTKVEIK
>SEQ ID:33 анти-ROR1 324C6 VHv2 нуклеотидная последовательность
CAGTCGCTGGTGGAGTCTGGGGGAGGCTTGGTCCAGCCTGGGGGGTCCCTGAGACTCTCCTGTACTGCCTCTGGATTCTCCCTCAGTAGGTACTACATGACCTGGGTCCGCCAGGCTCCAGGGAAGGGGCTGGAGTGGATCGGAACCATTTATACTAGTGGTAGTACATGGTACGCGAGCTGGACAAAAGGCAGATTCACCATCTCCAAAGACAATACCAAGAACACGGTGGATCTTCAAATGAACAGCCTGAGAGCCGAGGACACGGCTGTGTATTACTGTGCGAGATCCTATTATGGCGGTGATAAGACTGGTTTAGGCATCTGGGGCCAGGGAACTCTGGTTACCGTCTCTTCA
>SEQ ID:34 анти-ROR1 324C6 VHv2 аминокислотная последовательность
QSLVESGGGLVQPGGSLRLSCTASGFSLSRYYMTWVRQAPGKGLEWIGTIYTSGSTWYASWTKGRFTISKDNTKNTVDLQMNSLRAEDTAVYYCARSYYGGDKTGLGIWGQGTLVTVSS
>SEQ ID:35 анти-ROR1 324C6 VLv1 нуклеотидная последовательность
GACATCCAGATGACCCAGTCTCCTTCCACCCTGTCTGCATCTGTAGGAGACAGAGTCACCATCACTTGCCAGGCCAGTCAGAGCATTGATAGTTGGTTATCCTGGTATCAGCAGAAACCAGGGAAAGCCCCTAAGCTCCTGATCTATCAGGCATCCACTCTGGCATCTGGGGTCCCATCAAGGTTCAGCGGCAGTGGATCTGGGACAGAGTTCACTCTCACCATCAGCAGCCTGCAGCCTGATGATTTTGCAACTTATTACTGCCAATCTGCTTATGGTGTTAGTGGTACTAGTAGTTATTTATATACTTTCGGCGGAGGGACCAAGGTGGAGATCAAA
>SEQ ID:36 анти-ROR1 324C6 VLv1 аминокислотная последовательность
DIQMTQSPSTLSASVGDRVTITCQASQSIDSWLSWYQQKPGKAPKLLIYQASTLASGVPSRFSGSGSGTEFTLTISSLQPDDFATYYCQSAYGVSGTSSYLYTFGGGTKVEIK
>SEQ ID:37 анти-ROR1 323H7 VHv4 нуклеотидная последовательность
GAGGTGCAGCTGTTGGAGTCTGGGGGAGGCTTGGTACAGCCTGGGGGGTCCCTGAGACTCTCCTGTGCAGCCTCTGGATTCACCATCAGTCGCTACCACATGACTTGGGTCCGCCAGGCTCCAGGGAAGGGGCTGGAGTGGATCGGACATATTTATGTTAATAATGATGACACAGACTACGCGAGCTCCGCGAAAGGCCGGTTCACCATCTCCAGAGACAATTCCAAGAACACGCTGTATCTGCAAATGAACAGCCTGAGAGCCGAGGACACGGCCACCTATTTCTGTGCGAGATTGGATGTTGGTGGTGGTGGTGCTTATATTGGGGACATCTGGGGCCAGGGAACTCTGGTTACCGTCTCTTCA
>SEQ ID:38 анти-ROR1 323H7 VHv4 аминокислотная последовательность EVQLLESGGGLVQPGGSLRLSCAASGFTISRYHMTWVRQAPGKGLEWIGHIYVNNDDTDYASSAKGRFTISRDNSKNTLYLQMNSLRAEDTATYFCARLDVGGGGAYIGDIWGQGTLVTVSS
>SEQ ID:39 анти-ROR1 323H7 VLv1 нуклеотидная последовательность
GACATCCAGATGACCCAGTCTCCATCCTCCCTGTCTGCATCTGTAGGAGACAGAGTCACCATCACTTGCCAGTCCAGTCAGAGTGTTTATAACAACAACGACTTAGCCTGGTATCAGCAGAAACCAGGGAAAGTTCCTAAGCTCCTGATCTATTATGCTTCCACTCTGGCATCTGGGGTCCCATCTCGGTTCAGTGGCAGTGGATCTGGGACAGATTTCACTCTCACCATCAGCAGCCTGCAGCCTGAAGATGTTGCAACTTATTACTGTGCAGGCGGTTATGATACGGATGGTCTTGATACGTTTGCTTTCGGCGGAGGGACCAAGGTGGAGATCAAA
>SEQ ID:40 анти-ROR1 323H7 VLv1 аминокислотная последовательность
DIQMTQSPSSLSASVGDRVTITCQSSQSVYNNNDLAWYQQKPGKVPKLLIYYASTLASGVPSRFSGSGSGTDFTLTISSLQPEDVATYYCAGGYDTDGLDTFAFGGGTKVEIK
>SEQ ID:41 анти-ROR1 338H4 VHv3 нуклеотидная последовательность
GAGGTGCAGCTGGTGGAGTCTGGGGGAGGCTTGGTCCAGCCTGGGGGGTCCCTGAGACTCTCCTGTACTGCCTCTGGATTCTCCCTCAGTAGCTATGCAATGAGCTGGGTCCGCCAGGCTCCAGGGAGGGGGCTGGAGTGGATCGGAATCATTTATGCTAGTGGTAGCACATACTACGCGAGCTCGGCGAAAGGCAGATTCACCATCTCCAAAGACAATACCAAGAACACGGTGGATCTTCAAATGAACAGCCTGAGAGCCGAGGACACGGCTGTGTATTACTGTGCGAGAATTTATGACGGCATGGACCTCTGGGGCCAGGGAACTCTGGTTACCGTCTCTTCA
>SEQ ID:42 анти-ROR1 338H4 VHv3 аминокислотная последовательность
EVQLVESGGGLVQPGGSLRLSCTASGFSLSSYAMSWVRQAPGRGLEWIGIIYASGSTYYASSAKGRFTISKDNTKNTVDLQMNSLRAEDTAVYYCARIYDGMDLWGQGTLVTVSS
>SEQ ID:43 анти-ROR1 338H4 VLv4 нуклеотидная последовательность
GACATCCAGATGACCCAGTCTCCATCCTCCCTGTCTGCATCTGTAGGAGACAGAGTCACCATCAATTGCCAGGCCAGTCAGAACATTTACAGCTACTTATCCTGGTATCAGCAGAAACCAGGGAAAGTTCCTAAGCGCCTGATCTATCTGGCATCTACTCTGGCATCTGGGGTCCCATCTCGGTTCAGTGGCAGTGGATCTGGGACAGATTACACTCTCACCATCAGCAGCCTGCAGCCTGAAGATGTTGCAACTTATTACTGTCAAAGCAATTATAACGGTAATTATGGTTTCGGCGGAGGGACCAAGGTGGAGATCAAA
>SEQ ID:44 анти-ROR1 338H4 VLv4 аминокислотная последовательность
DIQMTQSPSSLSASVGDRVTINCQASQNIYSYLSWYQQKPGKVPKRLIYLASTLASGVPSRFSGSGSGTDYTLTISSLQPEDVATYYCQSNYNGNYGFGGGTKVEIK
>SEQ ID:45 анти-ROR1 330F11 VHv1 нуклеотидная последовательность
GAGGTGCAGCTGGTGGAGTCTGGGGGAGGCTTGGTCCAGCCTGGGGGGTCCCTGAGACTCTCCTGTGCAGCCTCTGGATTCTCCCTCAATAACTACTGGATGAGCTGGGTCCGCCAGGCTCCAGGGAAGGGGCTGGAGTGGATCGGAACCATTAGTAGTGGTGCGTATACATGGTTCGCCACCTGGGCGACAGGCAGATTCACCATCTCCAGAGACAATTCCAAGAACACGCTGTATCTTCAAATGAACAGCCTGAGAGCCGAGGACACGGCTGTGTATTACTGTGCGAGATATTCTTCTACTACTGATTGGACCTACTTTAACATCTGGGGCCAGGGAACTCTGGTTACCGTCTCTTCA
>SEQ ID:46 анти-ROR1 330F11 VHv1 аминокислотная последовательность
EVQLVESGGGLVQPGGSLRLSCAASGFSLNNYWMSWVRQAPGKGLEWIGTISSGAYTWFATWATGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARYSSTTDWTYFNIWGQGTLVTVSS
>SEQ ID:47 анти-ROR1 330F11 VLv1 нуклеотидная последовательность
GACATCCAGATGACCCAGTCTCCTTCCACCCTGTCTGCATCTGTAGGAGACAGAGTCACCATCACTTGCCAGGCCAGTCAGAGCATTAATAACTACTTAGCCTGGTATCAGCAGAAACCAGGGAAAGCCCCTAAGCTCCTGATCTATAGGGCATCCACTCTGGAATCTGGGGTCCCATCAAGGTTCAGCGGCAGTGGATCTGGGACAGAATTCACTCTCACCATCAGCAGCCTGCAGCCTGATGATTTTGCAACTTATTACTGCCAAAGCTATAATGGTGTTGGTAGGACTGCTTTCGGCGGAGGGACCAAGGTGGAGATCAAA
>SEQ ID:48 анти-ROR1 330F11 VLv1 аминокислотная последовательность
DIQMTQSPSTLSASVGDRVTITCQASQSINNYLAWYQQKPGKAPKLLIYRASTLESGVPSRFSGSGSGTEFTLTISSLQPDDFATYYCQSYNGVGRTAFGGGTKVEIK
>SEQ ID:49 анти-EGFRvIII mAb 806 VH нуклеотидная последовательность
GATGTGCAGCTTCAGGAGTCGGGACCTAGCCTGGTGAAACCTTCTCAGTCTCTGTCCCTCACCTGCACTGTCACTGGCTACTCAATCACCAGTGATTTTGCCTGGAACTGGATTCGGCAGTTTCCAGGAAACAAGCTGGAGTGGATGGGCTACATAAGTTATAGTGGTAACACTAGGTACAACCCATCTCTCAAAAGTCGAATCTCTATCACTCGCGACACATCCAAGAACCAATTCTTCCTGCAGTTGAACTCTGTGACTATTGAGGACACAGCCACATATTACTGTGTAACGGCGGGACGCGGGTTTCCTTATTGGGGCCAAGGGACTCTGGTCACTGTCTCTGCA
>SEQ ID:50 анти-EGFRvIII mAb 806 VH аминокислотная последовательность
DVQLQESGPSLVKPSQSLSLTCTVTGYSITSDFAWNWIRQFPGNKLEWMGYISYSGNTRYNPSLKSRISITRDTSKNQFFLQLNSVTIEDTATYYCVTAGRGFPYWGQGTLVTVSA
>SEQ ID:51 анти-EGFRvIII mAb 806 VL нуклеотидная последовательность
GACATCCTGATGACCCAATCTCCATCCTCCATGTCTGTATCTCTGGGAGACACAGTCAGCATCACTTGCCATTCAAGTCAGGACATTAACAGTAATATAGGGTGGTTGCAGCAGAGACCAGGGAAATCATTTAAGGGCCTGATCTATCATGGAACCAACTTGGACGATGAAGTTCCATCAAGGTTCAGTGGCAGTGGATCTGGAGCCGATTATTCTCTCACCATCAGCAGCCTGGAATCTGAAGATTTTGCAGACTATTACTGTGTACAGTATGCTCAGTTTCCGTGGACGTTCGGTGGAGGCACCAAGCTGGAAATCAAA
>SEQ ID:52 анти-EGFRvIII mAb 806 VL аминокислотная последовательность
DILMTQSPSSMSVSLGDTVSITCHSSQDINSNIGWLQQRPGKSFKGLIYHGTNLDDEVPSRFSGSGSGADYSLTISSLESEDFADYYCVQYAQFPWTFGGGTKLEIK
>SEQ ID:53 анти-CD19 21D4 VH нуклеотидная последовательность
GAGGTGCAGCTGGTGCAGTCTGGAGCAGAGGTGAAGAAACCAGGAGAGTCTCTGAAGATCTCCTGTAAGGGTTCTGGATACAGCTTTAGCAGTTCATGGATCGGCTGGGTGCGCCAGGCACCTGGGAAAGGCCTGGAATGGATGGGGATCATCTATCCTGATGACTCTGATACCAGATACAGTCCATCCTTCCAAGGCCAGGTCACCATCTCAGCCGACAAGTCCATCAGGACTGCCTACCTGCAGTGGAGTAGCCTGAAGGCCTCGGACACCGCTATGTATTACTGTGCGAGACATGTTACTATGATTTGGGGAGTTATTATTGACTTCTGGGGCCAGGGAACCCTGGTCACCGTCTCCTCA
>SEQ ID:54 анти-CD19 21D4 VH аминокислотная последовательность
EVQLVQSGAEVKKPGESLKISCKGSGYSFSSSWIGWVRQAPGKGLEWMGIIYPDDSDTRYSPSFQGQVTISADKSIRTAYLQWSSLKASDTAMYYCARHVTMIWGVIIDFWGQGTLVTVSS
>SEQ ID:55 анти-CD19 21D4 VL нуклеотидная последовательность
GCCATCCAGTTGACCCAGTCTCCATCCTCCCTGTCTGCATCTGTAGGAGACAGAGTCACCATCACTTGCCGGGCAAGTCAGGGCATTAGCAGTGCTTTAGCCTGGTATCAGCAGAAACCAGGGAAAGCTCCTAAGCTCCTGATCTATGATGCCTCCAGTTTGGAAAGTGGGGTCCCATCAAGGTTCAGCGGCAGTGGATCTGGGACAGATTTCACTCTCACCATCAGCAGCCTGCAGCCTGAAGATTTTGCAACTTATTACTGTCAACAGTTTAATAGTTACCCATTCACTTTCGGCCCTGGGACCAAAGTGGATATCAAA
>SEQ ID:56 анти-CD19 21D4 VL нуклеотидная последовательность
AIQLTQSPSSLSASVGDRVTITCRASQGISSALAWYQQKPGKAPKLLIYDASSLESGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQFNSYPFTFGPGTKVDIK
>SEQ ID:57 анти-FITC 4-4-20 VH нуклеотидная последовательность
GAGGTGAAGCTGGATGAGACTGGAGGAGGCTTGGTGCAACCTGGGAGGCCCATGAAACTCTCCTGTGTTGCCTCTGGATTCACTTTTAGTGACTACTGGATGAACTGGGTCCGCCAGTCTCCAGAGAAAGGACTGGAGTGGGTAGCACAAATTAGAAACAAACCTTATAATTATGAAACATATTATTCAGATTCTGTGAAAGGCAGATTCACCATCTCAAGAGATGATTCCAAAAGTAGTGTCTACCTGCAAATGAACAACTTAAGAGTTGAAGACATGGGTATCTATTACTGTACGGGTTCTTACTATGGTATGGACTACTGGGGTCAAGGAACCTCAGTCACCGTCTCCTCA
>SEQ ID:58 анти-FITC 4-4-20 VH аминокислотная последовательность
EVKLDETGGGLVQPGRPMKLSCVASGFTFSDYWMNWVRQSPEKGLEWVAQIRNKPYNYETYYSDSVKGRFTISRDDSKSSVYLQMNNLRVEDMGIYYCTGSYYGMDYWGQGTSVTVSS
>SEQ ID:59 анти-FITC 4-4-20 VL нуклеотидная последовательность
GATGTCGTGATGACCCAAACTCCACTCTCCCTGCCTGTCAGTCTTGGAGATCAAGCCTCCATCTCTTGCAGATCTAGTCAGAGCCTTGTACACAGTAATGGAAACACCTATTTACGTTGGTACCTGCAGAAGCCAGGCCAGTCTCCAAAGGTCCTGATCTACAAAGTTTCCAACCGATTTTCTGGGGTCCCAGACAGGTTCAGTGGCAGTGGATCAGGGACAGATTTCACACTCAAGATCAGCAGAGTGGAGGCTGAGGATCTGGGAGTTTATTTCTGCTCTCAAAGTACACATGTTCCGTGGACGTTCGGTGGAGGCACCAAGCTGGAAATCAAA
>SEQ ID:60 анти-FITC 4-4-20 VL аминокислотная последовательность
DVVMTQTPLSLPVSLGDQASISCRSSQSLVHSNGNTYLRWYLQKPGQSPKVLIYKVSNRFSGVPDRFSGSGSGTDFTLKISRVEAEDLGVYFCSQSTHVPWTFGGGTKLEIK
>SEQ ID:61 человеческий IgG1 с нулевой мутацией (G1m-fa с нулевой мутацией ADCC/CDC) нуклеотидная последовательность
GCTAGCACCAAGGGCCCATCGGTCTTCCCCCTGGCACCCTCCTCCAAGAGCACCTCTGGGGGCACAGCGGCCCTGGGCTGCCTGGTCAAGGACTACTTCCCCGAACCGGTGACGGTGTCGTGGAACTCAGGCGCCCTGACCAGCGGCGTGCACACCTTCCCGGCTGTCCTACAGTCCTCAGGACTCTACTCCCTCAGCAGCGTGGTGACCGTGCCCTCCAGCAGCTTGGGCACCCAGACCTACATCTGCAACGTGAATCACAAGCCCAGCAACACCAAGGTGGACAAGAGAGTTGAGCCCAAATCTTGTGACAAAACTCACACATGCCCACCGTGCCCAGCACCTGAAGCCGCGGGGGCACCGTCAGTCTTCCTCTTCCCCCCAAAACCCAAGGACACCCTCATGATCTCCCGGACCCCTGAGGTCACATGCGTGGTGGTGGACGTGAGCCACGAAGACCCTGAGGTCAAGTTCAACTGGTACGTGGACGGCGTGGAGGTGCATAATGCCAAGACAAAGCCGCGGGAGGAGCAGTACAACAGCACGTACCGTGTGGTCAGCGTCCTCACCGTCCTGCACCAGGACTGGCTGAATGGCAAGGAGTACAAGTGCGCGGTCTCCAACAAAGCCCTCCCAGCCCCCATCGAGAAAACCATCTCCAAAGCCAAAGGGCAGCCCCGAGAACCACAGGTGTACACCCTGCCCCCATCCCGGGATGAGCTGACCAAGAACCAGGTCAGCCTGACCTGCCTGGTCAAAGGCTTCTATCCCAGCGACATCGCCGTGGAGTGGGAGAGCAATGGGCAGCCGGAGAACAACTACAAGACCACGCCTCCCGTGCTGGACTCCGACGGCTCCTTCTTCCTCTATAGCAAGCTCACCGTGGACAAGAGCAGGTGGCAGCAGGGGAACGTCTTCTCATGCTCCGTGATGCATGAGGCTCTGCACAACCACTACACGCAGAAGAGCCTCTCCCTGTCTCCGGGT
>SEQ ID:62 человеческий IgG1 с нулевой мутацией (G1m-fa с нулевой мутацией ADCC/CDC) аминокислотная последовательность
ASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPEAAGAPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCAVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPG
>SEQ ID:63 каппа цепь человеческого Ig нуклеотидная последовательность
CGTACGGTGGCTGCACCATCTGTCTTCATCTTCCCGCCATCTGATGAGCAGTTGAAATCTGGAACTGCCTCTGTTGTGTGCCTGCTGAATAACTTCTATCCCAGAGAGGCCAAAGTACAGTGGAAGGTGGATAACGCCCTCCAATCGGGTAACTCCCAGGAGAGTGTCACAGAGCAGGACAGCAAGGACAGCACCTACAGCCTCAGCAGCACCCTGACGCTGAGCAAAGCAGACTACGAGAAACACAAAGTCTACGCCTGCGAAGTCACCCATCAGGGCCTGAGCTCGCCCGTCACAAAGAGCTTCAACAGGGGAGAGTGT
>SEQ ID:64 каппа цепь человеческого Ig аминокислотная последовательность
RTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC
>SEQ ID:65 SI-35E18 (60C3-L1H1-scFv x PL230C6-Fab x 323H7-H4L1-scFv x 284A10-H1L1-scFv) тяжелая цепь нуклеотидная последовательность
GACATCCAGATGACCCAGTCTCCTTCCACCCTGTCTGCATCTGTAGGAGACAGAGTCACCATCACTTGCCAGTCCAGTCAGAGTGTTTATAGTAACTGGTTCTCCTGGTATCAGCAGAAACCAGGGAAAGCCCCTAAGCTCCTGATCTATTCTGCATCCACTCTGGCATCTGGGGTCCCATCAAGGTTCAGCGGCAGTGGATCTGGGACAGAATTCACTCTCACCATCAGCAGCCTGCAGCCTGATGATTTTGCAACTTATTACTGCGCAGGCGGTTACAATACTGTTATTGATACTTTTGCTTTCGGCGGAGGGACCAAGGTGGAGATCAAAGGCGGTGGCGGTAGTGGGGGAGGCGGTTCTGGCGGCGGAGGGTCCGGCGGTGGAGGATCAGAGGTGCAGCTGTTGGAGTCTGGGGGAGGCTTGGTACAGCCTGGGGGGTCCCTGAGACTCTCCTGTGCAGCCTCTGGAATCGACTTCAGTAGGAGATACTACATGTGCTGGGTCCGCCAGGCTCCAGGGAAGGGGCTGGAGTGGATCGCATGCATATATACTGGTAGCCGCGATACTCCTCACTACGCGAGCTCCGCGAAAGGCCGGTTCACCATCTCCAGAGACAATTCCAAGAACACGCTGTATCTGCAAATGAACAGCCTGAGAGCCGAGGACACGGCCGTATATTACTGTGCGAGAGAAGGTAGCCTGTGGGGCCAGGGAACCCTGGTCACCGTCTCGAGCGGCGGTGGAGGGTCCGGCGGTGGTGGATCCCAGTCGGTGGAGGAGTCTGGGGGAGGCTTGGTCCAGCCTGGGGGGTCCCTGAGACTCTCCTGTACAGCCTCTGGAATCGACCTTAATACCTACGACATGATCTGGGTCCGCCAGGCTCCAGGCAAGGGGCTAGAGTGGGTTGGAATCATTACTTATAGTGGTAGTAGATACTACGCGAACTGGGCGAAAGGCCGATTCACCATCTCCAAAGACAATACCAAGAACACGGTGTATCTGCAAATGAACAGCCTGAGAGCTGAGGACACGGCTGTGTATTACTGTGCCAGAGATTATATGAGTGGTTCCCACTTGTGGGGCCAGGGAACCCTGGTCACCGTCTCTAGTGCTAGCACCAAGGGCCCATCGGTCTTCCCCCTGGCACCCTCCTCCAAGAGCACCTCTGGGGGCACAGCGGCCCTGGGCTGCCTGGTCAAGGACTACTTCCCCGAACCGGTGACGGTGTCGTGGAACTCAGGCGCCCTGACCAGCGGCGTGCACACCTTCCCGGCTGTCCTACAGTCCTCAGGACTCTACTCCCTCAGCAGCGTGGTGACCGTGCCCTCCAGCAGCTTGGGCACCCAGACCTACATCTGCAACGTGAATCACAAGCCCAGCAACACCAAGGTGGACAAGAGAGTTGAGCCCAAATCTTGTGACAAAACTCACACATGCCCACCGTGCCCAGCACCTGAAGCCGCGGGGGCACCGTCAGTCTTCCTCTTCCCCCCAAAACCCAAGGACACCCTCATGATCTCCCGGACCCCTGAGGTCACATGCGTGGTGGTGGACGTGAGCCACGAAGACCCTGAGGTCAAGTTCAACTGGTACGTGGACGGCGTGGAGGTGCATAATGCCAAGACAAAGCCGCGGGAGGAGCAGTACAACAGCACGTACCGTGTGGTCAGCGTCCTCACCGTCCTGCACCAGGACTGGCTGAATGGCAAGGAGTACAAGTGCGCGGTCTCCAACAAAGCCCTCCCAGCCCCCATCGAGAAAACCATCTCCAAAGCCAAAGGGCAGCCCCGAGAACCACAGGTGTATACCCTGCCCCCATCCCGGGATGAGCTGACCAAGAACCAGGTCAGCCTGACCTGCCTGGTCAAAGGCTTCTATCCCAGCGACATCGCCGTGGAGTGGGAGAGCAATGGGCAGCCGGAGAACAACTACAAGACCACGCCTCCCGTGCTGGACTCCGACGGCTCCTTCTTCCTCTATAGCAAGCTCACCGTGGACAAGAGCAGGTGGCAGCAGGGGAACGTCTTCTCATGCTCCGTGATGCATGAGGCTCTGCACAACCACTACACGCAGAAGAGCCTCTCCCTGTCTCCGGGTGGCGGTGGAGGGTCCGGCGGTGGTGGATCCGAGGTGCAGCTGTTGGAGTCTGGGGGAGGCTTGGTACAGCCTGGGGGGTCCCTGAGACTCTCCTGTGCAGCCTCTGGATTCACCATCAGTCGCTACCACATGACTTGGGTCCGCCAGGCTCCAGGGAAGGGGCTGGAGTGGATCGGACATATTTATGTTAATAATGATGACACAGACTACGCGAGCTCCGCGAAAGGCCGGTTCACCATCTCCAGAGACAATTCCAAGAACACGCTGTATCTGCAAATGAACAGCCTGAGAGCCGAGGACACGGCCACCTATTTCTGTGCGAGATTGGATGTTGGTGGTGGTGGTGCTTATATTGGGGACATCTGGGGCCAGGGAACTCTGGTTACCGTCTCTTCAGGCGGTGGCGGTAGTGGGGGAGGCGGTTCTGGCGGCGGAGGGTCCGGCGGTGGAGGATCAGACATCCAGATGACCCAGTCTCCATCCTCCCTGTCTGCATCTGTAGGAGACAGAGTCACCATCACTTGCCAGTCCAGTCAGAGTGTTTATAACAACAACGACTTAGCCTGGTATCAGCAGAAACCAGGGAAAGTTCCTAAGCTCCTGATCTATTATGCTTCCACTCTGGCATCTGGGGTCCCATCTCGGTTCAGTGGCAGTGGATCTGGGACAGATTTCACTCTCACCATCAGCAGCCTGCAGCCTGAAGATGTTGCAACTTATTACTGTGCAGGCGGTTATGATACGGATGGTCTTGATACGTTTGCTTTCGGCGGAGGGACCAAGGTGGAGATCAAAGGCGGTGGAGGGTCCGGCGGTGGTGGATCCGAGGTGCAGCTGGTGGAGTCTGGGGGAGGCTTGGTCCAGCCTGGGGGGTCCCTGAGACTCTCCTGTGCAGCCTCTGGATTCACCATCAGTACCAATGCAATGAGCTGGGTCCGCCAGGCTCCAGGGAAGGGGCTGGAGTGGATCGGAGTCATTACTGGTCGTGATATCACATACTACGCGAGCTGGGCGAAAGGCAGATTCACCATCTCCAGAGACAATTCCAAGAACACGCTGTATCTTCAAATGAACAGCCTGAGAGCCGAGGACACGGCTGTGTATTACTGTGCGCGCGACGGTGGATCATCTGCTATTACTAGTAACAACATTTGGGGCCAAGGAACTCTGGTCACCGTTTCTTCAGGCGGTGGCGGTAGTGGGGGAGGCGGTTCTGGCGGCGGAGGGTCCGGCGGTGGAGGATCAGACGTCGTGATGACCCAGTCTCCTTCCACCCTGTCTGCATCTGTAGGAGACAGAGTCACCATCAATTGCCAAGCCAGTGAGAGCATTAGCAGTTGGTTAGCCTGGTATCAGCAGAAACCAGGGAAAGCCCCTAAGCTCCTGATCTATGAAGCATCCAAACTGGCATCTGGGGTCCCATCAAGGTTCAGCGGCAGTGGATCTGGGACAGAGTTCACTCTCACCATCAGCAGCCTGCAGCCTGATGATTTTGCAACTTATTACTGCCAAGGCTATTTTTATTTTATTAGTCGTACTTATGTAAATTCTTTCGGCGGAGGGACCAAGGTGGAGATCAAA
>SEQ ID:66 SI-35E18 (460C3-L1H1-scFv x PL230C6-Fab x 323H7-H4L1-scFv x 284A10-H1L1-scFv) тяжелая цепь аминокислотная последовательность
DIQMTQSPSTLSASVGDRVTITCQSSQSVYSNWFSWYQQKPGKAPKLLIYSASTLASGVPSRFSGSGSGTEFTLTISSLQPDDFATYYCAGGYNTVIDTFAFGGGTKVEIK (анти-4-1BB 460C3 VLv1)
линкер GGGGSGGGGSGGGGSGGGGS (Gly4Ser)x4
EVQLLESGGGLVQPGGSLRLSCAASGIDFSRRYYMCWVRQAPGKGLEWIACIYTGSRDTPHYASSAKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCAREGSLWGQGTLVTVSS (анти-4-1BB 460C3 VHv1)
линкер GGGGSGGGGS (Gly4Ser)x2
QSVEESGGGLVQPGGSLRLSCTASGIDLNTYDMIWVRQAPGKGLEWVGIITYSGSRYYANWAKGRFTISKDNTKNTVYLQMNSLRAEDTAVYYCARDYMSGSHLWGQGTLVTVSS (анти-PD-L1 PL230C6 VHv3)
ASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPEAAGAPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCAVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPG (человеческий IgG1 с нулевой мутацией)
линкер GGGGSGGGGS (Gly4Ser)x2
EVQLLESGGGLVQPGGSLRLSCAASGFTISRYHMTWVRQAPGKGLEWIGHIYVNNDDTDYASSAKGRFTISRDNSKNTLYLQMNSLRAEDTATYFCARLDVGGGGAYIGDIWGQGTLVTVSS (анти-ROR1 323H7 VHv4)
линкер GGGGSGGGGSGGGGSGGGGS (Gly4Ser)x4
DIQMTQSPSSLSASVGDRVTITCQSSQSVYNNNDLAWYQQKPGKVPKLLIYYASTLASGVPSRFSGSGSGTDFTLTISSLQPEDVATYYCAGGYDTDGLDTFAFGGGTKVEIK (анти-ROR1 323H7 VLv1)
линкер GGGGSGGGGS (Gly4Ser)x2
EVQLVESGGGLVQPGGSLRLSCAASGFTISTNAMSWVRQAPGKGLEWIGVITGRDITYYASWAKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARDGGSSAITSNNIWGQGTLVTVSS (анти-CD3 284A10 VHv1)
линкер GGGGSGGGGSGGGGSGGGGS (Gly4Ser)x4
DVVMTQSPSTLSASVGDRVTINCQASESISSWLAWYQQKPGKAPKLLIYEASKLASGVPSRFSGSGSGTEFTLTISSLQPDDFATYYCQGYFYFISRTYVNSFGGGTKVEIK (анти-CD3 284A10 VLv1)
>SEQ ID:67 SI-35E18 (460C3-L1H1-scFv x PL230C6-Fab x 323H7-H4L1-scFv x 284A10-H1L1-scFv) легкая цепь нуклеотидная последовательность
GCCTATGATATGACCCAGTCTCCATCTTCCGTGTCTGCATCTGTAGGAGACAGAGTCACCATCAAGTGTCAGGCCAGTGAGGACATTTATAGCTTCTTGGCCTGGTATCAGCAGAAACCAGGGAAAGCCCCTAAGCTCCTGATCCATTCTGCATCCTCTCTGGCATCTGGGGTCCCATCAAGGTTCAGCGGCAGTGGATCTGGGACAGATTTCACTCTCACCATCAGCAGCCTGCAGCCTGAAGATTTTGCAACTTACTATTGTCAACAGGGTTATGGTAAAAATAATGTTGATAATGCTTTCGGCGGAGGGACCAAGGTGGAGATCAAACGTACGGTGGCTGCACCATCTGTCTTCATCTTCCCGCCATCTGATGAGCAGTTGAAATCTGGAACTGCCTCTGTTGTGTGCCTGCTGAATAACTTCTATCCCAGAGAGGCCAAAGTACAGTGGAAGGTGGATAACGCCCTCCAATCGGGTAACTCCCAGGAGAGTGTCACAGAGCAGGACAGCAAGGACAGCACCTACAGCCTCAGCAGCACCCTGACGCTGAGCAAAGCAGACTACGAGAAACACAAAGTCTACGCCTGCGAAGTCACCCATCAGGGCCTGAGCTCGCCCGTCACAAAGAGCTTCAACAGGGGAGAGTGT
>SEQ ID:68 SI-35E18 (460C3-L1H1-scFv x PL230C6-Fab x 323H7-H4L1-scFv x 284A10-H1L1-scFv) легкая цепь аминокислотная последовательность
AYDMTQSPSSVSASVGDRVTIKCQASEDIYSFLAWYQQKPGKAPKLLIHSASSLASGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQGYGKNNVDNAFGGGTKVEIK (анти-PD-L1 PL230C6 VLv2)
RTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (human Ig Kappa)
Другие последовательности:
Номер последовательностей:

Список последовательностей
<110> SYSTIMMUNE, INC.
SICHUAN BAILI PHARMACEUTICAL CO. LTD.
<120> МУЛЬТИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА И СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ
<130> SIBA035PCT
<140> PCT/US2018/039156
<141> 2018-06-22
<150> US62524557
<151> 2017-06-25
<160> 68
<170> PatentIn version 3.5
<210> 1
<211> 360
<212> ДНК
<213> Искуссвенная последовательность
<220>
<223> синтезированная
<400> 1
gaggtgcagc tggtggagtc tgggggaggc ttggtccagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt caccatcagt accaatgcaa tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg gatcggagtc attactggtc gtgatatcac atactacgcg 180
agctgggcga aaggcagatt caccatctcc agagacaatt ccaagaacac gctgtatctt 240
caaatgaaca gcctgagagc cgaggacacg gctgtgtatt actgtgcgcg cgacggtgga 300
tcatctgcta ttactagtaa caacatttgg ggccaaggaa ctctggtcac cgtttcttca 360
<210> 2
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 2
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Ile Ser Thr Asn
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Thr Gly Arg Asp Ile Thr Tyr Tyr Ala Ser Trp Ala Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Asp Gly Gly Ser Ser Ala Ile Thr Ser Asn Asn Ile Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 3
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 3
gacgtcgtga tgacccagtc tccttccacc ctgtctgcat ctgtaggaga cagagtcacc 60
atcaattgcc aagccagtga gagcattagc agttggttag cctggtatca gcagaaacca 120
gggaaagccc ctaagctcct gatctatgaa gcatccaaac tggcatctgg ggtcccatca 180
aggttcagcg gcagtggatc tgggacagag ttcactctca ccatcagcag cctgcagcct 240
gatgattttg caacttatta ctgccaaggc tatttttatt ttattagtcg tacttatgta 300
aattctttcg gcggagggac caaggtggag atcaaa 336
<210> 4
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 4
Asp Val Val Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Asn Cys Gln Ala Ser Glu Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Glu Ala Ser Lys Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gly Tyr Phe Tyr Phe Ile Ser
85 90 95
Arg Thr Tyr Val Asn Ser Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 5
<211> 360
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 5
gaggtgcagc tggtggagtc tgggggaggc ttggtccagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggaat cgacctcagt agcaatgcaa tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg gatcggagtc attactggtc gtgatatcac atactacgcg 180
agctgggcga aaggcagatt caccatctcc agagacaatt ccaagaacac gctgtatctt 240
caaatgaaca gcctgagagc cgaggacacg gctgtgtatt actgtgcgcg cgacggtgga 300
tcatctgcta ttaatagtaa gaacatttgg ggccaaggaa ctctggtcac cgtttcttca 360
<210> 6
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 6
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Ile Asp Leu Ser Ser Asn
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Thr Gly Arg Asp Ile Thr Tyr Tyr Ala Ser Trp Ala Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Asp Gly Gly Ser Ser Ala Ile Asn Ser Lys Asn Ile Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 7
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 7
gacatccaga tgacccagtc tccttccacc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgcc aagccagtga gagcattagc agttggttag cctggtatca gcagaaacca 120
gggaaagccc ctaagctcct gatctatgaa gcatccaaac tggcatctgg ggtcccatca 180
aggttcagcg gcagtggatc tgggacagag ttcactctca ccatcagcag cctgcagcct 240
gatgattttg caacttatta ctgccaaggc tatttttatt ttattagtcg tacttatgta 300
aatgctttcg gcggagggac caaggtggag atcaaa 336
<210> 8
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 8
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Glu Ser Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Glu Ala Ser Lys Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gly Tyr Phe Tyr Phe Ile Ser
85 90 95
Arg Thr Tyr Val Asn Ala Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 9
<211> 345
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 9
cagtcggtgg aggagtctgg gggaggcttg gtccagcctg gggggtccct gagactctcc 60
tgtacagcct ctggaatcga ccttaatacc tacgacatga tctgggtccg ccaggctcca 120
ggcaaggggc tagagtgggt tggaatcatt acttatagtg gtagtagata ctacgcgaac 180
tgggcgaaag gccgattcac catctccaaa gacaatacca agaacacggt gtatctgcaa 240
atgaacagcc tgagagctga ggacacggct gtgtattact gtgccagaga ttatatgagt 300
ggttcccact tgtggggcca gggaaccctg gtcaccgtct ctagt 345
<210> 10
<211> 115
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 10
Gln Ser Val Glu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser
1 5 10 15
Leu Arg Leu Ser Cys Thr Ala Ser Gly Ile Asp Leu Asn Thr Tyr Asp
20 25 30
Met Ile Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Gly
35 40 45
Ile Ile Thr Tyr Ser Gly Ser Arg Tyr Tyr Ala Asn Trp Ala Lys Gly
50 55 60
Arg Phe Thr Ile Ser Lys Asp Asn Thr Lys Asn Thr Val Tyr Leu Gln
65 70 75 80
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg
85 90 95
Asp Tyr Met Ser Gly Ser His Leu Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 11
<211> 330
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 11
gcctatgata tgacccagtc tccatcttcc gtgtctgcat ctgtaggaga cagagtcacc 60
atcaagtgtc aggccagtga ggacatttat agcttcttgg cctggtatca gcagaaacca 120
gggaaagccc ctaagctcct gatccattct gcatcctctc tggcatctgg ggtcccatca 180
aggttcagcg gcagtggatc tgggacagat ttcactctca ccatcagcag cctgcagcct 240
gaagattttg caacttacta ttgtcaacag ggttatggta aaaataatgt tgataatgct 300
ttcggcggag ggaccaaggt ggagatcaaa 330
<210> 12
<211> 110
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 12
Ala Tyr Asp Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Lys Cys Gln Ala Ser Glu Asp Ile Tyr Ser Phe
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
His Ser Ala Ser Ser Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Tyr Gly Lys Asn Asn
85 90 95
Val Asp Asn Ala Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 13
<211> 366
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 13
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt ctccttcagt agcgggtacg acatgtgctg ggtccgccag 120
gctccaggga aggggctgga gtggatcgca tgcattgctg ctggtagtgc tggtatcact 180
tacgacgcga actgggcgaa aggccggttc accatctcca gagacaattc caagaacacg 240
ctgtatctgc aaatgaacag cctgagagcc gaggacacgg ccgtatatta ctgtgcgaga 300
tcggcgtttt cgttcgacta cgccatggac ctctggggcc agggaaccct ggtcaccgtc 360
tcgagc 366
<210> 14
<211> 122
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 14
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser Ser Gly
20 25 30
Tyr Asp Met Cys Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp
35 40 45
Ile Ala Cys Ile Ala Ala Gly Ser Ala Gly Ile Thr Tyr Asp Ala Asn
50 55 60
Trp Ala Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Ala Arg Ser Ala Phe Ser Phe Asp Tyr Ala Met Asp Leu Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 15
<211> 330
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 15
gacatccaga tgacccagtc tccttccacc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgcc aggccagtca gagcattagt tcccacttaa actggtatca gcagaaacca 120
gggaaagccc ctaagctcct gatctataag gcatccactc tggcatctgg ggtcccatca 180
aggttcagcg gcagtggatc tgggacagaa tttactctca ccatcagcag cctgcagcct 240
gatgattttg caacttatta ctgccaacag ggttatagtt ggggtaatgt tgataatgtt 300
ttcggcggag ggaccaaggt ggagatcaaa 330
<210> 16
<211> 110
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 16
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Gln Ser Ile Ser Ser His
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Lys Ala Ser Thr Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Tyr Ser Trp Gly Asn
85 90 95
Val Asp Asn Val Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 17
<211> 345
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 17
gaggtgcagc tggtggagtc tgggggaggc ttggtccagc ctggggggtc cctgagactc 60
tcctgtacag cctctggatt ctccctaagt agctatgcaa tgagctgggt ccgccaggct 120
ccagggaagg ggctggagta catcggctac attggtgata ctactggcat agcctacgcg 180
agctgggcga atggcagatt caccatctcc aaagacaata ccaagaacac ggtggatctt 240
caaatgaaca gcctgagagc cgaggacacg gctgtgtatt actgtgcgag aggctggtcc 300
tacttagaca tctggggcca agggaccctg gtcaccgtct cgagc 345
<210> 18
<211> 115
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 18
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Thr Ala Ser Gly Phe Ser Leu Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Tyr Ile
35 40 45
Gly Tyr Ile Gly Asp Thr Thr Gly Ile Ala Tyr Ala Ser Trp Ala Asn
50 55 60
Gly Arg Phe Thr Ile Ser Lys Asp Asn Thr Lys Asn Thr Val Asp Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Gly Trp Ser Tyr Leu Asp Ile Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 19
<211> 327
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 19
gcccttgtga tgacccagtc tccatcctcc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgcc aggccagtca gaacatttac agcaatttag cctggtatca gcagaaacca 120
gggaaagttc ctaagctcct gatctatcag gcctccactc tggcatctgg ggtcccatct 180
cggttcagtg gcagtggata tgggacagat ttcactctca ccatcagcag cctgcagcct 240
gaagatgttg caacttatta ctgtcaaggc ggttattata gtgctgccct taatactttc 300
ggcggaggga ccaaggtgga gatcaaa 327
<210> 20
<211> 109
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 20
Ala Leu Val Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Gln Asn Ile Tyr Ser Asn
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Val Pro Lys Leu Leu Ile
35 40 45
Tyr Gln Ala Ser Thr Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Tyr Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Tyr Cys Gln Gly Gly Tyr Tyr Ser Ala Ala
85 90 95
Leu Asn Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 21
<211> 360
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 21
cagtcgctgg tggagtctgg gggaggcttg gtacagcctg gggggtccct gagactctcc 60
tgtgcagcct ctggattctc cttcagtagc aactactgga tatgctgggt ccgccaggct 120
ccagggaagg ggctggagtg gatcgcatgc atttatgttg gtagtagtgg tgacacttac 180
tacgcgagct ccgcgaaagg ccggttcacc atctccagag acaattccaa gaacacgctg 240
tatctgcaaa tgaacagcct gagagccgag gacacggccg tatattactg tgcgagagat 300
agtagtagtt attatatgtt taacttgtgg ggccagggaa ccctggtcac cgtctcgagc 360
<210> 22
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 22
Gln Ser Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser
1 5 10 15
Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser Ser Asn Tyr
20 25 30
Trp Ile Cys Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Ala Cys Ile Tyr Val Gly Ser Ser Gly Asp Thr Tyr Tyr Ala Ser Ser
50 55 60
Ala Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu
65 70 75 80
Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Asp Ser Ser Ser Tyr Tyr Met Phe Asn Leu Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 23
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 23
gcccttgtga tgacccagtc tccttccacc ctgtctgcat ctgtaggaga cagagtcacc 60
atcaattgcc aggccagtga ggacattgat acctatttag cctggtatca gcagaaacca 120
gggaaagccc ctaagctcct gatcttttat gcatccgatc tggcatctgg ggtcccatca 180
aggttcagcg gcagtggatc tgggacagaa ttcactctca ccatcagcag cctgcagcct 240
gatgattttg caacttatta ctgccaaggc ggttactata ctagtagtgc tgatacgagg 300
ggtgctttcg gcggagggac caaggtggag atcaaa 336
<210> 24
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 24
Ala Leu Val Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Asn Cys Gln Ala Ser Glu Asp Ile Asp Thr Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Phe Tyr Ala Ser Asp Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Gly Gly Tyr Tyr Thr Ser Ser
85 90 95
Ala Asp Thr Arg Gly Ala Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 25
<211> 345
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 25
cggtcgctgg tggagtctgg gggaggcttg gtccagcctg gggggtccct gagactctcc 60
tgtacagcct ctggattcac catcagtagc taccacatgc agtgggtccg ccaggctcca 120
gggaaggggc tggagtacat cggaaccatt agtagtggtg gtaatgtata ctacgcgagc 180
tccgcgagag gcagattcac catctccaga ccctcgtcca agaacacggt ggatcttcaa 240
atgaacagcc tgagagccga ggacacggct gtgtattact gtgcgagaga ctctggttat 300
agtgatccta tgtggggcca gggaaccctg gtcaccgtct cgagc 345
<210> 26
<211> 115
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 26
Arg Ser Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser
1 5 10 15
Leu Arg Leu Ser Cys Thr Ala Ser Gly Phe Thr Ile Ser Ser Tyr His
20 25 30
Met Gln Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Tyr Ile Gly
35 40 45
Thr Ile Ser Ser Gly Gly Asn Val Tyr Tyr Ala Ser Ser Ala Arg Gly
50 55 60
Arg Phe Thr Ile Ser Arg Pro Ser Ser Lys Asn Thr Val Asp Leu Gln
65 70 75 80
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg
85 90 95
Asp Ser Gly Tyr Ser Asp Pro Met Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 27
<211> 333
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 27
gacgttgtga tgacccagtc tccatcttcc gtgtctgcat ctgtaggaga cagagtcacc 60
atcacctgtc aggccagtca gaacattagg acttacttat cctggtatca gcagaaacca 120
gggaaagccc ctaagctcct gatctatgct gcagccaatc tggcatctgg ggtcccatca 180
aggttcagcg gcagtggatc tgggacagat ttcactctca ccatcagcga cctggagcct 240
ggcgatgctg caacttacta ttgtcagtct acctatcttg gtactgatta tgttggcggt 300
gctttcggcg gagggaccaa ggtggagatc aaa 333
<210> 28
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 28
Asp Val Val Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Gln Asn Ile Arg Thr Tyr
20 25 30
Leu Ser Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Ala Ala Asn Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Asp Leu Glu Pro
65 70 75 80
Gly Asp Ala Ala Thr Tyr Tyr Cys Gln Ser Thr Tyr Leu Gly Thr Asp
85 90 95
Tyr Val Gly Gly Ala Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 29
<211> 345
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 29
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggaat cgacttcagt aggagatact acatgtgctg ggtccgccag 120
gctccaggga aggggctgga gtggatcgca tgcatatata ctggtagccg cgatactcct 180
cactacgcga gctccgcgaa aggccggttc accatctcca gagacaattc caagaacacg 240
ctgtatctgc aaatgaacag cctgagagcc gaggacacgg ccgtatatta ctgtgcgaga 300
gaaggtagcc tgtggggcca gggaaccctg gtcaccgtct cgagc 345
<210> 30
<211> 115
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 30
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Ile Asp Phe Ser Arg Arg
20 25 30
Tyr Tyr Met Cys Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp
35 40 45
Ile Ala Cys Ile Tyr Thr Gly Ser Arg Asp Thr Pro His Tyr Ala Ser
50 55 60
Ser Ala Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Ala Arg Glu Gly Ser Leu Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 31
<211> 333
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 31
gacatccaga tgacccagtc tccttccacc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgcc agtccagtca gagtgtttat agtaactggt tctcctggta tcagcagaaa 120
ccagggaaag cccctaagct cctgatctat tctgcatcca ctctggcatc tggggtccca 180
tcaaggttca gcggcagtgg atctgggaca gaattcactc tcaccatcag cagcctgcag 240
cctgatgatt ttgcaactta ttactgcgca ggcggttaca atactgttat tgatactttt 300
gctttcggcg gagggaccaa ggtggagatc aaa 333
<210> 32
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 32
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ser Ser Gln Ser Val Tyr Ser Asn
20 25 30
Trp Phe Ser Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Ser Ala Ser Thr Leu Ala Ser Gly Val Pro Ser Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln
65 70 75 80
Pro Asp Asp Phe Ala Thr Tyr Tyr Cys Ala Gly Gly Tyr Asn Thr Val
85 90 95
Ile Asp Thr Phe Ala Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 33
<211> 357
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 33
cagtcgctgg tggagtctgg gggaggcttg gtccagcctg gggggtccct gagactctcc 60
tgtactgcct ctggattctc cctcagtagg tactacatga cctgggtccg ccaggctcca 120
gggaaggggc tggagtggat cggaaccatt tatactagtg gtagtacatg gtacgcgagc 180
tggacaaaag gcagattcac catctccaaa gacaatacca agaacacggt ggatcttcaa 240
atgaacagcc tgagagccga ggacacggct gtgtattact gtgcgagatc ctattatggc 300
ggtgataaga ctggtttagg catctggggc cagggaactc tggttaccgt ctcttca 357
<210> 34
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 34
Gln Ser Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser
1 5 10 15
Leu Arg Leu Ser Cys Thr Ala Ser Gly Phe Ser Leu Ser Arg Tyr Tyr
20 25 30
Met Thr Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile Gly
35 40 45
Thr Ile Tyr Thr Ser Gly Ser Thr Trp Tyr Ala Ser Trp Thr Lys Gly
50 55 60
Arg Phe Thr Ile Ser Lys Asp Asn Thr Lys Asn Thr Val Asp Leu Gln
65 70 75 80
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg
85 90 95
Ser Tyr Tyr Gly Gly Asp Lys Thr Gly Leu Gly Ile Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 35
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 35
gacatccaga tgacccagtc tccttccacc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgcc aggccagtca gagcattgat agttggttat cctggtatca gcagaaacca 120
gggaaagccc ctaagctcct gatctatcag gcatccactc tggcatctgg ggtcccatca 180
aggttcagcg gcagtggatc tgggacagag ttcactctca ccatcagcag cctgcagcct 240
gatgattttg caacttatta ctgccaatct gcttatggtg ttagtggtac tagtagttat 300
ttatatactt tcggcggagg gaccaaggtg gagatcaaa 339
<210> 36
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 36
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Gln Ser Ile Asp Ser Trp
20 25 30
Leu Ser Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Gln Ala Ser Thr Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Ser Ala Tyr Gly Val Ser Gly
85 90 95
Thr Ser Ser Tyr Leu Tyr Thr Phe Gly Gly Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 37
<211> 366
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 37
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt caccatcagt cgctaccaca tgacttgggt ccgccaggct 120
ccagggaagg ggctggagtg gatcggacat atttatgtta ataatgatga cacagactac 180
gcgagctccg cgaaaggccg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac acggccacct atttctgtgc gagattggat 300
gttggtggtg gtggtgctta tattggggac atctggggcc agggaactct ggttaccgtc 360
tcttca 366
<210> 38
<211> 122
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 38
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Ile Ser Arg Tyr
20 25 30
His Met Thr Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly His Ile Tyr Val Asn Asn Asp Asp Thr Asp Tyr Ala Ser Ser Ala
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Thr Tyr Phe Cys
85 90 95
Ala Arg Leu Asp Val Gly Gly Gly Gly Ala Tyr Ile Gly Asp Ile Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 39
<211> 339
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 39
gacatccaga tgacccagtc tccatcctcc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgcc agtccagtca gagtgtttat aacaacaacg acttagcctg gtatcagcag 120
aaaccaggga aagttcctaa gctcctgatc tattatgctt ccactctggc atctggggtc 180
ccatctcggt tcagtggcag tggatctggg acagatttca ctctcaccat cagcagcctg 240
cagcctgaag atgttgcaac ttattactgt gcaggcggtt atgatacgga tggtcttgat 300
acgtttgctt tcggcggagg gaccaaggtg gagatcaaa 339
<210> 40
<211> 113
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 40
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ser Ser Gln Ser Val Tyr Asn Asn
20 25 30
Asn Asp Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Val Pro Lys Leu
35 40 45
Leu Ile Tyr Tyr Ala Ser Thr Leu Ala Ser Gly Val Pro Ser Arg Phe
50 55 60
Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu
65 70 75 80
Gln Pro Glu Asp Val Ala Thr Tyr Tyr Cys Ala Gly Gly Tyr Asp Thr
85 90 95
Asp Gly Leu Asp Thr Phe Ala Phe Gly Gly Gly Thr Lys Val Glu Ile
100 105 110
Lys
<210> 41
<211> 345
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 41
gaggtgcagc tggtggagtc tgggggaggc ttggtccagc ctggggggtc cctgagactc 60
tcctgtactg cctctggatt ctccctcagt agctatgcaa tgagctgggt ccgccaggct 120
ccagggaggg ggctggagtg gatcggaatc atttatgcta gtggtagcac atactacgcg 180
agctcggcga aaggcagatt caccatctcc aaagacaata ccaagaacac ggtggatctt 240
caaatgaaca gcctgagagc cgaggacacg gctgtgtatt actgtgcgag aatttatgac 300
ggcatggacc tctggggcca gggaactctg gttaccgtct cttca 345
<210> 42
<211> 115
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 42
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Thr Ala Ser Gly Phe Ser Leu Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Arg Gly Leu Glu Trp Ile
35 40 45
Gly Ile Ile Tyr Ala Ser Gly Ser Thr Tyr Tyr Ala Ser Ser Ala Lys
50 55 60
Gly Arg Phe Thr Ile Ser Lys Asp Asn Thr Lys Asn Thr Val Asp Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Ile Tyr Asp Gly Met Asp Leu Trp Gly Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 43
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 43
gacatccaga tgacccagtc tccatcctcc ctgtctgcat ctgtaggaga cagagtcacc 60
atcaattgcc aggccagtca gaacatttac agctacttat cctggtatca gcagaaacca 120
gggaaagttc ctaagcgcct gatctatctg gcatctactc tggcatctgg ggtcccatct 180
cggttcagtg gcagtggatc tgggacagat tacactctca ccatcagcag cctgcagcct 240
gaagatgttg caacttatta ctgtcaaagc aattataacg gtaattatgg tttcggcgga 300
gggaccaagg tggagatcaa a 321
<210> 44
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 44
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Asn Cys Gln Ala Ser Gln Asn Ile Tyr Ser Tyr
20 25 30
Leu Ser Trp Tyr Gln Gln Lys Pro Gly Lys Val Pro Lys Arg Leu Ile
35 40 45
Tyr Leu Ala Ser Thr Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Val Ala Thr Tyr Tyr Cys Gln Ser Asn Tyr Asn Gly Asn Tyr
85 90 95
Gly Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 45
<211> 360
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 45
gaggtgcagc tggtggagtc tgggggaggc ttggtccagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt ctccctcaat aactactgga tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg gatcggaacc attagtagtg gtgcgtatac atggttcgcc 180
acctgggcga caggcagatt caccatctcc agagacaatt ccaagaacac gctgtatctt 240
caaatgaaca gcctgagagc cgaggacacg gctgtgtatt actgtgcgag atattcttct 300
actactgatt ggacctactt taacatctgg ggccagggaa ctctggttac cgtctcttca 360
<210> 46
<211> 120
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 46
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Leu Asn Asn Tyr
20 25 30
Trp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Thr Ile Ser Ser Gly Ala Tyr Thr Trp Phe Ala Thr Trp Ala Thr
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Tyr Ser Ser Thr Thr Asp Trp Thr Tyr Phe Asn Ile Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 47
<211> 324
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 47
gacatccaga tgacccagtc tccttccacc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgcc aggccagtca gagcattaat aactacttag cctggtatca gcagaaacca 120
gggaaagccc ctaagctcct gatctatagg gcatccactc tggaatctgg ggtcccatca 180
aggttcagcg gcagtggatc tgggacagaa ttcactctca ccatcagcag cctgcagcct 240
gatgattttg caacttatta ctgccaaagc tataatggtg ttggtaggac tgctttcggc 300
ggagggacca aggtggagat caaa 324
<210> 48
<211> 108
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 48
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Gln Ser Ile Asn Asn Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Arg Ala Ser Thr Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Asp Asp Phe Ala Thr Tyr Tyr Cys Gln Ser Tyr Asn Gly Val Gly Arg
85 90 95
Thr Ala Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 49
<211> 348
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 49
gatgtgcagc ttcaggagtc gggacctagc ctggtgaaac cttctcagtc tctgtccctc 60
acctgcactg tcactggcta ctcaatcacc agtgattttg cctggaactg gattcggcag 120
tttccaggaa acaagctgga gtggatgggc tacataagtt atagtggtaa cactaggtac 180
aacccatctc tcaaaagtcg aatctctatc actcgcgaca catccaagaa ccaattcttc 240
ctgcagttga actctgtgac tattgaggac acagccacat attactgtgt aacggcggga 300
cgcgggtttc cttattgggg ccaagggact ctggtcactg tctctgca 348
<210> 50
<211> 116
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 50
Asp Val Gln Leu Gln Glu Ser Gly Pro Ser Leu Val Lys Pro Ser Gln
1 5 10 15
Ser Leu Ser Leu Thr Cys Thr Val Thr Gly Tyr Ser Ile Thr Ser Asp
20 25 30
Phe Ala Trp Asn Trp Ile Arg Gln Phe Pro Gly Asn Lys Leu Glu Trp
35 40 45
Met Gly Tyr Ile Ser Tyr Ser Gly Asn Thr Arg Tyr Asn Pro Ser Leu
50 55 60
Lys Ser Arg Ile Ser Ile Thr Arg Asp Thr Ser Lys Asn Gln Phe Phe
65 70 75 80
Leu Gln Leu Asn Ser Val Thr Ile Glu Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Val Thr Ala Gly Arg Gly Phe Pro Tyr Trp Gly Gln Gly Thr Leu Val
100 105 110
Thr Val Ser Ala
115
<210> 51
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 51
gacatcctga tgacccaatc tccatcctcc atgtctgtat ctctgggaga cacagtcagc 60
atcacttgcc attcaagtca ggacattaac agtaatatag ggtggttgca gcagagacca 120
gggaaatcat ttaagggcct gatctatcat ggaaccaact tggacgatga agttccatca 180
aggttcagtg gcagtggatc tggagccgat tattctctca ccatcagcag cctggaatct 240
gaagattttg cagactatta ctgtgtacag tatgctcagt ttccgtggac gttcggtgga 300
ggcaccaagc tggaaatcaa a 321
<210> 52
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 52
Asp Ile Leu Met Thr Gln Ser Pro Ser Ser Met Ser Val Ser Leu Gly
1 5 10 15
Asp Thr Val Ser Ile Thr Cys His Ser Ser Gln Asp Ile Asn Ser Asn
20 25 30
Ile Gly Trp Leu Gln Gln Arg Pro Gly Lys Ser Phe Lys Gly Leu Ile
35 40 45
Tyr His Gly Thr Asn Leu Asp Asp Glu Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Ala Asp Tyr Ser Leu Thr Ile Ser Ser Leu Glu Ser
65 70 75 80
Glu Asp Phe Ala Asp Tyr Tyr Cys Val Gln Tyr Ala Gln Phe Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 53
<211> 363
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 53
gaggtgcagc tggtgcagtc tggagcagag gtgaagaaac caggagagtc tctgaagatc 60
tcctgtaagg gttctggata cagctttagc agttcatgga tcggctgggt gcgccaggca 120
cctgggaaag gcctggaatg gatggggatc atctatcctg atgactctga taccagatac 180
agtccatcct tccaaggcca ggtcaccatc tcagccgaca agtccatcag gactgcctac 240
ctgcagtgga gtagcctgaa ggcctcggac accgctatgt attactgtgc gagacatgtt 300
actatgattt ggggagttat tattgacttc tggggccagg gaaccctggt caccgtctcc 360
tca 363
<210> 54
<211> 121
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 54
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Glu
1 5 10 15
Ser Leu Lys Ile Ser Cys Lys Gly Ser Gly Tyr Ser Phe Ser Ser Ser
20 25 30
Trp Ile Gly Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Gly Ile Ile Tyr Pro Asp Asp Ser Asp Thr Arg Tyr Ser Pro Ser Phe
50 55 60
Gln Gly Gln Val Thr Ile Ser Ala Asp Lys Ser Ile Arg Thr Ala Tyr
65 70 75 80
Leu Gln Trp Ser Ser Leu Lys Ala Ser Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg His Val Thr Met Ile Trp Gly Val Ile Ile Asp Phe Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 55
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 55
gccatccagt tgacccagtc tccatcctcc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgcc gggcaagtca gggcattagc agtgctttag cctggtatca gcagaaacca 120
gggaaagctc ctaagctcct gatctatgat gcctccagtt tggaaagtgg ggtcccatca 180
aggttcagcg gcagtggatc tgggacagat ttcactctca ccatcagcag cctgcagcct 240
gaagattttg caacttatta ctgtcaacag tttaatagtt acccattcac tttcggccct 300
gggaccaaag tggatatcaa a 321
<210> 56
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 56
Ala Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Ser Ala
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Phe Asn Ser Tyr Pro Phe
85 90 95
Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys
100 105
<210> 57
<211> 354
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 57
gaggtgaagc tggatgagac tggaggaggc ttggtgcaac ctgggaggcc catgaaactc 60
tcctgtgttg cctctggatt cacttttagt gactactgga tgaactgggt ccgccagtct 120
ccagagaaag gactggagtg ggtagcacaa attagaaaca aaccttataa ttatgaaaca 180
tattattcag attctgtgaa aggcagattc accatctcaa gagatgattc caaaagtagt 240
gtctacctgc aaatgaacaa cttaagagtt gaagacatgg gtatctatta ctgtacgggt 300
tcttactatg gtatggacta ctggggtcaa ggaacctcag tcaccgtctc ctca 354
<210> 58
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 58
Glu Val Lys Leu Asp Glu Thr Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Pro Met Lys Leu Ser Cys Val Ala Ser Gly Phe Thr Phe Ser Asp Tyr
20 25 30
Trp Met Asn Trp Val Arg Gln Ser Pro Glu Lys Gly Leu Glu Trp Val
35 40 45
Ala Gln Ile Arg Asn Lys Pro Tyr Asn Tyr Glu Thr Tyr Tyr Ser Asp
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ser
65 70 75 80
Val Tyr Leu Gln Met Asn Asn Leu Arg Val Glu Asp Met Gly Ile Tyr
85 90 95
Tyr Cys Thr Gly Ser Tyr Tyr Gly Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Ser Val Thr Val Ser Ser
115
<210> 59
<211> 336
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 59
gatgtcgtga tgacccaaac tccactctcc ctgcctgtca gtcttggaga tcaagcctcc 60
atctcttgca gatctagtca gagccttgta cacagtaatg gaaacaccta tttacgttgg 120
tacctgcaga agccaggcca gtctccaaag gtcctgatct acaaagtttc caaccgattt 180
tctggggtcc cagacaggtt cagtggcagt ggatcaggga cagatttcac actcaagatc 240
agcagagtgg aggctgagga tctgggagtt tatttctgct ctcaaagtac acatgttccg 300
tggacgttcg gtggaggcac caagctggaa atcaaa 336
<210> 60
<211> 112
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 60
Asp Val Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly
1 5 10 15
Asp Gln Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Arg Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Val Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Phe Cys Ser Gln Ser
85 90 95
Thr His Val Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 61
<211> 987
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 61
gctagcacca agggcccatc ggtcttcccc ctggcaccct cctccaagag cacctctggg 60
ggcacagcgg ccctgggctg cctggtcaag gactacttcc ccgaaccggt gacggtgtcg 120
tggaactcag gcgccctgac cagcggcgtg cacaccttcc cggctgtcct acagtcctca 180
ggactctact ccctcagcag cgtggtgacc gtgccctcca gcagcttggg cacccagacc 240
tacatctgca acgtgaatca caagcccagc aacaccaagg tggacaagag agttgagccc 300
aaatcttgtg acaaaactca cacatgccca ccgtgcccag cacctgaagc cgcgggggca 360
ccgtcagtct tcctcttccc cccaaaaccc aaggacaccc tcatgatctc ccggacccct 420
gaggtcacat gcgtggtggt ggacgtgagc cacgaagacc ctgaggtcaa gttcaactgg 480
tacgtggacg gcgtggaggt gcataatgcc aagacaaagc cgcgggagga gcagtacaac 540
agcacgtacc gtgtggtcag cgtcctcacc gtcctgcacc aggactggct gaatggcaag 600
gagtacaagt gcgcggtctc caacaaagcc ctcccagccc ccatcgagaa aaccatctcc 660
aaagccaaag ggcagccccg agaaccacag gtgtacaccc tgcccccatc ccgggatgag 720
ctgaccaaga accaggtcag cctgacctgc ctggtcaaag gcttctatcc cagcgacatc 780
gccgtggagt gggagagcaa tgggcagccg gagaacaact acaagaccac gcctcccgtg 840
ctggactccg acggctcctt cttcctctat agcaagctca ccgtggacaa gagcaggtgg 900
cagcagggga acgtcttctc atgctccgtg atgcatgagg ctctgcacaa ccactacacg 960
cagaagagcc tctccctgtc tccgggt 987
<210> 62
<211> 329
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 62
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Ala Ala Gly Ala Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Ala Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu
225 230 235 240
Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly
325
<210> 63
<211> 321
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 63
cgtacggtgg ctgcaccatc tgtcttcatc ttcccgccat ctgatgagca gttgaaatct 60
ggaactgcct ctgttgtgtg cctgctgaat aacttctatc ccagagaggc caaagtacag 120
tggaaggtgg ataacgccct ccaatcgggt aactcccagg agagtgtcac agagcaggac 180
agcaaggaca gcacctacag cctcagcagc accctgacgc tgagcaaagc agactacgag 240
aaacacaaag tctacgcctg cgaagtcacc catcagggcc tgagctcgcc cgtcacaaag 300
agcttcaaca ggggagagtg t 321
<210> 64
<211> 107
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 64
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
1 5 10 15
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
20 25 30
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
35 40 45
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
50 55 60
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
65 70 75 80
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
85 90 95
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 65
<211> 3681
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 65
gacatccaga tgacccagtc tccttccacc ctgtctgcat ctgtaggaga cagagtcacc 60
atcacttgcc agtccagtca gagtgtttat agtaactggt tctcctggta tcagcagaaa 120
ccagggaaag cccctaagct cctgatctat tctgcatcca ctctggcatc tggggtccca 180
tcaaggttca gcggcagtgg atctgggaca gaattcactc tcaccatcag cagcctgcag 240
cctgatgatt ttgcaactta ttactgcgca ggcggttaca atactgttat tgatactttt 300
gctttcggcg gagggaccaa ggtggagatc aaaggcggtg gcggtagtgg gggaggcggt 360
tctggcggcg gagggtccgg cggtggagga tcagaggtgc agctgttgga gtctggggga 420
ggcttggtac agcctggggg gtccctgaga ctctcctgtg cagcctctgg aatcgacttc 480
agtaggagat actacatgtg ctgggtccgc caggctccag ggaaggggct ggagtggatc 540
gcatgcatat atactggtag ccgcgatact cctcactacg cgagctccgc gaaaggccgg 600
ttcaccatct ccagagacaa ttccaagaac acgctgtatc tgcaaatgaa cagcctgaga 660
gccgaggaca cggccgtata ttactgtgcg agagaaggta gcctgtgggg ccagggaacc 720
ctggtcaccg tctcgagcgg cggtggaggg tccggcggtg gtggatccca gtcggtggag 780
gagtctgggg gaggcttggt ccagcctggg gggtccctga gactctcctg tacagcctct 840
ggaatcgacc ttaataccta cgacatgatc tgggtccgcc aggctccagg caaggggcta 900
gagtgggttg gaatcattac ttatagtggt agtagatact acgcgaactg ggcgaaaggc 960
cgattcacca tctccaaaga caataccaag aacacggtgt atctgcaaat gaacagcctg 1020
agagctgagg acacggctgt gtattactgt gccagagatt atatgagtgg ttcccacttg 1080
tggggccagg gaaccctggt caccgtctct agtgctagca ccaagggccc atcggtcttc 1140
cccctggcac cctcctccaa gagcacctct gggggcacag cggccctggg ctgcctggtc 1200
aaggactact tccccgaacc ggtgacggtg tcgtggaact caggcgccct gaccagcggc 1260
gtgcacacct tcccggctgt cctacagtcc tcaggactct actccctcag cagcgtggtg 1320
accgtgccct ccagcagctt gggcacccag acctacatct gcaacgtgaa tcacaagccc 1380
agcaacacca aggtggacaa gagagttgag cccaaatctt gtgacaaaac tcacacatgc 1440
ccaccgtgcc cagcacctga agccgcgggg gcaccgtcag tcttcctctt ccccccaaaa 1500
cccaaggaca ccctcatgat ctcccggacc cctgaggtca catgcgtggt ggtggacgtg 1560
agccacgaag accctgaggt caagttcaac tggtacgtgg acggcgtgga ggtgcataat 1620
gccaagacaa agccgcggga ggagcagtac aacagcacgt accgtgtggt cagcgtcctc 1680
accgtcctgc accaggactg gctgaatggc aaggagtaca agtgcgcggt ctccaacaaa 1740
gccctcccag cccccatcga gaaaaccatc tccaaagcca aagggcagcc ccgagaacca 1800
caggtgtata ccctgccccc atcccgggat gagctgacca agaaccaggt cagcctgacc 1860
tgcctggtca aaggcttcta tcccagcgac atcgccgtgg agtgggagag caatgggcag 1920
ccggagaaca actacaagac cacgcctccc gtgctggact ccgacggctc cttcttcctc 1980
tatagcaagc tcaccgtgga caagagcagg tggcagcagg ggaacgtctt ctcatgctcc 2040
gtgatgcatg aggctctgca caaccactac acgcagaaga gcctctccct gtctccgggt 2100
ggcggtggag ggtccggcgg tggtggatcc gaggtgcagc tgttggagtc tgggggaggc 2160
ttggtacagc ctggggggtc cctgagactc tcctgtgcag cctctggatt caccatcagt 2220
cgctaccaca tgacttgggt ccgccaggct ccagggaagg ggctggagtg gatcggacat 2280
atttatgtta ataatgatga cacagactac gcgagctccg cgaaaggccg gttcaccatc 2340
tccagagaca attccaagaa cacgctgtat ctgcaaatga acagcctgag agccgaggac 2400
acggccacct atttctgtgc gagattggat gttggtggtg gtggtgctta tattggggac 2460
atctggggcc agggaactct ggttaccgtc tcttcaggcg gtggcggtag tgggggaggc 2520
ggttctggcg gcggagggtc cggcggtgga ggatcagaca tccagatgac ccagtctcca 2580
tcctccctgt ctgcatctgt aggagacaga gtcaccatca cttgccagtc cagtcagagt 2640
gtttataaca acaacgactt agcctggtat cagcagaaac cagggaaagt tcctaagctc 2700
ctgatctatt atgcttccac tctggcatct ggggtcccat ctcggttcag tggcagtgga 2760
tctgggacag atttcactct caccatcagc agcctgcagc ctgaagatgt tgcaacttat 2820
tactgtgcag gcggttatga tacggatggt cttgatacgt ttgctttcgg cggagggacc 2880
aaggtggaga tcaaaggcgg tggagggtcc ggcggtggtg gatccgaggt gcagctggtg 2940
gagtctgggg gaggcttggt ccagcctggg gggtccctga gactctcctg tgcagcctct 3000
ggattcacca tcagtaccaa tgcaatgagc tgggtccgcc aggctccagg gaaggggctg 3060
gagtggatcg gagtcattac tggtcgtgat atcacatact acgcgagctg ggcgaaaggc 3120
agattcacca tctccagaga caattccaag aacacgctgt atcttcaaat gaacagcctg 3180
agagccgagg acacggctgt gtattactgt gcgcgcgacg gtggatcatc tgctattact 3240
agtaacaaca tttggggcca aggaactctg gtcaccgttt cttcaggcgg tggcggtagt 3300
gggggaggcg gttctggcgg cggagggtcc ggcggtggag gatcagacgt cgtgatgacc 3360
cagtctcctt ccaccctgtc tgcatctgta ggagacagag tcaccatcaa ttgccaagcc 3420
agtgagagca ttagcagttg gttagcctgg tatcagcaga aaccagggaa agcccctaag 3480
ctcctgatct atgaagcatc caaactggca tctggggtcc catcaaggtt cagcggcagt 3540
ggatctggga cagagttcac tctcaccatc agcagcctgc agcctgatga ttttgcaact 3600
tattactgcc aaggctattt ttattttatt agtcgtactt atgtaaattc tttcggcgga 3660
gggaccaagg tggagatcaa a 3681
<210> 66
<211> 1227
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 66
Asp Ile Gln Met Thr Gln Ser Pro Ser Thr Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ser Ser Gln Ser Val Tyr Ser Asn
20 25 30
Trp Phe Ser Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Ser Ala Ser Thr Leu Ala Ser Gly Val Pro Ser Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu Gln
65 70 75 80
Pro Asp Asp Phe Ala Thr Tyr Tyr Cys Ala Gly Gly Tyr Asn Thr Val
85 90 95
Ile Asp Thr Phe Ala Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Gly
100 105 110
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
115 120 125
Gly Gly Ser Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln
130 135 140
Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Ile Asp Phe
145 150 155 160
Ser Arg Arg Tyr Tyr Met Cys Trp Val Arg Gln Ala Pro Gly Lys Gly
165 170 175
Leu Glu Trp Ile Ala Cys Ile Tyr Thr Gly Ser Arg Asp Thr Pro His
180 185 190
Tyr Ala Ser Ser Ala Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser
195 200 205
Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
210 215 220
Ala Val Tyr Tyr Cys Ala Arg Glu Gly Ser Leu Trp Gly Gln Gly Thr
225 230 235 240
Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
245 250 255
Gln Ser Val Glu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser
260 265 270
Leu Arg Leu Ser Cys Thr Ala Ser Gly Ile Asp Leu Asn Thr Tyr Asp
275 280 285
Met Ile Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Gly
290 295 300
Ile Ile Thr Tyr Ser Gly Ser Arg Tyr Tyr Ala Asn Trp Ala Lys Gly
305 310 315 320
Arg Phe Thr Ile Ser Lys Asp Asn Thr Lys Asn Thr Val Tyr Leu Gln
325 330 335
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Arg
340 345 350
Asp Tyr Met Ser Gly Ser His Leu Trp Gly Gln Gly Thr Leu Val Thr
355 360 365
Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro
370 375 380
Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val
385 390 395 400
Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala
405 410 415
Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly
420 425 430
Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly
435 440 445
Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys
450 455 460
Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys
465 470 475 480
Pro Pro Cys Pro Ala Pro Glu Ala Ala Gly Ala Pro Ser Val Phe Leu
485 490 495
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
500 505 510
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
515 520 525
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
530 535 540
Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu
545 550 555 560
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Ala
565 570 575
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
580 585 590
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
595 600 605
Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys
610 615 620
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
625 630 635 640
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
645 650 655
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
660 665 670
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
675 680 685
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Gly Gly Gly Gly
690 695 700
Ser Gly Gly Gly Gly Ser Glu Val Gln Leu Leu Glu Ser Gly Gly Gly
705 710 715 720
Leu Val Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly
725 730 735
Phe Thr Ile Ser Arg Tyr His Met Thr Trp Val Arg Gln Ala Pro Gly
740 745 750
Lys Gly Leu Glu Trp Ile Gly His Ile Tyr Val Asn Asn Asp Asp Thr
755 760 765
Asp Tyr Ala Ser Ser Ala Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn
770 775 780
Ser Lys Asn Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp
785 790 795 800
Thr Ala Thr Tyr Phe Cys Ala Arg Leu Asp Val Gly Gly Gly Gly Ala
805 810 815
Tyr Ile Gly Asp Ile Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
820 825 830
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
835 840 845
Gly Gly Gly Ser Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser
850 855 860
Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Gln Ser Ser Gln Ser
865 870 875 880
Val Tyr Asn Asn Asn Asp Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys
885 890 895
Val Pro Lys Leu Leu Ile Tyr Tyr Ala Ser Thr Leu Ala Ser Gly Val
900 905 910
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
915 920 925
Ile Ser Ser Leu Gln Pro Glu Asp Val Ala Thr Tyr Tyr Cys Ala Gly
930 935 940
Gly Tyr Asp Thr Asp Gly Leu Asp Thr Phe Ala Phe Gly Gly Gly Thr
945 950 955 960
Lys Val Glu Ile Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu
965 970 975
Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly Ser
980 985 990
Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Ile Ser Thr Asn Ala
995 1000 1005
Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile
1010 1015 1020
Gly Val Ile Thr Gly Arg Asp Ile Thr Tyr Tyr Ala Ser Trp Ala
1025 1030 1035
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu
1040 1045 1050
Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
1055 1060 1065
Tyr Cys Ala Arg Asp Gly Gly Ser Ser Ala Ile Thr Ser Asn Asn
1070 1075 1080
Ile Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly
1085 1090 1095
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
1100 1105 1110
Gly Ser Asp Val Val Met Thr Gln Ser Pro Ser Thr Leu Ser Ala
1115 1120 1125
Ser Val Gly Asp Arg Val Thr Ile Asn Cys Gln Ala Ser Glu Ser
1130 1135 1140
Ile Ser Ser Trp Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala
1145 1150 1155
Pro Lys Leu Leu Ile Tyr Glu Ala Ser Lys Leu Ala Ser Gly Val
1160 1165 1170
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu
1175 1180 1185
Thr Ile Ser Ser Leu Gln Pro Asp Asp Phe Ala Thr Tyr Tyr Cys
1190 1195 1200
Gln Gly Tyr Phe Tyr Phe Ile Ser Arg Thr Tyr Val Asn Ser Phe
1205 1210 1215
Gly Gly Gly Thr Lys Val Glu Ile Lys
1220 1225
<210> 67
<211> 651
<212> ДНК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 67
gcctatgata tgacccagtc tccatcttcc gtgtctgcat ctgtaggaga cagagtcacc 60
atcaagtgtc aggccagtga ggacatttat agcttcttgg cctggtatca gcagaaacca 120
gggaaagccc ctaagctcct gatccattct gcatcctctc tggcatctgg ggtcccatca 180
aggttcagcg gcagtggatc tgggacagat ttcactctca ccatcagcag cctgcagcct 240
gaagattttg caacttacta ttgtcaacag ggttatggta aaaataatgt tgataatgct 300
ttcggcggag ggaccaaggt ggagatcaaa cgtacggtgg ctgcaccatc tgtcttcatc 360
ttcccgccat ctgatgagca gttgaaatct ggaactgcct ctgttgtgtg cctgctgaat 420
aacttctatc ccagagaggc caaagtacag tggaaggtgg ataacgccct ccaatcgggt 480
aactcccagg agagtgtcac agagcaggac agcaaggaca gcacctacag cctcagcagc 540
accctgacgc tgagcaaagc agactacgag aaacacaaag tctacgcctg cgaagtcacc 600
catcagggcc tgagctcgcc cgtcacaaag agcttcaaca ggggagagtg t 651
<210> 68
<211> 217
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> синтезированная
<400> 68
Ala Tyr Asp Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Lys Cys Gln Ala Ser Glu Asp Ile Tyr Ser Phe
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
His Ser Ala Ser Ser Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Tyr Gly Lys Asn Asn
85 90 95
Val Asp Asn Ala Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg Thr
100 105 110
Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu
115 120 125
Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro
130 135 140
Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly
145 150 155 160
Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr
165 170 175
Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His
180 185 190
Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val
195 200 205
Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| БЕЛКИ УПРАВЛЕНИЯ, НАВИГАЦИИ И КОНТРОЛЯ И СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2019 |
|
RU2811457C2 |
| МУЛЬТИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА И СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2018 |
|
RU2811477C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ НАПРАВЛЯЮЩИХ И НАВИГАЦИОННЫХ КОНТРОЛЬНЫХ БЕЛКОВ | 2019 |
|
RU2824896C2 |
| АНТИ-ROR1/АНТИ-CD3 БИСПЕЦИФИЧЕСКИЕ СВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ | 2020 |
|
RU2831608C2 |
| КОМПОЗИЦИИ АНТИТЕЛ К ROR1 И СООТВЕТСТВУЮЩИЕ СПОСОБЫ | 2017 |
|
RU2766190C2 |
| ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ ДЛЯ ЛЕЧЕНИЯ РАКА | 2017 |
|
RU2826270C2 |
| ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР | 2019 |
|
RU2810092C2 |
| CD20 ТЕРАПИЯ, CD22 ТЕРАПИЯ И КОМБИНИРОВАННАЯ ТЕРАПИЯ КЛЕТКАМИ, ЭКСПРЕССИРУЮЩИМИ ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР (CAR) K CD19 | 2016 |
|
RU2752918C2 |
| БИСПЕЦИФИЧЕСКИЕ СВЯЗЫВАЮЩИЕ БЕЛКИ И ПУТИ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2766199C2 |
| ТЕРАПЕВТИЧЕСКИЕ СОЕДИНЕНИЯ И СПОСОБЫ | 2016 |
|
RU2770001C2 |





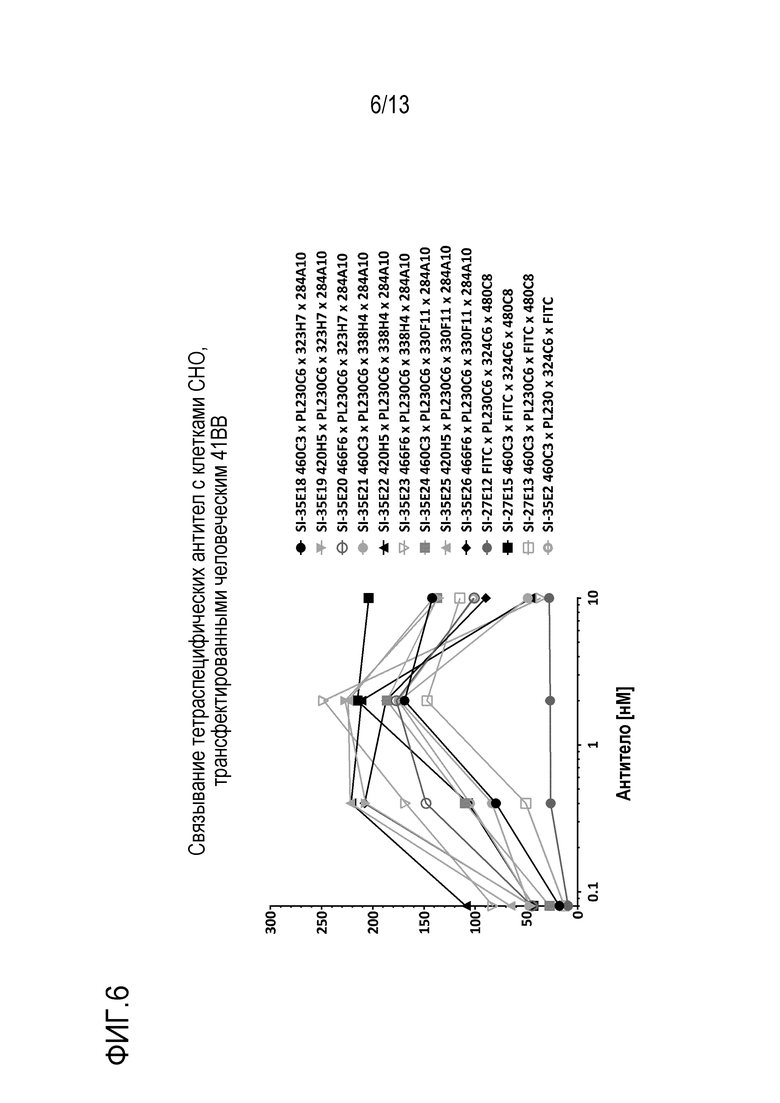

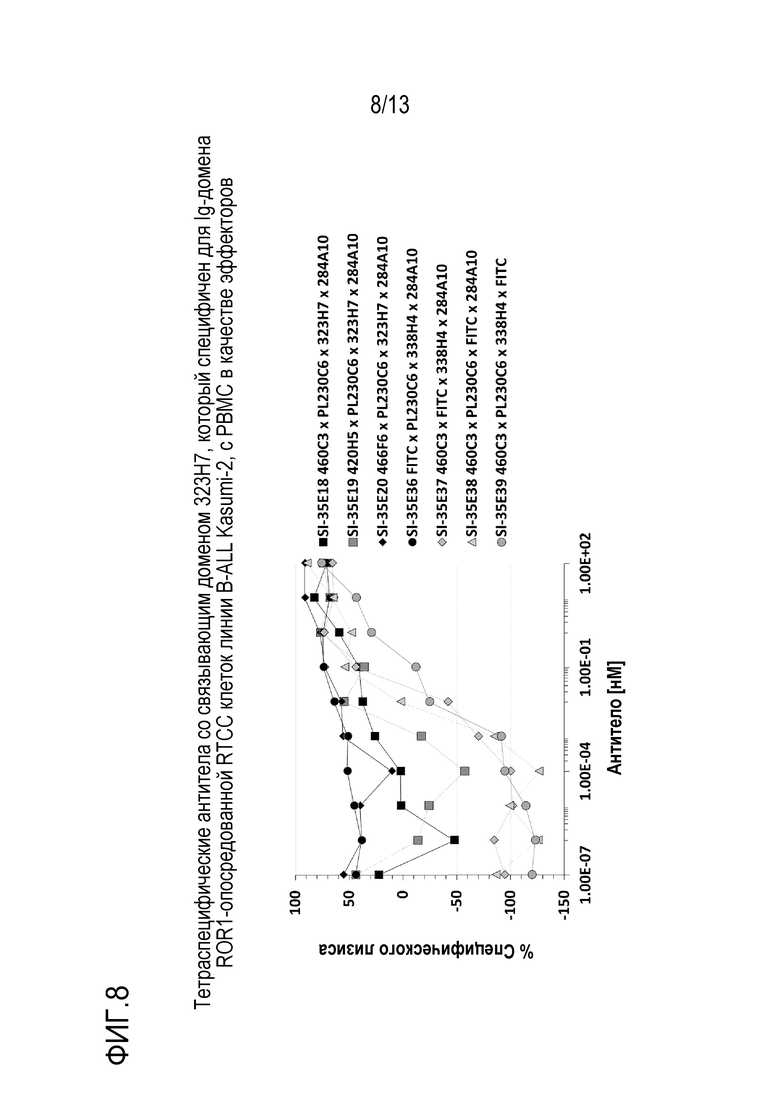
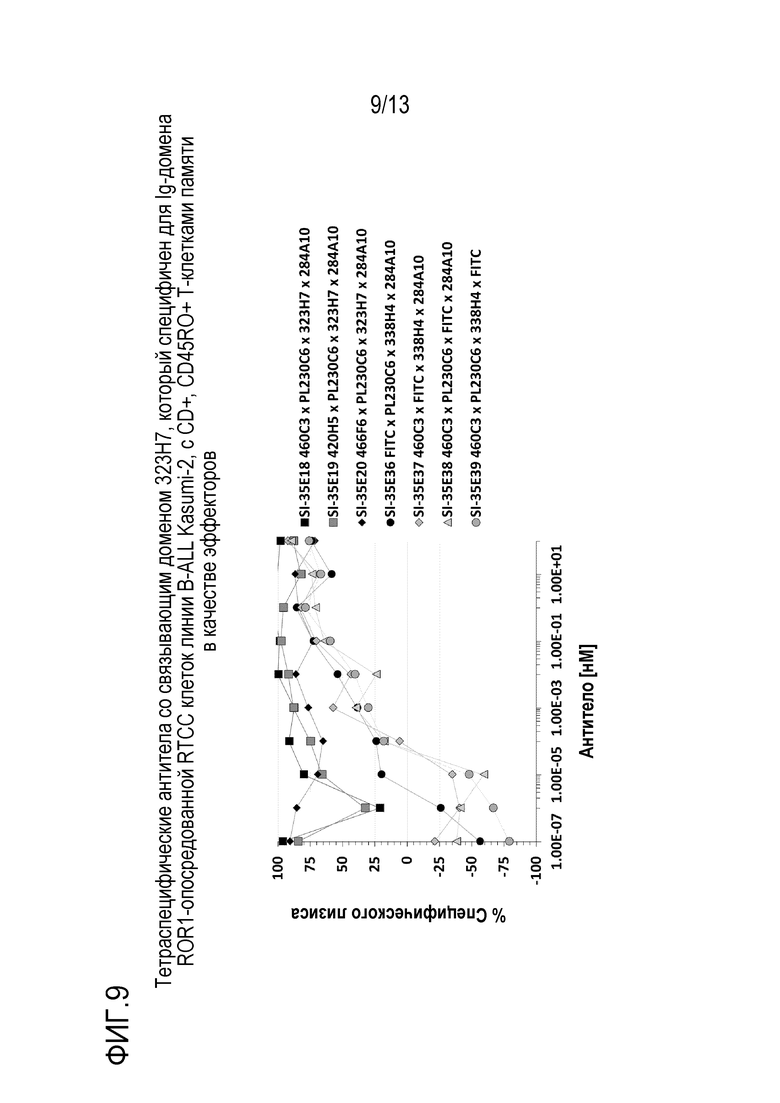
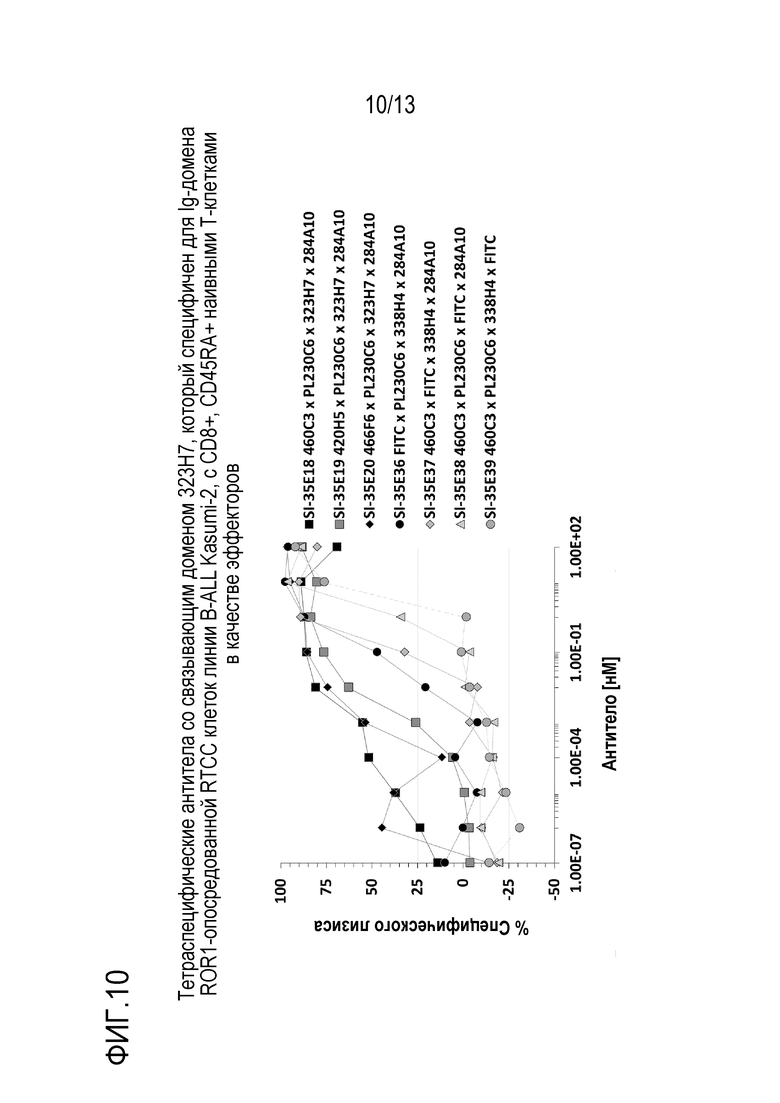
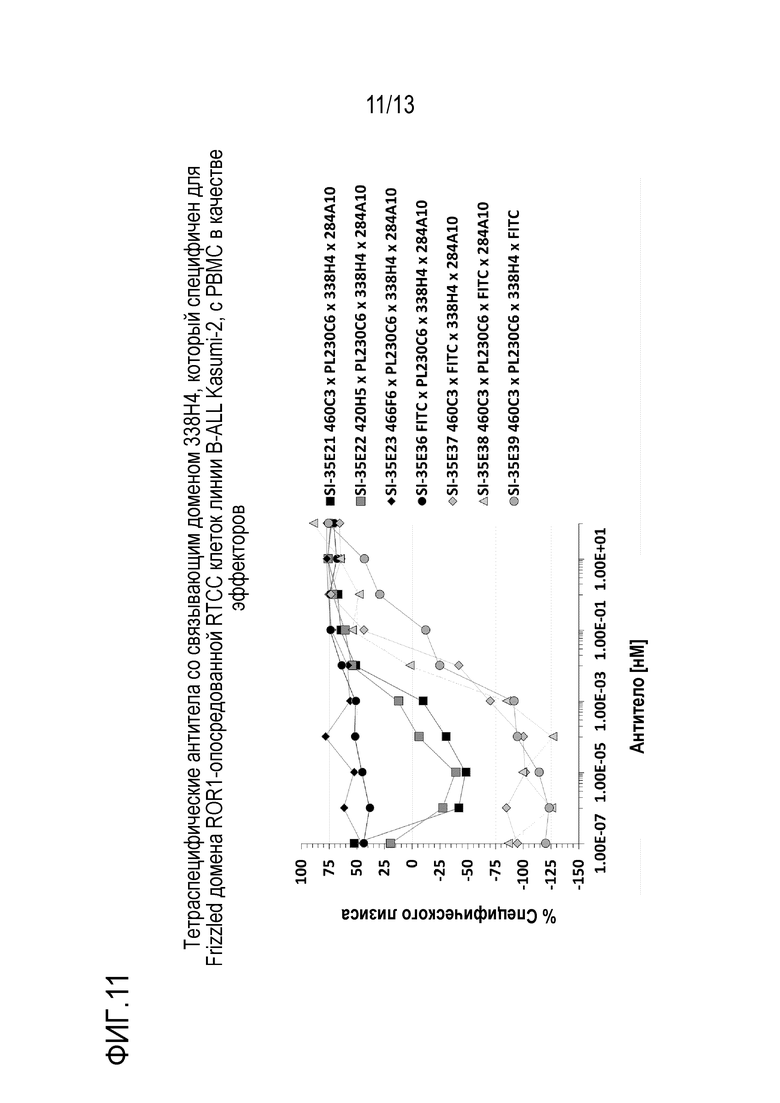

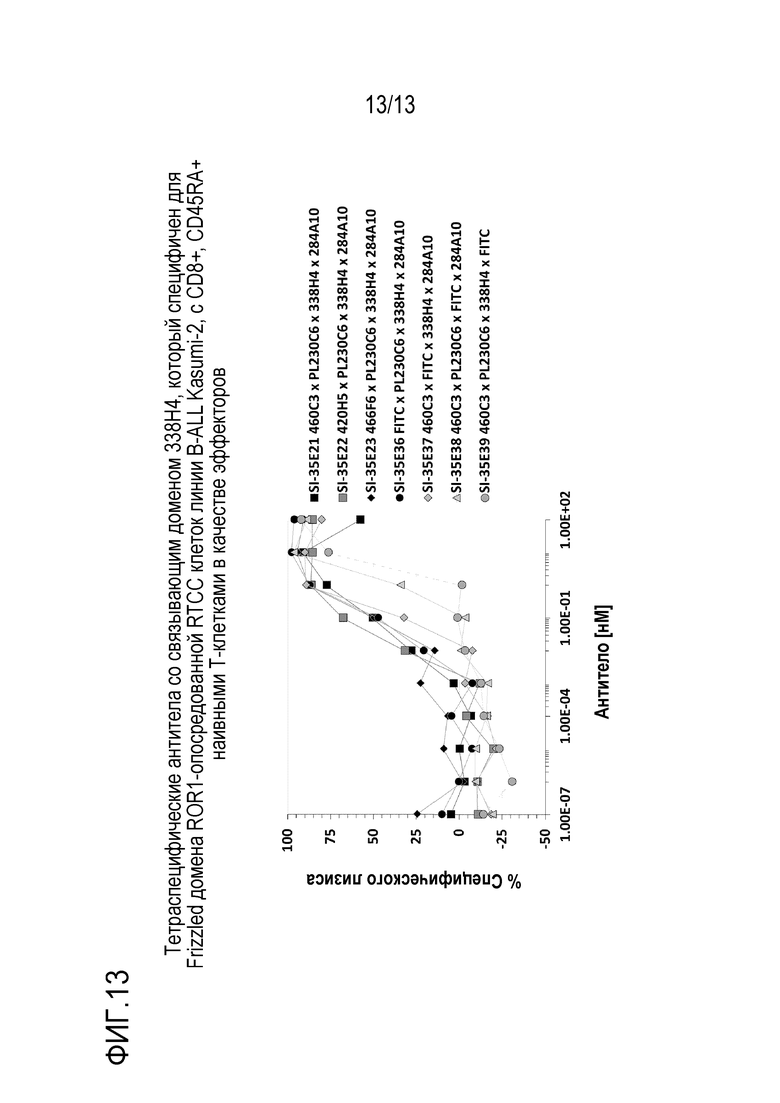
Изобретение относится к области биотехнологии. Описана группа изобретений, включающая тетраспецифический мономер антитела, имеющий специфичность связывания с CD3, EGFR vIII, PD-L1 и 4-1BB, тетраспецифическое антитело, имеющее специфичность связывания с CD3, EGFR vIII, PD-L1 и 4-1BB, фармацевтическая композиция для лечения рака, имеющего клетку, экспрессирующую EGFR vIII и способ лечения рака, имеющего клетку, экспрессирующую EGFR vIII, у человека. Изобретение расширяет арсенал средств, тетраспецифически связывающихся с CD3, EGFR vIII, PD-L1 и 4-1BB. 4 н. и 5 з.п. ф-лы, 13 ил., 8 табл., 14 пр.
1. Тетраспецифический мономер антитела, имеющий специфичность связывания с CD3, EGFRvIII, PD-L1 и 4-1BB, где мономер имеет N-конец и С-конец, включающий последовательно расположенные от N-конца к С-концу:
первый домен scFv на N-конце,
домен Fab,
домен Fc,
второй домен scFv, и
третий scFv на С-конце,
где первый домен scFv имеет специфичность связывания с CD3, домен Fab имеет специфичность связывания с EGFRvIII, второй домен scFv имеет специфичность связывания с PD-L1, и третий домен scFv имеет специфичность связывания с 4-1BB.
2. Тетраспецифический мономер антитела по п. 1, где указанный тетраспецифический мономер антитела содержит:
a) 3 CDR SEQ ID NO: 2 и 3 CDR SEQ ID NO: 4;
b) 3 CDR SEQ ID NO: 14 и 3 CDR SEQ ID NO: 16;
c) 3 CDR SEQ ID NO: 22 и 3 CDR SEQ ID NO: 24; и
d) 3 CDR SEQ ID NO: 50 и 3 CDR SEQ ID NO: 52.
3. Тетраспецифический мономер антитела по п. 1 или 2:
i) где первый домен scFv обладает специфичностью связывания с CD3, где домен Fab обладает специфичностью связывания с EGFRvIII, и где второй домен scFv обладает специфичностью связывания с PD-L1 и где третий домен scFv обладает специфичностью связывания с 4-1BB; или
ii) где первый домен scFv, второй домен scFv или третий домен scFv содержит линкер gly-gly-gly-ser(G4S)n, где n равно 2, 3 или 4; или
iii) содержит аминокислотную последовательность, имеющую по меньшей мере 98% идентичность последовательности с SEQ ID NO: 02, 04, 14, 16, 22, 24, 50 или 52.
4. Тетраспецифический мономер антитела по любому из пп. 1-3, где:
i) первый, второй или третий домен scFv содержащий аминокислотную последовательность, имеющую по меньшей мере 98% идентичность последовательности с SEQ ID NO: 02, 04, 14, 16, 22 или 24; или
ii) домен Fab содержит аминокислотную последовательность, имеющую по меньшей мере 98% идентичность последовательности с SEQ ID NO: 50 или 52.
5. Тетраспецифическое антитело, имеющее специфичность связывания с CD3, EGFR vIII, PD-L1 и 4-1BB, содержащее два тетраспецифических мономера антитела по любому из пп. 1-4.
6. Фармацевтическая композиция для лечения рака, имеющего клетку, экспрессирующую EGFRvIII, содержащая фармацевтически приемлемый носитель и тетраспецифическое антитело по п. 5 в терапевтически эффективном количестве.
7. Фармацевтическая композиция по п. 6, дополнительно включающая терапевтический агент, выбранный из радиоизотопа, радионуклида, токсина, химиотерапевтического агента или их комбинации.
8. Способ лечения рака, имеющего клетку, экспрессирующую EGFRvIII, у человека, включающий введение субъекту эффективного количества тетраспецифического антитела по п. 5 или фармацевтической композиции по п. 6.
9. Способ по п. 8, дополнительно включающий совместное введение эффективного количества терапевтического агента, где терапевтический агент включает антитело, химиотерапевтический агент, фермент, антиэстрогенный агент, ингибитор рецепторной тирозинкиназы, ингибитор киназ, ингибитор клеточного цикла, ингибитор иммунных контрольных точек, ингибитор синтеза ДНК, РНК или белка, ингибитор RAS, ингибитор PD1, PD-L1, CTLA4, 4-1BB, OX40, GITR, ICOS, LIGHT, TIM3, LAG3, TIGIT, CD40, CD27, HVEM, BTLA, VISTA, B7H4, CSF1R, NKG2D, CD73 или их комбинацию.
| ТРИ- ИЛИ ТЕТРАСПЕЦИФИЧЕСКИЕ АНТИТЕЛА | 2010 |
|
RU2570633C2 |
| WO 2015013671 A1, 29.01.2015 | |||
| WO 2017049004 A1, 23.03.2017 | |||
| WO 2010136172 A1, 02.12.2010. | |||
Авторы
Даты
2025-04-04—Публикация
2018-06-22—Подача