ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
[0001] Настоящая заявка испрашивает приоритет по предварительной заявке на патент США № 62/549732, поданной 24 августа 2017 года, и заявке на европейский патент № 17306720.8, поданной 7 декабря 2017 года. Раскрытие этих двух приоритетных заявок включено в данный документ посредством ссылки во всей своей полноте.
Перечень последовательностей
[0002] Настоящая заявка содержит перечень последовательностей, который был подан в электронном виде в формате с кодировкой ASCII и настоящим включен посредством ссылки во всей своей полноте. Копия указанного файла в формате ASCII, созданная 10 августа 2018 года, имеет название 022548_WO047_SL.txt, и ее размер составляет 21687 байтов.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0003] Настоящая заявка относится к применению кислой сфингомиелиназы человека для лечения патологических состояний кости у пациентов с дефицитом кислой сфингомиелиназы (ASMD).
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
[0004] Дефицит кислой сфингомиелиназы (ASMD) представляет собой редкую опасную для жизни лизосомную болезнь накопления. Она представляет собой аутосомно-рецессивное генетическое заболевание, которое возникает в результате мутаций в гене SMPD1, кодирующем лизосомный фермент кислую сфингомиелиназу (ASM) (Schuchman et al., Mol. Genet. Metab. 120(1-2):27-33 (2017)). У пациентов с ASMD не метаболизируется сфингомиелин, который в результате накапливается в лизосомах во многих органах, в тяжелых случаях вызывая заболевание и нейродегенерацию внутренних органов. У пациентов с ASMD наблюдается повышенный уровень холестерина и других липидов в селезенке, печени, легких и костном мозге.
[0005] Детский нейровисцеральный ASMD (ранее известный как болезнь Ниманна-Пика типа A или NPD A), наиболее тяжелый фенотип заболевания, характеризуется как острая нейропатическая форма с ранним началом и приводит к снижению прибавки массы тела и отставанию в росте, гепатоспленомегалии и быстро прогрессирующей нейродегенерации. Пациенты погибают в раннем детстве (McGovern et al., Neurology 66(2):228-232 (2006)). У пациентов с хроническим висцеральным ASMD (NPD B) и хроническим нейровисцеральным ASMD (NPD A/B) проявление заболевания варьируется от младенчества до зрелого возраста (Wasserstein et al., Pediatrics 114(6):e672-677 (2004); Wasserstein et al., J. Pediatr. 149(4):554-559 (2006)). Диагноз NPD B пациентам обычно ставят в детстве, как правило, после возраста 2 года. Большинство пациентов с NPD B доживают до зрелого возраста. Пациентов с NPD A/B классифицируют как имеющих промежуточную форму с проявлением детских неврологических симптомов, которые могут развиваться в виде нейродегенеративного заболевания.
[0006] Патологические проявления, обусловленные заболеваниями печени, легких и гематологическими заболеваниями, встречаются у всех пациентов с хроническим ASMD и включают гепатоспленомегалию, дисфункцию печени, инфильтративное заболевание легких и тромбоцитопению (McGovern et al., Genet. Med. 15(8):618-623 (2013); McGovern et al., Orphanet J. Rare Dis. 12(1):41 (2017)). Задержка роста в детском возрасте и поражение костей, такие как низкая плотность костей, также являются общими признаками хронического ASMD (Wasserstein et al., J. Pediatr. 142(4):424-428 (2003)). Заболевания легких и печени являются главными причинами смерти у таких пациентов (McGovern et al., Pediatrics 122(2):e341-349 (2008); Cassiman et al., Mol. Genet. Metab. 118(3):206-213 (2016)).
[0007] Ввиду высоких показателей заболеваемости и смертности от ASMD остается насущная потребность в эффективном лечении данного генетического заболевания.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0008] В настоящем изобретении представлен способ лечения патологического состояния кости у пациента с дефицитом кислой сфингомиелиназы (ASMD), предусматривающий стадии введения пациенту множества доз рекомбинантной кислой сфингомиелиназы человека (rhASM), измерения показателя состояния кости у пациента и сравнения показателя состояния кости у пациента с исходным показателем состояния кости у пациента перед стадией введения, где показатель состояния кости пациента улучшается или не ухудшается после множества доз rhASM. В некоторых вариантах осуществления показателем состояния кости является минеральная плотность кости (BMD), где BMD улучшается (например, увеличивается) или не ухудшается после множества доз rhASM. В некоторых вариантах осуществления показателем состояния кости является "нагрузка" костного мозга (BMB), где BMB уменьшается или не увеличивается после множества доз rhASM. В некоторых вариантах осуществления показателем состояния кости является развитие скелета (например, созревание и/или линейный рост кости), где развитие скелета улучшается после множества доз rhASM. В определенных вариантах осуществления патологическое состояние кости представляет собой остеопению или остеопороз.
[0009] В настоящем изобретении также представлен способ снижения "нагрузки" костного мозга (BMB) у пациента с дефицитом кислой сфингомиелиназы, нуждающегося в этом, предусматривающий стадии определения BMB у пациента и введения пациенту множества доз рекомбинантной кислой сфингомиелиназы человека (rhASM), за счет чего BMB у пациента уменьшается.
[0010] В настоящем изобретении также представлен способ улучшения минеральной плотности кости (BMD) у пациента с дефицитом кислой сфингомиелиназы, нуждающегося в этом, предусматривающий стадии определения BMD пациента и введения пациенту множества доз рекомбинантной кислой сфингомиелиназы человека (rhASM), за счет чего BMD пациента улучшается.
[0011] В настоящем изобретении также представлен способ снижения "нагрузки" костного мозга (BMB) у пациента с дефицитом кислой сфингомиелиназы, нуждающегося в этом, предусматривающий стадии выбора пациента с дефицитом кислой сфингомиелиназы, который не получает терапию бисфосфонатами, и введения пациенту множества доз рекомбинантной кислой сфингомиелиназы человека (rhASM), за счет чего BMB у пациента снижается.
[0012] В настоящем изобретении также представлен способ улучшения (например, увеличения) минеральной плотности кости (BMD) у пациента с дефицитом кислой сфингомиелиназы, нуждающемуся в этом, предусматривающий стадии отбора пациента с дефицитом кислой сфингомиелиназы, который не получает терапию бисфосфонатами, и введения пациенту множества доз рекомбинантной кислой сфингомиелиназы человека (rhASM), за счет чего BMD пациента улучшается.
[0013] В настоящем изобретении также представлен способ улучшения развития скелета (например, созревания и/или линейного роста кости) у пациента с дефицитом кислой сфингомиелиназы (ASMD), нуждающегося в этом, предусматривающий стадии отбора пациента с ASMD для улучшения развития скелета и введения пациенту множества доз рекомбинантной кислой сфингомиелиназы человека (rhASM), за счет чего развитие скелета у пациента улучшается.
[0014] В настоящем изобретении также представлен способ улучшения или поддержания качества жизни у пациента с дефицитом кислой сфингомиелиназы (ASMD), нуждающегося в этом, предусматривающий стадии отбора пациента с ASMD для улучшения качества жизни и введения пациенту множества доз рекомбинантной кислой сфингомиелиназы человека (rhASM), за счет чего качество жизни пациента улучшается или поддерживается.
[0015] В настоящем изобретении также представлен способ лечения остеопении у пациента с дефицитом кислой сфингомиелиназы (ASMD), нуждающегося в этом, предусматривающий стадии отбора пациента с ASMD для лечения остеопении и введения пациенту множества доз рекомбинантной кислой сфингомиелиназы человека (rhASM).
[0016] В настоящем изобретении также представлен способ лечения остеопороза у пациента с дефицитом кислой сфингомиелиназы, нуждающегося в этом, предусматривающий стадии отбора пациента с ASMD для лечения остеопороза и введения пациенту множества доз рекомбинантной кислой сфингомиелиназы человека (rhASM).
[0017] В любом из способов лечения, описанных в данном документе, множество доз можно вводить пациенту в течение периода от шести до тридцати месяцев. Таким образом, упомянутый эффект множества доз rhASM достигается в указанный период.
[0018] В любом из способов лечения, описанных в данном документе, пациент может иметь, например, хронический висцеральный ASMD (болезнь Ниманна-Пика типа B) или хронический нейровисцеральный ASMD (NPD A/B). Пациент может быть взрослым пациентом или пациентом детского возраста.
[0019] В любом из способов лечения, описанных в настоящем документе, первые две или более доз rhASM могут представлять собой повышающиеся дозы, и их можно вводить в последовательно увеличивающемся количестве. В некоторых вариантах осуществления дозы, вводимые после повышающихся доз, представляют собой поддерживающие дозы (которые могут начинаться, например, с самой высокой поддерживающей дозы), и их можно вводить в том же или меньшем количестве, чем последняя повышающаяся доза. В определенных вариантах осуществления самая высокая поддерживающая доза является самой высокой дозой, переносимой пациентом. Первая доза может составлять, например, 0,1 мг/кг как для взрослых пациентов, так и для пациентов детского возраста. Самая высокая поддерживающая доза может составлять, например, от 0,3 мг/кг до 3 мг/кг (например, от 1 мг/кг до 3 мг/кг), как, например, 1 мг/кг, 2 мг/кг или 3 мг/кг. Поддерживающие дозы могут составлять, например, от 0,1 мг/кг до 3 мг/кг или от 0,3 мг/кг до 3 мг/кг, как, например, 0,1 мг/кг, 0,2 мг/кг, 0,3 мг/кг, 0,4 мг/кг, 0,5 мг/кг, 0,6 мг/кг, 0,7 мг/кг, 0,8 мг/кг, 0,9 мг/кг, 1 мг/кг, 1,5 мг/кг, 2 мг/кг, 2,5 мг/кг или 3 мг/кг. В конкретных вариантах осуществления повышающиеся дозы можно вводить в следующем порядке: 0,1 мг/кг, 0,3 мг/кг, 0,3 мг/кг, 0,6 мг/кг, 0,6 мг/кг, 1,0 мг/кг, 2,0 мг/кг и 3,0 мг/кг.
[0020] В некоторых вариантах осуществления множество доз в любом из способов лечения, описанных в данном документе, вводят с интервалом через 2 недели. Введение множества доз можно осуществлять, например, посредством внутривенной инъекции.
[0021] В любом из способов лечения, описанных в данном документе, rhASM может представлять собой олипудазу-альфа (SEQ ID NO:2).
[0022] В настоящем изобретении также представлено применение рекомбинантной ASM человека (например, олипудазы-альфа) для изготовления лекарственного препарата для применения в любом из способов лечения, описанных в данном документе, а также представлена рекомбинантная ASM человека (например, олипудаза-альфа) для применения в любом из способов лечения, описанных в данном документе.
[0023] В настоящем изобретении также представлены готовые изделия (например, наборы), содержащие рекомбинантную ASM человека (например, олипудазу-альфа) для применения в любом из способов лечения, описанных в данном документе.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
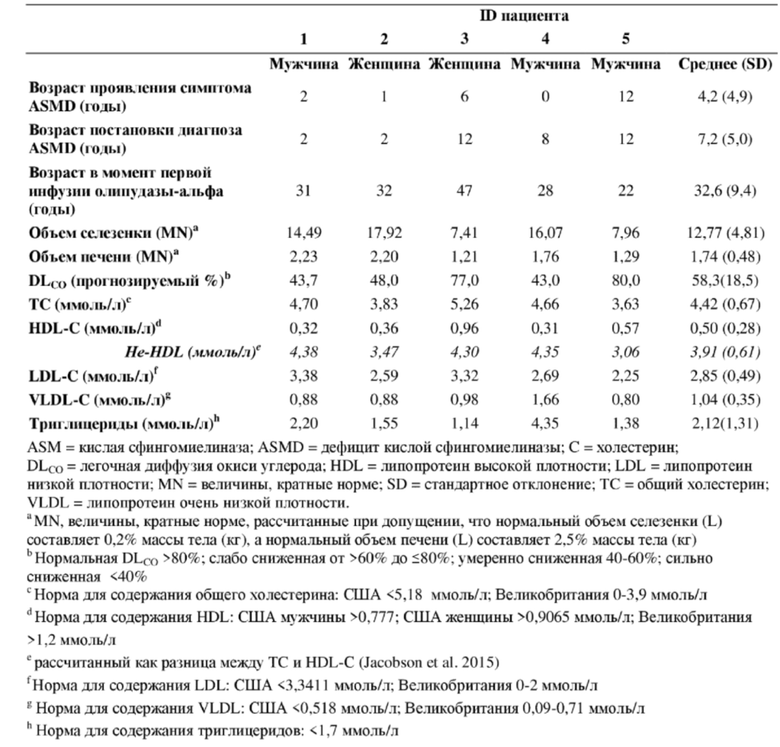
[0024] На ФИГ. 1А-С представлены графики, суммирующие изменения в активности церамида (А), лизосфингомиелина (В) и хитотриозидазы (С) на протяжении 30 месяцев лечения с помощью олипудазы-альфа. Норма для содержания церамида в плазме крови составлял 1,8-6,5 мг/л. Верхний предел нормы для содержания лизосфингомиелина в сухих каплях крови составлял <69 мкг/л, а нормальные уровни хитотриозидазы в сыворотке крови составляли ≤181 нмоль/час/мл (примечание: активность не корректировали для двух пациентов, гетерозиготных по нулевой мутации хитотриозидазы).
[0025] На ФИГ. 2А и 2В представлены графики, суммирующие эффект олипудазы-альфа на объем печени и селезенки (А) и заболевание легкого (В). На ФИГ. 2A: объемы печени и селезенки рассчитывали путем интегрирования поперечных магнитно-резонансных изображений и выражали как величины, кратные норме (MN), где нормальный объем селезенки (L) принимали равным 0,2% от массы тела, а нормальный объем печени (L) принимали равным 2,5% от массы тела. На ФИГ. 2B: заболевание легкого. Прогнозируемый процент DLco у отдельных пациентов, скорректированный по гемоглобину (Hb), на исходном уровне и на протяжении лечения рассчитывали с применением наблюдаемых значений для пациентов мужского и женского пола (Crapo et al., Am. Rev. Respir. Dis. 123(2):185-189 (1981); Macintyre et al., Eur. Respir. J. 26(4):720-735 (2005)). Степень тяжести: 80% = нижний предел нормы; >60%-79% = легкое снижение; 40%-60% = умеренное снижение; <40% = серьезное снижение. HRCT-оценка инфильтративного заболевания легких на исходном уровне и на протяжении лечения с помощью олипудазы-альфа включала оценку появление затемнений по типу матового стекла (GGA), интерстициальный процесс в легких (ILD) и ретикулонодулярное уплотнение (RD), оцениваемые по 4-балльной системе, где 0=отсутствие интерстициального процесса в легких; 1=легкая степень (поражает 1-25% объема легких); 2=умеренная степень (поражает 26-50% объема легких); 3=тяжелая степень (поражает 51-100% объема легких).
[0026] На ФИГ. 3А и 3В представлены фотографии, изображающие эффект олипудазы-альфа на "нагрузку" костного мозга. ФИГ. 3A (бедренная кость): изменения "нагрузки" костного мозга на фронтальной проекции бедренной кости пациента 2 (женщина, 32 года на исходном уровне). Гипоинтенсивность костного мозга в проксимальных эпифизах в момент скрининга на T1-взвешенном (A) и T2-взвешенном (B) изображениях сравнивается с уменьшенным количеством и слегка гипоинтенсивным костным мозгом диафизов после 30 месяцев лечения (T1-взвешенное, C и T2-взвешенное, D). Полная вертикальная масштабная линейка, 20 см. ФИГ. 3B (позвоночник): "нагрузка" костного мозга на сагиттальной проекции поясничного отдела позвоночника пациента 2. В момент скрининга наблюдается диффузная инфильтрация костного мозга с T1-взвешенной изоинтенсивностью непораженных межпозвонковых дисков (A) и T2-взвешенной интенсивностью сигнала предкрестцового жира (B) на уровне гиперинтенсивности. После 30 месяцев лечения инфильтрация костного мозга остается неизмененной (T1-взвешенное, C), в то время как показатель предкрестцового жира улучшился до слегка гиперинтенсивного (T2-взвешенное, D). Полная вертикальная масштабная линейка, 20 см.
[0027] На ФИГ. 4А-D представлены графики, изображающие параметры липидного обмена натощак на исходном уровне и на протяжении лечения (30 месяцев) с помощью олипудазы-альфа. Показаны средние (SD) уровни общего холестерина (A), триглицеридов (B), HDL-холестерина (C) и LDL-холестерина (D) натощак перед проведением инфузии. Норма для содержания общего холестерина: США <5,18 ммоль/л; Великобритания 0-3,9 ммоль/л. Норма для содержания HDL-C: США мужчины >0,777; США женщины >0,9065 ммоль/л; Великобритания >1,2 ммоль/л. Норма для содержания LDL-C: США <3,3411 ммоль/л; Великобритания 0-2 ммоль/л. Норма для содержания триглицеридов: <1,7 ммоль/л.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0028] Настоящее изобретение основано на открытии того, что ферментозаместительная терапия (ERT) с применением ASM облегчает патологические состояния кости у пациентов с ASMD, включая увеличение плотности их кости и уменьшение их "нагрузки" костного мозга. Такое улучшение можно наблюдать уже через 6-30 месяцев после начала терапии. Это открытие было неожиданным, поскольку было неясно, сможет ли ERT с применением АSМ купировать все симптомы ASMD, включая низкую плотность кости, и если сможет, то сколько времени займет терапия до достижения купирования симптомов. В случае других нарушений с накоплением липидов ERT сама по себе очень медленно улучшает минеральную плотность кости. Например, в случае болезни Гоше, другого генетического нарушения с накоплением липидов, ответ пациентов на лечение с помощью ERT является более медленным в отношении минеральной плотности кости (BMD), чем в отношении гематологических и висцеральных аспектов GD. Исследования показали, что потребовалось восемь лет ERT (имиглюцераза) для восстановления BMD пациентов до нормальных уровней (Wenstrup et al., J Bone Miner Res. 22(1):119-26 (2007)). Настоящее открытие также является значимым, поскольку пациенты с ASMD не могут принимать бисфосфонаты, лекарственные препараты-стандарты лечения при низкой BMD, одновременно с ERT с применением ASM, потому что бисфосфонаты препятствуют активности ASM.
[0029] Соответственно, в настоящем изобретении представлены способы лечения патологического состояния кости у пациента с ASMD с помощью ERT с применением ASM. ASMD вызывает накопление сфингомиелина в клетках костного мозга, в частности, в клетках-предшественниках линии дифференцировки мононуклеарных макрофагов. Эти клетки становятся заполненными и задерживаются в костном мозге, что вызывает инфильтрацию костного мозга и высокую "нагрузку" костного мозга (BMB). У пациентов с ASMD также зачастую наблюдается хроническое воспаление, в том числе в костях. Заболевание кости при ASMD неблагоприятно влияет на метаболизм и структуру кости. Пациенты страдают от целого ряда симптомов, включая задержки роста, замедление роста, задержки созревания, боль и переломы кости. Действительно, как было показано, что ASMD обратно коррелирует с Z-критерием минеральной плотности кости поясничного отдела позвоночника (BMD) (Wasserstein et al. J. Inherit. Metab. Dis. 36(1):123-7 (2013)) и влияет на скелетную систему. Используемый в данном документе термин "патологическое состояние кости или заболевание кости" относится к любой проблеме с костью, ассоциированной с ASMD, и обусловленным ею проявлениям, таким как высокая "нагрузка" костного мозга, низкая минеральная плотность кости, остеопения, остеопороз, задержка развития скелета (например, задержанный возраст (созревание) кости и задержка линейного роста), возрастающая потеря трудоспособности, боль в кости, снижение подвижности, остеонекроз и повышенный риск переломов.
[0030] В некоторых вариантах осуществления патологическое состояние кости, которое подвергают лечению у пациента с ASMD с помощью способов по настоящему изобретению, представляет собой остеопению или остеопороз. В некоторых вариантах осуществления пациенты являются взрослыми (например, пациентами возрастом 18 лет или более, включая гериатрических пациентов, возраст которых составляет 65 лет или более). В других вариантах осуществления пациенты являются пациентами детского возраста (пациентами, возраст которых составляет менее 18 лет, например, возраст которых составляет от новорожденного до 6 лет, возраст которых составляет от 6 до 12 лет или возраст которых составляет от 12 до 18 лет). В некоторых вариантах осуществления пациент может иметь болезнь Ниманна-Пика типа A, болезнь Ниманна-Пика типа B или болезнь Ниманна-Пика типа A/B. В конкретных вариантах осуществления способы, описанные в данном документе, применяют для лечения взрослых пациентов с хроническим висцеральным ASMD (NPD B). В некоторых вариантах осуществления способы, описанные в данном документе, применяют для лечения пациентов детского возраста с хроническим висцеральным ASMD (NPD B). В других вариантах осуществления способы, описанные в данном документе, применяют для лечения взрослых пациентов и пациентов детского возраста с проявлениями ASMD, отличными от неврологических.
Оценка состояния кости
[0031] Состояния кости у субъекта можно оценивать путем анализа параметров кости, которые в совокупности обозначаются в данном документе как "показатели состояния кости", с применением различных способов. Показатели состояния кости могут предусматривать, например, минеральную плотность кости (BMD), "нагрузку" костного мозга (BMB), возраст кости, линейный рост и статус определенных биомаркеров кости. В определенных вариантах осуществления патологические состояния кости можно оценивать с помощью визуализации кости, такой как рентгенография и магнитно-резонансная томография (MRI). Изображения сканов кости можно получать, например, для бедренной кости и поясничного отдела позвоночника в различные моменты времени для оценки минеральной плотности кости (BMD) и "нагрузки" костного мозга (BMB) в качестве показателей состояния кости у пациентов до, на протяжении и после лечения с помощью композиции по настоящему изобретению. В определенных вариантах осуществления изображения получают с применением DXA (двухэнергетической рентгеновской абсорбциометрии) или MRI. В некоторых вариантах осуществления изображения сканов кости можно получать приблизительно через неделю, 2 недели, 3 недели, 4 недели, 5 недель, шесть недель, месяц, 2 месяца, 3 месяца, 4 месяца, 5 месяцев, 6 месяцев, 7 месяцев, 8 месяцев, 9 месяцев, 10 месяцев, 11 месяцев, год, 2 года, 3 года, 4 года или 5 лет и сравнивать с исходными изображениями, полученными до лечения по настоящему изобретению. В определенных вариантах осуществления изображения сканов кости можно получать приблизительно через 6 месяцев или через год.
[0032] Для каждого пациента можно рассчитывать BMD с применением T- и Z-критериев. Т-критерий классифицирует плотность кости пациента по сравнению с таковой у здорового человека того же пола. Z-критерий классифицирует плотность кости пациента по сравнению с таковой у здорового человеком того же возраста, пола, веса и этнической принадлежности.
[0033] BMB можно оценивать на основании серийных MRI-сканов с применением системы оценки BMB, которая основана на системе оценки интенсивности сигнала костного мозга, приводящей к категориальному показателю из возможных восьми баллов каждый для поясничного отдела позвоночника и бедренной кости - критерии для бедренной кости являются усредненными для правой и левой бедренной кости - в виде общего показателя из 16 баллов. Система оценки интенсивности сигнала костного мозга описана, например, в Hangartner et al., Skeletal Radiol. 37(3): 185-188 (2008); Robertson et al., AJM Am J Roentgenol. 188(6): 1521-1528 (2007); и Maas et al., Radiology 229(2): 554-561 (2003), все из которых включены в данный документ посредством ссылки во всей своей полноте.
[0034] В других вариантах осуществления для оценки состояния кости у субъекта будут анализировать биомаркеры кости. Используемые в данном документе "биомаркеры кости" относятся к биомаркерам, ассоциированным с образованием и резорбцией кости. Например, биомаркеры кости, такие как костно-специфическая щелочная фосфатаза (ALP) в сыворотке крови и C-телопептид, можно анализировать в образцах, взятых от пациента. Костно-специфическая ALP, маркер активного образования кости, и C-телопептид, показатель резорбции кости, можно применять в качестве показателей состояния кости. Например, при болезни Гоше, другом нарушении с накоплением липидов, концентрация С-телопептида в сыворотке крови снижается. В некоторых вариантах осуществления биомаркеры кости можно анализировать приблизительно через 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или 11 месяцев или через 1, 2, 3, 4 или 5 лет и сравнивать с исходными уровнями, полученными до лечения по настоящему изобретению. В определенных вариантах осуществления биомаркеры кости можно анализировать через 3 или 6 месяцев.
[0035] У большинства детей с ASMD наблюдается задержка роста. Z-критерии для роста и веса у пациентов детского возраста с ASMD, зачастую ниже, чем у детей, не пораженных ASMD. У пациентов детского возраста с ASMD для оценки роста костей или развития скелета можно анализировать дополнительные показатели состояния кости, такие как возраст кости (например, определяемый посредством рентгенограммы руки) и линейный рост. В иллюстративном варианте осуществления рентгенограмму руки можно выполнять для сбора изображений рук, пальцев и запястий пациента. Возраст (созревание) кости можно рассчитать на основании рентгенограммы с применением атласа Greulich & Pyle (1959). Линейный рост, измеряемый по Z-критерию высоты, является еще одним показателем состояния кости для оценки роста у пациентов детского возраста.
Лечение патологических состояний кости с помощью ASM
[0036] Пациентов с патологическими состояниями кости, таких как пациенты с ASMD, можно лечить с помощью ERT с применением ASM. Используемые в данном документе "лечить", "осуществление лечения" и "лечение" относятся к способу облегчения, подавления или предотвращения или отсрочки проявления или ухудшения (т. е. прогрессирования) биологического нарушения или состояния и/или по меньшей мере одного из сопутствующих им симптомов. Используемый в данном документе термин "облегчить" заболевание, нарушение или состояние означает уменьшить тяжесть и/или частоту появления симптомов заболевания, нарушения или состояния.
[0037] В некоторых вариантах осуществления ASM, применяемая при ERT с применением ASM, может представлять собой ASM человека, например, рекомбинантную ASM человека (rhASM). Рекомбинантную ASM можно получать с применением рекомбинантной технологии в прокариотических или эукариотических клетках-хозяевах, таких как клетки-хозяева, являющиеся клетками млекопитающих (например, клетками яичника китайского хомячка (СНО)). В определенных вариантах осуществления rhASM представляет собой олипудазу-альфа, альфа-гликоформу ASM человека (EC-3.1.4.12), получаемую в клетках CHO. Зрелая олипудаза-альфа представляет собой полипептид из 570 аминокислот, который сохраняет ферментативную активность и активность нацеливания в лизосомы нативного белка человека. Аминокислотная последовательность олипудазы-альфа, включая ее лидерную последовательность (остатки 1-57), показана ниже, где лидерная последовательность выделена курсивом и жирным шрифтом. Последовательность зрелой олипудазы-альфа (SEQ ID NO:2, которая охватывает остатки 58-627 следующей последовательности) не содержит лидерную последовательность.
MARYGASLRQ SCPRSGREQG QDGTAGAPGL LWMGLALALA LALALSDSRV LWAPAEA HPL SPQGHPARLH RIVPRLRDVF GWGNLTCPIC KGLFTAINLG LKKEPNVARV GSVAIKLCNL LKIAPPAVCQ SIVHLFEDDM VEVWRRSVLS PSEACGLLLG STCGHWDIFS SWNISLPTVP KPPPKPPSPP APGAPVSRIL FLTDLHWDHD YLEGTDPDCA DPLCCRRGSG LPPASRPGAG YWGEYSKCDL PLRTLESLLS GLGPAGPFDM VYWTGDIPAH DVWHQTRQDQ LRALTTVTAL VRKFLGPVPV YPAVGNHEST PVNSFPPPFI EGNHSSRWLY EAMAKAWEPW LPAEALRTLR IGGFYALSPY PGLRLISLNM NFCSRENFWL LINSTDPAGQ LQWLVGELQA AEDRGDKVHI IGHIPPGHCL KSWSWNYYRI VARYENTLAA QFFGHTHVDE FEVFYDEETL SRPLAVAFLA PSATTYIGLN PGYRVYQIDG NYSGSSHVVL DHETYILNLT QANIPGAIPH WQLLYRARET YGLPNTLPTA WHNLVYRMRG DMQLFQTFWF LYHKGHPPSE PCGTPCRLAT LCAQLSARAD SPALCRHLMP DGSLPEAQSL WPRPLFC (SEQ ID NO:1)
[0038] В некоторых вариантах осуществления ASM на 99%, 98%, 97%, 96% или 95% идентична по аминокислотной последовательности олипудазе-альфа. Например, ASM, применимая в настоящем изобретении, имеет последовательность ASM, показанную в патенте США № 6541218, раскрытие которого включено в данный документ во всей своей полноте. Эта последовательность показана ниже с лидерной последовательностью, выделенной курсивом и жирным шрифтом, при этом зрелый белок не содержит лидерную последовательность:
MPRYGASLRQ SCPRSGREQG QDGTAGAPGL LWMGLVLALA LALALALSDS RVLWAPAEA H PLSPQGHPAR LHRIVPRLRD VFGWGNLTCP ICKGLFTAIN LGLKKEPNVA RVGSVAIKLC NLLKIAPPAV CQSIVHLFED DMVEVWRRSV LSPSEACGLL LGSTCGHWDI FSSWNISLPT VPKPPPKPPS PPAPGAPVSR ILFLTDLHWD HDYLEGTDPD CADPLCCRRG SGLPPASRPG AGYWGEYSKC DLPLRTLESL LSGLGPAGPF DMVYWTGDIP AHDVWHQTRQ DQLRALTTVT
ALVRKFLGPV PVYPAVGNHE SIPVNSFPPP FIEGNHSSRW LYEAMAKAWE PWLPAEALRT LRIGGFYALS PYPGLRLISL NMNFCSRENF WLLINSTDPA GQLQWLVGEL QAAEDRGDKV HIIGHIPPGH CLKSWSWNYY RIVARYENTL AAQFFGHTHV DEFEVFYDEE TLSRPLAVAF LAPSATTYIG LNPGYRVYQI DGNYSRSSHV VLDHETYILN LTQANIPGAI PHWQLLYRAR ETYGLPNTLP TAWHNLVYRM RGDMQLFQTF WFLYHKGHPP SEPCGTPCRL ATLCAQLSAR
ADSPALCRHL MPDGSLPEAQ SLWPRPLFC (SEQ ID NO:3)
[0039] ASM, применимая в настоящем изобретении, также может быть идентичной по аминокислотной последовательности ASM человека, раскрытой в базе данных UNIPROT, как последовательность P17405-1 или ее полиморфные варианты. Последовательность P17405-1 показана ниже с лидерной последовательностью, выделенной курсивом и жирным шрифтом, при этом зрелый белок не содержит лидерную последовательность:
MPRYGASLRQ SCPRSGREQG QDGTAGAPGL LWMGLVLALA LALALALSDS
RVLWAPAEA H PLSPQGHPAR LHRIVPRLRD VFGWGNLTCP ICKGLFTAIN
LGLKKEPNVA RVGSVAIKLC NLLKIAPPAV CQSIVHLFED DMVEVWRRSV
LSPSEACGLL LGSTCGHWDI FSSWNISLPT VPKPPPKPPS PPAPGAPVSR
ILFLTDLHWD HDYLEGTDPD CADPLCCRRG SGLPPASRPG AGYWGEYSKC
DLPLRTLESL LSGLGPAGPF DMVYWTGDIP AHDVWHQTRQ DQLRALTTVT
ALVRKFLGPV PVYPAVGNHE STPVNSFPPP FIEGNHSSRW LYEAMAKAWE
PWLPAEALRT LRIGGFYALS PYPGLRLISL NMNFCSRENF WLLINSTDPA
GQLQWLVGEL QAAEDRGDKV HIIGHIPPGH CLKSWSWNYY RIVARYENTL
AAQFFGHTHV DEFEVFYDEE TLSRPLAVAF LAPSATTYIG LNPGYRVYQI
DGNYSGSSHV VLDHETYILN LTQANIPGAI PHWQLLYRAR ETYGLPNTLP
TAWHNLVYRM RGDMQLFQTF WFLYHKGHPP SEPCGTPCRL ATLCAQLSAR
ADSPALCRHL MPDGSLPEAQ SLWPRPLFC(SEQ ID NO:4)
[0040] Проверку концепции для терапии с помощью олипудазы-альфа демонстрировали на мышиной модели с нокаутом ASMKO (ASMKO) (См., например, Miranda et al., FASEB 14 (13):1988-95 (2000); Dhami et al., Lab. Inves. 81(7): 987-99 (2001)). Эти исследования показали, что повторное внутривенное введение олипудазы мышам с ASMKO приводило к дозозависимому снижению содержания сфингомиелина в висцеральных органах. Снижение содержания сфингомиелина также наблюдали в легких. Исследования с ASMKO также показали, что олипудаза-альфа может вызывать токсичность при введении в высоких дозах. Однако, когда мышам с ASMKO вводили множество низких доз, за которыми следовала высокая доза, олипудаза-альфа не вызывала токсичности, наблюдаемой при однократной высокой дозе.
[0041] Олипудазу-альфа применяли в клинических исследованиях для лечения проявлений ASMD, отличных от неврологических. Наблюдения на мышах привели к разработке исследования фазы 1 для оценки безопасности и фармакокинетики при лечении с помощью олипудазы-альфа, в котором однократные возрастающие дозы олипудазы-альфа (0,03, 0,1, 0,3, 0,6 и 1,0 мг/кг) оценивали у 11 пациентов (McGovern et al., Genet. Med. 15(8):618-623 (2013) и WO 2011/025996; раскрытие которых включено в данный документ посредством ссылки во всей своей полноте). В данном исследовании у пациентов показано дозозависимое увеличение реагентов острой фазы, включая церамид, билирубин и высокочувствительный С-реактивный белок (hsCRP). Также сообщалось о дозозависимых нежелательных явлениях, охватывающих конституциональные симптомы (боль, лихорадку, тошноту и рвота), что согласуется с токсичностью первой дозы.
[0042] Исследование фазы 1b для оценки безопасности и переносимости олипудазы-альфа на протяжении 26-недельного периода лечения проводили с 5 взрослыми пациентами (Wasserstein et al., Mol. Genet. Metab. 116(1-2):88-97 (2015), включенный в данный документ посредством ссылки во всей своей полноте). В этом исследовании пациентам вводили олипудазу-альфа способом с повышением дозы при начальной дозе, составляющей 0,1 мг/кг, за которой следовало пошаговое увеличение раз в две недели с достижением целевой дозы 3,0 мг/кг. Исследование показало, что схема с повышением дозы хорошо переносилась без серьезных или тяжелых нежелательных явлений и приводила к постепенному снижению концентрации сфингомиелина и его катаболитов. "Снижение концентрации" относится к выведению сфингомиелина, который накопился в висцеральных органах пациента вследствие ASMD. Улучшения, наблюдаемые у пациентов, включали уменьшение объемов селезенки и печени, снижение показателей интерстициального процесса в легких, повышение легочной функции и снижение хитотриозидазы, CCL18, ACE в сыворотке крови и других биомаркеров заболевания. В настоящий момент авторы настоящего изобретения обнаружили, что, когда данные пациенты продолжали подвергаться лечению и мониторингу в течение 30 месяцев при долгосрочной оценке безопасности и эффективности, у них показаны устойчивый профиль безопасности и постоянные улучшения клинически значимых параметров, включая объемы селезенки и печени, показатель заболевания легких, профили липидов и биомаркеры ASM. Авторы настоящего изобретения также неожиданно обнаружили, что у пациентов наблюдалось явное улучшение минеральной плотности кости (BMD) и "нагрузки" костного мозга (BMB). Эти данные демонстрируют, что ERT с применением ASM может облегчить или предотвратить ухудшение патологического состояния кости пациента, такого как остеопения и остеопороз.
Дозировка и путь введения ASM
[0043] Фармацевтические композиции, содержащие ASM, описываемую в настоящем документе, будут вводить для лечения рассматриваемого состояния (например, ассоциированного с ASMD патологического состояния кости) в терапевтически эффективном количестве, т. е. в дозировках и в течение периодов времени, необходимых для достижения требуемого результата. Терапевтически эффективное количество может варьироваться в зависимости от таких факторов, как конкретное состояние, подвергаемое лечению, возраст, пол и вес пациента, и от того, вводится ли ферментозаместительная терапия в качестве отдельного вида лечения или в комбинации с одним или несколькими дополнительными видами лечения. "Терапевтически эффективное количество" относится к количеству подлежащего введению терапевтического средства, которое в некоторой степени будет ослаблять или предотвращать ухудшение одного или множества симптомов нарушения или состояния, подвергаемых лечению. Композиции на основе ASM можно вводить путем внутривенной инъекции.
[0044] В некоторых вариантах осуществления эффективность может быть указана как улучшение T-критериев минеральной плотности кости (например, T-критериев для позвоночника и/или бедренной кости). В определенных вариантах осуществления T-критерий улучшается на по меньшей мере 0,5 балла. В некоторых вариантах осуществления эффективность может быть указана как улучшение Z-критериев минеральной плотности кости (например, Z-критериев для позвоночника и/или бедренной кости). В определенных вариантах осуществления Z-критерий улучшается на по меньшей мере 0,1 балла.
В некоторых вариантах осуществления эффективность может быть указана как улучшение, отсутствие ухудшения или задержка прогрессирования заболеваний кости, таких как остеопения или остеопороз. В некоторых вариантах осуществления эффективность может быть указана как улучшения в развитии скелета, как, например, в линейном росте или возрасте (созревании) кости. В определенных вариантах осуществления улучшение в развитии скелета может быть измерено в сравнении с данными, собранным из исследования пациентов детского возраста (Wasserstein et al., J Pediatr 142(4):424-428 (2003)). В других вариантах осуществления улучшение в развитии скелета можно измерять в сравнении с картой физического развития каждого пациента перед проведением терапии с применением ASM.
[0045] В некоторых вариантах осуществления способы по настоящему изобретению предусматривают протокол с повышением дозы, в котором увеличивающиеся дозы ASM (например, rhASM, такой как олипудаза-альфа) вводят в течение соответствующего периода для постепенного сокращения концентрации ранее накопленного сфингомиелина и для сведения к минимуму токсических побочных эффектов, вызванных катаболитами сфингомиелина. Например, лечение может предусматривать введение одной или множества начальных, низких, нетоксичных доз ASM пациенту для уменьшения количества сфингомиелина, который накопился у пациента. Каждая повышающаяся доза может быть отделена от предыдущей дозы одной, двумя или тремя неделями. В конкретных вариантах осуществления повышающиеся дозы вводят с интервалом две недели. Используемый в данном документе термин "нетоксичная доза(-ы)" и т. п. относится к дозировке ASM, вводимой пациентам с ASMD, которая не приводит к одному, двум, трем или всему из следующего: (i) умеренное или тяжелое связанное нежелательное явление, определяемое по клиническому симптому, который мешает нормальному ежедневному функционированию и требует дополнительного мониторинга, вмешательства или лечения, или по отклоняющемуся значению лабораторных анализов или результату процедуры, вызывающим клиническое опасение, что требует дополнительного мониторинга, лечения или исследования. См., например, стандартную терминологию Модели классификации данных исследования Консорциума по стандартизации обмена клиническими данными v.3.1.1; (ii) значение общего билирубина, превышающее 1,5 мг/дл, 2 мг/дл, 3 мг/дл или 4 мг/дл, которое сохраняется более одной недели, двух недель или трех недель после введения дозы rhASM; (iii) концентрация церамида в плазме крови, превышающая 8,2 мкг/дл, 9 мкг/дл, 10 мкг/дл, 15 мкг/дл, 20 мкг/дл, 30 мкг/дл, 40 мкг/дл, 50 мкг/дл, 60 мкг/дл, 70 мкг/дл или 80 мкг/дл, через 24 часа, 36 часов, 48 часов или 72 часа после введения дозы ASM; или (iv) ответ/реакция острой фазы. "Нетоксичная доза" ASM может варьироваться в зависимости, например, от стабильности применяемого фермента, активности применяемого фермента и/или пути введения фермента. Например, дозировка модифицированного фермента ASM с повышенной активностью может быть ниже, чем дозировка немодифицированного ASM. Специалист в данной области техники сможет регулировать дозу вводимого фермента на основании стабильности фермента, активности фермента и/или пути введения фермента.
[0046] После определенного промежутка времени дозу ASM можно подвергать повышению до тех пор, пока не будет достигнута самая высокая терапевтически эффективная дозировка, переносимая пациентом. После определения такой дозировки ее можно применять в качестве поддерживающей дозы для лечения пациента. В качестве альтернативы поддерживающая доза может быть снижена относительно самой высокой повышающейся дозы после того, как состояние ASMD у пациента стабилизировалось после схемы с повышением дозы. Поддерживающие дозы можно вводить пациенту через 1, 2, 3 или 4 недели. В определенных вариантах осуществления поддерживающую дозу вводят раз в две недели.
[0047] Используемый в данном документе термин "поддерживающая доза" относится к дозировке ASM, описанной в данном документе, которую вводят пациентам с ASMD для поддержания требуемого терапевтического эффекта, например, улучшения или отсутствия ухудшения одного или множества патологических состояний кости, таких как описанные в данном документе. В конкретных вариантах осуществления поддерживающая доза(-ы) поддерживают один, два, три, четыре или более из следующих требуемых терапевтических эффектов: (i) уменьшение объема селезенки, оцениваемое с помощью методик, известных в данной области техники, например, MRI; (ii) снижение уровней сфингомиелина в печени, оцениваемое с помощью методик, известных в данной области техники, например, биохимического анализа и/или гистоморфометрического анализа образцов печени; (iii) увеличение способности к нагрузке, оцениваемое с помощью методик, известных в данной области техники, например, максимальной рабочей нагрузке при велоэргометрии, включая прогнозируемый процент максимальной рабочей нагрузки, пиковое потребление кислорода и выработку диоксида углерода; (iv) увеличение легочной функции, оцениваемое с помощью методик, известных в данной области техники, например, методик, описанных в American Thoracic Society, Am. Rev. Respir. Dis. 144: 1202-1218 (1991), например, диффузионной способности (DLco), прогнозируемого процента форсированной жизненной емкости (FVC), измеряемой, например, с помощью спирометрических методик, объеме формированного выдоха в течение 1 секунды (FEV1), измеряемого, например, с помощью спирометрических методик, и общей емкости легких; (v) уменьшение содержания сфингомиелина в бронхоальвеолярном лаваже (BAL); (vi) уменьшение объема печени, оцениваемое с помощью методик, известных в данной области техники, например, MRI: (vii) улучшение внешнего вида легкого, оцениваемое с помощью методик, известных в данной области техники, например, компьютерной томографии (CT) высокого разрешения или рентгенографии грудной клетки; (viii) уменьшение концентрации сфингомиелина или лизосфингомиелина в печени, коже, плазме и сухой капле крови (DBS), измеряемое, например, с помощью тандемной масс-спектрометрии; (ix) снижение или смягчение тяжести ASMD и/или симптома, ассоциированного с ним; (x) уменьшение продолжительности симптома, ассоциированного с ASMD; (xi) предотвращение рецидива симптома, ассоциированного с ASMD; (xii) уменьшение случаев госпитализации субъекта; (vi) уменьшение продолжительности госпитализации; (xiii) увеличение выживаемости субъекта; (xiv) снижение смертности; (xv) уменьшение частоты госпитализаций; (xvi) уменьшение числа симптомов, ассоциированных с ASMD; (xvii) увеличение бессимптомной выживаемости пациентов с ASMD; (xviii) улучшение неврологической функции (например, психомоторной функции, социальной отзывчивости и т. д.); (xix) улучшение клиренса легких, измеряемое, например, с помощью количества и профиля клеток BAL; (хх) снижение уровней хитотриозидазы в сыворотке крови; (xxi) снижение уровней лиганда-18 хемокинового мотива (c-c) (CCL18) в сыворотке крови; (xxii) улучшение профиля липидов (например, HDL, LDL, холестерина, триглицеридов и отношения общий холестерин:HDL); (xxiii) улучшение патологических состояний кости и (xxiv) улучшение качества жизни (QOL), оцениваемое, например, с помощью опросника, такого как краткий опросник для оценки утомляемости (BFI) (Mendoza et al., Cancer 85(5):1186-1196 (1999)), краткий опросник оценки боли - краткая форма (BPI-SF) (Cleeland C., Acta Paediatr. Suppl. 91(439):43-47 (2002)), или опросник оценки качества жизни у детей (PedsQL) (Varmi et al., Medical Care 39(8):800-812 (2001)), или многофакторная шкала оценки утомляемости PedsQL (Varmi et al., J Rheumatol 31(12):2494-2500 (2004)). В определенных вариантах осуществления самая высокая поддерживающая доза является самой высокой или максимальной дозой, переносимой пациентом.
[0048] В некоторых вариантах осуществления мониторинг пациента, получающего поддерживающую дозу, проводят через 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 или 11 месяцев или раз в год или раз в два года в отношении одного или множества из следующего: (i) связанные нежелательные явления; (ii) концентрации общего/прямого/непрямого билирубина; (iii) концентрация церамида в плазме крови или (iv) ответ острой фазы. В некоторых вариантах осуществления мониторинг пациента проводят через 3 месяца, через 6 месяцев или раз в год. Если пациент испытывает связанное нежелательное явление средней интенсивности, концентрация общего билирубина превышает значение общего билирубина для человека, не страдающего ASMD (например, здорового человека), концентрация церамида в плазме крови превышает концентрацию церамида в плазме крови человека, не страдающего ASMD (например, здорового человека), или наблюдают ответ острой фазы, то доза, вводимая пациенту, может оцениваться врачом или другим медицинским работником для определения необходимости ее коррекции.
[0049] В определенных вариантах осуществления способ лечения пациента-человека, имеющего ASMD, предусматривает: (а) схему с повышением дозы (например, для уменьшения концентрации накопленного сфингомиелинового субстрата у пациента), предусматривающую: (i) введение начальной дозы (например, низкой нетоксичной дозы, такой как 0,1 мг/кг) ASM (например, олипудазы-альфа), описываемой в данном документе, пациенту-человеку; (ii) введение последовательно более высоких доз ASM пациенту-человеку и (iii) мониторинг пациента в отношении одного или множества побочных эффектов после введения каждой последующей дозы, на которые указывает, например, повышенная концентрация общего билирубина, повышенная концентрация церамида в плазме крови, лизосфингомиелин, хитотриозидаза, выработка реагентов острой фазы, выработка медиаторов воспаления или нежелательное явление (например, как определено по стандартной терминологии Модели классификации данных исследования Консорциума по стандартизации обмена клиническими данными v.3.1.1); и (b) поддерживающую схему, предусматривающую введение дозы, которая равна или меньше самой высокой дозы, переносимой пациентом (например, равна или меньше 3 мг/кг), в качестве поддерживающей дозы для пациента.
[0050] В определенных вариантах осуществления способ лечения пациента-человека, имеющего ASMD, предусматривает: (а) схему с повышением дозы (например, для уменьшения концентрации накопленного сфингомиелинового субстрата у пациента), предусматривающую: (i) введение начальной дозы (например, низкой нетоксичной дозы, такой как 0,1 мг/кг) ASM (например, олипудазы-альфа), описываемой в данном документе, пациенту-человеку; (ii) введение последовательно более высоких доз ASM пациенту-человеку, если у пациента не проявляется один или множества нежелательных побочных явлений, на которые указывает, например, повышенная концентрация общего билирубина, повышенная концентрация церамида в плазме крови, выработка реагентов острой фазы, лизосфингомиелин, хитотриозидаза, выработка медиаторов воспаления или нежелательное явление (например, как определено по стандартной терминологии Модели классификации данных исследования Консорциума по стандартизации обмена клиническими данными v.3.1.1); и (b) поддерживающую схему, предусматривающую повторное введение поддерживающей дозы, которая равна или меньше самой высокой дозы, переносимой пациентом (например, равна или меньше 3 мг/кг). В некоторых вариантах осуществления мониторинг пациента проводят на протяжении некоторого периода времени после введения дозы ASM (например, 6 часов, 12 часов, 16 часов, 24 часов, 48 часов, 72 часов, недели или вплоть до введения следующей дозы) в отношении одного или множества нежелательных побочных явлений. В определенных вариантах осуществления поддерживающую дозу, которая вводится, можно корректировать на протяжении курса лечения пациента. В некоторых вариантах осуществления самая высокая поддерживающая доза, вводимая пациенту, является самой высокой дозой, переносимой пациентом.
[0051] В определенных вариантах осуществления начальная доза находится в диапазоне от 0,025 до 0,275 мг/кг, например, от 0,03 до 0,5 мг/кг, от 0,01 до 0,5 мг/кг или от 0,1 мг/кг до 1 мг/кг ASM (например, олипудазы-альфа). В конкретных вариантах осуществления начальная доза составляет 0,03 мг/кг или 0,1 мг/кг. Например, начальная доза для пациента детского возраста может составлять 0,03 мг/кг; а начальная доза для взрослого пациента может составлять 0,1 мг/кг. В некоторых вариантах осуществления начальная доза для пациента детского возраста или взрослого пациента может составлять 0,1 мг/кг.
[0052] В определенных вариантах осуществления пациентам будут вводить одну и ту же дозу олипудазы-альфа по меньшей мере дважды перед повышением до следующей более высокой дозы. В некоторых вариантах осуществления последовательные более высокие дозы вводят через одну, две, три или четыре недели после предыдущей дозы. В некоторых конкретных вариантах осуществления каждую из последовательных более высокие дозы вводят через две недели после предыдущей дозы. В конкретных вариантах осуществления последовательная более высокая доза на 0,05-1,0 мг/кг, 0,1-3,0 мг/кг или 0,5-2,0 мг/кг превышает предыдущую дозу, например, на приблизительно 0,07 мг/кг, 0,2 мг/кг, 0,3 мг/кг, 0,4 мг/кг или 1 мг/кг превышает предыдущую дозу.
[0053] В некоторых вариантах осуществления самая высокая терапевтически эффективная доза, переносимая пациентом, составляет от 1 мг/кг до 2,5 мг/кг, от 2 мг/кг до 3 мг/кг, от 3 мг/кг до 5 мг/кг. В некоторых вариантах осуществления самая высокая терапевтически эффективная доза, переносимая пациентом, составляет 1 мг/кг, 2 мг/кг, 3 мг/кг, 4 мг/кг или 5 мг/кг. В определенных вариантах осуществления самая высокая доза, переносимая пациентом, составляет от 1 мг/кг до 3 мг/кг, например, от 1 мг/кг до 2,5 мг/кг. В некоторых вариантах осуществления самую высокую дозу вводят пациенту-человеку в качестве самой высокой поддерживающей дозы. В определенных вариантах осуществления самая высокая поддерживающая доза составляет, например, 0,3 мг/кг, 0,6 мг/кг, 1 мг/кг, 2 мг/кг или 3 мг/кг. В конкретных вариантах осуществления самая высокая поддерживающая доза составляет 3 мг/кг. Последующие поддерживающие дозы можно вводить в том же количестве или меньшем, чем самая высокая поддерживающая доза. В некоторых вариантах поддерживающие дозы составляют 0,3-3 мг/кг.
[0054] В некоторых вариантах осуществления схема с повышением дозы может предусматривать введение ASM в виде множества доз в следующем порядке, например, 0,1 мг/кг, 0,3 мг/кг, 0,3 мг/кг, 0,6 мг/кг, 0,6 мг/кг, 1,0 мг/кг, 2,0 мг/кг и 3,0 мг/кг (самая высокая поддерживающая доза), где каждую из последовательных доз вводят через две недели после предыдущей дозы. В других вариантах осуществления схема с повышением дозы может предусматривать введение ASM в виде множества доз в следующем порядке, например, 0,03 мг/кг, 0,1 мг/кг, 0,3 мг/кг, 0,3 мг/кг, 0,6 мг/кг, 0,6 мг/кг, 1,0 мг/кг, 2,0 мг/кг и 3,0 мг/кг (самая высокая поддерживающая доза), где каждую из последовательных доз вводят через две недели после предыдущей дозы.
[0055] В определенных вариантах осуществления дозу ASM, описываемой в данном документе, вводят пациенту через неделю, через 2 недели, через 3 недели или через 4 недели. В конкретных вариантах осуществления дозы вводят с интервалом через две недели, например, посредством внутривенной инъекции.
[0056] В некоторых вариантах осуществления способы по настоящему изобретению предусматривают введение доз ASM в течение периода от 6 до 30 месяцев, например, в течение периода не более 6 месяцев, 7 месяцев, 8 месяцев, 9 месяцев, 10 месяцев, 11 месяцев, 12 месяцев, 13 месяцев, 14 месяцев, 15 месяцев, 16 месяцев, 17 месяцев, 18 месяцев, 19 месяцев, 20 месяцев, 21 месяца, 22 месяцев, 23 месяцев, 24 месяцев, 25 месяцев, 26 месяцев, 27 месяцев, 28 месяцев, 29 месяцев или 30 месяцев, для улучшения целевого состояния(-ий) кости. В определенных вариантах осуществления дозы ASM вводят в течение периода не более 30 месяцев.
[0057] В дополнительных вариантах осуществления способы по настоящему изобретению предусматривают протоколы введения доз и/или пути введения, описываемые, например, в WO 2011/025996, раскрытие которой включено в данный документ посредством ссылки во всей своей полноте.
[0058] В конкретных вариантах осуществления схема с повышением дозы, применяемая для лечения взрослых пациентов или пациентов детского возраста с ASMD, например, может быть такой, как показано в таблице ниже:
Таблица 1 График повышения дозы
[0059] В дополнительных конкретных вариантах осуществления схема с повышением дозы, применяемая для лечения пациентов детского возраста с ASMD, например, может быть такой, как показано в таблице ниже:
Таблица 2 График повышения дозы для пациентов детского возраста
[0060] В некоторых вариантах осуществления популяции пациентов детского возраста включают когорту подростков с ASMD (возрастом от 12 до <18 лет), когорту детей с ASMD (возрастом от 6 до <12 лет) и когорту младенцев/детей раннего возраста (возрастом от рождения до <6 лет).
Готовые изделия и наборы
[0061] В настоящем изобретении также представлены готовые изделия и наборы, содержащие ASM, описываемую в данном документе. В некоторых вариантах осуществления изделия и наборы подходят для лечения пациента, описываемого в данном документе, например, пациента с ASMD. Например, изделия и наборы могут подходить для лечения патологического состояния кости, описанного в данном документе, у пациента с ASMD. В некоторых вариантах осуществления фармацевтически активные ингредиенты в изделиях и наборах подготовлены для введения в дозах, описанных в данном документе, и составлены для введения с помощью способов, описанных в настоящем документе.
[0062] Если в данном документе не определено иное, научные и технические термины, используемые в связи с настоящим изобретением, должны иметь значения, которые обычно понятны средними специалистами в данной области. Иллюстративные способы и материалы описаны в данном документе, хотя при практическом осуществлении или при тестировании настоящего изобретения также можно применять способы и материалы, аналогичные или эквивалентные описанным в данном документе. В случае противоречий настоящее описание, включая определения, будет иметь преимущественную силу. Как правило, используемая номенклатура, связанная с культивированием клеток и тканей, молекулярной биологией, иммунологией, микробиологией, генетикой, аналитической химией, синтетической органической химией, медицинской и фармацевтической химией и химией и гибридизацией белков и нуклеиновых кислот, а также соответствующие методики, описанные в данном документе, являются хорошо известными и широко используемыми в данной области техники. Ферментативные реакции и методики очистки выполняют в соответствии с описаниями производителя, как обычно осуществляется в данной области техники или как описано в данном документе. Все публикации и другие литературные источники, упомянутые в данном документе, включены посредством ссылки во всей своей полноте. Хотя в данном документе цитируется ряд документов, данное цитирование не является признанием того, что любой из этих документов образует часть общеизвестных знаний в данной области техники. Кроме того, если иное не требуется по контексту, термины в единственном числе включают множественное число, а термины во множественном числе включают единственное число. Во всем настоящем описании и вариантах осуществления слова "иметь" и "содержать" или их варианты, такие как "имеет", "имеющий", "содержит" или "содержащий", следует понимать как подразумевающие включение указанного целого числа или группы целых чисел, но не исключение любого другого целого числа или группы целых чисел.
[0063] Для лучшего понимания настоящего изобретения приведены следующие примеры. Эти примеры предназначены только для целей иллюстрации и никоим образом не должны истолковываться как ограничивающие объем настоящего изобретения.
ПРИМЕР
Пример 1. Долгосрочное исследование для оценки безопасности и эффективности олипудазы-альфа у пациентов с ASMD
Пациенты и дизайн исследования
[0064] Целью исследования является получение информации, касающейся безопасности и эффективности олипудазы-альфа у пациентов с ASMD после длительного введения. В данном продолжающемся открытом долгосрочном исследовании (LTS) (NCT02004704; номер в EudraCT: 2013-000051-40) отслеживают 5 взрослых пациентов с хроническим ASMD, которые ранее участвовали в исследовании фазы 1b (Wasserstein et al. Mol Genet Metab 116(1-2):88-97 (2015)). Анализировали данные для всех пациентов после 30 месяцев лечения. Институциональный наблюдательный совет или комитет по вопросам этики в каждом сайте одобрили протокол, и все пациенты дали письменное информированное согласие. Исследование проводили в соответствии с надлежащей клинической практикой и в соответствии с принципами Хельсинкской декларации.
[0065] Критерии включения в исследование фазы 1b были описаны ранее. Там же. Пациенты, завершившие исследование фазы 1b с приемлемым профилем безопасности, соответствовали критериям включения в LTS и продолжали принимать ту же дозу олипудазы-альфа, которую они получали в конце исследования фазы 1b.
Показатели результатов и анализы
[0066] Оценки безопасности включали стандартный анализ крови и биохимический анализ крови, а также продолжительный мониторинг АЕ, включая реакции, ассоциированные с инфузией (IAR), как ранее описано в McGovern et al. Genet Med 18(1):34-40 (2015) и Wasserstein et al. Mol. Genet. Metab. 116(1-2):88-97 (2015). Содержание сфингомиелина и катаболита церамида в плазме крови оценивали с помощью жидкостной хроматографии с тандемной масс-спектрометрией (LC/MS/MS). Биомаркеры состояния кости также включали хитотриозидазу (сыворотка крови) и лизосфингомиелин [сухая капля крови (DBS)], которые определяли с помощью LC/MS/MS. Выработку антител к лекарственному средству оценивали, как описано ранее в McGovern et al., 2015, выше, и Wasserstein et al. Mol. Genet. Metab. 116(1-2):88-97 (2015).
[0067] Количественные измерения объемов селезенки и печени определяли c помощью MRI брюшной полости, и объемы органов выражали в виде величин, кратных норме (MN). Прогнозируемый процент диффузионной способности легких по окиси углерода (DLco), скорректированный по гемоглобину, рассчитывали с применением стандартизированных формул (Crapo and Morris Am Rev Respir Dis 123(2):185-189 (1981), Macintyre et al. Eur Respir J 26(4):720-735 (2005)). Посредством компьютерной томографии высокого разрешения (HRCT) оценивали инфильтративное заболевание легких. HRCT-изображения областей легких оценивали субъективно в отношении затемнений по типу матового стекла (GG), интерстициального процесса в легких (ILD) и ретикулонодулярного уплотнения (RND) от 0 (отсутствие заболевания) до 3 (тяжелое заболевание), как описано ранее в McGovern et al., 2015 выше и Wasserstein et al., 2015, выше.
[0068] Профили липидов в плазме крови натощак, включая значения для общего холестерина (TC), липопротеинов низкой плотности (LDL-C), липопротеинов высокой плотности (HDL-C) и триглицеридов, измеряли на протяжении всего исследования. Уровни не-HDL-холестерина рассчитывали post-hoc как разницу между уровнями общего холестерина и HDL-холестерина (Jacobson et al., J. Clin. Lipidol. 9(2):129-169 (2015)).
[0069] "Нагрузку" костного мозга (BMB) определяли по данным MRI поясничного отдела позвоночника и обеих бедренных костей, где количественная оценка изображения указывала на степень инфильтрации костного мозга клетками, нагруженными липидами (Robertson et al, AJR. Am. J. Roentgenol. 188(6):1521-1528 (2007)). Минеральную плотность кости (BMD) определяли по изображениям сканограмм кости с помощью двухэнергетической рентгеновской абсорбциометрии (DXA) поясничного отдела позвоночника и обеих бедренных костей, а также определению T- и Z-критериев (WHO JAMA 285(6):785-795 (2001)). BMD оценивали с применением руководства, предоставленного Международным обществом клинической денситометрии (ISCD 2015).
[0070] Сообщаемые пациентом результаты с применением 11-балльной шкалы от 0 (отсутствие) до 10 (наихудшее состояние) включали валидированный краткий опросник для оценки утомляемости (BFI) (Mendoza et al., Cancer 85 (5): 1186-1196 (1999)) и краткий опросник оценки боли - краткую форма (BPI-SF) для оценки препятствования повседневной деятельности на исходном уровне и периодически на протяжении всего лечения (Cleeland C., Acta Paediatr. Suppl. 91(439):43-47 (2002)).
Статистические методы
[0071] Для категориальных и непрерывных переменных представлены описательные статистики, изменение от исходного уровня и процентное изменение от исходного уровня рассчитывали для объемов органов и DLco и различия определяли с помощью парного t-критерия и критерия Уилкоксона-Манна-Уитни.
Пациенты и воздействие
[0072] Все пять взрослых пациентов (3 мужчин и 2 женщины европеоидной расы), которые завершили исследование фазы 1b, продолжили лечение в LTS. На исходном уровне у всех пациентов наблюдали спленомегалию (в диапазоне от 7,4 до 16,1 MN), гепатомегалию (в диапазоне от 1,2 до 2,2 MN), нарушение газообмена (прогнозируемая DLco в диапазоне 43-80%) и проатерогенный профиль липидов. Характеристики пациентов были опубликованы ранее (Wasserstein et al. Mol. Genet. Metab. 116(1-2):88-97 (2015)) и описаны в таблице 3. Большинство пациентов (4/5) оставались на целевой дозе олипудазы-альфа 3 мг/кг на протяжении всех 30 месяцев лечения. Для пациента 2 дозу снижали до 2 мг/кг в течение 6 месяцев (месяцы 12-18), а затем до 1 мг/кг (месяц 18-настоящее время) из-за АЕ, которые описаны ниже.
Таблица 3. Демографические данные пациентов и исходные характеристики (Wasserstein et al., 2015)
 Безопасность
Безопасность
[0073] На протяжении 30 месяцев лечения отсутствовали случаи смерти, серьезные или тяжелые явления или досрочное завершение лечения. У всех пациентов наблюдалось по меньшей мере 1 AE, и почти у всех (826/838, 98,5%) их интенсивность была легкой. Среди 443 АЕ, признанных связанными с лечением, 96 (21,7%) признавали как IAR (включая головную боль, тошноту, боль в животе, артралгию, скелетно-мышечную боль и миалгию). Шесть АЕ умеренной интенсивности, признанных IAR, наблюдались во время исследования фазы 1b (первые 6 месяцев) и о них сообщалось ранее (Wasserstein et al. Mol. Genet. Metab. 116(1-2):88-97 (2015)). Что касается 6-30 месяцев в LTS, 5 AE умеренной интенсивности, признанных как IAR, включали боль в животе, боль в печени, тошноту, мышечный спазм и сенсорное нарушение у пациента 2. Отсутствовали реакции гиперчувствительности, реакции острой фазы или синдром высвобождения цитокинов. Ни у одного пациента не произошла выработка IgG-антител к олипудазе-альфа. Отсутствовали клинически значимые неблагоприятные изменения показателей жизнедеятельности, гематологических параметров или параметров сердечной безопасности.
[0074] Уровни маркеров воспаления, IL-6, IL-8 и hsCRP, стабильные в конце исследования фазы 1b (Wasserstein et al. Mol. Genet. Metab. 116(1-2):88-97 (2015)), оставались стабильными у всех пациентов, за исключением пациента 2, у которого наблюдали колебания содержания hsCRP (1,10-33,3 мг/мл; норма 0-5) от месяца 6 по месяц 30. Уровни церамида в плазме крови у всех пациентов (ФИГ. 1А) оставались в пределах границ нормы (1,8-6,5 мкг/мл).
[0075] Уровни ферментов функции печени оставались в пределах нормы у всех пациентов вплоть до месяца 30, когда у пациента 4 отмечали кратковременные повышения содержания ALT (в 1,4 раза выше нормы) и AST (в 2,9 раза выше нормы), без соответствующих АЕ и с последующим возвратом до нормальных уровней. Уровни общего билирубина и GGT оставались такими же или ниже исходных уровней у всех пациентов. Уровни железа изменялись с течением времени, но оставались в пределах или вблизи нормы.
[0076] Во время повышения дозы на фазе 1b пациент 2 испытывал IAR, что привело к повторению дозы 2 мг/кг (Wasserstein et al. Mol. Genet. Metab. 116(1-2):88-97 (2015)). Впоследствии пациент получал целевую дозу 3 мг/кг на всем протяжении испытания фазы 1b и в течение первых 6 месяцев LTS, во время чего пациент сообщал о легких АЕ через 7-10 дней после большинства инфузий, включая тошноту, головную боль, усталость, боли, перемежающуюся боль в животе и периодическую лихорадку (от 38,3 до 40,0°C). Эпизоды продолжались ~3 дня и полностью устранялись до следующей инфузии. Дозу олипудазы-альфа снижали (2 мг/кг в течение 6 месяцев, затем до текущей дозы 1 мг/кг). Уменьшение дозы не изменило срок, частоту или типы зарегистрированных явлений.
Эффективность
Объемы селезенки и печени
[0077] Объемы селезенки и печени уменьшились у всех пациентов относительно исходного уровня (ФИГ. 2А). Средние объемы селезенки снизились от увеличенных в 12,8 раз относительно нормы (MN) на исходном уровне до 6,7 MN через 30 месяцев, при этом уменьшение от исходного уровня составило 47,3% (p<0,0001). Средние объемы печени снизились от 1,7 MN в начале исследования до 1,07 MN через 30 месяцев, при этом уменьшение от исходного уровня составило 35,6% (р=0,006).
Инфильтративное заболевание легких
[0078] Прогнозируемый процент DLco увеличился у всех пациентов относительно исходных значений (ФИГ. 2B) и улучшился от среднего значения 53,2% (умеренное нарушение) на исходном уровне до 67,1% через 30 месяцев (легкое нарушение). Наибольшие изменения наблюдали у трех пациентов с самым низким прогнозируемым % DLco на исходном уровне (<40%, в диапазоне тяжелого нарушения). На ФИГ. 2B также показана оценка инфильтративного заболевания легких со средними показателями для компонентов на исходном уровне, через 6 месяцев, 18 месяцев и 30 месяцев. Данные показывают прогрессирующее снижение всех параметров, в частности затемнения по типу GG и RND, которые почти полностью устранились.
Параметры липидного обмена натощак
[0079] Профили липидов натощак показаны на ФИГ. 4A-4D. За 30 месяцев содержание триглицеридов снизилось на 42,99% (р=0,02), содержание общего холестерина на 12,7% (р=0,04), содержание LDL-C на 22,8% (р=0,007), а содержание HDL-C увеличилось на 137,6% (р=0,01). Уровень не-HDL-холестерина (общий холестерин минус HDL-C) составлял >3,37 ммоль/л (>130 мг/дл) у 4/5 пациентов на исходном уровне (среднее 3,91 ммоль/л) и составлял <3,37 ммоль/л у всех пациентов через 30 месяцев (среднее 2,66 ммоль/л).
Оценка биомаркеров
[0080] Средние уровни лизосфингомиелина в DBS были в 5 раз выше верхнего предела нормы (ULN=69 мкг/л) на исходном уровне и снижались до почти нормальных уровней, которые оставались стабильными от 6 до 30 месяцев (ФИГ. 1B).
[0081] Уровни хитотриозидазы в сыворотке крови перед инфузией стабильно снизились на 72,3% от 735 нмоль/час/мл на исходном уровне до 221 нмоль/час/мл через 30 месяцев (p=0,0007), приближаясь к верхнему пределу нормального диапазона содержания хитотриозидазы (≤181 нмоль/час/мл) (ФИГ. 1C). Данные не корректировали для учета двух пациентов, гетерозиготных по общей дупликации в 24 п. о., которая снижает активность хитотриозидазы в сыворотке крови.
Гематологические исследования
[0082] У большинства пациентов количество тромбоцитов сохранялось чуть ниже нормы или в пределах низких показателей нормы. У пациента 1 значения (57-102х109/л) были ниже низких показателей нормы (150х109/л) на протяжении всего исследования. Средние изменения количества тромбоцитов по сравнению с исходным уровнем (увеличения) колебались с течением времени [от 5,9% (месяц 27) до 25,7% (месяц 9)] и составили 20,6% через 30 месяцев. Уровни гемоглобина оставались аналогичными исходным уровням (средние изменения от исходного уровня находились в диапазоне от -6,1% на неделе 12 до 6,9% в месяц 24) и были в пределах нормальных уровней у всех пациентов (данные не показаны).
Плотность кости
[0083] На исходном уровне средние значения T-критериев для позвоночника находились в диапазоне остеопении (от -1,0 до -2,5), составляя -1,48±1,14, в то время как Z-критерии указывали на нормальную BMD (-1,36±1,26) в пределах -1 стандартного отклонения от нижнего порогового значения BMD (-2,0). Как T-критерий, так и Z-критерий улучшились через 30 месяцев (-0,94±1,03 и -0,78±1,11 соответственно). У пациента 2 (женщина, возрастом 32 года на исходном уровне) исходный T-критерий для позвоночника (-3,06) находился в диапазоне остеопороза, при этом он улучшился через 18 (-2,48) и 30 месяцев (-2,65) до значений на границе остеопения/остеопороз. У двух пациентов с T-критериями в диапазоне остеопении на исходном уровне (пациент 1, мужчина возрастом 31 год на исходном уровне, -1,31; и пациент 4, мужчина возрастом 28 лет на исходном уровне, -2,14) через 30 месяцев критерии составляли норму (-0,76 и -0,82 соответственно). Результаты для индивидуальных Z-критериев с течением времени были аналогичными.
[0084] Средние значения T- и Z-критериев для бедренной кости составляли норму на исходном уровне (-0,38±1,35 и -0,27±1,46 соответственно) и через 30 месяцев (-0,28±1,27 и -0,13±1,4 соответственно). У пациента 2 исходный T-критерий для бедренной кости, находящий в диапазоне остеопении (-2,23), и Z-критерий, указывающий на низкую BMD (-2,18); оба незначительно улучшились (-1,89 и -1,82 соответственно) через 30 месяцев.
"Нагрузка" костного мозга
[0085] Средние категориальные показатели BMB были аналогичными на исходном уровне (6,2 ± 2,5) и через 30 месяцев (5,6 ± 1,1). У пациента 2 на исходном уровне был самый высокий общий показатель BMB, составлявший 10, который улучшился на 3 балла (показатель составил 7) через 18 и 30 месяцев. T1- и T2-взвешенные изображения бедренной кости и позвоночника для пациента 2 на исходном уровне и после 30 месяцев лечения олипудазой-альфа показаны на ФИГ. 3А и 3В. Гипоинтенсивность костного мозга в проксимальных эпифизах, наблюдаемая на исходном уровне, снижалась после 30 месяцев лечения. В позвоночнике диффузная инфильтрация костного мозга и интенсивность сигнала предкрестцового жира на уровне гиперинтенсивности, наблюдаемые на исходном уровне, не изменилась и улучшилась соответственно после 30 месяцев лечения.
Сообщаемые пациентами результаты
[0086] Средние показатели утомляемости по BFI±SD составляли 3,04±2,29 на исходном уровне и 2,44±3,44 через 30 месяцев. Средние показатели выраженности боли по BPI±SD составляли 3,45±2,77 на исходном уровне и 2,90±2,70 через 30 месяцев, а средние показатели мешающего воздействия боли по шкале BPI±SD составляли 2,03±1,58 на исходном уровне и 3,29±3,51 через 30 месяцев. Большинство индивидуальных показателей выраженности боли по BFI и BPI во все моменты времени находились в категориях легкой (0-3) или умеренной (4-6) интенсивности. Исключение составлял пациент 5, у которого боль по BPI была сильной (7-10) как на исходном уровне (6,8), так и через 30 месяцев (7). Показатели мешающего воздействия боли по BPI увеличились в случае пациентов 2 (2 на исходном уровне, 8,1 через 30 месяцев) и 3 (1,9 на исходном уровне, 5,3 через 30 месяцев). Утомляемость, о которой сообщил пациент 2, была умеренной (5,8) на исходном уровне и тяжелой (8,3) через 30 месяцев.
[0087] Данное исследование демонстрирует, что лечение в течение 30 месяцев с помощью олипудазы-альфа, первое специфическое по этиологии лечение ASMD в рамках разработки, хорошо переносилось и было ассоциировано с устойчивыми изменяющими жизнь улучшениями в соответствующих клинических показателях заболевания. Профиль безопасности через 30 месяцев был аналогичен профилю в исследовании фазы 1b (Wasserstein et al., Mol. Genet. Metab. 116(1-2):88-97 (2015)). Отсутствовали реакции гиперчувствительности и не обнаружили антитела к лекарственному средству. До настоящего времени синдром высвобождения цитокинов не наблюдали ни у одного пациента, подвергавшегося действию олипудазы-альфа. Поскольку IAR не представляли собой иммунологические реакции, они, по-видимому, связаны с высвобождением биологически активных метаболитов сфингомиелина, в первую очередь церамида, который является сигнальным посредником в высвобождении цитокинов, воспалении и апоптозе (Spiegel et al., Curr. Opin. Cell Biol. 8(2):159-167 (1996); Gulbins et al., J. Mol. Med. 82(6):357-363 (2004)). В течение первых шести месяцев лечения дозы олипудазы-альфа вызывали временные повышения уровней церамида в плазме крови, которые обычно достигали пика через 48 часов после инфузии (Wasserstein et al. Mol. Genet. Metab. 116(1-2):88-97 (2015)). Как пред-, так и постинфузионные уровни церамида стабильно снижались с каждой последующей инфузией олипудазы-альфа, достигая плато после 3 месяцев лечения и оставаясь стабильными до 30 месяцев.
[0088] Клинические улучшения сохранялись на протяжении всех 30 месяцев. Статистически значимые улучшения объемов печени и селезенки (средний процент уменьшения объема печени составил 31,2%, а селезенки - 39,3%) сопоставимы с ответами на ERT при других лизосомных болезнях накопления. При болезни Гоше терапевтическая цель для объема селезенки составляет снижение на 30-50% в течение первого года лечения, а для объема печени - снижение на 20-30% в течение первых 2 лет лечения (Pastores et al., Semin Hematol 41 (Supple 5):4-14 (2004)).
[0089] У пациентов с хроническим висцеральным или хроническим нейровисцеральным ASMD наблюдается ухудшение инфильтративного заболевания легких с возрастом (Wasserstein et al., Pediatrics 114 (6): e672-677 (2004)). В течение 30 месяцев лечения отмечалось 35% увеличение диффузионной способности легких относительно исходного уровня с выраженными изменениями у 3 пациентов с самым низким DLCO в начале исследования. Улучшения показателей заболевания легкого, наблюдаемые во время первых 6 месяцев лечения (Wasserstein et al. Mol. Genet. Metab. 116(1-2):88-97(2015)), продолжались во время последующих 2 лет лечения, так что нормализовались некоторые параметры (например, затемнения по типу GG и RND).
[0090] Атерогенные профили липидов, как правило, демонстрируют ухудшение с возрастом у пациентов с хроническим ASMD (Wasserstein et al., Pediatrics 114(6):e672-677(2004)), и нарушения липидного обмена могут быть ассоциированы с ранним проявлением ишемической болезни сердца (McGovern et al., J. Pediatr. 145(1):77-81(2004)). Исходя из профилей липидов, на исходном уровне пациенты были подвержены риску сердечно-сосудистого заболевания от легкой до умеренной степени (Wasserstein et al. Mol. Genet. Metab. 116(1-2):88-97(2015)), и профили улучшались в течение 30 месяцев лечения. Уровень не-HDL-холестерина считается хорошим прогностическим фактором сердечно-сосудистого риска во многих популяциях пациентов, и его оптимальный уровень составляет <3,37 ммоль/л (<130 мг/дл) (Jacobson et al., J. Clin. Lipidol. 9(2):129-169 (2015)). У всех пациентов, кроме одного, уровни не-HDL превышали 3,37 ммоль/л до ERT, а через 30 месяцев уровни общего холестерина и HDL улучшились у всех пациентов, при этом содержание не-HDL было ниже порогового значения 3,37 ммоль/л.
[0091] Осложнения, связанные со скелетом, также являются выраженными признаками хронического ASMD. У некоторых пациентов отмечали улучшение BMD, в частности в позвоночнике, что демонстрирует, что олипудаза-альфа оказывает положительный эффект на BMD у взрослых с ASMD. При других нарушениях с накоплением липидов, характеризующихся низкой BMD, таких как болезнь Гоше, ERT в комбинации с антирезорбтивной терапией может приводить к нормализации остеопении (Wenstrup et al., Blood 104(5):1253-1257 (2004)), хотя ответ заболевания кости на ERT саму по себе у взрослых пациентов является медленным (Wenstrup et al J. Bone Miner. Res. 22(1):119-126 (2007)). Однако бисфосфонаты могут не быть неподходящими для пациентов с ASMD вследствие ингибирования активности ASM (Arenz Cell Physiol. Biochem. 26(1):1-8 (2010)). Ни один пациент в исследовании не получал терапию бисфосфонатами. Результаты этого исследования указывают на то, что остеопения будет улучшаться при применении олипудазы-альфа отдельно.
[0092] Для другие клинических показателей показано улучшение или стабильность во время ERT. Количество тромбоцитов и уровни гемоглобина оставались стабильными. Умеренные уровни BMB измеряли на исходном уровне и после 30 месяцев лечения с помощью олипудазы-альфа, при этом у некоторых пациентов отмечались улучшения. На исходном уровне пациенты имели легкие или умеренные уровни боли и утомляемости, которые у большинства пациентов оставались неизменными через 30 месяцев. Ухудшение сообщаемых пациентом результатов в случае пациента 3 не было связано с AE. Пациент 2 сообщил об ухудшении в отношении утомляемости и боли с АЕ, характеризующимся гриппоподобными симптомами, после одного года ERT. У данного пациента была атипичная красная волчанка, и неясно, связано ли данное обстоятельство с утомляемостью и болью, АЕ и колебаниям воспалительных цитокинов. Уменьшение дозы олипудазы-альфа до 1 мг/кг/неделя у данного пациента не повлияло на частоту AE, утомляемость или боль. При такой более низкой дозе олипудазы-альфа (12 месяцев воздействия) пациент продолжает получать клиническое преимущество, включая уменьшение объемов селезенки и печени, а также улучшение прогнозируемого процента DLco, устойчивый клиренс инфильтративных параметров по HRCT и стабилизацию биомаркеров.
[0093] Хитотриозидаза, общеизвестный биомаркер для терапевтического мониторинга на протяжении ERT при болезни Гоше (Guo et al., J. Inherit. Metab. Dis. 18(6):717-722 (1995)) и маркер хронических воспалительных заболеваний, стабильно снижалась во время лечения с помощью олипудазы-альфа (Boot et al., Clin Chim Acta 411(1-2):31-36 (2010)). Содержание лизосфингомиелина, деацилированной формы сфингомиелина, уменьшилось в DBS, что свидетельствует о его применимости в качестве биомаркера для мониторинга результатов ERT, о чем свидетельствовало его постоянное снижение по мере того, как у пациентов происходит снижение концентрации сфингомиелина, а затем наблюдается стабильность во время длительного лечения. Содержание лизосфингомиелина в DBS у пациентов с хроническим висцеральным ASMD повышено приблизительно в 5 раз (Chuang Mol. Genet. Metab. 111(2):209-211 (2014)).
[0094] Данное открытое расширенное исследование олипудазы-альфа демонстрирует, что лечение с помощью олипудазы-альфа в течение 30 месяцев хорошо переносилось и было клинически эффективным.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> SANOFI
<120> Лечение патологических состояний кости у пациентов
с дефицитом кислой сфингомиелиназы
<130> 022548.WO047
<140>
<141>
<150> EP 17306720.8
<151> 2017-12-07
<150> 62/549,732
<151> 2017-08-24
<160> 4
<170> PatentIn версия 3.5
<210> 1
<211> 627
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 1
Met Ala Arg Tyr Gly Ala Ser Leu Arg Gln Ser Cys Pro Arg Ser Gly
1 5 10 15
Arg Glu Gln Gly Gln Asp Gly Thr Ala Gly Ala Pro Gly Leu Leu Trp
20 25 30
Met Gly Leu Ala Leu Ala Leu Ala Leu Ala Leu Ala Leu Ser Asp Ser
35 40 45
Arg Val Leu Trp Ala Pro Ala Glu Ala His Pro Leu Ser Pro Gln Gly
50 55 60
His Pro Ala Arg Leu His Arg Ile Val Pro Arg Leu Arg Asp Val Phe
65 70 75 80
Gly Trp Gly Asn Leu Thr Cys Pro Ile Cys Lys Gly Leu Phe Thr Ala
85 90 95
Ile Asn Leu Gly Leu Lys Lys Glu Pro Asn Val Ala Arg Val Gly Ser
100 105 110
Val Ala Ile Lys Leu Cys Asn Leu Leu Lys Ile Ala Pro Pro Ala Val
115 120 125
Cys Gln Ser Ile Val His Leu Phe Glu Asp Asp Met Val Glu Val Trp
130 135 140
Arg Arg Ser Val Leu Ser Pro Ser Glu Ala Cys Gly Leu Leu Leu Gly
145 150 155 160
Ser Thr Cys Gly His Trp Asp Ile Phe Ser Ser Trp Asn Ile Ser Leu
165 170 175
Pro Thr Val Pro Lys Pro Pro Pro Lys Pro Pro Ser Pro Pro Ala Pro
180 185 190
Gly Ala Pro Val Ser Arg Ile Leu Phe Leu Thr Asp Leu His Trp Asp
195 200 205
His Asp Tyr Leu Glu Gly Thr Asp Pro Asp Cys Ala Asp Pro Leu Cys
210 215 220
Cys Arg Arg Gly Ser Gly Leu Pro Pro Ala Ser Arg Pro Gly Ala Gly
225 230 235 240
Tyr Trp Gly Glu Tyr Ser Lys Cys Asp Leu Pro Leu Arg Thr Leu Glu
245 250 255
Ser Leu Leu Ser Gly Leu Gly Pro Ala Gly Pro Phe Asp Met Val Tyr
260 265 270
Trp Thr Gly Asp Ile Pro Ala His Asp Val Trp His Gln Thr Arg Gln
275 280 285
Asp Gln Leu Arg Ala Leu Thr Thr Val Thr Ala Leu Val Arg Lys Phe
290 295 300
Leu Gly Pro Val Pro Val Tyr Pro Ala Val Gly Asn His Glu Ser Thr
305 310 315 320
Pro Val Asn Ser Phe Pro Pro Pro Phe Ile Glu Gly Asn His Ser Ser
325 330 335
Arg Trp Leu Tyr Glu Ala Met Ala Lys Ala Trp Glu Pro Trp Leu Pro
340 345 350
Ala Glu Ala Leu Arg Thr Leu Arg Ile Gly Gly Phe Tyr Ala Leu Ser
355 360 365
Pro Tyr Pro Gly Leu Arg Leu Ile Ser Leu Asn Met Asn Phe Cys Ser
370 375 380
Arg Glu Asn Phe Trp Leu Leu Ile Asn Ser Thr Asp Pro Ala Gly Gln
385 390 395 400
Leu Gln Trp Leu Val Gly Glu Leu Gln Ala Ala Glu Asp Arg Gly Asp
405 410 415
Lys Val His Ile Ile Gly His Ile Pro Pro Gly His Cys Leu Lys Ser
420 425 430
Trp Ser Trp Asn Tyr Tyr Arg Ile Val Ala Arg Tyr Glu Asn Thr Leu
435 440 445
Ala Ala Gln Phe Phe Gly His Thr His Val Asp Glu Phe Glu Val Phe
450 455 460
Tyr Asp Glu Glu Thr Leu Ser Arg Pro Leu Ala Val Ala Phe Leu Ala
465 470 475 480
Pro Ser Ala Thr Thr Tyr Ile Gly Leu Asn Pro Gly Tyr Arg Val Tyr
485 490 495
Gln Ile Asp Gly Asn Tyr Ser Gly Ser Ser His Val Val Leu Asp His
500 505 510
Glu Thr Tyr Ile Leu Asn Leu Thr Gln Ala Asn Ile Pro Gly Ala Ile
515 520 525
Pro His Trp Gln Leu Leu Tyr Arg Ala Arg Glu Thr Tyr Gly Leu Pro
530 535 540
Asn Thr Leu Pro Thr Ala Trp His Asn Leu Val Tyr Arg Met Arg Gly
545 550 555 560
Asp Met Gln Leu Phe Gln Thr Phe Trp Phe Leu Tyr His Lys Gly His
565 570 575
Pro Pro Ser Glu Pro Cys Gly Thr Pro Cys Arg Leu Ala Thr Leu Cys
580 585 590
Ala Gln Leu Ser Ala Arg Ala Asp Ser Pro Ala Leu Cys Arg His Leu
595 600 605
Met Pro Asp Gly Ser Leu Pro Glu Ala Gln Ser Leu Trp Pro Arg Pro
610 615 620
Leu Phe Cys
625
<210> 2
<211> 570
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности:
синтетический полипептид"
<400> 2
His Pro Leu Ser Pro Gln Gly His Pro Ala Arg Leu His Arg Ile Val
1 5 10 15
Pro Arg Leu Arg Asp Val Phe Gly Trp Gly Asn Leu Thr Cys Pro Ile
20 25 30
Cys Lys Gly Leu Phe Thr Ala Ile Asn Leu Gly Leu Lys Lys Glu Pro
35 40 45
Asn Val Ala Arg Val Gly Ser Val Ala Ile Lys Leu Cys Asn Leu Leu
50 55 60
Lys Ile Ala Pro Pro Ala Val Cys Gln Ser Ile Val His Leu Phe Glu
65 70 75 80
Asp Asp Met Val Glu Val Trp Arg Arg Ser Val Leu Ser Pro Ser Glu
85 90 95
Ala Cys Gly Leu Leu Leu Gly Ser Thr Cys Gly His Trp Asp Ile Phe
100 105 110
Ser Ser Trp Asn Ile Ser Leu Pro Thr Val Pro Lys Pro Pro Pro Lys
115 120 125
Pro Pro Ser Pro Pro Ala Pro Gly Ala Pro Val Ser Arg Ile Leu Phe
130 135 140
Leu Thr Asp Leu His Trp Asp His Asp Tyr Leu Glu Gly Thr Asp Pro
145 150 155 160
Asp Cys Ala Asp Pro Leu Cys Cys Arg Arg Gly Ser Gly Leu Pro Pro
165 170 175
Ala Ser Arg Pro Gly Ala Gly Tyr Trp Gly Glu Tyr Ser Lys Cys Asp
180 185 190
Leu Pro Leu Arg Thr Leu Glu Ser Leu Leu Ser Gly Leu Gly Pro Ala
195 200 205
Gly Pro Phe Asp Met Val Tyr Trp Thr Gly Asp Ile Pro Ala His Asp
210 215 220
Val Trp His Gln Thr Arg Gln Asp Gln Leu Arg Ala Leu Thr Thr Val
225 230 235 240
Thr Ala Leu Val Arg Lys Phe Leu Gly Pro Val Pro Val Tyr Pro Ala
245 250 255
Val Gly Asn His Glu Ser Thr Pro Val Asn Ser Phe Pro Pro Pro Phe
260 265 270
Ile Glu Gly Asn His Ser Ser Arg Trp Leu Tyr Glu Ala Met Ala Lys
275 280 285
Ala Trp Glu Pro Trp Leu Pro Ala Glu Ala Leu Arg Thr Leu Arg Ile
290 295 300
Gly Gly Phe Tyr Ala Leu Ser Pro Tyr Pro Gly Leu Arg Leu Ile Ser
305 310 315 320
Leu Asn Met Asn Phe Cys Ser Arg Glu Asn Phe Trp Leu Leu Ile Asn
325 330 335
Ser Thr Asp Pro Ala Gly Gln Leu Gln Trp Leu Val Gly Glu Leu Gln
340 345 350
Ala Ala Glu Asp Arg Gly Asp Lys Val His Ile Ile Gly His Ile Pro
355 360 365
Pro Gly His Cys Leu Lys Ser Trp Ser Trp Asn Tyr Tyr Arg Ile Val
370 375 380
Ala Arg Tyr Glu Asn Thr Leu Ala Ala Gln Phe Phe Gly His Thr His
385 390 395 400
Val Asp Glu Phe Glu Val Phe Tyr Asp Glu Glu Thr Leu Ser Arg Pro
405 410 415
Leu Ala Val Ala Phe Leu Ala Pro Ser Ala Thr Thr Tyr Ile Gly Leu
420 425 430
Asn Pro Gly Tyr Arg Val Tyr Gln Ile Asp Gly Asn Tyr Ser Gly Ser
435 440 445
Ser His Val Val Leu Asp His Glu Thr Tyr Ile Leu Asn Leu Thr Gln
450 455 460
Ala Asn Ile Pro Gly Ala Ile Pro His Trp Gln Leu Leu Tyr Arg Ala
465 470 475 480
Arg Glu Thr Tyr Gly Leu Pro Asn Thr Leu Pro Thr Ala Trp His Asn
485 490 495
Leu Val Tyr Arg Met Arg Gly Asp Met Gln Leu Phe Gln Thr Phe Trp
500 505 510
Phe Leu Tyr His Lys Gly His Pro Pro Ser Glu Pro Cys Gly Thr Pro
515 520 525
Cys Arg Leu Ala Thr Leu Cys Ala Gln Leu Ser Ala Arg Ala Asp Ser
530 535 540
Pro Ala Leu Cys Arg His Leu Met Pro Asp Gly Ser Leu Pro Glu Ala
545 550 555 560
Gln Ser Leu Trp Pro Arg Pro Leu Phe Cys
565 570
<210> 3
<211> 629
<212> БЕЛОК
<213> Homo sapiens
<400> 3
Met Pro Arg Tyr Gly Ala Ser Leu Arg Gln Ser Cys Pro Arg Ser Gly
1 5 10 15
Arg Glu Gln Gly Gln Asp Gly Thr Ala Gly Ala Pro Gly Leu Leu Trp
20 25 30
Met Gly Leu Val Leu Ala Leu Ala Leu Ala Leu Ala Leu Ala Leu Ser
35 40 45
Asp Ser Arg Val Leu Trp Ala Pro Ala Glu Ala His Pro Leu Ser Pro
50 55 60
Gln Gly His Pro Ala Arg Leu His Arg Ile Val Pro Arg Leu Arg Asp
65 70 75 80
Val Phe Gly Trp Gly Asn Leu Thr Cys Pro Ile Cys Lys Gly Leu Phe
85 90 95
Thr Ala Ile Asn Leu Gly Leu Lys Lys Glu Pro Asn Val Ala Arg Val
100 105 110
Gly Ser Val Ala Ile Lys Leu Cys Asn Leu Leu Lys Ile Ala Pro Pro
115 120 125
Ala Val Cys Gln Ser Ile Val His Leu Phe Glu Asp Asp Met Val Glu
130 135 140
Val Trp Arg Arg Ser Val Leu Ser Pro Ser Glu Ala Cys Gly Leu Leu
145 150 155 160
Leu Gly Ser Thr Cys Gly His Trp Asp Ile Phe Ser Ser Trp Asn Ile
165 170 175
Ser Leu Pro Thr Val Pro Lys Pro Pro Pro Lys Pro Pro Ser Pro Pro
180 185 190
Ala Pro Gly Ala Pro Val Ser Arg Ile Leu Phe Leu Thr Asp Leu His
195 200 205
Trp Asp His Asp Tyr Leu Glu Gly Thr Asp Pro Asp Cys Ala Asp Pro
210 215 220
Leu Cys Cys Arg Arg Gly Ser Gly Leu Pro Pro Ala Ser Arg Pro Gly
225 230 235 240
Ala Gly Tyr Trp Gly Glu Tyr Ser Lys Cys Asp Leu Pro Leu Arg Thr
245 250 255
Leu Glu Ser Leu Leu Ser Gly Leu Gly Pro Ala Gly Pro Phe Asp Met
260 265 270
Val Tyr Trp Thr Gly Asp Ile Pro Ala His Asp Val Trp His Gln Thr
275 280 285
Arg Gln Asp Gln Leu Arg Ala Leu Thr Thr Val Thr Ala Leu Val Arg
290 295 300
Lys Phe Leu Gly Pro Val Pro Val Tyr Pro Ala Val Gly Asn His Glu
305 310 315 320
Ser Ile Pro Val Asn Ser Phe Pro Pro Pro Phe Ile Glu Gly Asn His
325 330 335
Ser Ser Arg Trp Leu Tyr Glu Ala Met Ala Lys Ala Trp Glu Pro Trp
340 345 350
Leu Pro Ala Glu Ala Leu Arg Thr Leu Arg Ile Gly Gly Phe Tyr Ala
355 360 365
Leu Ser Pro Tyr Pro Gly Leu Arg Leu Ile Ser Leu Asn Met Asn Phe
370 375 380
Cys Ser Arg Glu Asn Phe Trp Leu Leu Ile Asn Ser Thr Asp Pro Ala
385 390 395 400
Gly Gln Leu Gln Trp Leu Val Gly Glu Leu Gln Ala Ala Glu Asp Arg
405 410 415
Gly Asp Lys Val His Ile Ile Gly His Ile Pro Pro Gly His Cys Leu
420 425 430
Lys Ser Trp Ser Trp Asn Tyr Tyr Arg Ile Val Ala Arg Tyr Glu Asn
435 440 445
Thr Leu Ala Ala Gln Phe Phe Gly His Thr His Val Asp Glu Phe Glu
450 455 460
Val Phe Tyr Asp Glu Glu Thr Leu Ser Arg Pro Leu Ala Val Ala Phe
465 470 475 480
Leu Ala Pro Ser Ala Thr Thr Tyr Ile Gly Leu Asn Pro Gly Tyr Arg
485 490 495
Val Tyr Gln Ile Asp Gly Asn Tyr Ser Arg Ser Ser His Val Val Leu
500 505 510
Asp His Glu Thr Tyr Ile Leu Asn Leu Thr Gln Ala Asn Ile Pro Gly
515 520 525
Ala Ile Pro His Trp Gln Leu Leu Tyr Arg Ala Arg Glu Thr Tyr Gly
530 535 540
Leu Pro Asn Thr Leu Pro Thr Ala Trp His Asn Leu Val Tyr Arg Met
545 550 555 560
Arg Gly Asp Met Gln Leu Phe Gln Thr Phe Trp Phe Leu Tyr His Lys
565 570 575
Gly His Pro Pro Ser Glu Pro Cys Gly Thr Pro Cys Arg Leu Ala Thr
580 585 590
Leu Cys Ala Gln Leu Ser Ala Arg Ala Asp Ser Pro Ala Leu Cys Arg
595 600 605
His Leu Met Pro Asp Gly Ser Leu Pro Glu Ala Gln Ser Leu Trp Pro
610 615 620
Arg Pro Leu Phe Cys
625
<210> 4
<211> 629
<212> БЕЛОК
<213> Homo sapiens
<400> 4
Met Pro Arg Tyr Gly Ala Ser Leu Arg Gln Ser Cys Pro Arg Ser Gly
1 5 10 15
Arg Glu Gln Gly Gln Asp Gly Thr Ala Gly Ala Pro Gly Leu Leu Trp
20 25 30
Met Gly Leu Val Leu Ala Leu Ala Leu Ala Leu Ala Leu Ala Leu Ser
35 40 45
Asp Ser Arg Val Leu Trp Ala Pro Ala Glu Ala His Pro Leu Ser Pro
50 55 60
Gln Gly His Pro Ala Arg Leu His Arg Ile Val Pro Arg Leu Arg Asp
65 70 75 80
Val Phe Gly Trp Gly Asn Leu Thr Cys Pro Ile Cys Lys Gly Leu Phe
85 90 95
Thr Ala Ile Asn Leu Gly Leu Lys Lys Glu Pro Asn Val Ala Arg Val
100 105 110
Gly Ser Val Ala Ile Lys Leu Cys Asn Leu Leu Lys Ile Ala Pro Pro
115 120 125
Ala Val Cys Gln Ser Ile Val His Leu Phe Glu Asp Asp Met Val Glu
130 135 140
Val Trp Arg Arg Ser Val Leu Ser Pro Ser Glu Ala Cys Gly Leu Leu
145 150 155 160
Leu Gly Ser Thr Cys Gly His Trp Asp Ile Phe Ser Ser Trp Asn Ile
165 170 175
Ser Leu Pro Thr Val Pro Lys Pro Pro Pro Lys Pro Pro Ser Pro Pro
180 185 190
Ala Pro Gly Ala Pro Val Ser Arg Ile Leu Phe Leu Thr Asp Leu His
195 200 205
Trp Asp His Asp Tyr Leu Glu Gly Thr Asp Pro Asp Cys Ala Asp Pro
210 215 220
Leu Cys Cys Arg Arg Gly Ser Gly Leu Pro Pro Ala Ser Arg Pro Gly
225 230 235 240
Ala Gly Tyr Trp Gly Glu Tyr Ser Lys Cys Asp Leu Pro Leu Arg Thr
245 250 255
Leu Glu Ser Leu Leu Ser Gly Leu Gly Pro Ala Gly Pro Phe Asp Met
260 265 270
Val Tyr Trp Thr Gly Asp Ile Pro Ala His Asp Val Trp His Gln Thr
275 280 285
Arg Gln Asp Gln Leu Arg Ala Leu Thr Thr Val Thr Ala Leu Val Arg
290 295 300
Lys Phe Leu Gly Pro Val Pro Val Tyr Pro Ala Val Gly Asn His Glu
305 310 315 320
Ser Thr Pro Val Asn Ser Phe Pro Pro Pro Phe Ile Glu Gly Asn His
325 330 335
Ser Ser Arg Trp Leu Tyr Glu Ala Met Ala Lys Ala Trp Glu Pro Trp
340 345 350
Leu Pro Ala Glu Ala Leu Arg Thr Leu Arg Ile Gly Gly Phe Tyr Ala
355 360 365
Leu Ser Pro Tyr Pro Gly Leu Arg Leu Ile Ser Leu Asn Met Asn Phe
370 375 380
Cys Ser Arg Glu Asn Phe Trp Leu Leu Ile Asn Ser Thr Asp Pro Ala
385 390 395 400
Gly Gln Leu Gln Trp Leu Val Gly Glu Leu Gln Ala Ala Glu Asp Arg
405 410 415
Gly Asp Lys Val His Ile Ile Gly His Ile Pro Pro Gly His Cys Leu
420 425 430
Lys Ser Trp Ser Trp Asn Tyr Tyr Arg Ile Val Ala Arg Tyr Glu Asn
435 440 445
Thr Leu Ala Ala Gln Phe Phe Gly His Thr His Val Asp Glu Phe Glu
450 455 460
Val Phe Tyr Asp Glu Glu Thr Leu Ser Arg Pro Leu Ala Val Ala Phe
465 470 475 480
Leu Ala Pro Ser Ala Thr Thr Tyr Ile Gly Leu Asn Pro Gly Tyr Arg
485 490 495
Val Tyr Gln Ile Asp Gly Asn Tyr Ser Gly Ser Ser His Val Val Leu
500 505 510
Asp His Glu Thr Tyr Ile Leu Asn Leu Thr Gln Ala Asn Ile Pro Gly
515 520 525
Ala Ile Pro His Trp Gln Leu Leu Tyr Arg Ala Arg Glu Thr Tyr Gly
530 535 540
Leu Pro Asn Thr Leu Pro Thr Ala Trp His Asn Leu Val Tyr Arg Met
545 550 555 560
Arg Gly Asp Met Gln Leu Phe Gln Thr Phe Trp Phe Leu Tyr His Lys
565 570 575
Gly His Pro Pro Ser Glu Pro Cys Gly Thr Pro Cys Arg Leu Ala Thr
580 585 590
Leu Cys Ala Gln Leu Ser Ala Arg Ala Asp Ser Pro Ala Leu Cys Arg
595 600 605
His Leu Met Pro Asp Gly Ser Leu Pro Glu Ala Gln Ser Leu Trp Pro
610 615 620
Arg Pro Leu Phe Cys
625
<---
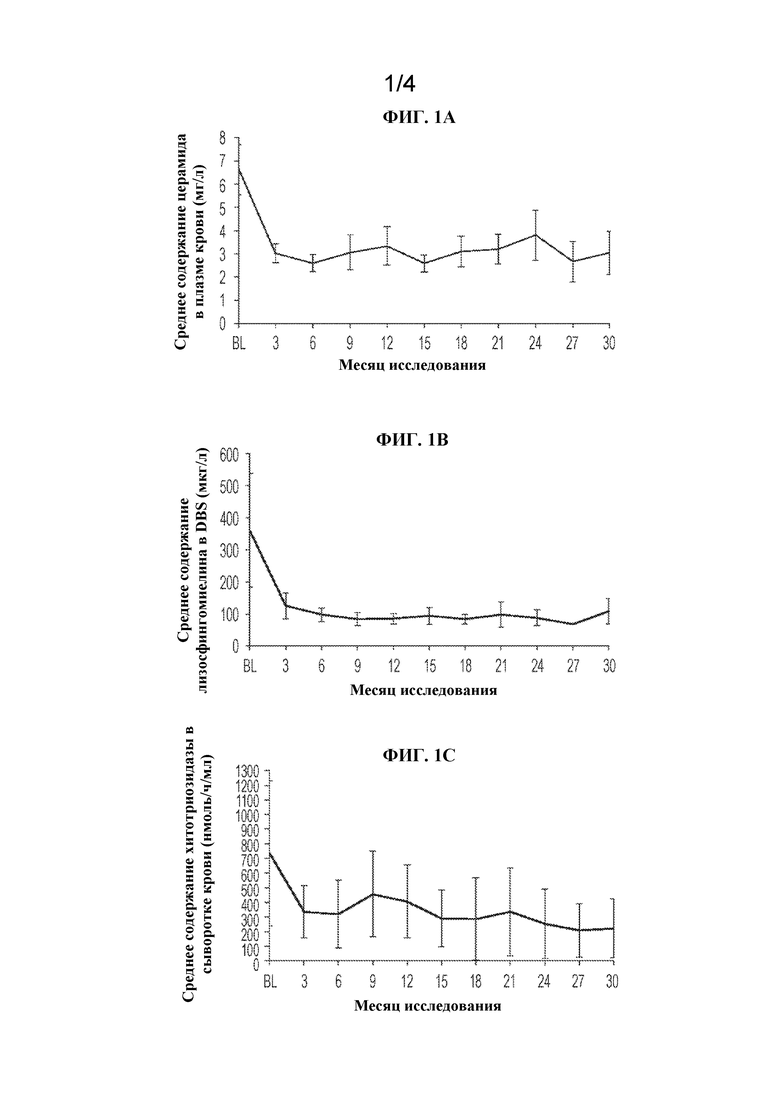
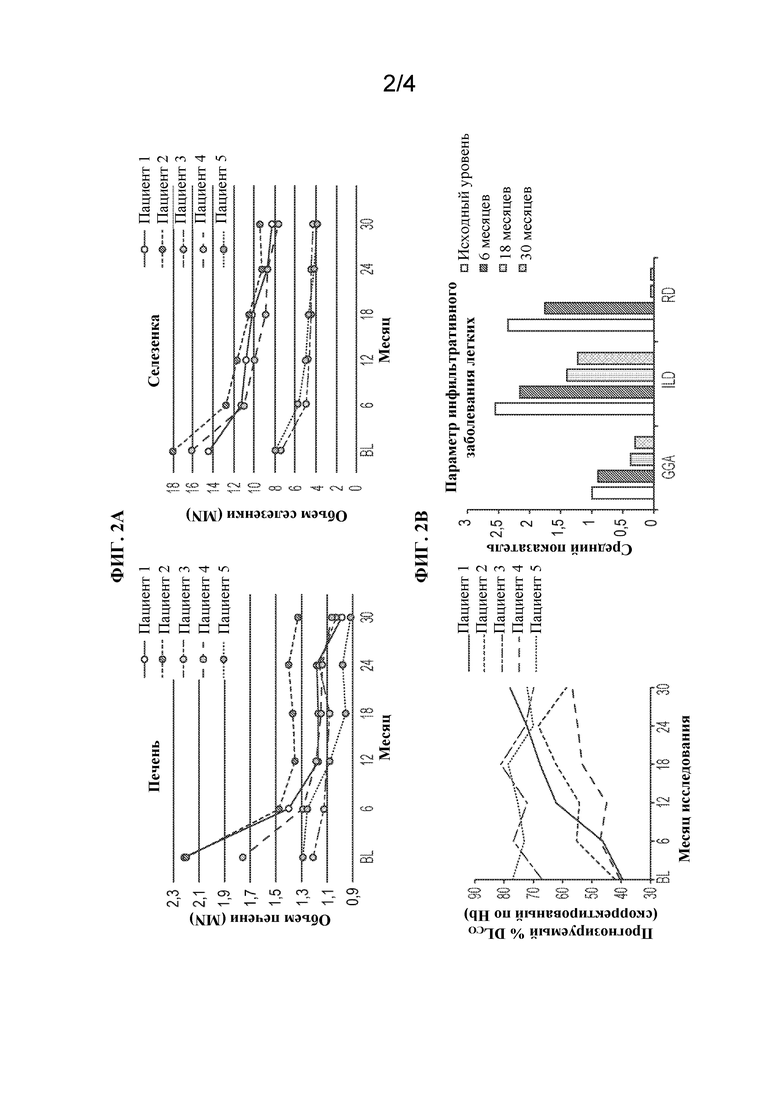
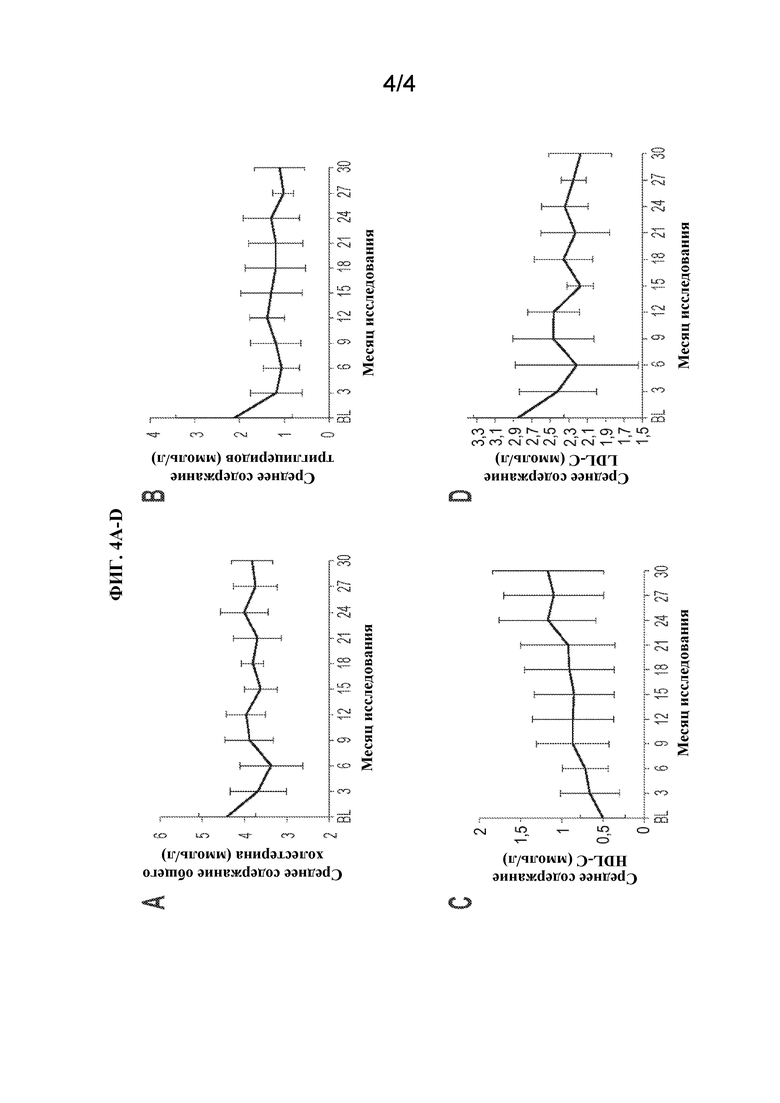
Изобретение относится к области медицины и фармацевтики, а именно к способу улучшения патологического состояния кости у пациента с дефицитом кислой сфингомиелиназы (ASMD), причем способ включает введение пациенту множества доз олипудазы-альфа, где на улучшение аномального состояния кости указывает улучшение показателя состояния кости у пациента после множества доз олипудазы-альфа. Технический результат заключается в облегчении патологических состояний кости ферментозаместительной терапией с применением ASM у пациентов с ASMD, включая увеличение плотности их кости и уменьшение их "нагрузки" костного мозга. 23 з.п. ф-лы, 4 ил., 3 табл., 1 пр.
1. Способ улучшения патологического состояния кости у пациента с дефицитом кислой сфингомиелиназы (ASMD), причем способ включает:
введение пациенту множества доз олипудазы-альфа, где на улучшение аномального состояния кости указывает улучшение показателя состояния кости у пациента после множества доз олипудазы-альфа.
2. Способ по п. 1, где показатель состояния кости представляет собой минеральную плотность кости (BMD), где BMD улучшается или не ухудшается после множества доз rhASM.
3. Способ по п. 1, где показатель состояния кости представляет собой "нагрузку" костного мозга (BMB), где BMB уменьшается или не увеличивается после множества доз rhASM.
4. Способ по п. 1, где показатель состояния кости представляет собой созревание кости, и где созревание кости улучшается после множества доз rhASM.
5. Способ по п. 1, где индикатором состояния кости является линейный рост, и где линейный рост улучшается после множества доз rhASM.
6. Способ по любому из пп. 1-5, где патологическое состояние кости представляет собой остеопению или остеопороз.
7. Способ по любому из пп. 1-6, где пациент с дефицитом кислой сфингомиелиназы не получает терапию бисфосфонатами.
8. Способ по любому из предыдущих пунктов, где множество доз вводятся пациенту в течение периода от шести до тридцати месяцев.
9. Способ по любому из предыдущих пунктов, где пациент имеет болезнь Ниманна-Пика типа В.
10. Способ по любому из пп. 1-8, где пациент имеет болезнь Ниманна-Пика типа A/B.
11. Способ по любому из предыдущих пунктов, где пациент является взрослым пациентом.
12. Способ по любому из пп. 1-10, где пациент является пациентом детского возраста.
13. Способ по любому из предыдущих пунктов, где первые две или более доз представляют собой повышающиеся дозы, и они вводятся в последовательно увеличивающемся количестве.
14. Способ по п. 13, где дозы после повышающихся доз являются поддерживающими дозами, и они вводятся в том же или меньшем количестве, чем последняя повышающаяся доза.
15. Способ по п. 13 или 14, где первая доза составляет 0,1 мг/кг, и пациент является пациентом детского возраста.
16. Способ по п. 13 или 14, где первая доза составляет 0,1 мг/кг, и пациент является взрослым пациентом.
17. Способ по любому из пп. 14-16, где самая высокая поддерживающая доза составляет от 0,3 мг/кг до 3 мг/кг.
18. Способ по любому из пп. 14-16, где самая высокая поддерживающая доза составляет 1 мг/кг.
19. Способ по любому из пп. 14-16, где самая высокая поддерживающая доза составляет 2 мг/кг.
20. Способ по любому из пп. 14-16, где самая высокая поддерживающая доза составляет 3 мг/кг.
21. Способ по любому из пп. 14-16, где самая высокая поддерживающая доза является самой высокой дозой, переносимой пациентом.
22. Способ по любому из пп. 13-21, где повышающиеся дозы вводятся в следующем порядке: 0,1 мг/кг, 0,3 мг/кг, 0,3 мг/кг, 0,6 мг/кг, 0,6 мг/кг, 1,0 мг/кг, 2,0 мг/кг и 3,0 мг/кг.
23. Способ по любому из предыдущих пунктов, где множество доз вводятся с интервалом через 2 недели.
24. Способ по любому из предыдущих пунктов, где множество доз вводятся путем внутривенной инъекции.
| ФЕРМЕНТНАЯ ЗАМЕСТИТЕЛЬНАЯ ТЕРАПИЯ С УВЕЛИЧЕНИЕМ ДОЗЫ ДЛЯ ЛЕЧЕНИЯ НЕДОСТАТОЧНОСТИ КИСЛОЙ СФИНГОМИЕЛИНАЗЫ | 2010 |
|
RU2569744C2 |
| US 2015071907 A1, 12.03.2015 | |||
| US 2014162954 A1, 12.06.2014 | |||
| ROTH A.G | |||
| et al | |||
| Potent and selective inhibition of acid sphingomyelinase by bisphosphonates // Angewandte Chemie International Edition | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
| - Vol | |||
| Приспособление для автоматической односторонней разгрузки железнодорожных платформ | 1921 |
|
SU48A1 |
| - No | |||
| Механический грохот | 1922 |
|
SU41A1 |
| - P | |||
| ПРИБОР ДЛЯ ГОРНОЙ ЭЛЕКТРИЧЕСКОЙ РАЗВЕДКИ ПРИ ПОМОЩИ ЭЛЕКТРОМАГНИТНЫХ ВОЛН | 1926 |
|
SU7560A1 |
| MCGOVERN M.M | |||
| et al | |||
| Disease manifestations and burden of illness in patients | |||
Авторы
Даты
2023-05-05—Публикация
2018-08-22—Подача