ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
[0001] Недостаточность кислой сфингомиелиназы (ASMD) представляет собой редкое опасное для жизни нарушение лизосомального накопления. Это аутосомно-рецессивное генетическое заболевание, которое возникает в результате мутаций в гене SMPD1, который кодирует лизосомальный фермент кислую сфингомиелиназу (ASM) (Schuchman et al., Mol. Genet. Metab. 120 (1-2):27-33 (2017)). У пациентов с ASMD не может метаболизироваться сфингомиелин, который в результате накапливается в лизосомах во многих органах, вызывая заболевание внутренних органов и нейродегенерацию в тяжелых случаях. Пациенты с ASMD имеют повышенный уровень холестерина и других липидов в селезенке, печени, легких и костном мозге.
[0002] Инфантильный нейровисцеральный ASMD (также известный как болезнь Ниманна-Пика типа A или NPD A) является наиболее тяжелым фенотипом заболевания и характеризуется как ранняя и острая невропатическая форма. NPD A приводит к задержке в развитии, гепатоспленомегалии и быстро прогрессирующей нейродегенерации. Пациенты умирают в раннем детстве (McGovern et al., Neurology 66(2):228-232 (2006)).
[0003] Пациенты с хроническим висцеральным ASMD (NPD B) и хроническим нейровисцеральным ASMD (NPD A/B) имеют начало, которое варьируется от младенчества до взрослого возраста (Wasserstein et al., Pediatrics 114 (6):e672-677 (2004); Wasserstein et al., J. Pediatr. 149(4):554-559 (2006)). Пациентам с NPD B обычно ставят диагноз в детстве, как правило, в возрасте после двух лет. Большинство пациентов с NPD B доживают до взрослого возраста. Пациенты с NPD A/B классифицируются как имеющие промежуточную форму с проявлением детских неврологических симптомов, которые могут развиться как нейродегенеративное заболевание. Заболеваемость печени, легких и гематологическими заболеваниями встречается у всех пациентов с хроническим ASMD и включает гепатоспленомегалию, дисфункцию печени, инфильтративное заболевание легких и тромбоцитопению (McGovern et al., Genet. Med. 15 (8): 618-623 (2013); McGovern et al., Orphanet J. Rare Dis. 12 (1):41 (2017)). Ограничение роста в детстве и нарушения со стороны костей, такие как низкая плотность костей, также являются общими признаками хронического ASMD (Wasserstein et al., J. Pediatr. 142(4):424-428 (2003)). Заболевания легких и печени являются основными причинами смерти этих пациентов (McGovern et al., Pediatrics 122(2):e341-349 (2008); Cassiman et al., Mol. Genet. Metab. 118(3):206-213 (2016)).
[0004] В связи с высокими показателями заболеваемости и смертности в результате ASMD, сохраняется острая необходимость в эффективном лечении этого генетического заболевания.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0005] В настоящем изобретении предусмотрены композиции рекомбинантной человеческой ASM (rhASM) для лечения ASMD. В некоторых вариантах осуществления композиции содержат rhASM, фосфат натрия, метионин и сахарозу (или трегалозу). В определенных вариантах осуществления rhASM представляет собой олипудазу альфа (SEQ ID NO: 2).
[0006] В некоторых вариантах осуществления композиция является лиофилизированной. Лиофилизированная композиция по настоящему изобретению может содержать, например:
4-7% вес/вес олипудазы альфа,
3-7% вес/вес фосфата натрия,
15-25% вес/вес L-метионина и
65-75% вес/вес сахарозы.
В определенных вариантах осуществления лиофилизированная композиция по настоящему изобретению может содержать:
5,5% вес/вес олипудазы альфа,
2,3% вес/вес гептагидрата двухосновного фосфата натрия,
2,6% вес/вес моногидрата одноосновного фосфата натрия,
20,5% вес/вес L-метионина и
68,6% вес/вес сахарозы.
[0007] В некоторых вариантах осуществления композиция представляет собой водную жидкую композицию. Водная жидкая композиция может содержать, например:
1-10 мг/мл олипудазы альфа,
10-50 мМ фосфата натрия,
70-150 мМ L-метионина и
1-10% вес/об. сахарозы,
где композиция имеет pH 5-8.
В определенных вариантах осуществления водная жидкая композиция по настоящему изобретению может содержать:
3-5 мг/мл олипудазы альфа,
10-30 мМ фосфата натрия,
80-120 мМ L-метионина и
4-6% вес/об. сахарозы,
где композиция имеет pH 6-7.
[0008] В конкретном варианте осуществления водная жидкая композиция по настоящему изобретению может содержать:
4 мг/мл олипудазы альфа,
20 мМ фосфата натрия,
100 мМ L-метионина и
5% вес/об. сахарозы,
где композиция имеет pH 6,5.
[0009] В некоторых вариантах осуществления водная жидкая композиция по настоящему изобретению может дополнительно содержать 0,005% вес/об. полисорбата 80.
[0010] В настоящем изобретении дополнительно предусматривается композиция, полученная посредством высушивания (например, лиофилизации или высушивания распылением) водной жидкой композиции, описанной в данном документе. Настоящее изобретение также предусматривает способ получения лиофилизированной композиции, включающий лиофилизацию водной жидкой композиции, описанной в данном документе.
[0011] В некоторых вариантах осуществления настоящее изобретение предусматривает флакон, содержащий лиофилизированную композицию, описанную в данном документе. В определенных вариантах осуществления лиофилизированная композиция во флаконе содержит или по сути состоит из:
21,2 мг олипудазы альфа,
9,0 мг гептагидрата двухосновного фосфата натрия,
10,0 мг моногидрата одноосновного фосфата натрия,
79 мг L-метионина и
265 мг сахарозы.
В некоторых вариантах осуществления лиофилизированную композицию восстанавливают в 5,1 мл стерильной воды для получения водной жидкой композиции.
[0012] В определенных вариантах осуществления лиофилизированная композиция во флаконе содержит или по сути состоит из:
4,8 мг олипудазы альфа,
2,0 мг гептагидрата двухосновного фосфата натрия,
2,3 мг моногидрата одноосновного фосфата натрия,
17,9 мг L-метионина и
60 мг сахарозы.
В некоторых вариантах осуществления лиофилизированную композицию восстанавливают в 1,1 мл стерильной воды для получения водной жидкой композиции.
[0013] В настоящем изобретении дополнительно предусматривается изделие, предусматривающее 1) флакон, содержащий лиофилизированную композицию, описанную в данном документе, и 2) флакон, содержащий, например, стерильную воду, 0,9% хлорида натрия или фосфатно-солевой буфер для восстановления лиофилизированной композиции.
[0014] В настоящем изобретении дополнительно предусматривается способ лечения ASMD у пациента-человека, включающий введение пациенту композиции, описанной в данном документе, где композицию восстанавливают в жидкую форму перед введением, если это лиофилизированная композиция.
[0015] Настоящее изобретение дополнительно предусматривает композицию, описанную в данном документе, для применения при лечении ASMD у пациента-человека.
[0016] Настоящее изобретение дополнительно предусматривает применение композиции, описанной в данном документе, для изготовления лекарственного препарата для лечения ASMD у пациента-человека.
[0017] В некоторых вариантах осуществления лечение ASMD, которое описано в данном документе, предназначено для болезни Ниманна-Пика типа A/B или типа B или для отличных от неврологических проявлений ASMD.
КРАТКОЕ ОПИСАНИЕ ФИГУР
[0018] На фиг. 1А показана стабильность rhASM, измеренная по специфической (ферментативной) активности после двух недель хранения при 30°C в сукцинатном, цитратном, цитратном/фосфатном или фосфатном буферах при различных значениях pH.
[0019] На фиг. 1B показана стабильность rhASM, измеренная по процентной доле высокомолекулярных соединений (% HMWS) после одной недели хранения при 30°C в сукцинатном, цитратном, цитратном/фосфатном или фосфатном буферах при различных значениях pH. HMWS определяли с помощью эксклюзионной хроматографии (SEC).
[0020] На фиг. 1С показана стабильность rhASM, измеренная по термической стабильности в цитратном/фосфатном или фосфатном буферах при различных значениях pH. Термическую стабильность определяли с помощью дифференциальной сканирующей калориметрии.
[0021] На фиг. 2А показана удельная активность rhASM в зависимости от времени в 10 мМ, 20 мМ, 50 мМ или 100 мМ фосфатном буфере с pH 6,5 при 30°C.
[0022] На фиг. 2B показана физическая стабильность rhASM в зависимости от времени, измеренная в % HMWS в 10 мМ, 20 мМ, 50 мМ или 100 мМ фосфатном буфере с pH 6,5 при 30°C.
[0023] На фиг. 3А показано влияние 5% вес/об. маннита, сахарозы или трегалозы на специфическую (ферментативную) активность 4 мг/мл rhASM до лиофилизации (жидкость) и после лиофилизации (лиофилизат).
[0024] На фиг. 3B показано влияние 5% вес/об. маннита, сахарозы или трегалозы на физическую стабильность 4 мг/мл rhASM, измеренную в % HMWS до лиофилизации (жидкость) и после лиофилизации (лиофилизат).
[0025] На фиг. 4A показана удельная активность rhASM в зависимости от времени при 5°C. rhASM лиофилизировали из раствора, содержащего 5% маннита, 5% сахарозы или 3% маннита и 2% сахарозы (все концентрации в вес/об.).
[0026] На фиг. 4B показана физическая стабильность rhASM в зависимости от времени при 5°C, измеренная в % HMWS. rhASM лиофилизировали из раствора, содержащего 5% маннита, 5% сахарозы или 3% маннита и 2% сахарозы (все концентрации в вес/об.).
[0027] На фиг. 5A показана удельная активность rhASM в зависимости от времени при 5°C. rhASM лиофилизировали из раствора, содержащего 5% сахарозы с или без 100 мМ метионина (все концентрации в вес/об.).
[0028] На фиг. 5B показана физическая стабильность rhASM в зависимости от времени при 5°C, измеренная в % HMWS. rhASM лиофилизировали из раствора, содержащего 5% сахарозы с или без 100 мМ метионина.
[0029] На фиг. 6 показано влияние pH, концентрации белка, концентрации метионина и концентрации сахарозы на процентное содержание димера в зависимости от времени в жидких композициях на основе rhASM при 2-8°C.
[0030] На фиг. 7 показано влияние pH, концентрации белка, концентрации метионина и концентрации сахарозы на удельную активность rhASM в зависимости от времени в жидких композициях при 2-8°C.
[0031] На фиг. 8 показан % HMWS в зависимости от времени при 2-8°C в жидких композициях на основе rhASM с изменяющимися pH, концентрацией белка, концентрацией метионина и концентрацией сахарозы. Номера составов указаны справа от графика.
[0032] На фиг. 9 показан % агрегации в зависимости от времени при 2-8°C в жидких композициях на основе rhASM с изменяющимися pH, концентрацией белка, концентрацией метионина и концентрацией сахарозы. Номера составов указаны справа от графика.
[0033] На фиг. 10 показан % димера, % агрегации и удельная активность при 25°C в жидких композициях на основе rhASM при различных значениях pH.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0034] Настоящее изобретение предусматривает композиции, содержащие рекомбинантная человеческая ASM, например олипудазу альфа, и один или несколько фармацевтически приемлемых наполнителей. Композиции по настоящему изобретению обладают улучшенной стабильностью и сроком хранения в сравнении с другими композициями. В некоторых вариантах осуществления композиции по настоящему изобретению представляют собой фармацевтические композиции, т. е. композиции, которые находятся в такой форме или могут быть получены в такой форме, чтобы биологическая активность активного ингредиента была эффективной, но не содержала дополнительных ингредиентов, которые являются в значительной степени токсичными или вызывали бы у пациентов нежелательные побочные эффекты, не связанные с активным ингредиентом. Термины "фармацевтическая композиция" и "фармацевтический препарат" используются взаимозаменяемо в данном документе. Фармацевтические композиции по настоящему изобретению полезны при лечении пациентов с недостаточностью ASM, как дополнительно описано ниже.
Рекомбинантная человеческая кислая сфингомиелиназа
[0035] ASM представляет собой фермент, катализирующий распад сфингомиелина до церамида и фосфорилхолина. "Рекомбинантная человеческая ASM" относится к человеческой ASM с определенными модификациями аминокислот по отношению к последовательности дикого типа, которую получают рекомбинантными средствами, или без них. Например, рекомбинантная человеческая ASM может экспрессироваться в культивируемых клетках-хозяевах млекопитающих (например, клетках COS, CHO, HeLa, 3T3, 293T, NS0, SP2/0 или HuT 78 и т. п.) или животных, трансгенных в отношении человеческой кодирующей последовательности ASM.
[0036] В некоторых вариантах осуществления рекомбинантная человеческая ASM представляет собой олипудазу альфа. Олипудаза альфа является гликоформой альфа человеческой ASM (EC-3.1.4.12), которая продуцируется в клетках CHO. Зрелая олипудаза альфа представляет собой полипептид из 570 аминокислот, который сохраняет ферментативную и направленную на лизосомы активность природного белка человека. Аминокислотная последовательность олипудазы альфа, включая ее лидерную последовательность (остатки 1-57), показана ниже как SEQ ID NO:1, где лидерная последовательность выделена курсивом и жирным шрифтом. Последовательность зрелой олипудазы альфа (SEQ ID NO:2, которая охватывает остатки 58-627 из SEQ ID NO:1) не имеет лидерной последовательности.
MARYGASLRQ SCPRSGREQG QDGTAGAPGL LWMGLALALA LALALSDSRV LWAPAEA HPL SPQGHPARLH RIVPRLRDVF GWGNLTCPIC KGLFTAINLG LKKEPNVARV GSVAIKLCNL LKIAPPAVCQ SIVHLFEDDM VEVWRRSVLS PSEACGLLLG STCGHWDIFS SWNISLPTVP KPPPKPPSPP APGAPVSRIL FLTDLHWDHD YLEGTDPDCA DPLCCRRGSG LPPASRPGAG YWGEYSKCDL PLRTLESLLS GLGPAGPFDM VYWTGDIPAH DVWHQTRQDQ LRALTTVTAL VRKFLGPVPV YPAVGNHEST PVNSFPPPFI EGNHSSRWLY EAMAKAWEPW LPAEALRTLR IGGFYALSPY PGLRLISLNM NFCSRENFWL LINSTDPAGQ LQWLVGELQA AEDRGDKVHI IGHIPPGHCL KSWSWNYYRI VARYENTLAA QFFGHTHVDE FEVFYDEETL SRPLAVAFLA PSATTYIGLN PGYRVYQIDG NYSGSSHVVL DHETYILNLT QANIPGAIPH WQLLYRARET YGLPNTLPTA WHNLVYRMRG DMQLFQTFWF LYHKGHPPSE PCGTPCRLAT LCAQLSARAD SPALCRHLMP DGSLPEAQSL WPRPLFC (SEQ ID NO:1)
[0037] В других вариантах осуществления человеческая ASM, применимая в настоящем изобретении, на 99%, 98%, 97%, 96% или 95% идентична по аминокислотной последовательности олипудазе альфа. Например, человеческая ASM в композиции может иметь последовательность, показанную в патенте США 6541218, описание которой включено в данный документ в полном объеме. Эта последовательность (SEQ ID NO:3) показана ниже с лидерной последовательностью (остатки 1-59) курсивом и жирным шрифтом, где зрелый белок (SEQ ID NO:4, который охватывает остатки 60-629 из SEQ ID NO:3) не имеет лидерной последовательности.
MPRYGASLRQ SCPRSGREQG QDGTAGAPGL LWMGLVLALA LALALALSDS RVLWAPAEA H PLSPQGHPAR LHRIVPRLRD VFGWGNLTCP ICKGLFTAIN LGLKKEPNVA RVGSVAIKLC NLLKIAPPAV CQSIVHLFED DMVEVWRRSV LSPSEACGLL LGSTCGHWDI FSSWNISLPT VPKPPPKPPS PPAPGAPVSR ILFLTDLHWD HDYLEGTDPD CADPLCCRRG SGLPPASRPG AGYWGEYSKC DLPLRTLESL LSGLGPAGPF DMVYWTGDIP AHDVWHQTRQ DQLRALTTVT
ALVRKFLGPV PVYPAVGNHE SIPVNSFPPP FIEGNHSSRW LYEAMAKAWE PWLPAEALRT LRIGGFYALS PYPGLRLISL NMNFCSRENF WLLINSTDPA GQLQWLVGEL QAAEDRGDKV HIIGHIPPGH CLKSWSWNYY RIVARYENTL AAQFFGHTHV DEFEVFYDEE TLSRPLAVAF LAPSATTYIG LNPGYRVYQI DGNYSRSSHV VLDHETYILN LTQANIPGAI PHWQLLYRAR ETYGLPNTLP TAWHNLVYRM RGDMQLFQTF WFLYHKGHPP SEPCGTPCRL ATLCAQLSAR
ADSPALCRHL MPDGSLPEAQ SLWPRPLFC (SEQ ID NO:3)
[0038] Человеческая ASM в композиции также может быть идентична по аминокислотной последовательности человеческой ASM, раскрытой в базе данных UNIPROT в виде последовательности P17405-1, или ее полиморфным вариантам. Последовательность P17405-1 показана ниже (SEQ ID NO:5) с лидерной последовательностью (остатки 1-59) курсивом и жирным шрифтом, где зрелый белок (SEQ ID NO:6, который охватывает остатки 60-629 из SEQ ID NO:5) не имеет лидерной последовательности.
MPRYGASLRQ SCPRSGREQG QDGTAGAPGL LWMGLVLALA LALALALSDS
RVLWAPAEA H PLSPQGHPAR LHRIVPRLRD VFGWGNLTCP ICKGLFTAIN
LGLKKEPNVA RVGSVAIKLC NLLKIAPPAV CQSIVHLFED DMVEVWRRSV
LSPSEACGLL LGSTCGHWDI FSSWNISLPT VPKPPPKPPS PPAPGAPVSR
ILFLTDLHWD HDYLEGTDPD CADPLCCRRG SGLPPASRPG AGYWGEYSKC
DLPLRTLESL LSGLGPAGPF DMVYWTGDIP AHDVWHQTRQ DQLRALTTVT
ALVRKFLGPV PVYPAVGNHE STPVNSFPPP FIEGNHSSRW LYEAMAKAWE
PWLPAEALRT LRIGGFYALS PYPGLRLISL NMNFCSRENF WLLINSTDPA
GQLQWLVGEL QAAEDRGDKV HIIGHIPPGH CLKSWSWNYY RIVARYENTL
AAQFFGHTHV DEFEVFYDEE TLSRPLAVAF LAPSATTYIG LNPGYRVYQI
DGNYSGSSHV VLDHETYILN LTQANIPGAI PHWQLLYRAR ETYGLPNTLP
TAWHNLVYRM RGDMQLFQTF WFLYHKGHPP SEPCGTPCRL ATLCAQLSAR
ADSPALCRHL MPDGSLPEAQ SLWPRPLFC (SEQ ID NO:5)
Композиции на основе рекомбинантной человеческой кислой сфингомиелиназы
[0039] Композиции по настоящему изобретению содержат рекомбинантную человеческую ASM и проявляет превосходную стабильность относительно фермента. "Стабильный" или "стабильность" относятся к способности активного ингредиента в композиции сохранять свою физическую стабильность, химическую стабильность и/или биологическую активность во время хранения и/или при воздействии физического или химического стресса. Стабильность может быть в контексте выбранной температуры, например в условиях охлаждения (например, 2-8°C) или при комнатной температуре (например, 23-25°C), в течение выбранного периода времени, например 16 недель, 24 недель, 36 недель, четырех месяцев, шести месяцев, одного года, двух лет, трех лет или дольше. Стабильность белка можно измерить с помощью анализов, которые проводят в течение более короткого периода времени, но результаты которых указывают на стабильность в клинических условиях. Такие анализы включают анализы с замораживанием/размораживанием, в которых композиция на основе белка подвергается одному или нескольким циклам замораживания-размораживания; или анализы с перемешиванием, когда композиция на основе белка подвергается механической обработке перемешиванием в течение заранее определенного периода. Стабильность белка может быть определена путем хранения композиции на основе белка при определенной температуре хранения (например, 2-8°C) в течение выбранного периода времени и анализа ее структурных и функциональных характеристик, таких как степень димеризации или агрегации (например, измеренные с помощью эксклюзионной HPLC или белкового геля), деградация белка (например, измеренная с помощью эксклюзионной HPLC или белкового геля), изменение цвета композиции, прозрачность жидкой композиции, ферментативная активность, содержание и состав гликанов, аффинность связывания рецептора, остаточное окисление метионина и биологическая активность композиции.
[0040] Композиции по настоящему изобретению содержат один или несколько фармацевтически приемлемых наполнителей. "Наполнитель" относится к инертному веществу, которое используется в качестве разбавителя, переносчика, носителя, консерванта, связующего или стабилизирующего средства для активного(ых) ингредиента(ов) лекарственного средства. Например, композиции могут содержать буферное средство, изотоническое средство и/или стабилизирующее средство, такое как антиоксидант. В некоторых случаях одно средство может служить для более чем одной из этих целей. В некоторых вариантах осуществления композиция по настоящему изобретению содержит рекомбинантную человеческую ASM, такую как олипудаза альфа, буферное средство, такое как фосфат натрия или цитрат натрия, стабилизатор, такой как L-метионин, и сахар, который не восстанавливается, такой как сахароза или трегалоза. Человеческая ASM обладает улучшенной стабильностью благодаря особому составу композиции. Композиции по настоящему изобретению могут быть водными жидкими растворами или лиофилизированными препаратами.
Жидкие композиции
[0041] В некоторых вариантах осуществления композиция представляет собой водную жидкую композицию, содержащую 1-10 мг/мл (например, 3-5 мг/мл) rhASM (например, олипудаза альфа); 10-50 мМ (например, 10-30 мМ) фосфата натрия; 70-150 мМ (например, 80-120 мМ) метионина (например, L-метионин) и 1-10% (например, 4-6%) вес/об. сахарозы или трегалозы. PH водной жидкой композиции может составлять 5-8 (например, 6-7).
[0042] В некоторых вариантах осуществления водная жидкая композиция не содержит выявляемое количество маннита, наиболее доступного кристаллического наполнителя, поскольку он может значительно усилить агрегацию человеческой ASM во время или после лиофилизации водной жидкой композиции, описанной в данном документе.
[0043] В некоторых вариантах осуществления водная жидкая композиция содержит 0,004-0,008%, 0,005-0,007% или 0,005% вес/об. поверхностно-активного(ых) вещества(веществ). Примеры поверхностно-активных веществ включают неионные детергенты, такие как полисорбаты (например, полисорбаты 20 и 80) и полоксамеры (например, полоксамер 188). В конкретном варианте осуществления водная жидкая композиция содержит 0,005% полисорбата 80. В некоторых случаях присутствие поверхностно-активного(ых) вещества(веществ) может помочь снизить мутность жидкой композиции.
[0044] В некоторых вариантах осуществления водная жидкая композиция содержит не более 0,05, 0,01 или 0,005 мМ хелатирующего(ых) средства(средств), такого как EDTA и EGTA; в иллюстративном варианте осуществления водная жидкая композиция не содержит выявляемого количества хелатирующего(их) средства(средств). В некоторых случаях присутствие хелатирующих средств в концентрации выше, например, 0,05 мМ или 0,1 мМ может увеличивать агрегацию человеческой ASM и снижать ее стабильность, особенно после длительного периода хранения, например в течение 12-16 недель, или после неохлажденных условий, например при 25°C.
[0045] В некоторых вариантах осуществления водная жидкая композиция может содержать 0-50 ppm (например, 15-30 ppm) цинка, который может быть, например, перенесен из производственного способа или добавлен извне.
[0046] В конкретном варианте осуществления водная жидкая композиция содержит или по сути состоит из 4 мг/мл олипудазы альфа, 20 мМ фосфата натрия, 100 мМ метионина и 5% (вес/об.) сахарозы и имеет pH 6,5. Термин "по сути состоит из" означает, что композиция не содержит других ингредиентов в выявляемых количествах или может содержать только следовые количества определенных материалов, полученных в процессе производства белка, если такие материалы не влияют на биологическую активность фермента или не приносят вред пациентам-людям.
[0047] В некоторых вариантах осуществления композиция представляет собой водную жидкую композицию, содержащую 1-20 мг/мл (например, 10 мг/мл) rhASM (например, олипудаза альфа) и 10-50 мМ (например, 20 мМ) фосфата натрия. В определенных вариантах осуществления водная жидкая композиция дополнительно содержит метионин (например, L-метионин) и сахарозу или трегалозу. В определенных вариантах осуществления водная жидкая композиция дополнительно содержит 80-120 мМ (например, 100 мМ) метионина и 4-6% (например, 5%) (вес/об.) сахарозы. В конкретных вариантах осуществления водная жидкая композиция имеет pH 6,5.
[0048] В некоторых вариантах осуществления композиция представляет собой водную жидкую композицию, содержащую 1-50 мг/мл (например, 3,8, 18 или 49 мг/мл) rhASM (например, олипудаза альфа) и 10-50 мМ (например, 20 мМ) фосфата натрия. В определенных вариантах осуществления водная жидкая композиция дополнительно содержит 1-15% (например, 5%, 6%, 7% или 8%) сахарозы или трегалозы. В определенных вариантах осуществления водная жидкая композиция дополнительно содержит 80-120 мМ (например, 100 мМ) метионина. В конкретных вариантах осуществления водная жидкая композиция имеет pH 6,5. Композиция может включать, например, 3,8 мг/мл rhASM, 20 мМ фосфата натрия и 5% сахарозы; 18 мг/мл rhASM, 20 мМ фосфата натрия и 5% сахарозы; или 49 мг/мл rhASM, 20 мМ фосфата и 8% сахарозы.
[0049] Водные жидкие композиции могут быть получены путем смешивания человеческой ASM, полученной с помощью рекомбинантной технологии, а затем очищенной из клеток-хозяев, с описанными в данном документе наполнителями в воде и доведения полученной смеси до необходимого pH. Например, человеческая ASM и необходимые наполнители могут быть добавлены или заменены буфером на натрий-фосфатный буфер с необходимой концентрацией фосфата натрия и pH.
[0050] В некоторых вариантах осуществления водная жидкая композиция может быть получена путем восстановления лиофилизированной композиции по настоящему изобретению, дополнительно подробно описанной ниже. Восстановление может быть выполнено с помощью фармацевтически приемлемой жидкости, такой как стерильная вода, физиологический раствор (например, 0,9% хлорида натрия) или физиологический раствор с фосфатным буфером.
Лиофилизированные композиции
[0051] Настоящее изобретение также предусматривает лиофилизированные композиции. Такие композиции могут быть получены посредством лиофилизации водных жидких композиций, описанных в данном документе. Лиофилизированные композиции подходят для длительного хранения. Лиофилизацию можно проводить способами, известными в уровне техники. Например, жидкую композицию можно охлаждать до температуры ниже нуля (по Цельсию) (например, от -5°C до -80°C), которая предусматривает замораживание, а затем поместить в камеру низкого давления (частичный вакуум), чтобы позволить произойти сублимации (первичное высушивание); где желательно, температура композиции может быть повышена на второй стадии высушивания (вторичное высушивание) для дальнейшего удаления нежелательных молекул воды. В некоторых вариантах осуществления после завершения процесса лиофилизации инертный газ, такой как азот, может быть введен в контейнер с композицией (например, стеклянный флакон) перед герметизацией контейнера.
[0052] В некоторых вариантах осуществления настоящее изобретение предусматривает порошковые композиции, которые можно получить, например, путем высушивания распылением водных жидких композиций, описанных в данном документе. Высушенные распылением композиции подходят для длительного хранения. Высушивание распылением можно проводить способами, известными из уровня техники. Например, жидкую композицию можно пропускать через распылитель или распыляющее сопло, чтобы распространить ее в виде крошечных капелек контролируемого размера в поток горячего газа в камере, что приводит к быстрому высыханию жидкой композиции до порошка. Затем высушенный порошок может собираться на дне сушильной камеры. Также предусмотрены другие способы высушивания для получения порошковых композиций.
[0053] Авторы настоящего изобретения неожиданно обнаружили, что сахароза (или трегалоза) и метионин, присутствующие в описанных в данном документе количествах, обеспечивают превосходные результаты во время лиофилизации; лиофилизированные продукты образуют ясный осадок, сохраняя при этом стабильность человеческой ASM во время хранения. Человеческая ASM в лиофилизированных композициях по настоящему изобретению может оставаться свободной от агрегации и биологически активной в течение по меньшей мере 4 месяцев (например, по меньшей мере 6 месяцев или по меньшей мере 12 месяцев) в условиях охлаждения (например, при 0-10°C, 2-8°C или 4°C).
[0054] В некоторых вариантах осуществления композиция настоящего изобретения представляет собой лиофилизированную фармацевтическую композицию, содержащую 4-50% олипудазы альфа, 3-7% фосфата натрия и 45-90% сахарозы (все процентные показатели в вес/вес). В определенных вариантах осуществления лиофилизированная композиция содержит 5,5% олипудазы альфа, 20,6% L-метионина, 2,3% гептагидрата двухосновного фосфата натрия, 2,6% моногидрата одноосновного фосфата натрия и 69,0% сахарозы (все процентные показатели в вес/вес). В определенных вариантах осуществления лиофилизированная композиция содержит 6,6% олипудазы альфа, 3,0% гептагидрата двухосновного фосфата натрия, 3,3% моногидрата одноосновного фосфата натрия и 87,1% сахарозы (все процентные показатели в вес/вес). В определенных вариантах осуществления лиофилизированная композиция содержит 25,2% олипудазы альфа, 2,4% гептагидрата двухосновного фосфата натрия, 2,6% моногидрата одноосновного фосфата натрия и 69,9% сахарозы (все процентные показатели в вес/вес). В определенных вариантах осуществления лиофилизированная композиция содержит 47,8% олипудазы альфа, 1,7% гептагидрата двухосновного фосфата натрия, 1,8% моногидрата одноосновного фосфата натрия и 48,8% сахарозы (все процентные показатели в вес/вес).
[0055] В некоторых вариантах осуществления композиция настоящего изобретения представляет собой лиофилизированную фармацевтическую композицию, содержащую 4-7% олипудазы альфа, 15-25% L-метионина, 3-7% фосфата натрия и 65-75% сахарозы (все процентные содержания в вес/вес). В конкретном варианте осуществления лиофилизированная композиция содержит 5,5% олипудазы альфа, 20,5% L-метионина, 2,3% гептагидрата двухосновного фосфата натрия, 2,6% моногидрата одноосновного фосфата натрия и 68,6% сахарозы (все процентные показатели в вес/вес). В определенных вариантах осуществления лиофилизированная композиция может также содержать, например, 0,1%, 0,2%, 0,3%, 0,4%, 0,5%, 0,6%, 0,7%, 0,8%, 0,9% или 1,0% влаги.
[0056] В некоторых вариантах осуществления настоящее изобретение предусматривает флакон, содержащий лиофилизированную фармацевтическую композицию, содержащую 15-25 мг олипудазы альфа, 75-85 мг L-метионина, 15-25 мг фосфата натрия и 250-300 мг сахарозы. Перед использованием композицию можно развести в 4-6 мл стерильной воды.
[0057] В некоторых вариантах осуществления флакон содержит лиофилизированную фармацевтическую композицию, содержащую или состоящую из 21,2 мг, 20,1 мг, 95,4 мг или 259,7 мг олипудазы альфа; 9,0 мг гептагидрата двухосновного фосфата натрия; 10,0 мг моногидрата одноосновного фосфата натрия и 265 мг сахарозы. Лиофилизированная композиция может необязательно содержать 79,1 мг L-метионина. Лиофилизированная фармацевтическая композиция может необязательно содержать 0-0,3 мг (например, 0,08-0,16 мг) цинка, который может быть, например, перенесен из производственного способа или добавлен извне. В определенных вариантах осуществления флакон может иметь внутренне стерильную атмосферу, заполненную азотом. В конкретном варианте осуществления лиофилизированная композиция может быть восстановленав 5,1 мл стерильной воды для получения концентрации олипудазы альфа приблизительно 4,0 мг/мл, 3,8 мг/мл, 18 мг/мл или 49 мг/мл соответственно. Восстановленная композиция может быть дополнительно разбавлена0,9% раствором хлорида натрия до определенного объема в зависимости от вводимой дозы.
[0058] В конкретном варианте осуществления флакон содержит лиофилизированную фармацевтическую композицию, содержащую или состоящую из 21,2 мг олипудазы альфа, 79 мг L-метионина, 9,0 мг гептагидрата двухосновного фосфата натрия, 10,0 мг моногидрата одноосновного фосфата натрия и 265 мг сахарозы. Лиофилизированная фармацевтическая композиция может необязательно содержать 0-0,3 мг (например, 0,08-0,16 мг) цинка, который может быть, например, перенесен из производственного способа или добавлен извне. В определенных вариантах осуществления лиофилизированная фармацевтическая композиция находится в форме осадка или лиофилизированного порошка. В определенных вариантах осуществления флакон может иметь внутренне стерильную атмосферу, заполненную азотом. В конкретном варианте осуществления лиофилизированная композиция может быть восстановлена в 5,1 мл стерильной воды для получения концентрации олипудазы альфа приблизительно 4,0 мг/мл. Восстановленная композиция может быть дополнительно разбавлена0,9% раствором хлорида натрия до определенного объема в зависимости от вводимой дозы.
[0059] В некоторых вариантах осуществления настоящее изобретение предусматривает флакон, содержащий лиофилизированную фармацевтическую композицию, содержащую 3-5 мг олипудазы альфа, 15-17 мг L-метионина, 3-5 мг фосфата натрия и 50-60 мг сахарозы. Перед использованием композицию можно развести в 0,8-1,2 мл стерильной воды.
[0060] В конкретном варианте осуществления флакон содержит лиофилизированную фармацевтическую композицию, содержащую или состоящую из 4,8 мг олипудазы альфа, 17,9 мг L-метионина, 2,0 мг гептагидрата двухосновного фосфата натрия, 2,3 мг моногидрата одноосновного фосфата натрия и 60 мг сахарозы. В определенных вариантах осуществления лиофилизированная фармацевтическая композиция находится в форме осадка или лиофилизированного порошка. Лиофилизированная композиция может необязательно содержать 0-0,06 мг цинка, который может быть, например, перенесен из производственного способа или добавлен извне. В определенных вариантах осуществления флакон может иметь внутренне стерильную атмосферу, заполненную азотом. В конкретном варианте осуществления лиофилизированная композиция может быть восстановлена в 1,1 мл стерильной воды для получения концентрации олипудазы альфа приблизительно 4,0 мг/мл. Восстановленная композиция может быть дополнительно разбавлена0,9% раствором хлорида натрия до определенного объема в зависимости от вводимой дозы.
Изделия
[0061] Композиции по настоящему изобретению могут подаваться в изделии (например, набор), которое включает инструкции по применению и, опционально, другие терапевтические средства для лечения расстройств, ассоциированных с ASM. Фармацевтически активный ингредиент в изделиях (например, rhASM) может поставляться в количестве, которое можно легко вводить в соответствии с описанными в данном документе схемами дозирования. Например, "стартовый набор" может включать несколько флаконов с различными количествами rhASM для применения в режиме с эскалацией дозы.
[0062] Например, изделие может включать флакон, содержащий 15-25 мг олипудазы альфа, 75-85 мг L-метионина, 15-25 мг фосфата натрия и 250-300 мг сахарозы. В конкретном варианте осуществления изделие предусматривает лиофилизированную композицию, содержащую или состоящую из 21,2 мг олипудазы альфа, 79 мг L-метионина, 9,0 мг гептагидрата двухосновного фосфата натрия, 10,0 мг моногидрата одноосновного фосфата натрия и 265 мг сахарозы.
[0063] В качестве другого примера, изделие может включать флакон, содержащий 3-5 мг олипудазы альфа, 15-17 мг L-метионина, 3-5 мг фосфата натрия и 50-60 мг сахарозы. В конкретном варианте осуществления изделие предусматривает лиофилизированную композицию, содержащую или состоящую из 4,8 мг олипудазы альфа, 17,9 мг L-метионина, 2,0 мг гептагидрата двухосновного фосфата натрия, 2,3 мг моногидрата одноосновного фосфата натрия и 60 мг сахарозы.
[0064] В некоторых вариантах осуществления изделие может дополнительно включать раствор (например, стерильную воду, 0,9% хлорида натрия и/или фосфатно-солевой буфер) для восстановления лиофилизированной композиции и/или дополнительного разбавления восстановленной композиции перед введением пациенту.
Применение композиций на основе кислой сфингомиелиназы
[0065] Фармацевтические композиции по настоящему изобретению можно вводить парентерально пациенту, нуждающемуся в этом, в качестве терапии с замещением ферментов. "Парентеральное введение" относится к способам введения, отличным от энтерального и местного введений, обычно путем инъекции. Парентеральное введение включает, без ограничения, внутривенную инфузию или инъекцию, а также внутримышечную, внутрикожную, внутрибрюшинную и подкожную инъекции. В конкретном варианте осуществления фармацевтическая композиция вводится посредством внутривенной инфузии.
[0066] Подходящий уровень дозы фармацевтической композиции, описанной в данном документе, может быть определен на основе множества факторов, включая возраст пациента, вес, болезненное состояние, общее состояние здоровья и анамнез, а также путь и частоту введения лекарственного средства, фармакодинамику и фармакокинетику активного ингредиента ASM в лекарственном средстве и любых других лекарственных средствах, которые пациент может принимать одновременно. В некоторых вариантах осуществления описанная в данном документе фармацевтическая композиция может вводиться в соответствии со схемой дозирования, описанной, например, в патенте США 9655954 (Schuchman et al.). Например, пациент может получать возрастающие дозы человеческой ASM, при этом концентрация дозы начинается, например, с 0,1 мг/кг или ниже, и заканчивается на уровне 3 мг/кг (поддерживающая доза) или ниже, в зависимости от возраста пациента и состояния. В некоторых вариантах осуществления первые одна или две дозы могут быть даны в концентрации дозы 0,03 мг/кг или 0,1 мг/кг для пациента педиатрического отделения или 0,1 мг/кг для взрослого пациента; после того, как пациент получил одну или две дозы, составляющие 0,03 и/или 0,1 мг/кг, пациенту затем вводят последующие последовательные дозы, составляющие 0,3 мг/кг, 0,3 мг/кг, 0,6 мг/кг, 0,6 мг/кг, 1,0 мг/кг, 2,0 мг/кг и 3,0 мг/кг. В определенных вариантах осуществления любая из указанных доз может быть повторена (например, дозы, составляющие 1,0 мг/кг и 2,0 мг/кг). Для некоторых пациентов концентрация дозы 3,0 мг/кг подходит для поддерживающей дозы, в то время как для других пациентов более низкая концентрация дозы может быть достаточной для поддержания. Интервалы между последовательными дозами могут составлять две недели, короче или больше двух недель, если врачом это будет сочтено целесообразным.
[0067] Настоящее изобретение предусматривает способ применения фармацевтической композиции, описанной в данном документе, для лечения ASMD у пациента, нуждающегося в этом, фармацевтическая композиция, описанная в данном документе, для применения при лечении ASMD у пациента, нуждающегося в этом, и применение фармацевтической композиции, описанной в данном документе, для изготовления лекарственного препарата для лечения ASMD у пациента, нуждающегося в этом. В некоторых вариантах осуществления фармацевтическая композиция может быть лиофилизированной композицией, которую можно восстановить в фармацевтически приемлемой жидкости, такой как стерильная вода, 0,9% раствор хлорида натрия или фосфатно-солевой буфер.
[0068] Пациенты могут быть взрослыми (например, пациенты 18 лет и старше, включая пожилых пациентов 65 лет и старше). Пациенты могут быть пациентами педиатрического отделения (пациентами моложе 18 лет, например пациентами от новорожденных до 6 лет, от 6 до 12 лет или от 12 до 18 лет). В некоторых вариантах осуществления пациенты могут иметь NPD A/B или NPD B. В некоторых вариантах осуществления пациенты могут иметь NPD A. В конкретных вариантах осуществления фармацевтическая композиция предназначена для лечения взрослого пациента или пациента педиатрического отделения с хроническим висцеральным ASMD (NPD B). В конкретных вариантах осуществления фармацевтическая композиция предназначена для лечения отличных от неврологических проявлений ASMD у взрослого пациента или пациента педиатрического отделения.
Иллюстративные варианты осуществления
[0069] Дополнительные конкретные варианты осуществления настоящего изобретения описаны, как указано далее.
1. Композиция, содержащая рекомбинантную человеческую кислую сфингомиелиназу, фосфат натрия, метионин и сахарозу.
2. Композиция по варианту осуществления 1, где композиция представляет собой лиофилизированную композицию, содержащую:
4-7% вес/вес олипудазы альфа (SEQ ID NO:2),
3-7% вес/вес фосфата натрия,
15-25% вес/вес L-метионина и
65-75% вес/вес сахарозы.
3. Композиция по варианту осуществления 2, по сути состоящая из:
5,5% вес/вес олипудазы альфа,
2,3% вес/вес гептагидрата двухосновного фосфата натрия,
2,6% вес/вес моногидрата одноосновного фосфата натрия,
20,5% вес/вес L-метионина и
68,6% вес/вес сахарозы.
4. Композиция по варианту осуществления 1, где композиция представляет собой водную жидкую композицию, содержащую:
1-10 мг/мл олипудазы альфа,
10-50 мМ фосфата натрия,
70-150 мМ L-метионина и
1-10% вес/об. сахарозы,
где композиция имеет pH 5-8.
5. Композиция по варианту осуществления 4, где композиция представляет собой водную жидкую композицию, содержащую:
3-5 мг/мл олипудазы альфа,
10-30 мМ фосфата натрия,
80-120 мМ L-метионина и
4-6% вес/об. сахарозы,
где композиция имеет pH 6-7.
6. Композиция по варианту осуществления 4, по сути состоящая из:
4 мг/мл олипудазы альфа,
20 мМ фосфата натрия,
100 мМ L-метионина и
5% вес/об. сахарозы,
где композиция имеет pH 6,5.
7. Композиция по любому из вариантов осуществления 4-6, дополнительно содержащая 0,005% вес/об. полисорбата 80.
8. Композиция, полученная посредством лиофилизации водной жидкой композиции по любому из вариантов осуществления 4-7.
9. Способ получения лиофилизированной композиции, включающий
получение водной жидкой композиции по любому из вариантов осуществления 4-7 и
лиофилизацию водной жидкой композиции.
10. Флакон, содержащий лиофилизированную композицию, по сути состоящую из:
21,2 мг олипудазы альфа,
9,0 мг гептагидрата двухосновного фосфата натрия,
10,0 мг моногидрата одноосновного фосфата натрия,
79 мг L-метионина и
265 мг сахарозы.
11. Водная жидкая композиция, полученная путем восстановления лиофилизированной композиции, по сути состоящей из:
21,2 мг олипудазы альфа,
9,0 мг гептагидрата двухосновного фосфата натрия,
10,0 мг моногидрата одноосновного фосфата натрия,
79 мг L-метионина и
265 мг сахарозы,
в 5,1 мл стерильной воды.
12. Флакон, содержащий лиофилизированную композицию, по сути состоящую из:
4,8 мг олипудазы альфа,
2,0 мг гептагидрата двухосновного фосфата натрия,
2,3 мг моногидрата одноосновного фосфата натрия,
17,9 мг L-метионина и
60 мг сахарозы.
13. Водная жидкая композиция, полученная путем восстановления лиофилизированной композиции, по сути состоящей из:
4,8 мг олипудазы альфа,
2,0 мг гептагидрата двухосновного фосфата натрия,
2,3 мг моногидрата одноосновного фосфата натрия,
17,9 мг L-метионина и
60 мг сахарозы,
в 1,1 мл стерильной воды.
14. Изделие, содержащее флакон по варианту осуществления 10 или 12, и при этом флакон содержит стерильную воду, 0,9% хлорида натрия или фосфатно-солевой буфер для восстановления лиофилизированной композиции.
15. Способ лечения недостаточности кислой сфингомиелиназы (ASMD) у пациента-человека, включающий введение пациенту композиции по любому из вариантов осуществления 1-8, 11 и 13, где композицию восстанавливают в жидкую форму перед введением, если она представляет собой лиофилизированную композицию.
16. Композиция по любому из вариантов осуществления 1-8, 11 и 13 для применения в лечении ASMD у пациента-человека.
17. Применение композиции по любому из вариантов осуществления 1-8, 11 и 13 для изготовления лекарственного препарата для лечения ASMD у пациента-человека.
18. Способ по варианту осуществления 15, композиция для применения по варианту осуществления 16 или применение по варианту осуществления 17, где ASMD представляет собой болезнь Ниманна-Пика типа A/B или типа B.
19. Способ, композиция для применения или применение по варианту осуществления 18, где лечение предназначено для отличных от неврологических проявлений ASMD.
[0070] Все публикации и другие ссылки, упомянутые в данном документе, включены посредством ссылки в полном объеме. Хотя ряд документов цитируется в данном документе, цитирование ссылок не является признанием того, что любой из этих документов образует часть общеизвестных знаний в уровне техники. Если не указано иное в данном документе, то научные и технические термины, используемые в связи с настоящим изобретением, должны иметь значения, которые обычно понимаются специалистами в данной области. Примерные способы и материалы описаны ниже, хотя способы и материалы, аналогичные или эквивалентные описанным в данном документе, могут быть использованы на практике или при тестировании настоящего изобретения. В случае противоречий настоящее описание, в том числе определения, будут иметь преимущественную силу. Как правило, номенклатура, используемая в связи с клеточной и тканевой культурами, молекулярной биологией, микробиологией, генетикой, аналитической химией, синтетической органической химией, медицинской и фармацевтической химией, а также химией белков и нуклеиновых кислот, описанными в данном документе, а также их методиками, является такой, которая хорошо известна и обычно используется в уровне техники. Ферментативные реакции и методики очистки выполняют в соответствии с описаниями производителя, как обычно осуществляется в уровне техники, или как описано в данном документе. Кроме того, если иное не требуется по контексту, термины единственного числа включают множественное число, а термины множественного числа включают единственное число. Во всем данном описании и вариантах осуществления слова "иметь" и "содержать" или варианты, такие как "имеет", "имеющий", "содержит" или "содержащий", следует понимать как подразумевающие включение указанного целого числа или группы целых чисел, но не исключение любого другого целого числа или группы целых чисел.
[0071] Для лучшего понимания настоящего изобретения представлены следующие примеры. Эти примеры приведены только в целях иллюстрации и не должны рассматриваться как ограничивающие объем настоящего изобретения каким-либо образом.
ПРИМЕРЫ
Пример 1. Состав на основе рекомбинантной человеческой кислой сфингомиелиназы
[0072] В этом примере описаны исследования, в которых оценивали стабильность различных водных жидких и лиофилизированных композиций олипудазы альфа.
Материалы и способы
Мутность раствора
[0073] Опалесценцию раствора оценивали с помощью спектроскопического анализа мутности. Оптическую плотность в диапазоне 340-360 нм использовали для установки диапазонов для ранее установленных категорий опалесценции на основе эталонных суспензий Европейской Фармакопеи при определенных значениях NTU. Анализ выполняли на спектрофотометре для микропланшетов SpectraMax Plus 384 (Molecular Devices, Саннивейл, штат Калифорния, США).
Агрегация
[0074] Агрегацию и анализ димеров выполняли с помощью SEC. Перед загрузкой во флаконы для HPLC каждый образец перемешивали с помощью пяти циклов осторожного пипетирования. SEC-анализ выполняли на приборе для HPLC серии 1100/1200 (Agilent, Санта-Клара, штат Калифорния, США), оснащенном аналитической колонкой TSKgel G3000SWXL (Tosoh Bioscience, Токио, Япония) и соответствующей защитной колонкой. Используемая подвижная фаза представляла собой 20 мМ фосфат натрия при pH 6, 200 мМ хлорида натрия с установленной скоростью потока 0,5 мл/мин.-1 в течение 35 минут. Для каждого образца было выполнено три инъекции примерно по 80 мкг. Выявление проводили по поглощению в УФ-области при 280 нм.
[0075] Уровень высокомолекулярных соединений (HMWS) относящихся к олипудазе альфа, определяли с помощью SDS-PAGE в невосстанавливающих условиях с последующим окрашиванием кумасси синим. Эталонный стандарт олипудазы альфа включали в каждый гель. Образцы олипудазы альфа смешивали с образцом буфера и загружали в гель с градиентом 4-20% трис-глицина вместе с маркерами молекулярной массы. После электрофореза при заданном значении 125 В в течение примерно 2 часов гели окрашивали кумасси синим и обесцвечивали в метаноле, уксусной кислоте и воде для HPLC. Денситометрический анализ был выполнен для получения количественных результатов определения процентного отношения полос HMWS ко всем наблюдаемым полосам.
Ферментная активность
[0076] Образцы rhASM разбавляли 2000:1 в пробирках для библиотеки объемом 1,2 мл. В этой процедуре измеряли скорость гидролиза 2-(N-гексадеканоиламино)-4-нитрофенилфосфорилхолина (HDA-PC) при 37°C, катализируемого rhASM. Высвободившийся хромофор измеряли по поглощению при 415 нм с применением спектрофотометра для микропланшетов SpectraMax Plus 384. Одну единицу активности rhASM определяли как количество фермента, которое обеспечивает образование одного мкмоля 2-(N-гексадеканоиламино)-4-нитрофенола в минуту из HDA-PC в указанных условиях анализа.
Концентрация белка
[0077] Концентрацию белка в образцах rhASM определяли по поглощению при 280 нм. Образцы разбавляли в двух повторностях до 1:10 и 1:20, используя соответствующий буфер. Поглощение при 280 нм определяли на спектрофотометре для микропланшетов SpectraMax Plus 384.
pH
[0078] Анализ pH образца выполняли на pH-метре Thermo Electron Microprobe (Thermo Scientific, Беверли, штат Массачусетс, США). Применяли стеклянный датчик Thermo Orion 8203BN PerHecT Ross Semi micro (Thermo Scientific).
Дифференциальный сканирующий калориметр
[0079] Анализ с помощью дифференциального сканирующего калориметра (DSC) выполняли с применением микрокалориметра CAP-VP-DSC (MicroCal-GE Healthcare, Нортгемптон, штат Массачусетс, США). Образцы разбавляли до 0,4 мг/мл подходящим буфером. Образцы анализировали со скоростью сканирования 200°C/час в диапазоне от 15 до 100°C. Анализ данных выполняли в пакете программ Origin 7.0 (OriginLab Corp., Нортгемптон, штат Массачусетс, США), оснащенном вспомогательными компонентами для DSC-анализа (MicroCal-GE Healthcare).
Результаты
Оценка буфер и pH
[0080] Различные значения pH буферов и типы буферов оценивали в отношении их влияния на стабильность rhASM. Анализы проводили путем инкубации 4 мг/мл олипудазы альфа в 20 мМ буфере при 30°C в течение двух недель и оценки физической и функциональной стабильности фермента (фиг. 1A-1C).
[0081] Значительную степень нестабильности, как физической, так и функциональной, для олипудазы альфа наблюдали при pH ниже 6,0. Ферментативная активность резко снижалась при pH ниже 6,0, но оставалась относительно постоянной при pH 6,0 и выше (фиг. 1A). Склонность к агрегации была минимальной в диапазоне pH от 5,5 до 6,5. Стремительное увеличение уровня агрегации наблюдали при pH ниже 5,5 и постепенное увеличение уровня агрегации наблюдали при pH выше 6,5 (фиг. 1B). При сопоставимых значениях pH стабильность была выше в фосфатном буфере по сравнению с цитратным/фосфатным буфером. Эти тенденции стабильности соответствовали данным, полученным в результате анализа образцов, хранящихся при температуре охлаждения. Постепенно повышающиеся уровни агрегации, наблюдаемые при pH выше 6,5, были подтверждены с помощью DSC-анализа, который показал пониженную термостабильность при более высоких значениях pH в фосфатном буфере (фиг. 1C). На основании этих данных натрий-фосфатный буфер со значением pH приблизительно 6,5 был определен в качестве подходящей буферной системы для состава на основе rhASM.
[0082] Затем влияние ионной силы или концентрации буфера на стабильность оценивали путем изменения концентрации фосфата натрия от 10 мМ до 100 мМ. Как показано на фиг. 2A и 2B, ионная сила при низких концентрациях буфера (10 мМ, 20 мМ или 50 мМ) мало влияла на ферментативную активность и физическую стабильность олипудазы альфа. Стабильность олипудазы альфа в фосфате натрия с pH 6,5 была относительно постоянной в случае концентраций буфера 50 мМ и ниже. Однако наблюдали заметное снижение стабильности при увеличении концентрации фосфата натрия до 100 мМ. Такая концентрация приводила к быстрому увеличению количества агрегированных соединений и сопутствующему снижению активности (фиг. 2A и 2B). Данные, полученные при 30°C, соответствовали данным, полученным при хранении олипудазы альфа в условиях охлаждения. Концентрация фосфата натрия 20 мМ была выбрана в качестве концентрации буфера, которая, будучи низкой, все же обеспечивала достаточную буферную емкость.
Оценка вспомогательных веществ
[0083] Различные фармацевтически приемлемые вспомогательные вещества оценивали в отношении их влияния на стабильность олипудазы альфа в жидких и лиофилизированных композициях. Сначала исследовали влияние известных стабилизаторов, действующих по механизму предпочтительного исключения, на стабильность жидкости (см., например, Timasheff, Proc Nat Acad Sci USA). 99: 9721-9726 (2002); и Lee et al., J. Biol. Chem. 256:7193-7201 (1981)). Сахарозу, трегалозу и пропиленгликоль добавляли к основному составу 20 мМ фосфата натрия, 0,005% PS80, pH 6,5, и оценивали их влияние на ферментативную активность и физическую стабильность олипудазы альфа 4 мг/мл. Данные показали, что присутствие любого из этих стабилизаторов, действующих по механизму предпочтительного исключения, не повышало стабильность олипудазы альфа в жидком состоянии при 5 или 30°C (данные не показаны). Хотя потерю ферментативной активности и физической стабильности наблюдали во всех изученных условиях, сахароза оказалась немного более предпочтительной, чем трегалоза и пропиленгликоль.
[0084] Затем исследовали влияние сахарозы и трегалозы на стабильность олипудазы альфа во время сублимационной сушки. Также исследовали маннит, поскольку он является объемообразующим средством, обычно используемым при сублимационной сушке (фиг. 3A и 3B). Три полиола в количестве 5% вес./об. включали в жидкие композиции, которые затем лиофилизировали. Данные на фиг. 3А показывают, что добавление маннита снижало ферментативную активность олипудазы альфа после сублимационной сушки. Данные на фиг. 3B показывают, что добавление маннита приводило к значительному увеличению уровня агрегации белка после сублимационной сушки. Увеличение уровня агрегации в присутствии сахарозы и трегалозы было минимальным. Сахароза была выбрана в качестве криопротектора при концентрации 5% вес./об. в жидких композициях, которые затем могут быть лиофилизированы.
[0085] Также исследовали стабильность лиофилизированных составов на основе олипудазы альфа в зависимости от времени в присутствии маннита. Олипудазу альфа получали путем сублимационной сушки из жидких композиций, содержащих 20 мМ натрий-фосфатный буфер (pH 6,5), 0,005% PS80 и (i) 5% вес./об. маннита, (ii) 5% вес./об. сахарозы или (iii) 3% маннита и 2% сахарозы). Данные показывают, что маннит не только приводил к немедленному, а также длительному увеличению уровня агрегации белка во время сублимационной сушки при использовании отдельно, но он также приводил к этому при использовании в комбинации с сахарозой в течение шестимесячного периода (фиг. 3B и 4B). Ферментативная активность через шесть месяцев также была ниже в присутствии маннита, чем в отсутствие маннита (фиг. 4B). Соответственно, маннит был признан неподходящим объемообразующим средством для лиофилизированных составов на основе rhASM.
[0086] Поскольку маннит оказался вредным для стабильности rhASM во время сублимационной сушки, в качестве потенциального объемообразующего средства оценивали метионин. Оценивали ферментативную активность и физическую стабильность во время хранения олипудазы альфа в жидком состоянии в присутствии L-метионина, и было обнаружено, что добавление 100 мМ L-метионина не улучшало стабильность олипудазы альфа в жидком состоянии, но и не оказывало отрицательного влияния на нее при 5°C. Как показано на фиг. 5A и 5B, лиофилизированные композиции, полученные из жидких композиций, содержащих 100 мМ L-метионина, приводили к получению стабильной лиофилизированной конфигурации олипудазы альфа. Никаких изменений активности или агрегации не наблюдали в течение шести месяцев хранения при 5°C. Кроме того, осадки, полученные в результате сублимационной сушки олипудазы альфа в присутствии метионина и сахарозы, имели лучший внешний вид по сравнению с осадками, лиофилизированными только с сахарозой.
[0087] Определение подходящего количества метионина для лиофилизации проводили с помощью рентгеновской дифрактометрии (XRD) осадков олипудазы альфа, полученных путем лиофилизации из жидких композиций, содержащих 20 мМ фосфат натрия (pH 6,5), 5% вес./об. сахарозы и увеличивающиеся количества L-метионина (данные не показаны). Образец, не содержащий метионин, был полностью аморфным. Были некоторые доказательства кристаллизации в образцах, содержащих 33 мМ метионина, и в большей мере - в образцах, содержащих 66 мМ и 100 мМ метионина. Лиофилизация олипудазы альфа при уровнях метионина ниже 100 мМ (например, 10 мМ и 33 мМ) приводила к тому, что флаконы выглядели покрытыми углублениями и деформированными (сморщенными). Следовательно, в качестве объемообразующего средства для лиофилизированных составов на основе rhASM было выбрано 100 мМ метионин.
Пример 2. Устойчивость композиций на основе олипудазы альфа
[0088] Для оценки устойчивости композиций, содержащих олипудазу альфа, сахарозу и L-метионин, каждый из этих компонентов был установлен на пяти различных уровнях относительно контроля - низком, умеренно низком, центральном (контрольном), умеренно высоком и высоком - в 20 мМ натрий-фосфатном буфере (таблица 1).
Таблица 1. Уровни вспомогательных веществ для оценки устойчивости составов на основе олипудазы альфа
[0089] Всего было создано 26 вариантов жидкого состава (таблица 2). Составы 2 и 7 представляют собой контрольные составы или центральные точки. Остальные 24 варианта состава представляют различные условия вокруг центральных точек. Все 26 вариантов хранили при 2-8°C (24 недели или до 12 месяцев) и 25°C (16 недель) для мониторинга их стабильности.
Таблица 2. Составы на основе олипудазы альфа для оценки устойчивости
[0090] В конце периодов испытаний следующие параметры будут указывать на стабильность композиций: (1) внешний вид - прозрачный, бесцветный; (2) pH 6,0-7,0; (3) содержание агрегата - не более 3,0%; (4) содержание белка - 3,5-4,5 мг/мл; (5) HMWS - не более 15%; и (6) удельная активность - 11-42 ед./мг. На фиг. 6-8 показаны эффекты различных факторов в отношении % димера, удельной активности и % HMWS соответственно в 26 вариантах составов после 24 недель хранения при 2-8°C. Данные показывают, что не было значительной разницы между вариантами относительно % димера, удельной активности или % HMWS, и, таким образом, все 24 варианта вместе с двумя контрольными составами являлись стабильными при 2-8°C в течение 24 недель.
[0091] Для некоторых вариантов отсутствие значительных эффектов изменений pH и концентраций ингредиентов в отношении % димера и удельной активности также наблюдали через 36 недель. Из фиг. 9 видно, что через 36 недель все варианты характеризовались сопоставимым уровнем агрегации.
[0092] При повышенной температуре, составляющей 25°C, эффект вспомогательных веществ в отношении стабильности также был незначительным в течение 16 недель в тестируемых диапазонах. Наиболее заметный эффект наблюдали в вариантах с различным значением pH (фиг. 10). При более высоком значении pH (от 6,8 до 7,0) была большей степень стабильности олипудазы альфа, а при более низком значении pH (6,5 или ниже) большим был уровень агрегации и содержание димера.
[0093] Это исследование показывает, что варианты составов при 2-8°C являлись устойчивыми и стабильными в выбранных диапазонах компонентов.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Genzyme Corporation
<120> ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ НЕДОСТАТОЧНОСТИ КИСЛОЙ СФИНГОМИЕЛИНАЗЫ
<130> 022548.WO048
<150> 62/676,525
<151> 2018-05-25
<160> 6
<170> PatentIn версия 3.5
<210> 1
<211> 627
<212> БЕЛОК
<213> Homo sapiens
<400> 1
Met Ala Arg Tyr Gly Ala Ser Leu Arg Gln Ser Cys Pro Arg Ser Gly
1 5 10 15
Arg Glu Gln Gly Gln Asp Gly Thr Ala Gly Ala Pro Gly Leu Leu Trp
20 25 30
Met Gly Leu Ala Leu Ala Leu Ala Leu Ala Leu Ala Leu Ser Asp Ser
35 40 45
Arg Val Leu Trp Ala Pro Ala Glu Ala His Pro Leu Ser Pro Gln Gly
50 55 60
His Pro Ala Arg Leu His Arg Ile Val Pro Arg Leu Arg Asp Val Phe
65 70 75 80
Gly Trp Gly Asn Leu Thr Cys Pro Ile Cys Lys Gly Leu Phe Thr Ala
85 90 95
Ile Asn Leu Gly Leu Lys Lys Glu Pro Asn Val Ala Arg Val Gly Ser
100 105 110
Val Ala Ile Lys Leu Cys Asn Leu Leu Lys Ile Ala Pro Pro Ala Val
115 120 125
Cys Gln Ser Ile Val His Leu Phe Glu Asp Asp Met Val Glu Val Trp
130 135 140
Arg Arg Ser Val Leu Ser Pro Ser Glu Ala Cys Gly Leu Leu Leu Gly
145 150 155 160
Ser Thr Cys Gly His Trp Asp Ile Phe Ser Ser Trp Asn Ile Ser Leu
165 170 175
Pro Thr Val Pro Lys Pro Pro Pro Lys Pro Pro Ser Pro Pro Ala Pro
180 185 190
Gly Ala Pro Val Ser Arg Ile Leu Phe Leu Thr Asp Leu His Trp Asp
195 200 205
His Asp Tyr Leu Glu Gly Thr Asp Pro Asp Cys Ala Asp Pro Leu Cys
210 215 220
Cys Arg Arg Gly Ser Gly Leu Pro Pro Ala Ser Arg Pro Gly Ala Gly
225 230 235 240
Tyr Trp Gly Glu Tyr Ser Lys Cys Asp Leu Pro Leu Arg Thr Leu Glu
245 250 255
Ser Leu Leu Ser Gly Leu Gly Pro Ala Gly Pro Phe Asp Met Val Tyr
260 265 270
Trp Thr Gly Asp Ile Pro Ala His Asp Val Trp His Gln Thr Arg Gln
275 280 285
Asp Gln Leu Arg Ala Leu Thr Thr Val Thr Ala Leu Val Arg Lys Phe
290 295 300
Leu Gly Pro Val Pro Val Tyr Pro Ala Val Gly Asn His Glu Ser Thr
305 310 315 320
Pro Val Asn Ser Phe Pro Pro Pro Phe Ile Glu Gly Asn His Ser Ser
325 330 335
Arg Trp Leu Tyr Glu Ala Met Ala Lys Ala Trp Glu Pro Trp Leu Pro
340 345 350
Ala Glu Ala Leu Arg Thr Leu Arg Ile Gly Gly Phe Tyr Ala Leu Ser
355 360 365
Pro Tyr Pro Gly Leu Arg Leu Ile Ser Leu Asn Met Asn Phe Cys Ser
370 375 380
Arg Glu Asn Phe Trp Leu Leu Ile Asn Ser Thr Asp Pro Ala Gly Gln
385 390 395 400
Leu Gln Trp Leu Val Gly Glu Leu Gln Ala Ala Glu Asp Arg Gly Asp
405 410 415
Lys Val His Ile Ile Gly His Ile Pro Pro Gly His Cys Leu Lys Ser
420 425 430
Trp Ser Trp Asn Tyr Tyr Arg Ile Val Ala Arg Tyr Glu Asn Thr Leu
435 440 445
Ala Ala Gln Phe Phe Gly His Thr His Val Asp Glu Phe Glu Val Phe
450 455 460
Tyr Asp Glu Glu Thr Leu Ser Arg Pro Leu Ala Val Ala Phe Leu Ala
465 470 475 480
Pro Ser Ala Thr Thr Tyr Ile Gly Leu Asn Pro Gly Tyr Arg Val Tyr
485 490 495
Gln Ile Asp Gly Asn Tyr Ser Gly Ser Ser His Val Val Leu Asp His
500 505 510
Glu Thr Tyr Ile Leu Asn Leu Thr Gln Ala Asn Ile Pro Gly Ala Ile
515 520 525
Pro His Trp Gln Leu Leu Tyr Arg Ala Arg Glu Thr Tyr Gly Leu Pro
530 535 540
Asn Thr Leu Pro Thr Ala Trp His Asn Leu Val Tyr Arg Met Arg Gly
545 550 555 560
Asp Met Gln Leu Phe Gln Thr Phe Trp Phe Leu Tyr His Lys Gly His
565 570 575
Pro Pro Ser Glu Pro Cys Gly Thr Pro Cys Arg Leu Ala Thr Leu Cys
580 585 590
Ala Gln Leu Ser Ala Arg Ala Asp Ser Pro Ala Leu Cys Arg His Leu
595 600 605
Met Pro Asp Gly Ser Leu Pro Glu Ala Gln Ser Leu Trp Pro Arg Pro
610 615 620
Leu Phe Cys
625
<210> 2
<211> 570
<212> БЕЛОК
<213> Homo sapiens
<400> 2
His Pro Leu Ser Pro Gln Gly His Pro Ala Arg Leu His Arg Ile Val
1 5 10 15
Pro Arg Leu Arg Asp Val Phe Gly Trp Gly Asn Leu Thr Cys Pro Ile
20 25 30
Cys Lys Gly Leu Phe Thr Ala Ile Asn Leu Gly Leu Lys Lys Glu Pro
35 40 45
Asn Val Ala Arg Val Gly Ser Val Ala Ile Lys Leu Cys Asn Leu Leu
50 55 60
Lys Ile Ala Pro Pro Ala Val Cys Gln Ser Ile Val His Leu Phe Glu
65 70 75 80
Asp Asp Met Val Glu Val Trp Arg Arg Ser Val Leu Ser Pro Ser Glu
85 90 95
Ala Cys Gly Leu Leu Leu Gly Ser Thr Cys Gly His Trp Asp Ile Phe
100 105 110
Ser Ser Trp Asn Ile Ser Leu Pro Thr Val Pro Lys Pro Pro Pro Lys
115 120 125
Pro Pro Ser Pro Pro Ala Pro Gly Ala Pro Val Ser Arg Ile Leu Phe
130 135 140
Leu Thr Asp Leu His Trp Asp His Asp Tyr Leu Glu Gly Thr Asp Pro
145 150 155 160
Asp Cys Ala Asp Pro Leu Cys Cys Arg Arg Gly Ser Gly Leu Pro Pro
165 170 175
Ala Ser Arg Pro Gly Ala Gly Tyr Trp Gly Glu Tyr Ser Lys Cys Asp
180 185 190
Leu Pro Leu Arg Thr Leu Glu Ser Leu Leu Ser Gly Leu Gly Pro Ala
195 200 205
Gly Pro Phe Asp Met Val Tyr Trp Thr Gly Asp Ile Pro Ala His Asp
210 215 220
Val Trp His Gln Thr Arg Gln Asp Gln Leu Arg Ala Leu Thr Thr Val
225 230 235 240
Thr Ala Leu Val Arg Lys Phe Leu Gly Pro Val Pro Val Tyr Pro Ala
245 250 255
Val Gly Asn His Glu Ser Thr Pro Val Asn Ser Phe Pro Pro Pro Phe
260 265 270
Ile Glu Gly Asn His Ser Ser Arg Trp Leu Tyr Glu Ala Met Ala Lys
275 280 285
Ala Trp Glu Pro Trp Leu Pro Ala Glu Ala Leu Arg Thr Leu Arg Ile
290 295 300
Gly Gly Phe Tyr Ala Leu Ser Pro Tyr Pro Gly Leu Arg Leu Ile Ser
305 310 315 320
Leu Asn Met Asn Phe Cys Ser Arg Glu Asn Phe Trp Leu Leu Ile Asn
325 330 335
Ser Thr Asp Pro Ala Gly Gln Leu Gln Trp Leu Val Gly Glu Leu Gln
340 345 350
Ala Ala Glu Asp Arg Gly Asp Lys Val His Ile Ile Gly His Ile Pro
355 360 365
Pro Gly His Cys Leu Lys Ser Trp Ser Trp Asn Tyr Tyr Arg Ile Val
370 375 380
Ala Arg Tyr Glu Asn Thr Leu Ala Ala Gln Phe Phe Gly His Thr His
385 390 395 400
Val Asp Glu Phe Glu Val Phe Tyr Asp Glu Glu Thr Leu Ser Arg Pro
405 410 415
Leu Ala Val Ala Phe Leu Ala Pro Ser Ala Thr Thr Tyr Ile Gly Leu
420 425 430
Asn Pro Gly Tyr Arg Val Tyr Gln Ile Asp Gly Asn Tyr Ser Gly Ser
435 440 445
Ser His Val Val Leu Asp His Glu Thr Tyr Ile Leu Asn Leu Thr Gln
450 455 460
Ala Asn Ile Pro Gly Ala Ile Pro His Trp Gln Leu Leu Tyr Arg Ala
465 470 475 480
Arg Glu Thr Tyr Gly Leu Pro Asn Thr Leu Pro Thr Ala Trp His Asn
485 490 495
Leu Val Tyr Arg Met Arg Gly Asp Met Gln Leu Phe Gln Thr Phe Trp
500 505 510
Phe Leu Tyr His Lys Gly His Pro Pro Ser Glu Pro Cys Gly Thr Pro
515 520 525
Cys Arg Leu Ala Thr Leu Cys Ala Gln Leu Ser Ala Arg Ala Asp Ser
530 535 540
Pro Ala Leu Cys Arg His Leu Met Pro Asp Gly Ser Leu Pro Glu Ala
545 550 555 560
Gln Ser Leu Trp Pro Arg Pro Leu Phe Cys
565 570
<210> 3
<211> 629
<212> БЕЛОК
<213> Homo sapiens
<400> 3
Met Pro Arg Tyr Gly Ala Ser Leu Arg Gln Ser Cys Pro Arg Ser Gly
1 5 10 15
Arg Glu Gln Gly Gln Asp Gly Thr Ala Gly Ala Pro Gly Leu Leu Trp
20 25 30
Met Gly Leu Val Leu Ala Leu Ala Leu Ala Leu Ala Leu Ala Leu Ser
35 40 45
Asp Ser Arg Val Leu Trp Ala Pro Ala Glu Ala His Pro Leu Ser Pro
50 55 60
Gln Gly His Pro Ala Arg Leu His Arg Ile Val Pro Arg Leu Arg Asp
65 70 75 80
Val Phe Gly Trp Gly Asn Leu Thr Cys Pro Ile Cys Lys Gly Leu Phe
85 90 95
Thr Ala Ile Asn Leu Gly Leu Lys Lys Glu Pro Asn Val Ala Arg Val
100 105 110
Gly Ser Val Ala Ile Lys Leu Cys Asn Leu Leu Lys Ile Ala Pro Pro
115 120 125
Ala Val Cys Gln Ser Ile Val His Leu Phe Glu Asp Asp Met Val Glu
130 135 140
Val Trp Arg Arg Ser Val Leu Ser Pro Ser Glu Ala Cys Gly Leu Leu
145 150 155 160
Leu Gly Ser Thr Cys Gly His Trp Asp Ile Phe Ser Ser Trp Asn Ile
165 170 175
Ser Leu Pro Thr Val Pro Lys Pro Pro Pro Lys Pro Pro Ser Pro Pro
180 185 190
Ala Pro Gly Ala Pro Val Ser Arg Ile Leu Phe Leu Thr Asp Leu His
195 200 205
Trp Asp His Asp Tyr Leu Glu Gly Thr Asp Pro Asp Cys Ala Asp Pro
210 215 220
Leu Cys Cys Arg Arg Gly Ser Gly Leu Pro Pro Ala Ser Arg Pro Gly
225 230 235 240
Ala Gly Tyr Trp Gly Glu Tyr Ser Lys Cys Asp Leu Pro Leu Arg Thr
245 250 255
Leu Glu Ser Leu Leu Ser Gly Leu Gly Pro Ala Gly Pro Phe Asp Met
260 265 270
Val Tyr Trp Thr Gly Asp Ile Pro Ala His Asp Val Trp His Gln Thr
275 280 285
Arg Gln Asp Gln Leu Arg Ala Leu Thr Thr Val Thr Ala Leu Val Arg
290 295 300
Lys Phe Leu Gly Pro Val Pro Val Tyr Pro Ala Val Gly Asn His Glu
305 310 315 320
Ser Ile Pro Val Asn Ser Phe Pro Pro Pro Phe Ile Glu Gly Asn His
325 330 335
Ser Ser Arg Trp Leu Tyr Glu Ala Met Ala Lys Ala Trp Glu Pro Trp
340 345 350
Leu Pro Ala Glu Ala Leu Arg Thr Leu Arg Ile Gly Gly Phe Tyr Ala
355 360 365
Leu Ser Pro Tyr Pro Gly Leu Arg Leu Ile Ser Leu Asn Met Asn Phe
370 375 380
Cys Ser Arg Glu Asn Phe Trp Leu Leu Ile Asn Ser Thr Asp Pro Ala
385 390 395 400
Gly Gln Leu Gln Trp Leu Val Gly Glu Leu Gln Ala Ala Glu Asp Arg
405 410 415
Gly Asp Lys Val His Ile Ile Gly His Ile Pro Pro Gly His Cys Leu
420 425 430
Lys Ser Trp Ser Trp Asn Tyr Tyr Arg Ile Val Ala Arg Tyr Glu Asn
435 440 445
Thr Leu Ala Ala Gln Phe Phe Gly His Thr His Val Asp Glu Phe Glu
450 455 460
Val Phe Tyr Asp Glu Glu Thr Leu Ser Arg Pro Leu Ala Val Ala Phe
465 470 475 480
Leu Ala Pro Ser Ala Thr Thr Tyr Ile Gly Leu Asn Pro Gly Tyr Arg
485 490 495
Val Tyr Gln Ile Asp Gly Asn Tyr Ser Arg Ser Ser His Val Val Leu
500 505 510
Asp His Glu Thr Tyr Ile Leu Asn Leu Thr Gln Ala Asn Ile Pro Gly
515 520 525
Ala Ile Pro His Trp Gln Leu Leu Tyr Arg Ala Arg Glu Thr Tyr Gly
530 535 540
Leu Pro Asn Thr Leu Pro Thr Ala Trp His Asn Leu Val Tyr Arg Met
545 550 555 560
Arg Gly Asp Met Gln Leu Phe Gln Thr Phe Trp Phe Leu Tyr His Lys
565 570 575
Gly His Pro Pro Ser Glu Pro Cys Gly Thr Pro Cys Arg Leu Ala Thr
580 585 590
Leu Cys Ala Gln Leu Ser Ala Arg Ala Asp Ser Pro Ala Leu Cys Arg
595 600 605
His Leu Met Pro Asp Gly Ser Leu Pro Glu Ala Gln Ser Leu Trp Pro
610 615 620
Arg Pro Leu Phe Cys
625
<210> 4
<211> 570
<212> БЕЛОК
<213> Homo sapiens
<400> 4
His Pro Leu Ser Pro Gln Gly His Pro Ala Arg Leu His Arg Ile Val
1 5 10 15
Pro Arg Leu Arg Asp Val Phe Gly Trp Gly Asn Leu Thr Cys Pro Ile
20 25 30
Cys Lys Gly Leu Phe Thr Ala Ile Asn Leu Gly Leu Lys Lys Glu Pro
35 40 45
Asn Val Ala Arg Val Gly Ser Val Ala Ile Lys Leu Cys Asn Leu Leu
50 55 60
Lys Ile Ala Pro Pro Ala Val Cys Gln Ser Ile Val His Leu Phe Glu
65 70 75 80
Asp Asp Met Val Glu Val Trp Arg Arg Ser Val Leu Ser Pro Ser Glu
85 90 95
Ala Cys Gly Leu Leu Leu Gly Ser Thr Cys Gly His Trp Asp Ile Phe
100 105 110
Ser Ser Trp Asn Ile Ser Leu Pro Thr Val Pro Lys Pro Pro Pro Lys
115 120 125
Pro Pro Ser Pro Pro Ala Pro Gly Ala Pro Val Ser Arg Ile Leu Phe
130 135 140
Leu Thr Asp Leu His Trp Asp His Asp Tyr Leu Glu Gly Thr Asp Pro
145 150 155 160
Asp Cys Ala Asp Pro Leu Cys Cys Arg Arg Gly Ser Gly Leu Pro Pro
165 170 175
Ala Ser Arg Pro Gly Ala Gly Tyr Trp Gly Glu Tyr Ser Lys Cys Asp
180 185 190
Leu Pro Leu Arg Thr Leu Glu Ser Leu Leu Ser Gly Leu Gly Pro Ala
195 200 205
Gly Pro Phe Asp Met Val Tyr Trp Thr Gly Asp Ile Pro Ala His Asp
210 215 220
Val Trp His Gln Thr Arg Gln Asp Gln Leu Arg Ala Leu Thr Thr Val
225 230 235 240
Thr Ala Leu Val Arg Lys Phe Leu Gly Pro Val Pro Val Tyr Pro Ala
245 250 255
Val Gly Asn His Glu Ser Ile Pro Val Asn Ser Phe Pro Pro Pro Phe
260 265 270
Ile Glu Gly Asn His Ser Ser Arg Trp Leu Tyr Glu Ala Met Ala Lys
275 280 285
Ala Trp Glu Pro Trp Leu Pro Ala Glu Ala Leu Arg Thr Leu Arg Ile
290 295 300
Gly Gly Phe Tyr Ala Leu Ser Pro Tyr Pro Gly Leu Arg Leu Ile Ser
305 310 315 320
Leu Asn Met Asn Phe Cys Ser Arg Glu Asn Phe Trp Leu Leu Ile Asn
325 330 335
Ser Thr Asp Pro Ala Gly Gln Leu Gln Trp Leu Val Gly Glu Leu Gln
340 345 350
Ala Ala Glu Asp Arg Gly Asp Lys Val His Ile Ile Gly His Ile Pro
355 360 365
Pro Gly His Cys Leu Lys Ser Trp Ser Trp Asn Tyr Tyr Arg Ile Val
370 375 380
Ala Arg Tyr Glu Asn Thr Leu Ala Ala Gln Phe Phe Gly His Thr His
385 390 395 400
Val Asp Glu Phe Glu Val Phe Tyr Asp Glu Glu Thr Leu Ser Arg Pro
405 410 415
Leu Ala Val Ala Phe Leu Ala Pro Ser Ala Thr Thr Tyr Ile Gly Leu
420 425 430
Asn Pro Gly Tyr Arg Val Tyr Gln Ile Asp Gly Asn Tyr Ser Arg Ser
435 440 445
Ser His Val Val Leu Asp His Glu Thr Tyr Ile Leu Asn Leu Thr Gln
450 455 460
Ala Asn Ile Pro Gly Ala Ile Pro His Trp Gln Leu Leu Tyr Arg Ala
465 470 475 480
Arg Glu Thr Tyr Gly Leu Pro Asn Thr Leu Pro Thr Ala Trp His Asn
485 490 495
Leu Val Tyr Arg Met Arg Gly Asp Met Gln Leu Phe Gln Thr Phe Trp
500 505 510
Phe Leu Tyr His Lys Gly His Pro Pro Ser Glu Pro Cys Gly Thr Pro
515 520 525
Cys Arg Leu Ala Thr Leu Cys Ala Gln Leu Ser Ala Arg Ala Asp Ser
530 535 540
Pro Ala Leu Cys Arg His Leu Met Pro Asp Gly Ser Leu Pro Glu Ala
545 550 555 560
Gln Ser Leu Trp Pro Arg Pro Leu Phe Cys
565 570
<210> 5
<211> 629
<212> БЕЛОК
<213> Homo sapiens
<400> 5
Met Pro Arg Tyr Gly Ala Ser Leu Arg Gln Ser Cys Pro Arg Ser Gly
1 5 10 15
Arg Glu Gln Gly Gln Asp Gly Thr Ala Gly Ala Pro Gly Leu Leu Trp
20 25 30
Met Gly Leu Val Leu Ala Leu Ala Leu Ala Leu Ala Leu Ala Leu Ser
35 40 45
Asp Ser Arg Val Leu Trp Ala Pro Ala Glu Ala His Pro Leu Ser Pro
50 55 60
Gln Gly His Pro Ala Arg Leu His Arg Ile Val Pro Arg Leu Arg Asp
65 70 75 80
Val Phe Gly Trp Gly Asn Leu Thr Cys Pro Ile Cys Lys Gly Leu Phe
85 90 95
Thr Ala Ile Asn Leu Gly Leu Lys Lys Glu Pro Asn Val Ala Arg Val
100 105 110
Gly Ser Val Ala Ile Lys Leu Cys Asn Leu Leu Lys Ile Ala Pro Pro
115 120 125
Ala Val Cys Gln Ser Ile Val His Leu Phe Glu Asp Asp Met Val Glu
130 135 140
Val Trp Arg Arg Ser Val Leu Ser Pro Ser Glu Ala Cys Gly Leu Leu
145 150 155 160
Leu Gly Ser Thr Cys Gly His Trp Asp Ile Phe Ser Ser Trp Asn Ile
165 170 175
Ser Leu Pro Thr Val Pro Lys Pro Pro Pro Lys Pro Pro Ser Pro Pro
180 185 190
Ala Pro Gly Ala Pro Val Ser Arg Ile Leu Phe Leu Thr Asp Leu His
195 200 205
Trp Asp His Asp Tyr Leu Glu Gly Thr Asp Pro Asp Cys Ala Asp Pro
210 215 220
Leu Cys Cys Arg Arg Gly Ser Gly Leu Pro Pro Ala Ser Arg Pro Gly
225 230 235 240
Ala Gly Tyr Trp Gly Glu Tyr Ser Lys Cys Asp Leu Pro Leu Arg Thr
245 250 255
Leu Glu Ser Leu Leu Ser Gly Leu Gly Pro Ala Gly Pro Phe Asp Met
260 265 270
Val Tyr Trp Thr Gly Asp Ile Pro Ala His Asp Val Trp His Gln Thr
275 280 285
Arg Gln Asp Gln Leu Arg Ala Leu Thr Thr Val Thr Ala Leu Val Arg
290 295 300
Lys Phe Leu Gly Pro Val Pro Val Tyr Pro Ala Val Gly Asn His Glu
305 310 315 320
Ser Thr Pro Val Asn Ser Phe Pro Pro Pro Phe Ile Glu Gly Asn His
325 330 335
Ser Ser Arg Trp Leu Tyr Glu Ala Met Ala Lys Ala Trp Glu Pro Trp
340 345 350
Leu Pro Ala Glu Ala Leu Arg Thr Leu Arg Ile Gly Gly Phe Tyr Ala
355 360 365
Leu Ser Pro Tyr Pro Gly Leu Arg Leu Ile Ser Leu Asn Met Asn Phe
370 375 380
Cys Ser Arg Glu Asn Phe Trp Leu Leu Ile Asn Ser Thr Asp Pro Ala
385 390 395 400
Gly Gln Leu Gln Trp Leu Val Gly Glu Leu Gln Ala Ala Glu Asp Arg
405 410 415
Gly Asp Lys Val His Ile Ile Gly His Ile Pro Pro Gly His Cys Leu
420 425 430
Lys Ser Trp Ser Trp Asn Tyr Tyr Arg Ile Val Ala Arg Tyr Glu Asn
435 440 445
Thr Leu Ala Ala Gln Phe Phe Gly His Thr His Val Asp Glu Phe Glu
450 455 460
Val Phe Tyr Asp Glu Glu Thr Leu Ser Arg Pro Leu Ala Val Ala Phe
465 470 475 480
Leu Ala Pro Ser Ala Thr Thr Tyr Ile Gly Leu Asn Pro Gly Tyr Arg
485 490 495
Val Tyr Gln Ile Asp Gly Asn Tyr Ser Gly Ser Ser His Val Val Leu
500 505 510
Asp His Glu Thr Tyr Ile Leu Asn Leu Thr Gln Ala Asn Ile Pro Gly
515 520 525
Ala Ile Pro His Trp Gln Leu Leu Tyr Arg Ala Arg Glu Thr Tyr Gly
530 535 540
Leu Pro Asn Thr Leu Pro Thr Ala Trp His Asn Leu Val Tyr Arg Met
545 550 555 560
Arg Gly Asp Met Gln Leu Phe Gln Thr Phe Trp Phe Leu Tyr His Lys
565 570 575
Gly His Pro Pro Ser Glu Pro Cys Gly Thr Pro Cys Arg Leu Ala Thr
580 585 590
Leu Cys Ala Gln Leu Ser Ala Arg Ala Asp Ser Pro Ala Leu Cys Arg
595 600 605
His Leu Met Pro Asp Gly Ser Leu Pro Glu Ala Gln Ser Leu Trp Pro
610 615 620
Arg Pro Leu Phe Cys
625
<210> 6
<211> 570
<212> БЕЛОК
<213> Homo sapiens
<400> 6
His Pro Leu Ser Pro Gln Gly His Pro Ala Arg Leu His Arg Ile Val
1 5 10 15
Pro Arg Leu Arg Asp Val Phe Gly Trp Gly Asn Leu Thr Cys Pro Ile
20 25 30
Cys Lys Gly Leu Phe Thr Ala Ile Asn Leu Gly Leu Lys Lys Glu Pro
35 40 45
Asn Val Ala Arg Val Gly Ser Val Ala Ile Lys Leu Cys Asn Leu Leu
50 55 60
Lys Ile Ala Pro Pro Ala Val Cys Gln Ser Ile Val His Leu Phe Glu
65 70 75 80
Asp Asp Met Val Glu Val Trp Arg Arg Ser Val Leu Ser Pro Ser Glu
85 90 95
Ala Cys Gly Leu Leu Leu Gly Ser Thr Cys Gly His Trp Asp Ile Phe
100 105 110
Ser Ser Trp Asn Ile Ser Leu Pro Thr Val Pro Lys Pro Pro Pro Lys
115 120 125
Pro Pro Ser Pro Pro Ala Pro Gly Ala Pro Val Ser Arg Ile Leu Phe
130 135 140
Leu Thr Asp Leu His Trp Asp His Asp Tyr Leu Glu Gly Thr Asp Pro
145 150 155 160
Asp Cys Ala Asp Pro Leu Cys Cys Arg Arg Gly Ser Gly Leu Pro Pro
165 170 175
Ala Ser Arg Pro Gly Ala Gly Tyr Trp Gly Glu Tyr Ser Lys Cys Asp
180 185 190
Leu Pro Leu Arg Thr Leu Glu Ser Leu Leu Ser Gly Leu Gly Pro Ala
195 200 205
Gly Pro Phe Asp Met Val Tyr Trp Thr Gly Asp Ile Pro Ala His Asp
210 215 220
Val Trp His Gln Thr Arg Gln Asp Gln Leu Arg Ala Leu Thr Thr Val
225 230 235 240
Thr Ala Leu Val Arg Lys Phe Leu Gly Pro Val Pro Val Tyr Pro Ala
245 250 255
Val Gly Asn His Glu Ser Thr Pro Val Asn Ser Phe Pro Pro Pro Phe
260 265 270
Ile Glu Gly Asn His Ser Ser Arg Trp Leu Tyr Glu Ala Met Ala Lys
275 280 285
Ala Trp Glu Pro Trp Leu Pro Ala Glu Ala Leu Arg Thr Leu Arg Ile
290 295 300
Gly Gly Phe Tyr Ala Leu Ser Pro Tyr Pro Gly Leu Arg Leu Ile Ser
305 310 315 320
Leu Asn Met Asn Phe Cys Ser Arg Glu Asn Phe Trp Leu Leu Ile Asn
325 330 335
Ser Thr Asp Pro Ala Gly Gln Leu Gln Trp Leu Val Gly Glu Leu Gln
340 345 350
Ala Ala Glu Asp Arg Gly Asp Lys Val His Ile Ile Gly His Ile Pro
355 360 365
Pro Gly His Cys Leu Lys Ser Trp Ser Trp Asn Tyr Tyr Arg Ile Val
370 375 380
Ala Arg Tyr Glu Asn Thr Leu Ala Ala Gln Phe Phe Gly His Thr His
385 390 395 400
Val Asp Glu Phe Glu Val Phe Tyr Asp Glu Glu Thr Leu Ser Arg Pro
405 410 415
Leu Ala Val Ala Phe Leu Ala Pro Ser Ala Thr Thr Tyr Ile Gly Leu
420 425 430
Asn Pro Gly Tyr Arg Val Tyr Gln Ile Asp Gly Asn Tyr Ser Gly Ser
435 440 445
Ser His Val Val Leu Asp His Glu Thr Tyr Ile Leu Asn Leu Thr Gln
450 455 460
Ala Asn Ile Pro Gly Ala Ile Pro His Trp Gln Leu Leu Tyr Arg Ala
465 470 475 480
Arg Glu Thr Tyr Gly Leu Pro Asn Thr Leu Pro Thr Ala Trp His Asn
485 490 495
Leu Val Tyr Arg Met Arg Gly Asp Met Gln Leu Phe Gln Thr Phe Trp
500 505 510
Phe Leu Tyr His Lys Gly His Pro Pro Ser Glu Pro Cys Gly Thr Pro
515 520 525
Cys Arg Leu Ala Thr Leu Cys Ala Gln Leu Ser Ala Arg Ala Asp Ser
530 535 540
Pro Ala Leu Cys Arg His Leu Met Pro Asp Gly Ser Leu Pro Glu Ala
545 550 555 560
Gln Ser Leu Trp Pro Arg Pro Leu Phe Cys
565 570
<---
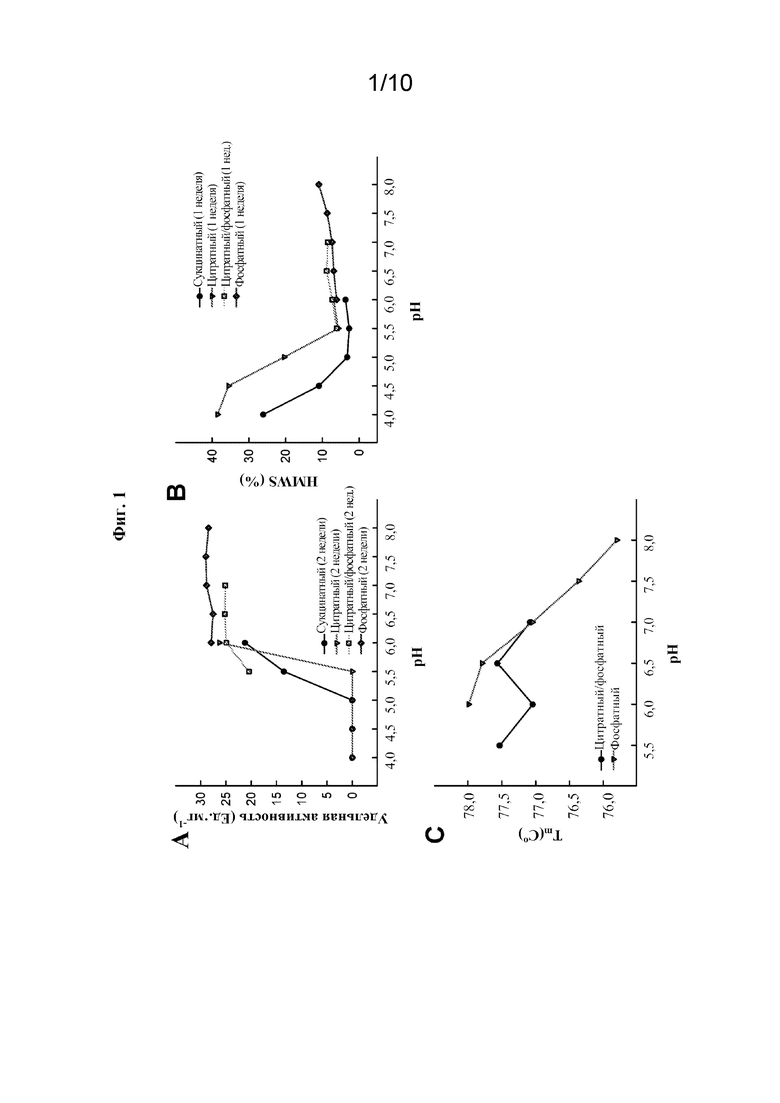
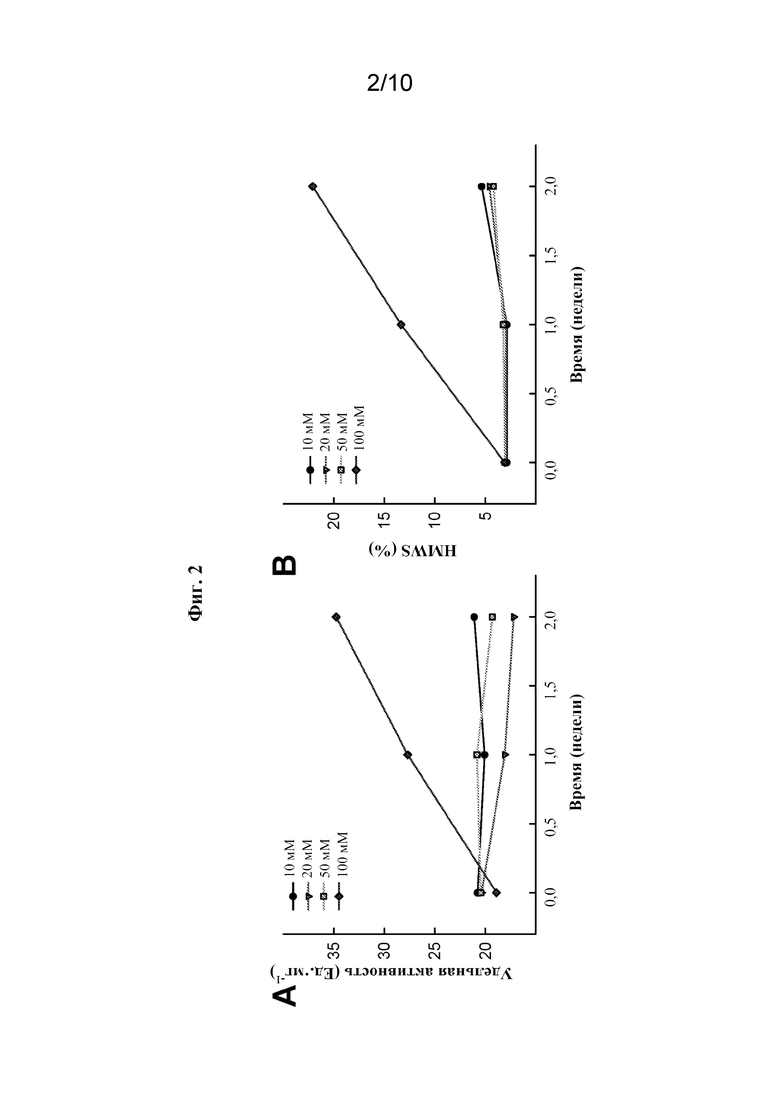
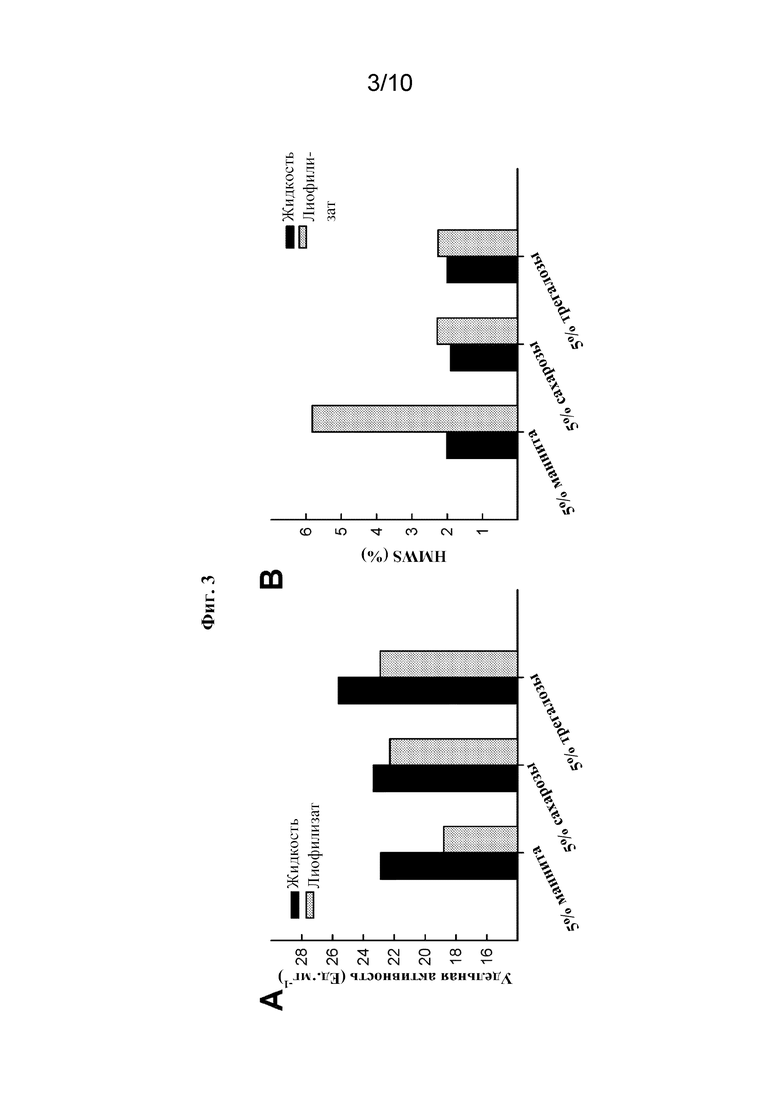
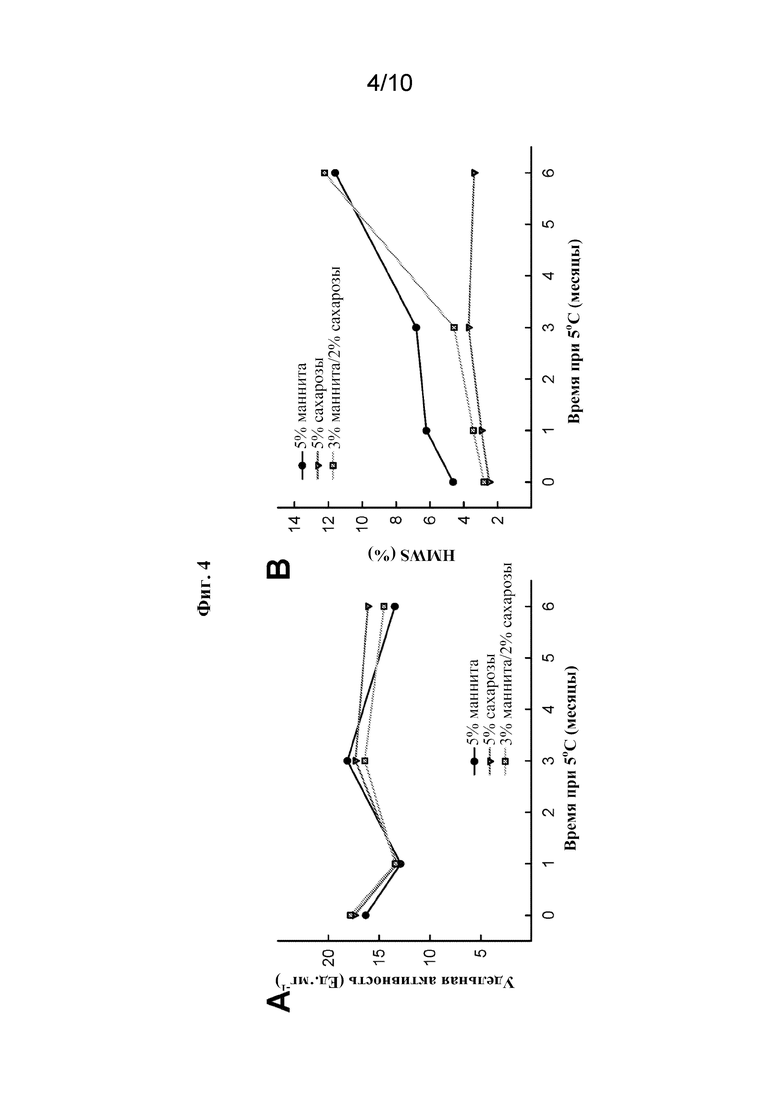
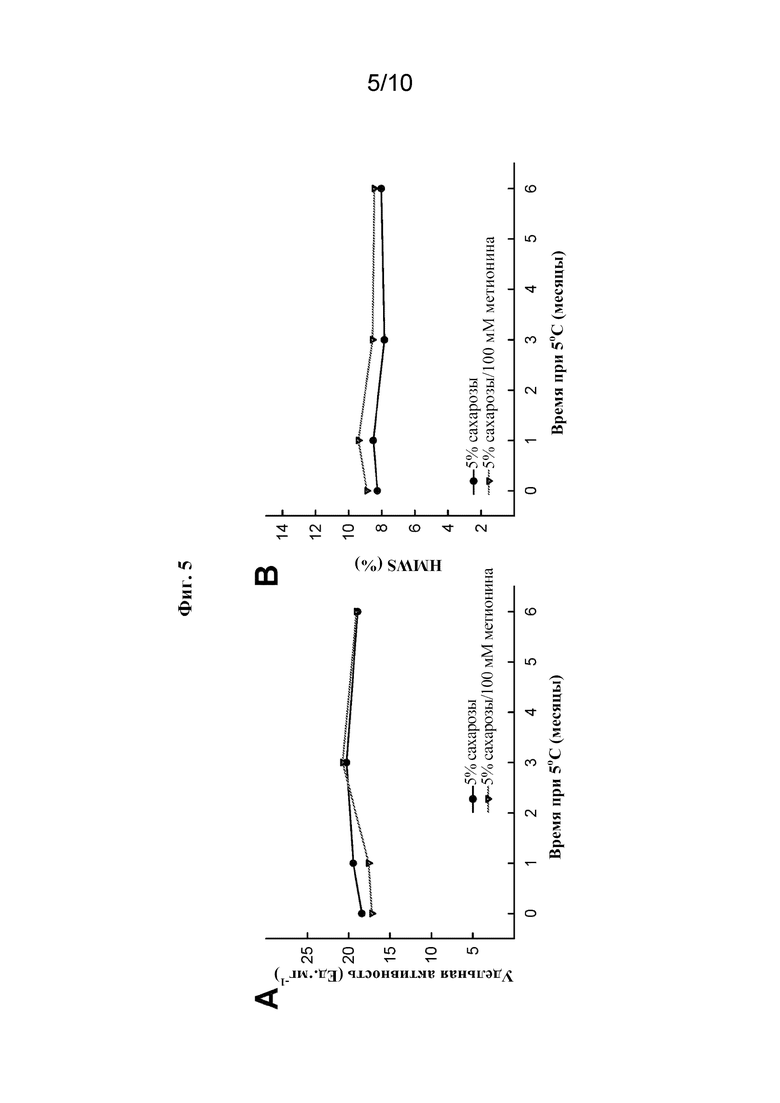
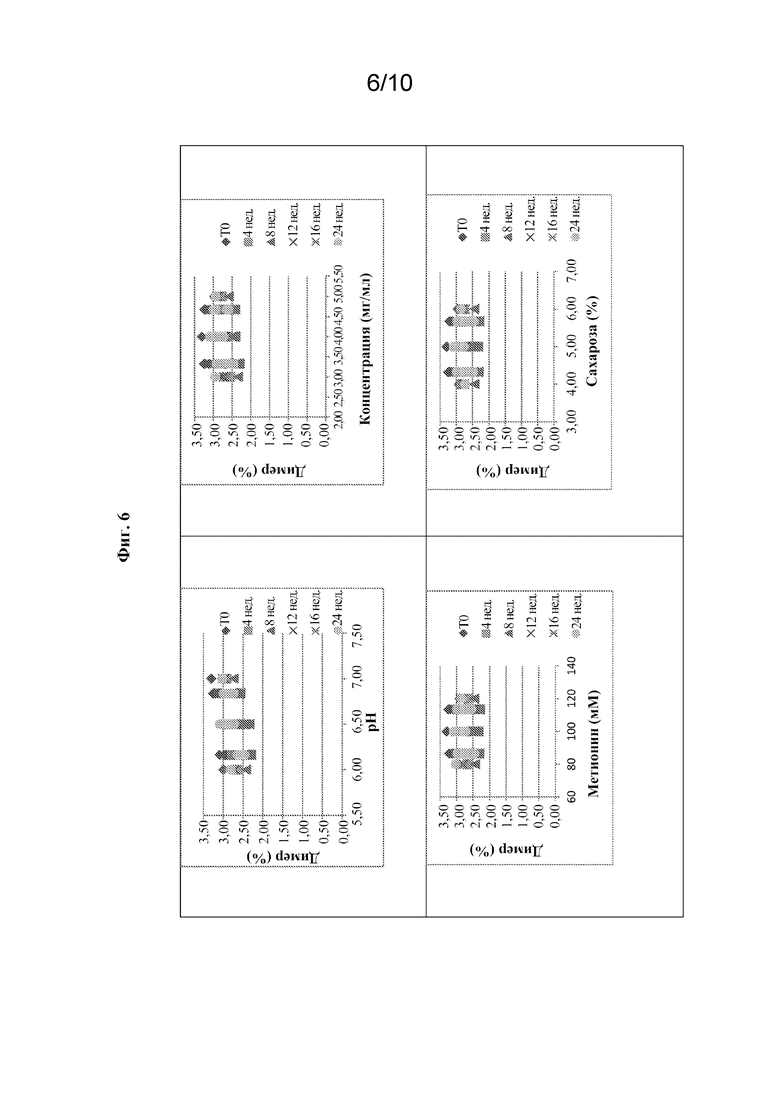
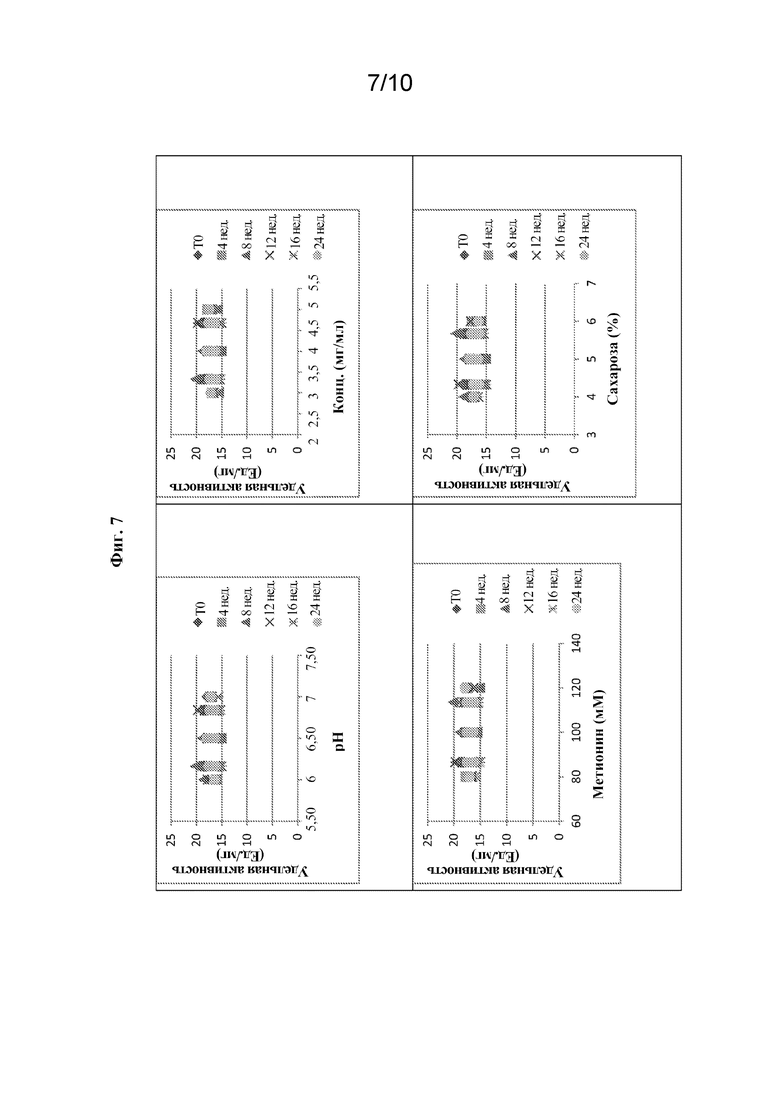
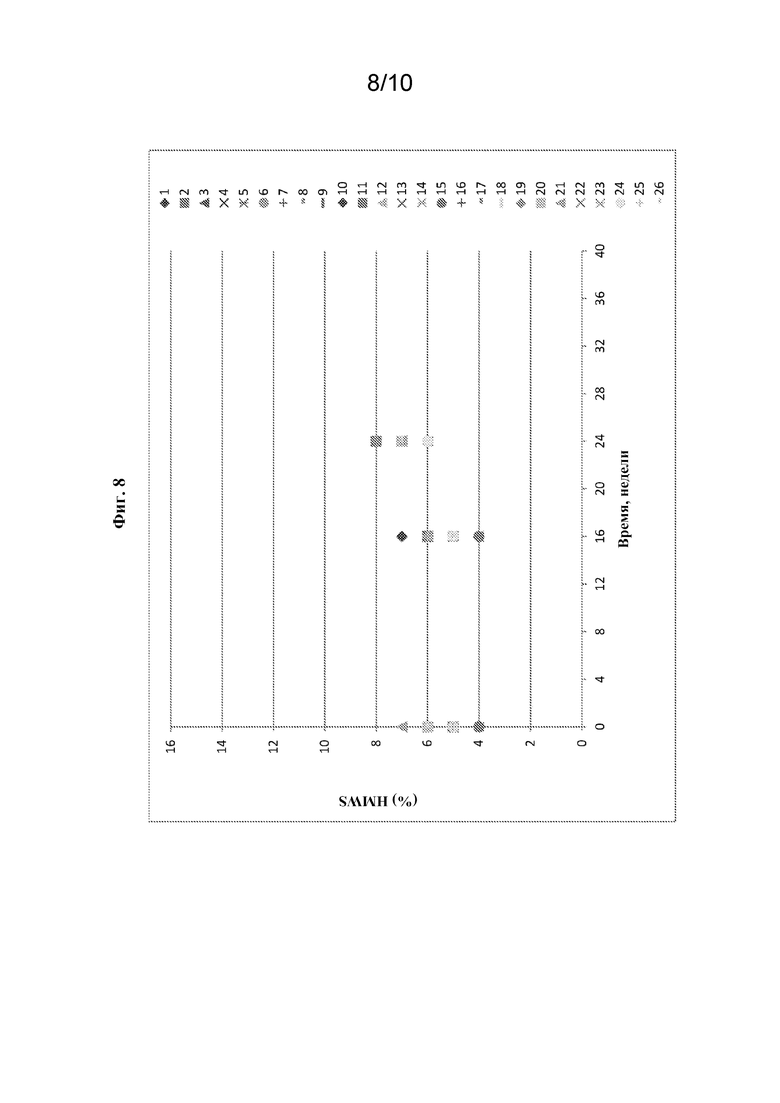
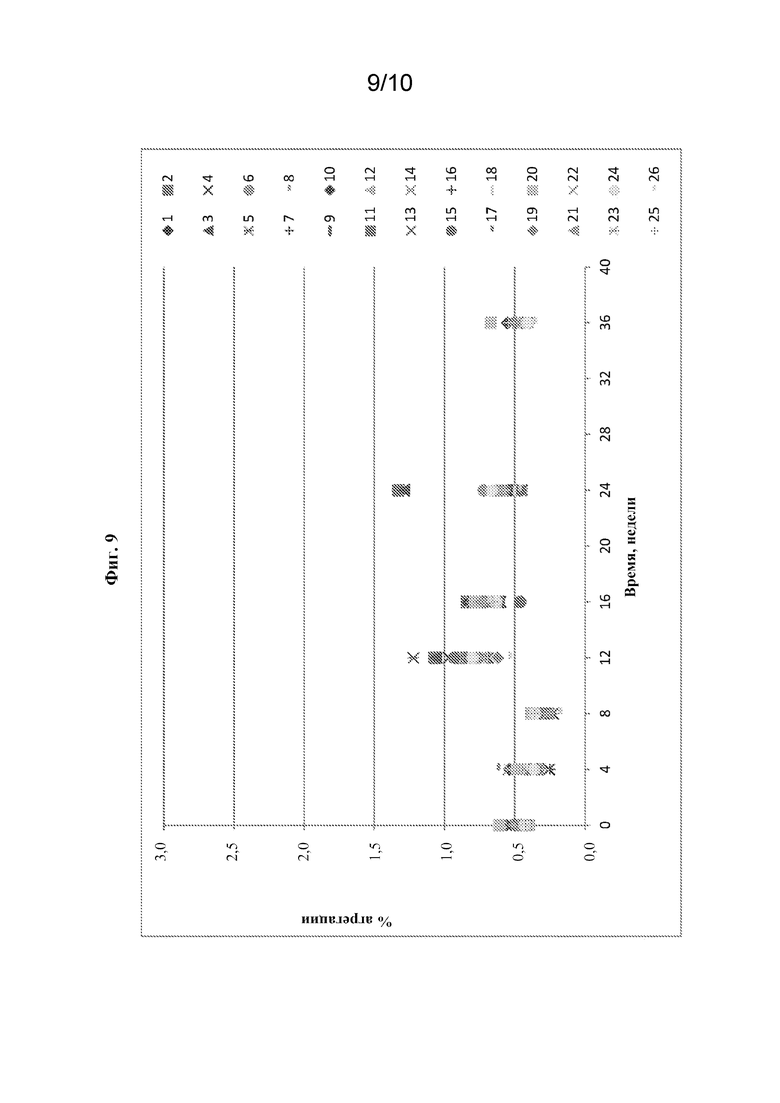
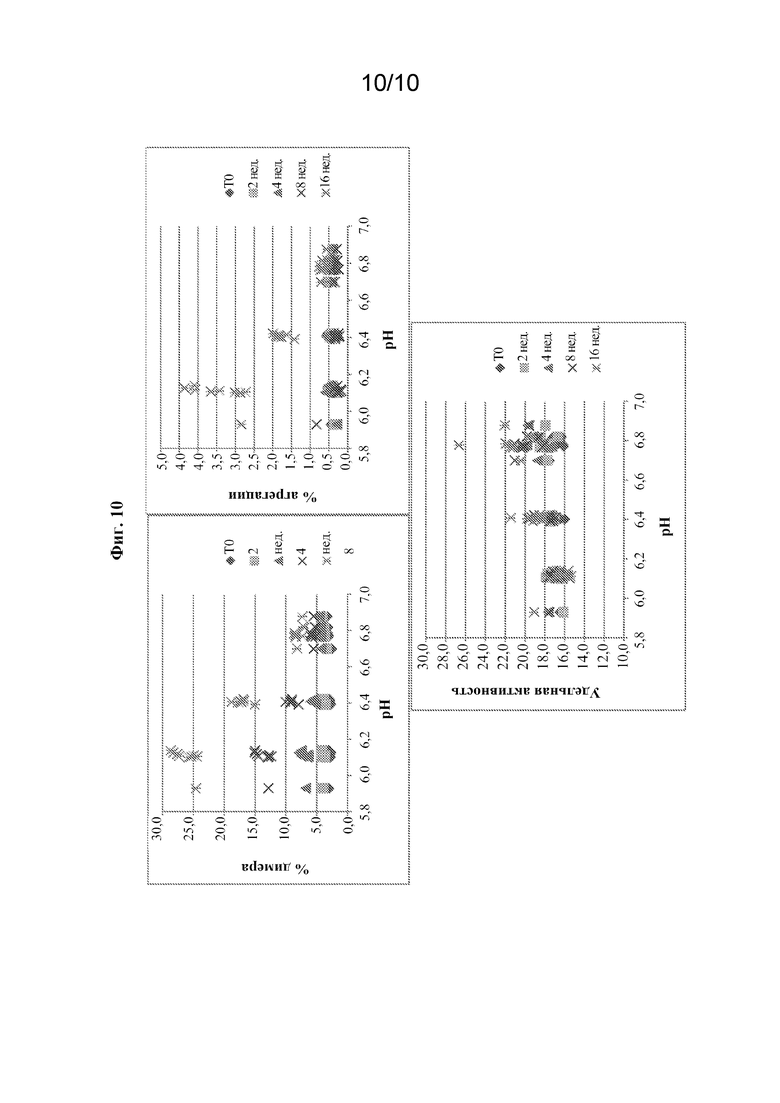
Изобретение относится к области биотехнологии, в частности к таким композициям, как водные жидкие композиции и лиофилизированные композиции, содержащие рекомбинантную человеческую кислую сфингомиелиназу. Также раскрыт способ получения лиофилизированной композиции, флакон для содержания в нем лиофилизированной композиции и изделие, содержащее флакон. Предусмотрены также способы применения композиций для лечения пациентов с недостаточностью кислой сфингомиелиназы. Изобретение обеспечивает эффективное лечение пациентов с недостаточностью кислой сфингомиелиназы. 10 н. и 10 з.п. ф-лы, 10 ил., 2 табл., 2 пр.
1. Композиция, содержащая рекомбинантную человеческую кислую сфингомиелиназу для лечения недостаточности кислой сфингомиелиназы (ASMD) у пациента-человека, где композиция представляет собой лиофилизированную композицию, содержащую:
4-7% вес/вес олипудазы альфа с последовательностью, приведенной в SEQ ID NO:2,
3-7% вес/вес фосфата натрия,
15-25% вес/вес L-метионина и
65-75% вес/вес сахарозы.
2. Композиция по п. 1, по сути состоящая из:
5,5% вес/вес олипудазы альфа с последовательностью, приведенной в SEQ ID NO:2,
2,3% вес/вес гептагидрата двухосновного фосфата натрия,
2,6% вес/вес моногидрата одноосновного фосфата натрия,
20,5% вес/вес L-метионина,
68,6% вес/вес сахарозы и
не более, чем 0,5% влаги.
3. Водная жидкая композиция для лечения недостаточности кислой сфингомиелиназы (ASMD) у пациента-человека, содержащая:
1-10 мг/мл олипудазы альфа,
10-50 мМ фосфата натрия,
70-150 мМ L-метионина и
1-10% вес/об. сахарозы,
где композиция содержит воду и имеет pH 5-8.
4. Композиция по п. 3, где композиция, содержит:
3-5 мг/мл олипудазы альфа,
10-30 мМ фосфата натрия,
80-120 мМ L-метионина и
4-6% вес/об. сахарозы,
где композиция имеет pH 6-7.
5. Композиция по п. 3, по сути состоящая из:
4 мг/мл олипудазы альфа,
20 мМ фосфата натрия,
100 мМ L-метионина,
5% вес/об. сахарозы и
воды,
где композиция имеет pH 6,5.
6. Композиция по любому из пп. 3-5, дополнительно содержащая 0,005% вес/об. полисорбата 80.
7. Композиция по п. 1 или 2, где лиофилизированная композиция содержит не более, чем 0,5% влаги и, необязательно, содержит 0,3% влаги.
8. Композиция для лечения недостаточности кислой сфингомиелиназы (ASMD) у пациента-человека, полученная посредством лиофилизации водной жидкой композиции по любому из пп. 3-6.
9. Способ получения лиофилизированной композиции, включающий
получение водной жидкой композиции по любому из пп. 3-6 и
лиофилизацию водной жидкой композиции.
10. Флакон для содержания в нем лиофилизированной композиции, где лиофилизированная композиция предназначена для лечения недостаточности кислой сфингомиелиназы (ASMD) у пациента-человека, и по сути состоит из:
21,2 мг олипудазы альфа,
9,0 мг гептагидрата двухосновного фосфата натрия,
10,0 мг моногидрата одноосновного фосфата натрия,
79 мг L-метионина и
265 мг сахарозы.
11. Флакон по п. 10, где лиофилизированная композиция содержит не более, чем 0,5% влаги и, необязательно, содержит 0,3% влаги.
12. Водная жидкая композиция для лечения недостаточности кислой сфингомиелиназы (ASMD) у пациента-человека, полученная путем восстановления лиофилизированной композиции, по сути состоящей из:
21,2 мг олипудазы альфа,
9,0 мг гептагидрата двухосновного фосфата натрия,
10,0 мг моногидрата одноосновного фосфата натрия,
79 мг L-метионина и
265 мг сахарозы,
в 5,1 мл стерильной воды.
13. Флакон для содержания в нем лиофилизированной композиции, где лиофилизированная композиция предназначена для лечения недостаточности кислой сфингомиелиназы (ASMD) у пациента-человека, и по сути состоит из:
4,8 мг олипудазы альфа,
2,0 мг гептагидрата двухосновного фосфата натрия,
2,3 мг моногидрата одноосновного фосфата натрия,
17,9 мг L-метионина и
60 мг сахарозы.
14. Флакон по п. 13, где лиофилизированная композиция содержит не более, чем 0,5% влаги и, необязательно, содержит 0,3% влаги.
15. Водная жидкая композиция для лечения недостаточности кислой сфингомиелиназы (ASMD) у пациента-человека, полученная путем восстановления лиофилизированной композиции, по сути состоящей из:
4,8 мг олипудазы альфа,
2,0 мг гептагидрата двухосновного фосфата натрия,
2,3 мг моногидрата одноосновного фосфата натрия,
17,9 мг L-метионина и
60 мг сахарозы,
в 1,1 мл стерильной воды.
16. Изделие для лечения недостаточности кислой сфингомиелиназы (ASMD) у пациента-человека, содержащее флакон по п. 10 или п. 13, и флакон, содержащий стерильную воду, 0,9% хлорида натрия или фосфатно-солевой буфер для восстановления лиофилизированной композиции.
17. Изделие по п. 16, где лиофилизированная композиция содержит не более, чем 0,5% влаги и, необязательно, содержит 0,3% влаги.
18. Применение композиции по любому из пп. 1-8, 12 и 15 для изготовления лекарственного препарата для лечения недостаточности кислой сфингомиелиназы (ASMD) у пациента-человека.
19. Применение по п. 18, где ASMD представляет собой болезнь Ниманна-Пика типа A/B или типа B.
20. Применение по п. 19, где лечение предназначено для отличных от неврологических проявлений ASMD.
| WO 2011163647 A2, 29.12.2011 | |||
| ВНУТРИЖЕЛУДОЧКОВАЯ ДОСТАВКА ФЕРМЕНТОВ ПРИ ЛИЗОСОМНЫХ БОЛЕЗНЯХ НАКОПЛЕНИЯ | 2007 |
|
RU2529830C2 |
| ФЕРМЕНТНАЯ ЗАМЕСТИТЕЛЬНАЯ ТЕРАПИЯ С УВЕЛИЧЕНИЕМ ДОЗЫ ДЛЯ ЛЕЧЕНИЯ НЕДОСТАТОЧНОСТИ КИСЛОЙ СФИНГОМИЕЛИНАЗЫ | 2010 |
|
RU2569744C2 |
| MURRAY J | |||
| M | |||
| et al., Nonclinical safety assessment of recombinant human acid sphingomyelinase (rhASM) for the treatment of acid sphingomyelinase deficiency: the utility of animal models of disease in the toxicological evaluation of potential therapeutics, | |||
Авторы
Даты
2024-09-04—Публикация
2019-05-24—Подача