ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0001] Настоящее изобретение относится к способу для получения 2-фтор-4-бороно-L-фенилаланина, 4-боронофенилаланина (фторированный BPA)(BPA: 4-боронофенилаланин), и его веществ-предшественников.
УРОВЕНЬ ТЕХНИКИ
[0002] В настоящий момент, уделяется большое внимание позитронной эмиссионной томографии (PET), используемой в качестве метода, который обладает высокой чувствительностью в части превосходного осуществления количественного определения и может легко формировать изображения в соответствии с его подходом. Этот метод широко используется. Период полураспада диагностических реагентов для PET (изотопных маркеров), используемых для постановки диагнозов, является коротким, и изотопные маркеры вводятся, каждый независимо, в малом количестве, так что любой живой организм почти не подвергается воздействию излучения, исходящего от них. Следовательно, такой способ обследования является малоинвазивным способом обследования, соответственно, является сильно преимущественным для PET. Кроме того, PET является высокочувствительной даже по отношению к опухолям, которые с трудом определяются посредством CT (компьютерной томографии) или MRI (магнитной резонансной визуализации), и ткани их опухоли могут быть оценены по полученным методом MRI изображениям.
[0003] 18F-меченый BPA, где атом фтора 18F введен в BPA, который представляет собой борированную аминокислоту, используемую в качестве борсодержащего реагента для BNCT (бор-нейтрон-захватная терапия), был разработан в качестве молекулярного зонда для PET в работе Ishiwata в 1991 (Непатентный Документ 1). С того времени, исследование методом PET с использованием 18F-меченого BPA посредством настоящего зонда является важным методом для поддерживающей бор-нейтрон-захватной терапии. Иными словами, в клинических и исследовательских целях, изображение, полученное методом PET с использованием 18F-BPA при обследовании субъекта, заведомо может предоставить данные по распределению внутреннего накопления BPA, по соотношению ткани опухоли/нормальные ткани (соотношение T/N) и прочему. На основе этих данных, могут быть заранее оценены лечебные эффекты BNCT, и затем может быть выработан исследовательский или терапевтический план.
[0004] В способе синтеза Ishiwata, BPA подвергают прямому фторированию для получения 18F-меченого BPA, and 18F+ используют в качестве электрофильного реагента. Из дейтерия (D) и неона (Ne), ускоренных циклотроном, получают газ 18F, и затем пропускают через колонку, заполненную ацетатом натрия, для превращения газа в CH3COO-18F+. После этого, раствор BPA в трифторуксусной кислоте барботируют путем введения полученного таким превращением соединения в раствор. Таким образом, добиваются осуществления синтеза целевого 18F-меченого BPA.
[0005] В качестве другого способа для проведения синтеза 18F-меченого BPA, Vahatalo и др. предложили способ, в котором такой обычно применяемый способ является частично усовершенствованным (Непатентный Документ 2). Этот способ представляет собой способ с применением H18F, который может быть получен в большем количестве, для осуществления синтеза 18F2 через CH318F в качестве промежуточного соединения. В результате инициирования реакции между CH3I и H18F, который получают путем облучения протонов до H218O [по реакции 18O(p,n)18F], сразу синтезируют CH318F. Получающееся в результате соединение CH318F подвергают действию электрического разряда с тем, чтобы вызвать диссоциацию его связей C-F с получением 18F2. Это соединение используют для проведения синтеза 18F-меченого BPA, эквивалентно способу синтеза Ishiwata.
ДОКУМЕНТЫ ИЗВЕСТНОГО УРОВНЯ ТЕХНИКИ
НЕПАТЕНТНЫЕ ДОКУМЕНТЫ
[0006] Непатентный Документ 1: Appl. Radiat. Isot., 42, 325, 1991
Непатентный Документ 2: J. Label. Compd. Radiopharm., 45, 697, 2002
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
ПРОБЛЕМЫ, ПОДЛЕЖАЩИЕ РАЗРЕШЕНИЮ ПОСРЕДСТВОМ ИЗОБРЕТЕНИЯ
[0007] Однако, 18F-меченый BPA, полученный обычно применяемым способом синтеза согласно работе Ishiwata и др., имеет низкую удельную радиоактивность и, кроме того, чрезвычайно небольшой выход. И даже с применением усовершенствованного способа, выход остается по-прежнему небольшим, хотя удельная радиоактивность получающихся в результате молекул 18F-меченого BPA повышается.
[0008] Одной из задач настоящего изобретения является обеспечение нового производного BPA, которое может быть промежуточным соединением для синтеза 18F-меченого BPA.
[0009] Другой задачей настоящего изобретения является обеспечение способа получения такого нового производного BPA, и способа получения фторированного BPA, включая 18F-меченого BPA, с использованием этого производного.
СРЕДСТВО ДЛЯ РАЗРЕШЕНИЯ ПРОБЛЕМ
[0010] Для того, чтобы разрешить вышеупомянутые проблемы, авторы изобретения провели упорные исследования для выявления нового способа для осуществления синтеза фторированного BPA. Таким образом, было достигнуто настоящее изобретение.
[0011] В соответствии с вышеизложенным, настоящее изобретение относится к соединению, представленному следующей формулой:
[Формула 1]
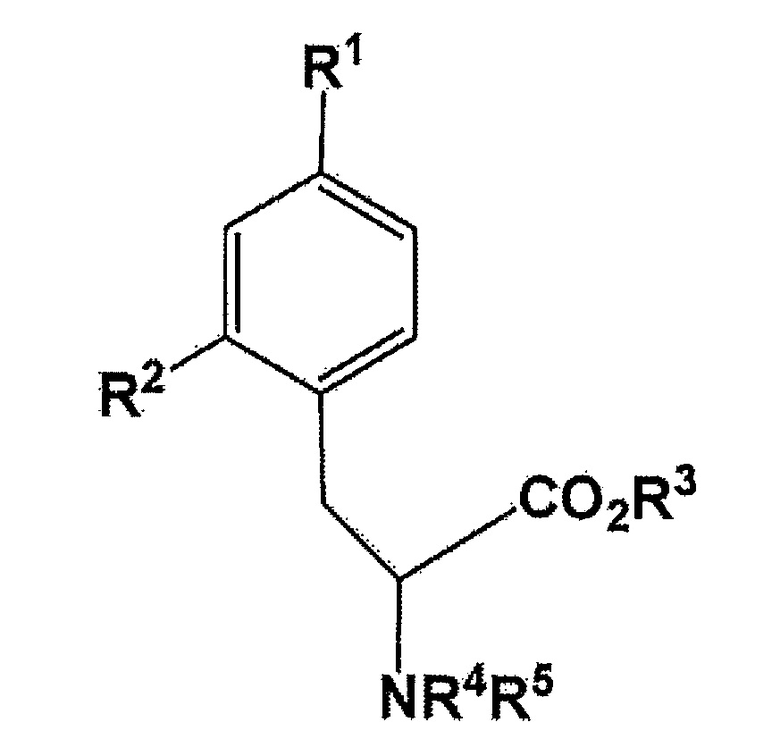
где R1 представляет собой бромогруппу, йодогруппу, хлорогруппу, нитрогруппу, или аминогруппу; R2 представляет собой галогеногруппу, нитрогруппу, аминогруппу, Sn(R6)3, N=N-NR7R8, OSO2R9, NR10R11, замещенный или незамещенный йод-фенил, замещенную или незамещенную гетероциклическую йодогруппу, или борную кислоту (B(OH)2) или сложный эфир борной кислоты, выбираемый из группы, состоящей из пинаколина, 2,2-диметил-1,3-пропандиола, N-метилдиэтаноламина, 1,8-диаминонафталина, N-метилиминодиуксусной кислоты, 1,1,1-трисгидроксиметилэтана, и пирокатехина (где R6 представляет собой алкильную группу, имеющую 1-7 атомов углерода, или бензильную группу; R7 и R8 являются одинаковыми или различными, где каждый из них представляет собой водород, алкильную группу, имеющую 1-7 атомов углерода, галоген-замещенную алкильную группу, имеющую 1-7 атомов углерода, или необязательно замещенную фенильную группу, или еще R7 и R8 соединяются вместе посредством N с образованием 3- 7-членной циклической структуры; R9 представляет собой алкильную группу, имеющую 1-7 атомов углерода, галоген-замещенную алкильную группу, имеющую 1-7 атомов углерода, или необязательно замещенную фенильную группу; R10 и R11 являются одинаковыми или различными, где каждый из них представляет собой алкильную группу, имеющую 1-7 атомов углерода, галоген-замещенную алкильную группу, имеющую 1-7 атомов углерода, или необязательно замещенную фенильную группу, или еще R10 и R11 связываются вместе посредством N с образованием 3- 7-членной циклической структуры); R3 представляет собой водород, этильную группу, трет-бутильную группу, или бензильную группу; R4 или R5 независимо представляет собой водород, бензилоксикарбонильную группу, или трет-бутоксикарбонильную группу, или еще NR4R5 связываются вместе с образованием C6H5(C6H5)C=N;
(если не считать то, что из этого исключаются следующие случаи:
1) случай, где все заместители из R3, R4, и R5 представляют собой водород, и R2 представляет собой хлорогруппу,
2) случай, где все заместители из R3, R4, и R5 являются водородом; R2 представляет собой бромогруппу; и R1 означает бромогруппу, хлорогруппу, нитрогруппу, или аминогруппу,
3) случай, где все заместители из R3, R4, и R5 представляют собой водород; R2 представляет собой йодогруппу; и R1 означает хлорогруппу или нитрогруппу,
4) случай, где R3 представляет собой водород; R2 означает хлорогруппу; R1 представляет собой хлорогруппу, бромогруппу, или нитрогруппу; и один заместитель из R4 и R5 представляет собой водород,
5) случай, где R3 представляет собой водород; R2 представляет собой бромогруппу; R1 представляет собой хлорогруппу; и один из заместителей R4 и R5 означает водород,
6) случай, где R4 и R5 представляют собой водород; R2 представляет собой хлорогруппу; и R1 означает нитрогруппу,
7) случай, где NR4R5 связываются вместе с образованием C6H5(C6H5)C=N, и R2 представляет собой фторогруппу, и
8) случай, где R1 представляет собой хлорогруппу; R2 представляет собой фторогруппу; R4 и R5 представляют собой водород; и R3 означает этильную группу).
[0012] В одном варианте осуществления, в вышеупомянутом соединении, R1 представляет собой бромогруппу, йодогруппу, хлорогруппу, нитрогруппу, или аминогруппу; R2 представляет собой галогеногруппу, нитрогруппу, аминогруппу, Sn(R6)3, N=N-NR7R8, OSO2R9, NR10R11, замещенный или незамещенный йод-фенил, замещенную или незамещенную гетероциклическую йодогруппу, или борную кислоту (B(OH)2) или сложный эфир борной кислоты, выбираемый из группы, состоящей из пинаколина, 2,2-диметил-1,3-пропандиола, N-метилдиэтаноламина, 1,8-диаминонафталина, N-метилиминодиуксусной кислоты, 1,1,1-трисгидроксиметилэтана, и пирокатехина (где R6 представляет собой алкильную группу, имеющую 1-7 атомов углерода, или бензильную группу; R7 и R8 являются одинаковыми или различными, где каждый из них представляет собой водород, алкильную группу, имеющую 1-7 атомов углерода, галоген-замещенную алкильную группу, имеющую 1-7 атомов углерода, или необязательно замещенную фенильную группу, или еще R7 и R8 соединяются вместе посредством N с образованием 3- 7-членной циклической структуры; R9 представляет собой алкильную группу, имеющую 1-7 атомов углерода, галоген-замещенную алкильную группу, имеющую 1-7 атомов углерода, или необязательно замещенную фенильную группу; R10 и R11 являются одинаковыми или различными, где каждый из них представляет собой алкильную группу, имеющую 1-7 атомов углерода, галоген-замещенную алкильную группу, имеющую 1-7 атомов углерода, или необязательно замещенную фенильную группу, или еще R10 и R11 связываются вместе посредством N с образованием 3- 7-членной циклической структуры) (здесь, по меньшей мере, один заместитель из R1 и R2 непременно представляет собой бромогруппу, йодогруппу, или хлорогруппу); R3 представляет собой водород, этильную группу, трет-бутильную группу, или бензильную группу; R4 или R5 независимо представляет собой водород, бензилоксикарбонильную группу, или трет-бутоксикарбонильную группу, или еще NR4R5 связываются вместе с образованием C6H5(C6H5)C=N;
(если не считать то, что из этого исключаются следующие случаи:
1) случай, где все заместители из R3, R4, и R5 представляют собой водород, и R2 представляет собой хлорогруппу,
2) случай, где все заместители из R3, R4, и R5 являются водородом; R2 представляет собой бромогруппу; и R1 означает бромогруппу, хлорогруппу, нитрогруппу, или аминогруппу,
3) случай, где все заместители из R3, R4, и R5 представляют собой водород; R2 представляет собой йодогруппу; и R1 означает хлорогруппу или нитрогруппу,
4) случай, где R3 представляет собой водород; R2 означает хлорогруппу; и R1 представляет собой хлорогруппу, бромогруппу, или нитрогруппу;
5) случай, где R3 представляет собой водород; R2 представляет собой бромогруппу; R1 представляет собой хлорогруппу; и один из заместителей R4 и R5 означает водород,
6) случай, где R4 и R5 представляют собой водород; R2 представляет собой хлорогруппу; и R1 означает нитрогруппу,
7) случай, где NR4R5 связываются вместе с образованием C6H5(C6H5)C=N, и R2 представляет собой фторогруппу, и
8) случай, где R1 представляет собой хлорогруппу; R2 представляет собой фторогруппу; R4 и R5 представляют собой водород; и R3 означает этильную группу).
[0013] В одном варианте осуществления, в вышеупомянутом соединении, R1 представляет собой бромогруппу, йодогруппу, хлорогруппу, нитрогруппу, или аминогруппу; R2 представляет собой галогеногруппу, нитрогруппу, аминогруппу, Sn(R6)3, N=N-NR7R8, OSO2R9, NR10R11, замещенный или незамещенный йод-фенил, замещенную или незамещенную гетероциклическую йодогруппу, или борную кислоту (B(OH)2) или сложный эфир борной кислоты, выбираемый из группы, состоящей из пинаколина, 2,2-диметил-1,3-пропандиола, N-метилдиэтаноламина, 1,8-диаминонафталина, N-метилиминодиуксусной кислоты, 1,1,1-трисгидроксиметилэтана, и пирокатехина (где R6 представляет собой алкильную группу, имеющую 1-7 атомов углерода, или бензильную группу; R7 и R8 являются одинаковыми или различными, где каждый из них представляет собой водород, алкильную группу, имеющую 1-7 атомов углерода, галоген-замещенную алкильную группу, имеющую 1-7 атомов углерода, или необязательно замещенную фенильную группу, или еще R7 и R8 соединяются вместе посредством N с образованием 3- 7-членной циклической структуры; R9 представляет собой алкильную группу, имеющую 1-7 атомов углерода, галоген-замещенную алкильную группу, имеющую 1-7 атомов углерода, или необязательно замещенную фенильную группу; R10 и R11 являются одинаковыми или различными, где каждый из них представляет собой алкильную группу, имеющую 1-7 атомов углерода, галоген-замещенную алкильную группу, имеющую 1-7 атомов углерода, или необязательно замещенную фенильную группу, или еще R10 и R11 связываются вместе посредством N с образованием 3- 7-членной циклической структуры) (здесь, по меньшей мере, один заместитель из R1 и R2 непременно представляет собой бромогруппу, йодогруппу, или хлорогруппу); R3 представляет собой водород, этильную группу, трет-бутильную группу, или бензильную группу; R4 или R5 независимо представляет собой водород, бензилоксикарбонильную группу, или трет-бутоксикарбонильную группу, или еще NR4R5 связываются вместе с образованием C6H5(C6H5)C=N;
(если не считать то, что из этого исключаются следующие случаи:
1) случай, где все заместители из R3, R4, и R5 представляют собой водород, и R2 представляет собой хлорогруппу,
2) случай, где все заместители из R3, R4, и R5 являются водородом; R2 представляет собой бромогруппу; и R1 означает бромогруппу, хлорогруппу, нитрогруппу, или аминогруппу,
3) случай, где все заместители из R3, R4, и R5 представляют собой водород; R2 представляет собой йодогруппу; и R1 означает хлорогруппу или нитрогруппу,
4) случай, где R3 представляет собой водород; R2 означает хлорогруппу; и R1 представляет собой хлорогруппу, бромогруппу, или нитрогруппу;
5) случай, где R3 представляет собой водород; R2 представляет собой бромогруппу; R1 представляет собой хлорогруппу;
6) случай, где R4 и R5 представляют собой водород; R2 представляет собой хлорогруппу; и R1 означает нитрогруппу,
7) случай, где NR4R5 связываются вместе с образованием C6H5(C6H5)C=N, и R2 представляет собой фторогруппу, и
8) случай, где R1 представляет собой хлорогруппу; R2 представляет собой фторогруппу; R4 и R5 представляют собой водород; и R3 означает этильную группу).
[0014] Настоящее изобретение также относится к способу для получения соединения, представленного следующей формулой:
[Формула 2]
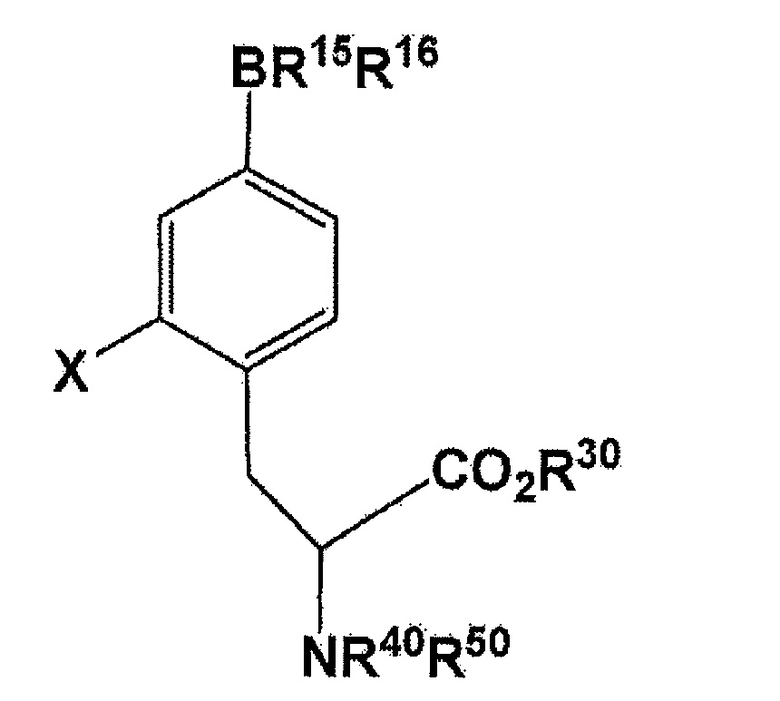
(где X представляет собой F или 18F; R30 представляет собой водород или защитную группу PG1 для карбоксильной группы; R40 или R50 независимо представляет собой водород или защитную группу PG2 для аминогруппы, или еще группы NR40R50 связываются вместе с образованием C6H5(C6H5)C=N; и R15 и R16 связываются вместе посредством B (атомом бора) с образованием кольца, служащего в качестве защитной группы для B), включающему в себя стадию использования соединения, представленного следующей формулой:
[Формула 3]
где R1 представляет собой бромогруппу, йодогруппу, хлорогруппу, нитрогруппу, или аминогруппу; R2 представляет собой галогеногруппу, нитрогруппу, аминогруппу, Sn(R6)3, N=N-NR7R8, OSO2R9, NR10R11, замещенный или незамещенный йод-фенил, замещенную или незамещенную гетероциклическую йодогруппу, или борную кислоту или сложный эфир борной кислоты (где R6 представляет собой алкильную группу, имеющую 1-7 атомов углерода, или бензильную группу; R7 и R8 являются одинаковыми или различными, где каждый из них представляет собой водород, алкильную группу, имеющую 1-7 атомов углерода, галоген-замещенную алкильную группу, имеющую 1-7 атомов углерода, или необязательно замещенную фенильную группу, или еще R7 и R8 связываются вместе посредством N с образованием 3- 7-членной циклической структуры; R9 представляет собой алкильную группу, имеющую 1-7 атомов углерода, галоген-замещенную алкильную группу, имеющую 1-7 атомов углерода, или необязательно замещенную фенильную группу; R10 и R11 являются одинаковыми или различными, где каждый из них представляет собой алкильную группу, имеющую 1-7 атомов углерода, галоген-замещенную алкильную группу, имеющую 1-7 атомов углерода, или необязательно замещенную фенильную группу, или еще R10 и R11 связываются вместе посредством N с образованием 3- 7-членной циклической структуры); и R30, R40, и R50 имеют значение, совпадающее с описанным ранее в данном документе.
[0015] Настоящее изобретение также относится к способу для получения 18F-меченого BPA, включающего в себя стадию использования соединения, представленного следующей формулой:
[Формула 4]
(где X представляет собой F или 18F; R30, R40, и R50 имеют значение, аналогичное описанному ранее в данном документе значению; и R15 и R16 связываются вместе посредством B (атомом бора) с образованием кольца, служащего в качестве защитной группы для B).
ЭФФЕКТ ИЗОБРЕТЕНИЯ
[0016] Новое соединение и способ получения по настоящему изобретению можно успешно использовать, в частности, для получения 18F-меченого BPA.
ТЕХНИЧЕСКОЕ ВЫПОЛНЕНИЕ ИЗОБРЕТЕНИЯ
[0017] Существующие способы для проведения синтеза 18F-меченого BPA представляют собой способы прямого фторирования BPA, и осуществляются, в частности, путем проведения электрофильной реакции с использованием 18F в качестве электрофильного реагента. Авторы изобретения уделили внимание следующему: на стадии получения газа 18F2 в циклотроне, на стадии использования F+ из получающегося в результате газа 18F2, и на некоторых других стадиях в таком применяемом пути синтеза, сталкиваются с соответствующими проблемами; и, кроме того, 18F-меченый BPA, получаемый в итоге, имеет сниженную удельную радиоактивность в результате вырабатывания продукта реакции из примешанных молекул 19F2 или по некоторым другим причинам, и количество 18F-меченого BPA, которое можно использовать для постановки диагноза методом PET в соответствии с одним синтезом, составляет некоторое количество, позволяющее провести диагностику только для нескольких человек. Новый способ по настоящему изобретению для проведения синтеза 18F-меченого BPA полностью отличается от обычно используемых способов, и представляет собой способ синтеза, в котором используются анионы 18F. Этот способ предусматривает небольшую нагрузку на установку, и позволяет синтезировать 18F-меченый BPA с обеспечением большего выхода по сравнению с соответственными выходами согласно обычно применяемым способам синтеза.
[0018] В настоящем изобретении, прежде всего, выявлен новый способ получения фторированного BPA, в частности, способ получения 18F-меченого BPA. Кроме того, в таком новом способе для получения 18F-меченого BPA, получено несколько новых промежуточных соединений. С применением этого нового способа получения 18F-меченого BPA, 18F-меченый BPA может быть получен простым и удобным образом с высоким выходом.
[0019] В настоящем изобретении, в данном документе, выражение “фторированный BPA” означает:
[Формула 5]
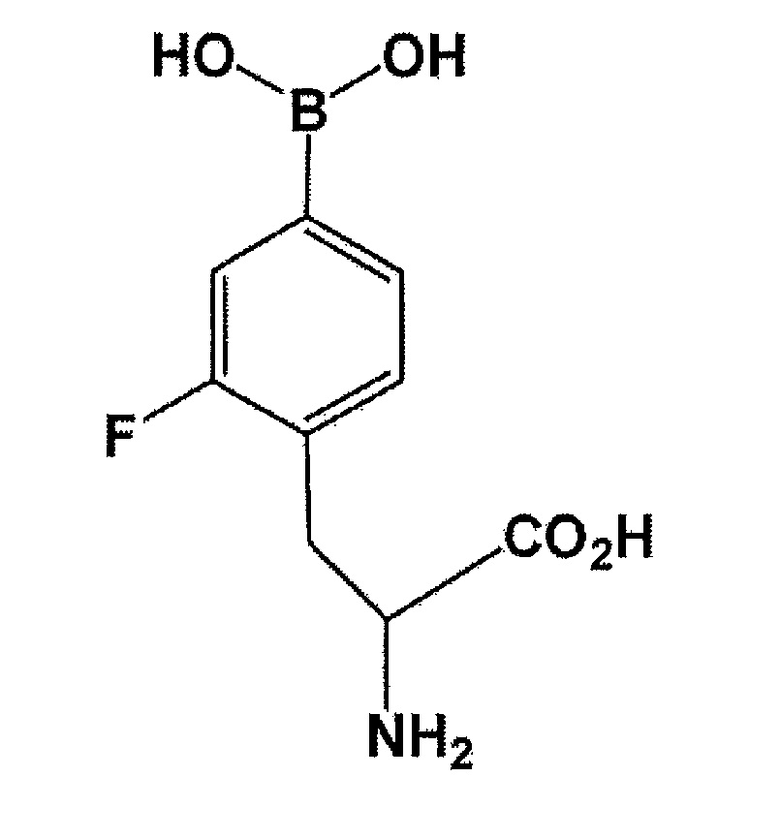
или используется в качестве термина, включающего в себя следующий 18F-меченый BPA. В данном документе, 18F-меченый BPA означает:
[Формула 6]
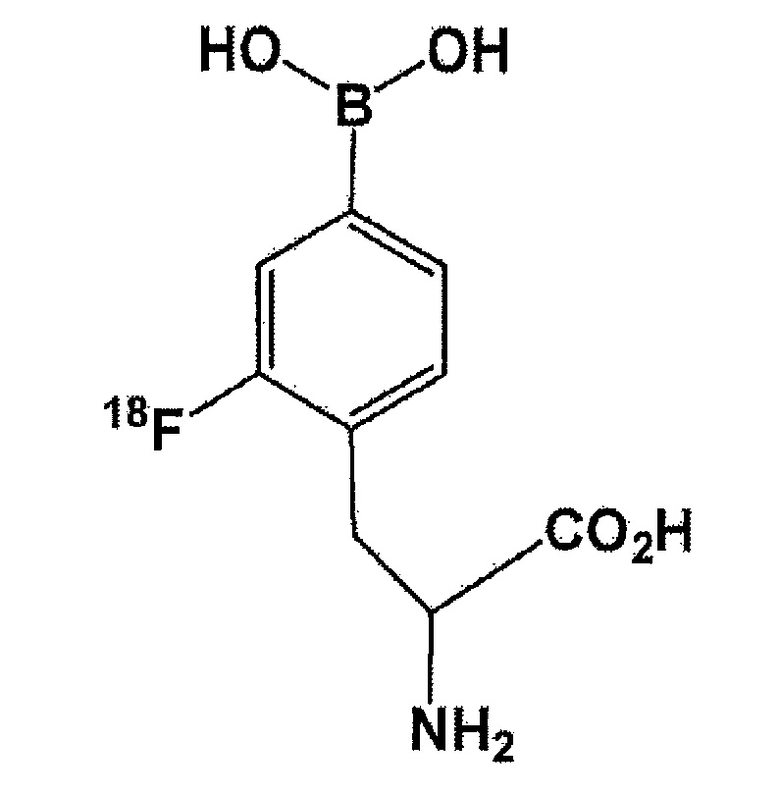
В настоящем изобретении, обеспечивают новое промежуточное соединение, которое в итоге приводит к синтезу этих фторированных соединений BPA.
[0020]
В настоящем изобретении, новое промежуточное соединение имеет аналогичное значение, что и соединение, представленное следующей формулой:
[Формула 7]
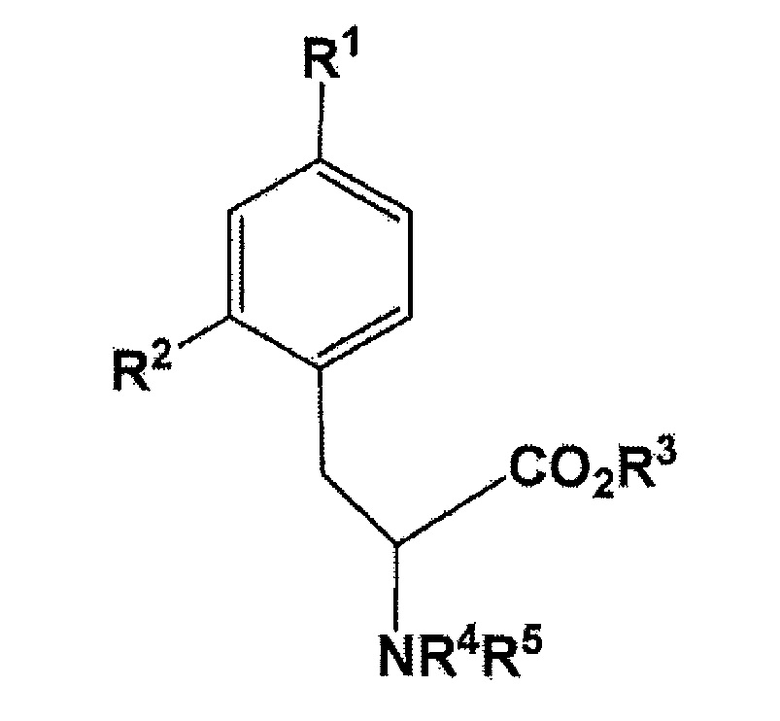
где R1 представляет собой бромогруппу, йодогруппу, хлорогруппу, нитрогруппу, или аминогруппу; R2 представляет собой галогеногруппу, нитрогруппу, аминогруппу, Sn(R6)3, N=N-NR7R8, OSO2R9, NR10R11, замещенный или незамещенный йод-фенил, замещенную или незамещенную гетероциклическую йодогруппу, или борную кислоту (B(OH)2), или сложный эфир борной кислоты, выбираемый из группы, состоящей из пинаколина, 2,2-диметил-1,3-пропандиола, N-метилдиэтаноламина, 1,8-диаминонафталина, N-метилиминодиуксусной кислоты, 1,1,1-трисгидроксиметилэтана, и пирокатехина (где R6 представляет собой алкильную группу, имеющую 1-7 атомов углерода, или бензильную группу; R7 и R8 являются одинаковыми или различными, где каждый из них представляет собой водород, алкильную группу, имеющую 1-7 атомов углерода, галоген-замещенную алкильную группу, имеющую 1-7 атомов углерода, или необязательно замещенную фенильную группу, или еще R7 и R8 соединяются вместе посредством N с образованием 3- 7-членной циклической структуры; R9 представляет собой алкильную группу, имеющую 1-7 атомов углерода, галоген-замещенную алкильную группу, имеющую 1-7 атомов углерода, или необязательно замещенную фенильную группу; R10 и R11 являются одинаковыми или различными, где каждый из них представляет собой алкильную группу, имеющую 1-7 атомов углерода, галоген-замещенную алкильную группу, имеющую 1-7 атомов углерода, или необязательно замещенную фенильную группу, или еще R10 и R11 связываются вместе посредством N с образованием 3- 7-членной циклической структуры); R3 представляет собой водород, этильную группу, трет-бутильную группу, или бензильную группу; R4 или R5 независимо представляет собой водород, бензилоксикарбонильную группу, или трет-бутоксикарбонильную группу, или еще NR4R5 связываются вместе с образованием C6H5(C6H5)C=N;
(если не считать то, что из этого исключаются следующие случаи:
1) случай, где все заместители из R3, R4, и R5 представляют собой водород, и R2 представляет собой хлорогруппу,
2) случай, где все заместители из R3, R4, и R5 являются водородом; R2 представляет собой бромогруппу; и R1 означает бромогруппу, хлорогруппу, нитрогруппу, или аминогруппу,
3) случай, где все заместители из R3, R4, и R5 представляют собой водород; R2 представляет собой йодогруппу; и R1 означает хлорогруппу или нитрогруппу,
4) случай, где R3 представляет собой водород; R2 означает хлорогруппу; и R1 представляет собой хлорогруппу, бромогруппу, или нитрогруппу; и один заместитель из R4 и R5 представляет собой водород,
5) случай, где R3 представляет собой водород; R2 представляет собой бромогруппу; R1 представляет собой хлорогруппу; и один заместитель из R4 и R5 представляет собой водород,
6) случай, где R4 и R5 представляют собой водород; R2 представляет собой хлорогруппу; и R1 означает нитрогруппу,
7) случай, где NR4R5 связываются вместе с образованием C6H5(C6H5)C=N, и R2 представляет собой фторогруппу, и
8) случай, где R1 представляет собой хлорогруппу; R2 представляет собой фторогруппу; R4 и R5 представляют собой водород; и R3 означает этильную группу).
[0021] Хотя и без особых ограничений, однако, кроме того, предпочтительно, что R1 представляет собой бромогруппу, йодогруппу, хлорогруппу, нитрогруппу, или аминогруппу; R2 представляет собой галогеногруппу, нитрогруппу, аминогруппу, Sn(R6)3, N=N-NR7R8, OSO2R9, NR10R11, замещенный или незамещенный йод-фенил, замещенную или незамещенную гетероциклическую йодогруппу, или борную кислоту (B(OH)2), или сложный эфир борной кислоты, выбираемый из группы, состоящей из пинаколина, 2,2-диметил-1,3-пропандиола, N-метилдиэтаноламина, 1,8-диаминонафталина, N-метилиминодиуксусной кислоты, 1,1,1-трисгидроксиметилэтана, и пирокатехина (где R6 представляет собой алкильную группу, имеющую 1-7 атомов углерода, или бензильную группу; R7 и R8 являются одинаковыми или различными, где каждый из них представляет собой водород, алкильную группу, имеющую 1-7 атомов углерода, галоген-замещенную алкильную группу, имеющую 1-7 атомов углерода, или необязательно замещенную фенильную группу, или еще R7 и R8 соединяются вместе посредством N с образованием 3- 7-членной циклической структуры; R9 представляет собой алкильную группу, имеющую 1-7 атомов углерода, галоген-замещенную алкильную группу, имеющую 1-7 атомов углерода, или необязательно замещенную фенильную группу; R10 и R11 являются одинаковыми или различными, где каждый из них представляет собой алкильную группу, имеющую 1-7 атомов углерода, галоген-замещенную алкильную группу, имеющую 1-7 атомов углерода, или необязательно замещенную фенильную группу, или еще R10 и R11 связываются вместе посредством N с образованием 3- 7-членной циклической структуры) (здесь, по меньшей мере, один заместитель из R1 и R2 обязательно представляет собой бромогруппу, йодогруппу, или хлорогруппу); R3 представляет собой водород, этильную группу, трет-бутильную группу, или бензильную группу; R4 или R5 независимо представляет собой водород, бензилоксикарбонильную группу, или трет-бутоксикарбонильную группу, или еще NR4R5 связываются вместе с образованием C6H5(C6H5)C=N;
(если не считать то, что из этого перечня исключаются следующие случаи:
1) случай, где все заместители из R3, R4, и R5 представляют собой водород, и R2 представляет собой хлорогруппу,
2) случай, где все заместители из R3, R4, и R5 являются водородом; R2 представляет собой бромогруппу; и R1 означает бромогруппу, хлорогруппу, нитрогруппу, или аминогруппу,
3) случай, где все заместители из R3, R4, и R5 представляют собой водород; R2 представляет собой йодогруппу; и R1 означает хлорогруппу или нитрогруппу,
4) случай, где R3 представляет собой водород; R2 означает хлорогруппу; и R1 представляет собой хлорогруппу, бромогруппу, или нитрогруппу,
5) случай, где R3 представляет собой водород; R2 представляет собой бромогруппу; R1 представляет собой хлорогруппу; и один заместитель из R4 и R5 представляет собой водород,
6) случай, где R4 и R5 представляют собой водород; R2 представляет собой хлорогруппу; и R1 означает нитрогруппу,
7) случай, где NR4R5 связываются вместе с образованием C6H5(C6H5)C=N, и R2 представляет собой фторогруппу, и
8) случай, где R1 представляет собой хлорогруппу; R2 представляет собой фторогруппу; R4 и R5 представляют собой водород; и R3 означает этильную группу).
[0022] Кроме того, в другом варианте осуществления, предпочтительно, что R1 представляет собой бромогруппу, йодогруппу, хлорогруппу, нитрогруппу, или аминогруппу; R2 представляет собой галогеногруппу, нитрогруппу, аминогруппу, Sn(R6)3, N=N-NR7R8, OSO2R9, NR10R11, замещенный или незамещенный йод-фенил, замещенную или незамещенную гетероциклическую йодогруппу, или борную кислоту (B(OH)2), или сложный эфир борной кислоты, выбираемый из группы, состоящей из пинаколина, 2,2-диметил-1,3-пропандиола, N-метилдиэтаноламина, 1,8-диаминонафталина, N-метилиминодиуксусной кислоты, 1,1,1-трисгидроксиметилэтана, и пирокатехина (где R6 представляет собой алкильную группу, имеющую 1-7 атомов углерода, или бензильную группу; R7 и R8 являются одинаковыми или различными, где каждый из них представляет собой водород, алкильную группу, имеющую 1-7 атомов углерода, галоген-замещенную алкильную группу, имеющую 1-7 атомов углерода, или необязательно замещенную фенильную группу, или еще R7 и R8 соединяются вместе посредством N с образованием 3- 7-членной циклической структуры; R9 представляет собой алкильную группу, имеющую 1-7 атомов углерода, галоген-замещенную алкильную группу, имеющую 1-7 атомов углерода, или необязательно замещенную фенильную группу; R10 и R11 являются одинаковыми или различными, где каждый из них представляет собой алкильную группу, имеющую 1-7 атомов углерода, галоген-замещенную алкильную группу, имеющую 1-7 атомов углерода, или необязательно замещенную фенильную группу, или еще R10 и R11 связываются вместе посредством N с образованием 3- 7-членной циклической структуры) (здесь, по меньшей мере, один заместитель из R1 и R2 обязательно представляет собой бромогруппу, йодогруппу, или хлорогруппу); R3 представляет собой водород, этильную группу, трет-бутильную группу, или бензильную группу; R4 или R5 независимо представляет собой водород, бензилоксикарбонильную группу, или трет-бутоксикарбонильную группу, или еще NR4R5 связываются вместе с образованием C6H5(C6H5)C=N;
(если не считать то, что из этого перечня исключаются следующие случаи:
1) случай, где все заместители из R3, R4, и R5 представляют собой водород, и R2 представляет собой хлорогруппу,
2) случай, где все заместители из R3, R4, и R5 представляют собой водород; R2 представляет собой бромогруппу; и R1 означает бромогруппу, хлорогруппу, нитрогруппу, или аминогруппу,
3) случай, где все заместители из R3, R4, и R5 представляют собой водород; R2 представляет собой йодогруппу; и R1 означает хлорогруппу или нитрогруппу,
4) случай, где R3 представляет собой водород; R2 означает хлорогруппу; и R1 представляет собой хлорогруппу, бромогруппу, или нитрогруппу,
5) случай, где R3 представляет собой водород; R2 представляет собой бромогруппу; R1 представляет собой хлорогруппу,
6) случай, где R4 и R5 представляют собой водород; R2 представляет собой хлорогруппу; и R1 означает нитрогруппу,
7) случай, где NR4R5 связываются вместе с образованием C6H5(C6H5)C=N, и R2 представляет собой фторогруппу, и
8) случай, где R1 представляет собой хлорогруппу; R2 представляет собой фторогруппу; R4 и R5 означают водород; и R3 представляет собой этильную группу).
[0023] Кроме того, в другом варианте осуществления, предпочтительно, что R1 представляет собой бромогруппу, йодогруппу, хлорогруппу, нитрогруппу, или аминогруппу; R2 представляет собой галогеногруппу, нитрогруппу, аминогруппу, Sn(R6)3, N=N-NR7R8, OSO2R9, NR10R11, I+R13, (R14-)I+R13, или борную кислоту (B(OH)2), или сложный эфир борной кислоты, выбираемый из группы, состоящей из пинаколина, 2,2-диметил-1,3-пропандиола, N-метилдиэтаноламина, 1,8-диаминонафталина, N-метилиминодиуксусной кислоты, 1,1,1-трисгидроксиметилэтана, и пирокатехина (где R6 представляет собой метил или н-бутил; R7 и R8 являются одинаковыми или различными, где каждый из них представляет собой водород, метил, этил, пропил, бутил, гептил, трифторметил, или необязательно замещенную фенильную группу, или еще R7 и R8 соединяются вместе посредством N с образованием азиридина, азетидина, пирролидина, или пиперидина; R9 представляет собой метил, этил, пропил, бутил, гептил, трифторметил, или необязательно замещенную фенильную группу; R10 и R11 являются одинаковыми или различными, где каждый из них представляет собой метил, этил, пропил, бутил, гептил, трифторметил, или необязательно замещенную фенильную группу, или еще R10 и R11 связываются вместе посредством N с образованием азиридина, азетидина, пирролидина, или пиперидина; R13 представляет собой С1-6-алкил-замещенную фенильную группу, С1-6-алкокси-замещенную фенильную группу, или фенильную группу, или еще представляет собой 5- 7-членную гетероциклическую группу, имеющую один или более атомов, выбираемых из N, S, и O; и R14 представляет собой галоген, тетрафторборатную группу, нитратную группу, трифлатную группу, сульфонилокси-группу, толуолсульфонилокси-группу, или перхлоратную группу) (здесь, по меньшей мере, один заместитель из R1 и R2 обязательно представляет собой бромогруппу, йодогруппу, или хлорогруппу); R3 представляет собой водород, этильную группу, трет-бутильную группу, или бензильную группу; R4 представляет собой водород; R5 представляет собой водород, бензилоксикарбонильную группу, или трет-бутоксикарбонильную группу, или еще NR4R5 связываются вместе с образованием C6H5(C6H5)C=N;
(если не считать то, что из этого перечня исключаются следующие случаи:
1) случай, где все заместители из R3, R4, и R5 представляют собой водород, и R2 представляет собой хлорогруппу,
2) случай, где все заместители из R3, R4, и R5 представляют собой водород; R2 представляет собой бромогруппу; и R1 означает бромогруппу, хлорогруппу, нитрогруппу, или аминогруппу,
3) случай, где все заместители из R3, R4, и R5 представляют собой водород; R2 представляет собой йодогруппу; и R1 означает хлорогруппу, или нитрогруппу,
4) случай, где R3 представляет собой водород; R2 означает хлорогруппу; и R1 представляет собой хлорогруппу, бромогруппу, или нитрогруппу (здесь, один заместитель из R4 и R5 может представлять собой водород; однако, также включен случай, где ни R4, ни R5 не является водородом),
5) случай, где R3 представляет собой водород; R2 представляет собой бромогруппу; и R1 представляет собой хлорогруппу (здесь, один заместитель из R4 и R5 может представлять собой водород; однако, также включен случай, где ни R4, ни R5 не является водородом),
6) случай, где R4 и R5 представляют собой водород; R2 представляет собой хлорогруппу; и R1 означает нитрогруппу,
7) случай, где NR4R5 связываются вместе с образованием C6H5(C6H5)C=N, и R2 представляет собой фторогруппу, и
8) случай, где R1 представляет собой хлорогруппу; R2 представляет собой фторогруппу; R4 и R5 означают водород; и R3 представляет собой этильную группу).
[0024] Новое промежуточное соединение по настоящему изобретению представляет собой особенно предпочтительно соединение, описываемое ранее в данном документе, где R1 представляет собой бромогруппу, йодогруппу, или хлорогруппу; и R2 представляет собой Sn(R6)3, N=N-NR7R8, OSO2R9, NR10R11, I+R13, (R14-)I+R13, или борную кислоту или один сложный эфир борной кислоты, выбираемый из пинаколина, 2,2-диметил-1,3-пропандиола, N-метилдиэтаноламина, 1,8-диаминонафталина, N-метилиминодиуксусной кислоты, 1,1,1-трисгидроксиметилэтана, и пирокатехина.
[0025] Новое промежуточное соединение по настоящему изобретению представляет собой особенно предпочтительно соединение, описываемое ранее в данном документе, где R2 представляет собой йодогруппу или бромогруппу.
[0026] Новое соединение по настоящему изобретению особенно предпочтительно обеспечивают, например, в качестве промежуточного соединения для получения диагностических средств для PET, хотя этим не ограничиваются.
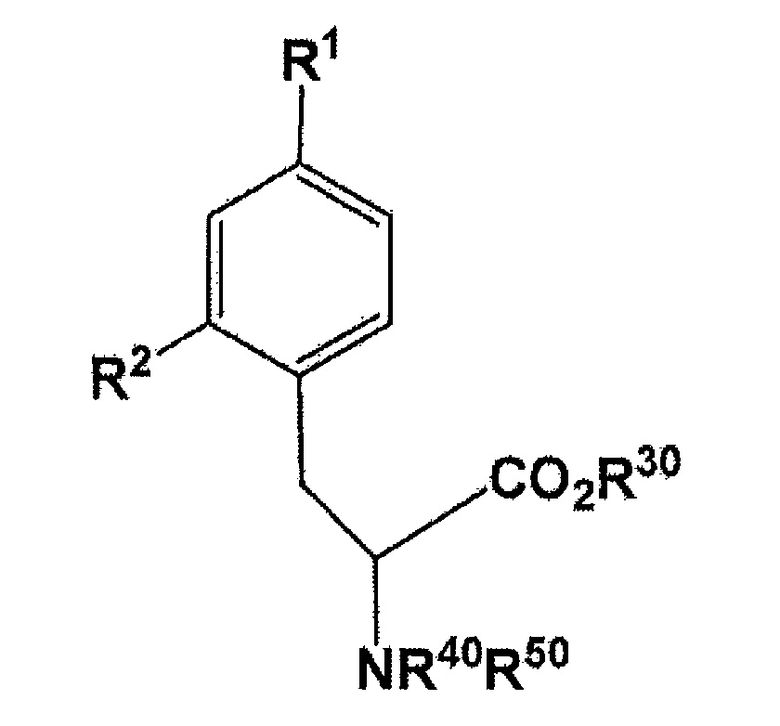
[0027] В настоящем изобретении, соединение, представленное следующей формулой:
[Формула 9]
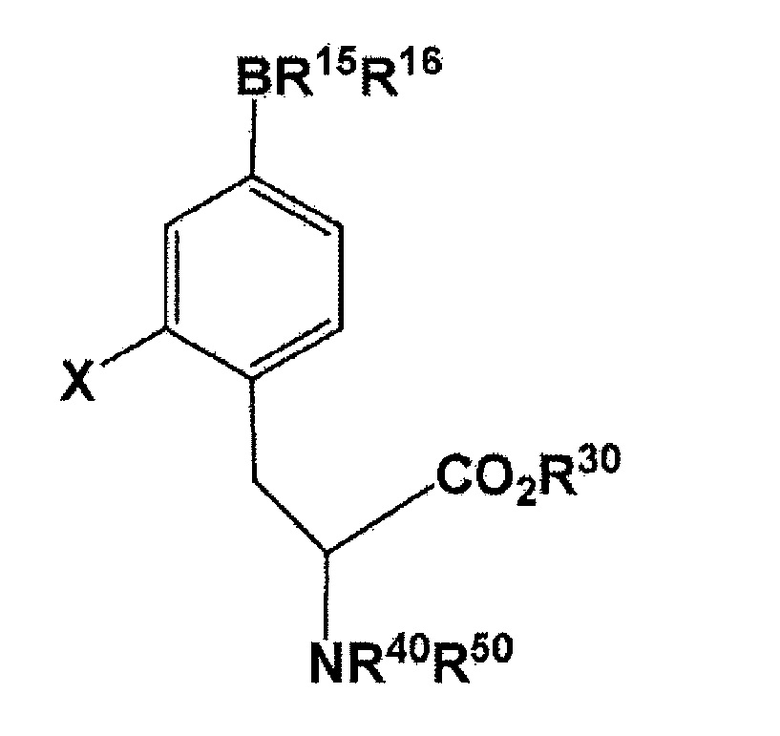
(где X представляет собой F или 18F; R30 представляет собой водород или защитную группу PG1 для карбоксильной группы; и R40 или R50 независимо представляет собой водород или защитную группу PG2 для аминогруппы, или еще NR40R50 связываются вместе с образованием C6H5(C6H5)C=N; и R15 и R16 связываются вместе посредством B (атомом бора) с образованием кольца, использующегося в качестве защитной группы для B) может быть получено с использованием соединения, представленного следующей формулой:
[Формула 8]
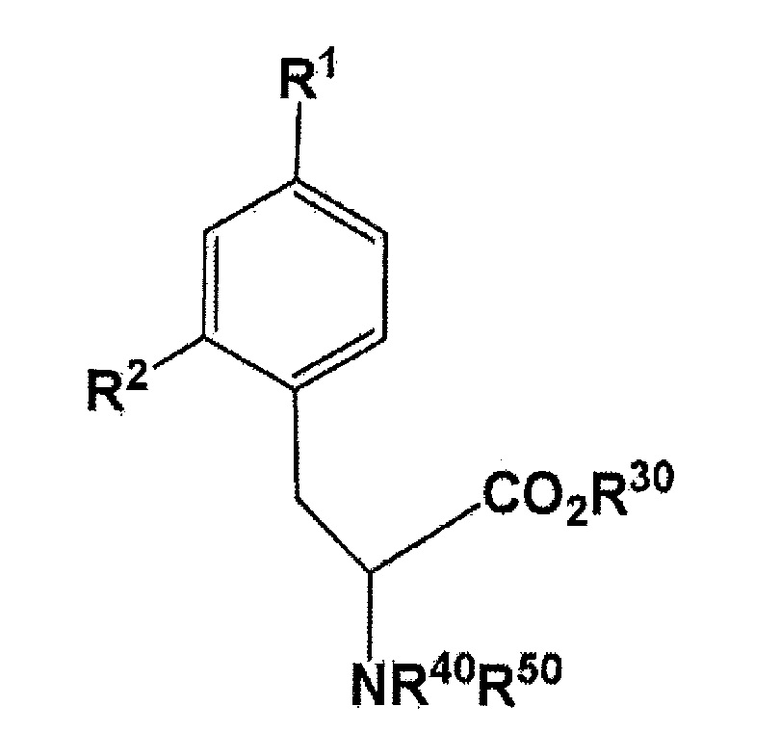
где R1 представляет собой бромогруппу, йодогруппу, хлорогруппу, нитрогруппу, или аминогруппу; R2 представляет собой галогеногруппу, нитрогруппу, аминогруппу, Sn(R6)3, N=N-NR7R8, OSO2R9, NR10R11, замещенный или незамещенный йод-фенил, замещенную или незамещенную гетероциклическую йодогруппу, или борную кислоту или сложный эфир борной кислоты (где R6 представляет собой алкильную группу, имеющую 1-7 атомов углерода, или бензильную группу; R7 и R8 являются одинаковыми или различными, где каждый из них представляет собой водород, алкильную группу, имеющую 1-7 атомов углерода, галоген-замещенную алкильную группу, имеющую 1-7 атомов углерода, или необязательно замещенную фенильную группу, или еще R7 и R8 соединяются вместе посредством N с образованием 3- 7-членной циклической структуры; R9 представляет собой алкильную группу, имеющую 1-7 атомов углерода, галоген-замещенную алкильную группу, имеющую 1-7 атомов углерода, или необязательно замещенную фенильную группу; R10 и R11 являются одинаковыми или различными, где каждый из них представляет собой алкильную группу, имеющую 1-7 атомов углерода, галоген-замещенную алкильную группу, имеющую 1-7 атомов углерода, или необязательно замещенную фенильную группу, или еще R10 и R11 связываются вместе посредством N с образованием 3- 7-членной циклической структуры) (предпочтительно, что, по меньшей мере, один заместитель из R1 и R2 непременно представляет собой бромогруппу, йодогруппу, или хлорогруппу); и R30, R40, и R50 имеют такое же значение, что описано ранее в данном документе. Полученное таким образом соединение может быть использовано в конечном получении фторированного BPA, в частности, 18F-меченого BPA.
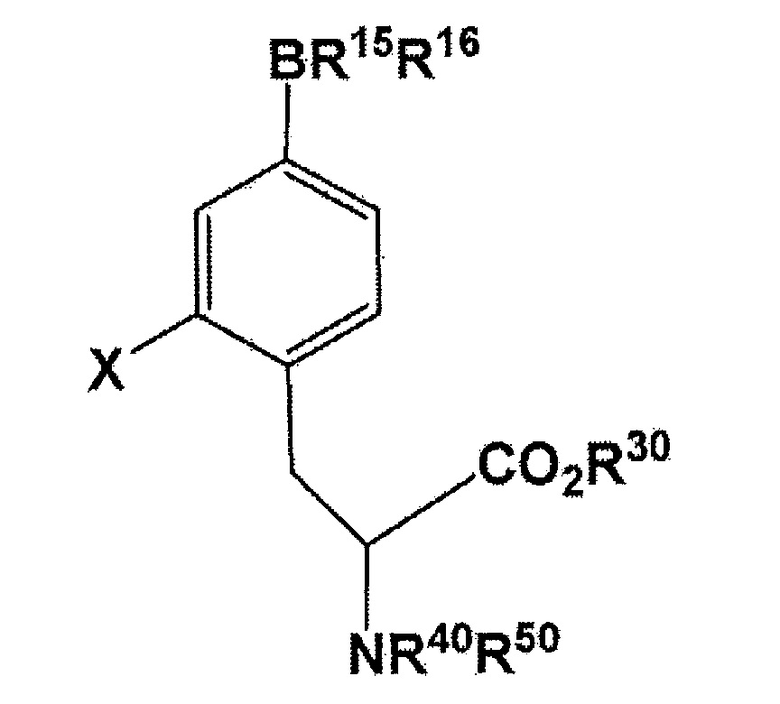
[0028] В настоящем изобретении, 18F-меченый BPA может быть получен с использованием соединения, представленного следующей формулы:
[Формула 10]
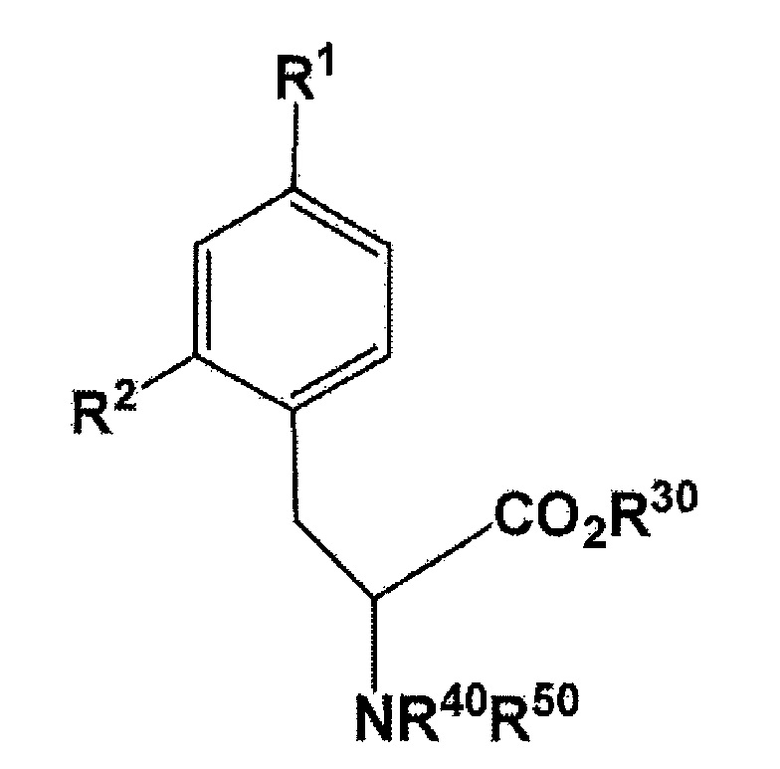
where R1 представляет собой бромогруппу, йодогруппу, хлорогруппу, нитрогруппу, или аминогруппу; R2 представляет собой галогеногруппу, нитрогруппу, аминогруппу, Sn(R6)3, N=N-NR7R8, OSO2R9, NR10R11, замещенный или незамещенный йод-фенил, замещенную или незамещенную гетероциклическую йодогруппу, или борную кислоту или сложный эфир борной кислоты (особенно предпочтительно пинаколин, 2,2-диметил-1,3-пропандиол, N-метилдиэтаноламин, 1,8-диаминонафталин, N-метилиминодиуксусную кислоту, 1,1,1-трисгидроксиметилэтан, или пирокатехин) (где R6 представляет собой алкильную группу, имеющую 1-7 атомов углерода, или бензильную группу; R7 и R8 являются одинаковыми или различными, где каждый из них представляет собой водород, алкильную группу, имеющую 1-7 атомов углерода, галоген-замещенную алкильную группу, имеющую 1-7 атомов углерода, или необязательно замещенную фенильную группу, или еще R7 и R8 соединяются вместе посредством N с образованием 3- 7-членной циклической структуры; R9 представляет собой алкильную группу, имеющую 1-7 атомов углерода, галоген-замещенную алкильную группу, имеющую 1-7 атомов углерода, или необязательно замещенную фенильную группу; R10 и R11 являются одинаковыми или различными, где каждый из них представляет собой алкильную группу, имеющую 1-7 атомов углерода, галоген-замещенную алкильную группу, имеющую 1-7 атомов углерода, или необязательно замещенную фенильную группу, или еще R10 и R11 связываются вместе посредством N с образованием 3- 7-членной циклической структуры) (здесь, по меньшей мере, один заместитель из R1 и R2 обязательно представляет собой бромогруппу, йодогруппу, или хлорогруппу); R30 представляет собой водород или защитную группу для PG1 для карбоксильной группы; и R40 или R50 независимо представляет собой водород или защитную группу PG2 для аминогруппы, или еще NR40R50 связываются вместе с образованием C6H5(C6H5)C=N.
[0029] В описании настоящего изобретения, формулировка “связываются вместе посредством N с образованием циклической структуры, имеющей 3-7 атомов” означает насыщенное или ненасыщенное кольцо, имеющее углерод и азот. Хотя и отсутствуют какие-либо ограничения, примеры этого включают пиперидин, пиперазин, пирролидин, пиридин, пиримидин, пиразин, пиразол, и имидазол.
[0030] В описании настоящего изобретения, формулировка “гетероциклическая группа” означает группу, имеющую насыщенную или ненасыщенную циклическую структуру, включающую в себя углерод и атом, отличающийся от углерода, и, в частности, тиенильная группа, фуранильная группа, пиридинильная группа, пиперидинильная группа, пиперазинильная группа, и тому подобное являются предпочтительными.
[0031] R30 представляет собой водород или защитную группу PG1 для карбоновой кислоты. Здесь, PG1 особым образом не ограничивается и означает любую защитную группу, известную специалистам в данной области для карбоновой кислоты. Ее примеры включают защитные группы, описываемые в книге Greene Wuts, “Protective Groups in Organic Synthesis”, 3-е издание (компания, Wiley-Interscience в США). Обычно, рассматриваемая группа может быть превращена в группу сложноэфирного типа, которая подлежит защите, с использованием условий сложноэфирной конденсации или условий алкилирования. PG1 представляет собой, например, алкильную группу, имеющую 1-7 атомов углерода, или ароматическую группу, такую как бензильная группа. Ее конкретные примеры включают алкильные группы, такие как метильная группа, этильная группа, н-пропильная группа, изо-пропильная группа, н-бутильная группа, изо-бутильная группа, втор.-бутильная группа, трет-бутильная группа, и н-пентильная группа, и ароматические группы, такие как бензильная, пара-метоксибензильная, и пара-нитробензильная группы. PG1 особенно предпочтительно представляет собой трет-бутильную или бензильную группу, которая не подвергается легкой рацемизации при осуществлении снятии защитных групп. Также, R30 может иметь такое же значение, что и R3.
[0032] R40 или R50 независимо представляет собой водород или защитную группу PG2 для аминогруппы. Защитная группа для аминокислоты может представлять собой любую защитную группу, известную специалистам в данной области. Ее примеры включают защитные группы, описываемые в книге Greene Wuts, “Protective Groups in Organic Synthesis”, 3-е издание (компания, Wiley-Interscience в США). Ее предпочтительные примеры включают бензилоксикарбонильную группу, ацетильную группу, трифторэтилкарбокси-группу, трет-бутилоксикарбонильную группу, флуоренилметилоксикарбонильную группу, трихлорэтоксикарбонильную группу, трифторацетильную группу, аллилоксикарбонильную группу, бензильную группу, пропаргилоксикарбонильную группу, бензоильную группу, фталоильную группу, толуолсульфонильную группу, и нитробензолсульфонильную группу, хотя защитная группа не ограничивается этим. Из числа этих примеров, предпочтительными являются бензилоксикарбонильная группа и трет-бутилоксикарбонильная группа, которые могут быть подвергнуты снятию за короткий период времени. R40 или R50 могут иметь то же самое значение, что и R4 и R5, соответственно.
[0033] В описании настоящего изобретения, в том случае, когда R15 и R16 связываются вместе посредством B (атомом бора) с образованием кольца в качестве защитной группы для B, R15 и R16 представляют собой предпочтительно группу, которая образует насыщенное или ненасыщенное 3-10-членное кольцо, которое может быть замещено. Примеры структуры кольца в данном документе также включают спро-кольца и конденсированные кольца. Примеры группы, которая может образовывать кольцо, включают пинаколин, 2,2-диметил-1,3-пропандиол, N-метилдиэтаноламин, 1,8-диаминонафталин, N-метилиминодиуксусную кислоту, 1,1,1-трисгидроксиметилэтан, и пирокатехин, хотя эта группа не ограничивается этим. В частности, пинаколин является предпочтительным.
[0034] В описании настоящего изобретения, алкильная группа, имеющая 1-7 атомов углерода, особенно предпочтительно представляет собой метильную группу, этильную группу, н-пропильную группу, изо-пропильную группу, н-бутильную группу, изо-бутильную группу, втор.-бутильную группу, трет-бутильную группу, или н-пентильную группу. Галоген-замещенная алкильная группа означает алкильную группу, имеющую 1-7 атомов углерода, где произвольное число их атомов водорода замещено одним или более галогенами. Галоген-замещенная алкильная группа представляет собой предпочтительно трифторметильную группу, хотя эта группа не ограничивается этим. Замещенная фенильная группа означает фенильную группу, или фенильную группу, имеющую, в одном-трех положениях фенильной группы, один или более заместителей независимо друг от друга. Замещенное 3-10-членное кольцо означает 3-10-членное кольцо, или 3-10-членное кольцо, имеющее, в одном-трех положениях 3-10-членного кольца, один или более заместителей независимо друг от друга. Замещенная гетероциклическая группа означает гетероцикл, или гетероциклическую группу, имеющую, в одном - трех положениях гетероцикла, один или более заместителей независимо друг от друга. Примеры заместителя(-ей) фенильной группы, 3-10-членного кольца, или гетероцикла включают C1-6 алкильную группу, C1-6 алкоксильную группу, гидроксильную группу, аминогруппу, и нитрогруппу, хотя заместитель(-и) не ограничивается(-ются) этим.
[0035] В новом способе для получения 18F-меченого BPA по настоящему изобретению, например, в качестве примера могут быть приведены следующие стадии: стадия S, стадия T, стадия U, или стадия, хотя стадии не ограничиваются этим. Здесь, защитные группы, используемые в формулах приведенных ниже реакций, могут быть соответственным образом изменены, так что защитные группы не ограничиваются этими примерами.
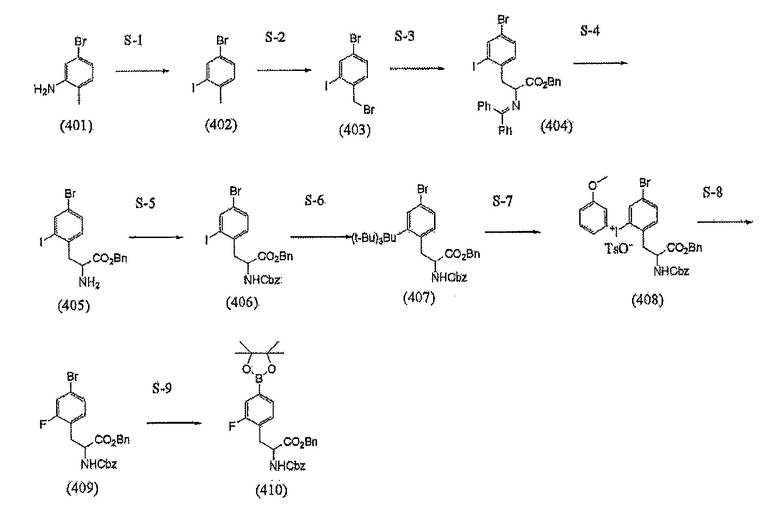
Стадия S
[Формула 11]
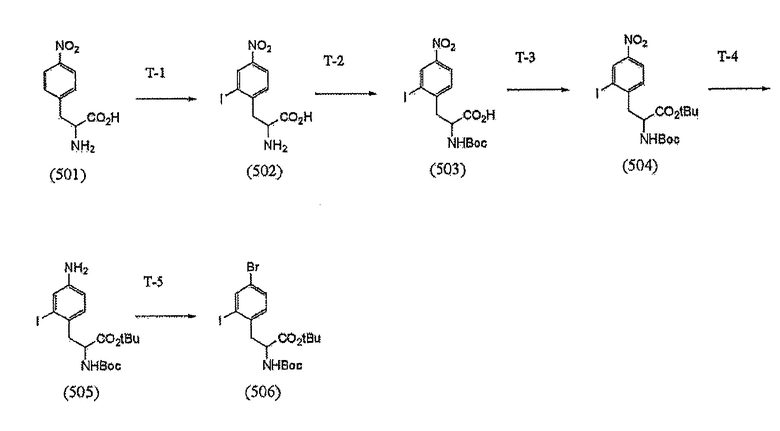
[0036] Стадия T
[Формула 12]
[0037] Стадия U
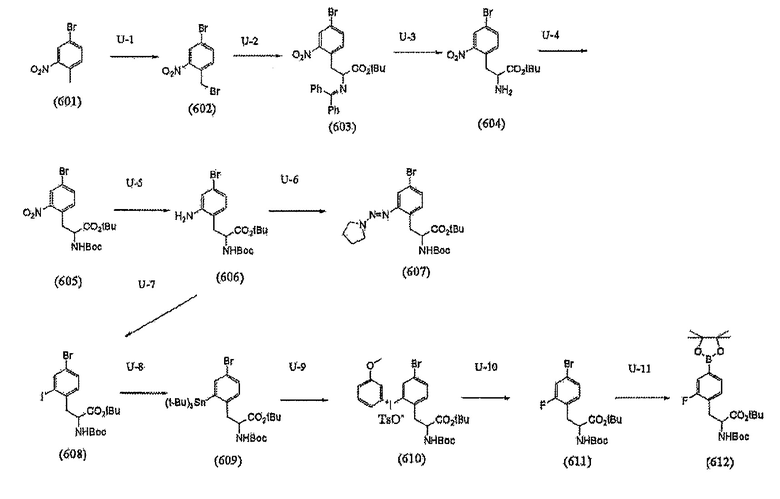
[Формула 13]
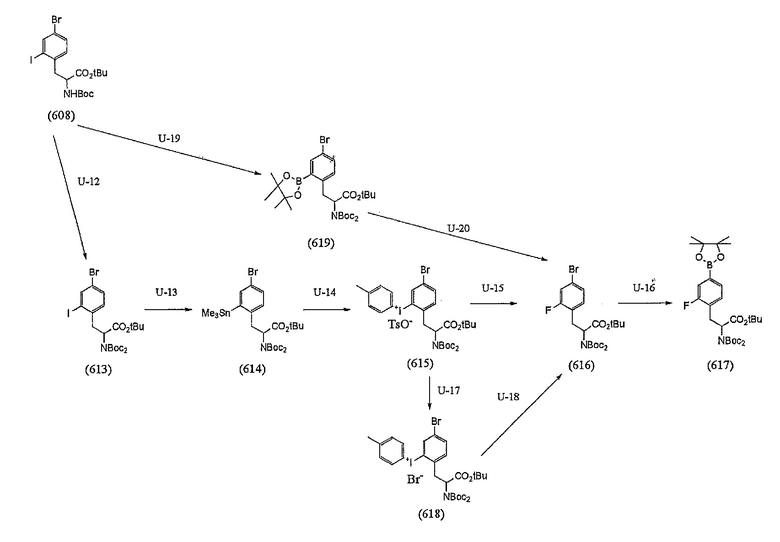
[0038] [Формула 14]
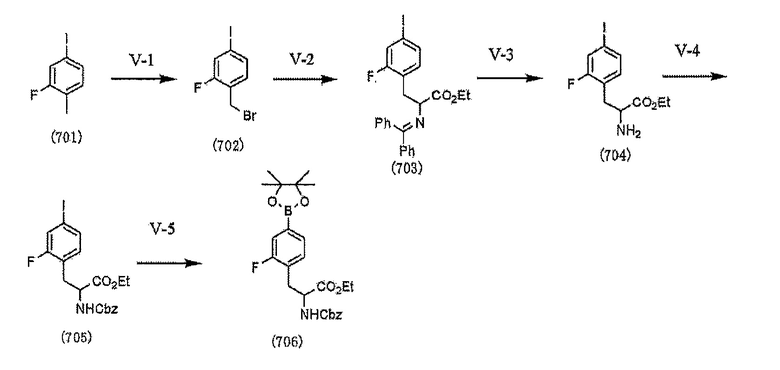
[0039] Стадия V
[Формула 15]
[0040] В реакции на каждой из стадий S - V, температура реакции варьируется в соответствии с растворителем, исходными веществами, реагентом(-ами), и прочим, и подбирается соответственно этому. Также, продолжительность реакции варьируется в соответствии с растворителем, исходными веществами, реагентом(-ами), температурой реакции, и прочим, и подбирается соответственно этому.
[0041] В реакции на каждой из стадий, целевое соединение каждой стадии может быть выделено из реакционной смеси с применением общепринятой методики по завершении каждой реакции.
[0042] Целевое соединение получают, например, путем (i) отфильтровывания катализатора и других нерастворимых веществ при необходимости, путем (ii) добавления, в реакционную смесь, воды и растворителя, несмешивающегося с водой (например, этилацетата, хлороформа, или тому подобного), для экстрагирования целевого соединения, путем (iii) промывания органического слоя водой и использования осушающего агента, такого как безводный сульфат магния, для осушивания получающегося в результате продукта при необходимости, и путем (iv) отгонки растворителя. Полученное целевое соединение может быть дополнительно очищено известным способом (например, колоночной хроматографией на силикагеле или тому подобным способом) по мере необходимости. Также, целевое соединение на каждой из стадий может быть направлено на следующую реакцию без очистки.
[0043] (Стадия S)
Иными словами, Стадия S-1 представляет собой стадию инициирования реакции соединения (401) с нитритом в кислотном водном растворе с получением соли диазония, с тем, чтобы получить соединение (402), которое представляет собой галогенсодержащее производное. Соединение (401) является известным и коммерчески доступным; однако, соединение (401) может быть получено в результате синтеза из коммерчески доступного соединения.
[0044] Реагент реакции с соединением диазония может представлять собой, например, нитрит натрия, нитрит калия, или, кроме того, алкилнитрит, такой как изобутилнитрит. Также, йодирующий реагент может представлять собой, например, йодид натрия, йодид калия, или йод, являющийся известным.
[0045] Примеры растворителя, который должен быть использован, включают воду, ацетон, ацетонитрил, тетрагидрофуран (THF), метанол, этанол, и смешанные растворители, каждый из которых состоит из двух или более типов таких растворителей. Из их числа, ацетон предпочтителен, поскольку этот растворитель неактивен в реакции диазотирования.
[0046] Температура реакции составляет предпочтительно от -20°C до комнатной температуры, более предпочтительно от -10°C до 5°C. Продолжительность реакции составляет предпочтительно от 30 минут до 2 часов, более предпочтительно от 30 минут до 1 часа.
[0047] (Стадия S-2)
Стадия S-2 представляет собой стадию инициирования реакции соединения (402) с галогенирующим реагентом в присутствии катализатора с получением соединения (403).
[0048] Примеры галогенирующего реагента, который должен быть использован, включают N-бромсукцинимид и дибром-изоциануровую кислоту. В случае, когда используют галогенирующий реагент, отличающийся от бромогруппы, примеры галогенирующего реагента, который должен быть использован, включают 1,3-дийод-5,5’-диметилгидантоин и N-йодсукцинимид. Необходимо отметить, что катализатор, который должен быть использован, представляет собой агент для радикальной полимеризации, такой как пероксид или AIBN (азо-бисизобутиронитрил).
[0049] Растворитель, который должен быть использован, особым образом не ограничивается и может представлять собой, например, бензол, хлороформ, четыреххлористый углерод. Четыреххлористый углерод является особенно предпочтительным.
[0050] Температура реакции составляет предпочтительно от комнатной температуры до 120°C, более предпочтительно от 70°C до 100°C.
[0051] Продолжительность реакции составляет предпочтительно от 1 часа до 24 часов, более предпочтительно от 6 часов до 18 часов.
[0052] Стадия S-3 представляет собой стадию инициирования реакции соединения (403) с модифицированной аминокислотой при участии катализатора фазового переноса, которые, как правило, используются в реакции Маруока в присутствии основания с получением соединения (404) иным способом.
[0053] Модифицированная аминокислота, которая должна быть использована в реакции Маруока, не ограничивается. Ее предпочтительные примеры включают метиловый сложный эфир N-дифенилметиленглицина, этиловый сложный эфир N-дифенилметиленглицина, трет-бутиловый сложный эфир N-дифенилметиленглицина, трет-бутиловый сложный эфир 4-хлорбензилиденглицина, и бензиловый сложный эфир N-дифенилметиленглицина. Из этих примеров, особенно предпочтительным является трет-бутиловый сложный эфир N-дифенилметиленглицина.
[0054] Основание, которое должно быть использовано, не ограничивается. Его предпочтительные примеры включают гидроксид лития, гидроксид натрия, гидроксид калия, и, кроме того, триэтиламин. С точки зрения скорости реакции, гидроксид калия является особенно предпочтительным.
[0055] Предпочтительные примеры модифицированной аминокислоты, которая должна быть использована в реакции Маруока, включают O-аллил-N-(9-антраценилметил)цинхонидинийбромид, и (S)-(+)-4,4-дибутил-2,6-бис(3,4,5-трифторфенил)-4,5-дигидро-3H-динафто[7,6,1,2-CDE]азепинийбромид.
[0056] Предпочтительные примеры растворителя, который должен быть использован, включают толуол, дихлорметан, и хлороформ. Толуол особенно предпочтителен с точки зрения безопасности для окружающей среды.
[0057] Температура реакции составляет предпочтительно от -20°C до 100°C, более предпочтительно от -4°C до комнатной температуры.
[0058] Продолжительность реакции составляет предпочтительно от 30 минут до 24 часов, более предпочтительно от 1 часа до 18 часов.
[0059] Полученное соединение может быть подвергнуто очистке; однако, соединениеможет быть перенесено на следующую стадию без очистки.
[0060] (Стадия S-4)
Стадия S-4 представляет собой стадию, где соединение (404) помещают в кислотный водный раствор для удаления в этом соединении защиты для аминогруппы. Растворитель, который должен быть использован для этого, может представлять собой смешанный растворитель, состоящий из лимонной кислоты или щавелевой кислоты в воде и ацетоне, ацетонитриле, тетрагидрофуране (THF), диметилформамиде (DMF), или диметилсульфоксиде (DMSO); однако, предпочтительным примером является смешанный растворитель, состоящий из лимонной кислоты или щавелевой кислоты в воде и ацетоне, ацетонитриле, или THF, с точки зрения отгонки растворителя.
[0061] Здесь, температура реакции составляет предпочтительно от комнатной температуры до 100°C, более предпочтительно от комнатной температуры до 80°C. Продолжительность реакции составляет предпочтительно от 30 минут до 24 часов, более предпочтительно от 1 часа до 3 часов.
[0062] (Стадия S-5)
Стадия S-5 представляет собой стадию, в которой используется реагент для введения защитных групп для соединения (405) с тем, чтобы ввести защиту для его аминогруппы в основных условиях. Реагент для введения защитных групп, который должен быть использован, представляет собой, например, бензил-хлорформиат, или ди-трет-бутил-дикарбонат, хотя реагент не ограничивается приведенными в качестве примера соединениями.
[0063] Предпочтительные примеры основания, которое должно быть использовано, включают гидроксид лития, гидроксид натрия, гидроксид калия, карбонат натрия, карбонат калия, и, кроме того, триэтиламин, хотя основание не ограничивается этим. В частности, предпочтительными являются карбонат натрия и карбонат калия, которые представляют собой слабые основания.
[0064] Растворитель, который должен быть использован, предпочтительно представляет собой амфифильный растворитель. В частности, его примеры включают ацетон, ацетонитрил, тетрагидрофуран (THF), диметилформамид (DMF), и диметилсульфоксид (DMSO). Растворитель предпочтительно представляет собой ацетон, ацетонитрил, или THF с точки зрения отгонки растворителя.
[0065] Температура реакции составляет предпочтительно от -20°C до 100°C, более предпочтительно от -4°C до комнатной температуры. Продолжительность реакции составляет предпочтительно от 30 минут до 24 часов, более предпочтительно от 3 часов до 18 часов.
[0066] (Стадия S-6)
Стадия S-6 представляет собой стадию получения соединения, из соединения триалкилолова реакцией сочетания по Сузуки-Мияура. Реагент для реакции, который должен быть использован, представляет собой соединение бензилолова, и катализатор, который должен быть использован, может представлять собой палладиевый катализатор, который, как правило, используется в реакции сочетания по Сузуки-Мияура, где его примеры включают циннамил-содержащий комплекс хлорида палладия, ацетат палладия, трисдибензилиденацетондипалладий, и тетракистрифенилфенилфосфинопалладий, хотя катализатор не ограничивается этими примерами. Из этих примеров, предпочтительным является тетракистрифенилфенилфосфинопалладий.
[0067] Примеры основания, которое должно быть использовано, включают гидроксид лития, гидроксид натрия, гидроксид калия, карбонат натрия, карбонат калия, ацетат натрия, ацетат калия, и, кроме того, триэтиламин; однако, предпочтительными являются ацетат натрия и ацетат калия, которые являются более слабыми основаниями.
[0068] Предпочтительный растворитель, который должен быть использован, представляет собой, например, толуол или диоксан. Температура реакции составляет предпочтительно от комнатной температуры до 150°C, более предпочтительно от 80°C до 120°С. Продолжительность реакции составляет предпочтительно от 1 часа до 48 часов, более предпочтительно от 2 часов до 24 часов.
[0069] (Стадия S-7)
Далее, Стадия S-7 для превращения соединения (407) в соединение (408) может быть, например, такой, как показано ниже, хотя и не ограничивается этим.
[0070] Соединение (407) растворяют в растворителе, и к этому добавляют иодоний, такой как реагент Козера, в потоке газообразного азота.
[0071] Примеры растворителя, который должен быть использован, включают воду, дихлорметан, ацетон, ацетонитрил, тетрагидрофуран (THF), метанол, этанол, трифторэтанол, и смешанные растворители, каждый из которых состоит из двух или более типов таких растворителей. Из их числа, дихлорметан предпочтителен.
[0072] Температура реакции составляет предпочтительно от -20°C до комнатной температуры, более предпочтительно от -10°C до 5°C. Продолжительность реакции составляет предпочтительно от 30 минут до 2 часов.
[0073] (Стадия S-8)
Реагент, используемый на Стадии S-8 для превращения соединения (408) в соединение (409), может представлять собой, например, фтороводород.
[0074] Примеры растворителя, который должен быть использован, включают воду, дихлорметан, ацетон, ацетонитрил, THF, метанол, этанол, диметилформамид (DMF), диметилсульфоксид (DMSO), и смешанные растворители, каждый из которых состоит из двух или более типов таких растворителей. Из этих примеров, предпочтительным является дихлорметан как таковой, или предпочтительной является комбинация с ацетонитрилом, DMF, или DMSO.
[0075] Температура реакции составляет предпочтительно от -20°C до 180°С, более предпочтительно от 80°C до 160°C. Продолжительность реакции составляет предпочтительно от 5 минут до 2 часов, более предпочтительно от 10 минут до 1 часа.
[0076] (Стадия S-9)
Стадия S-9 представляет собой стадию с использованием реагента для борирования пинаколина с получением производного на основе борной кислоты и пинаколина из соединения (409) при использовании микроволнового излучения или тому подобного в присутствии палладиевого катализатора и лиганда. Катализатор, который должен быть использован, может представлять собой палладиевый катализатор, который, как правило, используется в реакции сочетания по Сузуки-Мияура, где его примеры включают циннамил-содержащий комплекс хлорида палладия, ацетат палладия, и трисдибензилиденацетондипалладий, хотя катализатор не ограничивается этими примерами.
[0077] Условия микроволнового облучения включают температуру предпочтительно от комнатной температуры до 200°C, более предпочтительно от 80°C до 180°С. Продолжительность реакции составляет предпочтительно от 1 минуты до 60 минут, более предпочтительно от 5 минут до 30 минут.
[0078] Лиганд, который должен быть использован, может представлять собой лиганд на основе фосфора, который, как правило, используется в реакции сочетания по Сузуки-Мияура, где его примеры включают трициклогексилфосфин, 2-дициклогексилфосфино-2,4,6-триизопропилбифенил, 2-дициклогексилфосфино-2,-(N,N)-диметиламинобифенил, 3,5-диметокси-2-дициклогексилфосфино-2,4,6-триизопропилбифенил, и 3,5-диметокси-2-дитрет-бутилфосфино-2,4,6-триизопропилбифенил, хотя лиганд не ограничивается ими.
[0079] Примеры основания, которое должно быть использовано, включают гидроксид лития, гидроксид натрия, гидроксид калия, карбонат натрия, карбонат калия, и, кроме того, триэтиламин, хотя основание не ограничивается этим. В частности, предпочтительными являются карбонат натрия и карбонат калия, которые представляют собой слабые основания.
Предпочтительные примеры растворителя, который должен быть использован, включают толуол, диоксан, и диметилсульфоксид (DMSO).
[0080] (Стадия T-1)
Стадия T-1 представляет собой стадию получения соединения 502 путем йодирования соединения 501. Способ для проведения реакции йодирования может представлять собой, например, способ инициирования реакции между перхлоратом металла, таким как перхлорат натрия или перхлорат натрия, и йодом или йодидом металла, таким как йодид натрия, или, кроме того, способ с использованием иодирующего реагента, такого как N-йодсукцинимид, в сильной кислоте, такой как серная кислота или трифторметансульфоновая кислота.
[0081] (Стадия T-2)
Стадия T-2 представляет собой стадию, в которой используется реагент для введения защитной группы для соединения (502) с тем, чтобы ввести защиту для его аминогруппы в основных условиях. Реагент для введения защитных групп, который должен быть использован, может представлять собой, например, бензил-хлорформиат, или ди-трет-бутил-дикарбонат, хотя реагент не ограничивается приведенными в качестве примера соединениями.
[0082] Предпочтительные примеры основания, которое должно быть использовано, включают гидроксид лития, гидроксид натрия, гидроксид калия, карбонат натрия, карбонат калия, и, кроме того, триэтиламин, хотя основание не ограничивается этим. В частности, предпочтительными являются карбонат натрия и карбонат калия, которые представляют собой слабые основания.
[0083] Растворитель, который должен быть использован, предпочтительно представляет собой амфифильный растворитель. В частности, его примеры включают ацетон, ацетонитрил, тетрагидрофуран (THF), диметилформамид (DMF), и диметилсульфоксид (DMSO). Растворитель предпочтительно представляет собой ацетон, ацетонитрил, или THF с точки зрения отгонки растворителя.
[0084] Температура реакции составляет предпочтительно от -20°C до 100°C, более предпочтительно от -4°C до комнатной температуры. Продолжительность реакции составляет предпочтительно от 30 минут до 24 часов, более предпочтительно от 3 часов до 18 часов.
[0085] (Стадия T-3)
Стадия T-3 представляет собой стадию, в которой используется реагент для введения защитной группы для соединения (503) с тем, чтобы ввести защиту для его карбоксильной группы.
[0086] Примеры растворителя, который должен быть использован, включают ацетон, этилацетат, хлороформ, тетрагидрофуран (THF), диоксан, метанол, и этанол. Из их числа, метанол и этанол являются предпочтительными, поскольку эти растворители неактивны в реакции восстановления.
[0087] Температура реакции составляет предпочтительно от -20°C до 100°C, более предпочтительно от комнатной температуры до 50°C. Продолжительность реакции составляет предпочтительно от 30 минут до 24 часов, более предпочтительно от 3 часов до 18 часов.
[0088] (Стадия T-4)
Стадия T-4 представляет собой стадию получения соединения 505 в результате восстановления соединения 504 с превращением его нитрогруппы в аминогруппу. Примеры восстанавливающего агента включают реагенты, инициирующие реакцию с неорганической солью, такой как хлорид кальция, или с кислотой, такой как хлористоводородная кислота, в присутствии железа, цинка, или олова, и, кроме того, реагенты, восстанавливающие посредством газа водорода в присутствии палладия, рубидия, рутения, или их комплекса, хотя восстанавливающий агент не ограничивается этим.
[0089] Примеры растворителя, который должен быть использован, включают ацетон, ацетонитрил, тетрагидрофуран (THF), метанол, и этанол. Из их числа, метанол и этанол являются предпочтительными, поскольку эти растворители эти растворители неактивны в реакции восстановления.
[0090] Температура реакции составляет предпочтительно от -20°C до 100°С, более предпочтительно от комнатной температуры до 50°C. Продолжительность реакции составляет предпочтительно от 30 минут до 24 часов, более предпочтительно от 3 до 18 часов.
[0091] (Стадия T-5)
Стадия T-5 представляет собой стадию получения галогенсодержащего производного (506) из соединения (505) через соединение диазония. Реагент для реакции с соединением диазония может представлять собой, например, нитрит натрия, нитрит калия, или, кроме того, алкил-нитрит, такой как изобутил-нитрит. Также, йодирующий реагент может представлять собой, например, йодид натрия, йодид калия, или йод, являющийся известным.
[0092] Примеры растворителя, который должен быть использован, включают воду, ацетон, ацетонитрил, тетрагидрофуран (THF), метанол, этанол, и смешанные растворители, каждый из которых состоит из двух или более типов таких растворителей. Из их числа, ацетон предпочтителен, поскольку этот растворитель неактивен в реакции диазотирования.
[0093] Температура реакции составляет предпочтительно от -20°C до комнатной температуры, более предпочтительно от -10°C до 5°C. Продолжительность реакции составляет предпочтительно от 30 минут до 2 часов, более предпочтительно от 30 минут до 1 часа.
[0094] Галогенсодержащее производное (506), полученное таким способом, используют в синтезе соединения, подобного соединению 410, тем же самым способом, что и на Стадиях S-6 - S-9.
[0095] (Стадия U-1 - Стадия U-4)
Кроме того, Стадии U-1 - U-4 представляют собой стадии, аналогичные Стадиям S-2 - S-5, и являются стадиями получения соединений 601, 602, 603, 604, и 605.
[0096] (Стадия U-5)
Стадия U-5 представляет собой стадию, на которой соединение (605) подвергают восстановлению гидрированием с получением производного анилина. Катализатор, который должен быть испоьзован для этого, представляет собой, например, гидроксид палладия или палладий на углеродном носителе, хотя катализатор не ограничивается этим.
[0097] Примеры растворителя, который должен быть использован, включают ацетон, ацетонитрил, THF, метанол, и этанол. Среди них, метанол и этанол являются предпочтительными, поскольку эти растворители неактивны в реакции восстановления.
[0098] Температура реакции составляет предпочтительно от -20°C до 100°С, более предпочтительно от комнатной температуры до 50°C. Продолжительность реакции составляет предпочтительно от 30 минут до 24 часов, более предпочтительно от 3 до 18 часов.
[0099] (Стадия U-6)
Стадия U-6 представляет собой стадию получения, из соединения (606), производного триазена (607) через соединение диазония.
[0100] Реагент для реакции с соединением диазония, который должен быть использован, может представлять собой, например, нитрит натрия, нитрит калия, или, кроме того, алкил-нитрит, такой как изобутил-нитрит. Также, реагент для реакции может представлять собой, например, диметиламин, циклопентиламин, или циклогексиламин, который является известным.
[0101] Примеры растворителя, который должен быть использован, включают воду, ацетон, ацетонитрил, тетрагидрофуран (THF), метанол, этанол, и смешанные растворители, каждый из которых состоит из двух или более типов таких растворителей. Из их числа, ацетон предпочтителен, поскольку этот растворитель неактивен в реакции диазотирования.
[0102] Температура реакции составляет предпочтительно от -20°C до комнатной температуры, более предпочтительно от -10°C до 5°C. Продолжительность реакции составляет предпочтительно от 30 минут до 2 часов, более предпочтительно от 30 минут до 1 часа. Также, можно получить из соединения (607)-(611).
[0103] (Стадия U-7)
Стадия U-7 представляет собой стадию получения галогенсодержащего производного (608) из соединения (606) через соединение диазония. Реагент для реакции с соединением диазония может представлять собой, например, нитрит натрия, нитрит калия, или, кроме того, алкил-нитрит, такой как изобутил-нитрит. Также, йодирующий реагент может представлять собой, например, йодид натрия, йодид калия, или йод, являющийся известным.
[0104] Примеры растворителя, который должен быть использован, включают воду, ацетон, ацетонитрил, тетрагидрофуран (THF), метанол, этанол, и смешанные растворители, каждый из которых состоит из двух или более типов таких растворителей. Из их числа, ацетон предпочтителен, поскольку этот растворитель неактивен в реакции диазотирования.
[0105] Температура реакции составляет предпочтительно от -20°C до комнатной температуры, более предпочтительно от -10°C до 5°C. Продолжительность реакции составляет предпочтительно от 30 минут до 2 часов, более предпочтительно от 30 минут до 1 часа.
[0106] (Стадия U-8)
Стадия U-8 представляет собой стадию получения, из соединения (608), соединения триалкилолова (609) путем проведения реакции сочетания по Сузуки-Мияура. Реагент для этой реакции, который должен быть использован, может представлять собой, например, соединение трибутилолова или соединение триметилолова. Катализатор, который должен быть использован, может представлять собой палладиевый катализатор, который, как правило, используется в реакции сочетания по Сузуки-Мияура, где его примеры включают циннамил-содержащий комплекс хлорида палладия, ацетат палладия, трисдибензилиденацетондипалладий, и тетракистрифенилфенилфосфинопалладий, хотя катализатор не ограничивается этими примерами. Из этих примеров, предпочтительным является тетракистрифенилфенилфосфинопалладий.
[0107] Примеры основания, которое должно быть использовано, включают гидроксид лития, гидроксид натрия, гидроксид калия, карбонат натрия, карбонат калия, ацетат натрия, ацетат калия, и, кроме того, триэтиламин; однако, предпочтительными являются ацетат натрия и ацетат калия, которые являются более слабыми основаниями.
[0108] Предпочтительный растворитель, который должен быть использован, представляет собой, например, толуол или диоксан. Температура реакции имеет величину предпочтительно от комнатной температуры до 150°C, более предпочтительно от 80°C до 120°С. Продолжительность реакции составляет предпочтительно от 1 часа до 48 часов, более предпочтительно от 2 часов до 24 часов.
[0109] (Стадия U-9)
Для Стадии U-9 для превращения соединения (609) в соединение (610), в качестве примера ниже приводят следующую операцию, хотя операция для этой стадии не ограничивается.
[0110] Соединение (609) растворяют в растворителе, и к этому добавляют иодоний, такой как реагент Козера, в потоке газообразного азота.
[0111] Примеры растворителя, который должен быть использован, включают воду, дихлорметан, ацетон, ацетонитрил, тетрагидрофуран (THF), метанол, этанол, трифторэтанол, и смешанные растворители, каждый из которых состоит из двух или более типов таких растворителей. Из их числа, дихлорметан предпочтителен.
[0112] Температура реакции составляет предпочтительно от -20°C до комнатной температуры, более предпочтительно от -10°C до 5°C. Продолжительность реакции составляет предпочтительно от 30 минут до 2 часов.
[0113] (Стадия U-10)
Реагент, используемый на Стадии U-10 для превращения соединения (610) в соединение (611), может представлять собой, например, фтороводород.
[0114] Примеры растворителя, который должен быть использован, включают воду, дихлорметан, ацетон, ацетонитрил, THF, метанол, этанол, диметилформамид (DMF), диметилсульфоксид (DMSO), и смешанные растворители, каждый из которых состоит из двух или более типов таких растворителей. Из этих примеров, предпочтительным является дихлорметан как таковой, или предпочтительной является комбинация с ацетонитрилом, DMF, или DMSO.
[0115] Температура реакции имеет величину предпочтительно от -20°C до 180°С, более предпочтительно от 80°C до 160°C. Продолжительность реакции составляет предпочтительно от 5 минут до 2 часов, более предпочтительно от 10 минут до 1 часа.
[0116] (Стадия U-11)
Стадия U-11 представляет собой стадию с использованием реагента для борирования пинаколина с получением производного на основе борной кислоты и пинаколина из соединения 611 при использовании микроволнового излучения в присутствии палладиевого катализатора и лиганда с применением способа, аналогичного способу Стадии S-9.
[0117] (Стадия U-12)
Стадия U-12 представляет собой стадию, в которой используется реагент для бутоксикарбонилирования в присутствии диметиламинопиридина (DMAP), с получением ди-бутоксикарбонил-содержащего (di-Boc) производного кислоты из соединения (608).
[0118] Примеры растворителя, который должен быть использован, включают толуол, диоксан, ацетон, DMF, DMSO, и ацетонитрил (MeCN), хотя растворитель не ограничивается. В частности, ацетон и MeCN являются предпочтительными.
[0119] Температура реакции имеет величину предпочтительно от комнатной температуры до 100°C, более предпочтительно от 30°C до 60°C.
[0120] Продолжительность реакции составляет предпочтительно от 8 часов до 48 часов, более предпочтительно от 12 часов до 24 часов.
[0121] (Стадия U-13)
Стадия U-13 представляет собой стадию получения, из соединения (613), соединения триалкилолова (614) путем проведения реакции сочетания по Сузуки-Мияура. Реагент для этой реакции, который должен быть использован, может представлять собой, например, соединение трибутилолова или соединение триметилолова. Катализатор, который должен быть использован, может представлять собой палладиевый катализатор, который, как правило, используется в реакции сочетания по Сузуки-Мияура, где его примеры включают циннамил-содержащий комплекс хлорида палладия, ацетат палладия, трисдибензилиденацетондипалладий, и тетракистрифенилфенилфосфинопалладий, хотя катализатор не ограничивается этими примерами. Из этих примеров, предпочтительным является тетракистрифенилфенилфосфинопалладий.
[0122] Примеры основания, которое должно быть использовано, включают гидроксид лития, гидроксид натрия, гидроксид калия, карбонат натрия, карбонат калия, ацетат натрия, ацетат калия, и, кроме того, триэтиламин; однако, предпочтительными являются ацетат натрия и ацетат калия, которые являются более слабыми основаниями.
[0123] Предпочтительный растворитель, который должен быть использован, представляет собой, например, толуол или диоксан. Температура реакции имеет величину предпочтительно от комнатной температуры до 150°C, более предпочтительно от 80°C до 120°С. Продолжительность реакции составляет предпочтительно от 1 часа до 48 часов, более предпочтительно от 2 часов до 24 часов.
[0124] (Стадия U-14)
Стадия U-14 представляет собой стадию получения соли диарилиодония (615) из соединения олова (614). Для рассматриваемой стадии, в качестве примера приводят ниже следующую операцию, хотя операция для этой стадии особым образом не ограничивается.
[0125] Получение проводят путем добавления иодония, такого как реагент Козера, к соединению олова (614) в потоке газообразного азота.
[0126] Примеры растворителя, который должен быть использован, включают воду, дихлорметан, ацетон, ацетонитрил, тетрагидрофуран (THF), метанол, этанол, 2,2,2-трифторэтанол, 1,1,1,3,3,3-гексафторизопропанол, и смешанные растворители, каждый из которых состоит из двух или более типов таких растворителей. Из их числа, предпочтительным является дихлорметан, 2,2,2-трифторэтанол, или 1,1,1,3,3,3-гексафторизопропанол.
[0127] Температура реакции имеет величину предпочтительно от -20°C до 60°С, более предпочтительно от -10°C до комнатной температуры. Продолжительность реакции составляет предпочтительно от 30 минут до 2 часов.
[0128] (Стадия U-15)
Стадия U-15 представляет собой стадию получения фторированного соединения (616) из соли диарилиодония (615). Примеры реагента, который должен быть использован на Стадии U-15, включают фтороводород, фторид калия, и фторид цезия.
[0129] Примеры растворителя, который должен быть использован, включают воду, дихлорметан, ацетон, ацетонитрил, тетрагидрофуран (THF), метанол, этанол, диметилформамид (DMF), диметилсульфоксид (DMSO), и смешанные растворители, каждый из которых состоит из двух или более типов таких растворителей. Из этих примеров, предпочтительным(-ой) является дихлорметан как таковой, ацетонитрил как таковой, DMF как таковой, DMSO как таковой, или комбинация этих растворителей.
[0130] Температура реакции имеет величину предпочтительно от -20°C до 180°С, более предпочтительно от 80°C до 160°С. Продолжительность реакции составляет предпочтительно от 5 минут до 2 часов, более предпочтительно от 10 минут до 1 часа.
[0131] (Стадия U-16)
Стадия U-16 представляет собой стадию с использованием реагента для борирования пинаколина с получением производного на основе борной кислоты и пинаколина из соединения (616) при использовании микроволнового излучения в присутствии палладиевого катализатора и лиганда.
[0132] Катализатор, который должен быть использован, может представлять собой палладиевый катализатор, который, как правило, используется в реакции сочетания по Сузуки-Мияура, где его примеры включают циннамил-содержащий комплекс хлорида палладия, ацетат палладия, и трисдибензилиденацетондипалладий, хотя катализатор не ограничивается этими примерами.
[0133] Условия микроволнового облучения включают температуру предпочтительно от комнатной температуры до 200°C, более предпочтительно от 80°C до 180°С. Продолжительность реакции составляет предпочтительно от 1 минуты до 60 минут, более предпочтительно от 5 минут до 30 минут.
[0134] Лиганд, который должен быть использован, может представлять собой лиганд на основе фосфора, который, как правило, используется в реакции сочетания по Сузуки-Мияура, где его примеры включают трициклогексилфосфин, 2-дициклогексилфосфино-2,4,6-триизопропилбифенил, 2-дициклогексилфосфино-2,-(N,N)-диметиламинобифенил, 3,5-диметокси-2-дициклогексилфосфино-2,4,6-триизопропилбифенил, и 3,5-диметокси-2-дитрет-бутилфосфино-2,4,6-триизопропилбифенил, хотя лиганд не ограничивается этими примерами.
[0135] Примеры основания, которое должно быть использовано, включают гидроксид лития, гидроксид натрия, гидроксид калия, карбонат натрия, карбонат калия, и, кроме того, триэтиламин, хотя основание не ограничивается этим. В частности, предпочтительными являются карбонат натрия и карбонат калия, которые представляют собой слабые основания.
Предпочтительные примеры растворителя, который должен быть использован, включают толуол, диоксан, и диметилсульфоксид (DMSO).
[0136] (Стадия U-17)
Стадия U-17 представляет собой стадию, где соединение (615) подвергают реакции солевого обмена для замены противоионов, с тем, чтобы получить соединение (618). Реагент для этой реакции может представлять собой, например, хлорид натрия или бромид калия.
[0137] (Стадия U-18)
Примеры реагента, который должен быть использован на Стадии U-18, включают фтороводород, фторид калия, и фторид цезия.
[0138] Примеры растворителя, который должен быть использован, включают воду, дихлорметан, ацетон, ацетонитрил, THF, метанол, этанол, диметилформамид (DMF), диметилсульфоксид (DMSO), и смешанные растворители, каждый из которых состоит из двух или более типов таких растворителей. Из этих примеров, предпочтительным является дихлорметан как таковой, ацетонитрил как таковой, диметилформамид (DMF) как таковой, диметилсульфоксид (DMSO) как таковой, или предпочтительной является их комбинация.
[0139] Температура реакции имеет величину предпочтительно от -20°C до 180°С, более предпочтительно от 80°C до 160°С. Продолжительность реакции составляет предпочтительно от 5 минут до 2 часов, более предпочтительно от 10 минут до 1 часа.
[0140] (Стадия U-19)
Стадия U-19 представляет собой стадию с использованием реагента для борирования пинаколина с получением производного на основе борной кислоты и пинаколина из соединения (608) в присутствии палладиевого катализатора и лиганда. Катализатор, который должен быть использован, может представлять собой палладиевый катализатор, который, как правило, используется в реакции сочетания по Сузуки-Мияура, где его примеры включают дихлорбис(трифенилфосфин)палладий, циннамил-содержащий комплекс хлорида палладия, ацетат палладия, и трисдибензилиденацетондипалладий, хотя катализатор не ограничивается этими примерами.
[0141] Лиганд, который должен быть использован, может представлять собой лиганд на основе фосфора, который, как правило, используется в реакции сочетания по Сузуки-Мияура, где его примеры включают трициклогексилфосфин, 2-дициклогексилфосфино-2,4,6-триизо-пропилбифенил, 2-дициклогексилфосфино-2,-(N,N)-диметиламинобифенил, 3,5-диметокси-2-дициклогексилфосфино-2,4,6-триизопропилбифенил, и 3,5-диметокси-2-дитрет-бутилфосфино-2,4,6-триизопропилбифенил, хотя лиганд не ограничивается этими примерами.
[0142] Примеры основания, которое должно быть использовано, включают ацетат натрия, ацетат калия, гидроксид лития, карбонат натрия, карбонат калия, и, кроме того, триэтиламин, хотя основание не ограничивается этим. В частности, предпочтительными являются ацетат натрия и ацетат калия, которые представляют собой слабые основания.
[0143] Предпочтительные примеры растворителя, который должен быть использован, включают толуол, диоксан, и диметилсульфоксид (DMSO). Температура реакции имеет величину предпочтительно от комнатной температуры до 150°C, более предпочтительно от 80°C до 120°C.
[0144] Продолжительность реакции составляет предпочтительно от 30 минут до 48 часов, более предпочтительно от 2 часов до 18 часов.
[0145] (Стадия U-20)
Стадия U-20 представляет собой стадию инициирования реакции между соединением (619) и реагентом для фторирования в присутствии медного катализатора с получением соединения (616). Реагент для фторирования, который должен быть использован, может представлять собой, например, фтороводород или фторид калия.
[0146] Примеры растворителя, который должен быть использован, включают толуол, диоксан, диметилформамид (DMF), DMSO, и ацетонитрил (MeCN), среди которых DMF и MeCN являются предпочтительными.
[0147] Температура реакции имеет величину предпочтительно от комнатной температуры до 150°C, более предпочтительно от 80°C до 120°C.
[0148] Продолжительность реакции составляет предпочтительно от 1 минуты до 60 минут, более предпочтительно от 5 минут до 30 минут.
[0149] (Стадия V-1 - Стадия V-4)
Стадии V-1 - V-4 представляют собой стадии, аналогичные Стадиям S-2 - S-5, и представляют собой стадии получения соединений 701, 702, 703, 704, и 705.
[0150] (Стадия V-5)
Кроме того, Стадия V-5 аналогична Стадии U-11.
[0151] В том случае, когда F содержится в соединении в каждом производном, введение метки может быть выполнено посредством 18F вместо F.
[0152] Например, H218O может быть подвергнута облучению ускоренными протонами для выполнения синтеза H18F-фтористоводородной кислоты с применением реакции 18O(p, n), и затем эта кислота может быть пропущена через колонку с ионообменной смолой, на которой должна быть адсорбирована, для отделения этой кислоты от H218O, которая представляет собой неадсорбируемое исходное вещество. Эту колонку подвергают элюированию водным раствором K2CO3, что дает в результате K+18F-, который может быть использован в качестве нуклеофильного агента.
[Формула 16]
[0153] В том случае, когда в настоящем изобретении среди соединений перед фторированием присутствует N=N-NR7R8, можно осуществить введение метки посредством 18F известным способом. Имеется в виду, что полученные анионы 18F используют в качестве нуклеофильного агента, и эти анионы нагревают вместе с катализатором фазового переноса в органическом растворителе, в результате чего получают меченое тело (вещество).
[0154] Далее, что касается Sn(R6)3, то меченое тело получают с применением метода Эрмерта и других (Непатентный Документ: J. Label. Compd. Radiopharm., 47, 429, 2004.). Иными словами, меченое тело образуется с хорошей эффективностью в результате инициирования реакции с гидроксил(тозилокси)йодоареном, таким как реагент Козера, с получением соли диаллилиодония на некоторое время, и затем инициирования реакции между этой солью и нуклеофильным агентом 18F-.
[0155] Кроме того, каждая защитная группа может быть снята общепринятым способом, посредством чего может быть приготовлен целевой фторированный BPA (4-боронофенилаланин).
[0156] В результате использования способа по настоящему изобретению, такое 18F-меченое соединение может быть получено со сравнительно хорошим выходом и в состоянии, имеющем хорошую удельную активность.
ПРИМЕРЫ
[0157] Настоящее изобретение будет описано более подробно посредством приведенных ниже Примеров; однако, такое изобретение не ограничивается этим как таковым.
[0158] Здесь, в Примерах, описываемых ниже, для проведения анализа соединений и выделения/очистки соединений используют следующие установки и реагенты.
[0159] ЯМР-спектр: спектрометр JNM-AL серии AL400, изготовленный в JEOL Ltd., на 400 МГц
[0160] Микроволновое излучение: Инициатор+, изготовленный в Biotage
Анализ методом сверхэффективной жидкостной хроматографии (UPLC): хроматографическая система ACQUITY UPLC, изготовленная в Nihon Waters K.K.
[0161] (Пример 1)
Получение 4-бром-2-йодтолуола
В 30%-ном растворе серной кислоты (100 мл), суспендируют 4-бром-2-аминотолуол (10,0 г, 53,7 ммоль). К этому, медленно по каплям добавляют из капельной воронки водный раствор (15 мл) нитрита натрия (3,89 г, 56,4 ммоль) при одновременном охлаждении системы льдом. То, что получается в результате этого, перемешивают при 0°C в течение 45 минут. После этого, йодид натрия (12,1 г, 80,6 ммоль) растворяют в воде (50 мл). К этому водному раствору добавляют вышеупомянутый раствор соли диазония. То, что получается в результате этого, перемешивают дополнительно в течение 1 часа при комнатной температуре, и затем подвергают экстракции этилацетатом 3 раза. После этого, этилацетатный слой однократно промывают насыщенным солевым раствором, затем сушат над сульфатом магния, и концентрируют при пониженном давлении. После этого, то, что получается в результате, очищают на колонке с силикагелем (н-гексан), что дает целевое соединение (9,0 г, 45%).
1H-ЯМР (CDCl3); 2,37 (с, 3H, CH3), 7,08 (д, J=8,0, 1H, Ar), 7,35 (дд, J=1,6, 8,0, 1H, Ar), 7,93 (д, J=2,0, 1H, Ar).
[0162] Получение 4-бром-2-йодбензил-бромид
К четыреххлористому углероду (100 мл) добавляют 4-бром-2-йодтолуол (9,00 г, 23,9 ммоль), полученный на предыдущей стадии, N-бромсукцинимид (5,95 г, 33,5 ммоль), и 2,2-азобис(2-метилпропионитрил) (39 мг, 2,4 ммоль), что инициирует реакцию между реагентами в течение 18 часов при одновременном подвергании реакционной системы кипячению с обратным холодильником. После этого, реакционную жидкость фильтруют, и получающийся в результате фильтрат концентрируют при пониженном давлении. Получающийся в результате продукт очищают посредством колоночной хроматографии на силикагеле (н-гексан), что дает 7,0 г целевого соединения (78%).
1H-ЯМР (CDCl3); 4,53 (с, 2H, CH2), 7,32 (д, J=8,0, 1H, Ar), 7,46 (дд, J=2,0, 8,4, 1H, Ar), 7,93 (д, J=2,0, 1H, Ar).
[0163] Получение бензил-3-(4-бром-2-йодфенил)-2-(дифенилметиленамино)пропаноата
К толуолу (100 мл) добавляют гидроксид цезия (7,54 г, 50,3 ммоль), бензил-N-(дифенилметилен)глицинат (5,50 г, 16,7 ммоль), и O-аллил-N-9-антраценилметилцинхонидий-бромид (1,10 г, 1,67 ммоль, 0,1 экв.). Получающийся в результате раствор смеси охлаждают до 0°C. После этого, при энергичном перемешивании этого толуольного раствора смеси, за один прием добавляют весь толуольный (10 мл) раствор соединения (6,30 г, 16,7 ммоль), полученный на предыдущей стадии. После завершения добавления по каплям, получающийся в результате раствор перемешивают в течение 18 часов при поддерживании его в том же состоянии. После этого, реакционный раствор подвергают экстракции эфиром (50 мл) два раза, и, дополнительно, этот эфирный слой промывают насыщенным солевым раствором, затем сушат над сульфатом магния, и концентрируют при пониженном давлении, посредством чего получают в результате сырое целевое соединение (8,7 г).
Это соединение используют на следующей стадии без очистки.
[0164] Получение бензил-2-амино-3-(4-бром-2-йодфенил)пропаноата
Соединение бензил-3-(4-бром-2-йодфенил)-2-(дифенилметиленамино)пропаноат (8,6 г), полученное на предыдущей стадии, растворяют в THF (86 мл), и дополнительно, к этому добавляют 30%-ный водный раствор лимонной кислоты (50 мл). Раствор этой смеси приводят к вступлению в реакцию при кипячении с обратным холодильником в течение 1 часа. После завершения реакции, реакционный раствор промывают эфиром (80 мл), и затем нейтрализуют карбонатом калия. После этого, получающийся в результате раствор подвергают экстракции посредством EtOAc (80 мл) два раза, сушат над сульфатом магния, и затем концентрируют при пониженном давлении. Далее, получающийся в результате продукт очищают посредством колоночной хроматографии на силикагеле (AcOEt/н-гексан=1/1), что дает целевое соединение (2,40 г, с выходом 31%).
1H-ЯМР (CDCl3); 2,90 (дд, J=8,4, 13,6, 1H, CH2-α), 3,18 (дд, J=6,4, 13,6, 1H, CH2-β), 3,83 (дд, J=6,4, 8,2, 1H, CH), 5,14 (м, 2H, CH2Ar), 7,01 (д, J=8,4, 1H, Ar), 7,26-7,39 (м, J=6,0, 8,4, 1H, Ar), 7,96 (д, J=2,4, 1H, Ar).
[0165] Получение бензил-3-(2-бром-4-йодфенил)-2-(бензилоксикарбониламино)пропаноата
Вышеупомянутое соединение бензил-2-амино-3-(4-бром-2-йодфенил)пропаноат (2,32 г, 5,44 ммоль) растворяют в THF (50 мл). К тому добавляют H2O (50 мл) и K2CO3 (903 мг, 6,53 ммоль), и получающуюся в результате смесь перемешивают при одновременном охлаждении системы льдом. Туда, медленно добавляют раствор, полученный добавлением бензил-хлорформиата (1,11 г, 6,53 ммоль) к ацетонитрилу (10 мл), и получающуюся в результате смесь перемешивают при комнатной температуре в течение 12 часов. Реакционный раствор подвергают экстракции посредством AcOEt (50 мл) три раза, и органический слой промывают 10%-ным водным раствором лимонной кислоты (50 мл) три раза и дополнительно насыщенным солевым раствором (50 мл) два раза, с последующей сушкой над MgSO4. После концентрирования органического слоя, получающийся в результате продукт очищают посредством колоночной флэш-хроматографии (гексан:AcOEt=6:1), что дает в результате целнвое соединение в виде бесцветного маслянистого вещества (2,68 г, 83%).
1H-ЯМР(CDCl3); 3,10 (дд, J=8,0, 14,8, 1H, CH2-α), 3,26 (дд, J=6,4, 14,8, 1H, CH2-β), 4,73 (м, 1H, CH), 5,06 (м, 2H, CH2Ar), 5,15 (с, 2H, CH2Ar), 5,30 (м, J=8,0, 1H, NH), 7,24-7,36 (м, 11H, Ar), 7,91 (д, J=1,7, 1H, Ar).
[0166] Получение бензил-2-(бензилоксикарбониламино)-3-(4-бром-2-(три-н-бутилстаннил)фенил)пропаноата
PdCl2(dppf) (40 мг, 0,049 ммоль), бис(трибутилолово) (627 мг, 1,08 ммоль), и ацетат калия растворяют в DMSO (5 мл) в атмосфере Ar, и получающуюся в результате смесь поддерживают при перемешивании при комнатной температуре. После добавления туда DMSO-ного раствора (2 мл) вышеупомянутого соединения бензил-3-(2-бром-4-йодфенил)-2-(бензилоксикарбониламино)пропаноата (515 мг, 0,979 ммоль), получающуюся в результате смесь перемешивают при 80°C в течение 24 часов. Реакционный раствор разбавляют этилацетатом (70 мл) и подвергают фильтрации на Целите. После этого, получающийся в результате продукт промывают водой и солевым раствором, и органический слой сушат над MgSO4. Органический слой фильтруют, и органический растворитель концентрируют, и затем очищают посредством колоночной хроматографии (гексан:этилацетат=9:1), что дает в результате целевое соединение в виде бесцветного маслянистого вещества (381 мг, 74%).
1H-ЯМР(CDCl3); 0,85 (т, J=7,6, 9H, -CH2CH2CH3×3), 1,05 (м, 6H, -CH2CH2CH3×3), 1,27-1,45 (м, 6H, -CH2CH2CH3×3), 3,01 (дд, J=9,2, 14,4, 1H, CH2-α), 3,48 (дд, J=4,4, 14,4, 1H, CH2-β), 4,53 (м, 1H, CH), 5,04 (с, 2H, CH2Ar), 5,20 (м, 2H, CH2Ar), 6,95 (д, J=7,6, 1H, Ar), 7,10-7,44 (м, 12H, Ar).
[0167] Получение (2-(3-бензилокси-2-(бензилоксикарбониламино)-3-оксопропил)-5-бромфенил)(3-метоксифенил)иодоний-тозилата
Трифторэтанол (2 мл) добавляют к вышеупомянутому соединению бензил-2-(бензилоксикарбониламино)-3-(4-бром-2-(три-н-бутилстаннил)фенил)пропаноату (154 мг, 0,228 ммоль), и получающуюся в результате смесь перемешивают на водяной бане со льдом в потоке газообразного азота в течение 1 часа. Туда добавляют соль иодония (96,10 мг, 0,228 ммоль) при одновременном охлаждении системы льдом. Получающуюся в результате смесь перемешивают в течение 15 минут на водяной бане со льдом. Из реакционной смеси, представляющей собой жидкость, при комнатной температуре отгоняют растворитель. К полученной смеси добавляют гексан (10 мл), и смесь промывают и подвергают декантации для удаления части раствора. Аналогичную операцию выполняют два раза, и остаточный растворитель в полученной смеси полностью удаляют при пониженном давлении, в результате чего получают целевое соединение (159 мг, 80%).
1H-ЯМР (DMSO-d6); 2,29 (с, 3H, TsOH-CH3), 3,23 дд, J=10,8, 14,8, 1H, CH2-α), 3,39 (м, 1H, CH2-β, перекрывается с сигналом воды), 3,75 (с, 3H, -OCH3), 4,51 (м, 1H, CH), 5,00 (м, 2H, BnCH2), 5,17 (с, 2H, BnCH2), 7,12 (д, J=8,0, 2H, TsOH-Ar), 7,19-8,06 (м, 19H, Ar).
[0168] Получение бензил-2-(бензилоксикарбониламино)-3-(4-бром-2-фторфенил)пропаноата
Вышеупомянутое соединение (2-(3-бензилокси-2-(бензилоксикарбониламино)-3-оксопропил)-5-бромфенил)(3-метоксифенил)иодоний-тозилат (100 мг, 0,115 ммоль), криптофикс 2.2.2 (43,1 мг, 0,115 ммоль), и фторид калия (6,7 мг, 0,115 ммоль) перемешивают в DMF (10 мл) при 100°C в течение 15 минут. После завершения реакции, растворитель отгоняют при пониженном давлении, и полученный остаток очищают посредством колоночной хроматографии на силикагеле (гексан:AcOEt=7:1), что дает в результате целевое соединение (34,0 мг, 61%).
1H-ЯМР (CDCl3); 3,05 (дд, J=6,4, 14,0, 1H, CH2-α), 3,16 (дд, J=5,6, 14,0, 1H, CH2-β), 4,67 (м, 1H, CH), 5,08 (м, 2H, BnCH2), 5,13 (с, 2H, BnCH2), 5,31 (д, J=8,0, 1H, NH), 6,86 (м, 1H, Ar), 7,09-7,15 (м, 2H, Ar), 7,26-7,37 (м, 10H, Ar).
[0169] Получение бензил-2-(бензилоксикарбониламино)-3-(2-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-пропаноата
В потоке газообразного азота, PdCl2(dba) (27,5 мг, 0,03 экв.) и трициклофосфин (16,8 мг, 0,06 экв.) суспендируют в диоксане (5 мл). После перемешивания в течение 30 минут, добавляют бис(пинаколат)диборан (305 мг, 1,20 ммоль) и KOAc (294 мг, 3,00 ммоль), и, кроме того, добавляют вышеупомянутое соединение бензил-2-(бензилоксикарбониламино)-3-(4-бром-2-фторфенил)пропаноат (486 мг, 1,00 ммоль).
После этого, микроволновое облучение проводят при 150°C в течение 15 минут, что дает в результате целевое соединение (421 мг, 79%).
1H-ЯМР (CDCl3); 3,14 (дд, J=8,8, 13,6, 1H, CH2-α), 3,20 (дд, J=5,2, 13,6, 1H, CH2-β), 4,69 (м, 1H, CH), 5,08 (м, 1H, BnCH2), 5,14 (с, 1H, BnCH2), 5,30 (д, J=8,0, NH), 7,05 (т, J=7,3, 1H, Ar), 7,26-7,50 (м, 12H, Ar).
[0170] (Пример 2)
Получение трет-бутил-2-(трет-бутоксикарбониламино)-3-(2-йод-4-нитрофенил)пропаноата
В трифторметансульфоновой кислоте (5 мл), растворяют 4-нитрофенилаланин (1,00 , 4,76 ммоль). К этому, за 15 минут тремя частями добавляют N-йодсукцинимид (963 мг, 0.9 экв. Далее, инициируют протекание реакции в получающейся в результате смеси при комнатной температуре в течение 18 часов.
[0171] После этого, вышеупомянутую реакционную жидкость добавляют в воду со льдом, посредством карбоната калия устанавливают значение pH, которое должно быть на уровне 12 или более. Далее, добавляют ацетонитрильный раствор (приблизительно 10 мл) Boc2O (1,25 г, 5,71 ммоль), и смесь перемешивают при комнатной температуре в течение 18 часов. После завершения реакции, посредством лимонной кислоты устанавливают значение pH, которое должно быть 4 или менее, и получающуюся в результате смесь подвергают экстракции этилацетатом (50 мл) три раза. Далее, этот органический слой промывают водой (100 мл) и насыщенным солевым раствором (100 мл). Получающийся в результате продукт сушат над сульфатом магния и после этого концентрируют при пониженном давлении, что дает промежуточный сырой продукт. Далее, этот сырой продукт (503) растворяют в трет-BuOH (20 мл), и добавляют Boc2O (1,25 г, 5,71 ммоль). Впоследствии, добавляют диметиламинопиридин (DMAP) (116 мг, 0,951 ммоль). После этого, получающуюся в результате смесь перемешивают при комнатной температуре в течение 18 часов. После завершения реакции, растворитель отгоняют при пониженном давлении, и затем получающийся в результате продукт очищают посредством колоночной хроматографии на силикагеле, что дает целевое соединение трет-бутил-2-(трет-бутоксикарбониламино)-3-(2-йод-4-нитрофенил)пропаноат (1,26 г, 54%).
1H-ЯМР (CDCl3); 1,35 (с, 9Н, трет-Bu), 1,42 (с, 9H, трет-Bu), 3,10 (дд, J=8,4, 13,6, 1H, CH2-α), 3,18 (дд, J=6,4, 13,6, 1H, CH2-β), 3,83 (дд, J=6,4, 8,2, 1H, CH), 5,14 (м, 2H, CH2Ar), 7,41 (д, J=8,4, 1H, Ar), 8,13 (дд, J=2,0, 8,4, 1H, Ar), 8,68 (д, J=2,0, 1H, Ar).
[0172] Получение трет-бутил-2-(трет-бутоксикарбониламино)-3-(4-амино-2-йодфенил)пропаноата
Вышеупомянутое соединение трет-бутил-2-(трет-бутоксикарбониламино)-3-(2-йод-4-нитрофенил)пропаноат (2,32 г, 4,71 ммоль) растворяют в этаноле (23 мл), и, кроме того, добавляют порошковое железо (0,657 г, 2,5 экв.). После этого, температуру повышают до 80°C. После этого, водный раствор, полученный растворением хлорида аммония (0,252 г, 1,0 экв.) в воде (2 мл), добавляют весь за один прием. Далее, инициируют протекание реакции в получающейся в результате смеси при 80°C в течение 1 часа. После завершения реакции, порошковое железо и тому подобное отфильтровывают, и после этого фильтрат концентрируют при пониженном давлении. Концентрат растворяют в этилацетате (50 мл) и промывают водой (50 мл) и насыщенным солевым раствором (50 мл). Получающийся в результате продукт сушат над сульфатом магния и затем фильтруют. После этого, фильтрат концентрируют при пониженном давлении. Этот остаток очищают посредством колоночной хроматографии на силикагеле (AcOEt/н-гексан=1/2), что дает в результате целевое соединение (1,00 г, 46%).
1H-ЯМР (CDCl3); 1,39 (с, 9Н, трет-Bu), 1,42 (с, 9H, трет-Bu), 2,92 (дд, J=7,2, 14,0, 1H, CH2-α), 3,11 (дд, J=5,6, 14,0, 1H, CH2-β), 4,45 (м, 1H, CH), 4,99 (м, J=8,4, 1H, NH), 6,59 (дд, J=2,4, 8,4, 1H, Ar), 6,95 (д, J=8,4, 1H, Ar), 7,18 (д, J=2,4, 1H, Ar).
[0173] Получение трет-бутил-2-(трет-бутоксикарбониламино)-3-(4-бром-2-йодфенил)пропаноата
Вышеупомянутое соединение трет-бутил-2-(трет-бутоксикарбониламино)-3-(4-амино-2-йодфенил)пропаноат (2,5 г, 5,41 ммоль) подвергают обычно используемой реакции Зандмейера, что дает в результате целевое бромированное соединение трет-бутил-2-(трет-бутоксикарбониламино)-3-(4-бром-2-йодфенил)пропаноат (1,56 г, 55%).
1H-ЯМР (CDCl3); 1,37 (с, 9H, трет-Bu), 1,43 (с, 9H, трет-Bu), 2,98 (дд, J=8,4, 13,6, 1H, CH2-α), 3,20 (дд, J=5,6, 14,0, 1H, CH2-β), 4,51 (м, 1H, CH), 5,04 (д, J=9,2, 1H, NH), 7,10 (д, J=8,0, 1H, NH), 7,39 (дд, J=1,6, 8,0, 1H, Ar), 7,97 (д, J=1,6, 1H, Ar).
[0174] Далее, сложный эфир пинаколина и борной кислоты может быть получен с использованием соединения трет-бутил-2-(трет-бутоксикарбониламино)-3-(4-бром-2-йодфенил)пропаноата с применением способа, аналогичного способу Примера 1.
[0175] (Пример 3)
Получение 4-бром-2-нитробензил-бромида
Целевое соединение 4-бром-2-нитробензил-бромид получают способом, аналогичным способу бромирования Примера 1, описанного ранее в данном документе.
1H-ЯМР (CDCl3); 4,78 (с, 2H, CH2), 7,46 (д, J=8,0, 1H, Ar), 7,74 (м, J=2,0, 8,1, 1H, Ar), 8,18 (д, J=1,7, 1H, Ar).
[0176] Получение трет-бутил-2-амино-3-(4-бром-2-нитрофенил)пропаноата
Целевое соединение получают способом, аналогичным способу получения бензил-3-(4-бром-2-йодфенил)-2-(дифенилметиленамино)пропаноата и бензил-2-амино-3-(4-бром-2-йодфенил)пропаноата в Примере 1.
1H-ЯМР (CDCl3); 1,45 (с, 9H, трет-Bu), 3,08 (дд, J=8,8, 13,6, 1H, CH2-α), 3,29 (дд, J=5,6, 13,6, 1H, CH2-β), 3,62 (дд, J=5,6, 8,5, 1H, CH), 7,31 (д, J=8,4, 1H, Ar), 7,66 (дд, J=2,0, 8,4, 1H, Ar), 8,10 (д, J=2,0, 1H, Ar).
[0177] Получение трет-бутил-3-(4-бром-2-нитрофенил)-2-(трет-бутоксикарбониламино)пропаноата
Целевое соединение получают путем проведения реакции с введением защиты для аминогруппы, аналогичной реакции Примера 1, с использованием трет-бутил-N-(дифенилметилен)глицината и соединения, полученного на предыдущей стадии, в качестве исходных веществ.
1H-ЯМР (CDCl3); 1,37 (с, 9H, трет-Bu), 1,44 (с, 9H, трет-Bu), 3,08 (дд, J=8,0, 13,2, 1H, CH2-α), 3,29 (дд, J=5,2, 13,5, 1H, CH2-β), 4,54 (м, 1H, CH), 5,15 (д, J=8,0, 1H, NH), 7,29 (д, J=8,4, 1H, Ar), 7,65 (дд, J=1,7, 8,0, 1H, Ar), 8,11 (д, J=1,7, 1H, Ar).
[0178] Получение трет-бутил-3-(2-амино-4-бромфенил)-2-(трет-бутоксикарбониламино)пропаноата
Соединение, полученное на предыдущей стадии (1,0 г, 2,25 ммоль) растворяют в этаноле (10 мл), и, кроме того, добавляют порошковое железо (0,314 г, 2,5 экв.). После этого, температуру повышают до 80°C. После этого, водный раствор, полученный растворением хлорида аммония (0,120 г, 1,0 экв.) в воде (2 мл), добавляют весь за один прием. Далее, инициируют протекание реакции в получающейся в результате смеси при 80°C в течение 1 часа. После завершения реакции, порошковое железо и тому подобное отфильтровывают, и после этого фильтрат концентрируют при пониженном давлении. Концентрат растворяют в этилацетате (50 мл) и промывают водой (50 мл) и насыщенным солевым раствором (50 мл). Получающийся в результате продукт сушат над сульфатом магния и затем фильтруют. После этого, фильтрат концентрируют при пониженном давлении. Этот остаток очищают посредством колоночной хроматографии на силикагеле (AcOEt/н-гексан=1/2), что дает в результате целевое соединение (606) (0,547 г, 49%).
1H-ЯМР (CDCl3); 1,34 (с, 9H, трет-Bu), 1,44 (с, 9H, трет-Bu), 2,7 (дд, J=8,8, 14,0, 1H, CH2-α), 3,14 (дд, J=3,6, 13,6, 1H, CH2-β), 4,59 (м, 1H, CH), 5,41 (д, J=8,0, 1H, NH), 6,56 (д, J=1,7, 1H, Ar), 6,86 (д, J=8,0, 1H, Ar), 7,03 (дд, J=1,6, 8,0, 1H, Ar).
[0179] Получение трет-бутил-3-(4-бром-2-(пирролидин-1-илдиазенил)фенил)-2-(трет-бутоксикарбониламино)пропаноата
Соединение, полученное на предыдущей стадии, (60,0 мг, 0,144 ммоль) растворяют в MeCN (2 мл), и, кроме того, добавляют воду (5 мл). После этого, получающуюся в результате смесь охлаждают до 0°C, и, кроме того, добавляют 12N-ный раствор HCl (1,2 мл). При поддерживании температуры на уровне 0°C, добавляют по каплям нитрит натрия (10,5 мг, 0,152 ммоль), растворенный в воде (1 mL). После добавления по каплям, получающуюся в результате смесь дополнительно перемешивают при 0°C в течение 30 минут.
При поддерживании температуры на уровне 0°C, по каплям добавляют вышеупомянутый гидрохлорид диазония в раствор смеси, который отдельно получают путем растворения пирролидина (12,8 мг, 0,181 ммоль) и карбоната калия (100 мг, 0,722 ммоль) в MeCN (5 мл) и воде (10 мл). Далее, получающуюся в результате смесь перемешивают при 0°C в течение 30 минут и затем подвергают экстракции хлороформом (20 мл) два раза. Хророформный слой промывают водой (15 мл) и насыщенным солевым раствором (15 мл) и затем сушат над сульфатом магния. После фильтрации, фильтрат концентрируют при пониженном давлении. Полученный остаток очищают посредством колоночной хроматографии на силикагеле, что дает в результате целевое соединение (32,3 мг, 45%).
1H-ЯМР (CDCl3); 1,37 (с, 9H, трет-Bu), 1,39 (с, 9H, трет-Bu), 2,05 (шир.с, 4H, пирролидины-CH2CH2-), 3,06 (дд, J=9,2, 13,2, 1H, CH2-α), 3,16 (дд, J=4,0, 13,2, 1H, CH2-β), 3,76 (шир.с, 2H, пирролидины-NCH2-), 3,97 (шир.с, 2H, пирролидины-NCH2-), 4,31 (м, 1H, CH), 6,47 (д, J=6,4, 1H, NH), 7,04 (д, J=8,0, 1H, Ar), 7,16 (дд, J=2,0, 8,0, 1H, Ar), 7,56 (д, J=2,0, 1H, Ar).
[0180] Получение трет-бутил-3-(4-бром-2-йодфенил)-2-(трет-бутоксикарбониламино)пропаноата
Целевое соединение получают из трет-бутил-3-(2-амино-4-бромфенил)-2-(трет-бутоксикарбониламино)пропаноата в результате проведения стадии, аналогичной стадии, включающей в себя реакцию с использованием N-йодсукцинимида в Примере 1.
1H-ЯМР (CDCl3); 1,37 (с, 9H, трет-Bu), 1,43 (с, 9H, трет-Bu), 2,98 (дд, J=8,4, 13,6, 1H, CH2-α), 3,20 (дд, J=5,6, 14,0, 1H, CH2-β), 4,51 (м, 1H, CH), 5,04 (д, J=9,2, 1H, NH), 7,10 (д, J=8,0, 1H, NH), 7,39 (дд, J=1,6, 8,0, 1H, Ar), 7,97 (д, J=1,6, 1H, Ar).
[0181] Получение трет-бутил-3-(4-бром-2-фторфенил)-2-(трет-бутоксикарбониламино)пропаноата
Целевое соединение получают способом, аналогичным способу Стадий S-6 - S-8.
1H-ЯМР (CDCl3); 1,37 (с, 18H, трет-Bu×2), 2,98 (дд, J=6,8, 14,0, 1H, CH2-α), 3,10 (дд, J=6,4, 14,0, 1H, CH2-β), 4,43 (м, 1H, CH), 5,08 (д, J=7,6, 1H, NH), 7,09 (т, J=8,0, 1H, Ar), 7,20 (д, J=8,4, 1H, Ar), 7,21 (д, J=8,4, 1H, Ar).
[0182] Получение трет-бутил-2-(трет-бутоксикарбониламино)-3-(2-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)-пропаноата
В потоке газообразного азота, PdCl2(dba) (27,5 мг, 0,03 экв.) и трициклофосфин (16,8 мг, 0,06 экв.) суспендируют в диоксане (5 мл). После перемешивания в течение 30 минут, добавляют бис(пинаколат)диборан (305 мг, 1,20 ммоль) и KOAc (294 мг, 3,00 ммоль), и, кроме того, добавляют вышеупомянутое соединение (611) (418 мг, 1,00 ммоль). После этого, проводят микроволновое облучение при 150°C в течение 15 минут, что в результате дает целевое соединение (372 мг, 80%).
1H-ЯМР (CDCl3); 1,33 (с, 9H, -Boc), 1,40 (с, 21H, трет-Bu, пинаколин (CH3)4), 3,06 (дд, J=8,8, 13,6, 1H, CH2-α), 3,16 (дд, J=5,2, 13,6, 1H, CH2-β), 4,45 (м, 1H, CH), 5,04 (д, J=8,0, 1H, NH), 7,20 (м, J=6,7, 7,6, 1H, Ar), 7,42-7,50 (м, 2H, Ar).
[0183] (Пример 4)
Получение трет-бутил-2-(бис(трет-бутоксикарбонил)амино)-3-(4-бром-2-йодфенил)пропаноата
Соединение трет-бутил-3-(4-бром-2-йодфенил)-2-(трет-бутоксикарбониламино)пропаноат (1,50 г, 2,6 ммоль) растворяют в MeCN (15 мл), и к этому добавляют Boc2O (1,16 г, 5,33 ммоль) и, кроме того, DMAP (488 мг, 4,00 ммоль). Получающуюся в результате смесь нагревают до 50°C и инициируют протекание реакции при этой температуре в течение 24 часов. После этого, растворитель концентрируют при пониженном давлении и затем очищают посредством колоночной хроматографии на силикагеле (гексан:этилацетат=9:1), что в результате дает целевое соединение в виде бесцветного маслянистого вещества (1,50 г, 90%).
1H-ЯМР (CDCl3); 1,34-1,41 (м, 27H, трет-Bu), 3,35 (дд, J=11,2, 13,6, 1H, CH2-α), 3,46 (дд, J=4,4, 14,0, 1H, CH2-β), 5,08 (дд, J=4,0, 11,2, 1H, CH), 7,00 (д, J=8,0, 1H, Ar), 7,36 (дд, J=2,0, 8,0, 1H, Ar), 7,94 (д, J=2,0, 1H, Ar).
[0184] Получение трет-бутил-2-(бис(трет-бутоксикарбонил)амино)-3-(4-бром-2-(триметилстаннил)фенил)пропаноата
Соединение, полученное на предыдущей стадии, (876,8 мг, 1,40 ммоль) растворяют в толуоле (4 мл), и к этому добавляют тетракистрифенилфосфинпалладий (80,88 мг, 0,07 ммоль) и, кроме того, бис(триметилолово) (481,6 мг, 1,47 ммоль). Получающуюся в результате смесь нагревают до 120°C и инициируют протекание реакции при этой температуре в течение 3 часов. После этого, растворитель концентрируют при пониженном давлении и затем очищают посредством колоночной хроматографии на силикагеле (гексан:этилацетат=100:0-95:5), что в результате дает целевое соединение в виде бесцветного маслянистого вещества (803,3 мг, 86,5%).
1H-ЯМР (CDCl3); 0,36 (с, 9H, SnCH3×3), 1,39 (с, 18H, -Boc), 1,48 (с, 9H, трет-Bu), 3,28 (д, J=7,6, 2H, CH2), 4,84 (т, J=7,6, 1H, CH), 6,95 (д, J=8,4, 1H, Ar), 7,33 (дд, J=2,0, 8,4, 1H, Ar), 7,48 (д, J=2,0, 1H, Ar).
[0185] Получение (2-(3-трет-бутокси-2-(бензилоксикарбониламино)-3-оксипропил)-5-бромфенил)(4-метилфенил)иодоний-тозилата
Соединение, полученное на предыдущей стадии, (663 мг, 1,00 ммоль) растворяют в 2,2,2-трифторэтаноле (40 мл), и к этому добавляют 4-(гидрокси(тозилокси)йод)толуол (406 мг, 1,00 ммоль). Инициируют протекание реакции в получающейся в результате смеси при комнатной температуре в течение 15 минут. Проводят экстракцию диэтиловым эфиром, и диэтилэфирный слой сушат над сульфатом. После фильтрации, получающийся в результате продукт концентрируют при пониженном давлении, и полученный остаток очищают посредством колоночной хроматографии на силикагеле (гексан:этилацетат=100:1 - 10: 1), что в результате дает целевое соединение (180 мг, 20%).
1H-ЯМР (CDCl3); 1,35-1,47 (м, 27H, трет-Bu), 2,32 (с, 3H, TsO-CH3), 2,37 (с, 3H, Ar-CH3), 3,38 (дд, J=8,0, 14,4, 1H, CH2-α), 3,59 (дд, J=7,2, 14,4, 1H, CH2-β), 5,05 (т, J=7,6, 1H, CH), 7,06 (д, J=8,0, 2H, TsO-Ar), 7,18 (д, J=8,4, 2H, Ar), 7,28 (д, J=8,4, 1H, Ar), 7,53 (дд, J=1,6, 8,4, 1H, Ar), 7,61 (д, J=8,0, 2H, TsO-Ar), 7,87 (д, J=1,6, 1H, Ar), 7,91 (д, J=8,4, 2H, Ar).
[0186] Получение трет-бутил-2-(бис(трет-бутоксикарбонил)амино)-3-(2-фтор-4-бромфенил)пропаноата
В MeCN (4 мл), растворяют 4,7,13,16,21,24-гексаокса-1,10-диазабицикло[8.8.8]гексакозан (14,24 мг, 0,04 ммоль, и добавляют фторид калия (2,2 мг, 0,04 ммоль). Получающуюся в результате смесь концентрируют при 60°C при пониженном давлении. Аналогичную операцию выполняют повторно три раза, и после этого получающийся в результате продукт сушат в течение 12 часов при пониженном давлении с помощью вакуумного насоса. К полученной смеси, добавляют 2,2,6,6-тетраметилпиперидин-1-оксил (1 мг), и, кроме того, добавляют диметилформамидный раствор (1 мл) соединения (615) (28,0 мг, 0,03 ммоль). Получающуюся в результате смесь нагревают до 140°C, и инициируют протекание реакции при этой температуре в течение 15 минут. Проводят экстракцию этилацетатом, и этилацетатный слой промывают насыщенным солевым раствором и после этого сушат над сульфатом натрия. После фильтрации, получающийся в результате продукт концентрируют при пониженном давлении, что дает смесь, содержащую целевое соединение.
1H-ЯМР (CDCl3); 1,37 (с, 18H, трет-Bu×2), 1,43 (с, 9H, трет-Bu), 2,98 (дд, J=8,4, 13,6, 1H, CH2-α), 3,20 (дд, J=5,6, 14,0, 1H, CH2-β), 4,51 (м, 1H, CH), 5,04 (д, J=9,2, 1H, NH), 7,10 (д, J=8,0, 1H, NH), 7,39 (дд, J=1,6, 8,0, 1H, Ar), 7,97 (д, J=1,6, 1H, Ar).
Условия проведения анализа методом сверхэффективной жидкостной хроматографии (UPLC); колонка: колонка BEH C18 (130A 1,7 мкм 2,1 мм × 150 мм), скорость потока: 0,4 мл/мин, детектирование: 254 нм, хроматографическая система растворителей: 0,1%-ный раствор уксусной кислоты в смеси вода:ацетонитрил=30:70, период детектирования: 3,8 мин.
[0187] Получение (2-(3-трет-бутокси-2-(бензилоксикарбониламино)-3-оксопропил)-5-бромфенил)(4-метилфенил)иодоний-бромида
Соединение (2-(3-трет-бутокси-2-(бензилоксикарбониламино)-3-оксопропил)-5-бромфенил)(4-метилфенил)иодоний-тозилат (58,9 мг, 0,07 ммоль) растворяют в жидкости, представляющей собой смесь этилацетат-вода (1:1, 2 мл), и к этому добавляют бромид калия (39,4 мг, 0,33 ммоль). Инициируют протекание реакции в получающейся в результате смеси при комнатной температуре в течение 5 часов. Проводят экстракцию этилацетатом, и этилацетатный слой сушат над сульфатом натрия. После фильтрации, получающийся в результате продукт концентрируют при пониженном давлении, что двет целевое соединение (52,3 мг, 99%).
1H-ЯМР (CDCl3); 1,38-1,54 (м, 27H, трет-Bu), 2,37 (с, 3H, Ar-CH3), 3,40 (дд, J=8,4, 14,4, 1H, CH2-α), 3,61 (дд, J=7,2, 14,4, 1H, CH2-β), 5,06 (т, J=7,6, 1H, CH), 7,19 (д, J=8,0, 2H, Ar), 7,26 (д, J=8,0, 1H, Ar), 7,52 (дд, J=1,6, 8,0, 1H, Ar), 7,85 (д, J=1,6, 1H, Ar), 7,95 (д, J=8,4, 2H, Ar).
[0188] Получение трет-бутил-2-(бис(трет-бутоксикарбонил)амино)-3-(4-бром-2-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пропаноата
PdCl2(dppf) (98 мг, 0,120 ммоль), бис(пинаколато)диборан (638 мг, 2,51 ммоль), и ацетат калия растворяют в диметилсульфоксиде (DMSO) (7,5 мл) в атмосфере Ar, и получающуюся в результате смесь выдерживают при перемешивании при комнатной температуре. После добавления туда диметилсульфоксидного раствора (4,5 мл) соединения трет-бутил-2-(бис(трет-бутоксикарбонил)амино)-3-(4-бром-2-йодфенил)пропаноата (1,50 г, 2,40 ммоль), получающуюся в результате смесь перемешивают при 80°C в течение 24 часов. Реакционный раствор разбавляют этилацетатом (70 мл) и подвергают фильтрации на Целите. После этого, получающийся в результате продукт промывают водой и солевым раствором, и органический слой сушат над MgSO4. Органический слой фильтруют, и органический растворитель концентрируют и затем очищают посредством колоночной хроматографии (гексан:этилацетат=9:1), что в результате дает целевое соединение в виде бесцветного маслянистого вещества (705 мг, 47%).
1H-ЯМР (CDCl3); 1,35-1,48 (м, 39H, пинаколин-CH3×4, трет-Bu), 3,08 (дд, J=11,2, 13,6, 1H, CH2-α), 3,89 (дд, J=4,4, 14,0, 1H, CH2-β), 5,17 (дд, J=4,0, 11,2, 1H, CH), 6,91 (д, J=8,0, 1H, Ar), 7,41 (дд, J=2,0, 8,0, 1H, Ar), 7,89 (д, J=2,0, 1H, Ar).
[0189] Получение трет-бутил-2-(бис(трет-бутоксикарбонил)амино)-3-(2-фторo-4-бромфенил)пропаноата
Трифлат тетракис(пиридин)меди (3,6 мг, 0,0053 ммоль) добавляют к соединению, полученному на предыдущей стадии (37,6 мг, 0,060 ммоль). Далее, добавляют фторид калия (3,8 мг, 0,066 ммоль) и диметилформамидный раствор (4 мл) 4,7,13,16,21,24-гексаокса-1,10-диазабицикло[8.8.8]гексакозана (24,8 мг, 0,066 ммоль). Инициируют протекание реакции в получающейся в результате смеси при 130°C в течение 20 минут. После этого, получающийся в результате продукт фильтруют и затем концентрируют при пониженном давлении, что дает смесь, содержащую целевое соединение.
1H-ЯМР (CDCl3); 1,37 (с, 18H, трет-Bu×2), 1,43 (с, 9H, трет-Bu), 2,98 (дд, J=8,4, 13,6, 1H, CH2-α), 3,20 (дд, J=5,6, 14,0, 1H, CH2-β), 4,51 (м, 1H, CH), 5,04 (д, J=9,2, 1H, NH), 7,10 (д, J=8,0, 1H, NH), 7,39 (дд, J=1,6, 8,0, 1H, Ar), 7,97 (д, J=1,6, 1H, Ar).
[0190] (Пример 5)
Получение 2-фтор-4-йодбензил-бромида
Целевое соединение 2-фтор-4-йодбензил-бромид получают с применением способа, аналогичного способу Стадии S-2.
1H-ЯМР (CDCl3); 4,45 (с, 2H, CH2), 7,12 (т, J=8,0, 1H, Ar), 7,45 (д, J=8,4, 1H, Ar), 7,48 (д, J=8,4, 1H, Ar).
[0191] Получение этил-3-(2-фтор-4-йодфенил)-2-(дифенилметиленамино)пропаноата
Целевое соединение (703) получают путем инициирования протекания реакции между соединением, полученным на предыдущей стадии, и этил-N-(дифенилметилен)глицинатом вместо бензил-N-(дифенилметилен)глицината с применением способа, аналогичного способу Стадии S-3. Здесь, полученное соединение используют на следующей стадии без очистки.
[0192] Получение этил-2-амино-3-(2-фтор-4-йодфенил)пропаноата
Целевое соединение (704) получают с применением способа, аналогичного способу Стадии S-4.
1H-ЯМР (CDCl3); 1,24 (т, J=7,2, 3H, CH2CH3), 2,86 (дд, J=8,0, 13,6, 1H, CH2-α), 3,04 (дд, J=5,9, 14,0, 1H, CH2-β), 3,71 (дд, J=6,0, 7,6, 1H, CH), 4,16 (кв., J=7,2, 2H, CH2CH3), 6,95 (т, J=8,0, 1H, Ar), 7,40 (д, J=7,6, 1H, Ar), 7,42 (д, J=7,6, 1H, Ar).
[0193] Получение этил-3-(2-фтор-4-йодфенил)-2-(бензилоксикарбониламино)пропаноата
Целевое соединение (705) получают с применением способа, аналогичного способу Стадии S-5.
1H-ЯМР (CDCl3); 1,24 (т, J=7,3, 3H, CH2CH3), 3,06 (дд, J=6,8, 13,6, 1H, CH2-α), 3,16 (дд, J=4,8, 14,0, 1H, CH2-β), 4,17 (кв., J=7,2, 2H, CH2CH3), 4,61 (м, 1H, CH), 5,08 (м, 2H, CH2Ar), 5,29 (д, J=8,0, 1H, NH), 6,84 (т, J=7,6, 1H, Ar), 7,31-7,38 (м, 7H, Ar).
[0194] Кроме того, соединение, полученное на предыдущей стадии, может быть использовано для приготовления сложного эфира пинаколина и борной кислоты таким же способом, что и в Примере 1 или 3.
[0195] Справочный Пример 1
Удаление защитных групп со сложного эфира пинаколина и борной кислоты, меченого фтором
Сложные эфиры пинаколина и борной кислоты, полученные в Примерах 1-4, все могут быть подвергнуты удалению защитных групп для получения целевого фторированного BPA. В частности, прежде всего, с помощью 4N-ного раствора HCl в этилацетате (AcOE) удаляют защитные группы Boc и трет-Bu.
[0196] Далее, в том случае, когда проводят элюирование с помощью колонки с обращенной фазой с использованием 0,1%-ного раствора уксусной кислоты в ацетонитриле, также удаляют пинаколин, в результате чего получают целевой фторированный BPA.
| название | год | авторы | номер документа |
|---|---|---|---|
| ХИРАЛЬНОЕ 4-БОРОНОФЕНИЛАЛАНИНОВОЕ (ВРА) ПРОИЗВОДНОЕ И СПОСОБ ЕГО ПОЛУЧЕНИЯ И СПОСОБ ПОЛУЧЕНИЯ F-МЕЧЕННОГО ВРА С ИСПОЛЬЗОВАНИЕМ УКАЗАННОГО ПРОИЗВОДНОГО | 2013 |
|
RU2660433C2 |
| ПРОИЗВОДНЫЕ СПИРО[ИЗОХИНОЛИН-4(1Н),3-ПИРРОЛИДИН]-1,2',3,5'[2Н]ТЕТРОНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ПРЕДОТВРАЩЕНИЯ ИЛИ ЛЕЧЕНИЯ ОСЛОЖНЕНИЙ, СВЯЗАННЫХ С САХАРНЫМ ДИАБЕТОМ | 1991 |
|
RU2110518C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ 1-О-АЦИЛ-2-ДЕЗОКСИ-2-ФТОР-4-ТИО-β-D-АРАБИНОФУРАНОЗ | 2010 |
|
RU2559364C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ФЕНИЛАЛАНИНА С ХИНАЗОЛИНДИОНОВЫМ СКЕЛЕТОМ И ПРОМЕЖУТОЧНЫХ СОЕДИНЕНИЙ, ПРИМЕНЯЕМЫХ ПРИ ПОЛУЧЕНИИ ТАКИХ ПРОИЗВОДНЫХ | 2007 |
|
RU2469028C2 |
| НОВЫЕ ПРОИЗВОДНЫЕ ФЕНИЛАЛАНИНА | 2001 |
|
RU2286340C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ (S)-1-(3-ЭТОКСИ-4-МЕТОКСИФЕНИЛ)-2- МЕТАНСУЛЬФОНИЛЭТИЛАМИНА | 2013 |
|
RU2632875C2 |
| Способ получения L-глюфосината | 2019 |
|
RU2812725C2 |
| ПРОИЗВОДНЫЕ 4-АМИНОМЕТИЛБЕНЗОЙНОЙ КИСЛОТЫ | 2014 |
|
RU2673245C2 |
| Способ получения промежуточного соединения L-глюфосината и L-глюфосината | 2019 |
|
RU2799336C2 |
| СПОСОБ ПОЛУЧЕНИЯ НОВОГО АЗОТСОДЕРЖАЩЕГО СОЕДИНЕНИЯ ИЛИ ЕГО СОЛИ И ПОЛУЧЕНИЕ ЕГО ПРОМЕЖУТОЧНОГО СОЕДИНЕНИЯ | 2016 |
|
RU2720989C2 |
Изобретение относится к соединению, представленному формулой 1:
[Формула 1]
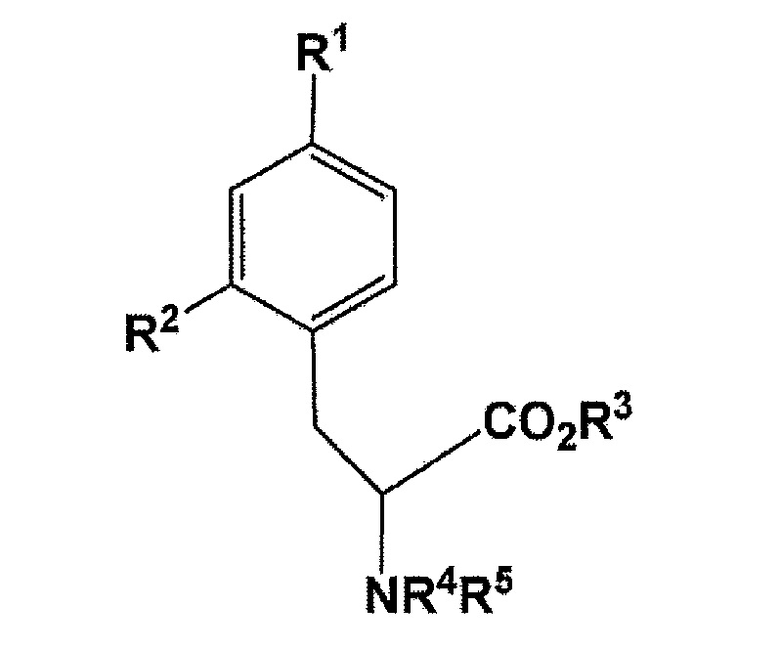
В формуле 1 R1 представляет собой бромогруппу, йодогруппу или хлорогруппу, R2 представляет собой Sn(R6)3, N=N-NR7R8, (R14-)I+R13 или борную кислоту (B(OH)2) или сложный эфир борной кислоты, выбираемый из группы, состоящей из пинаколина, 2,2-диметил-1,3-пропандиола, N-метилдиэтаноламина, 1,8-диаминонафталина, N-метилиминодиуксусной кислоты, 1,1,1-трисгидроксиметилэтана и пирокатехина, где R6 представляет собой алкильную группу, имеющую 1-7 атомов углерода, или бензильную группу, R7 и R8 соединяются вместе посредством N с образованием 3-7-членной циклической структуры, R13 представляет собой С1-6-алкилзамещенную фенильную группу, С1-6-алкоксизамещенную фенильную группу или фенильную группу или тиенил, R14 представляет собой галоген, тетрафторборатную группу, нитратную группу, трифлатную группу, сульфонилоксигруппу, толуолсульфонилоксигруппу или перхлоратную группу, R3 представляет собой водород, этильную группу, трет-бутильную группу или бензильную группу, R4 или R5 независимо представляет собой водород, бензилоксикарбонильную группу или трет-бутоксикарбонильную группу, или еще NR4R5 связываются вместе с образованием C6H5(C6H5)C=N. Также предложены способ получения соединения формулы 2 и способ получения 18F-меченого BPA. Изобретение обеспечивает новое производное BPA, которое может быть промежуточным соединением для синтеза 18F-меченого BPA с хорошим выходом и в состоянии, имеющем хорошую удельную активность. 3 н. и 2 з.п. ф-лы, 6 пр.
1. Соединение, представленное следующей формулой:
[Формула 1]
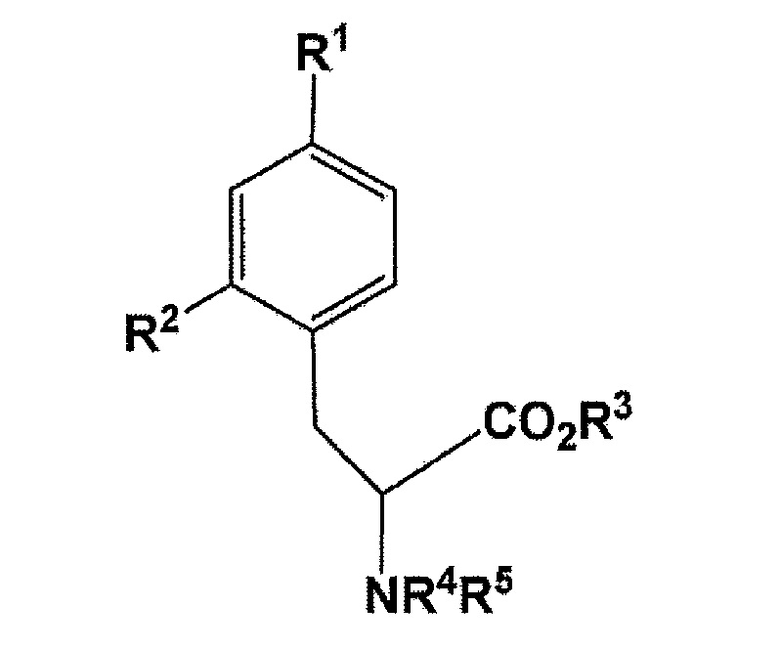
где R1 представляет собой бромогруппу, йодогруппу или хлорогруппу;
R2 представляет собой Sn(R6)3, N=N-NR7R8, (R14-)I+R13 или борную кислоту (B(OH)2) или сложный эфир борной кислоты, выбираемый из группы, состоящей из пинаколина, 2,2-диметил-1,3-пропандиола, N-метилдиэтаноламина, 1,8-диаминонафталина, N-метилиминодиуксусной кислоты, 1,1,1-трисгидроксиметилэтана и пирокатехина (где R6 представляет собой алкильную группу, имеющую 1-7 атомов углерода, или бензильную группу; R7 и R8 соединяются вместе посредством N с образованием 3-7-членной циклической структуры;
R13 представляет собой С1-6-алкилзамещенную фенильную группу, С1-6-алкоксизамещенную фенильную группу или фенильную группу или тиенил; и
R14 представляет собой галоген, тетрафторборатную группу, нитратную группу, трифлатную группу, сульфонилоксигруппу, толуолсульфонилоксигруппу или перхлоратную группу;
R3 представляет собой водород, этильную группу, трет-бутильную группу или бензильную группу;
R4 или R5 независимо представляет собой водород, бензилоксикарбонильную группу или трет-бутоксикарбонильную группу, или еще NR4R5 связываются вместе с образованием C6H5(C6H5)C=N.
2. Соединение по п.1, где R1 представляет собой йодогруппу или бромогруппу.
3. Соединение по любому из пп.1-2, где соединение представляет собой
бензил-2-(бензилоксикарбониламино)-3-(4-бром-2-(три-н-бутилстаннил)фенил)пропаноат;
тозилат (2-(3-бензилокси-2-(бензилоксикарбониламино)-3-оксопропил)-5-бромфенил)(3-метоксифенил)йодония;
трет-бутил-3-(4-бром-2-(пирролидин-1-илдиазенил)фенил)-2- (трет-бутоксикарбониламино)пропаноат;
трет-бутил-2-(бис(трет-бутоксикарбонил)амино)-3-(4-бром-2- (триметилстаннил)фенил)пропаноат;
или
трет-бутил-2-(бис(трет-бутоксикарбонил)амино)-3-(4-бром-2- (4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенил)пропаноат.
4. Способ получения соединения, представленного следующей формулой:
[Формула 2]
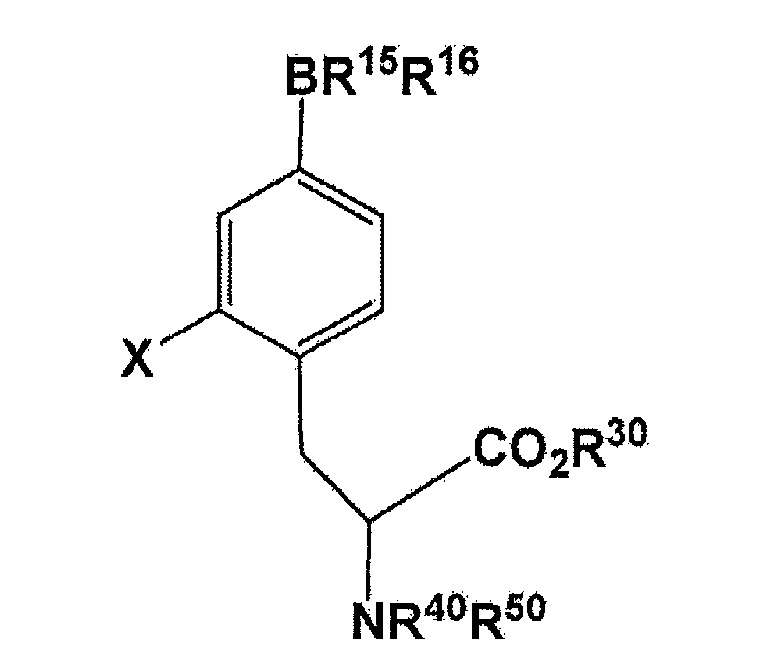
где X представляет собой F или 18F;
R30 представляет собой водород или защитную группу PG1 для карбоксильной группы;
R40 или R50 независимо представляет собой водород или защитную группу PG2 для аминогруппы, или еще группы NR40R50 связываются вместе с образованием C6H5(C6H5)C=N; и
R15 и R16 связываются вместе посредством B (атомом бора) с образованием кольца, служащего в качестве защитной группы для B, включающий в себя стадию использования соединения, представленного следующей формулой:
[Формула 3]
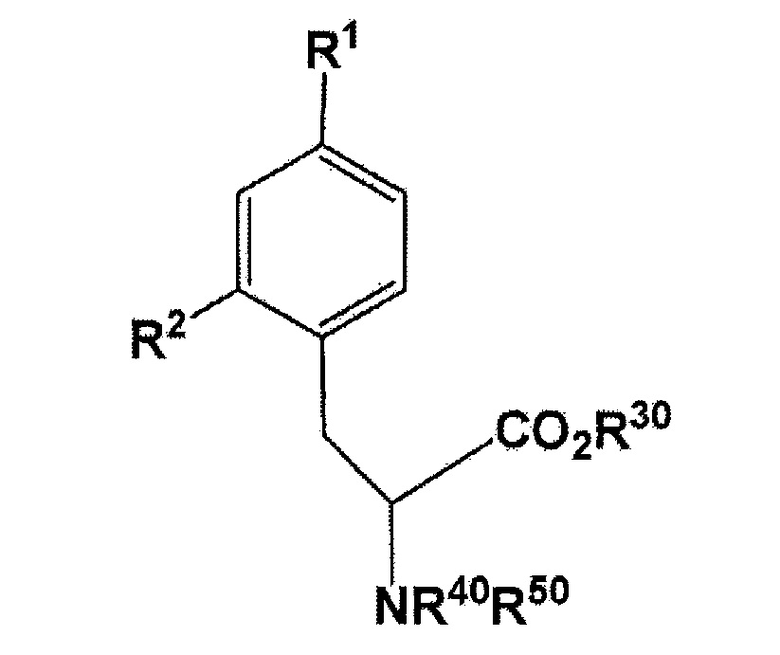
где R1 представляет собой бромогруппу, йодогруппу или хлорогруппу;
R2 представляет собой Sn(R6)3, N=N-NR7R8, (R14-)I+R13 или борную кислоту или сложный эфир борной кислоты, выбираемый из группы, состоящей из пинаколина, 2,2-диметил-1,3-пропандиола, N-метилдиэтаноламина, 1,8-диаминонафталина, N-метилиминодиуксусной кислоты, 1,1,1-трисгидроксиметилэтана и пирокатехина (где R6 представляет собой алкильную группу, имеющую 1-7 атомов углерода, или бензильную группу;
R7 и R8 связываются вместе посредством N с образованием 3- 7-членной циклической структуры;
R13 представляет собой С1-6-алкилзамещенную фенильную группу, С1-6-алкоксизамещенную фенильную группу или фенильную группу или тиенил; и
R14 представляет собой галоген, тетрафторборатную группу, нитратную группу, трифлатную группу, сульфонилоксигруппу, толуолсульфонилоксигруппу или перхлоратную группу); и R30, R40 и R50 имеют значение как указано выше.
5. Способ получения 18F-меченого BPA, включающий стадию с использованием соединения, представленного следующей формулой:
[Формула 4]
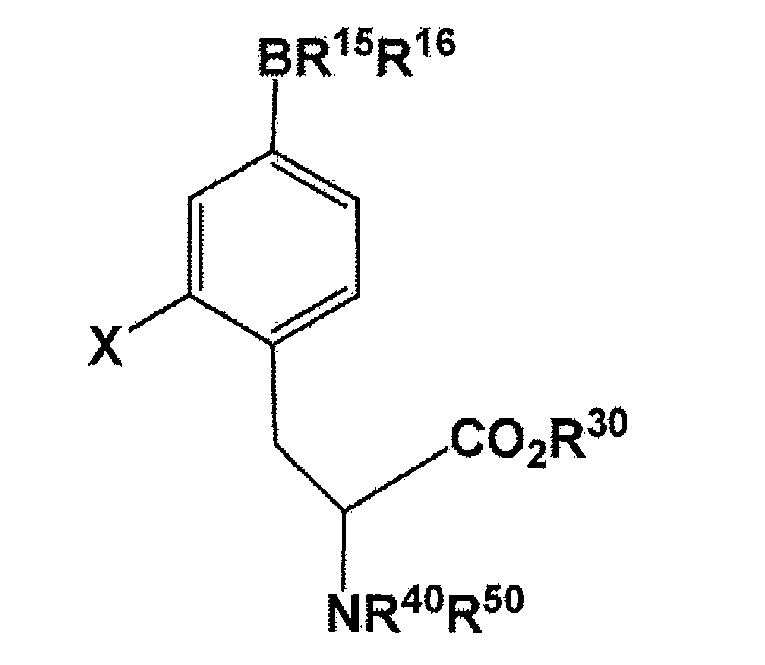
где X представляет собой F или 18F; R30, R40 и R50 имеют значение как указано выше; и R15 и R16 связываются вместе посредством B (атомом бора) с образованием кольца, служащего в качестве защитной группы для B.
| Способ обесфторивания природных вод | 1985 |
|
SU1330077A1 |
| Способ получения моноацилмочевин | 1976 |
|
SU614100A1 |
| MCALLISTER L.A | |||
| et al., A General Strategy for the Synthesis of Cyclic N-Aryl Hydroxamic Acids via Partial Nitro Group Reduction, J | |||
| Org | |||
| Chem., 2011, v | |||
| Аппарат, предназначенный для летания | 0 |
|
SU76A1 |
| ПРИБОР ДЛЯ ИЗМЕРЕНИЯ ВЫСОТ И ДЛЯ НИВЕЛЛИРОВАНИЯ | 1925 |
|
SU3484A1 |
| SAMET A.V | |||
| et al., An improved "one-pot" procedure for synthesis of fluorinated DL-phenylalanines, Synthesis Communications, 2002, v | |||
| Способ образования коричневых окрасок на волокне из кашу кубической и подобных производных кашевого ряда | 1922 |
|
SU32A1 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Школьный прибор для демонстрирования тепловых явлений | 1924 |
|
SU941A1 |
| AL-DARWICH M.J | |||
| et al., Enantioselective syntheses of no-carrier-added (n.c.a.) (S)-4-chloro-2-[18F] fluorophenylalanine and (S)-(alpha-methyl)-4-chloro-2-[18F] fluorophenylalanine, Journal of Fluorine Chemistry, 1996, v | |||
| Капельная масленка с постоянным уровнем масла | 0 |
|
SU80A1 |
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| Аппарат для испытания прессованных хлебопекарных дрожжей | 1921 |
|
SU117A1 |
| ENDO Y | |||
| et al., Role of the hydrophobic moiety of tumor promoters | |||
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
| Приспособление для плетения проволочного каркаса для железобетонных пустотелых камней | 1920 |
|
SU44A1 |
| Кипятильник для воды | 1921 |
|
SU5A1 |
| ЭЛЕКТРИЧЕСКИЙ ТЕРМОРЕГУЛЯТОР | 1924 |
|
SU1138A1 |
| PLISKA V | |||
| et al., Side chain lipophilicity of noncoded alpha-amino acids: п-values, Methods and Principles in Medicinal Chemistry, 1996, v | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Ручной дровокольный станок | 1921 |
|
SU375A1 |
| MCCORD T.J | |||
| et al., A Comparative Study of the Rearrangement of Some 6- and 7-Halo-substituted 3-Amino-3,4-dihydro-1-hydroxycarbostyrils in Concentrated Hydrohalic Acids, J | |||
| Heterocyclic Chem., 1982, v | |||
| Способ изготовления электрических сопротивлений посредством осаждения слоя проводника на поверхности изолятора | 1921 |
|
SU19A1 |
| Нефтяная топка для комнатных печей | 1922 |
|
SU401A1 |
| LEE H | |||
| et al., Puromycin Analogues | |||
| Effect of Aryl-Substituted Puromycin Analogues on the Ribosomal Peptidyltransferase Reaction, J | |||
| Med | |||
| Chem., 1981, v | |||
| Пишущая машина для тюркско-арабского шрифта | 1922 |
|
SU24A1 |
| Паровой котел с винтовым парообразователем | 1921 |
|
SU304A1 |
| DAVIS A.L | |||
| et al., Synthesis and Antibacterial Activities of Some Chloro Analogs of 3-Amino-3,4-dihydro-1-hedroxycarbostyril, J | |||
| Med | |||
| Chem., 1975, v | |||
| Способ использования делительного аппарата ровничных (чесальных) машин, предназначенных для мериносовой шерсти, с целью переработки на них грубых шерстей | 1921 |
|
SU18A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Патрон для электрической лампочки накаливания с цоколем Свана | 1923 |
|
SU752A1 |
| US 20090054308 A1, 26.02.2009 | |||
| CN 102887913 A, 23.01.2013 | |||
| [F-18] МЕЧЕННАЯ L-ГЛЮТАМИНОВАЯ КИСЛОТА, [F-18] МЕЧЕННЫЙ L-ГЛЮТАМИН, ИХ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЕ, А ТАКЖЕ СПОСОБ ИХ ПОЛУЧЕНИЯ | 2006 |
|
RU2395489C2 |
Авторы
Даты
2018-09-27—Публикация
2014-12-16—Подача