Изобретение относится к области биотехнологии, а именно к способам получения и производства терапевтических препаратов, выделения и очистки рекомбинантных белков, в частности в получении высокоочищенного препарата рекомбинантной экзо-бета-N-ацетилглюкозаминидазы StrH (β-N-GlcNAcase StrH). Основными сферами применения полученной предлагаемым способом бактериальной β-N-GlcNAcase StrH является включение ее в технологический процесс получения ряда медицинских лекарственных препаратов (ЛС), а также биомедицинские исследования в области гликобиологии.
Изобретение решает задачу создания способа получения больших количеств высокоочищенной ферментативно активной рекомбинантной β-N-GlcNAcase StrH, пригодной для использования на стадии ремоделирования для получения терапевтически функциональных препаратов гликопротеинов с заданными свойствами, для разработки инструментов для высокочувствительного анализа гликановых цепей гликопротеинов тканей растений, животных и эукариотических микроорганизмов. Изобретение относится также к способу получения препарата рекомбинантной β-N-GlcNAcase StrH, имеющего более высокую степень чистоты по сравнению с коммерческими препаратами, гомогенного по целевому продукту, с более низким содержанием эндотоксинов и ДНК продуцента в сравнении с коммерческими препаратами.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
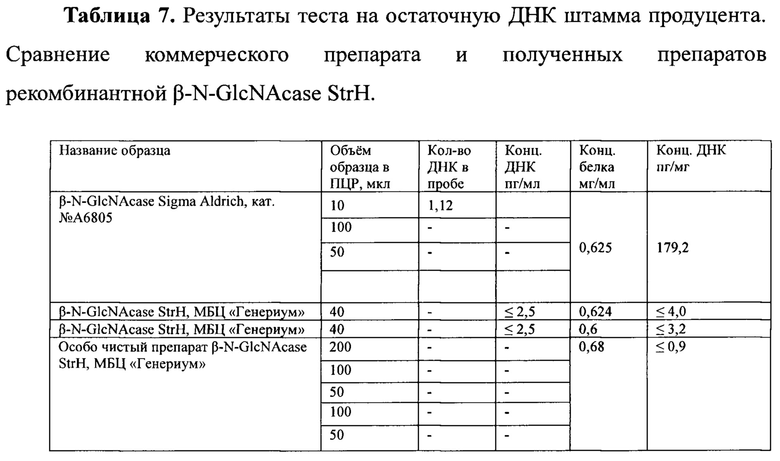
Фиг. 1. Схема строения N-гликозилированного человеческого гликопротеина. Названия сахарных остатков расположены под соответствующими им символами. Линии - связи между сахарными остатками, числа наверху - специфичность связи. Стрелки - связи, которые потенциально расщепляются гликозидазами, обозначенными вверху схемы;
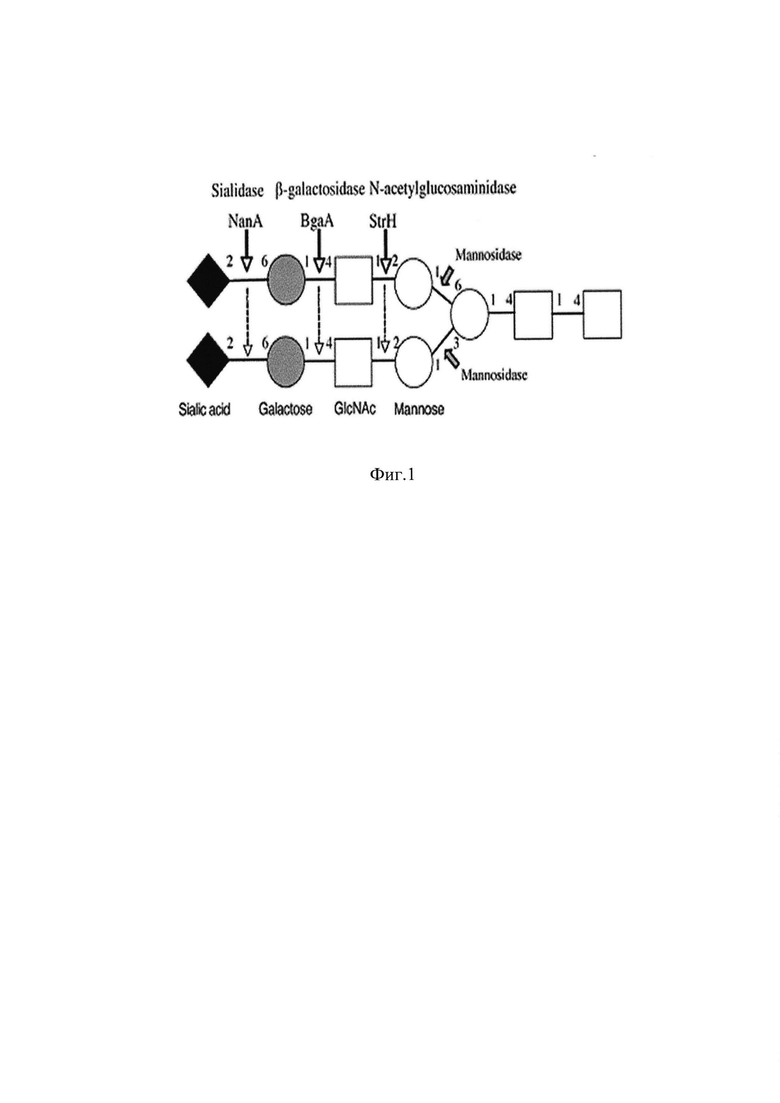
Фиг. 2. Субстратная специфичность β-N-GlcNAcase StrH. Данные для двух конструктов: 1 - соответствует полноразмерному StrH, 2 - каталитический домен GH20A. Сложность гликанов возрастает от (а) к (е). Активность на всех представленных субстратах наблюдается только для полноразмерного конструкта. Для GH20A наблюдается пониженная активность на субстрате (с) и ее отсутствие на субстратах (d) или (е).
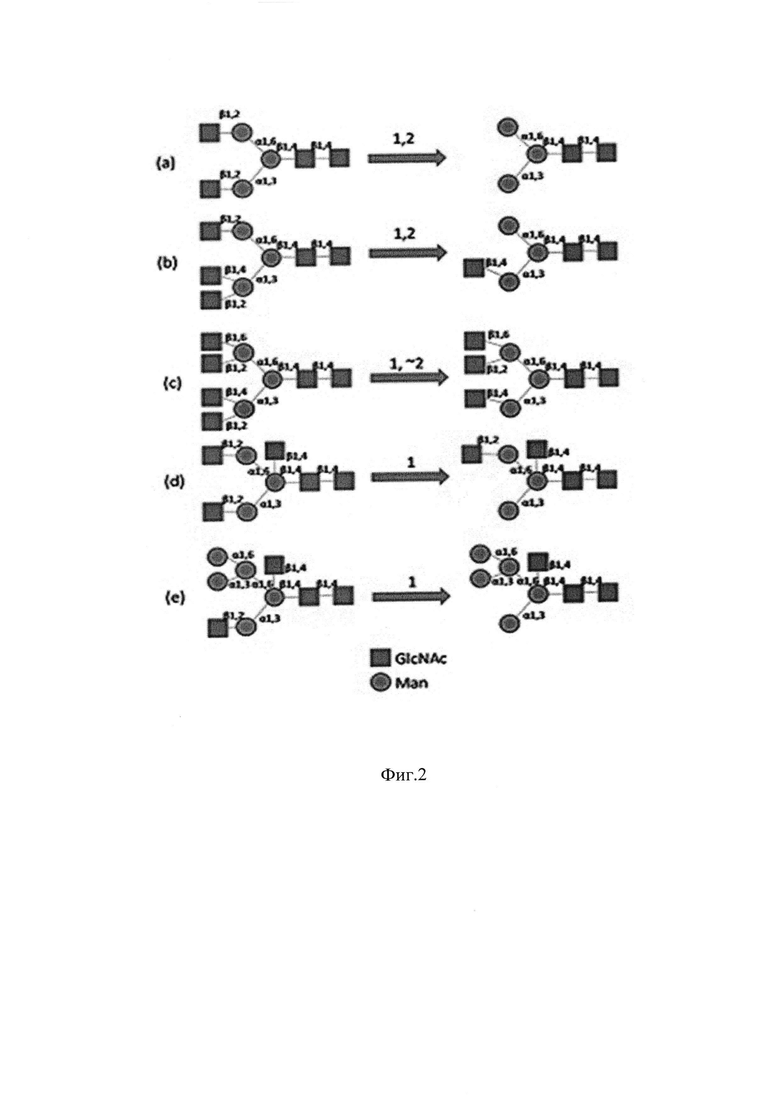
Фиг. 3. Карта плазмиды рМТ1618 (экспрессионный вектор на основе pET15b для получения стрептококковой β-N-GlcNAcase StrH). Обозначения: Т7 promoter - промотор Т7 РНК-полимеразы; N-terminal His-tagged β-N-GlcNAcase StrH - ген белка His-тэгированного (N-конец) β-N-GlcNAcase StrH, составной частью которого являются последовательности 20 аминокислотных остатков, содержащих гексагистидиновый тэг, и 1117 аминокислотных остатков (без сигнального пептида, одного из двух G5 доменов и якорного пептида) β-N-GlcNAcase StrH Streptococcus pneumoniae; T7 terminator - терминатор T7 РНК-полимеразы; AmpR promoter - промотер гена устойчивости к ампициллину; AmpR - ген устойчивости к ампициллину; ori - ориджин репликации; lacI - ген лактозного репрессора; lacI promoter -промотор гена лактозного репрессора; NdeI - сайт узнавания эндонуклеазы рестрикции NdeI; BamHI - сайт узнавания эндонуклеазы рестрикции BamHI
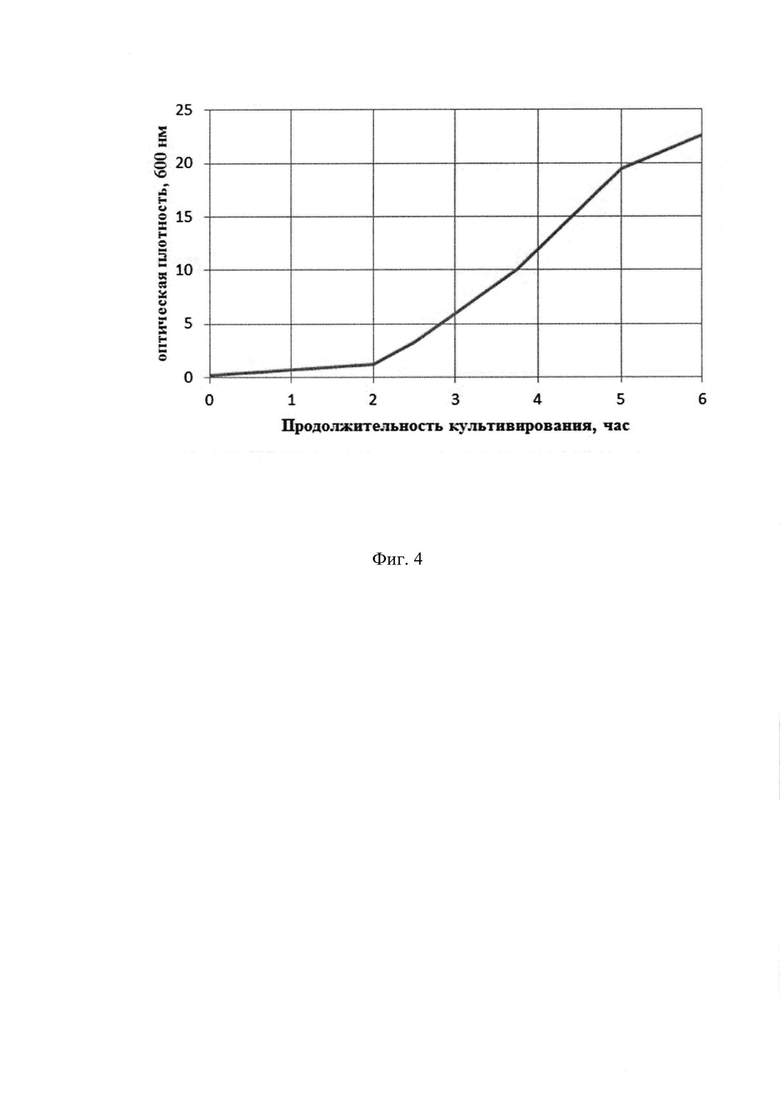
Фиг. 4. Динамика накопления биомассы при культивировании штамма-продуцента E. coli ВКПМ В-12747 в объеме 15 л. По оси абсцисс - часы культивирования, по оси ординат - накопление биомассы;
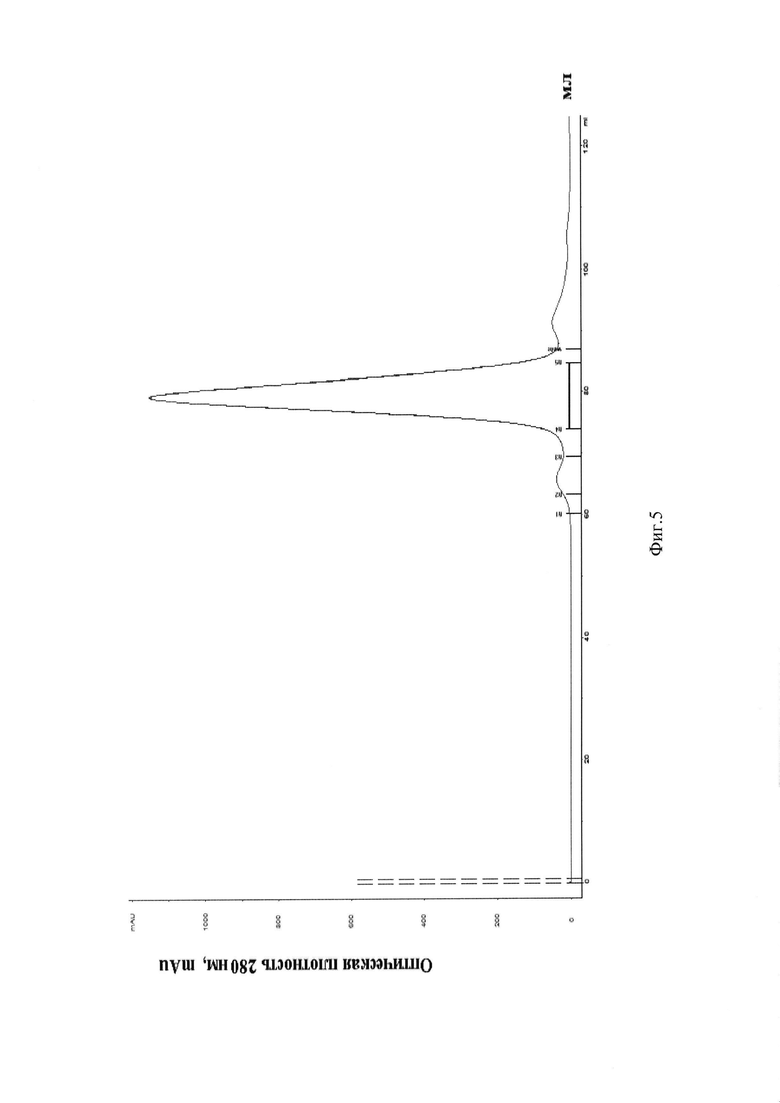
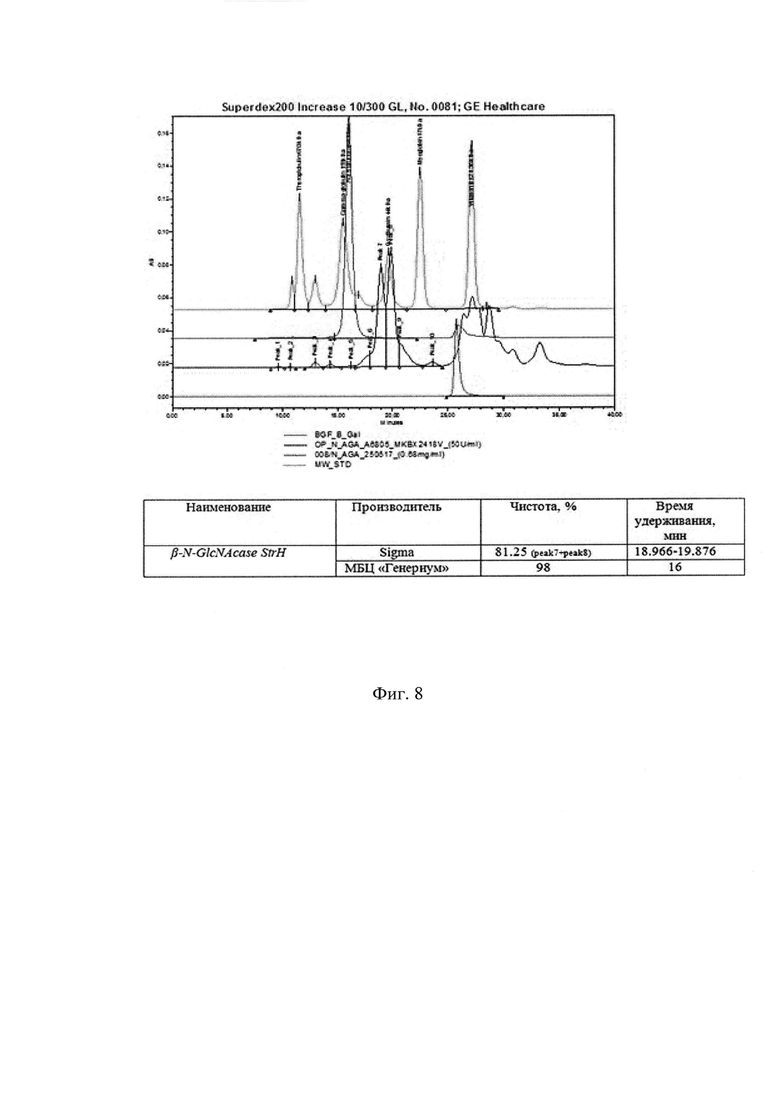
Фиг. 5. Профиль элюции целевого белка β-N-GlcNAcase StrH - гель-фильтрация на Superdex 200.
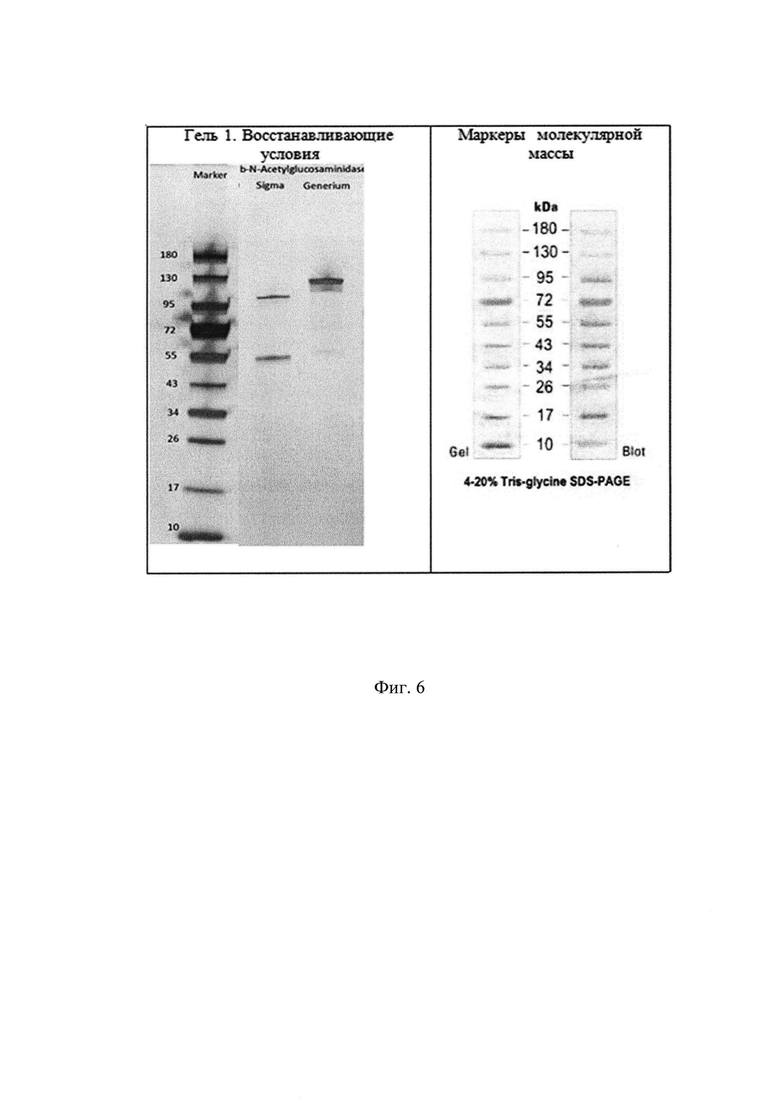
Фиг. 6. Результат выделения β-N-GlcNAcase StrH. Анализ электрофорезом в ПААГ. Сравнение коммерческого препарата и полученного препарата рекомбинантной β-N-GlcNAcase StrH. Дорожка 1 - маркеры молекулярной массы Thermo Scientific; Дорожка 2 - рекомбинантная коммерческая β-N-ацетилглюкозаминидаза; Дорожка 3 - Очищенный препарат рекомбинантной β-N-GlcNAcase StrH.
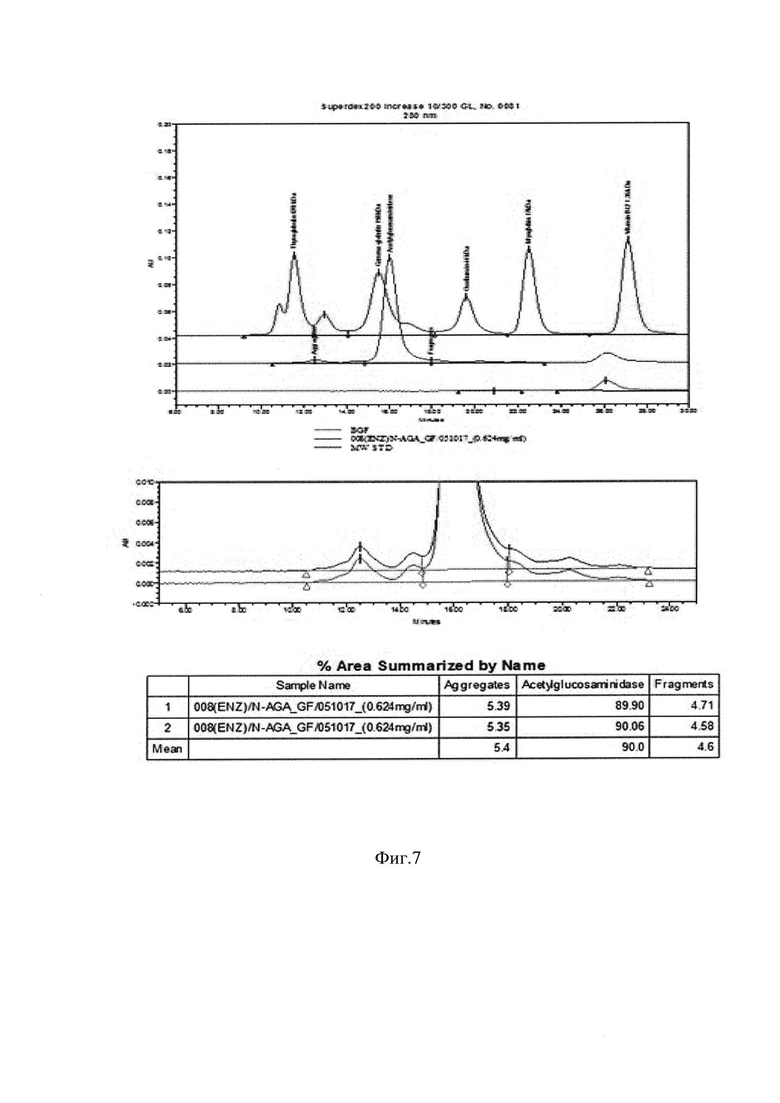
Фиг. 7. Результат анализа ГФ ВЭЖХ. Промышленная серия β-N-GlcNAcase StrH.
Фиг. 8. Результат анализа ГФ ВЭЖХ. Сравнение коммерческого препарата и препарата рекомбинантной β-N-GlcNAcase StrH с повышенной хроматографической чистотой.
Отсутствие отечественных коммерчески доступных препаратов рекомбинантной β-N-GlcNAcase StrH из Streptococcus pneumoniae, экспрессированных в E. coli, и чрезвычайно высокая стоимость препаратов у зарубежных производителей таких, как QA-Bio, Amsbio, ProZyme, Sigma делает коммерчески невыгодным использование этих препаратов при производстве лекарственных препаратов. Препараты данных фирм производятся не в соответствии со стандартами «Надлежащей производственной практики»/«Good Manufacturing Practice» (GMP) и предназначены только для аналитических исследований.
Подробные характеристики β-N-GlcNAcase StrH, принадлежащей к большому семейству 20 гликозидаз - гидролаз, которые гидролизуют терминальный сахарный остаток с нередуцирующего конца олигосахаридов и углеводной цепи гликоконьюгатов, таких как гликопротеины и гликолипиды (Фиг. 1.), даны в публикациях Kobata Akira, Use of Endo- and Exoglycosidases for Structural Studies of Glycoconiugates, // Analytical biochemistry - 1979. - V.100. - P. 1-14; Intra J at al., Phylogenetics analyses multiple changes of substrate specificity the glycosil hydrolase 20 family, // BMC Evol. Biol. - 2008. - P. 8214;.Lowrie R. Glascow at al, Systematic Purification of Five Glycosidases from Streptococcus (Diplococcus) pneumoniae, // The Journal of Biological Chemistry - 1977. - V. 252. - N. 23. - Issue of December 10. - P. 8615-8623. Раскрыто большое количество экзо-ацетилглюкозаминидаз, выделенных из множества организмов, таких как бактерии, вирусы, растительные и животные ткани, которые широко используются, как инструмент анализа структуры и функций гликоконьюгатов, олигосахаридов, ассоциированных с гликопротеинами и клеточными мембранами, и пользуются большим спросом в гликобиологических исследованиях и промышленных процессах. Однако все они обладают разной субстрат- специфичностью и многие из описанных гликозидаз имеют ограниченное значение, так как активны только при низких рН, или только на низкомолекулярных субстратах, и, как правило, при производстве препаратов из природных источников существуют трудности с получением чистых препаратов. Обычно они загрязнены примесями других гликозидаз, протеаз, бактериальных эндотоксинов. Кроме того, ограниченное количество экзо-ацетилглюкозаминидаз, которые выделяются и производятся из природных источников, коммерчески доступно. Перечень представлен в Таблице 1. (4. US Patent 7094563 В2, Isolation and composition of novel glycosidases, // 2006.).
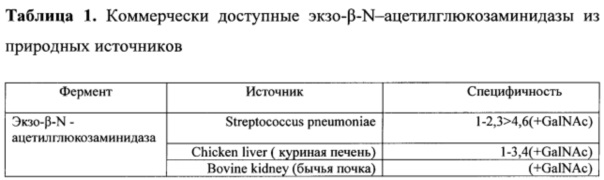
Впервые β-N-GlcNAcase StrH Diplococcus pneumonia, выделенная из природного источника, охарактеризована в публикации R. Colin Hughes at al., The Extracellular Glycosidases of Diplococcus pneumoniae. Purification and Properties of a β-N-Acetylglucosaminidase. Action on a Derivative of the α-Acid Glycoprotein of Human Plasma, // Biochemistry - 1964. - V. 3. - N. 10. - P. 1543-1548. Было выяснено, что β-N-GlcNAcase StrH активна и при нейтральной рН и на низко- и высокомолекулярных субстратах.
В публикации Valerie A. Clarke at al., Cloning and Expression of the β-N-Acetylglucosaminidase Gene from Streptococcus pneumoniae. Generation of truncated enzymes with modified aglycon specificity, // The Journal of Biological Chemistry - 1995. - V. 270. - N. 15. - P. 8805-8814), впервые идентифицирована структура гена β-N-GlcNAcase StrH из Streptococcus pneumoniae. Показано, что экспрессия почти полного ДНК-клона в Escherichia coli продуцировала функциональную и аутентичную β-N-GlcNAcase StrH, имеющую агликонспецифичность, идентичной ферменту дикого типа. Также было показано, что β-N-GlcNAcase StrH полностью гидролизует терминальные остатки GlcNAc из N-гликанов вне зависимости от того, какая ветвь в гликанах (1-3) или (1-6), (Фиг. 2.), (Samantha J. King at al., Deglycosylation of human glycoconjugates by the sequential activities of exoglycosidases expressed by Streptococcus pneumoniae, // Molecular Microbiology - 2005. - V. 59. - N. 3. - P. 961-974).
Получение β-N-GlcNAcase StrH в Escherichia coli в виде гомологичного варианта фермента ранее проводилось в исследовательских целях и раскрыто в публикации Clarke V.A. At al. // Int. J. Biochrom. - 1994. - V. 1. - P. 151-158. Авторы получают β-N-GlcNAcase StrH в виде фьюжен - белка с глутатион - S-трансферазой с использованием аффинной хроматографии на Glutathione Sepharose и последующим расщеплением фьюжен-белка протеазой фактором Ха. Данный метод выделения имеет свои очевидные недостатки для получения фермента в промышленных масштабах:
1. На коммерчески доступный сорбент glutathione (γ-glutamylcysteinylglycine) Sepharose может повлиять γ-глутамилтранспептидаза, находящаяся в неочищенных клеточных лизатах. Следовательно, глутатионный сорбент имеет конечный срок службы и может быть регенерирован и повторно использован 4-20 раз, в отличие от, например, IMAC сорбентов, которые можно использовать практически бесконечно (Michelle Е. Kimple at al, Overview of Affinity Tags for Protein Purification, HHS Public Access Author manuscript, // Curr Protoc Protein Sci. - 2015 - V.73. - P. 1-26).
2. Шаперонин - 70 kDa E. coli (белок теплового шока) также адсорбируется на сорбент и коэлюируется с целевым GST-фьюжен белком.
3. Высокий уровень экспрессии фьюжен белка GST в Е. coli может привести к накоплению агрегированного белка в телах включения. Хроматография на Glutathione Sepharose зависит от правильного рефолдинга GST. Поэтому перед очисткой должен быть проведен рефолдинг, однако большой размер GST 26 кДа и его димеризация в растворе может повлиять на свойства фьюжен белка.
4. Высокая стоимость фактора Ха, дополнительная очистка от фактора Ха и продуктов гидролиза, а также дополнительный контроль наличия фактора Ха в готовом продукте значительно увеличивают себестоимость препарата.
Наиболее близким к заявленному изобретению можно считать способ очистки β-N-GlcNAcase StrH, раскрытый в работе Benjamin Pluvinage at al, Conformational Analysis of StrH, the Surface-Attached exo-β-d-N-Acetylglucosaminidase from Streptococcus pneumoniae, // Journal of Molecular Biology - 2013. - V. 425. - N. 23. - P. 334-349. Данный способ предполагает очистку гомологичного варианта фермента и его вариантов в виде фьюжен белка с полигистидиновой последовательностью, в аналитических количествах. Целевые белки очищали с помощью металлохелатной хроматографии на IMAC Sepharose с последующим гидролизом тромбином и анионообменной хроматографией на UNOsphere Q (Bio-Rad Laboratories), гельфильтрацией на Sephacryl S200(GE Biosciences) с последующим концентрированием ультрафильтрацией с использованием мембраны с отсечением 10 кДа. Данная схема очистки с использованием тромбина является неприемлемой для масштабного производства препарата в силу уже упоминаемых причин по гидролизу фактором Ха. Кроме того, авторы не сообщают об уровне содержания в препарате бактериальных эндотоксинов. Удаление бактериальных эндотоксинов является принципиальным и необходимым требованием, как с точки зрения российских, так и международных стандартов (ГФ XIII, Document Q AS/ 11.452 FINAL July 2012). Однако часто остается технически трудновыполнимой задачей, поэтому содержание бактериальных эндотоксинов в промежуточных продуктах, применяемых при производстве ЛС, является критическим параметром. При оценке качества таких промежуточных продуктов, как гликозидазы, помимо соответствия субстратной специфичности, активности, особо должны оцениваться такие потенциально опасные контаминанты, как бактериальные эндотоксины и клеточная ДНК, в том числе потенциально онкогенная, а также гомогенность препарата.
Для решения задачи получения высокоочищенной β-N-GlcNAcase StrH в промышленных объемах авторы изобретения предлагают новый способ получения рекомбинантной β-N-GlcNAcase StrH из Streptococcus pneumoniae, включающий синтез оптимизированной для трансляции в E. coli последовательности ДНК, кодирующий белок β-N-GlcNAcase StrH, нуклеотидная последовательность которого приведена в составе SEQ ID NO 1, конструирование экспрессионного плазмидного вектора, кодирующего химерный белок с N-концевой химеризацией, составленного пептидными последовательностями шести гистидинов, сайт узнавания тромбина а также 1117 аминокислотных остатков (без сигнального пептида, одного из двух G5 доменов и якорного пептида) β-N-GlcNAcase StrH из Streptococcus pneumoniae (аминокислотная последовательность представлена SEQ ID NO 2), получение рекомбинантного белка продукцией в E. coli, очистку белка из растворимой фракции клеточного лизата с помощью металлохелатной хроматографии на IMAC Sepharose, хроматографии в режиме проскока на Blue Sepharose FF, анионобменной хроматографии на Toyopearl Giga Cap Q-650М, хроматографии в режиме проскока на Butyl Capto, концентрирующей анионобменной хроматографию на Q Sepharose FF, с выходом высокоочищенного активного препарата pGlcNAcase StrH, пригодного для использования на производстве ЛС и гликобиологических исследований, не менее 0,04 г с литра бактериальной культуры.
Для получения наиболее хроматографически гомогенного препарата (более 98% по результатам гель-фильтрационной ВЭЖХ), применяемого для точных гликобиологических исследований, в схему может быть дополнительно включено концентрирование ультрафильтрацией с использованием мембраны с отсечением 50 к Да и гель - фильтрация на Superdex 200.
Основным техническим результатом изобретения является получение в промышленных масштабах высокоочищенного активного препарата β-N-GlcNAcase StrH, пригодного для использования на производстве ЛС и гликобиологических исследований.
Для осуществления изобретения был создан штамм генно-инженерно-модифицированного микроорганизма E. coli ВКПМ В-12747: штамм получен трансформацией реципиентного штамма-хозяина BL21(DE3) плазмидами pLysS, несущей ген Т7 лизоцима, являющегося ингибитором Т7 РНК полимеразы, рМТ1618 (pET15b-STRH_STRPN), несущей ген белка β-N-GlcNAcase StrH, составной частью которого являются последовательности 20 аминокислотных остатков, содержащих гексагистидиновый тэг, сайт узнавания тромбина и 1117 аминокислотных остатков (без сигнального пептида, одного из двух G5 доменов и якорного пептида) β-N-GlcNAcase StrH (Фиг. 3.).
Рефолдинг продукта не требуется, так как он синтезируется в бактериальной цитоплазме преимущественно в растворенном состоянии при культивировании E. coli ВКПМ В-12747 с уровнем биосинтеза вариантов целевого белка не менее 40 мг/л культуральной жидкости.
Высокоэффективное извлечение целевого белка β-N-GlcNAcase StrH из клеток достигается в результате процедуры лизиса бактериальных клеток с использованием гомогенизатора высокого давления.
Получение активного, хроматографически гомогенного с низким содержанием бактериальных эндотоксинов и ДНК хозяина препарата β-N-GlcNAcase StrH достигается благодаря схеме хроматографической очистки, включающей в себя: металлохелатную хроматографию на IMAC Sepharose 6 F F, хроматографию в режиме проскока на Blue Sepharose FF, анионобменную хроматографию на Toyopearl Giga Cap Q-650М, хроматографию в режиме проскока на Butyl Capto, концентрирующую анионобменную хроматографию на Q Sepharose FF. Для получения наиболее хроматографически гомогенного препарата в схему может быть дополнительно включено концентрирование ультрафильтрацией с использованием мембраны с отсечением 50 к Да и гель-фильтрация на Superdex 200.
Введение в схему очистки стадии хроматографии на Blue Sepharose в режиме проскока позволяет значительно очистить целевой белок от контаминирующих примесей клеточных белков, коэлюирующихся с целевым белком на всех стадиях.
Применение TOYOPEARL GigaCap Q-650M, высокомолекулярного анионообменного сорбента с высоким разрешением, оптимизированным для захвата и очистки белков с большим молекулярным весом. Подобраны условия посадки и съема целевого белка, позволяющие максимально очистить целевой белок от контаминирующих примесей клеточных белков и липополисахаридов. Кроме того, способ отличается от ранее известных также применением хроматографии на Butyl Capto в режиме проскока, позволяющей удалить контаминирующие примеси гидрофобных белков и липополисахаридов.
Материалы и методы
Для экспрессии β-N-GlcNAcase StrH получают генно-инженерные конструкции (ГИК) рМТ1618. Для получения ГИК, кодирующих β-N-GlcNAcase StrH, была разработана схема клонирования на базе вектора рЕТ-15b (Novagen), предполагающая получение полной версии, имеющей 6×His-tag на N-конце. Для получения соответствующей ГИК в компании TOP Gene Technologies был заказан синтетический ген, кодирующий β-N-GlcNAcase StrH (геномная последовательность бактерии Streptococcus pneumoniae, кодирующая 1117 аминокислотных остатков (без сигнального пептида, одного из двух G5 доменов и якорного пептида) β-N-ацетилглюкозаминидазы (strH), слитая на 5'-конце с частью векторной последовательности материнской плазмиды pET15b(+), кодирующей 20 аминокислотных остатков, содержащих гексагистидиновый тэг), фланкированный сайтами рестрикции NdeI, BamHI, содержащий внутренние сайты рестрикции NheI для получения «каталитического» домена и стоп-кодоны на 3'-конце последовательности (TGATAA). В TOP Gene Technologies была проведена кодон-оптимизация последовательности для экспрессии белка в E. coli, принимая во внимание требование об отсутствии в последовательности «внутренних» сайтов эндонуклеаз рестрикции NdeI, BamHI, XhoI и NheI. Кодон-оптимизация полученной последовательности β-N-GlcNAcase StrH была проверена на сайте http://gcua.schoedl.de/sequential_v2.html. Соответствие транслируемой аминокислотной последовательности заказанной подтверждено с помощью выравнивания в программе MEGA 6.0. Отсутствие нежелательных сайтов рестрикции подтверждено с помощью программного обеспечения CloneManager 9.0. Для получения ГИК рМТ1618 (pET15b-STRH_STRPN) была проведена наработка и рестрикционное картирование синтетического гена pAPG110- β-N-GlcNAcase StrH. Согласно разработанной схеме было проведено клонирование фрагмента, кодирующего стрептококковую β-N-GlcNAcase StrH из плазмиды pAPG110-STRH_STRPN, в векторную плазмиду pET15b по сайтам рестрикции NdeI, BamHI. Полученные в ходе рестрикции фрагменты очищали и использовали для лигирования. Лигазной смесью трансформировали химически компетентные клетки E. coli XL10-GOLD. Клетки высевали для получения трансформированных клонов.
Затем выделяли плазмидную ДНК и проводили рестрикционное картирование с использованием эндонуклеазы рестрикции PstI. Образец плазмидной ДНК передавали на секвенирование в "Евроген". Полученная последовательность была выровнена с «теоретической» последовательностью рМТ1618.
Для проведения аналитической экспрессии плазмидную ДНК ГИК рМТ1618 трансформировали в штаммы BL21(DE3) pLysS. На основании аналитической экспрессии отбирали клоны-суперпродуценты β-N-GlcNAcase StrH. Затем получали штамм-суперпродуцент β-N-GlcNAcase StrH. Штамм был депонирован во Всероссийской коллекции промышленных микроорганизмов (ВКПМ) под инвентарным номером - ВКПМ В-12747.
Для получения целевого белка β-N-GlcNAcase StrH проводили препаративную экспрессию путем культивирования E. coli ВКПМ В-12747 в полноценной питательной среде с относительным содержанием растворенного кислорода не менее 10% при температуре 37°C, значении рН - 6,5-7,6. Длительность процесса культивирования составляла 5-6 часов. Благодаря обогащенной культуральной среде, в течение первого этапа происходил активный рост клеток. Присутствие в среде глюкозы подавляет экспрессию рекомбинантного белка, а, следовательно, снижает нагрузку на клетку штамма-продуцента, что приводит к увеличению количества накапливаемой биомассы.
С 2,5-3 часа культивирования начинается этап биосинтеза гибридного белка. Экспрессия белка β-N-GlcNAcase StrH находится под контролем промотора, который дерепрессируется внесением раствора ИПТГ до конечной концентрации 0,0476 мас. %. Уровень биосинтеза вариантов целевого белка β-N-GlcNAcase StrH составляет не менее 15 мг/л культуральной жидкости.
Бактериальную биомассу собирали центрифугированием и хранили при - 70°C. Клеточную биомассу лизировали, лизат осветляли центрифугированием и проводили выделение белка β-N-GlcNAcase StrH из лизата путем связывания целевого белка металлохелатной хроматографией на колонке с Ni2+ IMAC Sepharose FF. Доочищали фермент последовательными хроматографиями на Blue Sepharose FF в режиме проскока, анионообменной Toyopearl Giga Cap Q-650М, Butyl Capto в режиме проскока, хроматографией на Q HP, концентрированием и гельфильтрацией. На каждом этапе контроль степени очистки проводят электрофорезом в ПААГ.
Выход белка составляет не менее 0,04 мг на литр бактериальной культуры.
Конечный продукт, полученный способ по изобретению, имеет следующие параметры:
- содержание белка (УФ-спектрофотометрия) - не менее 0,5 мг/мл;
- содержание бактериальных эндотоксинов (ГФ XIII, гель-тромб тест с ЛАЛ-реактивом ОФС.1.2.4.0006.15) не более 100 ЭЕ/мг;
- Хроматографическая чистота (ГФ ВЭЖХ) не менее 85%;
- Ферментативная активность (Колориметрический метод, β-N-Acetylglucosaminidase Assay Kit" (Sigma)) не менее 150 U/мг;
- Остаточная ДНК штамма-продуцента (Количественный ПНР в реальном времени) не более 20 пг/мг;
С использованием методов очистки настоящего изобретения удалось получить препарат β-N-GlcNAcase StrH с хроматографической чистотой, определенной с помощью гель-фильтрационной ВЭЖХ, 90% гомогенности и более высокоочищенный - 98,8%-ной гомогенности.
Удельная активность препаратов β-N-GlcNAcase StrH по настоящему изобретению составляет от 230 единиц/мг белка и выше.
Содержание бактериальных эндотоксинов в препарате β-N-GlcNAcase StrH по настоящему изобретению составляет не более 4 ЕЭ /мг белка.
Содержание остаточной ДНК штамма продуцента в препарате β-N-GlcNAcase StrH настоящего изобретения предпочтительно составляет не более 4,0 пг/мг белка.
Получение β-N-GlcNAcase StrH на основе оптимизированной синтетической последовательности ДНК с короткой последовательностью из шести гистидинов на N-конце рекомбинантного белка происходит без удаления гексагистидинового тэга, что позволяет упростить очистку и удалить из схемы очистки применение дорогостоящих препаратов для удаления тэга. Аминокислотная последовательность β-N-GlcNAcase StrH представлена SEQ ID NO 2. В качестве первой стадии авторы изобретения применяют металлохелатную хроматографию на IMAC Sepharose 6 FF для полной сорбции целевого белка с гексагистидиновым тэгом. Применение на этой стадии промывок кислым буфером с высокой ионной силой позволяет в значительной степени удалить примеси клеточных белков из целевого продукта. Применение хроматографии на Blue Sepharose в режиме проскока позволяет очистить целевой белок от контаминирующих примесей клеточных белков, коэлюирующихся с целевым белком на всех стадиях. Анионообменную хроматографию проводят на Toyopearl Giga Cap Q-650M, высокомолекулярном анионообменном сорбенте с высоким разрешением, оптимизированным для захвата и очистки белков с большим молекулярным весом. Условия посадки и съема целевого белка подобраны таким образом, чтобы максимально очистить целевой белок от контаминирующих примесей клеточных белков и бактериальных эндотоксинов. Хроматография в режиме проскока на Butyl Capto позволяет удалить контаминирующие примеси гидрофобных белков и бактериальных эндотоксинов. Финальная концентрирующая анионообменная хроматография на Q Sepharose FF позволяет получить высокоочищенный активный препарат β-N-GlcNAcase StrH, пригодный для использования на производстве ЛС и гликобиологических исследований, с выходом не менее 0,04 г с литра бактериальной культуры.
С использованием методов очистки настоящего изобретения удалось получить препарат β-N-GlcNAcase StrH с хроматографической чистотой, определенной с помощью гель-фильтрационной ВЭЖХ 90,0%-ной гомогенности (Фиг. 7.).
Для получения наиболее хроматографически гомогенного препарата (более 98% по результатам гель-фильтрационной ВЭЖХ, Фиг. 8), применяемого для точных гликобиологических исследований, в схему может быть дополнительно включено концентрирование ультрафильтрацией с использованием мембраны с отсечением 50 кДа и гель - фильтрация на Superdex 200.
Удельная активность препаратов β-N-GlcNAcase StrH, полученных раскрытым в изобретении способом, составляет 240 единиц/мг белка; содержание бактериальных эндотоксинов составляет от 2 ЕЭ /мг до 4 ЕЭ /мг белка; содержание остаточной ДНК штамма продуцента составляет не более 4,0 пг/мг белка.
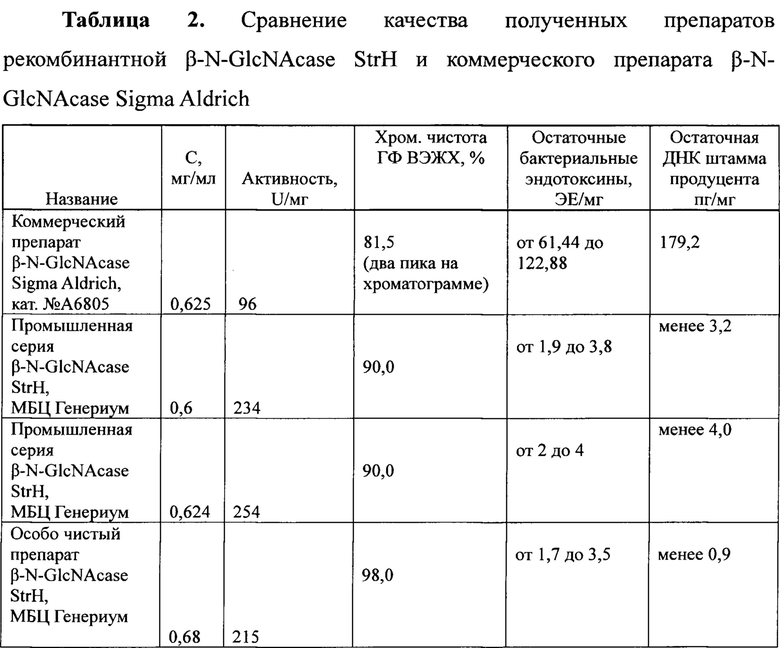
Заявленный способ позволяет получить препарат рекомбинантной βN-GlcNAcase StrH, имеющий более высокую степень чистоты по сравнению с коммерческими аналогами, результаты сравнения представлены в Таблице 2.
Для лучшего понимания сущности изобретения ниже следуют примеры его конкретного исполнения:
Пример 1. Микробиологический синтез белка β-N-GlcNAcase StrH
Заявленный способ реализован для штамма-продуцента E. coli ВКПМ В-12747 при культивировании в ферментере (Biotron LiFlus SP/SL-20L, Юж. Корея) в объеме питательной среды 15 л. рН поддерживают на уровне 7,0-7,6. Культивирование ведут при температуре 37°C. Относительное содержание растворенного кислорода поддерживают на уровне 20-100% путем перемешивания со скоростью 800 об/мин и подачи воздуха с объемным расходом 15 л/мин. Инокулят в объеме 0,75 л, выращенный до оптической плотности, измеренной при длине волны 600 нм (ОД600), равной 1,5 о.е. (оптических единиц), вносят в ферментер со стерильной питательной средой.
В ходе процесса культивирования производят мониторинг основных параметров роста культуры: ОД600, рН, морфология клеток, относительное содержание растворенного кислорода. На 2,5 час культивирования, когда оптическая плотность культуры достигает 3,2 о.е., вносят индуктор-стерильный раствор изопропил-β-D-1-тиогалактопиранозида до конечной концентрации 0,0476 мас. % (2 мМ). Культивирование проводят на протяжении 5-6 часов. Конечная оптическая плотность -28,2 о.е., выход биомассы - 44 г/л. Продуктивность по целевому продукту штамма E. coli ВКПМ В-12747 составляет 40 мг/л культуральной жидкости. На Фиг. 4. представлена динамика накопления биомассы при культивировании штамма-продуцента E. coli ВКПМ В-12747.
Пример 2. Выделение и очистка белка β-N-GlcNAcase StrH из бактериальной биомассы. Получение промышленной серии препарата β-N-GlcNAcase StrH.
2.1 Дезинтеграция биомассы.
Буфер А - 20 mM Tris-HCl, 0.5 М NaCl, рН 7.8;
Замороженную биомассу клеток 180 г, 3ХР по 60 г суспендируют в 350 мл буфера А с PMSF до 0,003% в течение 45 мин на льду и разрушают в проточном гомогенизаторе высокого давления Panda Plus 2000(GEA Niro Soavi). Гомогенизатор промывают 250 мл охлажденной до 0°С водой очищенной, настраивают по охлажденному до 0°С буферу А, настройка II ступени - 140 бар, настройка I ступени - 800 бар, затем лизируют суспензию клеток в этом режиме, собирая лизат в емкость, помещенную в ледяную баню, промывают гомогенизатор 30 мл буфера А. Лизис повторяют еще 2 раза в том же режиме. Лизат объемом 1500 мл осветляют центрифугированием 33250 × g (JLA-16.250) при 4°С в течение 60 мин.
Хроматографии проводят при 4°С, хроматографическая система Akta Purifer 100 (GE).
2.2. Хроматография на Ni2+ IMAC Sepharose FF.
Супернатант 1500 мл, разбавляют буфером А до 1800 мл, доводят рН до 7,8 2М NaOH, фильтруют через глубинный фильтр Sartopor 2 150 и наносят на колонку с Ni2+ IMAC Sepharose, уравновешенную буфером А. После нанесения колонку промывают буфером А и натрий - ацетатным буфером с 1 М NaCl, рН 5.0. Целевой белок элюируют 250 мМ имидазола.
2.3 Хроматография на Blue Sepharose 6 FF 30 мл в режиме проскока.
Элюат с Ni2+ IMAC Sepharose разбавляют стартовым буфером (50 mM MES, рН 6,5) до проводимости 5,7 mSm/sm, доводят рН до 6,5, и наносят на колонку с Blue Sepharose 6 FF 30 мл, уравновешенную стартовым буфером. Целевой белок собирают в режиме проскока.
2.4 Хроматография на Toyopearl Giga Cap Q- 650М.
Проскок с Blue Sepharose 6 FF разбавляют охлажденной до 4°С водой очищенной до проводимости 1,8 mSm/sm, доводят рН до 6,5 и наносят на колонку с Toyopearl Giga Cap Q- 650M уравновешенную буфером 50 mM MES, рН 6,5. Целевой белок элюируют градиентом от 3 мМ до 0,3 М NaCl в стартовом буфере.
2.5 Концентрирование на Q Sepharose FF с предколонкой HiTrap Butyl Capto 5 мл.
Элюат с Toyopearl Giga Cap Q-650М разбавляют водой очищенной до проводимости 2,04 mSm/sm, доводят рН до 7,5 и наносят на колонки с Q Sepharose FF с предколонкой HiTrap Butyl Capto, уравновешенные буфером 20 mM Tris -HCl, рН 7.5. Отмывают стартовым буфером до выхода элюата не сорбировавшихся компонентов, колонку с HiTrap Butyl Capto отсоединяют, отмывают буфером В (20 mM Tris -HCl, ImM EDTA, рН 7.5) и элюируют 250 mM NaCl в буфере В.
2.6 Разведение, стерилизующая фильтрация и фасовка.
Элюат с Q Sepharose FF разбавляют буфером В до получения готовой формы и стерильно фильтруют через FILTER-MAX, "rapid" - 150 ml, 0.22 μm, аликвотируют и хранят при минус 20°C.
Получено:
73,6 мг, 118,0 мл, ε280=1,07, С=0.624 мг/мл,
Содержание бактериальных эндотоксинов: От 9,6 до 19,2 ЕЭ/мл.
Активность на синтетическом субстрате: 234 U/мг.
Чистота образца по ГФ ВЭЖХ составляет: 90,0%.
Остаточная ДНК штамма продуцента (E. colli): ≤4,0 пг/мг.
Пример 3. Получение белка β-N-GlcNAcase StrH с улучшенными качественными характеристиками.
Гель-фильтрацию проводят при RT, хроматографическая система Akta Pure, GE.
Фракции с концентрирующей анионообменной хроматографии, содержащие целевой белок (получение по примеру 2) объединяют и концентрируют на центриконах Amicon Ultrac, 50 K. Затем концентрат наносят на колонку с Superdex 200, используя в качестве мобильной фазы буфер 20 mM Tris HCl, 0.05 М NaCl, 1 mM EDTA рН 7.5. Элюцию целевого белка проводят в том же буфере. Профиль элюциии представлен на Фиг. 5. Затем элюированный целевой белок β-N-GlcNAcase StrH разбавляют буфером подвижной фазы до концентрации белка не более 1 мг/мл и, соблюдая асептические условия, стерильно фильтруют через фильтр 0,22 мкм, фасуют на аликвоты и хранят при - 20°С.
Пример 4. Анализ активности рекомбинантной β-N-GlcNAcase StrH.
Определение активности рекомбинантной β-N-GlcNAcase StrH проводят постановкой теста на синтетическом субстрате NAG (4-Nitrophenyl N-acetyl-β-D-glucosaminide) используя набор "β-N-Acetylglucosaminidase Assay Kit" (Sigma). В результате гидролиза субстрата NAG (4-Nitrophenyl N-acetyl-β-D-glucosaminide) ферментом β-N-Acetylglucosaminidase образуется продукт p-nitrophenol, содержание которого измеряется колориметрически при длине волны 405 нм. Одна единица активности (1 unit) должна обеспечить гидролиз 1.0 μmole субстрата 4-Nitrophenyl N-acetyl-β-D-glucosaminide с образованием продуктов p-nitrophenol и N-acetyl-β-D-glucosaminide за 1 минуту при рН 4.7 и температуре 37°C. Для проведения теста готовят раствор субстрата «4-Nitrophenyl N-acetyl-β-D-glucosaminide» с концентрацией 1 мг/мл. Для этого растворяют 10 мг субстрата в 10 мл раствора 0.09М «Citrate Buffer Solution». В качестве положительного контроля готовят раствор «β-N-Acetylglucosaminidase from Jack beans» путем разведения в 100 раз в растворе «Dilution Buffer». Готовят раствор «Stop Solution» путем разведения содержимого флакона в 118 мл воды очищенной. В качестве контроля готовят разведения β-N-Acetylglucosaminidase (NAG) (Sigma, cat#A6805) в 50, 100,200, 400 раз в растворе «Dilution Buffer».
Готовят разведения очищенной рекомбинантной β-N-GlcNAcase StrH в 50, 100, 200, 400 раз в растворе «Dilution Buffer». Перед внесением в лунки 96-луночного планшета 5 мкл раствора «Standard Solution» (10 mM p-Nitrophenol) разбавляют в 995 мкл раствора «Stop Solution».
В лунки планшета вносят 98 мкл раствора субстрата, вносят по 2 мкл исследуемых образцов, раствора NAG и положительного контроля. Разбавленный стандартный раствор вносят по 300 мкл в лунку. В качестве «Blank» используют лунки, в которые внесено по 100 мкл раствора субстрата. Схема проведения реакции представлена в Таблице 3.

Инкубируют планшет при температуре 37°С в течение 11 минут.
Вносят по 200 мкл раствора «Stop Solution» в лунки, кроме лунок со стандартным раствором.
Измеряют оптическую плотность растворов при длине волны 405 нм.
Активность фермента вычисляют по формуле:
Units/ml = (Asample-Ablank)*0,05*0,3*DF/Astandard/time/V, где
Asample - оптическая плотность исследуемых образцов, 405 нм
Ablank - оптическая плотность раствора «Blank», 405 нм
0.05 - μmole/ml p-Nitrophenol в стандартном растворе
0.3 - финальный объем реакционной смеси в лунке после добавления раствора «Stop Solution», мл
DF - коэффициент разбавления
A standard - оптическая плотность стандартного раствора, 405 нм
time - время инкубации, мин
V - объем образцов, мл
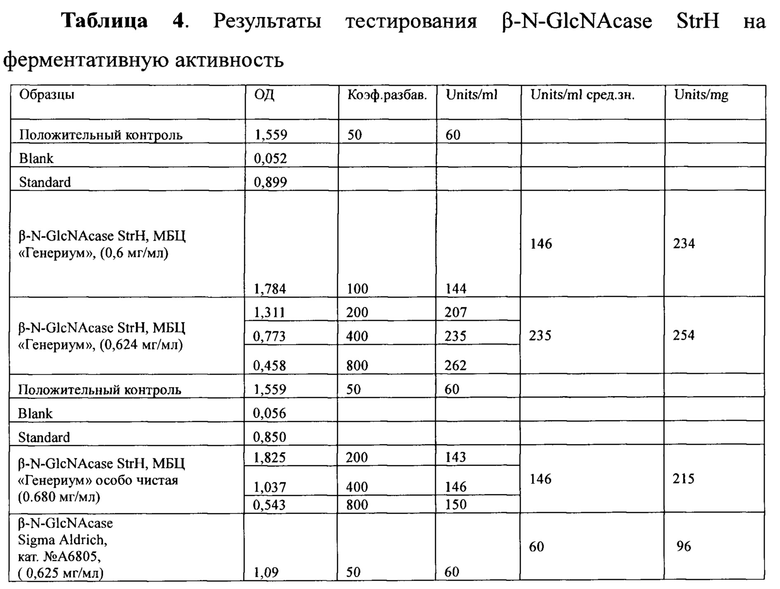
Результаты тестирования β-N-GlcNAcase StrH представлены в Таблице 4.
Пример 5. Электрофоретическое разделение белков
Электрофорез проводят в 4-20% градиентном ПААГ в восстанавливающих условиях, окрашивают солями серебра (Thermo Scientific).
Пробоподготовку образцов проводят разведением образцов до концентрации ~50 мкг/мл добавлением буфера для нанесения проб (S.b.) с добавлением 2 М раствора дитиотреитола (ДТТ). Прогревают в течение 5 минут при (100±2) 0С. Центрифугируют 1 мин., 13000 об/мин и наносят пробы (растворы, полученные при разведении образцов) по 10 мкл в лунку геля, маркеры молекулярной массы - 5 мкл в лунку геля.
Электрофорез проводят при напряжении - 400 В, силе тока - 30 мА, время - до выхода красителя. Затем окрашивают солями серебра по инструкции к набору Thermo Scientific. Результаты представлены на Фиг. 6.
Пример 6. Тестирование очищенных препаратов рекомбинантной β-N-GIcNAcase StrH в сравнении с коммерческим препаратом β-N-GlcNAcase на содержание бактериальных эндотоксинов.
Анализ на содержание бактериальных эндотоксинов проводят методом гель-тромб теста в соответствии с ГФ XIII, гель-тромб тест с ЛАЛ-реактивом ОФС.1.2.4.0006.15. Образцы разводят водой для лал-теста («Пиротест», Россия). Используют для работы: LAL-реактив Endosafe (Charles River, USA) с чувствительностью 0,03 ЕЭ/мл; Контрольный стандартный образец эндотоксина (Charles River, USA) с содержанием 20 ЕЭ/мл. В пробирки для анализа помещают по 100 мкл образцов и по 100 мкл LAL-реактива и инкубируют в течение 60 мин при температуре 37 0С. Положительный результат: образование плотного сгустка геля. При переворачивании пробирки на 180 градусов гель не разрушается. Отрицательный результат: гель не образуется или разрушается при переворачивании пробирки.
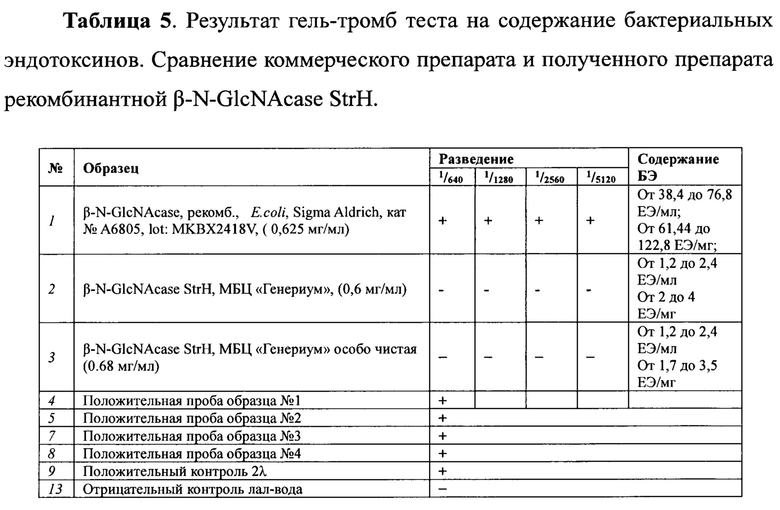
Содержание эндотоксинов в конечной точке выражается в ЕЭ/мл и рассчитывается по формуле: «С» = (разведение в конечной точке) × (чувствительность LAL-реактива). Полученные результаты представлены в Таблице 5.
Примечания к таблице:
«+» - положительный результат; «-» - отрицательный результат.
Положительный результат: образование плотного сгустка геля. При переворачивании пробирки на 180 градусов гель не разрушается. Отрицательный результат: гель не образуется или разрушается при переворачивании пробирки.
Содержание эндотоксинов в конечной точке выражается в ЕЭ/мл и рассчитывается по формуле: «С» = (разведение в конечной точке) × (чувствительность LAL-реактива).
Пример 7. Тестирование хроматографической чистоты очищенных препаратов рекомбинантной β-N-GlcNAcase StrH в сравнении с коммерческим препаратом β-N-GlcNAcase.
Тестирование производят методом ВЭЖХ гель-фильтрации на колонке с Superdex200 Increase 10/300 GL (GE) на хроматографической системе ВЭЖХ Alliance 2695, UV/Visible Detector 2487 (Waters). В качестве подвижной фазы используют буфер 0,02 М NaH2PO4; 0,3 М NaCl; рН=7.0. Очищенный препарат β-N-GlcNAcase StrH вносят без разведения, коммерческий до внесения в систему разводят в 2 раза подвижной фазой. Полученные результаты анализа представлены на Фиг. 7. Тестирование очищенного препарата рекомбинантной β-N-GlcNAcase StrH в сравнении с коммерческим препаратом β-N-GlcNAcase проводят таким же образом. Сравнение хроматографических профилей испытуемых образцов показывает (Фиг. 8.), что β-N-GlcNAcase StrH StrH от МБЦ «Генериум» существенно более однородна по составу, тогда как коммерческая β-N-GlcNAcase более гетерогенна, что вызывает трудности в определении основного пика на хроматограмме коммерческого образца.
Пример 8. Тестирование очищенных препаратов рекомбинантной β-N-GlcNAcase StrH в сравнении с коммерческим препаратом β-N-GlcNAcase на остаточную ДНК штамма продуцента.
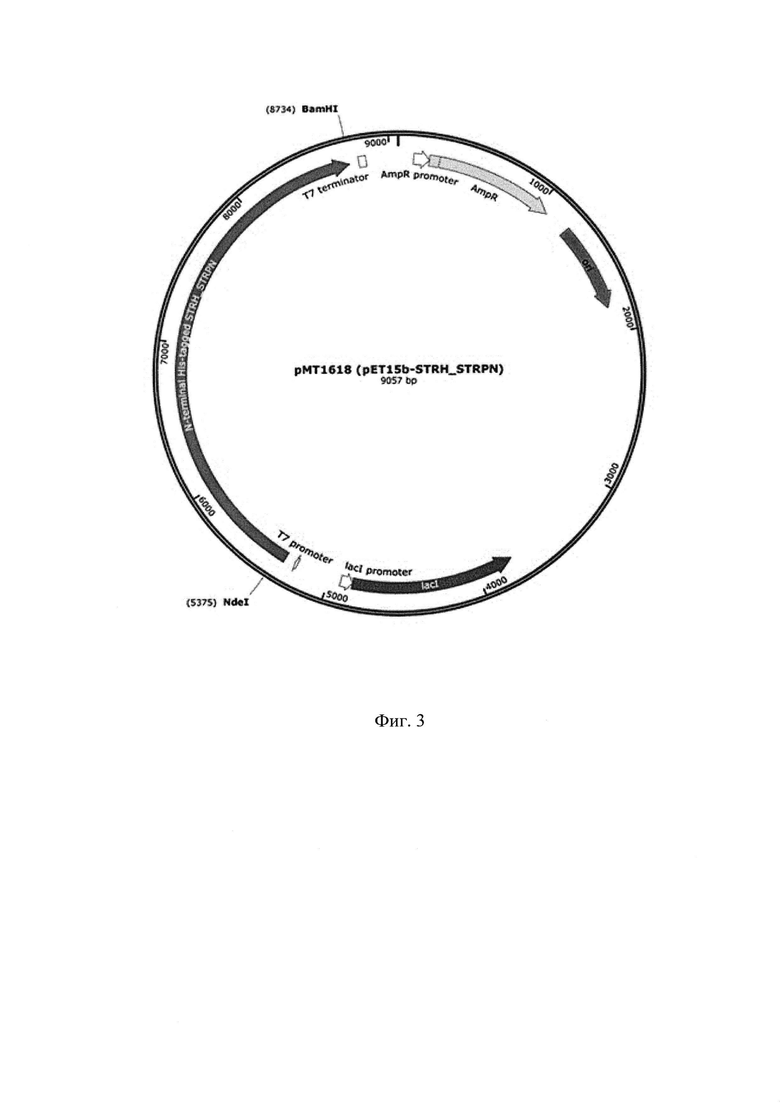
Тестирование на остаточную ДНК штамма продуцента проводят методом количественного ПЦР в реальном времени, не более 20 пг/мг. Для дизайна количественной полимеразной цепной реакции (The quantitative polymerase chain reaction - QPCR) была выбрана система Taqman, в которой при размножении специфической последовательности ДНКа, зонд деградируется ДНКа-полимеразой. Набор праймеров и зонд для детекции ДНК штамма продуцента E. colli представлен в Таблице 6. Перед проведением тестирования образцы были очищены с использованием набора QIAamp DNA Blood Mini Kit (Qiagen). Конечный объем при элюции составил 50 мкл. В реакцию qPCR (пробу) добавляли 10 мкл образца. Количество повторов для каждого образца - 3.
Количество ДНК в пробе менее 0,5 пг ниже предела достоверного обнаружения. Результаты анализа представлены в Таблице 7.



Изобретение относится к биотехнологии. Предложен промышленный способ получения биологически активного препарата рекомбинантной экзо-бета-N-ацетилглюкозаминидазы StrH (β-N-GlcNAcase StrH), продуцированного в соответствии с правилами GMP. Способ включает последовательные стадии металлохелатной хроматографии для сорбции целевого белка с гексагистидиновым тэгом; гель-фильтрации в режиме проскока для очистки целевого белка от контаминирующих примесей клеточных белков, коэлюирующихся с целевым белком на всех стадиях; анионобменной хроматографии на сорбенте, оптимизированным для захвата и очистки белков с большим молекулярным весом; гидрофобной хроматографии, где проводят очистку от контаминирующих примесей гидрофобных белков и бактериальных эндотоксинов. Способ пригоден для использования на стадии ремоделирования в получении терапевтически функциональных препаратов гликопротеинов с заданными свойствами, а также для разработки инструментов для высокочувствительного анализа гликановых цепей гликопротеинов тканей растений, животных и эукариотических микроорганизмов. 8 з.п. ф-лы, 8 ил., 7 табл., 8 пр.
1. Способ очистки в промышленных объемах рекомбинантной экзо-бета-N-ацетилглюкозаминидазы StrH из растворимой фракции клеточного лизата продуцента, отличающийся тем, что хроматографическую очистку проводят с использованием гексагистидинового тэга, с применением последовательно: стадии металлохелатной хроматографии для сорбции целевого белка с гексагистидиновым тэгом; гель-фильтрации в режиме проскока для очистки целевого белка от контаминирующих примесей клеточных белков, коэлюирующихся с целевым белком на всех стадиях; анионобменной хроматографии на сорбенте, оптимизированным для захвата и очистки белков с большим молекулярным весом; гидрофобной хроматографии, где проводят очистку от контаминирующих примесей гидрофобных белков и бактериальных эндотоксинов.
2. Способ по п. 1, где металлхелатную хроматографию проводят на IMAC Sepharose 6 FF.
3. Способ по п. 1, где промывка на стадии металлхелатной хроматографии проводится кислым буфером с высокой ионной силой.
4. Способ по п. 1, где гель-фильтрацию проводят на Blue Sepharose в режиме проскока.
5. Способ по п. 1, где анионобменную хроматографию проводят на Toyopearl Giga Cap Q-650M.
6. Способ по п. 1, где гидрофобную хроматографию проводят на сорбенте Capto Butyl.
7. Способ по п. 1, где после гидрофобной хроматографии проводят концентрирование препарата на анионобменном сорбенте.
8. Способ по п. 7, где концентрирование препарата проводят на Q Sepharose FF.
9. Способ по п. 1, где дополнительно проводят концентрирование белка ультрафильтрацией с использованием мембраны с отсечением 50 кДа и гель-фильтрацию на Superdex 200.
9. Способ по п. 1, где аминокислотная последовательность рекомбинантной экзо-бета-N-ацетилглюкозаминидазы StrH с гексагистидиновым тэгом идентична последовательности SEQ ID NO 2.
| Pluvinage B | |||
| et al | |||
| Conformational analysis of StrH, the surface-attached exo-β-dN-acetylglucosaminidase from Streptococcus pneumoniae //Journal of molecular biology | |||
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| - Vol | |||
| ПРИБОР ДЛЯ ОПРЕДЕЛЕНИЯ СКОРОСТИ ТЕЧЕНИЯ ВОДЫ И ОДНОВРЕМЕННОГО ПОЛУЧЕНИЯ ПРОБ ЕЕ | 1925 |
|
SU425A1 |
| - n | |||
| Аппарат для очищения воды при помощи химических реактивов | 1917 |
|
SU2A1 |
| - p | |||
| Способ искусственного получения акустического резонанса | 1922 |
|
SU334A1 |
| De Marco J | |||
| L., Valadares-Inglis M | |||
| C., Felix C | |||
| R | |||
| Purification and characterization of an N-acetylglucosaminidase produced by a Trichoderma harzianum strain which controls Crinipellis perniciosa //Applied microbiology and biotechnology | |||
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| - Vol | |||
| Нефтяной конвертер | 1922 |
|
SU64A1 |
| - n | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| - p | |||
| Деревянный торцевой шкив | 1922 |
|
SU70A1 |
| Журавлева Н | |||
| В., Лукьянов П | |||
| А | |||
| Хитинолитические ферменты: источники, характеристика и применение в биотехнологии //Вестник Дальневосточного отделения Российской академии наук | |||
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| - n | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
Авторы
Даты
2019-07-03—Публикация
2018-02-01—Подача