Область техники
Настоящее изобретение относится к назальной вакцине, индуцирующей клеточно-опосредованный иммунитет.
Предшествующий уровень техники
Приобретенный иммунитет реализуется посредством двух разных механизмов, а именно, гуморального иммунитета и клеточно-опосредованного иммунитета.
Гуморальный иммунитет представляет собой систему иммунитета, состоящую в основном из антител, представителей системы комплемента и тому подобного, которые присутствуют в крови. Если в живой организм проникает чужеродный антиген, то этот чужеродный антиген захватывается антигенпрезентирующей клеткой, такой как дендритная клетка, и затем расщепляется на фрагменты. После этого расщепленный таким образом на фрагменты антиген презент и руется на поверхности клетки при участии молекулы главного комплекса гистосовместимости (МНС, от англ. major histocompatibility complex) класса II. Далее, Т-хелперная клетка 2 типа (Th2), стимулированная антигенпрезентирующей клеткой, распознает фрагмент антигена, презентированный на В-клетке через Т-клеточный рецептор (TCR, от англ. Т cell antigen receptor) для антигена, и затем осуществляет высвобождение цитокина Th2-типа и так далее. Данная В-клетка продуцирует антитело в ответ на действие высвободившегося цитокина Th2-типа.
С другой стороны, кпеточно-опосредованный иммунитет представляет собой систему иммунитета, направленную на удаление чужеродных тел из живого организма под действием макрофагов, цитотоксических Т-лимфоцитов (CTL, от англ. cytotoxic Т lymphocytes), натуральных клеткок-киллеров и так далее. Если фрагментом антигена, презентированным на антигенпрезентирующей клетке при участии молекулы МНС класса II, активируется Т-хелперная клетка 1 типа (Th1), то данная ТМ-кпетка высвобождает интерферон-гамма (IFN-γ) и активирует макрофаг. Кроме того, Th1-клетка индуцирует образование не нейтрализующего антитела, а антитела, связывающегося с клеточной поверхностью, и активирует макрофаг или натуральную клетку-киллера (NK) через Fc-рецептор антитела, в результате чего макрофаг или NK клетка атакует и разрушает клетку-мишень. Таким образом, индукцирование антитело-зависимой клеточной цитотоксичности (ADCC, от англ. antibody-dependent-cellular-cytotoxicity) также учитывается. Помимо этого, активированная Th1-клетка высвобождает интерлейкин-2 (IL-2) и активирует CTL, который распознает фрагмент антигена, презентированный вместе с молекулой МНС класса I. Активированный макрофаг и CTL атакуют клетки, инфицированные вирусами и тому подобным, раковые клетки и т.д., и устраняют их.
Поскольку клеточно-опосредованный иммунитет также способен устранять инфицированные клетки, раковые клетки и т.д., ожидается, что клеточно-опосредованный иммунитет будет применен для устранения Mycobacterium tuberculosis, которые могут паразитировать в клетках, или для иммунотерапии рака.
На сегодняшний день авторы настоящего изобретения разработали эффективную систему доставки вакцины с использованием самоагрегирующегося наноразмерного гидрогеля, составленного из пуллулана катионного типа, несущего холестерильные группы (сСНР) (патентная литература 1 и непатентная литература 1). Когда в наноматрицу из сСНР наногеля включен белковый антиген, наногель действует как искусственный шаперон, предотвращает агрегацию и дегенерацию антигена и способствует рефолдингу после высвобождения антигена. Этот наногель обладает свойством эффективно связываться с поверхностью отрицательно заряженной слизистой оболочки. Наногель непрерывно высвобождает антигены и доставляет антигены к антигенпрезентирующим клеткам, чтобы вызывать иммунный ответ (непатентная литература 2, непатентная литература 3 и патентная литература 2). Кроме того, в случае мышей, несмотря на то, что сСНР наногель, который несет [111In]-меченный ВоНс/А (С-концевой не оказывающий токсического действия участок тяжелой цепи ботулинического токсина А типа) или пневмококковый поверхностный антиген PspA (пневмококковый поверхностный белок А типа), вводят мышам трансназально, он не накапливается в центральной нервной системе, как например, в обонятельной луковице или головном мозге (непатентная литература 2), и его безопасность подтверждена (непатентная литература 4).
Вакцина на основе наногеля, подходящая для трансназального введения (т.е. назальная вакцина на основе наногеля), чрезвычайно благоприятна как с точки зрения безопасности, так и индуцирования гуморального иммунитета.
Однако, до сих пор нет подтверждений тому, что такая назальная вакцина на основе наногеля индуцирует клеточно-опосредованный иммунитет.
Список цитированной литературы
Патентная литература
Патентная литература 1: WO 00/12564.
Патентная литература 2: патент Японии №5344558.
Непатентная литература
Непатентная литература 1: Ayame et al., Bioconjug. Chem., 19: 882-890, 2008. Непатентная литература 2: Nochi et al., Nat. Mater., 9: 572-578, 2010. Непатентная литература 3: Yuki et al., Biotechnol. Genet. Eng. Rev., 29: 61-72, 2013. Непатентная литература 4: Kong et al., Infect. Immun., 81: 1625-1634 2013.
Краткое описание сущности изобретения
Техническая проблема
Принимая во внимание вышеупомянутые обстоятельства, целью настоящего изобретения является разработка назальной вакцины на основе наногеля, которая индуцирует клеточно-опосредованный иммунитет.
Решение проблемы
Для достижения описанной выше цели авторы настоящего изобретения создали вакцину, в которой использованный в качестве адъюванта лиганд стимулятора генов интерферонов (STING, от англ. stimulator of interferon genes), а также вакцинный антиген включены в наногель, и затем трансназально ввели полученную вакцину мышам. В результате авторам настоящего изобретения удалось с успехом индуцировать антиген-специфичные Th1-клетки.
Конкретно, настоящее изобретение включает приведенные далее пункты от (1) до (11).
(1) Вакцинный препарат, содержащий комплекс наногеля, вакцинного антигена и адъюванта.
(2) Вакцинный препарат по указанному выше п. (1), отличающийся тем, что адъювант содержит один или более чем один лиганд STING.
(3) Вакцинный препарат по указанному выше п. (2), отличающийся тем, что по меньшей мере один из лигандов STING представляет собой циклический динуклеотид.
(4) Вакцинный препарат по указанному выше п. (3), отличающийся тем, что циклический динуклеотид представляет собой любой динуклеотид из: цГАМФ (цикло-ГМФ-АМФ), циклического ди-АМФ (аденозинмонофосфат), циклического ди-ГМФ (гуанозинмонофосфат), циклического ди-ЦМФ (цитидинмонофосфат), циклического ди-УМФ (уридинмонофосфат) или циклического ди-ИМФ (инозинмонофосфат).
(5) Вакцинный препарат по любому из указанных выше п.п. (1)-(4), отличающийся тем, что вакцинный антиген представляет собой антиген, происходящий из Mycobacterium tuberculosis.
(6) Вакцинный препарат по указанному выше п. (5), отличающийся тем, что происходящий из Mycobacterium tuberculosis антиген содержит, по меньшей мере, весь продукт гена Ag85 В или его часть, весь продукт гена Rv2608 или его часть, весь продукт гена Rv3619 или его часть, весь продукт гена Rv1813 или его часть, весь продукт гена МТВ32А или его часть, весь продукт гена МТВ39А или его часть и/или весь продукт гена MVA85A или его часть.
(7) Вакцинный препарат по указанному выше п. (5), отличающийся тем, что происходящий из Mycobacterium tuberculosis антиген представляет собой химерный белок, состоящий из продукта гена Rv3875, продукта гена Rv0266 и продукта гена Rv0288.
(8) Вакцинный препарат по любому из указанных выше п.п. (1)-(4), отличающийся тем, что вакцинный антиген представляет собой антиген, происходящий из папилломавируса человека (HPV).
(9) Вакцинный препарат по указанному выше п. (8), отличающийся тем, что происходящий из HPV антиген содержит по меньшей мере весь продукт гена Е6 или его часть и/или весь продукт гена Е7 или его часть.
(10) Вакцинный препарат по любому из указанных выше п.п. (1)-(4), отличающийся тем, что вакцинный антиген представляет собой антиген, происходящий из респираторно-синцитиального вируса (RSV).
(11) Вакцинный препарат по указанному выше п. (10), отличающийся тем, что происходящий из RSV антиген содержит по меньшей мере весь SH-пептид или его часть.
Полезные эффекты изобретения
В результате введения вакцины на основе наногеля по настоящему изобретению может быть индуцирован клеточно-опосредованный иммунитет.
В результате введения вакцины на основе наногеля по настоящему изобретению может быть эффективно индуцирован как системный иммунный ответ, так и мукозный иммунный ответ.
Краткое описание графических материалов
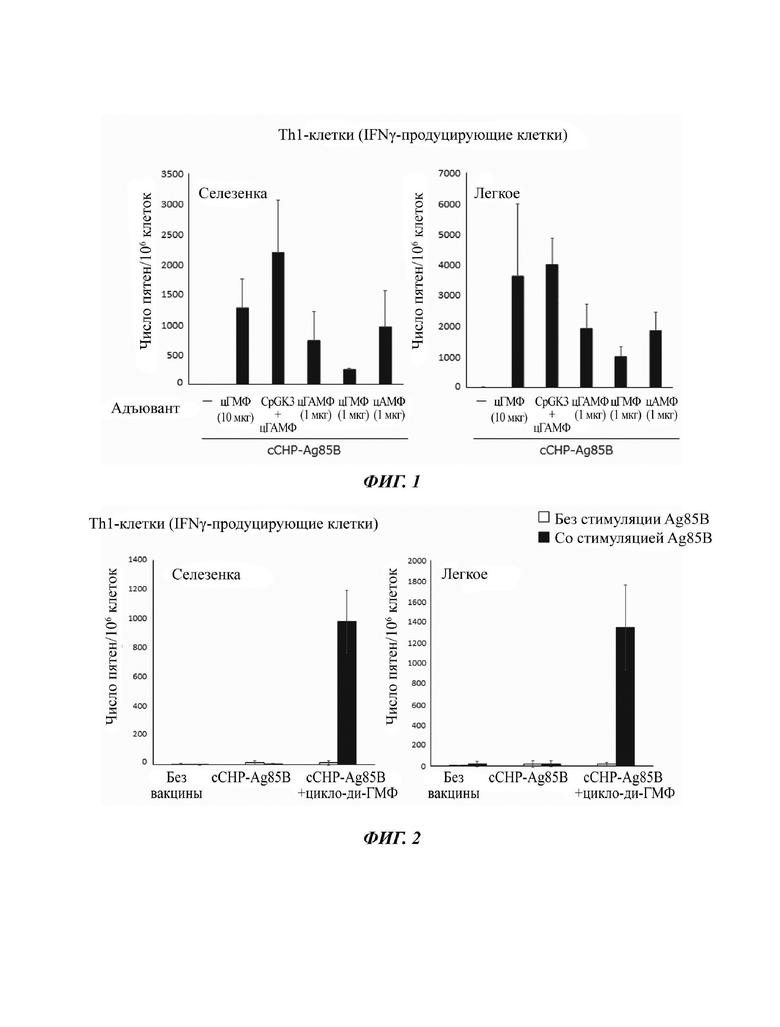
На Фиг. 1 показаны результаты детектирования Th1-клеточного ответа, индуцированного назальной вакциной против Mycobacterium tuberculosis, созданной на основе наногеля и лиганда STING. Термины "цГМФ", "цГАМФ" и "цАМФ" означают циклический ди-ГМФ, циклический ГМФ-АМФ и циклический ди-АМФ, соответственно; без вакцины; сСНР: пуллулан катионного типа, несущий холестерильные группы.
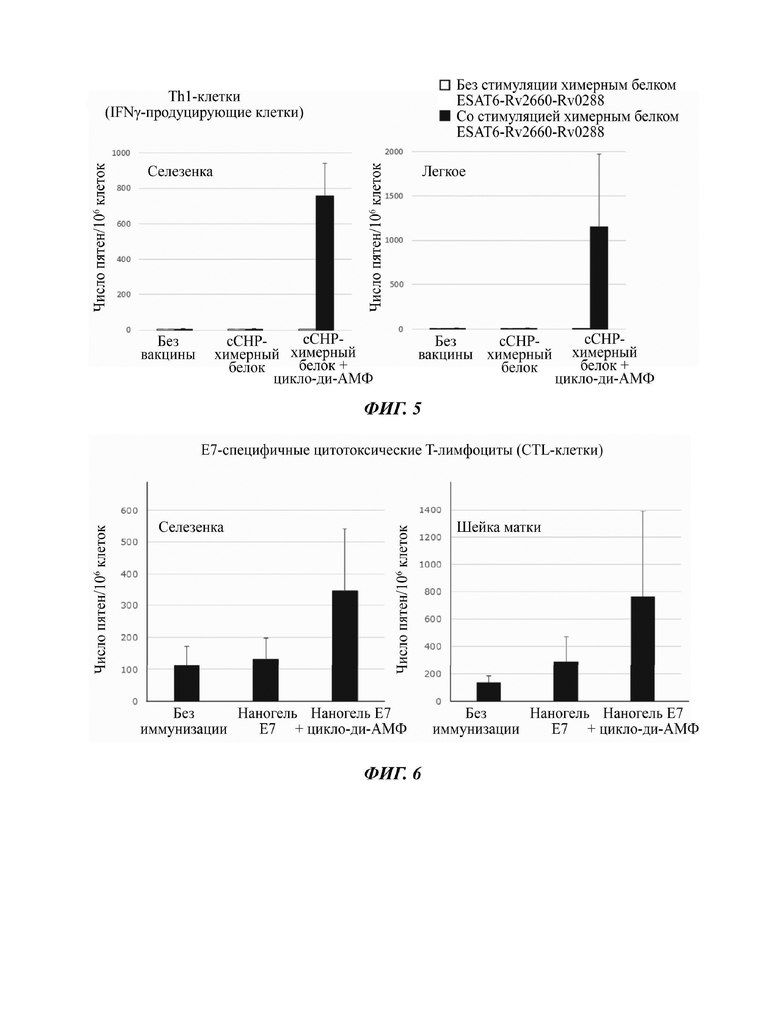
На Фиг. 2 показаны результаты детектирования Тп1 -клеточного ответа, индуцированного назальной вакциной на основе наногеля против Mycobacterium tuberculosis.
На Фиг. 3 показаны результаты детектирования ТМ7-клеточного ответа, индуцированного назальной вакциной на основе наногеля против Mycobacterium tuberculosis.
На Фиг. 4 показаны результаты исследований, относящихся к защитным иммунным эффектам, индуцированным назальной вакциной на основе наногеля против Mycobacterium tuberculosis. На Фиг. 4А показана степень выживаемости, а на Фиг. 4 В показано количество Mycobacterium tuberculosis, обнаруженных в легком и селезенке. "Контроль" означает группу неиммунизированных мышей, "БЦЖ (бацилла Кальмета-Герена)" означает группу, получавшую вакцинацию БЦЖ, а "наногель" означает группу, получавшую вакцинацию сСНР-Ag85 В плюс циклический ди-ГМФ.
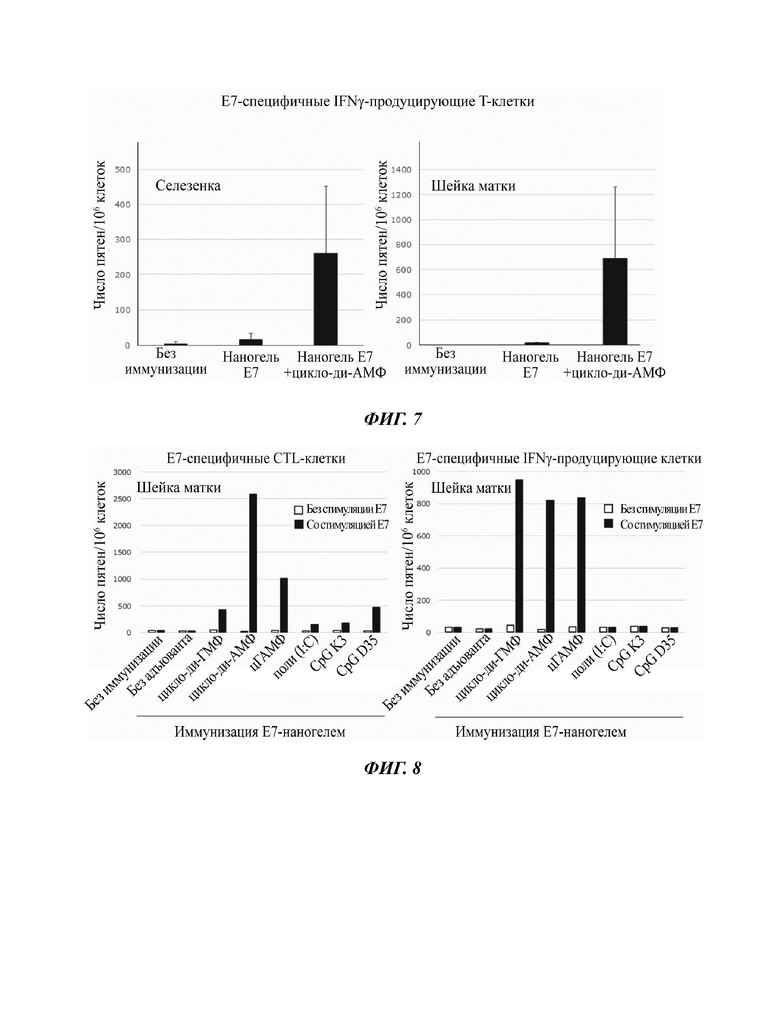
На Фиг. 5 показаны результаты детектирования Th1-клеточного ответа, индуцированного назальной вакциной на основе наногеля против Mycobacterium tuberculosis (химерный антиген).
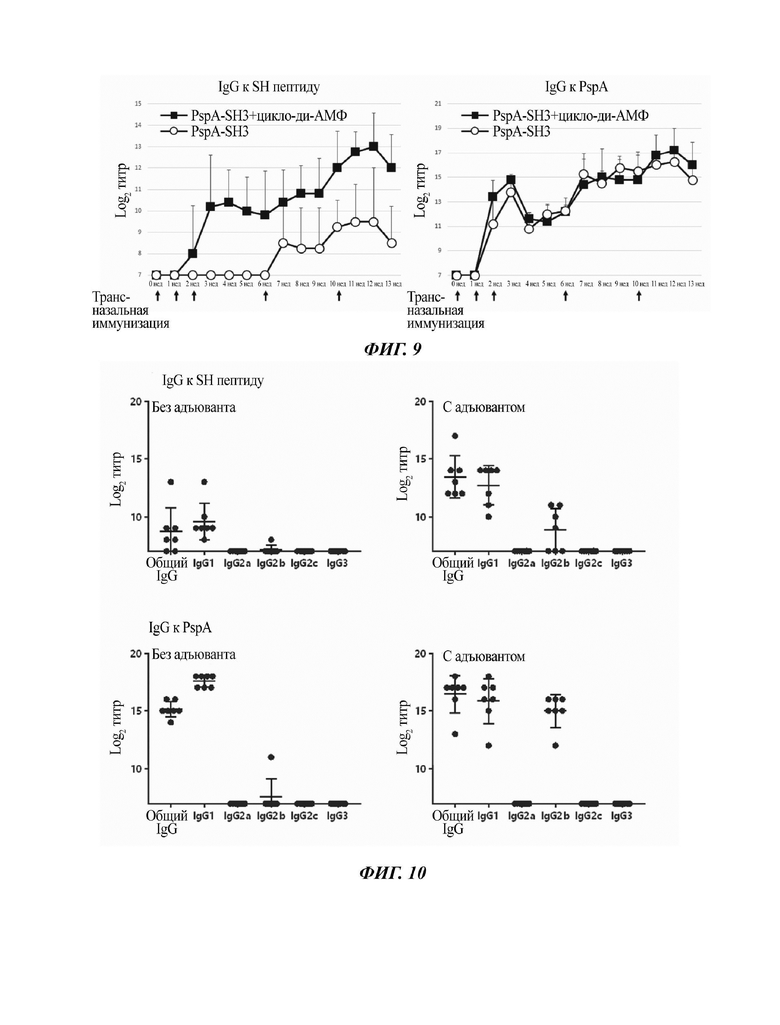
На Фиг. 6 показаны результаты детектирования CTL-клеточного ответа, индуцированного назальной вакциной на основе наногеля против HPV.
На Фиг. 7 показаны результаты детектирования Th1-клеточного ответа, индуцированного назальной вакциной на основе наногеля против HPV.
На Фиг. 8 приведено сравнение между CTL-клеточным ответом (слева) и Тп1-клеточным ответом (справа), индуцированными назальной вакциной на основе наногеля против HPV, в которой в качестве адъювантов использованы лиганды STING трех типов.
На Фиг. 9 показаны результаты детектирования иммунного ответа, индуцированного назальной вакциной на основе наногеля против RSV.
На Фиг. 10 показаны результаты детектирования подклассов IgG, индуцированных назальной вакциной на основе наногеля против RSV.
Описание воплощений
Первое воплощение настоящего изобретения относится к вакцинному препарату, содержащему комплекс наногеля, вакцинного антигена и адъюванта (далее по всему тексту также называемому как "вакцинный препарат по настоящему изобретению").
В настоящем изобретении термин "наногель" используется для обозначения наночастиц полимерного геля, в которых гидрофобный холестерин добавлен в виде боковой цепи к гидрофильному полисахариду (например, пуллулану). Такой наногель может быть получен в соответствии с известным способом, таким как способ, описанный, например, в международной публикации WO 00/12564.
Если говорить предметно, то сначала содержащий гидроксильные группы углеводород, имеющий 12-50 атомов углерода, или стерин приводят во взаимодействие с диизоцианатным соединением, представленным формулой OCN-R1-NCO (где R1 представляет собой углеводородную группу, имеющую 1-50 атомов углерода), с получением гидрофобного соединения, содержащего изоцианатные группы, с которым приводят во взаимодействие одну молекулу содержащего гидроксильные группы углеводорода, имеющего 12-50 атомов углерода, или стерина. Полученное содержащее изоцианатные группы гидрофобное соединение приводят во взаимодействие с полисахаридом с получением несущего гидрофобные группы полисахарида, содержащего углеводородную группу, имеющую 12-50 атомов углерода, или группу стерина. После этого полученный продукт очищают в растворителе на основе кетона, получая содержащий гидрофобные группы полисахарид с высокой степенью чистоты.
В качестве используемого в данной заявке полисахарида могут быть применены пуллулан, амилопектин, амилоза, декстран, гидроксиэтилдекстран, маннан, леван, инулин, хитин, хитозан, ксилоглюкан, водорастворимая целлюлоза и т.д., и особо предпочтительно, пуллулан.
Примеры наногеля, используемого в первом воплощении настоящего изобретения, могут включать катионный несущий холестерильные группы пуллулан (обозначаемый как "сСНР") и его производное. сСНР имеет структуру, в которой от 1 до 10 остатков холестерина, предпочтительно, от одного до нескольких остатков холестерина являются заместителями на 100 моносахаридных остатков в пуллулане, имеющем молекулярную массу от 30000 до 200000, например, имеющем молекулярную массу 100000. Кроме того, сСНР, используемый в настоящем изобретении, при необходимости может быть изменен, в плане количества замещающих остатков холестерина, в зависимости от размера или степени гидрофобное™ антигена. Помимо этого, чтобы изменить степень гидрофобности СНР, к СНР может быть добавлена алкильная группа (имеющая приблизительно 10-30, предпочтительно приблизительно 12-20 атомов углерода). Наногель, используемый в настоящем изобретении, имеет диаметр частиц от 10 до 40 нм и предпочтительно от 20 до 30 нм. Наногели уже широко представлены на рынке, и такие имеющиеся в продаже продукты на основе наногелей также могут быть использованы.
Наногель, используемый в воплощении настоящего изобретения, представляет собой наногель, в который введена функциональная группа, имеющая положительный заряд, такая, как например, аминогруппа, благодаря чему вакцина может внедряться в отрицательно заряженный поверхностный слой слизистой оболочки носовой полости. В качестве способа введения аминогруппы в наногель может быть применен способ, в котором используется холестерин-пуллулан с добавленой аминогруппой (CHPNH2). Конкретно, СНР, высушенный при пониженном давлении, растворяют в диметилсульфоксиде (DMSO) и затем к полученному раствору добавляют в токе газообразного азота 1,1'-карбонилдиимидазол, после чего реакцию проводят при комнатной температуре в течение нескольких часов. После этого к реакционному раствору постепенно добавляют этилендиамин и полученную смесь далее перемешивают в течение периода времени от нескольких часов до нескольких десятков часов. Полученный реакционный раствор диализуют против дистиллированной воды в течение нескольких суток. По завершении диализа реакционный раствор подвергают сублимационной сушке, получая опалесцирующее твердое вещество. Степень замещения этилендиамина можно оценить, применяя элементный анализ, Н-ЯМР (ядерный магнитный резонанс) и так далее.
Вакцинный антиген не ограничен конкретными примерами и может быть выбран произвольно в зависимости от предполагаемого применения вакцинного препарата. В частности, поскольку вакцинный препарат по настоящему изобретению может эффективно индуцировать клеточно-опосредованный иммунитет, то вакцинный препарат по настоящему изобретению в значительной степени подходит для использования в случае активации системы клеточно-опосредованного иммунитета с целью предупреждения или лечения заболеваний и так далее. Если такие заболевания приводятся в качестве примера целенаправленно, то примеры заболеваний могут включать: туберкулез, против которого в случае взрослых нет никаких эффективных вакцин; инфекцию нетипируемой Haemophilus influenzae (NTHi), инфекцию респираторно-синцитиальным вирусом (RSV) или инфекцию вирусом простого герпеса (HSV), против которых нет никаких вакцин; и инфекцию папилломавирусом человека (HPV), для лечения которой, как считается, важна индукция клеточно-опосредованного иммунитета, а также рак шейки матки, развившийся в результате инфицирования HPV.
Антиген для вакцины против туберкулеза не ограничен конкретными примерами. Например, антиген для вакцины против туберкулеза может представлять собой происходящий из Mycobacterium tuberculosis продукт гена Ag85B (Rv1886), продукт гена ESAT6 (Rv3875), продукт гена Rv2660, продукт гена Rv2608, продукт гена Rv3619, продукт гена Rv3620, продукт гена Rv1813, продукт гена МТВ32А (Rv0125), продукт гена МТВ39А (Rv1196), продукт гена МУА85Аили продукт гена Rv0288, целиком или в виде своей части, либо множество слитых белков, выбранных из этих белков (например, химерный белок ESAT6-Rv2660-Rv0288, составленный из генных продуктов).
Антиген для вакцины против нетипируемой Haemophilus influenzae (NTHi) может представлять собой D15, Р1, Р2, Р4, Р5, Р6, Hmw/hia, Нар, белок Е, белок F, белок D, Pil А, NucA, HtrA, ОМР26, РСР, TbpB или LOS, целиком или в виде своей части, либо множество слитых белков, выбранных из этих белков.
Антиген для вакцины против RSV не ограничен конкретными примерами. Например, антиген для вакцины против RSV может представлять собой происходящий из RSV белок F (слитый белок) или SH белок, целиком или в виде своей части, либо множество слитых белков, выбранных из этих белков.
Антиген для вакцины против HSV не ограничен конкретными примерами. Например, антиген для вакцины против HSV может представлять собой происходящий из HSV продукт гена gD, продукт гена дВ, продукт гена дС, продукт гена дЕ, капсидный белок UL19, белок UL47 оболочки или продукт гена gG, целиком или в виде своей части, либо множество слитых белков, выбранных из этих белков.
Антиген для вакцины против HPV не ограничен конкретными примерами. Например, антиген для вакцины против HPV может представлять собой происходящий из HPV продукт гена Е6 и, в частности, продукт гена Е6, содержащий мутацию или делецию в том месте, с которым связываются продукты гена-онкосупрессора Р53, происходящий из HPV продукт гена Е7 и, в частности, продукт гена Е7, содержащий мутацию или делецию в том месте, с которым связываются продукты гена-онкосупрессора Р53. Более конкретно, антиген для вакцины против HPV может представлять собой HPV6 Е7 (с делецией 23-27), HPV11 Е7 (с делецией 23-27), HPV16 Е7 (с мутациями D21G, C24G и E26G), HPV16 Е7 (с делецией 21-24), HPV18 Е7 (с делецией 24-27), HPV31 Е7 (с делецией 22-26), HPV33 Е7 (с делецией 22-26), HPV45 Е7 (с делецией 26-30), HPV52 Е7 (с делецией 22-26) или HPV58 Е7(с делецией 22-26), целиком или в виде своей части, или множество слитых белков, выбранных из этих белков.
Адъювант, используемый в воплощении настоящего изобретения, имеет те же определения, что и определения для агентов, называемых как "средство антигенного усиления", "иммуностимулирующее вещество" и тому подобные. В настоящем изобретении адъювант используют для общего предполагаемого применения этих агентов в рассматриваемой области техники. Активный ингредиент адъюванта, используемого в воплощении настоящего изобретения, не ограничен конкретными примерами. Примеры активного ингредиента адъюванта в настоящем изобретении могут включать лиганды STING, которые активируют STING (стимулятор генов интерферонов) (например, циклические динуклеотиды, такие как цГАМФ, циклический ди-АМФ, циклический ди-ГМФ, циклический ди-ЦМФ, циклический ди-УМФ или циклический ди-ИМФ, и производные ксантона, такие как DMXAA (5,6-диметил-ХАА (ксантон-4-уксусная кислота), вадимезан или ASA404), поли(1:С) (полиинозиновая-полицитидиловая кислота) и CpG-содержащий олигодезоксинуклеотид (ODN). Адъювант по настоящему изобретению может дополнительно содержать фармацевтически приемлемые носители или другие компоненты (например, стабилизаторы, регуляторы рН, консерванты, антисептики, буферные вещества и т.д.). Необходимо, чтобы такие фармацевтически приемлемые носители и другие компоненты представляли собой вещества, не влияющие на здоровье животного, которому вводят вакцину.
Комплекс наногеля, вакцинного антигена и адъюванта (или активного ингредиента адъюванта, как показано ниже) может быть получен посредством обеспечения совместного присутствия наногеля, вакцинного антигена и адъюванта, что позволяет им взаимодействовать друг с другом, и включения антигена и адъюванта в наногель. В настоящее время соотношение наногеля и вакцинного антигена при смешивании и соотношение наногеля и адъюванта при смешивании не ограничено конкретными примерами, и эти соотношения при смешивании может легко определить специалист в данной области техники в соответствии с предварительными экспериментами. Если методические инструкции по таким соотношениям при смешивании приводятся в качестве примера целенаправленно, то соотношение при смешивании вакцинного антигена и наногеля составляет, например, приблизительно 0,1:10, 1:5, 1:2 или 1:1, в виде молярного соотношения. Помимо этого, что касается содержания адъюванта, то адъювант может содержаться в количестве приблизительно от 0,01 мас. % до 99,99 мас. % из расчета от массы вакцины, принятой за 100%. Содержание адъюванта может составлять, например, приблизительно от 0,01 единицы массы до 10 единиц массы по отношению к массе антигена, принятой за 1 единицу массы.
Комплекс наногеля, вакцинного антигена и адъюванта может быть образован путем смешивания наногеля, вакцинного антигена и адъюванта и затем оставления полученной смеси в состоянии покоя при температуре от 4°С до 50°С, например, при 40°С, в течение от 30 минут до 48 часов, например, в течение приблизительно 1 часа. Буфер, используемый для образования комплекса наногеля, вакцинного антигена и адъюванта, не ограничен конкретными примерами, и, если буфер приводится в качестве примера целенаправленно, он может представлять собой, например, буфер на основе трис-HCl.
Если вакцинный препарат по настоящему изобретению используют в виде композиции (вакцинной композиции по настоящему изобретению), то он может содержать фармацевтически приемлемые вспомогательные вещества. Вакцинный препарат по настоящему изобретению подходит для трансназального введения, и лекарственная форма на его основе желательно представляет собой форму, которую можно вводить посредством трансназального введения. Примеры лекарственной формы на основе вакцинного препарата по настоящему изобретению могут включать препараты в жидкой форме (назальные капли, инъекционные формы и т.д.).
Если вакцинный препарат по настоящему изобретению представляет собой препарат в жидкой форме, то при необходимости активный ингредиент может быть растворен в дистиллированной воде для препаратов вместе с регулятором рН, таким как соляная кислота, гидроксид натрия, лактоза, молочная кислота, натрий, моногидрофосфат натрия или дигидрофосфат натрия, и веществом, регулирующим тоничность, таким как хлорид натрия или глюкоза, и полученный раствор может быть подвергнут фильтрованию в асептических условиях и затем полученный раствор может быть внесен в ампулу. В других случаях к полученному раствору могут быть дополнительно добавлены маннит, декстрин, циклодекстрин, желатин или тому подобное, после чего проведена сублимационная сушка в вакууме, чтобы приготовить препарат для экстемпорального растворения. Препарат по настоящему изобретению в жидкой форме может содержать известные фармацевтически приемлемые стабилизаторы, антисептики, антиоксиданты и так далее. Примеры стабилизаторов могут включать желатин, декстран и сорбит. Примеры антисептиков могут включать тимеросал и β-пропиолактон. Примером антиоксидантов может быть α-токоферол.
Второе воплощение настоящего изобретения относится к способу предупреждения и/или лечения заболевания, при этом способ включает трансназальное введение пациенту вакцинного препарата, содержащего комплекс наногеля, вакцинного антигена и адъюванта (согласно первому воплощению).
Целевое заболевание для лечения или предупреждения согласно второму воплощению не ограничено конкретными примерами и зависит от типа используемого вакцинного антигена. Целевое заболевание может включать раковые заболевания (например, рак шейки матки), а также инфекции, вызываемые патогенами (например, туберкулезной палочкой, HSV, RSV и т.д.). Целевое заболевание включает все заболевания, в лечении которых, как ожидается, будет задействован клеточно-опосредованный иммунитет.
Вакцинный препарат по настоящему изобретению можно вводить пациенту через слизистую оболочку носовой полости. Способом введения может быть, например, введение вакцинного препарата в носовую полость путем распыления, нанесения в виде покрытия, закапывания или тому подобного с целью внесения вакцинного препарата на слизистую оболочку носовой полости.
Применяемая доза мукозного вакцинного препарата может быть определена, при необходимости, с учетом возраста, массы тела и тому подобного у целевого субъекта, подлежащего введению. Мукозный вакцинный препарат содержит фармацевтически эффективное количество вакцинного антигена. Фармацевтически эффективное количество означает количество антигена, которое необходимо для индуцирования иммунного ответа на вакцинный антиген. Вакцинный препарат можно вводить целевому субъекту, например, в однократно применяемой дозе из расчета на вакцинный антиген, составляющей от нескольких мкг до нескольких десятков мг; от одного до нескольких раз в сутки, с интервалами от одной до нескольких недель, в общей сложности несколько раз, например, 1-5 раз.
Описания всех публикаций, процитированных в настоящем изобретении, включены в данный документ посредством ссылки во всей своей полноте. Кроме того, в целом по всему описанию настоящего изобретения, если используют термины в единственном числе (в английском варианте выражаемые артиклем "a", "an" и "the"), то эти термины включают в себя не только единичные элементы, но также и несколько элементов, если иное явно не конкретизируется из контекста.
В дальнейшем настоящее изобретение будет описано в следующих примерах. Однако эти примеры являются только иллюстративными примерами вариантов осуществления настоящего изобретения и, таким образом, не предназначены для ограничения объема настоящего изобретения.
Примеры Методы
1. Вакцина против Mycobacterium tuberculosis 1-1. Получение белка-антигена
Ген Ag85 В (987 пар оснований (п.о.)), происходящий из Mycobacterium tuberculosis (АТСС (Американская коллекция типовых культур), 25618) (SEQ ID NO: 1), искусственно синтезировали и затем встраивали по сайтам EcoRI-Hinlll (Takara Bio, Inc.) в вектор рЕТ-20b(+) (Novagen), содержащий генетическую последовательность для гистидиновой метки (His-tag). Полученный экспрессирующий вектор использовали для трансформации Rosetta2 (DE3) pLysS-Escherichia coli согласно общепринятому методу. Полученный трансформант культивировали в среде, содержащей ампициллин (100 мкг/мл) и хлорамфеникол (34 мкг/мл), при 37°С до тех пор, пока значение оптической плотности при длине волны 600 нм (OD600 нм) не достигало 0,5-0,8. После этого к культуре добавляли 1,0 мМ изопропил-|3-0-1-тиогалактопиранозид (Wako Pure Chemical Industries, Ltd.) и полученную смесь далее культивировали в течение 4 часов. Затем культивируемые клетки Escherichia coli извлекали посредством центрифугирования (5000 об./мин, 15 минут). Извлеченные клетки Escherichia coli промывали раствором, содержащим 10 мМ имидазол и раствор ингибиторов протеаз (Roche Diagnostics), и после этого белок экстрагировали, используя буфер для адсорбции, содержащий 20 мМ трис-HCl, 500 мМ NaCl, 10 мМ имидазол и 6 М мочевину. Фракцию экстрагированного белка загружали на заряженную ионами никеля колонку для аффинной хроматографии (GE Healthcare Bio-Sciences) и затем промывали буфером для адсорбции до тех пор, пока значение OD280 „м не достигало значения 0,01 или меньше. После этого белок элюировали, используя раствор, содержащий 20 мМ трис-HCl, 500 мМ NaCl, 500 мМ имидазол и 6 М мочевину. Далее элюат концентрировали на аппарате Amicon и затем подвергали гель-фильтрации, используя колонку с Сефакрилом S-100 (GE Healthcare Bio-Sciences), уравновешенную 6 М мочевиной в забуференном фосфатом физиологическом растворе (PBS). Далее выделяли Ag85 В-содержащую фракцию и затем постадийно диализовали против 4 М мочевины в PBS, 2 М мочевины в PBS, 1 М мочевины в PBS и PBS, чтобы получить нативный Ag85 В. Из 12 л культуры Escherichia coli извлекали 50 мг Ag85 В (SEQ ID NO: 2), и его чистота составила 95% по данным электрофореза в полиакриламидном геле в присутствии додецилсульфата натрия (SDS-PAGE).
1-2. Формирование наногеля, содержащего антиген (приготовление вакцины) сСНР наногель готовили согласно способу, приведенному в предыдущей публикации (непатентная литература 2).
Приготовленный сСНР наногель и очищенный белок Ag85 В смешивали друг с другом в молекулярном соотношении 1:1 и помимо этого к смеси в качестве адъювантов добавляли каждый из трех типов лигандов STING (циклический ди-ГМФ, циклический ди-АМФ и цГАМФ), затем проводили инкубацию в течение 1 часа, используя термоблок при 40°С.
С другой стороны, сСНР наногель и очищеный химерный белок (ESAT6-Rv2660c-Rv0288) (с аминокислотной последовательностью: SEQ ID NO: 8; и нуклеиновокислотной последовательностью: SEQ ID NO: 9) смешивали друг с другом в молекулярном соотношении 1:1 и помимо этого к смеси в качестве мукозного адъюванта добавляли лиганд STING (циклический ди-АМФ), затем проводили инкубацию в течение 1 часа, используя термоблок при 40°С.
1-3. Трансназальная иммунизация мышей
Раствор смеси сСНР-Ag85 В плюс лиганд STING вводили трансназально самкам мышей Balb/c в возрасте 7 недель. Что касается разовой дозы антигена, вводимой из расчета на одну мышь, то каждой мыши вводили по 10 мкг антигена в пересчете на количество белка Ag85 В. С другой стороны, получали лиганд STING и затем вводили в количестве от 1 мкг до 10 мкг на одну мышь. Такую трансназальную иммунизацию осуществляли в общей сложности три раза с интервалами в 1 неделю.
Одновременно с этим самкам мышей Balb/c в возрасте 7 недель трансназально вводили раствор, содержащий сСНР-химерный белок плюс лиганд STING. Что касается разовой дозы антигена, вводимой из расчета на одну мышь, то каждой мыши вводили по 10 мкг антигена в пересчете на количество химерного белка. С другой стороны, получали лиганд STING и затем вводили в количестве от 1 мкг до 10 мкг на одну мышь. Такую трансназальную иммунизацию осуществляли в общей сложности три раза с интервалами в 1 неделю.
1-4. Очистка и подсчет антиген-специфичных Т-клеток (1)
Антиген Ag85 В
Через две недели после заключительной вакцинации выполняли подсчет антиген-специфичных Th1-клеток (IFNγ-продуцирующих клеток) или ТМ7-клеток (IL-17-продуцирующих клеток) в соответствии с методом иммуноферментных пятен (ELISPOT). Системный иммунный ответ оценивали, используя селезенку, в то время как иммунный ответ на поверхности слизистой оболочки оценивали, используя антиген-специфичные Т-клетки, генерируемые в легочных тканях.
Мышей подвергали эвтаназии. У мышей вырезали легкие и селезенку и затем готовили клеточные суспензии. Из приготовленных клеточных суспензий очищали CD4-положительные Т-клетки, используя систему сортировки магнитно-активированных клеток (MACS) (Miltenyi Biotec). С другой стороны, из селезенки неиммунизированных мышей очищали СО90.2-отрицательные клетки аналогичным описанному выше образом и очищенные клетки использовали в качестве антигенпрезентирующих клеток. CD4-положительные Т-клетки и антигенпрезентирующие клетки, облученные гамма-лучами, совместно культивировали при стимуляции очищенным антигеном Ag85 В в течение от 48 до 72 часов. При такой процедуре культивирования антитело к I FN у или антитело к IL-17 предварительно адсорбировали в качестве захватывающего антитела на дне лунок планшета для культивирования.
Затем культуральные супернатанты и клетки удаляли и после этого лунки промывали. В лунки добавляли меченное биотином антитело к IFNγ или антитело к IL-17 и затем проводили взаимодействие при комнатной температуре в течение 2 часов. Вслед за этим лунки промывали, затем проводили взаимодействие с конъюгированной со стрептавидином пероксидазой хрена (HRP) с последующей промывкой. Далее в лунки для развития окраски добавляли 3-амино-9-этилкарбазол (АЕС), который является субстратом HRP, и затем выполняли детектирование антиген-специфичных Th1-клеток или Тп17-клеток в виде пятен. Количество пятен подсчитывали, используя счетчик для ELISpot.
(2) Химерный антиген ESAT6-Rv2660c-Rv0288
Через две недели после заключительного введения выполняли подсчет антиген-специфичных Th1-клеток (IFNY-продуцирующих клеток) в соответствии с методом ELISPOT. Системный иммунный ответ оценивали, используя селезенку, то время как иммунный ответ на поверхности слизистой оболочки оценивали, используя антиген-специфичные Т-клетки, генерируемые в легочных тканях.
Мышей подвергали эвтаназии. У мышей вырезали легкие и селезенку и затем готовили клеточные суспензии. Из приготовленных клеточных суспензий очищали CD4-положительные Т-клетки, используя магнитные гранулы. С другой стороны, из селезенки неиммунизированных мышей очищали СО90.2-отрицательные клетки аналогичным описанному выше образом и очищенные клетки использовали в качестве антигенпрезентирующих клеток. С04-положительные Т-клетки и антигенпрезентирующие клетки, облученные гамма-лучами, совместно культивировали при стимуляции очищенным химерным антигеном или рекомбинантным ESAT6 (Abeam) в течение от 48 до 72 часов. Антитело к IFNγ адсорбировали в качестве захватывающего на дне лунок планшета для культивирования и детектировали продуцирующие его клетки.
Культуральные супернатанты удаляли, после этого лунки промывали и оставшееся в них содержимое затем приводили во взаимодействие с меченным биотином антителом к I FN у- Лунки промывали еще раз, затем проводили взаимодействие с конъюгированной со стрептавидином HRP с последующей промывкой. Далее в лунки для развития окраски добавляли 3-амино-9-этилкарбазол (АЕС), который является субстратом HRP, и затем выполняли детектирование антиген-специфичных Th1-клеток или Т1 л17-клеток в виде пятен. Количество пятен подсчитывали, используя счетчик для ELISpot.
1-5. Исследования, касающиеся защитных иммунных эффектов
(1) Вакцинация мышей
Что касается мышей, то использовали самок мышей Balb/c в возрасте 7 недель. Вакцину БЦЖ, используемую в качестве положительного контроля, суспендировали в PBS растворе и ее один раз подкожно вводили мышам в момент начальной иммунизации. Что касается разовой дозы раствора смеси сСНР-Ag85 В плюс циклический ди-ГМФ, вводимой из расчета на одну мышь, то каждой мыши трансназально вводили 10 мкг белка Ag85 В в общей сложности три раза с интервалами в 1 неделю. Неиммунизированным контрольным мышам вводили PBS трансназально три раза каждые две недели, а в момент начальной иммунизации вводили PBS подкожно один раз.
(2) Синусно-пульмональная инфекция вирулентным штаммом Mycobacterium tuberculosis
Через восемь недель после заключительной вакцинации мышей инфицировали вирулентным штаммом Mycobacterium tuberculosis Erdman посредством синусно-пульмональной инфекции в дозе 100 колониеобразующих единиц (КОЕ) на одну мышь.
(3) Подсчет количества Mycobacterium tuberculosis в тканях селезенки и легкого
Через двенадцать недель после инфицирования мышей подвергали эвтаназии и затем извлекали легкие и селезенку. Ткани измельчали, суспендировали в PBS и готовили шесть серий разведений. Каждую из приготовленных серий разведений рассевали на агаризованную среду. Культивирование проводили в течение 4 недель в анаэробных условиях, затем подсчитывали число колоний и после этого рассчитывали количество Mycobacterium tuberculosis в отдельных тканях.
2. Приготовление вакцины против HPV
2-1. Получение белка-антигена
Ген белка Е7 вируса HPV16 с 3 аминокислотными мутациями D21G, C24G и E26G в продуктах гена-онкосупрессора (Van der Burg SH et.al. Vaccine, 19: 3652-3660, 2001) (307 n.o.) (SEQ ID NO: 3) искусственно синтезировали и затем встраивали по сайтам EcoRI-Hinlll (Takara Bio, Inc.) в вектор pET-20b(+) (Novagen), содержащий генетическую последовательность для His-tag. Полученный экспрессирующий вектор использовали для трансформации Rosetta2 (DE3) pLysS-Escherichia coli согласно общепринятому методу. Полученный трансформант культивировали в среде, содержащей ампициллин (100 мкг/мл) и хлорамфеникол (34 мкг/мл), при 37°С до тех пор, пока значение OD600 нм не достигало 0,5-0,8. После этого к культуре добавляли 1,0 мМ изопропил-β-D-1-тиогалактопиранозид (Wako Pure Chemical Industries, Ltd.) и полученную смесь далее культивировали в течение 4 часов. Затем культивируемые клетки Escherichia coli извлекали посредством центрифугирования (5000 об./мин, 15 минут). Извлеченные клетки Escherichia coli промывали раствором, содержащим 10 мМ имидазол и ингибитор протеаз (Roche Diagnostics), и после этого белок экстрагировали, используя буфер для адсорбции, содержащий 20 мМ трис-HCl, 500 мМ NaCl, 10 мМ имидазол и 6 М мочевину. Фракцию экстрагированного белка загружали на заряженную ионами никеля колонку для аффинной хроматографии (GE Healthcare Bio-Sciences) и затем промывали буфером для адсорбции до тех пор, пока значение OD2so нм не достигало значения 0,01 или меньше. После этого белок элюировали, используя раствор, содержащий 20 мМ трис-HCl, 500 мМ NaCl, 500 мМ имидазол и 6 М мочевину. Далее элюат диализовали против 6 М мочевины в PBS (0,15 М NaCl) и затем адсорбировали на колонке с ОЕАЕ(диэтиламиноэтил)-сефарозой (GE Healthcare Bio-Sciences), уравновешенной тем же буфером, который описан выше, и после этого элюировали раствором, содержащим 0,5 М NaCl и 6 М мочевину в PBS. Полученный элюат концентрировали на аппарате Amicon и затем подвергали гель-фильтрации, используя колонку с Сефакрилом S-100 (GE Healthcare Bio-Sciences), уравновешенную 6 М мочевиной в PBS. Далее выделяли фракцию, содержащую мутантный Е7, и затем постадийно диализовали против 4 М мочевины в PBS, 2 М мочевины в PBS, 1 М мочевины в PBS и PBS, чтобы получить нативную форму мутантного Е7 (SEQ ID NO: 4). Соответственно, из 12 л культуры Escherichia coli извлекали 60 мг мутантного Е7, и его чистота составила 95% по данным SDS-PAGE.
2-2. Формирование наногеля, содержащего антиген (приготовление вакцины) сСНР наногель готовили согласно способу, приведенному в предыдущей публикации (непатентная литература 2).
Приготовленный сСНР наногель и очищенный мутантный Е7 белок смешивали друг с другом в молекулярном соотношении 1:1 и помимо этого к смеси в качестве каждого из адъювантов добавляли только циклический ди-АМФ, три типа лигандов STING (циклический ди-ГМФ, циклический ди-АМФ и цГАМФ), поли(1:С) или CpG-содержащий ODN типа K3 или типа D35, затем проводили инкубацию в течение 1 часа, используя термоблок при 40°С.
2-3. Трансназальная иммунизация мышей
Раствор смеси сСНР-мутантный Е7 плюс каждый из мукозных адъювантов вводили трансназально самкам мышей Balb/c в возрасте 7 недель. Что касается разовой дозы антигена, вводимой из расчета на одну мышь, то каждой мыши вводили по 10 мкг антигена в пересчете на количество мутантного белка Е7. С другой стороны, каждый из мукозных адъювантов вводили в разовой дозе 5 мкг или 10 мкг на каждую мышь. Такую трансназальную иммунизацию осуществляли в общей сложности три раза с интервалами в 1 неделю.
2-4. Очистка и подсчет антиген-специфичных Т-клеток (1) В случае использования циклического ди-АМФ в качестве адъюванта Через одну неделю после заключительной вакцинации выполняли подсчет антиген-специфичных CTL-клеток (гранзим В-продуцирующих клеток) или Th1-клеток (IFNγ-продуцирующих клеток) в соответствии с методом ELISPOT. Системный иммунный ответ оценивали, используя селезенку, в то время как иммунный ответ в слизистых оболочках половых органов оценивали, используя антиген-специфичные Т-клетки, индуцируемые в шейке матки.
Мышей подвергали эвтаназии. У мышей вырезали селезенку и шейку матки и затем готовили клеточные суспензии. Из приготовленных клеточных суспензий очищали Т-клетки (СО90.2-положительные), используя систему MACS (Miltenyi Biotec). С другой стороны, из селезенки неиммунизированных мышей очищали СО90.2-отрицательные клетки аналогичным описанному выше образом и очищенные клетки использовали в качестве антигенпрезентирующих клеток. Очищенные Т-клетки и антигенпрезентирующие клетки, облученные гамма-лучами, совместно культивировали при стимуляции очищенным мутантным Е7 антигеном в течение от 48 до 72 часов. При такой процедуре культивирования антитело к гранзиму В или антитело к IFNγ предварительно адсорбировали в качестве захватывающего антитела на дне лунок планшета для культивирования.
Затем культуральные супернатанты и клетки удаляли и после этого лунки промывали. В лунки добавляли меченное биотином антитело к гранзиму В или антитело к I FN у и затем проводили взаимодействие при комнатной температуре в течение 2 часов. Вслед за этим лунки промывали, затем проводили взаимодействие с конъюгированной со стрептавидином HRP с последующей промывкой. Далее в лунки для развития окраски добавляли 3-амино-9-этилкарбазол (АЕС), который является субстратом HRP, и затем выполняли детектирование антиген-специфичных CTL-клеток или Th1-клеток в виде пятен. Количество пятен подсчитывали, используя счетчик для ELISpot.
(2) В случае использования лигандов STING трех типов (циклического ди-ГМФ, циклического ди-АМФ и цГАМФ) в качестве адъювантов
Через одну неделю после заключительной вакцинации выполняли подсчет антиген-специфичных Th1-клеток (IFNY-продуцирующих клеток) и CTL-клеток (гранзим В-продуцирующих клеток) в шейке матки в соответствии с методом ELISPOT. Мышей подвергали эвтаназии. У мышей вырезали шейку матки и затем готовили клеточные суспензии. После этого, используя магнитные гранулы, из клеточных суспензий очищали Т-клетки (СО90.2-положительные). С другой стороны, из селезенки неиммунизированных мышей очищали СО90.2-отрицательные клетки аналогичным описанному выше образом и очищенные клетки использовали в качестве антигенпрезентирующих клеток. Очищенные Т-клетки и антигенпрезентирующие клетки, облученные гамма-лучами, совместно культивировали при стимуляции очищенным мутантным Е7 антигеном в течение от 48 до 72 часов. Антитело к I FN у или антитело к гранзиму В добавляли в качестве захватывающего антитела на дно лунок планшета для культивирования и детектировали продуцирующие его клетки.
Затем культуральные супернатанты удаляли и после этого лунки промывали. В лунки добавляли меченное биотином антитело к IFNγ или антитело к гранзиму В и приводили во взаимодействие с оставшимся в них содержимым. Лунки промывали еще раз и затем проводили взаимодействие с конъюгированной со стрептавидином HRP с последующей промывкой. Далее в лунки для развития окраски добавляли АЕС, который является субстратом HRP, и затем выполняли детектирование антиген-специфичных CTL-клеток или Th1-клеток в виде пятен. Количество пятен подсчитывали, используя счетчик для ELISpot.
3. Приготовление вакцины против RSV
3-1. Получение белка-антигена
Искусственно синтезировали последовательность ДНК (1172 п. о.), в которой три PspA, были несколько раз добавлены к SH пептиду (SEQ ID NO: 5) вируса RSV через линкеры (GGGGS) (SEQ ID NO: 7), и затем, используя ферменты рестрикции EcoRV и Notl (Takara Bio, Inc.), последовательность ДНК встраивали в вектор pET-20b(+) (Novagen), содержащий генетическую последовательность для His-tag. Эту плазмиду использовали для трансформации Rosetta2 (DE3) pLysS-Escherichia coli согласно общепринятому методу. Полученные клетки Escherichia coli культивировали в среде, содержащей ампициллин (100 мкг/мл) и хлорамфеникол (34 мкг/мл), при 37°С до тех пор, пока значение OD600 нм не достигало 0,5-0,8. После этого к культуре добавляли 1,0 мМ изопропил-(3-0-1-тиогалактопиранозид (Wako Pure Chemical Industries, Ltd.) и полученную смесь далее культивировали в течение 4 часов. Затем полученные клетки Escherichia coli извлекали посредством центрифугирования (5000 об./мин, 15 минут). Извлеченные клетки Escherichia coli промывали раствором, содержащим 20 мМ имидазол и раствор ингибиторов протеаз (Roche Diagnostics), и после этого белок экстрагировали, используя буфер для адсорбции, содержащий 20 мМ трис-HCl, 500 мМ NaCl и 10 мМ имидазол. К экстракту добавляли насыщенный раствор сульфата аммония, чтобы насыщение составляло 80%, и после этого происходило осаждение сульфатом аммония. Осадок извлекали посредством центрифугирования и затем диализовали, используя в качестве внешней жидкости тот же самый буфер, который использовали при экстрагировании. Жидкость, полученную по завершении диализа, загружали на заряженную ионами никеля колонку для аффинной хроматографии (GE Healthcare Bio-Sciences) и затем промывали буфером для адсорбции до тех пор, пока значение OD28oHm не достигало значения 0,01 или меньше, после этого элюировали раствором, содержащим 20 мМ трис-HCl, 500 мМ NaCl и 500 мМ имидазол. Элюат концентрировали на аппарате Amicon и затем подвергали гель-фильтрации, используя колонку с Сефадексом G-100 (GE Healthcare Bio-Sciences), уравновешенную PBS. Далее выделяли фракцию, содержащую PspA-SH3, и затем концентрировали и очищали. Соответственно, из 20 л культуры Escherichia coli извлекали 70 мг PspA-SH3, и его чистота составила 95% по данным SDS-PAGE.
3-2. Формирование наногеля, содержащего антиген (приготовление вакцины) сСНР наногель и очищенный белок PspA-SH3 (SEQ ID NO:6) смешивали друг с другом в молекулярном соотношении 1:1 и помимо этого к смеси в качестве мукозного адъюванта добавляли циклический ди-АМФ, затем проводили инкубацию в течение 1 часа, используя термоблок при 40°С.
3-3. Трансназальная иммунизация мышей
Раствор смеси cCHP-PspA-SH3 плюс циклический ди-АМФ вводили трансназально самкам мышей Balb/c в возрасте 7 недель. Что касается разовой дозы антигена, вводимой из расчета на одну мышь, то каждой мыши вводили по 10 мкг антигена в пересчете на количество белка PspA-SH3. Кроме этого, вводили циклический ди-АМФ в дозе 10 мкг на каждую мышь. Такую трансназальную иммунизацию осуществляли в общей сложности пять раз, а именно, три раза с интервалами в 1 неделю, затем один раз после интервала в 4 недели и потом один раз после интервала в 4 недели.
3-4. Измерение титра антител
Каждую неделю из подчелюстной вены отбирали приблизительно 100 мкл крови и затем центрифугировали при 15000 об./мин при 4°С для извлечения сыворотки крови.
Измерение титра антитела IgG-типа в PspA- или SH-специфичной сыворотке крови и определение подклассов IgG проводили методом ELISA (иммуноферментный твердофазный анализ). За одни сутки до проведения ELISA конъюгат PspA или BSA (бычий сывороточный альбумин) с SH разбавляли PBS до концентрации 1 мкг/мл и затем по 100 мкл каждого из полученных растворов добавляли в качестве захватывающего вещества в лунки 96-луночного планшета (Thermo Scientific, 3355), после чего проводили инкубирование при 4°С в течение ночи. Применяя устройство для промывки планшетов, планшет промывали четыре раза по 300 мкл PBS, содержащего 0,05% твина (PBS-T) (Nacalai Tesque, 28353-85), и затем в планшет добавляли PBS-T, содержащий 1% BSA (Nacalai Tesque, 01863-48), в количестве 200 мкл/лунка. Инкубирование проводили при комнатной температуре в течение 1 часа и содержимое лунок блокировали. После этого, используя устройство для промывки планшетов, планшет промывали три раза по 300 мкл PBS-T. Каждый образец, разбавленный в 28 раза PBS-T, содержащим 1% BSA, добавляли в лунки на одном краю планшета и затем проводили двукратное серийное разведение в направлении другого края планшета, чтобы получить ряд серийных разведений. Затем проводили инкубирование при комнатной температуре в течение 2 часов. В качестве холостой пробы использовали PBS-T, содержащий 1% BSA. По завершении инкубирования планшет промывали четыре раза по 300 мкл PBS-T, используя устройство для промывки планшетов. Далее в планшет добавляли разбавленные в 4000 раз PBS-T, содержащим 1% BSA, антитела козы к каждому из 6 типов антител: IgG, IgG1, IgG2a, IgG2b, IgG2c и IgG3 человека (Southern Biotech) в количестве 100 мкл/лунка и затем проводили инкубирование при комнатной температуре в течение 1,5 часа. После этого планшет промывали четыре раза по 300 мкл PBS-T, используя устройство для промывки планшетов. Субстрат тетраметилбензидин (ТМВ), смешанный с раствором для ТМВ (Seracare, 5120-0050) в равных количествах, добавляли в планшет в количестве 100 мкл/лунка и затем проводили реакцию развития окраски в течение 30 минут. После этого в реакционную смесь добавляли 50 мкл 2 н. раствора H2S04 (Nacalai Tesque, 32520-55) для остановки реакции. Значение OD450 измеряли, используя планшетный ридер и затем рассчитывали величину титра в log2. Значение порога отсечения устанавливали равным среднему значению в лунке с холостой пробой плюс 0,1.
Результаты
1. Вакцина против Mycobacterium tuberculosis (1) Антиген Ag85B
По сравнению со случаем добавления смеси, состоящей из 10 мкг олигодезоксинуклеотидов CpGK3, которые, как известно, проявляют адъювантную активность, и 1 мкг цГАМФ в качестве одного из типов лиганда STING, такой же уровень индуцирования антиген-специфичного опосредованного Th1 клетками иммунитета наблюдали в результате добавления 10 мкг циклического ди-ГМФ (Фиг. 1). Когда сравнение проводили в плане использования только одного лиганда STING (цАМФ, ГМФ или цГАМФ), относительно эффективным оказался циклический ди-АМФ (цАМФ).
После этого исследовали эффект индуцирования Th1-клеток и ТМ7-клеток посредством использования лиганда STING в качестве адъюванта. В качестве лиганда STING использовали циклический ди-ГМФ. В случае использования мышей, которым был введен вакцинный антиген, не содержащий циклического ди-ГМФ, оказалось, что практически не индуцировались антиген-специфичные клетки ни Th1-типа, ни Th17-типа (Фиг. 2 и Фиг. 3, "сСНР-Ag85 В"). Кроме того, даже в случае, когда не происходило стимулирования антигеном антигенпрезентирующих клеток, никакие Т-клетки практически не индуцировались. С другой стороны, для легких и селезенки было обнаружено, что происходило значительное индуцирование антиген-специфичных Th1-клеток и ТМ7-клеток в результате трансназального введения сСНР-Ag85 В плюс циклический ди-ГМФ и что наблюдалось эффективное индуцирование как системного иммунного ответа, так и мукозного иммунного ответа (Фиг. 2 и Фиг. 3).
Мышам вводили назальную вакцину на основе наногеля по настоящему изобретению, содержащую лиганд STING в качестве адъюванта. В этом случае изучали влияние назальной вакцины на основе наногеля по настоящему изобретению на степень выживаемости и пролиферацию Mycobacterium tuberculosis при использовании вакцины БЦЖ в качестве положительного контроля. За период времени 12 недель от момента инфицирования наблюдали несколько случаев смерти. Учитывая число случаев смерти, рассчитывали степень выживаемости. В результате, по сравнению со степенью выживаемости неиммунизированных мышей (отрицательный контроль), которая составляла 56%, и степенью выживаемости в группе, получавшей вакцину БЦЖ (положительный контроль), которая составляла 67%, получавшая наногель группа (с введением сСНР-Ag85 В плюс циклический ди-ГМФ) имела степень выживаемости 89% и, таким образом, демонстрировала устойчивость к инфекции (Фиг. 4А). Более того, что касается числа Mycobacterium tuberculosis в селезенке, то пролиферация Mycobacterium tuberculosis оказалась значительно подавленной в равной мере и в группе, получавшей БЦЖ, и в группе, получавшей вакцину на основе наногеля, по сравнению с неиммунизированными мышами. Такую же тенденцию наблюдали также и в случае с легкими (Фиг. 4В).
(2) Химерный антиген ESAT6-Rv2660c-Rv0288
Было обнаружено, что в результате трансназального введения сСНР-химерный антиген плюс циклический ди-АМФ происходило индуцирование антиген-специфичных Th1-клеток в селезенке и шейке матки (Фиг. 5). С другой стороны, такие антиген-специфичные Th1-клетки не индуцировались ни в каком-либо из органов в результате введения сСНР, содержащего только химерный антиген. В соответствии с этим был сделан вывод что для индуцирования Th1-клеток необходим циклический ди-АМФ.
2. Вакцина против HPV
(1) В случае использования циклического ди-АМФ в качестве адъюванта Используя в качестве антигена мутантный Е7 белок HPV, готовили назальную вакцину на основе наногеля по настоящему изобретению и исследовали влияние этой вакцины на индуцирование Т-клетоки тому подобное.
Было обнаружено, что в результате трансназального введения сСНР-мутантный Е7 плюс циклический ди-АМФ в селезенке и шейке матки индуцировались антиген-специфичные CTL-клетки (Фиг. 6). Кроме того, также было обнаружено, что в результате трансназального введения cCHP-мутантный Е7 плюс циклический ди-АМФ в селезенке и шейке матки индуцировались антиген-специфичные Th1-клетки (Фиг. 7).
(2) В случае использования лигандов STING трех типов (циклического ди-ГМФ, циклического ди-АМФ и цГАМФ) в качестве адъювантов
Было обнаружено, что в результате использования мукозного адъюванта в комбинации с сСНР, содержащим в качестве антигена мутантный Е7 белок, и особенно в результате трансназальной иммунизации при сочетании с лигандами STING трех типов в шейке матки происходило индуцирование антиген-специфичных Th1-клеток (Фиг. 8, справа) и CTL (Фиг. 8, слева). В случае индуцирования Th1-клеток не было обнаружено большой разницы среди лигандов STING. В случае CTL наблюдали сильное индуцирование CTL при использовании циклического ди-АМФ.
3. Вакцина против RSV
Было обнаружено, что количество как антител к SH-пептиду, так и антител к PspA в качестве белка-носителя со временем возрастает в зависимости от числа трансназальных иммунизаций (Фиг. 9). Более того, что касается, SH-пептид-специфичного иммунного ответа, то индуцирование IgG в более значительной степени наблюдали в группе с добавлением циклического ди-АМФ (Фиг. 9, слева). Однако, даже в группе, которой вводили только cCHP-PspA-SH3 без циклического ди-АМФ, наблюдали зависимость индуцирования специфичного антитела от числа иммунизаций.
Что касается подклассов IgG, то в случаях как антител к SH-пептиду, так и антител к PspA, без использования циклического ди-АМФ в качестве адъюванта индуцировался предпочтительно IgG1, а при использовании адъюванта индуцировались предпочтительно IgG1 и IgG2b (Фиг. 10).
Как описано выше, если в состав вакцины на основе наногеля включали адъювант (который в рассматриваемом примере представляет собой лиганд STING) и затем эту вакцину вводили, то наблюдали индуцирование Т-кпеток, характерных для клеточно-опосредованного иммунитета, таких как Th1-клетки или CTL-клетки. Более того, стало ясно, что не только системный иммунитет, но также и мукозный иммунитет в тканях слизистой оболочки, относящейся к половым органам, а также в тканях слизистой оболочки верхних и нижних дыхательных путей индуцировался в результате введения вакцины.
Промышленная применимость
Поскольку назальная вакцина на основе наногеля по настоящему изобретению способна индуцировать клеточно-опосредованный иммунитет, то ожидается, что назальная вакцина на основе наногеля по настоящему изобретению будет применена в области медицины, как например, в клеточно-обусловленной иммунотерапии.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИИ, ВЫЗЫВАЮЩИЕ СПЕЦИФИЧЕСКИЙ ОТВЕТ ЦИТОТОКСИЧЕСКИХ Т-ЛИМФОЦИТОВ, ВКЛЮЧАЮЩИЕ ЛИМФО-АБЛАТИВНОЕ СОЕДИНЕНИЕ И МОЛЕКУЛУ, СОДЕРЖАЩУЮ АНТИГЕННЫЕ ПОСЛЕДОВАТЕЛЬНОСТИ И НАЦЕЛЕННУЮ НА СПЕЦИАЛИЗИРОВАННЫЕ АНТИГЕН-ПРЕЗЕНТИРУЮЩИЕ КЛЕТКИ | 2007 |
|
RU2448729C2 |
| СПОСОБ ПОЛУЧЕНИЯ ИММУНОГЕННОЙ КОМПОЗИЦИИ НА ОСНОВЕ ГИБРИДНОГО БЕЛКА Ag85A-DBD И ДЕКСТРАНА, РЕКОМБИНАНТНАЯ ПЛАЗМИДА pAg85A-DBD, ШТАММ Escherichia coli [pREP4, pAg85A-DBD], ХИМЕРНЫЙ БЕЛОК Ag85A-DBD | 2013 |
|
RU2520078C1 |
| ПРОФИЛАКТИЧЕСКАЯ ВАКЦИНА ОТ ТУБЕРКУЛЕЗА | 2007 |
|
RU2526910C2 |
| ПОЛИАНТИГЕННАЯ ВАКЦИНА ДЛЯ ПРОФИЛАКТИКИ И ВСПОМОГАТЕЛЬНОГО ЛЕЧЕНИЯ ТУБЕРКУЛЕЗА | 2019 |
|
RU2724896C1 |
| СРЕДСТВА И СПОСОБЫ ЛЕЧЕНИЯ ВИРУСА ГЕПАТИТА B | 2017 |
|
RU2740802C2 |
| СПОСОБ ПОЛУЧЕНИЯ ИММУНОГЕННОЙ КОМПОЗИЦИИ НА ОСНОВЕ ГИБРИДНОГО БЕЛКА pESAT6-DBD И ДЕКСТРАНА, РЕКОМБИНАНТНАЯ ПЛАЗМИДА pESAT6-DBD, ШТАММ Escherichia coli, ХИМЕРНЫЙ БЕЛОК ESAT6-DBD И ИХ ПРИМЕНЕНИЕ | 2013 |
|
RU2520737C1 |
| КОМПОЗИЦИЯ ДЛЯ СТИМУЛИРОВАНИЯ СОЗРЕВАНИЯ ДЕНДРИТНЫХ КЛЕТОК, СОДЕРЖАЩАЯ ГИБРИДНЫЙ БЕЛОК Rv2299c/ESAT-6 | 2017 |
|
RU2733886C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ЛЕЧЕНИЯ АКТИВНОЙ ИНФЕКЦИИ MYCOBACTERIUM TUBERCULOSIS | 2013 |
|
RU2659149C2 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДА pESAT6-CFP10-DBD, РЕКОМБИНАНТНЫЙ ШТАММ Escherichia coli M15 [pREP4, pESAT6-CFP10-DBD], СПОСОБ ПОЛУЧЕНИЯ, ИММОБИЛИЗАЦИИ, КОНЦЕНТРИРОВАНИЯ И ОЧИСТКИ РЕКОМБИНАНТНОГО БЕЛКА ESAT6-CFP10-DBD НА ДЕКСТРАНЕ, РЕКОМБИНАНТНЫЙ БЕЛОК ESAT6-CFP10-DBD И ИММУНОГЕННАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ БЕЛОК ESAT6-CFP10-DBD | 2013 |
|
RU2539026C1 |
| ЛИПОСОМНЫЙ ПРЕПАРАТ, ПРЕДНАЗНАЧЕННЫЙ ДЛЯ ЛЕЧЕНИЯ ИЛИ ПРЕДУПРЕЖДЕНИЯ ТУБЕРКУЛЕЗА | 2012 |
|
RU2648842C2 |

Изобретение относится к иммунологии. Описан вакцинный препарат для индукции клеточно-опосредованного иммунитета, содержащий комплекс cCHP вакцинного антигена и адъюванта, содержащего цГАМФ и/или циклический ди-АМФ. Вакцинный препарат может эффективно индуцировать клеточно-опосредованный иммунитет и также может эффективно индуцировать системный и мукозный иммунные ответы. 7 з.п. ф-лы, 10 ил., 3 пр.
1. Вакцинный препарат для индуцирования клеточно-опосредованного иммунитета, содержащий комплекс cCHP вакцинного антигена и адъюванта, содержащего цГАМФ и/или циклический ди-АМФ.
2. Вакцинный препарат по п. 1, где вакцинный антиген представляет собой антиген, происходящий из Mycobacterium tuberculosis.
3. Вакцинный препарат по п. 2, где происходящий из Mycobacterium tuberculosis антиген содержит по меньшей мере весь продукт гена Ag85B или его часть, весь продукт гена Rv2608 или его часть, весь продукт гена Rv3619 или его часть, весь продукт гена Rv3620 или его часть, весь продукт гена Rv1813 или его часть, весь продукт гена MTB32A или его часть, весь продукт гена MTB39A или его часть и/или весь продукт гена MVA85A или его часть.
4. Вакцинный препарат по п. 2, где происходящий из Mycobacterium tuberculosis антиген представляет собой химерный белок, состоящий из продукта гена Rv3875, продукта гена Rv0266 и продукта гена Rv0288.
5. Вакцинный препарат по п. 1, где вакцинный антиген представляет собой антиген, происходящий из папилломавируса человека (HPV).
6. Вакцинный препарат по п. 5, где происходящий из HPV антиген содержит по меньшей мере весь продукт гена E6 или его часть и/или весь продукт гена E7 или его часть.
7. Вакцинный препарат по п. 1, где вакцинный антиген представляет собой антиген, происходящий из респираторно-синцитиального вируса (RSV).
8. Вакцинный препарат по п. 7, отличающийся тем, что происходящий из RSV антиген содержит по меньшей мере весь SH пептид или его часть.
| T Azegami et al., Nanogel-based nasal ghrelin vaccine prevents obesity, Mucosal Immunol | |||
| Автомобиль-сани, движущиеся на полозьях посредством устанавливающихся по высоте колес с шинами | 1924 |
|
SU2017A1 |
| T Azegami et al., Intranasal vaccination against angiotensin II type 1 receptor and pneumococcal surface protein A attenuates hypertension and pneumococcal infection in rodents, J Hypertens | |||
| Способ получения цианистых соединений | 1924 |
|
SU2018A1 |
| EA | |||
Авторы
Даты
2023-05-29—Публикация
2019-08-02—Подача