Область изобретения
Настоящее изобретение относится к связанным молекулам эктодомена рецептора TGF-β (трансформирующий ростовой фактор бета) и их применению. Более конкретно, настоящее изобретение относится к связанным молекулам эктодомена рецептора суперсемейства TGF-β и их применению для нейтрализации лиганда TGF-β.
Предшествующий уровень техники
TGF-β является частью суперсемейства из более чем 30 лигандов, которые регулируют несколько физиологических процессов, включая пролиферацию, миграцию и дифференцировку клеток. Перетурбация их уровней и/или сигналинга приводит к серьезным патологическим эффектам. Например, TGF-β и активиновые лиганды играют существенную патогенную роль при многих заболеваниях, включая рак (Hawinkels & Ten Dijke, 2011; Massague et al., 2000; Rodgarkia-Dara et al, 2006). В частности, TGF-β считается критически важным регулятором развития опухоли и сверхэкспрессируется большинством типов опухолей. Это способствует онкогенезу, частично вызывая эпителиально-мезенхимальный переход (EMT) в клетках эпителиальных опухолей, что приводит к агрессивному метастазированию (Thiery et al, 2009). TGF-β также способствует онкогенезу, выступая в качестве мощного подавителя иммунного ответа в микроокружении опухоли (Li et al, 2006). Фактически, TGF-β признан одним из самых эффективных иммуносупрессивных факторов, присутствующих в микроокружении опухоли. TGF-β препятствует дифференцировке, пролиферации и выживанию многих типов иммунных клеток, включая дендритные клетки, макрофаги, NK-клетки (естественные клетки-киллеры), нейтрофилы, B-клетки и T-клетки; таким образом, он модулирует как врожденный, так и адаптивный иммунитет (Santarpia et al, 2015; Yang et al, 2010). Важность TGF-β в микроокружении опухоли подтверждается данными, свидетельствующими о том, что при некоторых типах опухолей (включая меланому, рак легких, рак поджелудочной железы, колоректальный рак, рак печени и молочной железы) повышенные уровни лиганда TGF-β коррелируют с прогрессированием и рецидивом заболевания, метастазированием и смертностью. Следовательно, значительные усилия были вложены в разработку противоопухолевых терапевтических подходов, которые включают ингибирование TGF-β (Arteaga, 2006; Mourskaia et al, 2007; Wojtowicz-Praga, 2003). Эти подходы включают использование связанных полипептидов эктодомена рецептора TGF-β, который связывает или «захватывает» лиганд TGF-β (см. WO 0183525; WO 2005028517; WO 2008113185; WO 2008157367; WO 2010003118; WO 2010099219; WO 2012071649; WO 2012142515; WO 2013000234; US5693607; US 20050203022; US 20070244042; US 8318135; US 8658135; US 8815247; US 20150225483; и US 20150056199).
Один из подходов к разработке терапевтических средств, которые ингибируют функцию TGF-β, заключался в использовании антител или растворимых рецепторов-ловушек (также называемых основанными на эктодомене рецептора (ECD) ловушками лигандов) для связывания и секвестрации лиганда, что блокирует доступ лиганда к его рецепторам на клеточной поверхности (Zwaagstra et al, 2012). В общем, рецепторы-ловушки на основе ECD представляют собой класс терапевтических агентов, которые способны секвестрировать широкий спектр лигандов и которые могут быть оптимизированы с использованием методов белковой инженерии (Economides et al, 2003; Holash et al, 2002; Jin et al, 2009).
Ранее для получения одноцепочечной бивалентной ловушки эктодомена рецептора TGF-β типа II (TβRII-ECD), которая способна эффективно нейтрализовать членов суперсемейства лигандов TGF-β благодаря авидности, использовалась новая стратегия конструирования белка (Zwaagstra et al, 2012) [WO 2008113185; WO 2010031168]. В этом случае бивалентность достигалась посредством ковалентного связывания двух эктодоменов TβRII с использованием внутренне неупорядоченных областей (IDR), которые фланкируют структурированный лиганд-связывающий домен TβRII-ECD. Пример этих одноцепочечных бивалентных ловушек, T22d35, продемонстрировал эффективности нейтрализации TGF-β приблизительно в 100 раз выше, чем у моновалентного несконструированного эктодомена TβRII, в то время, как бивалентная ловушка не нейтрализовала изотип TGF-β2 и имела относительно короткий период полувыведения из кровотока.
Было бы полезно обеспечить ловушки на основе TβRII-ECD с улучшенными свойствами, такими как повышенная эффективность.
Краткое описание изобретения
Настоящее изобретение обеспечивает полипептидную конструкцию с повышенной эффективность для ингибирования TGFβ.
Полипептидная конструкция по настоящему изобретению содержит первую область и вторую область, где первая область содержит первый и/или второй эктодомен TGFβ-рецептора (ECD); и где вторая область содержит второй константный домен (CH2) и/или третий константный домен (CH3) тяжелой цепи антитела. В предпочтительном неограничивающем варианте осуществления C-конец первой области связан с N-концом второй области. В предпочтительном неограничивающем варианте осуществления первая область полипептидной конструкции содержит первый TβRII-ECD (ECD1) и/или второй TβRII-ECD (ECD2), где ECD1 и ECD2 соединены последовательно.
Обеспечена полипептидная конструкция, где первая область содержит дублет (TβRII-ECD)-(TβRII-ECD), связанная на своем С-конце с константным доменом антитела, ингибирует активность TGFβ с нейтрализации по меньшей мере в 600 раз большей эффективностью, чем аналогичная конструкция, имеющая один TβRII-ECD, связанная на своем С-конце с константным доменом антитела (т.е. когда отсутствует второй ECD, также называемый в настоящем документе синглетом).
Обеспечена полипептидная конструкция, содержащая второй ECD эктодомена рецептора TGFβ, соединенный последовательно с первым ECD, где полипептидная конструкция (т.е. конструкция ECD дублета), соединенная с константным доменом антитела, проявляет нейтрализацию (ингибирует) TGFβ, которая по меньшей мере в 100, 200, 300, 400, 500, 600, 700, 800 или 900 раз больше, чем у аналогичной конструкции, в которой константный домен антитела отсутствует (т. е. конструкция ECD дублета, также называемая в настоящем документе дублет, не связанный с Fc).
В связи с TβRII-ECD и эффективностью, с которой они ингибируют активность TGF-β, было обнаружено, что неожиданно повышенные эффективности могут быть результатом тщательного выбора их компонентов. Это происходит, когда определенные TβRII-ECD соединены последовательно, а их C-конец связан с N-концом константного домена антитела (Fc). Когда они находятся в связаны в димерной форме, содержащей два таких полипептида, поперечно сшитых посредством цистеинового мостика между константным доменом(ами) каждого полипептида, получающиеся в результате так называемые «связанные с Fc», имеющие два TβRII-ECD (т.е. ECD «дублет») на каждой из двух «ветвей», могут проявлять ингибирующую активность, которая более чем в 600 раз больше для TGF-β1 и более чем в 20 раз больше для TGF-β3 по сравнению со «связанными с Fc», имеющими один эктодомен на каждой из двух «ветвей», что демонстрируется ингибированием TGF-β1 и β3-индуцированной секреции IL-11, среди прочих, клетками A549 немелкоклеточного рака легкого человека (NSCLC). Повышение эффективности очевидно по сравнению с аналогами, у которых либо отсутствует область Fc, либо отсутствует второй ECD (то есть ECD «синглет»). Повышение эффективности по меньшей мере в 100, 200, 300, 400, 500 или 600 раз больше для дублета, связанного с Fc по сравнению с синглетом, связанного с Fc. Повышение активности по меньшей мере в 100, 200, 300, 400, 500, 600, 700, 800, 900 раз и примерно в 1000 раз больше для дублета, связанного с Fc по сравнению с дублетом, связанного с Fc. Повышение эффективности очевидно по сравнению с аналогами, у которых либо отсутствует область Fc (дублета, связанного с Fc T22d35-Fc в 972 и 243 раза лучше для TGF-β1 и TGF-β3, соответственно, чем дублета, не связанного с Fc) или у которых отсутствует второй ECD (ECD «синглет»; дублета, связанного с Fc T22d35-Fc в 615 раз и в 24 раза больше для TGF-β1 и TGF-β3 соответственно, чем дублет, не связанный с Fc). Более конкретно, дублет, связанный с Fc (T22d35-Fc) демонстрирует усиление эффективности, которое, по меньшей мере, в 970 раз больше для TGF-β1 и, по меньшей мере, в 240 раз больше для TGF-β3 по сравнению с конструкцией ECD дублета, связанного с Fc. Кроме того, дублета, связанного с Fc (T22d35-Fc) демонстрирует усиление эффективность, которое по меньшей мере в 600 раз больше для TGF-β1 и более чем в 20 раз больше для TGF-β3 по сравнению со синглетом, связанным с Fc (T2m-Fc).
В общем аспекте обеспечена полипептидная конструкция, содержащая, по меньшей мере, два TβRII-ECD, соединенных последовательно (т.е. дублет ECD), и константный домен антитела, содержащий, по меньшей мере, второй константный домен (CH2) и/или третью константу домен (CH3) тяжелой цепи антитела, где С-конец эктодоменов связан с N-концом константного домена антитела. В этой форме конструкция представляет собой одноцепочечный полипептид. Таким образом, константный домен антитела может содержать только домен CH2 или он может содержать домен CH2 и домен CH3.
В вариантах осуществления полипептиды обеспечены из связанных полипептидов в виде димера, содержащих два одноцепочечных полипептида и средства для поперечного сшивания, связывающие цепи ковалентно.
В других вариантах осуществления два эктодомена являются одинаковыми с точки зрения их мишеней связывания в целом и/или их видов мишеней.
В предпочтительном варианте осуществления первая область содержит два эктодомена рецептора TGF-β (TGFβR-ECD или «TβR-ECD»). В предпочтительном варианте осуществления TβR-ECD представляет собой эктодомен TGF-β-рецептора типа II (TβRII-ECD). В предпочтительном варианте осуществления TβR-ECD содержит SEQ ID NO: 1 и последовательность по существу идентичную ей.
Вторая область может содержать последовательность, выбранную из группы, состоящей из SEQ ID NO: 12, SEQ ID NO: 15, SEQ ID NO: 18, SEQ ID NO: 24 и последовательности по существу идентичной ей.
В предпочтительном варианте осуществления вторая область полипептидной конструкции по настоящему изобретению может дополнительно содержать CH1. В вариантах осуществления конструкции являются монофункциональными.
Полипептидные конструкции по настоящему изобретению используют тяжелую цепь антитела человеческого происхождения. В предпочтительном варианте осуществления тяжелая цепь антитела выбрана из группы, состоящей из человеческого IgG1 (SEQ ID NO: 15) и IgG2 (SEQ ID NO: 24).
Таким образом, в другом аспекте обеспечена полипептидная конструкция в соответствии с настоящим изобретением, где конструкция представляет собой димерный полипептид; где димерный полипептид содержит:
(i) первый одноцепочечный полипептид, содержащий вторую область, содержащую второй константный домен (CH2) и третий константный домен (CH3) тяжелой цепи антитела, и первую область, содержащую два эктодомена рецептора TGF-β (TβRII-ECD ), где С-конец первой области связан с N-концом второй области, и
(ii) второй одноцепочечный полипептид, содержащий вторую область, содержащую второй константный домен (CH2) и третий константный домен (CH3) тяжелой цепи антитела, и первую область, содержащую два эктодомена рецептора TGF-β (TβRII-ECD ) соединенных в тандеме, где С-конец первой области связан с N-концом второй области, и первый одноцепочечный полипептид поперечно сшит со вторым одноцепочечным полипептидом.
Также обеспечена молекула нуклеиновой кислоты, кодирующая любую полипептидную конструкцию по настоящему изобретению. Также обеспечен вектор, содержащий молекулу нуклеиновой кислоты согласно настоящему изобретению.
Также предлагается композиция, содержащая одну или более независимо выбранных полипептидных конструкций согласно настоящему изобретению и фармацевтически приемлемый носитель, разбавитель или эксципиент.
Также предлагается трансгенный клеточный хозяин, содержащий молекулу нуклеиновой кислоты или вектор согласно настоящему изобретению. Трансгенный клеточный хозяин может дополнительно содержать вторую молекулу нуклеиновой кислоты или второй вектор, кодирующие вторую полипептидную конструкцию, когда эта вторая полипептидная конструкция является такой же или отличается от первой полипептидной конструкции. Вторая молекула нуклеиновой кислоты или второй вектор обязательно присутствуют, когда две полипептидные конструкции являются разными (гетеродимерными), но не являются необходимыми, когда конструкции являются одинаковыми (гомодимерными).
Также обеспечено применение полипептидной конструкции по настоящему изобретению для лечения медицинского состояния, заболевания или расстройства; где медицинское состояние, заболевание или расстройство включает, но не ограничивается ими, рак, глазные заболевания, фиброзные заболевания или генетические расстройства соединительной ткани и иммунные расстройства.
Полипептидная конструкция по настоящему изобретению может содержать CH2 и CH3 или только CH2 из тяжелой цепи антитела человеческого происхождения. Например, без ограничения, тяжелая цепь антитела может быть выбрана из группы, состоящей из человеческого IgG1 и IgG2. В вариантах осуществления константный домен в конструкциях представляет собой CH2 как таковой или CH3 как таковой или CH2-CH3. Соответственно, компонент тяжелой цепи антитела обеспечивает дисульфидное сшивание между одноцепочечными полипептидными конструкциями, которые являются одинаковыми или разными. Также целесообразно, чтобы тяжелая цепь антитела обеспечивала выделение димерного полипептида на основе белка А, который продуцируется клетками-хозяевами.
В вариантах осуществления область эктодомена рецептора содержит два независимо выбранных эктодомена, которые соединены последовательно, то есть линейным образом. В некоторых вариантах осуществления эктодомены являются одинаковыми по последовательности или, по меньшей мере, одинаковыми по отношению к своему лиганду-мишени.
Настоящее изобретение также обеспечивает молекулу нуклеиновой кислоты, кодирующей полипептидные конструкции, как описано в данном документе. Вектор, содержащий молекулу нуклеиновой кислоты, только что описанную, также включен в изобретение. Изобретение также включает трансгенного клеточного хозяина, содержащего молекулу нуклеиновой кислоты или вектор, как описано в данном документе; клеточный хозяин может дополнительно включать в себя вторую молекулу нуклеиновой кислоты или второй вектор, кодирующие вторую полипептидную конструкцию, отличную от первой полипептидной конструкции. Системы, используемые для получения полипептидов по настоящему изобретению, могут представлять собой системы секреции, особенно в случае, когда требуется димеризация через дисульфидные мостики, и полинуклеотиды экспрессии, таким образом, кодируют сигналы секреции, которые расщепляются хозяином при секреции в среду для культивирования.
Композиции, содержащие одну или более чем одну независимо выбранную полипептидную конструкцию, описанную в данном документе, и фармацевтически приемлемый носитель, разбавитель или эксципиент, также включены в настоящее изобретение.
Эти и другие признаки изобретения будут теперь описаны в качестве примера со ссылкой на прилагаемые рисунки, где:
Краткое описание рисунков
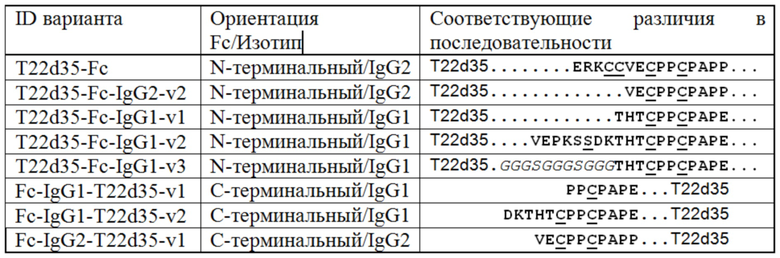
Фиг. 1 A/B представляет собой схематическое изображение эктодомена рецептора TGF-β типа II (TβRII-ECD; также сокращенно T2m) и одну цепь связанных доменов T2m (также сокращенно T22d35) (фиг. 1A); На Фиг. 1В представлены соответствующие аминокислотные последовательности, где последовательности природных линкеров (SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8) подчеркнуты, а последовательность структурного домена TβRII (SEQ ID NO: 4) выделена жирным шрифтом.
Фиг. 2 A-G, где Фиг. 2A/B/C представляет собой схематическое изображение модулей T2m и T22d35, связанных с N-концами тяжелых цепей области Fc IgG2 (2A) для генерирования слитых белков T2m-Fc (2B) и T22d35-Fc (2C); На Фиг. 2D представлена аминокислотная последовательность слитых белков T2m-Fc и T22d35-Fc (SEQ ID NO: 9, SEQ ID NO: 10). На Фиг. 2E представлена выровненная последовательность дополнительных вариантов области линкера между областью Fc и ECD в слитых конструкциях T22d35-Fc. На Фиг. 2F и 2G представлена аминокислотная последовательность вариантов линкера T22d35-Fc с использованием Fc человеческого IgG1 (Фиг. 2F; SEQ ID NO: 14, SEQ ID NO: 17, SEQ ID NO: 20) и области Fc человеческого IgG2. (Фиг. 2G; SEQ ID NO: 23). Последовательности природных линкеров (SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8) подчеркнуты, последовательность структурированного домена TβRII (SEQ ID NO: 4) показана жирным шрифтом, а варианты последовательности Fc человеческого Ig G (SEQ ID NO: 12, SEQ ID NO: 15, SEQ ID NO: 18, SEQ ID NO: 24) показаны жирным курсивом.
Фиг. 3 A/B/C показывает препаративный профиль SEC элюирования для слитого белка T2m-Fc (3А); Фракции (фр.) 6-11 объединяли и концентрировали. Целостность белка очищенного SEC материала затем оценивали с помощью профиля UPLC-SEC (3B) и оценки SDS-PAGE в невосстанавливающих (NR) и восстанавливающих (R) условиях (3C).
Фиг. 4 A/B/C показывает препаративный профиль SEC элюирования для слитого белка T22d35-Fc (4А); Фр. 7-10 были объединены и сконцентрированы. Целостность белка очищенного материала SEC затем оценивали с помощью профиля UPLC-SEC (4B) и оценки SDS-PAGE в невосстанавливающих (NR) и восстанавливающих (R) условиях (4C).
На Фиг. 5 A/B представлен анализ SDS-PAGE очищенных белком А T22d35-Fc, T22d35-Fc-IgG2-v2(CC), T22d35-Fc-IgG1-v1(CC), T22d35-Fc-IgG1-v2(SCC), T22d35-Fc-IgG1-v3(GSL-CC), hIgG1FcΔK(C)-T22d35, hIgG1FcΔK(CC)-T22d35 and hIgG2FcΔK(CC)-T22d35 вариантов в не восстановливающих (A) и восстановливающих (B) условиях.
Фиг. 6 A/B/C представляет процентное содержание интактного мономера (A), агрегатов (B) и фрагментов (C) различных слитых белков, что указывает на преимущества экспрессии дублета T22d35 на N-конце IgG Fc части. В таблице приведены численные различия параметров, которые были проанализированы.
Фиг. 7 A/B/C представляет функциональную оценку слитых белков T2m-Fc и T22d35-Fc по сравнению с одноцепочечной ловушкой T22d35, не связанной с Fc в анализе высвобождения IL-11 A549. Нейтрализацию TGF-β1 (5A), - β2 (5B), - β3 (5C) оценивали и рассчитывали как % от контроля TGF-β (среднее значение в трехкратном эксперименте +/- SD). В таблице приведены рассчитанные значения IC50, рассчитанные в Graphpad Prism (алгоритм 4-PL (логарифм (ингибитор) в сравнении с откликом - переменный наклон (четыре параметра)).
На Фиг. 8 представлена функциональная оценка T22d35-Fc, T22d35-Fc-IgG2-v2 (CC), T22d35-Fc-IgG1-v1 (CC), T22d35-Fc-IgG1-v2 (SCC) и T22d35-Fc- IgG1-v3 (GSL-CC) по сравнению с C-концевыми вариантами ловушки T22d35, связанной с Fc в анализе высвобождения IL-11 A549. Нейтрализацию TGF-β 1 оценивали и рассчитывали как % от контроля TGF-β 1 (среднее из трехкратного эксперимента +/- SD). В таблице приведены рассчитанные значения IC50 , рассчитанные в Graphpad Prism (алгоритм 4-PL (логарифм (ингибитор) vs отклик - переменный наклон (четыре параметра)).
На Фиг. 9 представлена функциональная оценка нейтрализации TGF-β1, -β2 и -β3 с помощью варианта T22d35-Fc-IgG1-v1 (CC) в анализе высвобождения IL-11 A549. Нейтрализацию TGF-β оценивали и рассчитывали как % от контроля TGF-β (среднее из трехкратного эксперимента +/- SD). В таблице приведены рассчитанные значения IC50 , рассчитанные в Graphpad Prism (алгоритм 4-PL (логарифм (ингибитор) vs отклик - переменный наклон (четыре параметра)).
Фиг. 10. Функциональная оценка in vivo слитого белка T22d35-Fc на модели сингенной карциномы ободочной кишки мыши MC-38. (A) Объемы опухолей рассчитывали, как описано, и наносили на график как средние значения опухолей +/- SD на группу. Двухсторонний анализ ANOVA был использован для анализа статистически значимых различий между рассчитанными средними объемами опухолей в когортах лечения T22d35-Fc и CTL IgG с течением времени. Кроме того, рост опухоли MC-38 (расчетный объем) наносили на график для каждой мыши для когорт, обработанных CTL IgG (B) и T22d35-Fc (C).
Дополнительные аспекты и преимущества настоящего изобретения будут очевидны с учетом следующего описания. Подробные описания и примеры, хотя и указывают предпочтительные варианты осуществления изобретения, даны только в качестве иллюстрации, поскольку различные изменения и модификации в пределах объема изобретения станут очевидными для специалистов в данной области техники.
Подробное описание изобретения
В настоящее время обеспечены полипептидные конструкции, которые связывают и нейтрализуют все изоформы трансформирующего фактора роста бета (TGF-β1, -β2 и -β3). Эти полипептиды используют эктодомены рецептора TGF-β для захвата или секвестрации различных видов TGFβ , включая TGF-β1 и TGF-β3, и в некоторой степени включая TGF-β2. Эффективность, с которой настоящие полипептидные конструкции нейтрализуют TGF-β1 и -β3, неожиданно намного выше, чем у родственных конструкций, как продемонстрировано в настоящем документе. По этой причине ожидается, что настоящие конструкции будут особенно полезны в качестве фармацевтических препаратов для лечения медицинских показаний, таких как рак, фиброзные заболевания и некоторые иммунные нарушения.
Настоящие полипептидные конструкции содержат два TβR-ECD, такие как TβRII-ECD, которые соединены последовательно (от С-конца до N-конца) и дополнительно содержат константный домен антитела, который содержит по меньшей мере второй константный домен (CH2) и/или третий константный домен (CH3) тяжелой цепи антитела. Константный домен антитела (Fc) связан на своем N-конце с С-концом эктодомена. Наличие эктодомена в качестве дублета и наличие этого дублета, связанного с N-концом константного домена антитела, обеспечивает «ловушку» с повышенной в 615 раз эффективностью нейтрализации для TGFβ1 и в 24 раза для TGFβ3 по сравнению с конструкцией, имеющей один ECD, связанный с N-концом константного домена антитела.
Используемый в данном документе термин TβRII-ECD относится к внеклеточной области рецептора TGFβ II типа, которая связывается с лигандом TGFβ. В предпочтительном варианте осуществления настоящих конструкций эктодомен TGFβ-RII представляет собой эктодомен вида TGFβ-R (то есть TβRII-ECD), содержащий последовательность, которая образует стабильную трехмерную складчатую структуру:
QLCKFCDVRFSTCDNQKSCMSNCSITSICEKPQEVCVAVWRKNDENITLETVCHDPKLPYHDFILEDAASPKCIMKEKKKPGETFFMCSCSSDECNDNIIF (SEQ ID NO:4).
В связанной форме, которая содержит гибкую естественную фланкирующую последовательность, ECD может включать подчеркнутые структуры, как показано ниже:
IPPHVQKSVNNDMIVTDNNGAVKFPQLCKFCDVRFSTCDNQKSCMSNCSITSICEKPQEVCVAVWRKNDENITLETVCHDPKLPYHDFILEDAASPKCIMKEKKKPGETFFMCSCSSDECNDNIIFSEEYNTSNPD (SEQ ID NO:1)
Эта последовательность связывается с изотипами лиганда TGFβ, обозначенными TGF-β1 и TGF-β3. Аффинность связывания для TGF-β2 меньше.
В настоящих полипептидных конструкциях два TβRII-ECD могут содержать одну и ту же последовательность. Два эктодомена соединены последовательно, в результате чего получается линейный полипептид, в котором С-конец одного эктодомена связан с N-концом другого эктодомена.
Два эктодомена могут быть связаны прямым связыванием, так что дополнительные аминокислотные остатки не вводятся. В ином случае, дополнительные аминокислотные остатки могут образовывать линкер, который последовательно соединяет два рецепторных эктодомена. В белковой конструкции по настоящему изобретению первая и вторая области полипептидной конструкции по настоящему изобретению также соединены. Под термином «соединенный» подразумевается, что две области ковалентно связаны. Химическая связь может быть достигнута химической реакцией или может быть продуктом рекомбинантной экспрессии двух областей в одной полипептидной цепи. В конкретном неограничивающем примере C-конец первой области связан непосредственно с N-концом второй области, то есть между двумя областями нет никаких дополнительных «линкерных» аминокислот. В случае, когда линкер отсутствует, то есть при прямом связывании двух областей, будет иметь место прямая связь между C-концом полного эктодомена и N-концом константных областей антитела CH2-CH3. Например, при варианте, связанной с Fc (SEQ ID NO: 12, SEQ ID NO: 15, SEQ ID NO: 18, SEQ ID NO: 24) с SEQ ID NO: 1 через линкер с внутренним нарушением порядка с SEQ ID NO: 8, который является частью TβRII-ECD, имеющего SEQ ID NO: 1 (т.е. без добавления дополнительных «линкерных» аминокислот), один соединяет аспарагиновую кислоту в последнем положении SEQ ID NO: 1 с глутаминовой кислотой, треонином, валином или валином, обнаруженными в первом положении SEQ ID NO: 12, SEQ ID NO: 15, SEQ ID NO: 18 или SEQ ID NO: 24 соответственно.
Обычной практикой при изготовлении слитых конструкций является введение глициновых или глицин-сериновых линкеров (GSL), таких как GGGGS или [G4S]n (где n равно 1, 2, 3, 4 или 5 или более, например 10, 25 или 50) между связанными компонентами. Как указано в приведенном выше абзаце, слитые полипептиды по настоящему изобретению могут быть получены путем прямого связывания без использования какой-либо дополнительной аминокислотной последовательности, за исключением тех, которые присутствуют в области Fc и в области эктодомена рецептора. Таким образом, можно воздерживаться от использования чужеродных последовательностей в качестве линкеров, обеспечивая преимущество из-за их потенциальной нежелательной иммуногенности и их добавленной молекулярной массы. Энтропийные факторы также являются потенциальной ответственностью глициновых и глицин-сериновых линкеров, которые очень гибки и могут стать частично ограниченными при связывании с мишенью, что приводит к потере энтропии, неблагоприятному для аффинности связывания. Следовательно, только гибкие, внутренне неупорядоченные N-концевые области TβRII-ECD были использованы в качестве природных линкеров в вариантах осуществления настоящего изобретения. Однако, конкретные аминокислотные составы и длины этих по существу неупорядоченных линкеров (например, SEQ ID NO: 6, SEQ ID NO: 7, SEQ ID NO: 8) не позволяли точно предсказать, будут ли полученные конструкции прямого связывания иметь требуемые геометрию и благоприятные молекулярные взаимодействия для правильного связывания с их предполагаемыми димерными лигандами. В других вариантах осуществления слитый полипептид может включать гибкий искусственный GSL, как проиллюстрировано в конструкции в SEQ ID NO: 20, где линкер GS с SEQ ID NO: 21 введен между аспарагиновой кислотой (D) в последней позиции TβRII-ECD, имеющего SEQ ID NO: 1, и треонином (T) в первом положении варианта области Fc, имеющего SEQ ID NO: 15.
Первая и вторая области полипептидной конструкции, в вариантах осуществления, соединены естественными полипептидными внутренне неупорядоченными линкерами, выбранными из группы, состоящей из SEQ ID NO: 8, 13, 16, 19, 25 и последовательности по существу идентичной им. В других вариантах осуществления области полипептидных конструкций соединены гибкими линкерами, выбранными из группы, состоящей из SEQ ID NO: 21 и SEQ ID NO: 22, и последовательности, по существу, идентичной им.
В этом варианте осуществления одна область настоящих полипептидных конструкций содержит дублет TβRII-ECD, содержащий первый и второй эктодомены рецептора, соединенные последовательно природным внутренне неупорядоченным полипептидным линкером с SEQ ID NO: 6 и имеющие аминокислотную последовательность, содержащую:
IPPHVQKSVNNDMIVTDNNGAVKFPQLCKFCDVRFSTCDNQKSCMSNCSITSICEKPQEVCVAVWRKNDENITLETVCHDPKLPYHDFILEDAASPKCIMKEKKKPGETFFMCSCSSDECNDNIIFSEEYNTSNPDIPPHVQKSVNNDMIVTDNNGAVKFPQLCKFCDVRFSTCDNQKSCMSNCSITSICEKPQEVCVAVWRKNDENITLETVCHDPKLPYHDFILEDAASPKCIMKEKKKPGETFFMCSCSSDECNDNIIFSEEYNTSNPD (SEQ ID NO:5).
Настоящие конструкции также содержат область, содержащая константный домен антитела, содержащая по меньшей мере второй константный домен (CH2) и/или третий константный домен (CH3) тяжелой цепи антитела. Константный домен антитела связан на своем N-конце с C-концом дублета эктодоменов, так что ориентация конструкции представляет собой одну цепь TβRII-ECD (связь) TβRII-ECD (связь) CH2-CH3.
Константный домен антитела обеспечивает поперечное сшивание между двумя из представленных полипептидных конструкций. Это достигается, когда экспрессируемые полипептидные конструкции секретируются их экспрессирующим хозяином. Таким образом, получение одноцепочечного полипептида предоставляет конструкцию в димерной форме, в которой две конструкции поперечно сшиты через дисульфидные мостики, которые включают один или несколько остатков цистеина в каждом из константных доменов антитела, присутствующих в каждой из конструкций.
Константный домен антитела, присутствующий в конструкции, желательно получен из константной области IgG и особенно из константного домена либо IgG1, либо IgG2.
Предоставленные конструкции являются монофункциональными в том смысле, что сама константная область может не обладать какой-либо конкретной активностью, кроме как действовать в качестве структуры, через которую могут образовываться димеры полипептидных конструкций. Эти минимальные константные области также могут быть изменены, чтобы обеспечить некоторое преимущество, путем включения соответствующих шарнирных областей и, необязательно, изменения состава остатков цистеина. Таким образом, некоторые или все остатки цистеина, включенные в мостик между двумя фрагментами Fc или используемые в природе для мостика между тяжелой и легкой цепями полноразмерного антитела, могут быть заменены или удалены. Одним из преимуществ минимизации количества остатков цистеина является снижение склонности к скремблированию дисульфидных связей, что может способствовать агрегации. Например, эти остатки цистеина и их изменение видны в природных или неприродных линкерных последовательностях, расположенных вокруг соединения первой и второй областей полипептидных конструкций и которые перечислены ниже:
SEEYNTSNPDTHTCPPCPAPE (SEQ ID NO:16), SEEYNTSNPDVEPKSSDKTHTCPPCPAPE (SEQ ID NO:19), SEEYNTSNPDGGGSGGGSGGGTHTCPPCPAPE (SEQ ID NO:22) включающие вариации шарнирной последовательности человеческого IgG1; и SEEYNTSNPDERKCCVECPPCPAPP (SEQ ID NO:13) и SEEYNTSNPDVECPPCPAPP (SEQ ID NO:25) включающие вариации шарнирной последовательности человеческого IgG2; и последовательность по существу идентичная им.
Не все встречающиеся в природе межшарнирные дисульфидные связи должны образовываться для гомодимеризации Fc, при этом следует отметить, что стабильность гомодимера Fc может зависеть от количества межмолекулярных дисульфидных мостиков.
В настоящем описании «антитело», также называемое в данной области техники «иммуноглобулином» (Ig), относится к белку, сконструированному из спаренных тяжелых и легких полипептидных цепей. Структура антитела и каждого из доменов хорошо известна и хорошо известна специалистам в данной области, не смотря на то, что в данном документе обобщена. Когда антитело правильно свернуто, каждая цепь складывается в ряд отдельных глобулярных доменов, соединенных более линейными полипептидными последовательностями; легкая цепь иммуноглобулина складывается в вариабельный ((VL) и константный (CL) домен, в то время как тяжелая цепь складывается в вариабельный (VH) и три константных (CH1, CH2, CH3) домена. После спаривания взаимодействие вариабельных доменов тяжелой и легкой цепей (VH и VL) и первого константного домена (CL и CH1) приводит к образованию Fab (фрагмент, антигенсвязывающий), содержащего область связывания (Fv); взаимодействие двух тяжелых цепей приводит к спариванию доменов CH2 и CH3, что приводит к образованию Fc (фрагмент, кристаллизующийся). Характеристики, описанные здесь для доменов CH2 и CH3, также применимы к Fc.
В настоящем изобретении и его конкретных вариантах осуществления полипептидные конструкции, которые проявляют значительно повышенную эффективность, включают следующие:
T22d35-Fc:
IPPHVQKSVNNDMIVTDNNGAVKFPQLCKFCDVRFSTCDNQKSCMSNCSITSICEKPQEVCVAVWRKNDENITLETVCHDPKLPYHDFILEDAASPKCIMKEKKKPGETFFMCSCSSDECNDNIIFSEEYNTSNPDIPPHVQKSVNNDMIVTDNNGAVKFPQLCKFCDVRFSTCDNQKSCMSNCSITSICEKPQEVCVAVWRKNDENITLETVCHDPKLPYHDFILEDAASPKCIMKEKKKPGETFFMCSCSSDECNDNIIFSEEYNTSNPDERKCCVECPPCPAPPVAGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTFRVVSVLTVVHQDWLNGKEYKCKVSNKGLPAPIEKTISKTKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDISVEWESNGQPENNYKTTPPMLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPG (SEQ ID NO:10)
T22d35-Fc-IgG2-v2 (CC):
IPPHVQKSVNNDMIVTDNNGAVKFPQLCKFCDVRFSTCDNQKSCMSNCSITSICEKPQEVCVAVWRKNDENITLETVCHDPKLPYHDFILEDAASPKCIMKEKKKPGETFFMCSCSSDECNDNIIFSEEYNTSNPDIPPHVQKSVNNDMIVTDNNGAVKFPQLCKFCDVRFSTCDNQKSCMSNCSITSICEKPQEVCVAVWRKNDENITLETVCHDPKLPYHDFILEDAASPKCIMKEKKKPGETFFMCSCSSDECNDNIIFSEEYNTSNPDVECPPCPAPPVAGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTFRVVSVLTVVHQDWLNGKEYKCKVSNKGLPAPIEKTISKTKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDISVEWESNGQPENNYKTTPPMLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPG (SEQ ID NO:23)
T22d35-Fc-IgG1-v1 (CC):
IPPHVQKSVNNDMIVTDNNGAVKFPQLCKFCDVRFSTCDNQKSCMSNCSITSICEKPQEVCVAVWRKNDENITLETVCHDPKLPYHDFILEDAASPKCIMKEKKKPGETFFMCSCSSDECNDNIIFSEEYNTSNPDIPPHVQKSVNNDMIVTDNNGAVKFPQLCKFCDVRFSTCDNQKSCMSNCSITSICEKPQEVCVAVWRKNDENITLETVCHDPKLPYHDFILEDAASPKCIMKEKKKPGETFFMCSCSSDECNDNIIFSEEYNTSNPDTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPG (SEQ ID NO:14)
T22d35-Fc-IgG1-v2 (SCC):
IPPHVQKSVNNDMIVTDNNGAVKFPQLCKFCDVRFSTCDNQKSCMSNCSITSICEKPQEVCVAVWRKNDENITLETVCHDPKLPYHDFILEDAASPKCIMKEKKKPGETFFMCSCSSDECNDNIIFSEEYNTSNPDIPPHVQKSVNNDMIVTDNNGAVKFPQLCKFCDVRFSTCDNQKSCMSNCSITSICEKPQEVCVAVWRKNDENITLETVCHDPKLPYHDFILEDAASPKCIMKEKKKPGETFFMCSCSSDECNDNIIFSEEYNTSNPDVEPKSSDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPG (SEQ ID NO:17); and
T22d35-Fc-IgG1-v3 (GSL-CC):
IPPHVQKSVNNDMIVTDNNGAVKFPQLCKFCDVRFSTCDNQKSCMSNCSITSICEKPQEVCVAVWRKNDENITLETVCHDPKLPYHDFILEDAASPKCIMKEKKKPGETFFMCSCSSDECNDNIIFSEEYNTSNPDIPPHVQKSVNNDMIVTDNNGAVKFPQLCKFCDVRFSTCDNQKSCMSNCSITSICEKPQEVCVAVWRKNDENITLETVCHDPKLPYHDFILEDAASPKCIMKEKKKPGETFFMCSCSSDECNDNIIFSEEYNTSNPDGGGSGGGSGGGTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPG (SEQ ID NO:20)
В конкретном варианте осуществления полипептидная конструкция содержит полипептид по настоящему изобретению, который проявляет значительно повышенную эффективность, например, полипептид, обладающий значительно повышенной эффективностью, может содержать SEQ ID NO: 10, SEQ ID NO.14, SEQ ID NO: 17, SEQ ID NO: 20 или SEQ ID NO: 23. В другом конкретном варианте осуществления полипептидная конструкция может представлять собой гомодимер, включающий два полипептида, которые проявляют значительно повышенную эффективность; например, если полипептидная конструкция, которая проявляет значительную повышенную эффективность, представляет собой SEQ ID NO: 14, полипептидная конструкция представляет собой гомодимер, содержащий две полипептидные конструкции, где каждая полипептидная конструкция содержит SEQ ID NO.14. Аналогично, если полипептид, который проявляет повышенную эффективность, представляет собой SEQ ID NO: 10, 14, 17, 20 или 23, гомодимер согласно настоящему изобретению также содержит две полипептидные конструкции, где каждый полипептид гомодимера представляет собой SEQ ID NO: 10, 14. 17, 20 или 23 соответственно.
Как отмечено, эти одноцепочечные полипептидные конструкции будут димеризоваться при секреции из продуцирующего хозяина с образованием димерной полипептидной конструкции, содержащей два одноцепочечных полипептида, связанных дисульфидными мостиками, которые образуются между константными доменами двух одноцепочечных полипептидов.
Под «значительно повышенной эффективностью» мы подразумеваем, что эффект или активность настоящей полипептидной конструкции в этой димерной форме больше, чем у аналогичной конструкции при измерении в анализе, подходящем для оценки биологической активности TGF-β. Соответствующие средства для этого определения приведены в качестве примера. Например, N-концевой дублет T22d35, связанный с Fc нейтрализует TGF-β в гораздо большей степени, чем N-концевой, синглета T2m-, связанный с Fc , как это было показано TGF-β-индуцированным высвобождением IL-11 клетками A549 (Фиг. 7).
Наблюдается, что слитые конструкции этого типа имеют преимущества по сравнению с несколькими другими версиями молекул на основе эктодомена рецептора TβRII, включая бивалентные конструкции эктодомена рецептора TGF-β, не связанные с Fc (такие как дублет T22d35) и конструкции, в которых один эктодомен рецептора связан с N-концом области Fc. В частности, предлагаемые в настоящее время конструкции, связанные с Fc обладают улучшенной технологичностью за счет присутствия области Fc (например, очистка может быть выполнена с использованием хроматографии на белке А). Область Fc также позволяет увеличить период полувыведения из кровотока. Важно, что настоящие конструкции имеют существенно более высокие значения нейтрализации TGF-β по сравнению с синглетом, связанным с Fc (T2m-Fc) и дублетом, не связанным с Fc (T22d35). N-концевые конструкции TGF-β ECD дублета, связанного с Fc (T22d35-Fc) обладают преимуществами в отношении значительного улучшения эффективности нейтрализации лиганда TGF-β (как показано, например, в более чем 970-кратном улучшении нейтрализации TGF-β1 относительно дублета, не связанного с Fc, как показано на Фиг. 7). Кроме того, они демонстрируют улучшенную технологичность, о чем свидетельствует биофизический анализ, показывающий содержание мономера более 99% (т.е. минимальное присутствие агрегатов и отсутствие фрагментов очищенных N-концевых слитых конструкций T22d35-Fc) (как показано на Фиг. 6). Таким образом, преимуществом настоящего изобретения является неожиданная высокая эффективность нейтрализации лиганда TGF-β, включая некоторую степень нейтрализации TGF-β2, которая не наблюдается с T2m-Fc (синглет, связанного с Fc) или T22d35 (не связанная с Fc) конструкциями.
В конкретных вариантах осуществления вторая область полипептидной конструкции по настоящему изобретению выбрана из группы последовательностей, демонстрирующих вариации в N-концевой последовательности, как проиллюстрировано SEQ ID NO: 12, 15, 18, 24. Они могут отличаться по длине и количеству остатков цистеина, удерживаемых из шарнирной области, в качестве средства для модуляции степени димеризации Fc-области и, следовательно, влияния как на эффективность, так и на технологичность. Таким образом, в вариантах осуществления полипептидная конструкция содержит вариацию в константном домене, где по меньшей мере один остаток цистеина, участвующий в поперечном сшивании, удален или замещен. Подходящие замены включают серин или аланин и предпочтительно серин.
По существу идентичная последовательность может содержать одну или несколько консервативных аминокислотных мутаций, которые все еще обеспечивают правильный фолдинг при секреции в среду для культивирования. В данной области техники известно, что одна или несколько консервативных аминокислотных мутаций в контрольной последовательности могут давать мутантный пептид без существенного изменения физиологических, химических, физико-химических или функциональных свойств по сравнению с контрольной последовательностью; в таком случае контрольные и мутантные последовательности будут считаться «по существу идентичными» полипептидами. Консервативная аминокислотная замена определяется здесь как замена аминокислотного остатка другим аминокислотным остатком со сходными химическими свойствами (например, размером, зарядом или полярностью). Эти консервативные аминокислотные мутации могут быть внесены в каркасные области при сохранении общей структуры константных доменов; таким образом функция Fc сохраняется.
В конкретном неограничивающем примере первая область полипептидной конструкции согласно настоящему изобретению может содержать рецептор TGF-β типа II, такой как:
IPPHVQKSVNNDMIVTDNNGAVKFPQLCKFCDVRFSTCDNQKSCMSNCSITSICEKPQEVCVAVWRKNDENITLETVCHDPKLPYHDFILEDAASPKCIMKEKKKPGETFFMCSCSSDECNDNIIFSEEYNTSNPD (SEQ ID NO:1, также упоминается здесь как T2m).
В предпочтительных вариантах осуществления полипептидные конструкции содержат «дублет» TβRII-ECD, в котором TβRII-ECD последовательно соединен с другим TβRII-ECD, причем эктодомены могут быть одинаковыми или разными эктодоменами рецептора суперсемейства TGF-β, такими как:
IPPHVQKSVNNDMIVTDNNGAVKFPQLCKFCDVRFSTCDNQKSCMSNCSITSICEKPQEVCVAVWRKNDENITLETVCHDPKLPYHDFILEDAASPKCIMKEKKKPGETFFMCSCSSDECNDNIIF
-линкер-
QLCKFCDVRFSTCDNQKSCMSNCSITSICEKPQEVCVAVWRKNDENITLETVCHDPKLPYHDFILEDAASPKCIMKEKKKPGETFFMCSCSSDECNDNIIFSEEYNTSNPD (SEQ ID NO:5, также упоминаемый здесь как T22d35), где в одном неограничивающем варианте осуществления линкер соответствует SEQ ID NO: 6; а также
последовательность, по существу идентичная ей. Термин «по существу идентичный» соответствует как определенному выше.
Дублет эктодоменов может включать в себя одинаковые или разные эктодомены, оба принадлежащие к семейству рецепторов суперсемейства TGFβ. В вариантах осуществления эктодомены связывают одну и ту же мишень. В других вариантах осуществления эктодомены принадлежат к одному и тому же виду рецепторов. В других вариантах осуществления эктодомены являются идентичными и, следовательно, являются гомомерными.
Например, полипептидные конструкции согласно по изобретению могут иметь эффективность нейтрализации TGF-β, выбранную из группы, имеющей, по меньшей мере в 900 и 200 раз большую эффективность, чем у конструкции только с дублетом T22d35, в отношении TGF-β1 и TGF-β3 соответственно. Например, в анализе высвобождения IL-11 конструкция с дублетом T22d35-Fc примерно в 972 раза эффективнее нейтрализует TGF-β1 и примерно в 243 раза эффективнее нейтрализует TGF-β3 по сравнению с одним дублетом T22d35 без Fc.
В другом примере эффективность конструкции по меньшей мере в 600 раз и по меньшей мере в 20 раз выше для нейтрализации TGF-β1 и TGF-β3 соответственно, чем у конструкции, в которой константный домен антитела связан с одним эктодоменом, а не дублетом. Полипептидные конструкции согласно настоящему изобретению могут иметь по меньшей мере в 615 и 24 раза лучшую эффективность нейтрализации относительно TGF-β1 и TGF-β3 соответственно по сравнению с эффективностью конструкции, в которой константный домен антитела связан с одним эктодоменом, а не с дублетом.
Эффективность нейтрализации можно обобщить следующим образом: эффективность нейтрализации дублета, связанного с Fc (ECD-ECD-Fc) больше, чем у синглета, связанного с Fc (ECD-Fc); то есть ECD-ECD-Fc больше ECD-Fc, тогда как ECD-Fc является более эффективной, чем у дублета, не содержащего Fc (ECD-ECD), а дублет, не связанный с Fc является более эффективной, чем синглета, не связанного с Fc; т.е. ECD-ECD-Fc больше ECD-Fc больше ECD-ECD больше ECD). С точки зрения технологичности присутствие белка Fc позволяет применять очистку белком A и предотвращает необходимость использования расщепляемых меток. Кроме того, расположение синглета или дублета ECD на N-конце Fc части предотвращает проблемы агрегации из-за неправильного спаривания остатков цистеина в шарнирной области Fc части. Следовательно, синглет или дублет, связанного с N-концом Fc-части обеспечивает улучшенную технологичность по сравнению с C-концевыми слитыми конструкциями (N-концевые слитые конструкции имеют более высокий процент мономерных частиц, меньше агрегатов, меньше фрагментов). Кроме того, наблюдается неожиданное значительное увеличение эффективности нейтрализации TGF-β для всех изотипов TGF-β для N-концевой конструкции ECD дублета, связанного с Fc по сравнению с N-концевым ECD синглетом T2m, связанного с Fc.
Кроме того, когда полипептидные конструкции согласно настоящему изобретению включают TβRII-ECD, который связывает TGF-β, полипептидная конструкция может в различной степени нейтрализовать все три изотипа TGF-β (то есть TGF-β1, TGF- β2 и TGF-β3).
Полипептидные конструкции по настоящему изобретению, как оценивают в клеточных анализах, обладают нейтрализующей TGF-β эффективностью, которая значительно выше (в 20 раз или более), чем у бивалентных полипептидов-компараторов, то есть T22d35, не связанной с Fc (только дублет) и T2m-Fc (синглет, связанный с Fc). В ряду полипептидных конструкций по настоящему изобретению те, которые содержат две или более копии TβRII-ECD, связанные с N-концом константной области Fc, имеют эффективность, которая выше, чем у тех конструкций, которые содержат только одну копию, по оценке клеточных анализов.
Полипептидная конструкция по настоящему изобретению экспрессируется в виде одноцепочечного полипептида. После экспрессии полипептидная конструкция по настоящему изобретению образует димер, где домены CH2 и CH3 соответствующих полипептидных конструкций взаимодействуют с образованием правильно собранной области Fc, которая возникает, когда экспрессируемые продукты секретируются в среду для культивирования.
Полипептидная конструкция по настоящему изобретению также может содержать дополнительные последовательности, способствующие экспрессии, обнаружению или очистке рекомбинантного антитела или его фрагмента. Могут быть использованы любые такие последовательности или метки, известные специалистам в данной области. Например, и без ограничения, антитело или его фрагмент может содержать таргетирующую или сигнальную последовательность (например, но не ограничиваясь, ompA), метку обнаружения/очистки (например, но не ограничиваясь этим, c-Myc, His5, His6, или His8G) или их комбинацию. В другом примере сигнальным пептидом может быть MDWTWRILFLVAAATGTHA (SEQ ID NO: 11). В дополнительном примере дополнительной последовательностью может быть сайт узнавания биотина, такой как описанный в [WO/1995/04069] или в [WO/2004/076670]. Как также известно специалистам в данной области техники, линкерные последовательности могут использоваться в сочетании с дополнительными последовательностями или метками или могут служить в качестве метки обнаружения/очистки. Соответственно, константная область содержит сайт связывания белка А (обычно находящийся между примерно CH2 и CH3), который позволяет экстрагировать/выделить одноцепочечный полипептид, используя подход аффинности к белку А.
Настоящее изобретение также охватывает последовательности нуклеиновых кислот, кодирующих молекулы, что описаны выше. Учитывая вырожденность генетического кода, ряд нуклеотидных последовательностей будет иметь свойство кодирования желаемого полипептида, как будет легко понятно специалисту в данной области. Последовательность нуклеиновой кислоты может быть оптимизирована по кодонам для экспрессии в различных микроорганизмах. Настоящее изобретение также охватывает векторы, содержащие нуклеиновые кислоты, как только что описано, где векторы обычно содержат промотор и сигнальную последовательность, которые функционально связаны с кодирующим конструкцию полинуклеотидом для управления его экспрессией в выбранном клеточном продуцирующем хозяине. Векторы могут быть одинаковыми или разными при условии, что оба приводят к секреции димерной полипептидной конструкции.
Кроме того, изобретение охватывает клетки, также называемые здесь трансгенными клеточными хозяевами, содержащие нуклеиновую кислоту и/или вектор, как описано, кодирующие первую полипептидную конструкцию. Клетки-хозяева могут содержать вторую нуклеиновую кислоту и/или вектор, кодирующие вторую полипептидную конструкцию, отличную от первой полипептидной конструкции. Совместная экспрессия первой и второй полипептидных конструкций может привести к образованию гетеродимеров.
Настоящее изобретение также охватывает композицию, содержащую одну или более чем одну полипептидную конструкцию, как описано в данном документе. Композиция может содержать одну полипептидную конструкцию, как описано выше, или может представлять собой комбинацию полипептидных конструкций. Композиция также может содержать одну или несколько полипептидных конструкций по настоящему изобретению, соединенных с одной или несколькими молекулами-грузами. Например, без какого-либо ограничения, композиция может содержать одну или несколько полипептидных конструкций по настоящему изобретению, соединенных с цитотоксическим лекарственным средством, для получения конъюгата антитело-лекарственное средство (ADC) в соответствии с настоящим изобретением.
Композиция также может содержать фармацевтически приемлемый разбавитель, эксципиент или носитель. Разбавитель, эксципиент или носитель может быть любым подходящим разбавителем, эксципиентом или носителем, известным в данной области техники, и должен быть совместим с другими ингредиентами в композиции, с методом доставки композиции и не вреден для реципиента композиции. Композиция может быть в любой подходящей форме; например, композиция может быть обеспечена в форме суспензии, в форме порошка (например, но без ограничения, лиофилизированным или инкапсулированным), в форме капсулы или таблетки. Например, и без ограничения, когда композиция обеспечена в виде суспензии, носитель может содержать воду, солевой раствор, подходящий буфер или добавки для улучшения растворимости и/или стабильности; восстановление для получения суспензии осуществляют в буфере при подходящем значении рН для обеспечения жизнеспособности антитела или его фрагмента. Сухие порошки могут также включать добавки для улучшения стабильности и/или носители для увеличения массы/объема; например, и без ограничения, композиция в сухом порошке может содержать сахарозу или трегалозу. В конкретном неограничивающем примере композиция может быть составлена таким образом, чтобы доставлять антитело или его фрагмент в желудочно-кишечный тракт субъекта. Таким образом, композиция может включать инкапсуляцию, медленное высвобождение или другие подходящие технологии для доставки антитела или его фрагмента. Специалист в данной области может приготовить подходящие композиции, содержащие настоящие соединения.
Конструкции по настоящему изобретению можно использовать для лечения заболеваний или расстройств, связанных со сверхэкспрессией или избыточной активацией лигандов суперсемейства TGF-β. Заболевание или расстройство могут быть выбраны, но не ограничены ими, из рака, глазных заболеваний, фиброзных заболеваний или генетических нарушений соединительной ткани.
В области терапии рака недавно было продемонстрировано, что TGF-β является ключевым фактором, ингибирующим противоопухолевый ответ, вызываемый иммунотерапией, такой как ингибиторы иммунной контрольной точки (ICI) (Hahn & Akporiaye, 2006). В частности, терапевтический ответ на антитела ICI обусловлен, прежде всего, повторной активацией локализованных в опухоли Т-клеток. Резистентность к антителам ICI объясняется наличием иммуносупрессивных механизмов, которые приводят к нехватке Т-клеток в микроокружении опухоли. Таким образом, в настоящее время признано, что для выявления ответов у резистентных пациентов необходимо комбинировать антитела ICI с агентами, которые могут активировать Т-клетки и индуцировать их рекрутирование в опухоль, то есть возвращать фенотип опухоли «без Т-клеточного воспаления». В одной публикации отмечалось, что преодоление микроокружения опухоли без Т-клеточного воспаления является наиболее значительным следующим препятствием в иммуноонкологии (Gajewski, 2015).
Авторами было доказано с использованием проверочной ловушки TGF-β, T22d35, что блокирование TGF-β эффективно обращает фенотип опухоли «без Т-клеточного воспаления» (Zwaagstra et al, 2012). Это позиционирует анти-TGF-β молекулы как потенциальные синергетические комбинации с ICI и другими иммунотерапевтическими средствами. В подтверждение этого в исследовании 2014 года (Holtzhausen et al., постерная презентация ASCO) были изучены эффекты блокатора TGF-β при объединении с антителами против CTLA-4 на физиологически релевантной модели трансгенной меланомы. Исследование продемонстрировало, что хотя монотерапия антителами против CTLA-4 не подавляла прогрессирование меланомы, комбинация антагониста TGF-β и антитела против CTLA-4 значительно и синергически подавляла как рост первичной меланомы, так и метастазирование меланомы. Эти наблюдения коррелировали со значительным увеличением количества эффекторных Т-клеток в тканях меланомы.
В данном документе показано, что полипептиды по настоящему изобретению, имеющие основную структуру, которая представляет собой T22d35-Fc, значительно снижают рост опухоли на модели рака толстой кишки сингенной мыши MC-38. Таким образом, это позволяет позиционировать молекулы анти-TGF-β в потенциальной синергетической комбинации с другими средствами иммунотерапии.
Настоящие конструкции могут быть полезны для лечения фиброзных заболеваний, в том числе тех, которые поражают любой орган тела, включая, но не ограничиваясь ими, почки, легкие, печень, сердце, кожу и глаза. Эти заболевания включают, но не ограничиваются ими, хроническую обструктивную болезнь легких (ХОБЛ), гломерулонефрит, фиброз печени, постинфарктный фиброз сердца, рестеноз, системный склероз, фиброз, вызванный хирургической операцией на глазах, и рубцевание.
Также можно лечить генетические нарушения соединительной ткани и включают, но не ограничиваются ими, синдром Марфана (MFS) и несовершенный остеогенез (OI).
Настоящее изобретение будет дополнительно проиллюстрировано в следующих примерах. Однако следует понимать, что эти примеры предназначены только для иллюстративных целей и не должны использоваться каким-либо образом для ограничения объема настоящего изобретения.
Материалы и методы
Производство и очистка
Временное выражение CHO
Каждый из различных вариантов слитой конструкции TβRII-ECD (такие как T2m-Fc и T22d35-Fc) состоит из области Fc тяжелой цепи и включает сигнальную последовательность MDWTWRILFLVAAATGTHA (SEQ ID NO: 11) на своих N-концах. Области кодирования ДНК для конструкций были получены синтетически (Biobasic Inc. или Genescript USA Inc.) и были клонированы в сайты HindIII (5'-конец) и BamH1 (3'-конец) экспрессионного плазмидного вектора млекопитающих pTT5 (Durocher et al, 2002). Слитые белки были получены путем временной трансфекции клеток яичника китайского хомячка (CHO) тяжелой цепью T2m или T22d35, связанных с конструкцией тяжелой цепи IgG (T2m-Hc и T22d35-HC, соответственно). Вкратце, плазмидные ДНК T2m-HC или T22d35-HC были трансфецированы в культуру клеток CHO-3E7 объемом 2,5 и 4,6 л соответственно в среде FreeStyle F17 (Invitrogen), содержащей 4 ммоль/л глутамина и 0,1% Kolliphor p-188 (Sigma) и поддерживаемой при 37°С. Условия трансфекции были следующими: ДНК (80% плазмидной конструкции, 15% плазмиды AKT, 5% плазмиды GFP):PEI(полиэтиленимин)pro (соотношение 1:2,5): PEIpro (Polyplus) (соотношение = 1:2,5). Через 24 часа после трансфекции добавляли подачу 10% триптона N1 (TekniScience Inc.) и 0,5 ммоль вальпроевой кислоты (VPA, Sigma) и температуру сдвигали до 32°C, чтобы стимулировать выработку и секрецию слитых белков, а затем поддерживали в течение 15 дней после трансфекции, после чего клетки собирали. При окончательном сборе жизнеспособность клеток составила 89,6%.
Стабильная экспрессия пулом CHO
Пулы клеток CHOBRI/rcTA были получены путем трансфекции клеток вектором, экспрессирующим ген-мишень, кодирующий различные TβRII-ECD, связанные с Fc. На следующий день после трансфекции клетки центрифугировали в течение 5 мин при 250 об/мин и высевали при плотности 0,5×106 клеток/мл в селективную среду (среда PowerCHO2 с добавлением 50 мкмоль/л метионинсульфоксимина). Среду для отбора заменяли каждые 2-3 дня в течение 14-18 дней инокуляцией при 0,5×106 клеток/мл. Количество и жизнеспособность клеток измеряли с помощью автоматического счетчика клеток Cedex Analyser Cedex, как описано выше. Когда жизнеспособность клеток достигала более 95%, пулы инокулировали при 0,2×106 клеток/мл в колбах Эрленмейера на 125 или 250 мл. Для культуры с подпиткой инокулировали пулы клеток CHOBRI/rcTA, как описано выше. На третий день после инокуляции, когда плотность клеток достигла 3,5-4,5×106 клеток/мл, экспрессию рекомбинантного белка индуцировали добавлением 2 мкг/мл кумата. Концентрацию MSX доводили до 125 мкмоль/л и добавляли подкормку F12.7 (Irvine Scientific) с последующим сдвигом температуры до 32°C. Каждые 2-3 дня культуры снабжали 5% (об:об) F12,7 и отбирали образцы для определения концентрации рекомбинантного белка (pA-HPLC) и глюкозы (VITROS 350, Orthoclinical Diagnostics, USA). Глюкозу добавляли для поддержания минимальной концентрации 17 ммоль/л.
Очистка
Супернатант, собранный из клеток СНО, фильтровали (0,2 мкм) и наносили на колонку с белком A MabSelect Sure (GE Healthcare). Колонку промывали 2 объемами колонки PBS (фосфатно-солевой буферный раствор_, и белок элюировали 3 объемами колонки 0,1 моль/л цитрата натрия, рН 3,6. Чтобы максимизировать выход, проходящий поток повторно загружают в колонку с белком А и элюировали, как описано выше. Элюированные фракции нейтрализовали 1 моль/л Tris, а фракции, содержащие слитые белки, объединяли и затем загружали в колонку эксклюзивной хроматографии (SEC) Superdex S200 размером 26/60 Hi-Load (GE Healthcare), уравновешенную в буфере для препарата (DPBS (фосфатно-солевой буфер Дюльбекко) без Ca2+, без Mg2+). Белок элюировали с использованием 1 объема колонки буфераной смеси, собирали в последовательные фракции и детектировали по УФ-поглощению при 280 нм. Фракции SEC основного пика, содержащие слитые белки, затем объединяли и концентрировали. Целостность очищенных слитых белков Prot-A и SEC в объединенных фракциях дополнительно анализировали с помощью UPLC-SEC и SDS-PAGE (4-15% полиакриламид) в восстанавливающих и невосстанавливающих условиях (окрашивание SYPRO Ruby). Для UPLC-SEC 2-10 мкг белка в DPBS (Hyclone, минус Ca2+, минус Mg2+) впрыскивали в колонку Waters BEH200 SEC (1,7 мкм, 4,6×150 мм) и растворяли при скорости потока 0,4 мл/мин. в течение 8,5 мин при комнатной температуре, используя биосистему Waters Acquity UPLC H-класса. Пики белка были обнаружены при 280 нм (детектор Acquity PDA).
Клеточные линии
Клетки немелкоклеточного рака легкого человека A549 были приобретены в ATCC (Cat# CCL-185, Cedarlane, Burlington, ON). Клетки культивировали в Dulbecco's Modified Eagles Medium (DMEM) (среда Игла, модифицированная по способу Дульбекко) с добавлением 5% фетальной бычьей сыворотки (FBS). Клетки аденокарциномы толстой кишки мыши МС-38 были приобретены в Kerafast (Cat# ENH204, Бостон, MA) и культивированы в DMEM с добавлением 2 ммоль/л L-глютамина и 10% эмбриональной бычьей сыворотки. Обе клеточные линии поддерживали при 37°С в увлажненной атмосфере с добавлением 5% CO2.
Анализ высвобождения индуцированного TGF-β IL-11 из клеток A549
Клетки рака легкого человека A549 высевали в 96-луночные планшеты (5×103 клеток/лунку). На следующий день 10 пмоль/л TGF-β в полной среде в отсутствие или в присутствии серийного разведения слитого белка-ловушки TGF-β инкубировали в течение 30 мин при комнатной температуре перед добавлением к клеткам. После 21 ч инкубации (37°C, 5% CO2, увлажненная атмосфера) кондиционированную среду собирали и добавляли в планшеты MSD Streptavidin Gold (Meso Scale Diagnostics, Gaithersburg, MD), которые были покрыты 2 мкг/мл биотинилированного мышиного антитела против человеческого IL-11 (MAB618, R & D Systems, Миннеаполис, Миннесота). Через 18 ч (4°C) планшеты промывали PBS, содержащим 0,02% Tween 20, а затем добавляли 2 мкг/мл меченого SULFO-меткой козьего антитела против человеческого IL-11 (AF-218-NA, R&D Systems Minneapolis, MN) и чашки инкубировали в течение 1 часа при комнатной температуре. После окончательной промывки планшеты считывали на машине MESO QuickPlex SQ120 (Meso Scale Diagnostics, Gaithersburg, MD). Показания IL-11 выражали в процентах высвобождения IL-11 по сравнению с контрольными клетками, обработанными одним TGF-β. Graphpad Prism (алгоритм 4-PL ((логарифм (ингибитор) vs отклик - переменный наклон (четыре параметра)) использовался для расчета IC50 (опция автоматического выброса использовалась при необходимости).
Оценка in vivo на мышиной подкожной модели MC-38 сингенного мышиного рака толстой кишки
Самки мышей C57BL / 6-Elite (в возрасте 5-7 недель) были приобретены в Charles River Laboratories (Wilmington, MA). Тринадцати мышам C57BL/6 в день 0 инъецировали 3×105 клеток MC-38 подкожно в правый бок. Когда опухоли достигли объема 50-100 мм3 (день 5), животных делили на 2 группы и начинали лечение:
- Когорта 1 (7 животных): контрольный изотипа (CTL IgG; BioxCell InVivo MAb крысиный IgG2b, анти-KLH; клон LTF-2, Cat# BE0090); 200 мкг в 100 мкл фосфатно-солевого буфера (PBS), внутрибрюшинно (в/б) на 5, 7, 9 и 11 день.
- Когорта 2 (6 животных): T22d35-Fc, 5 мг/кг в 100 мкл PBS, т.е. в день 5, 9, 12 и 16.
Опухоли измеряли два раза в неделю с использованием цифровых штангенциркулей в течение 15 дней после начала лечения. Объемы опухолей рассчитывали по этим измерениям с использованием модифицированной эллипсоидальной формулы (Tvol=π/6×(длина×ширина×ширина)), описанной ранее (Tomayko et al., 1986).
Результаты и обсуждение
Дизайн фьюжн-конструкций
Чтобы создать интересующие ловушки TGF-β, мы создали конструкцию TβRII-ECD синглета (обозначенного T2m), связанного с другим таким синглетом, образовав тем самым дублет эктодомена (обозначенный T22d35), который был связан с N-концами тяжелых цепей Fc-области человеческого (h) IgG2 и Fc-области человеческого IgG1. На Фиг. 1 показаны схемы (Фиг. 1А) и аминокислотные последовательности (Фиг. 1B) T2m и T22d35. Эти модули были в конструкции, связанной с N-концом тяжелых цепей Fc-области IgG (Фиг. 2A) с использованием нескольких вариаций линкера (Фиг. 2E), чтобы генерировать варианты слитых конструкций T2m-Fc (Фиг. 2B) и T22d35-Fc (Фиг. 2C). Последовательности этих слитых конструкций показаны на Фиг. 2D. Авторы также разработали варианты T22d35-Fc, которые исследуют количество остатков цистеина в шарнирной области домена Fc, различные изотипы IgG (человеческий IgG1 против IgG2) и последовательности различной длины и природы в качестве линкеров между T22d35 и N-концом домена Fc (Фиг. 2E, 2F и 2G). Эти изменения нацелены на изучение и в конечном итоге оптимизацию функциональных и технологических характеристик конструкции T22d35-Fc.
Экспрессия и очистка
Очистка переходного материала СНО
Соответствующие слитые конструкции белка временно экспрессировали в клетках CHO-3E7 (см. Таблицу 1), после чего кондиционированную среду собирали и очищали с использованием аффинной колонки с белком A с последующей препаративной эксклюзионной хроматографией (SEC). Профили SEC-элюирования T2m-Fc (Фиг. 3A) и T22d35-Fc (Фиг. 4A) показали, что эти слитые белки являются относительно чистыми и лишены агрегатов. Фракции 6-11 (T2m-Fc) и 7-10 (T22d35-Fc) объединяли и концентрировали до 5,6 мг/мл (T2m-Fc) и 6,03 мг/мл (T22d35-Fc). Конечные выходы составили 267 мг и 168 мг для T2m-Fc и T22d35-Fc соответственно. Было показано, что конечные продукты (указанные SEC-объединенные фракции) имеют чистоту более 99% с помощью UPLC-SEC (Фиг. 3B и 4B). Оценка SDS-PAGE (Фиг. 3C и 4C, окрашивание Sypro RUBY) показывает полосы T2m-Fc и T22d35-Fc приблизительно 60 кДа и приблизительно 90 кДа в восстанавливающих условиях, тогда как могут быть обнаружены полосы приблизительно 90 кДа и 150 кДа, представляющие полностью собранные и высокочистые слитые белки T2m-Fc и T22d35-Fc соответственно в невосстанавливающих условиях. Обзор деталей производства и очистки можно найти в Таблице 1. Вместе эти результаты демонстрируют хорошую технологичность слитых белков T2m-Fc и T22d35-Fc.
Таблица 1: Получение (временные пулы) и детали очистки слитых белков T2m-Fc и T22d35-Fc.
Очистка материала стабильных пулов СНО
N- и С-концевые варианты конструкций T22d35, связанных с Fc , были стабильно экспрессированы в клетках CHOBRI/rcTA, чтобы сравнить их уровень экспрессии и некоторые из их биофизических свойств. Кодирующую область каждого варианта лигировали в плазмиды экспрессии клеток млекопитающих и после трансфекции отбирали обогащенный пул клеток, который стабильно экспрессировал каждый из вариантов. Основное различие между вариантами можно обнаружить в аминокислотной последовательности, составляющей линкерную область, которая отделяет дублет T22d35 от домена Fc (в случае N-концевых слитых конструкций), тогда как для С-концевых слитых конструкций, содержащих Fc разница между каждым из вариантов заключается в крайнем аминоконце белка (Таблица 2).
Таблица 2: Описание аминокислотных вариаций в линкерной области N-концевых и C-концевых конструкций T22d35, связанных с Fc (жирный шрифт: естественная линкерная последовательность; курсив: искусственная линкерная последовательность). Парные остатки цистеина в каждом из вариантов подчеркнуты.
Слитые белки очищали посредством аффинности к белку А и использовали 100 ммоль/л цитрат (рН 3,6) в качестве буфера для элюирования. Образцы элюированного слитого белка нейтрализовали 1 моль/л HEPES, затем подвергали замене буфера на DPBS с использованием спин-колонок Zeba (Таблица 3), в то время как целостность некоторых из очищенных слитых белков оценивали с помощью SDS-PAGE (Фиг. 5). Очистка каждого варианта была аналогичной. Хотя многие свойства были очень похожи между вариантами, потенциал агрегации, который свидетельствует о неправильном фолдинге, выявил некоторые различия. Агрегация белка может свидетельствовать о снижении конформационной стабильности и может привести к снижению активности, эффективности или действенности. Эксклюзионная хроматография ВЭЖХ (SEC-HPLC) была использована для определения чистоты каждого из N- и C-концевых вариантов конструкций, связанных с Fc. Этот метод позволяет точно измерять процентное содержание интактных мономерных частиц, а также присутствие примесей, таких как агрегаты и/или продукты разложения. Как показано на Фиг. 6, может наблюдаться разительная разница между вариантами T22d35, выраженными в виде N-концевых конструкций, связанных с Fc, и вариантами, выраженными в виде С-концевых слитых конструкций. В частности, процентное содержание интактного мономера (Фиг. 6А) составляло приблизительно 99% для всех пяти N-концевых вариантов слитых конструкций (SEQ ID NO: 10, SEQ ID NO: 14, SEQ ID NO: 17, SEQ ID NO: 20, SEQ ID NO: 23), тогда как это было заметно ниже для трех С-концевых слитых конструкций (SEQ ID NO: 26, SEQ ID NO: 27, SEQ ID NO: 28). Это значительное снижение процентного содержания неповрежденного мономера является результатом накопления агрегатов с более высокой молекулярной массой, наблюдаемых во всех С-концевых конструкциях, связанных с Fc (Фиг. 6В), а также увеличения фрагментов с более низкой молекулярной массой в двух из трех С-концевых конструкциях, связанных с Fc (Фиг. 6C). Кроме того, оценка титров отдельных продукций объемом 500 мл и средних титров N-концевых конструкций T22d35, связанных с Fc и С-концевых конструкций T22d35, содержащих Fc показывает, что N-концевые варианты конструкций T22d35, содержащих Fc могут быть получены при более высоких значениях выхода по сравнению с С-концевыми слитыми конструкциями (Таблица 4). Взятые вместе, эти результаты показывают, что существуют существенные и неожиданные преимущества для экспрессии дублета T22d35 на N-конце фрагментов, таких как Fc-часть иммуноглобулина. Взятые вместе, эти данные демонстрируют повышенную технологичность N-концевых Fc T22d35 фьюжн белков.
Таблица 3: Обзор выходов белка вариантов T22d35 после очистки 500 мл материала стабильного пула.
Таблица 4: Сравнение титров отдельных N- и C-концевых Fc T22d35 фьюжнов
Функциональная оценка in vitro
Анализ высвобождения IL-11 из клеток A549 использовали для сравнения эффективности нейтрализации TGF-β слитых белков T2m-Fc и T22d35-Fc и одноцепочечной конструкции дублет ловушки T22d35, не связанный с Fc, как показано на Фиг. 7A/B/C. Эти данные показывают, что для всех изотипов TGF-β активность T22d35-Fc превосходит эффективность T2m-Fc и одноцепочечной конструкции ловушки T22d35, не связанной с Fc с рассчитанной IC50 (Таблица 5), составляющей 0,003348 и 0,003908 наномоль/л для TGF-β1 и TGF-β3 соответственно. Эти значения демонстрируют эффективность, которая, по крайней мере, в 970 раз и, по крайней мере, в 240 раз выше, чем для T22d35 (IC50=3,253 и 0,9491 наномоль/л, в отношении TGF-β 1 и TGF-β3, соответственно), а также в 615 и 24 раз выше, чем для T2m-Fc (IC50=2,059 и 0,0943 наномоль/л, в отношении TGF-β1 и TGF-β3 соответственно). Кроме того, T22d35-Fc нейтрализует TGF-β2, хотя и в значительно меньшей степени, чем TGF-β1 и -β3. Напротив, нейтрализация TGF-β2 не наблюдается ни для одноцепочечной ловушки T2m-Fc, ни для T22d35. Следует отметить, что, хотя эффективность нейтрализации ловушки T22d35-Fc схожа в отношении TGF-β1 и -β3, вариант T2m-Fc показал приблизительно в 22 раза более высокую эффективность нейтрализации для TGF-β3 по сравнению с TGF-β1 (2,059 наномоль/л и 0,0943 наномоль/л соответственно). Оценка дополнительных N-концевых конструкций T22d35, связанных с Fc [T22d35-Fc-IgG2-v2 (CC), T22d35-Fc-IgG1-v1 (CC), T22d35-Fc-IgG1-v2 (SCC) и T22d35-Fc -IgG1-v3 (GSL-CC)] (Фиг. 8, Таблица 6) показала, что все эти слитые конструкции демонстрируют сопоставимую эффективность нейтрализации TGF-β1, которые были очень похожи на эффективность T22d35-Fc. Дополнительная оценка варианта T22d35-Fc-IgG1-v1 (CC) (Фиг. 9) подтверждает, что в соответствии с вариантом T22d35-Fc его эффективность нейтрализации в отношении TGF-β1 и -β3 очень схожа (IC50=0,003327 наномоль/л и 0,003251 наномоль/л соответственно), тогда как эта эффективность намного ниже в отношении TGF-β2 (IC50 = 17,33 наномоль/л).
Таблица 5: Обзор статистической оценки кривых, показанных на Фиг. 5, с использованием алгоритма 4-PL (логарифм (ингибитор) vs отклик - переменный наклон (четыре параметра)), доступного в Graphpad Prism.
Таблица 6: Обзор статистической оценки кривых, показанных на Фиг. 7, с использованием алгоритма 4-PL (логарифм (ингибитор) в сравнении с откликом - переменный наклон (четыре параметра)), доступного в Graphpad Prism.
Функциональная оценка in vivo
Слитый белок T22d35-Fc (SEQ ID NO: 10) оценивали in vivo с использованием модели сингенной карциномы ободочной кишки мыши MC-38 (Фиг. 9). Рост опухоли у животных, которых лечили слитой конструкцией T22d35-Fc, сравнивали с ростом опухоли у животных, которых лечили контрольным IgG (CTL IgG). Как показано на Фиг.9, никаких существенных различий в росте опухоли не наблюдалось до 11-го дня после обработки, однако на 15-й день можно наблюдать значительное уменьшение роста опухоли в объеме у животных, получавших T22d35-Fc, по сравнению с CTL IgG (двухсторонний ANOVA). Эти данные показывают, что введение T22d35-Fc вызывало значительное ингибирование роста опухолей MC-38 по сравнению с группой, получавшей CTL IgG, предполагая, что блокирование TGF-β in vivo может аннулировать рост опухолей в этой сингенной модели колоректального рака.
Список последовательностей
ССЫЛКИ
Все патенты, патентные заявки и публикации, упомянутые в заявке, перечислены ниже.
Arteaga CL (2006) Inhibition of TGFβeta signaling in cancer therapy. Curr Opin Genet Dev 16: 30-37
De Crescenzo G, Grothe S, Zwaagstra J, Tsang M, O'Connor-McCourt MD (2001) Real-time monitoring of the interactions of transforming growth factor-beta (TGF-beta ) isoforms with latency-associated protein and the ectodomains of the TGF-beta type II and III receptors reveals different kinetic models and stoichiometries of binding. J Biol Chem 276: 29632-29643
Durocher Y, Perret S, Kamen A (2002) High-level and high-throughput recombinant protein production by transient transfection of suspension-growing human 293-EBNA1 cells. Nucleic Acids Res 30: E9
Economides AN, Carpenter LR, Rudge JS, Wong V, Koehler-Stec EM, Hartnett C, Pyles EA, Xu X, Daly TJ, Young MR, Fandl JP, Lee F, Carver S, McNay J, Bailey K, Ramakanth S, Hutabarat R, Huang TT, Radziejewski C, Yancopoulos GD, Stahl N (2003) Cytokine traps: multi-component, high-affinity blockers of cytokine action. Nat Med 9: 47-52
Eisenberg D, Schwarz E, Komaromy M, Wall R (1984) Analysis of membrane and surface protein sequences with the hydrophobic moment plot. J Mol Biol 179: 125-142
Gajewski TF (2015) The Next Hurdle in Cancer Immunotherapy: Overcoming the Non-T-Cell-Inflamed Tumor Microenvironment. Semin Oncol 42: 663-671
Garberg P, Ball M, Borg N, Cecchelli R, Fenart L, Hurst RD, Lindmark T, Mabondzo A, Nilsson JE, Raub TJ, Stanimirovic D, Terasaki T, Oberg JO, Osterberg T (2005) In vitro models for the blood-brain barrier. Toxicol In Vitro 19: 299-334
Hahn T, Akporiaye ET (2006) Targeting transforming growth factor beta to enhance cancer immunotherapy. Curr Oncol 13: 141-143
Haqqani AS, Caram-Salas N, Ding W, Brunette E, Delaney CE, Baumann E, Boileau E, Stanimirovic D (2013) Multiplexed evaluation of serum and CSF pharmacokinetics of brain-targeting single-domain antibodies using a NanoLC-SRM-ILIS method. Mol Pharm 10: 1542-1556
Hawinkels LJ, Ten Dijke P (2011) Exploring anti-TGF-beta therapies in cancer and fibrosis. Growth Factors 29: 140-152
Holash J, Davis S, Papadopoulos N, Croll SD, Ho L, Russell M, Boland P, Leidich R, Hylton D, Burova E, Ioffe E, Huang T, Radziejewski C, Bailey K, Fandl JP, Daly T, Wiegand SJ, Yancopoulos GD, Rudge JS (2002) VEGF-Trap: a VEGF blocker with potent antitumor effects. Proc Natl Acad Sci U S A 99: 11393-11398
Jin P, Zhang J, Beryt M, Turin L, Brdlik C, Feng Y, Bai X, Liu J, Jorgensen B, Shepard HM (2009) Rational optimization of a bispecific ligand trap targeting EGF receptor family ligands. Mol Med 15: 11-20
Li MO, Wan YY, Sanjabi S, Robertson AK, Flavell RA (2006) Transforming growth factor-beta regulation of immune responses. Annu Rev Immunol 24: 99-146
Massague J, Blain SW, Lo RS (2000) TGFβeta signaling in growth control, cancer, and heritable disorders. Cell 103: 295-309
Mourskaia AA, Northey JJ, Siegel PM (2007) Targeting aberrant TGF-beta signaling in pre-clinical models of cancer. Anticancer Agents Med Chem 7: 504-514
Rodgarkia-Dara C, Vejda S, Erlach N, Losert A, Bursch W, Berger W, Schulte-Hermann R, Grusch M (2006) The activin axis in liver biology and disease. Mutat Res 613: 123-137
Santarpia M, Gonzalez-Cao M, Viteri S, Karachaliou N, Altavilla G, Rosell R (2015) Programmed cell death protein-1/programmed cell death ligand-1 pathway inhibition and predictive biomarkers: understanding transforming growth factor-beta role. Transl Lung Cancer Res 4: 728-742
Thiery JP, Acloque H, Huang RY, Nieto MA (2009) Epithelial-mesenchymal transitions in development and disease. Cell 139: 871-890
Wojtowicz-Praga S (2003) Reversal of tumor-induced immunosuppression by TGF-beta inhibitors. Invest New Drugs 21: 21-32
Yang L, Pang Y, Moses HL (2010) TGF-beta and immune cells: an important regulatory axis in the tumor microenvironment and progression. Trends Immunol 31: 220-227
Yang X, Ambrogelly A (2014) Enlarging the repertoire of therapeutic monoclonal antibodies platforms: domesticating half molecule exchange to produce stable IgG4 and IgG1 bispecific antibodies. Curr Opin Biotechnol 30: 225-229
Zheng X, Koropatnick J, Chen D, Velenosi T, Ling H, Zhang X, Jiang N, Navarro B, Ichim TE, Urquhart B, Min W (2013) Silencing IDO in dendritic cells: a novel approach to enhance cancer immunotherapy in a murine breast cancer model. Int J Cancer 132: 967-977
Zwaagstra JC, Sulea T, Baardsnes J, Lenferink AE, Collins C, Cantin C, Paul-Roc B, Grothe S, Hossain S, Richer LP, L'Abbe D, Tom R, Cass B, Durocher Y, O'Connor-McCourt MD (2012) Engineering and therapeutic application of single-chain bivalent TGF-beta family traps. Mol Cancer Ther 11: 1477-1487
WO/1995/04069
WO/2004/076670
WO 2008/113185
WO 2010/031168
US 8815247
US 62777375
US 2015/0225483
WO 01/83525;
WO 2005/028517;
WO 2008/113185;
WO 2008/157367;
WO 2010/003118;
WO 2010/099219;
WO 2012/071649;
WO 2012/142515;
WO 2013/000234;
US 5693607;
US 2005/0203022;
US 2007/0244042;
US 8318135;
US 8658135;
US 8815247;
US 2015/0225483; и
US 2015/0056199.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> НЭШНЛ РИСЕЧ КАУНСИЛ ОФ КАНАДА
ЛЕНФЕРИНК Энн Э.Дж.
ЗВАГСТРА Джон К.
СУЛИ Трайан
О'КОННОР-МАККОРТ Морин Д.
<120> СЛИТЫЕ МОЛЕКУЛЫ ЭКТОДОМЕНА РЕЦЕПТОРА TGF-БЕТА И ИХ
ПРИМЕНЕНИЯ
<130> 2017-074-03
<140> PCT/IB2018/051320
<141> 2018-03-01
<150> US 62/465,969
<151> 2017-03-02
<150> US 62/468,586
<151> 2017-03-08
<160> 33
<170> PatentIn версии 3.5
<210> 1
<211> 136
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> TRII-ECD, включающий структурный домен и его природные линкеры
(также называемый T2m)
<400> 1
Ile Pro Pro His Val Gln Lys Ser Val Asn Asn Asp Met Ile Val Thr
1 5 10 15
Asp Asn Asn Gly Ala Val Lys Phe Pro Gln Leu Cys Lys Phe Cys Asp
20 25 30
Val Arg Phe Ser Thr Cys Asp Asn Gln Lys Ser Cys Met Ser Asn Cys
35 40 45
Ser Ile Thr Ser Ile Cys Glu Lys Pro Gln Glu Val Cys Val Ala Val
50 55 60
Trp Arg Lys Asn Asp Glu Asn Ile Thr Leu Glu Thr Val Cys His Asp
65 70 75 80
Pro Lys Leu Pro Tyr His Asp Phe Ile Leu Glu Asp Ala Ala Ser Pro
85 90 95
Lys Cys Ile Met Lys Glu Lys Lys Lys Pro Gly Glu Thr Phe Phe Met
100 105 110
Cys Ser Cys Ser Ser Asp Glu Cys Asn Asp Asn Ile Ile Phe Ser Glu
115 120 125
Glu Tyr Asn Thr Ser Asn Pro Asp
130 135
<210> 2
<211> 126
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Структурный домен TRII-ECD с его природным N-концевым
линкером
<400> 2
Ile Pro Pro His Val Gln Lys Ser Val Asn Asn Asp Met Ile Val Thr
1 5 10 15
Asp Asn Asn Gly Ala Val Lys Phe Pro Gln Leu Cys Lys Phe Cys Asp
20 25 30
Val Arg Phe Ser Thr Cys Asp Asn Gln Lys Ser Cys Met Ser Asn Cys
35 40 45
Ser Ile Thr Ser Ile Cys Glu Lys Pro Gln Glu Val Cys Val Ala Val
50 55 60
Trp Arg Lys Asn Asp Glu Asn Ile Thr Leu Glu Thr Val Cys His Asp
65 70 75 80
Pro Lys Leu Pro Tyr His Asp Phe Ile Leu Glu Asp Ala Ala Ser Pro
85 90 95
Lys Cys Ile Met Lys Glu Lys Lys Lys Pro Gly Glu Thr Phe Phe Met
100 105 110
Cys Ser Cys Ser Ser Asp Glu Cys Asn Asp Asn Ile Ile Phe
115 120 125
<210> 3
<211> 111
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Структурный домен TRII-ECD с его природными C-концевым
линкером
<400> 3
Gln Leu Cys Lys Phe Cys Asp Val Arg Phe Ser Thr Cys Asp Asn Gln
1 5 10 15
Lys Ser Cys Met Ser Asn Cys Ser Ile Thr Ser Ile Cys Glu Lys Pro
20 25 30
Gln Glu Val Cys Val Ala Val Trp Arg Lys Asn Asp Glu Asn Ile Thr
35 40 45
Leu Glu Thr Val Cys His Asp Pro Lys Leu Pro Tyr His Asp Phe Ile
50 55 60
Leu Glu Asp Ala Ala Ser Pro Lys Cys Ile Met Lys Glu Lys Lys Lys
65 70 75 80
Pro Gly Glu Thr Phe Phe Met Cys Ser Cys Ser Ser Asp Glu Cys Asn
85 90 95
Asp Asn Ile Ile Phe Ser Glu Glu Tyr Asn Thr Ser Asn Pro Asp
100 105 110
<210> 4
<211> 101
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Структурный домен TRII-ECD
<400> 4
Gln Leu Cys Lys Phe Cys Asp Val Arg Phe Ser Thr Cys Asp Asn Gln
1 5 10 15
Lys Ser Cys Met Ser Asn Cys Ser Ile Thr Ser Ile Cys Glu Lys Pro
20 25 30
Gln Glu Val Cys Val Ala Val Trp Arg Lys Asn Asp Glu Asn Ile Thr
35 40 45
Leu Glu Thr Val Cys His Asp Pro Lys Leu Pro Tyr His Asp Phe Ile
50 55 60
Leu Glu Asp Ala Ala Ser Pro Lys Cys Ile Met Lys Glu Lys Lys Lys
65 70 75 80
Pro Gly Glu Thr Phe Phe Met Cys Ser Cys Ser Ser Asp Glu Cys Asn
85 90 95
Asp Asn Ile Ile Phe
100
<210> 5
<211> 272
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Структурные домены слитого димера TRII-ECD-TRII-ECD с их
природнымие линкерами (также называемого T22d35)
<400> 5
Ile Pro Pro His Val Gln Lys Ser Val Asn Asn Asp Met Ile Val Thr
1 5 10 15
Asp Asn Asn Gly Ala Val Lys Phe Pro Gln Leu Cys Lys Phe Cys Asp
20 25 30
Val Arg Phe Ser Thr Cys Asp Asn Gln Lys Ser Cys Met Ser Asn Cys
35 40 45
Ser Ile Thr Ser Ile Cys Glu Lys Pro Gln Glu Val Cys Val Ala Val
50 55 60
Trp Arg Lys Asn Asp Glu Asn Ile Thr Leu Glu Thr Val Cys His Asp
65 70 75 80
Pro Lys Leu Pro Tyr His Asp Phe Ile Leu Glu Asp Ala Ala Ser Pro
85 90 95
Lys Cys Ile Met Lys Glu Lys Lys Lys Pro Gly Glu Thr Phe Phe Met
100 105 110
Cys Ser Cys Ser Ser Asp Glu Cys Asn Asp Asn Ile Ile Phe Ser Glu
115 120 125
Glu Tyr Asn Thr Ser Asn Pro Asp Ile Pro Pro His Val Gln Lys Ser
130 135 140
Val Asn Asn Asp Met Ile Val Thr Asp Asn Asn Gly Ala Val Lys Phe
145 150 155 160
Pro Gln Leu Cys Lys Phe Cys Asp Val Arg Phe Ser Thr Cys Asp Asn
165 170 175
Gln Lys Ser Cys Met Ser Asn Cys Ser Ile Thr Ser Ile Cys Glu Lys
180 185 190
Pro Gln Glu Val Cys Val Ala Val Trp Arg Lys Asn Asp Glu Asn Ile
195 200 205
Thr Leu Glu Thr Val Cys His Asp Pro Lys Leu Pro Tyr His Asp Phe
210 215 220
Ile Leu Glu Asp Ala Ala Ser Pro Lys Cys Ile Met Lys Glu Lys Lys
225 230 235 240
Lys Pro Gly Glu Thr Phe Phe Met Cys Ser Cys Ser Ser Asp Glu Cys
245 250 255
Asn Asp Asn Ile Ile Phe Ser Glu Glu Tyr Asn Thr Ser Asn Pro Asp
260 265 270
<210> 6
<211> 34
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Природный линкер TRII-ECD
<400> 6
Ser Glu Glu Tyr Asn Thr Ser Asn Pro Asp Ile Pro Pro His Val Gln
1 5 10 15
Lys Ser Val Asn Asn Asp Met Ile Val Thr Asp Asn Asn Gly Ala Val
20 25 30
Lys Phe
<210> 7
<211> 24
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> N-концевой природный линкер TRII-ECD
<400> 7
Ile Pro Pro His Val Gln Lys Ser Val Asn Asn Asp Met Ile Val Thr
1 5 10 15
Asp Asn Asn Gly Ala Val Lys Phe
20
<210> 8
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> С-концевой природный линкер TRII-ECD
<400> 8
Ser Glu Glu Tyr Asn Thr Ser Asn Pro Asp
1 5 10
<210> 9
<211> 363
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Конструкция T2m-Fc из T2m, связанного с областью Fc hIgG2Fc(CCCC)
<400> 9
Ile Pro Pro His Val Gln Lys Ser Val Asn Asn Asp Met Ile Val Thr
1 5 10 15
Asp Asn Asn Gly Ala Val Lys Phe Pro Gln Leu Cys Lys Phe Cys Asp
20 25 30
Val Arg Phe Ser Thr Cys Asp Asn Gln Lys Ser Cys Met Ser Asn Cys
35 40 45
Ser Ile Thr Ser Ile Cys Glu Lys Pro Gln Glu Val Cys Val Ala Val
50 55 60
Trp Arg Lys Asn Asp Glu Asn Ile Thr Leu Glu Thr Val Cys His Asp
65 70 75 80
Pro Lys Leu Pro Tyr His Asp Phe Ile Leu Glu Asp Ala Ala Ser Pro
85 90 95
Lys Cys Ile Met Lys Glu Lys Lys Lys Pro Gly Glu Thr Phe Phe Met
100 105 110
Cys Ser Cys Ser Ser Asp Glu Cys Asn Asp Asn Ile Ile Phe Ser Glu
115 120 125
Glu Tyr Asn Thr Ser Asn Pro Asp Glu Arg Lys Cys Cys Val Glu Cys
130 135 140
Pro Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val Phe Leu Phe
145 150 155 160
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
165 170 175
Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Gln Phe
180 185 190
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
195 200 205
Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Val Val Ser Val Leu Thr
210 215 220
Val Val His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
225 230 235 240
Ser Asn Lys Gly Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Thr
245 250 255
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg
260 265 270
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
275 280 285
Phe Tyr Pro Ser Asp Ile Ser Val Glu Trp Glu Ser Asn Gly Gln Pro
290 295 300
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Met Leu Asp Ser Asp Gly Ser
305 310 315 320
Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln
325 330 335
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
340 345 350
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
355 360
<210> 10
<211> 499
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Конструкция T22d35-Fc из T22d35, связанной с областью Fc hIgG2Fc
(CCCC)
<400> 10
Ile Pro Pro His Val Gln Lys Ser Val Asn Asn Asp Met Ile Val Thr
1 5 10 15
Asp Asn Asn Gly Ala Val Lys Phe Pro Gln Leu Cys Lys Phe Cys Asp
20 25 30
Val Arg Phe Ser Thr Cys Asp Asn Gln Lys Ser Cys Met Ser Asn Cys
35 40 45
Ser Ile Thr Ser Ile Cys Glu Lys Pro Gln Glu Val Cys Val Ala Val
50 55 60
Trp Arg Lys Asn Asp Glu Asn Ile Thr Leu Glu Thr Val Cys His Asp
65 70 75 80
Pro Lys Leu Pro Tyr His Asp Phe Ile Leu Glu Asp Ala Ala Ser Pro
85 90 95
Lys Cys Ile Met Lys Glu Lys Lys Lys Pro Gly Glu Thr Phe Phe Met
100 105 110
Cys Ser Cys Ser Ser Asp Glu Cys Asn Asp Asn Ile Ile Phe Ser Glu
115 120 125
Glu Tyr Asn Thr Ser Asn Pro Asp Ile Pro Pro His Val Gln Lys Ser
130 135 140
Val Asn Asn Asp Met Ile Val Thr Asp Asn Asn Gly Ala Val Lys Phe
145 150 155 160
Pro Gln Leu Cys Lys Phe Cys Asp Val Arg Phe Ser Thr Cys Asp Asn
165 170 175
Gln Lys Ser Cys Met Ser Asn Cys Ser Ile Thr Ser Ile Cys Glu Lys
180 185 190
Pro Gln Glu Val Cys Val Ala Val Trp Arg Lys Asn Asp Glu Asn Ile
195 200 205
Thr Leu Glu Thr Val Cys His Asp Pro Lys Leu Pro Tyr His Asp Phe
210 215 220
Ile Leu Glu Asp Ala Ala Ser Pro Lys Cys Ile Met Lys Glu Lys Lys
225 230 235 240
Lys Pro Gly Glu Thr Phe Phe Met Cys Ser Cys Ser Ser Asp Glu Cys
245 250 255
Asn Asp Asn Ile Ile Phe Ser Glu Glu Tyr Asn Thr Ser Asn Pro Asp
260 265 270
Glu Arg Lys Cys Cys Val Glu Cys Pro Pro Cys Pro Ala Pro Pro Val
275 280 285
Ala Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
290 295 300
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
305 310 315 320
His Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu
325 330 335
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr
340 345 350
Phe Arg Val Val Ser Val Leu Thr Val Val His Gln Asp Trp Leu Asn
355 360 365
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ala Pro
370 375 380
Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Gln Pro Arg Glu Pro Gln
385 390 395 400
Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val
405 410 415
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ser Val
420 425 430
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
435 440 445
Pro Met Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr
450 455 460
Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val
465 470 475 480
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
485 490 495
Ser Pro Gly
<210> 11
<211> 19
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Сигнальный пептид
<400> 11
Met Asp Trp Thr Trp Arg Ile Leu Phe Leu Val Ala Ala Ala Thr Gly
1 5 10 15
Thr His Ala
<210> 12
<211> 227
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Вариант области Fc hIgG2Fc(CCCC)
<400> 12
Glu Arg Lys Cys Cys Val Glu Cys Pro Pro Cys Pro Ala Pro Pro Val
1 5 10 15
Ala Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
20 25 30
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
35 40 45
His Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu
50 55 60
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr
65 70 75 80
Phe Arg Val Val Ser Val Leu Thr Val Val His Gln Asp Trp Leu Asn
85 90 95
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ala Pro
100 105 110
Ile Glu Lys Thr Ile Ser Lys Thr Lys Gly Gln Pro Arg Glu Pro Gln
115 120 125
Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val
130 135 140
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ser Val
145 150 155 160
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
165 170 175
Pro Met Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr
180 185 190
Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val
195 200 205
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
210 215 220
Ser Pro Gly
225
<210> 13
<211> 25
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Природный линкер T22d35-Fc с шарнирной областью hIgG2Fc (CCCC)
<400> 13
Ser Glu Glu Tyr Asn Thr Ser Asn Pro Asp Glu Arg Lys Cys Cys Val
1 5 10 15
Glu Cys Pro Pro Cys Pro Ala Pro Pro
20 25
<210> 14
<211> 496
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Конструкция T22d35-Fc-IgG1-v1(CC) из T22d35, связанной с областью Fc
hIgG1Fc(CC)
<400> 14
Ile Pro Pro His Val Gln Lys Ser Val Asn Asn Asp Met Ile Val Thr
1 5 10 15
Asp Asn Asn Gly Ala Val Lys Phe Pro Gln Leu Cys Lys Phe Cys Asp
20 25 30
Val Arg Phe Ser Thr Cys Asp Asn Gln Lys Ser Cys Met Ser Asn Cys
35 40 45
Ser Ile Thr Ser Ile Cys Glu Lys Pro Gln Glu Val Cys Val Ala Val
50 55 60
Trp Arg Lys Asn Asp Glu Asn Ile Thr Leu Glu Thr Val Cys His Asp
65 70 75 80
Pro Lys Leu Pro Tyr His Asp Phe Ile Leu Glu Asp Ala Ala Ser Pro
85 90 95
Lys Cys Ile Met Lys Glu Lys Lys Lys Pro Gly Glu Thr Phe Phe Met
100 105 110
Cys Ser Cys Ser Ser Asp Glu Cys Asn Asp Asn Ile Ile Phe Ser Glu
115 120 125
Glu Tyr Asn Thr Ser Asn Pro Asp Ile Pro Pro His Val Gln Lys Ser
130 135 140
Val Asn Asn Asp Met Ile Val Thr Asp Asn Asn Gly Ala Val Lys Phe
145 150 155 160
Pro Gln Leu Cys Lys Phe Cys Asp Val Arg Phe Ser Thr Cys Asp Asn
165 170 175
Gln Lys Ser Cys Met Ser Asn Cys Ser Ile Thr Ser Ile Cys Glu Lys
180 185 190
Pro Gln Glu Val Cys Val Ala Val Trp Arg Lys Asn Asp Glu Asn Ile
195 200 205
Thr Leu Glu Thr Val Cys His Asp Pro Lys Leu Pro Tyr His Asp Phe
210 215 220
Ile Leu Glu Asp Ala Ala Ser Pro Lys Cys Ile Met Lys Glu Lys Lys
225 230 235 240
Lys Pro Gly Glu Thr Phe Phe Met Cys Ser Cys Ser Ser Asp Glu Cys
245 250 255
Asn Asp Asn Ile Ile Phe Ser Glu Glu Tyr Asn Thr Ser Asn Pro Asp
260 265 270
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
275 280 285
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
290 295 300
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
305 310 315 320
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
325 330 335
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
340 345 350
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
355 360 365
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
370 375 380
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
385 390 395 400
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
405 410 415
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
420 425 430
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
435 440 445
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
450 455 460
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
465 470 475 480
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
485 490 495
<210> 15
<211> 224
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Вариант области Fc hIgG1Fc(CC)
<400> 15
Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro
1 5 10 15
Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser
20 25 30
Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp
35 40 45
Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn
50 55 60
Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val
65 70 75 80
Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu
85 90 95
Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys
100 105 110
Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr
115 120 125
Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr
130 135 140
Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu
145 150 155 160
Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu
165 170 175
Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys
180 185 190
Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu
195 200 205
Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
210 215 220
<210> 16
<211> 21
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Природный линкер T22d35-Fc-IgG1-v1(CC) с шарнирной областью
hIgG1Fc (CC)
<400> 16
Ser Glu Glu Tyr Asn Thr Ser Asn Pro Asp Thr His Thr Cys Pro Pro
1 5 10 15
Cys Pro Ala Pro Glu
20
<210> 17
<211> 504
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Конструкция T22d35-Fc-IgG1-v2(SCC) из T22d35, связанной с областью Fc
hIgG1Fc
<400> 17
Ile Pro Pro His Val Gln Lys Ser Val Asn Asn Asp Met Ile Val Thr
1 5 10 15
Asp Asn Asn Gly Ala Val Lys Phe Pro Gln Leu Cys Lys Phe Cys Asp
20 25 30
Val Arg Phe Ser Thr Cys Asp Asn Gln Lys Ser Cys Met Ser Asn Cys
35 40 45
Ser Ile Thr Ser Ile Cys Glu Lys Pro Gln Glu Val Cys Val Ala Val
50 55 60
Trp Arg Lys Asn Asp Glu Asn Ile Thr Leu Glu Thr Val Cys His Asp
65 70 75 80
Pro Lys Leu Pro Tyr His Asp Phe Ile Leu Glu Asp Ala Ala Ser Pro
85 90 95
Lys Cys Ile Met Lys Glu Lys Lys Lys Pro Gly Glu Thr Phe Phe Met
100 105 110
Cys Ser Cys Ser Ser Asp Glu Cys Asn Asp Asn Ile Ile Phe Ser Glu
115 120 125
Glu Tyr Asn Thr Ser Asn Pro Asp Ile Pro Pro His Val Gln Lys Ser
130 135 140
Val Asn Asn Asp Met Ile Val Thr Asp Asn Asn Gly Ala Val Lys Phe
145 150 155 160
Pro Gln Leu Cys Lys Phe Cys Asp Val Arg Phe Ser Thr Cys Asp Asn
165 170 175
Gln Lys Ser Cys Met Ser Asn Cys Ser Ile Thr Ser Ile Cys Glu Lys
180 185 190
Pro Gln Glu Val Cys Val Ala Val Trp Arg Lys Asn Asp Glu Asn Ile
195 200 205
Thr Leu Glu Thr Val Cys His Asp Pro Lys Leu Pro Tyr His Asp Phe
210 215 220
Ile Leu Glu Asp Ala Ala Ser Pro Lys Cys Ile Met Lys Glu Lys Lys
225 230 235 240
Lys Pro Gly Glu Thr Phe Phe Met Cys Ser Cys Ser Ser Asp Glu Cys
245 250 255
Asn Asp Asn Ile Ile Phe Ser Glu Glu Tyr Asn Thr Ser Asn Pro Asp
260 265 270
Val Glu Pro Lys Ser Ser Asp Lys Thr His Thr Cys Pro Pro Cys Pro
275 280 285
Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
290 295 300
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
305 310 315 320
Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr
325 330 335
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
340 345 350
Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
355 360 365
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
370 375 380
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
385 390 395 400
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu
405 410 415
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
420 425 430
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
435 440 445
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
450 455 460
Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val
465 470 475 480
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
485 490 495
Lys Ser Leu Ser Leu Ser Pro Gly
500
<210> 18
<211> 232
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Вариант области Fc hIgG1Fc(SCC)
<400> 18
Val Glu Pro Lys Ser Ser Asp Lys Thr His Thr Cys Pro Pro Cys Pro
1 5 10 15
Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
20 25 30
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
35 40 45
Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr
50 55 60
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
65 70 75 80
Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
85 90 95
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
100 105 110
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
115 120 125
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu
130 135 140
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
145 150 155 160
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
165 170 175
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
180 185 190
Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val
195 200 205
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
210 215 220
Lys Ser Leu Ser Leu Ser Pro Gly
225 230
<210> 19
<211> 29
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Природный линкер T22d35-Fc-IgG1-v2(SCC), с шарнирной областью
hIgG1Fc (SCC)
<400> 19
Ser Glu Glu Tyr Asn Thr Ser Asn Pro Asp Val Glu Pro Lys Ser Ser
1 5 10 15
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
20 25
<210> 20
<211> 507
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Конструкция T22d35-Fc-IgG1-v3(GSL-CC) из T22d35, с
областью Fc hIgG1Fc (CC), включающей искусственный линкер GS
<400> 20
Ile Pro Pro His Val Gln Lys Ser Val Asn Asn Asp Met Ile Val Thr
1 5 10 15
Asp Asn Asn Gly Ala Val Lys Phe Pro Gln Leu Cys Lys Phe Cys Asp
20 25 30
Val Arg Phe Ser Thr Cys Asp Asn Gln Lys Ser Cys Met Ser Asn Cys
35 40 45
Ser Ile Thr Ser Ile Cys Glu Lys Pro Gln Glu Val Cys Val Ala Val
50 55 60
Trp Arg Lys Asn Asp Glu Asn Ile Thr Leu Glu Thr Val Cys His Asp
65 70 75 80
Pro Lys Leu Pro Tyr His Asp Phe Ile Leu Glu Asp Ala Ala Ser Pro
85 90 95
Lys Cys Ile Met Lys Glu Lys Lys Lys Pro Gly Glu Thr Phe Phe Met
100 105 110
Cys Ser Cys Ser Ser Asp Glu Cys Asn Asp Asn Ile Ile Phe Ser Glu
115 120 125
Glu Tyr Asn Thr Ser Asn Pro Asp Ile Pro Pro His Val Gln Lys Ser
130 135 140
Val Asn Asn Asp Met Ile Val Thr Asp Asn Asn Gly Ala Val Lys Phe
145 150 155 160
Pro Gln Leu Cys Lys Phe Cys Asp Val Arg Phe Ser Thr Cys Asp Asn
165 170 175
Gln Lys Ser Cys Met Ser Asn Cys Ser Ile Thr Ser Ile Cys Glu Lys
180 185 190
Pro Gln Glu Val Cys Val Ala Val Trp Arg Lys Asn Asp Glu Asn Ile
195 200 205
Thr Leu Glu Thr Val Cys His Asp Pro Lys Leu Pro Tyr His Asp Phe
210 215 220
Ile Leu Glu Asp Ala Ala Ser Pro Lys Cys Ile Met Lys Glu Lys Lys
225 230 235 240
Lys Pro Gly Glu Thr Phe Phe Met Cys Ser Cys Ser Ser Asp Glu Cys
245 250 255
Asn Asp Asn Ile Ile Phe Ser Glu Glu Tyr Asn Thr Ser Asn Pro Asp
260 265 270
Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Thr His Thr Cys Pro
275 280 285
Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe
290 295 300
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
305 310 315 320
Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe
325 330 335
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
340 345 350
Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
355 360 365
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
370 375 380
Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala
385 390 395 400
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg
405 410 415
Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
420 425 430
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
435 440 445
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
450 455 460
Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln
465 470 475 480
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
485 490 495
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
500 505
<210> 21
<211> 11
<212> DNA
<213> Искусственная последовательность
<220>
<223> Искусственный GS-линкер слитой конструкции T22d35-Fc-IgG1-v3 (GSL-CC)
<400> 21
gggsgggsgg g 11
<210> 22
<211> 32
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Линкер T22d35-Fc-IgG1-v3(GSL-CC), включающий природные и искусственные
последовательности и шарнирную область hIgG1Fc (CC)
<400> 22
Ser Glu Glu Tyr Asn Thr Ser Asn Pro Asp Gly Gly Gly Ser Gly Gly
1 5 10 15
Gly Ser Gly Gly Gly Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu
20 25 30
<210> 23
<211> 494
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Конструкция T22d35-Fc-IgG2-v2(CC) из T22d35, связанного с областью
Fc hIgG2Fc (CC)
<400> 23
Ile Pro Pro His Val Gln Lys Ser Val Asn Asn Asp Met Ile Val Thr
1 5 10 15
Asp Asn Asn Gly Ala Val Lys Phe Pro Gln Leu Cys Lys Phe Cys Asp
20 25 30
Val Arg Phe Ser Thr Cys Asp Asn Gln Lys Ser Cys Met Ser Asn Cys
35 40 45
Ser Ile Thr Ser Ile Cys Glu Lys Pro Gln Glu Val Cys Val Ala Val
50 55 60
Trp Arg Lys Asn Asp Glu Asn Ile Thr Leu Glu Thr Val Cys His Asp
65 70 75 80
Pro Lys Leu Pro Tyr His Asp Phe Ile Leu Glu Asp Ala Ala Ser Pro
85 90 95
Lys Cys Ile Met Lys Glu Lys Lys Lys Pro Gly Glu Thr Phe Phe Met
100 105 110
Cys Ser Cys Ser Ser Asp Glu Cys Asn Asp Asn Ile Ile Phe Ser Glu
115 120 125
Glu Tyr Asn Thr Ser Asn Pro Asp Ile Pro Pro His Val Gln Lys Ser
130 135 140
Val Asn Asn Asp Met Ile Val Thr Asp Asn Asn Gly Ala Val Lys Phe
145 150 155 160
Pro Gln Leu Cys Lys Phe Cys Asp Val Arg Phe Ser Thr Cys Asp Asn
165 170 175
Gln Lys Ser Cys Met Ser Asn Cys Ser Ile Thr Ser Ile Cys Glu Lys
180 185 190
Pro Gln Glu Val Cys Val Ala Val Trp Arg Lys Asn Asp Glu Asn Ile
195 200 205
Thr Leu Glu Thr Val Cys His Asp Pro Lys Leu Pro Tyr His Asp Phe
210 215 220
Ile Leu Glu Asp Ala Ala Ser Pro Lys Cys Ile Met Lys Glu Lys Lys
225 230 235 240
Lys Pro Gly Glu Thr Phe Phe Met Cys Ser Cys Ser Ser Asp Glu Cys
245 250 255
Asn Asp Asn Ile Ile Phe Ser Glu Glu Tyr Asn Thr Ser Asn Pro Asp
260 265 270
Val Glu Cys Pro Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val
275 280 285
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
290 295 300
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
305 310 315 320
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
325 330 335
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Val Val Ser
340 345 350
Val Leu Thr Val Val His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
355 360 365
Cys Lys Val Ser Asn Lys Gly Leu Pro Ala Pro Ile Glu Lys Thr Ile
370 375 380
Ser Lys Thr Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
385 390 395 400
Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
405 410 415
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ser Val Glu Trp Glu Ser Asn
420 425 430
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Met Leu Asp Ser
435 440 445
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
450 455 460
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
465 470 475 480
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
485 490
<210> 24
<211> 222
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Вариант области Fc hIgG2Fc(CC)
<400> 24
Val Glu Cys Pro Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val
1 5 10 15
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
20 25 30
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
35 40 45
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
50 55 60
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Val Val Ser
65 70 75 80
Val Leu Thr Val Val His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
85 90 95
Cys Lys Val Ser Asn Lys Gly Leu Pro Ala Pro Ile Glu Lys Thr Ile
100 105 110
Ser Lys Thr Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
115 120 125
Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
130 135 140
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ser Val Glu Trp Glu Ser Asn
145 150 155 160
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Met Leu Asp Ser
165 170 175
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
180 185 190
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
195 200 205
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly
210 215 220
<210> 25
<211> 20
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Природный линкер T22d35-Fc-IgG2-v2(CC) с шарнирной областью
hIgG2Fc (CC)
<400> 25
Ser Glu Glu Tyr Asn Thr Ser Asn Pro Asp Val Glu Cys Pro Pro Cys
1 5 10 15
Pro Ala Pro Pro
20
<210> 26
<211> 492
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> hIgG1FcΔK(C)-T22d35
<400> 26
Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu
1 5 10 15
Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu
20 25 30
Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys
35 40 45
Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys
50 55 60
Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu
65 70 75 80
Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys
85 90 95
Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys
100 105 110
Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser
115 120 125
Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys
130 135 140
Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln
145 150 155 160
Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly
165 170 175
Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln
180 185 190
Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn
195 200 205
His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Ile Pro Pro His
210 215 220
Val Gln Lys Ser Val Asn Asn Asp Met Ile Val Thr Asp Asn Asn Gly
225 230 235 240
Ala Val Lys Phe Pro Gln Leu Cys Lys Phe Cys Asp Val Arg Phe Ser
245 250 255
Thr Cys Asp Asn Gln Lys Ser Cys Met Ser Asn Cys Ser Ile Thr Ser
260 265 270
Ile Cys Glu Lys Pro Gln Glu Val Cys Val Ala Val Trp Arg Lys Asn
275 280 285
Asp Glu Asn Ile Thr Leu Glu Thr Val Cys His Asp Pro Lys Leu Pro
290 295 300
Tyr His Asp Phe Ile Leu Glu Asp Ala Ala Ser Pro Lys Cys Ile Met
305 310 315 320
Lys Glu Lys Lys Lys Pro Gly Glu Thr Phe Phe Met Cys Ser Cys Ser
325 330 335
Ser Asp Glu Cys Asn Asp Asn Ile Ile Phe Ser Glu Glu Tyr Asn Thr
340 345 350
Ser Asn Pro Asp Ile Pro Pro His Val Gln Lys Ser Val Asn Asn Asp
355 360 365
Met Ile Val Thr Asp Asn Asn Gly Ala Val Lys Phe Pro Gln Leu Cys
370 375 380
Lys Phe Cys Asp Val Arg Phe Ser Thr Cys Asp Asn Gln Lys Ser Cys
385 390 395 400
Met Ser Asn Cys Ser Ile Thr Ser Ile Cys Glu Lys Pro Gln Glu Val
405 410 415
Cys Val Ala Val Trp Arg Lys Asn Asp Glu Asn Ile Thr Leu Glu Thr
420 425 430
Val Cys His Asp Pro Lys Leu Pro Tyr His Asp Phe Ile Leu Glu Asp
435 440 445
Ala Ala Ser Pro Lys Cys Ile Met Lys Glu Lys Lys Lys Pro Gly Glu
450 455 460
Thr Phe Phe Met Cys Ser Cys Ser Ser Asp Glu Cys Asn Asp Asn Ile
465 470 475 480
Ile Phe Ser Glu Glu Tyr Asn Thr Ser Asn Pro Asp
485 490
<210> 27
<211> 498
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> hIgG1FcΔK(CC)-T22d35
<400> 27
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
1 5 10 15
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
20 25 30
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
35 40 45
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
50 55 60
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
65 70 75 80
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
85 90 95
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
100 105 110
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
115 120 125
Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
130 135 140
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
145 150 155 160
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
165 170 175
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
180 185 190
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
195 200 205
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
210 215 220
Pro Gly Ile Pro Pro His Val Gln Lys Ser Val Asn Asn Asp Met Ile
225 230 235 240
Val Thr Asp Asn Asn Gly Ala Val Lys Phe Pro Gln Leu Cys Lys Phe
245 250 255
Cys Asp Val Arg Phe Ser Thr Cys Asp Asn Gln Lys Ser Cys Met Ser
260 265 270
Asn Cys Ser Ile Thr Ser Ile Cys Glu Lys Pro Gln Glu Val Cys Val
275 280 285
Ala Val Trp Arg Lys Asn Asp Glu Asn Ile Thr Leu Glu Thr Val Cys
290 295 300
His Asp Pro Lys Leu Pro Tyr His Asp Phe Ile Leu Glu Asp Ala Ala
305 310 315 320
Ser Pro Lys Cys Ile Met Lys Glu Lys Lys Lys Pro Gly Glu Thr Phe
325 330 335
Phe Met Cys Ser Cys Ser Ser Asp Glu Cys Asn Asp Asn Ile Ile Phe
340 345 350
Ser Glu Glu Tyr Asn Thr Ser Asn Pro Asp Ile Pro Pro His Val Gln
355 360 365
Lys Ser Val Asn Asn Asp Met Ile Val Thr Asp Asn Asn Gly Ala Val
370 375 380
Lys Phe Pro Gln Leu Cys Lys Phe Cys Asp Val Arg Phe Ser Thr Cys
385 390 395 400
Asp Asn Gln Lys Ser Cys Met Ser Asn Cys Ser Ile Thr Ser Ile Cys
405 410 415
Glu Lys Pro Gln Glu Val Cys Val Ala Val Trp Arg Lys Asn Asp Glu
420 425 430
Asn Ile Thr Leu Glu Thr Val Cys His Asp Pro Lys Leu Pro Tyr His
435 440 445
Asp Phe Ile Leu Glu Asp Ala Ala Ser Pro Lys Cys Ile Met Lys Glu
450 455 460
Lys Lys Lys Pro Gly Glu Thr Phe Phe Met Cys Ser Cys Ser Ser Asp
465 470 475 480
Glu Cys Asn Asp Asn Ile Ile Phe Ser Glu Glu Tyr Asn Thr Ser Asn
485 490 495
Pro Asp
<210> 28
<211> 494
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> hIgG2FcΔK(CC)-T22d35
<400> 28
Val Glu Cys Pro Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val
1 5 10 15
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
20 25 30
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
35 40 45
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
50 55 60
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe Arg Val Val Ser
65 70 75 80
Val Leu Thr Val Val His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
85 90 95
Cys Lys Val Ser Asn Lys Gly Leu Pro Ala Pro Ile Glu Lys Thr Ile
100 105 110
Ser Lys Thr Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
115 120 125
Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
130 135 140
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ser Val Glu Trp Glu Ser Asn
145 150 155 160
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Met Leu Asp Ser
165 170 175
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
180 185 190
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
195 200 205
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Ile Pro
210 215 220
Pro His Val Gln Lys Ser Val Asn Asn Asp Met Ile Val Thr Asp Asn
225 230 235 240
Asn Gly Ala Val Lys Phe Pro Gln Leu Cys Lys Phe Cys Asp Val Arg
245 250 255
Phe Ser Thr Cys Asp Asn Gln Lys Ser Cys Met Ser Asn Cys Ser Ile
260 265 270
Thr Ser Ile Cys Glu Lys Pro Gln Glu Val Cys Val Ala Val Trp Arg
275 280 285
Lys Asn Asp Glu Asn Ile Thr Leu Glu Thr Val Cys His Asp Pro Lys
290 295 300
Leu Pro Tyr His Asp Phe Ile Leu Glu Asp Ala Ala Ser Pro Lys Cys
305 310 315 320
Ile Met Lys Glu Lys Lys Lys Pro Gly Glu Thr Phe Phe Met Cys Ser
325 330 335
Cys Ser Ser Asp Glu Cys Asn Asp Asn Ile Ile Phe Ser Glu Glu Tyr
340 345 350
Asn Thr Ser Asn Pro Asp Ile Pro Pro His Val Gln Lys Ser Val Asn
355 360 365
Asn Asp Met Ile Val Thr Asp Asn Asn Gly Ala Val Lys Phe Pro Gln
370 375 380
Leu Cys Lys Phe Cys Asp Val Arg Phe Ser Thr Cys Asp Asn Gln Lys
385 390 395 400
Ser Cys Met Ser Asn Cys Ser Ile Thr Ser Ile Cys Glu Lys Pro Gln
405 410 415
Glu Val Cys Val Ala Val Trp Arg Lys Asn Asp Glu Asn Ile Thr Leu
420 425 430
Glu Thr Val Cys His Asp Pro Lys Leu Pro Tyr His Asp Phe Ile Leu
435 440 445
Glu Asp Ala Ala Ser Pro Lys Cys Ile Met Lys Glu Lys Lys Lys Pro
450 455 460
Gly Glu Thr Phe Phe Met Cys Ser Cys Ser Ser Asp Glu Cys Asn Asp
465 470 475 480
Asn Ile Ile Phe Ser Glu Glu Tyr Asn Thr Ser Asn Pro Asp
485 490
<210> 29
<211> 1560
<212> DNA
<213> Искусственная последовательность
<220>
<223> Последовательность нуклеиновой кислоты, кодирующей T22d35-Fc в
форме, которую можно секретрировать
<400> 29
atggattgga cctggagaat cctcttcctt gtagcagcag caacaggtac acatgctatc 60
cctcctcatg ttcaaaagtc cgttaacaac gacatgatcg tcaccgataa caacggtgct 120
gtcaagttcc cacaactctg taagttctgc gatgtgcgtt tctccacatg tgataaccag 180
aagtcctgta tgagcaactg ctcaatcacc tccatctgcg aaaagccaca agaggtatgc 240
gtagctgtat ggcgaaagaa cgatgaaaac atcaccctgg aaaccgtctg tcacgatcca 300
aagctcccat accatgattt catcctggaa gacgcagctt ctccaaagtg tatcatgaag 360
gagaagaaga agcccggtga aaccttcttc atgtgctcct gttcctcaga tgaatgcaac 420
gataacatca tcttctccga ggagtacaac acctccaacc cagatatccc tccacacgtt 480
cagaagtccg taaacaatga catgattgtg accgacaaca acggggctgt taagttccca 540
cagctctgta agttttgcga cgttaggttc agcacctgtg ataatcagaa gagctgcatg 600
tccaactgca gcatcaccag tatttgcgag aagcctcaag aagtgtgtgt cgctgtttgg 660
agaaagaacg acgaaaacat aaccctggag accgtttgcc acgatccaaa actcccatat 720
cacgatttca ttctggagga cgccgccagt cctaaatgta taatgaaaga gaagaagaaa 780
ccaggggaga ccttctttat gtgcagctgc agcagcgacg agtgtaacga taatataatt 840
tttagcgagg agtataatac aagcaatccc gacgagcgca agtgctgcgt cgagtgccct 900
ccatgccctg cccctcctgt tgccggacct agtgtgtttt tgtttcctcc taaacctaaa 960
gatacactca tgattagcag gacacctgag gtgacatgtg tcgtcgtgga cgtgagtcat 1020
gaagaccccg aagtgcagtt taattggtat gtcgacggag tcgaagtcca taatgccaaa 1080
actaaaccaa gggaagaaca gtttaattca acttttcgcg tggtctctgt gctgactgtg 1140
gtgcaccagg actggcttaa tggaaaggaa tacaagtgta aggtgagtaa taagggcctg 1200
cccgccccca ttgaaaaaac tattagtaag actaaagggc agccccgaga gccccaggtg 1260
tatactttgc ccccctctcg ggaggagatg actaaaaatc aggtgagtct tacatgtctt 1320
gtgaaaggat tttacccctc tgacatttca gtggagtggg agtctaatgg ccagcccgag 1380
aataattaca aaactactcc ccccatgttg gactctgacg gctcattttt cttgtactct 1440
aaactgacag tggacaaaag tcggtggcag cagggcaatg tgttttcttg ttcagtgatg 1500
cacgaggccc tgcataatca ctatacacag aaatctctgt ctctgtcacc cggctgatga 1560
<210> 30
<211> 1545
<212> DNA
<213> Искусственная последовательность
<220>
<223> Последовательность нуклеиновой кислоты, кодирующей T22d35-Fc-IgG1-v1
(CC) в форме, которую можно секретировать
<400> 30
atggactgga cctggagaat cctgttcctg gtggctgctg ctaccggaac acacgctatc 60
ccccctcatg tgcagaagtc cgtgaacaat gacatgatcg tgacagataa caatggcgcc 120
gtgaagtttc ctcagctgtg caagttctgt gacgtgaggt ttagcacctg cgataaccag 180
aagtcctgca tgagcaattg ttctatcaca tccatctgcg agaagccaca ggaggtgtgc 240
gtggccgtgt ggcggaagaa cgacgagaat atcaccctgg agacagtgtg ccacgatcct 300
aagctgccat accatgactt catcctggag gatgctgcct ctcccaagtg tatcatgaag 360
gagaagaaga agcctggcga gacattcttc atgtgctcct gttccagcga cgagtgcaac 420
gataatatca tcttcagcga ggagtataac acctctaatc cagatatccc accccacgtg 480
cagaagtctg tcaataacga tatgattgtc acagataaca atggcgctgt gaagtttccc 540
cagctgtgca aattttgtga cgtgagattt tccacctgtg ataaccagaa gagctgcatg 600
tctaattgtt ccatcacatc tatttgtgaa aaacctcagg aagtgtgcgt ggccgtgtgg 660
agaaaaaatg atgaaaacat caccctggag acagtgtgcc atgatcccaa gctgccttat 720
cacgacttca tcctggaaga cgctgccagc ccaaaatgca ttatgaaaga gaagaagaag 780
cccggtgaga cattcttcat gtgcagctgt tcttctgatg aatgtaacga taatatcatc 840
ttttccgagg agtataacac aagcaatccc gacacccaca catgccctcc atgtccagct 900
cctgagctgc tgggaggacc tagcgtgttc ctgtttcccc ctaagccaaa ggataccctg 960
atgatcagca ggacccccga ggtgacatgc gtggtggtgg acgtgtctca cgaggacccc 1020
gaggtgaagt ttaactggta cgtggacggc gtggaggtgc ataatgccaa gaccaagcct 1080
agggaggagc agtacaactc tacctatcgg gtggtgtccg tgctgacagt gctgcatcag 1140
gattggctga acggcaagga gtataagtgc aaggtgtcca ataaggctct gccagccccc 1200
attgagaaga ccatcagcaa ggctaagggc cagccaagag agccccaggt gtacacactg 1260
ccaccctctc gcgacgagct gaccaagaac caggtgtccc tgacatgtct ggtgaagggc 1320
ttctatcctt ccgatatcgc tgtggagtgg gagagcaacg gacagccaga gaacaattac 1380
aagaccacac ctccagtgct ggactctgat ggctccttct ttctgtatag caagctgacc 1440
gtggacaagt ctaggtggca gcagggcaac gtgtttagct gttctgtgat gcatgaggcc 1500
ctgcacaatc attacacaca gaagtccctg agcctgtctc ctggc 1545
<210> 31
<211> 1569
<212> DNA
<213> Искусственная последовательность
<220>
<223> Последовательность нуклеиновой кислоты, кодирующей T22d35-Fc-IgG1-v2
(SCC) в форме, которую можно секретировать
<400> 31
atggactgga cctggagaat cctgttcctg gtggctgctg ctaccggaac acacgctatc 60
ccccctcatg tgcagaagtc tgtgaacaat gacatgatcg tgacagataa caatggcgcc 120
gtgaagtttc cccagctgtg caagttctgt gacgtgaggt tttccacctg cgataaccag 180
aagtcttgca tgtccaattg tagcatcaca tctatctgcg agaagcctca ggaggtgtgc 240
gtggccgtgt ggcggaagaa cgacgagaat atcaccctgg agacagtgtg ccacgatcct 300
aagctgccat accatgactt catcctggag gatgctgcca gcccaaagtg tatcatgaag 360
gagaagaaga agcccggcga gacattcttc atgtgctctt gttccagcga cgagtgcaac 420
gataatatca tcttctccga ggagtataac accagcaatc ctgacatccc accccacgtg 480
cagaagagcg tcaataacga tatgattgtc acagataaca atggcgctgt gaagtttcca 540
cagctgtgca aattttgtga cgtgagattt tctacctgtg ataaccagaa gtcctgcatg 600
agcaattgtt ctatcacatc catctgcgag aagccacagg aagtgtgcgt ggccgtgtgg 660
agaaaaaatg atgaaaacat caccctggag acagtgtgcc atgatcccaa gctgccttat 720
cacgacttca tcctggaaga cgctgcctcc cctaaatgca ttatgaaaga gaagaagaag 780
ccaggtgaga cattcttcat gtgcagctgt tcttctgatg agtgcaacga taacatcatc 840
ttttctgagg agtacaacac atccaatcct gacgtggagc caaagagctc tgataagacc 900
cacacatgcc ctccatgtcc agctcctgag ctgctgggag gaccatccgt gttcctgttt 960
ccacctaagc ctaaggacac cctgatgatc tccaggaccc cagaggtgac atgcgtggtg 1020
gtggacgtga gccacgagga ccccgaggtg aagtttaact ggtacgtgga tggcgtggag 1080
gtgcataatg ccaagaccaa gccaagggag gagcagtaca acagcaccta tcgggtggtg 1140
tctgtgctga cagtgctgca tcaggactgg ctgaacggca aggagtataa gtgcaaggtg 1200
tctaataagg ctctgccagc ccccatcgag aagaccatct ccaaggctaa gggccagcca 1260
agagagcccc aggtgtacac actgccaccc agccgcgacg agctgaccaa gaaccaggtg 1320
tctctgacat gtctggtgaa gggcttctat ccctctgata tcgctgtgga gtgggagtcc 1380
aacggacagc ctgagaacaa ttacaagacc acacctccag tgctggacag cgatggctct 1440
ttctttctgt attccaagct gaccgtggat aagagcaggt ggcagcaggg caacgtgttt 1500
tcctgtagcg tgatgcatga ggccctgcac aatcattaca cacagaagtc tctgtccctg 1560
agccctggc 1569
<210> 32
<211> 1578
<212> DNA
<213> Искусственная последовательность
<220>
<223> Последовательность нуклеиновой кислоты, кодирующей T22d35-Fc-IgG1-v3
(GSL-CC) в форме, которую можно секретировать
<400> 32
atggattgga cctggagaat cctgttcctg gtggctgctg ctaccggaac acacgctatc 60
ccccctcatg tgcagaagtc tgtgaacaat gacatgatcg tgacagataa caatggcgcc 120
gtgaagtttc ctcagctgtg caagttctgt gacgtgaggt tttccacctg cgataaccag 180
aagtcctgca tgagcaattg ttctatcaca tccatctgcg agaagccaca ggaggtgtgc 240
gtggccgtgt ggcggaagaa cgacgagaat atcaccctgg agacagtgtg ccacgatcct 300
aagctgccat accatgactt catcctggag gatgctgcca gccccaagtg tatcatgaag 360
gagaagaaga agcctggcga gacattcttc atgtgctctt gttccagcga cgagtgcaac 420
gataatatca tcttctccga ggagtataac accagcaatc cagacatccc accccacgtg 480
cagaagagcg tcaataacga tatgattgtc acagataaca atggcgctgt gaagtttccc 540
cagctgtgca aattttgtga cgtgagattt tctacctgtg ataaccagaa gagctgcatg 600
tctaattgtt ccatcacatc tatttgtgaa aaacctcagg aagtgtgcgt ggccgtgtgg 660
agaaaaaatg atgaaaacat caccctggag acagtgtgcc atgatcccaa gctgccttat 720
cacgacttca tcctggaaga cgctgcctcc ccaaaatgca ttatgaaaga gaagaagaag 780
cccggtgaga cattcttcat gtgcagctgt tcttctgatg agtgcaacga taacatcatc 840
ttttctgagg agtacaacac atccaatcct gacggaggag gcagcggagg aggctctgga 900
ggcggcaccc acacatgccc tccatgtcca gctcctgagc tgctgggagg accttccgtg 960
ttcctgtttc cccctaagcc aaaggacacc ctgatgatct ccaggacccc cgaggtgaca 1020
tgcgtggtgg tggacgtgag ccacgaggac cccgaggtga agtttaactg gtacgtggat 1080
ggcgtggagg tgcataatgc caagaccaag ccaagggagg agcagtacaa cagcacctat 1140
cgggtggtgt ctgtgctgac agtgctgcat caggattggc tgaacggcaa ggagtataag 1200
tgcaaggtgt ctaataaggc tctgccagcc cccattgaga agaccatctc caaggctaag 1260
ggccagccaa gagagcccca ggtgtacaca ctgccaccca gccgcgacga gctgaccaag 1320
aaccaggtgt ctctgacatg tctggtgaag ggcttctatc cttctgatat cgctgtggag 1380
tgggagtcca acggacagcc agagaacaat tacaagacca cacctccagt gctggactct 1440
gatggctcct tctttctgta ttccaagctg accgtggaca agagcaggtg gcagcagggc 1500
aacgtgttta gctgttctgt gatgcatgag gccctgcaca atcattacac acagaagtcc 1560
ctgagcctgt ctcctggc 1578
<210> 33
<211> 1545
<212> DNA
<213> Искусственная последовательность
<220>
<223> Последовательность нуклеиновой кислоты, кодирующей T22d35-Fc-IgG2-v2
в форме, которую можно секретировать
<400> 33
atggattgga cctggagaat cctcttcctt gtagcagcag caacaggtac acatgctatc 60
cctcctcatg ttcaaaagtc cgttaacaac gacatgatcg tcaccgataa caacggtgct 120
gtcaagttcc cacaactctg taagttctgc gatgtgcgtt tctccacatg tgataaccag 180
aagtcctgta tgagcaactg ctcaatcacc tccatctgcg aaaagccaca agaggtatgc 240
gtagctgtat ggcgaaagaa cgatgaaaac atcaccctgg aaaccgtctg tcacgatcca 300
aagctcccat accatgattt catcctggaa gacgcagctt ctccaaagtg tatcatgaag 360
gagaagaaga agcccggtga aaccttcttc atgtgctcct gttcctcaga tgaatgcaac 420
gataacatca tcttctccga ggagtacaac acctccaacc cagatatccc tccacacgtt 480
cagaagtccg taaacaatga catgattgtg accgacaaca acggggctgt taagttccca 540
cagctctgta agttttgcga cgttaggttc agcacctgtg ataatcagaa gagctgcatg 600
tccaactgca gcatcaccag tatttgcgag aagcctcaag aagtgtgtgt cgctgtttgg 660
agaaagaacg acgaaaacat aaccctggag accgtttgcc acgatccaaa actcccatat 720
cacgatttca ttctggagga cgccgccagt cctaaatgta taatgaaaga gaagaagaaa 780
ccaggggaga ccttctttat gtgcagctgc agcagcgacg agtgtaacga taatataatt 840
tttagcgagg agtataatac aagcaatccc gacgtcgagt gccctccatg ccctgcccct 900
cctgttgccg gacctagtgt gtttttgttt cctcctaaac ctaaagatac actcatgatt 960
agcaggacac ctgaggtgac atgtgtcgtc gtggacgtga gtcatgaaga ccccgaagtg 1020
cagtttaatt ggtatgtcga cggagtcgaa gtccataatg ccaaaactaa accaagggaa 1080
gaacagttta attcaacttt tcgcgtggtc tctgtgctga ctgtggtgca ccaggactgg 1140
cttaatggaa aggaatacaa gtgtaaggtg agtaataagg gcctgcccgc ccccattgaa 1200
aaaactatta gtaagactaa agggcagccc cgagagcccc aggtgtatac tttgcccccc 1260
tctcgggagg agatgactaa aaatcaggtg agtcttacat gtcttgtgaa aggattttac 1320
ccctctgaca tttcagtgga gtgggagtct aatggccagc ccgagaataa ttacaaaact 1380
actcccccca tgttggactc tgacggctca tttttcttgt actctaaact gacagtggac 1440
aaaagtcggt ggcagcaggg caatgtgttt tcttgttcag tgatgcacga ggccctgcat 1500
aatcactata cacagaaatc tctgtctctg tcacccggct gatga 1545
<---

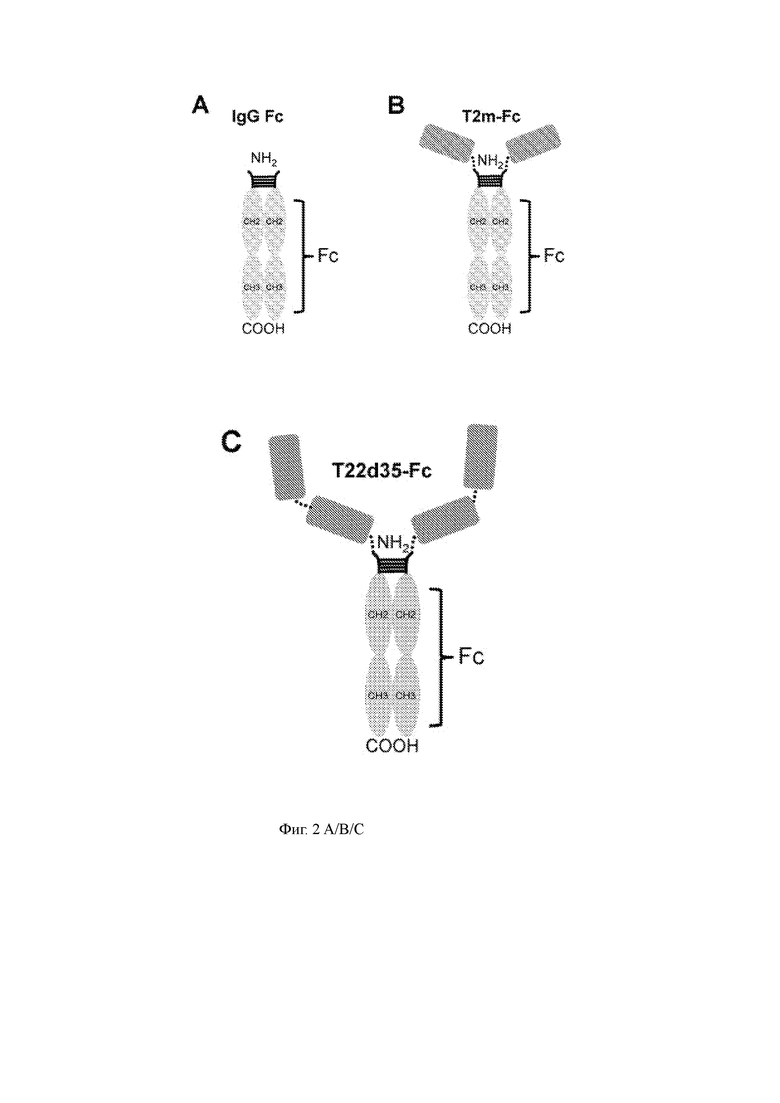



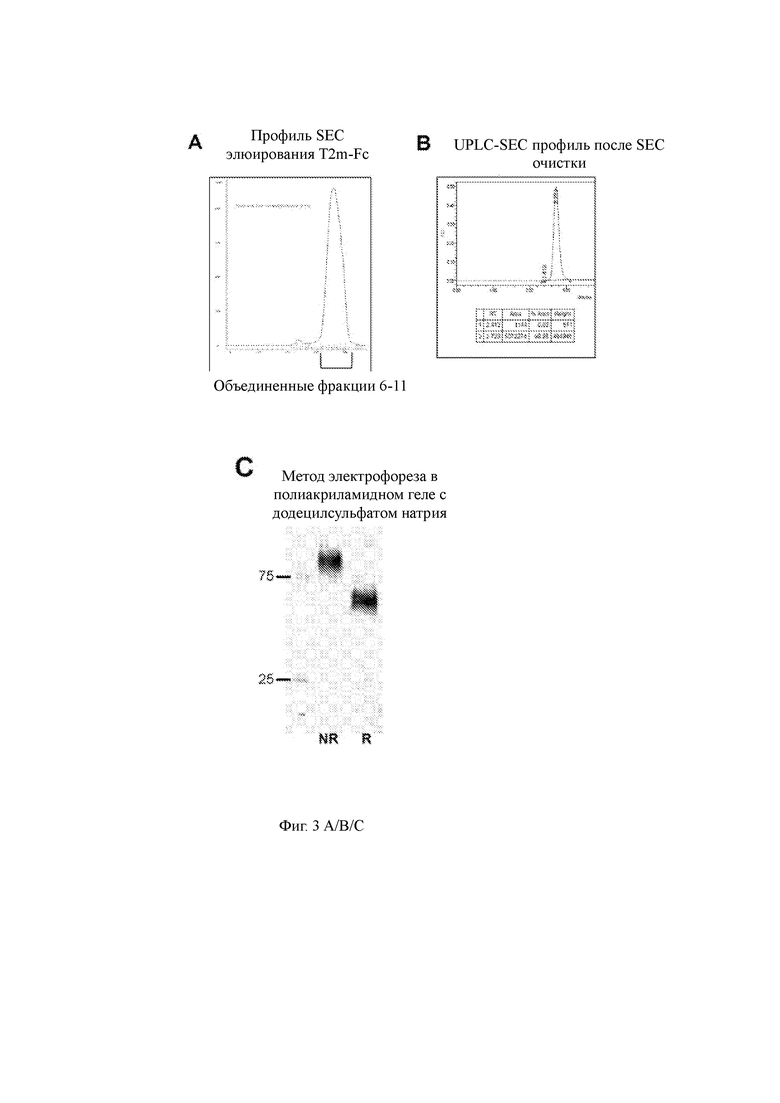
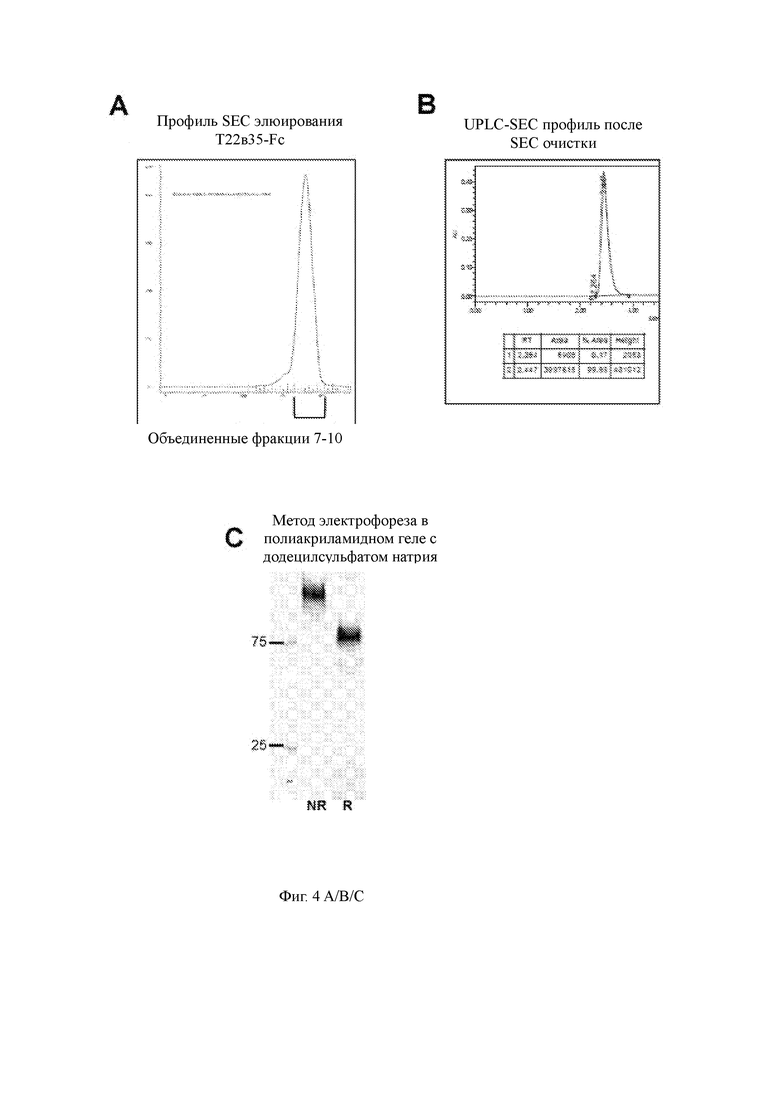

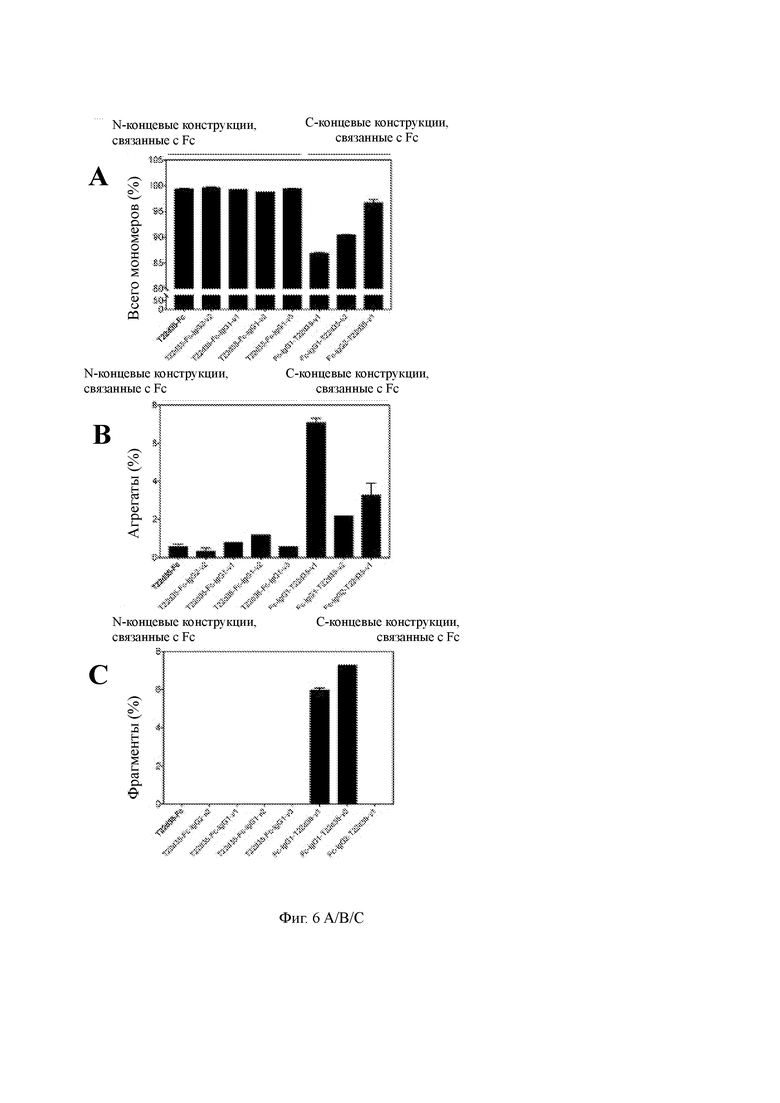

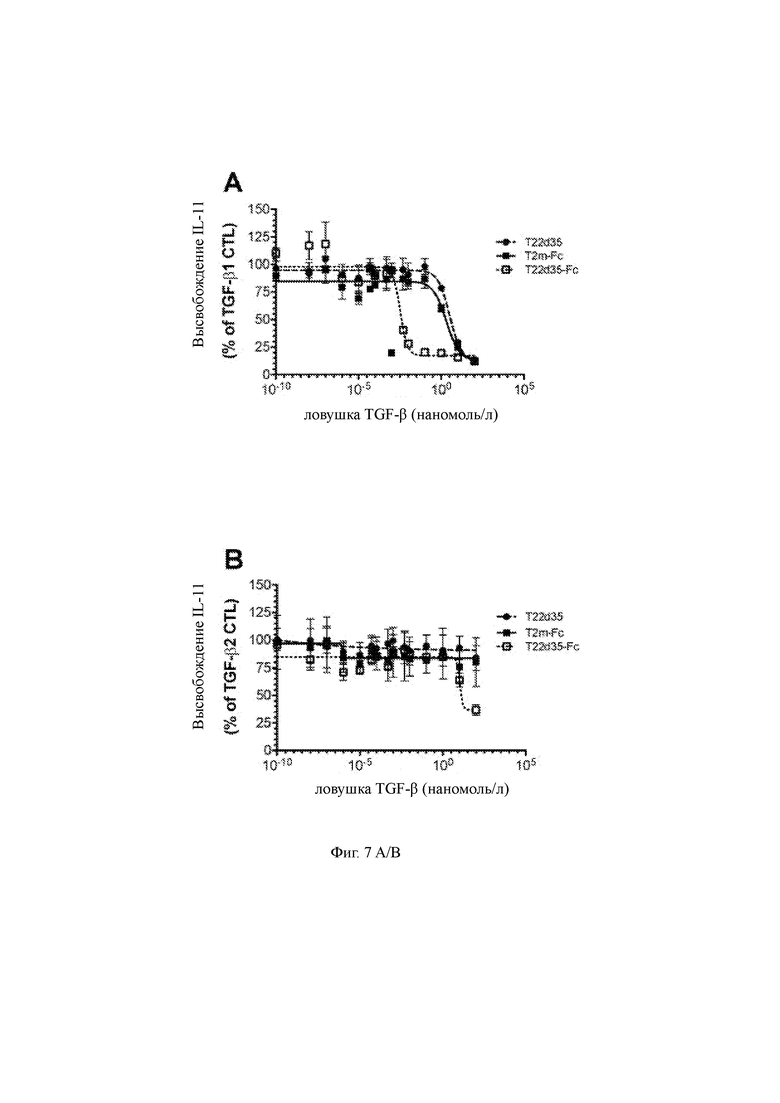
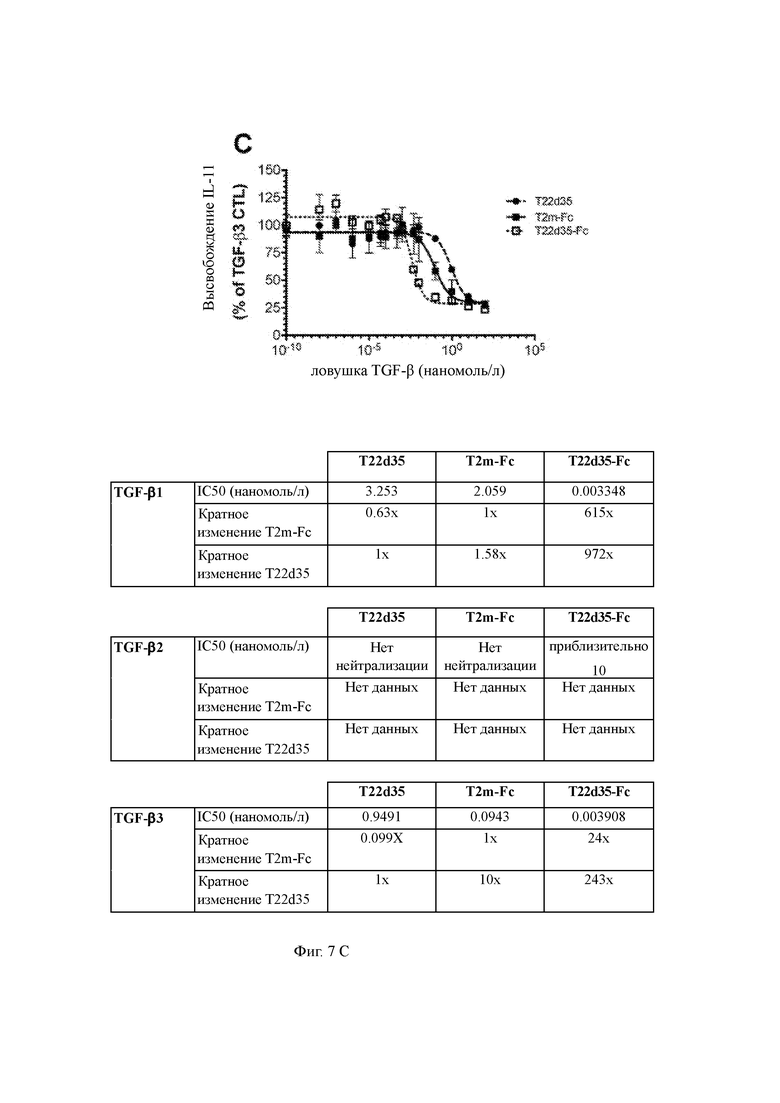
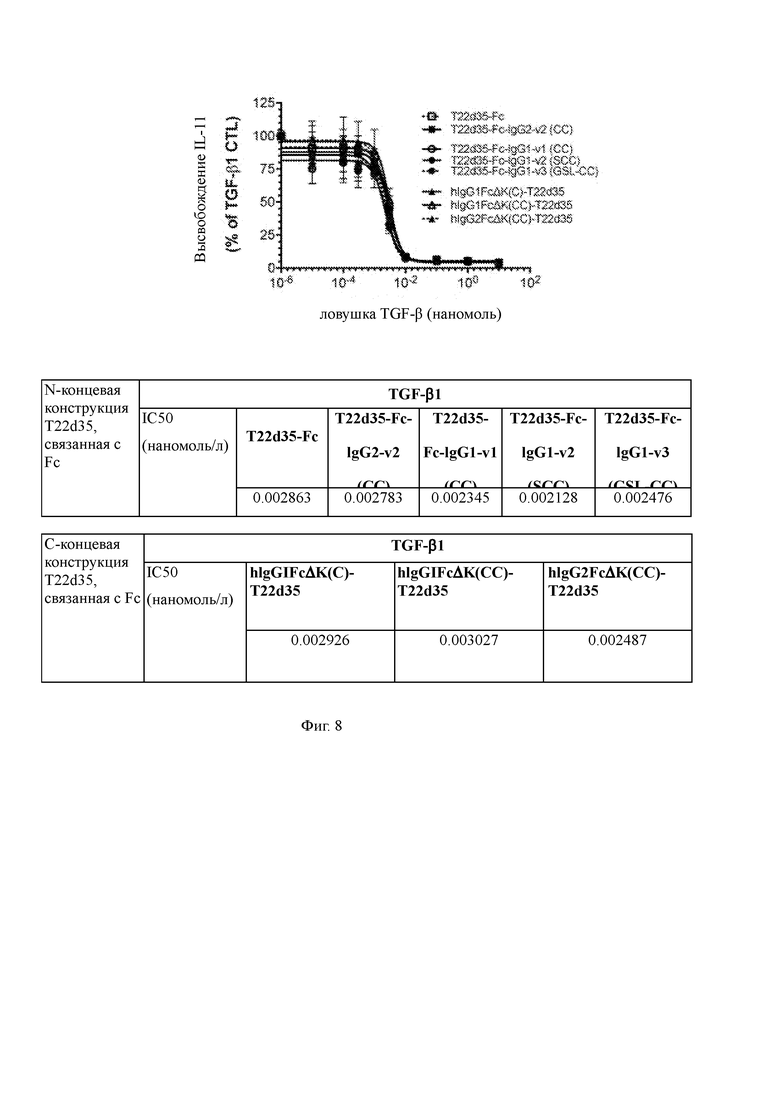
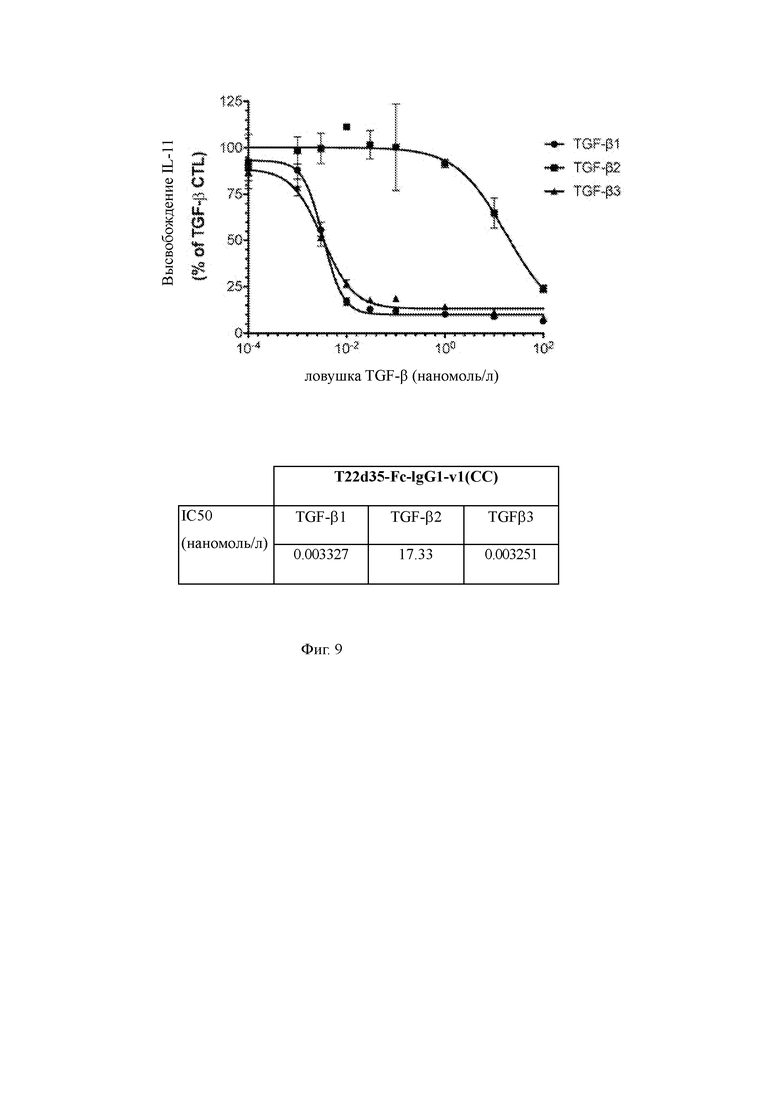
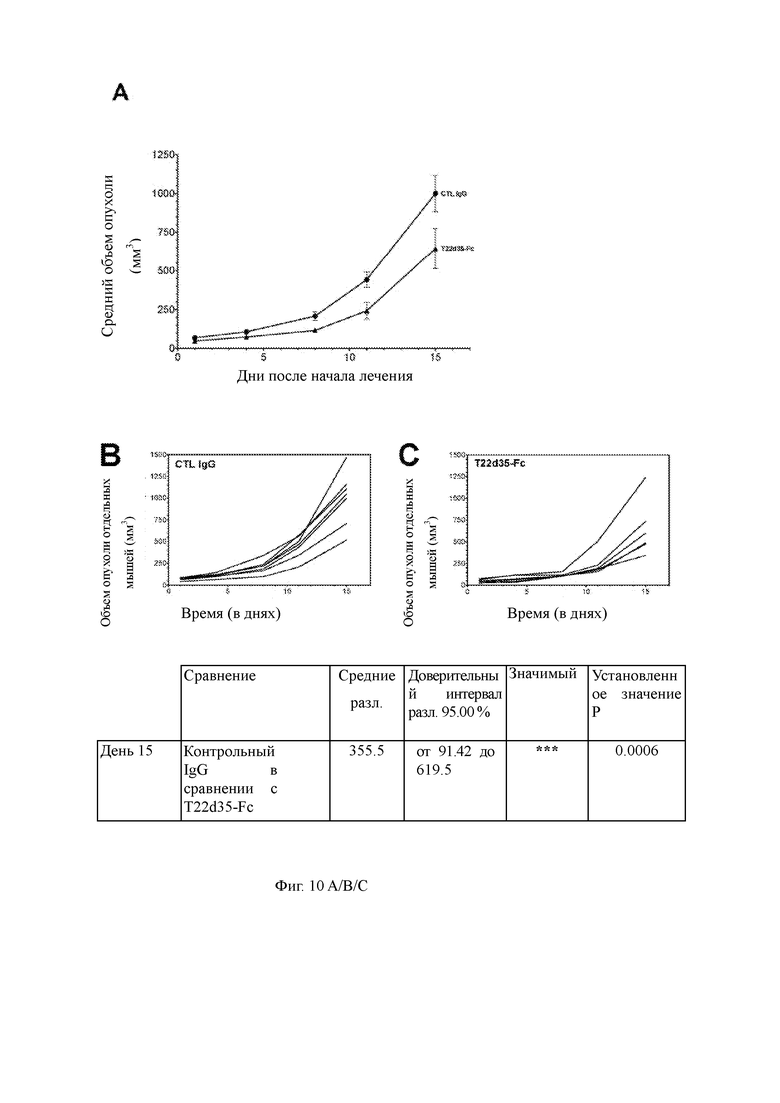
Группа изобретений относится к биотехнологии. Представлены: полипептидные конструкции, способные связывать и нейтрализовать лиганды трансформирующего ростового фактора бета (TGF-β), способы их получения и применения этих полипептидов для лечения расстройств, связанных с экспрессией или активацией TGF-бета, например рака и фиброзных расстройств. Также представлены молекулы нуклеиновых кислот, кодирующие любые полипептидные конструкции, векторы, содержащие молекулы нуклеиновых кислот, композиции для ингибирования активности TGF-β, трансгенные клеточные хозяева для продуцирования полипептидной конструкции. Изобретение позволяет получить полипептидные конструкции, способные связывать и эффективно применять их для лечения расстройств, связанных с экспрессией или активацией TGF-бета. 16 н. и 10 з.п. ф-лы, 15 ил., 6 табл.
1. Полипептидная конструкция, эффективная для ингибирования эффекта изотипа трансформирующего ростового фактора бета (TGF-β), содержащая:
первую область, содержащую первый эктодомен рецептора TGF-β (TβR-ECD), содержащий аминокислотную последовательность SEQ ID NO: 1, соединенный последовательно со вторым TβR-ECD, содержащим аминокислотную последовательность SEQ ID NO: 1, где C-конец первого эктодомена связан с N-концом второго эктодомена, и
вторую область, содержащую второй константный домен (CH2) и/или третий константный домен (CH3) тяжелой цепи антитела, выбранную из группы, состоящей из SEQ ID NO: 12, SEQ ID NO: 15, SEQ ID NO: 18, SEQ ID NO: 24 и последовательности, по существу идентичной им;
где N-конец второй области соединен с C-концом первой области.
2. Полипептидная конструкция по п. 1, где указанный TβR-ECD содержит эктодомен рецептора TGF-β II типа (TβRII-ECD).
3. Полипептидная конструкция по п. 1, где первый TβR-ECD и второй TβR-ECD связывают один и тот же изотип TGF-β.
4. Полипептидная конструкция по п. 3, где каждый из первого TβR-ECD и второго TβR-ECD связывает как TGF-β1, так и TGF-β3.
5. Полипептидная конструкция по п. 1, где первый TβR-ECD имеет аминокислотную последовательность, состоящую из SEQ ID NO: 1, и второй эктодомен рецептора TGF-β имеет аминокислотную последовательность, состоящую из SEQ ID NO: 1.
6. Полипептидная конструкция по любому из пп. 1-5, где вторая область представляет собой аминокислотную последовательность SEQ ID NO: 15.
7. Полипептидная конструкция по п. 1, содержащая аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 10, SEQ ID NO: 14, SEQ ID NO: 17, SEQ ID NO: 20, SEQ ID NO: 23 и последовательности, по существу идентичной им.
8. Гомодимерная полипептидная конструкция, эффективная для ингибирования эффекта изотипа трансформирующего ростового фактора бета (TGF-β), содержащая первую полипептидную и вторую полипептидную конструкции, связанные через соответствующие константные домены антитела по меньшей мере одним дисульфидным мостиком, где гомодимерный полипептид содержит:
первый одноцепочечный полипептид, содержащий первую и вторую области;
где вторая область содержит второй константный домен (CH2) и третий константный домен (CH3) тяжелой цепи антитела и вариабельную область тяжелой цепи данного антитела;
где первая область содержит два TβRII-ECD;
где N-конец второй области связан с C-концом первой области; и
второй одноцепочечный полипептид, содержащий полипептид указанного первого одноцепочечного полипептида, где первый одноцепочечный полипептид и второй одноцепочечный полипептид выбраны из группы, состоящей из SEQ ID NO: 10, SEQ ID NO: 14, SEQ ID NO: 17, SEQ ID NO: 20, SEQ ID NO: 23 и последовательности, по существу идентичной им.
9. Кодирующая молекула нуклеиновой кислоты, кодирующая любую полипептидную конструкцию по любому из пп. 1-8.
10. Вектор экспрессии, содержащий молекулу нуклеиновой кислоты по п. 9.
11. Молекула нуклеиновой кислоты, кодирующая любую полипептидную конструкцию по любому из пп. 1-8 в форме, которую можно секретировать выбранным хозяином экспрессии.
12. Молекула нуклеиновой кислоты по п. 11, кодирующая белок, имеющий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 10, SEQ ID NO: 14, SEQ ID NO: 17, SEQ ID NO: 20 и SEQ ID NO: 23, или последовательность, по существу идентичную им.
13. Молекула нуклеиновой кислоты по п. 12, имеющая последовательность нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO: 29, SEQ ID NO: 30, SEQ ID NO: 31, SEQ ID NO: 32 и SEQ ID NO: 33.
14. Композиция для ингибирования активности TGF-β, содержащая эффективное количество полипептидной конструкции по любому из пп. 1-8 и фармацевтически приемлемый носитель, разбавитель или эксципиент.
15. Трансгенный клеточный хозяин для продуцирования полипептидной конструкции по любому из пп. 1-8, содержащий молекулу нуклеиновой кислоты по п. 9 или вектор по п. 10, где трансгенный клеточный хозяин включает клетки яичника китайского хомячка (CHO).
16. Трансгенный клеточный хозяин по п. 15, дополнительно содержащий вторую молекулу нуклеиновой кислоты или второй вектор, кодирующие вторую полипептидную конструкцию, такую же, как первая полипептидная конструкция.
17. Способ получения гомодимерного полипептида, включающий культивирование хозяина и выделение из среды, обусловленной ростом указанного хозяина, гомодимерной полипептидной конструкции по п. 8.
18. Применение полипептидной конструкции по любому из пп. 1-8 для лечения рака.
19. Полипептидная конструкция по п. 8, где полипептидная конструкция содержит аминокислотную последовательность SEQ ID NO: 14.
20. Фармацевтическая композиция для ингибирования активности TGF-β, содержащая эффективное количество полипептидной конструкции по п. 19.
21. Применение полипептидной конструкции по п. 19 для лечения рака.
22. Молекула нуклеиновой кислоты, кодирующая полипептидную конструкцию по п. 19.
23. Молекула нуклеиновой кислоты, кодирующая полипептидную конструкцию по п. 19, в форме, которую можно секретировать выбранным хозяином экспрессии, с получением таким образом гомодимера, имеющего две копии полипептидной конструкции, имеющей аминокислотную последовательность, содержащую SEQ ID NO: 14, связанные с Fc.
24. Вектор экспрессии, содержащий молекулу нуклеиновой кислоты по п. 22.
25. Трансгенный клеточный хозяин для продуцирования полипептидной конструкции по п. 19, содержащий молекулу нуклеиновой кислоты по п. 22, где трансгенный клеточный хозяин включает клетки яичника китайского хомячка (CHO).
26. Способ получения гомодимерной полипептидной конструкции, включающий культивирование хозяина по п. 25 и получение гомодимерной полипептидной конструкции, содержащей две копии полипептидной конструкции, содержащей SEQ ID NO: 14, связанные с Fc.
| WO 1998048024 A1, 29.10.1998 | |||
| US 8318135 B2, 27.11.2012 | |||
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pET-32a, КОДИРУЮЩАЯ ГЕН ЛИГАНД-СВЯЗЫВАЮЩЕГО ДОМЕНА РЕЦЕПТОРА II ТИПА ТРАНСФОРМИРУЮЩЕГО ФАКТОРА РОСТА-β ЧЕЛОВЕКА (TβRII), ШТАММ БАКТЕРИЙ Escherichia coli - ПРОДУЦЕНТ СЛИТНОГО БЕЛКА ТИОРЕДОКСИН/TβRII И СПОСОБ РЕНАТУРАЦИИ И ОЧИСТКИ ЦЕЛЕВОГО БЕЛКА TβRII | 2009 |
|
RU2413769C1 |
| WIESER R | |||
| et al., GS domain mutations that constitutively activate T beta R‐I, the downstream signaling component in the TGF‐beta receptor complex, The EMBO journal, 1995, V | |||
| Паровоз для отопления неспекающейся каменноугольной мелочью | 1916 |
|
SU14A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| ARNAU J | |||
| et al., Current strategies for the use of affinity tags | |||
Авторы
Даты
2023-06-06—Публикация
2018-03-01—Подача