ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
В этой заявке испрашивается приоритет предварительной заявки на патент США № 62/554605, зарегистрированной 6 сентября 2017 года, и 62/652279, зарегистрированной 3 апреля 2018 года, полное содержание каждой из которых включено в настоящее изобретение путем ссылки на них.
ВВЕДЕНИЕ
Интерлейкин 18 (IL-18) представляет собой провоспалительный цитокин, который может стимулировать T-клетки, NK-клетки и миелоидные клетки. IL-18 был предложен в качестве иммунотерапевтического средства для лечения рака в связи с его способностью стимулировать противоопухолевые иммуноциты. Однако IL-18 имел ограниченную эффективность в клинической практике.
Поэтому, существует потребность в композициях и способах, которые могут обеспечивать эффективную активацию сигнального пути IL-18, для лечения и предотвращения рака и других заболеваний и нарушений. Настоящее изобретение направлено на решение проблемы, связанной с этой неудовлетворенной потребностью.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В одном аспекте, изобретение относится к композиции, включающей вариант полипептида IL-18. В некоторых вариантах осуществления, вариант полипептида IL-18 специфически связывается с рецептором IL-18 (IL-18R), но при этом вариант полипептида IL-18 проявляет в значительной степени пониженное связывание с IL-18-связывающим белком (IL-18BP).
В некоторых вариантах осуществления, вариант полипептида IL-18 включает, по меньшей мере, одну мутацию относительно IL-18 дикого типа (WT IL-18). В некоторых вариантах осуществления, WT IL-18 представляет собой человеческий IL-18, включающий аминокислотную последовательность SEQ ID NO: 30. В некоторых вариантах осуществления, WT IL-18 представляет собой мышиный IL-18, включающий аминокислотную последовательность SEQ ID NO: 31.
В некоторых вариантах осуществления, вариант полипептида IL-18 включает, по меньшей мере, одну мутацию, выбранную из группы, состоящей из Y1X, L5X, K8X, M51X, K53X, S55X, Q56X, P57X, G59X, M60X, E77X, Q103X, S105X, D110X, N111X, M113X, V153X и N155X, относительно SEQ ID NO: 30.
В некоторых вариантах осуществления, вариант полипептида IL-18 включает, по меньшей мере, одну мутацию, выбранную из группы, состоящей из Y1H, Y1R, L5H, L5I, L5Y, K8Q, K8R, M51T, M51K, M51D, M51N, M51E, M51R, K53R, K53G, K53S, K53T, S55K, S55R, Q56E, Q56A, Q56R, Q56V, Q56G, Q56K, Q56L, P57L, P57G, P57A, P57K, G59T, G59A, M60K, M60Q, M60R, M60L, E77D, Q103E, Q103K, Q103P, Q103A, Q103R, S105R, S105D, S105K, S105N, S105A, D110H, D110K, D110N, D110Q, D110E, D110S, D110G, N111H, N111Y, N111D, N111R, N111S, N111G, M113V, M113R, M113T, M113K, V153I, V153T, V153A, N155K и N155H, относительно SEQ ID NO: 30.
В некоторых вариантах осуществления, вариант полипептида IL-18 включает мутации M51X, M60X, S105X, D110X и N111X относительно SEQ ID NO: 30.
В некоторых вариантах осуществления, вариант полипептида IL-18 включает мутации M51X, K53X, Q56X, S105X N111X относительно SEQ ID NO: 30.
В некоторых вариантах осуществления, вариант полипептида IL-18 включает аминокислотную последовательность, представленную любой одной из SEQ ID NOs.: 34-59, 73-91, 191-193, или ее фрагмент.
В некоторых вариантах осуществления, вариант полипептида IL-18 включает, по меньшей мере, одну мутацию, выбранную из группы, состоящей из N1X, M50X, Y51X, K52X, S54X, E55X, V56X, R57X, G58X, L59X, R104X, N109X и L151X, относительно SEQ ID NO: 31.
В некоторых вариантах осуществления, вариант полипептида IL-18 включает, по меньшей мере, одну мутацию, выбранную из группы, состоящей из N1H, N1Y, M50A, M50S, M50V, M50G, M50T, Y51R, K52V, K52S, K52T, K52G, K52A, S54R, S54K, S54G, S54N, E55R, E55H, E55N, E55D, E55G, V56L, V56M, V56R, V56A, V56S, V56Q, R57G, R57K, G58A, L59K, L59R, L59V, R104K, R104L, R104Q, R104S, N109D и L151V, относительно SEQ ID NO: 31.
В некоторых вариантах осуществления, вариант полипептида IL-18 включает аминокислотную последовательность, представленную любой одной из SEQ ID NOs.: 60-72, или ее фрагмент.
В одном аспекте, изобретение относится к композиции, включающей нуклеиновую кислоту, кодирующую вариант полипептида IL-18.
В некоторых вариантах осуществления, композиция дополнительно включает одно или более лекарственных средств, выбранных из (i) ингибитора иммунных контрольных точек; (ii) средства, которое ингибирует один или более белков, выбранных из PD-L1, PD1, CTLA4, TIM3, TIGIT, LAG3, B7H3, B7H4, VISTA, ICOS, GITR, 41BB, OX40 и CD40; (iii) средства, опсонизирующего раковые клетки; и (iv) средства, которое целенаправленно воздействует на один или более антигенов, выбранных из CD19, CD20, CD22, CD24, CD25, CD30, CD33, CD37, CD38, CD44, CD45, CD47, CD51, CD52, CD56, CD62L, CD70, CD74, CD79, CD80, CD96, CD97, CD99, CD123, CD134, CD138, CD152 (CTLA-4), CD200, CD213A2, CD221, CD248, CD276 (B7-H3), B7-H4, CD279 (PD-1), CD274 (PD-L1), CD319, EGFR, EPCAM, 17-1A, HER1, HER2, HER3, CD117, C-Met, HGFR, PDGFRA, AXL, TWEAKR, PTHR2, HAVCR2 (TIM3), GD2 ганглиозида, MUC1, муцина CanAg, мезотелина, эндоглина, антигена Льюиса Y, CEA, CEACAM1, CEACAM5, CA-125, PSMA, BAFF, FGFR2, TAG-72, желатиназы B, глипикана 3, нектин-4, BCMA, CSF1R, SLAMF7, интегрина αvβ3, TYRP1, GPNMB, CLDN18.2, FOLR1, CCR4, CXCR4, MICA, антигена C242, DLL3, DLL4, EGFL7, виментина, экстра домена-B фибронектина, TROP-2, LRRC15, FAP, SLITRK6, NOTCH2, NOTCH3, танасцина-3, STEAP1 и NRP1.
В одном аспекте, изобретение относится к способу лечения или предотвращения заболевания или нарушения у субъекта, нуждающегося в этом, включающему введение субъекту композиции, включающей вариант полипептида IL-18 или нуклеиновую кислоту, кодирующую вариант полипептида IL-18.
В некоторых вариантах осуществления, заболевание или нарушение представляет собой рак. В некоторых вариантах осуществления, рак представляет собой рак, который является резистентным к ингибиторам иммунных контрольных точек (ICIs). В некоторых вариантах осуществления, рак ассоциирован с опухолью, в которой отсутствует экспрессия молекул MHC класса I.
В некоторых вариантах осуществления, заболевание или нарушение представляет собой метаболическое заболевание или нарушение. В некоторых вариантах осуществления, заболевание или нарушение представляет собой инфекционное заболевание.
В некоторых вариантах осуществления, способ включает введение субъекту варианта полипептида IL-18 и, по меньшей мере, одно другое средство. В некоторых вариантах осуществления, по меньшей мере, одно другое средство включает ингибитор иммунных контрольных точек. В некоторых вариантах осуществления, ингибитор иммунных контрольных точек представляет собой средство, которое ингибирует PD-L1, PD1, CTLA4, TIM3, TIGIT, LAG3, B7H3, B7H4, VISTA, ICOS, GITR, 41BB, OX40 или CD40, или любую их комбинацию. В некоторых вариантах осуществления, по меньшей мере, одно другое средство включает средство, опсонизирующее раковые клетки. В некоторых вариантах осуществления, по меньшей мере, одно другое средство целенаправленно воздействует на один или более антигенов, выбранных из CD19, CD20, CD22, CD24, CD25, CD30, CD33, CD37, CD38, CD44, CD45, CD47, CD51, CD52, CD56, CD62L, CD70, CD74, CD79, CD80, CD96, CD97, CD99, CD123, CD134, CD138, CD152 (CTLA-4), CD200, CD213A2, CD221, CD248, CD276 (B7-H3), B7-H4, CD279 (PD-1), CD274 (PD-L1), CD319, EGFR, EPCAM, 17-1A, HER1, HER2, HER3, CD117, C-Met, HGFR, PDGFRA, AXL, TWEAKR, PTHR2, HAVCR2 (TIM3), GD2 ганглиозида, MUC1, муцина CanAg, мезотелина, эндоглина, антигена Льюиса Y, CEA, CEACAM1, CEACAM5, CA-125, PSMA, BAFF, FGFR2, TAG-72, желатиназы B, глипикана 3, нектина-4, BCMA, CSF1R, SLAMF7, интегрина αvβ3, TYRP1, GPNMB, CLDN18.2, FOLR1, CCR4, CXCR4, MICA, антигена C242, DLL3, DLL4, EGFL7, виментина, экстра домена-B фибронектина, TROP-2, LRRC15, FAP, SLITRK6, NOTCH2, NOTCH3, танасцина-3, STEAP1 и NRP1. В некоторых вариантах осуществления, по меньшей мере, одно другое средство конъюгировано с вариантом полипептида IL-18. В некоторых вариантах осуществления, по меньшей мере, одно другое средство представляет собой измененные Т-клетки или NK-клетки. В некоторых вариантах осуществления, по меньшей мере, одно другое средство представляет собой онколитический вирус.
В одном аспекте, изобретение относится к композиции, включающей ингибитор IL-18-связывающего белка (IL-18BP) или антагонист IL-18BP, где ингибитор или антагонист ингибирует способность IL-18BP нейтрализовывать эндогенный IL-18. В некоторых вариантах осуществления, ингибитор или антагонист включает, по меньшей мере, один, выбранный из группы, состоящей из химического соединения, полипептида, пептида, пептидомиметика, антитела, рибозима, низкомолекулярного химического соединения и молекулы антисмысловой нуклеиновой кислоты.
В некоторых вариантах осуществления, композиция включает вариант полипептида IL-18, где вариант полипептида IL-18 специфически связывается с IL-18BP и где вариант полипептида IL-18 проявляет в значительной степени пониженное связывание с рецептором IL-18 (IL-18R).
В некоторых вариантах осуществления, вариант полипептида IL-18 включает, по меньшей мере, одну мутацию относительно IL-18 дикого типа (WT IL-18). В некоторых вариантах осуществления, WT IL-18 представляет собой человеческий IL-18, включающий аминокислотную последовательность SEQ ID NO: 30. В некоторых вариантах осуществления, WT IL-18 представляет собой мышиный IL-18, включающий аминокислотную последовательность SEQ ID NO: 31.
В некоторых вариантах осуществления, вариант полипептида IL-18 включает, по меньшей мере, одну мутацию, выбранную из группы, состоящей из Y1X, L5X, D17X, E31X, T34X, D35X, S36X, D37X, D40X, N41X, M51X, Q56X, M60X, Q103X, H109X, M113X и R131X, относительно SEQ ID NO: 30.
В некоторых вариантах осуществления, вариант полипептида IL-18 включает, по меньшей мере, одну мутацию, выбранную из группы, состоящей из Y1D, Y1F, Y1H, Y1L, L5F, L5H, D17A, D17G, D17R, D17H, E31A, E31T, E31G, E31K, E31R, T34A, T34K T34E, D35S, D35A, D35Y, S36N, S36K, S36R, D37P, D37A, D37R, D37H, D37L, D37V, D40Y D40S, D40A, N41K, N41S, N41R, M51F, M51L, M51I, Q56H, M60L, M60F, M60I, Q103L, Q103I, H109A, H109P, H109D, M113L, M113I, M113F и R131S, относительно SEQ ID NO: 30.
В некоторых вариантах осуществления, вариант полипептида IL-18 включает аминокислотную последовательность, представленную любой одной из SEQ ID NOs.: 92-125, или ее фрагмент.
В некоторых вариантах осуществления, вариант полипептида IL-18 включает мутации D17X, E30X и Q103X, относительно SEQ ID NO: 30.
В некоторых вариантах осуществления, вариант полипептида IL-18 включает мутации D17X, E30X, D35X, M51X и Q103X, относительно SEQ ID NO: 30.
В некоторых вариантах осуществления, вариант полипептида IL-18 включает, по меньшей мере, одну мутацию, выбранную из группы, состоящей из N1X, L5X, D17X, E30X, T33X, D34X, I35X, D36X, M50X, Q102X, R104, H108X, N109X, M111X, D129X и D130X, относительно SEQ ID NO: 31.
В некоторых вариантах осуществления, вариант полипептида IL-18 включает, по меньшей мере, одну мутацию, выбранную из группы, состоящей из N1Y, N1D, N1H, N1L, N1F, N1V, N1I, L5Y, L5H, D17Q, D17G, D17A, D17E, D17S, D17N, E30A, E30R, E30K, E30T, E30G, T33G, T33A, T33E, T33R, T33K, D34Y, D34S, D34A, I35T, I35K, I35R, D36V, D36A, D36G, D36H, D36P, D36R, D36L, M50F, M50L, Q102L, Q102I, R104E, R104A, R104P, R104G, R104Q, R104H, H108D, H108A, N109R, N109S, N109T, N109I, M111L, M111I, D129A, D129F, D129V, D129Y, D129S, D130E, D130T, D130G, D130N, D130R, D130S, D130Q и D130H, относительно SEQ ID NO: 31.
В некоторых вариантах осуществления, вариант полипептида IL-18 включает аминокислотную последовательность, представленную любой одной из SEQ ID NOs.: 126-190, или ее фрагмент.
В одном аспекте, изобретение относится к композиции, включающей нуклеиновую кислоту, кодирующую вариант полипептида IL-18.
В одном аспекте, композиция дополнительно включает одно или более лекарственных средств, выбранных из (i) ингибитора иммунных контрольных точек; (ii) средства, которое ингибирует один или более белков, выбранных из PD-L1, PD1, CTLA4, TIM3, TIGIT, LAG3, B7H3, B7H4, VISTA, ICOS, GITR, 41BB, OX40 и CD40; (iii) средства, опсонизирующего раковые клетки; и (iv) средства, которое целенаправленно воздействует на один или более антигенов, выбранных из CD19, CD20, CD22, CD24, CD25, CD30, CD33, CD37, CD38, CD44, CD45, CD47, CD51, CD52, CD56, CD62L, CD70, CD74, CD79, CD80, CD96, CD97, CD99, CD123, CD134, CD138, CD152 (CTLA-4), CD200, CD213A2, CD221, CD248, CD276 (B7-H3), B7-H4, CD279 (PD-1), CD274 (PD-L1), CD319, EGFR, EPCAM, 17-1A, HER1, HER2, HER3, CD117, C-Met, HGFR, PDGFRA, AXL, TWEAKR, PTHR2, HAVCR2 (TIM3), GD2 ганглиозида, MUC1, муцина CanAg, мезотелина, эндоглина, антигена Льюиса Y, CEA, CEACAM1, CEACAM5, CA-125, PSMA, BAFF, FGFR2, TAG-72, желатиназы B, глипикана 3, нектин-4, BCMA, CSF1R, SLAMF7, интегрина αvβ3, TYRP1, GPNMB, CLDN18.2, FOLR1, CCR4, CXCR4, MICA, антигена C242, DLL3, DLL4, EGFL7, виментина, экстра домена-B фибронектина, TROP-2, LRRC15, FAP, SLITRK6, NOTCH2, NOTCH3, танасцина-3, STEAP1 и NRP1.
В одном аспекте, изобретение относится к способу лечения или предотвращения заболевания или нарушения у субъекта, нуждающегося в этом, включающему введение субъекту композиции, включающей ингибитор IL-18-связывающего белка (IL-18BP) или антагонист IL-18BP.
В некоторых вариантах осуществления, заболевание или нарушение представляет собой рак. В некоторых вариантах осуществления, рак представляет собой рак, который является резистентным к ингибиторам иммунных контрольных точек (ICIs). В некоторых вариантах осуществления, рак ассоциирован с опухолью, в которой отсутствует экспрессия молекул MHC класса I.
В некоторых вариантах осуществления, заболевание или нарушение представляет собой метаболическое заболевание или нарушение. В некоторых вариантах осуществления, заболевание или нарушение представляет собой инфекционное заболевание.
В некоторых вариантах осуществления, способ включает введение субъекту, по меньшей мере, одно другое средство в дополнении к ингибитору IL-18BP или антагонисту IL-18BP. В некоторых вариантах осуществления, по меньшей мере, одно другое средство включает ингибитор иммунных контрольных точек. В некоторых вариантах осуществления, ингибитор иммунных контрольных точек представляет собой средство, которое ингибирует PD-L1, PD1, CTLA4, TIM3, TIGIT, LAG3, B7H3, B7H4, VISTA, ICOS, GITR, 41BB, OX40 или CD40, или любую их комбинацию. В некоторых вариантах осуществления, по меньшей мере, одно другое средство включает средство, опсонизирующее раковые клетки. В некоторых вариантах осуществления, по меньшей мере, одно другое средство целенаправленно воздействует на один или более антигенов, выбранных из CD19, CD20, CD22, CD24, CD25, CD30, CD33, CD37, CD38, CD44, CD45, CD47, CD51, CD52, CD56, CD62L, CD70, CD74, CD79, CD80, CD96, CD97, CD99, CD123, CD134, CD138, CD152 (CTLA-4), CD200, CD213A2, CD221, CD248, CD276 (B7-H3), B7-H4, CD279 (PD-1), CD274 (PD-L1), CD319, EGFR, EPCAM, 17-1A, HER1, HER2, HER3, CD117, C-Met, HGFR, PDGFRA, AXL, TWEAKR, PTHR2, HAVCR2 (TIM3), GD2 ганглиозида, MUC1, муцина CanAg, мезотелина, эндоглина, антигена Льюиса Y, CEA, CEACAM1, CEACAM5, CA-125, PSMA, BAFF, FGFR2, TAG-72, желатиназы B, глипикана 3, нектин-4, BCMA, CSF1R, SLAMF7, интегрина αvβ3, TYRP1, GPNMB, CLDN18.2, FOLR1, CCR4, CXCR4, MICA, антигена C242, DLL3, DLL4, EGFL7, виментина, экстра домена-B фибронектина, TROP-2, LRRC15, FAP, SLITRK6, NOTCH2, NOTCH3, танасцина-3, STEAP1 и NRP1. В некоторых вариантах осуществления, ингибитор или антагонист представляет собой вариант полипептида IL-18, и, по меньшей мере, одно другое средство конъюгировано с вариантом полипептида IL-18. В некоторых вариантах осуществления, по меньшей мере, одно другое средство представляет собой измененные Т-клетки или NK-клетки. В некоторых вариантах осуществления, по меньшей мере, одно другое средство представляет собой онколитический вирус.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Следующее далее подробное описание вариантов осуществления изобретения будет более понятным при ознакомлении с ним в сочетании с прилагаемыми чертежами. Следует иметь в виду, что изобретение не ограничивается представленными на чертежах конкретными средствами и инструментарием вариантов осуществления.
На фигуре 1A и фигуре 1B представлены результаты из примера проведения исследований, которые демонстрируют, что сигнальный путь IL-18 является мишенью для иммунотерапии опухолей. На фигуре 1A показан сигнальный путь IL-18 (включая IL-18 и его рецепторные субъединицы), который сверхрегулируется в программах как активированных, так и дисфункциональных опухолевых Т-клеток, как это видно из анализа экспрессии РНКseq для цитокинов и рецепторов в CD8+TIL. Генам присваивают оценки в баллах относительно их "активации" и "дисфункции" по сравнению с наивными Т-клетками. Желтым цветом обозначены цитокин IL-18, IL-18R1 (Rα) и IL-18RAP (Rβ). Данные взяты из публикации Singer, M. et al., 2016, Cell, 166: 1500-1511, e1509. На фигуре 1В показаны рецепторы субъединиц IL-18 IL-18Rα и IL-18Rβ, которые являются частью программы экспрессии генов, связанной с хроническим воздействием антигена, как это видно после заражения вирусом лимфатического хориоменингита (LCMV) (слева, CD4) или рекомбинантным вирусом везикулярного стоматита, кодирующим овальбумин (VSV-OVA) (справа, CD8). Данные взяты из базы данных ImmGen.
На фигурах 2A - 2C представлены результаты из примера проведения исследований, которые демонстрируют, что IL-18BP обладает функцией "растворимой формы иммунной контрольной точки". На фигуре 2A показан IL-18BP, который опосредует интерферон-γ (IFN-γ)-управляемую отрицательную обратную связь IL-18, напоминающую иммунную контрольную точку PD-L1. Схематически изображена петля обратной связи IL-18/ IFN-γ /IL-18BP. Черные стрелки указывают на стимуляцию, красные кружки указывают на ингибирование. На фигуре 2B показано, что IL-18BP сверхрегулируется при раке желудка и раке молочной железы, как это видно из данных, полученных из баз данных TCGA и Oncomine. На фигуре 2C показано, что экспрессия PD-1 и IL-18BP сильно коррелирует в выборке образцов рака молочной железы и рака желудка (из базы данных TCGA). R=0,78 и 0,65, соответственно.
На фигурах 3А - 3С представлены результаты из примера проведения исследований, которые демонстрируют конструирование человеческого IL-18, независимого от IL-18BP, с использованием технологии дрожжевого дисплея. На фигуре 3А показана библиотека с поиском по химической структуре для рандомизации остатков на границе поверхности IL-18:IL-18BP, которая была разработана и введена в систему дрожжевого дисплея. Отбирали клоны дрожжей, которые связываются с IL-18R и не связываются с IL-18BP, используя магнитную и флуоресцентную сортировку клеток. На фигуре 3В представлены результаты направленного развития с целью создания IL-18BP-резистентных вариантов IL-18. Текст, выделенный синим цветом, указывает на положительный отбор, текст, выделенный красным цветом, указывает на отрицательный отбор. На фигуре 3C представлены результаты проточного цитометрического анализа WT IL-18 (слева) или вариантов после направленного развития (справа) с использованием технологии дрожжевого дисплея. На осях Y отложено связывание IL-18BP, на осях X отложено связывание IL-18Rα. После 5 раундов направленного развития, оставшиеся клоны в значительно большей степени предпочитали IL-18R2, чем IL-18BP.
На фигуре 4 представлены результаты из примера проведения исследований, которые характеризуют последовательности резистентных к рецептору-ловушке вариантов человеческого IL-18 ("DR-IL-18", также называемых "DR-18"). Положение каждой мутации и соответствующего остатка в зрелой форме человеческого IL-18 дикого типа указано в верхней части таблицы. hC4 - hE12 представляют последовательности, полученные после отбора методом направленного развития. hCS1-hCS4 представляют собой консенсусные последовательности, полученные из выбранных последовательностей. Оттененные розовым цветом остатки представляют пять наиболее консервативных наблюдаемых мутаций.
На фигурах 5А и 5В представлены результаты из примера проведения исследований, демонстрирующие биофизические характеристики вариантов DR-IL-18 человека. На фигуре 5А показано с помощью технологии дрожжевого дисплея, что варианты hCS1-hCS4 и A8 человеческого DR-IL-18 способны связываться с hIL-18Rα, что характеризуется изотермами связывания, сопоставимыми с изотермами связывания для человеческого WT IL-18 (слева). В отличие от этого, очень слабое связывание наблюдается с теми же вариантами и hIL-18BP (справа). На фигуре 5В приведены типичные сенсограммы поверхностного плазмонного резонанса между иммобилизованным биотинилированным hIL-18BP и вариантами DR-IL-18. Рекомбинантный hIL-18 (слева) связывает IL-18BP с исключительно высокой аффинностью, KD=2,0 пМ, тогда как hCS1 (справа) демонстрирует в высокой степени ослабленное связывание с гораздо более высокой скоростью диссоциации и KD=15,2 нМ. Эти данные приведены в таблицах 6 и 7.
На фигурах 6А и 6В представлены результаты из примера проведения исследований, которые демонстрируют, что варианты человеческого DR-IL-18 не ингибируются в результате воздействия IL-18BP. На фигуре 6А показано с помощью технологии дрожжевого дисплея, что рекомбинантный IL-18BP ингибирует биотинилированный IL-18Rα от связывания IL-18, но не влияет на варианты DR-IL-18 hCS1-4 и A8 (слева). В отличие от этого, IL-18BP эффективно нейтрализует ранее описанные IL-18 E42A, K89A и E42A/K89A (Kim et al., 2001, Proc. Natl. Acad. Sci., 98 (6): 3304-3309) (справа) [E42 и K89 (Kim et al.) представляют собой E6 и K53 последовательности SEQ ID NO: 30, соответственно]. Для всех образцов поддерживали фиксированную концентрацию биотинилированного IL-18R2, равную 100 нМ. На фигуре 6В показано, что WT IL-18 и hCS1, hCS3 и hCS4 стимулируют репортерные клетки IL-18 HEK-Blue со сопоставимой активностью и эффективностью (слева). В этом анализе, IL-18 дикого типа очень чувствителен к применению рекомбинантного IL-18BP (IC50=3 нМ), тогда как hCS1 и hCS3 не ингибируются рекомбинантным IL-18BP даже при концентрациях IL-18BP 1 мкМ (справа). Поддерживали фиксированную концентрацию hIL-18, равную 5 нМ, а фиксированную концентрацию hCS1 и hCS3, равную 2,5 нМ.
На фигурах 7А-7С представлены результаты из примера проведения исследований, которые демонстрируют конструирование дополнительных вариантов человеческого IL-18, независимого от IL-18BP (вариантов версии 2) с использованием технологии дрожжевого дисплея. На фигуре 7А приведены данные по положениям в человеческом IL-18, рандомизированным в библиотеке версии 2.0. Для каждого положения приведены вырожденные кодоны и набор кодированных аминокислот. На фигуре 7B приведены результаты направленного развития для генерации IL-18BP-резистетных вариантов IL-18 версии 2.0. Текст, выделенный синим цветом, указывает на положительный отбор, текст, выделенный красным цветом, указывает на отрицательный отбор. На фигуре 7C представлены результаты проточного цитометрического анализа процесса создании вариантов DR-IL-18 версии 2.0. Дрожжи, полученные после раундов 1, 4 и 6, одновременно окрашивали с помощью 250 нМ тетрамеров IL-18BP стрептавидин-РЕ или с помощью 100 нМ IL-18Rα, непосредственно меченного AlexaFluor647. На осях Y отложено связывание IL-18BP, на осях X отложено связывание IL-18Rα. После 6 раундов направленного развития, оставшиеся клоны в значительно большей степени предпочитали IL-18Rα, чем IL-18BP.
На фигуре 8 представлены результаты из примера проведения исследований, которые характеризуют последовательности резистентных к рецептору-ловушке вариантов человеческого IL-18 (DR-IL-18) версии 2. Положение каждой мутации и соответствующего остатка в зрелой форме человеческого IL-18 дикого типа указано в верхней части таблицы. Оттененные разными цветами строки указывают варианты рекуррентной последовательности, полученные как в 5 раунде, так и в 6 раунде.
На фигуре 9 представлены результаты из примера проведения исследований, демонстрирующие биофизические характеристики вариантов DR-IL-18 человека версии 2.0. На фигуре 9A показано с помощью технологии дрожжевого дисплея, что DR-IL-18 версии 2.0, способны связываться с hIL-18Rα, что характеризуется изотермами связывания, сопоставимыми с изотермами связывания для человеческого WT IL-18. На фигуре 9В показано, что, в отличие от этого, очень слабое связывание наблюдается с теми же вариантами и hIL-18BP. На фигуре 9C приведены результаты оценки термостабильности вариантов DR-IL-18 версии 2.0 путем нагревания полученных с помощью технологии дрожжевого дисплея вариантов в диапазоне температур в течение 15 минут с последующим окрашиванием с помощью hIL-18Rα. Варианты DR-IL-18 версии 2.0 были более термостабильными, чем WT IL-18 (Tm=47,6°С) и консенсусные последовательности первого поколения (Tm=50,9° и 40,2° для hCS1 и hCS2, соответственно). На фигуру 9D приведены характеристика связывания с рецептором и термическая стабильность вариантов DR-IL-18 второго поколения. NBD=связывание не обнаружено. N.D. = величину не измеряли.
На фигурах 10А - 10С представлены результаты из примера проведения исследований, которые демонстрируют конструирование мышиных вариантов IL-18, независимых от IL-18BP, с использованием технологии дрожжевого дисплея. На фигуре 10А представлены результаты направленного развития с целью создания IL-18BP-резистентных вариантов мышиного IL-18. Текст, выделенный синим цветом, указывает на положительный отбор, текст, выделенный красным цветом, указывает на отрицательный отбор. На фигуре 10В представлены результаты проточного цитометрического анализа полученного технологий дрожжевого дисплея варианта мышиного IL-18 после 5 раундов направленного развития. На осях Y отложено связывание IL-18BP, на осях X отложено связывание IL-18Rα. На фигуре 10C представлены результаты, которые характеризуют последовательности резистентных к рецептору-ловушке вариантов мышиного IL-18 (DR-IL-18). Положение каждой мутации и соответствующего остатка в зрелой форме мышиного IL-18 дикого типа указано в верхней части таблицы. mC1 - mH3 представляют последовательности, полученные после отбора с помощью направленного развития. mCS1 и mCS2 являются консенсусными последовательностями, полученными из выбранных последовательностей. Оттененные розовым цветом остатки представляют пять наблюдаемых наиболее консервативных мутаций.
На фигурах 11А и 11В представлены результаты из примера проведения исследований, демонстрирующие биофизические характеристики вариантов мышиных DR-IL-18. На фигуре 11A показано, что полученные технологией дрожжевого дисплея DR-IL-18 варианты mA7, mB1, mC1, mE8, mCS1 и mCS2 способны связывать mIL-18Rα, что характеризуется изотермами связывания, сопоставимыми с изотермами связывания для мышиного WT IL-18с (слева). В отличие от этого, очень слабое связывание наблюдается с теми же вариантами и mIL-18BP (справа). На фигуре 11В приведены типичные сенсограммы поверхностного плазмонного резонанса между иммобилизованным биотинилированным mIL-18BP и вариантами мышиного DR-IL-18. Рекомбинантный mIL-18 (слева) связывает mIL-18BP с высокой аффинностью, KD=0,8 пМ, тогда как mCS2 (справа) демонстрирует значительно более низкое связывание со значением KD, превышающим 10 мкМ. Эти данные приведены в таблицах 8 и 9.
На фигурах 12А - 12D представлены результаты из примера проведения фармакодинамического исследования вводимого мышам DR-IL-18. На фигуре 12А схематично представлен дизайн исследования. Мышам вводили плацебо (PBS), mIL-18 (1 мг/кг) или DR-IL-18 вариант mCS2 (1 мг/кг) один раз в сутки суммарно семь доз в течение семи дней (обозначенных в виде шприцов). Образцы крови отбирали за пять часов после инъекции за два дня до эксперимента и в дни 0, 3 и 6. На фигуре 12В приведены результаты подсчета клеток периферической крови для CD4, CD8, NK-клеток и моноцитов в день 0, день 3 и день 6. Как IL-18, так и mCS2 вызывали в одинаковой степени увеличение количества NK-клеток и моноцитов к 3-му дню. Для каждого момента времени (дня), левый столбец относится к PBS, средний столбец относится к IL-18, и правый столбец относится к mCS2. На фигуре 12C приведены данные по экспрессии CD69 на периферических CD4, CD8 и NK-клетках. mCS2, но не IL-18, стимулировал экспрессию CD69 на клетках CD4 и CD8. Как IL-18, так и mCS2 увеличивали CD69 на NK-клетках, но обработка mCS2 вызывала устойчивую экспрессию CD69, выраженную на 6-й день, по сравнению с IL-18, в случае которого CD69 возвращался к исходным уровням. Для каждого момента времени (дня), левый столбец относится к PBS, средний столбец относится к IL-18, и правый столбец относится к mCS2. На фигуре 12D приведены уровни сывороточных цитокинов для интерферона-γ (IFN-γ), MIP-1b и G-CSF. Введение mCS2 давало более высокие уровни IFN-γ, MIP-1b и G-CSF, чем введение mIL-18.
На фигуре 13 представлены результаты из примера проведения исследований, которые демонстрируют, что введение DR-IL-18 уменьшает содержание жировой ткани у мышей. Содержание жировой ткани и массу нежировых тканей измеряли у мышей, которым вводили с помощью 0,01, 0,1 или 1 мг/кг DR-IL-18 варианта mCS2 или 1 мг/кг WT mIL-18 каждые три дня. Введение mCS2 приводило к значительному снижению содержания жировой ткани, выраженного как процент от суммарной массы (верхняя панель). Это выражалось уменьшением или стабильностью содержания жировой ткани (левая панель), рассчитанных как процент от суммарной массы (правая панель). У мышей, которым вводили плацебо, и у мышей, которым вводили mIL-18, наблюдалось увеличение содержания жировой ткани и стабильность содержания массы нежировых тканей за тот же период лечения.
На фигурах 14А - 14В представлены результаты из примера проведения исследований, которые демонстрируют, что DR-IL-18 является эффективным иммунотерапевтическим средством в модели меланомы. На фигуре 14А представлены кривые восприимчивости роста опухоли у мышей с опухолями меланомы Yummer1.7, которым вводили физиологический раствор (контроль), WT IL-18 (0,32 мг/кг), DR-IL-18 вариант mCS2 (0,32 мг/кг), антитело против PD1 (8 мг/кг), IL-18+антитело против PD1 или mCS2+антитело против PD1 дважды в неделю. На фигуре 14B приведены кривые выживания в тех же группах, что и на фигуре 14A. В этой модели, mCS2 проявлял эффективность в качестве монотерапии и синергизм в комбинации с антителом против PD1.
На фигурах 15А и 15В представлены результаты из примера проведения исследований, которые демонстрируют, что эффективность DR-IL-18 в модели меланомы на фигуре 14 зависит от лимфоцитов CD4 и CD8 и гамма-интерферона. На фигуре 15А приведены графики роста опухолей у мышей с опухолями меланомы Yummer1.7, которым вводили физиологический раствор (контроль) или DR-IL-18 вариант mCS2 (0,32 мг/кг) при монотерапии или в комбинации с истощающими антителами против CD8, CD4, интерфероном гамма или NK1.1. На фигуре 15B приведены кривые выживания в тех же группах, что и на фигуре 15A.
На фигуре 16 представлены результаты из примера проведения исследований, демонстрирующие дозозависимую активность DR-IL-18 в модели опухоли MC38. Приведены кривые восприимчивости роста опухоли у мышей с опухолями рака толстой кишки MC38, которым вводили PBS (контроль), 1,0 мг/кг WT IL-18, 1,0 мг/кг mCS2, 0,1 мг/кг mCS2 или 0,01 мг/кг mCS2 каждые три дня. IL-18 WT не проявлял активности при 1 мг/кг, тогда как mCS2 характеризовался частичной активностью при 0,1 мг/кг и максимальной активностью при 1,0 мг/кг.
На фигуре 17 представлены результаты из примера проведения исследований, демонстрирующие активность DR-IL-18 при монотерапии и в комбинации с ингибитором иммунных контрольных точек антителом против PD1 в модели опухоли MC38. Приведены кривые восприимчивости роста опухоли у мышей с опухолями рака толстой кишки MC38, которым вводили PBS (контроль), 0,32 мг/кг WT IL-18, 0,32 мг/кг DR-IL-18 вариант mCS2, 5 мг/кг антитело против PD1, комбинации антитела против PD1 с WT IL-18 или комбинации антитела против PD1 с mCS2. Все лекарственные средства вводили интраперитонеально два раза в неделю суммарно до 6 доз.
На фигуре 18А и фигуре 18В представлены результаты из примера проведения исследований механизма противоопухолевого действия DR-IL-18 у мышей с опухолями MC38. На фигуре 18А представлены результаты экспериментов по иммунофенотипированию опухолей у мышей, которым дважды в неделю вводили четыре дозы физиологического раствора, WT IL-18 или DR-IL-18 варианта mCS2. Введение DR-IL-18 приводило к увеличению количества CD8 и NK-клеток на миллиграмм опухоли (две верхних левых панели) и повышению экспрессии маркеров активации гранзима B и KLRG1 на CD8 и NK-клетках (две верхние правые панели). Введение DR-IL-18 не улучшало соотношение CD8:Treg по сравнению с введением физиологического раствора, тогда как введение WT IL-18 делало это соотношение менее благоприятным. Однако введение DR-IL-18 увеличивало отношение клеток CD8 к миелоидным ингибиторным популяциям, включающим опухоль-ассоциированные макрофаги (TAM) и миелоидные моноцитарные и гранулоцитарные супрессорные клетки (mMDSCs и gMDSCs). На фигуре 18В представлены результаты измерений уровня цитокинов на приборе Luminex в сыворотке у тех же мышей, что и на фигуре 18А, взятой через 24 часа после введения 4-й дозы. DR-IL-18 демонстрирует резко измененный профиль высвобождения вторичных цитокинов при обработке с помощью WT IL-18, в частности, повышение более чем в 100 раз уровней интерферона-гамма, IL-7 и IL-15.
На фигурах 19А - 19С представлены результаты из примера проведения исследований, которые демонстрируют способность DR-IL-18 эффективно оказывать терапевтическое воздействие на опухоли, которые невосприимчивы к воздействию ингибиторов иммунных контрольных точек в результате отсутствия экспрессии молекул MHC класса I на поверхности опухолевых клеток. На фигуре 19A приведены кривые восприимчивости роста опухоли у мышей с опухолями Ymmer1.7 с дефицитом B2m, которым вводили физиологический раствор, антитело против PD1+антитело против CTLA4, DR-IL-18 вариант mCS2 или mCS2 с истощением NK-клеток с помощью антител против NK1.1. DR-IL-18 продемонстрировал высокую активность в отношении роста и выживаемости опухоли (фигура 19B), позволяя излечивать 60% подвергнутых лечению мышей в этой модели опухоли, которая является полностью резистентной даже к комбинированной терапии с помощью антитела против CTLA4+антитела против PD1. Эта активность зависит от NK-клеток, поскольку введение антитела против NK1.1 отменяет лечебное воздействие mCS2. На фигуре 19C показано, что NK-клетки, выделенные из B2m-дефицитной опухоли Yummer1.7, являются дисфункциональными и характеризуются пониженной пролиферацией (окрашивание Ki67) и функцией (секреция интерферона-гамма). Однако лечение с применением DR-IL-18 полностью изменяет этот фенотип, обеспечивая устойчивую пролиферацию и секрецию цитокинов.
На фигурах 20А - 20С представлены результаты из примера проведения исследований, которые демонстрируют конструирование человеческих вариантов IL-18 в качестве антагонистов IL-18BP (или "рецептор ловушка с рецептором ловушкой", D2D) с использованием технологии дрожжевого дисплея. Эти варианты связывают IL-18BP, но не передают сигнал, вследствие чего антагонизируют воздействие IL-18BP на эндогенный IL-18. На фигуре 20A приведены положения в человеческом IL-18, рандомизированные в библиотеке D2D. Для каждого положения приведены вырожденные кодоны и набор кодированных аминокислот. На фигуре 20В схематично изображено использование направленного развития для генерации вариантов D2D IL-18, которые связывают и нейтрализуют IL-18BP, но не передают сигналы через IL-18R. Текст, выделенный синим цветом, указывает на положительный отбор, текст, выделенный красным цветом, указывает на отрицательный отбор. На фигуре 20C представлены результаты проточного цитометрического анализа процесса создания вариантов D2D hIL-18. Дрожжи, полученные после раундов 1-4, окрашивали с помощью 1 нМ мышиного IL-18BP (левая панель), с помощью 1 нМ человеческого IL-18BP (средняя панель) или с помощью 1 мкМ IL18Rα плюс 1 мкМ IL18Rβ. Выбранные варианты демонстрируют усиление связывания IL-18BP во всех раундах отбора без увеличения связывания IL18Rα или IL18Rβ.
На фигуре 21 представлены результаты из примера проведения исследований, которые характеризуют последовательности вариантов D2D человеческого IL-18. Положение каждой мутации и соответствующего остатка в зрелой форме человеческого IL-18 дикого типа указано в верхней части таблицы.
На фигурах 22A - 22C представлены результаты из примера проведения исследований, демонстрирующие биофизические характеристики вариантов "рецептор ловушка с рецептором ловушкой" (D2D) человеческих IL-28. На фигуре 22A показано, что полученные технологией дрожжевого дисплея D2D-варианты 5-B02, 5-E08, 5-F10, 5-F02, 5-F01, hD2D-CS1, hD2D-CS2 и hD2D-CS3 для IL-8, способны связывать hIL-18RBP, что характеризуется изотермами связывания, сопоставимыми с изотермами связывания для человеческого WT IL-18. На фигуре 22b, показано, что, в отличие от этого, очень слабое связывание наблюдается с теми же вариантами и hIL-18Rα. На фигуре 22С приведены характеристики связывания с рецептором вариантов D2D IL-18. NBD=связывание не обнаружено.
На фигуре 23 представлены результаты из примера проведения исследований, которые характеризуют последовательности D2D вариантов мышиного IL-18. Положение каждой мутации и соответствующего остатка в зрелой форме человеческого IL-18 дикого типа указано в верхней части таблицы.
На фигуре 24 представлены результаты измерений биофизической аффинности (сенсограммы) вариантов DR-IL-18 второго поколения для связывания с IL-18Ra и IL-18BP с использованием метода поверхностного плазмонного резонанса (SPR). Верхний ряд: типичные сенсограммы указанных вариантов IL-18 (растворимые аналиты) для hIL-18Ra (иммобилизованный лиганд). Нижний ряд: типичные сенсограммы указанных вариантов IL-18 для человека (hIL-18BP). На оси X отложено время в секундах, а на оси Y отложены единицы ответа (RU). Кривые представляют собой наблюдаемые данные во времени для различных концентраций (двукратные разведения, начиная с 1 нМ), наложенные на кривые наилучшего приближения, рассчитанные на основе модели связывания Ленгмюра 1:1.
На фигурах 25A и 25B приведены данные, демонстрирующие активность DR-IL-18 в модели колоректальной опухоли CT26. Имплантировали подкожно 250000 клеток CT26, и начинали лечение на 7-й день после того, как размеры опухолей в среднем составляли ~ 60 мм3. WT IL-18 и mCS2 вводили в дозе 0,32 мг/кг два раза в неделю суммарно 5 доз. Антитело против PD1 вводили в дозе 10 мг/кг по той же схеме. (A) Представлены кривые восприимчивости роста опухоли у животных, которым вводили физиологический раствор (PBS), черными линиями (кружками), WT IL-18 голубыми линиями (квадратами) и DR-IL-18 (mCS2) розовыми линями (треугольники). Только введение DR-IL-18, но не введение WT IL-18, приводило к ингибированию роста опухоли и клиренсу опухоли у подгруппы животных. (B) Представлены кривые выживаемости для мышей, которым вводили антитело против PD-1, WT IL-18 и DR-IL-18 (mCS2). Число полных ответов указаны в скобках. Введение DR-IL-18, но не введение WT IL-18, приводило к увеличению выживаемости и к клиренсу опухоли у 40% мышей, улучшению по сравнению с ингибитором иммунной контрольной точкой антителом против PD-1.
На фигурах 26A и 26B приведены данные, демонстрирующие активность DR-IL-18 в модели рака молочной железы 4T1 и модели меланомы B16-F10. (А) Представлены кривые роста опухолей 4Т1, инокулированных мышам линии BALB/C после введения физиологического раствора (PBS; черного цвета), введения WT IL-18 (синего цвета) или введения DR-IL-18 варианта CS2 (розового цвета). (B) Представлены кривые роста опухолей B16-F10, имплантированных мышам линии C57BL/6 после введения физиологического раствора (PBS; черного цвета), введения WT IL-18 (синего цвета) или введения DR-IL-18 варианта CS2 (розового цвета). В обеих моделях только введение DR-IL-18, но не введение WT IL-18, приводило к ингибированию роста опухоли. Лечение проводили после того, как средний размер опухоли превышал 50 мм3, как указано в прямоугольниках, помеченных буквой "t".
На фигурах 27А и 27В приведены данные, которые дополняют данные, представленные на фигурах 19А - 19С. Представленные данные демонстрируют активность DR-IL-18 при лечении дополнительных моделей опухолей с дефицитом молекул МНС I класса, которые резистентны к ингибиторам иммунных контрольных точек. (A) Клетки MC38 с дефицитом B2m получали с использованием опосредованной CRISPR/Cas9 делеции, описанной для клеток YUMMER с дефицитом B2m. Имплантировали подкожно клетки B2m-/-MC38, и начинали лечение на 7-й день после того, как размеры опухолей в среднем составляли ~65 мм3. mCS2 вводили в дозе 0,32 мг/кг два раза в неделю суммарно 5 доз. Антитело против PD1 и антитело против CTLA4 вводили в дозе 8 мг/кг по той же схеме. (B) RMA/S является вариантом линии лимфомы RMA, который содержит спонтанную мутацию в TAP-ассоциированном гликопротеине. Результатом является дефект в загрузке антигена и, следовательно, снижение поверхностной экспрессии молекул МНС класса I. Он является конгенным для линии мышей C57BL/6C57BL и устойчивым к ингибиторам иммунных контрольных точек. Мышам имплантировали подкожно 1000000 клеток RMA/S и начинали лечение на 7-й день. МКС2 вводили в дозе 0,32 мг/кг два раза в неделю. Антитело против PD1 вводили в дозе 8 мг/кг по той же схеме. В обоих исследованиях, только лечение с помощью варианта DR-18 mCS2 показало противоопухолевый эффект в виде ингибирования роста опухоли (B2m - / - MC38) или клиренса опухоли (RMA/S).
На фигуре 28 приведены данные, демонстрирующие активность DR-IL-18 в отношении усиления противоопухолевой антителозависимой клеточно-опосредованной цитотоксичности (ADCC). В исследованиях цитотоксичности ex vivo использовали клетки линии Raji (В-клеточной лимфомы), меченные с помощью CFSE, и выделенные мононуклеарные клетки периферической крови человека (РВМС). РВМС и меченые клетки Раджи инкубировали вместе при соотношении эффектор:мишень (E:T) 1:10 в течение 25 часов. На указанные образцы наносили вариант hCS-1 человеческого DR-IL-18 (1 мкМ), ритуксимаб (10 мкг/мл) или комбинацию обоих средств. Цитотоксичность определяли с помощью проточной цитометрии и рассчитывали как долю клеток CFSE, которая стала DAPI-положительной. DR-18 значимо стимулировал гибель опухолевых клеток при монотерапии и его воздействие на гибель клеток значимо усиливалось при комбинации с терапевтическим антителом ритуксимабом. *p <0,05 по двустороннему анализу ANOVA с коррекцией Тьюки для множественных сравнений.
На фигурах 29А и 29В приведены данные, демонстрирующие противовирусную активность варианта mCS2 DR-18 при лечении вирусных инфекций (например, в данном случае при лечении системной инфекции вирусом осповакцины). (А) Схема плана эксперимента. Мышей линии C57BL/6 внутрибрюшинно (IP) инфицировали с помощью 106 БОЕ вируса осповакцины (VACV) и вводили внутрибрюшинно 1 мг/кг WT mIL-18 или mCS2. Мышей умерщвляли и определяли вирусные титры в крови и яичниках методом полимеразной цепной реакции с обратной транскрипцией (RT-PCR) на 3-ий день после инфицирования. (B) Количественная оценка вирусных копий VACV в яичниках и крови подвергнутых обработке мышей на 3-ий день после заражения. Обработка с помощью CS2 показало значительное снижение вирусных титров, тогда как обработка с помощью WT IL-18 была неэффективной. *р <0,05, **р <0,01, ***р <0,001.
На фигуре 30А приведены данные, демонстрирующие активность вариантов DR-IL-18 человека второго поколения. На фигуре 30А показано, что WT IL-18 и h6-12, h6-27, h6-29 и h6-31 стимулируют репортерные клетки IL-18 HEK-Blue. h6-12, h6-27 и h6-29 демонстрируют повышенную активность по сравнению с WT hIL-18, тогда как h6-31 обладает такой же активностью, что и WT hIL-18. Таким образом, данные демонстрируют, что все подвергнутые испытаниям варианты человеческого DR-IL-18 второго поколения активно передают сигналы через IL-18R.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к вариантам IL-18, индуцирующим или усиливающим активацию сигнального пути IL-18. В одном аспекте, изобретение относится к вариантам IL-18, которые могут связываться с рецептором IL-18 (IL-18R), но не связываются с IL-18-связывающим белком (IL-18BP), обеспечивая в силу этого активацию сигнального пути IL-18, но которые не подвергаются ингибированию при воздействии IL-18BP. В одном аспекте, изобретение относится к вариантам IL-18, которые связываются с IL-18BP, тем самым уменьшая или предотвращая связывание IL-18BP с эндогенным IL-18 и ингибирование эндогенного IL-18 и обеспечивая в силу этого активацию сигнального пути IL-18. Поэтому, в изобретении предлагаются композиции и способы для обеспечения активации сигнального пути IL-18 даже в присутствии IL-18BP.
В различных вариантах осуществления, изобретение представляет собой вариант полипептида IL-18 или его фрагмент, который специфически связывается с IL-18R и проявляет в значительной степени ослабленное связывание с IL-18BP. В некоторых вариантах осуществления, вариант полипептида IL-18 или его фрагмент, который связывается с IL-18R, но практически не связывается с IL-18BP, применяют для обеспечения активации сигнального пути IL-18, который не ингибируется в результате присутствия и активности IL-18BP. В различных вариантах осуществления, изобретение относится к варианту полипептида IL-18 или его фрагменту, который специфически связывается с IL-18BP и уменьшает или предотвращает ингибирование эндогенного IL-18 под воздействием IL-18BP. В некоторых вариантах осуществления, вариант полипептида IL-18 или ее фрагмент, который связывается с IL-18BP, применяют для ингибирования активности IL-18BP, в силу этого индуцируя, усиливая или промотируя активность сигнального пути IL-18.
В некоторых вариантах осуществления, варианты полипептида IL-18 применяют для лечения и предотвращения заболевания или нарушения. В различных вариантах осуществления, заболевание или нарушение представляет собой рак или инфекционное заболевание, такое как поксвирусы, которые кодируют ортолог IL-18BP, метаболическое заболевание или нарушение (в том числе ожирение и диабет) или макулярную дегенерацию (например, влажную форму макулярной дегенерации, например, влажную форму возрастной макулярной дегенерации, например, вариант IL-18 может быть применен в качестве антиангиогенного средства, и в некоторых случаях, упомянутый вариант полипептида IL-18 может, например, ослаблять неоваскуляризацию хориоидеи). Поэтому, в некоторых вариантах осуществления, изобретение представляет собой композицию, включающую, по меньшей мере, один вариант полипептида IL-18 или его фрагмент. В других вариантах осуществления, изобретение представляет собой способ введения, по меньшей мере, одного варианта полипептида IL-18 или его фрагмента для лечения или предотвращения заболевания или нарушения, такого как, но этим не ограничивая, рак или инфекционное заболевание, метаболическое заболевание или нарушение, или макулярная дегенерация (например, влажная форма макулярной дегенерации, такая как влажная форма возрастной макулярной дегенерации).
В различных вариантах осуществления, вариант полипептида IL-18 включает мутацию относительно дикой формы (WT) полипептида IL-18. В некоторых вариантах осуществления, WT IL-18 полипептид включает аминокислотную последовательность SEQ ID NO: 30. В других вариантах осуществления, WT IL-18 полипептид включает аминокислотную последовательность SEQ ID NO: 31.
В некоторых вариантах осуществления, варианты полипептида IL-18 по изобретению проявляют пониженную аффинность связывания с IL-18BP по сравнению с полипептидом WT IL-18. В некоторых вариантах осуществления, варианты полипептида IL-18 по изобретению проявляют повышенную аффинность связывания с IL-18BP по сравнению с полипептидом WT IL-18. В некоторых вариантах осуществления, варианты полипептида IL-18 по изобретению проявляют аффинность связывания с IL-18BP, аналогичную величине аффинности связывания полипептида WT IL-18.
В некоторых вариантах осуществления, вариант полипептида IL-18 проявляет повышенную аффинность связывания с IL-18R по сравнению с полипептидом WT IL-18. В некоторых вариантах осуществления, вариант полипептида IL-18 проявляет аффинность связывания с IL-18R, аналогичную величине аффинности связывания полипептида WT IL-18. В некоторых вариантах осуществления, вариант полипептида IL-18 проявляет пониженную аффинность связывания с IL-18R по сравнению с полипептидом WT IL-18.
В некоторых вариантах осуществления, вариант полипептида IL-18 представляет собой вариант полипептида IL-18 млекопитающего. В некоторых вариантах осуществления, вариант полипептида IL-18 представляет собой вариант полипептида IL-18 человека. В некоторых вариантах осуществления, вариант полипептида IL-18 представляет собой вариант полипептида IL-18 человека мыши.
В различных вариантах осуществления, композиции и способы по изобретению включают композиции и способы для лечения и предотвращения заболевания и нарушений, таких как рак, инфекционное заболевание и метаболические заболевания и нарушения. В некоторых вариантах осуществления, способ включает введение субъекту, нуждающемуся в этом, композиции, включающей, по меньшей мере, один вариант полипептида IL-18. В некоторых вариантах осуществления, способ включает введение субъекту, нуждающемуся в этом, композиции, включающей, по меньшей мере, один вариант полипептида IL-18, и введение субъекту композиции, включающей дополнительное лекарственное средство.
В одном таком варианте осуществления, дополнительное лекарственное средство включает иммунотерапевтическое средство, включающее, по меньшей мере, одно средство, выбранное из группы, включающей, но этим не ограничивая, измененные Т-клетки, Т-клетки с химерным антигенным рецептором (CAR-T), бронированные CAR-T клетки, вирус, антиген, вакцину, антитело, ингибитор иммунных контрольных точек, малую молекулу, химиотерапевтическое средство и стволовые клетки. В некоторых вариантах осуществления, композицию, включающую, по меньшей мере, один вариант полипептида IL-18, применяют в способе для повышения активности иммунной системы до, в процессе или после инфицирования бактериями, вирусом или другим патогеном. В некоторых вариантах осуществления, композицию, включающую, по меньшей мере, один вариант полипептида IL-18, применяют в способе для повышения числа и/или активности иммуноцитов in vitro, in vivo или ex vivo, например, числа и/или активности T-клеток, NK-клеток и/или миелоидных клеток.
Определения
Если не указано иначе, то все используемые в изобретении технические и научные термины имеют те же значения, которые являются общепринятыми для обычных специалистов в области техники, к которой относится изобретение. При описании настоящего изобретения и его патентной формулы будет использоваться приведенная ниже терминология.
Следует также иметь в виду, что используемая в изобретении терминология служит только для описания конкретных вариантов осуществления и не является ограничениями для изобретения.
Используемая в изобретении форма единственного числа обозначает в тексте один грамматический объект или более чем один грамматический объект (то есть, по меньшей мере, один). Например, "элемент" означает один элемент или более чем один элемент.
Подразумевается, что используемый в изобретении термин "приблизительно" в отношении измеряемой величины, такой как количество, временная продолжительность и другие подобные величины, включает неограничивающие отклонения на ±40% или ±20% или ±10%, ±5%, ±1% или ±0,1% от указанной величины, если такие отклонения являются приемлемыми.
Используемый термин "аномальный" применительно к организмам, тканям, клеткам или их компонентам относится к тем организмам, тканям, клеткам или их компонентам, которые отличаются, по меньшей мере, одной наблюдаемой или обнаруживаемой характеристикой (например, возраст, лечение время суток и т. д.) от тех организмов, тканей, клеток или их компонентов, которые демонстрируют "нормальную" (ожидаемую) соответствующую характеристику. Характеристики, которые являются нормальными или ожидаемыми для одного типа клеток или тканей, могут быть аномальными для другого типа клеток или тканей.
Используемый в изобретении термин "антитело" обозначает молекулу иммуноглобулина, которая способна специфически связываться с конкретным эпитопом на антигене. Антитела могут представлять собой интактные иммуноглобулины, полученные из природных источников или из рекомбинантных источников, и могут представлять собой иммунореактивные части интактных иммуноглобулинов. Антитела в настоящем изобретении могут существовать в различных формах, включая, например, поликлональные антитела, моноклональные антитела, внутриклеточные антитела ("интраантитела"), Fv, Fab и F (ab) 2, а также одноцепочечные антитела (scFv), антитела из тяжелых цепей, такие как верблюжьи антитела, синтетические антитела, химерные антитела и гуманизированные антитела (Harlow et al., 1999, Using Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, NY; Harlow et al., 1989, Antibodies: A Laboratory Manual, Cold Spring Harbor, New York; Houston et al., 1988, Proc. Natl. Acad. Sci. USA 85:5879-5883; Bird et al., 1988, Science 242:423-426).
Используемый в изобретении термин "тяжелая цепь антитела" относится к бóльшей из двух типов полипептидных цепей, присутствующих в молекулах всех антител в их природных конформациях.
Используемый в изобретении термин "легкая цепь антитела" относится к меньшей из двух типов полипептидных цепей, присутствующих в молекулах всех антител в их природных конформациях. κ и λ легкие цепи относятся к двум главным изотипам легких цепей антитела.
Под используемым в изобретении термином "синтетическое антитело" подразумевают антитело, которое генерируют методом рекомбинантных ДНК, такое как, например, описанное в изобретении антитело, экспрессируемое бактериофагом. Термин также следует истолковывать как обозначающий антитело, которое было генерировано путем синтеза молекулы ДНК, кодирующей антитело, и которая молекула ДНК экспрессирует белок антитела, или сигнальную последовательность, определяющую антитело, где ДНК или аминокислотная последовательность были получены с использованием технологии синтетической ДНК или аминокислотной последовательности, которая хорошо известна и применяется и в данной области.
Используемый в изобретении термин "иммунологический анализ" относится к любому анализу связывания, в котором используют антитело, способное специфически связываться с молекулой-мишенью, для обнаружения и количественного определения молекулы-мишени.
Под используемым в настоящем изобретении термином "специфически связывает" применительно к варианту полипептида IL-18 подразумевают вариант полипептида IL-18, который распознает и связывается с конкретным рецептором, таким как IL-18R, или с IL-18BP. В некоторых случаях, вариант полипептида IL-18 существенно уменьшал связывание с IL-18BP. Например, вариант полипептида IL-18, который специфически связывается с рецептором от одного вида, также может связываться с этим рецептором от одного или более видов. Но такая межвидовая реактивность сама по себе не меняет классификацию варианта полипептида IL-18 в качестве специфического. В другом примере, вариант полипептида IL-18, который специфически связывается с рецептором, также может связываться с различными аллельными формами рецептора. Однако такая перекрестная реактивность сама по себе не меняет классификацию варианта полипептида IL-18 как специфического. В некоторых случаях, термины "специфическое связывание" или "специфически связывающий" могут использоваться в отношении взаимодействия антитела, белка или пептида со вторым химическим видом для обозначения того, что взаимодействие зависит от присутствия определенной структуры (например, антигенного детерминанта или эпитопа) на химических видах; например, вариант полипептида IL-18 распознает и связывается с определенной структурой белка, а не с белками в целом.
Под используемым в настоящем изобретении термином "аппликатор" подразумевают любое устройство, включающее, но этим не ограничивая, шприц для подкожных инъекций, пипетку, устройство для лекарственного электрофореза, пластырь и другие подобные приспособления, для введения субъекту композиций по изобретению.
Используемый в изобретении термин "рак" относится к аномальному росту или делению клеток. Как правило, рост и/или продолжительность жизни раковых клеток превышают и не согласуются с ростом и/или продолжительностью жизни нормальных клеток и тканей вокруг них. Рак может быть доброкачественным, предзлокачественным или злокачественным. Рак возникает в различных клетках и тканях, в том числе в полости рта (например, во рту, языке, глотке и так далее), пищеварительной системе (например, пищеводе, желудке, тонкой кишке, толстой кишке, прямой кишке, печени, желчном протоке, желчном пузыре, поджелудочной железе и так далее), дыхательной системе (например, гортани, легких, бронхах и так далее), костях, суставах, на коже (например, базальных клетках, сквамозных клетках, менингиоме и так далее), молочной железе, половых органах (например, матке, яичнике, предстательной железе, яичке и так далее), мочевой системе (например, мочевом пузыре, почке, мочеточнике и так далее), в глазу, нервной системе (например, мозге и так далее), эндокринной системе (например, щитовидной железе и так далее) и в системе кроветворения (например, лимфома, миелома, лейкоз, острый лимфоцитарный лейкоз, хронический лимфолейкоз, острый миелоидный лейкоз, хронический миелоидный лейкоз и так далее).
Используемый в изобретении термин "кодирующая последовательность" обозначает последовательность нуклеиновой кислоты или ее комплемента, или ее часть, которая может быть подвергнута транскрибированию и/или транслированию с образованием мРНК и/или полипептида или его фрагмента. Кодирующие последовательности включают экзоны в геномной ДНК или первичные транскрипты незрелой РНК, которые объединяются под воздействием биохимических механизмов клеток с образованием зрелой мРНК. Антисмысловая нить является комплементом такой нуклеиновой кислоты, и из нее может быть образована кодирующая последовательность. В отличие от этого, используемый в изобретении термин "некодирующая последовательность" обозначает последовательность нуклеиновой кислоты или ее комплемента, или ее часть, которая не транслируется в аминокислоту in vivo, или где тРНК не взаимодействует с целью внедрить или попытаться внедрить аминокислоту. Некодирующие последовательности включают как последовательности интрона в геномной ДНК, так и первичные транскрипты незрелой РНК и ген-ассоциированные последовательности, такие как промоторы, энхансеры, сайленсеры и другие подобные.
Используемые в изобретении термины "комплементарный" или "комплементарность" применяют в отношении полинуклеотидов (то есть, последовательности нуклеотидов), связанных на основе правил спаривания оснований. Например, последовательность "A-G-T" является комплементарной для последовательности "T-C-A". Комплементарность может быть "частичной", при которой только некоторые из оснований нуклеиновых кислот полностью подходят друг другу в соответствии с правилами спаривания оснований. Или может существовать "полная" или "общая" комплементарность между нуклеиновыми кислотами. Степень комплементарности между нитями нуклеиновых кислот оказывает сильное влияние на эффективность и интенсивность гибридизации между нитями нуклеиновых кислот. Это является особенно важным при реакциях амплификации, а также для методов детекции, которые зависят от связывания между нуклеиновыми кислотами.
"Заболевание" представляет собой состояние здоровья животного, при котором животное не может поддерживать гомеостаз и при котором, если болезненное состояние не облегчают, здоровье животного продолжает ухудшаться. В отличие от этого, "нарушение" у животного представляет собой состояние здоровья, при котором животное способно поддерживать гомеостаз, но при котором состояние здоровья животного является менее благоприятным, чем оно могло бы быть при отсутствии нарушения. Не будучи подвергнуто лечению, нарушение необязательно приводит к дальнейшему ухудшению состояния здоровья животного.
Используемый в изобретении термин "эффективное количество" обозначает количество, которое обеспечивает достижение терапевтического, профилактического или другого требуемого положительного эффекта.
"Кодирование" относится к свойству, присущему для специфических последовательностей нуклеотидов в полинуклеотиде, таком как ген, кДНК или мРНК, служить в качестве матриц для синтеза других полимеров и макромолекул в биологических процессах, имеющих либо определенную последовательность нуклеотидов (то есть рРНК, тРНК и мРНК), или определенную последовательность аминокислот, и полученные в результате этого биологические свойства. Таким образом, ген кодирует белок, если транскрипция и трансляция мРНК, соответствующей этому гену, продуцирует белок в клетке или другой биологической системе. Как кодирующая цепь, нуклеотидная последовательность которой идентична последовательности мРНК и обычно указывается в перечнях последовательностей, так и некодирующая цепь, используемая в качестве матрицы для транскрипции гена или кДНК, могут называться последовательностями, кодирующими белок или другой продукт этого гена, или кДНК.
Используемый в изобретении термин "фрагмент" применительно к нуклеиновой кислоте, обозначает последовательность более крупной нуклеиновой кислоты. "Фрагмент" нуклеиновой кислоты может составлять, по меньшей мере, приблизительно 15 нуклеотидов в длину; например, по меньшей мере, от приблизительно 50 нуклеотидов до приблизительно 100 нуклеотидов; по меньшей мере, приблизительно 100 to приблизительно 500 нуклеотидов, по меньшей мере, от приблизительно 500 до приблизительно 1000 нуклеотидов; по меньшей мере, от приблизительно 1000 нуклеотидов до приблизительно 1500 нуклеотидов; от приблизительно 1500 нуклеотидов до приблизительно 2500 нуклеотидов; или приблизительно 2500 нуклеотидов (и любое целочисленное значение между ними). Используемый в изобретении термин "фрагмент" применительно к белку, полипептиду или пептиду, обозначает последовательность более крупного белка, полипептида или пептида. "Фрагмент" белка, полипептида или пептида может составлять, по меньшей мере, приблизительно 5 аминокислот в длину; например, по меньшей мере, приблизительно 10 аминокислот в длину; по меньшей мере, приблизительно 20 аминокислот в длину; по меньшей мере, приблизительно 50 аминокислот в длину; по меньшей мере, приблизительно 100 аминокислот в длину; по меньшей мере, приблизительно 200 аминокислот в длину; или, по меньшей мере, приблизительно 300 аминокислот в длину (и любое целочисленное значение между ними).
Термин "ген" относится к последовательности нуклеиновой кислоты (например, ДНК), которая включает кодирующие последовательности, необходимые для продуцирования полипептида, предшественника или РНК (например, мРНК). Полипептид может быть кодирован полноразмерной кодирующей последовательностью или любой частью кодирующей последовательности до тех пор, пока сохраняется желаемая активность или функциональное свойство (например, ферментативная активность, связывание с рецептором, сигнальная трансдукция, иммуногенность и другие подобные характеристики) полноразмерной последовательности или фрагмента. Термин также охватывает кодирующую область структурного гена и последовательности, расположенные рядом с кодирующей областью как на 5', так и на 3' концах на расстоянии около 2 тысяч нуклеотидов или более на любом конце, так что ген соответствует длине полноразмерной мРНК и 5'-регуляторных последовательностей, которые влияют на транскрипционные свойства гена. Последовательности, расположенные в положении 5' кодирующей области и присутствующие в мРНК, называют 5'-нетранслируемыми последовательностями. 5'-нетранслируемые последовательности обычно содержат регуляторные последовательности. Последовательности, расположенные в положении 3' или ниже от кодирующей области и присутствующие в мРНК, называют 3'-нетранслируемыми последовательностями. Термин "ген" охватывает как кДНК, так и геномные формы гена. Геномная форма или клон гена содержит кодирующую область, прерываемую некодирующими последовательностями, называемыми "интронами" или "промежуточными областями" или "промежуточными последовательностями". Интроны представляют собой сегменты гена, которые транскрибируются в ядерную РНК (hnРНК). Интроны могут содержать регуляторные элементы, такие как энхансеры. Интроны удаляются или "сплайсируются" из ядерного или первичного транскрипта, в силу чего интроны отсутствуют в транскрипте информационной РНК (мРНК). мРНК в процессе трансляции выполняет функцию, связанную с определением последовательности или порядка аминокислот в образующемся полипептиде.
Термины "гомологичная", "идентичная" или "идентичность", используемые в изобретении применительно к двум или более последовательностям нуклеиновых кислот или полипептидов, означают, что последовательности имеют определенный процент остатков, которые являются одинаковыми в указанной области. Процент может быть рассчитан путем оптимального выравнивания двух последовательностей, сравнения двух последовательностей в указанной области, определения количества положений, в которых идентичный остаток встречается в обеих последовательностях, с получением числа совпадающих положений, деления числа совпадающих положений на общее количество положений в указанной области и умножения результата на 100 с получением процента идентичности последовательности. В тех случаях, когда две последовательности имеют разную длину или выравнивание приводит к возникновению одного или более концов ступенчатого профиля и указанная область сравнения включает в себя только одну последовательность, остатки одной последовательности включают в знаменатель, а не в числитель при вычислении. При сравнении ДНК и РНК, тимин (T) и урацил (U) можно считать эквивалентными. Идентификация может быть выполнена вручную или с помощью алгоритма компьютерного секвенирования, такого как BLAST или BLAST 2.0.
Используемый в изобретении термин "инструктивный материал" включает публикацию, запись, диаграмму или любой другое средство выражения, которое может быть использовано для предоставления информации по поводу применимости нуклеиновой кислоты, пептида, полипептида и/или соединения по изобретению в фармацевтическом наборе для выявления или облегчения или лечения различных заболеваний или нарушений, описанных в изобретении. Необязательно, или в качестве варианта, в инструктивном материале могут быть описаны один или более способов выявления или облегчения заболеваний или нарушений в клетке или ткани субъекта. Инструктивный материал фармацевтического набора, например, может быть прикреплен к контейнеру, который содержит нуклеиновую кислоту, полипептид и/или соединение по изобретению, или может поставляться вместе с контейнером, который содержит нуклеиновую кислоту, полипептид и/или соединение. В качестве варианта, инструктивный материал может быть отправлен отдельно от контейнера, но при предположении, что получатель будет совместно использовать инструктивный материал и соединение.
"Выделенный" означает видоизмененный или высвобожденный из своего естественного состояния. Например, нуклеиновая кислота или полипептид, естественно присутствующие в организме животного, не являются "выделенными", но эта же нуклеиновая кислота или полипептид, частично или полностью отделенные от сосуществующих материалов в своем естественном состоянии, являются "выделенными". Выделенная нуклеиновая кислота или белок могут существовать в практически чистой форме или могут существовать в ненативной среде, такой как, например, клетка-хозяин.
"Выделенная нуклеиновая кислота" относится к сегменту или фрагменту нуклеиновой кислоты, который был отделен от последовательностей, фланкирующих его в естественном состоянии, например фрагмент ДНК, который был удален из последовательностей, которые обычно расположены рядом с фрагментом, например, из последовательностей, расположенных рядом с фрагментом в геноме, в котором он встречается в природе. Термин также применяется к нуклеиновым кислотам, которые были практически очищены от других компонентов, которые сопровождают нуклеиновую кислоту в природе, например, от РНК или ДНК или белков, которые сопровождают ее в клетке. Следовательно, термин включает, например, рекомбинантную ДНК, которая включена в вектор, в автономно реплицирующуюся плазмиду или вирус, или в геномную ДНК прокариота или эукариота, или которая существует в виде отдельной молекулы (например, в виде кДНК или геномного фрагмента или фрагмента кДНК, продуцированного с помощью ПЦР или расщепления рестрикционной эндонуклеазой), независимой от других последовательностей. Термин также включает рекомбинантную ДНК, которая является частью гибридного гена, кодирующего дополнительную полипептидную последовательность.
Используемый в изобретении термин "метка" относится к обнаруживаемому соединению или композиции, которые прямо или косвенно конъюгированы с зондом для генерации "меченого" зонда. Метка может быть обнаруживаемой сама по себе (например, радиоизотопные метки или флуоресцентные метки) или, в случае ферментативной метки, может катализировать химическое изменение обнаруживаемого субстратного соединения или композиции (например, авидин-биотин). В некоторых случаях, для обнаружения продукта ПЦР, метки могут быть нанесены на праймеры.
Под используемым в изобретении термином "модулирующий" подразумевают опосредование обнаруживаемого увеличения или уменьшения активности и/или уровня мРНК, полипептида или ответной реакции у субъекта по сравнению с активностью и/или уровнем мРНК, полипептида или ответной реакцией у субъекта в отсутствие лечения или соединения, и/или по сравнению с активностью и/или уровнем мРНК, полипептида или ответной реакцией у такого же, но не подвергнутого лечению субъекта. Термин охватывает активацию, ингибирование и/или иное воздействие на нативный сигнал или ответную реакцию, тем самым опосредуя положительную терапевтическую, профилактическую или другую требуемую ответную реакцию у субъекта, например, человека.
Используемые в изобретении термины "мутация", "мутант" или "вариант" относятся к изменению последовательности нуклеиновой кислоты или последовательности полипептида относительно референсной последовательности (которая может представлять собой нормальную последовательность природного происхождения или последовательность "дикого типа"), и это изменение включает транслокации, делеции, вставки и замены/точечные мутации. Используемый в изобретении термин "мутант" или "вариант" относится к нуклеиновой кислоте или белку, содержащему мутацию.
Термин "нуклеиновая кислота" относится к полинуклеотиду и включает полирибонуклеотиды и полидезоксирибонуклеотиды. Нуклеиновые кислоты по настоящему изобретению могут включать любой полимер или олигомер пиримидиновых и пуриновых оснований, предпочтительно, цитозин, тимин и урацил, и аденин и гуанин, соответственно (смотрите руководство Albert L. Lehninger, Principles of Biochemistry, at 793-800 (Worth Pub. 1982), полное содержание которого включено в настоящее изобретение путем ссылки на него). И действительно, в настоящем изобретении рассматривается любой дезоксирибонуклеотидный, рибонуклеотидный или пептидный компонент нуклеиновой кислоты и любые его химические варианты, такие как метилированные, гидроксиметилированные или глюкозилированные формы этих оснований и другие подобные формы. Полимеры или олигомеры могут быть гетерогенными или гомогенными по составу и могут быть выделены из природных источников или могут быть получены искусственно или синтетически. Кроме того, нуклеиновые кислоты могут представлять собой ДНК или РНК или их смесь и могут существовать постоянно или временно в одноцепочечной или двухцепочечной форме, включая гомодуплекс, гетеродуплекс и гибридные состояния.
"Олигонуклеотид" или "полинуклеотид" представляет собой нуклеиновую кислоту с длиной в диапазоне, по меньшей мере, 2, предпочтительно, по меньшей мере, 8, 15 или 25 нуклеотидов, но длина может составлять до 50, 100, 1000 или 5000 нуклеотидов, или соединение, которое специфически гибридизуется с полинуклеотидом. Полинуклеотиды включают последовательности дезоксирибонуклеиновой кислоты (ДНК) или рибонуклеиновой кислоты (РНК) или их миметиков, которые могут быть выделены из природных источников, рекомбинантно продуцированы или искусственно синтезированы. Дополнительным примером полинуклеотида по настоящему изобретению может быть пептидная нуклеиновая кислота (PNA) (смотрите Патент США № 6155601, полное содержание которого включено в настоящее изобретение путем ссылки на него). Изобретение также включает ситуации, в которых существует нетрадиционное спаривание оснований, такое как хугстиновское спаривание оснований, которое было идентифицировано в определенных молекулах тРНК и предположительно существует в форме тройной спирали. Термины "полинуклеотид" и "олигонуклеотид" в этом изобретении используются взаимозаменяемо. Следует иметь в виду, что когда нуклеотидная последовательность представлена в изобретении последовательностью ДНК (например, A, T, G и C), она также включает соответствующую последовательность РНК (например, A, U, G, C), в которой "U" заменяет "Т".
Термины "пациент", "субъект", "индивидуум" и другие подобные термины используются в изобретении взаимозаменяемо и относятся к любому животному или его клеткам, будь то in vivo, in vitro или in situ, подлежащим лечению описанными в изобретении способами. В конкретных неограничивающих вариантах осуществления, пациентом, субъектом или индивидуумом является человек.
Используемые в изобретении термины "пептид", "полипептид" и "белок" применяются взаимозаменяемо и относятся к соединению, состоящему из аминокислотных остатков, ковалентно связанных пептидными связями. Белок или пептид должен содержать, по меньшей мере, две аминокислоты, и никакие ограничения не налагаются на максимальное количество аминокислот, которые могут включать последовательность белка или пептида. Полипептиды включают любой пептид или белок, содержащий две или более аминокислоты, соединенные друг с другом пептидными связями. Используемый в изобретении термин относится к обеим коротким цепям, которые также обычно называют в данной области техники, например, пептидами, олигопептидами и олигомерами, и к более длинным цепям, которые обычно называют в данной области техники белками, среди которых существуют много типов. "Полипептиды" включают, например, биологически активные фрагменты, практически гомологичные полипептиды, олигопептиды, гомодимеры, гетеродимеры, варианты полипептидов, модифицированные полипептиды, производные, аналоги, слитые белки и другие. Полипептиды включают природные пептиды, рекомбинантные пептиды, синтетические пептиды, мутантные полипептиды, вариантные полипептиды или их комбинации.
Используемый в изобретении термин "полинуклеотид" включает кДНК, РНК, гибрид ДНК/РНК, антисмысловую РНК, рибозим, геномную ДНК, синтетические формы и смешанные полимеры, как смысловые, так и антисмысловые цепи, и полинуклеотид может быть химически или биохимически модифицирован с целью проявления им свойств неприродных или дериватизированных синтетических или полусинтетических нуклеотидных оснований. Кроме того, в изобретении рассматриваются изменения гена дикого типа или синтетического гена, в том числе делеция, вставка, замена одного или более нуклеотидов или слияние с другими полинуклеотидными последовательностями.
Используемый в изобретении термин "предотвращать" заболевание или нарушение означает уменьшение тяжести или частоты проявления, по меньшей мере, одного признака или симптома заболевания или нарушения, которые может испытывать субъект.
Используемый в изобретении термин "образец" или "биологический образец" обозначает биологический материал, взятый у субъекта. Биологический образец может содержать любой биологический материал, подходящий для обнаружения мРНК, полипептида или другого маркера физиологического или патологического процесса у субъекта, и может включать жидкость, ткань, клеточный и/или неклеточный материал, взятые у субъекта.
Используемый в изобретении термин "практически очищенный" означает практическое отсутствие других компонентов. Например, практически очищенный полипептид представляет собой полипептид, который был отделен от других компонентов, с которыми он обычно ассоциирован в его природном состоянии.
Используемые в изобретении термины "терапия" или "схема лечения" относятся к тем действиям, которые предпринимаются для предотвращения, лечения или видоизменения заболевания или нарушения, например, к курсу лечения, предназначенного для уменьшения или устранения, по меньшей мере, одного признака или симптома заболевания или нарушения с использованием фармакологических, хирургических, диетических и/или других методов. Схема лечения может включать предписанное дозирование одного или более соединений или хирургическое вмешательство. Терапия чаще всего будет оказывать положительный эффект и уменьшать или устранять, по меньшей мере, один признак или симптом нарушения или болезненного состояния, но в некоторых случаях, эффект терапии будет характеризоваться нежелательными или побочными эффектами. На эффект терапии будет также влиять физиологическое состояние субъекта, например, возраст, пол, генетика, масса тела, другие болезненные состояния и другие подобные факторы.
Термин "терапевтически эффективное количество" относится к количеству рассматриваемого соединения или композиции, которое вызывает биологический, физиологический, клинический или медицинский ответ клетки, ткани, органа, системы или субъекта, который пытается достигнуть исследователь, ветеринар, врач или другой клиницист. Термин "терапевтически эффективное количество" включает такое количество соединения или композиции, которое при введении является достаточным для предотвращения развития или для лечения в определенной степени одного или более признаков или симптомов нарушения или заболевания, которые подвергают лечению. Терапевтически эффективное количество будет варьировать в зависимости от соединения или композиции, заболевания и его тяжести, а также возраста, массы тела и других подобных параметров подлежащего лечению субъекта.
Используемый в изобретении термин "лечить" заболевание или нарушение означает уменьшение частоты или тяжести, по меньшей мере, одного признака или симптома заболевания или нарушения, испытываемого субъектом. Термины "лечение", "лечить" и другие подобные термины обычно используются в изобретении для обозначения достижения желаемого фармакологического и/или физиологического эффекта. Эффект может быть профилактическим с точки зрения полного или частичного предотвращения заболевания или его симптома (симптомов) и/или может быть терапевтическим с точки зрения частичной или полной стабилизации или излечения от заболевания и/или неблагоприятного эффекта, связанного с заболеванием. Термин "лечение" охватывает любое лечение заболевания у млекопитающего, в частности, у человека, и включает: (а) предотвращение возникновения заболевания и/или симптома (симптомов) у субъекта, который может быть предрасположен к возникновению заболевания или симптома, но у которого еще не было диагностировано наличие этого заболевания или симптома; (б) ингибирование заболевания и/или симптома (симптомов), например, замедление или остановка их развития (например, остановка роста опухолей, замедление скорости роста опухоли, замедление скорости пролиферация раковых клеток и так далее); или (с) ослабление симптома (симптомов) заболевания, то есть достижение регрессии заболевания и/или симптома (симптомов) (например, достижение уменьшения размера опухоли, уменьшения количества присутствующих раковых клеток и так далее). К числу тех, кто нуждается в лечении, относятся пациенты, которые уже страдают от заболевания (например, пациенты, страдающие от рака, инфекция, метаболического нарушения, макулярной дегенерации и так далее), а также пациенты, нуждающиеся в профилактическом лечении (например, пациенты с повышенной предрасположенностью к раку, пациенты с повышенной вероятностью заражения, пациенты с подозрением на наличие рака, пациенты с подозрением на наличие инфекции, пациенты с повышенной предрасположенностью к метаболическому заболеванию, пациенты с повышенной предрасположенностью к макулярной дегенерации и так далее).
Используемый в изобретении термин "дикий тип" относится к гену или продукту гена, выделенному из природного источника. Ген дикого типа представляет собой ген, который чаще всего наблюдается в популяции, и поэтому произвольно обозначается как "нормальная" или "дикая" форма гена. В отличие от этого, термин "модифицированный", "вариант" или "мутант" относится к гену или продукту гена, который обладает модификациями в последовательности и/или в функциональных свойствах (то есть измененными характеристиками) по сравнению с геном дикого типа или продуктом гена.
Диапазоны: в этом описании изобретения могут быть представлены различные аспекты изобретения с указанием диапазона. Следует иметь в виду, что описание диапазона применяется просто для удобства и краткости, и его не следует рассматривать в качестве жесткого ограничения объема изобретения. Соответственно, следует считать, что описание диапазона конкретно раскрывает все возможные поддиапазоны, а также отдельные числовые значения в этом диапазоне. Например, следует считать, что описание диапазона, такого как от 1 до 6, включает конкретно описываемые поддиапазоны, такие как от 1 до 3, от 1 до 4, от 1 до 5, от 2 до 4, от 2 до 6, от 3 до 6 и так далее, а также отдельные числа в этом диапазоне, например, 1, 2, 2,7, 3, 4, 5, 5,3 и 6. Это применимо независимо от ширины диапазона.
Описание
В некоторых вариантах осуществления, композиции и способы по изобретению включают активатор активности IL-18, такой как активность сигнального пути через IL-18R. В некоторых вариантах осуществления, активатор представляет собой вариант полипептида IL-18. В некоторых вариантах осуществления, активатор представляет собой молекулу, которая способна связываться и передавать сигнал через IL-18R. В некоторых вариантах осуществления, активатор представляет собой молекулу, которая ингибирует IL-18BP, вследствие чего промотируя активацию сигнального пути IL-18.
В некоторых вариантах осуществления, в изобретении предлагается вариант полипептида IL-18 или его фрагмент, который специфически связывается с IL-18R и проявляет в значительной степени пониженное связывание IL-18BP. В некоторых вариантах осуществления, вариант полипептида IL-18 или его фрагмент, который связывается с IL-18R, но практически не связывается с IL-18BP, применяют для обеспечения активности сигнального пути IL-18, который ингибирован в результате присутствия и активности IL-18BP.
В некоторых вариантах осуществления, вариант полипептида IL-18 является резистентным к негативной регуляции в результате воздействия полипептида IL-18BP или является независимым от его воздействия. В некоторых вариантах осуществления, полипептид IL-18BP не способен в значительной степени связываться с вариантом полипептида IL-18. Варианты полипептида IL-18 по изобретению проявляют пониженную аффинность связывания с IL-18BP по сравнению с полипептидом WT IL-18. В некоторых вариантах осуществления, вариант полипептида IL-18 проявляют повышенную аффинность связывания с IL-18R по сравнению с полипептидом WT IL-18. В некоторых вариантах осуществления, вариант полипептида IL-18 проявляет аналогичную аффинность связывания с IL-18R по сравнению с полипептидом WT IL-18. В некоторых вариантах осуществления, вариант полипептида IL-18 проявляет пониженную аффинность связывания с IL-18R по сравнению с полипептидом WT IL-18.
В некоторых вариантах осуществления, в изобретении предлагается композиция, включающая ингибитор IL-18BP, где ингибитор ингибирует или уменьшает экспрессию, активность IL-18BP, или и то и другое. Примеры ингибиторов IL-18BP включают, но этим не ограничивая, химическое соединение, белок, пептидомиметик, антитело, рибозим и молекулу антисмысловой нуклеиновой кислоты. В конкретных вариантах осуществления, ингибитор IL-18BP включает вариант IL-18, который связывает IL-18BP, тем самым снижая или предотвращая ингибирование IL-18BP в результате воздействия IL-18 и активации сигнального пути IL-18.
В некоторых вариантах осуществления, варианты полипептида IL-18 применяют для лечения или предотвращения заболевания или нарушения. В различных вариантах осуществления, заболевание или нарушение представляет собой рак или метаболическое заболевание или нарушение, включающее ожирение и диабет (например, предлагаемый способ может приводить к снижению содержания жировой ткани). Так, в некоторых вариантах осуществления, в изобретении предлагается композиция, включающая, по меньшей мере, один вариант полипептида IL-18 или его фрагмент. В других вариантах осуществления, в изобретении предлагается способ введения, по меньшей мере, одного варианта полипептида IL-18 или его фрагмента, для лечения или предотвращения заболевания или нарушения, такого как, но этим не ограничивая, рак или метаболическое заболевание или нарушение.
В некоторых вариантах осуществления, вариант полипептида IL-18 связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, связывается с IL-18BP с аффинностью связывания, которая составляет приблизительно от 0,000000000001% до 95% от аффинности связывания IL-18 дикого типа с IL-18BP.
В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, связывается с IL-18BP с аффинностью связывания, которая составляет приблизительно 95% от аффинности связывания IL-18 дикого типа с IL-18BP. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, связывается с IL-18BP с аффинностью связывания, которая составляет приблизительно 90% от аффинности связывания IL-18 дикого типа с IL-18BP. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, связывается с IL-18BP с аффинностью связывания, которая составляет приблизительно 85% от аффинности связывания IL-18 дикого типа с IL-18BP. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, связывается с IL-18BP с аффинностью связывания, которая составляет приблизительно 80% от аффинности связывания IL-18 дикого типа с IL-18BP. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, связывается с IL-18BP с аффинностью связывания, которая составляет приблизительно 75% от аффинности связывания IL-18 дикого типа с IL-18BP. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, связывается с IL-18BP с аффинностью связывания, которая составляет приблизительно 70% от аффинности связывания IL-18 дикого типа с IL-18BP. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, связывается с IL-18BP с аффинностью связывания, которая составляет приблизительно 65% от аффинности связывания IL-18 дикого типа с IL-18BP. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, связывается с IL-18BP с аффинностью связывания, которая составляет приблизительно 60% от аффинности связывания IL-18 дикого типа с IL-18BP. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, связывается с IL-18BP с аффинностью связывания, которая составляет приблизительно 55% от аффинности связывания IL-18 дикого типа с IL-18BP. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, связывается с IL-18BP с аффинностью связывания, которая составляет приблизительно 50% от аффинности связывания IL-18 дикого типа с IL-18BP. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, связывается с IL-18BP с аффинностью связывания, которая составляет приблизительно 45% от аффинности связывания IL-18 дикого типа с IL-18BP. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, связывается с IL-18BP с аффинностью связывания, которая составляет приблизительно 40% от аффинности связывания IL-18 дикого типа с IL-18BP. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, связывается с IL-18BP с аффинностью связывания, которая составляет приблизительно 35% от аффинности связывания IL-18 дикого типа с IL-18BP. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, связывается с IL-18BP с аффинностью связывания, которая составляет приблизительно 30% от аффинности связывания IL-18 дикого типа с IL-18BP. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, связывается с IL-18BP с аффинностью связывания, которая составляет приблизительно 25% от аффинности связывания IL-18 дикого типа с IL-18BP. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, связывается с IL-18BP с аффинностью связывания, которая составляет приблизительно 20% от аффинности связывания IL-18 дикого типа с IL-18BP. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, связывается с IL-18BP с аффинностью связывания, которая составляет приблизительно 15% от аффинности связывания IL-18 дикого типа с IL-18BP. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, связывается с IL-18BP с аффинностью связывания, которая составляет приблизительно 10% от аффинности связывания IL-18 дикого типа с IL-18BP.
В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, связывается с IL-18BP с аффинностью связывания, которая составляет приблизительно 5% от аффинности связывания IL-18 дикого типа с IL-18BP. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, связывается с IL-18BP с аффинностью связывания, которая составляет приблизительно 4% от аффинности связывания IL-18 дикого типа с IL-18BP. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, связывается с IL-18BP с аффинностью связывания, которая составляет приблизительно 3% от аффинности связывания IL-18 дикого типа с IL-18BP. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, связывается с IL-18BP с аффинностью связывания, которая составляет приблизительно 2% от аффинности связывания IL-18 дикого типа с IL-18BP. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, связывается с IL-18BP с аффинностью связывания, которая составляет приблизительно 1% от аффинности связывания IL-18 дикого типа с IL-18BP.
В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, связывается с IL-18BP с аффинностью связывания, которая составляет приблизительно 0,1% от аффинности связывания IL-18 дикого типа с IL-18BP. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, связывается с IL-18BP с аффинностью связывания, которая составляет приблизительно 0,01% от аффинности связывания IL-18 дикого типа с IL-18BP. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, связывается с IL-18BP с аффинностью связывания, которая составляет приблизительно 0,001% от аффинности связывания IL-18 дикого типа с IL-18BP. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, связывается с IL-18BP с аффинностью связывания, которая составляет приблизительно 0,0001% от аффинности связывания IL-18 дикого типа с IL-18BP. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, связывается с IL-18BP с аффинностью связывания, которая составляет приблизительно 0,00001% от аффинности связывания IL-18 дикого типа с IL-18BP. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, связывается с IL-18BP с аффинностью связывания, которая составляет приблизительно 0,000001% от аффинности связывания IL-18 дикого типа с IL-18BP. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, связывается с IL-18BP с аффинностью связывания, которая составляет приблизительно 0,0000001% от аффинности связывания IL-18 дикого типа с IL-18BP. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, связывается с IL-18BP с аффинностью связывания, которая составляет приблизительно 0,00000001% от аффинности связывания IL-18 дикого типа с IL-18BP. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, связывается с IL-18BP с аффинностью связывания, которая составляет приблизительно 0,000000001% от аффинности связывания IL-18 дикого типа с IL-18BP. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, связывается с IL-18BP с аффинностью связывания, которая составляет приблизительно 0,0000000001% от аффинности связывания IL-18 дикого типа с IL-18BP. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, связывается с IL-18BP с аффинностью связывания, которая составляет приблизительно 0,00000000001% от аффинности связывания IL-18 дикого типа с IL-18BP. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, связывается с IL-18BP с аффинностью связывания, которая составляет приблизительно 0,000000000001% от аффинности связывания IL-18 дикого типа с IL-18BP.
В некоторых вариантах осуществления, предлагаемый вариант полипептида IL-18 (DR-IL-18), который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, имеет величину KD для IL-18BP, которая составляет 10 нM или более (более высокое значение KD означает более низкую аффинность связывания). В некоторых вариантах осуществления, предлагаемый DR-вариант полипептида IL-18 имеет величину KD для IL-18BP, которая составляет 20 нM или более (например, 50 нM или более, 100 нM или более, 500 нM или более, или 1 мкM или более).
В некоторых вариантах осуществления, вариант полипептида IL-18 связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP. В некоторых вариантах осуществления, вариант полипептида, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, имеет отношение констант диссоциации IL-18BP/IL-18R, которое приблизительно, по меньшей мере, в 2 раза выше, чем отношение констант диссоциации IL-18BP/IL-18R дикого типа IL-18 (необходимо отметить, что повышенное отношение констант диссоциации свидетельствует об относительном уменьшении IL-18BP связывания относительно IL-18R связывания). В некоторых вариантах осуществления, вариант полипептида, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, имеет отношение констант диссоциации IL-18BP/IL-18R, которое приблизительно, по меньшей мере, в 20 раз выше, чем отношение констант диссоциации IL-18BP/IL-18R дикого типа IL-18. В некоторых вариантах осуществления, вариант полипептида, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, имеет отношение констант диссоциации IL-18BP/IL-18R, которое приблизительно, по меньшей мере, в 200 раз выше, чем отношение констант диссоциации IL-18BP/IL-18R дикого типа IL-18. В некоторых вариантах осуществления, вариант полипептида, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, имеет отношение констант диссоциации IL-18BP/IL-18R, которое приблизительно, по меньшей мере, в 2000 раз выше, чем отношение констант диссоциации IL-18BP/IL-18R дикого типа IL-18. В некоторых вариантах осуществления, вариант полипептида, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, имеет отношение констант диссоциации IL-18BP/IL-18R, которое приблизительно, по меньшей мере, в 20000 раз выше, чем отношение констант диссоциации IL-18BP/IL-18R дикого типа IL-18. В некоторых вариантах осуществления, вариант полипептида, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, имеет отношение констант диссоциации IL-18BP/IL-18R, которое приблизительно, по меньшей мере, в 200000 раз выше, чем отношение констант диссоциации IL-18BP/IL-18R дикого типа IL-18. В некоторых вариантах осуществления, вариант полипептида, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, имеет отношение констант диссоциации IL-18BP/IL-18R, которое приблизительно, по меньшей мере, в 2000000 раз выше, чем отношение констант диссоциации IL-18BP/IL-18R дикого типа IL-18. В некоторых вариантах осуществления, вариант полипептида, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, имеет отношение констант диссоциации IL-18BP/IL-18R, которое приблизительно, по меньшей мере, в 20000000 раз выше, чем отношение констант диссоциации IL-18BP/IL-18R дикого типа IL-18.
В некоторых вариантах осуществления, вариант полипептида IL-18 связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP. В некоторых вариантах осуществления, вариант полипептида, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, имеет отношение констант диссоциации IL-18BP/IL-18R, которое приблизительно, по меньшей мере, в 3 раза выше, чем отношение констант диссоциации IL-18BP/IL-18R дикого типа IL-18. В некоторых вариантах осуществления, вариант полипептида, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, имеет отношение констант диссоциации IL-18BP/IL-18R, которое приблизительно, по меньшей мере, в 30 раз выше, чем отношение констант диссоциации IL-18BP/IL-18R дикого типа IL-18. В некоторых вариантах осуществления, вариант полипептида, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, имеет отношение констант диссоциации IL-18BP/IL-18R, которое приблизительно, по меньшей мере, в 300 раз выше, чем отношение констант диссоциации IL-18BP/IL-18R дикого типа IL-18. В некоторых вариантах осуществления, вариант полипептида, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, имеет отношение констант диссоциации IL-18BP/IL-18R, которое приблизительно, по меньшей мере, в 3000 раз выше, чем отношение констант диссоциации IL-18BP/IL-18R дикого типа IL-18. В некоторых вариантах осуществления, вариант полипептида, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, имеет отношение констант диссоциации IL-18BP/IL-18R, которое приблизительно, по меньшей мере, в 30000 раз выше, чем отношение констант диссоциации IL-18BP/IL-18R дикого типа IL-18. В некоторых вариантах осуществления, вариант полипептида, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, имеет отношение констант диссоциации IL-18BP/IL-18R, которое приблизительно, по меньшей мере, в 300000 раз выше, чем отношение констант диссоциации IL-18BP/IL-18R дикого типа IL-18. В некоторых вариантах осуществления, вариант полипептида, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, имеет отношение констант диссоциации IL-18BP/IL-18R, которое приблизительно, по меньшей мере, в 3000000 раз выше, чем отношение констант диссоциации IL-18BP/IL-18R дикого типа IL-18. В некоторых вариантах осуществления, вариант полипептида, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, имеет отношение констант диссоциации IL-18BP/IL-18R, которое приблизительно, по меньшей мере, в 30000000 раз выше, чем отношение констант диссоциации IL-18BP/IL-18R дикого типа IL-18.
В некоторых вариантах осуществления, вариант полипептида IL-18 связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP. В некоторых вариантах осуществления, вариант полипептида, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, имеет отношение констант диссоциации IL-18BP/IL-18R, которое приблизительно, по меньшей мере, в 5 раз выше, чем отношение констант диссоциации IL-18BP/IL-18R дикого типа IL-18. В некоторых вариантах осуществления, вариант полипептида, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, имеет отношение констант диссоциации IL-18BP/IL-18R, которое приблизительно, по меньшей мере, в 50 раз выше, чем отношение констант диссоциации IL-18BP/IL-18R дикого типа IL-18. В некоторых вариантах осуществления, вариант полипептида, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, имеет отношение констант диссоциации IL-18BP/IL-18R, которое приблизительно, по меньшей мере, в 500 раз выше, чем отношение констант диссоциации IL-18BP/IL-18R дикого типа IL-18. В некоторых вариантах осуществления, вариант полипептида, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, имеет отношение констант диссоциации IL-18BP/IL-18R, которое приблизительно, по меньшей мере, в 5000 раз выше, чем отношение констант диссоциации IL-18BP/IL-18R дикого типа IL-18. В некоторых вариантах осуществления, вариант полипептида, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, имеет отношение констант диссоциации IL-18BP/IL-18R, которое приблизительно, по меньшей мере, в 50000 раз выше, чем отношение констант диссоциации IL-18BP/IL-18R дикого типа IL-18. В некоторых вариантах осуществления, вариант полипептида, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, имеет отношение констант диссоциации IL-18BP/IL-18R, которое приблизительно, по меньшей мере, в 500000 раз выше, чем отношение констант диссоциации IL-18BP/IL-18R дикого типа IL-18. В некоторых вариантах осуществления, вариант полипептида, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, имеет отношение констант диссоциации IL-18BP/IL-18R, которое приблизительно, по меньшей мере, в 5000000 раз выше, чем отношение констант диссоциации IL-18BP/IL-18R дикого типа IL-18. В некоторых вариантах осуществления, вариант полипептида, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, имеет отношение констант диссоциации IL-18BP/IL-18R, которое приблизительно, по меньшей мере, в 50000000 раз выше, чем отношение констант диссоциации IL-18BP/IL-18R дикого типа IL-18.
В некоторых вариантах осуществления, вариант полипептида IL-18 связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP. В некоторых вариантах осуществления, вариант полипептида, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, имеет отношение констант диссоциации IL-18BP/IL-18R, которое приблизительно, по меньшей мере, в 10 раз выше, чем отношение констант диссоциации IL-18BP/IL-18R дикого типа IL-18. В некоторых вариантах осуществления, вариант полипептида, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, имеет отношение констант диссоциации IL-18BP/IL-18R, которое приблизительно, по меньшей мере, в 100 раз выше, чем отношение констант диссоциации IL-18BP/IL-18R дикого типа IL-18. В некоторых вариантах осуществления, вариант полипептида, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, имеет отношение констант диссоциации IL-18BP/IL-18R, которое приблизительно, по меньшей мере, в 1000 раз выше, чем отношение констант диссоциации IL-18BP/IL-18R дикого типа IL-18. В некоторых вариантах осуществления, вариант полипептида, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, имеет отношение констант диссоциации IL-18BP/IL-18R, которое приблизительно, по меньшей мере, в 10000 раз выше, чем отношение констант диссоциации IL-18BP/IL-18R дикого типа IL-18. В некоторых вариантах осуществления, вариант полипептида, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, имеет отношение констант диссоциации IL-18BP/IL-18R, которое приблизительно, по меньшей мере, в 100000 раз выше, чем отношение констант диссоциации IL-18BP/IL-18R дикого типа IL-18. В некоторых вариантах осуществления, вариант полипептида, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, имеет отношение констант диссоциации IL-18BP/IL-18R, которое приблизительно, по меньшей мере, в 1000000 раз выше, чем отношение констант диссоциации IL-18BP/IL-18R дикого типа IL-18. В некоторых вариантах осуществления, вариант полипептида, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, имеет отношение констант диссоциации IL-18BP/IL-18R, которое приблизительно, по меньшей мере, в 10000000 раз выше, чем отношение констант диссоциации IL-18BP/IL-18R дикого типа IL-18. В некоторых вариантах осуществления, вариант полипептида, который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, имеет отношение констант диссоциации IL-18BP/IL-18R, которое приблизительно, по меньшей мере, в 100000000 раз выше, чем отношение констант диссоциации IL-18BP/IL-18R дикого типа IL-18.
В некоторых вариантах осуществления, предлагаемый вариант полипептида IL-18 (DR-IL-18), который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, имеет величину константы ингибирования (Ki) для IL-18BP, которая больше чем 3 нM (например, 5 нM или более, 10 нM или более, 50 нM или более, 100 нM или более, 500 нM или более, 750 нM или более, или 1 мкM или более). В некоторых вариантах осуществления, предлагаемый DR-вариант полипептида IL-18 имеет величину Ki для IL-18BP, которая составляет 500 нM или более. В некоторых вариантах осуществления, предлагаемый DR-вариант полипептида IL-18 имеет величину Ki для IL-18BP, которая составляет 1 мкM или более.
В некоторых вариантах осуществления, предлагаемый вариант полипептида IL-18 (DR-IL-18), который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, имеет величину Ki для IL-18BP, которая составляет более чем 200 нM (например, 500 нM или более, 750 нM или более, или 1 мкM или более). В некоторых вариантах осуществления, предлагаемый DR-вариант полипептида IL-18 имеет величину Ki для IL-18BP, которая составляет 1 мкM или более.
В некоторых вариантах осуществления, предлагаемый вариант полипептида IL-18 (DR-IL-18), который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, имеет величину константы ингибирования (Ki) для IL-18BP, которая, по меньшей мере, в 2 раза выше, чем величина Ki дикого типа IL-18 для IL-18BP (то есть, величина Ki предлагаемого варианта полипептида IL-18 для IL-18BP, по меньшей мере, в 2 раза выше величины Ki WT IL-18 для IL-18BP). Например, в некоторых случаях, предлагаемый DR-вариант полипептида IL-18 имеет величину Ki для IL-18BP, которая, по меньшей мере, в 5 раз выше (например, по меньшей мере, в 10 раз выше, по меньшей мере, в 50 раз выше, по меньшей мере, в 100 раз выше, по меньшей мере, в 200 раз выше, по меньшей мере, в 500 раз выше, или, по меньшей мере, в 1000 раз выше), чем величина Ki дикого типа IL-18 для IL-18BP.
В некоторых вариантах осуществления, предлагаемый вариант полипептида IL-18 (DR-IL-18), который связывается с IL-18R и проявляет в значительной степени пониженное связывание с IL-18BP, имеет величину EC50 для IL-18BP, которая, по меньшей мере, в 2 раза выше величины EC50 дикого типа IL-18 для IL-18BP (то есть, величина EC50 предлагаемого варианта полипептида IL-18 для IL-18BP, по меньшей мере, в 2 раза выше величины EC50 WT IL-18 для IL-18BP). Например, в некоторых случаях, предлагаемый DR-вариант полипептида IL-18 имеет величину EC50 для IL-18BP, которая, по меньшей мере, в 5 раз выше (например, по меньшей мере, в 10 раз, по меньшей мере, в 50 раз, по меньшей мере, в 100 раз, по меньшей мере, в 200 раз, по меньшей мере, в 500 раз, или, по меньшей мере, в 1000 раз выше) величины EC50 дикого типа IL-18 для IL-18BP.
В различных вариантах осуществления, вариант полипептида IL-18 включает мутацию относительно полипептида дикого типа (WT) IL-18. В некоторых вариантах осуществления, полипептид WT IL-18 включает аминокислотную последовательность SEQ ID NO: 30. В других вариантах осуществления, полипептид WT IL-18 включает аминокислотную последовательность SEQ ID NO: 31. Если не указано иначе, то символ "X" используют далее для обозначения любой аминокислоты.
В различных вариантах осуществления, вариант полипептида IL-18 человека или его фрагмент включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3, по меньшей мере, 4, по меньшей мере, 5, или, по меньшей мере, 6 мутаций), выбранную из группы, состоящей из Y1X, L5X, K8X, M51X, K53X, S55X, Q56X, P57X, G59X, M60X, E77X, Q103X, S105X, D110X, N111X, M113X, V153X и N155X, где X обозначает любую аминокислоту. В различных вариантах осуществления, вариант полипептида IL-18 человека или его фрагмент включает, по меньшей мере, 4 мутации, выбранные из группы, состоящей из Y1X, L5X, K8X, M51X, K53X, S55X, Q56X, P57X, G59X, M60X, E77X, Q103X, S105X, D110X, N111X, M113X, V153X и N155X. В различных вариантах осуществления, вариант полипептида IL-18 человека или его фрагмент включает, по меньшей мере, 6 мутаций, выбранных из группы, состоящей из Y1X, L5X, K8X, M51X, K53X, S55X, Q56X, P57X, G59X, M60X, E77X, Q103X, S105X, D110X, N111X, M113X, V153X и N155X. В различных вариантах осуществления, вариант полипептида IL-18 человека или его фрагмент включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3, по меньшей мере, 4, по меньшей мере, 5, или, по меньшей мере, 6 мутаций), выбранную из группы, состоящей из Y1X, L5X, K8X, S55X, Q56X, P57X, G59X, E77X, Q103X, S105X, D110X, N111X, M113X, V153X и N155X В некоторых вариантах осуществления, вариант полипептида IL-18 человека или его фрагмент включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3, по меньшей мере, 4, по меньшей мере, 5, или, по меньшей мере, 6 мутаций), выбранную из группы, состоящей из Y1H, Y1R, L5H, L5I, L5Y, K8Q, K8R, M51T, M51K, M51D, M51N, M51E, M51R, K53R, K53G, K53S, K53T, S55K, S55R, Q56E, Q56A, Q56R, Q56V, Q56G, Q56K, Q56L, P57L, P57G, P57A, P57K, G59T, G59A, M60K, M60Q, M60R, M60L, E77D, Q103E, Q103K, Q103P, Q103A, Q103R, S105R, S105D, S105K, S105N, S105A, D110H, D110K, D110N, D110Q, D110E, D110S, D110G, N111H, N111Y, N111D, N111R, N111S, N111G, M113V, M113R, M113T, M113K, V153I, V153T, V153A, N155K и N155H. В некоторых вариантах осуществления, вариант полипептида IL-18 человека включает, по меньшей мере, один вариант полипептида IL-18 или его фрагмент, выбранный из группы, состоящей из hCS1 (SEQ ID NO: 34), hCS2 (SEQ ID NO: 35), hCS3 (SEQ ID NO: 36), hCS4 (SEQ ID NO: 37), hC4 (SEQ ID NO: 38), hA8 (SEQ ID NO: 39), hD6 (SEQ ID NO: 40), hH12 (SEQ ID NO: 41), hB11 (SEQ ID NO: 42), hC3 (SEQ ID NO: 43), hC2 (SEQ ID NO: 44), hG10 (SEQ ID NO: 45), hG1 (SEQ ID NO: 46), hF1 (SEQ ID NO: 47), hD2 (SEQ ID NO: 48), hA1 (SEQ ID NO: 49), hB3 (SEQ ID NO: 50), hB4 (SEQ ID NO: 51), hH3 (SEQ ID NO: 52), hH5 (SEQ ID NO: 53), hH4 (SEQ ID NO: 54), hE1 (SEQ ID NO: 55), hG2 (SEQ ID NO: 56), hB9 (SEQ ID NO: 57), hE12 (SEQ ID NO: 58), hC5 (SEQ ID NO: 59), 5-18 (SEQ ID NO: 73), 5-29 (SEQ ID NO: 74), 5-8 (SEQ ID NO: 75), 5-6 (SEQ ID NO: 76), 5-27 (SEQ ID NO: 77), 5-20 (SEQ ID NO: 78), 5-2 (SEQ ID NO: 79), 5-9 (SEQ ID NO: 80), 5-42 (SEQ ID NO: 81), 5-13 (SEQ ID NO: 82), 5-12 (SEQ ID NO: 83), 5-1 (SEQ ID NO: 84), 5-33 (SEQ ID NO: 85), 5-21 (SEQ ID NO: 86), 6-31 (SEQ ID NO: 87), 6-20 (SEQ ID NO: 88), 6-12 (SEQ ID NO: 89), 6-27 (SEQ ID NO: 90), 6-29 (SEQ ID NO: 91), 5-26 (SEQ ID NO: 191), 5-17 (SEQ ID NO: 192), 5-41 (SEQ ID NO: 193) или его фрагмента.
В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3, или, по меньшей мере, 4 мутации), выбранную из группы, состоящей из M51X, M60X, S105X, D110X и N111X, относительно SEQ ID NO: 30. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает, по меньшей мере, 3 мутации, выбранные из группы, состоящей из M51X, M60X, S105X, D110X и N111X, относительно SEQ ID NO: 30. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3, или, по меньшей мере, 4 мутации), выбранную из группы, состоящей из M51X1, M60X2, S105X3, D110X4 и N111X5, относительно SEQ ID NO: 30, где X1 представляет собой T, K, D, E, R или N; X2 представляет собой K, Q, L или R; X3 представляет собой R, D, K, A или N; X4 представляет собой H, K, N, Q, E, N, S или G; и X5 представляет собой H, D, Y, R, S или G. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3, или, по меньшей мере, 4 мутации), выбранную из группы, состоящей из M51X1, M60X2, S105X3, D110X4 и N111X5, относительно SEQ ID NO: 30, где X1 представляет собой T, K, D, E, R или N; X2 представляет собой K, Q, L или R; X3 представляет собой R, D, K, A или N; X4 представляет собой H, K, N, Q, E, N, S или G; и X5 представляет собой H, D, Y, R, S или G. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3 или, по меньшей мере, 4 мутации), выбранную из группы, состоящей из M51X1, M60X2, S105X3, D110X4 и N111X5, относительно SEQ ID NO: 30, где X1 представляет собой T или K; X2 представляет собой K или L; X3 представляет собой D, N или A; X4 представляет собой K, N, S или G; и X5 представляет собой H, Y, G или R.
В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает мутации M51X, M60X, S105X, D110X и N111X, относительно SEQ ID NO: 30. Например, в некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает мутации M51X1, M60X2, S105X3, D110X4 и N111X5, относительно SEQ ID NO: 30, где X1 представляет собой T, K, D, E, R или N; X2 представляет собой K, Q, L или R; X3 представляет собой R, D, K, A или N; X4 представляет собой H, K, N, Q, E, N, S или G; и X5 представляет собой H, D, Y, R, S или G. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает мутации M51X1, M60X2, S105X3, D110X4 и N111X5, относительно SEQ ID NO: 30, где X1 представляет собой T или K; X2 представляет собой K или L; X3 представляет собой D, N или A; X4 представляет собой K, N, S или G; и X5 представляет собой H, Y, G или R. Другими словами, в некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает мутации {M51T или M51K}; {M60K или M60L}; {S105D, S105N, S105A}; {D110K, D110N, D110S или D110G}; и {N111H, N111Y, N111R или N111G}, относительно SEQ ID NO: 30.
В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3 или, по меньшей мере, 4 мутации), выбранную из группы, состоящей из M51X, K53X, Q56X, S105X и N111X, относительно SEQ ID NO: 30. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает, по меньшей мере, 3 мутации, выбранные из группы, состоящей из M51X, K53X, Q56X, S105X и N111X, относительно SEQ ID NO: 30. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3 или, по меньшей мере, 4 мутации), выбранную из группы, состоящей из M51X1, K53X2, Q56X3, S105X4 и N111X5, относительно SEQ ID NO: 30, где X1 представляет собой E, R или K; X2 представляет собой G, S или T; X3 представляет собой E, A, R, V, G, K или L; X4 представляет собой N, S, K или G; и X5 представляет собой R, S, G или D. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает, по меньшей мере, 3 мутации, выбранные из группы, состоящей из M51X1, K53X2, Q56X3, S105X4 и N111X5, относительно SEQ ID NO: 30, где X1 представляет собой E, R или K; X2 представляет собой G, S или T; X3 представляет собой E, A, R, V, G, K или L; X4 представляет собой N, S, K или G; и X5 представляет собой R, S, G или D. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3 или, по меньшей мере, 4 мутации), выбранную из группы, состоящей из M51X1, K53X2, Q56X3, S105X4 и N111X5, относительно SEQ ID NO: 30, где X1 представляет собой K; X2 представляет собой G или S; X3 представляет собой G, R или L; X4 представляет собой S, N или G; и X5 представляет собой G или R.
В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает мутации M51X, K53X, Q56X, S105X и N111X, относительно SEQ ID NO: 30. Например, в некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает мутации M51X1, K53X2, Q56X3, S105X4 и N111X5, относительно SEQ ID NO: 30, где X1 представляет собой E, R или K; X2 представляет собой G, S или T; X3 представляет собой E, A, R, V, G, K или L; X4 представляет собой N, S, K или G; и X5 представляет собой R, S, G или D. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает мутации M51X1, K53X2, Q56X3, S105X4 и N111X5, относительно SEQ ID NO: 30, где X1 представляет собой K; X2 представляет собой G или S; X3 представляет собой G, R или L; X4 представляет собой S, N или G; и X5 представляет собой G или R. Другими словами, в некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает мутации {M51K}; {K53G или K53S}; {Q56G, Q56R или Q56L}; {D110S, D110N или D110G}; и {N111R или N111G}, относительно SEQ ID NO: 30.
В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, имеющую идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30. Соответственно, в некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислоту. Последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3, по меньшей мере, 4, по меньшей мере, 5 или, по меньшей мере, 6 мутаций) относительно дикого типа IL-18 (например, человеческого IL-18).
В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, имеющую идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью, представленной любой одной из SEQ ID NOs: 34-59, 73-91 и 191-193. Соответственно, в некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью, представленной любой одной из SEQ ID NOs: 34-59, 73-91 и 191-193; и (ii) включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3, по меньшей мере, 4, по меньшей мере, 5 или, по меньшей мере, 6 мутаций) относительно дикого типа IL-18 (например, человеческого IL-18).
В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3, по меньшей мере, 4, по меньшей мере, 5 или, по меньшей мере, 6 мутаций), выбранную из группы, состоящей из Y1X, L5X, K8X, M51X, K53X, S55X, Q56X, P57X, G59X, M60X, E77X, Q103X, S105X, D110X, N111X, M113X, V153X и N155X, относительно SEQ ID NO: 30. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает, по меньшей мере, 4 мутации, выбранные из группы, состоящей из Y1X, L5X, K8X, M51X, K53X, S55X, Q56X, P57X, G59X, M60X, E77X, Q103X, S105X, D110X, N111X, M113X, V153X и N155X, относительно SEQ ID NO: 30. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает, по меньшей мере, 6 мутаций, выбранных из группы, состоящей из Y1X, L5X, K8X, M51X, K53X, S55X, Q56X, P57X, G59X, M60X, E77X, Q103X, S105X, D110X, N111X, M113X, V153X и N155X, относительно SEQ ID NO: 30. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3, по меньшей мере, 4, по меньшей мере, 5 или, по меньшей мере, 6 мутаций), выбранную из группы, состоящей из Y1X, L5X, K8X, S55X, Q56X, P57X, G59X, E77X, Q103X, S105X, D110X, N111X, M113X, V153X и N155X, относительно SEQ ID NO: 30.
В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3 или, по меньшей мере, 4 мутации), выбранную из группы, состоящей из M51X, M60X, S105X, D110X и N111X, относительно SEQ ID NO: 30. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает, по меньшей мере, 3 мутации, выбранные из группы, состоящей из M51X, M60X, S105X, D110X и N111X, относительно SEQ ID NO: 30. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3 или, по меньшей мере, 4 мутации), выбранную из группы, состоящей из M51X1, M60X2, S105X3, D110X4 и N111X5, относительно SEQ ID NO: 30, где X1 представляет собой T, K, D, E, R или N; X2 представляет собой K, Q, L или R; X3 представляет собой R, D, K, A или N; X4 представляет собой H, K, N, Q, E, N, S или G; и X5 представляет собой H, D, Y, R, S или G. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает, по меньшей мере, 3 мутации, выбранные из группы, состоящей из M51X1, M60X2, S105X3, D110X4 и N111X5, относительно SEQ ID NO: 30, где X1 представляет собой T, K, D, E, R или N; X2 представляет собой K, Q, L или R; X3 представляет собой R, D, K, A или N; X4 представляет собой H, K, N, Q, E, N, S или G; и X5 представляет собой H, D, Y, R, S или G. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3 или, по меньшей мере, 4 мутации), выбранную из группы, состоящей из M51X1, M60X2, S105X3, D110X4 и N111X5, относительно SEQ ID NO: 30, где X1 представляет собой T или K; X2 представляет собой K или L; X3 представляет собой D, N или A; X4 представляет собой K, N, S или G; и X5 представляет собой H, Y, G или R.
В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает мутации M51X, M60X, S105X, D110X и N111X, относительно SEQ ID NO: 30. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает мутации M51X1, M60X2, S105X3, D110X4 и N111X5, относительно SEQ ID NO: 30, где X1 представляет собой T, K, D, E, R или N; X2 представляет собой K, Q, L или R; X3 представляет собой R, D, K, A или N; X4 представляет собой H, K, N, Q, E, N, S или G; и X5 представляет собой H, D, Y, R, S или G. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает мутации M51X1, M60X2, S105X3, D110X4 и N111X5, относительно SEQ ID NO: 30, где X1 представляет собой T или K; X2 представляет собой K или L; X3 представляет собой D, N или A; X4 представляет собой K, N, S или G; и X5 представляет собой H, Y, G или R.
В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3 или, по меньшей мере, 4 мутации), выбранную из группы, состоящей из M51X, K53X, Q56X, S105X и N111X, относительно SEQ ID NO: 30. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает, по меньшей мере, 3 мутации, выбранные из группы, состоящей из M51X, K53X, Q56X, S105X и N111X, относительно SEQ ID NO: 30. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3 или, по меньшей мере, 4 мутации), выбранную из группы, состоящей из M51X1, K53X2, Q56X3, S105X4 и N111X5, относительно SEQ ID NO: 30, где X1 представляет собой E, R или K; X2 представляет собой G, S или T; X3 представляет собой E, A, R, V, G, K или L; X4 представляет собой N, S, K или G; и X5 представляет собой R, S, G или D. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает, по меньшей мере, 3 мутации, выбранные из группы, состоящей из M51X1, K53X2, Q56X3, S105X4 и N111X5, относительно SEQ ID NO: 30, где X1 представляет собой E, R или K; X2 представляет собой G, S или T; X3 представляет собой E, A, R, V, G, K или L; X4 представляет собой N, S, K или G; и X5 представляет собой R, S, G или D. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3 или, по меньшей мере, 4 мутации), выбранную из группы, состоящей из M51X1, K53X2, Q56X3, S105X4 и N111X5, относительно SEQ ID NO: 30, где X1 представляет собой K; X2 представляет собой G или S; X3 представляет собой G, R или L; X4 представляет собой S, N или G; и X5 представляет собой G или R.
В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает мутации M51X, K53X, Q56X, S105X и N111X, относительно SEQ ID NO: 30. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает мутации M51X1, K53X2, Q56X3, S105X4 и N111X5, относительно SEQ ID NO: 30, где X1 представляет собой E, R или K; X2 представляет собой G, S или T; X3 представляет собой E, A, R, V, G, K или L; X4 представляет собой N, S, K или G; и X5 представляет собой R, S, G или D. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает мутации M51X1, K53X2, Q56X3, S105X4 и N111X5, относительно SEQ ID NO: 30, где X1 представляет собой K; X2 представляет собой G или S; X3 представляет собой G, R или L; X4 представляет собой S, N или G; и X5 представляет собой G или R.
В некоторых вариантах осуществления, мышиный вариант полипептида IL-18 включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3, по меньшей мере, 4, по меньшей мере, 5 или, по меньшей мере, 6 мутаций), выбранную из группы, состоящей из N1X, M50X, Y51X, K52X, S54X, E55X, V56X, R57X, G58X, L59X, R104X, N109X и L151X, где X обозначает любую аминокислоту. В некоторых вариантах осуществления, мышиный вариант полипептида IL-18 или его фрагмент включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3, по меньшей мере, 4, по меньшей мере, 5 или, по меньшей мере, 6 мутаций), выбранную из группы, состоящей из N1H, N1Y, M50A, M50S, M50V, M50G, M50T, Y51R, K52V, K52S, K52T, K52G, K52A, S54R, S54K, S54G, S54N, E55R, E55H, E55N, E55D, E55G, V56L, V56M, V56R, V56A, V56S, V56Q, R57G, R57K, G58A, L59K, L59R, L59V, R104K, R104L, R104Q, R104S, N109D и L151V. В некоторых вариантах осуществления, мышиный вариант полипептида IL-18 включает, по меньшей мере, один вариант, выбранный из группы, состоящей из mCS1 (SEQ ID NO: 60), mCS2 (SEQ ID NO: 61), mC1 (SEQ ID NO: 62), mA12 (SEQ ID NO: 63), mE8 (SEQ ID NO: 64), mC10 (SEQ ID NO: 65), mB7 (SEQ ID NO: 66), mB1 (SEQ ID NO: 67), mD1 (SEQ ID NO: 68), mH7 (SEQ ID NO: 69), mA7 (SEQ ID NO: 70), mE1 (SEQ ID NO: 71) и mH3 (SEQ ID NO: 72), или его фрагмент.
В некоторых вариантах осуществления, в изобретении предлагается нуклеиновая кислота (например, ДНК, кДНК, мРНК и другие), которая кодирует, по меньшей мере, один вариант полипептида IL-18.
Терапевтические композиции и способы для ингибирования
В различных вариантах осуществления, настоящее изобретение включает композиции и способы для ингибирования IL-18BP для лечения или предотвращения заболевания или нарушения, при которых желательно снижать активность или уровень IL-18BP. Показания к применению для такого лекарственного средства включают в себя приведенные выше показания, разработанные для варианта DR-IL-18. Неограничивающие примеры заболеваний или нарушений, при которых желательно снижать активность или уровень IL-18BP, и которые могут быть подвергнуты лечению или могут быть предотвращены с помощью композиций и способов по изобретению, включают рак, инфекционное заболевание, метаболические заболевания и нарушения и макулярную дегенерацию. В различных вариантах осуществления, композиции и способы для ингибирования IL-18BP для лечения или предотвращения заболевания или нарушения по изобретению снижают количество полипептида IL-18BP, количество IL-18BP мРНК, величину ферментативной активности IL-18BP, величину активности связывания субстрата IL-18BP или их комбинаций.
В результате ознакомления с описанием настоящего изобретения, для обычного специалиста в данной области станет очевидным, что снижение уровня IL-18BP подразумевает и снижение экспрессии IL-18BP, в том числе транскрипции, трансляции или и той и другой. После ознакомления с идеями настоящего изобретения, для обычного специалиста в данной области станет также очевидным, что снижение уровня IL-18BP подразумевает снижение активности IL-18BP (например, ферментативной активности, активности связывания субстрата и так далее). Таким образом, снижение уровня или активности IL-18BP включает, но этим не ограничивая, уменьшение транскрипции, трансляции, или и той и другой, нуклеиновой кислоты, кодирующей IL-18BP; и это также включает снижение любой активности полипептида IL-18BP. Композиции и способы для ингибирования IL-18BP по изобретению могут селективно ингибировать IL-18BP или могут ингибировать как IL-18BP, так и другую молекулу.
Ингибирование IL-18BP может быть оценено с использованием большого разнообразия методов, включая методы, которые описаны в настоящем изобретении, а также методы, известные в данной области техники или методы, которые будут разработаны в будущем. Таким образом, после ознакомления с описанием настоящего изобретения, для обычного специалиста в данной области должно быть очевидным, что снижение уровня или активности IL-18BP можно легко оценить с использованием методов, которые позволяют оценивать уровень нуклеиновой кислоты, кодирующей IL-18BP (например, мРНК), уровень полипептида IL-18BP, присутствующего в биологическом образце, уровень активности IL-18BP (например, ферментативной активности, активности связывания субстрата и так далее) или их комбинаций.
После ознакомления с описанием настоящего изобретения, для обычного специалиста в данной области должно быть очевидным, что изобретение может применяться для лечения или предотвращения заболевания или нарушения у субъекта, нуждающегося в этом, независимо от того, подвергается ли субъект лечению с помощью другого лекарственного препарата или терапии. Кроме того, после ознакомления с идеями настоящего изобретения, для обычного специалиста в данной области должно быть очевидным, что заболевание или нарушение, которые могут быть подвергнуты лечению с помощью композиций и способов, описанных в настоящем изобретении, включают любое заболевание или нарушение, при которых определенную роль играет IL-18BP и при которых снижение уровня или снижение активности IL-18BP способствует достижению положительного терапевтического результата.
Композиции и способы для ингибирования IL-18BP по изобретению, которые снижают уровень или активность (например, ферментативная активность, активность связывания с лигандом, и так далее) IL-18BP, включают, но этим не ограничивая, химическое соединение, полипептид, пептид, пептидомиметик, антитело, рибозим, низкомолекулярное химическое соединение, молекулу антисмысловой нуклеиновой кислоты (например, миРНК, микроРНК, и так далее) или их комбинации. После ознакомления с описанием настоящего изобретения, для обычного специалиста в данной области должно быть очевидным, что композиция для ингибирования IL-18BP включает химическое соединение, которое снижает уровень или активность IL-18BP. Кроме того, композиция для ингибирования IL-18BP включает химически модифицированные соединения и производные, которые хорошо известны любому специалисту в области химии.
Композиции и способы для ингибирования IL-18BP по изобретению, которые снижают уровень или активность (например, ферментативная активность, активность связывания с лигандом, и так далее) IL-18BP, включают антитела. Антитела по изобретению включают большое разнообразие форм антител, в том числе, например, поликлональные антитела, моноклональные антитела, внутриклеточные антитела ("интраантитела"), Fv, Fab и F(ab)2, одноцепочечные антитела (scFv), антитела из тяжелых цепей (такие как верблюжьи антитела), синтетические антитела, химерные антитела и гуманизированные антитела. В некоторых вариантах осуществления, антитело по изобретению представляет собой антитело, которое специфически связывается с IL-18BP.
В некоторых вариантах осуществления, ингибитор IL-18BP включает сконструированный вариант IL-18, который предназначен для связывания с IL-18BP, но практически не связывается или не взаимодействует с IL-18R (например, IL-18Rα и IL-18Rβ). Этот вариант, "рецептор ловушка с рецептором ловушкой" (D2D), служит для связывания с IL-18BP, в результате чего предотвращается возможность IL-18BP ингибировать эндогенно-продуцированный или терапевтически-введенный IL-18. Вариант "рецептор ловушка с рецептором ловушкой" мог бы быть сконструирован с использованием почти такой же стратегии отбора с применением технологии дрожжевого дисплея, описанной в других местах изобретения, но с заменой положительного отбора для связывания IL-18BP и отрицательного отбора против значительного связывания с IL-18Rα.
В различных вариантах осуществления, вариант полипептида IL-18, который связывает и ингибирует IL-18BP, включает мутацию относительно полипептида дикого типа (WT) IL-18. В некоторых вариантах осуществления, полипептид WT IL-18 включает аминокислотную последовательность SEQ ID NO: 30. В других вариантах осуществления, полипептид WT IL-18 включает аминокислотную последовательность SEQ ID NO: 31.
В различных вариантах осуществления, вариант полипептида IL-18, который связывает и ингибирует IL-18BP, включает вариант полипептида IL-18 человека или его фрагмент, включающий, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3, по меньшей мере, 4, по меньшей мере, 5 или, по меньшей мере, 6 мутаций), выбранную из группы, состоящей из Y1X, L5X, D17X, E31X, T34X, D35X, S36X, D37X, D40X, N41X, M51X, Q56X, M60X, Q103X, H109X, M113X и R131X, где X обозначает любую аминокислоту. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывает и ингибирует IL-18BP, включает вариант полипептида IL-18 человека или его фрагмент, включающий, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3, по меньшей мере, 4, по меньшей мере, 5 или, по меньшей мере, 6 мутаций), выбранную из группы, состоящей из Y1D, Y1F, Y1H, Y1L, L5F, L5H, D17A, D17G, D17R, D17H, E31A, E31T, E31G, E31K, E31R, T34A, T34K T34E, D35S, D35A, D35Y, S36N, S36K, S36R, D37P, D37A, D37R, D37H, D37L, D37V, D40Y D40S, D40A, N41K, N41S, N41R, M51F, M51L, M51I, Q56H, M60L, M60F, M60I, Q103L, Q103I, H109A, H109P, H109D, M113L, M113I, M113F и R131S. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывает и ингибирует IL-18BP, включает вариант полипептида IL-18 человека или его фрагмент, выбранный из группы, состоящей из hD2D-5F12 (SEQ ID NO: 92), hD2D-5F11 (SEQ ID NO: 93), hD2D-5F10 (SEQ ID NO: 94), hD2D-5F08 (SEQ ID NO: 95), hD2D-5F06 (SEQ ID NO: 96), hD2D-5F04 (SEQ ID NO: 97), hD2D-5F02 (SEQ ID NO: 98), hD2D-5F01 (SEQ ID NO: 99), hD2D-5E10 (SEQ ID NO: 100), hD2D-5E08 (SEQ ID NO: 101), hD2D-5E03 (SEQ ID NO: 102), hD2D-5E02 (SEQ ID NO: 103), hD2D-5D10 (SEQ ID NO: 104), hD2D-5D08 (SEQ ID NO: 105), hD2D-5D06 (SEQ ID NO: 106), hD2D-5D05 (SEQ ID NO: 107), hD2D-5D03 (SEQ ID NO: 108), hD2D-5D02 (SEQ ID NO: 109), hD2D-5C10 (SEQ ID NO: 110), hD2D-5C09 (SEQ ID NO: 111), hD2D-5C08 (SEQ ID NO: 112), hD2D-5C05 (SEQ ID NO: 113), hD2D-5C04 (SEQ ID NO: 114), hD2D-5C03 (SEQ ID NO: 115), hD2D-5B11 (SEQ ID NO: 116), hD2D-5B10 (SEQ ID NO: 117), hD2D-5B06 (SEQ ID NO: 118), hD2D-5B05 (SEQ ID NO: 119), hD2D-5B02 (SEQ ID NO: 120), hD2D-5A09 (SEQ ID NO: 121), hD2D-5A02 (SEQ ID NO: 122), hD2D-CS1 (SEQ ID NO: 123), hD2D-CS2 (SEQ ID NO: 124), hD2D-CS3 (SEQ ID NO: 125), или его фрагмент.
В некоторых случаях, предлагаемый вариант D2D-IL-18 или его фрагмент включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3 или, по меньшей мере, 4 мутации), выбранную из группы, состоящей из D17X, E30X и Q103X, относительно SEQ ID NO: 30. В некоторых случаях, предлагаемый вариант D2D-IL-18 или его фрагмент включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3 или, по меньшей мере, 4 мутации), выбранную из группы, состоящей из D17X1, E30X2 и Q103X3, относительно SEQ ID NO: 30, где X1 представляет собой G, H, R или A; X2 представляет собой A, T, G, K или R; и X3 представляет собой I или L. В некоторых случаях, предлагаемый вариант D2D-IL-18 или его фрагмент включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3 или, по меньшей мере, 4 мутации), выбранную из группы, состоящей из D17G, E30A и (Q103L или Q103I).
В некоторых случаях, предлагаемый вариант D2D-IL-18 или его фрагмент включает мутации D17X, E30X и Q103X, относительно SEQ ID NO: 30. Например, в некоторых случаях, предлагаемый вариант D2D-IL-18 или его фрагмент включает мутации D17X1, E30X2 и Q103X3, относительно SEQ ID NO: 30, где X1 представляет собой G, H, R или A; X2 представляет собой A, T, G, K или R; и X3 представляет собой I или L. В некоторых случаях, предлагаемый вариант D2D-IL-18 или его фрагмент включает мутации D17G, E30A и (Q103L или Q103I).
В некоторых случаях, предлагаемый вариант D2D-IL-18 или его фрагмент включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3 или, по меньшей мере, 4 мутации), выбранную из группы, состоящей из D17X, E30X, D35X, M51X и Q103X, относительно SEQ ID NO: 30. В некоторых случаях, предлагаемый вариант D2D-IL-18 или его фрагмент включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3 или, по меньшей мере, 4 мутации), выбранную из группы, состоящей из D17X1, E30X2, D35X3, M51X4 и Q103X3, относительно SEQ ID NO: 30, где X1 представляет собой G, H, R или A; X2 представляет собой A, T, G, K или R; X3 представляет собой S, A или Y; X4 представляет собой F, I или L; и X5 представляет собой I или L. В некоторых случаях, предлагаемый вариант D2D-IL-18 или его фрагмент включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3 или, по меньшей мере, 4 мутации), выбранную из группы, состоящей из D17G, E30A, D35S, M51F и (Q103L или Q103I), относительно SEQ ID NO: 30.
В некоторых случаях, предлагаемый вариант D2D-IL-18 или его фрагмент включает мутации D17X, E30X, D35X, M51X и Q103X, относительно SEQ ID NO: 30. Например, в некоторых случаях, предлагаемый вариант D2D-IL-18 или его фрагмент включает мутации D17X1, E30X2, D35X3, M51X4 и Q103X3, относительно SEQ ID NO: 30, где X1 представляет собой G, H, R или A; X2 представляет собой A, T, G, K или R; X3 представляет собой S, A или Y; X4 представляет собой F, I или L; и X5 представляет собой I или L. В некоторых случаях, предлагаемый вариант D2D-IL-18 или его фрагмент включает мутации D17G, E30A, D35S, M51F и (Q103L или Q103I), относительно SEQ ID NO: 30.
В некоторых случаях, предлагаемый вариант D2D-IL-18 или его фрагмент включает аминокислотную последовательность, имеющую идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30. Соответственно, в некоторых случаях, предлагаемый вариант D2D-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3, по меньшей мере, 4, по меньшей мере, 5 или, по меньшей мере, 6 мутаций) относительно дикого типа IL-18 (например, человеческого IL-18).
В некоторых случаях, предлагаемый вариант D2D-IL-18 или его фрагмент включает аминокислотную последовательность, имеющую идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью, представленной любой одной из SEQ ID NOs: 126-190. Соответственно, в некоторых случаях, предлагаемый вариант D2D-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью, представленной любой одной из SEQ ID NOs: 126-190; и (ii) включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3, по меньшей мере, 4, по меньшей мере, 5 или, по меньшей мере, 6 мутаций) относительно дикого типа IL-18 (например, человеческого IL-18).
В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3, по меньшей мере, 4, по меньшей мере, 5 или, по меньшей мере, 6 мутаций), выбранную из группы, состоящей из Y1X, L5X, D17X, E31X, T34X, D35X, S36X, D37X, D40X, N41X, M51X, Q56X, M60X, Q103X, H109X, M113X и R131X.
В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3, по меньшей мере, 4, по меньшей мере, 5 или, по меньшей мере, 6 мутаций), выбранную из группы, состоящей из D17X, E30X и Q103X, относительно SEQ ID NO: 30. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3, по меньшей мере, 4, по меньшей мере, 5 или, по меньшей мере, 6 мутаций), выбранную из группы, состоящей из D17X1, E30X2 и Q103X3, относительно SEQ ID NO: 30, где X1 представляет собой G, H, R или A; X2 представляет собой A, T. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3, по меньшей мере, 4, по меньшей мере, 5 или, по меньшей мере, 6 мутаций), выбранную из группы, состоящей из D17G, E30A и (Q103L или Q103I).
В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает мутации D17X, E30X и Q103X, относительно SEQ ID NO: 30. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает мутации D17X1, E30X2 и Q103X3, относительно SEQ ID NO: 30, где X1 представляет собой G, H, R или A; X2 представляет собой A, T. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает мутации D17G, E30A и (Q103L или Q103I).
В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3, по меньшей мере, 4, по меньшей мере, 5 или, по меньшей мере, 6 мутаций), выбранную из группы, состоящей из D17X, E30X, D35X, M51X и Q103X, относительно SEQ ID NO: 30. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3, по меньшей мере, 4, по меньшей мере, 5 или, по меньшей мере, 6 мутаций), выбранную из группы, состоящей из D17X1, E30X2, D35X3, M51X4 и Q103X3, относительно SEQ ID NO: 30, где X1 представляет собой G, H, R или A; X2 представляет собой A, T, G, K или R; X3 представляет собой S, A или Y; X4 представляет собой F, I или L; и X5 представляет собой I или L. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3, по меньшей мере, 4, по меньшей мере, 5 или, по меньшей мере, 6 мутаций), выбранную из группы, состоящей из D17G, E30A, D35S, M51F и (Q103L или Q103I), относительно SEQ ID NO: 30.
В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает мутации D17X, E30X, D35X, M51X и Q103X, относительно SEQ ID NO: 30. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает мутации D17X1, E30X2, D35X3, M51X4 и Q103X3, относительно SEQ ID NO: 30, где X1 представляет собой G, H, R или A; X2 представляет собой A, T, G, K или R; X3 представляет собой S, A или Y; X4 представляет собой F, I или L; и X5 представляет собой I или L. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает мутации D17G, E30A, D35S, M51F и (Q103L или Q103I), относительно SEQ ID NO: 30.
В некоторых вариантах осуществления, вариант полипептида IL-18, который связывает и ингибирует IL-18BP, включает мышиный вариант полипептида IL-18, включающий, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3, по меньшей мере, 4, по меньшей мере, 5 или, по меньшей мере, 6 мутаций) выбранную из группы, состоящей из N1X, L5X, D17X, E30X, T33X, D34X, I35X, D36X, M50X, Q102X, R104, H108X, N109X, M111X, D129X и D130X, где X обозначает любую аминокислоту. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывает и ингибирует IL-18BP, включает мышиный вариант полипептида IL-18 или его фрагмент, включающий, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3, по меньшей мере, 4, по меньшей мере, 5 или, по меньшей мере, 6 мутаций), выбранную из группы, состоящей из N1Y, N1D, N1H, N1L, N1F, N1V, N1I, L5Y, L5H, D17Q, D17G, D17A, D17E, D17S, D17N, E30A, E30R, E30K, E30T, E30G, T33G, T33A, T33E, T33R, T33K, D34Y, D34S, D34A, I35T, I35K, I35R, D36V, D36A, D36G, D36H, D36P, D36R, D36L, M50F, M50L, Q102L, Q102I, R104E, R104A, R104P, R104G, R104Q, R104H, H108D, H108A, N109R, N109S, N109T, N109I, M111L, M111I, D129A, D129F, D129V, D129Y, D129S, D130E, D130T, D130G, D130N, D130R, D130S, D130Q и D130H. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывает и ингибирует IL-18BP, включает мышиный вариант полипептида IL-18 или его фрагмент, выбранный из группы, состоящей из mD2D-A5 (SEQ ID NO: 126), mD2D-A6 (SEQ ID NO: 127), mD2D-A7 (SEQ ID NO: 128), mD2D-A8 (SEQ ID NO: 129), mD2D-A9 (SEQ ID NO: 130), mD2D-A11 (SEQ ID NO: 131), mD2D-A12 (SEQ ID NO: 132), mD2D-B4 (SEQ ID NO: 133), mD2D-B7 (SEQ ID NO: 134), mD2D-B11 (SEQ ID NO: 135), mD2D-B12 (SEQ ID NO: 136), mD2D-C1 (SEQ ID NO: 137), mD2D-C3 (SEQ ID NO: 138), mD2D-C5 (SEQ ID NO: 139), mD2D-C6 (SEQ ID NO: 140), mD2D-C9 (SEQ ID NO: 141), mD2D-C10 (SEQ ID NO: 142), mD2D-C11 (SEQ ID NO: 143), mD2D-D1 (SEQ ID NO: 144), mD2D-D9 (SEQ ID NO: 145), mD2D-D12 (SEQ ID NO: 146), mD2D-E3 (SEQ ID NO: 147), mD2D-E4 (SEQ ID NO: 148), mD2D-E5 (SEQ ID NO: 149), mD2D-E7 (SEQ ID NO: 150), mD2D-E8 (SEQ ID NO: 151), mD2D-E9 (SEQ ID NO: 152), mD2D-E10 (SEQ ID NO: 153), mD2D-E11 (SEQ ID NO: 154), mD2D-E12 (SEQ ID NO: 155), mD2D-F3 (SEQ ID NO: 156), mD2D-F4 (SEQ ID NO: 157), mD2D-F5 (SEQ ID NO: 158), mD2D-F7 (SEQ ID NO: 159), mD2D-F8 (SEQ ID NO: 160), mD2D-F9 (SEQ ID NO: 161), mD2D-G1 (SEQ ID NO: 162), mD2D-G7 (SEQ ID NO: 163), mD2D-G9 (SEQ ID NO: 164), mD2D-H7 (SEQ ID NO: 165), mD2D-E1 (SEQ ID NO: 166), mD2D-G8 (SEQ ID NO: 167), mD2D-H3 (SEQ ID NO: 168), mD2D-A10 (SEQ ID NO: 169), mD2D-H1 (SEQ ID NO: 170), mD2D-F12 (SEQ ID NO: 171), mD2D-G10 (SEQ ID NO: 172), mD2D-G12 (SEQ ID NO: 173), mD2D-E2 (SEQ ID NO: 174), mD2D-G11 (SEQ ID NO: 175), mD2D-C4 (SEQ ID NO: 176), mD2D-F11 (SEQ ID NO: 177), mD2D-C2 (SEQ ID NO: 178), mD2D-F10 (SEQ ID NO: 179), mD2D-A2 (SEQ ID NO: 180), mD2D-F6 (SEQ ID NO: 181), mD2D-A1 (SEQ ID NO: 182), mD2D-E6 (SEQ ID NO: 183), mD2D-D4 (SEQ ID NO: 184), mD2D-D6 (SEQ ID NO: 185), mD2D-A3 (SEQ ID NO: 186), mD2D-A4 (SEQ ID NO: 187), mD2D-B10 (SEQ ID NO: 188), mD2D-B8 (SEQ ID NO: 189), mD2D-B9 (SEQ ID NO: 190), или его фрагмент.
В некоторых вариантах осуществления, в изобретении предлагается нуклеиновая (например, ДНК, кДНК, мРНК, и так далее), которая кодирует, по меньшей мере, один вариант полипептида IL-18.
В некоторых вариантах осуществления, ингибитор IL-18BP представляет собой вариант полипептида IL-18, который связывается с IL-18BP и проявляет в значительной степени пониженное связывание с IL-18R. В некоторых вариантах осуществления, ингибитор IL-18BP, который связывается с IL-18BP и проявляет в значительной степени пониженное связывание с IL-18R, связывается с IL-18R с аффинностью связывания, которая составляет приблизительно от 0,000000000001% до приблизительно 95% от аффинности связывания IL-18 дикого типа с IL-18R.
В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18BP и проявляет в значительной степени пониженное связывание с IL-18R, связывается с IL-18R с аффинностью связывания, которая составляет приблизительно 95% от аффинности связывания IL-18 дикого типа с IL-18R. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18BP и проявляет в значительной степени пониженное связывание с IL-18R, связывается с IL-18R с аффинностью связывания, которая составляет приблизительно 90% от аффинности связывания IL-18 дикого типа с IL-18R. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18BP и проявляет в значительной степени пониженное связывание с IL-18R, связывается с IL-18R с аффинностью связывания, которая составляет приблизительно 85% от аффинности связывания IL-18 дикого типа с IL-18R. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18BP и проявляет в значительной степени пониженное связывание с IL-18R, связывается с IL-18R с аффинностью связывания, которая составляет приблизительно 80% от аффинности связывания IL-18 дикого типа с IL-18R. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18BP и проявляет в значительной степени пониженное связывание с IL-18R, связывается с IL-18R с аффинностью связывания, которая составляет приблизительно 75% от аффинности связывания IL-18 дикого типа с IL-18R. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18BP и проявляет в значительной степени пониженное связывание с IL-18R, связывается с IL-18R с аффинностью связывания, которая составляет приблизительно 70% от аффинности связывания IL-18 дикого типа с IL-18R. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18BP и проявляет в значительной степени пониженное связывание с IL-18R, связывается с IL-18R с аффинностью связывания, которая составляет приблизительно 65% от аффинности связывания IL-18 дикого типа с IL-18R. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18BP и проявляет в значительной степени пониженное связывание с IL-18R, связывается с IL-18R с аффинностью связывания, которая составляет приблизительно 60% от аффинности связывания IL-18 дикого типа с IL-18R. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18BP и проявляет в значительной степени пониженное связывание с IL-18R, связывается с IL-18R с аффинностью связывания, которая составляет приблизительно 55% от аффинности связывания IL-18 дикого типа с IL-18R. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18BP и проявляет в значительной степени пониженное связывание с IL-18R, связывается с IL-18R с аффинностью связывания, которая составляет приблизительно 50% от аффинности связывания IL-18 дикого типа с IL-18R. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18BP и проявляет в значительной степени пониженное связывание с IL-18R, связывается с IL-18R с аффинностью связывания, которая составляет приблизительно 45% от аффинности связывания IL-18 дикого типа с IL-18R. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18BP и проявляет в значительной степени пониженное связывание с IL-18R, связывается с IL-18R с аффинностью связывания, которая составляет приблизительно 40% от аффинности связывания IL-18 дикого типа с IL-18R. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18BP и проявляет в значительной степени пониженное связывание с IL-18R, связывается с IL-18R с аффинностью связывания, которая составляет приблизительно 35% от аффинности связывания IL-18 дикого типа с IL-18R. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18BP и проявляет в значительной степени пониженное связывание с IL-18R, связывается с IL-18R с аффинностью связывания, которая составляет приблизительно 30% от аффинности связывания IL-18 дикого типа с IL-18R. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18BP и проявляет в значительной степени пониженное связывание с IL-18R, связывается с IL-18R с аффинностью связывания, которая составляет приблизительно 25% от аффинности связывания IL-18 дикого типа с IL-18R. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18BP и проявляет в значительной степени пониженное связывание с IL-18R, связывается с IL-18R с аффинностью связывания, которая составляет приблизительно 20% от аффинности связывания IL-18 дикого типа с IL-18R. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18BP и проявляет в значительной степени пониженное связывание с IL-18R, связывается с IL-18R с аффинностью связывания, которая составляет приблизительно 15% от аффинности связывания IL-18 дикого типа с IL-18R. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18BP и проявляет в значительной степени пониженное связывание с IL-18R, связывается с IL-18R с аффинностью связывания, которая составляет приблизительно 10% от аффинности связывания IL-18 дикого типа с IL-18R.
В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18BP и проявляет в значительной степени пониженное связывание с IL-18R, связывается с IL-18R с аффинностью связывания, которая составляет приблизительно 5% от аффинности связывания IL-18 дикого типа с IL-18R. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18BP и проявляет в значительной степени пониженное связывание с IL-18R, связывается с IL-18R с аффинностью связывания, которая составляет приблизительно 4% от аффинности связывания IL-18 дикого типа с IL-18R. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18BP и проявляет в значительной степени пониженное связывание с IL-18R, связывается с IL-18R с аффинностью связывания, которая составляет приблизительно 3% от аффинности связывания IL-18 дикого типа с IL-18R. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18BP и проявляет в значительной степени пониженное связывание с IL-18R, связывается с IL-18R с аффинностью связывания, которая составляет приблизительно 2% от аффинности связывания IL-18 дикого типа с IL-18R. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18BP и проявляет в значительной степени пониженное связывание с IL-18R, связывается с IL-18R с аффинностью связывания, которая составляет приблизительно 1% от аффинности связывания IL-18 дикого типа с IL-18R.
В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18BP и проявляет в значительной степени пониженное связывание с IL-18R, связывается с IL-18R с аффинностью связывания, которая составляет приблизительно 0,1% от аффинности связывания IL-18 дикого типа с IL-18R. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18BP и проявляет в значительной степени пониженное связывание с IL-18R, связывается с IL-18R с аффинностью связывания, которая составляет приблизительно 0,01% от аффинности связывания IL-18 дикого типа с IL-18R. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18BP и проявляет в значительной степени пониженное связывание с IL-18R, связывается с IL-18R с аффинностью связывания, которая составляет приблизительно 0,001% от аффинности связывания IL-18 дикого типа с IL-18R. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18BP и проявляет в значительной степени пониженное связывание с IL-18R, связывается с IL-18R с аффинностью связывания, которая составляет приблизительно 0,0001% от аффинности связывания IL-18 дикого типа с IL-18R. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18BP и проявляет в значительной степени пониженное связывание с IL-18R, связывается с IL-18R с аффинностью связывания, которая составляет приблизительно 0,00001% от аффинности связывания IL-18 дикого типа с IL-18R. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18BP и проявляет в значительной степени пониженное связывание с IL-18R, связывается с IL-18R с аффинностью связывания, которая составляет приблизительно 0,000001% от аффинности связывания IL-18 дикого типа с IL-18R. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18BP и проявляет в значительной степени пониженное связывание с IL-18R, связывается с IL-18R с аффинностью связывания, которая составляет приблизительно 0,0000001% от аффинности связывания IL-18 дикого типа с IL-18R. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18BP и проявляет в значительной степени пониженное связывание с IL-18R, связывается с IL-18R с аффинностью связывания, которая составляет приблизительно 0,00000001% от аффинности связывания IL-18 дикого типа с IL-18R. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18BP и проявляет в значительной степени пониженное связывание с IL-18R, связывается с IL-18R с аффинностью связывания, которая составляет приблизительно 0,000000001% от аффинности связывания IL-18 дикого типа с IL-18R. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18BP и проявляет в значительной степени пониженное связывание с IL-18Rсвязывается с IL-18R с аффинностью связывания, которая составляет приблизительно 0,0000000001% от аффинности связывания IL-18 дикого типа с IL-18R. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18BP и проявляет в значительной степени пониженное связывание с IL-18R, связывается с IL-18R с аффинностью связывания, которая составляет приблизительно 0,00000000001% от аффинности связывания IL-18 дикого типа с IL-18R. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывается с IL-18BP и проявляет в значительной степени пониженное связывание с IL-18R, связывается с IL-18R с аффинностью связывания, которая составляет приблизительно 0,000000000001% от аффинности связывания IL-18 дикого типа с IL-18R.
Кроме того, для специалиста в данной области, после ознакомления с этим изобретением и приведенными в изобретении примерами способов, должно быть очевидным, что композиция для ингибиторов IL-18BP включает такие ингибиторы, которые будут созданы в будущем на основе хорошо известных в фармакологии критериев, таких как физиологические результаты ингибирования IL-18BP, подробно описанные в изобретении и/или известные в данной области. Поэтому, настоящее изобретение никоим образом не ограничивается какой-либо конкретной композицией для ингибирования IL-18BP, приведенной в качестве примера или описанной в изобретении; более того, изобретение охватывает даже те композиции ингибиторов, которые являются известными для обычного специалиста в данной области и которые будут созданы в будущем.
Кроме того, обычным специалистам в данной области хорошо известны способы идентификации и получения композиций ингибиторов IL-18BP, включая, но этим не ограничивая, получение ингибитора из природного источника (например, Streptomyces sp., Pseudomonas sp., Stylotella aurantium, и так далее). В качестве варианта, ингибитор IL-18BP может быть синтезирован химическим путем. Кроме того, на основе приведенных в изобретении идей, для специалиста должно быть очевидно, что композиция ингибитора IL-18BP может быть получена из рекомбинантного организма. Композиции и способы химического синтеза ингибиторов IL-18BP и их получения из природных источников хорошо известны в данной области и описаны в научной литературе.
Для обычного специалиста в данной области является очевидным, что ингибитор может быть введен в форме малой молекулы химического вещества, белка, антитела, конструкции нуклеиновой кислоты, кодирующей белок, антисмысловой нуклеиновой кислоты, конструкции нуклеиновой кислоты, кодирующей антисмысловую нуклеиновую кислоту или их комбинаций. Хорошо известны многочисленные векторы и другие композиции и методы для введения белка или конструкции нуклеиновой кислоты, кодирующей белок, в клетки или ткани. Поэтому, изобретение включает способ введения белка или нуклеиновой кислоты, кодирующей белок, которые являются ингибитором IL-18BP. (Sambrook et al., 2012, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory, New York; Ausubel et al., 1997, Current Protocols in Molecular Biology, John Wiley & Sons, New York).
Для любого специалиста в данной области должно быть очевидным, что снижение количества или активности молекулы, которая сама как таковая увеличивает количество или активность IL-18BP, может использоваться в композициях и способах по настоящему изобретению для снижения количества или активности IL-18BP.
Антисмысловые олигонуклеотиды представляют собой молекулы ДНК или РНК, которые являются комплементарными с некоторой частью молекулы РНК. При нахождении в клетки, антисмысловые олигонуклеотиды гибридизируются с существующей молекулой РНК и ингибируют трансляцию в продукте гена. Ингибирование экспрессии гена с использованием антисмыслового олигонуклеотида хорошо известно (Marcus-Sekura, 1988, Anal. Biochem. 172:289), as are methods of expressing антисмысловой олигонуклеотид in a cell (Inoue, U.S. Pat. No. 5,190,931). Способы по изобретению включают применение антисмыслового олигонуклеотида для уменьшения количества IL-18BP или для уменьшения количества молекулы, которые вызывают увеличение количества или активности IL-18BP, что приводит к снижению количества или активности IL-18BP.
В настоящем изобретении предлагаются антисмысловые олигонуклеотиды, которые синтезируют и доставляют в клетку с помощью методов, хорошо известных обычным специалистом в данной области. Например, может быть синтезирован антисмысловой олигонуклеотид, имеющий длину в диапазоне от приблизительно 10 до приблизительно 100 нуклеотидов, более типично, от приблизительно 15 до приблизительно 50 нуклеотидов. Хорошо известен синтез молекул нуклеиновой кислоты, используемый для синтеза модифицированных антисмысловых олигонуклеотидов с целью повышения биологической активности по сравнению с немодифицированными антисмысловыми олигонуклеотидами (Tullis, 1991, U.S. Pat. No. 5023243).
Аналогично, экспрессия гена может быть ингибирована путем гибридизации антисмысловой молекулы с промотором или другим регуляторным элементом гена, вследствие воздействия на транскрипцию гена. Методы идентификации промотора или другого регуляторного элемента, который взаимодействует с соответствующим геном, хорошо известны, и они включают такие методы, как дрожжевая двугибридная система (Bartel and Fields, eds., In: The Yeast Two Hybrid System, Oxford University Press, Cary, N.C.).
В качестве варианта, ингибирование гена, экспрессирующего IL-18BP, или гена, экспрессирующего белок, который повышает уровень или активность IL-18BP, может быть осуществлено путем использования рибозима. Использование рибозимов для ингибирования экспрессии гена хорошо известна специалистам в данной области (смотрите, например, Cech et al., 1992, J. Biol. Chem. 267:17479; Hampel et al., 1989, Biochemistry 28: 4929; Altman et al., U.S. Pat. No. 5,168,053). Рибозимы представляют собой каталитические молекулы РНК, обладающие способностью расщеплять другие молекулы одноцепочечной РНК. Известно, что рибозимы обладают избирательностью к последовательностям и, поэтому, могут быть модифицированы для распознавания специфической нуклеотидной последовательности (Cech, 1988, J. Amer. Med. Assn. 260:3030), что дает возможность селективно расщеплять специфические молекулы мРНК. Имея нуклеотидную последовательность молекулы, любой специалист в данной области может синтезировать антисмысловой олигонуклеотид или рибозим без проведения излишних экспериментов, используя описание настоящего изобретения и включенные в изобретение ссылки.
Для любого специалиста в данной области является очевидным, что ингибиторы IL-18BP могут вводиться краткосрочно (например, в течение короткого периода времени, такого как сутки, неделя или месяц) или постоянно (например, в течение длительного периода времени, такого как несколько месяцев или год или более). Для любого специалиста в данной области является очевидным, что ингибиторы IL-18BP могут вводиться по отдельности или в любой комбинации с другими лекарственными средствами. Кроме того, ингибиторы IL-18BP могут вводиться по отдельности или в любой комбинации применительно ко времени, в которое они могут быть введены одновременно и/или до и/или после друг друга. Для любого специалиста в данной области является очевидным, исходя из приведенного описания изобретения, что композиции ингибитора IL-18BP могут применяться для лечения или предотвращения заболевания или нарушения у субъекта, нуждающегося в этом, и что композиция ингибитора может применяться по отдельности или в любой комбинации с другим лекарственным средством с целью достижения терапевтического результата.
В различных вариантах осуществления, любые описанные в изобретении ингибиторы IL-18BP по изобретению могут быть введены по отдельности или в комбинации с другими ингибиторами других молекул, ассоциируемых с заболеванием или нарушением, описанным в изобретении или известных в данной области.
После ознакомления с описанием настоящего изобретения и, в том числе, с подробно описанными способами, для любого специалиста в данной области должно быть очевидным, что изобретение не ограничивается лечением заболевания или нарушения, наличие которого уже установлено. В частности, заболевание или нарушение не обязательно должно уже проявиться с нанесением ущерба здоровью субъекта; напротив, заболевание или нарушение необязательно должно быть выявлено у субъекта до начала лечения. То есть, заболевание или нарушение не должно быть достоверно выявлено, прежде чем применение настоящего изобретения может дать положительный эффект. Поэтому, настоящее изобретение включает способ предотвращения заболевания или нарушения у субъекта, в котором субъекту может быть введена описанная в изобретении композиция ингибитора IL-18BP до начала возникновения заболевания или нарушения, в результате чего предотвращается развитие заболевания или нарушения. Описанные в изобретении способы профилактики также включают лечение субъекта, находящегося в стадии ремиссии, для предотвращения рецидива заболевания или нарушения.
После ознакомления с описанием настоящего изобретения, для любого специалиста в данной области должно быть очевидным, что предотвращение заболевания или нарушения включает введение субъекту композиции ингибитора IL-18BP в качестве профилактической меры против возникновения заболевания или нарушения. Как уже было более подробно описано в изобретении, способы снижения уровня или активности IL-18BP включают широкое разнообразие методов снижения не только активности IL-18BP, но также методов снижения экспрессии нуклеиновой кислоты, кодирующей IL-18BP, в том числе или снижения транскрипции, или снижения трансляции, или и той и другой.
Кроме того, после ознакомления с идеями настоящего изобретения, для любого специалиста в данной области должно быть очевидным, что настоящее изобретение включает способ предотвращения целого ряда заболеваний, нарушений и патологий, при которых снижение экспрессии и/или активности IL-18BP опосредует, оказывает лечебный эффект или предотвращает возникновение заболевания, нарушения или патологии. Методы оценки связи заболевания с уровнями или активностью IL-18BP хорошо известны. Кроме того, изобретение включает лечение или предотвращение таких заболеваний, которые могут возникнуть в будущем.
Изобретение включает введение ингибитора IL-18BP с целью осуществления способов по изобретению; после ознакомления с описанием настоящего изобретения, для любого специалиста в данной области является очевидным, как приготавливать и вводить соответствующий ингибитор IL-18BP субъекту. Однако, настоящее изобретение не ограничивается каким-либо конкретным способом введения или схемой лечения.
Ингибиторы цитокинов
В некоторых вариантах осуществления, композиция по настоящему изобретению включает ингибитор одного или более цитокинов. В некоторых вариантах осуществления, ингибитор одного или более цитокинов включает химическое соединение, белок, пептид, пептидомиметик, антитело, рибозим, низкомолекулярное химическое соединение или молекулу антисмысловой нуклеиновой кислоты (например, миРНК, микроРНК, и так далее), которые ингибируют экспрессию, активность, или и то и другое, одного или более цитокинов. В некоторых вариантах осуществления, ингибитор ингибируют экспрессию, активность, или и то и другое, IL-17, IL-5 или IL-3. В некоторых вариантах осуществления, ингибитор цитокина снижает токсичность. В некоторых вариантах осуществления, ингибитор цитокина повышает активность введенного варианта полипептида IL-18 или ингибитора IL-18BP.
Композиции и способы для лечения и предотвращения заболевания
В различных вариантах осуществления, настоящее изобретение включает композиции, включающие активатор активности IL-18, такой как активация сигнального пути, по меньшей мере, через один IL-18R, и способы повышения активности IL-18, такой как активация сигнального пути, по меньшей мере, через один IL-18R, в клетке, ткани органа, системе или у субъекта, нуждающегося в этом. В различных вариантах осуществления, активатор активности IL-18 в композициях и способы лечения по изобретению, повышают величину активации сигнального пути IL-18R, величину активности иммуноцитов, или и то и другое. В различных вариантах осуществления, заболевания или нарушения, при которых повышение активации сигнального пути IL-18R может улучшать терапевтические эффекты, включают, но этим не ограничивая, рак, инфекционные заболевания, макулярную дегенерацию и метаболические заболевания и нарушения.
Далее приведены неограничивающие примеры типов рака, которые могут быть подвергнуты лечению или предотвращены с помощью способов и композиций по изобретению: острый лимфобластный лейкоз, острый миелолейкоз, адренокортикальная карцинома, рак аппендикса, базальноклеточная карцинома, рак желчевыводящих путей, рак мочевого пузыря, рак костей, опухоли головного и спинного мозга, глиома ствола головного мозга, опухоль головного мозга, рак молочной железы, бронхиальные опухоли, лимфома Беркитта, карциноидная опухоль, атипичная тератоидная/рабдоидная опухоль центральной нервной системы, эмбриональные опухоли центральной нервной системы, лимфома центральной нервной системы, астроцитома мозжечка, церебральная астроцитома/злокачественная глиома, рак шейки матки, опухоль зрительного проводящего пути у детей, хордома, хронический лимфолейкоз, хронический миелолейкоз, хронические миелопролиферативные нарушения, рак толстой кишки, колоректальный рак, краниофарингиома, кожный рак, кожная Т-клеточная лимфома, эндометриальный рак, эпендимобластома, эпендимома, рак пищевода, семейство опухолей Юинга, экстракраниальный рак, внегонадная герминогенная опухоль, внепеченочный рак желчевыводящих путей, внепеченочный рак, рак глаза, фунгоидный микоз, рак желчного пузыря, рак желудка, рак желудочно-кишечного тракта, гастроинтестинальная карциноидная опухоль, гастроинтестинальная стромальная опухоль, герминогенная опухоль, гестациозный рак, гестациозная трофобластическая опухоль, глиобластома, глиома, волосатоклеточный лейкоз, рак головы и шеи, гепатоцеллюлярный рак (рак печени), гистиоцитоз, лимфома Ходжкина, гипофарингеальный рак, гипоталамическая глиома и глиома зрительного проводящего пути, гипоталамическая опухоль, интраокулярный рак (рак глаза), интраокулярная меланома, инсулиномы, саркома Капоши, рак почки (почечно-клеточный рак), лангергансоклеточный рак, лангергансоклеточный гистиоцитоз, рак гортани, лейкоз, рак губ и ротовой полости, рак печени, рак легкого, лимфома, макроглобулинемия, злокачественная фиброзная гистиоцитома костей и остеосаркома, медуллобластома, медуллоэпителиома, меланома, карцинома из клеток Меркеля, мезотелиома, метастатический плоскоклеточный рак шеи неизвестного происхождения, рак ротовой полости, синдром множественных эндокринных неоплазий, множественная миелома, микоз, миелодиспластические синдромы, миелодиспластические/миелопролиферативные заболевания, миелогенный лейкоз, миелоидный лейкоз, миелома, миелопролиферативные нарушения, рак носовой полости и придаточных пазух носа, назофарингеальный рак, нейробластома, неходжкинская лимфома, немелкоклеточный рак легкого, рак полости рта, рак ротоглотки, остеосаркома и злокачественная фиброзная гистиоцитома, остеосаркома и злокачественная фиброзная гистиоцитома костей, рак яичников, эпителиальный рак яичников, герминогенная опухоль яичников, пограничная опухоль яичника, рак поджелудочной железы, папилломатоз, параганглиома, рак паращитовидной железы, рак полового члена, фарингеальный рак, феохромоцитома, паренхимальные опухоли шишковидной железы промежуточной дифференциации, пинеобластома и супратенториальные примитивные нейроэктодермальные опухоли, опухоль гипофиза, неоплазия плазматических клеток, неоплазия плазматических клеток/множественная миелома, плевролегочная бластома, первичный рак центральной нервной системы, первичная лимфома центральной нервной системы, рак предстательной железы, рак прямой кишки, почечно-клеточный рак (рак почки), рак почечной лоханки и мочеточника, карцинома дыхательных путей, включающая ген NUT на хромосоме 15, ретинобластома, рабдомиосаркома, рак слюнной железы, саркома, синдром Сезари, рак кожи (меланома), немеланоцитарный рак кожи, карцинома кожи, мелкоклеточный рак легкого, рак тонкого кишечника, рак мягких тканей, саркома мягких тканей, плоскоклеточная карцинома, плоскоклеточный рак шеи, рак желудка, супратенториальные примитивные нейроэктодермальные опухоли, супратенториальные примитивные нейроэктодермальные опухоли и пинеобластома, Т-клеточная лимфома, рак яичка, рак горла, тимома и карцинома вилочковой железы, рак щитовидной железы, переходно-клеточный рак, переходно-клеточный рак почечной лоханки и мочеточника, трофобластическая опухоль, рак мочеиспускательного канала, рак матки, саркома матки, вагинальный рак, глиома зрительного проводящего пути и гипоталамуса, рак влагалища, макроглобулинемия Вальденстрема и опухоль Вильмса.
Таким образом, неограничивающие примеры типов рака, которые могут быть подвергнуты лечению или которые могут быть предотвращены с помощью способов и композиций по изобретению, включают солидные раковые опухоли, жидкие раковые опухоли, раковые опухоли крови, тератомы, саркомы и карциномы.
В некоторых вариантах осуществления, способ по настоящему изобретению применяется для лечения или предотвращения опухоли или рака, который резистентен к ингибиторам иммунных контрольных точек (ICIs). Примеры ингибиторов иммунных контрольных точек включают, но этим не ограничивая, антитело против PD1 (например, ниволумаб), антитело против CTLA4 (например, ипилимумаб), антитело против TIM3, антитело против TIGIT, антитело против LAG3, антитело против B7H3, антитело против B7H4, антитело против VISTA, антитело против ICOS, антитело против GITR, антитело против 41BB, антитело против OX40 и антитело против CD40. Примеры мишеней для ингибиторов иммунных контрольных точек включают, но этим не ограничивая: PD-L1, PD1, CTLA4, TIM3, TIGIT, LAG3, B7H3, B7H4, VISTA, ICOS, GITR, 41BB, OX40 и CD40. Таким образом, примеры ингибиторов иммунных контрольных точек включают лекарственные средства, которые ингибируют белки, такие как PD-L1, PD1, CTLA4, TIM3, TIGIT, LAG3, B7H3, B7H4, VISTA, ICOS, GITR, 41BB, OX40 или CD40. В некоторых случаях, предлагаемый вариант полипептида IL-18 (например, вариант DR-IL-18, вариант D2D-IL-18) вводят совместно с ингибитором иммунных контрольных точек (например, со средством, которое ингибирует PD-L1, PD1, CTLA4, TIM3, TIGIT, LAG3, B7H3, B7H4, VISTA, ICOS, GITR, 41BB, OX40 или CD40 или любой комбинацией этих средств).
Слияния/конъюгации
В некоторых вариантах осуществления, вариант полипептида IL-18 по настоящему изобретению подвергают слиянию с другим белком, то есть, вариант полипептида IL-18 или ее фрагмент может быть подвергнут слиянию в рамке со вторым полипептидом (с партнером по слиянию). В некоторых вариантах осуществления, второй полипептид (партнер по слиянию) способен увеличивать общий размер слитого белка, например, вследствие чего слитый белок не будет быстро выводиться из кровотока. В некоторых случаях, вариант полипептида IL-18 или ее фрагмент не подвергают слиянию со вторым полипептидом.
В некоторых вариантах осуществления, второй полипептид (партнер по слиянию с вариантом полипептида IL-18 или его фрагмента) является частью или всей областью Fc-фрагмента иммуноглобулина (то есть, последовательность Fc-фрагмента антитела). В других вариантах осуществления, второй полипептид представляет собой любой подходящий полипептид, который практически аналогичен Fc, например, обеспечивающий увеличение размера, мультимеризацию доменов и/или дополнительное связывание или взаимодействие с молекулами Ig. В некоторых вариантах осуществления, второй полипептид является частью или представляет собой полностью сывороточный альбумин человека (HSA). В некоторых вариантах осуществления, второй полипептид является частью или представляет собой полностью антитело, фрагмент антитела, верблюжье антитело или "нанотело" или другое аффинное средство, которое связывается или взаимодействует с HSA. Эти слитые белки могут облегчать очистку, мультимеризацию и характеризоваться повышенным периодом полувыведения in vivo. Слитые белки, имеющие присоединенные за счет дисульфидных связей мультимерные структуры, также могут быть, в некоторых случаях, более эффективными при связывании и нейтрализации других молекул.
При слиянии с гетерологичным полипептидом, часть, соответствующая варианту полипептида IL-18 или его фрагменту, может называться "частью варианта полипептида IL-18" предлагаемого варианта полипептида IL-18. В некоторых случаях, "часть варианта полипептида IL-18" может иметь длину, составляющую 100 аминокислот или более (например, 110 аминокислот или более, 125 аминокислот или более, 150 аминокислот или более, 90 аминокислот или более, 95 аминокислот или более, 100 аминокислот или более, 105 аминокислот или более, 110 аминокислот или более, 115 аминокислот или более, 120 аминокислот или более, 125 аминокислот или более, 130 аминокислот или более, 140 аминокислот или более или 150 аминокислот или более), вплоть до полноразмерного IL-18, и может быть подвергнута слиянию с гетерологичным полипептидом.
В некоторых случаях, часть варианта полипептида IL-18 предложенного варианта полипептида IL-18 имеет длину в диапазоне от 100 аминокислот до 157 аминокислот (например, от 100 аминокислот до 150 аминокислот, от 100 аминокислот до 140 аминокислот, от 140 аминокислот до 157 аминокислот, от 140 аминокислот до 150 аминокислот, от 145 аминокислот до 157 аминокислот, или от 150 аминокислот до 157 аминокислот).
В некоторых случаях, второй полипептид представляет собой маркерную последовательность (например, аффинную метку), такую как пептид, который облегчает очистку слитого полипептида. Например, маркерная аминокислотная последовательность может представлять собой, среди прочих, гистидиновый гексапептид, такой как метка, введенная в вектор pQE (QIAGEN, Inc., 9259 Eton Avenue, Chatsworth, Calif., 91311), многие из которых выпускаются промышленностью. Например, как описано в публикации Gentz et al., Proc. Natl. Acad. Sci. USA 86: 821-824, 1989, гистидиновый гексапептид позволяет легко очищать слитый белок. Другая пептидная метка, применяемая для очистки, метка "HA", соответствует эпитопу, полученному из гемагглютининового белка вируса гриппа (Wilson et al., Cell 37: 767, 1984). Добавление пептидных фрагментов для облегчения манипуляций с полипептидами является давно известным и общепринятым методом.
Предлагаемый вариант полипептида IL-18 может быть подвергнут модификации, например, объединен/конъюгирован с другими разнообразными олигопептидами, белками и/или небелковыми фрагментами, для различных целей. Например, предлагаемый вариант полипептида IL-18 может быть подвергнут посттрансляционной модификации, например, путем пренилирования, ацетилирования, амидирования, карбоксилирования, гликозилирования, пегилирования (путем ковалентного присоединения полимерных цепей полиэтиленгликоля (PEG)), и так далее. Такие модификации могут также включать модификации гликозилирования, например, модификации, сделанные путем модифицирования профилей гликозилирования полипептида во время его синтеза и процессинга или на дополнительных стадиях процессинга; например, путем воздействия на полипептид ферментов, которые негативно действуют на гликозилирование, таких как гликозилирующие или дегликозилирующие ферменты млекопитающих. В некоторых вариантах осуществления, предлагаемый вариант полипептида IL-18 имеет один или более фосфорилированных аминокислотных остатков, например, фосфотирозин, фосфосерин или фосфотреонин.
В некоторых других вариантах осуществления, варианты полипептида IL-18 по изобретению включают реагенты, дополнительно модифицированные для улучшения их устойчивости к протеолитическому распаду или для оптимизации растворимости или для превращения их в более удобные для применения в качестве терапевтического средства. Например, варианты по настоящему изобретению дополнительно включают аналоги, содержащие остатки, не являющиеся остатками природных L-аминокислот, например, остатки D-аминокислот или неприродных синтетических аминокислот. Некоторые или все аминокислотные остатки могут быть заменены на D-аминокислоты.
Совместное введение и мультиспецифические варианты полипептида IL-18
Как уже отмечалось в этом изобретении, в некоторых случаях, предлагаемый вариант полипептида IL-18 вводят с дополнительным лекарственным средством. Термины "совместное введение", "совместно вводимое" и "в комбинации с" включают введение двух или более терапевтических средств (например, предлагаемого варианта IL-18, такого как DR-IL-18 или D2D, в комбинации с дополнительным лекарственным средством) либо одновременно, параллельно, либо последовательно без конкретного указания моментов времени. В некоторых вариантах осуществления, лекарственные средства присутствуют в клетках или в организме субъекта в одно и то же время или оказывают их биологическое или терапевтическое воздействие в одно и то же время. В некоторых вариантах осуществления, терапевтические средства находятся в одной и той же композиции или лекарственной форме с разовой дозой. В других вариантах осуществления, терапевтические средства находятся в отдельных композициях или лекарственных формах с разовой дозой. В конкретных вариантах осуществления, первое лекарственное средство может быть введено за (например, за 5 минут, 15 минут, 30 минут, 45 минут, 1 час, 2 часа, 4 часа, 6 часов, 12 часов, 24 часа, 48 часов, 72 часа, 96 часов, 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 8 недель или 12 недель до), одновременно или после (например, 5 минут, 15 минут, 30 минут, 45 минут, 1 час, 2 часа, 4 часа, 6 часов, 12 часов, 24 часа, 48 часов, 72 часа, 96 часов, 1 неделю, 2 недели, 3 недели, 4 недели, 5 недель, 6 недель, 8 недель или 12 недель после) введения второго терапевтического средства.
В некоторых случаях, предлагаемый вариант IL-18 (например, вариант DR-IL-18 или вариант D2D) (например, приготовленный в форме фармацевтической композиции) вводят совместно с противораковым терапевтическим средством, терапевтическим средством для лечения инфекций или нацеленным против рака антителом. Такое введение может включать параллельное (то есть в одно и то же время), предшествующее или последующее введение лекарственного средства/антитела относительно введения лекарственного средства или лекарственных средств по изобретению. Для обычного специалиста в данной области не составит труда определить соответствующие моменты времени, последовательность и дозы для введения конкретных лекарственных средств и композиций по настоящему изобретению.
В некоторых вариантах осуществления, лечение проводят путем введения комбинации (путем совместного введения) предлагаемого варианта IL-18 (например, варианта DR-IL-18 или варианта D2D) с еще одним лекарственным средством (например, с иммуностимулятором, средством для лечения хронической инфекции, цитотоксическим средством, противораковым средством, и другими подобными средствами). Одним примером класса цитотоксических средств, которые могут быть использованы, являются химиотерапевтическое средство. Примеры химиотерапевтических средств включают, но этим не ограничивая, альдеслейкин, алтретамин, амифостин, аспарагиназу, блеомицин, капецитабин, карбоплатин, кармустин, кладрибин, цизаприд, цисплатин, циклофосфамид, цитарабин, дакарбазин (DTIC), дактиномицин, доцетаксел, доксорубицин, дронабинол, дуокармицин, этопозид, филграстим, флударабин, фторурацил, гемцитабин, гранисетрон, гидроксимочевину, идарубицин, ифосфамид, интерферон альфа, иринотекан, лансопразол, левамизол, лейковорин, мегестрол, месну, метотрексат, метоклопрамид, митомицин, митотан, митоксантрон, омепразол, ондансетрон, паклитаксел (таксолTM), пилокарпин, прохлорперазин, ритуксимаб, сапроин, тамоксифен, таксол, гидрохлорид топотекана, трастузумаб, винбластин, винкристин и тартрат винорелбина.
Предлагаемый вариант IL-18 (например, вариант DR-IL-18 или вариант D2D) не обязательно, но по желанию, может быть приготовлен с одним или более лекарственными средствами, которые усиливают активность или же которые повышают терапевтический эффект. В некоторых вариантах осуществления, лечение проводят путем введения комбинации (путем совместного введения) предлагаемого варианта IL-18 (например, варианта DR-IL-18) и средства, которое опсонирует клетку-мишень. Поэтому, в изобретении также предусматриваются композиции (и способы, в которых применяются композиции), которые включают: (a) предлагаемый вариант IL-18 (например, вариант DR-IL-18); и (b) средство, которое опсонирует клетку-мишень. В некоторых случаях, это средство, которое опсонирует клетку-мишень, представляет собой ритуксимаб. В некоторых случаях, это средство, которое опсонирует клетку-мишень, представляет собой цетуксимаб.
"Средство, которое опсонирует клетку-мишень" ("опсонизирующее средство") представляет собой любое средство, которое может связываться с клеткой-мишенью (например, с раковой клеткой, с клеткой, содержащей внутриклеточный патоген, и другими подобными клетками) и опсонировать клетку-мишень (например, наносить метку на клетку-мишень для фагоцитоза и/или для антителозависимой клеточноопосредованной цитотоксичности (ADCC)). Например, любое антитело, которое может связываться с клеткой мишенью (например, с раковой клеткой, такой как опухолевая клетка), и которое имеет FC-область, рассматривают в качестве средства, которое опсонирует клетку-мишень, и является антителом, которое связывается с клеткой мишенью (например, противоопухолевым антителом, противораковым антителом, противоинфекционным антителом и другим подобным антителом).
Например, антитела, селективные в отношении маркеров опухолевых клеток, лучевой, хирургической и/или гормональной депривации, описаны в публикации Kwon et al., Proc. Natl. Acad. Sci U.S.A., 96: 15074-9, 1999. Ингибиторы ангиогенеза могут также применяться в комбинации со способами по изобретению. Целый ряд антител в настоящее время используется в клинической практике для лечения рака, а другие антитела находятся на различных стадиях клинических испытаниях. Например, известен целый ряд антигенов и соответствующих моноклональных антител для лечения B-клеточных злокачественных опухолей. Одним антигеном-мишенью является CD20. Ритуксимаб представляет собой химерное неконъюгированное моноклональное антитело, нацеленное на антиген CD20. CD20 играет важную функциональную роль в активации, пролиферации и дифференцировке B-клеток. На антиген CD52 нацелено моноклональное антитело алемтузумаб, которое предписано для лечения хронического лимфолейкоза. На CD22 нацелен ряд антител, и недавно было продемонстрировано, что они проявляют активность в сочетании с токсином при резистентном к химиотерапии волосатоклеточном лейкозе. Два новых моноклональных антитела, нацеленных на CD20, тозитумомаб и ибритумомаб, были представлены для регистрации в Управление по контролю качества пищевых продуктов и лекарственных средств США (FDA). Эти антитела конъюгированы с радиоизотопами. Алемтузумаб (кампат) применяют при лечении хронического лимфолейкоза; гемтузумаб (милотарг) находит применение при лечении острого миелобластного лейкоза; ибритумомаб (зевалин) находит применение при лечении неходжкинской лимфомы; панитумумаб (вектибикс) находит применение при лечении рака толстой кишки.
Моноклональные антитела, применяемые в способах по изобретению, которые нашли применение при лечении солидных опухолях, включают, без ограничения, эдреколомаб и трастузумаб (герцептин). Эдреколомаб нацелен на антиген 17-1A, обнаруживаемый при раке толстой кишки и раке прямой кишки, и он был одобрен к применению в Европе при этих показаниях. Трастузумаб нацелен на антиген HER-2/neu. Цетуксимаб (эрбитукс) также представляет интерес для применения в способах по изобретению. Это антитело связывается с рецептором EGF (EGFR), и оно было использовано при лечении солидных опухолей, включая рак толстой кишки и мелкоклеточную карциному головы и шеи (SCCHN).
Предлагаемый вариант полипептида IL-18 (например, вариант DR-IL-18, вариант D2D-IL-18) может быть объединен с любым из упомянутых выше средств (например, с такими средствами, как антитела, которые опсонирует клетки-мишени). Поэтому, в некоторых случаях, предлагаемый вариант полипептида IL-18 (например, вариант DR-IL-18, вариант D2D-IL-18) используют при комбинированной терапии (совместно вводят) с одним или более опсонизирующими средствами, селективными в отношении раковых клеток, например, опухолевых клеток. В некоторых случаях, предлагаемый вариант полипептида IL-18 (например, вариант DR-IL-18, вариант D2D-IL-18) используют при комбинированной терапии (совместно вводят) с одним или более из следующих средств: цетуксимаб (связывает EGFR), панитумумаб (связывает EGFR), ритуксимаб (связывает CD20), трастузумаб (связывает HER2), пертузумаб (связывает HER2), алемтузумаб (связывает CD52), брентуксимаб (связывает CD30), тозитумомаб, ибритумомаб, гемтузумаб, ибритумомаб и эдреколомаб (связывает 17-1A) или их комбинации.
В некоторых случаях, предлагаемый вариант полипептида IL-18 (например, вариант DR-IL-18, вариант D2D-IL-18) вводят совместно со средством, опсонизирующим раковые клетки (например, со средством, которое включает антигенсвязывающую область, которая нацелена на CD19, CD20, CD22, CD24, CD25, CD30, CD33, CD37, CD38, CD44, CD45, CD47, CD51, CD52, CD56, CD62L, CD70, CD74, CD79, CD80, CD96, CD97, CD99, CD123, CD134, CD138, CD152 (CTLA-4), CD200, CD213A2, CD221, CD248, CD276 (B7-H3), B7-H4, CD279 (PD-1), CD274 (PD-L1), CD319, EGFR, EPCAM, 17-1A, HER1, HER2, HER3, CD117, C-Met, HGFR, PDGFRA, AXL, TWEAKR, PTHR2, HAVCR2 (TIM3), GD2 ганглиозид, MUC1, муцин CanAg, мезотелин, эндоглин, антиген Льюиса Y, CEA, CEACAM1, CEACAM5, CA-125, PSMA, BAFF, FGFR2, TAG-72, желатиназу B, глипикан 3, нектин-4, BCMA, CSF1R, SLAMF7, интегрин αvβ3, TYRP1, GPNMB, CLDN18.2, FOLR1, CCR4, CXCR4, MICA, антиген C242, DLL3, DLL4, EGFL7, виментин, экстра домен-B фибронектина, TROP-2, LRRC15, FAP, SLITRK6, NOTCH2, NOTCH3, танасцин-3, STEAP1 или NRP1 или любую их комбинацию).
В некоторых случаях, предлагаемый вариант полипептида IL-18 (например, вариант DR-IL-18, вариант D2D-IL-18) вводят совместно со средством, которое нацелено на один или более антигенов, выбранных из CD19, CD20, CD22, CD24, CD25, CD30, CD33, CD38, CD44, CD47, SIRPA, CD52, CD56, CD70, CD96, CD97, CD99, CD123, CD279 (PD-1), CD274 (PD-L1), EGFR, 17-1A, HER2, CD117, C-Met, PTHR2 и HAVCR2 (TIM3).
В некоторых случаях, предлагаемый вариант полипептида IL-18 (например, вариант DR-IL-18, вариант D2D-IL-18) используют при комбинированной терапии (совместно вводят) с любым подходящим иммуномодулирующим средством (например, с антителом против CTLA4, антителом против PD-1, антителом против PD-L1, антителом против TIGIT, антителом против TIM3, антителом против LAG3, антителом против VISTA, антителом против B7H3, антителом против B7H4, с агонистом CD40, с модулятором 4-1BB (например, агонистом 41BB), с модулятором OX-40 (например, агонистом OX-40), с модулятором GITR (например, агонистом GITR), со средством, связывающим CD47, таким как антитело против CD47 или средство, связывающее CD47 с высокой аффинностью, со средством, связывающим SIRPA, таким как антитело против SIRPA или средство, связывающее SIRPA с высокой аффинностью, с антагонистом TGFbeta, таким как антитело против TGF, с цитокином или вариантом цитокина, включающим IL-1, IL-2, IL-10, IL-12, IL-15, IL-18, IL-21, IL-33, с интерфероном альфа, интерфероном бета, интерфероном гамма, TNF, TRAIL, лимфотоксином, LIGHT/TNSF14 или с агонистом Toll-подобного рецептора, включающим TLR2, TLR4, TLR5, TLR7, TLR9, с агонистом инфламмасомы, с агонистом пути STING/cGAS или с агонистом пути RIG-I, с антагонистом аденозиновых рецепторов A2aR/A2bR, с антагонистом арил-гидрокарбонового рецептора, с антагонистом IDO и/или TDO или с онколитическим вирусом.
В некоторых случаях, предлагаемый вариант полипептида IL-18 (например, вариант DR-IL-18, вариант D2D-IL-18) используют при комбинированной терапии (совместно вводят) с ингибитором BTLA и/или CD160. В некоторых случаях, предлагаемый вариант полипептида IL-18 (например, вариант DR-IL-18, вариант D2D-IL-18) используют при комбинированной терапии (совместно вводят) с антителом против CD47/SIRPA (например, антителом против CD47, антителом против SIRPA, средством, связывающим CD47 с высокой аффинностью, средством, связывающим SIRPA с высокой аффинностью и с другими подобными средствами). В некоторых случаях, предлагаемый вариант полипептида IL-18 (например, вариант DR-IL-18, вариант D2D-IL-18) используют при комбинированной терапии (совместно вводят) с ингибитором TIM3 и/или CEACAM1.
Как было указано выше, в некоторых случаях, предлагаемый вариант полипептида IL-18 подвергают слиянию с еще одним белком (то есть, с "партнером по слиянию", "вторым полипептидом"). В некоторых вариантах осуществления, второй полипептид (партнер по слиянию для предлагаемого варианта полипептида IL-18) специфически связывается с молекулой-мишенью, которая не является молекулой-мишенью, связанной с помощью части варианта полипептида IL-18 слитого белка (например, которая не является молекулой-мишенью для вариантов IL-18R, которые связывают IL-18R; или которая не является молекулой-мишенью для вариантов IL-18BP, которые связываются с IL-18BP).
Поэтому, в некоторых вариантах осуществления, предлагаемый вариант полипептида IL-18 является мультиспецифичным (например, биспецифичным). Термины "мультиспецифичный" или "биспецифичный" являются общепринятыми в случаях, когда речь идет о лекарственных средствах (например, лигандах или антителах), которые распознают два или более различных антигенов, вследствие того, что они обладают, по меньшей мере, одной областью (например, лигандом или Fab первого антитела), которая является специфичной для первой мишени, и, по меньшей мере, второй областью (например, лигандом или Fab второго антитела), которая является специфичной для второй мишени. Биспецифичное средство специфически связывается с двумя мишенями и при этом представляет собой один тип мультиспецифичного средства.
В некоторых вариантах осуществления, предлагаемый вариант полипептида IL-18 является мультиспецифичным (например, биспецифичным), вследствие того, что первая область полипептида включает последовательность предлагаемого варианта полипептида IL-18 (то есть первая область включает вариант полипептида IL-18) и вторую область, которая специфически связывается с другой молекулой-мишенью (например, антигеном). Например, в некоторых случаях, вариант полипептида IL-18 подвергают слиянию со вторым полипептидом, который специфически связывается с молекулой мишенью, которая не является молекулой-мишенью, связываемой вариантом полипептида IL-18.
Любое одно из средств, обсужденных выше применительно к совместному введению, может быть конъюгировано с предлагаемым вариантом полипептида IL-18. Предполагается, что используемый в изобретении термин "совместное введение" включает в себя такие конъюгированные соединения. Например, в случае, когда средство 1 вводят совместно со средством 2, подразумевается, что этот термин включает в себя варианты осуществления, в которых средство 1 и средство 2 не конъюгированы друг с другом, но также подразумевается, что этот термин включает варианты осуществления, в которых средство 1 и средство 2 конъюгированы друг с другом (например, когда средство 1 и средство 2 оба являются белками и средство 1 подвергают слиянию со средством 2).
В некоторых случаях, вторая область мультиспецифичного варианта полипептида IL-18 представляет собой ингибитор иммунной контрольной точки. В некоторых случаях, вторая область мультиспецифичного варианта полипептида IL-18 ингибирует один или более белков, выбранных из PD-L1, PD1, CTLA4, TIM3, TIGIT, LAG3, B7H3, B7H4, VISTA, ICOS, GITR, 41BB, OX40 и CD40.
В некоторых случаях, вторая область мультиспецифичного варианта полипептида IL-18 представляет собой средство, опсонизирующее раковые клетки. В некоторых случаях, вторая область мультиспецифичного варианта полипептида IL-18 нацелена на один или более белков, выбранных из CD19, CD20, CD22, CD24, CD25, CD30, CD33, CD38, CD44, CD47, SIRPA, CD52, CD56, CD70, CD96, CD97, CD99, CD123, CD279 (PD-1), CD274 (PD-L1), EGFR, 17-1A, HER2, CD117, C-Met, PTHR2 и HAVCR2 (TIM3). В некоторых случаях, вторая область мультиспецифичного варианта полипептида IL-18 представляет собой опсонизирующее средство, которое нацелено на один или более белков, выбранных из CD19, CD20, CD22, CD24, CD25, CD30, CD33, CD38, CD44, CD47, SIRPA, CD52, CD56, CD70, CD96, CD97, CD99, CD123, CD279 (PD-1), CD274 (PD-L1), EGFR, 17-1A, HER2, CD117, C-Met, PTHR2 и HAVCR2 (TIM3).
Например, в некоторых случаях, вторая область мультиспецифичного варианта полипептида IL-18 включает эктодомен, например, эктодомен из PD-1, PD-L1, CD47 (например, варианта CD47 с высокой аффинностью/полипептида) или SIRPA (например, варианта SIRPA с высокой аффинностью/полипептида). В некоторых случаях, вторая область мультиспецифичного варианта полипептида IL-18 специфически связывает антиген, выбранный из CTLA-4, Lag-3, BTLA, Tim-3, CD244, CD40, CD40L, CD47, SIRPA, PD-1 и PD-L1.
В некоторых вариантах осуществления, предлагаемый вариант полипептида IL-18 включает линкер (например, полипептидный линкер). Например, в некоторых вариантах осуществления, предлагаемый вариант полипептида IL-18 и партнер по слиянию разделены линкером (например, полипептидным линкером). Полипептидный линкер может иметь любую из большого разнообразия аминокислотных последовательностей. Белки могут быть соединены с помощью полипептидного линкера, который по своей природе может быть гибким (например, с помощью гибкого полипептидного линкера), хотя не исключаются и другие химические связи. Подходящие линкеры включают полипептиды длиной в диапазоне от приблизительно 6 аминокислот до приблизительно 40 аминокислот или от приблизительно 6 аминокислот до приблизительно 25. Эти линкеры могут быть получены путем использования синтетических олигонуклеотидов, кодирующих линкер, для связывания с белками. Могут быть использованы пептидные линкеры с определенной степенью гибкости. Линкерные пептиды могут иметь по существу любую аминокислотную последовательность, принимая во внимание, что в некоторых случаях, линкеры могут иметь последовательность, которая дает в результате гибкий пептид. Использование аминокислот небольших размеров, таких как глицин и аланин, находит применение при создании гибкого пептида. Создание таких последовательностей хорошо известно специалистам в данной области. Целый ряд различных линкеров производятся промышленностью, и они могут быть использованы.
В некоторых вариантах осуществления, вариант полипептида IL-18 вводят совместно с конструированным иммуноцитом, таким как CAR-T- или CAR-NK-клетка или T- или NK-клетка, трансфектированным с помощью сконструированного рецептора T-клетки. В других вариантах осуществления, вариант полипептида IL-18 вводят совместно с онколитическим вирусом.
В некоторых вариантах осуществления, нуклеиновую кислоту, кодирующую вариант полипептида IL-18, вводят внутрь сконструированного ("измененного") иммуноцита, такого как CAR-T- или CAR-NK-клетка или T- или NK-клетка, трансфектированного с помощью сконструированного рецептора T-клетки. В этом случае, сконструированная клетка (например, измененная T-клетка, измененная NK-клетка) будет секретировать вариант полипептида IL-18. Способность секретировать вариант пептида IL-18 может регулироваться контекстуальным способом (например, путем регулирования в микроокружении опухоли), например, с помощью синтетического рецептора NOTCH .
В некоторых вариантах осуществления, нуклеиновую кислоту, кодирующую вариант полипептида IL-18, вводят в онколитический вирус. В этом случае, клетки, инфицированные онколитическим вирусом, будут секретировать вариант полипептида IL-18.
В некоторых вариантах осуществления, способ по настоящему изобретению применяют для лечения или предотвращения опухоли или злокачественных опухолей, в которых отсутствует экспрессия молекул MHC класса I на поверхности опухолевых клеток; таких как опухоль, в которой отсутствует B2m, локус MHC, или которая имеет мутации в других представителях презентации антигена и/или комплекса, загружающего антиген, таком как TAP-ассоциированный гликопротеин.
Метаболические заболевания и нарушения включают различные метаболические и связанные с эндокринной системой заболевания и нарушения. Далее приведены неограничивающие примеры метаболических и связанных с эндокринной системой заболеваний, которые могут быть подвергнуты лечению или могут быть предотвращены с помощью способов и композиций по изобретению: ожирение, диабет, преддиабет, диабет типа II, юношеский диабет взрослого типа вариант 1 (MODY), гипергликемия, метаболический синдром, дислипидемия, гипертриглицеридемия и гиперхолестеринемия.
Неограничивающие примеры других заболеваний и нарушений, которые могут быть подвергнуты лечению или могут быть предотвращены с помощью композиций и способов по изобретению, включают вирусные инфекции, бактериальные инфекции, паразитарные инфекции и низкая иммунная активность. В некоторых вариантах осуществления, вирусная инфекция представляет собой, по меньшей мере, одну из инфекций поксвируса, вируса натуральной оспы, контагиозного моллюска, папилломавируса человека и вызванных вирусом бородавок. В некоторых вариантах осуществления, инфекция представляет собой системную инфекцию. В некоторых вариантах осуществления, вирусная инфекция представляет собой инфекцию вирусом коровьей оспы. В некоторых вариантах осуществления, вирусная инфекция представляет собой системную инфекцию вирусом коровьей оспы. В некоторых вариантах осуществления, бактериальная инфекция представляет собой сепсис. В некоторых вариантах осуществления, низкая иммунная активность представляет собой нейтропению, например, возникающую в результате проведения химиотерапии.
Неограничивающие примеры других заболеваний и нарушений, которые могут быть подвергнуты лечению или могут быть предотвращены с помощью композиций и способов по изобретению, включают макулярную дегенерацию. Например, в некоторых случаях, заболевание или нарушение представляет собой влажную форму макулярной дегенерации, а в некоторых случаях, заболевание или нарушение представляет собой влажную форму возрастной макулярной дегенерации. В некоторых таких случаях, вариант IL-18 может применяться в качестве антиангиогенного средства. Например, предлагаемый вариант полипептида IL-18 может, в некоторых случаях, уменьшать неоваскуляризацию хороидеи.
Поэтому настоящее изобретение относится к предотвращению и лечению заболевания или нарушения путем введения терапевтически эффективного количества варианта полипептида IL-18, рекомбинантного варианта полипептида IL-18, активного фрагмента варианта полипептида IL-18 (например, варианта пептида IL-18, и других подобных), активатора экспрессии или активности варианта IL-18, или нуклеиновой кислоты (например, ДНК, кДНК, мРНК, и так далее), которая кодирует, по меньшей мере, один вариант полипептида IL-18, в клетку, ткань органа или субъекту, нуждающемуся в этом, с целью лечения или предотвращения заболевания или нарушения или связанных с ним признаков, симптомов или патологий.
В некоторых вариантах осуществления, композицию по изобретению вводят в клетку, ткань органа, систему или субъекту для лечения или предотвращения заболевания или нарушения. В некоторых вариантах осуществления, вариант полипептида IL-18 человека вводят в клетку, ткань органа, систему или субъекту. В некоторых вариантах осуществления, нуклеиновую кислоту (например, ДНК, кДНК, мРНК, и так далее), кодирующую, по меньшей мере, один вариант полипептида IL-18 человека, вводят в клетку, ткань органа, систему или субъекту.
В различных вариантах осуществления, вариант полипептида IL-18 человека или его фрагмент включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3, по меньшей мере, 4, по меньшей мере, 5 или, по меньшей мере, 6 мутаций), выбранную из группы, состоящей из Y1X, L5X, K8X, M51X, K53X, S55X, Q56X, P57X, G59X, M60X, E77X, Q103X, S105X, D110X, N111X, M113X, V153X и N155X, где X обозначает любую аминокислоту. В различных вариантах осуществления, вариант полипептида IL-18 человека или его фрагмент включает, по меньшей мере, 4 мутации, выбранные из группы, состоящей из Y1X, L5X, K8X, M51X, K53X, S55X, Q56X, P57X, G59X, M60X, E77X, Q103X, S105X, D110X, N111X, M113X, V153X и N155X, где X обозначает любую аминокислоту. В различных вариантах осуществления, вариант полипептида IL-18 человека или его фрагмент включает, по меньшей мере, 6 мутаций, выбранных из группы, состоящей из Y1X, L5X, K8X, M51X, K53X, S55X, Q56X, P57X, G59X, M60X, E77X, Q103X, S105X, D110X, N111X, M113X, V153X и N155X. В различных вариантах осуществления, вариант полипептида IL-18 человека или его фрагмент включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3, по меньшей мере, 4, по меньшей мере, 5 или, по меньшей мере, 6 мутаций), выбранную из группы, состоящей из Y1X, L5X, K8X, S55X, Q56X, P57X, G59X, E77X, Q103X, S105X, D110X, N111X, M113X, V153X и N155X.
В некоторых вариантах осуществления, вариант полипептида IL-18 человека или его фрагмент включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3, по меньшей мере, 4, по меньшей мере, 5 или, по меньшей мере, 6 мутаций), выбранную из группы, состоящей из Y1H, Y1R, L5H, L5I, L5Y, K8Q, K8R, M51T, M51K, M51D, M51N, M51E, M51R, K53R, K53G, K53S, K53T, S55K, S55R, Q56E, Q56A, Q56R, Q56V, Q56G, Q56K, Q56L, P57L, P57G, P57A, P57K, G59T, G59A, M60K, M60Q, M60R, M60L, E77D, Q103E, Q103K, Q103P, Q103A, Q103R, S105R, S105D, S105K, S105N, S105A, D110H, D110K, D110N, D110Q, D110E, D110S, D110G, N111H, N111Y, N111D, N111R, N111S, N111G, M113V, M113R, M113T, M113K, V153I, V153T, V153A, N155K и N155H. В некоторых вариантах осуществления, вариант полипептида IL-18 человека включает, по меньшей мере, один вариант полипептида IL-18 или его фрагмент, выбранный из группы, состоящей из hCS1 (SEQ ID NO: 34), hCS2 (SEQ ID NO: 35), hCS3 (SEQ ID NO: 36), hCS4 (SEQ ID NO: 37), hC4 (SEQ ID NO: 38), hA8 (SEQ ID NO: 39), hD6 (SEQ ID NO: 40), hH12 (SEQ ID NO: 41), hB11 (SEQ ID NO: 42), hC3 (SEQ ID NO: 43), hC2 (SEQ ID NO: 44), hG10 (SEQ ID NO: 45), hG1 (SEQ ID NO: 46), hF1 (SEQ ID NO: 47), hD2 (SEQ ID NO: 48), hA1 (SEQ ID NO: 49), hB3 (SEQ ID NO: 50), hB4 (SEQ ID NO: 51), hH3 (SEQ ID NO: 52), hH5 (SEQ ID NO: 53), hH4 (SEQ ID NO: 54), hE1 (SEQ ID NO: 55), hG2 (SEQ ID NO: 56), hB9 (SEQ ID NO: 57), hE12 (SEQ ID NO: 58), hC5 (SEQ ID NO: 59), 5-18 (SEQ ID NO: 73), 5-29 (SEQ ID NO: 74), 5-8 (SEQ ID NO: 75), 5-6 (SEQ ID NO: 76), 5-27 (SEQ ID NO: 77), 5-20 (SEQ ID NO: 78), 5-2 (SEQ ID NO: 79), 5-9 (SEQ ID NO: 80), 5-42 (SEQ ID NO: 81), 5-13 (SEQ ID NO: 82), 5-12 (SEQ ID NO: 83), 5-1 (SEQ ID NO: 84), 5-33 (SEQ ID NO: 85), 5-21 (SEQ ID NO: 86), 6-31 (SEQ ID NO: 87), 6-20 (SEQ ID NO: 88), 6-12 (SEQ ID NO: 89), 6-27 (SEQ ID NO: 90), 6-29 (SEQ ID NO: 91), 5-26 (SEQ ID NO: 191), 5-17 (SEQ ID NO: 192), 5-41 (SEQ ID NO: 193), или его фрагмент.
В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3 или, по меньшей мере, 4 мутации), выбранную из группы, состоящей из M51X, M60X, S105X, D110X и N111X, относительно SEQ ID NO: 30. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает, по меньшей мере, 3 мутации, выбранные из группы, состоящей из M51X, M60X, S105X, D110X и N111X, относительно SEQ ID NO: 30. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3 или, по меньшей мере, 4 мутации), выбранную из группы, состоящей из M51X1, M60X2, S105X3, D110X4 и N111X5, относительно SEQ ID NO: 30, где X1 представляет собой T, K, D, E, R или N; X2 представляет собой K, Q, L или R; X3 представляет собой R, D, K, A или N; X4 представляет собой H, K, N, Q, E, N, S или G; и X5 представляет собой H, D, Y, R, S или G. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает, по меньшей мере, 3 мутации, выбранные из группы, состоящей из M51X1, M60X2, S105X3, D110X4 и N111X5, относительно SEQ ID NO: 30, где X1 представляет собой T, K, D, E, R или N; X2 представляет собой K, Q, L или R; X3 представляет собой R, D, K, A или N; X4 представляет собой H, K, N, Q, E, N, S или G; и X5 представляет собой H, D, Y, R, S или G. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3 или, по меньшей мере, 4 мутации), выбранную из группы, состоящей из M51X1, M60X2, S105X3, D110X4 и N111X5, относительно SEQ ID NO: 30, где X1 представляет собой T или K; X2 представляет собой K или L; X3 представляет собой D, N или A; X4 представляет собой K, N, S или G; и X5 представляет собой H, Y, G или R.
В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает мутации M51X, M60X, S105X, D110X и N111X относительно SEQ ID NO: 30. Например, в некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает мутации M51X1, M60X2, S105X3, D110X4 и N111X5 относительно SEQ ID NO: 30, где X1 представляет собой T, K, D, E, R или N; X2 представляет собой K, Q, L или R; X3 представляет собой R, D, K, A или N; X4 представляет собой H, K, N, Q, E, N, S или G; и X5 представляет собой H, D, Y, R, S или G. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает мутации M51X1, M60X2, S105X3, D110X4 и N111X5 относительно SEQ ID NO: 30, где X1 представляет собой T или K; X2 представляет собой K или L; X3 представляет собой D, N или A; X4 представляет собой K, N, S или G; и X5 представляет собой H, Y, G или R. Другими словами, в некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает мутации {M51T или M51K}; {M60K или M60L}; {S105D, S105N, S105A}; {D110K, D110N, D110S или D110G}; и {N111H, N111Y, N111R или N111G} относительно SEQ ID NO: 30.
В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3 или, по меньшей мере, 4 мутации), выбранную из группы, состоящей из M51X, K53X, Q56X, S105X и N111X, относительно SEQ ID NO: 30. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает, по меньшей мере, 3 мутации, выбранные из группы, состоящей из M51X, K53X, Q56X, S105X и N111X, относительно SEQ ID NO: 30. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3 или, по меньшей мере, 4 мутации), выбранную из группы, состоящей из M51X1, K53X2, Q56X3, S105X4 и N111X5, относительно SEQ ID NO: 30, где X1 представляет собой E, R или K; X2 представляет собой G, S или T; X3 представляет собой E, A, R, V, G, K или L; X4 представляет собой N, S, K или G; и X5 представляет собой R, S, G или D. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает, по меньшей мере, 3 мутации, выбранные из группы, состоящей из M51X1, K53X2, Q56X3, S105X4 и N111X5, относительно SEQ ID NO: 30, где X1 представляет собой E, R или K; X2 представляет собой G, S или T; X3 представляет собой E, A, R, V, G, K или L; X4 представляет собой N, S, K или G; и X5 представляет собой R, S, G или D. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3 или, по меньшей мере, 4 мутации), выбранную из группы, состоящей из M51X1, K53X2, Q56X3, S105X4 и N111X5, относительно SEQ ID NO: 30, где X1 представляет собой K; X2 представляет собой G или S; X3 представляет собой G, R или L; X4 представляет собой S, N или G; и X5 представляет собой G или R.
В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает мутации M51X, K53X, Q56X, S105X и N111X относительно SEQ ID NO: 30. Например, в некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает мутации M51X1, K53X2, Q56X3, S105X4 и N111X5 относительно SEQ ID NO: 30, где X1 представляет собой E, R или K; X2 представляет собой G, S или T; X3 представляет собой E, A, R, V, G, K или L; X4 представляет собой N, S, K или G; и X5 представляет собой R, S, G или D. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает мутации M51X1, K53X2, Q56X3, S105X4 и N111X5 относительно SEQ ID NO: 30, где X1 представляет собой K; X2 представляет собой G или S; X3 представляет собой G, R или L; X4 представляет собой S, N или G; и X5 представляет собой G или R. In other words, В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает мутации {M51K}; {K53G или K53S}; {Q56G, Q56R или Q56L}; {D110S, D110N или D110G}; и {N111R или N111G} относительно SEQ ID NO: 30.
В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, имеющую идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30. В силу этого, в некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3, по меньшей мере, 4, по меньшей мере, 5 или, по меньшей мере, 6 мутаций) относительно дикого типа IL-18 (например, человеческого IL-18).
В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3, по меньшей мере, 4, по меньшей мере, 5 или, по меньшей мере, 6 мутаций), выбранную из группы, состоящей из Y1X, L5X, K8X, M51X, K53X, S55X, Q56X, P57X, G59X, M60X, E77X, Q103X, S105X, D110X, N111X, M113X, V153X и N155X, относительно SEQ ID NO: 30. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает, по меньшей мере, 4 мутации, выбранные из группы, состоящей из Y1X, L5X, K8X, M51X, K53X, S55X, Q56X, P57X, G59X, M60X, E77X, Q103X, S105X, D110X, N111X, M113X, V153X и N155X, относительно SEQ ID NO: 30. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает, по меньшей мере, 6 мутаций, выбранных из группы, состоящей из Y1X, L5X, K8X, M51X, K53X, S55X, Q56X, P57X, G59X, M60X, E77X, Q103X, S105X, D110X, N111X, M113X, V153X и N155X, относительно SEQ ID NO: 30. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3, по меньшей мере, 4, по меньшей мере, 5 или, по меньшей мере, 6 мутаций), выбранную из группы, состоящей из Y1X, L5X, K8X, S55X, Q56X, P57X, G59X, E77X, Q103X, S105X, D110X, N111X, M113X, V153X и N155X, относительно SEQ ID NO: 30.
В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3 или, по меньшей мере, 4 мутации), выбранную из группы, состоящей из M51X, M60X, S105X, D110X и N111X, относительно SEQ ID NO: 30. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает, по меньшей мере, 3 мутации (например, по меньшей мере, 2, по меньшей мере, 3 или, по меньшей мере, 4 мутации) выбранная из группы, состоящей из M51X, M60X, S105X, D110X и N111X, относительно SEQ ID NO: 30. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3 или, по меньшей мере, 4 мутации), выбранную из группы, состоящей из M51X1, M60X2, S105X3, D110X4 и N111X5, относительно SEQ ID NO: 30, где X1 представляет собой T, K, D, E, R или N; X2 представляет собой K, Q, L или R; X3 представляет собой R, D, K, A или N; X4 представляет собой H, K, N, Q, E, N, S или G; и X5 представляет собой H, D, Y, R, S или G. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает, по меньшей мере, 3 мутации, выбранные из группы, состоящей из M51X1, M60X2, S105X3, D110X4 и N111X5, относительно SEQ ID NO: 30, где X1 представляет собой T, K, D, E, R или N; X2 представляет собой K, Q, L или R; X3 представляет собой R, D, K, A или N; X4 представляет собой H, K, N, Q, E, N, S или G; и X5 представляет собой H, D, Y, R, S или G. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3 или, по меньшей мере, 4 мутации), выбранную из группы, состоящей из M51X1, M60X2, S105X3, D110X4 и N111X5, относительно SEQ ID NO: 30, где X1 представляет собой T или K; X2 представляет собой K или L; X3 представляет собой D, N или A; X4 представляет собой K, N, S или G; и X5 представляет собой H, Y, G или R.
В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает мутации M51X, M60X, S105X, D110X и N111X, относительно SEQ ID NO: 30. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает мутации M51X1, M60X2, S105X3, D110X4 и N111X5 относительно SEQ ID NO: 30, где X1 представляет собой T, K, D, E, R или N; X2 представляет собой K, Q, L или R; X3 представляет собой R, D, K, A или N; X4 представляет собой H, K, N, Q, E, N, S или G; и X5 представляет собой H, D, Y, R, S или G. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает мутации M51X1, M60X2, S105X3, D110X4 и N111X5 относительно SEQ ID NO: 30, где X1 представляет собой T или K; X2 представляет собой K или L; X3 представляет собой D, N или A; X4 представляет собой K, N, S или G; и X5 представляет собой H, Y, G или R.
В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3 или, по меньшей мере, 4 мутации), выбранную из группы, состоящей из M51X, K53X, Q56X, S105X и N111X, относительно SEQ ID NO: 30. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает, по меньшей мере, 3 мутации, выбранные из группы, состоящей из M51X, K53X, Q56X, S105X и N111X, относительно SEQ ID NO: 30. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3 или, по меньшей мере, 4 мутации), выбранную из группы, состоящей из M51X1, K53X2, Q56X3, S105X4 и N111X5, относительно SEQ ID NO: 30, где X1 представляет собой E, R или K; X2 представляет собой G, S или T; X3 представляет собой E, A, R, V, G, K или L; X4 представляет собой N, S, K или G; и X5 представляет собой R, S, G или D. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает, по меньшей мере, 3 мутации, выбранные из группы, состоящей из M51X1, K53X2, Q56X3, S105X4 и N111X5, относительно SEQ ID NO: 30, где X1 представляет собой E, R или K; X2 представляет собой G, S или T; X3 представляет собой E, A, R, V, G, K или L; X4 представляет собой N, S, K или G; и X5 представляет собой R, S, G или D. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3 или, по меньшей мере, 4 мутации), выбранную из группы, состоящей из M51X1, K53X2, Q56X3, S105X4 и N111X5, относительно SEQ ID NO: 30, где X1 представляет собой K; X2 представляет собой G или S; X3 представляет собой G, R или L; X4 представляет собой S, N или G; и X5 представляет собой G или R.
В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает мутации M51X, K53X, Q56X, S105X и N111X относительно SEQ ID NO: 30. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает мутации M51X1, K53X2, Q56X3, S105X4 и N111X5 относительно SEQ ID NO: 30, где X1 представляет собой E, R или K; X2 представляет собой G, S или T; X3 представляет собой E, A, R, V, G, K или L; X4 представляет собой N, S, K или G; и X5 представляет собой R, S, G или D. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает мутации M51X1, K53X2, Q56X3, S105X4 и N111X5 относительно SEQ ID NO: 30, где X1 представляет собой K; X2 представляет собой G или S; X3 представляет собой G, R или L; X4 представляет собой S, N или G; и X5 представляет собой G или R.
В различных вариантах осуществления, вариант полипептида IL-18, который связывает и ингибирует IL-18BP, включает вариант полипептида IL-18 человека или его фрагмент, включающий, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3, по меньшей мере, 4, по меньшей мере, 5 или, по меньшей мере, 6 мутаций), выбранную из группы, состоящей из Y1X, L5X, D17X, E31X, T34X, D35X, S36X, D37X, D40X, N41X, M51X, Q56X, M60X, Q103X, H109X, M113X и R131X, где X обозначает любую аминокислоту. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывает и ингибирует IL-18BP, включает вариант полипептида IL-18 человека или его фрагмент, включающий, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3, по меньшей мере, 4, по меньшей мере, 5 или, по меньшей мере, 6 мутаций), выбранную из группы, состоящей из Y1D, Y1F, Y1H, Y1L, L5F, L5H, D17A, D17G, D17R, D17H, E31A, E31T, E31G, E31K, E31R, T34A, T34K T34E, D35S, D35A, D35Y, S36N, S36K, S36R, D37P, D37A, D37R, D37H, D37L, D37V, D40Y D40S, D40A, N41K, N41S, N41R, M51F, M51L, M51I, Q56H, M60L, M60F, M60I, Q103L, Q103I, H109A, H109P, H109D, M113L, M113I, M113F и R131S. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывает и ингибирует IL-18BP, включает вариант полипептида IL-18 человека или его фрагмент, выбранный из группы, состоящей из hD2D-5F12 (SEQ ID NO: 92), hD2D-5F11 (SEQ ID NO: 93), hD2D-5F10 (SEQ ID NO: 94), hD2D-5F08 (SEQ ID NO: 95), hD2D-5F06 (SEQ ID NO: 96), hD2D-5F04 (SEQ ID NO: 97), hD2D-5F02 (SEQ ID NO: 98), hD2D-5F01 (SEQ ID NO: 99), hD2D-5E10 (SEQ ID NO: 100), hD2D-5E08 (SEQ ID NO: 101), hD2D-5E03 (SEQ ID NO: 102), hD2D-5E02 (SEQ ID NO: 103), hD2D-5D10 (SEQ ID NO: 104), hD2D-5D08 (SEQ ID NO: 105), hD2D-5D06 (SEQ ID NO: 106), hD2D-5D05 (SEQ ID NO: 107), hD2D-5D03 (SEQ ID NO: 108), hD2D-5D02 (SEQ ID NO: 109), hD2D-5C10 (SEQ ID NO: 110), hD2D-5C09 (SEQ ID NO: 111), hD2D-5C08 (SEQ ID NO: 112), hD2D-5C05 (SEQ ID NO: 113), hD2D-5C04 (SEQ ID NO: 114), hD2D-5C03 (SEQ ID NO: 115), hD2D-5B11 (SEQ ID NO: 116), hD2D-5B10 (SEQ ID NO: 117), hD2D-5B06 (SEQ ID NO: 118), hD2D-5B05 (SEQ ID NO: 119), hD2D-5B02 (SEQ ID NO: 120), hD2D-5A09 (SEQ ID NO: 121), hD2D-5A02 (SEQ ID NO: 122), hD2D-CS1 (SEQ ID NO: 123), hD2D-CS2 (SEQ ID NO: 124), hD2D-CS3 (SEQ ID NO: 125), или его фрагмент.
В некоторых случаях, предлагаемый вариант D2D-IL-18 или его фрагмент включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3 или, по меньшей мере, 4 мутации), выбранную из группы, состоящей из D17X, E30X и Q103X, относительно SEQ ID NO: 30. В некоторых случаях, предлагаемый вариант D2D-IL-18 или его фрагмент включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3 или, по меньшей мере, 4 мутации), выбранную из группы, состоящей из D17X1, E30X2 и Q103X3, относительно SEQ ID NO: 30, где X1 представляет собой G, H, R или A; X2 представляет собой A, T, G, K или R; и X3 представляет собой I или L. В некоторых случаях, предлагаемый вариант D2D-IL-18 или его фрагмент включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3 или, по меньшей мере, 4 мутации), выбранную из группы, состоящей из D17G, E30A и (Q103L или Q103I).
В некоторых случаях, предлагаемый вариант D2D-IL-18 или его фрагмент включает мутации D17X, E30X и Q103X относительно SEQ ID NO: 30. Например, в некоторых случаях, предлагаемый вариант D2D-IL-18 или его фрагмент включает мутации D17X1, E30X2 и Q103X3 относительно SEQ ID NO: 30, где X1 представляет собой G, H, R или A; X2 представляет собой A, T, G, K или R; и X3 представляет собой I или L. В некоторых случаях, предлагаемый вариант D2D-IL-18 или его фрагмент включает мутации D17G, E30A и (Q103L или Q103I).
В некоторых случаях, предлагаемый вариант D2D-IL-18 или его фрагмент включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3 или, по меньшей мере, 4 мутации), выбранную из группы, состоящей из D17X, E30X, D35X, M51X и Q103X, относительно SEQ ID NO: 30. В некоторых случаях, предлагаемый вариант D2D-IL-18 или его фрагмент включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3 или, по меньшей мере, 4 мутации), выбранную из группы, состоящей из D17X1, E30X2, D35X3, M51X4 и Q103X3, относительно SEQ ID NO: 30, где X1 представляет собой G, H, R или A; X2 представляет собой A, T, G, K или R; X3 представляет собой S, A или Y; X4 представляет собой F, I или L; и X5 представляет собой I или L. В некоторых случаях, предлагаемый вариант D2D-IL-18 или его фрагмент включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3 или, по меньшей мере, 4 мутации), выбранную из группы, состоящей из D17G, E30A, D35S, M51F и (Q103L или Q103I), относительно SEQ ID NO: 30.
В некоторых случаях, предлагаемый вариант D2D-IL-18 или его фрагмент включает мутации D17X, E30X, D35X, M51X и Q103X относительно SEQ ID NO: 30. Например, в некоторых случаях, предлагаемый вариант D2D-IL-18 или его фрагмент включает мутации D17X1, E30X2, D35X3, M51X4 и Q103X3 относительно SEQ ID NO: 30, где X1 представляет собой G, H, R или A; X2 представляет собой A, T, G, K или R; X3 представляет собой S, A или Y; X4 представляет собой F, I или L; и X5 представляет собой I или L. В некоторых случаях, предлагаемый вариант D2D-IL-18 или его фрагмент включает мутации D17G, E30A, D35S, M51F и (Q103L или Q103I) относительно SEQ ID NO: 30.
В некоторых случаях, предлагаемый вариант D2D-IL-18 или его фрагмент включает аминокислотную последовательность, имеющую идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30. Соответственно, в некоторых случаях, предлагаемый вариант D2D-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3, по меньшей мере, 4, по меньшей мере, 5 или, по меньшей мере, 6 мутаций) относительно дикого типа IL-18 (например, человеческого IL-18).
В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3, по меньшей мере, 4, по меньшей мере, 5 или, по меньшей мере, 6 мутаций), выбранную из группы, состоящей из Y1X, L5X, D17X, E31X, T34X, D35X, S36X, D37X, D40X, N41X, M51X, Q56X, M60X, Q103X, H109X, M113X и R131X.
В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3, по меньшей мере, 4, по меньшей мере, 5 или, по меньшей мере, 6 мутаций), выбранную из группы, состоящей из D17X, E30X и Q103X, относительно SEQ ID NO: 30. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3, по меньшей мере, 4, по меньшей мере, 5 или, по меньшей мере, 6 мутаций), выбранную из группы, состоящей из D17X1, E30X2 и Q103X3, относительно SEQ ID NO: 30, где X1 представляет собой G, H, R или A; X2 представляет собой A, T. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3, по меньшей мере, 4, по меньшей мере, 5 или, по меньшей мере, 6 мутаций), выбранную из группы, состоящей из D17G, E30A и (Q103L или Q103I).
В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает мутации D17X, E30X и Q103X относительно SEQ ID NO: 30. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает мутации D17X1, E30X2 и Q103X3 относительно SEQ ID NO: 30, где X1 представляет собой G, H, R или A; X2 представляет собой A, T. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает мутации D17G, E30A и (Q103L или Q103I).
В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3, по меньшей мере, 4, по меньшей мере, 5 или, по меньшей мере, 6 мутаций), выбранную из группы, состоящей из D17X, E30X, D35X, M51X и Q103X, относительно SEQ ID NO: 30. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3, по меньшей мере, 4, по меньшей мере, 5 или, по меньшей мере, 6 мутаций), выбранную из группы, состоящей из D17X1, E30X2, D35X3, M51X4 и Q103X3, относительно SEQ ID NO: 30, где X1 представляет собой G, H, R или A; X2 представляет собой A, T, G, K или R; X3 представляет собой S, A или Y; X4 представляет собой F, I или L; и X5 представляет собой I или L. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3, по меньшей мере, 4, по меньшей мере, 5 или, по меньшей мере, 6 мутаций), выбранную из группы, состоящей из D17G, E30A, D35S, M51F и (Q103L или Q103I), относительно SEQ ID NO: 30.
В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает мутации D17X, E30X, D35X, M51X и Q103X относительно SEQ ID NO: 30. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает мутации D17X1, E30X2, D35X3, M51X4 и Q103X3 относительно SEQ ID NO: 30, где X1 представляет собой G, H, R или A; X2 представляет собой A, T, G, K или R; X3 представляет собой S, A или Y; X4 представляет собой F, I или L; и X5 представляет собой I или L. В некоторых случаях, предлагаемый вариант DR-IL-18 или его фрагмент включает аминокислотную последовательность, которая (i) имеет идентичность 85% или более (например, 90% или более, 92% или более, 93% или более, 94% или более, 95% или более, 96% или более, 97% или более, 98% или более, или 99% или более) с аминокислотной последовательностью дикого типа IL-18 человека, представленной как SEQ ID NO: 30; и (ii) включает мутации D17G, E30A, D35S, M51F и (Q103L или Q103I) относительно SEQ ID NO: 30.
В некоторых вариантах осуществления, композицию по изобретению вводят в мышиную клетку, ткань органа, систему или субъекту для лечения или предотвращения заболевания или нарушения. В некоторых вариантах осуществления, мышиный вариант полипептида IL-18 или его фрагмент вводят в клетку, ткань органа, систему или субъекту (например, в человеческую клетку, ткань органа, систему или субъекту). В некоторых вариантах осуществления, нуклеиновую кислоту (например, ДНК, кДНК, мРНК, etc.) кодирующую, по меньшей мере, один мышиный вариант полипептида IL-18 вводят в клетку, ткань органа, систему или субъекту.
В некоторых вариантах осуществления, мышиный вариант полипептида IL-18 или его фрагмент включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3, по меньшей мере, 4, по меньшей мере, 5 или, по меньшей мере, 6 мутаций), выбранную из группы, состоящей из N1X, M50X, Y51X, K52X, S54X, E55X, V56X, R57X, G58X, L59X, R104X, N109X и L151X, где X обозначает любую аминокислоту. В некоторых вариантах осуществления, мышиный вариант полипептида IL-18 или его фрагмент включает, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3, по меньшей мере, 4, по меньшей мере, 5 или, по меньшей мере, 6 мутаций), выбранную из группы, состоящей из N1H, N1Y, M50A, M50S, M50V, M50G, M50T, Y51R, K52V, K52S, K52T, K52G, K52A, S54R, S54K, S54G, S54N, E55R, E55H, E55N, E55D, E55G, V56L, V56M, V56R, V56A, V56S, V56Q, R57G, R57K, G58A, L59K, L59R, L59V, R104K, R104L, R104Q, R104S, N109D и L151V. В некоторых вариантах осуществления, мышиный вариант полипептида IL-18 включает, по меньшей мере, один вариант, выбранный из группы, состоящей из mCS1 (SEQ ID NO: 60), mCS2 (SEQ ID NO: 61), mC1 (SEQ ID NO: 62), mA12 (SEQ ID NO: 63), mE8 (SEQ ID NO: 64), mC10 (SEQ ID NO: 65), mB7 (SEQ ID NO: 66), mB1 (SEQ ID NO: 67), mD1 (SEQ ID NO: 68), mH7 (SEQ ID NO: 69), mA7 (SEQ ID NO: 70), mE1 (SEQ ID NO: 71) и mH3 (SEQ ID NO: 72), или его фрагмента.
В некоторых вариантах осуществления, вариант полипептида IL-18, который связывает и ингибирует IL-18BP, включает мышиный вариант полипептида IL-18, включающий, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3, по меньшей мере, 4, по меньшей мере, 5 или, по меньшей мере, 6 мутаций) выбранную из группы, состоящей из N1X, L5X, D17X, E30X, T33X, D34X, I35X, D36X, M50X, Q102X, R104, H108X, N109X, M111X, D129X и D130X, где X обозначает любую аминокислоту. В некоторых вариантах осуществления, вариант полипептида IL-18, который связывает и ингибирует IL-18BP, включает мышиный вариант полипептида IL-18 или его фрагмент, включающий, по меньшей мере, одну мутацию (например, по меньшей мере, 2, по меньшей мере, 3, по меньшей мере, 4, по меньшей мере, 5 или, по меньшей мере, 6 мутаций), выбранную из группы, состоящей из N1Y, N1D, N1H, N1L, N1F, N1V, N1I, L5Y, L5H, D17Q, D17G, D17A, D17E, D17S, D17N, E30A, E30R, E30K, E30T, E30G, T33G, T33A, T33E, T33R, T33K, D34Y, D34S, D34A, I35T, I35K, I35R, D36V, D36A, D36G, D36H, D36P, D36R, D36L, M50F, M50L, Q102L, Q102I, R104E, R104A, R104P, R104G, R104Q, R104H, H108D, H108A, N109R, N109S, N109T, N109I, M111L, M111I, D129A, D129F, D129V, D129Y, D129S, D130E, D130T, D130G, D130N, D130R, D130S, D130Q и D130H. Вариант полипептида IL-18, который связывает и ингибирует IL-18BP, включает мышиный вариант полипептида IL-18 или его фрагмент, выбранный из группы, состоящей из mD2D-A5 (SEQ ID NO: 126), mD2D-A6 (SEQ ID NO: 127), mD2D-A7 (SEQ ID NO: 128), mD2D-A8 (SEQ ID NO: 129), mD2D-A9 (SEQ ID NO: 130), mD2D-A11 (SEQ ID NO: 131), mD2D-A12 (SEQ ID NO: 132), mD2D-B4 (SEQ ID NO: 133), mD2D-B7 (SEQ ID NO: 134), mD2D-B11 (SEQ ID NO: 135), mD2D-B12 (SEQ ID NO: 136), mD2D-C1 (SEQ ID NO: 137), mD2D-C3 (SEQ ID NO: 138), mD2D-C5 (SEQ ID NO: 139), mD2D-C6 (SEQ ID NO: 140), mD2D-C9 (SEQ ID NO: 141), mD2D-C10 (SEQ ID NO: 142), mD2D-C11 (SEQ ID NO: 143), mD2D-D1 (SEQ ID NO: 144), mD2D-D9 (SEQ ID NO: 145), mD2D-D12 (SEQ ID NO: 146), mD2D-E3 (SEQ ID NO: 147), mD2D-E4 (SEQ ID NO: 148), mD2D-E5 (SEQ ID NO: 149), mD2D-E7 (SEQ ID NO: 150), mD2D-E8 (SEQ ID NO: 151), mD2D-E9 (SEQ ID NO: 152), mD2D-E10 (SEQ ID NO: 153), mD2D-E11 (SEQ ID NO: 154), mD2D-E12 (SEQ ID NO: 155), mD2D-F3 (SEQ ID NO: 156), mD2D-F4 (SEQ ID NO: 157), mD2D-F5 (SEQ ID NO: 158), mD2D-F7 (SEQ ID NO: 159), mD2D-F8 (SEQ ID NO: 160), mD2D-F9 (SEQ ID NO: 161), mD2D-G1 (SEQ ID NO: 162), mD2D-G7 (SEQ ID NO: 163), mD2D-G9 (SEQ ID NO: 164), mD2D-H7 (SEQ ID NO: 165), mD2D-E1 (SEQ ID NO: 166), mD2D-G8 (SEQ ID NO: 167), mD2D-H3 (SEQ ID NO: 168), mD2D-A10 (SEQ ID NO: 169), mD2D-H1 (SEQ ID NO: 170), mD2D-F12 (SEQ ID NO: 171), mD2D-G10 (SEQ ID NO: 172), mD2D-G12 (SEQ ID NO: 173), mD2D-E2 (SEQ ID NO: 174), mD2D-G11 (SEQ ID NO: 175), mD2D-C4 (SEQ ID NO: 176), mD2D-F11 (SEQ ID NO: 177), mD2D-C2 (SEQ ID NO: 178), mD2D-F10 (SEQ ID NO: 179), mD2D-A2 (SEQ ID NO: 180), mD2D-F6 (SEQ ID NO: 181), mD2D-A1 (SEQ ID NO: 182), mD2D-E6 (SEQ ID NO: 183), mD2D-D4 (SEQ ID NO: 184), mD2D-D6 (SEQ ID NO: 185), mD2D-A3 (SEQ ID NO: 186), mD2D-A4 (SEQ ID NO: 187), mD2D-B10 (SEQ ID NO: 188), mD2D-B8 (SEQ ID NO: 189), mD2D-B9 (SEQ ID NO: 190), или его фрагмент.
В некоторых вариантах осуществления, способ включает введение молекулы выделенной нуклеиновой кислоты, кодирующей один или более вариантов пептида IL-18, описанных выше, субъекту, в клетку или ткань.
Для любого специалиста в данной области должно быть очевидным, что повышение уровня активации сигнального пути IL-18 через IL-18R включает повышение количества IL-18 или варианта полипептида IL-18, доступного для связывания и активации IL-18R. Это может быть осуществлено путем повышения уровня или активации IL-18, которое включает, но этим не ограничивая, прямое или косвенное введение IL-18, прямое или косвенное введение варианта полипептида IL-18 и прямое или косвенное введение ингибитора IL-18BP, а также увеличение транскрипции, трансляции, или и того и другого, нуклеиновой кислоты, кодирующей IL-18 или вариант полипептида IL-18; и это также включает повышение любой активности IL-18, также как и варианта полипептида IL-18.
Повышение уровня активации сигнального пути IL-18, в том числе, путем использования варианта полипептида IL-18, может быть оценено разнообразными методами, включающими методы, описанные в изобретении, а также методы, которые известны в данной области или будут разработаны в будущем. То есть, после ознакомления с описанием изобретения, для обычного специалиста в данной области должно быть очевидным, что повышение уровня и активности сигнального пути IL-18 может быть легко оценено с помощью методов, которые позволяют оценивать уровень нуклеиновой кислоты (например, мРНК), кодирующей IL-18 или вариант полипептида IL-18 или его фрагмент, уровень IL-18 или варианта полипептида IL-18 или фрагмента полипептида и/или уровень активности IL-18 или варианта полипептида IL-18 или фрагмента в биологическом образце, взятом у субъекта.
После ознакомления с описанием настоящего изобретения, для любого специалиста в данной области должно быть очевидным, что изобретение может применяться в отношении субъектов, которые, в целом (например, системно) или частично (например, местно, на уровне клеток, ткани органа), подвергаются в настоящий момент или будет подвергаться лечению заболевания или нарушения, при котором повышение активности сигнального пути IL-18 может давать положительный эффект. На основе представленных в изобретении идей, для специалиста в данной области должно быть очевидным, что заболевания и нарушения, подвергаемые лечению с помощью композиций и способов, описанных в изобретении, включают любое заболевание или нарушение, при котором повышение активности сигнального пути IL-18 будет усиливать положительный биологический, физиологический, клинический или терапевтический результат.
Для любого специалиста в данной области должно быть очевидным, что помимо непосредственного повышения активности сигнального пути IL-18, уменьшение количества или активности молекулы, которая сама по себе уменьшает количество или активность сигнального пути IL-18, может быть использовано для повышения количества IL-18 или активности сигнального пути IL-18. Поэтому, активатор активности IL-18 может включать, но этим не ограничивая, химическое соединение, белок, пептидомиметик, антитело, рибозим и молекулу антисмысловой нуклеиновой кислоты. На основе ознакомления с описанием изобретения, для любого специалиста в данной области должно быть очевидным, что активатор активности IL-18 включает соединение, которое повышает уровень активации сигнального пути IL-18. Кроме того, активатор активности IL-18 включает соединение, которое ингибирует уровень или активность молекулы, которая сама по себе снижает количество IL-18 или активацию сигнального пути IL-18 (то есть IL-18BP). В настоящем изобретении предлагаются антагонисты IL-18BP, которые включают (но этим не ограничивая) моноклональные антитела, низкомолекулярные терапевтические средства, которые нейтрализовывают IL-18BP, и сконструированный вариант IL-18, который связывается с IL-18BP, но который практически не связывается или не взаимодействует с IL-18R, и в результате ингибирования IL-18BP таким способом, активность эндогенно-продуцированного IL-18 повышается вследствие дисингибирования (растормаживания).
После ознакомления с идеями, изложенными в описании изобретения, для специалиста в данной области должно быть также очевидным, что повышение уровня активации сигнального пути IL-18 включает повышение уровня IL-18 или активации IL-18 (например, активности связывания с рецептором, активности сигнального пути рецептора, и так далее). Поэтому, повышение уровня или активности сигнального пути IL-18 включает, но этим не ограничивая, повышение количества доступного полипептида IL-18 или варианта полипептида IL-18, повышение транскрипции, трансляции, или и того и другого, нуклеиновой кислоты, кодирующей полипептид IL-18 или вариант полипептида IL-18; и оно также включает повышение любой активности полипептида IL-18 или также варианта полипептида IL-18. Активатор активности IL-18 в композициях и способах по изобретению может селективно активировать сигнальный путь IL-18, или может активировать как сигнальный путь IL-18, так и сигнальный путь другой молекулы. Поэтому, настоящее изобретение относится к введению активатора активности IL-18, рекомбинантного активатора активности полипептида IL-18, активатора активности полипептидного фрагмента L-18 или активатора экспрессии или активности компонента сигнального пути IL-18.
Кроме того, после ознакомления с описанием этого изобретения и с приведенными примерами, для любого специалиста в данной области должно быть очевидным, что активатор активности IL-18 включает активаторы, которые будут созданы в будущем на основе хорошо известных в области фармакологии критериев, таких как физиологические результаты активации сигнального пути IL-18, описанные подробно в изобретении и/или известные в данной области. Поэтому, настоящее изобретение никоим образом не ограничивается любым конкретным активатором активности IL-18, приведенным в качестве примера или описанным в изобретении; и более того, изобретение включает активаторы, известные в данной области или созданные в будущем, которые по мнению специалистов в данной области могут применяться.
Кроме того, обычным специалистам в данной области хорошо известны методы идентификации и получения активатора активности IL-18, включающие, но этим не ограничивая, получение активатора из природного источника (например, Streptomyces sp., Pseudomonas sp., Stylotella aurantium, и так далее). В качестве варианта, активатор активности IL-18 может быть синтезирован химическими путем. Кроме того, после ознакомления с приведенными в настоящем изобретении идеями, для обычного специалиста в данной области должно быть очевидным, что, активатор активности IL-18 может быть получен из рекомбинантного организма. Композиции и методы для химического синтеза активатора активности IL-18 и для получения их из природных источников, хорошо известны и описаны в данной области.
Для любого специалиста в данной области является очевидным, что активатор может быть введен в виде низкомолекулярного химического соединения, полипептида, конструкции нуклеиновой кислоты, кодирующей полипептид, или их комбинаций. Хорошо известны многочисленные векторы и другие композиции и методы для введения полипептида или нуклеиновой кислоты, кодирующей полипептид, в клетки или в ткани. Поэтому изобретение включает способ введения полипептида или нуклеиновой кислоты, кодирующей полипептид, которые являются активатором сигнального пути IL-18 (Sambrook et al., 2012, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory, New York; Ausubel et al., 1997, Current Protocols in Molecular Biology, John Wiley & Sons, New York).
Для любого специалиста в данной области должно быть очевидным, что снижение количества или активность молекулы, которая сама по себе снижает количество или активность сигнального пути IL-18, может быть использовано для повышения количества или активности сигнального пути IL-18 (например, IL-18BP). Антисмысловые олигонуклеотиды представляют собой молекулы ДНК или РНК, которые являются комплементарными с некоторой частью молекулы мРНК. При присутствии в клетки, антисмысловые олигонуклеотиды гибридизируются с существующей молекулой мРНК и ингибируют трансляцию в продукт гена. В данной области хорошо известно ингибирование экспрессии гена с использованием антисмыслового олигонуклеотида (Marcus-Sekura, 1988, Anal. Biochem. 172:289) в качестве методов экспрессии антисмыслового олигонуклеотида в клетке (Inoue, U.S. Pat. No. 5190931). Способы по изобретению включают применение антисмыслового олигонуклеотида для снижения количества молекулы, которая снижает количество или активность сигнального пути IL-18, в результате чего повышается количество или активность сигнального пути IL-18. В настоящем изобретении предлагаются антисмысловые олигонуклеотиды, которые синтезируют и доставляют в клетку с помощью методов, которые хорошо известны обычным специалистам в данной области. В качестве примера, может быть синтезирован антисмысловой олигонуклеотид с длиной в диапазоне от приблизительно 10 до приблизительно 100, более предпочтительно, от приблизительно 15 до приблизительно 50 нуклеотидов. Синтез молекул нуклеиновой кислоты хорошо известен в качестве синтеза модифицированных антисмысловых олигонуклеотидов для повышения их биологической активности по сравнению с немодифицированными антисмысловыми олигонуклеотидами (Tullis, 1991, U.S. Pat. No. 5023243).
Аналогично, экспрессия гена может быть ингибирована путем гибридизации антисмысловой молекулы с промотором или другим регуляторным элементом гена, тем самым оказывая воздействие на транскрипцию гена. Методы идентификации промотора или другого регуляторного элемента, который взаимодействует с представляющим интерес геном, хорошо известны в данной области и включают такие методы, как дрожжевая двугибридная система (Bartel and Fields, eds., In: The Yeast Two Hybrid System, Oxford University Press, Cary, N.C.).
В качестве варианта, ингибирование экспрессии генов белками, которая снижает уровень или активность сигнального пути IL-18, может быть осуществлено путем использования рибозима. Использование рибозимов для ингибирования экспрессии гена хорошо известно специалистам в данной области (смотрите, например, Cech et al., 1992, J. Biol. Chem. 267:17479; Hampel et al., 1989, Biochemistry 28: 4929; Altman et al., U.S. Pat. No. 5168053). Рибозимы представляют собой молекулы каталитической РНК, обладающие способностью расщеплять другие молекулы одноцепочечной РНК. Известно, что рибозимы обладают специфичностью к последовательностям и, поэтому, могут быть модифицированы для распознавания специфической нуклеотидной последовательности (Cech, 1988, J. Amer. Med. Assn. 260:3030), что позволят селективно расщеплять специфические молекулы мРНК. При наличии нуклеотидной последовательности молекулы, обычный специалист в данной области может синтезировать антисмысловой олигонуклеотид или рибозим без проведения излишних экспериментов, руководствуясь настоящим изобретением и включенными в него ссылками.
Для любого специалиста в данной области является очевидным, что активатор активности IL-18, такой как вариант полипептида IL-18 или его фрагмент, или нуклеиновая кислота (например, ДНК, кДНК, мРНК, и так далее), кодирующая вариант полипептида IL-18 или его фрагмент, может быть введен по отдельности или в любой его комбинации.
Для любого специалиста в данной области также является очевидным, что введение может быть краткосрочным (например, в течение короткого периода времени, такого как сутки, неделя или месяц) или постоянным (например, в течение длительного периода времени, такого как несколько месяцев или год или более). Кроме того, активатор активности IL-18, такой как вариант полипептида IL-18 или его фрагмент или нуклеиновая кислота (например, ДНК, кДНК, мРНК, и так далее), кодирующая вариант полипептида IL-18 или его фрагмент, может быть введен по отдельности или в любой комбинации с другими лекарственными средствами применительно ко времени, в которое они могут быть введены, одновременно, до и/или после друг друга. Для любого специалиста в данной области является очевидным, исходя из приведенного описания изобретения, что активатор активности IL-18, активатор активности полипептида IL-18, рекомбинантный активатор активности полипептида IL-18 или активатор активности фрагмента полипептида IL-18 может применяться по отдельности или в любой комбинации с другим активатором активности IL-18, активатором активности полипептида IL-18, рекомбинантным активатором активности полипептида IL-18 или активатором активности фрагмента полипептида IL-18 с целью достижения терапевтического результата.
После ознакомления с описанием настоящего изобретения и, в том числе, с подробно описанными способами, для любого специалиста в данной области должно быть очевидным, что изобретение не ограничивается лечением заболевания или нарушения, наличие которого уже установлено. В частности, симптомы заболевания или нарушения не обязательно должны проявиться с нанесением ущерба здоровью субъекта; напротив, заболевание или нарушение необязательно должно быть выявлено у субъекта до начала лечения. То есть, значительная патология в результате заболевания или нарушения не должна возникать, прежде чем применение настоящего изобретения может дать положительный эффект. Поэтому, описанное очень подробно настоящее изобретение включает способ предотвращения заболевания или нарушения у субъекта, в котором субъекту может быть введен активатор активности молекулы IL-18 (например, полипептида, пептида, и так далее) или активатор активности IL-18, описанный в изобретении, до начала возникновения заболевания или нарушения, в результате чего предотвращается развитие заболевания или нарушения.
Изобретение включает введение активатора активности IL-18, активатора активности полипептида IL-18, сигнального пути рекомбинантного полипептида IL-18 или активации сигнального пути фрагмента полипептида IL-18 для осуществления способов по изобретению; после ознакомления с описанием настоящего изобретения, специалисту в данной области должно быть очевидным, как приготовить и вводить соответствующий активатор активности IL-18, активатор активности полипептида IL-18, сигнального пути рекомбинантного полипептида IL-18 или активности сигнального пути фрагмента IL-18 субъекту. Однако, настоящее изобретение не ограничивается каким-либо конкретным способом введения или схемой лечения. Это особенно верно в тех случаях, когда для любого специалиста в данной области является очевидным, в результате ознакомления с описанием изобретения, включающим применение на практике использование признанной в данной области модели заболевания, что способы введения активатора активности IL-18, сигнального пути полипептида IL -18, сигнального пути рекомбинантного полипептида IL-18 или сигнального пути фрагмента полипептида IL-18 могут быть определены любым специалистом в области фармакологии.
В некоторых вариантах осуществления, способ включает введение субъекту, нуждающемуся в этом, композиции, включающей, по меньшей мере, один вариант полипептида IL-18, и введение субъекту композиции, включающей дополнительное лекарственное средство. В одном таком варианте осуществления, дополнительное лекарственное средство включает иммунотерапевтическое средство, включающее, по меньшей мере, иммунотерапевтическое средство, выбранное из группы, включающей, но этим не ограничивая, измененные Т-клетки, Т-клетки с химерным антигенным рецептором (CAR-T), бронированные CAR-T клетки, вирус, антиген, вакцину, антитело, ингибитор иммунных контрольных точек, малую молекулу, химиотерапевтическое средство и стволовые клетки. В некоторых вариантах осуществления, композиция, включающая, по меньшей мере, один вариант полипептида IL-18, применяется в способе повышения активности иммунной системы до, в процессе или после бактериальной инфекции, вирусной инфекции или инфицирования другим патогеном. В некоторых вариантах осуществления, композиция, включающая, по меньшей мере, один вариант полипептида IL-18, применяется в способе повышения числа и/или активности иммуноцитов in vitro, in vivo или ex vivo, например, числа и/или активности T-клеток, NK-клеток и/или миелоидных клеток.
В некоторых вариантах осуществления, дополнительное лекарственное средство включает ингибитор одного или более цитокинов. В некоторых вариантах осуществления, ингибитор одного или более цитокинов включает химическое соединение, белок, пептид, пептидомиметик, антитело, рибозим, низкомолекулярное химическое соединение или молекулу антисмысловой нуклеиновой кислоты (например, миРНК, микроРНК, и так далее), которое ингибирует экспрессию, активность, или и то и другое, одного или более цитокинов. В некоторых вариантах осуществления, ингибитор ингибирует экспрессию, активность, или и то и другое, IL-17, IL-5 или IL-3. В некоторых вариантах осуществления, введение ингибитора цитокина снижает токсичность. В некоторых вариантах осуществления, введение ингибитора цитокина повышает активность вводимого варианта полипептида IL-18 или ингибитора IL-18BP.
Используемый в изобретении термин "фармацевтически приемлемый носитель" обозначает химическую композицию, с которой может быть объединен ее соответствующий модулятор активации сигнального пути IL-18, и которая, после объединения, может быть использована в качестве средства для введения ее соответствующего модулятора активации сигнального пути IL-18 субъекту.
Наборы
Настоящее изобретение также относится к наборам, применяемым в способах по изобретению. Такие наборы включают различные комбинации компонентов, применяемых в любом из описанных в изобретении способов, включая например, активатор активности IL-18, такой как вариант полипептида IL-18 и/или ингибитор IL-18BP, и/или материалы для количественного анализа варианта полипептида IL-18 или нуклеиновой кислоты варианта IL-18, и/или материалов для оценки активности варианта полипептида IL-18 или нуклеиновой кислоты варианта IL-18, и/или инструктивный материал. Например, в некоторых вариантах осуществления, набор включает компоненты, применяемые для количественного определения нуклеиновой кислоты варианта IL-18 в биологическом образце. В другом варианте осуществления, набор включает компоненты, применяемые для количественного определения варианта полипептида IL-18 в биологическом образце. В еще одном варианте осуществления, набор включает компоненты, применяемые для оценки активности (например, ферментативной активности, активности связывания с лигандом, и так далее) варианта полипептида IL-18 в биологическом образце.
В еще одном варианте осуществления, набор включает компоненты для проведения мониторинга эффективности лечения субъекта, нуждающегося в этом, содержащие инструктивный материал и компоненты для определения того, осуществляется ли модулирование уровня активации сигнального пути IL-18 в биологическом образце, взятом у субъекта, в процессе или после проведения лечения. В различных вариантах осуществления, для определения того, осуществляется ли модулирование уровня активации сигнального пути IL-18 в биологическом образце, взятом у субъекта, уровень активации сигнального пути IL-18 сравнивают с уровнем, по меньшей мере, одного сравнительного контроля, содержащегося в наборе, такого как положительный контроль, отрицательный контроль, исторический контроль, историческая норма или уровень другой референсной молекулы в биологическом образце. В конкретных вариантах осуществления, в качестве помощи при проведении мониторинга лечения, определяют отношение активации сигнального пути IL-18 и референсной молекулы.
Фармацевтические композиции и их введение
Композиции, включающие описанные в изобретении полипептид, фрагмент полипептида, активатор уровня или активности сигнального пути IL-18 или ингибитор уровня или активности IL-18BP, могут быть приготовлены и введены субъекту, как это описано в изобретении. В качестве неограничивающих примеров, композиция, идентифицируемая в качестве активатора активности IL-18, включающего варианты полипептида IL-18, рекомбинантные варианты полипептида IL-18 и активные фрагменты вариантов полипептида IL-18, для лечения и/или предотвращения заболевания или нарушения, может быть приготовлена и введена субъекту, как это описано в изобретении. В качестве дополнительных неограничивающих примеров, композиция, идентифицируемая в качестве применяемого ингибитора IL-18BP, включающего химическое соединение, белок, пептид, пептидомиметик, антитело, рибозим, низкомолекулярное химическое соединение, молекулу антисмысловой нуклеиновой кислоты (например, миРНК, микроРНК, и так далее), для лечения и/или предотвращения заболевания или нарушения, может быть приготовлена и введена субъекту, как это описано в изобретении.
Изобретение включает приготовление и применение фармацевтических композиций, включающих композицию, применяемую для лечения или предотвращения описанного в изобретении заболевания или нарушения, в качестве активного ингредиента. Такая фармацевтическая композиция может состоять только из одного активного ингредиента в форме, подходящей для введения субъекту, или фармацевтическая композиция может включать активный ингредиент и один или более фармацевтически приемлемых носителей, один или более дополнительных ингредиентов, или некоторые комбинации и них. Активный ингредиент может присутствовать в фармацевтической композиции в форме физиологически приемлемого эфира или соли, например, в комбинации с физиологически приемлемым катионом или анионом, как это известно в данной области. В различных вариантах осуществления, активный ингредиент представляет собой описанные в изобретении полипептид, фрагмент полипептида, активатор уровня сигнального пути или активности IL-18, ингибитор уровня или активности IL-18BP или их комбинацию.
Используемый в изобретении термин "фармацевтически приемлемый носитель" обозначает химическую композицию, с которой может быть объединен ее соответствующий модулятор активации сигнального пути IL-18, и которая, после объединения, может быть использована в качестве средства для введения ее соответствующего модулятора (например, активатора, ингибитора, и так далее) субъекту.
В некоторых вариантах осуществления, фармацевтические композиции могут включать крупные, медленно метаболизирующиеся макромолекулы, такие как белки, полисахариды, такие как хитозан, полимолочные кислоты, полигликолиевые кислоты и сополимеры (такие как функционализированная латексом сефарозаTM, арагоза, целлюлоза и другие подобные), полимерные аминокислоты, сополимеры аминокислот и липидные агрегаты (такие как капли масла или липосомы).
Фармацевтические композиции, используемые для применения изобретения на практике, могут быть введены для доставки дозы в диапазоне от приблизительно 0,1 нг/кг/сутки до 100 мг/кг/сутки или более.
В различных вариантах осуществления, фармацевтические композиции, применяемые в способах по изобретению, могут быть введены, например, системно, парентерально или местно, например, в пероральных лекарственных формах, в ингаляционных лекарственных формах, включающих твердую или аэрозольную формы, и в лекарственных формах для местного применения или в других аналогичных формах. Помимо соответствующей терапевтической композиции, такие фармацевтические композиции могут содержать фармацевтически приемлемые носители и другие известные ингредиенты для более эффективного или более удобного введения лекарственного средства. Другие возможные формы, такие как наночастицы, липосомы, другие препараты, содержащие активный ингредиент, и иммунологические системы могут быть также использованы для введения соответствующего модулятора в соответствии со способами по изобретению.
Носитель может нести на себе предлагаемое средство (например, вариант полипептида IL-18) различными способами, включая ковалентное связывание либо непосредственное, либо через линкерную группу, и нековалетные ассоциации. Подходящие носители, образующие ковалентную связь, включают белки, такие как альбумины, пептиды, и полисахариды, такие как аминодекстран, каждый из которых имеет много сайтов для присоединения фрагментов. Носитель может также нести на себе вариант полипептида IL-18 в результате образования нековалентных ассоциаций, таких как нековалентное связывание, или в результате инкапсулирования. Применительно к целям настоящего изобретения, растворитель может быть растворимым или нерастворимым.
Приемлемые носители, вспомогательные вещества или стабилизаторы являются нетоксичными для реципиентов при используемых дозах и концентрациях, и они включают буферы, такие как фосфат, цитрат и другие органические кислоты; антиоксиданты, в том числе аскорбиновую кислоту и метионин; консерванты, такие как окстадецилдиметилбензиламмония хлорид; гексаметония хлорид; бензалкония хлорид, бензетония хлорид; фенол, бутиловый или бензиловый спирт; алкилпарабены, такие как метил- или пропилпарабен; катехин; резорцин; циклогексанол; 3-пентанол; и м-крезол); низкомолекулярные (менее чем приблизительно 10 остатков) полипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутамин, аспарагин, гистидин, аргинин или лизин; моносахариды, дисахариды и другие углеводы, включая глюкозу, маннозу или декстрины; хелатообразующие реагенты, такие как EDTA; сахара, такие как сахароза, маннит, трегалоза или сорбит; солеобразующие противоионы, такие как натрий; комплексы металлов (например, комплексы Zn-белок); и/или неионогенные поверхностно-активные вещества, такие как TWEENTM, PLURONICSTM или полиэтиленгликоль (PEG). Лекарственные формы, которые предназначены для in vivo введения, должны быть стерильными. Это легко достигается путем фильтрации через стерильные фильтрующие мембраны.
Активные ингредиенты могут быть также заключены в микрокапсулу, приготовленную, например, методами коацервации или путем полимеризации на границе фаз, например, гидроксиметилцеллюлозную или желатиновую микрокапсулу и полиметилметакрилатную микрокапсулу, соответственно, в коллоидные системы доставки лекарственных средств (например, в липосомы, микросферы альбумина, микроэмульсии, наночастицы и нанокапсулы) или в макроэмульсии. Эти методы описаны в монографии Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980).
Композиции могут быть приготовлены в форме инъекционных препаратов, либо в форме жидких растворов, либо суспензий; они могут быть также приготовлены в твердой форме, используемой для растворения или суспендирования в жидких средах перед проведением инъекции. Препарат может быть также эмульгирован или инкапсулирован в липосомы или микрочастицы, такие как, полигликолид или сополимер, для усиления адъювантного эффекта, описанного выше (Langer, Science 249: 1527, 1990 and Hanes, Advanced Drug Delivery Reviews 28: 97-119, 1997). Лекарственные средства по этому изобретению могут быть введены в форме инъекции замедленного всасывания или имплантируемого препарата, который может быть приготовлен таким образом, что позволяет осуществлять замедленное или пульсирующее высвобождение активного ингредиента. Фармацевтические композиции обычно приготавливают стерильными, практически изотоническими и строго соблюдая все нормы Управления по контролю качества продовольствия и медикаментов США по надлежащей практики организации производства (GMP).
Используемый в изобретении термин "физиологически приемлемые" эфир или соль обозначает эфирную или солевую форму активного ингредиента, которая совместима с любыми другими ингредиентами фармацевтической композиции, и которая не оказывает вредного действия на субъекта, которому вводят композицию.
Лекарственные формы описанных в изобретении фармацевтических композиций могут быть приготовлены любым известным в фармакологии методом или методом, который будет разработан в будущем. Обычно такие методы приготовления включают стадию контактирования с целью смешения активного ингредиента с носителем или одним или более другими вспомогательными ингредиентами и затем, если это необходимо или желательно, формование или фасовку продукта в требуемую лекарственную форму с разовой дозой или в многодозовую лекарственную форму.
Несмотря на то что приведенные в изобретении описания фармацевтических композиций в первую очередь относятся к фармацевтическим композициям, которые применяют по предписанию врача для введения людям, тем не менее для специалиста в данной области должно быть очевидным, что такие композиции могут широко применяться для введения различным животным. Модификация фармацевтических композиций, применяемых для введения людям, с целью создания композиций, применяемых для введения различным животным, хорошо изучена, и обычный специалист в области ветеринарной фармакологии может продумать и осуществить такую модификацию, если она необходима, путем проведения простого эксперимента.
Фармацевтические композиции, которые применяют в способах по изобретению, могут быть приготовлены, расфасованы или реализованы на рынке лекарственных препаратов в лекарственных формах, применяемых для перорального, ректального, вагинального, парентерального, местного, пульмонального, интраназального, буккального, внутривенного, трансдермального, внутриочагового, подкожного, внутримышечного, офтальмического, интратекального и других известных способов введения. Другие предполагаемые лекарственные формы включают перспективные наночастицы, липосомальные препараты, другие препараты, содержащие активный ингредиент, и лекарственные формы на иммунологической основе.
Фармацевтическая композиция по изобретению может быть приготовлена, расфасована или реализована на рынке лекарственных препаратов в нерасфасованной форме, в лекарственной форме с разовой дозой или с большим количеством разовых доз. Используемый в изобретении термин "разовая доза" обозначает дискретное количество фармацевтической композиции, включающей заданное количество активного ингредиента. Количество активного ингредиента обычно равно дозе активного ингредиента, которую следует ввести субъекту, или равно удобной для введения части такой дозы, например, половине или одной трети такой дозы.
Относительные количества активного ингредиента, фармацевтически приемлемого носителя и любых дополнительных ингредиентов в фармацевтической композиции по изобретению будут изменяться в зависимости от индивидуальных особенностей, роста и массы тела и общего состояния здоровья субъекта, подвергаемого лечению, и, кроме того, в зависимости от способа введения композиции. В качестве примера, композиция может содержать от 0,1 до 100% (по массе) активного ингредиента.
Помимо активного ингредиента, фармацевтическая композиция по изобретению может дополнительно включать одно или более дополнительных фармацевтически активных средств.
Путем использования традиционной технологии могут быть приготовлены лекарственные формы фармацевтической композиции по изобретению с контролируемым или замедленным высвобождением.
Лекарственная форма фармацевтической композиции по изобретению, применяемая для перорального введения, может быть приготовлена, расфасована или реализована на рынке лекарственных препаратов в форме дискретной твердой разовой дозы, включающей, но этим не ограничивая, таблетку, твердую или мягкую капсулу, крахмальную капсулу, пастилку или леденец, содержащие заданное количество активного ингредиента. Другие лекарственные формы, применяемые для перорального введения, включают, но этим не ограничивая, порошковую или гранулированную форму, водную или масляную суспензию, водный или масляный раствор или эмульсию.
Фармацевтически приемлемые вспомогательные вещества, используемые в производстве фармацевтических композиций, включают, но этим не ограничивая, инертные разбавители, гранулирующие и дезинтегрирующие средства, связующие вещества и смазывающие вещества. Известные диспергирующие средства включают, но этим не ограничивая, картофельный крахмал и натрия гликолят крахмала. Известные поверхностно-активные вещества включают, но этим не ограничивая, лаурилсульфат натрия. Известные разбавители включают, но этим не ограничивая, карбонат кальция, карбонат натрия, лактозу, микрокристаллическую целлюлозу, фосфат кальция, гидрофосфат кальция и фосфат натрия. Известные гранулирующие и дезинтегрирующие средства включают, но этим не ограничивая, кукурузный крахмал и альгиновую кислоту. Известные связующие вещества включают, но этим не ограничивая, желатин, аравийскую камедь, предварительно желатинизированный кукурузный крахмал, поливинилпирролидон и гидроксипропилметилцеллюлозу. Известные смазывающие вещества включают, но этим не ограничивая, стеарат магния, стеариновую кислоту, диоксид кремния и тальк.
Жидкие лекарственные формы фармацевтической композиции по изобретению могут быть приготовлены, расфасованы или реализованы на рынке лекарственных препаратов либо в жидкой форме, либо в форме сухого продукта, предназначенного для разведения водой или другой подходящей средой перед использованием.
Жидкие суспензии могут быть приготовлены с использованием традиционных методов получения суспензии активного ингредиента в водной или масляной среде. Водные среды включают, например, воду и изотонический солевой раствор. Масляные среды включают, например, миндальное масло, эфиры масел, этиловый спирт, растительные масла, такие как арахисовое, оливковое, кунжутное или кокосовое масло, фракционированные растительные масла и минеральные масла, такие как жидкий парафин. Жидкие суспензии могут дополнительно содержать один или более дополнительных ингредиентов, включая, но эти не ограничивая, суспендирующие средства, диспергирующие или смачивающие средства, эмульгаторы, мягчительные средства, консерванты, буферы, соли, ароматизаторы, красители и подсластители. Масляные суспензии могут дополнительно включать загуститель.
Известные суспендирующие средства включают, но этим не ограничивая, сироп сорбита, гидрированные пищевые жиры, альгинат натрия, поливинилпирролидон, трагакантовую камедь, аравийскую камедь и производные целлюлозы, такие как карбоксиметилцеллюлоза натрия, метилцеллюлоза и гидроксипропилметилцеллюлоза. Известные диспергирующие или смачивающие средства включают, но этим не ограничивая, природные фосфатиды, такие как лецитин, продукты конденсации оксида алкилена с жирной кислотой, с длинноцепочечным алифатическим спиртом, с неполным сложным эфиром, полученным из жирной кислоты и гексита, или с неполным эфиром, полученным из жирной кислоты и ангидрида гексита (например, полиоксиэтиленстеарат, гептадекаэтиленоксицетанол, полиоксиэтиленсорбитолмоноолеат и полиоксиэтиленсорбитан-моноолеат, соответственно). Известные эмульгаторы включают, но этим не ограничивая, лецитин и аравийскую камедь. Известные консерванты включают, но этим не ограничивая, метил-, этил- или н-пропил-пара-гидроксибензоаты, аскорбиновую кислоту и сорбиновую кислоту. Известные подсластители включают, например, глицерин, пропиленгликоль, сорбит, сахарозу и сахарин. Известные загустители для масляных суспензий включают, например, пчелиный воск, твердый парафин и цетиловый спирт.
Жидкие растворы активного ингредиента в водных или масляных растворителях могут быть приготовлены практически таким же методом, как и жидкие суспензии, при этом основное отличие состоит в том, что активный ингредиент растворяют, а не суспендируют в растворителе. Жидкие растворы фармацевтической композиции по изобретению могут включать каждый из компонентов, описанных применительно к жидким суспензиям, при этом следует иметь в виду, что суспендирующие средства не обязательно будут способствовать растворению активных ингредиентов в растворителе. Водные растворители включают, например, воду и изотонический солевой раствор. Масляные растворители включают, например, миндальное масло, эфиры масел, этиловый спирт, растительные масла, такие как арахис, оливковое, кунжутное или кокосовое масло, фракционированные растительные масла и минеральные масла, такие как жидкий парафин.
Порошковые и гранулированные лекарственные формы фармацевтического препарата по изобретению могут быть приготовлены с использованием известных методов. Такие лекарственные формы могут быть введены непосредственно субъекту, но могут быть использованы, например, для формования таблеток, для заполнения капсул или для приготовления водной или масляной суспензии или раствора путем добавления к ним водной или масляной среды. Каждая из этих лекарственных форм может дополнительно включать одно или более диспергирующих или смачивающих средств, суспендирующих средств и консервантов. В эти лекарственные формы могут быть также включены дополнительные вспомогательные вещества, такие как наполнители и подсластители, ароматизаторы или красители.
Фармацевтическая композиция по изобретению также может быть приготовлена, расфасована или реализована на рынке лекарственных препаратов в форме эмульсии масло-в-воде или эмульсии вода-в-масле. Масляная фаза может представлять собой растительное масло, такое как оливковое или арахисовое масло, минеральное масло, такое как жидкий парафин, или их комбинацию. Такие композиции могут дополнительно содержать один или более эмульгаторов, таких как природные камеди, такие как аравийская камедь или трагакантовая камедь, природные фосфатиды, такие как фосфатид сои или лецитина, сложные эфиры или неполные сложные эфиры, полученные из комбинаций жирных кислот и ангидридов гекситола, такие как сорбитанмоноолеат, и продукты конденсации таких неполных эфиров с этиленоксидом, такие как полиоксиэтиленсорбитанмоноолеат. Эти эмульсии могут также содержать дополнительные ингредиенты, в том числе, например, подсластители или ароматизаторы.
В данной области хорошо известны методы импрегнирования с помощью химической композиции или нанесения покрытия из химической композиции на материал, и они включают, но этим не ограничивая, способы нанесения или связывания химической композиции на поверхности, методы введения химической композиции в структуру материала в процессе синтеза материала (то есть, такого материала, который разлагается в результате физиологического воздействия) и методы поглощения водного или масляного раствора или суспензии абсорбирующим материалом с последующей сушкой или без нее.
Используемый в изобретении термин "парентеральное введение" фармацевтической композиции включает любой способ введения, характеризующийся образованием прокола или разреза в ткани субъекта в результате механического воздействия и введением фармацевтической композиции через прокол или разрез в ткани. Поэтому, парентеральное введение включает, но этим не ограничивая, введение фармацевтической композиции путем инъекции композиции, путем нанесения композиции через хирургический разрез, путем нанесения композиции через проникающую в ткань нехирургическую рану и другой подобный метод введение. В частности, предполагается, что парентеральное введение включает, но этим не ограничивая, кожную, подкожную, интраперитонеальную, внутривенную, внутримышечную, интрацистернальную инъекции и инфузионные методы почечного диализа.
Лекарственные формы фармацевтической композиции, применяемые для парентерального введения, содержат активный ингредиент в сочетании с фармацевтически приемлемым носителем, таким как стерильная вода или стерильный изотонический солевой раствор. Такие лекарственные формы могут быть приготовлены, расфасованы или реализованы на рынке лекарственных препаратов в форме, применяемой для болюсного введения или для непрерывного введения. Инъецируемые лекарственные формы могут быть приготовлены, расфасованы или реализованы на рынке лекарственных препаратов в лекарственной форме с разовой дозой, например, в ампулах или в многодозовых контейнерах, содержащих консервант. Лекарственные формы для парентерального введения включают, но этим не ограничивая, суспензии, растворы, эмульсии в масляных или водных средах, пасты и имплантируемые лекарственные формы с замедленным высвобождением или биоразлагаемые лекарственные формы. Такие лекарственные формы могут дополнительно содержать один или более дополнительных ингредиентов, включающих, но этим не ограничивая, суспендирующие, стабилизирующие или диспергирующие средства. В некоторых вариантах осуществления лекарственной формы для парентерального введения, активный ингредиент поставляют в сухой (то есть в порошковой или гранулированной) форме для растворения его в подходящей среде (например, в стерильной апирогенной воде) перед парентеральным введением приготовленной таким образом композиции.
Фармацевтические композиции могут быть приготовлены, расфасованы или реализованы на рынке лекарственных препаратов в форме стерильной инъецируемой водной или масляной суспензии или раствора. Эта суспензия или раствор могут быть приготовлены в соответствии с известным уровнем техники и могут включать, помимо активных ингредиентов, дополнительные ингредиенты, такие как описанные в изобретении диспергирующие средства, смачивающие средства или суспендирующие средства. Такие стерильные инъецируемые лекарственные формы могут быть приготовлены с использованием нетоксичного парентерально приемлемого разбавителя или растворителя, такого как, например, вода или 1,3-бутандиол. Другие приемлемые разбавители и растворители включают, но этим не ограничивая, раствор Рингера, изотонический раствор хлорида натрия и нелетучие масла, такие как синтетические моно- или диглицериды. Другие применяемые парентерально вводимые лекарственные формы включают лекарственные формы, которые содержат активный ингредиент в микрокристаллической форме, в липосомном препарате или в качестве компонента биоразлагаемых полимерных систем. Композиции для замедленного высвобождения или для имплантации могут содержать фармацевтически приемлемые полимерные или гидрофобные материалы, такие как эмульсия, ионообменная смола, умеренно растворимый полимер или умеренно растворимая соль.
Лекарственные формы, применяемые для местного введения, включают, но этим не ограничивая, жидкие или полужидкие препараты, такие как линименты, лосьоны, эмульсии масло-в-воде или вода-в-масле, такие как кремы, мази или пасты, а также растворы или суспензии. Лекарственные формы для местного введения могут, содержать, например, от приблизительно 1% до приблизительно 10% (по массе) активного ингредиента, хотя концентрация активного ингредиента может достигать и предела растворимости активного ингредиента в растворителе. Кроме того, лекарственные формы для местного применения могут включать один или более описанных в изобретении дополнительных ингредиентов.
Фармацевтическая композиция по изобретению может быть приготовлена, расфасована или реализована на рынке лекарственных препаратов в лекарственной форме, применяемой для пульмонального введения через ротовую полость. Такая лекарственная форма может включать сухие частицы, которые содержат активный ингредиент и которые имеют диаметр в диапазоне от приблизительно 0,5 до приблизительно 7 нанометров и, предпочтительно, от приблизительно 1 до приблизительно 6 нанометров. Удобно, если такие композиции находятся в форме сухих порошков для введения с использованием устройства, содержащего резервуар для сухого порошка, в который может быть направлен поток пропеллента для диспергирования порошка, или с использованием дозирующего порошок контейнера с самодвижущимся растворителем, такого как устройство, включающее активный ингредиент, растворенный или суспендированный в низкокипящем пропелленте в герметичном контейнере. Предпочтительно, чтобы такие порошки включали частицы, в которых по меньшей мере 98% частиц по массе имели диаметр более 0,5 нанометров, и, по меньшей мере, 95% частиц по количеству имели диаметр менее 7 нанометров. Более предпочтительно, чтобы, по меньшей мере, 95% частиц по массе имели диаметр более 1 нанометра, и, по меньшей мере, 90% частиц по количеству имели диаметр менее 6 нанометров. Предпочтительно, чтобы сухие порошковые композиции включали твердый мелкодисперсный порошковый разбавитель, такой как сахар, и удобно, что их приготавливали в лекарственной форме с разовой дозой.
Низкокипящие пропелленты обычно включают жидкие пропелленты, имеющие температуру кипения ниже 18°С при атмосферном давлении. Обычно пропеллент может составлять от 50 до 99,9% (по массе) от суммарной массы композиции, а активные ингредиенты могут составлять от 0,1 до 20% (по массе) от суммарной массы композиции. Кроме того, пропеллент может включать дополнительные ингредиенты, такие как жидкое неионногенное или твердое анионное поверхностно-активное вещество или твердый разбавитель (предпочтительно, имеющий размер частиц того же порядка, что и частицы, включающие активный ингредиент).
Фармацевтические композиции по изобретению, приготовленные для пульмональной доставки, могут также обеспечивать введение активного ингредиента в форме капель раствора или суспензии. Такие лекарственные формы могут быть приготовлены, расфасованы или реализованы на рынке лекарственных препаратов в виде водных или разбавленных спиртовых растворов или суспензий, необязательно стерильных, содержащих активные ингредиенты, и они могут быть удобно введены с использованием любого устройства для распыления или пульверизации. Кроме того, такие лекарственные формы могут включать один или более дополнительных ингредиентов, в том числе, но этим не ограничивая, ароматизатор, такой как сахаринат натрия, летучее масло, буферное средство, поверхностно-активное вещество или консервант, такой как метилгидроксибензоат. Предпочтительно, чтобы капли, доставляемые этим способом введения, имели средний диаметр в диапазоне от приблизительно 0,1 до приблизительно 200 нанометров. Описанные в изобретении лекарственные формы, применяемые для пульмональной доставки, могут также применяться для интраназальной доставки фармацевтической композиции по изобретению. Другой лекарственной формой, применяемой для интраназального введения, является порошок с крупными по размеру частицами, включающий активный ингредиент и имеющий средний размер частиц от приблизительно 0,2 до 500 микрометров.
Такую лекарственную форму вводят путем вздоха через нос, то есть, путем быстрого вдыхания через носовой проход порошка из контейнера, который держат близко к ноздрям. Лекарственные формы, применяемые для назального введения, могут, например, включать всего лишь от приблизительно 0,1% (по массе) и вплоть до 100% (по массе) активного ингредиента, и, кроме того, могут включать один или более описанных в изобретении дополнительных ингредиентов.
Фармацевтическая композиция по изобретению может быть приготовлена, расфасована или реализована на рынке лекарственных препаратов в лекарственной форме, применяемой для буккального введения. Такие лекарственные формы могут представлять собой, например, таблетки или пастилки, изготовленные традиционным методом, и содержать, например, от 0,1 до 20% (по массе) активного ингредиента, причем оставшаяся часть включает перорально растворимую или разлагаемую композицию и, необязательно, один или более из описанных в изобретении дополнительных ингредиентов. В качестве варианта, лекарственные формы, применяемые для буккального введения, могут включать порошок или распрыскиваемый или распыляемый раствор или суспензию, содержащие активные ингредиенты. Предпочтительно, чтобы такие порошковые, распрыскиваемые или распыляемые лекарственные формы при диспергировании имели средний размер частиц или капель в диапазоне от приблизительно 0,1 до приблизительно 200 нанометров и, кроме того, могли содержать один или более описанных в изобретении дополнительных ингредиентов.
Фармацевтическая композиция по изобретению может быть приготовлена, расфасована или реализована на рынке лекарственных препаратов в лекарственной форме, применяемой для офтальмического введения. Такие лекарственные формы могут представлять собой, например, глазные капли, включающие, например, 0,1-1,0% (по массе) раствора или суспензии активных ингредиентов в водном или масляном жидком носителе. Такие капли могут дополнительно включать буферные вещества, соли или один или более других описанных в изобретении дополнительных ингредиентов. Другие применяемые офтальмически вводимые лекарственные формы включают формы, которые содержат активные ингредиенты в микрокристаллической форме или в липосомном препарате.
Используемые в изобретении "дополнительные ингредиенты" включают, но этим не ограничивая, один или более из следующих ингредиентов: вспомогательные вещества; поверхностно-активные вещества; диспергирующие средства, инертные разбавители, гранулирующие и дезинтегрирующие средства, связующие вещества, смазывающие вещества, подсластители, ароматизаторы, красители, консерванты, разлагаемые при физиологическом воздействии композиции, такие как желатин, водные среды и растворители, масляные среды и растворители, суспендирующие средства, диспергирующие или смачивающие средства, эмульгаторы, мягчительные средства, буферы, соли, загустители, наполнители, эмульгаторы, антиоксиданты, антибиотики, противогрибковые средства, стабилизаторы и фармацевтически приемлемые полимерные или гидрофобные материалы. Другие "дополнительные ингредиенты", которые могут быть введены в фармацевтические композиции по изобретению, известны в данной области и описаны, например, в монографии Genaro, ed., 1985, Remington's Pharmaceutical Sciences, Mack Publishing Co., Easton, PA., полное содержание которой включено в настоящее изобретение путем ссылки на нее.
Типичные дозы соединения по изобретению, которые могут быть введены животному, предпочтительно, человеку, находятся в диапазоне от приблизительно 0,001 до приблизительно 1000 мг на килограмм массы тела животного. Точная величина вводимой дозы будет изменяться в зависимости от некоторого числа факторов, включающих, но этим не ограничивая, тип животного и тип заболевания или нарушения, подвергаемого лечению, возраст животного и способ введения. Предпочтительно, если доза соединения будет изменяться в диапазоне от приблизительно 0,1 до приблизительно 10 мг на килограмм массы тела животного. Соединение может быть введено животному с такой частотой, как как несколько раз в сутки, или оно может быть введено реже, например, один раз в сутки, один раз в неделю, один раз каждые две недели, один раз в месяц или даже реже, например один раз каждые несколько месяцев или даже один раз в год или еще более редко. Частота введения дозы может быть легко определена специалистом в данной области, и она будет зависеть от некоторого числа факторов, таких как, но этим не ограничивая, тип и тяжесть заболевания или нарушения, подвергаемого лечению, тип и возраст животного и другие подобные факторы.
ПРИМЕРЫ ПРОВЕДЕНИЯ ЭКСПЕРИМЕНТАЛЬНЫХ ИССЛЕДОВАНИЙ
Далее изобретение подробно описано с использованием представленных ниже примеров проведения экспериментальных исследований. Эти примеры представлены только в иллюстративных целях, и их не следует рассматривать в качестве ограничений, если не указано иное. Поэтому никоим образом не следует считать, что изобретение ограничивается приведенными далее примерами, наоборот, следует считать, что изобретение включает в себя все возможные варианты, которые становятся очевидными в результате ознакомления с описанными в изобретении идеями.
Можно считать, что, даже без дополнительного описания изобретения, любой специалист в данной области, используя представленное выше описание и представленные ниже иллюстративные примеры, может воссоздать и использовать настоящее изобретение и применить на практике заявленные в пунктах патентной формулы способы. Поэтому приведенные далее рабочие примеры не следует рассматривать никоим образом в качестве ограничивающих остальную часть изобретения.
Пример 1. Варианты полипептида ИЛ-18
IL-18 представляет собой провоспалительный цитокин, который может стимулировать Т-клетки, НК-клетки и миелоидные клетки. Его было предложено применять в качестве иммунотерапевтического средства при лечении рака, учитывая его способность стимулировать противоопухолевые иммуноциты. Как показано в изобретении, терапевтическая эффективность лечения с помощью рекомбинантного IL-18 в значительной степени ограничена в результате сверхрегуляции его природного эндогенного растворимого ингибитора IL-18BP. Настоящее изобретение, помимо прочего, основано на разработке вариантов человеческого и мышиного IL-18, которые являются практически полностью независимыми от IL-18BP. Эти варианты цитокинов характеризуются изменением относительного предпочтения к рецепторам (IL-18Rα и IL-18BP) в диапазоне от сотен тысяч до более чем миллион раз. Эти варианты демонстрируют мощную противоопухолевую активность на доклинических моделях опухоли, как в форме монотерапии, так и в комбинации с ингибиторами иммунных контрольных точек, такими как антитело против PD-1. Что касается дополнительного варианта применения, то хорошо известно, что IL-18 также оказывает положительный терапевтический эффект при лечении ожирения, и в изобретении показано, что введение этих вариантов значительно снижает содержание жировой ткани по сравнению с лечением при использовании WT IL-18. Поэтому, помимо противоопухолевой иммунотерапии, эти новые варианты могут применяться при лечении эндокринологических, метаболических нарушений и ожирения.
Кроме того, в изобретении описан дополнительный набор вариантов IL-18, которые действуют как антагонисты IL-18BP за счет исключительно связывания IL-18BP, но при отсутствии или значительно сниженным связыванием IL-18Rα. Предполагается, что эти белки могут быть использованы для усиления активности эндогенного IL-18 путем нейтрализации IL-18BP.
Далее описаны материалы и методы, используемые в этих экспериментах.
Экспрессия и очистка белка
Человеческий IL-18, мышиный IL-18 (аминокислоты 1-157) и их варианты собирали в виде блоков фрагментов генов gBlocks (Integrated DNA Technologies, IDT) и клонировали в вектор pET28a-smt для экспрессии N-концевых белков, меченых с помощью SUMO, и C-концевых белков, меченых с помощью гексагистидина, в штамме Е. coli BL21 (DE3) Rosetta. Экспрессию белка индуцировали с помощью 0,5 мМ IPTG (изопропилтиогалактозида) при 16°С в течение 20 часов. Слитые белки сначала очищали с использованием загруженных никелем хелатообразующих смол, и затем расщепляли метки SUMO с помощью SUMO-протеазы. После этого, белки отделяли от агрегатов путем последовательного осаждения фракций с помощью сульфата аммония, причем агрегаты осаждали 20% раствором сульфата аммония, а целевые белки осаждали 70% раствором сульфата аммония. Осадки белков ресуспендировали и снова наносили на загруженные никелем хелатообразующие смолы для удаления меток SUMO, и подвергали промывке с помощью 0,1% Triton X-114 для удаления эндотоксина. И, наконец, элюированный белок подвергали замене буфера на PBS, используя колонку PD-10 (GE Healthcare). Образец белка тестировали на монодисперсность методом гель-проникающей хроматографии с использованием колонки FPLC (Bio-Rad) и SEC650 (Bio-Rad).
Выделяли эктодомен IL-18Rα человека (аминокислоты 19-329), эктодомен IL-18Rβ человека (аминокислоты 15-356) и IL-18BP (аминокислоты 31-194) и очищали с помощью бакуловирусной системы экспрессии. Вкратце, все последовательности конструкции клонировали в вектор pAcBN-BH3 (BD Biosciences) с N-концевым сигнальным пептидом gp67 и C-концевой меткой AviTag™ и гексагистидиновой меткой. Клетки насекомого Spodoptera frugiperda (Sf9), культивированные при 27°C в бессывороточной среде SF900 II (Invitrogen), трансфицировали плазмидными конструкциями для создания рекомбинантного вируса с высоким титром, который затем амплифицировали. Клетки насекомого Trichopulsia ni (High-Five) (Invitrogen), выращенные в среде Insect Xpress (Lonza) при 27°C, инфицировали вирусами для экспрессии рекомбинантного белка. Через три дня после инфицирования, белки извлекали методом аффинной хроматографии Ni-NTA (QIAGEN), концентрировали и очищали до гомогенности >98%, используя колонки для разделения биомолекул по размерам SEC650 (Bio-Rad), приведенные в равновесное состояние в 10 мМ HEPES (pH 7,5) и 150 мМ NaCl.
Продуцировали эктодомен мышиного IL-18Rα (аминокислоты 19-329) и IL-18BP (аминокислоты 31-194) в виде секретируемых белков с использованием экспрессирующей системы Expi293 (Thermo Fisher). Вкратце, все последовательности конструкции клонировали в вектор pEZT_D_Lux экспрессирующей системы BacMam с N-концевым сигнальным пептидом H7 и C-концевой меткой AviTag™ и гексагистидиновой меткой. Клетки Expi293, культивируемые при 37° C в среде для экспрессии Expi293 (Thermo Fisher), трансфицировали плазмидами с использованием набора для трансфекции ExpiFectamine 293 (Thermo Fisher) в соответствии с инструкциями фирмы-производителя. Клетки собирали через 3-5 дней после трансфекции. Методы очистки белка были такими же, как и в случае белков человека.
Для биотинилирования белка, C-концевой биотин-акцепторный пептид (AviTag)-GLNDIFEAQKIEWHE подвергали слиянию со всеми конструкциями рецепторов IL-18. Биотинилирование белка проводили с помощью растворенного фермента биотин-лигазы BirA в 0,1 мМ бицина (рН 8,3), 10 мМ АТФ, 10 мМ ацетата магния и 0,5 мМ биотина (Sigma). Белки очищали, используя колонки для разделения биомолекул по размерам SEC650, как описано выше.
Дрожжевой дисплей IL-18
Синтезировали блок гена человеческого и мышиного IL-18 (IDT) и клонировали в вектор pYAL, и воспроизводили на штамме Saccharomyces cerevisiae EBY100. Выращивали индивидуальные колонии дрожжей IL-18 в течение ночи при 30°C в жидкой среде SDCAA, и индуцировали в жидкой среде SGCAA в течение 1 дня при 20°C. Уровни дисплея IL-18 на дрожжах были подтверждены методом проточной цитометрией с использованием антитела против метки cMyc (anti-myc-PE; Cell Signaling Technologies). Проводили окрашивание рецепторов с помощью биотинилированного IL-18Rα (в присутствии или отсутствии IL-18Rβ) или с помощью биотинилированного IL-18BP в PBS с добавлением 0,5% BSA и 2 мМ EDTA (PBE) на льду. Весь анализ проводился на проточном цитометре Sony SA3800.
Конструирование библиотеки человеческого IL-18 и проведение отбора
Для первой библиотеки человеческого IL-18, резистентного к рецептору ловушке, в hIL-18 были идентифицированы по гомологичным положениям четырнадцать контактных остатков hIL-18Rα и hIL-18BP (таблица 1) путем выравнивания структуры комплекса hIL-18/hIL-18Rα/hIL-18Rβ (Protein Data Bank (PDB ID) code 3OW4) со структурой IL-18/IL-18BP (PDB ID 3F62). Конструировали библиотеку, рандомизирующую эти остатки, используя сборочную ПЦР с вырожденными праймерами, приведенными в таблице 2. Теоретическое разнообразие библиотеки составляло ~1,96 × 1011 уникальных белковых последовательностей. Затем продукты ПЦР амплифицировали с помощью праймеров, имеющих гомологию с вектором pYAL, и совместно электропорировали вместе с линеаризованным pYAL в дрожжи EBY100. Полученная библиотека содержала 2,5 × 108 трансформантов.
Для второй библиотеки человеческого IL-18, резистентного к рецептору ловушке, в hIL-18 были отобраны одиннадцать контактных остатков hIL-18Rα и hIL-18BP для рандомизации с теоретическим разнообразием 3,44 × 109 вариантов (представлено на фигуре 7А). Конструировали библиотеку, рандомизирующую эти остатки, используя сборочную ПЦР с вырожденными праймерами, и совместно электропорировали вместе с pYAL в дрожжи EBY100. Полученная библиотека имела разнообразие 6 × 108 трансформантов.
Таблица 1. Дизайн первой библиотеки человеческого IL-18
Таблица 2. Сборочные праймеры первой библиотеки человеческого IL-18
В случае обеих библиотек, трансформированные дрожжи извлекали и размножали в жидкой синтетической среде декстрозы с казаминокислотами (SDCAA) при 30°C и индуцировали путем разбавления 1:10 в жидкой синтетической среде галактозы с казаминокислотами (SGCAA) и культивировали при 20°C в течение 24 часов. В каждом раунде использовали соответствующее количество индуцированных дрожжей для обеспечения, по меньшей мере, 10-кратного охвата ожидаемого разнообразия библиотеки на каждом этапе и не менее чем 108 клеток. Все стадии отбора проводили при 4°C с использованием буфера PBE (PBS с 0,5% BSA и 2 мМ EDTA). Для библиотеки первого поколения, реагенты для проведения отбора в каждом раунде приведены в таблице 3. В первом раунде, дрожжи подвергали отрицательному отбору с помощью микросфер антитела против Cy5/AlexaFluor 647 (Miltenyi) и колонки LS MACS (Miltenyi) для удаления неспецифически связующих гранул. Положительный отбор проводили путем нанесения на дрожжи метки с помощью 1 мкМ биотинилированного hIL-18Rα в течение 1 часа при 4°C с последующим магнитным отбором с помощью микросфер антитела против Cy5/AlexaFluor 647 и колонки LS MACS. Во втором раунде, отрицательный отбор проводили с помощью 1 мкМ биотинилированного IL-18BP, а положительный отбор проводили так же, как в первом раунде. Для раундов 3-5, отбор проводили путем инкубации дрожжей с 100 нМ (раунды 3-4) или 10 нМ (раунд 5) биотинилированного IL-18Rα и 250 нМ предварительно образованных тетрамеров hIL-18BP/SA-PE, покрытых биотином. После конкурентного связывания, дрожжи промывали и наносили на них метку с помощью SA AlexaFluor 647 для обнаружения IL-18Rα. Уровни дисплея определяли путем окрашивания с использованием конъюгированного с AlexaFluor 488 антитела против cMyc (Cell Signaling Technologies), и выделяли верхнюю 1% часть нормализованных по отношению к дисплею связывающих IL-18Rα (из несвязывающих IL-18BP) с помощью FACS с использованием сортировщика клеток Sony SA3800. После каждого раунда отбора, извлеченные дрожжи размножали в среде SDCAA при 30°С в течение ночи, и затем индуцировали при 20°С путем разведения 1:10 в среде SGCAA в течение 24 часов.
Библиотека V-2.0 человеческого DR-IL-18 была отобрана подобным образом путем проведения конкретных стадий отбора, подробно представленных на фигуре 7B.
Конструирование библиотеки мышиного IL-18 и проведение отбора
Конструирование и методика отбора являются такими же, как в случаи человеческого IL-18, но со следующими изменениями. Конструирование библиотеки была основано на информации, полученной в результате компьютерного моделирования структуры комплекса мышиный IL-18/рецептор (предсказанного с использованием программы Phyer2.0). Для рандомизации были выбраны тринадцать положений (таблица 3) с использованием праймеров, описанных в таблице 4. В результате совместной электропорации с pYAL, была получена библиотека из 4 × 108 трансформантов. Реагенты для отбора, используемые для каждого раунда, представлены в таблице 5.
Таблица 3. Дизайн библиотеки мышиного IL-18
Таблица 4. Сборочные праймеры библиотеки мышиного IL-18
Таблица 5. Краткое описание реагентов для проведения отбора в библиотеки
Поверхностный плазмонный резонанс
Эксперименты проводили с использованием системы Biacore T100 при температуре 25°C. Биотинилированный IL-18Rα или IL-18BP иммобилизировали на чипе захвата биотина Biacore (сенсорный чип Series S CAP, GE Healthcare) для получения Rmax ~50 RU (IL-18Rα) или ~10 RU (IL-18BP). Измерения проводились для последовательно разведенных вариантов IL-18 в забуференном HEPES Saline-P+ (10 мМ HEPES, pH 7,4, 150 мМ NaCl, 0,005% поверхностно-активного вещества P20). Поверхность регенерировали с помощью трех 60-секундных инъекций регенерационного буфера (3/4 (по объему) 8 М гидрохлорида гуанидина с 1/4 (по объему) 1 М гидроксида натрия). Эксперименты проводились одновременно по нескольким каналам для увеличения количества наблюдений. Все данные анализировали с помощью программного обеспечения для оценки Biacore T100 версии 2.0 с моделью связывания Ленгмюра 1:1.
Линии клеток
Сенсорные клетки HEK-Blue IL-18 (InvivoGen) содержали в полной среде (DMEM, содержащей 10% термоинактивированной FBS, 2 мМ L-глутамина, 50 ед/мл пенициллина и 50 мкг/мл стрептомицина) с добавлением 100 мкг/мл нормоцина, 30 мкг/мл бластицидина, 180 мкг/мл зеоцина и 200 мкг/мл гигромицина. Клетки меланомы YUMMER1.7 культивировали и получали, как описано в публикации Wang et al., 2017, Pigment Cell Melanoma Res., 30 (4): 428-435.
Исследование активности цитокинов с помощью клеток HEK-Blue
Для измерения активности цитокинов, 50000 сенсорных клеток HEK-Blue IL-18 на лунку 96-луночного планшета с плоским дном инкубировали с рекомбинантным человеческим IL-18 при последовательно уменьшающихся концентрациях в общем объеме 200 мкл полной среды. После 20-24 часов инкубации при 37°С и 5% СО2, 30 мкл надосадочной жидкости клеточной культуры смешивали с 170 мкл среды для определения QUANTI-Blue (InvivoGen) и инкубировали при 37°С и 5% СО2 до тех пор, пока не происходило наблюдаемое изменение цвета от розового до синего (0,5-4 часа). Количественно определяли уровни щелочной фосфатазы с использованием спектрофотометра при длине волны 655 нм. Активность цитокинов определяли путем расчета величины относительного поглощения (в процентах от максимального значения поглощения, измеренного при 655 нм) для каждого исследуемого цитокина.
В экспериментах по блокаде IL-18BP, фиксированную концентрацию рекомбинантного человеческого IL-18 предварительно инкубировали с рекомбинантным человеческим IL-18BP при последовательно уменьшающихся концентрациях в течение 1 часа при 4°C. После чего белковые смеси добавляли в сенсорные клетки HEK-Blue IL-18 и проводили анализ, как описано.
Мыши
Для проведения in vivo экспериментов на мышах, использовали мышей линии C57BL/6 дикого типа (в возрасте 6-9 недель) из лаборатории Джексона. Экспериментальные группы были сопоставимы по массе тела, полу и возрасту. Все эксперименты на животных проводились в соответствии с одобрением Институционального комитета по уходу за животными и их использованию Йельского университета.
Фармакодинамические и фармакокинетические исследования in vivo
Мышам (n=9 в группе) ежедневно инъецировали интраперитонеально (i.p.) 1 мг/кг рекомбинантного IL-18 (WT или вариант mCS2) или PBS в качестве плацебо для контроля. В день 1, день 4 и день 7-й проведения эксперимента, 3 мышей в группе умерщвляли через 5 часов после инъекции с целью забора крови путем пункции сердца и проведения последующего анализа плазмы крови или лейкоцитов (см. метод анализа ELISA мышиного IL-18BP, метод мультиплексного иммуноанализа на основе технологии Luminex для анализа мышиных цитокинов, а также метод иммунофенотипирования с помощью проточной цитометрии). В течение 7 дней эксперимента ежедневно контролировали температуру тела с использованием термометра Rodent BIO-TK8851 (Bioseb) и ректального зонда RET 3 для мышей (Braintree Scientific Inc.). Ежедневно контролировали массу тела.
Приготовление плазмы из цельной крови
Приготовление плазмы из цельной крови выполняли с использованием покрытых EDTA пробирок плазмасепаратора Microtainer (BD) в соответствии с инструкцией фирмы-производителя. Образцы плазмы замораживали один раз при -20°С перед тем, как использовать для проведения анализов.
Анализ IFN-γ и IL-18BP методом ELISA
Для измерения уровней человеческого IFN-γ в надосадочной жидкости клеточной культуры использовали в соответствии с инструкциями фирмы-производителя набор Human IFN-γ ELISA MAX Deluxe Set (BioLegend) с чувствительностью 4 пг/мл и диапазоном обнаружения 7,8-500 пг/мл. Для количественного определения человеческого IL-18BP в надосадочной жидкости клеточной культуры использовали иммуноанализ Quantikine Human IL-18BP Immunoassay (R&D Systems)) с чувствительностью 7,52 пг/мл и диапазоном обнаружения 26,6-1700 пг/мл. Проводили количественное определение уровней мышиного IL-18BP в плазме крови с использованием набора Mouse IL-18BP ELISA Kit (R&D systems) с чувствительностью 0,156 нг/мл и диапазоном обнаружения 0,156-10 нг/мл. Все анализы, включая подготовку проб, проводили в соответствии с инструкциями фирмы-производителя.
Метод мультиплексного иммуноанализа на основе технологии Luminex для анализа мышиных цитокинов
Для количественной оценки уровней различных цитокинов в плазме крови мышей, в том числе IFN-γ и IL-12, проводили мультиплексный иммуноанализ на основе технологии Luminex (Bio-Rad) с использованием системы Bio-Plex 200 (Bio-Rad). Представляющие интерес цитокины анализировали с использованием стандарта мышиного цитокина Bio-Plex Pro Mouse Cytokine Standard 23-Plex (Group I), восстановленного в DMEM, в соответствии с инструкциями фирмы-производителя.
Иммунофенотипирование методом проточной цитометрии
Для анализа лейкоцитов, 100 мкл цельной крови собирали в покрытую EDTA пробирку плазмасепаратора Microtainer (BD), дополнительно содержащую 50 мкл раствора гепарина, и перемешивали путем опрокидывания пробирки вверх дном несколько раз. Проводили лизис эритроцитов путем добавления лизирующего буфера ACK Lysing Buffer (VWR) и инкубации в течение 3-5 минут при комнатной температуре. После добавления буфера MACS (2 мМ EDTA, 2% FBS в PBS), собирали лейкоциты центрифугированием (5 минут, 400 × g, 4°C) и аспирацией надосадочной жидкости. Лейкоциты промывали один раз холодным буфером MACS и снова собирали описанным способом. Осадок клеток ресуспендировали в 200 мкл буфера MACS, содержащего 10% (по объему) крысиной сыворотки (STEMCELL Technologies Inc.) и специфические флуоресцентно-меченные антитела для окрашивания для последующего анализа методом проточной цитометрии. Окрашивание проводили в течение 30 минут при 4°C с использованием следующих антител: αCD4-AF700 (BioLegend), αCD8-APC (BioLegend), B220-APC-Cy7 (BioLegend), CD11b-PB (BioLegend), NK1.1-PE (BioLegend), NKp46-PE (BioLegend) и CD69-FITC (BioLegend). Затем лейкоциты дважды промывали буфером MACS, как описано выше. И, наконец, клетки ресуспендировали в 100 мкл буфера MACS, и отбирали образцы для анализа в проточном цитометре (Sony SA3800). Отбирали аликвоту 10 мкл для подсчета клеток на автоматическом счетчике клеток Invitrogen Countess II Automated Cell Counter (Thermo Fisher Scientific). Для анализа данных использовали программное обеспечение FlowJo v10.3, и гейтировали лейкоциты и единичные события с использованием прямого и бокового светорассеяния.
Проведение экспериментов по лечению опухолей
0,5 × 106 клеток линии YUMMER1.7 имплантировали подкожно мышам линии C57BL/6J. Через 7 дней после имплантации, когда масса опухолей достигала приблизительно 50 мг, начинали лечение. Мышей разделяли на группы по применяемому лечению, которые включали: 1) плацебо (физиологический раствор), 2) антитело против PD1 (крысиный клон RMP1-14, Bio X Cell, West Lebanon, New Hampshire, US), 3) IL-18 дикого типа, 4) mCS2, 5) IL-18 дикого типа+антитело против PD-1 и 6) CS2 IL-18+антитело против PD1. Антитело против PD-1, IL-18 дикого типа и mCS2 IL-18 вводили путем интраперитонеальной инъекции два раза в неделю в дозе 8 мг/кг, 0,32 мг/кг и 0,32 мг/кг, соответственно. Мышей подвергали мониторингу на наличие признаков клинической токсичности, и рост опухоли определяли два раза в неделю с помощью штангенциркуля. Мышей умерщвляли, когда диаметр опухоли в месте наибольшего измерения достигал или превышал 1,5 см; это считалось конечной точкой проведения исследования на выживание анализа выживания.
Аналогичным образом с небольшими изменениями проводили исследования B2m-дефицитных клеток линии YUMMER1.7. Проводили пересадку 1,0 × 106 клеток, поскольку опухоли росли медленнее, чем родительский штамм. Лечение заключалось в введении физиологического раствора, антитела против PD1 плюс антитело против CTLA4 и mCS2, вводимых по той же схеме и в тех же дозах, что и в приведенных выше исследованиях.
Далее описаны результаты экспериментов.
Ось IL-18 в качестве мишени при иммунотерапии рака
С целью идентификации потенциальных узлов сигнального пути для иммунотерапевтического вмешательства, проводили анализ данных по секвенированию РНК отдельных клеток из противоопухолевые эффекторных лимфоцитов для экспрессии компонентов сигнального пути цитокинов (Singer et al., 2016, Cell, 166: 1500-1511, e1509). Как видно на фигуре 1А, субъединицы рецептора для IL-18-IL-18Rα (то есть, IL-18R1) и IL-18Rβ (то есть, IL-18RAP), а также самого по себе IL-18 были сверхрегулированы как в программах активированных лимфоцитов, так и в программах дисфункциональных лимфоцитов. Дальнейший анализ базы данных иммунологического генома (ImmGen) показал, что экспрессия обеих субъединиц рецептора IL-18 коррелировала с экспрессией маркеров "истощения" Т-клеток в клетках CD4 и CD8, включая PD-1, Tim3, Lag3 и TIGIT, после длительного воздействия антигена (фигура 1B). Эти особенности экспрессии позволяют предположить, что путь IL-18 можно использовать для селективной стимуляции активированных и дисфункциональных/истощенных Т-клеток в опухолях в качестве теоретически обоснованного подхода при иммунотерапии.
IL-18 представляет собой Th1 цитокин, первоначально названный "интерферон-гамма-индуцирующим фактором" (IGIF) из-за его способности надежно стимулировать высвобождение Т-клетками и NK-клетками интерферона-гамма (IFN-γ). Ингибирования IL-18 по принципу обратной связи достигается путем IFN-γ-запускаемой индукцией IL-18BP, секретируемого высокоаффинного рецептора-ловушки для IL-18, который стерически препятствует способности IL-18 связывать и активировать его рецептор (фигура 2А). Не привлекая в качестве обоснования какую-либо конкретную теорию, тем не менее, можно предположить, что этот механизм напоминает индукцию PD-L1 при воздействии IFN-γ, указывая на то, что IL-18BP может действовать как "растворимая иммунная контрольная точка". На основе этой гипотезы было обнаружено с использованием базы данных Атласа генной антологии и генома рака (TCGA) и базы данных ONCOMINE, что IL-18BP сверхрегулируется при нескольких типах рака, в частности, при раке молочной железы, раке желудка и раке головного мозга (фигура 2B). Кроме того, экспрессия IL-18BP сильно коррелирует с экспрессией ключевой иммунной контрольной точки PD-1 в опухолях (r=0,65 и 0,78 при раке желудка и раке молочной железы, соответственно, фигура 2C), что позволяет предположить, что IL-18BP также может способствовать ускользание опухоли от иммунологического надзора и истощению лимфоцитов.
Рекомбинантный IL-18 вводили больным раком при проведении многочисленных клинических испытаний. Было обнаружено, что он хорошо переносится даже при высоких дозах 2 мг/кг со стабильными фармакодинамическими результатами, включающими увеличение числа активированных CD69+ естественных клеток-киллеров (NK) и резкое повышение уровней IFN-γ в сыворотке. Однако клиническое испытание в фазе II пациентов с меланомой было прекращено в связи с отсутствием эффективности лечения. Анализ представленных результатов фармакодинамики, полученных в результате этих клинических испытаний, показывает, что эффективность rIL-18 снижается при повторном дозировании, при этом наблюдается тахифилаксия в отношении активации/экспансии периферических NK-клеток и высвобождения цитокинов (в том числе IFN-γ и GM-CSF). Снижение эффективности rIL-18 совпадает с выраженным увеличением уровней IL-18BP в сыворотке крови более чем в два раза по сравнению с уровнями до проведения лечения и часто превышают 100 нг/мл. Не привлекая в качестве обоснования какую-либо конкретную теорию, тем не менее, можно предположить, что IL-18BP ограничивает эффективность терапии rIL-18, и что варианты IL-18, неподдающиеся ингибирующему воздействию IL-18BP, могут служить эффективными противоопухолевыми иммунотерапевтическими средствами. Кроме того, вероятно, что могут быть эффективными при иммунотерапии опухолей ингибиторы IL-18BP.
Конструирование вариантов IL-18, которые резистентны к ингибирующему действию IL-18BP (вариантов DR-IL-18 человека)
Для получения вариантов IL-18, которые могут передавать сигналы через IL-18Rα/IL-18Rβ, но не подвержены ингибирующему действию IL-18BP, использовали направленное развитие с применением технологии дрожжевого поверхностного дисплея. Сначала проводили анализ структуры трехкомпонентного комплекса сигнального пути человеческого IL-18:IL-18Rα:IL-18Rβ (PDB=3OW4), и идентифицировали остатки IL-18, которые имеют общий интерфейс с комплексом сигнального пути и IL-18BP (фигура 3А). Поскольку не была определена структура hIL-18:hIL-18BP, использовали родственный комплекс между IL-18 и вирусным (вирус оспы мышей) ортологом IL-18BP (PDB=3F62). Создавали комбинаторную библиотеку, рандомизирующую этот набор остатков в определенный набор альтернатив (смотрите таблицу 1), используя вырожденные олигонуклеотидные праймеры и сборочную ПЦР. Эту библиотеку электропорировали в дрожжи вместе с N-концевым вектором дрожжевого дисплея pYAL с получением библиотеки с 2,5 × 108 трансформантов. Используя эту библиотеку, осуществляли направленное развитие путем проведения последовательных раундов отбора с использованием магнитной и флуоресцентной сортировки клеток (FACS) с рекомбинантным hIL-18Rα и отрицательного отбора с hIL-18BP, как это показано на фигуре 3B. После пяти раундов отбора, явное большинство библиотечных клонов полностью поменяли их относительные предпочтения в отношении hIL-18BP и hIL-18Rα по сравнению с WT hIL-18 (фигура 3C). Эти клоны обозначали как варианты "DR-hIL-18", где "DR" означает "резистентный к рецептору- ловушке".
Секвенирование 96 клонов из пула после пятого раунда позволило выявить 21 уникальную последовательность, которые были проанализированы по поводу возможности создания четырех "консенсусных последовательностей", hCS1-4 (фигура 4). Для оценки аффинности связывания этих вариантов в отношении hIL-18Rα и hIL-18BP, были построены изотермы связывания для связывания hIL-18Rα и IL-18BP с использованием вариантов цитокинов, получаемых технологией дрожжевого дисплея, и проточной цитометрии. Как видно на фигуре 5А, варианты DR-hIL-18 связывали hIL-18Rα с аффинностью, сравнимой с аффинностью в случае IL-18 WT, но демонстрировали значительно более слабое связывание с hIL-18BP, при этом кажущиеся значения EC50 для связывания значительно превышали 1 мкМ. С целью дополнительной характеристики активности вариантов DR-IL-18 по связыванию рецептора, экспрессировали рекомбинантно цитокины и проводили исследование IL-18Rα и IL-18BP методом поверхностного плазмонного резонанса (смотрите типичные сенсограммы на фигуре 5B). Эти результаты представлены в таблицах 6 и 7, и они показывают, что варианты DR-hIL-18 характеризуются значительно более низким, на несколько порядков величины, предпочтением в отношении IL-18BP по сравнению с предпочтением в отношении IL-18Rα .
Таблица 6. Аффинности связывания вариантов человеческого IL-18 с IL-18Rα и IL-18BP на основе изотерм связывания, полученных технологией дрожжевого дисплея.
IL-18BP/IL-18Rα
NBD, не было обнаружено связывания (для расчетов отношения использовали 20 мкM);
------, величину не определяли.
Таблица 7. Аффинности связывания вариантов человеческого IL-18 с IL-18Rα и IL-18BP на основе исследований методом поверхностного плазмонного резонанса (SPR)
IL-18BP/IL-18Rα
------, величину не определяли.
Функциональная характеристика вариантов DR-IL-18 человека
В упомянутой выше публикации Kim et al., 2001, Proc Natl Acad Sci USA, 98 (6): 3304-9) описаны 3 варианта hIL-18 с повышенной активностью и предполагаемым снижением ингибирующего действия на них IL-18BP, а именно: E42A, K89A и E42A/K89A. Эти варианты цитокинов были получены технологией дрожжевого дисплея, и ингибирующее действие IL-18BP на связывание IL-18Rα оценивали с помощью проточной цитометрии. Как видно на фигуре 6А, в то время как варианты DR-hIL-18 были невосприимчивы к ингибирования связывания hIL-18Rα при воздействии hIL-18BP, варианты, описанные в публикации Kim et al., демонстрировали примерно эквивалентную нейтрализацию hIL-18BP по сравнению с WT hIL-18. Эти результаты показывают, что варианты DR-hIL-18 не зависят от IL-18BP, тогда как варианты, описанные в публикации Kim et al., очень чувствительны к ингибирующему действию IL-18BP, подобно WT hIL-18.
Для подтверждения того, что DR-hIL-18 может обеспечивать эффективную передачу сигналов через рецептор IL-18 в клетках, проводили эксперименты по исследованию зависимости концентрация-эффект с использованием линии репортерных клеток HEK-blue IL-18. В этой системе, передача сигналов IL-18R считывается путем экспрессии секретируемой щелочной фосфатазы (SEAP) ниже молекул промотора NFκb/AP1. В отсутствие IL-18BP, варианты DR-hIL-18 давали величины EC50 для передачи сигналов, соразмерные с WT hIL-18. Однако варианты DR-hIL-18 продемонстрировали практическое отсутствие ингибирования при воздействии hIL-18BP, при этом не обнаруживалось ингибирование при 1 мкМ IL-18BP (фигура 6B). Взятые в совокупности, результаты этих исследований показывают, что варианты DR-hIL-18 являются биологически активными и невосприимчивыми к нейтрализующему действию IL-18BP при клеточной сигнализации.
Конструирование и характеристика вариантов второго поколения человеческого IL-18, резистентных к ингибирующему воздействию IL-18BP (варианты v2.0 DR-IL-18 человека)
Для получения дополнительных потенциально более активных вариантов человеческого DR-IL-18, конструировали вторую библиотеку человеческого IL-18, рандомизированную при 11 положениях (фигура 7А), и трансформировали дрожжи, как описано выше. Отбирали полученную библиотеку, содержащую 6 × 108 трансформантов, как показано на фигуре 7В, получая стабильное предпочтение в отношении IL-18Rα по сравнению с IL-18BP процессе последовательных стадий отбора (фигура 7C). Извлекали 17 уникальных последовательностей после 5-6 раундов отбора (фигура 8). На фигура 9А показано, что по сравнению с WT IL-18, клоны 6-12, 6-27, 6-29 и 6-31 имели эквивалентное или более сильное связывание с IL18Rα, которое измеряли на основе изотерм связывания с биотинилированным IL18Rα, используя технологию дрожжевого дисплея. Однако на фигуре 9В показано, что эти клоны не демонстрируют заметного связывания с IL-18BP. На фигуре 9С показано проведение измерения термостабильности полученных технологией дрожжевого дисплея клонов в диапазоне температур, которые показывают, что клоны являются более термостабильными, чем WT IL-18 в диапазоне температур 7-13°С. Эти результаты представлены на фигуре 9D.
Конструирование вариантов IL-18, которые резистентны к ингибирующему действию IL-18BP (мышиные варианты DR-IL-18)
Поскольку межвидовая перекрестная реактивность IL-18 человека и мыши относительно IL-18Rα является низкой, создавали мышиные эквиваленты вариантов DR-IL-18, которые можно было бы использовать для исследований на мышах. Аналогично подходу, используемому выше для hIL-18, создавали комбинаторную библиотеку вариантов mIL-18, рандомизирующую подобный набор контактных остатков mIL-18Rα/mIL-18BP (таблица 3), получая в результате библиотеку из 4 × 108 трансформантов. На этой библиотеке проводили направленное развитие аналогично тому, как это проводилось в случае библиотеке человеческого IL-18; стратегия отбора показана на фигуре 10А. После завершения шести раундов отбора, оставшиеся клоны имели почти полное предпочтение в отношении mIL-18Rα по сравнению с mIL-18BP (фигура 10B). Анализ 96 клонов выявил 11 уникальных последовательностей, из которых были получены две консенсусные последовательности mCS1 и mCS2 (фигура 10C). Изотермы связывания на дрожжевом дисплее и эксперименты по исследованию методом поверхностного плазмонного резонанса подтвердили, что эти клоны DR-IL-18 имеют даже большую независимость в отношении IL-18BP, чем описанные здесь варианты человеческого IL-18, причем KD связывания mIL-18BP имеет величину значительно выше 1 мкМ, а величина связывания mIL-18Rα остается примерно эквивалентной величине связывания для WT mIL-18 (фигура 11А, фигура 11В, таблицы 8 и 9).
Таблица 8. Аффинности связывания IL-18Rα и IL-18BP вариантов мышиного IL-18 на основе изотерм связывания, полученных технологией дрожжевого дисплея
IL-18BP/IL-18Rα
NBD, не было обнаружено связывания (для расчетов отношения использовали 10 мкM).
Таблица 9. Аффинности связывания вариантов мышиного IL-18 с IL-18Rα и IL-18BP на основе исследований методом поверхностного плазмонного резонанса (SPR)
IL-18BP/IL-18Rα
NBD, не было обнаружено связывания (для расчетов отношения использовали 30 мкM).
Фармакодинамические исследования in vivo вариантов DR-IL-18
С целью оценки биологических эффектов в результате введения вариантов DR-IL-18 in vivo, проводили фармакодинамические исследования на мышах, сравнивая WT mIL-18 с mCS2. В первом исследовании, мышей подвергали лечению путем введения плацебо (PBS), mIL-18 (1 мг/кг/сутки) или mCS2 (1 мг/кг/сутки), что суммарно составляло семь инъекций (фигура 12А). Анализ фенотипов периферической крови методом проточной цитометрии показал, что введение как WT mIL-18, так и mCS2, приводило к увеличению количества NK-клеток периферической крови более чем в десять раз и количества моноцитов периферической крови более чем в пять раз по сравнению с введением плацебо, не оказывая существенного влияния на общее количество клеток CD4 и CD8 (фигура 12B). Изучение статуса клеточной активации путем индукции CD69 показало, что лечение с помощью mCS2 резко увеличивало уровни CD69 в клетках CD4 и CD8 по сравнению с введением mIL-18 или плацебо, позволяя достигать от 30% до более 50% положительных результатов для субпопуляций CD4 и CD8, соответственно (фигура 12С). В то время как mIL-18 и mCS2 стимулировали экспрессию CD69 на NK-клетках периферической крови до уровня более 20% положительных результатов на 3-й день, уровни CD69 снижались до незначительных величин при введении mIL-18 на 6-ой день, но оставались значительно повышенными при введении mCS2 (фигура 12С). Уровни цитокинов периферической крови также измеряли методом мультиплексного иммуноанализа на основе технологии Luminex. Как видно на фигуре 12D, введение mIL-18 и mCS2 увеличивало содержание IFN-g, MIP1b и G-CSF в сыворотке крови по сравнению с введением плацебо, но mCS2 позволял достигать гораздо более высоких уровней, чем mIL-18, на 6-й день в случае каждого из этих цитокинов, так как mIL-18 характеризовался проявлением тахифилаксии со стабилизацией или снижением уровня индуцированных цитокинов при последующем введении.
Влияние mCS2 на содержание жировой ткани
С целью оценки влияния вариантов DR-IL-18 на содержание жировой ткани, вводили мышам линии C57BL/6 путем интраперитонеальной инъекции каждый день в течение трех дней WT IL-18 в дозе 1 мг/кг, или 0,01, 0,1 или 1 мг/кг mCS2. Проводили мониторинг содержания жировой ткани и нежировых тканей методом на основе технологии EchoMRI™. Все подвергнутые испытаниям дозы mCS2 (1 мг/кг, 0,1 мг/кг и 0,01 мг/кг) приводили к резкому снижению суммарного процента жировой ткани на 12-ый день, в то время как в случае мышей, которым вводили плацебо и mIL-18, не обнаруживалось значительного изменения суммарного содержания жировой ткани (фигура 13, сверху). В частности, мыши, которым вводили mCS2, характеризовались либо пониженными, либо стабильными уровнями суммарной массы жира во время проведения эксперимента (фигура 13, внизу слева), но у них существенно увеличивалось суммарное содержание нежировых тканей (фигура 13, внизу справа). Эти результаты указывают на то, что mCS2 и другие варианты, раскрытые в изобретении, могут применяться для терапевтического снижения содержания жировой ткани (например, при лечении ожирения, диабета и/или метаболического синдрома).
Противоопухолевая активность вариантов DR-IL-18
Противоопухолевую активность DR-IL-18 (mCS2) оценивали на модели трансплантируемой сингенной опухоли злокачественной меланомы YUMMER1.7. на мышах. Мышам, несущим опухоли YUMMER1.7WT, вводили раз в две недели mIL-18 и mCS2 в дозе 0,32 мг/кг при совместном введении или без совместного введения антител против PD1 (8 мг/кг/q3d). В соответствии с ранее опубликованными данными по применению WT IL-18 на мышах и людях, WT IL-18 не влиял на рост опухоли или выживаемость по сравнению с плацебо (физиологическим раствором) и лишь незначительно повышал активность антитела против PD1 при комбинированном введении. Однако, применение mCS2 в форме монотерапии позволяло достигать выздоровления у 27% подвергнутых лечению мышей и частичной ремиссии еще у 27% мышей, то есть достигать эффекта, который соизмерим с лечением с помощью антитела против PD1. Комбинация mCS2 с антителом против PD1 позволяла достигать выздоровления у 80% подвергнутых лечению мышей (фигура 14А и фигура 14В).
Для выяснения механизма действия DR-IL-18 на опухоли YUMMER1.7, проводили исследования по истощению клеток с использованием антител против CD8, CD4, NK1.1 и интерферона-гамма. Как видно на фигуре 15A и фигуре 15B, истощение клеток CD8 или нейтрализация интерферона-гамма полностью аннулирует активность DR-IL-18. Истощение клеток CD4 не влияло на начальную активность DR-IL-18 с точки зрения роста опухоли, однако, у CD4 обработанных мышей терапевтические ответы являются неустойчивыми, что свидетельствует о роли клеток CD4 в поддержании противоопухолевого иммунитета. Истощение NK-клеток не влияло на опухолевый рост или выживаемость клеток YUMMER1.7.
Кроме того, дополнительно оценивали активность DR-IL-18 на модели иммуногенной колоректальной опухоли MC38. Сначала проводили исследование по подбору величины дозы путем введения физиологического раствора, IL-18 WT (1 мг/кг два раза в неделю) или введения DR-IL-18 в диапазоне доз 0,01 мг/кг, 0,1 мг/кг или 1 мг/кг два раза в неделю. Как видно на фигуре 16, WT IL-18 не оказывал влияния на рост опухоли, тогда как DR-IL-18 (mCS2) проявлял дозозависимую активность, замедляя рост опухоли при дозе 0,1 мг/кг и вызывая регресс опухоли при дозе 1 мг/кг. Затем группы расширяли и оценивали проявление возможного синергетического эффекта в комбинации с ингибитором иммунных контрольных точек. И в этом случае, WT IL-18 не оказывал действия при применении в форме монотерапии и не влиял на повышение активности антитела против PD1. В отличие от этого, DR-IL-18 проявлял высокую активность при монотерапии, соразмерную или превосходящую активность антитела против PD1, а комбинированная терапия с антителом против PD1 оказывала чрезвычайно высокое синергетическое действие, приводящее к полному регрессу опухоли у всех подвергнутых лечению мышей (фигура 17).
Для дополнительного выяснения механизм действия DR-IL-18, проводили исследования методом проточной цитометрии иммунного инфильтрата опухолей MC38 у мышей, которым вводили физиологический раствор, WT IL-18 или DR-IL-18 (mCS2). По сравнению с физиологическим раствором или WT IL-18, введение DR-IL-18 увеличивало инфильтрацию CD8 и NK-клеток на один мг опухоли и, кроме того, приводило к сверхрегуляции маркеров активации эффекторных клеток, таких как гранзим B и KLRG1 (фигура 18A, верхний ряд). В отличие от других методов лечения с помощью цитокинов, таких как IL-2 или IL-15, введение DR-IL-18 не увеличивает соотношение CD8:Treg в опухолях по сравнению с введением физиологического раствора. Однако введение DR-IL-18 приводит к возникновению более благоприятного опухолевого иммунного микроокружения за счет увеличения отношения клеток CD8 к опухолевым макрофагам (ТАМ) и клеткам-супрессорам, образовавшихся из моноцитарных и гранулоцитарных миелоидов (MDSC). Кроме того, также измеряли профиль высвобождения вторичных цитокинов в сыворотке крови тех же мышей с использованием анализа Luminex. Как видно на фигуре 18B, введение DR-IL-18 увеличивало системные уровни интерферона-гамма, IL-7 и IL-15 более чем в 100 раз по сравнению с введением WT IL-18. Взятые в совокупности, эти результаты показывают, что DR-IL-18 обладает противоопухолевой активностью, обусловленной уникальным механизмом действия, отличным от механизма действия IL-2, IL-15 или WT IL-18.
Можно было бы предположить, что некоторые из вторичных цитокинов, индуцированных в результате проведения терапии с помощью DR-IL-18, потенциально могут способствовать токсическому действию и/или снижению активности. Например, IL-17, который сверхрегулируется более чем в 100 раз под воздействием DR-IL-18, способствует развитию колита и псориаза и, кроме того, стимулирует гранулоциты, которые могут стать иммуносупрессивными клетками-супрессорами, образовавшимися из миелоидных клеток. IL-5 и IL-13 являются цитокинами типа 2, которые также сверхрегулируются под воздействием DR-IL-18, могут способствовать возникновению аллергии, обострению астмы или анафилаксии. Т-клетки 2-го типа (Th2) не способствуют возникновения иммунотерапевтических ответов и могут промотировать развитие иммунодепрессивных Treg-клеток. По существу, в некоторых случаях, активность и безопасность DR-IL-18 можно повысить путем селективного ингибирования нежелательных вторичных цитокинов, таких как IL-17, IL-5 и IL-13, например, с помощью нейтрализующего антитела.
Многие опухоли являются резистентными к ингибированию иммунных контрольных точек, либо при начальном проявлении (первичная резистентность), либо после первоначальной ответной реакции на лечение (вторичная резистентность). Наиболее распространенной причиной резистентности к лечению путем ингибирования контрольных точек является потеря презентации антигена через молекулы MHC класса I. Потеря поверхностных молекул MHC класса I классически ассоциируют с цитолизом, опосредованным NK-клетками, однако NK-клетки могут истощаться в MHC I-дефицитных опухолях. Поскольку NK-клетки экспрессируют IL-18R, а ранее полученные результаты в MC38 показали, что NK-клетки размножаются и активируются при воздействии DR-IL-18, то поэтому были проведены исследования возможности с помощью DR-IL-18 стимулировать атаку NK-клеток против MHC I-дефицитных опухолей. Использовали CRISPR/cas9 для нокаута B2m в клеточной линии Yummer1.7, и было обнаружено, что имплантированные B2m-дефицитные опухоли YUMMER1.7 были невосприимчивыми даже к комбинированной терапии как с антителом против CTLA4, так и с антителом против PD1 (фигура 19A и фигура 19B), к комбинации, которая обычно приводит к излечению почти 100% родительских опухолей Yummer1.7. Однако монотерапия с применением DR-IL-18 (mCS2) приводила к излечению 60% B2m-дефицитных опухолей Yummer1.7, зависимым от NK-клеток образом, так как истощение анти-NK1.1 аннулировало это действие (фигура 19A и фигура 19B). Были проведены эксперименты для выяснения влияния DR-IL-18 на внутриопухолевые NK-клетки в MHC I-дефицитных опухолях. Исследования по иммунофенотипированию проводили методом проточной цитометрии на B2m-дефицитных опухолях Yummer.17 у мышей, которым вводили физиологический раствор или DR-IL-18. Через 24 часа после введения 3-й дозы, мышей умерщвляли, опухоли диссоциировали, и суспензию клеток обрабатывали с помощью PMA/ иономицин в течение четырех часов. Затем определяли пролиферативный индекс и функциональную способность NK-клеток методом внутриклеточной проточной цитометрии с использованием Ki67 и интерферон-гамма. Как видно на фигуре 19C, NK-клетки из В2m-дефицитных опухолей Yummer1.7 мышей, которым вводили физиологический раствор, имели низкие уровни продукции интерферона-гамма и Ki67, что указывает на истощенный фенотип. В отличие от этого, NK-клетки из опухолей мышей, которым вводили DR-IL-18, имели высокие уровни продукции интерферона-гамма и Ki67, при этом большинство NK-клеток были положительными по обоим маркерам. Таким образом, эти результаты позволяют сделать вывод, что DR-IL-18 проявляет активность при лечении опухолей с дефицитом МНС класса I, которые устойчивы к блокаде иммунных контрольных точек, зависимым от NK-клеток образом.
Эти результаты позволяют считать DR-IL-18 очень перспективным иммунотерапевтическим противоопухолевым средством, и предоставляют убедительные доказательства того, что IL-18BP значительно ограничивает эффективность терапии с помощью IL-18, принимая во внимание значительно более высокую активность варианта mCS2 DR-IL-18. На основе этих результатов, можно предположить, что другие стратегии, такие как блокирование IL-18BP с помощью антитела, небольшого белка и/или малой молекулы, могут повышать эффективность терапии с помощью IL-18 и другие схемы иммунотерапии.
Были предприняты усилия для конструирования антагониста IL-18BP путем создания вариантов "рецептор ловушка с рецептором ловушкой" (D2D) или вариантов IL-18, которые специфически связывают IL-18BP, но не связывают IL-18Rα и, следовательно, не передают сигнал. Потенциальное преимущество такого лекарственного средства заключается в том, что оно может служить для нейтрализации IL-18BP и повышения активности эндогенного IL-18, в отличие от запуска IL-18R системной передачи сигналов. Поэтому, рандомизировали IL-18 в контактных положениях для IL-18Rα (фигура 20А), и готовили библиотеку человеческого и мышиного DR-IL-18 с использованием описанной выше технологии дрожжевого дисплея. Полученную библиотеку из 3,9 × 108 трансформантов отбирали в течение 3 раундов, как показано на фигуре 20B, проводя отбор на остаточное связывание с IL-18BP, в то же время проводя отрицательный отбор против IL-18Rα. Как видно на фигуре 20C, каждый раунд отбора обеспечивал обогащение связывания с IL-18BP (у человека и мыши), но без приобретения связывания IL-18Rα. Подвергали секвенированию 96 клонов с получением 31 уникальной последовательности, из которой были образованы три консенсусные последовательности hD2D-CS1, hD2D-CS2 и hD2D-CS3 (фигура 21). Биофизическое исследование полученных клонов свидетельствовало о том, что они характеризовались изотермами связывания с IL-18BP, аналогичными изотермам связывания с WT IL-18 (фигура 22A), но сильно ослабленным/отсутствующим связыванием с IL-18Rα (фигура 22B). Эти данные представлены на фигуре 22C. Аналогичный процесс отбора проводили для мышиного IL-18 с созданием библиотеки из 2,0 х 108 трансформантов, в результате чего был произведен отбор с получением 51 уникальной последовательности (результаты представлены на фигуре 23).
Пример 2. Измерение аффинности связывания вариантов второго поколения
Для биофизического измерения аффинности вариантов DR-IL-18 второго поколения (связывание с IL-18R по сравнению со связыванием с IL-18BP) использовали метод поверхностного плазмонного резонанса (SPR). На фигуре 24 представлены полученные сенсограммы. Результаты кинетических исследований приведены в таблице 10, результаты измерений аффинности представлены в таблице 11, а в таблице 12 приведены обобщенные результаты, включающие отношения констант диссоциации вариантов DR-IL-18 второго поколения.
Таблица 10. Данные результатов кинетических исследований методом SPR для вариантов hDR-IL-18 второго поколения
(1/сек)
эксперимент 2
эксперимент 1
Таблица 11. Данные результатов измерения аффинности методом SPR для вариантов hDR-IL-18 второго поколения
Таблица 12. Результаты измерений аффинности методом SPR. Результаты измерений аффинности вариантов hDR-IL-18 второго поколения в отношение IL-18Ra и IL-18BP методом SPR. Отношение константы диссоциации IL-18 BP:Ra представляет собой отношение KD для IL-18BP к KD для IL-18Ra, нормализованное к тому же отношению в случае WT IL-18. Более высокая величина этого соотношения указывает на то, что вариант IL-18 имеет повышенное предпочтение к связыванию IL-18Ra, чем к связыванию IL-18BP по сравнению с WT IL-18. *Среднее по результатам 2 измерений. k является кратно 1000, m является кратным 1000000.
KD Ra (нM)
KD BP (нM)
Пример 3. Эффективность при лечении рака
Исследовали эффективность вариантов DR-IL-18 с использованием различных моделей рака, включая модели колоректальных опухолей, рака молочной железы, меланомы и опухолей с дефицитом МНС I класса, которые резистентны к ингибиторам иммунных контрольных точек. Результаты показывают, что варианты DR-IL-18 с преобладанием связывания IL-18R, но не IL-18BP, могут быть использованы для лечения широкого спектра раковых заболеваний (причем не только тех типов рака, которые были исследованы).
На фигурах 25А и 25В представлены данные, демонстрирующие эффективность DR-IL-18 на модели колоректальной опухоли CT26. Мышам имплантировали подкожно 250000 клеток линии CT26, и лечение начинали на 7-й день после того, как размер опухолей составлял в среднем ~60 мм3. Вводили WT IL-18 и mCS2 в дозе 0,32 мг/кг два раза в неделю, суммарно 5 доз. Вводили антитело против PD1 в дозе 10 мг/кг по той же схеме. (A) Представлены кривые восприимчивости роста опухоли у животных, которым вводили физиологический раствор (PBS), черными линиями (кружками), WT IL-18 голубыми линиями (квадратами) и DR-IL-18 (mCS2) розовыми линями (треугольники). Только введение DR-IL-18, но не WT IL-18, приводило к ингибированию роста опухоли и клиренсу опухоли у подгруппы животных. (B) Представлены кривые выживаемости для мышей, которым вводили антитело против PD-1, WT IL-18 и DR-IL-18 (mCS2). Число полных ответов указаны в скобках. Введение DR-IL-18, но не WT IL-18, приводило к увеличению выживаемости и к клиренсу опухоли у 40% мышей, улучшению по сравнению с ингибитором иммунной контрольной точкой антителом против PD-1.
На фигурах 26A и 26B приведены данные, демонстрирующие активность DR-IL-18 в модели рака молочной железы 4T1 и модели меланомы B16-F10. (А) Представлены кривые роста опухолей 4Т1, инокулированных мышам линии BALB/C после введения физиологического раствора (PBS; черного цвета), введения WT IL-18 (синего цвета) или введения DR-IL-18 варианта CS2 (розового цвета). (B) Представлены кривые роста опухолей B16-F10, имплантированных мышам линии C57BL/6 после введения физиологического раствора (PBS; черного цвета), введения WT IL-18 (синего цвета) или введения DR-IL-18 варианта CS2 (розового цвета). В обеих моделях только введение DR-IL-18, но не WT IL-18, приводило к ингибированию роста опухоли. Введение проводили после того, как средний размер опухоли превышал 50 мм3, как указано в прямоугольниках, помеченных буквой "t".
На фигурах 27А и 27В приведены данные, которые дополняют данные, представленные на фигурах 19А - 19С. Представленные данные демонстрируют активность DR-IL-18 при лечении в случае дополнительных моделей опухолей с дефицитом молекул МНС I класса, которые резистентны к ингибиторам иммунных контрольных точек. (A) Клетки MC38 с дефицитом B2m получали с использованием опосредованной CRISPR/Cas9 делеции, описанной для клеток YUMMER с дефицитом B2m. Имплантировали подкожно клетки B2m-/-MC38, и начинали лечение на 7-й день после того, как размеры опухолей в среднем составляли ~65 мм3. mCS2 вводили в дозе 0,32 мг/кг два раза в неделю суммарно 5 доз. Антитело против PD1 и антитело против CTLA4 вводили в дозе 8 мг/кг по той же схеме. (B) RMA/S является вариантом линии лимфомы RMA, который содержит спонтанную мутацию в TAP-ассоциированном гликопротеине. Результатом является дефект в загрузке антигена и, следовательно, снижение поверхностной экспрессии молекул МНС класса I. Он является конгенным для линии мышей C57BL/6C57BL и устойчивым к ингибиторам иммунных контрольных точек. Мышам имплантировали подкожно 1000000 клеток RMA/S и начинали лечение на 7-й день. МКС2 вводили в дозе 0,32 мг/кг два раза в неделю. Антитело против PD1 вводили в дозе 8 мг/кг по той же схеме.
Пример 4. Комбинированная терапия
На фигуре 28 приведены данные, демонстрирующие активность DR-IL-18 в отношении усиления противоопухолевой антителозависимой клеточно-опосредованной цитотоксичности (ADCC) (поддерживающая комбинированная терапия с опсонизирующими агентами, такими как нацеленные на опухоль антитела). В исследованиях цитотоксичности ex vivo использовали клетки линии Raji (В-клеточной лимфомы), меченные с помощью CFSE, и выделенные мононуклеарные клетки периферической крови человека (РВМС). РВМС и меченые клетки Раджи инкубировали вместе при соотношении эффектор:мишень (E:T) 1:10 в течение 25 часов. На указанные образцы наносили вариант hCS-1 человеческого DR-IL-18 (1 мкМ), ритуксимаб (10 мкг/мл) или комбинацию обоих средств. Цитотоксичность определяли с помощью проточной цитометрии и рассчитывали как долю клеток CFSE, которая стала DAPI-положительной. *p <0,05 по двустороннему анализу ANOVA с коррекцией Тьюки для множественных сравнений.
Пример 5. Эффективность против вирусной инфекции
На фигурах 29А и 29В приведены данные, демонстрирующие противовирусную активность вариантов DR-18 при лечении вирусных инфекций (например, вирусной инфекции, например, в этом иллюстративном примере, при лечении системной инфекции вирусом осповакцины использовали вариант mCS2). (А) Схема плана эксперимента. Мышей линии C57BL/6 внутрибрюшинно (IP) инфицировали с помощью 106 БОЕ вируса осповакцины (VACV) и вводили внутрибрюшинно 1 мг/кг WT mIL-18 или mCS2. Мышей умерщвляли и определяли вирусные титры в крови и яичниках методом полимеразной цепной реакции с обратной транскрипцией (RT-PCR) на 3-ий день после инфицирования. (B) Количественная оценка вирусных копий VACV в яичниках и крови подвергнутых обработке мышей на 3-й день после заражения. Лечение с помощью CS2 показало значительное снижение вирусных титров, тогда как лечение с помощью WT IL-18 было неэффективным. *р <0,05, **р <0,01, ***р <0,001.
Пример 6. Варианты DR-IL-18 человека второго поколения
На фигуре 30А приведены данные, демонстрирующие активность вариантов DR-IL-18 человека второго поколения. На фигуре 30А показано, что WT IL-18 и h6-12, h6-27, h6-29 и h6-31 стимулируют репортерные клетки IL-18 HEK-Blue. h6-12, h6-27 и h6-29 демонстрируют повышенную активность по сравнению с WT hIL-18, тогда как h6-31 обладает такой же активностью, что и WT hIL-18. Таким образом, данные демонстрируют, что все подвергнутые испытаниям варианты человеческого DR-IL-18 второго поколения активно передают сигналы через IL-18R.
Аминокислотные последовательности IL-18 дикого типа
Человеческий интерлейкин-18 (зрелая форма)
YFGKLESKLSVIRNLNDQVLFIDQGNRPLFEDMTDSDCRDNAPRTIFIISMYKDSQPRGMAVTISVKCEKISTLSCENKIISFKEMNPPDNIKDTKSDIIFFQRSVPGHDNKMQFESSSYEGYFLACEKERDLFKLILKKEDELGDRSIMFTVQNED (SEQ ID NO: 30)
Мышиный интерлейкин-18 (зрелая форма)
NFGRLHCTTAVIRNINDQVLFVDKRQPVFEDMTDIDQSASEPQTRLIIYMYKDSEVRGLAVTLSVKDSKMSTLSCKNKIISFEEMDPPENIDDIQSDLIFFQKRVPGHNKMEFESSLYEGHFLACQKEDDAFKLILKKKDENGDKSVMFTLTNLHQS (SEQ ID NO: 31)
Q14116|IL18_человеческий интерлейкин-18 (нерасщепленный предшественник)
MAAEPVEDNCINFVAMKFIDNTLYFIAEDDENLESDYFGKLESKLSVIRNLNDQVLFIDQGNRPLFEDMTDSDCRDNAPRTIFIISMYKDSQPRGMAVTISVKCEKISTLSCENKIISFKEMNPPDNIKDTKSDIIFFQRSVPGHDNKMQFESSSYEGYFLACEKERDLFKLILKKEDELGDRSIMFTVQNED (SEQ ID NO: 32)
P70380|IL18_мышиный интерлейкин-18 (нерасщепленный предшественник)
MAAMSEDSCVNFKEMMFIDNTLYFIPEENGDLESDNFGRLHCTTAVIRNINDQVLFVDKRQPVFEDMTDIDQSASEPQTRLIIYMYKDSEVRGLAVTLSVKDSKMSTLSCKNKIISFEEMDPPENIDDIQSDLIFFQKRVPGHNKMEFESSLYEGHFLACQKEDDAFKLILKKKDENGDKSVMFTLTNLHQS (SEQ ID NO: 33)
Аминокислотные последовательности вариантов поколения 1 человеческого интерлейкин-18, резистентных к рецептору-ловушке
Аминокислотные последовательности вариантов поколения 2 человеческого интерлейкин-18, резистентных к рецептору-ловушке
Аминокислотные последовательности вариантов мышиного интерлейкин-18, резистентных к рецептору-ловушке
Аминокислотные последовательности вариантов "рецептор ловушка с рецептором ловушкой" (D2D) человека
Аминокислотные последовательности вариантов "рецептор ловушка с рецептором ловушкой" (D2D) мыши
Примеры неограничивающих аспектов изобретения
Описанные выше аспекты, в том числе варианты осуществления, объекта настоящего изобретения, позволяют достигать положительного эффекта по отдельности или в комбинации с одним или более другими аспектами или вариантами осуществления. Не ограничивая приведенное выше описание изобретения, ниже представлены конкретные неограничивающие аспекты изобретения в НАБОРЕ АСПЕКТОВ A и НАБОРЕ АСПЕКТОВ B. После ознакомления с описанием изобретения, для обычного специалиста в данной области должно быть очевидным, что может использоваться каждый из пронумерованных аспектов по отдельности или в комбинации с любым из предшествующих или последующих индивидуально пронумерованных аспектов. Предполагается, что это подтверждает все такие комбинации аспектов и не ограничивается комбинациями аспектов, в явном виде предоставленными ниже. Для обычного специалиста в данной области должно быть очевидным, что могут быть сделаны различные изменения и модификации без отклонения от сущности или объема изобретения.
НАБОР АСПЕКТОВ A
1. Композиция, включающая вариант полипептида IL-18, где вариант полипептида IL-18 специфически связывается с рецептором IL-18 (IL-18R) и где вариант полипептида IL-18 проявляет в значительной степени пониженное связывание с IL-18-связывающим белком (IL-18BP).
2. Композиция по п. 1, где вариант полипептида IL-18 включает, по меньшей мере, одну мутацию относительно IL-18 дикого типа (WT IL-18).
3. Композиция по п. 2, где WT IL-18 представляет собой человеческий IL-18, включающий аминокислотную последовательность SEQ ID NO: 30.
4. Композиция по п. 2, где WT IL-18 представляет собой мышиный IL-18, включающий аминокислотную последовательность SEQ ID NO: 31.
5. Композиция по п. 3, где вариант полипептида IL-18 включает, по меньшей мере, одну мутацию, выбранную из группы, состоящей из Y1X, L5X, K8X, M51X, K53X, S55X, Q56X, P57X, G59X, M60X, E77X, Q103X, S105X, D110X, N111X, M113X, V153X и N155X, относительно SEQ ID NO: 30.
6. Композиция по п. 3, где вариант полипептида IL-18 включает, по меньшей мере, одну мутацию, выбранную из группы, состоящей из Y1H, Y1R, L5H, L5I, L5Y, K8Q, K8R, M51T, M51K, M51D, M51N, M51E, M51R, K53R, K53G, K53S, K53T, S55K, S55R, Q56E, Q56A, Q56R, Q56V, Q56G, Q56K, Q56L, P57L, P57G, P57A, P57K, G59T, G59A, M60K, M60Q, M60R, M60L, E77D, Q103E, Q103K, Q103P, Q103A, Q103R, S105R, S105D, S105K, S105N, S105A, D110H, D110K, D110N, D110Q, D110E, D110S, D110G, N111H, N111Y, N111D, N111R, N111S, N111G, M113V, M113R, M113T, M113K, V153I, V153T, V153A, N155K и N155H, относительно SEQ ID NO: 30.
7. Композиция по п. 2, где вариант полипептида IL-18 включает, по меньшей мере, один вариант полипептида IL-18, выбранный из группы, состоящей из SEQ ID NO: 34, SEQ ID NO: 35, SEQ ID NO: 36, SEQ ID NO: 37, SEQ ID NO: 38, SEQ ID NO: 39, SEQ ID NO: 40, SEQ ID NO: 41, SEQ ID NO: 42, SEQ ID NO: 43, SEQ ID NO: 44, SEQ ID NO: 45, SEQ ID NO: 46, SEQ ID NO: 47, SEQ ID NO: 48, SEQ ID NO: 49, SEQ ID NO: 50, SEQ ID NO: 51, SEQ ID NO: 52, SEQ ID NO: 53, SEQ ID NO: 54, SEQ ID NO: 55, SEQ ID NO: 56, SEQ ID NO: 57, SEQ ID NO: 58, SEQ ID NO: 59, SEQ ID NO: 73, SEQ ID NO: 74, SEQ ID NO: 75, SEQ ID NO: 76, SEQ ID NO: 77, SEQ ID NO: 78, SEQ ID NO: 79, SEQ ID NO: 80, SEQ ID NO: 81, SEQ ID NO: 82, SEQ ID NO: 83, SEQ ID NO: 84, SEQ ID NO: 85, SEQ ID NO: 86, SEQ ID NO: 87, SEQ ID NO: 88, SEQ ID NO: 89, SEQ ID NO: 90, SEQ ID NO: 91, или ее фрагмента.
8. Композиция по п. 4, где вариант полипептида IL-18 включает, по меньшей мере, одну мутацию, выбранную из группы, состоящей из N1X, M50X, Y51X, K52X, S54X, E55X, V56X, R57X, G58X, L59X, R104X, N109X и L151X, относительно SEQ ID NO: 31.
9. Композиция по п. 4, где вариант полипептида IL-18 включает, по меньшей мере, одну мутацию, выбранную из группы, состоящей из N1H, N1Y, M50A, M50S, M50V, M50G, M50T, Y51R, K52V, K52S, K52T, K52G, K52A, S54R, S54K, S54G, S54N, E55R, E55H, E55N, E55D, E55G, V56L, V56M, V56R, V56A, V56S, V56Q, R57G, R57K, G58A, L59K, L59R, L59V, R104K, R104L, R104Q, R104S, N109D и L151V, относительно SEQ ID NO: 31.
10. Композиция по п. 2, где вариант полипептида IL-18 включает, по меньшей мере, один вариант полипептида IL-18, выбранный из группы, состоящей из SEQ ID NO: 60, SEQ ID NO: 61, SEQ ID NO: 62, SEQ ID NO: 63, SEQ ID NO: 64, SEQ ID NO: 65, SEQ ID NO: 66, SEQ ID NO: 67, SEQ ID NO: 68, SEQ ID NO: 69, SEQ ID NO: 70, SEQ ID NO: 71, SEQ ID NO: 72, или его фрагмент.
11. Композиция, включающая нуклеиновую кислоту, кодирующую, по меньшей мере, один из вариантов полипептида IL-18 по пп. 1-10.
12. Способ лечения или предотвращения заболевания или нарушения у субъекта, нуждающегося в этом, включающий введение субъекту, по меньшей мере, одной композиции по пп. 1-11.
13. Способ по п. 12, где заболевание или нарушение представляет собой рак.
14. Способ по п. 13, где рак представляет собой рак, который является резистентным к ингибиторам иммунных контрольных точек (ICI).
15. Способ по п. 13, где рак ассоциирован с опухолью, в которой отсутствует экспрессия молекул MHC класса I.
16. Способ по п. 12, где заболевание или нарушение представляет собой метаболическое заболевание или нарушение.
17. Способ по п. 12, где заболевание или нарушение представляет собой инфекционное заболевание.
18. Способ по п. 12, дополнительно включающий введение субъекту, по меньшей мере, одного другого средства.
19. Способ по п. 18, где, по меньшей мере, одно другое средство включает ингибитор одного или более вторичных цитокинов.
20. Способ по п. 19, где один или более вторичных цитокинов представляют собой, по меньшей мере, один цитокин, выбранный из группы, состоящей из IL-17, IL-5 и IL-13.
21. Способ по п. 19, где ингибитор одного или более вторичных цитокинов включает, по меньшей мере, один ингибитор, выбранный из группы, состоящей из химического соединения, полипептида, пептида, пептидомиметика, антитела, рибозима, низкомолекулярного химического соединения и молекулы антисмысловой нуклеиновой кислоты.
22. Композиция, включающая ингибитор IL-18BP или антагонист IL-18BP, где ингибитор или антагонист ингибируют способность IL18BP нейтрализовывать эндогенный IL-18.
23. Композиция по п. 22, где ингибитор или антагонист включает, по меньшей мере, один ингибитор или антагонист, выбранный из группы, состоящей из химического соединения, полипептида, пептида, пептидомиметика, антитела, рибозима, низкомолекулярного химического соединения и молекулы антисмысловой нуклеиновой кислоты.
24. Композиция по п. 22, включающая вариант полипептида IL-18, где вариант полипептида IL-18 специфически связывается с IL-18-связывающим белком (IL-18BP) и где вариант полипептида IL-18 проявляет в значительной степени пониженное связывание с рецептором IL-18 (IL-18R).
25. Композиция по п. 24, где вариант полипептида IL-18 включает, по меньшей мере, одну мутацию относительно IL-18 дикого типа (WT IL-18).
26. Композиция по п. 24, где WT IL-18 представляет собой человеческий IL-18, включающий аминокислотную последовательность SEQ ID NO: 30.
27. Композиция по п. 24, где WT IL-18 представляет собой мышиный IL-18, включающий аминокислотную последовательность SEQ ID NO: 31.
28. Композиция по п. 26, где вариант полипептида IL-18 включает, по меньшей мере, одну мутацию, выбранную из группы, состоящей из Y1X, L5X, D17X, E31X, T34X, D35X, S36X, D37X, D40X, N41X, M51X, Q56X, M60X, Q103X, H109X, M113X и R131X, относительно SEQ ID NO: 30.
29. Композиция по п. 26, где вариант полипептида IL-18 включает, по меньшей мере, одну мутацию, выбранную из группы, состоящей из Y1D, Y1F, Y1H, Y1L, L5F, L5H, D17A, D17G, D17R, D17H, E31A, E31T, E31G, E31K, E31R, T34A, T34K T34E, D35S, D35A, D35Y, S36N, S36K, S36R, D37P, D37A, D37R, D37H, D37L, D37V, D40Y D40S, D40A, N41K, N41S, N41R, M51F, M51L, M51I, Q56H, M60L, M60F, M60I, Q103L, Q103I, H109A, H109P, H109D, M113L, M113I, M113F и R131S, относительно SEQ ID NO: 30.
30. Композиция по п. 24, где вариант полипептида IL-18 включает, по меньшей мере, один вариант полипептида IL-18, выбранный из группы, состоящей из SEQ ID NO: 92, SEQ ID NO: 93, SEQ ID NO: 94, SEQ ID NO: 95, SEQ ID NO: 96, SEQ ID NO: 97, SEQ ID NO: 98, SEQ ID NO: 99, SEQ ID NO: 100, SEQ ID NO: 101, SEQ ID NO: 102, SEQ ID NO: 103, SEQ ID NO: 104, SEQ ID NO: 105, SEQ ID NO: 106, SEQ ID NO: 107, SEQ ID NO: 108, SEQ ID NO: 109, SEQ ID NO: 110, SEQ ID NO: 111, SEQ ID NO: 112, SEQ ID NO: 113, SEQ ID NO: 114, SEQ ID NO: 115, SEQ ID NO: 116, SEQ ID NO: 117, SEQ ID NO: 118, SEQ ID NO: 119, SEQ ID NO: 120, SEQ ID NO: 121, SEQ ID NO: 122, SEQ ID NO: 123, SEQ ID NO: 124, SEQ ID NO: 125, или его фрагмент.
31. Композиция по п. 27, где вариант полипептида IL-18 включает, по меньшей мере, одну мутацию, выбранную из группы, состоящей из N1X, L5X, D17X, E30X, T33X, D34X, I35X, D36X, M50X, Q102X, R104, H108X, N109X, M111X, D129X и D130X, относительно SEQ ID NO: 31.
32. Композиция по п. 4, где вариант полипептида IL-18 включает, по меньшей мере, одну мутацию, выбранную из группы, состоящей из N1Y, N1D, N1H, N1L, N1F, N1V, N1I, L5Y, L5H, D17Q, D17G, D17A, D17E, D17S, D17N, E30A, E30R, E30K, E30T, E30G, T33G, T33A, T33E, T33R, T33K, D34Y, D34S, D34A, I35T, I35K, I35R, D36V, D36A, D36G, D36H, D36P, D36R, D36L, M50F, M50L, Q102L, Q102I, R104E, R104A, R104P, R104G, R104Q, R104H, H108D, H108A, N109R, N109S, N109T, N109I, M111L, M111I, D129A, D129F, D129V, D129Y, D129S, D130E, D130T, D130G, D130N, D130R, D130S, D130Q и D130H, относительно SEQ ID NO: 31.
33. Композиция по п. 2, где вариант полипептида IL-18 включает, по меньшей мере, один вариант полипептида IL-18, выбранный из группы, состоящей из SEQ ID NO: 126, SEQ ID NO: 127, SEQ ID NO: 128, SEQ ID NO: 129, SEQ ID NO: 130, SEQ ID NO: 131, SEQ ID NO: 132, SEQ ID NO: 133, SEQ ID NO: 134, SEQ ID NO: 135, SEQ ID NO: 136, SEQ ID NO: 137, SEQ ID NO: 138, SEQ ID NO: 139, SEQ ID NO: 140, SEQ ID NO: 141, SEQ ID NO: 142, SEQ ID NO: 143, SEQ ID NO: 144, SEQ ID NO: 145, SEQ ID NO: 146, SEQ ID NO: 147, SEQ ID NO: 148, SEQ ID NO: 149, SEQ ID NO: 150, SEQ ID NO: 151, SEQ ID NO: 152, SEQ ID NO: 153, SEQ ID NO: 154, SEQ ID NO: 155, SEQ ID NO: 156, SEQ ID NO: 157, SEQ ID NO: 158, SEQ ID NO: 159, SEQ ID NO: 160, SEQ ID NO: 161, SEQ ID NO: 162, SEQ ID NO: 163, SEQ ID NO: 164, SEQ ID NO: 165, SEQ ID NO: 166, SEQ ID NO: 167, SEQ ID NO: 168, SEQ ID NO: 169, SEQ ID NO: 170, SEQ ID NO: 171, SEQ ID NO: 172, SEQ ID NO: 173, SEQ ID NO: 174, SEQ ID NO: 175, SEQ ID NO: 176, SEQ ID NO: 177, SEQ ID NO: 178, SEQ ID NO: 179, SEQ ID NO: 180, SEQ ID NO: 181, SEQ ID NO: 182, SEQ ID NO: 183, SEQ ID NO: 184, SEQ ID NO: 185, SEQ ID NO: 186, SEQ ID NO: 187, SEQ ID NO: 188, SEQ ID NO: 189, SEQ ID NO: 190, или еее фрагмента.
34. Композиция, включающая нуклеиновую кислоту, кодирующую, по меньшей мере, один из вариантов полипептида IL-18 по пп. 24-33.
35. Способ лечения или предотвращения заболевания или нарушения у субъекта, нуждающегося в этом, включающий введение субъекту, по меньшей мере, одной композиции по пп. 22-34.
36. Способ по п. 35, где заболевание или нарушение представляет собой рак.
37. Способ по п. 36, где рак представляет собой рак, который является резистентным к ингибиторам иммунных контрольных точек (ICI).
38. Способ по п. 36, где рак ассоциирован с опухолью, в которой отсутствует экспрессия молекул MHC класса I.
39. Способ по п. 35, где заболевание или нарушение представляет собой метаболическое заболевание или нарушение.
40. Способ по п. 35, где заболевание или нарушение представляет собой инфекционное заболевание.
41. Способ по п. 35, дополнительно включающий введение субъекту, по меньшей мере, одного другого средства.
42. Способ по п. 41, где, по меньшей мере, одно другое средство включает ингибитор одного или более вторичных цитокинов.
43. Способ по п. 42, где один или более вторичных цитокинов представляют собой, по меньшей мере, один цитокин, выбранный из группы, состоящей из IL-17, IL-5 и IL-13.
44. Способ по п. 42, где ингибитор одного или более вторичных цитокинов включает, по меньшей мере, один ингибитор, выбранный из группы, состоящей из химического соединения, полипептида, пептида, пептидомиметика, антитела, рибозима, низкомолекулярного химического соединения и молекулы антисмысловой нуклеиновой кислоты.
НАБОР АСПЕКТОВ B
1. Композиция, включающая вариант полипептида IL-18, где вариант полипептида IL-18 специфически связывается с рецептором IL-18 (IL-18R) и где вариант полипептида IL-18 проявляет в значительной степени пониженное связывание с IL-18-связывающим белком (IL-18BP).
2. Композиция по п. 1, где вариант полипептида IL-18 включает, по меньшей мере, одну мутацию относительно IL-18 дикого типа (WT IL-18).
3. Композиция по п. 2, где WT IL-18 представляет собой человеческий IL-18, включающий аминокислотную последовательность SEQ ID NO: 30.
4. Композиция по п. 2, где WT IL-18 представляет собой мышиный IL-18, включающий аминокислотную последовательность SEQ ID NO: 31.
5. Композиция по п. 3, где вариант полипептида IL-18 включает, по меньшей мере, одну мутацию, выбранную из группы, состоящей из Y1X, L5X, K8X, M51X, K53X, S55X, Q56X, P57X, G59X, M60X, E77X, Q103X, S105X, D110X, N111X, M113X, V153X и N155X, относительно SEQ ID NO: 30.
6. Композиция по п. 3, где вариант полипептида IL-18 включает, по меньшей мере, одну мутацию, выбранную из группы, состоящей из Y1H, Y1R, L5H, L5I, L5Y, K8Q, K8R, M51T, M51K, M51D, M51N, M51E, M51R, K53R, K53G, K53S, K53T, S55K, S55R, Q56E, Q56A, Q56R, Q56V, Q56G, Q56K, Q56L, P57L, P57G, P57A, P57K, G59T, G59A, M60K, M60Q, M60R, M60L, E77D, Q103E, Q103K, Q103P, Q103A, Q103R, S105R, S105D, S105K, S105N, S105A, D110H, D110K, D110N, D110Q, D110E, D110S, D110G, N111H, N111Y, N111D, N111R, N111S, N111G, M113V, M113R, M113T, M113K, V153I, V153T, V153A, N155K и N155H, относительно SEQ ID NO: 30.
7. Композиция по п. 3, где вариант полипептида IL-18 включает мутации M51X, M60X, S105X, D110X и N111X относительно SEQ ID NO: 30.
8. Композиция по п. 3, где вариант полипептида IL-18 включает мутации M51X, K53X, Q56X, S105X и N111X относительно SEQ ID NO: 30.
9. Композиция по п. 2, где вариант полипептида IL-18 включает аминокислотную последовательность, представленную любой одной из SEQ ID NOs.: 34-59, 73-91, 191-193, или ее фрагмент.
10. Композиция по п. 4, где вариант полипептида IL-18 включает, по меньшей мере, одну мутацию, выбранную из группы, состоящей из N1X, M50X, Y51X, K52X, S54X, E55X, V56X, R57X, G58X, L59X, R104X, N109X и L151X, относительно SEQ ID NO: 31.
11. Композиция по п. 4, где вариант полипептида IL-18 включает, по меньшей мере, одну мутацию, выбранную из группы, состоящей из N1H, N1Y, M50A, M50S, M50V, M50G, M50T, Y51R, K52V, K52S, K52T, K52G, K52A, S54R, S54K, S54G, S54N, E55R, E55H, E55N, E55D, E55G, V56L, V56M, V56R, V56A, V56S, V56Q, R57G, R57K, G58A, L59K, L59R, L59V, R104K, R104L, R104Q, R104S, N109D и L151V, относительно SEQ ID NO: 31.
12. Композиция по п. 2, где вариант полипептида IL-18 включает аминокислотную последовательность, представленную любой одной из SEQ ID NOs.: 60-72, или его фрагмент.
13. Композиция, включающая нуклеиновую кислоту, кодирующую вариант полипептида IL-18 композиции по любому одному из пп. 1-12.
14. Композиция по любому одному из пп. 1-13, дополнительно включающая одно или более средств, выбранных из (i) ингибитора иммунных контрольных точек; (ii) средства, которое ингибирует один или более белков, выбранных из PD-L1, PD1, CTLA4, TIM3, TIGIT, LAG3, B7H3, B7H4, VISTA, ICOS, GITR, 41BB, OX40 и CD40; (iii) средства, опсонизирующего раковые клетки; и (iv) средства, которое целенаправленно воздействует на один или более антигенов, выбранных из CD19, CD20, CD22, CD24, CD25, CD30, CD33, CD37, CD38, CD44, CD45, CD47, CD51, CD52, CD56, CD62L, CD70, CD74, CD79, CD80, CD96, CD97, CD99, CD123, CD134, CD138, CD152 (CTLA-4), CD200, CD213A2, CD221, CD248, CD276 (B7-H3), B7-H4, CD279 (PD-1), CD274 (PD-L1), CD319, EGFR, EPCAM, 17-1A, HER1, HER2, HER3, CD117, C-Met, HGFR, PDGFRA, AXL, TWEAKR, PTHR2, HAVCR2 (TIM3), GD2 ганглиозида, MUC1, муцина CanAg, мезотелина, эндоглина, антигена Льюиса Y, CEA, CEACAM1, CEACAM5, CA-125, PSMA, BAFF, FGFR2, TAG-72, желатиназы B, глипикана 3, нектин-4, BCMA, CSF1R, SLAMF7, интегрина αvβ3, TYRP1, GPNMB, CLDN18.2, FOLR1, CCR4, CXCR4, MICA, антигена C242, DLL3, DLL4, EGFL7, виментина, экстра домена-B фибронектина, TROP-2, LRRC15, FAP, SLITRK6, NOTCH2, NOTCH3, танасцина-3, STEAP1 и NRP1.
15. Способ лечения или предотвращения заболевания или нарушения у субъекта, нуждающегося в этом, включающий введение субъекту композиции по любому одному из пп. 1-14.
16. Способ по п. 15, где заболевание или нарушение представляет собой рак.
17. Способ по п. 16, где рак представляет собой рак, который является резистентным к ингибиторам иммунных контрольных точек (ICI).
18. Способ по п. 16, где рак ассоциирован с опухолью, в которой отсутствует экспрессия молекул MHC класса I.
19. Способ по п. 15, где заболевание или нарушение представляет собой метаболическое заболевание или нарушение.
20. Способ по п. 15, где заболевание или нарушение представляет собой инфекционное заболевание.
21. Способ по любому одному из пп. 15-20, где способ включает введение субъекту варианта полипептида IL-18 и, по меньшей мере, одного другого средства.
22. Способ по п. 21, где, по меньшей мере, одно другое средство включает ингибитор иммунных контрольных точек.
23. Способ по п. 22, где ингибитор иммунных контрольных точек представляет собой средство, которое ингибирует PD-L1, PD1, CTLA4, TIM3, TIGIT, LAG3, B7H3, B7H4, VISTA, ICOS, GITR, 41BB, OX40 или CD40 или любую их комбинацию.
24. Способ по п. 21, где, по меньшей мере, одно другое средство включает средство, опсонизирующее раковые клетки.
25. Способ по п. 24, где, по меньшей мере, одно другое средство целенаправленно воздействует на один или более антигенов, выбранных из CD19, CD20, CD22, CD24, CD25, CD30, CD33, CD37, CD38, CD44, CD45, CD47, CD51, CD52, CD56, CD62L, CD70, CD74, CD79, CD80, CD96, CD97, CD99, CD123, CD134, CD138, CD152 (CTLA-4), CD200, CD213A2, CD221, CD248, CD276 (B7-H3), B7-H4, CD279 (PD-1), CD274 (PD-L1), CD319, EGFR, EPCAM, 17-1A, HER1, HER2, HER3, CD117, C-Met, HGFR, PDGFRA, AXL, TWEAKR, PTHR2, HAVCR2 (TIM3), GD2 ганглиозида, MUC1, муцина CanAg, мезотелина, эндоглина, антигена Льюиса Y, CEA, CEACAM1, CEACAM5, CA-125, PSMA, BAFF, FGFR2, TAG-72, желатиназы B, глипикана 3, нектин-4, BCMA, CSF1R, SLAMF7, интегрина αvβ3, TYRP1, GPNMB, CLDN18.2, FOLR1, CCR4, CXCR4, MICA, антигена C242, DLL3, DLL4, EGFL7, виментина, экстра домена-B фибронектина, TROP-2, LRRC15, FAP, SLITRK6, NOTCH2, NOTCH3, танасцина-3, STEAP1 и NRP1.
26. Способ по любому одному из пп. 21-25, где, по меньшей мере, одно другое средство конъюгировано с вариантом полипептида IL-18.
27. Способ по п. 21, где, по меньшей мере, одно другое средство представляет собой измененные Т-клетки или NK-клетки.
28. Способ по п. 21, где, по меньшей мере, одно другое средство представляет собой онколитический вирус.
29. Композиция, включающая ингибитор IL-18BP или антагонист IL-18BP, где ингибитор или антагонист ингибируют способность IL18BP нейтрализовывать эндогенный IL-18.
30. Композиция по п. 29, где ингибитор или антагонист включает, по меньшей мере, один ингибитор или антагонист, выбранный из группы, состоящей из химического соединения, полипептида, пептида, пептидомиметика, антитела, рибозима, низкомолекулярного химического соединения и молекулы антисмысловой нуклеиновой кислоты.
31. Композиция по п. 30, включающая вариант полипептида IL-18, где вариант полипептида IL-18 специфически связывается с IL-18-связывающим белком (IL-18BP) и где вариант полипептида IL-18 проявляет в значительной степени пониженное связывание с рецептором IL-18 (IL-18R).
32. Композиция по п. 31, где вариант полипептида IL-18 включает, по меньшей мере, одну мутацию относительно IL-18 дикого типа (WT IL-18).
33. Композиция по п. 32, где WT IL-18 представляет собой человеческий IL-18, включающий аминокислотную последовательность SEQ ID NO: 30.
34. Композиция по п. 32, где WT IL-18 представляет собой мышиный IL-18, включающий аминокислотную последовательность SEQ ID NO: 31.
35. Композиция по п. 33, где вариант полипептида IL-18 включает, по меньшей мере, одну мутацию, выбранную из группы, состоящей из Y1X, L5X, D17X, E31X, T34X, D35X, S36X, D37X, D40X, N41X, M51X, Q56X, M60X, Q103X, H109X, M113X и R131X, относительно SEQ ID NO: 30.
36. Композиция по п. 33, где вариант полипептида IL-18 включает, по меньшей мере, одну мутацию, выбранную из группы, состоящей из Y1D, Y1F, Y1H, Y1L, L5F, L5H, D17A, D17G, D17R, D17H, E31A, E31T, E31G, E31K, E31R, T34A, T34K T34E, D35S, D35A, D35Y, S36N, S36K, S36R, D37P, D37A, D37R, D37H, D37L, D37V, D40Y D40S, D40A, N41K, N41S, N41R, M51F, M51L, M51I, Q56H, M60L, M60F, M60I, Q103L, Q103I, H109A, H109P, H109D, M113L, M113I, M113F и R131S, относительно SEQ ID NO: 30.
37. Композиция по п. 33, где вариант полипептида IL-18 включает аминокислотную последовательность, представленную любой одной из SEQ ID NOs.: 92-125, или ее фрагмент.
38. Композиция по п. 33, где вариант полипептида IL-18 включает мутации D17X, E30X и Q103X относительно SEQ ID NO: 30.
39. Композиция по п. 33, где вариант полипептида IL-18 включает мутации D17X, E30X, D35X, M51X и Q103X относительно SEQ ID NO: 30.
40. Композиция по п. 34, где вариант полипептида IL-18 включает, по меньшей мере, одну мутацию, выбранную из группы, состоящей из N1X, L5X, D17X, E30X, T33X, D34X, I35X, D36X, M50X, Q102X, R104, H108X, N109X, M111X, D129X и D130X, относительно SEQ ID NO: 31.
41. Композиция по п. 34, где вариант полипептида IL-18 включает, по меньшей мере, одну мутацию, выбранную из группы, состоящей из N1Y, N1D, N1H, N1L, N1F, N1V, N1I, L5Y, L5H, D17Q, D17G, D17A, D17E, D17S, D17N, E30A, E30R, E30K, E30T, E30G, T33G, T33A, T33E, T33R, T33K, D34Y, D34S, D34A, I35T, I35K, I35R, D36V, D36A, D36G, D36H, D36P, D36R, D36L, M50F, M50L, Q102L, Q102I, R104E, R104A, R104P, R104G, R104Q, R104H, H108D, H108A, N109R, N109S, N109T, N109I, M111L, M111I, D129A, D129F, D129V, D129Y, D129S, D130E, D130T, D130G, D130N, D130R, D130S, D130Q и D130H, относительно SEQ ID NO: 31.
42. Композиция по п. 34, где вариант полипептида IL-18 включает аминокислотную последовательность, представленную любой одной из SEQ ID NOs.: 126-190, или ее фрагмент.
43. Композиция, включающая нуклеиновую кислоту, кодирующую вариант полипептида IL-18 композиции по любому одному из пп. 31-42.
44. Композиция по любому одному из пп. 19-43, дополнительно включающая одно или более средств, выбранных из (i) ингибитора иммунных контрольных точек; (ii) средства, которое ингибирует один или более белков, выбранных из PD-L1, PD1, CTLA4, TIM3, TIGIT, LAG3, B7H3, B7H4, VISTA, ICOS, GITR, 41BB, OX40 и CD40; (iii) средства, опсонизирующего раковые клетки; и (iv) средства, которое целенаправленно воздействует на один или более антигенов, выбранных из CD19, CD20, CD22, CD24, CD25, CD30, CD33, CD37, CD38, CD44, CD45, CD47, CD51, CD52, CD56, CD62L, CD70, CD74, CD79, CD80, CD96, CD97, CD99, CD123, CD134, CD138, CD152 (CTLA-4), CD200, CD213A2, CD221, CD248, CD276 (B7-H3), B7-H4, CD279 (PD-1), CD274 (PD-L1), CD319, EGFR, EPCAM, 17-1A, HER1, HER2, HER3, CD117, C-Met, HGFR, PDGFRA, AXL, TWEAKR, PTHR2, HAVCR2 (TIM3), GD2 ганглиозида, MUC1, муцина CanAg, мезотелина, эндоглина, антигена Льюиса Y, CEA, CEACAM1, CEACAM5, CA-125, PSMA, BAFF, FGFR2, TAG-72, желатиназы B, глипикана 3, нектин-4, BCMA, CSF1R, SLAMF7, интегрина αvβ3, TYRP1, GPNMB, CLDN18.2, FOLR1, CCR4, CXCR4, MICA, антигена C242, DLL3, DLL4, EGFL7, виментина, экстра домена-B фибронектина, TROP-2, LRRC15, FAP, SLITRK6, NOTCH2, NOTCH3, танасцина-3, STEAP1 и NRP1.
45. Способ лечения или предотвращения заболевания или нарушения у субъекта, нуждающегося в этом, включающий введение субъекту композиции по любому одному из пп. 29-44.
46. Способ по п. 45, где заболевание или нарушение представляет собой рак.
47. Способ по п. 46, где рак представляет собой рак, который является резистентным к ингибиторам иммунных контрольных точек (ICI).
48. Способ по п. 46, где рак ассоциирован с опухолью, в которой отсутствует экспрессия молекул MHC класса I.
49. Способ по п. 45, где заболевание или нарушение представляет собой метаболическое заболевание или нарушение.
50. Способ по п. 45, где заболевание или нарушение представляет собой инфекционное заболевание.
51. Способ по любому одному из пп. 45-50, где способ включает введение субъекту, по меньшей мере, одного другого средства помимо ингибитора IL-18BP или антагониста IL-18BP.
52. Способ по п. 51, где, по меньшей мере, одно другое средство включает ингибитор иммунных контрольных точек.
53. Способ по п. 52, где ингибитор иммунных контрольных точек представляет собой средство, которое ингибирует PD-L1, PD1, CTLA4, TIM3, TIGIT, LAG3, B7H3, B7H4, VISTA, ICOS, GITR, 41BB, OX40 или CD40 или любую их комбинацию.
54. Способ по п. 51, где, по меньшей мере, одно другое средство включает средство, опсонизирующее раковые клетки.
55. Способ по п. 51, где, по меньшей мере, одно другое средство целенаправленно воздействует на один или более антигенов, выбранных из CD19, CD20, CD22, CD24, CD25, CD30, CD33, CD37, CD38, CD44, CD45, CD47, CD51, CD52, CD56, CD62L, CD70, CD74, CD79, CD80, CD96, CD97, CD99, CD123, CD134, CD138, CD152 (CTLA-4), CD200, CD213A2, CD221, CD248, CD276 (B7-H3), B7-H4, CD279 (PD-1), CD274 (PD-L1), CD319, EGFR, EPCAM, 17-1A, HER1, HER2, HER3, CD117, C-Met, HGFR, PDGFRA, AXL, TWEAKR, PTHR2, HAVCR2 (TIM3), GD2 ганглиозида, MUC1, муцина CanAg, мезотелина, эндоглина, антигена Льюиса Y, CEA, CEACAM1, CEACAM5, CA-125, PSMA, BAFF, FGFR2, TAG-72, желатиназы B, глипикана 3, нектин-4, BCMA, CSF1R, SLAMF7, интегрина αvβ3, TYRP1, GPNMB, CLDN18.2, FOLR1, CCR4, CXCR4, MICA, антигена C242, DLL3, DLL4, EGFL7, виментина, экстра домена-B фибронектина, TROP-2, LRRC15, FAP, SLITRK6, NOTCH2, NOTCH3, танасцина-3, STEAP1 и NRP1.
56. Способ по любому одному из пп. 51-55, где ингибитор или антагонист представляет собой вариант полипептида IL-18 и, по меньшей мере, одно другое средство, конъюгированное с вариантом полипептида IL-18.
57. Способ по п. 51, где, по меньшей мере, одно другое средство представляет собой измененные Т-клетки или NK-клетки.
58. Способ по п. 51, где, по меньшей мере, одно другое средство представляет собой онколитический вирус.
Полное содержание каждого патента, патентной заявки и публикации, процитированных в изобретении, включено в настоящее изобретение путем ссылки на них. Несмотря на то, что это изобретение было раскрыто с помощью описания конкретных вариантов осуществления, тем не менее, очевидно, что другие варианты осуществления и варианты этого изобретения могут быть разработаны другими специалистами в данной области без отклонения от сущности и объема изобретения. Предполагается, что прилагаемая формула изобретения включает все такие варианты осуществления и эквивалентные варианты.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Ринг, Аарон
Чжоу, Тин
Фишер, Сьюзан
<120> ВАРИАНТЫ ИНТЕРЛЕЙКИНА-18 И СПОСОБЫ ИХ ПРИМЕНЕНИЯ
<130> 047162-5249-00-WO.607779
<150> US 62/554,605
<151> 2017-09-06
<150> US 62/652,279
<151> 2018-04-03
<160> 193
<170> PatentIn version 3.5
<210> 1
<211> 58
<212> ДНК
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 1
cattttcatt aagatgcagt tacttcgctg tttttcaata ttttctgtta ttgctagc 58
<210> 2
<211> 80
<212> ДНК
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<220>
<221> прочие_признаки
<222> (31)..(31)
<223> n представляет собой a, c, g или t
<220>
<221> прочие_признаки
<222> (42)..(42)
<223> n представляет собой a, c, g или t
<400> 2
aattacggat gaccgaaagt ykggattcaw ncttgccgaa anrtgctaaa acgctagcaa 60
taacagaaaa tattgaaaaa 80
<210> 3
<211> 51
<212> ДНК
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 3
actttcggtc atccgtaatt tgaacgacca agtccttttt attgaccagg g 51
<210> 4
<211> 55
<212> ДНК
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 4
actatccgtc atatcctcga ataagggacg attgccctgg tcaataaaaa ggact 55
<210> 5
<211> 44
<212> ДНК
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 5
cttattcgag gatatgacgg atagtgattg ccgtgacaac gccc 44
<210> 6
<211> 84
<212> ДНК
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<220>
<221> прочие_признаки
<222> (22)..(22)
<223> n представляет собой a, c, g или t
<220>
<221> прочие_признаки
<222> (46)..(46)
<223> n представляет собой a, c, g или t
<400> 6
actgagattg ttaccgcchb tnyacggggt tgwyyatcty tatasnyaga gatgatgaaa 60
attgtacgag gggcgttgtc acgg 84
<210> 7
<211> 52
<212> ДНК
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 7
ggcggtaaca atctcagtta agtgcgaaaa aatctcgaca ctttcttgtg aa 52
<210> 8
<211> 53
<212> ДНК
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 8
ggttcatttc cttgaacgaa atgatcttgt tttcacaaga aagtgtcgag att 53
<210> 9
<211> 62
<212> ДНК
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 9
catttcgttc aaggaaatga acccgccgga taatatcaag gatacaaaat cagatattat 60
tt 62
<210> 10
<211> 88
<212> ДНК
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<220>
<221> прочие_признаки
<222> (27)..(27)
<223> n представляет собой a, c, g или t
<400> 10
tgatgagctc tcgaattgca tcttatnwtb gtgtccaggc acwyyacgwt bgaagaaaat 60
aatatctgat tttgtatcct tgatatta 88
<210> 11
<211> 51
<212> ДНК
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 11
ataagatgca attcgagagc tcatcatacg aaggttactt tttagcctgc g 51
<210> 12
<211> 50
<212> ДНК
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 12
aattaactta aacaggtcgc gctccttctc gcaggctaaa aagtaacctt 50
<210> 13
<211> 49
<212> ДНК
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 13
gcgacctgtt taagttaatt cttaagaaag aagatgagtt gggggatcg 49
<210> 14
<211> 61
<212> ДНК
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 14
ccagaaccac cgtcctcwtb ctgadyggta aacatgatgc tacgatcccc caactcatct 60
t 61
<210> 15
<211> 52
<212> ДНК
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 15
gaggacggtg gttctggatc cgaacaaaag cttatctccg aagaagactt gg 52
<210> 16
<211> 41
<212> ДНК
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 16
ccaccagatc caccaccacc caagtcttct tcggagataa g 41
<210> 17
<211> 62
<212> ДНК
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 17
cattttcatt aagatgcagt tacttcgctg tttttcaata ttttctgtta ttgctagcgt 60
tt 62
<210> 18
<211> 55
<212> ДНК
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<220>
<221> прочие_признаки
<222> (25)..(25)
<223> n представляет собой a, c, g или t
<400> 18
ttgtacagtg aagtcggcca aaawntgcta aaacgctagc aataacagaa aatat 55
<210> 19
<211> 59
<212> ДНК
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 19
gccgacttca ctgtacaacc gcagtaatac ggaatataaa tgaccaagtt ctcttcgtt 59
<210> 20
<211> 67
<212> ДНК
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 20
ttgatcaata tcagtcatat cctcgaacac aggctgtctt ttgtcaacga agagaacttg 60
gtcattt 67
<210> 21
<211> 54
<212> ДНК
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 21
gtgttcgagg atatgactga tattgatcaa agtgccagtg aaccccagac caga 54
<210> 22
<211> 78
<212> ДНК
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<220>
<221> прочие_признаки
<222> (24)..(24)
<223> n представляет собой a, c, g или t
<220>
<221> прочие_признаки
<222> (30)..(30)
<223> n представляет собой a, c, g или t
<220>
<221> прочие_признаки
<222> (32)..(32)
<223> n представляет собой a, c, g или t
<220>
<221> прочие_признаки
<222> (42)..(42)
<223> n представляет собой a, c, g или t
<220>
<221> прочие_признаки
<222> (44)..(44)
<223> n представляет собой a, c, g или t
<220>
<221> прочие_признаки
<222> (46)..(46)
<223> n представляет собой a, c, g или t
<220>
<221> прочие_признаки
<222> (48)..(48)
<223> n представляет собой a, c, g или t
<400> 22
tcacagagag ggtcacagcy hbtnywbybn bnybwyygtc snbnynsnyg tatattatca 60
gtctggtctg gggttcac 78
<210> 23
<211> 58
<212> ДНК
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 23
gctgtgaccc tctctgtgaa ggatagtaaa atgtctaccc tctcctgtaa gaacaaga 58
<210> 24
<211> 69
<212> ДНК
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 24
gtatatcatc aatattttca ggtggatcca tttcctcaaa ggaaatgatc ttgttcttac 60
aggagaggg 69
<210> 25
<211> 99
<212> ДНК
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<220>
<221> прочие_признаки
<222> (59)..(59)
<223> n представляет собой a, c, g или t
<220>
<221> прочие_признаки
<222> (74)..(74)
<223> n представляет собой a, c, g или t
<400> 25
aatggatcca cctgaaaata ttgatgatat acaaagtgat ctcatattct ttcagaaand 60
hgttccagga cacnataaga tggagtttga atcttcact 99
<210> 26
<211> 57
<212> ДНК
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 26
ccttttggca agcaagaaag tgtccttcat acagtgaaga ttcaaactcc atcttat 57
<210> 27
<211> 60
<212> ДНК
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 27
ctttcttgct tgccaaaagg aagatgatgc tttcaaactc attctgaaaa aaaaggatga 60
<210> 28
<211> 77
<212> ДНК
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 28
ccaccacttt gatgtaagtt agtrdbagtg aacattacag atttatcccc attttcatcc 60
ttttttttca gaatgag 77
<210> 29
<211> 59
<212> ДНК
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 29
actaacttac atcaaagtgg tggttctgga tccgaacaaa agcttatctc cgaagaaga 59
<210> 30
<211> 157
<212> PRT
<213> homo sapiens
<400> 30
Tyr Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Glu Asp
20 25 30
Met Thr Asp Ser Asp Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Met Tyr Lys Asp Ser Gln Pro Arg Gly Met Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Gln Arg Ser Val Pro Gly His Asp Asn Lys
100 105 110
Met Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 31
<211> 157
<212> PRT
<213> домовая мышь
<400> 31
Asn Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Asp Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Glu Asp Met
20 25 30
Thr Asp Ile Asp Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Met Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Gln Lys Arg Val Pro Gly His Asn Lys Met Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp Asp Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 32
<211> 193
<212> PRT
<213> homo sapiens
<400> 32
Met Ala Ala Glu Pro Val Glu Asp Asn Cys Ile Asn Phe Val Ala Met
1 5 10 15
Lys Phe Ile Asp Asn Thr Leu Tyr Phe Ile Ala Glu Asp Asp Glu Asn
20 25 30
Leu Glu Ser Asp Tyr Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile
35 40 45
Arg Asn Leu Asn Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro
50 55 60
Leu Phe Glu Asp Met Thr Asp Ser Asp Cys Arg Asp Asn Ala Pro Arg
65 70 75 80
Thr Ile Phe Ile Ile Ser Met Tyr Lys Asp Ser Gln Pro Arg Gly Met
85 90 95
Ala Val Thr Ile Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys
100 105 110
Glu Asn Lys Ile Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile
115 120 125
Lys Asp Thr Lys Ser Asp Ile Ile Phe Phe Gln Arg Ser Val Pro Gly
130 135 140
His Asp Asn Lys Met Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe
145 150 155 160
Leu Ala Cys Glu Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys
165 170 175
Glu Asp Glu Leu Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu
180 185 190
Asp
<210> 33
<211> 192
<212> PRT
<213> домовая мышь
<400> 33
Met Ala Ala Met Ser Glu Asp Ser Cys Val Asn Phe Lys Glu Met Met
1 5 10 15
Phe Ile Asp Asn Thr Leu Tyr Phe Ile Pro Glu Glu Asn Gly Asp Leu
20 25 30
Glu Ser Asp Asn Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg
35 40 45
Asn Ile Asn Asp Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe
50 55 60
Glu Asp Met Thr Asp Ile Asp Gln Ser Ala Ser Glu Pro Gln Thr Arg
65 70 75 80
Leu Ile Ile Tyr Met Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val
85 90 95
Thr Leu Ser Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn
100 105 110
Lys Ile Ile Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp
115 120 125
Ile Gln Ser Asp Leu Ile Phe Phe Gln Lys Arg Val Pro Gly His Asn
130 135 140
Lys Met Glu Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys
145 150 155 160
Gln Lys Glu Asp Asp Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu
165 170 175
Asn Gly Asp Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
180 185 190
<210> 34
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 34
Tyr Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Glu Asp
20 25 30
Met Thr Asp Ser Asp Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Thr Tyr Lys Asp Ser Gln Pro Arg Gly Lys Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Gln Arg Asp Val Pro Gly His Lys His Lys
100 105 110
Met Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 35
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 35
Tyr Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Glu Asp
20 25 30
Met Thr Asp Ser Asp Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Thr Tyr Lys Asp Lys Gln Pro Arg Ala Lys Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Gln Arg Asp Val Pro Gly His Lys His Lys
100 105 110
Met Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Ile Gln Asn Glu Asp
145 150 155
<210> 36
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 36
Arg Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Glu Asp
20 25 30
Met Thr Asp Ser Asp Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Thr Tyr Lys Asp Ser Gln Pro Arg Gly Lys Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Gln Arg Asp Val Pro Gly His Lys His Lys
100 105 110
Met Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 37
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 37
Arg Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Glu Asp
20 25 30
Met Thr Asp Ser Asp Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Thr Tyr Arg Asp Ser Gln Pro Arg Gly Lys Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Gln Arg Asn Val Pro Gly His Lys Tyr Lys
100 105 110
Met Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 38
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 38
Tyr Phe Gly Lys Leu Glu Ser Gln Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Glu Asp
20 25 30
Met Thr Asp Ser Asp Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Thr Tyr Lys Asp Lys Gln Pro Arg Thr Lys Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Gln Arg Arg Val Pro Gly His His Asn Lys
100 105 110
Met Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Lys Glu Asp
145 150 155
<210> 39
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 39
Tyr Phe Gly Lys Leu Glu Ser Arg Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Glu Asp
20 25 30
Met Thr Asp Ser Asp Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Lys Tyr Lys Asp Lys Gln Pro Arg Ala Gln Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Gln Arg Asp Val Pro Gly His Lys His Lys
100 105 110
Met Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Ile Gln Asn Glu Asp
145 150 155
<210> 40
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<220>
<221> прочие_признаки
<222> (60)..(60)
<223> Xaa может представлять собой любую природную аминокислоту
<400> 40
Tyr Phe Gly Lys Leu Glu Ser Arg Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Glu Asp
20 25 30
Met Thr Asp Ser Asp Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Asp Tyr Lys Asp Lys Gln Pro Arg Ala Xaa Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Gln Arg Asp Val Pro Gly His Lys His Lys
100 105 110
Met Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Ile Gln Asn Glu Asp
145 150 155
<210> 41
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 41
Tyr Phe Gly Lys His Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Glu Asp
20 25 30
Met Thr Asp Ser Asp Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Thr Tyr Arg Asp Ser Gln Pro Arg Gly Lys Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Gln Arg Asp Val Pro Gly His Asn Asn Lys
100 105 110
Met Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Thr Gln Asn Glu Asp
145 150 155
<210> 42
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 42
Tyr Phe Gly Lys Ile Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Glu Asp
20 25 30
Met Thr Asp Ser Asp Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Lys Tyr Lys Asp Lys Gln Pro Arg Ala Gln Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Gln Arg Lys Val Pro Gly His Gln His Lys
100 105 110
Met Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Lys Glu Asp
145 150 155
<210> 43
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 43
Tyr Phe Gly Lys Ile Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Glu Asp
20 25 30
Met Thr Asp Ser Asp Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Thr Tyr Lys Asp Arg Gln Pro Arg Gly Lys Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Glu Arg Asp Val Pro Gly His His His Lys
100 105 110
Met Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Ile Gln Asn Glu Asp
145 150 155
<210> 44
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 44
Tyr Phe Gly Lys Ile Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Glu Asp
20 25 30
Met Thr Asp Ser Asp Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Thr Tyr Lys Asp Lys Gln Pro Arg Gly Lys Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Gln Arg Asp Val Pro Gly His Lys His Lys
100 105 110
Met Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Thr Gln His Glu Asp
145 150 155
<210> 45
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 45
Tyr Phe Gly Lys Ile Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Glu Asp
20 25 30
Met Thr Asp Ser Asp Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Thr Tyr Lys Asp Lys Gln Pro Arg Ala Lys Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Gln Arg Arg Val Pro Gly His His His Lys
100 105 110
Met Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Ile Gln Lys Glu Asp
145 150 155
<210> 46
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 46
Tyr Phe Gly Lys Ile Glu Ser Arg Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Glu Asp
20 25 30
Met Thr Asp Ser Asp Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Thr Tyr Lys Asp Lys Gln Pro Arg Gly Lys Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Gln Arg Asp Val Pro Gly His Asp Tyr Lys
100 105 110
Met Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Ile Gln Lys Glu Asp
145 150 155
<210> 47
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 47
Tyr Phe Gly Lys Tyr Glu Ser Arg Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Glu Asp
20 25 30
Met Thr Asp Ser Asp Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Thr Tyr Arg Asp Ser Gln Pro Arg Gly Lys Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Gln Arg Asp Val Pro Gly His Glu His Lys
100 105 110
Met Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Lys Glu Asp
145 150 155
<210> 48
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 48
His Phe Gly Lys Tyr Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Glu Asp
20 25 30
Met Thr Asp Ser Asp Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Thr Tyr Arg Asp Ser Gln Pro Arg Gly Lys Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Gln Arg Asp Val Pro Gly His His Asn Lys
100 105 110
Met Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Lys Glu Asp
145 150 155
<210> 49
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 49
Arg Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Glu Asp
20 25 30
Met Thr Asp Ser Asp Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Thr Tyr Arg Asp Ser Gln Pro Arg Ala Lys Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Gln Arg Asp Val Pro Gly His Gln His Lys
100 105 110
Met Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Ala Gln Lys Glu Asp
145 150 155
<210> 50
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 50
Arg Phe Gly Lys Leu Glu Ser Arg Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Glu Asp
20 25 30
Met Thr Asp Ser Asp Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Asp Tyr Arg Asp Ser Gln Pro Arg Gly Arg Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Lys Arg Asn Val Pro Gly His Lys Tyr Lys
100 105 110
Met Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln His Glu Asp
145 150 155
<210> 51
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 51
Arg Phe Gly Lys Leu Glu Ser Arg Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Glu Asp
20 25 30
Met Thr Asp Ser Asp Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Asn Tyr Arg Asp Ser Gln Pro Arg Gly Gln Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Lys Arg Arg Val Pro Gly His Asn His Lys
100 105 110
Met Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Lys Glu Asp
145 150 155
<210> 52
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 52
Arg Phe Gly Lys Leu Glu Ser Arg Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Glu Asp
20 25 30
Met Thr Asp Ser Asp Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Thr Tyr Lys Asp Ser Gln Pro Arg Gly Lys Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Gln Arg Asp Val Pro Gly His Lys His Lys
100 105 110
Met Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 53
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 53
Arg Phe Gly Lys His Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Glu Asp
20 25 30
Met Thr Asp Ser Asp Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Thr Tyr Arg Asp Ser Gln Pro Arg Gly Lys Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Glu Arg Asn Val Pro Gly His Lys Tyr Lys
100 105 110
Met Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 54
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<220>
<221> прочие_признаки
<222> (155)..(155)
<223> Xaa может представлять собой любую природную аминокислоту
<400> 54
Arg Phe Gly Lys Leu Glu Ser Arg Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Glu Asp
20 25 30
Met Thr Asp Ser Asp Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Thr Tyr Arg Asp Ser Gln Pro Arg Ala Lys Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Glu Arg Asp Val Pro Gly His Gln His Lys
100 105 110
Met Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Ile Gln Xaa Glu Asp
145 150 155
<210> 55
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 55
Arg Phe Gly Lys Leu Glu Ser Arg Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Glu Asp
20 25 30
Met Thr Asp Ser Asp Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Thr Tyr Arg Asp Ser Gln Pro Arg Thr Lys Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Gln Arg Asn Val Pro Gly His His Asp Lys
100 105 110
Met Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln His Glu Asp
145 150 155
<210> 56
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 56
Arg Phe Gly Lys Leu Glu Ser Arg Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Glu Asp
20 25 30
Met Thr Asp Ser Asp Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Thr Tyr Lys Asp Ser Gln Pro Arg Ala Lys Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Glu Arg Asp Val Pro Gly His Gln His Lys
100 105 110
Met Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Ile Gln Lys Glu Asp
145 150 155
<210> 57
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 57
Arg Phe Gly Lys His Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Glu Asp
20 25 30
Met Thr Asp Ser Asp Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Thr Tyr Arg Asp Ser Gln Pro Arg Gly Lys Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Glu Arg Asn Val Pro Gly His Lys Tyr Lys
100 105 110
Met Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 58
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 58
Arg Phe Gly Lys Tyr Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Glu Asp
20 25 30
Met Thr Asp Ser Asp Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Thr Tyr Lys Asp Ser Gln Pro Arg Thr Lys Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Asp Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Gln Arg Asp Val Pro Gly His Lys His Lys
100 105 110
Met Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 59
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 59
Arg Phe Gly Lys Leu Glu Ser Arg Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Glu Asp
20 25 30
Met Thr Asp Ser Asp Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Thr Tyr Arg Asp Ser Gln Pro Arg Thr Lys Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Gln Arg Lys Val Pro Gly His Asn His Lys
100 105 110
Met Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Lys Glu Asp
145 150 155
<210> 60
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 60
Asn Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Asp Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Glu Asp Met
20 25 30
Thr Asp Ile Asp Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Gly Tyr Ala Asp Ser Arg Val Arg Gly Lys Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Gln Lys Arg Val Pro Gly His Asn Lys Met Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp Asp Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 61
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 61
His Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Asp Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Glu Asp Met
20 25 30
Thr Asp Ile Asp Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Ala Tyr Gly Asp Ser Arg Ala Arg Gly Lys Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Gln Lys Arg Val Pro Gly His Asn Lys Met Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp Asp Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 62
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 62
Asn Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Asp Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Glu Asp Met
20 25 30
Thr Asp Ile Asp Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Ala Tyr Val Asp Arg Arg Leu Arg Gly Lys Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Gln Lys Lys Val Pro Gly His Asn Lys Met Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp Asp Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 63
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 63
Asn Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Asp Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Glu Asp Met
20 25 30
Thr Asp Ile Asp Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Ser Tyr Ser Asp Lys His Met Arg Gly Lys Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Gln Lys Leu Val Pro Gly His Asn Lys Met Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp Asp Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 64
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 64
Asn Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Asp Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Glu Asp Met
20 25 30
Thr Asp Ile Asp Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Val Tyr Thr Asp Gly Arg Arg Arg Gly Lys Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Gln Lys Lys Val Pro Gly His Asp Lys Met Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp Asp Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 65
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 65
His Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Asp Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Glu Asp Met
20 25 30
Thr Asp Ile Asp Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Ala Tyr Gly Asp Ser His Met Arg Gly Lys Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Gln Lys Gln Val Pro Gly His Asn Lys Met Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp Asp Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Val Thr Asn Leu His Gln Ser
145 150 155
<210> 66
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 66
His Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Asp Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Glu Asp Met
20 25 30
Thr Asp Ile Asp Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Ala Tyr Gly Asp Ser Asn Ala Gly Gly Arg Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Gln Lys Lys Val Pro Gly His Asn Lys Met Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp Asp Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 67
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 67
His Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Asp Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Glu Asp Met
20 25 30
Thr Asp Ile Asp Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Gly Tyr Ala Asp Ser Asp Ala Arg Ala Lys Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Gln Lys Ser Val Pro Gly His Asn Lys Met Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp Asp Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Val Thr Asn Leu His Gln Ser
145 150 155
<210> 68
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 68
His Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Asp Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Glu Asp Met
20 25 30
Thr Asp Ile Asp Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Gly Tyr Ser Asp Arg Gly Ser Lys Gly Lys Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Gln Lys Gln Val Pro Gly His Asn Lys Met Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp Asp Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 69
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 69
Tyr Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Asp Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Glu Asp Met
20 25 30
Thr Asp Ile Asp Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Met Tyr Ala Asp Arg Arg Ala Arg Gly Lys Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Gln Lys Lys Val Pro Gly His Asp Lys Met Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp Asp Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Val Thr Asn Leu His Gln Ser
145 150 155
<210> 70
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 70
Tyr Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Asp Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Glu Asp Met
20 25 30
Thr Asp Ile Asp Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Ala Tyr Gly Asp Asn Arg Val Arg Gly Lys Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Gln Lys Arg Val Pro Gly His Asn Lys Met Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp Asp Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 71
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 71
Tyr Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Asp Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Glu Asp Met
20 25 30
Thr Asp Ile Asp Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Gly Tyr Gly Asp Ser Glu Arg Gly Gly Arg Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Gln Lys Arg Val Pro Gly His Asp Lys Met Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp Asp Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 72
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 72
Tyr Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Asp Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Glu Asp Met
20 25 30
Thr Asp Ile Asp Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Thr Arg Thr Asp Gly Gly Gln Lys Gly Val Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Gln Lys Arg Val Pro Gly His Asp Lys Met Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp Asp Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 73
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 73
Tyr Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Glu Asp
20 25 30
Met Thr Asp Ser Asp Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Glu Tyr Lys Asp Ser Glu Leu Arg Gly Arg Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Pro Arg Ala Val Pro Gly His Asn Arg Lys
100 105 110
Val Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 74
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 74
Tyr Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Glu Asp
20 25 30
Met Thr Asp Ser Asp Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Lys Tyr Lys Asp Ser Ala Gly Arg Gly Leu Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Glu Arg Asp Val Pro Gly His Ser Asn Lys
100 105 110
Val Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 75
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 75
Tyr Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Glu Asp
20 25 30
Met Thr Asp Ser Asp Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Lys Tyr Gly Asp Ser Ala Ala Arg Gly Leu Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Gln Arg Ser Val Pro Gly His Lys Arg Lys
100 105 110
Met Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 76
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 76
Tyr Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Glu Asp
20 25 30
Met Thr Asp Ser Asp Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Lys Tyr Gly Asp Ser Arg Gly Arg Gly Leu Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Glu Arg Asp Val Pro Gly His Asn Ser Lys
100 105 110
Arg Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 77
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 77
Tyr Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Glu Asp
20 25 30
Met Thr Asp Ser Asp Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Lys Tyr Gly Asp Ser Val Pro Arg Gly Leu Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Ala Arg Ala Val Pro Gly His Ser Arg Lys
100 105 110
Thr Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 78
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 78
Tyr Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Glu Asp
20 25 30
Met Thr Asp Ser Asp Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Lys Tyr Ser Asp Ser Gly Ala Arg Gly Leu Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Ala Arg Ala Val Pro Gly His Gly Arg Lys
100 105 110
Thr Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 79
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 79
Tyr Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Glu Asp
20 25 30
Met Thr Asp Ser Asp Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Lys Tyr Ser Asp Ser Lys Ala Arg Gly Met Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Ala Arg Asp Val Pro Gly His Ser Ser Lys
100 105 110
Arg Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 80
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 80
Tyr Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Glu Asp
20 25 30
Met Thr Asp Ser Asp Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Lys Tyr Ser Asp Ser Leu Ala Arg Gly Leu Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Gln Arg Asp Val Pro Gly His Ser Arg Lys
100 105 110
Met Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 81
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 81
Tyr Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Glu Asp
20 25 30
Met Thr Asp Ser Asp Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Lys Tyr Ser Asp Ser Arg Ala Arg Gly Leu Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Gln Arg Asn Val Pro Gly His Gly Arg Lys
100 105 110
Met Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 82
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 82
Tyr Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Glu Asp
20 25 30
Met Thr Asp Ser Asp Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Lys Tyr Ser Asp Ser Arg Ala Arg Gly Leu Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Ala Arg Ser Val Pro Gly His Gly Arg Lys
100 105 110
Thr Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 83
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 83
Tyr Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Glu Asp
20 25 30
Met Thr Asp Ser Asp Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Lys Tyr Ser Asp Ser Arg Ala Arg Gly Leu Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Ala Arg Asp Val Pro Gly His Ser Gly Lys
100 105 110
Arg Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 84
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 84
Tyr Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Glu Asp
20 25 30
Met Thr Asp Ser Asp Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Lys Tyr Thr Asp Ser Arg Pro Arg Gly Leu Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Glu Arg Asp Val Pro Gly His Ser Ser Lys
100 105 110
Lys Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 85
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 85
Tyr Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Glu Asp
20 25 30
Met Thr Asp Ser Asp Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Lys Tyr Thr Asp Ser Arg Ala Arg Gly Met Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Glu Arg Asp Val Pro Gly His Asn Asp Lys
100 105 110
Arg Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 86
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 86
Tyr Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Glu Asp
20 25 30
Met Thr Asp Ser Asp Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Arg Tyr Lys Asp Ser Gly Lys Arg Gly Leu Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Arg Arg Ser Val Pro Gly His Ser Arg Lys
100 105 110
Val Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 87
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 87
Tyr Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Glu Asp
20 25 30
Met Thr Asp Ser Asp Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Lys Tyr Gly Asp Ser Gly Ala Arg Gly Leu Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Glu Arg Asp Val Pro Gly His Ser Gly Lys
100 105 110
Val Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 88
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 88
Tyr Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Glu Asp
20 25 30
Met Thr Asp Ser Asp Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Lys Tyr Gly Asp Ser Arg Pro Arg Gly Met Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Gln Arg Ala Val Pro Gly His Asn Arg Lys
100 105 110
Met Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 89
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 89
Tyr Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Glu Asp
20 25 30
Met Thr Asp Ser Asp Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Lys Tyr Ser Asp Ser Leu Ala Arg Gly Leu Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Gln Arg Asp Val Pro Gly His Ser Arg Lys
100 105 110
Met Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 90
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 90
Tyr Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Glu Asp
20 25 30
Met Thr Asp Ser Asp Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Lys Tyr Ser Asp Ser Arg Ala Arg Gly Leu Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Ala Arg Ser Val Pro Gly His Gly Arg Lys
100 105 110
Thr Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 91
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 91
Tyr Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Glu Asp
20 25 30
Met Thr Asp Ser Asp Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Lys Tyr Ser Asp Ser Arg Ala Arg Gly Leu Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Gln Arg Asn Val Pro Gly His Gly Arg Lys
100 105 110
Met Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 92
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 92
His Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Gly Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Lys Asp
20 25 30
Met Thr Ala Ser Asp Cys Arg Ala Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Phe Tyr Lys Asp Ser Gln Pro Arg Gly Met Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Ile Arg Ser Val Pro Gly Ala Asp Asn Lys
100 105 110
Phe Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 93
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 93
Asp Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Ala Asp
20 25 30
Met Thr Asp Asn Pro Cys Arg Ser Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Phe Tyr Lys Asp Ser Gln Pro Arg Gly Ile Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Leu Arg Ser Val Pro Gly Pro Asp Asn Lys
100 105 110
Met Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 94
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 94
His Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Gly Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Ala Asp
20 25 30
Met Glu Ala Ser Pro Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Phe Tyr Lys Asp Ser Gln Pro Arg Gly Leu Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Leu Arg Ser Val Pro Gly His Asp Asn Lys
100 105 110
Met Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 95
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 95
Leu Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Gly Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Ala Asp
20 25 30
Met Thr Ser Ser Pro Cys Arg Ser Arg Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Phe Tyr Lys Asp Ser Gln Pro Arg Gly Phe Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Ile Arg Ser Val Pro Gly His Asp Asn Lys
100 105 110
Ile Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 96
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 96
His Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Thr Asp
20 25 30
Met Glu Ser Lys Pro Cys Arg Asp Ser Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Met Tyr Lys Asp Ser Gln Pro Arg Gly Ile Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Ile Arg Ser Val Pro Gly His Asp Asn Lys
100 105 110
Phe Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 97
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 97
Tyr Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Arg Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Thr Asp
20 25 30
Met Thr Tyr Lys Asp Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Phe Tyr Lys Asp Ser Gln Pro Arg Gly Phe Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Ile Arg Ser Val Pro Gly Ala Asp Asn Lys
100 105 110
Ile Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 98
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 98
His Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Gly Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Gly Asp
20 25 30
Met Glu Ala Ser Pro Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Phe Tyr Lys Asp Ser Gln Pro Arg Gly Met Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Ile Arg Ser Val Pro Gly Ala Asp Asn Lys
100 105 110
Leu Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 99
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 99
His Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Gly Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Thr Asp
20 25 30
Met Thr Ser Ser Asp Cys Arg Asp Lys Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Phe Tyr Lys Asp Ser Gln Pro Arg Gly Leu Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Leu Arg Ser Val Pro Gly Pro Asp Asn Lys
100 105 110
Phe Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 100
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 100
His Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Gly Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Ala Asp
20 25 30
Met Glu Ser Asn Arg Cys Arg Asp Ser Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Met Tyr Lys Asp Ser Gln Pro Arg Gly Phe Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Leu Arg Ser Val Pro Gly His Asp Asn Lys
100 105 110
Ile Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 101
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 101
Tyr Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Gly Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Thr Asp
20 25 30
Met Thr Ala Ser Pro Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Phe Tyr Lys Asp Ser Gln Pro Arg Gly Leu Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Leu Arg Ser Val Pro Gly His Asp Asn Lys
100 105 110
Ile Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Ser Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 102
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 102
Asp Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Ala Asp
20 25 30
Met Lys Ser Asn Val Cys Arg Ala Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Met Tyr Lys Asp Ser Gln Pro Arg Gly Met Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Ile Arg Ser Val Pro Gly Pro Asp Asn Lys
100 105 110
Leu Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 103
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 103
His Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Gly Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Gly Asp
20 25 30
Met Glu Ala Ser Pro Cys Arg Ala Lys Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Ile Tyr Lys Asp Ser Gln Pro Arg Gly Phe Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Leu Arg Ser Val Pro Gly His Asp Asn Lys
100 105 110
Phe Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Ser Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 104
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 104
His Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Gly Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Ala Asp
20 25 30
Met Ala Ser Asn Arg Cys Arg Ala Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Met Tyr Lys Asp Ser Gln Pro Arg Gly Phe Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Ile Arg Ser Val Pro Gly Pro Asp Asn Lys
100 105 110
Phe Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 105
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 105
Tyr Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Ala Asp
20 25 30
Met Lys Ala Lys Ala Cys Arg Ser Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Phe Tyr Lys Asp Ser Gln Pro Arg Gly Phe Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Leu Arg Ser Val Pro Gly Ala Asp Asn Lys
100 105 110
Ile Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 106
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 106
His Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
His Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Thr Asp
20 25 30
Met Ala Asp Asn Ala Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Phe Tyr Lys Asp Ser Gln Pro Arg Gly Leu Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Ile Arg Ser Val Pro Gly Asp Asp Asn Lys
100 105 110
Met Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 107
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 107
Tyr Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Gly Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Thr Asp
20 25 30
Met Lys Ser Asn Leu Cys Arg Ser Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Phe Tyr Lys Asp Ser Gln Pro Arg Gly Ile Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Ile Arg Ser Val Pro Gly Asp Asp Asn Lys
100 105 110
Ile Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 108
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 108
His Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Gly Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Arg Asp
20 25 30
Met Ala Ala Ser His Cys Arg Asp Ser Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Ile Tyr Lys Asp Ser Gln Pro Arg Gly Phe Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Leu Arg Ser Val Pro Gly His Asp Asn Lys
100 105 110
Ile Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 109
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 109
Tyr Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Ala Asp
20 25 30
Met Ala Ser Asn Pro Cys Arg Tyr Lys Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Met Tyr Lys Asp Ser Gln Pro Arg Gly Leu Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Leu Arg Ser Val Pro Gly Ala Asp Asn Lys
100 105 110
Leu Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 110
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 110
His Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Gly Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Thr Asp
20 25 30
Met Ala Ser Asn His Cys Arg Tyr Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Met Tyr Lys Asp Ser Gln Pro Arg Gly Leu Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Leu Arg Ser Val Pro Gly Ala Asp Asn Lys
100 105 110
Ile Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 111
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 111
His Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Gly Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Ala Asp
20 25 30
Met Thr Asp Asn Pro Cys Arg Ser Arg Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Phe Tyr Lys Asp Ser Gln Pro Arg Gly Met Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Ile Arg Ser Val Pro Gly His Asp Asn Lys
100 105 110
Phe Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 112
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 112
Tyr Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Gly Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Thr Asp
20 25 30
Met Thr Ala Ser His Cys Arg Ser Ser Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Leu Tyr Lys Asp Ser Gln Pro Arg Gly Met Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Leu Arg Ser Val Pro Gly His Asp Asn Lys
100 105 110
Phe Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 113
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 113
Tyr Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Gly Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Thr Asp
20 25 30
Met Glu Tyr Arg Leu Cys Arg Ala Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Phe Tyr Lys Asp Ser His Pro Arg Gly Leu Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Leu Arg Ser Val Pro Gly Asp Asp Asn Lys
100 105 110
Leu Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 114
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 114
Tyr Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Gly Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Thr Asp
20 25 30
Met Glu Ser Ser Leu Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Leu Tyr Lys Asp Ser Gln Pro Arg Gly Met Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Leu Arg Ser Val Pro Gly Ala Asp Asn Lys
100 105 110
Phe Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Ser Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 115
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 115
Tyr Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Gly Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Lys Asp
20 25 30
Met Glu Ala Asn Asp Cys Arg Ser Ser Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Ile Tyr Lys Asp Ser Gln Pro Arg Gly Leu Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Ile Arg Ser Val Pro Gly Ala Asp Asn Lys
100 105 110
Met Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 116
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 116
Asp Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Ala Asp
20 25 30
Met Lys Ala Ser Ala Cys Arg Ala Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Met Tyr Lys Asp Ser Gln Pro Arg Gly Leu Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Leu Arg Ser Val Pro Gly His Asp Asn Lys
100 105 110
Phe Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 117
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 117
Tyr Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Gly Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Gly Asp
20 25 30
Met Thr Ala Lys His Cys Arg Ala Arg Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Phe Tyr Lys Asp Ser Gln Pro Arg Gly Met Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Ile Arg Ser Val Pro Gly Ala Asp Asn Lys
100 105 110
Phe Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 118
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 118
Phe Phe Gly Lys Phe Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Gly Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Thr Asp
20 25 30
Met Glu Ser Lys Asp Cys Arg Asp Arg Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Phe Tyr Lys Asp Ser Gln Pro Arg Gly Leu Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Leu Arg Ser Val Pro Gly His Asp Asn Lys
100 105 110
Leu Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 119
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 119
Phe Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Gly Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Ala Asp
20 25 30
Met Ala Ser Asn His Cys Arg Ala Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Leu Tyr Lys Asp Ser Gln Pro Arg Gly Leu Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Ile Arg Ser Val Pro Gly His Asp Asn Lys
100 105 110
Met Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 120
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 120
Tyr Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Gly Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Ala Asp
20 25 30
Met Thr Ser Lys Arg Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Leu Tyr Lys Asp Ser Gln Pro Arg Gly Phe Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Ile Arg Ser Val Pro Gly His Asp Asn Lys
100 105 110
Ile Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 121
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 121
Leu Phe Gly Lys His Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Gly Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Gly Asp
20 25 30
Met Glu Ser Ser Pro Cys Arg Tyr Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Phe Tyr Lys Asp Ser Gln Pro Arg Gly Leu Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Ile Arg Ser Val Pro Gly His Asp Asn Lys
100 105 110
Met Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 122
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 122
Tyr Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Ala Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Thr Asp
20 25 30
Met Thr Ala Ser Pro Cys Arg Ser Ser Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Leu Tyr Lys Asp Ser Gln Pro Arg Gly Leu Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Leu Arg Ser Val Pro Gly Pro Asp Asn Lys
100 105 110
Ile Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 123
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 123
Tyr Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Gly Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Ala Asp
20 25 30
Met Thr Asp Ser Asp Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Met Tyr Lys Asp Ser Gln Pro Arg Gly Met Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Leu Arg Ser Val Pro Gly His Asp Asn Lys
100 105 110
Met Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 124
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 124
Tyr Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Gly Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Ala Asp
20 25 30
Met Thr Ser Ser Asp Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Phe Tyr Lys Asp Ser Gln Pro Arg Gly Met Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Leu Arg Ser Val Pro Gly His Asp Asn Lys
100 105 110
Met Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 125
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 125
Tyr Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Gly Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Ala Asp
20 25 30
Met Glu Ser Ser Asp Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Phe Tyr Lys Asp Ser Gln Pro Arg Gly Leu Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Leu Arg Ser Val Pro Gly His Asp Asn Lys
100 105 110
Met Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 126
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 126
Tyr Phe Gly Arg Tyr His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Gln Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Ala Asp Met
20 25 30
Gly Tyr Thr Val Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Met Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Leu Lys Glu Val Pro Gly His Arg Lys Leu Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp Glu Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 127
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 127
Asp Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Asp Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Ala Asp Met
20 25 30
Gly Ser Ile Ala Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Phe Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Tyr Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Leu Lys Ala Val Pro Gly Asp Asn Lys Ile Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Ala Thr Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 128
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 128
Tyr Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Gly Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Arg Asp Met
20 25 30
Ala Asp Thr Val Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Phe Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Ile Lys Pro Val Pro Gly Ala Ser Lys Met Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Ala Gly Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 129
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 129
His Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Asp Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Lys Asp Met
20 25 30
Glu Tyr Thr Val Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Met Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Ile Lys Ala Val Pro Gly Asp Arg Lys Ile Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp Asn Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 130
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 130
Tyr Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Ala Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Ala Asp Met
20 25 30
Ala Asp Lys Gly Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Met Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Leu Lys Pro Val Pro Gly Asp Thr Lys Met Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Phe Gly Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 131
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 131
Tyr Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Glu Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Ala Asp Met
20 25 30
Gly Asp Arg His Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Met Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Ile Lys Pro Val Pro Gly Ala Ser Lys Leu Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp Asp Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 132
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 132
His Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Asp Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Arg Asp Met
20 25 30
Gly Ala Ile Gly Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Phe Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Ile Lys Pro Val Pro Gly Asp Ser Lys Leu Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Val Asp Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 133
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 133
His Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Ser Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Thr Asp Met
20 25 30
Gly Ser Ile Val Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Met Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Ile Lys Gly Val Pro Gly Asp Asn Lys Ile Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp Arg Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 134
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 134
Tyr Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Ser Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Arg Asp Met
20 25 30
Glu Asp Thr Pro Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Phe Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Ile Lys Arg Val Pro Gly Asp Ser Lys Leu Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Phe Glu Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 135
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 135
His Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Ala Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Gly Asp Met
20 25 30
Thr Ala Thr Val Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Phe Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Ile Lys Pro Val Pro Gly Asp Ser Lys Leu Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp Asn Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 136
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 136
Asn Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Asn Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Lys Asp Met
20 25 30
Glu Tyr Thr Leu Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Phe Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Ile Lys Pro Val Pro Gly Asp Asn Lys Leu Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Tyr Glu Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 137
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 137
Tyr Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Gly Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Ala Asp Met
20 25 30
Glu Ala Thr Arg Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Phe Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Ile Lys Gly Val Pro Gly Ala Asn Lys Met Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp Gly Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Asn Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 138
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 138
Asn Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Gly Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Ala Asp Met
20 25 30
Arg Ala Ile Leu Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Phe Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Leu Lys Gly Val Pro Gly Asp Asn Lys Leu Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp Arg Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 139
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 139
Tyr Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Ala Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Ala Asp Met
20 25 30
Glu Ala Thr Ala Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Phe Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Ile Lys Gly Val Pro Gly Ala Ser Lys Met Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp Gly Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 140
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 140
Leu Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Gly Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Ala Asp Met
20 25 30
Gly Ala Thr Leu Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Met Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Leu Lys Pro Val Pro Gly Asp Thr Lys Met Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Ala Ser Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 141
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 141
Asn Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Gly Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Glu Asp Met
20 25 30
Ala Tyr Thr Val Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Phe Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Ile Lys Gly Val Pro Gly Asp Ser Lys Met Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Tyr Asp Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 142
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 142
Asp Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Asp Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Lys Asp Met
20 25 30
Glu Ser Lys Pro Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Phe Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Leu Lys Ala Val Pro Gly Ala Ser Lys Leu Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Ala Asn Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 143
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 143
Leu Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Gly Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Ala Asp Met
20 25 30
Gly Asp Lys Val Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Met Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Ile Lys Pro Val Pro Gly Asp Asn Lys Leu Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp Glu Ala Phe Lys Leu Ile Leu Lys Thr Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 144
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 144
Tyr Phe Gly Arg His His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Gln Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Arg Asp Met
20 25 30
Ala Ala Thr Arg Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Met Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Leu Lys Gly Val Pro Gly Asp Asn Lys Met Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp Asp Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 145
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 145
Asn Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Gln Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Thr Asp Met
20 25 30
Glu Ser Ile Gly Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Phe Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Leu Lys Ala Val Pro Gly Ala Asn Lys Leu Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp Ser Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 146
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 146
Phe Phe Gly Arg His His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Gly Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Gly Asp Met
20 25 30
Gly Asp Arg Val Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Met Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Ile Lys Ala Val Pro Gly Asp Ser Lys Ile Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp Gly Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 147
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 147
Val Phe Gly Arg His His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Gly Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Lys Asp Met
20 25 30
Thr Tyr Ile Asp Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Met Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Leu Lys Ala Val Pro Gly Asp Thr Lys Met Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Ala Gln Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Ile Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 148
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 148
Asn Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Gly Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Ala Asp Met
20 25 30
Thr Ala Thr Arg Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Met Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Ile Lys Gln Val Pro Gly Ala Asn Lys Ile Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Phe Arg Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 149
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 149
Asp Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Gly Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Gly Asp Met
20 25 30
Ala Tyr Ile Gly Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Phe Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Ile Lys Ala Val Pro Gly His Ser Lys Ile Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Ser Gly Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 150
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 150
Tyr Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Asp Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Arg Asp Met
20 25 30
Gly Ser Ile Ala Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Met Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Ile Lys Pro Val Pro Gly Ala Thr Lys Leu Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp Gly Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Asn Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 151
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 151
Tyr Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Glu Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Thr Asp Met
20 25 30
Glu Ala Ile Gly Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Phe Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Ile Lys Gly Val Pro Gly Asp Arg Lys Met Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp Gly Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 152
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 152
Phe Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Asn Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Glu Asp Met
20 25 30
Glu Tyr Arg Leu Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Met Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Leu Lys Pro Val Pro Gly Ala Ser Lys Leu Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Ser Asp Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 153
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 153
Asn Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Asn Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Ala Asp Met
20 25 30
Glu Asp Arg Leu Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Met Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Leu Lys Gly Val Pro Gly Asp Asn Lys Met Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp His Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 154
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 154
Tyr Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Ala Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Arg Asp Met
20 25 30
Gly Tyr Ile Leu Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Leu Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Glu Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Leu Lys Pro Val Pro Gly Asp Thr Lys Ile Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp Asn Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 155
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 155
Tyr Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Asp Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Gly Asp Met
20 25 30
Ala Asp Thr Ala Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Phe Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Ile Lys Pro Val Pro Gly Asp Ser Lys Met Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Ala Asp Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 156
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 156
Asp Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Gly Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Glu Asp Met
20 25 30
Ala Tyr Ile Ala Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Phe Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Ile Lys Pro Val Pro Gly Asp Ser Lys Ile Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Ala Asp Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 157
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 157
Asn Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Glu Gln Val Leu Ser Val Asp Lys Arg Gln Pro Val Phe Arg Asp Met
20 25 30
Lys Tyr Ile Leu Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Phe Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Leu Lys Gly Val Pro Gly Asp Asn Lys Met Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Tyr Gly Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 158
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 158
Asp Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Glu Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Thr Asp Met
20 25 30
Ala Tyr Ile Leu Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Phe Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Glu Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Ile Lys Ala Val Pro Gly Asp Ser Lys Leu Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp Thr Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 159
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 159
Asp Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Asn Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Lys Asp Met
20 25 30
Glu Ser Thr Ala Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Met Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Leu Lys Gly Val Pro Gly Ala Ser Lys Leu Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Ala Gly Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 160
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 160
His Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Glu Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Ala Asp Met
20 25 30
Glu Ala Ile Gly Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Phe Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Glu Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Ile Lys Gly Val Pro Gly Asp Thr Lys Leu Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Ala Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp Gly Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 161
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 161
Ile Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Glu Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Lys Asp Met
20 25 30
Arg Tyr Ile Val Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Phe Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Ile Lys Glu Val Pro Gly Ala Ser Lys Leu Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp Glu Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 162
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 162
Tyr Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Ala Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Thr Asp Met
20 25 30
Gly Tyr Thr Leu Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Leu Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Ile Lys Pro Val Pro Gly His Asn Lys Ile Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp Arg Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 163
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 163
Asn Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Asn Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Arg Asp Met
20 25 30
Ala Ser Thr Ala Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Met Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Ile Lys Gly Val Pro Gly Ala Asn Lys Ile Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp Asp Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 164
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 164
Asp Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Gly Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Glu Asp Met
20 25 30
Lys Asp Arg Ala Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Phe Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Leu Lys Ala Val Pro Gly His Ser Lys Met Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp Glu Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 165
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 165
Asn Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Glu Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Ala Asp Met
20 25 30
Thr Asp Ile Ala Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Met Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Glu Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Leu Lys Pro Val Pro Gly Asp Ile Lys Met Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Tyr Gly Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Asn Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 166
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 166
Tyr Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Glu Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Ala Asp Met
20 25 30
Thr Asp Thr Leu Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Phe Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Leu Lys Gly Val Pro Gly Asp Asn Lys Met Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp Thr Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 167
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 167
Tyr Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Glu Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Ala Asp Met
20 25 30
Thr Asp Thr Leu Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Phe Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Leu Lys Gly Val Pro Gly Asp Asn Lys Met Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp Thr Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 168
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 168
Tyr Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Glu Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Ala Asp Met
20 25 30
Thr Asp Thr Leu Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Phe Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Leu Lys Gly Val Pro Gly Asp Asn Lys Met Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp Thr Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 169
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 169
His Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Gly Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Lys Asp Met
20 25 30
Lys Tyr Ile Val Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Met Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Leu Lys Ala Val Pro Gly His Ser Lys Ile Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp Ser Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 170
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 170
His Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Gly Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Lys Asp Met
20 25 30
Lys Tyr Ile Val Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Met Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Leu Lys Ala Val Pro Gly His Ser Lys Ile Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp Ser Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 171
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 171
Tyr Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Gly Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Glu Asp Met
20 25 30
Lys Ala Lys Ala Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Phe Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Ile Lys Pro Val Pro Gly Ala Ser Lys Met Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp Gly Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 172
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 172
Tyr Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Gly Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Glu Asp Met
20 25 30
Lys Ala Lys Ala Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Phe Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Ile Lys Pro Val Pro Gly Ala Ser Lys Met Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp Gly Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 173
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 173
Tyr Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Gly Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Glu Asp Met
20 25 30
Lys Ala Lys Ala Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Phe Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Ile Lys Pro Val Pro Gly Ala Ser Lys Met Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp Gly Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 174
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 174
Leu Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Gly Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Gly Asp Met
20 25 30
Gly Ser Ile Pro Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Phe Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Ile Lys His Val Pro Gly Ala Thr Lys Met Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp Asn Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 175
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 175
Leu Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Gly Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Gly Asp Met
20 25 30
Gly Ser Ile Pro Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Phe Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Ile Lys His Val Pro Gly Ala Thr Lys Met Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp Asn Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 176
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 176
Tyr Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Ser Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Thr Asp Met
20 25 30
Ala Tyr Thr Val Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Phe Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Ile Lys Ala Val Pro Gly Asp Ser Lys Leu Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp Asn Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 177
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 177
Tyr Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Ser Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Thr Asp Met
20 25 30
Ala Tyr Thr Val Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Phe Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Ile Lys Ala Val Pro Gly Asp Ser Lys Leu Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp Asn Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 178
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 178
Tyr Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Gly Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Thr Asp Met
20 25 30
Gly Ala Arg Val Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Phe Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Tyr Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Leu Lys Pro Val Pro Gly Asp Asn Lys Leu Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Ser Gly Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 179
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 179
Tyr Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Gly Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Thr Asp Met
20 25 30
Gly Ala Arg Val Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Phe Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Tyr Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Leu Lys Pro Val Pro Gly Asp Asn Lys Leu Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Ser Gly Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 180
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 180
Asp Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Gly Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Gly Asp Met
20 25 30
Lys Ala Thr Gly Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Phe Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Ile Lys Ala Val Pro Gly Ala Asn Lys Leu Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Ala Gly Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 181
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 181
Asp Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Gly Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Gly Asp Met
20 25 30
Lys Ala Thr Gly Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Phe Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Ile Lys Ala Val Pro Gly Ala Asn Lys Leu Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Ala Gly Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 182
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 182
Asp Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Ser Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Arg Asp Met
20 25 30
Gly Ser Ile His Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Phe Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Leu Lys Ala Val Pro Gly Ala Asn Lys Leu Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp Gly Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 183
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 183
Asp Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Ser Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Arg Asp Met
20 25 30
Gly Ser Ile His Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Phe Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Leu Lys Ala Val Pro Gly Ala Asn Lys Leu Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp Gly Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 184
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 184
Tyr Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Glu Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Lys Asp Met
20 25 30
Lys Asp Lys Leu Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Phe Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Leu Lys Gly Val Pro Gly Asp Asn Lys Leu Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Phe Gly Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 185
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 185
Tyr Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Glu Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Lys Asp Met
20 25 30
Lys Asp Lys Leu Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Phe Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Leu Lys Gly Val Pro Gly Asp Asn Lys Leu Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Phe Gly Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 186
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 186
Tyr Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Gly Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Ala Asp Met
20 25 30
Ala Ser Thr His Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Phe Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Leu Lys Gly Val Pro Gly Ala Asn Lys Ile Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp Asp Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 187
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 187
Tyr Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Gly Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Ala Asp Met
20 25 30
Ala Ser Thr His Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Phe Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Leu Lys Gly Val Pro Gly Ala Asn Lys Ile Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp Asp Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 188
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 188
Tyr Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Gly Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Ala Asp Met
20 25 30
Ala Ser Thr His Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Phe Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Leu Lys Gly Val Pro Gly Ala Asn Lys Ile Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Asp Asp Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 189
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 189
Tyr Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Ser Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Gly Asp Met
20 25 30
Lys Tyr Ile Val Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Phe Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Leu Lys Gly Val Pro Gly Asp Thr Lys Met Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Ser Gly Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 190
<211> 157
<212> PRT
<213> искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 190
Tyr Phe Gly Arg Leu His Cys Thr Thr Ala Val Ile Arg Asn Ile Asn
1 5 10 15
Ser Gln Val Leu Phe Val Asp Lys Arg Gln Pro Val Phe Gly Asp Met
20 25 30
Lys Tyr Ile Val Gln Ser Ala Ser Glu Pro Gln Thr Arg Leu Ile Ile
35 40 45
Tyr Phe Tyr Lys Asp Ser Glu Val Arg Gly Leu Ala Val Thr Leu Ser
50 55 60
Val Lys Asp Ser Lys Met Ser Thr Leu Ser Cys Lys Asn Lys Ile Ile
65 70 75 80
Ser Phe Glu Glu Met Asp Pro Pro Glu Asn Ile Asp Asp Ile Gln Ser
85 90 95
Asp Leu Ile Phe Phe Leu Lys Gly Val Pro Gly Asp Thr Lys Met Glu
100 105 110
Phe Glu Ser Ser Leu Tyr Glu Gly His Phe Leu Ala Cys Gln Lys Glu
115 120 125
Ser Gly Ala Phe Lys Leu Ile Leu Lys Lys Lys Asp Glu Asn Gly Asp
130 135 140
Lys Ser Val Met Phe Thr Leu Thr Asn Leu His Gln Ser
145 150 155
<210> 191
<211> 157
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 191
Tyr Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Glu Asp
20 25 30
Met Thr Asp Ser Asp Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Lys Tyr Gly Asp Ser Val Pro Arg Gly Leu Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Ala Arg Ala Val Pro Gly His Ser Arg Lys
100 105 110
Thr Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 192
<211> 157
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 192
Tyr Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Glu Asp
20 25 30
Met Thr Asp Ser Asp Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Lys Tyr Ser Asp Ser Arg Ala Arg Gly Leu Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Ala Arg Ser Val Pro Gly His Gly Arg Lys
100 105 110
Thr Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<210> 193
<211> 157
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 193
Tyr Phe Gly Lys Leu Glu Ser Lys Leu Ser Val Ile Arg Asn Leu Asn
1 5 10 15
Asp Gln Val Leu Phe Ile Asp Gln Gly Asn Arg Pro Leu Phe Glu Asp
20 25 30
Met Thr Asp Ser Asp Cys Arg Asp Asn Ala Pro Arg Thr Ile Phe Ile
35 40 45
Ile Ser Lys Tyr Ser Asp Ser Arg Ala Arg Gly Leu Ala Val Thr Ile
50 55 60
Ser Val Lys Cys Glu Lys Ile Ser Thr Leu Ser Cys Glu Asn Lys Ile
65 70 75 80
Ile Ser Phe Lys Glu Met Asn Pro Pro Asp Asn Ile Lys Asp Thr Lys
85 90 95
Ser Asp Ile Ile Phe Phe Ala Arg Asp Val Pro Gly His Ser Gly Lys
100 105 110
Arg Gln Phe Glu Ser Ser Ser Tyr Glu Gly Tyr Phe Leu Ala Cys Glu
115 120 125
Lys Glu Arg Asp Leu Phe Lys Leu Ile Leu Lys Lys Glu Asp Glu Leu
130 135 140
Gly Asp Arg Ser Ile Met Phe Thr Val Gln Asn Glu Asp
145 150 155
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРИМЕНЕНИЕ IL-18-СВЯЗЫВАЮЩЕГО БЕЛКА (IL-18BP) ПРИ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЯХ | 2014 |
|
RU2731713C2 |
| IL-18-СВЯЗЫВАЮЩИЕ БЕЛОК (IL-18BP) И АНТИТЕЛА ПРИ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЯХ | 2016 |
|
RU2755691C2 |
| IL-18-СВЯЗЫВАЮЩИЙ БЕЛОК (IL-18BP) И АНТИТЕЛА ПРИ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЯХ | 2016 |
|
RU2810206C1 |
| ИММУНОЦИТОКИНЫ И ИХ ПРИМЕНЕНИЕ | 2021 |
|
RU2818371C1 |
| АНТИТЕЛА, СОДЕРЖАЩИЕ ПОЛИПЕПТИД, ВСТРОЕННЫЙ В УЧАСТОК КАРКАСНОЙ ОБЛАСТИ 3 | 2019 |
|
RU2796254C2 |
| СЛИТЫЕ СЕРПИНОВЫЕ ПОЛИПЕПТИДЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2728861C1 |
| СЛИТЫЕ СЕРПИНОВЫЕ ПОЛИПЕПТИДЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2698655C2 |
| СЛИТЫЕ СЕРПИНОВЫЕ ПОЛИПЕПТИДЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2746550C2 |
| СЛИТЫЙ ПОЛИПЕПТИД С ПРОТИВОРАКОВОЙ АКТИВНОСТЬЮ | 2016 |
|
RU2754466C2 |
| АНТИТЕЛА, НАПРАВЛЕННЫЕ ПРОТИВ РЕЦЕПТОРА ИНТЕРЛЕЙКИНА 36 (IL-36R) | 2016 |
|
RU2745898C2 |
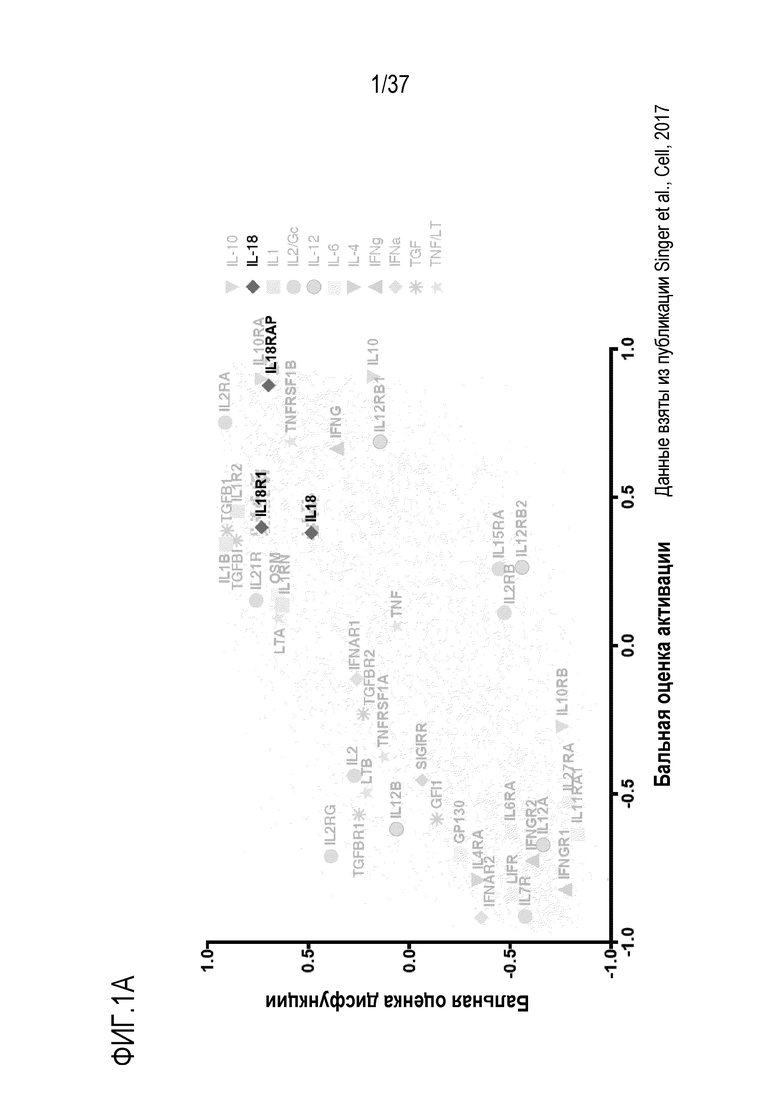

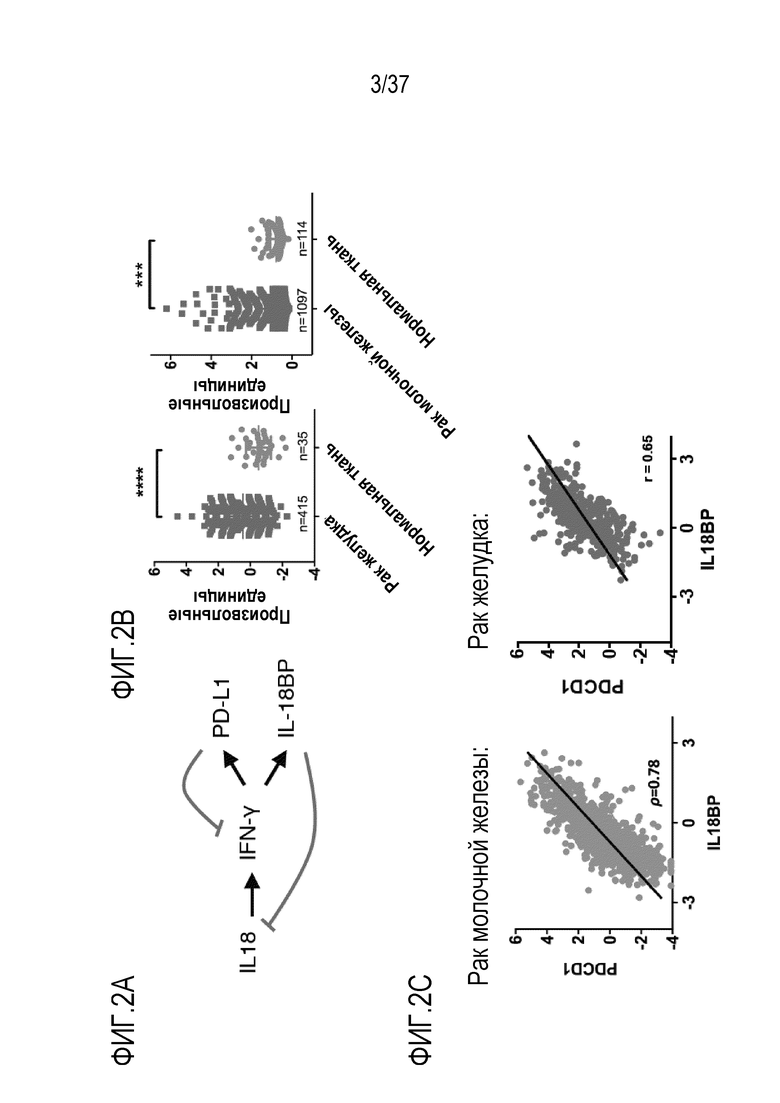
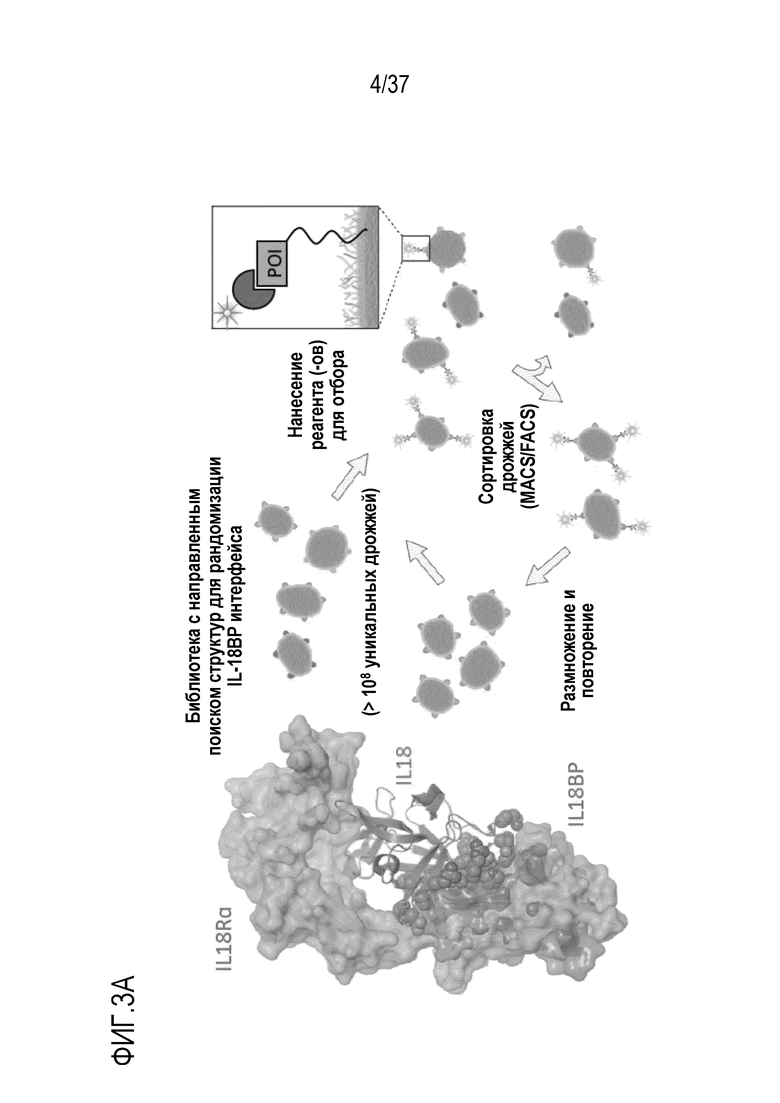
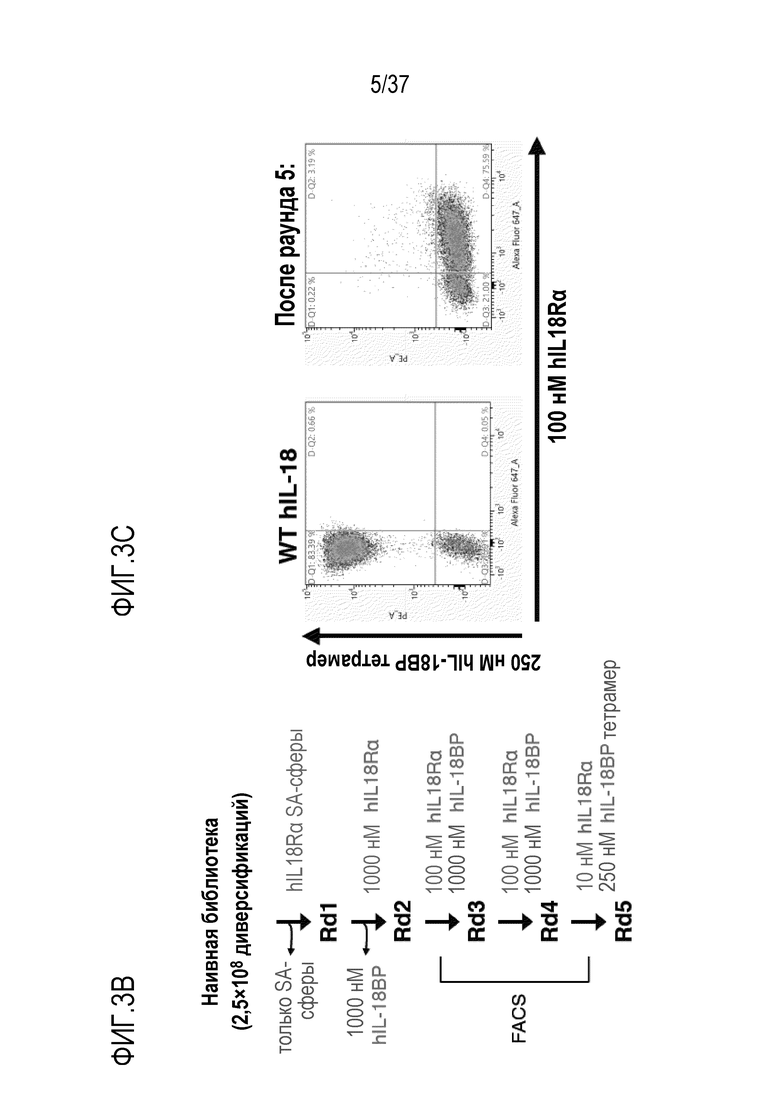
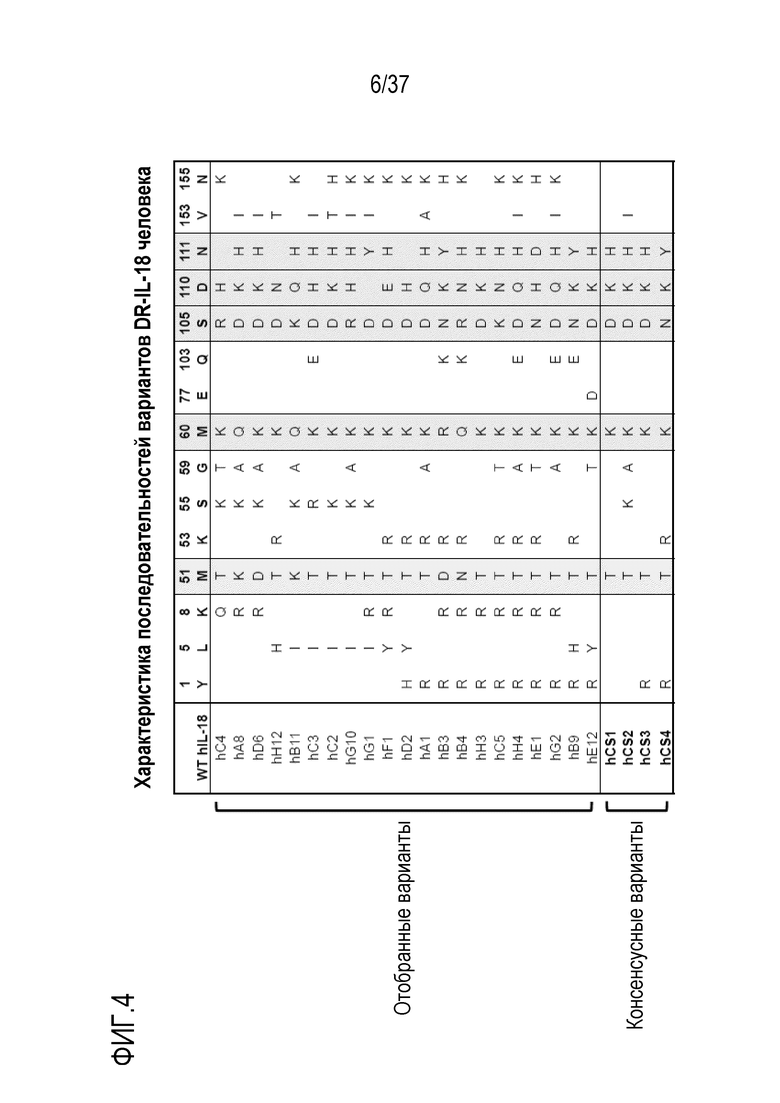
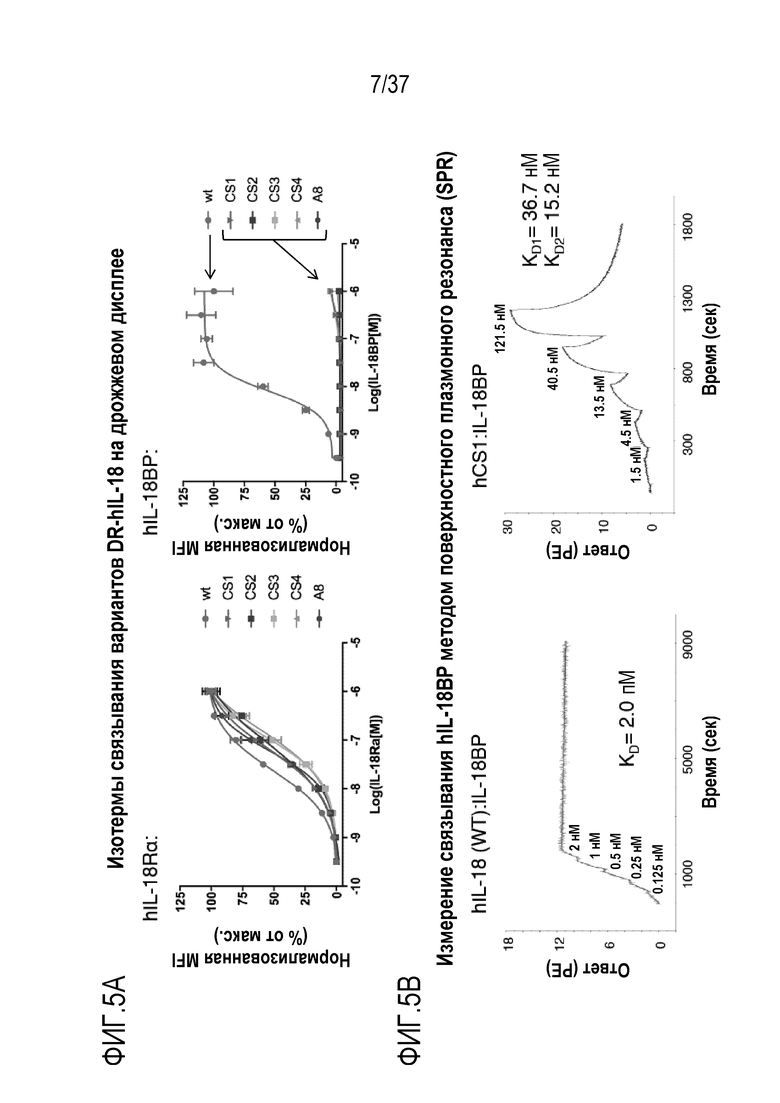
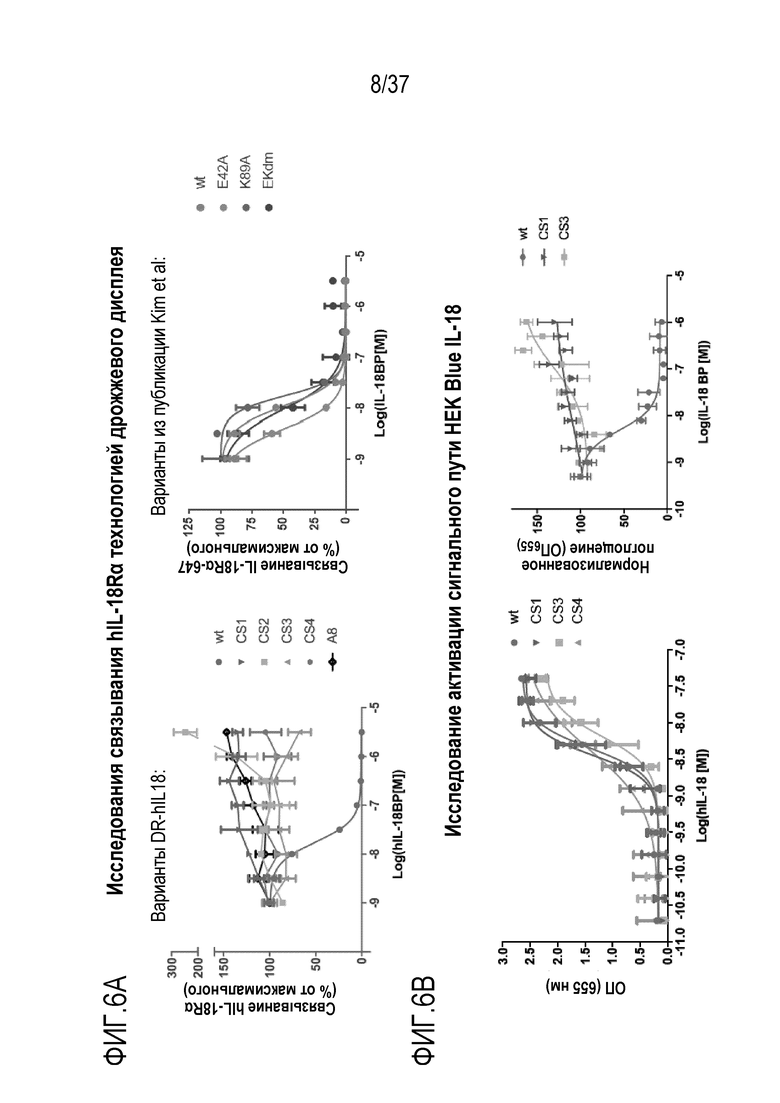
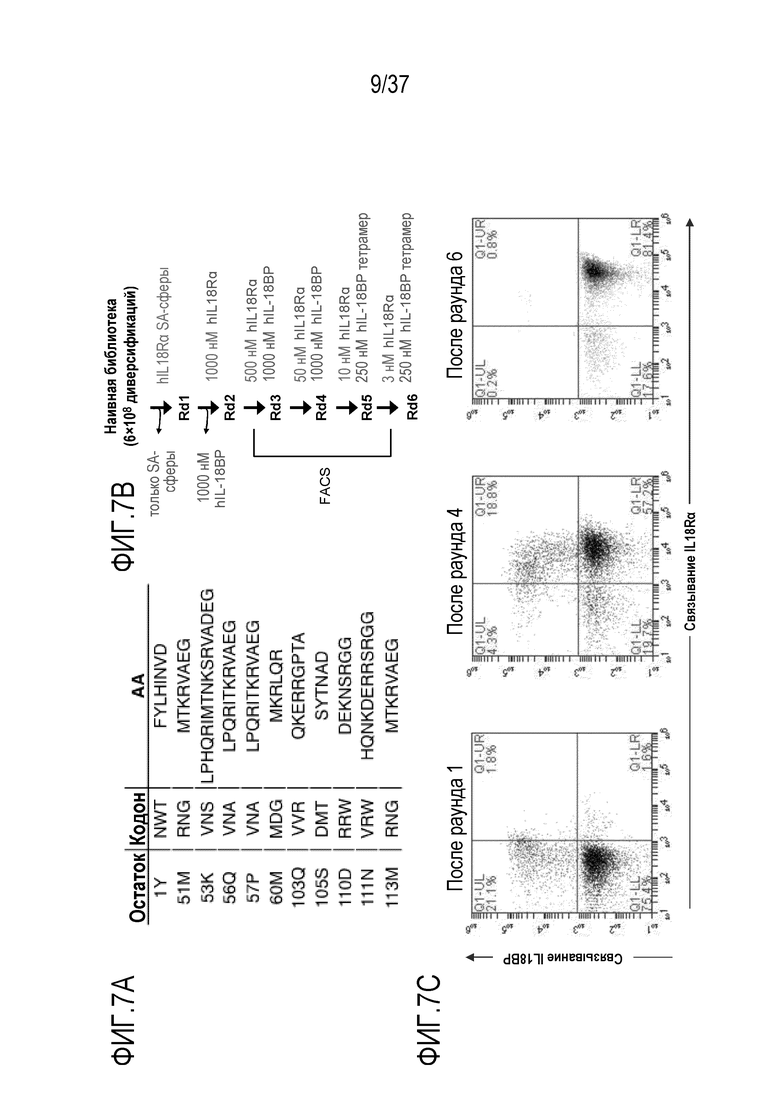

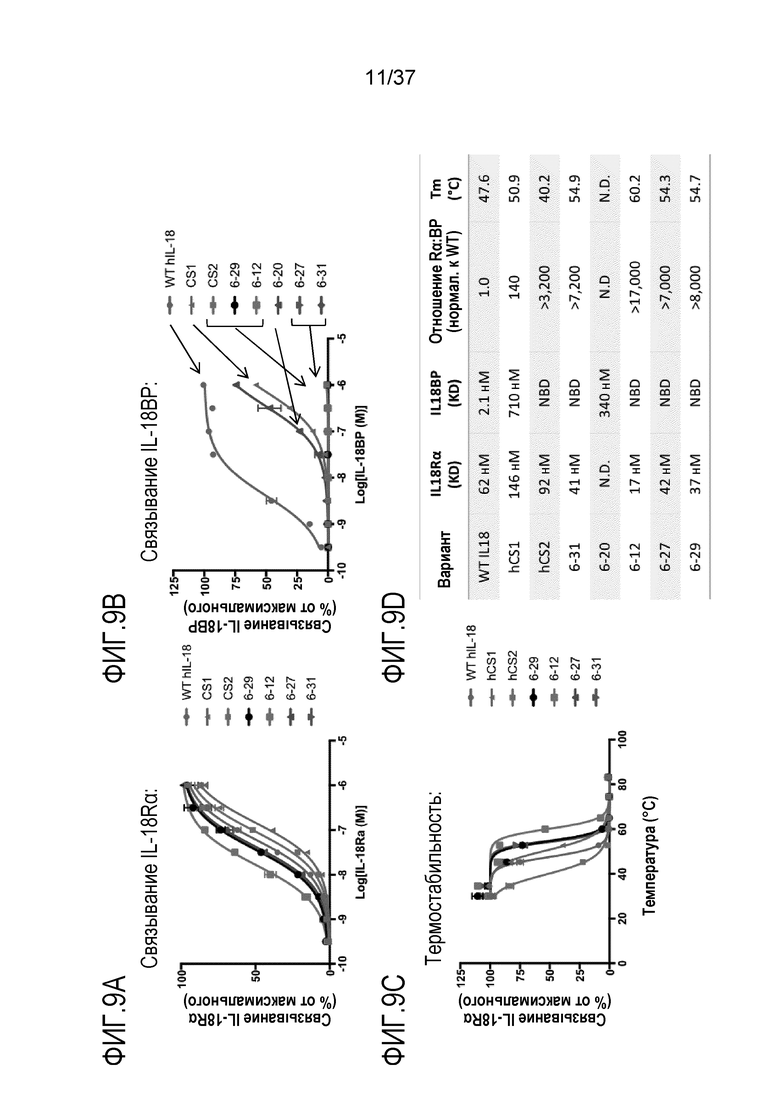
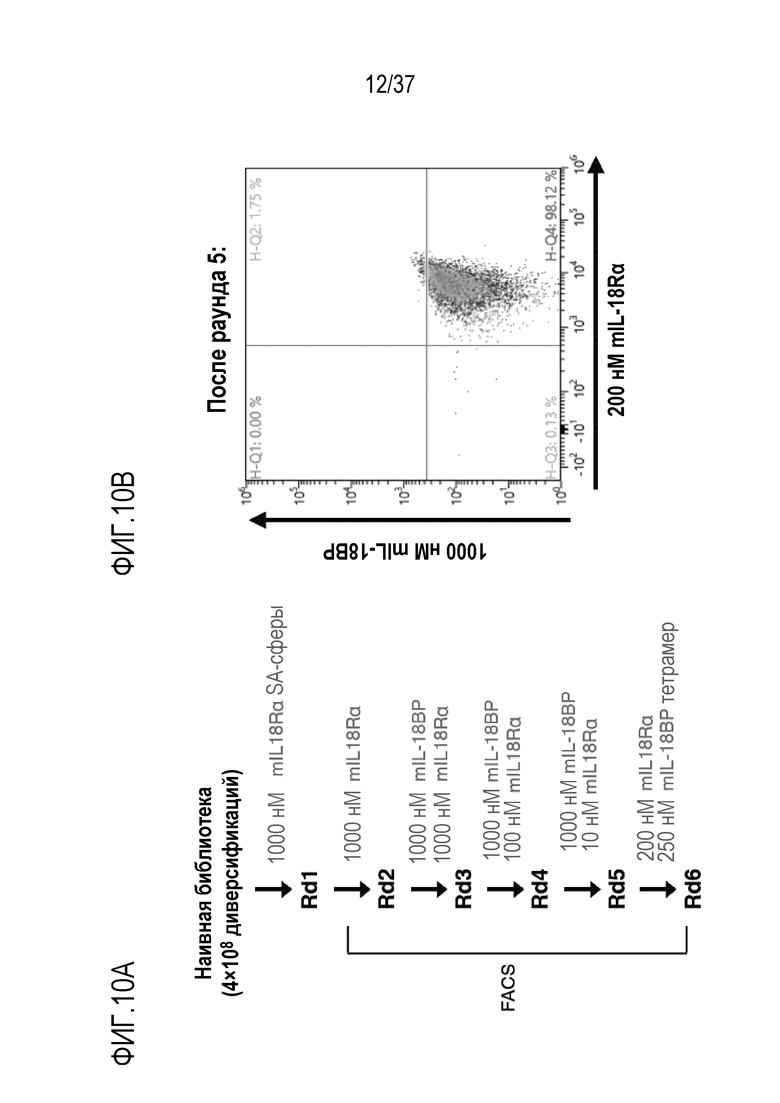
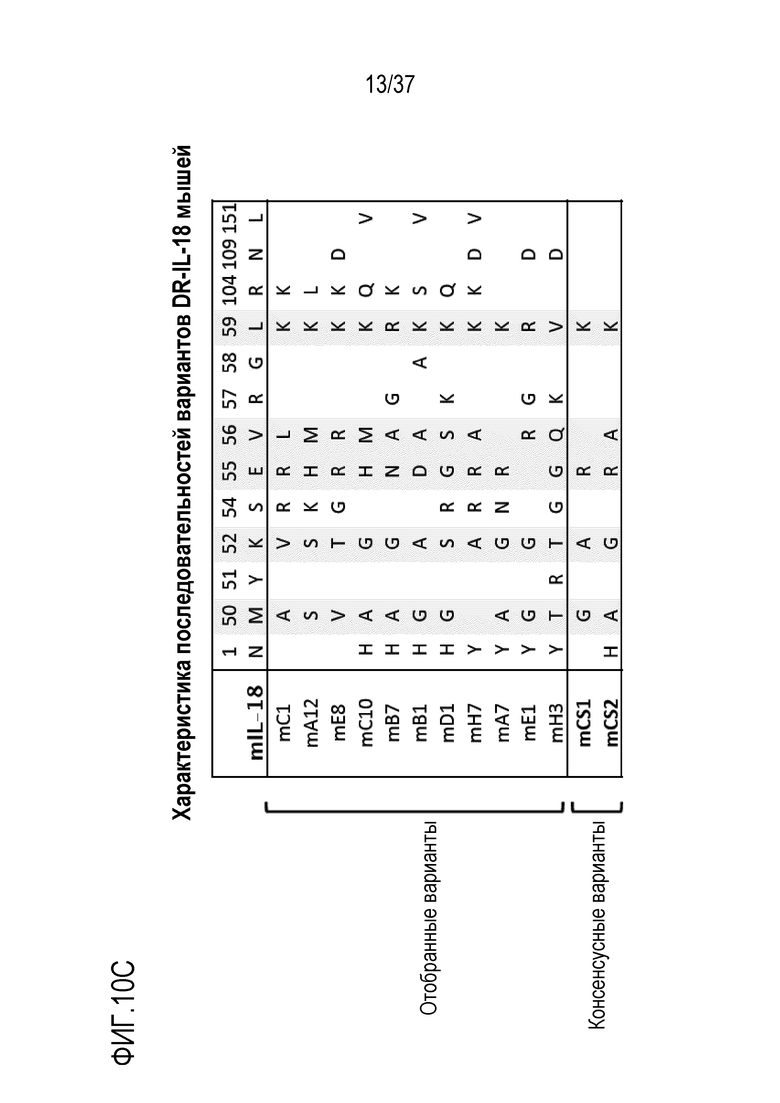
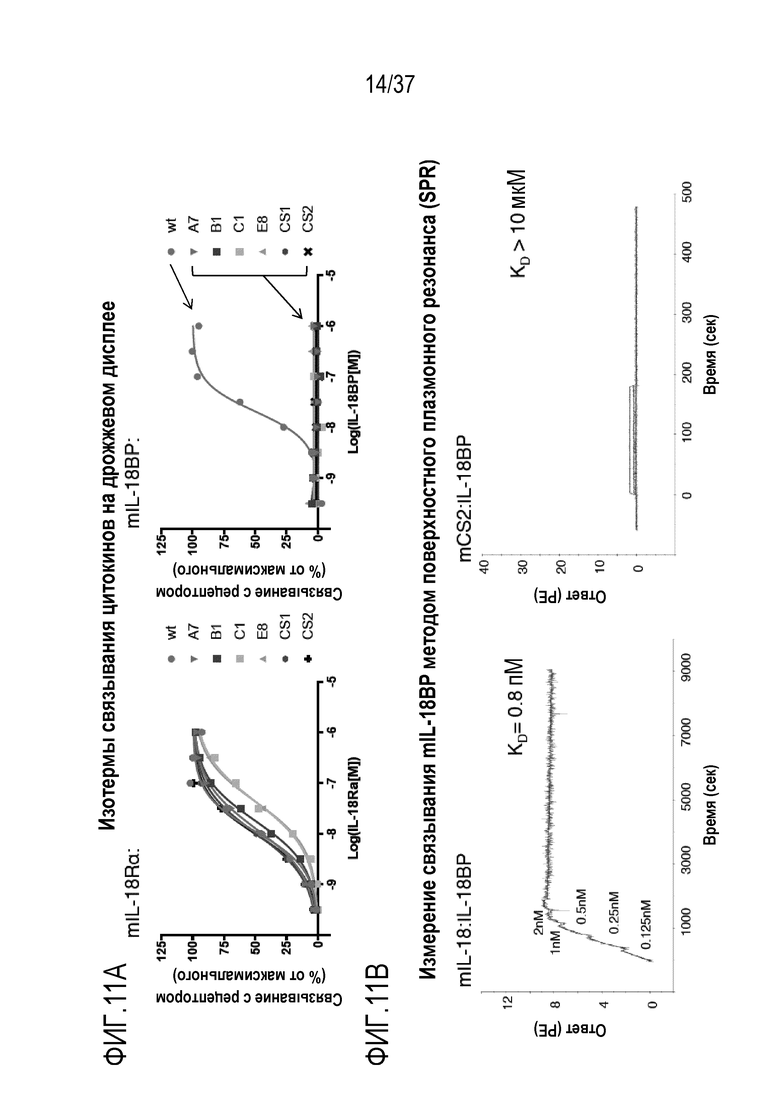
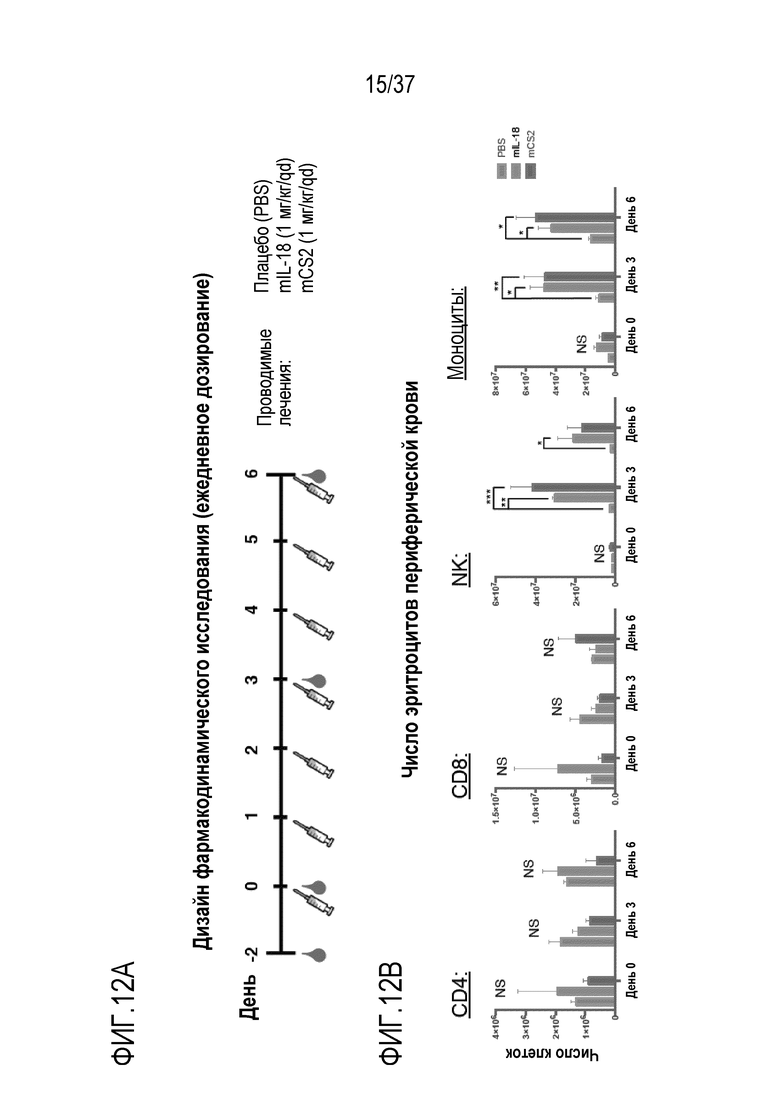
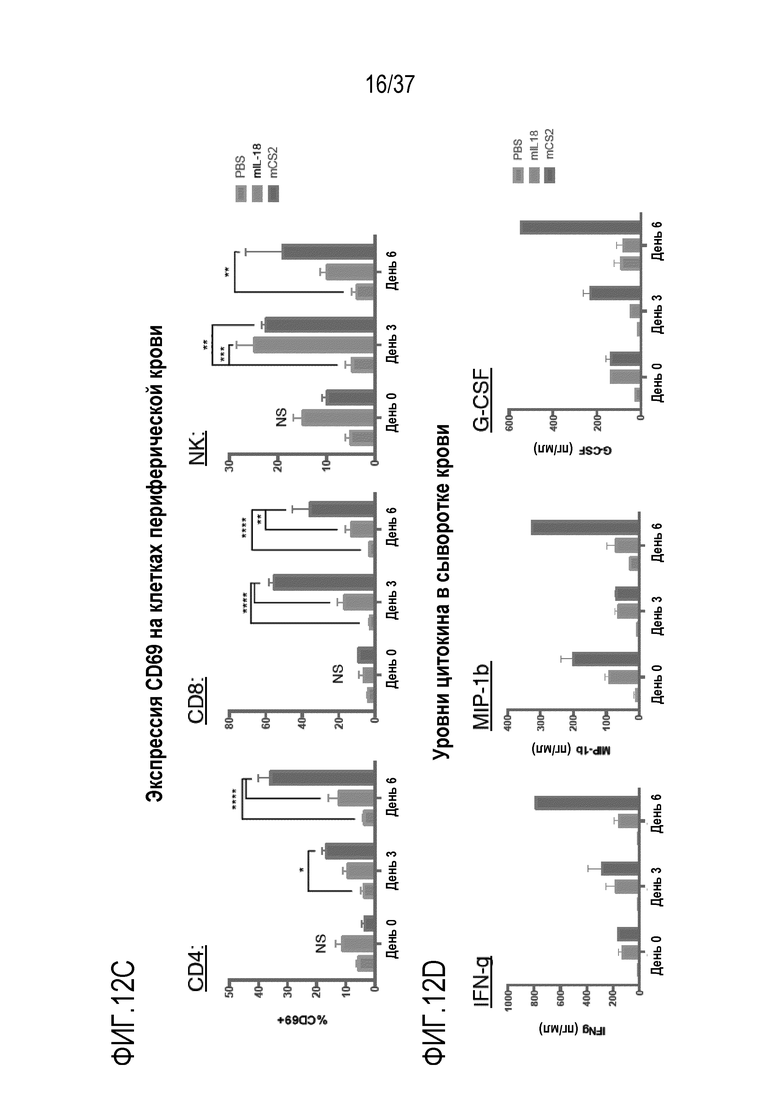

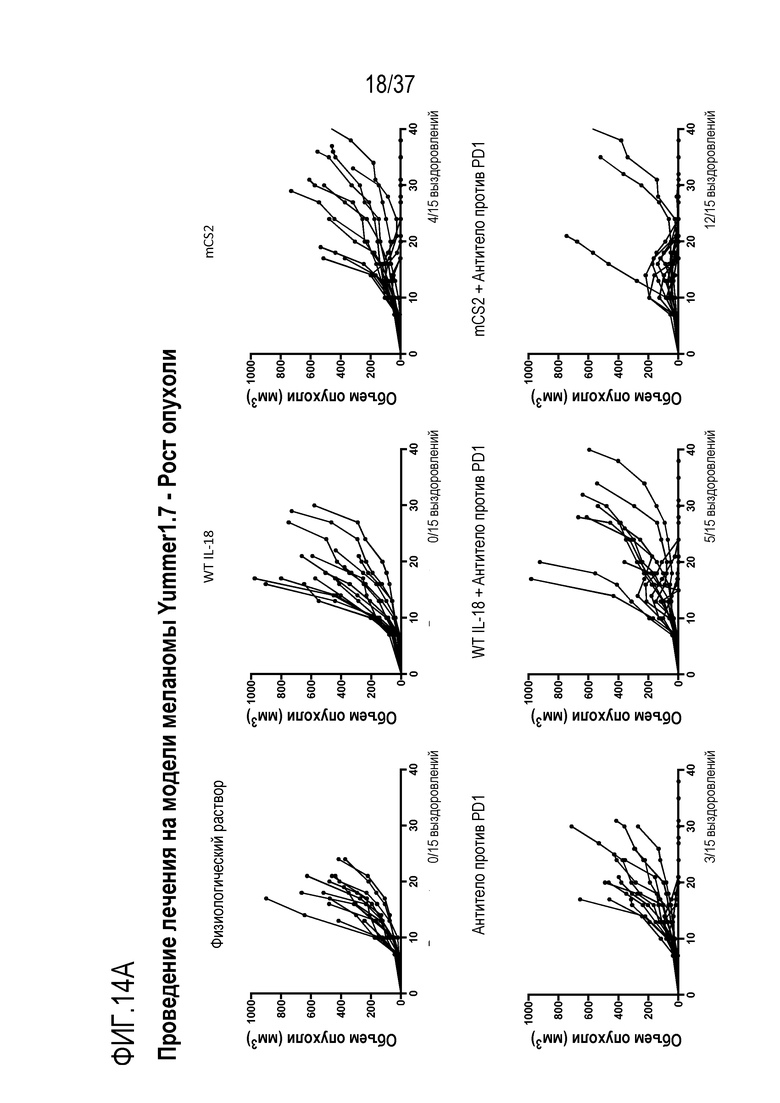
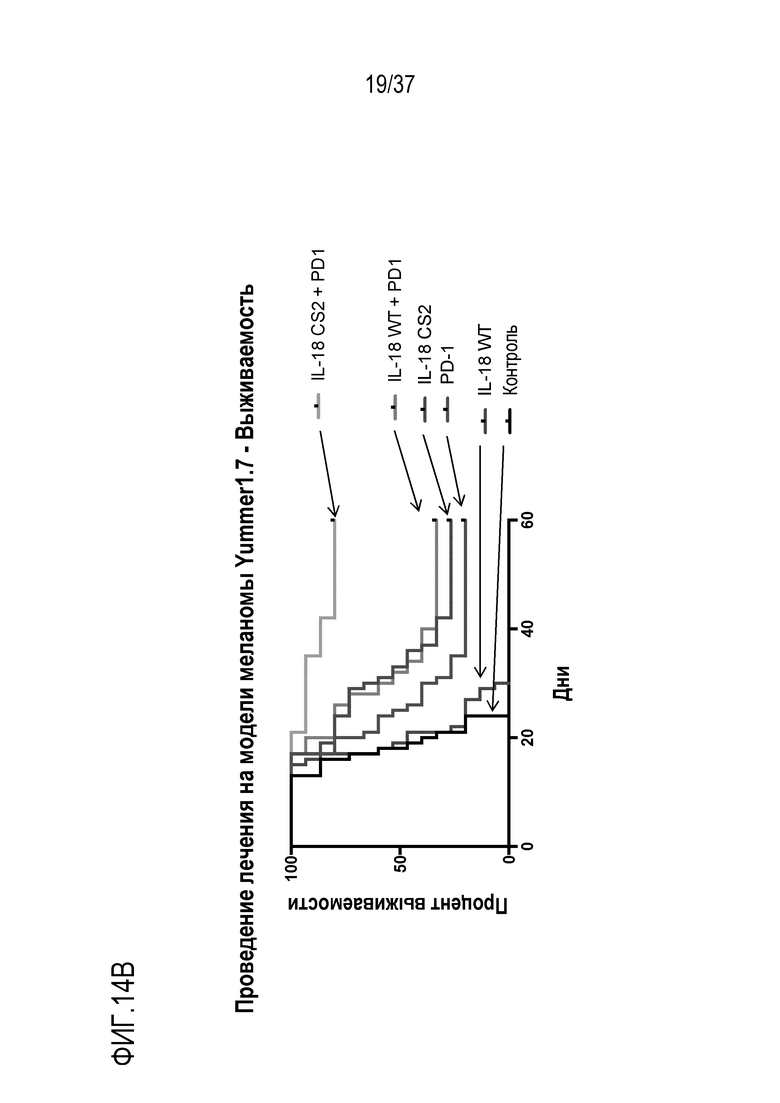
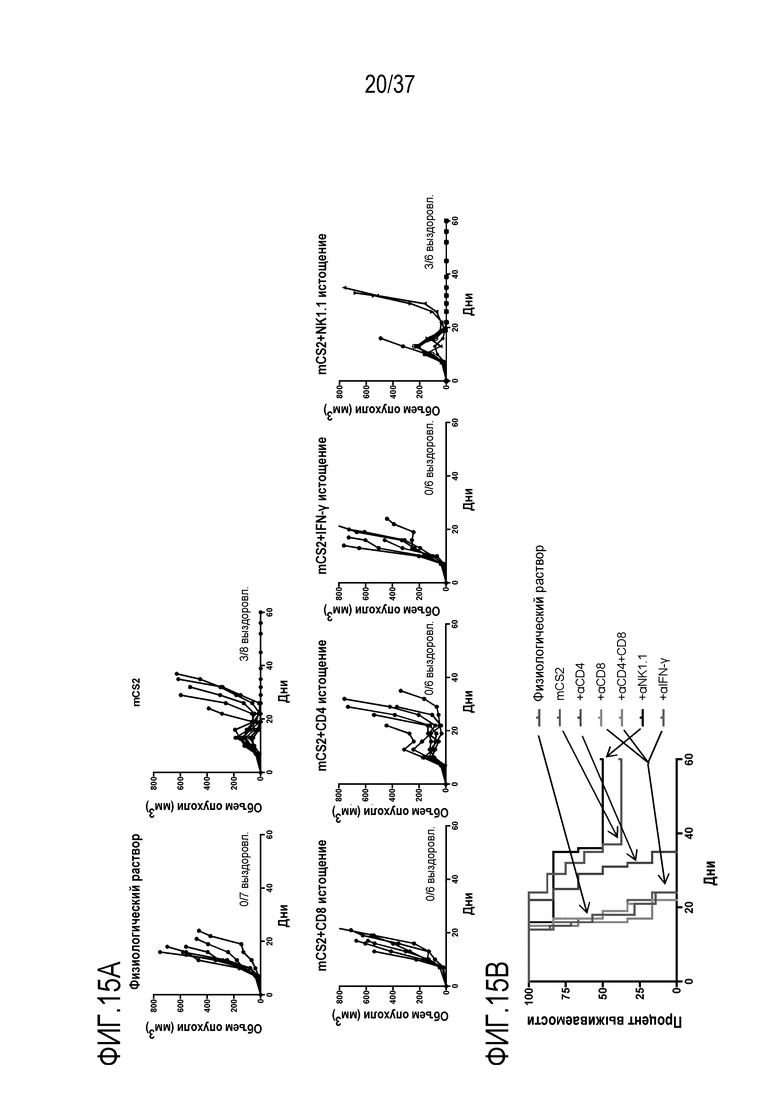
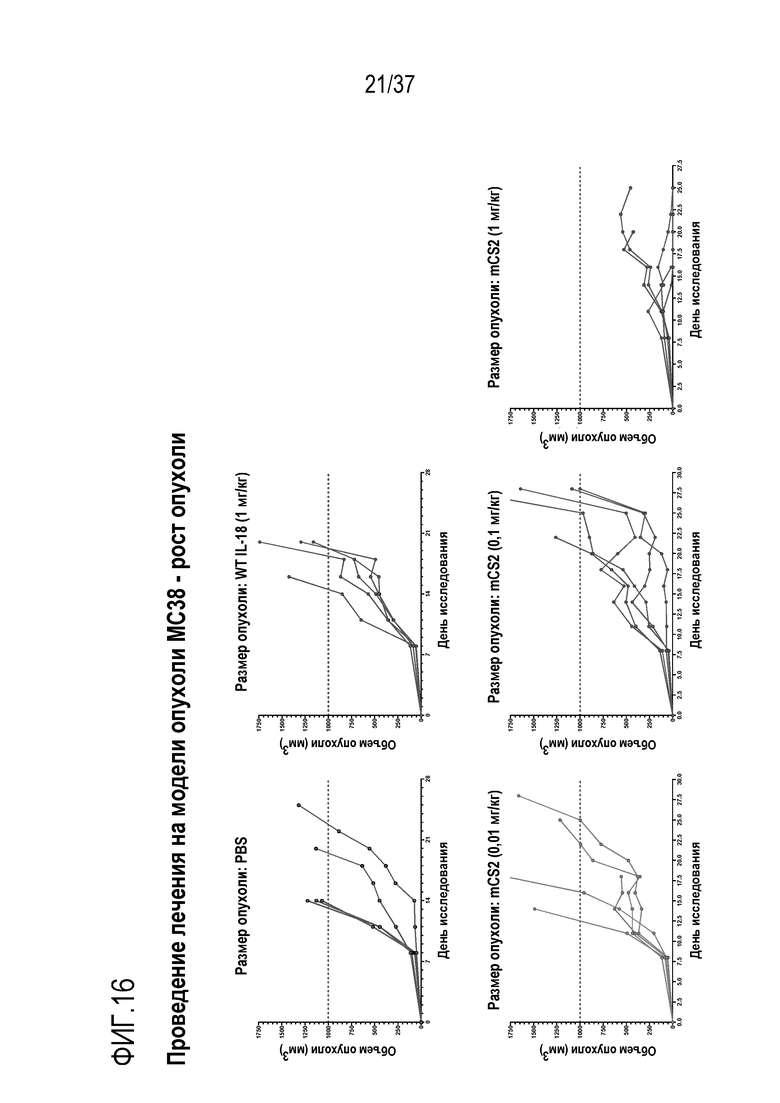
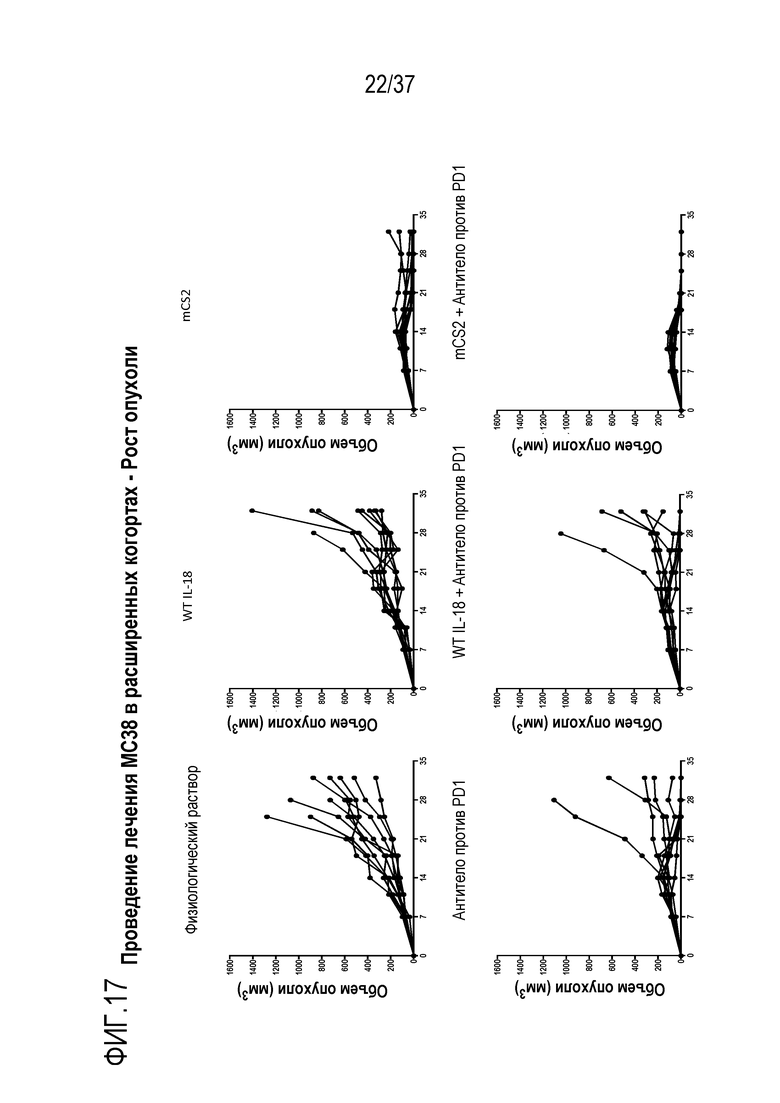
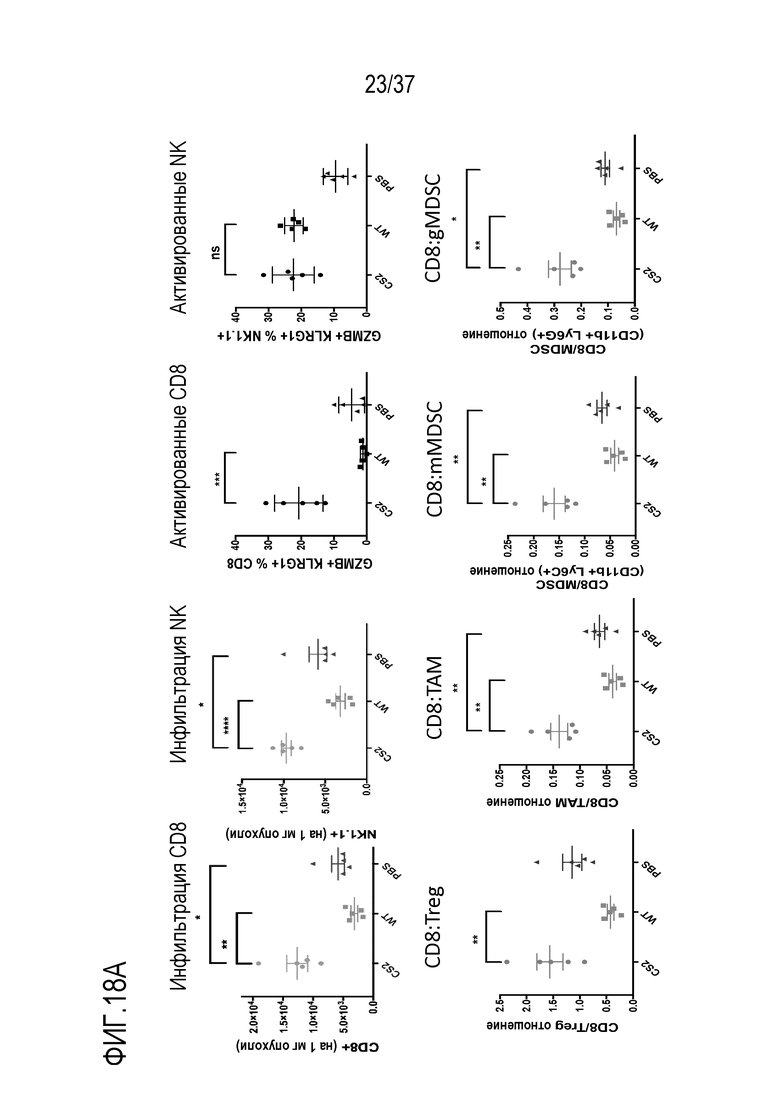
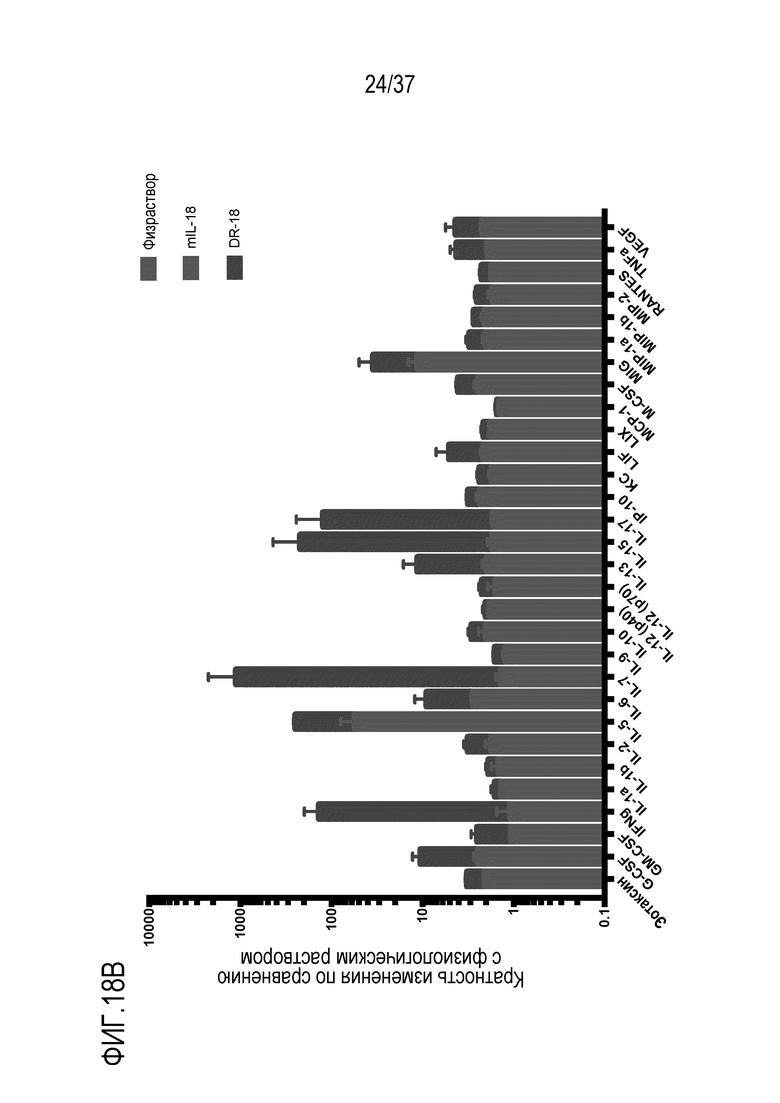
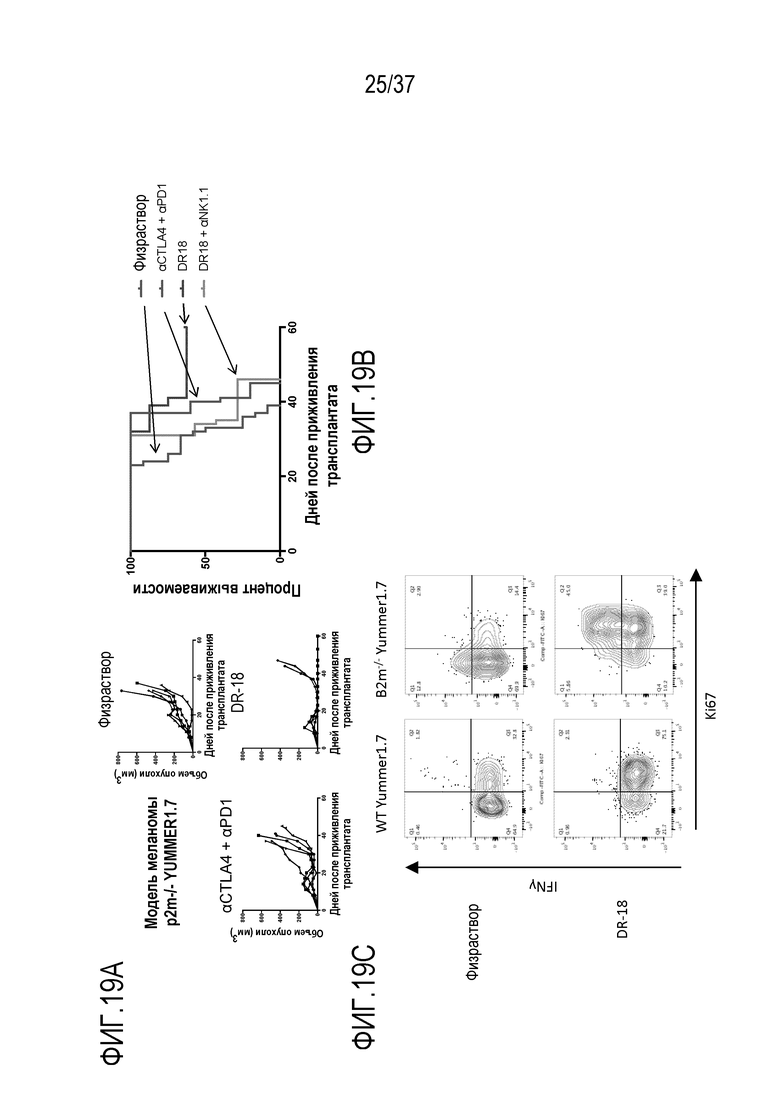
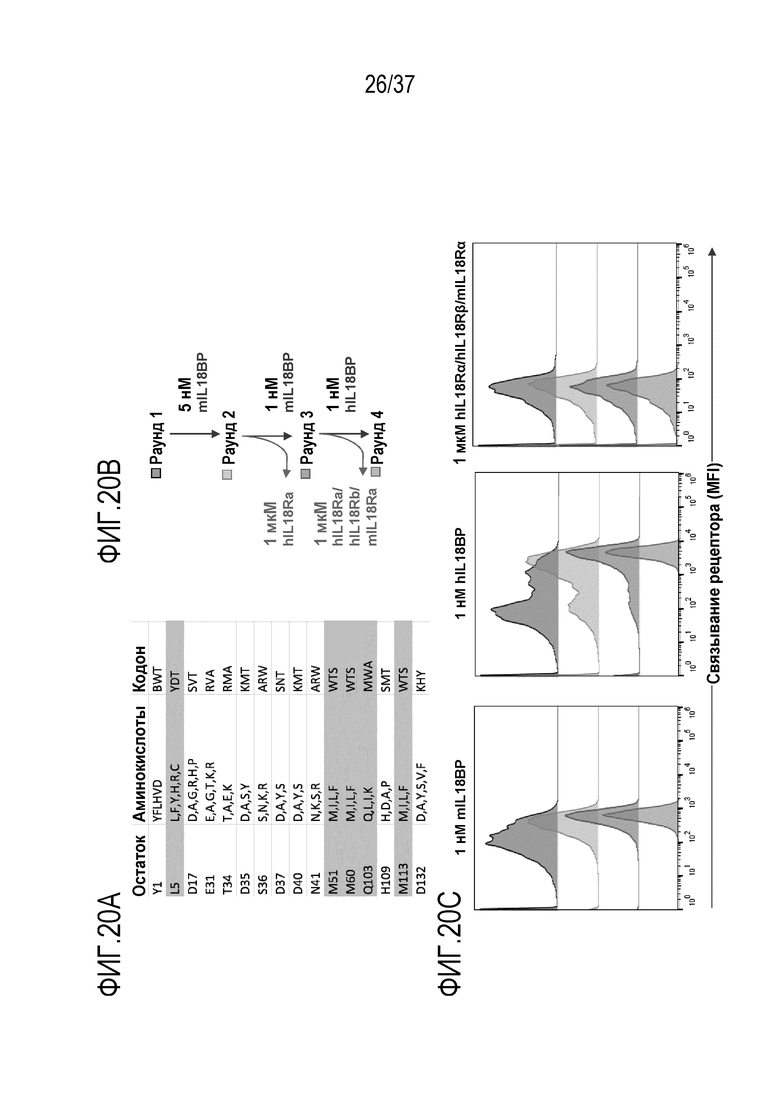
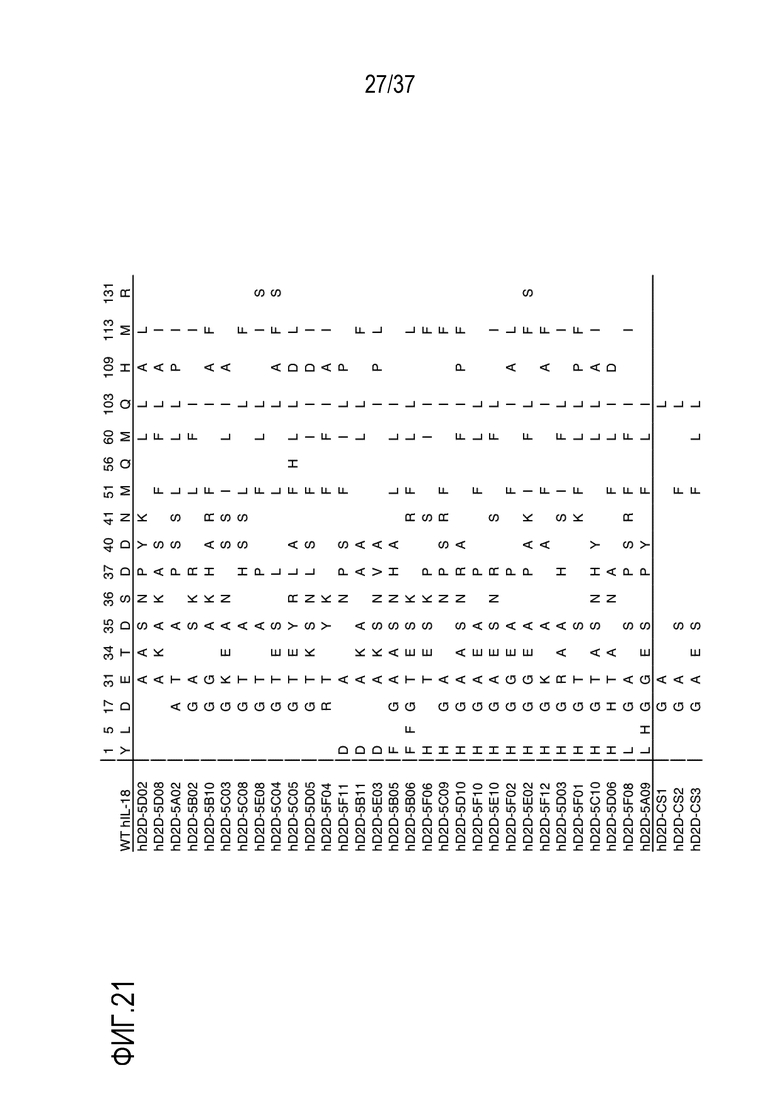
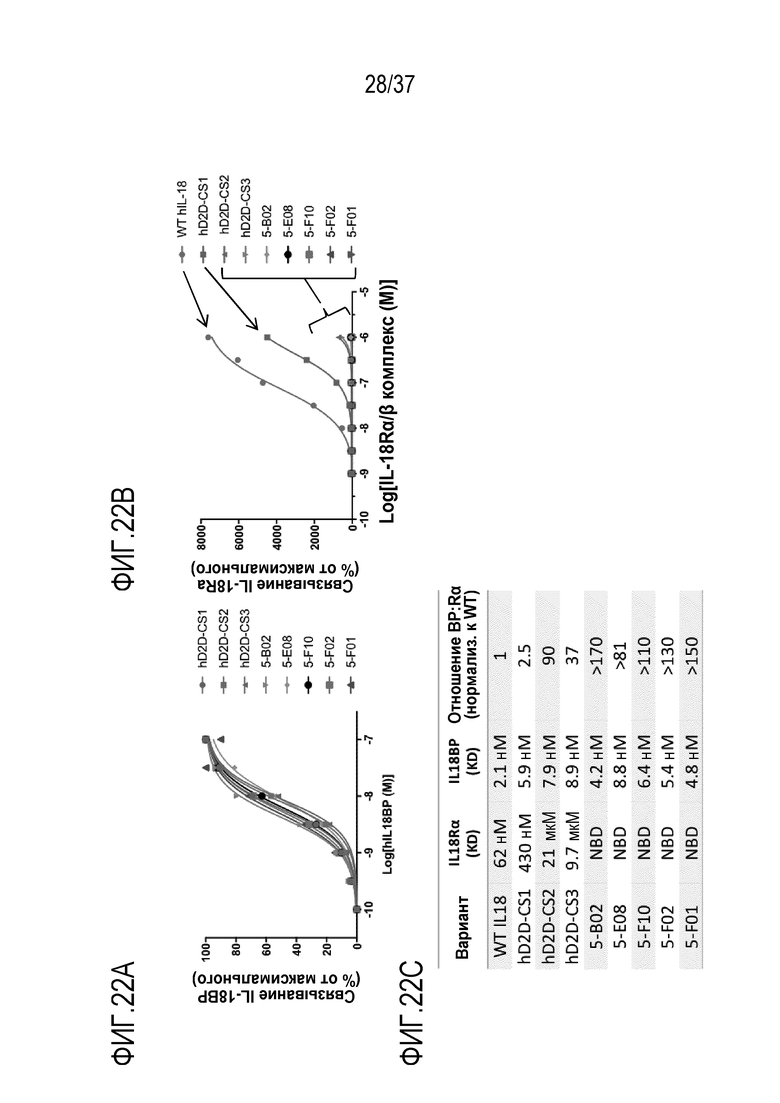
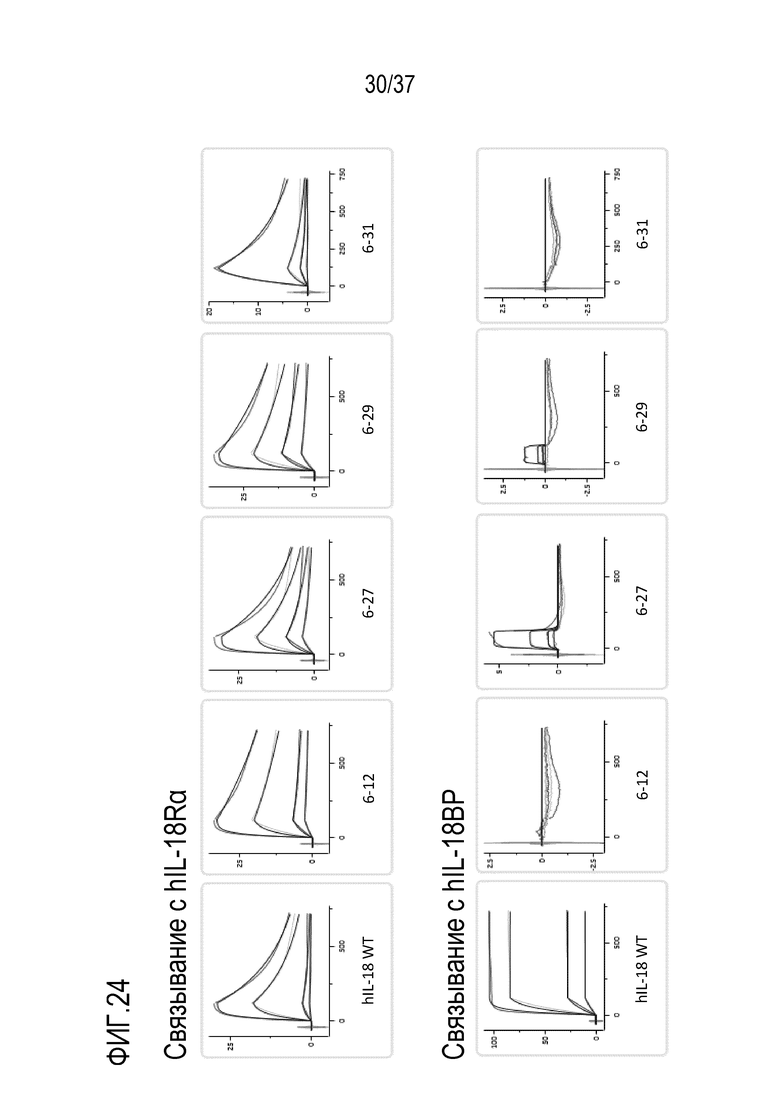
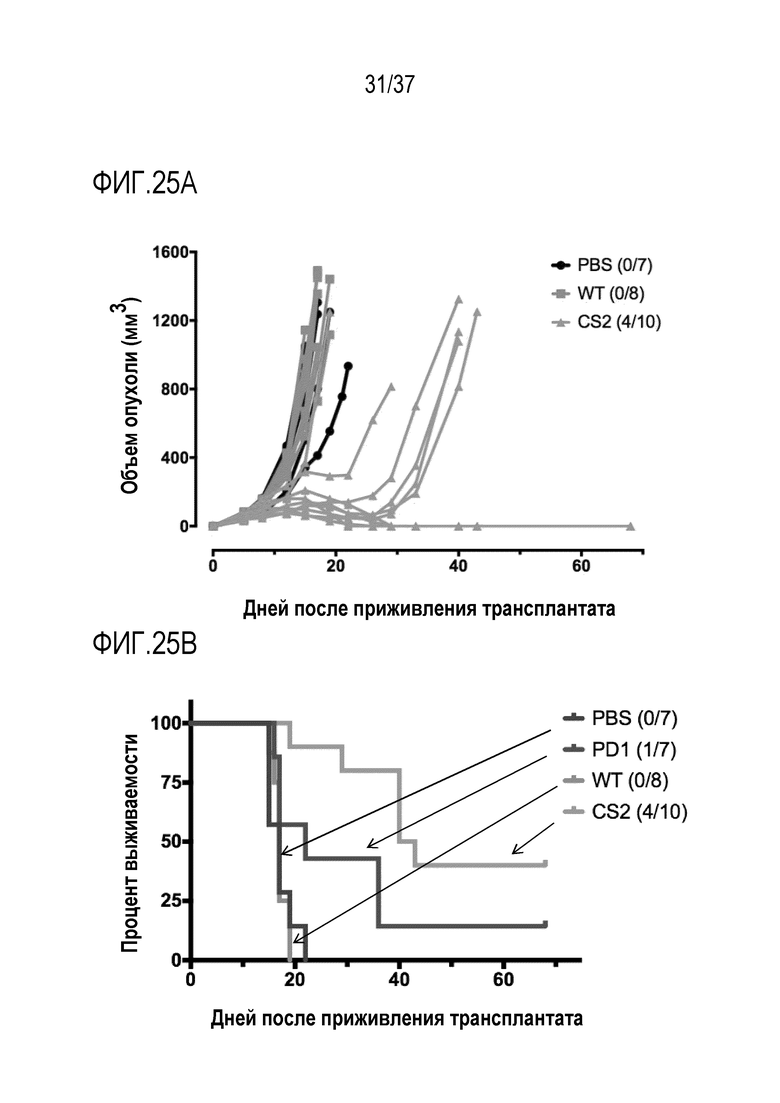
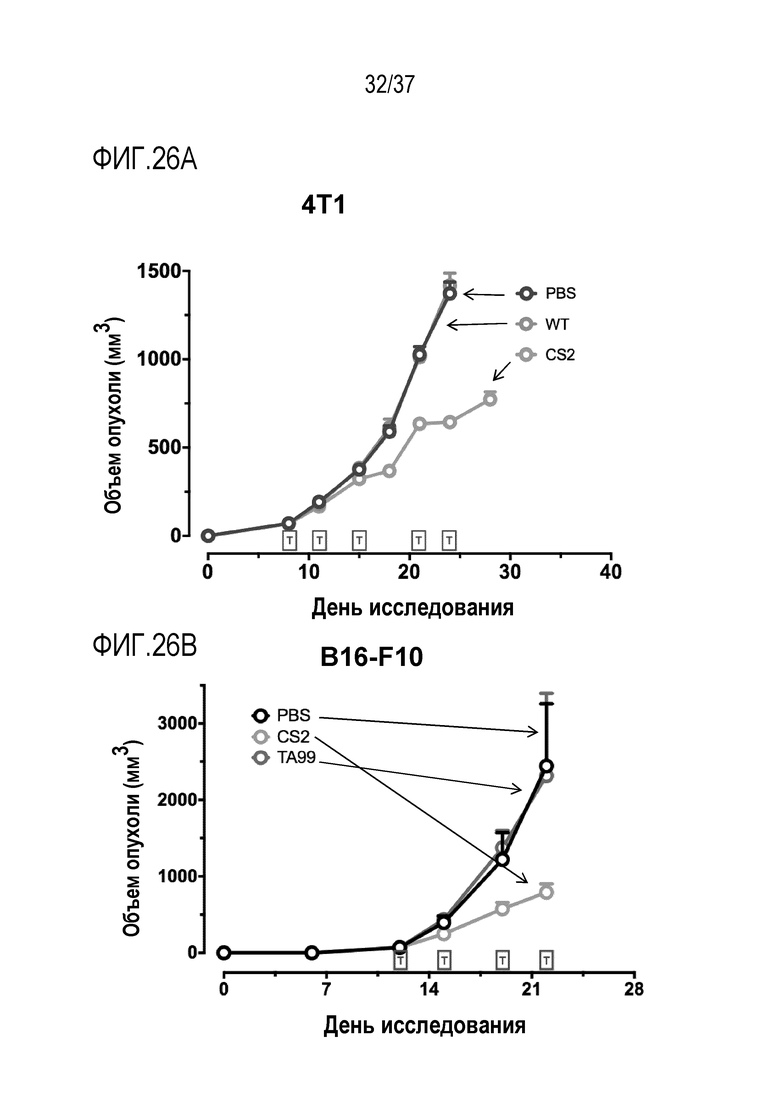
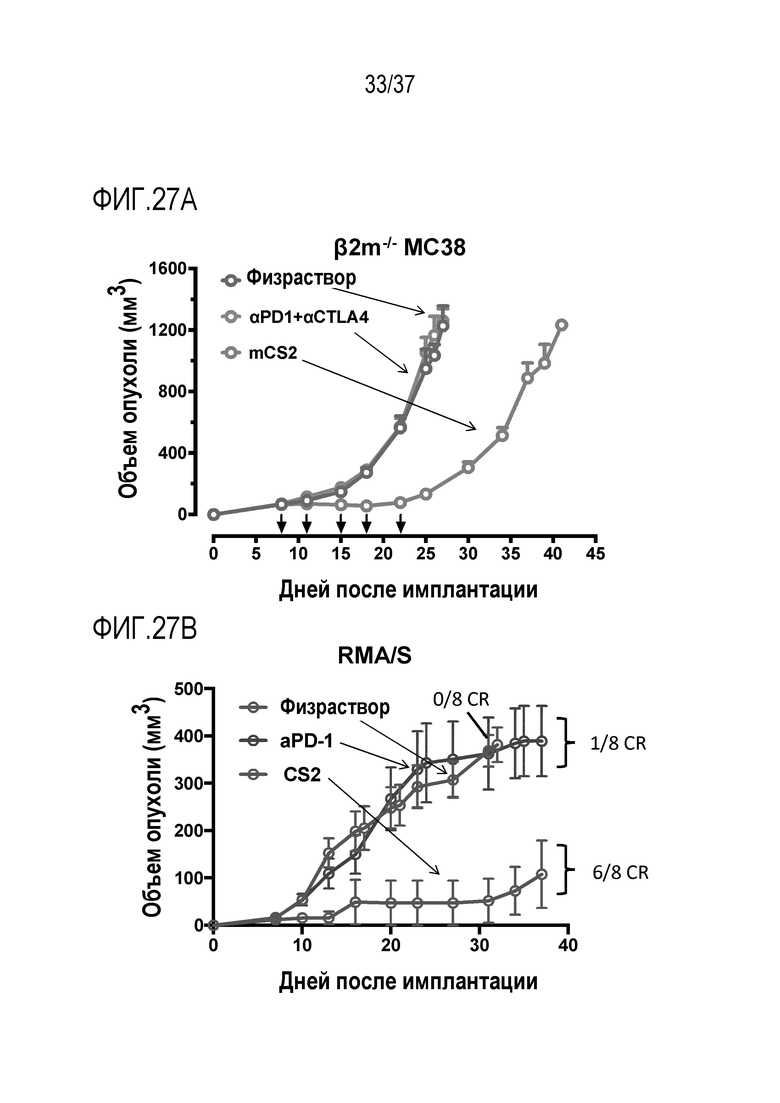
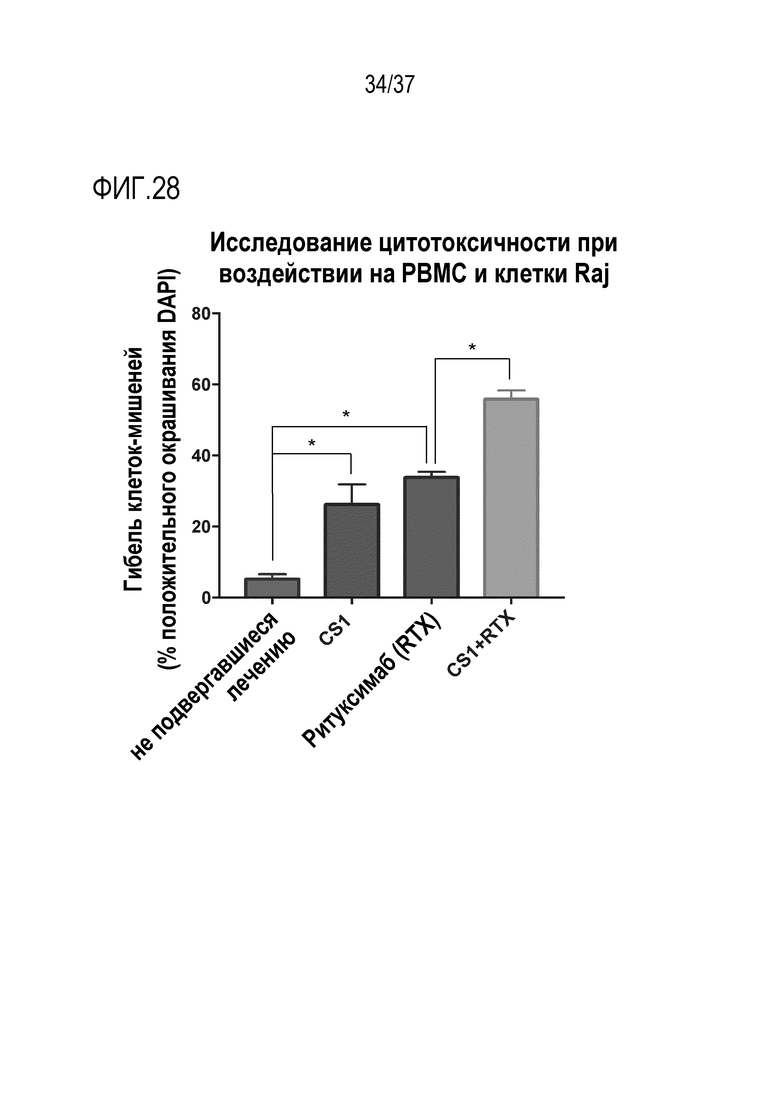
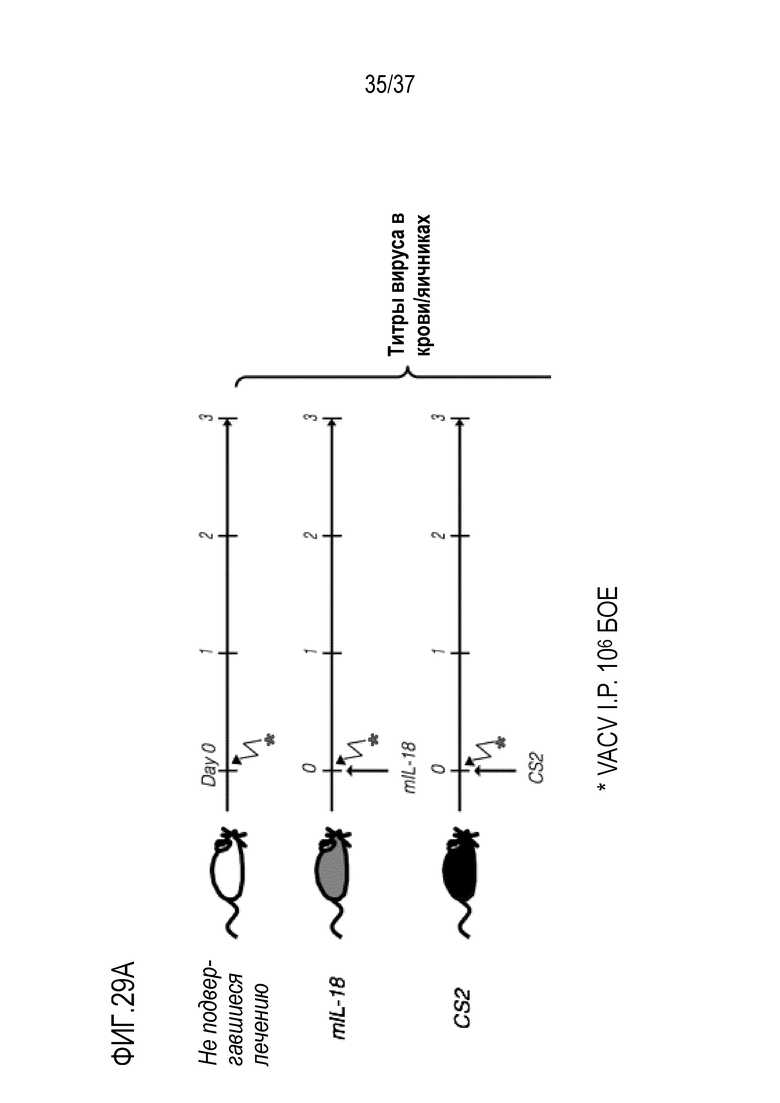
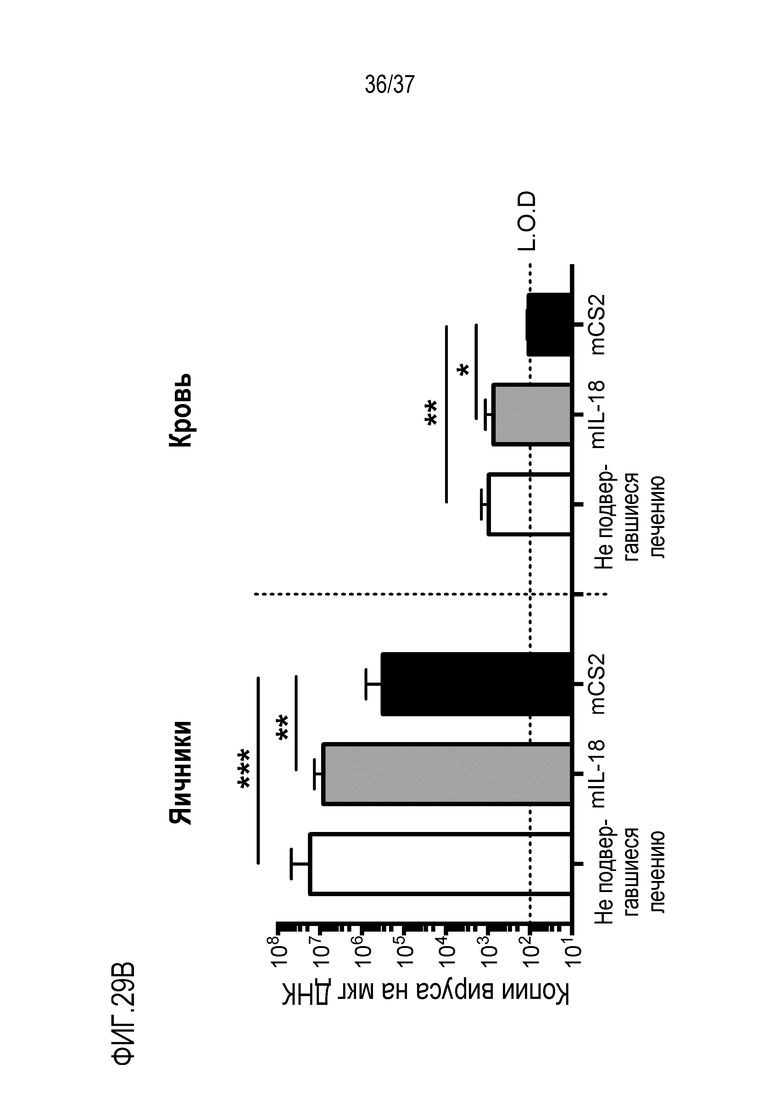
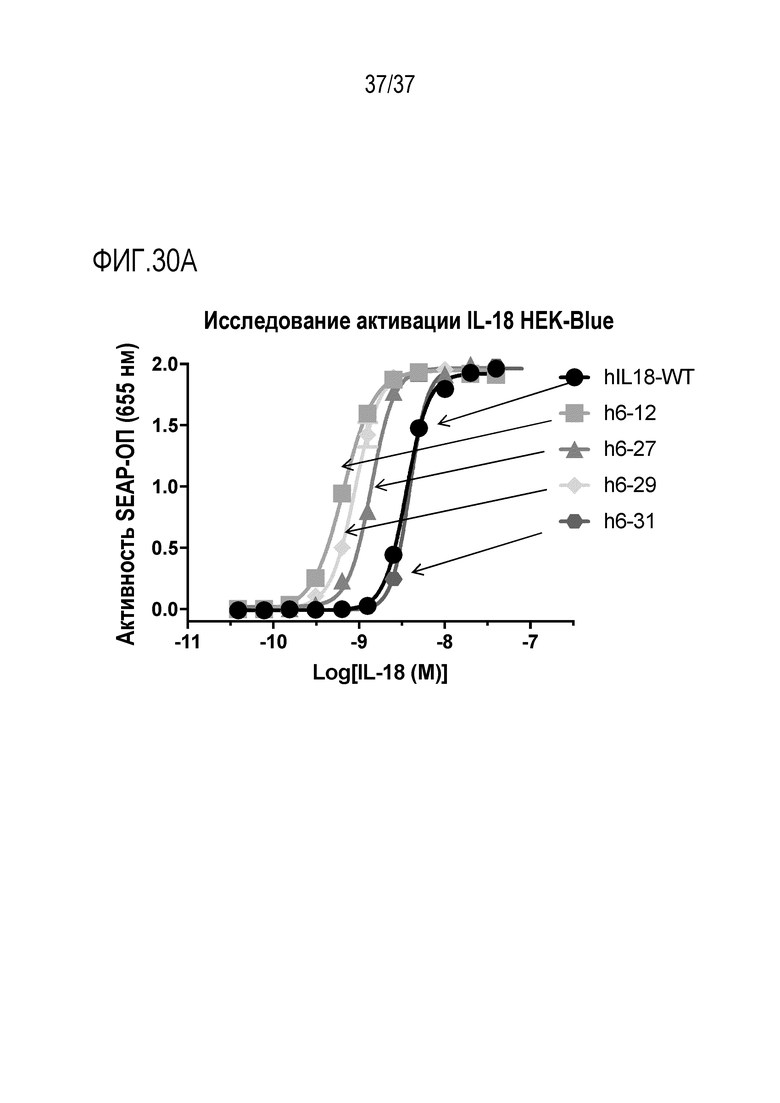
Настоящее изобретение относится к области биотехнологии, в частности к новым фармацевтическим композициям. Изобретение раскрывает композицию, содержащую варианты усилителя активности IL-18, обеспечивающего активность сигнального пути IL-18 даже в присутствии ингибирующей молекулы, такой как IL-18BP. Изобретение может быть применимо в иммунотерапии различных видов рака, в том числе и резистентных к ингибиторам иммунных контрольных точек. 3 н. и 18 з.п. ф-лы, 30 ил., 12 табл., 6 пр.
1. Композиция для усиления активности IL-18, включающая:
(a) терапевтически эффективное количество варианта полипептида интерлейкина-18 (IL-18), где указанный вариант полипептида IL-18 содержит пять или более мутаций относительно IL-18 дикого типа (WT), приведенного в SEQ ID NO: 30, где по меньшей мере пять из указанных пяти или более мутаций находятся в положениях, выбранных из M51, K53, Q56, P57, M60, S105, D110 и N111; и
(b) фармацевтически приемлемое вспомогательное вещество.
2. Композиция по п. 1, где указанный вариант полипептида IL-18 связывается с IL-18BP с аффинностью связывания, которая составляет приблизительно 10% или менее от аффинности связывания IL-18 дикого типа с IL-18BP.
3. Композиция по п. 1, где указанный вариант полипептида IL-18 имеет величину KD для IL-18BP, которая составляет 10 нM или более.
4. Композиция для применения в лечении рака, включающая:
(a) фармацевтически приемлемое вспомогательное вещество; (b) терапевтически эффективное количество варианта полипептида интерлейкина-18 (IL-18), где указанный вариант полипептида IL-18 специфически связывается с рецептором IL-18 (IL-18R) и содержит пять или более мутаций относительно IL-18 дикого типа (WT), приведенного в SEQ ID NO: 30, где по меньшей мере пять из указанных пяти или более мутаций находятся в положениях, выбранных из M51, K53, Q56, P57, M60, S105, D110 и N111 относительно WT IL-18, и где, по сравнению с WT IL-18, приведенным в SEQ ID NO: 30, указанный вариант полипептида IL-18 проявляет пониженное связывание с IL-18-связывающим белком (IL-18BP).
5. Композиция по п. 4, где вариант полипептида IL-18 включает, по меньшей мере, одну мутацию, выбранную из группы, состоящей из Y1X, L5X, K8X, M51X, K53X, S55X, Q56X, P57X, G59X, M60X, E77X, Q103X, S105X, D110X, N111X, M113X, V153X и N155X, относительно SEQ ID NO: 30, где X обозначает любую аминокислоту.
6. Композиция по п. 5, где вариант полипептида IL-18 включает, по меньшей мере, одну мутацию, выбранную из группы, состоящей из Y1H, Y1R, L5H, L5I, L5Y, K8Q, K8R, M51T, M51K, M51D, M51N, M51E, M51R, K53R, K53G, K53S, K53T, S55K, S55R, Q56E, Q56A, Q56R, Q56V, Q56G, Q56K, Q56L, P57L, P57G, P57A, P57K, G59T, G59A, M60K, M60Q, M60R, M60L, E77D, Q103E, Q103K, Q103P, Q103A, Q103R, S105R, S105D, S105K, S105N, S105A, D110H, D110K, D110N, D110Q, D110E, D110S, D110G, N111H, N111Y, N111D, N111R, N111S, N111G, M113V, M113R, M113T, M113K, V153I, V153T, V153A, N155K и N155H, относительно SEQ ID NO: 30.
7. Композиция по п. 1, где вариант полипептида IL-18 включает по меньшей мере одну мутацию, выбранную из группы, состоящей из M51X, M60X, S105X, D110X и N111X относительно SEQ ID NO: 30, где X обозначает любую аминокислоту.
8. Композиция по п. 7, где вариант полипептида IL-18 содержит мутации M51X, M60X, S105X, D110X и N111X, где M в положении 51 мутирован на T, K, D, E, R или N; M в положении 60 мутирован на K, Q, L или R; S в положении 105 мутирован на R, D, K, A или N; D в положении 110 мутирован на H, K, N, Q, E, N, S или G; и N в положении 111 мутирован на H, D, Y, R, S или G.
9. Композиция по п. 7, где вариант полипептида IL-18 содержит мутации M51X, M60X, S105X, D110X и N111X, где M в положении 51 мутирован на T или K; M в положении 60 мутирован на K или L; S в положении 105 мутирован на D, N или A; D в положении 110 мутирован на K, N, S или G; и N в положении 111 мутирован на H, Y, G или R.
10. Композиция по п. 1, где вариант полипептида IL-18 включает по меньшей мере одну мутацию, выбранную из группы, состоящей из M51X, K53X, Q56X, D110X и N111X относительно SEQ ID NO: 30, где X обозначает любую аминокислоту.
11. Композиция по п. 10, где вариант полипептида IL-18 содержит мутации M51X, K53X, Q56X, D110X и N111X, где M в положении 51 мутирован на E, R или K; K в положении 53 мутирован на G, S или T; Q в положении 56 мутирован на E, A, R, V, G, K или L; D в положении 110 мутирован на N, S, K или G; и N в положении 111 мутирован на R, S, G или D.
12. Композиция по п. 10, где вариант полипептида IL-18 содержит мутации M51X, K53X, Q56X, D110X и N111X, где M в положении 51 мутирован на K; K в положении 53 мутирован на G или S; the Q в положении 56 мутирован на G, R или L; D в положении 110 мутирован на S, N или G; и N в положении 111 мутирован на G или R.
13. Композиция по п. 1, где вариант полипептида IL-18 включает аминокислотную последовательность, имеющую идентичность 85% или более с аминокислотной последовательностью, представленной любой одной из SEQ ID NO: 34-59, 73-91, 191-193.
14. Композиция по любому из пп. 8, 9 и 11, 12, где вариант полипептида IL-18 включает аминокислотную последовательность, имеющую идентичность 85% или более с аминокислотной последовательностью, представленной в SEQ ID NO: 30.
15. Композиция по любому из пп. 1-14 для применения в лечении рака, где терапевтически эффективное количество варианта полипептида IL-18 вводят в виде нуклеиновой кислоты.
16. Способ лечения или предотвращения опухоли у субъекта, нуждающегося в этом, включающий введение субъекту композиции по любому одному из пп. 1-15.
17. Способ по п. 16, где опухоль представляет собой рак.
18. Способ по п. 17, где рак представляет собой рак, который является резистентным к ингибиторам иммунных контрольных точек (ICI).
19. Способ по п. 17, где рак ассоциирован с опухолью, в которой отсутствует экспрессия молекул MHC класса I.
20. Способ по любому из пп. 16-19, где способ включает введение субъекту варианта полипептида IL-18 и, по меньшей мере, одного другого средства, выбранного из ингибитора иммунных контрольных точек.
21. Способ по п. 20, где ингибитор иммунных контрольных точек представляет собой
(a) средство, которое ингибирует PD-L1, PD1, CTLA4, TIM3, TIGIT, LAG3, B7H3, B7H4 или VISTA;
(b) агонист CD40, агонист 41BB, агонист OX40 или агонист GITR;
(c) средство, опсонизирующее раковые клетки;
(d) средство, которое целенаправленно воздействует на один или более антигенов, выбранных из CD19, CD20, CD22, CD24, CD25, CD30, CD33, CD37, CD38, CD44, CD45, CD47, CD51, CD52, CD56, CD62L, CD70, CD74, CD79, CD80, CD96, CD97, CD99, CD123, CD134, CD138, CD152 (CTLA-4), CD200, CD213A2, CD221, CD248, CD276 (B7-H3), B7-H4, CD279 (PD-1), CD274 (PD-L1), CD319, EGFR, EPCAM, 17-1A, HER1, HER2, HER3, CD117, C-Met, HGFR, PDGFRA, AXL, TWEAKR, PTHR2, HAVCR2 (TIM3), GD2 ганглиозида, MUC1, муцина CanAg, мезотелина, эндоглина, антигена Льюиса Y, CEA, CEACAM1, CEACAM5, CA-125, PSMA, BAFF, FGFR2, TAG-72, желатиназы B, глипикана 3, нектина-4, BCMA, CSF1R, SLAMF7, интегрина αvβ3, TYRP1, GPNMB, CLDN18.2, FOLR1, CCR4, CXCR4, MICA, антигена C242, DLL3, DLL4, EGFL7, виментина, экстра домена-B фибронектина, TROP-2, LRRC15, FAP, SLITRK6, NOTCH2, NOTCH3, танасцина-3, STEAP1 и NRP1;
(e) измененную T-клетку или NK-клетку;
(f) онколитический вирус;
(g) цитокин, необязательно выбранный из IL-1, IL-2, IL-10, IL-12, IL-15, IL-18, IL-21, IL-33, интерферона-альфа, интерферона-бета, интерферона-гамма и TNF;
(h) агонист Toll-подобного рецептора, необязательно выбранный из TLR2, TLR4, TLR5, TLR7 и TLR9;
(i) агонист инфламмасомы;
(j) агонист пути STING/cGAS; и
(k) агонист пути RIG-I.
| US 20050008615 A1, 13.01.2005 | |||
| WO 2002101049 A2, 19.12.2002 | |||
| US 20140112915 A1, 24.04.2014 | |||
| WO 2005075648 A1, 18.08.2005 | |||
| US 20110189131 A1, 04.08.2011 | |||
| US 7279155 B2, 09.10.2007 | |||
| Ударный механизм для огнестрельного оружия | 1927 |
|
SU5769A1 |
Авторы
Даты
2023-06-07—Публикация
2018-09-06—Подача