ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
Настоящая заявка исправшивает приоритет согласно 35 U.S.C. §119(e) к предварительной заявке на патент США No. 62/671753, поданной 15 мая 2018 г., описание которой включено в настоящий документ посредством ссылки.
Уровень техники изобретения
Матриксные металлопротеиназы (MMP) представляют собой суперсемейство протеиназ ферментов, которые важны для деградации большинства белков внеклеточного матрикса во время органогенеза, роста и нормального тканевого оборота. Также считается, что MMP играют важную роль в неконтролируемом разрушении соединительной ткани, что связано с некоторыми болезненными процессами, такими как ревматоидный артрит, остеоартрит, язва желудка, астма, эмфизема и метастазирование опухоли. Следовательно, ингибирование одной или нескольких MMP может быть полезным при этих заболеваниях.
Человеческая эластаза макрофагов (MMP-12) представляет собой конкретную MMP. MMP-12 проявляет все характеристики других MMP, но преимущественно продуцируется из макрофагов, инфильтрирующих в ткани, где происходит повреждение или ремоделирование, и разрушает внеклеточный матрикс. Например, повышенные уровни ММР-12 наблюдались во время начала эмфиземы. Кроме того, модель мышей, нокаутированных по MMP-12, не показала развития эмфиземы после длительного воздействия сигаретного дыма (Hautamkai et al. Science, 1997, 277: 2002-2004). Эти данные дают основание предполагать, что MMP-12 играет роль в прогрессировании эмфиземы. Участие MMP-12 в развитии хронической астмы также было предположено на основании исследований модели астмы с дефицитом MMP-12 (Warner et al. Am J Pathol. 2004 ; 165(6): 1921-1930). В FAS-индуцированной модели острого повреждения легких мыши с дефицитом MMP 12 защищены от развития фиброза легких (Matute-Bello et al., Am J Respir Cell Mol Biol. 2007; 37(2): 210-221). В модели фиброза легких и печени, вызванного инфекцией Schistosoma mansoni, MMP-12 проявляет профибротическую активность в легких и печени (Madala et al. J Immunol 2010;184:3955-3963). MMP-12 может также может способствовать патогенезу идиопатического легочного фиброза (IPF) за счет расщепления белков внеклеточного матрикса (ECM), поскольку уровни BALF фрагмента коллагена типа IV, генерируемого MMP-12, повышаются у пациентов с IPF (Sand et al. PLoS One 2013; 8:e84934), а человеческая ММР-12 может расщеплять ряд белков ЕСМ человека in vitro (Owen etal. J Leuk°C Biol 1999;65:137-150). Вместе эти результаты дают основание предполагать, что ингибиторы MMP-12 могут быть полезны при лечении заболеваний легких, таких как хроническая обструктивная болезнь легких (ХОБЛ), эмфизема, астма, острое повреждение легких, идиопатический легочный фиброз (IPF), фиброз печени и неалкогольный стеатогепатит (NASH).
Было показано, что ММР-12 секретируется из альвеолярных макрофагов у курильщиков (Shapiro et al., Journal of Biological Chemistry, 1993, 268: 23824), в пенистых клетках при атеросклеротических поражениях (Matsumoto et al., Am. J. Pathol., 1998, 153: 109), и в модели крыс с нефритом (Kaneko et al., J. lmmunol., 2003, 170:3377). MMP-12 также играет роль при ишемической болезни сердца (Jormsjo et al., Circulation Research, 2000, 86: 998). Также было показано, что MMP-12 повышается у пациентов с воспалительным заболеванием кишечника (IBD), а также на T-клеточно-опосредованной модели колита и способствует деградации эпителия, а мыши MMP-12-/- были защищены от колита, индуцированного TNBS (Pender et al., Ann N Y Acad Sci. 2006, 1072:386-8.). Эпителиальные и стромальные ММР-12 вместе с ММР-3 и -7 также были повышены в слизистой оболочке мешка начала ЯК у детей, что позволяет предположить, что экспрессия ММР в мешочке ЯК у детей в долгосрочной перспективе имеет общие характеристики с IBD ( et al., World J Gastroenterol. 2012, 18(30):4028-36). Взятые вместе, эти наблюдения позволяют предположить, что MMP-12 может быть мишенью для лечения этих заболеваний.
et al., World J Gastroenterol. 2012, 18(30):4028-36). Взятые вместе, эти наблюдения позволяют предположить, что MMP-12 может быть мишенью для лечения этих заболеваний.
Принимая во внимание участие MMP-12 в ряде заболеваний, были предприняты попытки получить ингибиторы MMP-12. Известен ряд ингибиторов MMP-12 (см., например, публикацию международной заявки на патент WO 00/40577; публикацию европейской патентной заявки EP 1 288 199 A1; патент США No. 63529761 и публикацию заявки на патент США № 2004/0072871; и публикацию европейской патентной заявки EP1394159).
Конкретным классом ингибиторов MMP, которые были описаны, являются производные гидантоина. Например, в публикации Международной заявки на патент WO 02/096426 описаны производные гидантоина общей формулы:
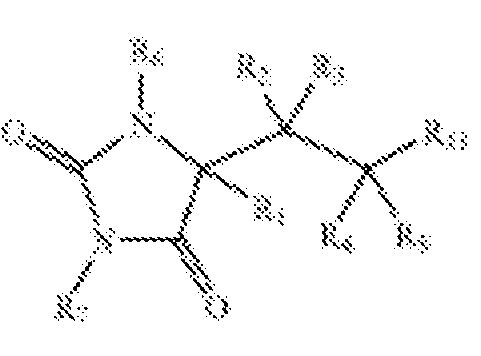 , которые раскрыты как активные в качестве ингибиторов MMP, в частности, в отношении фактор некроза опухолей-альфа-превращающего фермента (ТАСЕ) и аггреканазы. Особенностью раскрытых структур этих производных является спиросвязь между гидантоиновым кольцом и его боковой цепью. В публикации патентной заявки США No. 2004/0067996 и публикации Международной заявки на патент WO 2004/108086 описаны аналогичные производные гидантоина общей формулы:
, которые раскрыты как активные в качестве ингибиторов MMP, в частности, в отношении фактор некроза опухолей-альфа-превращающего фермента (ТАСЕ) и аггреканазы. Особенностью раскрытых структур этих производных является спиросвязь между гидантоиновым кольцом и его боковой цепью. В публикации патентной заявки США No. 2004/0067996 и публикации Международной заявки на патент WO 2004/108086 описаны аналогичные производные гидантоина общей формулы:
 , которые также описаны как ингибиторы MMP, в частности, для ТАСЕ и аггреканазы.
, которые также описаны как ингибиторы MMP, в частности, для ТАСЕ и аггреканазы.
В публикации международной заявки на патент WO 02/074752 описан синтез ингибиторов MMP и публикации международной заявки на патент WO 2004/020415 описаны ингибиторы MMP-12, которые представляют собой производные гидантоина общей формулы:
 и
и 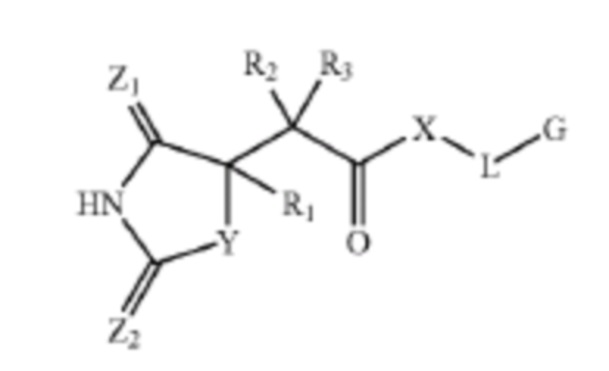 , соответственно. Некоторые из раскрытых соединений проявляли ингибирующую активность в отношении MMP, в том числе ингибирующую активность в отношении MMP-12.
, соответственно. Некоторые из раскрытых соединений проявляли ингибирующую активность в отношении MMP, в том числе ингибирующую активность в отношении MMP-12.
Совсем недавно в патенте США No. 7179831 были описаны ингибиторы MMP-12, которые представляют собой производные гидантоина общей формулы:
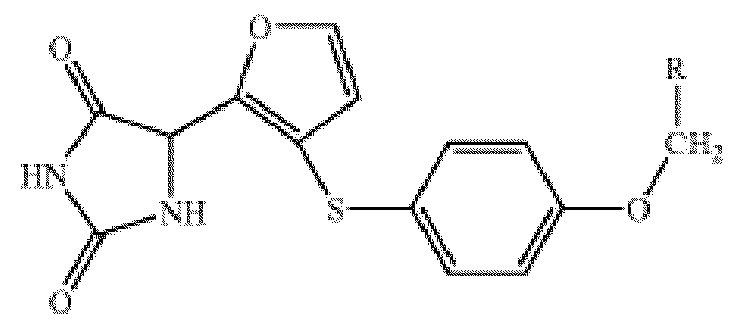 .
.
Производные гидантоина представляют собой полезный класс ингибиторов MMP. Однако в данной области существует потребность в идентификации производных гидантоина, обладающих улучшенной специфичностью, активностью и фармакологическими свойствами.
КРАТКОЕ ИЗЛОЖЕНИЕ ИЗОБРЕТЕНИЯ
Заявка удовлетворяет эту потребность, предоставляя производные гидантоина, обладающие высокой активностью и специфичностью в отношении MMP, в частности, эластазы макрофагов (MMP-12).
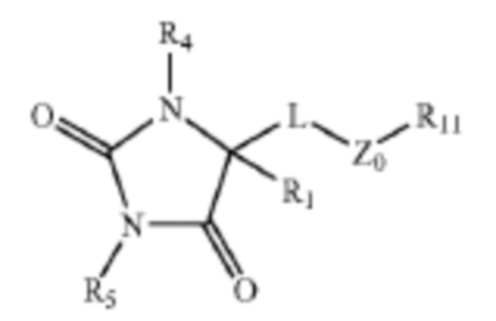
В общем аспекте изобретение относится к соединению формулы (I-b):
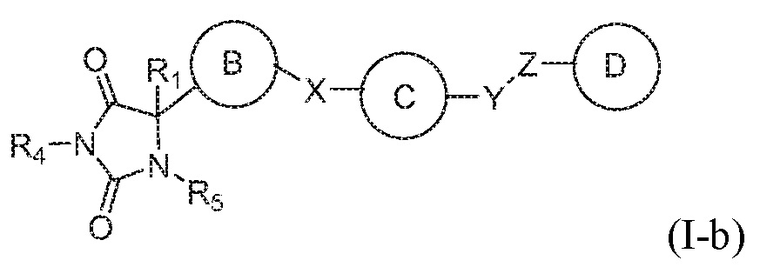
или его таутомеру, стереоизомеру, фармацевтически приемлемой соли или сольвату,
где:
кольцо B представляет собой необязательно замещенный арил или необязательно замещенный гетероарил;
кольцо C представляет собой необязательно замещенный арил или необязательно замещенный гетероарил;
кольцо D представляет собой необязательно замещенный арил или необязательно замещенный гетероарил;
каждый из X, Y и Z независимо выбраны из группы, состоящей из CH2, O, NRx и S(O)q, где Rx представляет собой водород или алкил;
R1 представляет собой водород или алкил;
R4 представляет собой водород или алкил;
R5 представляет собой водород; и
q имеет значение 0, 1 или 2,
при условии, что кольцо B не является фуранилом.
В одном варианте осуществления заявка относится к соединению формулы (I):
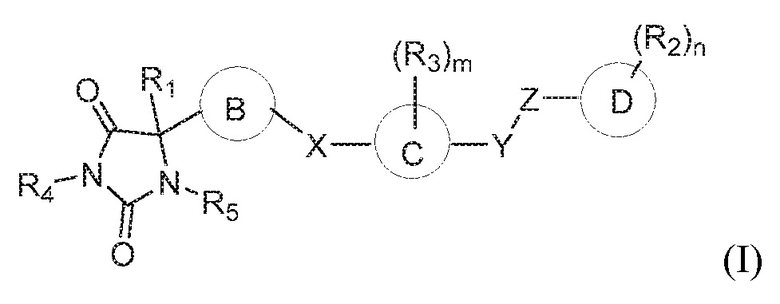
или его таутомеру, стереоизомеру, фармацевтически приемлемой соли или сольвату,
где:
кольцо B представляет собой необязательно замещенный арил или необязательно замещенный гетероарил;
кольцо C представляет собой арил или гетероарил;
кольцо D представляет собой арил или гетероарил;
каждый из X, Y и Z независимо выбран из группы, состоящей из CH2, O, NRx и S(O)q, где Rx представляет собой водород или алкил;
R1 представляет собой водород или алкил;
каждый R2 независимо выбран из группы, состоящей из водорода, алкила, галогена, гидроксила, галогеналкила, алкокси, алкилтио, амина, амида, алкиламина, аминоалкила, циано, гидроксиалкила, -(CH2)pC(O)OR6, и -(CH2)pOC(O)R6;
каждый R3 независимо выбран из группы, состоящей из водорода, алкила и галогена;
R4 представляет собой водород или алкил;
R5 представляет собой водород;
каждый R6 независимо выбран из группы, состоящей из водорода и алкила, где алкил является незамещенным или замещен одной или несколькими группами, независимо выбранными из группы, состоящей из амина, гидроксила, галогена и алкокси;
m имеет значение 1, 2, 3 или 4;
n имеет значение 1, 2, 3, 4 или 5;
p имеет значение 0, 1, 2, 3, 4 или 5; и
q имеет значение 0, 1 или 2,
при условии, что кольцо B не является фуранилом.
В одном варианте осуществления заявка относится к соединению формулы (I), или его таутомеру, стереоизомеру, фармацевтически приемлемой соли или сольвату, где кольцо C представляет собой фенил.
В одном варианте осуществления заявка относится к соединению формулы (I), или его таутомеру, стереоизомеру, фармацевтически приемлемой соли или сольвату, где кольцо D представляет собой пириднил или фенил.
В одном варианте осуществления заявка относится к соединению формулы (I), или его таутомеру, стереоизомеру, фармацевтически приемлемой соли или сольвату, где кольцо D представляет собой:
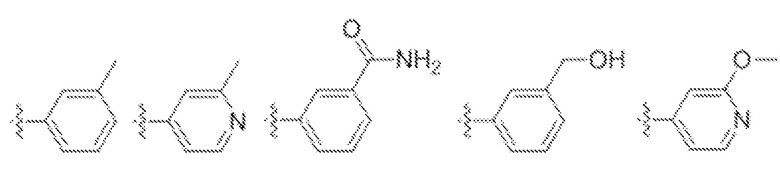
или 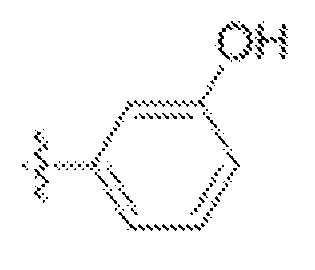 .
.
В одном варианте осуществления заявка относится к соединению формулы (I), или его таутомеру, стереоизомеру, фармацевтически приемлемой соли или сольвату, где каждый из R1, R4 и R5 представляет собой водород.
В одном варианте осуществления заявка относится к соединению формулы (I), или его таутомеру, стереоизомеру, фармацевтически приемлемой соли или сольвату, где X представляет собой S; Y представляет собой O; и Z представляет собой CH2.
В одном варианте осуществления заявка относится к соединению формулы (I), или его таутомеру, стереоизомеру, фармацевтически приемлемой соли или сольвату, где кольцо B представляет собой пяти- или шестичленный моноциклический гетероарил, имеющий 1-2 гетероатома, независимо выбранных из N, S и O, где пяти- или шестичленный моноциклический гетероарил необязательно замещен -CH3.
В одном варианте осуществления заявка относится к соединению формулы (I), или его таутомеру, стереоизомеру, фармацевтически приемлемой соли или сольвату, где кольцо B представляет собой пиридинил, тиофенил, имидазолил, пиразолил или оксазолил, где каждый из пиридинила, тиофенила, имидазолила, пиразолила и оксазолила необязательно замещен -CH3.
В одном варианте осуществления заявка относится к соединению формулы (I), или его таутомеру, стереоизомеру, фармацевтически приемлемой соли или сольвату, где кольцо B представляет собой пиридинил.
В одном варианте осуществления заявка относится к соединению, выбранному из группы, состоящей из соединения формулы (II-a), соединения формулы (II-b), соединения формулы (II-c) и соединения формулы (II-d):
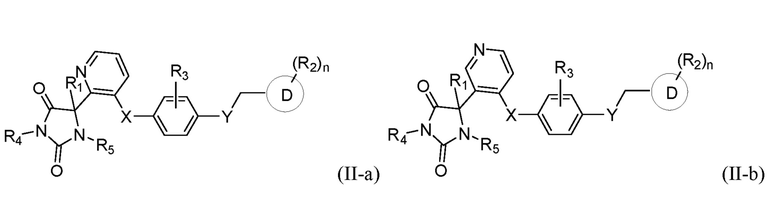
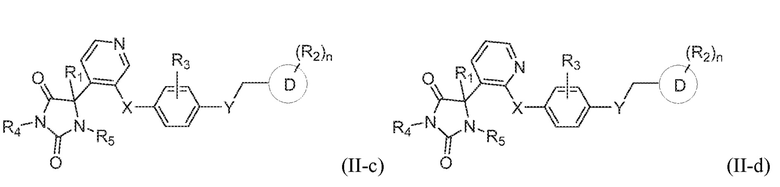
или его таутомеру, стереоизомеру, фармацевтически приемлемой соли или сольвату,
где:
R1 представляет собой водород, -CH3, или -CH2CH3;
R4 представляет собой водород или -CH3;
R5 представляет собой водород или -CH3;
R3 представляет собой водород, -F, -Cl, или CH3;
X представляет собой S, SO, или SO2;
Y представляет собой O, NH, CH2, или NHCH3;
кольцо D представляет собой пиридинил или фенил;
R2 представляет собой -CH3, -CH2OH, -OH, CH2OC(O)CH(NH2)CH(CH3)2, -COOH, -C(O)NH2, -C(O)NHCH3, -OCH3, -OCH2CH3, -OCH(CH3)2, или -CH2CH(CH3)2; и
n имеет значение 0 или 1.
В одном варианте осуществления заявка относится к соединению формулы (I), или его таутомеру, стереоизомеру, фармацевтически приемлемой соли или сольвату, где кольцо B представляет собой тиофенил.
В одном варианте осуществления заявка относится к соединению формулы (IV):
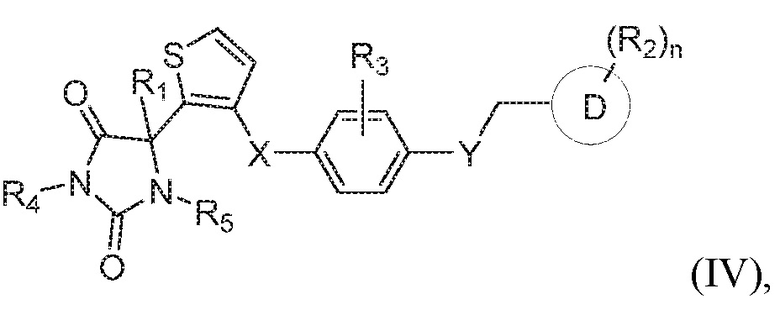
или его таутомеру, стереоизомеру, фармацевтически приемлемой соли или сольвату,
где:
каждый из R1, R4 и R5 представляет собой водород;
X представляет собой S;
Y представляет собой O;
R3 представляет собой водород;
кольцо D представляет собой фенил или пиридинил;
R2 представляет собой -CH3, -C(O)NH2, -CH2OH, -OCH3, или -OH; и
n имеет значение 0 или 1.
В одном варианте осуществления заявка относится к соединению, выбранному из группы, состоящей из соединения формулы (Va), соединения формулы (Vb) и соединения формулы (VI):
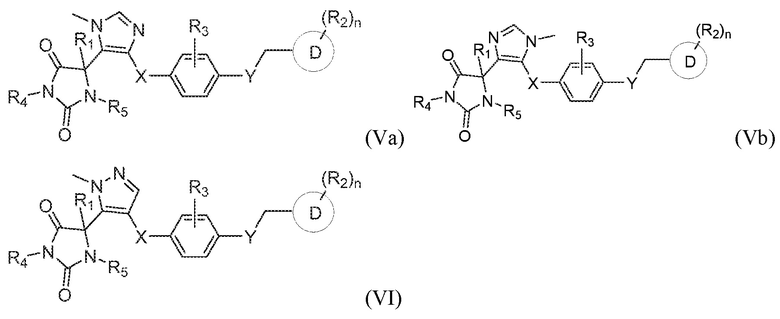
или его таутомеру, стереоизомеру, фармацевтически приемлемой соли или сольвату,
где:
R1 представляет собой водород, -CH3 или -CH2CH3;
R4 представляет собой водород или -CH3;
R5 представляет собой водород или -CH3;
R3 представляет собой водород, -F, -Cl или CH3;
X представляет собой S, SO или SO2;
Y представляет собой O, NH, CH2 или NHCH3;
кольцо D представляет собой пиридинил или фенил;
R2 представляет собой -CH3, -CH2OH, -OH, CH2OC(O)CH(NH2)CH(CH3)2, -COOH, -C(O)NH2, -C(O)NHCH3, -OCH3, -OCH2CH3, -OCH(CH3)2, или -CH2CH(CH3)2; и
n имеет значение 0 или 1.
В одном варианте осуществления заявка относится к соединению, выбранному из группы, состоящей из соединения формулы (VII-a) и соединения формулы (VII-b):
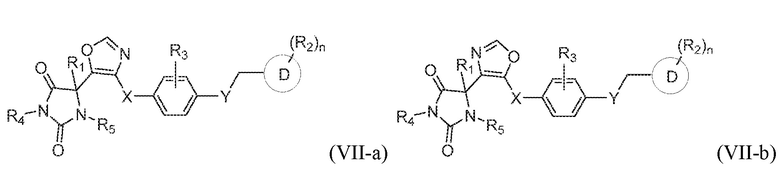
или его таутомеру, стереоизомеру, фармацевтически приемлемой соли или сольвату,
где:
каждый из R1, R3, R4, и R5 представляет собой водород;
X представляет собой S;
Y представляет собой O;
кольцо D представляет собой фенил или пиридинил;
R2 представляет собой -CH3, -C(O)NH2, -CH2OH, -OCH3, или -OH; и
n имеет значение 0 или 1.
В одном варианте осуществления заявка относится к соединению формулы (I-a):
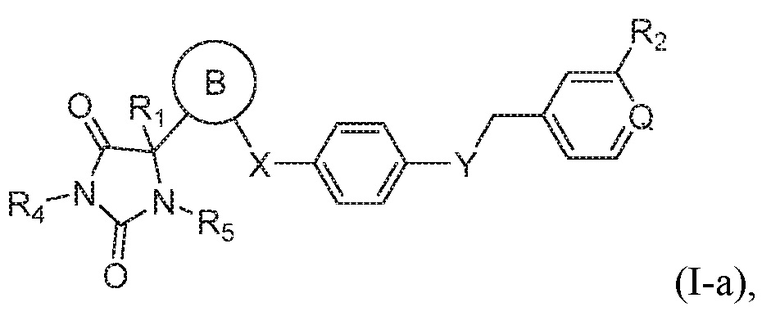
или его таутомеру, стереоизомеру, фармацевтически приемлемой соли или сольвату,
где:
кольцо B представляет собой пиридинил;
Q представляет собой CH или N;
R1 представляет собой водород, -CH3, или -CH2CH3;
R4 представляет собой водород или -CH3;
R5 представляет собой водород или -CH3;
R2 выбран из группы, состоящей из -CH3, -C(O)NH2, -CH2OH, -OCH3, или -OH;
X представляет собой S; и
Y представляет собой O.
В одном варианте осуществления заявка относится к соединению, выбранному из группы, состоящей из соединений, перечисленных в Таблице 1, или его таутомеру, стереоизомеру, фармацевтически приемлемой соли или сольвату.
В одном варианте осуществления заявка относится к соединению, выбранному из группы, состоящей из соединений, перечисленных в Таблице 1, или его фармацевтически приемлемой соли.
В другом общем аспекте заявка относится к фармацевтической композиции, содержащей соединение по заявке, как описано в настоящем документе, или его таутомер, стереоизомер, фармацевтически приемлемую соль или сольват, и по меньшей мере один фармацевтически приемлемый носитель.
Другие общие аспекты заявки относятся к способам ингибирования эластазы макрофагов (ММР-12) у субъекта, который в этом нуждается, и к способам лечения заболевания, опосредованного эластазой макрофагов (ММР-12), у субъекта, нуждающегося в этом.
В одном варианте осуществления заявка относится к способу ингибирования эластазы макрофагов (ММР-12) у субъекта, нуждающегося в этом, включающему введение субъекту соединения или фармацевтической композиции по заявке.
В одном варианте осуществления заявка относится к способу лечения заболевания, опосредованного эластазой макрофагов (ММР-12), у субъекта, нуждающегося в этом, включающему введение субъекту соединения или фармацевтической композиции по заявке.
В некоторых вариантах осуществления заболевание выбрано из группы, состоящей из астмы, хронической обструктивной болезни легких (COPD), эмфиземы, острого повреждения легких, и идиопатического легочного фиброза (IPF), саркоидоза, системного склероза, фиброза печени, неалкогольного стеатогепатита (NASH), артрита, рака, болезни сердца, воспалительного заболевания кишечника (IBD), острого повреждения почек (AKI), хронического заболевания почек (CKD), синдрома Альпорта и нефрита.
В настоящем документе также предложено соединение по заявке или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, или композиция по заявке для применения в способе ингибирования эластазы макрофагов (MMP-12) или лечения заболевания, опосредованного эластазой макрофагов (MMP-12). В некоторых вариантах осуществления заболевание выбрано из группы, состоящей из астмы, хронической обструктивной болезни легких (COPD), эмфиземы, острого повреждения легких, и идиопатического легочного фиброза (IPF), саркоидоза, системного склероза, фиброза печени, неалкогольного стеатогепатита (NASH), артрита, рака, болезни сердца, воспалительного заболевания кишечника (IBD), острого повреждения почек (AKI), хронического заболевания почек (CKD), синдрома Альпорта и нефрита.
В настоящем документе также предусмотрено применение соединения по заявке или его таутомера, стереоизомера, фармацевтически приемлемой соли или сольвата, или композиции по заявке при производстве лекарственного средства для ингибирования эластазы макрофагов (MMP-12) или лечения заболевания, опосредованного эластазой макрофагов (MMP-12). Предпочтительно, заболевание выбрано из группы, состоящей из астмы, хронической обструктивной болезни легких (COPD), эмфиземы, острого повреждения легких, и идиопатического легочного фиброза (IPF), саркоидоза, системного склероза, фиброза печени, неалкогольного стеатогепатита (NASH), артрита, рака, болезни сердца, воспалительного заболеваниея кишечника (IBD), острого повреждения почек (AKI), хронического заболевания почек (CKD), синдрома Альпорта и нефрита.
В еще одном общем аспекте заявка относится к способу получения фармацевтической композиции по заявке, включающему объединение соединения по заявке, или его таутомера, стереоизомера, фармацевтически приемлемой соли или сольвата, и по меньшей мере одного фармацевтически приемлемого носителя.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Вышеизложенное краткое изложение, а также следующее подробное описание изобретения будет лучше понято, при чтении в сочетании с прилагаемыми фигурами. Следует понимать, что изобретение не ограничивается определенными вариантами осуществления, показанными на фигурах.
На фигурах:
На фиг. 1A-1H показаны результаты исследования эффективности ингибиторов ММР-12 на модели фиброза почки крыс SD путем односторонней окклюзии мочеточника (UUO), описанного в примере 3; на фиг. 1A показаны изменения уровня азота мочевины в сыворотке через 2 недели по сравнению с периодом до операции (до операции) для каждой из экспериментальных групп крыс SD; на фиг. 1B показаны изменения сывороточного креатина через 2 недели по сравнению с периодом до операции (до операции) для каждой из экспериментальных групп крыс SD; на фиг. 1C показаны изображения почек после окрашивания H&E при увеличении x200; панель A: правая почка в качестве нормального контроля, панель B: животные, получавшие носитель, панель C: животные, получавшие PC-16 (2 мг/кг/день), панель D: животные, получавшие PC-16 (6 мг/кг/день), панель E: животные, получавшие PC-16 (20 мг/кг/день); на фиг. 1D показывает оценку повреждения почечных канальцев (I) и оценку интерстициального воспаления почек (II) для каждой из экспериментальных групп крыс SD; T-тест в (I): ***p<0,05 vs. эталон, $p<0,05 vs. PC-16 (2 мг/кг/день), $$p<0,01 vs. PC-16 (6 мг/кг/день); T-тест в (II): **p<0,05 vs. эталон, ***p<0,001 vs. эталон, на фиг. 1E показаны гистологические изображения почек после окрашивания трихромом по Массону при увеличении x200; панели A-E соответствуют панелям A-E, как описано на фиг. 1C; на фиг. 1F показана оценка интерстициального фиброза для интерстициального фиброза почек в корковом веществе; T-тест: **p<0,01 vs. эталон, ***p<0,001 vs. эталон, $p<0,05 vs. PC-16 (2 мг/кг/день), $$p<0,01 vs. PC-16 (2 мг/кг/день); на фиг. 1G показаны отложение коллагена I (I) и отложение коллагена IV (II) в области коры левой почки путем окрашивания IHC при увеличении x200; панели A-E соответствуют панелям A-E, как описано на фиг. 1C; на фиг. 1H показано положительное окрашивание отложения коллагена I (%) (I) и положительное окрашивание отложения коллагена IV (%) (II) в области коры левой почки, как определено по окрашиванию IHC на фиг. 1G; однофакторный дисперсионный анализ: ***p<0,001 vs. нормальным контролем; T-тест: #p<0,05 vs. эталон.
Подробное описание изобретения
Различные публикации, статьи и патенты процитированы или описаны в предшествующем уровне техники и на протяжении всего описания; каждая из этих ссылок полностью включена в данную заявку посредством ссылки. Обсуждение документов, актов, материалов, устройств, статей или тому подобного, которое включено в настоящее описание, предназначено в целях предоставления контекста для настоящего изобретения. Такое обсуждение не является признанием того, что любой или все из этих объектов составляют часть предшествующего уровня техники в отношении каких-либо раскрытых или заявленных изобретений.
Если не указано иное, все технические и научные термины, используемые в настоящем документе, имеют то же значение, которое обычно понимается специалистом в области, к которой относится это изобретение. В противном случае некоторые термины, используемые в настоящем документе, имеют значения, указанные в описании. Все патенты, опубликованные патентные заявки и публикации, упоминаемые в настоящем документе, включены посредством ссылки, как если бы они были полностью изложены в настоящем документе.
Следует отметить, что используемые в описании и в прилагаемой формуле изобретения формы единственного числа включают множественное число, если контекст явно не диктует иное.
Если не указано иное, термин «по меньшей мере», предшествующий ряду элементов, следует понимать как относящийся к каждому элементу в ряду. Специалисты в данной области техники поймут или смогут установить, используя не более чем рутинные эксперименты, многие эквиваленты конкретных вариантов осуществления изобретения, описанных в настоящем документе. Подразумевается, что такие эквиваленты входят в объем настоящего изобретения.
Во всем настоящем описании и последующей формуле изобретения, если контекст не требует иного, слово “содержать” и варианты, такие как “содержит” и “содержащий”, будут пониматься как подразумевающие включение указанного целого числа или стадии или группы целых чисел или стадий, но не исключение любого другого целого числа или стадии или группы целых чисел или стадий. При использовании в настоящем документе термин «содержащий» может быть заменен термином «состоящий» или «включающий», а иногда при использовании в настоящем документе термином «имеющий».
При использовании в настоящем документе «состоящий из» исключает любой элемент, стадию или ингредиент, не указанные в элементе формулы изобретения. При использовании в настоящем документе «состоящий по существу из» не исключает материалы или стадии, которые существенно не влияют на основные и новые характеристики формулы изобретения. Любой из вышеупомянутых терминов «содержащий», «состоящий», «включающий» и «имеющий», всякий раз, когда они используются в настоящем документе в контексте аспекта или варианта осуществления заявки, может быть заменен термином «состоящий из» или «состоящий из по существу» для изменения объема раскрытия.
При использовании в настоящем описании союзный термин «и/или» между несколькими перечисленными элементами понимается как охватывающий как отдельные, так и комбинированные варианты. Например, когда два элемента соединены посредством «и/или», первый вариант относится к возможности использования первого элемента без второго. Второй вариант относится к возможности использования второго элемента без первого. Третий вариант относится к возможности использования первого и второго элемента совместно. Подразумевают, что любой из этих вариантов входит в объем значения данного термина и, следовательно, соответствует требованию термина «и/или», как он используется в настоящем описании. Подразумевают, что возможность одновременного использования нескольких вариантов также входит в объем значения данного термина и, следовательно, соответствует требованию термина «и/или».
Если не указано иное, любое числовое значение, такое как концентрация или диапазон концентраций, описанные в настоящем документе, следует понимать как изменяемые во всех случаях термином «примерно». Таким образом, числовое значение обычно включает ±10% от приведенного значения. Например, включение «10-кратное» включает 9-кратное и 11-кратное. Как используется в настоящем документе, использование числового диапазона явно включает в себя все возможные поддиапазоны, все отдельные числовые значения в пределах этого диапазона, включая целые числа в пределах таких диапазонов и доли значений, если контекст явно не указывает на иное.
Как используется в настоящем документе, “субъект " означает любое животное, предпочтительно млекопитающее, наиболее предпочтительно человека, которому будет или было оказано лечение способом в соответствии с вариантом осуществления заявки. Термин "млекопитающее", как используется в настоящем документе, охватывает любое млекопитающее. Примеры млекопитающих включают, но не ограничиваются ими, коров, лошадей, овец, свиней, кошек, собак, мышей, крыс, кроликов, морских свинок, нечеловеческих приматов (NHP), таких как обезьяны или человекообразные обезьяны, человека и т.п. более предпочтительно человека.
Фраза «фармацевтически приемлемая соль(и)», как используется в настоящем документе, означает те соли интересующего соединения, которые безопасны и эффективны для местного применения у млекопитающих и которые обладают желаемой биологической активностью. Фармацевтически приемлемые соли включают соли кислотных или основных групп, присутствующих в указанных соединениях. Фармацевтически приемлемые кислотно-аддитивные соли включают, но не ограничиваются ими, соли гидрохлорид, гидробромид, гидроиодид, нитрат, сульфат, бисульфат, фосфат, кислый фосфат, изоникотинат, карбонат, бикарбонат, ацетат, лактат, салицилат, цитрат, тартрат, пропионат, бутират, пируват, оксалат, малонат, пантотенат, битартрат, аскорбат, сукцинат, малеат, гентизинат, фумарат, глюконат, глюкаронат, сахарат, формиат, бензоат, глутамат, метансульфонат, этансульфонат, бензолсульфонат, пара-толуолсульфонат и памоат (т.е. 1,1′-метилен-бис-(2-гидрокси-3-нафтоат)). Некоторые соединения, используемые в настоящем изобретении, могут образовывать фармацевтически приемлемые соли с различными аминокислотами. Подходящие соли оснований включают, но не ограничены ими, соли алюминия, кальция, лития, магния, калия, натрия, цинка, висмута и диэтаноламина. В качестве обзора фармацевтически приемлемых солей см. Berge et al., 66 J. Pharm. Sci. 1-19 (1977), включенную в настоящий документ посредством ссылки.
Как используется в настоящем документе, термин «алкил» означает насыщенную, одновалентную, неразветвленную или разветвленную углеводородную цепь. Алкильная группа может быть незамещенной или замещенной одним или несколькими подходящими заместителями. Примеры алкильных групп включают, но не ограничиваются ими, метил (Me), этил (Et), пропил (например, н-пропил, изопропил), бутил (например, н-бутил, изобутил, трет-бутил) и пентил (например, н-пентил, изопентил, неопентил) и т.п. Алкильная группа может иметь определенное количество атомов углерода. Когда числа находятся в нижнем индексе после символа «C», нижний индекс определяет более конкретно количество атомов углерода, которое может содержать конкретный алкил. Например, “C1 - C10 алкил” или “C1-10 алкил” предназначен для включения C1, C2, C3, C4, C5, C6, C7, C8, C9 и C10 алкильных групп. Кроме того, например, “C1 - C6 алкил” или “C1-6 алкил” обозначает алкил, содержащий от одного до шести атомов углерода.
Термин «алкокси», как используется в настоящем документе, относится к -O-алкильной группе, где алкил имеет значения, указанные выше. Алкоксигруппа присоединена к исходной молекуле через атом кислорода. Алкоксигруппа может иметь определенное число атомов углерода. Например, “C1 - C10 алкокси” или “C1-10 алкокси” предназначены для включения C1, C2, C3, C4, C5, C6, C7, C8, C9, и C10 алкоксигрупп. Кроме того, например, “C1 - C6 алкокси” или “C1-6 алкокси” обозначает алкокси, имеющий от 1 до 6 атомов углерода. Примеры алкокси включают, но не ограничиваются ими, метокси, этокси, пропокси (например, н-пропокси, изопропокси), бутокси (например, н-бутокси, изобутокси, трет-бутокси), пентилокси (например, н-пентилокси, изопентилокси, неопентилокси) и т.п. Алкоксигруппа может быть незамещенной или замещена одним или несколькими подходящими заместителями. Аналогично, «алкилтио» или «тиоалкокси» представляет собой алкильную группу, как определено выше, присоединенную через серный мостик, например -S-метил, -S-этил и т.п. Типичные примеры алкилтио включают, но не ограничиваются ими, -SCH3, -SCH2CH3, и т.п.
Как используется в настоящем документе, термин «галоген» означает фтор, хлор, бром или йод. Соответственно, термин «гало» означает фтор, хлор, бром и йод.
“Галогеналкил” предназначен для включения как разветвленных, так и прямоцепочечных насыщенных алифатических углеводородных групп, замещенных одним или несколькими атомами галогена. Примеры галогеналкила включают, но не ограничиваются ими, фторметил, дифторметил, трифторметил, хлорметил, дихлорметил, трихлорметил, пентафторэтил, пентахлорэтил, 2,2,2-трифторэтил, гептафторпропил и гептахлорпропил.
Термины «гидрокси» и «гидроксил» могут использоваться взаимозаменяемо и относятся к -OH.
Термин «карбокси» относится к -COOH.
Термин «циано» относится к -CN.
Термин «амино» относится к -NH2. Термин «алкиламино» относится к аминогруппе, в которой один или оба атома водорода, присоединенные к азоту, замещены алкильной группой. Например, алкиламино включает метиламино (-NHCH3), диметиламино (-N(CH3)2), -NHCH2CH3, и т.п.
Термин «аминоалкил», как используется в настоящем документе, предназначен для включения как разветвленных, так и неразветвленных насыщенных алифатических углеводородных групп, замещенных одной или несколькими аминогруппами. Например, “C1-4 аминоалкил” предназначен для включения C1, C2, C3, и C4 алкильных групп, замещенных одной или несколькими аминогруппами. Типичные примеры аминоалкильных групп включают, но не ограничиваются ими, -CH2NH2, -CH2CH2NH2, и -CH2CH(NH2)CH3.
Как используется в настоящем документе, «амид» относится к -C(O)N(R)2, где каждый R независимо представляет собой алкильную группу или водород. Примеры амидов включают, но не ограничиваются ими, -C(O)NH2, -C(O)NHCH3, и -C(O)N(CH3)2.
Термины «гидроксилалкил» и «гидроксиалкил» используются взаимозаменяемо и относятся к алкильной группе, замещенной одной или несколькими гидроксильными группами. Алкил может быть алифатическим углеводородом с разветвленной или неразветвленной цепью. Примеры гидроксилалкила включают, но не ограничиваются ими, гидроксилметил (-CH2OH), гидроксилэтил (-CH2CH2OH), и т.п.
Термин «арил», как используется в настоящем документе, означает группу, которая содержит любую ароматическую группу на основе углерода, включая, помимо прочего, фенил, нафтил, антраценил, фенантранил и тому подобное. Арильные фрагменты хорошо известны и описаны, например, в Lewis, R. J., ed., Hawley’s Condensed Chemical Dictionary, 13th Edition, John Wiley & Sons, Inc., New York (1997). Арильная группа может быть замещенной или незамещенной одним или несколькими подходящими заместителями. Арильная группа может иметь однокольцевую структуру (т.е. моноциклическая) или включать несколько кольцевых структур (т.е. полициклическая), которые представляют собой конденсированные кольцевые структуры. Предпочтительно, арильная группа представляет собой моноциклическую арильную группу, например фенил.
Как используется в настоящем документе, термин «гетероарил» включает стабильные моноциклические и полициклические ароматические углеводороды, которые включают по меньшей мере один член кольца, представляющий собой гетероатом, такой как сера, кислород или азот. Гетероарил может быть моноциклическим или полициклическим, например бициклическим или трициклическим. Каждое кольцо гетероарильной группы, содержащей гетероатом, может содержать один или два атома кислорода или серы и/или от одного до четырех атомов азота при условии, что общее количество гетероатомов в каждом кольце составляет четыре или меньше, и каждое кольцо имеет по меньшей мере один атом углерода. Для бициклических гетероарильных групп конденсированные кольца, завершающие бициклическую группу, могут содержать только атомы углерода и могут быть насыщенными, частично насыщенными или ненасыщенными. Гетероарильные группы, которые являются полициклическими, например, бициклическими или трициклическими, должны включать по меньшей мере одно полностью ароматическое кольцо, но другое конденсированное кольцо или кольца могут быть ароматическими или неароматическими. Гетероарильная группа может быть присоединена к любому доступному атому азота или углерода любого кольца гетероарильной группы. Предпочтительно, термин «гетероарил» относится к 5- или 6-членным моноциклическим группам и 9- или 10-членным бициклическим группам, которые имеют по меньшей мере один гетероатом (O, S или N) в по меньшей мере одном из колец, где гетероатом-содержащее кольцо предпочтительно имеет 1, 2 или 3 гетероатома, более предпочтительно 1 или 2 гетероатома, выбранных из O, S и/или N. Гетероарильная группа может быть незамещенной или замещена одним или несколькими подходящими заместителями. Гетероатом(ы) азота гетероарила может быть замещенным или незамещенным. Гетероатом(ы) азота и серы гетероарила необязательно могут быть окислены (т.е. N→O и S(O)r, где r имеет значение 0, 1 или 2).
Примеры моноциклических гетероарильных групп включают, но не ограничиваются ими, пирролил, пиразолил, пиразолинил, имидазолил, оксазолил, изоксазолил, тиазолил, тиадиазолил, изотиазолил, фуранил, тиофенил, оксадиазолил, пиридинил, пиразинил, пиримидинил, пиридазинил и триазинил. Примеры бициклических гетероарильных групп включают, но не ограничиваются ими, индолил, бензотиазолил, бензодиоксолил, бензоксазолил, бензотиенил, хинолинил, тетрагидроизохинолинил, изохинолинил, бензимидазолил, бензопиранил, индолизинил, бензофуранил, хромонил, кумаринил, бензопиранил, циннолинил, хиноксалинил, индазолил, пирролопиридинил, фуропиридинил, дигидроизоиндолил и тетрагидрохинолинил.
В соответствии с соглашением, используемым в данной области техники:

используется в структурных формулах в настоящем документе для изображения связи, которая является точкой присоединения фрагмента или заместителя к структуре ядра или основной цепи.
Когда показано, что связь с заместителем пересекает связь, соединяющую два атома в кольце, тогда такой заместитель может быть связан с любым атомом в кольце.
В данном контексте термин «замещенный» означает, что по меньшей мере один атом водород замещен на группу, не являющуюся водородом, при условии, что все нормальные валентности сохраняются и что замещение приводит к стабильному соединению. Когда конкретная группа является «замещенной», эта группа может иметь один или несколько заместителей, предпочтительно от одного до пяти заместителей, более предпочтительно от одного до трех заместителей, наиболее предпочтительно от одного до двух заместителей, независимо выбранных из списка заместителей. Термин «независимо», когда он используется в отношении заместителей, означает, что, когда возможно более одного из таких заместителей, такие заместители могут быть одинаковыми или отличаться друг от друга. Примеры подходящих заместителей включают, но не ограничиваются ими, алкил, галоген, алкокси, амид, алкитио, амин, алкиламин, аминоалкил, гидроксиалкил, гидроксил, карбоксил и т.п., такие как C1-4 алкил, C1-3 алкокси, -OH, -COOH, -F, -Cl, -C(O)NHCH3, -C(O)N(CH3)2.
Если какая-либо переменная встречается более одного раза в любом компоненте или формуле соединения, ее определение в каждом случае не зависит от ее определения в каждом другом случае. Таким образом, например, если показано, что группа замещена 0-3 группами R, тогда указанная группа может быть необязательно замещена максимум тремя группами R, и в каждом случае R выбирается независимо из определения R.
Термины «необязательный» или «необязательно» означают, что событие или обстоятельство, описанное впоследствии, может, но не обязательно, произойти, и такое описание включает ситуацию, в которой событие или обстоятельство происходит или не происходит. Например, «необязательно замещенный арил» означает, что группа заместителя может присутствовать, но не обязательно, и такое описание включает ситуацию, когда арильная группа замещена подходящим заместителем, а арильная группа не замещена каким-либо заместителем.
Специалист в данной области поймет, что в некоторых вариантах осуществления соединения заявки могут иметь один или несколько асимметрических атомов углерода в своей структуре. Как используется в настоящем документе, любые химические формулы со связями, показанными только сплошными линиями, а не сплошными клиновидными или заштрихованными клиновидными связями, или иным образом обозначенные как имеющие конкретную конфигурацию (например, R или S) вокруг одного или нескольких атомов, рассматривают каждый возможный стереоизомер, или смесь двух или более стереоизомеров. Другими словами, если стереохимия структуры не определена, предполагается, что структура охватывает все отдельные стереоизомеры и их смеси. Стереоизомеры включают энантиомеры и диастереомеры. Энантиомеры представляют собой стереоизомеры, которые не являются сверх-наложенными зеркальными отображениями друг друга. Смесь 1:1 пары энантиомеров представляет собой рацемат или рацемическую смесь. Диастереомеры (или диастереоизомеры) представляют собой стереоизомеры, которые не являются энантиомерами, т.е. они не связаны как зеркальные изображения, и возникают, когда два или более стереоизомеров соединения имеют разные конфигурации в одном или нескольких эквивалентных стереоцентрах и не являются зеркальными отражениями друг друга. Группы заместителей (например, алкил, гетероциклил и т.п.) могут содержать стереоцентры в R- или S-конфигурации.
Таким образом, в объем изобретения включены стереохимически чистые изомерные формы соединений по изобретению (то есть одиночный энантиомер или одиночный диастереомер), а также их смеси, включая их рацематы. Когда конкретный стереоизомер идентифицирован, это означает, что стереоизомер по существу свободен, то есть связан с менее чем 50%, предпочтительно менее чем 20%, более предпочтительно менее чем 5%, в частности менее чем 2% и наиболее предпочтительно менее чем 1% других стереоизомеров. Например, когда соединение, например, указано как (R), это означает, что соединение по существу не содержит (S) изомер. Соединения по заявке, описанные в настоящем документе, можно использовать в виде рацемических смесей, энантиомерно или диастереомерно обогащенных смесей, или в виде энантиомерно или диастереомерно чистых индивидуальных стереоизомеров.
Стереохимически чистые изомерные формы могут быть получены способами, известными в данной области техники с учетом настоящего раскрытия. Например, диастереоизомеры можно разделить методами физического разделения, такими как фракционная кристаллизация и хроматографические методы, а энантиомеры можно отделены друг от друга путем селективной кристаллизации диастереомерных солей с оптически активными кислотами или основаниями или с помощью хиральной хроматографии. Чистые стереоизомеры также можно получить синтетически из подходящих стереохимически чистых исходных веществ или с помощью стереоселективных реакций.
Соединения по заявке также могут образовывать таутомеры. Термин «таутомер» относится к соединениям, которые являются взаимозаменяемыми формами определенной структуры соединения и которые различаются по смещению атомов водород и электронов. Таутомеры представляют собой структурные изомеры химических соединений, которые легко превращаются друг в друга, что обычно приводит к перемещению протона (водород). Таким образом, две структуры могут находиться в равновесии за счет движения пи-электронов и атома (обычно водород). Все таутомерные формы и смеси таутомеров соединений по заявке включены в объем заявки.
Соединения по заявке могут существовать в сольватированной и несольватированной формах. Термин «сольват» означает физическую ассоциацию, например, посредством связывания водородом, соединения по заявке с одной или несколькими молекулами растворителя. Молекулы растворителя в сольвате могут находиться в регулярном расположении и/или неупорядоченном расположении. Сольват может содержать стехиометрическое или нестехиометрическое количество молекул растворителя. «Сольват» включает сольваты в фазе раствора и выделяемые сольваты. Соединения по заявке могут образовывать сольваты с водой (т.е. гидраты) или обычными органическими растворителями. Примеры сольватов включают, но не ограничиваются ими, гидраты, этанолаты, метанолаты и изопропанолаты. Способы сольватации широко известны в данной области.
В объем заявки также включены все изотопы атомов, встречающиеся в соединениях по заявке. Изотопы включают атомы, имеющие одинаковый атомный номер, но разные массовые числа. В качестве общего примера и без ограничения изотопы водорода включают дейтерий и тритий. Изотопы углерода включают 13C и 14C. Изотопно-меченные соединения по изобретению, как правило, могут быть получены обычными методами, известными специалистам в данной области, или способами, аналогичными описанным в настоящем документе, с использованием соответствующего изотопно-меченного реагента вместо немеченого реагента, используемого иным образом.
Как используется в настоящем документе, название соединения предназначено для охвата всех возможных существующих изомерных форм (например, оптического изомера, энантиомера, диастереомера, рацемата или рацемической смеси), таутомеров и фармацевтически приемлемых солей соединения.
Соединения
В общем аспекте изобретение относится к соединению формулы (I-b):
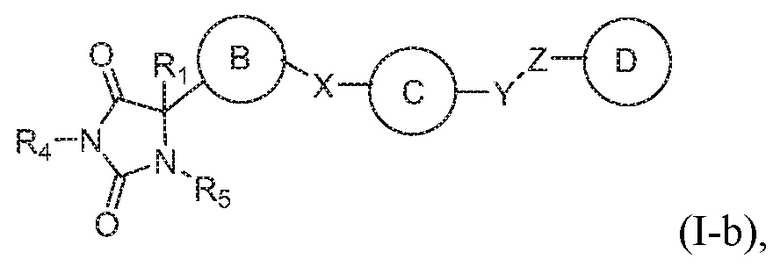
или его таутомеру, стереоизомеру, фармацевтически приемлемой соли или сольвату,
где:
кольцо B представляет собой необязательно замещенный арил или необязательно замещенный гетероарил;
кольцо C представляет собой необязательно замещенный арил или необязательно замещенный гетероарил;
кольцо D представляет собой необязательно замещенный арил или необязательно замещенный гетероарил;
каждый из X, Y и Z независимо выбраны из группы, состоящей из CH2, O, NRx и S(O)q, где Rx представляет собой водород или алкил;
R1 представляет собой водород или алкил;
R4 представляет собой водород или алкил;
R5 представляет собой водород; и
q имеет значение 0, 1 или 2,
при условии, что кольцо B не является фуранилом.
В одном варианте осуществления предложено соединение формулы (I):
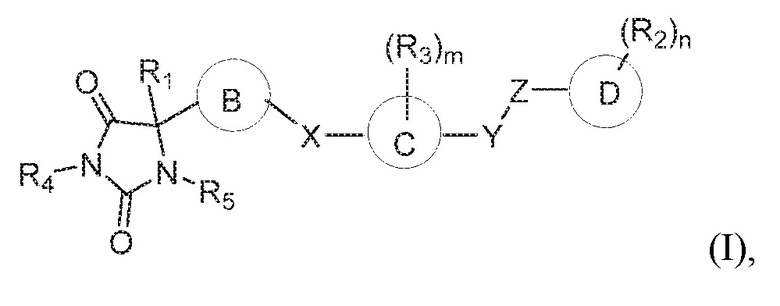
или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват,
где:
кольцо B представляет собой необязательно замещенный арил или необязательно замещенный гетероарил;
кольцо C представляет собой арил или гетероарил;
кольцо D представляет собой арил или гетероарил;
каждый из X, Y и Z независимо выбран из группы, состоящей из O, CH2, NRx и S(O)q, где Rx представляет собой водород или алкил;
R1 представляет собой водород или алкил;
каждый R2 независимо выбран из группы, состоящей из водорода, алкила, галогена, гидроксил, галогеналкила, алкокси, алкилтио, амино, амида, алкиламино, аминоалкила, циано, гидроксиалкила, -(CH2)pC(O)OR6, и -(CH2)pOC(O)R6 ;
каждый R3 независимо выбран из группы, состоящей из водорода, алкила и галогена;
R4 представляет собой водород или алкил;
R5 представляет собой водород;
каждый R6 независимо выбран из группы, состоящей из водорода и алкила, где алкил является незамещенным или замещен одной или несколькими группами, независимо выбранными из группы, состоящей из амино, гидроксила, галогена и алкокси;
m имеет значение 1, 2, 3 или 4;
n имеет значение 1, 2, 3, 4 или 5;
p имеет значение 0, 1, 2, 3, 4 или 5; и
q имеет значение 0, 1 или 2.
В одном варианте осуществления предложено соединение формулы (I) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где кольцо C представляет собой необязательно замещенный арил, предпочтительно необязательно замещенный фенил.
В одном варианте осуществления предложено соединение формулы (I) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где кольцо C представляет собой необязательно замещенный гетероарил, предпочтительно необязательно замещенный пиридинил.
В одном варианте осуществления предложено соединение формулы (I) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где m имеет значение 1, и R3 независимо представляет собой водород, алкил или галоген, предпочтительно водород, -CH3, -F, или -Cl, более предпочтительно ч.
В одном варианте осуществления предложено соединение формулы (I) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где кольцо C представляет собой фенил, m имеет значение 1, и R3 представляет собой водород.
В одном варианте осуществления предложено соединение формулы (I) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где кольцо C представляет собой фенил, m имеет значение 1, и R3 представляет собой фтор.
В одном варианте осуществления предложено соединение формулы (I) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где кольцо C представляет собой фенил, m имеет значение 1, и R3 представляет собой метил.
В одном варианте осуществления предложено соединение формулы (I) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где кольцо D представляет собой необязательно замещенный арил, предпочтительно необязательно замещенный фенил.
В одном варианте осуществления предложено соединение формулы (I) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где кольцо D представляет собой необязательно замещенный гетероарил.
В одном варианте осуществления предложено соединение формулы (I) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где кольцо D необязательно замещено 1, 2, 3, 4 или 5 группами заместителей, предпочтительно 1 или 2 группами заместителей, независимо выбранными из группы, состоящей из алкила, галогена, галогеналкила, алкокси, алкилтио, амино, амида, алкиламино, аминоалкила, циано, гидроксиалкила, -(CH2)pC(O)OR6 и -(CH2)pOC(O)R6, где p имеет значение 0, 1, 2, 3, 4 или 5. Группа заместителей, если присутствует, может быть присоединена в любом положении кольца D. Предпочтительно, кольцо D замещено одной группой заместителя.
В одном варианте осуществления предложено соединение формулы (I) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где кольцо D представляет собой моноциклическую арильную или моноциклическую гетероарильную группу, замещенную одним заместителем в мета-положении, предпочтительно фенилом или пиридинилом, замещенным в мета-положении, относительно связи с переменной Z. Особенно предпочтительные группы заместителей для кольца D включают метил (-CH3), амид (-C(O)NH2), метокси (-OCH3), гидроксил (-OH), и гидроксилметил (-CH2OH).
В конкретном варианте осуществления кольцо D представляет собой фенил.
В другом конкретном варианте осуществления кольцо D представляет собой пиридинил.
В одном варианте осуществления предложено соединение формулы (I) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где n имеет значение 1 и R2 представляет собой C1-3 алкокси (например, -OCH3, -OCH2CH2CH3, -OCH2CH3, -OCH(CH3)2), C1-4 алкил (например, -CH3, -CH2CH3, -CH2CH(CH3)2), -CH2OH, -OH, -COOH, -C(O)NH2, -C(O)NHCH3 или -CH2OC(O)CH(NH2)CH(CH3)2, -C(O)NH2, -C(O)NHCH3. Предпочтительно R2 представляет собой -CH3, -C(O)NH2, -CH2OH, -OCH3 или OH.
В одном варианте осуществления предложено соединение формулы (I) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где кольцо D представляет собой:
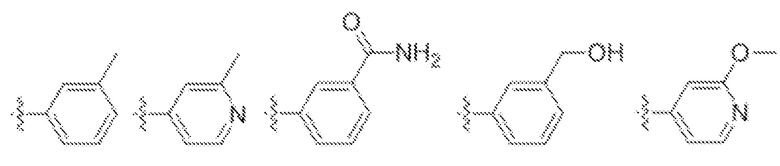
или 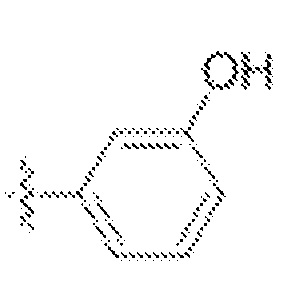 .
.
Согласно вариантам осуществления заявки, хиральный атом углерода гидантоинового фрагмента может быть незамещенным (т.е. R1 представляет собой водород) или замещенным. В случае замещения заместитель R1 предпочтительно представляет собой алкил. Предпочтительные алкильные группы для замещения хирального атома углерода гидантоинового фрагмента включают C1-2 алкильные группы, такие как метил и этил.
В одном варианте осуществления предложено соединение формулы (I) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где R1 представляет собой водород, -CH3 или -CH2CH3.
В одном варианте осуществления предложено соединение формулы (I) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где R1 представляет собой водород.
Также возможно замещение атомов азота гидантоинового фрагмента. Согласно вариантам осуществления заявки каждый из R4 и R5 независимо представляет собой водород или алкил. Предпочтительные алкильные группы включают метил.
В одном варианте осуществления предложено соединение формулы (I) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где R4 представляет собой водород или -CH3 и R5 представляет собой -CH3.
В одном варианте осуществления предложено соединение формулы (I) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где каждый из R4 и R5 представляет собой водород.
Согласно вариантам осуществления заявки, каждый из X, Y, и Z независимо выбран из группы, состоящей из O, NRx, CH2, и S(O)q, где q имеет значение 0, 1 или 2 и Rx представляет собой водород или алкил. Таким образом, каждая из линкерных единиц X, Y и Z независимо выбрана из O, S, S(O), SO2, NH, N-алкила и CH2. Предпочтительно, каждый из X, Y и Z независимо выбран из S, S(O), S(O)2, CH2, и O, более предпочтительно S, CH2, и O.
В одном варианте осуществления предложено соединение формулы (I) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где X представляет собой O, Y представляет собой O, и Z представляет собой CH2.
В одном варианте осуществления предложено соединение формулы (I) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где X представляет собой S, Y представляет собой S, и Z представляет собой CH2.
В одном варианте осуществления предложено соединение формулы (I) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где X представляет собой O, Y представляет собой S, и Z представляет собой CH2.
В одном варианте осуществления предложено соединение формулы (I) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где X представляет собой S, Y представляет собой O, и Z представляет собой CH2.
В одном варианте осуществления предложено соединение формулы (I) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где Z представляет собой O, Y представляет собой CH2, и X представляет собой S.
В одном варианте осуществления предложено соединение формулы (I) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где Z представляет собой S, Y представляет собой CH2, и X представляет собой O.
В одном варианте осуществления предложено соединение формулы (I) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где X представляет собой S(O), Y представляет собой O, и Z представляет собой CH2.
В одном варианте осуществления предложено соединение формулы (I) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где X представляет собой S(O)2, Y представляет собой O, и Z представляет собой CH2.
В одном варианте осуществления предложено соединение формулы (I) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где X представляет собой S, Y представляет собой NH, и Z представляет собой CH2.
В одном варианте осуществления предложено соединение формулы (I) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где X представляет собой S, Y представляет собой N(CH3), и Z представляет собой CH2.
В предпочтительном варианте осуществления, предложено соединение формулы (I), или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где один из X и Y представляет собой S, а другой представляет собой O.
В более предпочтительном варианте осуществления, предложено соединение формулы (I) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где X представляет собой S и Y представляет собой O.
В другом предпочтительном варианте осуществления, предложено соединение формулы (I) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где Z представляет собой CH2.
В одном варианте осуществления предложено соединение формулы (I) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где кольцо B представляет собой необязательно замещенный арил, такой как фенил.
В одном варианте осуществления предложено соединение формулы (I) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где кольцо В представляет собой необязательно замещенный гетероарил. Предпочтительно, кольцо B представляет собой необязательно замещенный 5- или 6-членный гетероарил, имеющий 1-2 гетероатома, выбранных из N, S и O. В конкретных вариантах осуществления кольцо B представляет собой 5-членное гетероарильное кольцо, такое как имидазолил, тиофенил, оксазолил или пиразолил. В других конкретных вариантах осуществления кольцо B представляет собой 6-членный гетероарил, такой как пиридинил или пиридинил N-оксид. Может быть использован любой позиционный или региоизомер гетероарильного кольца, что означает, что гидантоиновый фрагмент и линкер X могут быть связаны с гетероарилом по любому замещаемому атому углерода в гетероарильном кольце. Например, когда кольцо B представляет собой 5-членное гетероарильное кольцо, содержащее 1 гетероатом, гидантоиновый фрагмент и X линкер могут быть связаны с 5-членным гетероарильным кольцом по схеме замещения 2, 3, по схеме замещения 2, 4, по схеме замещения 2, 5, по схеме замещения 3, 4, и т.п., относительно гетероатома. В качестве другого иллюстративного примера, когда кольцо B представляет собой 6-членное гетероарильное кольцо, содержащее один гетероатом, гидантоиновый фрагмент и линкер X могут быть связаны с 6-членным гетероарильным кольцом по схеме замещения 2, 3, по схеме замещения 2, 4, по схеме замещения 2, 5, по схеме замещения 2, 6, по схеме замещения 3, 4 и т.п., относительно гетероатома.
В некоторых вариантах осуществления предложено соединение формулы (I) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где кольцо B является замещенным. Кольцо B может быть замещено у любого замещаемого атома углерода арильного или гетероарильного кольца или у любого замещаемого гетероатома, например, у атома азота, гетероарильного кольца. Например, кольцо B может быть замещено алкильной группой, например, метилом, включая замещение метильной группой, например, у атома азота гетероарильного кольца, например имидазолила или пиразолила.
В некоторых вариантах осуществления предложено соединение формулы (I) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где кольцо B представляет собой пиридинил, пиразолил или имидазолил, где каждый из пиридинила, пиразолила или имидазолила необязательно замещен -CH3.
В одном варианте осуществления предложено соединение формулы (I) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где кольцо B представляет собой пиридинил, необязательно замещенный -CH3.
В одном варианте осуществления предложено соединение формулы (I) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где кольцо B представляет собой пиридинил N-оксид.
В некоторых вариантах осуществления, где кольцо B представляет собой пиридинил, предложено соединение формулы (II):
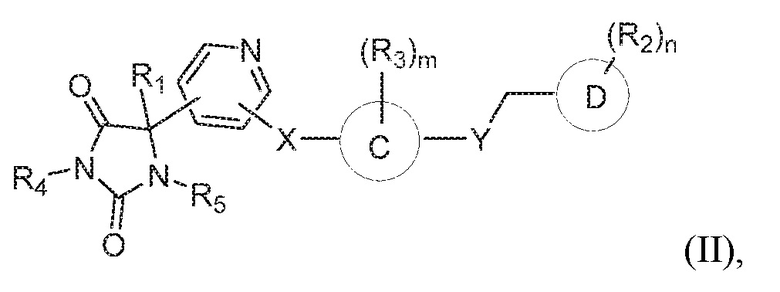
или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват,
где каждая из переменных имеет значения, как определено выше для соединения формулы (I).
В определенных вариантах осуществления, предложено соединение формулы (II), или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где:
кольцо C представляет собой фенил или пиридинил;
R1 представляет собой водород, -CH3 или -CH2CH3;
R4 представляет собой водород или -CH3;
R5 представляет собой водород или -CH3;
X представляет собой S, S(O), или SO2;
R3 представляет собой водород, -CH3, -F, или -Cl;
Y представляет собой O, NH, CH2, или -NH3;
Z представляет собой CH2;
кольцо D представляет собой фенил или пиридинил; и
R2 представляет собой C1-3 алкокси, C1-4 алкил, -CH2OH, -OH, -COOH, -C(O)NH2, -C(O)NHCH3, или -CH2OC(O)CH(NH2)CH(CH3)2;
m имеет значение 1; и
n имеет значение 1.
В конкретных вариантах осуществления, предложено соединение формулы (II-a), (II-b), (II-c), или (II-d):
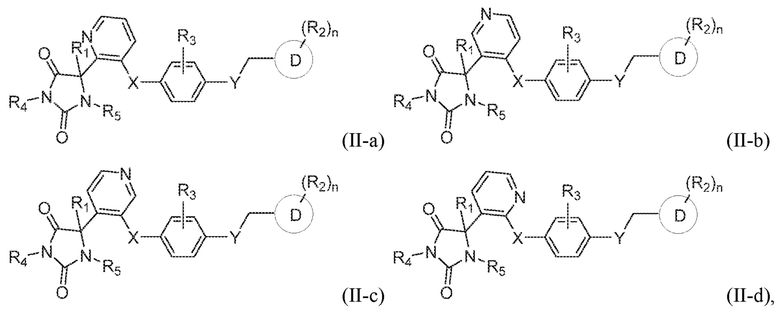
или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где каждая из переменных имеет значения, как определено выше для соединения формулы (I) или формулы (II).
В определенных вариантах осуществления, предложено соединение формулы формулы (II-a), (II-b), (II-c) или (II-d), или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где:
R1 представляет собой водород, -CH3 или -CH2CH3;
R4 представляет собой водород или -CH3;
R5 представляет собой водород или -CH3;
X представляет собой S, S(O), или SO2;
R3 представляет собой водород, -CH3, -F, или -Cl;
Y представляет собой O, NH, CH2, или -NH3;
Z представляет собой CH2;
кольцо D представляет собой фенил или пиридинил; и
R2 представляет собой C1-3 алкокси, C1-4 алкил, -CH2OH, -OH, -COOH, -C(O)NH2, -C(O)NHCH3, или -CH2OC(O)CH(NH2)CH(CH3)2; и
n имеет значение 1.
В предпочтительном варианте осуществления, где кольцо B представляет собой пиридинил, предложено соединение формулы (II-b), или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват.
В одном варианте осуществления предложено соединение формулы (I) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где кольцо B представляет собой тиофенил.
В некоторых вариантах осуществления, где кольцо B представляет собой тиофенил, предложено соединение формулы (IV):
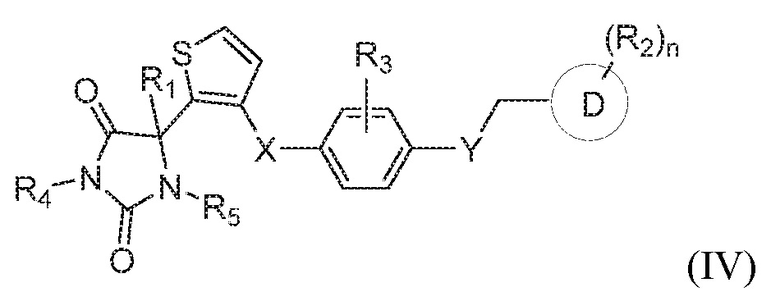
или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват,
где каждая из переменных имеет значения, как определено выше для соединения формулы (I).
В определенных вариантах осуществления, предложено соединение формулы (IV), или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где:
каждый из R1, R4, и R5 представляет собой водород;
X представляет собой S;
Y представляет собой O;
Z представляет собой CH2;
R3 представляет собой водород;
кольцо D представляет собой фенил или пиридинил; и
R2 представляет собой -CH3, -C(O)NH2, -CH2OH, -OCH3, или -OH; и
n имеет значение 1.
В одном варианте осуществления предложено соединение формулы (I) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где кольцо B представляет собой имидазолил.
В некоторых вариантах осуществления, где кольцо B представляет собой имидазолил, предложено соединение формулы (Va) или (Vb):
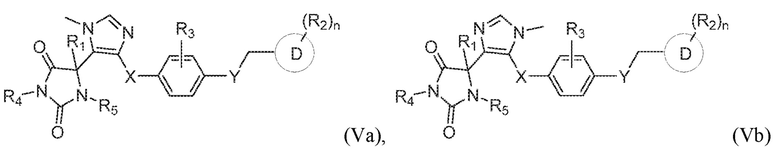
или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват,
где каждая из переменных имеет значения, как определено выше для соединения формулы (I).
В определенных вариантах осуществления, предложено соединение формулы (V), или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где:
каждый из R1, R4, и R5 представляет собой водород;
X представляет собой S;
Y представляет собой O;
Z представляет собой CH2;
R3 представляет собой водород;
кольцо D представляет собой фенил или пиридинил; и
R2 представляет собой -CH3, -C(O)NH2, -CH2OH, -OCH3, или -OH; и
n имеет значение 1.
В одном варианте осуществления предложено соединение формулы (I) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где кольцо B представляет собой пиразолил.
В некоторых вариантах осуществления, где кольцо B представляет собой пиразолил, предложено соединение формулы (VI):
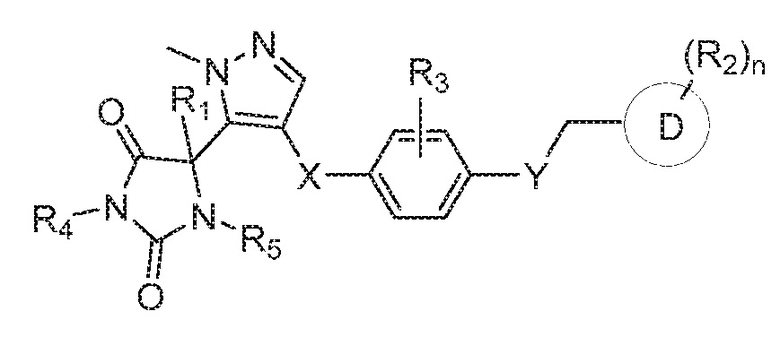
или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват,
где каждая из переменных имеет значения, как определено выше для соединения формулы (I).
В определенных вариантах осуществления, предложено соединение формулы (VI), или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где:
каждый из R1, R4, и R5 представляет собой водород;
X представляет собой S;
Y представляет собой O;
Z представляет собой CH2;
R3 представляет собой водород;
кольцо D представляет собой фенил или пиридинил; и
R2 представляет собой -CH3, -C(O)NH2, -CH2OH, -OCH3, или -OH; и
n имеет значение 1.
В одном варианте осуществления предложено соединение формулы (I) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где кольцо B представляет собой оксазолил.
В некоторых вариантах осуществления, где кольцо B представляет собой оксазолил, предложено соединение формулы (VII):
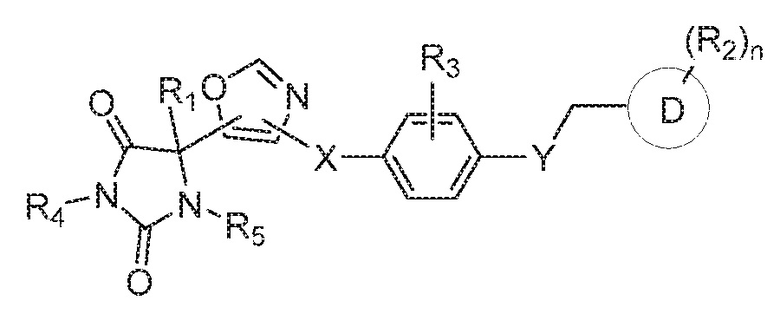
или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват,
где каждая из переменных имеет значения, как определено выше для соединения формулы (I).
В определенных вариантах осуществления, предложено соединение формулы (VII), или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где:
каждый из R1, R4, и R5 представляет собой водород;
X представляет собой S;
Y представляет собой O;
Z представляет собой CH2;
R3 представляет собой водород;
кольцо D представляет собой фенил или пиридинил; и
R2 представляет собой -CH3, -C(O)NH2, -CH2OH, -OCH3 или -OH; и
n имеет значение 1.
В конкретных вариантах осуществления, где кольцо B представляет собой оксазолил, предложено соединение формулы (VII-a) или соединение формулы (VII-b):
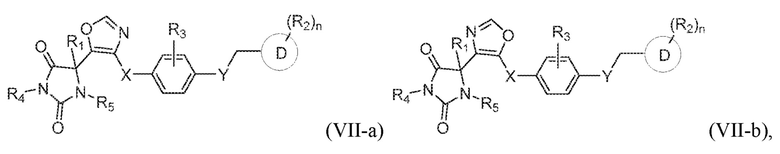
или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват,
где каждая из переменных имеет значения, как определено выше для соединения формулы (I) или формулы (VII).
Соединения, представляющие особый интерес, включают соединения формулы (I-a):
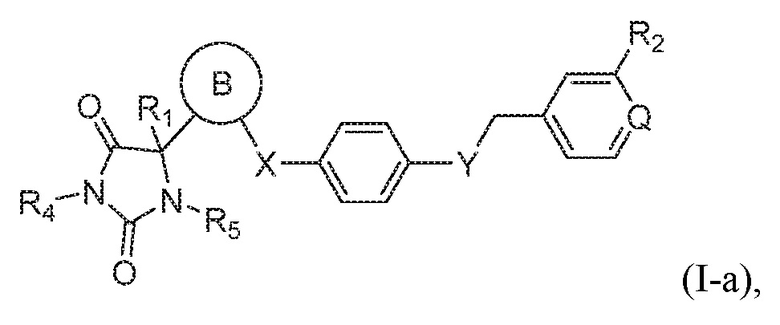
или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват,
где Q представляет собой CH или N, и остальные вариабельные группы имеют значения, указанные выше для соединения формулы (I).
В одном варианте осуществления предложено соединение формулы (I-a) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где Q представляет собой CH.
В одном варианте осуществления предложено соединение формулы (I-a) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где Q представляет собой N.
В одном варианте осуществления предложено соединение формулы (I-a) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где R2 представляет собой алкил, галоген, галогеналкил, алкокси, алкилтио, амино, амид, алкиламино, аминоалкил, циано, гидроксиалкил, -(CH2)pC(O)OR6 и -(CH2)pOC(O)R6, где p имеет значение 0, 1, 2, 3, 4, или 5.
В одном варианте осуществления предложено соединение формулы (I-a) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где R2 представляет собой C1-3 алкокси (например, -OCH3, -OCH2CH2CH3, -OCH2CH3, -OCH(CH3)2), C1-4 алкил (например, -CH3, -CH2CH3, -CH2CH(CH3)2), -CH2OH, -OH, -COOH, -C(O)NH2, -C(O)NHCH3, или -CH2OC(O)CH(NH2)CH(CH3)2, -C(O)NH2, -C(O)NHCH3. Предпочтительно R2 представляет собой -CH3, -C(O)NH2, -CH2OH, -OCH3 или -OH.
В одном варианте осуществления предложено соединение формулы (I-a) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где R1 представляет собой водород, -CH3, или -CH2CH3. Предпочтительно, R1 представляет собой водород.
В одном варианте осуществления предложено соединение формулы (I-a) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где R4 представляет собой водород.
В одном варианте осуществления предложено соединение формулы (I-a) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где R5 представляет собой водород или -CH3.
В одном варианте осуществления предложено соединение формулы (I-a) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где каждый из R1, R4, и R5 представляет собой водород.
В одном варианте осуществления предложено соединение формулы (I-a) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где X представляет собой S, S(O), или SO2.
В одном варианте осуществления предложено соединение формулы (I-a) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где Y представляет собой O, NH, CH2, или N(CH3).
В одном варианте осуществления предложено соединение формулы (I-a) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где X представляет собой S и Y представляет собой O.
В одном варианте осуществления предложено соединение формулы (I-a) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где кольцо B представляет собой пиридинил.
В одном варианте осуществления предложено соединение формулы (I-a) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где кольцо B представляет собой тиофенил.
В одном варианте осуществления предложено соединение формулы (I-a) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где кольцо B представляет собой фенил.
В одном варианте осуществления предложено соединение формулы (I-a) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где кольцо B представляет собой пиразолил.
В одном варианте осуществления предложено соединение формулы (I-a) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где кольцо B представляет собой имидазолил.
В одном варианте осуществления предложено соединение формулы (I-a) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где кольцо B представляет собой оксазолил.
В одном варианте осуществления предложено соединение формулы (I-a) или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват, где:
кольцо B представляет собой пиридинил;
Q представляет собой CH или N;
каждый из R1, R4 и R5 представляет собой водород;
R2 выбран из группы, состоящей из алкила, амида, гидроксила, алкокси и гидроксилалкила;
X представляет собой S; и
Y представляет собой O.
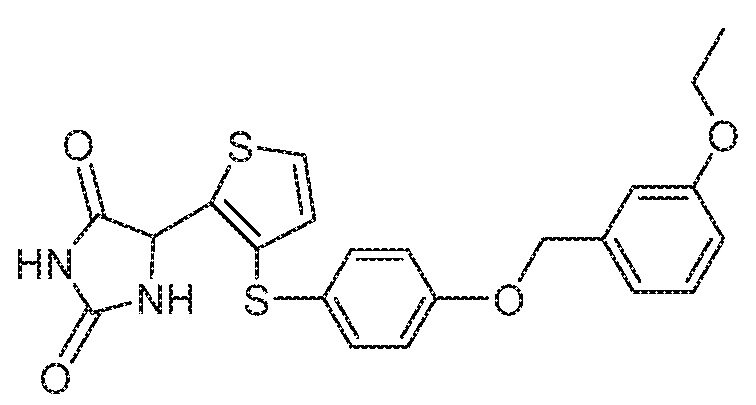
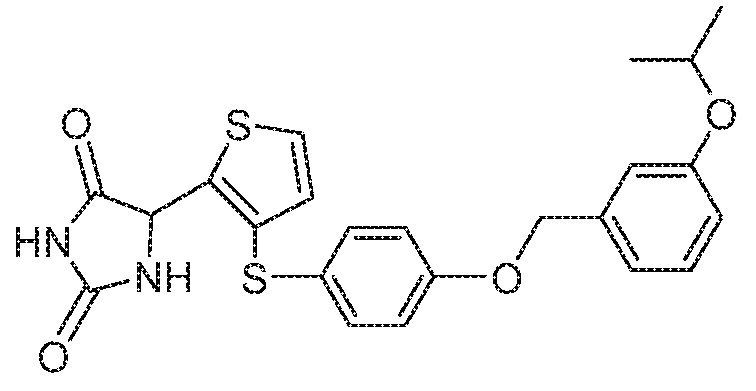
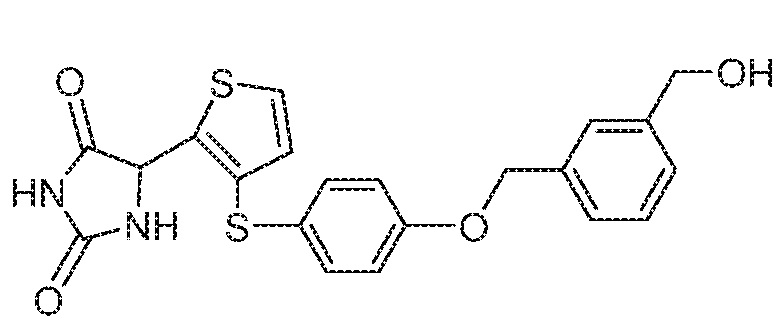
Примеры соединений заявки включают, но не ограничиваются ими, соединения, перечисленные в таблице 1 ниже, и любой их таутомер, стереоизомер, фармацевтически приемлемую соль или сольват. Значения IC50 ММР-12 определяли согласно анализу, описанному в Примере 1 ниже. Значения IC50 представлены следующим образом: A=менее 10 нM, B=10 нM - 100 нM, C=100 нM - 1000 нM, D=более 1000 нM.
IC50 (нM)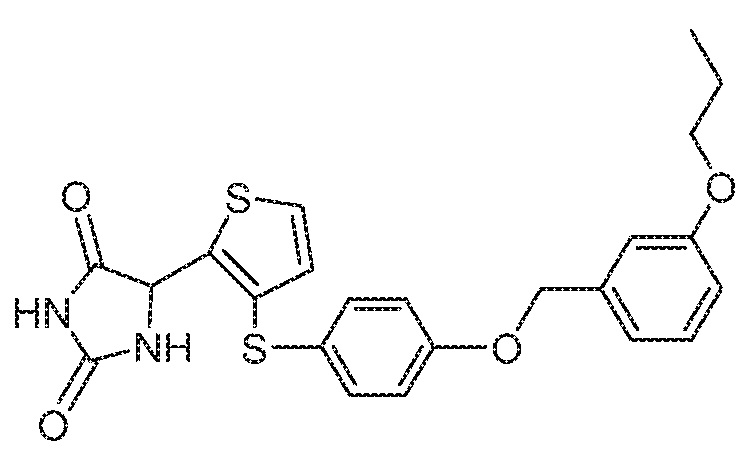
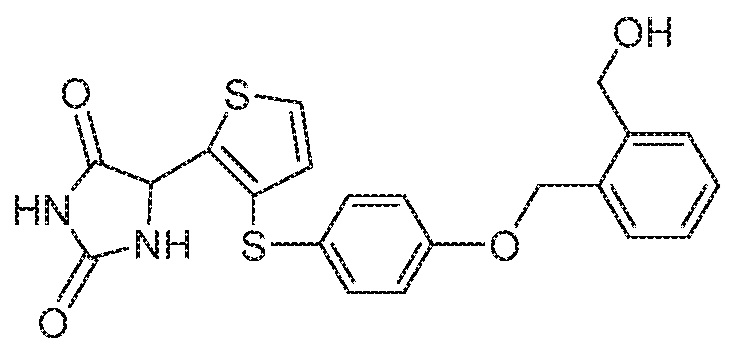
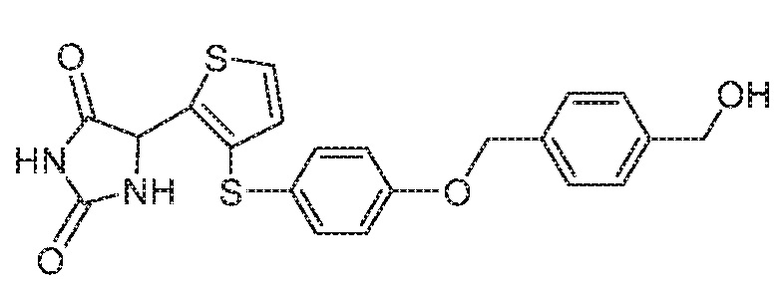
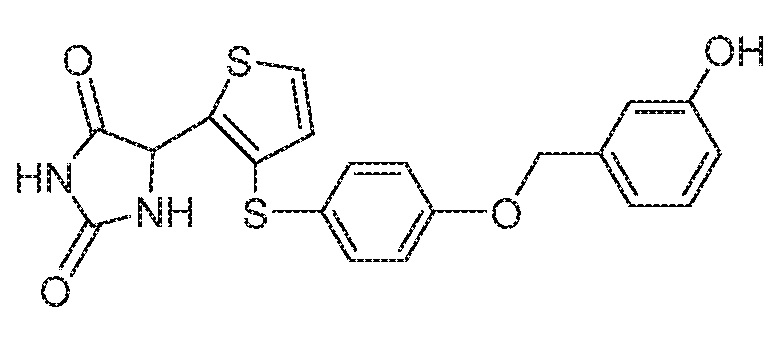
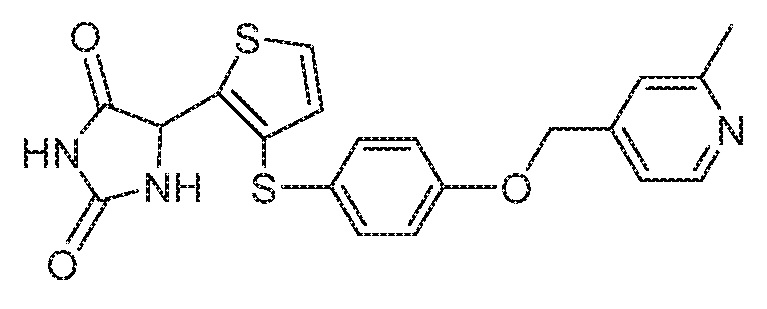
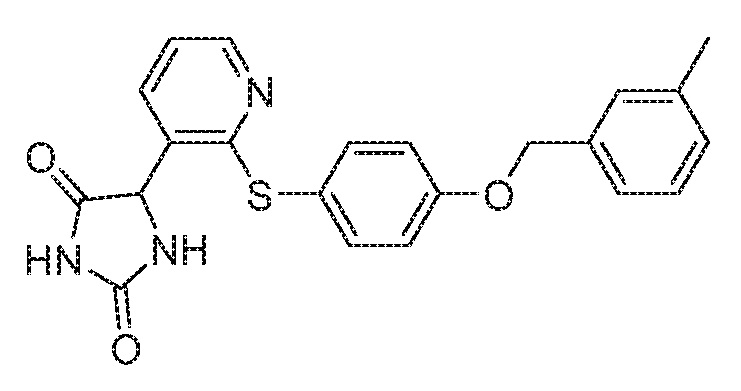
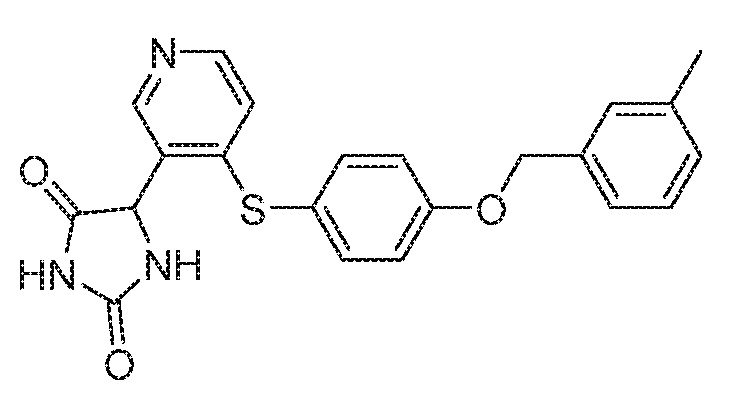
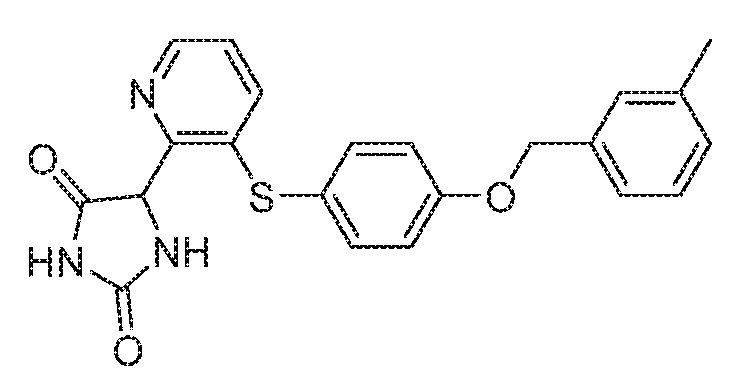
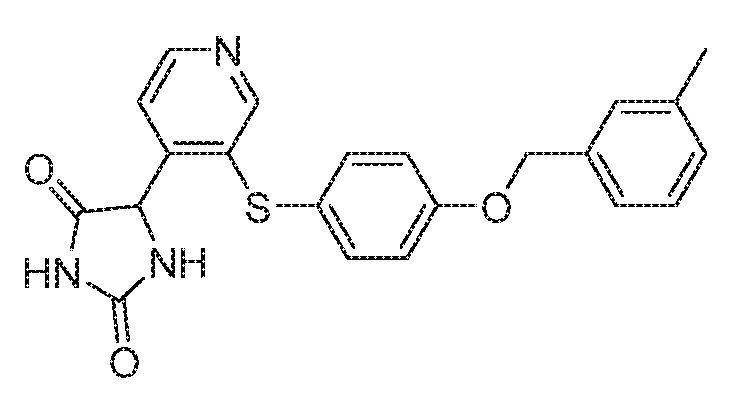
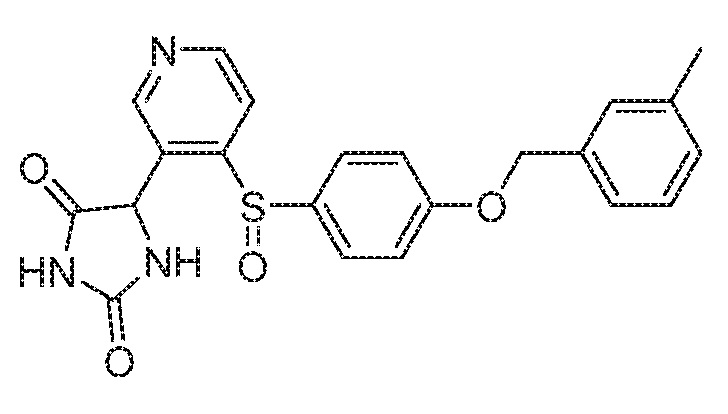
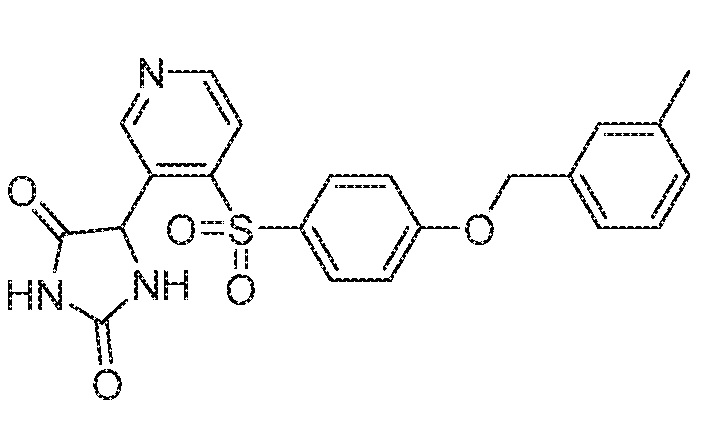
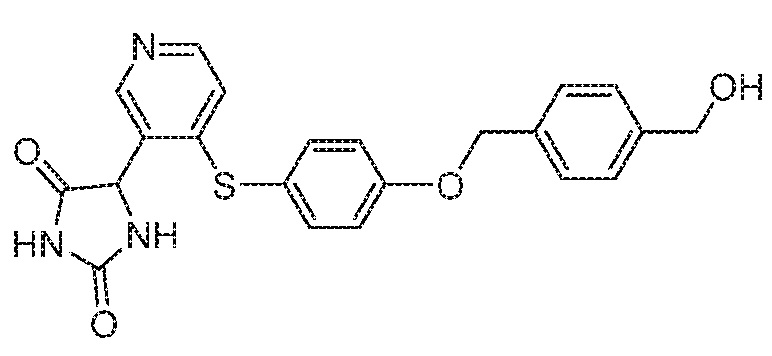
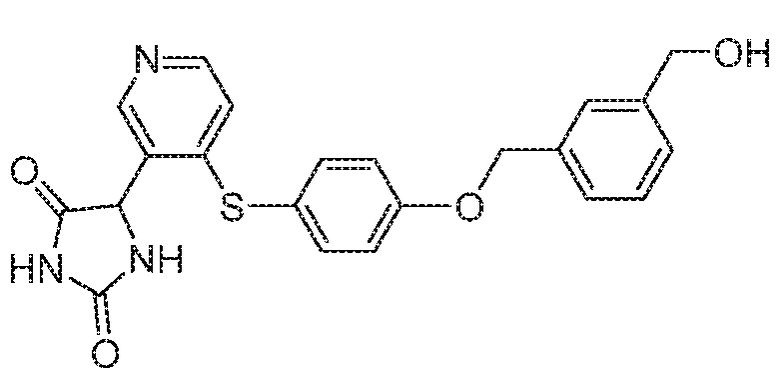
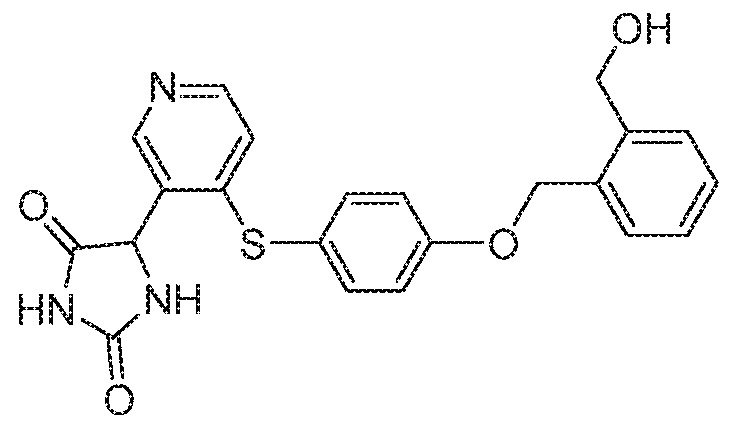
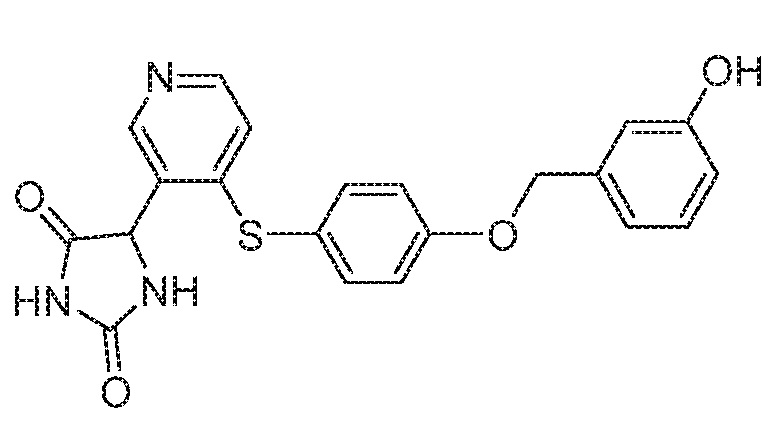
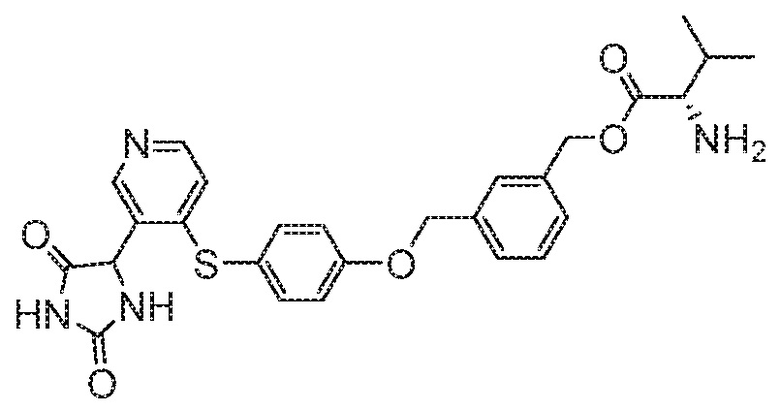
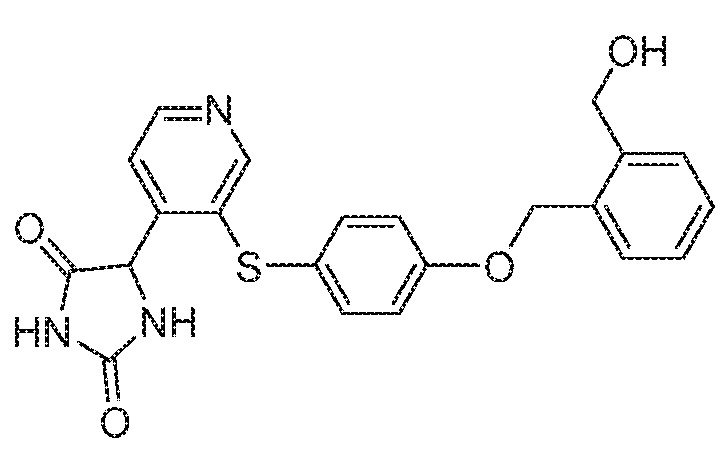
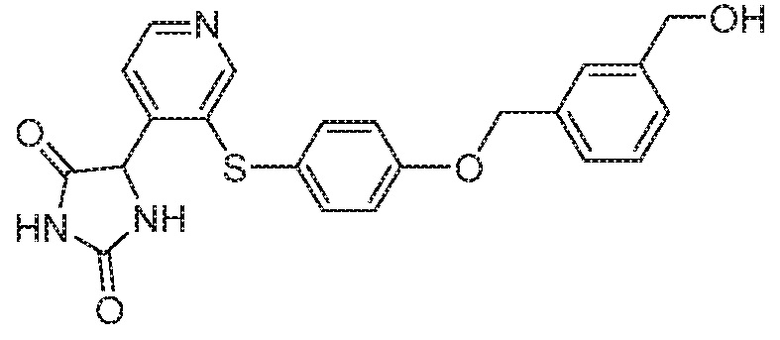
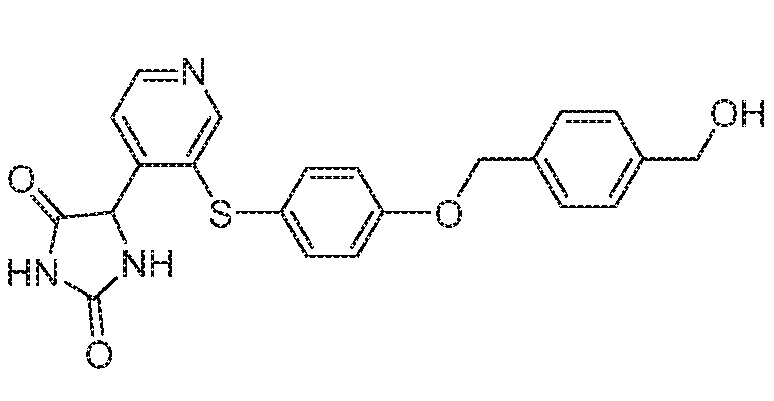
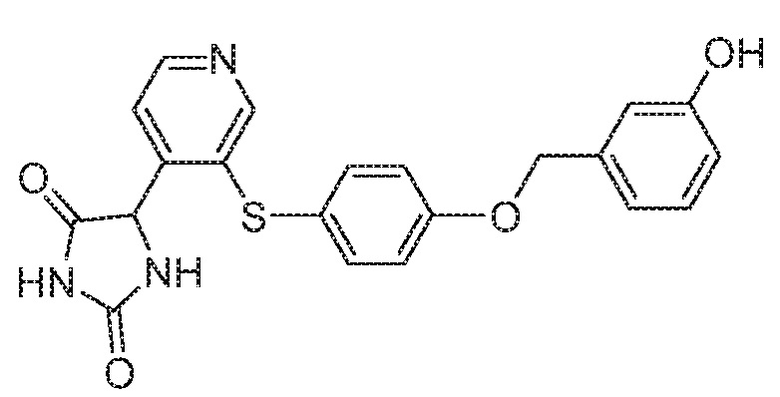
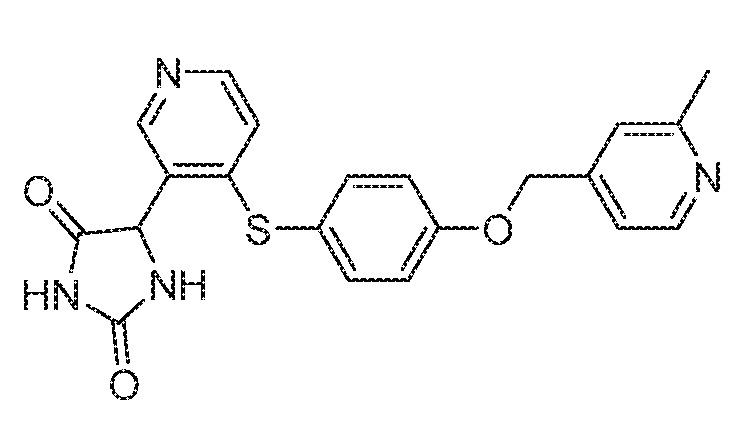
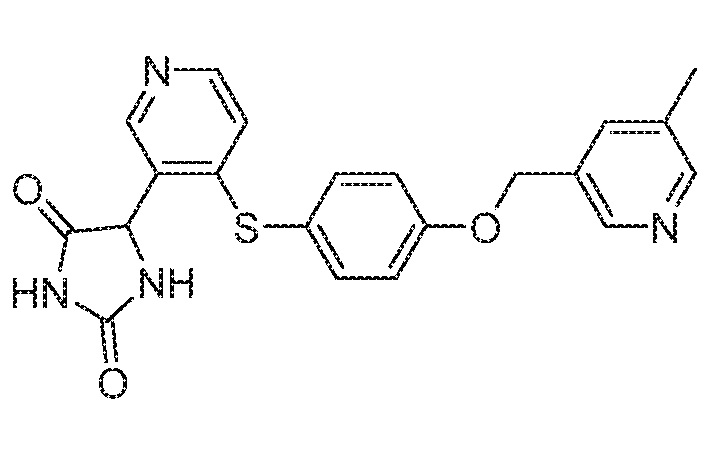
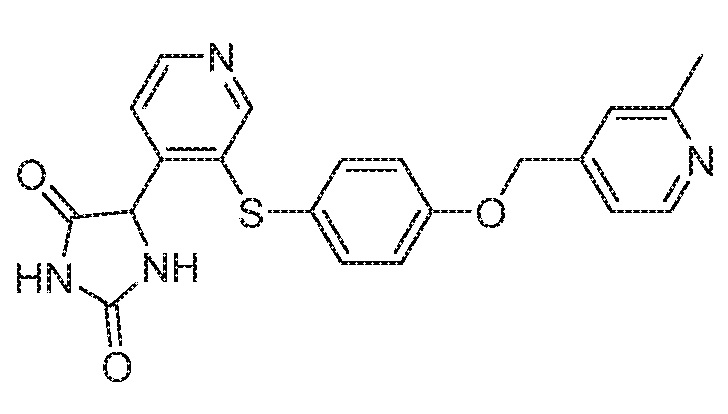
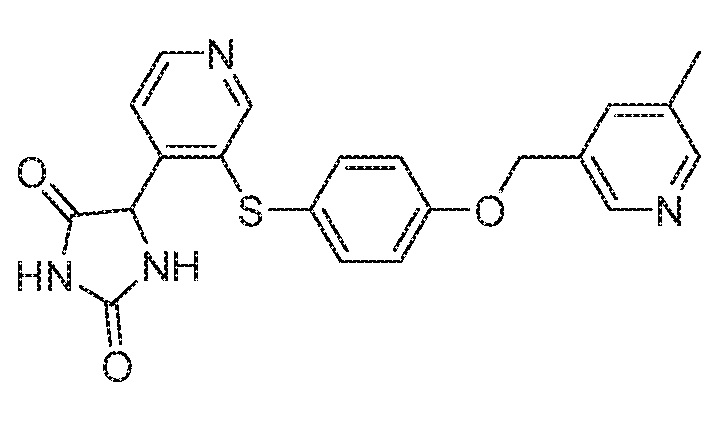
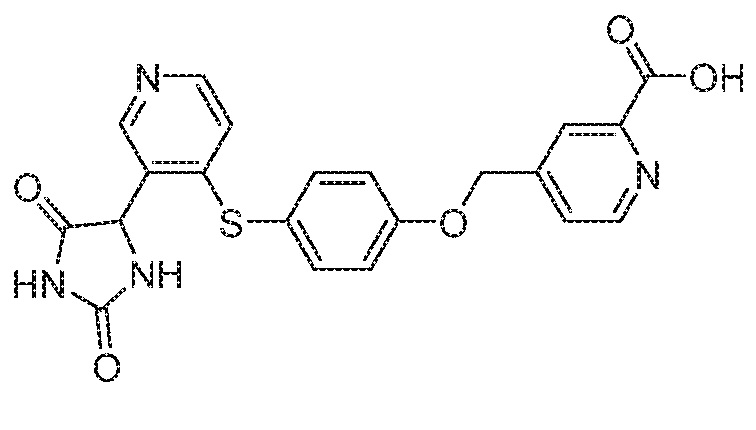
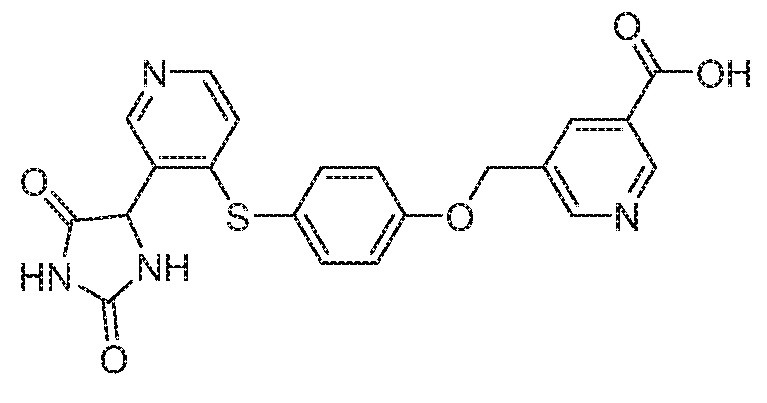
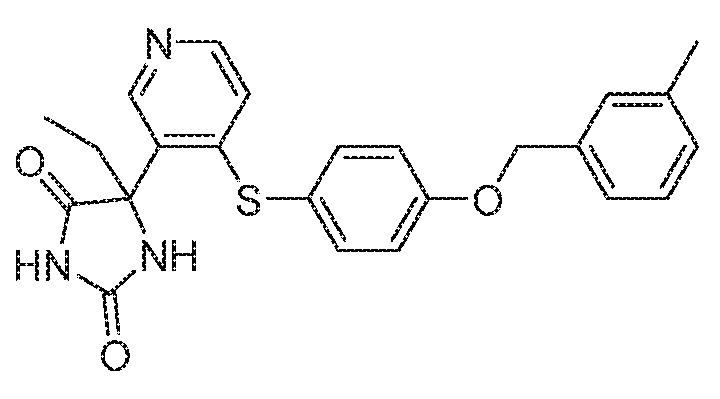
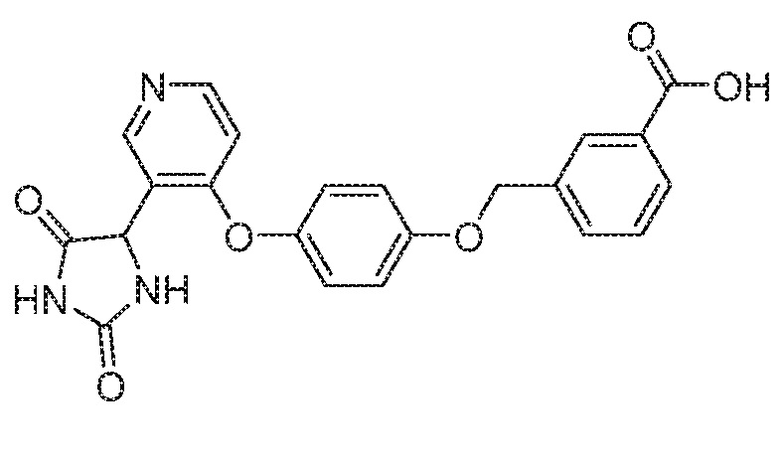
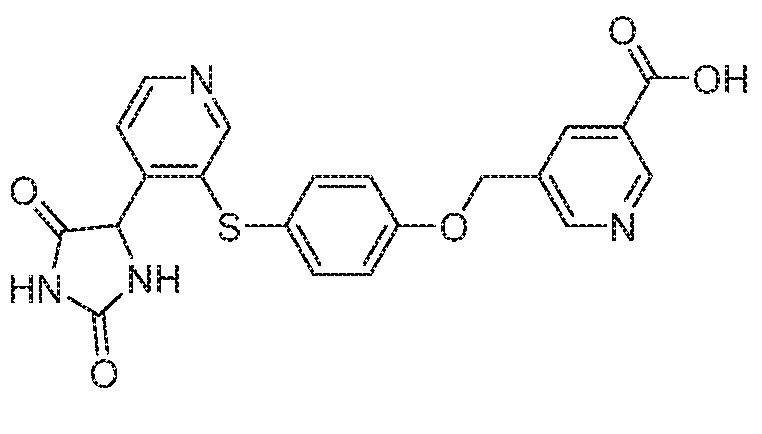
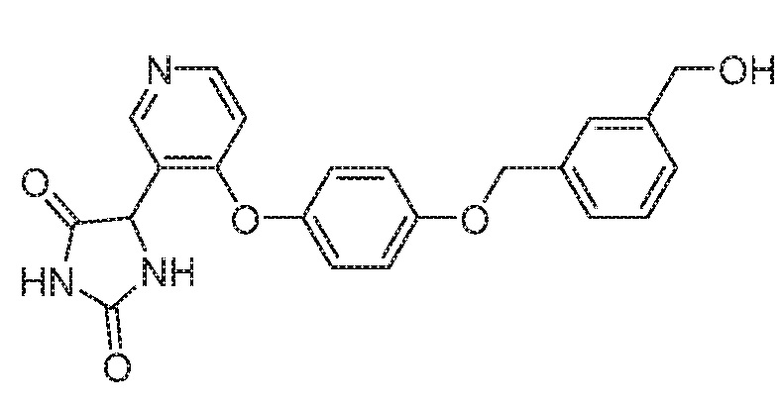
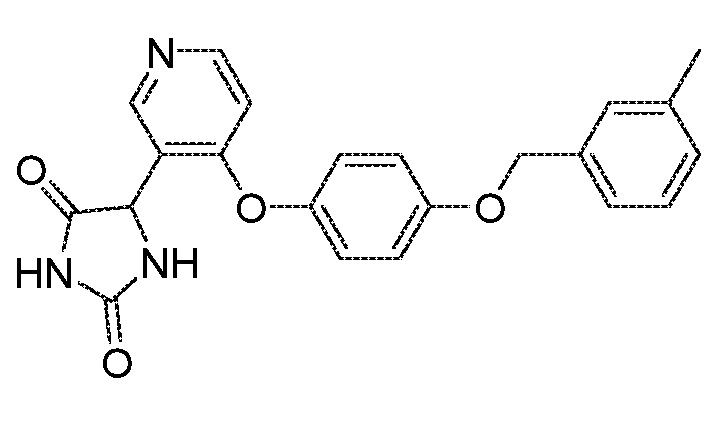
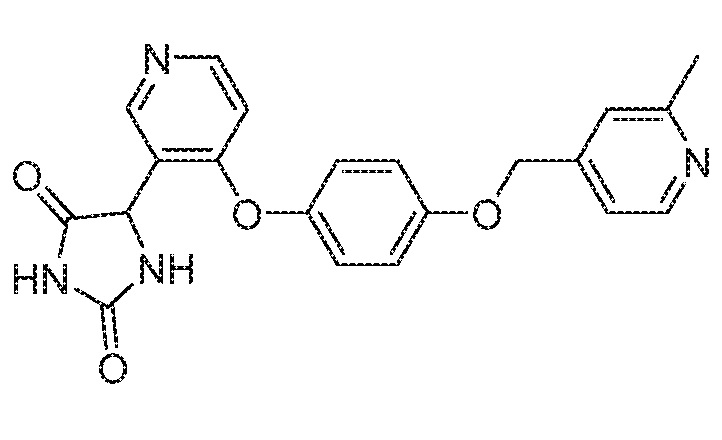
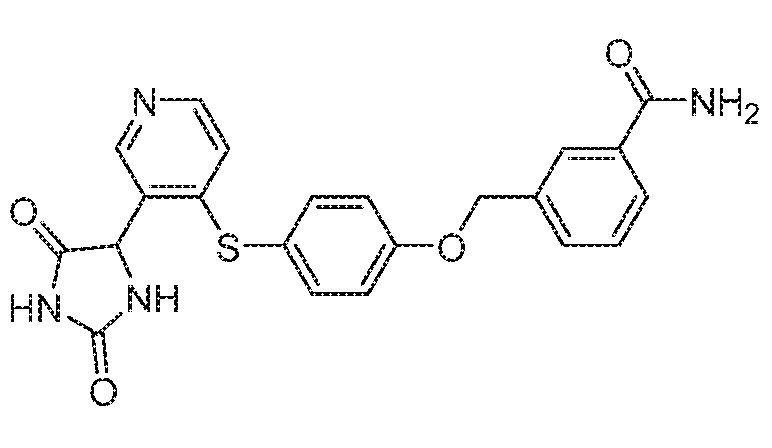
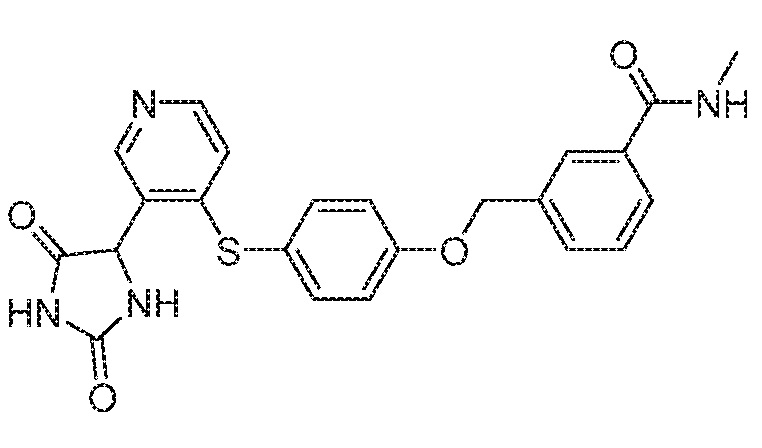
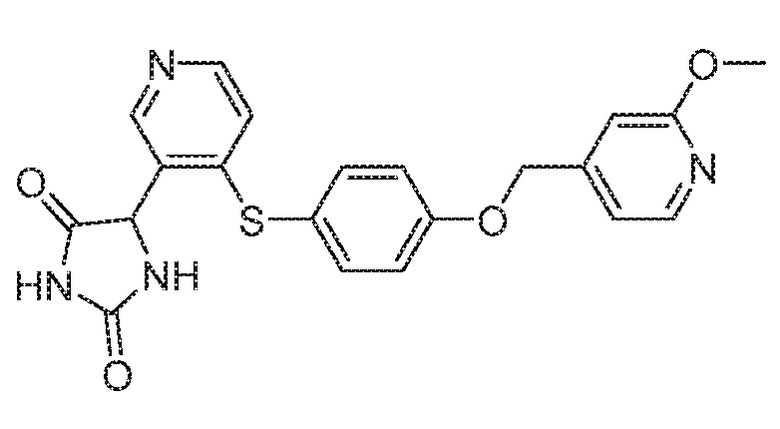
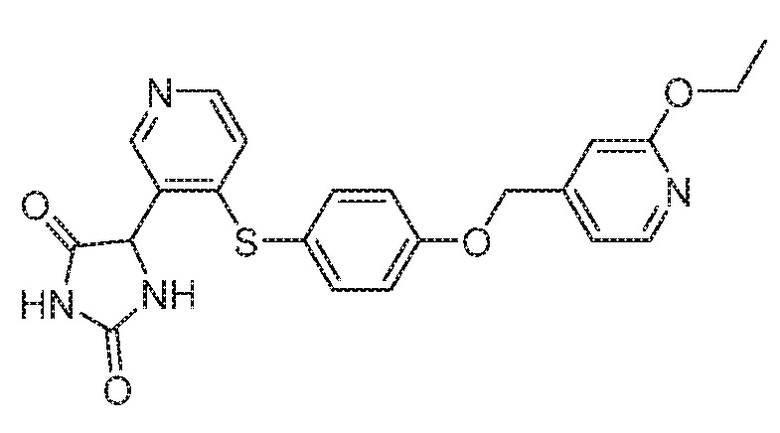
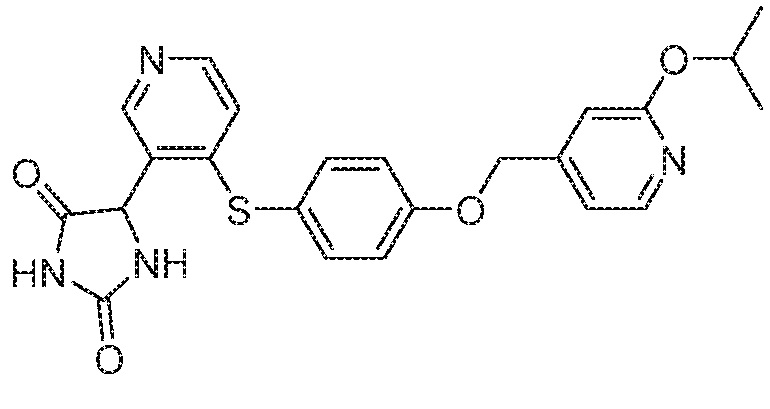
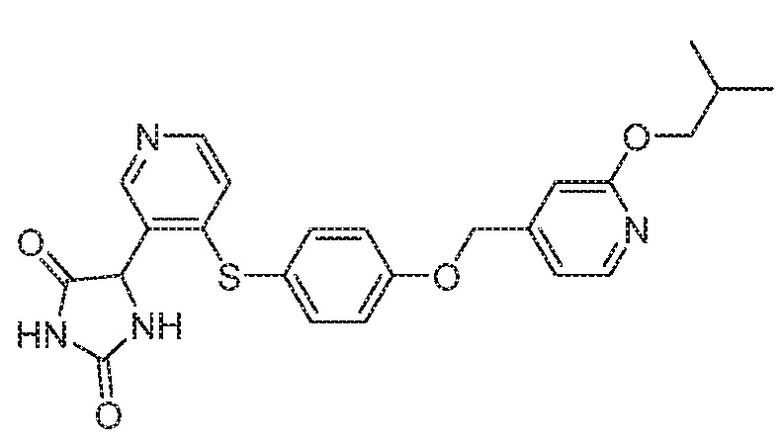
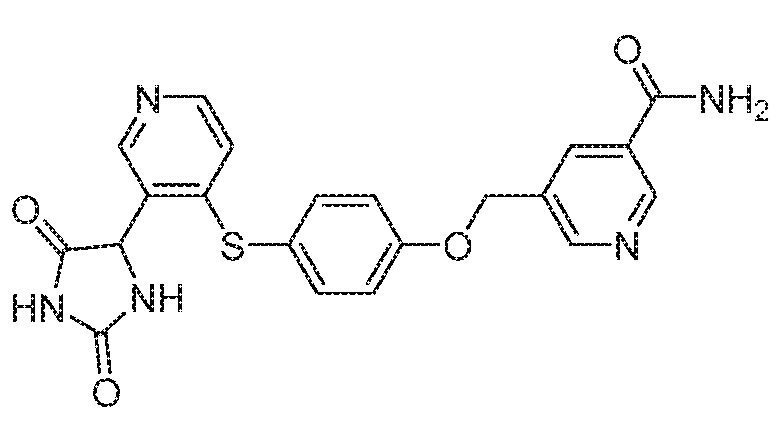
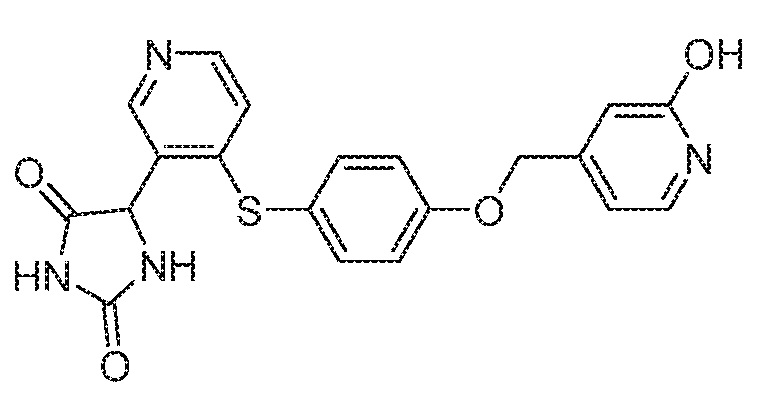
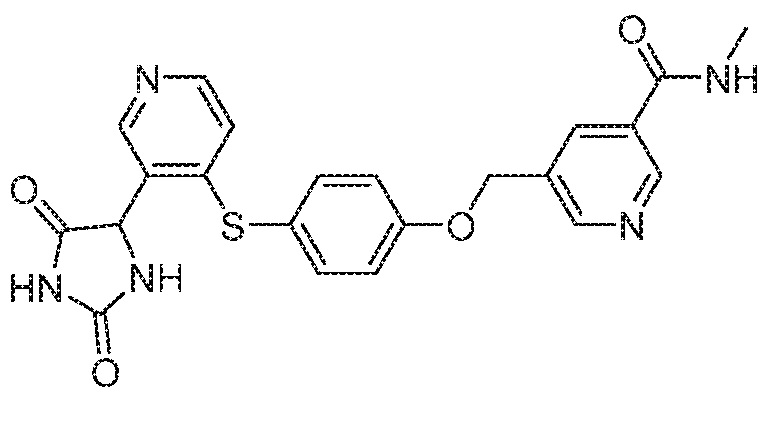
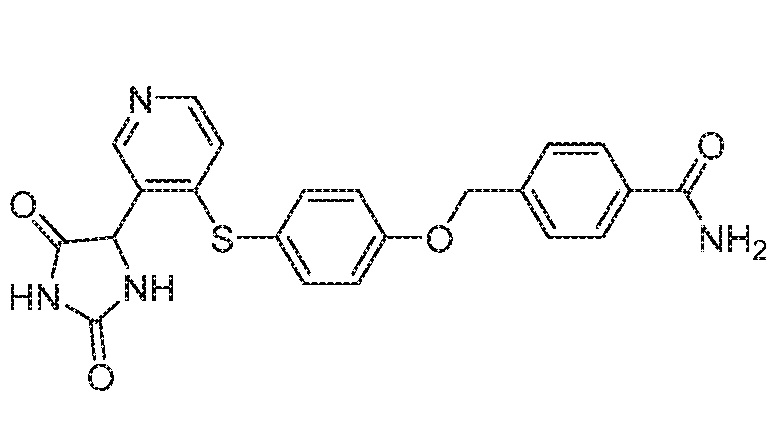
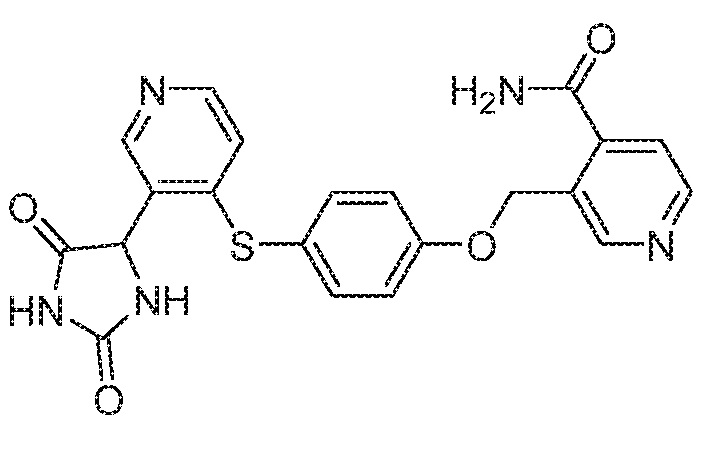
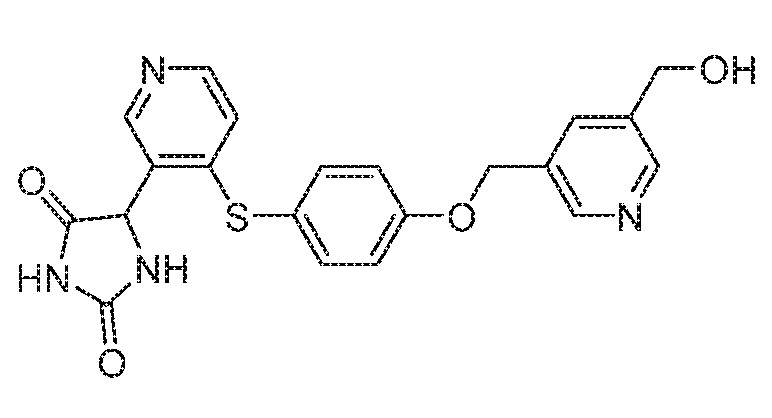
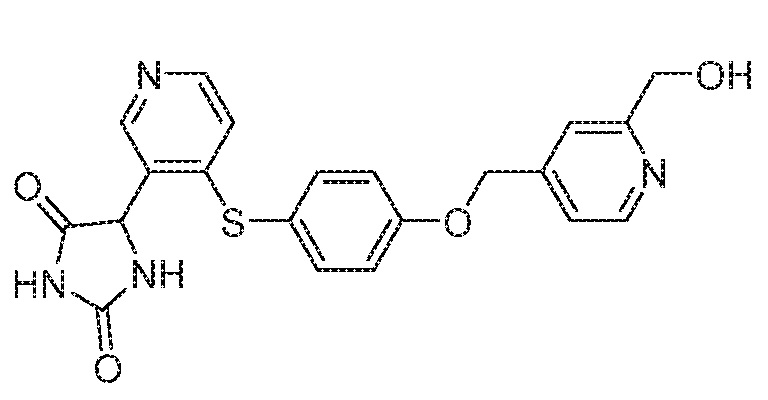
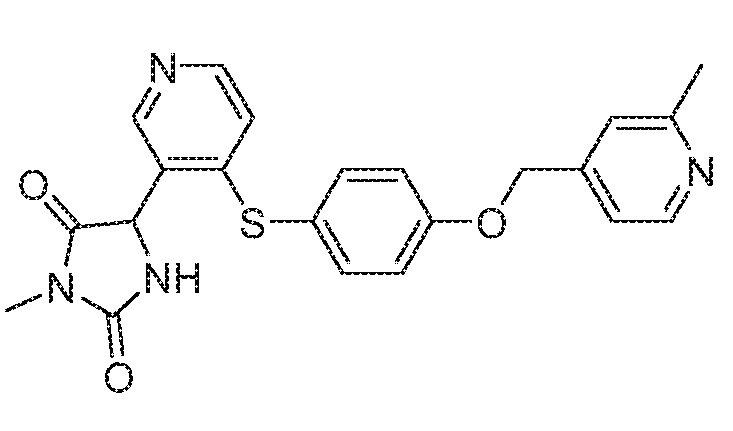
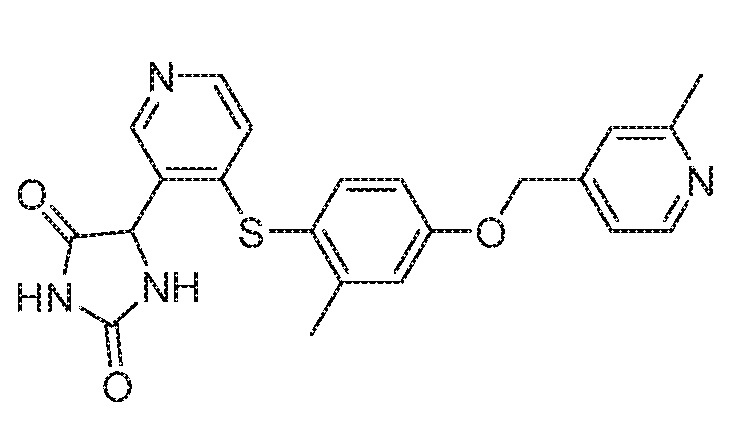
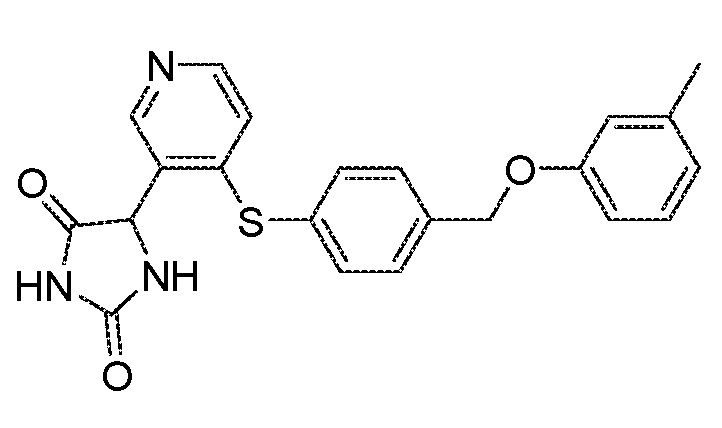
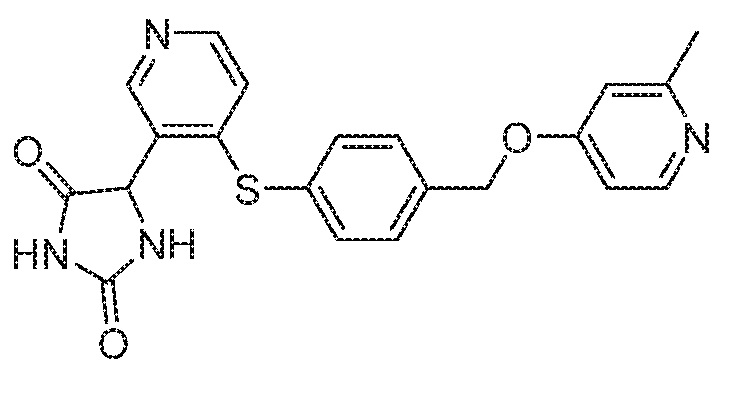
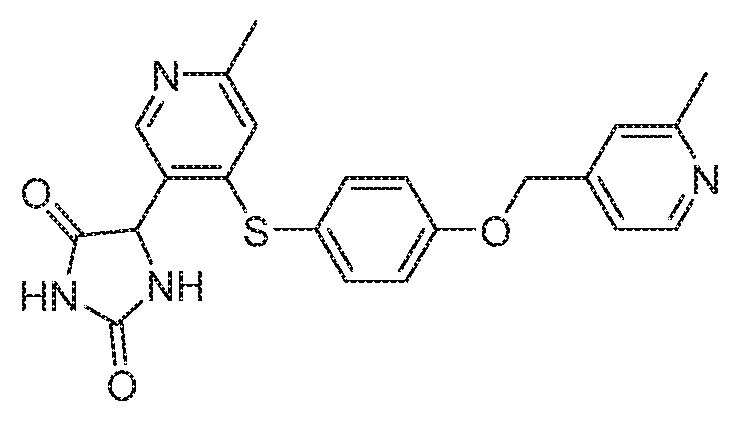
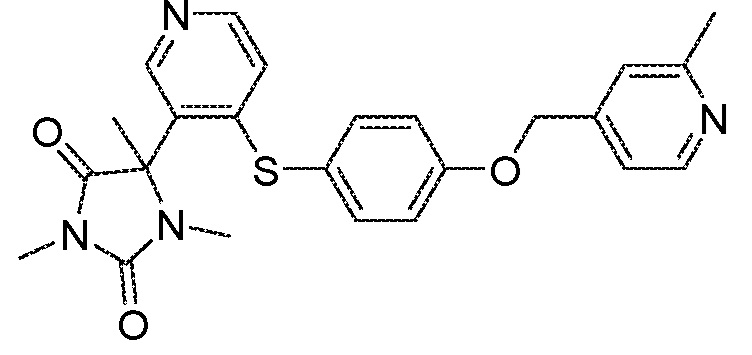
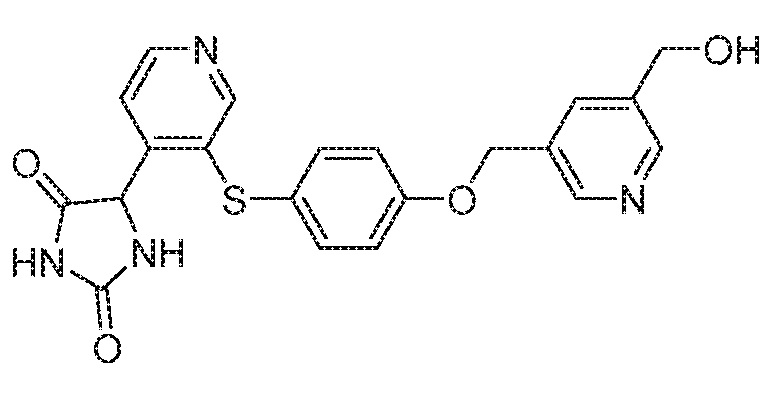
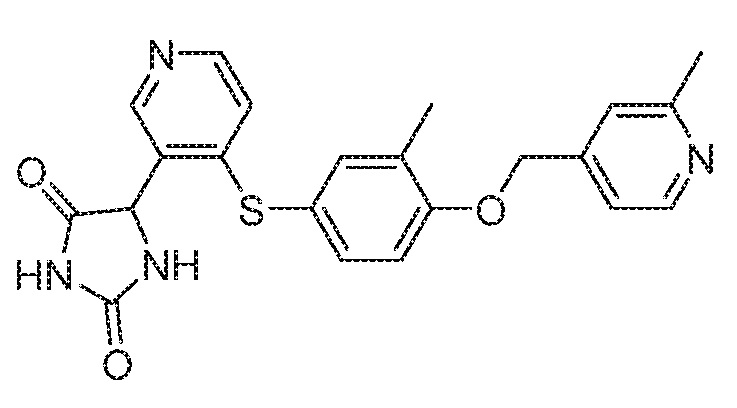
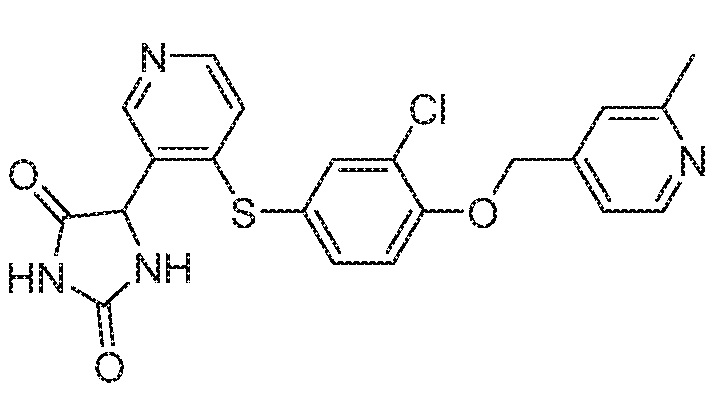
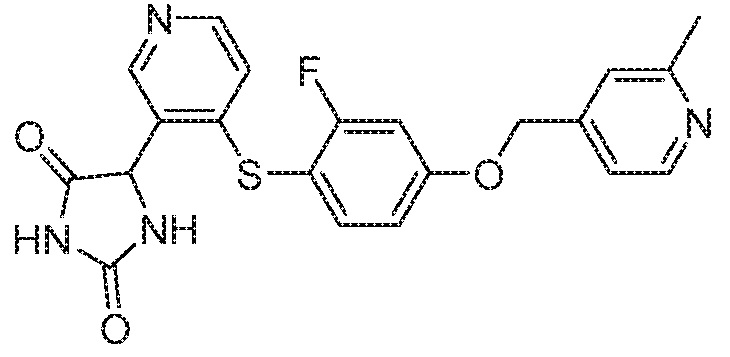
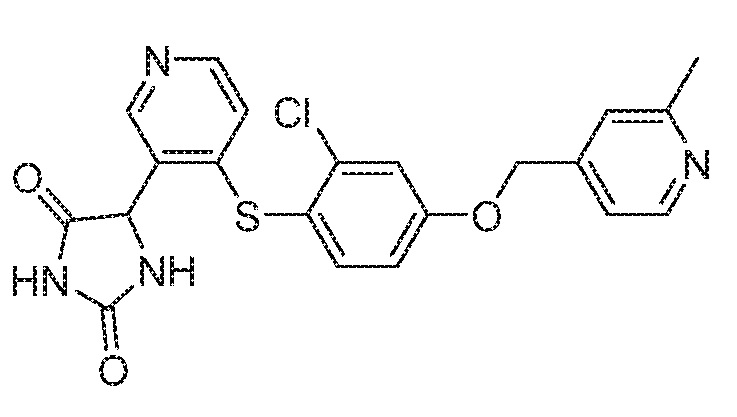
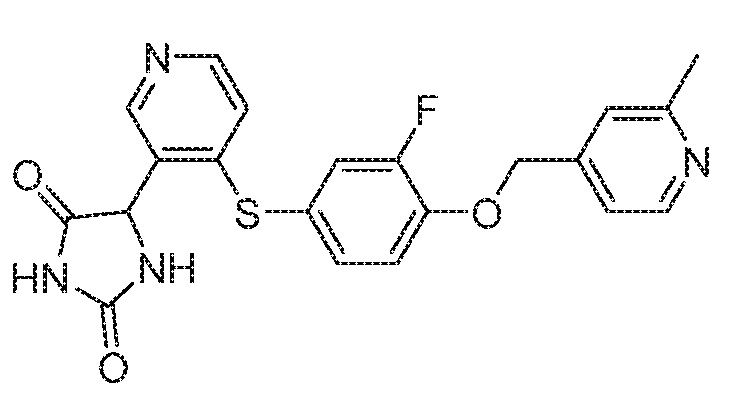
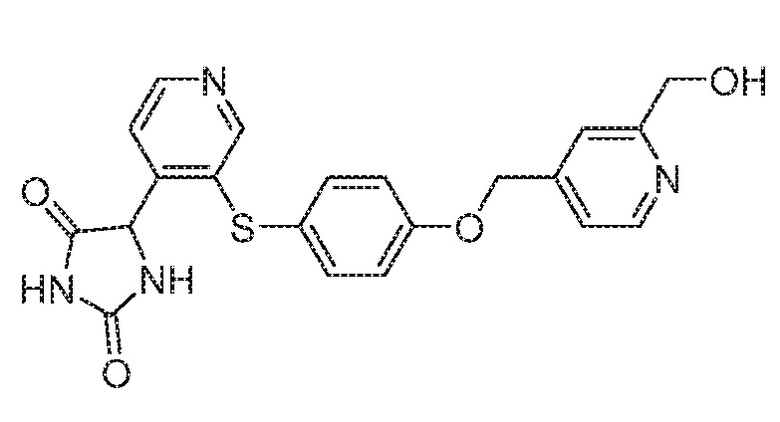
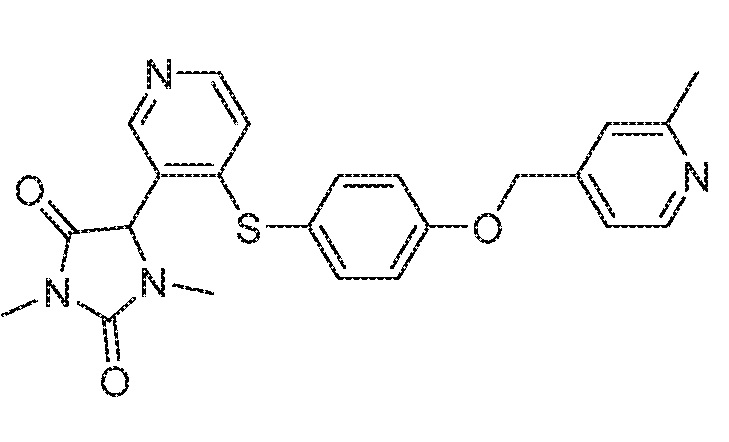
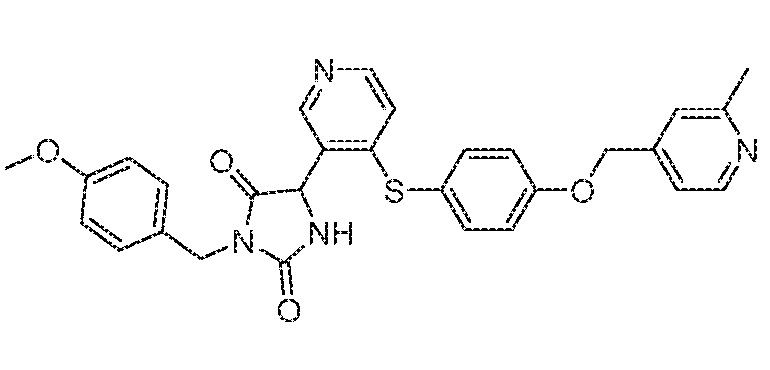
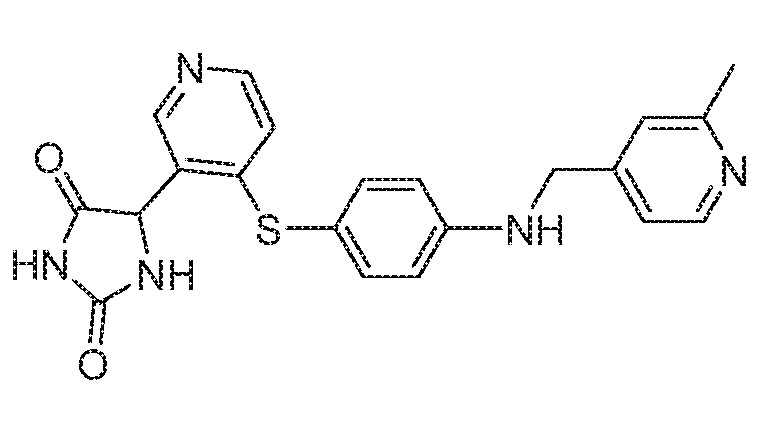
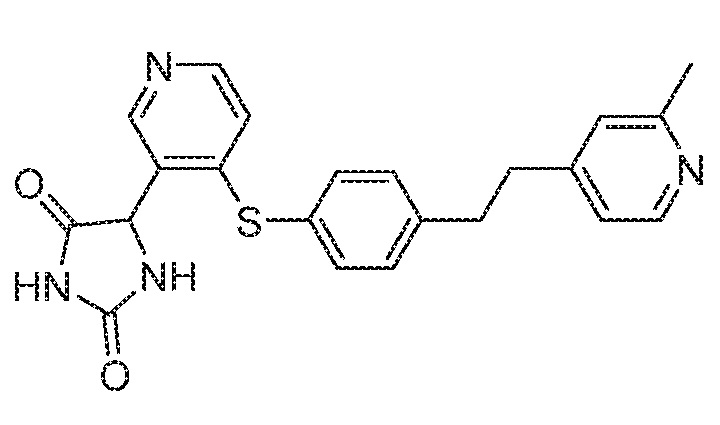
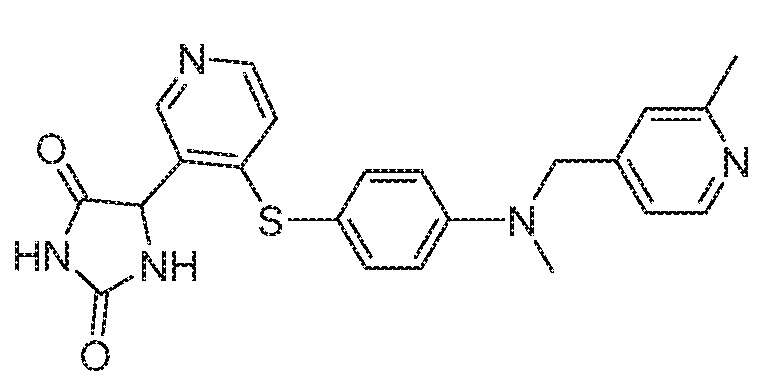
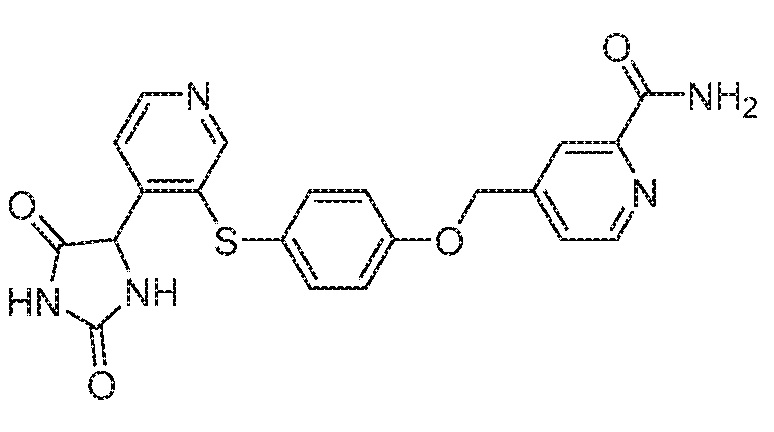
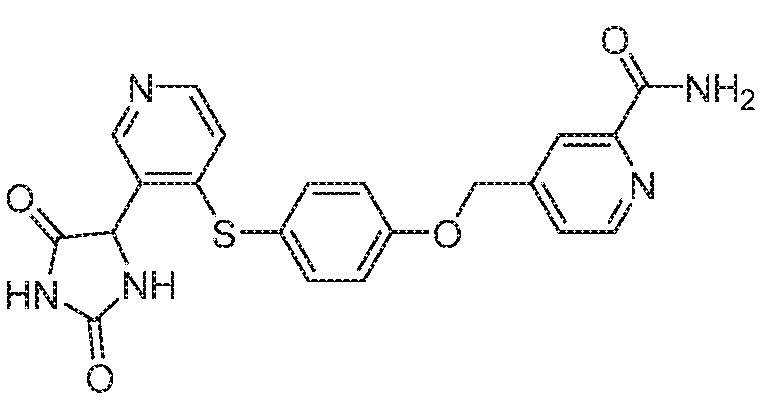
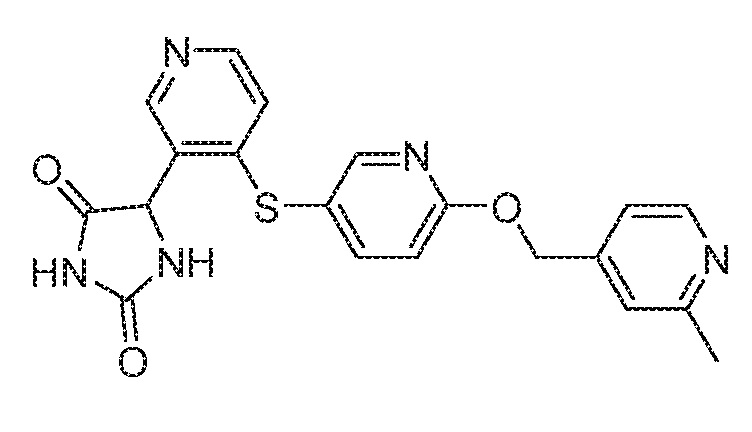
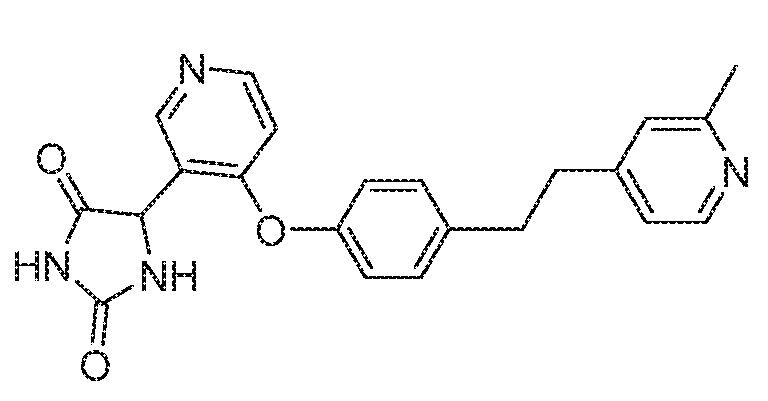
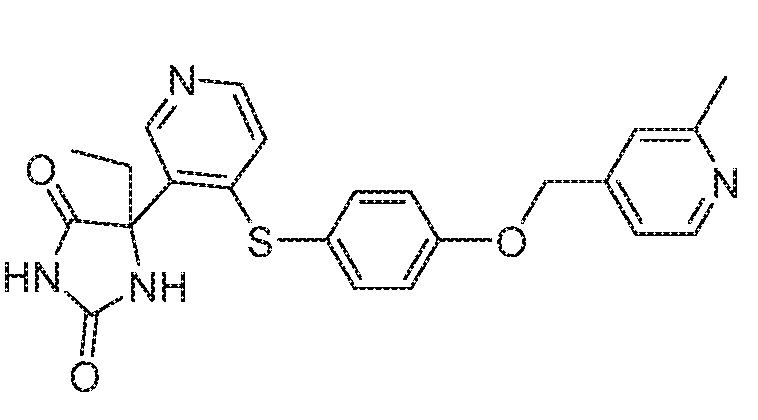
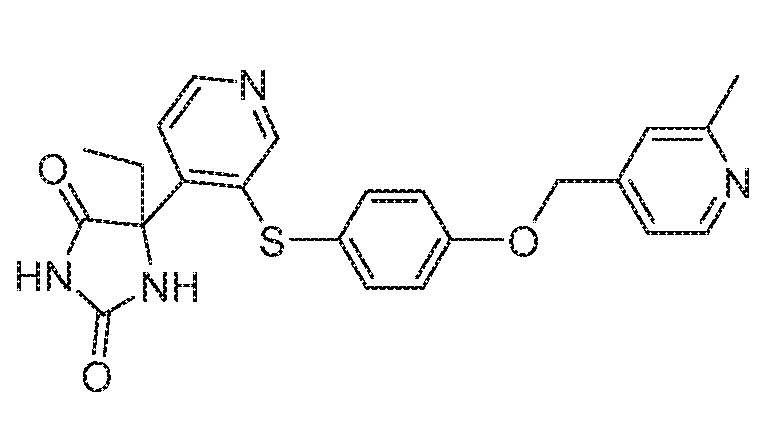
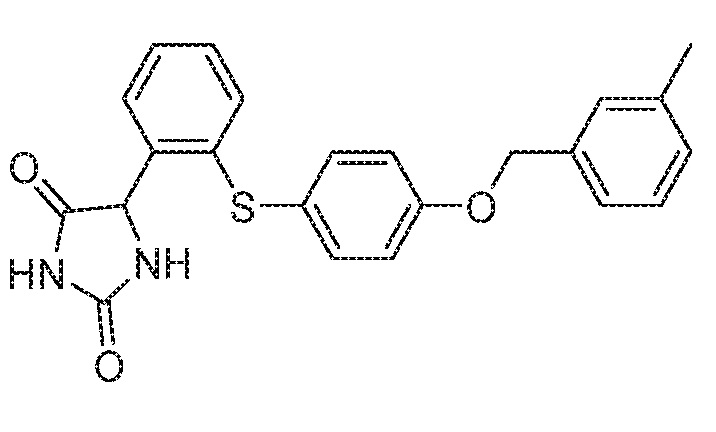
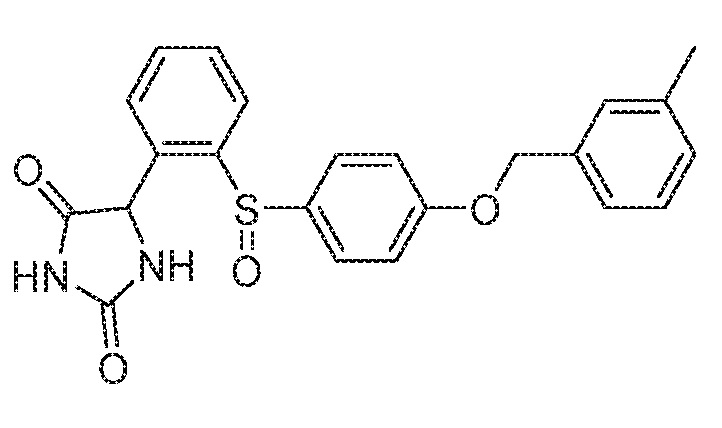
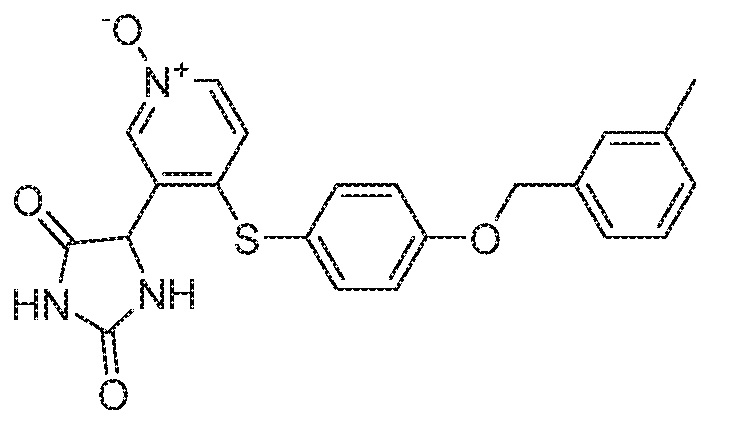
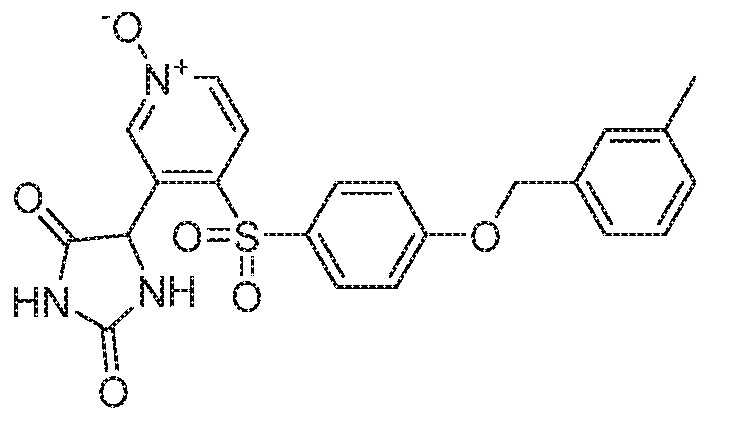
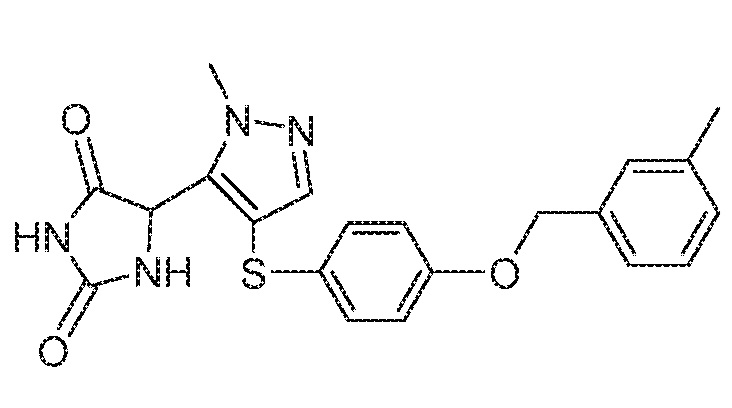
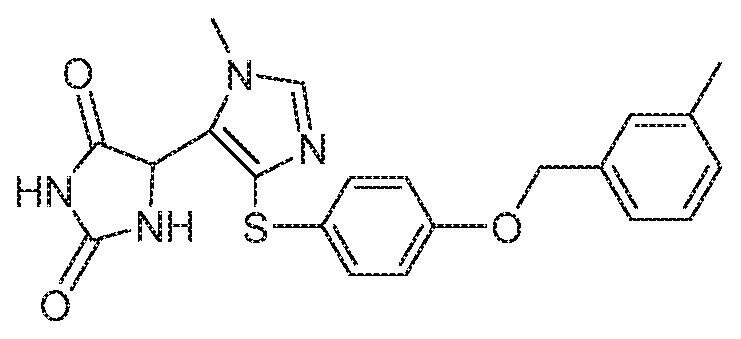
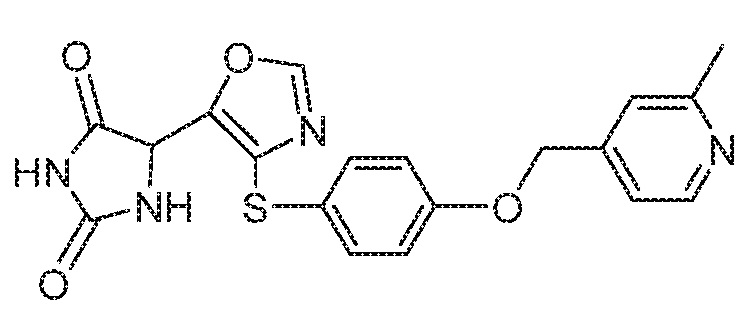
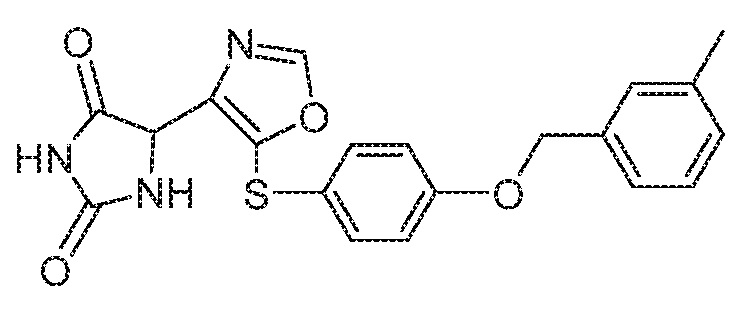
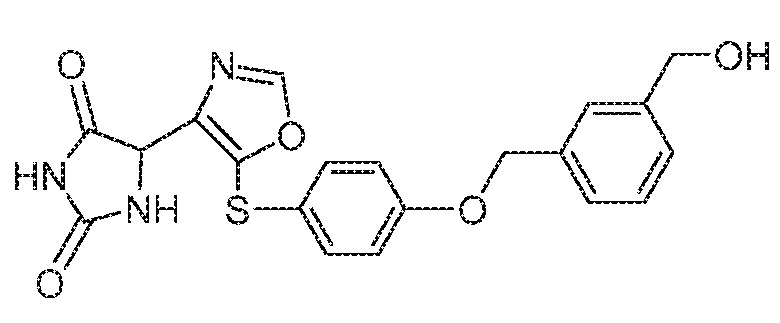
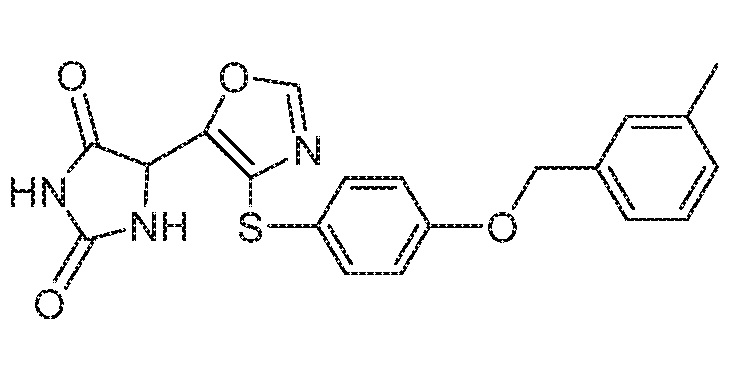
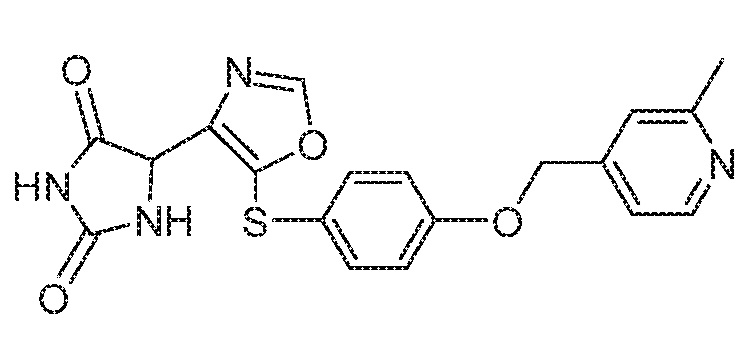
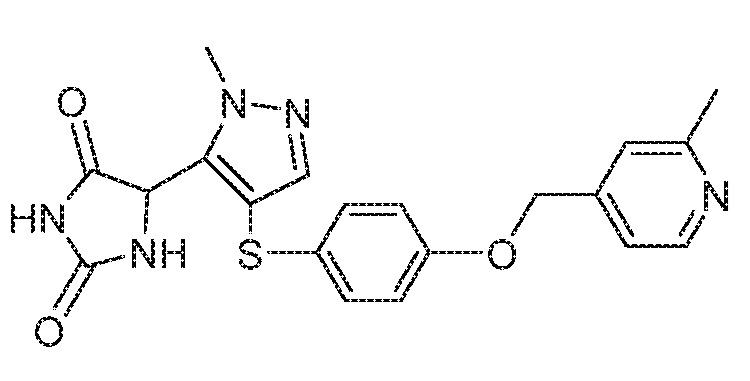
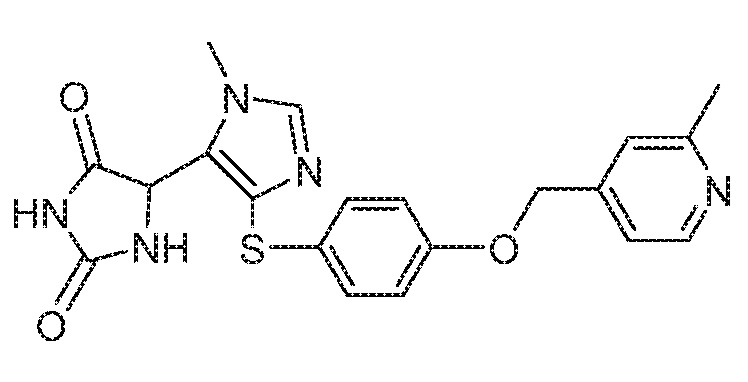
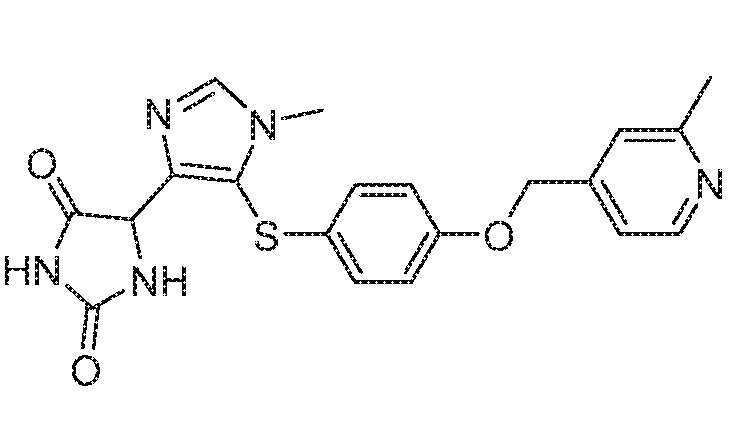
Соединения заявки могут быть получены любым количеством способов, как описано в общем ниже и более конкретно иллюстрировано иллюстративными примерами, которые следуют ниже. Например, соединения заявки могут быть получены согласно любой из общих схем с 1 по 9. В частности, соединения, в которых X представляет собой S, Y представляет собой O и Z представляет собой CH2 могут быть получены, как показано на общих схемах 1-4 и 9; соединения, в которых каждый из X и Y представляет собой O и Z представляет собой CH2 могут быть получены, как показано на общих схемах 5; соединения, в которых X представляет собой S, Y представляет собой CH2 и Z представляет собой O могут быть получены, как показано на общих схемах 6; соединения, в которых X представляет собой S, Y представляет собой NH и Z представляет собой CH2 могут быть получены, как показано на общих схемах 7; и соединения, в которых X представляет собой S и каждый из Y и Z представляет собой CH2 могут быть получены, как показано на общих схемах 8.
Общая схема 11
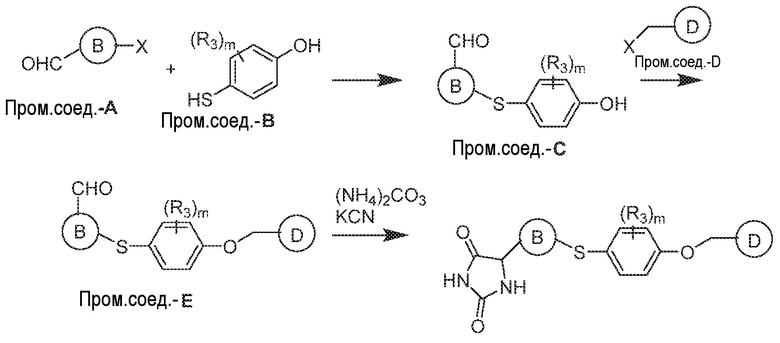
1X представляет собой галоген; кольцо D представляет собой необязательно замещенный арил или гетероарил; R3 независимо выбран из водорода алкила и галогена; m представляет собой целое число от 1 до 4; кольцо B представляет собой необязательно замещенный арил или гетероарил
Получают раствор Пром.соед.-A и Пром.соед.-B в органическом растворителе и к раствору добавляют гидроксид натрия с образованием реакционной смеси. Реакционную смесь перемешивают в течение ночи, затем смешивают с водой и органическим растворителем и экстрагируют. Органический слой сушат и выпаривают в высоком вакууме и остаток очищают колоночной хроматографией для Пром.соед.-C. Затем Пром.соед.-C смешивают с Пром.соед.-D и карбонатом калия в органическом растворителе, и реакцию контролируют с помощью тонкослойной хроматографии (ТСХ). После подтверждения образования Пром.соед.-E с помощью ТСХ, реакционную смесь экстрагируют и органический слой сушат и выпаривают в высоком вакууме. Остаток очищают колоночной хроматографией с получением Пром.соед.-E. Затем Пром.соед.-E подвергают взаимодействию с (NH4)2CO3 и цианидом калия (KCN) в водном спирте в течение ночи. Реакционную смесь выпаривают для удаления растворителя и затем экстрагируют. Органический слой сушат и выпаривают и остаток очищают с помощью колоночной хроматографии с получением соединений согласно вариантам осуществления заявки.
Общая схема 21
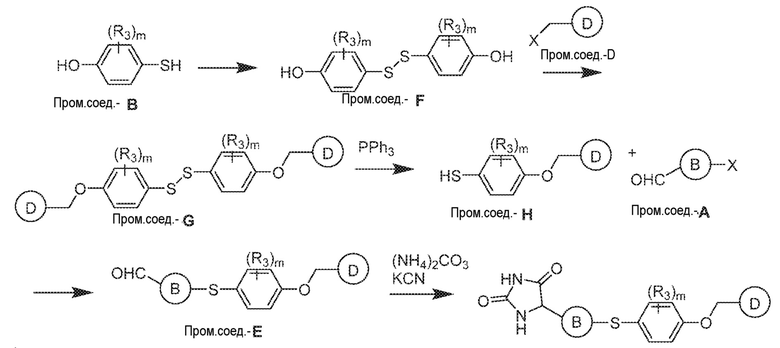
1X представляет собой галоген; кольцо D представляет собой необязательно замещенный арил или гетероарил; R3 независимо выбран из водорода алкила и галогена; m представляет собой целое число от 1 до 4; кольцо B представляет собой необязательно замещенный арил или гетероарил
Смесь Пром.соед.-B в DMSO перемешивают в течение ночи при нагревании в атмосфере азота. Затем смесь разбавляют водой и экстрагируют. Органический слой промывают насыщенным солевым раствором, сушат, фильтруют и концентрируют с получением Пром.соед.-F. Смесь Пром.соед.-F, Пром.соед.-D и карбоната калия перемешивают в течение ночи при нагревании в атмосфере азота. Смесь разбавляют водой и экстрагируют. Органический слой промывают насыщенным солевым раствором, сушат, фильтруют, концентрируют и очищают колоночной хроматографией, получая Пром.соед.-G. Трифенифосфин, тетра-н-бутиламмония бромид (TBAB) и разбавленную хлористоводродную кислоту добавляют к Пром.соед.-G в органическом растворителе с образованием смеси, которую перемешивают при комнатной температуре. Смесь концентрируют и остаток очищают колоночной хроматографией, получая Пром.соед.-H. Пром.соед.-H подвергают взаимодействию с Пром.соед.-A и карбонатом калия и смесь перемешивают в течение ночи при нагревании в атмосфере азота. Смесь концентрируют под вакуумом и очищают препаративной ТСХ с получением Пром.соед.-E. Затем Пром.соед.-E подвергают взаимодействию с (NH4)2CO3 и цианидом калия (KCN) в водном спирте в течение ночи. Реакционную смесь выпаривают для удаления растворителя и затем экстрагируют. Органический слой сушат и выпаривают и остаток очищают с помощью колоночной хроматографии с получением соединений согласно вариантам осуществления заявки.
Общая схема 31
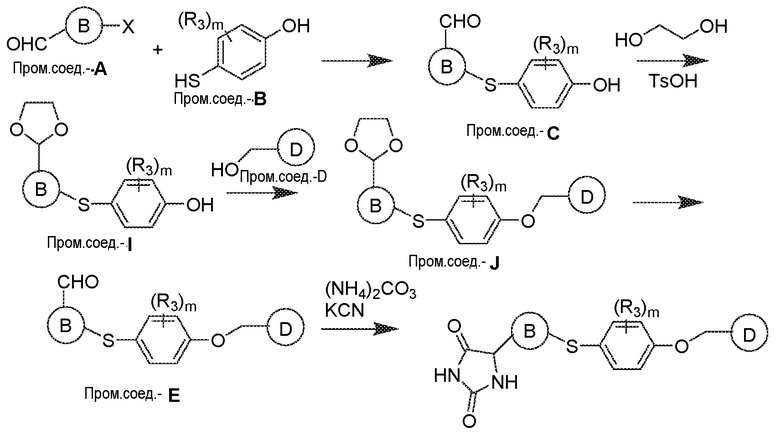
1 X представляет собой галоген; кольцо D представляет собой необязательно замещенный арил или гетероарил; R3 независимо выбран из водорода алкила и галогена; m представляет собой целое число от 1 до 4; кольцо B представляет собой необязательно замещенный арил или гетероарил.
Получают раствор Пром.соед.-A и Пром.соед.-B в органическом растворителе и к раствору добавляют гидроксид натрия с образованием реакционной смеси. Реакционную смесь перемешивают в течение ночи, затем смешивают с водой и органическим растворителем и экстрагируют. Органический слой сушат и выпаривают в высоком вакууме и остаток очищают колоночной хроматографией с получением Пром.соед.-C. Этан-1,2-диол и TsOH добавляют к смеси Пром.соед.-C в органическом растворителе и смесь нагревают с обратным холодильником в атмосфере азота. Смесь концентрируют при пониженном давлении и остаток очищают колоночной хроматографией с получением Пром.соед.-I. Пром.соед.-I подвергают взаимодействию с Пром.соед.-D, трифенилфосфином и диэтилазодикарбоксилатом (DEAD) при комнатной температуре при перемешивании. Реакцию гасят водой и экстрагируют. Органический слой сушат, концентрируют при пониженном давлении, и остаток очищают колоночной хроматографией, получая Пром.соед.-J. Смесь Пром.соед.-J в кислоте перемешивают при нагревании. Реакционную смесь охлаждают до комнатной температуры и концентрируют при пониженном давлении. К остатку добавляют насыщенный бикарбонат натрия и экстрагируют. Органический слой промывают, сушат, и концентрируют при пониженном давлении с получением Пром.соед.-E. Затем Пром.соед.-E подвергают взаимодействию с (NH4)2CO3 и цианидом калия (KCN) в водном спирте в течение ночи. Реакционную смесь выпаривают для удаления растворителя и затем экстрагируют. Органический слой сушат и выпаривают и остаток очищают с помощью колоночной хроматографии с получением соединений согласно вариантам осуществления заявки.
Общая схема 41
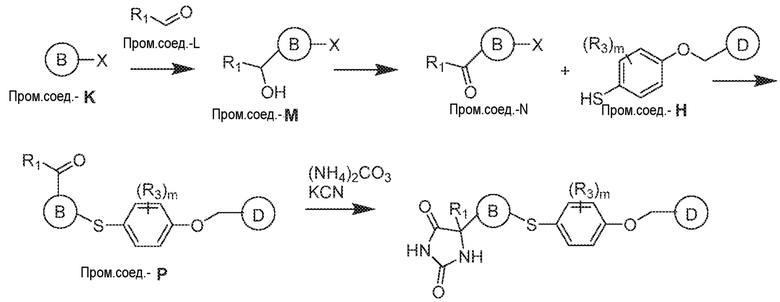
1 X представляет собой галоген; кольцо D представляет собой необязательно замещенный арил или гетероарил; R3 независимо выбран из водорода алкила и галогена; m представляет собой целое число от 1 до 4; кольцо B представляет собой необязательно замещенный арил или гетероарил; R1 представляет собой алкил.
LDA добавляют к смеси Пром.соед.-K при -78°C в атмосфере азота и смесь перемешивают в течение 1 часа. Затем, Пром.соед.-L добавляют по каплям и смесь перемешивают в течение 1 часа. Реакцию гасят насыщенным водным раствором хлорида аммония и экстрагируют. Органический слой промывают, сушат, концентрируют под вакуумом и остаток очищают колоночной хроматографией с получением Пром.соед.-M. Пром.соед.-M окисляется с получением Пром.соед.-N. Pd(dba)2 добавляют к смеси Пром.соед.-N, Пром.соед.-H (полученной, как описано выше в общей схеме 2), DPPF и DIEA. Смесь перемешивают при нагревании, затем фильтруют и экстрагируют. Органическую фазу сушат, концентрируют при пониженном давлении и остаток очищают колоночной хроматографией, с получением Пром.соед.-P. Затем Пром.соед.-P подвергают взаимодействию с (NH4)2CO3 и цианидом калия (KCN) в водном спирте в течение ночи. Реакционную смесь выпаривают для удаления растворителя и затем экстрагируют. Органический слой сушат и выпаривают и остаток очищают с помощью колоночной хроматографии с получением соединений согласно вариантам осуществления заявки.
Общая схема 51
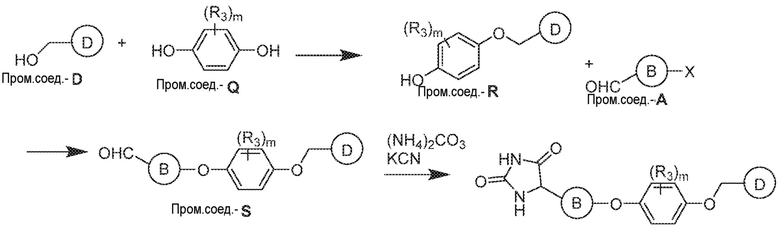
1 X представляет собой галоген; кольцо D представляет собой необязательно замещенный арил или гетероарил; R3 независимо выбран из водорода алкила и галогена; m представляет собой целое число от 1 до 4; кольцо B представляет собой необязательно замещенный арил или гетероарил.
К раствору Пром.соед.-D в органическом растворителе, Пром.соед.-Q, трифенилфосфин, и DEAD добавляют при 0°. Смесь нагревают до комнатной температуры и перемешивают. Затем смесь гасят водой и экстрагируют. Органический слой промывают, сушат, концентрируют под вакуумом и остаток очищают колоночной хроматографией с получением Пром.соед.-R. К раствору Пром.соед.-R в органическом растворителе, Пром.соед.-A и карбонат калия добавляют. Смесь перемешивают при нагревании, затем хлористоводродную кислоту добавляют для доведения pH до 6-7. Смесь экстрагируют и органический слой промывают, сушат, концентрируют при пониженном давлении, и остаток очищают колоночной хроматографией с получением Пром.соед.-S. Затем Пром.соед.-S подвергают взаимодействию с (NH4)2CO3 и цианидом калия (KCN) в водном спирте в течение ночи. Реакционную смесь выпаривают для удаления растворителя и затем экстрагируют. Органический слой сушат и выпаривают и остаток очищают с помощью колоночной хроматографии с получением соединений согласно вариантам осуществления заявки.
Общая схема 61
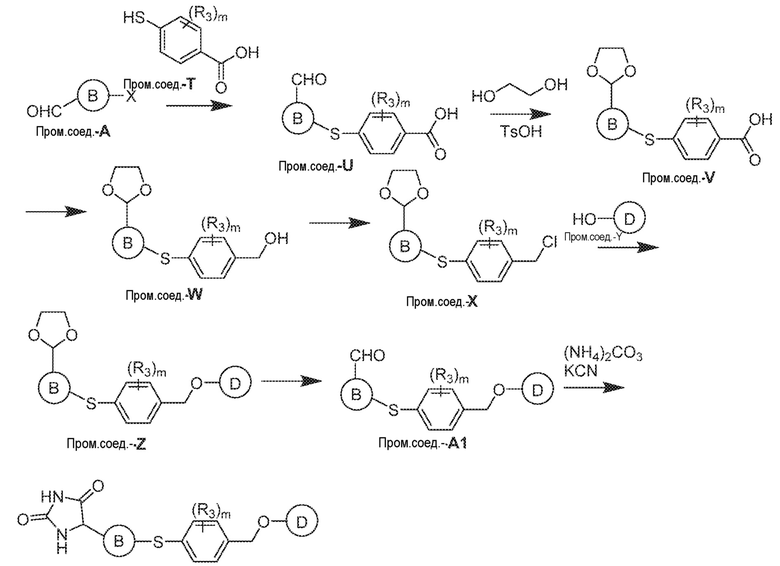
1 X представляет собой галоген; кольцо D представляет собой необязательно замещенный арил или гетероарил; R3 независимо выбран из водорода алкила и галогена; m представляет собой целое число от 1 до 4; кольцо B представляет собой необязательно замещенный арил или гетероарил.
К раствору Пром.соед.-A в органическом растворителе, Пром.соед.-T и карбонат калия добавляют при комнатной температуре в атмосфере азота. Смесь перемешивают при комнатной температуре и после того, как анализ смеси с помощью ТСХ показывает превращение в желаемый продукт, смесь разбавляют водой, экстрагируют и органический слой промывают, сушат, концентрируют при пониженном давлении, и остаток очищают колоночной хроматографией с получением Пром.соед.-U. TsOH добавляют к раствору Пром.соед.-U в органическом растворителе. После нескольких минут перемешивания, по каплям добавляют раствор этан-1,2-диола в органическом растворителе. Смесь перемешивают при нагревании и затем выливают насыщенный раствор бикарбоната натрия и экстрагируют. Органическую фазу сушат, концентрируют при пониженном давлении и очищают колоночной хроматографией с получением Пром.соед.-V. Пром.соед.-V восстанавливают с помощью LAH, и реакцию гасят, экстрагируют и органический слой сушат и концентрируют при пониженном давлении. Остаток очищают колоночной хроматографией, получая Пром.соед.-Y. S°Cl2 добавляют к смеси Пром.соед.-Y в органическом растворителе при 0°C. После перемешивания в течение нескольких часов pH доводят до 7 и смесь экстрагируют. Органический слой сушат, концентрируют при пониженном давлении и остаток очищают колоночной хроматографией с получением Пром.соед.-X. Пром.соед.-X подвергают взаимодействию с Пром.соед.-Y и карбонатом калия при комнатной температуре в атмосфере азота. Смесь разбавляют водой и экстрагируют, и органический слой промывают, сушат, концентрируют при пониженном давлении, и остаток очищают колоночной хроматографией с получением Пром.соед.-Z. Смесь Пром.соед.-Z в кислоте перемешивают при нагревании. Реакционную смесь охлаждают до комнатной температуры и концентрируют при пониженном давлении. К остатку добавляют насыщенный бикарбонат натрия и экстрагируют. Органический слой промывают, сушат, и концентрируют при пониженном давлении с получением Пром.соед.-A1. Затем Пром.соед.-A1 подвергают взаимодействию с (NH4)2CO3 и цианидом калия (KCN) в водном спирте в течение ночи. Реакционную смесь выпаривают для удаления растворителя и затем экстрагируют. Органический слой сушат и выпаривают и остаток очищают с помощью колоночной хроматографии с получением соединений согласно вариантам осуществления заявки.
Общая схема 71
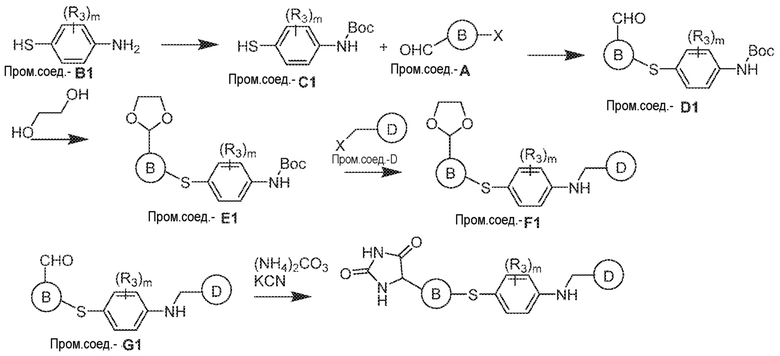
1X представляет собой галоген; кольцо D представляет собой необязательно замещенный арил или гетероарил; R3 независимо выбран из водорода алкила и галогена; m представляет собой целое число от 1 до 4; кольцо B представляет собой необязательно замещенный арил или гетероарил.
Триэтиламин и DMAP добавляют к раствору Пром.соед.-B1 и BOC2O в органическом растворителе и смесь перемешивают при комнатной температуре. Смесь гасят, экстрагируют и органическую фазу промывают, сушат, концентрируют при пониженном давлении и остаток очищают колоночной хроматографией с получением Пром.соед.-C1. Пром.соед.-C1 подвергают взаимодействию с Пром.соед.-A и карбонатом калия при комнатной температуре. Смесь разбавляют водой, экстрагируют, и органическую фазу промывают, сушат, концентрируют при пониженном давлении и остаток очищают колоночной хроматографией с получением Пром.соед.-D1. TsOH добавляют к перемешиваемому раствору Пром.соед.-D1 в органическом растворителе. После нескольких минут перемешивания, по каплям добавляют раствор этан-1,2-диола в органическом растворителе. Смесь перемешивают при нагревании и затем выливают насыщенный раствор бикарбоната натрия и экстрагируют. Органическую фазу сушат, концентрируют при пониженном давлении и очищают колоночной хроматографией с получением Пром.соед.-E1. Гидрид натрия добавляют к раствору Пром.соед.-E1 и Пром.соед.-D. Смесь разбавляют водой и экстрагируют, и органический слой промывают, сушат, концентрируют при пониженном давлении, и остаток очищают колоночной хроматографией с получением Пром.соед.-F1. Смесь Пром.соед.-F1 в кислоте перемешивают при нагревании. Реакционную смесь охлаждают до комнатной температуры и концентрируют при пониженном давлении. К остатку добавляют насыщенный бикарбонат натрия и экстрагируют. Органический слой промывают, сушат, и концентрируют при пониженном давлении с получением Пром.соед.-G1. Затем Пром.соед.-G1 подвергают взаимодействию с (NH4)2CO3 и цианидом калия (KCN) в водном спирте в течение ночи. Реакционную смесь выпаривают для удаления растворителя и затем экстрагируют. Органический слой сушат и выпаривают и остаток очищают с помощью колоночной хроматографии с получением соединений согласно вариантам осуществления заявки.
Общая схема 81
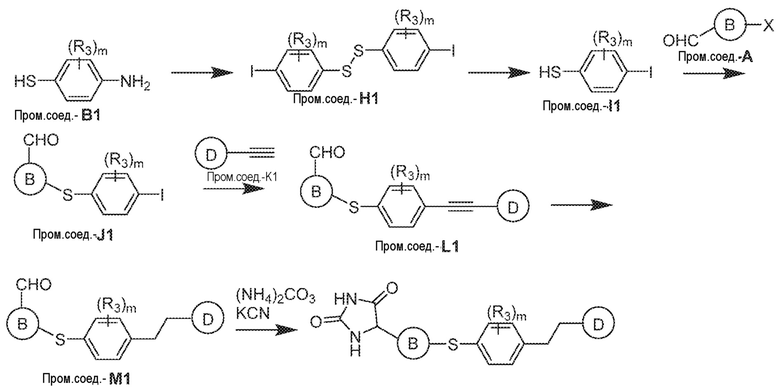
1X представляет собой галоген; кольцо D представляет собой необязательно замещенный арил или гетероарил; R3 независимо выбран из водорода алкила и галогена; m представляет собой целое число от 1 до 4; кольцо B представляет собой необязательно замещенный арил или гетероарил.
Хлористоводродную кислоту (HCl), серную кислоту (H2SO4) и NaNO2 последовательно добавляют к раствору Пром.соед.-B1 при 0°C и смесь перемешивают. Затем добавляют мочевину. После перемешивания в течение нескольких минут по каплям добавляют раствор KI в воде и смесь перемешивают при 0°C. Смесь экстрагируют, органический слой сушат и выпаривают, и остаток очищают колоночной хроматографией с получением Пром.соед.-H1. Смесь Пром.соед.-H1 в спирте перемешивают при комнатной температуре в течение нескольких часов, затем смесь концентрируют при пониженном давлении, экстрагируют и очищают колоночной хроматографией с получением Пром.соед.-I1. Пром.соед.-A и карбонат калия добавляют к раствору Пром.соед.-I1 и смесь перемешивают при комнатной температуре. Затем добавляют воду и смесь экстрагируют. Органический слой сушат и выпаривают, и остаток очищают колоночной хроматографией с получением Пром.соед.-J1. К раствору Пром.соед.-J1 и Пром.соед.-K1 в триэтиламине добавляют комплекс палладия, подходящий для реакций сочетания, катализируемых палладием и CuI в атмосфере азота. Смесь перемешивают при комнатной температуре и затем гасят насыщенным раствором хлорида аммония. Смесь экстрагируют, и органический слой промывают, сушат, и концентрируют при пониженном давлении с получением Пром.соед.-L1. Pd/C добавляют к раствору Пром.соед.-L1 в спирте и смесь перемешивают в атмосфере водорода при комнатной температуре. Смесь фильтруют, и фильтрат концентрируют с получением Пром.соед.-M1. Затем Пром.соед.-M1 подвергают взаимодействию с (NH4)2CO3 и цианидом калия (KCN) в водном спирте в течение ночи. Реакционную смесь выпаривают для удаления растворителя и затем экстрагируют. Органический слой сушат и выпаривают и остаток очищают с помощью колоночной хроматографии с получением соединений согласно вариантам осуществления заявки.
Общая схема 91
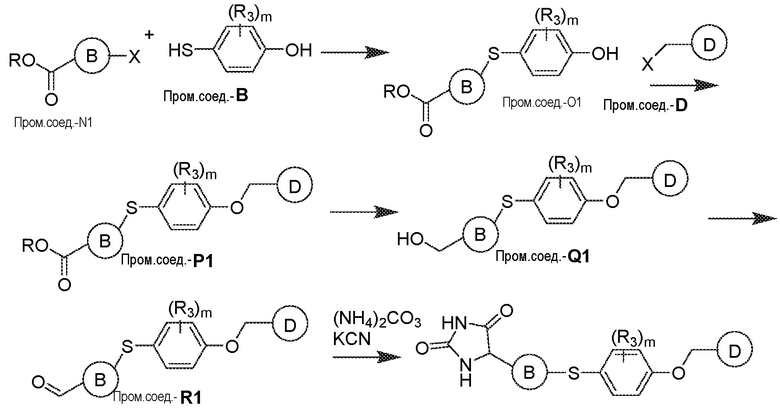
1X представляет собой галоген; кольцо D представляет собой необязательно замещенный арил или гетероарил; R3 независимо выбран из водорода алкила и галогена; m представляет собой целое число от 1 до 4; кольцо B представляет собой необязательно замещенный арил или гетероарил; R представляет собой алкил.
К раствору Пром.соед.-N1, гидроксид натрия и Пром.соед.-B добавляют и смесь перемешивают в течение ночи. Реакционную смесь экстрагируют, органический слой сушат, и остаток очищают флэш-хроматографией с получением Пром.соед.-O1. К раствору Пром.соед.-O1, карбоната калия и Пром.соед.-D добавляют и смесь перемешивают при комнатной температуре. Смесь экстрагируют, органический слой промывают, сушат, концентрируют при пониженном давлении, и остаток очищают колоночной хроматографией с получением Пром.соед.-P1. К раствору Пром.соед.-P1 в безводном растворителе добавляют DIBAL-H при 0°C. Смесь гасят, экстрагируют, органический слой промывают, сушат, концентрируют при пониженном давлении, и остаток очищают колоночной хроматографией с получением Пром.соед.-Q1. Пром.соед.-Q1 окисляется с получением Пром.соед.-R1. Затем Пром.соед.-R1 подвергают взаимодействию с (NH4)2CO3 и цианидом калия (KCN) в водном спирте в течение ночи. Реакционную смесь выпаривают для удаления растворителя и затем экстрагируют. Органический слой сушат и выпаривают и остаток очищают с помощью колоночной хроматографии с получением соединений согласно вариантам осуществления заявки.
Атомы азота гидантоинового фрагмента соединений по заявке могут быть алкилированы путем взаимодействия соединений, полученных согласно любой из приведенных выше общих схем, с гидридом натрия и алкилйодидом (например, CH3I). Соединения, в которых один из X, Y и Z представляет собой S(O) или SO2, могут быть получены взаимодействием соединений, полученных в соответствии с любой из приведенных выше общих схем, с m-CPBA.
Фармацевтически приемлемые соли соединений по заявке могут быть синтезированы из исходного соединения, содержащего кислотный или основной фрагмент, обычными химическими методами. Как правило, такие соли могут быть получены путем взаимодействия свободных кислотных или основных форм этих соединений со стехиометрическим количеством соответствующей кислоты или основания в воде или в органическом растворителе или в смеси этих двух. Примеры подходящих органических растворителей включают, но не ограничиваются ими, простой эфир, этилацетат, этанол, изопропанол или ацетонитрил.
Композиции
Другой аспект заявки относится к фармацевтической композиции, включающей соединение по заявке, как описано в настоящем документе, или его таутомер, стереоизомер, фармацевтически приемлемая соль или сольват.
Композиции по заявке также могут включать фармацевтически приемлемый носитель. Фармацевтически приемлемый носитель является нетоксичным и не должен влиять на эффективность активного ингредиента. Фармацевтически приемлемые носители могут включать один или несколько эксципиентов, таких как связующие, разрыхлители, вещества, способствующие набуханию, суспендирующие средства, эмульгирующие агенты, смачивающие агенты, скользящие вещества, ароматизаторы, подсластители, консерванты, красители, солюбилизаторы и покрытия. Определенная природа носителя или другого вещества может зависеть от пути введения, например, внутримышечный, внутрикожный, подкожный, пероральный, внутривенный, кожный, внутрислизистый (например, через кишечник), интраназальный или внутрибрюшинный пути. Для жидких препаратов для инъекций, например суспензий и растворов, подходящие носители и добавки включают воду, гликоли, масла, спирты, консерванты, красители и тому подобное. Для твердых пероральных препаратов, например, порошков, капсул, каплет, желатиновых капсул и таблеток, подходящие носители и добавки включают крахмалы, сахара, разбавители, гранулирующие агенты, скользящие вещества, связующие, разрыхлители и тому подобное. Для смесей назальных спреев/ингаляторов водный раствор/суспензия может включать воду, гликоли, масла, смягчающие вещества, стабилизаторы, смачивающие агенты, консерванты, ароматические вещества, вкусоароматические добавки и т.п. в качестве подходящих носителей и добавок.
Композиции для применения могут быть составлены из любого материала, подходящего для введения субъекту, для облегчения введения и повышения эффективности, включая, помимо прочего, пероральное (энтеральное) введение и парентеральные инъекции. Парентеральные инъекции включают внутривенную инъекцию или инфузию, подкожную инъекцию, внутрикожную инъекцию и внутримышечную инъекцию. Композиции по заявке также могут быть составлены для других путей введения, включая чрескожный, окулярный, ректальный, длительного действия имплантацию, сублингвальное введение, под язык, из слизистой оболочки полости рта в обход портального кровообращения, ингаляции или интраназально.
В конкретных вариантах осуществления, композиции составлены для перорального применения.
Еще один аспект заявки относится к способу получения фармацевтической композиции, включающему объединение соединения по заявке или его таутомера, стереоизомера, фармацевтически приемлемой соли или сольвата, по меньшей мере, с одним фармацевтически приемлемым носителем. Фармацевтические композиции могут быть получены любым способом, известным в данной области техники с учетом настоящего изобретения, и специалисты в данной области будут знакомы с такими способами, используемыми для получения фармацевтических композиций. Например, фармацевтическая композиция согласно заявке может быть получена путем смешивания соединения заявки с одним или несколькими фармацевтически приемлемыми носителями согласно общепринятым методам фармацевтического компаундирования, включая, но не ограничиваясь ими, процессы обычного смешивания, растворения, гранулирования, эмульгирования, инкапсулирования, включения или лиофилизации.
Способы применения
В заявке также представлены способы ингибирования матриксной металлопротеиназы (MMP) и лечения заболеваний, опосредованных MMP, с использованием соединений по заявке и фармацевтических композиций по заявке.
Матриксные металлопротеиназы (ММП), также известные как матриксины, представляют собой группу ферментов, которые совместно ответственны за деградацию большинства белков внеклеточного матрикса во время органогенеза, роста и нормального тканевого оборота. MMP представляют собой кальций-зависимые цинксодержащие эндопептидазы и принадлежат к большему семейству протеаз, известному как суперсемейство метцинцина. MMP способны разрушать белки внеклеточного матрикса, но также могут обрабатывать ряд биоактивных молекул и, как известно, участвуют, например, в расщеплении рецепторов клеточной поверхности, высвобождении апоптотических лигандов и инактивации хемокинов/цитокинов. Также считается, что MMP играют важную роль в поведении клеток, таком как пролиферация, миграция (адгезия/дисперсия), дифференциация, ангиогенез, апоптоз и иммунная защита организма. MMP ингибируются специфическим эндогенным тканевым ингибитором металлопротеиназ (TIMP), которые составляют семейство из четырех ингибиторов протеаз: TIMP-1, TIMP-2, TIMP-3 и TIMP-4. Примеры MMP включают, но не ограничиваются ими, MMP-1(Интерстициальная коллагеназа), MMP-2 (желатиназа-A), MMP-3 (стромелизин 1), MMP-7 (матрилизин), MMP-8 (нейтрофильная коллагеназа), MMP-9 (желатиназа-B), MMP-10 (стромелизин 2), MMP-11 (стромелизин 3), MMP-12 (эластаза макрофагов), MMP-13 (коллагеназа 3), MMP-14 (MT1-MMP), и т.п.
В предпочтительном варианте осуществления, соединения по заявке способны ингибировать эластазу макрофагов (MMP-12) и/или лечить заболевания, опосредованные MMP-12. MMP-12, также известная как макрофагальная металлоэластаза (MME) или макрофагальная эластаза (ME), у человека кодируется геном MMP12. В других вариантах осуществления соединения по заявке способны селективно ингибировать MMP-12. Термины «селективный», «селективность» и «селективно», когда они используются в отношении связывания или ингибирования активности конкретной MMP, означают, что соединение связывает или ингибирует активность конкретной MMP в большей степени, чем указанное соединение связывает или ингибирует активность других MMP. Например, соединение, обладающее селективностью в отношении MMP-12, ингибирует активность MMP-12 в большей степени, чем других MMP, например, MMP-1, MMP-2, MMP-3, MMP-7, MMP-8, MMP-9, MMP-10, MMP-13, MMP-14, и т.п.
Согласно вариантам осуществления заявки, соединение, которое является селективным в отношении MMP-12, ингибирует активность MMP-12, по меньшей мере, примерно в 10, 100 или 1000 раз больше, чем один или несколько других MMP, и предпочтительно ингибирует активность MMP-12 по меньшей мере примерно в 1000 раз больше, чем по меньшей мере один другой MMP, такой как MMP-1 или MMP-7.
Заявка также предоставляет способы лечения заболевания, опосредованного MMP-12. Согласно вариантам осуществления изобретения способ лечения заболевания, опосредованного ММР-12, включает введение субъекту терапевтически эффективного количества соединения по заявке, или любого его таутомера, стереоизомера, фармацевтически приемлемой соли или сольвата, или фармацевтической композиции по заявке.
Как используется в настоящем документе, термины «лечить», «лечение» и «терапия» предназначены для обозначения облегчения или устранения по меньшей мере одного измеримого физического параметра, связанного с заболеванием, опосредованным MMP-12, которое не обязательно различимо у субъекта, но может быть различимо у субъекта. Термины «лечить», «лечение» и «терапия» также могут относиться к регрессии, предотвращению прогрессирования или, по крайней мере, замедлению прогрессирования заболевания, опосредованного MMP-12. В конкретном варианте осуществления, «лечить», «лечение» и «терапия» относятся к облегчению, предотвращению развития или начала или уменьшению продолжительности одного или нескольких симптомов, связанных с заболеванием, опосредованным MMP-12. В конкретном варианте осуществления, «лечить», «лечение» и «терапия» относятся к предотвращению рецидива заболевания, опосредованного MMP-12. В конкретном варианте осуществления, «лечить», «лечение» и «терапия» относятся к увеличению выживаемости субъекта, страдающего заболеванием, опосредованным ММР-12. В конкретном варианте осуществления, «лечить», «лечение» и «терапия» относятся к устранению заболевания, опосредованного ММР-12, у субъекта.
Как используется в настоящем документе, термин «терапевтически эффективное количество» означает количество композиции или соединения, которое вызывает биологическую или лекарственную реакцию в тканевой системе или у субъекта, к которой стремиться исследователь, ветеринар, врач или другие состояния, которые могут включать облегчение симптомов заболевания или расстройства, подлежащего лечению. Терапевтически эффективное количество может варьироваться в зависимости от множества факторов, таких как физическое состояние субъекта, возраст, масса, состояние здоровья и т.п.; и конкретного заболевания, подлежащего лечению. Терапевтически эффективное количество может легко определить специалист в данной области с учетом настоящего изобретения.
В конкретных вариантах осуществления заявки, терапевтически эффективное количество относится к количеству композиции или соединения по заявке, которое является достаточным для ингибирования MMP-12 или лечения заболевания, опосредованного MMP-12. Заболевания, опосредованные ММР-12, которые можно лечить в соответствии со способами, указанными в заявке, включают, но не ограничиваются ими, астму, хроническую обструктивную болезнь легких (COPD), эмфизему, острое повреждение легких, идиопатический легочный фиброз (IPF), саркоидоз, системный склероз, фиброз печени, неалкогольный стеатогепатит (NASH), артрит, рак, болезнь сердца, воспалительным заболеванием кишечника (IBD), острое повреждение почек (AKI), хроническое заболевание почек (CKD), синдром Альпорта и нефрит.
Варианты осуществления
Вариант осуществления 1 представляет собой соединение формулы (I-b):
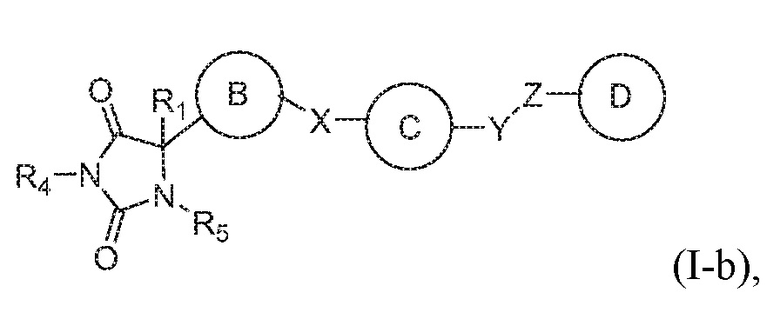
или его таутомер, стереоизомер, фармацевтически приемлемые соли или сольват,
где:
кольцо B представляет собой необязательно замещенный арил или необязательно замещенный гетероарил;
кольцо C представляет собой необязательно замещенный арил или необязательно замещенный гетероарил;
кольцо D представляет собой необязательно замещенный арил или необязательно замещенный гетероарил;
каждый из X, Y и Z независимо выбраны из группы, состоящей из CH2, O, NRx и S(O)q, где Rx представляет собой водород или алкил;
R1 представляет собой водород или алкил;
R4 представляет собой водород или алкил;
R5 представляет собой водород; и
q имеет значение 0, 1 или 2,
при условии, что кольцо B не является фуранилом.
Вариант осуществления 2 представляет собой соединение формулы (I):
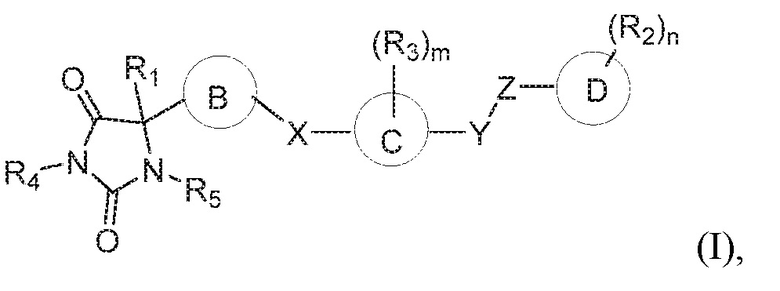
или его таутомер, стереоизомер, фармацевтически приемлемую соль или сольват,
где:
кольцо B представляет собой необязательно замещенный арил или необязательно замещенный гетероарил;
кольцо C представляет собой арил или гетероарил;
кольцо D представляет собой арил или гетероарил;
каждый из X, Y и Z независимо выбран из группы, состоящей из O, CH2, NRx, и S(O)q, где Rx представляет собой водород или алкил;
R1 представляет собой водород или алкил;
каждый R2 независимо выбран из группы, состоящей из водорода, алкила, галогена, гидроксила, галогеналкила, алкокси, алкилтио, амина, амида, алкиламина, аминоалкила, циано, гидроксиалкила, -(CH2)pC(O)OR6, и -(CH2)p°C(O)R6 ;
каждый R3 независимо выбран из группы, состоящей из водорода, алкила и галогена;
R4 представляет собой водород или алкил;
R5 представляет собой водород;
каждый R6 независимо выбран из группы, состоящей из водорода и алкила, где алкил является незамещенным или замещен одной или несколькими группами, независимо выбранными из группы, состоящей из амина, гидроксила, галогена и алкокси;
m имеет значение 1, 2, 3 или 4;
n имеет значение 1, 2, 3, 4 или 5;
p имеет значение 0, 1, 2, 3, 4 или 5; и
q имеет значение 0, 1 или 2
при условии, что кольцо B не является фуранилом.
Вариант осуществления 3 представляет собой соединение по варианту осуществления 1 или варианту осуществления 2, где кольцо B представляет собой пяти- или шестичленный моноциклический гетероарил, имеющий 1-2 гетероатома, независимо выбранных из N, S и O.
Вариант осуществления 4 представляет собой соединение по любому из вариантов осуществления 1-3, где кольцо B представляет собой пиридинил, тиофенил, имидазолил, пиразолил или оксазолил.
Вариант осуществления 5 представляет собой соединение по варианту осуществления 4, где кольцо B представляет собой пиридинил.
Вариант осуществления 6 представляет собой соединение по варианту осуществления 5, где соединение представляет собой соединение формулы (II):
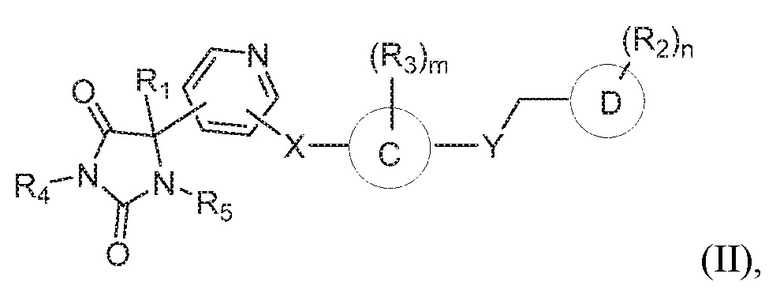
или его таутомер, стереоизомер, фармацевтически приемлемую соль или сольват,
где каждая из переменных имеет значение, как определено в соединении формулы (I).
Вариант осуществления 7 представляет собой соединение по варианту осуществления 5, где соединение представляет собой соединение формулы (II-a), (II-b), (II-c), или (II-d):
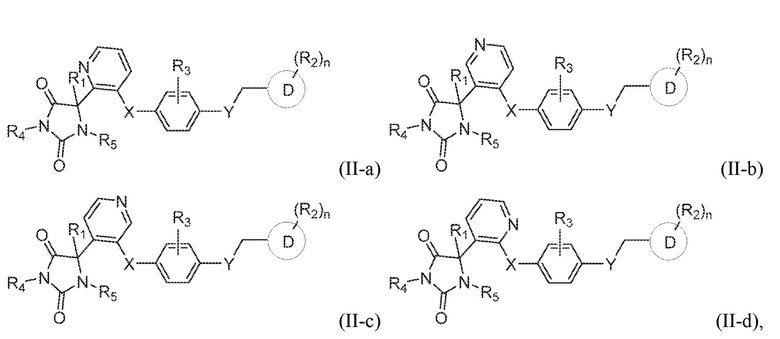
или его таутомер, стереоизомер, фармацевтически приемлемую соль или сольват,
где каждая из переменных имеет значение, как определено в соединении формулы (I).
Вариант осуществления 8 представляет собой соединение по варианту осуществления 4, где кольцо B представляет собой тиофенил.
Вариант осуществления 9 представляет собой соединение по варианту осуществления 8, где соединение представляет собой соединение формулы (IV):
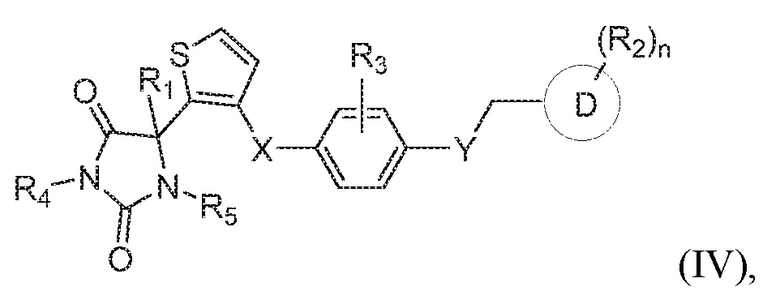
или его таутомер, стереоизомер, фармацевтически приемлемую соль или сольват,
где каждая из переменных имеет значение, как определено в соединении формулы (I).
Вариант осуществления 10 представляет собой соединение по варианту осуществления 4, где кольцо B представляет собой имидазолил.
Вариант осуществления 11 представляет собой соединение по варианту осуществления 10, где соединение представляет собой соединение формулы (Va) или (Vb):
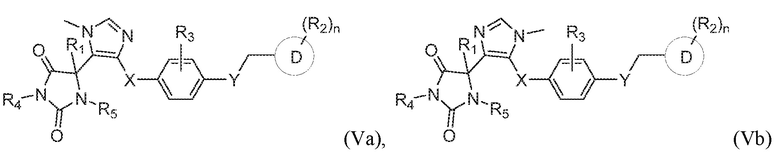
или его таутомер, стереоизомер, фармацевтически приемлемую соль или сольват,
где каждая из переменных имеет значение, как определено в соединении формулы (I).
Вариант осуществления 12 представляет собой соединение по варианту осуществления 4, где кольцо B представляет собой пиразолил.
Вариант осуществления 13 представляет собой соединение по варианту осуществления 12, где соединение представляет собой соединение формулы (VI):
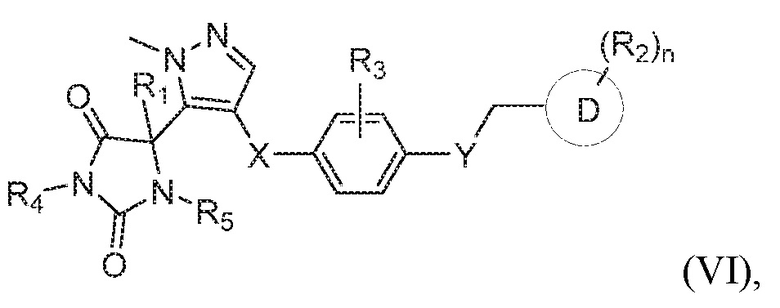
или его таутомер, стереоизомер, фармацевтически приемлемую соль или сольват,
где каждая из переменных имеет значение, как определено в соединении формулы (I).
Вариант осуществления 14 представляет собой соединение по варианту осуществления 4, где кольцо B представляет собой оксазолил.
Вариант осуществления 15 представляет собой соединение по варианту осуществления 14, где соединение представляет собой соединение формулы (VII):
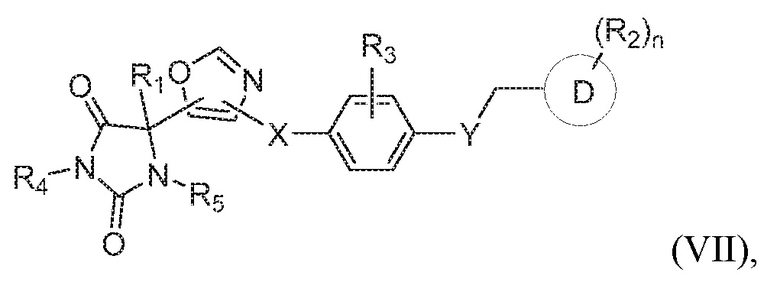
или его таутомер, стереоизомер, фармацевтически приемлемую соль или сольват,
где каждая из переменных имеет значение, как определено в соединении формулы (I).
Вариант осуществления 16 представляет собой соединение по варианту осуществления 15, где соединение представляет собой соединение формулы (VII-a) или (VII-b):
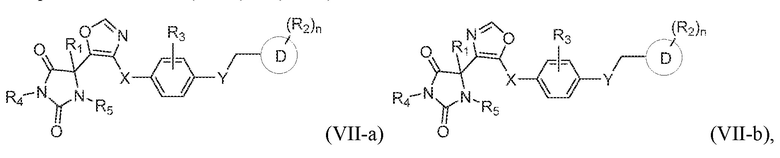
или его таутомер, стереоизомер, фармацевтически приемлемую соль или сольват,
где каждая из переменных имеет значение, как определено в соединении формулы (I).
Вариант осуществления 17 представляет собой соединение по любому из вариантов осуществления 1-6, где кольцо C представляет собой фенил.
Вариант осуществления 18 представляет собой соединение по любому из вариантов осуществления 1-6, где кольцо C представляет собой пиридинил.
Вариант осуществления 19 представляет собой соединение по любому из вариантов осуществления 2-18, где R3 выбран из группы, состоящей из водорода, метила, фтора и хлора.
Вариант осуществления 20 представляет собой соединение по любому из вариантов осуществления 1-19, где кольцо D представляет собой пиридинил или фенил.
Вариант осуществления 21 представляет собой соединение по любому из вариантов осуществления 2-20, где R2 выбран из группы, состоящей из метила, -CH2OH, гидроксила, -OC(O)CH(NH2)CH(CH3)2, -COOH, - CH2OC(O)CH(NH2)CH(CH3)2, -C(O)NH2, -C(O)NH(CH3), и C1-4алкокси.
Вариант осуществления 22 представляет собой соединение по любому из вариантов осуществления 1-21, где кольцо D представляет собой:
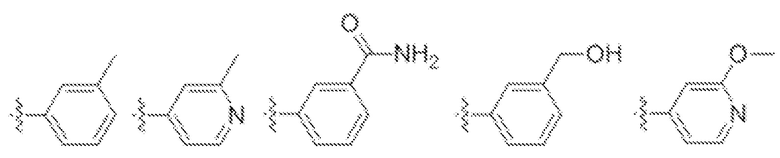 или
или  .
.
Вариант осуществления 23 представляет собой соединение по любому из вариантов осуществления 1-22, где R4 представляет собой водород.
Вариант осуществления 24 представляет собой соединение по любому из вариантов осуществления 1-22, где R4 представляет собой алкил.
Вариант осуществления 25 представляет собой соединение по варианту осуществления 24, где R4 представляет собой метил.
Вариант осуществления 26 представляет собой соединение по любому из вариантов осуществления 1-25, где R5 представляет собой метил.
Вариант осуществления 27 представляет собой соединение по любому из вариантов осуществления 1-25, где R5 представляет собой водород.
Вариант осуществления 28 представляет собой соединение по любому из вариантов осуществления 1-27, где R1 представляет собой C1-4 алкил.
Вариант осуществления 29 представляет собой соединение по варианту осуществления 28, где R1 представляет собой метил или этил.
Вариант осуществления 30 представляет собой соединение по любому из вариантов осуществления 1-27, где R1 представляет собой водород.
Вариант осуществления 31 представляет собой соединение по любому из вариантов осуществления 1-30, где X представляет собой S, Y представляет собой O, и Z представляет собой CH2.
Вариант осуществления 32 представляет собой соединение формулы (I-a):
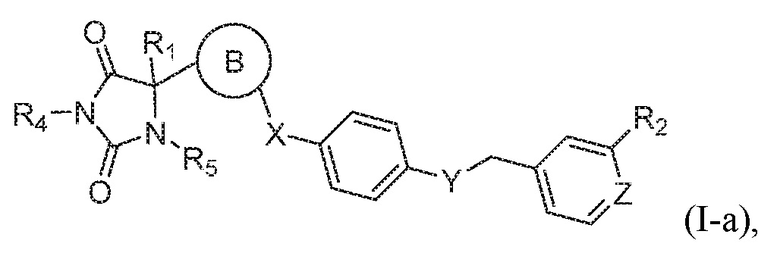
или его таутомер, стереоизомер, фармацевтически приемлемую соль или сольват,
где:
кольцо B представляет собой 5- или -6-членный гетероарил;
Z представляет собой CH или N;
каждый из R1 и R4 представляет собой алкил или водород;
R5 представляет собой водород;
R2 выбран из группы, состоящей из алкила, амида, гидроксила, алкокси и гидроксилалкила; и
X и Y каждый независимо выбран из S и O.
Вариант осуществления 33 представляет собой соединение по варианту осуществления 32, где кольцо B представляет собой пиридинил, тиофенил, имидазолил, пиразолил или оксазолил.
Вариант осуществления 34 представляет собой соединение по варианту осуществления 32 или варианту осуществления 33, где R1 представляет собой водород.
Вариант осуществления 35 представляет собой соединение по варианту осуществления 32 или варианту осуществления 33, где R1 представляет собой C1-4 алкил.
Вариант осуществления 36 представляет собой соединение по варианту осуществления 35, где R1 представляет собой метил или этил.
Вариант осуществления 37 представляет собой соединение по любому из вариантов осуществления 32-36, где R4 представляет собой водород.
Вариант осуществления 38 представляет собой фармацевтическую композицию, включающую соединение по любому из вариантов осуществления 1-37, и по меньшей мере один фармацевтически приемлемый носитель.
Вариант осуществления 39 представляет собой способ ингибирования эластазы макрофагов (ММР-12) у субъекта, нуждающегося в этом, причем способ включает введение субъекту фармацевтической композиции в соответствии с вариантом осуществления 38.
Вариант осуществления 40 представляет собой способ лечения заболевания, опосредованного эластазой макрофагов (ММР-12), у субъекта, нуждающегося в этом, причем способ включает введение субъекту фармацевтической композиции согласно варианту осуществления 38.
Вариант осуществления 41 представляет собой способ по варианту осуществления 40, где заболевание выбрано из группы, состоящей из астмы, хронической обструктивной болезни легких (COPD), эмфиземы, острого повреждения легких, идиопатического легочного фиброза (IPF), саркоидоза, системного склероза, фиброза печени, неалкогольного стеатогепатита (NASH), артрита, рака, болезни сердца, воспалительного заболевания кишечника (IBD), острого повреждения почек (AKI), хронического заболевания почек (CKD), синдрома Альпорта и нефрита.
Вариант осуществления 42 представляет собой соединение по любому из вариантов осуществления 1-37, или фармацевтическую композицию по варианту осуществления 38 для применения в ингибировании эластазы макрофагов (MMP-12).
Вариант осуществления 43 представляет собой соединение по любому из вариантов осуществления 1-37, или фармацевтическую композицию по варианту осуществления 38 для применения при лечении заболевания, опосредованного эластазой макрофагов (MMP-12).
Вариант осуществления 44 представляет собой соединение или композицию для применения в соответствии с вариантом осуществления 43, где заболевание выбрано из группы, состоящей из астмы, хронической обструктивной болезни легких (COPD), эмфиземы, острого повреждения легких, идиопатического легочного фиброза (IPF), саркоидоза, системного склероза, фиброза печени, неалкогольного стеатогепатита (NASH), артрита, рака, болезни сердца, воспалительного заболевания кишечника (IBD), острого повреждения почек (AKI), хронического заболевания почек (CKD), синдрома Альпорта и нефрита.
Вариант осуществления 45 представляет собой применение соединения по любому из вариантов осуществления 1-37, или фармацевтической композиции по варианту осуществления 38 при производстве лекарственного средства для ингибирования эластазы макрофагов (MMP-12).
Вариант осуществления 46 представляет собой применение соединения по любому из вариантов осуществления 1-37, или фармацевтической композиции по варианту осуществления 38 при производстве лекарственного средства для лечения заболевания, опосредованного эластазой макрофагов (MMP-12).
Вариант осуществления 47 представляет собой вариант осуществления 46, где заболевание выбрано из группы, состоящей из астмы, хронической обструктивной болезни легких (COPD), эмфиземы, острого повреждения легких, идиопатического легочного фиброза (IPF), саркоидоза, системного склероза, фиброза печени, неалкогольного стеатогепатита (NASH), артрита, рака, болезни сердца, воспалительного заболевания кишечника (IBD), острого повреждения почек (AKI), хронического заболевания почек (CKD), синдрома Альпорта и нефрита.
Вариант осуществления 48 представляет собой способ получения фармацевтической композиции по варианту осуществления 38, включающий объединение соединения или его фармацевтически приемлемой соли по меньшей мере с одним фармацевтически приемлемым носителем.
Примеры
Следующие ниже примеры заявки служат для дополнительной иллюстрации характера заявки. Следует понимать, что приведенные ниже примеры не ограничивают заявку и объем заявки должен определяться прилагаемой формулой изобретения.
Способы синтеза
Если не указано иное, сокращения для химических реагентов и условий синтеза имеют свое обычное значение, известное в данной области техники, а именно:
“LDA” означает диизопропиламид лития;
“EA” означает этилацетат;
“PE” означает петролейный эфир;
“комн.темп.” означает комнатную температуру;
“THF” означает тетрагидрофуран;
“DEAD” означает диэтилазодикарбоксилат;
“TBAB” означает тетрабутиламмоний бромид;
“DCM” означает дихлорметан;
“HOBT” означает гидроксибензотриазол;
“LAH” означает литийалюминийгидрид;
"ТСХ" означает тонкослойную хроматографию;
“преп.-ТСХ” означает препаративную тонкослойную хроматографию;
“TMS-I” означает триметилсилил иодид;
“Гексан” означает гексаны;
“DMF” означает диметилформамид;
“ч” означает часы;
“EDCI” означает 1-этил-3-(3-диметиламинопропил)карбодиимид;
“DMAP” означает 4-диметиламинопиридин;
“Преп-ВЭЖХ” означает препаративную высокоэффективную жидкостную хроматографию;
“DHP” означает дигидропиран;
“DPPF” означает 1,1'-бис(дифенилфосфино)ферроцен; и
“DIEA” означает диизопропилэтиламин.
Получение ключевого промежуточного соединения TI-1 для синтеза соединений TC-1, TC-2, TC-3, TC-4, TC-5, TC-6, TC-7 и TC-8.
К раствору 3-бромтиофен-2-карбальдегида (10 г, 52,5 ммоль) и 4-меркаптофенола (6,3 г, 50 ммоль) в THF (255 мл) добавляли NaOH (0,06 г, 1,5 ммоль). Реакционную смесь перемешивали в течение ночи при комнатной температуре. К остатку добавляли воду и EA, и дважды экстрагировали EA. Объединенный органический слой сушили MgSO4, и выпаривали в высоком вакууме с получением желтого твердого вещества. Остаток очищали флэш-хроматографией с DCM/MeOH (DCM/MeOH=1:50) с получением TI-1a в виде светло-желтого твердого вещества (9,2 г, 75%).
Синтез соединений TC-1, TC-2, TC-3, TC-4, TC-5 и TC-6:
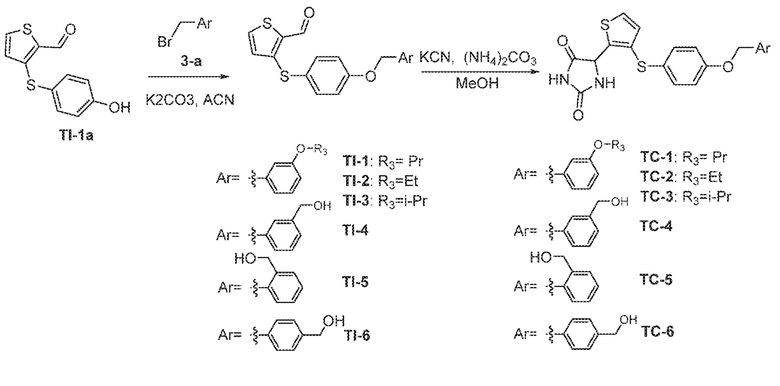
Раствор 3-a (0,2 г, 1,65 ммоль), TI-1a (0,40 г, 1,7 ммоль), и K2CO3 (0,7 г) в ACN перемешивали при комнатной температуре в течение ночи. За реакцией наблюдали с помощью ТСХ (EA/гексан=2/7), для определения, когда пятно бензилбромида исчезло. В реакционную смесь добавляли EA и воду, и дважды экстрагировали EA. Объединенный органический слой сушили MgSO4. Остаток очищали флэш-хроматографией с EA/гексаном (EA/гексан=1:3) с получением промежуточного соединения TI-1 в виде светло-желтого твердого вещества (0,41 г, 55%). Промежуточные соединения TI-2, TI-3, TI-4, TI-5 и TI-6 синтезировали в соответствии с той же процедурой, за исключением того, что исходное вещество 3-12 заменяли на 3-14, 3-15, 3-16 или 3-17, соответственно.
К раствору TI-1 (0,42 г, 1,18 ммоль) в EtOH/H2O (10 мл/5мл) добавляли (NH4)2CO3 (1,71 г, 17,8 ммоль) и KCN (0,15 г, 0,98 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Раствор выпаривали для удаления большей части растворителя. В смесь добавляли воду и затем дважды экстрагировали EA. Органические слои объединяли, сушили MgSO4 и выпаривали. Остаток очищали флэш-хроматографией с EA/гексаном (EA/гексан=1:1) с получением TC-1 в виде светло-желтого твердого вещества (0,28 г, 38%). Соединения TI-2, TI-3, TI-4, TI-5 и TI-6 синтезировали с использованием аналогичной процедуры, за исключением того, что промежуточное соединение TI-1 заменяли на промежуточные соединения TI-2, TI-3, TI-4, TI-5 или TI-6, соответственно.
Получение соединения TC-7:
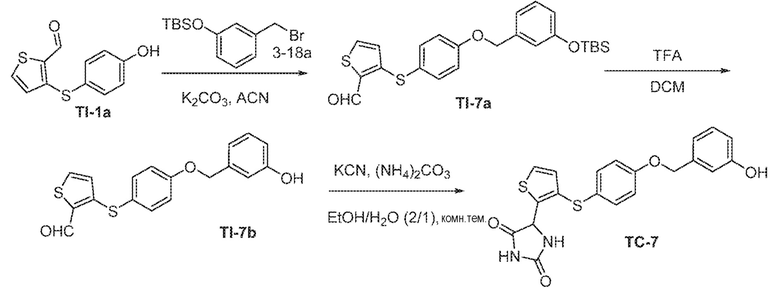
Раствор 3-18a (0,23 г, 0,76 ммоль), TI-1a (0,15 г, 0,64 ммоль), и K2CO3 (0,35 г, 2,56 ммоль) в ACN (4 мл) перемешивали при комнатной температуре в течение ночи. В реакционную смесь добавляли воду и EA, и дважды экстрагировали EA. Объединенный органический слой сушили MgSO4, и выпаривали в высоком вакууме. Остаток очищали флэш-хроматографией с EA/гексаном (EA/гексан=1:10-1:4) с получением TI-7a в виде желтого твердого вещества (0,17 г, 50%)
К раствору TI-7a (1,03 г) в DCM (25 мл) добавляли TFA (1 мл) по каплям при комнатной температуре. Реакционную смесь перемешивали в течение ночи, затем растворитель и TFA удаляли с получением коричневого масла. К коричневому маслу добавляли NaHCO3 и MeOH. Затем растворитель снова удаляли. Остаток очищали флэш-хроматографией с EA/гексаном (EA/гексан=1:4) с получением TI-7b в виде белого твердого вещества (0,14 г).
К раствору TI-1b (0,14 г, 0,41 ммоль) в EtOH/H2O (5 мл/2,5 мл) добавляли (NH4)2CO3 (0,24 г, 2,46 ммоль) и KCN (32 мг, 0,41 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Раствор выпаривали для удаления большей части растворителя. В смесь добавляли воду и EA, и затем дважды экстрагировали EA. Органические слои объединяли, сушили MgSO4 и выпаривали в высоком вакууме. Остаток очищали флэш-хроматографией с DCM/MeOH (DCM/MeOH=20:1) с получением TC-7 в виде маслянистого соединения (51 мг).
Получение соединения TC-8:
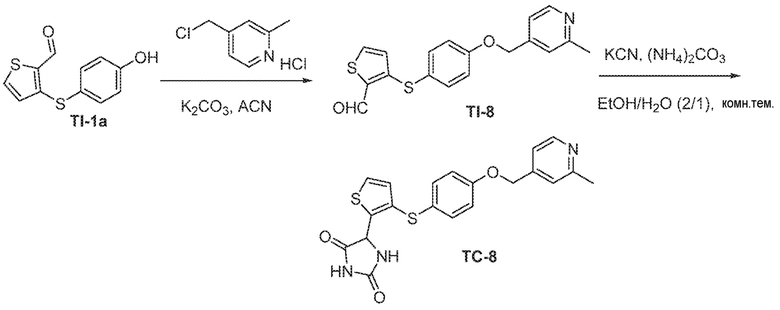
Раствор TI-1a (0,9 г, 3,81 ммоль, 1 экв.), 4-хлорметил-2-метилпиридин (мг, 1,19 ммоль, 1 экв.), и K2CO3 (1,58g, 3 экв.) в 70 мл ACN перемешивали и нагревали до 50°C. Смесь контролировали методом ТСХ. Растворитель удаляли на ротационном испарителе. К остатку добавляли EA и воду, и водный слой гасили EA два раза. Неочищенный продукт очищали силикагелем (DCM/EA=1/4) с получением TI-8 в виде бледно-желтого твердого вещества (1,02 г, 76%).
К раствору TI-8 (200 мг, 0,4 ммоль, 1 экв.), KCN (0,057 мг, 1,5 экв.) и карбонат аммония (0,844 г, 15 экв.) в 10 мл EtOH/деионизированная вода (2/1) добавляли к смеси. Смесь контролировали методом ТСХ. Растворитель удаляли на ротационном испарителе. К остатку добавляли EA и воду, и водный слой гасили EA два раза. Неочищенный продукт очищали на силикагеле (DCM/MeOH=30/2) с получением TC-8 в виде желтого твердого вещества (45 мг, 18%).
Общая схема: Получение промежуточного соединения 4a-1
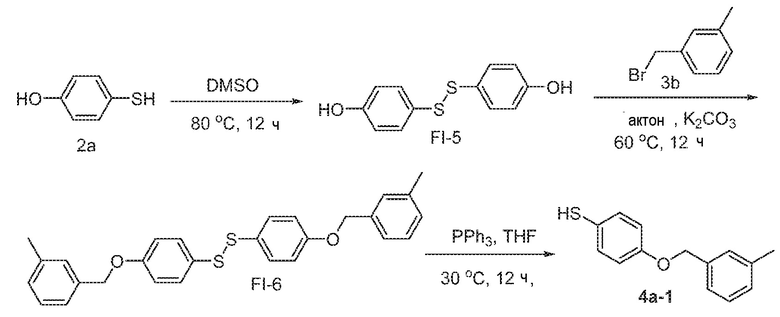
Синтез промежуточного соединения FI-5:
Смесь соединения 2a (68 г, 538,9 ммоль, 1,0 экв.) в DMSO (500 мл) перемешивали 80°C в течение ночи в атмосфере азота. Затем смесь разбавляли H2O (1000 мл) и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над Na2SO4, фильтровали и концентрировали с получением соединения FI-5 (67 г, 99%).
Синтез промежуточного соединения FI-6:
Смесь соединения FI-5 (5 г, 19,97 ммоль, 1,0 экв.), соединения 3b (7,39 г, 39,95 ммоль, 2 экв.) и K2CO3 (11,04 г, 79,89 ммоль, 4,0 экв.) в ацетоне (100 мл) перемешивали при 60°C в течение 4 ч в атмосфере азота. Затем смесь разбавляли H2O (1000 мл) и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над Na2SO4, фильтровали и концентрировали. Остаток очищали колоночной хроматографией на силикагеле (PE/EA, 10:1) с получением соединения FI-6 (8,7 г, 97%).
Синтез соединения 4a-1:
К смеси соединения FI-6 (10,7 г, 23,33 ммоль, 1,0 экв.) в THF (100 мл) добавляли PPh3 (6,11 г, 23,33 ммоль, 1 экв.), TBAB (15,04 г, 46,66 ммоль, 2 экв.) и 5% HCl (5 мл). Смесь перемешивали при комнатной температуре в течение 12 ч в атмосфере азота. Затем смесь концентрировали. Остаток очищали колоночной хроматографией на силикагеле (PE/EA, 2:1) с получением соединения 4a-1 (6,6 г, 56%).
Получение соединения PC-1:
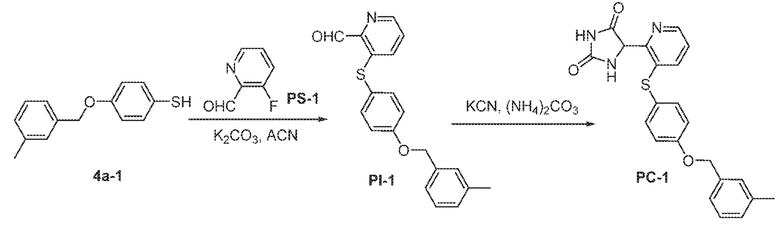
К смеси соединения 4a-1 (0,5 г, 2,17 ммоль, 1,0 экв.) в ACN (15 мл) добавляли соединение 2-хлорникотинальдегид (0,307 г, 2,17 ммоль, 1,0 экв.) и K2CO3 (0,906 г, 6,52 ммоль, 3,0 экв.). Смесь перемешивали при 85°C в течение ночи в атмосфере азота. Затем смесь концентрировали под вакуумом. Остаток очищали препаративной ТСХ с получением соединения PI-1 (500 мг, 69%).
К смеси соединения PI-1 (450 мг, 1,34 ммоль, 1,0 экв.) в MeOH (30 мл) добавляли KCN (174 мг, 2,68 ммоль, 2,0 экв.) и (NH4)2CO3 (516 мг, 5,3 ммоль, 4,0 экв.). Смесь перемешивали при 40°C в течение ночи в атмосфере азота. Затем смесь концентрировали в вакууме. Остаток очищали препаративной ТСХ с получением соединения PC-1 (44 мг, 10%).
Получение соединений PC-2, PC-3 и PC-4:
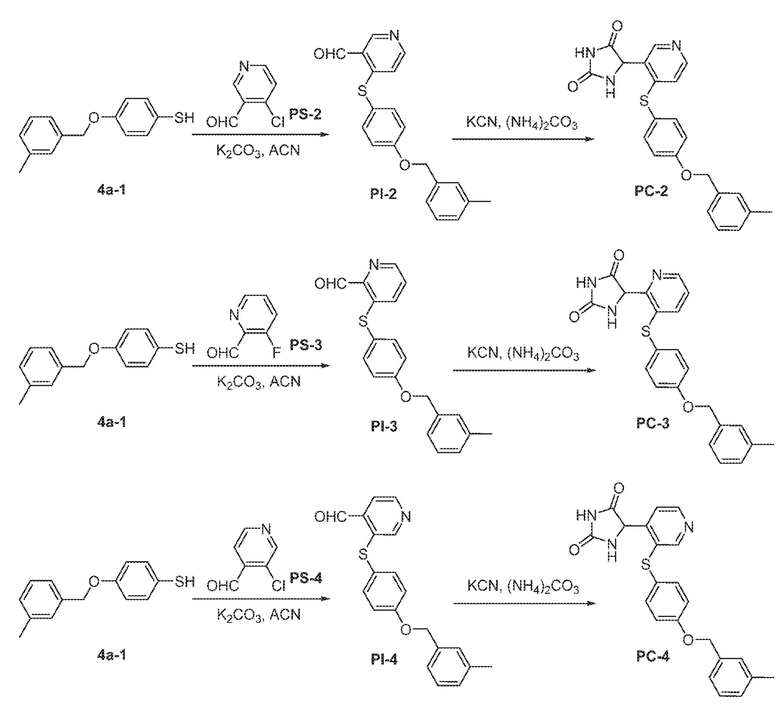
Соединения PC-2, PC-3, и PC-4 синтезировали с использованием аналогичной процедуры, что и синтез PC-1, за исключением того, что исходное вещество 2-хлорникотинальдегид PS-1 заменяли 4-хлорникотинальдегидом PS-2, 3-фторпиколинальдегидом PS-3, или 3-хлоризоникотинальдегидом PS-4, соответственно.
Получение ключевого промежуточного соединения PI-a.1
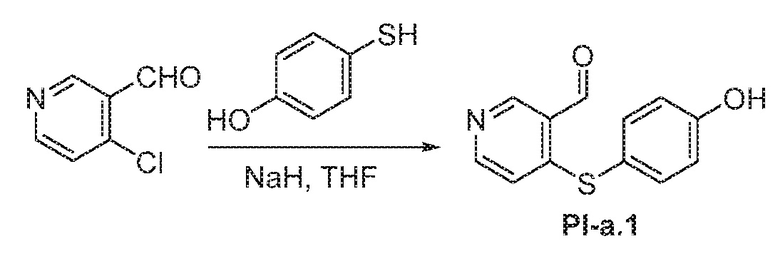
К смеси 4-хлорникотинальдегида (2,2 г, 15,54 ммоль, 1,0 экв.) и 4-меркаптофенола (2,94 г, 23,31 ммоль, 1,5 экв.) в THF (20 мл) добавляли NaH (1,24 г, 31,08 ммоль, 2,0 экв.) при 0°C и смесь перемешивали при комнатной температуре в течение ночи в атмосфере азота. Затем смесь концентрировали до половины количества растворителя и затем добавляли 2,0 н. HCl для доведения pH=6, и фильтровали с получением соединения PI-a.1 (950 мг, 26%), которое использовали на следующей стадии без дополнительной очистки.
Получение соединений PC-7, PC-8 и PC-9:
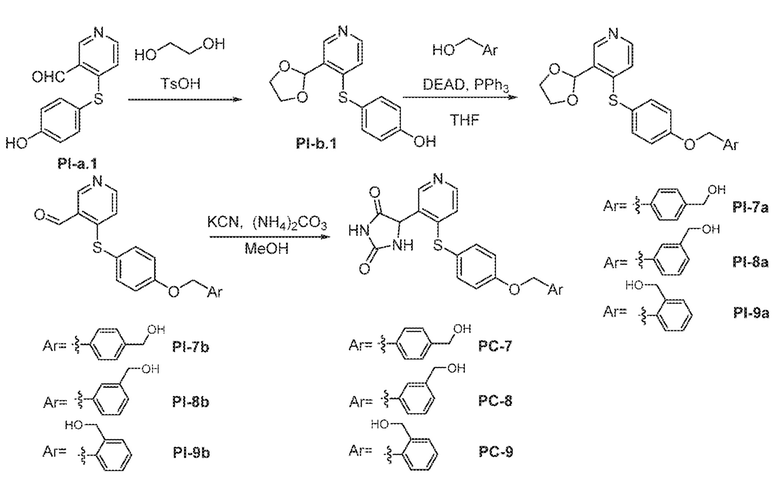
К смеси соединения PI-a.1 (3,0 г, 12,99 ммоль, 1,0 экв.) в толуоле (100 мл) последовательно добавляли этан-1,2-диол (1,6 г, 260 ммоль, 20 экв.) и TsOH (0,112 г, 0,65 ммоль, 0,05 экв.). Смесь нагревали с обратным холодильником в течение 12 ч в атмосфере азота. Затем смесь концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (PE/EA, 2:1) с получением соединения PI-b.1 (2,9 г, 82%).
К раствору соединения PI-b.1 (200 мг, 0,727 ммоль, 1,0 экв.) в THF (10 мл) последовательно добавляли 1,4-фенилендиметанол (50 мг, 3,64 ммоль, 5,0 экв.), PPh3 (381 мг, 1,454 ммоль, 2,0 экв.) и DEAD (253 мг, 1,454 ммоль, 2,0 экв.) при 0°C. Смеси давали нагреться до комнатной температуры и перемешивали в течение 16 ч. Затем смесь гасили H2O (10 мл) и экстрагировали этилацетатом (2×10 мл). Объединенные органические слои сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле с получением соединения PI-7a (200 мг, 70%).
Смесь соединения PI-7a (140 мг, 0,354 ммоль, 1,0 экв.) в HCl/THF (2,0 M, 3 мл /3 мл) перемешивали при 70°C в течение 3 ч. Реакционную смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении. К остатку добавляли насыщенный раствор NaHCO3 для доведения pH=8 и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении с получением соединения PI-7b (130 мг, 100%), которое использовали на следующей стадии без дополнительной очистки.
К смеси соединения PI-7b (150 мг, 0,427 ммоль, 1,0 экв.) в MeOH (5 мл) добавляли KCN (55 мг, 0,854 ммоль, 2,0 экв.) и (NH4)2CO3 (164 мг, 1,71 ммоль, 4,0 экв.). Смесь перемешивали при комнатной температуре в течение 12 ч. Затем смесь разбавляли водой и экстрагировали этилацетатом. Органическую фазу сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали препаративной ТСХ с получением соединения PC-7 (38 мг, 21%) в виде белого твердого вещества.
Соединения PC-8 и PC-9 синтезировали по той же процедуре, за исключением того, что 1,4-фенилендиметанол заменяли 1,3-фенилендиметанолом или 1,2-фенилендиметанолом, соответственно.
Получение соединения PC-10:
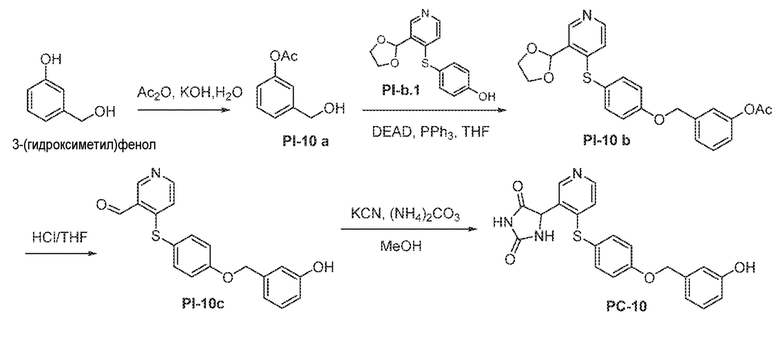
Смесь 3-(гидроксиметил)фенола (180 мл, 1,9 моль, 4,0 экв.) в Ac2O (360 мл, 9,54 моль, 21,2 экв.) перемешивали при 60°C в течение 1 ч в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, затем добавляли KOH (42,3 г, 0,45 моль, 1,0 экв.). Затем, смесь перемешивали при комнатной температуре в течение 16 ч. После экстрагирования смеси EA (3×150 мл) и водой, объединенные органические слои промывали H2O (3×100 мл) и насыщенным раствором NaHCO3 (2×100 мл), сушили над Na2SO4 и концентрировали при пониженном давлении с получением соединения PI-10a (60 г, 26%).
К раствору соединения PI-b.1 (300 мг, 1,09 ммоль, 1,0 экв.) в THF (10 мл) последовательно добавляли соединение PI-10a (905 мг, 5,45 ммоль, 5,0 экв.), PPh3 (572 мг, 2,18 ммоль, 2,0 экв.) и DEAD (380 мг, 2,18 ммоль, 2,0 экв.) при 0°C. Смеси давали нагреться до комнатной температуры и перемешивали в течение 16 ч. Затем смесь гасили H2O (10 мл) и экстрагировали этилацетатом (2×10 мл). Объединенные органические слои сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле с получением соединения PI-10b (200 мг, 44%).
Смесь соединения PI-10b (200 мг, 0,473 ммоль, 1,0 экв.) в HCl/THF (2,0 M, 3 мл /3 мл) перемешивали при 70°C в течение 3 ч. Реакционную смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении. К остатку добавляли насыщенный раствор NaHCO3 для доведения pH=8 и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении с получением соединения PI-10c (150 мг, 91%), которое использовали на следующей стадии без дополнительной очистки.
К смеси соединения PI-10c (150 мг, 0,427 ммоль, 1,0 экв.) в MeOH (5 мл) добавляли KCN (55 мг, 0,854 ммоль, 2,0 экв.) и (NH4)2CO3 (164 мг, 1,71 ммоль, 4,0 экв.). Смесь перемешивали при комнатной температуре в течение 12 ч. Затем смесь разбавляли водой и экстрагировали этилацетатом. Органическую фазу сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали препаративной ТСХ с получением соединения PC-10 (55 мг, 30%) в виде белого твердого вещества.
Получение соединения PC-11:
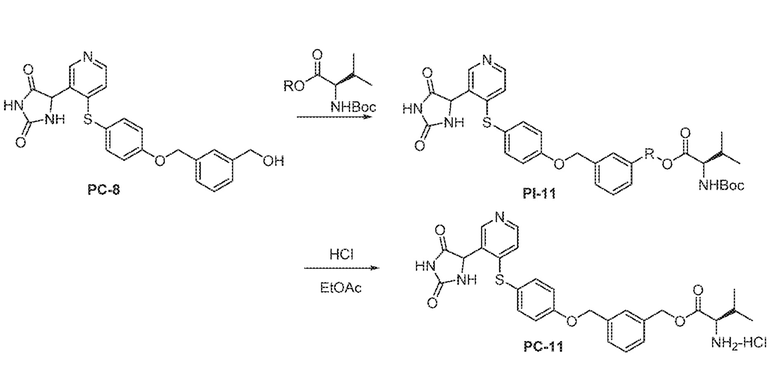
К раствору соединения PC-8 (1,0 г, 2,37 ммоль, 1,0 экв.) в DCM (50 мл) последовательно добавляли (трет-бутоксикарбонил)-D-валин (1,02 г, 2,61 моль, 1,1 экв.), EDCI (0,53 г, 2,84 моль, 1,2 экв.) и DMAP (0,056 г, 0,47 моль, 0,2 экв.). Смесь перемешивали при 25°C в течение 24 ч. Затем смесь концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (DCM/MeOH, 10:1) с получением соединения PI-11 (496 мг, 35%) в виде желтого твердого вещества.
К раствору соединения PI-11 (0,5 г, 0,8 ммоль, 1,0 экв.) в EA (20 мл) добавляли HCl (4,5 M в EA, 20 мл). Смесь перемешивали при комнатной температуре в течение 12 ч. Затем смесь концентрировали при пониженном давлении с получением PC-11 (430 мг, 96%) в виде белого твердого вещества.
Получение ключевого промежуточного соединения PI-a.2.
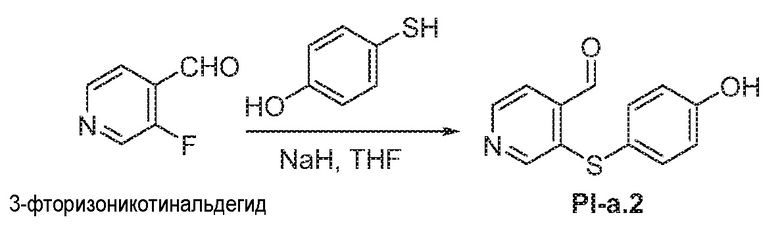
К смеси 3-фторизоникотинальдегида (2,9 г, 23,2 ммоль, 1,0 экв.) в DMF (150 мл) последовательно добавляли 4-меркаптофенол (5,85 г, 46,4 ммоль, 2,0 экв.) и K2CO3 (12,8 г, 92,8 ммоль, 4,0 экв.). Смесь перемешивали при комнатной температуре в течение 16 ч в атмосфере азота. Затем дбавляли 3 M HCl для доведения pH=6-7. Смесь экстрагировали EA и органический слой промывали насыщенным солевым раствором, сушили над Na2SO4, концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле с получением соединения PI-a.2 (1,6 г, 30%).
Получение соединений PC-12, PC-13 и PC-14:
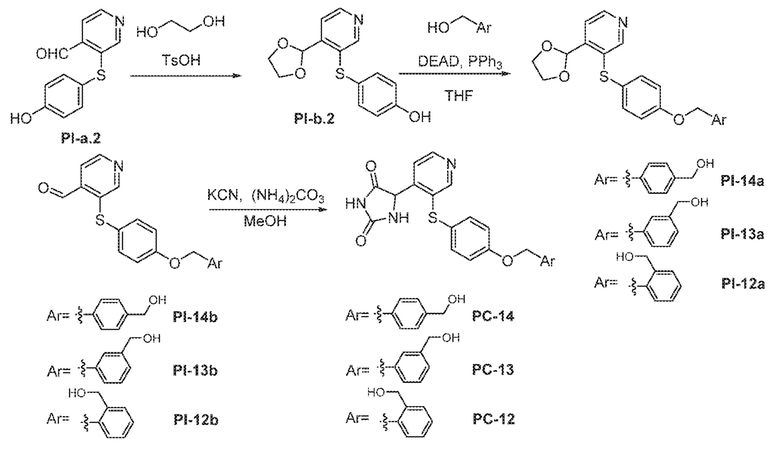
К смеси соединения PI-a.2 (2,3 г, 9,96 ммоль, 1,0 экв.) в толуоле (100 мл) последовательно добавляли этан-1,2-диол (1,2 г, 19,9 ммоль, 20 экв.) и TsOH (86 мг, 0,498 ммоль, 0,05 экв.). Смесь нагревали с обратным холодильником в течение 12 ч в атмосфере азота. Затем смесь концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле с получением соединения PI-b.2 (2,2 г, 81%).
К раствору соединения PI-b.2 (1,5 г, 5,45 ммоль, 1,0 экв.) в THF (50 мл) последовательно добавляли 1,4-фенилендиметанол (2,63 г, 19 ммоль, 3,5 экв.), PPh3 (2,86 г, 10,9 ммоль, 2,0 экв.) и DEAD (1,9 г, 10,9 ммоль, 2,0 экв.) при 0°C. Смеси давали нагреться до комнатной температуры и перемешивали в течение 16 ч. Затем смесь гасили H2O (50 мл) и экстрагировали этилацетатом (2×50 мл). Объединенные органические слои сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле с получением соединения PI-14a (1,5 г, 70%).
Смесь соединения PI-14a (500 мг, 1,266 ммоль, 1,0 экв.) в HCl/THF (3,0 M, 35 мл /35 мл) перемешивали при 70°C в течение 12 ч. Реакционную смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении. К остатку добавляли насыщенный раствор NaHCO3 для доведения pH=8 и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением соединения PI-14b (280 мг, 63%).
К смеси соединения PI-14b (150 мг, 0,427 ммоль, 1,0 экв.) в EtOH (5 мл) и H2O (2,5 мл) добавляли KCN (42 мг, 0,641 ммоль, 1,5 экв.) и (NH4)2CO3 (410 мг, 4,27 ммоль, 10,0 экв.). Смесь перемешивали при 50°C в течение 5 ч. Затем смесь разбавляли водой и экстрагировали этилацетатом. Органическую фазу сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали препаративной ТСХ с получением соединения PC-14 (70 мг, 25%) в виде белого твердого вещества.
Соединения PC-12 и PC-13 синтезировали по той же процедуре, за исключением того, что 1,2-фенилендиметанол заменяли 1,3-фенилендиметанолом или 1,4-фенилендиметанолом, соответственно.
Получение соединения PC-15:
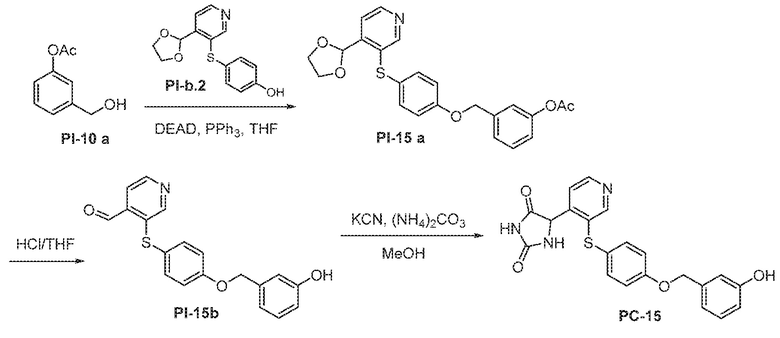
К раствору соединения PI-b.2 (500 мг, 1,82 ммоль, 1,0 экв.) в THF (20 мл) последовательно добавляли соединение PI-10a (1,1 г, 6,37 ммоль, 3,5 экв.), PPh3 (954 мг, 3,64 ммоль, 2,0 экв.) и DEAD (634 мг, 3,64 ммоль, 2,0 экв.) при 0°C. Смеси давали нагреться до комнатной температуры и перемешивали в течение 16 ч. Затем смесь гасили H2O (10 мл) и экстрагировали этилацетатом (2×10 мл). Объединенные органические слои сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле с получением соединения PI-15a (460 мг, 60%).
Смесь соединения PI-15a (1 г, 2,364 ммоль, 1,0 экв.) в HCl/THF (3,0 M, 25 мл/25 мл) перемешивали при 70°C в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении. К остатку добавляли насыщенный раствор NaHCO3 для доведения pH=8 и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением соединения PI-15b (200 мг, 25%).
К смеси соединения PI-15b (200 мг, 0,593 ммоль, 1,0 экв.) в EtOH (6 мл) и H2O (6 мл) добавляли KCN (58 мг, 0,89 ммоль, 1,5 экв.) и (NH4)2CO3 (570 мг, 5,93 ммоль, 10,0 экв.). Смесь перемешивали при 50°C в течение 4 ч. Затем смесь разбавляли водой и экстрагировали этилацетатом. Органическую фазу сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали с помощью преп.-ВЭЖХ с получением соединения PC-15 (58 мг, 24%) в виде белого твердого вещества.
Получение соединений PC-16 и PC-17:
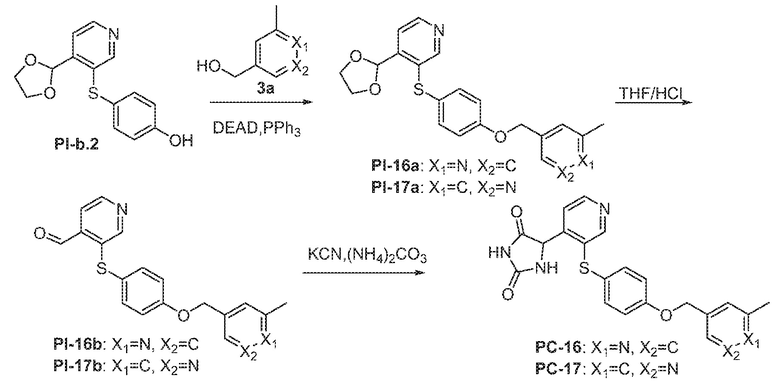
К раствору соединения PI-b.2 (1,2 г, 4,363 ммоль, 1,0 экв.) в THF (20 мл) последовательно добавляли (2-метилпиридин-4-ил)метанол (2,68 г, 21,8 ммоль, 5,0 экв.), PPh3 (2,29 г, 8,73 ммоль, 2,0 экв.) и DEAD (1,5 г, 8,73 ммоль, 2,0 экв.) при 0°C. Смеси давали нагреться до комнатной температуры и перемешивали в течение 16 ч. Затем смесь гасили H2O (50 мл) и экстрагировали этилацетатом (2×50 мл). Объединенные органические слои сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле с получением соединения PI-16a (1,4 г, 84%).
Смесь соединения PI-16a (1,4 г, 3,684 ммоль, 1,0 экв.) в HCl/THF (2,0 M, 30 мл /30 мл) перемешивали при 70°C в течение 3 ч. Реакционную смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении. К остатку добавляли насыщенный раствор NaHCO3 для доведения pH=8 и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении с получением соединения PI-16b (760 мг, 61%), которое использовали на следующей стадии без дополнительной очистки.
К смеси соединения PI-16b (760 мг, 2,262 ммоль, 1,0 экв.) в MeOH (10 мл) добавляли KCN (294 мг, 4,524 ммоль, 2,0 экв.) и (NH4)2CO3 (869 мг, 9,048 ммоль, 4,0 экв.). Смесь перемешивали при комнатной температуре в течение 12 ч. Затем смесь разбавляли водой и экстрагировали этилацетатом. Органическую фазу сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением соединения PC-16 (130 мг, 14%) в виде белого твердого вещества.
Соединение PC-17 синтезировали по той же процедуре, что и синтез соединения PC-16, за исключением того, что (2-метилпиридин-4-ил)метанол заменяли (5-метилпиридин-3-ил)метанолом.
Получение соединений PC-18 и PC-19:
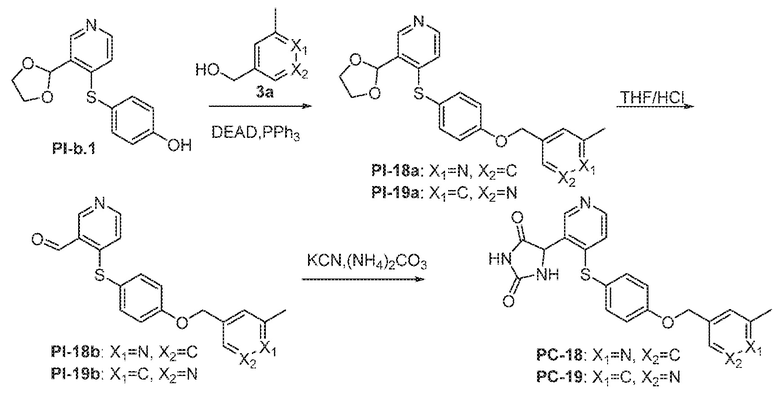
Соединения PC-18 и PC-19 синтезировали по той же процедуре, что и синтез PC-16 за исключением того, что PI-b.2 заменяли на PI-b.1, в качестве исходного вещества.
Получение соединений PC-20 и PC-21:
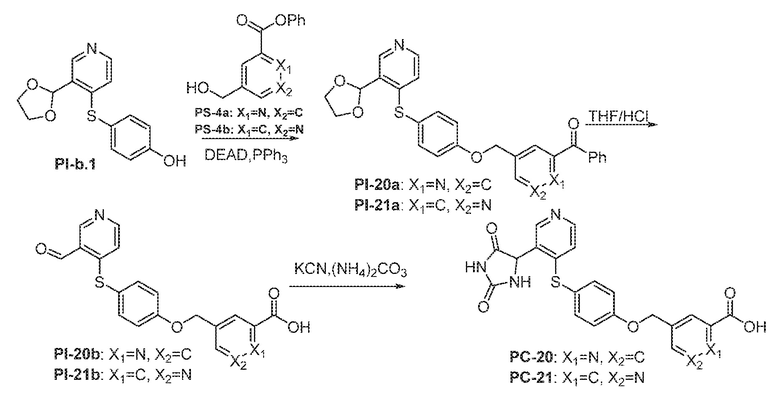
К раствору соединения соединения PI-b.1 (1,2 г, 4,36 ммоль, 1,0 экв.) в THF (10 мл) последовательно добавляли соединение PS-4a (2,0 г, 8,73 ммоль, 2,0 экв.), PPh3 (3,4 г, 13,0 ммоль, 3,0 экв.) и DEAD (2,3 г, 13,0 ммоль, 3,0 экв.) при 0°C. Смеси давали нагреться до комнатной температуры и перемешивали в течение 20 ч. Затем смесь гасили H2O (100 мл) и экстрагировали этилацетатом (2×100 мл). Объединенные органические слои сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (PE/EA, 1:1) с получением соединения PI-20a (2,0 г, 95%) в виде белого твердого вещества.
Смесь соединения PI-20a (500 мг, 1,02 ммоль, 1,0 экв.) и HCl (3 M в H2O, 10 мл) в THF (15 мл) перемешивали при 70°C в течение 12 ч. Реакционную смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении. К остатку добавляли насыщенный раствор NaHCO3 для доведения pH=8 и фильтровали с получением соединения PI-20b (400 мг, 100%), которое использовали на следующей стадии без дополнительной очистки.
К раствору соединения PI-20b (220 мг, 0,601 ммоль, 1,0 экв.) и KCN (117 мг, 1,803 ммоль, 3,0 экв.) в EtOH (12 мл) и H2O (6 мл) добавляли (NH4)2CO3 (577 мг, 6,01 ммоль, 10,0 экв.). Смесь перемешивали при 50°C в течение 5 ч. В смесь добавляли 0,5 М HCl для доведения pH=1~2 и перемешивали в течение 10 мин. Затем добавляли насыщенный раствор NaHCO3 для доведения pH=6-7. Смесь перемешивали в течение 1 ч и фильтровали. Остаток очищали с помощью преп.-ВЭЖХ с получением PC-20 (160 мг, 61,3%) в виде белого твердого вещества.
Получение промежуточных соединений PS-4a и PS-4b:
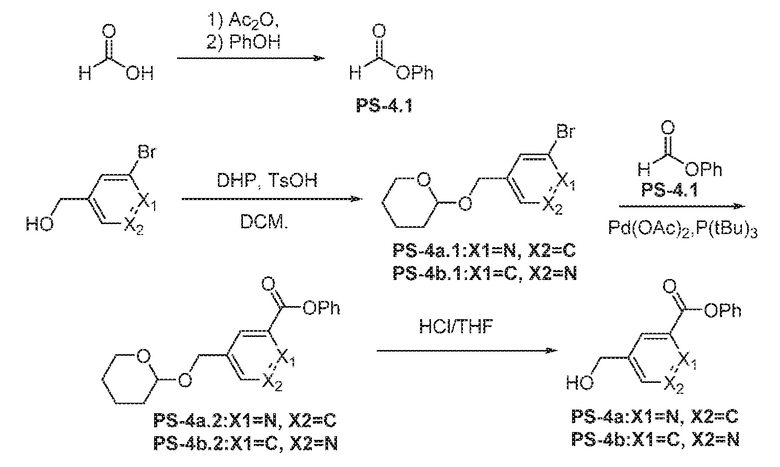
Смесь муравьиной кислоты (180 мл, 1,9 моль, 4,0 экв.) в Ac2O (360 мл, 9,54 моль, 21,2 экв.) перемешивали при 60°C в течение 1 ч в атмосфере азота. Реакционную смесь охлаждали до комнатной температуры, затем добавляли PhOH (42,3 г, 0,45 моль, 1,0 экв.) и NaHCO3 (76,5 г, 0,91 моль, 2,0 экв.). Затем, смесь перемешивали при комнатной температуре в течение 16 ч. После экстрагирования смеси EA (3×150 мл) и водой, объединенные органические слои промывали H2O (3×100 мл) и насыщенным раствором NaHCO3 (2×100 мл), сушили над Na2SO4 и концентрировали при пониженном давлении с получением соединения PS-4.1 (60 г, 26%).
К смеси (2-бромпиридин-4-ил)метанола (25 г, 133,69 ммоль, 1,0 экв.) и DHP (22,46 г, 267,38 ммоль, 2,0 экв.) в DCM (290 мл) добавляли TsOH (2,23 г, 13,37 ммоль, 0,1 экв.). Смесь перемешивали при комнатной температуре в течение 15 ч. Анализ реакционной смеси методом ТСХ показал полное превращение в целевой продукт. Затем смесь разбавляли H2O (100 мл) и экстрагировали дихлорметаном. Органический слой промывали насыщенным солевым раствором (100 мл), сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (PE/EA, 4:1) с получением соединения PS-4a.1 (34,1 г, 94,1%).
К смеси соединения PS-4a.1 (30 г, 110,7 ммоль, 1,0 экв.), соединения PS-4.1 (33,7 г, 276,75 ммоль, 2,5 экв.), Et3N (28 г, 276,75 ммоль, 2,5 экв.) и P(t-Bu)3HBF4 (3,85 г, 13,284 ммоль, 0,12 экв.) в ACN (700 мл) добавляли Pd(OAc)2 (743,9 мг, 3,321 ммоль, 0,03 экв.) в атмосфере азота. Смесь перемешивали при 80°C в течение 15 ч. Затем смесь фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (PE/EA, 1:1) с получением соединения PS-4a.2 (11 г, 32%).
Смесь соединения PS-4a.2 (25 г, 79,8 ммоль, 1,0 экв.) и HCl (2 M в H2O, 55 мл) в THF (55 мл) перемешивали при комнатной температуре в течение 3 ч. Анализ реакционной смеси методом ТСХ показал полное превращение в целевой продукт. Затем смесь сушили над Na2SO4 и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (PE/EA, 2:1) с получением соединения PS-4a (8 г, 44%).
Промежуточное соединение PS-4b получали с помощью той же процедуры синтеза PS-4a, за исключением того, что (2-бромпиридин-4-ил)метанол заменяли на (5-бромпиридин-3-ил)метанол, в качестве исходного вещества.
Получение соединения PC22:
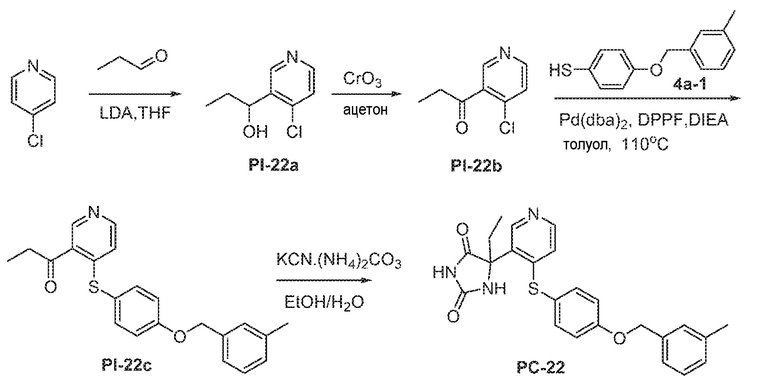
К смеси 4-хлорпиридина (100 г, 0,667 моль, 1,0 экв.) в сухом THF (1 л) быстро добавляли LDA (2 M в THF, 733,26 мл, 1,467 моль, 2,2 экв.) при -78°C в атмосфере азота. Смесь перемешивали при -78°C в течение 1 ч. Затем пропиональдегид (74,1 г, 0,999 моль, 1,5 экв.) добавляли по каплям и смесь перемешивали в течение 1 ч. Анализ реакционной смеси методом ТСХ показал полное превращение в целевой продукт. Реакцию гасили насыщенным водным раствором NH4Cl и экстрагировали EA (3 x500 мл). Органический слой промывали насыщенным солевым раствором и водой, сушили над Na2SO4 и концентрировали под вакуумом. Остаток очищали колоночной хроматографией на силикагеле (PE:EA, 3:1) с получением соединения PI-22a (45 г, 48%).
К смеси PI-22a (26,3 г, 0,154 моль, 1,0 экв.) в ацетоне (300 мл) добавляли CrO3 (30,8 г, 0,308 моль, 2,0 экв.). Смесь перемешивали при комнатной температуре в течение 5 ч. Затем смесь фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением соединения PI-22b (16,0 г, 62%).
К смеси PI-22b (850 мг, 5,03 ммоль, 1,0 экв.), соединения 4a-1 (1,27 г, 5,53 ммоль, 1,1 экв.), DPPF (42 мг, 0,503 ммоль, 0,1 экв.) и DIEA (973 мг, 7,55 ммоль, 1,5 экв.) в толуоле (10 мл) добавляли Pd(dba)2 (202 мг, 0,352 ммоль, 0,07 экв.) в атмосфере азота. Смесь перемешивали при 110°C в течение 16 ч. Затем смесь фильтровали и экстрагировали водой и этилацетатом. Органическую фазу сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением соединения PI-22c (550 мг, 30%).
К смеси PI-22c (550 мг, 1,515 ммоль, 1,0 экв.) в EtOH (8 мл) и H2O (2 мл) добавляли KCN (295 мг, 4,55 ммоль, 3,0 экв.) и (NH4)2CO3 (720 мг, 7,576 ммоль, 5,0 экв.). Смесь перемешивали при 50°C в течение 3 д. Затем смесь разбавляли водой и экстрагировали этилацетатом. Органическую фазу сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением соединения PC-22 (50 мг, 7%) в виде белого твердого вещества.
Получение соединения PC-23:
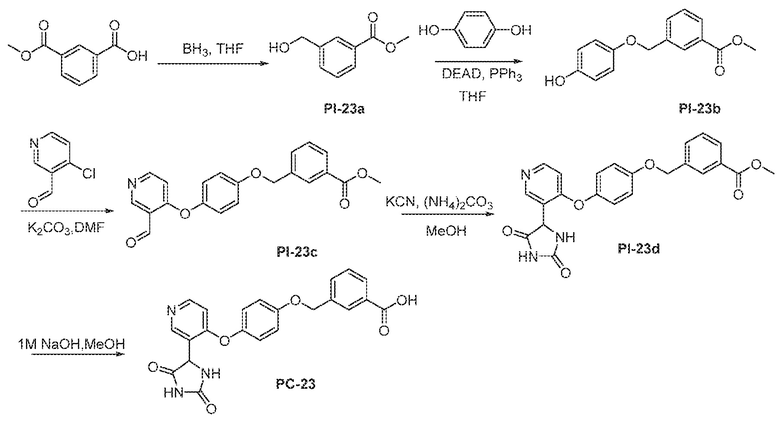
К смеси 3-(метоксикарбонил)бензойной кислоты (5 г, 27,78 ммоль, 1,0 экв.) в сухом THF (20 мл) добавляли BH3/THF (1 M в THF, 55 мл, 55,5 ммоль, 2,0 экв.) при 0°C. Смесь перемешивали при 30°C в течение 16 ч в атмосфере азота. Затем смесь разбавляли водой и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле с получением соединения PI-23a (4,2 г, 91%).
К раствору PI-23a (4,1 г, 24,7 ммоль, 1,0 экв.) в THF (100 мл) последовательно добавляли 1,4-гидрохинон (5,4 г, 49,4 ммоль, 2,0 экв.), PPh3 (13,0 г, 49,4 ммоль, 2,0 экв.) и DEAD (8,6 г, 49,4 ммоль, 2,0 экв.) при 0°C. Смеси давали нагреться до комнатной температуры и перемешивали в течение 16 ч. Затем смесь гасили H2O (100 мл) и экстрагировали этилацетатом (2×100 мл). Объединенные органические слои сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (PE/EA, 2:1) с получением соединения PI-23b (2,1 г, 33%).
К раствору соединения PI-23b (2,1 г, 8,14 ммоль, 1,0 экв.) в DMF (15 мл) добавляли 4-хлорникотинальдегид (1,73 г, 12,2 ммоль, 1,5 экв.) и K2CO3 (2,25 г, 16,28 ммоль, 2,0 экв.). Смесь перемешивали при 80°C в течение 4 ч в атмосфере азота. Затем 3 M HCl добавляли для доведения pH=6-7. Смесь экстрагировали EA и органический слой промывали насыщенным солевым раствором, сушили над Na2SO4, концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (PE/EA, 3:1) с получением соединения PI-23c (900 мг, 31%).
К смеси соединения PI-23c (200 мг, 0,551 ммоль, 1,0 экв.) в MeOH (5 мл) добавляли KCN (72 мг, 1,1 ммоль, 2,0 экв.) и (NH4)2CO3 (211 мг, 2,2 ммоль, 4,0 экв.). Смесь перемешивали при комнатной температуре в течение 12 ч. Затем смесь разбавляли водой и экстрагировали этилацетатом. Органическую фазу сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали препаративной ТСХ с получением соединения PI-23d (100 мг, 42%).
К смеси PI-23d (100 мг, 0,23 ммоль, 1,0 экв.) в MeOH (5 мл) добавляли NaOH (80 мг, 2,0 ммоль, 10,0 экв.). Смесь перемешивали при комнатной температуре в течение 3 ч. Смесь концентрировали для уменьшения вдвое количества растворителя и затем добавляли 1 н. HCl для доведения pH=5. Смесь фильтровали с получением PC-23 (47 мг, 48%).
Получение соединения PC-24:
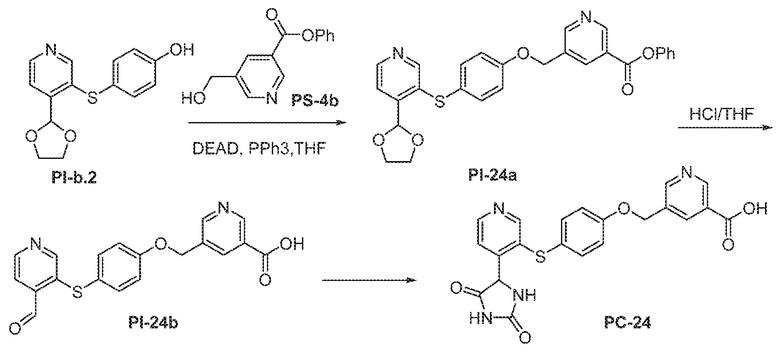
Соединение PC-24 синтезировали по той же процедуре, что и синтез PC-22, за исключением того, что исходное вещество PI-b.1 заменяли на PI-b.2.
Получение соединения PC-25:
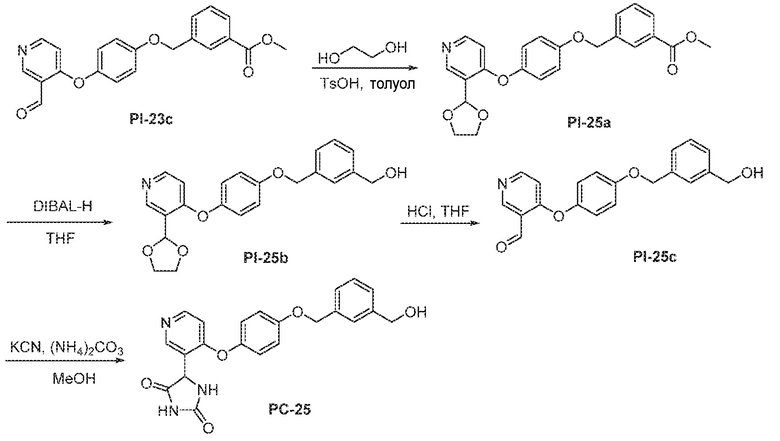
К смеси PI-23c (2,4 г, 6,61 ммоль, 1,0 экв.) в толуоле (40 мл) последовательно добавляли этан-1,2-диол (3,7 г, 60 ммоль, 10 экв.) и TsOH (56,5 мг, 0,33 ммоль, 0,05 экв.). Смесь нагревали с обратным холодильником в течение 12 ч в атмосфере азота. Затем смесь концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (PE/EA, 2:1) с получением соединения PI-25a (2,3 г, 85%).
К смеси PI-25a (2,3 г, 25,65 ммоль, 1,0 экв.) в сухом THF (100 мл) добавляли DIBAL-H (1,0 M в толуоле, 14,1 мл, 14,1 ммоль, 2,5 экв.) по каплям при 0°C в атмосфере азота. Смесь перемешивали при 0°C в течение 1 ч. Затем Na2SO4⋅10 H2O (6,6 г, 20,5 ммоль, 0,8 экв.) добавляли по каплям и смесь перемешивали в течение 0,5 ч. Реакцию гасили насыщенным водным раствором NH4Cl и экстрагировали EtOAc (3 x100 мл). Органический слой промывали насыщенным солевым раствором и водой, сушили над Na2SO4 и концентрировали под вакуумом. Остаток очищали колоночной хроматографией на силикагеле (PE:EA, 3:1) с получением соединения PI-25b (1,1 г, 51%).
Смесь PI-25b (1,1 г, 2,902 ммоль, 1,0 экв.) в HCl/THF (2,0 M, 20 мл /20 мл) перемешивали при 70°C в течение 3 ч. Реакционную смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении. К остатку добавляли насыщенный раствор NaHCO3 для доведения pH=8 и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении с получением соединения PI-25c (1,0 г, 100%), которое использовали на следующей стадии без дополнительной очистки.
К смеси соединения PI-25c (1,0 г, 2,98 ммоль, 1,0 экв.) в MeOH (20 мл) добавляли KCN (38 мг, 5,96 ммоль, 2,0 экв.) и (NH4)2CO3 (1,14 г, 11,92 ммоль, 4,0 экв.). Смесь перемешивали при комнатной температуре в течение 12 ч. Затем смесь разбавляли водой и экстрагировали этилацетатом. Органическую фазу сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали препаративной ТСХ с получением соединения PC-25 (215 мг, 18%) в виде белого твердого вещества.
Получение соединений PC-26 и PC-27:
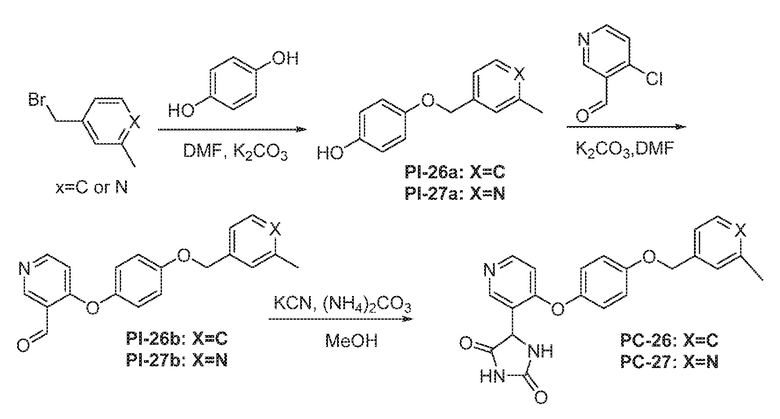
К смеси 1-(бромметил)-3-метилбензола (5,0 г, 27 ммоль, 1,0 экв.) в DMF (150 мл) последовательно добавляли 1,4-гидрохинон (5,94 г, 54 ммоль, 2,0 экв.) и K2CO3 (14,9 г, 108 ммоль, 4,0 экв.). Смесь перемешивали при 80°C в течение 3 ч в атмосфере азота. Затем 3 M HCl добавляли для доведения pH=6-7. Смесь экстрагировали EA и органический слой промывали насыщенным солевым раствором, сушили над Na2SO4, и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (PE/EA, 3:1) с получением соединения PI-26a (2,6 г, 45%).
К смеси PI-26a (1,0 г, 4,67 ммоль, 1,0 экв.) в DMF (15 мл) последовательно добавляли 4-хлорникотинальдегид (0,99 г, 7 ммоль, 1,5 экв.) и K2CO3 (1,5 г, 9,34 ммоль, 2,0 экв.). Смесь перемешивали при 80°C в течение 3,5 ч в атмосфере азота. Анализ реакционной смеси методом ТСХ показал полное превращение в целевой продукт. Затем смесь разбавляли H2O (100 мл) и экстрагировали EA (3×100 мл). Объединенные органические слои промывали насыщенным водным раствором NH4Cl (3×100 мл), насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (PE/EA, 1:1) с получением соединения PI-26b (480 мг, 32%).
К раствору соединения PI-26b (480 мг, 1,5 ммоль, 1,0 экв.) в MeOH (10 мл) добавляли (NH4)2CO3 (578 мг, 6,01 ммоль, 4,0 экв.) и KCN (195 мг, 3 ммоль, 2,0 экв.). Смесь перемешивали при 45°C в течение 16 ч. В реакционную смесь добавляли 3 M HCl для доведения pH=1-2 и перемешивали при комнатной температуре 1 ч, затем добавляли насыщенный водный раствор NaHCO3 для доведения pH=6-7 и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали препаративной ТСХ с получением PC-26 (208,1 мг, 44%) в виде белого твердого вещества. Соединение PC-27 синтезировали таким же образом, за исключением того, что исходное вещество 1-(бромметил)-3-метилбензол заменяли на 4-(бромметил)-2-метилпиридин.
Получение соединений PC-28 и PC-29:
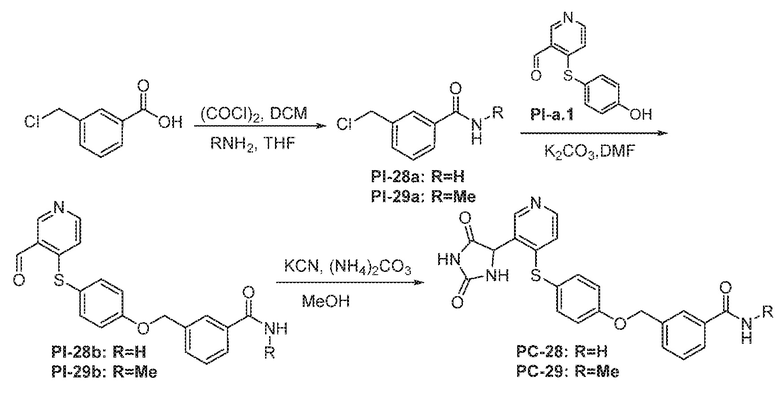
К смеси 3-(хлорметил)бензойной кислоты (1,7 г, 9,965 ммоль, 1,0 экв.) в DCM (50 мл) добавляли (COCl)2 (1,7 мл, 19,931 ммоль, 2,0 экв.) по каплям при 0°C. Смесь перемешивали в течение 1 ч, пока раствор не стал прозрачным. Затем смесь концентрировали при пониженном давлении. К смеси остатка в DCM добавляли раствор NH3 в THF при -10°C. Смесь перемешивали в течение 0,5 и затем концентрировали при пониженном давлении с получением соединения PI-28a (1,3 г, 77%)
К смеси соединения PI-28a (1,0 г, 5,92 ммоль, 1,0 экв.) в DMF (50 мл) последовательно добавляли соединение PI-a.1 (1,36 г, 5,92 ммоль, 1,0 экв.) и K2CO3 (2,45 г, 17,76 ммоль, 3,0 экв.). Смесь перемешивали при комнатной температуре в течение 16 ч в атмосфере азота. Затем 3 M HCl добавляли для доведения pH=6-7. Смесь экстрагировали EA и органический слой промывали насыщенным солевым раствором, сушили над Na2SO4, и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле с получением соединения PI-28b (850 мг, 40%).
К смеси соединения PI-28b (850 мг, 2,33 ммоль, 1,0 экв.) в MeOH (10 мл) добавляли KCN (303 мг, 4,66 ммоль, 2,0 экв.) и (NH4)2CO3 (904 мг, 9,33 ммоль, 4,0 экв.). Смесь перемешивали при 45°C в течение 16 ч. Затем смесь разбавляли водой и экстрагировали этилацетатом. Органическую фазу сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали препаративной ТСХ с получением соединения PC-28 (500 мг, 49%) в виде белого твердого вещества.
Соединение PC-29 синтезировали по той же процедуре, за исключением того, что NH3 заменяли на MeNH2.
Получение соединений PC-30, PC-31, PC-32 и PC-33:
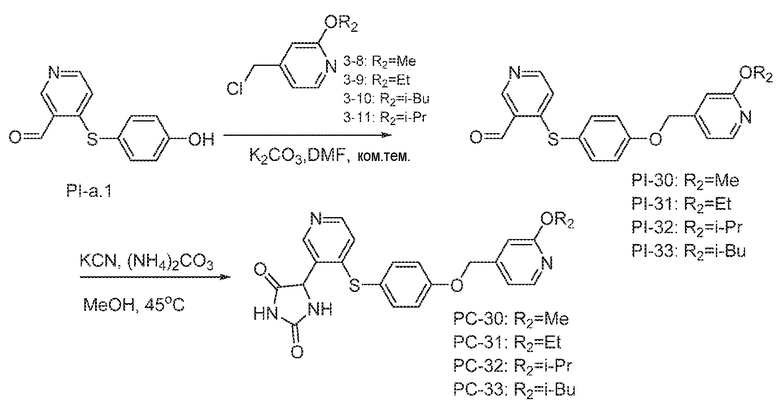
К смеси соединения 3-8 (750 мг, 3,876 ммоль, 1,0 экв.) в DMF (15 мл) последовательно добавляли соединение PI-a.1 (895 мг, 3,876 ммоль, 1,0 экв.) и K2CO3 (2,14 г, 15,5 ммоль, 4,0 экв.). Смесь перемешивали при комнатной температуре в течение 16 ч в атмосфере азота. Затем 3 M HCl добавляли для доведения pH=6-7. Смесь экстрагировали EA и органический слой промывали насыщенным солевым раствором, сушили над Na2SO4, и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле (PE/EA, 1:1) с получением соединения PI-30 (610 мг, 36%).
К раствору соединения PI-30 (500 мг, 1,419 ммоль, 1,0 экв.) в MeOH (6 мл) добавляли (NH4)2CO3 (545 мг, 5,676 ммоль, 4,0 экв.) и KCN (185 мг, 2,838 ммоль, 2,0 экв.). Смесь перемешивали при 45°C в течение 16 ч. В реакционную смесь добавляли 3 M HCl для доведения pH=1-2 и перемешивали при комнатной температуре 1 ч, затем добавляли насыщенный водный раствор NaHCO3 для доведения pH=6-7 и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали препаративной ТСХ с получением PC-30 (350 мг, 58%) в виде белого твердого вещества. Соединения PC-31, PC-32 и PC-33 синтезировали таким же образом, за исключением того, что промежуточное соединение 3-8 заменяли на 3-9, 3-11, и 3-10, соответственно.
Получение соединений PC-34 и PC-36:
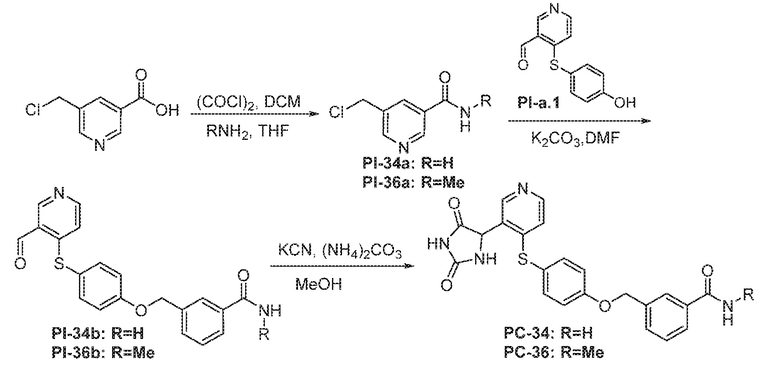
Соединения PC-34 и PC-36 синтезировали по той же процедуре, что и синтез соединений PC-28 и PC-29, за исключением того, что исходное вещество 3-(хлорметил)бензойную кислоту заменяли 5-(хлорметил)никотиновой кислотой.
Получение соединения PC-35:
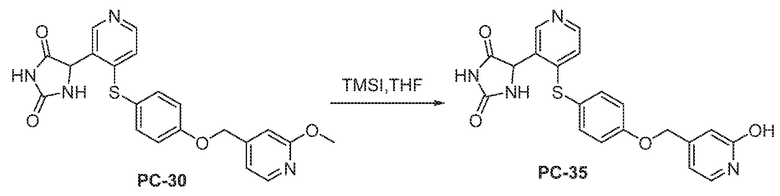
К раствору соединения PC-30 (400 мг, 0,95 ммоль, 1,0 экв.) в CHCl3 (30 мл) добавляли TMS-I (1,35 мл, 9,5 ммоль, 10,0 экв.). Смесь перемешивали при 55°C в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении. Остаток очищали препаративной ТСХ (EA:MeOH, 10:1) с получением соединения PC-35 (350 мг, 90%) в виде белого твердого вещества.
Получение соединения PC-37:
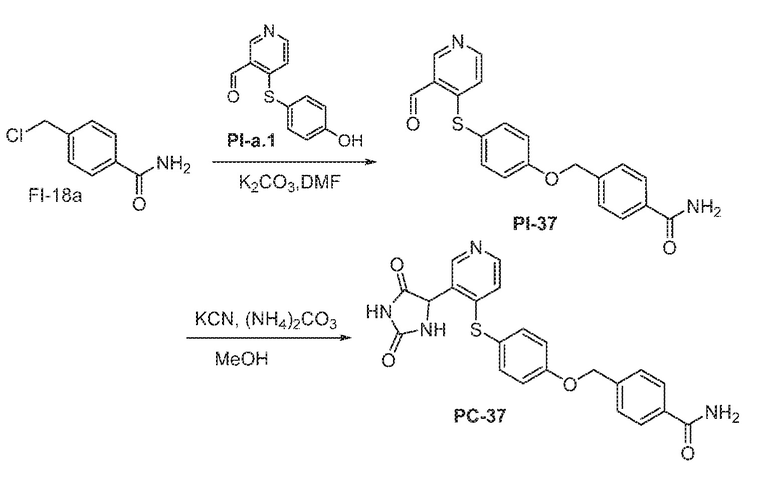
Соединение PC-37 синтезировали по той же процедуре, что и синтез соединения PC-28, за исключением того, что промежуточное соединение PC-28a заменяли на FI-18a.
Получение соединения PC-38:
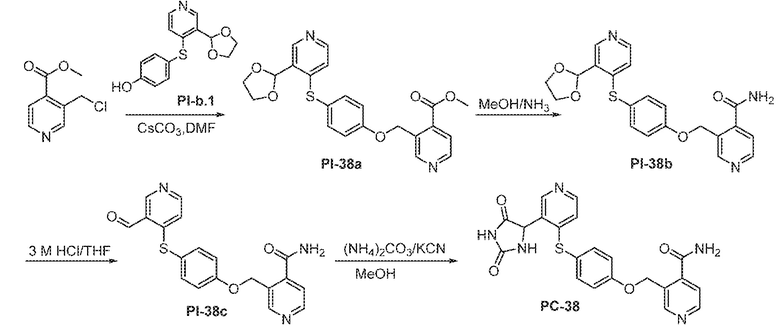
К смеси метил 3-(хлорметил)изоникотината (800 мг, 4,32 ммоль, 1,0 экв.) в DMF (10 мл) последовательно добавляли соединение PI-b.1 (1,19 г, 4,32 ммоль, 1,0 экв.) и CsCO3 (4,23 г, 12,97 ммоль, 3,0 экв.). Смесь перемешивали при комнатной температуре в течение 16 ч в атмосфере азота. Анализ реакционной смеси методом ТСХ показал полное превращение в целевой продукт. Затем смесь разбавляли H2O (50 мл) и экстрагировали EA (3×50 мл). Объединенные органические слои промывали насыщенным водным раствором NH4Cl (3×50 мл), насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле с получением соединения PI-38a (300 мг, 16%).
Раствор соединения PI-38a (300 мг, 0,708 ммоль, 1,0 экв.) в MeOH (10 мл) продували газообразным NH3 в течение 10 мин при -78°C. Колбу герметизировали и смесь перемешивали при комнатной температуре в течение 16 ч. Анализ реакционной смеси методом ТСХ показал полное превращение в целевой продукт. Смесь концентрировали при пониженном давлении и остаток очищали хроматографией на силикагеле с получением соединения PI-38b (180 мг, 62%).
Смесь соединения PI-38b (180 мг, 0,440 ммоль, 1,0 экв.) в HCl/THF (3,0 M, 2 мл /2 мл) перемешивали при 70°C в течение 3 ч. Реакционную смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении. К остатку добавляли насыщенный раствор NaHCO3 для доведения pH=8 и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали препаративной ТСХ с получением соединения PI-38c (100 мг, 62%).
К раствору соединения PI-38c (90 мг, 0,247 ммоль, 1,0 экв.) в MeOH (5 мл) добавляли (NH4)2CO3 (94 мг, 0,986 ммоль, 4,0 экв.) и KCN (32 мг, 0,493 ммоль, 2,0 экв.). Смесь перемешивали при 45°C в течение 16 ч. В реакционную смесь добавляли 3 M HCl для доведения pH=1-2 и перемешивали при комнатной температуре 1 ч, затем добавляли насыщенный водный раствор NaHCO3 для доведения pH=6-7 и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали препаративной ТСХ с получением PC-38 (55 мг, 51%) в виде белого твердого вещества.
Получение соединений PC-39 и PC-40:
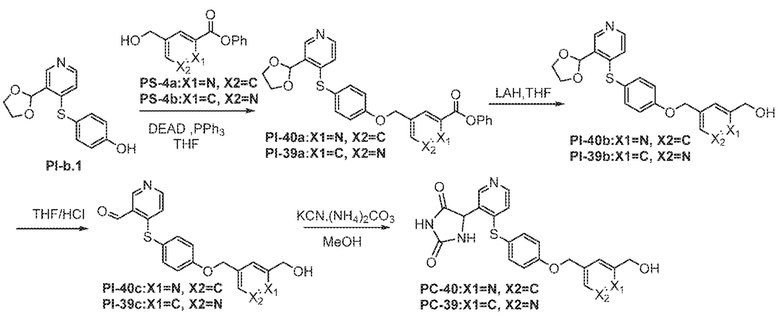
К раствору соединения PI-b.1 (738 мг, 2,68 ммоль, 1,0 экв.) в THF (20 мл) последовательно добавляли соединение PS-4b (615 мг, 2,68 ммоль, 1,0 экв.), PPh3 (1,4 г, 5,37 ммоль, 2,0 экв.) и DEAD (934 мг, 5,37 ммоль, 2,0 экв.) при 0°C. Смеси давали нагреться до комнатной температуры и перемешивали в течение 16 ч. Затем смесь гасили H2O (50 мл) и экстрагировали этилацетатом (2×50 мл). Объединенные органические слои сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле с получением соединения PI-39a (490 мг, 37%).
К смеси соединения PI-39a (300 мг, 0,617 ммоль, 1,0 экв.) в сухом THF (10 мл) быстро добавляли LAH (47 мг, 1,23 ммоль, 2,0 экв.) при 0°C в атмосфере азота. Смесь перемешивали при 0°C в течение 1 ч. Анализ реакционной смеси методом ТСХ показал полное превращение в целевой продукт. Реакцию гасили Na2SO4⋅10 H2O (159 мг, 0,494 ммоль, 0,8 экв.) и смесь перемешивали в течение 0,5 ч. Затем смесь фильтровали, и органический слой концентрировали под вакуумом. Остаток очищали препаративной ТСХ с получением соединения PI-39b (150 мг, 61%).
Смесь соединения PI-39b (150 мг, 0,379 ммоль, 1,0 экв.) в HCl/THF (3,0 M, 4 мл/4 мл) перемешивали при 70°C в течение 16 ч. Реакционную смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении. К остатку добавляли насыщенный раствор NaHCO3 для доведения pH=8 и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали препаративной ТСХ с получением соединения PI-39c (110 мг, 82%).
К раствору соединения PI-39c (110 мг, 0,313 ммоль, 1,0 экв.) в MeOH (5 мл) добавляли (NH4)2CO3 (120 мг, 1,25 ммоль, 4,0 экв.) и KCN (40 мг, 0,625 ммоль, 2,0 экв.). Смесь перемешивали при 45°C в течение 16 ч. В реакционную смесь добавляли 3 M HCl для доведения pH=1-2 и перемешивали при комнатной температуре 1 ч, затем добавляли насыщенный водный раствор NaHCO3 для доведения pH=6-7 и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали препаративной ТСХ с получением соединения PC-39 (49 мг, 37%) в виде белого твердого вещества.
Соединение PC-40 синтезировали по той же процедуре, за исключением того, что PS-4b заменяли на PS-4a.
Получение соединений PC-41, PC-46, PC-54, и PC-55
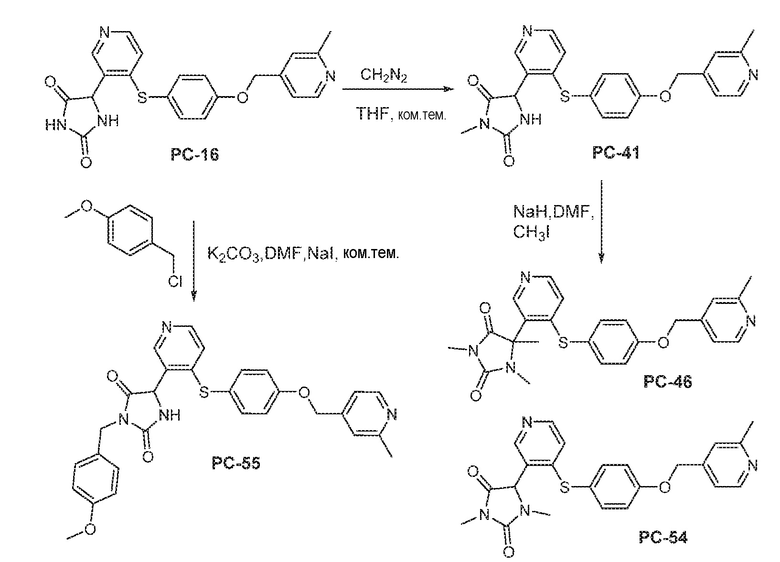
К смеси соединения PC-16 (250 мг, 0,616 ммоль, 1,0 экв.) в THF (2 мл) добавляли CH2N2 (1 M в эфире, 3 мл, 3,08 ммоль, 5,0 экв.). Смесь перемешивали при комнатной температуре в течение 3 ч. Затем смесь концентрировали при пониженном давлении с получением соединения PC-41 (80 мг, 30%) в виде белого твердого вещества.
К перемешиваемому раствору соединения PC-41 (100 мг, 0,238 ммоль, 1,0 экв.) в DMF (2 мл) добавляли NaH (12 мг, 0,476 ммоль, 2,0 экв.) при 0°C. Через 10 мин, добавляли CH3I (68 мг, 0,476 ммоль, 2,0 экв.). После дополнительного перемешивания при 0°С в течение 0,5 ч, смеси давали нагреться до комнатной температуры и перемешивали в течение 12 ч. Реакционную смесь гасили водой и экстрагировали EA (3×50 мл). Объединенные органические фазы сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали препаративной ТСХ с получением соединения PC-46 (40 мг, 37%) в виде желтого твердого вещества.
К перемешиваемому раствору соединения PC-41 (300 мг, 0,714 ммоль, 1,0 экв.) в DMF (5 мл) добавляли NaH (17 мг, 0,714 ммоль, 1,0 экв.) при 0°C. Через 10 мин, добавляли CH3I (101 мг, 0,714 ммоль, 1,0 экв.). После дополнительного перемешивания при 0°С в течение 0,5 ч, смеси давали нагреться до комнатной температуры и перемешивали в течение 12 ч. Реакционную смесь гасили водой и экстрагировали EA (3×50 мл). Объединенные органические фазы сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали препаративной ТСХ с получением соединения PC-54 (45 мг, 14%) в виде белого твердого вещества.
К раствору соединения PC-16 (1 г, 2,46 ммоль, 1,0 экв.) и 1-(хлорметил)-4-метоксибензола (461 мг, 2,96 ммоль, 1,2 экв.) в DMF (10 мл) добавляли NaI (369 мг, 2,46 моль, 1,0 экв.) и K2CO3 (679 мг, 4,92 ммоль, 2,0 экв.). Смесь перемешивали при комнатной температуре в течение 16 ч. Анализ реакционной смеси методом ЖХМС показал полное превращение в целевой продукт. Затем смесь разбавляли водой и экстрагировали DCM. Органический слой сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением соединения PC-55 (130 мг, 34%) в виде розового твердого вещества.
Получение соединений PC-42, PC-50 и PC-51:
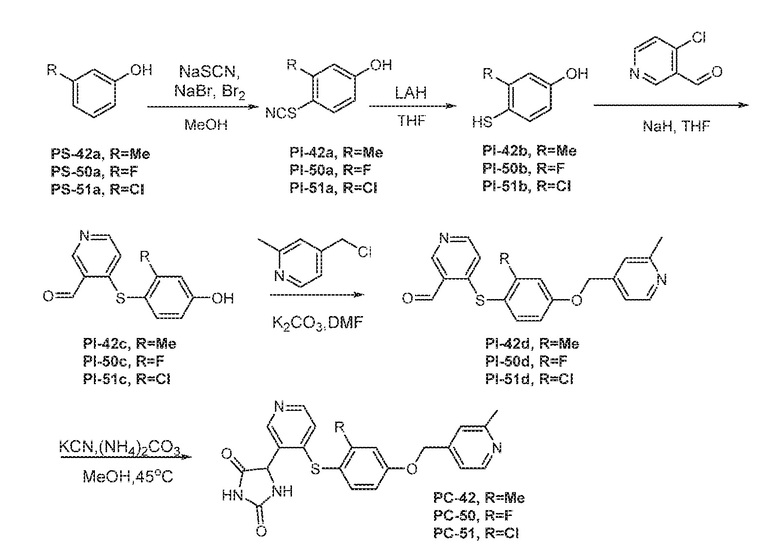
К смеси м-крезола (10 г, 92,5 ммоль, 1,0 экв.) и NaSCN (22,5 г, 277,6 ммоль, 3,0 экв.) в MeOH (100 мл) по каплям добавляли раствор NaBr (9,5 г, 92,5 ммоль, 1,0 экв.) и Br2 (5,7 мл, 111 ммоль, 1,2 экв.) в MeOH (100 мл). Смесь перемешивали при комнатной температуре в течение 14 ч. Анализ реакционной смеси методом ТСХ показал полное превращение в целевой продукт. В реакционную смесь добавляли воду и экстрагировали EA (3×100 мл). Органический слой промывали насыщенным солевым раствором и водой, сушили над Na2SO4 и концентрировали под вакуумом. Остаток очищали колоночной хроматографией на силикагеле с получением соединения PI-42a (5 г, 33%).
К смеси соединения PI-42a (5,0 г, 30,3 ммоль, 1,0 экв.) в сухом THF (50 мл) быстро добавляли LAH (1,72 г, 45,5 ммоль, 1,5 экв.) при 0°C в атмосфере азота. Смесь перемешивали при комнатной температуре в течение 3 ч. Анализ реакционной смеси методом ТСХ показал полное превращение в целевой продукт. Реакцию гасили Na2SO4·10 H2O и перемешивали при 0°C в течение 0,5 ч. Затем смесь фильтровали, и органический слой концентрировали под вакуумом. Остаток очищали хроматографией на силикагеле с получением соединения PI-42b (2,9 г, 68%).
К перемешиваемому раствору соединения PI-42b (1,0 г, 7,1 ммоль, 1,5 экв.) в THF (10 мл) добавляли NaH (170,4 мг, 7,1 ммоль, 1,5 экв.) при 0°C. Через 30 мин, добавляли 4-хлорникотинальдегид (667,4 мг, 4,73 ммоль, 1,0 экв.) при 0°C. Смеси давали нагреться до комнатной температуры и перемешивали в течение 16 ч. Реакционную смесь гасили водой и экстрагировали EA (3×10 мл). Объединенные органические фазы сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением соединения PI-42c (1,2 г, 100%).
К смеси соединения PI-42c (200 мг, 0,82 ммоль, 1,0 экв.) и 4-(хлорметил)-2-метилпиридина (130 мг, 0,902 ммоль, 1,1 экв.) в DMF (2 мл) последовательно добавляли K2CO3 (340 мг, 2,46 ммоль, 3,0 экв.). Смесь перемешивали при 50°C в течение 3 ч в атмосфере азота. Анализ реакционной смеси методом ТСХ показал полное превращение в целевой продукт. Затем смесь выливали в воду и экстрагировали EA (3×5 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле с получением соединения PI-42d (150 мг, 52%).
К раствору соединения PI-42d (190 мг, 0,54 ммоль, 1,0 экв.) в MeOH (2 мл) добавляли (NH4)2CO3 (208,45 мг, 2,17 ммоль, 4,0 экв.) и KCN (70,2 мг, 1,08 ммоль, 2,0 экв.). Смесь перемешивали при 45°C в течение 16 ч. В реакционную смесь добавляли 3 M HCl для доведения pH=1-2 и перемешивали при комнатной температуре 1 ч, затем добавляли насыщенный водный раствор NaHCO3 для доведения pH=6-7 и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали препаративной ТСХ с получением соединения PC-42 (200 мг, 88%) в виде белого твердого вещества. Соединения PC-50 и PC-51 синтезированы таким же образом, за исключением того, что исходное вещество м-крезол заменяли на 3-фторфенол и 3-хлорфенол, соответственно.
Получение соединений PC-48, PC-49 и PC-52:
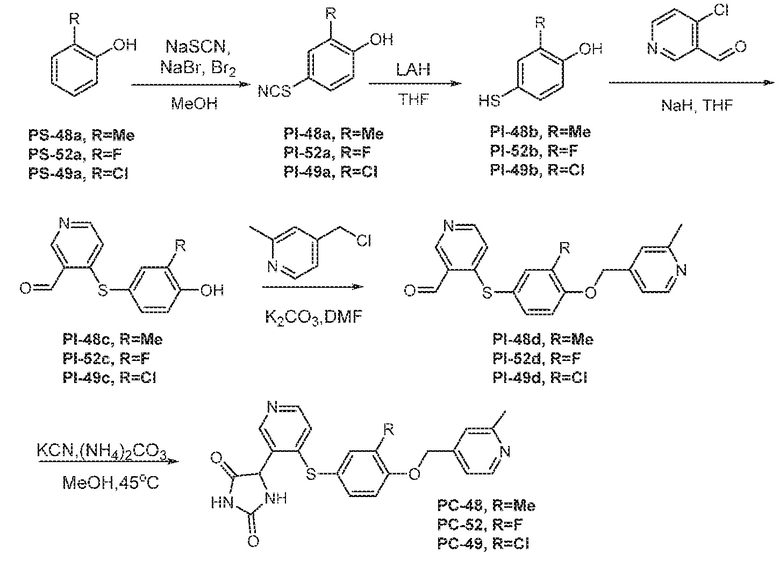
Соединения PC-48, PC-49 и PC-52 синтезировали по той же процедуре, что и синтез PC-42, за исключением того, что исходное вещество м-крезол заменяли о-крезолом, 2-хлорфенолом и 2-фторфенолом, соответственно.
Получение соединений PC-43 и PC-44:
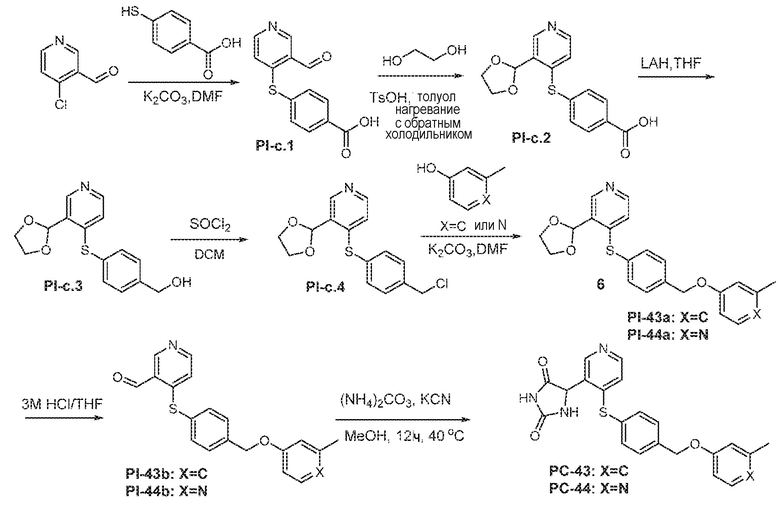
К раствору 4-хлорникотинальдегида (10 г, 70,92 ммоль, 1,0 экв.) в DMF (100 мл) добавляли 4-меркаптобензойную кислоту (13,1 г, 85,11 ммоль, 1,2 экв.) и K2CO3 (29,4 г, 0,213 моль, 3,0 экв.) при комнатной температуре в атмосфере азота. Смесь перемешивали при комнатной температуре в течение 16 ч. Анализ реакционной смеси методом ТСХ показал полное превращение в целевой продукт. Затем смесь разбавляли водой и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением PI-c.1 (11 г, 59%).
К перемешиваемому раствору PI-c.1 (11 г, 42,47 ммоль, 1,0 экв.) в THF (100 мл) добавляли TsOH (731 мг, 4,25 ммоль, 0,1 экв.). Через 10 мин, этан-1,2-диол (13,1 г, 0,212 моль, 5,0 экв.) в THF (50 мл) добавляли по каплям. Смесь перемешивали при 110°C в течение 16 ч. Реакционную смесь выливали в насыщенный раствор NaHCO3 (160 мл) и экстрагировали EA (3×100 мл). Объединенные органические фазы сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением PI-c.2 (8 г, 62%).
К смеси PI-c.2 (8 г, 26,40 ммоль, 1,0 экв.) в сухом THF (100 мл) быстро добавляли LAH (2 г, 52,81 ммоль, 2,0 экв.) при 0°C в атмосфере азота. Смесь перемешивали при 0°C в течение 1 ч. Анализ реакционной смеси методом ТСХ показал полное превращение в целевой продукт. Реакцию гасили Na2SO4·10 H2O (6,8 г, 21,12 ммоль, 0,8 экв.) и смесь перемешивали в течение 0,5 ч. Смесь экстрагировали и затем органический слой сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением PI-c.3 (4 г, 52%).
К смеси PI-c.3 (1 г, 3,46 ммоль, 1,0 экв.) в DCM (10 мл) добавляли S°Cl2 (824 мг, 6,92 ммоль, 2,0 экв.) при 0°C в атмосфере азота. Смесь перемешивали при 0°C в течение 4 ч. Анализ реакционной смеси методом ТСХ показал полное превращение в целевой продукт. В реакционную смесь добавляли NaHCO3 (водн.) для доведения pH >7 и экстрагировали DCM. Затем органический слой сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением PI-c.4 (1 г, 94%).
К раствору соединения PI-c.4 (500 мг, 1,63 ммоль, 1,0 экв.) в DMF (5 мл) добавляли м-крезол (211 мг, 1,95 ммоль, 1,2 экв.) и K2CO3 (675 мг, 4,89 ммоль, 3,0 экв.) при комнатной температуре в атмосфере азота. Смесь перемешивали при комнатной температуре в течение 16 ч. Анализ реакционной смеси методом ТСХ показал полное превращение в целевой продукт. Затем смесь разбавляли водой и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением соединения PI-43a (230 мг, 37%).
Смесь PI-43a (230 мг, 0,607 ммоль, 1,0 экв.) в HCl/THF (3,0 M, 2 мл/2 мл) перемешивали при 70°C в течение 14 ч. Реакционную смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении. К остатку добавляли насыщенный раствор NaHCO3 для доведения pH=8 и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением PI-43b (150 мг, 73%).
К раствору PI-43b (150 мг, 0,448 ммоль, 1,0 экв.) в MeOH (3 мл) добавляли (NH4)2CO3 (172 мг, 1,79 ммоль, 4,0 экв.) и KCN (58 мг, 0,896 ммоль, 2,0 экв.). Смесь перемешивали при 40°C в течение 12 ч. В реакционную смесь добавляли 3 M HCl для доведения pH=1-2 и перемешивали при комнатной температуре 1 ч, затем добавляли насыщенный водный раствор NaHCO3 для доведения pH=6-7 и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали препаративной ТСХ с получением соединения PC-43 (40 мг, 22%) в виде белого твердого вещества.
Соединение PC-44 синтезировали таким же образом, за исключением того, что м-крезол заменяли на 2-метилпиридин-4-ол.
Получение соединения PC-45:
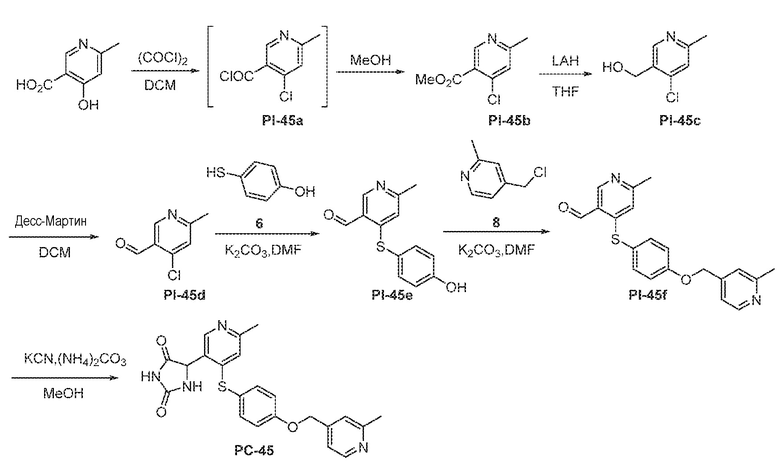
К смеси 4-гидрокси-6-метилникотиновой кислоты (10 г, 65,4 ммоль, 1,0 экв.) в DCM (100 мл), раствор (C°Cl)2 (12,35 г, 98,1 ммоль, 1,5 экв.) добавляли по каплям при 0°C. Смесь перемешивали в течение 12 ч. Анализ реакционной смеси методом ТСХ показал полное превращение в целевой продукт. Реакционную смесь сушили над Na2SO4 и концентрировали под вакуумом с получением неочищенного PI-45a (10 г, неочищенный).
Смесь PI-45a (10 г, 52,9 ммоль, 1,0 экв.) в MeOH (100 мл) перемешивали при комнатной температуре в течение 2 ч. Анализ реакционной смеси методом ТСХ показал полное превращение в целевой продукт. Реакционную смесь сушили над Na2SO4 и концентрировали под вакуумом. Остаток очищали хроматографией на силикагеле с получением неочищенного PI-45b (12 г, 100%).
К смеси PI-45b (12,0 г, 64,86 ммоль, 1,0 экв.) в сухом THF (100 мл) быстро добавляли LAH (3,69 г, 97,3 ммоль, 1,5 экв.) при 0°C в атмосфере азота. Смесь перемешивали при комнатной температуре в течение 3 ч. Анализ реакционной смеси методом ТСХ показал полное превращение в целевой продукт. Реакцию гасили Na2SO4·10 H2O и перемешивали при 0°C в течение 0,5 ч. Затем смесь фильтровали, и органический слой концентрировали под вакуумом. Остаток очищали хроматографией на силикагеле с получением PI-45c (6,0 г, 59%).
К перемешиваемому раствору PI-45c (6,0 г, 38,2 ммоль, 1,0 экв.) в DCM (60 мл) добавляли периодинан Десс-Мартина (32,4 г, 76,4 ммоль, 2,0 экв.). Смесь перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь гасили водой и экстрагировали EA (3×60 мл). Объединенные органические фазы сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением PI-45d (2,3 г, 39%).
К смеси PI-45d (2,3 г, 14,8 ммоль, 1,0 экв.) и 4-меркаптофенола (2,06 г, 16,3 ммоль, 1,1 экв.) в DMF (25 мл) последовательно добавляли K2CO3 (6,14 г, 44,4 ммоль, 3,0 экв.). Смесь перемешивали при 50°C в течение 3 ч в атмосфере азота. Анализ реакционной смеси методом ТСХ показал полное превращение в целевой продукт. Затем смесь выливали в воду и экстрагировали EA (3×30 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле с получением PI-45e (1,6 г, 44%).
К смеси PI-45e (1,0 г, 4,08 ммоль, 1,0 экв.) и 4-(хлорметил)-2-метилпиридина (633 мг, 4,48 ммоль, 1,1 экв.) в DMF (10 мл) последовательно добавляли K2CO3 (1,69 г, 12,24 ммоль, 3,0 экв.). Смесь перемешивали при 50°C в течение 3 ч в атмосфере азота. Анализ реакционной смеси методом ТСХ показал полное превращение в целевой продукт. Затем смесь выливали в воду и экстрагировали EA (3×10 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле с получением PI-45f (700 мг, 49%).
К раствору PI-45f (700 мг, 2,0 ммоль, 1,0 экв.) в MeOH (1 мл) добавляли (NH4)2CO3 (767,8 мг, 8,0 ммоль, 4,0 экв.) и KCN (260 мг, 4,0 ммоль, 2,0 экв.). Смесь перемешивали при 45°C в течение 16 ч. В реакционную смесь добавляли 3 M HCl для доведения pH=1-2 и перемешивали при комнатной температуре 1 ч, затем добавляли насыщенный водный раствор NaHCO3 для доведения pH=6-7 и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали препаративной ТСХ с получением PC-45 (512 мг, 61%) в виде белого твердого вещества.
Получение соединений PC-47 и PC-53:
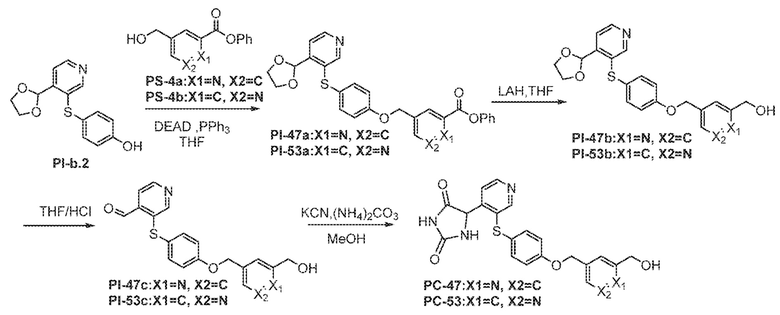
Соединения PC-47 и PC-53 синтезировали по той же процедуре, что и синтез PC-39 и PC-40 за исключением того, что исходное вещество PI-b.1 заменяли на PI-b.2.
Получение соединения PC-56:
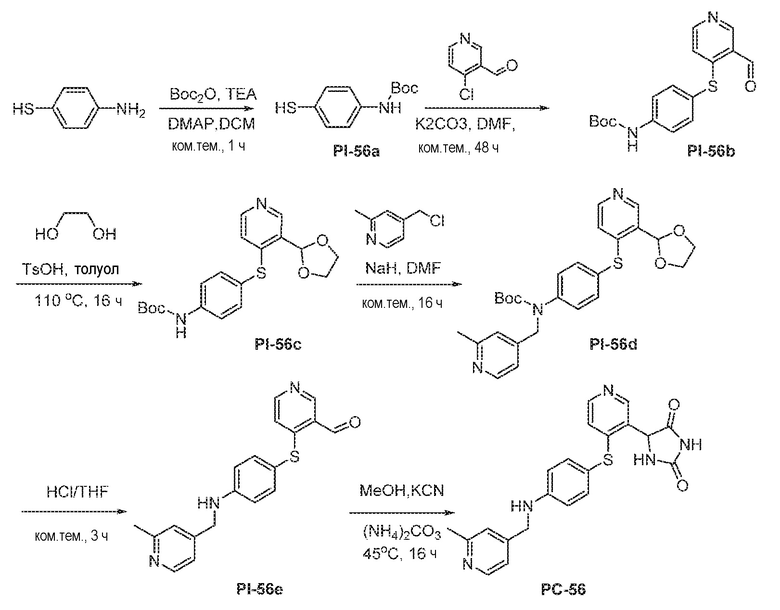
К раствору 4-аминотиофенола (16 г, 127,8 ммоль, 1,0 экв.) и Boc2O (55,2 г, 255,6 ммоль, 2,0 экв.) в DCM (200 мл) добавляли TEA (25,8 г, 255,6 ммоль, 2,0 экв.) и DMAP (1,56 г, 12,78 ммоль, 0,05 экв.) при -0°C. Смесь перемешивали при комнатной температуре в течение 16 ч в атмосфере азота. Затем смесь гасили насыщенным раствором NH4Cl. Смесь экстрагировали этилацетатом. Объединенные органические фазы промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением PI-56a (8,1 г, 28%).
К раствору PI-56a (5 г, 22,19 ммоль, 1,0 экв.) в DMF (40 мл) добавляли 4-хлорникотинальдегид (3,14 г, 22,19 ммоль, 1,0 экв.) и K2CO3 (9,12 г, 66,57 ммоль, 3,0 экв.) при комнатной температуре в атмосфере азота. Смесь перемешивали при комнатной температуре в течение 16 ч. Анализ реакционной смеси методом ТСХ показал полное превращение в целевой продукт. Затем смесь разбавляли водой и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением PI-56b (1,4 г, 19%).
К смеси PI-56b (0,6 г, 1,82 ммоль, 1,0 экв.) в толуоле (50 мл) последовательно добавляли этан-1,2-диол (2,25 г, 36,3 ммоль, 20 экв.) и TsOH (0,02 г, 0,09 ммоль, 0,05 экв.). Смесь нагревали с обратным холодильником в течение 12 ч в атмосфере азота. Затем смесь концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле с получением PI-56c (0,25 г, 36%).
К раствору PI-56c (0,2 г, 0,53 ммоль, 1,0 экв.) в DMF (5 мл) добавляли соединение 4-(хлорметил)-2-метилпиридин (0,09 г, 0,64 ммоль, 1,2 экв.) и NaH (14 мг, 0,58 ммоль, 1,1 экв., 60%) при комнатной температуре в атмосфере азота. Смесь перемешивали при комнатной температуре в течение 16 ч. Анализ реакционной смеси методом ТСХ показал полное превращение в целевой продукт. Затем смесь разбавляли водой и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением PI-56d (0,13 г, 51%).
Смесь PI-56d (250 мг, 0,52 ммоль, 1,0 экв.) в HCl/THF (2,0 M, 3 мл /3 мл) перемешивали при комнатной температуре в течение 5 ч. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли насыщенный раствор NaHCO3 для доведения pH=8 и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением PI-56e (110 мг, 63%).
К раствору PI-56e (110 мг, 0,33 ммоль, 1,0 экв.) в MeOH (3 мл) добавляли (NH4)2CO3 (126 мг, 1,31 ммоль, 4,0 экв.) и KCN (43 мг, 0,66 ммоль, 2,0 экв.). Смесь перемешивали при 45°C в течение 16 ч. В реакционную смесь добавляли 3 M HCl для доведения pH=1~2 и перемешивали при комнатной температуре 1 ч, затем добавляли насыщенный водный раствор NaHCO3 для доведения pH=7~8 и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали препаративной ТСХ с получением PC-56 (50 мг, 37%) в виде белого твердого вещества.
Получение соединения PC-57:
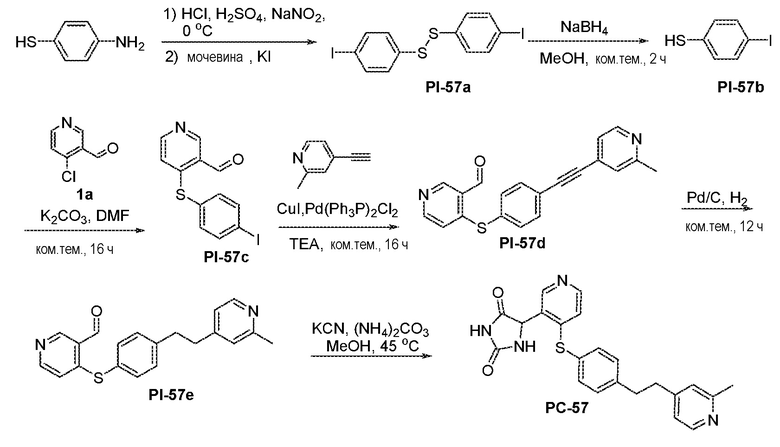
К раствору 4-аминотиофенола (10 г, 79,87 ммоль, 1,0 экв.) в H2O (80 мл) последовательно добавляли HCl (80 мл), H2SO4 (30 мл) и NaNO2 (6,6 г, 95,84 ммоль, 1,2 экв.) при 0°C. Смесь перемешивали при 0°C в течение 0,5 ч. Затем добавляли мочевину (0,46 г, 7,99 ммоль, 0,1 экв.). Через 15 мин раствор KI (26,5 г, 159,74 ммоль, 2,0 экв.) в H2O (1,5 L) по каплям добавляли при 0°C. Смесь перемешивали при 0°C в течение 5 ч. Затем смесь экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением PI-57a (7,3 г, 39%).
Смесь PI-57a (1,8 г, 3,83 ммоль, 1,0 экв.) в MeOH (40 мл) перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь концентрировали при пониженном давлении. Остаток разбавляли этилацетатом (50 мл) и промывали водой и насыщенным солевым раствором. Органический слой сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением PI-57b (0,9 г, 50%).
К раствору PI-57b (230 мг, 1 ммоль, 1,0 экв.) в DMF (10 мл) добавляли 4-хлорникотинальдегид (140 мг, 1 ммоль, 1,0 экв.) и K2CO3 (276 мг, 2 ммоль, 2,0 экв.). Смесь перемешивали при комнатной температуре в течение 16 ч. Затем добавляли воду (30 мл) и экстрагировали этилацетатом (20 мл х 3). Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением PI-57c (0,3 г, 88%).
К раствору PI-57c (1 г, 2,9 ммоль, 1,0 экв.) и 4-этинил-2-метилпиридина (0,41 г, 3,5 ммоль, 1,2 экв.) в TEA (1,19 г, 0,29 ммоль, 0,1 экв.) добавляли Pd(Ph3P)2Cl2 (0,21 г, 0,29 ммоль, 0,1 экв.) и CuI (0,06 г, 0,29 ммоль, 0,1 экв.) в атмосфере азота. Смесь перемешивали при комнатной температуре в течение 16 ч в атмосфере азота. Затем смесь гасили насыщенным раствором NH4Cl. Смесь экстрагировали этилацетатом. Объединенные органические фазы промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением PI-57d (0,8 г, 83%).
К раствору PI-57d (0,2 г, 0,61 ммоль, 1,0 экв.) в метаноле (10 мл) добавляли Pd/C (20 мг). Смесь перемешивали в атмосфере водорода (20 фунт/кв. дюйм) при комнатной температуре в течение 16 ч. Смесь фильтровали и фильтрат концентрировали с получением PI-57e (170 мг, 84%) без дополнительной очистки.
К раствору PI-57e (180 мг, 0,54 ммоль, 1,0 экв.) в MeOH (5 мл) добавляли (NH4)2CO3 (206 мг, 2,15 ммоль, 4,0 экв.) и KCN (70 мг, 1,08 ммоль, 2,0 экв.). Смесь перемешивали при 45°C в течение 16 ч. В реакционную смесь добавляли 3 M HCl для доведения pH=1~2 и перемешивали при комнатной температуре 1 ч, затем добавляли насыщенный водный раствор NaHCO3 для доведения pH=7~8 и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали препаративной ТСХ с получением PC-57 (60 мг, 27%) в виде желтого твердого вещества.
Получение соединения PC-58:
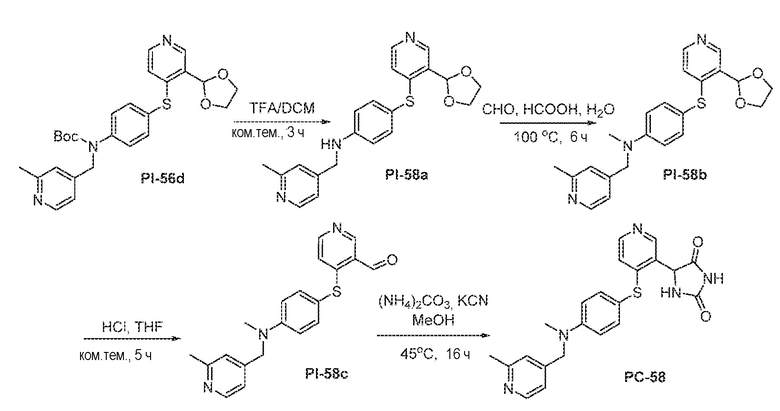
Смесь PI-56d (400 мг, 0,83 ммоль, 1,0 экв.) в TFA/DCM (1 мл /3 мл) перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли насыщенный раствор NaHCO3 для доведения pH=8 и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении с получением PI-58a (350 мг, 100%), которое использовали на следующей стадии без дополнительной очистки.
Получали смесь PI-58a (360 мг, 0,95 ммоль, 1,0 экв.) в муравьиной кислоте (80%, 3 мл) и растворе формальдегида (40%, 1 мл). Смесь нагревали при 100°C в течение 6 часов. Реакционную смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении. К остатку добавляли насыщенный раствор NaHCO3 для доведения pH=8 и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением PI-58b (210 мг, 56%).
Смесь PI-58b (210 мг, 0,53 ммоль, 1,0 экв.) в HCl/THF (2,0 M, 3 мл /3 мл) перемешивали при комнатной температуре в течение 5 ч. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли насыщенный раствор NaHCO3 для доведения pH=8 и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении с получением PI-58c (160 мг, 86%), которое использовали на следующей стадии без дополнительной очистки.
К раствору PI-58c (180 мг, 0,52 ммоль, 1,0 экв.) в MeOH (3 мл) добавляли (NH4)2CO3 (198 мг, 2,06 ммоль, 4,0 экв.) и KCN (67 мг, 1,03 ммоль, 2,0 экв.). Смесь перемешивали при 45°C в течение 16 ч. В реакционную смесь добавляли 3 M HCl для доведения pH=1~2 и перемешивали при комнатной температуре 1 ч, затем добавляли насыщенный водный раствор NaHCO3 для доведения pH=7~8 и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением PC-58 (118 мг, 54%) в виде желтого твердого вещества.
Получение соединения PC-59:
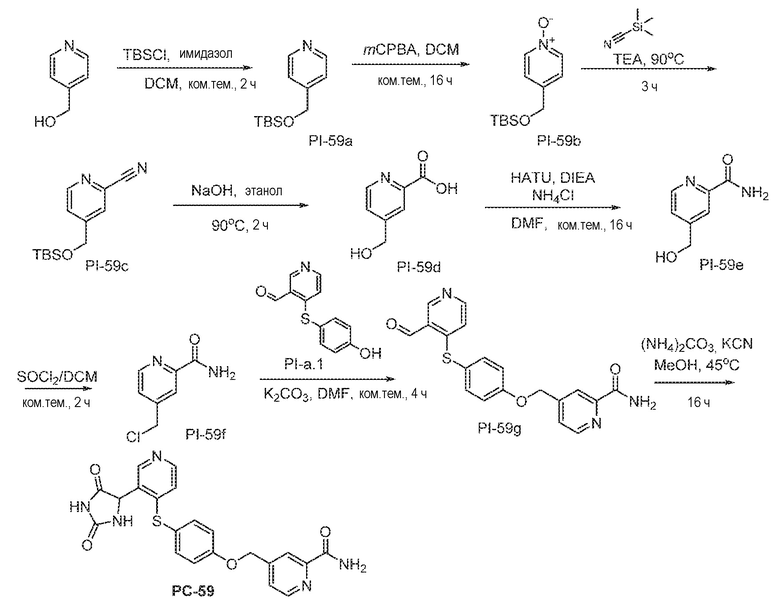
К раствору соединения 4-пиридинметанол (5 г, 45,82 ммоль, 1,0 экв.) и имидазола (7,97 г, 137,45 ммоль, 3,0 экв.) в DCM (100 мл) добавляли TBSCl (13,8 г, 91,64 ммоль, 2,0 экв.) при 0°C. Смесь перемешивали при комнатной температуре в течение 2 ч. Затем смесь гасили насыщенным раствором NH4Cl (100 мл). Смесь экстрагировали этилацетатом (50 млх3). Объединенные органические фазы промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением соединения PI-59a (7,2 г, 70%).
К раствору соединения PI-59a (10 г, 44,76 ммоль, 1,0 экв.) в DCM (150 мл) добавляли m-CPBA (11,58 г, 67,14 ммоль, 1,5 экв.) при комнатной температуре. Смесь перемешивали при комнатной температуре в течение 16 ч. Анализ реакционной смеси методом ТСХ показал полное превращение в целевой продукт. Затем смесь гасили насыщенным водным раствором сульфита натрия. Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением соединения PI-59b (8,1 г, 75%).
К смеси соединения PI-59b (10,3 г, 43,4 ммоль, 1,0 экв.) в TEA (40 мл) добавляли триметилсилилцианид (13 г, 130,4 ммоль, 3 экв.). Смесь нагревали при 90°C в течение 3 ч в атмосфере азота. Затем смесь концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением PI-59c (5,1 г, 47%).
К раствору PI-59c (5,1 г, 20,53 ммоль, 1,0 экв.) в этаноле/H2O (100/17 мл) добавляли NaOH (6,9 г, 172,5 ммоль, 8,4 экв.). Смесь перемешивали при 90°C в течение 2 ч. Затем смесь охлаждали до комнатной температуры и разбавляли водой (100 мл) и экстрагировали этилацетатом. Водный слой подкисляли до pH=4~5 и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением PI-59d (3,2 г, 99%).
К раствору PI-59d (2,2 г, 14,36 ммоль, 1,0 экв.) в DMF (100 мл) последовательно добавляли NH4Cl (1,54 г, 28,73 ммоль, 2,0 экв.), HATU (5,46 г, 14,36 ммоль, 1,0 экв.) и DIEA (5,57 г, 43,08 ммоль, 3,0 экв.). Смесь перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь разбавляли этилацетатом (200 мл) и промывали насыщенным солевым раствором, водой, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением PI-59e (0,6 г, 27%).
К смеси PI-59e (0,53 г, 3,48 ммоль, 1,0 экв.) в DCM (50 мл) добавляли SOCl2 (0,83 г, 6,96 ммоль, 2,0 экв.) по каплям при 0°C в атмосфере азота. Смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь разбавляли DCM (50 мл) и промывали насыщенным водным раствором NaHCO3, насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении с получением PI-59f (0,47 г, 79%).
К раствору PI-59f (470 мг, 2,75 ммоль, 1,0 экв.) в DMF (20 мл) добавляли PI-a.1 (636 мг, 2,75 ммоль, 1,0 экв.) и K2CO3 (759 мг, 5,5 ммоль, 2 экв.). Смесь перемешивали при комнатной температуре в течение 4 ч. Затем смесь разбавляли водой (50 мл) и экстрагировали этилацетатом (30 мл х 3). Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением PI-59g (210 мг, 21%).
К раствору PI-59g (400 мг, 1,09 ммоль, 1,0 экв.) в MeOH (7 мл) добавляли (NH4)2CO3 (419 мг, 4,38 ммоль, 4,0 экв.) и KCN (141 мг, 2,19 ммоль, 2,0 экв.). Смесь перемешивали при 45°C в течение 16 ч. В реакционную смесь добавляли 3 M HCl для доведения pH=1~2 и перемешивали при комнатной температуре 1 ч, затем добавляли насыщенный водный раствор NaHCO3 для доведения pH=7~8 и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением PC-59 (52 мг, 11%) в виде белого твердого вещества.
Получение соединения PC-60:
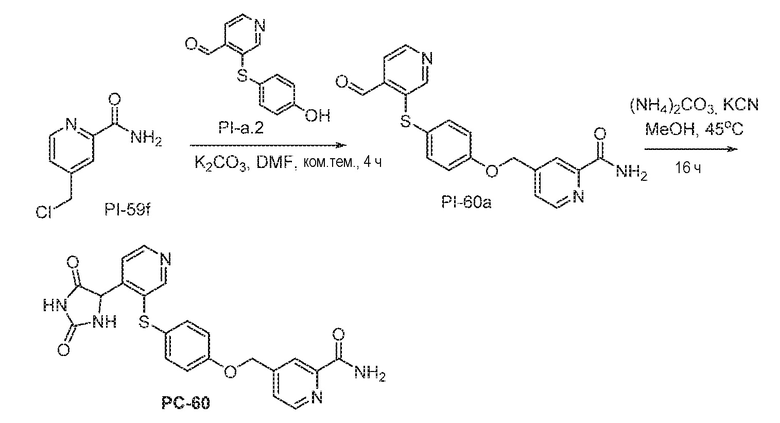
К раствору PI-59f (470 мг, 2,75 ммоль, 1,0 экв.) в DMF (20 мл) добавляли PI-a.2 (636 мг, 2,75 ммоль, 1,0 экв.) и K2CO3 (759 мг, 5,5 ммоль, 2 экв.). Смесь перемешивали при комнатной температуре в течение 4 ч. Затем смесь разбавляли водой (50 мл) и экстрагировали этилацетатом (30 мл х 3). Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением PI-60a (230 мг, 23%).
К раствору PI-60a (230 мг, 0,63 ммоль, 1,0 экв.) в MeOH (6 мл) добавляли (NH4)2CO3 (241 мг, 2,51 ммоль, 4,0 экв.) и KCN (81 мг, 1,26 ммоль, 2,0 экв.). Смесь перемешивали при 45°C в течение 16 ч. В реакционную смесь добавляли 3 M HCl для доведения pH=1~2 и перемешивали при комнатной температуре 1 ч, затем добавляли насыщенный водный раствор NaHCO3 для доведения pH=7~8 и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением PC-60 (53 мг, 19%) в виде желтого твердого вещества.
Получение соединения PC-61:
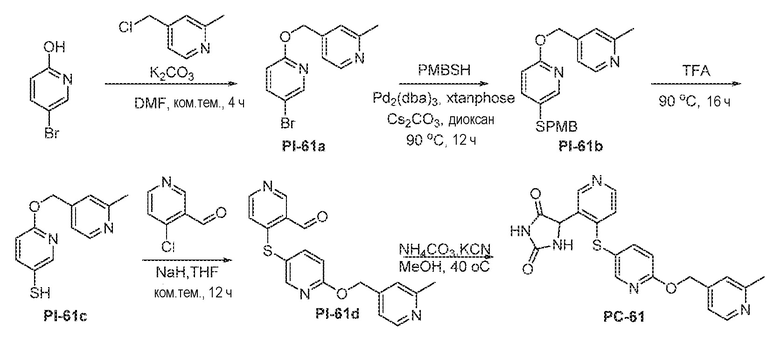
К раствору 5-бром-2-гидроксипиридина (5 г, 28,74 ммоль, 1,0 экв.) в DMF (100 мл) добавляли 4-(хлорметил)-2-метилпиридин (4,07 г, 28,74 ммоль, 1,0 экв.) и K2CO3 (7,93 г, 57,47 ммоль, 2 экв.). Смесь перемешивали при комнатной температуре в течение 4 ч. Затем смесь разбавляли водой (200 мл) и экстрагировали этилацетатом (100 мл x3). Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением PI-61a (4,1 г, 51%).
К смеси PI-61a (1 г, 3,58 ммоль, 1,0 экв.), 4-метокси-α-толуентиола (607 мг, 3,94 ммоль, 1,1 экв.), xantphose (207 мг, 0,36 ммоль, 0,1 экв.) и Cs2CO3 (1,75 г, 5,37 ммоль, 1,5 экв.) в диоксане (30 мл) добавляли Pd2(dba)3 (230 мг, 0,25 ммоль, 0,07 экв.) в атмосфере азота. Смесь перемешивали при 90°C в течение 12 ч. Затем смесь фильтровали и экстрагировали водой (50 мл) и этилацетатом (30 мл x 3). Органическую фазу сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением PI-61b (0,8 г, 63%).
PI-61b (1 г, 2,83 ммоль, 1,0 экв.) растворяли в TFA (20 мл) и перемешивали при 90°C в течение 16 ч в атмосфере азота. Затем смесь концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением PI-61c (0,5 г, 76%).
К раствору PI-61c (600 мг, 2,58 ммоль, 1,0 экв.) в THF (20 мл) добавляли NaH (103 мг, 2,58 ммоль, 1 экв., 60%) при 0°C в атмосфере азота. Смесь перемешивали при 0°C в течение 1 ч. Затем 4-хлорникотинальдегид (365 мг, 2,58 ммоль, 1,0 экв.) добавляли. Смесь перемешивали при комнатной температуре в течение 12 ч. Смесь разбавляли водой (50 мл) и экстрагировали этилацетатом (30 мл х 3). Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением PI-61d (250 мг, 29%)
К раствору PI-61d (200 мг, 0,59 ммоль, 1,0 экв.) в MeOH (5 мл) добавляли (NH4)2CO3 (227 мг, 2,37 ммоль, 4,0 экв.) и KCN (77 мг, 1,19 ммоль, 2,0 экв.). Смесь перемешивали при 45°C в течение 16 ч. В реакционную смесь добавляли 3 M HCl для доведения pH=1~2 и перемешивали при комнатной температуре 1 ч, затем добавляли насыщенный водный раствор NaHCO3 для доведения pH=7~8 и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением PC-61 (104 мг, 43%) в виде белого твердого вещества.
Получение соединения PC-62:
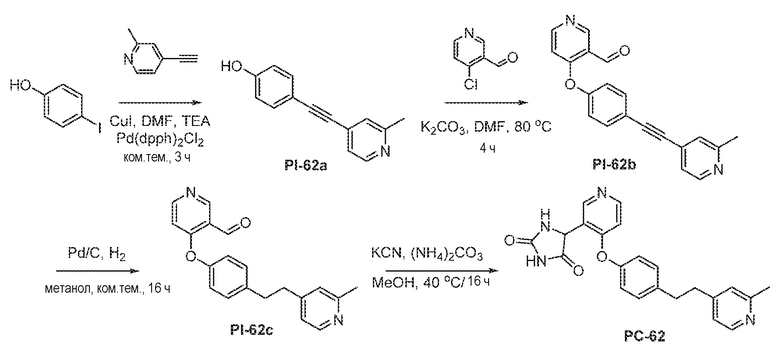
К раствору 4-йодофенола (2,2 г, 10 ммоль, 1,0 экв.) и 4-этинил-2-метилпиридина (1,29 г, 11 ммоль, 1,1 экв.) в DMF (30 мл) добавляли TEA (3,2 г, 30 ммоль, 3 экв.), Pd(Ph3P)2Cl2 (1,4 г, 2 ммоль, 0,2 экв.) и CuI (0,38 г, 2 ммоль, 0,2 экв.) в атмосфере азота. Смесь перемешивали при комнатной температуре в течение 3 ч в атмосфере азота. Затем смесь гасили насыщенным раствором NH4Cl (50 мл). Смесь экстрагировали этилацетатом (30 мл х 3). Объединенные органические фазы промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением PI-62a (1,05 г, 45%).
К раствору PI-62a (0,8 г, 3,82 ммоль, 1,0 экв.) в DMF (40 мл) добавляли 4-хлорникотинальдегид (0,54 г, 3,82 ммоль, 1,0 экв.) и K2CO3 (1,05 г, 7,64 ммоль, 2 экв.). Смесь перемешивали при 80°C в течение 4 ч. Затем смесь разбавляли водой (100 мл) и экстрагировали этилацетатом (50 млх3). Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением PI-62b (0,45 г, 37%).
К раствору PI-62b (1,0 экв.) в метаноле (10 мл) добавляли Pd/C (20 мг). Смесь перемешивали в атмосфере водорода (20 фунт/кв. дюйм) при комнатной температуре в течение 16 ч. Смесь фильтровали, и фильтрат концентрировали с получением PI-62c без дополнительной очистки.
К раствору PI-62c (1,0 экв.) в MeOH (5 мл) добавляли (NH4)2CO3 (4,0 экв.) и KCN (2,0 экв.). Смесь перемешивали при 45°C в течение 16 ч. В реакционную смесь добавляли 3 М HCl для доведения pH=1~2 и перемешивали при комнатной температуре 1 ч, затем добавляли насыщенный водный раствор NaHCO3 для доведения pH=7~8 и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении с получением PC-62.
Получение соединения PC-63:
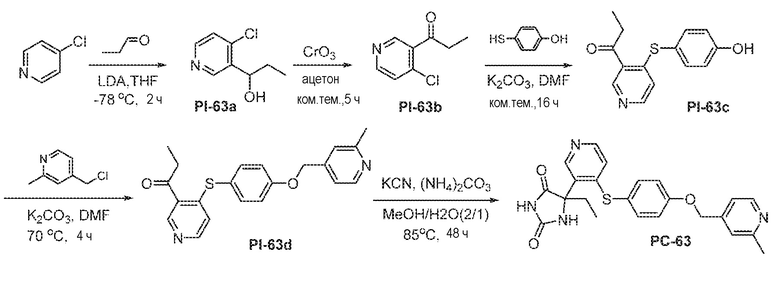
К смеси 4-хлорпиридина (100 г, 0,667 моль, 1,0 экв.) в сухом THF (1 л) быстро добавляли LDA (2 M в THF, 733,26 мл, 1,467 моль, 2,2 экв.) при -78°C в атмосфере азота. Смесь перемешивали при -78°C в течение 1 ч. Затем пропиональдегид (74,1 г, 0,999 моль, 1,5 экв.) добавляли по каплям и смесь перемешивали в течение 1 ч. Анализ реакционной смеси методом ТСХ показал полное превращение в целевой продукт. Реакцию гасили насыщенным водным раствором NH4Cl и экстрагировали этилацетатом (3 x500 мл). Органический слой промывали насыщенным солевым раствором и водой, сушили над Na2SO4 и концентрировали под вакуумом. Остаток очищали колоночной хроматографией на силикагеле (PE:EA, 3:1) с получением PI-63a (45 г, 48%).
К смеси PI-63a (26,3 г, 0,154 моль, 1,0 экв.) в ацетоне (300 мл) добавляли CrO3 (30,8 г, 0,308 моль, 2,0 экв.). Смесь перемешивали при комнатной температуре в течение 5 ч. Затем смесь фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением PI-63b (16,0 г, 62%)
К смеси PI-63b (1 г, 4,67 ммоль, 1,0 экв.) и 4-меркаптофенола (590 мг, 4,67 ммоль, 1,0 экв.) в DMF (50 мл) добавляли K2CO3 (1,29 г, 9,34 ммоль, 2 экв.). Смесь перемешивали при комнатной температуре в течение 16 ч в атмосфере азота. Затем смесь гасили H2O (100 мл) и экстрагировали этилацетатом (50 мл x3). Объединенные органические фазы промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением PI-63c (1,2 г, 99%).
К смеси PI-63c (500 мг, 1,93 ммоль, 1,0 экв.) и 4-(хлорметил)-2-метилпиридин (409 мг, 2,89 ммоль, 1,5 экв.) в DMF (20 мл) добавляли K2CO3 (798 мг, 5,78 ммоль, 3 экв.). Смесь перемешивали при 70°C в течение 4 ч в атмосфере азота. Затем смесь гасили H2O (60 мл) и экстрагировали этилацетатом (30 мл х 3). Объединенные органические фазы промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением PI-63d (610 мг, 87%).
К раствору PI-63d (610 мг, 1,68 ммоль, 1,0 экв.) в MeOH/H2O (12 мл, 5/1) добавляли (NH4)2CO3 (644 мг, 6,71 ммоль, 4,0 экв.) и KCN (218 мг, 3,36 ммоль, 2,0 экв.). Смесь перемешивали при 45°C в течение 16 ч. В реакционную смесь добавляли 3 M HCl для доведения pH=1~2 и перемешивали при комнатной температуре 1 ч, затем добавляли насыщенный водный раствор NaHCO3 для доведения pH=7~8 и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением PC-63 (80 мг, 11%) в виде белого твердого вещества.
Получение соединения PC-64:
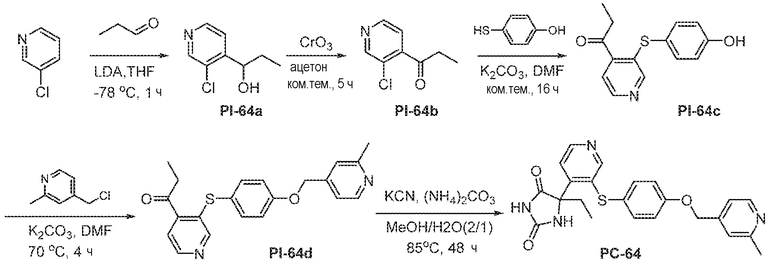
К смеси 3-хлорпиридина (100 г, 0,667 моль, 1,0 экв.) в сухом THF (1 л) быстро добавляли LDA (2 M в THF, 733,26 мл, 1,467 моль, 2,2 экв.) при -78°C в атмосфере азота. Смесь перемешивали при -78°C в течение 1 ч. Затем пропиональдегид (74,1 г, 0,999 моль, 1,5 экв.) добавляли по каплям и смесь перемешивали в течение 1 ч. Анализ реакционной смеси методом ТСХ показал полное превращение в целевой продукт. Реакцию гасили насыщенным водным раствором NH4Cl и экстрагировали этилацетатом (3 x500 мл). Органический слой промывали насыщенным солевым раствором и водой, сушили над Na2SO4 и концентрировали под вакуумом. Остаток очищали колоночной хроматографией на силикагеле (PE:EA, 3:1) с получением PI-64a (45 г, 48%).
К смеси PI-64a (26,3 г, 0,154 моль, 1,0 экв.) в ацетоне (300 мл) добавляли CrO3 (30,8 г, 0,308 моль, 2,0 экв.). Смесь перемешивали при комнатной температуре в течение 5 ч. Затем смесь фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением PI-64b (16,0 г, 62%)
К смеси PI-64b (1 г, 4,67 ммоль, 1,0 экв.) и 4-меркаптофенола (590 мг, 4,67 ммоль, 1,0 экв.) в DMF (50 мл) добавляли K2CO3 (1,29 г, 9,34 ммоль, 2 экв.). Смесь перемешивали при комнатной температуре в течение 16 ч в атмосфере азота. Затем смесь гасили H2O (100 мл) и экстрагировали этилацетатом (50 млх3). Объединенные органические фазы промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением PI-64c (1,2 г, 99%).
К смеси PI-64c (500 мг, 1,93 ммоль, 1,0 экв.) и 4-(хлорметил)-2-метилпиридина (409 мг, 2,89 ммоль, 1,5 экв.) в DMF (20 мл) добавляли K2CO3 (798 мг, 5,78 ммоль, 3 экв.). Смесь перемешивали при 70°C в течение 4 ч в атмосфере азота. Затем смесь гасили H2O (60 мл) и экстрагировали этилацетатом (30 мл х 3). Объединенные органические фазы промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением PI-64d (610 мг, 87%).
К раствору PI-64d (700 мг, 1,92 ммоль, 1,0 экв.) в MeOH/H2O (12 мл, 5/1) добавляли (NH4)2CO3 (637 мг, 7,68 ммоль, 4,0 экв.) и KCN (248 мг, 3,83 ммоль, 2,0 экв.). Смесь перемешивали при 45°C в течение 16 ч. В реакционную смесь добавляли 3 M HCl для доведения pH=1~2 и перемешивали при комнатной температуре в течение 1 ч, затем добавляли насыщенный водный раствор NaHCO3 для доведения pH=7~8 и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением PC-64 (242 мг, 29%) в виде белого твердого вещества.
Получение соединений OC-1 и OC-2:
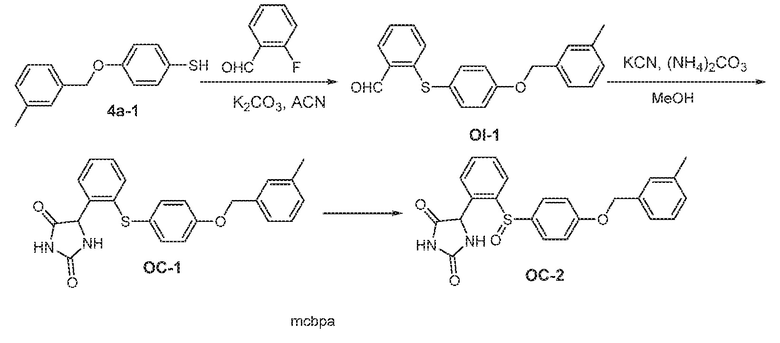
К смеси соединения 4a-1 (0,5 г, 2,17 ммоль, 1,0 экв.) в ACN (15 мл) добавляли 2-фторбензальдегид (0,271 г, 2,17 ммоль, 1,0 экв.) и K2CO3 (0,906 г, 6,52 ммоль, 3,0 экв.). Смесь перемешивали при 85°C в течение ночи в атмосфере азота. Затем смесь концентрировали под вакуумом. Остаток очищали препаративной ТСХ с получением соединения OI-1 (490 мг, 68%).
К смеси соединения OI-1 (200 мг, 0,6 ммоль, 1,0 экв.) в MeOH (10 мл) добавляли KCN (78 мг, 1,2 ммоль, 2,0 экв.) и (NH4)2CO3 (230 мг, 2,4 ммоль, 4,0 экв.). Смесь перемешивали при 40°C в течение ночи в атмосфере азота. Затем смесь концентрировали в вакууме, получая соединение OC-1 (200 мг, 82%).
К смеси соединения OC-1 (15 мг, 0,037 ммоль, 1,0 экв.) в диоксане (1 мл) добавляли m-CPBA (6,4 мг, 0,037 ммоль, 1,0 экв.). Смесь перемешивали при комнатной температуре в течение 12 ч. Затем смесь разбавляли EA и промывали насыщенным водным раствором NaHCO3. Органический слой концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением соединения OC-2 (9,6 мг, 62%).
Получение соединений OC-3 и OC-4:
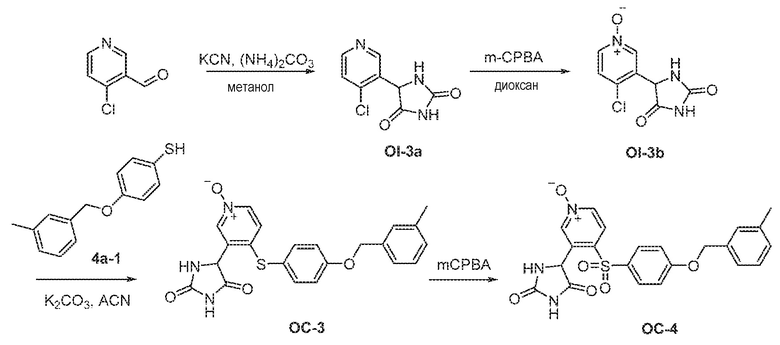
К смеси 4-хлорникотинальдегида (1 г, 7,1 ммоль, 1,0 экв.) в MeOH (6 мл) добавляли KCN (0,92 мг, 14,2 ммоль, 2,0 экв.) и (NH4)2CO3 (2,71 г, 28,2 ммоль, 4,0 экв.). Смесь перемешивали при комнатной температуре в течение 12 ч. Затем смесь разбавляли водой и экстрагировали этилацетатом. Органическую фазу сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали препаративной ТСХ с получением соединения OI-3a (1,0 г,66%) в виде белого твердого вещества.
К смеси OI-3a (1,0 г, 4,73 ммоль, 1,0 экв.) в диоксане (10 мл) добавляли m-CPBA (0,82 г, 4,73 ммоль, 1,0 экв.). Смесь перемешивали при комнатной температуре в течение 12 ч. Затем смесь разбавляли EA и промывали насыщенным водным раствором NaHCO3. Органический слой концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением OI-3b (200 мг, 19%).
К смеси OI-3b (100 мг, 0,43 ммоль, 1,0 экв.) и соединения 4a-1 (99 мг, 0,43 ммоль, 1 экв.) в ACN (2 мл) последовательно добавляли K2CO3 (182 мг, 1,31 ммоль, 3,0 экв.). Смесь перемешивали при 85°C в течение 12 ч в атмосфере азота. Анализ реакционной смеси методом ТСХ показал полное превращение в целевой продукт. Затем смесь выливали в воду и экстрагировали EA (3×5 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле с получением OC-3 (23,6 мг, 13%).
К смеси соединения OC-3 (20 мг, 0,05 ммоль, 1,0 экв.) в диоксане (1 мл) добавляли m-CPBA (8,5 мг, 0,05 ммоль, 1,0 экв.). Смесь перемешивали при комнатной температуре в течение 12 ч. Затем смесь разбавляли EA и промывали насыщенным водным раствором NaHCO3. Органический слой концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением OC-4 (8 мг, 40%).
Получение соединения OC-5:
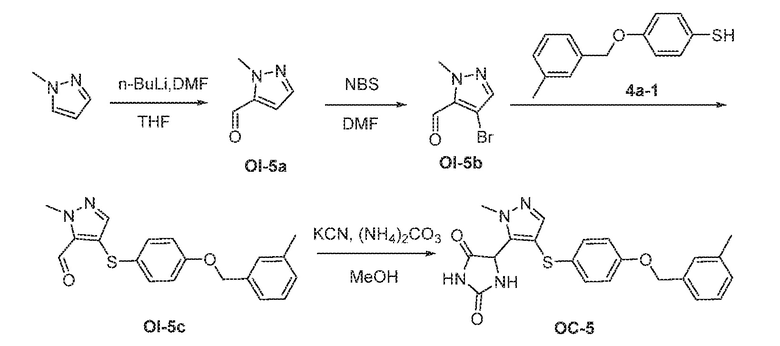
К смеси 1-метил-1H-пиразола (16,4 г, 0,2 моль, 1,0 экв.) в сухом THF (150 мл) добавляли n-BuLi (2,5 M в гексане, 96 мл, 0,24 моль, 1,2 экв.) при -78°C в атмосфере азота. Смесь перемешивали при -78°C в течение 1 ч. Затем DMF (30,8 мл, 0,4 моль, 2,0 экв.) добавляли по каплям и смесь перемешивали в течение 1 ч. Анализ реакционной смеси методом ТСХ показал полное превращение в целевой продукт. Реакцию гасили насыщенным водным раствором NH4Cl и экстрагировали EA (3 x500 мл). Органический слой промывали насыщенным солевым раствором и водой, сушили над Na2SO4 и концентрировали под вакуумом. Остаток очищали колоночной хроматографией на силикагеле с получением соединения OI-5a (12,7 г, 58%).
К смеси соединения OI-5a (2 г, 18,2 ммоль, 1,0 экв.) в DMF (20 мл) добавляли NBS (4,86 г, 27,3 ммоль, 1,5 экв.). Смесь перемешивали при комнатной температуре в течение 16 ч в атмосфере азота. Затем смесь фильтровали и экстрагировали водой и этилацетатом. Органическую фазу сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением соединения OI-5b (2,3 г, 67%).
К смеси OI-5b (700 мг, 3,72 ммоль, 1,0 экв.), 4a-1 (1,27 г, 4,09 ммоль, 1,1 экв.), DPPF (42 мг, 0,503 ммоль, 0,1 экв.) и DIEA (942 мг, 7,55 ммоль, 1,5 экв.) в толуоле (10 мл) добавляли Pd(dba)2 (150 мг, 0,260 ммоль, 0,07 экв.) в атмосфере азота. Смесь перемешивали при 110°C в течение 16 ч. Затем смесь фильтровали и экстрагировали водой и этилацетатом. Органическую фазу сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением OI-5c (120 мг, 10%)
К смеси соединения OI-5c (140 мг, 0,414 ммоль, 1,0 экв.) в MeOH (5 мл) добавляли KCN (54 мг, 0,828 ммоль, 2,0 экв.) и (NH4)2CO3 (159 мг, 1,66 ммоль, 4,0 экв.). Смесь перемешивали при комнатной температуре в течение 12 ч. Затем смесь разбавляли водой и экстрагировали этилацетатом. Органическую фазу сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали препаративной ТСХ с получением соединения OC-5 (67 мг, 40%) в виде белого твердого вещества.
Получение соединения OC-6:
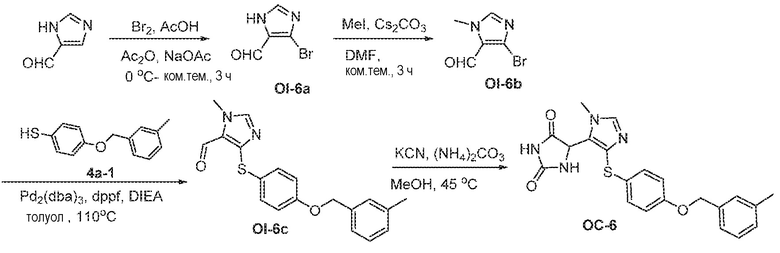
К смеси 4-имидазолкарбоксальдегида (1 г, 10,4 ммоль, 1,0 экв.) и NaOAc (14,15 г, 104 ммоль, 10 экв.) в AcOH (100 мл) по каплям добавляли раствор Br2 (3,8 г, 23,77 ммоль, 2,3 экв.) в Ac2O (20 мл) при 0°C в атмосфере азота. Смесь перемешивали при комнатной температуре в течение 3 ч. Анализ реакционной смеси методом ТСХ показал полное превращение в целевой продукт. Реакцию гасили насыщенным водным NaHCO3 и экстрагировали EA (3 x20 мл). Органический слой промывали насыщенным солевым раствором и водой, сушили над Na2SO4 и концентрировали в вакууме. Остаток очищали колоночной хроматографией с получением OI-6a (0,8 г, 44%).
К смеси OI-6a (1 г, 5,71 ммоль, 1,0 экв.) и Cs2CO3 (1,86 г, 5,71 ммоль, 1,0 экв.) в DMF (50 мл) последовательно добавляли MeI (0,82 г, 5,71 ммоль, 1,0 экв.). Смесь перемешивали при комнатной температуре в течение 3 ч в атмосфере азота. Анализ реакционной смеси методом ТСХ показал полное превращение в целевой продукт. Затем смесь выливали в воду и экстрагировали EA (3×30 мл). Объединенные органические слои промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на силикагеле с получением OI-6b (0,7 г, 65%).
К смеси OI-6b (0,7 г, 3,7 ммоль, 1,0 экв.), 4a-1 (1,27 г, 5,56 ммоль, 1,5 экв.), CyPF-tBu (CAS: 158923-11-6) (21 мг, 0,04 ммоль, 0,01 экв.) и Cs2CO3 (942 мг, 7,55 ммоль, 2,5 экв.) в DME (10 мл) добавляли Pd(OAc)2 (8 мг, 0,04 ммоль, 0,01 экв.) в атмосфере азота. Смесь перемешивали при 110°C в течение 16 ч. Затем смесь фильтровали и экстрагировали водой и этилацетатом. Органическую фазу сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением OI-6c (0,28 г, 22%)
К раствору OI-6c (280 мг, 0,83 ммоль, 1,0 экв.) в MeOH (5 мл) добавляли (NH4)2CO3 (320 мг, 3,31 ммоль, 4,0 экв.) и KCN (108 мг, 1,65 ммоль, 2,0 экв.). Смесь перемешивали при комнатной температуре в течение 16 ч. В реакционную смесь добавляли 3 M HCl для доведения pH=1~2 и перемешивали при комнатной температуре в течение 1 ч, затем добавляли насыщенный водный раствор NaHCO3 для доведения pH=6~7 и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением OC-6 (200 мг, 59%) в виде белого твердого вещества.
Получение соединений OC-7 и OC-10:
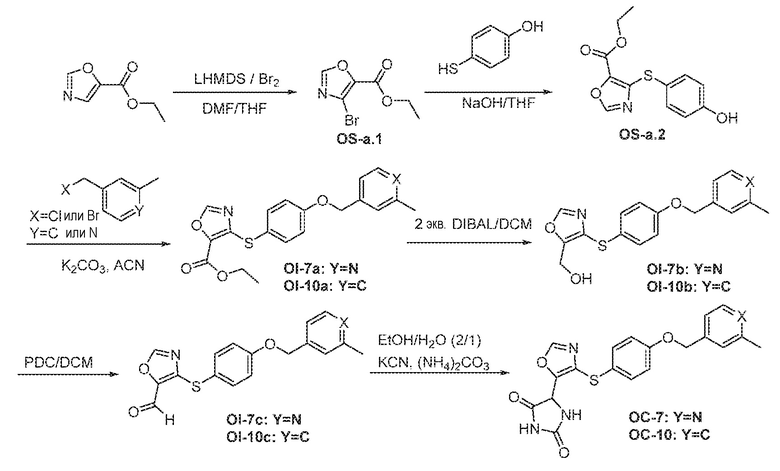
К раствору этилоксазол-5-карбоксилата (0,28 г, 2,00 ммоль) в THF/DMF (2/2 мл) добавляли Br2 (0,13 мл, 2,6 ммоль, 1,3 экв.) и LHMDS (2,6 мл 2,6 ммоль, 1,3 экв.) с получением реакционной смеси, кторую перемешивали при -60°C в течение 4 часов. Реакционную смесь экстрагировали ЕА и водой и объединенный органический слой сушили MgSO4. Остаток очищали флэш-хроматографией с EA/гексаном (EA/гексан=1:4) с получением OS-a.1 в виде желтого масла (0,1 г, 30%).
К раствору OS-a.1 (0,3 г, 1,36 ммоль) в THF (10 мл) добавляли NaOH (81 мг, 2,05 ммоль, 1,5 экв.) и 4-меркаптофенол (0,17 г, 1,36 ммоль, 1 экв.) перемешивали в течение ночи. Реакционную смесь экстрагировали ЕА и водой и объединенный органический слой сушили MgSO4. Остаток очищали флэш-хроматографией с EA/гексаном (EA/гексан=1:2) с получением OS-a.2 в виде желтого твердого вещества (0,25 г, 71%).
К раствору соединения OS-a.2 (4,2 г, 15,85 ммоль, 1,0 экв.) в DMF (40 мл) добавляли 4-(хлорметил)-2-метилпиридин (2,2 г, 15,85 ммоль, 1,0 экв.) и K2CO3 (6,6 г, 47,55 ммоль, 3,0 экв.) при комнатной температуре в атмосфере азота. Смесь перемешивали при 30°C в течение 16 ч. Анализ реакционной смеси методом ТСХ показал полное превращение в целевой продукт. Затем смесь разбавляли водой и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением соединения OI-7a (2,5 г, 44%).
К раствору OI-7a (1,4 г, 3,93 ммоль, 1,0 экв.) в безводном THF (10 мл) добавляли DIBAL-H (1 M в гексане, 7,87 мл, 7,87 ммоль, 2,0 экв.) по каплям при 0°C. Смесь перемешивали при 0°C в течение 2 ч в атмосфере азота. Анализ реакционной смеси методом ТСХ показал полное превращение в целевой продукт. Затем смесь гасили насыщенным раствором Na2SO4⋅10H2O (50 мл). Смесь экстрагировали DCM (3×30 мл). Объединенные органические фазы промывали насыщенным солевым раствором (2×60 мл), сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением OI-7b (620 мг, 48%).
К раствору OI-7b (620 мг, 1,89 ммоль, 1,0 экв.) в DCM (5 мл) добавляли PDC (1,4 г, 3,78 ммоль, 2,0 экв.) и K2CO3 (782 мг, 5,67 ммоль, 3,0 экв.) при комнатной температуре в атмосфере азота. Смесь перемешивали при 40°C в течение 16 ч. Анализ реакционной смеси методом ТСХ показал полное превращение в целевой продукт. Затем смесь разбавляли водой и экстрагировали DCM. Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением OI-7c (205 мг, 33%).
К раствору OI-7c (205 мг, 0,629 ммоль, 1,0 экв.) в MeOH (3 мл) добавляли (NH4)2CO3 (241 мг, 2,52 ммоль, 4,0 экв.) и KCN (82 мг, 1,26 ммоль, 2,0 экв.). Смесь перемешивали при комнатной температуре в течение 16 ч. В реакционную смесь добавляли 3 M HCl для доведения pH=1-2 и перемешивали при комнатной температуре в течение 1 ч, затем добавляли насыщенный водный раствор NaHCO3 для доведения pH=6-7 и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали препаративной ТСХ с получением OC-7 (41 мг, 16%) в виде белого твердого вещества. Соединение OC-10 синтезировали таким же образом, за исключением того, что (хлорметил)-2-метилпиридин заменяли на 1-(бромметил)-3-метилбензол.
Получение соединения OC-8:
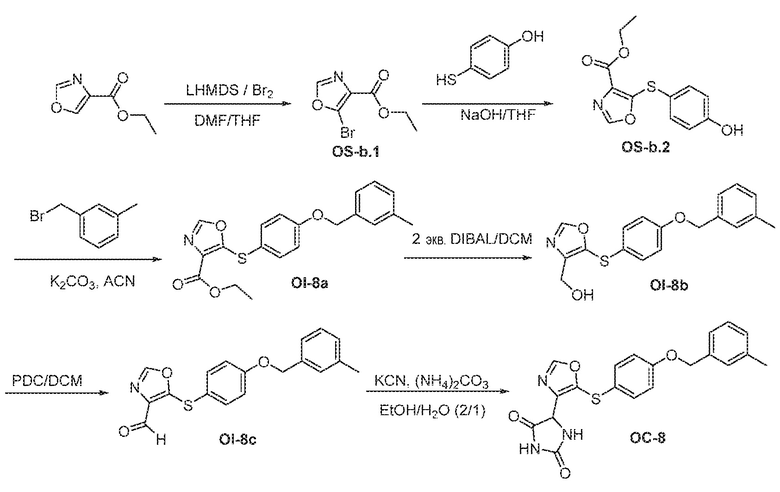
Соединение OC-8 синтезировали по той же процедуре, что и синтез соединения OC-10, за исключением того, что исходное вещество этилоксазол-5-карбоксилат заменяли на этилоксазол-4-карбоксилат.
Получение соединения OC-9:
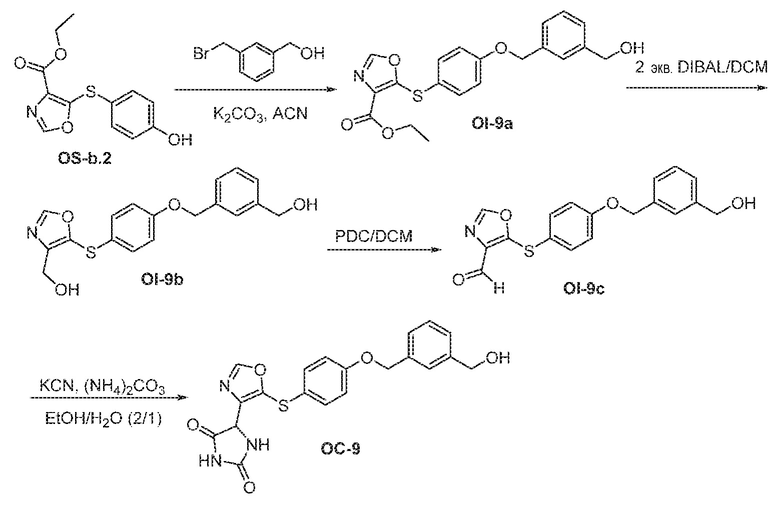
Соединение OC-9 синтезировали по той же процедуре, что и синтез OC-8 за исключением того, что исходное вещество 1-(бромметил)-3-метилбензол заменяли на (3-(бромметил)фенил)метанол.
Получение соединения OC-11
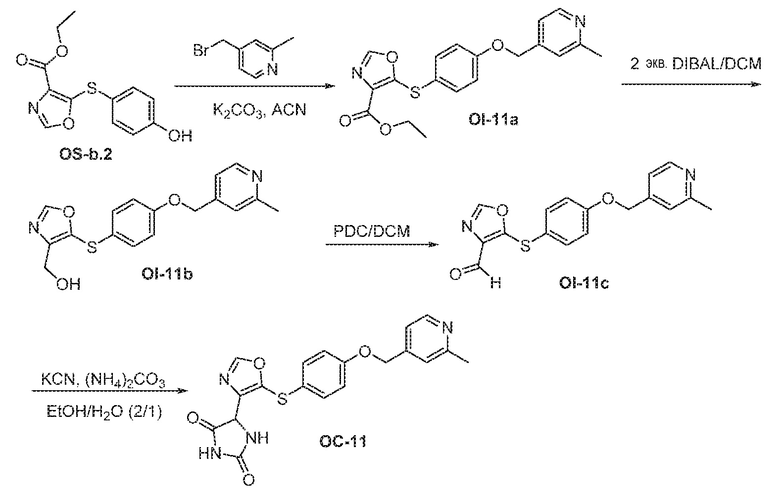
Соединение OC-11 синтезировали по той же процедуре, что и синтез OC-8 за исключением того, что исходное вещество 1-(бромметил)-3-метилбензол заменяли на 4-(хлорметил)-2-метилпиридин.
Получение соединения OC-12:
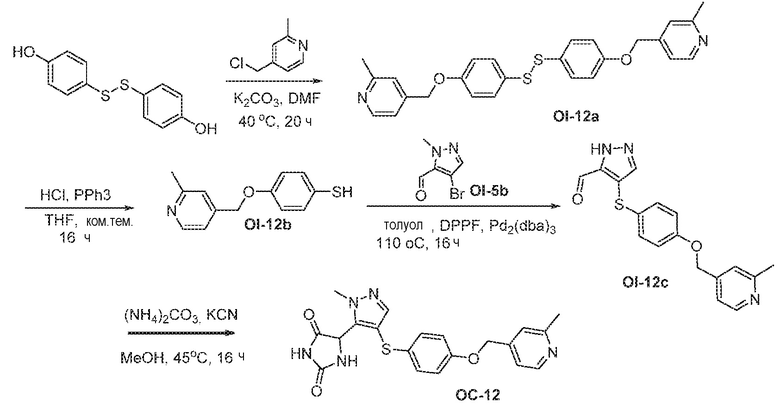
К раствору бис(4-гидроксифенил)дисульфида (5,0 г, 19,97 ммоль, 1,0 экв.) в DMF (100 мл) добавляли 4-(хлорметил)-2-метилпиридин (6,22 г, 43,94 ммоль, 2,2 экв.) и K2CO3 (8,2 г, 59,91 ммоль, 3 экв.). Смесь перемешивали при 45°C в течение 12 ч. Затем смесь разбавляли водой (200 мл) и экстрагировали этилацетатом (100 мл*3). Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением OI-12a (3,9 г, 42%).
К раствору OI-12a (3,9 г, 8,46 ммоль, 1,0 экв.) в THF (50 мл) добавляли PPh3 (2,22 г, 8,46 ммоль, 1,0 экв.) и концентрированную HCl (8,8 мл, 84,6 ммоль, 10 экв.). Смесь перемешивали при комнатной температуре в течение 16 ч. Затем смесь разбавляли водой (100 мл) и экстрагировали этилацетатом (50 мл x3). Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением соединения OI-12b (2,1 г, 53%).
К смеси OI-12b (296 мг, 1,28 ммоль, 1,1 экв.), OI-5b (220 мг, 1,16 ммоль, 1,0 экв.), DPPF (10 мг, 0,12 ммоль, 0,1 экв.) и DIEA (225 мг, 1,74 ммоль, 1,5 экв.) в толуоле (10 мл) добавляли Pd2(dba)3 (47 мг, 0,08 ммоль, 0,07 экв.) в атмосфере азота. Смесь перемешивали при 110°C в течение 16 ч. Затем смесь фильтровали и экстрагировали водой и этилацетатом. Органическую фазу сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением OI-12c (180 мг, 45%)
К смеси OI-12c (120 мг, 0,35 ммоль, 1,0 экв.) в MeOH (4 мл) добавляли KCN (46 мг, 0,7 ммоль, 2,0 экв.) и (NH4)2CO3 (134 мг, 1,4 ммоль, 4,0 экв.). Смесь перемешивали при 45°C в течение 16 ч. В реакционную смесь добавляли 3 M HCl для доведения pH=1~2 и перемешивали при комнатной температуре в течение 1 ч, затем добавляли насыщенный водный раствор NaHCO3 для доведения pH=7~8 и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали препаративной ТСХ с получением соединения OC-12 (50 мг, 35%) в виде белого твердого вещества.
Получение соединения OC-13:
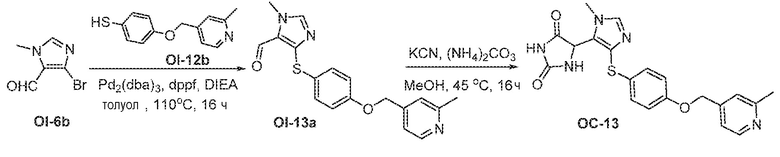
К смеси OI-6b (310 мг, 1,63 ммоль, 1,0 экв.), OI-12b (414 мг, 1,79 ммоль, 1,1 экв.), DPPF (88 мг, 0,16 ммоль, 0,1 экв.) и DIEA (313 мг, 2,43 ммоль, 1,5 экв.) в толуоле (16 мл) добавляли Pd2(dba)3 (104 мг, 0,11 ммоль, 0,07 экв.) в атмосфере азота. Смесь перемешивали при 110°C в течение 16 ч. Затем смесь фильтровали и экстрагировали водой (50 мл) и этилацетатом (30 мл х 3). Органическую фазу сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением OI-13a (400 мг, 72%)
К смеси OI-13a (370 мг, 1,09 ммоль, 1,0 экв.) в MeOH (10 мл) добавляли KCN (142 мг, 2,18 ммоль, 2,0 экв.) и (NH4)2CO3 (418 мг, 4,36 ммоль, 4,0 экв.). Смесь перемешивали при 45°C в течение 16 ч. В реакционную смесь добавляли 3 M HCl для доведения pH=1~2 и перемешивали при комнатной температуре 1 ч, затем добавляли насыщенный водный раствор NaHCO3 для доведения pH=7~8 и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали препаративной ТСХ с получением OC-13 (73 мг, 16%) в виде белого твердого вещества.
Получение соединения OC-14:
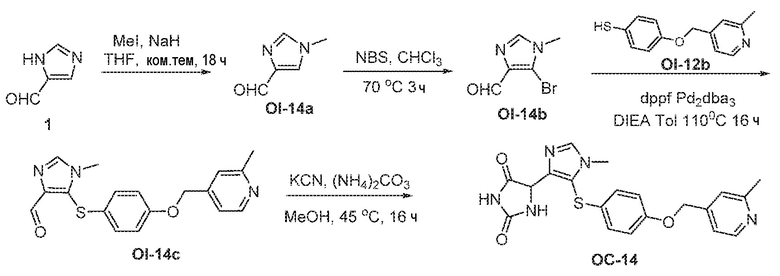
К смеси 4-имидазолкарбоксальдегида (6 г, 62,44 ммоль, 1,0 экв.) в THF (60 мл) добавляли NaH (3 г, 74,9 ммоль, 1,2 экв.) при комнатной температуре. Через 10 мин, смесь охлаждали до -78°C и добавляли MeI (10,5 г, 74,9 ммоль, 1,2 экв.). Затем смесь постепенно подогревали до комнатной температуры и перемешивали в течение 18 ч. Реакцию гасили метанолом (10 мл) и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением OI-14a (4 г, 58%).
К раствору OI-14a (4 г, 36,36 ммоль, 1,0 экв.) в хлороформе (40 мл) добавляли NBS (7,12 г, 40 ммоль, 1,1 экв.). Смесь перемешивали при 70°C в течение 3 ч. Затем смесь охлаждали до комнатной температуры и разбавляли насыщенным водным раствором Na2CO3 (50 мл) и DCM (100 мл). Органический слой промывали насыщенным солевым раствором и водой, сушили над Na2SO4 и концентрировали под вакуумом. Остаток очищали колоночной хроматографией на силикагеле с получением OI-14b (333 мг, 4,8%).
К смеси OI-14b (333 мг, 1,76 ммоль, 1,0 экв.), соединения OI-12b (448 мг, 1,94 ммоль, 1,1 экв.), DPPF (100 мг, 0,18 ммоль, 0,1 экв.) и DIEA (340 мг, 2,64 ммоль, 1,5 экв.) в толуоле (20 мл) добавляли Pd2(dba)3 (113 мг, 0,12 ммоль, 0,07 экв.) в атмосфере азота. Смесь перемешивали при 110°C в течение 16 ч. Затем смесь фильтровали и экстрагировали водой (50 мл) и этилацетатом (30 мл x 3). Органическую фазу сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле с получением OI-14c (261 мг, 43%)
К смеси OI-14c (261 мг, 0,77 ммоль, 1,0 экв.) в MeOH (5 мл) добавляли KCN (100 мг, 1,53 ммоль, 2,0 экв.) и (NH4)2CO3 (295 мг, 3,08 ммоль, 4,0 экв.). Смесь перемешивали при 45°C в течение 16 ч. В реакционную смесь добавляли 3 M HCl для доведения pH=1~2 и перемешивали при комнатной температуре 1 ч, затем добавляли насыщенный водный раствор NaHCO3 для доведения pH=7~8 и экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Остаток очищали препаративной ТСХ с получением соединения OC-14 (183 мг, 58%) в виде белого твердого вещества.
Биологическое тестирование
Пример 1. Анализы ингибирования MMP
Ингибирующее действие соединений на скорость расщепления флуорогенного субстрата MMP (Enzo, BML-P128) рекомбинантным человеческим каталитическим доменом MMP-12 (Enzo, BML-SE138) осуществляли способами, известными в данной области. Вкратце, в каждую лунку 96-луночного черного непрозрачного планшета все реагенты последовательно добавляли пипеткой, и конечная реакционная смесь содержала 4 нМ рекомбинантного человеческого каталитического домена ММР-12, 4 мкМ флуорогенного субстрата MMP и различные концентрации (0,15 нМ-10000 нМ) разведений тестируемого соединения в буфере HEPES (pH 7,5), содержащем 10 мМ CaCl2, 0,01% Brij® 35 (полиоксиэтилен (23) лауриловый эфир) и 0,1 мг/мл BSA.
Фермент и соединения предварительно инкубировали на шейкере для смешивания в лунках. После часа перемешивания в каждую лунку добавляли флуорогенный субстрат. Реакционную смесь без фермента использовали в качестве холостого контроля в планшете. Затем планшет загружали в планшет-ридер для измерения интенсивности флуоресценции при длинах волн возбуждения/излучения 340 нм/440 нм каждые 10 минут в течение по меньшей мере 1 часа при 37°C. IC50 каждого соединения в ингибировании ММР-12 определяли, используя считывание показаний, полученные в момент времени 30 минут. Результаты для каждого протестированного соединения показаны в таблице 1.
Пример 2: Анализ селективности
Анализ селективности MMP проводили с использованием других рекомбинантных человеческих MMP, включая MMP-1, MMP-2, MMP-3, MMP-7, MMP-8, MMP-9, MMP-10, MMP-13 и MMP-14. IC50 соединений для других рекомбинантных человеческих MMP определяли, как описано выше в Примере 1, и они показаны в Таблице 2.
Таблица 2: Профиль селективности соединений MMP-12 согласно вариантам осуществления заявки
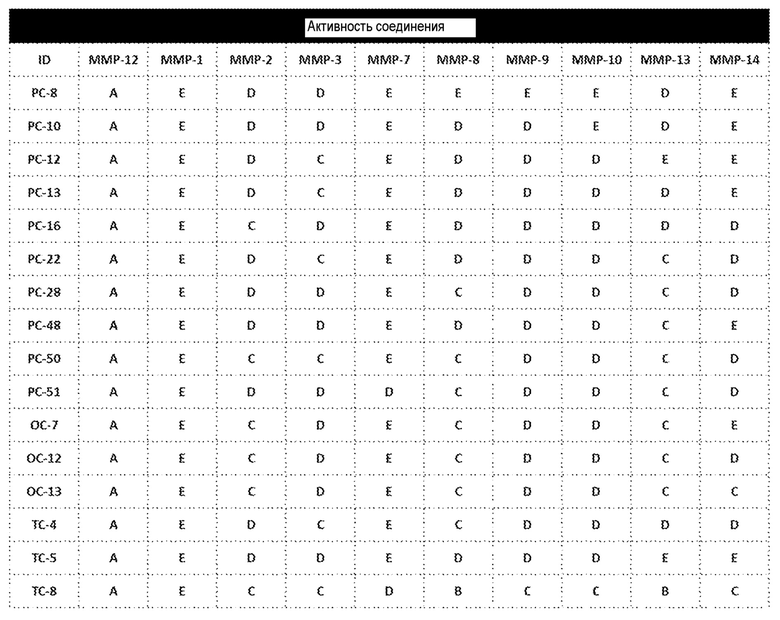
А=менее 10 нМ, В=10 нМ до 100 нМ, С=100 нМ до 1000 нМ, D=1000 нМ до 10000 нМ, Е=больше чем 10000 нМ
Результаты в Таблице 2 выше показывают, что соединения согласно вариантам осуществления заявки обладают высокой селективностью в отношении MMP-12 по сравнению с другими MMP, включая MMP-1 MMP-2, MMP-3, MMP-7, MMP-8, MMP-9, MMP-10, MMP-13, и MMP-14.
Пример 3: Исследования эффективности ингибиторов ММР-12 на модели фиброза почки крыс SD путем односторонней окклюзии мочеточника (UUO)
Это исследование должно было оценить терапевтическую эффективность ингибитора MMP-12, PC-16 на модели фиброза почки при односторонней окклюзии мочеточника (UUO). В этом исследовании использовали самцов крыс Sprague Dawley (SD) (180-220 г, n=71). Животные были случайным образом разделены на 4 группы: группа, получающая носитель (группа-1, n=8), группа, получающая PC-16 2 мг/кг/день (группа-2, n=9), группа, получающая PC-16 6 мг/кг/день (группа-3, n=10), группа, получающая PC-16 20 мг/кг/день (группа-4, n=9). Животных анестезировали ингаляцией 2,5% изофлурана. Левый мочеточник перевязывали для создания модели односторонней окклюзии мочеточника (UUO) для индуцирования почечного фиброза. Тестируемый препарат PC-16 вводили два раза в день перорально после моделирования в течение 14 дней. Сыворотку периферической крови получали до моделирования и на день-15 (через день после последнего введения дозы). Всех животных подвергали эвтаназии и обрабатывали для исследования патологии левой почки.
Лечение PC-16 в дозе 20 мг/кг/день несколько ограничило повышение уровня азота мочевины крови (BUN) по сравнению с группой, получавшей носитель, однако все данные не показали статистически значимой разницы по сравнению с эталонной группой. Уровни креатинина в сыворотке показали такие же изменения, как и в BUN.
Гистологически левая почка показала значительные морфологические изменения по сравнению с UUO, включая расширение лоханки, медуллу почек и корковую атропию и коры головного мозга, уплощение тубулярной эпителиальной клетки и расширение канальцев, воспаление и некроз. Интерстициальный фиброз отчетливо наблюдали в стенке малого таза, медулле и корковом слое. Лечение PC-16 показало отчетливый дозозависимый эффект, и доза 20 мг/кг/день была более эффективной, чем доза 2 мг/кг/день (p<0,01). Полуколичественная оценка интерстициального воспаления в корковом слое показала значительное снижение при лечении PC-16 и показала дозозависимую эффективность PC-16. Полуколичественная оценка интерстициального фиброза в корковом слое показала значительное снижение показателя фиброза при лечении PC-16 во всех группах доз. В группах лечения PC-16 наблюдали явный дозозависимый эффект.
Анализ иммуногистохимического (IHC) окрашивания в области коры левой почки у животных, получавших PC-16, показал значительное снижение отложения коллагена-I при дозе 20 мг/кг/день (P<0,05) с прослеживанием дозозависимого снижения с лечением PC-1. Он также показал значительное снижение отложения коллагена-IV при дозе PC-16 6 мг/кг/день (P <0,05), PC-16 20 мг/кг/день с прослеживанием дозозависимого снижения с лечением PC-16.
В заключение, UUO вызывал значительное повреждение коры почек, воспаление и интерстициальный фиброз в течение 15 дней после моделирования. Лечение PC-16 имело явную дозозависимую эффективность в отношении ограничения повреждения почек, интерстициального воспаления или интерстициального фиброза. Анализ биомаркеров, связанных с фиброзом, показал, что лечение PC-16 снижает связанное с этим отложение коллагена (коллаген-I и IV) в области коры поврежденной почки.
Подробные экспериментальные методы
Животные: Пол: Самцы, крысы SD, 180-220 г, всего 71. Сертификат: 11400700272659, Beijing Vital River Laboratory Animal Technology Co., Ltd., China. Содержание животных: животных содержали в среде с контролируемой температурой с циклом 12 часов света/12 часов темноты и свободным доступом к пище и воде. Экспериментальные процедуры осуществляли в соответствии с руководящими принципами IACUC в исследовательском центре на животных KCI (SuZhou) Biotech Inc. (KCI). Создание модели. Всего в этом исследовании использовали 35 крыс-самцов SD. После анестезии ингаляцией 2,5% изофлураном живот животного вскрывали хирургическим путем. Левый мочеточник обнажали и перевязывали рядом с мочевым пузырем для создания модели UUO. После подтверждения отсутствия кровотечения стенку брюшной полости закрывали послойно. Животных содержали под терморегулируемой подушкой (37°C) для выхода из анестезии, а затем переводили в клетки для содержания с обычной пищей и водой.
Распределение по группам для эксперимента: животных с моделью UUO разделяли на 7 групп рандомизированно, как группа, получающая носитель (группа-1, n=8), PC-16 2 мг/кг/день (группа-5, n=9), PC-16 6 мг/кг/день (группа-6, n=10), PC-16 20 мг/кг/день (группа-7, n=9) (таблица 4.1). Режим дозирования: все исследуемые препараты были разработаны для перорального введения посредством желудочной перфузии. Исследуемые препараты были разработаны для доставки дважды в день, начиная с одного и того же дня моделирования в течение 14 дней (Таблица 4.1). Конечные точки: 1) Сбор крови: у всех животных в каждой группе собирали периферическую кровь и получали сыворотки перед моделированием и на 15-й день (один день после последнего введения), хранили при -80°C. Всех животных подвергали эвтаназии согласно KCI SOP. После подтверждения смерти животного без дыхания и биения сердца левую почку перфузировали холодным PBS, затем 10% нейтральным формалином и собирали для дальнейшего изучения патологии. 2) Определение BUN и креатинина в сыворотке крови: Уровень BUN и креатинина в сыворотке определяли с помощью автоматического биохимического анализатора Hitachi 7060 и соответствующих наборов для тестирования. 3) Обследование на патологию почек: 3a) Окрашивание H&E и анализ почек: После патологического SOP KCI все левые почки фиксировали в 10% формалине в течение по меньшей мере 24 часов при комнатной температуре. После фиксации почку разрезали в продольном направлении для получения наибольшей поверхности, и обезвоживали в ступенчатом этаноле, очищали ксилолом и заливали парафином. Тонкие срезы (3 мкм) помещали на предметные стекла, депарафинизировали, регидратировали в дистиллированной воде и окрашивали гематоксилином и эозином (H&E). Все окрашенные предметные стекла сканировали с помощью сканера NanoZoomer Digital Pathology (S210, Hamamaci, Japan). Полуколичественная оценка степени уплощения и дилатации канальцевого эпителия оценивали от 0 до 5 в соответствии с процентом канальцевого поражения: оценка 0=отсутствие повреждения; оценка 1=1-10% повреждения; оценка 2=10-25% повреждения; оценка 3=25-50% повреждения; оценка 4=50-75% повреждения; оценка 5=75-100% повреждения. Полуколичественная оценка канальцевого некроза оценивается от 0 до 3 в соответствии с процентом канальцевого поражения: балл 0=некроз отсутствует; оценка 1=некроз <25%; оценка 2=некроз 25-50%; оценка 3=некроз >50%. Было представлено среднее значение уплощения, дилатации и некроза канальцев как общего канальцевого повреждения. Полуколичественную оценку интерстициального воспаления оценивали от 0 до 4 в соответствии со степенью инфильтрации воспалительных клеток: оценка 0=отсутствие воспалительных клеток; оценка 1=легкая инфильтрация воспалительных клеток; оценка 2=умеренная инфильтрация воспалительных клеток; оценка 3=сильная инфильтрация воспалительных клеток; оценка 4=обширная инфильтрация воспалительных клеток. 3b) Окрашивания трихромом по Массону и анализ: Тонкие срезы (3 мкм) помещали на предметные стекла, депарафинизировали, регидратировали в дистиллированной воде и окрашивали трихромом по Массону. Все окрашенные предметные стекла сканировали с помощью сканера NanoZoomer Digital Pathology (S210, Hamamaci, Japan). Полуколичественная оценка коркового интерстициального фиброза с пятью различными полями при увеличении х10 выбирается случайным образом из коры почек, оцениваемых с использованием следующей системы оценок от 0 до 4 в соответствии с процентом вовлечения интерстициального фиброза: оценка 0=отсутствие фиброза; оценка 1=фиброз <10%; оценка 2=фиброз 10-25%; оценка 3=фиброз 25-75%; оценка 4=фиброз >75%. 3c) Окрашивание IHC и анализ почек: все левые почки из каждой группы (восемь правых почек из эталонной группы) обрабатывали для биомаркерного анализа с использованием методов IHC, таких как коллаген-I (Abcam, Cat# ab34710), коллаген-IV (Abcam, Cat# ab6586). IHC Окрашивание обрабатывали согласно стандартному протоколу IHC в KCI. Затем окрашенные предметные стекла сканировали с помощью слайд-сканера Hamamatsu NanoZoomer Digital Pathology S210 и анализировали с использованием программного обеспечения для получения области положительного окрашивания/области анализа (%). 4) Статистический анализ: для всех статистических анализов использовали Graphpad, prism 5.0, значение p <0,05 считалось значимым. Все данные представлены как среднее±SEM. Различия между группами определяли с использованием либо дисперсионных анализов с тестом Бонферрони, либо Т-теста Стьюдента.
Результаты:
a) Физиологические изменения животных в течение периодов проведения эксперимента: несколько животных умерли в течение периода проведения эксперимента, которые рассматривали как неудачную модель, например, разрыв мочеточника во время операции, что вызвало перитонит. Количество погибших животных в каждой группе показано в таблице 4.1.
b) Изменения уровня BUN и креатинина в сыворотке: уровень BUN в сыворотке у всех животных был повышен после UUO на 15 день по сравнению перед моделированием (p<0,001). Лечение PC-16 в дозе 20 мг/кг/день показало такой же результат (фиг. 1A); все данные не показали статистически значимой разницы по сравнению с эталонной группой. Уровни креатинина в сыворотке показали такие же изменения, как и в BUN (фиг. 1B).
c) Изменения в поражении левой почки-Канальцевое повреждение: после 15 дней UUO левая почка показала расширение тазовой полости у всех животных. Кора почки представляла собой значительную атрофию с разной степенью уплощения тубулярной эпителиальной клетки, расширения канальцев и инфильтрацию интерстициальными воспалительными клетками, а также несколько очагов канальцевого некроза (фиг. 1C). Лечение PC-16 представляло явный дозозависимый эффект, и доза в 20 мг/кг/день была больше эффективна, чем доза 2 мг/кг/день (p<0,01) (фиг. 1D (I)).
d) Изменения в поражении левой почки-Интерстициальное воспаление: полуколичественная оценка интерстициального воспаления в коре показала значительное снижение при лечении PC-16 и показала дозозависимую эффективность PC-16 (фиг. 1D (II)).
e) Изменения в поражении левой почки-Корковый интерстициальный фиброз: через 15 дней UUO в левой почке наблюдали тазовую полость, область медуллы и область коры со значительным интерстициальным фиброзом у всех животных. Интерстициальный фиброз в области коры был проанализирован и показал различную степень при лечении тестируемыми CPD (фиг. 1E). Полуколичественная оценка интерстициального фиброза в корковом слое показала значительное снижение показателя фиброза при лечении PC-16 в дозе 20 мг/кг/день (p<0,001). В группах лечения PC-16 наблюдали явный дозозависимый эффект (фиг. 1F).
f) Патологический анализ нескольких биомаркеров в левой почке: Коллаген-I: анализ IHC-окрашивания в области коры левой почки у животных, получавших PC-16, показал значительное снижение отложения коллагена-I в дозе 20 мг/кг/день (p<0,05); прослеживание дозозависимого снижения в группах лечения PC-16 (фиг. 1G(I) и фиг. 1H(I)). Коллаген-IV: IHC окрашивание в области коры левой почки у животных, получавших PC-16, показало значительное снижение отложения коллагена-IV при дозе 20 мг/кг/день (p<0,05); прослеживание дозозависимого снижения с лечением PC-16 (фиг. 1G(II) и фиг. 1H(II)).
Ссылки
1. US 7179831.
2. WO 02/096426.
3. US 2004/0067996.
4. WO 2004/108086.
5. WO 02/074752.
6. WO 2004/020415.
| название | год | авторы | номер документа |
|---|---|---|---|
| ИНГИБИТОРЫ МАТРИКСНОЙ МЕТАЛЛОПРОТЕИНАЗЫ (MMP) И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2820540C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ ИНГИБИТОРЫ MAT2A И СПОСОБЫ ПРИМЕНЕНИЯ ДЛЯ ЛЕЧЕНИЯ РАКА | 2019 |
|
RU2809987C2 |
| Производные 2H-[1,4]оксазино- и 2H-[1,4]тиазино[3,2-c]хинолин-3(4H)-онов в качестве ингибиторов ATM и DNA-PK киназ для лечения и/или профилактики онкологических заболеваний | 2024 |
|
RU2835676C1 |
| ИМИДАЗОПИРАЗИНОНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ PDE1 | 2016 |
|
RU2712219C2 |
| СОЕДИНЕНИЯ 3,5-ДИАМИНО-6-ХЛОР-N-(N-(4-ФЕНИЛБУТИЛ)КАРБАМИМИДОИЛ)ПИРАЗИН-2-КАРБОКСАМИДА | 2013 |
|
RU2671976C2 |
| МОДУЛЯТОРЫ АНДРОГЕНОВОГО РЕЦЕПТОРА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2797622C2 |
| ИНГИБИТОРЫ ПРОТЕИНТИРОЗИНФОСФАТАЗЫ | 2020 |
|
RU2799449C2 |
| СОЕДИНЕНИЯ ДЛЯ ЛЕЧЕНИЯ НЕКОТОРЫХ ЛЕЙКОЗОВ | 2019 |
|
RU2804709C2 |
| Замещенные N2-(4-амино-2-метоксифенил)-N4-[2-(диметилфосфорил)-фенил]-5-хлор-пиримидин-2,4-диамины в качестве модуляторов ALK и EGFR, предназначенные для лечения рака | 2015 |
|
RU2607371C1 |
| ПИРАЗОЛПИРИМИДИНОВОЕ ПРОИЗВОДНОЕ И ЕГО ПРИМЕНЕНИЕ | 2016 |
|
RU2735522C2 |
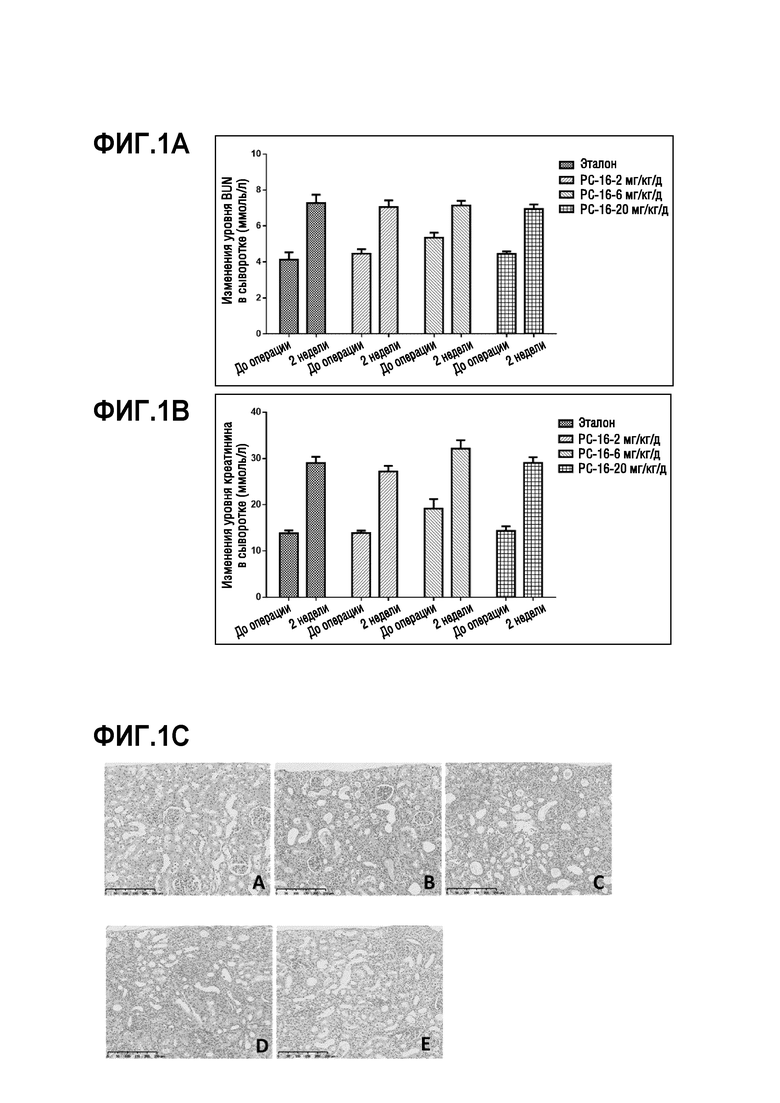
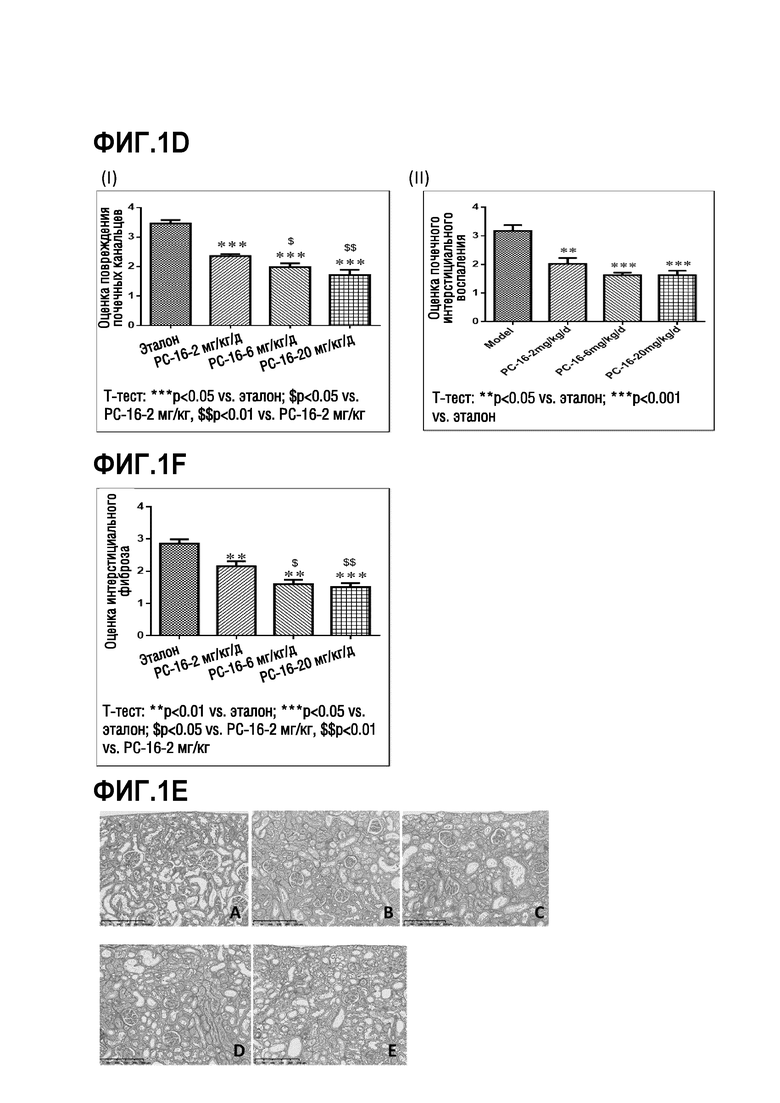
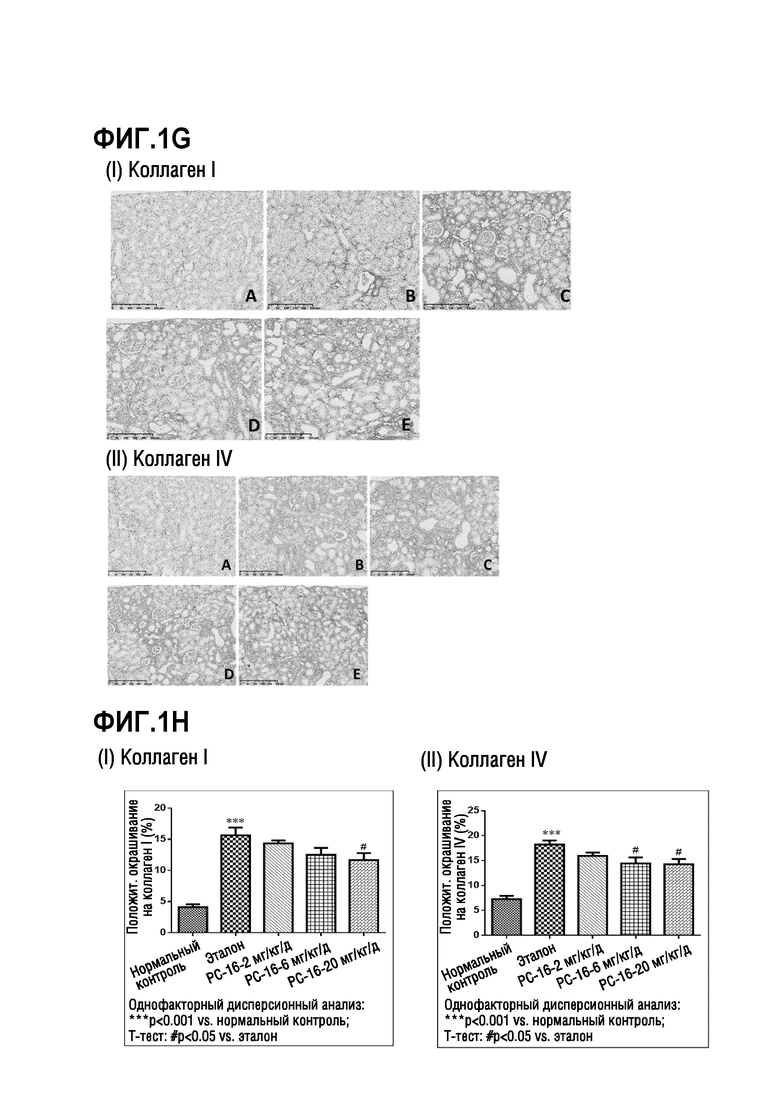
Изобретение относится к соединениям на основе гидантоина формулы (II) или его фармацевтически приемлемым солям, где кольцо B представляет собой пиридинил или тиофенил; кольцо C представляет собой фенил; кольцо D представляет собой фенил или пиридинил; X представляет собой S; Y представляет собой О; Z представляет собой СН2; R1-R5, m и n определены в формуле изобретения. Соединения обладают активностью ингибиторов матриксных металлопротеиназ (MMP), в частности эластазы макрофагов (MMP-12). Также описаны фармацевтические композициии и способы применения соединений для ингибирования MMP-12 и лечения заболеваний, опосредованных MMP-12, например, таких как астма, хроническая обструктивная болезнь легких (COPD), эмфизема, острое повреждение легких, идиопатический легочный фиброз (IPF), саркоидоз, системный склероз, фиброз печени, неалкогольный стеатогепатит (NASH), артрит, рак, болезнь сердца, воспалительное заболевание кишечника (IBD), острое повреждение почек (AKI), хроническое заболевание почек (CKD), синдром Альпорта и нефрит. 5 н. и 8 з.п. ф-лы, 1 ил., 3 табл., 3 пр.
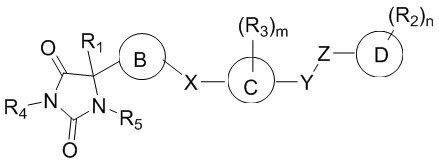 (II)
(II)
1. Соединение формулы (II)
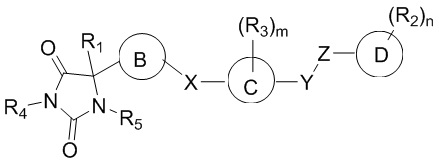 (II)
(II)
или его фармацевтически приемлемая соль,
где кольцо B представляет собой пиридинил или тиофенил;
кольцо C представляет собой фенил;
кольцо D представляет собой фенил или пиридинил;
X представляет собой S;
Y представляет собой О;
Z представляет собой СН2;
R1 представляет собой водород или C1-6алкил;
каждый R2 независимо выбран из группы, состоящей из C1-6алкила, гидроксила, C1-6алкокси, амида и гидроксиC1-6алкила;
каждый R3 независимо выбран из группы, состоящей из водорода, C1-6алкила и галогена;
R4 представляет собой водород;
R5 представляет собой водород;
m имеет значение 1, 2, 3 или 4; и
n имеет значение 1, 2, 3, 4 или 5.
2. Соединение по п. 1, где каждый из R1, R4 и R5 представляет собой водород.
3. Соединение по п. 1, где кольцо B представляет собой пиридинил.
4. Соединение по п. 3, где соединение выбрано из группы, состоящей из соединения формулы (II-a), соединения формулы (II-b), соединения формулы (II-c) и соединения формулы (II-d):
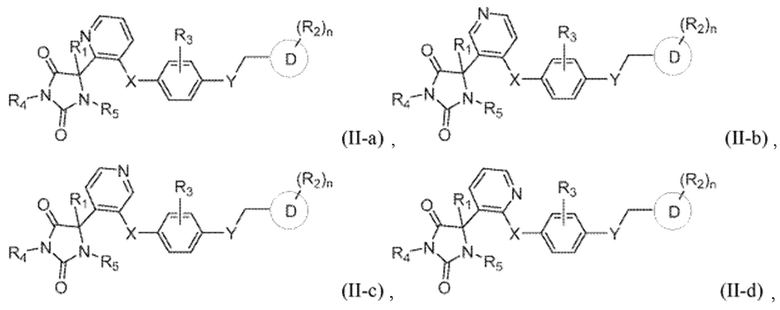 или его фармацевтически приемлемая соль,
или его фармацевтически приемлемая соль,
где R1 представляет собой водород, -CH3 или -CH2CH3;
R3 представляет собой водород, -F, -Cl, или CH3;
R2 представляет собой -CH3, -CH2OH, -OH, -C(O)NH2, -C(O)NHCH3, -OCH3, -OCH2CH3, -OCH(CH3)2 или -CH2CH(CH3)2; и
n имеет значение 0 или 1.
5. Соединение по п. 1, где кольцо B представляет собой тиофенил.
6. Соединение по п. 5, где соединение представляет собой соединение формулы (IV)
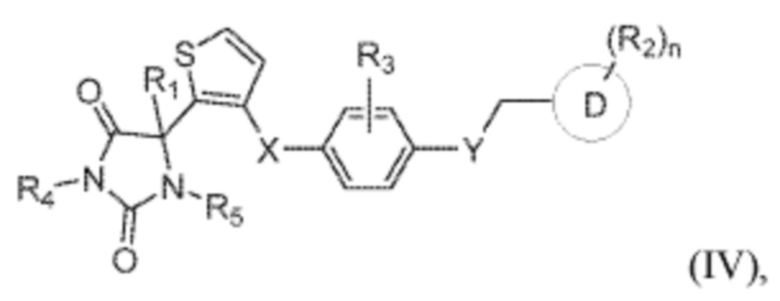
или его фармацевтически приемлемую соль,
где каждый из R1, R4 и R5 представляет собой водород;
X представляет собой S;
Y представляет собой O;
R3 представляет собой водород;
кольцо D представляет собой фенил или пиридинил;
R2 представляет собой -CH3, -C(O)NH2, -CH2OH, -OCH3 или -OH; и
n имеет значение 0 или 1.
7. Соединение по п. 1, представляющее собой соединение формулы (I-a)
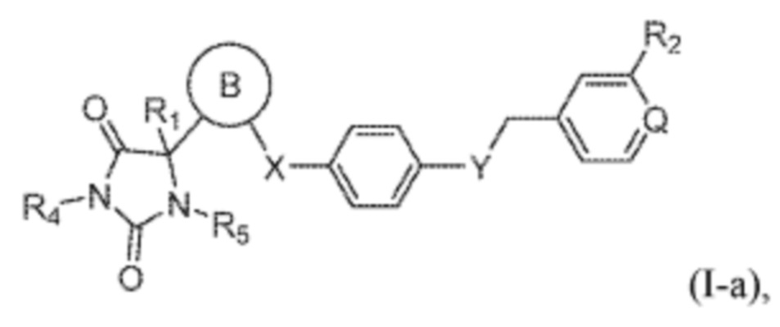
или его фармацевтически приемлемая соль,
где кольцо B представляет собой пиридинил;
Q представляет собой CH или N;
R1 представляет собой водород, -CH3 или -CH2CH3;
R2 выбран из группы, состоящей из -CH3, -C(O)NH2, -CH2OH, -OCH3 или -OH.
8. Соединение по п. 7, где каждый из R1, R4 и R5 представляет собой водород.
9. Соединение, выбранное из группы, состоящей из:
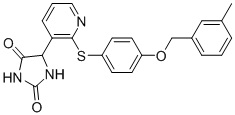 ,
,
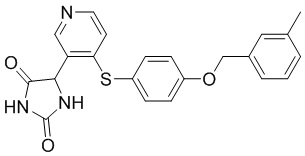 ,
,
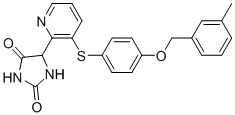 ,
,
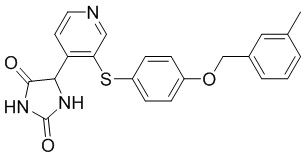 ,
,
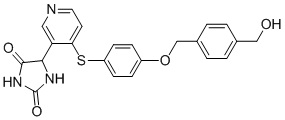 ,
,
 ,
,
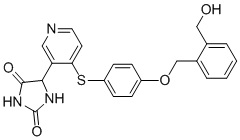 ,
,
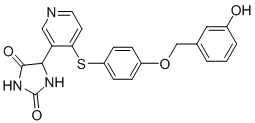 ,
,
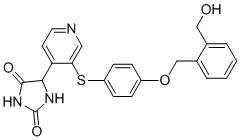 ,
,
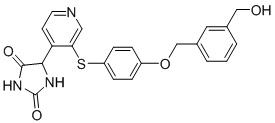 ,
,
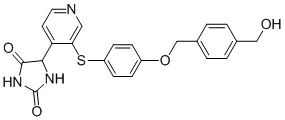 ,
,
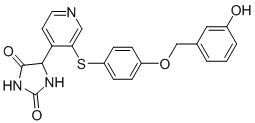 ,
,
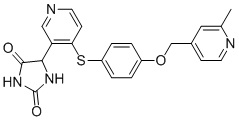 ,
,
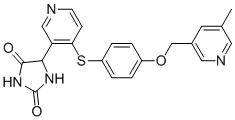 ,
,
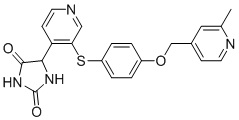 ,
,
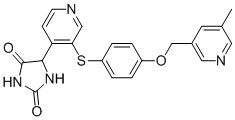 ,
,
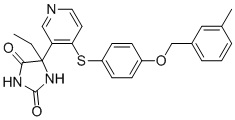 ,
,
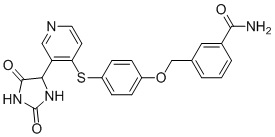 ,
,
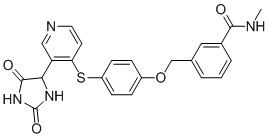 ,
,
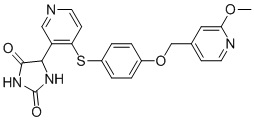 ,
,
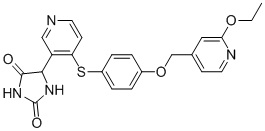 ,
,
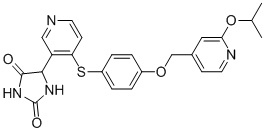 ,
,
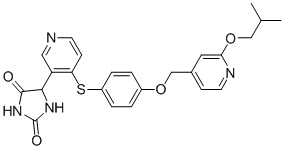 ,
,
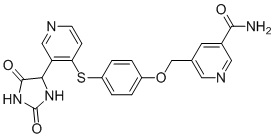 ,
,
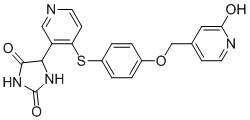 ,
,
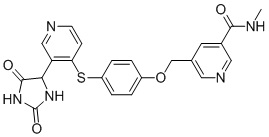 ,
,
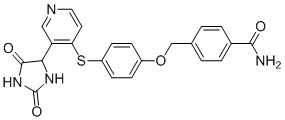 ,
,
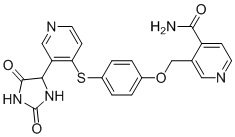 ,
,
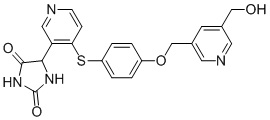 ,
,
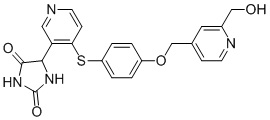 ,
,
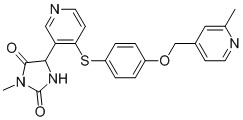 ,
,
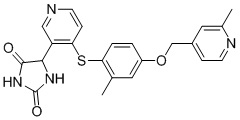 ,
,
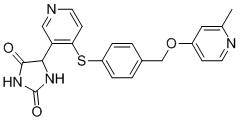 ,
,
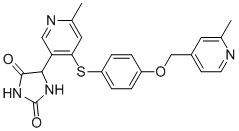 ,
,
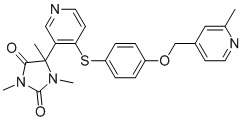 ,
,
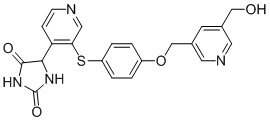 ,
,
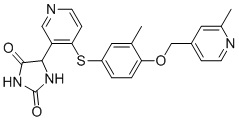 ,
,
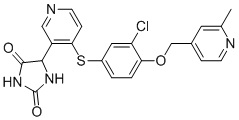 ,
,
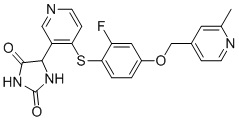 ,
,
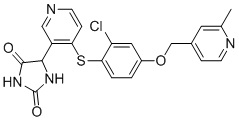 ,
,
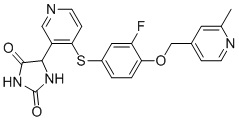 ,
,
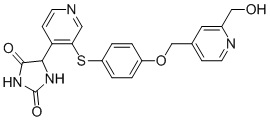 ,
,
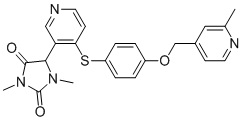 ,
,
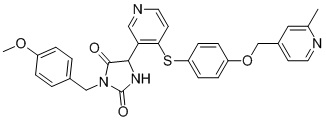 ,
,
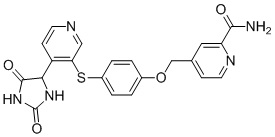 ,
,
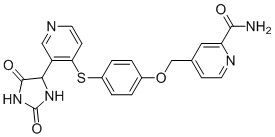 ,
,
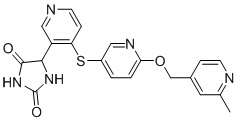 ,
,
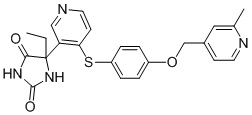 ,
,
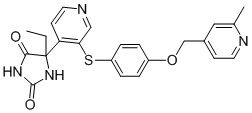 ,
,
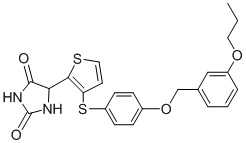 ,
,
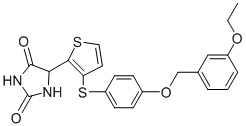 ,
,
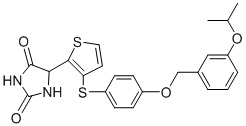 ,
,
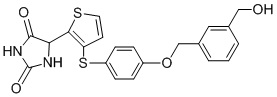 ,
,
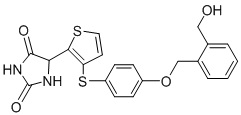 ,
,
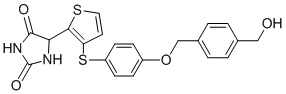 ,
,
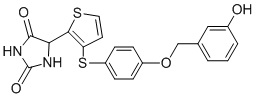 и
и 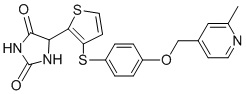 ,
,
или его фармацевтически приемлемая соль.
10. Соединение по п.9, представляющее собой его фармацевтически приемлемую соль.
11. Фармацевтическая композиция, ингибирующая эластазу макрофагов (ММР-12), включающая терапевтически эффективное количество соединения по любому из пп.1-10 и по меньшей мере один фармацевтически приемлемый носитель.
12. Способ ингибирования эластазы макрофагов (ММР-12) у субъекта, нуждающегося в этом, включающий введение субъекту фармацевтической композиции по п. 11.
13. Способ лечения заболевания, опосредованного эластазой макрофагов (ММР-12), у субъекта, нуждающегося в этом, включающий введение субъекту фармацевтической композиции по п. 11, где заболевание выбрано из группы, состоящей из астмы, хронической обструктивной болезни легких (COPD), эмфиземы, острого повреждения легких, идиопатического легочного фиброза (IPF), саркоидоза, системного склероза, фиброза печени, неалкогольного стеатогепатита (NASH), артрита, рака, болезни сердца, воспалительного заболевания кишечника (IBD), острого повреждения почек (AKI), хронического заболевания почек (CKD), синдрома Альпорта и нефрита.
| US 20040067996 A1, 08.04.2004 | |||
| US 7179831 B2, 20.02.2007 | |||
| WO 2004108086 A2, 16.12.2004 | |||
| ПРОИЗВОДНЫЕ ИМИДАЗОЛИДИН-2,4-ДИОНА, СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И ИХ ПРИМЕНЕНИЕ | 2002 |
|
RU2285695C2 |
| ПРОИЗВОДНЫЕ ГИДАНТОИНА, ПОЛЕЗНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ МЕТАЛЛОПРОТЕИНАЗ | 2005 |
|
RU2388758C2 |
| ИНГИБИТОРЫ МЕТАЛЛОПРОТЕИНАЗ, ИХ ПРИМЕНЕНИЕ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ | 2002 |
|
RU2293730C2 |
Авторы
Даты
2023-06-07—Публикация
2019-05-14—Подача