Область техники
[0001]
Настоящее изобретение относится к макроциклическому соединению, обладающему активностью в отношении активации фактора-2, связанного с ядерным эритроидным фактором 2 (в настоящем документе может быть сокращенно назван «NRF2»), и, как ожидается, подходящему для лечения заболеваний, связанных с окислительным стрессом.
Уровень техники
[0002]
Окислительный стресс относится к состоянию, при котором окисление и антиокисление не сбалансированы, и чрезмерная реакция окисления неблагоприятно влияет на организм, и выяснено, что окислительный стресс тесно связан с различными патогенезами. Живой организм обеспечивает механизм защиты от окислительного стресса, и NRF2 (фактор-2, связанный с ядерным эритроидным фактором 2) играет центральную роль в этом механизме. В равновесном состоянии NRF2 связан с KEAP1 (Kelch-подобный ЕСН-ассоциированный белок 1) и его внутриклеточная концентрация поддерживается на низком уровне благодаря протеасомной регуляции разложения. Однако при возникновении какого-либо окислительного стресса NRF2 диссоциирует от KEAP1, перемещается внутрь ядра и связывается с транскрипционной областью, называемой ARE (элемент антиоксидантного ответа), тем самым индуцируя экспрессию генов различных антиокислительных веществ (активация NRF2). Система NRF2-KEAP1 представляет собой механизм биологической защиты для быстрого реагирования на окислительный стресс (Free Radical Biology and Medicine 2015 88: 362-372; непатентная литература (1)). Соответственно, можно ожидать, что активаторы NRF2 будут обеспечивать мощную антиокислительную активность за счет активации системы NRF2-KEAP1. Среди активаторов NRF2 существует один тип, который модифицирует остаток Cys в KEAP1, и другой тип, который ингибирует белок-белковое взаимодействие NRF2-KEAP1, но известно, что оба они активируют NRF2 (Med Res Rev. 2016 36 (5): 924-63; непатентная литература (2)).
Активаторы NRF2 предположительно являются эффективными для профилактики или лечения различных заболеваний, связанных с окислительным стрессом. В частности, примеры заболеваний включают заболевание печени (неалкогольный стеатогепатит (НАСГ) или т.п.), заболевание желчных протоков (первичный склерозирующий холангит (ПСХ) или т.п.), заболевание легких (обструктивная болезнь легких (ХОБЛ) или т.п.), заболевание почек (хроническая болезнь почек (ХБП), острое повреждение почек (ОПП) или т.п.), заболевание сердца (сердечная недостаточность, легочная артериальная гипертензия или т.п.), заболевание центральной нервной системы (болезнь Паркинсона, болезнь Альцгеймера, церебральный инсульт или т.п.), митохондриальное заболевание (моторная атаксия Фридрейха, митохондриальная миопатия или т.п.), воспалительное заболевание (например, рассеянный склероз (PC), воспалительная болезнь кишечника (ВЗК)), серповидно-клеточная болезнь, рак и т.п. (Clin Sci (Lond). 2015 129(12): 989-99; непатентная литература (3)).
Бардоксолон-метил (CDDO-Me), который активирует NRF2 путем модификации остатка Cys в KEAP1, продемонстрировал эффект улучшения функции почек в крупномасштабном клиническом исследовании пациентов с ХБП и диабетом 2 типа; однако были подтверждены серьезные побочные эффекты, такие как обострение явлений со стороны сердечно-сосудистой системы и начало сердечной недостаточности, и поэтому клиническое испытание было остановлено на ранней стадии (N Engl J Med. 2013 26; 369 (26): 2492-2503; непатентная литература (4)). Ожидается, что низкомолекулярные соединения, ингибирующие белок-белковое взаимодействие NRF2-KEAP1, будут проявлять эффективность при заболеваниях, связанных с окислительным стрессом, описанных выше, за счет активации NRF2 по механизму, отличному от механизма CDDO-Me.
[0003]
К настоящему времени известны соединения моноцнклнческого типа, которые относятся к талу соединений с двумя связанными кольцами и к типу соединений с конденсированным кольцом, которые обладают активностью в отношении регуляции NRF2.
(1) Следующие соединения известны как соединения моноциклического типа.
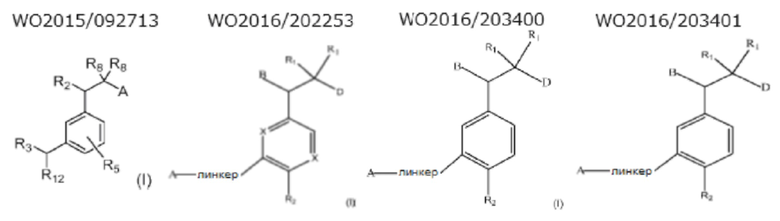
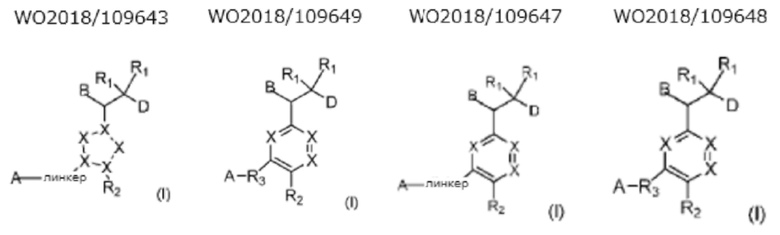
(2) Следующие соединения известны как соединения с двумя связанными кольцами.
(3) Следующие соединения известны как соединения с конденсированным кольцом.
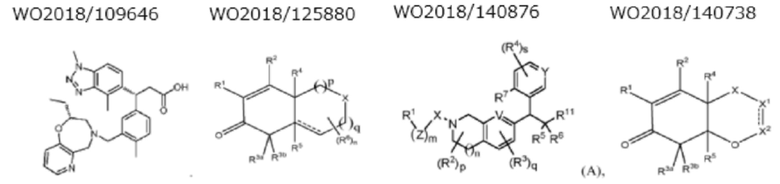
(Значение символов в формулах приведено в соответствующих пубпикациях).
[0004]
Задача настоящего изобретения заключается в обеспечении соединения, обладающего активирующим действием в отношении NRF2, имеющего новую структуру и предположительно подходящего для применения в качестве профилактического или терапевтического агента для заболеваний, связанных с окислительным стрессом, в частности, заболевания печени (например, неалкогольного стеатогепатита (НАСТ), заболевания желчных протоков (первичного склерозирующего холангнта (ПСХ) или т.п.), сердечно-сосудистого заболевания (например, сердечной недостаточности или легочной артериальной гипертензии), заболевания легких (например, хронической обструктивной болезни легких (ХОБЛ)), заболевания почек (например, хронической болезни почек (ХБП) или острого повреждения почек (ОПП)), заболевания центральной нервной системы (например, болезни Паркинсона, болезни Альцгеймера, церебрального инсульта), митохондриального заболевания (например, моторной атаксии Фридрейха, митохондриальной миопатии), воспалительного заболевания (например, рассеянного склероза (PC), воспалительной болезни кишечника (ВЗК)), серповидно-клеточной болезни, рака или т.п.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0005]
В результате всесторонних исследований, направленных на решение проблем, описанных выше, авторами настоящего изобретения обнаружено, что макроциклическое соединение, представленное приведенной ниже формулой (I), обладает активирующим действием в отношении NRF2, и поэтому можно ожидать, что оно будет подходить для применения в качестве профилактического или терапевтического агента для заболеваний, связанных с окислительным стрессом, в частности, заболевания печени (например, неалкогольного стеатогепатита (НАСГ), заболевания желчных протоков (первичного склерозирующего холангита (ПСХ) или т.п.), сердечно-сосудистого заболевания (например, сердечной недостаточности или легочной артериальной гипертензии), заболевания легких (например, хронической обструктивной болезни легких (ХОБЛ)), заболевания почек (например, хронической болезни почек (ХБП) или острого повреждения почек (ОПП)), заболевания центральной нервной системы (например, болезни Паркинсона, болезни Альцгеймера, церебрального инсульта), митохондриального заболевания (например, моторной атаксии Фридрейха, митохондриальной миопатии), воспалительного заболевания (например, рассеянного склероза (PC), воспалительной болезни кишечника (ВЗК)), серповидно-клеточной болезни, рака или т.п., дополняя настоящее изобретение.
[0006]
Таким образом, настоящее изобретение представлено ниже:
<1>
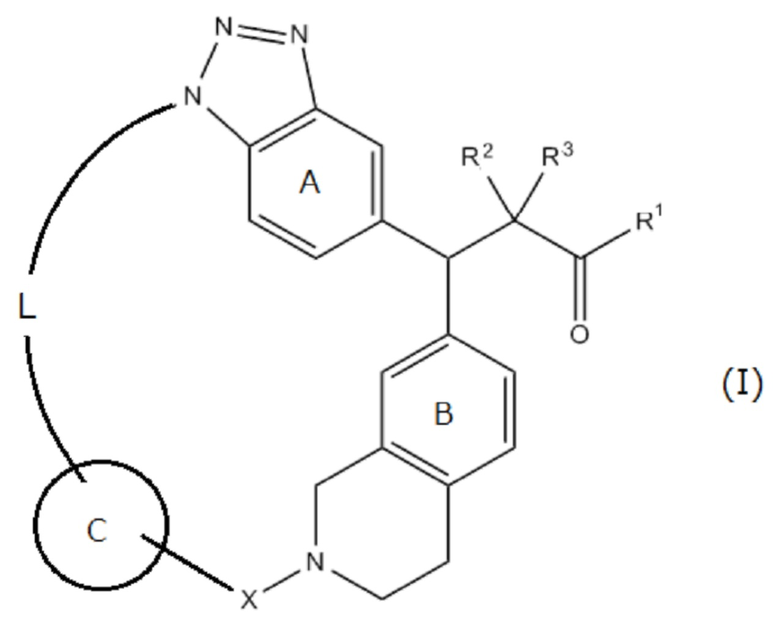
Соединение, представленное следующей формулой (I):
где
R1 представляет собой ОН, ORy или NHRy;
Ry представляет собой необязательно замещенную C1-6 алкильную группу или необязательно замещенную циклическую группу;
R2 и R3, которые могут быть одинаковыми или разными, представляют собой атом водорода или необязательно замещенную С1-6 алкильную группу, или R2 и R3 соединены друг с другом с образованием С3-6 циклоалкильной группы;
X представляет собой С(=O), SO2 или CRx1Rx2;
Rx1 и Rx2, которые могут быть одинаковыми или разными, представляют собой атом водорода или необязательно замещенную С1-6 алкильную группу;
кольцо А представляет собой бензольное кольцо, которое может содержать дополнительный заместитель (заместители);
кольцо В представляет собой бензольное кольцо, которое может содержать дополнительный заместитель (заместители);
кольцо С представляет собой необязательно замещенное 5- или 6-членное ароматическое кольцо, которое может содержать гетероатом(ы) в кольце; и
L представляет собой необязательно замещенный насыщенный или ненасыщенный линейный С4-8 алкилен, необязательно содержащий вставленный гетероатом, или его соль.
<2>
Соединение по п. <1> выше или его соль, отличающиеся тем, что в формуле (I)
L представляет собой -(CR4R5)n-Y1-(CR7)m-Y2-*
где * означает точку присоединения к кольцу С;
n представляет собой целое число, равное 2 или более и 4 или менее;
m представляет собой целое число, равное 1 или более и 4 или менее;
R4 и R5 одинаковы или отличаются друг от друга, и каждый из них представляет собой атом водорода, атом галогена, ОН, необязательно замещенную С1-6 алкильную группу или необязательно замещенную C1-6 алкокси-группу, или R4 и R5 соединены друг с другом с образованием необязательно замещенной С3-6 циклоалкильной группы, и некоторое множество R4 или некоторое множество R5 может включать одинаковые или различающиеся R, и соседние R4 или R5 могут быть соединены друг с другом с образованием двойной связи;
R6 и R7 одинаковы или отличаются друг от друга, и каждый из них представляет собой атом водорода, атом галогена, ОН, необязательно замещенную С1-6 алкильную группу или необязательно замещенную C1-6 алкокси-группу, или R6 и R7 соединены друг с другом с образованием необязательно замещенной С3-6 циклоалкильной группы, и если m равен 2 или более, то некоторое множество R6 или некоторое множество R7 может включать одинаковые или различающиеся R, и соседние R6 или R7 могут быть соединены друг с другом с образованием двойной связи;
Y1 и Y2, которые могут быть одинаковыми или разными, представляют собой связь, атом кислорода, атом серы, SO, SO2 или NR8, при условии, что если Y1 представляет собой связь, то m равен 1 или 4; и
R8 представляет собой атом водорода, необязательно замещенную С1-6 алкильную группу или необязательно замещенную С1-6 алкокси-группу, при условии, что если присутствует некоторое множество R8, то некоторое множество R8 может включать одинаковые или различающиеся R.
<3>
Соединение по п. <1> или <2> выше или его соль, отличающиеся тем, что в формуле (I)
L выбран из группы, состоящей из следующих формул:
-CR4R5-CR4R5-CR6R7-CR6R7-CR6R7-CR6R7-*;
-CR4R5-CR4R5-CR4R5-CR4R5-CR6R7-*;
-CR4R5-CR4R5-CR4R5-CR6R7-O-*;
-CR4R5-CR4R5-CR4R5-O-CR6R7-*; и
-CR4R5-CR4R5-O-CR6R7-CR6R7-*.
<4-1>
Соединение по любому из пп. <1>-<3> выше или его соль, отличающиеся тем, что в формуле (I)
R1 представляет собой ОН или ORy;
Ry представляет собой необязательно замещенную циклическую группу;
R2 и R3, которые могут быть одинаковыми или разными, представляют собой атом водорода или необязательно замещенную C1-6 алкильную группу;
X представляет собой С(=O);
кольцо А представляет собой бензольное кольцо, которое может содержать дополнительный заместитель (заместители);
кольцо В представляет собой бензольное кольцо, которое может содержать дополнительный заместитель (заместители); и
кольцо С представляет собой необязательно замещенное бензольное кольцо.
<4-2>
Соединение по любому из пп. <1>-<3> выше или его соль, отличающиеся тем, что в формуле (I)
R1 представляет собой ОН или ORy;
Ry представляет собой С1-6 алкильную группу;
R2 и R3, которые могут быть одинаковыми или разными, представляют собой атом водорода или С1-3 алкильную группу;
X представляет собой С(=O);
кольцо А представляет собой бензольное кольцо, которое может содержать дополнительный заместитель (заместители) из атома фтора, атома хлора, С1-3 алкильной группы, необязательно замещенной 1-3 заместителями (выбранными из атома галогена и С1-3 алкокси-группы), или С1-3 алкокси-группы, необязательно замещенной 1-3 заместителями (выбранными из атома галогена и С1-3 алкокси-группы);
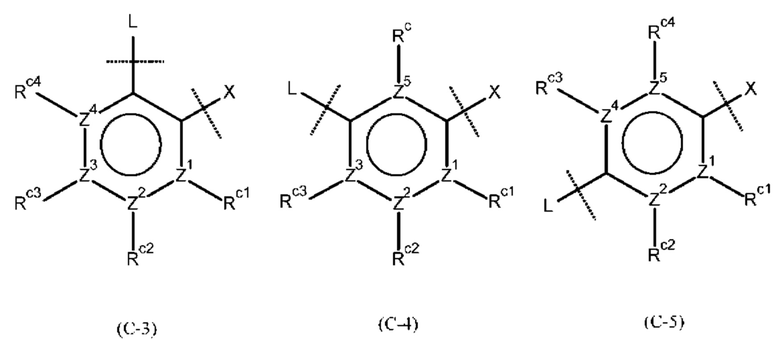
кольцо В представляет собой бензольное кольцо, которое может содержать дополнительный заместитель (заместители) из атома фтора, атома хлора, циано-группы, С1-3 алкильной группы, необязательно замещенной 1-3 заместителями (выбранными из атома галогена и С1-3 алкокси-группы), или С1-3 алкокси-группы, необязательно замещенной 1-3 заместителями (выбранными из атома галогена и С1-3 алкокси-группы); и кольцо С представляет собой группу, представленную следующей формулой:
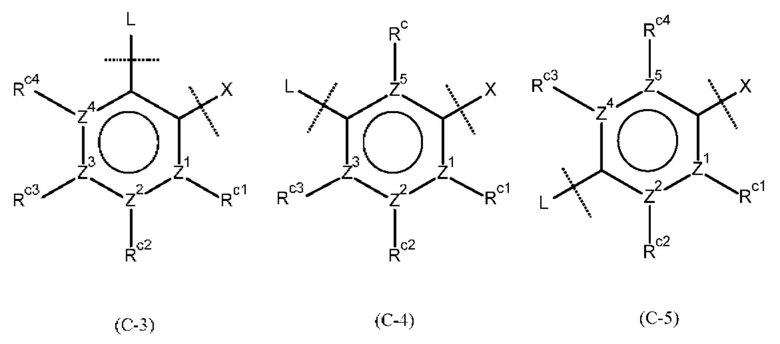
где Z1, Z2, Z3, Z4 и Z5, которые могут быть одинаковыми или разными, представляют собой атом углерода или атом азота;
Rc представляет собой атом водорода, атом галогена, нитро-группу, циано-группу, гидрокси-группу, необязательно галогенированную С1-6 алкильную группу, необязательно галогенированную С1-6 алкокси-группу или С3-10 циклоалкильную группу; и
Rc1, Rc2, Rc3 и Rc4, которые могут быть одинаковыми или разными, представляют собой атом водорода, атом галогена, нитро-группу, циано-группу, гидрокси-группу, необязательно галогенированную С1-6 алкильную группу, необязательно галогенированную С1-6 алкокси-группу или С3-10 циклоалкильную группу; или два соседних Rc1, Rc2, Rc3 и Rc4 соединены друг с другом с образованием необязательно замещенного кольца, при условии, что если Z1, Z2, Z3, Z4 или Z5 представляет собой атом азота, то Rc, Rc1, Rc2, Rc3 или Rc4 отсутствует.
<5>
Соединение по любому из пп. <1>-<4> выше или его соль, отличающиеся тем, что в формуле (I)
R1 представляет собой ОН;
R2 и R3, которые могут быть одинаковыми или разными, представляют собой атом водорода или С1-3 алкильную группу;
X представляет собой С(=O);
кольцо А представляет собой бензольное кольцо, которое может иметь дополнительный заместитель из С1-3 алкильной группы;
кольцо В представляет собой бензольное кольцо, которое не содержит дополнительный заместитель; и
кольцо С представляет собой группу, представленную следующей формулой:
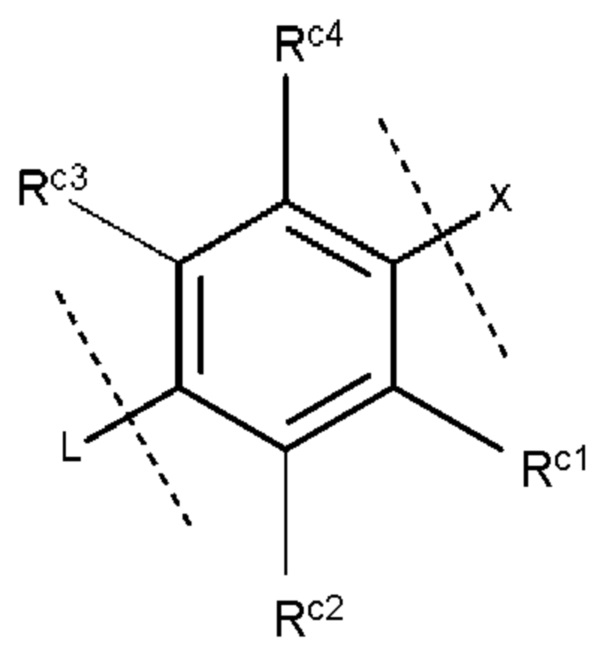
где
Rc1 и Rc4, которые могут быть одинаковыми или разными, представляют собой атом водорода, необязательно галогенированную C1-6 алкильную группу, необязательно галогенированную С1-6 алкокси-группу, атом хлора или атом фтора, и каждый Rc2 и Rc3 представляет собой атом водорода; и
L представляет собой -СН2-СН2-СН2-СН2-СН2-*,
-СН2-СН2-СН2-СН2-О-*,
-СН2-СН2-СН2-О-СН2-* или
-СН2-СН2-О-СН2-СН2-*.
<6>
Соединение по любому из пп. <1>-<5> выше или его соль, отличающиеся тем, что в формуле (I)
R1 представляет собой ОН;
R2 и R3, которые могут быть одинаковыми или разными, представляют собой атом водорода или метальную группу;
X представляет собой С(=O);
кольцо А представляет собой субструктуру, представленную следующей формулой:
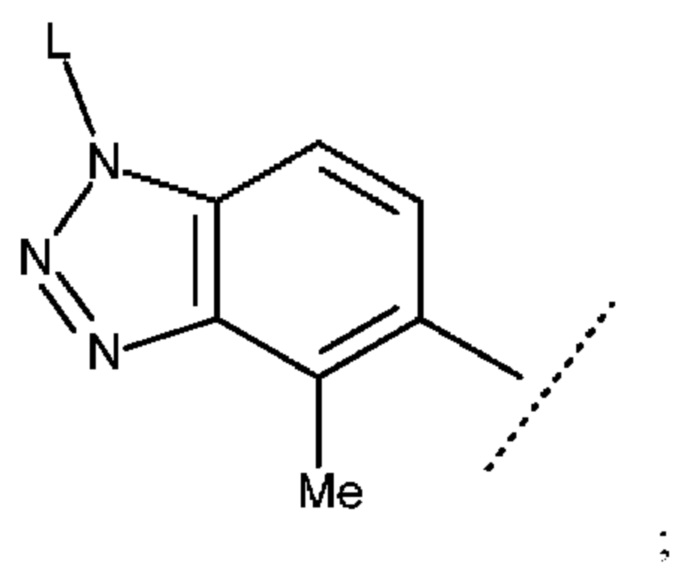
кольцо В представляет собой бензольное кольцо, которое не содержит дополнительный заместитель;
кольцо С представляет собой группу, представленную следующей формулой:
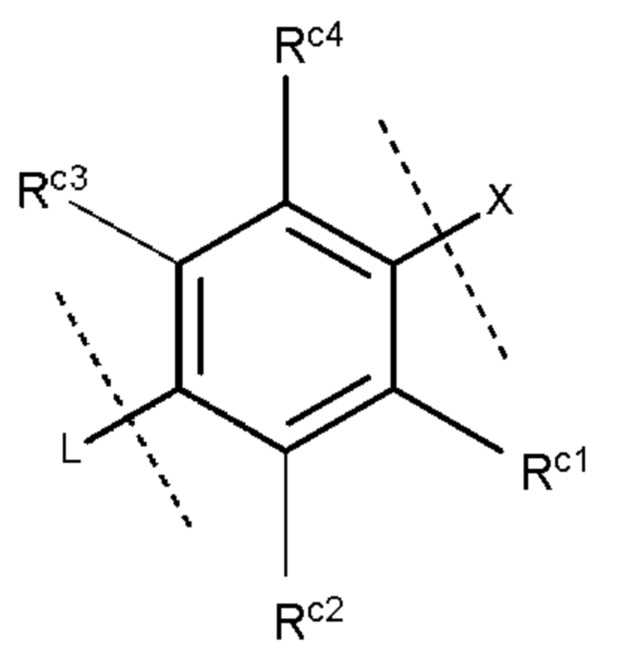
где
Rc1 и Rc4, которые могут быть одинаковыми или разными, представляют собой атом водорода, атом хлора или метальную группу, и каждый Rc2 и Rc3 представляет собой атом водорода; и
L представляет собой -СН2-СН2-СН2-СН2-СН2-*,
-CH2-СН2-CH2-CH2-О-*,
-СН2-СН2-СН2-О-СН2-* или
-СН2-СН2-О-СН2-СН2-*.
<7>
Соединение, выбранное из группы, состоящей из:
[32-метил-20-оксо-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]уксусной кислоты:
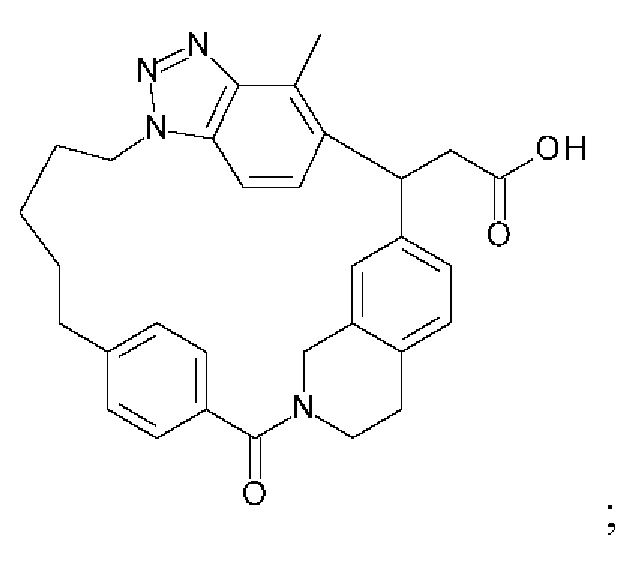
[32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]уксусной кислоты:
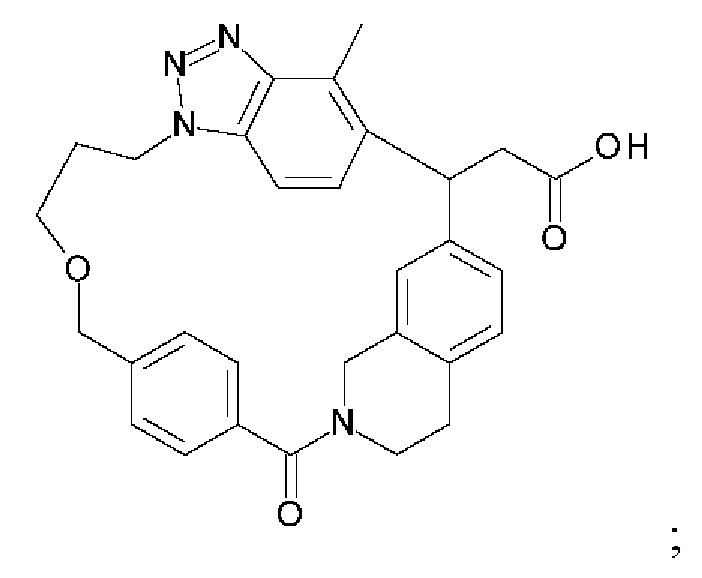
2-метил-2-[32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16,18,24(28),25,30-декаен-2-ил]пропионовой кислоты:
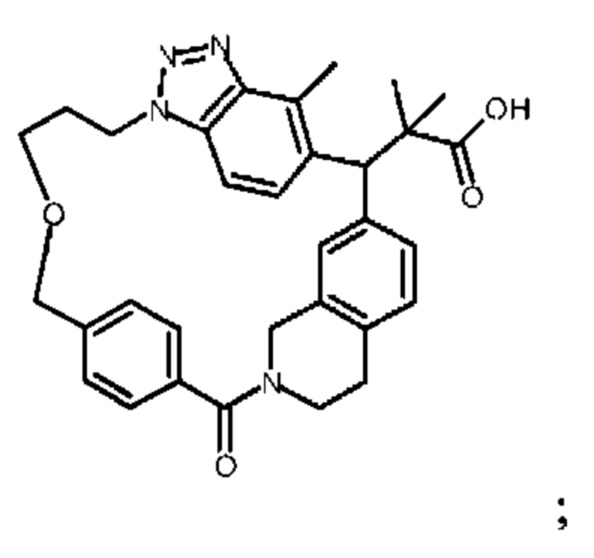
2-метил-2-[18,30,32-триметил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,23]дотриаконта-1(27),3(32),4,6,8,16(31),17,19(30),24(28),25-декаен-2-ил]пропионовой кислоты:
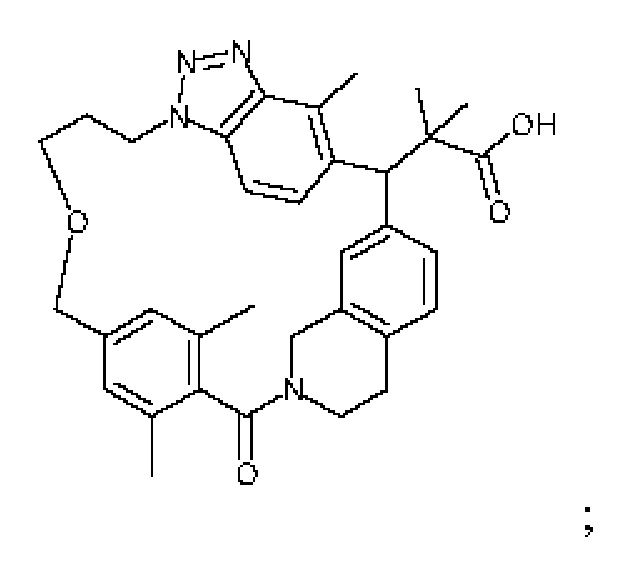
2-метил-2-[32-метил-20-оксо-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16(31),17,19(30),24(28),25-декаен-2-ил]пропановой кислоты
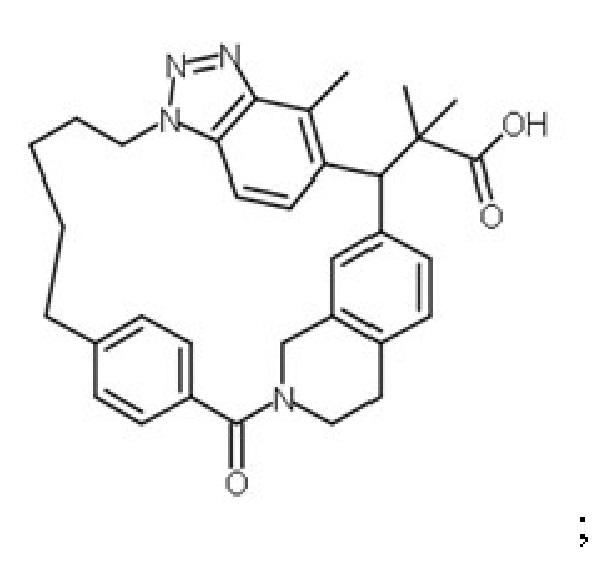
или ее соли.
<7-2>
[32-метил-20-оксо-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]уксусной кислоты:
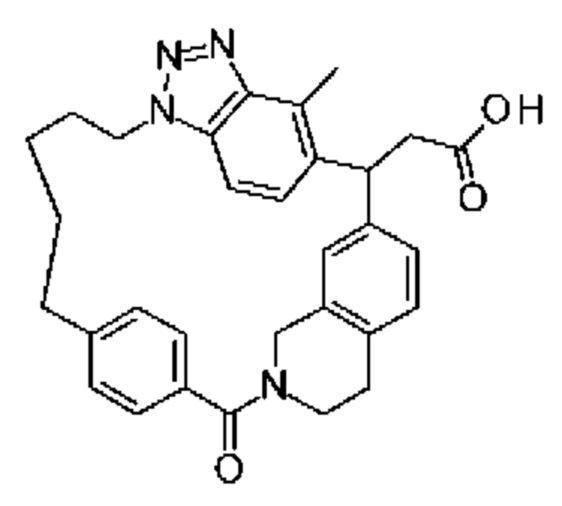
или ее соли.
<7-3>
[32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]уксусной кислоты:
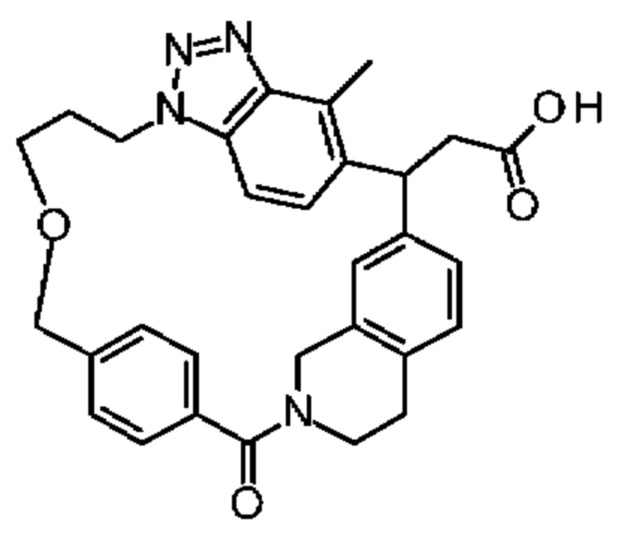
или ее соли.
<8>
Медикамент, содержащий соединение по любому из пп. <1>-<7> выше или его соль.
<9>
Медикамент по п. <8> выше, отличающийся тем, что указанный медикамент является активатором NRF2.
<10>
Медикамент по п. <9> выше, отличающийся тем, что указанный медикамент представляет собой профилактический или терапевтический агент для лечения заболевания печени и желчных протоков, сердечно-сосудистого заболевания, заболевания легких, заболевания почек, заболевания центральной нервной системы, рака, серповидно-клеточной болезни, митохондриального заболевания или воспалительного заболевания.
<11>
Фармацевтическая композиция, содержащая соединение по любому из пп. <1>-<7> выше или его фармацевтически приемлемую соль, для применения для предотвращения или лечения заболевания печени и желчных протоков, сердечнососудистого заболевания, заболевания легких, заболевания почек, заболевания центральной нервной системы, рака, серповидно-клеточной болезни, митохондриального заболевания или воспалительного заболевания.
<12>
Способ активации NRF2 у млекопитающего, включающий введение указанному млекопитающему соединения по любому из пп. <1>-<7> выше или его соли в эффективном количестве.
<13>
Способ предотвращения или лечения заболевания печени и желчных протоков, сердечно-сосудистого заболевания, заболевания легких, заболевания почек, заболевания центральной нервной системы, рака, серповидно-клеточной болезни, митохондриального заболевания или воспалительного заболевания у млекопитающего, включающий введение указанному млекопитающему соединения по любому из пп. <1>-<7> или его соли.
<14>
Применение соединения по любому из пп. <1>-<7> выше или его соли для получения профилактического или терапевтического агента для лечения заболевания печени и желчных протоков, сердечно-сосудистого заболевания, заболевания легких, заболевания почек, заболевания центральной нервной системы, рака, серповидно-клеточной болезни, митохондриального заболевания или воспалительного заболевания.
[0007]
Настоящее изобретение может обеспечивать соединение, которое обладает превосходным активирующим действием в отношении NRF2 и предположительно подходит для применения в качестве профилактического или терапевтического агента для заболеваний, связанных с окислительным стрессом, в частности, заболевания печени и желчных протоков, такого как заболевание печени (например, неалкогольный стеатогепатит (НАСГ) и заболевание желчных протоков (первичный склерозирующий холангит (ПСХ) или т.п.), сердечно-сосудистого заболевания (например, сердечной недостаточности или легочной артериальной гипертензии), заболевания легких (например, хронической обструктивной болезни легких (ХОБЛ)), заболевания почек (например, хронической болезни почек (ХБП) или острого повреждения почек (ОПП)), заболевания центральной нервной системы (например, болезни Паркинсона, болезни Альцгеймера, церебрального инсульта), митохондриального заболевания (например, моторной атаксии Фридрейха, митохондриальной миопатии), воспалительного заболевания (например, рассеянного склероза (PC), воспалительной болезни кишечника (ВЗК)), серповидно-клеточной болезни, рака или т.п.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ РЕАЛИЗАЦИИ ИЗОБРЕТЕНИЯ
[0008]
(Подробное описание изобретения)
Ниже представлено подробное описание настоящего изобретения.
[0009]
Ниже представлено подробное описание определения каждого заместителя, используемого в настоящем документе. Если не указано иное, каждый заместитель имеет следующее определение.
Примеры «атома галогена» в настоящем документе включают фтор, хлор, бром и йод.
Примеры «C1-6 алкильной группы» в настоящем документе включают метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил, пентил, изопентил, неопентил, 1-этилпропил, гексил, изогексил, 1,1-диметилбутил, 2,2-диметилбутил, 3,3-диметилбутил и 2-этилбутил.
[0010]
Примеры «циклической группы» в «необязательно замещенной циклической группе» включают С3-10 циклоалкильную группу, С3-10 циклоалкенильную группу, С6-14 арильную группу, ароматическую гетероциклическую группу и неароматическую гетероциклическую группу.
Следует отметить, что «необязательно замещенное кольцо» означает кольцо, которое не содержит связывающий фрагмент циклической группы, определенной как «необязательно замещенная циклическая группа».
Примеры «С3-10 циклоалкильной группы» в настоящем документе включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, бицикло[2.2.1]гептил, бицикло[2.2.2]октил, бицикло[3.2.1]октил и адамантил.
С3-10 циклоалкильная группа может быть конденсирована с бензольным кольцом, и примеры такого конденсированного кольца включают тетрагидронафтил и дигидроинденил.
Примеры «С3-10 циклоалкенильной группы» включают циклопропенил, циклобутенил, циклопентенил, циклогексенил, циклогептенил и циклооктенил.
Примеры «С6-14 арильной группы» включают фенил, 1-нафтил, 2-нафтил, 1-антрил, 2-антрил и 9-антрил.
С6-14 арильная группа, описанная выше, может быть конденсирована с С3-10 циклоалкановым кольцом (предпочтительно с С5-6 циклоалкановым кольцом (например, с циклопентаном и циклогексаном)), и примеры такого конденсированного кольца включают тетрагидронафтил и дигидроинденил.
[0011]
Ароматическая гетероциклическая группа в «циклической группе» «необязательно замещенной циклической группы» предпочтительно представляет собой 5 14-членную ароматическую гетероциклическую группу, и более предпочтительно 5-6-членную моноциклическую ароматическую гетероциклическую группу (например, пиридил, тиазолил, оксазолил, пиразолил, триазолил и тиенил) или 8-14-членную конденсированную полициклическую (предпочтительно бициклическую или трициклическую) ароматическую гетероциклическую группу (например, индазолил, индолил, бензимидазолил, бензотриазолил, бензотиенил и бензофурил).
Неароматическая гетероциклическая группа в «циклической группе» «необязательно замещенной циклической группы» предпочтительно представляет собой 3-14-членную неароматическую гетероциклическую группу, и более предпочтительно 3-8-членную моноциклическую неароматическую гетероциклическую группу (например, оксетанил и тетрагидропиранил) или 9-14-членную конденсированную полициклическую (предпочтительно бициклическую или трициклическую) неароматическую гетероциклическую группу (например, дигидрокуменил, дигидробензофурил, дигидрдобензодиоксепинил, тетрагидрохинолил, тетрагидроизохинолил, индолинил, дигидробензодиоксинил, дигидробензоксазинил и дигидробензоксазепинил).
Кроме того, неароматическая гетероциклическая группа может представлять собой спирокольцо, и примеры такого спирокольца включают спиро[1-бензофуран-2,1'-циклопропан]-ил, спиро[1-бензофуран-2,1'-циклогексан]-ил, тетрагидро-3Н-спиро[1-бензофуран-2,4'-пиран]-ил, спиро[1-бензофуран-2,1'-циклопентан]-ил и дигидроспиро[1,4-бензоксазин-2,1'-циклобутан]-ил.
[0012]
Примеры «С3-6 циклоалкильной группы» в настоящем документе включают циклопропил, циклобутил, циклопентил и циклогексил.
Примеры «C1-6 алкокси-группы» в настоящем документе включают метокси, этокси, пропокси, изопропокси, бутокси, изобутокси, втор-бутокси, трет-бутокси, пентилокси и гексилокси.
[0013]
Примеры «5- или 6-членного ароматического кольца, которое может содержать гетероатом(ы) в кольце» в настоящем документе включают 5- или 6-членное ароматическое гетероциклическое кольцо, содержащее, помимо атомов углерода, от 1 до 4 гетероатомов, выбранных из атома азота, атома серы и атома кислорода в качестве составных атомов кольца, или 6-членное ароматическое карбоциклическое кольцо, не содержащее гетероатомов.
Кроме того, «необязательно замещенное 5- или 6-членное ароматическое кольцо, которое может содержать гетероатом(ы) в кольце» представлено, в частности, следующими формулами:
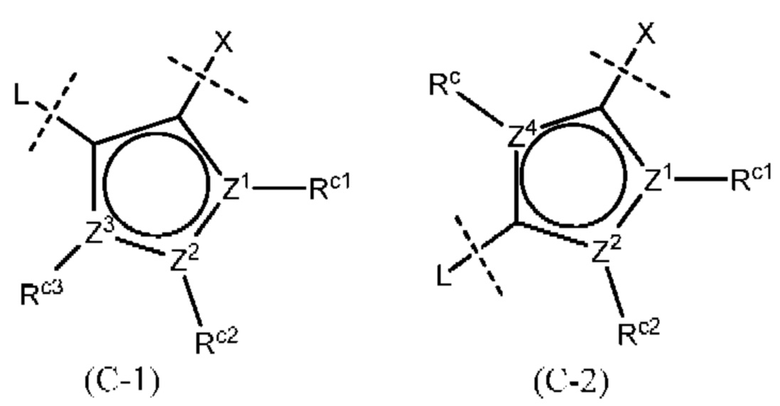
[0014]
где Z1, Z2, Z3, Z4 и Z5, которые могут быть одинаковыми или разными, представляют собой атом углерода или атом азота;
Rc представляет собой атом водорода или атом галогена, нитро-группу, циано-группу, гидрокси-группу, необязательно галогенированную C1-6 алкильную группу, необязательно галогенированную C1-6 алкокси-группу или С3-10 циклоалкильную группу; и
Rc1, Rc2, Rc3 и Rc4, которые могут быть одинаковыми или разными, представляют собой атом водорода или атом галогена, нитро-группу, циано-группу, гидрокси-группу, необязательно галогенированную C1-6 алкильную группу, необязательно галогенированную С1-6 алкокси-группу или С3-10 циклоалкильную группу; или два соседних Rc1, Rc2, Rc3 и Rc4 вместе могут образовывать необязательно замещенное кольцо, при условии, что если Z1, Z2, Z3, Z4 или Z5 представляет собой атом азота, то Rc, Rc1, Rc2, Rc3 или Rc4 отсутствует.
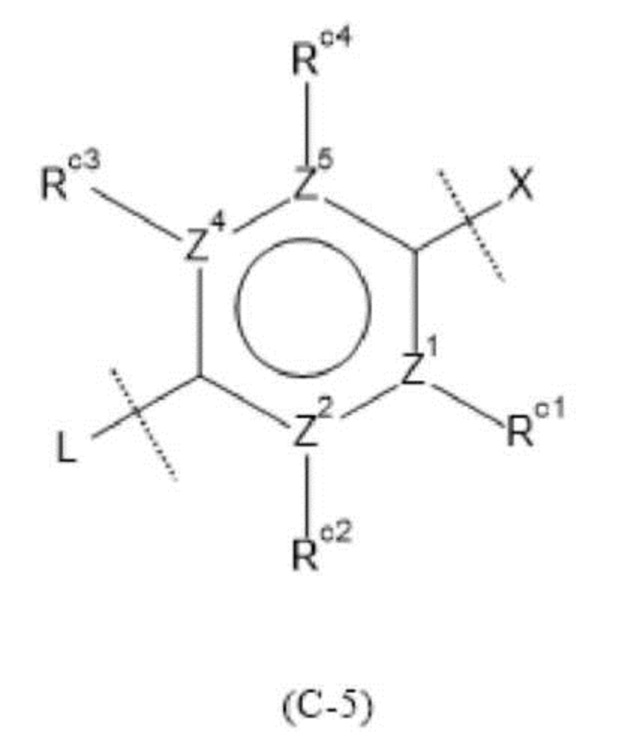
Следует отметить, что формулы (С-1) и (С-5) присоединены к X и L в формуле (I) в определенных положениях связывания.
[0015]
«Необязательно галогенированный» в настоящем документе означает, например, необязательно замещенный 1-7, предпочтительно 1-5 атомами галогена.
Подходящие примеры такого 5- или 6-членного ароматического гетероциклического кольца включают тиофен, фуран, пиррол, имидазол, пиразол, тиазол, изотиазол, оксазол, изоксазол, пиридин, пиразин, пиримидин, пиридазин, 1,2,4-оксадиазол, 1,3,4-оксадиазол, 1,2,4-тиадиазол, 1,3,4-тиадиазол, триазол, тетразол и триазин, и 6-членное ароматическое карбоциклическое кольцо, не содержащее гетероатомов, представляет собой бензольное кольцо.
[0016]
«Насыщенный или ненасыщенный линейный С4-8 алкилен, необязательно содержащий вставленный гетероатом» в настоящем документе означает насыщенную или ненасыщенную линейную алкиленовую группу, в которой один или два гетероатома, выбранных из атома азота или NRc (Rc представляет собой атом водорода или С1-6 алкильную группу, необязательно содержащую заместитель), атома серы, SO, SO2 и атома кислорода, вставлены в произвольном положении С4-8 алкилена, разделяя указанный алкилен на два или более; насыщенную или ненасыщенную линейную алкиленовую группу, которая замещена гетероатомом, описанным выше; или насыщенную или ненасыщенную линейную С4-8 алкиленовую группу.
Более конкретно, он представляет собой группу, представленную следующей формулой:
-(CR4R5)n-Y1-(CR6R7)m-Y2-*
где * означает точку присоединения к кольцу С;
n представляет собой целое число, равное 2 или более и 4 или менее;
m представляет собой целое число, равное 1 или более и 4 или менее;
R4 и R5, которые могут быть одинаковыми или отличаться друг от друга, представляют собой атом водорода, атом галогена, ОН, необязательно замещенную С1-6 алкильную группу или необязательно замещенную C1-6 алкокси-группу, или R4 и R5 соединены друг с другом с образованием необязательно замещенной С3-6 циклоалкильной группы, и некоторое множество R4 или некоторое множество R5 может включать одинаковые или различающиеся R, и соседние R4 или R5 могут быть соединены друг с другом с образованием двойной связи;
R6 и R7, которые могут быть одинаковыми или отличаться друг от друга, представляют собой атом водорода, атом галогена, ОН, необязательно замещенную C1-6 алкильную группу или необязательно замещенную C1-6 алкокси-группу, или R6 и R7 соединены друг с другом с образованием необязательно замещенной С3-6 циклоалкильной группы, и если m равен 2 или более, то некоторое множество R6 или некоторое множество R7 может включать одинаковые или различающиеся R, и соседние R6 или R7 могут быть соединены друг с другом с образованием двойной связи;
Y1 и Y2, которые могут быть одинаковыми или разными, представляют собой связь, атом кислорода, NR8, атом серы, SO или SO2, при условии, что если Y1 представляет собой связь, то m равен 1 или 4; и
R8 представляет собой атом водорода или необязательно замещенную C1-6 алкильную группу, при условии, что если присутствует некоторое множество R8, то некоторое множество R8 может включать одинаковые или различающиеся R.
[0018]
«R4 и R5 соединены друг с другом с образованием необязательно замещенной С3-6 циклоалкильной группы» или «R6 и R7 соединены друг с другом с образованием необязательно замещенной С3-6 циклоалкильной группы» означает необязательно замещенный С3-6 циклоалкил, содержащий атом углерода, к которому присоединены R4 и R5, или атом углерода, к которому присоединены R6 и R7, в качестве составного элемента кольца.
[0019]
«Соседние R6 или R7 могут быть соединены друг с другом с образованием двойной связи» означает, например, в случае -CR6R7-CR6R7- группу -CR6=CR7-, -CR7=CR6-, -CR7=CR7- или -CR6=CR6-.
В частности, предпочтительные группы представлены формулой: -(CR4R5)n-Y1-(CR6R7)m-Y2-*, причем символы в указанной формуле соответствуют определению выше и представляют собой группы, представленные ниже в таблице 1.
[0020]


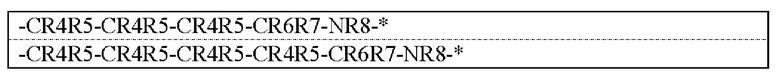
[0021]
Предпочтительно такая группа является любой из групп, представленных следующими формулами:
-CR4R5-CR4R5-CR4R5-CR4R5-CR6R7-*;
-CR4R5-CR4R5-CR4R5-CR6R7-O-*;
-CR4R5-CR4R5-CR4R5-O-CR6R7-*; и
-CR4R5-CR4R5-O-CR6R7-CR6R7-*.
Более предпочтительно такая группа является любой из групп, представленных следующими формулами:
-СН2-СН2-СН2-СН2-СН2-*; и
-СН2-СН2-СН2-О-СН2-*.
[0022]
Примеры заместителя в «необязательно замещенной C1-6 алкильной группе», «необязательно замещенной циклической группе», «бензольном кольце, которое может содержать дополнительный заместитель (заместители)», «необязательно замещенном 5- или 6-членном ароматическом кольце, которое может содержать гетероатом(ы) в кольце» и «необязательно замещенном насыщенном или ненасыщенном линейном С4-8 алкилене, необязательно содержащем включенный гетероатом» в настоящем документе включают заместители, выбранные из группы заместителей А, описанных ниже, и количество заместителей составляет, например, от 1 до 5 (предпочтительно от 1 до 3). Если количество заместителей равно двум или более, то указанные заместители могут быть одинаковыми или отличаться друг от друга.
[Группа заместителей А]
(1) Атом галогена;
(2) Циано-группа;
(3) Нитро-группа;
(4) Необязательно замещенная углеводородная группа;
(5) Необязательно замещенная гетероциклическая группа;
(6) Ацильная группа;
(7) Необязательно замещенная аминогруппа;
(8) Необязательно замещенная карбамоильная группа;
(9) Необязательно замещенная тиокарбамоильная группа;
(10) Необязательно замещенная сульфамоильная группа;
(11) Необязательно замещенная гидрокси-группа;
(12) Необязательно замещенная сульфанильная (SH) группа; и
(13) Необязательно замещенная силильная группа.
[0023]
Примеры «углеводородной группы» в «необязательно замещенной углеводородной группе» в группе заместителей А включают C1-6 алкильную группу, С2-6 алкенильную группу, С2-6 алкинильную группу, С3-10 циклоалкильную группу, С3-10 циклоалкенильную группу, С6-14 арильную группу и С7-16 аралкильную группу.
Примеры «С2-6 алкенильной группы» включают этенил, 1-пропенил, 2-пропенил, 2-метил-1-пропенил, 1-бутенил, 2-бутенил, 3-бутенил, 3-метил-2-бутенил, 1-пентенил, 2-пентенил, 3-пентенил, 4-пентенил, 4-метил-3-пентенил, 1-гексенил, 3-гексенил и 5-гексенил.
Примеры «С2-6 алкинильной группы» включают этинил, 1-пропинил, 2-пропинил, 1-бутинил, 2-бутинил, 3-бутинил, 1-пентинил, 2-пентинил, 3-пентинил, 4-пентинил, 1-гексинил, 2-гексинил, 3-гексинил, 4-гексинил, 5-гексинил и 4-метил-2-пентинил.
Примеры «С7-16 аралкильной группы» включают бензил, фенэтил, нафтилметил и фенилпропил.
[0024]
Примеры «необязательно замещенной углеводородной группы» в группе заместителей А включают углеводородную группу, необязательно содержащую заместитель, выбранный из группы заместителей В, описанных ниже.
[Группа заместителей В]
(1) Атом галогена;
(2) Нитро-группа;
(3) Циано-группа;
(4) Оксо-группа;
(5) Гидрокси-группа;
(6) Необязательно галогенированная С1-6 алкокси-группа;
(7) С6-14 Арилокси-группа (например, фенокси, нафтокси);
(8) С7-16 Аралкилокси-группа (например, бензилокси);
(9) 5-14-членная ароматическая гетероциклическая кольцевая окси-группа (например, пиридилокси);
(10) 3-14-членная неароматическая гетероциклическая кольцевая окси-группа (например, морфолинилокси, пиперидинилокси);
(11) С1-6 Алкилкарбонилокси-группа (например, ацетокси, пропаноилокси);
(12) С6-14 Арилкарбонилокси-группа (например, бензоилокси, 1-нафтоилокси, 2-нафтоилокси);
(13) C1-6 Алкоксикарбонилокси-группа (например, метоксикарбонилокси, этоксикарбонилокси, пропоксикарбонилокси, бутоксикарбонилокси);
(14) Моно- или ди-С1-6 алкилкарбамоилокси-группа (например, метилкарбамоилокси, этилкарбамоилокси, диметилкарбамоилокси, диэтилкарбамоилокси);
(15) С6-14 Арилкарбамоилокси-группа (фенилкарбамоилокси, нафтилкарбамоилокси);
(16) 5-14-членная ароматическая гетероциклическая кольцевая карбонилокси-группа (например, никотиноилокси);
(17) 3-14-членная неароматическая карбонилокси-группа (например, морфолинилкарбонилокси, пиперидинилкарбонилокси);
(18) Необязательно галогенированная С1-6 алкилсульфонилокси-группа (например, метилсульфонилокси, трифторметилсульфонилокси);
(19) С6-14 Арилсульфонилокси-группа, необязательно замещенная С1-6 алкильной группой (например, фенилсульфонилокси, толуолсульфонилокси);
(20) Необязательно галогенированная С1-6 алкилтио-группа;
(21) 5-14-членная ароматическая гетероциклическая группа;
(22) 3-14-членная неароматическая гетероциклическая группа;
(23) Формильная группа;
(24) Карбокси-группа;
(25) Необязательно галогенированная C1-6 алкилкарбонильная группа;
(26) С6-14 Арилкарбонильная группа;
(27) 5-14-членная ароматическая гетероциклическая кольцевая карбонильная группа;
(28) 3-14-членная неароматическая гетероциклическая кольцевая карбонильная группа;
(29) С1-6 Алкоксикарбонильная группа;
(30) С6-14 Арилоксикарбонильная группа (например, фенилоксикарбонил, 1-нафтилоксикарбонил, 2-нафтилоксикарбонил);
(31) С7-16 Аралкоксикарбонильная группа (например, бензилоксикарбонил, фенэтилоке икар бонил);
(32) Карбамоильная группа;
(33) Тиокарбамоильная группа;
(34) Моно- или ди-С1-6 алкилкарбамоильная группа;
(35) С6-14 Арилкарбамоильная группа (например, фенилкарбамоил);
(36) 5-14-членная ароматическая гетероциклическая кольцевая карбамоильная группа (например, пиридилкарбамоил, тиенилкарбамоил);
(37) 3-14-членная неароматическая гетероциклическая кольцевая карбамоильная группа (например, морфолинилкарбамоил, пиперидинилкарбамоил);
(38) Необязательно галогенированная C1-6 алкилсульфонильная группа;
(39) С6-14 Арилсульфонильная группа;
(40) 5-14-членная ароматическая гетероциклическая кольцевая сульфонильная группа (например, пиридилсульфонил, тиенилсульфонил);
(41) Необязательно галогенированная С1-6 алкилсульфинильная группа;
(42) С6-14 Арилсульфинильная группа (например, фенилсульфинил, 1-нафтилсульфинил, 2-нафтилсульфинил);
(43) 5-14-членная ароматическая гетероциклическая кольцевая сульфинильная группа (например, пиридилсульфинил, тиенилсульфинил);
(44) Аминогруппа;
(45) Моно- или ди-С1-6 алкиламино-группа (например, метиламино, этиламино, пропиламино, изопропиламино, бутиламино, диметиламино, диэтиламино, дипропиламино, дибутиламино, N-этил-N-метиламино);
(46) Моно- или ди-С6-14 ариламино-группа (например, фениламино);
(47) 5-14-членная ароматическая гетероциклическая кольцевая аминогруппа (например, пиридиламино);
(48) С7-16 Аралкиламино-группа (например, бензиламино);
(49) Формиламино-группа;
(50) С1-6 Алкилкарбониламино-группа (например, ацетиламино, пропаноиламино, бутаноиламино);
(51) (C1-6 Алкил)(С1-6 алкилкарбонил)аминогруппа (например, N-ацетил-N-метиламино);
(52) С6-14 Арилкарбониламино-группа (например, фенилкарбониламино, нафтилкарбониламино);
(53) C1-6 Алкоксикарбониламино-группа (например, метоксикарбониламино, этоксикарбониламино, пропоксикарбониламино, бутоксикарбониламино, трет-бутоксикарбониламино);
(54) С7-16 Аралкилоксикарбониламино-группа (например, бензилоксикарбониламино);
(55) C1-6 Алкилсульфониламино-группа (например, метилсульфониламино, этилсульфониламино);
(56) С6-14 Арилсульфониламино-группа, необязательно замещенная С1-6 алкильной группой (например, фенилсульфониламино, толуолсульфониламино);
(57) Необязательно галогенированная C1-6 алкильная группа;
(58) С2-6 Алкенильная группа;
(59) С2-6 Алкинильная группа;
(60) С3-10 Циклоалкильная группа;
(61) С3-10 Циклоалкенильная группа; и
(62) С6-14 Арильная группа.
Количество заместителей, выбранных из заместителей В, описанных выше, в «необязательно замещенной углеводородной группе» из группы заместителей А составляет, например, от 1 до 5, и предпочтительно от 1 до 3. Если количество заместителей равно двум или более, то указанные заместители могут быть одинаковыми или отличаться друг от друга.
[0025]
Примеры «гетероциклической группы» в «необязательно замещенной гетероциклической группе» из группы заместителей А включают (i) ароматическую гетероциклическую группу, (ii) неароматическую гетероциклическую группу и (iii) 7-10-членную мостиковую гетероциклическую группу, каждая из которых содержит, помимо атомов углерода, от 1 до 4 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, в качестве составных атомов кольца.
[0026]
Примеры «ароматической гетероциклической группы» в «гетероциклической группе» из группы заместителей А (включая «5-14-членную ароматическую гетероциклическую группу») включают 5-14-членную (предпочтительно 5-10-членную) ароматическую гетероциклическую группу, содержащую, помимо атомов углерода, от 1 до 4 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, в качестве составных атомов кольца.
Подходящие примеры такой «ароматической гетероциклической группы» включают: 5-6-членную моноциклическую ароматическую гетероциклическую группу, такую как тиенил, фурил, пирролил, имидазолил, пиразолил, тиазолил, изотиазолил, оксазолил, изоксазолил, пиридил, пиразинил, пиримидинил, пиридазинил, 1,2,4-оксадиазолил, 1,3,4-оксадиазолил, 1,2,4-тиадиазолил, 1,3,4-тиадиазолил, триазолил, тетразолил и триазинил; и
8-14-членную конденсированную полициклическую (предпочтительно бициклическую или трициклическую) ароматическую гетероциклическую группу, такую как бензотиофенил, бензофуранил, бензимидазолил, бензоксазолил, бензизоксазолил, бензотиазолил, бензизотиазолил, бензотриазолил, имидазопиридинил, тиенопиридинил, фуропиридинил, пирролопиридинил, пиразолопиридинил, оксазолопиридинил, тиазолопиридинил, имидазопиразинил, имидазопиримидинил, тиенопиримидинил, фуропиримидинил, пирролопиримидинил, пиразолопиримидинил, оксазолопиримидинил, тиазолопиримидинил, пиразолотриазинил, нафто[2,3-b]тиенил, феноксатиинил, индолил, изоиндолил, 1Н-индазолил, пуринил, изохинолил, хинолил, фталазинил, нафтиридинил, хиноксалинил, хиназолинил, циннолинил, карбазолил, β-карболинил, фенантридинил, акридинил, феназизнил, фенотиазинил и феноксазинил.
[0027]
Примеры «неароматической гетероциклической группы» в «гетероциклической группе» из группы заместителей А (включая «3-14-членную неароматическую гетероциклическую группу») включают 3-14-членную (предпочтительно 4-10-членную) неароматическую гетероциклическую группу, содержащую, помимо атомов углерода, от 1 до 4 гетероатомов, выбранных из атома азота, атома серы и атома кислорода, в качестве составных атомов кольца.
Подходящие примеры такой «неароматической гетероциклической группы» включают: 3-8-членную моноциклическую неароматическую гетероциклическую группу, такую как азиридинил, оксиранил, тииранил, азетидинил, оксетанил, тиетанил, тетрагидротиенил, тетрагидрофуранил, пирролинил, пирролидинил, имидазолинил, имидазолидинил, оксазолинил, оксазолидинил, пиразолинил, пиразолидинил, тиазолинил, тиазолидинил, тетрагидроизотиазолил, тетрагидроксазолил, тетрагидроизоксазолил, пиперидинил, пиперазинил, тетрагидропиридинил, дигидропиридинил, дигидротиопиранил, тетрагидропиримидинил, тетрагидропиридазинил, дигидропиранил, тетрагидропиранил, тетрагидротиопиранил, морфолинил, тиоморфолинил, азепанил, диазепанил, азепинил, оксепанил, азоканил и диазоканил; и
9-14-членную конденсированную полициклическую (предпочтительно бициклическую или трициклическую) неароматическую гетероциклическую группу, такую как дигидробензофуранил, дигидробензимидазолил, дигидробензоксазолил, дигидробензотиазолил, дигидробензизотиазолил, дигидронафто[2,3-b]тиенил, тетрагидроизохинолил, тетрагидрохинолил, 4Н-хинолизинил, индолинил, изоиндолинил, тетрагидротиено[2,3-с]пиридинил, тетрагидробензазепинил, тетрагидрохиноксалинил, тетрагидрофенантридинил, гексагидрофенотиазинил, гексагидрофеноксазинил, тетрагидрофталазинил, тетрагидронафтиридинил, тетрагидрохиназолинил, тетрагидроциннолинил, тетрагидрокарбазолил, тетрагидро-β-карболинил, тетрагидроакридинил, тетрагидрофеназинил, тетрагидротиоксантенил и октагидроизохинолил.
[0028]
Подходящие примеры «7-10-членной мостиковой гетероциклической группы» в гетероциклической группе» из группы заместителей А включают хинуклидинил и 7-азабицикло[2.2.1]гептанил.
Примеры «необязательно замещенной гетероциклической группы» в настоящем документе включают гетероциклическую группу, необязательно содержащую заместитель, выбранный из группы заместителей В, описанных выше.
Количество заместителей в «необязательно замещенной гетероциклической группе» составляет, например, от 1 до 3. Если количество заместителей равно двум или более, то указанные заместители могут быть одинаковыми или отличаться друг от друга.
[0029]
Примеры «необязательно замещенной аминогруппы» из группы заместителей А включают аминогруппу, необязательно содержащую «1 или 2 заместителя, выбранных из C1-6 алкильной группы, С2-6 алкенильной группы, С3-10 циклоалкильной группы, С6-14 арильной группы, С7-16 аралкильной группы, С1-6 алкилкарбонильной группы, С6-14 арилкарбонильной группы, С7-16 аралкилкарбонильной группы, 5-14-членной ароматической гетероциклической кольцевой карбонильной группы, 3-14-членной неароматической гетероциклической кольцевой карбонильной группы, С1-6 алкоксикарбонильной группы, 5-14-членной ароматической гетероциклической группы, карбамоильной группы, моно- или ди-C1-6 алкилкарбамоильной группы, моно- или ди-С7-16 аралкилкарбамоильной группы, C1-6 алкилсульфонильной группы и С6-14 арилсульфонильной группы, каждая из которых необязательно содержит от 1 до 3 заместителей, выбранных из группы заместителей А».
Подходящие примеры необязательно замещенной аминогруппы включают аминогруппу, моно- или ди(необязательно галогенированный C1-6 алкил)аминогруппу (например, метиламино, трифторметиламино, диметиламино, этиламино, диэтиламино, пропиламино, дибутиламино), моно- или ди-С2-6 алкениламино-группу (например, диаллиламино), моно- или ди-С3-10 циклоалкиламино-группу (например, циклопропиламино, циклогексиламино), моно- или ди-С6-14 ариламино-группу (например, фениламино), моно- или ди-С7-16 аралкиламино-группу (например, бензиламино, дибензиламино), моно- или ди(необязательно галогенированный С1-6 алкил)карбониламино-группу (например, ацетиламино, пропиониламино), моно- или ди-С6-14 арилкарбониламино-группу (например, бензоиламино), моно- или ди-С7-16 аралкилкарбониламино-группу (например, бензилкарбониламино), моно- или ди-5-14-членную ароматическую гетероциклическую кольцевую карбониламино-группу (например, никотиноиламино, изоникотиноиламино), моно- или ди-3-14-членную неароматическую гетероциклическую кольцевую карбониламино-группу (например, пиперидинилкарбониламино), моно- или ди-C1-6 алкокси-карбониламино-группу (например, трет-бутоксикарбониламино), 5-14-членную ароматическую гетероциклическую кольцевую аминогруппу (например, пиридиламино), карбамоиламино-группу, (моно- или ди-С1-6 алкилкарбамоил)аминогруппу (например, метилкарбамоиламино), (моно- или ди-С7-16 аралкилкарбамоил)аминогруппу (например, бензилкарбамоиламино), C1-6 алкилсульфониламино-группу (например, метилсульфониламино, этилсульфониламино), С6-14 арилсульфониламино-группу (например, фенилсульфониламино), (С1-6 алкил)(С1-6 алкилкарбонил)аминогруппу (например, N-ацетил-N-метиламино) и (C1-6 алкил)(С6-14 арилкарбонил)аминогруппу (например, N-бензоил-N-метиламино).
[0030]
Примеры «необязательно замещенной карбамоильной группы» из группы заместителей А включают карбамоильную группу, необязательно содержащую «1 или 2 заместителя, выбранных из С1-6 алкильной группы, С2-6 алкенильной группы, С3-10 циклоалкильной группы, С6-14 арильной группы, С7-16 аралкильной группы, С1-6 алкилкарбонильной группы, С6-14 арилкарбонильной группы, С7-16 аралкилкарбонильной группы, 5-14-членной ароматической гетероциклической кольцевой карбонильной группы, 3-14-членной неароматической гетероциклической кольцевой карбонильной группы, С1-6 алкоксикарбонильной группы, 5-14-членной ароматической гетероциклической группы, карбамоильной группы, моно- или ди-С1-6 алкилкарбамоильной группы и моно- или ди-С7-16 аралкилкарбамоильной группы, каждая из которых необязательно содержит от 1 до 3 заместителей, выбранных из группы заместителей В».
Подходящие примеры необязательно замещенной карбамоильной группы включают карбамоильную группу, моно- или ди-С1-6 алкилкарбамоильную группу, моно- или ди-С2-6 алкенилкарбамоильную группу (например, диаллилкарбамоил), моно- или ди-С3-10 циклоалкилкарбамоильную группу (например, циклопропилкарбамоил, циклогексилкарбамоил), моно- или ди-С6-14 арилкарбамоильную группу (например, фенилкарбамоил), моно- или ди-С7-16 аралкилкарбамоильную группу, моно- или ди-С1-6 алкилкарбонилкарбамоильную группу (например, ацетилкарбамоил, пропионилкарбамоил), моно- или ди-С6-14 арилкарбонил карбамоильную группу (например, бензоилкарбамоил) и 5-14-членную ароматическую гетероциклическую кольцевую карбамоильную группу (например, пиридилкарбамоил).
[0031]
Примеры «необязательно замещенной тиокарбамоильной группы» из группы заместителей А включают тиокарбамоильную группу, необязательно содержащую «1 или 2 заместителя, выбранных из C1-6 алкильной группы, С2-6 алкенильной группы, С3-10 циклоалкильной группы, С6-14 арильной группы, С7-16 аралкильной группы, С1-6 алкилкарбонильной группы, С6-14 арилкарбонильной группы, С7-16 аралкилкарбонильной группы, 5-14-членной ароматической гетероциклической кольцевой карбонильной группы, 3-14-членной неароматической гетероциклической кольцевой карбонильной группы, C1-6 алкоксикарбонильной группы, 5-14-членной ароматической гетероциклической группы, карбамоильной группы, моно- или ди-С1-6 алкилкарбамоильной группы и моно- или ди-С7-16 аралкилкарбамоильной группы, каждая из которых необязательно содержит от 1 до 3 заместителей, выбранных из группы заместителей В».
Подходящие примеры необязательно замещенной тиокарбамоильной группы включают тиокарбамоильную группу, моно- или ди-С1-6 алкилтиокарбамоильную группу (например, метилтиокарбамоил, этилтиокарбамоил, диметилтиокарбамоил, диэтилтиокарбамоил, N-этил-N-метилтиокарбамоил), моно- или ди-С2-6 алкенилтиокарбамоильную группу (например, диаллилтиокарбамоил), моно- или ди-С3-10 циклоалкилтиокарбамоильную группу (например, циклопропилтиокарбамоил, циклогексилтиокарбамоил), моно- или ди-С6-14 арилтиокарбамоильную группу (например, фенилтиокарбамоил), моно- или ди-С7-16 аралкилтиокарбамоильную группу (например, бензилтиокарбамоил, фенэтилтиокарбамоил), моно- или ди-С1-6 алкилкарбонилтиокарбамоильную группу (например, ацетилтиокарбамоил, пропионилтиокарбамоил), моно- или ди-С6-14 арилкарбонилтиокарбамоильную группу (например, бензоилтиокарбамоил) и 5-14-членную ароматическую гетероциклическую кольцевую карбамоильную группу (например, пиридилтиокарбамоил).
[0032]
Примеры «необязательно замещенной сульфамоильной группы» из группы заместителей А включают сульфамоильную группу, необязательно содержащую «1 или 2 заместителя, выбранных из С1-6 алкильной группы, С2-6 алкенильной группы, С3-10 циклоалкильной группы, С6-14 арильной группы, С7-16 аралкильной группы, С1-6 алкилкарбонильной группы, С6-14 арилкарбонильной группы, С7-16 аралкилкарбонильной группы, 5-14-членной ароматической гетероциклической кольцевой карбонильной группы, 3-14-членной неароматической гетероциклической кольцевой карбонильной группы, C1-6 алкоксикарбонильной группы, 5-14-членной ароматической гетероциклической группы, карбамоильной группы, моно- или ди-С1-6 алкилкарбамоильной группы и моно- или ди-С7-16 аралкилкарбамоильной группы, каждая из которых необязательно содержит от 1 до 3 заместителей, выбранных из группы заместителей В».
Подходящие примеры необязательно замещенной сульфамоильной группы включают сульфамоильную группу, моно- или ди-C1-6 алкилсульфамоильную группу (например, метилсульфамоил, этилсульфамоил, диметилсульфамоил, диэтилсульфамоил, N-этил-N-метилсульфамоил), моно- или ди-С2-6 алкенилсульфамоильную группу (например, диаллилсульфамоил), моно- или ди-С3-10 циклоалкилсульфамоильную группу (например, циклопропилсульфамоил, циклогексилсульфамоил), моно- или ди-С6-14 арилсульфамо ильную группу (например, фенилсульфамоил), моно- или ди-С7-16 аралкилсульфамоильную группу (например, бензилсульфамоил, фенэтилсульфамоил), моно- или ди-С1-6 алкилкарбонилсульфамоильную группу (например, ацетилсульфамоил, пропионилсульфамоил), моно- или ди-С6-14 арилкарбонилсульфамоильную группу (например, бензоилсульфамоил) и 5-14-членную ароматическую гетероциклическую кольцевую сульфамоильную группу (например, пиридилсульфамоил).
[0033]
Примеры «необязательно замещенной гидрокси-группы» из группы заместителей А включают гидрокси-группу, необязательно содержащую «заместитель, выбранный из С1-6 алкильной группы, С2-6 алкенильной группы, С3-10 циклоалкильной группы, С6-14 арильной группы, С7-16 аралкильной группы, С1-6 алкилкарбонильной группы, С6-14 арилкарбонильной группы, С7-16 аралкилкарбонильной группы, 5-14-членной ароматической гетероциклической кольцевой карбонильной группы, 3-14-членной неароматической гетероциклической кольцевой карбонильной группы, С1-6 алкоксикарбонильной группы, 5-14-членной ароматической гетероциклической группы, карбамоильной группы, моно- или ди-C1-6 алкилкарбамоильной группы, моно- или ди-С7-16 аралкилкарбамоильной группы, C1-6 алкилсульфонильной группы и С6-14 арилсульфонильной группы, каждая из которых необязательно содержит от 1 до 3 заместителей, выбранных из группы заместителей В».
Подходящие примеры необязательно замещенной гидрокси-группы включают гидрокси-группу, C1-6 алкокси-группу, С2-6 алкенилокси-группу (например, аллилокси, 2-бутенилокси, 2-пентенилокси, 3-гексенилокси), С3-10 циклоалкилокси-группу (например, циклогексилокси), С6-14 арилокси-группу (например, фенокси, нафтилокси), С7-16 аралкилокси-группу (например, бензилокси, фенэтилокси), C1-6 алкилкарбонилокси-группу (например, ацетилокси, пропионилокси, бутирилокси, изобутирилокси, пивалоилокси), С6-14 арилкарбонилокси-группу (например, бензоилокси), С7-16 аралкилкарбонилокси-группу (например, бензилкарбонилокси), 5-14-членную ароматическую гетероциклическую кольцевую карбонилокси-группу (например, никотиноилокси), 3-14-членную неароматическую гетероциклическую кольцевую карбонилокси-группу (например, пиперидинилкарбонилокси), С1-6 алкоксикарбонилокси-группу (например, трет-бутоксикарбонилокси), 5-14-членную ароматическую гетероциклическую кольцевую окси-группу (например, пиридилокси), карбамоилокси-группу, C1-6 алкилкарбамоилокси-группу (например, метилкарбамоилокси), С7-16 аралкилкарбамоилокси-группу (например, бензилкарбамоилокси), C1-6 алкилсульфонилокси-группу (например, метилсульфонилокси, этилсульфонилокси) и С6-14 арилсульфонилокси-группу (например, фенилсульфонилокси).
[0034]
Примеры «необязательно замещенной сульфанильной группы» из группы заместителей А включают сульфанильную группу, необязательно содержащую «заместитель, выбранный из C1-6 алкильной группы, С2-6 алкенильной группы, С3-10 циклоалкильной группы, С6-14 ар ильной группы, С7-16 аралкильной группы, С1-6 алкилкарбонильной группы, С6-14 арилкарбонильной группы и 5-14-членной ароматической гетероциклической группы, каждая из которых необязательно содержит от 1 до 3 заместителей, выбранных из группы заместителей В», и галогенированную сульфанильную группу.
Подходящие примеры необязательно замещенной сульфанильной группы включают сульфанильную (-SH) группу, С1-6 алкилтио-группу, С2-6 алкенилтио-группу (например, аллилтио, 2-бутенилтио, 2-пентенилтио, 3-гексенилтио), С3-10 циклоалкилтио-группу (например, циклогексилтио), С6-14 арилтио-группу (например, фенилтио, нафтилтио), С7-16 аралкилтио-группу (например, бензилтио, фенэтилтио), C1-6 алкилкарбонилтио-группу (например, ацетилтио, пропионилтио, бутирилтио, изобутирилтио, пивалоилтио), С6-14 арилкарбонилтио-группу (например, безоилтио), 5-14-членную ароматическую гетероциклическую кольцевую тиогруппу (например, пиридилтио) и галогенированную тиогруппу (например, пентафтортио).
Примеры «С3-10 циклоалкилокси-группы» в настоящем документе включают циклопропилокси, циклобутилокси, циклопентилокси, циклогексилокси, циклогептилокси и циклооктилокси.
Примеры «C1-6 алкилтио-группы» в настоящем документе включают метилтио, этилтио, пропилтио, изопропилтио, бутилтио, втор-бутилтио, трет-бутилтио, пентилтио и гексилтио.
[0035]
Примеры «необязательно замещенной силильной группы» из группы заместителей А включают силильную группу, необязательно содержащую «от 1 до 3 заместителей, выбранных из C1-6 алкильной группы, С2-6 алкенильной группы, С3-10 циклоалкильной группы, С6-14 арильной группы и С7-16 аралкильной группы, каждая из которых необязательно содержит от 1 до 3 заместителей, выбранных из группы заместителей В».
Подходящие примеры необязательно замещенной силильной группы включают три-С1-6 алкилсилильную группу (например, триметилсилил, трет-бутил(диметил)силил).
[0036]
Далее представлено подробное описание определения каждого символа в формуле (I).
R1 предпочтительно представляет собой ОН или ORy.
Ry предпочтительно представляет собой С1-6 алкильную группу.
R1 более предпочтительно представляет собой ОН.
R2 и R3 предпочтительно являются одинаковыми или разными, и каждый из них представляет собой атом водорода или необязательно замещенную C1-6 алкильную группу (например, метил).
R2 и R3 более предпочтительно являются одинаковыми или разными, и каждый представляет собой атом водорода или C1-3 алкильную группу (например, метил).
Особенно предпочтительно каждый R2 и R3 представляет собой атом водорода или метальную группу.
X предпочтительно представляет собой С(=O).
[0037]
«Бензольное кольцо» из «бензольного кольца, которое может содержать дополнительный заместитель (заместители)», обозначенное как кольцо А, может быть дополнительно замещено, например, заместителем(ями), выбранным(и) из группы заместителей А, описанной выше, и количество заместителей равно, например, от 1 до 3. Если количество заместителей равно двум или более, то указанные заместители могут быть одинаковыми или отличаться друг от друга.
В настоящем описании, если бензольное кольцо кольца А содержит дополнительный заместитель (заместители), то положение замещения предпочтительно включает положение, выбранное из положений а и b, указанных стрелками ниже:
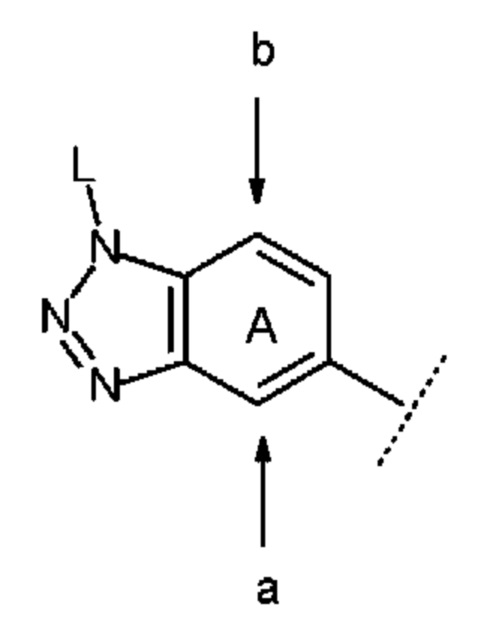
причем символы в указанной формуле соответствуют определению выше.
[0038]
Кольцо А предпочтительно представляет собой бензольное кольцо, которое может содержать дополнительный заместитель (заместители), выбранный из атома фтора, атома хлора, С1-3 алкильной группы, необязательно замещенной 1-3 заместителями (выбранными из атома галогена и С1-3 алкокси-группы), или С1-3 алкокси-группы, необязательно замещенной 1-3 заместителями (выбранными из атома галогена и С1-3 алкокси-группы).
Также предпочтительно кольцо А представляет собой бензольное кольцо, которое может содержать от 1 до 3 дополнительных заместитель(ей), выбранных из:
(a) С1-6 алкильной группы (например, метила); и
(b) С1-6 алкокси-группы (например, метокси).
[0039]
Более предпочтительно кольцо А представляет собой бензольное кольцо, которое содержит один дополнительный заместитель, выбранный из:
(a) С1-3 алкильной группы (например, метила); и
(b) С1-3 алкокси-группы (например, метокси).
[0040]
В данном случае положение замещения в бензольном кольце кольца А предпочтительно представляет собой положение а или b, указанное следующими стрелками:
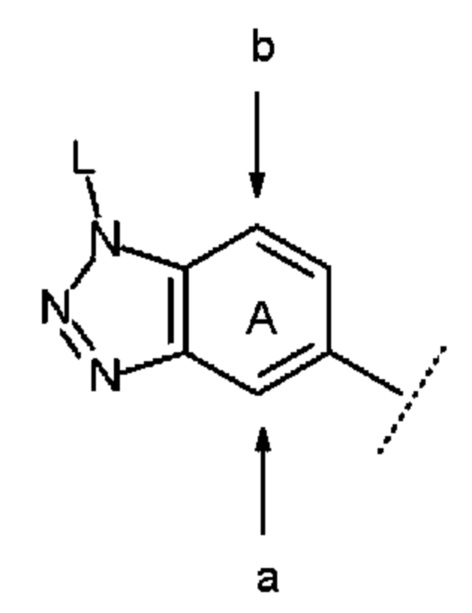
причем символы в указанной формуле соответствуют определению выше.
[0041]
В другом варианте реализации кольцо А более предпочтительно представляет собой бензольное кольцо, которое содержит 1 или 2 дополнительных заместителя, выбранных из:
(a) C1-3 алкильной группы (например, метила); и
(b) C1-3 алкокси-группы (например, метокси).
[0042]
В данном случае положение(я) замещения в бензольном кольце кольца А предпочтительно представляет собой положение, выбранное из положений а и b, указанных следующими стрелками:
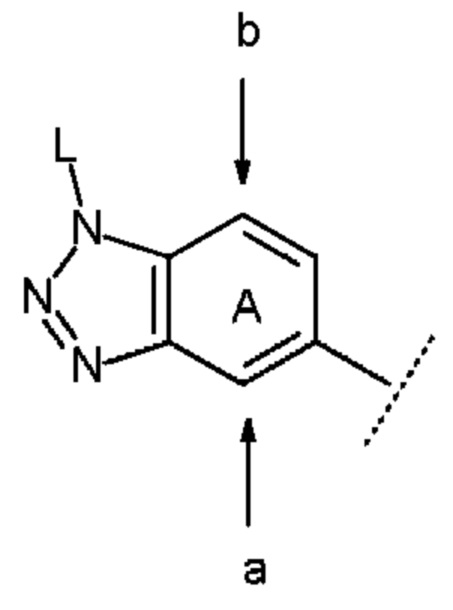
причем символы в указанной формуле соответствуют определению выше.
[0043]
В таком варианте реализации кольцо А также предпочтительно представляет собой бензольное кольцо, которое содержит дополнительный заместитель, представляющий собой C1-3 алкильную группу (например, метил).
[0044]
В данном случае положение замещения в бензольном кольце кольца А предпочтительно представляет собой положение а, указанное следующей стрелкой:
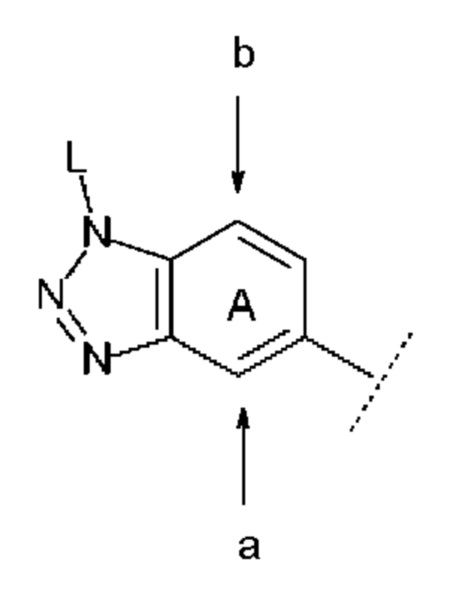
причем символы в указанной формуле соответствуют определению выше.
[0045]
Структура, представленная следующей формулой:
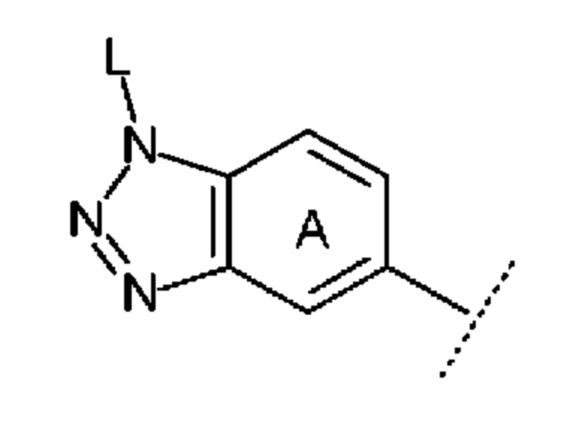
причем символы в указанной формуле соответствуют определению выше,
предпочтительно представляет собой субструктуру, представленную следующей формулой:
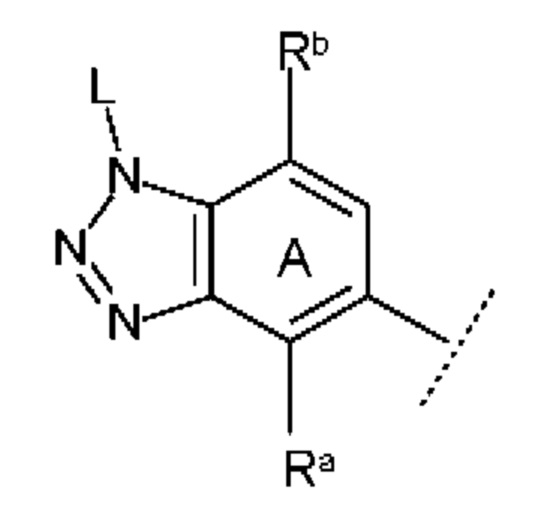
где
Ra представляет собой атом водорода или С1-6 алкильную группу;
Rb представляет собой атом водорода или C1-6 алкокси-группу; и
L имеет такое же значение, как описано выше.
[0046]
В данном случае Ra предпочтительно представляет собой C1-3 алкильную группу (например, метил), и более предпочтительно метил. Rb предпочтительно представляет собой атом водорода или C1-3 алкокси-группу (например, метокси).
Также предпочтительно кольцо А представляет собой субструктуру, представленную следующей формулой:
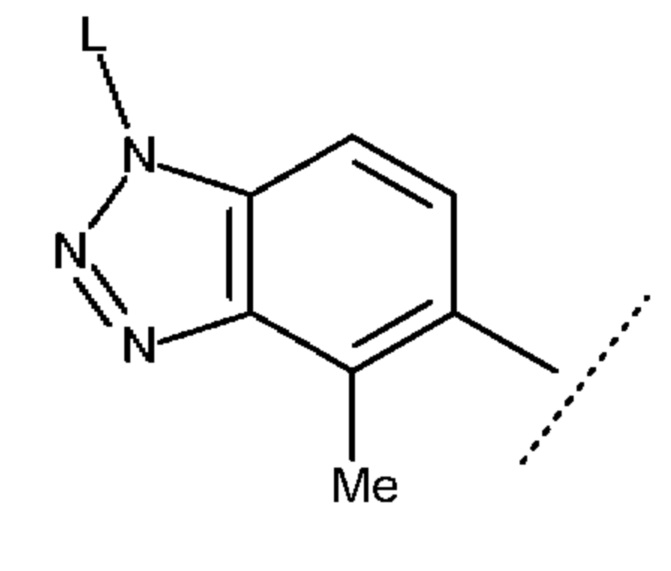
[0047]
«Бензольное кольцо» из «бензольного кольца, которое может содержать дополнительный заместитель (заместители)», обозначенное как кольцо В, может содержать дополнительный заместитель (заместители), например, заместитель, выбранный из группы заместителей А, описанной выше, и количество заместителей равно, например, от 1 до 3. Если количество заместителей равно двум или более, то указанные заместители могут быть одинаковыми или отличаться друг от друга.
Кольцо В предпочтительно представляет собой бензольное кольцо, которое может содержать дополнительный заместитель (заместители), выбранный из атома фтора, атома хлора, циано-группы, C1-3 алкильной группы, необязательно замещенной 1-3 заместителями (выбранными из атома галогена и C1-3 алкокси-группы), или С1-3 алкокси-группы, необязательно замещенной 1-3 заместителями (выбранными из атома галогена и C1-3 алкокси-группы).
Более предпочтительно кольцо В представляет собой бензольное кольцо, которое не содержит дополнительного заместителя. В настоящем документе выражение «которое не содержит дополнительного заместителя» означает, что кольцо В является таким же, как кольцо В, описанное в формуле I, и не имеет заместителя, отличного от заместителей в кольце В, описанных в формуле I.
[0048]
«Необязательно замещенное 5- или 6-членное ароматическое кольцо, которое может содержать гетероатом(ы) в кольце», обозначенное как кольцо С, предпочтительно представляет собой кольцо, изображенное следующей формулой:
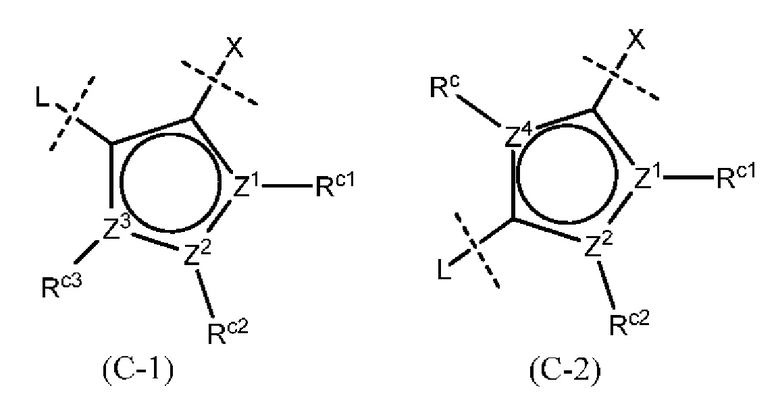
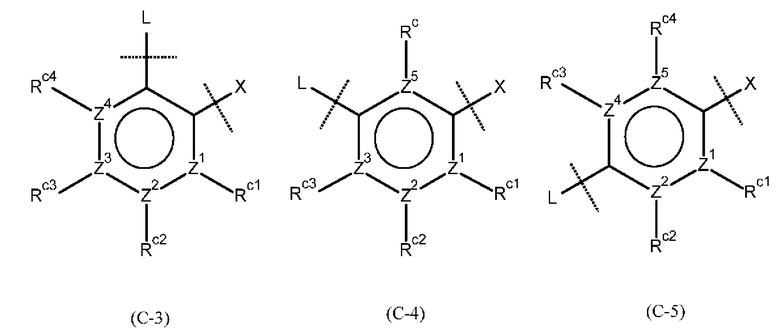
[0049]
где Z1, Z2, Z3, Z4 и , которые могут быть одинаковыми или разными, представляют собой атом углерода или атом азота;
Rc представляет собой Н, атом галогена, нитро-группу, циано-группу, гидрокси-группу, необязательно галогенированную С1-6 алкильную группу, необязательно галогенированную С1-6 алкокси-группу или С3-10 циклоалкильную группу; и
Rc1, Rc2, Rc3 и Rc4, которые могут быть одинаковыми или разными, представляют собой Н, атом галогена, нитро-группу, циано-группу, гидрокси-группу, необязательно галогенированную С1-6 алкильную группу, необязательно галогенированную C1-6 алкокси-группу или С3-10 циклоалкильную группу; или два соседних Rc1, Rc2, Rc3 и Rc4 могут быть соединены друг с другом с образованием необязательно замещенного кольца, при условии, что если Z1, Z2, Z3, Z4 или представляет собой атом азота, то Rc, Rc1, Rc2, Rc3 или Rc4 отсутствует.
Кроме того, формулы (С-1) и (С-5) присоединены к X и L в формуле (I) в определенных положениях связывания.
Предпочтительно кольцо С является любой из групп, представленных следующими формулами:
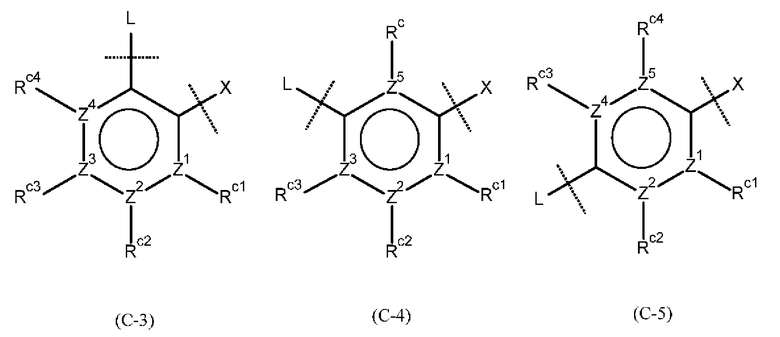
где Z1, Z2, Z3, Z4 и Z5, которые могут быть одинаковыми или разными, представляют собой атом углерода или атом азота.
Также предпочтительно кольцо С представляет собой группу, в которой каждый Z1, Z2, Z3, Z4 и Z5 представляет собой атом углерода; и Rc1, Rc2, Rc3 и Rc4, которые могут быть одинаковыми или разными, представляют собой Н или атом галогена, нитро-группу, циано-группу, гидрокси-группу, необязательно галогенированную C1-6 алкильную группу, необязательно галогенированную С1-6 алкокси-группу или С3-10 циклоалкильную группу; или два соседних Rc1, Rc2, Rc3 и Rc4 могут быть соединены друг с другом с образованием необязательно замещенного кольца.
Также предпочтительно кольцо С представляет собой кольцо, представленное формулой (С-5), и представляет собой группу, в которое два соседних Rc1, Rc2, Rc3 и Rc4 могут быть соединены друг с другом с образованием необязательно замещенного насыщенного кольца.
«Насыщенное кольцо» из «необязательно замещенного насыщенного кольца» означает С5-8 циклоалкильное кольцо или насыщенное гетероциклическое кольцо, и такое насыщенное гетероциклическое кольцо означает 5- или 8-членное насыщенное гетероциклическое кольцо, содержащее, помимо атомов углерода, от 1 до 4 гетероатомов, выбранных из атома азота, атома серы и атома кислорода в качестве составных атомов кольца. Его предпочтительные примеры включают 5-6-членное насыщенное гетероциклическое кольцо (например, тетрагидрофуран, тетрагидропиран, 1,3-диоксолан, морфолин). Более предпочтительно оно представляет собой необязательно замещенный тетрагидропиран или необязательно замещенный морфолин.
Заместитель в «необязательно замещенном насыщенном кольце» означает от 1 до 3 заместителей, которые могут быть одинаковыми или разными и выбраны из атома галогена, нитро-группы, циано-группы, гидрокси-группы, оксо-группы, необязательно галогенированной С1-6 алкильной группы, необязательно галогенированной С1-6 алкокси-группы, С3-10 циклоалкильной группы и С3-10 циклоалкил-С1-6 алкильной группы.
Более предпочтительно кольцо С является кольцом, представленным формулой (С-5), где все Z1, Z2, Z4 и Z5 представляют собой атомы углерода; и в одной из комбинаций Rc1 и Rc2 или Rc3 и Rc4 указанные две группы могут быть одинаковыми или разными и представляют собой Н или атом галогена, нитро-группу, циано-группу, гидрокси-группу, необязательно галогенированную C1-6 алкильную группу, необязательно галогенированную С1-6 алкокси-группу или С3-10 циклоалкильную группу; а в другой комбинации два соседних Rc1, Rc2, Rc3 и Rc4 соединены друг с другом с образованием 5- или 6-членного гетероциклического кольца, содержащего, помимо атомов углерода, от 1 до 4 гетероатомов, выбранных из атома азота, атома серы и атома кислорода в качестве составных атомов кольца.
Гетероциклическое кольцо, описанное выше, может представлять собой ароматическое гетероциклическое кольцо или неароматическое гетероциклическое кольцо. Примеры ароматического гетероциклического кольца включают, среди тех, которые описаны как моноциклические ароматические гетероциклические кольца, упомянутые выше, например, пиридил, тиазолил, оксазолил, пиразолил, триазолил и тиенил. Примеры неароматического гетероциклического кольца включают, среди моноциклических неароматических гетероциклических колец, упомянутых выше, те, которые являются 5- или 6-членными, такие как тетрагидротиенил, тетрагидрофуранил, пирролинил, пирролидинил, имидазолинил, имидазолидинил, оксазолинил, оксазолидинил, пиразолинил, пиразолидинил, тиазолинил, тиазолидинил, тетрагидроизотиазолил, тетрагидрооксазолил, тетрагидроизоксазолил, пиперидинил, пиперазинил, тетрагидропиридинил, дигидропиридинил, дигидротиопиранил, тетрагидропиримидинил и тетрагидропиридазинил. Предпочтительно оно представляет собой тетрагидрофуран или морфолин.
Если кольцо, описанное выше, является насыщенным, оно может быть замещено 1-3 заместителями, которые могут быть одинаковыми или разными и выбраны из атома галогена, нитро-группы, циано-группы, гидрокси-группы, оксо-группы, необязательно галогенированной С1-6 алкильной группы, необязательно галогенированной С1-6 алкокси-группы, С3-10 циклоалкильной группы и С3-10 циклоалкил-С1-6 алкильной группы.
Более конкретно, кольцо С предпочтительно представляет собой группу, представленную следующей формулой:
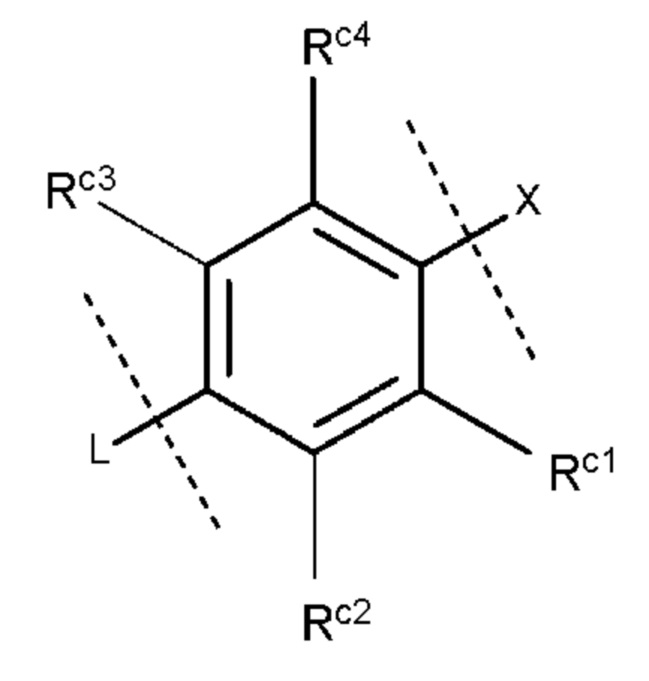
где
Rc1 и Rc4, которые могут быть одинаковыми или разными, представляют собой атом водорода, необязательно галогенированную C1-6 алкильную группу, атом хлора, необязательно галогенированную С1-6 алкокси-группу или атом фтора, и каждый Rc2 и Rc3 представляет собой атом водорода.
Более конкретно, кольцо С предпочтительно представляет собой группу, представленную следующей формулой:
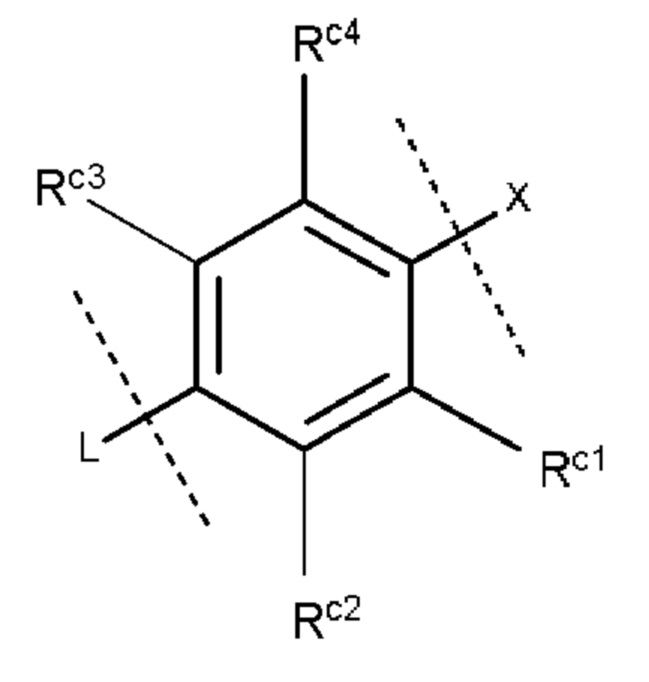
где
Rc1 и Rc4, которые могут быть одинаковыми или разными, представляют собой атом водорода, метильную группу или атом хлора, и каждый Rc2 и Rc3 представляет собой атом водорода.
[0050]
L предпочтительно представляет собой -(CR4R5)n-Y1-(CR6R7)m-Y2-*
где * означает точку присоединения к кольцу С;
n представляет собой целое число, равное 2 или более и 4 или менее;
m представляет собой целое число, равное 1 или более и 4 или менее;
каждый R4 и R5, которые могут быть одинаковыми или отличаться друг от друга, представляют собой атом водорода, атом галогена, ОН, необязательно замещенную C1-6 алкильную группу или необязательно замещенную С1-6 алкокси-группу, или R4 и R5 соединены друг с другом с образованием необязательно замещенной С3-6 циклоалкильной группы, и некоторое множество R4 или некоторое множество R5 может включать одинаковые или различающиеся R, и соседние R4 или R5 могут быть соединены друг с другом с образованием двойной связи;
R6 и R7, которые могут быть одинаковыми или отличаться друг от друга, представляют собой атом водорода, атом галогена, ОН, необязательно замещенную C1-6 алкильную группу или необязательно замещенную C1-6 алкокси-группу, или R6 и R7 соединены друг с другом с образованием необязательно замещенной С3-6 циклоалкильной группы, и если m равен 2 или более, то некоторое множество R6 или некоторое множество R7 может включать одинаковые или различающиеся R, и соседние R6 или R7 могут быть соединены друг с другом с образованием двойной связи;
Y1 и Y2, которые могут быть одинаковыми или разными, представляют собой связь, атом кислорода или NR8, при условии, что если Y1 представляет собой связь, то m равен 1 или 4; и
R8 представляет собой атом водорода или необязательно замещенную С1-6 алкильную группу.
Более предпочтительно L является любой из групп, представленных следующими формулами:
-CR4R5-CR4R5-CR4R5-CR4R5-CR6R7-*;
-CR4R5-CR4R5-CR4R5-CR6R7-O-*;
-CR4R5-CR4R5-CR4R5-O-CR6R7-*; и
-CR4R5-CR4R5-O-CR6R7-CR6R7-*.
Наиболее предпочтительно L представляет собой
-СН2-СН2-СН2-СН2-СН2-* или
-СН2-СН2-СН2-О-СН2-*.
[0051]
Примеры соединения, представленного формулой (I) (далее в настоящем документе также упоминаемого как соединение (I)), включают представленные ниже соединения А-D или их соли.
[Соединение А]
Соединение или его соль, где:
R1 представляет собой ОН;
R2 и R3, которые могут быть одинаковыми или разными, представляют собой атом водорода или необязательно замещенную С1-6 алкильную группу;
X представляет собой С(=O);
кольцо А представляет собой бензольное кольцо, которое может содержать дополнительный заместитель (заместители);
кольцо В представляет собой бензольное кольцо, которое может содержать дополнительный заместитель (заместители);
кольцо С представляет собой необязательно замещенное бензольное кольцо; и
L представляет собой -CR4R5-CR4R5-CR6R7-CR6R7-CR6R7-CR6R7-*;
-CR4R5-CR4R5-CR4R5-CR4R5-CR6R7-*;
-CR4R5-CR4R5-CR4R5-CR6R7-O-*;
-CR4R5-CR4R5-CR4R5-O-CR6R7-*; или
-CR4R5-CR4R5-O-CR6R7-CR6R7-*.
[0052]
[Соединение В]
Соединение или его соль, где:
R1 представляет собой NHRy;
Ry представляет собой необязательно замещенную циклическую группу;
R2 и R3, которые могут быть одинаковыми или разными, представляют собой атом водорода или необязательно замещенную С1-6 алкильную группу;
X представляет собой С(=O);
кольцо А представляет собой бензольное кольцо, которое может содержать дополнительный заместитель (заместители);
кольцо В представляет собой бензольное кольцо, которое может содержать дополнительный заместитель (заместители);
кольцо С представляет собой необязательно замещенное бензольное кольцо; и
L представляет собой -CR4R5-CR4R5-CR6R7-CR6R7-CR6R7-CR6R7-*;
-CR4R5-CR4R5-CR4R5-CR4R5-CR6R7-*;
-CR4R5-CR4R5-CR4R5-CR6R7-O-*;
-CR4R5-CR4R5-CR4R5-O-CR6R7-*; или
-CR4R5-CR4R5-O-CR6R7-CR6R7-*.
[0053]
[Соединение С]
Соединение или его соль, где:
R1 представляет собой ОН;
R2 и R3, которые могут быть одинаковыми или разными, представляют собой атом водорода или необязательно замещенную C1-6 алкильную группу;
X представляет собой С(=O);
кольцо А представляет собой бензольное кольцо, которое может содержать дополнительный заместитель (заместители);
кольцо Б представляет собой бензольное кольцо, которое может содержать дополнительный заместитель (заместители);
кольцо С представляет собой группу, представленную следующей формулой:
[0054]
где все Z1, Z2, Z4 и Z5 представляют собой атомы углерода; и в одной из комбинаций Rc1 и Rc2 или Rc3 и Rc4 указанные две группы, которые могут быть одинаковыми или разными, представляют собой атом водорода или атом галогена, нитро-группу, циано-группу, гидрокси-группу, необязательно галогенированную С1-6 алкильную группу, необязательно галогенированную С1-6 алкокси-группу или С3-10 циклоалкильную группу; а в другой комбинации два соседних Rc1, Rc2, Rc3 и Rc4 соединены друг с другом с образованием необязательно замещенного кольца; и
L представляет собой -CR4R5-CR4R5-CR6R7-CR6R7-CR6R7-CR6R7-*;
-CR4R5-CR4R5-CR4R5-CR4R5-CR6R7-*;
-CR4R5-CR4R5-CR4R5-CR6R7-O-*;
-CR4R5-CR4R5-CR4R5-O-CR6R7-*; или
-CR4R5-CR4R5-O-CR6R7-CR6R7-*.
[0055]
[Соединение D]
Соединение или его соль, где:
R1 представляет собой ORy;
Ry представляет собой необязательно замещенную C1-6 алкильную группу;
R2 и R3, которые могут быть одинаковыми или разными, представляют собой атом водорода или необязательно замещенную C1-6 алкильную группу;
X представляет собой С(=O);
кольцо А представляет собой бензольное кольцо, которое может содержать дополнительный заместитель (заместители);
кольцо В представляет собой бензольное кольцо, которое может содержать дополнительный заместитель (заместители);
кольцо С представляет собой необязательно замещенное бензольное кольцо; и
L представляет собой -CR4R5-CR4R5-CR6R7-CR6R7-CR6R7-CR6R7-*;
-CR4R5-CR4R5-CR4R5-CR4R5-CR6R7-*;
-CR4R5-CR4R5-CR4R5-CR6R7-O-*;
-CR4R5-CR4R5-CR4R5-O-CR6R7-*; или
-CR4R5-CR4R5-O-CR6R7-CR6R7-*.
Предпочтительно соединение (I) представляет собой соединение А или его соль.
Конкретные примеры соединения (I) включают соединения из примеров 1-68 и их соли.
[0057]
Если соединение (I) представляет собой соль, то примеры такой соли включают соли металлов, соли аммония, соли с органическими основаниями, соли с неорганическими кислотами, соли с органическими кислотами и соли с основными или кислотными аминокислотами. Подходящие примеры соли металла включают соли щелочных металлов, такие как натриевая соль и калиевая соль; соли щелочноземельных металлов, такие как кальциевая соль, магниевая соль и бариевая соль; и соль алюминия. Подходящие примеры соли с органическим основанием включают соли с триметиламином, триэтиламином, пиридином, пиколином, 2,6-лутидином, этаноламином, диэтаноламином, триэтаноламином, циклогексиламином, дициклогексиламином и N,N'-дибензилэтилендиамино. Подходящие примеры металла с неорганической кислотой включают соли с хлористоводородной кислотой, бромистоводородной кислотой, азотной кислотой, серной кислотой и фосфорной кислотой. Подходящие примеры соли с органической кислотой включают соли с муравьиной кислотой, уксусной кислотой, трифторуксусной кислотой, фталевой кислотой, фумаровой кислотой, щавелевой кислотой, винной кислотой, малеиновой кислотой, лимонной кислотой, янтарной кислотой, яблочной кислотой, метансульфоновой кислотой, бензолсульфоновой кислотой и n-толуолсульфоновой кислотой. Подходящие примеры соли с основной аминокислотой включают соли с аргинином, лизином и орнитином, и подходящие примеры соли с кислотной аминокислотой включают соли с аспарагиновой кислотой и глутаминовой кислотой. Среди них предпочтительны фармацевтически приемлемые соли. Например, если в соединение входит кислотная функциональная группа, то их примеры включают неорганические соли, такие как соли с щелочными металлами (например, натриевая соль, калиевая соль) и соли с щелочноземельными металлами (например, кальциевая соль, магниевая соль, бариевая соль), соль аммония и т.п., и если в соединение входит основная функциональная группа, то их примеры включают соли с неорганическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, азотная кислота, серная кислота и фосфорная кислота, или соли с органическими кислотами, такими как уксусная кислота, фталевая кислота, фумаровая кислота, щавелевая кислота, винная кислота, малеиновая кислота, лимонная кислота, янтарная кислота, метансульфоновая кислота и n-толуолсульфоновая кислота.
Если соединение (I) имеет изомеры, такие как таутомеры, энантиомеры, стереоизомеры, региоизомеры и ротамеры, то в соединение согласно настоящему изобретению включен любой из изомеров и их смеси. Кроме того, если соединение (I) имеет энантиомеры, то в соединение (I) включен также энантиомер, выделенный из рацемата.
Соединение (I) может представлять собой кристалл, и независимо от того, имеет ли оно только одну кристаллическую форму или смесь кристаллических форм, они включены в соединение (I).
Соединение (I) может представлять собой фармацевтически приемлемый сокристалл или сокристаллическую соль. В настоящем документе сокристалл или сокристаллическая соль означает кристаллический материал, состоящий из двух или более отдельных твердых веществ при комнатной температуре, каждое твердое вещество имеет различные физические свойства (например, структуру, температуру плавления, теплоту плавления, гигроскопичность, растворимость и стабильность). Сокристалл или сокристаллическая соль может быть получена широко известными методами сокристаллизации.
Соединение (I) может представлять собой сольват (например, гидрат) или несольват (например, негидрат), и соединение (I) предусматривает оба варианта.
Кроме того, соединение (I) предусматривает дейтерированные продукты, полученные путем замены 1H на 2H(D).
В соединение (I) входят также соединения, содержащие метку или замещенные изотопом (например, 3Н, 11С, 14С, 18F, 35S, 125I) или т.п. Например, соединения, содержащие метку или замещенные изотопом, можно использовать в качестве индикатора для применения в позитронно-эмиссионной томографии (ПЭТ) (метки для следовой ПЭТ), и они могут подходить для применения в таких областях, как медицинская диагностика.
[0058]
Далее описан способ получения соединения согласно настоящему изобретению.
Ингредиенты и реагенты, использованные на каждой стадии описанного ниже способа получения, а также полученные соединения могут быть в их солевых формах. Примеры таких солей включают соли или т.п., такие же, как соли соединения согласно настоящему изобретению, упомянутые выше.
Если соединение, полученное на каждой стадии, представляет собой свободное соединение, оно может быть преобразовано в требуемую соль общеизвестным способом. С другой стороны, если соединение, полученное на каждой стадии, представляет собой соль, она может быть преобразована в свободную форму или в другую требуемую соль общеизвестным способом.
Соединение, полученное на каждой стадии, может оставаться в реакционном растворе или может быть использовано для следующей реакции после получения в виде неочищенного продукта. Как вариант, соединение, полученное на каждой стадии, может быть, в соответствии с обычным способом, выделено и/или очищено из реакционной смеси такими способами разделения, как концентрирование, кристаллизация, перегонка, экстракция с применением растворителя, фракционная перегонка и хроматография. Рацемическое соединение может быть разделено на хиральные соединения с применением хиральной колонки для очистки.
Если ингредиенты и соединения-реагенты для каждой стадии коммерчески доступны, то коммерческие продукты могут быть использованы в том виде, в котором они приобретены.
На каждой стадии реакции время реакции может быть различным в зависимости от используемых реагентов и растворителей, но обычно составляет от 1 минуты до 7 дней, и предпочтительно от 10 минут до 8 часов, при отсутствии специального описания.
На каждой стадии реакции температура реакции может быть различной в зависимости от используемых реагентов и растворителей, но обычно составляет от -78°С до 300°С, и предпочтительно от -78°С до 150°С, при отсутствии специального описания.
На каждой стадии реакции давление может быть различным в зависимости от используемых реагентов и растворителей, но обычно составляет от 1 атм. до 20 атм., и предпочтительно от 1 атм. до 3 атм., при отсутствии специального описания.
На каждой стадии реакции, например, может быть использован синтез в условиях микроволнового излучения, например, с применением прибора Initiator производства Biotage. Температура реакции может быть различной в зависимости от используемых реагентов и растворителей, но обычно составляет от комнатной температуры до 300°С, и предпочтительно от 50°С до 250°С, при отсутствии специального описания. Время реакции может быть различным в зависимости от используемых реагентов и растворителей, но обычно составляет от 1 минуты до 48 часов, и предпочтительно от 1 минуты до 8 часов, при отсутствии специального описания.
На каждой стадии реакции реагент используют в количестве от 0,5 эквивалента до 20 эквивалентов и предпочтительно от 0,8 эквивалента до 5 эквивалентов относительно субстрата, при отсутствии специального описания. При использовании реагента в качестве катализатора указанный реагент используют в количестве от 0,001 эквивалента до 1 эквивалента и предпочтительно от 0,01 эквивалента до 0,2 эквивалента относительно субстрата. Если реагент также действует как реакционный растворитель, то указанный реагент используют в количестве, указанном для растворителя.
[0059]
На каждой стадии реакции указанную реакцию проводят без растворителя или в растворенном или суспендированном состоянии в соответствующем растворителе, при отсутствии специального описания. Конкретные примеры растворителя включают растворители, описанные в разделе «Примеры», или следующие:
спирты: метанол, этанол, трет-бутиловый спирт, 2-метоксиэтанол и т.п.;
простые эфиры: диэтиловый эфир, дифениловый эфир, тетрагидрофуран, 1,2-диметоксиэтан и т.п., циклопентилметиловый эфир;
ароматические углеводороды: хлорбензол, толуол, ксилол и т.п.;
насыщенные углеводороды: циклогексан, гексан и т.п.;
амиды: N,N-диметилформамид, N-метилпирролидон и т.п.;
галогенированные углеводороды: дихлорметан, дихлорэтан, тетрахлорид углерода и т.п.;
нитрилы: ацетонитрил и т.п.;
сульфоксиды: диметилсульфоксид и т.п.;
ароматические органические основания: пиридин и т.п.;
ангидриды кислот: уксусный ангидрид и т.п.;
органические кислоты: муравьиная кислота, уксусная кислота, трифторуксусная кислота и т.п.;
неорганические кислоты: хлористоводородная кислота, серная кислота и т.п.;
сложные эфиры: этилацетат и т.п.; кетоны: ацетон, метилэтилкетон и т.п.; и
вода.
Два или более растворителей, описанных выше, могут быть смешаны для применения в подходящей пропорции.
[0060]
При использовании оснований на каждой стадии реакции используют основания, указанные ниже, или основания, описанные в разделе «Примеры»:
неорганические основания: гидроксид натрия, фосфат калия, фосфат натрия, гидроксид калия, гидроксид магния, карбонат натрия, карбонат кальция, карбонат цезия, бикарбонат натрия и т.п.;
органические основания: триэтиламин, диэтиламин, пиридин, 4-диметиламинопиридин, N,N-диметиланилин, 1,4-диазабицикло[2.2.2]октан, 1,8-диазабицикло[5.4.0]-7-ундецен, имидазол, пиперидин, триметилсиланолат калия и т.п.;
алкоксиды металлов: этоксид натрия, третт-бутоксид калия и т.п.;
гидриды щелочных металлов: гидрид натрия и т.п.;
амиды металлов: амид натрия, диизопропиламид лития, гексаметилдисилазид лития и т.п.; и
литийорганические соединения: н-бутиллитий и т.п.
[0061]
При использовании кислоты или кислотного катализатора на каждой стадии реакции используют, например, кислоты или кислотные катализаторы, указанные ниже, или кислоты или кислотные катализаторы, описанные в разделе «Примеры»:
неорганические кислоты: хлористоводородная кислота, серная кислота, азотная кислота, бромистоводородная кислота, фосфорная кислота и т.п.;
органические кислоты: уксусная кислота, трифторуксусная кислота, лимонная кислота, n-толуолсульфоновая кислота, 10-камфорсульфоновая кислота и т.п.; и
кислоты Льюиса: комплекс трифторида бора с диэтиловым эфиром, йодид цинка, безводный хлорид алюминия, безводный хлорид цинка, хлорид титана, безводный хлорид железа и т.п.
[0062]
Реакцию на каждой стадии проводят в соответствии с общеизвестным способом, например, способами, описанными в изданиях: The Fifth Series of Experimental Chemistry, тома 13-19 (под ред. Химического общества Японии); The New Experimental Chemistry, тома 14-15 (под ред. Химического общества Японии); Fine Organic Chemistry, пересмотренное 2е издание (L.F. Tietze, Th. Eicher, Nankodo); Organic Name Reactions; The Reaction Mechanism and Essence, пересмотренное издание (Hideo Togo, Kodansha); ORGANIC SYNTHESES Collective, тома I-VII (John Wiley & Sons Inc.); Modern Organic Synthesis in the Laboratory A Collection of Standard Experimental Procedures (автор Jie Jack Li, опубликовано в OXFORD UNIVERSITY); Comprehensive Heterocyclic Chemistry III, том 1 - том 14 (Elsevier, Inc.); Strategic Applications of Named Reactions in Organic Synthesis (перевод Kiyoshi Tomioka, издано в Kagakudojin); Comprehensive Organic Transformations (VCH Publishers Inc.), издание 1989; и т.п., или способами, описанными в разделе «Примеры».
[0063]
При осуществлении реакции гидролиза на каждой стадии в качестве реагента используют кислоту или основание. Кроме того, при осуществлении реакции кислотного гидролиза для сложного трет-бутилового эфира можно добавлять муравьиную кислоту, триэтилсилан или т.п. для восстановительного улавливания вторично образующегося трет-бутил-кагиона.
При осуществлении реакции эстерификации, реакции амидирования или реакции образования производных мочевины на каждой стадии примеры используемых реагентов включают ацилгалогенидные формы, такие как хлорангидриды кислот и бромангидриды кислот; и активированные карбоновые кислоты в форме ангидрида кислоты, активного сложного эфира, сернокислого сложного эфира или т.п. Примеры активатора для карбоновой кислоты включают конденсирующие агенты на основе карбодиимида, такие как 1-этил-3-(3-диметиламинопропил)карбодиимида гидрохлорид (WSCD); конденсирующие агенты на основе триазина, такие как 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолиния хлорид-н-гидрат (DMT-MM); конденсирующие агенты на основе сложного эфира карбоновой кислоты, такие как 1,1-карбонилдиимидазол (CDI); дифенилфосфорилазид (DPPA); бензотриазол-1-илокси-трис-диметиламинофосфониевая соль (реагент ВОР); 2-хлор-1-метилпиридиния йодид (реагент Мукаямы); тионихлорид; низшие алкилгалогенформиаты, такие как этилхлорформиат; (9-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония гексафторфосфат (HATU); 1-[бис(диметиламино)метилен]-1H-бензотриазолий-3-оксида тетрафторборат (TBTU); серную кислоту; и их комбинации. При использовании конденсирующего агента на основе карбодиимида в реакцию можно дополнительно добавлять добавки, такие как 1-гидроксибензотриазол (HOBt), N-гидроксисукцинимид (HOSu) и диметиламинопиридин (DMAP).
[0064]
При осуществлении реакции алкилирования на каждой стадии используют электрофил, такой как галогенированный алкил или необязательно замещенная сульфонилокси-группа (например, метансульфонилокси, этансульфонилокси, трифторметансульфонилокси, бензолсульфонилокси, п-толуолсульфонилокси и т.п.), и нуклеофил (например, амин, спирт, активное метиленовое соединение вблизи группы, притягивающей электроны, и т.п.) и основание (например, органическое основание, алкоксид металла, неорганическое основание и т.п.) в качестве реагентов. Кроме того, алкилирование также можно осуществлять, после превращения спирта в активный сложный эфир, в присутствии силил-енольного простого эфира и кислоты, такой как 1,1,1-трифтор-N-[(трифторметил)сульфонил]метансульфонамид. Кроме того, алкилирование также можно осуществлять в присутствии спирта, силил-енольного простого эфира и кислоты Льюиса.
[0065]
На каждой стадии реакцию защиты или снятия защиты с функциональной группы осуществляют в соответствии с общеизвестным способом, например, способами, описанными в публикациях "Protective Groups in Organic Synthesis, 4th Ed." (авторы Theodora W. Greene, Peter G.M. Wuts), Wiley-Interscience, издание 2007 г.; "Protecting Groups 3rd Ed." (автор P.J. Kocienski), Thieme, издание 2004 г.; и т.п., или способами, описанными в разделе «Примеры».
Примеры защитной группы для гидрокси-группы спирта и т.п., и для фенольной гидрокси-группы включают простые эфирные защитные группы, такие как метоксиметиловый эфир, бензиловый эфир, трет-бутилдиметилсилиловый эфир и тетрагидропираниловый эфир; карбоксилатные сложноэфирные защитные группы, такие как ацетатный эфир; сульфонатные сложноэфирные защитные группы, такие как метансульфонатный эфир; и карбонатные сложноэфирные защитные группы, такие как трет-бутилкарбонат.
Примеры защитной группы для карбонильной группы альдегида включают ацетальные защитные группы, такие как диметилацеталь; и циклические ацетальные защитные группы, такие как 1,3-диоксан.
Примеры защитной группы для карбонильной группы кетона включают кетальные защитные группы, такие как диметилкеталь; циклические кетальные защитные группы, такие как 1,3-диоксан; оксимные защитные группы, такие как (9-метилоксим; и гидразонные защитные группы, такие как N,N-диметилгидразон.
Примеры защитной группы для карбоксильной группы включают сложноэфирные защитные группы, такие как метиловый эфир; и амидные защитные группы, такие n,n-диметиламид.
Примеры защитной группы для тиола включают простые эфирные защитные группы, такие как бензиловый тиоэфир; и сложноэфирные защитные группы, такие как тиоацетатный эфир, тиокарбонат и тиокарбамат.
Примеры защитной группы для аминогруппы и ароматического гетероцикла, такого как имидазол, пиррол и индол, включают карбаматные защитные группы, такие как бензилкарбамат и трет-бутилкарбамат; амидные защитные группы, такие как ацетамид; алкиламинные защитные группы, такие как N-трифенилметиламин; и сульфонамидные защитные группы, такие как метансульфонамид.
[0066]
Защитная группа может быть удалена общеизвестным способом, например, способом с применением кислоты, основания, ультрафиолетового света, гидразина, фенилгидразина, N-метилдитиокарбамата натрия, фторида тетрабутиламмония, ацетата палладия или триалкилсилилгалогенида (например, триметилсилилйодида, триметилсилилбромида), способом восстановления и т.п. При превращении соединения, представляющего собой алкиловый сложный эфир, в соединение, представляющее собой карбоновую кислоту, указанное превращение можно осуществлять с применением сильного основания (триметилсиланолата калия), водорода на палладиевом катализаторе или палладиевого катализатора с нулевой валентностью.
[0067]
При осуществлении реакции связывания на каждой стадии примеры используемого металлического катализатора включают соединения палладия, такие как ацетат палладия (II), тетракис(трифенилфосфин)палладий (0), дихлорбис(трифенилфосфин)палладий (II), дихлорбис(триэтилфосфин)палладий (II), трис(дибензилиденацетон)дипалладий (0) и хлорид 1,1'-бис(дифенилфосфино)ферроценпалладия (II); соединения никеля, такие как тетракис(трифенилфосфин)никель (0); соединения родия, такие как хлор(1,5-циклооктадиен)родий (I) (димер) и хлорид трис(трифенилфосфин)родия (III); соединения кобальта; соединения меди, такие как оксид меди и йодид меди (I); и соединения платины. Кроме того, в реакцию может быть добавлен фосфиновый лиганд, и примеры такого фосфина включают трифенилфосфин, 1,1'-бис(дифенилфосфино)ферроцен и три-о-толилфосфин. Кроме того, в реакцию может быть добавлено основание, и примеры такого основания включают органические основания, неорганические основания и т.п.
При осуществлении реакции борилирования на каждой стадии примеры используемого металлического катализатора включают соединения палладия, такие как тетракис(трифенилфосфин)палладий (0), трис(дибензилиденацетон)дипалладий (0) и хлорид 1,1'-бис(дифенилфосфино)ферроценпалладия (II). Кроме того, в реакцию может быть добавлено основание, и примеры такого основания включают органические основания, неорганические основания и т.п. Кроме того, примеры источника бора включают пинаколдиборан. Кроме того, боратная сложноэфирная группа может быть преобразована в группу борной кислоты с применением ацетата аммония и периодата натрия в качестве реагентов.
При осуществлении реакции цианирования на каждой стадии примеры используемого металлического катализатора включают соединения палладия, такие как ацетат палладия, тетракис(трифенилфосфин)палладий (0), трис(дибензилиденацетон)дипалладий (0) и хлорид 1,1'-бис(дифенилфосфино)ферроценпалладия (II); и цианиды, такие как цианид натрия, цианид цинка и цианид меди. Кроме того, в реакцию может быть добавлен фосфиновый лиганд, такой как 1,1'-бис(дифенилфосфино)ферроцен, или цинковый порошок.
[0068]
Соединение (I) может быть получено, например, следующим способом.
Способ получения 1
Соединение (Ia), соединение (Ib) и соединение (Ic), где R1 в соединении (I) представляет собой гидрокси-группу, ORy HNHRy, соответственно, могут быть получены следующим способом.
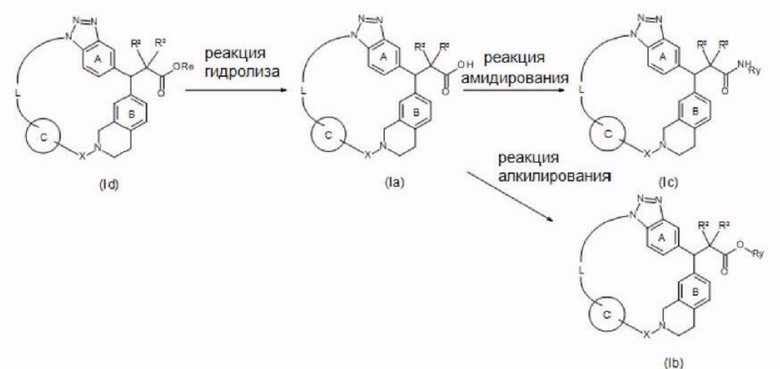
где Re представляет собой необязательно замещенную C1-6 алкильную группу (например, метил, этил, пропил, изопропил, бутил, трет-бутил), аллильную группу или бензильную группу, а другие символы соответствуют определению выше.
[0069]
Способ получения 2
Соединение (Ie), в котором Х в соединении (Id) представляет собой С(=O), может быть получено следующим способом.
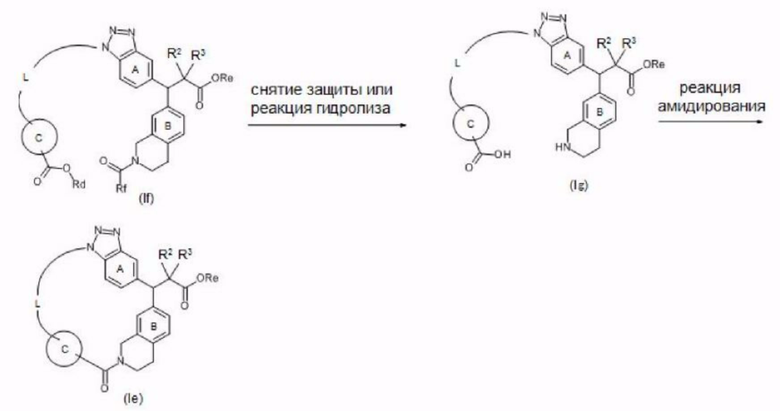
где Rd представляет собой необязательно замещенную C1-6 алкильную группу (например, метил, этил, пропил, изопропил, бутил, трет-бутил), аллильную группу или бензильную группу; Rf представляет собой трет-бутокси-группу или бензилокси-группу; а другие символы соответствуют определению выше.
[0070]
Способ получения 3
Соединение (Ii), в котором R2 и R3 в соединении (If) представляют собой водород, может быть получено следующим способом.
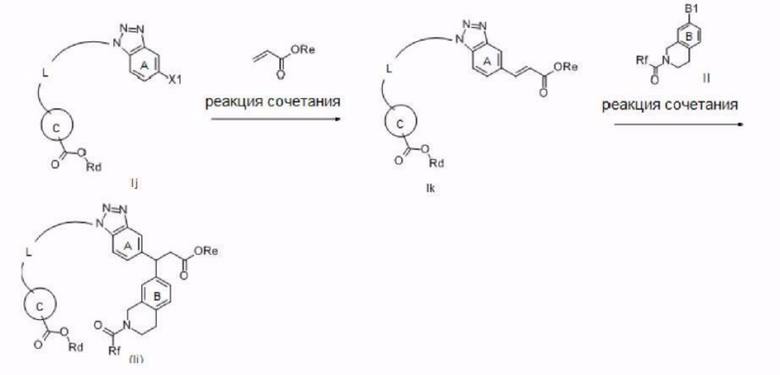
где X1 представляет собой атом хлора, атом брома, атом йода, необязательно замещенную сульфонилокси-группу (например, метансульфонилокси, этансульфонилокси, трифторметансульфонилокси, бензолсульфонилокси, п-толуолсульфонилокси и т.п.); В1 представляет собой борсодержащую группу (например, трифторборат калия (-BF3K), группу бороновой кислоты (-В(ОН)2), боратную сложноэфирную группу (-B(OR')2, где R' представляет собой C1-6 алкильную группу) или борсодержащую циклическую группу (например, 4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил и т.п.); и другие символы соответствуют определению выше.
[0071] Способ получения 4
Соединение (II) может быть получено следующим способом.
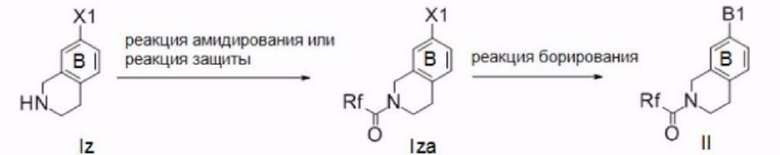
где символы в указанной формуле соответствуют определению выше.
[0072]
Способ получения 5
Соединение (Ij) может быть получено следующим способом
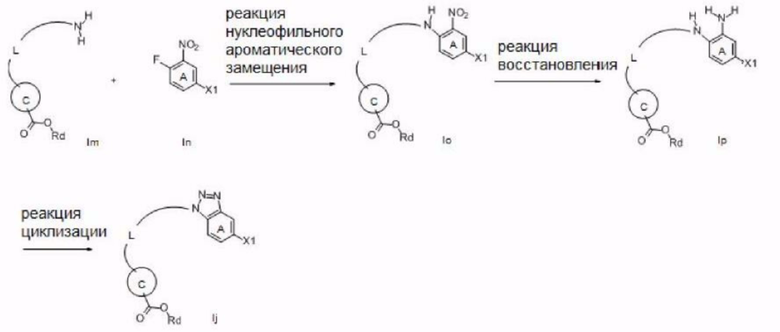
где символы в указанной формуле соответствуют определению выше.
[0073]
Способ получения 6
Соединение (Iq), где L в соединении (Ij) представляет собой -CR4R5-CR4R5-CR4R5-O-CR6R7-*, может быть получено следующим способом.
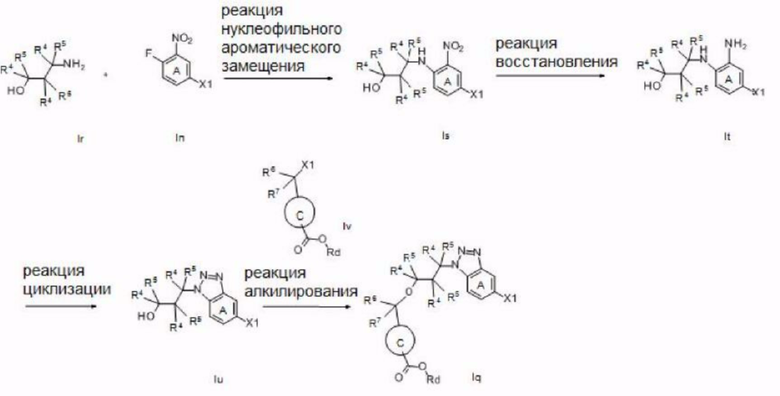
где символы в указанной формуле соответствуют определению выше.
[0074]
Способ получения 7
Соединение (If) может быть получено следующим способом.
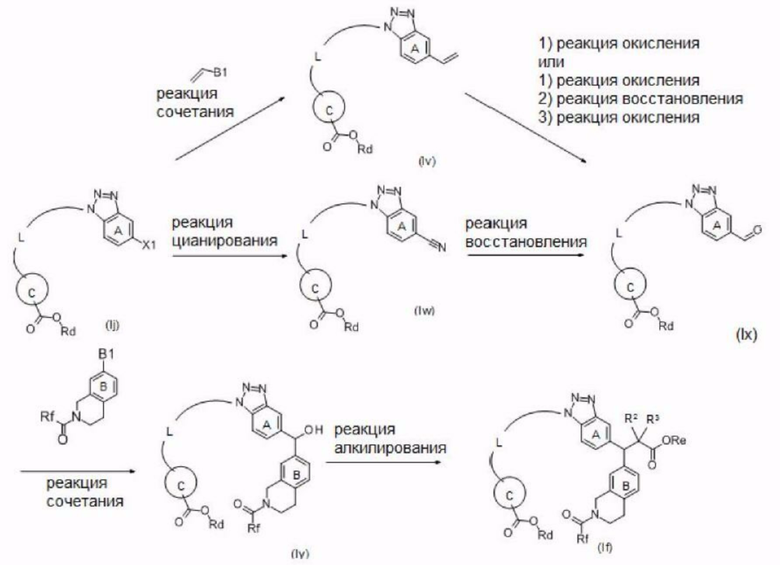
где символы в указанной формуле соответствуют определению выше.
[0075]
Кроме того, на стадии получения соединения (I) из соединений-ингредиентов и/или получения промежуточных соединений для соединения (I) может быть при желании синтезировано соединение (I) путем осуществления одной реакции восстановления, реакции окисления, реакции Виттига, реакции Хорнера-Эммонса, реакции защиты, реакции нуклеофильного ароматического замещения, реакции нуклеофильного присоединения с карбанионом, реакции Гриньяра, реакции азидирования, реакции восстановительного аминирования, реакции перегруппировки Кляйзена, реакции Мицунобу, реакции Воля-Циглера, реакции сульфонатной эстерификации, реакции Штаудингера, реакции галогенирования гидрокси-группы, реакции дегидрирования, реакции циклизации, или реакции метатезиса с замыканием цикла, или путем осуществления двух или более указанных реакции в комбинации, в зависимости от различных заместителей, которые может иметь соединение (I).
При осуществлении на каждой стадии реакции восстановления примеры используемого восстановительного агента включают железо; гидриды металлов, такие как алюмогидрид лития, триацетоксиборгидрид натрия, цианоборгидрид натрия, гидрид диизобутилалюминия (DIBAL-H), боргидрид натрия и триацетоксиборгидрид тетраметиламмония; бораны, такие как комплекс борана с тетрагидрофураном; никель Ренея; кобальт Ренея; Pd/C; PtO2; цинк; водород; муравьиную кислоту; и триэтилсилан. При восстановлении двойной или тройной углерод-углеродной связи указанную реакцию восстановления можно осуществлять способом с применением такого катализатора как палладий на углероде, катализатор Линдлара и т.п. При восстановлении нитрогруппы указанную реакцию восстановления также можно осуществлять с применением железа и хлорида аммония. При восстановлении цианогруппы указанную реакцию восстановления также можно осуществлять с применением восстановительных агентов, описанных выше, и фосфината натрия. При восстановлении карбоновой кислоты указанную реакцию восстановления также можно осуществлять, после получения смешанного ангидрида кислоты с изобутилхлорформиатом или т.п., с применением боргидрида натрия. Указанную стадию можно осуществлять с применением только одного из указанных реагентов или с применением двух или более из них в комбинации.
[0076]
При осуществлении на каждой стадии реакции окисления примеры используемого окислительного агента включают перкислоты, такие как м-хлорпербензойная кислота (mCPBA), пероксид водорода и трет-бутилгидропероксид; перхлораты, такие как перхлорат тетрабутиламмония; хлораты, такие как хлорат натрия; хлориты, такие как хлорит натрия; периодаты, такие как периодат натрия; реагенты поливалентного йода, такие как йодозилбензол; реагенты, содержащие марганец, такие как диоксид марганца и перманганат калия; соединения свинца, такие как тетраацетат свинца; реагенты, содержащие хром, такие как хлорхромат пиридиния (РСС), дихромат пиридиния (PDC) и реагент Джонса; галогенсодержащие соединения, такие как N-бромсукцинимид (NBS); кислород; озон; комплекс триоксида серы с пиридином; оксалилхлорид-диметилсульфоксид; тетраоксид осмия; диоксид селена; и 2,3-дихлор-5,6-дициано-1,4-бензохинон (DDQ).
[0077]
При осуществлении на каждой стадии реакции Виттига примеры используемого реагента Виттига включают алкилиденфосфораны. Алкилиденфосфораны могут быть получены общеизвестным способом, например, приведением в контакт соли фосфония с сильным основанием.
При осуществлении на каждой стадии реакции Хорнера-Эммонса примеры используемого реагента включают фосфоноацетатные сложные эфиры, такие как метил-диметилфосфоноацетат и этил-диэтилфосфоноацетат; и основания, такие как гидриды щелочных металлов и литийорганические соединения.
При осуществлении на каждой стадии реакции нуклеофильного ароматического замещения в качестве реагента используют нуклеофил (например, амин) и основание (например, неорганическое основание, органическое основание и т.п.).
При осуществлении на каждой стадии реакции нуклеофильного присоединения с карбанионом, реакции нуклеофильного 1,4-присоединения с карбанионом (реакция присоединения Михаэля) или реакции нуклеофильного замещения с карбанионом примеры основания, используемого для получения карбаниона, включают литийорганические соединения, алкоксиды металлов, неорганические основания и органические основания.
[0078]
При осуществлении на каждой стадии реакции Гриньяра примеры реагента Гриньяра включают галогениды арилмагния, такие как фенилмагнийбромид; и галогениды алкилмагния, такие как метилмагнийбромид. Реагент Гриньяра может быть получен общеизвестным способом, например, приведением в контакт алкилгалогенида или арилгалогенида с металлическим магнием в эфире или тетрагидрофуране в качестве растворителя.
[0079]
При осуществлении на каждой стадии реакции азидирования спирта, алкилгалогенида или сульфонатного сложного эфира примеры используемого агента азидирования включают дифенилфосфорилазид (DPPA), триметилсилилазид и азид натрия. Например, при азидировании спирта реакцию азидирования можно осуществлять способом с применением дифенилфосфорилазида и 1,8-диазабицикло[5,4,0]ундец-7-ена (DBU), способом с применением триметилсилилазида и кислоты Льюиса, или т.п.
[0080]
При осуществлении на каждой стадии реакции восстановительного аминирования примеры используемого восстановительного агента включают триацетоксиборгидрид натрия, цианоборгидрид натрия, водород и муравьиную кислоту. Если субстрат представляет собой аминное соединение, то примеры используемого карбонильного соединения включают, помимо параформальдегида, альдегиды, такие как ацетальдегид, и кетоны, такие как циклогексанон. Если субстрат представляет собой карбонильное соединение, то примеры используемого амина включают аммиак; первичные амины, такие как метиламин; и вторичные амины, такие как диметиламин.
При осуществлении на каждой стадии реакции Мицунобу в качестве реагентов используют азодикарбоксилатные сложные эфиры (например, диэтилазодикарбоксилат (DEAD), диизопропилазодикарбоксилат (DIAD) и т.п.) и трифенилфосфин.
[0081]
При осуществлении на каждой стадии реакции Воля-Циглера примеры используемого галогенирующего агента включают N-йодсукцинимид, N-бромсукцинимид (NBS), N-хлорсукцинимид (NCS), бром и сульфурилхлорид. Кроме того, реакция может быть ускорена путем нагревания, использования света, введения в реакцию радикальных инициаторов, таких как бензоилпероксид и азобисизобутиронитрил.
[0082]
При осуществлении на каждой стадии реакции галогенирования гидрокси-группы примеры используемого галогенирующего агента включают галогенводородную кислоту и галогенангидрид неорганической кислоты; в частности, хлористоводородную кислоту, тионилхлорид и оксихлоридфосфора для хлорирования и 48% бромистоводородную кислоту для бромирования. Кроме того, можно использовать способ получения алкилгалогенида из спирта путем взаимодействия между трифенилфосфином и тетрахлоридом углерода, тетрабромидом углерода или т.п. Альтернативно, можно также использовать способ синтеза алкилгалогенида в ходе двухстадийной реакции, включающей превращение спирта в сульфонатный сложный эфир и приведения его в контакт с бромидом лития, хлоридом лития или йодидом натрия.
[0083]
При осуществлении на каждой стадии реакции сульфонатной эстерификации примеры используемого сульфонилирующего агента включают метансульфонилхлорид, п-толуолсульфонилхлорид, метансульфоновый ангидрид и п-толуолсульфоновый ангидрид.
[0084]
При осуществлении на каждой стадии реакции дегидратации примеры используемого дегидратирующего агента включают серную кислоту, пентаоксид фосфора, оксихлорид фосфора, N,N'-дициклогексилкарбодиимид, оксид алюминия и полифосфорную кислоту.
[0085]
При осуществлении на каждой стадии реакции циклизации в качестве реагента используют нитрит натрия, и в качестве растворителя используют кислотный растворитель, такой как уксусная кислота и хлористоводородная кислота.
При осуществлении на каждой стадии реакции Штаудингера примеры реагента включают фосфины, такие как трифенилфосфин, и воду.
При осуществлении на каждой стадии реакции метатезиса с замыканием цикла в качестве металлического катализатора используют соединение рутения, такое как катализатор Граббса 1 поколения, катализатор Граббса 2 поколения и катализатор Граббса-Ховейды 2 поколения.
При осуществлении на каждой стадии реакции перегруппировки Кляйзена реакцию можно проводить путем нагревания реакционного раствора, полученного из ингредиентов и растворителя.
При осуществлении на каждой стадии реакции нуклеофильного присоединения с карбанионом, реакции нуклеофильного 1,4-присоединения с карбанионом (реакция присоединения Михаэля) или реакции нуклеофильного замещения с карбанионом примеры основания, используемого для получения карбаниона, включают литийорганические соединения, алкоксиды металлов, неорганические основания и органические основания.
Соединения-ингредиенты и/или промежуточные соединения для получения соединения (I) могут быть представлены в солевых формах, и несмотря на то, что, при условии успешного осуществления реакции, они не имеют специального ограничения, используют соли и т.п., такие же, как соли, которые может образовывать соединение (I) и т.п.
[0086]
В соединениях-ингредиентах и/или промежуточных соединениях для получения соединения (I) могут образовываться конфигурационные изомеры (Е, Z формы), и в тот момент, когда образуются конфигурационные изомеры (Е, Z формы), они могут быть выделены и очищены обычными средствами разделения, такими как экстракция, перекристаллизация, перегонка и хроматография, с получением чистого соединения. Кроме того, изомеризация двойной связи может быть усилена путем нагревания, добавления кислотного катализатора, комплекса переходного металла, металлического катализатора, катализатора на основе радикальных частиц, фото облучения, добавления сильного основного катализатора или т.п. для получения соответствующего чистого изомера в соответствии со способами, описанными в публикациях The New Experimental Chemistry, том 14 (под ред. Химического общества Японии), сс. 251-253; The Fourth Series of Experimental Chemistry, том 19 (под ред. Химического общества Японии), сс. 273-274, и способами, эквивалентными им.
Если по реакциям, описанным выше, получено целевое соединение в свободной форме, то его можно обычным способом преобразовать в соль, а если целевое соединение получено в форме соли, ее можно обычным способом преобразовать в свободную форму или другую соль. Полученное без очистки соединение (I) может быть выделено или очищено из реакционного раствора известными способами, например, заменой растворителя, концентрированном, экстракцией с применением растворителя, фракционной перегонкой, кристаллизацией, перекристаллизацией, хроматографией или т.п.
[0087]
Полученное без очистки соединение (I), другие промежуточные соединения реакции и соединения-ингредиенты могут быть выделены или очищены от реакционной смеси в соответствии с общеизвестным способом, например, с помощью таких способов как экстракция, концентрирование, нейтрализация, фильтрование, перегонка, перекристаллизации, колоночная хроматография, тонкослойная хроматография, препаративная высокоэффективная жидкостная хроматография (препаративная ВЭЖХ) и препаративная жидкостная хроматография в условиях среднего давления (препаративная ЖХ среднего давления).
Соединение (I) может находиться в форме соли, и соль соединения (I) может быть получена общеизвестным способом. Например, если соединение (I) представляет собой основное соединение, соль может быть получена путем добавления неорганической кислоты или органической кислоты, или если соединение (I) представляет собой кислотное соединение, соль может быть получена добавлением органического основания или неорганического основания.
Если соединение (I) представляет собой сольват (например, гидрат), то сольват целевого соединения может быть выделен из реакционной смеси различными способами, такими как перегонка и кристаллизация после взаимодействия ингредиентов в соответствующем растворителе. Несольват может быть получен путем десольватирующего перехода сольвата при повышении температуры, сушке и т.п.
Если соединение (I) может иметь энантиомеры, то в объем настоящего изобретения, безусловно, входят все отдельные энантиомеры и их смеси, и указанные изомеры при необходимости можно подвергать оптическому разделению или получать по отдельности, в соответствии с общеизвестным способом.
Если соединение (I) присутствует в форме конфигурационных изомеров, диастереомеров, конформеров или т.п., они могут быть при необходимости выделены в соответствии со способами разделения или очистки, описанными выше. Кроме того, если соединение (I) представляет собой рацемат, его можно разделить на S-форму и R-форму обычными способами оптического разделения.
Если соединение (I) имеет стереоизомеры, то в настоящее изобретение входят отдельные стереоизомеры и их смеси.
[0088]
Соединение (I) может представлять собой пролекарство. Пролекарство относится к соединению, которое превращается в соединение (I) в результате реакции с ферментом, желудочной кислотой или т.п. в физиологических условиях in vivo, то есть к соединению, которое подвергается ферментативному окислению, восстановлению, гидролизу или т.п. с превращением в соединение (I), и к соединению, которое подвергается гидролизу или т.п. под действием желудочной кислоты или т.п. с превращением в соединение (I).
Примеры пролекарства для соединения (I) включают соединения с ацилированной, алкилированной и фосфорилированной аминогруппой в соединении (I) (например, соединения с эйкозаноилированой, аланилированной, пентиламинокарбонилированной, (5-метил-2-оксо-1,3-диоксолен-4-ил)метоксикарбонилированной, тетрагидрофуранилированной, пирролидилметилированной, пивалоилоксиметилированной, трет-бутилированной и т.п. аминогруппой в соединении (I)); соединения с ацилированной, алкилированной, фосфорилированной и борированной гидроксильной группой в соединении (I) (например, соединения с ацетилированной, пальмитоилированной, пропаноилированной, пивалоилированной, сукцинилированной, фумарилированной, аланилированной, фумарилированной, аланилированной, диметиламинометилкарбонилированной и т.п. гидроксильной группой в соединении (I)); и соединения с эстерифицированной и амидированной карбоксильной группой в соединении (I) (например, соединения с этил-эстерифицированной, фенил-эстерифицированной, карбоксиметил-эстерифицированной, диметиламино метил-эстерифицированной, пивалоилоксиметил-эстерифицированной, этоксикарбонилоксиэтил-эстерифицированной, фталидил-эстерифицированной, (5-метил-2-оксо-1,3-диоксолен-4-ил)метил-эстерифицированной, циклогексилоксикарбонилэтил-эстерифицированной, метиламидированной и т.п. карбоксильной группой в соединении (I)). Такие соединения могут быть получены из соединения (I) известным способом. Кроме того, пролекарство соединения (I) также может представлять собой соединение, которое превращается в соединение (I) в физиологических условиях, как описано в публикации "Pharmaceutical Research and Development", том 7, Design of Molecules, cc. 163-198, издание 1990, HIROKAWA SHOTEN.
[0089]
Соединение (I) или его пролекарство (далее в настоящем документе может быть просто сокращенно указано как соединение согласно настоящему изобретению) может обладать превосходным эффектом активации NRF2 in vivo и может подходить для применения в качестве профилактического или терапевтического агента для лечения заболеваний, связанных с окислительным стрессом.
Соединение согласно настоящему изобретению предположительно обладает превосходной фармакокинетикой (например, пероральной абсорбцией, периодом полувыведения лекарственного средства из крови, интрацеребральной применимостью, метаболической стабильностью) и имеет низкую токсичность (например, острую токсичность, хроническую токсичность, генетическую токсичность, репродуктивную токсичность, кардиотоксичность, взаимодействие с другими лекарственными средствами, карциногенность), и его можно безопасно вводить пероральным или парентеральным способом млекопитающим (например, людям, обезьянам, крупному рогатому скоту, лошадям, свиньям, мышам, крысам, хомякам, кроликам, кошкам, собакам, овцам, козам) в качестве медикамента без каких-либо изменений или в форме фармацевтической композиции, полученной смешиванием соединения согласно настоящему изобретению с фармацевтически приемлемым носителем или т.п. Примеры «парентерального» введения включают сублингвальное, внутривенное, внутримышечное, подкожное, внутриорганное, интраназальное, внутрикожное, инсталляционное, интрацеребральное, интраректальное, внутривагинальное, интраперитонеальное и внутриопухолевое введение, введение вблизи опухоли и т.п., а также непосредственное введение в очаг поражения.
[0090]
Соединение согласно настоящему изобретению предположительно имеет фиксированную конформацию за счет макроциклической структуры и обладает превосходным эффектом активации NRF2, и, следовательно, может проявлять эффективность для предотвращения или лечения заболеваний, связанных с окислительным стрессом и вызванных окислительным стрессом, таких как заболевание печени (например, гепатит (например, неалкогольный стеатогепатит, синдром жировой печени, алкогольный гепатит, гепатит В, гепатит С, веноокклюзионная болезнь печени), цирроз печени, заболевание желчных протоков (например, первичный склерозирующий холангит (ПСХ)), сердечно-сосудистое заболевание (например, сердечная недостаточность, легочная артериальная гипертензия, инфаркт миокарда, артериосклероз, стенокардия, инфаркт головного мозга, внутримозговое кровоизлияние, аневризма аорты, расслоение аорты, нефросклероз (например, гипертензивный нефросклероз), заболевание периферических артерий (PAD), облитерирующий артериосклероз, дизритмия), заболевание легких (например, хроническая обструктивная болезнь легких (ХОБЛ), идиопатический фиброз легких (IPF), кистозный фиброз, астма, пневмония, аспирационная пневмония, интерстициальная пневмония, респираторная инфекция, острое повреждение легких, острый респираторный дистресс-синдром (ОРДС), дефицит α1-антитрипсина), заболевание почек (например, хроническая болезнь почек (ХБП), диабетическая болезнь почек (ДБП), острое повреждение почек (ОПП), гломерулярный нефрит, пиелонефрит, интерстициальный нефрит, гломерулосклероз, нефротический синдром, волчаночный нефрит, синдром Альпорта, IgA-нефропатия, поликистоз почек), заболевание центральной нервной системы (например, болезнь Паркинсона, болезнь Альцгеймера, деменция, церебральный инсульт, амиотрофический боковой склероз (БАС), спиноцеребеллярная дегенерация (SCD), полиглутаминовая болезнь, прионная болезнь, болезнь Хантингтона, травматическое повреждение головного мозга, эпилепсия, аутизм, депрессия, адренолейкодистрофия), митохондриальное заболевание (например, моторная атаксия Фридрейха, митохондриальная миопатия), воспалительное заболевание (например, рассеянный склероз, хронический ревматизм, системная красная волчанка, синдром Шегрена, склеродермия, аутоиммунный гепатит, сахарный диабет 1 типа, язвенный колит, болезнь Крона, воспалительная болезнь кишечника (ВЗК), спондилоартрит, поллиноз, коллагеновая болезнь), заболевание, связанное с образом жизни (например, сахарный диабет, гиперлипидемия, ожирение, повышенное кровяное давление, гиперхолестеринемия), и его осложнения (например, диабетическая ретинопатия, ДБП, диабетическая невропатия), серповидно-клеточная болезнь, талассемия, анемия (например, апластическая анемия, гемолитическая анемия), рак (например, рак печени, рак легких, рак почек, рак толстой кишки, меланома, медуллобластома, нейробластома, лейкоз), кахексия, желудочно-кишечное заболевание (например, функциональное желудочно-кишечное расстройство, язва желудка, рефлюкс-эзофагит, панкреатит), эндокринное заболевание (например, синдром Кушинга, болезнь Хашимото), заболевание глаз (например, возрастная дегенерация желтого пятна, эндотелиальное нарушение роговицы, эндотелиальная дистрофия роговицы Фукса (FECD), воспаление глаз, офтальмалгия, ретинопатия недоношенных, катаракта, сухость глаз), заболевание кожи (например, псориаз, дерматит, радиационный дерматит, буллезный эпидермолиз, атопический дерматит, стоматит), нарушение заживления раны, костное заболевание (например, остеопороз, системное костное заболевание, перелом кости), вирусная инфекция (например, вирус ВИЧ, цитомегаловирус, респираторно-синцитиальный вирус, вирус гриппа), отравление тяжелыми металлами (например, отравление свинцом, отравление ртутью), отравление пестицидами (например, отравление паракватом, отравление фосфорорганическими соединениями), медикаментозное заболевание (например, медикаментозная болезнь почек, медикаментозная болезнь печени (например, заболевание печени вследствие приема ацетаминофена), медикаментозное заболевание легких, ортопедическое заболевание (например, боль в нижней части спины, невралгия седалищного нерва, смещение межпозвоночного диска, тугоподвижность плеча), боль (например, фибромиалгия, невропатическая боль), ишемическое и реперфузионное повреждение, а также шок при трансплантации органа и операции, старение, прогерия, гипермотильность (например, саркопения), урологическое заболевание (например, расстройство мочеиспускания), стоматологическое заболевание (например, заболевание пародонта), отоларингологическое заболевание (например, нарушение слуха), горная болезнь, синдром хронической усталости и поредение волос. Кроме того, соединение согласно настоящему изобретению может демонстрировать усиление эффекта противоракового лечения и эффекта улучшения степени выживания при комбинированном применении с иммунным противораковым агентом (например, с ингибирующим антителом иммунной контрольной точки). Кроме того, оно может демонстрировать активность в отношении ускорения регенерации (например, агент для ускорения регенерации печени после гепатэктомии).
[0091]
В частности, соединение согласно настоящему изобретению, на основании его эффекта активации NRF2, может подходить для применения в качестве профилактического или терапевтического агента для лечения заболевания печени (например, неалкогольного стеатогепатита (НАСГ), алкогольного гепатита, медикаментозного заболевания печени), заболевания желчных протоков (например, первичного склерозирующего холангита (ПСХ)), сердечно-сосудистого заболевания (например, сердечной недостаточности или легочной артериальной гипертензии), заболевания легких (например, хронической обструктивной болезни легких (ХОБЛ)), заболевания почек (например, хронической болезни почек (ХБП) или острого повреждения почек (ОПП)), отравления ацетаминофеном, заболевания центральной нервной системы (например, болезни Паркинсона, болезни Альцгеймера, церебрального инсульта); митохондриального заболевания (например, моторной атаксии Фридрейха, митохондриальной миопатии), воспалительного заболевания (например, рассеянного склероза, воспалительной болезни кишечника (ВЗК)), серповидно-клеточной болезни или т.п.
[0092]
Доза соединения согласно настоящему изобретению варьирует в зависимости от способа введения, симптома и т.п. Например, для перорального введения пациенту с гепатитом (взрослому человеку с массой тела от 40 до 80 кг, например, 60 кг) доза составляет, например, от 0,001 до 1000 мг/кг массы тела в сутки, предпочтительно от 0,01 до 100 мг/кг массы тела в сутки и более предпочтительно от 0,1 до 10 мг/кг массы тела в сутки. Указанное количество можно вводить в виде одной-трех порций в сутки.
[0093]
Медикамент, содержащий соединение согласно настоящему изобретению, можно использовать в виде соединения согласно настоящему изобретению отдельно или в виде фармацевтической композиции, полученной путем смешивания соединения согласно настоящему изобретению с фармацевтически приемлемым носителем в соответствии со способом (например, способами, описанными в Фармакопее Японии), который широко известен в качестве способа получения фармацевтического состава. Медикамент, содержащий соединение согласно настоящему изобретению, можно безопасно вводить перорально или парентерально (например, путем внутривенного, внутримышечного, подкожного, внутриорганного, интраназального, внутрикожного, инстилляционного, интрацеребрального, интраректального, внутривагинального и интраперитонеального введения, а также введения в очаг поражения) в форме, например, таблетки (включая таблетку с сахарным покрытием, таблетку с пленочным покрытием, сублингвальную таблетку, распадающуюся в полости рта таблетку, буккальную таблетку или т.п.), пилюли, порошка, гранулы, капсулы (включая мягкую капсулу, микрокапсулу), пастилки, сиропа, жидкости, эмульсии, суспензии, состава с контролируемым высвобождением (например, состава с мгновенным высвобождением, состава с устойчивым высвобождением, микрокапсулы с устойчивым высвобождением), аэрозоля, пленки (например, распадающейся в полости рта пленки или пленки, наклеиваемой на слизистую оболочку полости рта), инъекции (например, подкожной инъекции, внутривенной инъекции, внутримышечной инъекции, интраперитонеальной инъекции), капельной инфузии, состава для трансдермальной абсорбции, мази, лосьона, пластыря, суппозитория (например, ректального суппозитория, вагинального суппозитория), гранулы, назального состава, легочного состава (ингаляционного), глазных капель или т.п.
[0094]
В качестве «фармацевтически приемлемого носителя», описанного выше, используют различные органические или неорганические носители, которые традиционно используют в качестве материалов для составления композиций (исходных материалов). Например, для твердой лекарственной формы используют вспомогательное вещество, смазывающее вещество, связующее вещество, разрыхлитель и т.п., а для жидкой лекарственной формы используют растворитель, добавку для улучшения растворения, суспендирующий агент, агент для обеспечения изотоничности, буферный агент, успокаивающий агент и т.п. Кроме того, при необходимости также можно использовать добавки для лекарственных средств, такие как консервант, антиоксидант, окрашивающий агент и подсластитель.
Примеры вспомогательного вещества включают лактозу, белый сахар, D-маннит, крахмал, кукурузный крахмал, кристаллическую целлюлозу и легкую безводную кремниевую кислоту.
Примеры смазывающего вещества включают стеарат магния, стеарат кальция, тальк и коллоидный диоксид кремния.
Примеры связующего вещества включают кристаллическую целлюлозу, белый сахар, D-маннит, декстрин, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, поливинилпирролидон, крахмал, сахарозу, желатин, метилцеллюлозу и карбоксиметилцеллюлозу натрия.
Примеры разрыхлителя включают крахмал, карбоксиметилцеллюлозу, карбоксиметилцеллюлозу натрия, карбоксиметилкрахмал натрия и L-гидроксипропилцеллюлозу.
Примеры растворителя включают воду для инъекций, спирт, пропиленгликоль, макрогол, кунжутное масло, кукурузное масло и оливковое масло.
Примеры добавки для улучшения растворения включают полиэтиленгликоль, пропиленгликоль, D-маннит, бензилбензоат, этанол, трис-аминометан, холестерин, триэтаноламин, карбонат натрия и цитрат натрия.
Примеры суспендирующего агента включают поверхностно-активные вещества, такие как стеарилтриэтаноламин, лаурилсульфат натрия, лауриламинопропионовая кислота, лецитин, хлорид бензалкония, хлорид бензетония и моностеарат глицерина; и гидрофильные полимеры, такие как поливиниловый спирт, поливинилпирролидон, карбоксиметилцеллюлоза натрия, метилцеллюлоза, гидроксиметилцеллюлоза, гидроксиэтилцеллюлоза и гидроксипропилцеллюлоза.
Примеры агента для обеспечения изотоничности включают глюкозу, D-сорбит, хлорид натрия, глицерин и D-маннит.
Примеры буферного агента включают буферные растворы фосфатной соли, ацетатной соли, карбонатной соли и цитратной соли.
Примеры успокаивающего агента включают бензиловый спирт.
Примеры консерванта включают пара-оксибензоатные сложные эфиры, хлорбутанол, бензиловый спирт, фенилэтиловый спирт, дегидроуксусную кислоту и сорбиновую кислоту.
Примеры антиоксиданта включают сульфитную соль, аскорбиновую кислоту, α-токоферол.
[0095]
Фармацевтическая композиция может быть получена в соответствии с обычным способом путем добавления соединения согласно настоящему изобретению в пропорции обычно от 0,01 до 100% (мас./мас.) и предпочтительно от 0,1 до 95% (мас./мас.) относительно общего количества композиции, хотя указанная пропорция варьирует в зависимости от лекарственной формы, способа введения, носителя и т.п.
[0096]
Соединение согласно настоящему изобретению можно использовать в комбинации с другим активным ингредиентом (далее в настоящем документе сокращенно называемым сопутствующим лекарственным средством).
[0097]
В качестве сопутствующего лекарственного средства в состав может быть надлежащим образом введено соединение, которое может обладать профилактическим и/или терапевтическим эффектом против заболеваний, связанных с окислительным стрессом, или его соль, в зависимости от заболевания, подлежащего лечению. Примеры соединения, которое может обладать профилактическим и/или терапевтическим эффектом против заболеваний, связанных с окислительным стрессом, или его соли включают кардиотонические агенты, такие как дигоксин, β-агонисты, такие как добутамин, β-ингибиторы, такие как карведилол, сосудорасширяющие средства, такие как нитроглицерин, простациклин и риоцигуат, ингибиторы ангиотензин-превращающего фермента, такие как рамиприл, антагонисты рецептора ангиотензина II, такие как кандесартан, диуретические лекарственные средства, такие как гидрохлортиазид и фуросемид, антагонисты кальциевого рецептора, такие как амлодипин, антагонисты минералокортикоидного рецептора, такие как эплеренон, антагонисты рецептора эндотелина, такие как босентан, антикоагулирующие лекарственные средства, такие как ривароксабан, антитромбоцитарные лекарственные средства, такие как клопидогрел, антидиабетические лекарственные средства, такие как метформин, алоглиптин, пиоглитазон и ипраглифлозин, лекарственные средства для облегчения дислипидемии, такие как аторвастатин, фенофибрат, азетимиб и ниацин, противовоспалительные лекарственные средства, такие как рофлумиласт, агонисты адренергического рецептора β-2, такие как сальбутамол, стероидные составы, предшественники допамина, такие как леводопа, ингибиторы моноаминоксидазы В, такие как селегилин, и антихолинергические лекарственные средства, такие как бипериден. Другие примеры сопутствующего лекарственного средства включают ингибиторы иммунной контрольной точки, такие как антитела против PD-1, антитела против PD-L1 и антитела против CTLA-4.
[0098]
При комбинировании соединения согласно настоящему изобретению с сопутствующим лекарственным средством может быть достигнут превосходный эффект, например:
(1) может быть снижена доза по сравнению с введением по отдельности соединения согласно настоящему изобретению или сопутствующего лекарственного средства;
(2) лекарственное средство для комбинирования с соединением согласно настоящему изобретению может быть выбрано в зависимости от симптомов пациента (слабый симптом, тяжелый симптом и т.п.);
(3) может быть увеличена продолжительность лечения путем выбора сопутствующего лекарственного средства, имеющего механизм действия, отличный от механизма действия соединения согласно настоящему изобретению;
(4) может быть обеспечен продолжительный лечебный эффект за счет выбора сопутствующего лекарственного средства, имеющего механизм действия, отличный от механизма действия соединения согласно настоящему изобретению; и
(5) может быть достигнут синергетический эффект в результате комбинированного применения соединения согласно настоящему изобретению и сопутствующего лекарственного средства.
[0099]
Далее в настоящем документе применение соединения согласно настоящему изобретению в комбинации с сопутствующим лекарственным средством называется «комбинированным агентом согласно настоящему изобретению».
При использовании комбинированного агента согласно настоящему изобретению время введения соединения согласно настоящему изобретению и сопутствующего лекарственного средства не ограничено, и соединение согласно настоящему изобретению или его фармацевтическую композицию и сопутствующее лекарственное средство или его фармацевтическую композицию можно вводить субъекту одновременно или с разрывом по времени. Доза сопутствующего лекарственного средства может быть определена в соответствии с дозой, используемой в клинических условиях, и может быть соответствующим образом выбрана в зависимости от субъекта, которому предназначено введение, способа введения, заболевания, используемой комбинации и т.п.
Способ введения комбинированного агента согласно настоящему изобретению не связан конкретными ограничениями, и достаточно, чтобы соединение согласно настоящему изобретению и сопутствующее лекарственное средство были скомбинированы при введении. Примеры такого способа введения включают (1) введение единой лекарственной формы, полученной при одновременном составлении лекарственной формы соединения согласно настоящему изобретению и сопутствующего лекарственного средства, (2) одновременное введение двух видов лекарственных форм, полученных при отдельном составлении лекарственных форм соединения согласно настоящему изобретению и сопутствующего лекарственного средства, одним и тем же способом введения, (3) введение двух видов лекарственных форм, полученных при отдельном составлении лекарственных форм соединения согласно настоящему изобретению и сопутствующего лекарственного средства, одним и тем же способом введения, но в разное время, (4) одновременное введение двух видов лекарственных форм, полученных при отдельном составлении лекарственных форм соединения согласно настоящему изобретению и сопутствующего лекарственного средства, разными способами введения, (5) введение двух видов лекарственных форм, полученных при отдельном составлении соединения согласно настоящему изобретению и сопутствующего лекарственного средства, разными способами введения в разное время (например, введение соединения согласно настоящему изобретению и сопутствующего лекарственного средства в описанном порядке или в обратном порядке) и т.п.
[0100]
Комбинированный агент согласно настоящему изобретению имеет низкую токсичность. Например, соединение согласно настоящему изобретению или (и) сопутствующее лекарственное средство, описанные выше, можно объединять с фармакологически приемлемым носителем в соответствии с известным способом получения фармацевтической композиции, такой как таблетка (включая таблетку с сахарным покрытием и таблетку с пленочным покрытием), порошок, гранула, капсула (включая мягкую капсулу), жидкость, инъекцию, суппозиторий, агент для устойчивого высвобождения и т.п. Указанные композиции можно безопасно вводить перорально или парентерально (например, местное, ректальное, внутривенное введение). Инъекции могут осуществляться внутривенно, внутримышечно, подкожно или внутрь органа, или непосредственно в очаг поражения.
Примеры фармакологически приемлемого носителя, который можно использовать для получения комбинированного агента согласно настоящему изобретению, включают различные органические или неорганические вещества-носители, которые обычно используют в качестве материалов для получения лекарственных форм. Например, для твердой лекарственной формы можно использовать вспомогательное вещество, смазывающее вещество, связующее вещество и разрыхлитель. Для жидкой лекарственной формы можно использовать растворитель, добавку для улучшения растворения, суспендирующий агент, агент для обеспечения изотоничности, буферный агент, успокаивающий агент и т.п. Кроме того при необходимости можно использовать обычные добавки, такие как консервант, антиоксидант, окрашивающий агент, подсластитель, адсорбент и смачивающий агент, в соответствующем количестве.
Примеры вспомогательного вещества включают лактозу, белый сахар, D-маннит, крахмал, кукурузный крахмал, кристаллическую целлюлозу и легкую безводную кремниевую кислоту.
Примеры смазывающего вещества включают стеарат магния, стеарат кальция, тальк и коллоидный диоксид кремния.
Примеры связующего вещества включают кристаллическую целлюлозу, белый сахар, D-маннит, декстрин, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, поливинилпирролидон, крахмал, сахарозу, желатин, метилцеллюлозу и карбоксиметилцеллюлозу натрия.
Примеры разрыхлителя включают крахмал, карбоксиметилцеллюлозу, карбоксиметилцеллюлозу натрия, карбоксиметилкрахмал натрия и L-гидроксипропилцеллюлозу.
Примеры растворителя включают воду для инъекций, спирт, пропиленгликоль, макрогол, кунжутное масло, кукурузное масло и оливковое масло.
Примеры добавки для улучшения растворения включают полиэтиленгликоль, пропиленгликоль, D-маннит, бензилбензоат, этанол, трис-аминометан, холестерин, триэтаноламин, карбонат натрия и цитрат натрия.
Примеры суспендирующего агента включают поверхностно-активные вещества, такие как стеарилтриэтаноламин, лаурилсульфат натрия, лауриламинопропионовая кислота, лецитин, хлорид бензалкония, хлорид бензетония и моностеарат глицерина; и гидрофильные полимеры, такие как поливиниловый спирт, поливинилпирролидон, карбоксиметилцеллюлоза натрия, метилцеллюлоза, гидроксиметилцеллюлоза, гидроксиэтилцеллюлоза и гидроксипропилцеллюлоза.
[0101]
Примеры агента для обеспечения изотоничности включают глюкозу, D-сорбит, хлорид натрия, глицерин и D-маннит.
Примеры буферного агента включают буферизующие растворы фосфатной соли, ацетатной соли, карбонатной соли и цитратной соли.
Примеры успокаивающего агента включают бензиловый спирт.
Примеры консерванта включают пара-оксибензоатные сложные эфиры, хлорбутанол, бензиловый спирт, фенилэтиловый спирт, дегидроуксусную кислоту и сорбиновую кислоту.
Примеры антиоксиданта включают сульфитную соль, аскорбиновую кислоту, α-токоферол.
[0102]
Соотношение при смешивании соединения согласно настоящему изобретению и сопутствующего лекарственного средства в комбинированном агенте согласно настоящему изобретению может быть соответствующим образом выбрано в зависимости от субъекта, которому предназначено введение, способа введения, заболевания и т.п.
Например, содержание соединения согласно настоящему изобретению в комбинированном агенте согласно настоящему изобретению варьирует в зависимости от формы лекарственного средства, но обычно составляет от примерно 0,01 до 100% по массе, предпочтительно от примерно 0,1 до 50% по массе, и более предпочтительно приблизительно от примерно 0,5 до 20% по массе относительно общей массы лекарственной формы.
Содержание сопутствующего лекарственного средства в комбинированном агенте согласно настоящему изобретению варьирует в зависимости от формы лекарственного средства, но обычно составляет от примерно 0,01 до 100% по массе, предпочтительно от примерно 0,1 до 50% по массе, и более предпочтительно приблизительно от примерно 0,5 до 20% по массе относительно общей массы лекарственной формы.
Содержание добавок, таких как носитель, в комбинированном агенте согласно настоящему изобретению варьирует в зависимости от формы препарата, но обычно составляет от примерно 1 до 99,99% по массе и предпочтительно приблизительно от примерно 10 до 90% по массе относительно общей массы лекарственной формы.
Кроме того, при составлении отдельных лекарственных форм соединения согласно настоящему изобретению и сопутствующего лекарственного средства их содержание может быть таким же, как указано выше.
[Примеры]
[0103]
Настоящее изобретение подробно описано ниже путем обращения к представленным примерам, тестовым примерам и примерам лекарственных форм. Однако они не ограничивают настоящее изобретение и могут варьировать в диапазоне, не выходящем за пределы объема настоящего изобретения.
В приведенных далее примерах «комнатная температура» обычно означает от примерно 10°С до примерно 35°С. Соотношения, указанные в смешанных растворителях, означают объемные отношения, если не указано иное. % означает % по массе, если не указано иное.
Элюирование при колоночной хроматографии в приведенных примерах осуществляли при наблюдении с помощью ТСХ (тонкослойной хроматографии), если не указано иное. Для наблюдения с помощью ТСХ использовали 60 F254 производства Merck KGaA в качестве ТСХ-пластины, а растворитель, который использовали в качестве элюирующего растворителя в колоночной хроматографии, использовали в качестве проявляющего растворителя. Кроме того, для детекции использовали УФ-детектор. Для колоночной хроматографии на силикагеле для описания NH использовали силикагель с привитым аминопропилсиланом, а при описании диола использовали силикагель с привитым 3-(2,3-дигидроксипропокси)пропилсиланом. Для ВЭЖХ (высокоэффективной жидкостной хроматографии) при описании С18 использовали силикагель с привитыми октадецил-группами. Соотношения элюирующих растворителей означают объемные отношения, если не указано иное.
В представленных далее примерах использованы сокращения, описанные ниже.
Т.пл.: температура плавления
МС: масс-спектр
М: молярная концентрация
н.: нормальность
CDCl3: дейтерированный хлороформ
ДМСО-d6 дейтерированный диметилсульфоксид
1H ЯМР: протонный ядерный магнитный резонанс
ЖХ/МС: жидкостный хроматограф/масс-спектрометр
ИЭР: электрораспылительная ионизация
EtOAc: этилацетат
APCI: химическая ионизация при атмосферном давлении
ДМФА: N,N-диметилформамид
ДМСО: диметилсульфоксид
DMAP: ДД-диметиламино-4-аминопиридин
Et: этил
EDCI: 1-этил-3-(3-диметиламинопропил)карбодиимида гидрохлорид
HATU: 2-(7-азабензотриазол- 1-ил)-1,1,3,3-тетраметилурония гексафторфосфат
HOBt: 1-гидроксибензотриазол
PPh3: трифенилфосфин
ТГФ: тетрагидрофуран
СРМЕ: циклопентилметиловый эфир
АсОН: уксусная кислота
ВЭЖХ: высокоэффективная жидкостная хроматография
Вое: трет-бутоксикарбонил
Ts: n-толуолсульфонил
TBTU: тетрафторборат 1-[бис(диметиламино)метилен]-1Н-бензотриазолий-3-оксида
KHMDS: гексаметилдисилазид калия
BuLi: бутиллитий
COD: 1,5-циклооктадиен
ДХМ: дихлорметан
DEAD: диэтилазодикарбоксилат
DIPEA: диизопропилэтиламин
DMA: N,N-диметилацетамид
dba: дибензилиденацетон
dppf: 1,1'-бис(дифенилфосфино)ферроцен
iPr: изопропил
NBS: N-бромсукцинимид
NMM: N-метилморфолин
ТФК: трифторуксусная кислота
TCX: тонкослойная хроматография
TMS: триметилсилил
Обращенно-фазовая препаративная ВЭЖХ: Способ А
Препаративную ВЭЖХ проводили на инструменте с автоматической очисткой Waters. Название колонки: YMC Triart С18 (100×30 мм, 5 мкм), работающая при температуре окружающей среды и скорости потока 30 мл/мин. Подвижная фаза: А=20 мМ бикарбоната аммония в воде, В=ацетонитрил; профиль градиента: Исходный состав подвижной фазы 80% А и 20% В, затем 60% А и 40% В за 2 минуты, затем до 20% А и 80% В за 12 минут, затем до 5% А и 95% В за 13 минут, удерживали указанный состав до 15 минут для промывания колонки, затем возвращали к исходному составу за 16 минут и удерживали до 18 минут.
Обращенно-фазовая хиральная препаративная ВЭЖХ: Способ В
Препаративную ВЭЖХ проводили на инструменте с автоматической очисткой Waters. Название колонки: REFLECT I CELLULOSE С (250×21,2 мм, 5 мкм), работающая при температуре окружающей среды и скорости потока 16 мл/мин. Подвижная фаза: А=0,1% ТФК в воде, В=ацетонитрил; профиль градиента: Исходный состав подвижной фазы 80% А и 20% В, затем 70% А и 30% В за 2,5 минуты, затем до 55% А и 45% В за 6 минут, затем до 15% А и 85% В за 25 минут, затем до 5% А и 95% В за 26 минут, удерживали указанный состав до 30 минут для промывания колонки, затем возвращали к исходному составу за 30,5 минуты и удерживали до 36 минут.
Нормально-фазовая хиральная препаративная ВЭЖХ: Способ С
Препаративную ВЭЖХ проводили в системе Agilent Prep-HPLC. Название колонки: CHIRALPAK IA (21,0×250 мм, 5 мкм), работающая при температуре окружающей среды и скорости потока 21 мл/мин. Подвижная фаза: гексан/ДХМ/EtOH/ТФК: 70/15/15/0,1; профиль градиента: Исходный состав подвижной фазы 80% А и 20% В, затем 70% А и 30% В за 2,5 минуты, затем до 55% А и 45% В за 6 минут, затем до 15% А и 85% В за 25 минут, затем до 5% А и 95% В за 26 минут, удерживали указанный состав до 30 минут для промывания колонки, затем возвращали к исходному составу за 30,5 минуты и удерживали до 36 минут.
Нормально-фазовая хиральная препаративная ВЭЖХ: Способ D
Хиральную ВЭЖХ проводили в системе с ручной очисткой Waters с четырехканальным градиентным насосом 2545 и УФ детектором 2489. Название колонки: CHIRALPAK ΙΑ (250×21,2 мм, 5 мкм), работающая при температуре окружающей среды и скорости потока 26 мл/мин. Подвижная фаза: А=этанол, В=0,1% ТЭА в н-гексане; изократический профиль: А: В=30%: 70%, этот же состав удерживали в течение всего времени выполнения 35 минут. Детектор программировали на длину волны соединения, т.е. 293 нм, а подготовку образцов осуществляли с использованием метанола и ДХМ.
Для измерения 1H ЯМР использовали ЯМР с преобразованием Фурье. Для анализа использовали ACD/SpecManager (наименование продукта) или аналог. Очень слабые пики протонов, например, пики гидрокси-групп или аминогрупп, не описывали.
МС измеряли с помощью ЖХ/МС. В качестве метода ионизации использовали метод ИЭР или метод APCI. В качестве данных описывали измеренные (обнаруженные) значения. Как правило, наблюдали пики молекулярных ионов (таких как [М+Н]+ и [М-Н]-), но, например, в случае соединения, содержащего трет-бутоксикарбонильную группу, пик, для которого десорбирована трет-бутоксикарбонильная группа или трет-бутильная группа, можно наблюдать как фрагментный ион, и в случае соединения, содержащего гидрокси-группу, пик, для которого десорбирована H2O, можно наблюдать как фрагментный ион. В случае соли обычно наблюдают пик молекулярного иона свободной формы или пик фрагментного иона.
Единица концентрации образца (с) при оптическом вращении ([α]D) представлена г/100 мл.
Для значений элементного анализа (аналит.) описывают расчетные значения (расч.) и измеренные значения (обнаруженные).
Порошковые рентгеновские дифрактограммы получали с помощью Cu-Κα характеристических рентгеновских лучей прибора Rigaku Ultima IV и описывали характеристические пики.
[0104] Пример 1
[32-Метил-20-оксо-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]уксусная кислота
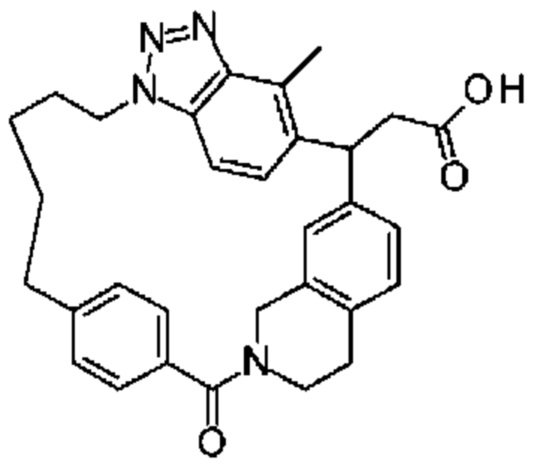
А) трет-Бутил-4-(5-гидроксипент-1-ин-1-ил)бензоат
Смесь трет-бутил-4-йодбензоата (3,68 г), 4-пентин-1-ола (1,32 г), PdCl2(PPh3)2 (425 мг), йодида меди (46,1 мг) и триэтиламина (20 мл) перемешивали при комнатной температуре в течение ночи. К полученной смеси добавляли этилацетат при комнатной температуре и промывали реакционную смесь насыщенным водным раствором хлорида аммония и насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (3,15 г).
1H ЯМР (300 МГц, ДМСО-d6) δ 1,54 (9Н, с), 1,64-1,76 (2Н, м), 2,45-2,49 (2Н, м), 3,47-3,56 (2Н, м), 4,56 (1H, т, J=5,2 Гц), 7,49 (2Н, д, J=8,1 Гц), 7,85 (2Н, д, J=8,1 Гц).
В) трет-Бутил-4-(5-гидроксипентил)бензоат
трет-Бутил-4-(5-гидроксипент-1-ин-1-ил)бензоат (3,15 г) и суспензию палладия на углероде (500 мг) в этаноле (50 мл) перемешивали в атмосфере водорода в течение ночи. Удаляли палладий на углероде и концентрировали реакционную смесь при пониженном давлении с получением указанного в заголовке соединения (3,05 г).
1H ЯМР (300 МГц, ДМСО-d6) δ 1,23-1,34 (2Н, м), 1,37-1,49 (2Н, м), 1,51-1,65 (11Н, м), 2,63 (2Н, т, J=7,3 Гц), 3,34-3,41 (2Н, м), 4,34 (1H, т, J=4,9 Гц), 7,31 (2Н, д, J=7,9 Гц), 7,81 (2Н, д, J=8,0 Гц). [0105]
С) трет-Бутил-4-{5-[(4-метилбензол-1 -сульфонил)окси]пентил}бензоат
К раствору трет-бутил-4-(5-гидроксипентил)бензоата (22,4 г) в тетрагидрофуране (200 мл) добавляли триэтиламин (17,2 г), n-толуолсульфонилхлорид (19,4 г) и 4-диметиламинопиридин (1,04 г) при комнатной температуре и перемешивали реакционную смесь при комнатной температуре в течение 2 часов. Затем добавляли n-толуолсульфонилхлорид (19,4 г) и триэтиламин (8,6 г) и перемешивали реакционную смесь при 60°С еще 3 часа. К полученному реакционному раствору дополнительно добавляли триэтиламин (8,6 г) и n-толуолсульфонилхлорид (19,4 г), и перемешивали реакционный раствор при 50°С в течение 5 часов. К полученной смеси добавляли этилацетат при комнатной температуре, и промывали реакционную смесь водой и насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (30,2 г).
1H ЯМР (300 МГц, ДМСО-d6) δ 1,19-1,32 (2Н, м), 1,39-1,67 (13Н, м), 2,41 (3Н, с), 2,56 (2Н, шт, J=7,5 Гц), 4,00 (2Н, т, J=6,2 Гц), 7,26 (2Н, д, J=7,8 Гц), 7,47 (2Н, шд, J=7,9 Гц), 7,79 (4Н, шт, J=9,0 Гц).
D) трет-Бутил-4-(5-азидопентил)бензоат
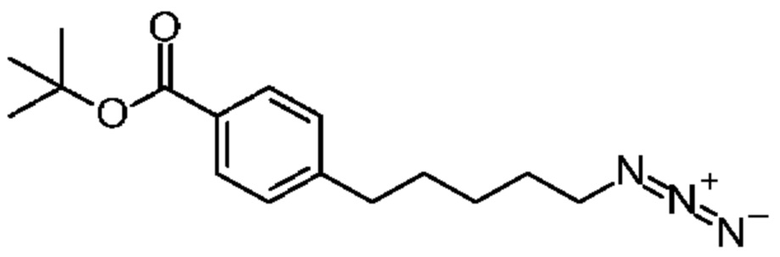
К раствору трет-бутил-4-{5-[(4-метилбензол-1-сульфонил)окси]пентил}бензоата (30,2 г) в N,N-диметилформамиде (150 мл) добавляли йодид натрия (10,8 г) и азид натрия (9,39 г) и перемешивали реакционную смесь при 90°С в течение 3 часов. К полученной смеси добавляли этилацетат при комнатной температуре и промывали реакционную смесь водой и насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (18,8 г).
1H ЯМР (300 МГц, ДМСО-d6) δ 1,27-1,40 (2Н, м), 1,47-1,69 (13Н, м), 2,64 (2Н, шт, J=7,5 Гц), 3,27-3,33 (2Н, м), 7,32 (2Н, д, J=7,7 Гц), 7,82 (2Н, д, J=7,9 Гц).
[0106]
Е) трет-Бутил-4-[5-(4-бром-3-метил-2-нитроанилино)пентил]бензоат
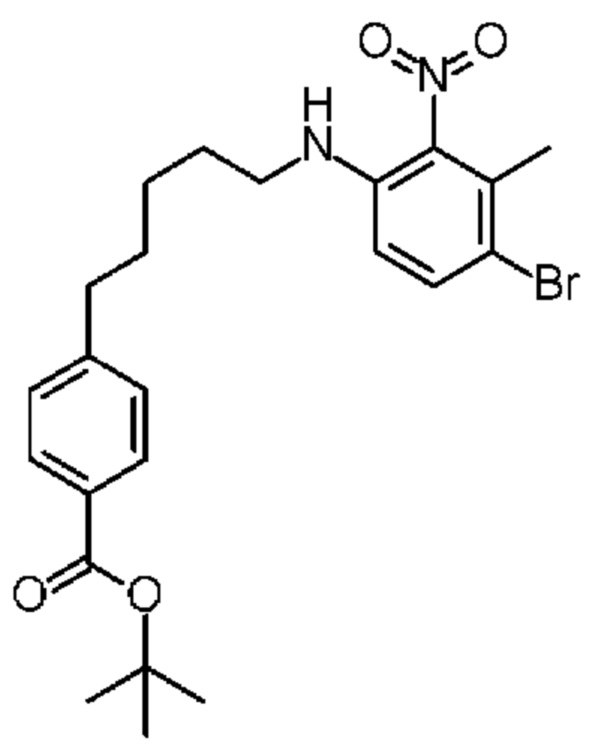
К раствору трет-бутил-4-(5-азидопентил)бензоата (141 мг) в тетрагидрофуране (1 мл) и воде (1 мл) добавляли трифенилфосфин (128 мг) при комнатной температуре. Перемешивали смесь в течение 4 часов и затем концентрировали. К раствору полученного остатка в N,N-диметилформамиде (3 мл) добавляли карбонат калия (135 мг) и 1-бром-4-фтор-2-метил-3-нитробензол (101 мг) при комнатной температуре и перемешивали реакционную смесь при 80°С в течение ночи. К полученной смеси добавляли воду при 0°С и экстрагировали смесь этилацетатом. Раствор с экстрактом промывали насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (189 мг).
1H ЯМР (300 МГц, CDCl3) δ 1,35-1,52 (2Н, м), 1,59 (9Н, с), 1,61-1,78 (4Н, м), 2,44 (3H, с), 2,67 (2Н, т, J=7,5 Гц), 3,13 (2Н, к, J=6,5 Гц), 5,68 (1H, шс), 6,52 (1H, д, J=9,1 Гц), 7,21 (2Н, д, J=7,9 Гц), 7,46 (1H, д, J=9,1 Гц), 7,90 (2Н, д, J=8,0 Гц).
F) трет-Бутил-4-[5-(2-амино-4-бром-3-метиланилино)пентил]бензоат
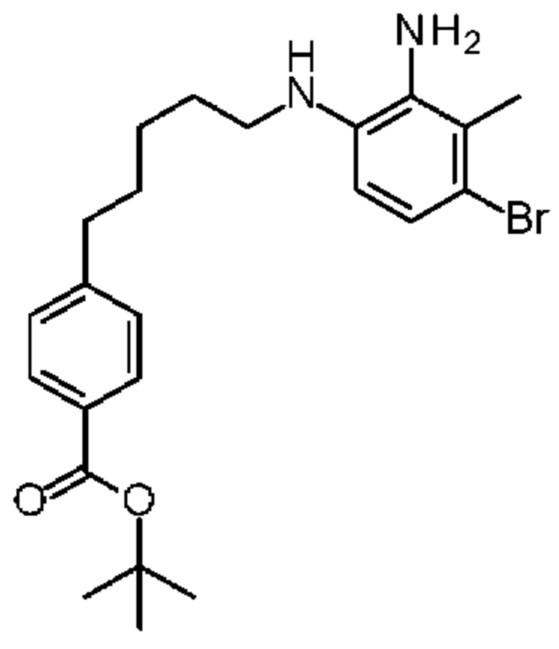
Смесь трет-бутил-4-[5-(4-бром-3-метил-2-нитроанилино)пентил]бензоата (9,27 г), хлорида аммония (5,19 г), железа (5,42 г), этанола (100 мл), этилацетата (30 мл) и воды (50 мл) перемешивали при 85°С в течение 4 часов. Смесь фильтровали и концентрировали фильтрат до половины объема. К полученной смеси добавляли воду и экстрагировали смесь этилацетатом. Раствор с экстрактом промывали насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (7,4 г).
1H ЯМР (300 МГц, ДМСО-d6) δ 1,27-1,69 (15Н, м), 2,16 (3Н, с), 2,65 (2Н, шт, J=7,3 Гц), 2,86-3,14 (2Н, м), 4,44-4,71 (3Н, м), 6,23 (1H, д, J=8,4 Гц), 6,70 (1H, д, J=8,4 Гц), 7,31 (2Н, д, J=7,9 Гц), 7,81 (2Н, д, J=7,9 Гц).
МС m/z 447,2 [М+Н]+.
[0107]
G) трет-Бутил-4-[5-(5-бром-4-метил-1H-бензотриазол-1-ил)пентил]бензоат
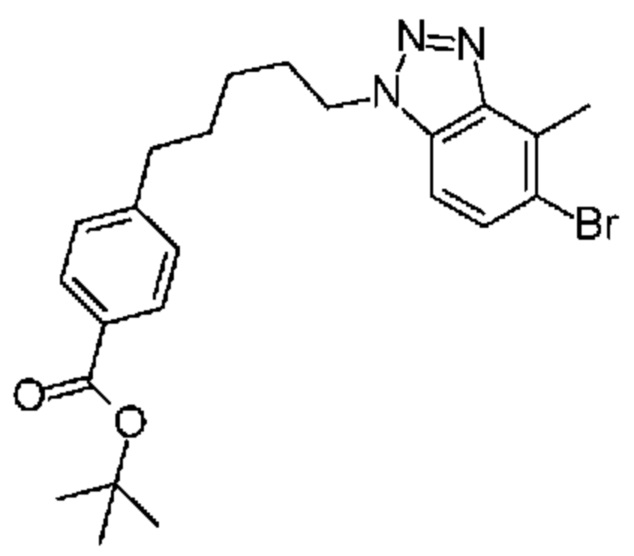
К смеси трет-бутил-4-[5-(2-амино-4-бром-3-метиланилино)пентил]бензоата (7,4 г) в уксусной кислоте (80 мл) добавляли водный раствор (25 мл) нитрита натрия (2,28 г) при комнатной температуре в течение 1 часа. К полученной смеси добавляли лед и экстрагировали смесь этилацетатом. Раствор с экстрактом промывали водой, насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) и колоночной хроматографией на силикагеле (ΝΗ, этилацетат/гексан) с получением указанного в заголовке соединения (4,9 г).
1H ЯМР (300 МГц, ДМСО-d6) δ 1,07-1,28 (2Н, м), 1,49-1,65 (11Н, м), 1,84-1,96 (2Н, м), 2,57 (2Н, шт, J=7,6 Гц), 2,72 (3Н, с), 4,69 (2Н, т, J=6,7 Гц), 7,21 (2Н, д, J=7,8 Гц), 7,69 (2Н, с), 7,75 (2Н, д, J=7,9 Гц). МС m/z 458,2 [М+Н]+.
Н) трет-Бутил-4-(5-{5-[(1E)-3-этокси-3-оксопроп-1-ен-1-ил]-4-метил-1Н-бензотриазол-1-ил}пентил)бензоат
К раствору трет-бутил-4-[5-(5-бром-4-метил-1Н-бензотриазол-1-ил)пентил]бензоата (4,8 г), этилакрилата (6,85 мл) и N,N-диизопропилэтиламина (7,72 мл) в N,N-диметилформамиде (50 мл) добавляли три(о-толил)фосфин (0,96 г) и ацетат палладия (353 мг) и перемешивали реакционную смесь при 120°С в течение 4 часов в атмосфере азота. Дополнительно к реакционной смеси добавляли этилакрилат (6,9 мл), N,N-диизопропилэтиламин (7,72 мл), три(о-толил)фосфин (0,96 г) и ацетат палладия (353 мг), и перемешивали реакционную смесь при 120°С в течение 1 часа в атмосфере азота. К полученной смеси добавляли воду и экстрагировали смесь этилацетатом. Раствор с экстрактом промывали водой и насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) и колоночной хроматографией на силикагеле (ΝΗ, этилацетат/гексан) с получением указанного в заголовке соединения (4,84 г).
1H ЯМР (300 МГц, ДМСО-d6) δ 1,10-1,33 (5Н, м), 1,44-1,67 (11Н, м), 1,85-1,98 (2Н, м), 2,58 (2Н, шт, J=7,2 Гц), 2,81 (3Н, с), 4,22 (2Н, к, J=7,2 Гц), 4,69 (2Н, шт, J=6,6 Гц), 6,66 (1Н д, J=16,0 Гц), 7,21 (2Н, шд, J=7,7 Гц), 7,61-7,78 (3Н, м), 7,91-8,14 (2Н, м).
МС m/z 478,3 [М+Н]+.
[0108]
I) трет-Бутил-7-[1-(1-{5-[4-(трет-бутоксикарбонил)фенил]пентил}-4-метил-1Н-бензотриазол-5-ил)-3-этокси-3-оксопропил]-3,4-дигидроизохинолин-2(1H)-карбоксилат
К смеси трет-бутил-4-(5-{5-[(1E)-3-этокси-3-оксопроп-1-ен-1-ил]-4-метил-1H-бензотриазол-1-ил}пентил)бензоата (4,8 г), трет-бутил-7-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-3,4-дигидро-1Н-изохинолин-2-карбоксилата (10,8 г), додецилсульфата натрия (1,45 г) и триэтиламина (4,2 мл) в СРМЕ (100 мл) и воде (50 мл) добавляли димер хлор(1,5-циклооктадиен)родия (I) (496 мг). Перемешивали смесь при 100°С в течение 4 часов в атмосфере аргона. К полученной смеси добавляли насыщенный водный раствор хлорида аммония и экстрагировали смесь этилацетатом. Раствор с экстрактом промывали насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (6,55 г).
1H ЯΜΡ (300 МГц, CDCl3) δ 1,10 (3Н, т, J=7,2 Гц), 1,32-1,43 (2Н, м), 1,47 (9Н, с), 1,54-1,60 (9Н, м), 1,62-1,76 (2Н, м), 1,93-2,03 (2Н, м), 2,62 (2Н, шт, J=7,3 Гц), 2,71-2,79 (2Н, м), 2,86 (3Н, с), 2,95-3,22 (2Н, м), 3,49-3,69 (2Н, м), 4,02 (2Н, к, J=7,0 Гц), 4,45-4,51 (2Н, м), 4,56 (2Н, шт, J=6,8 Гц), 4,88-5,09 (1Н, м), 6,89-6,96 (1Н, м), 7,03 (2Н, с), 7,17 (2Н, шд, J=7,8 Гц), 7,26 (1Н, с), 7,31-7,39 (1Н, м), 7,88 (2Н, д, J=8,0 Гц).
МС m/z 711,5 [М+Н]+.
J) Этил-[32-метил-20-оксо-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]ацетат
К раствору трет-бутил-7-[1-(1-{5-[4-(трет-бутоксикарбонил)фенил]пентил}-4-метил-1Н-бензотриазол-5-ил)-3-этокси-3-оксопропил]-3,4-дигидроизохинолин-2(1Н)-карбоксилата (6,55 г) в СРМЕ (10 мл) добавляли 4 н. раствор HCl/СРМЕ (70 мл) при комнатной температуре. Перемешивали смесь при комнатной температуре в течение 2 часов и затем концентрировали. К полученной смеси добавляли тетрагидрофуран и концентрировали смесь. Раствор полученного остатка и N,N-диизопропилэтиламина (9,65 мл) в N,N-диметилформамиде (30 мл) по каплям добавляли к раствору HATU (5,25 г) в N,N-диметилформамиде (150 мл) в течение 1 часа. Перемешивали смесь при комнатной температуре в течение 3 часов. К полученной смеси добавляли насыщенный водный раствор бикарбоната натрия и экстрагировали смесь этилацетатом. Раствор с экстрактом промывали водой и насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (2,59 г).
МС m/z 537,4 [М+Н]+.
[0109]
K) [32-Метил-20-оксо-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]уксусная кислота
К раствору этил-[32-метил-20-оксо-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]ацетата (280 мг) в тетрагидрофуране (4 мл) и этаноле (4 мл) добавляли 2 н. водный раствор гидроксида натрия (4 мл) и перемешивали реакционную смесь при комнатной температуре в течение 3 часов. Органические растворители удаляли при пониженном давлении и затем нейтрализовали реакционную смесь при 0°С 2 н. хлористоводородной кислотой. Осадок отфильтровывали и промывали водой с получением указанного в заголовке соединения (265 мг).
1H ЯМР (300 МГц, ДМСО-d6) δ 0,76-1,16 (2Н, м), 1,35-1,62 (2Н, м), 1,79-2,21 (2Н, м), 2,37-2,73 (5Н, м), 2,75-2,90 (2Н, м), 2,91-3,21 (2Н, м), 3,58-4,23 (4Н, м), 4,48-4,91 (3Н, м), 5,89 (1H, с), 6,77-7,00 (4Н, м), 7,08-7,19 (1H, м), 7,27-7,47 (2Н, м), 7,60 (1H, шд, J=8,9 Гц), 12,30 (1H, шс).
[0110]
Пример 2
[20-оксо-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]уксусная кислота
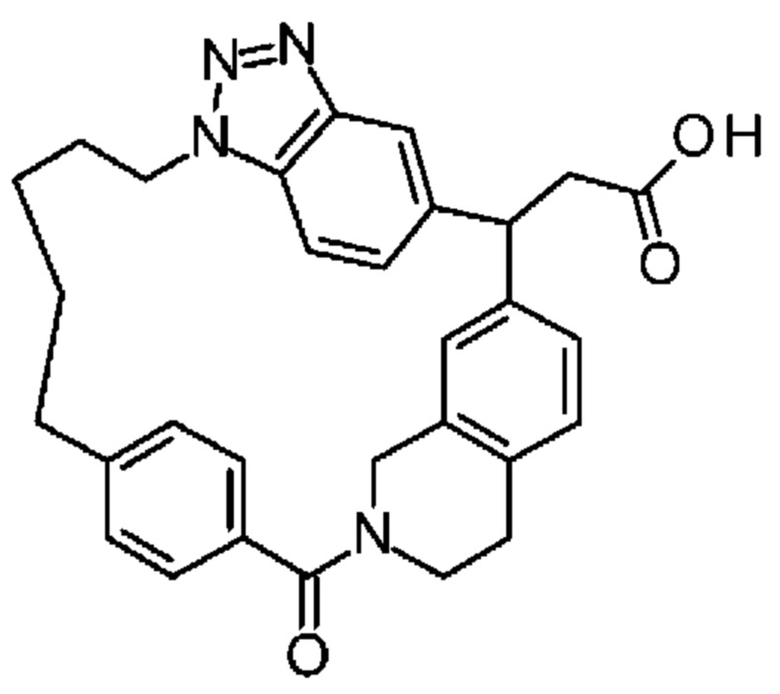
Синтез осуществляли в соответствии со способами, описанными в примере 9, или способами, эквивалентными им.
[0111]
Пример 3
[18-Этил-32-метил-20-оксо-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]уксусная кислота
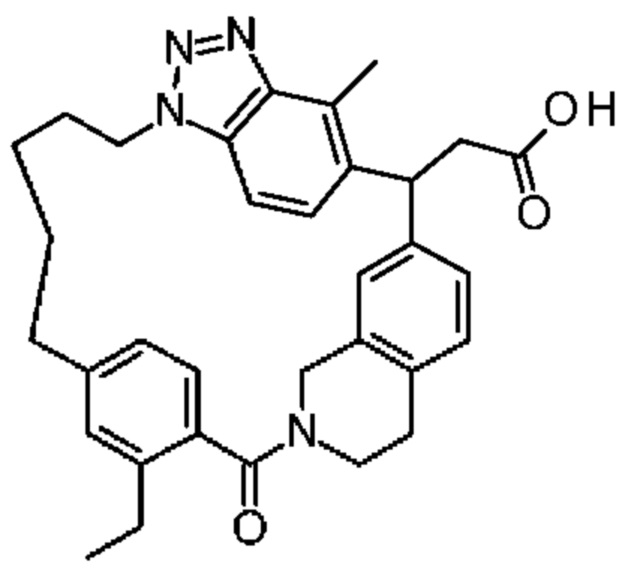
А) Метил-4-бром-2-этилбензоат
К смеси 4-бром-2-фторбензойной кислоты (10,2 г) и тетрагидрофурана (50 мл) по каплям добавляли примерно 1 Μ раствор этилмагнийхлорида в тетрагидрофуране (140 мл) при 0°С. После перемешивания реакционной смеси при 0°С в течение 4 часов добавляли 1 н. хлористоводородную кислоту при 0°С. Органические растворители удаляли при пониженном давлении и затем экстрагировали остаток этилацетатом. Раствор с экстрактом промывали насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. К смеси остатка и метанола (100 мл) добавляли концентрированную серную кислоту (5,00 мл) при комнатной температуре и перемешивали реакционную смесь в течение ночи при кипении с обратным холодильником. Реакционную смесь концентрировали при пониженном давлении и затем экстрагировали этилацетатом. Раствор с экстрактом промывали насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (3,26 г).
1H ЯМР (300 МГц, ДМСО-d6) δ 1,15 (3Н, т, J=7,6 Гц), 2,88 (2Н, к, J=7,5 Гц), 3,83 (3Н, с), 7,53 (1H, шд, J=8,6 Гц), 7,57-7,60 (1H, с), 7,71 (1H, д, J=8,6 Гц).
В) Метил-2-этил-4-(3-гидроксипроп-1-ин-1-ил)бензоат
К смеси метил-4-бром-2-этилбензоата (3,26 г), 4-пентин-1-ола (3,74 мл) и триэтиламина (35,0 мл) добавляли дихлорбис(трифенилфосфин)палладий (II) (0,941 г) и йодид меди (I) (0,255 г) при комнатной температуре. Затем полученную смесь деаэрировали, несколько раз понижая давление и пропуская газообразный азот. Перемешивали смесь при 70°С в течение 3 часов и затем концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (2,78 г).
1H ЯМР (300 МГц, ДМСО-d6) δ 1,14 (3Н, т, J=7,5 Гц), 2,88 (2Н, к, J=7,6 Гц), 3,83 (3Н, с), 4,32 (2Н, д, J=5,7 Гц), 5,36-5,42 (1H, м), 7,35 (1H, шд, J=7,8 Гц), 7,40 (1H, с), 7,76 (1H, д, J=8,0 Гц).
[0112]
С) Метил-2-этил-4-(3-гидроксипропил)бензоат
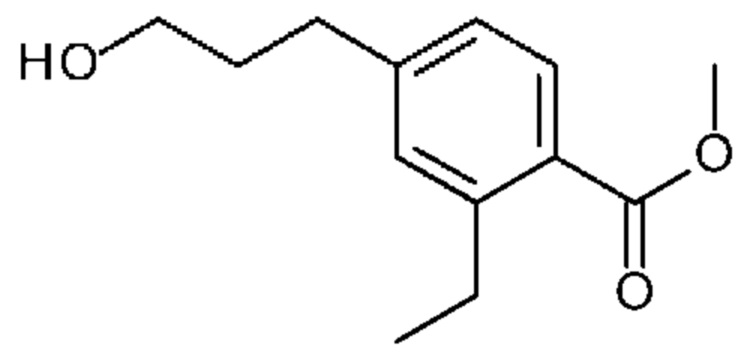
Смесь метил-2-этил-4-(3-гидроксипроп-1-ин-1-ил)бензоата (2,78 г), 10% палладия на углероде (влажный, с содержанием воды около 50%) (1,50 г) и метанола (50 мл) перемешивали в атмосфере водорода в течение 2 часов. Удаляли палладий на углероде фильтрованием, осадок промывали этилацетатом и затем концентрировали фильтрат при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (1,47 г).
MC m/z 223,2 [М+Н]+.
D) Метил-2-этил-4-(3-оксопропил)бензоат
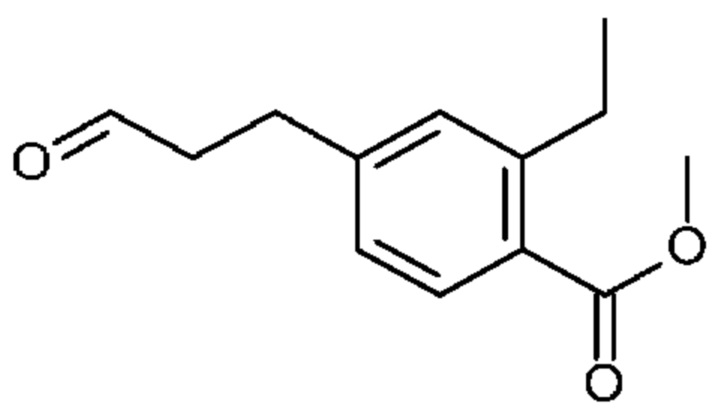
К смеси метил-2-этил-4-(3-гидроксипропил)бензоата (1,47 г), триэтиламина (4,60 мл) и ДМСО (30 мл) добавляли комплекс триоксида серы и пиридина (3,15 г) и затем перемешивали реакционную смесь при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и затем экстрагировали смесь этилацетатом. Раствор с экстрактом промывали насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (0,420 г).
MC m/z 221,2 [М+Н]+.
[0113]
Е) Метил-4-(бут-3-ен-1-ил)-2-этилбензоат
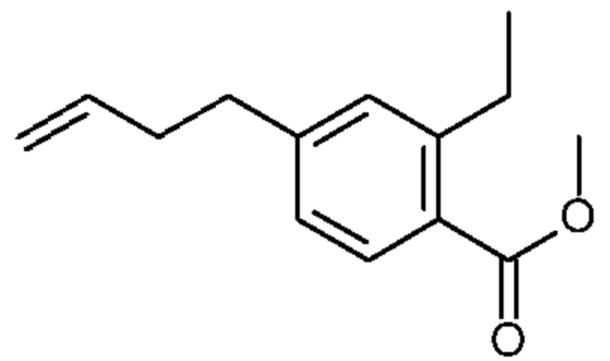
К смеси бромида метилтрифенилфосфония (1,02 г) и тетрагидрофурана (5,00 мл) добавляли 1,6 Μ раствор н-бутиллития в гексане (1,79 мл) при 0°С и перемешивали реакционную смесь при 0°С в течение 30 минут. Затем добавляли раствор метил-2-этил-4-(3-оксопропил)бензоата (420 мг) в тетрагидрофуране (5,00 мл) при 0°С. После перемешивания реакционной смеси при 0°С в течение 1 часа в нее добавляли насыщенный водный раствор хлорида аммония и экстрагировали смесь этилацетатом. Раствор с экстрактом промывали насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (254 мг).
МС m/z 219,2 [М+Н]+.
F) 4-(Бут-3-ен-1-ил)-2-этилбензойная кислота
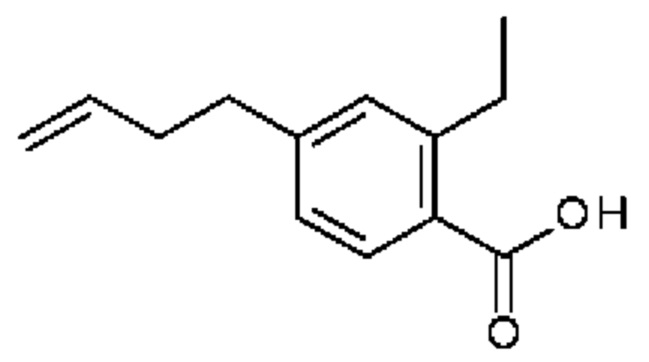
К смеси метил-4-(бут-3-ен-1-ил)-2-этилбензоата (254 мг), этанола (5,00 мл) и тетрагидрофурана (5,00 мл) добавляли 1 н. водный раствор гидроксида натрия (5,00 мл) при комнатной температуре и перемешивали реакционную смесь при 50°С в течение ночи. Реакционную смесь концентрировали при пониженном давлении. Остаток нейтрализовали 1 Μ хлористоводородной кислотой и затем экстрагировали этилацетатом. Раствор с экстрактом промывали насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (187 мг).
МС m/z 205,2 [М+Н]+.
G) [18-этил-32-метил-20-оксо-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]уксусная кислота
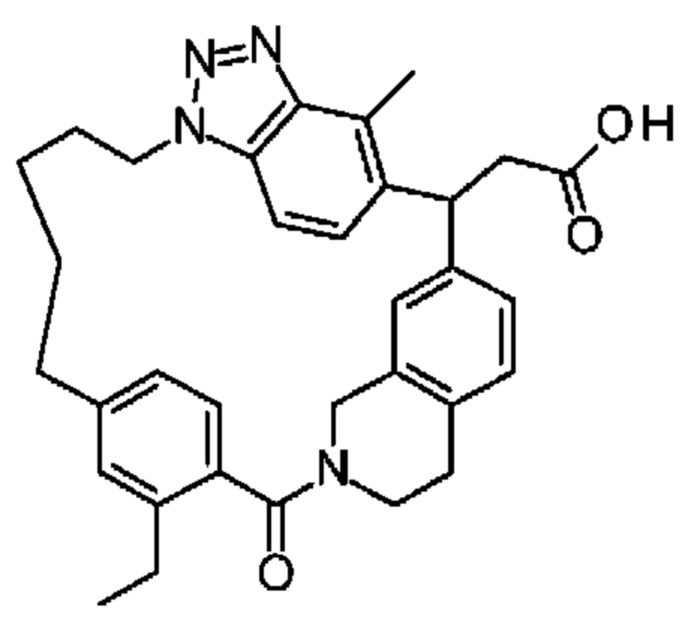
Указанное в заголовке соединение получали, используя 4-(бут-3-ен-1-ил)-2-этилбензойную кислоту, в соответствии со способами, описанными в примере 9, или способами, эквивалентными им.
[0114]
Пример 4
[33-Метил-2-оксо-7-окса-1,15,16,17-тетраазагептацикло [22.5.3.23,9.118,22.04,8.015,19.027,31] пентатриаконта-3,8,16,18(33),19,21,24,26,31,34-декаен-23-ил]уксусная кислота
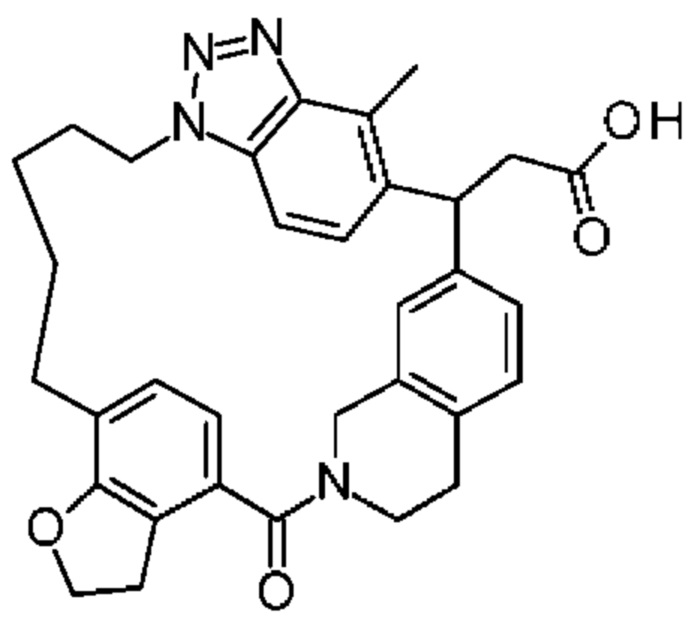
А) Метил-4-бром-3-[(проп-2-ен-1-ил)окси]бензоат
Смесь метил-4-бром-3-гидроксибензоата (5,07 г), карбоната калия (4,55 г), 3-бромпроп-1-ена (2,28 мл) и Ν,Ν-диметилформамида (50 мл) перемешивали при 60°С в течение 3 часов. К реакционной смеси добавляли воду и экстрагировали смесь этилацетатом. Отделяли органический слой и промывали водой и насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (5,93 г).
MC m/z 271,0 [М+Н]+.
B) Метил-4-бром-3-гидрокси-2-(проп-2-ен-1-ил)бензоат
Смесь метил-4-бром-3-[(проп-2-ен-1-ил)окси]бензоата (2,06 г) и N-метил-2-пирролидона (12 мл) перемешивали при 200°С в течение 3 часов под микроволновым излучением. К реакционной смеси добавляли воду и экстрагировали смесь этилацетатом. Отделяли органический слой и промывали водой и насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (1,38 г).
MC m/z 271,0 [М+Н]+.
[0115]
C) Метил-7-бром-2-гидрокси-2,3-дигидро-1-бензофуран-4-карбоксилат
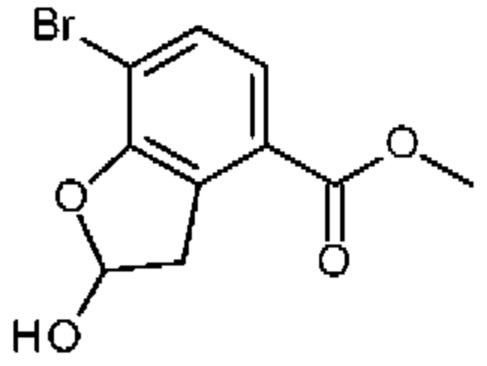
Смесь метил-4-бром-3-гидрокси-2-(проп-2-ен-1-ил)бензоата (1,38 г), периодата натрия (2,17 г), микроинкапсулированного тетраоксида осмия (7,00%, 923 мг), тетрагидрофурана (25 мл) и воды (25 мл) перемешивали при комнатной температуре в течение 6 часов. Фильтровали реакционную смесь и концентрировали фильтрат. К остатку добавляли воду и экстрагировали остаток этилацетатом. Отделяли органический слой и промывали водой и насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (711 мг).
МС m/z 273,0 [М+Н]+.
D) Метил-4-бром-3-гидрокси-2-(2-гидроксиэтил)бензоат
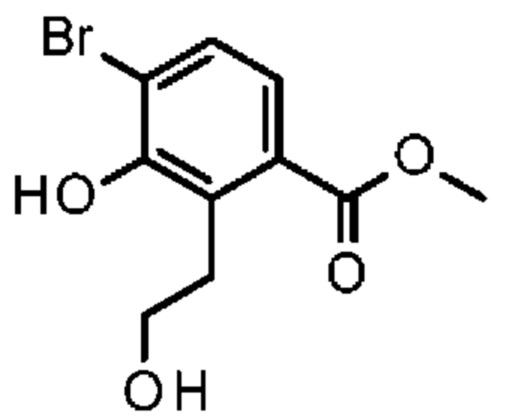
К смеси метил-7-бром-2-гидрокси-2,3-дигидро-1-бензофуран-4-карбоксилата (711 мг), тетрагидрофурана (10 мл) и метанола (10 мл) добавляли боргидрид натрия (98,5 мг) при 0°С и перемешивали реакционную смесь при той же температуре в течение 1 часа. К полученной реакционной смеси добавляли насыщенный водный раствор хлорида аммония при 0°С и экстрагировали смесь этилацетатом. Отделяли органический слой и промывали насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (640 мг).
МС m/z 275,0 [М+Н]+.
[0116]
D) Метил-7-бром-2,3-дигидро-1-бензофуран-4-карбоксилат
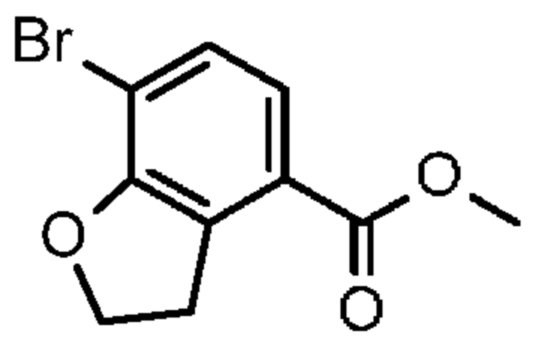
К смеси метил-4-бром-3-гидрокси-2-(2-гидроксиэтил)бензоата (640 мг), трифенилфосфина (733 мг) и тетрагидрофурана (20 мл) добавляли диизопропилазодикарбоксилат (1,9 Μ раствор в толуоле, 1,47 мл) при комнатной температуре и перемешивали реакционную смесь при 50°С в течение 5 часов. Реакционную смесь концентрировали при пониженном давлении и очищали полученный остаток колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (590 мг).
МС m/z 257,0 [М+Н]+.
F) 7-(Бут-3-ен-1-ил)-2,3-дигидро-1-бензофуран-4-карбоновая кислота
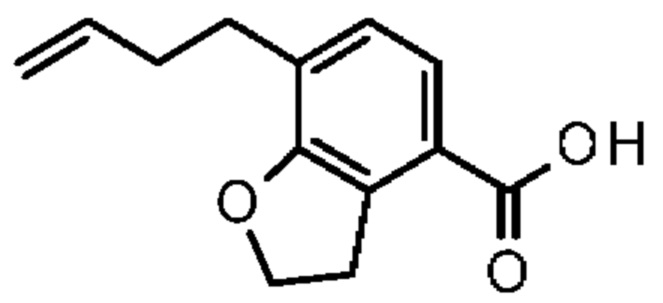
Указанное в заголовке соединение получали, используя метил-7-бром-2,3-дигидро-1-бензофуран-4-карбоксилат, в соответствии со способами, описанными в примере 3, или способами, эквивалентными им.
МС m/z 219,2 [М+Н]+.
G) [33-Метил-2-оксо-7-окса-1,15,16,17-тетраазагептацикло [22.5.3.23,9.118,22.04,8.015,19.027,31]пентатриаконта-3,8,16,18(33),19,21,24,26,31,34-декаен-23-ил]уксусная кислота
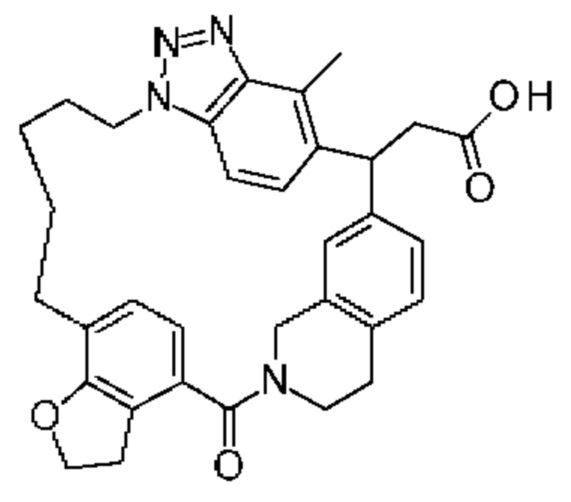
Указанное в заголовке соединение получали, используя 7-(бут-3-ен-1-ил)-2,3-дигидро-1-бензофуран-4-карбоновую кислоту, в соответствии со способами, описанными в примере 9, или способами, эквивалентными им.
[0117]
Пример 5
[6,6,33-Триметил-2-оксо-7-окса-1,15,16,17-тетраазагептацикло [22.5.3.23,9.118,22.04,8.015,19.027,31]пентатриаконта-3,8,16,18(33),19,21,24,26,31,34-декаен-23-ил]уксусная кислота
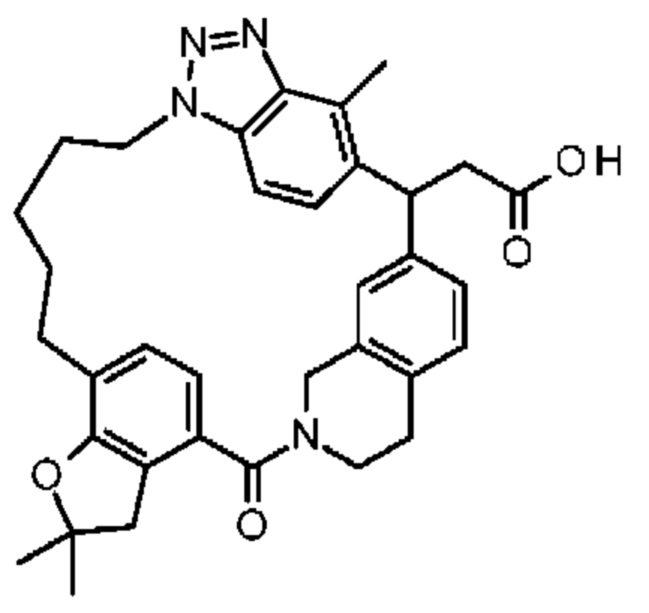
А) Этил-3-гидрокси-4-йодбензоат
Смесь 3-гидрокси-4-йодбензойной кислоты (5,00 г), концентрированной серной кислоты (1,01 мл) и этанола (50 мл) перемешивали при 80°С в течение ночи. Реакционную смесь концентрировали при пониженном давлении. К остатку добавляли воду и насыщенный водный раствор бикарбоната натрия и экстрагировали остаток этилацетатом. Отделяли органический слой и промывали водой и насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (4,67 г).
МС m/z 293,0 [М+Н]+.
В) Этил-4-йод-3-[(2-метилпроп-2-ен-1-ил)окси]бензоат
Смесь этил-3-гидрокси-4-йодбензоата (4,67 г), карбоната калия (4,42 г), 3-хлор-2-метилпроп-1-ена (2,35 мл) и N,N-диметилформамида (50 мл) перемешивали при 70°С в течение ночи. К реакционной смеси добавляли воду и экстрагировали смесь этилацетатом. Отделяли органический слой и промывали водой и насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (5,48 г).
МС m/z 347,1 [М+Н]+.
[0118]
C) Этил-7-йод-2,2-диметил-2,3-дигидро-1-бензофуран-4-карбоксилат
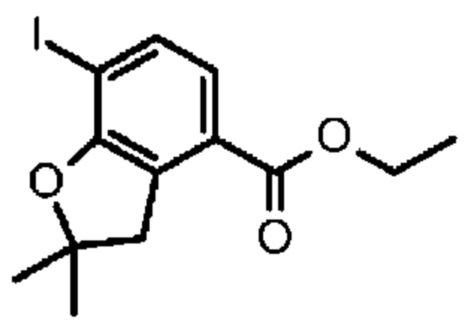
Смесь этил-4-йод-3-[(2-метилпроп-2-ен-1-ил)окси]бензоата (5,48 г) и N-метил-2-пирролидона (50 мл) перемешивали при 190°С в течение ночи. К реакционной смеси добавляли воду и экстрагировали смесь этилацетатом. Отделяли органический слой и промывали водой и насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (1,69 г).
MC m/z 347,1 [М+Н]+.
D) 7-(Бут-3-ен- 1-ил)-2,2-диметил-2,3-дигидро-1-бензофуран-4-карбоновая кислота
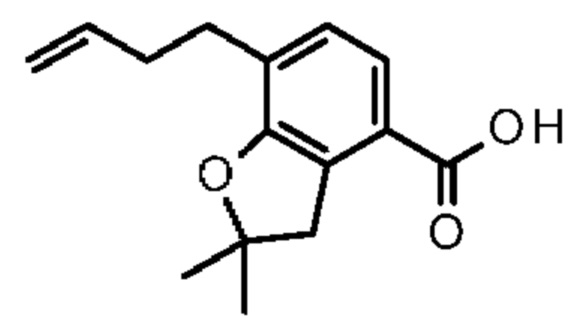
Указанное в заголовке соединение получали, используя этил-7-йод-2,2-диметил-2,3-дигидро-1-бензофуран-4-карбоксилат, в соответствии со способами, описанными в примере 3, или способами, эквивалентными им.
MC m/z 247,2 [М+Н]+.
E) [6,6,33-Триметил-2-оксо-7-окса-1,15,16,17-тетраазагептацикло[22.5.3.23,9.118,22.04,8.015,19.027,31]пентатриаконта-3,8,16,18(33),19,21,24,26,31,34-декаен-23-ил]уксусная кислота
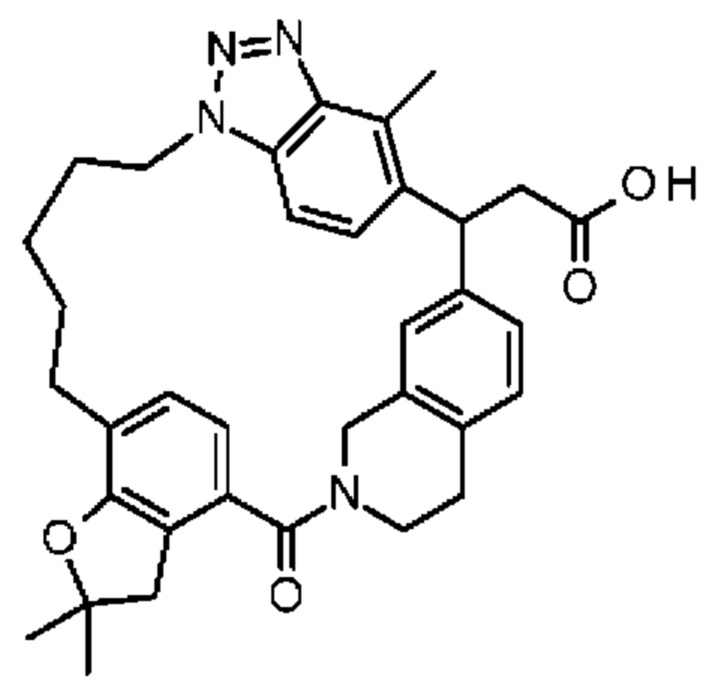
Указанное в заголовке соединение получали, используя 7-(бут-3-ен-1-ил)-2,2-диметил-2,3-дигидро-1-бензофуран-4-карбоновую кислоту, в соответствии со способами, описанными в примере 9, или способами, эквивалентными им.
[0119]
Пример 6
2-[32-Метил-20-оксо-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]пропановая кислота
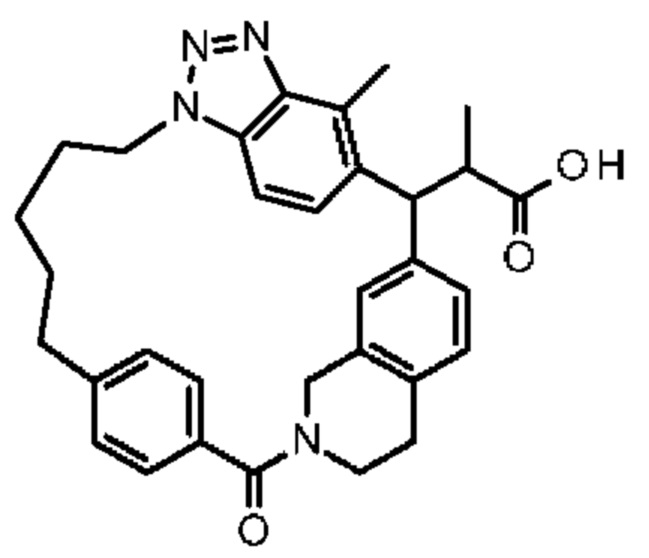
К раствору этил-[32-метил-20-оксо-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]ацетата (90 мг) в тетрагидрофуране (2 мл) по каплям добавляли 1 Μ раствор KHMDS в тетрагидрофуране (0,389 мл) при -78°С. После перемешивания смеси при -78°С в течение 45 минут по каплям добавляли метилиодид (0,0242 мл). Продолжая перемешивать смесь, температуру повышали с -78°С до 0°С в течение часа. К реакционному раствору добавляли насыщенный водный раствор хлорида аммония и экстрагировали реакционную смесь этилацетатом. Раствор с экстрактом промывали насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан).
К раствору полученного остатка в тетрагидрофуране (1 мл) и этаноле (1 мл) добавляли 2 Μ водный раствор гидроксида натрия (1 мл) и перемешивали реакционную смесь при комнатной температуре в течение ночи. Реакционный раствор нейтрализовали при 0°С 2 н. хлористоводородной кислотой и концентрировали. Остаток очищали препаративной ВЭЖХ (YMC-Actus Triart С18, подвижная фаза: вода/ацетонитрил (система, содержащая 0,1% ТФК) с получением указанного в заголовке соединения (4 мг).
1H ЯМР (300 МГц, ДМСО-d6) δ 0,76-1,21 (6Н, м), 1,37-1,74 (2Н, м), 1,79-2,22 (2Н, м), 2,43 (3Н, с), 2,54-2,68 (1H, м), 2,71-2,96 (2Н, м), 3,09-3,33 (2Н, м), 3,87-4,05 (1H, м), 4,08-4,49 (3Н, м), 4,52-4,94 (2Н, м), 6,26 (1H, шс), 6,76-6,96 (4Н, м), 7,02-7,38 (2Н, м), 7,47-7,76 (2Н, м), 12,16 (1H, шс).
[0120]
Пример 7
[33-Метил-2-оксо-5-окса-1,15,16,17-тетраазагептацикло [22.5.3.23,9.118,22.04,8.015,19.027,31]пентатриаконта-3,8,16,18(33),19,21,24,26,31,34-декаен-23-ил]уксусная кислота
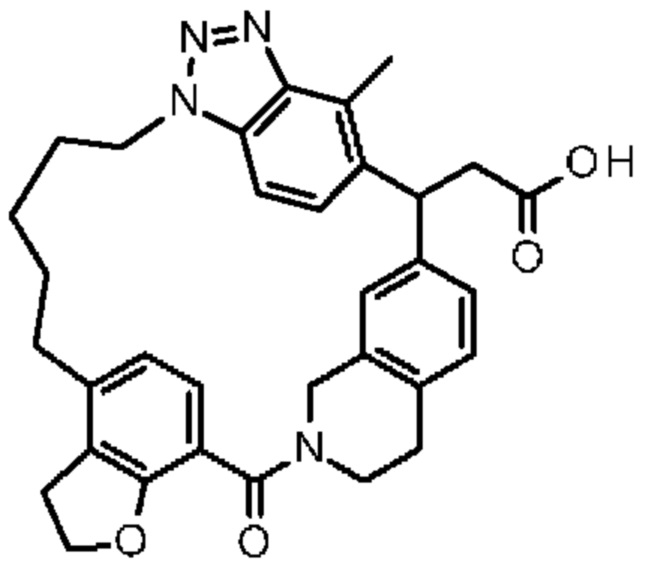
А) Метил-4-бром-2-гидрокси-3-(проп-2-ен-1-ил)бензоат
Указанное в заголовке соединение получали, используя метил-4-бром-2-гидроксибензоат, в соответствии со способами, описанными в примере 4, или способами, эквивалентными им.
МС m/z 271,0 [М+Н]+.
B) Метил-4-бром-3-(2,3-дигидроксипропил)-2-гидроксибензоат
Смесь метил-4-бром-2-гидрокси-3-(проп-2-ен-1-ил)бензоата (1,50 г), микроинкапсулированного тетраоксида осмия (7,00%, 1,00 г), N-метилморфолин-N-оксида (1,94 г), ацетонитрила (10 мл), ацетона (10 мл) и воды (10 мл) перемешивали при комнатной температуре в течение ночи. Фильтровали реакционную смесь и концентрировали фильтрат. К остатку добавляли воду и экстрагировали остаток этилацетатом. Отделяли органический слой и промывали водой и насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (1,18 г).
МС m/z 305,1 [М+Н]+.
C) Метил-4-бром-2-гидрокси-3-(2-гидроксиэтил)бензоат
К смеси метил-4-бром-3-(2,3-дигидроксипропил)-2-гидроксибензоата (1,18 г), тетрагидрофурана (15 мл) и воды (15 мл) добавляли периодат натрия (2,49 г) при 0°С и перемешивали реакционную смесь при комнатной температуре в течение 3 часов. К реакционной смеси добавляли воду и экстрагировали смесь этилацетатом. Отделяли органический слой и промывали водой и насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. К смеси полученного остатка, тетрагидрофурана (15 мл) и метанола (15 мл) добавляли боргидрид натрия (147 мг) при 0°С и перемешивали реакционную смесь при той же температуре в течение 1 часа. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония при 0°С и экстрагировали смесь этилацетатом. Отделяли органический слой и промывали насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (870 мг).
МС m/z 275,1 [М+Н]+.
[0121]
D) Метил-4-бром-2,3-дигидро-1-бензофуран-7-карбоксилат
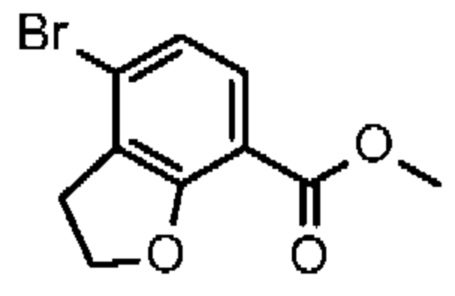
Указанное в заголовке соединение получали, используя метил-4-бром-2-гидрокси-3-(2-гидроксиэтил)бензоат, в соответствии со способами, описанными в примере 4, или способами, эквивалентными им.
MC m/z 257,1 [М+Н]+.
E) 4-(Бут-3-ен-1-ил)-2,3-дигидро-1-бензофуран-7-карбоновая кислота
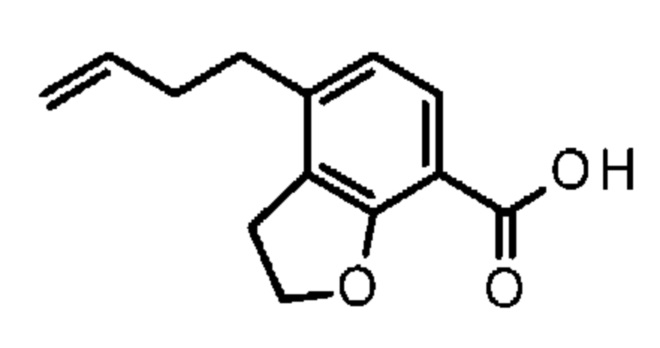
Указанное в заголовке соединение получали, используя метил-4-бром-2,3-дигидро-1-бензофуран-7-карбоксилат, в соответствии со способами, описанными в примере 3, или способами, эквивалентными им.
MC m/z 219,2 [М+Н]+.
F) [33-Метил-2-оксо-5-окса-1,15,16,17-тетраазагептацикло[22.5.3.23,9.118,22.04,8.015,19.027,31]пентатриаконта-3,8,16,18(33),19,21,24,26,31,34-декаен-23-ил]уксусная кислота
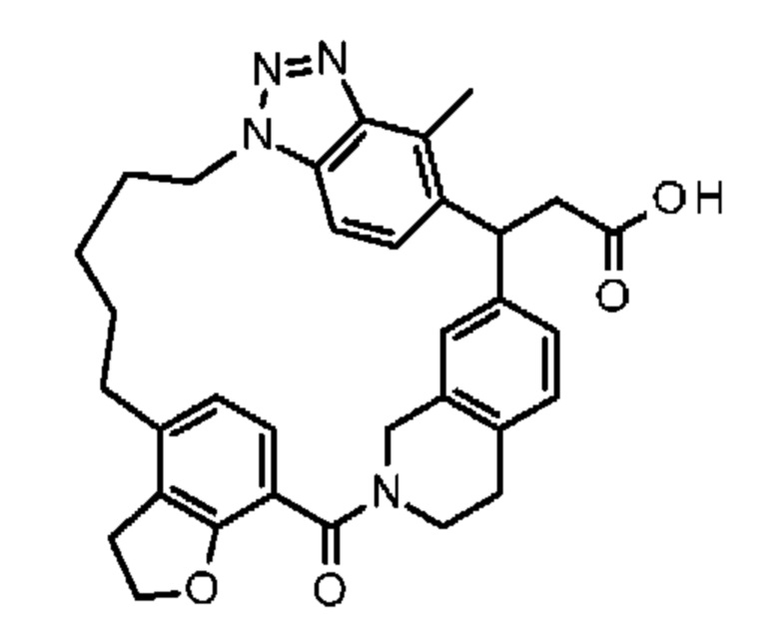
Указанное в заголовке соединение получали, используя 4-(бут-3-ен-1-ил)-2,3-дигидро-1-бензофуран-7-карбоновую кислоту, в соответствии со способами, описанными в примере 9, или способами, эквивалентными им.
[0122] Пример 8
[6,6,33-Триметил-2-оксо-5-окса-1,15,16,17-тетраазагептацикло[22.5.3.23,9.118,22.04,8.015,19.027,31]пентатриаконта-3,8,16,18(33),19,21,24,26,31,34-декаен-23-ил]уксусная кислота
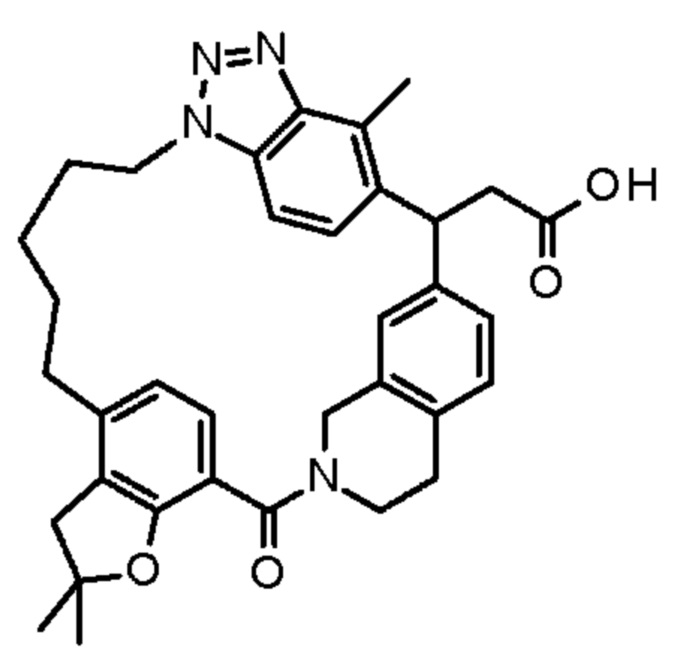
A) Метил-4-йод-2-[(2-метилпроп-2-ен-1-ил)окси]бензоат
Указанное в заголовке соединение получали, используя метил-2-гидрокси-4-йодбензоат, в соответствии со способами, описанными в примере 5, или способами, эквивалентными им.
МС m/z 333,0 [М+Н]+.
B) Метил-2-гидрокси-4-йод-3-(2-метилпроп-2-ен-1-ил)бензоат
Смесь метил-4-йод-2-[(2-метилпроп-2-ен-1-ил)окси]бензоата (5,93 г) и N-метил-2-пирролидона (50 мл) перемешивали при 190°С в течение ночи. К реакционной смеси добавляли воду и экстрагировали смесь этилацетатом. Отделяли органический слой и промывали водой и насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (3,97 г).
МС m/z 333,1 [М+Н]+.
[0123]
C) Метил-4-йод-2,2-диметил-2,3-дигидро-1-бензофуран-7-карбоксилат
Смесь метил-2-гидрокси-4-йод-3-(2-метилпроп-2-ен-1-ил)бензоата (310 мг) и муравьиной кислоты (3 мл) перемешивали при 100°С в течение ночи. Реакционную смесь концентрировали при пониженном давлении и очищали полученный остаток колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (212 мг).
МС m/z 333,0 [М+Н]+.
D) 4-(Бут-3-ен-1-ил)-2,2-диметил-2,3-дигидро-1-бензофуран-7-карбоновая кислота
Указанное в заголовке соединение получали, используя метил-4-йод-2,2-диметил-2,3-дигидро-1-бензофуран-7-карбоксилат, в соответствии со способами, описанными в примере 3, или способами, эквивалентными им.
МС m/z 247,2 [М+Н]+.
Е) [6,6,33-Триметил-2-оксо-5-окса-1,15,16,17-тетраазагептацикло[22.5.3.23,9.118,22.04,8.015,19.027,31]пентатриаконта-3,8,16,18(33),19,21,24,26,31,34-декаен-23-ил]уксусная кислота
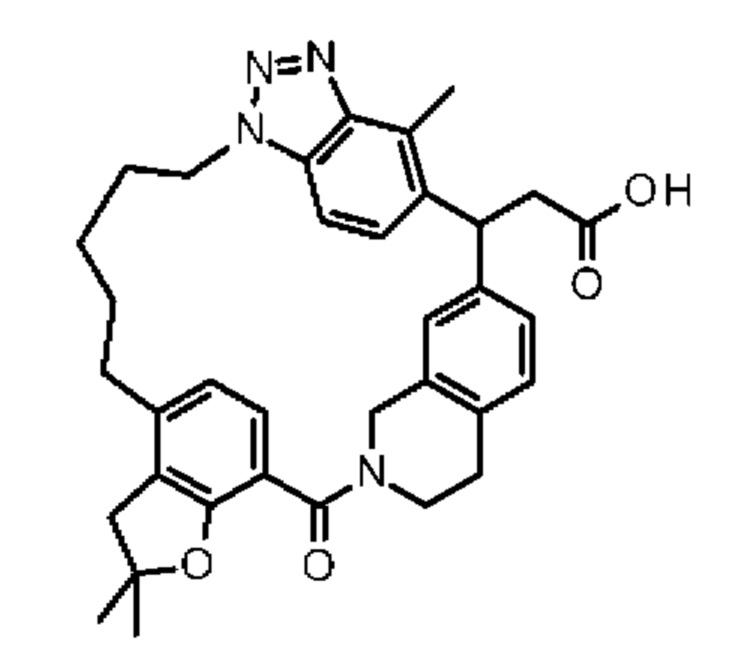
Указанное в заголовке соединение получали, используя 4-(бут-3-ен-1-ил)-2,2-диметил-2,3-дигидро-1-бензофуран-7-карбоновую кислоту, в соответствии со способами, описанными в примере 9, или способами, эквивалентными им.
[0124] Пример 9
[18-Хлор-32-метил-20-оксо-8,9,10,21-тетраазагексацикло[19.5.3.216,9.13,7.06.10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]уксусная кислота
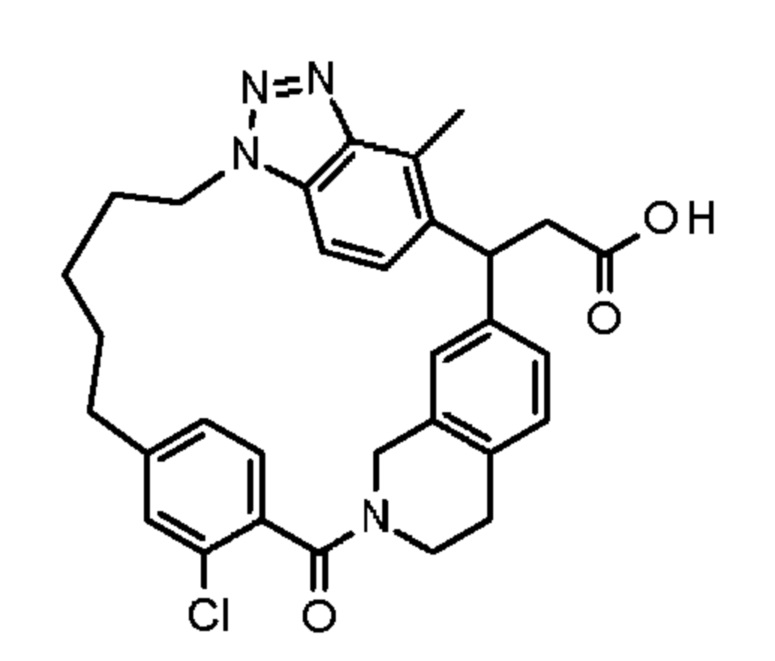
А) трет-Бутил-(4-бром-3-метил-2-нитрофенил)карбамат
К смеси 4-бром-3-метил-2-нитроанилина (2 г) и ди-трет-бутилдикарбоната (3,97 г) в тетрагидрофуране (20 мл) добавляли N,N-диметил-4-аминопиридин (106 мг) и перемешивали реакционную смесь при комнатной температуре в течение 3 дней. После концентрирования реакционного раствора добавляли тетрагидрофуран (20 мл), 2 М водный раствор гидроксида натрия (5,2 мл) и перемешивали реакционную смесь при 70°С в течение ночи. К полученной смеси добавляли воду и экстрагировали смесь диизопр опило вы м эфиром. Раствор с экстрактом промывали насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (2,13 г). 1Н ЯМР (300 МГц, ДМСО-d6) δ 1,42 (9Н, с), 2,30 (3Н, с), 7,32 (1Н, д, J=8,9 Гц), 7,82 (1Н, д, J=8,8 Гц), 9,35 (1Н, с).
В) трет-Бутил-(4-бром-3-метил-2-нитрофенил)(2Е)-бут-2-ен-1-илкарбамат
К раствору 4-бром-3-метил-2-нитроанилина (8,5 г) и ди-трет-бутилдикарбоната (17,7 мл) в тетрагидрофуране (80 мл) добавляли N,N-диметил-4-аминопиридин (900 мг) и перемешивали реакционную смесь при комнатной температуре в течение ночи. К реакционному раствору добавляли 2 М водный раствор гидроксида натрия (37 мл) и перемешивали реакционную смесь при 70°С в течение ночи. К полученной смеси добавляли воду и экстрагировали смесь диэтиловым эфиром. Раствор с экстрактом промывали насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением Вос-формы (11,4 г).
К раствору полученной Вос-формы (10 г) в N,N-диметилформамиде (70 мл) добавляли гидрид натрия (50%, 1,59 г) при 0°С. После перемешивания реакционной смеси при 0°С в течение 30 минут добавляли кротилбромид (4,48 г) при 0°С. После перемешивания смеси при комнатной температуре в течение 4 часов дополнительно добавляли кротилбромид (4,48 г) при 0°С. Реакционную смесь перемешивали при комнатной температуре в течение ночи. К полученной смеси добавляли насыщенный водный раствор хлорида аммония при 0°С и экстрагировали смесь этилацетатом. Отделяли органический слой и промывали водой и насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (7 г).
1H ЯМР (300 МГц, CDCl3) δ 1,37 (9Н, шс), 1,66 (3Н, шс), 2,37 (3Н, с), 3,43-4,00 (1Н, м), 4,15-4,61 (1Н, м), 5,41-5,71 (2Н, м), 6,97 (1Н, шд, J=7,7 Гц), 7,64 (1Н, д, J=8,5 Гц).
[0125]
С) 4-Бром-N-[(2Е)-бут-2-ен-1-ил]-3-метил-2-нитроанилин
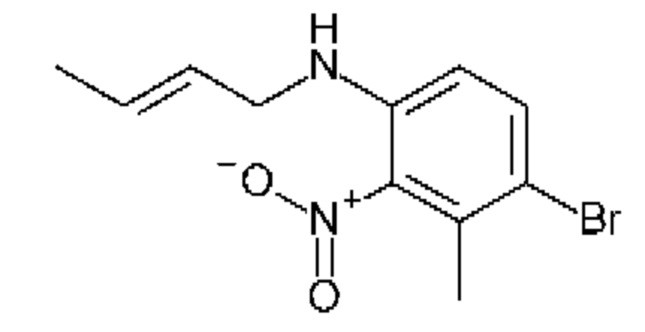
К смеси трет-бутил-(4-бром-3-метил-2-нитрофенил)(2Е)-бут-2-ен-1-илкарбамата (7 г) в этилацетате (10 мл) добавляли 4 и. раствор HCl в этилацетате (30 мл) при комнатной температуре. Перемешивали смесь при комнатной температуре в течение ночи и концентрировали. К полученному остатку добавляли насыщенный водный раствор бикарбоната натрия и экстрагировали смесь этилацетатом. Отделяли органический слой и промывали насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении с получением указанного в заголовке соединения (4,9 г).
1H ЯМР (300 МГц, ДМСО-d6) δ 1,58-1,74 (3Н, м), 2,24 (3Н, с), 3,61-3,87 (2Н, м), 5,24-5,72 (2Н, м), 6,24-6,43 (1Н, м), 6,55-6,74 (1Н, м), 7,45-7,65 (1Н, м).
D) 4-Бром-N-1-[(2Е)-бут-2-ен-1-ил]-3-метилбензол-1,2-диамин
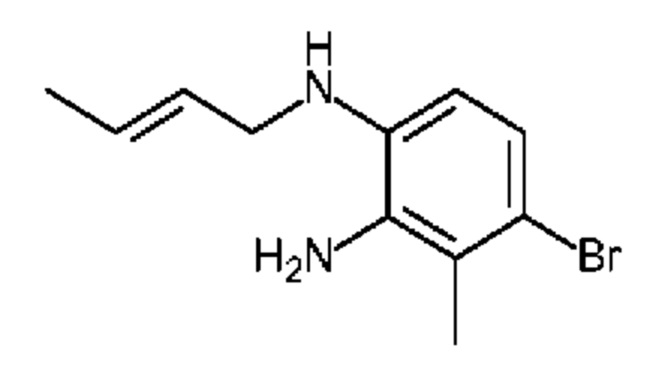
Смесь 4-бром-N-[(2Е)-бут-2-ен-1-ил]-3-метил-2-нитроанилина (4,9 г), хлорида аммония (9,19 г) и железа (4,8 г) в этаноле (50 мл) и воде (10 мл) перемешивали при 85°С в течение 6 часов. Смесь фильтровали, к фильтрату добавляли насыщенный водный раствор бикарбоната натрия и экстрагировали смесь этилацетатом. Раствор с экстрактом промывали насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (3,8 г).
1Н ЯМР (300 МГц, CDCl3) δ 1,72 (3Н, шд, J=5,9 Гц), 2,31 (3Н, с), 3,02-3,31 (1Н, м), 3,35-3,58 (2Н, м), 3,59-3,78 (2Н, м), 5,53-5,89 (2Н, м), 6,45 (1Н, д, J=8,5 Гц), 7,00 (1Н, д, J=8,5 Гц).
[0126]
E) Этил-(2Е)-3-[1-(бут-2-ен-1-ил)-4-метил-1Н-бензотриазол-5-ил]проп-2-еноат (смесь E/Z-изомеров)
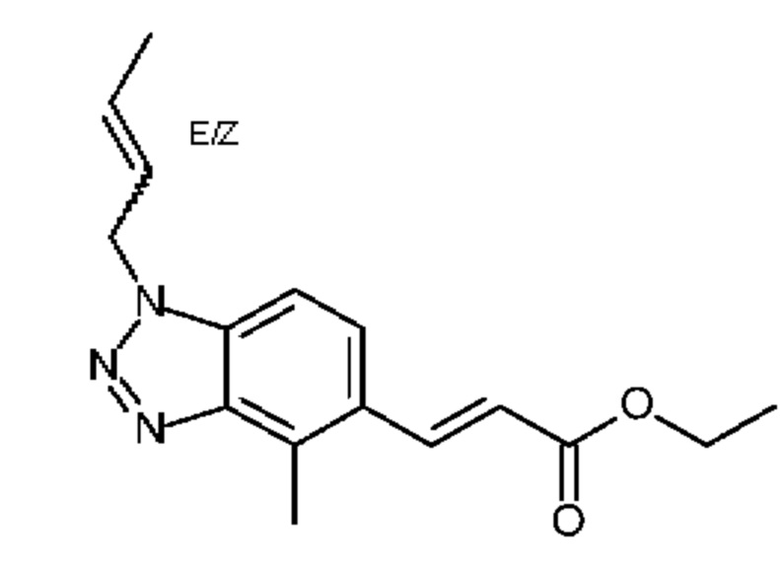
К смеси 4-бром-N-1-[(2Е)-бут-2-ен-1-ил]-3-метилбензол-1,2-диамина (3,6 г) в 6 М хлористоводородной кислоте (38 мл) медленно добавляли раствор нитрита натрия (2,06 г) в воде (4 мл) при 0°С. Перемешивали смесь при комнатной температуре в течение 2 часов. К реакционному раствору добавляли 2 М водный раствор гидроксида натрия при 0°С и экстрагировали смесь этилацетатом. Раствор с экстрактом промывали насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением циклизованной формы (3,2 г).
К раствору циклизованной формы (3,13 г), этилакрилата (7,7 мл) и N,N-диизопропилэтиламина (8,11 мл) в N,N-диметилформамиде (14 мл), добавляли три(о-толил)фосфин (1,07 г) и ацетат палладия (396 мг) и перемешивали реакционную смесь при 120°С в течение 6 часов. Затем, после охлаждения реакционной смеси до комнатной температуры, к ней добавляли воду и экстрагировали смесь этилацетатом. Раствор с экстрактом промывали водой и насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (3,2 г). 1H ЯМР (300 МГц, ДМСО-d6) δ 1,28 (3Н, т, J=7,1 Гц), 1,62-1,98 (3Н, м), 2,81 (3Н, с), 4,22 (2Н, к, J=7,1 Гц), 5,22-5,44 (2Н, м), 5,56-5,94 (2Н, м), 6,65 (1Н, д, J=15,9 Гц), 7,58-7,72 (1Н, м), 7,87-8,19 (2Н, м).
МС m/z 286,2 [М+Н]+.
F) трет-Бутил-7-{1-[1-(бут-2-ен-1-ил)-4-метил-1Н-бензотриазол-5-ил]-3-этокси-3-оксопропил}-3,4-дигидроизохинолин-2(1Н)-карбоксилат (смесь E/Z-изомеров)
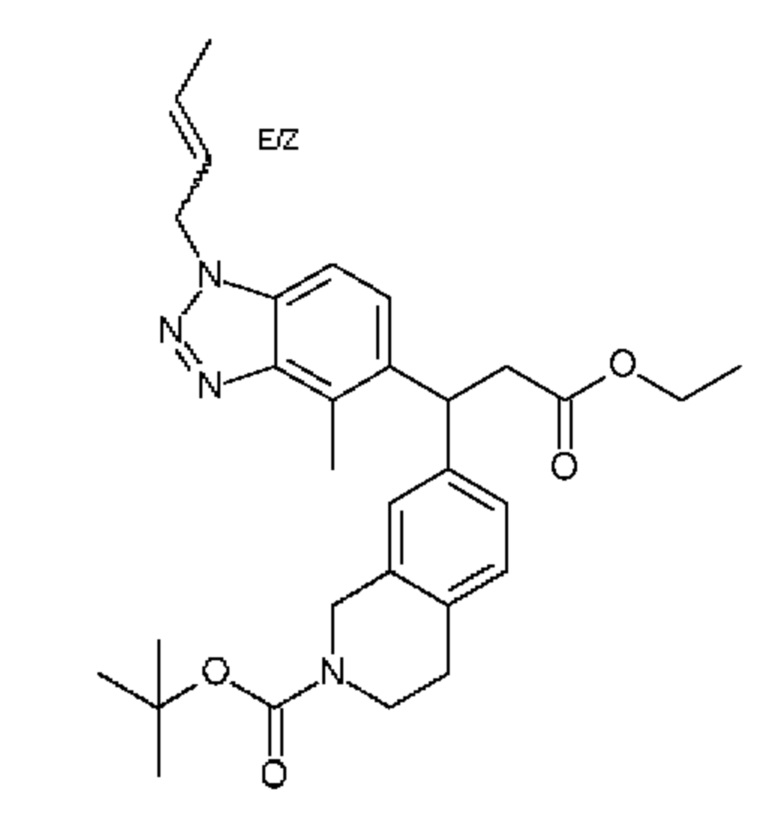
К смеси этил-(2Е)-3-[1-(бут-2-ен-1-ил)-4-метил-1Н-бензотриазол-5-ил]проп-2-еноата (смесь E/Z-изомеров) (3,1 г), трет-бутил-7-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-3,4-дигидро-1H-изохинолин-2-карбоксилата (5,85 г), додецилсульфата натрия (1,57 г) и триэтиламина (4,54 мл) в СРМЕ (50 мл) и воде (25 мл) добавляли димер хлор(1,5-циклооктадиен)родия (I) (536 мг) при комнатной температуре. Перемешивали смесь при 90°С в течение 4 часов в атмосфере азота. К полученной смеси добавляли воду и экстрагировали смесь этилацетатом. Раствор с экстрактом промывали насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (4,27 г).
1Н ЯМР (300 МГц, ДМСО-d6) δ 1,01 (3Н, шт, J=7,0 Гц), 1,41 (9Н, с), 1,59-1,88 (3Н, м), 2,68 (2Н, шт, J=5,7 Гц), 2,77 (3Н, с), 3,16 (2Н, шд, J=7,6 Гц), 3,49 (2Н, шт, J=5,4 Гц), 3,93 (2Н, к, J=7,0 Гц), 4,43 (2Н, шс), 4,82 (1Н, шт, J=7,8 Гц), 5,14-5,41 (2Н, м), 5,50-5,93 (2Н, м), 6,96-7,24 (3Н, м), 7,53 (2Н, к, J=8,5 Гц).
MC m/z 519,4 [М+Н]+.
[0127]
G) Этил-3-[1-(бут-2-ен-1-ил)-4-метил-1Н-бензотриазол-5-ил]-3-(1,2,3,4-тетрагидроизохинолин-7-ил)пропаноат (смесь E/Z-изомеров)
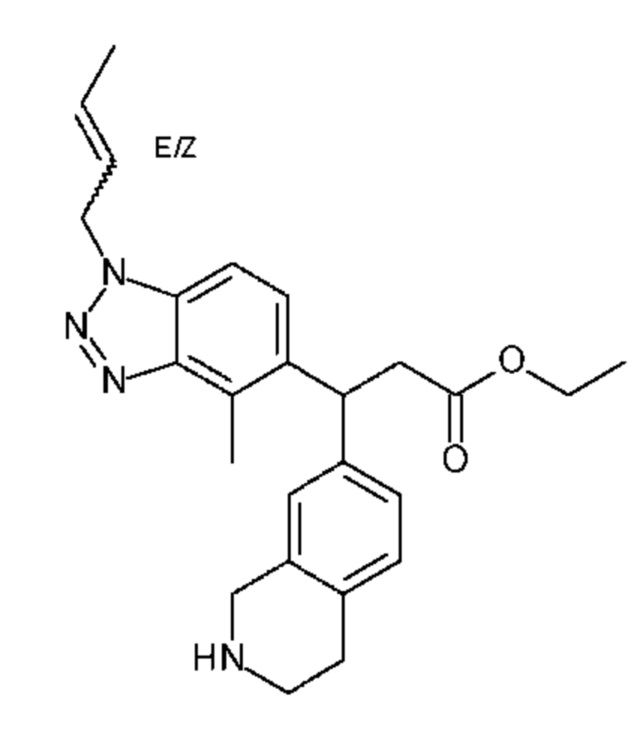
К смеси трет-бутил-7-{1-[1-(бут-2-ен-1-ил)-4-метил-1Н-бензотриазол-5-ил]-3-этокси-3-оксопропил}-3,4-дигидроизохинолин-2(1Н)-карбоксилата (смесь E/Z-изомеров) (4,2 г) в этилацетате (5 мл) добавляли 4 н. раствор HCl в этилацетате (40 мл) и перемешивали реакционную смесь при комнатной температуре в течение 5 часов. Смесь концентрировали и к полученному остатку добавляли насыщенный водный раствор бикарбоната натрия, и экстрагировали смесь этилацетатом. Отделяли органический слой и промывали насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (2,4 г).
1H ЯМР (300 МГц, ДМСО-d6) δ 1,01 (3Н, т, J=6,8 Гц), 1,53-1,87 (3Н, м), 2,22-2,43 (1Н, м), 2,54-2,61 (2Н, м), 2,75 (3Н, с), 2,87 (2Н, шт, J=5,3 Гц), 3,12 (2Н, шд, J=7,6 Гц), 3,74 (2Н, с), 3,93 (2Н, к, J=7,1 Гц), 4,79 (1Н, шт, J=7,7 Гц), 5,13-5,40 (2Н, м), 5,54-5,90 (2Н, м), 6,81-7,11 (3Н, м), 7,35-7,67 (2Н, м).
H) трет-Бутил-2-хлор-4-(3-гидроксипроп-1-ин-1-ил)бензоат
трет-Бутил-4-бром-2-хлорбензоат (3,67 г), 2-пропин-1-ол (2,117 г), йодид меди (I) (120 мг), триэтиламин (3,54 мл) и дихлорид бис(трифенилфосфин)палладия (II) (442 мг) суспендировали в ДМФА (30 мл) и перемешивали реакционную смесь при 80°С в течение 8 часов в атмосфере азота. Реакционный раствор разбавляли этилацетатом и промывали насыщенным солевым раствором, затем сушили над безводным сульфатом натрия и концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (1,85 г). 1H ЯМР (300 МГц, CDCl3) δ 1,60 (9Н, с), 4,51 (2Н, д, J=6,1 Гц), 7,30-7,36 (1Н, м), 7,45-7,50 (1Н, м), 7,68 (1Н, д, J=8,0 Гц). [0128]
I) трет-Бутил-2-хлор-4-(3-гидроксипропил)бензоат
трет-Бутил-2-хлор-4-(3-гидроксипроп-1-ин-1-ил)бензоат (1,2 г) и хлорид трис(трифенилфосфин)родия (I) (208 мг) растворяли в толуоле (100 мл) и перемешивали реакционную смесь при 60°С в течение 20 часов в атмосфере водорода. Реакционный раствор охлаждали и затем концентрировали при пониженном давлении, а полученный таким образом в остатке продукт очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (1,047 г). 1H ЯМР (300 МГц, ДМСО-d6) δ 1,54 (9Н, с), 1,64-1,78 (2Н, м), 2,65 (2Н, шт, J=7,7 Гц), 3,39 (2Н, к, J=5,9 Гц), 4,51 (1Н, т, J=5,0 Гц), 7,26 (1Н, д, J=8,0 Гц), 7,38 (1Н, с), 7,60-7,67 (1Н, м).
J) трет-Бутил-2-хлор-4-(3-оксопропил)бензоат
Раствор трет-бутил-2-хлор-4-(3-гидроксипропил)бензоата (600 мг) и триэтиламина (2,49 мл) в ДМСО (30 мл) охлаждали до 0°С, несколькими порциями добавляли комплекс триоксида серы и пиридина (1,764 г) и перемешивали реакционную смесь при комнатной температуре в течение 15 часов. Реакционный раствор разбавляли этилацетатом и затем промывали водой. Органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении, а полученный в остатке продукт очищали хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (476 мг).
1Н ЯМР (300 МГц, CDCl3) δ 1,60 (9Н, с), 2,75-2,84 (2Н, м), 2,90-3,01 (2Н, м), 7,12 (1Н, д, J=8,0 Гц), 7,26 (1Н, с), 7,68 (1Н, д, J=8,0 Гц), 9,81 (1Н, с).
[0129]
K) трет-Бутил-4-(бут-3-ен- 1-ил)-2-хлорбензоат
Суспензию бромида метилтрифенилфосфония (2924 мг) в ТГФ (30 мл) охлаждали до 0°С и несколькими порциями добавляли трет-бутоксид калия (835 мг). После повышения температуры реакционного раствора до комнатной температуры перемешивали раствор в течение еще 1 часа. Реакционный раствор снова охлаждали до 0°С и по каплям добавляли в него раствор трет-бутил-2-хлор-4-(3-оксопропил)бензоата (400 мг) в ТГФ (1 мл). Температуру реакционной смеси повышали до комнатной температуры и затем перемешивали смесь в течение 15 часов. Реакционный раствор выливали в насыщенный водный раствор хлорида аммония и экстрагировали реакционную смесь этилацетатом.. Органический слой промывали насыщенным солевым раствором, сушили над безводным сульфатом натрия и затем концентрировали при пониженном давлении. Полученный в остатке продукт очищали хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (270 мг). 1H ЯМР (300 МГц, CDCl3) δ 1,55-1,66 (9Н, м), 2,25-2,45 (2Н, м), 2,61-2,77 (2Н, м), 4,90-5,11 (2Н, м), 5,68-5,90 (1Н, м), 7,10 (1Н, д, J=7,9 Гц), 7,33 (1Н, с), 7,68 (1Н, д, J=7,9 Гц).
L) 4-(Бут-3-ен-1-ил)-2-хлорбензойная кислота
К раствору трет-бутил-4-(бут-3-ен-1-ил)-2-хлорбензоат (200 мг) в толуоле (2,0 мл) по каплям добавляли трифторуксусную кислоту (2,0 мл) при комнатной температуре. Реакционный раствор перемешивали при той же температуре в течение 2 часов и затем концентрировали при пониженном давлении с получением указанного в заголовке соединения (150 мг).
1H ЯМР (300 МГц, ДМСО-d6) δ 2,27-2,41 (2Н, м), 2,72 (2Н, т, J=7,6 Гц), 4,93-5,08 (2Н, м), 5,70-5,91 (1Н, м), 7,27 (1Н, д, J=7,9 Гц), 7,41 (1Н, с), 7,72 (1Н, д, J=7,9 Гц), 13,02-13,34 (1Н, м).
[0130]
М) Этил-3-{2-[4-(бут-3-ен-1-ил)-2-хлорбензоил]-1,2,3,4-тетрагидроизохинолин-7-ил}-3-{1-[(2Е)-бут-2-ен-1-ил]-4-метил-1Н-бензотриазол-5-ил}пропаноат
К раствору этил-3-[1-(бут-2-ен-1-ил)-4-метил-1Н-бензотриазол-5-ил]-3-(1,2,3,4-тетрагидроизохинолин-7-ил)пропаноата (смесь E/Z-изомеров) (25 мг), 4-(бут-3-ен-1-ил)-2-хлорбензойной кислоты (18,5 мг), безводного 1-гидроксибензотриазола (16,1 мг) и триэтиламина (0,025 мл) в ДМФА (1 мл) добавляли 1-[3-(диметиламино)пропил]-3-этилкарбодиимид (18,5 мг) и перемешивали реакционную смесь при комнатной температуре в течение 15 часов. Реакционный раствор разбавляли этилацетатом и затем промывали насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и концентрировали при пониженном давлении, а полученный неочищенный продукт очищали хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (30 мг).
МС m/z 611,3 [М+Н]+.
N) Этил-[(12Z)-18-хлор-32-метил-20-оксо-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,12,16,18,24,27,30-ундекаен-2-ил]ацетат
Этил-3-{2-[4-(бут-3-ен-1-ил)-2-хлорбензоил]-1,2,3,4-тетрагидроизохинолин-7-ил}-3-{1-[(2Е)-бут-2-ен-1-ил]-4-метил-1Н-бензотриазол-5-ил}пропаноат (30 мг) растворяли в 1,2-дихлорэтане (35 мл), добавляли (1,3-бис-(2,4,6-триметилфенил)-2-имидазолидинилиден)дихлор(о-изопропоксифенилметилен)рутений (6,15 мг) и перемешивали реакционную смесь при 50°С в течение 15 часов. Реакционный раствор концентрировали при пониженном давлении и очищали полученный неочищенный продукт хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (15 мг).
МС m/z 569,3 [М+Н]+.
[0131]
О) [18-Хлор-32-метил-20-оксо-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]уксусная кислота
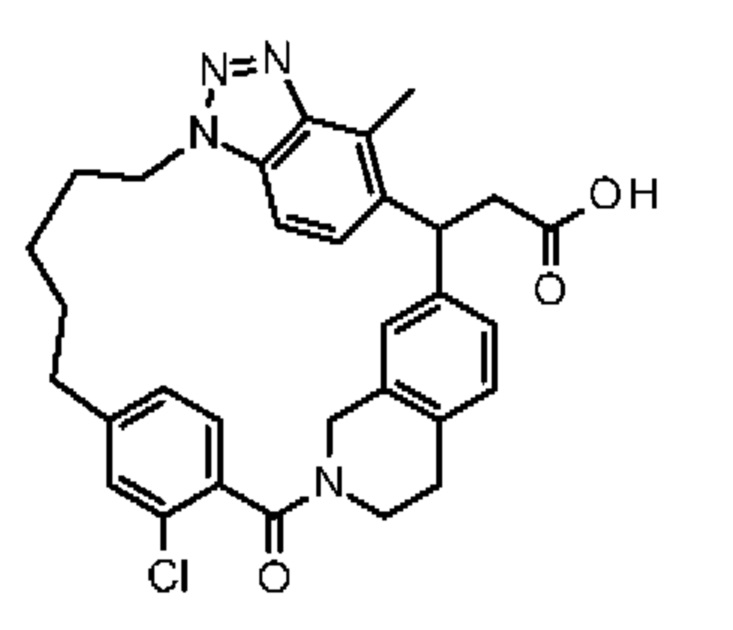
Этил-[(12Z)-18-хлор-32-метил-20-оксо-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,12,16,18,24,27,30-ундекаен-2-ил]ацетат (33 мг) и хлорид трис(трифенилфосфин)родия (I) (3,0 мг) растворяли в толуоле (10 мл) и перемешивали реакционную смесь при 60°С в течение 20 часов в атмосфере водорода, и затем концентрировали при пониженном давлении. Остаток очищали хроматографией на силикагеле (этилацетат/гексан). Полученный неочищенный продукт растворяли в смеси этанола (1 мл) и ТГФ (1 мл), добавляли 2 М водный раствор гидроксида натрия (1 мл) и перемешивали реакционную смесь при комнатной температуре в течение 1 часа. К реакционному раствору добавляли 1 М HCl (2,1 мл), чтобы подкислить раствор, и затем экстрагировали смесь этилацетатом. Раствор с экстрактом сушили над безводным сульфатом магния и затем концентрировали при пониженном давлении с получением указанного в заголовке соединения (12,0 мг).
1H ЯМР (300 МГц, ДМСО-d6) δ 1,29-1,68 (2Н, м), 1,88-2,14 (2Н, м), 2,45 (3Н, м), 2,85 (2Н, м), 2,90-3,17 (3Н, м), 3,57-3,77 (3Н, м), 3,80-4,07 (3Н, м), 4,60-4,89 (4Н, м), 5,68-5,90 (1Н, м), 6,56 (2Н, м), 6,91-7,07 (1Н, м), 7,11-7,23 (1Н, м), 7,25-7,44 (2Н, м), 7,55-7,66 (1Н, м), 12,12-12,34 (1Н, м).
[0132] Пример 10
[18-Фтор-32-метил-20-оксо-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]уксусная кислота
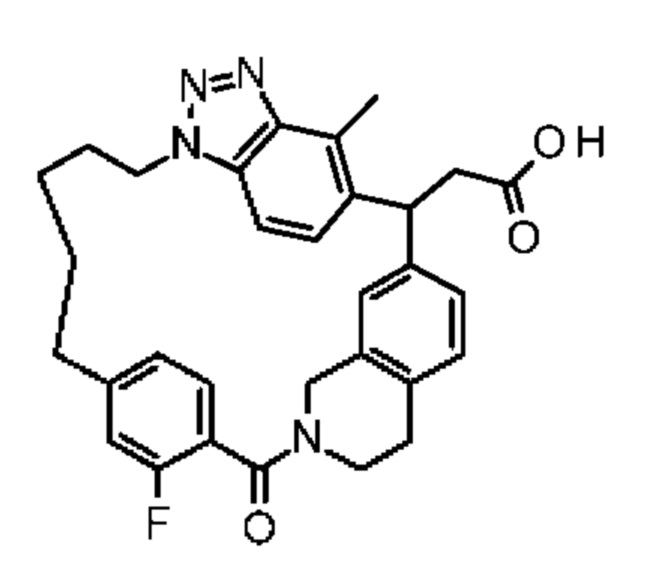
А) 4-(Бут-3-ен-1-ил)-2-фторбензойная кислота
Указанное в заголовке соединение получали из трет-бутил-4-бром-2-фторбензоата таким же способом, как в примере 9.
1Н ЯМР (300 МГц, ДМСО-d6) δ 2,24-2,43 (2Н, м), 2,67-2,81 (2Н, м), 4,87-5,13 (2Н, м), 5,82 (1Н, ддт, J=16,7, 10,1, 6,5 Гц), 7,06-7,25 (2Н, м), 7,78 (1Н, шт, J=8,0 Гц), 13,08 (1Н, шс).
В) [18-Фтор-32-метил-20-оксо-8,9,10,21-тетраазагексацикло[19.5.3.219.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]уксусная кислота
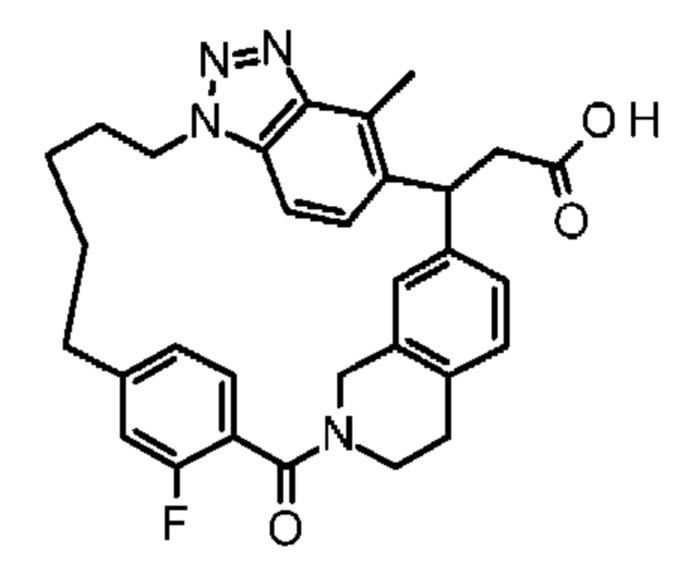
Указанное в заголовке соединение получали из 4-(бут-3-ен-1-ил)-2-фторбензойной кислоты таким же способом, как в примере 9.
[0133] Пример 11
[32-Метил-20-оксо-8,9,10,21-[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]уксусная кислота
<Хиральная, синтез из хирального этил-[32-метил-20-оксо-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]ацетата (короткое время удерживания)>
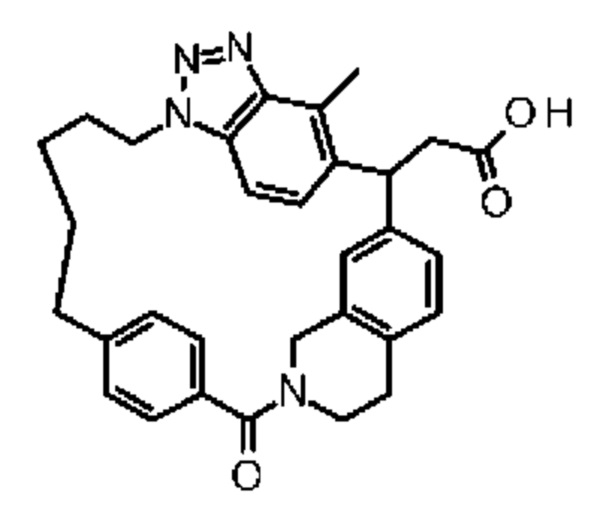
А) Этил-[32-метил-20-оксо-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]ацетат
(хиральный, продолжительное время удерживания)
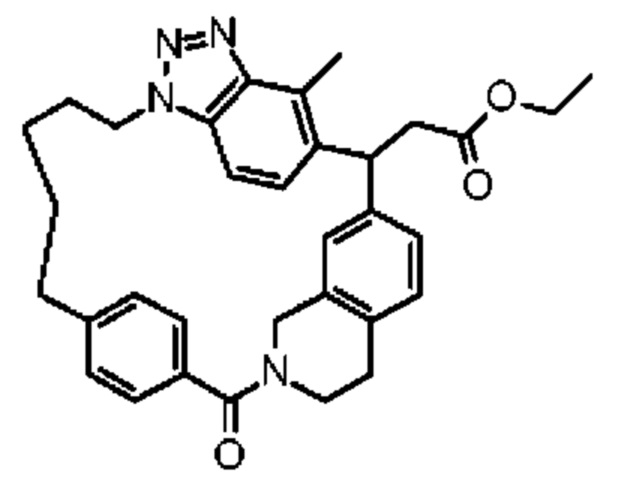
Рацемат этил-2-(32-метил-20-оксо-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3,5,7(32),8,16(31), 17,19(30),24,27-декаен-2-ил]ацетата (2,59 г) фракционировали с помощью системы для препаративной сверхкритической СО2 хроматографии (колонка: Cellulose-C (5 мкм) 250 × 30 мм внутр. диам., подвижная фаза: диоксид углерода / метанол = 65/35). Полученную фракцию концентрировали при пониженном давлении с получением указанного в заголовке соединения (1,22 г) (хиральное, продолжительное время удерживания).
Условия анализа. Время удерживания: 4,997 минуты (колонка: Alcyon SFC CSP Cellulose-С (5 мкм), 250 × 4,6 мм внутр. диам., подвижная фаза: диоксид углерода / метанол = 65/35, скорость потока: 3,0 мл/мин., температура: 35°С, детекция: УФ 210 нм, концентрация образца: 1 мг/мл, объем ввода: 0,005 мл).
В) Этил-[32-метил-20-оксо-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]ацетат (хиральный, короткое время удерживания)
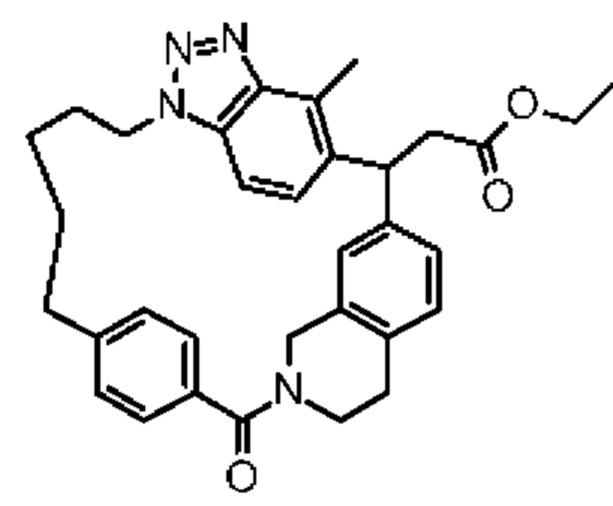
Рацемат этил-[32-метил-20-оксо-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]ацетата (2,59 г) фракционировали с помощью системы для препаративной сверхкритической СО2 хроматографии (колонка: Cellulose-C (5 мкм) 250 × 30 мм внутр. диам., подвижная фаза: диоксид углерода / метанол = 65/35). Полученную фракцию концентрировали при пониженном давлении с получением указанного в заголовке соединения (1,23 г) (хиральное, короткое время удерживания).
Условия анализа. Время удерживания: 3,795 минуты (колонка: Alcyon SFC CSP Cellulose-С (5 мкм), 250 × 4,6 мм внутр. диам., подвижная фаза: диоксид углерода / метанол = 65/35, скорость потока: 3,0 мл/мин., температура: 35°С, детекция: УФ 210 нм, концентрация образца: 1 мг/мл, объем ввода: 0,005 мл).
[0134]
С) [32-Метил-20-оксо-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]уксусная кислота
<Хиральная, синтез из хирального этил-[32-метил-20-оксо-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]ацетата (короткое время удерживания)>
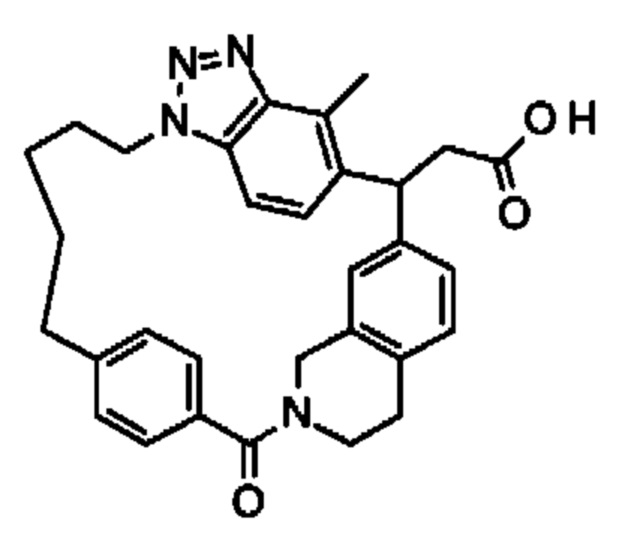
К раствору этил-[32-метил-20-оксо-8,9,10,21-тетраазагексацикло[19.5.3. 216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]ацетата (хиральный, короткое время удерживания) (1,23 г) в тетрагидрофуране (12 мл) и этаноле (6 мл) добавляли 1 н. водный раствор гидроксида натрия (11,5 мл) и перемешивали реакционную смесь при комнатной температуре в течение 6 часов. Реакционный раствор концентрировали для удаления органических растворителей. Затем раствор разбавляли водой, и затем доводили до слабокислой среды (рН 4-7) с помощью 1 н. хлористоводородной кислоты при 0°С. Осадок отфильтровывали и промывали водой с получением указанного в заголовке соединения (1 г).
1H ЯМР (300 МГц, ДМСО-d6) δ 0,70-1,12 (2Н, м), 1,30-1,66 (2Н, м), 1,80-2,21 (2Н, м), 2,50 (5Н, шс), 2,75-2,88 (2Н, м), 2,91-3,18 (2Н, м), 3,57-4,20 (4Н, м), 4,55-4,89 (3Н, м), 5,89 (1Н, с), 6,80-6,94 (4Н, м), 7,14 (1Н, шд, J=7,0 Гц), 7,27-7,45 (2Н, м), 7,60 (1Н, д, J=9,1 Гц), 12,25 (1Н, с).
Условия анализа. Время удерживания: 19,0 минуты (колонка: DAICEL CHIRAEPAK IB N-5 (5 мкм), 250 × 4,6 мм внутр. диам., подвижная фаза: А/В=82,5/17,5, А = гексан (0,1% трифторуксусной кислоты), В = этанол (0,1% трифторуксусной кислоты), температура измерения: комнатная температура, скорость потока: 2,0 мл/мин., детекция: УФ 220 нм и 254 нм, концентрация образца: 0,5 мг/мл, объем ввода: 0,01 мл).
[0135] Пример 12
[32-Метил-20-оксо-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]уксусная кисло
<Хиральная, синтез из хирального этил-[32-метил-20-оксо-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]ацетата (продолжительное время удерживания)>
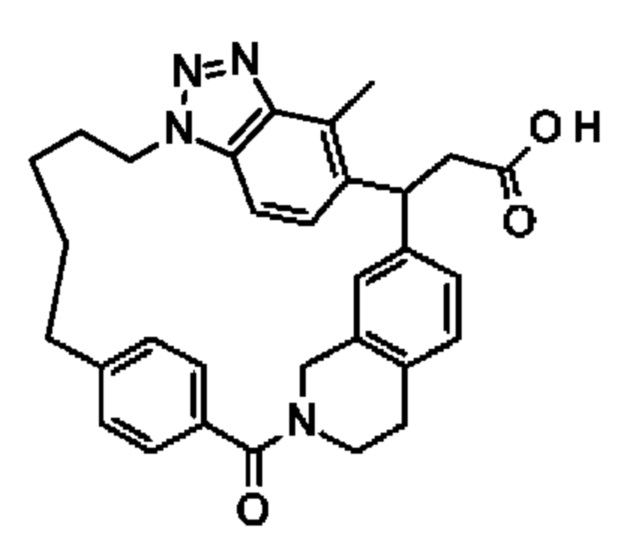
К раствору этил-[32-метил-20-оксо-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]ацетата (хиральный, продолжительное время удерживания) (1,22 г) в тетрагидрофуране (12 мл) и этаноле (6 мл), добавляли 1 М водный раствор гидроксида натрия (11 мл) и перемешивали реакционную смесь при комнатной температуре в течение 6 часов. Реакционный раствор концентрировали для удаления органических растворителей. Затем раствор разбавляли водой и доводили до слабокислой среды (рН 4-7) с помощью 1 н. хлористоводородной кислоты при 0°С. Осадок отфильтровывали и промывали водой с получением указанного в заголовке соединения (1,12 г).
1Н ЯМР (300 МГц, ДМСО-d6) δ 0,72-1,09 (2Н, м), 1,38-1,64 (2Н, м), 1,71-2,25 (2Н, м), 2,42-2,63 (5Н, м), 2,83 (2Н, шт, J=6,1 Гц), 2,92-3,20 (2Н, м), 3,67 (1Н, дт, J=13,0, 6,4 Гц), 3,81-4,24 (3Н, м), 4,42-5,07 (3Н, м), 5,89 (1Н, с), 6,77-6,98 (4Н, м), 7,14 (1Н, д, J=7,9 Гц), 7,28-7,47 (2Н, м), 7,61 (1Н, д, J=8,6 Гц), 12,21 (1Н, шс).
Условия анализа. Время удерживания: 29,9 минуты (колонка: DAICEL CHIRALPAK IB N-5 (5 мкм), 250 × 4,6 мм внутр. диам., подвижная фаза: А/В=82,5/17,5, А = гексан (0,1% трифторуксусной кислоты), В = этанол (0,1% трифторуксусной кислоты), температура измерения: комнатная температура, скорость потока: 2,0 мл/мин., детекция: УФ 220 нм и 254 нм, концентрация образца: 0,5 мг/мл, объем ввода: 0,01 мл).
[0136] Пример 13
[31-Метил-19-оксо-8,9,10,20-тетраазагексацикло[18.5.3.215,18.13,7.06,10.023,27]гентриаконта-1(25),3(31),4,6,8,15,17,23,26,29-декаен-2-ил]уксусная кислота
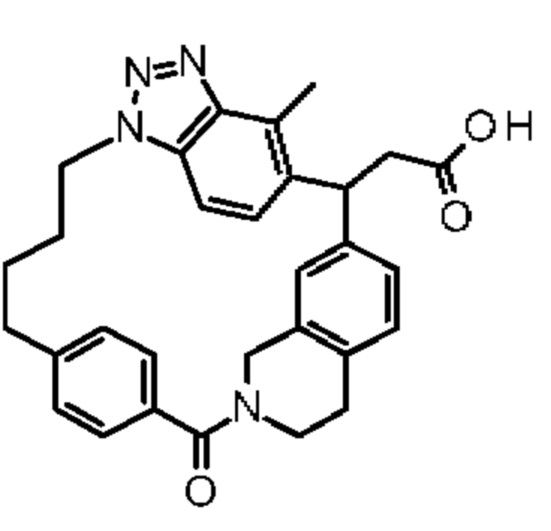
Синтез осуществляли в соответствии со способами, описанными в примере 9, или способами, эквивалентными им.
Пример 14
[(13Z)-33-Метил-21-оксо-8,9,10,22-тетраазагексацикло[20.5.3.217,20.13,7.06,10.025,29]тритриаконта-1(27),3(33),4,6,8,13,17,19,25,28,31-ундекаен-2-ил]уксусная кислота
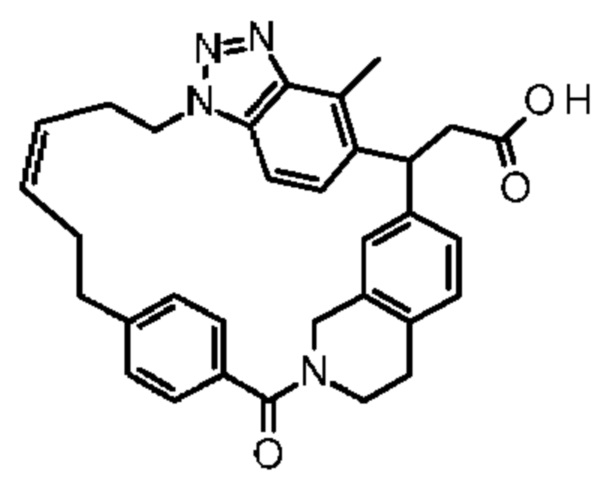
А) трет-Бутилбут-3-ен-1-ил(3-метил-2-нитрофенил)карбамат
К раствору трет-бутил-N-(3-метил-2-нитрофенил)карбамата (7 г) в N,N-диметилформамиде (70 мл) добавляли гидрид натрия (50%, 1,33 г) при 0°С. После перемешивания реакционной смеси при 0°С в течение 20 минут добавляли 4-бром-1-бутен (3,75 г) при 0°С. После перемешивания смеси при комнатной температуре в течение 4 часов добавляли дополнительное количество 4-бром-1-бутена (3,75 г) при 0°С. Реакционную смесь перемешивали при 60°С в течение ночи. К полученной смеси добавляли насыщенный водный раствор хлорида аммония при 0°С и экстрагировали смесь этилацетатом. Отделяли органический слой и промывали водой и насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (4,33 г). 1H ЯМР (300 МГц, ДМСО-d6) δ 1,27 (9Н, шс), 2,14-2,38 (5Н, с), 3,25-3,85 (2Н, м), 4,92-5,19 (2Н, м), 5,65-5,87 (1Н, м), 7,29-7,48 (2Н, м), 7,49-7,60 (1Н, м).
В) 4-Бром-N-(бут-3-ен-1-ил)-3-метил-2-нитроанилин
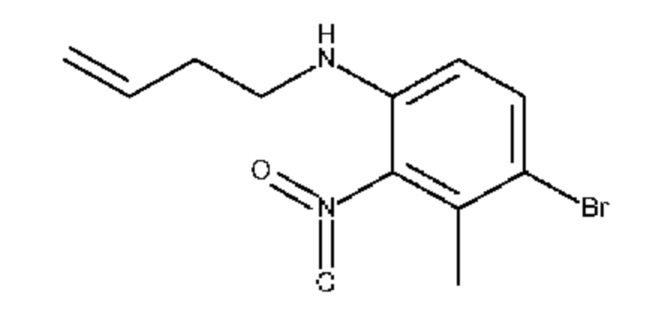
К смеси трет-бутилбут-3-ен-1-ил-(3-метил-2-нитрофенил)карбамата (4,33 г) в этилацетате (10 мл) добавляли 4 н. раствор HCl в этилацетате (40 мл) при 0°С. Перемешивали смесь при 0°С в течение 20 минут, перемешивали при комнатной температуре в течение ночи и затем концентрировали. К полученному остатку добавляли насыщенный водный раствор бикарбоната натрия и экстрагировали смесь этилацетатом. Отделяли органический слой и промывали насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. К раствору полученного остатка в N,N-диметилформамиде (25 мл) добавляли N-бромсукцинимид (2,5 г) при 0°С. После перемешивания реакционного раствора при комнатной температуре в течение ночи в него добавляли воду при 0°С и экстрагировали смесь этилацетатом. Отделяли органический слой и промывали водой и насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (3,38 г). 1H ЯМР (300 МГц, ДМСО-d6) δ 2,18-2,36 (5Н, м), 3,20 (2Н, к, J=6,6 Гц), 4,92-5,16 (2Н, м), 5,81 (1Н, ддт, J=17,1, 10,3, 6,6 Гц), 6,09 (1Н, шт, J=5,3 Гц), 6,76 (1Н, д, J=9,1 Гц), 7,55 (1Н, д, J=9,1 Гц). МС m/z 285,0 [М+Н]+.
[0137]
С) Этил-(2Е)-3-[1-(бут-3-ен-1-ил)-4-метил-1Н-бензотриазол-5-ил]проп-2-еноат
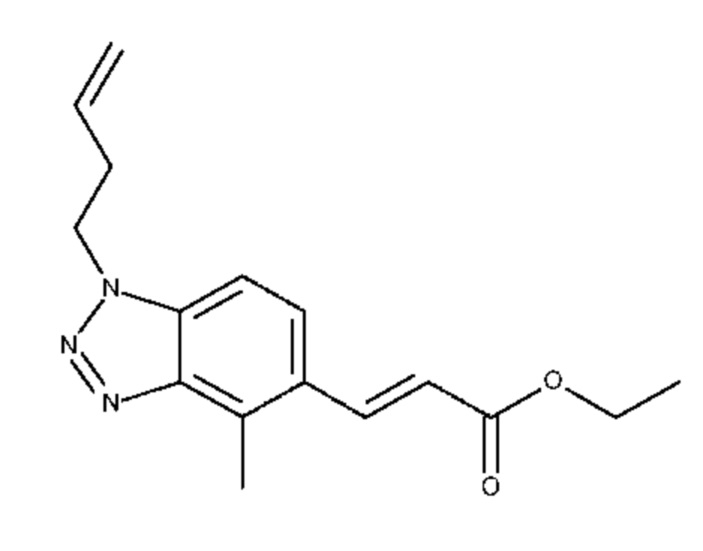
К смеси 4-бром-N-(бут-3-ен-1-ил)-3-метил-2-нитроанилина (3,18 г) в этаноле (40 мл) добавляли дигидрат хлорида олова (2,53 г). После перемешивания смеси при 90°С в течение 3 часов добавляли дополнительное количество дигидрата хлорида олова (2,53 г). Реакционную смесь перемешивали при 90°С в течение 3 часов и затем концентрировали. К полученному остатку добавляли лед. Затем к смеси добавляли 1 М гидроксид натрия для нейтрализации и затем экстрагировали смесь этилацетатом. Отделяли органический слой и промывали насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан).
К смеси полученного остатка (1,6 г) в 6 М хлористоводородной кислоте (16 мл) медленно добавляли раствор нитрита натрия (865 мг) в воде (2 мл) при 0°С. Перемешивали смесь при комнатной температуре в течение ночи. К реакционному раствору добавляли 2 М водный раствор гидроксида натрия и экстрагировали смесь этилацетатом. Раствор с экстрактом промывали насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением бензотриазольного производного (1,23 г). К раствору полученного бензотриазольного производного (1,23 г), этилакрилата (2,78 г), N,N-диизопропилэтиламина (2,39 г) и три(о-толил)фосфина (422 мг) в N,N-диметилформамиде (20 мл) добавляли ацетат палладия (156 мг) и перемешивали реакционную смесь при 120°С в течение 4 часов под микроволновым излучением. После охлаждения реакционной смеси до комнатной температуры в нее добавляли воду и этилацетат и отфильтровывали нерастворимое вещество. К фильтрату добавляли воду и экстрагировали смесь этилацетатом. Раствор с экстрактом промывали водой и насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (490 мг).
1Н ЯМР (300 МГц, ДМСО-d6) δ 1,28 (3Н, т, J=7,1 Гц), 2,68 (2Н, к, J=6,7 Гц), 2,80 (3Н, с), 4,22 (2Н, к, J=7,1 Гц), 4,78 (2Н, т, J=6,8 Гц), 4,89-5,09 (2Н, м), 5,79 (1Н, ддт, J=17,1, 10,1, 6,8 Гц), 6,65 (1Н, д, J=15,9 Гц), 7,74 (1Н, д, J=8,7 Гц), 7,90-8,09 (2Н, м). MC m/z 286,2 [М+Н]+.
О) Этил-[(13Z)-33-метил-21-оксо-8,9,10,22-тетраазагексацикло[20.5.3.217,20.13.7.06.10.025.29]тритриаконта-1(27),3(33),4,6,8,13,17,19,25,28,31-ундекаен-2-ил]ацетат
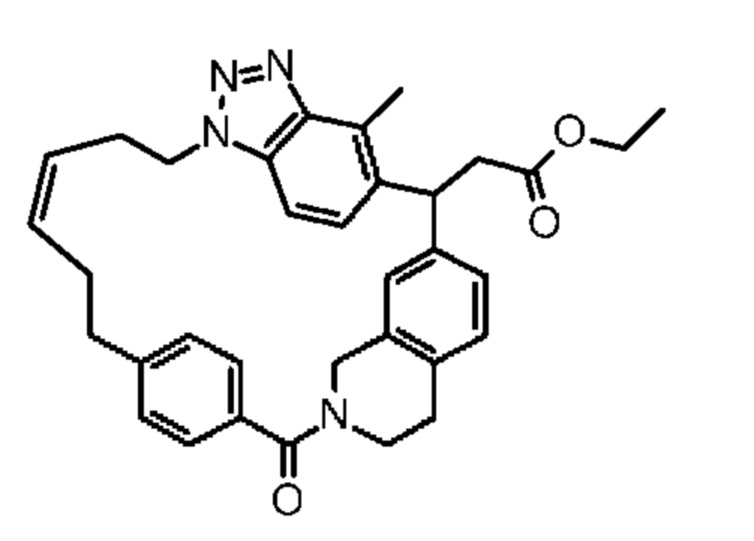
Синтез осуществляли, используя этил-(2Е)-3-[1-(бут-3-ен-1-ил)-4-метил-1Н-бензотриазол-5-ил]проп-2-еноат, в соответствии со способами, описанными в примере 9, или способами, эквивалентными им.
Е) [(13Z)-33-Метил-21-оксо-8,9,10,22-тетраазагексацикло[20.5.3. 217,20.13.7.06.10.025.29]тритриаконта-1(27),3(33),4,6,8,13,17,19,25,28,31-ундекаен-2-ил]уксусная кислота
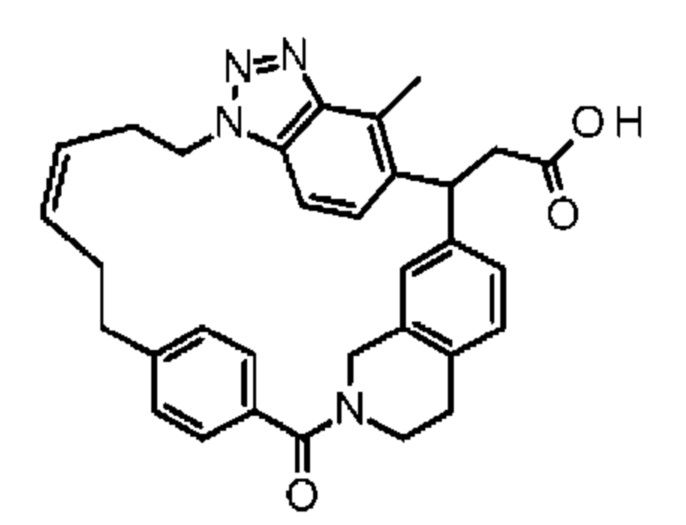
К раствору этил-[(13Z)-33-метил-21-оксо-8,9,10,22-тетраазагексацикло[20.5.3.217,20.13,7.06,10.025,29]тритриаконта-1(27),3(33),4,6,8,13,17,19,25,28,31-ундекаен-2-ил]ацетата (40 мг) в тетрагидрофуране (1 мл) и этаноле (1 мл) добавляли 2 М водный раствор гидроксида натрия (2 мл) и перемешивали реакционную смесь при комнатной температуре в течение ночи. Реакционный раствор концентрировали для удаления органических растворителей и затем нейтрализовали 1 н. хлористоводородной кислотой при 0°С. Осадок отфильтровывали и промывали водой с получением указанного в заголовке соединения (30 мг).
[0138] Пример 15
[33-Метил-21-оксо-8,9,10,22-тетраазагексацикло[20.5.3.217,20.13,7.06,10.025,29]тритриаконта-1(27),3(33),4,6,8,17,19,25,28,31-декаен-2-ил]уксусная кислота
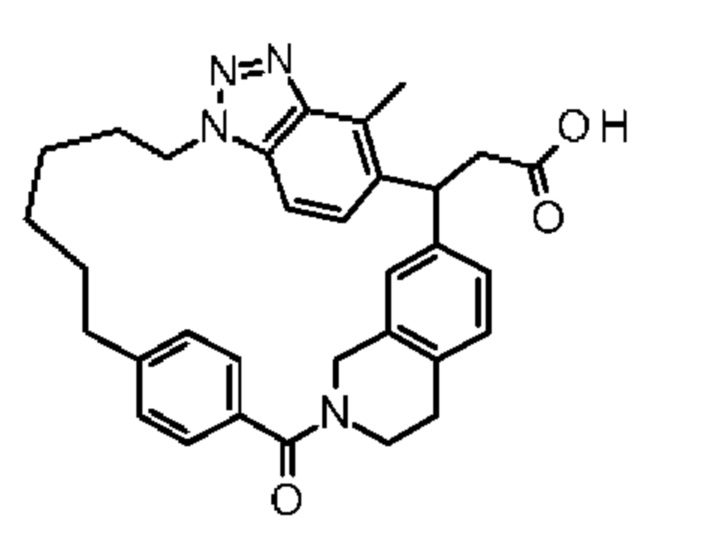
Синтез осуществляли в соответствии со способами, описанными в примере 9 или 14, или способами, эквивалентными им.
[0139] Пример 16
[32-Метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]уксусная кислота
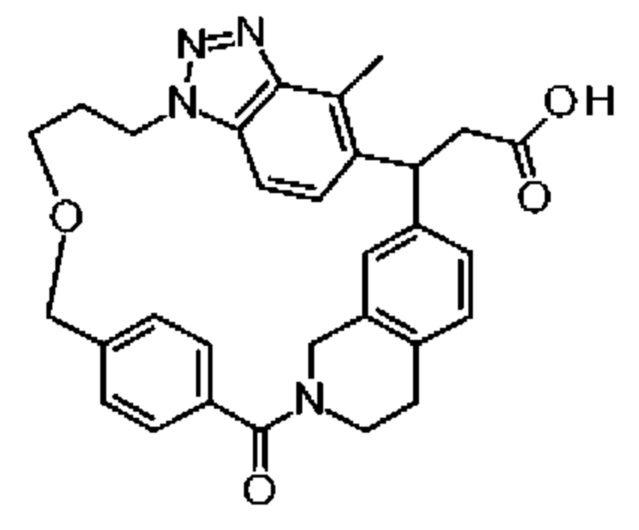
А) 3-(4-Бром-3-метил-2-нитроанилино)пропан-1-ол
К раствору 1-бром-4-фтор-2-метил-3-нитробензола (2 г) в N,N-диметилформамиде (15 мл) добавляли карбонат калия (2,36 г) и 3-амино-1-пропанол (0,83 г) при комнатной температуре и перемешивали реакционную смесь при 80°С в течение ночи. К смеси добавляли воду (80 мл) при 0°С. Осадок отделяли фильтрованием и затем промывали водой с получением указанного в заголовке соединения (2,4 г).
1Н ЯМР (300 МГц, ДМСО-d6) δ 1,67 (2Н, квинтет, J=6,3 Гц), 2,25 (3Н, с), 3,19 (2Н, к, J=6,1 Гц), 3,47 (2Н, к, J=5,5 Гц), 4,59 (1Н, т, J=4,9 Гц), 6,08-6,35 (1Н, м), 6,74 (1Н, д, J=9,2 Гц), 7,54 (1Н, д, J=9,1 Гц).
В) 3-(2-Амино-4-бром-3-метиланилино)пропан-1-ол
Смесь 3-(4-бром-3-метил-2-нитроанилино)пропан-1-ола (7,53 г), хлорида аммония (13,9 г), железа (7,27 г), этанола (54 мл) и воды (20 мл) перемешивали при 85°С в течение ночи. Смесь фильтровали и концентрировали фильтрат. К полученной смеси добавляли насыщенный водный раствор бикарбоната натрия и экстрагировали смесь этилацетатом. Раствор с экстрактом промывали насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Остаток промывали этилацетатом с получением указанного в заголовке соединения. Промывочную жидкость концентрировали и очищали полученный остаток колоночной хроматографией на силикагеле (этилацетат/гексан) с получением дополнительного количества указанного в заголовке соединения. В общей сложности получали 4,8 г указанного в заголовке соединения.
1H ЯМР (300 МГц, ДМСО-d6) δ 1,73 (2Н, квинтет, J=6,6 Гц), 2,16 (3Н, с), 3,04 (2Н, к, J=6,5 Гц), 3,51 (2Н, к, J=5,6 Гц), 4,40-4,67 (4Н, м), 6,25 (1Н, д, J=8,6 Гц), 6,71 (1Н, д, J=8,5 Гц).
[0140]
C) 3-(5-Бром-4-метил-1Н-бензотриазол- 1-ил)пропан-1-ол
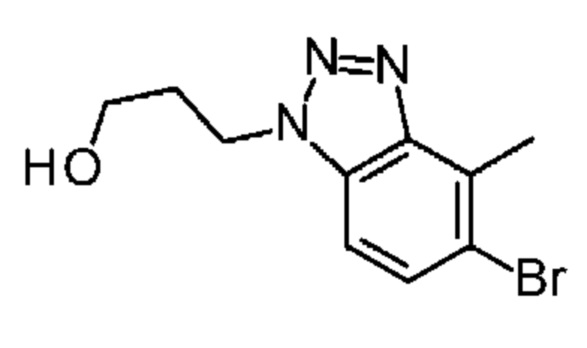
К смеси 3-(2-амино-4-бром-3-метиланилино)пропан-1-ола (4,8 г) в 6 н. хлористоводородной кислоте (45 мл) медленно добавляли раствор нитрита натрия (2,56 г) в воде (10 мл) при 0°С. Перемешивали смесь при комнатной температуре в течение 2 часов. К реакционному раствору добавляли 4 и. водный раствор гидроксида натрия при 0°С для нейтрализации и экстрагировали смесь этилацетатом. Раствор с экстрактом промывали насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (4 г).
1Н ЯМР (300 МГц, ДМСО-d6) δ 2,04 (2Н, квинтет, J=6,4 Гц), 2,72 (3Н, с), 3,39 (2Н, к, J=5,5 Гц), 4,67 (1Н, шт, J=4,7 Гц), 4,74 (2Н, т, J=6,9 Гц), 7,69 (2Н, с).
МС m/z 270,1 [М+Н]+.
D) трет-Бутил-4-{[3-(5-бром-4-метил-1Н-бензотриазол-1-ил)пропокси]метил}бензоат
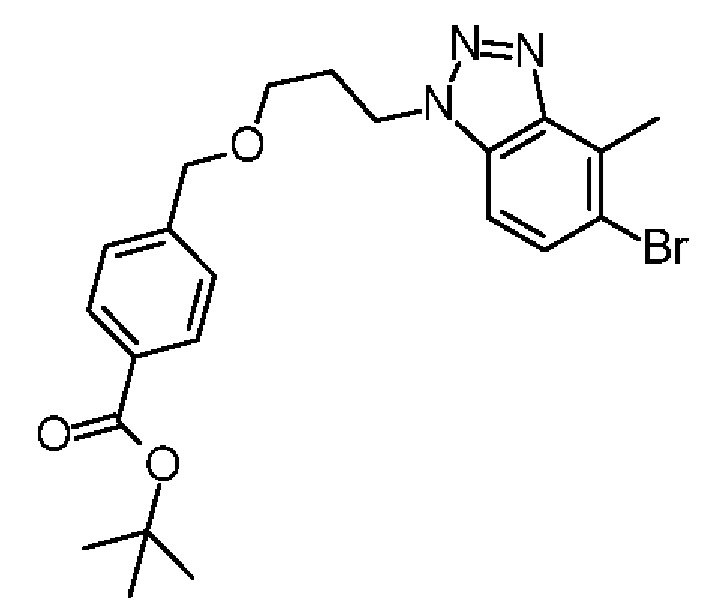
К раствору 3-(5-бром-4-метил-1Н-бензотриазол-1-ил)пропан-1-ола (6,55 г) в N,N-диметилформамиде (100 мл) добавляли гидрид натрия (в масле, 50%, 1,51 г) при 0°С в атмосфере азота. После перемешивания реакционной смеси при 0°С в течение 30 минут добавляли трет-бутил-4-(бромметил)бензоат (7,23 г) при 0°С. После перемешивания смеси при комнатной температуре в течение 2 часов в нее добавляли насыщенный водный раствор хлорида аммония и экстрагировали смесь этилацетатом. Отделяли органический слой и промывали насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (8,61 г).
1H ЯМР (300 МГц, ДМСО-d6) δ 1,55 (9Н, с), 2,21 (2Н, квинтет, J=6,1 Гц), 2,69 (3Н, с), 3,43 (2Н, шт, J=5,6 Гц), 4,43 (2Н, с), 4,79 (2Н, т, J=6,5 Гц), 7,26 (2Н, шд, J=7,8 Гц), 7,66 (2Н, с), 7,81 (2Н, д, J=7,8 Гц).
МС m/z 460,2 [М+Н]+.
Е) трет-Бутил-4-[(3-{5-[(1Е)-3-этокси-3-оксопроп-1-ен-1-ил]-4-метил-1Н-бензотриазол-1-ил}пропокси)метил]бензоат
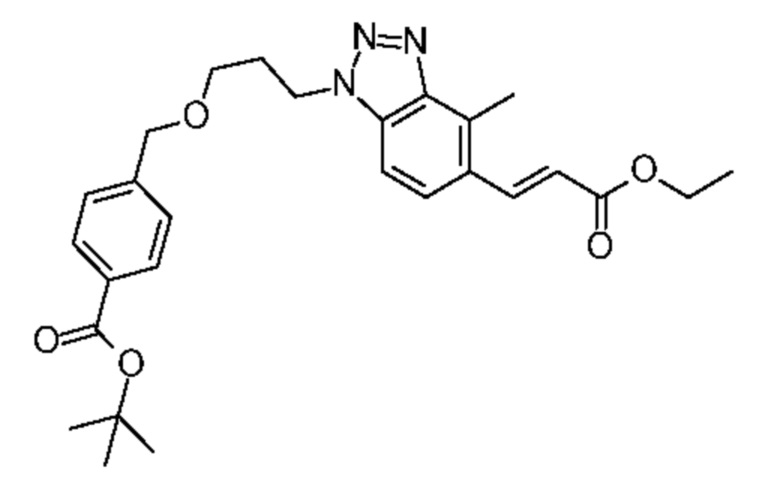
К раствору трет-бутил-4-{[3-(5-бром-4-метил-1Н-бензотриазол-1-ил)пропокси]метил}бензоата (9 г), этилакрилата (11,7 г) и N,N-диизопропилэтиламина (13,5 мл) в N,N-диметилформамиде (200 мл) добавляли три(о-толил)фосфин (1,79 г) и ацетат палладия (658 мг) и перемешивали реакционную смесь при 120°С в течение 4 часов в атмосфере аргона. Реакционную смесь концентрировали, добавляли в нее воду и экстрагировали смесь этилацетатом. Раствор с экстрактом промывали водой и насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (7,9 г).
1H ЯМР (300 МГц, ДМСО-d6) δ 1,28 (3Н, т, J=7,2 Гц), 1,54 (9Н, с), 2,10-2,32 (2Н, м), 2,79 (3Н, с), 3,43 (2Н, шт, J=5,5 Гц), 4,22 (2Н, к, J=7,0 Гц), 4,44 (2Н, с), 4,79 (2Н, шт, J=6,4 Гц), 6,64 (1H, д, J=15,8 Гц), 7,28 (2Н, д, J=7,9 Гц), 7,59-7,84 (3Н, м), 7,87-8,14 (2Н, м).
[0141]
F) трет-Бутил-7-{1-[1-(3-{[4-(трет-бутоксикарбонил)фенил]метокси}пропил)-4-метил-1Н-бензотриазол-5-ил]-3-этокси-3-оксопропил}-3,4-дигидроизохинолин-2(1Н)-карбоксилат
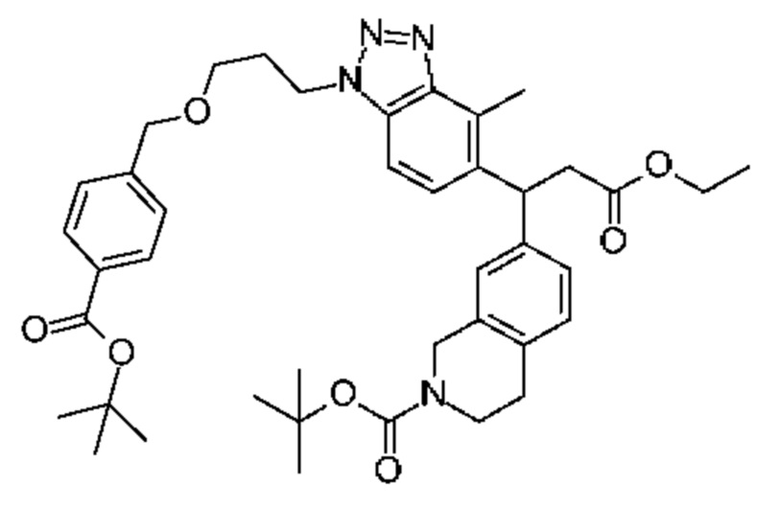
К смеси трет-бутил-4-[(3-{5-[(1Е)-3-этокси-3-оксопроп-1-ен-1-ил]-4-метил-1Н-бензотриазол-1-ил}пропокси)метил]бензоата (6,88 г), трет-бутил-7-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-3,4-дигидро-1Н-изохинолин-2-карбоксилата (15,5 г), додецилсульфата натрия (2,07 г), триэтиламина (6 мл), СРМЕ (200 мл) и воды (100 мл) добавляли димер хлор(1,5-циклооктадиен)родия (I) (707 мг) при комнатной температуре. Перемешивали смесь при 100°С в течение 3 часов в атмосфере аргона. К полученной смеси добавляли насыщенный водный раствор хлорида аммония и экстрагировали смесь этилацетатом. Раствор с экстрактом промывали насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (10,2 г).
1H ЯМР (300 МГц, ДМСО-d6) δ 1,00 (3Н, т, J=7,0 Гц), 1,40 (9Н, с), 1,54 (9Н, с), 2,06-2,32 (2Н, м), 2,63-2,72 (2Н, м), 2,77 (3Н, с), 3,06-3,20 (2Н, м), 3,37-3,55 (4Н, м), 3,92 (2Н, к, J=7,0 Гц), 4,36-4,50 (4Н, м), 4,73 (2Н, шт, J=6,3 Гц), 4,76-5,00 (1H, м), 6,99-7,20 (3Н, м), 7,33 (2Н, шд, J=7,7 Гц), 7,42-7,65 (2Н, м), 7,83 (2Н, д, J=7,7 Гц).
МС m/z 713,4 [М+Н]+.
G) Этил-[32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]ацетат
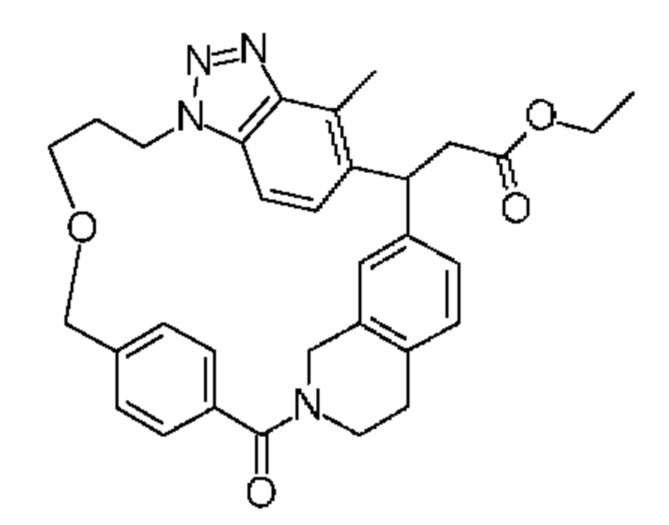
К раствору трет-бутил-7-{1-[1-(3-{[4-(трет-бутоксикарбонил)фенил]метокси}пропил)-4-метил-1Н-бензотриазол-5-ил]-3-этокси-3-оксопропил}-3,4-дигидроизохинолин-2(1Н)-карбоксилата (6,55 г) в СРМЕ (10 мл) добавляли 4 н. раствор HCl в СРМЕ (69 мл) при комнатной температуре. Перемешивали смесь при комнатной температуре в течение 2 часов и затем концентрировали. К полученной смеси добавляли тетрагидрофуран и концентрировали смесь. К раствору полученного остатка в N,N-диметилформамиде (50 мл) добавляли N,N-диизопропилэтиламин (8,35 мл) при 0°С. Полученный раствор медленно, по каплям добавляли к раствору HATU (4,55 г) в N,N-диметилформамиде (350 мл) при комнатной температуре. Перемешивали смесь при комнатной температуре в течение 3 часов. К полученной смеси добавляли насыщенный водный раствор бикарбоната натрия и экстрагировали смесь этилацетатом. Раствор с экстрактом промывали водой и насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (3,35 г).
1H ЯМР (300 МГц, ДМСО-d6) δ 1,05 (3Н, т, J=7,1 Гц), 2,35 (2Н, шс), 2,55 (3Н, с), 2,90 (2Н, шт, J=6,4 Гц), 3,02-3,48 (4Н, м), 3,79 (2Н, шт, J=6,6 Гц), 3,85-4,09 (4Н, м), 4,18-4,50 (2Н, м), 4,67-5,06 (3Н, м), 6,08 (1H, с), 6,59-6,87 (4Н, м), 7,20 (1H, д, J=7,7 Гц), 7,38 (2Н, шд, J=8,1 Гц), 7,66 (1H, д, J=8,7 Гц). МС m/z 539,3 [М+Н]+.
[0142]
Н) [32-Метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]уксусная кислота
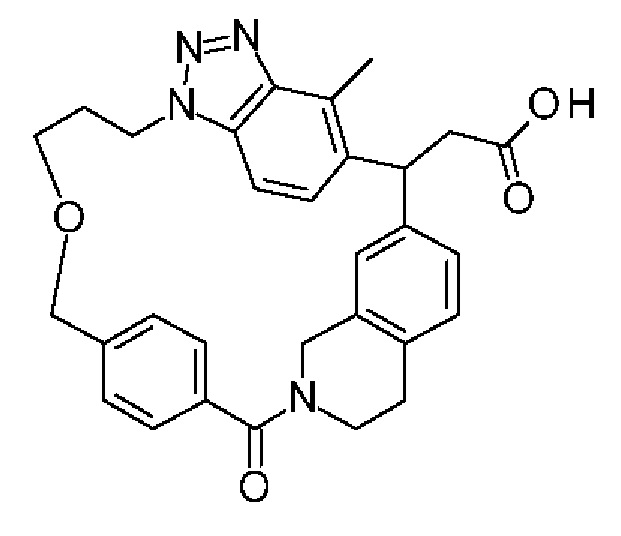
К раствору этил-[32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]ацетата (19 мг) в тетрагидрофуране (0,5 мл) и этаноле (0,5 мл) добавляли 2 н. водный раствор гидроксида натрия (0,5 мл) и перемешивали реакционную смесь при комнатной температуре в течение 5 часов. Реакционный раствор нейтрализовали 2 и. хлористоводородной кислотой и затем концентрировали. Остаток очищали препаративной ВЭЖХ (YMC-Actus Triart C18, подвижная фаза: 10 мМ водный раствор бикарбоната аммония/ацетонитрил) с получением указанного в заголовке соединения (11 мг).
1Н ЯМР (300 МГц, CDCl3) δ 2,34-2,60 (2Н, м), 2,68 (3Н, с), 2,88-3,08 (3Н, м), 3,12-3,27 (1H, м), 3,30-3,53 (2Н, м), 3,69-3,88 (1Н, м), 3,97-4,15 (3Н, м), 4,25 (1H, д, J=13,2 Гц), 4,52 (1H, д, J=12,7 Гц), 4,61-4,83 (2Н, м), 4,85-4,98 (1H, м), 6,04 (1H, с), 6,70-6,80 (2Н, м), 6,88 (2Н, д, J=8,2 Гц), 7,10-7,25 (2Н, м), 7,35 (2Н, шт, J=9,2 Гц).
[0143]
Пример 17
[18,32-Диметил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]уксусная кислота
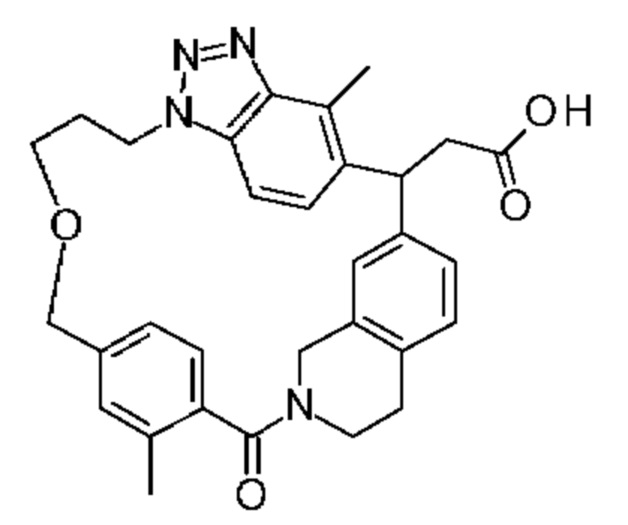
Синтез осуществляли в соответствии со способами, описанными в примере 16, или способами, эквивалентными им.
[0144]
Пример 18
[18-Этил-32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]уксусная кислота
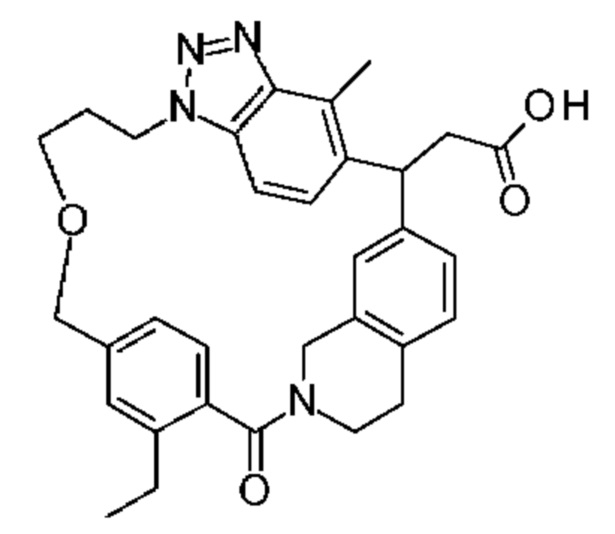
А) 3-Этил-4-гидроксибензальдегид
К смеси 3-бром-4-гидроксибензальдегида (10,0 г), [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия (II) (3,64 г), карбоната цезия (48,6 г) и тетрагидрофурана (150 мл) добавляли 1 М раствор триэтилборана в гексане (100 мл). Реакционную смесь деаэрировали, несколько раз понижая давление и продувая азотом, и затем перемешивали при 70°С в течение ночи. Реакционную смесь концентрировали при пониженном давлении и добавляли к остатку воду и этилацетат. После удаления нерастворимого вещества фильтрованием и промывания остатка этилацетатом фильтрат экстрагировали этилацетатом. Раствор с экстрактом промывали насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (3,71 г). МС m/z 151,1 [М+Н]+.
B) 2-Этил-4-формилфенилтрифторметансульфонат
К смеси 3-этил-4-гидроксибензальдегида (2,10 г), N,N-диизопропилэтиламина (4,89 мл), 4-диметиламинопиридина (0,171 г) и тетрагидрофурана (25 мл) добавляли N-фенилбис(трифторметансульфонимид) (5,00 г) и перемешивали реакционную смесь при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и этилацетат и затем экстрагировали смесь этилацетатом. Раствор с экстрактом промывали насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (3,22 г).
1H ЯМР (300 МГц, ДМСО-d6) δ 1,25 (3Н, т, J=7,6 Гц), 2,78 (2Н, к, J=7,6 Гц), 7,64 (1H, д, J=8,5 Гц), 7,95 (1H, шд, J=8,6 Гц), 8,07 (1H, с), 10,05 (1H, с).
C) Этил-2-этил-4-формилбензоат
Смесь 2-этил-4-формилфенилтрифторметансульфоната (3,22 г), [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладия (II) (0,835 г), триэтиламина (1,59 мл), этанола (30 мл) и ДМФА (30 мл) перемешивали в течение ночи при кипении с обратным холодильником и в атмосфере монооксида углерода. Затем к реакционной смеси добавляли воду и этилацетат. После удаления нерастворимого вещества фильтрованием и промывания остатка этилацетатом фильтрат экстрагировали этилацетатом. Раствор с экстрактом промывали насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (0,577 г).
1Н ЯМР (300 МГц, ДМСО-d6) δ 1,20 (3Н, т, J=7,4 Гц), 1,33 (3Н, т, J=7,1 Гц), 2,94 (2Н, к, J=7,4 Гц), 4,34 (2Н, к, J=7,0 Гц), 7,80-7,86 (1H, м), 7,87-7,93 (2Н, м), 10,06 (1H, с).
[0145]
D) трет-Бутил-2-этил-4-формилбензоат
К смеси этил-2-этил-4-формилбензоата (577 мг), этанола (10,0 мл) и тетрагидрофурана (10,0 мл) добавляли 2 М водный раствор гидроксида натрия (5,00 мл) при комнатной температуре и перемешивали реакционную смесь при 50°С в течение ночи. Органические растворители удаляли при пониженном давлении, а затем нейтрализовали остаток 1 М хлористоводородной кислотой. Полученный осадок собирали фильтрованием и промывали водой с получением твердого вещества. К смеси полученного твердого вещества и толуола (10 мл) добавляли N,N-диметилформамид-ди-трет-бутилацеталь (2,22 мл) при 100°С и затем перемешивали реакционную смесь при 100°С в течение 1 часа. Добавляли дополнительное количество N,N-диметилформамид-ди-трет-бутилацеталя (2,22 мл), реакционную смесь перемешивали при 100°С в течение 2 часов и затем добавляли дополнительное количество N,N-диметилформамид-ди-трет-бутилацеталя (2,22 мл) при 100°С. Реакционную смесь перемешивали при 100°С в течение 30 минут и затем концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (420 мг).
1Н ЯМР (300 МГц, ДМСО-d6) δ 1,13-1,24 (3Н, м), 1,56 (13Н, д, J=2,0 Гц), 2,83-2,97 (2Н, м), 7,69-7,88 (3Н, м), 10,05 (1H, с).
E) трет-Бутил-2-этил-4-(гидроксиметил)бензоат
К смеси трет-бутил-2-этил-4-формилбензоата (420 мг) и метанола (10 мл) добавляли боргидрид натрия (102 мг) и перемешивали реакционную смесь при комнатной температуре в течение 1 часа. Добавляли дополнительное количество боргидрида натрия (33,9 мг) и перемешивали реакционную смесь при комнатной температуре в течение 1 часа, и затем концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (191 мг).
1H ЯМР (300 МГц, ДМСО-d6) δ 1,10-1,20 (3Н, м), 1,54 (9Н, с), 2,86 (2Н, к, J=7,4 Гц), 4,51 (2Н, д, J=5,6 Гц), 5,28 (1H, т, J=5,7 Гц), 7,17-7,26 (2Н, м), 7,63 (1H, д, J=7,9 Гц).
F) трет-Бутил-4-(бромметил)-2-этилбензоат
К смеси трет-бутил-2-этил-4-(гидроксиметил)бензоата (191 мг), трифенилфосфина (318 мг) и тетрагидрофурана (5 мл) добавляли тетрабромид углерода (402 мг) и перемешивали реакционную смесь при комнатной температуре в течение ночи. К реакционной смеси добавляли воду и экстрагировали смесь этилацетатом. Раствор с экстрактом промывали насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток дважды очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (178 мг).
1H ЯМР (300 МГц, ДМСО-d6) δ 1,15 (3Н, т, J=7,4 Гц), 1,54 (9Н, с), 2,84 (2Н, к, J=7,3 Гц), 4,70 (2Н, с), 7,31-7,41 (2Н, м), 7,64 (1H, д, J=7,7 Гц).
G) [18-Этил-32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]уксусная кислота
Синтез осуществляли, используя трет-бутил-4-(бромметил)-2-этилбензоат, в соответствии со способами, описанными в примере 16, или способами, эквивалентными им.
[0146]
Пример 19
[18-Циклопропил-32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]уксусная кислота
Синтез осуществляли, используя 3-циклопропил-4-гидроксибензальдегид, в соответствии со способами, описанными в примере 18, или способами, эквивалентными им.
[0147]
Пример 20
[32-Метил-20-оксо-18-(трифторметокси)-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]уксусная кислота
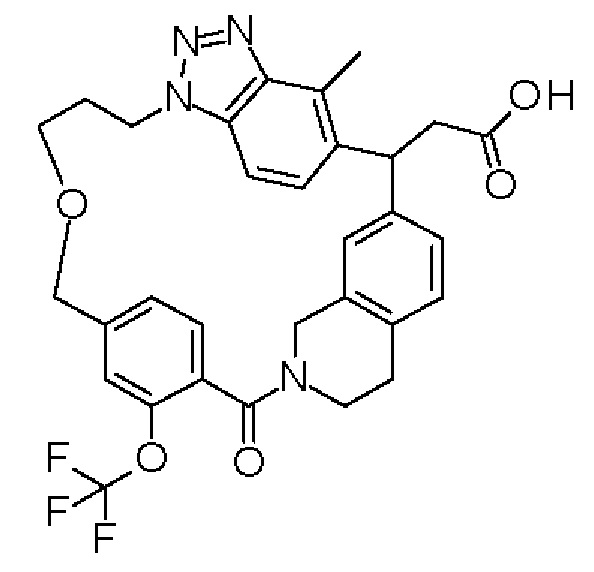
Синтез осуществляли в соответствии со способами, описанными в примере 16, или способами, эквивалентными им.
[0148]
Пример 21
[18-Фтор-32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]уксусная кислота
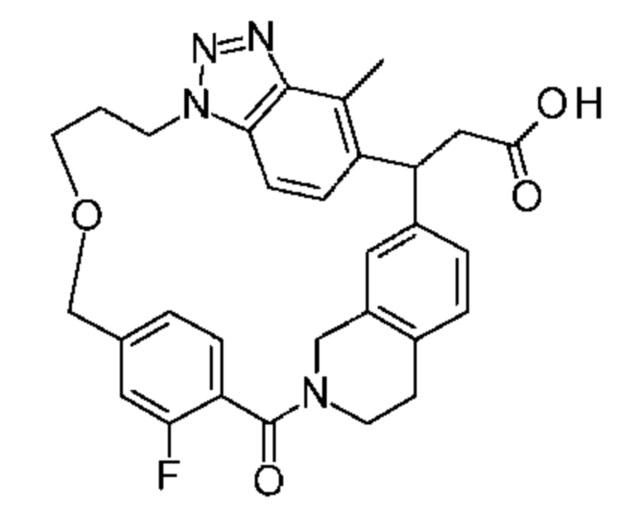
Синтез осуществляли в соответствии со способами, описанными в примере 16, или способами, эквивалентными им.
[0149]
Пример 22
[18-Метокси-32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]уксусная кислота
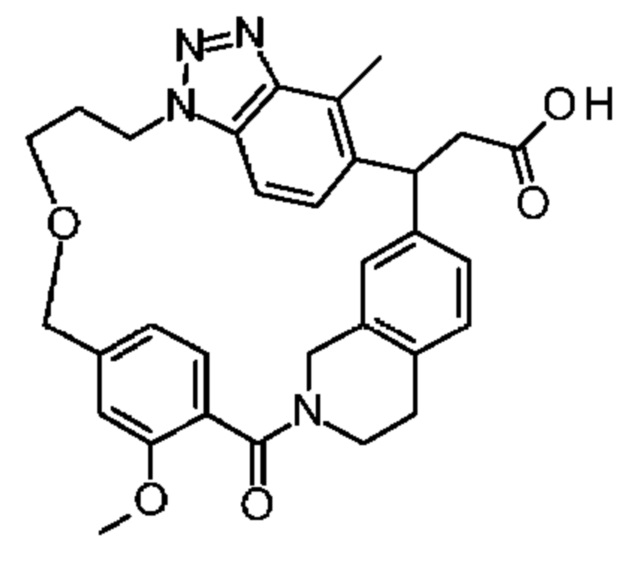
Синтез осуществляли в соответствии со способами, описанными в примере 16, или способами, эквивалентными им.
[0150]
Пример 23
[32-Метил-20-оксо-18-(трифторметил)-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]уксусная кислота
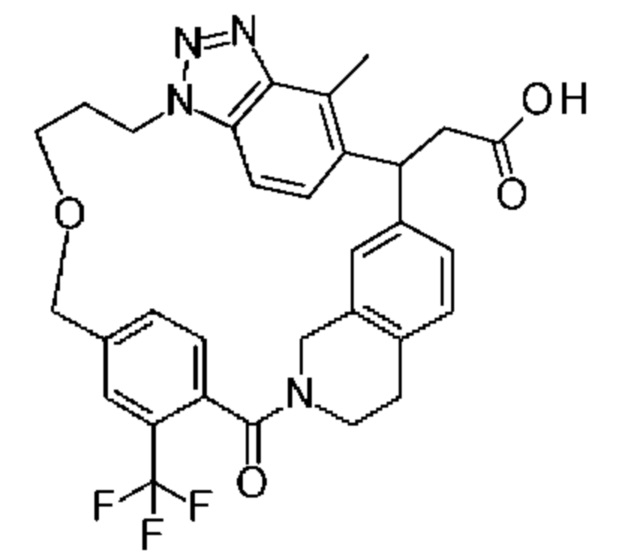
Синтез осуществляли в соответствии со способами, описанными в примере 16, или способами, эквивалентными им.
[0151]
Пример 24
[18-Хлор-32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]уксусная кислота
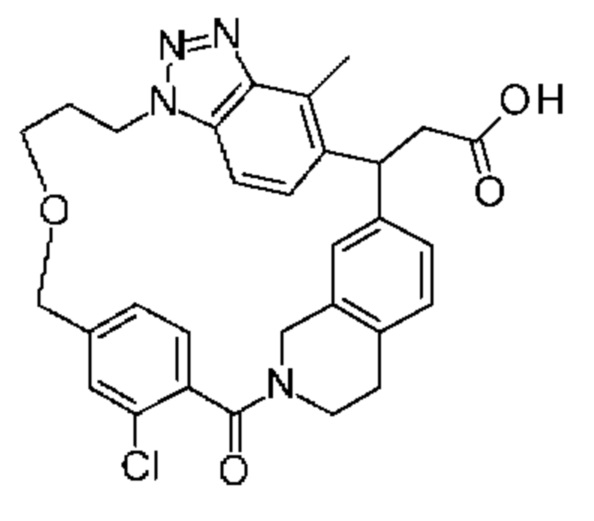
Синтез осуществляли в соответствии со способами, описанными в примере 16, или способами, эквивалентными им.
[0152]
Пример 25
[32-Метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]уксусная кислота <Синтез из хирального этил-[32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]ацетата (короткое время удерживания)>
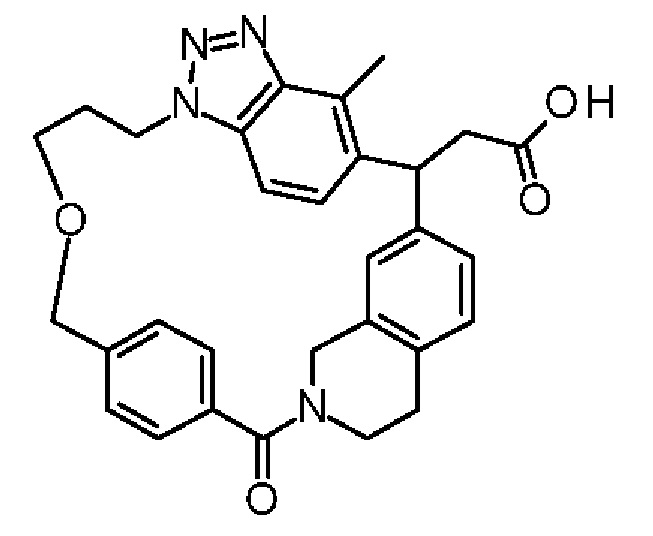
А) Этил-[32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]ацетат (хиральный, продолжительное время удерживания)
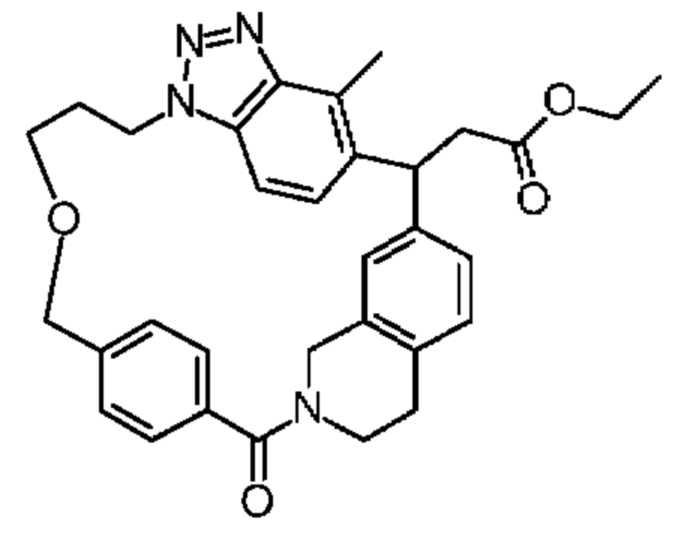
Рацемат этил-[32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]ацетата (3,2 г) фракционировали с помощью системы для препаративной сверхкритической СО2 хроматографии (колонка: Cellulose-C (5 мкм) 250×30 мм внутр.диам., подвижная фаза: диоксид углерода/метанол = 70/30). Полученную фракцию концентрировали при пониженном давлении с получением этил-[32-метил-20-оксо- 14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]ацетата (1,5 г) (хиральный, продолжительное время удерживания).
Условия анализа. Время удерживания: 5,706 минуты (колонка: Alcyon SFC CSP Cellulose-С (5 мкм), 250×4,6 мм внутр. диам., подвижная фаза: диоксид углерода/метанол = 70/30, скорость потока: 3,0 мл/мин., температура: 35°С, детекция: УФ 210 нм, концентрация образца: 1 мг/мл, объем ввода: 0,005 мл).
В) Этил-[32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]ацетат (хиральный, короткое время удерживания)
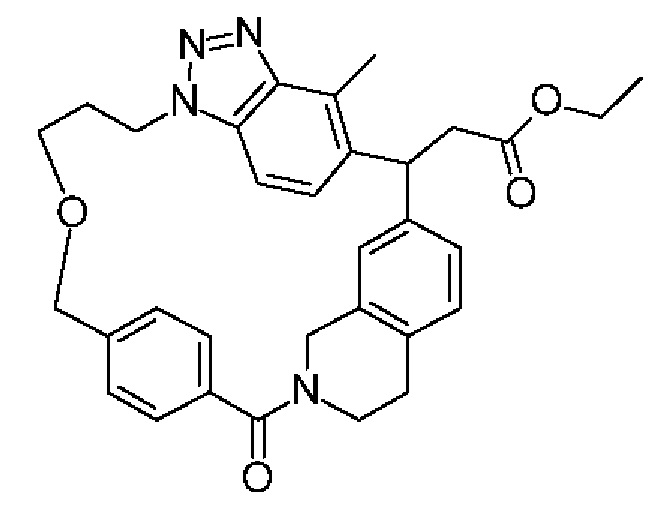
Рацемат этил-[32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]ацетата (3,2 г) фракционировали с помощью системы для препаративной сверхкритической СО2 хроматографии (колонка: Cellulose-C (5 мкм) 250×30 мм внутр. диам., подвижная фаза: диоксид углерода/метанол = 70/30). Полученную фракцию концентрировали при пониженном давлении с получением этил-[32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]ацетата (1,5 г) (хиральный, короткое время удерживания).
Условия анализа. Время удерживания: 4,465 минуты (колонка: Alcyon SFC CSP Cellulose-С (5 мкм), 250×4,6 мм внутр.диам., подвижная фаза: диоксид углерода/метанол = 70/30, скорость потока: 3,0 мл/мин., температура: 35°С, детекция: УФ 210 нм, концентрация образца: 1 мг/мл, объем ввода: 0,005 мл).
[0153]
С) [32-Метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]уксусная кислота
<Хиральная, синтез из хирального этил-[32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]ацетата (короткое время удерживания)>
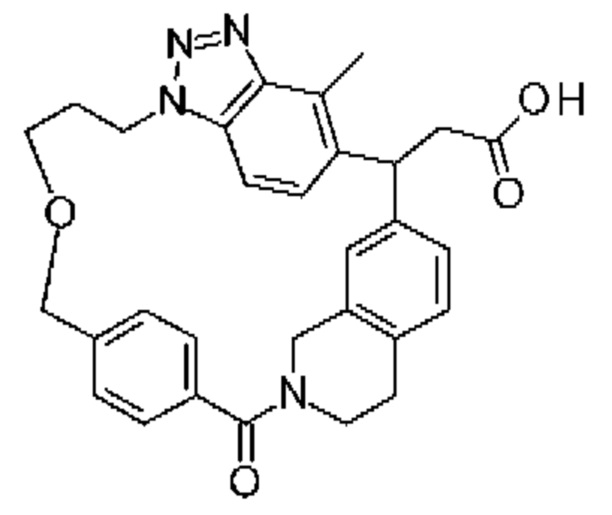
К раствору этил-[32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]ацетата (хиральный, короткое время удерживания) (1,5 г) в тетрагидрофуране (15 мл) и этаноле (7,5 мл) добавляли 1 н. водный раствор гидроксида натрия (14 мл) и перемешивали реакционную смесь при комнатной температуре в течение 6 часов. Органические растворители удаляли при пониженном давлении. После этого реакционную смесь разбавляли водой и затем подкисляли 1 н. хлористоводородной кислотой при 0°С.Осадок отделяли фильтрованием, промывали водой и перекристаллизовали из смеси этанола (50 мл) и воды (45 мл) с получением указанного в заголовке соединения (1,37 г).
1Н ЯМР (300 МГц, ДМСО-d6) δ 2,35 (2Н, шс), 2,54 (3Н, с), 2,90 (2Н, шт, J=6,5 Гц), 2,96-3,20 (2Н, м), 3,35-3,47 (2Н, м), 3,72-3,83 (2Н, м), 3,84-4,09 (2Н, м), 4,19-4,32 (1H, м), 4,36-4,46 (1H, м), 4,66-4,90 (3Н, м), 6,07 (1H, с), 6,66-6,85 (4Н, м), 7,20 (1H, д, J=8,1 Гц), 7,33-7,45 (2Н, м), 7,65 (1H, д, J=8,5 Гц), 11,86-12,62 (1H, м).
Условия анализа. Время удерживания: 22,3 минуты, колонка: DAICEL CHIRALPAK IB N-5 (5 мкм, 250×4,6 мм внутр.диам.), подвижная фаза: А/В=82,5/17,5, А = гексан (0,1% трифторуксусной кислоты), В = этанол (0,1% трифторуксусной кислоты), скорость потока: 2,0 мл/мин., детекция: УФ 220 нм и 254 нм, температура измерения: комнатная температура, концентрация образца: 0,5 мг/мл, объем ввода: 0,01 мл.
[0154]
Пример 26
[32-Метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]уксусная кислота
<Хиральная, синтез из хирального этил-[32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]ацетата (продолжительное время удерживания)>
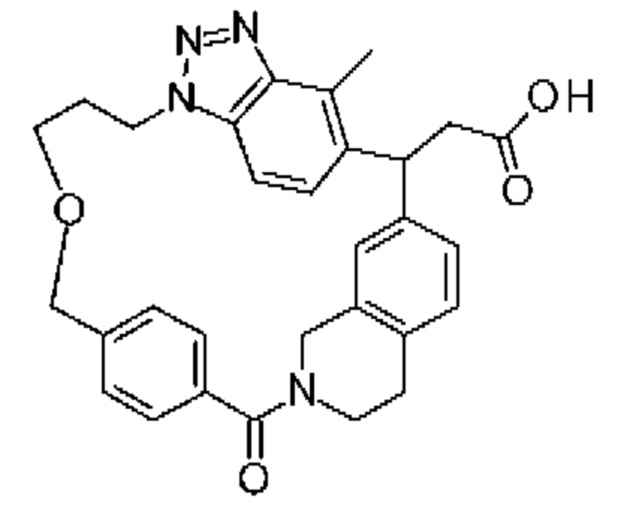
К раствору этил-[32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]ацетата (хиральный, продолжительное время удерживания) (1,5 г) в тетрагидрофуране (15 мл) и этаноле (7,5 мл) добавляли 1 М водный раствор гидроксида натрия (13,9 мл) и перемешивали реакционную смесь при комнатной температуре в течение ночи. Органические растворители удаляли при пониженном давлении. После этого реакционный раствор разбавляли водой и затем подкисляли 1 и. хлористоводородной кислотой при 0°С. Осадок отделяли фильтрованием и перекристаллизовали, используя этанол (38 мл) и воду (38 мл), с получением указанного в заголовке соединения (1,38 г).
1Н ЯМР (300 МГц, ДМСО-d6) δ 2,35-2,36 (2Н, м), 2,54 (3Н, с), 2,87-3,18 (4Н, м), 3,25-3,51 (2Н, м), 3,79 (2Н, шт, J=6,3 Гц), 3,85-4,09 (2Н, м), 4,20-4,52 (2Н, м), 4,71-4,91 (3Н, м), 6,07 (1H, с), 6,66-6,82 (4Н, м), 7,20 (1H, д, J=7,8 Гц), 7,34-7,44 (2Н, м), 7,65 (1H, д, J=8,3 Гц), 12,27 (1H, с).
Условия анализа. Время удерживания: 32,4 минуты, колонка: DAICEL CHIRALPAK IB N-5 (5 мкм, 250×4,6 мм внутр.диам.), подвижная фаза: А/В=82,5/17,5, А = гексан (0,1% трифторуксусной кислоты), В = этанол (0,1% трифторуксусной кислоты), скорость потока: 2,0 мл/мин., детекция: УФ 220 им и 254 им, температура измерения: комнатная температура, концентрация образца: 0,5 мг/мл, объем ввода: 0,01 мл.
[0155]
Пример 27
Этил-[32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]ацетат
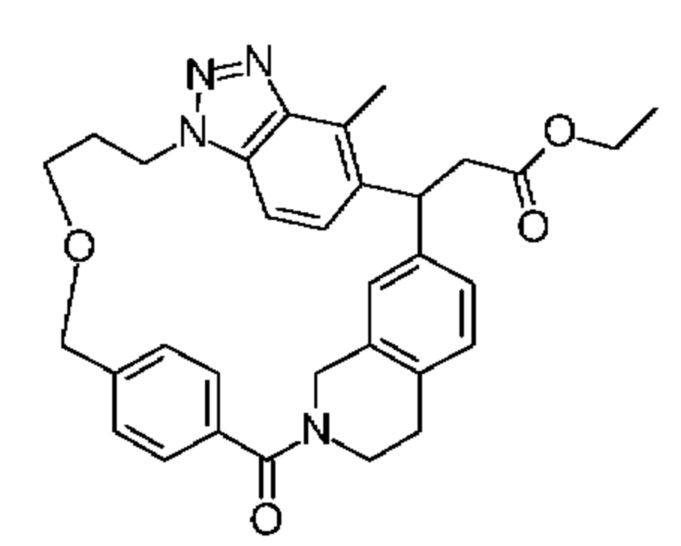
Синтез осуществляли в соответствии со способами, описанными в примере 16, или способами, эквивалентными им.
[0156]
Пример 28
2-Метил-2-[32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]пропановая кислота
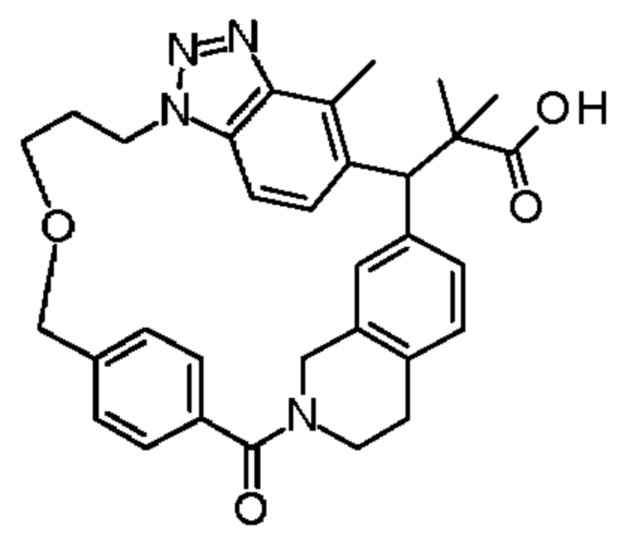
А) трет-Бутил-4-{[3-(5-циано-4-метил-1Н-бензотриазол-1-ил)пропокси]метил}бензоат
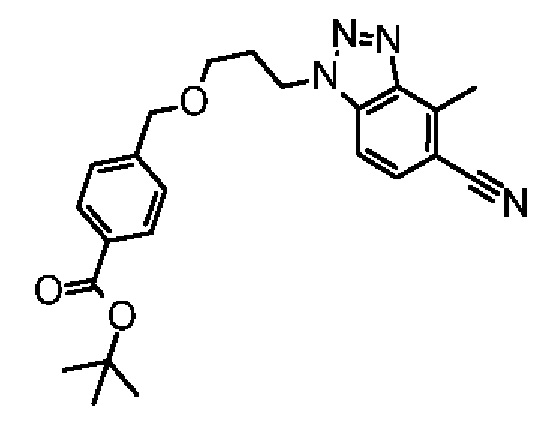
К раствору трет-бутил-4-{[3-(5-бром-4-метил-1Н-бензотриазол-1-ил)пропокси]метил}бензоата (1,4 г) в N,N-диметилформамиде (20 мл) добавляли тетракис(трифенилфосфин)палладий (0) (351 мг) и цианид цинка (1,07 г) и перемешивали реакционную смесь при 120°С в течение ночи. К реакционному раствору добавляли насыщенный водный раствор хлорида аммония и экстрагировали реакционную смесь этилацетатом. Раствор с экстрактом отделяли и промывали водой и насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (NH, этилацетат/гексан) с получением указанного в заголовке соединения (1,16 г).
1Н ЯМР (300 МГц, CDCl3) δ 1,61 (9Н, с), 2,32 (2Н, квинтет, J=6,2 Гц), 3,01 (3Н, с), 3,43 (2Н, т, J=5,6 Гц), 4,48 (2Н, с), 4,79 (2Н, т, J=6,7 Гц), 7,32 (2Н, д, J=8,3 Гц), 7,40 (1H, д, J=8,6 Гц), 7,58 (1H, д, J=8,6 Гц), 7,89-8,05 (2Н, м).
В) трет-Бутил-4-{[3-(5-формил-4-метил-1Н-бензотриазол-1-ил)пропокси]метил}бензоат
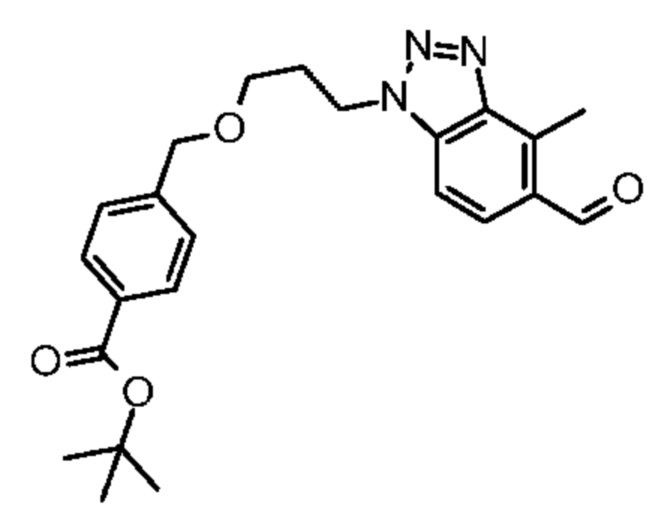
К смеси трет-бутил-4-{[3-(5-циано-4-метил-1Н-бензотриазол-1-ил)пропокси]метил}бензоата (1 г), уксусной кислоты (7 мл), пиридина (7 мл) и воды (7 мл) добавляли водную суспензию никеля Ренея (1,5 мл) и перемешивали реакционную смесь в течение ночи в атмосфере водорода. После отфильтровывания никеля Ренея в реакционную смесь добавляли воду и экстрагировали раствор этилацетатом. Раствор с экстрактом промывали насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (450 мг).
1H ЯМР (300 МГц, CDCl3) δ 1,60 (9Н, с), 2,23-2,41 (2Н, м), 3,17 (3Н, с), 3,44 (2Н, т, J=5,6 Гц), 4,48 (2Н, с), 4,79 (2Н, т, J=6,7 Гц), 7,30-7,43 (3Н, м), 7,96 (3Н, дд, J=8,5, 2,0 Гц), 10,52 (1H, с), МС m/z 410,3 [М+Н]+.
[0157]
С) трет-Бутил-7-{[1-(3-{[4-(трет-бутоксикарбонил)фенил]метокси}пропил)-4-метил-1Н-бензотриазол-5-ил](гидрокси)метил}-3,4-дигидроизохинолин-2(1Н)-карбоксилат
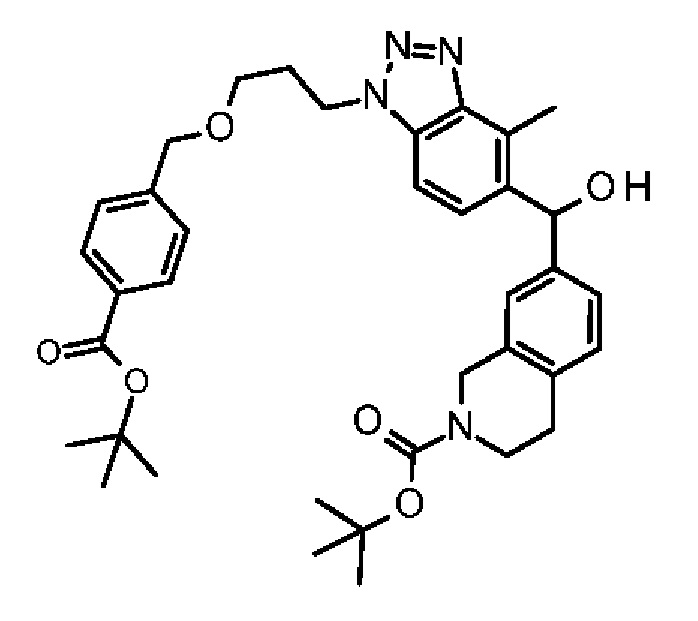
К смеси трет-бутил-4-{[3-(5-формил-4-метил-1Н-бензотриазол-1-ил)пропокси]метил}бензоата (330 мг), фосфата калия (513 мг), трет-бутил-7-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-3,4-дигидро-1Н-изохинолин-2-карбоксилата (2 г), СРМЕ (20 мл) и воды (4 мл), димер хлор(1,5-циклооктадиен)родия (I) (80 мг) при комнатной температуре. Перемешивали смесь при 110°С в течение 1 часа в атмосфере аргона. К полученной смеси добавляли насыщенный водный раствор хлорида аммония и экстрагировали смесь этилацетатом. Раствор с экстрактом промывали насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) и колоночной хроматографией на силикагеле (NH, этилацетат/гексан) с получением указанного в заголовке соединения (260 мг).
1H ЯМР (300 МГц, CDCl3) δ 1,47 (9Н, с), 1,57-1,63 (9Н, м), 2,20-2,41 (2Н, м), 2,60 (1H, шд, J=2,0 Гц), 2,70-2,89 (5Н, м), 3,29-3,51 (2Н, м), 3,62 (2Н, шт, J=5,7 Гц), 4,40-4,57 (4Н, м), 4,73 (2Н, т, J=6,6 Гц), 6,23 (1H, д, J=3,2 Гц), 7,04-7,18 (3Н, м), 7,27-7,37 (3Н, м), 7,64 (1H, д, J=8,7 Гц), 7,89 (2Н, д, J=8,3 Гц).
D) 4-[(3-{5-[3-Метокси-2,2-диметил-3-оксо-1-(1,2,3,4-тетрагидроизохинолин-7-ил)пропил]-4-метил-1Н-бензотриазол-1-ил}пропокси)метил]бензойная кислота
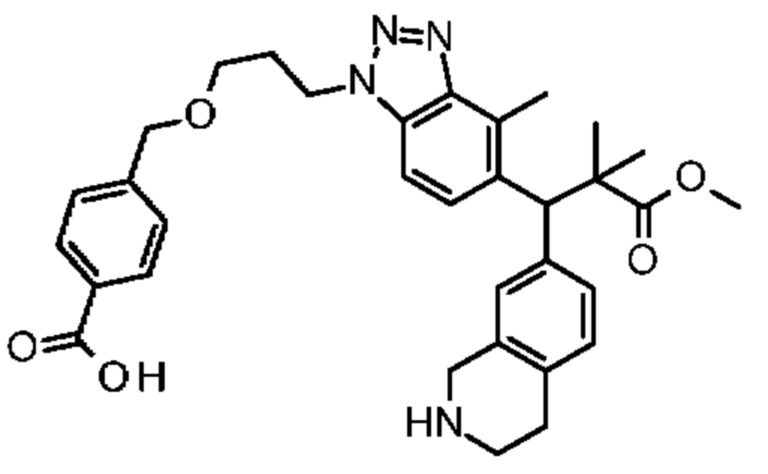
К раствору трет-бутил-7-{[1-(3-{[4-(трет-бутоксикарбонил)фенил]метокси}пропил)-4-метил-1Н-бензотриазол-5-ил](гидрокси)метил}-3,4-дигидроизохинолин-2(1Н)-карбоксилата (50 мг) в ацетонитриле (0,5 мл) добавляли 2,2,2-трихлорацетонитрил (22,5 мг) при комнатной температуре. После перемешивания реакционной смеси в течение 5 минут в нее добавляли 1,8-диазабицикло[5.4.0]-7-ундецен (2,4 мг). Реакционный раствор перемешивали при комнатной температуре в течение 30 минут и добавляли к нему (1-метокси-2-метил-проп-1-енокси)триметилсилан (79 мкл) и 1,1,1-трифтор-N-[(трифторметил)сульфонил]метансупьфонамид (5 мг). После перемешивания реакционного раствора при комнатной температуре в течение 2 часов в него добавляли насыщенный водный раствор бикарбоната натрия и экстрагировали смесь этилацетатом. Раствор с экстрактом промывали водой и насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (NH, этилацетат/гексан, этилацетат/метанол) с получением смеси. К полученной смеси добавляли 4 М раствор HCl/СРМЕ (2 мл) с получением указанного в заголовке соединения. Полученный остаток использовали для следующей реакции без очистки.
[0158]
E) Метил-2-метил-2-[32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]пропаноат
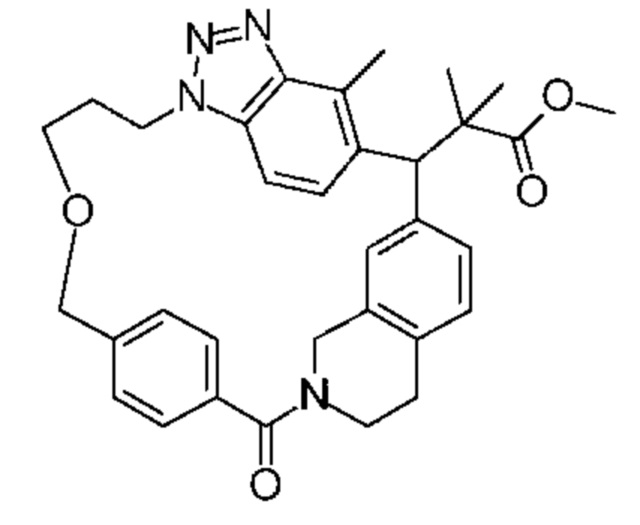
К раствору остатка, полученного на предыдущей стадии, в N,N-диметилформамиде (1,5 мл) добавляли N,N-диизопропилэтиламин (0,062 мл) при 0°С. Полученный раствор по каплям добавляли к раствору HATU (40 мг) в N,N-диметилформамиде (2 мл) при комнатной температуре в течение 1 часа. Перемешивали смесь при комнатной температуре в течение 3 часов. К смеси добавляли насыщенный водный раствор бикарбоната натрия и экстрагировали смесь этилацетатом. Раствор с экстрактом промывали водой и насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения. Полученный остаток использовали для следующей реакции без дополнительной очистки.
F) 2-Метил-2-[32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]пропановая кислота
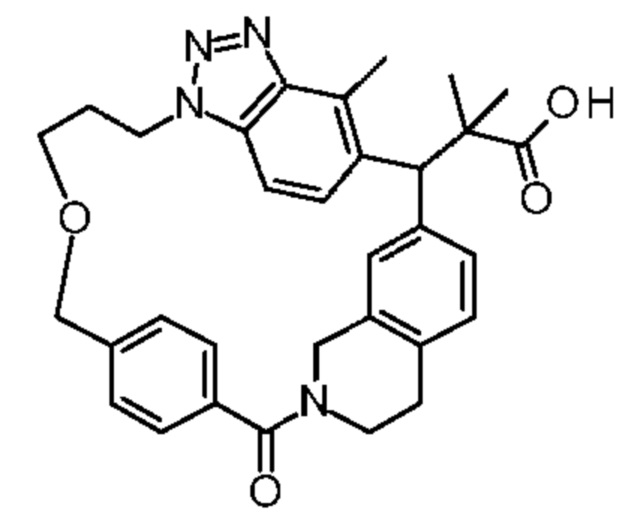
К раствору остатка, полученного на предыдущей стадии, в диметилсульфоксиде (0,25 мл) добавляли триметилсиланолат калия (16,2 мг) при комнатной температуре. После перемешивания смеси при 50°С в течение 8 часов добавляли дополнительное количество триметилсиланолата калия (8 мг) при комнатной температуре. После перемешивания смеси при 50°С в течение ночи к смеси добавляли воду и экстрагировали смесь этилацетатом. Раствор с экстрактом промывали водой и насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/метанол). К полученному остатку добавляли воду и отделяли осадок фильтрованием с получением указанного в заголовке соединения (7 мг).
1H ЯМР (300 МГц, ДМСО-d6) δ 1,18 (3Н, с), 1,32 (3Н, с), 2,31-2,42 (3Н, м), 2,85-2,95 (2Н, м), 3,36-3,44 (3Н, м), 3,57-3,76 (1H, м), 3,83-4,15 (3Н, м),4,23-4,45 (2Н, м), 4,73-4,82 (3Н, м), 6,13 (1H, с), 6,63-6,80 (4Н, м), 7,17 (1H, д, J=8,0 Гц), 7,33-7,42 (1H, м), 7,44-7,53 (1H, м), 7,61 (1Н, д, J=9,0 Гц), 12,36 (1H, с).
[0159]
Пример 29
[32-Метил-20-оксо-13-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]уксусная кислота
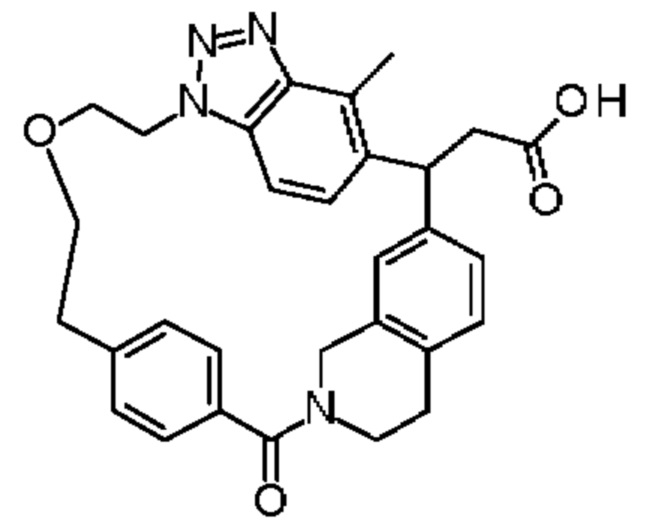
A) 2-{2-[2-(4-Бромфенил)этокси]этокси}оксан
К раствору 2-(4-бромфенил)этанола (1 г) в N,N-диметилформамиде (20 мл) добавляли гидрид натрия (50%, 597 мг) при 0°С. После перемешивания реакционной смеси при 0°С в течение 1 часа добавляли 2-(2-бромэтокси)тетрагидропиран (2,08 г) при 0°С. Перемешивали смесь при комнатной температуре в течение 2 часов. К полученной смеси добавляли насыщенный водный раствор хлорида аммония и экстрагировали смесь этилацетатом. Отделяли органический слой и промывали насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (907 мг). МС m/z 353,2 [M+Na]+.
B) 4-(2-{2-[(Оксан-2-ил)окси]этокси}этил)бензойная кислота
К раствору 2-{2-[2-(4-бромфенил)этокси]этокси}оксана (2,81 г) в тетрагидрофуране (30 мл) добавляли н-бутиллитий (1,6 М раствор в гексане, 8,01 мл) при -78°С и перемешивали реакционную смесь при той же температуре в течение 1 часа. Диоксид углерода, получаемый из сухого льда, пропускали через реакционный раствор при -78°С и перемешивали раствор при той же температуре в течение 1 часа, и перемешивали при комнатной температуре в течение ночи. К полученной смеси добавляли 1 М хлористоводородную кислоту для нейтрализации и затем экстрагировали смесь этилацетатом. Отделяли органический слой и промывали насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (1,76 г). 1Н ЯМР (300 МГц, ДМСО-d6) δ 1,30-1,78 (6Н, м), 2,88 (2Н, шт, J=6,6 Гц), 3,24-3,60 (4Н, м), 3,61-3,76 (4Н, м), 4,53 (1H, шс), 7,37 (2Н, д, J=7,9 Гц), 7,85 (2Н, д, J=8,0 Гц), 12,59-12,88 (1H, м).
[0160]
С) трет-Бутил-4-[2-(2-гидроксиэтокси)этил]бензоат
К раствору 4-(2-{2-[(оксан-2-ил)окси]этокси}этил)бензойной кислоты (1,76 г) в толуоле (20 мл) добавляли 1,1-ди-трет-бутокси-N,N-диметилметанамин (6,08 г) при 100°С и перемешивали реакционную смесь при той же температуре в течение 1 часа. Добавляли дополнительное количество 1,1-ди-трет-бутокси-N,N-диметилметанамина (6,08 г) при 100°С и перемешивали реакционную смесь при той же температуре в течение 2 часов. Реакционный раствор концентрировали и очищали полученный остаток колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (1,47 г). Полученный остаток использовали для следующей реакции без дополнительной очистки.
К смеси полученного остатка (1,47 г) в этаноле (15 мл) добавляли n-толуолсульфонат пиридиния (105 мг) при 50°С и перемешивали реакционную смесь при той же температуре в течение 2 часов. К реакционному раствору добавляли триэтиламин при комнатной температуре и концентрировали раствор. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (1,1 г).
1H ЯМР (300 МГц, ДМСО-d6) δ 1,54 (9Н, с), 2,88 (2Н, т, J=6,8 Гц), 3,37-3,52 (4Н, м), 3,62 (2Н, т, J=6,6 Гц), 4,57 (1H, т, J=5,1 Гц), 7,37 (2Н, шд, J=7,9 Гц), 7,81 (2Н, д, J=8,0 Гц).
D) трет-Бутил-4-(2-{2-[(4-метилбензол-1-сульфонил)окси]этокси}этил)бензоат
Смешивали трет-бутил-4-[2-(2-гидроксиэтокси)этил]бензоат (1,14 г), n-толуолсульфонилхлорид (1,63 г), 4-диметиламинопиридин (52,3 мг), триэтиламин (2,39 мл) и тетрагидрофуран (10 мл), реакционную смесь перемешивали при комнатной температуре в течение 5 часов. К реакционному раствору добавляли триэтиламин (1,2 мл) и n-толуолсульфонилхлорид (815 мг) и перемешивали реакционный раствор при комнатной температуре в течение 3 дней. К реакционному раствору добавляли воду и экстрагировали смесь этилацетатом. Отделяли органический слой и промывали насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (1,62 г).
1Н ЯМР (300 МГц, ДМСО-d6) δ 1,54 (9Н, с), 2,42 (3Н, с), 2,80 (2Н, шт, J=6,5 Гц), 3,50-3,59 (4Н, м), 4,05-4,13 (2Н, м), 7,30 (2Н, д, J=8,0 Гц), 7,47 (2Н, шд, J=8,1 Гц), 7,72-7,83 (4Н, м). МС m/z 443,2 [M+Na]+.
[0161]
E) трет-Бутил-4-{2-[2-(4-бром-3-метил-2-нитроанилино)этокси]этил}бензоат
Раствор трет-бутил-4-(2-{2-[(4-метилбензол-1-сульфонил)окси]этокси}этил)бензоата (1,32 г), 4-бром-3-метил-2-нитроанилина (869 мг) и карбоната цезия (2,04 г) в N,N-диметилформамиде (15 мл) перемешивали при 80°С в течение ночи. В смесь добавляли воду и экстрагировали смесь этилацетатом. Отделяли органический слой и промывали насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (761 мг).
МС m/z 501,2 [M+Na]+.
F) трет-Бутил-4-{2-[2-(5-бром-4-метил-1Н-бензотриазол-1-ил)этокси]этил}бензоат
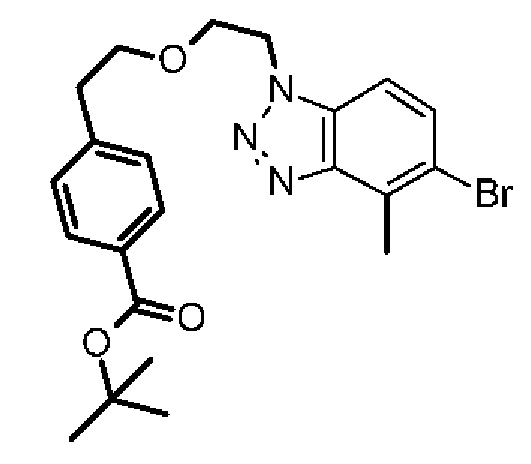
Смесь трет-бутил-4-{2-[2-(4-бром-3-метил-2-нитроанилино)этокси]этил}бензоата (761 мг), хлорида аммония (849 мг), железа (443 мг), этанола (10 мл) и воды (2 мл) перемешивали при 80°С в течение 3 часов. К полученной смеси добавляли воду и экстрагировали смесь этилацетатом. Раствор с экстрактом промывали насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (299 мг). Полученный остаток использовали для следующей реакции без дополнительной очистки. К смеси полученного остатка в уксусной кислоте (3 мл) и воде (0,5 мл) добавляли раствор нитрита натрия (91,8 мг) в воде (1 мл) при 0°С. После перемешивания смеси при 0°С в течение 30 минут в смесь добавляли воду и экстрагировали смесь этилацетатом. Раствор с экстрактом промывали водой, насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) и колоночной хроматографией на силикагеле (NH, этилацетат/гексан) с получением указанного в заголовке соединения (223 мг).
1Н ЯМР (300 МГц, CDCl3) δ 1,60 (9Н, с), 2,74-2,82 (2Н, м), 2,84 (3Н, с), 3,59 (2Н, т, J=6,5 Гц), 3,89 (2Н, т, J=5,0 Гц), 4,74 (2Н, т, J=5,0 Гц), 7,07 (2Н, шд, J=7,9 Гц), 7,21 (1H, шд, J=8,5 Гц), 7,51 (1H, д, J=8,6 Гц), 7,82 (2Н, шд, J=7,8 Гц); МС m/z 460,1 [М+Н]+;
[0162]
G) трет-Бутил-4-[2-(2-{5-[(1Е)-3-этокси-3-оксопроп-1-ен-1-ил]-4-метил-1Н-бензотриазол-1-ил}этокси)этил]бензоат
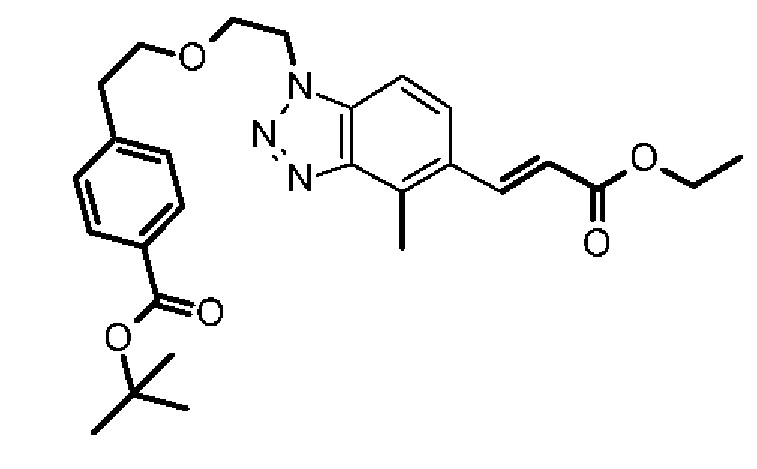
К раствору трет-бутил-4-{2-[2-(5-бром-4-метил-1Н-бензотриазол-1-ил)этокси]этил}бензоата (148 мг), этилакрилата (0,211 мл) и N,N-диизопропилэтиламина (0,225 мл) в N,N-диметилформамиде (2,5 мл) добавляли три(о-толил)фосфин (29,4 мг) и ацетат палладия (11 мг) и перемешивали реакционную смесь при 120°С в течение 4 часов под микроволновым излучением. К полученной смеси добавляли воду и экстрагировали смесь этилацетатом. Раствор с экстрактом промывали насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (163 мг).
1H ЯМР (300 МГц, CDCl3) δ 1,36 (3H, т, J = 7,1 Гц), 1,58 (9Н, с), 2,74-2,83 (2Н, м), 2,92 (3H, с), 3,60 (2Н, т, J = 6,5 Гц), 3,90 (2Н, шт, J = 4,9 Гц), 4,30 (2Н, к, J = 7,2 Гц), 4,75 (2Н, т, J = 4,8 Гц), 6,42 (1H, д, J = 16,0 Гц), 7,07 (2Н, шд, J = 8,0 Гц), 7,34 (1Н, д, J = 8,8 Гц), 7,64 (1Н, д, J = 8,7 Гц), 7,81 (2Н, шд, J = 8,0 Гц), 8,15 (1H, д, J = 16,0 Гц).
МС m/z 480,3 [М+Н]+.
Н) трет-Бутил-7-{1-[1-(2-{2-[4-(трет-бутоксикарбонил)фенил]этокси}этил)-4-метил-1Н-бензотриазол-5-ил]-3-этокси-3-оксопропил}-3,4-дигидроизохинолин-2(1Н)-карбоксилат
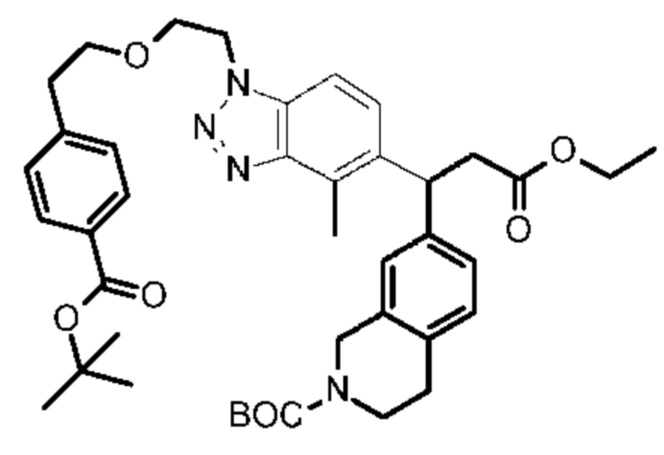
К смеси трет-бутил-4-[2-(2-{5-[(1Е)-3-этокси-3-оксопроп-1-ен-1-ил]-4-метил-1Н-бензотриазол-1-ил}этокси)этил]бензоата (163 мг), трет-бутил-7-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-3,4-дигидро-1Н-изохинолин-2-карбоксилата (147 мг), додецилсульфата натрия (49,1 мг), триэтиламина (0,14 мл), СРМЕ (2 мл) и воды (1 мл) добавляли димер хлор(1,5-циклооктадиен)родия (I) (16,8 мг) при комнатной температуре. Перемешивали смесь при 100°С в течение ночи. К полученной смеси добавляли воду и экстрагировали смесь этилацетатом. Раствор с экстрактом промывали насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (NH, этилацетат/гексан) с получением указанного в заголовке соединения (126 мг).
1Н ЯМР (300 МГц, CDCl3) δ 1,10 (3H, т, J = 7,1 Гц), 1,46 (9Н, с), 1,59 (9Н, с), 2,70-2,83 (4Н, м), 2,86 (3H, с), 2,98-3,19 (2Н, м), 3,59 (4Н, шт, J = 6,2 Гц), 3,89 (2Н, шт, J = 5,0 Гц), 4,02 (2Н, к, J = 7,1 Гц), 4,42-4,52 (2Н, м), 4,72 (2Н, т, J = 5,0 Гц), 4,96 (1H, шт, J = 7,8 Гц), 6,91-6,97 (1H, м), 7,00-7,06 (2Н, м), 7,11 (2Н, шд, J = 8,0 Гц), 7,30-7,36 (2Н, м), 7,84 (2Н, д, J = 8,1 Гц).
МС m/z 713,4 [М+Н]+.
[0163]
I) Этил-[32-метил-20-оксо-13-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]ацетат
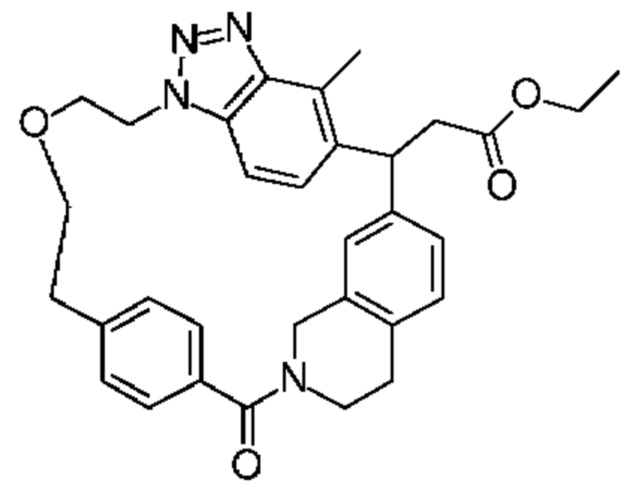
К раствору трет-бутил-7-{1-[1-(2-{2-[4-(трет-бутоксикарбонил)фенил]этокси}этил)-4-метил-1Н-бензотриазол-5-ил]-3-этокси-3-оксопропил}-3,4-дигидроизохинолин-2(1Н)-карбоксилата (139 мг) в СРМЕ (1,5 мл) добавляли 4 н. раствор HCl/СРМЕ (1,27 мл) при комнатной температуре. Перемешивали смесь при комнатной температуре в течение 2 часов и затем концентрировали. Полученный остаток использовали для следующей реакции без очистки.
Раствор полученного остатка и N,N-диизопропилэтиламина (0,17 мл) в N,N-диметилформамиде (10 мл) по каплям добавляли к раствору HATU (111 мг) в N,N-диметилформамиде (10 мл) при комнатной температуре в течение 30 минут. Перемешивали смесь при комнатной температуре в течение 3,5 часа. В смесь добавляли воду и экстрагировали смесь этилацетатом. Раствор с экстрактом промывали насыщенным солевым раствором, затем сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан, метанол/этилацетат) и колоночной хроматографией на силикагеле (NH, этилацетат/гексан) с получением указанного в заголовке соединения (80 мг).
1Н ЯМР (300 МГц, CDCl3) δ 1,13 (3H, т, J = 7,1 Гц), 2,68-2,91 (5Н, м), 2,94-3,11 (3H, м), 3,17-3,29 (1Н, м), 3,52-3,63 (1Н, м), 3,66-3,76 (1H, м), 3,77-3,90 (1H, м), 3,91-4,19 (7Н, м), 4,63-4,78 (1H, м), 4,91-5,05 (2Н, м), 6,29 (1H, с), 6,76-6,85 (4Н, м), 7,19 (1Н, д, J = 8,0 Гц), 7,30-7,40 (2Н, м), 7,49 (1H, д, J = 8,7 Гц).
МС m/z 539,3 [М+Н]+.
J) [32-Метил-20-оксо-13-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]уксусная кислота
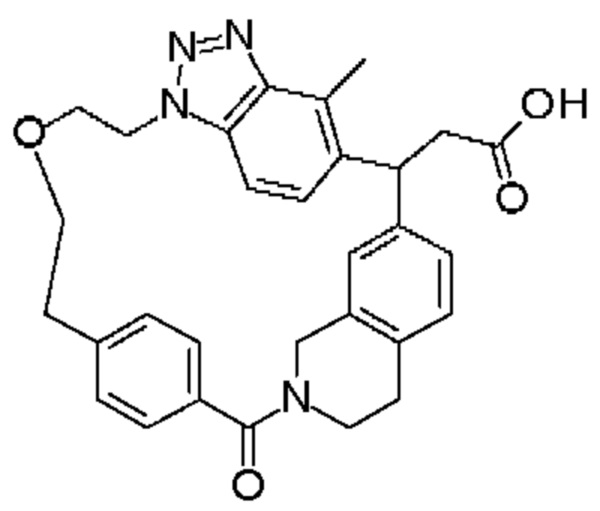
К раствору этил-[32-метил-20-оксо-13-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]ацетата (105 мг) в тетрагидрофуране (1,5 мл) и этаноле (1,5 мл) добавляли 4 М водный раствор гидроксида лития (0,5 мл) и перемешивали реакционную смесь при комнатной температуре в течение 2 часов. К реакционному раствору добавляли дополнительное количество 4 М водного раствора гидроксида лития (0,5 мл) и перемешивали реакционный раствор при комнатной температуре в течение 1 часа. Реакционный раствор концентрировали, к остатку добавляли воду (3 мл) и нейтрализовали раствор при 0°С, используя 2 н. хлористоводородную кислоту. Осадок отфильтровывали с получением указанного в заголовке соединения (72,5 мг).
1H ЯМР (300 МГц, ДМСО-d6) δ 2,58 (3H, с), 2,68-2,79 (2Н, м), 2,87-2,96 (2Н, м), 2,96-3,08 (1H, м), 3,08-3,20 (1H, м), 3,50-3,68 (2Н, м), 3,69-3,81 (2Н, м), 3,94-4,10 (4Н, м), 4,74-4,84 (1H, м), 4,87-4,96 (2Н, м), 6,30 (1H, с), 6,59-6,66 (2Н, м), 6,69-6,77 (2Н, м), 7,21 (1H, д, J = 7,5 Гц), 7,38-7,50 (2Н, м), 7,70 (1Н, д, J = 8,5 Гц), 12,19-12,34 (1H, м).
[0164]
Пример 30
[32-Метил-20-оксо-15-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]уксусная кислота
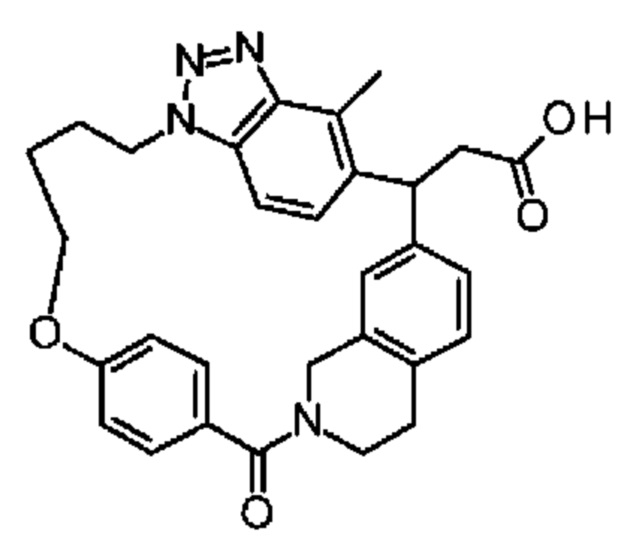
Синтез осуществляли в соответствии со способами, описанными в примере 9, или способами, эквивалентными им.
[0165]
Пример 31
[18-Фтор-32-метил-20-оксо-15-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]уксусная кислота
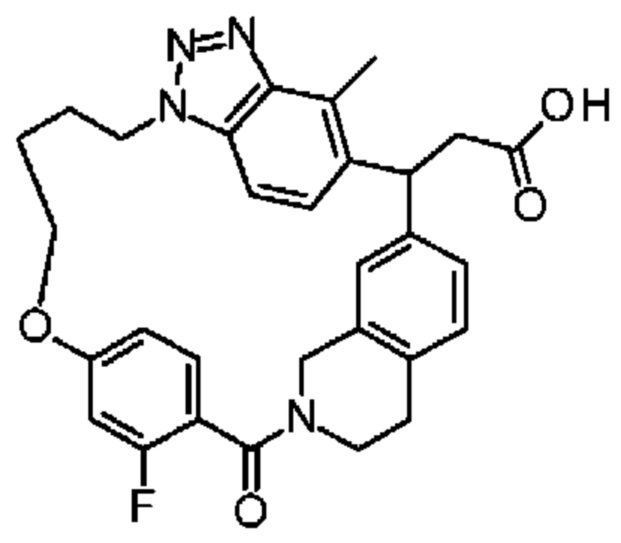
Синтез осуществляли в соответствии со способами, описанными в примере 9, или способами, эквивалентными им.
[0166]
Пример 32
[18,30-Дифтор-32-метил-20-оксо-15-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]уксусная кислота
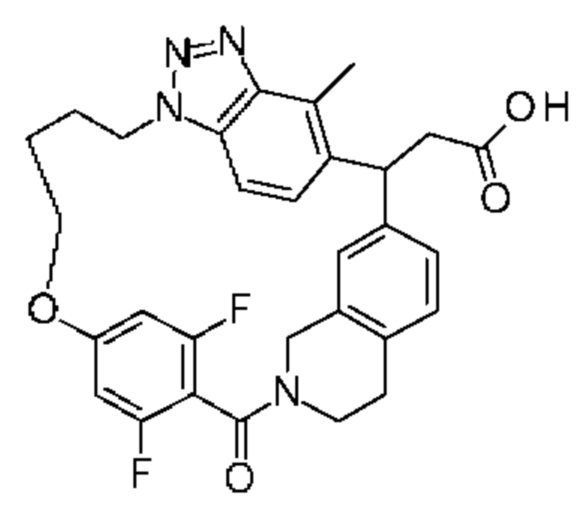
Синтез осуществляли в соответствии со способами, описанными в примере 9, или способами, эквивалентными им.
[0167]
Пример 33
[6,6,33-Триметил-2-оксо-7,10-диокса-1,15,16,17-тетраазагептацикло[22.5.3.23,9.118,22.04,8.015,19.027,31]пентатриаконта-3,8,16,18(33),19,21,24,26,31,34-декаен-23-ил]уксусная кислота
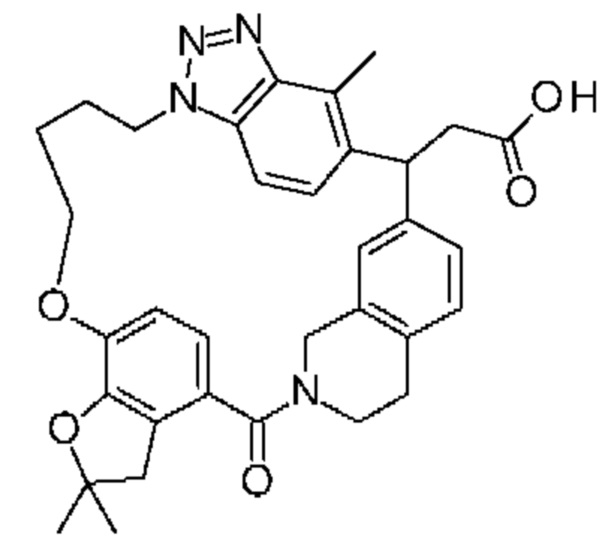
А) Метил-4-(бензилокси)-3-гидрокси-2-(2-метилпроп-2-ен-1-ил)бензоат
Указанное в заголовке соединение получали, используя метил-3-гидрокси-4-фенилметоксибензоат, в соответствии со способами, описанными в примере 8А) и до примера 8В), или способами, эквивалентными им.
МС m/z 313,2 [М+Н]+.
B) Метил-7-гидрокси-2,2-диметил-2,3-дигидро-1-бензофуран-4-карбоксилат
Смесь метил-4-(бензилокси)-3-гидрокси-2-(2-метилпроп-2-ен-1-ил)бензоата (390 мг), муравьиной кислоты (5 мл) и воды (0,5 мл) перемешивали при 100°С в течение ночи. Реакционную смесь концентрировали при пониженном давлении и очищали полученный остаток колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (125 мг).
МС m/z 223,2 [М+Н]+.
[0168]
C) 2,2-Диметил-7-[(проп-2-ен-1-ил)окси]-2,3-дигидро-1-бензофуран-4-карбоновая кислота
Указанное в заголовке соединение получали, используя метил-7-гидрокси-2,2-диметил-2,3-дигидро-1-бензофуран-4-карбоксилат, в соответствии со способами, описанными в примере 30 А) и до примера 30 В), или способами, эквивалентными им.
МС m/z 249,1 [М+Н]+.
D) [6,6,33-Триметил-2-оксо-7,10-диокса-1,15,16,17-тетраазагептацикло[22.5.3.23,9.118,22.04,8.015,19.027,31]пентатриаконта-3,8,16,18(33),19,21,24,26,31,34-декаен-23-ил]уксусная кислота
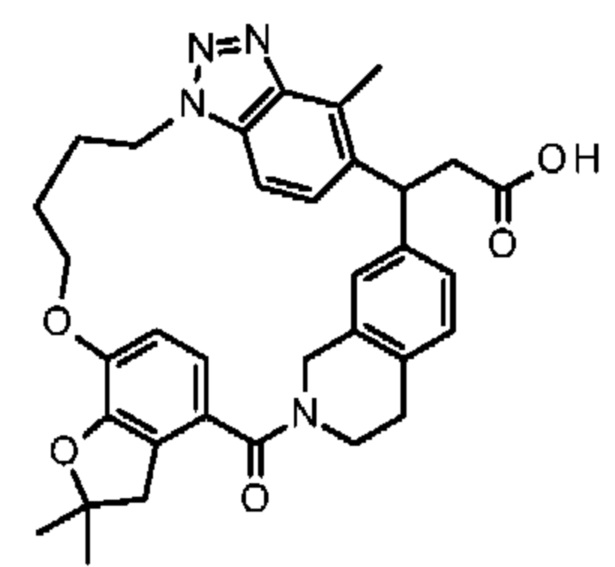
Указанное в заголовке соединение получали, используя 2,2-диметил-7-[(проп-2-ен-1-ил)окси]-2,3-дигидро-1-бензофуран-4-карбоновую кислоту, в соответствии со способами, описанными в примере 9 L) и до примера 9 N), или способами, эквивалентными им.
[0169]
Пример 34
(5-Метил-2-оксо-2Н-1,3-диоксол-4-ил)метил-[32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]ацетат
<Хиральный, синтез из хирального этил-[32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]ацетата (короткое время удерживания)>
К раствору [32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]уксусной кислоты <52,6 мг, хиральная, синтез из хирального этил-[32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.2216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]ацетата (короткое время удерживания)> в N,N-диметилформамиде (0,5 мл) добавляли карбонат калия (28,5 мг) и 4-(хлорметил)-5-метил-1,3-диоксол-2-он (0,011 мл) и перемешивали реакционную смесь при комнатной температуре в течение ночи. Смесь разбавляли этилацетатом и промывали водой и насыщенным солевым раствором. Затем смесь сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан) с получением указанного в заголовке соединения (25 мг).
[0170]
Пример 35
(5-Метил-2-оксо-2Н-1,3-диоксол-4-ил)метил-[32-метил-20-оксо-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]ацетат
<Синтез из хирального этил-[32-метил-20-оксо-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]ацетата (продолжительное время удерживания)>
Синтез осуществляли в соответствии со способами, описанными в примере 34, или способами, эквивалентными им.
[0171]
Пример 36
Этил-[32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]ацетат (хиральный, короткое время удерживания)
Синтез осуществляли, используя йодэтан, в соответствии со способами, описанными в примере 34, или способами, эквивалентными им.
[0172]
Пример 37
Этил-[32-метил-20-оксо-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]ацетат (хиральный, короткое время удерживания)
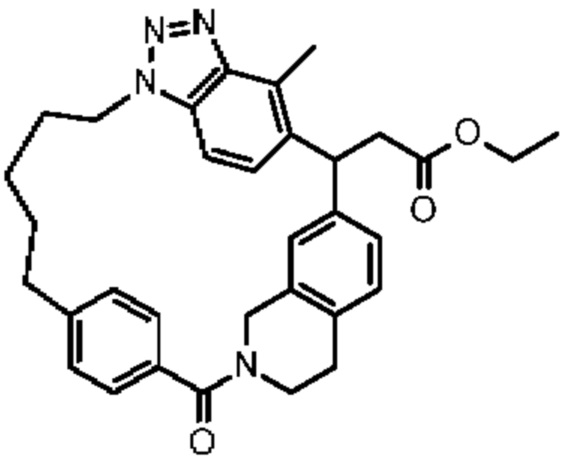
Синтез осуществляли, используя йодэтан, в соответствии со способами, описанными в примере 34, или способами, эквивалентными им.
[0173]
Пример 38
2-[32-Метил-20-оксо-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]-N-(6-метилпиридин-3-ил)ацетамид
<Хиральный, синтез из хирального этил-[32-метил-20-оксо-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]ацетата (короткое время удерживания)>
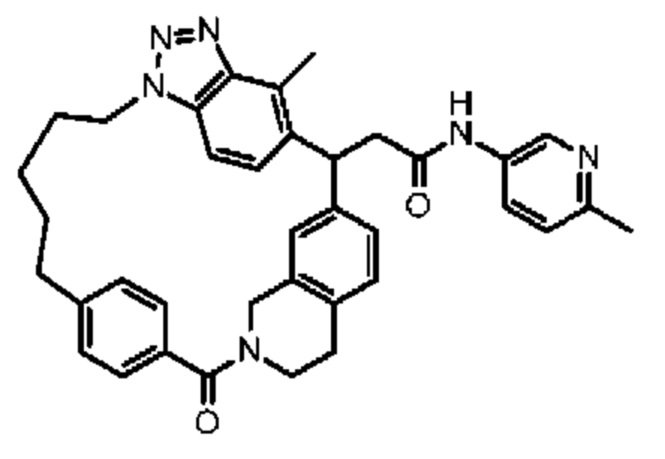
К смеси [32-метил-20-оксо-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]уксусной кислоты <25 мг, хиральная, синтез из хирального этил-[32-метил-20-оксо-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]ацетата (короткое время удерживания)> и N,N-диметилформамида (0,25 мл) добавляли триэтиламин (0,0138 мл), HOBt (8 мг), гидрохлорид 1-этил-3-(3-диметиламинопропил)карбодиимида (11,3 мг) и 6-метилпиридин-3-амин (6 мг) и перемешивали реакционную смесь при комнатной температуре в течение ночи. К смеси добавляли насыщенный водный раствор бикарбоната натрия и отделяли осадок фильтрованием. Твердое вещество промывали этилацетатом с получением указанного в заголовке соединения (20 мг).
[0174]
Пример 39
2-[32-Метил-20-оксо-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]-N-(пиридин-3-ил)ацетамид
<Хиральный, синтез из хирального этил-[32-метил-20-оксо-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]ацетата (короткое время удерживания)>
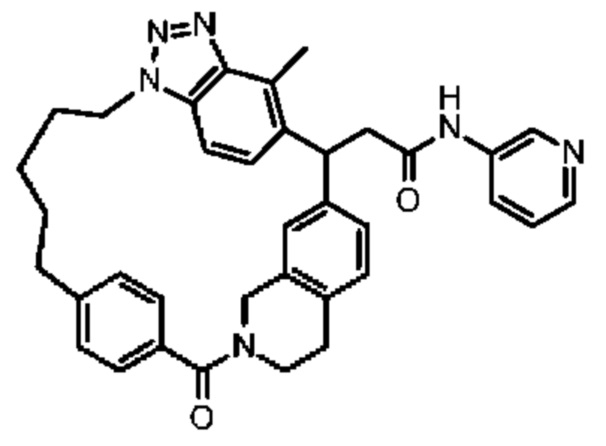
Синтез осуществляли в соответствии со способами, описанными в примере 38, или способами, эквивалентными им.
[0175]
Пример 40
1-{[(Циклогексилокси)карбонил]окси}этил[32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]ацетат
<Синтез из хирального этил-[32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексапикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]ацетата (короткое время удерживания)>
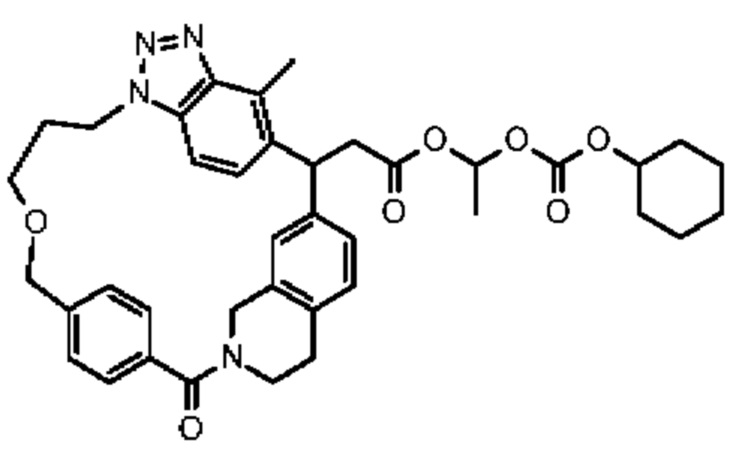
К раствору [32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]уксусной кислоты <53,3 мг, хиральная, синтез из хирального этил-[32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]ацетата (короткое время удерживания)> в N,N-диметилформамиде (0,5 мл) добавляли карбонат цезия (51 мг) и 1-хлорэтилциклогексилкарбонат (34,5 мг) и перемешивали реакционную смесь при комнатной температуре в течение ночи. Смесь разбавляли этилацетатом и промывали водой и насыщенным солевым раствором. Затем смесь сушили над безводным сульфатом магния и концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле (этилацетат/гексан). После суспендирования полученного остатка в воде суспензию концентрировали с получением указанного в заголовке соединения (49 мг).
[0176]
Пример 41
[32-Метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]ацетат натрия
<Синтез из хирального этил-[32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]ацетата (короткое время удерживания)>
К смеси [32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]уксусной кислоты <синтез из хирального этил-[32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]ацетата (короткое время удерживания)> (42,7 мг) в метаноле (0,5 мл) добавляли 2 н. гидроксид натрия (0,0418 мл) при комнатной температуре. Реакционный раствор концентрировали с получением указанного в заголовке соединения (40 мг).
1H ЯМР (300 МГц, ДМСО-d6) δ 2,25-2,41 (2Н, м), 2,53-2,68 (2Н, м), 2,88 (2Н, т, J = 6,7 Гц), 3,35-3,47 (2Н, м), 3,77 (2Н, т, J = 6,7 Гц), 3,82-4,08 (2Н, м), 4,20-4,30 (1H, м), 4,34-4,46 (1H, м), 4,67-4,91 (3H, м), 5,96 (1H, с), 6,67-6,74 (2Н, м), 6,74-6,87 (2Н, м), 7,14 (1H, д, J = 7,9 Гц), 7,35 (1H, д, J = 8,6 Гц), 7,43 (1H, д, J = 7,9 Гц), 7,57 (1H, д, J = 8,6 Гц).
[0177]
Пример 42
2-[32-Метил-20-оксо-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]-N-(6-метилпиридин-3-ил)ацетамид
Синтез осуществляли в соответствии со способами, описанными в примере 38, или способами, эквивалентными им.
[0178]
Соединения из примеров 43-54 могут быть получены в соответствии со способами, описанными выше в примере 28, или способами, эквивалентными им.
Пример 43
2-[18,30-дихлор-32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]-2-метилпропановая кислота
Пример 44
2-Метил-2-[32-метил-20-оксо-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]пропановая кислота
Пример 45
2-Метил-2-[18,30,32-триметил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]пропановая кислота
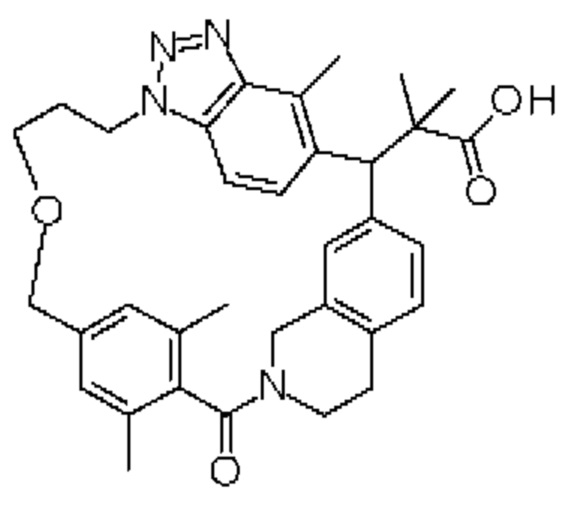
[0179]
Пример 46
2-[18,30-Дихлор-32-метил-20-оксо-15-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]-2-метилпропановая кислота
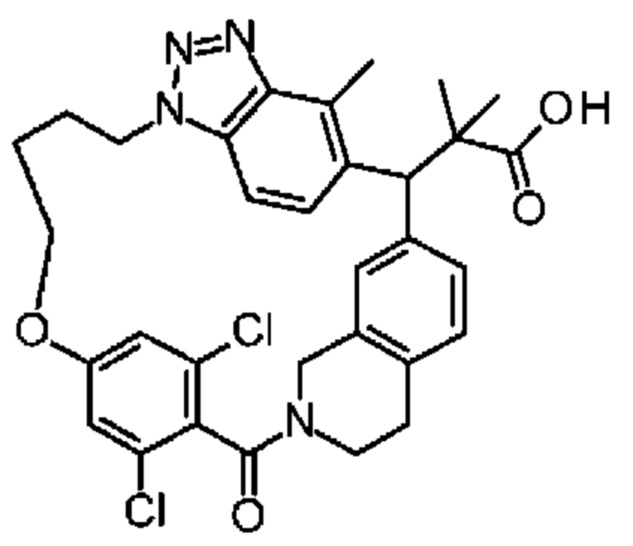
Пример 47
2-Метил-2-[18,30,32-триметил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]пропановая кислота
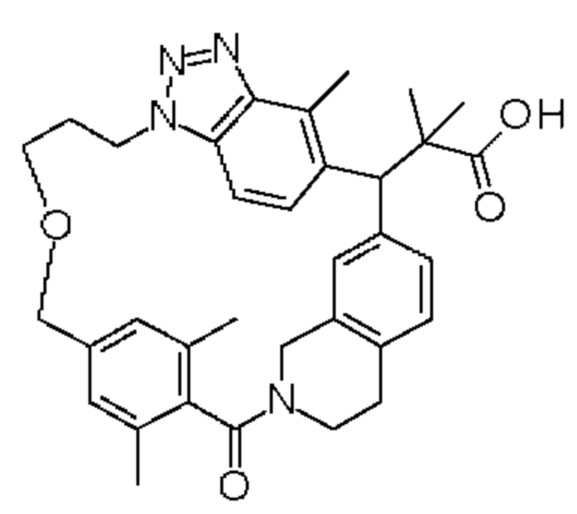
Пример 48
2-[18,30-Дихлор-25,32-диметил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]-2-метилпропановая кислота
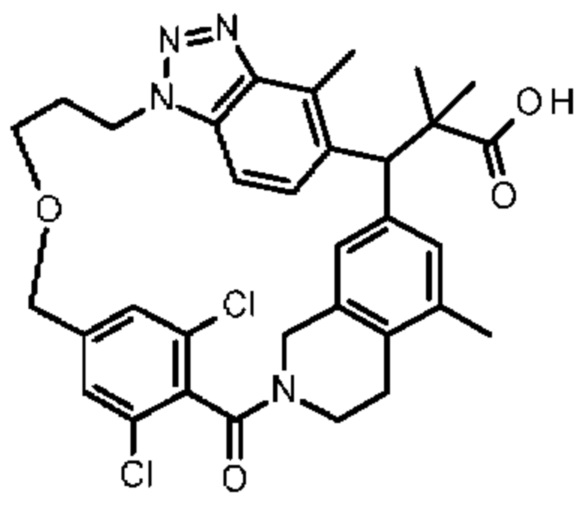
Пример 49
2-Метил-2-[18,25,30-трихлор-32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]пропановая кислота
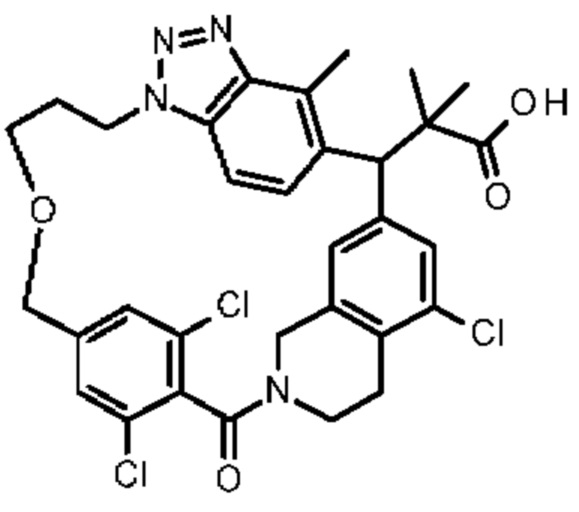
[0180]
Пример 50
2-[18,30-Дихлор-32-метил-20-оксо-25-(трифторметил)-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]-2-метилпропановая кислота
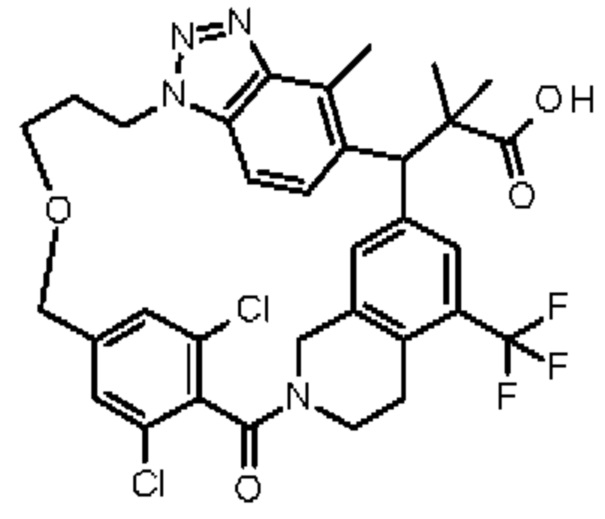
Пример 51
2-[8-(Циклопропилметил)-34-метил-2,7-диоксо-5-окса-1,8,16,17,18-пентаазагептацикло[23.5.3.23,10.119,23.04,9.016,20.028,32]гексатриаконта-3,9,17,19(34),20,22,25,27,32,35-декаен-24-ил]-2-метилпропановая кислота
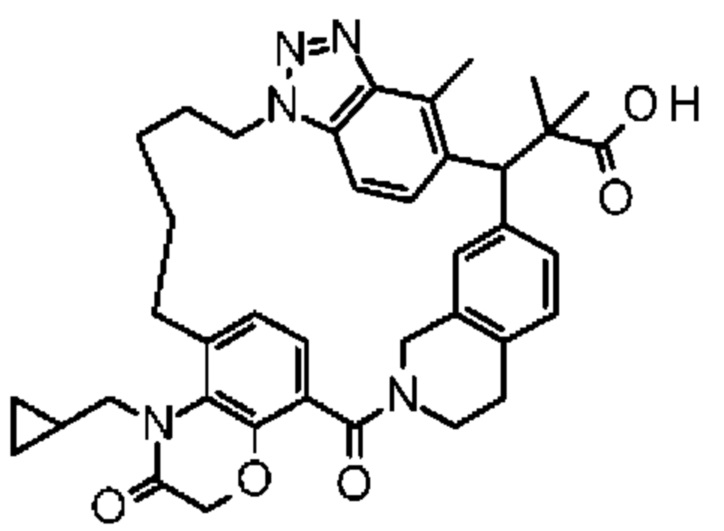
Пример 52
2-[18,30-Дихлор-32-метил-20-оксо-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]-2-метилпропановая кислота
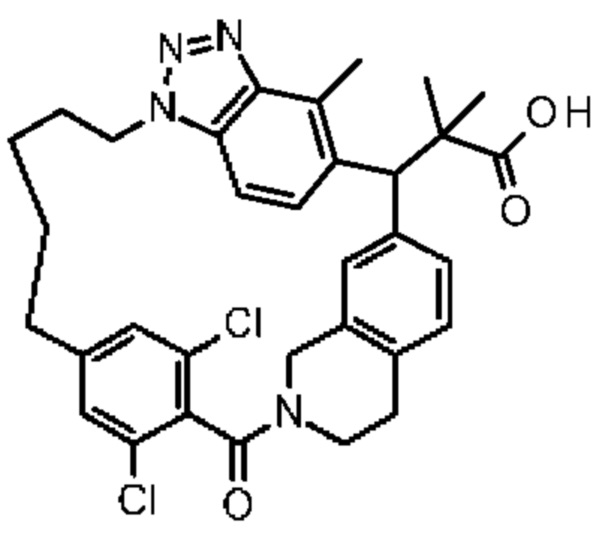
Пример 53
2-[18,30-Дихлор-5-метокси-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]-2-метилпропановая кислота
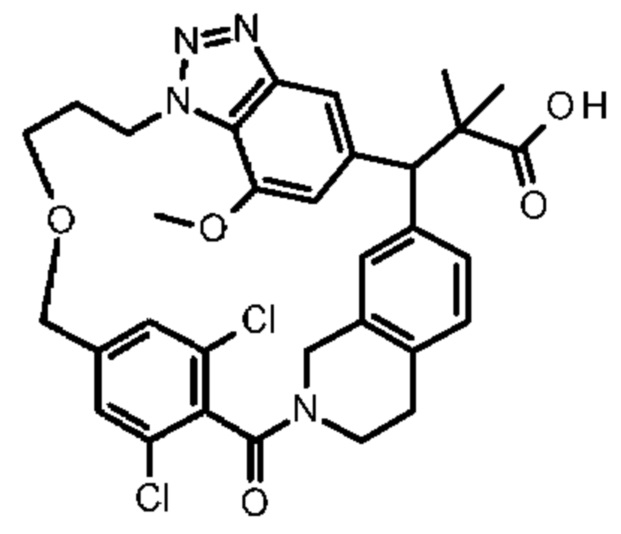
Пример 54
2-[18,30-Дихлор-5-метокси-32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]-2-метилпропановая кислота
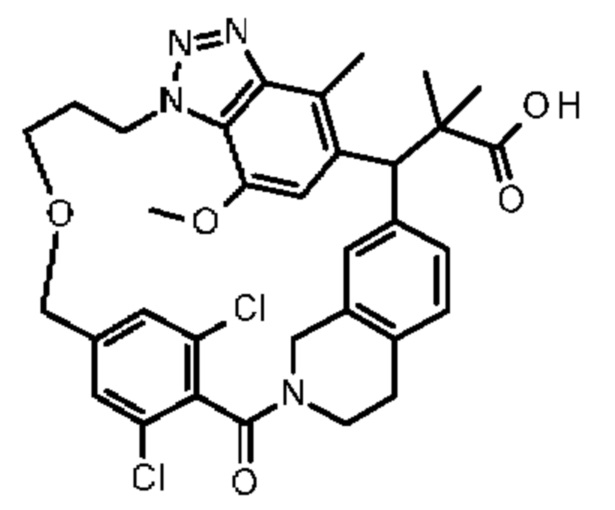
[0181]
Пример 55
2-Метил-2-[32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16,28,24(28),25,30-декаен-2-ил]пропановая кислота
<Хиральная, синтез из хирального метил-2-метил-2-[32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16,28,24(28),25,30-декаен-2-ил]пропаноата (короткое время удерживания)>
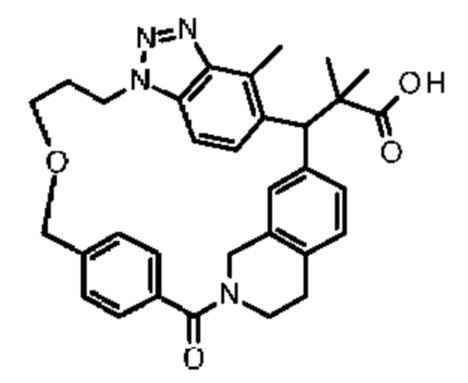
А) 1-Бром-4-фтор-2-метил-3-нитробензол
К раствору 1-фтор-3-метил-2-нитробензола (10 г) в ТФК (23 мл) и H2SO4 (10 мл) добавляли NBS (14 г) при 0°С. Перемешивали смесь при комнатной температуре в течение ночи. Смесь выливали в лед. Осадок отфильтровывали и промывали водой с получением указанного в заголовке соединения (14 г) в виде твердого вещества белого цвета.
1H ЯМР (400 МГц, ДМСО-d6): δ 2,34 (3H, с), 7,46 (1H, т, J = 9,3 Гц), 7,93-7,97 (1H, м)
B) 3-[(4-Бром-3-метил-2-нитрофенил)амино]пропан-1-ол
К раствору 1-бром-4-фтор-2-метил-3-нитробензола (14 г) в ДМФА (150 мл) добавляли K2CO3 (16,655 г) и 3-аминопропанол (6 мл) при комнатной температуре. Перемешивали смесь при 80°С в течение ночи. После завершения реакции в реакционную массу добавляли ледяную воду при 0°С. Осадок отфильтровывали и промывали водой. Остаток выпаривали и промывали н-пентаном с получением указанного в заголовке соединения (14 г) в виде твердого вещества оранжевого цвета.
1H ЯМР (400 МГц, ДМСО-d6): δ 1,68 (2Н, к, J = 5,9 Гц), 2,24 (3H, с), 3,17 (2Н, к, J = 6,0 Гц), 3,44 (2Н, к, J = 5,1 Гц), 4,58-4,60 (1H, м), 6,22 (1H, шс), 6,73 (1H, д, J = 9,1 Гц), 7,54 (1H, д, J = 9,0 Гц).
МС m/z 289,2 [М+Н]+.
C) 3-[(2-Амино-4-бром-3-метилфенил)амино]пропан-1-ол
К перемешиваемому раствору 3-[(4-бром-3-метил-2-нитрофенил)амино]пропан-1-ола (14,6 г) в этаноле (150 мл) и воде (80 мл) добавляли железо (14,1 г) и NH4Cl (27 г) при 25°С и кипятили реакционную смесь с обратным холодильником в течение 4 часов. Реакционную смесь фильтровали через слой целита и выпаривали растворитель. Остаток гасили насыщенным водным раствором NaHCO3. Водный слой экстрагировали этилацетатом (50 мл × 3). Объединенный органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и выпаривали при пониженном давлении с получением указанного в заголовке соединения (11,8 г) в виде твердого вещества коричневого цвета.
1H ЯМР (400 МГц, ДМСО-d6): δ 1,69-1,76 (2Н, квинтет, J = 6,6 Гц), 2,15 (3H, с), 3,18 (2Н, к, J = 6,5 Гц), 3,49 (2Н, к, J = 5,7 Гц), 4,45-4,48 (1Н, м), 4,53-4,64 (3H, м), 6,25 (1H, д, J = 8,5 Гц), 6,70 (1H, д, J = 8,4 Гц).
МС m/z 258,9 [М+Н]+.
D) 3-(5-Бром-4-метил-1Н-1,2,3-бензотриазол-1-ил)пропан-1-ол
К раствору 3-[(2-амино-4-бром-3-метилфенил)амино]пропан-1-ола (12 г) в 6 н. HCl (122 мл) медленно добавляли раствор NaNO2 (6,4 г) в воде (36 мл) при 0°С. Перемешивали смесь при комнатной температуре в течение 2 часов. Реакционную смесь нейтрализовали 4 н. NaOH при 0°С. Водный слой экстрагировали EtOAc, объединенные органические слои промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Неочищенный продукт очищали на силикагелевой колонке (120 г, 60% EtOAc/гексан) с получением указанного в заголовке соединения (11 г) в виде твердого вещества коричневого цвета.
1H ЯМР (400 МГц, ДМСО-d6): δ 2,03 (2Н, квинтет, J = 6,4 Гц), 2,71 (3H, с), 3,39 (2Н, к, J = 5,5 Гц), 4,66 (1H, шт, J = 4,7 Гц), 4,74 (2Н, т, J = 6,7 Гц), 7,68 (2Н, с).
МС m/z 270,1 [М+Н]+.
E) 4-{[3-(5-Бром-4-метил-1Н-1,2,3-бензотриазол-1-ил)пропокси]метил}бензоат
К перемешиваемому раствору 3-(5-бром-4-метил-1H-1,2,3-бензотриазол-1-ил)пропан-1-ола (11,4 г) в ТГФ (250 мл) добавляли NaH (60% в масле, 10,12 г) при 0°С и перемешивали при 25°С в течение 1 часа. К полученной смеси добавляли TBAI (31 г) и трет-бутил-4-(бромметил)бензоат (22,8 г) при 0°С и перемешивали при 25°С в течение 4 часов. Реакционную смесь гасили льдом. Водный слой экстрагировали EtOAc, объединенные органические слои промывали насыщенным солевым раствором; сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Полученный таким образом неочищенный продукт очищали колоночной хроматографией на силикагеле (SiO2; 10% EtOAc/гексаны) с получением указанного в заголовке соединения (16 г) в виде светло-желтой жидкости.
1H ЯМР (400 МГц, ДМСО-d6): δ 1,54 (9Н, с), 2,17-2,23 (2Н, м), 2,67 (3H, с), 3,42 (2Н, т, J = 5,7 Гц), 4,43 (2Н, с), 4,78 (2Н, т, J = 6,5 Гц), 7,25 (2Н, д, J = 8,1 Гц), 7,65 (2Н, м), 7,80 (2Н, д, J = 8,1 Гц). МС m/z 460,1 [М+Н]+.
F) трет-Бутил-4-{[3-(5-циано-4-метил-1Н-1,2,3-бензотриазол-1-ил)пропокси]метил}бензоат
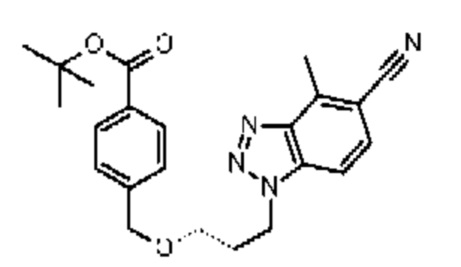
В высушенной в печи герметичной пробирке к перемешиваемому раствору трет-бутил-4-{[3-(5-бром-4-метил-1Н-1,2,3-бензотриазол-1-ил)пропокси]метил}бензоата (15 г) в DMA (125 мл) добавляли Zn(CN)2 (2,3 г), Zn пыль (0,637 г) при 25°С и дегазировали реакционную смесь аргоном в течение 10 минут. К полученной смеси добавляли Pd2(dba)3 (1,495 г), затем dppf (1,8 г) при 25°С и нагревали реакционную смесь при 150°С в течение 6 часов. Реакционную смесь охлаждали до 25°С, фильтровали через целит и промывали EtOAc. Фильтрат разбавляли водой (в 10 раз) и перемешивали в течение 30 минут. Водный слой экстрагировали EtOAc, объединенные органические слои промывали водой, насыщенным солевым раствором, сушили над безводным Na2SO4, фильтровали и концентрировали фильтрат при пониженном давлении. Полученный таким образом неочищенный продукт очищали колоночной хроматографией на силикагеле (SiO2, 20-25% EtOAc/гексан) с получением указанного в заголовке соединения (10 г) в виде бесцветного вязкого маслянистого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ 1,54 (9Н, с), 2,22 (2Н, т, J = 6,1 Гц), 2,83-2,85 (3H, м), 3,44 (2Н, т, J = 5,7 Гц), 4,40 (2Н, с), 4,84 (2Н, т, J = 6,5 Гц), 7,21 (2Н, д, J = 8,1 Гц), 7,77-7,80 (4Н м). МС m/z 407,0 [М+Н]+.
G) трет-бутил-4-{[3-(5-формил-4-метил-1H-1,2,3-бензотриазол-1-ил)пропокси]метил}бензоат
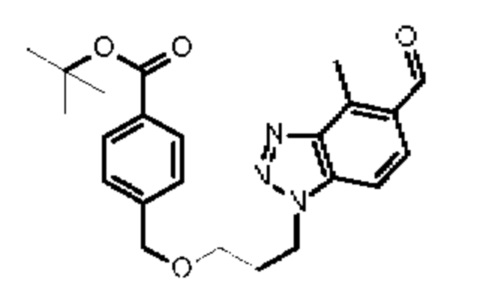
К перемешиваемому раствору 4-{[3-(5-циано-4-метил-1H-1,2,3-бензотриазол-1-ил)пропокси]метил}бензоата (4,7 г) в пиридине (85 мл) добавляли АсОН (85 мл), воду (85 мл), затем Ni Ренея (в воде, 47 мл) при 25°С. Реакционную смесь перемешивали при положительном давлении водорода из баллона в течение 24 часов при 25°С. За ходом реакции следили только по ЖХ/МС. После завершения реакции (по данным ЖХ/МС) реакционную смесь фильтровали через целит и промывали EtOAc. Фильтрат разбавляли этилацетатом, промывали 0,5 М лимонной кислотой, насыщенным водным раствором NaHCO3, объединенные органические слои промывали водой, насыщенным солевым раствором, сушили над безводным Na2SO4, фильтровали и концентрировали фильтрат при пониженном давлении. Полученный таким образом неочищенный продукт очищали колоночной хроматографией на силикагеле (SiO2, 30-35% EtOAc/гексан) с получением указанного в заголовке соединения (2,3 г) в виде маслянистого вещества коричневого цвета.
1H ЯМР (400 МГц, ДМСО-d6): δ 1,54 (9Н, с), 2,21-2,26 (2Н, м), 3,04 (3H, с), 3,43 (2Н, т, J = 5,8 Гц), 4,43 (2Н, с), 4,82 (2Н, т, J = 6,6 Гц), 7,28 (2Н, д, J = 8,0 Гц), 7,77-7,80 (3H, м), 7,92 (1H, д, J = 8,6 Гц), 10,43 (1H, с). МС m/z 410,4 [М+Н]+.
H) трет-Бутил-7-({1-[3-({4-[(трет-бутокси)карбонил]фенил}метокси)пропил]-4-метил-1H-1,2,3-бензотриазол-5-ил}(гидрокси)метил)-1,2,3,4-тетрагидроизохинолин-2-карбоксилат
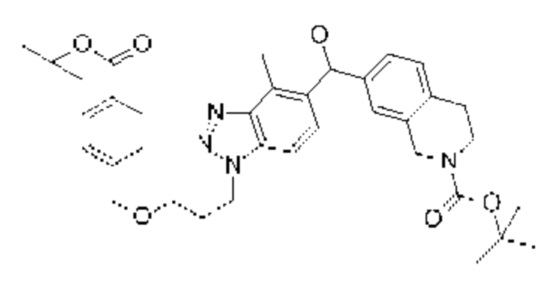
К дегазированному раствору трет-бутил-4-{[3-(5-формил-4-метил-1Н-1,2,3-бензотриазол-1-ил)пропокси]метил}бензоата (2,6 г) в смеси СРМЕ (60 мл) и воды (12 мл) добавляли трет-бутил-7-(тетраметил-1,3,2-диоксаборолан-2-ил)-1,2,3,4-тетрагидроизохинолин-2-карбоксилат (6,8 г), K3PO4 (4,04 г) при 25°С. К полученной смеси добавляли [RhCl(COD)]2 (627 мг) и нагревали реакционную смесь при 50°С в течение 2 часов. Реакционную смесь охлаждали до 25°С и гасили насыщенным водным раствором NH4Cl. Водный слой экстрагировали EtOAc, объединенные органические слои промывали водой, насыщенным солевым раствором, сушили над безводным Na2SO4, фильтровали и концентрировали фильтрат при пониженном давлении. Полученный таким образом неочищенный продукт очищали колоночной хроматографией на силикагеле (SiO2, 25% EtOAc/гексан) с получением указанного в заголовке соединения (2 г) в виде светло-желтого вязкого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ 1,39 (9Н, с), 1,53 (9Н, с), 2,19-2,16 (2Н, м), 2,68-2,72 (5Н, м), 3,41 (2Н, т, J = 5,88 Гц), 3,48-3,51 (2Н, м), 4,42-4,46 (4Н, м), 4,74 (2Н, т, J = 6,68 Гц), 5,87-5,88 (1H, м), 6,03-6,04 (1H, м), 7,04-7,12 (3H, м), 7,34 (2Н, д, J = 8,04 Гц), 7,58 (2Н, с), 7,83 (2Н, д, J = 8,12 Гц). МС m/z 643,1 [М+Н]+.
I) 4-[(3-{5-[3-Метокси-2,2-диметил-3-оксо-1-(1,2,3,4-тетрагидроизохинолин-7-ил)пропил]-4-метил-1H-1,2,3-бензотриазол-1-ил}пропокси)метил]бензойная кислота
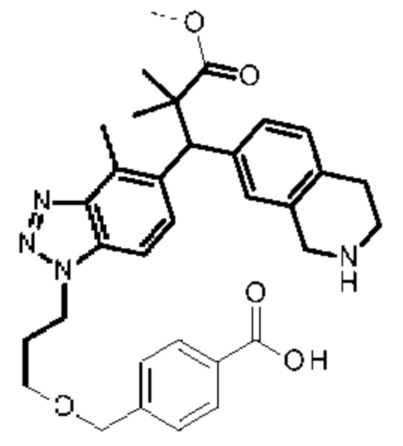
К перемешиваемому раствору трет-бутил-7-({1-[3-({4-[(трет-бутокси)карбонил]фенил}метокси)пропил]-4-метил-1Н-1,2,3-бензотриазол-5-ил}(гидрокси)метил)-1,2,3,4-тетрагидроизохинолин-2-карбоксилата (700 мг) в ДХМ (30 мл) добавляли [(1-метокси-2-метилпроп-1-ен-1-ил)окси]триметилсилан (1,2 мл) и TiCl4 (1 М в ДХМ, 2,4 мл) при 0°С и перемешивали реакционную смесь при 0°С в течение 5 минут. После завершения реакции (по данным ЖХМС и ТСХ) реакционную смесь гасили водой. Водный слой подщелачивали насыщенным раствором NaHCO3 (рН ~8) и фильтровали через слой целита. После фильтрования экстрагировали водный слой 10% МеОН/ДХМ (3 × 50 мл), объединенный органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и выпаривали с получением смеси, которую использовали на следующей стадии без дополнительной очистки.
К смеси диоксана (6 мл) по каплям добавляли 4 М раствор HCl в диоксане (6 мл) при 25°С и перемешивали реакционную смесь при указанной температуре в течение 2 часов. После завершения реакции (по данным ЖХ/МС) удаляли летучие вещества при пониженном давлении и очищали полученный неочищенный продукт обращенно-фазовой препаративной ВЭЖХ с получением указанного в заголовке соединения (250 мг) в виде грязновато-белого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ 1,24-1,29 (6Н, м), 2,18 (2Н, т, J = 5,8 Гц), 2,67-2,71 (5Н, м), 3,07-3,08 (2Н, м), 3,33-3,42 (2Н, м), 3,42 (3H, с), 3,95 (2Н, с), 4,28-4,38 (2Н, м), 4,70-4,73 (3H, м), 6,95 (1H, д, J = 7,7 Гц), 7,01-7,09 (4Н, м), 7,47-7,54 (2Н, м), 7,61 (2Н, д, J = 7,9 Гц). МС m/z 571,2 [М+Н]+.
J) Метил-2-метил-2-[32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16,18,24(28),25,30-декаен-2-ил]пропаноат (короткое время удерживания) и метил-2-метил-2-[32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16,28,24(28),25,30-декаен-2-ил]пропаноат (продолжительное время удерживания)
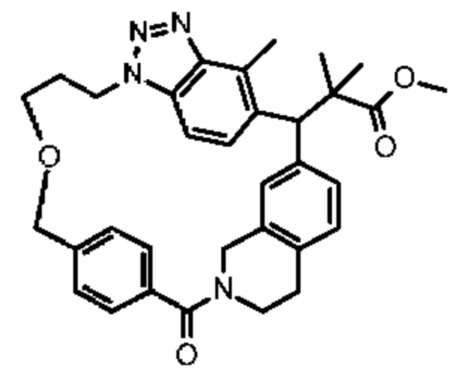
К раствору HATU (406 мг) в ДМ ФА (15 мл) через поршневый насос добавляли смесь 4-[[3-[5-[3-метокси-2,2-диметил-3-оксо-1-[1,2,3,4-тетрагидроизохинолин-7-ил]пропил]-4-метил-1H-1,2,3-бензотриазол-1-ил]пропокси]метил]бензойной кислоты (500 мг) и N,N-диизопропилэтиламина (0,74 мл) в ДМ ФА (32 мл) при 25°С в течение 1 часа и перемешивали реакционную смесь при указанной температуре в течение 3 часов. После завершения реакции (по данным ЖХ/МС) реакционную смесь разбавляли насыщенным раствором NaHCO3. Водный слой экстрагировали EtOAc. Объединенный органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и выпаривали при пониженном давлении. Полученный неочищенный продукт очищали нормально-фазовой хиральной ВЭЖХ (способ С) с получением метил-2-метил-2-[32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16,18,24(28),25,30-декаен-2-ил]пропаноата (короткое время удерживания) (55 мг) и метил-2-метил-2-[32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16,18,24(28),25,30-декаен-2-ил]пропаноата (продолжительное время удерживания) (45 мг) в виде твердого вещества белого цвета.
Метил-2-метил-2-[32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16,18,24(28),25,30-декаен-2-ил]пропаноат (короткое время удерживания)
1Н ЯМР (400 МГц, ДМСО-d6): δ 1,22-1,34 (6Н, м), 2,32-2,36 (2Н, м), 2,90 (2Н, шс), 3,35-3,38 (4Н, м), 3,48 (3H, с), 3,50-3,65 (1Н, м), 3,86-3,90 (1H, м), 4,00-4,03 (2Н, м), 4,10-4,14 (1H, м), 4,25-4,29 (1H, м), 4,37-4,40 (1H, м), 4,76-4,78 (3H, м), 6,17 (1H, с), 6,66 (2Н, д, J = 7,8 Гц), 6,76 (2Н, д, J = 8,1 Гц), 7,18 (1Н, д, J = 8,0 Гц), 7,31 (1H, д, J = 6,5 Гц), 7,41 (1H, д, J = 8,9 Гц), 7,61 (1H, д, J = 8,9 Гц). МС m/z 553,0 [М+Н]+.
Метил-2-метил-2-[32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16,18,24(28),25,30-декаен-2-ил]пропаноат (продолжительное время удерживания)
1H ЯМР (400 МГц, ДМСО-d6): δ 1,22-1,34 (6Н, м), 2,32-2,36 (1Н, м), 2,90-2,95 (2Н, м), 3,35-3,38 (4Н, м), 3,48 (3H, с), 3,62-3,63 (1H, м), 3,86-3,90 (1H, м), 4,00-4,03 (2Н, м), 4,10-4,14 (1H, м), 4,26-4,29 (1H, м), 4,37-4,40 (1H, м), 4,78 (3H, с), 6,17 (1H, с), 6,66 (2Н, д, J = 7,5 Гц), 6,76 (2Н, д, J = 7,8 Гц), 7,18 (1H, д, J = 8,0 Гц), 7,31 (1H, д, J = 8,0 Гц), 7,41 (1Н, д, J = 8,1 Гц), 7,61 (1H, д, J = 8,8 Гц). МС m/z 553,2 [М+Н]+.
К) 2-Метил-2-[32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16,18,24(28),25,30-декаен-2-ил]пропановая кислота
<Хиральная, синтез из хирального метил-2-метил-2-[32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16,18,24(28),25,30-декаен-2-ил]пропаноата (короткое время удерживания)>
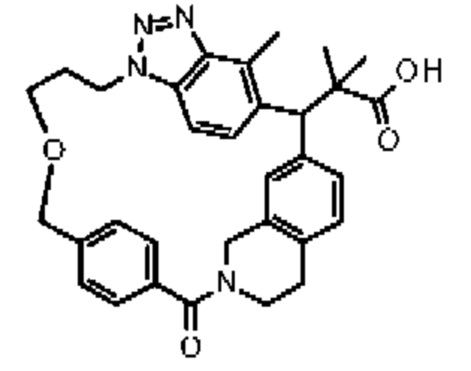
К перемешиваемому раствору хирального метил-2-метил-2-[32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16,18,24(28),25,30-декаен-2-ил]пропаноата (короткое время удерживания) (80 мг) в ДМСО (1,5 мл) добавляли TMSOK (92 мг) при 25°С и нагревали реакционную смесь при 50°С в течение 3 часов. После завершения реакции (по данным ТСХ и ЖХ/МС) реакционную смесь охлаждали до 25°С. Реакционную смесь разбавляли EtOAc и нейтрализовали 1 н. HCl. Водный слой экстрагировали EtOAc. Объединенный органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и выпаривали при пониженном давлении. Полученный неочищенный продукт очищали обращенно-фазовой препаративной ВЭЖХ (способ А) с получением указанного в заголовке соединения (21,15 мг) в виде твердого вещества белого цвета.
1H ЯМР (400 МГц, ДМСО-d6): δ 1,22-1,32 (6Н, м), 2,36 (2Н, шс), 2,90 (2Н, шс), 3,35-3,38 (4Н, м), 3,65-3,67 (1H, м), 3,86-3,96 (3H, м), 4,08-4,12 (1H, м), 4,25-4,28 (1H, м), 4,37-4,40 (1H, м), 4,76-4,79 (3H, м), 6,13 (1H, с), 6,67 (2Н, д, J = 7,4 Гц), 6,76 (2Н, д, J = 7,7 Гц), 7,18 (1H, д, J = 7,7 Гц), 7,37 (1H, д, J = 7,5 Гц), 7,47 (1H, д, J = 8,6 Гц), 7,61 (1H, д, J = 8,5 Гц), 12,35 (1H, шс). МС m/z 539,4 [М+Н]+.
[0182]
Пример 56
2-Метил-2-[32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16,18,24(28),25,30-декаен-2-ил]пропановая кислота
<Хиральная, синтез из хирального метил-2-метил-2-[32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16,18,24(28),25,30-декаен-2-ил]пропаноата (продолжительное время удерживания)>
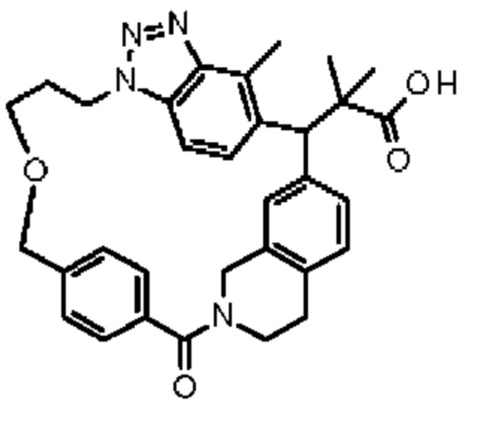
К перемешиваемому раствору хирального метил-2-метил-2-[32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16,18,24(28),25,30-декаен-2-ил]пропаноата (продолжительное время удерживания) (73 мг) в ДМСО (1,5 мл) добавляли TMSOK (84 мг) при 25°С и нагревали реакционную смесь при 50°С в течение 3 часов. После завершения реакции (по данным ТСХ и ЖХ/МС) реакционную смесь охлаждали до 25°С. Реакционную смесь разбавляли EtOAc и нейтрализовали 1 н. HCl. Водный слой экстрагировали EtOAc. Объединенный органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и выпаривали при пониженном давлении. Полученный неочищенный продукт очищали обращенно-фазовой препаративной ВЭЖХ (способ А) с получением указанного в заголовке соединения (16,42 мг) в виде твердого вещества белого цвета.
1Н ЯМР (400 МГц, ДМСО-d6): δ 1,18-1,32 (6Н, м), 2,36 (2Н, шс), 2,90 (2Н, шс), 3,35-3,38 (4Н, м), 3,64 (1H, шс), 3,86-3,99 (3H, м), 4,09-4,12 (1H, м), 4,25-4,28 (1H, м), 4,37-4,40 (1H, м), 4,76-4,79 (3H, м), 6,13 (1Н, с), 6,67 (2Н, д, J = 7,6 Гц), 6,76 (2Н, д, J = 7,7 Гц), 7,18 (1H, д, J = 7,6 Гц), 7,37 (1H, д, J = 8,0 Гц), 7,47 (1H, д, J = 8,6 Гц), 7,61 (1H, д, J = 8,7 Гц), 12,35 (1H, шс). МС m/z 539,4 [М+Н]+.
[0183]
Пример 57
2-[18,30-Дихлор-32-метил-20-оксо-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(26),3(32),4,6,8,16,18,24,27,30-декаен-2-ил]-2-метилпропановая кислота
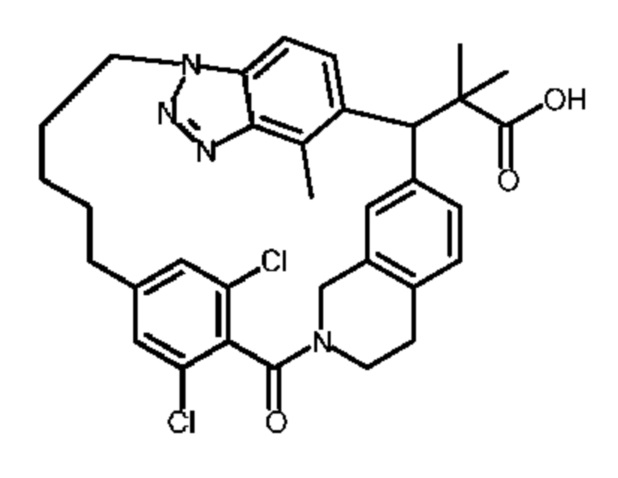
Соединения из примера 57 могут быть получены способами получения, описанными в настоящем документе, способом, представленным в разделе «Примеры», или способом, аналогичным им.
[0184]
Пример 58
2-Метил-2-[18,30,32-триметил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16(31),17,19(30),24(28),25-декаен-2-ил]пропановая кислота <Хиральная, синтез из хирального метил-2-метил-2-[18,30,32-триметил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16,18,24(28),25,30-декаен-2-ил]пропаноата (короткое время удерживания)>
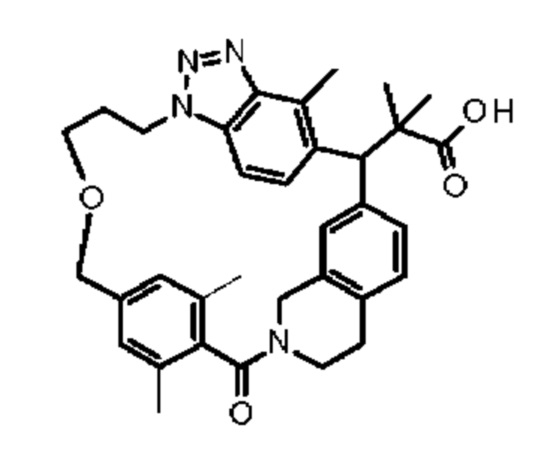
А) трет-Бутил-4-бром-2,6-диметилбензоат
Раствор 4-бром-2,6-диметилбензойной кислоты (1 г) в толуоле (10 мл) нагревали до 100°С в течение 1 часа. К полученной смеси по каплям добавляли N,N-диметилформамид-ди-трет-бутилацеталь (6,2 мл) в толуоле (5 мл) при нагревании и перемешивали реакционную смесь еще 1 час при указанной температуре. После завершения реакции (по данным ТСХ) выпаривали летучие вещества при пониженном давлении. Полученный таким образом неочищенный продукт очищали колоночной хроматографией на силикагеле (SiO2, 40 г, 12% EtOAc/гексан) с получением указанного в заголовке соединения (840 мг) в виде бесцветного маслянистого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ 1.53 (9Н, с), 2.24 (6Н, с), 7.32 (2Н, с).
B) трет-Бутил-4-формил-2,6-диметилбензоат
К перемешиваемому раствору трет-бутил-4-бром-2,6-диметилбензоата (2 г) в ТГФ (20 мл) добавляли n-BuLi (1,6 М в гексане) (4,4 мл) при -78°С и перемешивали реакционную смесь при указанной температуре в течение 15 минут. К полученной смеси добавляли ДМ ФА (1,1 мл) при -78°С и перемешивали реакционную смесь при указанной температуре в течение 15 минут. Реакционную смесь гасили насыщенным водным раствором NH4Cl и экстрагировали этилацетатом. Объединенный органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении с получением указанного в заголовке соединения (1,5 г) в виде твердого вещества коричневого цвета, которое использовали на следующей стадии без очистки.
1H ЯМР (400 МГц, ДМСО-d6): δ 1,56 (9Н, с), 2,33 (6Н, с), 7,62 (2Н, с), 9,95 (1H, с).
C) трет-Бутил-4-[гидроксиметил]-2,6-диметилбензоат
К перемешиваемому раствору трет-бутил-4-формил-2,6-диметилбензоата (3,8 г) в метаноле (35 мл) медленно, по частям добавляли NaBH4 (676 мг) при 0°С и перемешивали реакционную смесь при указанной температуре в течение 20 минут. После завершения реакции (по данным ТСХ) удаляли летучие вещества при пониженном давлении. Остаток растворяли в ледяной воде. Водный слой экстрагировали EtOAc. Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4, и концентрировали при пониженном давлении. Полученный таким образом неочищенный продукт очищали колоночной хроматографией на силикагеле (SiO2, 40 г, 15% EtOAc/гексан) с получением указанного в заголовке соединения (2,7 г) в виде бесцветного маслянистого вещества.
1Н ЯМР (400 МГц, ДМСО-d6): δ 1,54 (9Н, с), 2,23 (6Н, с), 4,42 (2Н, д, J=5,6 Гц), 5,16 (1H, т, J=5,6 Гц), 6,90 (2Н, с).
D) трет-Бутил-4-[бромметил]-2,6-диметилбензоат
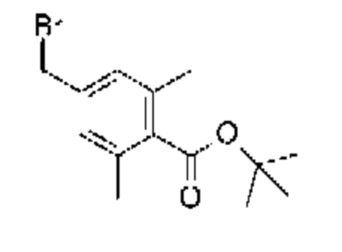
К перемешиваемому раствору трет-бутил-4-[гидроксиметил]-2,6-диметилбензоата (2.8 г) в ТГФ (60 мл) добавляли PPh3 (3,734 г), затем CBr4 (5,9 г) при 0°С и перемешивали реакционную смесь при 0°С в течение 30 минут. После завершения реакции (по данным ТСХ) удаляли летучие вещества при пониженном давлении. Полученный таким образом неочищенный продукт очищали колоночной хроматографией на силикагеле (SiO2, 40 г, 12% EtOAc/гексан) с получением указанного в заголовке соединения (3 г) в виде твердого вещества белого цвета.
1H ЯМР (400 МГц, ДМСО-d6): δ 1,54 (9Н, с), 2,23 (6Н, с), 4,62 (2Н, с), 7,15 (2Н, с).
E) трет-Бутил-4-[[3-[5-бром-4-метил-1H-1,2,3-бензотриазол-1-ил]пропокси]метил]-2,6-диметилбензоат
К перемешиваемому раствору 3-(5-бром-4-метил-1H-1,2,3-бензотриазол-1-ил)пропан-1-ола (7,2 г) в ДМ ФА (50 мл) добавляли NaH (1,28 г) при 0°С и перемешивали реакционную смесь в течение 30 минут при указанной температуре. К полученной смеси добавляли трет-бутил-4-(бромметил)-2,6-диметилбензоат (8 г) и перемешивали реакционную смесь еще 2,5 часа при той же температуре. После завершения реакции (по данным ТСХ и ЖХ/МС) реакционную смесь гасили ледяной водой. Водный слой экстрагировали EtOAc. Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Полученный таким образом неочищенный продукт очищали колоночной хроматографией на силикагеле (SiO2; 120 г; 30% EtOAc/гексан) с получением указанного в заголовке соединения (11 г) в виде маслянистого вещества коричневого цвета.
1Н ЯМР (400 МГц, ДМСО-d6): δ 1,54 (9Н, с), 2,16-2,21 (8Н, м), 2,70 (3Н, с), 3,38 (2Н, т, J=5,8 Гц), 4,31 (2Н, с), 4,77 (2Н, т, J=6,6 Гц), 6,89 (2Н, с), 7,79-7,87 (2Н, м). МС m/z 489,3 [М+Н]+.
F) трет-Бутил-4-[[3-[5-циано-4-метил-1H-1,2,3-бензотриазол-1-ил]пропокси]метил]-2,6-диметилбензоат
К перемешиваемому раствору трет-бутил-4-[[3-[5-бром-4-метил-1H-1,2,3-бензотриазол-1-ил]пропокси]метил]-2,6-диметилбензоата (6 г) в DMA (30 мл) добавляли Zn(CN)2 (866 мг) и цинковую пыль (240 мг) при 25°С и дегазировали реакционную смесь аргоном в течение 10 минут. К полученной смеси добавляли Pd2(dba)3 (563 мг), затем dppf (681 мг) при 25°С и нагревали реакционную смесь при 150°С в течение 6 часов. После завершения реакции (по данным ТСХ и ЖХ/МС) реакционную смесь охлаждали до 25°С, фильтровали через целит и промывали EtOAc. Фильтрат разбавляли водой (в 10 раз) и перемешивали в течение 30 минут. Водный слой экстрагировали EtOAc. Органический слой промывали водой и насыщенным солевым раствором, сушили над безводным Na2SO4, фильтровали и концентрировали при пониженном давлении. Полученный таким образом неочищенный продукт очищали колоночной хроматографией на силикагеле (SiO2, 40 г, 20-25% EtOAc/гексан) с получением указанного в заголовке соединения (3 г) в виде бесцветного вязкого маслянистого вещества.
1Н ЯМР (400 МГц, ДМСО-d6): δ 1,54 (9Н, с), 2,16-2,21 (8Н, м), 2,85 (3Н, с), 3,41 (2Н, т, J=5,8 Гц), 4,26 (2Н, с), 4,83 (2Н, т, J=6,6 Гц), 6,84 (2Н, с), 7,78 (1H, д, J=8,7 Гц), 7,93 (1H, д, J=8,7 Гц). МС m/z 435,0 [М+Н]+.
G) трет-Бутил-4-[[3-[5-формил-4-метил-1H-1,2,3-бензотриазол-1-ил]пропокси]метил]-2,6-диметилбензоат
К перемешиваемому раствору трет-бутил-4-[[3-[5-циано-4-метил-1H-1,2,3-бензотриазол-1-ил]пропокси]метил]-2,6-диметилбензоата (3 г) в смеси пиридина (120 мл), АсОН (60 мл) и воды (60 мл) добавляли NaPO2H2 (6 г), затем Ni Ренея (в воде) (15 мл) и перемешивали реакционную смесь при 50°С в течение 1 часа. После завершения реакции (по данным ТСХ и ЖХ/МС) реакционную смесь фильтровали через целит и промывали EtOAc. Фильтрат разбавляли этилацетатом, промывали 0,5 М водным раствором лимонной кислоты, насыщенным водным раствором NaHCO3, водой и насыщенным солевым раствором. Органический слой сушили над безводным Na2SO4, фильтровали и концентрировали при пониженном давлении. Полученный таким образом неочищенный продукт очищали колоночной хроматографией на силикагеле (SiO2, 40 г, 30-35% EtOAc/гексан) с получением указанного в заголовке соединения (2,1 г) в виде маслянистого вещества коричневого цвета.
1H ЯМР (400 МГц, ДМСО-d6): δ 1,54 (9Н, с), 2,17-2,20 (8Н, м), 3,05 (3Н, с), 3,40 (2Н, т, J=5,8 Гц), 4,30 (2Н, с), 4,81 (2Н, т, J=6,6 Гц), 6,88 (2Н, с), 7,78 (1H, д, J=8,6 Гц), 7,93 (1H, д, J=8,6 Гц), 10,44 (1H, с). МС m/z 438,1 [М+Н]+.
Н) трет-Бутил-7-[[1-[3-[[4-[[трет-бутокси]карбонил]-3,5-диметилфенил]метокси]пропил]-4-метил-1H-1,2,3-бензотриазол-5-ил][гидрокси]метил]-1,2,3,4-тетрагидроизохинолин-2-карбоксилат
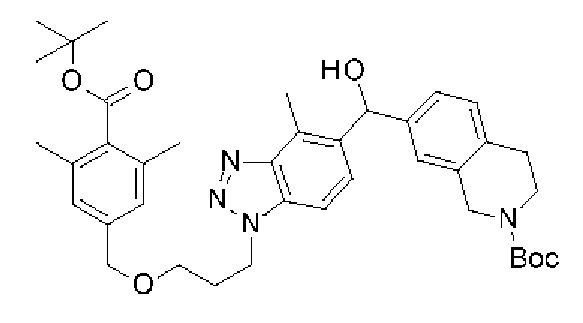
К дегазированному раствору трет-бутил-4-[[3-[5-формил-4-метил-1H-1,2,3-бензотриазол-1-ил]пропокси]метил]-2,6-диметилбензоата (700 мг) в смеси СРМЕ (45 мл) и воды (9 мл) добавляли трет-бутил-7-[тетраметил-1,3,2-диоксаборолан-2-ил]-1,2,3,4-тетрагидроизохинолин-2-карбоксилат (1,725 г), затем К3РО4 (1,02 г) и [RhCl(COD)]2 (158 мг) при 25°С. Реакционную смесь нагревали при 50°С в течение 2 часов. Реакционную смесь охлаждали до 25°С и гасили насыщенным раствором NH4Cl. Водный слой экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Полученный таким образом неочищенный продукт очищали колоночной хроматографией на силикагеле (SiO2, 12 г, 25% EtOAc/гексан) с получением указанного в заголовке соединения (500 мг) в виде светло-желтого вязкого вещества.
МС m/z 671,1 [М+Н]+.
I) трет-Бутил-7-[1-[1-[3-[[4-[(трет-бутокси]карбонил]-3,5-диметилфенил]метокси]пропил]-4-метил-1H-1,2,3-бензотриазол-5-ил]-3-метокси-2,2-диметил-3-оксопропил]-1,2,3,4-тетрагидроизохинолин-2-карбоксилат
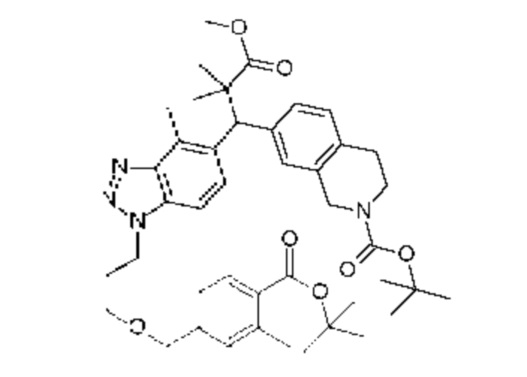
К перемешиваемому раствору трет-бутил-7-[[1-[3-[[4-[[трет-бутокси]карбонил]-3,5-диметилфенил]метокси]пропил]-4-метил-1H-1,2,3-бензотриазол-5-ил][гидрокси]метил]-1,2,3,4-тетрагидроизохинолин-2-карбоксилата (550 мг) в ДХМ (30 мл) добавляли [[1-метокси-2-метилпроп-1-ен-1-ил]окси]триметилсилан (0,9 мл), затем TiCl4 (1 М в ДХМ, 1,8 мл) при -10°С и перемешивали реакционную смесь при -10°С в течение 5 минут. После завершения реакции (по данным ЖХ/МС и ТСХ) реакционную смесь гасили водой. Водный слой подщелачивали насыщенным водным раствором NaHCO3 (рН ~ 8) и фильтровали через слой целита. Водный слой экстрагировали 10% МеОН/ДХМ (3 × 10 мл), объединенный органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали в вакууме с получением указанного в заголовке соединения (600 мг) в виде светло-серого твердого вещества, которое использовали на следующей стадии без дополнительной очистки.
МС m/z 755,6 [М+Н]+.
J) 4-[[3-[5-[3-Метокси-2,2-диметил-3-оксо-1-[1,2,3,4-тетрагидроизохинолин-7-ил]пропил]-4-метил-1H-1,2,3-бензотриазол-1-ил]пропокси]метил]-2,6-диметилбензойная кислота
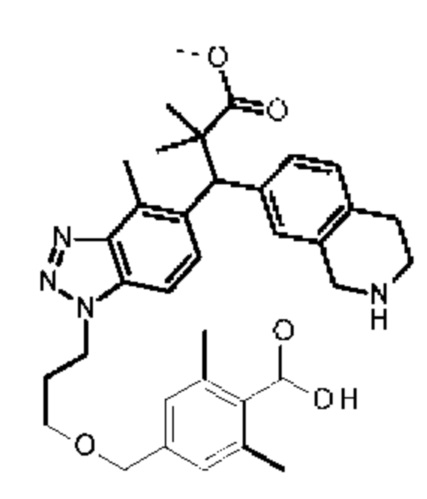
К перемешиваемому раствору трет-бутил-7-[1-[1-[3-[[4-[[трет-бутокси]карбонил]-3,5-диметилфенил]метокси]пропил]-4-метил-1H-1,2,3-бензотриазол-5-ил]-3-метокси-2,2-диметил-3-оксопропил]-1,2,3,4-тетрагидроизохинолин-2-карбоксилата (1,4 г) в диоксане (14 мл) по каплям добавляли HCl (4 M в диоксане, 14 мл) при 25°С и перемешивали реакционную смесь при указанной температуре в течение 2 часов. После завершения реакции (по данным ЖХ/МС) удаляли летучие вещества при пониженном давлении и очищали полученный неочищенный продукт обращенно-фазовой препаративной ВЭЖХ (способ А) с получением указанного в заголовке соединения (600 мг) в виде грязновато-белого твердого вещества.
1Н ЯМР (400 МГц, ДМСО-d6): δ 1,24-1,30 (6Н, м), 1,61 (6Н, с), 2,23-2,25 (2Н, м), 2,74 (3Н, с), 2,90 (2Н, шс), 3,13-3,33 (5Н, м), 3,42 (5Н, с), 3,82-3,86 (1H, м), 4,02-4,05 (1H, м), 4,31-4,34 (1H, м), 4,69-4,73 (3Н, м), 6,18 (2Н, с), 6,73 (1H, с), 7,07 (1H, д, J=7,9 Гц), 7,34 (1Н, д, J=7,0 Гц), 7,54 (1H, д, J=8,9 Гц), 7,62 (1H, д, J=8,7 Гц). МС m/z 599,1 [М+Н]+.
К) Метил-2-метил-2-[18,30,32-триметил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16,18,24(28),25,30-декаен-2-ил]пропаноат (короткое время удерживания) L) Метил-2-метил-2-[18,30,32-триметил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16,18,24(28),25,30-декаен-2-ил]пропаноат (продолжительное время удерживания)
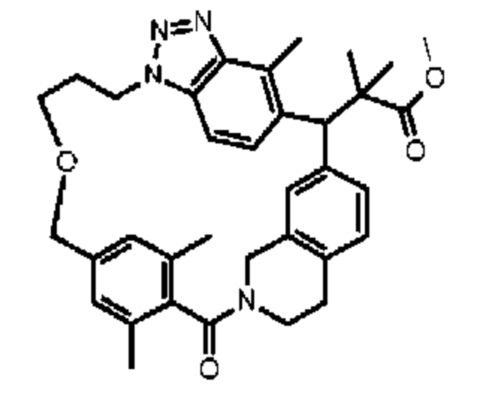
К перемешиваемому раствору HATU (330,643 мг) в ДМФА(10 мл) через поршневый насос добавляли смесь 4-[[3-[5-[3-метокси-2,2-диметил-3-оксо-1-[1,2,3,4-тетрагидроизохинолин-7-ил]пропил]-4-метил-1Н-1,2,3-бензотриазол-1-ил]пропокси]метил]бензойной кислоты (400 мг, 0,669 ммоль) и N,N-диизопропилэтиламина (0,437 мл, 2,508 ммоль) в ДМФА (12 мл) в течение 1 часа при 25°С и перемешивали реакционную смесь при комнатной температуре в течение 3 часов. После завершения реакции (по данным ЖХ/МС); реакционную смесь разбавляли насыщенным раствором NaHCO3. Водный слой экстрагировали EtOAc, объединенный органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и выпаривали при пониженном давлении. Полученный неочищенный продукт очищали нормально-фазовой препаративной ВЭЖХ (способ С) с получением метил-2-метил-2-[18,30,32-триметил-20-оксо- 14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16,18,24(28),25,30-декаен-2-ил]пропаноата (короткое время удерживания) (55 мг) и метил-2-метил-2-[18,30,32-триметил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16,18,24(28),25,30-декаен-2-ил]пропаноата (продолжительное время удерживания) (60 мг).
Метил-2-метил-2-[18,30,32-триметил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16,18,24(28),25,30-декаен-2-ил]пропаноат (короткое время удерживания) МС m/z 581,0 [М+Н]+.
Метил-2-метил-2-[18,30,32-триметил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16,18,24(28),25,30-декаен-2-ил]пропаноат (продолжительное время удерживания)
МС m/z 580,9 [М+Н]+.
М) 2-Метил-2-[18,30,32-триметил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16(31),17,19(30),24(28),25-декаен-2-ил]пропановая кислота <Хиральная, синтез из хирального метил-2-метил-2-[18,30,32-триметил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16,18,24(28),25,30-декаен-2-ил]пропаноата (короткое время удерживания)>
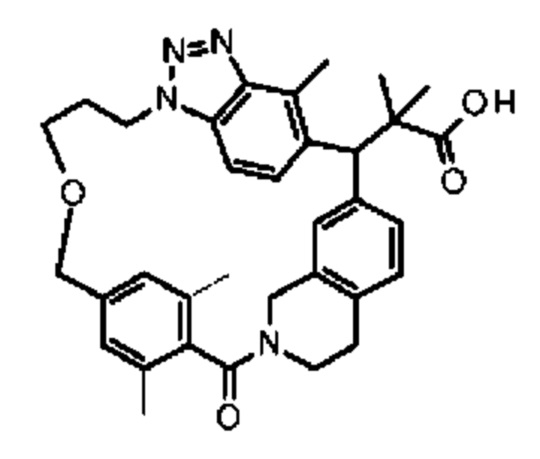
К перемешиваемому раствору метил-2-метил-2-[18,30,32-триметил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16,18,24(28),25,30-декаен-2-ил]пропаноата (короткое время удерживания) (121 мг) в ДМСО (2,3 мл) добавляли TMSOK (133,82 мг) при 25°С и нагревали реакционную смесь при 50°С в течение 3 часов. После завершения реакции (по данным ТСХ и ЖХ/МС) реакционную смесь охлаждали до 25°С. Реакционную смесь разбавляли EtOAc и нейтрализовали 1 н. HCl. Отделяли органический слой и экстрагировали водный слой EtOAc. Объединенный органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Полученный неочищенный продукт очищали обращенно-фазовой препаративной ВЭЖХ (способ А) с получением указанного в заголовке соединения (40 мг) в виде твердого вещества белого цвета.
1H ЯМР (400 МГц, ДМСО-d6): δ 1,15 (3Н, с), 1,31 (3H, с), 1,34 (3Н, с), 1,92 (3Н, с), 2,39 (5Н, шс), 2,90 (2Н, т, J=6,4 Гц), 3,34-3,35 (2Н, м), 3,52-3,63 (2Н, м), 3,98-4,25 (4Н, м), 4,68-4,73 (2Н, м), 4,80-4,85 (1H, м), 5,84 (1H, с), 5,94 (1H, с), 6,78 (1H, с), 7,15 (1H, д, J=7,9 Гц), 7,32-7,38 (2Н, м), 7,55 (1H, д, J=8,7 Гц), 12,30 (1H, шс). МС m/z 567,5 [М+Н]+.
[0185]
Пример 59
2-Метил-2-[18,30,32-триметил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16(31),17,19(30),24(28),25-декаен-2-ил]пропановая кислота <Хиральная, синтез из хирального метил-2-метил-2-[18,30,32-триметил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло [19.5.3.216,19.13,7.06,10.024,28] дотриаконта-1(27),3(32),4,6,8,16,18,24(28),25,30-декаен-2-ил]пропаноата (продолжительное время удерживания)>
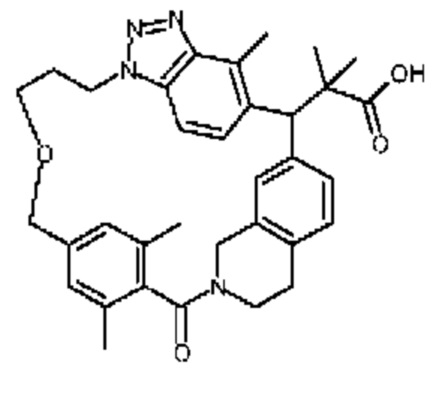
К перемешиваемому раствору метил-2-метил-2-[18,30,32-триметил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло [19.5.3.216,19.13,7.06,10.024,28] дотриаконта-1(27),3(32),4,6,8,16,18,24(28),25,30-декаен-2-ил]пропаноата (продолжительное время удерживания) (100 мг) в ДМСО (1,8 мл) добавляли TMSOK (110,59 мг) при 25°С и нагревали реакционную смесь при 50°С в течение 3 часов. После завершения реакции (по данным ТСХ и ЖХ/МС) реакционную смесь охлаждали до 25°С. Реакционную смесь разбавляли EtOAc и нейтрализовали 1 н. HCl. Водный слой экстрагировали EtOAc. Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Полученный неочищенный продукт очищали обращенно-фазовой препаративной ВЭЖХ (способ А) с получением указанного в заголовке соединения (40 мг) в виде твердого вещества белого цвета. 1H ЯМР (400 МГц, ДМСО-d6): δ 1,15 (3Н, с), 1,31 (3Н, с), 1,34 (3Н, с), 1,92 (3Н, с), 2,39 (5Н, шс), 2,90 (2Н, т, J=6,3 Гц), 3,33-3,34 (2Н, м), 3,52-3,65 (2Н, м), 3,98-4,02 (1H, м), 4,09-4,25 (3H, м), 4,66-4,71 (2Н, м) 4,80-4,85 (1H, м), 5,83 (1H, с), 5,94 (1H, с), 6,78 (1H, с), 7,15 (1H, д, J=7,8 Гц), 7,33 (1H, д, J=8,0 Гц), 7,37 (1H, д, J=8,8 Гц), 7,55 (1H, д, J=8,8 Гц), 12,22 (1H, шс). МС m/z 567,5 [М+Н]+.
[0186] Пример 60
2-[18,30-Дихлор-32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16,18,24(28),25,30-декаен-2-ил]-2-метилпропановая кислота <Хиральная, синтез из хирального метил-2-[18,30-дихлор-32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло [19.5.3.216,19.13,7.06,10.024,28] дотриаконта-1(27),3(32),4,6,8,16,18,24(28),25,30-декаен-2-ил]-2-метилпропаноата (короткое время удерживания)>
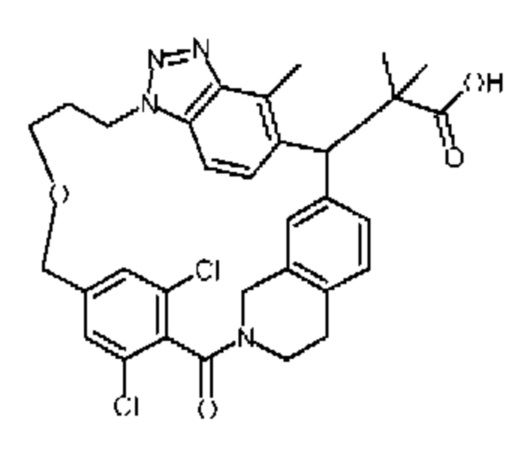
А) трет-Бутил-4-бром-2,6-дихлорбензоат
Раствор 4-бром-2,6-дихлорбензойной кислоты (5 г) в толуоле (50 мл) нагревали до 100°С в течение 1 часа. К полученной смеси по каплям добавляли N,N-диметилформамид-ди-трет-бутилацеталь (27 мл) в толуоле (20 мл) при нагревании и перемешивали реакционную смесь еще 1 час. После завершения реакции (по данным ТСХ) выпаривали летучие вещества при пониженном давлении и очищали полученный таким образом неочищенный продукт колоночной хроматографией на силикагеле (SiO2, 40 г, 10% EtOAc/гексан) с получением указанного в заголовке соединения (5,6 г) в виде твердого вещества белого цвета.
1Н ЯМР (400 МГц, ДМСО-d6): δ 1,54 (9Н, с), 7,90 (2Н, с).
B) трет-Бутил-2,6-дихлор-4-формилбензоат
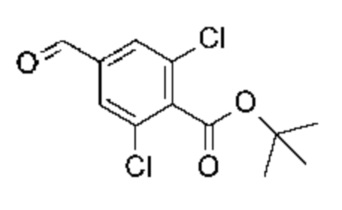
К перемешиваемому раствору трет-бутил-4-бром-2,6-дихлорбензоата (5,6 г) в ТГФ (100 мл) добавляли iPrMgBr (2 M в ТГФ) (17 мл) при 0°С и перемешивали реакционную смесь при указанной температуре еще 15 минут. К полученной смеси добавляли ДМФА (0,6 мл) при 0°С и перемешивали реакционную смесь при указанной температуре еще 15 минут. После завершения реакции (по данным ТСХ) реакционную смесь гасили насыщенным водным раствором NH4Cl. Водный слой экстрагировали EtOAc, объединенные органические слои промывали насыщенным солевым раствором; сушили над безводным Na2SO4 и концентрировали при пониженном давлении с получением указанного в заголовке соединения (4,6 г) в виде бесцветного маслянистого вещества, которое использовали на следующей стадии без дополнительной очистки.
1Н ЯМР (400 МГц, ДМСО-d6): δ 1,55 (9Н, с), 8,04 (2Н, с), 9,97 (1H, с).
C) трет-Бутил-2,6-дихлор-4-[гидроксиметил]бензоат
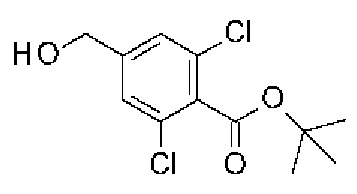
К перемешиваемому раствору трет-бутил-2,6-дихлор-4-формилбензоата (4,6 г) в метаноле (35 мл) медленно, по частям добавляли NaBH4 (700 мг) при 0°С и перемешивали реакционную смесь при указанной температуре в течение 20 минут. После завершения реакции (по данным ТСХ) удаляли летучие вещества при пониженном давлении. Остаток выливали в ледяную воду. Водный слой экстрагировали EtOAc, объединенные органические слои промывали насыщенным солевым раствором; сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Полученный таким образом неочищенный продукт очищали колоночной хроматографией на силикагеле (SiO2, 40 г, 10% EtOAc/гексан) с получением указанного в заголовке соединения (3,3 г) в виде бесцветной жидкости.
1H ЯМР (400 МГц, ДМСО-d6): δ 1,54 (9Н, с), 4,51 (2Н, д, J=5,8 Гц), 5,51 (1H, т, J=5,8 Гц), 7,44 (2Н, с).
D) трет-Бутил-4-(бромметил)-2,6-дихлорбензоат
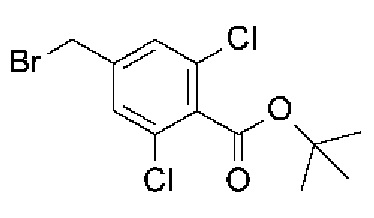
К перемешиваемому раствору трет-бутил-2,6-дихлор-4-[гидроксиметил]бензоата (3,7 г) в ТГФ (45 мл) добавляли PPh3 (8,7 г), затем NBS (5,24 г) при 0°С и перемешивали реакционную смесь при 0°С в течение 2 часов. После завершения реакции (по данным ТСХ) удаляли летучие вещества при пониженном давлении. Полученный таким образом неочищенный продукт очищали колоночной хроматографией на силикагеле (SiO2, 40 г, 10% EtOAc/гексан) с получением указанного в заголовке соединения (3,8 г) в виде твердого вещества белого цвета.
1Н ЯМР (400 МГц, ДМСО-d6): δ 1,55 (9Н, с), 4,69 (2Н, с), 7,67 (2Н, с).
E) 3-[5-Этенил-4-метил-1H-1,2,3-бензотриазол-1-ил]пропан-1-ол
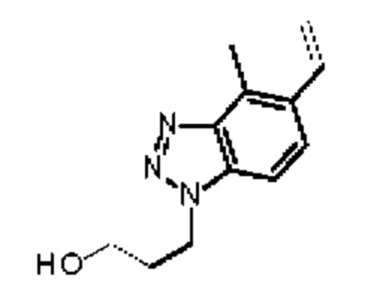
К дегазированному раствору 3-[5-бром-4-метил-1Н-1,2,3-бензотриазол-1-ил]пропан-1-ола (5 г) в смеси ТГФ (50 мл) и н-пропанола (100 мл) добавляли винилтрифторборат калия (10 г), затем ТЭА (10 мл) при 25°С и дегазировали реакционную смесь аргоном в течение 15 минут. К полученной смеси добавляли PdCl2(dppf), ДХМ (1,5 г) при 25°С и нагревали реакционную смесь при 100°С в течение 2 часов. После завершения реакции (по данным ТСХ и ЖХ/МС) реакционную смесь охлаждали до 25°С. Удаляли летучие вещества при пониженном давлении и растворяли полученный неочищенный продукт в воде. Водный слой экстрагировали EtOAc, объединенные органические слои промывали насыщенным солевым раствором; сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Полученный таким образом неочищенный продукт очищали колоночной хроматографией на силикагеле (SiO4, 40 г, 60% EtOAc/гексан) с получением указанного в заголовке соединения (3,5 г) в виде жидкости коричневого цвета.
1H ЯМР (400 МГц, ДМСО-d6): δ 2,04 (2Н, т, J=6,4 Гц), 2,70 (3H, с), 3,38 (2Н, к, J=5,6 Гц), 4,71 (3H, т, J=7,0 Гц), 5,38 (1H, д, J=11,0 Гц), 5,75-5,83 (1H, м), 7,08-7,15 (1H, м), 7,60-7,69 (1H, м), 7,75 (1H, д, J=8,7 Гц). МС m/z 218,0 [М+Н]+.
F) трет-Бутил-2,6-дихлор-4-[[3-[5-этенил-4-метил-1H-1,2,3-бензотриазол-1-ил]пропокси]метил]бензоат
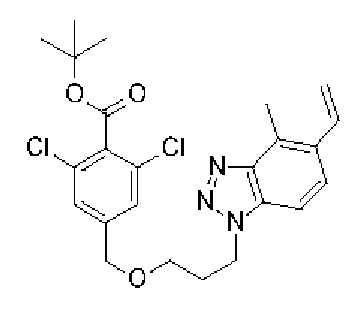
К перемешиваемому раствору 3-[5-этенил-4-метил-1H-1,2,3-бензотриазол-1-ил]пропан-1-ола (4,5 г) в ТГФ (100 мл) добавляли NaH (60% в масле, 2,5 г) при 0°С и перемешивали реакционную смесь при 25°С в течение 30 минут. К полученной смеси добавляли трет-бутил-4-[бромметил]-2,6-дихлорбензоат (7 г) при 0°С и перемешивали реакционную смесь при 25°С в течение 4 часов. После завершения реакции (по данным ТСХ и ЖХ/МС) реакционную смесь гасили ледяной водой. Водный слой экстрагировали EtOAc, объединенные органические слои промывали насыщенным солевым раствором; сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Полученный таким образом неочищенный продукт очищали колоночной хроматографией на силикагеле (SiO2; 120 г; 10%EtOAc/гексан) с получением указанного в заголовке соединения (6 г) в виде жидкости коричневого цвета.
1H ЯМР (400 МГц, ДМСО-d6): δ 1,55 (9Н, с), 2,15-2,21 (2Н, м), 2,68 (3H, с), 3,42 (2Н, т, J=5,7 Гц), 4,39 (2Н, с), 4,77 (2Н, т, J=6,6 Гц), 5,36-5,39 (1H, м), 5,77-5,80 (1H, м), 7,07-7,11 (1H, м), 7,34 (2Н, с), 7,62 (1H, д, J=8,8 Гц), 7,73 (1H, д, J=8,7 Гц). МС m/z 475,8 [М+Н]+.
G) трет-Бутил-2,6-дихлор-4-[[3-[5-(гидроксиметил]-4-метил-1H-1,2,3-бензотриазол-1-ил]пропокси]метил]бензоат
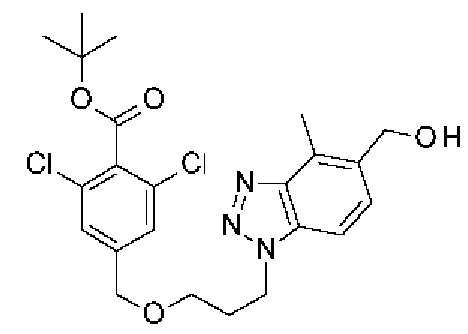
К перемешиваемому раствору трет-бутил-2,6-дихлор-4-[[3-[5-этенил-4-метил-1H-1,2,3-бензотриазол-1-ил]пропокси]метил]бензоата (4,1 г) в ДХМ (80 мл) добавляли пиридин (2,08 мл) и охлаждали до -78°С. Через полученную смесь пропускали газообразный озон в течение 10 минут при -78°С. После завершения реакции (по данным ТСХ) реакционную смесь нагревали до 25°С. Реакционную смесь разбавляли ДХМ и гасили 0,5 н. лимонной кислотой. Водный слой экстрагировали ДХМ, объединенные органические слои промывали насыщенным солевым раствором; сушили над безводным Na2SO4 и концентрировали при пониженном давлении с получением пригодной для разделения смеси 1-[3-[{4-[[трет-бутокси)карбонил]-3,5-дихлорфенил}метокси)пропил]-4-метил-1H-1,2,3-бензотриазол-5-карбоновой кислоты и трет-бутил-2,6-дихлор-4-[[3-[5-формил-4-метил-1H-1,2,3-бензотриазол-1-ил]пропокси]метил]бензоата (4 г, неочищенная) в виде бесцветной жидкости, которую использовали на следующей стадии без дополнительной очистки.
К раствору 1-[3-[[4-[[трет-бутокси]карбонил]-3,5-дихлорфенил]метокси]пропил]-4-метил-1H-1,2,3-бензотриазол-5-карбоновой кислоты и трет-бутил-2,6-дихлор-4-[[3-[5-формил-4-метил-1H-1,2,3-бензотриазол-1-ил]пропокси]метил]бензоата (4,6 г) в ТГФ (50 мл) последовательно добавляли NMM (1,5 мл), затем изобутилхлорформиат (2,4 мл) при -15°С и перемешивали реакционную смесь в течение 10 минут при указанной температуре. После завершения реакции (по данным ТСХ) реакционную смесь фильтровали и промывали осадок ТГФ (2 X 50 мл). К нему одной порцией добавляли NaBH4 (1,4 г) в воде (10 мл) при -15°С и перемешивали реакционную смесь при указанной температуре в течение 5 минут. После завершения реакции (по данным ТСХ) добавляли воду (125 мл). Водный слой экстрагировали ДХМ, объединенные органические слои промывали насыщенным солевым раствором; сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Полученный таким образом неочищенный продукт очищали колоночной хроматографией на силикагеле (SiO2; 40 г; 40% EtOAc/гексан) с получением указанного в заголовке соединения (1,9 г) в виде бесцветной жидкости.
МС m/z 479,7 [М+Н]+.
Н) трет-Бутил-2,6-дихлор-4-[[3-[5-формил-4-метил-1H-1,2,3-бензотриазол-1-ил]пропокси]метил]бензоат
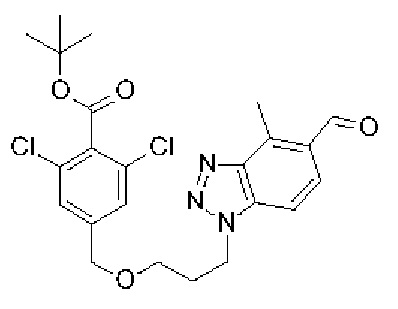
К перемешиваемому раствору трет-бутил-2,6-дихлор-4-[[3-[5-[гидроксиметил]-4-метил-1H-1,2,3-бензотриазол-1-ил]пропокси]метил]бензоата (1,9 г) в ДХМ (50 мл) добавляли активный MnO2 (6 г) при 25°С и перемешивали реакционную смесь при 25°С в течение 4 часов. После завершения реакции (по данным ТСХ) отфильтровывали нерастворимое вещество через слой целита. Фильтрат выпаривали при пониженном давлении с получением указанного в заголовке соединения (1,7 г) в виде жидкости коричневого цвета, которую использовали на следующей стадии без дополнительной очистки. 1Н ЯМР (400 МГц, ДМСО-d6): δ 1,55 (9Н, с), 2,19-2,25 (2Н, м), 3,02 (3H, с), 3,47 (2Н, т, J=5,7 Гц), 4,33 (2Н, с), 4,83 (2Н, т, J=6,4 Гц), 7,24 (2Н, с), 7,80 (1H, д, J=8,6 Гц), 7,92 (1H, д, J=8,6 Гц), 10,42 (1H, с). МС m/z 477,9 [М+Н]+.
I) трет-Бутил-7-[[1-(3-[[3,5-дихлор-4-[метоксикарбонил]фенил]метокси]пропил]-4-метил-1Н-1,2,3-бензотриазол-5-ил][гидрокси]метил]-1,2,3,4-тетрагидроизохинолин-2-карбоксилат
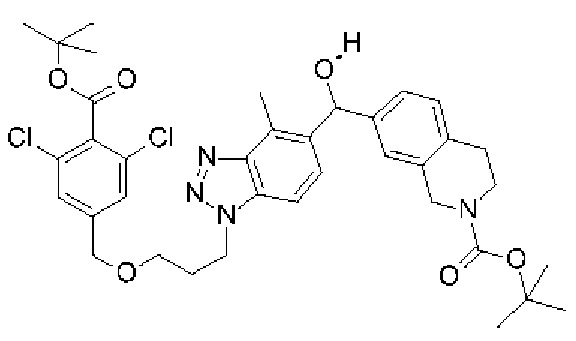
К дегазированному раствору трет-бутил-2,6-дихлор-4-[[3-[5-формил-4-метил-1H-1,2,3-бензотриазол-1-ил]пропокси]метил]бензоата (1,2 г) в смеси СРМЕ (50 мл) и воды (10 мл) добавляли трет-бутил-7-[тетраметил-1,3,2-диоксаборолан-2-ил]-1,2,3,4-тетрагидроизохинолин-2-карбоксилат (2,7 г), затем К3РО4 (1,6 г) при 25°С. К полученной смеси добавляли [RhCl(COD)]2 (627 мг) при 25°С и нагревали реакционную смесь при 50°С в течение 2 часов. ТСХ и ЖХ/МС реакционной смеси показали образование требуемого продукта вместе с непрореагировавшим исходным веществом. Реакционную смесь охлаждали до 25°С и гасили насыщенным водным раствором NH4Cl. Водный слой экстрагировали EtOAc, объединенные органические слои промывали водой, насыщенным солевым раствором, сушили над безводным Na2SO4, фильтровали и концентрировали фильтрат при пониженном давлении. Полученный таким образом неочищенный продукт очищали колоночной хроматографией на силикагеле (SiO2, 12 г, 25% EtOAc/гексан) с получением указанного в заголовке соединения (800 мг) в виде желтого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ 1,40 (9Н, с), 1,55 (9Н, с), 2,18 (2Н, т, J=5,8 Гц), 2,69-2,74 (5Н, м), 3,42-3,50 (4Н, м), 4,36-4,42 (4Н, м), 4,74 (2Н, т, J=6,1 Гц), 5,86 (1H, д, J=3,4 Гц), 6,03 (1H, д, J=3,7 Гц), 7,04-7,13 (3H, м), 7,41 (2Н, с), 7,59 (2Н, с). МС m/z 711,2 [М+Н]+.
J) трет-Бутил-2,6-дихлор-4-[[3-[5-[3-метокси-2,2-диметил-3-оксо-1-[1,2,3,4-тетрагидроизохинолин-7-ил]пропил]-4-метил-1Н-1,2,3-бензотриазол-1-ил]пропокси]метил]бензоат
К перемешиваемому раствору трет-бутил-7-[[1-(3-[[3,5-дихлор-4-[метоксикарбонил]фенил]метокси]пропил]-4-метил-1H-1,2,3-бензотриазол-5-ил][гидрокси]метил]-1,2,3,4-тетрагидроизохинолин-2-карбоксилата (970 мг) в ДХМ (30 мл) добавляли [(1-метокси-2-метилпроп-1-ен-1-ил)окси]триметилсилан (1,5 мл), затем TiCl4 (1 M в ДХМ, 3 мл) при 0°С и перемешивали реакционную смесь при указанной температуре в течение 5 минут. После завершения реакции (по данным ЖХ/МС и ТСХ) реакционную смесь гасили водой. Водный слой подщелачивали насыщенным раствором NaHCO3 (рН ~ 8) и фильтровали через слой целита. После фильтрования экстрагировали водный слой 10% МеОН/ДХМ (3 × 50 мл), промывали объединенный органический слой насыщенным солевым раствором, сушили над безводным Na2SO4 и выпаривали с получением указанного в заголовке соединения (1 г, неочищенное) в виде бесцветной жидкости, которую использовали на следующей стадии без дополнительной очистки. МС m/z 795,3 [М+Н]+.
К) 2,6-Дихлор-4-[[3-[5-[3-метокси-2,2-диметил-3-оксо-1-[1,2,3,4-тетрагидроизохинолин-7-ил]пропил]-4-метил-1H-1,2,3-бензотриазол-1-ил]пропокси]метил]бензойная кислота
К перемешиваемому раствору трет-бутил-2,6-дихлор-4-[[3-[5-[3-метокси-2,2-диметил-3-оксо-1-[1,2,3,4-тетрагидроизохинолин-7-ил]пропил]-4-метил-1Н-1,2,3-бензотриазол-1-ил]пропокси]метил]бензоата (970 мг) в диоксане (10 мл) по каплям добавляли HCl (4 M в диоксане, 10 мл) при 25°С и перемешивали реакционную смесь при указанной температуре в течение 2 часов. После завершения реакции (по данным ЖХ/МС) удаляли летучие вещества при пониженном давлении и очищали полученный неочищенный продукт обращенно-фазовой препаративной ВЭЖХ (способ А) с получением указанного в заголовке соединения (250 мг) в виде твердого вещества белого цвета. 1Н ЯМР (400 МГц, ДМСО-d6): δ 1,26-1,30 (6Н, м), 2,25-2,29 (2Н, м), 2,78 (3H, с), 2,90-2,92 (2Н, м), 3,13-3,28 (4Н, м), 3,39-3,41 (1H, м), 3,43 (3H, с), 3,82-3,87 (1Н, м), 4,04-4,13 (2Н, м), 4,34-4,38 (1Н, м), 4,63-4,68 (1Н, м), 4,74-4,79 (2Н, м), 6,71 (2Н, с), 6,98 (1Н, с), 7,03 (1H, д, J=8,0 Гц), 7,32 (1H, д, J=7,5 Гц), 7,54 (1H, д, J=8,8 Гц), 7,59 (1H, д, J=8,6 Гц), 10,10 (1H, шс). МС m/z 638,6 [М+Н]+.
L) Метил-2-[18,30-дихлор-32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16,18,24(28),25,30-декаен-2-ил]-2-метилпропаноат (короткое время удерживания)
М) Метил-2-[18,30-дихлор-32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16,18,24(28),25,30-декаен-2-ил]-2-метилпропаноат (продолжительное время удерживания)
К раствору HATU (293 мг) в ДМФА (15 мл) через поршневый насос добавляли смесь 2,6-дихлор-4-[[3-[5-[3-метокси-2,2-диметил-3-оксо-1-[1,2,3,4-тетрагидроизохинолин-7-ил]пропил]-4-метил-1H-1,2,3-бензотриазол-1-ил]пропокси]метил]бензойной кислоты (380 мг) и N,N-диизопропилэтиламина (0,5 мл) в ДМ ФА (20 мл) при 25°С в течение 1 часа и перемешивали реакционную смесь при указанной температуре в течение 3 часов. После завершения реакции (по данным ЖХ/МС) реакционную смесь разбавляли насыщенным раствором NaHCO3. Водный слой экстрагировали EtOAc, объединенный органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и выпаривали при пониженном давлении с получением метил-2-[18,30-дихлор-32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16,18,24(28),25,30-декаен-2-ил]-2-метилпропаноата (рацемат, 250 мг, неочищенный) в виде твердого вещества белого цвета.
Полученный неочищенный продукт очищали нормально-фазовой хиральной ВХЖХ (способ С) с получением метил-2-[18,30-дихлор-32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16,18,24(28),25,30-декаен-2-ил]-2-метилпропаноата (короткое время удерживания) (55 мг) и метил-2-[18,30-дихлор-32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16,18,24(28),25,30-декаен-2-ил]-2-метилпропаноата (продолжительное время удерживания) (45 мг) в виде твердого вещества белого цвета.
Метил-2-[18,30-дихлор-32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16,18,24(28),25,30-декаен-2-ил]-2-метилпропаноат (короткое время удерживания)
1H ЯМР (400 МГц, ДМСО-d6): δ 1,23-1,27 (6Н, м), 1,32 (3H, с), 2,19-2,52 (5Н, м), 2,89-2,92 (2Н, м), 3,39-3,40 (2Н, м), 3,61-3,70 (2Н, м), 4,01-4,09 (2Н, м), 4,22-4,34 (2Н, м), 4,72-4,80 (3H, м), 5,98 (1H, с), 6,31 (1Н, с), 7,12 (1H, д, J=7,6 Гц), 7,24-7,29 (3H, м), 7,55 (1Н, д, J=8,7 Гц). МС m/z 621,0 [М+Н]+.
Метил-2-[18,30-дихлор-32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16,18,24(28),25,30-декаен-2-ил]-2-метилпропаноат (продолжительное время удерживания)
1Н ЯМР (400 МГц, ДМСО-d6): δ 1,17-1,30 (6Н, м), 1,32 (3H, с), 2,19-2,52 (5Н, м), 2,90-2,92 (2Н, м), 3,39-3,40 (2Н, м), 3,57-3,68 (2Н, м), 4,01-4,09 (2Н, м), 4,22-4,34 (2Н, м), 4,72-4,80 (3H, м), 5,98 (1H, с), 6,31 (1H, с), 7,12 (1H, д, J=8,1 Гц), 7,24-7,29 (3H, м), 7,55 (1H, д, J=9,0 Гц). МС m/z 621,0 [М+Н]+.
N) 2-[18,30-Дихлор-32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16,18,24(28),25,30-декаен-2-ил]-2-метилпропановая кислота <Хиральная, синтез из хирального метил-2-[18,30-дихлор-32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16,18,24(28),25,30-декаен-2-ил]-2-метилпропаноата (короткое время удерживания)>
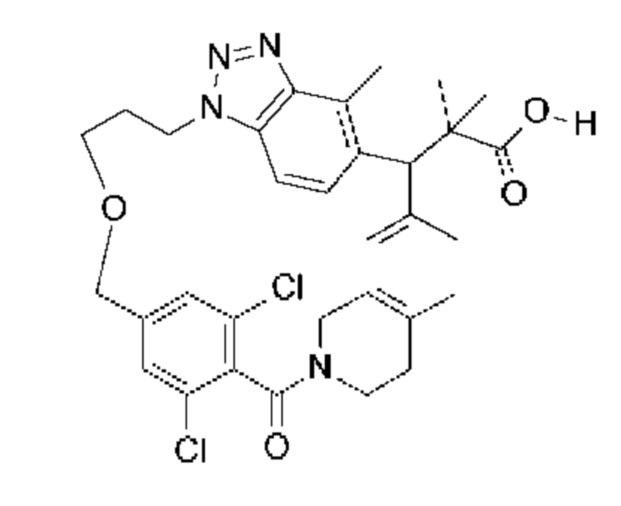
К перемешиваемому раствору метил-2-[18,30-дихлор-32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16,18,24(28),25,30-декаен-2-ил]-2-метилпропаноата (короткое время удерживания) (100 мг) в смеси ДМСО (2 мл) и МеОН (2 мл) добавляли водный раствор КОН (8 н., 1 мл) при 25°С и нагревали реакционную смесь при 100°С в течение 3 часов. После завершения реакции (по данным ЖХ/МС) реакционную смесь охлаждали до 25°С. Реакционную смесь разбавляли EtOAc и нейтрализовали 1 н. HCl. Водный слой экстрагировали EtOAc, объединенный органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и выпаривали при пониженном давлении. Полученный неочищенный продукт очищали обращенно-фазовой препаративной ВЭЖХ (способ А) с получением указанного в заголовке соединения (32,65 мг) в виде грязновато-белого вязкого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ 1,15-1,30 (6Н, м), 2,38-2,50 (5Н, м), 2,91 (2Н, т, J=6,5 Гц), 3,29-3,42 (2Н, м), 3,58-3,62 (1H, м), 3,69-3,72 (1H, м), 3,99-4,07 (2Н, м), 4,22-4,35 (2Н, м), 4,71-4,82 (3H, м), 5,95 (1H, с), 6,34 (1H, с), 7,12 (1Н, д, J=7,9 Гц), 7,28-7,36 (3H, м), 7,55 (1H, д, J=8,7 Гц), 12,30 (1H, шс). МС m/z 607,5 [М+Н]+.
[0187]
Пример 61
2-[18,30-Дихлор-32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16,18,24(28),25,30-декаен-2-ил]-2-метилпропановая кислота <Хиральная, синтез из хирального метил-2-[18,30-дихлор-32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло [19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16,18,24(28),25,30-декаен-2-ил]-2-метилпропаноата (продолжительное время удерживания)>
К перемешиваемому раствору метил-2-[18,30-дихлор-32-метил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16,18,24(28),25,30-декаен-2-ил]-2-метилпропаноата (продолжительное время удерживания) (100 мг) в смеси ДМСО (2 мл) и МеОН (2 мл) добавляли КОН (8 н., 1 мл) при 25°С и нагревали реакционную смесь при 100°С в течение 3 часов. После завершения реакции (по данным ЖХ/МС) реакционную смесь охлаждали до 25°С. Реакционную смесь разбавляли EtOAc и нейтрализовали 1 н. HCl. Водный слой экстрагировали EtOAc, объединенный органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и выпаривали при пониженном давлении. Полученный неочищенный продукт очищали обращенно-фазовой препаративной ВЭЖХ (способ А) с получением указанного в заголовке соединения (22,16 мг) в виде грязновато-белого вязкого вещества.
1H ЯМР (400 МГц, ДМСО-d6): δ 1,14-1,33 (6Н, м), 2,32-2,42 (5Н, м), 2,90 (2Н, т, J=6,2 Гц), 3,31-3,41 (2Н, м), 3,58-3,62 (1H, м), 3,67-3,63 (1H, м), 3,98-4,06 (2Н, м), 4,22-4,34 (2Н, м), 4,70-4,81 (3H, м), 5,95 (1H, с), 6,34 (1H, с), 7,12 (1H, д, J=7,8 Гц), 7,28-7,36 (3H, м), 7,55 (1H, д, J=8,7 Гц), 12,27 (1H, шс). МС m/z 607,5 [М+Н]+.
[0188]
Пример 62
2-Метил-2-[32-метил-20-оксо-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16(31),17,19(30),24(28),25-декаен-2-ил]пропановая кислота
<Хиральная, синтез из хирального метил-2-метил-2-[32-метил-20-оксо-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16(31),17,19(30),24(28),25-декаен-2-ил]пропаноата (короткое время удерживания)>
А) трет-Бутил-4-[5-[4-метил-5-винил-1H-бензо[d][1,2,3]триазол-1-ил]пентил]бензоат
Раствор винилтрифторбората калия (1,50 г), PdCl2(dppf)-CH2Cl2 (0,28 г), трет-бутил-4-[5-(5-бром-4-метил-1H-бензотриазол-1-ил)пентил]бензоата (3,50 г) и К2СО3 (3,10 г) в ДМСО (35 мл) нагревали до 80°С в течение 16 часов. После завершения реакции реакционную смесь охлаждали до комнатной температуры, разбавляли этилацетатом, фильтровали через слой целита. Фильтрат промывали водой, затем насыщенным солевым раствором и сушили над безводным Na2SO4. Na2SO4 отфильтровывали и концентрировали фильтрат в вакууме. Полученный неочищенный продукт очищали флэш-хроматографией, используя силикагелевый картридж Redisep, 40 г, на инструменте для хроматографии на силикагеле, элюируя градиентом 20-50% этилацетата в гексанах, с получением указанного в заголовке соединения (2,50 г) в виде маслянистого вещества коричневого цвета. 1Н ЯМР (400 МГц, ДМСО-d6) δ 1,34-1,42 (2Н, м), 1,58 (9Н, м), 1,62-1,70 (2Н, м), 1,86-2,04 (2Н, м), 2,61 (2Н, т, J=7,2 Гц), 2,82 (3H, с), 4,59 (2Н, т, J=6,8 Гц), 5,40 (1H, т, J=11,2 Гц), 5,71 (1H, т, J=17,6 Гц), 7,07-7,11 (1H, м), 7,16 (2Н, т, J=8,0 Гц), 7,26-7,29 (1H, м), 7,66 (1H, т, J=8,8 Гц), 7,87 (2Н, т, J=8,0 Гц). МС m/z 406,15 [М+Н]+.
B) трет-Бутил-4-[5-[5-формил-4-метил-1H-бензо[d][1,2,3]триазол-1-ил)пентил)бензоат
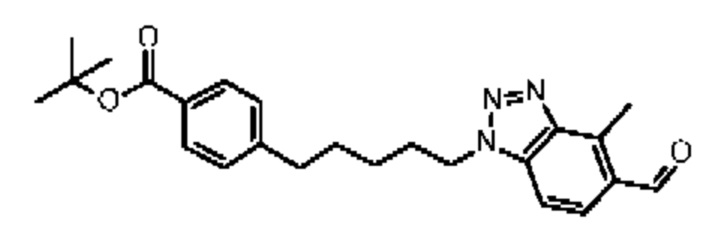
К раствору трет-бутил-4-[5-[4-метил-5-винил-1H-бензо[d][1,2,3]триазол-1-ил]пентил]бензоата (3,40 г) в 1,4-диоксане (100 мл) добавляли 2,6-лутидин (1,50 г, 14,70 ммоль) и OsO4 (0,21 г, 0,84 ммоль) и перемешивали смесь при комнатной температуре в течение 20 минут. К полученной смеси добавляли раствор NaIO4 (6,30 г, 29,40 ммоль) в воде (25 мл) и продолжали перемешивание при комнатной температуре в течение 2 часов. После завершения реакции реакционную смесь фильтровали через целит и экстрагировали фильтрат этилацетатом. Органический экстракт сушили над Na2SO4, фильтровали и выпаривали растворитель из фильтрата при пониженном давлении. Полученный неочищенный продукт очищали флэш-хроматографией, используя силикагелевый картридж Redisep, 40 г, на инструменте для хроматографии на силикагеле, элюируя градиентом 20-50% этилацетата в гексанах, с получением указанного в заголовке соединения (3,00 г) в виде грязновато-белого твердого вещества. 1Н ЯМР (400 МГц. ДМСО-d6) δ 1,17-1,23 (2Н, м), 1,52 (9Н, с), 1,56-1,61 (2Н, м), 1,90-1,97 (2Н, м), 2,57 (2Н, т, J=7,5 Гц), 3,06 (3H, с), 4,72 (2Н, т, J=6,8 Гц), 7,20 (2Н, д, J=8,0 Гц), 7,73 (2Н, д, J=8,0 Гц), 7,81 (1H, д, J=8,7 Гц), 7,94 (1H, д, J=8,7 Гц), 10,44 (1H, с). МС: чистота m/z 408,24 [М+Н]+.
C) трет-Бутил-7-[[1-[5-[4-[трет-бутоксикарбонил]фенил]пентил]-4-метил-1H-бензо[d][1,2,3]триазол-5-ил][гидрокси]метил]-3,4-дигидроизохинолин-2(1H)-карбоксилат
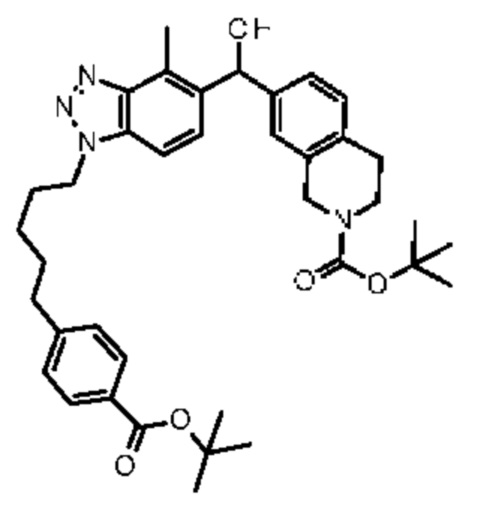
К раствору трет-бутил-4-[5-[5-формил-4-метил-1H-бензо[d][1,2,3]триазол-1-ил]пентил]бензоата (0,50 г) и трикалийфосфата (0,78 г) в СРМЕ (30 мл) и воде (6 мл) добавляли 7-[4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил]-3,4-дигидроизохинолин-2(1Н)-карбоксилат (1,30 г) и димер хлор[1,5-циклооктадиен]родия (I) (0,21 г) в атмосфере аргона и перемешивали смесь при комнатной температуре в течение 16 часов. После завершения реакции смесь разбавляли насыщенным водным раствором NH4Cl и экстрагировали этилацетатом. Органический экстракт промывали насыщенным солевым раствором, сушили над безводным Na2SO4, фильтровали и выпаривали из фильтрата растворители при пониженном давлении. Полученный неочищенный продукт очищали флэш-хроматографией, используя силикагелевый картридж Redisep, 12 г, на приборе для хроматографии на силикагеле, элюируя градиентом 20-70% этилацетата в гексанах, с получением указанного в заголовке соединения (0,25 г) в виде грязновато-белого твердого вещества. 1Н ЯМР (400 МГц, ДМСО-d6) δ 1,04-1,13 (2Н, м), 1,47 (9Н, с), 1,58-1,74 (1H, м), 1,74-1,84 (2Н, м), 2,00-2,04 (2Н, м), 2,59-2,62 (2Н, м), 2,80 (3H, с), 2,46-2,53 (2Н, м), 2,80 (2Н, шс), 3,62-3,66 (2Н, м), 4,52 (1H, с), 4,59-4,61 (1H, м), 6,25 (1H, с), 7,04-7,12 (4Н, м), 7,26 (1H, с), 7,65 (1H, д, J=8,2 Гц), 7,81 (2Н, д, J=7,9 Гц). МС m/z 641,46 [М+Н+].
D) 4-[5-[5-[3-Метокси-2,2-диметил-3-оксо-1-[1,2,3,4-тетрагидроизохинолин-7-ил)пропил]-4-метил-1H-бензо[d][1,2,3]триазол-1-ил]пентил] бензойной кислоты гидрохлорид
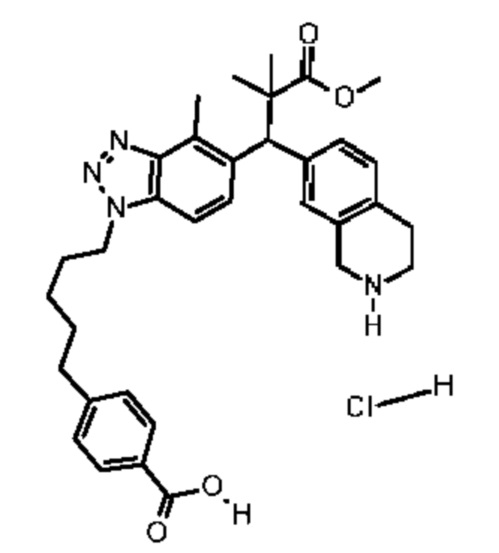
К перемешиваемому раствору трет-бутил-7-[[1-[5-[4-[трет-бутоксикарбонил]фенил]пентил]-4-метил-1H-бензо[d][1,2,3]триазол-5-ил][гидрокси]метил]-3,4-дигидроизохинолин-2(1Н)-карбоксилата (0,35 г) в ДХМ (14 мл) добавляли [[1-метокси-2-метилпроп-1-ен-1-ил]окси]триметилсилан (0,57 г) и TiCi4(1 М в ДХМ, 0,54 мл) при 0°С и перемешивали реакционную смесь в течение 5 минут. После завершения реакции (по данным ЖХМС и ТСХ) реакционную смесь гасили водой. Водный слой подщелачивали насыщенным раствором NaHCO3 (рН ~ 8) и фильтровали через слой целита. После фильтрования водный слой экстрагировали 10% смесью метанола в дихлорметане. Объединенный органический экстракт промывали насыщенным солевым раствором, сушили над безводным Na2SO4, фильтровали и выпаривали из фильтрата растворитель с получением смеси (0,43 г) в виде светло-серого твердого вещества, которое использовали в таком виде на следующей стадии.
К полученной смеси в 1,4-диоксане (5 мл) по каплям добавляли 4 М HCl в 1,4-диоксане (6 мл) при 25°С и перемешивали реакционную смесь в течение 6 часов. После завершения реакции (по данным ЖХМС) удаляли летучие вещества при пониженном давлении с получением указанного в заголовке соединения (0,40 г, неочищенное) в виде серого твердого вещества, которое использовали в таком виде на следующей стадии. МС m/z 569,43 [М+Н+].
Е) Метил-2-метил-2-[32-метил-20-оксо-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16(31),17,19(30),24(28),25-декаен-2-ил]пропаноат
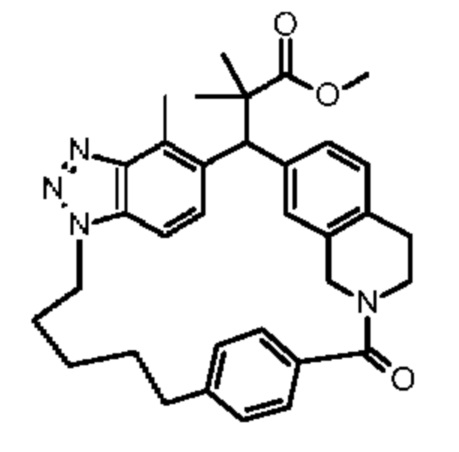
К раствору HATU (0,66 г, 1,75 ммоль) в ДМФА (10 мл) через поршневый насос добавляли смесь 4-[5-[5-[3-метокси-2,2-диметил-3-оксо-1-[1,2,3,4-тетрагидроизохинолин-7-ил]пропил]-4-метил-1H-бензо[d][1,2,3]триазол-1-ил]пентил]бензойной кислоты (0,4 г, неочищенная) и N,N-диизопропилэтиламина (2,3 г, 17,6 ммоль) в ДМФА (30 мл) в течение 3 часов при 30°С и перемешивали реакционную смесь при комнатной температуре в течение 16 часов. После завершения реакции (по данным ЖХМС); реакционную смесь разбавляли насыщенным раствором NaHCO3. Водный слой экстрагировали этилацетатом. Объединенный органический экстракт промывали насыщенным солевым раствором, сушили над безводным Na2SO4, фильтровали и выпаривали из фильтрата растворители при пониженном давлении. Полученный неочищенный продукт очищали флэш-хроматографией, используя силикагелевый картридж Redisep, 12 г, на инструменте для хроматографии на силикагеле, элюируя градиентом 20-60% этилацетата в гексане, с получением указанного в заголовке соединения (0,048 г) в виде твердого вещества белого цвета. 1Н ЯМР (400 МГц, CDCl3) δ 1,03-1,06 (2Н, м), 1,28-1,36 (5Н, м), 1,45 (3H, с), 2,07 (2Н, шс), 2,56-2,59 (2Н, м), 2,65 (3H, м), 2,90-2,99 (2Н, м), 3,56 (3H, с), 3,74-3,79 (1H, м), 4,03-4,07 (1H, м), 4,14-4,18 (2Н, м), 4,38-4,42 (1H, м), 4,87 (1H, с), 4,90-4,95 (1H, м), 6,01 (1H, с), 6,80 (2Н, д, J=7,7 Гц), 6,95 (2Н, д, J=7,7 Гц), 7,08-7,09 (1H, м), 7,18 (2Н, д, J=8,6 Гц), 7,39 (1H, д, J=8,7 Гц). МС m/z 551,31 [М+Н+].
F) 2-Метил-2-[32-метил-20-оксо-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16(31),17,19(30),24(28),25-декаен-2-ил]пропановая кислота <Синтез из хирального метил-2-метил-2-[32-метил-20-оксо-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16(31), 17,19(30),24(28),25-декаен-2-ил)пропаноата (короткое время удерживания)>
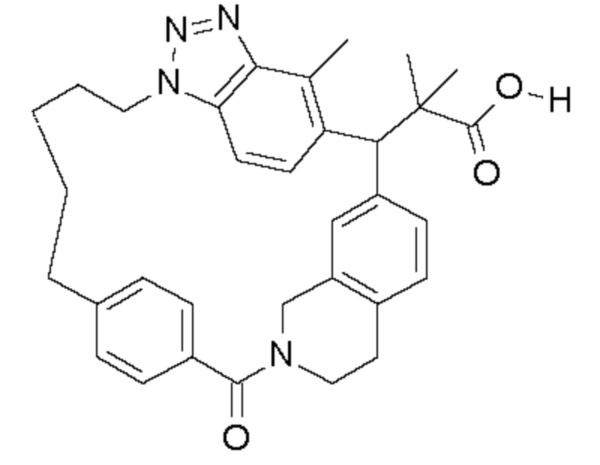
Метил-2-метил-2-[32-метил-20-оксо-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.024,28]дотриаконта-1(27),3(32),4,6,8,16(31),17,19(30),24(28),25-декаен-2-ил]пропаноат (рацемат) очищали с помощью ВЭЖХ (способ D) с получением хирального метил-2-метил-2-[32-метил-20-оксо-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16(31),17,19(30),24(28),25-декаен-2-ил]пропаноата (короткое время удерживания) и хирального метил-2-метил-2-[32-метил-20-оксо-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16(31),17,19(30),24(28),25-декаен-2-ил]пропаноата (продолжительное время удерживания), которые по отдельности использовали на следующей стадии. К раствору хирального метил-2-метил-2-[32-метил-20-оксо-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16(31),17,19(30),24(28),25-декаен-2-ил]пропаноата (короткое время удерживания, 0,080 г) в ТГФ (8 мл) добавляли TMSOK (0,37 г) при комнатной температуре и перемешивали смесь при 60°С в течение 16 часов. Затем смесь охлаждали до комнатной температуры, разбавляли этилацетатом, нейтрализовали 1 н. НС1 и экстрагировали этилацетатом. Объединенный органический экстракт промывали водой и насыщенным солевым раствором, сушили над безводным Na2SO4, фильтровали и выпаривали из фильтрата растворитель при пониженном давлении. Остаток очищали препаративной ТСХ с получением указанного в заголовке соединения (0,028 г) в виде твердого вещества белого цвета. 1Н ЯМР (400 МГц, CDCl3) δ м.д. 1,05-1,12 (2Н, м), 1,29 (3Н, с), 1,48 (3Н, с), 1,64 (1H, шс), 2,07 (2Н, шс), 2,51-2,58 (2Н, м), 2,65 (3Н, с), 2,89-2,99 (2Н, м), 3,74-3,78 (2Н, м), 4,03-4,18 (3Н, м), 4,38-4,42 (1H, м), 4,88-4,95 (2Н, м), 6,01 (1H, с), 6,80 (2Н, д, J=7,6 Гц), 6,95 (2Н, д, J=7,6 Гц), 7,08 (1H, д, J=7,8 Гц), 7,18-7,26 (2Н, м), 7,44 (1H, д, J=8,6 Гц). МС m/z 537,30 [М+Н+].
[0189]
Пример 63
2-Метил-2-[32-метил-20-оксо-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16(31),17,19(30),24(28),25-декаен-2-ил]пропановая кислота
<Хиральная, синтез из хирального метил-2-метил-2-[32-метил-20-оксо-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16(31), 17,19(30),24(28),25-декаен-2-ил]пропаноата (продолжительное время удерживания)>
К раствору хирального метил-2-метил-2-[32-метил-20-оксо-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16(31), 17,19(30),24(28),25-декаен-2-ил]пропаноата (продолжительное время удерживания) (0,070 г) в ТГФ (8 мл) добавляли TMSOK (0,32 г, 2,50 ммоль) при комнатной температуре и перемешивали смесь при 60°С в течение 16 часов. Затем смесь охлаждали до комнатной температуры, разбавляли этилацетатом, нейтрализовали 1 н. НС1 и экстрагировали этилацетатом. Объединенный органический экстракт промывали водой и насыщенным солевым раствором, сушили над безводным Na2SO4, фильтровали и выпаривали из фильтрата растворитель при пониженном давлении. Остаток очищали препаративной ТСХ с получением указанного в заголовке соединения (0,020 г) в виде твердого вещества белого цвета.
1Н ЯМР (400 МГц, CDCl3) δ 1,05-1,12 (2Н, м), 1,29 (3Н, с), 1,48 (3Н, с), 1,64 (1Н, шс), 2,07 (2Н, шс), 2,51-2,58 (2Н, м), 2,65 (3Н, с), 2,88-2,98 (2Н, м), 3,73-3,77 (2Н, м), 4,03-4,18 (3Н, м), 4,38-4,42 (1Н, м), 4,88-4,94 (2Н, м), 6,01 (1Н, с), 6,80 (2Н, д, J=7,6 Гц), 6,95 (2Н, д, J=7,6 Гц), 7,08 (1H, д, J=7,8 Гц), 7,18-7,26 (2Н, м), 7,44 (1H, д, J=8,6 Гц). МС m/z 537,37 [М+Н+].
[0190]
Пример 64
[2-[18,30-Дихлор-32-метил-20-оксо-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16(31),17,19(30),24(28),25-декаен-2-ил]ацетил]оксинатрий
Соединения из примера 64 могут быть получены в соответствии со способами получения, описанными в настоящем документе, способом, представленным в разделе «Примеры», или способом, аналогичным им.
[0191]
Пример 65
2-[18,30-Дихлор-32-метил-20-оксо-15-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16(31),17,19(30),24(28),25-декаен-2-ил]-2-метилпропановая кислота (хиральная, короткое время удерживания)
A) 4-[[4-Бром-3-метил-2-нитрофенил]амино]бутан-1-ол
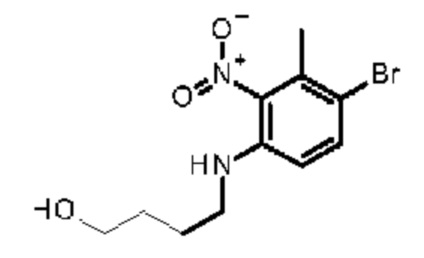
К раствору 1-бром-4-фтор-2-метил-3-нитробензола (33 г) в ДМФА (450 мл) добавляли K2CO3 (39,259 г), затем 4-аминобутанол (17,162 мл) при 25°С и перемешивали смесь при 80°С в течение 16 часов. После завершения реакции (по данным ТСХ и ЖХ/МС) реакционную смесь гасили ледяной водой. Образовавшийся осадок отфильтровывали и промывали водой и, наконец, сушили под вакуумом с получением указанного в заголовке соединения (40 г) в виде твердого вещества оранжевого цвета, которое использовали на следующей стадии без дополнительной очистки.
1H ЯМР (400 МГц, ДМСО-d6): δ 1,43-1,53 (4Н, м), 2,24 (3Н, с), 3,12 (2Н, д, J=5,7 Гц), 3,39 (2Н, с), 4,40 (1H, с), 6,13 (1H, с), 6,72 (1H, д, J=8,9 Гц), 7,52 (1H, д, J=8,9 Гц).
B) 4-[[2-Амино-4-бром-3-метилфенил]амино]бутан-1-ол
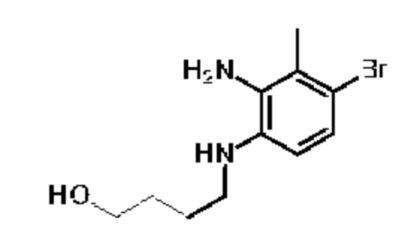
К перемешиваемому раствору 4-[[4-бром-3-метил-2-нитрофенил]амино]бутан-1-ола(23 г) в смеси этанола (230 мл) и воды (115 м) добавляли порошкообразное железо (21,197 г), затем NH4Cl (40,299 г) при 25°С и кипятили реакционную смесь с обратным холодильником в течение 4 часов. После завершения реакции (по данным ТСХ) нерастворимое вещество отфильтровывали через слой целита и выпаривали растворитель при пониженном давлении. Остаток растворяли в насыщенном растворе NaHCO3. Водный слой экстрагировали этилацетатом (50 мл × 3), объединенный органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и выпаривали при пониженном давлении с получением указанного в заголовке соединения (11,8 г) в виде твердого вещества коричневого цвета, которое использовали на следующей стадии без дополнительной очистки.
1Н ЯМР (400 МГц, ДМСО-d6): δ 1,48-1,63 (4Н, м), 2,16 (3Н, с), 2,96 (2Н, к, J=6,4 Гц), 3,40 (2Н, к, J=6,0 Гц), 4,40 (1H, т, J=5,0 Гц), 4,53 (1H, т, J=4,9 Гц), 4,59 (2Н, с), 6,24 (1H, д, J=8,5 Гц), 6,70 (1H, д, J=8,4 Гц), МС m/z 275,1 [М+Н]+.
C) 4-[5-Бром-4-метил-1Н-1,2,3-бензотриазол-1 -ил]бутан-1-ол
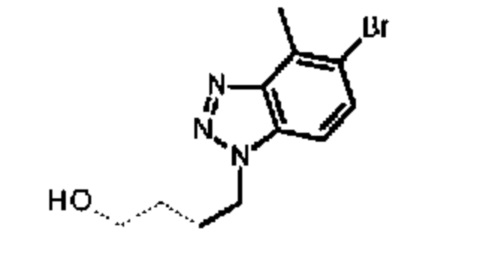
К перемешиваемому раствору 4-[[2-амино-4-бром-3-метилфенил]амино]бутан-1-ола (20 г) в 6 н. HCl (265 мл) медленно добавляли раствор NaNO2 (10,11 г) в воде (87 мл) при 0°С и перемешивали реакционную смесь при 25°С в течение 2 часов. После завершения реакции (по данным ТСХ и ЖХ/МС) реакционную смесь нейтрализовали 4 н. раствором NaOH при 0°С. Водный слой экстрагировали EtOAc, объединенные органические слои промывали насыщенным солевым раствором; сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Полученный неочищенный продукт очищали на силикагелевой колонке (SiO2, 120 г, 60% EtOAc/гексан) с получением указанного в заголовке соединения (14 г) в виде твердого вещества коричневого цвета.
1H ЯМР (400 МГц, ДМСО-d6): δ 1.32-1,40 (2Н, м), 1,88-1,96 (2Н, м), 2,71 (3Н, с), 3,38 (2Н т, J=6,3 Гц), 4,70 (2Н, т, J=7,0 Гц), 7,69 (2Н, т, J=8,9 Гц). МС m/z 286,1 [М+Н]+.
D) 4-(5-Этенил-4-метил-1Н-1,2,3-бензотриазол-1-ил)бутан-1-ол
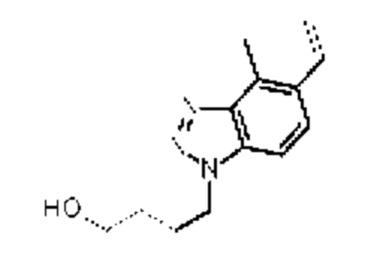
К дегазированному раствору 4-[5-бром-4-метил-1H-1,2,3-бензотриазол-1-ил]бутан-1-ола (5 г) в смеси ТГФ (50 мл) и н-пропанола (100 мл) добавляли винилтрифторборат калия (9 г), затем ТЭА (10 мл, 70,423 ммоль) при 25°С и дегазировали реакционную смесь аргоном в течение 10 минут. К полученной смеси добавляли PdCl2(dppf)-ДХМ (1,5 г) и нагревали реакционную смесь при 100°С в течение 2 часов. После завершения реакции (по данным ЖХ/МС) удаляли летучие вещества при пониженном давлении. Остаток растворяли в воде, водный слой экстрагировали EtOAc, объединенные органические слои промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Полученный таким образом неочищенный продукт очищали колоночной хроматографией на силикагеле (SiO2, 40 г, 60% EtOAc/гексан) с получением указанного в заголовке соединения (3 г) в виде жидкости коричневого цвета. 1Н ЯМР (400 МГц, ДМСО-d6): δ 1,33-1,40 (2Н, м), 1,88-1,96 (2Н, м), 2,70 (3Н, с), 3,36 (2Н, к, J=5,9 Гц), 4,43 (1H, т, J=4,9 Гц), 4,68 (2Н, т, J=6,9 Гц), 5,38 (1H, д, J=11,2 Гц), 5,81 (1H, д, J=17,4 Гц), 7,08 (1H, к, J=11,1 Гц), 7,68 (1H, т, J=8,7 Гц), 7,75 (1H, д, J=8,6 Гц). МС m/z 232,0 [М+Н]+.
Е) трет-Бутил-2,6-дихлор-4-[4-(5-этенил-4-метил-1Н-1,2,3-бензотриазол-1-ил)бутокси]бензоат

К перемешиваемому раствору 4-[5-этенил-4-метил-1H-1,2,3-бензотриазол-1-ил]бутан-1-ола (3 г) в ТГФ (40 мл) добавляли трет-бутил-2,6-дихлор-4-гидроксибензоат (3,4 г) и PPh3 (8,5 г) при 25°С. К полученной смеси добавляли DEAD (4 мл) в ТГФ (10 мл) при 0°С и перемешивали реакционную смесь при 25°С в течение 3 часов. После завершения реакции (по данным ТСХ и ЖХ/МС) удаляли летучие вещества при пониженном давлении. Полученный таким образом неочищенный продукт очищали колоночной хроматографией на силикагеле (SiO2, 40 г, 20% EtOAc/гексан) с получением указанного в заголовке соединения (4,9 г) в виде бесцветной жидкости.
1H ЯМР (400 МГц, ДМСО-d6) δ 1,53 (9Н, с), 1,65-1,70 (2Н, м), 2,05-2,03 (2Н, м), 2,70 (3Н, с), 4,04 (2Н, т, J=6,2 Гц), 4,75 (2Н, т, J=6,8 Гц), 5,38 (1H, д, J=11,9 Гц), 5,76-5,83 (2Н, м), 7,06-7,08 (1H, м), 7,10-7,15 (1Н, м), 7,69 (1H, д, J=8,7 Гц), 7,76 (1H, д, J=9,4 Гц). МС m/z 276,0 [М+Н]+.
F) трет-Бутил-2,6-дихлор-4-[4-[5-(гидроксиметил)-4-метил-1H-1,2,3-бензотриазол-1-ил]бутокси]бензоат
К перемешиваемому раствору трет-бутил-2,6-дихлор-4-[4-[5-этенил-4-метил-1H-1,2,3-бензотриазол-1-ил]бутокси]бензоата (5 г) в смеси МеОН (50 мл) и ДХМ (50 мл) добавляли NaHCO3 (1,1 г) при 25°С. Через смесь пропускали газообразный озон при -78°С в течение 2 часов. После завершения реакции (по данным ТСХ) реакционную смесь нагревали до 0°С. К полученной смеси добавляли NaBH4 (0,796 г) при 0°С и перемешивали реакционную смесь при указанной температуре в течение 1 часа. После завершения реакции (по данным ТСХ) удаляли летучие вещества при пониженном давлении. Остаток разбавляли ледяной водой. Водный слой экстрагировали ДХМ, объединенные органические слои промывали насыщенным солевым раствором; сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Полученный таким образом неочищенный продукт очищали колоночной хроматографией на силикагеле (SiO2, 12 г, 30% EtOAc/гексан) с получением указанного в заголовке соединения (3,5 г) в виде бесцветной вязкой жидкости.
1Н ЯМР (400 МГц, ДМСО-d6) δ 1,53 (9Н, с), 1,66-1,69 (2Н, м), 2,03 (2Н, т, J=7,2 Гц), 2,64 (3Н, с), 4,03 (2Н, т, J=6,3 Гц), 4,63 (2Н, д, J=5,4 Гц), 4,74 (2Н, т, J=6,8 Гц), 5,13 (1H, т, J=5,3 Гц), 7,06 (2Н, с), 7,55 (1H, д, J=8,5 Гц), 7,65 (1H, д, J=8,4 Гц). МС m/z 480,1 [М+Н]+.
G) трет-Бутил-2,6-дихлор-4-[4-(5-формил-4-метил-1Н-1,2,3-бензотриазол-1-ил)бутокси]бензоат
К перемешиваемому раствору трет-бутил-2,6-дихлор-4-[4-[5-(гидроксиметил)-4-метил-1H-1,2,3-бензотриазол-1-ил]бутокси]бензоата (3,3 г) в ДХМ (50 мл) добавляли активированный MnO2(10 г) при 25°С и перемешивали реакционную смесь при 25°С в течение 4 часов. После завершения реакции (по данным ТСХ) отфильтровывали нерастворимое вещество через слой целита и растворяли остаток в ДХМ. Фильтрат выпаривали при пониженном давлении с получением указанного в заголовке соединения (3 г) в виде грязновато-белого твердого вещества, которое использовали на следующей стадии без дополнительной очистки.
1H ЯМР (400 МГц, ДМСО-d6) δ 1,53 (9Н, с), 1,71 (2Н, т, J=7,2 Гц), 2,07 (2Н, т, J=7,6 Гц), 3,06 (3Н, с), 4,03 (2Н, т, J=6,4 Гц), 4,81 (2Н, т, J=6,7 Гц), 7,02 (2Н, с), 7,86 (1H, д, J=8,7 Гц), 7,97 (1H, д, J=8,6 Гц), 10,45 (1H, с). МС m/z 478,4 [М+Н]+.
H) трет-Бутил-7-[[1-[4-[4-[[трет-бутокси]карбонил]-3,5-дихлорфенокси]бутил]-4-метил-1Н-1,2,3-бензотриазол-5-ил][гидрокси]метил]-1,2,3,4-тетрагидроизохинолин-2-карбоксилат
К дегазированному раствору трет-бутил-2,6-дихлор-4-[4-(5-формил-4-метил-1H-1,2,3-бензотриазол-1-ил)бутокси]бензоата (360 мг) в смеси СРМЕ (10 мл) и воды (5 мл) добавляли [2-[[трет-бутокси)карбонил]-1,2,3,4-тетрагидроизохинолин-7-ил]бороновую кислоту (627 мг), затем K3PO4 (480 мг) при 25°С. К полученной смеси добавляли [RhCl(COD)]2 (74 мг) при 25°С и перемешивали реакционную смесь при 25°С в течение 4 часов под синим светом от светодиодной лампы. Реакционную смесь гасили насыщенным раствором NH4Cl. Водный слой экстрагировали EtOAc, объединенные органические слои промывали водой, насыщенным солевым раствором, сушили над безводным Na2SO4, фильтровали и концентрировали фильтрат при пониженном давлении. Полученный таким образом неочищенный продукт очищали колоночной хроматографией на силикагеле (SiO2, 12 г, 25% EtOAc/гексан) с получением указанного в заголовке соединения (300 мг) в виде светло-желтого твердого вещества.
1H ЯМР (400 МГц, ДМСО-d6) δ 1,40 (9Н, с), 1,52 (9Н, с), 1,67 (2Н, т, J=6,8 Гц), 2,01 (2Н, т, J=7,3 Гц), 2,65-2,71 (5Н, м), 3,50 (2Н, т, J=5,7 Гц), 4,06 (2Н, т, J=8,0 Гц), 4,43 (2Н, с), 4,72 (2Н, т, J=6,7 Гц), 5,86 (1H, д, J=4,0 Гц), 6,03 (1H, д, J=4,0 Гц), 7,06-7,13 (5Н, м), 7,59 (2Н, к, J=8,6 Гц). МС m/z 711,6 [М+Н]+.
I) трет-Бутил-7-[1-[1-[4-[4-[[трет-бутокси]карбонил]-3,5-дихлорфенокси]бутил]-4-метил-1H-1,2,3-бензотриазол-5-ил]-3-метокси-2,2-диметил-3-оксопропил]-1,2,3,4-тетрагидроизохинолин-2-карбоксилат
К перемешиваемому раствору трет-бутил-7-[[1-[4-[4-[[трет-бутокси]карбонил]-3,5-дихлорфенокси]бутил]-4-метил-1H-1,2,3-бензотриазол-5-ил][гидрокси]метил]-1,2,3,4-тетрагидроизохинолин-2-карбоксилата (1,2 г) в ДХМ (100 мл) добавляли [[1-метокси-2-метилпроп-1-ен-1-ил]окси]триметилсилан (1,8 мл), затем TiCl4 (1M в ДХМ, 3,7 мл) при 0°С и перемешивали реакционную смесь при 0°С в течение 5 минут. После завершения реакции (по данным ЖХМС и ТСХ) реакционную смесь гасили водой. Водный слой подщелачивали насыщенным раствором NaHCO3 (рН ~ 8) и фильтровали через слой целита. Водный слой экстрагировали 10% смесью МеОН/ДХМ (3×50 мл), объединенный органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и выпаривали при пониженном давлении с получением соединения (1 г, неочищенное) в виде светло-серого твердого вещества, которое использовали на следующей стадии без дополнительной очистки. МС m/z 795,8 [М+Н]+.
J) 2,6-Дихлор-4-(4-[5-[3-метокси-2,2-диметил-3-оксо-1-[1,2,3,4-тетрагидроизохинолин-7-ил]пропил]-4-метил-1Н-1,2,3-бензотриазол- 1-ил]бутокси)бензойная кислота
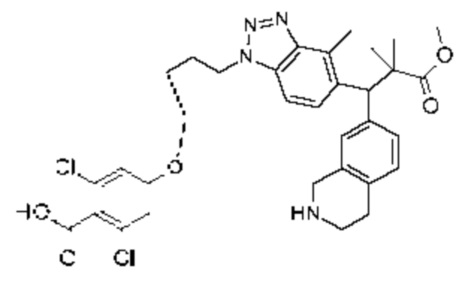
К перемешиваемому раствору трет-бутил-7-[1-[1-[4-[4-[[трет-бутокси]карбонил]-3,5-дихлорфенокси]бутил]-4-метил-1H-1,2,3-бензотриазол-5-ил]-3-метокси-2,2-диметил-3-оксопропил]-1,2,3,4-тетрагидроизохинолин-2-карбоксилата (1,3 г, неочищенный) в диоксане (13 мл) по каплям добавляли HCl (4 M в диоксане, 13 мл) при 25°С и перемешивали реакционную смесь при указанной температуре в течение 2 часов. После завершения реакции (по данным ЖХ/МС) удаляли летучие вещества при пониженном давлении и очищали полученный неочищенный продукт обращенно-фазовой препаративной ВЭЖХ (способ А) с получением указанного в заголовке соединения (320 мг) в виде твердого вещества белого цвета.
1H ЯМР (400 МГц, ДМСО-d6) δ 1,03 (3Н, д, J=5,9 Гц), 1,27 (6Н, д, J=21,0 Гц), 1,50-1,60 (2Н, м), 2,03 (2Н, т, J=6,1 Гц), 2,73 (3Н, с), 3,22-3,25 (2Н, м), 3,43 (3Н, с), 3,83-3,93 (3Н, м), 4,70-4,75 (3Н, м), 6,62 (2Н, с), 6,98 (1H, с), 7,07 (1Н, д, J=7,8 Гц), 7,27 (1Н, д, J=7,7 Гц), 7,58 (1H, д, J=7,5 Гц), 7,65 (1Н, д, J=8,7 Гц), 9,70-9,80 (1H, м). МС m/z 639,4 [М+Н]+.
К) Метил-2-[18,30-дихлор-32-метил-20-оксо-15-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27), (32),4,6,8,16,18,24(28),25,30-декаен-2-ил]-2-метилпропаноат
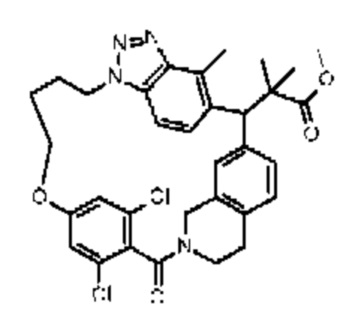
К раствору HATU (301 мг) в ДМФА (10 мл) через поршневый насос добавляли смесь 2,6-дихлор-4-[4-[5-[3-метокси-2,2-диметил-3-оксо-1-[1,2,3,4-тетрагидроизохинолин-7-ил]пропил]-4-метил-1H-1,2,3-бензотриазол-1-ил]бутокси]бензойной кислоты (390 мг) и N,N-диизопропилэтиламин (0,5 мл) в ДМФА (30 мл) в течение 1 часа при 25°С и перемешивали реакционную смесь при указанной температуре в течение 3 часов. После завершения реакции (по данным ЖХ/МС) реакционную смесь разбавляли насыщенным раствором NaHCO3. Водный слой экстрагировали EtOAc, объединенный органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и выпаривали при пониженном давлении. Полученный таким образом неочищенный продукт очищали растиранием с получением указанного в заголовке соединения (180 мг) в виде грязновато-белого твердого вещества, которое использовали на следующей стадии без дополнительной очистки. MCm/z 621,1 [М+Н]+.
Г) 2-[18,30-Дихлор-32-метил-20-оксо-15-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16(31),17,19(30),24(28),25-декаен-2-ил]-2-метилпропановая кислота (хиральная, короткое время удерживания)
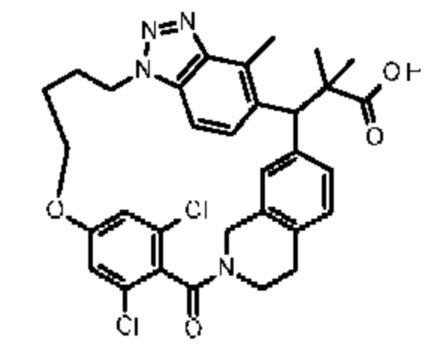
К перемешиваемому раствору метил-2-[18,30-дихлор-32-метил-20-оксо-15-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28] дотриаконта-1(27), (32),4,6,8,16,18,24(28),25,30-декаен-2-ил]-2-метилпропаноата (180 мг) в смеси ДМСО (4 мл) и МеОН (4 мл) добавляли KOH (8 н., 2 мл) при 25°С и нагревали реакционную смесь при 100°С в течение 16 часов. После завершения реакции (по данным ЖХ/МС) реакционную массу охлаждали до 25°С и разбавляли смесь EtOAc. Реакционную смесь подкисляли 1 и. раствором HCl (рН ~ 4-5). Водный слой экстрагировали EtOAc, объединенный органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и выпаривали при пониженном давлении. Полученный неочищенный продукт очищали обращенно-фазовой препаративной ВЭЖХ (способ В) с получением 2-[18,30-дихлор-32-метил-20-оксо-15-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16,18,24(28),25,30-декаен-2-ил]-2-метилпропановой кислоты (хиральная, короткое время удерживания, 27,06 мг) в виде грязновато-белого вязкого вещества и 2-[18,30-дихлор-32-метил-20-оксо-15-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16,18,24(28),25,30-декаен-2-ил]-2-метилпропановой кислоты (хиральная, продолжительное время удерживания, 57,59 мг) в виде грязновато-белого вязкого вещества.
2-[18,30-Дихлор-32-метил-20-оксо-15-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16,18,24(28),25,30-декаен-2-ил]-2-метилпропановая кислота (хиральная, короткое время удерживания)
1Н ЯМР (400 МГц, ДМСО-d6) δ 1,22 (3Н, с), 1,33 (3Н, с), 1,51-1,60 (2Н, м), 2,07 (2Н, к, J=6,2 Гц), 2,56 (3Н, с), 2,88-2,90 (2Н, м), 3,57-3,76 (3Н, м), 3,96-4,64 (3Н, м), 4,65-4,70 (1Н, м), 4,84-5,10 (2Н, м), 6,16 (1H, с), 6,20 (1H, с), 6,90 (1H, с), 7,09 (1H, д, J=7,8 Гц), 7,29 (1H, д, J=7,4 Гц), 7,51 (1H, д, J=8,7 Гц), 7,57 (1H, д, J=8,6 Гц), 11,50-11,60 (1H, м). МС m/z 607,5 [М+Н]+.
2-[18,30-Дихлор-32-метил-20-оксо-15-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16,18,24(28),25,30-декаен-2-ил]-2-метилпропановая кислота (хиральная, продолжительное время удерживания)
1H ЯМР (400 МГц, ДМСО-d6) δ 1,22 (3Н, с), 1,33 (3Н, с), 1,51-1,60 (2Н, м), 2,09 (2Н, к, J=5,0 Гц), 2,56 (3Н, с), 2,90 (2Н, т, J=6,2 Гц), 3,55-3,76 (3Н, м), 3,96-4,64 (3Н, м), 4,65-4,70 (1H, м), 4,79-4,83 (2Н, м), 6,15-6,20 (2Н, м), 6,91 (1Н, с), 7,09 (1Н, д, J=7,8 Гц), 7,29 (1H, д, J=8,0 Гц), 7,50-7,58 (2Н, м). МС m/z 605,3 [М-Н]+.
[0192]
Пример 66
2-[18,30-Дихлор-32-метил-20-оксо-15-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16(31),17,19(30),24(28),25-декаен-2-ил]-2-метилпропановая кислота (хиральная, продолжительное время удерживания)
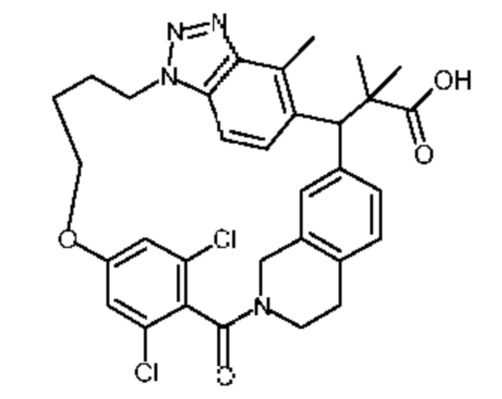
Соединения из примера 66 могут быть получены в соответствии со способами получения, описанными в настоящем документе, способом, представленным в разделе «Примеры», или способом, аналогичным им.
[0193]
Пример 67
[18,30,32-Триметил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16,18,24(28),25,30-декаен-2-ил]уксусная кислота (хиральная, короткое время удерживания)
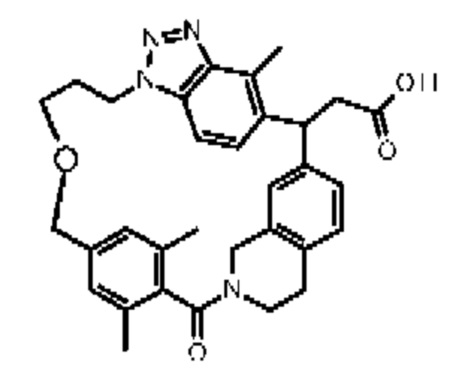
А) трет-Бутил-7-бром-1,2,3,4-тетрагидроизохинолин-2-карбоксилат
К перемешиваемому раствору гидрохлоридной соли 7-бром-1,2,3,4-тетрагидроизохинолина (25 г) в ТГФ (400 мл) и H2O (150 мл) добавляли Na2CO3 (24 г) и Boc2O (39 мл) при 25°С и перемешивали реакционную смесь при указанной температуре еще 16 часов. После завершения реакции (по данным ТСХ) реакционную смесь гасили льдом. Водный слой экстрагировали EtOAc, объединенные органические слои промывали насыщенным солевым раствором; сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Полученный таким образом неочищенный продукт очищали колоночной хроматографией на силикагеле (SiO2, 5% EtOAc/гексан) с получением указанного в заголовке соединения (30 г) в виде твердого вещества белого цвета.
1Н ЯМР (400 МГц, ДМСО-d6): δ 1,42 (9Н, с), 2,72 (2Н, т, J=5,8 Гц), 3,52 (2Н, т, J=5,8 Гц), 4,49 (2Н, с), 7,12 (1H, д, J=8,1 Гц), 7,34 (1H, д, J=8,0 Гц), 7,42 (1H, с).
B) трет-Бутил-7-(тетраметил-1,3,2-диоксаборолан-2-ил)-1,2,3,4-тетрагидроизохинолин-2-карбоксилат
К дегазированному раствору трет-бутил-7-бром-1,2,3,4-тетрагидроизохинолин-2-карбоксилата (20 г) в ДМЭ (90 мл) добавляли бис(пинаколато)дибор (19 г) и ацетат калия (19 г) при 25°С и дегазировали реакционную смесь аргоном в течение 15 минут. К полученной смеси добавляли Pd(dppf)2Cl2. ДХМ (2,6 г) при 25°С и перемешивали реакционную смесь при 90°С в течение 4 часов. Смесь фильтровали и концентрировали фильтрат в вакууме. Остаток очищали колоночной хроматографией (SiO2, 10-20% EtOAc в гексане) с получением указанного в заголовке соединения (16 г) в виде твердого вещества белого цвета.
1Н ЯМР (400 МГц, ДМСО-d6) δ 1,28 (12Н, с), 1,42 (9Н, с), 2,78 (2Н, т, J=5,4 Гц), 3,53 (2Н, т, J=5,4 Гц), 4,50 (2Н, с), 7,16 (1H, д, J=7,4 Гц), 7,45 (2Н, м).
C) {2-[(трет-Бутокси)карбонил]-1,2,3,4-тетрагидроизохинолин-7-ил}бороновая кислота
К перемешиваемому раствору трет-бутил-7-(тетраметил-1,3,2-диоксаборолан-2-ил)-1,2,3,4-тетрагидроизохинолин-2-карбоксилата (2,00 г) в ацетоне (40 мл) добавляли NaIO4 (3,57 г), затем ацетат аммония (1,0 М в воде, 27,8 мл) при 25°С и перемешивали реакционную смесь при 25°С в течение 16 часов. После завершения реакции (по данным ТСХ) выпаривали растворитель. Остаток разбавляли водой. Водный слой экстрагировали EtOAc, объединенные органические слои промывали насыщенным солевым раствором; сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Полученный таким образом неочищенный продукт очищали колоночной хроматографией на силикагеле (SiO2, 12 г, 50% EtOAc/гексан) с получением указанного в заголовке соединения (760 мг) в виде твердого вещества белого цвета.
1H ЯМР (400 МГц, ДМСО-d6): δ 1,42 (9Н, с), 2,75-2,78 (2Н, м), 3,52-3,55 (2Н, м), 4,48-4,54 (2Н, м), 7,10-7,16 (1H, м), 7,54-7,67 (2Н, м), 7,94 (2Н, с).
D) трет-Бутил-4-[[3-[5-[(1E)-3-этокси-3-оксопроп-1-ен-1-ил]-4-метил-1H-1,2,3-бензотриазол-1-ил]пропокси]метил]-2,6-диметилбензоат
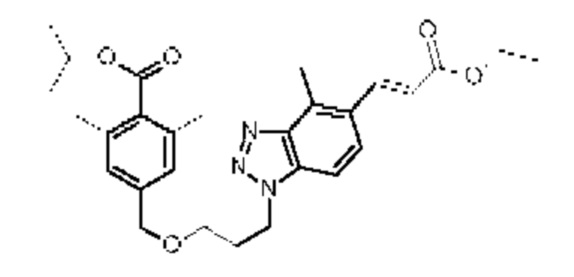
К дегазированному раствору трет-бутил-4-[3-[5-бром-4-метил-1H-1,2,3-бензотриазол-1-ил]пропокси]метил]-2,6-диметилбензоата (3,7 г) в ДМФА (25 мл) добавляли этилакрилат (8,0 мл; 75,82 ммоль), затем DIPEA (7 мл, 37,9 ммоль) при 25°С и дегазировали реакционную смесь аргоном в течение 10 минут. К полученной смеси добавляли три-о-толилфосфин (700 мг) и Pd(OAc)2 (255 мг) при 25°С и нагревали реакционную смесь при 120°С в течение 4 часов. После завершения реакции (по данным ТСХ и ЖХ/МС) реакционную смесь охлаждали до 25°С и гасили ледяной водой. Водный слой экстрагировали EtOAc, объединенные органические слои промывали насыщенным солевым раствором; сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Полученный таким образом неочищенный продукт очищали колоночной хроматографией на силикагеле (SiO2; 40 г; 30% EtOAc/гексан) с получением указанного в заголовке соединения (3 г) в виде коричневой вязкой жидкости.
1H ЯМР (400 МГц, ДМСО-d6): δ 1,28 (3Н, т, J=7,0 Гц), 1,53 (9Н, с), 2,17-2,20 (8Н, м), 2,78 (3Н, с), 3,39 (2Н, т, J=5,5 Гц), 4,19 (2Н, к, J=7,0 Гц), 4,30 (2Н, с), 4,78 (2Н, т, J=6,4 Гц), 6,63 (1H, д, J=15,8 Гц), 6,89 (2Н, с), 7,65 (1H, д, J=8,7 Гц), 7,93 (1H, д, J=8,8 Гц), 8,00 (1H, д, J=12,0 Гц). МС m/z 508,2 [М+Н]+.
Е) трет-Бутил-7-[1-[1-[3-[[4-[[трет-бутокси]карбонил]-3,5-диметилфенил]метокси]пропил]-4-метил-1H-1,2,3-бензотриазол-5-ил]-3-этокси-3-оксопропил]-1,2,3,4-тетрагидроизохинолин-2-карбоксилат
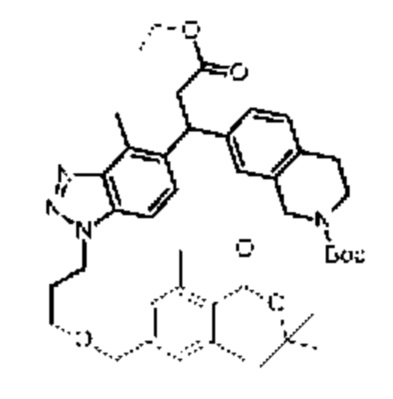
К дегазированному раствору трет-бутил-4-[(3-[5-[(1E)-3-этокси-3-оксопроп-1-ен-1-ил]-4-метил-1H-1,2,3-бензотриазол-1-ил]пропокси]метил]-2,6-диметилбензоата (500 мг) в смеси диоксана (12 мл) и воды (1,2 мл) добавляли [2-[[трет-бутокси]карбонил]-1,2,3,4-тетрагидроизохинолин-7-ил]бороновую кислоту (821,5 мг), затем K3PO4 (626,45 мг) при 25°С. К полученной смеси добавляли [RhCl(COD)]2 (48,56 мг) при 25°С и перемешивали реакционную смесь при 25°С в течение 4 часов под синим светом от светодиодной лампы. Реакционную смесь гасили насыщенным водным раствором NH4Cl. Водный слой экстрагировали EtOAc, объединенные органические слои промывали водой, насыщенным солевым раствором, сушили над безводным Na2SO4, фильтровали и концентрировали фильтрат при пониженном давлении. Полученный таким образом неочищенный продукт очищали колоночной хроматографией на силикагеле (SiO2, 12 г, 40% EtOAc/гексан) с получением указанного в заголовке соединения (450 мг) в виде коричневого вязкого вещества.
1Н ЯМР (400 МГц, ДМСО-d6): δ 0,99 (3Н, т, J=6,8 Гц), 1,40 (9Н, с), 1,53 (9Н, с), 2,14 (2Н, т, J=6,6 Гц), 2,20 (6Н, с), 2,65-2,70 (2Н, м), 2,77 (3Н, с), 3,12-3,14 (2Н, м), 3,37 (2Н, т, J=5,5 Гц), 3,45-3,49 (2Н, м), 3,89 (2Н, к, J=6,5 Гц), 4,33 (2Н, с), 4,41 (2Н, с), 4,70 (2Н, т, J=6,2 Гц), 4,81 (1H, т, J=7,5 Гц), 6,94 (2Н, с), 7,03 (1H, д, J=7,5 Гц), 7,10-7,14 (2Н, м), 7,49 (1H, д, J=8,9 Гц), 7,55 (1H, д, J=8,7 Гц). МС m/z 741,0 [М+Н]+.
F) 4-[[3-[5-[3-Этокси-3-оксо-1-[1,2,3,4-тетрагидроизохинолин-7-ил]пропил]-4-метил-1H-1,2,3-бензотриазол-1-ил]пропокси]метил]-2,6-диметилбензойная кислота
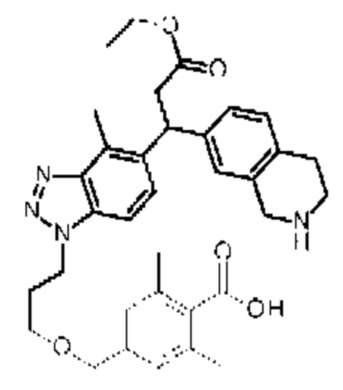
К перемешиваемому раствору трет-бутил-7-[1-[1-[3-[[4-[[трет-бутокси]карбонил]-3,5-диметилфенил]метокси]пропил]-4-метил-1H-1,2,3-бензотриазол-5-ил]-3-этокси-3-оксопропил]-1,2,3,4-тетрагидроизохинолин-2-карбоксилата (1,2 г) в ДХМ (40 мл) добавляли ТФК (1,2 мл) при 25°С. Реакционную смесь перемешивали при 25°С в течение 2 часов. После завершения реакции (по данным ЖХ/МС) реакционную смесь концентрировали при пониженном давлении и очищали неочищенный продукт обращенно-фазовой препаративной ВЭЖХ (способ А) с получением указанного в заголовке соединения (320 мг) в виде грязновато-белого твердого вещества. МС m/z 585,4 [М+Н]+.
G) Этил-2-[18,30,32-триметил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16,18,24(28),25,30-декаен-2-ил]ацетат
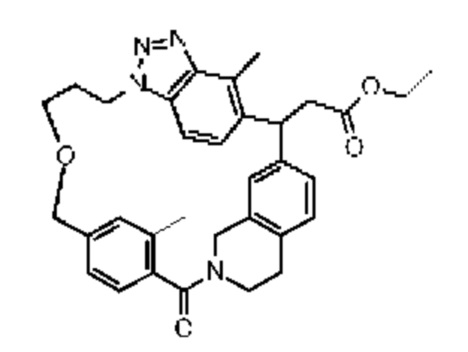
К раствору TBTU (100,069 мг) в ДМФА (10 мл) через поршневый насос добавляли смесь 4-[[[3-[5-[3-этокси-3-оксо-1-[1,2,3,4-тетрагидроизохинолин-7-ил]пропил]-4-метил-1Н-1,2,3-бензотриазол-1-ил]пропокси]метил]-2,6-диметилбензойной кислоты (140 мг) в ДМФА (10 мл) и N,N-диизопропилэтиламина (0,215 мл) в течение 1 часа при 25°С и перемешивали реакционную смесь при 25°С в течение 3 часов. После завершения реакции (по данным ЖХ/МС) реакционную смесь разбавляли насыщенным водным раствором NaHCO3. Водный слой экстрагировали EtOAc, объединенный органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и выпаривали при пониженном давлении с получением указанного в заголовке соединения (120 мг, неочищенное), которое напрямую использовали на следующей стадии без дополнительной очистки. МС m/z 567,4 [М+Н]+.
Н) [18,30,32-Триметил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16,18,24(28),25,30-декаен-2-ил]уксусная кислота (короткое время удерживания) и [18,30,32-триметил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16,18,24(28),25,30-декаен-2-ил]уксусная кислота (продолжительное время удерживания)
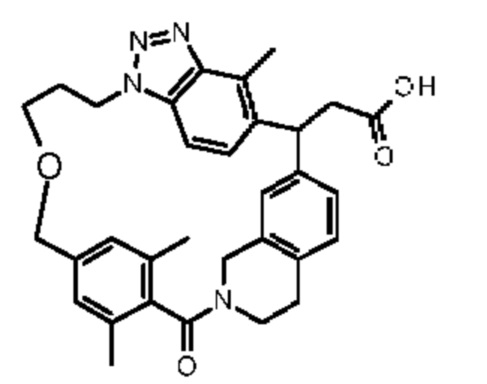
К перемешиваемому раствору этил-2-[18,30,32-триметил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16,18,24(28),25,30-декаен-2-ил]ацетата (150 мг) в смеси ТГФ (3 мл) и МеОН (1,5 мл) добавляли 1 н. NaOH (1,2 мл) при 25°С и перемешивали реакционную смесь при 25°С в течение 2 часов. После завершения реакции (по данным ТСХ и ЖХ/МС) удаляли летучие вещества при пониженном давлении. Неочищенный продукт растворяли в H2O и подкисляли водный слой 1 н. раствором HCl. Образовавшееся твердое вещество отфильтровывали и окончательно очищали обращенно-фазовой хиральной препаративной ВЭЖХ (способ В) с получением [18,30,32-триметил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16,18,24(28),25,30-декаен-2-ил]уксусной кислоты (короткое время удерживания, 30 мг) в виде вязкого вещества серого цвета и [18,30,32-триметил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16,18,24(28),25,30-декаен-2-ил]уксусной кислоты (продолжительное время удерживания, 30 мг) в виде вязкого вещества серого цвета.
[18,30,32-Триметил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16,18,24(28),25,30-декаен-2-ил]уксусная кислота (короткое время удерживания)
1H ЯМР (400 МГц, ДМСО-d6): δ 1,42 (3Н, с), 1,85 (3Н, с), 2,38 (2Н, к, J=8,0 Гц), 2,93-3,08 (5Н, м), 3,34 (2Н, к, J=8,0 Гц), 3,64-3,68 (1H, м), 3,77-3,92 (5Н, м), 4,17 (1H, д, J=12,0 Гц), 4,30 (1H, д, J=12,0 Гц), 4,68-4,85 (3Н, м), 5,81 (1H, с), 6,15 (1H, с), 6,73 (1H, с), 7,17 (1H, д, J=8,0 Гц), 7,28 (1H, д, J=8,0 Гц), 7,37 (1H, д, J=8,0 Гц), 7,54 (1H, д, J=8,0 Гц), 11,54 (шс, 1H). МС m/z 539,4 [М+Н]+.
[18,30,32-Триметил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16,18,24(28),25,30-декаен-2-ил]уксусная кислота (продолжительное время удерживания)
1Н ЯМР (400 МГц, ДМСО-d6): δ 1,42 (3Н, с), 1,85 (3Н, с), 2,38 (2Н, к, J=8,0 Гц), 2,93-3,08 (5Н, м), 3,34 (2Н, к, J=8,0 Гц), 3,64-3,68 (1H, м), 3,77-3,92 (5Н, м), 4,17 (1H, д, J=12,0 Гц), 4,30 (1H, д, J=12,0 Гц), 4,68-4,85 (3Н, м), 5,81 (1Н, с), 6,15 (1H, с), 6,73 (1H, с), 7,17 (1H, д, J=8,0 Гц), 7,28 (1H, д, J=8,0 Гц), 7,37 (1H, д, J=8,0 Гц), 7,54 (1H, д, J=8,0 Гц), 11,49 (шс, 1H). МС m/z 539,4 [М+Н]+.
[0194]
Пример 68
[18,30,32-Триметил-20-оксо-14-окса-8,9,10,21-тетраазагексацикло[19.5.3.216,19.13,7.06,10.024,28]дотриаконта-1(27),3(32),4,6,8,16,18,24(28),25,30-декаен-2-ил]уксусная кислота (хиральная, продолжительное время удерживания)
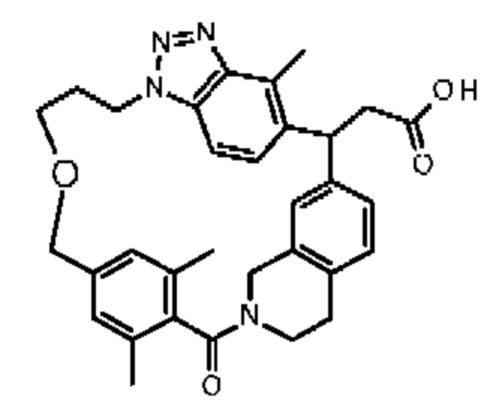
Соединения из примера 68 могут быть получены в соответствии со способами получения, описанными в настоящем документе, способом, представленным в разделе «Примеры», или способом, аналогичным им.
[0195]
Структуры из примеров 1 68 представлены в таблице 2.
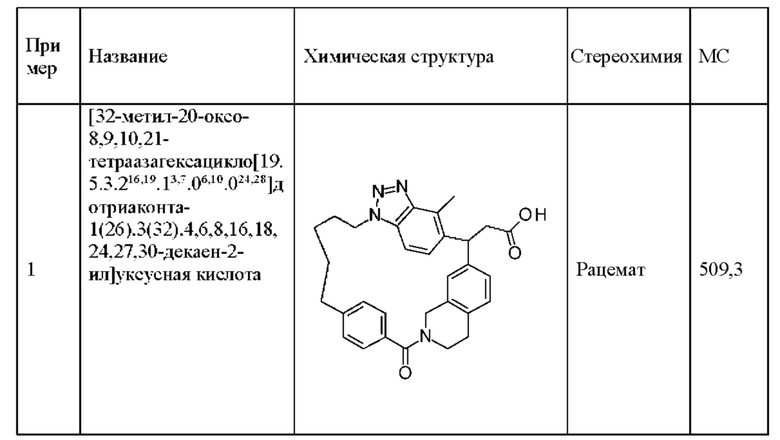
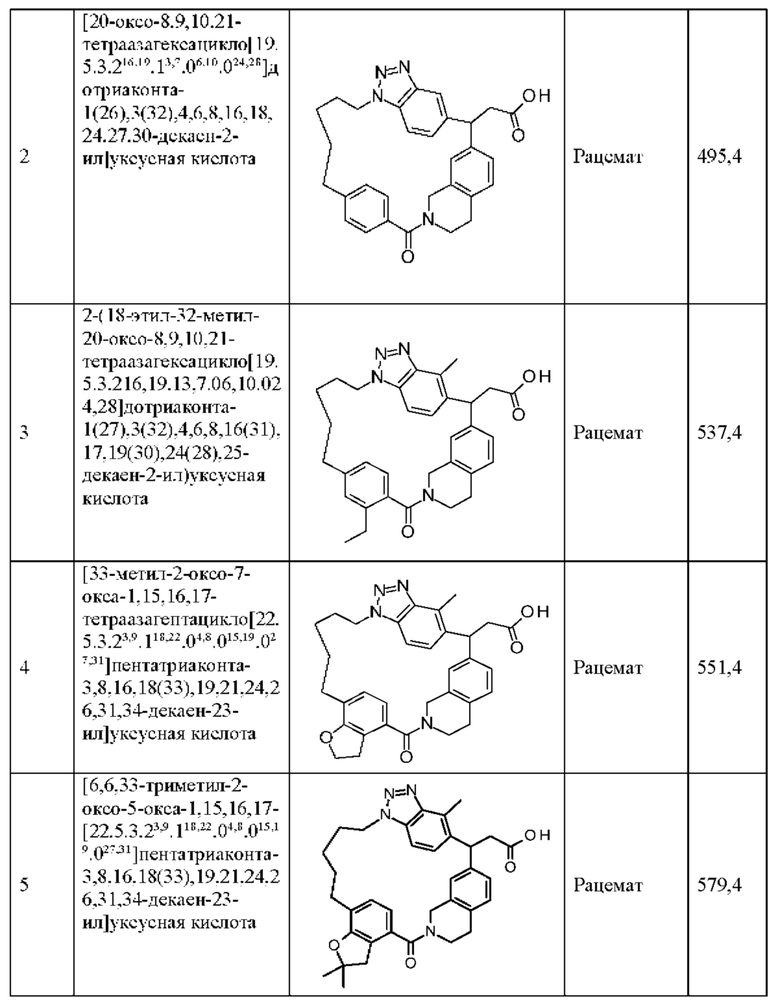
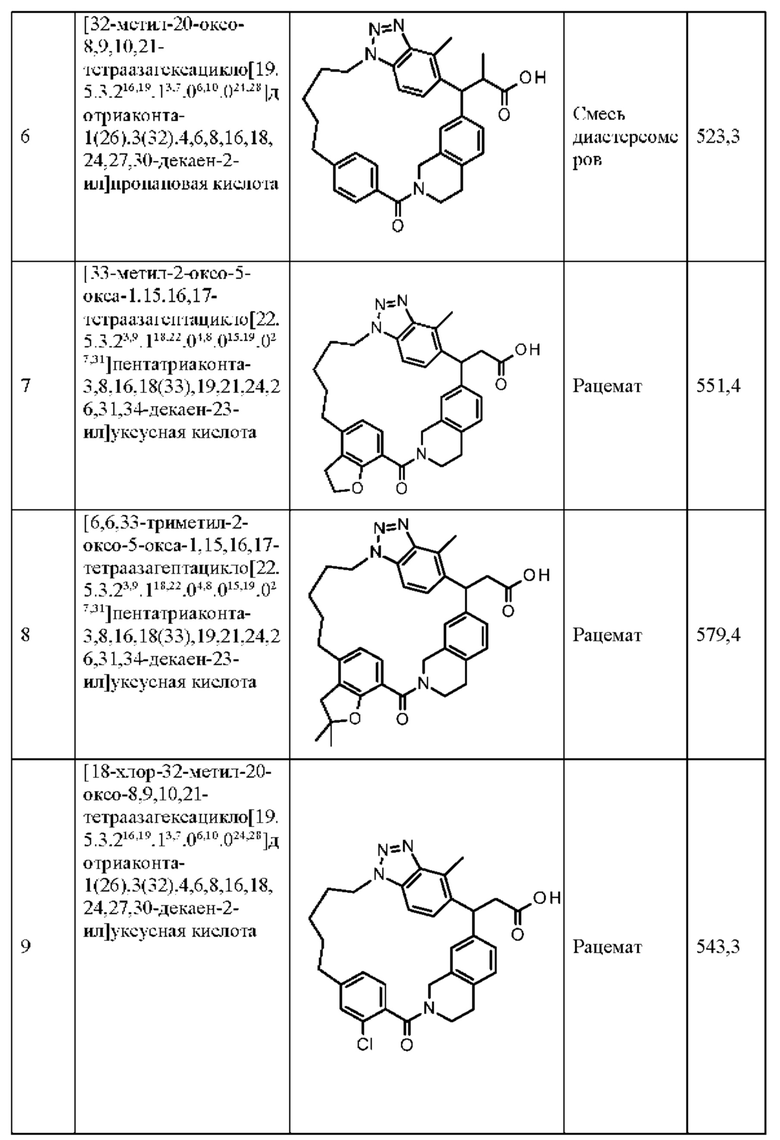
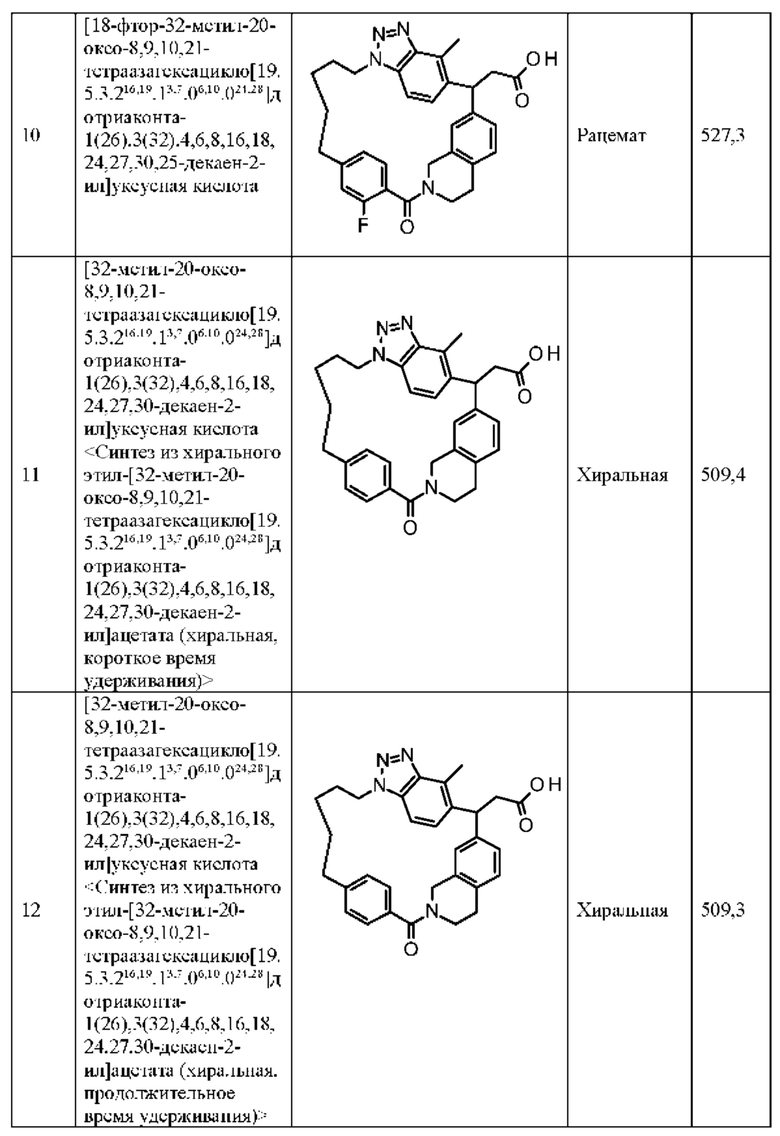
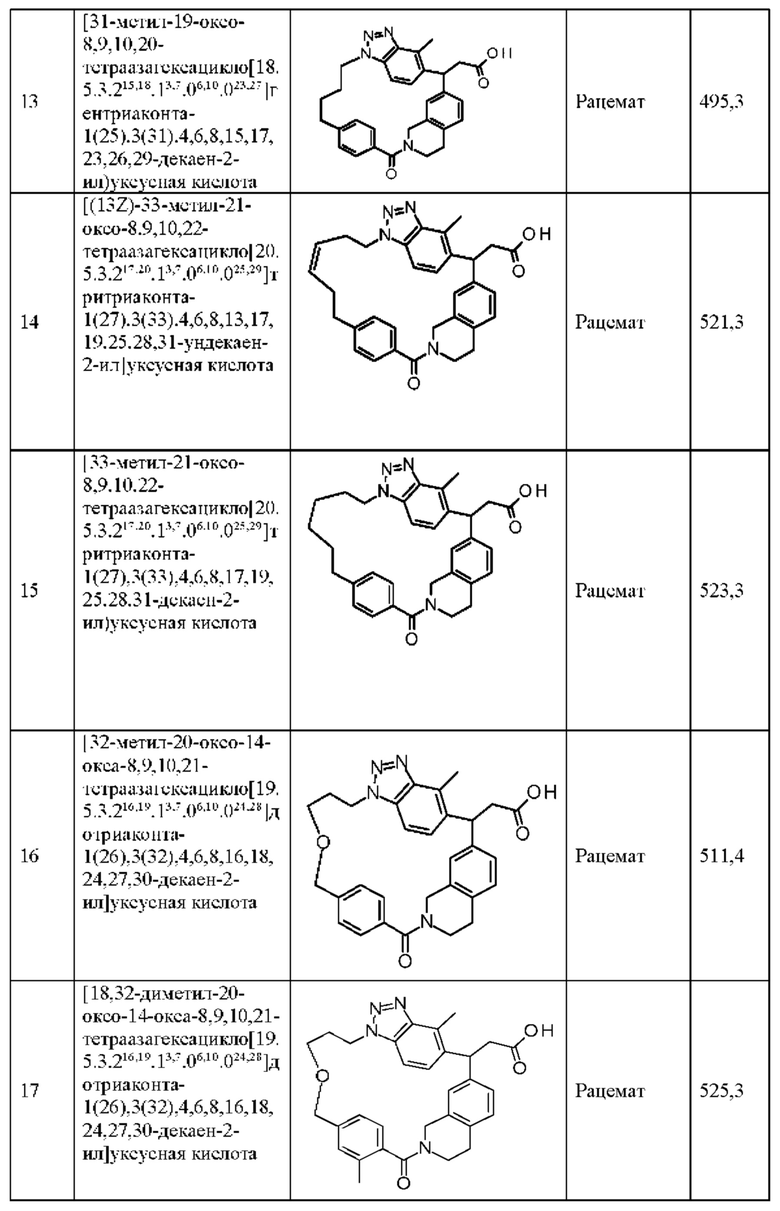
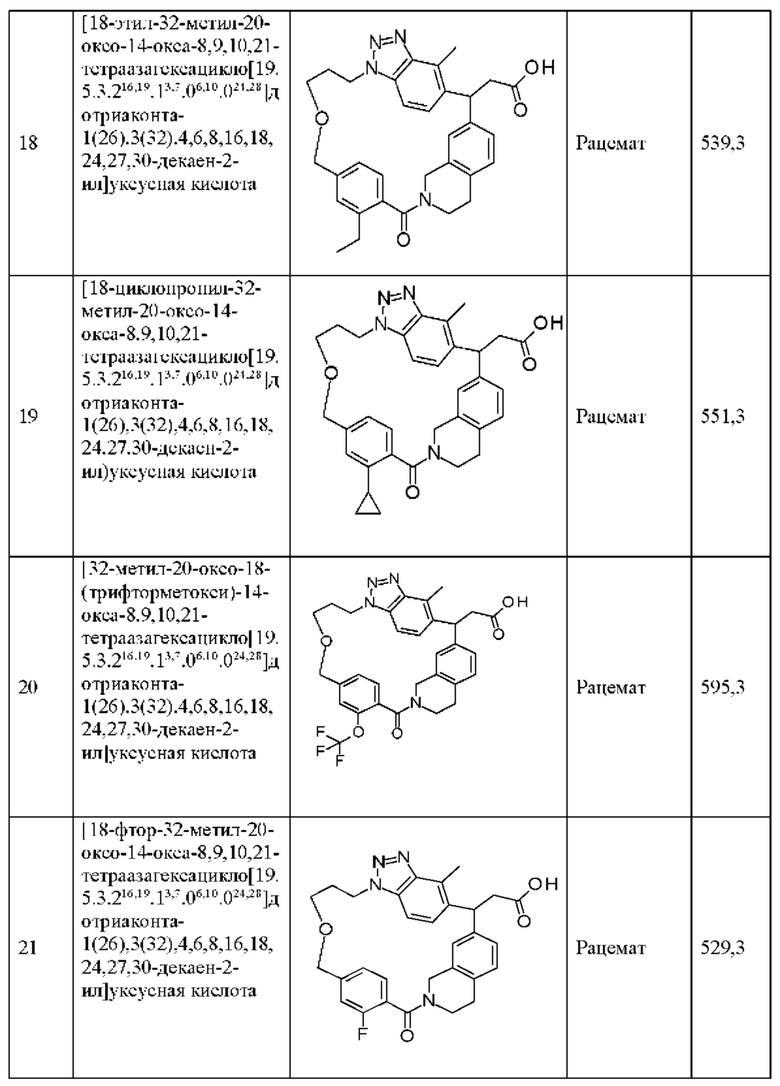
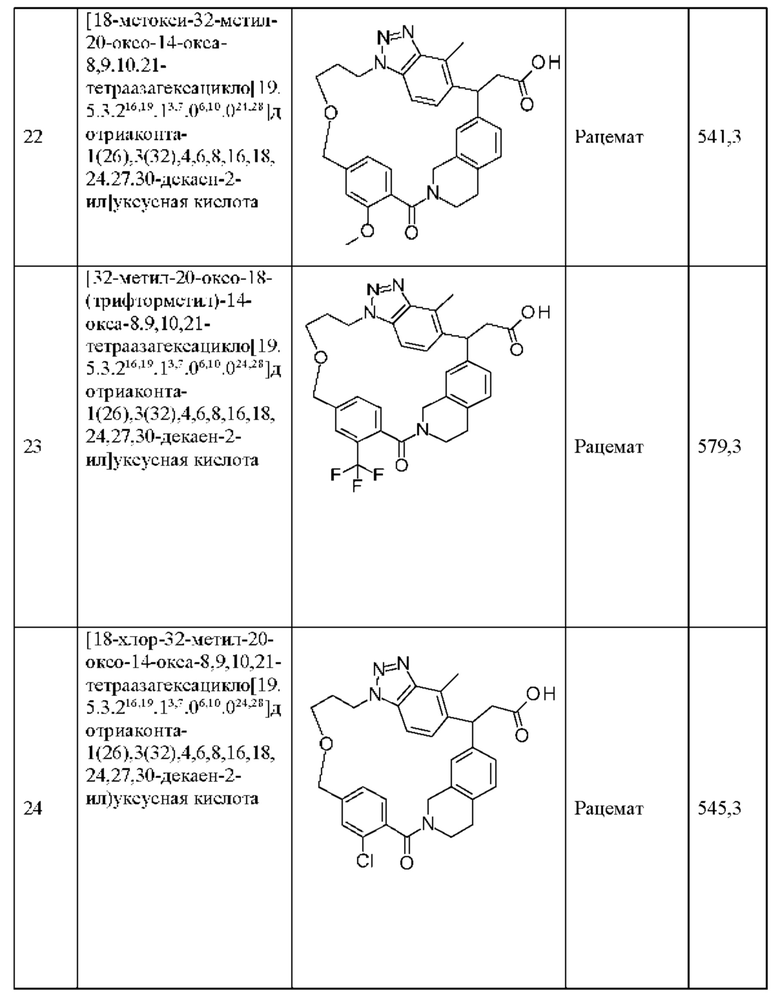
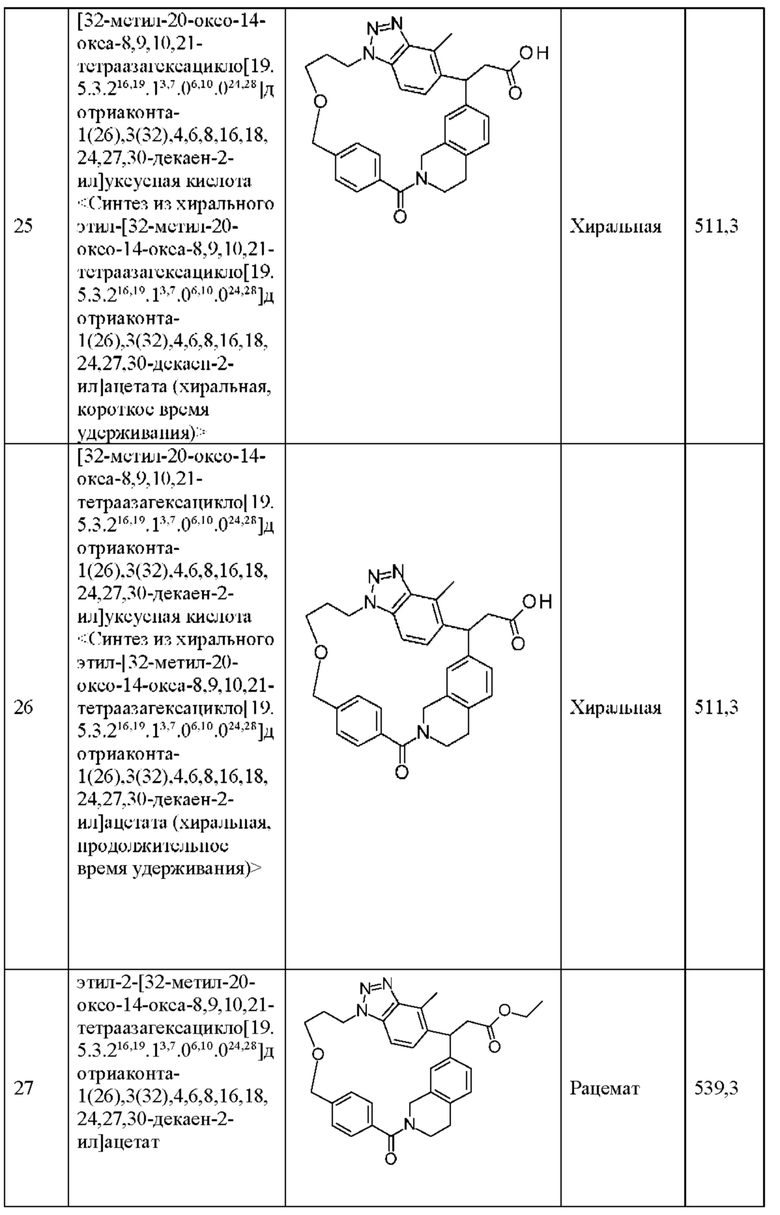
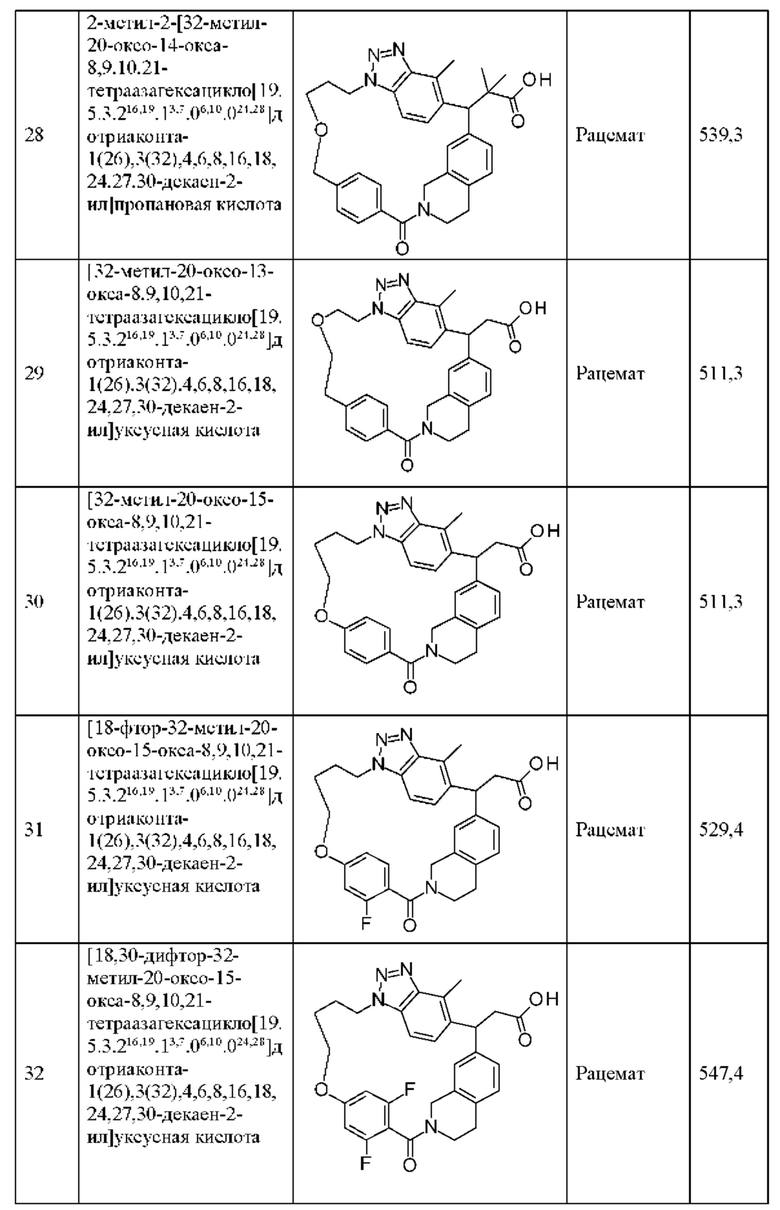
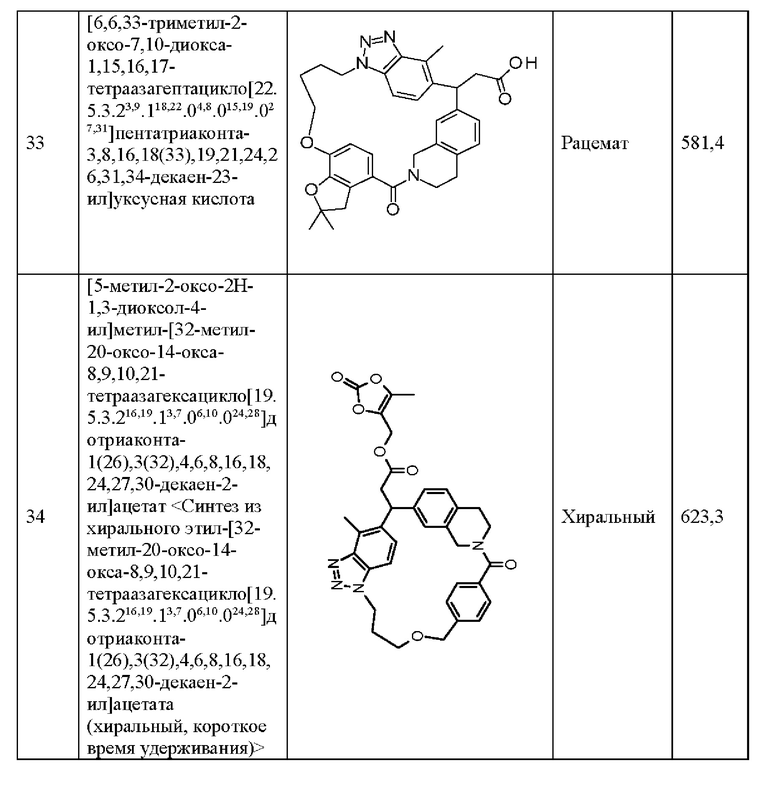
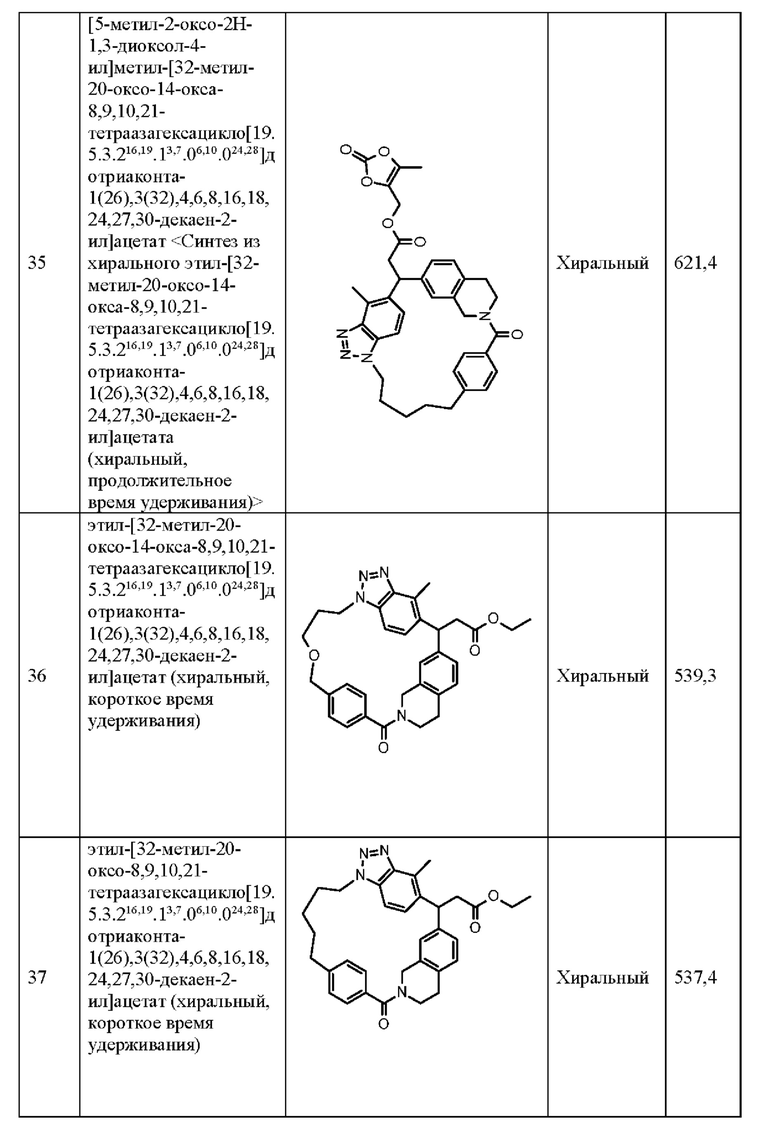
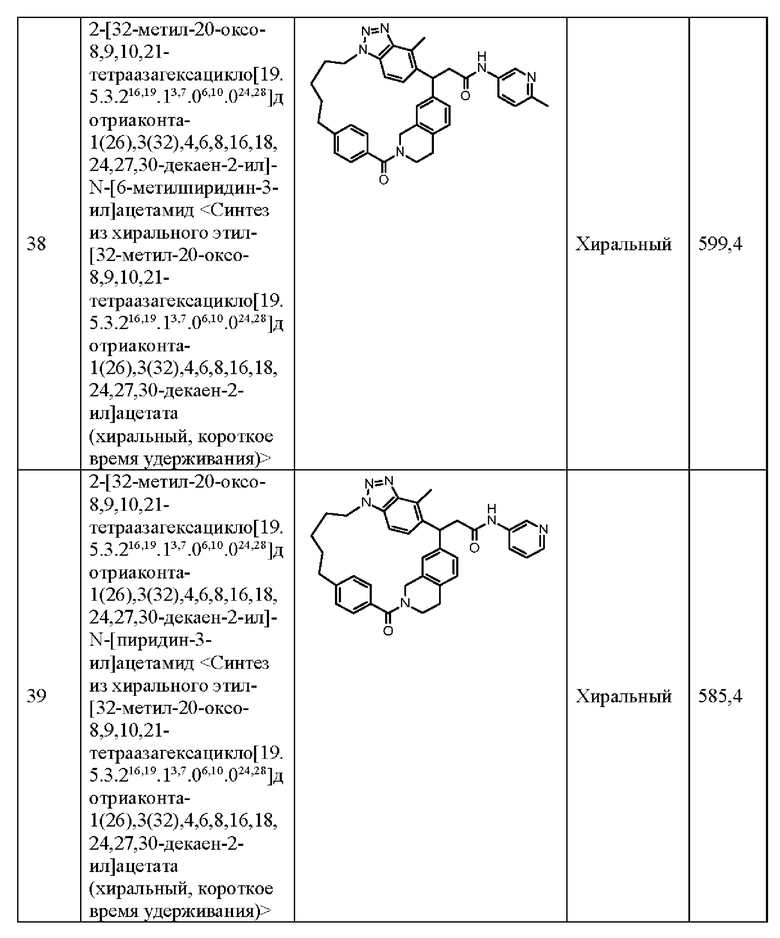
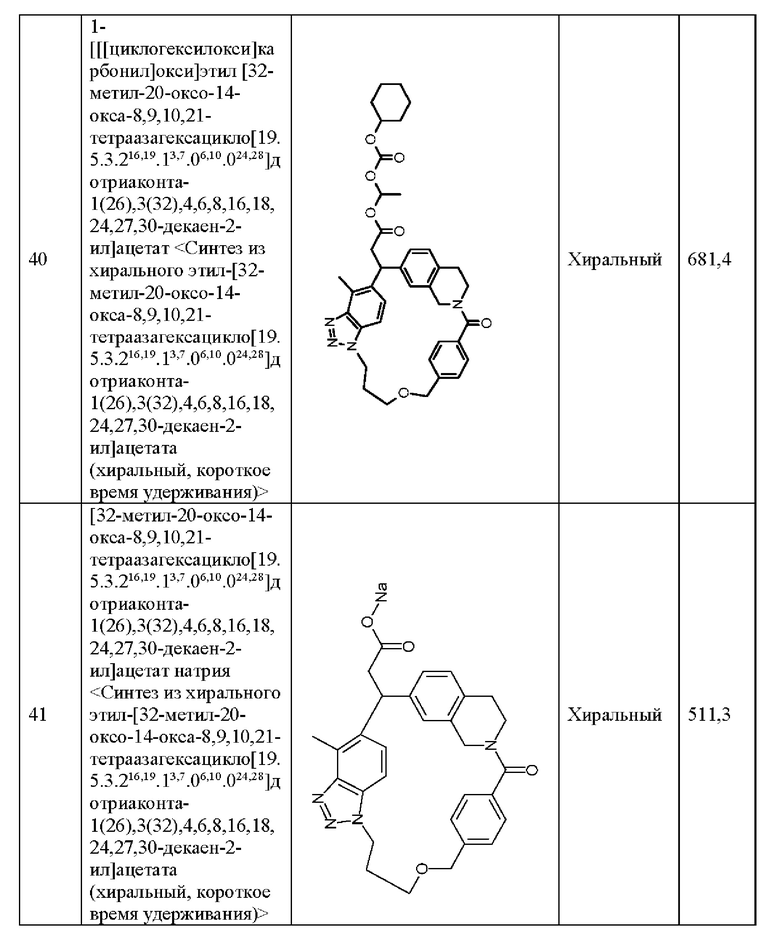
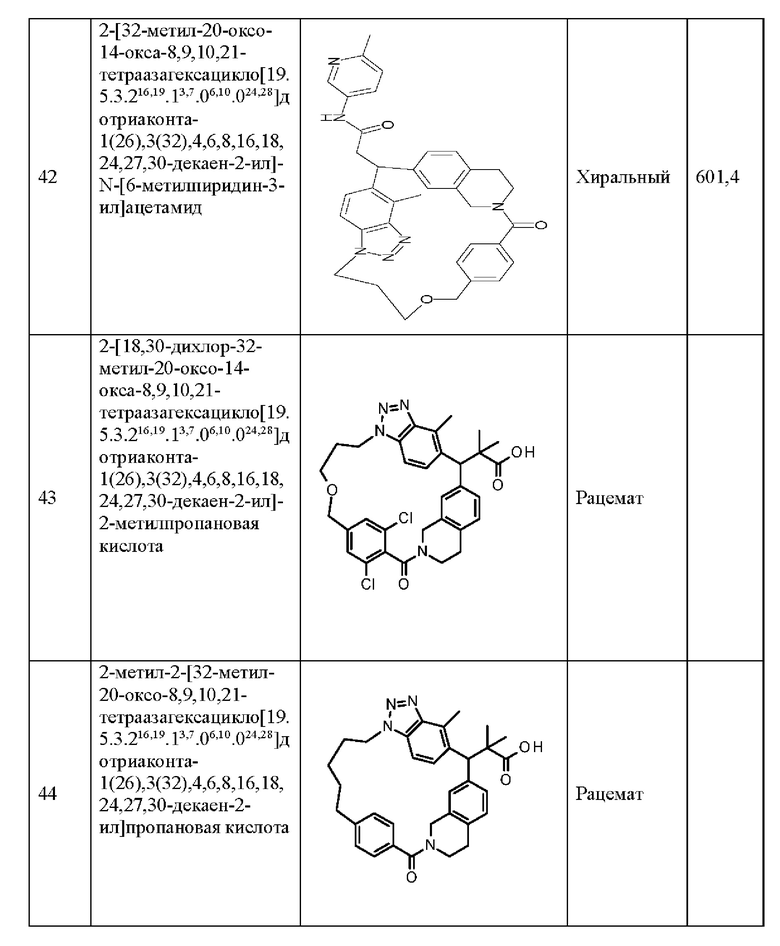
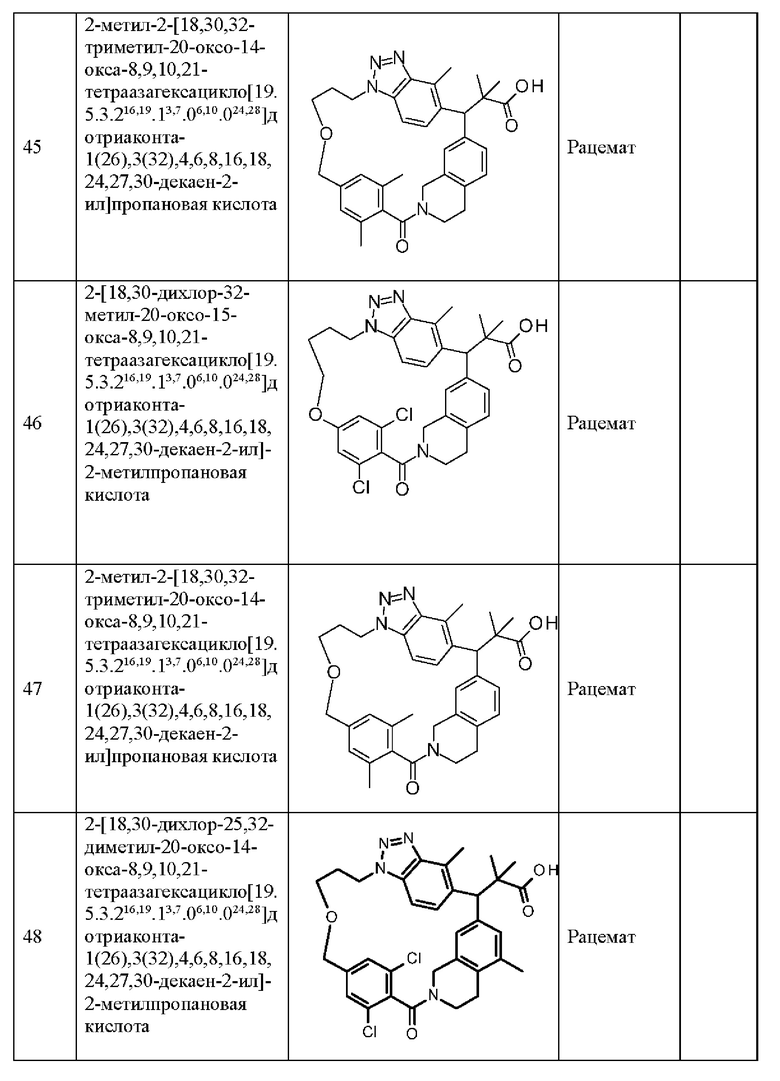
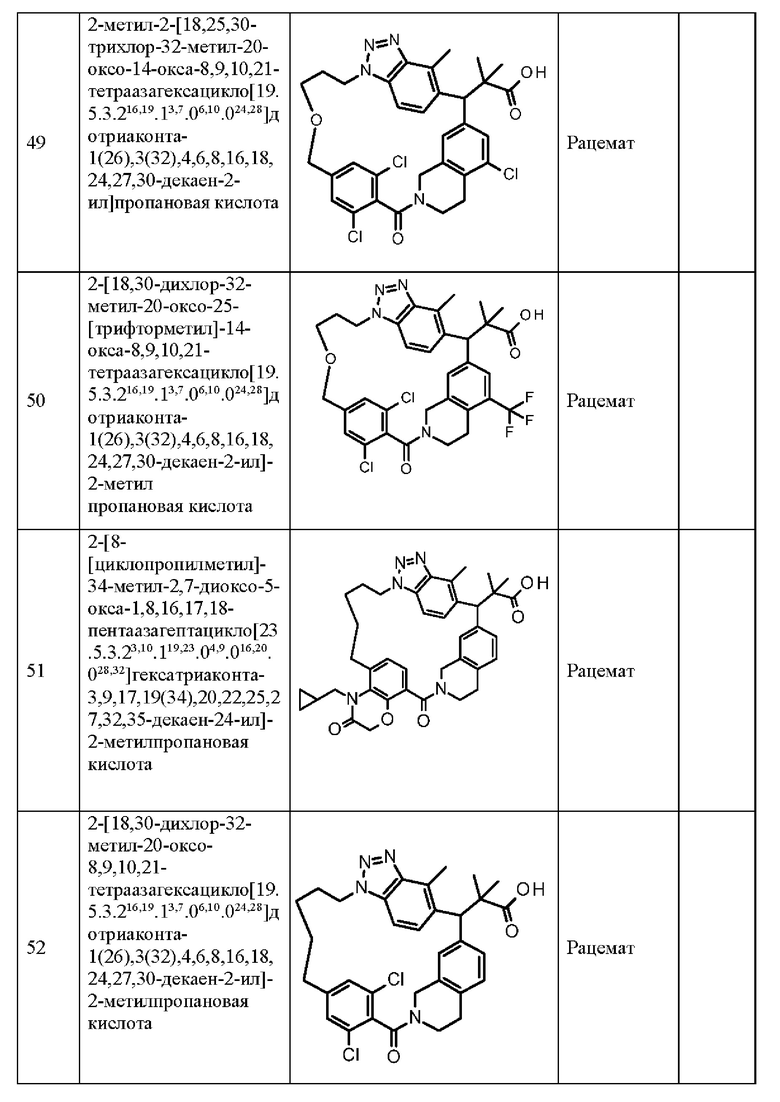
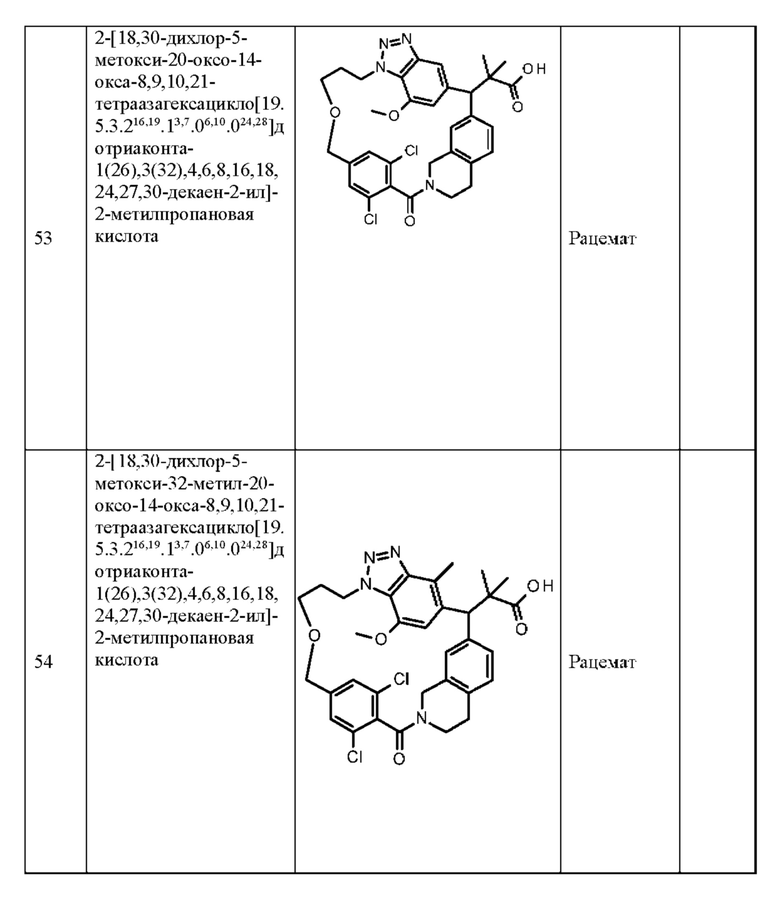
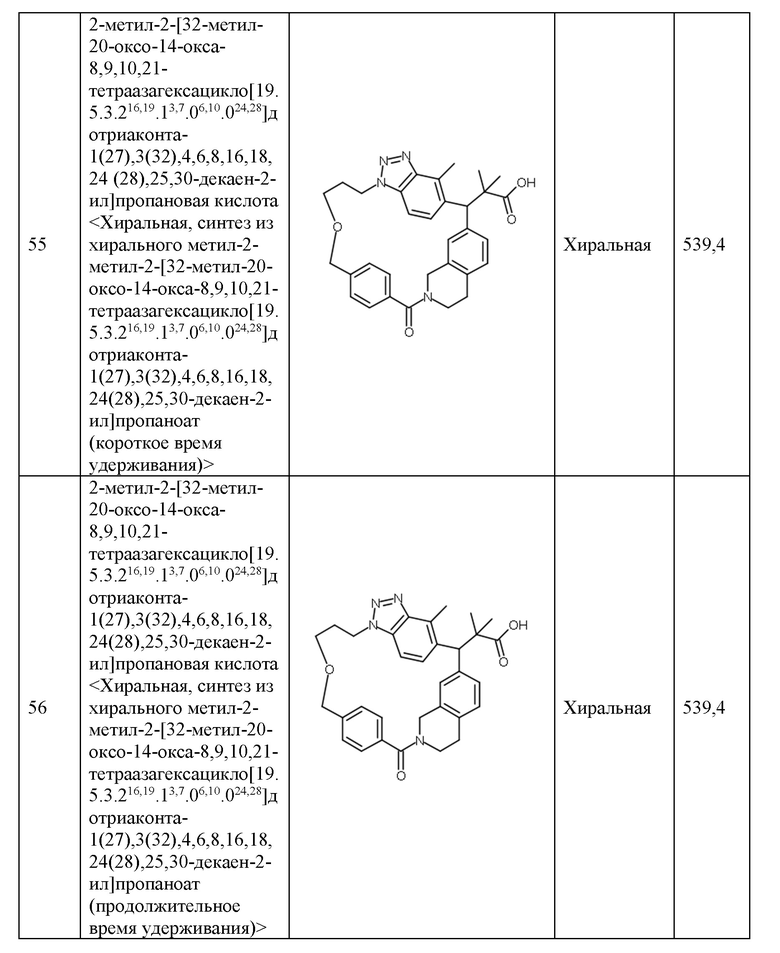
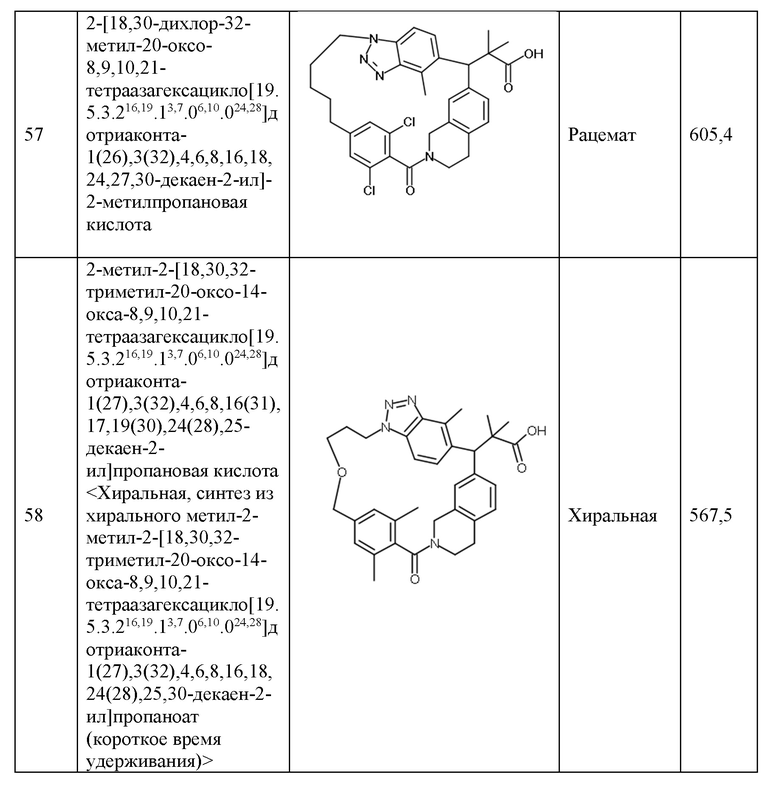
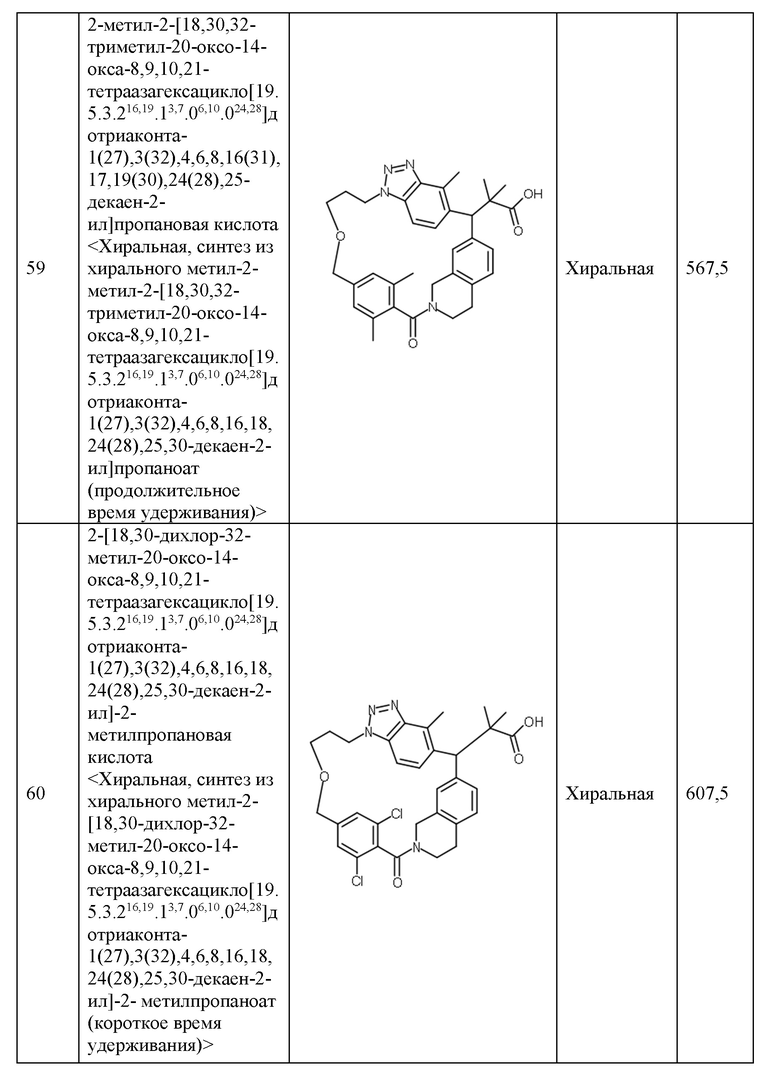
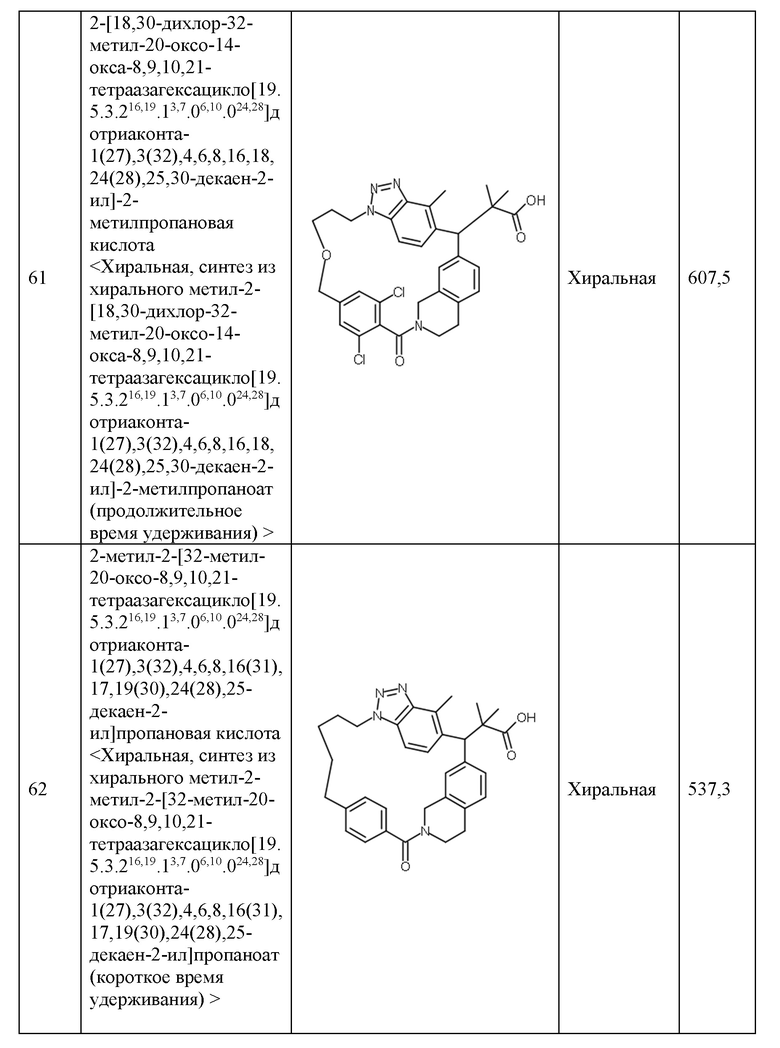
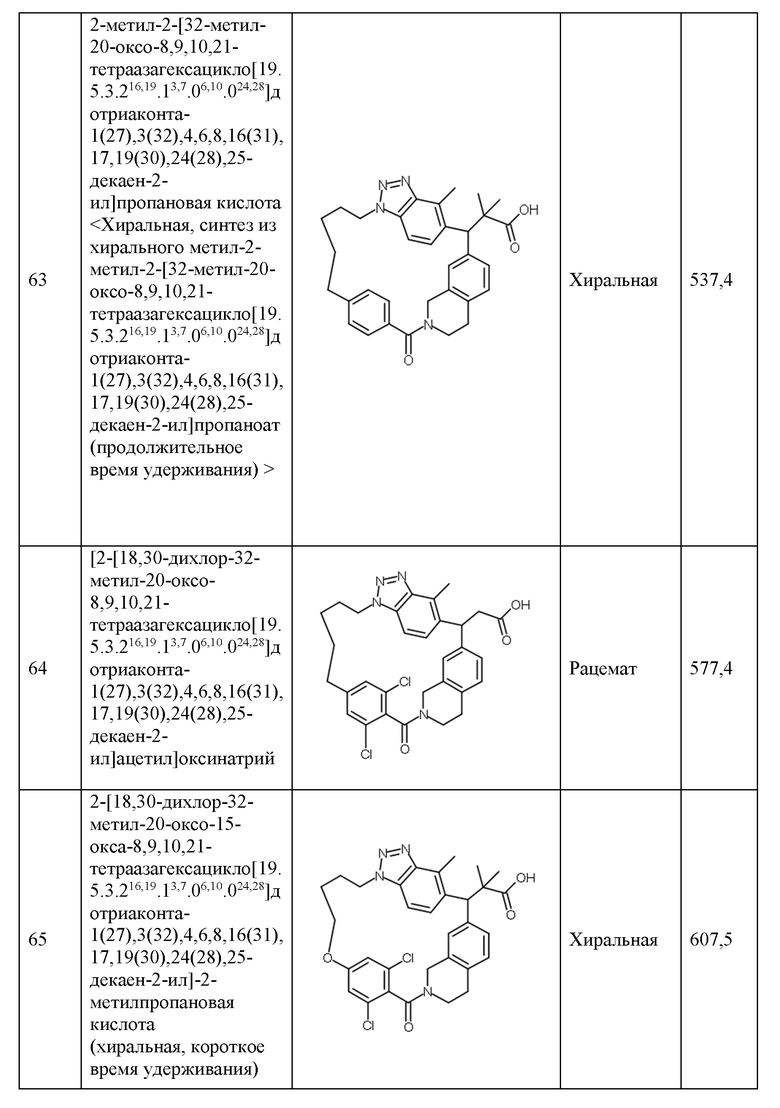
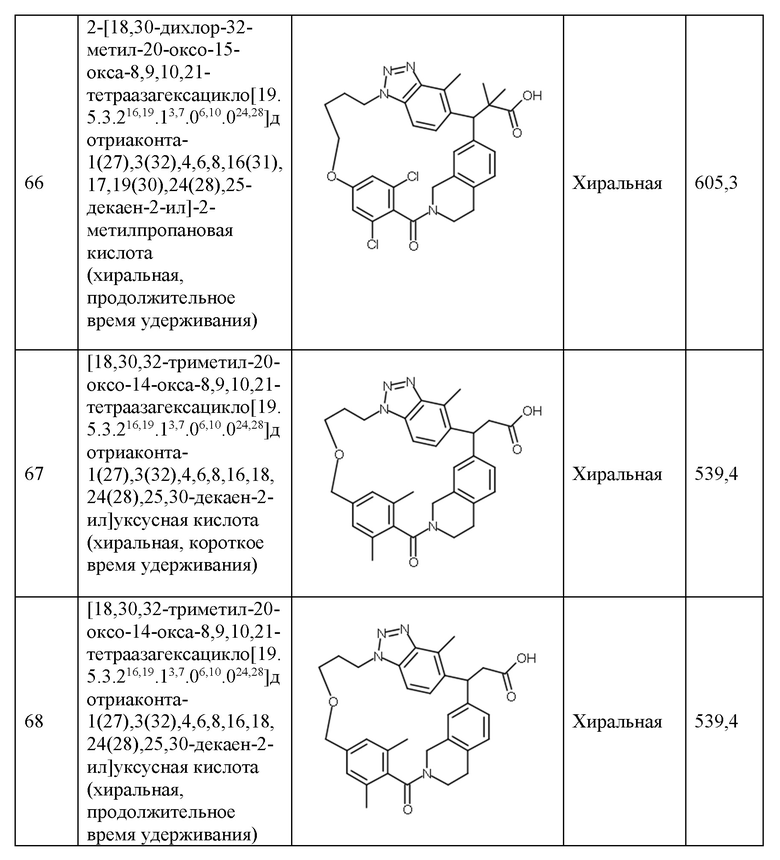
[0196]
Тестовый пример 1: Измерение активности в отношении ингибирования связывания NRF2 Ингибирующую активность экспериментальных соединений в отношении связывания между NRF2 и КЕАР1 измеряли методом времяразрешенного флуоресцентного индуктивно-резонансного переноса энергии (TR-FRET). В 384-луночный планшет помещали 2 мкл соединения, 2 мкл 2 нМ раствора биотинилированного человеческого белка КЕАР1 (домен Kelch), 2 мкл 14 нМ раствора пептида NRF2 с меткой TAMRA (TAMRA-Abu(4)-VWYTDIRMRDWM-OH) и 2 мкл 2 нМ раствора стрептавидина с меткой Tb, все растворы разбавляли аналитическим буфером (25 мМ HEPES, рН 7,5, 150 мМ NaCl, 0,01% Tween-20). В некоторые лунки не добавляли белок КЕАР1 для задания контрольных лунок. Планшет инкубировали при комнатной температуре в течение 60 минут и измеряли времяразрешенную флуоресценцию на планшет-ридере Envision (производства PerkinElmer). Ингибирующую активность каждого соединения при концентрации соединения 100 нМ рассчитывали как относительное значение активности, принимая интенсивность флуоресценции в контрольных лунках, в которые не добавляли белок КЕАР1, за 100% ингибирования, и интенсивность флуоресценции в лунках без добавления соединения за 0%.
Результаты измерений в соответствии со способом, описанным выше (степень ингибирования значения сигнала относительно контрольного образца при концентрации 100 нМ экспериментального соединения), представлены в таблице 3.
[0197]
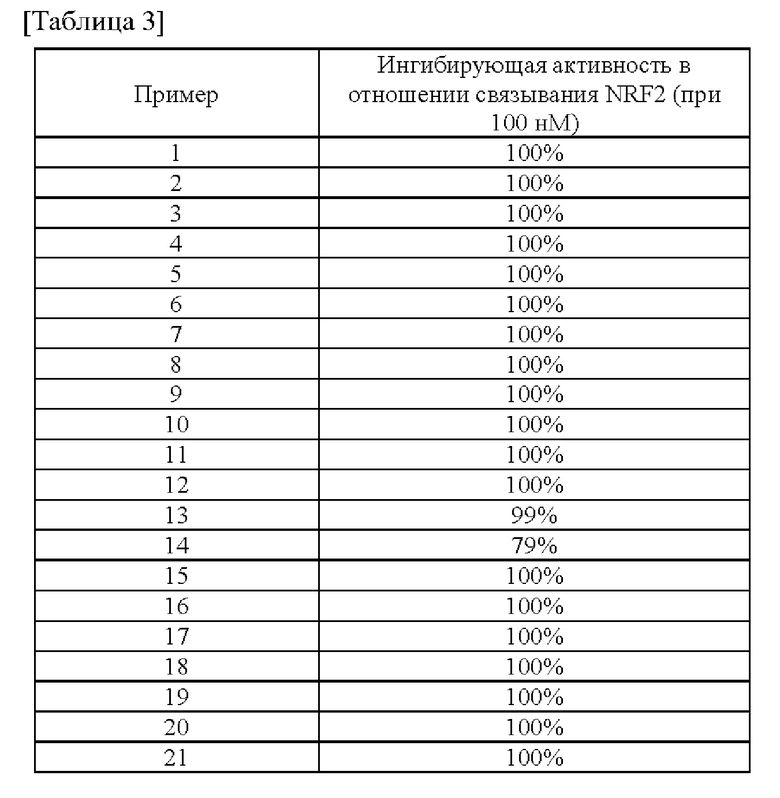
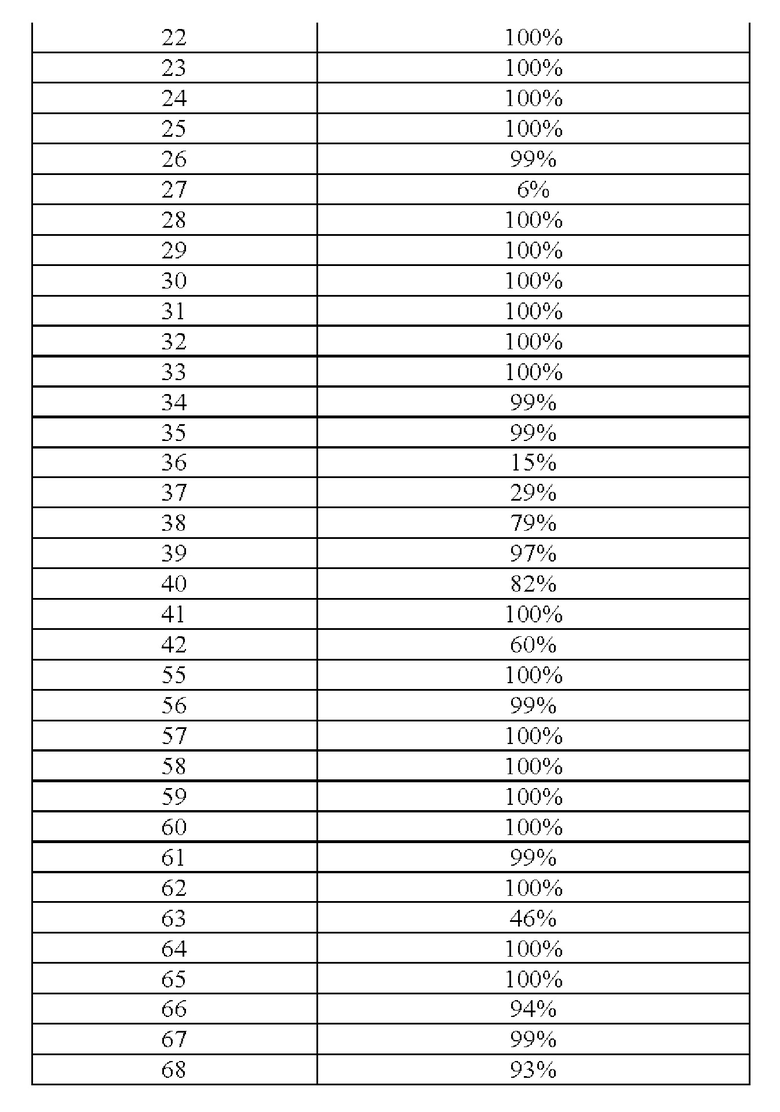
[0198]
Тестовый пример 2: Активность соединения в отношении экспрессии зависимого otNRF2 гена в почках и печени крыс
Изучали уровень экспрессии в почках мРНК Nqol в качестве зависимого от NRF2 гена. Соединения получали в 0,5% суспензиях метилцеллюлозы (МЦ, METOLOSE, Shin-Etsu Chemical Co., Ltd.) и перорально вводили самцам крыс Спрег-Доули (CLEA Japan, Inc.) в дозе 5 мл/кг. Примерно через 17 часов после введения крыс умерщвляли под анестезией и собирали почки и печень. Используя набор для экстракции РНК QIAsymphony (QIAGEN, номер по каталогу 931636) или RNeasy 96 (QIAGEN, номер по каталогу 74182) экстрагировали тотальную РНК. Из полученной тотальной РНК получали кДНК, используя набор для синтеза кДНК, Superscript IV VILO Master Mix (Thermo Fisher Scientific, номер по каталогу 11754-250). Используя полученную таким образом кДНК, с применением реагентов Taqman Fast Advanced Master Mix (Thermo Fisher Scientific, номер по каталогу 4444557) или Platinum Quantitative PCR SuperMix (Thermo Fisher Scientific, номер по каталогу 11743-500), а также праймеров и зонда, последовательности которых представлены в таблице 4, проводили количественную ПЦР в реальном времени в системе для быстрой ПЦР в реальном времени 7900НТ или в системе для быстрой ПЦР в реальном времени ViiA7 (Applied Biosystems). Уровень экспрессии мРНК Nqo1 в каждом органе крысы, которой вводили носитель, 0,5% раствор МЦ, принимали за 1; изменения представлены в таблице 5.


[0199]
Примеры составов
Медикамент, содержащий соединение согласно настоящему изобретению в качестве активного ингредиента, может быть получено, например, в соответствии со следующей рецептурой.
1. Капсула
Все количество компонентов (1), (2) и (3), а также 5 мг (4) смешивали и затем гранулировали. К полученной смеси добавляли оставшиеся 5 мг (4) и целиком инкапсулировали в желатиновую капсулу.
[0200]
2. Таблетка
Все количество компонентов (1), (2) и (3), а также 20 мг (4) и 2,5 мг (5) смешивали и затем гранулировали. К полученным гранулам добавляли оставшиеся 10 мг (4) и 2,5 мг (5) и прессовали гранулы в формах с получением таблеток.
[0201]
Настоящее изобретение может обеспечивать соединение, которое обладает превосходным действием в отношении активации NRF2 и предположительно подходит для применения в качестве профилактического или терапевтического агента для лечения заболеваний, связанных с окислительным стрессом, в частности, заболевания печени (например, неалкогольного стеатогепатита (НАСГ)), заболевания желчных протоков (например, первичного склерозирующего холангита (ПСХ)), сердечно-сосудистого заболевания (например, сердечной недостаточности или легочной артериальной гипертензии), заболевания легких (например, хронической обструктивной болезни легких (ХОБЛ)), заболевания почек (например, хронической болезни почек (ХБП) или острого повреждения почек (ОПП)), заболевания центральной нервной системы (например, болезни Паркинсона, болезни Альцгеймера, церебрального инсульта), митохондриального заболевания (например, моторной атаксии Фридрейха, митохондриальной миопатии), воспалительного заболевания (например, рассеянного склероза (PC), воспалительной болезни кишечника (ВЗК)), серповидно-клеточной болезни, рака или т.п.
| название | год | авторы | номер документа |
|---|---|---|---|
| МАКРОЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ ПИРИДАЗИНОНА | 2014 |
|
RU2660435C2 |
| ГЕТЕРОЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ ПИРИМИДИН-4(3H)-ОНА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2021 |
|
RU2839367C1 |
| Ингибитор CDK4/6 | 2017 |
|
RU2747311C2 |
| НОВОЕ СОЕДИНЕНИЕ БИФЕНИЛА ИЛИ ЕГО СОЛЬ | 2016 |
|
RU2726622C2 |
| C-3 и C-17 модифицированные тритерпеноиды в качестве ингибиторов ВИЧ-1 | 2017 |
|
RU2716502C2 |
| ПРОИЗВОДНЫЕ 7-ОКСО-1,6-ДИАЗАБИЦИКЛО[3.2.1]ОКТ-3-ЕНА, ПОЛЕЗНЫЕ ДЛЯ ЛЕЧЕНИЯ БАКТЕРИАЛЬНЫХ ИНФЕКЦИЙ | 2013 |
|
RU2645678C2 |
| МАКРОЦИКЛИЧЕСКИЕ АНТИБИОТИКИ ШИРОКОГО СПЕКТРА ДЕЙСТВИЯ | 2020 |
|
RU2834484C2 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ ТЕРАПЕВТИЧЕСКОГО ЭФФЕКТА ИНГИБИТОРА LSD1 НА ОСНОВЕ ЭКСПРЕССИИ INSM1 | 2018 |
|
RU2789449C2 |
| НОВЫЕ АЦИКЛИЧЕСКИЕ НУКЛЕОЗИДФОСФОНАТНЫЕ ПРОИЗВОДНЫЕ, ИХ СОЛИ И СПОСОБ ПОЛУЧЕНИЯ ЭТИХ СОЕДИНЕНИЙ | 2002 |
|
RU2266294C2 |
| СОЕДИНЕНИЯ N, N-ЗАМЕЩЕННОГО ЦИКЛИЧЕСКОГО АМИНА | 1999 |
|
RU2232156C2 |
Изобретение относится к гетероароматическим соединениям. Предложено соединение, представленное формулой (I), где R1 представляет собой OH; R2 и R3, которые могут быть одинаковыми или разными, представляют собой атом водорода или метильную группу; X представляет собой C(=O); кольцо B представляет собой незамещенное бензольное кольцо; кольцо A представляет собой бензольное кольцо, которое может содержать один заместитель - метил; образуя структуру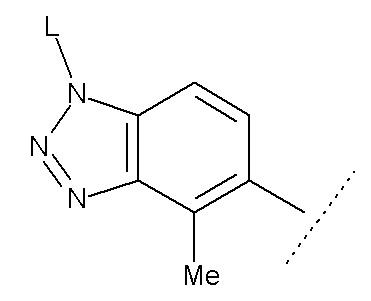 ; кольцо C представляет собой
; кольцо C представляет собой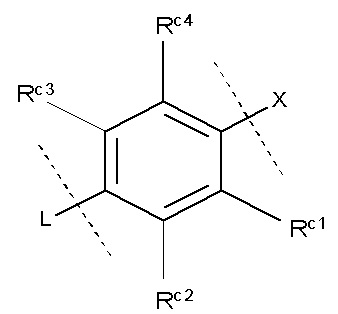 , где Rc1 и Rc4, которые могут быть одинаковыми или разными, представляют собой атом водорода, атом хлора или метильную группу, и каждый Rc2 и Rc3 представляет собой атом водорода; и L представляет собой -CH2-CH2-CH2-CH2-CH2-*, -CH2-CH2-CH2-CH2-O-*, -CH2-CH2-CH2-O-CH2-* или -CH2-CH2-O-CH2-CH2-*, и где * означает точку присоединения к кольцу C. Также раскрываются конкретные соединения, медикамент и фармацевтическая композиция, способы активации NRF2 и предотвращения или лечения заболевания, связанного с окислительным стрессом, а также применение соединения. Технический результат – получение соединений, которые обладают активирующим действием в отношении NRF2. 9 н. и 3 з.п. ф-лы, 5 табл., 68 пр.
, где Rc1 и Rc4, которые могут быть одинаковыми или разными, представляют собой атом водорода, атом хлора или метильную группу, и каждый Rc2 и Rc3 представляет собой атом водорода; и L представляет собой -CH2-CH2-CH2-CH2-CH2-*, -CH2-CH2-CH2-CH2-O-*, -CH2-CH2-CH2-O-CH2-* или -CH2-CH2-O-CH2-CH2-*, и где * означает точку присоединения к кольцу C. Также раскрываются конкретные соединения, медикамент и фармацевтическая композиция, способы активации NRF2 и предотвращения или лечения заболевания, связанного с окислительным стрессом, а также применение соединения. Технический результат – получение соединений, которые обладают активирующим действием в отношении NRF2. 9 н. и 3 з.п. ф-лы, 5 табл., 68 пр.
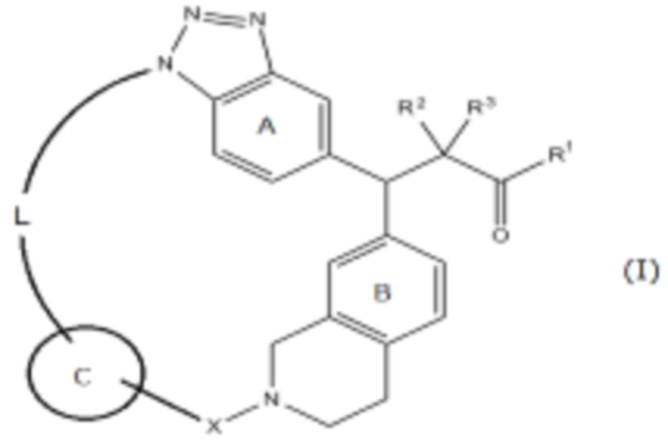
1. Соединение, представленное следующей формулой (I), или его соль:
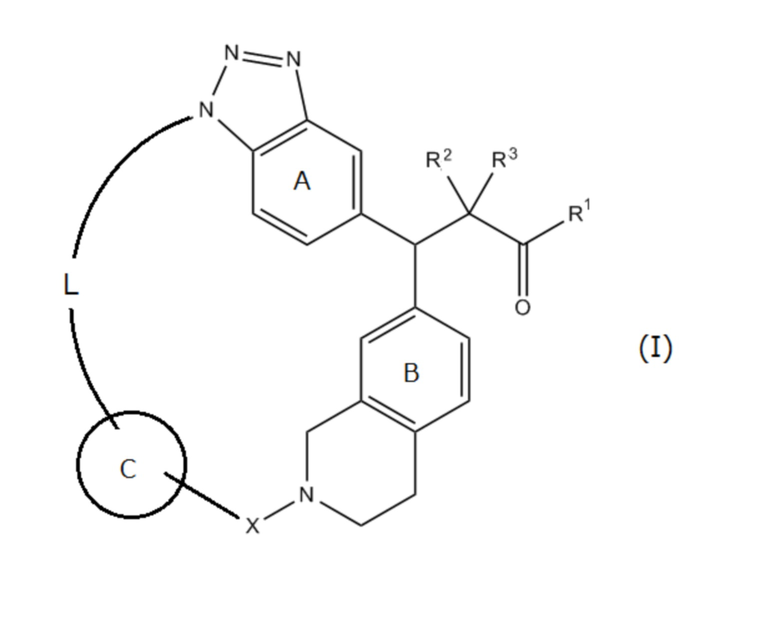
где
R1 представляет собой OH;
R2 и R3, которые могут быть одинаковыми или разными, представляют собой атом водорода или метильную группу;
X представляет собой C(=O);
кольцо A представляет собой бензольное кольцо, которое может содержать один заместитель-метил, образуя структуру, представленную формулой:
 ;
;
кольцо B представляет собой незамещенное бензольное кольцо;
кольцо C представляет собой группу, представленную следующей формулой:
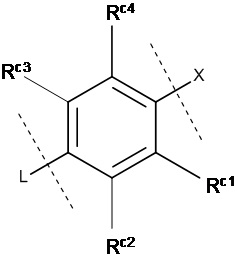
где
Rc1 и Rc4, которые могут быть одинаковыми или разными, представляют собой атом водорода, атом хлора или метильную группу, и каждый Rc2 и Rc3 представляет собой атом водорода; и
L представляет собой -CH2-CH2-CH2-CH2-CH2-*,
-CH2-CH2-CH2-CH2-O-*,
-CH2-CH2-CH2-O-CH2-* или
-CH2-CH2-O-CH2-CH2-*,
где * означает точку присоединения к кольцу C.
2. Соединение по п. 1 или его соль, где в формуле (I):
R1 представляет собой OH;
R2 и R3, которые могут быть одинаковыми или разными, представляют собой атом водорода или метильную группу;
X представляет собой C(=O);
кольцо A представляет собой субструктуру, представленную следующей формулой:
кольцо B представляет собой незамещенное бензольное кольцо; и
C представляет собой группу, представленную следующей формулой:

где
Rc1 и Rc4, которые могут быть одинаковыми или разными, представляют собой атом водорода или метильную группу, и каждый из Rc2 и Rc3 представляет собой атом водорода; и
L представляет собой -CH2-CH2-CH2-O-CH2-*,
где * означает точку присоединения к кольцу C.
3. Соединение следующей формулы:
или его соль.
4. Соединение следующей формулы:
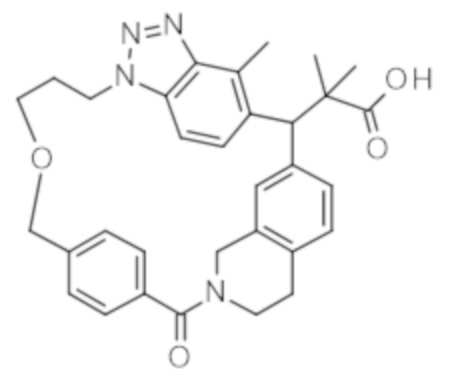
или его соль.
5. Соединение следующей формулы:
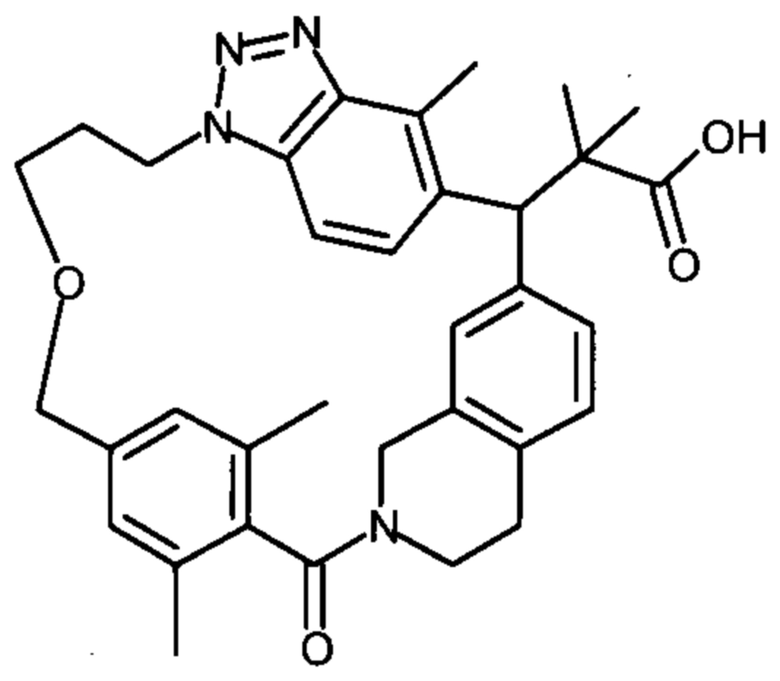
или его соль.
6. Медикамент для активации NRF2, содержащий соединение по любому из пп. 1–5 или его соль в эффективном количестве.
7. Медикамент по п. 6, отличающийся тем, что указанный медикамент является активатором NRF2.
8. Медикамент по п. 6, отличающийся тем, что указанный медикамент представляет собой профилактический или терапевтический агент для лечения заболевания, связанного с окислительным стрессом, выбранного из заболевания печени и желчных протоков, сердечно-сосудистого заболевания, заболевания легких, заболевания почек, заболевания центральной нервной системы, рака, серповидно-клеточной болезни, митохондриального заболевания и воспалительного заболевания.
9. Фармацевтическая композиция, содержащая эффективное количество соединения по любому из пп. 1–5 выше или его фармацевтически приемлемую соль, для применения для предотвращения или лечения заболевания, связанного с окислительным стрессом, выбранного из заболевания печени и желчных протоков, сердечно-сосудистого заболевания, заболевания легких, заболевания почек, заболевания центральной нервной системы, рака, серповидно-клеточной болезни, митохондриального заболевания и воспалительного заболевания.
10. Способ активации NRF2 у млекопитающего, включающий введение указанному млекопитающему эффективного количества соединения по любому из пп. 1–5 или его соли, обладающих активирующим действием в отношении NRF2, в эффективном количестве.
11. Способ предотвращения или лечения заболевания, связанного с окислительным стрессом, выбранного из заболевания печени и желчных протоков, сердечно-сосудистого заболевания, заболевания легких, заболевания почек, заболевания центральной нервной системы, рака, серповидно-клеточной болезни, митохондриального заболевания и воспалительного заболевания у млекопитающего, включающий введение указанному млекопитающему эффективного количества соединения по любому из пп. 1–5 или его соли, обладающих активирующим действием в отношении NRF2.
12. Применение соединения по любому из пп. 1–5 или его соли, обладающих активирующим действием в отношении NRF2, для получения профилактического или терапевтического агента для заболевания, связанного с окислительным стрессом, выбранного из заболевания печени и желчных протоков, сердечно-сосудистого заболевания, заболевания легких, заболевания почек, заболевания центральной нервной системы, рака, серповидно-клеточной болезни, митохондриального заболевания и воспалительного заболевания.
| WO 2018181345 A1 04.10.2018 | |||
| WO 2015092713 А1 25.06.2015 | |||
| WO 2018140876 A1 02.08.2018 | |||
| ТЕЛЕЖКА ДЛЯ ПЕРЕВОЗКИ БОЧЕК В ИХ ВЕРТИКАЛЬНОМ ПОЛОЖЕНИИ | 1932 |
|
SU29743A1 |
| АГОНИСТЫ РЕЦЕПТОРОВ НЕЙРОТРОФИНОВ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2011 |
|
RU2606622C2 |
Авторы
Даты
2023-06-19—Публикация
2019-12-04—Подача