Изобретение относится к области биотехнологии растений, в частности к способам размножения редких и реликтовых хвойных растений, и может быть использовано для массового получения качественного посадочного материала секвойи вечнозеленой (Sequoia sempervirens L.), трудно размножаемой вегетативным способом. Полученные микроклоны могут быть использованы для реинтродукции секвойи вечнозеленой в естественные места произрастания для расширения коллекции ботанических садов и природные зоны РФ, в качестве ценной, реликтовой древесной хвойной породы устойчивой к пожарам.
Sequoia sempervirens (L.) - самые высокие реликтовые растения - тысячелетние долгожители, характеризующиеся ограниченным ареалом произрастания. Ценная древесина секвойи способна накапливать уникальные вторичные метаболиты, не имеющие синтетических аналогов. Фенольные соединения являются одними из наиболее распространенных в растениях представителями вторичного метаболизма, образование которых свойственно практически всем их клеткам. В настоящее время установлено участие этих веществ в формировании клеточных стенок, фотосинтезе, дыхании, аллелопатии, сверхчувствительности и некротизации, а также защите растений от ряда стрессовых воздействий. Полифенолы имеют и важное практическое значение. На их окислительных превращениях основаны технологические процессы в пищевой и легкой промышленности. В медицине широко применяются лекарственные препараты, изготовленные на основе фенольных соединений, получившие тривиальное название -биофлавоноиды. Они обладают капилляроукрепляющим, противовоспалительным, антисклеротическим, противолучевым и противоопухолевым действием. Интерес к секвойи вечнозеленой обусловлен способностью клеток и тканей растений к синтезу соединений фенольной природы, природных антиоксидантов, которые могут успешно использоваться в терапии онкологических заболеваний.
Растения рода секвойя произрастают в специализированных микроэкологических нишах, ограничивающих их природный ареал распространения. Известно, что биотический стресс является одними из основных факторов окружающей среды, ограничивающих интродукцию ценных видов растений - возможных источников производства уникальных метаболитов. Ограничивающие факторы окружающей среды оказывают прямое влияние на рост, развитие и продуктивность вторичного метаболизма растений. Создать стрессоустойчивые и высокопродуктивные растения можно с использованием методов клеточной биотехнологии. Поэтому необходимо разрабатывать технологии in vitro быстрого получения хорошо развивающихся, устойчивых к биотическим стрессорам и продуктивных микроклонов Sequoia sempervirens (L.). К таким технологиям относится метод клонального микроразмножения, позволяющий проводить работы в лабораторных условиях круглогодично, получать генетически стабильный, «здоровый» посадочный материал с высоким коэффициентом размножения.
В мире проводятся исследования по размножению в культуре in vitro некоторых редких и реликтовых хвойных растений, таких как Taxus chinensis, Т. brevifolia, Т. wallichiana, Sequoiadendron и др. [A. Sârbu, G,Cogalniceanu, D. Smarandache, G. Pascale Morpho-anatomical studies on vegetative organs of Sequoia sempervirens, in vitro culture on carbon microstructure substrates // Acta Horti Bot. 2008. 35:51-59]. Что касается секвойи вечнозеленой (Sequoia sempervirens), то исследования, как правило, направлены на изучение отдельных минеральных солей питательной среды на морфгенетический потенциал культивируемых экспланто in vitro или на разработку технологии укоренение микропобегов in vitro. Следует отметить, что технология клонального микроразмножения, включающая все этапы размножения in vitro секвойи вечнозеленой от введения изолированных эксплантов в культуру in vitro и до адаптации микроклонов к условиям ех vitro в научной литературе обнаружены не были.
Известен способ культивирования секвойи вечнозеленой (Sequoia sempervirens) in vitro [A. Sârbu, G,Cogalniceanu, D. Smarandache, G. Pascale Morpho-anatomical studies on vegetative organs of Sequoia sempervirens, in vitro culture on carbon microstructure substrates // Acta Horti Bot. 2008. 35:51-59]. Способ заключается в размножении растений in vitro через изолированные вегетативные побеги, изолированные со взрослых растений секвойи и культивирование их на питательной среде, содержащей минеральные соли по прописи Мурасига и Скуга (МС), а также кинетин 0,2 мг/л в сочетании с ИУК 0,5 мг/л. Способ предполагает размножение растений через индукцию образования адвентивных почек, формирование микропобегов с последующим переносом их на питательную среду для укоренения, содержащую ИМК 1 мг/л. Недостатком данного способа является низкий коэффициент размножения, который составил 3,7 на один первичный эксплант.
Известен другой способ размножения in vitro секвойидендрона гигантского (Sequoiadendron giganteum) [Султонова М.С.Особенности микроклонального размножения и органогенез некоторых представителей хвойных пород (Sequoiadendron qiqanteum Lindl, и Biota orientalis h.). Автореферат на соискание диссертации на соискание ученой степени кандидата сельскохозяйственных наук, 2016, Санкт-Петербург, 26 с.] включающий культиврование черенков, изолированных со взрослых деревьев, на питательной среде Мурасиге Скуга с добавлением кинетина 0,1 мг/л и НУК 2 мг/л, а также ПВП 1 г/л. Недостатком предлагаемого способа является получение растений-регенерантов из каллусной ткани, что приводит к проявлению сомаклоной вариабельности и не обеспечивает получение генетически стабильного посадочного материала.
Известен другой способ размножения секвойи в условиях in vitro [Marie-Claude Bon, Frederique Riccardi, Olivier Monteuuis Influence of phase change within a 90-year-old Sequoiasempervirens on its in vitro organogenic capacity and protein patterns // Trees, 1994, 8:283-287] включающий культивирование 2-х см побегов, изолированных с 90-летних растений секвойи на питательной среде, содержащей 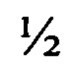 минеральных солей по прописи Мурасига и Скуга (МС) и 1 г/л активированного угля, обеспечивающей удлинение побегов. В дальнейшем сформировавшиеся в пробирках побеги переносят на среду МС для укоренения, содержащую НУК в концентрации 2 мг/л. Недостатком предлагаемого способа является разработка технологии только по укоренению побегов in vitro. Полной технологии клонального микроразмножения не приводится.
минеральных солей по прописи Мурасига и Скуга (МС) и 1 г/л активированного угля, обеспечивающей удлинение побегов. В дальнейшем сформировавшиеся в пробирках побеги переносят на среду МС для укоренения, содержащую НУК в концентрации 2 мг/л. Недостатком предлагаемого способа является разработка технологии только по укоренению побегов in vitro. Полной технологии клонального микроразмножения не приводится.
Наиболее близким по технической сущности к предлагаемому способу, взятом за прототип, относится способ клонального микроразмножения секвой вечнозеленой [Lobna S. Tahal, Walaa Н. Salama2, Azza A.M. Mazharl, Kh. I. Hashish 1, Iman M. El-Sayed A comparative study of biochemical changes on micropropagated Sequoia sempervirens using potassium silicate and silica nanoparticles // Journal of Pharmaceutical Negative Results, 2022, Volume 13, Special Issue 8, p.2592-2601] с использованием в качестве объекта исследований побегов, изолированных со взрослых растений, которые после поверхностной стерилизации 0,1% раствором хлорида ртути (HgCl2) в течение 5 минут и последующей стерилизации 15% раствором гипохлорида калия в течение 7 минут культивировали на питательной среде МС, содержащей БАП 0,2 мг/л и наночастицы оксида кремния в различных концентрациях (0-10 мг/л) для изучения их влияния на рост и укоренение микропобегов in vitro, образование фотосинтетических пигментов, фенольных соединений в тканях и активность специфических антиоксидантных ферментов. Недостатком способа является применение ступенчатой стерилизации растительного материала и использование высоких концентраций и временных экспозиций разносоставных стерилизующих веществ, а также применение наночастиц, которые трудно получить самостоятельно в лаборатории.
В результате анализа литературных данных и патентного поиска установлено, что исследования, направленные на разработку способа размножения in vitro секвойи вечнозеленой с использованием вегетативных органов растений начиная от получения асептической культуры и заканчивая адаптацией микроклонов секвойи к условиям ex vitro - отсутствуют. Использование вегетативных органов растений позволяет получать высококачественный, генетически однородный посадочный материал.
Задача предполагаемого изобретения - разработать способ клонального микроразмножения секвойи вечнозеленой (Sequoia sempervirens) за счет использования вегетативных частей растения.
Технический результат изобретения - обеспечение ускоренного получения высококачественного, генетически однородного посадочного материала.
Поставленная задача достигается за счет того, что в качестве первичного экспланта используют побеги, изолированные со взрослых растений секвойи, которые первоначально выдерживают в 0,2%-ном растворе ИМК в течение 2 часов, затем проводят поверхностную стерилизацию и потом культивируют в течение 20-30 суток на безгормонольной питательной среде Мурасига и Скуга (МС) [Murashige Т., Skoog F. A revised medium for rapid growth and bio assays with tobacco tissue cultures // Physiol. Plant. - 1962. - vol. 5, 95 - P. 473-497] с добавлением поливинил пиролидона (ПВП) 1 г/л. Для роста побеги переносят на питательную среду, содержащую 2 мг/л 2,4-Д, 2 мг/л БАП и 1 г/л ПВП. После двух циклов культивирования (по 35-40 суток) микропобеги переносят на питательную среду МС, дополненную 2 мг/л 2,4-Д, 0,5 мг/л БАЛ, 0,5 мг/л НУК и 1 г/л ПВП для индукции образования адвентивных побегов и корней. Сформированные в условиях in vitro микроклоны в дальнейшем переносят для адаптации в почвенные условия ex vitro.
Известных в научно-технической и патентной литературе способов клонального микроразмножения секвойи вечнозеленой с использованием вегетативных побегов и аналогичным составом питательной среды не обнаружено. Результат, полученный у данного решения и обусловленный применением питательной среды для размножения и укоренения in vitro и почвенного субстрата для адаптации ex vitro секвойи вечнозеленой не достигался в известных решениях.
Конкретный пример осуществления предполагаемого способа.
В качестве первичного экспланта использовали черенки, заготовленные с побегов первого года вегетации со взрослых деревьев секвойи вечнозеленой в период с сентября по декабрь. Перед введением в культуру in vitro черенки выдерживали в 0,2%-ном растворе ИМК в течение 2 часов, после чего проводят ступенчатую стерилизацию. Для этого первоначально черенки промывают мыльным раствором в течение 10 минут, затем споласкивают проточной водой 2 минуты, выдерживают в слабом растворе марганцовки 10 мин. После этого в условиях ламинар-бокса черенки стерилизуют 0,1% раствором хлорида ртути (HgCl2) 18 минут и трижды промывают стерильной дистиллированной водой. Затем черенки разрезают скальпелем на сегменты длиной 1,5-2 см с сохранением хвои в количестве 7-10 шт. и помещают в биологические пробирки диаметром 20 мм на безгормональную питательную модифицированную МС с добавлением поливинил пиролидона (ПВП) 1 г/л. рН питательной среды МС доводят до 5,8 перед автоклавированием. В этих условиях микрочеренки культивируют 20-30 суток до формирования из верхушечных и боковых почек побегов, которые в дальнейшем отделяют от материнского экспланта и самостоятельно культивируют на питательной среде МС дополненной 2 мг/л 2,4-Д, 2 мг/л БАП и ПВП 1 г/л. После двух циклов культивирования (по 35-40 суток) вновь образованные множественные микропобеги (длиной не более 3 см) переносят для дальнейшего роста и укоренения на питательную среду МС, дополненную 2 мг/л 2,4-Д, 0,5 мг/л БАП, 0,5 мг/л НУК и 1 г/л ПВП. В этих условиях наблюдается активное образование адвентивных побегов в базальной части главного побега, которые в процессе культивирования через каллусную «подушку» формируют корни. Сформированные в условиях in vitro микроклоны в дальнейшем переносят для адаптации в почвенные условия ex vitro.
Изобретение проиллюстрировано на рисунках.
На фиг.1 Молодые побеги, изолированные со взрослых деревьев секвойи, перед введением в культуру in vitro
На фиг.2 Асептическая культура Sequoia sempervirens и рост верхушечной почки после стерилизации 0,1% HgCl2 в течение 18 минут
На фиг.3 Формирование адвентивных побегов в базальной части главного побега
На фиг.4 Формирование микропобегов, готовых к укоренению
На фиг.5 Образование корневой системы на этапе укоренения
На фиг.6 Адаптация микроклонов Sequoia sempervirens к условиям ех vitro.
Пример 1. Для получения стерильной культуры черенков применяли ступенчатую стерилизацию. Перед введением в культуру in vi tro че ренки секвойи разрезают и выдерживают в 0,2%-ном растворе ИМК в течение 2 часов. Затем их промывают мыльным раствором в течение 10 минут, споласкивают проточной водой 2 минуты, выдерживают в слабом растворе марганцовки 10 мин. Последующие действия проводят в условиях ламинар-бокса. Черенки помещают в мешочки из марли и переносят в ламинар-бокс, где проводят поверхностную стерилизацию 0,1% раствором хлорида ртути (HgCl2). Временная экспозиция хлорида ртути была от 15 до 20 минут. В качестве контроля черенки обрабатывали гипохлоритом натрия (7%) в течение 15 минуты. После этого черенки промывают стерильной дистиллированной водой 3 раза, разрезают скальпелем на сегменты длиной 1,5-2 см с сохранением хвои в количестве 7-10 шт. и помещают в биологические пробирки диаметром 20 мм на безгормональную питательную среду МС. Оценивали количество стерильных и зараженных черенков. Основные результаты приведены в таблице 1 и рисунках 1 и 2.

На основании проведенных исследований установлено, что наибольший выход стерильных эксплантов (80%) был получен при временной экспозиции воздействия хлорида ртути на черенки секвойи вечнозеленой 18 минут. В этом варианте на 20-30 сутки культивирования отмечалось формирование побегов из спящих почек, которые характеризовались активным ростом и имели ярко-зеленую хвою. Использование гипохлорита натрия, в качестве стерилизатора, было не эффективно из-за низкой жизнеспособности эксплантов и повсеместных некротических очагов.
Пример 2. Стерилизацию черенков проводили по методике, описанной в примере 1. После поверхностной стерилизации, черенки разделяли на сегменты длиной 1,5-2 см с сохранением хвои в количестве 7-10 шт. и культивировали на безгормональной питательной среде, содержащей различные минеральные соли и антиоксиданты. Исследовали влияние минеральных солей по прописи Мурасига и Скуга и минеральные соли по прописи Woody Plant Medium (WPM) на биометрические показатели побегов и коэффициент размножения. Результаты приведены в таблице 2 и на рисунках 3 и 4.
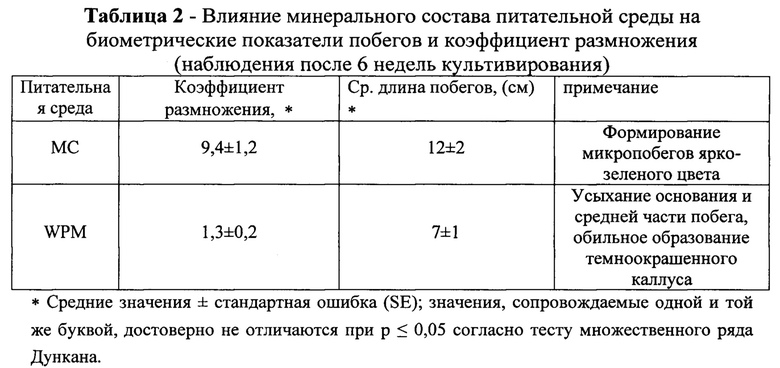
На основании проведенных экспериментов установлено, что исследуемые питательные среды, отличающиеся по минеральному составу, оказывают различное влияние на рост верхушечных и пазушных почек. Причем, действие минеральных солей по прописи МС превышало действие солей по WPM. В варианте с МС наблюдали активный рост верхушечных и пазушных почек и формирование побегов высотой более 12 см. Побеги имели ярко-зеленый цвет стеблей и хвои.
Пример 3. Получение микропобегов проводили по методике, описанной в примере 2. Изучали влияние гормонального состава питательной среды на микроразмножение и укоренение микропобегов. Для этого в состав питательной среды добавляли различные регуляторы роста (ауксины и цитокиины) в различных концентрациях и сочетаниях. В качестве цитокининов исследовали БАП и НУК в концентраци 2 мг/л и 0,5 мг/л соответственно, а в качестве ауксинов - 2 мг/л 2,4-Д. Во все питательные среды добавляли 1 г/л ПВП. Результаты приведены в таблице 3 и на рисунке 4 и 5.
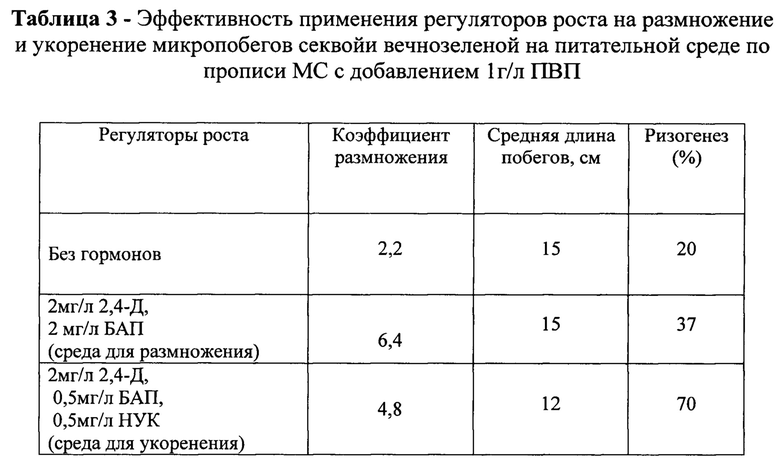
На основании проведенных исследований установлено, что наилучшие результаты по размножению и укоренению микропобегов секвой вечнозеленой были получены на питательной среде МС, содержащей 2 мг/л 2,4-Д, 0,5 мг/л БАП, 0,5 мг/л НУК. В этих условиях формировались побеги высотой 12. см, коэффициент размножения составил 9,4 а укореняемость - более 70%. В остальных вариантах питательных сред, учитываемые показатели были существенно ниже.
В результате проведения цикла исследований был разработан способ клонального микроразмножения секвойи вечнозеленой (Sequoia sempervirens L.), включающий предварительную обработку черенков 0,2%-ным раствором ИМК, проведение ступенчатой стерилизации, культивирование сегментов черенков на безгормональной питательной среде МС, с последующим культивированием на среде, содержащей минеральные соли по прописи МС, дополненной 2 мг/л 2,4-Д, 2 мг/л БАП на этапе размножения и содержащей 2 мг/л 2,4-Д, 0,5 мг/л БАП, 0,5 мг/л НУК на этапе укоренения.
Предлагаемый способ микроразмножения секвойи вечнозеленой in vitro сочетает ряд положительных свойств, которые позволяют использовать его в практической работе и для получения высококачественного, генетически однородного посадочного материала реликтовых хвойных растений:
1. Технология предполагает получение генетически однородный материал за счет образования побегов непосредственно на первичном экспланте, минуя образование каллусной ткани.
2. Технология предполагает проведение работ по размножению и получению ценного посадочного материала в лабораторных условиях не зависимо от сезона и негативных факторов окружающей среды.
3. Предлагаемая технология легка в исполнении и не требует привлечения дорогостоящего оборудования и специфических питательных сред.
4. Предлагаемый способ размножения предполагает ускоренное получение высококачественного, генетически однородного посадочного материала, за счет отсутствия третьего этапа клонального микрорамзножения - укоренения.
5. Предлагаемый способ является универсальным для клонирования реликтовых хвойных растений с высоким содержанием биологически активных веществ.
Заявляемое изобретение обеспечит ускоренное получение высококачественного, генетически однородного посадочного материала секвойи вечнозеленой.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ клонального микроразмножения кардамона черного (Amomum tsao-ko) | 2023 |
|
RU2814183C1 |
| Способ клонального микроразмножения княженики арктической (Rubus arcticus L.) | 2023 |
|
RU2824884C1 |
| Способ размножения катальпы бигнониевидной (Catalpa bignonioides) | 2024 |
|
RU2834051C1 |
| Способ получения безвирусного, генетически однородного посадочного материала батата (Ipomoea Batatas L.) in vitro | 2021 |
|
RU2783183C1 |
| Способ выращивания морошки приземистой (Rubus chamaemorus L.) | 2024 |
|
RU2824883C1 |
| Способ выращивания княженики арктической (Rubus arcticus L.) | 2023 |
|
RU2811144C1 |
| Способ выращивания красники (Vaccinium praestans Lamb.) | 2024 |
|
RU2827218C1 |
| Способ выращивания голубики узколистной (Vaccinium angustifolium Ait.) | 2024 |
|
RU2825762C1 |
| Способ культивирования растений in vitro разных таксономических групп | 2023 |
|
RU2804965C1 |
| Способ адаптации неукорененных микропобегов растений разных таксономических групп к нестерильным условиям ex vitro | 2022 |
|
RU2791513C1 |



Изобретение относится к области биотехнологии. Изобретение представляет собой способ клонального микроразмножения секвойи вечнозеленой (Sequoia sempervirens), достигается за счет использования черенков секвойи, которые после предварительной обработки 0,2%-ным раствором ИМК и поверхностной стерилизации культивируют на питательной среде Мурасига и Скуга, в состав которой дополнительно включают на этапе роста побегов 2 мг/л 2,4-Д, 2 мг/л БАП и 1 г/л ПВП, а на этапе размножения и укоренения микропобегов 2 мг/л 2,4-Д, 0,5 мг/л БАП, 0,5 мг/л НУК и 1 г/л ПВП. Изобретение позволяет ускорить получение высококачественного, генетически однородного посадочного материала 6 ил., 3 табл.
Способ клонального микроразмножения секвойи вечнозеленой (Sequoia sempervirens L.), включающий получение микрокрастений в условиях in vitro из сегментов асептических растений секвойи вечнозеленой, отличающийся тем, что микрорастения получают из сегментов черенков, предварительно обработанных 0,2%-ным раствором индолил-3-масляной кислоты, и затем культивируют на питательной среде Мурасига и Скуга, в состав которой на этапе роста побегов дополнительно включают 2 мг/л 2,4-дихлорфеноксиуксусной кислоты, 2 мг/л 6-бензиламинопурина и 1 г/л поливинилпирролидона, а на этапе размножения и укоренения микропобегов - 2 мг/л 2,4-дихлорфеноксиуксусной кислоты, 0,5 мг/л индолил-3-масляной кислоты, 0,5 мг/л 1-нафталинуксусной кислоты и 1 г/л поливинилпирролидона.
| LOBNA S | |||
| et al | |||
| A comparative study of biochemical changes on micropropagated Sequoia sempervirens using potassium silicate and silica nanoparticles, Journal of Pharmaceutical Negative Results, 2022, Volume 13, Special Issue 8, p.2592-2601 | |||
| SARBU, G | |||
| et al | |||
| Morpho-anatomical studies on vegetative organs of Sequoia sempervirens, in vitro culture |
Авторы
Даты
2024-03-15—Публикация
2023-09-07—Подача